Спосіб одержання 1,3,4-заміщених піразольних сполук
Номер патенту: 106470
Опубліковано: 10.09.2014
Автори: Рак Міхаель, Майвальд Фолькер, Кайл Міхаель, Цірке Томас, Вольф Бернд, Корадін Крістофер, Зукопп Мартін
Формула / Реферат
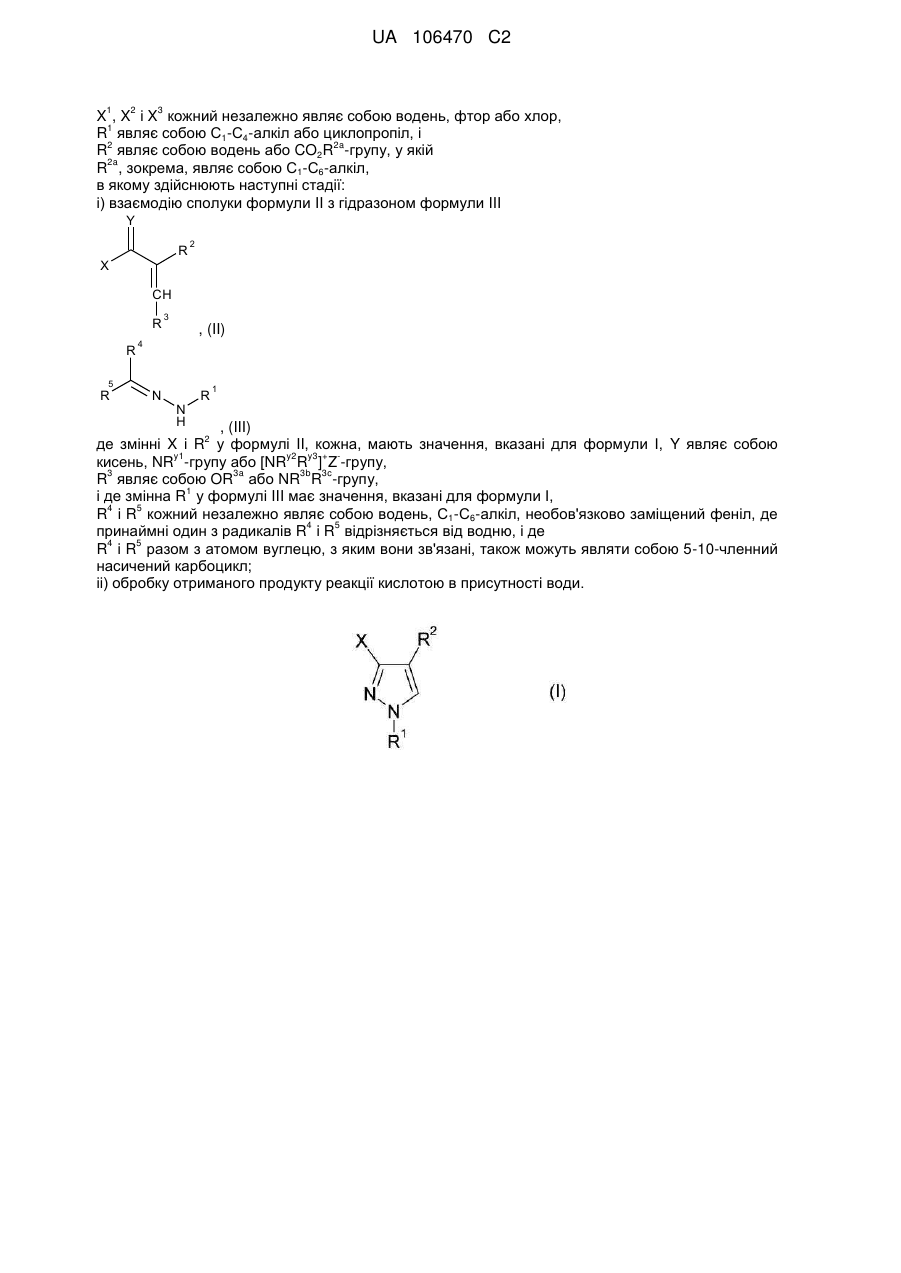
1. Спосіб одержання 1,3,4-заміщених піразольних сполук формули І
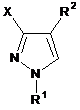 , (I)
, (I)
у якій
X являє собою СХ1X2Х3-групу, у якій
X1, X2 і X3 кожний незалежно являє собою водень, фтор або хлор, де X1 також може являти собою С1-С6-алкіл або С1-С4-галогеналкіл і де принаймні один з радикалів X1, X2 відрізняється від водню,
R1 являє собою С1-С4-алкіл, і
R2 являє собою CO2R2a-групу, у якій
R2a являє собою С5-С6-циклоалкіл, необов'язково заміщений феніл або С1-С6-алкіл, який необов'язково може бути заміщений С1-С4-алкокси, фенілом або С3-С6-циклоалкілом,
в якому здійснюють наступні стадії за якими:
і) сполуку формулу II піддають взаємодії з гідразоном формули III
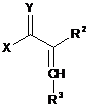 ,
,
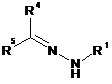 ,
,
(II)
(III)
де змінні X і R2 у формулі II, кожна, мають значення, вказані для формули І,
Y являє собою кисень, NRy1-групу або [NRy2Ry3]+Z--групу, де
Ry1, Ry2 і Ry3 кожний незалежно являє собою С1-С6-алкіл, С5-С6-циклоалкіл, необов'язково заміщений феніл або необов'язково заміщений феніл-С1-С4-алкіл, або
Ry2 і Ry3 разом з атомом азоту, до якого вони приєднані, являють собою N-зв'язаний, 5-8-членний насичений, необов'язково заміщений гетероцикл, який, додатково до атома азоту, також може містити 1 або 2 інші гетероатоми, вибрані з N, О і S, як кільцеві атоми, і
Z- являє собою аніон, вибраний із фтору, [MgF3]-, [BF4]-, [BCl3F]-, [AlF4]-, [AlCl3F]-, [ZnCl2F]-, [PF6]-, [SbF6]-, [BiCl3F]-, [GaCl3F]-, [SnCl4F]- або [SiCl4F]-,
R3 являє собою OR3a або NR3bR3c-групу, де
R3a, R3b і R3c кожний незалежно являє собою С1-С6-алкіл, С5-С6-циклоалкіл, необов'язково заміщений феніл або необов'язково заміщений феніл-С1-С4-алкіл, або
R3b і R3c разом з атомом азоту, до якого вони приєднані, являють собою N-зв'язаний 5-8-членний насичений, необов'язково заміщений гетероцикл, який, додатково до атома азоту, також може містити 1 або 2 інші гетероатоми, вибрані з N, О і S, як кільцеві атоми,
і де змінна R1 у формулі III має значення, вказані для формули І,
R4 і R5 кожний незалежно являє собою водень, С1-С6-алкіл, який необов'язково може бути заміщений С1-С4-алкокси, фенілом або С3-С6-циклоалкілом; С3-С6-циклоалкіл або необов'язково заміщений феніл, де принаймні один з радикалів R4 і R5 відрізняється від водню, і де
R4 і R5 разом з атомом вуглецю, з яким вони зв'язані, також можуть являти собою 5-10-членний насичений карбоцикл, який необов'язково моно- або полізаміщений С1-С4-алкільними групами та/або необов'язково заміщеним фенілом, та/або містить одне або 2 спряжених фенільних кільця;
іі) отриманий продукт реакції обробляють кислотою в присутності води.
2. Спосіб відповідно до пункту 1, в якому додатково здійснюють одержання сполуки III шляхом взаємодії карбонільної сполуки формули IV із заміщеною гідразиновою сполукою формули V
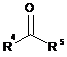 ,
,
![]() ,
,
(IV)
(V)
де R1, R4 і R5 у формулах IV і V, кожна, мають значення, вказані для формули III.
3. Спосіб відповідно до будь-якого з попередніх пунктів, де R3 у формулі II являє собою O-R3a, де R3a має значення, вказані вище, і особливо являє собою С1-С4-алкіл.
4. Спосіб відповідно до будь-якого з попередніх пунктів, де Y у формулі II являє собою кисень.
5. Спосіб відповідно до будь-якого з попередніх пунктів, де X у формулах І і II являє собою СХ1X2Х3-групу, у якій X1 і X2 кожний являє собою фтор і X3 являє собою водень, фтор або хлор.
6. Спосіб відповідно до будь-якого з попередніх пунктів, де R2a в COOR2a-групі являє собою С1-С6-алкіл або С1-С4-алкоксі-С1-С6-алкіл.
7. Спосіб відповідно до будь-якого з попередніх пунктів, де R1 у формулах І, III і V являє собою метил.
8. Спосіб відповідно до будь-якого з попередніх пунктів, де
R4 являє собою водень або С1-С6-алкіл, і
R5 являє собою С1-С6-алкіл, С3-С6-циклоалкіл або необов'язково заміщений феніл, або
R4 і R5 разом з атомом вуглецю, з яким вони зв'язані, можуть являти собою 5-10-членний насичений карбоцикл, який необов'язково моно- або полізаміщений С1-С4-алкільними групами та/або містить конденсоване фенільне кільце.
9. Спосіб відповідно до будь-якого з попередніх пунктів, де
R4 являє собою водень, і
R5 являє собою необов'язково заміщений феніл.
10. Сполука загальної формули VI
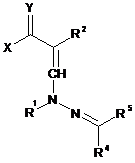 , (VI)
, (VI)
де X, Y, R1, R2, R4 і R5 кожний має значення, вказані в пункті 1,
крім сполук формули VI, де R4 і R5 кожний являє собою необов'язково заміщений феніл і Y являє собою кисень.
11. Сполука відповідно до пункту 10, де Y являє собою кисень.
12. Сполука відповідно до будь-якого з пунктів 10 і 11, де X являє собою СХ1X2Х3-групу, у якій X1 і X2 кожний являє собою фтор і X3 являє собою водень, фтор або хлор.
13. Сполука відповідно до будь-якого з пунктів 10-12, де R2a в COOR2a-групі являє собою С1-C6-алкіл або С1-С4-алкоксі-С1-С6-алкіл.
14. Сполука відповідно до будь-якого з пунктів 10-13, де R1 являє собою метил.
15. Сполука відповідно до будь-якого з пунктів 10-14, де
R4 являє собою водень або С1-С6-алкіл, і
R5 являє собою С1-С6-алкіл, С3-С6-циклоалкіл або необов'язково заміщений феніл, або
R4 і R5 разом з атомом вуглецю, з яким вони зв'язані, можуть являти собою 5-10-членний насичений карбоцикл, який необов'язково моно- або полізаміщений С1-С4-алкільними групами та/або містить конденсоване фенільне кільце.
16. Сполука відповідно до будь-якого з пунктів 10-15, де
R4 являє собою водень, і
R5 являє собою необов'язково заміщений феніл.
17. Сполука відповідно до будь-якого з пунктів 10-15, де
R4 і R5 разом з атомом вуглецю, з яким вони зв'язані, являють собою 5-10-членний насичений карбоцикл, який необов'язково моно- або полізаміщений С1-С4-алкільними групами.
18. Спосіб одержання піразолкарбонової кислоти формули Іа
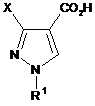 , (Ia)
, (Ia)
де X і R1 кожний має значення, вказані в будь-якому з пунктів 1, 5 або 7, в якому здійснюють наступні стадії, за якими:
а) одержують піразольну сполуку формули І за способом відповідно до будь-якого з пунктів 1-9,
б) сполуку І гідролізують з одержанням 1,3-заміщеної піразолкарбонової кислоти формули Іа.
19. Спосіб одержання сполуки формули VII
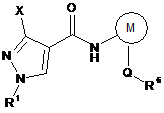 , (VII)
, (VII)
де X і R1 кожний має значення, вказані в будь-якому з пунктів 1, 5 або 7,
М являє собою тієніл або феніл, який може нести галогеновий замісник;
Q являє собою простий зв'язок, циклопропілен, спряжене біцикло[2,2,1]гептанове або біцикло[2,2,1]гептенове кільце;
R6 являє собою водень, галоген, С1-С4-алкіл, С1-С4-галогеналкокси, одно-тризаміщений феніл, де замісники, кожний незалежно, вибирають із галогену й трифторметилтіо, або циклопропіл;
в якому здійснюють наступні стадії, за якими:
а) одержують піразольну сполуку формули І за способом відповідно до будь-якого з пунктів 1-9,
б) сполуку І гідролізують з одержанням 1,3-заміщеної піразолкарбонової кислоти формули Іа
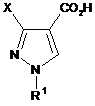 , (Ia)
, (Ia)
де X і R1 кожний має значення, вказані вище;
в) необов'язково перетворюють сполуку Іа у її галогенангідрид, і
г) проводять взаємодію сполуки формули Іа або її галогенангідриду з аміновою сполукою формули VIII
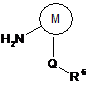 , (VIII)
, (VIII)
де M, Q і R6 кожний має значення, вказані для формули VII.
Текст
Реферат: Даний винахід стосується способу одержання 1,3-заміщених піразольних сполук формули І X R 2 N N R 1 , (I) у якій 1 2 3 X являє собою СХ X Х -групу, у якій UA 106470 C2 (12) UA 106470 C2 1 2 3 X , X і X кожний незалежно являє собою водень, фтор або хлор, 1 R являє собою С1-С4-алкіл або циклопропіл, і 2 2a R являє собою водень або CO2R -групу, у якій 2a R , зокрема, являє собою С1-С6-алкіл, в якому здійснюють наступні стадії: і) взаємодію сполуки формули II з гідразоном формули III Y R X 2 CH R R 5 R 3 , (II) 4 N N H R 1 , (III) 2 де змінні X і R у формулі II, кожна, мають значення, вказані для формули І, Y являє собою y1 y2 y3 + кисень, NR -групу або [NR R ] Z -групу, 3 3a 3b 3c R являє собою OR або NR R -групу, 1 і де змінна R у формулі III має значення, вказані для формули І, 4 5 R і R кожний незалежно являє собою водень, С1-С6-алкіл, необов'язково заміщений феніл, де 4 5 принаймні один з радикалів R і R відрізняється від водню, і де 4 5 R і R разом з атомом вуглецю, з яким вони зв'язані, також можуть являти собою 5-10-членний насичений карбоцикл; іі) обробку отриманого продукту реакції кислотою в присутності води. UA 106470 C2 Даний винахід стосується способу одержання 1,3,4-заміщених піразольних сполук формули I 5 10 15 20 25 30 35 40 45 у якій 1 2 3 X являє собою CX X X групу, у якій 1 2 3 1 X , X і X кожний незалежно являє собою водень, фтор або хлор, де X також може являти 1 2 собою C1-С6-алкіл або C1-С4-галоалкіл і де принаймні один з X , X радикалів відрізняється від водню, 1 R являє собою C1-С4-алкіл або циклопропіл, і 2 2a R являє собою CN або CO2R групу, у якій 2a R являє собою C5-С6-циклоалкіл, необов'язково заміщений фенілом або C1-С6-алкілом, який необов'язково може бути заміщений C1-С4-алкокси, фенілом або C3-С6-циклоалкілом. Піразоли загальної формули I є важливими вихідними матеріалами для різних активних фармацевтичних компонентів і активних компонентів засобів захисту сільськогосподарських структур, особливо, для 1,3-заміщених піразол-4-ілкарбоксанілідів, як описано, наприклад, в US 5,498,624, EP 545099 A1, EP 589301 A1, WO 92/12970, WO 03/066610, WO 2006/024389, WO 2007/003603, WO 2007/006806. 1,3,4-заміщені піразольні сполуки формули I звичайно одержують шляхом циклізації підходящих 1,3-дифункціональних сполук із заміщеними гідразиновими сполуками, або шляхом взаємодії 1,3-дифункціональних сполук з гідразином, з наступним алкілуванням для введення замісника біля атома азоту (1 положення). Основним недоліком при здійсненні цієї процедури є відсутність регіоселективності циклізації 1,3-дифункціональних сполук із заміщеними гідразиновими сполуками, а також відсутність регіоселективності N-алкілування піразолів, таким чином, що в обох випадках, утворюється не тільки бажана 1,3,4-заміщена піразольна сполука формули I (1,3 ізомер), але також і 1,4,5-заміщений ізомер формули I' (1,5 ізомер). Незважаючи на той факт, що відсутність селективності приводить до низьких виходів, 1,3ізомер формули I і 1,5-ізомер формули I' часто можуть бути розділені тільки із труднощами. Для досягнення прийнятних селективностей, реакції необхідно здійснювати при низьких температурах, що суттєво підвищує складність апарата. Додатково, регіоселективність також не є повністю задовільною в холодних умовах. В US 5,498,624 і інших джерелах описаний спосіб одержання складних ефірів (3дифторметил-1-метилпіразол-4-іл)карбонових кислот, де складний ефір α-етоксиметилен-4, 3кетомасляної кислоти циклізують з метилгідразином, одержуючи піразольну сполуку. В WO 92/12970 описаний подібний процес, у якому складний ефір 4,4-дифтор-3-кетомасляної кислоти поетапно піддають реакції із триетил ортоформіатом і з метилгідразином, при цьому утворюється як проміжна сполука складний ефір етоксиметилен-4,4-дифтор-3-кетомасляної кислоти. Селективність бажаного ізомеру не є задовільною. В WO 2003/051820 і WO 2005/042468 описана циклізація складних ефірів 2-галоацил-3аміноакрилових кислот з алкілгідразинами з одержанням складних ефірів 1-алкіл-3галоалкілпіразол-4-карбонових кислот. Селективність бажаного ізомеру не є задовільною. В WO 2008/022777 описаний спосіб одержання складних ефірів 1-заміщених 3(дигалометил) піразол-4-карбонових кислот, у якому вінілогові солі амідінію, які одержують шляхом взаємодії α-(галометил)дифторметиламінів з акрилатами в присутності кислоти Л'юіса, піддають реакції із заміщеними гідразинами. Селективність бажаного ізомеру не є задовільною. Таким чином, задачею даного винаходу є забезпечення способу одержання 1,3,4-заміщених піразольних сполук формули I, процитованих, як вказано вище, який забезпечує бажаний 1,3ізомер формули I з високими виходами й гарною селективністю. Несподівано було виявлено, що 1,3,4-заміщені піразольні сполуки формули I, визначені, як 1 UA 106470 C2 5 вказано вище, можуть бути отримані простим способом з високими виходами й високою регіоселективністю для бажаного 1,3-ізомеру, де підходящі 1,3-дифункціональні сполуки формули II, описані нижче, спочатку піддають реакції з гідразоном формули III, описаної нижче, і утворену проміжну сполуку обробляють із кислотою в присутності води. Таким чином, даний винахід стосується способу одержання 1,3-заміщених піразольних сполук формули I, визначених, як вказано вище, який включає наступні стадії: i) взаємодію сполуки формули II з гідразоном формули III 2 10 15 20 25 30 35 40 де змінні X і R у формулі II кожна має значення, вказані для формули I, y1 y2 y3 + Y являє собою кисень, NR групу або [NR R ] Z групу, де y1 y2 y3 R , R і R кожний незалежно являє собою C1-С6-алкіл, C5-С6-циклоалкіл, необов'язково заміщений феніл або необов'язково заміщений феніл-C1-С4-алкіл, або y2 y3 R і R разом з атомом азоту, до якого вони приєднані, являють собою N-зв'язаний, 5-ти - 8ми членний, насичений, необов'язково заміщений гетероцикл, який, додатково до атома азоту, також може містити 1 або 2 інших гетероатомів, вибраних з N, O і S, як кільцеві атоми, і Z являє собою аніон; 3 3a 3b 3c R являє собою OR або NR R групу, де 3a 3b 3c R , R і R кожний незалежно являє собою C1-С6-алкіл, C5-С6-циклоалкіл, необов'язково заміщений феніл або необов'язково заміщений феніл-C1-С4-алкіл, або 3b 3c R і R разом з атомом азоту, до якого вони приєднані, являють собою N-зв'язаний 5-ти - 8ми членний, насичений, необов'язково заміщений гетероцикл, який, додатково до атома азоту, також може містити 1 або 2 інших гетероатомів, вибраних з N, O і S, як кільцеві атоми, 1 і де змінна R у формулі III має значення, вказані для формули I, 4 5 R і R кожний незалежно являє собою водень, C 1-С6-алкіл, який необов'язково може бути заміщений C1-С4-алкокси, фенілом або C3-С6-циклоалкілом, C3-C6 циклоалкілом або 4 5 необов'язково заміщеним фенілом, де принаймні один з R і R радикалів відрізняється від водню, і де 4 5 R і R разом з атомом вуглецю, з яким вони зв'язані, також можуть являти собою 5-ти - 10ти членний насичений карбоцикл, який необов'язково моно- або полізаміщений C1-С4алкільними групами та/або необов'язково заміщеним фенілом, та/або містить одне або 2 спряжених фенільних кільця; ii) обробку отриманого продукту реакції з кислотою в присутності води. Спосіб відповідно до винаходу надає різні переваги. Насамперед, він забезпечує одержання бажаних 1,3,4-заміщених піразолів з високим виходом і високою регіоселективністю, виходячи з бажаного 1,3-ізомеру формули I. Додатково, для досягнення бажаної селективності, низькі температури не є необхідними, і стадію i) і стадію ii) можна здійснювати при помірних температурах, наприклад, в інтервалі від 10 до 180 °C, особливо в інтервалі від 20 до 150 °C. Слід прийняти до уваги, що реакцію на стадіях i) і ii) також можна здійснити при більш низьких температурах, наприклад, при температурах аж до -20 °C, що, однак, не є необхідним для досягнення бажаної регіоселективності. На стадії i) способу відповідно до винаходу, утворюється сполука формули VI, представлена нижче, яка типово може бути виділена: 1 45 2 4 5 У формулі VI, X, Y, R , R , R і R мають значення, вказані в даній заявці вище й далі. 4 5 Сполуки формули VI є новими, крім сполук формули VI, у яких R і R кожний являє собою необов'язково заміщений феніл і Y являє собою кисень. Ці останні сполуки відомі з EP 581725. Нові сполуки формули VI також є об'єктом даного винаходу. 2 UA 106470 C2 5 10 15 20 25 30 35 40 45 50 55 Терміни, використовувані для органічних груп у визначеннях змінних, наприклад, вираз "галоген", являють собою збірні терміни, які відображають окремих представників цих груп органічних одиниць. Префікс C x-Cy означає кількість можливих атомів вуглецю в конкретному випадку. Термін "галоген" означає в кожному випадку фтор, бром, хлор або йод, особливо фтор, хлор або бром. Прикладами інших визначень є: Термін "C1-С6-алкіл", як використовується в даній заявці, означає насичену, нерозгалужену або розгалужену вуглеводневу групу, яка містить від 1 до 6 атомів вуглецю, особливо від 1 до 4 атомів вуглецю, наприклад, метил, етил, пропіл, 1-метилетил, бутил, 1-метилпропіл, 2метилпропіл, 1,1-диметилетил, пентил, 1-метилбутил, 2-метилбутил, 3-метилбутил, 2,2диметилпропіл, 1-етилпропіл, гексил, 1,1-диметилпропіл, 1,2-диметилпропіл, 1-метилпентил, 2метилпентил, 3-метилпентил, 4-метилпентил, 1,1-диметилбутил, 1,2-диметилбутил, 1,3диметилбутил, 2,2-диметилбутил, 2,3-диметилбутил, 3,3-диметилбутил, 1-етилбутил, 2етилбутил, 1,1,2-триметилпропіл, 1,2,2-триметилпропіл, 1,1-етил-2-метилпропіл і їх ізомери. C1-С4-алкіл включає, наприклад, метил, етил, пропіл, 1-метилетил, бутил, 1-метилпропіл, 2метилпропіл або 1,1-диметилетил. Термін "C1-С6-алкіл", який необов'язково може бути заміщений C1-С4-алкокси, фенілом або C3-С6-циклоалкілом, являє собою незаміщений C1-С6-алкіл, як визначено вище, або C1-С6-алкіл, у якому один з атомів водню замінений C1-С4-алкокси, фенілом або C3-С6-циклоалкільною групою. Термін "C1-С4-галоалкіл", як використовується в даній заявці, описує нерозгалужені або розгалужені алкільні групи, що містять від 1 до 4 атомів вуглецю, де атоми водню цих груп повністю або частково замінені атомами галогену, особливо фтором та/або хлором, наприклад, хлорметил, дихлорметил, трихлорметил, фторметил, дифторметил, трифторметил, хлорфторметил, дихлорфторметил, хлордифторметил, 1-хлоретил, 1-фторетил, 2-фторетил, 2,2-дифторетил, 2,2,2-трифторетил, 2-хлор-2-фторетил, хлор-2, 2-дифторетил, 2,2 дихлор-2фторетил, 2,2,2-трихлоретил, пентафторетил, і ін. Термін "C1-С6-алкокси", як використовується в даній заявці, описує нерозгалужені або розгалужені насичені алкільні групи, що містять від 1 до 6 атомів вуглецю, які зв'язані з допомогою атома кисню. Приклади включають C1-С6-алкокси, наприклад, метокси, етокси, OCH2-C2H5, OCH(CH3)2, н-бутокси, OCH(CH3)-C2H5, OCH2-CH(CH3)2, C(CH3)3, н-пентокси, 1метилбутокси, 2-метилбутокси, 3-метилбутокси, 1,1-диметилпропокси, 1,2-диметилпропокси, 2, 2-диметилпропокси, 1-етилпропокси, н-гексокси, 1-метилпентокси, 2-метилпентокси, 3метилпентокси, 4-метилпентокси, 1,1-диметилбутокси, 1,2-диметилбутокси, 1,3диметилбутокси, 2,2-диметилбутокси, 2,3-диметилбутокси, 3,3-диметилбутокси, 1-етилбутокси, 2-етилбутокси, 1,1,2-триметилпропокси, 1,2,2-триметилпропокси, 1-етил-1-метилпропокси, 1етил-2-метилпропокси й ін. Термін "C1-C4-алкокси-C1-С6-алкіл", як використовується в даній заявці, описує C1-С6-алкіл, у якому один з атомів водню замінений C1-С4-алкокси групою. Їх прикладами є CH2-OCH3, CH2-OC2H5, н-пропоксиметил, CH2-OCH(CH3)2, н-бутоксиметил, (1-метилпропокси)метил, (2метилпропокси)метил, CH2-OC(CH3)3, 2-(метокси)етил, 2-(етокси)етил, 2-(н-пропокси)етил, 2-(1метилетокси)етил, 2-(н-бутокси)етил, 2-(1-метилпропокси)етил, 2-(2-метилпропокси)етил, 2-(1,1диметилетокси)етил, 2-(метокси)пропіл, 2-(етокси)пропіл, 2-(н-пропокси)пропіл, 2-(1метилетокси)пропіл, 2-(н-бутокси)пропіл, 2-(1-метилпропокси)пропіл, 2-(2метилпропокси)пропіл, 2-(1,1-диметилетокси)пропіл, 3-(метокси)пропіл, 3-(етокси)пропіл, 3-(нпропокси)пропіл, 3-(1-метилетокси)пропіл, 3-(н-бутокси)пропіл, 3-(1-метилпропокси)пропіл, 3-(2метилпропокси)пропіл, 3-(1,1-диметилетокси)пропіл, 2-(метокси)бутил, 2-(етокси)бутил, 2-(нпропокси)бутил, 2-(1-метилетокси)бутил, 2-(н-бутокси)бутил, 2-(1-метилпропокси)бутил, 2-(2метилпропокси)бутил, 2-(1,1-диметилетокси)бутил, 3-(метокси)бутил, 3-(етокси)бутил, 3-(нпропокси)бутил, 3-(1-метилетокси)бутил, 3-(н-бутокси)бутил, 3-(1-метилпропокси)бутил, 3-(2метилпропокси)бутил, 3-(1,1-диметилетокси)бутил, 4-(метокси)бутил, 4-(етокси)бутил, 4-(нпропокси)бутил, 4-(1-метилетокси)бутил, 4-(н-бутокси)бутил, 4-(1-метилпропокси)бутил, 4-(2метилпропокси)бутил, 4-(1,1-диметилетокси)бутил та ін. Термін "C3-С6-циклоалкіл", як використовується в даній заявці, описує моноциклічні насичені вуглеводневі радикали, що містять від 3 до 6 атомів вуглецю. Прикладами моноциклічних радикалів є циклопропіл, циклобутил, циклопентил і циклогексил. Термін "необов'язково заміщений феніл", як використовується в даній заявці, означає незаміщений феніл або описує феніл, який несе 1, 2, 3, 4 або 5 і особливо 1, 2 або 3 замісники, 3 UA 106470 C2 5 10 15 20 25 30 35 які є інертними в умовах реакції. Прикладами інертних замісників є галоген, особливо фтор, хлор або бром, CN, NO2, C1-С6-алкіл, C1-С6-алкілтіо, C1-С6-алкілсульфоніл, C1-С4-галоалкіл, C1-С6-алкокси, C3-С6-циклоалкіл, і C1-C4-алкокси-C1-С6-алкіл. Термін "необов'язково заміщений феніл-C1-С6-алкіл", як використовується в даній заявці, описує C1-C6-алкіл, у якому один з атомів водню замінений необов'язково заміщеному фенільною групою. Прикладами є бензил, 4-метилбензил, фенілетил і ін. Термін "N-зв'язаний 5-ти - 8-ми членний, насичений, необов'язково заміщений гетероцикл" означає насичений гетероцикл, який зв'язаний за допомогою кільцевого атома азоту й має 5, 6, 7 або 8 кільцевих атомів, де, крім атома азоту, кільцеві атоми також можуть включати додаткові гетероатоми, і який незаміщений або несе 1, 2, 3, 4 або 5 і особливо 1, 2 або 3 замісники, які є інертними в умовах реакції. Прикладами інертних замісників є CN, C 1-С6-алкіл, C1-С6-алкілтіо, C1-С6-алкілсульфоніл, C1-С4-галоалкіл, C1-С6-алкокси, C3-С6-циклоалкіл, і C1-C4-алкокси-C1-С6-алкіл. Гетероцикл може містити, крім атома азоту в положенні 1 і кільцевих атомів вуглецю, також 1 або 2 інших гетероатомів, вибраних з N, O і S, як кільцеві атоми. Прикладами N-зв'язаних, 5-ти - 8-ми членних, насичених, необов'язково заміщених гетероциклів є піролідин-1-іл, піпердин-1-іл, морфолін-4-іл, піперазин-1-іл і N-метилпіперазин-1--іл. Кращий варіант здійснення винаходу стосується одержання піразольних сполук формули I, 2 2a 2a де R являє собою COOR групу, у якій R має значення, вказані вище, і, зокрема, являє собою C1-С6-алкіл або C1-C4-алкокси-C1-С6-алкіл і особливо C1-С4-алкіл. Таким чином, у цьому варіанті 2 2a 2a здійснення, R група у формулах II і VI також являє собою COOR групу, у якій R має значення, вказані вище, і, зокрема, являє собою C1-С6-алкіл або C1-C4-алкокси-C1-С6-алкіл і особливо C1-С4-алкіл. Інший варіант здійснення винаходу стосується одержання піразольних сполук формули I, де 2 2 R являє собою CN. Таким чином, R у сполуках формул II і VI також являє собою CN. Спосіб відповідно до винаходу особливо придатний для одержання сполук загальної 1 2 3 1 2 3 формули I, де X являє собою CX X X групу, у якій X , X і X кожний має значення, вказані 1 2 1 2 вище, де принаймні один з X і X радикалів відрізняється від водню. Більш переважно, X і X 3 кожний являє собою фтор. X переважно являє собою водень, фтор або хлор. Прикладами 1 2 3 кращих CX X X радикалів є дихлорметил, хлорфторметил, дифторметил, хлордифторметил і трифторметил. У специфічному варіанті здійснення, X являє собою CHF 2 групу. 1 Додатково, було виявлено, що є сприятливим, коли R у формулі I і, отже, у формулі III являє собою C1-С4-алкіл і особливо метил. У першому варіанті здійснення винаходу, піразольні сполуки формули I одержують шляхом застосування сполуки формули II, де Y являє собою кисень. Такі сполуки також позначають далі 2 2a 2a в даній заявці як сполуки IІa. Сполуки формули IІa, де R являє собою COOR групу, у якій R має значення, вказані вище, і особливо являє собою C1-C6-алкіл або C1-C4-алкокси-C1-С6-алкіл і особливо C1-С4-алкіл також позначають далі в даній заявці як сполуки IІa.1. 2 40 45 50 2a 3 У формулах IІa і IІa.1, R , R , R і X кожний має значення, вказані вище. 1 2 3 1 2 3 Більш переважно, X у формулах IІa і IІa.1 являє собою CX X X групу, у якій X , X і X 1 2 кожний має значення, вказані вище. Зокрема, принаймні один з X і X радикалів відрізняється 1 2 3 від водню. Більш переважно, X і X кожний являє собою фтор. X переважно являє собою 1 2 3 водень, фтор або хлор. Прикладами особливо кращих CX X X груп є дихлорметил, трифторметил, хлордифторметил, фторхлорметил і дифторметил. У специфічному варіанті здійснення винаходу, X являє собою CHF2 групу. У другому варіанті здійснення винаходу, піразольні сполуки формули I одержують шляхом y2 y3 + застосування сполуки формули II, де Y являє собою [NR R ] Z групу. Такі сполуки також 2 2a позначають далі в даній заявці як сполуки IІb. Сполуки формули IІb, де R являє собою COOR 2a групу, у якій R має значення, вказані вище, і, зокрема, являє собою C1-С6-алкіл або C1-C4-алкокси-C1-С6-алкіл також позначають далі в даній заявці як сполуки IІb.1. 4 UA 106470 C2 2 5 10 15 20 25 30 35 40 45 50 2a y2 y3 3 У формулах IІb і IІb.1, R , R , R , R , Z, R і X кожний має значення, вказані вище. 1 2 3 1 2 3 Більш переважно, X у формулах IІb і IІb.1 являє собою CX X X групу, у якій X , X і X 1 2 кожний має значення, вказані вище. Більш переважно, принаймні один з X і X радикалів 1 2 3 відрізняється від водню. Більш переважно, X і X кожний являє собою фтор. X переважно 1 2 3 являє собою водень, фтор або хлор. Прикладами особливо кращих CX X X груп є 1 2 3 трифторметил, хлордифторметил, фторхлорметил і дифторметил. Більш переважно, CX X X група у формулах IІb, IІb.1 і IІb, 2 являє собою ChClF або CHF 2. y2 y3 R і R являють собою, зокрема, C1-С4-алкіл і особливо метил. Z являє собою аніон або еквівалент аніона, який переважно являє собою похідне кислоти Л'юіса, таке як MgF2, BF3, BCl3, AlCl3, AlF3, ZnCl2, PF5, SbF5, BiCl3, GaCl3, SnCl4, або SiCl4, наприклад, являє собою фторид, [MgF3] , [BF4] , [BCl3F] , [AlF4] , [AlCl3F] , [ZnCl2F] , [PF6] , [SbF6] , [BiCl3F] , [GaCl3F] , [SnCl4F] або [SiCl4F] . 3 У першому варіанті способу відповідно до винаходу, R у формулах II, IІa і IІa.1, IІb і IІb.1 3a 3a являє собою OR групу. У цьому випадку, R має значення, вказані вище, і, зокрема, являє собою C1-С4-алкіл і особливо метил або етил. 3 У другому варіанті способу відповідно до винаходу, R у формулах II, IІa і IІa.1, IІb і IІb.1 3b 3c 3b 3c являє собою NR R групу. У цій групі, R і R кожний має значення, вказані вище, і являють 3b 3c собою, зокрема, C1-С4-алкіл і особливо метил або етил, або R і R разом з атомом азоту, до якого вони приєднані, являють собою N-зв'язаний 5-ти - 8-ми членний, насичений гетероцикл, який, додатково до атома азоту, також може мати 1 або 2 інших гетероатомів, вибраних з N, O і S, як кільцеві атоми і який може необов'язково нести 1 або 2 C 1-С4-алкільні групи. Прикладами 3b 3c такої циклічної NR R групи є піролідин-1-іл, морфолін-4-іл, піперидин-1-іл і N-метилпіперазин1-іл. Тип гідразону формули III, використовуваний у реакції, у принципі не є істотним. У принципі,кращими є ті гідразони формули III (і відповідно також сполуки формули VI), де 4 R являє собою водень або C1-С6-алкіл і 5 R являє собою C1-С6-алкіл, C3-С6-циклоалкіл або необов'язково заміщений феніл, або 4 5 R і R разом з атомом вуглецю, з яким вони зв'язані, може являти собою 5-ти - 10-ти членний насичений карбоцикл, який необов'язково моно- або полізаміщений, наприклад, одно-, двох-, трьох- або чотирьох-заміщений, C1-С4-алкільними групами та/або містить конденсоване фенільне кільце. В особливо кращому варіанті здійснення способу відповідно до винаходу, використовують гідразон формули III, де 4 R являє собою водень або C1-С4-алкіл, особливо водень і 5 R являє собою необов'язково заміщений феніл. В іншому особливо кращому варіанті здійснення способу відповідно до винаходу, 4 5 використовують гідразон формули III, де R і R кожний являє собою C1-С4-алкіл або, разом з атомом вуглецю, з яким вони зв'язані, утворюють 5-ти - 8-ми членний, насичений карбоцикл, який необов'язково заміщений способом, описаним вище. Вираз "необов'язково заміщений феніл" у цьому контексті має визначення, вказані вище, і, зокрема, являє собою незаміщений феніл, або феніл, який має 1, 2 або 3 замісники, вибраних з галогену, особливо фтор, хлор або бром, нітро, ціано, C1-С4-алкілу, особливо метил або етил, і C1-С4-алкокси, особливо метокси або етокси, наприклад, як в 2-, 3- або 4-фторфенілі, 2-, 3- або 4-хлорфенілі, 4-бромфенілі, 2-, 3- або 4-метилфенілі, 2-, 3-, або 4-метоксифенілі, 4-ціанофенілі, 4-нітрофенілі. 5 Що стосується R , вираз "необов'язково заміщений феніл" має вищевказані визначення й більш переважно означає незаміщений феніл або феніл, який має 1 або 2 замісники, вибрані з галогену, особливо хлор, C1-C4-алкілу, особливо метил або етил, і C1-С4-алкокси, особливо метокси або етокси, наприклад, як в 2-, 3- або 4-хлорфенілі, 2-, 3- або 4-метилфенілі, 2-, 3- або 4-метоксифенілі. У надзвичайно кращій конфігурації способу відповідно до винаходу, використовують 5 UA 106470 C2 5 10 15 20 25 30 35 40 45 50 55 60 гідразон формули III, де 4 R являє собою водень і 5 R являє собою необов'язково заміщений феніл, особливо незаміщений феніл або феніл, який має 1 або 2 замісники, де замісники мають значення, вказані вище й переважно вибирають із галогену, особливо хлор, C1-С4-алкілу, особливо метил або етил, і C1-С4-алкокси, особливо метокси або етокси. У надзвичайно кращій конфігурації способу відповідно до винаходу, використовують гідразон формули III, де 4 5 R і R разом з атомом вуглецю, з яким вони зв'язані, являють собою 5-ти - 10-ти членний, особливо 5-ти - 8-ми членний насичений карбоцикл, який необов'язково моно- або полізаміщений, наприклад, одно-, двох-, трьох- або чотирьох-заміщений, C1-C4-алкільними групами. Сполуки формули II піддають реакції з гідразоном формули III на стадії i) способу відповідно до винаходу звичайно при температурах в інтервалі від 0 до 180 °C, особливо в інтервалі від 10 до 150 °C. Для реакції, сполуки II і III переважно використовують у співвідношенні, яке відповідає стехіометрії реакції, але також можливо відступати від стехіометрії. Звичайно, молярне співвідношення сполуки II до сполуки III знаходиться в інтервалі від 1,5:1 до 1:1,5, часто в інтервалі від 1,2:1 до 1:1,2 і особливо в інтервалі від 1,1:1 до 1:1,1. Звичайно, реакцію на стадії i) здійснюють в інертному органічному розчиннику. Прикладами інертних органічних розчинників є, зокрема, апротонні органічні розчинники, такі як ароматичні вуглеводні й галовуглеводні, наприклад, бензол, толуол, ксилоли, ізопропілбензол, хлорбензол і трет-бутилбензол, циклічні або ациклічні прості ефіри, такі як діетиловий ефір, діізопропіловий ефір, трет-бутил метиловий ефір (MTBE), трет-бутил етиловий ефір, тетрагідрофуран (ТГФ) або діоксан, нітрили, такі як ацетонітрил і пропіoнітрил, аліфатичні галовуглеводні, такі як дихлорметан, дихлоретан, трихлорметан і їх суміші. Кращим є обробка по суті в безводних умовах на стадії i), тобто вміст води в розчині становить менше 1 %, особливо менше 0,1 %, виходячи із загальної ваги розчинника. Для реакції сполук формули II з гідразонами формули III, процедура звичайно полягає в об'єднанні сполуки формули II, переважно у формі розчину в одному з вищевказаних інертних органічних розчинників, з гідразоном III, який також переважно використовують у формі розчину в одному з вищевказаних інертних органічних розчинників. У цьому випадку, гідразон III можна спочатку завантажувати у вигляді розчину в органічному розчиннику й можна додавати сполуку II, переважно у вигляді розчину. Альтернативно, сполуку II можна спочатку завантажувати у вигляді розчину в органічному розчиннику й гідразон можна додавати, переважно у вигляді розчину. Гідразон III і сполуку II можна поєднувати у вищевказаних температурних інтервалах. Процедуру часто здійснюють таким чином, що сполуки II і III поєднують при температурах в інтервалі від 0 до 50 °C, особливо від 10 до 50 °C, і потім реакційну суміш нагрівають до бажаної температури. Час реакції звичайно знаходиться в інтервалі від 1 години до 15 години. У такий спосіб одержують сполуку формули VI і вона може бути виділена з реакційної суміші. Альтернативно, реакційну суміш також можна додавати до реакції на стадії ii) способу відповідно до винаходу без виділення сполуки VI. Спосіб без виділення проміжної сполуки VI є сприятливим, оскільки зниження виходів, що відбувається, наприклад, при видаленні проміжної сполуки у твердому стані шляхом фільтрації (наприклад, втрати в маточній рідині), зменшується або вдається уникнути при такому здійсненні способу. У цих випадках, частину органічного розчинника, використовуваного на стадії i), необов'язково можна видаляти й необов'язково заміняти на інший розчинник. Спосіб без виділення проміжної сполуки VI також є особливо y2 y3 + сприятливим, коли Y група у використовуваній сполуці II являє собою [NR R ] Z . Відповідно до винаходу, реакцію здійснюють у присутності кислоти, особливо кислоти Бренстеда. Кращі кислоти мають значення pka не більше, ніж 4, особливо не більше, ніж 3 або не більше, ніж 2 (у розведеному (наприклад, 0,01 M) водному розчині при 25 °C). Кращими кислотами є галоводневі кислоти, такі як HF, HCl і HВr, особливо у формі їх водних розчинів, сірчана кислота, фосфорна кислота, HBF4, і органічні сульфонові кислоти, наприклад, ароматичні сульфонові кислоти формули Ar-SO3H, де Ar являє собою необов'язково заміщений феніл, такі як бензилсульфонова кислота й п-толуолсульфонова кислота, а також аліфатичні сульфонові кислоти, такі як метансульфонова кислота, етансульфонова кислота й трифторметансульфонова кислота. Також підходящими є аліфатичні й ароматичні карбонові кислоти, такі як мурашина кислота, хлороцтова кислота, дихлороцтова кислота, трихлороцтова кислота, трифтороцтова кислота, саліцилова кислота й 2-хлорбензойна кислота. Слід прийняти до уваги, що також підходящими є суміші вищевказаних кислот. 6 UA 106470 C2 5 10 15 20 25 30 35 40 45 50 Для реакції на стадії ii), звичайно достатньо каталітичних кількостей кислоти. Проте, кислоту також можна використовувати в стехіометричній або понадстехіометричній кількості. Як правило, кислоту використовують у кількості від 0,01 до 10 моль і особливо в кількості від 0,02 до 5 моль на моль сполуки VI, або, у випадку приготування in situ сполуки VI, у кількості від 0,01 до 10 моль і особливо в кількості від 0,02 до 2 моль на моль сполуки II. Відповідно до винаходу, реакцію на стадії ii) способу відповідно до винаходу здійснюють у присутності води. Припускають, що вода приводить до відщеплення гідразонової групи в сполуці формули VI, утвореному на стадії I, з утворенням сполуки VІa (показана з Y=O), яку потім циклізують з піразолом. Коли Y=O, то спосіб відповідно до винаходу можна проілюструвати за допомогою наступної схеми 1: Як стає очевидним зі схеми, у тому випадку, коли Y=O, навіть присутність каталітичних кількостей води достатньо для реакції, оскільки вода утворюється при здійсненні реакції. Воду також можна використовувати в стехіометричній або понадстехіометричній кількості. Як правило, воду використовують у кількості від 0,001 до 50 моль і особливо в кількості від 0,01 до 20 моль на моль сполуки VI, або, у випадку приготування in situ сполуки VI, у кількості від 0,001 до 50 моль і особливо в кількості від 0,01 до 20 моль на моль сполуки II. y1 y2 y3 + Припускають, що реакцію сполуки II, де Y являє собою NR або [NR R ] Z , з гідразоном III і наступну циклізацію з піразольною сполукою I здійснюють аналогічно, хоча, на відміну від варіанта, де Y=O, для повного перетворення при циклізації необхідні принаймні стехіометричні кількості води. Таким чином, у цьому випадку, воду звичайно використовують у кількості від 1 до 50 моль і особливо в кількості від 1,1 до 20 моль на моль сполуки VI, або, у випадку приготування in situ сполуки VI, у кількості від 1 до 50 моль і особливо в кількості від 1,1 до 20 моль на моль сполуки II. Звичайно, реакцію на стадії ii) здійснюють у присутності органічного розчинника або суміші розчинників. Підходящими органічними розчинниками для реакції на стадії ii) є протонні полярні розчинники, наприклад, аліфатичні спирти, що містять переважно від 1 до 4 атомів вуглецю, такі як метанол, етанол, н-пропанол, ізопропанол, н-бутанол, ізобутанол або трет-бутанол, або карбонові кислоти, такі як оцтова кислота, ароматичні вуглеводні, такі як бензол, толуол, ксилоли, ізопропілбензол, хлорбензол, нітробензол або трет-бутилбензол, апротонні полярні розчинники, наприклад, циклічні або ациклічні прості ефіри, такі як діетиловий ефір, діізопропіловий ефір, трет-бутил метиловий ефір (MTBE), трет-бутил етиловий ефір, тетрагідрофуран (ТГФ) або діоксан, циклічні або ациклічні аміди, такі як диметилформамід, диметилацетамід, N-метилпіролідин або тетраметилсечовина, або аліфатичні нітрили, такі як ацетонітрил або пропіoнітрил, і суміші вищевказаних розчинників. Для реакції на стадії ii), процедуру звичайно ініціюють шляхом завантаження сполуки формули VI, приготовленої на стадії i) способу відповідно до винаходу, або реакційної суміші, отриманої на стадії i), необов'язково після часткового або повного обміну розчинника, використовуваного на стадії i), у підходящому органічному розчиннику й додаючи до них кислоту й воду. Можна вводити воду, необхідну для здійснення реакції, за допомогою органічного розчинника. Також представляється можливим вводити воду, необхідну для здійснення реакції, за допомогою кислоти, наприклад, у формі водного розчину кислоти або у формі гідрату кислоти. Реакцію на стадії ii) способу відповідно до винаходу звичайно здійснюють при температурах в інтервалі від 0 до 150 °C, особливо в інтервалі від 20 до 110 °C. Час реакції звичайно знаходиться в інтервалі від 0,1 години до 15 годин. На стадії ii), бажану 1,3-піразольну сполуку I одержують із високим виходом при високої селективності, тобто з дуже низькою або невизначуваною часткою небажаного 1,5-ізомеру I'. Наприклад, молярне співвідношення 1,3-ізомеру формули I до 1,5-ізомеру формули I' звичайно становить принаймні 20:1, часто принаймні 50:1, зокрема принаймні 80:1 і особливо принаймні 7 UA 106470 C2 5 10 15 100:1. Бажана 1,3-піразольна сполука I може бути виділена з реакційної суміші за допомогою загальноприйнятих методів, шляхом осадження, кристалізації або дистиляції, або можна піддавати додаткової обробки для перетворення продуктів у формі реакційної суміші. Сполуки формули II, використовувані в процесі відповідно до винаходу, є відомими, наприклад, з рівня техніки, процитованого в даній заявці, або можуть бути отримані аналогічно до методів, описаних у даній заявці. 3 3a Сполуки формули II, де Y являє собою кисень і R являє собою OR групу, є відомими, наприклад, з US 5,498,624, JACS, 73, 3684, WO 92/12970, Chem. Ber. 1982, 115, 2766, Journal of Medicinal Chemistry, 2000, том 43, № 21 і з більш ранніх заявок PCT/EP2007/061833 і EP 07109463.5, або можуть бути отримані аналогічно до способів, описаних у цих джерелах, 2 2a наприклад, шляхом взаємодії акрилових сполук формули IX (R =CN або CO2R ) з ацилгалогенідами (Q = галоген) або ацилангідридами (Q=OC(O)X) формули X згідно з 2 2a наступною схемою 2a, або шляхом взаємодії ß-кето ефірів формули XI (R =CO2R ) або ß-кето 2 нітрилів XI (R =CN) з ефірами орто-мурашиної кислоти формули XII згідно з наступною схемою 2b. 2 20 25 3a На схемах 2a і 2b, змінні R , R і X кожний має значення, вказані вище. Q особливо являє собою фтор, хлор або OC(O)X радикал в X має одне з визначень, вказаних вище. 3 3b 3c Сполуки формули II, де Y являє собою кисень і R являє собою NR R групу, є відомими, наприклад, з WO 03/051820, WO 2005/042468 і з більш ранніх заявок PCT/EP2007/064390, EP 08155612,8 і EP 08155611.0 або можуть бути отримані аналогічно до способів, описаних у цих 2 2a джерелах. Сполуки формули II, де R =CN або CO2R , можуть бути отримані, наприклад, шляхом взаємодії відповідних 3-аміноакрилових сполук XIII з ацильними сполуками формули X, описаними на схемі 2, шляхом реакції, представленої на схемі 3. y1 30 y2 Сполуки формули II, де Y являє собою [NR R ]Z групу (сполуки IІb), можуть бути отримані, наприклад, за допомогою способів, описаних в WO 2008/022777 і більш ранній заявці EP y1 y2 07110397.2. Відповідно до цього, II, де Y являє собою [NR R ]Z групу, звичайно одержують шляхом взаємодії α,α-дифторамінів формули XIV з олефіновою сполукою формули XV у присутності кислотою Л'юіса, такої як MgF2, BF3, BCl3, AlCl3, AlF3, ZnCl2, PF5, SbF5, BiCl3, GaCl3, SnCl4, або SiCl4, шляхом способу, представленого на схемі 4. 8 UA 106470 C2 5 10 У цьому контексті, було виявлено, що є корисним не виділяти сполуку імінію IІb, отриману шляхом реакції XIV з XV, а замість цього використовувати отриману реакційну суміш, необов'язково після видалення частини розчинника, у реакції з гідразоном формули III. Для більш докладних описів одержання сполук IІb, можна привести посилання на розкриття WO 2008/022777 і більш ранню заявку WO 2008/152138 (раніше EP 07110397.2), які в такий спосіб включені в дану заявку як посилання. Гідразонові сполуки формули III, використовувані відповідно до винаходу, відомі або можуть бути отримані за допомогою способу, відомого per se, шляхом взаємодії карбонільної сполуки формули IV із заміщеною гідразиновою сполукою формули V. 1 15 20 25 30 35 40 4 5 У формулах IV і V, R , R і R кожний має значення, вказані для формули III і VI. Сполуки IV і V можуть бути перетворені в гідразон III за допомогою способу, відомого per se. Карбонільну сполуку IV піддають реакції з гідразиновою сполукою V звичайно при температурах в інтервалі від 10 до 180 °C, особливо в інтервалі від 20 до 150 °C. Для взаємодії, сполуки IV і V переважно використовують у співвідношенні, яке відповідає стехіометрії реакції, але також можна відступати від стереохімії. Як правило, молярне співвідношення сполуки IV до сполуки V знаходиться в інтервалі від 1,5:1 до 1:1,5, часто в інтервалі від 1,2:1 до 1:1,2 і особливо в інтервалі від 1,1:1 до 1:1,1. Звичайно, IV взаємодіє з V в інертному органічному розчиннику. Прикладами інертних органічних розчинників є, зокрема, апротонні органічні розчинники, такі як ароматичні вуглеводні й галовуглеводні, наприклад, бензол, толуол, ксилоли, ізопропілбензол, хлорбензол і третбутилбензол, циклічні або ациклічні прості ефіри, такі як діетиловий ефір, діізопропіловий ефір, трет-бутил метиловий ефір (MTBE), трет-бутил етиловий ефір, тетрагідрофуран (ТГФ) або діоксан, нітрили, такі як ацетонітрил і пропіoнітрил, аліфатичні галовуглеводні, такі як дихлорметан, дихлоретан, трихлорметан і їх суміші. Для взаємодії сполук формули IV з гідразиновою сполукою формули V, методика звичайно полягає в об'єднанні сполуки формули IV, переважно у формі розчину в одному з вищевказаних інертних органічних розчинників, з гідразиновою сполукою V, переважно у вигляді розчину у воді. Сполуки IV і V можна поєднувати у вищевказаних температурних діапазонах. Часто, методику здійснюють таким чином, що сполуки IV і V поєднують при температурах в інтервалі від 0 до 50 °C, особливо від 10 до 50 °C, і потім реакційну суміш нагрівають до бажаної температури. Час реакції звичайно знаходиться в інтервалі від 0,5 години до 8 годин. У цілому, було виявлено, що сприятливо видаляти воду, утворену при здійсненні реакції, або воду, введену шляхом застосування водного розчину гідразину V, наприклад, шляхом дистиляції, відділення води, за допомогою азеотропуючого засобу, шляхом розділення фаз, іншого типу осушення або комбінації цих методів. Гідразон може бути виділений з реакційної суміші, отриманої шляхом взаємодії IV з V або його можна використовувати як реакційну суміш на наступній стадії, тобто на стадії I способу відповідно до винаходу. Даний винахід також стосується способу одержання сполуки загальної формули Ia 1 де X і R кожний має значення, вказані вище, який включає наступні стадії 9 UA 106470 C2 5 10 15 20 25 30 35 40 45 50 55 60 a) забезпечення піразольної сполуки формули I за допомогою способу згідно зі способом, описаним у даній заявці, б) перетворення сполуки I в 1,3-заміщену піразолкарбонову кислоту формули Ia. Перетворення звичайне здійснюють шляхом гідролізу. Таким чином, кращий варіант здійснення винаходу стосується способу, який включає наступні стадії: a) надання сполуки формули I за допомогою способу відповідно до винаходу, як описано, і б) гідроліз сполуки I з утворенням 1,3-заміщеної піразол-4-ілкарбонової кислоти формули Ia. Гідроліз можна здійснювати в умовах кислотного каталізу або лужного каталізу або іншим чином. Сполуку I можна використовувати як таку, тобто після виділення. Проте, також представляється можливим використовувати реакційну суміш, отриману на стадії a), для гідролізу без додаткового очищення, необов'язково після видалення летких складових, таких як розчинники. Для лужного гідролізу сполуки I, сполуку формули I звичайно обробляють гідроксидом лужного металу, таким як гідроксид натрію, гідроксид калію або гідроксид літію, переважно з водним розчином гідроксиду лужного металу, особливо водним розчином NaOH або водним розчином KOH, до повного гідролізу складного ефіру, переважно при нагріванні. При лужному гідролізі, молярне співвідношення сполуки формули I до основи звичайно знаходиться в інтервалі від 1,2:1 до 1:10 і особливо є приблизно еквімолярним (тобто знаходиться в інтервалі від 1,1:1 до 1:1,5), але також можуть бути сприятливими відносно великого надлишок основи, наприклад, аж до 5 моль на моль сполуки I. Звичайно, лужний гідроліз здійснюють у розріджувачі або розчиннику. Підходящими розріджувачами або розчинниками є вода, а також органічні розчинники, які стійкі до дії лугу, і їх суміші з водою. Прикладами стабільних до дії лугу органічних розчинників є, зокрема, вищевказані C1-С4-алканоли й вищевказані ациклічні прості ефіри й циклічні прості ефіри. Кращим є здійснення гідролізу у водній фазі, тобто у воді або в суміші води з одним з вищевказаних органічних розчинників, у цьому випадку вміст органічного розчинника у водній фазі звичайно не перевищує в більшості випадків 30 % за об'ємом, виходячи із загальної кількості води й органічного розчинника. Кращим є здійснення лужного гідролізу при температурах від 20 до 100 °C. Як правило, верхньою температурною межею є точка кипіння використовуваного розчинника, коли реакцію здійснюють при атмосферному тиску. Температуру реакції 100 °C і особливо 90 °C переважно не перевищують. Проте, у кращому варіанті здійснення винаходу, лужний гідроліз здійснюють при температурі, нижче за точку кипіння спиртового компонента, наприклад, при температурах в інтервалі від 40 до < 80 °C, особливо в інтервалі від 50 до 75 °C, особливо, якщо здійснюють 1 обробку зі сполуки загальної формули I, де R являє собою метил або етил. Проте, більш високі температури також є можливими. Наприклад, в іншому варіанті здійснення лужного гідролізу, застосовують температуру вище точки кипіння спиртового компонента складного ефіру. Наприклад, після цього будуть здійснювати гідроліз переважно при температурі принаймні 80 °C, наприклад, в інтервалі від 80 до 100 °C, наприклад, якщо здійснюють обробку зі сполуки 1 загальної формули I, де R являє собою етил. Час реакції в цьому випадку залежить від температури реакції, концентрації й стабільності конкретної складноефірного зв'язку. Як правило, умови реакції вбирають таким чином, щоб час реакції знаходився в інтервалі від 1 до 12 годин, особливо в інтервалі від 2 до 8 годин. В особливо кращому варіанті здійснення винаходу, для одержання сполуки загальної 2 2a формули Ia, піразольну сполуку I, отриману на стадії a), у випадку, коли R являє собою CO2R або CN, без проміжного виділення, сприятливо разом з органічним розчинником, будуть піддавати реакції з водним розчином гідроксиду лужного металу. Утворену сіль лужного металу піразолкарбонової кислоти Ia одержують у вигляді водної фази додатково до органічної фази, 4 5 яку можна вилучити шляхом розділення фаз. Таким чином, карбонільна сполука IV (R R C=O) 4 вивільняється знову в реакції сполук II і III на стадії ii), особливо, коли R являє собою необов'язково заміщений феніл, може бути вилучена з органічної фази. Таким чином, можливе повторне використання карбонільної сполуки IV у реакційному процесі для утворення гідразону (необов'язково після здійснення додаткової обробки, наприклад, шляхом дистиляції). Також можна здійснювати повторне застосування використовуваного органічного розчинника. Водна фаза, отримана при розділення фаз, містить сіль лужного металу 1,3-заміщеної кислоти Ia звичайно в розчиненій формі й. Після цього сіль може бути перетворена у вільну кислоту Ia шляхом підкислення розчину, як описано вище. Як правило, кислоту Ia одержують у вигляді твердої речовини й вона може бути виділена шляхом фільтрації й необов'язково висушена. У цій процедурі, одержують 1,3-заміщені піразолкарбонові кислоти з високою чистотою й з дуже гарним виходом. Вихід, виходячи з використовуваної сполуки II, звичайно становить принаймні 10 UA 106470 C2 5 10 15 20 25 30 80 % і особливо принаймні 85 %. Кислотний гідроліз сполуки I можна здійснювати аналогічно до відомих гідролізів кислотних складних ефірів, тобто в присутності каталітичних або стехіометричних кількостей кислоти й води (див., наприклад, J. March, Advanced Organic Chemistry, 2-е вид., 334-338, Mcgraw-hill, 1977 і література, процитована в цьому джерелі). Часто, реакцію будуть здійснювати в суміші води й апротонного органічного розчинника, наприклад, простого ефіру, як описано вище. Прикладами кислот є гідрогалогенові кислоти, сірчана кислота, органічні сульфонові кислоти, такі як птолуолсульфонова кислота, метансульфонова кислота, фосфорна кислота й кислотних аніонообмінники, та інші. Підходящими каталізаторами для гідролізу також є йодиди лужних металів, такі як йодид літію, триметилйодсилан або суміші триметилхлорсилану з йодидами лужних металів, такими як йодид літію, натрію або калію. Після цього виділяють кислоту Ia за допомогою загальноприйнятих процесів поділу, наприклад, осадження шляхом доведення значення pH або екстракції. Піразольні сполуки формули I, особливо піразолкарбонові кислоти формули Ia, є цінними проміжними сполуками для одержання активних компонентів, які мають 1,3-заміщений піразольний радикал, особливо для одержання активних фунгіцидних компонентів формули VII, описаних нижче: 1 де R і X кожний має одне зі значень, вказаних у пункті 1; M являє собою тієніл або феніл, який може нести галогеновий замісник; Q являє собою простий зв'язок, циклопропілен, конденсоване біцикло[2,2,1]гептанове або біцикло[2,2,1]гептенове кільце; і 6 R являє собою водень, галоген, C1-С4-алкіл, C1-С4-галоалкокси, одно- - тризаміщений феніл, де замісники кожний незалежно вибирають із галогену й трифторметилтіо, або циклопропіл. Таким чином, даний винахід також стосується способу одержання сполуки формули VII, який включає наступні стадії: a) забезпечення піразольної сполуки формули I за допомогою способу відповідно до винаходу; б) перетворення сполуки I в 1,3-заміщену піразолкарбонову кислоту формули Ia, 1 35 де X і R кожний має значення, вказані вище; в) необов'язкове перетворення сполуки Ia у її галоїдангідрид; і г) взаємодію сполуки формули Ia або її галоїдангідриду з аміновою сполукою формули VIII, 6 40 45 де M, Q і R кожна має значення, вказані для формули VII. Підходящі методи одержання карбонових кислот і реакцій карбонових кислот або карбонільних галогенідів з ароматичними амінами відомі фахівцеві в даній галузі техніки, наприклад, з рівня техніки, процитованого в даній заявці (див. US 5,498,624, EP 545099 A1, DE 19531813 A1, EP 589301 A1, DE 19840322 A1, WO 92/12970, WO 03/066610, WO 2006/024389, WO 2007/003603, WO 2007/006806) і з J. March, Advanced Organic Chemistry, 3-є вид. J. Wiley і Sons, New York 1985, стор. 370-386 і літературу, процитовану в цьому джерелі, а також Organikum, 21-е вид., Wiley-vch, Weinheim 2001, стор. 481-484 і літературу, процитовану в цьому джерелі, і може застосовуватися для одержання відповідно до винаходу сполук VII шляхом взаємодії піразолкарбонової кислоти Ia або її галоїдангідриду з аніліновою сполукою VIII 11 UA 106470 C2 5 10 15 20 25 30 35 40 45 50 55 60 аналогічним образом. Часто, процедуру здійснюють спочатку шляхом перетворення піразолкарбонової кислоти формули Ia у її галоїдангідрид, наприклад, її хлорангідрид, і потім шляхом взаємодії галоїдангідриду з аміновою сполукою формули VIII. Піразолкарбонову кислоту можна перетворювати в її хлорангідрид аналогічно до стандартних процесів органічної хімії, наприклад, шляхом взаємодії з тіонілхлоридом. Наступну реакцію галоїдангідриду з аміновою сполукою VIII звичайно здійснюють у присутності допоміжної основи, наприклад, третинного аміну. Альтернативно, піразолкарбонову кислоту формули Ia також можна піддавати прямій реакції з аміновою сполукою VIII, переважно в присутності дегідруючого засобу, такого як 1,1'карбонілдіімідазол, біс (3-оксазолідиніл)фосфорил хлорид, N,N'-дициклогексилкарбодіімід або N-(3-диметиламінопропіл)- N'-етилкарбодіімід у присутності допоміжної основи, наприклад, третинного аміну, одержуючи сполуку VII, як описано, наприклад, у більш ранній патентній заявці PCT/EP2007/064390, розкриття якої в такий спосіб повністю включене в дану заявку як посилання. Прикладами сполук формули VII, які можна одержати за допомогою способів, описаних у даній заявці, є: N-(2-біциклопропіл-2-іл-феніл)-3-дифторметил-1-метилпіразол-4-ілкарбоксамід, N-(3',4',5'трифторбіфеніл-2-іл)-1,3-диметилпіразол-4-ілкарбоксамід, N-(3',4',5'-трифторбіфеніл-2-іл)-3фторметил-1-метилпіразол-4-ілкарбоксамід, N-(3',4',5'-трифторбіфеніл-2-іл)-3-(хлорфторметил)1-метилпіразол-4-ілкарбоксамід, N-(3',4',5'-трифторбіфеніл-2-іл)-3-дифторметил-1метилпіразол-4-ілкарбоксамід, N-(3',4',5'-трифторбіфеніл-2-іл)-3-(хлордифторметил)-1метилпіразол-4-ілкарбоксамід, N-(3',4',5'-трифторбіфеніл-2-іл)-1-метил-3-трифторметилпіразол4-ілкарбоксамід, N-(2',4',5'-трифторбіфеніл-2-іл)-1,3-диметилпіразол-4-ілкарбоксамід, N-(2',4',5'трифторбіфеніл-2-іл)-3-фторметил-1-метилпіразол-4-ілкарбоксамід, N-(2',4',5'-трифторбіфеніл2-іл)-3-(хлорфторметил)-1-метилпіразол-4-ілкарбоксамід, N-(2',4',5'-трифторбіфеніл-2-іл)-3дифторметил-1-метилпіразол-4-ілкарбоксамід, N-(2',4',5'-трифторбіфеніл-2-іл)-3(хлордифторметил)-1-метилпіразол4-ілкарбоксамід, N-(2',4',5'-трифторбіфеніл-2-іл)-1-метил-3трифторметилпіразол4-ілкарбоксамід, N-(3',4'-дихлор-3-фторбіфеніл-2-іл)-1-метил-3трифторметил-1H-піразол-4-ілкарбоксамід, N-(3',4'-дихлор-3-фторбіфеніл-2-іл)-1-метил-3дифторметил-1H-піразол-4-ілкарбоксамід, N-(3',4'-дифтор-3-фторбіфеніл-2-іл)-1-метил-3трифторметил-1H-піразол-4-карбоксамід, N-(3',4'-дифтор-3-фторбіфеніл-2-іл)-1-метил-3дифторметил-1H-піразол-4-ілкарбоксамід, N-(3'-хлор-4'-фтор-3-фторбіфеніл-2-іл)-1-метил-3дифторметил-1H-піразол-4-ілкарбоксамід, N-(3',4'-дихлор-4-фторбіфеніл-2-іл)-1-метил-3трифторметил-1H-піразол-4-ілкарбоксамід, N-(3',4'-дифтор-4-фторбіфеніл-2-іл)-1-метил-3трифторметил-1H-піразол-4-ілкарбоксамід, N-(3',4'-дихлор-4-фторбіфеніл-2-іл)-1-метил-3дифторметил-1H-піразол-4-ілкарбоксамід, N-(3',4'-дифтор-4-фторбіфеніл-2-іл)-1-метил-3дифторметил-1H-піразол-4-ілкарбоксамід, N-(3'-хлор-4'-фтор-4-фторбіфеніл-2-іл)-1-метил-3дифторметил-1H-піразол-4-ілкарбоксамід, N-(3',4'-дихлор-5-фторбіфеніл-2-іл)-1-метил-3трифторметил-1H-піразол-4-ілкарбоксамід, N-(3',4'-дифтор-5-фторбіфеніл-2-іл)-1-метил-3трифторметил-1H-піразол-4-ілкарбоксамід, N-(3',4'-дихлор-5-фторбіфеніл-2-іл)-1-метил-3дифторметил-1H-піразол-4-ілкарбоксамід, N-(3',4'-дифтор-5-фторбіфеніл-2-іл)-1-метил-3дифторметил-1H-піразол-4-ілкарбоксамід, N-(3',4'-дихлор-5-фторбіфеніл-2-іл)-1,3-диметил-1Hпіразол-4-ілкарбоксамід, N-(3'-хлор-4'-фтор-5-фторбіфеніл-2-іл)-1-метил-3-дифторметил-1Hпіразол-4-ілкарбоксамід, N-(4'-фтор-4-фторбіфеніл-2-іл)-1-метил-3-трифторметил-1H-піразол-4ілкарбоксамід, N-(4'-фтор-5-фторбіфеніл-2-іл)-1-метил-3-трифторметил-1H-піразол-4ілкарбоксамід, N-(4'-хлор-5-фторбіфеніл-2-іл)-1-метил-3-трифторметил-1H-піразол-4ілкарбоксамід, N-(4'-метил-5-фторбіфеніл-2-іл)-1-метил-3-трифторметил-1H-піразол-4ілкарбоксамід, N-(4'-фтор-5-фторбіфеніл-2-іл)-1,3-диметил-1H-піразол-4-ілкарбоксамід, N-(4'хлор-5-фторбіфеніл-2-іл)-1,3-диметил-1H-піразол-4-ілкарбоксамід, N-(4'-метил-5-фторбіфеніл-2іл)-1,3-диметил-1H-піразол-4-ілкарбоксамід, N-(4'-фтор-6-фторбіфеніл-2-іл)-1-метил-3трифторметил-1H-піразол-4-ілкарбоксамід, N-[2-(1,1,2,3,3,3-гексафторпропокси)-феніл]-3дифторметил-1-метил1H-піразол-4-ілкарбоксамід, N-[4"-(трифторметилтіо)біфеніл-2-іл]-3дифторметил-1-метил-1H-піразол- 4-илкарбоксамід, N-[4'-(трифторметилтіо)біфеніл-2-іл]-1метил-3-трифторметил-1-метил-1H-піразол-4-ілкарбоксамід, 3-(дифторметил)-1-метил-N[1,2,3,4-тетрагидро-9-(1-метилетил)-1,4-метанонафталін-5-іл]-1H-піразол-4-ілкарбоксамід, N-(3'хлор-5-фторбіфеніл-2-іл)-3-(дифторметил)-1-метилпіразол-4-ілкарбоксамід, N-(4'-хлор-5фторбіфеніл-2-іл)-3-(дифторметил)-1-метилпіразол-4-ілкарбоксамід, N-(4'-хлорбіфеніл-2-іл)-3(дифторметил)-1-метилпіразол-4-ілкарбоксамід, N-(4'-бромбіфеніл-2-іл)-3-(дифторметил)-1метилпіразол-4-ілкарбоксамід, N-(4'-йодбіфеніл-2-іл)-3-(дифторметил)-1-метилпіразол-4ілкарбоксамід, N-(3',5'-дифторбіфеніл-2-іл)-3-(дифторметил)-1-метилпіразол-4-ілкарбоксамід, N 12 UA 106470 C2 5 10 15 (2-хлор-4-фторфеніл)3-(дифторметил)-1-метилпіразол-4-ілкарбоксамід, N-(2-бром-4фторфеніл)-3-(дифторметил)-1-метилпіразол-4-ілкарбоксамід, N-(2-йод-4-фторфеніл)-3(дифторметил)-1-метилпіразол-4-ілкарбоксамід і N-[2-(1,3-диметилбутил)феніл]-1,3-диметил-5фтор-1H-піразол-4-ілкарбоксамід. Приклади, представлені нижче, служать для подальшої ілюстрації винаходу. Приклад одержання 1: бензальдегід метилгідразон 18,4 г (0,4 моль) метилгідразину спочатку завантажували в 248,7 г діетилового ефіру. При 22-26 °C, 42,4 г (0,4 моль) бензальдегіду додавали по краплях протягом 1,75 годин. Потім реакційну суміш перемішували при температурі флегми протягом 5 годин. Залишок, отриманий після відгону розчинника, ресуспендували в діетиловому ефірі й розчин висушували над сульфатом натрію. Після висушування, розчин концентрували при зниженому тиску й отриманий залишок дистилювали при 78 °C/0,5-1 мбар. 1 H ЯМР (500 МГц, CdCl3): δ (част. на млн.) = 2,85 (s, 3H), 5,55 (Br., 1H), 7,2 (1H), 7,3 (2H), 7,45 (1H), 7,55 (2H) Аналогічно до методу із прикладу одержання 1, одержували наступні гідразони: Пр. одержання 2 3 4 5 6 7 20 25 30 35 40 45 50 Гідразон o-хлорбензиліден метилгідразон п-метоксибензиліден метилгідразон п-метилбензиліден метилгідразон o-нітробензиліден метилгідразон п-нітробензиліден метилгідразон циклогексиліден метилгідразон Приклад 1: Одержання етил 3-дифторметил-1-метил-1H-піразол-4-карбоксилату й наступний гідроліз до 3-дифторметил-1-метил-1H-піразол-4-карбонової кислоти 1.1. Етил 4,4-дифтор-2-[1-{N-метил-N'-[1-фенілметиліден]гідразино}-метиліден]-3оксобутират 13,8 г (0,1 моль) бензальдегіду метилгідразону й 62,2 г толуолу змішували з 23,7 г (0,1 моль) етил 2-етоксиметилен-4,4-дифтор-3-оксобутирату, у результаті цього внутрішня температура підвищувалася до 35 °C. Реакційну суміш перемішували при температурі флегми протягом 1,25 годин і потім перемішували при 25 °C протягом 15 годин. Осаджену тверду речовину відфільтровували з вакуумним фільтром і два рази промивали з 25 м; кожного разу толуолу. Після висушування при 40 – 50 °C при зниженому тиску, одержували 23 г продукту. Чистота згідно із ВЕРХ: 99,2 % поверхні MС: Моноізотопна відносна молекулярна маса m/z=310 1 H ЯМР (500 МГц, ДМСО-d6): E/Z ізомерна суміш (прибл. 2:1) виходячи з C=C подвійного зв'язку: δ (част. на млн.) = 1,07 і 2,2 (3H), 3,55 і 3,62 (3H), 4,08 - 4,2 (2H), 6,15 і 6,7 (t, 1H, -CHF2-), 7,4 – 7,75 (5H), 7,93 (1H), 8,05 і 8,13 (1H) 13 C ЯМР: 190,1, 181,4, 166,6, 164,7, 148,9, 146,1, 145,5, 133,9, 130,3, 128,8, 127,7, 110,4, 108,5, 107,0, 99,23, 60,46, 59,66, 39,43, 13,81. 1.2. 3-Дифторметил-1-метил-1H-піразол-4-карбонова кислота 20 г (0,065 моль) етил 4,4-дифтор-2-[1-{N-метил-N'-[1-фенілметиліден]гідразино}метиліден]3-оксобутирату зі стадії 1.1. спочатку завантажували разом з 252,7 г етанолу в атмосфері азоту при 25 °C. Протягом 5 хвилин, по краплях додавали 14,8 г (0,13 моль) соляної кислоти (32 %). Суспензію нагрівали до 45 °C і перемішували при температурі навколишнього середовища додатково протягом 30 хвилин. Після цього, одержували прозорий жовтий розчин. Розчин (285 г) містив 4,12 % за вагою бажаного етил 3-дифторметил-1-метил-1H-піразол-4-карбоксилату (ВЕРХ аналіз, визначення кількості із внутрішнім стандартом), що відповідає виходу 89,2 %. Пропорція ізомерного етил 5-дифторметил-1-метил-1H-піразол-4-карбоксилату становила тільки 0,05 % за вагою (співвідношення ізомерів прибл. 82:1). При 25-27 °C, 104 г (0,26 моль) 10 % розчину гідроксиду натрію потім дозували протягом 5 хвилин і промивали за допомогою 50 мл води. Реакційну суміш перемішували при 60 °C протягом 2,5 годин. При 58 °C/370 мбар, 320 г розчинника (етанол/вода) відганяли, після цього залишався двофазний залишок від перегонки. Після розведення за допомогою 100 мл толуолу, фази розділяли. Толуольна верхня фаза містила головним чином вивільнений бензальдегід. Нижня водна фаза містила, як основний компонент, натрієву сіль бажаної 3-дифторметил-1метил-1H-піразол-4-карбонової кислоти. Вилучену водну фазу підкисляли за допомогою 29,7 г (0,26 моль) концентрованої соляної кислоти (ph 200: 1). Потім дозували 168,3 г (0,3 моль) 10 % розчину гідроксиду калію й реакційну суміш перемішували при 60 °C протягом 3 годин. Після охолодження до 25 °C, фази розділяли. Толуольна верхня фаза містила головним чином вивільнений бензальдегід. Нижня водна фаза містила, як основний компонент, калієву сіль бажаної 3-дифторметил-1-метил-1H-піразол-4карбонової кислоти. Толуольну фазу ще два рази промивали кожного разу за допомогою 50 г води. Об'єднані водні фази підкисляли при 55 °C за допомогою 66 г (0,579 моль) концентрованої соляної кислоти (32 %) (ph 92:1). 168,3 г 10 % розчину гідроксиду калію (0,3 моль) додавали до розчину й суміш перемішували при 60 °C протягом 3 годин. Після охолодження до 25 °C, фази розділяли. Толуольна верхня фаза містила головним чином вивільнений бензальдегід. Нижня водна фаза містила, як основний компонент, калієву сіль бажаної 3-дифторметил-1-метил-1H-піразол-4карбонової кислоти. Толуольну фазу ще два рази промивали кожного разу із 50 г води. Об'єднані водні фази підкисляли при 55 °C за допомогою 66 г (0,579 моль) конц. соляної кислоти (32 %) (ph 175:1). До розчину додавали 202 г 10 % розчину гідроксиду калію (0,361 моль) і суміш перемішували при 60 °C протягом 3 годин. Після охолодження до 25 °C, фази розділяли. Толуольна верхня фаза містила головним чином вивільнений бензальдегід. Нижня водна фаза містила, як основний компонент, калієву сіль вказаної в заголовку сполуки. Толуольну фазу ще два рази промивали кожного разу за допомогою 50 г води. Об'єднані водні фази підкисляли при 55 °C за допомогою 80 г (0,7 моль) концентрованої соляної кислоти (32 %) (ph < 2), що осаджувало бажану піразолкарбонову кислоту. Тверді речовини відфільтровували при 3 °C і промивали за допомогою 160 г холодної води. Після висушування (60 °C, 20 мбар), одержували 34,6 г 3-дифторметил-1-метил-1H-піразол-4-карбонову кислоту із чистотою 99 % за вагою. Вихід, заснований на молярній кількості використовуваного етил 2-етоксиметилен-4,4-дифтор-3оксобутирату, становив 81 %. Небажаний 1,5-ізомер більше не піддавався виявленню. Приклад 5: Одержання метил 3-дифторметил-1-метилпіразол-4-карбоксилату з 1,1,2,2тетрафторетилдиметиламіну, метил 3-метоксіакрилату й N-метилбензальдегід гідразону До розчину 96 % чистого 1,1,2,2-тетрафторетилдиметиламіну (48,1 г, 318 ммоль) в ацетонітрилі (97 г) в атмосфері аргону по краплях додавали, при 25 °C, 38,4 г (270 ммоль) BF3 ефірату. Після закінчення додавання, суміш нагрівали в колбі зі зворотним холодильником (70 °C). При цій температурі, до реакційної суміші по краплях додавали розчин 95 % чистого метил 3-метоксіакрилату (33,1 г, 271 ммоль) в ацетонітрилі (61 г) протягом 1 години. Після перемішування в колбі зі зворотним холодильником протягом 20 годин, реакційну суміш охолоджували до 25 °C і додавали 99,8 г 38 % розчину N-метилбензальд гідразону в толуолі (287 ммоль) при 25 °C протягом 15 хвилин. Після додаткової фази перемішування протягом 0,5 годин, додавали 10,4 г 50 % за вагою розчину води в ацетонітрилі (289 ммоль). Потім додавали 32,7 г (287 ммоль) 32 % соляної кислоти й суміш нагрівали в колбі зі зворотним холодильником при перемішуванні протягом 3 годин. Після цього, суміш охолоджували до 25 °C і додавали 100 мл води. Органічну фазу видаляли; водну фазу екстрагували один раз за допомогою 100 мл метиленхлориду. Об'єднані органічні фази промивали один раз за допомогою 100 мл води. Одержували 391 г органічної фази. Аналіз за допомогою газової хроматографії показав, що небажаний 1,5-ізомер (метил 5-дифторметил-1-метилпіразол-4-карбоксилат) був виявлений тільки в слідових кількостях додатково до метил 3-дифторметил-1-метилпіразол-4карбоксилату. Співвідношення ізомерів склало 141: 1. Органічну фазу концентрували. Одержували 63,6 г залишку, який, додатково до бензальдегіду, відповідно до кількісного ВЕРХ аналізу, містив 71,7 % за вагою метил 3-дифторметил-1-метилпіразол-4-карбоксилату. Це відповідало 89 % виходу, виходячи з метил 3-метоксіакрилату. Бензальдегід легко може бути вилучений шляхом фракціонованої дистиляції або після гідролізу вказаної в заголовку сполуки, як описано в прикладах 1-4. Приклад 6: Одержання 3-дифторметил-1-метил-1H-піразол-4-карбонової кислоти з бензальдегіду, водного розчину метилгідразину й етил етоксиметилен-4,4-дифтор-3оксобутирату без виділення/очищення проміжних сполук (метод в одній посудині) 108,2 г (0,816 моль) розчину метилгідразину (34,7 % за вагою метилгідразину у вигляді) і 560 г толуолу спочатку завантажували в атмосфері азоту в посудину, що перемішується. При 2540 °C, додавали по краплях 85,7 г (0,8 моль) бензальдегіду (99 %) протягом 10 хвилин. Реакційну суміш перемішували при 40 °C протягом 3 годин і при 60 °C протягом 3 годин. Після 15 UA 106470 C2 5 10 15 20 25 30 35 40 45 50 55 60 цього, толуол/воду відганяли при 70 °C/150 мбар, при цьому коду з конденсованого дистиляту видаляли на роздільнику фаз і толуольну фазу повторно використовували в реакторі. Після відділення води, залишалося 656 г прозорого розчину бензальдегіду метилгідразону в толуолі. До цього розчину по краплях додавали, при 20-30 °C протягом 1 години, 189,5 г (0,8 моль) етил 2-етоксиметилен-4,4-дифтор-3-оксобутирату (чистота 93,7 %) у вигляді розчину в 189,5 г толуолу. Суміш перемішували при 25 °C додатково протягом 18 годин. Утворювалася суспензія (осаджувався етил 4,4-дифтор-2-[1-{N-метил-N'-[1-фенілметиліден]гідразино}метиліден]- 3оксобутират). 6,2 г моногідрату п-толуолсульфонової кислоти (0,032 моль) додавали при 10 °C до суспензії, яку перемішували при 50 °C протягом 1 години, при цьому утворювався прозорий розчин. Згідно із ВЕРХ аналізом (визначення кількості із зовнішнім стандартом), концентрація бажаного етил 3-дифторметил-1-метил-1H-піразол-4-карбоксилату становила 11,4 % за вагою. До розчину додавали 672 г 10 % розчину гідроксиду калію (1,2 моль) і суміш перемішували при 60 °C протягом 3 годин. Після охолодження до 25 °C, фази розділяли. Толуольна верхня фаза містила головним чином вивільнений бензальдегід. Нижня водна фаза містила, як основний компонент, калієву сіль бажаної 3-дифторметил-1-метил-1H-піразол-4-карбонової кислоти. Толуольну фазу ще два рази промивали кожного разу за допомогою 200 г води. Об'єднані водні фази підкисляли при 55 °C за допомогою 265 г (2,32 моль) конц. соляної кислоти (32 %) (ph < 2), що осаджувало бажану піразолкарбонову кислоту. Тверді речовини відфільтровували при 3 °C і два рази промивали, кожного разу за допомогою 265 г холодної води. Після висушування (60 °C, 20 мбар), одержували 121,8 г 3-дифторметил-1-метил-1Hпіразол-4-карбонової кислоти із чистотою 99,5 % за вагою. Вихід, заснований на молярній кількості використовуваного бензальдегіду або етил 2-етоксиметилен-4,4-дифтор-3оксобутирату, становив 86,1 %. Небажаний ізомер карбонової кислоти більше не піддавався виявленню. Приклад 7: Одержання 3-дифторметил-1-метил-1H-піразол-4-карбонової кислоти з бензальдегіду, водного розчину метилгідразину й етил етоксиметилен 4,4-дифтор-3оксобутирату без виділення/очищення проміжних сполук (метод в одній посудині) 368,3 г (2,78 моль) розчину метилгідразину (34,7 % за вагою метилгідразину у вигляді) і 1888 г толуолу спочатку завантажували в посудину, що перемішується, в атмосфері азоту. Реакційну суміш нагрівали до 40 °C. При температурі від 40 °C до 60 °C, до нього додавали 300,9 г (2,81 моль) бензальдегіду (99 %) протягом 30 хвилин. Реакційну суміш перемішували при 60 °C протягом 4 годин. Після охолодження до 25 °C, нижню водну фазу видаляли. З органічної фази, що залишилася в реакторі, близько 99 г толуолу/води відганяли (азеотропне сушіння) при температурі від 25 до 45 °C і тиску 100 мбар. Після дистиляції, знову додавали 99 г свіжого толуолу. При цьому залишалося близько 2282 г прозорого розчину бензальдегіду метилгідразону в толуолі. 635,6 г (2,70 моль) етил 2-етоксиметилен-4,4-дифтор-3-оксобутирату (94,2 % за вагою) додавали до цього розчину при температурі від 25 до 30 °C протягом 2 годин, і суміш перемішували при 30 °C додатково протягом 1 години. Отриманий розчин містив 27,8 % за вагою бажаного етил 4,4-дифтор-2-[1-{N-метил-N'-[1-фенілметиліден]гідразино}-метиліден]-3оксобутирату (ВЕРХ аналіз). 17,6 г (0,054 моль) сірчаної кислоти (30 % у вигляді) додавали при 40 °C до цього розчину, після цього суміш нагрівали до 60 °C протягом 30 хвилин і перемішували при температурі 60 °C протягом 2 годин. Отриманий розчин містив 16,4 % за вагою бажаного етил 3-дифторметил-1метил-1H-піразол-4-карбоксилатату (ВЕРХ аналіз, визначення кількості із зовнішнім стандартом). 1620 г (4,05 моль) 10 % за вагою розчину гідроксиду натрію дозували до розчину при 60 °C і суміш перемішували при 60 °C протягом 3 годин. Після охолодження до 25 °C, фази розділяли. Толуольна верхня фаза містила головним чином вивільнений бензальдегід. Нижня водна фаза містила, як основний компонент, натрієву сіль бажаної 3-дифторметил-1-метил-1H-піразол-4карбонової кислоти. Толуольну фазу промивали за допомогою 540 г води. До об'єднаних водних фаз додатково додавали 1125 г води. Після цього 1277,5 г (3,91 моль) сірчаної кислоти (30 % у вигляді) додавали до водного розчину карбоксилату при температурі від 53 до 56 °C протягом 30 хвилин, що осаджувало бажану піразолкарбонову кислоту. Після охолодження до 3 °C, тверді речовини відфільтровували й промивали в цілому 1880 г води (25 °C) порціями. Після висушування (60 °C, 20 мбар), одержували 402,2 г 3-дифторметил-1-метил-1H-піразол-4карбонової кислоти із чистотою 99,4 % за вагою. Вихід, заснований на молярній кількості використовуваного етил 2-етоксиметилен-4,4-дифтор-3-оксобутирату, становив 84,2 %. Небажаний ізомер карбонової кислоти більше не піддавався виявленню. 16 UA 106470 C2 5 10 15 20 25 Приклад 8: Одержання 3-дифторметил-1-метил-1H-піразол-4-карбонової кислоти з пхлорбензальдегіду, метилгідразину й етил етоксиметилен-4,4-дифтор-3-оксобутирату без виділення/очищення проміжних сполук (метод в одній посудині) 9,4 г (0,2 моль) метилгідразину (98 %) спочатку завантажували в 150,2 г толуолу. При кімнатній температурі, додавали 28,11 г (0,2 моль) п-хлорбензальдегіду протягом 10 хвилин, таким чином, що температура підвищилася до 45-50 °C. Після цього, суміш перемішували при 60 °C додатково протягом 1 години. Водну фазу видаляли. З толуольної фази, що містить гідразон, достатню кількість розчинника відганяли при 40 °C при зниженому тиску для того, щоб розчин став прозорим (видалення залишкової води). Розчин, що залишився, відновлювали з толуолом до вихідної загальної маси й охолоджували до°3 C. При температурі від 3 до 6 °C, до нього додавали 47,4 г (0,2 моль) етил 2-етоксиметилен-4,4-дифтор-3-оксобутирату (93,8 %) протягом 45 хвилин. Суміш нагрівали до 25 °C і перемішували при цій температурі додатково протягом 15 годин. При цьому утворювалася ясно-жовта суспензія (осаджувався етил 4,4-дифтор-2-[1-{N-метил-N'-[1-(4хлорфеніл)метиліден]гідразин}метиліден]-3-оксобутират. До суспензії додавали 1,8 г моногідрату п-толуолсульфонової кислоти (0,009 моль), і суміш перемішували при 70 °C протягом 1 години, при цьому утворювався прозорий розчин. До цього розчину додавали 250 г 10 % розчину гідроксиду калію (0,45 моль), і суміш перемішували при 60 °C протягом 3 годин. Після охолодження до 25 °C, фази розділяли. Толуольну фазу два рази промивали, кожного разу із 50 г води. Об'єднані водні фази підкисляли при 50 °C за допомогою 60 г (0,52 моль) концентрованої соляної кислоти (32 % за вагою) (ph < 2), що осаджувало бажану карбонову кислоту. Тверді речовини відфільтровували при 10 °C і промивали холодною водою. Після висушування (60 °C, 20 мбар), одержували 26,3 г 3-дифторметил-1-метил-1Hпіразол-4-карбонової кислоти із чистотою 93,3 % за вагою. Вихід, заснований на молярній кількості використовуваного метилгідразину або етил 2-етоксиметилен-4,4-дифтор-3оксобутирату, становив 75,5 %. Аналогічно до прикладу 8, здійснювали синтез 3-дифторметил-1-метил-1H-піразол-4карбонової кислоти за допомогою відповідно заміщених бензальдегідів і кетонів: Приклад 9 10 11 12 13 14 Бензальдегід/кетон o-хлорбензальдегід п-метоксибензальдегід п-метилбензальдегід 1 o-нітробензальдегід 1 п-нітробензальдегід циклогексанон Вихід [%[ 67,2 52,1 70,7 52,1 58,1 71,5 Чистота [% за вагою] 98,5 96,5 100 н.д. н.д. 100 1 Реакція нітробензальдегіду з метилгідразином з відповідним гідразоном не приводить до повного перетворення. Отже, кінцевий продукт забруднений нітробензальдегідом, який осаджується з водних розчинів у вигляді твердої речовини разом з 3-дифторметил-1-метил1H-піразол-4-карбоновою кислотою. 30 35 40 45 Аналогічно до одержання етил 4,4-дифтор-2-[1-{N-метил-N'-[1фенілметиліден]гідразино}метиліден]-3-оксобутирату (приклад 1, стадія 1.1), одержували наступні сполуки формули VI: Приклад 15: Етил 4,4-дифтор-2-[1-{N-метил-N'-[1-(4хлорфеніл)метиліден]гідразино}метиліден]-3-оксобутират 13 C ЯМР: 190,2, 181,5, 166,6, 164,6, 148,8, 144,8, 144,2, 135,2, 132,8, 128,9, 128,6, 110,4, 108,4, 107,2, 99,60, 60,51, 59,71, 40,08, 13,86. Приклад 16: Етил 4,4-дифтор-2-[1-{N-метил-N'-[1-(2хлорфеніл)метиліден]гідразино}метиліден]-3-оксобутират 13 C ЯМР: 190,3, 181,6, 166,4, 164,5, 148,6, 140,9, 140,2, 133,5, 132,1, 131,0, 130,0, 127,5, 127,4, 110,2, 108,3, 107,7, 100,3, 60,46, 59,77, 39,94, 13,74. Приклад 17: Етил 4,4-дифтор-2-[1-{N-метил-N'-[1-(4метоксифеніл)метиліден]гідразино}метиліден]-3-оксобутират 13 C ЯМР: 190,8, 181,1, 166,8, 164,8, 161,3, 148,7, 146,1, 145,5, 129,5, 126,4, 114,3, 110,4, 108,5, 106,4, 98,46, 60,36, 59,54, 55,30, 39,36, 13,86. Приклад 18: Етил 4,4-дифтор-2-[1-{N-метил-N'-[1-(4метилфеніл)метиліден]гідразино}метиліден]-3-оксобутират 17 UA 106470 C2 13 5 10 C ЯМР: 189,9, 181,2, 166,6, 164,6, 148,8, 146,1, 145,5, 140,7, 131,1, 129,4, 109,3, 108,4, 106,7, 98,82, 60,34, 59,54, 39,43, 21,00, 13,81. Приклад 19: Етил 4,4-дифтор-2-[1-{N-метил-N'-[1-(2нітрофеніл)метиліден]гідразино}метиліден]-3-оксобутират 13 C ЯМР: 190,8, 181,8, 164,5, 164,4, 148,6, 148,3, 141,5, 140,6, 133,7, 132,8, 131,2, 128,6, 124,9, 110,2, 108,3, 108,1, 100,8, 60,51, 59,66, 39,33, 13,69. Приклад 20: Етил 4,4-дифтор-2-[1-{N-метил-N'-[1-(4нітрофеніл)метиліден]гідразино}метиліден]-3-оксобутират 13 C ЯМР: 190,3, 181,8, 164,4, 148,1, 143,5, 142,9, 140,0, 139,8, 128,4, 124,0, 110,3, 108,2, 108,1, 100,8, 60,67, 59,89, 39,65, 14,15. Сполуки із прикладів 15-20, аналогічно до прикладу 1, стадії 1.2, перетворювали в етил 3дифторметил-1-метил-1H-піразол-4-карбоксилат, який після цього гідролізували до 3дифторметил-1-метил-1H-піразол-4-карбонової кислоти. ФОРМУЛА ВИНАХОДУ 15 1. Спосіб одержання 1,3,4-заміщених піразольних сполук формули І X R 2 N N R 20 25 1 , (I) у якій 1 2 3 X являє собою СХ X Х -групу, у якій 1 2 3 1 X , X і X кожний незалежно являє собою водень, фтор або хлор, де X також може являти 1 2 собою С1-С6-алкіл або С1-С4-галогеналкіл і де принаймні один з радикалів X , X відрізняється від водню, 1 R являє собою С1-С4-алкіл, і 2 2a R являє собою CO2R -групу, у якій 2a R являє собою С5-С6-циклоалкіл, необов'язково заміщений феніл або С1-С6-алкіл, який необов'язково може бути заміщений С1-С4-алкокси, фенілом або С3-С6-циклоалкілом, в якому здійснюють наступні стадії за якими: і) сполуку формулу II піддають взаємодії з гідразоном формули III Y R R X R 30 35 40 45 2 5 R CH 4 N N H R 1 , 3 , (II) (III) 2 де змінні X і R у формулі II, кожна, мають значення, вказані для формули І, y1 y2 y3 + Y являє собою кисень, NR -групу або [NR R ] Z -групу, де y1 y2 y3 R , R і R кожний незалежно являє собою С1-С6-алкіл, С5-С6-циклоалкіл, необов'язково заміщений феніл або необов'язково заміщений феніл-С1-С4-алкіл, або y2 y3 R і R разом з атомом азоту, до якого вони приєднані, являють собою N-зв'язаний, 5-8членний насичений, необов'язково заміщений гетероцикл, який, додатково до атома азоту, також може містити 1 або 2 інші гетероатоми, вибрані з N, О і S, як кільцеві атоми, і Z являє собою аніон, вибраний із фтору, [MgF3] , [BF4] , [BCl3F] , [AlF4] , [AlCl3F] , [ZnCl2F] , [PF6] , [SbF6] , [BiCl3F] , [GaCl3F] , [SnCl4F] або [SiCl4F] , 3 3a 3b 3c R являє собою OR або NR R -групу, де 3a 3b 3c R , R і R кожний незалежно являє собою С1-С6-алкіл, С5-С6-циклоалкіл, необов'язково заміщений феніл або необов'язково заміщений феніл-С1-С4-алкіл, або 3b 3c R і R разом з атомом азоту, до якого вони приєднані, являють собою N-зв'язаний 5-8членний насичений, необов'язково заміщений гетероцикл, який, додатково до атома азоту, також може містити 1 або 2 інші гетероатоми, вибрані з N, О і S, як кільцеві атоми, 1 і де змінна R у формулі III має значення, вказані для формули І, 18 UA 106470 C2 4 5 10 5 R і R кожний незалежно являє собою водень, С1-С6-алкіл, який необов'язково може бути заміщений С1-С4-алкокси, фенілом або С3-С6-циклоалкілом; С3-С6-циклоалкіл або необов'язково 4 5 заміщений феніл, де принаймні один з радикалів R і R відрізняється від водню, і де 4 5 R і R разом з атомом вуглецю, з яким вони зв'язані, також можуть являти собою 5-10-членний насичений карбоцикл, який необов'язково моно- або полізаміщений С1-С4-алкільними групами та/або необов'язково заміщеним фенілом, та/або містить одне або 2 спряжених фенільних кільця; іі) отриманий продукт реакції обробляють кислотою в присутності води. 2. Спосіб відповідно до пункту 1, в якому додатково здійснюють одержання сполуки III шляхом взаємодії карбонільної сполуки формули IV із заміщеною гідразиновою сполукою формули V O 4 R 15 20 25 30 H2 N R H N 1 R , 5 , (IV) (V) 1 4 5 де R , R і R у формулах IV і V, кожна, мають значення, вказані для формули III. 3 3a 3. Спосіб відповідно до будь-якого з попередніх пунктів, де R у формулі II являє собою O-R , 3a де R має значення, вказані вище, і особливо являє собою С1-С4-алкіл. 4. Спосіб відповідно до будь-якого з попередніх пунктів, де Y у формулі II являє собою кисень. 5. Спосіб відповідно до будь-якого з попередніх пунктів, де X у формулах І і II являє собою 1 2 3 1 2 3 СХ X Х -групу, у якій X і X кожний являє собою фтор і X являє собою водень, фтор або хлор. 2a 2a 6. Спосіб відповідно до будь-якого з попередніх пунктів, де R в COOR -групі являє собою С1-С6-алкіл або С1-С4-алкоксі-С1-С6-алкіл. 1 7. Спосіб відповідно до будь-якого з попередніх пунктів, де R у формулах І, III і V являє собою метил. 8. Спосіб відповідно до будь-якого з попередніх пунктів, де 4 R являє собою водень або С1-С6-алкіл, і 5 R являє собою С1-С6-алкіл, С3-С6-циклоалкіл або необов'язково заміщений феніл, або 4 5 R і R разом з атомом вуглецю, з яким вони зв'язані, можуть являти собою 5-10-членний насичений карбоцикл, який необов'язково моно- або полізаміщений С1-С4-алкільними групами та/або містить конденсоване фенільне кільце. 9. Спосіб відповідно до будь-якого з попередніх пунктів, де 4 R являє собою водень, і 5 R являє собою необов'язково заміщений феніл. 10. Сполука загальної формули VI Y R X 2 CH 1 R N N R R 35 40 45 5 4 , (VI) 1 2 4 5 де X, Y, R , R , R і R кожний має значення, вказані в пункті 1, 4 5 крім сполук формули VI, де R і R кожний являє собою необов'язково заміщений феніл і Y являє собою кисень. 11. Сполука відповідно до пункту 10, де Y являє собою кисень. 1 2 3 1 12. Сполука відповідно до будь-якого з пунктів 10 і 11, де X являє собою СХ X Х -групу, у якій X 2 3 і X кожний являє собою фтор і X являє собою водень, фтор або хлор. 2a 2a 13. Сполука відповідно до будь-якого з пунктів 10-12, де R в COOR -групі являє собою С1-C6алкіл або С1-С4-алкоксі-С1-С6-алкіл. 1 14. Сполука відповідно до будь-якого з пунктів 10-13, де R являє собою метил. 15. Сполука відповідно до будь-якого з пунктів 10-14, де 4 R являє собою водень або С1-С6-алкіл, і 5 R являє собою С1-С6-алкіл, С3-С6-циклоалкіл або необов'язково заміщений феніл, або 4 5 R і R разом з атомом вуглецю, з яким вони зв'язані, можуть являти собою 5-10-членний насичений карбоцикл, який необов'язково моно- або полізаміщений С1-С4-алкільними групами та/або містить конденсоване фенільне кільце. 19 UA 106470 C2 5 16. Сполука відповідно до будь-якого з пунктів 10-15, де 4 R являє собою водень, і 5 R являє собою необов'язково заміщений феніл. 17. Сполука відповідно до будь-якого з пунктів 10-15, де 4 5 R і R разом з атомом вуглецю, з яким вони зв'язані, являють собою 5-10-членний насичений карбоцикл, який необов'язково моно- або полізаміщений С1-С4-алкільними групами. 18. Спосіб одержання піразолкарбонової кислоти формули Іа X CO2 H N N R 10 1 , (Ia) 1 де X і R кожний має значення, вказані в будь-якому з пунктів 1, 5 або 7, в якому здійснюють наступні стадії, за якими: а) одержують піразольну сполуку формули І за способом відповідно до будь-якого з пунктів 1-9, б) сполуку І гідролізують з одержанням 1,3-заміщеної піразолкарбонової кислоти формули Іа. 19. Спосіб одержання сполуки формули VII O X M N H N Q N R 15 20 R 6 1 , (VII) 1 де X і R кожний має значення, вказані в будь-якому з пунктів 1, 5 або 7, М являє собою тієніл або феніл, який може нести галогеновий замісник; Q являє собою простий зв'язок, циклопропілен, спряжене біцикло[2,2,1]гептанове або біцикло[2,2,1]гептенове кільце; 6 R являє собою водень, галоген, С1-С4-алкіл, С1-С4-галогеналкокси, одно-тризаміщений феніл, де замісники, кожний незалежно, вибирають із галогену й трифторметилтіо, або циклопропіл; в якому здійснюють наступні стадії, за якими: а) одержують піразольну сполуку формули І за способом відповідно до будь-якого з пунктів 1-9, б) сполуку І гідролізують з одержанням 1,3-заміщеної піразолкарбонової кислоти формули Іа X CO2 H N N R 25 1 , (Ia) 1 де X і R кожний має значення, вказані вище; в) необов'язково перетворюють сполуку Іа у її галогенангідрид, і г) проводять взаємодію сполуки формули Іа або її галогенангідриду з аміновою сполукою формули VIII M H2 N Q 30 6 R , (VIII) 6 де M, Q і R кожний має значення, вказані для формули VII. Комп’ютерна верстка С. Чулій Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 20
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for preparing
Автори англійськоюWolf, Bernd, Maywald, Volker, Keil, Michael, Koradin, Christopher, Rack, Michael, Zierke, Thomas, Sukopp, Martin
Автори російськоюВольф Бернд, Кайль Михаэль, Корадин Кристофер, Рак, Михаэль, Зукопп Мартин
МПК / Мітки
МПК: C07D 231/14
Мітки: піразольних, спосіб, одержання, 1,3,4-заміщених, сполук
Код посилання
<a href="https://ua.patents.su/22-106470-sposib-oderzhannya-134-zamishhenikh-pirazolnikh-spoluk.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання 1,3,4-заміщених піразольних сполук</a>
Попередній патент: Керовані пристроями списки точок доступу в бездротовому зв’язку
Наступний патент: Спосіб розрахунку електричних мереж з негармонійними струмом і напругою
Випадковий патент: Пристрій повороту верхнього бойка кувального преса