Похідні тієнопіридину як інгібітори меk
Номер патенту: 95939
Опубліковано: 26.09.2011
Автори: Брукінгс Даніель Крістофер, Нейсс Джуді Шарлотт, Джонсон Джеймс Ендрю, Лангхам Баррі Джон, Хатчінгс Мартін Клайв, Арчібальд Сара Кетрін, Давіс Джеремі Мартін
Формула / Реферат
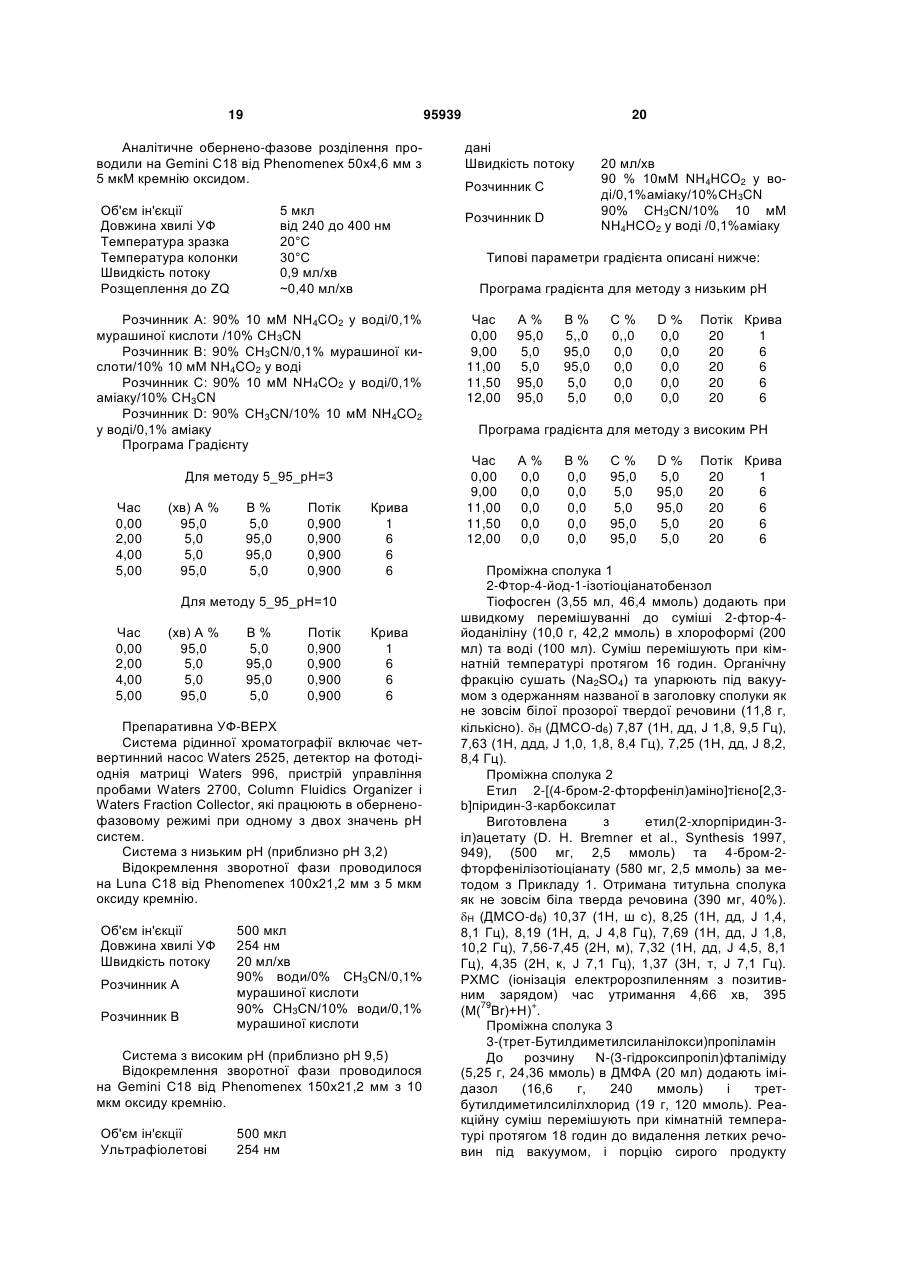
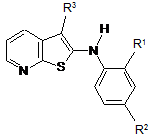
1. Сполука формули (І) або її фармацевтично прийнятна сіль, сольват або N-оксид:
 , (І)
, (І)
де
R1 представляє водень, галоген або С1-6алкіл;
R2 представляє галоген або С1-6алкіл;
R3 представляє -CONRbRc; та
Rb та Rc, взяті разом з атомом азоту, до якого вони обидва приєднані, представляють азетидин-1-іл, піролідин-1-іл, піперидин-1-іл, морфолін-4-іл, тіоморфолін-4-іл, піперазин-1-іл, гомопіперидин-1-іл, гомоморфолін-4-іл або гомопіперазин-1-іл, будь-яка з цих груп необов'язково може бути заміщена одним або декількома замісниками, вибраними з С1-6алкілу, С1-6алкокси, гідрокси, гідроксі(С1-6)алкілу, аміно(С1-6)алкілу, (аміно)(гідроксі)-(С1-6)алкілу, галогену, оксо, С2-6алкілкарбонілу, карбокси, С2-6алкоксикарбонілу, ді(С1-6)алкілгідразинілкарбонілу, аміно, С1-6алкіламіно, ді(С1-6)алкіламіно, С2-6алкілкарбоніламіно, амінокарбоніламіно, амінокарбонілу, С1-6алкіламінокарбонілу, ді(С1-6)алкіламінокарбонілу, аміносульфонілу, С1-6алкілсульфонілу, С1-6алкіламінокарбоніл(С1-6)алкілу, С1-6алкоксі(С1-6)алкілу, карбоксі(С1-6)алкілу, С2-6алкоксикарбоніл(С1-6)алкілу, С2-6алкоксикарбоніламіно та С2-6алкоксикарбоніламіно(С1-6)алкілу.
2. Сполука за п. 1, яка відрізняється тим, що циклічний фрагмент -NRbRc представляє азетидин-1-іл, піролідин-1-іл, піперидин-1-іл, морфолін-4-іл, піперазин-1-іл або гомопіперазин-1-іл, будь-яка з цих груп необов'язково може бути заміщена одним або декількома замісниками, як це визначено в п. 1.
3. Сполука за будь-яким з п. 1 або 2, яка відрізняється тим, що циклічний фрагмент -NRbRc є незаміщеним або заміщеним одним або двома замісниками, як це визначено в п. 1.
4. Сполука за будь-яким з попередніх пунктів, яка відрізняється тим, що замісники циклічного фрагмента -NRbRc вибрані з С1-6алкілу, С1-6алкоксі(С1-6)алкілу, гідрокси, гідроксі(С1-6)алкілу, аміно, аміно(С1-6)алкілу, карбоксиметилу, С2-6алкоксикарбонілу, С2-6алкоксикарбоніл(С1-6)алкілу, ді(С1-6)алкіламіно, С2-6алкоксикарбоніламіно та С2-6алкоксикарбоніламіно(С1-6)алкілу.
5. Сполука за п. 4, яка відрізняється тим, що замісники циклічного фрагмента -NRbRc вибрані з метилу, метоксиметилу, гідрокси, гідроксиметилу, 2-гідроксіетилу, аміно, амінометилу, карбоксиметилу, тpeт-бутоксикарбонілу, етоксикарбонілметилу, диметиламіно, тpeт-бутоксикарбоніламіно і трет-бутоксикарбоніламінометилу.
6. Сполука за п. 1, яка відрізняється тим, що циклічний фрагмент -NRbRc представляє 3-гідроксіазетидин-1-іл, 3-аміноазетидин-1-іл, 3-(амінометил)азетидин-1-іл, 3-(трет-бутоксикарбоніламіно)азетидин-1-іл, 3-(трет-бутоксикарбоніламінометил)азетидин-1-іл, піролідин-1-іл, 2-(метоксиметил)піролідин-1-іл, 3-гідроксипіролідин-1-іл, 3-амінопіролідин-1-іл, 3-(трет-бутоксикарбоніламіно)піролідин-1-іл, 2-(гідроксиметил)піперидин-1-іл, 4-амінопіперидин-1-іл, 4-(трет-бутоксикарбоніламіно)піперидин-1-іл, морфолін-4-іл, 2-(гідроксиметил)морфолін-4-іл, піперазин-1-іл, 4-метилпіперазин-1-іл, 2-(гідроксиметил)-піперазин-1-іл, 4-(2-гідроксіетил)піперазин-1-іл, 4-(карбоксиметил)піперазин-1-іл, 4-(трет-бутоксикарбоніл)-2(гідроксиметил)піперазин-1-іл, 4-(етоксикарбонілметил)-піперазин-1-іл або гомопіперазин-1-іл.
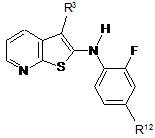
7. Сполука за п. 1, представлена формулою (II), або її фармацевтично прийнятні солі, сольвати та N-оксиди:
 , (ІІ)
, (ІІ)
де
R12 представляє галоген; та
R3 є таким, як визначено в п. 1.
8. Сполука за п. 7, в якій R12 представляє бром або йод.
9. Сполука за п. 8, в якій R12 являє собою йод.
10. Сполука за п. 1, яка вибрана з наступних:
N-(2-фтор-4-йодфеніл)-3-(морфолін-4-ілкарбоніл)тієно[2,3-b]піридин-2-амін;
N-(2-фтор-4-йодфеніл)-3-[(4-метилпіперазин-1-іл)карбоніл]-тієно[2,3-b]піридин-2-амін;
2-[(2-фтор-4-йодфеніл)аміно]тієно[2,3-b]піридин-3-іл(піролідин-1-іл)-метанон;
тpeт-бутиловий ефір (1-{2-[(2-фтор-4-йодфеніл)аміно]тієно[2,3-b]піридин-3-карбоніл}піперидин-4-іл)-карбамінової кислоти;
дигідрохлорид (4-амінопіперидин-1-іл)аміду 2-[(2-фтор-4-йодфеніл)аміно]тієно[2,3-b]піридин-3-карбонової кислоти;
тpeт-бутиловий ефір (1-{2-[(2-фтор-4-йодфеніл)аміно]тієно[2,3-b]піридин-3-карбоніл}азетидин-3-ілметил)-карбамінової кислоти;
[3-(амінометил)азетидин-1-іл]-{2-[(2-фтор-4-йодфеніл)аміно]тієно[2,3-b]піридин-3-іл}-метанон;
трет-бутиловий ефір (1-{2-[(2-фтор-4-йодфеніл)аміно]тієно[2,3-b]піридин-3-карбоніл}-(3R)-піролідин-3-іл)-карбамінової кислоти;
тpeт-бутиловий ефір (1-{2-[(2-фтор-4-йодфеніл)аміно]тієно[2,3-b]піридин-3-карбоніл}-(3S)-піролідин-3-іл)-карбамінової кислоти;
тpeт-бутиловий ефір (1-{2-[(2-фтор-4-йодфеніл)аміно]тієно[2,3-b]піридин-3-карбоніл}азетидин-3-іл)-карбамінової кислоти;
[(3R)-3-амінопіролідин-1-іл]-{2-[(2-фтор-4-йодфеніл)аміно]тієно[2,3-b]-піридин-3-іл}-метанон;
[(3S)-3-амінопіролідин-1-іл]-{2-[(2-фтор-4-йодфеніл)аміно]тієно[2,3-b]-піридин-3-іл}-метанон;
(3-аміноазетидин-1-іл)-{2-[(2-фтор-4-йодфеніл)аміно]тієно[2,3-b]-піридин-3-іл}-метанон;
{2-[(2-фтор-4-йодфеніл)аміно]тієно[2,3-b]піридин-3-іл}-(3-гідроксіазетидин-1-іл)-метанон;
{2-[(2-фтор-4-йодфеніл)аміно]тієно[2,3-b]піридин-3-іл}-[(3R)-3-гідроксипіролідин-1-іл]-метанон;
{2-[(2-фтор-4-йодфеніл)аміно]тієно[2,3-b]піридин-3-іл}-[(3S)-3-гідроксипіролідин-1-іл]-метанон;
{2-[(2-фтор-4-йодфеніл)аміно]тієно[2,3-b]піридин-3-іл}-[2-(гідроксиметил)-піперидин-1-іл]-метанон;
{2-[(2-фтор-4-йодфеніл)аміно]тієно[2,3-b]піридин-3-іл}-[(3S)-3-(гідроксиметил)-морфолін-4-іл]-метанон;
тpeт-бутиловий ефір 4-{2-[(2-фтор-4-йодфеніл)аміно]тієно[2,3-b]піридин-3-карбоніл}-(3R)-3-(гідроксиметил)піперазин-1-карбонової кислоти;
2-[4-({2-[(2-фтор-4-йодфеніл)аміно]тієно[2,3-b]піридин-3-іл}карбоніл)піперазин-1-іл]етанол;
3-(1,4-діазепан-1-ілкарбоніл)-N-(2-фтор-4-йодфеніл)тієно[2,3-b]піридин-2-амін;
N-(2-фтор-4-йодфеніл)-3-(піперазин-1-ілкарбоніл)тієно[2,3-b]піридин-2-амін;
етил[4-({2-[(2-фтор-4-йодфеніл)аміно]тієно[2,3-b]піридин-3-іл}карбоніл)-піперазин-1-іл]ацетат;
[4-({2-[(2-фтор-4-йодфеніл)аміно]тієно[2,3-b]піридин-3-іл}карбоніл)-піперазин-1-іл]оцтова кислота;
{2-[(2-фтор-4-йодфеніл)аміно]тієно[2,3-b]піридин-3-іл}-[(2R)-2-(метоксиметил)-піролідин-1-іл]-метанон та
{2-[(2-фтор-4-йодфеніл)аміно]тієно[2,3-b]піридин-3-іл}-[(2R)-2-(гідроксиметил)-піперазин-1-іл]-метанон.
11. Сполука за п. 1 для застосування в терапії.
12. Сполука за п. 1 для застосування в лікуванні та/або запобіганні розладам, при яких показане застосування селективного інгібітора МЕK.
13. Сполука за п. 1 для застосування в лікуванні та/або запобіганні запальним, аутоімунним, серцево-судинним, проліферативним станам та станам, що супроводжуються болем.
14. Сполука за п. 1 для застосування в лікуванні та/або запобіганні онкологічним станам.
15. Фармацевтична композиція, яка містить сполуку формули (І) за п. 1 або її фармацевтично прийнятну сіль, сольват або N-оксид в сполученні з фармацевтично прийнятним носієм.
16. Застосування сполуки формули (І) за п. 1 або її фармацевтично прийнятної солі, сольвату або N-оксиду для виробництва лікарського засобудля лікування та/або профілактики розладів, при яких показане застосування селективного інгібітора МЕK.
17. Застосування сполуки формули (І) за п. 1 або її фармацевтично прийнятної солі, сольвату або N-оксиду для виробництва лікарського засобу для лікування та/або профілактики запальних, аутоімунних, серцево-судинних, проліферативних станів та станів, що супроводжуються болем.
18. Застосування сполуки формули (І) за п. 1 або її фармацевтично прийнятної солі, сольвату або N-оксиду для виробництва лікарського засобу для лікування та/або профілактики онкологічних станів.
19. Спосіб лікування та/або профілактики розладів, при яких показане застосування селективного інгібітора МЕK, який включає призначення пацієнту, якому необхідне таке лікування, ефективної кількості сполуки формули (І) за п. 1 або її фармацевтично прийнятної солі, сольвату або N-оксиду.
Текст
1. Сполука формули (І) або її фармацевтично прийнятна сіль, сольват або N-оксид: R3 2 (19) 1 3 95939 метилу, метоксиметилу, гідрокси, гідроксиметилу, 2-гідроксіетилу, аміно, амінометилу, карбоксиметилу, тpeт-бутоксикарбонілу, етоксикарбонілметилу, диметиламіно, тpeт-бутоксикарбоніламіно і трет-бутоксикарбоніламінометилу. 6. Сполука за п. 1, яка відрізняється тим, що цикb c лічний фрагмент -NR R представляє 3гідроксіазетидин-1-іл, 3-аміноазетидин-1-іл, 3(амінометил)азетидин-1-іл, 3-(третбутоксикарбоніламіно)азетидин-1-іл, 3-(третбутоксикарбоніламінометил)азетидин-1-іл, піролідин-1-іл, 2-(метоксиметил)піролідин-1-іл, 3гідроксипіролідин-1-іл, 3-амінопіролідин-1-іл, 3(трет-бутоксикарбоніламіно)піролідин-1-іл, 2(гідроксиметил)піперидин-1-іл, 4-амінопіперидин-1іл, 4-(трет-бутоксикарбоніламіно)піперидин-1-іл, морфолін-4-іл, 2-(гідроксиметил)морфолін-4-іл, піперазин-1-іл, 4-метилпіперазин-1-іл, 2(гідроксиметил)-піперазин-1-іл, 4-(2гідроксіетил)піперазин-1-іл, 4(карбоксиметил)піперазин-1-іл, 4-(третбутоксикарбоніл)-2(гідроксиметил)піперазин-1-іл, 4-(етоксикарбонілметил)-піперазин-1-іл або гомопіперазин-1-іл. 7. Сполука за п. 1, представлена формулою (II), або її фармацевтично прийнятні солі, сольвати та N-оксиди: R3 H N N F S R12 , (ІІ) де 12 R представляє галоген; та 3 R є таким, як визначено в п. 1. 12 8. Сполука за п. 7, в якій R представляє бром або йод. 12 9. Сполука за п. 8, в якій R являє собою йод. 10. Сполука за п. 1, яка вибрана з наступних: N-(2-фтор-4-йодфеніл)-3-(морфолін-4ілкарбоніл)тієно[2,3-b]піридин-2-амін; N-(2-фтор-4-йодфеніл)-3-[(4-метилпіперазин-1іл)карбоніл]-тієно[2,3-b]піридин-2-амін; 2-[(2-фтор-4-йодфеніл)аміно]тієно[2,3-b]піридин-3іл(піролідин-1-іл)-метанон; тpeт-бутиловий ефір (1-{2-[(2-фтор-4йодфеніл)аміно]тієно[2,3-b]піридин-3карбоніл}піперидин-4-іл)-карбамінової кислоти; дигідрохлорид (4-амінопіперидин-1-іл)аміду 2-[(2фтор-4-йодфеніл)аміно]тієно[2,3-b]піридин-3карбонової кислоти; тpeт-бутиловий ефір (1-{2-[(2-фтор-4йодфеніл)аміно]тієно[2,3-b]піридин-3карбоніл}азетидин-3-ілметил)-карбамінової кислоти; [3-(амінометил)азетидин-1-іл]-{2-[(2-фтор-4йодфеніл)аміно]тієно[2,3-b]піридин-3-іл}-метанон; трет-бутиловий ефір (1-{2-[(2-фтор-4йодфеніл)аміно]тієно[2,3-b]піридин-3-карбоніл}(3R)-піролідин-3-іл)-карбамінової кислоти; 4 тpeт-бутиловий ефір (1-{2-[(2-фтор-4йодфеніл)аміно]тієно[2,3-b]піридин-3-карбоніл}(3S)-піролідин-3-іл)-карбамінової кислоти; тpeт-бутиловий ефір (1-{2-[(2-фтор-4йодфеніл)аміно]тієно[2,3-b]піридин-3карбоніл}азетидин-3-іл)-карбамінової кислоти; [(3R)-3-амінопіролідин-1-іл]-{2-[(2-фтор-4йодфеніл)аміно]тієно[2,3-b]-піридин-3-іл}-метанон; [(3S)-3-амінопіролідин-1-іл]-{2-[(2-фтор-4йодфеніл)аміно]тієно[2,3-b]-піридин-3-іл}-метанон; (3-аміноазетидин-1-іл)-{2-[(2-фтор-4йодфеніл)аміно]тієно[2,3-b]-піридин-3-іл}-метанон; {2-[(2-фтор-4-йодфеніл)аміно]тієно[2,3-b]піридин-3іл}-(3-гідроксіазетидин-1-іл)-метанон; {2-[(2-фтор-4-йодфеніл)аміно]тієно[2,3-b]піридин-3іл}-[(3R)-3-гідроксипіролідин-1-іл]-метанон; {2-[(2-фтор-4-йодфеніл)аміно]тієно[2,3-b]піридин-3іл}-[(3S)-3-гідроксипіролідин-1-іл]-метанон; {2-[(2-фтор-4-йодфеніл)аміно]тієно[2,3-b]піридин-3іл}-[2-(гідроксиметил)-піперидин-1-іл]-метанон; {2-[(2-фтор-4-йодфеніл)аміно]тієно[2,3-b]піридин-3іл}-[(3S)-3-(гідроксиметил)-морфолін-4-іл]-метанон; тpeт-бутиловий ефір 4-{2-[(2-фтор-4йодфеніл)аміно]тієно[2,3-b]піридин-3-карбоніл}(3R)-3-(гідроксиметил)піперазин-1-карбонової кислоти; 2-[4-({2-[(2-фтор-4-йодфеніл)аміно]тієно[2,3b]піридин-3-іл}карбоніл)піперазин-1-іл]етанол; 3-(1,4-діазепан-1-ілкарбоніл)-N-(2-фтор-4йодфеніл)тієно[2,3-b]піридин-2-амін; N-(2-фтор-4-йодфеніл)-3-(піперазин-1ілкарбоніл)тієно[2,3-b]піридин-2-амін; етил[4-({2-[(2-фтор-4-йодфеніл)аміно]тієно[2,3b]піридин-3-іл}карбоніл)-піперазин-1-іл]ацетат; [4-({2-[(2-фтор-4-йодфеніл)аміно]тієно[2,3b]піридин-3-іл}карбоніл)-піперазин-1-іл]оцтова кислота; {2-[(2-фтор-4-йодфеніл)аміно]тієно[2,3-b]піридин-3іл}-[(2R)-2-(метоксиметил)-піролідин-1-іл]-метанон та {2-[(2-фтор-4-йодфеніл)аміно]тієно[2,3-b]піридин-3іл}-[(2R)-2-(гідроксиметил)-піперазин-1-іл]-метанон. 11. Сполука за п. 1 для застосування в терапії. 12. Сполука за п. 1 для застосування в лікуванні та/або запобіганні розладам, при яких показане застосування селективного інгібітора МЕK. 13. Сполука за п. 1 для застосування в лікуванні та/або запобіганні запальним, аутоімунним, серцево-судинним, проліферативним станам та станам, що супроводжуються болем. 14. Сполука за п. 1 для застосування в лікуванні та/або запобіганні онкологічним станам. 15. Фармацевтична композиція, яка містить сполуку формули (І) за п. 1 або її фармацевтично прийнятну сіль, сольват або N-оксид в сполученні з фармацевтично прийнятним носієм. 16. Застосування сполуки формули (І) за п. 1 або її фармацевтично прийнятної солі, сольвату або Nоксиду для виробництва лікарського засобу для лікування та/або профілактики розладів, при яких показане застосування селективного інгібітора МЕK. 17. Застосування сполуки формули (І) за п. 1 або її фармацевтично прийнятної солі, сольвату або Nоксиду для виробництва лікарського засобу для 5 95939 6 лікування та/або профілактики запальних, аутоімунних, серцево-судинних, проліферативних станів та станів, що супроводжуються болем. 18. Застосування сполуки формули (І) за п. 1 або її фармацевтично прийнятної солі, сольвату або Nоксиду для виробництва лікарського засобу для лікування та/або профілактики онкологічних станів. 19. Спосіб лікування та/або профілактики розладів, при яких показане застосування селективного інгібітора МЕK, який включає призначення пацієнту, якому необхідне таке лікування, ефективної кількості сполуки формули (І) за п. 1 або її фармацевтично прийнятної солі, сольвату або N-оксиду. Даний винахід стосується класу похідних тієнопіридину та їх застосування в терапії. Зокрема, винахід відноситься до похідних тієно[2,3b]піридину, заміщених в положенні 2 аніліновим компонентом. Такі сполуки являють собою селективні інгібітори ферментів MEK (МАРKK), і, відповідно є придатними як фармацевтичні препарати, особливо в лікуванні несприятливих запальних, аутоімунних, серцево-судинних, проліферативних станів (в тому числі онкологічних) та станів, що супроводжуються болем. Ферменти MEK залучені до різноманітних фізіологічних і патологічних функцій, які, як вважається, діють при ряді людських захворювань. Вказані функції узагальнюються в параграфах [0004] і [0005] документу US 2005/0049276 А1. Сполуки, які застосовуються в даному винаході, є потужними і селективними інгібіторами MEK, і, таким чином, є придатними для лікування та/або запобігання різноманітним захворюванням людини. Вони включають такі аутоімунні і запальні розлади, як ревматоїдний артрит, остеоартрит, розсіяний склероз, астма, запалення кишечнику, псоріаз і відторгнення пересаджених органів; серцево-судинні розлади, включаючи тромбоз, серцеву гіпертрофію, підвищений кров'яний тиск, і нерегулярну скоротність серця (наприклад, під час паралічу серця); такі проліферативні розлади, як рестеноз, і онкологічні стани, включаючи білокрів'я, гліобластому, лімфому, меланому, і рак печінки, кісток, шкіри, мозку, підшлункової залози, легені, молочних залоз, шлунку, товстої кишки, прямої кишки, простати, яєчника і шийки; і больові та ноцицептивні розлади, в тому числі хронічний біль і невропатичний біль. Крім того, сполуки, які застосовуються в даному винаході, можуть використовуватися як фармакологічні стандарти в розробці нових біологічних випробувань і в пошуку нових фармакологічних агентів. Тому сполуки, які застосовуються в даному винаході, можуть бути придатними як радіоліганди у випробуваннях для виявлення сполук, здатних до зв'язування з ферментами MEK людини. Інгібітори MEK, що базуються на системі ароматичних двоциклічних кілець, до яких приєднується заміщений аніліновий фрагмент, відомі з рівня техніки. Приклади відповідних публікацій включають WO 2005/051906, WO 2005/023251, USA-2005/0049276, WO 2005/009975, WO 03/077914 і WO 03/077855. У WO 2005/023818 описано великий клас сполук, що базуються на двоциклічній системі об'єднаних ароматичних кілець, що загалом включає похідні тієнопіридину, до яких приєднаний заміщений аніліновий фрагмент, але ніде конкретно не розкрита будь-яка точна сполука цього типу. Ніяка дискретна фармакологічна активність в термінах визначеного фармакологічного механізму не приписується описаним там сполукам, але вони все ж вважаються придатними серед інших у лікуванні таких проліферативних клітинних захворювань, як рак. US-A-2003/0220365 також відповідає пов'язаному контексту. Ніде в попередній статті, однак, точно не розкривається клас похідних тієно[2,3-b]піридину, заміщених в положенні 2 аніліновим фрагментом. Нами виявлено, що такі сполуки особливо цінні як селективні інгібітори ферментів MEK. Сполуки за даним винаходом є потужними і селективними інгібіторами MEK, що демонструють спорідненість зв'язування (ІС50) по відношенню до ферментів людини MEK1 та/або MEK2 50 мкМ або менше, загалом 20 мкМ або менше, звичайно 5 мкМ або менше, типово 1 мкМ або менше, відповідно 500 нМ або менше, ідеально 100 нМ або менше, і бажано 20 нМ або менше (фахівцю в даній галузі буде зрозуміло, що нижче значення ІС50 означає активнішу сполуку). Сполуки за винаходом можуть демонструвати як мінімум в 10 разів більш селективну спорідненість, звичайно як мінімум в 20 разів більш селективну спорідненість, бажано як мінімум в 50 разів більш селективну спорідненість, та в ідеалі як мінімум в 100 разів більш селективну спорідненість по відношенню до ферментів людини MEK1 та/або MEK2 відносно інших кіназ людини. В даному винаході пропонується сполука формули (І) або її фармацевтично прийнятна сіль, сольват або N-оксид: де 1 R представляє водень, галоген або С1-6 алкіл; 2 R представляє галоген або С1-6 алкіл; 3 a R представляє водень, ціано, -CO2R , b c b c CONR R або -CON(OR )R ; 7 a R представляє С1-6 алкіл; b R представляє водень; або С1-6 алкіл, С3-7 циклоалкіл, С3-7 циклоалкіл(С1-6) алкіл, арил, арил(С16)алкіл, С3-7 гетероциклоалкіл, С3-7 гетероциклоалкіл(С1-6)алкіл, гетероарил або гетероарил(С16)алкіл, будь-яка з цих груп необов'язково може бути заміщена одним або декількома замісниками; та c R представляє водень або С1-6 алкіл (необов'язково заміщений гідроксильною групою); або b c R та R , взяті разом з атомом азоту, до якого вони обидва приєднані, представляють азетидиніл, піролідиніл, піперидиніл, морфолініл, тіоморфолініл, піперазиніл, гомопіперидиніл, гомоморфолініл або гомопіперазиніл, будь-яка з цих груп необов'язково може бути заміщена одним або декількома замісниками. Даний винахід також представляє сполуку формули (І), зображену вище, або її фармацевтично прийнятну сіль, сольват або N-оксид, де 1 2 R та R є такими, як визначено вище; 3 3 b c R представляє ціано, -CO2R , -CONR R або b c CON(OR )R ; a R представляє С1-6 алкіл; b R представляє водень; або С1-6 алкіл, С3-7 циклоалкіл, С3-7 циклоалкіл(С1-6) алкіл, арил, арил(С16)алкіл, С3-7 гетероциклоалкіл, С3-7 гетероциклоалкіл(С1-6)алкіл, гетероарил або гетероарил(С16)алкіл, будь-яка з цих груп необов'язково може бути заміщена одним або декількома замісниками; та c R представляє водень або С1-6 алкіл; або b c R та R , взяті разом з атомом азоту, до якого обидва приєднані, представляють азетидиніл, піролідиніл, піперидиніл, морфолініл, тіоморфолініл, піперазиніл, гомопіперидиніл або гомоморфолініл, будь-яка з цих груп необов'язково може бути ι заміщена одним або декількома замісниками. Для застосування в медицині солі сполук формули (І) будуть фармацевтично прийнятними. Інші солі можуть, однак, бути придатними для виготовлення сполук за винаходом або їх фармацевтично прийнятних солей. Відповідні фармацевтично прийнятні солі сполук за даним винаходом включають кислотно-адитивні солі, які можуть, наприклад, утворюватися при змішуванні розчину сполуки за винаходом з розчином такої фармацевтично прийнятної кислоти, як хлористоводнева кислота, сірчана кислота, метансульфокислота, фумарова кислота, малеїнова кислота, бурштинова кислота, оцтова кислота, бензойна кислота, лимонна кислота, винна кислота або фосфорна кислота. Крім того, там, де сполуки за винаходом містять кислотний фрагмент, наприклад карбоксильну групу, відповідні фармацевтично прийнятні солі можуть включати солі лужних металів, наприклад, солі натрію або калію; солі лужноземельних металів, наприклад, солі кальцію і магнію; та солі, утворені з відповідними органічними лігандами, наприклад, четвертинні солі амонію. Даний винахід включає сольвати сполук формули (І) вище. Такі сольвати можуть утворюватися з такими звичайними органічними розчинниками, як, наприклад, вуглеводневі розчинники, такі як бензол або толуол; розчинниками, які містять 95939 8 хлор, такі як хлороформ або дихлорметан; спиртовими розчинниками, такими як метанол, етанол або ізопропанол; ефірними розчинниками, такими як діетиловий ефір або тетрагідрофуран; або складно естерними розчинниками, такими як етилацетат. Альтернативно, сольвати сполук формули (І) можуть утворюватися з водою, і в цьому випадку вони будуть гідратами. Відповідні алкільні групи, які можуть бути присутніми в сполуках за винаходом, включають нерозгалужені та розгалужені С1-6 алкільні групи, наприклад, С1-4 алкільні групи. Типові приклади включають метильні та етильні групи, та нерозгалужені або розгалужені пропільні, бутильні та пентильні групи. Окремі алкілові групи включають метильні, етильні, н-пропільні, ізопропільні, нбутильні, втор-бутильні, ізобутильні, трет-бутильні та 2,2-диметилпропільні. Такі вирази, що позначають похідні, як "С1-6 алкокси", "С1-6 алкілтіо", "С1-6 алкілсульфоніл" та "С1-6 алкіламіно", пояснюються відповідно. Специфічними С3-7 циклоалкільними групами є циклопропіл, циклобутил, циклопентил, циклогексил та циклогептил. Відповідні арильні групи включають феніл та нафтил, переважно феніл. Відповідні арил(С1-6)алкільні групи включають бензил, фенілетил, фенілпропіл та нафтилметил. Відповідні гетероциклоалкільні групи, які можуть включати з'єднані з бензолом аналоги, які включають азетидиніл, тетрагідрофураніл, діоксоланіл, піролідиніл, індолініл, імідазолідиніл, тетрагідропіраніл, піперидиніл, 1,2,3,4тетрагідрохінолініл, 1,2,3,4-тетрагідроізохінолініл, піперазиніл, морфолініл та тіоморфолініл. Відповідні гетероарильні групи включають фурил, бензофурил, дибензофурил, тієніл, бензотієніл, піроліл, індоліл, піразоліл, індазоліл, оксазоліл, ізоксазоліл, тіазоліл, ізотіазоліл, імідазоліл, бензімідазоліл, оксадіазоліл, тіадіазоліл, триазоліл, тетразоліл, піридиніл, хінолініл, ізохінолініл, піридазиніл, піримідиніл та піразиніл. Термін "галоген" в даному описі позначає атоми фтору, хлору, брому та йоду. Якщо сполуки формули (І) мають один або більше асиметричних центрів, вони, відповідно, можуть існувати як оптичні ізомери. Якщо сполуки за винаходом мають два або більше асиметричних центрів, вони можуть додатково існувати як діастереомери. Слід розуміти, що винахід поширюється на всі такі оптичні ізомери та діастереомери, а також на їх суміші в будь-якій пропорції, в тому числі рацемати. Формула (І) та формули, зображені нижче в даному описі, призначені для представлення всіх індивідуальних стереоізомерів та всіх можливих сумішей, за винятком заявлених або показаних в інший спосіб; крім того, сполуки формули (І) можуть існувати як таутомери, наприклад, кето(СН2С=O)-єнольні (СН=СНОН) таутомери. Формула (I) та формули, зображені нижче в даному описі, призначені для представлення всіх індивідуальних таутомерів і всіх можливих їх сумішей, за винятком заявлених або показаних в інший спосіб. 9 95939 1 В одному варіанті R представляє водень, в 1 іншому варіанті R представляє галоген, зокрема фтор або хлор, головним чином, фтор. У додатко1 вому варіанті R представляє С1-6 алкіл, головним чином, метил. 1 Типово R являє собою фтор. 2 В одному варіанті R представляє галоген, го2 ловним чином, бром або йод В іншому варіанті R представляє Сі.6 алкіл, головним чином, метил. 2 В одному специфічному варіанті R являє со2 бою бром. В іншому специфічному варіанті R являє собою йод. a Відповідно, R представляє метил або етил, головним чином, етил. b Переважно, R представляє водень, або С1-6 алкіл, С3-7 циклоалкіл(С1.6)алкіл, С3-7 гетероциклоалкіл або С3-7 гетероциклоалкіл(С1-6)алкіл, будьяка з цих груп необов'язково може бути заміщена одним або декількома замісниками. b Відповідно, R представляє водень; або С1-6 алкіл, арил, арил(С1-6)алкіл, С3-7 гетероциклоалкіл, С3-7 гетероциклоалкіл(С1-6)алкіл, гетероарил або гетероарил(С1-6) алкіл, будь-яка з цих груп необов'язково може бути заміщена одним або декількома замісниками. b Відповідно, група R або циклічний фрагмент b c NR R може бути незаміщений, або заміщений одним або декількома замісниками, звичайно одним або двома замісниками. В одному варіанті b b c група R або циклічний фрагмент -NR R є незаміb щеним. В іншому варіанті група R або циклічний b c фрагмент -NR R є монозаміщеним. В додатковоb му варіанті група R або циклічний фрагмент b c NR R є дизаміщеним. b Приклади типових замісників на R або на циb c клічному фрагменті -NR R включають С1-6 алкіл, С1-6 алкокси, гідрокси, гідрокси(С1-6)алкіл, аміно(С1.6)алкіл, (аміно)(гідрокси)-(С1-6)алкіл, галоген, оксо, С2-6 алкілкарбоніл, карбокси, С2-6 алкоксикарбоніл, ди(С1-6)алкілгідразинілкарбоніл, аміно, С1-6 алкіламіно, ди(С1-6)алкіламіно, С2-6 алкілкарбоніламіно, амінокарбоніламіно, амінокарбоніл, С1-6 алкіламінокарбоніл, ди(С1-6)алкіламінокарбоніл, аміносульфоніл, С1-6 алкілсульфоніл та С1-6 алкіламінокарбоніл(С1-6)алкіл. Додаткові приклади включають С1-6алкокси(С1-6)алкіл, карбокси(С16)алкіл, С2-6алкоксикарбоніл(С1-6) алкіл, С2-6 алкоксикарбоніламіно та С2-6 алкоксикарбоніламіно(С16)алкіл. b Приклади окремих замісників на R або на циb c клічному фрагменті -NR R включають метил, метокси, гідрокси, гідроксиметил, 2-гідроксиетил, амінометил, 2-аміно-3-гідроксипропіл, фтор, оксо, ацетил, карбокси, метоксикарбоніл, етоксикарбоніл, трет-бутоксикарбоніл, диметилгідразинілкарбоніл, аміно, метиламіно, 1,3-диметил-бутиламіно, диметиламіно, ацетиламіно, амінокарбоніламіно, амінокарбоніл, етиламінокарбоніл, діетиламінокарбоніл, аміносульфоніл, метилсульфоніл та метиламінокарбонілметил. Додаткові приклади включають метоксиметил, карбоксиметил, етоксикарбонілметил, трет-бутоксикарбоніламіно і трет-бутоксикарбоніламінометил. Приклади найбільш розповсюджених замісниb b c ків на R або на циклічному фрагменті -NR R 10 включають С1-6 алкіл, С1-6 алкокси(С1-6)іалкіл, гідрокси, гідрокси(С1-6)алкіл, аміно, аміно(С1-6) алкіл, карбоксиметил, С2-6 алкоксикарбоніл, С2-6 алкоксикарбоніл(С1-6)алкіл, ди(С1-6)алкіламіно, С2-6 алкоксикарбоніламіно та С2-6 алкоксикарбоніламіно(С1-6) алкіл. b Приклади конкретних замісників на R або на b c циклічному фрагменті -NR R включають метил, метоксиметил, гідрокси, гідроксиметил, 2гідроксиетил, аміно, амінометил, карбоксиметил, трет-бутоксикарбоніл, етоксикарбонілметил, диметиламіно, трет-бутоксикарбоніламіно і третбутоксикарбоніламінометил. b Переважні значення R включають водень, метил, етил, пропіл, циклопропіл-метил, азетидиніл, піролідиніл, піперидиніл, азетидинілметил, діоксоланілметил, піролідинілметил, морфолінілетил та морфолінілпропіл, будь-яка з цих груп необов'язково може бути заміщена одним або декількома замісниками. Переважні замісники в цьому контексті включають С-і.6алкіл (головним чином, метил), гідрокси, аміно, С2-6алкоксикарбоніл (головним чином, трет-бутоксикарбоніл) та ди(С16)алкіламіно (головним чином, диметиламіно). b Конкретні значення R включають водень, метил, 2-гідроксиетил, 3-гідроксипропіл, 1гідроксипроп-2-іл, 2,3-дигідроксипропіл, 2-аміно-2метилпропіл, 2,2-диметил-3-(диметиламіно)пропіл, циклопропіл метил, 1-третбутоксикарбонілазетидин-3-іл, піролідин-3-іл, 1трет-бутоксикарбонілпіролідин-3-іл, піперидин-3-іл, піперидин-4-іл, 1-метилпіперидин-4-іл, 1-третбутоксикарбоніл піперидин-3-іл, 1-третбутоксикарбоніл-піперидин-4-іл, 1-третбутоксикарбонілазетидин-3-ілметил, 2,2-диметил[1,3]діоксолан-4-ілметил, піролідин-2-ілметил, 2(морфолін-4-іл)етил та 3-(морфолін-4-іл)пропіл. b Типово R представляє водень; або С1-6 алкіл, необов'язково заміщений одним або кількома, переважно однією або двома, гідроксильними групами. b Типові значення R включають водень, метил, гідроксипропіл та дигідроксипропіл. В одному варіb b анті R представляє водень. В іншому варіанті R b представляє метил. У додатковому варіанті R представляє гідроксипропіл, головним чином, 3b гідроксипропіл. В іншому додатковому варіанті R представляє дигідроксипропіл, головним чином, 2,3-дигідроксипропіл. c В одному варіанті R являє собою водень. В c іншому варіанті R представляє С1-6алкіл, головc ним чином, метил. У додатковому варіанті R представляє гідрокси(С1-6)алкіл, наприклад гідроксиетил (головним чином, 2-гідроксиетил). b c Альтернативно, фрагмент -NR R може, відповідно, представляти азетидин-1-іл, піролідин-1-іл, піперидин-1-іл, морфолін-4-іл, тіоморфолін-4-іл, піперазин-1-іл, гомопіперидин-1-іл або гомоморфолін-4-іл, будь-яка з цих груп необов'язково може бути заміщена одним або декількома замісниками. b c Фрагмент -NR R також може представляти необов'язково заміщений гомопіперазин-1-іл. b c Окремі значення циклічного фрагменту -NR R включають азетидин-1-іл, піролідин-1-іл, піперидин-1-іл, морфолін-4-іл, піперазин-1-іл та гомопі 11 перазин-1-іл, будь-яка з цих груп необов'язково може бути заміщена одним або декількома замісниками. Конкретні значення циклічного фрагменту b c NR R включають 3-гідроксиазетидин-1-іл, 3аміноазетидин-1-іл, 3-(амінометил)азетидин-1-іл, 3-(трет-бутоксикарбоніламіно)азетидин-1-іл, 3(трет-бутоксикарбоніламінометил)азетидин-1-іл, піролідин-1-іл, 2-(метокси-метил)піролідин-1-іл, 3гідроксипіролідин-1-іл, 3-амінопіролідин-1-іл, 3(трет-бутоксикарбоніламіно)піролідин-1-іл, 2(гідроксиметил)піперидин-1-іл, 4-аміно-піперидин1-іл, 4-(трет-бутоксикарбоніламіно)піперидин-1-іл, морфолін-4-іл, 2-(гідрокси-метил)морфолін-4-іл, піперазин-1-іл, 4-метилпіперазин-1-іл, 2(гідроксиметил)-піперазин-1-іл, 4-(2гідроксиетил)піперазин-1-іл, 4(карбоксиметил)піперазин-1-іл, 4-(третбутоксикарбоніл)-2 (гідроксиметил)піперазин-1-іл, 4-(етоксикарбоніл метил)-піперазин-1-іл та гомопіперазин-1-іл. b c Відповідно, циклічний фрагмент -NR R може бути заміщений С1-6 алкілом, головним чином, меb c тилом. Окремі значення -NR R включають піролідин-1-іл, морфолін-4-іл та 4-метилпіперазин-1-іл. 3 a Типово R представляє ціано, -CO2R , b c b c a b c CONR R або -CON(OR )R , де R , R та R є таки3 ми, як визначено вище. Відповідно, R представa b c ляє ціано, -CO2R або -CONR R , головним чином, b c a b c ціано або -CONR R , де R , R та R є такими, як 3 визначено вище. Відповідно, R представляє b c b c CON(OR )R , де R та R є такими, як визначено вище. 3 В одному варіанті R представляє ціано. В ін3 a a шому варіанті R представляє -CO2R , де R ви3 значений вище. У наступному варіанті R предстаb c b c вляє -CONR R , де R та R є такими, як визначено 3 вище. У додатковому варіанті R представляє b c b c CON(OR )R , де R та R є такими, як визначено 3 вище. В іншому додатковому варіанті R представляє водень. Окрема підгрупа сполук у відповідності до винаходу представлена сполуками формули (II) та їх фармацевтично прийнятними солями, сольватами та N-оксидами: де 12 R представляє галоген; та 3 R являє собою як визначено вище. 12 В конкретному варіанті R - це бром. В іншому 12 специфічному варіанті R - це йод. Конкретні нові сполуки у відповідності до даного винаходу включають кожну сполуку, одержання 95939 12 якої описано в супровідних Прикладах, та їх фармацевтично прийнятні солі та сольвати. В даному винаході також пропонується фармацевтична композиція, що включає сполуку формули (І), як визначено вище, або її фармацевтично прийнятну сіль, сольват або N-оксид, в сполученні з одним або декількома фармацевтично прийнятними носіями. Фармацевтичні композиції у відповідності до винаходу можуть набувати форми, придатної для перорального, букального, парентерального, назального, місцевого, очного або ректального введення, або форму, придатну для прийому шляхом інгаляції або вдування. Для перорального прийому фармацевтичні композиції можуть набувати форми, наприклад, таблеток або капсул, виготовлених звичайним способом з такими фармацевтично прийнятними наповнювачами, як зв'язуючі агенти (наприклад, прежелатинізований кукурудзяний крохмаль, полівінілпіролідон або гідроксипропілметилцелюлоза); наповнювачі (наприклад, лактоза, мікрокристалічна целюлоза або гідрофосфат кальцію); змащувачі (наприклад, стеарат магнію, тальк або діоксид кремнію); речовини для подрібнення (наприклад, картопляний крохмаль або гліколят натрію); або зволожуючі агенти (наприклад, лаурилсульфат натрію). На таблетки можуть бути нанесені оболонки добре відомими методами. Рідкі препарати для перорального прийому можуть набувати форми, наприклад, розчинів, сиропів або суспензій, або вони можуть бути в сухому вигляді для розбавлення водою або іншим придатним розчинником перед застосуванням. Такі рідкі препарати можуть виготовлятися звичайним способом з такими фармацевтично придатними добавками, як суспендуючі засоби, емульгатори, неводні розчинники або консерванти. Препарати також можуть містити буферні солі, ароматизатори, барвники або солодкі речовини, відповідно. Препарати для перорального прийому можуть бути розроблені відповідно для одержання контрольованого вивільнення активної речовини. Для букального введення композиції можуть набувати форми таблеток, одержаних звичайним способом. Сполуки формули (І) можуть виготовлятися для парентерального введення шляхом ін'єкції, наприклад, ін'єкції ударної дози речовини або інфузії. Препарати для ін'єкції можуть бути представленими у формі одиничних доз, наприклад, у скляних ампулах, або в багатодозових контейнерах, наприклад, у скляних флаконах. Композиції для ін'єкцій можуть набувати таких форм, як суспензії, розчини або емульсії в масляних або водних розчинниках, і можуть містити такі агенти за розробленою рецептурою, як суспендуючі засоби, стабілізатори, консерванти та/або диспергувальні засоби. Альтернативно, активна складова частина може бути у формі порошку для утворення розчину з відповідним розчинником, наприклад, стерильною апірогенною водою, перед застосуванням. На додаток до описаних вище препаратів, сполуки формули (І) також можуть бути розроблені як препарати депо. Такі препарати тривалої дії 13 можуть бути введені шляхом імплантації або внутрішньом'язової ін'єкції. Для назального введення або введення шляхом інгаляції сполуки у відповідності до даного винаходу можуть придатним чином постачатися у формі аерозолю в герметичних упаковках або розпилювачах, із застосуванням відповідного стиснутого газу, наприклад, дихлордифторметану, фтортрихлорметану, дихлортетрафторетану, діоксиду вуглецю або іншого відповідного газу або суміші газів. Композиції можуть, за бажанням, бути вміщені до упаковки або дозуючого пристрою, який може містити одну або більше одиничних доз, що містять активну речовину. Упаковка або дозатор можуть супроводжуватися інструкціями з застосування. Для місцевого застосування сполуки у відповідності до даного винаходу можуть бути придатним чином виготовлені у формі відповідної мазі, що містить активний компонент, суспендований або розчинений в одному або декількох фармацевтично придатних носіях. Окремі носії включають, наприклад, мінеральне масло, вазелінове масло, пропіленгліколь, поліоксиетилен, поліоксипропілен, емульсійний віск та воду. Альтернативно, сполуки у відповідності до даного винаходу можуть бути введені у відповідний лосьйон, що містить активний компонент, суспендований або розчинений в одному або декількох фармацевтично придатних носіях. Окремі носії включають, наприклад, мінеральне масло, сорбітолмоностеарат, естер поліоксиетилену 60 та жирної кислоти, віск цетилових ефірів, цетеариловий спирт, бензиловий спирт, 2-октилдодеканол та воду. Для застосування в очі сполуки у відповідності до даного винаходу можуть придатним чином бути введені у мікронізовані суспензії в ізотонічному, стерильному сольовому розчині з встановленим рН, або з таким консервантом, як бактерицидний або фунгіцидний агент, наприклад, фенілртутьнітрат, хлорид бензалконію або ацетат хлоргексидину. Альтернативно, для застосування в очі сполуки можуть бути введені у вазелінову мазь. Для ректального застосування сполуки у відповідності до даного винаходу можуть придатним чином бути введені у супозиторії, які можна виготовити змішуванням активного компоненту з відповідним не подразнюючим наповнювачем, що являє собою тверду речовину при кімнатній температурі, але стає рідким при температурі прямої кишки, і тому буде плавитися в прямій кишці з вивільненням активного компоненту. Такі матеріали включають, наприклад, масло какао, бджолиний віск та поліетиленгліколі. Кількість сполуки за винаходом, необхідна для профілактики або лікування в конкретному випадку буде варіювати в залежності від вибраної сполуки та стану пацієнта, якого лікують. В цілому, однак, щоденні дози можуть коливатися в ряду від 10 нг/кг до 1000 мг/кг, звичайно від 100 нг/кг до 100 мг/кг, наприклад, приблизно від 0,01 мг/кг до 40 мг/кг маси тіла, для перорального прийому або букального введення, приблизно від 10 нг/кг до 50 мг/кг маси тіла для парентерального введення та 95939 14 від 0,05 мг до близько 1000 мг, наприклад, від близько 0,5 мг до близько 1000 мг для введення в ніс або введення шляхом інгаляції або вдування. Сполуки формули (І) вище та їх N-оксиди можуть бути одержані за способом, що включає реакцію сполуки формули (III) або її N-оксиду із сполукою формули (IV): 1 2 3 де R , R та R є такими, як визначено вище, та L представляє відповідну залишкову групу. 1 Групою L , яка уходить, звичайно є атом галогену, наприклад, хлору. Реакцію придатним чином проводять при підвищеній температурі у випадку необхідності, у відповідному розчиннику, наприклад диметилсульфоксиді, типово в основних умовах, наприклад в присутності такої неорганічної основи, як гідрид натрію. Проміжні сполуки формули (IV) вище можуть бути одержані шляхом реакції сполуки формули (V): 1 1 2 де R та R є такими, як визначено вище; з тіофосгеном. Реакцію придатним чином проводять у відповідному розчиннику, типово в суміші хлороформу та води. За іншою методикою сполуки формули (І) ви3 b c ще, де R представляє -CONR R або b c CON(OR )R , та їх N-оксиди, можуть бути одержані за способом, що включає реакцію сполуки формуb c b c ли H-NR R або H-N(OR )R із сполукою формули (VI), або її N-оксидом: 15 1 2 c де R , R , R та R є такими, як визначено вище; в присутності конденсуючого агента. Придатним конденсуючим агентом є 1-(3диметиламінопропіл)-3-карбодіімід гідрохлорид (EDC), у цьому випадку реакцію зручно проводити в присутності 1-гідроксибензотриазолу (НОВТ) та N-метилморфоліну (NMM). Сполуки формули (VI) вище можуть бути одержані за реакцією сполуки формули (VII): із сполукою формули (V), як визначено вище. Реакцію можна придатним чином проводити шляхом обробки сполуки (V) основою, наприклад біс(триметилсиліл)амідом літію, у відповідному розчиннику, наприклад тетрагідрофурані, з наступним додаванням сполуки (VII). Проміжна сполука формули (VII) вище може бути виготовлена зі сполуки формули (VIII): a де R є таким, як визначено вище; шляхом омилення ефірного фрагменту з наступним окисненням метилсульфанільної групи. a Омилення етильного фрагменту -CO2R у сполуці (VIII) може бути здійснено шляхом обробки лужним розчином, наприклад, гідроксиду натрію, у відповідному розчиннику, наприклад, у суміші води з таким нижчим спиртом, як метанол, і таким циклічним ефіром, як тетрагідрофуран. Подальше окиснення метилсульфанільної групи в одержаних сполуках може бути здійснено шляхом обробки відповідним окиснювачем, наприклад, Оксоном (пероксимоносульфатом калію), в придатному розчиннику, наприклад, водному метанолі. Проміжні сполуки формули (VIII) вище можуть бути одержані шляхом реакції сполуки формули 3 a (III), де R являє собою -CO2R , як визначено вище, з дисульфідом вуглецю, з наступною обробкою таким метил галогенідом, як йодметан. Реакцію придатним чином проводять у відповідному розчиннику, наприклад, у диметилсульфоксиді, в присутності основи, такої як гідрид натрію. Якщо вони комерційно не доступні, початкові матеріали формули (III) та (V) можна виготовити за способами, аналогічними описаним у супровідних Прикладах, або добре відомими стандартними способами. Слід розуміти, що будь-яка сполука формули (І), спочатку одержана в будь-якому згаданому 95939 16 вище способі, може, якщо необхідно, далі бути додатково перетворена на наступну сполуку формули (І) з допомогою відомих технологій. Для при3 кладу, сполука формули (І) де R представляє a CO2R може бути перетворена на відповідну спо3 луку, де R представляє -CONH2, шляхом обробки аміаком, звичайно розчиненого в нижчому спирті, наприклад етанолі, при підвищеній температурі та 3 тиску. Альтернативно, сполука формули (І), де R a представляє -CO2R , може бути перетворена на 3 b c відповідну сполуку, де R представляє -CONR R , шляхом обробки відповідним аміном формули Hb c NR R в присутності триметилалюмінію. Сполука 3 a формули (І), де R представляє -CO2R , може бути 3 перетворена на відповідну сполуку, де R представляє водень, шляхом обробки таким лужним реагентом, як гідроксид літію, в підсилюючих умовах, наприклад, при кип'ятінні із зворотним холодильником у суміші етанолу та води. Сполука фо3 рмули (І), де R містить фрагмент 2,2-диметил[1,3]діоксолан-4-ілметилу, може бути перетворена 3 на відповідну сполуку, де R містить фрагмент 2,3дигідроксипропілу, шляхом обробки такою мінеральною кислотою, як хлористоводнева кислота. 3 Сполука формули (І), де R містить атом азоту, до якого приєднана група трет-бутоксикарбонілу (ВОС), може бути перетворена на відповідну спо3 луку, де R містить функціональну групу N-H, шляхом обробки кислотою, наприклад такою мінеральною кислотою, як хлористоводнева кислота, або такою органічною кислотою, як трифтороцтова 3 кислота. Сполука формули (І), де R містить функціональну групу N-H, може бути перетворена на 3 відповідну сполуку, де R містить атом азоту, до якого приєднана група етоксикарбонілметилу, шляхом обробки етилхлорацетатом, звичайно в присутності триетиламіну; одержана сполука далі може бути перетворена на відповідну сполуку, де 3 R містить атом азоту, до якого приєднана карбоксиметильна група, шляхом обробки таким лужним реагентом, як гідроксид натрію, звичайно у водному розчині такого нижчого спирту, як етанол. Піридин-N-оксидне похідне сполуки формули (І) може бути перетворена на відповідну сполуку формули (І) шляхом обробки трифенілфосфіном і фосфору трихлоридом. Якщо суміш продуктів одержана в будь-який спосіб, описаний вище, для одержання сполук у відповідності до винаходу, цільовий продукт відокремлюють на відповідній стадії такими звичайними методами, як попередня рідинна хроматографія високого тиску; або через хроматографічну колонку, в якій використовується, наприклад, оксид кремнію та/або алюмінію в поєднанні з відповідною системою розчинників. Якщо описаний вище спосіб одержання сполук у відповідності до винаходу призводить до утворення сумішей стереоізомерів, такі ізомери можна розділити за допомогою звичайних технологій. Конкретно, якщо бажано одержати окремий оптичний ізомер сполуки формули (І), його можна виробити з відповідної суміші оптичних ізомерів з використанням будь-якої доступної звичайної методики розчинення оптичних ізомерів. Таким чином, наприклад, діастереомерні похідні, наприклад солі, 17 можуть бути утворені шляхом реакції суміші оптичних ізомерів формули (І), наприклад, рацемату, і відповідної хіральної сполуки, наприклад, хіральної основи. Далі діастереомери можна розділити будь-яким зручним способом, наприклад кристалізацією, та одержати знову бажаний оптичний ізомер, наприклад, шляхом обробки кислотою у випадку, де діастереоізомер являє собою сіль. В іншому способі розчинення рацемат формули (І) може бути розділений з використанням хіральної високоефективної рідинної хроматографії. Більше того, за бажанням окремий оптичний ізомер можна одержати з використанням відповідної хіральної проміжної сполуки в одному з описаних вище способів. Альтернативно, окремий оптичний ізомер можна одержати шляхом проведення специфічної для енантіомерів ферментної біотрансформації, наприклад, гідролізу естерів з використанням естерази, з наступним очищенням тільки гідролізованої кислоти з чистими оптичними ізомерами від ефірних антиподів, які не прореагували. Хроматографія, перекристалізація та інші звичайні процедури розділення також можуть застосовуватися для проміжних або кінцевих сполук, де бажано одержати окремий геометричний ізомер за винаходом. Протягом будь-якої з вищезгаданих послідовностей синтезу може бути необхідно та/або бажано захистити чутливі або реагуючі групи будь-якої з описаних молекул. Цього можна досягти за допомогою звичайних захисних груп, які описані в Protective Groups in Organic Chemistry, ed. J.F.W. McOmie, Plenum Press, 1973; and T.W. Greene & P.G.M. Wuts, Protective Groups in Organic rd Synthesis, John Wiley & Sons, 3 edition, 1999. Захисні групи можна видалити на будь-якій придатній наступній стадії, використовуючи відомі методи. Наступні Приклади ілюструють одержання сполук у відповідності до винаходу. Сполуки у відповідності до даного винаходу потужно інгібують фермент MEK людини. Аналіз MEK в лабораторних умовах Активність MEK1 вимірювали в ступінчастому аналізі, розпочатому активним Raf, через активацію MEK, Еrk2 та наступне фосфорилювання міченого флуоресцеїном Erk-tide субстрату в аналізі, що базується на поляризації флуоресценції (ІМАР). Проба проводилася в 20 мМ Трис + 5 мМ МgСІ2 + 2 мМ DL-дитіотреітол + 0,01% Твіну 20 (рН 7,2), що містить 1,5 нМ неактивного MEK, 100 нМ неактивного Erk та 200 нМ Erk-tide (усі концентрації являють собою кінцеві концентрації). Сполуки, або контроль ДМСО, перевіряли в кінцевій концентрації 2% ДМСО, та аналіз розпочинала в присутності 5 мкМ АТФ додаванням 1,25 нМ активного Raf у буфер для аналізу. Після проходження 20 хв при кімнатній температурі додавали кінцевий розчин з наступним додаванням крапель, які зв'язують ІМАР, суміш аналізу далі витримували 90 хв при кімнатній температурі (при перемішуванні) і потім зчитували на приладі для зчитування Molecular Devices LJL HT. Після перевірки в описаному вище аналізі було виявлено, що усі сполуки супровідних Прикла 95939 18 дів інгібують фермент MEK людини із значеннями ІС50 10 мкМ або ефективніше. Приклади Використані скорочення EtOAc - етилацетат ТГФ - тетрагідрофуран Ефір - діетиловий ефір МеОН - метанол EtOH - етанол DMF - Ν,Ν-диметилформамід SiO2 - оксид кремнію год - година (години) r.t. - кімнатна температура sat. - насичений ВОС - трет-бутоксикарбоніл ДМСО - диметилсульфоксид ДХМ -дихлорметан CDCI3 - дейтерохлороформ MeCN - ацетонітрил ES - електророзпилення НОВТ - 1-гідроксибензотриазол NMM - N-метилморфолін хв - хвилина (хвилини) водн. - водний RT - час утримання LiHMDS - літію біс(триметилсиліл) амід МСРВА - 3-хлорпероксибензойна кислота EDC - 1-(3-диметиламінопропіл)-3-карбодііміду гідрохлорид Усі спектри ЯМР одержували при 300 МГц або 400 МГц. Сполуки назвали за допомогою ACD Labs Name (версія 7.0), доставленого Advanced Chemical Development, Торонто, Канада. Стандартний метод РХМС Використана система РХ-МС містить четвертинну систему високоефективної рідинної хроматографії Waters Alliance 2795 НТ, детектор Waters 996 на фотодіодній матриці та один квадрупольний мас-спектрометр Waters ZQ 4000. ZQ, що може реєструвати дані одночасно в режимах іонізації електророзпиленням з позитивним та негативним зарядом. Мас-спектрометр ZQ Капілярний 3,5 кВ Екстрактор 2В Конус 50 В Температура 80°С джерела Температура 200°С Газ в конусі десольватації Газ для десо250 л/год Множник льватації 150 л/год. 650 В Дані одержані при повному скануванні від 100 до 1000 m/z. Тривалість сканування Затримка між скануванням 0,80 с 0,20 с Високоефективна рідинна хроматографія 19 95939 Аналітичне обернено-фазове розділення проводили на Gemini C18 від Phenomenex 50x4,6 мм з 5 мкМ кремнію оксидом. Об'єм ін'єкції Довжина хвилі УФ Температура зразка Температура колонки Швидкість потоку Розщеплення до ZQ 5 мкл від 240 до 400 нм 20°С 30°C 0,9 мл/хв ~0,40 мл/хв Розчинник А: 90% 10 мМ NH4CO2 у воді/0,1% мурашиної кислоти /10% CH3CN Розчинник В: 90% CH3CN/0,1% мурашиної кислоти/10% 10 мМ NH4CO2 у воді Розчинник С: 90% 10 мМ NH4CO2 у воді/0,1% аміаку/10% CH3CN Розчинник D: 90% CH3CN/10% 10 мМ NH4CO2 у воді/0,1% аміаку Програма Градієнту Для методу 5_95_рН=3 Час 0,00 2,00 4,00 5,00 (хв) А % 95,0 5,0 5,0 95,0 В% 5,0 95,0 95,0 5,0 Потік 0,900 0,900 0,900 0,900 Крива 1 6 6 6 Для методу 5_95_рН=10 Час 0,00 2,00 4,00 5,00 (хв) А % 95,0 5,0 5,0 95,0 В% 5,0 95,0 95,0 5,0 Потік 0,900 0,900 0,900 0,900 Крива 1 6 6 6 Препаративна УФ-ВЕРХ Система рідинної хроматографії включає четвертинний насос Waters 2525, детектор на фотодіоднія матриці Waters 996, пристрій управління пробами Waters 2700, Column Fluidics Organizer і Waters Fraction Collector, які працюють в оберненофазовому режимі при одному з двох значень рН систем. Система з низьким рН (приблизно рН 3,2) Відокремлення зворотної фази проводилося на Luna C18 від Phenomenex 100x21,2 мм з 5 мкм оксиду кремнію. Об'єм ін'єкції Довжина хвилі УФ Швидкість потоку Розчинник А Розчинник В 500 мкл 254 нм 20 мл/хв 90% води/0% CH3CN/0,1% мурашиної кислоти 90% CH3CN/10% води/0,1% мурашиної кислоти Система з високим рН (приблизно рН 9,5) Відокремлення зворотної фази проводилося на Gemini C18 від Phenomenex 150x21,2 мм з 10 мкм оксиду кремнію. Об'єм ін'єкції Ультрафіолетові 500 мкл 254 нм 20 дані Швидкість потоку Розчинник С Розчинник D 20 мл/хв 90 % 10мМ NH4HCO2 у воді/0,1%аміаку/10%CH3CN 90% СН3CN/10% 10 мΜ ΝΗ4НСО2 у воді /0,1%аміаку Типові параметри градієнта описані нижче: Програма градієнта для методу з низьким рН Час 0,00 9,00 11,00 11,50 12,00 А% 95,0 5,0 5,0 95,0 95,0 В% 5,,0 95,0 95,0 5,0 5,0 С% 0,,0 0,0 0,0 0,0 0,0 D% 0,0 0,0 0,0 0,0 0,0 Потік Крива 20 1 20 6 20 6 20 6 20 6 Програма градієнта для методу з високим РН Час 0,00 9,00 11,00 11,50 12,00 А% 0,0 0,0 0,0 0,0 0,0 В% 0,0 0,0 0,0 0,0 0,0 С% 95,0 5,0 5,0 95,0 95,0 D% 5,0 95,0 95,0 5,0 5,0 Потік Крива 20 1 20 6 20 6 20 6 20 6 Проміжна сполука 1 2-Фтор-4-йод-1-ізотіоціанатобензол Тіофосген (3,55 мл, 46,4 ммоль) додають при швидкому перемішуванні до суміші 2-фтор-4йоданіліну (10,0 г, 42,2 ммоль) в хлороформі (200 мл) та воді (100 мл). Суміш перемішують при кімнатній температурі протягом 16 годин. Органічну фракцію сушать (Na2SO4) та упарюють під вакуумом з одержанням названої в заголовку сполуки як не зовсім білої прозорої твердої речовини (11,8 г, кількісно). Η (ДМСО-d6) 7,87 (1Н, дд, J 1,8, 9,5 Гц), 7,63 (1Н, ддд, J 1,0, 1,8, 8,4 Гц), 7,25 (1Н, дд, J 8,2, 8,4 Гц). Проміжна сполука 2 Етил 2-[(4-бром-2-фторфеніл)аміно]тієно[2,3b]піридин-3-карбоксилат Виготовлена з етил(2-хлорпіридин-3іл)ацетату (D. Н. Bremner et al., Synthesis 1997, 949), (500 мг, 2,5 ммоль) та 4-бром-2фторфенілізотіоціанату (580 мг, 2,5 ммоль) за методом з Прикладу 1. Отримана титульна сполука як не зовсім біла тверда речовина (390 мг, 40%). Η (ДМСО-d6) 10,37 (1Н, ш с), 8,25 (1Н, дд, J 1,4, 8,1 Гц), 8,19 (1Н, д, J 4,8 Гц), 7,69 (1Н, дд, J 1,8, 10,2 Гц), 7,56-7,45 (2Н, м), 7,32 (1Н, дд, J 4,5, 8,1 Гц), 4,35 (2Н, к, J 7,1 Гц), 1,37 (3H, т, J 7,1 Гц). РХМС (іонізація електророзпиленням з позитивним зарядом) час утримання 4,66 хв, 395 79 + (М( Br)+Н) . Проміжна сполука 3 3-(трет-Бутилдиметилсиланілокси)пропіламін До розчину N-(3-гідроксипропіл)фталіміду (5,25 г, 24,36 ммоль) в ДМФА (20 мл) додають імідазол (16,6 г, 240 ммоль) і третбутилдиметилсилілхлорид (19 г, 120 ммоль). Реакційну суміш перемішують при кімнатній температурі протягом 18 годин до видалення летких речовин під вакуумом, і порцію сирого продукту 21 піддають хроматографії на колонках (SiO2, суміш ДХМ/гексан [1:1]) з одержанням 2-[3-(третбутилдиметил-силанілокси)пропіл]ізоіндол-1,3діону як прозорого масла (5 г). 2-[3-(третБутилдиметил-силанілокси)пропіл]ізоіндол-1,3діон (5 г, 26,4 ммоль) розчиняють в етанолі (50 мл) і додають метилгідразин (2,94 мл, 55,4 ммоль). Реакційну суміш нагрівають до 75°C, витримуючи при цій температурі протягом 8 годин перед упарюванням під вакуумом. Сирий залишок розтирають з сумішшю діетилового ефіру (150 мл) та гексану (50 мл) та одержану тверду речовину видаляють шляхом фільтрації. Розчинники видаляють під вакуумом з одержанням названої в заголовку сполуки у вигляді блідо-жовтого масла (1,8 г, 61%). Η (ДМСО-d6) 4,58 (2Н, ш с), 3,63-3,58 (2Н, м), 2,67-2,62 (2Н, м), 1,60-1,55 (2Н, м), 0,83 (9Н, д, J 1,1 Гц), 0,00 (6Н, д, J 1,2 Гц). РХМС (іонізація електророзпиленням з позитивним зарядом) час + утримання 1,77 хв, 190 (М+Н) . Проміжна сполука 4 Етиловий естер 2-метилсульфанілтієно[2,3b]піридин-3-карбонової кислоти. До розчину етил(2-хлорпіридин-3-іл)ацетату (D. Н. Bremner et al., Synthesis, 1997, 949) (8,0 г, 40,0 ммоль) і дисульфіду вуглецю (3,18 г, 42,0 ммоль) в ДМСО (100 мл) порціями додають гідрид натрію (2,4 г, 60,0 ммоль). Після перемішування протягом 60 хв при кімнатній температурі суміш нагрівають до 80°C, витримуючи при цій температурі протягом 2 годин. Після проходження цього часу реакційну суміш охолоджують до кімнатної температури та додають метилйодид (7,6 г, 54,0 ммоль). Після проходження 18 годин додають лід (50 мл), і утворюється жовтий осад, який відокремлюють шляхом фільтрації з одержанням названої в заголовку сполуки як сірої твердої речовини (7,95 г, 78%). Η (ДМСО-d6) 8,60 (1Н, дд, J 1,6, 8,2 Гц), 8,46, (1Н, дд, J 1,6, 4,6 Гц), 7,35 (1Н, дд, J 4,6, 8,2 Гц), 4,48 (2Н, к, J 7,1 Гц), 2,71, (3H, с), 1,49 (3H, т, J 7,1 Гц). Проміжна сполука 5 2-Метилсульфанілтієно[2,3-b]піридин-3карбонова кислота Суміш Проміжної сполуки 4 (12,5 г, 50,0 ммоль) в ТГФ (200 мл) та МеОН (50 мл) обробляють розчином гідроксиду натрію (10% розчин у воді, 50 мл) та перемішують при кімнатній температурі протягом 18 годин. Після проходження цього часу реакційну суміш доводять під вакуумом до третини початкового об'єму. Потім додають воду (50 мл) перед додаванням 10% НСІ, до утворення білого осаду. Його фільтрують для одержання названої в заголовку сполуки як білої кристалічної твердої речовини (10,6 г, 95%). Η (ДМСО-d6) 13,50-13,20 (1Н ш с), 8,55 (1Н, дд, J 1,2, 8,2 Гц), 8,48 (1Н, дд, J 1,3, 4,5 Гц), 7,49 (1Н,дд, J4,6, 8,2 Гц), 3,25 (3H, с). Проміжна сполука 6 2-Метансульфінілтієно[2,3-b]піридин-3карбонова кислота Оксон (14,5 г, 24,0 ммоль), розчинений у воді (25 мл), додають при швидкому перемішуванні до суміші Проміжної сполуки 5 (10,6 г, 47 ммоль) в метанолі (250 мл). Суміш перемішують при кімнат 95939 22 ній температурі протягом 4 годин. Реакційну суміш розділяють між ДХМ (300 мл) та водою (200 мл). Органічну фракцію сушать (Na2SO4) та упарюють під вакуумом з одержанням названої в заголовку сполуки як білої кристалічної твердої речовини (10,0 г, 88%). Η (ДМСО-d6) 14,20-13,80 (1Н, ш с), 8,73 (1Н, дд, J 1,7, 8,3 Гц), 8,69 (1Н, J 1,7, 4,6 Гц), 7,61 (1Н, дд, J 4,6, 8,3 Гц), 3,05 (3H, с). Проміжна сполука 7 2-[(2-Фтор-4-йодфеніл)аміно]тієно[2,3b]піридин-3-карбонова кислота При перемішуванні до розчину 2-фтор-4йоданіліну (6,0 г, 25 ммоль) в ТГФ (100 мл) при 0°C (льодяна баня) повільно додають LiHMDS (1,0 Μ розчин в ТГФ, 20,0 мл, 20,0 ммоль). Суміш перемішують при кімнатній температурі протягом 30 хв перед охолодженням до 0°C, та порціями додають Проміжну сполуку 6 (2,0 г, 8,3 ммоль). Суміш перемішують при кімнатній температурі протягом 1 години. Після проходження цього часу реакційну суміш виливають на лід і при кімнатній температурі додають лимонну кислоту до утворення осаду. Суміш фільтрують з одержанням названої в заголовку сполуки як блідо-коричневої твердої речовини (2,9 г, 84%). Η (ДМСО-d6) 14,00-13,00 (1Н, ш с), 10,80 (1Н, с), 8,36 (1Н, дд, J 1,3, 8,1 Гц), 8,32 (1Н, дд, J, 1,3, 4,8 Гц), 7,84 (1Н, дд, J 1,8, 10,1 Гц), 7,69 (1Н, д, J 8,3 Гц), 7,54 (1Н, м), 7,42 (1Н, дд, J 8,3, 4,8 Гц). Проміжна сполука 8 4-Йодо-1-ізотіоціанато-2-метилбензол До розчину 4-йод-2-метиланіліну (1,0 г, 4,2 ммоль) в ДХМ (50 мл) при перемішуванні додають воду (20 мл) з наступним додаванням тіофосгену (490 мг, 4,2 ммоль). Реакційну суміш перемішують протягом ночі перед розділенням шарів, висушуванням органічної фракції (Na2SO4) та випаровуванням під вакуумом з одержанням цільового продукту у вигляді твердої речовини коричневого кольору (1,05 г, 89%). Η (CDCI3) 7,75 (1Н, д, J 1,2 Гц), 7,62 (1Н, дд, J 1,2, 8,3 Гц), 7,15 (1H, д, J 8,3 Гц), 2,20 (3H, с). Проміжна сполука 9 2-Хлор-4-йод-1-ізотіоціанатобензол При перемішуванні до розчину 2-хлор-4йоданіліну (1,0 г, 3,9 ммоль) в ДХМ (50 мл) додають воду (20 мл) з наступним додаванням тіофосгену (476 мг, 4,1 ммоль). Реакційну суміш перемішують протягом ночі перед розділенням шарів та сушать органічну фракцію (Na2SO4) та випаровують під вакуумом з одержанням цільового продукту у вигляді твердої речовини коричневого кольору (1,0 г, 86%). Η (CDCI3) 7,79 (1Н, д, J 1,9 Гц), 7,58 (1Н, дд, J 1,9, 8,4 Гц), 6,97(1H, д, J 8,4 Гц). Проміжна сполука 10 (2R)-2-[({2-[(2-Фтор-4-йодфеніл)аміно]тієно[2,3b]піридин-3-карбоніл}аміно)-метил]піролідин-1карбонової кислоти трет-бутиловий ефір 1-(3-Диметиламінопропіл)-3-карбодііміду гідрохлорид (139 мг, 0,72 ммоль) додають до розчину Проміжної сполуки 7 (150 мг, 0,36 ммоль), 1гідроксибензотриазолу (98 мг, 0,72 ммоль), Nметилморфоліну (0,11 мл, 0,99 ммоль) та (R)-2(амінометил)-1-ВОС-піролідину (144 мг, 0,72 ммоль) у Ν,Ν-диметилформаміді (5 мл). Реакційну 23 суміш перемішують при кімнатній температурі протягом 20 годин, потім виливають в етилацетат (25 мл). Органічний розчин промивають насиченим розчином солі (3x25 мл), висушують (Na2SO4), фільтрують та упарюють під вакуумом з одержанням коричневої твердої речовини. Сирий продукт піддають хроматографії на колонках (SiO2, 4:1 гексану/ЕtOАс) з одержанням названої в заголовку сполуки, яку випарюють від ефіру з одержанням твердої піни (135 мг, 63%). Η (CDCI3) 11,67 (1Н, с), 8,35-8,33 (2Н, м), 8,04 (1Н, ш с), 7,54-7,43 (3H, м), 7,32-7,30 (1Н, м), 4,19 (1Н, м), 3,82-3,78 (1Н, м), 3,53-3,35 (3H, м), 2,18-1,86 (3H, м), 1,78 (1Н, м), 1,45 (9Н, с). Проміжна сполука 11 (2S)-2-[({2-[(2-Фтор-4-йодфеніл)аміно]тієно[2,3b]піридин-3-карбоніл}аміно)метил]піролідин-1карбонової кислоти трет-бутиловий ефір Одержують з Проміжної сполуки 7 (150 мг, 0,36 ммоль), 1-гідрокси-бензотриазолу (98 мг, 0,72 ммоль), N-метилморфоліну (0,11 мл, 0,99 ммоль), 1-(3-диметиламінопропіл)-3-карбодііміду гідрохлориду (139 мг, 0,72 ммоль) та (S)-2-(амінометил)-1ВОС-піролідину (144 мг, 0,72 ммоль) за методом Проміжної сполуки 10. Названу в заголовку сполуку випарюють з ефіру з одержанням безбарвної твердої піни (139 мг, 64%). Η (CDCI3) 11,67 (1Н, с), 8,35-8,33 (2Н, м), 8,04 (1Н, ш с), 7,54-7,43 (3H, м), 7,32-7,30 (1Н, м), 4,19 (1Н, м), 3,82-3,78 (1Н, м), 3,53-3,35 (3H, м), 2,18-1,86 (3H, м), 1,78 (1Н, м), 1,45 (9Н, с). Проміжна сполука 12 (2-Хлорпіридин-3-іл)оцтова кислота 2-Хлор-3-(ціанометил)піридин (D. Н. Bremner et al., Synthesis, 1997, 949) (10,3 г, 67,1 ммоль) в концентрованій НСІ (100 мл) кип'ятять із зворотним холодильником протягом 3 годин. Реакційну суміш упарюють під вакуумом і залишок суспендують у воді. Білу тверду речовину збирають фільтрацією і промивають водою, потім сушать під вакуумом з одержанням цільового продукту (11,15 г). Η (ДМСО-d6) 12,60 (1Н, ш с), 8,32 (1Н, дд, J 4,7, 1,9 Гц), 7,86 (1Н, дд, J 7,5, 1,9 Гц), 7,40 (1Н, дд, J 7,5, 4,7 Гц), 3,75 (2Н, с). РХМС (іонізація електророзпиленням з позитивним зарядом) час утриман+ ня 1,85 хв, 174 (М+Н) . Проміжна сполука 13 Метиловий ефір (2-хлорпіридин-3-іл)оцтової кислоти До суспензії Проміжної сполуки 12 (3,88 г, 22,6 ммоль) в метанолі додають ацетилхлорид (1,8 мл, 24,9 ммоль) і суміш нагрівають до 70°C, витримуючи при цій температурі протягом 18 годин. Розчинники видаляють під вакуумом з одержанням названої в заголовку сполуки як блідо-коричневого масла (4,63 г, кількісно). Η (ДМСО-d6) 8,35 (1Н, дд, J 4,7, 1,9 Гц), 7,88 (1Н, дд, J 8,5, 1,9 Гц), 7,43 (1Н, дд, J 8,5, 4,7 Гц), 3,80 (2Н, с), 3,65 (3H, с). РХМС (іонізація електророзпиленням з позитивним заря+ дом) час утримання 2,40 хв, 186 (М+Н) . Проміжна сполука 14 Метиловий ефір 2-[(2-фтор-4йодфеніл)аміно]тієно[2,3-b]піридин-3-карбонової кислоти 95939 24 До розчину Проміжної сполуки 13 (4,1 г, 22,1 ммоль) та Проміжної сполуки 1 (6,16 г, 22,1 ммоль) в сухому ДМСО в атмосфері азоту додають гідрид натрію (1,05 г, 24,3 ммоль, 60% [мас] дисперсія в мінеральному маслі). Суміш перемішують при кімнатній температурі протягом 15 хв, потім нагрівають до 90°C, витримуючи при цій температурі протягом 3 годин. Реакційну суміш охолоджують, потім виливають у льодяну воду (200 мл). Водну фракцію екстрагують етилацетатом (3 χ 200 мл), об'єднані органічні речовини промивають розчином солі, сушать (MgSO4), фільтрують і розчинники видаляють під вакуумом. Липку тверду речовину жовтого кольору розтирають з етанолом з одержанням жовтої твердої речовини, яку збирають фільтрацією, промивають діетиловим ефіром та сушать під вакуумом з одержанням названої в заголовку сполуки у вигляді твердої речовини блідо-жовтого кольору (1,73 г). Η (ДМСО-d6) 10,30 (1Н, с), 8,36-8,31 (2Н, м), 7,87 (1Н, дд, J 1,9, 10,0 Гц), 7,70 (1Н, д, J 6,6 Гц), 7,51 (1Н, т, J 8,5 Гц), 7,42 (1Н, дд, J 5,7, 8,1 Гц), 3,94 (3H, с). РХМС (іонізація електророзпиленням з позитивним зарядом) час + утримання 4,00 хв, 429 (МН-Н) . Проміжна сполука 15 2-(2-Хлорпіридин-3-іл)-N-метокси-Nметилацетамід Проміжну сполуку 12 (500 мг, 2,9 ммоль) в дихлорметані (20 мл) з N,0-диметилгідроксиламіном (300 мг, 3,04 ммоль), ЕДК (EDC, 583 мг, 3,04 ммоль) та N-метилморфоліном (0,98 мл, 8,70 ммоль) перемішують при кімнатній температурі протягом 18 годин. Реакційну суміш промивають 2 Μ НСІ, органічну фракцію сушать (сульфат магнію) та упарюють під вакуумом. Хроматографія (SiO2; суміш етилацетат/ДХМ [1:1]) в результаті видала названу сполуку (320 мг) у вигляді білої твердої речовини. Η (ДМСО-d6) 8,31 (1Н, дд, J 4,7, 1,9 Гц), 7,81 (1Н, дд, J 7,5, 1,9 Гц), 7,40 (1Н, дд, J 7,5, 4,7 Гц), 3,93 (2Н, с), 3,76 (3H, с), 3,15 (3H, с). РХМС (іонізація електророзпиленням з позитивним заря+ дом) час утримання 2,22 хв, 215/217 (М+Н) . Проміжна сполука 16 2-(2-Хлор-1-оксипіридин-3-іл)-N-метокси-Nметилацетамід Проміжну сполуку 15 (270 мг, 1,25 ммоль) розчиняють в ДХМ (5 мл) та обробляють м-ХПБК (mСРВА, 324 мг, 1,88 ммоль). Після перемішування при кімнатній температурі протягом 3 днів реакційну суміш виливають безпосередньо у випарювальну колонку та хроматографують (SiO2; етилацетат 5% метанолу в етилацетаті), в результаті одержують необхідний продукт (265 мг) у вигляді білої твердої речовини. Η (ДМСО-d6) 8,39 (1Н, дд, J 5,4, 2,5 Гц), 7,37-7,35 (2Н, м), 3,98 (2Н, с), 3,76 (3H, с), 3,15 (3H, с). РХМС (іонізація електророзпиленням з позитивним зарядом) час утри+ мання 1,81 хв, 231/233 (М+Н) . Приклад 1 Етил 2-[(2-фтор-4-йодфеніл)аміно]тієно[2,3b]піридин-3-карбоксилат Гідрид натрію (650 мг 60% дисперсії в мінеральному маслі, 16,2 ммоль) порціями додають протягом 10 хв до суміші Проміжної сполуки 1 (3,75 г, 13,5 ммоль) та етил(2-хлорпіридин-3-іл)ацетату 25 (D. Н. Bremner et al, Synthesis, 1997, 949) (2,7 г, 13,5 ммоль) в ДМСО (25 мл). Коли виділення газу уповільнюється, суміш нагрівають до 70°C, витримуючи при цій температурі протягом 3 годин, потім залишають при кімнатній температурі протягом ночі. Додають воду (150 мл) і зливають рідину з одержаної твердої речовини. Тверду масу обробляють етанолом (40 мл) з одержанням тонкої білої суспензії, яку фільтрують, промивають етанолом (10 мл) та ефіром (2x15 мл) та сушать під вакуумом при 40°C з одержанням названої в заголовку сполуки у вигляді білої твердої речовини (2,90 г, 48%). Η (ДМСО-d6) 10,40 (1Н, с), 8,40-8,30 (2Н, м), 7,85 (1Н, дд, J 1,9, 10,1 Гц), 7,70 (1Н, д, J 8,5 Гц), 7,55-7,49 (1Н, м), 7,43 (1Н, дд, J 4,9, 8,0 Гц), 4,43 (2Н, к, J 7,9 Гц), 1,41 (3H, т, J 7,9 Гц). РХМС (іонізація електророзпиленням з позитивним зарядом) + час утримання 5,27 хв, 443 (М+Н) . Приклад 2 2-[(2-Фтор-4-йодфеніл)аміно]-Nметилтієно[2,3-b]піридин-3-карбоксамід Триметилалюміній (1,5 мл 2 Μ розчину в гексані, 3,0 ммоль) додають до розчину метиламіну (1,5 мл 2 Μ розчину в ТГФ, 3,0 ммоль) в толуолі (5 мл). Після проходження 5 хв Приклад 1 (250 мг, 0,60 ммоль) додають і суміш нагрівають до 100°С, витримуючи при цій температурі протягом 4 годин. Після охолодження реакцію гасять за допомогою насиченого розчину хлориду амонію (75 мл) та НСІ (10 мл, 2 М), потім екстрагують етилацетатом (80 мл). Органічну фракцію сушать (Na2SO4) та упарюють під вакуумом з одержанням твердої речовини. Розтирання з ефіром (30 мл) та фільтрація дає названу сполуку у вигляді твердої речовини майже білого кольору (138 мг, 57%). Η (CDCI3) 11,13 (1Н, ш с), 8,25 (1Н, дд, J 1,4, 4,7 Гц), 7,80 (1Н, дд, J 1,4, 8,2 Гц), 7,46-7,42 (2Н, м), 7,33 (1Н, дд, J 8,3, 8,3 Гц), 7,21 (1Н, дд, J 4,7, 8,2 Гц), 5,82 (1Н, ш с), 3,00 (3H, д, J 4,8 Гц). РХМС (іонізація електророзпиленням з негативним зарядом) час утримання 3,63 хв, 426 (М-Н). Приклад 3 2-[(2-Фтор-4-йодфеніл)аміно]-N,Nдиметилтієно[2,3-b]піридин-3-карбоксамід Одержаний із сполуки за Прикладом 1 (100 мг, 0,23 ммоль) та диметиламіну (0,35 мл 2,0 Μ розчину в ТГФ, 0,7 ммоль) за методом з Прикладу 2. Названу сполуку одержують у вигляді білої твердої речовини (21 мг, 20%). Η (ДМСО-d6) 9,12 (1Н, с), 8,35 (1Н, дд, J 1,6, 4,7 Гц), 7,77 (1Н, дд, J 1,6, 8,1 Гц), 7,67 (1Н, дд, J 1,9, 10,6 Гц), 7,48 (1Н, дд, J 1,1, 1,9 Гц), 7,35 (1Н, дд, J 4,7, 8,0 Гц), 7,15-7,10 (1Н, м), 2,87 (6Н, с). РХМС (іонізація електророзпиленням з позитивним зарядом) час утримання 3,29 хв, + 442 (М+Н) . Приклад 4 N-(2-Фтор-4-йодфеніл)-3-(морфолін-4ілкарбоніл)тієно[2,3-b]піридин-2-амін) Одержаний із сполуки за Прикладом 1 (250 мг, 0,60 ммоль) та морфоліну (0,26 мл, 3 ммоль) за методом з Прикладу 2. Названу сполуку одержують у вигляді білої твердої речовини (215 мг, 78%). Η (ДМСО-d6) 9,22 (1Н, ш с), 8,34 (1Н, дд, J 1,4, 4,6 Гц), 7,81 (1Н, дд, J 1,4, 8,0 Гц), 7,68 (1Н, дд, J 1,9, 10,5 Гц), 7,50-7,46 (1Н, м), 7,35 (1Н, дд, J 4,6, 8,0 95939 26 Гц), 7,13 (1Н, дд, J 8,6, 8,6 Гц), 3,54-3,48 (4Н, м), 3,43-3,39 (4Н, м). РХМС (іонізація електророзпиленням з позитивним зарядом) час утримання 3,17 + хв, 484 (М+Н) . Приклад 5 N-(2-Фтор-4-йодфеніл)-3-[(4-метилпіперазин-1іл)карбоніл]-тієно[2,3-b]піридин-2-амін Триметилалюміній (1,5 мл 2 Μ розчину в гексані, 3,0 ммоль) додають до розчину 1метилпіперазину (0,333 мл, 3,0 ммоль) в толуолі (5 мл). Після проходження 10 хв додають сполуку за Прикладом 1 (250 мг, 0,60 ммоль) і толуол (2 мл) і суміш нагрівають до 90°C, витримуючи при цій температурі протягом 6 годин. Після охолодження суміш гасять за допомогою розчину NaOH (50 мл, 1 М) та екстрагують етилацетатом (50 мл плюс 25 мл). Об'єднані органічні екстракти промивають насиченим розчином солі (50 мл), сушать (Na2SO4) та упарюють під вакуумом з одержанням жовтої твердої речовини. Розтирання з гексаном/ефіром (10:1, 30 мл) та фільтрація дає названу сполуку у вигляді твердої речовини блідо-жовтого кольору (245 мг, 87%). Η (ДМСО-d6) 9,13 (1Н, ш с), 8,37 (1Н, ш д, J 4,4 Гц), 7,79 (1H, ш д, J 7,8 Гц), 7,67 (1H, ш д, J 10,4 Гц), 7,47 (1H, ш д, J 8,4 Гц), 7,37 (1H, дд, J 4,7, 8,1 Гц), 7,10 (1Н, м), 3,30 (4Н, ш с), 2,21 (4Н3 ш с), 2,14 (3H, с). РХМС (іонізація електророзпиленням з позитивним зарядом) час утри+ мання 2,09 хв, 497 (М+Н) . Приклад 6 2-[(4-Бром-2-фторфеніл)аміно]-N-(2,3дигідроксипропіл)тієно[2,3-b]піридин-3-карбоксамід Триметилалюміній (0,95 мл 2 Μ розчину в гексані, 1,90 ммоль) додають до розчину 2,2диметил-1,3-діоксолан-4-метанаміну (249 мг, 1,9 ммоль) в толуолі (4 мл). Після проходження 2 хв додають Проміжну сполуку 2 (150 мг, 0,38 ммоль) і суміш нагрівають до 90°C, витримуючи при цій температурі протягом 4 годин. Після охолодження реакцію гасять за допомогою насиченого розчину хлориду амонію (5 мл) та НСІ (5 мл, 2 М), перемішують, потім екстрагують етилацетатом (2x25 мл) та ДХМ (25 мл). Органічну фракцію сушать (Na2SO4) та упарюють під вакуумом з одержанням твердої речовини. Розтирання з ефіром/гексаном (1:3, 10 мл) та фільтрація дає названу сполуку у вигляді білої твердої речовини (95 мг, 57%). Η (ДМСО-d6) 10,64 (1Н, ш с), 8,36 (1Н, дд, J 1,4, 4,7 Гц), 8,20 (1Н, дд, J 1,4, 8,2 Гц), 7,89 (1Н, дд, J 8,8, 8,8 Гц), 7,69 (1Н, дд, J 2,1, 10,6 Гц), 7,58 (1Н, дд, J 8,8, 8,8 Гц), 7,48-7,41 (2Н, м), 4,86 (1Н, д, J 5,0 Гц), 4,64 (1Н, т, J 5,7 Гц), 3,72-3,66 (1Н, м), 3,52-3,36 (3H, м), 3,31- 3,22 (1Н, м). РХМС (іонізація електророзпиленням з позитивним зарядом) час утри79 + мання 2,80 хв, 440 (М( Br)+Н) . Приклад 7 2-[(2-Φтορ-4-йодфеніл)аміно]-N-(2,3дигідроксипропіл)тієно[2,3-b]піридин-3-карбоксамід Виготовлений з Прикладу 1 (150 мг, 0,34 ммоль) та 2,2-диметил-1,3-діоксолан-4-метанаміну (0,14 мл, 1,0 ммоль) за методом з Прикладу 6. Названу сполуку одержують у вигляді блідо-жовтої твердої речовини (94 мг, 57%). Η (ДМСО-d6) 10,68 (1Н, с), 8,36-8,35 (1Н, м), 8,20 (1Н, дд, J 1,2, 8,2 Гц), 7,90-7,87 (1Н, м), 7,76 (1Н, дд, J 1,7, 10,4 Гц), 27 7,62-7,59 (1Н, м), 7,45-7,40 (2Н, м), 4,86 (1Н, д, J 5,0 Гц), 4,64 (1Н, т, J 5,7 Гц), 3,72- 3,64 (1Н, м), 3,51-3,41 (3H, м), 3,40-3,34 (1Н, м). РХМС (іонізація електророзпиленням з позитивним зарядом) час + утримання 2,91 хв, 488 (М+Н) . Приклад 8 Етил 2-[(2-фтор-4-йодфеніл)аміно]тієно[2,3b]піридин-3-карбоксилат 7-оксид Одержують з Проміжної сполуки 1 (2,38 г, 8,58 ммоль) та етил(2-хлор-1-оксидопіридин-3іл)ацетату (D. Н. Bremner et al., Synthesis 1997, 949) (1,85 г, 8,58 ммоль) за методом з Прикладу 1. Названу сполуку одержують у вигляді твердої речовини блідо-жовтого кольору (3,10 г, 79%). Η (ДМСО-d6) 10,31 (1Н, ш с), 8,20 (1Н, д, J 5,9 Гц), 7,94 (1Н, д, J 7,8 Гц), 7,89 (1Н, дд, J 1,8, 10,0 Гц), 7,72 (1Н, д, J 8,4 Гц), 7,55-7,46 (2Н, м), 4,41 (2H, к, J 8,4 Гц), 1,40 (3H, т, J 7,1 Гц). РХМС (іонізація електророзпиленням з позитивним зарядом) час + утримання 3,44 хв, 459 (М+Н) . Приклад 9 Ν-(2,3-Дигідроксипропіл)-2-[(2-фтор-4йодфеніл)аміно]тієно[2,3-b]піридин-3-карбоксамід 7-оксид Одержують із сполуки за Прикладом 8 (200 мг, 0,43 ммоль) та 2,2-диметил-1,3-діоксолан-4метанаміну (0,18 мл, 1,3 ммоль) за методом з Прикладу 6. Названу сполуку одержують у вигляді білої твердої речовини (32 мг, 15%). Η (ДМСО-d6) 10,60 (1Н, с), 8,22 (1Н, м), 7,90 (1Н, с), 7,84-7,76 (2Н, м), 7,64-7,60 (1Н, м), 7,45-7,40 (2Н, м), 4,78 (1Н, д, J 4,9 Гц), 4,64 (1Н, т, J 5,6 Гц), 3,70-3,60 (1H, м), 3,50-3,15 (4Н, м). РХМС (іонізація електророзпиленням з негативним зарядом) час утримання 2,37 хв, 502 (М-Н). Приклад 10 2-[(2-Фтор-4-йодфеніл)аміно]тієно[2,3b]піридин-3-карбонітрил До розчину (2-хлорпіридин-3-іл)ацетонітрилу (D. H. Bremner et al., Synthesis 1997, 949) (700 мг, 4,59 ммоль) та Проміжної сполуки 1 (1,28 г, 4,60 ммоль) в сухому ДМСО (15 мл) додають гідрид натрію (202 мг, 60% в мінеральному маслі, 5,06 ммоль). Суміш перемішують при кімнатній температурі протягом 15 хв перед нагріванням до 90°C, витримуючи при цій температурі протягом 4 годин. Реакційну суміш виливають у воду (80 мл), твердий осад відфільтровують і промивають водою/етанолом (суміш 2:1, 50 мл) з наступним додаванням діетилового ефіру/гексану (суміш 1:1, 20 мл). Тверду речовину сушать у вакуумній печі та перекристалізують з суміші етанол/вода з одержанням названої в заголовку сполуки у вигляді блідо-коричневої твердої речовини (800 мг, 45%). Η (ДМСО-d6) 10,40 (1Н, с), 8,37 (1Н, дд, J 1,3, 4,6 Гц), 7,83-7,81 (2Н, м), 7,64 (1Н, д, J 8,3 Гц), 7,44 (1Н, дд, J 4,7, 8,0 Гц), 7,33 (1Н, дд, J 8,3, 8,3 Гц). РХМС час утримання 3,08 хв, (іонізація електророзпиленням з негативним зарядом) 394 (М-Н), (іонізація електророзпиленням з позитивним заря+ дом) 396 (М+Н) . Приклад 11 Амід 2-[(2-фтор-4-йодфеніл)аміно]тієно[2,3b]піридин-3-карбонової кислоти 95939 28 Розчин сполуки за Прикладом 1 (250 мг, 0,56 ммоль) в етанолі (5 мл) додають до рідкого аміаку (15 мл), і суміш нагрівають в апараті Парра до 2 95°C при 800 фунт/дюйм протягом 18 годин. Леткі речовини видаляють під вакуумом з одержанням маслянистого коричневого залишку. Повторне розтирання з етанолом та ДХМ дає названу сполуку у вигляді білої твердої речовини (18 мг). Η (ДМСО-d6) 11,20 (1Н, бс), 8,34 (1Н, д, J 3,4 Гц), 8,20 (1Н, дд, J 8,2, 1,3 Гц), 7,76 (1Н, дд, J 10,4, 1,8 Гц), 7,62 (1Н, д, J 8,2 Гц), 7,57 (2Н, ш с), 7,49-7,39 (2H, м). РХМС (іонізація електророзпиленням з позитивним зарядом) час утримання 3,11 хв, 412 + (М+Н) . Приклад 12 [2-[(2-Фтор-4-йодфеніл)аміно]тієно[2,3b]піридин-3-іл(піролідин-1-іл)-метанон Одержують із сполуки за Прикладом 1 (250 мг, 0,60 ммоль) та піролідину (0,25 мл, З ммоль) за методом з Прикладу 2. Названу сполуку одержують у вигляді твердої речовини блідо-жовтого кольору (136 мг, 51%). Η (ДМСО-d6) 9,21 (1Н, ш с), 8,35 (1Н, дд, J 1,6, 4,7 Гц), 7,81 (1Н, дд, J 1,6, 8,1 Гц), 7,67 (1Н, дд, J 1,9, 10,5 Гц), 7,50-7,46 (1Н, м), 7,35 (1Н, дд, J 4,7, 8,1 Гц), 7,13 (1Н, дд, J 8,6, 8,6 Гц), 3,32-3,30 (4Н, м), 1,78-1,73 (4Н, м). РХМС (іонізація електророзпиленням з позитивним заря+ дом) час утримання 3,32 хв, 468 (М+Н) . Приклад 13 (3-Гідрокси-пропіл)амід 2[(2-фтор-4йодфеніл)аміно]тієно[2,3-b]піридин-3-карбонової кислоти Сполуку за Прикладом 1 (500 мг, 1,13 ммоль) розчиняють в сухому толуолі (6 мл) в атмосфері азоту. До одержаного розчину додають триметилалюміній (2,83 мл 2 Μ розчину в гексані, 5,66 ммоль) протягом 5 хв. Після проходження 10 хв додають розчин Проміжної сполуки 3 (1,07 г, 5,66 ммоль) в сухому толуолі (5 мл) та нагрівають реакційну суміш до 100°C, витримуючи при цій температурі протягом 6 годин. Реакційну суміш охолоджують до кімнатної температури та обробляють 2 Μ НСІ (10 мл) і водою (30 мл). Суміш екстрагують етилацетатом (3x50 мл), потім органічні фракції сушать над сульфатом натрію та фільтрують і розчинники забирають під вакуумом. Сирий залишок розчиняють в метанолі (30 мл), обробляють 2 Μ НСІ (20 мл) та перемішують при кімнатній температурі протягом 18 годин. Суміш упарюють під вакуумом, обробляють 2 Μ розчином NaOH (20 мл) та екстрагують етилацетатом (3x50 мл). Органічні фракції сушать над сульфатом натрію, фільтрують та видаляють леткі речовини під вакуумом. Твердий залишок розтирають з діетиловим ефіром (10 мл) та сушать у вакуумній духовці з одержанням названої в заголовку сполуки у вигляді твердої речовини блідо-жовтого кольору (100 мг, 19%). Η (ДМСО-d6) 10,75 (1Н, ш с), 8,35 (1Н, м), 8,17 (1Н, д, J 7,9 Гц), 8,01 (1Н, ш с), 7,75 (1Н, д, J 10,1 Гц), 7,59 (1Н, д, J 8,1 Гц), 7,44-7,41 (2Н, м), 4,55 (1Н, т, J 5,1 Гц), 3,54-3,48 (2Н, м), 3,41-3,34 (2Н, м), 1,75-1,67 (2Н, м). РХМС (іонізація електророзпиленням з позитивним зарядом) час утримання 3,22 хв, 472 + (М+Н) . Приклад 14 29 (2(S),3-Дигідроксипропіл)амід 2-[(2-фтор-4йодфеніл)аміно]тієно[2,3-b]піридин-3-карбонової кислоти Одержують із сполуки за Прикладом 1 (1,0 г, 2,26 ммоль) та (S)-(2,2-диметил-1,3-діоксолан-4іл)метиламіну (1,48 г, 11,3 ммоль) за методом з Прикладу 6. Названу сполуку одержують у вигляді білої твердої речовини (425 мг, 39%). Η (ДМСО-d6) 10,67 (1Н, бс), 8,36 (1Н, д, J3,8 Гц), 8,20 (1H, д, J 8,5 Гц), 7,88 (1H, бс), 7,76 (1H, д, J 10,5 Гц), 7,61 (1Н, д, J 8,5 Гц), 7,46-7,40 (2Н, м), 4,86 (1Н, д, J 5,0 Гц), 4,64 (1Н, т, J 5,7 Гц), 3,72-3,67 (1Н, м), 3,523,38 (3H, м), 3,30-3,22 (1Н, м). РХМС (іонізація електророзпиленням з позитивним зарядом) час + утримання 2,91 хв, 488 (М+Н) . Приклад 15 (2(R),3-Дигідроксипропіл)амід 2-[(2-фтор-4йодфеніл)аміно]тієно[2,3-b]піридин-3-карбонової кислоти Одержують із сполуки за Прикладом 1 (500 мг, 1,13 ммоль) та (R)-(2,2-диметил-1,3-діоксолан-4іл)метиламіну (655 г, 4,52 ммоль) за методом з Прикладу 6. Названу сполуку одержують у вигляді білої твердої речовини (100 мг, 18%). Η (ДМСО-d6) 10,67 (1Н, бс), 8,36 (1Н, д, J 3,8 Гц), 8,20 (1Н, д, J 8,5 Гц), 7,88 (1Н, бс), 7,76 (1Н, д, J 10,5 Гц), 7,61 (1Н, д, J 8,5 Гц), 7,46-7,40 (2Н, м), 4,86 (1Н, д, J 5,0 Гц), 4,64 (1Н, т, J 5,7 Гц), 3,72-3,67 (1Н, м), 3,523,38 (3H, м), 3,30-3,22 (1Н, м). РХМС (іонізація електророзпиленням з позитивним зарядом) час + утримання 2,91 хв, 488 (М+Н) . Приклад 16 Метиламід 2-[(4-бром-2фторфеніл)аміно]тієно[2,3-b]піридин-3-карбонової кислоти Одержують з Проміжної сполуки 2 (150 мг, 0,38 ммоль) та 2 Μ розчину метиламіну в ТГФ (0,95 мл, 1,9 ммоль) за методом з Прикладу 2. Названу сполуку одержують у вигляді білої твердої речовини (125 мг, 87%). Η (ДМСО-d6) 10,83 (1Н, бс), 8,35 (1Н, дд, J 1,4, 4,6 Гц), 8,18 (1Н, дд, J 1,4, 8,2 Гц), 7,92 (1Н, бс), 7,69 (1Н, дд, J 2,1, 10,6 Гц), 7,59 (1Н, дд, J 8,8, 8,8 Гц), 7,48-7,43 (1Н, м), 7,42 (1Н, дд, J 8,2, 4,6 Гц), 2,83 (3H, д, J 4,5 Гц). РХМС (іонізація електророзпиленням з позитивним заря79 81 дом) час утримання 3,45 хв, 380/382 [Br /Br ] + (М+Н) . Приклад 17 Етиловий ефір 2-[(4-йодфеніл)аміно]тієно[2,3b]піридин-3-карбонової кислоти Одержують з етил(2-хлорпіридин-3-іл)ацетату (D. Н. Bremner et al., Synthesis 1997, 949) (750 мг, 3,8 ммоль) та 4-йодфенілізотіоціанату (1,0 г, 3,8 ммоль) за методом з Прикладу 1. Названу сполуку одержують у вигляді твердої речовини майже білого кольору (800 мг, 50%). Η (ДМСО-d6) 10,34 (1Н, ш с), 8,33-8,30 (2Н, м), 7,79 (2Н, дт, J 2,0, 6,7 Гц), 7,43-7,31 (3H, м), 4,40 (2Н, к, J 7,1 Гц), 1,40 (3H, т, J 7,1 Гц). РХМС (іонізація електророзпиленням з позитивним зарядом) час утримання 4,31 хв, + 425 (М+Н) . Приклад 18 2-[(4-Йодо-2-метилфеніл)аміно]тієно[2,3b]піридин-3-карбонітрил 95939 30 При перемішуванні до розчину Проміжної сполуки 8 (429 мг, 3,28 ммоль) та (2-хлорпіридин-3іл)ацетонітрилу (D. Н. Bremner et al., Synthesis 1997, 949) (500 мг, 3,28 ммоль) в ДМСО (20 мл) додають гідрид натрію (164 мг, 4,1 ммоль). Коли виділення газів закінчується, реакційну суміш нагрівають протягом 3 годин при 80°С. Після проходження цього часу реакційну суміш виливають на лід та екстрагують у ДХМ (2x50 мл). Органічні фракції сушать (Na2SO4) і потім випаровують під вакуумом з одержанням коричневого залишку. Хроматографія на колонках (SiO2, суміш гексан/етилацетат [5:1]) дає названу сполуку у вигляді жовтого порошку (198 мг, 15%). Η (ДМСО-d6) 10,11 (1Н, с), 8,29 (1Н, дд, J 1,5, 4,7 Гц), 7,75 (2Н, м), 7,63 (1Н, дд, J 1,7, 8,1 Гц), 7,39 (1Н, дд, J 8,1, 4,8 Гц), 7,19 (1Н, д, J 8,3 Гц), 2,24 (3H, с). РХМС (іонізація електророзпиленням з позитивним заря+ дом) час утримання 3,68 хв, 392 (М+Н) . Приклад 19 2-[(4-Бром-2-фторфеніл)аміно]тієно[2,3b]піридин-3-карбонітрил 4-Бром-2-фтор-1-ізотіоціанатобензол (250 мг, 1,08 ммоль) та (2-хлорпіридин-3-іл)ацетонітрил (D. Н. Bremner et al., Synthesis 1997, 949) (165 мг, 1,08 ммоль) перемішують у ДМСО (20 мл) і порціями додають гідрид натрію (52 мг, 1,3 ммоль). Після закінчення виділення газів реакційну суміш нагрівають протягом 4 годин при 80°C. Після проходження вказаного часу реакційну суміш додають до льоду (50 мл) і утворюється осад, який відфільтровують та очищують препаративною рідинною хроматографією високого тиску (рН 10, 2-3 хв) з одержанням названої в заголовку сполуки у вигляді білого порошку (30 мг, 9%). Η (ДМСО-d6) 10,45 (1Н, с), 8,31 (1Н, д, J 3,9 Гц), 7,75 (2Н, м), 7,51-7,38 (3H, м). РХМС (іонізація електророзпиленням з позитивним зарядом) час утримання 3,49 + хв, 350 (М+Н) . Приклад 20 2-[(2-Хлор-4-йодфеніл)аміно]тієно[2,3b]піридин-3-карбонітрил Проміжну сполуку 9 (300 мг, 1,01 ммоль) та (2хлорпіридин-3-іл)ацетонітрил (D. Н. Bremner et al., Synthesis 1997, 949) (165 мг, 1,01 ммоль) перемішують разом у ДМСО (20 мл) та порціями додають гідрид натрію (48 мг, 1,21 ммоль). Після закінчення виділення газів реакційну суміш нагрівають протягом 4 годин при 80°C. Після проходження цього часу реакційну суміш додають до льоду (50 мл) і потім екстрагують в ДХМ (2x50 мл), який сушать (Na2SO4) та упарюють під вакуумом з одержанням жовтого залишку. Одержаний залишок піддають хроматографії на колонках (SiO2, суміш етилацетат/гексан [1:4]) з одержанням названої в заголовку сполуки у вигляді жовтого порошку (118 мг, 28%). Η (ДМСО-d6) 10,38 (1Н, с), 8,35 (1Н, дд, J 1,5, 4,8 Гц), 8,00 (1Н, д, J 1,9 Гц), 7,80 (2Н, м), 7,42 (1H, дд, J 8,0, 4,8 Гц), 7,35 (1Н, д, J 8,3 Гц). РХМС (іонізація електророзпиленням з позитивним заря+ дом) час утримання 3,70 хв, 412 (М+Н) . Приклад 21 (2-Аміно-2-метилпропіл)амід 2-[(2-фтор-4йодфеніл)аміно]тієно[2,3-b]піридин-3-карбонової кислоти 31 Триметилалюміній (2,85 мл 2 Μ розчину в гексані, 5,7 ммоль) додають до розчину 1,2-діаміно-2метилпропану (498 мг, 5,7 ммоль) в толуолі (5 мл). Після проходження 10 хв додають Приклад 1 (500 мг, 1,13 ммоль) і нагрівають суміш до 100°C, витримуючи при цій температурі протягом 4 годин. Після охолодження реакцію гасять за допомогою 10% розчину гідроксиду натрію (75 мл) та екстрагують етилацетатом (100 мл). Органічну фракцію сушать (Na2SO4) та упарюють під вакуумом з одержанням твердої речовини. Розтирання з гексаном (30 мл) та фільтрація дає названу сполуку у вигляді твердої речовини жовтого кольору (248 мг, 45%). Η (DMSO-d6) 10,72 (1Н, м), 8,43 (1Н, дд, J 1,7, 8,0 Гц), 7,84 (1Н, ДД, J 1,7, 4,7 Гц), 7,80-7,40 (2Н, с), 7,46-7,35 (2Н, м), 7,21 (1Н, м), 7,00 (1Н, дд, J 4,7, 8,0 Гц), 3,40 (2Н, д, J 5,7 Гц), 1,25 (6Н, с). РХМС (іонізація електророзпиленням з позитив+ ним зарядом) час утримання 2,23 хв, 501 (М+Н) . Приклад 22 [(4R)-2,2-Диметил-[1,3]діоксолан-4ілметокси]амід 2-[(2-фтор-4йодфеніл)аміно]тієно[2,3-b]піридин-3-карбонової кислоти 1-(3-Диметиламінопропіл)-3-карбодііміду гідрохлорид (131 мг, 0,68 ммоль) додають до розчину Проміжної сполуки 7 (142 мг, 0,34 ммоль), 1гідроксибензотриазолу (93 мг, 0,68 ммоль), Nметилморфоліну (0,10 мл, 0,94 ммоль) та (4R)-2,2диметил-[1,3]діоксолан-4-ілметоксиламіну (WO 02/006213) (101 мг, 0,68 ммоль) у Ν,Νдиметилформаміді (5 мл). Реакційну суміш перемішують при кімнатній температурі протягом 20 годин, потім виливають в етилацетат (25 мл). Органічний розчин промивають насиченим розчином солі (2x25 мл), потім сушать (Na2SO4), фільтрують та упарюють під вакуумом з одержанням коричневої твердої речовини. Сирий продукт піддають хроматографії на колонках (SiO2, 2:1 гексан/етилацетат) з одержанням названої в заголовку сполуки у вигляді блідо-жовтого порошку (135 мг, 95%). Η (ДМСО-d6) 10,98 (1Н, с), 8,74 (1Н, с), 8,28-8,26 (1Н, м), 7,94-7,91 (1Н, м), 7,48-7,46 (2Н, м), 7,37-7,32 (1Н, м), 7,23 (1Н, дд, J 4,8, 8,2 Гц), 4,46-4,40 (1Н, м), 4,17 (1Н, дд, J 3,8, 11,7 Гц), 4,114,01 (2Н, м), 3,79 (1Н, дд, J 7,0, 8,3 Гц), 1,15 (3H, с), 1,10 (3H, с). РХМС час утримання 3,38 хв, (іонізація електророзпиленням з негативним зарядом) 542 (М-Н), (іонізація електророзпиленням з пози+ тивним зарядом) 544 (М+Н) . Приклад 23 [(2R)-2,3-Дигідроксипропокси]амід 2-[(2-фтор4-йодфеніл)аміно]тієно[2,3-b]піридин-3-карбонової кислоти Розчин Прикладу 22 (125 мг, 0,23 ммоль) в метанолі (5 мл) та ТГФ (5 мл) обробляють 10% водним розчином НСІ (5 мл). Реакційну суміш перемішують протягом 3,5 годин при кімнатній температурі, потім розбавляють етилацетатом (25 мл). Органічний розчин промивають насиченим розчином солі (2x25 мл), потім сушать (Na2SO4), фільтрують та упарюють під вакуумом з одержанням названої в заголовку сполуки у вигляді білого порошку, який промивають етилацетатом, потім гексаном, та сушать під вакуумом (76 мг, 66%). Η 95939 32 (ДМСО-d6) 11,31 (1Н, с), 10,33 (1Н, с), 8,34-8,33 (1Н, м), 8,12-8,09 (1Н, м), 7,79-7,76 (1Н, м), 7,637,60 (1Н, м), 7,45-7,40 (2Н, м), 4,89-4,88 (1Н, м), 4,62-4,59 (1Н, м), 3,99-3,97 (1Н, м), 3,85-3,80 (2Н, м), 3,43 (2Н, м). РХМС час утримання 3,38 хв, (іонізація електророзпиленням з негативним зарядом) 502 (М-Н), (іонізація електророзпиленням з + позитивним зарядом) 504 (М+Н) . Приклад 24 трет-Бутиловий ефір (1-{2-[(2-фтор-4йодфеніл)аміно]тієно[2,3-b]піридин-3карбоніл}піперидин-4-іл)-карбамінової кислоти Одержують з Проміжної сполуки 7 (150 мг, 0,36 ммоль), 1-гідроксибензотриазолу (98 мг, 0,72 ммоль), N-метилморфоліну (0,11 мл, 0,99 ммоль), 1-(3-диметиламінопропіл)-3-карбодііміду гідрохлориду (139 мг, 0,72 ммоль) та 4-(ВОС-аміно)піперидину (145 мг, 0,72 ммоль), за методом з Прикладу 22. Названу в заголовку сполуку випарюють з ефіру з одержанням безбарвної твердої піни (111 мг, 51%). Η (CDCI3, містить ротаційні ізомери) 9,17 (0,64H, с), 8,90 (0,36H, с), 8,39-8,37 (1H, м), 7,75-7,73 (0,36H, м), 7,66-7,63 (0,64H, м), 7,53-7,50 (2Н, м), 7,44-7,39 (1Н, м), 7,31-7,28 (1Н, м), 4,57 (0,36H, м), 4,40 (0,64H, м), 4,20-4,15 (1,28H, м), 4,03-3,98 (0,72H, м), 3,72 (1Н, м), 3,163,08 (2Н, м), 2,05-2,00 (2Н, м), 1,47 (3,2H, с), 1,44 (5,8H, с), 1,36-1,28 (2Н, м). РХМС час утримання 3,36 хв, (іонізація електророзпиленням з негативним зарядом) 595 (М-Н), (іонізація електророзпи+ ленням з позитивним зарядом) 597 (М+Н) . Приклад 25 Дигідрохлорид (4-амінопіперидин-1-іл)аміду 2[(2-фтор-4-йодфеніл)аміно]тієно[2,3-b]піридин-3карбонової кислоти Розчин сполуки за Прикладом 24 (99 мг, 0,17 ммоль) в метанолі (2 мл) обробляють 4 Μ НСІ в 1,4-діоксані (5 мл) та перемішують при кімнатній температурі протягом 3 годин. Реакційну суміш упарюють під вакуумом з одержанням жовтої камеді, яку розчиняють у воді (25 мл). Водний розчин промивають ефіром (2x25 мл) і потім випаровують під вакуумом. Одержану камедь розтирають з ефіром з одержанням названої в заголовку сполуки у вигляді жовтого порошку (89 мг, 94%). Η (ДМСОd6, містить поворотні ізомери) 9,24 (0,5H, с), 9,14 (0,5H, с), 8,38-8,37 (1H, м), 8,13 (3H, ш с), 7,82-7,75 (1H, м), 7,72-7,66 (1H, м), 7,55-7,47 (1Η, м), 7,38 (1H, дд, J 4,7, 8,1 Гц), 7,23-7,10 (1H, м), 4,02 (2H, ш м), 3,25 (1H, ш м), 3,06-2,98 (1H, м), 2,88-2,81 (1H, м), 1,93-1,89 (2H, м), 1,43 (2H, ш м). РХМС час утримання 2,86 хв, (іонізація електророзпиленням + з позитивним зарядом) 497 (М+Н) . Приклад 26 (2-Гідрокси-1-метилетил)амід 2-[(2-фтор-4йодфеніл)аміно]тієно[2,3-b]піридин-3-карбонової кислоти Одержують з Проміжної сполуки 7 (150 мг, 0,36 ммоль), 1-гідроксибензотриазолу (98 мг, 0,72 ммоль), N-метилморфоліну (0,11 мл, 0,99 ммоль), 1-(3-диметиламінопропіл)-3-карбодііміду гідрохлориду (139 мг, 0,72 ммоль) та 2-амінопропанолу (0,06 мл, 0,72 ммоль), за методом з Прикладу 22. Сирий продукт піддають хроматографії на колонках (SiO2, 1:1 гексан/етилацетат) з одержанням 33 названої в заголовку сполуки, яку перекристалізують з суміші етилацетат/гексан з одержанням бежевого порошку (56 мг, 33%). Η (ДМСО-d6) 10,45 (1H, с), 8,37-8,36 (1H, м), 8,16-8,13 (1H, м), 7,767,71 (2H, м), 7,60- 7,57 (1Н, м), 7,46-7,36 (2H, м), 4,78 (1H, т, J 5,6 Гц), 4,10-4,03 (1H, м), 3,52-3,35 (2H, м), 1,13 (3H, д, J 6,7 Гц). РХМС час утримання 3,46 хв, (іонізація електророзпиленням з позитив+ ним зарядом) 472 (М+Н) . Приклад 27 трет-Бутиловий ефір 3-[({2-[(2-фтор-4йодфеніл)аміно]тієно[2,3-b]піридин-3карбоніл}аміно)метил]-азетидин-1-карбонової кислоти Одержують з Проміжної сполуки 7 (150 мг, 0,36 ммоль), 1-гідроксибензотриазолу (98 мг, 0,72 ммоль), N-метилморфоліну (0,11 мл, 0,99 ммоль), 1-(3-диметиламінопропіл)-3-карбодііміду гідрохлориду (139 мг, 0,72 ммоль) та 1-ВОС-3(амінометил)азетидину (135 мг, 0,72 ммоль), за методом з Прикладу 22. Сирий продукт піддають хроматографії на колонках (SiO2, 3:2 гексан/етилацетат) з одержанням названої в заголовку сполуки, яку перекристалізують з ефіру/гексану з одержанням порошку кремового кольору (116 мг, 55%). Η (CDCI3) 8,37 (1H, дд, J 1,3, 4,7 Гц), 7,84 (1H, дд, J 1,3, 8,2 Гц), 7,56-7,53 (2H, м), 7,46-7,41 (1H, м), 7,32 (1H, дд, J 4,7, 8,2 Гц), 6,08 (1H, м), 4,14-4,09 (2H, м), 3,77-3,73 (4H, м), 2,94-2,92 (1H, м), 1,46 (9H, с). РХМС час утримання 3,68 хв, (іонізація електророзпиленням з негативним зарядом) 581 (М-Н), (іонізація електророзпиленням з пози+ тивним зарядом) 583 (М+Н) . Приклад 28 трет-Бутиловий ефір(1-{2-[(2-фтор-4йодфеніл)аміно]тієно[2,3-b]піридин-3карбоніл}азетидин-3-іл-метил) карбамінової кислоти Одержують з Проміжної сполуки 7 (150 мг, 0,36 ммоль), 1-гідроксибензотриазолу (98 мг, 0,72 ммоль), N-метилморфоліну (0,11 мл, 0,99 ммоль), 1-(3-диметиламінопропіл)-3-карбодііміду гідрохлориду (139 мг, 0,72 ммоль) та 3-(ВОС-амінометил)азетидину (135 мг, 0,72 ммоль), за методом з Прикладу 22. Названу в заголовку сполуку випарюють з ефіру з одержанням безбарвної твердої піни (75 мг, 36%). Η (CDCI3) 8,25 (1H, дд, J 1,5, 4,7 Гц), 7.67 (1H, дд, J 1,5, 8,1 Гц), 7,46-7,41 (2H, м), 7,387,33 (1H, м), 7,22 (1H, дд, J 4,7, 8,1 Гц), 4,59 (1H, ш с), 4,15-4,09 (2H, м), 3,80-3,75 (2H, м), 3,32 (2H, м), 2,78-2,74 (1H, м), 1,35 (9H, с). РХМС час утримання 3,41 хв, (іонізація електророзпиленням з негативним зарядом) 581 (М-Н), (іонізація електророз+ пиленням з позитивним зарядом) 583 (МН-Н) . Приклад 29 трет-Бутиловий ефір 3-({2-[(2-фтор-4йодфеніл)аміно]тієно[2,3-b]піридин-3карбоніл}аміно)азетидин-1-карбонової кислоти Одержують з Проміжної сполуки 7 (150 мг, 0,36 ммоль), 1-гідроксибензотриазолу (98 мг, 0,72 ммоль), N-метилморфоліну (0,11 мл, 0,99 ммоль), 1-(3-диметиламінопропіл)-3-карбодііміду гідрохлориду (139 мг, 0,72 ммоль) та 1-ВОС-3аміноазетидину (125 мг, 0,72 ммоль), за методом з Прикладу 22. Названу в заголовку сполуку перек 95939 34 ристалізують з суміші ефір/гексан з одержанням порошку кремового кольору (116 мг, 57%). Η (CDCI3) 8,38 (1H, дд, J 1,2, 4,7 Гц), 7,90 (1H, дд, J 1,2, 8,1 Гц), 7,56-7,53 (2H, м), 7,45-7,40 (1H, м), 7,35 (1H, дд, J 4,7, 8,1 Гц), 6,19 (1H, д, J 6,9 Гц), 4,89-4,84 (1H, м), 4,44.4,38 (2H, м), 3,93-3,88 (2H, м), 1,48 (9H, с). РХМС час утримання 3,66 хв, (іонізація електророзпиленням з негативним зарядом) 567 (М-Н), (іонізація електророзпиленням з пози+ тивним зарядом) 569 (М+Н) . Приклад 30 [3-(Амінометил)азетидин-1-іл]-{2-[(2-фтор-4йодфеніл)аміно]тієно[2,3-b]піридин-3-іл}-метанон Розчин сполуки за Прикладом 28 (65 мг, 0,11 ммоль) в ДХМ (7 мл) обробляють трифтороцтовою кислотою (3 мл) та перемішують протягом 1 години при кімнатній температурі. Реакційну суміш упарюють під вакуумом з одержанням жовтої камеді, яку розчиняють у воді (25 мл) та підлужують карбонатом натрію до рН 10. Водний розчин екстрагують 5% метанолом в ДХМ (4x25 мл) та екстракти об'єднують, потім сушать (Na2SO4), фільтрують та упарюють під вакуумом. Сирий продукт піддають хроматографії на колонках (SiO2, суміш ДХМ/метанол [4:1]) з одержанням названої в заголовку сполуки у вигляді твердої камеді, яку розтирають з ефіром з одержанням порошку кремового кольору (34 мг, 63%). Η (ДМСО-d6) 8,31 (1H, м), 7,93 (1H, м), 7,72 (1H, дд, J 1,5, 10,5 Гц), 7,55 (1H, м), 7,37 (1H, дд, J 4,6, 8,1 Гц), 7,29-7,24 (1H, м), 4,88 (2H, ш с), 4,03-3,97 (2H, м), 3,71-3,67 (2H, м), 2,65 (1H, м), 2,70-2,68 (2H, м). РХМС час утримання 2,93 хв, (іонізація електророзпиленням з негативним зарядом) 481 (М-Н), (іонізація електророз+ пиленням з позитивним зарядом) 483 (М+Н) . Приклад 31 [(2R)-Піролідин-2-ілметил]амід 2-[(2-фтор-4йодфеніл)аміно]тієно[2,3-b]піридин-3-карбонової кислоти Розчин Проміжної сполуки 10 (135 мг, 0,23 ммоль) в метанолі (2 мл) обробляють 4 Μ НСІ в 1,4-діоксані (5 мл) та перемішують при кімнатній температурі протягом 30 хв. Реакційну суміш упарюють під вакуумом з одержанням жовтої камеді, яку розчиняють у воді (25 мл). Водний розчин промивають ефіром (2x25 мл), потім підлужують 25% водним розчином гідроксиду амонію до рН 11. Водний розчин екстрагують ДХМ (2x25 мл), об'єднують органічні екстракти, сушать (Na2SO4), фільтрують та упарюють під вакуумом. Сирий продукт піддають хроматографії на колонках (SiO2, 91:8:1 ДХМ/метанол/25% водний розчин гідроксиду амонію) з одержанням названої в заголовку сполуки, яку ліофілізують протягом ночі з суміші ацетонітрил/вода з одержанням порошку кремового кольору (73 мг, 65%). Η (ДМСО-d6) 10,63 (1H, с), 9,12 (1H, ш с), 8,37 (1H, дд, J 1,7, 8,0 Гц), 7,84 (1H, дд, J 1,7, 4,7 Гц), 7,47 (1H, дд, J 2,0, 10,4 Гц), 7,42-7,38 (1H, м), 7,17-7,11 (1H, м), 7,00 (1H, дд, J 4,7, 8,0 Гц), 3,68-3,61 (1H, м), 3,51-3,49 (2H, м), 3,17-3,12 (2H, м), 2,28-1,62 (4H, м). РХМС час утримання 2,42 хв, (іонізація електророзпиленням з негативним зарядом) 495 (М-Н), (іонізація електророзпи+ ленням з позитивним зарядом) 497 (М+Н) . Приклад 32 35 [(2S)-Піролідин-2-ілметил]амід 2-[(2-фтор-4йодфеніл)аміно]тієно[2,3-b]піридин-3-карбонової кислоти Одержують з Проміжної сполуки 11 (139 мг, 0,23 ммоль) за методом з Прикладу 31. Названу в заголовку сполуку одержують у вигляді порошку кремового кольору (81 мг, 70%). Η (ДМСО-d6) 10,63 (1H, с), 9,12 (1H, ш с), 8,37 (1H, дд, J 1,7, 8,0 Гц), 7,84 (1H, дд, J 1,7, 4,7 Гц), 7,47 (1H, дд, J 2,0, 10,4 Гц), 7,42-7,38 (1H, м), 7,17-7,11 (1H, м), 7,00 (1H, дд, J 4,7, 8,0 Гц), 3,68-3,61 (1H, м), 3,51-3,49 (2H, м), 3,17-3,12 (2H, м), 2,28-1,62 (4H, м). РХМС час утримання 2,42 хв, (іонізація електророзпиленням з негативним зарядом) 495 (М-Н), (іонізація електророзпиленням з позитивним зарядом) + 497 (М+Н) . Приклад 33 трет-Бутиловий ефір (3S)-3-({2-[(2-фтор-4йодфеніл)аміно]тієно[2,3-b]піридин-3карбоніл}аміно)-піперидин-1-карбонової кислоти Одержують з Проміжної сполуки 7 (150 мг, 0,36 ммоль), 1-гідроксибензотриазолу (98 мг, 0,72 ммоль), N-метилморфоліну (0,11 мл, 0,99 ммоль), 1-(3-диметиламіно-пропіл)-3-карбодііміду гідрохлориду (139 мг, 0,72 ммоль) та (S)-1-ВОС-3амінопіперидину (145 мг, 0,72 ммоль), за методом з Прикладу 22. Названу в заголовку сполуку одержують у вигляді жовтої твердої камеді (131 мг, 61%). Η (CDCI3) 11,34 (1H, с), 8,36-8,34 (1H, м), 7,90-7,88 (1H, м), 7,55-7,52 (2H, м), 7,45-7,42 (1H, м), 7,32-7,29 (1H, м), 5,32 (1H, ш с), 4,31 (1H, м), 3,83-3,78 (2H, м), 3,46-3,42 (1H, м), 3,17 (1H, м), 1,89-1,73 (2H, м), 1,67 (2H, м), 1,47 (9H, с). РХМС час утримання 4,04 хв, (іонізація електророзпи+ ленням з позитивним зарядом) 597 (М+Н) . Приклад 34 трет-Бутиловий ефір (3R)-3-({2-[(2-фтор-4йодфеніл)аміно]тієно[2,3-b]піридин-3карбоніл}аміно)-піперидин-1-карбонової кислоти Одержують з Проміжної сполуки 7 (150 мг, 0,36 ммоль), 1-гідроксибензотриазолу (98 мг, 0,72 ммоль), N-метилморфоліну (0,11 мл, 0,99 ммоль), 1-(3-диметиламіно-пропіл)-3-карбодііміду гідрохлориду (139 мг, 0,72 ммоль) та (R)-1-ВОС-3амінопіперидину (145 мг, 0,72 ммоль), за методом з Прикладу 22. Названу в заголовку сполуку одержують у вигляді блідо-рожевої твердої камеді (136 мг, 63%). Η (CDCI3) 11,34 (1H, с), 8,36-8,34 (1H, м), 7,90-7,88 (1H, м), 7,55-7,52 (2H, м), 7,45-7,42 (1H, м), 7,32-7,29 (1H, м), 5,32 (1H, ш с), 4,31 (1H, м), 3,83-3,78 (2H, м), 3,46-3,42 (1H, м), 3,17 (1H, м), 1,89-1,73 (2H, м), 1,67 (2H, м), 1,47 (9H, с). РХМС час утримання 4,03 хв, (іонізація електророзпи+ ленням з позитивним зарядом) 597 (М+Н) . Приклад 35 Дигідрохлорид [(3S)-піперидин-3-іл]аміду 2-[(2фтор-4-йодфеніл)аміно]тієно[2,3-b]піридин-3карбонової кислоти Розчин сполуки за Прикладом 33 (120 мг, 0,20 ммоль) в метанолі (2 мл) обробляють 4 Μ НСІ в 1,4-діоксані (5 мл) та перемішують при кімнатній температурі протягом 3 годин. Реакційну суміш випарюють під вакуумом з одержанням названої в заголовку сполуки у вигляді жовтої твердої камеді, яку розтирають з ефіром з одержанням жовтого 95939 36 порошку (112 мг, 98%). Η (ДМСО-d6) 10,38 (1H, с), 9,04-8,92 (2H, м), 8,38 (1H, дд, J 1,3, 4,6 Гц), 8,178,14 (2H, м), 7,75 (1H, дд, J 1,8, 10,4 Гц), 7,61-7,58 (1H, м), 7,44 (1H, дд, J 4,6, 8,2 Гц), 7,42-7,36 (1H, м), 4,09 (1H, м), 3,34-3,31 (1H, м), 3,21-3,17 (1H, м), 2,94-2,79 (2H, м), 1,91 (2H, м), 1,74-1,61 (2H, м). РХМС час утримання 2,38 хв (іонізація електро+ розпиленням з позитивним зарядом) 497 (М+Н) . Приклад 36 Дигідрохлорид [(3R)-піперидин-3-іл]аміду 2-[(2фтор-4-йодфеніл)аміно]тієно[2,3-b]піридин-3карбонової кислоти Одержують із сполуки за Прикладом 34 (126 мг, 0,21 ммоль) за методом з Прикладу 35. Названу в заголовку сполуку одержують у вигляді жовтого порошку (115 мг, 96%). Η (ДМСО-d6) 10,38 (1H, с), 9,04-8,92 (2H, м), 8,38 (1H, дд, J 1,3, 4,6 Гц), 8,17-8,14 (2H, м), 7,75 (1H, дд, J 1,8, 10,4 Гц), 7,617,58 (1H, м), 7,44 (1H, дд, J 4,6, 8,2 Гц), 7,42-7,36 (1H, м), 4,09 (1H, м), 3,34-3,31 (1H, м), 3,21-3,17 (1H, м), 2,94-2,79 (2H, м), 1,91 (2H, м), 1,74-1,61 (2H, м). РХМС час утримання 2,38 хв, (іонізація електророзпиленням з позитивним зарядом) 497 + (М+Н) . Приклад 37 Трет-бутиловий ефір (1-{2-[(2-фтор-4йодфеніл)аміно]тієно[2,3-b]піридин-3-карбоніл}(3R)-піролідин-3-іл)карбамінової кислоти Одержують з Проміжної сполуки 7 (150 мг, 0,36 ммоль), 1-гідроксибензотриазолу (98 мг, 0,72 ммоль), N-метилморфоліну (0,11 мл, 0,99 ммоль), 1-(3-диметиламіно-пропіл)-3-карбодііміду гідрохлориду (139 мг, 0,72 ммоль) та (R)-3-(ВОС-аміно)піролідину (186 мг, 0,72 ммоль), за методом з Прикладу 22. Сирий продукт піддають хроматографії на колонках (SiO2, 3:2 гексан/етилацетат) з одержанням названої в заголовку сполуки, яку випарюють від ефіру з одержанням безбарвної твердої піни (110 мг, 52%). Η (CDCI3) 9,03 (1H, с), 8,28 (1H, дд, J 1,5, 4,7 Гц), 7,56 (1H, дд, J 1,5, 8,1 Гц), 7,437,39 (2H, м), 7,34-7,29 (1H, м), 7,22-7,18 (1H, м), 4,50 (1H, ш с), 4,16-4,14 (1H, м), 3,71 (1H, дд, J 6,2, 11,8 Гц), 3,63-3,56 (2H, м), 3,30 (1H, дд, J 5,1, 11,8 Гц), 2,19-2,12 (1H, м), 1,86-1,77(1H, м), 1,35(9H, с). РХМС час утримання 3,33 хв, (іонізація електророзпиленням з негативним зарядом) 581 (М-Н), (іонізація електророзпиленням з позитивним заря+ дом) 583 (М+Н) . Приклад 38 трет-Бутиловий ефір (1-{2-[(2-фтор-4йодфеніл)аміно]тієно[2,3-b]піридин-3-карбоніл}(3S)-піролідин-3-іл)карбамінової кислоти Одержують з Проміжної сполуки 7 (150 мг, 0,36 ммоль), 1-гідроксибензотриазолу (98 мг, 0,72 ммоль), N-метилморфоліну (0,11 мл, 0,99 ммоль), 1-(3-диметиламіно-пропіл)-3-карбодііміду гідрохлориду (139 мг, 0,72 ммоль) та (S)-3-(ВОС-аміно)піролідину (186 мг, 0,72 ммоль), за методом з Прикладу 37. Названу в заголовку сполуку одержують у вигляді безбарвної твердої піни (125 мг, 59%). Η (CDCI3) 9,03 (1H, с), 8,28 (1H, дд, J 1,5, 4,7 Гц), 7,56 (1H, дд, J 1,5, 8,1 Гц), 7,43-7,39 (2H, м), 7,347,29 (1H, м), 7,22-7,18 (1H, м), 4,50 (1H, ш с), 4,164,14(1H, м), 3,71 (1H, дд, J 6,2, 11,8 Гц), 3,63-3,56 (2H, м), 3,30 (1H, дд, J 5,1, 11,8 Гц), 2,19-2,12 (1H, 37 м), 1,86-1,77 (1H, м), 1,35 (9H, с). РХМС час утримання 3,33 хв, (іонізація електророзпиленням з негативним зарядом) 581 (М-Н), (іонізація електророзпиленням з позитивним зарядом) 583 + (М+Н) . Приклад 39 трет-Бутиловий ефір (1-{2-[(2-фтор-4йодфеніл)аміно]тієно[2,3-b]піридин-3карбоніл}азетидин-3-іл)- карбамінової кислоти Одержують з Проміжної сполуки 7 (150 мг, 0,36 ммоль), 1-гідроксибензотриазолу (98 мг, 0,72 ммоль), N-метилморфоліну (0,11 мл, 0,99 ммоль), 1-(3-диметиламіно-пропіл)-3-карбодііміду гідрохлориду (139 мг, 0,72 ммоль) та 3-(ВОСаміно)азетидину (125 мг, 0,72 ммоль), за методом з Прикладу 22. Сирий продукт піддають хроматографії на колонках (SiO2, суміш гексан/етилацетат [3:1]) з одержанням названої в заголовку сполуки, яку випарюють від ефіру до порошку кремового кольору (100 мг, 49%). Η (CDCI3) 10,11 (1Н, с), 8,35 (1Н, дд, J 1,5, 4,7 Гц), 7,76 (1Н, дд, J 1,5, 8,1 Гц), 7,55-7,51 (2Н, м), 7,47-7,41 (1Н, м), 7,31 (1Н, дд, J 4,7, 8,1 Гц), 4,95 (1Н, ш с), 4,52 (1Н, ш с), 4,46-4,40 (2Н, м), 4,01-3,96 (2Н, м), 1,45 (9Н, с). РХМС час утримання 3,47 хв, (іонізація електророзпиленням з негативним зарядом) 567 (М-Н), (іонізація електророзпиленням з позитивним заря+ дом) 569 (М+Н) . Приклад 40 Трет-бутиловий ефір 4-({2-[(2-фтор-4йодфеніл)аміно]тієно[2,3-b]піридин-3карбоніл}аміно)-піперидин-1-карбонової кислоти Одержують з Проміжної сполуки 7 (150 мг, 0,36 ммоль), 1-гідроксибензотриазолу (98 мг, 0,72 ммоль), N-метилморфоліну (0,11 мл, 0,99 ммоль), 1-(3-диметиламіно-пропіл)-3-карбодііміду гідрохлориду (139 мг, 0,72 ммоль) та 4-аміно-1-ВОСпіперидину (145 мг, 0,72 ммоль), за методом з Прикладу 22. Сирий продукт адсорбують на SiO2 та піддають хроматографії на колонках (SiO2, 2:1 гексан/етилацетат) з одержанням названої в заголовку сполуки, з якої випарюють ефір до одержання пластівців кремового кольору (97 мг, 45%). Η (CDCI3) 11,18 (1H, с), 8,36 (1H, дд, J 1,4, 4,7 Гц), 7,81 (1H, дд, J 1,4, 8,2 Гц), 7,55-7,53 (2H, м), 7,467,41 (1H, м), 7,32 (1H, дд, J 4,7, 8,2 Гц), 5,74 (1H, д, J 7,6 Гц), 4,27-4,20 (1H, м), 4,15-4,11 (2H, м), 3,032,96 (2H, м), 2,15- 2,10 (2H, м), 1,50 (9H, с), 1,45 (2H, м). РХМС час утримання 3,95 хв, (іонізація електророзпиленням з негативним зарядом) 567 (М-Н), (іонізація електророзпиленням з позитив+ ним зарядом) 569 (М+Н) . Приклад 41 [(3R)-3-Амінопіролідин-1-іл]-{2-[(2-фтор-4йодфеніл)аміно]тієно[2,3-b]-піридин-3-іл}-метанон Одержують із сполуки за Прикладом 37 (100 мг, 0,17 ммоль) за методом з Прикладу 35. Названу в заголовку сполуку одержують у вигляді жовтого порошку (100 мг, кількісно), Η (ДМСО-d6) 9,29 (1H, с), 8,36 (1H, дд, J 1,5, 4,7 Гц), 8,29 (3H, с), 7,91-7,89 (1H, м), 7,72 (1H, дд, J 1,8, 10,4 Гц), 7,557,52 (1H, м), 7,37 (1H, дд, J 4,7, 8,1 Гц), 7,24-7,19 (1H, м), 3,79-3,72 (1H, м), 3,70-3,58 (2H, м), 3,513,38 (2H, м), 2,20-2,13 (1H, м), 2,01-1,97 (1H, м) РХМС час утримання 2,24 хв, (іонізація електро 95939 38 розпиленням з негативним зарядом) 481 (М-Н), (іонізація електророзпиленням з позитивним заря+ дом) 483 (М+Н) . Приклад 42 [(3S)-3-Амінопіролідин-1-іл]-{2-[(2-фтор-4йодфеніл)аміно]тієно[2,3-b]піридин-3-іл}-метанон Одержують із сполуки за Прикладом 38 (115 мг, 0,20 ммоль) за методом з Прикладу 35. Названу в заголовку сполуку одержують у вигляді жовтого порошку (109 мг, 99%). Η (ДМСО-d6) 9,29 (1H, с), 8,36 (1H, дд, J 1,5, 4,7 Гц), 8,29 (3H, с), 7,91-7,89 (1H, m), 7,72 (1H, дд, J 1,8, 10,4 Гц), 7,55-7,52 (1H, м), 7,37 (1H, дд, J 4,7, 8,1 Гц), 7,24-7,19 (1H, м), 3,79-3,72 (1H, м), 3,70-3,58 (2H, м), 3,51-3,38 (2H, м), 2,20-2,13 (1H, м), 2,01-1,97 (1H, м). РХМС час утримання 2,24 хв, (іонізація електророзпиленням з негативним зарядом) 481 (М-Н), (іонізація електророзпиленням з позитивним зарядом) 483 + (М+Н) . Приклад 43 (Піперидин-4-іл)амід 2-[(2-фтор-4йодфеніл)аміно]тієно[2,3-b]піридин-3-карбонової кислоти Одержують із сполуки за Прикладом 40 (87 мг, 0,15 ммоль) за методом з Прикладу 35. Названу в заголовку сполуку одержують у вигляді жовтого порошку (80 мг, 96%). Η (ДМСО-d6) 10,31 (1H, с), 8,84 (1H, м), 8,68 (1H, м), 8,38 (1H, дд, J 1,3, 4,6 Гц), 8,24 (1H, д, J 7,5 Гц), 8,09 (1H, дд, J 1,3, 8,2 Гц), 7,74 (1H, дд, J 1,8, 10,5 Гц), 7,59-7,57 (1H, m), 7,44 (1H, дд, J 4,7, 8,2 Гц), 7,39-7,34 (1H, м), 4,053,97 (1H, м), 3,32-3,27 (2H, м), 3,03-2,87 (2H, м), 2,00-1,97 (2H, м), 1,82-1,71 (2H, м). РХМС час утримання 2,40 хв, (іонізація електророзпиленням з негативним зарядом) 495 (М-Н), (іонізація електророзпиленням з позитивним зарядом) 497 (МН+ Н) . Приклад 44 (3-Аміноазетидин-1-іл)-{2-[(2-фтор-4йодфеніл)аміно]тієно[2,3-b]-піридин-3-іл]-метанон Одержують із сполуки за Прикладом 39 (90 мг, 0,16 ммоль) за методом з Прикладу 30. Реакційну суміш упарюють під вакуумом з одержанням жовтої камеді, яку розчиняють у метанолі (5 мл) та воді (5 мл) та підлужують 25% водним розчином гідроксиду амонію до рН 10. Водний розчин упарюють під вакуумом на SiO2 та сирий продукт піддають хроматографії на колонках (SiO2, 95:4:1 ДХМ/метанол/25% водний розчин гідроксиду амонію). Названу в заголовку сполуку сушать при заморожуванні протягом ночі від ацетонітрилу/метанолу/води з одержанням порошку кремового кольору (31 мг, 42%). Η (ДМСО-d6) 8,33 (1H, дд, J 1,5, 4,7 Гц), 7,94 (1H, дд, J 1,5, 8,1 Гц), 7,73 (1H, дд, J 1,9, 10,5 Гц), 7,54 (1H, ддд, J 0,9, 0,9, 8,4 Гц), 7,38 (1H, дд, J 4,7, 8,1 Гц), 7,31-7,26 (1H, м), 4,23-4,11 (2H, м), 3,72-3,59 (3H, м). РХМС час утримання 3,00 хв, (іонізація електророзпиленням з негативним зарядом) 467 (М-Н), (іонізація електророзпиленням з позитивним зарядом) + 469 (М+Н) . Приклад 45 Біс(2-гідроксиетил)амід 2-[(2-фтор-4йодфеніл)аміно]тієно[2,3-b]піридин-3-карбонової кислоти 39 Одержують з Проміжної сполуки 7 (150 мг, 0,36 ммоль), 1-гідроксибензотриазолу (98 мг, 0,72 ммоль), N-метилморфоліну (0,11 мл, 0,99 ммоль), 1-(3-диметиламіно-пропіл)-3-карбодііміду гідрохлориду (139 мг, 0,72 ммоль) та діетаноламіну (76 мг, 0,72 ммоль), за методом з Прикладу 22. Сирий продукт піддають хроматографії на колонках (SiO2, етилацетат, двічі) з одержанням названої в заголовку сполуки, яку висушують при заморожуванні протягом ночі з суміші ацетонітрил/вода з одержанням порошку кремового кольору (62 мг, 34%). Η (ДМСО-d6) 8,79 (1H, ш с), 8,38 (1H, дд, J 1,5, 4,7 Гц), 7,77 (1H, дд, J 1,5, 8,1 Гц), 7,67 (1H, дд, J 1,9, 10,5 Гц), 7,69-7,46 (1H, м), 7,38 (1H, дд, J 4,7, 8,1 Гц), 7,18-7,12 (1H, м), 4,83 (2H, ш с), 3,30 (8H, с). РХМС час утримання 3,01 хв, (іонізація електро+ розпиленням з позитивним зарядом) 502 (М+Н) . Приклад 46 {2-[(2-Фтор-4-йодфеніл)аміно]тієно[2,3b]піридин-3-іл}-(3-гідроксиазетидин-1-іл)-метанон Одержують з Проміжної сполуки 7 (225 мг, 0,54 ммоль), 1-гідроксибензотриазолу (147 мг, 1,08 ммоль), N-метилморфоліну (0,16 мл, 1,48 ммоль), 1-(3-диметиламіно-пропіл)-3-карбодііміду гідрохлориду (208 мг, 1,08 ммоль) та 3гідроксиазетидину гідрохлориду (120 мг, 1,08 ммоль), за методом з Прикладу 22. Після хроматографії названу в заголовку сполуку перекристалізують з суміші метанол/ефір та одержують білий порошок (125 мг, 49%). Η (ДМСО-d6) 9,60 (1H, с), 8,35-8,34 (1H, м), 7,94 (1H, дд, J 1,4, 8,1 Гц), 7,757,71 (1H, м), 7,57-7,54 (1H, м), 7,41-7,37 (1H, м), 7,31-7,25 (1H, м), 5,68 (1H, д, J 6,0 Гц), 4,47-4,44 (1H, м), 4,21-4,16 (2H, м), 3,79-3,74 (2H, м). РХМС час утримання 3,31 хв, (іонізація електророзпи+ ленням з позитивним зарядом) 470 (М+Н) . Приклад 47 {2-[(2-Фтор-4-йодфеніл)аміно]тієно[2,3b]піридин-3-іл}-[(3R)-3-гідроксипіролідин-1-іл]метанон Одержують з Проміжної сполуки 7 (150 мг, 0,36 ммоль), 1-гідроксибензотриазолу (98 мг, 0,72 ммоль), N-метилморфоліну (0,11 мл, 0,99 ммоль), 1-(3-диметиламіно-пропіл)-3-карбодііміду гідрохлориду (139 мг, 0,72 ммоль) та (R)-3-гідроксипіролідину (63 мг, 0,72 ммоль) за методом з Прикладу 22. Після хроматографії названу в заголовку сполуку висушують після заморожування протягом ночі з суміші ацетонітрил/вода з одержанням порошку кремового кольору (116 мг, 66%). Η (ДМСОd6) 9,20 (1H, с), 8,35 (1H, дд, J 1,5, 4,7 Гц), 7,81 (1H, дд, J 1,5, 8,1 Гц), 7,67 (1H, дд, J 1,9, 10,5 Гц), 7,50-7,47 (1H, м), 7,36 (1H, дд, J 4,7, 8,1 Гц), 7,177,11 (1H, м), 4,91 (1H, с), 4,22 (1H, с), 3,54-3,30 (3H, м), 3,21-3,17 (1H, м), 1,90-1,74 (2H, м). РХМС час утримання 3,18 хв, (іонізація електророзпиленням + з позитивним зарядом) 484 (М+Н) . Приклад 48 {2-[(2-Фтор-4-йодфеніл)аміно]тієно[2,3b]піридин-3-іл}-[(3S)-3-гідроксипіролідин-1-іл]метанон Одержують з Проміжної сполуки 7 (150 мг, 0,36 ммоль), 1-гідроксибензотриазолу (98 мг, 0,72 ммоль), N-метилморфоліну (0,11 мл, 0,99 ммоль), 1-(3-диметиламіно-пропіл)-3-карбодііміду гідрох 95939 40 лориду (139 мг, 0,72 ммоль) та (S)-3гідроксипіролідину (63 мг, 0,72 ммоль), за методом з Прикладу 47. Названу в заголовку сполуку одержують у вигляді порошку кремового кольору (105 мг, 60%). Η (ДМСО-d6) 9,20 (1H, с), 8,35 (1H, дд, J 1,5, 4,7 Гц), 7,81 (1H, дд, J 1,5, 8,1 Гц), 7,67 (1H, дд, J 1,9, 10,5 Гц), 7,50-7,47 (1H, м), 7,36 (1H, дд, J 4,7, 8,1 Гц), 7,17-7,11 (1H, м), 4,91 (1H, с), 4,22 (1H, с), 3,54-3,30 (3H, м), 3,21-3,17 (1H, м), 1,90-1,74 (2H, м). РХМС час утримання 3,17 хв, (іонізація електророзпиленням з позитивним зарядом) 484 + (М+Н) . Приклад 49 {2-[(2-Фтор-4-йодфеніл)аміно]тієно[2,3b]піридин-3-іл}-[2-(гідроксиметил)-піперидин-1-іл]метанон Одержують з Проміжної сполуки 7 (150 мг, 0,36 ммоль), 1-гідроксибензотриазолу (98 мг, 0,72 ммоль), N-метилморфоліну (0,11 мл, 0,99 ммоль), 1-(3-диметиламіно-пропіл)-3-карбодііміду гідрохлориду (139 мг, 0,72 ммоль) та 2піперидинметанолу (83 мг, 0,72 ммоль) за методом з Прикладу 22. Після хроматографії названу сполуку перекристалізують з етилацетату/гексану з одержанням блідо-жовтого порошку (44 мг, 24%). Η (ДМСО-d6, 130°C) 8,38 (1H, дд, J 1,5, 4,7 Гц), 7,83 (1H, дд, J 1,5, 8,0 Гц), 7,59 (1H, дд, J 1,9, 10,5 Гц), 7,47 (1H, д, J 8,5 Гц), 7,35 (1H, дд, J 4,7, 8,0 Гц), 7,16 (1H, дд, J 8,8, 8,8 Гц), 4,30 (1H, ш с), 4,21 (1H, м), 3,89 (1H, м), 3,65-3,60 (1H, м), 3,51-3,47 (1H, м), 3,03-2,97 (1H, м), 1,74-1,72 (1H, м), 1,651,56 (4H, м), 1,37 (1H, м). РХМС час утримання 2,86 хв, (іонізація електророзпиленням з негативним зарядом) 510 (М-Н), (іонізація електророзпи+ ленням з позитивним зарядом) 512 (М+Н) . Приклад 50 {2-[(2-Фтор-4-йодфеніл)аміно]тієно[2,3b]піридин-3-іл}-[(3S)-3-(гідроксиметил)-морфолін-4іл]-метанон Одержують з Проміжної сполуки 7 (150 мг, 0,36 ммоль), 1-гідроксибензотриазолу (98 мг, 0,72 ммоль), N-метилморфоліну (0,11 мл, 0,99 ммоль), 1-(3-диметиламіно-пропіл)-3-карбодііміду гідрохлориду (139 мг, 0,72 ммоль) та (3S)-3(гідроксиметил)-морфоліну (85 мг, 0,72 ммоль) за методом з Прикладу 22. Після хроматографії названу сполуку висушують після заморожування протягом ночі з суміші ацетонітрил/вода з одержанням порошку кремового кольору (81 мг, 44%). Η (ДМСО-d6, 120°С) 8,37-8,36 (1H, м), 7,85-7,83 (1H, м), 7,60 (1H, дд, J 1,8, 10,5 Гц), 7,49-7,47 (1H, м), 7,35 (1H, дд, J 4,7, 8,0 Гц), 7,15 (1H, дд, J 8,7, 8,7 Гц), 3,99 (1H, м), 3,85 (1H, д, J 11,6 Гц), 3,803,77 (1H, м), 3,70- 3,67 (1H, м), 3,65-3,56 (2H, м), 3,48-3,45 (1H, м), 3,34 (1H, м), 3,27-3,21 (1H, м). РХМС час утримання 2,60 хв, (іонізація електророзпиленням з негативним зарядом) 512 (М-Н), (іонізація електророзпиленням з позитивним заря+ дом) 514 (М+Н) . Приклад 51 трет-Бутиловий ефір4-{2-[(2-фтор-4йодфеніл)аміно]тієно[2,3-b]піридин-3-карбоніл}(3R)-3-(гідроксиметил)піперазин-1-карбонової кислоти 41 Одержують з Проміжної сполуки 7 (150 мг, 0,36 ммоль), 1-гідроксибензотриазолу (98 мг, 0,72 ммоль), N-метилморфоліну (0,11 мл, 0,99 ммоль), 1-(3-диметиламіно-пропіл)-3-карбодііміду гідрохлориду (139 мг, 0,72 ммоль) та (2R)-4-BOC-2(гідроксиметил)піперазину (157 мг, 0,72 ммоль) за методом з Прикладу 22. Сирий продукт піддають хроматографії на колонках (SiO2, 1:1 гексан/етилацетат) з одержанням названої в заголовку сполуки, яку випарюють з ефіру з одержанням блідо-рожевої, твердої піни (95 мг, 43%). Η (ДМСО-d6, 120°С) 8,53 (1H, ш с), 8,38-8,37 (1H, м), 7,86-7,84 (1H, м), 7,60 (1H, дд, J 1,7, 10,5 Гц), 7,49 (1H, д, J 8,5 Гц), 7,36 (1H, дд, J 4,7, 8,0 Гц), 7,197,15 (1H, дд, J 8,5, 8,7 Гц), 4,52 (1H, ш с), 4,16 (1H, м), 3,95 (1H, д, J 13,5 Гц), 3,88-3,81 (2H, м), 3,493,43 (2H, м), 3,14-3,10 (1H, м), 3,02-2,95 (1H, м), 1,43 (9H, с). РХМС час утримання 2,98 хв, (іонізація електророзпиленням з позитивним зарядом) + 613 (М+Н) . Приклад 52 2-[(2-Фтор-4-йодфеніл)аміно]тієно[2,3b]піридин-7-оксид Сполуку за Прикладом 8 (250 мг, 0,55 ммоль) суспендують в суміші етанолу (20 мл) та води (10 мл). Додають гідрат гідроксиду літію (24,0 мг, 0,57 ммоль), і суміш кип'ятять із зворотним холодильником протягом 24 годин. Після проходження упарювання та висушування після заморожування суміш очищують хроматографією (оксид кремнію, дихлорметан потім 2% МеОН в дихлорметані). Названу в заголовку сполуку одержують у вигляді твердої речовини майже білого кольору (50 мг, 24%). Η (ДМСО-d6) 9,42 (1H, ш с), 8,13 (1H, дд, J 0,7, 6,2 Гц), 7,69 (1H, дд, J 1,9, 10,7 Гц), 7,54-7,51 (2H, м), 7,39-7,32 (2H, м), 6,73 (1H, с). РХМС (іонізація електророзпиленням з позитивним зарядом) + час утримання 2,84 хв, 387 (М+Н) . Приклад 53 2-[(2-Фтор-4-йодфеніл)аміно]-N-[2-(морфолін4-іл)етил]тієно[2,3-b]-піридин-3-карбоксамід Одержують із сполуки за Прикладом 1 (250 мг, 0,56 ммоль) та 4-(2-аміноетил)морфоліну (292 мг, 2,24 ммоль) за методом з Прикладу 5. Після хроматографії (5% метанолу, 95% дихлорметану) названу сполуку одержують у вигляді твердої речовини майже білого кольору (140 мг, 47%). Η (CDCI3) 11,43 (1H, ш с), 8,36 (1H, дд, J 1,4, 4,7 Гц), 8,03 (1H, дд, J 1,4, 8,2 Гц), 7,55-7,51 (2H, м), 7,44 (1H, дд, J 8,2, 8,2 Гц), 7,32 (1H, дд, J 4,7, 8,2 Гц), 6,84 (1H, ш с), 3,80-3,77 (4H, м), 3,67-3,62 (2H, м), 2,73-2,69 (2H, м), 2,62-2,59 (4H, м). РХМС (іонізація електророзпиленням з позитивним зарядом) час + утримання 2,37 хв, 527 (М+Н) . Приклад 54 2-[4-({2-[(2-Фтор-4-йодфеніл)аміно]тієно[2,3b]піридин-3-іл}карбоніл)піперазин-1-іл]етанол Одержують із сполуки за Прикладом 1 (250 мг, 0,56 ммоль) та Ы-(2-гідроксиетил)-піперазину (292 мг, 2,24 ммоль) за методом з Прикладу 5. Після хроматографії (5% метанол, 95% дихлорметан) названу сполуку одержують у вигляді білої твердої речовини (86 мг, 29%). Η (ДМСО-d6) 9,13 (1H, ш с), 8,36 (1H, дд, J 1,5, 4,7 Гц), 7,80 (1H, дд, J 1,5, 8,1 Гц), 7,68 (1H, дд, J 1,9, 10,5 Гц), 7,49-7,45 (1H, 95939 42 м), 7,37 (1H, дд, J 4,7, 8,1 Гц), 7,10 (1H, дд, J 8,7, 8,7 Гц), 4,37 (1H, т, J 5,4 Гц), 3,50-3,40 (6H, м), 2,37-2,33 (6H, м). РХМС (іонізація електророзпиленням з позитивним зарядом) час утримання 2,16 + хв, 527 (М+Н) . Приклад 55 3-(1,4-Діазепан-1-іл карбоніл )-N-(2-фтор-4йодфеніл)тієно[2,3-b]піридин-2-амін Одержують із сполуки за Прикладом 1 (250 мг, 0,56 ммоль) та гомопіперазину (224 мг, 2,24 ммоль) за методом з Прикладу 5. Після хроматографії (10-15% метанол в дихлорметані) названу сполуку одержують у вигляді твердої речовини блідо-жовтого кольору (180 мг, 64%). Η (CDCI3) 8,99 (1H, ш с), 8,34 (1H, дд, J 1,6, 4,7 Гц), 7,74 (1H, дд, J 1,6, 8,1 Гц), 7,47-7,43 (2H, м), 7,35 (1H, дд, J 8,5, 8,5 Гц), 7,28-7,22 (1H, м), 4,30-4,10 (1H, ш м), 3,95-3,80 (1H, ш м), 3,39-2,86 (6H, ш м), 2,17-1,77 (3H, ш м). РХМС (іонізація електророзпиленням з позитивним зарядом) час утримання 2,17 хв, 497 + (М+Н) . Приклад 56 N-[3-(Диметиламіно)-2,2-диметилпропіл]-2-[(2фтор-4-йодфеніл)аміно]тієно[2,3-b]піридин-3карбоксамід Одержують із сполуки за Прикладом 1 (250 мг, 0,56 ммоль) та N,N,2,2-тетраметил-1,3пропандіаміну (292 мг, 2,24 ммоль) за методом з Прикладу 5. Після хроматографії (5% метанол, 95% дихлорметан) названу сполуку одержують у вигляді твердої речовини блідо-жовтого кольору (60 мг, 20%). Η (ДМСО-d6) 10,81 (1H, ш с), 9,10 (1H, ш с), 8,24-8,21 (2H, м), 7,69-7,65 (1H, м), 7,557,52 (1H, м), 7,37-7,31 (2H, м), 3,29-3,27 (2H, м), 2,50-2,37 (8H, ш м), 0,96 (6H, с). РХМС (іонізація електророзпиленням з позитивним зарядом) час + утримання 2,39 хв, 527 (М+Н) . Приклад 57 2-[(2-Фтор-4-йодфеніл)аміно]-N-[3-(морфолін4-іл)пропіл]тієно[2,3-b]піридин-3-карбоксамід Одержують із сполуки за Прикладом 1 (250 мг, 0,56 ммоль) та 4-(3-амінопропіл)-морфоліну (323 мг, 2,24 ммоль) за методом з Прикладу 5. Після хроматографії (5% метанол, 95% дихлорметан) названу сполуку одержали у вигляді твердої речовини блідо-жовтого кольору (115 мг, 38%). Η (CDCI3) 11,29 (1H, ш с), 8,36 (1H, дд, J 1,4, 4,7 Гц), 7,99 (1H, дд, J 1,4, 8,2 Гц), 7,63-7,51 (2H, м), 7,477,41 (1H, м), 7,33-7,29 (1H, м), 7,12 (1H, ш с), 3,703,64 (2H, м), 3,60-3,56 (4H, м), 2,58-2,54 (2H, м), 2,49-2,46 (4H, м), 1,90-1,82 (2H, м). РХМС (іонізація електророзпиленням з позитивним зарядом) час + утримання 2,34 хв, 541 (М+Н) . Приклад 58 N-(2-Фтор-4-йодфеніл)-3-(піперазин-1ілкарбоніл)тієно[2,3-b]піридин-2-амін Піперазин (3,90 г, 45,2 ммоль) розчиняють у сухому толуолі (100 мл) в атмосфері азоту. Суміш вміщують у водяну баню при 20°C та повільно додають триметилалюміній (2.0 Μ в толуолі, 22,6 мл, 45,2 ммоль). Після проходження 10 хв додають Приклад 1 (4,00 г, 0,56 ммоль). Суміш нагрівають до 100°C в атмосфері азоту протягом 6 годин. Після охолодження до кімнатної температури суміш виливають у суспензію діоксиду кремнію (100 г) у 43 хлороформі (400 мл) та метанолі (200 мл). Після перемішування протягом 10 хв суміш залишають стояти протягом ночі. Фільтрація і упарювання органічного розчинника під вакуумом дає сирий матеріал, який очищують розтиранням з діетиловим ефіром (50 мл), фільтрацією та промиванням діетиловим ефіром (20 мл). Названу в заголовку сполуку виділяють у вигляді твердої речовини жовтого кольору (3,56 г, 82%), яку можна далі використовувати в хімії. Дигідрохлорид названої сполуки одержують розчиненням вільної основи (1,60 г, 3,32 ммоль) в суміші дихлорметану (30 мл) та метанолу (5 мл). Додають НСІ в ефірі (2,0 М, 3,34 мл, 6,70 ммоль), і суміш упарюють під вакуумом. Розтирання з діетиловим ефіром (40 мл) та фільтрація дає дигідрохлорид названої сполуки (1,80 г, 98%). Η (ДМСО-d6) 9,75 (0,25H, ш с), 9,43 (1,75H, ш с), 9,30 (1H, с), 8,36 (1H, дд, J 1,6, 4,7 Гц), 7,87 (1H, дд, J 1,6, 8,1 Гц), 7,72 (1H, дд, J 1,9, 10,6 Гц), 7,53 (1H, м), 7,39 (1H, дд, J 4,7, 8,1 Гц), 7,22 (1H, дд, J 8,5, 8,5 Гц), 3,75-3,58 (4H, м), 3,17-3,06 (4H, м). РХМС (іонізація електророзпиленням з позити+ вним зарядом) час утримання 2,19 хв, 483 (М+Н) . Приклад 59 Етил[4-({2-[(2-фтор-4-йодфеніл)аміно]тієно[2,3b]піридин-3-іл}карбоніл)-піперазин-1-іл]ацетат Сполуку за Прикладом 58 (300 мг, 0,62 ммоль) розчиняють у дихлорметані (10 мл) та триетиламіні (94 мкл, 0,65 ммоль) і додають етилхлорацетат (56 мкл, 0,65 ммоль). Суміш кип'ятять із зворотним холодильником протягом 12 годин. Після охолодження та розподілу між дихлорметаном та водою (25 мл кожного) органічну фракцію сушать (Na2SO4) та упарюють під вакуумом. Очищення хроматографією (оксид кремнію, 3% метанолу, 97% дихлорметану) дає продукт у вигляді олії, яку розчиняють у діетиловому ефірі (5 мл) та упарюють під глибоким вакуумом з одержанням названої в заголовку сполуки у вигляді білої твердої речовини (240 мг, 68%). Η (CDCI3) 9,11 (1H, ш с), 8,37 (1H, дд, J 1,5, 4,7 Гц), 7,71 (1H, дд, J 1,5, 8,1 Гц), 7,53-7,49 (2H, м), 7,40 (1H, дд, J 8,4, 8,4 Гц), 7,327,28 (1H, м), 4,21 (2H, κ, J 7,1 Гц), 3,75-3,61 (4H, м), 3,31 (2H, с), 2,79-2,62 (4H, м), 1,29 (3H, т, J 7,1 Гц). РХМС (іонізація електророзпиленням з позитив+ ним зарядом) час утримання 3,26 хв, 569 (М+Н) . Приклад 60 [4-({2-[(2-Фтор-4-йодфеніл)аміно]тієно[2,3b]піридин-3-іл}карбоніл)-піперазин-1-іл]оцтова кислота Сполуку за Прикладом 59 (213 мг, 0,375 ммоль) розчиняють в етанолі (7 мл) та воді (7 мл). Додають гідроксид натрію (15,0 мг, 0,375 ммоль), і суміш перемішують при кімнатній температурі протягом 18 годин. Висушування після заморожування дає названу сполуку у вигляді натрієвої солі (200 мг, 99%). Η (ДМСО-d6) 9,29 (1H, ш с), 8,22-8,17 (1H, ш м), 7,68 (1H, ш д, J 8,0 Гц), 7,56 (1H, ш д, J 10,4 Гц), 7,40 (1H, ш д, J 8,6 Гц), 7,28-7,20 (1H, ш м), 7,07 (1H, дд, J 8,6, 8,6 Гц), 3,42-3,38 (4H, м), 2,65 (2H, с), 2,37-2,35 (4H, м). РХМС (іонізація електророзпиленням з позитивним зарядом) час + утримання 2,64 хв, 541 (М+Н) . Приклад 61 95939 44 трет-Бутил(3R)-3-[({2-[(2-фтор-4йодфеніл)аміно]тієно[2,3-b]піридин-3-іл}карбоніл)аміно]піролідин-1-карбоксилат Одержують із сполуки за Прикладом 1 (250 мг, 0,56 ммоль) та (R)-3-аміно-1-третбутоксикарбонілпіролідину (417 мг, 2,24 ммоль) за методом з Прикладу 5. Після хроматографії (25% етилацетат, 75% дихлорметан) названу сполуку одержують у вигляді твердої речовини майже білого кольору (45 мг, 13%). Η (ДМСО-d6) 10,27 (1H, ш с), 8,35 (1H, дд, J 1,4, 4,7 Гц), 8,23 (1H, ш д, J 6,5 Гц), 8,06 (1H, дд, J 1,4, 8,2 Гц), 7,74 (1H, дд, J 1,9, 10,5 Гц), 7,57 (1H, д, J 8,5 Гц), 7,43 (1H, дд, J 4,7, 8,2 Гц), 7,36 (1H, дд, J 8,6, 8,6 Гц), 4,46-4,40 (1H, ш м), 3,57-3,54 (1H, м), 3,52-3,30 (3H, м), 2,15-2,05 (1H, ш м), 1,95-1,85 (1H, ш м), 1,41 (9H, с). РХМС (іонізація електророзпиленням з позитивним заря+ дом) час утримання 3,70 хв, 583 (М+Н) . Приклад 62 Трет-бутил (3S)-3-[({2-[(2-фтор-4йодфеніл)аміно]тієно[2,3-b]піридин-3-іл}карбоніл)аміно]піролідин-1-карбоксилат Одержують із сполуки за Прикладом 1 (250 мг, 0,56 ммоль) та (S)-3-аміно-1-третбутоксикарбонілпіролідину (417 мг, 2,24 ммоль) за методом з Прикладу 5. Після хроматографії (25% етилацетат, 75% дихлорметан) названу сполуку одержують у вигляді твердої речовини майже білого кольору (190 мг, 58%). Η (ДМСО-d6) 10,27 (1H, ш с), 8,35 (1H, дд, J 1,4, 4,7 Гц), 8,23 (1H, ш д, J 6,5 Гц), 8,06 (1H, дд, J 1,4, 8,2 Гц), 7,74 (1H, дд, J 1,9, 10,5 Гц), 7,57 (1H, д, J 8,5 Гц), 7,43 (1H, дд, J 4,7, 8,2 Гц), 7,36 (1H, дд, J 8,6, 8,6 Гц), 4,46-4,40 (1H, ш м), 3,57-3,54 (1H, м), 3,52-3,30 (3H, м), 2,152,05 (1H, ш м), 1,95-1,85 (1H, ш м), 1,41 (9H, с). РХМС (іонізація електророзпиленням з позитив+ ним зарядом) час утримання 3,70 хв, 583 (М+Н) . Приклад 63 2-[(2-Фтop-4-йoдфeнiл)aмiнo]-N-[(3R)пipoлiдин-3-iл]тiєнo[2,3-b]пipидин-3-карбоксамід Сполуку за Прикладом 61 (40 мг, 0,069 ммоль) розчиняють у дихлорметані (3 мл) та додають НСІ в діоксані (4,0 М, 1,0 мл, 4,0 ммоль). Суміш перемішують при кімнатній температурі протягом 18 годин. Одержану тверду речовину фільтрують і висушують під вакуумом при 40°C з одержанням дигідрохлориду названої сполуки (28 мг, 73%). Η (ДМСО-d6) 10,44 (1H, ш с), 9,25 (2H, ш м), 8,37-8,31 (2H, м), 8,21 (1H, дд, J 1,3, 8,2 Гц), 7,76 (1H, дд, J 1,8, 10,4 Гц), 7,61 (1H, д, J 8,5 Гц), 7,45-7,39 (2H, м), 4,61-4,57 (1H, м), 3,45-3,23 (4H, м), 2,27-2,15 (1H, м), 2,09-1,98 (1H, м). РХМС (іонізація електророзпиленням з позитивним зарядом) час утриман+ ня 2.30 хв, 483 (М+Н) . Приклад 64 2-[(2-Фтор-4-йодфеніл)аміно]-N-[(3S)піролідин-3-іл]тієно[2,3-b]піридин-3-карбоксамід Сполуку за Прикладом 62 (170 мг, 0,069 ммоль) розчиняють у дихлорметані (4 мл) і додають НСІ в діоксані (4,0 М, 4,0 мл, 16,0 ммоль). Суміш перемішують при кімнатній температурі протягом 18 годин. Одержану тверду речовину фільтрують і сушать під вакуумом при 40°С з одержанням дигідрохлориду названої сполуки (150 мг, 92%). Η (ДМСО-d6) 10,44 (1H, ш с), 9,25 (2H, ш м), 45 8,37-8,31 (2H, м), 8,21 (1H, дд, J 1,3, 8,2 Гц), 7,76 (1H, дд, J 1,8, 10,4 Гц), 7,61 (1H, д, J 8,5 Гц), 7,457,39 (2H, м), 4,61-4,57 (1H, м), 3,45-3,23 (4H, м), 2,27-2,15 (1H, м), 2,09-1,98 (1H, м). РХМС (іонізація електророзпиленням з позитивним зарядом) час + утримання 2,30 хв, 483 (М+Н) . Приклад 65 2-[(2-Фтор-4-йодфеніл)аміно]-N-(1метилпіперидин-4-іл)тієно[2,3-b]піридин-3карбоксамід Одержують із сполуки за Прикладом 1 (250 мг, 0,56 ммоль) та 4-аміно-1-метилпіперидину (255 мг, 2,24 ммоль) за методом з Прикладу 5. Після хроматографії (10% метанол, 90% дихлорметан) сирий матеріал розчиняють у дихлорметані (2 мл) і додають 2,0 Μ НСІ в діетиловому ефірі (2 мл). Одержану тверду речовину фільтрують з одержанням дигідрохлориду названої сполуки у вигляді твердої речовини жовтого кольору (145 мг, 44%). Η (ДМСО-d6) 10,62 (1H, ш с), 10,37 (0,8H, с), 10,26 (0,2H, с), 8,40-8,36 (1H, м), 8,31-8,28 (0,8H, м), 8,22-8,20 (0,2H, м), 8,19-8,16 (0,2H, м), 8,10-8,07 (0,8H, м), 7,75-7,71 (1H, м), 7,59-7,56 (1H, м), 7,477,31 (2H, м), 4,05 (1H, ш м), 3,45-3,05 (5H, м), 2,70 (3H, д, J 6,0 Гц), 2,03-1,85 (4H, м). РХМС (іонізація електророзпиленням з позитивним зарядом) час + утримання 2,34 хв, 511 (М+Н) . Приклад 66 {2-[(2-Фтор-4-йодфеніл)аміно]тієно[2,3b]піридин-3-іл}-[(2R)-2-(метоксиметил)-піролідин-1іл]-метанон Одержують з Проміжної сполуки 14 (285 мг, 0,66 ммоль), 2 Μ триметилалюмінію в гексані (1,6 мл, 3,30 ммоль) та (R)-2-(метоксиметил)піролідину (383 мг, 3,30 ммоль) за методом з Прикладу 5, з одержанням названої в заголовку сполуки (17 мг). Η (ДМСО-d6) 9,17 (1H, ш с), 8,37 (1H, дд, J 4,6, 1,3 Гц), 7,78 (1H, д, J 7,7 Гц), 7,76 (1H, дд, J 10,6, 1,8 Гц), 7,46 (1H, д, J 8,5 Гц), 7,37 (1H, д, J 8,0, 4,6 Гц), 7,05 (1H, т, J 8,5 Гц), 4,10-4,00 (1H, ш м), 3,33-3,01 (7H, ш м), 1,90-1,64 (4H, ш м). РХМС (іонізація електророзпиленням з позитивним зарядом) час + утримання 3,27 хв, 215 (М+Н) . Приклад 67 (Циклопропілметил)амід 2-[(2-фтор-4йодфеніл)аміно]тієно[2,3-b]піридин-3-карбонової кислоти Одержують з Проміжної сполуки 14 (450 мг, 1,05 ммоль), 2 Μ триметилалюмінію в гексані (2,6 мл, 5,26 ммоль) та (амінометил)циклопропану (374 мг, 5,26 ммоль) за методом з Прикладу 5, з одержанням названої в заголовку сполуки (250 мг). Η (ДМСО-d6) 10,68 (1H, ш с), 8,36 (1H, д, J 3,8 Гц), 8,17 (1H, д, J 8,1 Гц), 8,15-8,00 (1H, ш м), 7,75 (1H, д, J 10,4 Гц), 7,60 (1H, д, J 7,6 Гц), 7,47-7,38 (2H, ш м), 3,18 (2H, т, J 6,2 Гц), 1,10-1,03 (1H, ш м), 0,470,41 (2H, ш м), 0,28-0,23 (2H, ш м). РХМС (іонізація електророзпиленням з позитивним зарядом) час + утримання 3,54 хв, 468 (М+Н) . Приклад 68 (N-Метокси-N-метил)амід 2-[(2-фтор-4йодфеніл)аміно]-7-окситієно[2,3-b]піридин-3карбонової кислоти До розчину Проміжної сполуки 16 (260 мг, 1,12 ммоль) в ДМСО додають гідрид натрію (50 мг, 1,23 95939 46 ммоль), і реакційну суміш перемішують протягом 10 хв. Додають Проміжну сполуку 1 (328 мг, 1,18 ммоль), і реакційну суміш додатково перемішують протягом 1 години при кімнатній температурі. Реакційну суміш виливають у воду та екстрагують в етилацетаті. Органічну фракцію промивають розчином солі, сушать (сульфат магнію) та упарюють під вакуумом. Сирий продукт очищують хроматографією (SiO2; 10% метанол в етилацетаті), одержують необхідний продукт у вигляді твердої речовини блідо-жовтого кольору (64 мг). Η (ДМСО-d6) 9,41 (1H, с), 8,20 (1H, дд, J 5,9, 1,0 Гц), 7,74 (1H, дд, J 10,3, 1,9 Гц), 7,57-7,54 (1H, м), 7,48-7,38 (2H, м), 7,22 (1H, т, J 8,6 Гц), 3,47 (3H, с), 3,17 (3H, с). РХМС (іонізація електророзпиленням з позитив+ ним зарядом) час утримання 2,70 хв, 474 (М+Н) . Приклад 69 (N-Метокси-N-метил)амід 2-[(2-фтор-4йодфеніл)аміно]тієно[2,3-b]піридин-3-карбонової кислоти Сполуку за Прикладом 68 (64 мг, 0,13 ммоль) і трифенілфосфін (177 мг, 0,68 ммоль) в ТГФ (1 мл) нагрівають до 65°C, витримуючи при цій температурі протягом ночі. Додають трихлорид фосфору (34 мг, 0,39 ммоль) і перемішують реакційну суміш при кімнатній температурі протягом 90 хв. Реакцію гасять за допомогою розчину гідрокарбонату натрію та екстрагують продукт у ДХМ, сушать (сульфат магнію) та упарюють під вакуумом. Після проходження препаративної рідинної хроматографії високого тиску одержують необхідний продукт (10 мг) у вигляді твердої речовини майже білого кольору, Η (ДМСО-d6) 9,23 (1H, с), 8,35 (1H, дд, J 4,7, 1,6 Гц), 7,84 (1H, дд, J 8,1, 1,6 Гц), 7,70 (1H, дд, J 10,3, 1,9 Гц), 7,53 (1H, д, J 8,4 Гц), 7,37 (1H, дд, J 8,1, 4,7 Гц), 7,22 (1H, т, J 8,6 Гц), 3,47 (3H, с), 3,20 (3H, с). РХМС (іонізація електророзпиленням з позитивним зарядом) час утримання 3,23 хв, 458 + (М+Н) . Приклад 70 {2-[(2-Фтор-4-йодфеніл)аміно]тієно[2,3b]піридин-3-іл}-[(2R)-2-(гідроксиметил)-піперазин-1іл]-метанон Розчин сполуки за Прикладом 51 (80 мг, 0,13 ммоль) в метанолі (2 мл) обробляють 4 Μ НСІ в 1,4-дюксані (5 мл) та перемішують при кімнатній температурі протягом 3 годин. Реакційну суміш упарюють під вакуумом з одержанням жовтої камеді, яку розчиняють у метанолі (20 мл) та воді (5 мл), потім підлужують 25% водним розчином гідроксиду амонію до рН 11. Водний розчин екстрагують ДХМ (3x25 мл) та об'єднують органічні екстракти, сушать (Na2SO4), фільтрують та упарюють під вакуумом. Сирий продукт піддають хроматографії на колонках (SiO2, суміш ДХМ/метанол/25% водний розчин гідроксиду амонію[95.4:1]) з одержанням названої в заголовку сполуки у вигляді суміші 2 ротаційних ізомерів, яку сушать після заморожування протягом ночі з суміші ацетонітрил/вода з одержанням порошку кремового кольору (63 мг, 94%). Η (ДМСО-d6, 120°C, містить ротаційні ізомери) 8,37-8,36 (1H, м), 8,29-8,28 (0,44H, м), 8,33 (0,56H, дд, J 1,4, 8,0 Гц), 7,75 (0,44H, дд, J 1,8, 10,0 Гц), 7,68-7,66 (0,44H, м), 7,58 (0,56H, дд, J 1,9, 10,5 Гц), 7,48-7,44 (1H, м), 7,39 47 7,33 (1H, м), 7,17-7,13 (0,56H, м), 4,31-4,29 (1H, м), 4,00 (1H, м), 3,74-3,60 (2H, м), 3,10-2,83 (3H, м), 2,76-2,65 (2H, м), 2,60-2,53 (1H, м). РХМС час Комп’ютерна верстка О. Гапоненко 95939 48 утримання 2,07 та 1,95 хв, (іонізація електророз+ пиленням з позитивним зарядом) 513 (М+Н) . Підписне Тираж 23 прим. Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюThieno-pyridine derivatives as mek inhibitors
Автори англійськоюHutchings Martin Clive, Archibald Sarah Catherine, Brookings Daniel Christopher, Davis Jeremy Martin, Johnson James Andrew, Langham Barry John, Neuss Judi Charlotte
Назва патенту російськоюПроизводные тиенопиридина как ингибиторы мек
Автори російськоюХатчингс Мартин Клайв, Арчибальд Сарра Кетрин, Брукингс Даниэль Кристофер, Давис Джереми Мартин, Джонсон Джеймс Эндрю, Лангхам Барри Джон, Нейсс Джуди Шарлотт
МПК / Мітки
МПК: C07D 495/04, A61K 31/4365
Мітки: похідні, інгібітори, мек, тієнопіридину
Код посилання
<a href="https://ua.patents.su/24-95939-pokhidni-tiehnopiridinu-yak-ingibitori-mek.html" target="_blank" rel="follow" title="База патентів України">Похідні тієнопіридину як інгібітори меk</a>
Попередній патент: Спосіб регулювання ряду пристроїв для розділення повітря кріогенною дистиляцією
Наступний патент: Азаіндоли як інгібітори кіназ януса
Випадковий патент: Спосіб виробництва твердих сирів з низькою температурою другого нагрівання