Похідні 1-бензиліндол-2-карбоксаміду
Номер патенту: 92000
Опубліковано: 27.09.2010
Автори: Вішарт Ґрант, Коулі Філіп Мартін, ібсон Сем'юел Джордж
Формула / Реферат
1. Сполука, яка є похідним 1-бензиліндол-2-карбоксаміду формули
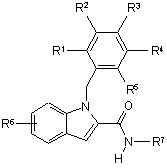 , формула І
, формула І
дe R1 - H aбo F;
R2 - Н, галоген, С1-4алкіл, С1-4алкілоксил, С3-6циклоалкіл або С3-6циклоалкілС1-2алкіл, вказані С1-4алкіл та С1-4алкілоксил необов'язково заміщено одним-трьома галогенами, або
R2 - 5-6-членне гетероарильне кільце, що містить один або два гетероатоми, вибрані з N та О, або
R2 - 5-6-членне насичене гетероциклічне кільце, що містить одну або дві гетероатомні частини, вибрані з О та NR8;
R3 - H aбo F;
R4 - Н, галоген, СН3, ОСН3 або CF3, або разом з R5 та фенільним кільцем R4 утворює індол-4-іл або хінолін-5-іл;
R5 - Н, галоген, С1-4алкіл, CF3, С1-4алкілоксил, OCF3, або разом з R4 та фенільним кільцем R5 утворює індол-4-іл або хінолін-5-іл;
за умови, що один-три з R1-R5 не являють собою Н;
R6 - один або два замісники, що вибрано з Сl, Вr та CN;
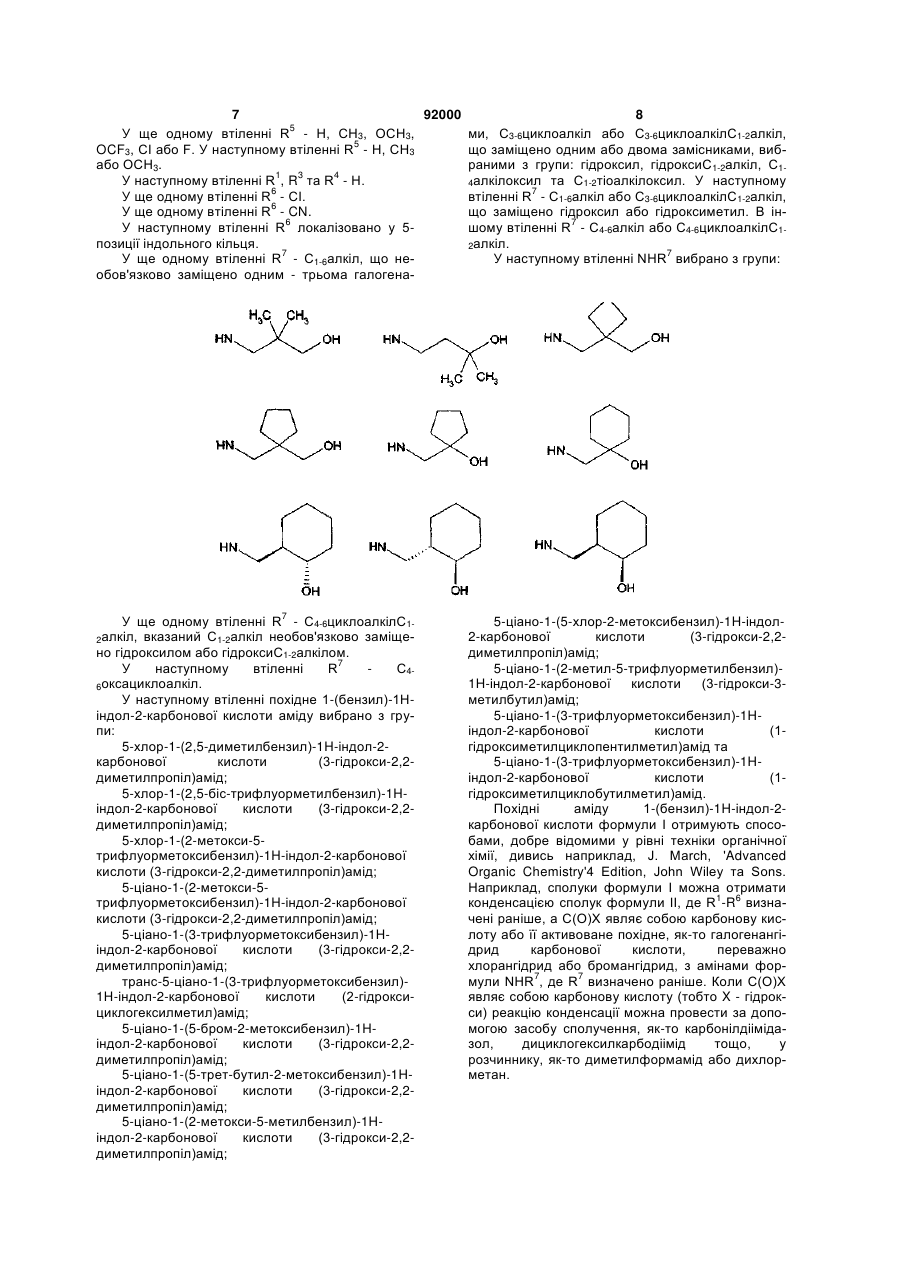
R7 - С1-6алкіл, необов'язково заміщений одним-трьома галогенами, С3-6циклоалкіл або С3-6циклоалкілС1-2алкіл, кожний з яких заміщено одним або двома замісниками, вибраними з групи: гідроксил, гідроксіС1-2алкіл, С1-4алкілоксил та С1-2тіоалкілоксил, або
R7 - С4-6оксациклоалкілС1-2алкіл, вказаний С1-2алкіл необов'язково заміщено гідроксилом або гідроксіС1-2алкілом, або R7 – С4-6оксациклоалкіл, а
R8 - Н, С1-4алкіл або С1-4ацил;
або її фармацевтично прийнятні сіль або сольват.
2. Сполука за п. 1, де R1, R3 та R4 - Н.
3. Сполука за п. 1 або за п. 2, де R2-CH3, CH(CH3)3, CF3, OCH3, OCH(CH3)2, OCHF2, OCF3, Вr, Сl або F.
4. Сполука за будь-яким з пп. 1-3, де R5 - Н, СН3, ОСН3, OCF3, Сl або F.
5. Сполука за будь-яким з пп. 1-4, де R6 - CN.
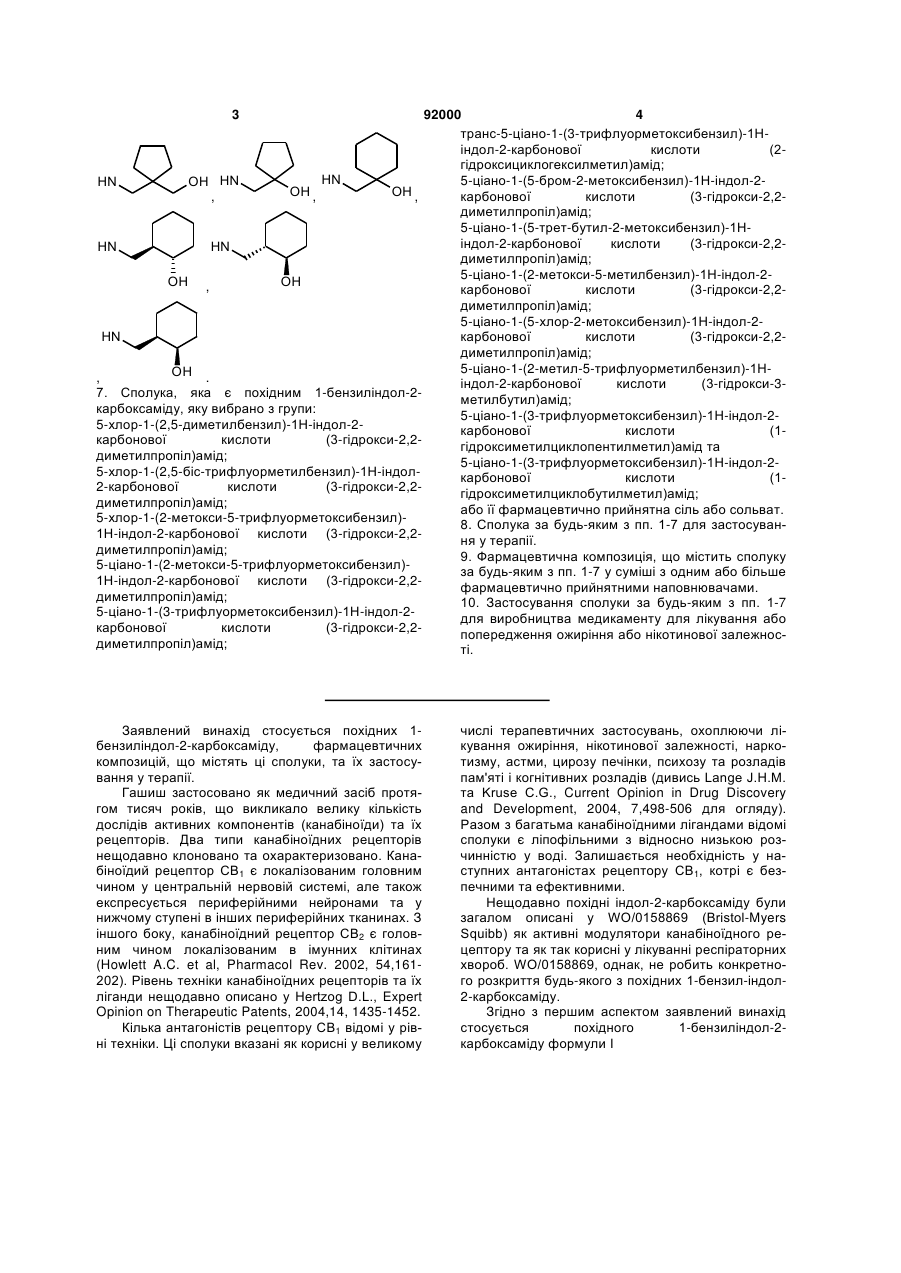
6. Сполука за будь-яким з пп. 1-5, де NHR7 вибрано з групи:
![]() ,
, 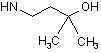 ,
, 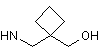 ,
,
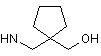 ,
, 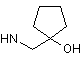 ,
, 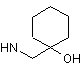 ,
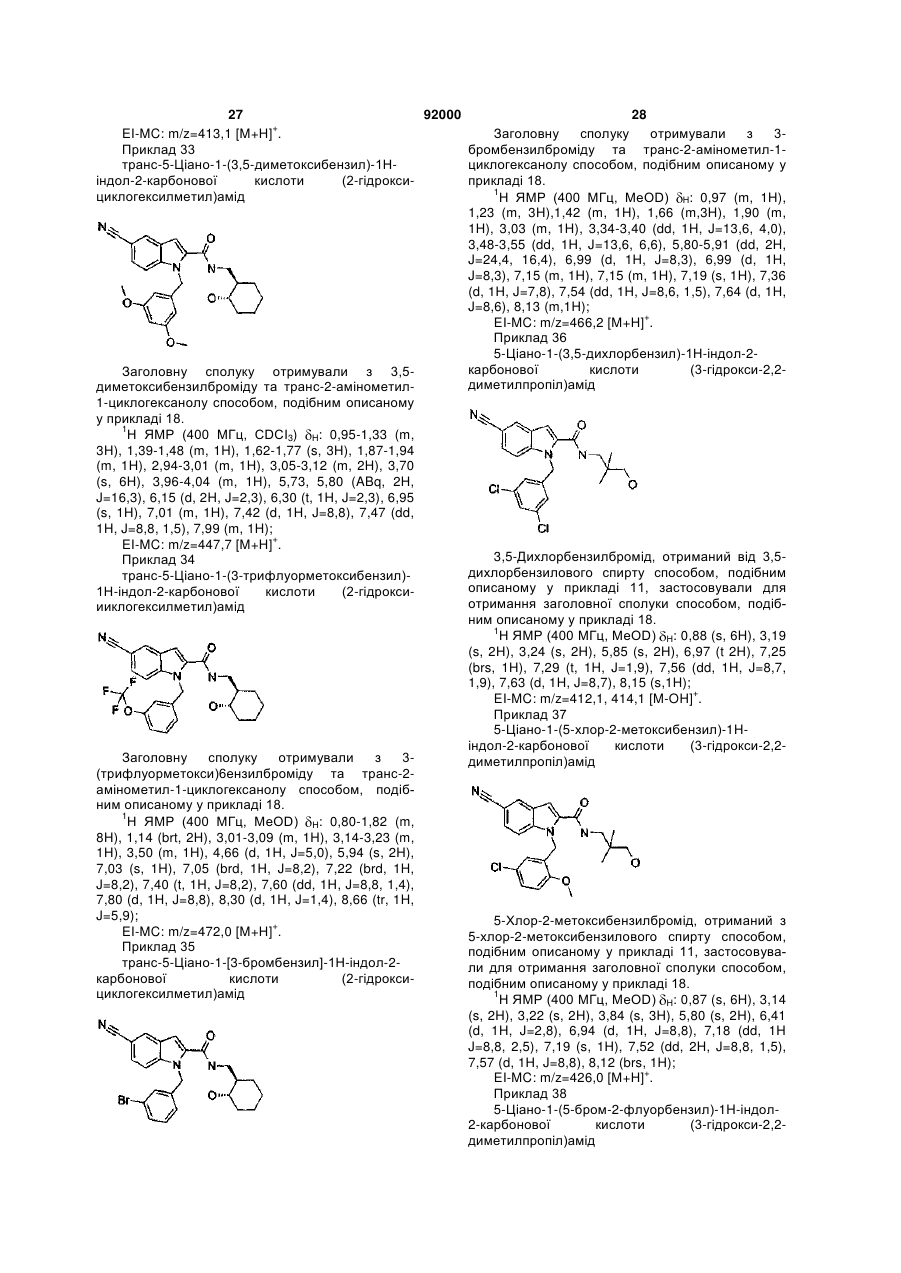
,
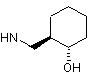 ,
,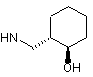 ,
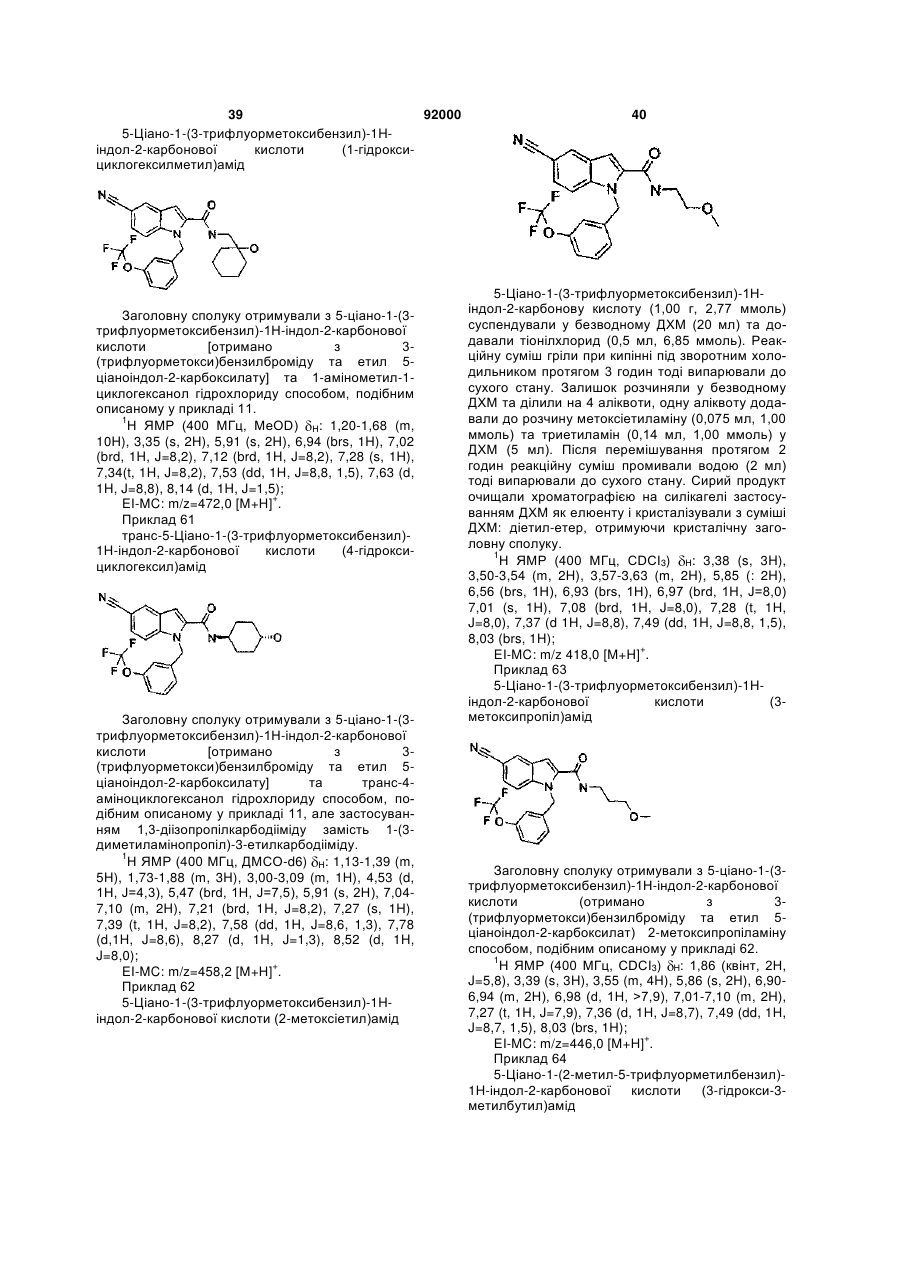
,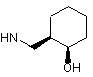 .
.
7. Сполука, яка є похідним 1-бензиліндол-2-карбоксаміду, яку вибрано з групи:
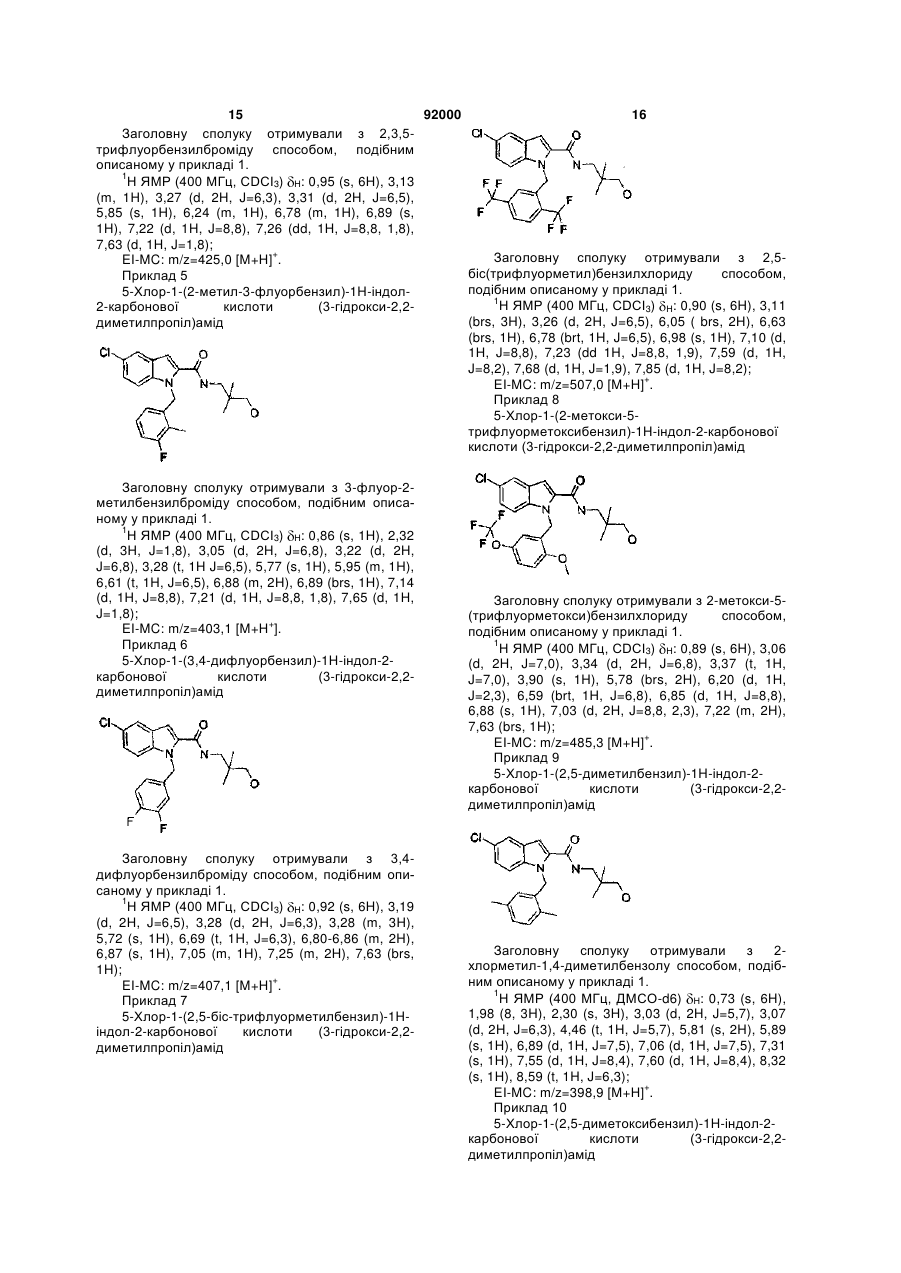
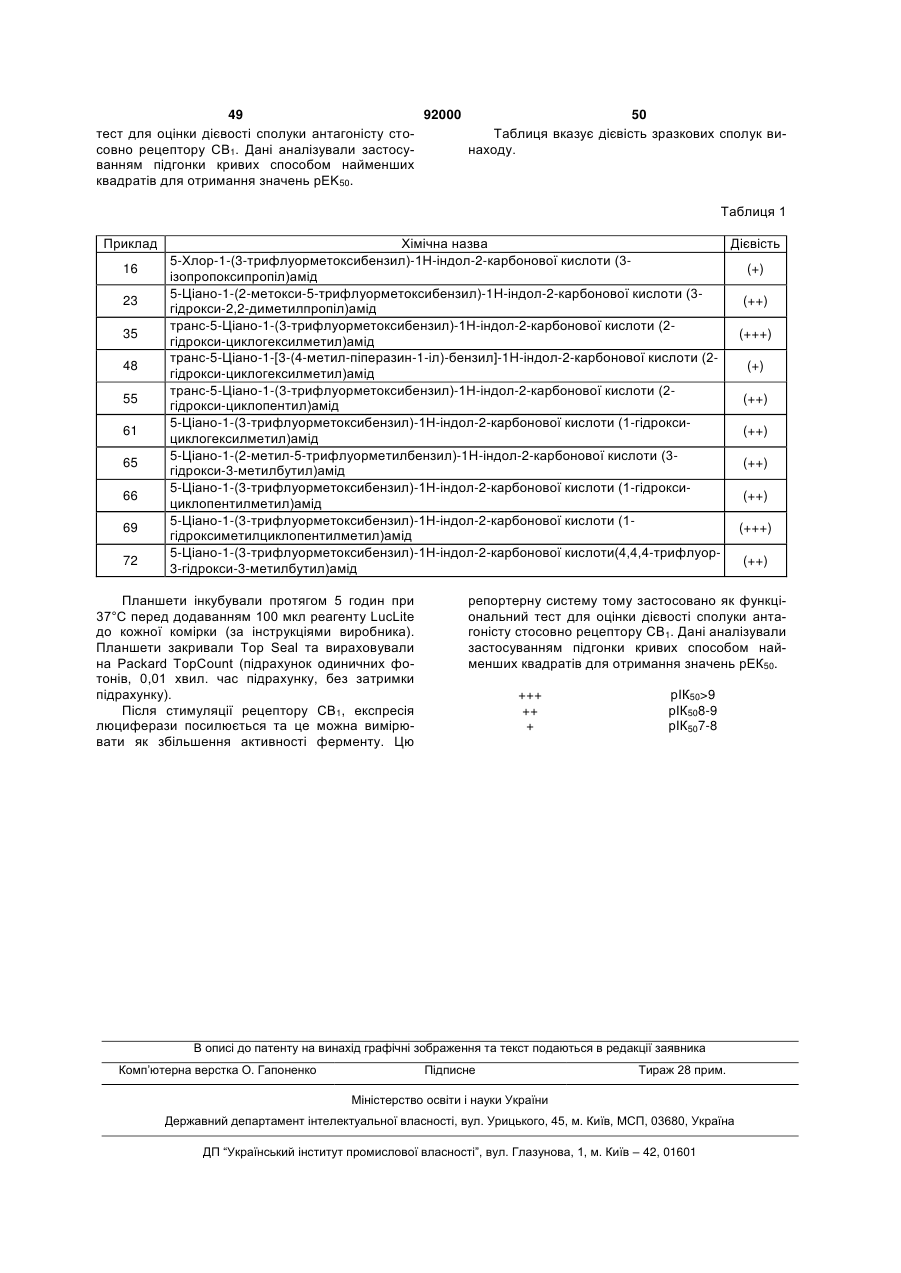
5-хлор-1-(2,5-диметилбензил)-1Н-індол-2-карбонової кислоти (3-гідрокси-2,2-диметилпропіл)амід;
5-хлор-1-(2,5-біс-трифлуорметилбензил)-1Н-індол-2-карбонової кислоти (3-гідрокси-2,2-диметилпропіл)амід;
5-хлор-1-(2-метокси-5-трифлуорметоксибензил)-1Н-індол-2-карбонової кислоти (3-гідрокси-2,2-диметилпропіл)амід;
5-ціано-1-(2-метокси-5-трифлуорметоксибензил)-1Н-індол-2-карбонової кислоти (3-гідрокси-2,2-диметилпропіл)амід;
5-ціано-1-(3-трифлуорметоксибензил)-1Н-індол-2-карбонової кислоти (3-гідрокси-2,2-диметилпропіл)амід;
транс-5-ціано-1-(3-трифлуорметоксибензил)-1Н-індол-2-карбонової кислоти (2-гідроксициклогексилметил)амід;
5-ціано-1-(5-бром-2-метоксибензил)-1Н-індол-2-карбонової кислоти (3-гідрокси-2,2-диметилпропіл)амід;
5-ціано-1-(5-трет-бутил-2-метоксибензил)-1Н-індол-2-карбонової кислоти (3-гідрокси-2,2-диметилпропіл)амід;
5-ціано-1-(2-метокси-5-метилбензил)-1Н-індол-2-карбонової кислоти (3-гідрокси-2,2-диметилпропіл)амід;
5-ціано-1-(5-хлор-2-метоксибензил)-1Н-індол-2-карбонової кислоти (3-гідрокси-2,2-диметилпропіл)амід;
5-ціано-1-(2-метил-5-трифлуорметилбензил)-1Н-індол-2-карбонової кислоти (3-гідрокси-3-метилбутил)амід;
5-ціано-1-(3-трифлуорметоксибензил)-1Н-індол-2-карбонової кислоти (1-гідроксиметилциклопентилметил)амід та
5-ціано-1-(3-трифлуорметоксибензил)-1Н-індол-2-карбонової кислоти (1-гідроксиметилциклобутилметил)амід;
або її фармацевтично прийнятна сіль або сольват.
8. Сполука за будь-яким з пп. 1-7 для застосування у терапії.
9. Фармацевтична композиція, що містить сполуку за будь-яким з пп. 1-7 у суміші з одним або більше фармацевтично прийнятними наповнювачами.
10. Застосування сполуки за будь-яким з пп. 1-7 для виробництва медикаменту для лікування або попередження ожиріння або нікотинової залежності.
Текст
УКРАЇНА (19) UA (11) 92000 (13) C2 (51) МПК (2009) C07D 209/42 (2006.01) C07D 405/12 (2006.01) A61K 31/405 (2006.01) A61P 43/00 МІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ ОПИС ДЕРЖАВНИЙ ДЕПАРТАМЕНТ ІНТЕЛЕКТУАЛЬНОЇ ВЛАСНОСТІ ДО ПАТЕНТУ НА ВИНАХІД (54) ПОХІДНІ 1-БЕНЗИЛІНДОЛ-2-КАРБОКСАМІДУ R5 O N R6 N H R7 , формула І дe R1 - H aбo F; R2 - Н, галоген, С1-4алкіл, С1-4алкілоксил, С36циклоалкіл або С3-6циклоалкілС1-2алкіл, вказані С1-4алкіл та С1-4алкілоксил необов'язково заміщено одним-трьома галогенами, або R2 - 5-6-членне гетероарильне кільце, що містить один або два гетероатоми, вибрані з N та О, або 3 HN 3 OH , HN OH , H3C CH3 , (13) 92000 R4 (11) R1 R2 - 5-6-членне насичене гетероциклічне кільце, що містить одну або дві гетероатомні частини, вибрані з О та NR8; R3 - H aбo F; R4 - Н, галоген, СН3, ОСН3 або CF3, або разом з R5 та фенільним кільцем R4 утворює індол-4-іл або хінолін-5-іл; R5 - Н, галоген, С1-4алкіл, CF3, С1-4алкілоксил, OCF3, або разом з R4 та фенільним кільцем R5 утворює індол-4-іл або хінолін-5-іл; за умови, що один-три з R1-R5 не являють собою Н; R6 - один або два замісники, що вибрано з Сl, Вr та CN; R7 - С1-6алкіл, необов'язково заміщений однимтрьома галогенами, С3-6циклоалкіл або С36циклоалкілС1-2алкіл, кожний з яких заміщено одним або двома замісниками, вибраними з групи: гідроксил, гідроксіС1-2алкіл, С1-4алкілоксил та С12тіоалкілоксил, або R7 - С4-6оксациклоалкілС1-2алкіл, вказаний С12алкіл необов'язково заміщено гідроксилом або гідроксіС1-2алкілом, або R7 – С4-6оксациклоалкіл, а R8 - Н, С1-4алкіл або С1-4ацил; або її фармацевтично прийнятні сіль або сольват. 2. Сполука за п. 1, де R1, R3 та R4 - Н. 3. Сполука за п. 1 або за п. 2, де R2-CH3, CH(CH3)3, CF3, OCH3, OCH(CH3)2, OCHF2, OCF3, Вr, Сl або F. 4. Сполука за будь-яким з пп. 1-3, де R5 - Н, СН3, ОСН3, OCF3, Сl або F. 5. Сполука за будь-яким з пп. 1-4, де R6 - CN. 6. Сполука за будь-яким з пп. 1-5, де NHR7 вибрано з групи: HN OH H C CH UA (21) a200709943 (22) 17.03.2006 (24) 27.09.2010 (86) PCT/EP2006/060821, 17.03.2006 (31) 05102217.6 (32) 21.03.2005 (33) EP (46) 27.09.2010, Бюл.№ 18, 2010 р. (72) КОУЛІ ФІЛІП МАРТІН, GB, ҐІБСОН СЕМ'ЮЕЛ ДЖОРДЖ, GB, ВІШАРТ ҐРАНТ, GB (73) Н.В. ОРҐАНОН, NL (56) WO 0158869 A LANGE J H M et al: "Recent advances in CB1 cannabinoid receptor antagonists" current opinion in drug discovery and development, current drugs, London, GB, vol.7, no.4, July 2004 (2004-07) pages 498-506, XP009045300 ISSN: 1367-6733 cited in the application the whole document SALL, DANIEL J.et all: J.MED.CHEM., vol.40, 1997,pages 2843-2857, XP002342338 abstracts; compound 49 *scheme 10* (57) 1. Сполука, яка є похідним 1-бензиліндол-2карбоксаміду формули R2 R3 C2 2 (19) 1 3 92000 4 транс-5-ціано-1-(3-трифлуорметоксибензил)-1Ніндол-2-карбонової кислоти (2гідроксициклогексилметил)амід; HN 5-ціано-1-(5-бром-2-метоксибензил)-1Н-індол-2HN OH HN OH , OH , карбонової кислоти (3-гідрокси-2,2, диметилпропіл)амід; 5-ціано-1-(5-трет-бутил-2-метоксибензил)-1Ніндол-2-карбонової кислоти (3-гідрокси-2,2HN HN диметилпропіл)амід; 5-ціано-1-(2-метокси-5-метилбензил)-1Н-індол-2OH , OH карбонової кислоти (3-гідрокси-2,2диметилпропіл)амід; 5-ціано-1-(5-хлор-2-метоксибензил)-1Н-індол-2HN карбонової кислоти (3-гідрокси-2,2диметилпропіл)амід; 5-ціано-1-(2-метил-5-трифлуорметилбензил)-1НOH . , індол-2-карбонової кислоти (3-гідрокси-37. Сполука, яка є похідним 1-бензиліндол-2метилбутил)амід; карбоксаміду, яку вибрано з групи: 5-ціано-1-(3-трифлуорметоксибензил)-1Н-індол-25-хлор-1-(2,5-диметилбензил)-1Н-індол-2карбонової кислоти (1карбонової кислоти (3-гідрокси-2,2гідроксиметилциклопентилметил)амід та диметилпропіл)амід; 5-ціано-1-(3-трифлуорметоксибензил)-1Н-індол-25-хлор-1-(2,5-біс-трифлуорметилбензил)-1Н-індолкарбонової кислоти (12-карбонової кислоти (3-гідрокси-2,2гідроксиметилциклобутилметил)амід; диметилпропіл)амід; або її фармацевтично прийнятна сіль або сольват. 5-хлор-1-(2-метокси-5-трифлуорметоксибензил)8. Сполука за будь-яким з пп. 1-7 для застосуван1Н-індол-2-карбонової кислоти (3-гідрокси-2,2ня у терапії. диметилпропіл)амід; 9. Фармацевтична композиція, що містить сполуку 5-ціано-1-(2-метокси-5-трифлуорметоксибензил)за будь-яким з пп. 1-7 у суміші з одним або більше 1Н-індол-2-карбонової кислоти (3-гідрокси-2,2фармацевтично прийнятними наповнювачами. диметилпропіл)амід; 10. Застосування сполуки за будь-яким з пп. 1-7 5-ціано-1-(3-трифлуорметоксибензил)-1Н-індол-2для виробництва медикаменту для лікування або карбонової кислоти (3-гідрокси-2,2попередження ожиріння або нікотинової залежносдиметилпропіл)амід; ті. Заявлений винахід стосується похідних 1бензиліндол-2-карбоксаміду, фармацевтичних композицій, що містять ці сполуки, та їх застосування у терапії. Гашиш застосовано як медичний засіб протягом тисяч років, що викликало велику кількість дослідів активних компонентів (канабіноїди) та їх рецепторів. Два типи канабіноїдних рецепторів нещодавно клоновано та охарактеризовано. Канабіноїдий рецептор СB1 є локалізованим головним чином у центральній нервовій системі, але також експресується периферійними нейронами та у нижчому ступені в інших периферійних тканинах. З іншого боку, канабіноїдний рецептор СВ2 є головним чином локалізованим в імунних клітинах (Howlett A.C. et al, Pharmacol Rev. 2002, 54,161202). Рівень техніки канабіноїдних рецепторів та їх ліганди нещодавно описано у Hertzog D.L., Expert Opinion on Therapeutic Patents, 2004,14, 1435-1452. Кілька антагоністів рецептору СB1 відомі у рівні техніки. Ці сполуки вказані як корисні у великому числі терапевтичних застосувань, охоплюючи лікування ожиріння, нікотинової залежності, наркотизму, астми, цирозу печінки, психозу та розладів пам'яті і когнітивних розладів (дивись Lange J.H.M. та Kruse C.G., Current Opinion in Drug Discovery and Development, 2004, 7,498-506 для огляду). Разом з багатьма канабіноїдними лігандами відомі сполуки є ліпофільними з відносно низькою розчинністю у воді. Залишається необхідність у наступних антагоністах рецептору СB1, котрі є безпечними та ефективними. Нещодавно похідні індол-2-карбоксаміду були загалом описані у WO/0158869 (Bristol-Myers Squibb) як активні модулятори канабіноїдного рецептору та як так корисні у лікуванні респіраторних хвороб. WO/0158869, однак, не робить конкретного розкриття будь-якого з похідних 1-бензил-індол2-карбоксаміду. Згідно з першим аспектом заявлений винахід стосується похідного 1-бензиліндол-2карбоксаміду формули І 5 формула І, де R1 - Η або F; R2 - Н, галоген, С1-4алкіл, С1-4алкілоксил, С36цикпоалкіл або С3-6циклоалкілС1-2алкіл, вказані С1-4алкіл та С1-4алкілоксил необов'язково заміщено одним - трьома галогенами або R2 - 5-6членне гетероарильне кільце, що містить один або два гетероатоми, вибрані з N та О, або R2 - 56-членне насичене гетероциклічне кільце, що містить одну або дві гетероатомні частини, вибрані з О та NR8; R3 - H або F; R4 - Η, галоген, СН3, ОСН3, або CF3, або разом з R5 та фенільним кільцем R4 утворює індол4-іл або хінолін-5-іл; R5 - Н, галоген, С1-4алкіл, CF3, С1-4алкілоксил, 4 5 OCF3 або разом з R та фенільним кільцем R утворює індол-4-іл або хінолін-5-іл; за умови, що один - три з R1 - R5 не являють собою Н; R6 - один або два замісники, що вибрано з СІ, Br та CN; R7 - С1-6алкіл необов'язково заміщений одним - трьома галогенами, С3-6циклоалкіл або С36циклоалкілС1-2алкіл, кожний з яких заміщено одним або двома замісниками, вибраними з групи: гідроксил, гідроксиС1-2алкіл, С1-4алкілоксил та С1-2тіоалкілоксил, або R7 - С4-6оксациклоалкілС12алкіл, вказаний С1-2алкіл необов'язково заміщено гідроксилом або гідроксиС1-2алкілом, або R7 С1-6oкcaциклoaлкiл, а R8 - Н, С1-4алкіл або С1-4ацил або його фармацевтично прийнятної солі або сольвату. Термін С1-6алкіл при застосовувані тут являє собою розгалужений або нерозгалужений алкіл, що має 1-6 атомів карбону. Прикладами таких груп є метил, етил, ізопропіл, третинний бутил, пентил та гексил. Подібно термін С1-4алкіл при застосовувані тут являє собою розгалужений або нерозгалужений алкіл, що має 1-4 атоми карбону. Термін С1-4ацил при застосовувані тут являє собою ацильне похідне карбонової кислоти, що має 1-4 атоми карбону. Ацил може містити вуглеводень, котрий може бути розгалуженим, нерозгалуженим, насиченим або ненасиченим. Приклади таких груп охоплюють форміл, ацетил, пропаноїл, пропеноїл та півалоїл. Також визначення С1-6ацил охоплює групи, похідні від дикарбонової кислот типу гемі-маланоїлу. 92000 6 Термін С1-4алкілоксил при застосовувані тут являє собою розгалужений або нерозгалужений алкілоксил, що має 1-4 атоми карбону. Прикладами таких груп є метоксил, етоксил, ізопропілоксил та третинний бутилоксил. Так само С12алкілоксил, при застосовувані тут являє собою розгалужений або нерозгалужений алкілоксил, що має 1-2 атоми карбону Термін С3-6циклоалкіл при застосовувані тут являє собою розгалужений або нерозгалужений циклічний алкіл, що має 3-6 атомів карбону. Прикладами таких груп є циклопропіл, циклопентил та 2-метилциклопентил. Так само, термін С46циклоалкіл являє собою розгалужений або нерозгалужений циклічний алкіл, що має 4-6 атомів карбону. Термін С3-6циклоалкілС1-2алкіл при застосовувані тут являє собою С1-2алкіл, котрий заміщено С3-6циклоалкілом. Прикладами таких кілець є циклопропілметил та 2-циклобутилетил. Термін гідроксиС1-2алкіл при застосовувані тут являє собою С1-2алкіл, котрий заміщено гідроксигрупою. Прикладами таких груп є гідроксиметил та гідроксіетил. Термін С1-2тіоалкілоксил при застосовувані тут являє собою С1-2алкілоксил, де у атом оксигену замінено на сульфур (тобто, SС1-2алкіл). Прикладами таких груп є тіометоксил та тіоетоксил. Термін С4-6оксациклоалкіл при застосовувані тут являє собою розгалужений або нерозгалужений циклічний алкіл, що має 4-6 атомів карбону, у котрому один з кільцевих атомів карбону замінено на оксиген. Приклади таких груп охоплюють тетрагідрофураніл та 3-метил-тетрагідрофураніл. Термін С4-6оксациклоалкілС1-2алкіл при застосовувані тут являє собою С1-2алкіл, котрий заміщено С4-6оксациклоалкілом. Приклади таких груп охоплюють тетрагідропіран-4-ілметил та 2[3-метилтетрагідрофуран-2-іл]етил. Термін галоген при застосовувані тут являє собою атом F, СІ, Br або І. Приклади 5-6-членного гетероарильного кільця, що містить один або два гетероатоми, вибрані з N та О, охоплюють фураніл, піроліл, піридиніл, оксазоліл, імідазоліл та піримідиніл. Приклади 5-6-членного насиченого гетероциклічного кільця, що містить одну або дві гетероатомні частини, вибрані з О та NR8, при застосовувані тут, де R8 визначено вище, охоплюють піперидиніл, гомопіперидиніл, морфолініл та 4метилпіперазиніл. В одному втіленні заявленого винаходу R1 Н. У ще одному втіленні R2 - С1-4алкіл або С1алкілоксил, що необов'язково заміщено галоге4 ном або галогеном. У наступному втіленні R2 CH3, CH(CH3)3, CF3, OCH3, OCH(CH3)2, OCHF2, 2 OCF3, Br, СІ або F. У наступному втіленні R - CF3 або OCF3. У ще одному втіленні R3 - Н. У ще одному втіленні R4 - Н, СН3, ОСН3, F або СІ. У наступному втіленні R4 - Н. 7 92000 8 У ще одному втіленні R5 - Н, СН3, ОСН3, ми, С3-6циклоалкіл або С3-6циклоалкілС1-2алкіл, OCF3, СІ або F. У наступному втіленні R5 - Н, СН3 що заміщено одним або двома замісниками, вибабо ОСН3. раними з групи: гідроксил, гідроксиС1-2алкіл, С1У наступному втіленні R1, R3 та R4 - Н. 4алкілоксил та С1-2тіоалкілоксил. У наступному У ще одному втіленні R6 - СІ. втіленні R7 - С1-6алкіл або С3-6циклоалкілС1-2алкіл, 6 У ще одному втіленні R - CN. що заміщено гідроксил або гідроксиметил. В інУ наступному втіленні R6 локалізовано у 5шому втіленні R7 - С4-6алкіл або С4-6циклоалкілС1позиції індольного кільця. 2алкіл. У ще одному втіленні R7 - С1-6алкіл, що неУ наступному втіленні NHR7 вибрано з групи: обов'язково заміщено одним - трьома галогена У ще одному втіленні R7 - С4-6циклоалкілС12алкіл, вказаний С1-2алкіл необов'язково заміщено гідроксилом або гідроксиС1-2алкілом. У наступному втіленні R7 С4оксациклоалкіл. 6 У наступному втіленні похідне 1-(бензил)-1Ніндол-2-карбонової кислоти аміду вибрано з групи: 5-хлор-1-(2,5-диметилбензил)-1H-індол-2карбонової кислоти (3-гідрокси-2,2диметилпропіл)амід; 5-хлор-1-(2,5-біс-трифлуорметилбензил)-1Hіндол-2-карбонової кислоти (3-гідрокси-2,2диметилпропіл)амід; 5-хлор-1-(2-метокси-5трифлуорметоксибензил)-1H-індол-2-карбонової кислоти (3-гідрокси-2,2-диметилпропіл)амід; 5-ціано-1-(2-метокси-5трифлуорметоксибензил)-1H-індол-2-карбонової кислоти (3-гідрокси-2,2-диметилпропіл)амід; 5-ціано-1-(3-трифлуорметоксибензил)-1Hіндол-2-карбонової кислоти (3-гідрокси-2,2диметилпропіл)амід; транс-5-ціано-1-(3-трифлуорметоксибензил)1H-індол-2-карбонової кислоти (2-гідроксициклогексилметил)амід; 5-ціано-1-(5-бром-2-метоксибензил)-1Hіндол-2-карбонової кислоти (3-гідрокси-2,2диметилпропіл)амід; 5-ціано-1-(5-трет-бутил-2-метоксибензил)-1Hіндол-2-карбонової кислоти (3-гідрокси-2,2диметилпропіл)амід; 5-ціано-1-(2-метокси-5-метилбензил)-1Hіндол-2-карбонової кислоти (3-гідрокси-2,2диметилпропіл)амід; 5-ціано-1-(5-хлор-2-метоксибензил)-1H-індол2-карбонової кислоти (3-гідрокси-2,2диметилпропіл)амід; 5-ціано-1-(2-метил-5-трифлуорметилбензил)1H-індол-2-карбонової кислоти (3-гідрокси-3метилбутил)амід; 5-ціано-1-(3-трифлуорметоксибензил)-1Hіндол-2-карбонової кислоти (1гідроксиметилциклопентилметил)амід та 5-ціано-1-(3-трифлуорметоксибензил)-1Hіндол-2-карбонової кислоти (1гідроксиметилциклобутилметил)амід. Похідні аміду 1-(бензил)-1H-індол-2карбонової кислоти формули І отримують способами, добре відомими у рівні техніки органічної хімії, дивись наприклад, J. March, 'Advanced Organic Chemistry'4 Edition, John Wiley та Sons. Наприклад, сполуки формули І можна отримати конденсацією сполук формули II, де R1-R6 визначені раніше, а С(О)Х являє собою карбонову кислоту або її активоване похідне, як-то галогенангідрид карбонової кислоти, переважно хлорангідрид або бромангідрид, з амінами формули NHR7, де R7 визначено раніше. Коли С(О)Х являє собою карбонову кислоту (тобто X - гідрокси) реакцію конденсації можна провести за допомогою засобу сполучення, як-то карбонілдіімідазол, дициклогексилкарбодіімід тощо, у розчиннику, як-то диметилформамід або дихлорметан. 9 Коли С(О)Х являє собою галогенангідрид карбонової кислоти (тобто X - галогенід) конденсацію з похідним аміну II можна проводити при наявності основи, наприклад, триетиламіну, у розчиннику, як-то дихлорметан. Галогенангідрид, наприклад, хлорангідрид карбонової кислоти можна отримати обробкою відповідної карбонової кислоти, наприклад, оксалілхлоридом або тіоніл хлоридом, у розчиннику, як-то толуол або дихлорметан. Аміни NHR7 отримані з комерційних дже Сполуки формули III можна отримати з комерційних джерел, отримати літературними способами або модифікаціями літературних способів, відомих спеціалістам. Наприклад, сполуки формули III можна отримати галогенуванням пов'язаних з бензиловим спиртом похідних способами, добре відомими у рівні техніки. Наприклад, хлорування можна здійснювати застосуванням, наприклад, тіонілхлориду або оксалілхлориду, а бромування можна здійснювати застосуванням фосфор триброміду або комбінації карбон тетраброміду та трифенілфосфіну. Бензилові спирти можна отримати способами, добре відомими у рівні техніки, наприклад, відновленням відповідного естеру бензойної кислоти застосуванням відновнику, як-то комплекс борантетрагідрофуран або літій алюмогідрид. Сполуки формули IV можна отримати з комерційних джерел, отримати літературними способами або модифікаціями літературних способів, відомих спеціалістам, дивись наприклад, WO 199639384 стор. 100-101 та ЕР 0655439 А2 стор. 34, 48-49, отримуючи сполуку, де R6 - CN. 92000 10 рел, отримані літературними способами або модифікаціями літературних способів, відомих спеціалістам, наприклад, відновленням нітрилу застосуванням літій алюмогідриду. Сполуки формули II можна отримати реакці1 5 єю сполук формули III, де R -R визначені раніше, a Y - придатна відщеплювана група, зі сполуками формули IV, де R6 визначено раніше, a PG придатна захисна група, при наявності основи, як-то натрій гідрид. Придатними відщеплюваними групами є, наприклад, галогенід або алкілсульфонат. Приклади звичайних захисних груп описані у T.W. Greene та P.G.M. Wutts 'Protective Groups in Organic Synthesis' 2nd Edition, John Wiley та Sons, 1991. Наприклад, захист PG як естеру карбонової кислоти можна здійснювати способами, добре відомими у рівні техніки, наприклад, реакцією карбонової кислоти з гідрогенхлоридом в етанолі при підвищеній температурі. Після реакції захисну групу PG можна зручно видаляти способами, також добре відомими у рівні техніки, наприклад, коли PG - естер карбонової кислоти, незахищену карбонову кислоту можна отримати каталізованим основою гідролізом застосуванням натрій гідроксиду при підвищеній температурі. Заявлений винахід також охоплює у своїх рамках усі стереоізомерні форми утворених сполук внаслідок конфігураційної ізомерії, як-то енантіомери та діастереомери. Наприклад, у випадку, де NHR7 - 2-метил-3-гідроксипропіламіно, сполука існує як пара енантіомерів. У випадку окремих енантіомерів сполук формули І або їх солей або сольватів, заявлений винахід охоплює вищезгадані енантіомер по суті вільні, тобто, асоційовані з менше 5%, переважно менше 2% та зокрема, менше 1% іншого енантіомеру. Суміші стереоізомерів у будь-якій пропорції, наприклад, рацемічна суміш, що містить по суті рівні кількості двох енантіомерів є також у рамках заявленого винаходу. Для хіральних сполук способи асиметричного синтез, за допомогою чого отримані чисті стереоізомери, добре відомі у рівні техніки, наприклад, синтез із хіральною індукцією, синтез, починаючи з хіральних інтермедіатів, енантіоселективні ферментативні перетворення, розділення стереоізомерів хроматографією на хіральному середовищі. Такі способи описані у Chiralityln Industry 11 92000 12 (edited byA.N. Collins, G.N. Sheldrake and J. Згідно з ще одним аспектом 1-бензиліндол-2Crosby, 1992; John Wiley). карбоксамідні похідні згідно з винаходом корисні Похідні 1-бензиліндол-2-карбоксамід заявледля виробництва медикаменту для застосування ного винаходу у формі вільної основи виділяють з у лікуванні когнітивних розладів, шизофренії або реакційних сумішей як фармацевтично прийнятні депресії. солі. Ці солі також отримують обробкою вказаної Заявлений винахід крім того, охоплює спосіб вільної основи органічною або неорганічною кислікування ссавця, охоплюючи людину, яка потерлотою, як-то гідрогенхлорид, гідрогенбромід, гідпає або схильна потерпати від будь-як з вищерогенйодид, сульфатна кислота, фосфатна кисзгаданих хвороб або розладів, спосіб полягає у лота, оцтова кислота, трифлуороцтова кислота, застосуванні ефективної кількості сполуки заявпропіонова кислота, гліколева кислота, малеїноленого винаходу або її фармацевтично прийнятва кислота, малонова кислота, метансульфонова ної солі або сольвату. кислота, фумарова кислота, бурштинова кислота, Кількість сполуки заявленого винаходу або її винна кислота, лимонна кислота, бензойна кисфармацевтично прийнятної солі або сольвату, лота та аскорбінова кислота. Усі солі, фармацевтакож позначених тут як активний інгредієнт, коттично прийнятні або ні, є у рамках заявленого ра є потрібною для досягнення терапевтичної дії, винаходу. безумовно, варіюватиме з конкретною сполукою, 1-бензиліндол-2-карбоксамідні похідні заявшляхом застосування, віком та станом реципієнленого винаходу існують у сольватованій та нета та конкретним розладом або хворобою, що сольватованій формі, охоплюючи гідратовані лікують. форми. Усі ці форми є у рамках заявленого винаПридатна добова доза для будь-якого з виходу. щезгаданих розладів буде у діапазоні 0,001-50 1-бензиліндол-2-карбоксамідні похідні заявмг/кг маси тіла реципієнта (наприклад, людини) леного винаходу також існують як аморфні форна добу, переважно у діапазоні 0,01-20 мг/кг маси ми. Багато кристалічних форми є також можлитіла на добу. Потрібну доз можна представити як вими. Усі ці фізичні форми є у рамках заявленого багатократні субдози, застосовувані з прийнятвинаходу. ними інтервалами протягом доби. В іншому аспекті 1-бензиліндол-2Хоча можливо застосовувати активний інгрекарбоксамідні похідні заявленого винаходу коридієнт сам по собі, його переважно представляють сні у терапії. Зокрема, 1-бензиліндол-2як фармацевтичну композицію. Заявлений винакарбоксамідні похідні заявленого винаходу корихід тому також стосується фармацевтичної комсні у терапії людей або тварин. Як такі 1позиції, що містить сполуку згідно з заявленим бензиліндол-2-карбоксамідні похідні заявленого винаходом у суміші з одним або більше фармавинаходу корисні для виробництва медикаменту цевтично прийнятними наповнювачами, як-то для лікування або попередження розладів, хараописаними у Gennaro et. al., Remmington: The ктеризованих модуляцією активності рецептори Science and Practice of Pharmacy, 20th Edition, СB1. Lippincott, Williams та Wilkins, 2000; дивись особЗгідно з наступним аспектом 1-бензиліндолливо частину 5: фармацевтичне виробництво. 2-карбоксамідні похідні заявленого винаходу коПридатні наповнювачі описані наприклад, у рисні для виробництва медикаменту для лікуванHandbook of Pharmaceutical Excipients, 2nd ня або попередження потреби в їжі, збільшення Edition; Editors A. Wade and P.J.Weller, American маси, ожиріння, метаболічного синдрому або діаPharmaceutical Association, Washington, The бету. Спеціалісту зрозуміло, що таке збільшення Pharmaceutical Press, London, 1994. Композиції маси могло б бути в результаті лікування іншими охоплюють придатні для перорального, назальліками, як-то лікування антипсихотичним засобом ного, місцевого (охоплюючи букальне, сублінгваабо антидепресантом. льне та трансдермальне), парентерального (охоЗгідно з наступним аспектом 1-бензиліндолплюючи підшкірне, внутрішньовенне та 2-карбоксамідні похідні заявленого винаходу ковнутрішньом'язове) або ректального застосуванрисні для виробництва медикаменту для лікування. ня або попередження залежності від речовин або Суміші сполуки згідно з винаходом та одного маніакального жадання. Спеціалісту зрозуміло, або більше фармацевтично прийнятних наповщо залежність від речовин може охоплювати різні нювачів можна пресувати у тверді дозовані одиформи, як-то залежність від нікотину або паління, ниці, як-то таблетки, або обробляти у капсули опіоїдів (наприклад, героїну або морфіну), стимуабо супозиторії. За допомогою фармацевтично ляторів (наприклад, кокаїну або амфетаміну), придатних рідин сполуки можна також застосовуспирту або гашишу. Лікування або попередження вати ін'єкціями у формі розчину, суспензії, емульзалежності від речовин крім того охоплює допосії, або як розпилюваний розчин, наприклад, намогу відмові від застосування, лікування симптозальний або букальний розпилюваний розчин. мів припинення зловживання (охоплюючи жаданДля створення дозованих одиниць наприклад, ня і де проблематичне збільшення маси) та таблеток, застосовують звичайні добавки, як-то попередження рецидиву у реакції на піддавання наповнювачі, барвники, полімерні зв'язуючі тощо. дії середовища або ліків чи стресу. Загалом, можна застосовувати будь-яку фармаЗгідно з наступним аспектом 1-бензиліндолцевтично прийнятну добавку. Сполуки винаходу 2-карбоксамідні похідні заявленого винаходу котакож придатні для застосування у імплантаті, рисні у виробництві медикаменту для лікування пластирі, гелі або будь-якому іншому препараті або попередження розладів з імпульсивністю. для негайного та/або безперервного вивільнення. 13 92000 14 1 Придатні наповнювачі, з котрими можна Н ЯМР (400 МГц, CDCI3) Η: 0,88 (s, 6H), 2,26 отримати та застосовувати фармацевтичну ком(s, 3H), 3,09 (brd, 2H, J=6,8), 3,25 (d, 2H, J=6,8), позицію, охоплюють лактозу, крохмаль, целюлозу 3,45 (m,1H), 5,74 (s, 2H), 6,54 (111, 1H), 6,77 (brd, та її похідні тощо, або їх суміші у придатній кіль1H, J=7,8), 6,85 (s, 1H), 6,88 (s, 1H), 7,01 (brd, 1H, кості. J=7,8), 7,11 (t, 1H, J=7,8), 7,22 (dd, 1H, J=8,8, 1,9), Винахід далі ілюстровано наступними прик7,30 (d, 1H, J=8,8), 7,61 (d,1H, J=1,9); ладами: EI-MC: m/z=385,8 [M+H]+. Приклад 1 Приклад 2 5-Хлор-1-(3-метилбензил)-1Н-індол-25-Хлор-1-(3-трифлуорметилбензил)-1Нкарбонової кислоти (3-гідрокси-2,2індол-2-карбонової кислоти (3-гідрокси-2,2диметилпропіл)амід диметилпропіл)амід Натрій гідрид (60% дисперсія у мінеральному маслі, 0,44 г, 7,45 ммоль) додавали до суспензії 5-хлор-1H-індол-2-карбонової кислоти етилестеру (2,00 г, 8,94 ммоль) у Ν,Ν'диметилформаміді (ДМФ) (20 мл) під азотом. Суміш перемішували протягом години перед додаванням 3-метилбензилброміду (2,07 г, 2,48 мл) та реакційну суміш перемішували протягом 17,5 годин. Воду додавали до реакційної суміші, що осаджувало смолистий твердий продукт. Супернатант декантували та твердий продукт промивали водою. Продукт розчиняли у дихлорметані (ДХМ), промивали водою, сушили магній сульфатом та концентрували. Хроматографія на силікагелі застосуванням ДХМ як елюентом, дала 5хлор-1-(3-метилбензил)-1H-індол-2-карбонової кислоти етил-естер (3,03 г, 95%). Розчин 4 Μ водного натрій гідроксиду (0,29 мл) додавали до розчину 5-хлор-1-(3метилбензил)-1H-індол-2-карбонової кислоти етил-естеру (2,90 г, 8,85 ммоль) в етанолі (30 мл) та реакційну суміш гріли при 45°С протягом 3 годин. Після концентрування суміші до 5 мл, розчин 2 Μ водної НСІ (2 мл) додавали для осадження блідого твердого продукту, котрий фільтрували, промивали водою (3x30 мл) та сушили під вакуумом, отримуючи 5-хлор-1-(3метилбензил)-1Н-індол-2-карбонову кислоту (2,57 г, 89%). 1-(3-Диметиламінопропіл)-3-етилкарбодіімід гідрохлорид (EDCI) (0,14 г, 0,57 ммоль) та 1гідроксибензотриазол гідрат (НОВТ) (0,11 г, 0,59 ммоль) додавали до розчину 5-хлор-1-(3метилбензил)-1H-індол-2-карбонової кислоти (0,20 г, 0,67 ммоль) у ДХМ (10 мл). Після перемішування протягом 10 хвил. додавали 3-аміно-2,2диметилпропан-1-ол (0,083 г, 0,80 ммоль). Після перемішування протягом 17,5 годин, додавали воду (10 мл), шари відокремлювали, органічну фазу промивали водою (3x15 мл) та сушили магній сульфатом. Очищали хроматографією на силікагелі застосуванням суміші ДХМ:метанол (3:1) як елюенту. Кристалізація сирого продукту дала 5-хлор-1-(3-метилбензил)-1H-індол-2-карбонової кислоти (3-гідрокси-2,2-диметилпропіл)амід як білий твердий продукт (0,100 г, 43%). Заголовну сполуку отримували з 3(трифлуорметил)бензилброміду способом, подібним описаному у прикладі 1. 1 Н ЯМР (400 МГц, CDCI3) Η: 0,89 (s, 6H), 3,13 (d, 2H, J=6,8), 3,24 (d, 1H, J=6,5), 3,26 (d, 2H, J=6,5), 5,83 (s, 2H), 6,67 (brt, 1H, J=6,5), 6,88 (s, 1H), 7,20 (d, 1H, J=7,8), 7,24 (m, 2H), 7,30 (brs, 1H), 7,36 (t, 1H, J=7,8), 7,47 (d, 1H, J=7,8), 7,64 (m, 1H); EI-MC: m/z=439,1 [M+H]+. Приклад 3 5-Хлор-1-(2-трифлуорметил-5-флуорбензил)1H-індол-2-карбонової кислоти (3-гідрокси-2,2диметилпропіл)амід Заголовну сполуку отримували з 2-флуор-5(трифлуорметил)бензилброміду способом, подібним описаному у прикладі 1. 1 Н ЯМР (400 МГц, CDCI3) Η: 0,92 (s, 6H), 3,14 (dd, 1H, J=5,9, 7,2), 3,20 (m, 2H), 3,28 (d, 2H, J=6,0), 5,99 (brs, 1H), 6,09 (dd, 1H, J=10,0), 6,75 (brt, 1H, J=6,0), 6,95 (s, 1H), 6,98 (m, 1H), 7,09 (d, 1H, J=8,9), 7,20-7,24 (dd, 1H, J=8,9, 2,0), 7,67 (d, 1H, J=2,0), 7,70 (m, 1H); EI-MC: m/z=457,4 [M+H]+. Приклад 4 5-Хлор-1-(2,3,5-трифлуорбензил)-1h-iндол-2карбонової кислоти (3-гідрокси-2,2диметилпропіл)амід 15 92000 16 Заголовну сполуку отримували з 2,3,5трифлуорбензилброміду способом, подібним описаному у прикладі 1. 1 Н ЯМР (400 МГц, CDCI3) Η: 0,95 (s, 6H), 3,13 (m, 1H), 3,27 (d, 2H, J=6,3), 3,31 (d, 2H, J=6,5), 5,85 (s, 1H), 6,24 (m, 1H), 6,78 (m, 1H), 6,89 (s, 1H), 7,22 (d, 1H, J=8,8), 7,26 (dd, 1H, J=8,8, 1,8), 7,63 (d, 1H, J=1,8); Заголовну сполуку отримували з 2,5EI-MC: m/z=425,0 [M+H]+. біс(трифлуорметил)бензилхлориду способом, Приклад 5 подібним описаному у прикладі 1. 5-Хлор-1-(2-метил-3-флуорбензил)-1H-індол1 Н ЯМР (400 МГц, CDCI3) Η: 0,90 (s, 6H), 3,11 2-карбонової кислоти (3-гідрокси-2,2(brs, 3H), 3,26 (d, 2H, J=6,5), 6,05 ( brs, 2H), 6,63 диметилпропіл)амід (brs, 1H), 6,78 (brt, 1H, J=6,5), 6,98 (s, 1H), 7,10 (d, 1H, J=8,8), 7,23 (dd 1H, J=8,8, 1,9), 7,59 (d, 1H, J=8,2), 7,68 (d, 1H, J=1,9), 7,85 (d, 1H, J=8,2); EI-MC: m/z=507,0 [M+H]+. Приклад 8 5-Хлор-1-(2-метокси-5трифлуорметоксибензил)-1H-індол-2-карбонової кислоти (3-гідрокси-2,2-диметилпропіл)амід Заголовну сполуку отримували з 3-флуор-2метилбензилброміду способом, подібним описаному у прикладі 1. 1 Н ЯМР (400 МГц, CDCI3) Η: 0,86 (s, 1H), 2,32 (d, 3H, J=1,8), 3,05 (d, 2H, J=6,8), 3,22 (d, 2H, J=6,8), 3,28 (t, 1H J=6,5), 5,77 (s, 1H), 5,95 (m, 1H), 6,61 (t, 1H, J=6,5), 6,88 (m, 2H), 6,89 (brs, 1H), 7,14 (d, 1H, J=8,8), 7,21 (d, 1H, J=8,8, 1,8), 7,65 (d, 1H, J=1,8); EI-MC: m/z=403,1 [M+H+]. Приклад 6 5-Хлор-1-(3,4-дифлуорбензил)-1H-індол-2карбонової кислоти (3-гідрокси-2,2диметилпропіл)амід Заголовну сполуку отримували з 3,4дифлуорбензилброміду способом, подібним описаному у прикладі 1. 1 Н ЯМР (400 МГц, CDCI3) Η: 0,92 (s, 6H), 3,19 (d, 2H, J=6,5), 3,28 (d, 2H, J=6,3), 3,28 (m, 3H), 5,72 (s, 1H), 6,69 (t, 1H, J=6,3), 6,80-6,86 (m, 2H), 6,87 (s, 1H), 7,05 (m, 1H), 7,25 (m, 2H), 7,63 (brs, 1H); EI-MC: m/z=407,1 [M+H]+. Приклад 7 5-Хлор-1-(2,5-біс-трифлуорметилбензил)-1Hіндол-2-карбонової кислоти (3-гідрокси-2,2диметилпропіл)амід Заголовну сполуку отримували з 2-метокси-5(трифлуорметокси)бензилхлориду способом, подібним описаному у прикладі 1. 1 Н ЯМР (400 МГц, CDCI3) Η: 0,89 (s, 6H), 3,06 (d, 2H, J=7,0), 3,34 (d, 2H, J=6,8), 3,37 (t, 1H, J=7,0), 3,90 (s, 1H), 5,78 (brs, 2H), 6,20 (d, 1H, J=2,3), 6,59 (brt, 1H, J=6,8), 6,85 (d, 1H, J=8,8), 6,88 (s, 1H), 7,03 (d, 2H, J=8,8, 2,3), 7,22 (m, 2H), 7,63 (brs, 1H); EI-MC: m/z=485,3 [M+H]+. Приклад 9 5-Хлор-1-(2,5-диметилбензил)-1H-індол-2карбонової кислоти (3-гідрокси-2,2диметилпропіл)амід Заголовну сполуку отримували з 2хлорметил-1,4-диметилбензолу способом, подібним описаному у прикладі 1. 1 Н ЯМР (400 МГц, ДMCO-d6) Η: 0,73 (s, 6H), 1,98 (8, 3H), 2,30 (s, 3H), 3,03 (d, 2H, J=5,7), 3,07 (d, 2H, J=6,3), 4,46 (t, 1H, J=5,7), 5,81 (s, 2H), 5,89 (s, 1H), 6,89 (d, 1H, J=7,5), 7,06 (d, 1H, J=7,5), 7,31 (s, 1H), 7,55 (d, 1H, J=8,4), 7,60 (d, 1H, J=8,4), 8,32 (s, 1H), 8,59 (t, 1H, J=6,3); EI-MC: m/z=398,9 [M+H]+. Приклад 10 5-Хлор-1-(2,5-диметоксибензил)-1H-індол-2карбонової кислоти (3-гідрокси-2,2диметилпропіл)амід 17 Розчин фосфор триброміду (5,74 мл, 60,4 ммоль) у безводному ДХМ (90 мл) додавали протягом 20 хвил. при перемішуванні до охолодженого розчину 2,5-диметоксибензилового спирту (25,0 г, 148,8 ммоль) у ДХМ (180 мл), підтримуючи температур між -5°С та 0°С. Після додавання реакційну суміш перемішували при цій температурі ще 20 хвил. Додавали воду (200 мл). Після розділення шарів органічний матеріал промивали водою (3x200 мл), сушили магній сульфатом та випарювали до сухого стану під зменшеним тиском. Утворений сирий продукт кристалізували з суміші діетил-етер/гептан, отримуючи 2бромметил-1,4-диметокси-бензол (24,2 г, 72%). Заголовну сполуку тоді отримували способом, подібним описаному у прикладі 1. 1 Н ЯМР (400 МГц, CDCI3) Η: 0,88 (s, 6H), 3,08 (d, 2H, J=7,0), 3,25 (d, 2H, J=6,8), 3,52 (t, 1H, J=7,0), 3,57 (s, 3H), 3,84 (s, 3H), 5,75 (s, 2H), 6,03 (d, 1H, J=2,9), 6,59 (brt, 1H, J=6,8), 6,68 (dd, 1H, J=8,8, 2,9), 6,80 (d, 1H, J=8,8), 6,85 (s, 1H), 7,19 (dd, J=8,8, 1,9), 7,27 (m, 1H), 7,60 (d, 1H, J=1,9); EI-MC: m/z=431,3 [M+H]+. Приклад 11 5-Хлор-1-(5-трет-бутил-2-метоксибензил)-1Hіндол-2-карбонової кислоти (3-гідрокси-2,2диметилпропіл)амід Гідрогенхлорид продували протягом 5 хвил. при перемішуванні у розчин 5-трет-бутил-2метоксибензойної кислоти (5,00 г, 24,0 ммоль) у метанолі (100 мл) при 0°С, після чого розчин гріли при кипінні під зворотним холодильником протягом 17,5 годин. Реакційну суміш охолоджували, випарювали до сухого стану під зменшеним тиском та очищали хроматографією на силікагелі застосуванням діетил-етеру як елюенту, отримуючи 5-трет-бутил-2-метоксибензойної кислоти метил-естер як блідо-кремовий твердий продукт (5,06 г, 95%). Розчин 1,0М літій алюмогідриду у діетилетері (27,0 мл, 27,0 ммоль) додавали краплями протягом 10 хвил. до розчину 5-трет-бутил-2метоксибензойної кислоти метил-естеру (5,00 г, 22,4 ммоль) у діетил-етері (90 мл) під азотом, підтримуючи температуру між 0°С та 5°С. При закінченні додавання реакційну суміш перемішували при 20°С протягом 3,5 годин, тоді знов охолоджували до 0°С. Додавання води (5 мл) знищувало будь-який надлишок реагенту, а 92000 18 фільтруванням утвореної суміші через дикаліт видаляли непотрібний неорганічний залишок. Сушка утвореного фільтрату магній сульфатом, випарювання під зменшеним тиском дали (5трет-бутил-2-метоксифеніл)метанол як блідожовту смолу (4,20 г, 21,6ммоль, 96%). Трифенілфосфін (5,84 г, 22,3 ммоль) додавали до розчину (5-трет-бутил-2метоксифеніл)метанолу (4,20 г, 21,8 ммоль) у безводному ДХМ (80 мл) та суміш охолоджували до 10°С. Карбон тетрабромід (7,39 г, 22,3 ммоль) додавали при перемішуванні протягом 10 хвил., та після 30 хвил. температуру підвищували до зовнішньої температури. Перемішування продовжували протягом 17,5 годин, коли розчинник зменшували до 20 мл під зменшеним тиском. Додавання гептану (80 мл) при перемішуванні призводило до осадження трифенілфосфін оксиду, котрий видаляли фільтруванням суміші через дикаліт. Випарювання фільтрату дало соломенно-жовту смолу, очистки котрої було досягнуто хроматографією на силікагелі застосуванням суміші гептан:ДХМ (1: 1) як елюенту, отримуючи 2-бромметил-4-трет-бутил-1-метоксибензол як прозору смолу (2,02 г, 36%). Натрій гідрид (60% дисперсія у мінеральному маслі, 0,154 г, 3,85 ммоль) додавали до розчину 5-хлор-1Н індол-2-карбонової кислоти етилестеру (0,70 г, 3,14 ммоль) у диметилформаміді (8 мл) при перемішуванні під азотом, а потім через 1 годину 2-бромметил-4-трет-бутил-1метоксибензол (1,00 г, 3,89 ммоль). Після перемішування протягом 17 годин, реакційну суміш розбавляли водою (15 мл), екстрагували етилацетатом (2x30 мл), промивали водою (2x30 мл), сушили магній сульфатом та випарювали до сухого стану під зменшеним тиском. Очищали хроматографією на силікагелі застосуванням ДХМ як елюенту, отримуючи 1-(5-трет-бутил-2метоксибензил)-5-хлор-1Н-індол-2-карбонової кислоти етил-естер як білуватий твердий продукт (1,18 г, 2,95 ммоль, 94%). Розчин 4 Μ водного натрій гідроксиду (1,10 мл) додавали до розчину 1-(5-трет-бутил-2метоксибензил)-5-хлор-1Н-індол-2-карбонової кислоти етил-естеру (1,13 г, 2,82 ммоль) в етанолі (15 мл) та реакційну суміш гріли при 45°С протягом 3 годин. Після концентрування суміші до 5,0 мл додавали розчин 2 Μ водної НСІ (2,0 мл) для осадження блідого твердого продукту, котрий фільтрували, промивали водою (3x30 мл) та сушили під вакуумом, отримуючи 1-(5-трет-бутил-2метоксибензил)-5-хлор-1Н-індол-2-карбонову кислоту (1,03 г, 2,77 ммоль, 98%). 1-(3-Диметиламінопропіл)-3-етилкарбодіімід гідрохлорид (0,11 г, 0,57 ммоль) а потім 1гідроксибензотриазол гідрат (0,08 г, 0,59 ммоль) додавали до розчину 1-(5-трет-бутил-2метоксибензил)-5-хлор-1Н-індол-2-карбонової кислоти (0,20 г, 0,54 ммоль) у ДХМ (10,0 мл) та після перемішування протягом 10 хвил. додавали 3-аміно-2,2-диметилпропан-1-ол (67 мг, 0,65 ммоль). Після перемішування протягом 17,5 годин, додавали воду (10 мл), шари відокремлювали, органічний матеріал промивали водою (3x15 мл) та сушили магній сульфатом. Очищали хро 19 92000 20 матографією на силікагелі застосуванням суміші ДХМ:метанол (3:1) як елюенту. Кристалізація Заголовну сполуку отримували з 3сирого продукту дала заголовну сполуку як білий трифлуорметоксибензилброміду та транс-2твердий продукт (90 мг, 36%). амінометил-1-циклогексанолу способом, подіб1 ним описаному у прикладі 1. Н ЯМР (400 МГц, CDCI3) Η: 0,88 (s, 6H), 1,07 1 (s, 9H), 3,08 (d, 2H, J=6,8), 3,25 (d, 2H, J=7,0), 3,46 Н ЯМР (400 МГц, CDCI3) Η: 0,86-1,35 (m, (t, 1H, J=7,0), 3,83 (s, 3H), 5,77 (s, 2H), 6,52 (m, 4H), 1,40-1,49 (m, 1H), 1,63-1,70 (m, 2H), 1,70-1,77 2H), 6,78 (d, 1H, J=8,5), 6,85 (s, 1H), 7,14-7,20 (m, (m, 1H), 1,88-1,95 (m, 1H), 2,98 (ddd, 1H, J=14,1, 2H), 7,31 (d, 1H, J=8,8), 7,60 (d, 1H, J=1,8); 5,5, 4,0), 3,06-3,15 (m, 2H), 3,99 (ddd, 1H, J=13,8, EI-MC: m/z=457,1 [M+H]+. 8,5, 3,5), 5,80, 5,83 (ABq, 2H, J=16,5), 6,85 (s, 1H), Приклад 12 6,86 (s, 1H), 6,93-6,98 (m, 2H), 7,04-7,08 (m, 1H), 5-Хлор-1-(2-метокси-5-бромбензил)-1Н-індол7,23-7,29 (m, 3H), 7,62 (brt. 1H, J=1,4); 2-карбонової кислоти (3-гідрокси-2,2-диметилEI-MC: m/z=481,2 [M+H]+, 503,0 [M+Na]+. пропіл)амід Приклад 15 5-Хлор-1-(3-трифлуорметоксибензил)-1Hіндол-2-карбонової кислоти (3 ізопропоксипропіл)амід Заголовну сполуку отримували з 2-метокси-5бромбензилового спирту способом, подібним описаному у прикладі 11. 1 Н ЯМР (400 МГц, CDCI3) Η: 0,90(s, 6H), 3,07 (brs, 2H), 3,25 (d, 2H, J=6,6), 3,45 (brs, 1H), 3,87 (s, 3H), 5,74 (s, 2H), 6,47 (d, 1H, J=2,5), 6,64 (t, 1H, J=6,6), 6,75 (d, 1H, J=8,8), 6,88 (s, 1H), 7,20-7,24 (m, 2H), 7,27 (dd, 1H, J=8,8, 2,5), 7,63 (brs, 1H); EI-MC: m/z=481,0 [M+H]+. Приклад 13 5-Хлор-1-(2-метокси-5-метилбензил)-1Hіндол-2-карбонової кислоти (3-гідрокси-2,2диметилпропіл)амід Заголовну сполуку отримували з 5-метил-2метоксибензойної кислоти способом, подібним описаному у прикладі 11. 1 Н ЯМР (400 МГц, CDCI3) Η: 0,88 (s, 6H), 2,08 (s, 3H), 3,08 (d, 2H, J=7,0), 3,25 (d, 2H, J=6,8), 3,47 (m, 1H), 3,83 (s, 3H), 5,73 (s, 2H), 6,30 (d, 1H, J=1,7), 6,55 (s, 1H), 6,76 (d, 1H, J=8,3), 6,85 (s, 1H), 6,96 (dd, 1H, J=8,3, 1,7), 7,19 (dd, 1H J=8,8, 1,9), 7,29 (d, 1H, J=8,8), 7,61 (d, 1H, J=1,9); EI-MC: m/z=415,0[M+H]+. Приклад 14 транс-5-Хлор-1-(3-трифлуорметоксибензил)1H-індол-2-карбонової кислоти (2-гідроксициклогексилметил)амід Заголовну сполуку отримували з 3трифлуорметоксибензилброміду та етил 3ізопропоксипропіламіну способом, подібним описаному у прикладі 1. 1 Н ЯМР (400 МГц, CDCI3) Η: 1,19 (s, 3H), 1,21 (s, 3H), 1,85 (квінт, 2Н, J=5,8), 3,51-3,63 (m, 5Н), 5,84 (s, 2Н), 6,83 (s, 1Н), 6,91 (brs, 1Н), 6,96 (brd, 1Н, J=7,9), 7,06 (d brt, 1H, J=7,9, 1,3), 7,20 (8,1H), 7,21 (s, 1H), 7,26 (t, 1H, J=7,9), 7,32 (brt, 1H), 7,62 (t, 1H, J=1,3); EI-MC: m/z=469,5 [M+H]+. Приклад 16 5-Хлор-1-(3-трифлуорметоксибензил)-1Hіндол-2-карбонової кислоти (1-гідроксициклогексилметил)амід Заголовну сполуку отримували з 3трифлуорметоксибензилброміду та 1амінометил-1-циклогексанол гідрохлориду способом, подібним описаному у прикладі 1. 1 Н ЯМР (400 МГц, MeOD) Η: 1,22-1,67 (m, 10H), 3,34 (brs, 2H), 5,85 (s, 2H), 6,91 (brs, 1H), 7,00 (brd, 1H, J=8,0), 7,10 (brd, 1H, J=8,0), 7,13 (s, 1H), 7,23 (dd, 1H, J=8,8, 2,0), 7,32 (t, 1H, J=8,0), 7,42 (d, 1H, J=8,8), 7,67 (d, 1H, J=2,0); EI-MC: m/z=481,3 [M+H]+. Приклад 17 5-Хлор-1-(3-трифлуорметоксибензил)-1Hіндол-2-карбонової кислоти (3-гідрокси-3метилбутил)амід 21 Розчин 3,0М метилмагній броміду у діетилетері (0,5 мл, 1,50 ммоль) додавали краплями до розчину 3-{[5-хлор-1-(3-трифлуорметоксибензил)1Н-індол-2-карбоніл]аміно}пропіонової кислоти етил-естеру (Приклад 15) (200 мг, 0,42 ммоль) у ТГФ (4 мл) під азотом, підтримуючи температуру між 0 та 5°С. Після перемішування при 0°С протягом 2 годин реакцію гасили повільним виливанням реакційної суміші у воду (2,0 мл). Леткі розчинники тоді видаляли під зменшеним тиском та водний залишок фільтрували. Очищали хроматографією на силікагелі застосуванням суміші гептан:етилацетат (9:1, а потім 4:1) як елюенту, отримуючи 5-хлор-1-(3-трифлуорметоксибензил)1Н-індол-2-карбонової кислоти (3-гідрокси-3метилбутил)амід як білуватий твердий продукт (28 мг, 15%). 1 Н ЯМР (400 МГц, CDCI3) Η: 1,31 (s, 6H), 1,56 (t, 2H, J=6,2), 3,57 (q, 2H, J=6,2), 5,83 (s, 2H), 6,82 (s, 1H), 6,92 (brs, 1H), 6,96 (d, 1H, J=8,0), 7,05 (d, 1H, J=8,0), 7,20 (m, 2H), 7,25 (t, 1H, J=7,9), 7,29 (t, 1H, J=8,0), 7,60 (t, 1H, J=1,3); EI-MC: m/z=455,2 [M+H]+. Приклад 18 5-Ціано-1-(2,5-диметилбензил)-1H-індол-2карбонової кислоти (3-гідрокси-2,2диметилпропіл)амід Заголовну сполуку отримували з 2хлорметил-1,4-диметилбензолу та 5-ціано-1Hіндол-2-карбонової кислоти (отримано літературним способом - дивись, наприклад, WO 199639384 pages 100-101 та ЕР 0655439 А2 pages 34, 48-49) способом, подібним описаному у прикладі 1. 1 Н ЯМР (ДMCO-d6) Η: 0,72 (s, 6H), 1,98 (s, 3H), 2,30 (s, 3H), 3,03 (d, 2H, J=5,7), 3,07 (d, 2H, j=6,3), 4,47 (t, 1Н, J=5,7), 5,81 (s, 2H), 5,88 (s, 1H), 6,89 (d, 1H, J=7,5), 7,06 (d, 1H, J=7,5), 7,31 (s, 1H), 7,56 (dd, 1H, J=8,5, 1,3), 7,59 (d, 1H, J=8,5), 6,59 (t, 1H, J=6,3); EI-MC: m/z=390,0 [M+H]+. Приклад 19 5-Ціано-1-(2-метоксибензил)-1H-індол-2карбонової кислоти (3-гідрокси-2,2диметилпропіл)амід 92000 22 Заголовну сполуку отримували з 2метоксибензилхлориду способом, подібним описаному у прикладі 18. 1 Н ЯМР (400 МГц, CDCI3) Η: 0,89 (s, 6H), 3,11 (s, 2H), 3,27 (d, 2H, J=6,5), 3,86 (s, 3H), 5,81 (s, 2H), 6,49 (d, 1H, J=7,5), 6,66 (brt, 1H, J=6,5), 6,74 (t, 1H, J=7,5), 6,87 (01, 1H, J=8,2), 6,97 (s, 1H), 7,19 (dt, 1H, J=7,5, 1,5), 7,43 (d, 1H, J=8,6), 7,46 (dd, 1H, J=8,6, 1,4), 8,00 (s, 1H); EI-MC: m/z=392,3 [M+H]+. Приклад 20 5-Ціано-1-(3,5-диметилбензил)-1H-індол-2карбонової кислоти (3-гідрокси-2,2диметилпропіл)амід Заголовну сполуку отримували з 3,5диметилбензилброміду способом, подібним описаному у прикладі 18. 1 Н ЯМР (400 МГц, CDCI3) Η: 0,89 (s, 6H), 2,21 (s, 6H), 3,12 (d, 2H, J=6,8), 3,28 (d, 2H, J=6,3), 3,32 (t, 1H, J=6,8), 5,74 (s, 2H), 6,64 (brs, 2H), 6,68 (t, 1H, J=6,3), 6,85 (brs, 1H), 6,98 (s, 1H), 7,45 (d, 1H, J=8,8), 7,49 (dd, J=8,8, 1,5), 8,02 (brs, 1H); EI-MC: m/z=390,4 [M+H]+. Приклад 21 5-Ціано-1-(4-флуор-бензил)-1H-індол-2карбонової кислоти (3-гідрокси-2,2диметилпропіл)амід Заголовну сполуку отримували з 4флуорбензилброміду способом, подібним описаному у прикладі 18. 1 Н ЯМР (400 МГц, CDCI3) Η: 0,91 (s, 6Н), 3,19 (s, 2Н), 3,29 (d, 2Н, J=6,3), 5,78 (s, 2H), 6,76 (brt, 1H, J=6,3), 6,90-7,00 (m, 3H), 7,02-7,08 (m, 2H), 7,43 (d, 1H, J=8,6, 1,5), 7,50 (dd, 1H, J=8,6, 1,5), 8,02 (brs,1H); EI-MC: m/z=380,3 [M+H]+. Приклад 22 23 5-Ціано-1-(2-метокси-5трифлуорметоксибензил)-1H-індол-2-карбонової кислоти (3-гідрокси-2,2-диметилпропіл)амід Заголовну сполуку отримували з 2-метокси-5трифлуорметоксил бензилброміду способом, подібним описаному у прикладі 18. 1 Н ЯМР (400 МГц, CDCI3): Η: 0,90 (s, 6Н), 3,13 (s, 2Н), 3,28 (d, 2Н, J=6,5), 3,89 (s, 3H), 5,82 (s, 2Н), 6,28 (d, 1Н, J=1,8), 6,80 (brt, 1H, J=6,5), 6,86 (d, 1H, J=8,9), 7,01 (s, 1H), 7,05 (dd, 1H, J=8,9, 1,8), 7,40 (d, 1H, J=8,8), 7,48 (dd, 1H, J=8,8, 1,3), 8,02 (brs, 1H); EI-MC: m/z=476,0 [M+H]+. Приклад 23 5-Ціано-1-(3-трифлуорметоксибензил)-1Hіндол-2-карбонової кислоти (3-гідрокси-2,2диметилпропіл)амід Заголовну сполуку отримували з 3трифлуорметоксибензилброміду способом, подібним описаному у прикладі 18. 1 Н ЯМР (400 МГц, CDCI3) Η: 0,90 (s, 6H), 3,18 (s, 2H), 3,29 (d, 2H, J=6,2), 5,84 (s, 2H), 6,80 (brt, 1H, J=6,2), 6,84 (brs, 1H), 6,99 (br d, 1H, J=7,9), 7,01 (s, 1H), 7,08 (br d, 1H, J=7,9), 7,29 (t, 1H, J=7,9), 7,40 (d, 1H, J=8,7), 7,50 (dd, 1H, J=8,7, 1,4), 8,03 (d, 1H, J=1,4); EI-MC: m/z=446,0 [M+H]+. Приклад 24 5-Ціано-1-(2,5-дихлорбензил)-1H-індол-2карбонової кислоти (3-гідрокси-2,2диметилпропіл)амід Заголовну сполуку отримували з 2,5дихлорбензилброміду способом, подібним описаному у прикладі 18. 1 Н ЯМР (400 МГц, CDCI3) Η: 0,93 (8, 6Н), 3,01 (t, 1Η, J=6,4), 3,23 (d, 2H, J=6,4), 3,28 (d, 2H, J=6,2), 5,88 (s, 2H), 6,37 (d, 1H, J=2,4), 6,91 (br t, 1H, J=6,2), 7,06 (s, 1H), 7,16 (dd, 1H, J=6,0, 2,4), 92000 24 7,31 (d, 1H, J=8,4), 7,34 (d, 1H, J=8,4), 7,50 (dd, 1H, J=8,5, 2,4), 8,05 (brs, 1H); EI-MC: m/z=430,0, 432,4 [M+H]+. Приклад 25 5-Цано-1-(3-флуор-5-трифлуорметилбензил)1H-індол-2-карбонової кислоти (3-гідрокси-2,2диметилпропіл)амід Заголовну сполуку отримували з 3-флуор-5трифлуорметилбензилброміду способом, подібним описаному у прикладі 18. 1 Н ЯМР (400 МГц, CDCI3) Η: 0,94 (s, 6H), 2,92 (t, 1H, J=6,2), 3,25 (d, 2H, J=6,5), 3,31 (d, 2H, J=6,5), 5,29 (s, 1H), 6,03 (s, 2H), 6,10 (dd, 1H, J=9,3, 1,8), 6,90-7,04 (m, 2H), 7,08 (s, 1H), 7,48 (d, 1H, J=8,7), 7,72 (m, 1H), 8,07 (s, 1H); EI-MC: m/z=448,0 [M+H]+. Приклад 26 5-Ціано-1-(2-метилбензил)-1H-індол-2карбонової кислоти (3-гідрокси-2,2диметилпропіл)амід Заголовну сполуку отримували з 2метилбензилброміду способом, подібним описаному у прикладі 18. 1 Н ЯМР (400 МГц, CDCI3) Η: 0,84 (s, 6Н), 2,41 (s, 3H), 3,01 (d, 2Н, J=5,8), 3,10-3,19 (m, 1H), 3,22 (d, 2H, J=6,5), 5,80 (s, 2H), 6,13 (d, 1H, J=7,5), 6,66 (br s, 1H), 6,93 (t, 1H, J=7,5), 7,01 (s, 1H), 7,12 (t, 1H, J=7,5), 7,19 (d, 1H, J=7,5), 7,31 (d, 1H, J=8,7), 7,46 (dd, 1H, J=8,7, 1,5), 8,04 (brs, 1H); EI-MC: m/z=376,5 [M+H]+. Приклад 27 5-Ціано-1-(2-трифлуорметоксибензил)-1Hіндол-2-карбонової кислоти (3-гідрокси-2,2диметилпропіл)амід 25 92000 26 Заголовну сполуку отримували з 2(трифлуорметокси)бензилброміду способом, подібним описаному у прикладі 18. 1 Н ЯМР (400 МГц, CDCI3) Η: 0,92 (s, 6H), 3,01 (t, 1H, J=6,5), 3,22 (d, 2H,7=6,5), 3,30 (d, 2H, J=6,5), 5,90 (s, 2H), 6,59 (d, 1H, J=8,2), 6,82 (ddd, 1H, J=8,2, 6,0, 2,8), 7,01 (s, 1H), 7,09 (m, 1H), 7,28 (m, 3H), 7,47 (dd, 1H, J=8,7, 1,5), 8,03 (brs, 1H); EI-MC: m/z=446,0 [M+H]+. Заголовну сполуку отримували з 3,5Приклад 28 диметоксибензилброміду способом, подібним 5-Ціано-1-(2-флуор-3-метилбензил)-1Н-індолописаному у прикладі 18. 2-карбонової кислоти (3-гідрокси-2,21 диметилпропіл)амід Н ЯМР (400 МГц, CDCI3) Η: 0,90 (s, 6H), 3,13 (d, 2H, J=6,7), 3,31 (d, 2H, J=6,6), 3,35 (t, 1H, J=6,7), 3,70 (s, 6H), 5,75 (s, 2H), 6,15 (d, 2H, J=2,2), 6,31 (t, 1H, J=2,3), 6,74 (br t, 1H, J=6,6), 6,98 (s, 1H), 7,43 (d, 1H, J=8,7), 7,48 (dd, 1H, J=8,7, 1,5), 8,00 (brs, 1H); EI-MC: m/z=422,1 [M+H]+. Приклад 31 5-Ціано-1-(3-дифлуорметоксибензил)-1Hіндол-2-карбонової кислоти (3-гідрокси-2,2диметилпропіл)амід Заголовну сполуку отримували з 2-флуор-3метилбензилброміду способом, подібним описаному у прикладі 18. 1 Н ЯМР (400 МГц, CDCI3) Η: 0,92 (s, 6H), 2,26 (d, 3H, J=1,5), 3,21 (s, 2H), 3,31 (d, 2H, J=6,4), 5,87 (s, 2H), 6,58 (brt, 1H, J=7,3), 6,80 (brt, 1H, J=6,4), 6,85 (t, 1H, J=7,5), 6,98 (s, 1H), 7,05 (t, 1H, J=7,3), 7,43 (d, 1H, J=8,7), 7,48 (dd, 1H, J=8,7, 1,4), 8,00 (s, 1H); EI-MC: m/z=394,0 [M+H]+. Заголовну сполуку отримували з 3Приклад 29 (дифлуорметокси)бензилброміду способом, поді5-Ціано-1-(2-бромбензил)-1H-індол-2бним описаному у прикладі 18. 1 карбонової кислоти (3-гідрокси-2,2Н ЯМР (400 МГц, CDCI3) Η: 0,90 (s, 6H), диметилпропіл)амід 3,10-3,18 (m, 2H), 3,18-3,22 (m, 1H), 3,28 (d, 2H, J=7,2), 5,82 (s, 2H), 6,46 (t, 1H, J=73,8), 6,75-6,80 (m, 2H), 6,87 (brd, 1H, J=8,0), 6,98 (dd, 1H, J=8,0, 2,0), 7,01 (s, 1H), 7,25 (t, 1H, J=8,0), 7,41 (d, 1H, J=8,4), 7,51 (dd, 1H, J=8,8, 1,6),8,04 (brs, 1H); + EI-MC: m/z=428,1 [M+H] . Приклад 32 5-Ціано-1-хінолін-8-іл-метил-1H-індол-2карбонової кислоти (3-гідрокси-2,2диметилпропіл)амід Заголовну сполуку отримували з 2бромбензилброміду способом, подібним описаному у прикладі 18. 1 Н ЯМР (400 МГц, CDCI3): Η: 0,91 (s, 6H), 3,17 (d, 2H, J=5,2), 3,18 (s, 1H), 3,28 (d, 2H, J=6,5), 5,88 (s, 2H), 6,30 (m, 1H), 6,83 (m, 1H), 7,05 (s, 1H), 7,08 (m, 2H), 7,30 (d, 1H, J=8,8), 7,47 (d, 1H, J=8,5), 7,60 (d, 1H, J=7,2), 8,05 (s, 1H); EI-MC: m/z=440,0, 442,0 [M+H]+. Приклад 30 5-Ціано-1-(3,5-диметоксибензил)-1Н-індол-2Заголовну сполуку отримували з 8карбонової кислоти (3-гідрокси-2,2(бромметил)хіноліну способом, подібним описадиметилпропіл)амід ному у прикладі 18. 1 Н ЯМР (400 МГц, CDCI3) Η: 0,90 (8, 6Н), 3,16-3,20 (m, 2H), 3,22-3,26 (m, 1H), 3,30 (d, 2H, J=6,5), 6,49 (s, 2H), 7,00 (d, 1H, J=7,1), 7,04 (s, 1H), 7,13 (brt, 1H, J=6,5), 7,33-7,45 (m, 3H), 7,47 (dd, 1H, J=8,3, 4,3), 7,73 (d, 1H, J=8,3), 8,01 (brs, 1H), 8,18 (dd, 1H, J=8,3, 1,8), 8,97 (dd, 1H, J=4,3, 1,8); 27 92000 28 EI-MC: m/z=413,1 [M+H]+. Заголовну сполуку отримували з 3Приклад 33 бромбензилброміду та транс-2-амiнометил-1транс-5-Ціано-1-(3,5-диметоксибензил)-1Нциклогексанолу способом, подібним описаному у індол-2-карбонової кислоти (2-гідроксиприкладі 18. 1 циклогексилметил)амід Н ЯМР (400 МГц, MeOD) Η: 0,97 (m, 1H), 1,23 (m, 3H),1,42 (m, 1H), 1,66 (m,3H), 1,90 (m, 1H), 3,03 (m, 1H), 3,34-3,40 (dd, 1H, J=13,6, 4,0), 3,48-3,55 (dd, 1H, J=13,6, 6,6), 5,80-5,91 (dd, 2H, J=24,4, 16,4), 6,99 (d, 1H, J=8,3), 6,99 (d, 1H, J=8,3), 7,15 (m, 1H), 7,15 (m, 1H), 7,19 (s, 1H), 7,36 (d, 1H, J=7,8), 7,54 (dd, 1H, J=8,6, 1,5), 7,64 (d, 1H, J=8,6), 8,13 (m,1H); EI-MC: m/z=466,2 [M+H]+. Приклад 36 5-Ціано-1-(3,5-дихлорбензил)-1Н-індол-2карбонової кислоти (3-гідрокси-2,2Заголовну сполуку отримували з 3,5диметилпропіл)амід диметоксибензилброміду та транс-2-амінометил1-циклогексанолу способом, подібним описаному у прикладі 18. 1 Н ЯМР (400 МГц, CDCI3) Η: 0,95-1,33 (m, 3H), 1,39-1,48 (m, 1H), 1,62-1,77 (s, 3H), 1,87-1,94 (m, 1H), 2,94-3,01 (m, 1H), 3,05-3,12 (m, 2H), 3,70 (s, 6H), 3,96-4,04 (m, 1H), 5,73, 5,80 (ABq, 2H, J=16,3), 6,15 (d, 2H, J=2,3), 6,30 (t, 1H, J=2,3), 6,95 (s, 1H), 7,01 (m, 1H), 7,42 (d, 1H, J=8,8), 7,47 (dd, 1H, J=8,8, 1,5), 7,99 (m, 1H); EI-MC: m/z=447,7 [M+H]+. 3,5-Дихлорбензилбромід, отриманий від 3,5Приклад 34 дихлорбензилового спирту способом, подібним транс-5-Ціано-1-(3-трифлуорметоксибензил)описаному у прикладі 11, застосовували для 1Н-індол-2-карбонової кислоти (2-гідроксиотримання заголовної сполуки способом, подібииклогексилметил)амід ним описаному у прикладі 18. 1 Н ЯМР (400 МГц, MeOD) Η: 0,88 (s, 6H), 3,19 (s, 2H), 3,24 (s, 2H), 5,85 (s, 2H), 6,97 (t 2H), 7,25 (brs, 1H), 7,29 (t, 1H, J=1,9), 7,56 (dd, 1H, J=8,7, 1,9), 7,63 (d, 1H, J=8,7), 8,15 (s,1H); EI-MC: m/z=412,1, 414,1 [M-OH]+. Приклад 37 5-Ціано-1-(5-хлор-2-метоксибензил)-1Hіндол-2-карбонової кислоти (3-гідрокси-2,2Заголовну сполуку отримували з 3диметилпропіл)амід (трифлуорметокси)6ензилброміду та транс-2амінометил-1-циклогексанолу способом, подібним описаному у прикладі 18. 1 Η ЯМР (400 МГц, MeOD) Η: 0,80-1,82 (m, 8H), 1,14 (brt, 2H), 3,01-3,09 (m, 1H), 3,14-3,23 (m, 1H), 3,50 (m, 1H), 4,66 (d, 1H, J=5,0), 5,94 (s, 2H), 7,03 (s, 1H), 7,05 (brd, 1H, J=8,2), 7,22 (brd, 1H, J=8,2), 7,40 (t, 1H, J=8,2), 7,60 (dd, 1H, J=8,8, 1,4), 7,80 (d, 1H, J=8,8), 8,30 (d, 1H, J=1,4), 8,66 (tr, 1H, J=5,9); 5-Хлор-2-метоксибензилбромід, отриманий з EI-MC: m/z=472,0 [M+H]+. 5-хлор-2-метоксибензилового спирту способом, Приклад 35 подібним описаному у прикладі 11, застосовуватранс-5-Ціано-1-[3-бромбензил]-1Н-індол-2ли для отримання заголовної сполуки способом, карбонової кислоти (2-гідроксиподібним описаному у прикладі 18. 1 циклогексилметил)амід Н ЯМР (400 МГц, MeOD) : 0,87 (s, 6H), 3,14 Η (s, 2H), 3,22 (s, 2H), 3,84 (s, 3H), 5,80 (s, 2H), 6,41 (d, 1H, J=2,8), 6,94 (d, 1H, J=8,8), 7,18 (dd, 1H J=8,8, 2,5), 7,19 (s, 1H), 7,52 (dd, 2H, J=8,8, 1,5), 7,57 (d, 1H, J=8,8), 8,12 (brs, 1H); EI-MC: m/z=426,0 [M+H]+. Приклад 38 5-Ціано-1-(5-бром-2-флуорбензил)-1H-індол2-карбонової кислоти (3-гідрокси-2,2диметилпропіл)амід 29 5-Бром-2-флуорбензилбромід, отриманий з 5-бром-2-флуорбензилового спирту способом, подібним описаному у прикладі 11, застосовували для отримання заголовної сполуки способом, подібним описаному у прикладі 18. 1 Н ЯМР (400 МГц, CDCI3) Η: 0,95 (s, 6H), 3,16-3,22 (m, 1H), 3,26 (d, 2H, J=5,8), 3,34 (d, 2H, J=6,5), 5,87 (s, 2H), 6,86 (brt, 1H, J=6,5), 6,90-6,94 (m, 1H), 6,97 (t, 1H, J=8,8), 7,02 (s, 1H), 7,31-7,37 (m, 1H), 7,42 (d, 1H, J=8,7), 7,54 (d, 1H, J=8,7), 8,05 (brs, 1H); EI-MC: m/z=458,3, 460,3 [M+H]+. Приклад 39 5-Ціано-1-(5-бром-2-метоксибензил)-1Ніндол-2-карбонової кислоти (3-гідрокси-2,2диметилпропіл)амід 5-Бром-2-метоксибензилбромід, отриманий з 5-бром-2-метоксибензилового спирту способом, подібним описаному у прикладі 11, застосовували для отримання заголовної сполуки способом, подібним описаному у прикладі 18. 1 Н ЯМР (400 МГц, CDCI3) Η: 0,90 (s, 6H), 3,12 (m, 2H), 3,15 (m, 1H), 3,29 (d, 2H, J=6,4), 3,86 (s, 3H), 5,78 (8, 2H), 6,55 (d, 1H, J=2,1), 6,73 (brt, 1H, J=6,4), 6,76 (d, 1H, J=8,7), 7,00 (s, 1H), 7,30 (dd, 1H, J=6,5, 2,1), 7,40 (d, 1H, J=8,6), 7,49 (dd,1H, J=8,6, 1,3), 8,03 (brs, 1H); EI-MC: m/z=470,3, 472,3 [M+H]+. Приклад 40 2,3-Диметокси-5-бромбензилбромід, отриманий з 5-бром-2,3-диметоксибензойн кислот способом, подібним описаному у прикладі 11, застосовували для отримання заголовної сполуки способом, подібним описаному у прикладі 18. 1 Н ЯМР (400 МГц, CDCI3) Η: 0,93 (s, 6H), 3,15 (s, 2H), 3,30 (d, 2H, J=6,5), 3,85 (s, 3H), 3,86 (s, 3H), 5,83 (s, 2H), 6,30 (d, 1H, J=2,2), 6,80 (t, 1H, 92000 30 J=6,5), 6,91 (d, 1H, J=2,2), 7,01 (s, 1H), 7,40 (d, 1H, J=8,6), 7,48 (dd, 1H, J=8,6, 1,4), 8,02 (brs, 1H); EI-MC: m/z=500,1, 502,1 [M+H]+. Приклад 41 5-Ціано-1-(5-трет-бутил-2-метоксибензил)1H-індол-2-карбонової кислоти (3-гідрокси-2,2диметилпропіл)амід 5-трет-бутил-2-метоксибензилбромід, отриманий з 5-трет-бутил-2-метоксибензойної кислоти способом, подібним описаному у прикладі 11, застосовували для отримання заголовної сполуки способом, подібним описаному у прикладі 18. 1 Н ЯМР (400 МГц, CDCI3) Η: 0,90 (s, 6H), 1,08 (s, 9H), 3,10 (d, 2H, J=6,3), 3,27 (d, 2H, J=6,5), 3,44 (t, 1H, J=6,3), 3,82 (s, 3H), 5,81 (s, 2H), 6,57 (d, 1H, J=2,4), 6,67 (brt, 1H, J=6,5), 6,79 (d, 1H, J=8,5), 6,98 (s, 1H), 7,19 (dd, 1H, J=8,5, 2,4), 7,46 (dd, 1H, J=8,8, 1,5) 7,49 (d, 2H, J=8,8), 8,00 (brs, 1H); EI-MC: m/z=448,3 [M+H]+. Приклад 42 5-Ціано-1-(2-метокси-5-метилбензил)-1Hіндол-2-карбонової кислоти (3-гідрокси-2,2диметилпропіл)амід 2-Метокси-5-метилбензилбромід, отриманий з 2-метокси-5-метилбензойної кислоти способом, подібним описаному у прикладі 11, застосовували для отримання заголовної сполуки способом, подібним описаному у прикладі 18. 1 Н ЯМР (400 МГц, CDCI3) Η: 0,90 (s, 6H), 2,09 (s, 3H), 3,13 (d, 2H, J=6,6), 3,25-3,32 (m, 3H, J=6,5), 3,81 (s, 3H), 5,77 (s, 2H), 6,38 (d, 1H, J=1,8), 6,65 (brt, 1H, J=6,6), 6,76 (d, 1H, J=8,5), 6,96-7,01 (m, 2H), 7,45-7,46 (m, 2H), 8,03 (t, 1H, J=1,3); EI-MC: m/z=406,5 [M+H]+. Приклад 43 5-Ціано-1-[3-(2-метоксіетокси)бензил]-1Ніндол-2-карбонової кислоти (3-гідрокси-2,2диметилпропіл)амід 31 92000 32 3-Гідроксибензиловий спирт (3,76 г, 30 ммоль), 2-брометилметил-етер (8,0 мл, 85 ммоль) та цезій карбонат (14,7 г, 45 ммоль) гріли при 60°С протягом 3 годин. Реакційну суміш розбавляли водою, екстрагували (3х) етилацетатом та сушили натрій сульфатом. Розчин фільтрували, концентрували та очищали хроматографією на силікагелі (ДХМ, а потім ДХМ/МеОН 19:1, тоді До розчину ізофталальдегіду (1,77 г, 13,0 9:1), отримуючи [3-(2ммоль) у EtOH (30 мл) при 0°С, додавали натрій метоксіетокси)феніл]метанол як оранжеве масло борогідрид (135 мг, 3,5 ммоль). Реакційну суміш (3,92 г, 72%). перемішували при 0°С протягом 1 години. Роз1-Бромметил-3-(2-метоксіетокси)бензол, чинник випарювали та залишок очищали хромаотриманий з [3-(2-метокситографією на силікагелі застосуванням ДХМ а етокси)феніл]метанолу способом, подібним опипотім ДХМ: МеОН (19: 1), отримуючи 3саному у прикладі 11, застосовували для отригідроксиметил-бензальдегід (1,14 г, 64%) як жовмання заголовної сполуки способом, подібним те масло. описаному у прикладі 18. 1 3-Гідроксиметил-бензальдегід (1,14 г, 8,35 Н ЯМР (400 МГц, CDCI3) Η: 0,89 (s, 6H), 3,15 ммоль), тозилметил ізоціанід (2,47 г, 12,5 ммоль) (d, 2H, J=6,8), 3,27 (d, 2H, J=6,8), 3,33 (t, 1H, та калій карбонат (1,75 г, 12,5 ммоль) у метанолі J=6,8), 3,40 (s, 3H), 3,66-3,70 (m, 2H), 3,99-4,03 (25 мл) гріли при кипінні під зворотним холодиль(m, 2H), 5,78 (s, 2H), 6,55 (brs, 1H), 6,65 (d, 1H, ником при 85°С протягом 1 години. Реакційну J=7,8), 6,75-6,78 (m, 2H), 6,97 (s, 1H), 7,17 (t, 1H, суміш концентрували, залишок розчиняли у суJ=7,9), 7,41 (d, 1H, J=8,8), 7,48 (dd, 1H, J=8,8, 1,2), міші ДХМ/вода та відокремлювали застосуван8,00 (brs, 1H); + ням гідрофобної фільтр-туби. Органічну фазу EI-MC: m/z=436,5 [M+H] . концентрували та очищали хроматографією на Приклад 44 силікагелі застосуванням ДХМ а потім 5-Ціано-1-(3-ізопропоксибензил)-1H-індол-2ДХМ:МеОН (19:1), отримуючи (3-оксазол-5-ілкарбонової кислоти (3-гідрокси-2,2феніл)метанол (1,32 г, 90%) як оранжеве масло. диметилпропіл)амід 5-(3-бромметилфеніл)оксазол, отриманий з 3-оксазол-5-іл-феніл)метанолу способом, подібним описаному у прикладі 11, застосовували для отримання заголовної сполуки способом, подібним описаному у прикладі 18. 1 Н ЯМР (400 МГц, CDCI3) Η: 0,89 (s, 6H), 3,15-3,25 (m, 3H), 3,30 (d, 2H, J=6,0), 5,87 (s, 2H), 6,81 (brt, 1H, J=6,0), 6,99 (d, 1H, J=7,9), 7,02 (s, 1H), 7,29 (s, 1H), 7,32 (t, 1H, J=7,9), 7,39 (brs, 1H), Суміш 3-гідроксибензилового спирту (2,00 г, 7,45 (d, 1H, J=8,4), 7,48-7,55 (m, 2H), 7,87 (s, 1H), 0,014 моль), 2-йодпропану (2,4 мл, 8,29 ммоль), 8,03 (brs, 1H); цезій карбонату (8,00 г, 0,0246 моль) у ДМФ (10 EI-MC: m/z=429,3 [M+H]+. мл) гріли при 85°С протягом години. Реакційну Приклад 46 суміш розбавляли водою (100 мл) та екстрагува5-Ціано-1-(3-імідазол-1-іл-бензил)-1H-індол-2ли ДХМ (30 мл) та це промивали водою (2x30 карбонової кислоти (3-гідрокси-2,2мл). Продукт хроматографували на силікагелі диметилпропіл)амід застосуванням суміші ДХМ:метанол (19: 1), отримуючи 3-ізопропоксибензиловий спирт (1,70 г, 73%) як оранжеву рідину. 3-ізопропоксибензилбромід, отриманий з 3ізопропоксибензилового спирту способом, подібним описаному у прикладі 11, застосовували для отримання заголовної сполуки способом, подібним описаному у прикладі 18. 1 Н ЯМР (400 МГц, MeOD) Η: 0,87 (s, 6H), 1,19 3-йодбензиловий спирт (5,17 г, 21,0 ммоль), (d, 6H, J=6,0), 3,17 (s, 2H), 3,23(s, 2H), 4,43 (сепімідазол (1,73 г, 25,2 ммоль), калій карбонат (3,78 тет, 1H, J=6,0), 5,81 (s, 2H), 6,48 (s, 1H), 6,58 (d, г, 27,3 ммоль), порошок купрум(0) (275 мг, 4,33 1H, J=8,2), 6,72 (d, 1H, J=8,2), 7,12 (t, 1H, J=8,2), ммоль) та калій флуорид (260 мг, 4,44 ммоль) у 7,18 (s, 1H), 7,51 (dd, 1H, J=8,6, 1,5), 7,62 (d, 1H, ДМФ (30 мл) гріли при кипінні під зворотним хоJ=8,6), 8,12 (brs, 1H); лодильником при 175°С протягом 6 годин. РеакEI-MC: m/z=420,4 [M+H]+. ційну суміш фільтрували, твердий продукт проПриклад 45 мивали ДХМ та промивки та фільтрат 5-Ціано-1-(3-оксазол-5-іл-бензил)-1H-індол-2концентрували. Хроматографія на силікагелі закарбонової кислоти (3-гідрокси-2,2стосуванням ДХМ а потім ДХМ: МеОН (15:1 тоді диметилпропіл)амід 10:1) дала (3-імідазол-1-іл-феніл)-метанол як оранжеве масло (3,17 г, 72%). 33 92000 34 Тіонілхлорид (4,0 мл, 54,0 ммоль) додавали до розчину (3-імідазол-1-іл-феніл)-метанолу (3,17 г, 17,0 ммоль) у ДМФ (50 мл) та реакційну суміш перемішували при кімнатній температурі протягом 40 годин. Розчинник випарювали, залишок розбавляли ДХМ та промивали водою, нейтралізували водним натрій гідрокарбонатом (рН 9-10) та тоді екстрагували 5 ДХМ (3х). Органічну фазу сушили натрій сульфатом, фільтрували та конЗаголовну сполуку отримували з 5-ціано-1-(3центрували, отримуючи 1-(3-хлорметил-феніл)трифлуорметоксибензил)-1Н-індол-2-карбонової 1Н-імідазол як оранжеве масло (5,3 г, сире, закислоти [отримано з 3бруднене ДМФ). (трифлуорметокси)бензилброміду та етил 5Заголовну сполуку отримували з сирого 1-(3ціаноіндол-2-карбоксилату] та (S)-(+)-2-аміно-3хлорметилфеніл)-1Н-імідазолу способом, подібметил-1-бутанолу способом, подібним описаному ним описаному у прикладі 18. у прикладі 11. 1 Н ЯМР (400 МГц, CDCI3) Η: 0,90 (s, 6H), 3,18 1 Н ЯМР (400 МГц, MeOD) Η: 0,89 (d, 3H, (s, 2H), 3,30 (d, 2H, J=6,4), 5,89 (s, 2H), 6,97 (brt, J=7,0), 0,95 (d, 3H, J=6,8), 1,93 (окт, 1Н, J=6,8, 1H, J=6,4), 7,00-7,05 (m, 2H), 7,09 (brs, 1H), 7,15 7,0), 3,63 (dd, 1H, J=11,4, 6,5), 3,69 (dd, 1H, (brs, 1H), 7,20 (brs, 1H), 7,22-7,27 (m, 1H), 7,38 (t, J=11,4, 4,4), 3,85 (ddd, 1H, J=11,4, 6,8, 4,5), 5,85, 1H, J=7,8), 7,43 (d, 1H, J=8,9), 7,52 (dd, 1H, J=8,9, 5,93 (ABq, 2H, J=16,3), 6,96(brs, 1H), 7,05 (brd, 1H, 1,4), 7,75 (brs, 1H), 8,04 (brs, 1H); J=7,9), 7,11 (brd, 1H, J=7,9), 7,28 (s, 1H), 7,34 (t, + EI-MC: m/z=428,3 [M+H] . 1H, J=7,9), 7,52 (dd, 1H, J=8,8, 1,5), 7,62 (d, 1H, Приклад 47 J=8,8), 8,14 (brs, 1H); транс-5-Ціано-1-[3-(4-метил-піперазин-1-іл]EI-MC: m/z=446,0 [M+H]+. бензил)-1H-індол-2-карбонової кислоти (2Приклад 49 гідрокси-циклогексилметил)амід 5-Ціано-1-(3-трифлуорметоксибензил)-1Hіндол-2-карбонової кислоти (тетрагідро-фуран-2іл)-амід Суміш 5-ціано-1-[3-бромбензил]-1Н-індол-2карбонової кислоти (2-гідроксициклогексилметил)аміду (отримано застосуванням 3-бромбензилброміду та 3-аміно-2,2диметил-1-пропанолу способом, подібним описаному у прикладі 35) (0,250 г, 0,54 ммоль), трис(дибензилідинацетон)дипаладію (125 мг, 0,014 ммоль), 2-(дициклогексилфосфін)біфенілу (9,6 мг, 0,027 ммоль), калій фосфату (1,44 г, 0,82 ммоль) та N-метилпіперазину (64 мг, 0,64 ммоль) у 1,2-диметоксіетані (3 мл) гріли у герметичній реакційній колбі при 100°С під азотом протягом 30 годин. Після охолодження до зовнішньої температури суміш фільтрували через дикаліт та утворений фільтрат випарювали до сухого стану. Очистка хроматографією на силікагелі застосуванням суміші ДХМ:метанол (19:1) як елюенту, дала заголовну сполуку (0,021 г, 8%). 1 Н ЯМР (400 МГц, MeOD) Η: 0,97 (m, 1H), 1,20 (m, 3H), 1,42 (m, 1H), 1,65 (m, 3H), 1,89 (m, 1H), 2,31 (s, 3H), 2,55 (t, 4H, J=5,0), 3,03 (m, 1H), 3,08 (t, 4H, J=5,0), 3,34 (d, 1H, J=4,0), 3,37 (d, 1H, J=4,2), 3,53 (q, 1H, J=6,5), 5,80 (dd, 2H, J=23,6, 16,0), 6,47 (d, 1H, J=7,5), 6,59 (m, 1H), 6,81 (dd, 1H, J=8,0), 7,14 (s,1H), 7,46 (dd, 1H, J=8,8, 1,8), 7,64 (d, 1H, J=8,5), 8,10 (m, 1H); EI-MC: m/z 486,2 [M+H]+. Приклад 48 (S)-(+)-5-Ціано-1-(3трифлуорметоксибензил)-1H-індол-2-карбонової кислоти (1-гідроксиметил-2-метилпропіл)амід Заголовну сполуку отримували з 5-ціано-1-(3трифлуорметокси-бензил)-1Н-індол-2-карбонової кислоти [отримано з 3(трифлуорметокси)бензилброміду та етил 5ціаноіндол-2-карбоксилату] та тетрагідрофурфуриламіну способом, подібним описаному у прикладі 11. 1 Н ЯМР (400 МГц, MeOD) Η: 1,52-1,64 (m, 1H), 1,81-2,01 (m, 3H), 3,34-3,48 (m, 2H), 3,70-3,77 (m, 1H), 3,82-3,89 (m, 1H), 3,99-4,07 (m, 1H), 5,90 (s, 2H), 6,91 (brs, 1H), 7,03 (br d, 1H, J=8,0), 7,12 (d, 1H, J=8,0), 7,24 (s, 1H), 7,34 (t, 1H, J=8,0), 7,52 (dd, 1H, J=8,6, 1,5), 7,62 (d, 1H, J=8,6), 8,13 (brs, 1H); EI-MC: m/z 444,0 [M+H]+. Приклад 50 R-(+)-5-Ціано-1-(3-трифлуорметоксибензил)1H-індол-2-карбонової кислоти (тетрагідрофуран-3-іл)-амід 35 92000 36 Заголовну сполуку отримували з 5-ціано-1-(3(br, 1H), 3,50-3,60 (m, 2H), 3,60-3,70 (m, 1Н), 5,83 трифлуорметоксибензил)-1Н-індол-2-карбонової (s, 2Н), 6,49 (d, 1Н, J=8,0), 6,84 (s, 1H), 7,00 (d, кислоти [отримано з 31H, J=7,9), 7,03 (s, 1H), 7,09 (d, 1H, J=7,9), 7,30 (t, (трифлуорметокси)бензилброміду та етил 51H, J=7,9), 7,40 (d, 1H, J=8,7), 7,50 (dd, 1H, J=8,7, ціаноіндол-2-карбоксилату] та R-(+)-31,4), 8,03 (brs, 1H); + амінотетрагідрофуран толуол-4-сульфонату споEI-MC: m/z=458,1 [M+H] . собом, подібним описаному у прикладі 11. Приклад 53 1 5-Ціано-1-(3-трифлуорметоксибензил)-1НН ЯМР (400 МГц, d6-ДМСО) Η: 1,82-1,94 (m, індол-2-карбонової кислоти (3-гідроксибутил)амід 1H), 2,07-2,20 (m, 1H), 3,49-3,59 (m, 1H), 3,66-3,75 (m, 1H), 3,76-3,89 (m, 2H), 4,35-4,49 (m, 1H), 5,92 (s, 2H), 7,02-7,12 (m, 2H), 7,22 (d, 1Н, J=8,2), 7,37 (s,1H), 7,40 (t, 1H, J=8,2), 7,60 (dd, 1H, J=8,5, 1,5), 7,78 (d, 1H, J=8,5), 8,31 (d, 1H, J=1,5), 8,80 (d, 1H, J=6,5); EI-MC: m/z 400,0. Приклад 51 цис-5-Ціано-1-(3-трифлуорметоксибензил)1Н-індол-2-карбонової кислоти (2Заголовну сполуку отримували з 5-ціано-1-(3гідроксиметилциклогексил)-амід трифлуорметокси-бензил)-1Н-індол-2-карбонової кислоти [отримано з 3(трифлуорметокси)бензилброміду та етил 5ціаноіндол-2-карбоксилату] та 4-аміно-2-бутанолу способом, подібним описаному у прикладі 11. 1 Н ЯМР (400 МГц, CDCI3) Η: 1,22 (d, 3H, J=6,3), 1,55-1,65 (m, 1H), 1,68-1,80 (m, 1H), 2,39 (brs, 1H), 3,25-3,40 (m, 1H), 3,75-3,90 (111, 2H), 5,84, 5,87 (ABq, 2H, J=16,3), 6,87 (br s, 1H), 6,907,02 (m, 3H), 7,08 (brd, 1H, J=8,0), 7,29 (t, 1H, Заголовну сполуку отримували з 5-ціано-1-(3J=8,0), 7,37 (d, 1H, J=8,8), 7,50 (dd, 1H, J=8,8, 1,2), трифлуорметокси-бензил)-1Н-індол-2-карбонової 8,02 (brs, 1H); кислоти [отримано з 3EI-MC: m/z=432,1 [M+H]+. (трифлуорметокси)бензилброміду та етил 5Приклад 54 ціаноіндол-2-карбоксилату] та цис-2транс-5-Цано-1-(3-трифлуорметоксибензил)гідроксиметил-1-циклогексиламіну способом, по1H-індол-2-карбонової кислоти (2-гідроксидібним описаному у прикладі 11. 1 циклопентил)амід Н ЯМР (400 МГц, MeOD) Η: 1,33-1,69 (m, 7H), 1,71-1,84 (m, 1H), 1,86-1,96 (m, 1H), 3,43 (dd, 1H, >11,2, 6,2), 3,51 (dd, 1H, J=8,2, 11,2), 4,26-4,31 (m, 1H), 5,86 (s, 2H), 6,97 (brs, 1H), 7,05 (brd, 1H, J=7,7), 7,12 (brd, 1H, J=7,7), 7,20 (s, 1H), 7,35 (t, 1H, J=7,7), 7,52 (dd, 1H, J=8,8, 1,8), 7,63 (d, 1H, J=8,8), 8,13 (brs, 1H); EI-MC: m/z=472,3 [M+H]+. Приклад 52 5-Ціано-1-(3-трифлуорметоксибензил)-1HЗаголовну сполуку отримували з 5-ціано-1-(3індол-2-карбонової кислоти (1-циклопропіл-3трифлуорметоксибензил)-1Н-індол-2-карбонової гідроксипропіл)амід кислоти [отримано з 3 Заголовну сполуку отримували з 5-ціано-1-(3трифлуорметоксибензил)-1Н-індол-2-карбонової кислоти [отримано з 3(трифлуорметокси)бензилброміду та етил 5ціаноіндол-2-карбоксилату] та 3-аміно-3циклопропілпропан-1-олу способом, подібним описаному у прикладі 11. 1 Н ЯМР (400 МГц, CDCI3) Η: 0,25-0,40 (m, 2H), 0,48-0,56 (m, 1H), 0,57-0,65 (m, 1H), 0,90-1,00 (m, 1H), 1,50-1,65 (m, 1H), 1,98-2,10 (m, 1H), 2,83 (трифлуорметокси)бензилброміду та етил 5ціаноіндол-2-карбоксилату] та транс-2аміноциклопентанол гідрохлориду способом, подібним описаному у прикладі 11. 1 Н ЯМР (400 МГц, CDCI3) Η: 1,40-1,50 (m, 1H), 1,65-1,80 (m, 2H), 1,80-1,90 (m, 1H), 2,00-2,10 (m, 1Н), 2,20-2,30 (m, 1Н), 3,77 (brs, 1Н), 3,95-1,05 (m, 2Н), 5,83 (s, 2Н), 6,27 (brs, 1H), 6,88 (brs, 1H), 6,95-7,05 (m, 2H), 7,09 (brd, 1H, J=7,8), 7,30 (t, 1H, J=7,8), 7,40 (d, 1H, J=8,7), 7,50 (dd, 1H, J=8,7, J=1,3), 8,02 (brs, 1H); EI-MC: m/z=444,1 [M+H]+. Приклад 55 5-Ціано-1-(3-трифлуорметоксибензил)-1Hіндол-2-карбонової кислоти (1гідроксиметилпропіл)амід 37 Заголовну сполуку отримували з 5-ціано-1-(3трифлуорметоксибензил)-1Н-індол-2-карбонової кислоти [отримано з 3(трифлуорметокси)бензилброміду та етил 5ціаноіндол-2-карбоксилату] та 2-аміно-1-бутанолу способом, подібним описаному у прикладі 11. 1 Н ЯМР (400 МГц, MeOD) Η: 0,90 (t, 3H, J=7,4), 1,43-1,56 (m, 1H), 1,64-1,76 (m, 1H), 3,58 (d, 2H, J=5,5), 3,91-3,99 (m, 1H), 4,49 (brs, 1H), 5,86, 5,93 (ABq, 2H, J=16,4), 6,96 (brs, 1H), 7,05 (brd, 1H, J=8,0), 7,12 (brd, 1H, J=8,0), 7,26 (s, 1H), 7,34 (t, 1H, J-8,0), 7,53 (dd, 1H, J=8,6, 1,5), 7,62 (d, 1H, J=8,6), 8,13 (brs, 1H); EI-MC: m/z=432,4 (M+H)+. Приклад 56 5-Ціано-1-(3-трифлуорметоксибензил)-1Ніндол-2-карбонової кислоти (1-гідроксиметил-3метилсульфанілпропіл)амід Заголовну сполуку отримували з 5-ціано-1-(3трифлуорметоксибензил)-1Н-індол-2-карбонової кислоти [отримано з 3(трифлуорметокси)бензилброміду та етил 5ціаноіндол-2-карбоксилату] та L-(-)-метіонінолу способом, подібним описаному у прикладі 11. 1 Н ЯМР (400 МГц, MeOD) Η: 1,72-1,85 (m, 1H), 1,88-2,01 (m, 1H), 2,04 (s, 3H), 2,40-2,52 (m, 2Н), 3,53-3,63 (m, 2Н), 4,12-4,22 (m, 1Н), 5,86, 5,93 (ABq, 2Н, J=16,2), 6,94 (s, 1H), 7,04 (brd, 1H, J=7,9), 7,12 (d, 1H, J=7,9), 7,27 (s, 1H), 7,34 (t, 1H, J=7,9), 7,49-7,55 (m, 1H), 7,61 (d, 1H, J=8,5), 8,13 (brs, 1H); EI-MC: m/z=478,0 (M+H)+. Приклад 57 5-Ціано-1-(3-трифлуорметоксибензил)-1Hіндол-2-карбонової кислоти (3-гідроксипропіл)амід Заголовну сполуку отримували з 5-ціано-1-(3трифлуорметоксибензил)-1Н-індол-2-карбонової кислоти [отримано з 3(трифлуорметокси)бензилброміду та етил 5ціаноіндол-2-карбоксилату] та 3-аміно-1 92000 38 пропанолу способом, подібним описаному у прикладі 11. 1 Н ЯМР (400 МГц, MeOD) Η: 1,74-1,82 (квінт, 2Н, J=6,5), 3,43 (t, 2Н, J=6,5), 3,59 (t, 2H, J=6,5), 5,90 (s, 2H), 6,95 (brs, 1H), 7,04 (brd, 1H, J=8,0), 7,11 (d, 1H, J=8,0), 7,20 (s, 1H), 7,34 (dd, 1H, J=8,0), 7,53 (dd, 1H, J=8,5, 1,5), 7,61 (d, 1H, J=8,7), 8,13 (brs, 1H); EI-MC: m/z=418,0 (M+H)+. Приклад 58 5-Ціано-1-(3-трифлуорметоксибензил)-1Hіндол-2-карбонової кислоти (2-гідроксибутил)амід Заголовну сполуку отримували з 5-ціано-1-(3трифлуорметоксибензил)-1Н-індрл-2-карбонової кислоти [отримано з 3(трифлуорметокси)бензилброміду та етил 5ціаноіндол-2-карбоксилату] та 1-аміно-2-бутанолу способом, подібним описаному у прикладі 11. 1 Н ЯМР (400 МГц, MeOD) Η: 0,92-1,00 (m, 3H), 1,35-1,45 (m, 1H), 1,45-1,57 (m, 1H), 3,26-3,34 (m, 1H), 3,39-3,47 (m, 1H), 3,60-3,68 (m, 1H), 5,91 (s, 2H), 6,97 (s, 1H), 7,04 (d, 1H, J=7,8), 7,13 (d, 1H, J=8,3), 7,23-7,28 (m, 1H), 7,30-7,38 (m, 1H), 7,50-7,56 (m, 1H), 7,58-7,63 (m, 1H), 8,11-8,15 (m, 1H); EI-MC: m/z=432,3 (M+H)+. Приклад 59 5-Ціано-1-(3-трифлуорметоксибензил)-1Hіндол-2-карбонової кислоти [2-гідрокси-1(тетрагідропіран-4-іл)етил]амід Заголовну сполуку отримували з 5-ціано-1-(3трифлуорметоксибензил)-1Н-індол-2-карбонової кислоти [отримано з 3(трифлуорметокси)бензилброміду та етил 5ціаноіндол-2-карбоксилату] та 2-аміно-2(тетрагідропіран-4-іл)етанолу способом, подібним описаному у прикладі 11. 1 Н ЯМР (400 МГц, MeOD) Η: 1,20-1,40 (m, 2H), 1,47 (d, 1H, J=12,8), 1,66 (d, 1H, J=12,8), 1,801,95 (m, 1H), 3,30-3,40 (m, 2H), 3,60-3,75 (m, 2H), 3,80-4,00 (m, 3H), 5,85, 5,94 (ABq, 2H, J=16,6), 6,92 (brs, 1H), 7,03 (brd, 1H, J=8,0), 7,12 (brd, 1H, J=8,0), 7,28 (s, 1H), 7,34 (t, 1H, J=8,0), 7,53 (d, 1H, J=8,7), 7,63 (d, 1H, J=8,7), 8,14 (brs, 1H); EI-MC: m/z=488,1 [M+H]+. Приклад 60 39 92000 5-Ціано-1-(3-трифлуорметоксибензил)-1Hіндол-2-карбонової кислоти (1-гідроксициклогексилметил)амід Заголовну сполуку отримували з 5-ціано-1-(3трифлуорметоксибензил)-1Н-індол-2-карбонової кислоти [отримано з 3(трифлуорметокси)бензилброміду та етил 5ціаноіндол-2-карбоксилату] та 1-амінометил-1циклогексанол гідрохлориду способом, подібним описаному у прикладі 11. 1 НЯМР (400 МГц, MeOD) Η: 1,20-1,68 (m, 10H), 3,35 (s, 2H), 5,91 (s, 2H), 6,94 (brs, 1H), 7,02 (brd, 1H, J=8,2), 7,12 (brd, 1H, J=8,2), 7,28 (s, 1H), 7,34(t, 1H, J=8,2), 7,53 (dd, 1H, J=8,8, 1,5), 7,63 (d, 1H, J=8,8), 8,14 (d, 1H, J=1,5); EI-MC: m/z=472,0 [M+H]+. Приклад 61 транс-5-Ціано-1-(3-трифлуорметоксибензил)1H-індол-2-карбонової кислоти (4-гідроксициклогексил)амід Заголовну сполуку отримували з 5-ціано-1-(3трифлуорметоксибензил)-1Н-індол-2-карбонової кислоти [отримано з 3(трифлуорметокси)бензилброміду та етил 5ціаноіндол-2-карбоксилату] та транс-4аміноциклогексанол гідрохлориду способом, подібним описаному у прикладі 11, але застосуванням 1,3-діізопропілкарбодііміду замість 1-(3диметиламінопропіл)-3-етилкарбодііміду. 1 Н ЯМР (400 МГц, ДMCO-d6) Η: 1,13-1,39 (m, 5H), 1,73-1,88 (m, 3H), 3,00-3,09 (m, 1H), 4,53 (d, 1Н, J=4,3), 5,47 (brd, 1H, J=7,5), 5,91 (s, 2H), 7,047,10 (m, 2H), 7,21 (brd, 1H, J=8,2), 7,27 (s, 1H), 7,39 (t, 1H, J=8,2), 7,58 (dd, 1H, J=8,6, 1,3), 7,78 (d,1H, J=8,6), 8,27 (d, 1H, J=1,3), 8,52 (d, 1H, J=8,0); EI-MC: m/z=458,2 [M+H]+. Приклад 62 5-Ціано-1-(3-трифлуорметоксибензил)-1Hіндол-2-карбонової кислоти (2-метоксіетил)амід 40 5-Ціано-1-(3-трифлуорметоксибензил)-1Ніндол-2-карбонову кислоту (1,00 г, 2,77 ммоль) суспендували у безводному ДХМ (20 мл) та додавали тіонілхлорид (0,5 мл, 6,85 ммоль). Реакційну суміш гріли при кипінні під зворотним холодильником протягом 3 годин тоді випарювали до сухого стану. Залишок розчиняли у безводному ДХМ та ділили на 4 аліквоти, одну аліквоту додавали до розчину метоксіетиламіну (0,075 мл, 1,00 ммоль) та триетиламін (0,14 мл, 1,00 ммоль) у ДХМ (5 мл). Після перемішування протягом 2 годин реакційну суміш промивали водою (2 мл) тоді випарювали до сухого стану. Сирий продукт очищали хроматографією на силікагелі застосуванням ДХМ як елюенту і кристалізували з суміші ДХМ: діетил-етер, отримуючи кристалічну заголовну сполуку. 1 Н ЯМР (400 МГц, CDCI3) Η: 3,38 (s, 3H), 3,50-3,54 (m, 2H), 3,57-3,63 (m, 2H), 5,85 (: 2H), 6,56 (brs, 1Н), 6,93 (brs, 1Н), 6,97 (brd, 1Н, J=8,0) 7,01 (s, 1H), 7,08 (brd, 1H, J=8,0), 7,28 (t, 1H, J=8,0), 7,37 (d 1H, J=8,8), 7,49 (dd, 1H, J=8,8, 1,5), 8,03 (brs, 1H); EI-MC: m/z 418,0 [M+H]+. Приклад 63 5-Ціано-1-(3-трифлуорметоксибензил)-1Hіндол-2-карбонової кислоти (3метоксипропіл)амід Заголовну сполуку отримували з 5-ціано-1-(3трифлуорметоксибензил)-1Н-індол-2-карбонової кислоти (отримано з 3(трифлуорметокси)бензилброміду та етил 5ціаноіндол-2-карбоксилат) 2-метоксипропіламіну способом, подібним описаному у прикладі 62. 1 Н ЯМР (400 МГц, CDCI3) Η: 1,86 (квінт, 2Н, J=5,8), 3,39 (s, 3H), 3,55 (m, 4H), 5,86 (s, 2H), 6,906,94 (m, 2Н), 6,98 (d, 1Н, >7,9), 7,01-7,10 (m, 2H), 7,27 (t, 1H, J=7,9), 7,36 (d, 1H, J=8,7), 7,49 (dd, 1H, J=8,7, 1,5), 8,03 (brs, 1H); EI-MC: m/z=446,0 [M+H]+. Приклад 64 5-Ціано-1-(2-метил-5-трифлуорметилбензил)1H-індол-2-карбонової кислоти (3-гідрокси-3метилбутил)амід 41 3-Метил-2-бутен-1-амін гідрохлорид (2,86 г, 0,02 ммоль) розчиняли у 5% водній сульфатній кислоті (25 мл) та суміш гріли до 90°С протягом 18 годин. Розчинник видаляли під зменшеним тиском, отримуючи 4-аміно-2-метил-бутан-2-ол сульфат як жовте масло (4,73 г, 85%). Заголовну сполуку отримували з 5-ціано-1-[2метил-5-(трифлуорметил)]бензил-1Н-індол-2карбонової кислоти [отримано з 2-метил-5(трифлуорметил)бензилброміду та етил 5ціаноіндол-2-карбоксилату] та 4-аміно-2-метилбутан-2-ол сульфату способом, подібним описаному у прикладі 11. 1 Н ЯМР (400 МГц, CDCI3) Η: 1,30 (s, 6H), 1,56 (s, 1H), 1,72 (t, 2H, J=6,3), 2,47 (s, 3H), 3,50-3,57 (m, 2H), 5,87 (s, 2H), 6,47 (s, 1H), 7,00 (s, 1H), 7,22 (d, 1H, J=8,7), 7,30 (d, 1H, J=7,8), 7,38 (d, 1H, J=7,8), 7,41-7,44 (m, 1H), 7,45 (dd, 2H, J=8,7, 1,5), 8,03-8,05 (m, 1H); EI-MC: m/z 444,3 [M+H]+, 426,0 [M-OH]+. Приклад 65 5-Ціано-1-(3-трифлуорметоксибензил)-1Hіндол-2-карбонової кислоти (1-гідроксициклопентилметил)амід До охолодженої суміші циклопентанону (1,10 г, 13,0 ммоль) та цинк броміду (40 мг, 0,17 ммоль) додавали краплями триметилсилілціанід (2,0 мл, 14,7 ммоль). Реакційну суміш перемішували при кімнатній температурі протягом 30 хвил. Розчин ціаногідрину тоді додавали краплями до розчину літій алюмогідриду (1,67 г, 42 ммоль) в етері (30 мл) при швидкості, достатній для підтримування помірного кипіння під зворотним холодильником. Цю суспензію тоді гріли при кипінні під зворотним холодильником протягом 1 години, охолоджували та додавали воду (2 мл), 4 Μ водний натрій гідроксид (2 мл), а потім воду (10 мл). Утворений осад фільтрували через шар дикаліту, органічну фазу відокремлювали та сушили калій гідроксидом. Розчин декантували, сушили натрій сульфатом, фільтрували та концентрували. Залишок розбавляли діетил-етером та додавали розчин 2 Μ хлоридної кислоти в етері. Утворений осад збирали, промивали етером та сушили, отримуючи 1амінометил-циклопентанол гідрохлорид (775 мг, 40%). Заголовну сполуку отримували з 5-ціано-1-(3трифлуорметоксибензил)-1Н-індол-2-карбонової кислоти [отримано з 3(трифлуорметокси)бензилброміду та етил 5 92000 42 ціаноіндол-2-карбоксилату] та 1-амінометилциклопентанол гідрохлориду способом, подібним описаному у прикладі 11. 1 Н ЯМР (400 МГц, CDCI3) Η: 1,58-1,72 (m, 6H), 1,74 (s, 1H), 1,78-1,88 (m, 2H), 3,53 (d, 2H, J=5,6), 6,67 (brt, 1H, J=5,6), 6,91 (brs, 1H), 6,97 (d, 1H, J=7,8), 7,02 (s, 1H), 7,08 (d, 1H, J=7,8), 7,28(t, 1H, J=7,8), 7,39(d, 1H, J=8,8), 7,50 (dd, 1H, J=8,8, 1,6), 8,03 (brs, 1H); EI-MC: m/z=458,4 [M+H]+. Приклад 66 5-Ціано-1-(3-трифлуорметоксибензил)-1Hіндол-2-карбонової кислоти (1-гідроксициклобутилметил)амід Заголовну сполуку отримували з 5-ціано-1-(3трифлуорметоксибензил)-1Н-індол-2-карбонової кислоти [отримано з 3(трифлуорметокси)бензилброміду та етил 5ціаноіндол-2-карбоксилату] способом, подібним описаному у прикладі 11, та 1-амінометилциклобутанол гідрохлориду (отримано з циклобутанону та триметилсилілціаніду) способом, подібним описаному у прикладі 65. 1 Н ЯМР (400 МГц, MeOD) Η: 1,49-1,66 (m, 1H), 1,67-1,80 (m, 1H), 1,94-2,12 (m, 4H), 3,53 (8, 2H), 5,89 (8, 2Н), 6,97 (brs, 1H), 7,02 (brd, 1Н, J=7,8), 7,10 (brd, 1Н, J=7,8), 7,26 (s, 1H), 7,32 (t, 1H, J=7,8), 7,49 (dd, 1H, J=8,8, 1,5), 7,58 (d, 1H, J=8,8), 8,09 (brs, 1H); EI-MC: m/z=442,0 [M-H]". Приклад 67 5-Ціано-1-(3-трифлуорметоксибензил)-1Ніндол-2-карбонової кислоти (1гідроксиметилцикпопропіл)амід 1-аміно-циклопропанкарбонової кислоти етил-естер гідрохлорид (350 мг, 2,11 ммоль) розчиняли у безводному ТГФ (15 мл) та охолоджували до 0°С під аргоном. 1,0 Μ розчин літій алюмогідриду у ТГФ (2,5 мл, 2,50 ммоль) додавали краплями та реакційну суміш нагрівали до кімнатної температури та перемішували протягом 17 годин. Реакцію гасили обережним додаванням натрій сульфату декагідрату до припинення виділення водню. Суспензію перемішували протягом 2 годин, фільтрували через дикаліт та залишок промивали етером. Фільтрат та промивки комбінували та концентрували, отримуючи (1-аміноциклопропіл)метанол (180 мг, 98%) як безбарвне 43 92000 44 масло. Заголовну сполуку отримували з 5-ціанофобної фільтр-туби та ДХМ видаляли під змен1-(3-трифлуорметоксибензил)-1H-індол-2шеним тиском та очищали напів-препаративною карбонової кислоти [отримано з 3ВЕРХ а потім очищали на нейтральному алюмі(трифлуорметокси)бензилброміду та етил 5ній оксиді, отримуючи заголовну сполуку (75 мг, ціаноіндол-2-карбоксилату] та (1-аміно28%) як склоподібний твердий продукт. 1 циклопропіл)метанолу способом, подібним опиН ЯМР (400 МГц, CD3CN) Η: 1,38-1,44 (m, саному у прикладі 11. 4H), 1,57-1,70 (m, 4H), 3,22 (d, 2H, J=6,5), 3,34 (d, 1 Н ЯМР (400 МГц, MeOD) Η: 0,70-0,92 (m, 2H, J=6,5), 3,65 (t, 1H, J=6,5), 5,90 (s, 2H), 6,99 4H), 3,63 (3, 2H), 5,89 (s, 2H), 6,97 (brs, 1H), 7,05 (brs, 1H), 7,07 (d, 1H, J=7,9), 7,16-7,21 (m, 2H), (brd, 1Н, J=7,9), 7,12 (brd, 1H, J=7,9), 7,23 (s, 1H), 7,39 (t, 1H, J=7,9), 7,54-7,62 (m, 3H), 8,17-8,19 (m, 7,35 (t, 1H, J=7,9), 7,52 (dd, 1H, J=8,8, 1,5), 7,60 (d, 1H); 1H, J=8,8), 8,11 (d, 1H, J=1,5); EI-MC: m/z=472,1 (M+H)+. EI-MC: m/z=428,3 [M-H]". Приклад 69 Приклад 68 5-Ціано-1-(3-трифлуорметоксибензил)-1Н5-Ціано-1-(3-трифлуорметоксибензил)-1Ніндол-2-карбонової кислоти (1індол-2-карбонової кислоти (1гідроксиметилциклобутилметил)амід гідроксиметилциклопентилметиліамід Етилціаноацетат (2,50 г, 22 ммоль) та 1,4дибромбутан (5,00 г, 23,0 ммоль) розчиняли у безводному ДМФ (20 мл) під азотом та додавали цезій карбонат (21,0 г, 64 ммоль) при охолодженні водяною банею. Після перемішування при кімнатній температурі протягом 18 годин реакційну суміш розбавляли водою та екстрагували етилацетатом (2x80 мл), органічні шари комбінували та промивали водою (40 мл) та насиченим водним розчином натрій хлориду (25 мл). Органічний шар сушили магній сульфатом, фільтрували та випарювали під зменшеним тиском, отримуючи 1ціано-циклопентанкарбонової кислоти етил-естер як майже безбарвне масло (3,64 г, 98%). 1-Ціано-циклопентанкарбонової кислоти етил-естер (2,00 г, 12,0 ммоль) розчиняли у безводному тетрагідрофурані (5 мл) під азотом та додавали краплями при 0°С літій алюмогідрид (36 мл, 36 ммоль, 1,0М у ТГФ). Після перемішування при кімнатній температурі протягом 24 годин воду обережно додавали до реакційної суміші та суміш продуктів екстрагували етилацетатом (3x50 мл). Органічні шари комбінували та промивали водою (40 мл) та насиченим водним розчином натрій хлориду (25 мл). Комбіновані органічні фази сушили магній сульфатом, фільтрували та випарювали під зменшеним тиском, отримуючи 1гідроксиметил-циклопентанкарбонітрил (75 мг, 28%) як масло, котре загущувалося при стоянні, даючи воскоподібний жовтий твердий продукт. 5-Ціано-1-(3-трифлуорметоксибензил)-1Ніндол-2-карбонову кислоту (200 мг, 0,56 ммоль), 1-гідроксиметил-циклопентанкарбонітрил (145 мг, 1,12 ммоль), 1-(3-диметиламінопропіл)-3-етил карбодіімід гідрохлорид (117 мг, 0,61 ммоль) та 1гідроксибензотриазол гідрат (83 мг, 0,61 ммоль) перемішували у ДХМ (20 мл) протягом 66 годин при кімнатній температурі. Реакційну суміш виливали у воду (25 мл) та розбавляли ДХМ (25 мл). Органічний шар відділяли застосуванням гідро 1-Ціано-циклобутанкарбонової кислоти етилестер отримували з етилціаноацетату (10,0 г, 88,4 ммоль) та 1,3-дибромпропану (8,9 мл, 88,5 ммоль) так же, як 1-ціано-циклопентанкарбонової кислоти етил-естер, отримуючи 1-ціаноциклобутанкарбонової кислоти етил-естер як жовте масло (9,03 г, 67%). 1-Ціано-циклобутанкарбонової кислоти етилестер (2,00 г, 13,0 ммоль) розчиняли в етанолі (30 мл) та обробляли нікелем Рені (1 мл як кашка у воді) та воднем при 4 бар та нагріванням при 40°С протягом 18 годин. Реакційну суміш фільтрували через дикаліт та промивали через із етанол (50 мл). Розчинник видаляли під зменшеним тиском, отримуючи 1-амінометилциклобутанкарбонової кислоти етил-естер як жовте масло (1,47 г, 72%). 1-({[5-Ціано-1-(3трифлуорметоксибензил)-1Н-індол-2карбоніл]аміно}метил)-циклобутанкарбонової кислоти етил-естер отримували з 1-амінометилциклобутанкарбонової кислоти етил-естеру (262 мг, 1,65 ммоль) та 5-ціано-1-(3трифлуорметоксибензил)-1H-індол-2-карбонової кислоти (400 мг, НО ммоль) так же, як 5-ціано-1(3-трифлуорметоксибензил)-1H-індол-2карбонової кислоти (1-гідроксиметилциклопентилметил)амід, отримуючи 1-({[5-ціано1-(3-трифлуорметоксибензил)-1H-індол-2карбоніл]аміно}метил)циклобутанкарбонової кислоти етил-естер як безбарвну смолу (287 мг, 50%). 5-Ціано-1-(3-трифлуорметоксибензил)-1Hіндол-2-карбонової кислоти (1-гідроксиметилциклобутилметил)амід отримували з 1-({[5-ціано1-(3-трифлуорметоксибензил)-1Н-індол-2карбоніл]аміно}метил)циклобутанкарбонової кислоти етил-естеру (267 мг, 0,52 ммоль) так же, як 5-ціано-1-(3-трифлуорметоксибензил)-1Н-індол2-карбонової кислоти (3-гідрокси-2метилпропіл)амід, отримуючи 5-ціано-1-(3трифлуорметоксибензил)-1H-індол-2-карбонової 45 92000 46 кислоти (1-гідроксиметилциклобутилметил)амід 3,65 (m, 2H), 5,84 (s, 2H), 6,86 (brs, 1H), 6,91 (brt, як безбарвну смолу (74 мг, 30%). 1H, J=5,9), 6,98 (brd, 1H, J=8,1), 7,00 (s, 1H), 7,09 1 (brd, 1H, J=8,1), 7,29 (t, 1H, J=8,1), 7,39 (d, 1H, Н ЯМР (400 МГц, CDCI3) Η: 1,73-1,80 (m, J=8,8), 7,50 (dd, 1H, J=1,5, 8,8), 8,00-8,03 (m, 1H); 4H), 1,85-2,04 (m, 2H), 3,46 (s, 2H), 3,55 (d, 2H, EI-MC: m/z=432,1 (M+H)+. J=6,3), 5,84 (s, 2H), 6,83 (brs, 1H), 6,99 (d, 1H, Приклад 71 J=7,8), 7,04 (s, 1H), 7,06-7,14 (m, 2H), 7,30 (t, 1H, 5-Ціано-1-(3-трифлуорметоксибензил)-1HJ=8,0), 7,40 (d, 1H, J=8,8), 7,50 (dd, 1H, J=8,8, 1,5), індол-2-карбонової кислоти (4,4,4-трифлуор-37,99-8,02 (m, 1H); гідрокси-3-метилбутил)амід EI-MC: m/z=458,3 (M+H)+. Приклад 70 5-Ціано-1-(3-трифлуорметоксибензил)-1Hіндол-2-карбонової кислоти (3-гідрокси-2метилпропіл)амід 3-аміноізомасляну кислоту (1,00 г, 9,7 ммоль) перемішували у ДХМ під азотом та додавали при кімнатній температурі тіонілхлорид (1,4 мл, 19,4 ммоль). Реакційну суміш гріли до 50°С протягом 2 годин. Розчинник та будь-який надлишок тіонілхлориду видаляли під зменшеним тиском та отримане масло розчиняли в етанолі (20 мл) при перемішуванні при кімнатній температурі протягом 18 годин. Розчинник видаляли під зменшеним тиском, отримуючи 3-аміноізомасляної кислоти етил-естер гідрохлорид як в'язке непрозоре масло (1,47 г, 90%). 3-{[5-Ціано-1-(3-трифлуорметоксибензил)-1Ніндол-2-карбоніл]аміно}-2-метилпропіонової кислоти етил-естер отримували так же, як 5-ціано-1(3-трифлуорметоксибензил)-1H-індол-2карбонової кислоти (1гідроксиметилциклопентилметил)амід з 5-ціано1-(3-трифлуорметоксибензил)-1H-індол-2карбонової кислоти (300 мг, 83,3 ммоль) та 3аміноізомасляної кислоти етил-естеру гідрохлориду (168 мг, 0,10 ммоль), отримуючи 3-{[5-ціано1-(3-трифлуорметоксибензил)-1Н-індол-2карбоніл]аміно}-2-метилпропіонової кислоти етил-естер (204 мг, 51%). 3-{[5-Ціано-1-(3трифлуорметоксибензил)-1H-індол-2карбоніл]аміно}-2-метилпропіонової кислоти етил-естер (170 мг, 0,36 ммоль) розчиняли у сухому тетрагідрофурані (10 мл) та додавали літій борогідрид (28 мг, 1,28 ммоль) і суміш гріли до кипіння під зворотним холодильником протягом 90 годин. Реакційну суміш розбавляли водою та екстрагували етилацетатом (2x30 мл), органічні шари комбінували та промивали водою (20 мл) та насиченим розчином натрій хлориду (20 мл). Органічний шар сушили магній сульфатом, фільтрували та випарювали під зменшеним тиском, отримуючи 5-ціано-1-(3трифлуорметоксибензил)-1Н-індол-2-карбонової кислоти (3-гідрокси-2-метилпропіл)амід як блідожовтий твердий продукт, котрий очищали препаративною ВЕРХ (75 мг, 48%). 1 Н ЯМР (400 МГц, CDCI3) Η: 0,90-0,94 (d, 3H, J=6,8), 1,85-1,98 (m, 1H), 3,24-3,37 (m, 2H), 3,54 До розчину 4,4,4-трифлуор-3-гідрокси-3метилмасляної кислоти (1,81 г, 10,0 ммоль) у метанолі (10 мл) додавали краплями (триметилсиліл)діазометан (10 мл). Реакційну суміш тоді перемішували при кімнатній температурі протягом 4 годин. Видалення розчиннику дало сирий 3(трифлуорметил)-3-гідроксимасляної кислоти метил-естер як жовте масло (1,92 г, 100%). До розчину сирої 4,4,4-трифлуор-3-гідрокси-3метилмасляної кислоти (1,90 г, 10,0 ммоль) у метанолі (5 мл) додавали концентрований водний амоній гідроксид (10 мл) та реакційну суміш перемішували протягом 40 годин при кімнатній температурі, тоді випарювали до сухого стану, отримуючи сири 4,4,4,-трифлуор-3-гідрокси-3метил бутирамід (1,77 г, 100%) як жовте масло. 1,0М розчин літій алюмогідриду у тетрагідрофурані (30 мл, 30,0 ммоль) додавали краплями до розчину 4,4,4,-трифлуор-3-гідрокси-3метилбутирамід (1,77 г, 10 ммоль). Реакційну суміш перемішували при кімнатній температурі протягом 20 годин, тоді гасили водою (1,2 мл), тоді 4 Μ водним натрій гідроксидом (1,2 мл) і водою (3,6 мл). Неорганічні солі відфільтровували та фільтрат випарювали до сухого стану, отримуючи 4-аміно-1,1,1-трифлуор-2-метилбутан-2-ол (1,27 г, 81 %) як жовтий твердий продукт. Заголовну сполуку отримували з 5-ціано-1-(3трифлуорметоксибензил)-1Н-індол-2-карбонової кислоти [отримано з 3(трифлуорметокси)бензилброміду та етил 5ціаноіндол-2-карбоксилату] та 4-аміно-1,1,1трифлуор-2-метилбутан-2-олу способом, подібним описаному у прикладі 11. 1 Н ЯМР (400 МГц, CDCI3) 1,43 (s, 3H), 1,89 (m, 1H), 2,05 (m, 1H), 2,72 (s, 1H), 3,57 (m, 1H), 3,72 (m, 1H), 5,84 (s, 2H), 6,85 (brs, 1H), 6,89 (s, 1H), 6,96 (s, 1H), 6,97 (d, 1H, J=7,8), 7,09 (d, 1H, J=8,0), 7,28 (t, J=8,0), 7,37 (d, 1H, J=7,5), 7,49 (d, 1H, J=7,5), 8,01 (s, 1H). EI-MS: m/z=500,0 (M+H)+. Приклад 72 5-Ціано-1-(3-трифлуорметоксибензил-1Hіндол-2-карбонової кислоти (3-метокси-2,2диметилпропіл)амід При перемішуванні до розчину ізобутиронітрилу (1,00 г, 14,5 ммоль) у тетрагідрофурані (15 мл) охолодженого до -70°С додавали краплями 47 92000 48 протягом 10 хвил. 2,0 М Літій діізопропіламід 5-Ціано-1-(3-трифлуорметоксибензил-1H(8,80 мл, 17,6 ммоль). Реакційну суміш перемішуіндол-2-карбонової кислоти (2,2-диметил-3вали при -70°С протягом 1 години, тоді додавали (тетрагідро-фуран-2-ілн-пропіл)амід краплями хлорметил-метил-етер (1,33 мл, 17,5 ммоль) у тетрагідрофурані (5 мл). Охолоджувальну баню видаляли та реакційну суміш перемішували при кімнатній температурі протягом 1 години. Насичений водний амоній хлорид (10 мл) додавали та суміш екстрагували ДХМ, промивали водою (1x10 мл), розсолом (1x10 мл), сушили натрій сульфатом та концентрували до малого об'єму. Хроматографія на силікагелі сумішшю Заголовну сполуку отримували з 5-ціано-1-(3гептан:діетил-етер (4:1) дала 3-метокси-2,2трифлуорметоксибензил)-1Н-індол-2-карбонової диметилпропіонітрил (1,60 г, 98%) як смолу. кислоти та 2,2-диметил-3-(тетрагідро-фуран-23-Метокси-2,2-диметилпропіонітрил (1,60 г, іл)пропіламіну (отримано з тетра14,1 ммоль), розчиняли в етанолі (100 мл), додагідрофурфурилхлориду та ізобутиронітрилу) сповали нікель Рені (50% кашка у воді, 0,5 мл) та собом, описаним у прикладі 72. суміш гідрогенували протягом 3 годин (50°С, 5 1 Н ЯМР (400 МГц, CDCI3): Η: 0,93 (s, 3H), атм). Реакційну суміш охолоджували, фільтрува0,93 (s, 3H), 1,43-1,60 (m, 3H), 1,85-2,09 (m, 3H), ли через дикаліт та концентрували під зменше3,20 (dd, 1Н, J=13,5, 6,0), 3,35 (dd, 1Н, J=13,5, ним тиском, отримуючи 3-метокси-2,26,8), 3,81-3,89 (m, 1H), 3,89-4,02 (m, 2H), 5,90 (s, диметилпропіламін (440 мг, 27%) як прозоре ма2H), 6,89 (br s, 1H), 6,94 (s, 1H), 7,07 (br d, 1H, сло. J=7,9), 7,06 (br d, 1H, J=7,9), 7,27 (t, 1H, J=7,9), Заголовну сполуку отримували з 5-ціано-1-(37,37 (d, 1H, J=8,8), 7,47 (dd, 1H, J=8,8, 1,5), 8,03 трифлуорметоксибензил)-1Н-індол-2-карбонової (s, 1H), 8,16 (brt, 1H, J=6,0); кислоти [отримано з 3EI-MC: m/z=499,9 [M+H]+. (трифлуорметокси)бензилброміду та етил 5Приклад 75 ціаноіндол-2-карбоксилату] 3-метокси-2,2Визначення in vitro ефективності та дієвості диметилпропіламіну способом, подібним описана рецепторі СB1 людини, експресованому у кліному у прикладі 11. 1 тинах СНО Н ЯМР (400 МГц, CDCI3): Η: 0,95 (s, 6Н), Клітини яєчнику китайського хом'яка (СНО), 3,25 (s, 2Н), 3,34 (d, 2Н, J=5,5), 3,41 (s, 3H), 5,87 котрі стабільно експресують людини канабіноїд(s, 2Н), 6,91 (m, 2Н), 6,99 (brd, 1Н, J=8,2), 7,07 ний рецептор СB1 співтрансфектували з репор(brd, 1H, J=8,2), 7,27 (t, 1H, J=8,2), 7,33 (brt, 1H, терним геном люциферази, котрий знаходиться J=5,5), 7,37 (d, 1H, J=8,6), 7,48 (dd, 1H, J=8,6, 1,8), під регуляторним контролем АР1-чутливого еле8,04 (brs, 1H); + менту (АР1 luc). Клітини суспендували у комерEI-MC: m/z=460,1 [M+H] . ційно доступному DMEM/F12 nut mix без фенолПриклад 73 червоного, що містить пеніцилін/стрептоміцин 5-Ціано-1-(3-трифлуорметоксибензил-1H(50U/50 мкг/мл) та фунгізон (мкг/мл) перед засііндол-2-карбонової кислоти (4-етокси-2,2ванням у 96-коміркові планшети з білими стінкадиметил-бутил)амід ми та дном при густині 3x104 клітин на комірку (100 мкл кінцевий об'єм) та інкубували протягом ночі (приблизно 18 г при 37°С, 5% СО2 у повітрі) перед аналізом. Тест-сполуки (10 мМ розчин у ДМСО) розбавляли DMEM/F12 nut mix (без фенолу червоного), що містить 3% альбуміну коров'ячої сироватки, отримуючи діапазон концентрацій 0,1 мМ - 1 нМ. 10 мкл кожного розбавлення додавали до відповідної комірки у клітинному планшеті, отримуючи Заголовну сполуку отримували з 5-ціано-1-(3кінцевий діапазон концентрацій 10 мкМ - 0,1 нМ. трифлуорметоксибензил)-1Н-індол-2-карбонової Через 5 хвил. після додавання сполук, 10 мкл 1 кислоти та 4-етокси-2,2-диметилбутиламіну мкМ СР-55,940 додавали до усіх комірок за виня(отримано з хлоретил-етил-етеру та ізобутиронітком контрольних комірок. трилу) способом, описаним у прикладу 72. 1 Планшети інкубували протягом 5 годин при Н ЯМР (400 МГц, CDCI3): Η: 0,91 (s, 6Н), 37°С перед додаванням 100 мкл реагенту LucLite 1,21 (t, 3H, J=7,0), 1,55 (t, 2Н, J=5,0), 3,25 (d, 2H, до кожної комірки (за інструкціями виробника). J=6,5), 3,49-3,56 (m, 4H), 5,88 (s, 2H), 6,89 (br s, Планшети закривали Top Seal та вираховували 1H), 6,95 (s, 1H), 6,97 (br d, 1H, J=8,0), 7,07 (brd, на Packard TopCount (підрахунок одиничних фо1H, J=8,0), 7,27 (t, 1H, J=8,0), 7,37 (d, 1H, J=8,7), тонів, час підрахунку 0,01 хвил., без затримки 7,48 (dd, 1H, J=8,7, 1,4), 7,50 (brt, 1H, J=S,5), 8,02 підрахунку). (brs, 1H); Після стимуляції рецептору СB1, експресія EI-MC: m/z=488,3 [M+H]+. люциферази посилюється і це можна вимірювати Приклад 74 як збільшення активності ферменту. Цю репортерну систему тому застосовано як функціональний 49 92000 50 тест для оцінки дієвості сполуки антагоністу стоТаблиця вказує дієвість зразкових сполук висовно рецептору СB1. Дані аналізували застосунаходу. ванням підгонки кривих способом найменших квадратів для отримання значень pEK50. Таблиця 1 Приклад 16 23 35 48 55 61 65 66 69 72 Хімічна назва Дієвість 5-Хлор-1-(3-трифлуорметоксибензил)-1Н-індол-2-карбонової кислоти (3(+) ізопропоксипропіл)амід 5-Ціано-1-(2-метокси-5-трифлуорметоксибензил)-1H-індол-2-карбонової кислоти (3(++) гідрокси-2,2-диметилпропіл)амід транс-5-Ціано-1-(3-трифлуорметоксибензил)-1Н-індол-2-карбонової кислоти (2(+++) гідрокси-циклогексилметил)амід транс-5-Ціано-1-[3-(4-метил-піперазин-1-іл)-бензил]-1H-індол-2-карбонової кислоти (2(+) гідрокси-циклогексилметил)амід транс-5-Ціано-1-(3-трифлуорметоксибензил)-1Н-індол-2-карбонової кислоти (2(++) гідрокси-циклопентил)амід 5-Ціано-1-(3-трифлуорметоксибензил)-1Н-індол-2-карбонової кислоти (1-гідрокси(++) циклогексилметил)амід 5-Ціано-1-(2-метил-5-трифлуорметилбензил)-1H-індол-2-карбонової кислоти (3(++) гідрокси-3-метилбутил)амід 5-Ціано-1-(3-трифлуорметоксибензил)-1Н-індол-2-карбонової кислоти (1-гідрокси(++) циклопентилметил)амід 5-Ціано-1-(3-трифлуорметоксибензил)-1Н-індол-2-карбонової кислоти (1(+++) гідроксиметилциклопентилметил)амід 5-Ціано-1-(3-трифлуорметоксибензил)-1Н-індол-2-карбонової кислоти(4,4,4-трифлуор(++) 3-гідрокси-3-метилбутил)амід Планшети інкубували протягом 5 годин при 37°С перед додаванням 100 мкл реагенту LucLite до кожної комірки (за інструкціями виробника). Планшети закривали Top Seal та вираховували на Packard TopCount (підрахунок одиничних фотонів, 0,01 хвил. час підрахунку, без затримки підрахунку). Після стимуляції рецептору СB1, експресія люциферази посилюється та це можна вимірювати як збільшення активності ферменту. Цю репортерну систему тому застосовано як функціональний тест для оцінки дієвості сполуки антагоністу стосовно рецептору СB1. Дані аналізували застосуванням підгонки кривих способом найменших квадратів для отримання значень рЕК50. +++ ++ + рІК50>9 рІК508-9 рІК507-8 В описі до патенту на винахід графічні зображення та текст подаються в редакції заявника Комп’ютерна верстка О. Гапоненко Підписне Тираж 28 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійською1-benzylindole-2-carboxamide derivatives
Автори англійськоюCowley Phillip Martin, Gibson Samuel George, Wishart Gran
Назва патенту російськоюПроизводные 1-бензилиндол-2-карбоксамида
Автори російськоюКоули Филип Мартин, Гибсон Семьюэл Джордж, Вишарт Грант
МПК / Мітки
МПК: A61K 31/405, C07D 405/12, A61P 43/00, C07D 209/42
Мітки: 1-бензиліндол-2-карбоксаміду, похідні
Код посилання
<a href="https://ua.patents.su/25-92000-pokhidni-1-benzilindol-2-karboksamidu.html" target="_blank" rel="follow" title="База патентів України">Похідні 1-бензиліндол-2-карбоксаміду</a>
Попередній патент: Застосування олігоестердіолів як пластифікатора епоксидної композиції
Наступний патент: Спосіб фокусування світла, випущеного світловипромінювальним діодом (свд), та лампа, в котрій як джерело світла використовується світловипромінювальний діод (свд)
Випадковий патент: Спосіб одержання феніл-о-хлорфенілфосфорної кислоти