Гідрохлоридні солі антибіотичної сполуки
Номер патенту: 115086
Опубліковано: 11.09.2017
Автори: Лі Цзюньнін, Філіпов Дімітар, Чжан Вейцзянь, Грін Джек, Чеунг Ронні
Формула / Реферат
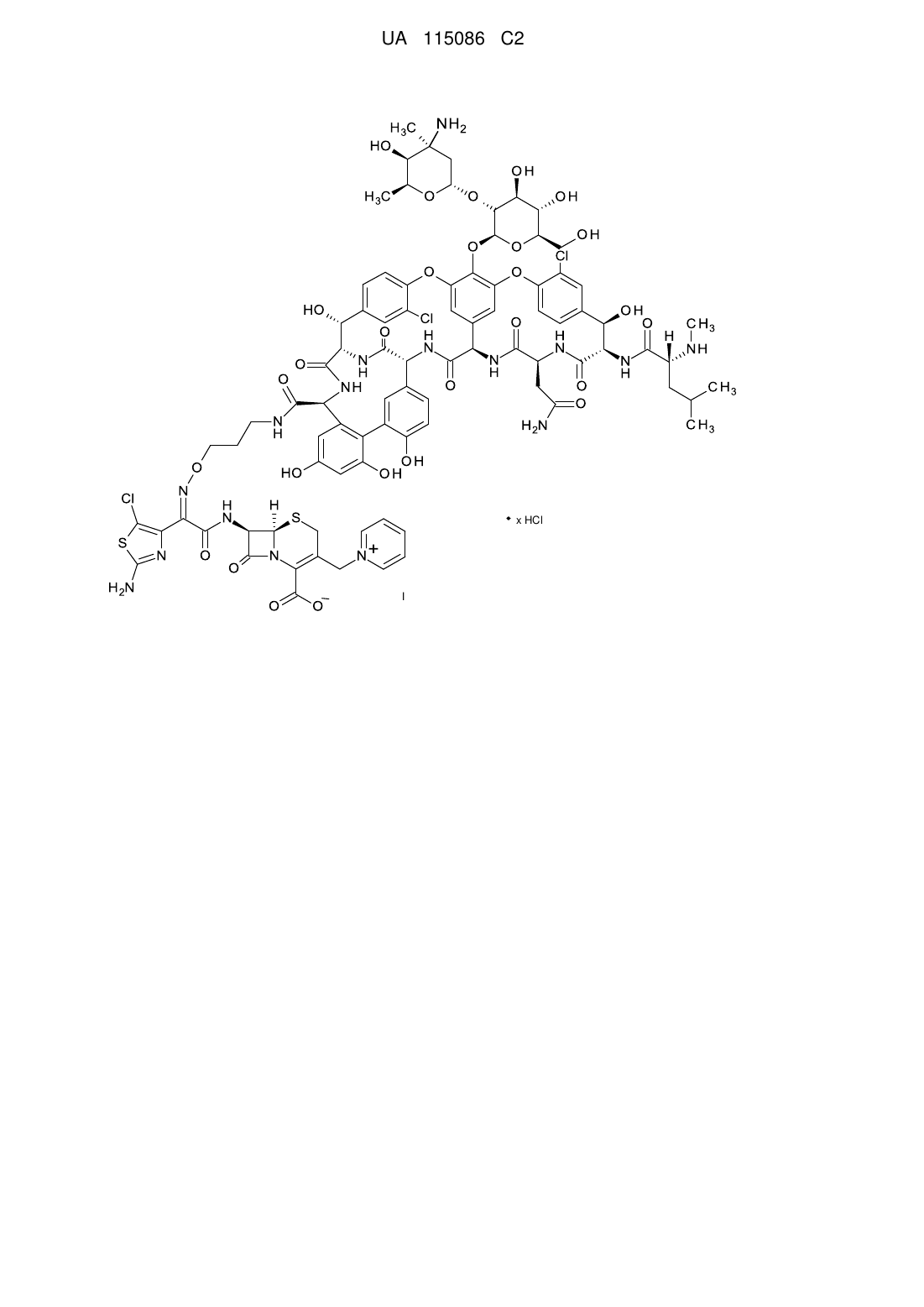
1. Сполука формули І:
 ,
,
у якій х знаходиться в межах від приблизно 1 до приблизно 2.
2. Сполука за п. 1, де х дорівнює приблизно 1.
3. Сполука за п. 1, де х дорівнює приблизно 2.
4. Фармацевтична композиція, яка містить фармацевтично прийнятний носій і сполуку за пп. 1, 2 або 3.
5. Фармацевтична композиція, яка містить (а) сполуку за пп. 1, 2 або 3; (b) сахарозу і (с) гліцин або його фармацевтично прийнятну сіль.
6. Фармацевтична композиція за п. 5, де композиція є ліофілізованою композицією.
7. Фармацевтична композиція, яка містить:
(a) сполуку за пп. 1, 2 або 3;
(b) від приблизно 0,5 до приблизно 2,0 частин за масою сахарози; і
(c) від приблизно 0,5 до приблизно 2,0 частин за масою гліцину (у вигляді еквівалента вільної основи);
де масові частини сахарози і гліцину основані на масовій частині сполуки за пп. 1, 2 або 3 (у вигляді еквівалента вільної основи).
8. Фармацевтична композиція за п. 6, де композиція містить приблизно 1,0 частину за масою сахарози і приблизно 1,5 частини за масою гліцину.
9. Фармацевтична композиція за п. 8, де зміна чистоти сполуки за пп. 1, 2 або 3 (у вигляді еквівалента вільної основи) у фармацевтичній композиції становить менше ніж приблизно 10 %, що визначено високоефективною рідинною хроматографією після зберігання протягом 12 місяців при температурі в межах від приблизно 18 °C до приблизно 25 °C.
10. Спосіб лікування бактеріальної інфекції у пацієнта, який включає введення пацієнту сполуки за пп. 1, 2 або 3.
11. Спосіб лікування бактеріальної інфекції у пацієнта, який включає введення пацієнту фармацевтичної композиції, яка включає фармацевтично прийнятний носій і сполуку за пп. 1, 2 або 3.
12. Сполука за пп. 1, 2 або 3 для застосування в терапії.
13. Сполука за пп. 1, 2 або 3 для використання у виробництві лікарського засобу.
14. Спосіб отримання сполуки за п. 1, де зазначений спосіб включає наступні стадії:
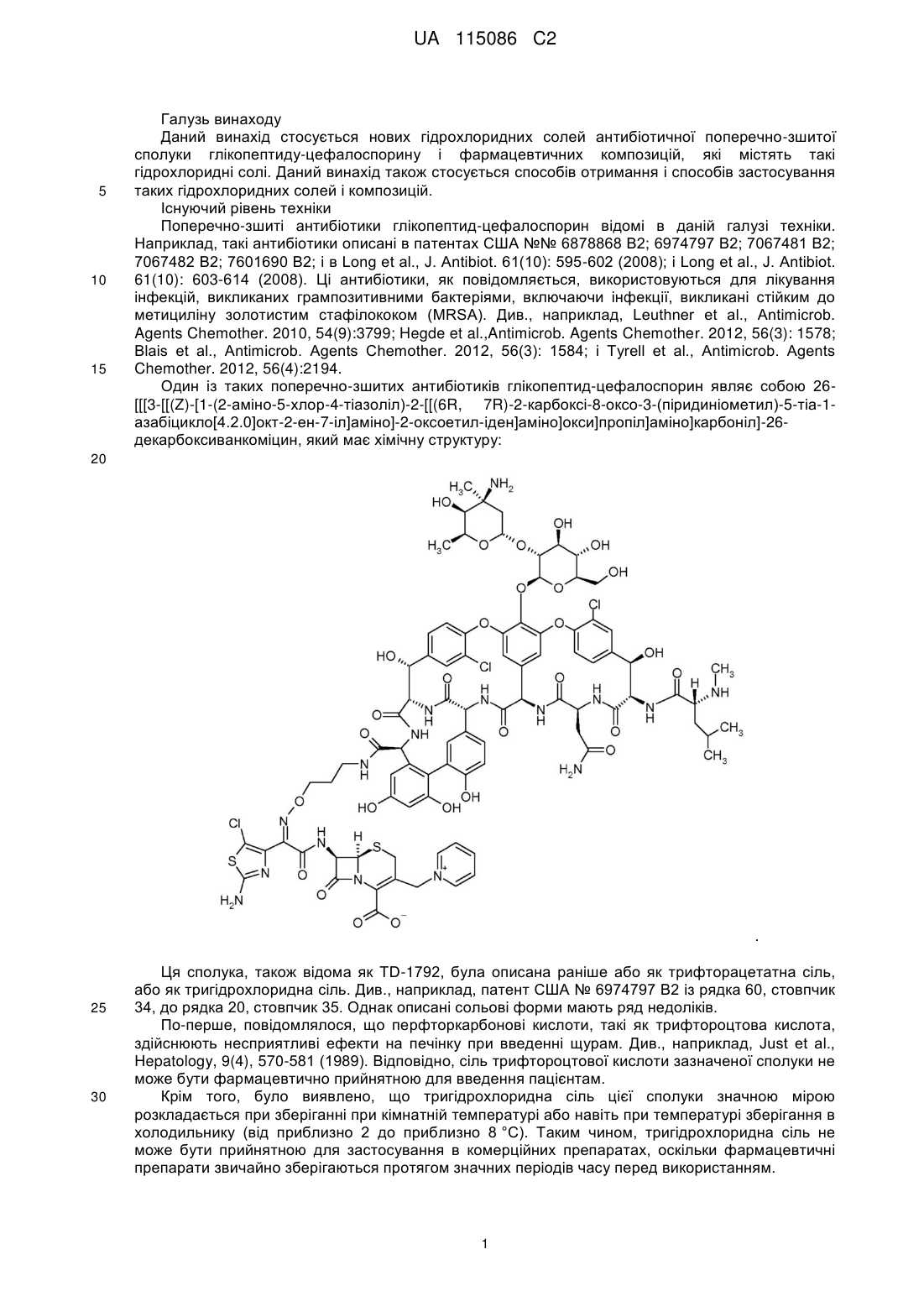
(a) приготування водної композиції, яка містить 26-[[[3-[[(Z)-[1-(2-аміно-5-хлор-4-тіазоліл)-2-[[(6R,7R)-2-карбоксі-8-оксо-3-(піридиніометил)-5-тіа-1-азабіцикло-[4.2.0]окт-2-ен-7-іл]аміно]-2-оксоетиліден]аміно]окси]пропіл]аміно]карбоніл]-26-декарбоксиванкоміцин і
соляну кислоту в молярному співвідношенні від приблизно 1:1 до приблизно 1:2;
(b) ліофілізація водної композиції із отриманням сполуки за п. 1.
15. Спосіб за п. 14, де молярне співвідношення становить приблизно 1:1.
16. Спосіб за п. 14, де молярне співвідношення становить приблизно 1:2.
17. Спосіб зниження розпаду 26-[[[3-[[(Z)-[1-(2-аміно-5-хлор-4-тіазоліл)-2-[[(6R,7R)-2-карбоксі-8-оксо-3-(піридиніометил)-5-тіа-1-азабіцикло[4.2.0]окт-2-ен-7-іл]аміно]-2-оксоетиліден]аміно]окси]пропіл]аміно]карбоніл]-26-декарбоксиванкоміцину під час зберігання, де спосіб включає (а) отримання сполуки за пп. 1, 2 або 3, і (b) зберігання сполуки за пп. 1, 2 або 3 при температурі в межах від приблизно -25 °C до приблизно 25 °C.
18. Спосіб за п. 17, де температура знаходиться у діапазоні від приблизно 2 °C до приблизно 8 °C.
19. Спосіб зниження розпаду 26-[[[3-[[(Z)-[1-(2-аміно-5-хлор-4-тіазоліл)-2-[[(6R,7R)-2-карбоксі-8-оксо-3-(піридиніометил)-5-тіа-1-азабіцикло[4.2.0]окт-2-ен-7-іл]аміно]-2-оксоетиліден]аміно]окси]пропіл]аміно]карбоніл]-26-декарбоксиванкоміцину під час зберігання, де спосіб включає (а) отримання фармацевтичної композиції за п. 8 і (b) зберігання фармацевтичної композиції при температурі в діапазоні від приблизно -25 °C до приблизно 25 °C.
20. Спосіб за п. 19, де температура знаходиться у діапазоні від приблизно 2 °C до приблизно 8 °C.
Текст
Реферат: Даний винахід стосується сполуки формули І, де х знаходиться у діапазоні від приблизно 1 до приблизно 2. Винахід також стосується фармацевтичних композицій, які містять таку сполуку; способів отримання такої сполуки і способів застосування такої сполуки у, наприклад, лікуванні бактеріальної інфекції. UA 115086 C2 (12) UA 115086 C2 x HCl I UA 115086 C2 5 10 15 Галузь винаходу Даний винахід стосується нових гідрохлоридних солей антибіотичної поперечно-зшитої сполуки глікопептиду-цефалоспорину і фармацевтичних композицій, які містять такі гідрохлоридні солі. Даний винахід також стосується способів отримання і способів застосування таких гідрохлоридних солей і композицій. Існуючий рівень техніки Поперечно-зшиті антибіотики глікопептид-цефалоспорин відомі в даній галузі техніки. Наприклад, такі антибіотики описані в патентах США №№ 6878868 В2; 6974797 В2; 7067481 В2; 7067482 В2; 7601690 В2; і в Long et al., J. Antibiot. 61(10): 595-602 (2008); і Long et al., J. Antibiot. 61(10): 603-614 (2008). Ці антибіотики, як повідомляється, використовуються для лікування інфекцій, викликаних грампозитивними бактеріями, включаючи інфекції, викликані стійким до метициліну золотистим стафілококом (MRSA). Див., наприклад, Leuthner et al., Antimicrob. Agents Chemother. 2010, 54(9):3799; Hegde et al.,Antimicrob. Agents Chemother. 2012, 56(3): 1578; Blais et al., Antimicrob. Agents Chemother. 2012, 56(3): 1584; і Tyrell et al., Antimicrob. Agents Chemother. 2012, 56(4):2194. Один із таких поперечно-зшитих антибіотиків глікопептид-цефалоспорин являє собою 26[[[3-[[(Z)-[1-(2-аміно-5-хлор-4-тіазоліл)-2-[[(6R, 7R)-2-карбоксі-8-оксо-3-(піридиніометил)-5-тіа-1азабіцикло[4.2.0]окт-2-ен-7-іл]аміно]-2-оксоетил-іден]аміно]окси]пропіл]аміно]карбоніл]-26декарбоксиванкоміцин, який має хімічну структуру: 20 . 25 30 Ця сполука, також відома як TD-1792, була описана раніше або як трифторацетатна сіль, або як тригідрохлоридна сіль. Див., наприклад, патент США № 6974797 В2 із рядка 60, стовпчик 34, до рядка 20, стовпчик 35. Однак описані сольові форми мають ряд недоліків. По-перше, повідомлялося, що перфторкарбонові кислоти, такі як трифтороцтова кислота, здійснюють несприятливі ефекти на печінку при введенні щурам. Див., наприклад, Just et al., Hepatology, 9(4), 570-581 (1989). Відповідно, сіль трифтороцтової кислоти зазначеної сполуки не може бути фармацевтично прийнятною для введення пацієнтам. Крім того, було виявлено, що тригідрохлоридна сіль цієї сполуки значною мірою розкладається при зберіганні при кімнатній температурі або навіть при температурі зберігання в холодильнику (від приблизно 2 до приблизно 8 °С). Таким чином, тригідрохлоридна сіль не може бути прийнятною для застосування в комерційних препаратах, оскільки фармацевтичні препарати звичайно зберігаються протягом значних періодів часу перед використанням. 1 UA 115086 C2 5 10 15 20 25 30 35 40 Відповідно, існує потреба в нових фармацевтично прийнятних сольових формах цієї сполуки, які мають підвищену стабільність при зберіганні. Також становлять інтерес нові фармацевтичні композиції, які містять такі солі. Особливий інтерес становлять нові фармацевтичні композиції, які додатково підвищують стабільність при зберіганні сполуки. Однак в існуючій науковій літературі часто є протиріччя з точки зору того, які наповнювачі можуть використовуватися для забезпечення підвищеної стабільності при зберіганні фармацевтичних препаратів. Наприклад, в ЕР 0325112 А1 описано, що цефалоспорини стабілізуються шляхом розчинення цефалоспорину із лактозою, сахарозою, глюкозою або галактозою (і необов'язково гліцином), а потім сушінням розчину. На відміну від цього в патенті США № 5254545 зазначено, що фармацевтичні препарати, описані в ЕР 0325112 A1, не є задовільними для стабілізації конкретної сполуки цефалоспорину і, альтернативно, цефалоспорин змішують із (I) лактозою, (II) лимонною кислотою або її натрієвою сіллю і (III) аргініном або його гідрохлоридом, або хлоридом натрію, із отриманням стабільного препарату. Крім того, відносно використання вуглеводів, у Burgess et al., J. Chem. Soc. Perkin Trans. 2, 97 (1994) зазначено, що розпад деяких цефалоспоринів каталізується глюкозою, галактозою, мальтозою, сахарозою, манітом і α-метилглюкозидом у водних розчинах при рН 9-11. Недавно в публікації заявки на патент США № 2010/010278 А1 були розглянуті переваги і недоліки різних наповнювачів, використовуваних для отримання ліофілізованих композицій цефалоспоринів, таких як поліоли і амінокислоти (сторінка 1, параграфи 004-0019), і зроблені висновки, що в науковій літературі є протиріччя і вона не дозволяє визначити, які композиції будуть забезпечувати стабільність для ліофілізованого продукту (стор. 1, параграф 0020). Цей документ описує ліофілізовані композиції для похідних цефалоспорину, які містять принаймні один стабілізатор, вибраний із вуглеводів, багатоатомних спиртів і полівінілпіролідону. Відносно фармацевтичних композицій для глікопептидів, у EP 0438747 А1 описані стабілізовані ліофілізовані композиції глікопептидів, такі як орієнтицини А-D, хлорорієнтицини АЕ, і ванкоміцин, які містять 0,05 частин за масою або більше одного або декількох сахаридів. У JP 414249 В2 описані ліофілізовані препарати ванкоміцину, які містять амінокислоти, вибрані із аргініну, аланіну, аспарагінової кислоти, гістидину і гліцину. Крім того, у JP 2010105965 описані препарати ванкоміцину, які містять розчинні у воді аміди кислоти, такі як нікотинамід. Таким чином, був описаний широкий ряд наповнювачів для використання при надаванні цефалоспоринам і глікопептидам форми лікарського препарату. Однак у науковій літературі найчастіше існують протиріччя з точки зору того, який наповнювач необхідний для використання із конкретним фармацевтичним засобом. У результаті, визначення наповнювача або сполучення наповнювачів, які підвищують стабільність при зберіганні поперечно-зшитого цефалоспорину-глікопептиду, є особливо складним, оскільки такі сполуки містять як фрагменти цефалоспорину, так і глікопептиду в одній і тій же молекулі. СУТЬ ВИНАХОДУ Даний винахід стосується сполуки формули I: 2 UA 115086 C2 , 5 10 15 20 25 30 35 де х знаходиться у діапазоні від приблизно 1 до приблизно 2. Було виявлено, що такі гідрохлориди мають значно підвищену стабільність при зберіганні при кімнатній температурі і при температурі охолодження порівняно із відповідною тригідрохлоридною сіллю. Крім того, було встановлено, що стабільність при зберіганні таких гідрохлоридних солей додатково покращена в композиціях, які містять сахарозу і гліцин. В одному із варіантів здійснення х дорівнює приблизно 1, тобто, сполука формули I являє собою моногідрохлоридну сіль. В іншому варіанті здійснення, х дорівнює приблизно 2, тобто, сполука формули I являє собою дигідрохлоридну сіль. В іншому аспекті даний винахід стосується фармацевтичної композиції, яка містить сполуку формули I. В одному із варіантів здійснення винаходу, фармацевтична композиція містить фармацевтично прийнятного носія і сполуку формули I. У конкретному варіанті здійснення фармацевтична композиція містить сахарозу і гліцин. У ще одному варіанті здійснення фармацевтична композиція містить: (a) сполуку формули I; (b) від приблизно 0,5 до приблизно 2,0 частин за масою сахарози; і (c) від приблизно 0,5 до приблизно 2,0 частин за масою гліцину (у вигляді еквівалента вільної основи); де масові частини сахарози і гліцину основані на масовій частині сполуки формули I (у вигляді еквівалента вільної основи). У конкретному варіанті здійснення фармацевтична композиція являє собою ліофілізовану композицію. В іншому конкретному варіанті здійснення фармацевтична композиція містить приблизно 1,0 частину за масою сахарози; і приблизно 1,5 частини за масою гліцину. У ще одному конкретному варіанті здійснення зміна чистоти сполуки формули I у фармацевтичній композиції становить менше, ніж приблизно 10 %, що визначено за допомогою високоефективної рідинної хроматографії після зберігання протягом 12 місяців при температурі в інтервалі від приблизно 18 °С до приблизно 25 °С. В іншому аспекті даний винахід стосується способу лікування бактеріальної інфекції в пацієнта із використанням сполуки формули I. В одному із варіантів здійснення даного винаходу спосіб включає введення пацієнту сполуки формули I. В іншому варіанті здійснення спосіб включає введення пацієнту фармацевтичної композиції, яка містить фармацевтично прийнятний носій і сполуку формули I. В іншому аспекті даний винахід стосується сполуки формули I для застосування в терапії. В одному із варіантів здійснення застосуванням у терапії є лікування бактеріальної інфекції. 3 UA 115086 C2 5 10 15 20 25 30 35 40 45 50 55 60 В іншому аспекті даний винахід стосується сполуки формули I для застосування при отриманні лікарського засобу. В одному із варіантів здійснення лікарський засіб призначений для лікування бактеріальної інфекції. В іншому аспекті даний винахід стосується способу отримання сполуки формули I. В одному із варіантів здійснення спосіб включає стадії: (a) отримання водної композиції, яка містить 26-[[[3-[[(Z)-[1-(2-аміно-5-хлор-4-тіазоліл)-2[[(6R, 7R)-2-карбоксі-8-оксо-3-(піридиніометил)-5-тіа-1-азабіцикло-[4.2.0]окт-2-ен-7-іл]аміно]-2оксоетиліден]аміно]окси]пропіл]аміно]-карбоніл]-26-декарбоксиванкоміцин і хлористоводневу кислоту в молярному співвідношенні від приблизно 1:1 до приблизно 1:2; (b) ліофілізації водної композиції із отриманням сполуки формули I. В іншому своєму аспекті даний винахід стосується продукту, отриманого способом, описаним у даному документі. В іншому аспекті даний винахід стосується способу зменшення розкладання 26-[[[3-[[(Z)-[1(2-аміно-5-хлор-4-тіазоліл)-2-[[(6R, 7R)-2-карбоксі-8-оксо-3-(піри-диніометил)-5-тіа-1азабіцикло[4.2.0]окт-2-ен-7-іл]аміно]-2-оксоетиліден]аміно]-окси]пропіл]аміно]карбоніл]-26декарбоксиванкоміцину в процесі зберігання. В одному із варіантів здійснення даного винаходу, спосіб включає (а) отримання сполуки формули I і (b) зберігання сполуки формули I при температурі в інтервалі від приблизно -25 °С до приблизно 25 °С. В іншому варіанті здійснення сполуку формули I зберігають при від приблизно 2 °С до 8 °С. У ще одному варіанті здійснення спосіб включає зберігання фармацевтичної композиції, яка містить (a) сполуку формули I; (b) від приблизно 0,5 до приблизно 2,0 частин за масою сахарози; і (c) від приблизно 0,5 до приблизно 2,0 частин за масою гліцину (у вигляді еквівалента вільної основи); де масові частини сахарози і гліцину на масову частину сполуки формули I (у вигляді еквівалента вільної основи) при температурі в межах від приблизно -25 °С до приблизно 25 °С. В іншому варіанті здійснення фармацевтичну композицію зберігають при температурі від приблизно 2 °С до приблизно 8 °С. Інші аспекти і варіанти здійснення даного винаходу, описані в даному документі. КОРОТКИЙ ОПИС КРЕСЛЕНЬ Різні аспекти даного винаходу ілюструються із посиланням на прикладені креслення. На фіг. 1 показана зміна чистоти (у відсотках) залежно від часу (місяці) для моно-, ди- і тригідрохлоридних солей 26-[[[3-[[(Z)-[1-(2-аміно-5-хлор-4-тіазоліл)-2-[[(6R, 7R)-2-карбоксі-8оксо-3-(піридиніометил)-5-тіа-1-азабіцикло[4.2.0]окт-2-ен-7-іл]аміно]-2оксоетиліден]аміно]окси]пропіл]аміно]карбоніл]-26-декарбоксиванкоміцину, який зберігається при температурі охолодження. На фіг. 2 показана зміна чистоти (у відсотках) залежно від часу (місяці) для моно-, ди- і тригідрохлоридних солей 26-[[[3-[[(Z)-[1-(2-аміно-5-хлор-4-тіазоліл)-2-[[(6R, 7R)-2-карбоксі-8оксо-3-(піридиніометил)-5-тіа-1-азабіцикло[4.2.0]окт-2-ен-7-іл]аміно]-2оксоетиліден]аміно]окси]пропіл]аміно]карбоніл]-26-декарбоксиванкоміцину, який зберігається при кімнатній температурі. На фіг. 3 показана зміна чистоти (у відсотках) залежно від часу (місяці) для композицій, які містять (a) моно-, ди- або тригідрохлоридні солі 26-[[[3-[[(Z)-[1-(2-аміно-5-хлор-4-тіазоліл)-2-[[(6R, 7R)-2-карбоксі-8-оксо-3-(піридиніометил)-5-тіа-1-азабіцикло[4.2.0]окт-2-ен-7-іл]аміно]-2оксоетиліден]аміно]окси]пропіл]аміно]-карбоніл]-26-декарбоксиванкоміцину; (b) сахарозу; і (c) гліцин; де композицію зберігали при кімнатній температурі. На фіг. 4 показана зміна чистоти (у відсотках) залежно від часу (місяці) для моногідрохлоридної солі 26-[[[3-[[(Z)-[1-(2-аміно-5-хлор-4-тіазоліл)-2-[[(6R, 7R)-2-карбоксі-8-оксо3-(піридиніометил)-5-тіа-1-азабіцикло[4.2.0]окт-2-ен-7-іл]аміно]-2оксоетиліден]аміно]окси]пропіл]аміно]карбоніл]-26-декарбоксиванкоміцину і композиції, яка містить (a) моногідрохлоридну сіль; (b) сахарозу; і (c) гліцин; де моногідрохлоридну сіль і композицію зберігали при кімнатній температурі. На фіг. 5 показана зміна чистоти (у відсотках) залежно від часу (місяці) для дигідрохлоридної солі 26-[[[3-[[(Z)-[1-(2-аміно-5-хлор-4-тіазоліл)-2-[[(6R, 7R)-2-карбоксі-8-оксо-3(піридиніометил)-5-тіа-1-азабіцикло[4.2.0]окт-2-ен-7-іл]аміно]-2оксоетиліден]аміно]окси]пропіл]аміно]карбоніл]-26-декарбоксиванкоміцину і композиції, яка містить (a) дигідрохлоридну сіль; (b) сахарозу; і (c) гліцин; де дигідрохлоридну сіль і композицію зберігали при кімнатній температурі. ДОКЛАДНИЙ ОПИС ВИНАХОДУ Даний винахід стосується сполук формули I. Такі сполуки являють собою кислотно-адитивні солі хлористоводневої кислоти і 26-[[[3-[[(Z)-[1-(2-аміно-5-хлор-4-тіазоліл)-2-[[(6R, 7R)-2-карбоксі8-оксо-3-(піридиніометил)-5-тіа-1-азабі-цикло[4.2.0]окт-2-ен-7-іл]аміно]-2оксоетиліден]аміно]окси]пропіл]аміно]карбо-ніл]-26-декарбоксиванкоміцин. У сполуках формули 4 UA 115086 C2 5 10 15 20 25 30 35 40 45 50 55 I будь-який атом, здатний бути протонованим хлористоводневою кислотою (наприклад, аміногрупа або група карбонової кислоти), може бути в такий спосіб протонований із утворенням солі, і всі такі форми включені в об'єм даного винаходу, якщо не зазначене інше. Визначення При описі даного винаходу наступні терміни мають наступні значення, якщо не зазначене інше. Термін "фармацевтично прийнятна сіль" означає сіль, яка є прийнятною для введення пацієнту або ссавцю, такому як людина (наприклад, солі, які мають прийнятну безпеку для ссавців для даного режиму дозування). Приклади фармацевтично прийнятних солей включають солі оцтової, аскорбінової, бензолсульфонової, бензойної, камфорсульфонової, лимонної, етансульфонової, едизилової, фумарової, гентизинової, глюконової, глюкуронової, глутамінової, гіпурової, бромистоводневої, хлористоводневої, ізетіонової, молочної, лактобіонової, малеїнової, яблучної, мигдальної, метансульфонової, муцинової, нафталінсульфонової, нафталін-1,5-дисульфонової, нафталін-2,6-дисульфонової, нікотинової, азотної, оротової, памової, пантотенової, фосфорної, бурштинової, сірчаної, винної, п-толуолсульфонової і ксинафоєвої кислоти тощо. Термін "температура охолодження" означає температуру від приблизно 2 °С до приблизно 8 °С. Термін "кімнатна температура" означає температуру навколишнього середовища в хімічній лабораторії, звичайно, від приблизно 18 °С до приблизно 25 °С. Термін "терапевтично ефективна кількість" означає кількість, достатню для ефективного лікування при введенні пацієнту, який потребує такого лікування. Термін "лікувати" або "лікування" означає: (а) запобігання захворюванню або медичному стану, тобто профілактичне лікування пацієнта або суб'єкта; (b) зменшення інтенсивності захворювання або медичного стану, тобто, усунення або регрес захворювання або медичного стану в пацієнта; (с) пригнічення захворювання або медичного стану, тобто уповільнення або зупинка розвитку захворювання або медичного стану в пацієнта; або (d) полегшення симптомів захворювання або медичного стану в пацієнта. Загальні способи синтезу Сполуки формули I звичайно отримують спочатку шляхом забезпечення або отримання водної композиції, яка містить 26-[[[3-[[(Z)-[1-(2-аміно-5-хлор-4-тіазоліл)-2-[[(6R, 7R)-2-карбоксі-8оксо-3-(піридиніометил)-5-тіа-1-азабіцикло-[4.2.0]окт-2-ен-7-іл]аміно]-2оксоетиліден]аміно]окси]пропіл]аміно]карбоніл]-26-декарбоксиванкоміцин і від приблизно 1 до приблизно 2 молярних еквівалентів соляної кислоти. Потім водну композицію ліофілізують із отриманням сполуки формули I. Звичайно, водну композицію отримують шляхом додавання відповідної кількості розведеного водного розчину соляної кислоти (такого як 1н водний розчин соляної кислоти) до водної композиції 26-[[[3-[[(Z)-[1-(2-аміно-5-хлор-4-тіазоліл)-2-[[(6R, 7R)-2-карбоксі-8-оксо-3(піридиніометил)-5-тіа-1-азабіцикло-[4.2.0]окт-2-ен-7-іл]аміно]-2оксоетиліден]аміно]окси]пропіл]аміно]карбоніл]-26-декарбоксиванкоміцину. Для визначення кількості сполуки, яка присутня у водному розчині, звичайно, водну композицію, яка містить сполуку, аналізують, наприклад, методом ВЕРХ. Після того, як кількість сполуки визначена, додають відповідну кількість соляної кислоти для того, щоб отримана водна композиція містила від приблизно 1 до приблизно 2 молярних еквівалентів соляної кислоти на молярний еквівалент сполуки. Звичайно, соляну кислоту додають при температурі в межах від приблизно -10 °С до приблизно 25 °С. У деяких випадках, водний розчин може вже містити деяку кількість соляної кислоти (наприклад, менше 1 молярного еквівалента) і у таких випадках, кількість соляної кислоти, яка вже присутня у водному розчині, враховується при додаванні додаткової кількості соляної кислоти. Альтернативно, якщо водний розчин, який містить 26-[[[3-[[(Z)-[1-(2-аміно-5-хлор-4тіазоліл)-2-[[(6R, 7R)-2-карбоксі-8-оксо-3-(піридиніометил)-5-тіа-1-азабіцикло[4.2.0]окт-2-ен-7іл]аміно]-2-оксоетиліден]-аміно]окси]пропіл]аміно]карбоніл]-26-декарбоксиванкоміцин, який містить більше приблизно 2 еквівалентів соляної кислоти, тоді водний розчин може бути нейтралізованою основою, такою як бікарбонат лужного металу, карбонат лужного металу тощо, для встановлення молярного співвідношення хлористоводневої кислоти до сполуки у діапазоні від приблизно 1 до приблизно 2. Як приклад, бікарбонат натрію може бути використаний як основа. Основу звичайно додають у вигляді розведеного водного розчину, 5 UA 115086 C2 5 10 15 20 25 30 наприклад, такого як 5 % водний розчин бікарбонату натрію. Основу звичайну додають до водного розчину при температурі в межах від приблизно -10 °С до приблизно 25 °С. При описі таких водних композицій варто врахувати, що соляна кислота протонує сполуку для того, щоб водна композиція містила кислотно-адитивну сіль соляної кислоти і сполуку. Таким чином, потрібно розуміти, що будь-яке посилання на молярне співвідношення сполуки до соляної кислоти стосується молярного співвідношення компонентів у формі кислотно-адитивних солей. Після утворення водної композиції, яка містить сполуку і соляну кислоту в кількості від приблизно 1 до приблизно 2 молярних еквівалентів, водну композицію, звичайно, ліофілізують із отриманням сполуки формули Iу вигляді ліофілізованого порошку. Ліофілізацію звичайно проводять при температурі в межах від приблизно -60 °С до приблизно -20 °С при зниженому тиску в діапазоні від приблизно 20 торр (мм ртутного стовпчика) до приблизно 100 торр, наприклад, від приблизно 40 торр до 60 торр. Ліофілізацію звичайно виконують протягом від приблизно 48 годин до приблизно 200 годин або до видалення, значною мірою, летких компонентів. Ліофілізація забезпечує сполуку Формули I у вигляді ліофілізованого порошку. Альтернативно, сполука формули I може бути осаджена і виділена фільтруванням або центрифугуванням. Наприклад, для осадження сполуки формули I із водної композиції можна використовувати надлишкову кількість органічного розріджувача. Придатні органічні розчинники включають, як ілюстрацію, ацетонітрил, метанол, етанол, ацетон тощо. За необхідності осад може необов'язково бути промитий придатним органічним розчинником. Наприклад, у випадку, коли для осадження сполуки формули I використовують ацетон, отриманий осад необов'язково промивають ацетоном і потім сушать. Звичайно, процедуру виділення проводять при температурі від приблизно 0 °С до приблизно 30 °С, звичайно в діапазоні від приблизно 5 °С до приблизно 20 °С, і всі стадії фільтрації, промивання і сушіння виконують в інертній атмосфері, такій як азот, аргон тощо. Способи отримання 26-[[[3-[[(Z)-[1-(2-аміно-5-хлор-4-тіазоліл)-2-[[(6R, 7R)-2-карбоксі-8-оксо3-(піридиніометил)-5-тіа-1-азабіцикло[4.2.0]окт-2-ен-7-іл]аміно]-2оксоетиліден]аміно]окси]пропіл]аміно]карбоніл]-26-декарбоксиванкоміцину відомі в даній галузі. Наприклад, отримання цієї сполуки описано в патенті США № 6974797 В2 і Long et al., J. Antibiot. 61(10): 603-614 (2008). Як ілюстрація, ванкоміцин або його солі можуть бути піддані взаємодії із сполукою A , яка має формулу: , 35 40 45 або її сіллю, у присутності пептидного конденсуючого реагенту із отриманням 26-[[[3-[[(Z)-[1(2-аміно-5-хлор-4-тіазоліл)-2-[[(6R, 7R)-2-карбоксі-8-оксо-3-(піридиніометил)-5-тіа-1азабіцикло[4.2.0]окт-2-ен-7-іл]аміно]-2-оксоетил-іден]аміно]окси]пропіл]аміно]карбоніл]-26декарбоксиванкоміцину або його солі. Звичайно, цю реакцію виконують шляхом приведення в контакт ванкоміцину або його солі із конденсуючим пептид реагентом у кількості від приблизно 1 до приблизно 1,1 молярних еквівалентів у розчиннику, такому як ДМФ, ДМСО або їх суміш. Цю взаємодію звичайно виконують при температурі в межах від приблизно -10С до приблизно 10С протягом від приблизно 10 хвилин до приблизно 60 хвилин або доти, доки взаємодія, по суті, не завершиться. Потім розчин сполуки A або її солі в кількості від приблизно 0,9 до приблизно 1,1 молярних еквівалентів у розчиннику, такому як ДМФ, ДМСО або їх суміш, додають до активованого похідного ванкоміцину. Після додавання сполуки A додають амін, такий як діізопропілетиламін, у кількості, яка становить від приблизно 2 до приблизно 10 мольних еквівалентів (наприклад, приблизно 5 мольних еквівалентів). Амін звичайно додають із 6 UA 115086 C2 5 10 15 20 25 30 35 40 45 50 55 60 швидкістю, яка дозволяє підтримувати температуру реакції у діапазоні від приблизно -10 °С до приблизно 5 °С. Потім реакційну суміш звичайно витримують при температурі у діапазоні від приблизно -10 °С до приблизно 5 °С протягом від приблизно 0,5 до приблизно 3 год., або доти, доки взаємодія, по суті, не завершиться. У цій реакції можуть використовуватися різні конденсуючі пептиди реагенти. Типові приклади включають гексафторфосфат бензотриазол-1-ілокситрипіролідинофосфонію (РуВОР) з або без 1-гідроксі-7-азабензотриазолу (HOAt); тетрафторборат 0-(6-хлор-1гідроксибензотриазол-1-іл)-1,1,3,3-тетраметилуронію (TCTU); гексафторфосфат 0-(6хлорбензотриазол-1-іл)-N, N,N',N'-тетраметилуронію (HCTU); тетрафторборат 0-(бензотриазол1-іл)-N, N,N',N'-тетраметилуронію (TBTU); хлорид 4-(4,6-диметокси-1,3,5-триазин-2-іл)-4метилморфоліну (DMTMM); 1-етил-3-(3-диметиламінопропіл)карбодіімід (EDCI) із HOAt; діетилціанофосфонат (DECP) тощо. В одному із варіантів здійснення пептидний конденсуючий реагент являє собою хлорид 4-(4,6-диметокси-1,3,5-триазин-2-іл)-4-метилморфоліну. Після завершення реакції конденсації продукт реакції виділяють і очищають із використанням звичайних способів, таких як осадження і фільтрування, колонкова хроматографія, ВЕРХ тощо. Сполука A є відомою у даній галузі техніки. Наприклад, сполука A може бути отримана способом, описаним у патенті США № 6974797 В2 (приклад A, із рядка 51, стовпчик 27, до рядка 56, стовпчик 30,) або в Long et al., J. Antibiot. 61(10): 603-614 (2008) (CoxSynthon 18 на сторінках 61 1-612). Способи отримання сполуки A також описані в прикладах. Ванкоміцин також відомий у даній галузі техніки. Наприклад, ванкоміцину гідрохлорид є комерційно доступним від фірми Sigma-Aldrich (St. Louis, MO 63103) і від фірми Haorui PharmaChem Inc. (Irvine, CA 92618). Після отримання 26-[[[3-[[(Z)-[1-(2-аміно-5-хлор-4-тіазоліл)-2-[[(6R, 7R)-2-карбоксі-8-оксо-3(піридиніометил)-5-тіа-1-азабіцикло[4.2.0]окт-2-ен-7-іл]аміно]-2оксоетиліден]аміно]окси]пропіл]аміно]карбоніл]-26-декарбоксиванкоміцин, який використовується у даному винаході, може бути очищений із використанням обернено-фазової ВЕРХ або іншими хроматографічними методами. Наприклад, сполука може бути очищена із використанням полімеру полі(стиролдивінілбензол) (ПС-ДВБ). Звичайно полімер ПС-ДВБ, який використовується для очищення сполуки, являє собою макропористу смолу із твердою структурою, яка має розмір пор у діапазоні від приблизно 100 ангстрем до приблизно 1000 ангстрем і розмір частинок у межах від приблизно 10 мкм до приблизно 50 мкм. Типовою смолою, придатною для використання, є PLRP-S (Agilent Technologies, Santa Clara CA 95051), яка має розмір пор приблизно 100 ангстрем і розмір частинок приблизно 50 мкм. Звичайно елюент для очищення містить водний розчин кислоти, який містить різні кількості полярного органічного розчинника. Типові полярні органічні розчинники включають ацетонітрил, етанол, ізопропанол, метанол тощо. Придатні кислоти включають оцтову кислоту, трифтороцтову кислоту, соляну кислоту тощо. Елюент може також містити буфер, такий як ацетатний буфер або фосфатний буфер. В одному із варіантів здійснення елюент містить водний ацетатний буфер (100 мм), який містить ацетонітрил у кількостях від приблизно 2 % об'єм/об'єм до приблизно 13 % об'єм/об'єм. Залежно від використовуваного способу очищення сольовий обмін може бути виконаний після очищення із отриманням гідрохлоридної солі сполуки. Наприклад, якщо кислота, яка використовується в способі очищення, є кислотою, іншою, ніж соляна кислота (тобто, оцтова кислота або трифтороцтова кислота), тоді сольовий обмін, як правило, виконується із утворенням солі соляної кислоти. Звичайно для очищення сольовий обмін виконується із використанням полімеру ПС-ДВБ, як описано в даному документі. Сіль сполуки звичайно поміщають на полімер ПС-ДВБ, а потім смолу елююють водним розчином соляної кислоти, яка містить різні кількості полярного органічного розчинника. Типові полярні органічні розчинники включають ацетонітрил, етанол, ізопропанол, метанол тощо. Звичайно кількість використовуваного полярного органічного розчинника знаходиться в діапазоні від приблизно 10 % об'єм/об'єм до приблизно 80 % об'єм/об'єм; включаючи від приблизно 10 % об'єм/об'єм до приблизно 50 % об'єм/об'єм; наприклад, від приблизно 10 % об'єм/об'єм до приблизно 20 % об'єм/об'єм. В одному із варіантів здійснення елюент, який використовується для сольового обміну, містить приблизно 10 мМ водного розчину соляної кислоти, який містить приблизно 20 % об'єм/об'єм ацетонітрилу. Фармацевтичні композиції Сполуки формули I звичайно вводять пацієнту у вигляді фармацевтичної композиції. Такі фармацевтичні композиції можуть містити будь-який прийнятний носій або наповнювач. Вибір 7 UA 115086 C2 5 10 15 20 25 30 35 40 45 50 55 60 конкретного носія, або сполучення носіїв, буде залежати від багатьох факторів, таких як спосіб введення, сумісність компонентів, стабільність композиції тощо. Звичайні способи отримання фармацевтичних композицій відомі в даній галузі техніки і описані, наприклад, у REMINGTON: THE SCIENCE AND PRACTICE OF PHARMACY (REMINGTON: THE SCIENCE & PRACTICE OF PHARMACY), Pharmaceutical Press, Philadelphia, st PA; 21 Ed. (жовтень 7, 2011). Крім того, звичайні інгредієнти, необхідні для таких композицій, є комерційно доступними від, наприклад, фірми Sigma-Aldrich, St. Louis, MO 63178 і інших комерційних постачальників. Фармацевтичну композицію, звичайно, отримують шляхом ретельного і рівномірного перемішування або змішування сполуки формули I із фармацевтично прийнятним носієм і будьякими додатковими інгредієнтами. В одному із варіантів здійснення фармацевтична композиція підходить для парентерального введення, зокрема для внутрішньовенного введення. Такі фармацевтичні композиції звичайно містять стерильний фізіологічно прийнятний водний розчин носія, який містить сполуку формули I. В одному із варіантів здійснення композиція не містить пірогени. Необов'язково, розчин носія може містити інші компоненти, такі як цукри, амінокислоти, електроліти тощо. Типові фізіологічно прийнятні водні носії включають, як приклад, стерильну воду для ін'єкцій, (USP, фармакопея США); розчин декстрози для ін'єкцій, USP (наприклад, 2,5, 5,0, 10, 20 %-ний розчин декстрози, включаючи 5 % розчин декстрози для ін'єкцій (D5/W)); розчин декстрози і хлориду натрію для ін'єкцій, USP (наприклад, декстроза в межах від 2,5 до 10 %, а хлорид натрію в межах від 0,12 (19 мг-екв. натрію) до 0,9 % (154 мг-екв. натрію)); розчин маніту для ін'єкцій, USP, (наприклад, 5, 10, 15, 20 і 25 % маніту); розчин Рінгера для ін'єкцій, USP (наприклад, 147 мг-екв. натрію, 4 мг-екв. калію, 4,5 мг-екв. кальцію і 156 мг-екв. хлориду на літр); розчин Рінгера із лактатом для ін'єкцій, USP (наприклад, 2,7 мг-екв. кальцію, калію 4 мг-екв, 130 мг-екв. натрію і 28 мг-екв. лактату на літр); розчин хлориду натрію для ін'єкцій, USP (наприклад, 0,9 % хлориду натрію) тощо. При введенні пацієнту сполуку формули I будуть, звичайно, розводити у від приблизно 0,5 мл до приблизно 10 мл водного носія на мг сполуки формули I, наприклад, від приблизно 0,6 до приблизно 8 мл на мг. Альтернативно, фармацевтична композиція може бути у твердій формі, яка придатна для відновлення і наступного парентерального введення. Такі композиції звичайно знаходяться у вигляді стерильної ліофілізованої композиції, яку перед використанням відновлюють за допомогою стерильного фізіологічно прийнятного водного носія. У цьому варіанті здійснення фармацевтична композиція звичайно містить сполуку формули I і фармацевтично прийнятний носій. Типові носії для використання в таких фармацевтичних композиціях включають, як приклад, сахарозу, маніт, декстрозу, декстран, лактозу, гліцин або їх сполучення. В одному з варіантів здійснення фармацевтична композиція містить (а) сполуку формули I, (b) сахарозу і (c) гліцин або його фармацевтично прийнятну сіль. Такі композиції звичайно містять від приблизно 0,5 до приблизно 2,0 частин за масою, включаючи приблизно 1,0 частину за масою, сахарози на частину за масою сполуки формули I (у вигляді еквівалента вільної основи); і від приблизно 0,5 до приблизно 2,0 частин за масою, включаючи приблизно 1,5 частин за масою, гліцину (у вигляді еквівалента вільної основи) на частину за масою сполуки формули I (у вигляді еквівалента вільної основи). В одному із варіантів здійснення фармацевтична композиція містить приблизно 1,0 частину за масою сахарози і приблизно 1,5 частин за масою гліцину (у вигляді еквівалента вільної основи) на частину за масою сполуки формули I (у вигляді еквівалента вільної основи). Наприклад, такі фармацевтичні композиції можуть містити від приблизно 0,5 мг до приблизно 2,0 мг сахарози і приблизно 1,0 мг до приблизно 2,0 мг гліцину (у вигляді еквівалента вільної основи) на міліграм сполуки формули I (у вигляді еквівалента вільної основи), наприклад, приблизно 1,0 мг сахарози і приблизно 1,5 мг гліцину (у вигляді еквівалента вільної основи) на міліграм сполуки формули I (у вигляді еквівалента вільної основи). В іншому варіанті здійснення фармацевтична композиція містить (а) від приблизно 10 мас. % до приблизно 60 мас. % сполуки формули I (еквівалент у чистій основі); (b) від приблизно 10 мас. % до приблизно 60 мас. % сахарози; і (с) від приблизно 10 мас. % до приблизно 80 мас. % гліцину (еквівалент у чистій основі). Наприклад, цей варіант здійснення включає фармацевтичну композицію, яка містить (а) від приблизно 20 мас. % до 50 мас. % сполуки формули I (еквівалент у чистій основі); (b) від приблизно 20 мас. % до 50 мас. % сахарози; і (с) від приблизно 20 мас. % до приблизно 70 мас. % гліцину (еквівалент у чистій основі); таку як фармацевтична композиція, яка містить (а) від приблизно 25 мас. % до 35 мас. % сполуки формули I (еквівалент у чистій основі); (b) від приблизно 25 мас. % до 35 мас. % 8 UA 115086 C2 5 10 15 20 сахарози; і (с) від приблизно 30 мас. % до приблизно 50 мас. % гліцину (еквівалент у чистій основі); від загальної маси композиції. В одному із варіантів здійснення фармацевтична композиція являє собою ліофілізований порошок. Звичайно, ліофілізований порошок є стерильним і упаковується в герметично закриту посудину або ампулу або аналогічний контейнер. Стабільність при зберіганні Було виявлено, що сполуки формули I мають значно покращену стабільність при зберіганні порівняно із відповідною тригідрохлоридною сіллю. Крім того, було встановлено, що стабільність при зберіганні сполук формули I додатково покращена в композиціях, які містять сахарозу і гліцин. Тригідрохлоридна сіль 26-[[[3-[[(Z)-[1-(2-аміно-5-хлор-4-тіазоліл)-2-[[(6R, 7R)-2-карбоксі-8оксо-3-(піридиніометил)-5-тіа-1-азабіцикло[4.2.0]окт-2-ен-7-іл]аміно]-2оксоетиліден]аміно]окси]пропіл]аміно]карбоніл]-26-декарбоксиванкоміцину відома у даній галузі техніки. Наприклад, тригідрохлоридна сіль описана в патенті США № 6974797 В2, стовпчик 35, рядка 16-20. Проте, було виявлено, що чистота тригідрохлоридної солі суттєво знижується при зберіганні. Наприклад, було виявлено, що при зберіганні при кімнатній температурі протягом 12 місяців, чистота тригідрохлоридної солі знижується більше, ніж на 30 % (як показано на фіг. 2). Такий розпад становить інтерес тому, що продукти розпаду можуть відрізнятися по своїй біологічній активності або терапевтичному ефекту порівняно із вихідною молекулою. Див., наприклад, J. Diana et al., Journal of Chromatography A, 996: 115-131 (2003), у якій розглядаються домішки ванкоміцину. Один із продуктів розпаду тригідрохлоридної солі, як вважають, являє собою сполуку формули II: 25 30 або її сіль. Цю сполуку також називають деградантом B. Сполука формули II є ізомером із подвійним зв'язком, у якому подвійний зв'язок у A-кільці фрагмента цефалоспорину 3 2 2 ізомеризований із положення Δ у положення Δ . Δ ізомери цефалоспоринових кислот, як повідомляється, є неактивними. Див., наприклад, Crocker et al., J. Chem. Soc. (C), 1 142 (1966); і Saab et al., J. Pharm. Sci., 77(10), 906 (1988). 2 Таким чином, важливо звести до мінімуму утворення Δ ізомеру під час зберігання сполуки. Інший деградант, як вважають, є продуктом гідролізу, який має формулу III: 35 9 UA 115086 C2 5 10 15 20 25 30 35 або його сіль. Сполука формули III також називається деградантом А. В наш час виявлено, що сполуки формули I є стабільнішими порівняно із тригідрохлоридною сіллю при зберіганні при кімнатній температурі або температурі охолодження протягом 12 місяців. Див., наприклад, фіг. 1 і 2. Крім того, сполуки формули I є стабільнішими при кімнатній температурі, коли їх поєднують у форму лікарського препарату із сахарозою і гліцином. Див., наприклад, фіг. 3, 4 і 5. В одному із варіантів здійснення зміна (або зменшення) чистоти сполуки формули I у фармацевтичній композиції становить менше приблизно 10 %, що виміряно за допомогою високоефективної рідинної хроматографії ("ВЕРХ") після зберігання протягом 12 місяців при температурі в межах від приблизно 18 °С до приблизно 25 °С (кімнатна температура). В іншому варіанті здійснення, ділянка під кривою (AUC) для сполуки формули I зменшується менше, ніж приблизно на 10 %, що визначено за допомогою високоефективної рідинної хроматографії ("ВЕРХ") після зберігання фармацевтичної композиції протягом 12 місяців при температурі в межах від приблизно 18 °С до приблизно 25 °С (кімнатна температура). У конкретному варіанті здійснення, даний винахід стосується фармацевтичної композиції, яка містить: (a) сполуку формули I; (b) приблизно 1,0 частину за масою сахарози; і (c) приблизно 1,5 частини за масою гліцину (у вигляді еквівалента вільної основи); у якій масові частини сахарози і гліцину обчислюються по масовій частині сполуки формули I (у вигляді еквівалента вільної основи); і де зміна чистоти сполуки формули I у фармацевтичній композиції становить менше ніж приблизно 10 %, що визначено високоефективною рідинною хроматографією після зберігання протягом 12 місяців при температурі в межах від приблизно 18C до приблизно 25С. Корисність винаходу 26-[[[3-[[(Z)-[1-(2-аміно-5-хлор-4-тіазоліл)-2-[[(6R, 7R)-2-карбоксі-8-оксо-3-(піридиніометил)-5тіа-1-азабіцикло[4.2.0]окт-2-ен-7-іл]аміно]-2-оксоетиліден]-аміно]окси]пропіл]аміно]карбоніл]-26декарбоксиванкоміцин і його солі використовуються як антибіотики або бактерицидні засоби проти грампозитивних бактерій, включаючи резистентні до багатьох лікарських препаратів організми, такі як стійкий до метициліну золотистий стафілокок (MRSA) і S. aureus (VISA), у якого є проміжна чутливість до ванкоміцину. Див., наприклад, Leuthner et al., Antimicrob. Agents Chemother. 2010, 54(9):3799; Hegde et al., Antimicrob. Agents Chemother. 2012, 56(3): 1578; Blais et al., Antimicrob. Agents Chemother. 2012, 56(3): 1584; і Tyrell et al., Antimicrob. Agents Chemother. 2012, 56(4):2194. Мінімальна інгібуюча концентрація (MIC) сполук формули I проти різних бактерій і бактеріальних штамів може бути визначена із використанням стандартних способів, наприклад, 10 UA 115086 C2 5 10 15 20 25 30 35 40 45 50 55 тих, які опубліковані Clinical and Laboratories Standards Institute (CLSI) (Wayne, PA 19087). Див., наприклад, CLSI. Methods for Dilution Antimicrobial Susceptibility Tests for Bacteria That Grow Aerobically; Approved Standard-Ninth Edition. CLSI Document M07-A9. Wanye, PA: Clinical and Laboratories Standards Institute; 2012. Сполуки формули I, звичайно, вводять у терапевтично ефективній кількості будь-яким прийнятним способом введення. Звичайно, сполуки вводять парентерально, наприклад, внутрішньовенно. Сполуки можуть бути введені у вигляді одноразової денної дози або у вигляді багаторазових доз у день. Схема лікування може потребувати введення протягом тривалих періодів часу, наприклад, протягом декількох днів або протягом від одного до шести тижнів або більше. Кількість сполуки, яка вводиться у дозі, або сумарна кількість, яка вводиться, буде, як правило, визначатися лікуючим лікарем пацієнта і буде залежати від таких факторів, як природа і тяжкість інфекції, вік і загальний стан здоров'я пацієнта, толерантність хворого до сполуки, мікроорганізм(и), який(і) викликає(ють) інфекцію, спосіб введення тощо. Типові дози знаходяться у діапазоні від приблизно 0,25 до приблизно 2,5 мг/кг/день сполуки формули I (еквівалент у чистій основі), включаючи від приблизно 1 до приблизно 2 мг/кг/день. В одному із варіантів здійснення сполуку формули I вводять у дозі приблизно 2 мг/кг/день (еквівалент у чистій основі). Типова схема лікування складається із введення сполуки формули I один раз у день у дозі приблизно 2 мг/кг/день (еквівалент у чистій основі) протягом від приблизно 7 до приблизно 14 днів. При введенні у фізіологічно прийнятному водному носії сполуку формули I, звичайно, вводять пацієнту внутрішньовенно протягом від приблизно 0,5 год. до приблизно 2 год., наприклад, протягом приблизно 1 год. Типові інфекції або медичні стани, пов'язані із бактеріями, які можна лікувати або попереджати за допомогою сполуки формули I, включають, як приклад, інфекції, викликані грампозитивними бактеріями, включаючи інфекції шкіри і підшкірної клітковини, пневмонію, ендокардит, менінгіт, сепсис, інфекції сечовивідних шляхів, інфекції кровотоку, остеомієліт тощо. При лікуванні таких станів, пацієнт уже може бути інфікований мікроорганізмом, який підлягає лікуванню, або може бути сприйнятливий до інфекції і у цьому випадку антибіотик вводять профілактично. ПРИКЛАДИ Наступні приклади наведені для ілюстрації різних типових варіантів здійснення і аспектів даного винаходу, і не призначені для обмеження об'єму даного винаходу яким-небудь чином, якщо не зазначено особливо. Ванкоміцину гідрохлорид був придбаний у фірми Haorui Pharma-Chem Inc., Irvine, California, USA. Хлорид 4-(4,6-диметокси-1,3,5-триазин-2-іл)-4-метилморфоліну (DMTMM) був придбаний у фірми Ubichem Pic, Hampshire, UK. 1-[[(6R, 7R)-7-аміно-2-карбоксі-8-оксо-5-тіа-1азабіцикло[4.2.0]окт-2-ен-3-іл]метил]-піридинію хлорид моногідрохлорид (7-PYCA) був придбаний у фірми Zhejiang Hengdian Apeloa Imp. & Exp. Co., Ltd., Zhejiang, China, і Aurisco Pharmaceuticals Limited, Shanghai, China; або він може бути отриманий способом, наприклад, описаним у патенті США 4258041, або іншими опублікованими способами. Всі інші реагенти, вихідні речовини і розчинники, використовувані в наступних прикладах, були отримані від комерційних постачальників (таких як Sigma-Aldrich Chemical Company, St. Louis, MO) і були використані без додаткового очищення, якщо не зазначено інше. Використовуються наступні абревіатури: ДМФ = N, N-диметилформамід; ДМСО = диметилсульфоксид; год. = години; хв. = хвилини. Приклад 1 Метод ВЕРХ визначення чистоти зразків 26-[[[3-[[(Z)-[1-(2-аміно-5-хлор-4-тіазоліл)-2-[[(6R, 7R)-2-карбоксі-8-оксо-3-(піридиніометил)-5-тіа-1-азабіцикло-[4.2.0]окт-2-ен-7-іл]аміно]-2оксоетиліден]аміно]окси]пропіл]аміно]карбоніл]-26-декарбоксиванкоміцину Досліджувані зразки досліджували на вміст 26-[[[3-[[(Z)-[1-(2-аміно-5-хлор-4-тіазоліл)-2-[[(6R, 7R)-2-карбоксі-8-оксо-3-(піридиніометил)-5-тіа-1-азабіцикло-[4.2.0]окт-2-ен-7-іл]аміно]-2оксоетиліден]аміно]окси]пропіл]аміно]карбоніл]-26-декарбоксиванкоміцину і його продуктів розпаду, використовуючи систему ВЕРХ із детектором із фотодіодною матрицею (ВЕРХ система Agilent 1100 або 1200; Agilent Technologies Inc., Santa Clara, CA 95051), контрольовану програмним забезпеченням обробки хроматографічних даних (Empower Software, Waters Corporation, Milford, MA 01757). Усі розчинники мали відповідну чистоту для ВЕРХ і придбані у фірми Honeywell Burdick & Jackson (Muskegon, MI 49442). Фосфорна кислота (85 % мас./мас.) і дигідрофосфат натрію мали відповідну чистоту для ВЕРХ і придбані в Fluka (Sigma-Aldrich, St. Louis, МО 63103). Усі реагенти були використані без додаткового очищення. 11 UA 115086 C2 Перед аналізом аналітичні зразки фільтрували через фільтр із полівініліденфториду (ПВДФ) із діаметром пор 0,2 мкм, і перший 1 мл виключали. Умови аналізу ВЕРХ представлені в таблиці А. Таблиця A Умови аналізу ВЕРХ Колонка Температура автодозатора Температура колонки Довжина хвилі Рухома фаза A Рухома фаза В Розчинник зразка Пробовідбірний конус Об'єм введеної проби Швидкість потоку Градієнт Колонка Halo С18 від фірми Advanced Materials Technology. 2,7 мкм, 4,6150 мм 5,0C 30,0C 214 нм 2:98 ацетонітрил:вода w/65 мM фосфатний буфер pH=2,0 60:40 ацетонітрил:вода w/65 мM фосфатний буфер pH=2,0 2:98 ацетонітрил:вода w/65 мM фосфатний буфер pH=3,2 0,25 мг/мл 7 мкл 1,00 мл/хв. Час (хв.) Рухома фаза A Рухома фаза В 0 92,0 % об'єм/об'єм 8,0 % об'єм/об'єм 93,0 70,0 30,0 98,0 45,0 55,0 98,1 5,0 95,0 100,1 5,0 95,0 100,2 92,0 8,0 105,0 92 0 8,0 5 Час утримування для конкретних компонентів зразка наведений в таблиці В. Таблиця B Час утримування ВЕРХ Сполука Деградант A Деградант B 26-[[[3-[[(Z)-[1-(2-аміно-5-хлор-4-тіазоліл)-2-[[(6R, 7R)-2карбоксі-8-оксо-3-(піридиніометил)-5-тіа-1-азабіцикло[4.2.0]окт-2-ен-7-іл]аміно]-2-оксоетиліден]аміно]окси]пропіл]аміно]карбоніл]-26-декарбоксиванкоміцин 10 15 20 Час утримування (хв.) 23,4 24,5 27,2Чистоту досліджуваного зразка визначали, виходячи із сумарної площі піка (площа під кривою або AUC) для сполуки у відсотках від суми всіх піків. Концентрацію (значення аналізу) сполуки у тестованому зразку визначали шляхом порівняння із еталоном. Приклад 2 Метод ГХ для визначення залишкового розчинника Залишкові кількості розчинників в аналітичних зразках 26-[[[3-[[(Z)-[1-(2-аміно-5-хлор-4тіазоліл)-2-[[(6R, 7R)-2-карбоксі-8-оксо-3-(піридиніометил)-5-тіа-1-азабіцикло[4.2.0]окт-2-ен-7іл]аміно]-2-оксоетиліден]аміно]окси]пропіл]аміно]-карбоніл]-26-декарбоксиванкоміцину визначали із використанням системи газової хроматографії (Agilent GC 6890, Agilent Technologies, Santa Clara CA 9505), оснащеної дозатором рівноважної пари (Agilent 7694 Headspace Sampler). Використовували ГХ колонку DB-624 (30 м довжина × 0,53 мм внутрішній діаметр × 3 мкм) (Agilent, Part No. 125-1334). Розчин внутрішнього стандарту готували шляхом додавання 1-бутанолу (4 мл) у 1 літрову мірну колбу. Додавали ДМСО (800 мл) і суміш ретельно перемішували, і потім додавали додаткову кількість ДМСО із отриманням сумарного об'єму, який дорівнює 1 л. 12 UA 115086 C2 5 Кожен досліджуваний зразок (50 мг) переносили в 20 міліметрову віалу для парофазного аналізу і додавали розчин внутрішнього стандарту (1 мл), і отриману суміш енергійно перемішували доти, доки зразок не розчинився. Аналітичні стандарти готували із концентрацією 2 мг/мл у розчині внутрішнього стандарту із комерційно доступних розчинників відомої чистоти. Усі розчинники аналітичного стандарту типово поєднували в одному розчині аналітичного стандарту, який готували в трьох екземплярах. Для кожного репліката аналітичного стандарту додавали 1 мл розчину в 20 міліметрову віалу для парофазного аналізу і герметично обтискали. Умови Гх-аналізу наведені в таблиці С. 10 Таблиця C Умови проведення дослідження методом газової хроматографії (ГХ) Газ-носій Термостат ГХ Зміна температури термостата Початкова Зміна температури 1 Зміна температури 2 Зміна температури 3 Зміна температури 4 Вхід Дозатор рівноважної пари Детектор Гелій в режимі постійного потоку при швидкості 2,60 мл/хв. Час встановлення рівноваги = 1 хв. Загальний час аналізу = 29,7 хв. Швидкість зміни температури Гранична темп. Час аналізу (хв.) (C/хв.) (C) 30 0 2 60 15 10 140 23 1 143 26 10 160 29,7 200C; 10:1 коефіцієнт розподілу Температура в парофазному термостаті = 85C Температура в петлі = 100C Перехідна лінія = 110C Час встановлення рівноваги у віалі = 10 хв., при інтенсивному струшуванні Тиск у віалі = 11 псі (He) Пробовідбірна петля об'ємом 1 мл Полум'яно-іонізаційний детектор (FID), 300С Потік водню - 30 мл/хв. Потік повітря = 400 мл/хв. Газ-компенсатор азот при 30 мл/хв. Час утримування ГХ для типових розчинників відносно внутрішнього стандарту 1-бутанолу показаний в таблиці D. Елюювання 1-бутанолом звичайно виконували приблизно на 19,0 хв. Таблиця D Відносний час утримування ГХ порівняно із 1-бутанолом Розчинник Ацетон Ацетонітрил 1-Бутанол Диметилсульфоксид Метил-трет-бутиловий ефір Відносний час утримування 0,45 0,50 1,00 1,38 0,57 15 Кількість залишкового розчинника в досліджуваному зразку визначали шляхом порівняння площ піків зразка із площами піків аналітичних стандартів. Приклад 3 Отримання трет-бутил 3-бромпропілкарбамату 13 UA 115086 C2 5 10 15 20 25 30 35 40 45 50 55 60 До розчину гідроксиду натрію (105 г, 2625 моль) у воді (1,15 л), підтримуваному при температурі, яка дорівнює або трохи нижче 10 °С, додавали розчин ди-трет-бутилдикарбонату (229 г, 1,05 моль) у гептані (1,03 л). Посудина, яка містить розчин ди-трет-бутилдикарбонату, промивали гептаном (125 мл) і до реакційної суміші додавали рідину після промивання. Отриману суміш охолоджували до температури трохи нижче 10 °С і додавали розчин 3бромпропіламіну гідроброміду (251 г, 1,15 моль) у воді (250 мл) по краплях із швидкістю, яка дозволяє підтримувати внутрішню температуру реакційної суміші нижче приблизно 20 °С. Посудину, яка містить розчин 3-бромпропіламіну гідроброміду, промивали водою (20 мл) і до реакційної суміші додавали рідини після промивання. Після того, як додавання було завершено, реакційну суміш залишали повільно нагріватися до кімнатної температури (приблизно 22 °С) і перемішування продовжували протягом приблизно 2 год. при кімнатній температурі. Перемішування завершували, і суміш витримували протягом 30 хв. Нижній водний шар відокремлювали від органічного шару і видаляли. До органічного шару додавали насичений водний розчин хлориду натрію (250 мл), і отриману суміш перемішували протягом 5 хв. Суміш витримували протягом 30 хв. і нижній водний шар відокремлювали і видаляли. Органічний шар концентрували до об'єму приблизно 350 мл, і цей концентрований розчин охолоджували до 5С і перемішували протягом 4 год. при 5С. Отриманий осад збирали вакуумною фільтрацією із отриманням зазначеної в заголовку сполуки у вигляді кристалічної твердої речовини білого кольору (211 г, 84 % вихід). Фільтрат концентрували і концентрований розчин охолоджували до 5С і перемішували протягом 4 год. при 5С. Отриманий додатковий осад збирали за допомогою вакуумної фільтрації із отриманням додаткової кількості зазначеної в заголовку 1 1 сполуки (17 г, 6,8 % вихід) H-ЯМР (400 МГц, ДМСО-d6) δ H-ЯМР (400 МГц, ДМСО-d6) δ 3,50 (т, J=6,8 Гц, 2H), 3,03 (кв, J=6,8 Гц, 2H), 1,91 (м, J=6,8 Гц, 2H), 1,38 (с, 9H). Приклад 4 Отримання етил (2Z)-2-(2-амінотіазол-4-іл)-2-(3-N-третбутоксикарбоніламінопропоксііміно)ацетату До суміші етил 2-аміно-α-(гідроксііміно)-4-тіазолацетат (139,9 г, 650 ммоль), трет-бутил 3бромпропілкарбамату (209,0 г, 877,5 ммоль) і порошкоподібного карбонату калію (157,2 г, 1137,5 ммоль) додавали ДМФ (550 мл) і воду (24,4 мл). Отриману суміш перемішували при 30 °С протягом приблизно 11 год. Реакційну суміш охолоджували до кімнатної температури, і додавали етилацетат (2,3 л) і воду (1,7 л), і отриману суміш перемішували протягом 5 хв. Суміш витримували протягом 60 хв., і нижній шар (водний шар) відокремлювали і видаляли. Додавали водний розчин бікарбонату натрію (10 мас. %, 600 мл), і отриману суміш перемішували протягом 5 хв. Суміш витримували протягом 60 хв., і нижній шар (водний шар) відокремлювали і видаляли. Додавали водний розчин хлориду натрію (10 мас. %, 600 мл), і отриману суміш перемішували протягом 5 хв. Суміш витримували протягом 60 хв., і нижній шар (водний шар) відокремлювали і видаляли. Органічний шар концентрували до об'єму, який дорівнює приблизно 600 мл. До концентрату по краплях додавали гексани (250 мл) із обережним перемішуванням при 0С протягом 1 години із утворенням осаду. Осад збирали шляхом вакуумної фільтрації із отриманням зазначеної в заголовку сполуки (232 г, 96 % вихід) у вигляді 1 кристалічної твердої речовини кремового кольору. H-ЯМР (400 МГц, ДМСО-d6) δ 7,25 (с, 2H), 6,89 (с, 1H), 6,82 (ушир. с, 1H), 4,26 (кв, J=8 Гц, 2H), 4,08 (т, J=6,4 Гц, 2H), 2,97 (кв, J=6,4 Гц, 2H), 1,72 (м, J=6,4 Гц, 2H), 1,37 (с, 9H), 1,26 (т, J=8 Гц, 3H). При бажанні, продукт може бути перекристалізований. Сирий продукт від декількох партій (1,0 кг, 91,2 % чистота) розчиняли в етилацетаті (2 л) при 60 °С і повільно додавали гептан (1 л). Отриманий розчин нагрівали до 60 °С протягом 1 години при перемішуванні, в процесі чого утворився осад. Потім суміш повільно охолоджували до кімнатної температури. Осад збирали шляхом вакуумної фільтрації в атмосфері сухого азоту, промивали сумішшю гептану і етилацетату (1 л, 3:1), і сушили у вакуумі протягом ночі із отриманням зазначеної в заголовку сполуки (770 г, 98,3 % чистота). За необхідності продукт може бути перекристалізований. Неочищену речовину із декількох партій (1,0 кг, 91,2 % чистота) розчиняли в етилацетаті (2 л) при 60 °С, і повільно додавали гептан (1 л). Отриманий розчин нагрівали до 60 °С протягом 1 години при перемішуванні в процесі чого утворювався осад. Потім суміш повільно охолоджували до кімнатної температури. Осад збирали шляхом вакуумної фільтрації в атмосфері сухого азоту, промивали сумішшю гептану і етилацетату (1 л, 3:1), і сушили у вакуумі протягом ночі із отриманням зазначеної в заголовку сполуки (770 г, 98,3 % чистота) Приклад 5 Отримання (2Z)-2-(2-амінотіазол-4-іл)-2-(3-N-трет-бутоксикарбоніламінопропоксііміно)оцтової кислоти 14 UA 115086 C2 5 10 15 20 25 30 35 40 45 50 55 60 До розчину етил (2Z)-2-(2-амінотіазол-4-іл)-2-(3-N-трет-бутоксикарбоніламінопропоксііміно)ацетату (232,0 г, 622,9 ммоль) в абсолютному етанолі (1,63 л) додавали по краплях розчин гідроксиду натрію (29,9 г, 747,4 ммоль) у воді (748 мл). Отриману суміш нагрівали при 35 °С протягом приблизно 8 годин. Потім суміш охолоджували до приблизно -5 °С і додавали по краплях трифтороцтову кислоту (приблизно 10 мл) доти, доки значення рН суміші не стало дорівнювати приблизно 6,0. Потім, для видалення більшої частини летких компонентів, суміш концентрували у вакуумі і додавали абсолютний етанол (500 мл). Для видалення води за допомогою азеотропної суміші, отриману суміш знову концентрували. Цю процедуру знову повторювали при додаванні абсолютного етанолу (500 мл) із наступним концентруванням із отриманням зазначеної в заголовку сполуки, яку використовували в наступній реакції без додаткового виділення або очищення. Приклад 6 Отримання триетиламінової солі (2Z)-2-(2-аміно-5-хлортіазол-4-іл)-2-(3-N-третбутоксикарбоніламінопропоксііміно)оцтової кислоти До суміші (2Z)-2-(2-амінотіазол-4-іл)-2-(3-N-трет-бутоксикарбоніл-амінопропоксііміно)оцтової кислоти (приблизно 213 г, 627 ммоль) у метанолі (200 мл) додавали етилацетат (2,0 л) із утворенням суспензії. Додавали N-хлорсукцинімід (108,0 г, 815 ммоль) і отриману суміш перемішували при кімнатній температурі протягом 3 годин. Додавали воду (2,5 л), хлорид натрію (514 г) і трифтороцтову кислоту (93 мл, 1254 ммоль), і отриману суміш перемішували протягом 15 хв. Суміш витримували протягом 1 години, а потім нижній водний шар відокремлювали і видаляли. Органічний шар концентрували у вакуумі до об'єму, який дорівнює приблизно 500 мл. Додавали ацетонітрил (1,0 л), і суміш концентрували у вакуумі. Цю процедуру повторювали шляхом додавання ацетонітрилу (1,0 л) і концентрування суміші у вакуумі до об'єму, який дорівнює приблизно 600 мл. Потім суміш фільтрували через діатомітовий шар (целіт). Додавали триетиламін (350 мл, 2 508 ммоль) і суміш охолоджували до 0С, при цьому утворювався осад. Осад збирали шляхом вакуумної фільтрації, промивали ацетонітрил (165 мл), і сушили при кімнатній температурі у вакуумі із отриманням зазначеної в заголовку сполуки (224 г, 79 % вихід) у вигляді кристалічної твердої речовини ясно-коричневого кольору. 1H-ЯМР (400 МГц, MeOH-d6) δ 4,15 (т, J=6,4 Гц, 2H), 3,18 (м, 8H), 1,86 (м, 2H), 1,43 (с, 9H), 1,30 (т, J=7,9Гц, 9H). Приклад 7 Отримання гідрохлориду 1-[[(6R, 7R)-7-[[(2Z)-(2-аміно-5-хлор-4-тіазоліл)[(3-N-третбутоксикарбоніламінопропоксі)іміно]ацетил]аміно]-2-карбоксі-8-оксо-5-тіа-1-азабіцикло[4.2.0]окт2-ен-3-іл]метил]піридинію До суміші триетиламінової солі (2Z)-2-(2-аміно-5-хлортіазол-4-іл)-2-(3-N-третбутоксикарбоніламінопропоксііміно)оцтової кислоти (44,88 г, 93,5 ммоль) у диметилацетаміді (300 мл) при 20 °С додавали дитіобіс(бензотіазол) (32,7 г, 98,2 ммоль). Додавали трифенілфосфін (25,8 г, 98,2 ммоль) (незначний екзотермічний ефект), і отриману суміш перемішували протягом 30 хв. при кімнатній температурі, у процесі чого реакційна суміш перетворювалася в прозорий розчин червоно-коричневого кольору. Реакційну суміш охолоджували до 0 °С і додавали діізопропілетиламін (14,8 мл, 85 ммоль). Отриману суміш перемішували протягом приблизно 5 хв., а потім додавали 1-[[(6R, 7R)-7-аміно-2-карбоксі-8оксо-5-тіа-1-азабіцикло[4.2.0]окт-2-ен-3-іл]метил]піридинію хлорид моногідрохлорид (7-русА) (34,00 г, 85,0 ммоль). Отриману суміш перемішували при 0 °С протягом 16 годин, а потім повільно додавали розчин соляної кислоти в 1,4-діоксані (4,0 М, 44,6 мл, 178,5 ммоль), підтримуючи внутрішню температуру реакційної суміші у діапазоні від приблизно 0 °С до приблизно 5 °С. Отриману суміш перемішували протягом приблизно 20 хв., а потім фільтрували через фільтрувальний папір. Потім до етилацетату (2,5 л) повільно додавали фільтрат протягом 30 хв. при кімнатній температурі із утворенням осаду. Отриману суспензію перемішували протягом приблизно 1 год. при кімнатній температурі, і потім осад збирали фільтруванням в атмосфері сухого азоту. Вологий осад на фільтрі промивали етилацетатом (1×300 мл) і метилтрет-бутиловим ефіром (1×300 мл), потім сушили в струмені сухого азоту протягом приблизно 25 хв. Потім речовину сушили у вакуумній печі протягом 4 год. при кімнатній температурі із отриманням зазначеної в заголовку сполуки (56,6 г, приблизно 85 % чистота). Приклад 8 Отримання дигідрохлориду 1-[[(6R, 7R)-7-[[(2Z)-(2-аміно-5-хлор-4-тіазоліл)[(3амінопропоксі)іміно]ацетил]аміно]-2-карбоксі-8-оксо-5-тіа-1-азабі-цикло[4.2.0]окт-2-ен-3іл]метил]піридинію До метанолу (187,5 мл, 4751,9 ммоль) при -10 °С додавали по краплях ацетилхлорид (138,8 мл, 1952,1 ммоль) при швидкості, достатній для підтримки внутрішньої температури на рівні або 15 UA 115086 C2 5 10 15 20 25 30 35 40 45 50 55 60 нижче 15 °С. Після додавання реакційну суміш нагрівали до кімнатної температури і перемішували протягом 1 години. Потім реакційну суміш додавали по краплях до суміші гідрохлориду 1-[[(6R, 7R)-7-[[(2Z)-(2-аміно-5-хлор-4-тіазоліл)[(3-N-третбутоксикарбоніламінопропоксі)іміно]-ацетил]аміно]-2-карбоксі-8-оксо-5-тіа-1азабіцикло[4.2.0]окт-2-ен-3-іл]метил]піри-динію (50,0 г, 65,1 ммоль) у метанолі (187,5 мл), охолодженому до -10 °С. Додавання виконували із швидкістю, достатньою для підтримки внутрішньої температури реакційної суміші, яка дорівнює або нижче 0 °С. Отриману суміш перемішували при 0 °С протягом приблизно 6 год., а потім її додавали по краплях до ацетону (1,50 л). Отриману суміш перемішували при кімнатній температурі протягом 1 години, а потім осад збирали фільтруванням в атмосфері сухого азоту. Вологий залишок на фільтрі промивали 1:1 об'єм/об'єм сумішшю ізопропілового спирту і ізопропілацетату (1×600 мл), а потім метилтрет-бутиловим ефіром (1×600 мл). Потім речовину сушили у вакуумній печі (із продувкою азотом) при кімнатній температурі протягом приблизно 4 годин із отриманням зазначеної в заголовку сполуки (33,34 г, приблизно 93,1 % чистота). Другу порцію зазначеної в заголовку сполуки також виділяли із фільтрату аналогічним чином (2,6 г, приблизно 90,6 % чистота). Приклад 9 Отримання тригідрохлориду 26-[[[3-[[(Z)-[1-(2-аміно-5-хлор-4-тіазоліл)-2-[[(6R, 7R)-2-карбоксі8-оксо-3-(піридиніометил)-5-тіа-1-азабіцикло[4.2.0]окт-2-ен-7-іл]аміно]-2оксоетиліден]аміно]окси]пропіл]аміно]карбоніл]-26-декарбоксиванкоміцину До перемішуваного розчину гідрохлориду ванкоміцину (56,56 г, 38,07 ммоль) у суміші ДМСО (280,0 мл) і ДМФ (218,4 мл) при 0 °С додавали суспензію 4-(4,6-диметокси-1,3,5-триазин-2-іл)-4метилморфолін хлориду (12,04 г, 43,51 ммоль) у ДМСО (30,80 мл) і ДМФ (30,80 мл). Отриману суміш перемішували при 0 °С протягом приблизно 20 хвилин, а потім додавали суміш дигідрохлориду 1-[[(6R, 7R)-7-[[(2Z)-(2-аміно-5-хлор-4-тіазоліл)[(3-амінопропоксі)іміно]ацетил]аміно]-2-карбоксі-8-оксо-5-тіа-1-азабіцикло[4.2.0]окт-2-ен-3-іл]метил]піридинію (28,00 г, 31,4 ммоль) у ДМСО (30,80 мл) і ДМФ (92,40 мл). Отриману суміш охолоджували до -10 °С і перемішували протягом 10 хвилин. До цієї суміші додавали N, N-діізопропілетиламін (DIPEA) (27,58 мл, 158,34 ммоль) при швидкості, яка забезпечує підтримку температури реакційної суміші нижче -5 °С. Після завершення додавання DIPEA, реакційну суміш перемішували при 10 °С до приблизно 1 години (при цьому ВЕРХ аналіз показав, що реакція, посуті, завершена). До реакційної суміші додавали 1н водний розчин соляної кислоти (186,76 мл) при швидкості, яка забезпечує підтримку температури реакційної суміші нижче 0 °С. Після завершення додавання соляної кислоти реакційну суміш нагрівали до 10 °С і додавали суміш ацетонітрилу (560,0 мл) і води (мл) 92.40. Потім до реакційної суміші додавали ацетон (1,40 л) протягом приблизно 1 години, і отриману суспензію перемішували протягом приблизно 30 хвилин. Потім, щоб зібрати твердий продукт (вологий осад), завись фільтрували в атмосфері азоту. Вологий залишок на фільтрі промивали ацетоном (621,60 мл) і продували азотом до висихання. До вологого залишку на фільтрі додавали ацетон (621,60 мл), і отриману суміш перемішували із утворенням суспензії, і потім фільтрували в атмосфері азоту, щоб зібрати тверду речовину, яку продували азотом протягом приблизно 20 хвилин. Потім тверду речовину сушили у вакуумі при кімнатній температурі протягом приблизно 18 годин із отриманням зазначеної в заголовку сполуки у вигляді тригідрохлоридної солі (81,9 г, 39,12 ммоль, 92,2 % вихід). Приклад 10 Очищення 26-[[[3-[[(Z)-[1-(2-аміно-5-хлор-4-тіазоліл)-2-[[(6R, 7R)-2-карбоксі-8-оксо-3(піридиніометил)-5-тіа-1-азабіцикло[4.2.0]окт-2-ен-7-іл]аміно]-2-оксоетиліден]аміно]окси]пропіл]аміно]карбоніл]-26-декарбоксиванкоміцину У 150 міліметрову колонку із лабораторного скла завантажували співполімер полі(стиролдивінілбензол) (PLRP-S, 100 A, 50 мкм) і врівноважували 98:2 об'єм/об'єм розчином ацетатний буфер (100 мМ)/ацетонітрил протягом приблизно 40 хвилин при швидкості потоку 15 мл/хв. Розчин тригідрохлориду 26-[[[3-[[(Z)-[1-(2-аміно-5-хлор-4-тіазоліл)-2-[[(6R, 7R)-2-карбоксі-8-оксо3-(піридиніо-метил)-5-тіа-1-азабіцикло[4.2.0]окт-2-ен-7-іл]аміно]-2оксоетиліден]аміно]окси]пропіл]-аміно]карбоніл]-26-декарбоксиванкоміцину (9,0 г, 4,30 ммоль) у 98:2 об'єм/об'єм розчині ацетатний буфер/ацетонітрил (120 мл), потім поміщали на урівноважену колонку. Колонку елюювали 98:2 об'єм/об'єм розчином ацетатний буфер/ацетонітрил протягом приблизно 10 хвилин при швидкості потоку 15 мл/хв., а потім 93:7 об'єм/об'єм розчином ацетатний буфер/ацетонітрил протягом приблизно 62 хвилин при швидкості потоку 15 мл/хв. (при цьому зупинялося елюювання домішок). Потім колонку елюювали послідовно (I) 92:8 об'єм/об'єм розчином ацетатний буфер/ацетонітрил протягом приблизно 80 хвилин; (II) 91:9 об'єм/об'єм розчином ацетатний буфер/ацетонітрил протягом приблизно 15 хвилин; (III) 89:11 об'єм/об'єм розчином ацетатний буфер/ацетонітрил протягом 16 UA 115086 C2 5 10 15 20 25 30 35 40 45 50 55 60 приблизно 20 хвилин; і (IV) 87:13 об'єм/об'єм розчином ацетатний буфер/ацетонітрил протягом 20-30 хвилин (усі при швидкості потоку 15 мл/хв.). У процесі елюювання елюент контролювали за допомогою УФ-детектора при 254 нм, і збирали фракції, які містять зазначену в заголовку сполуку. Фракції, які містять зазначену в заголовку сполуку, поєднували із отриманням розчину зазначеної в заголовку сполуки у вигляді трет-ацетатної солі в приблизно 1500 мл розчину ацетатний буфер/ацетонітрил. Приклад 11 Сольовий обмін із отриманням дигідрохлориду 26-[[[3-[[(Z)-[1-(2-аміно-5-хлор-4-тіазоліл)-2[[(6R, 7R)-2-карбоксі-8-оксо-3-(піридиніометил)-5-тіа-1-азабі-цикло[4.2.0]окт-2-ен-7-іл]аміно]-2оксоетиліден]аміно]окси]пропіл]аміно]карбо-ніл]-26-декарбоксиванкоміцину У 150 міліметрову колонку із лабораторного скла завантажували співполімер полі(стиролдивінілбензол) (PLRP-S, 100 A, 50 мкМ) і врівноважували 98:2 об'єм/об'єм розчином ацетатний буфер (100мМ)/ацетонітрил протягом приблизно 2,25 годин при швидкості потоку 15 мл/хв. Розчин зазначеної в заголовку сполуки у вигляді трет-ацетатної солі в розчині ацетатний буфер/ацетонітрил (приблизно 1500 мл) розбавляли водою (4,6 л), і отриманий розчин завантажували в колонку при швидкості потоку 15-30 мл/хв. протягом 4,65 годин. Колонку елюювали 98:2 об'єм/об'єм 20 мМ водним розчином соляна кислота/ацетонітрил (600 мл) при швидкості потоку 10-15 мл/хв. (приблизно 48 хв.). Потім колонку елюювали 80:20 об'єм/об'єм 10 мМ водним розчином соляна кислота/ацетонітрил при швидкості потоку 15 мл/хв. протягом 25 хв. У процесі елюювання, елюент контролювали за допомогою УФ-детектора при 254 нМ, і елюент, який містить зазначену в заголовку сполуку, збирали. Значення pН розчину, який містить зазначену в заголовку сполуку, становило 2,2 (при 13 °С). Значення pН розчину встановлювали рівним 4,27 (при 14 °С) шляхом додавання 5 мас. % водного розчину бікарбонату натрію. Отриманий розчин, який містить в основному дигідрохлоридну сіль зазначеної в заголовку сполуки, мав сумарний об'єм, який дорівнює 212 мл. За допомогою ВЕРХ було визначено, що цей розчин містить 26,0 мг/мл зазначеної в заголовку сполуки (у вигляді еквівалента чистої основи). Розчин розбавляли холодною водою (212 мл) із отриманням розчину, який має загальний об'єм 424 мл і який містить 13 мг/мл у зазначеній в заголовку сполуці (у вигляді еквівалента чистої основи). Приклад 12 Отримання стабільних зразків A. Моногідрохлоридна сіль (формула I, де х дорівнює приблизно 1) Значення рН розчину сольового обміну дигідрохлориду 26-[[[3-[[(Z)-[1-(2-аміно-5-хлор-4тіазоліл)-2-[[(6R, 7R)-2-карбоксі-8-оксо-3-(піридиніометил)-5-тіа-1-азабіцикло[4.2.0]окт-2-ен-7іл]аміно]-2-оксоетиліден]аміно]окси]пропіл]аміно]-карбоніл]-26-декарбоксиванкоміцину (124 мл, 13,0 мг/мл вільної основи) доводили до рН 6,5 шляхом додавання 5 мас. % розчину бікарбонату натрію. Зразки (2 мл кожний) цього розчину поміщали в 21 флакон із гумовими пробками із отворами. Флакони ліофілізували при -40C у вакуумі (40-60 мТорр) протягом приблизно 5 днів із отриманням 21 флаконів, які містять моногідрохлоридну сіль (26 мг, у вигляді еквівалента чистої основи) (формула I, у якій дорівнює приблизно 1) у вигляді ліофілізованого порошку. Аналіз репрезентативних флаконів показав, що зразки мали вміст води 1,7 % (за Карлом Фішером), залишкового розчинника (ацетонітрил) 0,6 % (ГХ-аналіз) і чистоту 90,4 % (ВЕРХаналіз). B. Моногідрохлоридна сіль (формула I, х дорівнює приблизно 1), сахароза і гліцин До розчину моногідрохлориду 26-[[[3-[[(Z)-[1-(2-аміно-5-хлор-4-тіазоліл)-2-[[(6R, 7R)-2карбоксі-8-оксо-3-(піридиніометил)-5-тіа-1-азабіцикло[4.2.0]окт-2-ен-7-іл]аміно]-2оксоетиліден]аміно]окси]пропіл]аміно]карбоніл]-26-декарбоксиванкоміцину (75 мл, 13,0 мг/мл, 975 мг) додавали сахарозу (975 мг) і гліцин (1,46 г). Суміш перемішували доти, доки речовина не розчинилася. Значення рН отриманого розчину становило 6,7. Зразки (2 мл кожний) цього розчину поміщали в 21 флакон із гумовими пробками із отворами. Флакони ліофілізували при -40 °С у вакуумі (40-60 мТорр) протягом приблизно 5 днів із отриманням 21 флаконів, які містять моногідрохлоридну сіль (26 мг у вигляді еквівалента чистої основи), сахарозу (26 мг) і гліцин (39 мг) у вигляді ліофілізованого порошку. Аналіз репрезентативних флаконів показав, що зразки мали вміст води 0,5 % (за Карлом Фішером), залишкового розчинника (ацетонітрил) 0,6 % (ГХ-аналіз) і чистоту 90,4 % (ВЕРХаналіз). C. Дигідрохлоридна сіль (формула I, де х дорівнює приблизно 2) Зразки (2 мл кожний) розчину сольового обміну дигідрохлориду 26-[[[3-[[(Z)-[1-(2-аміно-5хлор-4-тіазоліл)-2-[[(6R, 7R)-2-карбоксі-8-оксо-3-(піридиніо-метил)-5-тіа-1-азабіцикло[4.2.0]окт-2 17 UA 115086 C2 5 10 15 20 25 30 35 40 45 50 55 ен-7-іл]аміно]-2-оксоетиліден]аміно]окси]-пропіл]аміно]-карбоніл]-26-декарбоксиванкоміцину (124 мл, 13,0 мг/мл), який має рН 4,4, поміщали в 21 флакон із гумовими пробками з отворами. Флакони ліофілізували при -40 °С у вакуумі (40-60 мТорр) протягом приблизно 6 днів із отриманням 21 флаконів, які містять дигідрохлоридну сіль (26 мг у вигляді еквівалента чистої основи), у вигляді ліофілізованого порошку. Аналіз репрезентативних флаконів показав, що зразки мали вміст води 1,1 % (за Карлом Фішером), залишкового розчинника (ацетонітрил) 0,3 % (ГХ-аналіз) і чистоту 90,1 % (ВЕРХаналіз). D. Дигідрохлоридна сіль (формула I, де х дорівнює приблизно 2), сахароза і гліцин До розчину сольового обміну дигідрохлориду 26-[[[3-[[(Z)-[1-(2-аміно-5-хлор-4-тіазоліл)-2[[(6R, 7R)-2-карбоксі-8-оксо-3-(піридиніометил)-5-тіа-1-азабі-цикло[4.2.0]окт-2-ен-7-іл]аміно]-2оксоетиліден]аміно]окси]пропіл]аміно]карбо-ніл]-26-декарбоксиванкоміцину (150 мл, 13,0 мг/мл, 1,95 г) при pН 4,27 додавали сахарозу (1,95 г), і суміш перемішували доти, доки сахароза не розчинилася. До цього розчину (104 мл) додавали гліцин (2,03 г). Суміш перемішували доти, доки гліцин не розчинився. Зразки (2 мл кожний) цього розчину поміщали в 21 флакон із гумовими пробками із отворами. Посудини ліофілізували при -40 °С у вакуумі (40-60 мТорр) протягом приблизно 6 днів із отриманням 21 флаконів, які містять дигідрохлоридну сіль (26 мг у вигляді еквівалента чистої основи), сахарозу (26 мг) і гліцин (39 мг) у вигляді ліофілізованого порошку. Аналіз репрезентативних флаконів показав, що зразки мали вміст води, який становить 0,5 % (за Карлом Фішером), залишкового розчинника (ацетонітрил), який становить 0,8 % (ГХаналіз) і чистоту 90,6 % (ВЕРХ-аналіз). E. Тригідрохлоридна сіль (формула I, де х дорівнює приблизно 3) Значення pН розчину сольового обміну дигідрохлориду 26-[[[3-[[(Z)-[1-(2-аміно-5-хлор-4тіазоліл)-2-[[(6R, 7R)-2-карбоксі-8-оксо-3-(піридиніометил)-5-тіа-1-азабіцикло[4.2.0]окт-2-ен-7іл]аміно]-2-оксоетиліден]аміно]окси]пропіл]аміно]-карбоніл]-26-декарбоксиванкоміцину доводили до 2,0 шляхом додавання 1н водного розчину соляної кислоти. Зразки (2 мл кожний) цього розчину поміщали в 21 флакон із гумовими пробками із отворами. Посудини ліофілізували при -40 °С у вакуумі (40-60 мТорр) протягом приблизно 6 днів із отриманням 21 флаконів, які містять тригідрохлоридну сіль (26 мг у вигляді еквівалента чистої основи) у вигляді ліофілізованого порошку. Аналіз репрезентативних флаконів показав, що зразки мають вміст води, який становить
ДивитисяДодаткова інформація
Назва патенту англійськоюHydrochloride salts of an antibiotic compound
Автори англійськоюZhang, Weijiang, Cheung, Ronnie, Filipov, Dimitar, Green, Jack, Lee, Junning
Автори російськоюЧжан Вэйцзянь, Чеунг Ронни, Филипов Димитар, Грин Джэк, Ли Цзюньнин
МПК / Мітки
МПК: C07K 9/00, C07D 501/00, A61K 38/14, A61K 31/545
Мітки: солі, сполуки, гідрохлоридні, антибіотичної
Код посилання
<a href="https://ua.patents.su/27-115086-gidrokhloridni-soli-antibiotichno-spoluki.html" target="_blank" rel="follow" title="База патентів України">Гідрохлоридні солі антибіотичної сполуки</a>
Попередній патент: Спосіб спалювання низькосортного палива
Наступний патент: Кристалічна форма триетиламінової солі заміщеної тіазолілоцтової кислоти
Випадковий патент: Транспортна колія для експресного сполучення