Новий карбамілований еро та спосіб його одержання
Номер патенту: 91983
Опубліковано: 27.09.2010
Автори: Педерсен Аннерс Єлхолт, Хрістенсен Сьорен, Валб'йорн Єспер, Фолдаґер Ларс, Туесен Маріанна Халберґ, Мунк Мортен
Формула / Реферат
1. Спосіб одержання карбамілованого білка еритропоетину, при якому здійснюють взаємодію кількості еритропоетину з кількістю ціанату з одержанням продукту, що включає ізоформи карбамілованого білка еритропоетину та є частково агрегованим, який відрізняється тим, що взаємодію еритропоетину з ціанатом здійснюють при pH приблизно 9 та при температурі і протягом періоду часу, необхідними для принаймні приблизно 90 % карбамілування аміногруп в лізинах і N-кінцевій амінокислоті еритропоетину, внаслідок чого одержують продукт з менш ніж приблизно 40 % агрегованого білка і менш ніж приблизно 40 % мас. надмірно і недостатньо карбамілованого білка, визначеного ESI-мас-спектрометрією.
2. Спосіб за п. 1, який відрізняється тим, що карбамілований білок еритропоетину є людським еритропоетином.
3. Спосіб за п. 1, який відрізняється тим, що карбамілований білок еритропоетину має менш ніж приблизно 30 % агрегованого білка.
4. Спосіб за п. 1, який відрізняється тим, що карбамілований білок еритропоетину має менш ніж приблизно 20 % агрегованого білка.
5. Спосіб за п. 1, який відрізняється тим, що карбамілований білок еритропоетину має менш ніж приблизно 10 % агрегованого білка.
6. Спосіб за п. 1, який відрізняється тим, що карбамілований білок еритропоетину має менш ніж приблизно 30 % мас. надмірно і недостатньо карбамілованого білка.
7. Спосіб за п. 1, який відрізняється тим, що карбамілований білок еритропоетину має менш ніж приблизно 20 % мас. надмірно і недостатньо карбамілованого білка.
8. Спосіб за п. 1, який відрізняється тим, що карбамілований білок еритропоетину має менш ніж приблизно 10 % мас. надмірно і недостатньо карбамілованого білка.
9. Спосіб за п. 1, який відрізняється тим, що карбамілований білок еритропоетину має менш ніж приблизно 30 % мас. надмірно карбамілованого білка.
10. Спосіб за п. 1, який відрізняється тим, що карбамілований білок еритропоетину має менш ніж приблизно 20 % мас. надмірно карбамілованого білка.
11. Спосіб за п. 1, який відрізняється тим, що карбамілований білок еритропоетину має менш ніж приблизно 10 % мас. надмірно карбамілованого білка.
12. Спосіб за п. 1, який відрізняється тим, що концентрація взаємодіючого з ціанатом білка еритропоетину становить від приблизно 0,05 мг/мл до приблизно 10 мг/мл.
13. Спосіб за п. 1, який відрізняється тим, що концентрація взаємодіючого з ціанатом білка еритропоетину становить від приблизно 2 мг/мл до приблизно 5 мг/мл.
14. Спосіб за п. 1, який відрізняється тим, що концентрація ціанату становить від приблизно 0,05 М до приблизно 10 М.
15. Спосіб за п. 1, який відрізняється тим, що концентрація ціанату становить від приблизно 0,05 М до приблизно 2 М.
16. Спосіб за п. 1, який відрізняється тим, що температура знаходиться в діапазоні від приблизно 0 °C до приблизно 60 °C.
17. Спосіб за п. 1, який відрізняється тим, що температура знаходиться в діапазоні від приблизно 30 °C до приблизно 34 °C.
18. Спосіб за п. 1, який відрізняється тим, що pH становить приблизно 9.
19. Спосіб за п. 1, який відрізняється тим, що pH становить 9,0.
20. Спосіб за п. 1, який відрізняється тим, що період часу становить від приблизно 10 хвилин до приблизно 30 діб.
21. Спосіб за п. 1, який відрізняється тим, що період часу становить від приблизно 1 години до приблизно 5 діб.
22. Спосіб за п. 1, який відрізняється тим, що білок еритропоетину піддають взаємодії з ціанатом у присутності буферного розчину.
23. Спосіб за п. 22, який відрізняється тим, що буферним розчином є борат.
24. Спосіб за п. 22, який відрізняється тим, що концентрація буферного розчину становить від приблизно 0,05 М до приблизно 2 М.
25. Спосіб за п. 22, який відрізняється тим, що концентрація буферного розчину становить від приблизно 0,1 М до приблизно 1 М.
26. Спосіб за п. 22, який відрізняється тим, що концентрація буферного розчину становить приблизно 0,5 М.
27. Спосіб за п. 1, який відрізняється тим, що концентрація взаємодіючого з ціанатом білка еритропоетину становить приблизно 3 мг/мл, концентрація ціанату становить приблизно 0,5 М, температура становить приблизно 32 °C, pH становить приблизно 9,0, а період часу становить приблизно 24 години.
28. Спосіб одержання карбамілованого білка еритропоетину, при якому здійснюють взаємодію кількості еритропоетину з кількістю ціанату з одержанням продукту, що включає ізоформи карбамілованого білка еритропоетину та є частково агрегованим, який відрізняється тим, що взаємодію еритропоетину з ціанатом здійснюють при pH приблизно 9 та при температурі і протягом періоду часу, необхідними для принаймні приблизно 90 % карбамілування аміногруп в лізинах і N-кінцевій амінокислоті еритропоетину, одержуючи карбамілований білок еритропоетину з менш ніж приблизно 40 % агрегованого білка і менш ніж приблизно 40 % мас. надмірно і недостатньо карбамілованого білка, визначеного ESI-мас-спектрометрією, після чого здійснюють очищення із застосуванням аніонообмінної, катіонообмінної, гідрофобної хроматографії, хроматографії з оберненими фазами, афінної хроматографії або хроматографії з виключенням за розміром, внаслідок чого одержують продукт з менш ніж приблизно 3 % агрегованого білка і менш ніж приблизно 40 % мас. надмірно і недостатньо карбамілованого білка, визначеного ESI-мас-спектрометрією.
29. Спосіб за п. 28, який відрізняється тим, що карбамілований білок еритропоетину є людським еритропоетином.
30. Спосіб за п. 28, який відрізняється тим, що карбамілований білок еритропоетину має менш ніж приблизно 2,5 % агрегованого білка.
31. Спосіб за п. 28, який відрізняється тим, що карбамілований білок еритропоетину має приблизно 0,5 % або менше агрегованого білка.
32. Спосіб за п. 28, який відрізняється тим, що карбамілований білок еритропоетину має менш ніж приблизно 30 % мас. надмірно і недостатньо карбамілованого білка.
33. Спосіб за п. 28, який відрізняється тим, що карбамілований білок еритропоетину має менш ніж приблизно 20 % мас. надмірно і недостатньо карбамілованого білка.
34. Спосіб за п. 28, який відрізняється тим, що карбамілований білок еритропоетину має менш ніж приблизно 10 % мас. надмірно і недостатньо карбамілованого білка.
35. Спосіб за п. 28, який відрізняється тим, що карбамілований білок еритропоетину має менш ніж приблизно 30 % мас. надмірно карбамілованого білка.
36. Спосіб за п. 28, який відрізняється тим, що карбамілований білок еритропоетину має менш ніж приблизно 20 % мас. надмірно карбамілованого білка.
37. Спосіб за п. 28, який відрізняється тим, що карбамілований білок еритропоетину має менш ніж приблизно 10 % мас. надмірно карбамілованого білка.
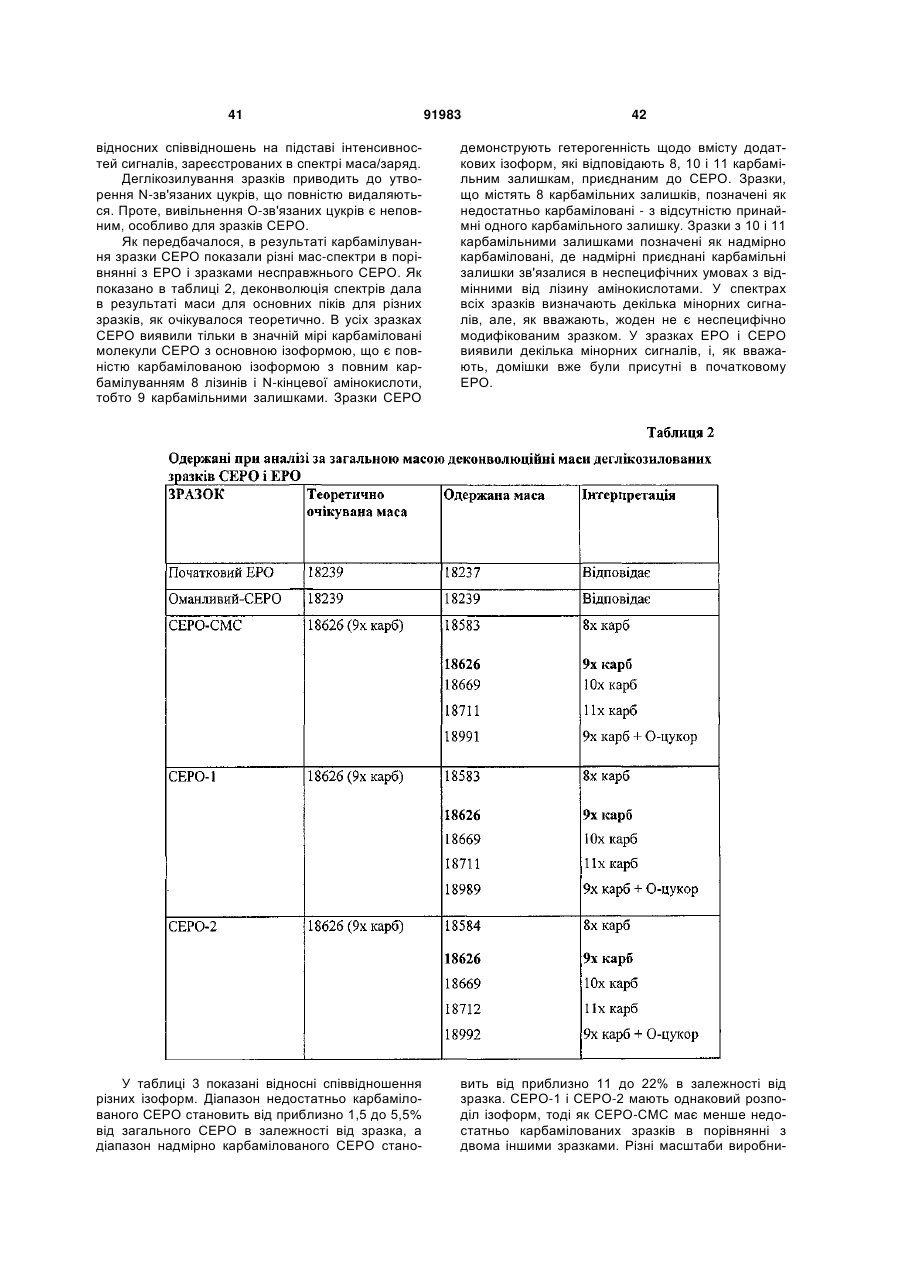
38. Спосіб за п. 28, який відрізняється тим, що концентрація взаємодіючого з ціанатом білка еритропоетину становить від приблизно 0,05 мг/мл до приблизно 10 мг/мл.
39. Спосіб за п. 28, який відрізняється тим, що концентрація взаємодіючого з ціанатом білка еритропоетину становить від приблизно 2 мг/мл до приблизно 5 мг/мл.
40. Спосіб за п. 28, який відрізняється тим, що концентрація взаємодіючого з ціанатом білка еритропоетину становить приблизно 3 мг/мл.
41. Спосіб за п. 28, який відрізняється тим, що концентрація ціанату становить від приблизно 0,05 М до приблизно 10 М.
42. Спосіб за п. 28, який відрізняється тим, що концентрація ціанату становить від приблизно 0,05 М до приблизно 2 М.
43. Спосіб за п. 28, який відрізняється тим, що концентрація ціанату становить приблизно 0,5 М.
44. Спосіб за п. 28, який відрізняється тим, що температура знаходиться в діапазоні від приблизно 0 °C до приблизно 60 °C.
45. Спосіб за п. 28, який відрізняється тим, що температура знаходиться в діапазоні від приблизно 30 °C до приблизно 34 °C.
46. Спосіб за п. 28, який відрізняється тим, що температура становить приблизно 32°C.
47. Спосіб за п. 28, який відрізняється тим, що pH становить приблизно 9.
48. Спосіб за п. 28, який відрізняється тим, що pH становить 9,0.
49. Спосіб за п. 28, який відрізняється тим, що період часу становить від приблизно 10 хвилин до приблизно 30 діб.
50. Спосіб за п. 28, який відрізняється тим, що період часу становить від приблизно 1 години до приблизно 5 діб.
51. Спосіб за п. 28, який відрізняється тим, що період часу становить приблизно 24 години.
52. Спосіб за п. 28, який відрізняється тим, що білок еритропоетину піддають взаємодії з ціанатом у присутності буферного розчину.
53. Спосіб за п. 52, який відрізняється тим, що буферним розчином є борат.
54. Спосіб за п. 52, який відрізняється тим, що концентрація буферного розчину становить від приблизно 0,05 М до приблизно 2 М.
55. Спосіб за п. 52, який відрізняється тим, що концентрація буферного розчину становить від приблизно 0,1 М до приблизно 1 М.
56. Спосіб за п. 52, який відрізняється тим, що концентрація буферного розчину становить приблизно 0,5 М.
57. Спосіб за п. 28, який відрізняється тим, що концентрація взаємодіючого з ціанатом білка еритропоетину становить приблизно 3 мг/мл, концентрація ціанату становить приблизно 0,5 М, температура становить приблизно 32 °C, pH становить приблизно 9,0, а період часу становить приблизно 24 години.
58. Карбамілований білок еритропоетину, що має принаймні приблизно 90 % карбамілування первинних амінів лізинів і амінокінцевої амінокислоти, менш ніж приблизно 3% агрегованого білка і менш ніж приблизно 40 % мас. надмірно і недостатньо карбамілованого білка, визначеного ESI-мас-спектрометрією.
59. Карбамілований білок еритропоетину за п. 58, де білок еритропоетину є людським еритропоетином.
60. Карбамілований білок еритропоетину за п. 58 з менш ніж приблизно 2,5 % агрегованого білка.
61. Карбамілований білок еритропоетину за п. 58 з менш ніж приблизно 0,5 % або менше агрегованого білка.
62. Карбамілований білок еритропоетину за п. 58, де кількість агрегованого білка визначена за допомогою SEC-HPLC.
63. Карбамілований білок еритропоетину за п. 58 з менш ніж приблизно 30 % мас. надмірно і недостатньо карбамілованого білка.
64. Карбамілований білок еритропоетину за п. 58 з менш ніж приблизно 20 % мас. надмірно і недостатньо карбамілованого білка.
65. Карбамілований білок еритропоетину за п. 58 з менш ніж приблизно 10 % мас. надмірно і недостатньо карбамілованого білка.
66. Карбамілований білок еритропоетину за п. 58 з менш ніж приблизно 30 % надмірно карбамілованого білка.
67. Карбамілований білок еритропоетину за п. 58 з менш ніж приблизно 20 % надмірно карбамілованого білка.
68. Карбамілованоий білок еритропоетину за п. 58 з менш ніж приблизно 10 % надмірно карбамілованого білка.
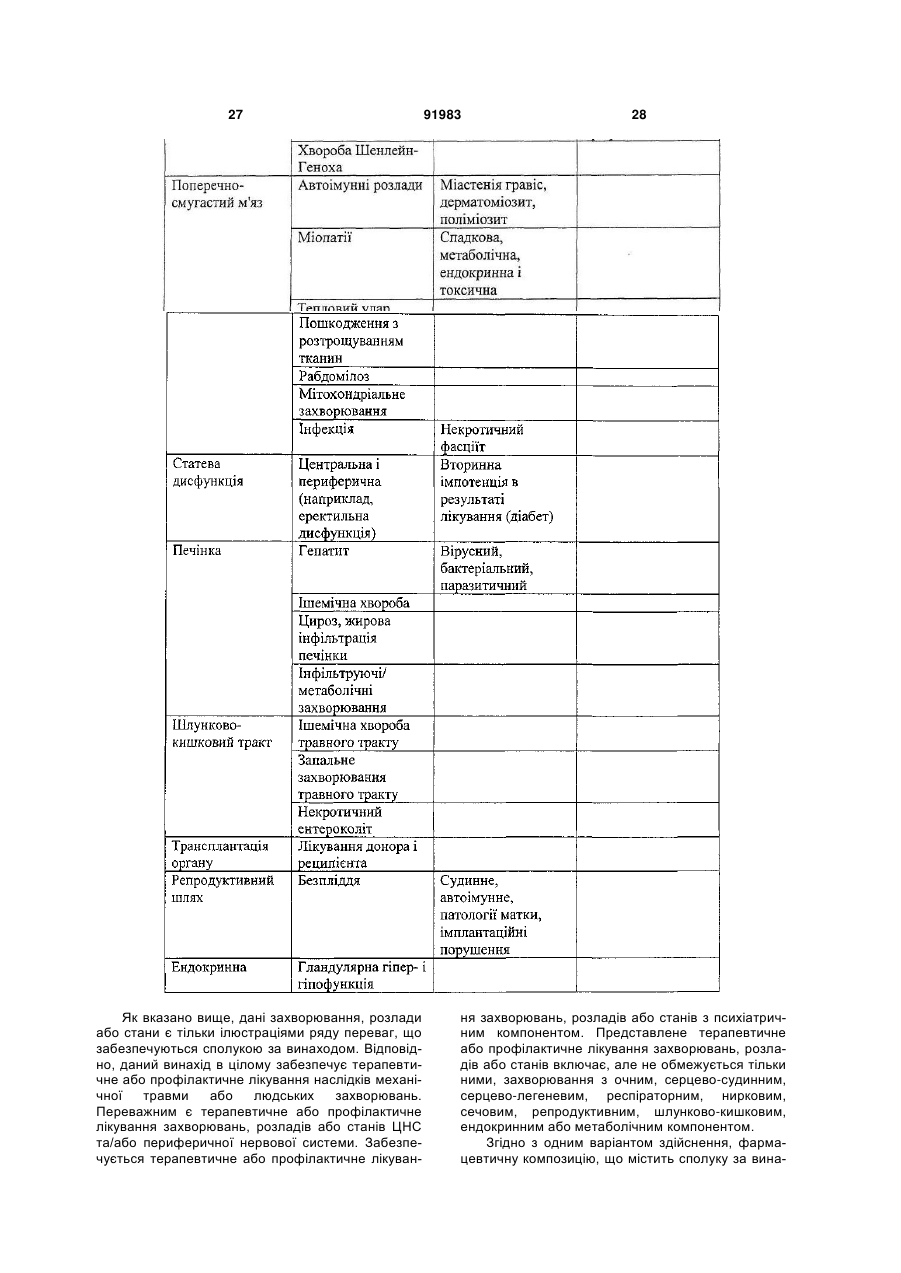
69. Фармацевтична композиція для лікування захворювань центральної нервової системи або периферичної нервової системи, яка містить терапевтично ефективну кількість карбамілованого білка еритропоетину у відповідності з будь-яким з пп. 58-68 і фармацевтично прийнятний носій.
Текст
1. Спосіб одержання карбамілованого білка еритропоетину, при якому здійснюють взаємодію кількості еритропоетину з кількістю ціанату з одержанням продукту, що включає ізоформи карбамілованого білка еритропоетину та є частково агрегованим, який відрізняється тим, що взаємодію еритропоетину з ціанатом здійснюють при pH приблизно 9 та при температурі і протягом періоду часу, необхідними для принаймні приблизно 90% карбамілування аміногруп в лізинах і N-кінцевій амінокислоті еритропоетину, внаслідок чого одержують продукт з менш ніж приблизно 40% агрегованого білка і менш ніж приблизно 40% мас. надмірно і недостатньо карбамілованого білка, визначеного ESI-мас-спектрометрією. 2. Спосіб за п.1, який відрізняється тим, що карбамілований білок еритропоетину є людським еритропоетином. 3. Спосіб за п.1, який відрізняється тим, що карбамілований білок еритропоетину має менш ніж приблизно 30% агрегованого білка. 4. Спосіб за п.1, який відрізняється тим, що карбамілований білок еритропоетину має менш ніж приблизно 20 % агрегованого білка. 5. Спосіб за п.1, який відрізняється тим, що карбамілований білок еритропоетину має менш ніж приблизно 10% агрегованого білка. 6. Спосіб за п.1, який відрізняється тим, що карбамілований білок еритропоетину має менш ніж приблизно 30% мас. надмірно і недостатньо карбамілованого білка. 7. Спосіб за п.1, який відрізняється тим, що карбамілований білок еритропоетину має менш ніж приблизно 20% мас. надмірно і недостатньо карбамілованого білка. 8. Спосіб за п.1, який відрізняється тим, що карбамілований білок еритропоетину має менш ніж приблизно 10% мас. надмірно і недостатньо карбамілованого білка. 9. Спосіб за п.1, який відрізняється тим, що карбамілований білок еритропоетину має менш ніж приблизно 30% мас. надмірно карбамілованого білка. 10. Спосіб за п.1, який відрізняється тим, що карбамілований білок еритропоетину має менш ніж приблизно 20% мас. надмірно карбамілованого білка. UA (21) a200700792 (22) 07.07.2005 (24) 27.09.2010 (86) PCT/DK2005/000477, 07.07.2005 (31) 60/586,370 (32) 07.07.2004 (33) US (31) 60/693,870 (32) 23.06.2005 (33) US (31) PA 2004 01075 (32) 07.07.2004 (33) DK (46) 27.09.2010, Бюл.№ 18, 2010 р. (72) ХРІСТЕНСЕН СЬОРЕН, DK, ФОЛДАҐЕР ЛАРС, DK, ВАЛБ'ЙОРН ЄСПЕР, DK, ТУЕСЕН МАРІАННА ХАЛБЕРҐ, DK, ПЕДЕРСЕН АННЕРС ЄЛХОЛТ, DK, МУНК МОРТЕН, DK (73) Х. ЛУННБЕК А/С, DK (56) PARK KYUNG-DAE ET AL:"Inhibition of erythropoietin activity by cyanate SCANDINAVIAN JOURNAL OF UROLOGY AND NEPHROLOGY, 2004, 38(1), 69-72. PARK KYUNG-DAE ET AL:"Inhibition of erythropoietin activity by cyanate SCANDINAVIAN JOURNAL OF UROLOGY AND NEPHROLOGY, 2004, 38(1), 69-72. MUN KYOCHEOL ET AL: "Impaired biological activity of erythropoietin by cyanate carbamylation". BLOOD PURIFICATION, 2000, 18(1), 13-17. LEIST M. ET AL: "Derivatives of Erythropoietin That Are Tissue Protective But Not Erythropoietic" SCIENCE., vol. 305, no. 5681, 9 July 2004 (2004-07-09), pages 239242. PARK KYUNG-DAE ET AL:"Inhibition of erythropoietin activity by cyanate SCANDINAVIAN JOURNAL OF UROLOGY AND NEPHROLOGY, 2004, 38(1), 69-72. MUN KYO-CHEOL ET AL: "Impaired biological activity of erythropoietin by cyanate carbamylation". BLOOD PURIFICATION, 2000, 18(1), 13-17. LEIST M. ET AL: "Derivatives of Erythropoietin That Are Tissue Protective But Not Erythropoietic" SCIENCE., vol. 305, no. 5681, 9 July 2004 (2004-0709), pages 239-242. WO 02053580 A, 11.07.02. WO 2004112693 A, 29.12.04. 2 (19) 1 3 11. Спосіб за п.1, який відрізняється тим, що карбамілований білок еритропоетину має менш ніж приблизно 10% мас. надмірно карбамілованого білка. 12. Спосіб за п.1, який відрізняється тим, що концентрація взаємодіючого з ціанатом білка еритропоетину становить від приблизно 0,05мг/мл до приблизно 10мг/мл. 13. Спосіб за п.1, який відрізняється тим, що концентрація взаємодіючого з ціанатом білка еритропоетину становить від приблизно 2мг/мл до приблизно 5мг/мл. 14. Спосіб за п.1, який відрізняється тим, що концентрація ціанату становить від приблизно 0,05М до приблизно 10М. 15. Спосіб за п.1, який відрізняється тим, що концентрація ціанату становить від приблизно 0,05М до приблизно 2М. 16. Спосіб за п.1, який відрізняється тим, що температура знаходиться в діапазоні від приблизно 0 °C до приблизно 60 °C. 17. Спосіб за п.1, який відрізняється тим, що температура знаходиться в діапазоні від приблизно 30 °C до приблизно 34°C. 18. Спосіб за п.1, який відрізняється тим, що pH становить приблизно 9. 19. Спосіб за п.1, який відрізняється тим, що pH становить 9,0. 20. Спосіб за п.1, який відрізняється тим, що період часу становить від приблизно 10 хвилин до приблизно 30 діб. 21. Спосіб за п.1, який відрізняється тим, що період часу становить від приблизно 1 години до приблизно 5 діб. 22. Спосіб за п.1, який відрізняється тим, що білок еритропоетину піддають взаємодії з ціанатом у присутності буферного розчину. 23. Спосіб за п.22, який відрізняється тим, що буферним розчином є борат. 24. Спосіб за п.22, який відрізняється тим, що концентрація буферного розчину становить від приблизно 0,05 М до приблизно 2 М. 25. Спосіб за п.22, який відрізняється тим, що концентрація буферного розчину становить від приблизно 0,1 М до приблизно 1 М. 26. Спосіб за п.22, який відрізняється тим, що концентрація буферного розчину становить приблизно 0,5М. 27. Спосіб за п.1, який відрізняється тим, що концентрація взаємодіючого з ціанатом білка еритропоетину становить приблизно 3 мг/мл, концентрація ціанату становить приблизно 0,5М, температура становить приблизно 32°C, pH становить приблизно 9,0, а період часу становить приблизно 24 години. 28. Спосіб одержання карбамілованого білка еритропоетину, при якому здійснюють взаємодію кількості еритропоетину з кількістю ціанату з одержанням продукту, що включає ізоформи карбамілованого білка еритропоетину та є частково агрегованим, який відрізняється тим, що взаємодію еритропоетину з ціанатом здійснюють при pH приблизно 9 та при температурі і протягом періоду часу, необхідними для принаймні приблизно 90% карбамілування аміногруп в лізинах і N 91983 4 кінцевій амінокислоті еритропоетину, одержуючи карбамілований білок еритропоетину з менш ніж приблизно 40% агрегованого білка і менш ніж приблизно 40% мас. надмірно і недостатньо карбамілованого білка, визначеного ESI-масспектрометрією, після чого здійснюють очищення із застосуванням аніонообмінної, катіонообмінної, гідрофобної хроматографії, хроматографії з оберненими фазами, афінної хроматографії або хроматографії з виключенням за розміром, внаслідок чого одержують продукт з менш ніж приблизно 3% агрегованого білка і менш ніж приблизно 40% мас. надмірно і недостатньо карбамілованого білка, визначеного ESI-мас-спектрометрією. 29. Спосіб за п.28, який відрізняється тим, що карбамілований білок еритропоетину є людським еритропоетином. 30. Спосіб за п.28, який відрізняється тим, що карбамілований білок еритропоетину має менш ніж приблизно 2,5% агрегованого білка. 31. Спосіб за п.28, який відрізняється тим, що карбамілований білок еритропоетину має приблизно 0,5% або менше агрегованого білка. 32. Спосіб за п.28, який відрізняється тим, що карбамілований білок еритропоетину має менш ніж приблизно 30% мас. надмірно і недостатньо карбамілованого білка. 33. Спосіб за п.28, який відрізняється тим, що карбамілований білок еритропоетину має менш ніж приблизно 20 % мас. надмірно і недостатньо карбамілованого білка. 34. Спосіб за п.28, який відрізняється тим, що карбамілований білок еритропоетину має менш ніж приблизно 10% мас. надмірно і недостатньо карбамілованого білка. 35. Спосіб за п.28, який відрізняється тим, що карбамілований білок еритропоетину має менш ніж приблизно 30% мас. надмірно карбамілованого білка. 36. Спосіб за п.28, який відрізняється тим, що карбамілований білок еритропоетину має менш ніж приблизно 20% мас. надмірно карбамілованого білка. 37. Спосіб за п.28, який відрізняється тим, що карбамілований білок еритропоетину має менш ніж приблизно 10% мас. надмірно карбамілованого білка. 38. Спосіб за п.28, який відрізняється тим, що концентрація взаємодіючого з ціанатом білка еритропоетину становить від приблизно 0,05мг/мл до приблизно 10мг/мл. 39. Спосіб за п.28, який відрізняється тим, що концентрація взаємодіючого з ціанатом білка еритропоетину становить від приблизно 2мг/мл до приблизно 5мг/мл. 40. Спосіб за п.28, який відрізняється тим, що концентрація взаємодіючого з ціанатом білка еритропоетину становить приблизно 3 мг/мл. 41. Спосіб за п.28, який відрізняється тим, що концентрація ціанату становить від приблизно 0,05М до приблизно 10 М. 42. Спосіб за п.28, який відрізняється тим, що концентрація ціанату становить від приблизно 0,05М до приблизно 2М. 43. Спосіб за п.28, який відрізняється тим, що 5 91983 6 концентрація ціанату становить приблизно 0,5М. 44. Спосіб за п.28, який відрізняється тим, що температура знаходиться в діапазоні від приблизно 0°C до приблизно 60°C. 45. Спосіб за п.28, який відрізняється тим, що температура знаходиться в діапазоні від приблизно 30 °C до приблизно 34°C. 46. Спосіб за п.28, який відрізняється тим, що температура становить приблизно 32°C. 47. Спосіб за п.28, який відрізняється тим, що pH становить приблизно 9. 48. Спосіб за п.28, який відрізняється тим, що pH становить 9,0. 49. Спосіб за п.28, який відрізняється тим, що період часу становить від приблизно 10 хвилин до приблизно 30 діб. 50. Спосіб за п.28, який відрізняється тим, що період часу становить від приблизно 1 години до приблизно 5 діб. 51. Спосіб за п.28, який відрізняється тим, що період часу становить приблизно 24 години. 52. Спосіб за п.28, який відрізняється тим, що білок еритропоетину піддають взаємодії з ціанатом у присутності буферного розчину. 53. Спосіб за п.52, який відрізняється тим, що буферним розчином є борат. 54. Спосіб за п.52, який відрізняється тим, що концентрація буферного розчину становить від приблизно 0,05М до приблизно 2М. 55. Спосіб за п.52, який відрізняється тим, що концентрація буферного розчину становить від приблизно 0,1М до приблизно 1М. 56. Спосіб за п.52, який відрізняється тим, що концентрація буферного розчину становить приблизно 0,5М. 57. Спосіб за п.28, який відрізняється тим, що концентрація взаємодіючого з ціанатом білка еритропоетину становить приблизно 3мг/мл, концентрація ціанату становить приблизно 0,5М, температура становить приблизно 32°C, pH становить приблизно 9,0, а період часу становить приблизно 24 години. 58. Карбамілований білок еритропоетину, що має принаймні приблизно 90% карбамілування первинних амінів лізинів і амінокінцевої амінокислоти, менш ніж приблизно 3% агрегованого білка і менш ніж приблизно 40% мас. надмірно і недостатньо карбамілованого білка, визначеного ESI-масспектрометрією. 59. Карбамілований білок еритропоетину за п.58, де білок еритропоетину є людським еритропоетином. 60. Карбамілований білок еритропоетину за п.58 з менш ніж приблизно 2,5% агрегованого білка. 61. Карбамілований білок еритропоетину за п.58 з менш ніж приблизно 0,5% або менше агрегованого білка. 62. Карбамілований білок еритропоетину за п.58, де кількість агрегованого білка визначена за допомогою SEC-HPLC. 63. Карбамілований білок еритропоетину за п.58 з менш ніж приблизно 30% мас. надмірно і недостатньо карбамілованого білка. 64. Карбамілований білок еритропоетину за п.58 з менш ніж приблизно 20% мас. надмірно і недостатньо карбамілованого білка. 65. Карбамілований білок еритропоетину за п.58 з менш ніж приблизно 10% мас. надмірно і недостатньо карбамілованого білка. 66. Карбамілований білок еритропоетину за п.58 з менш ніж приблизно 30% надмірно карбамілованого білка. 67. Карбамілований білок еритропоетину за п.58 з менш ніж приблизно 20% надмірно карбамілованого білка. 68. Карбамілованоий білок еритропоетину за п.58 з менш ніж приблизно 10% надмірно карбамілованого білка. 69. Фармацевтична композиція для лікування захворювань центральної нервової системи або периферичної нервової системи, яка містить терапевтично ефективну кількість карбамілованого білка еритропоетину у відповідності з будь-яким з пп.5868 і фармацевтично прийнятний носій. Цей винахід відноситься до нової сполуки, а також способу одержання вказаної сполуки. Нову сполуку, що є карбамілованим еритропоетином (СЕРО), карбаміловано по усіх або більшості первинних амінів лізинів і по N-кінцевій амінокислоті молекули, і, крім того, дана сполука має низький рівень карбамілування первинних амінів інших амінокислот в молекулі. Крім того, дана нова сполука вільна від агрегованих білків і полімерів і прийнятна для застосування у фармацевтичних композиціях для лікування захворювань, наприклад, центральної або периферичної нервової системи, та інших тканин, експресуючих центральний рецептор ЕРО. Однією додатковою несподіваною перевагою даного способу одержання є той факт, що спосіб забезпечує одержання продукту, що містить меншу кількість агрегованого білка і меншу кількість полімерів, ніж продукти, що одер жуються за іншими описаними для еритропоетину відомими способами карбамілування. Satake, R. зі співавторами ((1990) Biochimica et Biophysica Acta; 1038: 125-129 і Mun, K-C. and Golper, ТА. (2000) Blood Purif.; 18: 13-17) показали зниження біологічної гематопоетичної активності карбамілованого ЕРО. Brines зі співавторами (2003, патентна заявка США №20030072737) показали, що втрата гематопоетичної активності не перешкоджає тканинним захисним властивостям ЕРО. Карбамілування білків широко відомо як побічний ефект застосування сечовини в очищенні білків і як результат високого рівня сечовини в сироватці. Карбамілування викликане спонтанним розкладанням сечовини до ціанату. Ціанат відповідає за карбамілування первинних амінів білка, оскільки N-кінцева ділянка та лізини білка сприй 7 нятливі до карбамілуванню (креслення Фіг.). Крім того, інші можливі сприйнятливі до карбамілування амінокислотні залишки являють собою аргінін, цистеїн, тирозин, аспарагінову кислоту, глутамінову кислоту та гістидин, проте реакція залежить від рН і не протікає так швидко, як з N-кінцевим залишком і залишком лізину. Hörkkö, S. зі співавторами ((1992) Kidney International.; 41: 1175-1181), Plapp, B.V. зі співавторами ((1971) Jour. Biol. Chem.; 246(4): 939-945), Satake, Я.зі співавторами ((1990) Biochimica et Biophysica Acta; 1038: 125-129) і Mun, K-C. та Golper, T.A. ((2000) Blood Purif.; 18: 13-17) провели дослідження для того, щоб з'ясувати, чи здатне карбамілування білків покращувати або погіршувати біологічну активність білків. Вони досліджували біологічну дію карбамілування білків, використовуючи KCNO як джерело ціанату. В результаті підвищеного карбамілування всі вони спостерігали зниження або зміну біологічної активності. Оцінка ступеня карбамілування була заснована на двох аналітичних способах: 1. Вимірювання зменшення вільних аміногруп із застосуванням аналізу з тринітробензолсульфоновою кислотою (TNBS) і 2. Амінокислотний аналіз, що визначає лізини, перетворені в залишки гомоцитруліну. Hörkkö, S. зі співавторами (1992) виконували карбамілування ліпопротеїну низької густини максимум протягом 6 годин при 37°С 2 Μ KCNO, але, як показав аналіз з TNBS, не одержали повністю карбамілований білок. Plapp, B.V. зі співавторами (1971) вивчали вплив часу і одержали майже повністю карбаміловану бичачу панкреатичну дезоксирибонуклеазу А після 24 годинної обробки 1 Μ KCNO при 37°С. Mun, K-С. та Golper, T.A. (2000) вивчали залежність від часу з максимальним часом реакції 6 годин із застосуванням 2 Μ KCNO. Вони також вивчали дію підвищення концентрації KCNO протягом 6 годин, всі реакції проводили при 37°С. Експерименти були зроблені таким чином, що Mun, K-C. та Golper, T.A. (2000) не змогли встановити точний ступень карбамілування (будь ласка, дивіться рядки 33-35 на стор.16). Автори цього винаходу виявили, що таке карбамілування ЕРО приводить до утворення полімерів і агрегатів, роблячи його, таким чином, біофармацевтично непридатним. Крім того, автори виявили, що утворення таких полімерів і агрегатів залежить від умов процесу карбамілування. Отже, необхідна розробка процесу з оптимальними параметрами стосовно рН, часу, концентрації ціанату, температури, концентрації білка і найбільш важливого параметра - ступеня полімеризації білка. Цей винахід включає оптимальний процес карбамілування з утворенням продукту з низьким ступенем полімеризації і агрегації, і, крім того, несподівано автори винаходу виявили, що одержується повністю карбамілований ЕРО, маючи на увазі N-кінцеву амінокислоту і всі залишки лізину (останнє відбувається у вказаному діапазоні рН). Для видалення агрегатів і полімерів, що утворилися, виконували подальшу стадію способу за винаходом. 91983 8 Одержаний карбамілований чистий ЕРО є новою сполукою, і як такий заявлений в цій заявці поряд з фармацевтичними композиціями, що містять дану сполуку. Раніше було проілюстровано, що ступінь карбамілування залежить від концентрації ціанату та часу. Проте не описано, як проводити процес масштабного карбамілування для виробництва біофармацевтичного продукту. Присутність агрегатів при недостатньо оптимальному одержанні пов'язано з індукцією антитіл. І, отже, присутність агрегатів приводить до неприйнятного для застосування у людей біофармацевтичного продукту. Описаний в цьому винаході спосіб карбамілування і очищення приводить до одержання білка, що характеризується як повністю карбамілований з найменшим з можливого ступенем утворення полімерів або агрегатів і з мінімальною втратою кінцевого продукту, що робить його, таким чином, економічно доцільним. Крім того, одержання карбамілованого білка надає біофармацевтично прийнятний продукт з виключно мінімальним ризиком розвитку імунологічної реакції до білка із-за агрегатів і полімерів. Окрім амінокислотного аналізу, аналітичні способи оцінки повного карбамілування являють собою вимірювання вільних первинних аміногруп із застосуванням TNBS і, нарешті, визначення продукту і розщепленого продукту за допомогою MALDI-TOF. Для одержання фармацевтичних композицій для лікування сприйнятливих до нейрозахисної дії нативного еритропоетину захворювань можна застосовувати нову сполуку за винаходом, що є еритропоетином, який повністю карбамілований на вільних аміногрупах на N-кінцевій амінокислоті та лізинах молекули і, крім того, не агрегований і не полімеризований в кількості понад 2,5% і який містить мінімальну кількість надмірно або недостатньо карбамілованого еритропоетину. Цей винахід відноситься до масштабного способу карбамілування білка для одержання біофармацевтичних продуктів. Крім того, винахід відноситься до продукту, одержаного вказаним способом, до фармацевтичних композицій, що містять цю сполуку, і до застосування даних композицій. Описаний в цій заявці спосіб карбамілування і очищення приводить до одержання білка, що характеризується як повністю карбамілований з найменшим з можливих ступенем утворення полімерів або агрегатів і з мінімальною втратою кінцевого продукту. Спосіб карбамілування оптимізували до одержання карбамілованого білка з найменшою кількістю полімеру або агрегатів, що робить його економічно доцільним способом. Крім того, кінцевий продукт містить обмежені кількості ізоформ надмірно та/або недостатньо карбамілованого еритропоетину (менше або більше 9 карбамілувань на молекулу). Недостатньо карбамілований ЕРО містить менше 9 карбамільних залишків, тобто карбаміловані не усі з 8 лізинів і N-кінцева амінокислота. Недостатньо карбамілований ЕРО може 9 мати, наприклад, близько 5 карбамільних залишків і, проте, не мати класичну активність еритропоетину, роблячи його прийнятним для застосування за цим винаходом. Надмірно карбамілований ЕРО має більше 9 карбамільних залишків і карбамілований на амінокислотах, відмінних від восьми лізинових залишків і N-кінцевої амінокислоти. СЕРО може мати так само і 15 карбамільних залишків і, проте, мати бажану дію, тобто, не мати класичної активності еритропоетину. Принаймні приблизно 90% і найбільш переважно 95% ізоформ СЕРО карбаміловані тільки на 8 лізинових залишках і Nкінцевому залишку. Крім того, обробка карбамілованого білка видаляє агрегований і полімеризований продукт до максимального рівня 3% або 2,5%, і, таким чином, забезпечує біофармацевтично прийнятний продукт з виключно мінімальним ризиком розвитку імунологічної реакції до білка із-за агрегатів і полімерів. Окрім амінокислотного аналізу аналітичні способи оцінки карбамілування являють собою вимірювання вільних первинних аміногруп із застосуванням TNBS і визначення продукту і розщепленого продукту за допомогою MALDI-TOF і РХ-МС/МС. Способи одержання Спосіб карбамілування білків складається з 6 стадій: 1. Концентрація ультрафільтрацією; 2. Модифікування карбамілуванням; 3. Знесолювання гель-фільтрацією; 4. Очищення аніонним обміном; 5. Концентрування і заміна буфера ультра- і діафільтрацією; 6. Фільтрування через фільтр з розміром пор 0,22мкм. За даним способом карбамілування початковою речовиною є ефективно очищений людський ЕРО, але може бути будь-яка форма ЕРО тваринного або людського типа, як необмежуючий приклад, ЕРО являє собою синтетичний, рекомбінантний людський ЕРО або біологічно або хімічно модифікований людський ЕРО, як наприклад, асіало-ЕРО, мутанти людського ЕРО, тобто, молекула з включеними в амінокислотну послідовність замінами, фрагменти ЕРО, пептиди ЕРО, інші білки або суміш білків, якщо бажано карбамілування декількох білків. Перша стадія способу включає підбір концентрації білка ультрафільтрацією, де концентрацію білка підбирають з метою підтримки малого об'єму в ході виробництва. Згідно з переважним варіантом здійснення концентрація білка становить 0,0510мг/мл або 0,05-8мг/мл. Більш переважним варіантом здійснення є 0,05-7мг/мл, а найбільш переважним 2-5мг/мл. Агрегати формуються більшою мірою, якщо концентрація підвищена. Ультрафільтрацію виконують за допомогою ВіоМах (Millipore) з нижньою межею молекулярної маси від 5кДа. Можна застосовувати інші фільтри. Крім того, за допомогою додавання стабілізаторів можна підібрати розчинність білка. Після завершення стадії концентрування білковий розчин змішують з K-борату тетрагідратом, 91983 10 K-ціанатом з рН7-11 або рН7-10. Згідно з переважним варіантом здійснення рН дорівнює 8-10, а найбільш переважно 9,0. Температура знаходиться в діапазоні 0°С-60°С, або 0°С-50°С, або 0°С40°С, або від 0°С до менш ніж 37°С, але переважним варіантом здійснення є температурний інтервал 30-34°С, переважно 32°С, протягом періоду часу 10 хвилин - 30 діб, або 30 хвилин - 30 діб, або 1 година - 30 діб, або 1 година - 20 діб, або 1 година - 10 діб, або 1 година - 5 діб, або 1 година - 2 доби, або 1 година - 26 годин, або 18-26 годин або переважно 22 години - 26 годин, найбільш переважно 24 години. Проте, дані переважні інтервали можна міняти, якщо міняють інші параметри способу, тобто температуру, концентрацію ціанату і концентрацію білка. При зниженні температури нижче граничної, вихід є низьким із-за повільного і неефективного карбамілування. При перевищенні температурних меж вихід є низьким із-за підвищеної агрегації. Ще одним критичним параметром є час, оскільки карбамілування не буде завершеним, якщо час скорочений, або, якщо час збільшений, спостерігають формування агрегатів, що призводить до більш низького виходу. Отже, представлено процес з узгодженими параметрами, тобто, якщо температура знижується, то зменшення реакції карбамілування можна компенсувати за допомогою збільшення концентрації ціанату та/або часу реакції. Крім того, якщо час реакції зменшується, то зменшення реакції карбамілування можна компенсувати за допомогою підвищення температури та/або концентрації ціанату. Нарешті, в способі зі зниженою концентрацією ціанату, зменшення реакції карбамілування можна компенсувати за допомогою підвищення часу реакції та/або температури. Отже, на закінчення необхідно відзначити, що одна значуща зміна одного критичного параметра (часу, температуру, концентрації ціанату та концентрації білка) припускає зміну одного або декількох з решти критичних параметрів для того, щоб одержати повністю карбаміловану молекулу з низьким утворенням агрегатів і полімерів. Концентрація боратного буфера може бути 0,05-2М, але в переважному варіанті здійснення 0,1-1М, а найбільш переважно 0,5Μ із-за істотного гідролізу і полімеризації ціанату при поглинанні протонів і втраті буферної здатності, що приводить до зсуву рН розчину. Крім того, концентрація ціанату переважно знаходиться в інтервалі 0,05-10М, або 0,05-8М, або 0,05-6М, або 0,05-4М, або 0,05-2М, переважним варіантом здійснення є 0,05-1М, а найбільш переважним - 0,5М. Для контролю зсуву рН, викликаного поглинанням протонів використовуваної 0,5Μ концентрації ціанату, необхідна 0,5Μ концентрація боратного буфера. Можна використовувати спосіб із застосуванням інших ціанатних і боратних солей. Крім того, можна застосовувати інші реакційні буфери, крім борату, наприклад, карбонатний буфер або фосфатний буфер. Знесолювання реакційної суміші білка і ціанату виконують хроматографічною гель-фільтрацією. 11 Застосовують матрицю G-25 Fine (Amersham Biosciences). Час витримки до нанесення зразка на колонку контролюють, і він не повинен перевищувати 2 години, оскільки це може викликати додаткове карбамілування і утворення полімеру. Знесолювання і заміну буфера білків можна виконувати діалізом, діа-ультрафільтрацією або хроматографічною гель-фільтрацією. Можна застосовувати інші матриці гель-фільтрації, такі, як наприклад, матриці зшитих полісахаридів або зшитих змішаних полісахаридів, поліакриламід, полістирол або матриці керамічної природи. Крім того, на цій стадії можна міняти висоту колонки. Можна відрегулювати стадію карбамілування для одержання продукту з менше ніж 40% агрегатів і полімерів, або менше ніж 30%, або менше ніж 25%, або менше ніж 20%, або менше ніж 15%, або менше ніж 12,5%, або менше ніж 10%, або менше ніж 8%, або менше ніж 7%. Видалення агрегатів і полімерів виконують за допомогою стадії очищення із застосуванням аніонного обміну. Відзначають, що можна відокремити карбамілований ЕРО від залишків початкової речовини та від агрегатів/полімерів. Буфер для розділення А являє собою: 0,3% Трис (25мМ), 0,3% (50мМ) NaCl, рН8,5±0,2, а буфер для елюювання В: 0,3% Трис (25мМ), 5,8% (1М) NaCl, рН8,5±0,2. Градієнт виконують з 0-30% більше 20 об'ємів колонки, що приводить до бажаного розділення. Стадія очищення може приводити до одержання продукту з менше ніж 3% агрегатів і полімерів, або менше ніж 2,5%, або менше ніж 2%, або менше ніж 1,5%, або менше ніж 1%, або менше ніж приблизно 0,5%. Елюювання і збір і об'єднання піку карбамілованого ЕРО впливає на розподіл неоднорідності елюйованого білка, тобто на ізоформи. Іншими словами, кількість надмірно і недостатньо карбамілованого СЕРО змінюються залежно від способу збору і об'єднання. Точне об'єднання призводить до зниження вмісту надмірно та/або недостатньо карбамілованого еритропоетину. Збільшення інтервалу градієнта забезпечить виділення більш визначеного продукту за допомогою виключення інших продуктів. Один варіант здійснення винаходу являє собою композицію карбамілованого ЕРО з менш ніж приблизно 40% мас. надмірно і недостатньо карбамілованих ізоформ, визначених ESI-масспектрометрією. Більш переважний варіант здійснення являє собою СЕРО з менш ніж приблизно 35% мас. надмірно і недостатньо карбамілованих ізоформ, визначених ESI-мас-спектрометрією. Ще більш переважний варіант здійснення являє собою СЕРО з менш ніж приблизно 30% мас. надмірно і недостатньо карбамілованих ізоформ, визначених ESI-мас-спектрометрією. Ще більш переважний варіант здійснення являє собою СЕРО з менш ніж приблизно 25% мас. надмірно і недостатньо карбамілованих ізоформ, визначених ESI-масспектрометрією. Ще більш переважний варіант здійснення являє собою СЕРО з менш ніж приблизно 20% мас. надмірно і недостатньо карбамілованих ізоформ, визначених ESI-масспектрометрією. Ще більш переважний варіант 91983 12 здійснення являє собою СЕРО з менш ніж приблизно 15% мас. надмірно і недостатньо карбамілованих ізоформ, визначених ESI-масспектрометрією. Ще більш переважний варіант здійснення являє собою СЕРО з менш ніж приблизно 10% мас. надмірно і недостатньо карбамілованих ізоформ, визначених ESI-масспектрометрією. Ще більш переважний варіант здійснення являє собою СЕРО з менш ніж приблизно 5% мас. надмірно і недостатньо карбамілованих ізоформ, визначених ESI-мас-спектрометрією. Ще більш переважний варіант здійснення являє собою СЕРО з менш ніж приблизно 2% мас. надмірно і недостатньо карбамілованих ізоформ, визначених ESI-мас-спектрометрією. Найбільш переважний варіант здійснення являє собою СЕРО з менш ніж приблизно 1% мас. надмірно і недостатньо карбамілованих ізоформ, визначених ESI-масспектрометрією. Крім того, вплив сумарного вмісту ізоформ, збір і об'єднання піку карбамілованого ЕРО впливає на розподіл надмірно карбамілованого СЕРО. Переважно, щоб кількість визначених ESI-масспектрометрією ізоформ надмірно карбамілованого СЕРО становила менш ніж приблизно 35% мас. Ще більш переважно, щоб кількість визначених ESI-мас-спектрометрією ізоформ надмірно карбамілованого СЕРО становила менш ніж приблизно 30% мас, а ще більш переважно, щоб кількість визначених ESI-мас-спектрометрією ізоформ надмірно карбамілованого СЕРО становила менш ніж приблизно 25% мас, а ще більш переважно, щоб кількість визначених ESI-мас-спектрометрією ізоформ надмірно карбамілованого СЕРО становила менш ніж приблизно 20% мас, а ще більш переважно, щоб кількість визначених ESI-масспектрометрією ізоформ надмірно карбамілованого СЕРО становила менш ніж приблизно 15% мас. Найбільш переважно кількість надмірно карбамілованого ЕРО повинна складати не більше, ніж приблизно 10%, приблизно 5% або приблизно 1% мас. від сумарного СЕРО. Можна застосовувати інші буфери для розділення і елюювання, а також інші аніонообмінні матриці та фільтри. Як необмежуючий приклад, матриці є зшитими полісахаридами або зшитими змішаними полісахаридами, поліакриламідом, полістиролом або матрицями керамічної природи. Крім того, для очищення можна рівноцінно застосовувати катіонообмінну, гідрофобну хроматографію, хроматографію з оберненими фазами, афінну хроматографію і хроматографію з виключенням за розміром. У наступній стадії для підбору концентрації і буфера діа/ультрафільтрацією застосовують установку з проточною фільтрацією уздовж потоку. Концентрацію карбамілованого ЕРО коректують до більше 0,5мг/мл і замінюють буфер на буферний розчин з 20мМ цитрату, 100мМ NaCl. Концентрування і заміну буфера виконують за допомогою ВіоМах (Мilliporе) з нижньою межею молекулярної маси від 5кДа. Можна застосовувати інші фільтри. Нарешті, для виключення зростання патогенного середовища очищену біофармацевтичну лікарську речовину фільтрують через фільтр з роз 13 міром пор 0,22мкм із застосуванням Millipak (Мilliporе). Можна застосовувати будь-який фільтр з розміром пор 0,22мкм. Із застосуванням цього способу одержують повністю карбамілований ЕРО з менше ніж 3% або переважно менше ніж 2,5% агрегатів, як виміряно ВЕРХ з виключенням за розміром (SEC-HPLC). Повне карбамілування 8 лізинових залишків підтверджують із застосуванням амінокислотного аналізу, що визначає лізини, перетворені на гомоцитрулін. Крім того, після карбамілування застосовують аналіз з TNBS для визначення первинних амінів, доводячи, таким чином, повне карбамілування лізинів і Текінця. Крім того, повне дослідження із застосуванням MALDI-TOF визначає зміну в початковій масі обробленого PNGaзою білка і білка з N-гліканами. Крім того, MALDI-TOF аналіз пептидних мас за методом "відбитку пальців"/РХ-МС/МС аналіз показують, що усі 8 лізинів і N-кінцева амінокислота карбаміловані. Інші карбаміловані амінокислоти не визначають і не реєструють модифікації гліканів. Крім того, в кінцевому продукті одержують зменшену кількість надмірно і недостатньо карбамілованих форм ЕРО. Даний продукт є новим і заявленим. Один варіант здійснення винаходу являє собою композицію, одержану після стадії карбамілування, але до аніонообмінного очищення, що містить карбамілований ЕРО з менш ніж приблизно 40% мас. агрегатів і полімерів, або менш ніж приблизно 30%, або менш ніж приблизно 25%, або менш ніж приблизно 20%, або менш ніж приблизно 15%, або менш ніж приблизно 12,5%, або менш ніж приблизно 10%, або менш ніж приблизно 8% або менш ніж приблизно 7% і кількість ціанату. Крім того, один варіант здійснення винаходу являє собою композицію, одержану після аніонообмінного очищення, що містить карбамілований ЕРО з менш ніж приблизно 3% мас. агрегатів і полімерів, або менш ніж приблизно 2,5%, або менш ніж приблизно 2%, або менш ніж приблизно 1,5%, або менш ніж приблизно 1%, або менш ніж приблизно 0,5%. Крім того, дана композиція містить ізоформи, що складаються з надмірно або недостатньо карбамілованого ЕРО в кількості менш ніж приблизно 40% мас. від сумарного карбамілованого ЕРО, або більш перевалено менш ніж приблизно 35%, або менш ніж приблизно 30%, або менш ніж приблизно 25%, або менш ніж приблизно 20%, або менш ніж приблизно 15%, або менш ніж приблизно 10%, або менш ніж приблизно 7,5%, або менш ніж приблизно 5%, або менш ніж приблизно 2%, і найбільш переважно менш ніж приблизно 1%. Крім того, кількість надмірно карбамілованого ЕРО в композиції може становити менш ніж приблизно 35% мас. від сумарного карбамілованого ЕРО, або більш переважно менш ніж приблизно 30%, або менш ніж приблизно 25%, або менш ніж приблизно 20%, або менш ніж приблизно 15%, або менш ніж приблизно 10%, або менш ніж приблизно 7,5%, або менш ніж приблизно 5%, або менш ніж приблизно 2%, і найбільш переважно менш ніж приблизно 1%. Фармацевтичні композиції за винаходом 91983 14 Один аспект винаходу являє собою застосування сполук за винаходом для приготування фармацевтичних композицій для застосування у людей або ссавців для лікування описаних нижче станів. Один варіант здійснення винаходу являє собою фармацевтичну композицію, що містить терапевтично ефективну кількість карбамілованого ЕРО з менш ніж приблизно 3% мас. агрегатів і полімерів, або більш переважно менш ніж приблизно 2,5%, або менш ніж приблизно 2%, або менш ніж приблизно 1,5%, або менш ніж приблизно 1%, а найбільш переважно менш ніж приблизно 0,5%, і, крім того, дана композиція містить ізоформи, що складаються з надмірно або недостатньо карбамілованого ЕРО в кількості менш ніж приблизно 40% мас. від сумарного карбамілованого ЕРО, або більш переважно менш ніж приблизно 35%, або менш ніж приблизно 30%, або менш ніж приблизно 25%, або менш ніж приблизно 20%, або менш ніж приблизно 15%, або менш ніж приблизно 10%, або менш ніж приблизно 5%, або менш ніж приблизно 3%, або менш ніж приблизно 2%, а найбільш переважно менш ніж приблизно 1%. Крім того, кількість надмірно карбамілованого ЕРО в композиції може становити менш ніж приблизно 35% мас. від сумарного карбамілованого ЕРО, або більш переважно менш ніж приблизно 30%, або менш ніж приблизно 25%, або менш ніж приблизно 20%, або менш ніж приблизно 15%, або менш ніж приблизно 10%, або менш ніж приблизно 5%, або менш ніж приблизно 3%, або менш ніж приблизно 2%, а найбільш переважно менш ніж приблизно 1%. При здійсненні першого аспекту цього винаходу описану вище фармацевтичну композицію, що містить сполуку за винаходом, можна вводити ссавцю будь-яким способом, що забезпечує необхідний рівень сполуки за винаходом в судинній системі для забезпечення проходження крізь ендотеліально-клітинний бар'єр і сприятливої дії на сприйнятливі клітини. Аналогічні ефекти бажані при використанні з метою перфузії тканини або органу. У випадку, коли клітини або тканина не васкуляризована та/або коли введення являє собою промивання клітин або тканини композицією за винаходом, фармацевтична композиція забезпечує ефективну для лікування клітин кількість сполуки за винаходом. Ендотеліально-клітинні бар'єри, крізь які може проходити сполука за винаходом, включають замикаючі зони, перфоровані з'єднання, фенестровані з'єднання та будь-які інші представлені у ссавця типи ендотеліальних бар'єрів. Як необмежуючий приклад, переважним бар'єром є ендотеліально-клітинне щільне з'єднання. Вказана вище сполука за винаходом, як правило, прийнятна для терапевтичного або профілактичного лікування людських захворювань центральної нервової системи або периферичної нервової системи, що мають, головним чином, неврологічні або психіатричні симптоми, очних захворювань, серцево-судинних захворювань, серцево-легеневих захворювань, респіраторних захворювань, захворювань нирок, захворювань сечових шляхів і захворювань репродуктивної системи, шлунково-кишкових захворювань і ендок 15 ринних і метаболічних порушень. Конкретно, такі стани і захворювання включають гіпоксичні стани, що несприятливо впливають на збудливі тканини, як наприклад, збудливі тканини в тканині центральної нервової системи, тканини периферичної нервової системи, або серцевої тканини, або тканини сітківки, такі як наприклад, в головному мозку, серці або сітківці/оці. Таким чином, сполуку за винаходом можна застосовувати для лікування або профілактики пошкодження збудливої тканини в результаті гіпоксичних станів у ряді умов і обставин. Як не обмежуючі приклади, такі умови і обставини представлені тут далі в таблиці. У прикладі захисту нервової тканини від патологій, що піддаються лікуванню за цим винаходом, такі патології включають стани, що виникли в результаті пониженої оксигенації нервових тканин. Будь-який стан, що знижує доступ кисню до нервової тканини, що призводить до стресу, пошкодження і, нарешті, загибелі нервової клітини, можна лікувати способами за цим винаходом. Як правило, визначувані як гіпоксія та/або ішемія, дані стани виникають в результаті або включають в себе, але не обмежуючись тільки ними, інсульт, судинну оклюзію, пренатальне або постнатальне кисневе голодування, задушення, ядуху, утоплення із загрозою життя, отруєння чадним газом, вдихання диму, травму, включаючи хірургічну і від радіотерапії, асфіксію, епілепсію, гіпоглікемію, хронічне обструктивне захворювання легенів, емфізему, синдром розладу дихання у дорослих, гіпотензивний шок, септичний шок, анафілактичний шок, інсуліновий шок, гостру симптоматику серповидно-клітинної хвороби, зупинку серця, порушення ритму, кесонну хворобу і неврологічні розлади, викликані застосуванням штучного кровообігу. Згідно з одним варіантом здійснення, наприклад, конкретні фармацевтичні композиції, що містять композицію за винаходом, можна вводити для запобігання травмі або пошкодженню тканини, що виникає в результаті ризику травми або пошкодження тканини під час хірургічних процедур, таких, як наприклад, резекція пухлини або лікування аневризми. Інші патології, викликані або виникаючі в результаті гіпоглікемії, що піддаються лікуванню описаними тут способами, включають передозування інсуліну, що також називається ятрогенною гіперінсулінемією, інсуліному, дефіцит соматотропного гормону, гіпокортицизм, передозування лікарського препарату і певні новоутворення. Інші патології, що є результатом пошкодження збудливої нервової тканини, включають судомні розлади, такі як епілепсія, конвульсії або хронічні судомні розлади. Інші стани і захворювання, що піддаються лікуванню, включають, але не обмежуючись тільки ними, захворювання, такі як інсульт (ішемічний інсульт, субарахноїдальний крововилив, внутрішньомозковий крововилив), розсіяний склероз, гіпотензія, зупинка серця, хвороба Альцгеймера, хвороба Паркінсона, церебральний параліч, травма головного або спинного мозку, СНІД-деменція, вікова втрата когнітивної функції, втрата пам'яті, аміотрофічний бічний склероз, судомні розлади, алкоголізм, ішемія сіткі 91983 16 вки, обумовлене глаукомою пошкодження зорового нерва і втрата нейронів. Конкретну композицію та способи за цим винаходом можна застосовувати для лікування запалення, обумовленого хворобливими станами або різними травмами, такими як фізично або хімічно індуковане запалення. Такі травми можуть включати ангіїт, хронічний бронхіт, панкреатит, остеомієліт, ревматоїдний артрит, гломерулонефрит, запалення зорового нерва, темпоральний артеріїт, енцефаліт, менінгіт, поперечний мієліт, дерматоміозит, поліміозит, некротичний фасциліт, гепатит і некротичний ентероколіт. Дані демонструють, що активовані астроцити можуть проявляти цитотоксичну роль по відношенню до нейронів, продукуючи нейротоксини. Оксид азоту, активні форми кисню і цитокіни синтезуються гліальними клітинами у відповідь на церебральну ішемію (дивися Becker, K.J. 2001. Targeting the central nervous system inflammatory response in ischemic stroke. Curr Opinion Neurol 14: 349-353 і Mattson, M.P., Culmsee, C, and Yu, Z.F. 2000. Apoptotic і Antiapoptotic mechanisms in stroke. Cell TissueRes 301: 173-187.). Крім того, дослідження демонструють, що на моделях нейродегенерації активація глії і подальше продукування запальних цитокінів залежить від первинного нейронного пошкодження (дивися Viviani, В., Corsini, E., Galli, C.L., Padovani, Α., Ciusani, Ε., and Marinovich, Μ. 2000. Dying neural cells activate glia through the release of a protease product. Glia 32: 84-90 і Rabuffetti, M., Scioratti, C, Tarozzo, G., Clementi, E., Manfredi, A.A., and Beltramo, M. 2000. Inhibition of caspase-1-like activity by Ac-Tyr-Val-AlaAsp-chloromethyl ketone includes long lasting neuroprotection in cerebral ischemia through apoptosis reduction and decrease of proinflammatory cytokines. J Neurosci 20: 4398-4404). Запалення і активація глії властиві різним формам нейродегенеративних розладів, що включають церебральну ішемію, травму головного мозку і експериментальний алергічний енцефаломієліт, розлади, при яких еритропоетин виявляє нейрозахисну дію. Інгібування продукування цитокінів еритропоетином може принаймні частково, опосередкувати його захисний ефект. Проте, на відміну від "класичних" протизапальних цитокінів, таких як IL-10 і IL-13, що інгібують безпосередньо фактор некрозу пухлини, еритропоетин виявляється активним тільки за наявності загибелі нейрона. Не бажаючи бути обмеженими будь-якою конкретною теорією, вважаємо, що дану протизапальну активність можна гіпотетично пояснити декількома необмежувальними теоріями. По-перше, оскільки еритропоетин запобігає апоптозу, то можна запобігти й викликаним апоптозом запальним подіям. Крім того, еритропоетин може запобігати вивільненню молекулярних сигналів від помираючих нейронів, стимулюючих клітини глії або здатних діяти безпосередньо на клітини глії, що знижують їх взаємодію з даними продуктами. Ще одна можливість полягає в тому, що еритропоетин спрямований на більш проксимальних учасників запального каскаду (наприклад, каспазу 1, реак 17 ційно-здатний кисень або проміжні сполуки азоту), що запускають апоптоз і запалення. Крім того, очевидно, що еритропоетин забезпечує протизапальний захист без зворотної дії, звичайно пов'язаної з іншими протизапальними сполуками, такими як дексаметазон. Знову не бажаючи бути зв'язаними будь-якою конкретною теорією, вважаємо, що це може бути обумовлено дією еритропоетину на нейротоксини з широким спектром дії, такі як оксид азоту (NO). Хоча у відповідь на різні травми активовані астроцити і мікроглія продукують нейротоксичні кількості NO, NO служить для багатьох цілей в організмі, що включають модуляцію необхідних фізіологічних функцій. Таким чином, хоча застосування протизапального засобу може ослабити запалення за допомогою супресії NО або інших нейротоксинів, якщо протизапальний засіб має дуже довгий період напіввиведення, він також може перехрещуватися із призначеннями даних хімічних реагентів щодо відновлення пошкодження, викликаного травмою, що приводить до запалення. Припускають, що сполука за цим винаходом здатна послабляти запалення без інтерференції з відновлювальними можливостями нейротоксинів, таких як NО. Конкретні композиції та способи за винаходом можна застосовувати для лікування станів і пошкоджень тканини сітківки. Такі захворювання включають, але не обмежуючись тільки ними, ішемію сітківки, дистрофію жовтої плями, відшаровування сітківки, пігментну дегенерацію сітківки, артеріосклеротичну ретинопатію, гіпертензивну ретинопатію, закупорку артерії сітківки, закупорку вени сітківки, гіпотензію і діабетичну ретинопатію. Згідно з ще одним з варіантів здійснення, способи і принципи цього винаходу можна застосовувати для профілактики або лікування пошкоджень, викликаних променевим ураженням, або індукованого хіміотерапією пошкодження збудливої тканини. Необмежувальним прикладом є захист від пошкоджень, викликаних сполуками, такими як таксани, цисплатин і інші хіміотерапевтичні засоби, здатні індукувати периферичну невропатію. Додаткова користь способів за цим винаходом полягає в лікуванні нейротоксичного отруєння, такого як отруєння домоєвою кислотою молюска, нейролатиризм і хвороба Гуама, аміотрофічний бічний склероз і хвороба Паркінсона. Як вказано вище, цей винахід також відноситься до способу посилення функції збудливості тканини у ссавця за допомогою периферичного введення сполуки за винаходом, як описано вище. Різні захворювання і розлади піддаються лікуванню із застосуванням даного способу, і, крім того, даний спосіб прийнятний для посилення когнітивної функції за відсутності будь-якого розладу або захворювання. Такі застосування цього винаходу описані в додатковій частині далі та включають поліпшення пізнавальної здатності та навчання у людини і ссавців, що не відносяться до людини. Розлади і захворювання, що піддаються лікуванню за допомогою способів згідно з цим аспектом даного винаходу, спрямованого на центральну нервову систему, включають, але не обмежуються тільки ними, розлади настрою, тривожні розлади, 91983 18 депресію, аутизм, синдром дефіциту уваги з гіперактивністю і когнітивну дисфункцію. При даних розладах характерно посилення нейронної функції. Інші розлади, що піддаються лікуванню відповідно до задуму цього винаходу включають, наприклад, розлад сну, апное уві сні та розлади, пов'язані з подорожами; субарахноїдальні та аневризматичні кровотечі, гіпотензивний шок, ударне пошкодження, септичний шок, анафілактичний шок і ускладнення різних енцефалітів і менінгітів, наприклад, пов'язані із захворюванням сполучної тканини енцефаліти, як наприклад, туберкульоз шкіри. Інші застосування включають профілактику або захист від отруєння нейротоксинами, такого як отруєння домоєвою кислотою молюска, нейролатиризм і хвороба Гуама, аміотрофічний бічний склероз, хвороба Паркінсона; постопераційного лікування емболії або ішемічного пошкодження; тотальне опромінювання головного мозку; гостра симптоматика серповидно-клітинної хвороби і еклампсія. Додаткова група тих розладів, що піддаються лікуванню способами за цим винаходом, включає мітохондріальну дисфункцію спадкової або придбаної природи, що є причиною ряду неврологічних захворювань, що є типовим прикладом нейронального пошкодження і загибелі. Наприклад, хвороба Лі (підгостра некротична енцефалопатія) характеризується прогресивною втратою зору та енцефалопатією із-за різкого зниження нейронної функції і міопатією. У цих випадках, дефектний мітохондріальний метаболізм не в змозі постачати достатньо високі енергетичні субстрати для підтримки метаболізму збудливих клітин. Модулятор активності рецептора еритропоетину оптимізує недостатню функцію у ряді мітохондріальних захворювань. Як вказано вище, гіпоксичні стани несприятливо діють на збудливі тканини. Збудливі тканини включають як не обмежуючі приклади в себе тканину центральної нервової системи, тканину периферичної нервової системи і серцеву тканину. Окрім описаних вище станів, способи за цим винаходом прийнятні для лікування отруєння вдиханням, наприклад, чадного газу, і вдихання диму, важкої астми, синдрому розладу дихання у дорослих, задушення, ядухи і утоплення із загрозою життя. Додаткові стани, що створюють гіпоксичні умови або що індукують пошкодження збудливої тканини іншими способами, включають гіпоглікемію, яка може відбутися при неадекватному дозуванні інсуліну або при інсулін-продукуючих новоутвореннях (інсулінома). Як вважається, різні нейрофізіологічні розлади, що виникають із-за пошкодження збудливої тканини, піддаються лікуванню за допомогою термінових процедур. Хронічні розлади, в які залучено нейрональне пошкодження і лікування яких забезпечується за цим винаходом, включають розлади, пов'язані з центральною нервовою системою та/або периферичною нервовою системою, включаючи вікову втрату когнітивної функції і сенільну деменцію, хронічні судомні розлади, хворобу Альцгеймера, хворобу Паркінсона, деменцію, втрату пам'яті, аміотрофічний латеральний склероз, розсіяний склероз, туберозний склероз, хво 19 робу Вільсона, церебральний і прогресивний над'ядерний параліч, хворобу Гуама, деменцію з тільцями Леві, прионні захворювання, такі як спонгійна енцефалопатія, наприклад, хвороба Крейцфельдта-Якоба, хворобу Хантингтона, міотонічну дистрофію, хворобу Шарко-Марі-Тута, атаксію Фрідріха та інші атаксії, а також синдром Жілля де ла Туретта, судомні розлади, такі як епілепсія і хронічні судомні розлади, інсульт, травму головного або спинного мозку, СНІД-деменцію, алкоголізм, аутизм, ішемію сітківки, глаукому, розлади автоматичної функції, такі як гіпертензія і розлади сну, і нейропсихіатричні розлади, що включають, але не обмежуються тільки ними, шизофренію, шизоафективний розлад, синдром порушення уваги з гіперактивністю, дистимічний розлад, великий депресивний розлад, манію, обсесивно-компульсивний розлад, розлади, пов'язані із застосуванням психоактивних речовин, тривожний розлад, панічний 91983 20 розлад, а також уніполярні та біполярні афективні розлади. Додаткові нейропсихіатричні та нейродегенеративні розлади включають, наприклад, розлади, вказані в керівництві American Psychiatric Association's Diagnostic i Statistical Manual of Mental Disorders (DSM), остання версія, IV, яке повністю включено сюди шляхом посилання. Згідно з ще одним варіантом здійснення можна застосовувати рекомбінантні химерні молекули токсинів, що містять сполуку за винаходом, для терапевтичного застосування токсинів для лікування проліферативного захворювання, такого як злоякісна пухлина, або вірусного захворювання, такого як підгострий склерозуючий паненцефаліт. В таблиці 1 перелічені необмежувальні додаткові приклади відносно різних станів і захворювань, що піддаються лікуванню вказаними вище сполуками за винаходом. 21 91983 22 23 91983 24 25 91983 26 27 Як вказано вище, дані захворювання, розлади або стани є тільки ілюстраціями ряду переваг, що забезпечуються сполукою за винаходом. Відповідно, даний винахід в цілому забезпечує терапевтичне або профілактичне лікування наслідків механічної травми або людських захворювань. Переважним є терапевтичне або профілактичне лікування захворювань, розладів або станів ЦНС та/або периферичної нервової системи. Забезпечується терапевтичне або профілактичне лікуван 91983 28 ня захворювань, розладів або станів з психіатричним компонентом. Представлене терапевтичне або профілактичне лікування захворювань, розладів або станів включає, але не обмежується тільки ними, захворювання з очним, серцево-судинним, серцево-легеневим, респіраторним, нирковим, сечовим, репродуктивним, шлунково-кишковим, ендокринним або метаболічним компонентом. Згідно з одним варіантом здійснення, фармацевтичну композицію, що містить сполуку за вина 29 ходом, можна вводити системно для захисту або поліпшення стану цільових клітин, тканини або органу. Таке введення може бути парентеральним, за допомогою інгаляції, через слизисту оболонку, наприклад, пероральним, назальним, ректальним, інтравагінальним, сублінгвальним, підслизовим введенням або трансдермальним. Переважним є парентеральне введення, наприклад, внутрішньовенною або інтраперитонеальною ін'єкцію, а також включаючи, але не обмежуючись тільки ними, внутрішньоартеріальне, внутрішньом'язове, внутрішньошкірне і підшкірне введення. Для інших шляхів введення, якими вводять фармацевтичну композицію, як наприклад, застосування перфузату, ін'єкції в орган або іншого місцевого введення, буде досягнутий результат стосовно відповідних концентрацій сполуки за винаходом, як описано вище. Переважна концентрація становить приблизно 0,01 пМ - 30 нМ. Фармацевтичні композиції за винаходом можуть містити терапевтично ефективну кількість сполуки і фармацевтично прийнятний носій. У конкретному варіанті здійснення термін "фармацевтично прийнятний" означає засоби, схвалені Федеральним регулюючим органом або урядом штату або перелічені в американській Фармакопеї або іншій загальновизнаній іноземній фармакопеї для застосування у тварин, а конкретніше, у людей. Термін "носій" відноситься до розчинника, ад'юванту, ексципієнту або носія, з яким вводять ліки. Такі фармацевтичні носії можуть бути стерильними рідинами, такими як сольові розчини у воді та оліях, що включають оливи та олії з нафтопродуктів, тварин, рослинного або синтетичного походження, такі як арахісову олію, соєву олію, мінеральну оливу, кунжутну олію і т.п.Переважним носієм є фізіологічний розчин, коли фармацевтичну композицію вводять внутрівенно. Як рідкі носії, конкретно для ін'єкційних розчинів також можна застосовувати сольові розчини, і водний розчин декстрози, і розчини гліцерину. Фармацевтично прийнятні наповнювачі включають крохмаль, глюкозу, лактозу, сахарозу, желатин, солод, рис, муку, крейду, силікагель, стеарат натрію, моностеарат гліцерину, тальк, хлорид натрію, сухе зняте молоко, гліцерин, пропілен, гліколь, воду, етанол і т.п.Якщо бажано, композиція також може містити невеликі кількості зволожувачів, або емульгаторів, або рН-буферів. Дані композиції можуть приймати форму розчинів, суспензій, емульсій, пігулок, пілюль, капсул, порошків, складів із уповільненим вивільненням і т.п.Композицію можна виготовляти як супозиторії із звичайними зв'язуючими речовинами і носіями, такими як тригліцериди. Сполуки за винаходом можна виготовляти як нейтральні або сольові форми. Фармацевтично прийнятні солі включають солі, утворені вільними аміногрупами, такі як одержані з соляною, фосфорною, оцтовою, щавлевою, винною кислотою тощо, і солі, утворені вільними карбоксильними групами, як наприклад, солі, одержані з натрію, калію, амонію, кальцію, гідроксидів заліза, ізопропіламіну, триетиламіну, 2етиламіноетанолу, гістидину, прокаіну і т.д. Приклади прийнятних фармацевтичних носіїв описані в керівництві "Remington's Pharmaceutical Sciences", 91983 30 автор E.W. Martin. Такі композиції містять терапевтично ефективну кількість сполуки, переважно в очищеній формі, разом з прийнятною кількістю носія для забезпечення форми для відповідного введення пацієнту. Композиція повинна відповідати способу введення. Пристосовані для перорального введення фармацевтичні композиції можна виготовити у вигляді капсул або пігулок; у вигляді порошків або гранул; у вигляді розчинів, сиропів або суспензій (у водних або неводних рідинах); у вигляді їстівної піни або кремів або у вигляді емульсій. Пігулки або тверді желатинові капсули можуть містити лактозу, крохмаль або їх похідні, стеарат магнію, натрієву сіль сахарину, целюлозу, карбонат магнію, стеаринову кислоту або її солі. М'які желатинові капсули можуть містити рослинні олії, віск, жири, напівтверді або рідкі поліолі і т.д. Розчини і сиропи можуть містити воду, поліолі та цукри. Призначену для перорального введення активну речовину можна покривати або змішувати з речовиною, що затримує розпад і/або абсорбцію активної речовини в шлунково-кишковому тракті (наприклад, можна застосовувати гліцерилмоностеарат або гліцерилдистеарат). Таким чином, можна досягти уповільненого вивільнення активної речовини протягом багатьох годин, і, якщо необхідно, активну речовину можна захищати від деградації в шлунку. Для полегшення вивільнення активної речовини в конкретній ділянці шлунковокишкового тракту фармацевтичні композиції для перорального введення можна формулювати для визначеного рН або ферментативних умов. Пристосовані для трансдермального введення фармацевтичні композиції можна виготовити у вигляді дискретних частин, призначених для знаходження в безпосередньому контакті з епідермісом реципієнта протягом тривалого проміжку часу. Пристосовані для місцевого введення фармацевтичні композиції можна виготовити у вигляді мазей, кремів, суспензій, лосьйонів, порошків, розчинів, паст, гелів, спреїв, аерозолів або олій. Для місцевого застосування на шкірі, у роті, на оці або на інших зовнішніх тканинах переважно застосовувати місцево мазь або крем. При формулюванні у вигляді мазі активний інгредієнт можна застосовувати з парафіновою або водорозчинною мазевою основою. Як альтернатива, активний інгредієнт можна виготовити як крем з основою "олія-в-воді" або основою "вода-в-олії". Пристосовані до місцевого введення в очі фармацевтичні композиції включають очні краплі. У даних композиціях активний інгредієнт може бути розчиненим або суспендованим в прийнятному носії, наприклад, у водному розчиннику. Пристосовані до місцевого введення в ротовій порожнині фармацевтичні композиції включають пігулки, пастили і рідини для полоскання рота. Пристосовані для назального та легеневого введення фармацевтичні композиції можуть містити тверді носії, такі як порошки (переважно з розміром частинок в діапазоні від 20 до 500 мікрон). Порошки можна вводити вдиханням, тобто за допомогою швидкого вдихання носом з піднесеного близько до носа контейнера з порошком. Як аль 31 тернатива, пристосовані для назального введення композиції можуть містити рідкі носії, наприклад, спреї для носа або краплі для носа. Як альтернатива, інгаляцію безпосередньо в легені можна виконувати за допомогою глибокої інгаляції або установки загубника в ротоглотку. Дані композиції можуть містити водні або масляні розчини активного інгредієнта. Композиції для введення інгаляцією можна поставляти в спеціально зроблених пристроях, що включають, але не обмежуються тільки ними, аерозолі під тиском, розпилювачі або порошковдувачі, які можна конструювати для введення визначених наперед доз активного інгредієнта. Згідно з переважним варіантом здійснення, фармацевтичні композиції за винаходом вводять прямо в носову порожнину або легені через носову порожнину або ротоглотку. Пристосовані для ректального введення фармацевтичні композиції можна виготовити у вигляді супозиторієв або клізм. Пристосовані для вагінального введення фармацевтичні композиції можна виготовити у вигляді вагінальних супозиторіїв, тампонів, кремів, гелів, паст, піни або аерозольних препаратів. Пристосовані для парентерального введення фармацевтичні композиції включають водні та неводні стерильні ін'єкційні розчини або суспензії, які можуть містити антиоксиданти, буферні розчини, бактеріостатичні речовини і розчини з кров'ю передбачуваного реципієнта, що перетворюють композиції, головним чином, в ізотонічні. Інші компоненти, які можуть бути присутніми в таких композиціях, включають, наприклад, воду, спирти, поліолі, гліцерин і рослинні олії. Пристосовані для парентерального введення фармацевтичні композиції можна випускати в контейнерах, що містять одну або багато доз, наприклад, герметично закритих ампулах і флаконах, і можна зберігати у висушеному сублімацією (ліофілізованому) стані, що вимагає тільки додавання стерильного рідкого носія безпосередньо перед застосуванням, наприклад, стерильного фізіологічного розчину для ін'єкцій. Призначені для негайного прийому ін'єкційні розчини і суспензії можна приготувати з порошків, гранул і пігулок. Згідно з одним варіантом здійснення можна виготовити автоінжектор, що містить ін'єкційний розчин сполуки за винаходом, який можна використовувати для невідкладного застосування в машинах швидкої допомоги, пунктах медичної допомоги і в умовах бойових дій, а також для самостійного введення в домашніх умовах, особливо у випадках можливої травматичної ампутації, як наприклад, необережного поводження з газонокосаркою. Вірогідність виживання клітин і тканин у відрізаній нозі або пальці ноги після реплантації можна збільшити введенням сполуки за винаходом в декілька ділянок у відрізану частину, як тільки здійснення цього стане можливим, навіть до прибуття медичного персоналу на місце події або до доставки постраждалого індивідуума з відрізаним пальцем ноги у відділення невідкладної хірургії. Згідно з переважним варіантом здійснення композицію виготовляють відповідно до загальноприйнятих способів як фармацевтичну компози 91983 32 цію, пристосовану для внутрішньовенного введення людям. Як правило, композиції для внутрішньовенного введення є розчинами в стерильному ізотонічному водному буфері. Якщо необхідно, композиція також може включати розчинник і місцевий анестетик для зняття болю в ділянці ін'єкції, як наприклад, лідокаїн. Як правило, інгредієнти комплектують окремо або змішують разом в стандартну лікарську форму, наприклад, у вигляді сухого ліофілізованого порошку або безводного концентрату в герметично закритому контейнері, такому як ампула або пакет-саше з вказівкою кількості активної речовини. При інфузійному введенні композицію можна дозувати за допомогою інфузійної судини, що містить фармацевтично стерильну воду або фізіологічний розчин. При введенні композиції за допомогою ін'єкції ампулу із стерильним фізіологічним розчином можна приготувати так, щоб інгредієнти можна було змішати безпосередньо перед введенням. Як правило, супозиторії містять активну речовину в діапазоні від 0,5% до 10% мас; пероральні препарати переважно містять від 10% до 95% активної речовини. Композицію-перфузат можна приготувати для застосування в судинах для пересаджених органів, для перфузії in situ або для введення в судинну систему донорського органу перед його забором. Такі фармацевтичні композиції можуть містити неприйнятні для гострого або хронічного, місцевого або системного введення індивідууму концентрації сполуки за винаходом, але вони можуть задовольняти визначеним тут функціям в трупі, судині для органу, перфузаті для органу або перфузаті in situ до видалення або зниження концентрацій сполуки за винаходом, що містилися там, до видалення або повернення обробленого органу або тканини до умов регулярного кровообігу. Винахід також відноситься до фармацевтичної упаковки або набору, що містить один або декілька контейнерів, заповнених одним або декількома інгредієнтами фармацевтичних композицій за винаходом. Такий(і) контейнер(и) необов'язково супроводжуються повідомленням у формі, встановленій державними органами, контролюючими виробництво, застосування або продаж фармацевтичних препаратів або біологічних продуктів; таке повідомлення відображує ухвалення введення людям, надане органами, контролюючими виробництво, застосування або продаж. Згідно з ще одним варіантом здійснення, наприклад, сполуку за винаходом можна випускати в системі з контрольованим вивільненням. Наприклад, поліпептид можна вводити із застосуванням внутрішньовенної інфузії, імплантованої осмотичної помпи, трансдермального пластиру, ліпосом або інших способів введення. Згідно з одним варіантом здійснення молена застосовувати помпу (дивися Langer, вище; Sefton, 1987, CRC Crit. Ref. Biomed. Eng. 14: 201; Buchwald et al., 1980, Surgery 88: 507; Saudek et al., 1989, N. Engl. J. Med. 321: 574). Згідно з ще одним варіантом здійснення сполуку можна доставляти у везикулі, конкретно, ліпосомі (дивися Langer, Science 249: 1527-1533 33 (1990); Treat et al., in Liposomes in the Therapy of Infectious Disease and Cancer, Lopez-Berestein and Fidler (eds.), Liss, New York, pp.353-365 (1989); WO 91/04014; патент США №4704355; Lopez-Berestein, там же, pp. 317-327; дивися взагалі там же). Згідно з ще одним варіантом здійснення можна застосовувати полімерні матеріали (дивися Medical Applications of Controlled Release, Langer and Wise (eds.), CRC Press: Boca Raton, Florida, 1974; Controlled Drug Bioavailability, Drug Product Design and Performance, Smolen and Ball (eds.), Wiley: New York (1984); Ranger and Peppas, J. Macromol. Sci. Rev. Macromol. Chem. 23: 61, 1953; також дивися Levy et al., 1985, Science 228: 190; During et al., 1989, Ann. Neurol. 25: 351; Howard et al, 1989, J. Neurosurg. 71: 105). Згідно з ще одним варіантом здійснення систему з контрольованим вивільненням можна поміщати близько від терапевтичної мішені, тобто цільових клітин, тканини або органу, що вимагає, таким чином, тільки частини системної дози (дивися, наприклад, Goodson, pp.115-138 in Medical Applications of Controlled Release, vol.2, вище, 1984). Інші системи з контрольованим вивільненням обговорюються в огляді Langer (1990, Science 249: 1527-1533). Згідно з ще одним варіантом здійснення сполуку за винаходом у вигляді відповідного складу можна вводити за допомогою назального, перорального, ректального, вагінального або сублінгвального введення. У конкретному варіанті здійснення може бути бажаним введення композицій за винаходом місцево в потребуючу лікування ділянку; цього можна досягти, наприклад, але не обмежуючись тільки ними, локальною інфузією під час хірургічної операції, місцевою аплікацією, наприклад, в поєднанні з обробкою рани після хірургічної операції, ін'єкцією, за допомогою катетера, за допомогою супозиторія або за допомогою імплантату, вказаний імплантат є пористим, непористим або гелеподібним матеріалом, що включає мембрани, як наприклад, силіконові мембрани, або нитки. Вибір переважної ефективної дози кваліфікований фахівець проводить на підставі розгляду декількох чинників, відомих звичайному фахівцю в даній галузі. Такі чинники включають конкретну форму сполуки за винаходом і її фармакокінетичні параметри, такі як біодоступність, метаболізм, період напіввиведення і т.д., визначені під час стандартних процедур розробки, звичайно використовуваних при одержанні дозволу контролюючого органу для фармацевтичної сполуки. Додаткові чинники щодо дози включають стан, що піддається лікуванню, або захворювання, або досягнення користі у нормального індивідуума, масу тіла пацієнта, шлях введення, якщо введення є гострим або хронічним, супутні призначення лікарських засобів та інші чинники, добре відомі для досягнення ефекту від введених фармацевтичних речовин. Таким чином, точне дозування слід визначати згідно з висновком практикуючого лікаря і обставин кожного пацієнта, наприклад, залежно від стану та імунного статусу окремого пацієнта, і відповідно до стандартних клінічних методик. 91983 34 За ще одним аспектом цього винаходу перфузат або перфузійний розчин виготовляють для перфузії та зберігання органів для трансплантації; цей перфузійний розчин містить кількість сполуки за винаходом, ефективну для захисту сприйнятливих клітин і асоційованих клітин, тканин або органів. Трансплантація як необмежуючий приклад включає ксенотрансплантацію, де орган (включаючи клітини, тканину або іншу частину тіла) забирають від одного донора та пересаджують до іншого реципієнта; і аутотрансплантацію, при якій орган забирають з однієї частини тіла та поміщають до іншої, включаючи хірургічні процедури на столі, при яких орган можна видалити, а під час його положення ex vivo резеціювати, відновити або іншим чином обробити, як наприклад, видалення пухлини, а потім повернути в початкове положення. Згідно з одним варіантом здійснення перфузійний розчин є розчином, розробленим Університетом штату Вісконсін (University of Wisconsin (UW)) (патент США №4798824), що містить від приблизно 1 до приблизно 25Од/мл еритропоетину, 5% гідроксіетилкрохмалю (з молекулярною масою від приблизно 200000 до приблизно 300000 і в значній мірі вільного від етиленгліколю, етиленхлоргідрину, хлориду натрію і ацетону); 25мМ KН2РО4; 3мМ глутатіону; 5мМ аденозину; 10мМ глюкози; 10мМ буферного розчину HEPES; 5мМ глюконату магнію; 1,5мМ СаСl2; 105мМ глюконату натрію; 200000 одиниць пеніциліну; 40 одиниць інсуліну; 16мг дексаметазону; 12мг фенолового червоного; з рН7,4-7,5 і осмотичною концентрацією розчина приблизно 320мОсм/л. Розчин застосовують для підтримки трупних нирок і підшлункових залоз до трансплантації. Із застосуванням цього розчину консервацію можна продовжувати довше 30-годинного обмеження, рекомендованого для консервації трупних нирок. Даний конкретний перфузат є лише ілюстративним з ряду подібних розчинів, які можна пристосувати для цього застосування включенням ефективної кількості сполуки за винаходом. За додатковим варіантом здійснення перфузійний розчин містить від приблизно 0,01пг/мл до приблизно 400нг/мл сполуки за винаходом або від приблизно 40 до приблизно 300нг/мл сполуки за винаходом. Тоді як переважним реципієнтом сполуки за винаходом у всіх цілях тут є людина, вживані тут способи однакові для всіх ссавців, зокрема одомашнених тварин, худоби, домашніх тварин і тварин зоопарку. Отже, винахід не обмежений таким чином, і переваги можна застосовувати до будьякого ссавця. Терапевтичні та профілактичні застосування сполук за винаходом Як відмічено далі в прикладі 1, присутність рецепторів еритропоетину в ендотелії капілярів головного мозку людини указує, що мішені сполук за винаходом присутні в головному мозку людини, а дослідження на тваринах даних сполук за винаходом безпосередньо переносяться на лікування або профілактику людей. За ще одним аспектом винаходу способи та композиції для поліпшення життєздатності клітин, тканин або органів, не відокремлених від судинної 35 системи ендотеліально-клітинним бар'єром, забезпечують безпосередню дію на клітини, тканини або органи фармацевтичної композиції що містить сполуку за винаходом або введенням, або взаємодією сполуки за винаходом - взаємодією фармацевтичної композиції - з судинною системою тканини або органу. Посилена активність сприйнятливих клітин в обробленій тканині або органі сприяє наданим позитивним ефектам. Як описано вище, винахід частково заснований на відкритті, що молекули еритропоетину можна транспортувати від люмінальної поверхні до базальної поверхні мембрани ендотеліальних клітин капілярів органів з ендотеліально-клітинними щільними контактами, що включають, наприклад, головний мозок, сітківку і яєчка. Таким чином, сприйнятливі клітини упоперек бар'єру є сприйнятливими мішенями для лікувальних дій сполуки за винаходом, а інші типи клітин або тканин або органів, що містять і залежать повністю або частково від сприйнятливих клітин, є тут мішенями для способів за винаходом. Не бажаючи бути обмеженими будь-якою конкретною теорією, все ж таки вважаємо, що після трансцитоза сполуки за винаходом, сполука за винаходом може взаємодіяти з рецептором еритропоетину на сприйнятливій клітині, наприклад, нервовій, ретинальній, м'язовій, серцевій, легеневій, печінковій, нирковій, клітині тонкого кишечнику, кори надниркових залоз, мозкової речовини надниркових залоз, капілярного ендотелію, яєчок, яєчників, підшлункової залози, кісткової, клітини шкіри або ендометріальної клітини, а зв'язування рецептора може ініціювати сигнальну передачу по каскаду, приводячи до активації програми генної експресії в сприйнятливій клітині або тканині, приводячи до захисту клітини, або тканини, або органу від пошкодження, як наприклад, токсинами, хіміотерапевтичними речовинами, променевою терапією, гіпоксією і т.д. Отже, способи захисту тканини, що містить сприйнятливі клітини, від пошкодження або гіпоксичного стресу, і посилення функції такої тканини описані докладним чином у цьому описі винаходу далі. Як вказано вище, способи за винаходом однаково застосовні до людей, а також до інших тварин. За одним із способів одного варіанту здійснення винаходу, хворого-ссавця для лікування злоякісної пухлини піддають системній хіміотерапії, що включає променеву терапію, яка звичайно має побічні ефекти, такі як поразка нервів, легенів, серця, яєчників або яєчок. Введення фармацевтичної композиції, що містить сполуку за винаходом, як описано вище, виконують перед або під час хіміотерапії та/або променевої терапії для захисту різних тканин і органів від пошкодження хіміотерапевтичною речовиною, наприклад, для захисту яєчок. Лікування можна продовжувати до тих пір, поки концентрації хіміотерапевтичної речовини у крові знизяться нижче рівня потенційної небезпеки в організмі ссавця. За одним із способів ще одного варіанту здійснення винаходу, різні органи, заплановані для відбору у жертви автомобільної аварії для трансплантації декільком реципієнтам, деякі з яких необхідно транспортувати на великі відстані та протя 91983 36 гом тривалого періоду часу. Перед відбором органу жертві вводять шляхом інфузії фармацевтичну композицію, що містить сполуку за винаходом, як тут описано. Для транспортування забрані органи перфузують перфузійною рідиною, що містить сполуку за винаходом, як тут описано, та зберігають в судині, що містить сполуку за винаходом. Певні органи безперервно перфузують за допомогою пульсуючого пристрою для перфузії, використовуючи перфузат, що містить сполуку за винаходом. При транспортуванні та при імплантації і реперфузії органів in situ відбувається мінімальне пошкодження функції органу. Згідно з ще одним варіантом здійснення винаходу, хірургічне втручання для відновлення серцевого клапана вимагає тимчасової зупинки серця та артеріальної оклюзії. Перед хірургічною операцією пацієнту вводять 4мкг сполуки за винаходом на кг маси тіла. Таке лікування запобігає гіпоксичному ішемічному клітинному пошкодженню, конкретно, після реперфузії. Згідно з ще одним варіантом здійснення винаходу, сполуку за винаходом можна застосовувати при будь-якому хірургічному втручанні, як наприклад, операція в умовах штучного кровообігу. Згідно з одним варіантом здійснення, для захисту головного мозку, серця та інших органів введення фармацевтичної композиції, що містить сполуку за винаходом, як описано вище, виконують перед, під час і/або після процедури штучного кровообігу. У вказаних вище прикладах, в яких сполуку за винаходом застосовують для аплікацій ex vivo або для обробки сприйнятливих клітин, як наприклад, нервової тканини, тканини сітківки, серця, легенів, печінки, нирок, тонкого кишечнику, кори надниркової залози, мозкової речовини надниркової залози, капілярного ендотелію, яєчок, яєчників або ендометріальних клітин або тканини, винахід відноситься до фармацевтичної композиції в стандартній лікарській формі, пристосованій для захисту або активації сприйнятливих клітин, тканин або органів, віддалених від судинної системи, що містить в стандартному дозуванні ефективну нетоксичну кількість сполуки за винаходом в діапазоні від приблизно 0,01пг до 5мг, 1пг-5мг, 500пг-5мг, 1нг-5мг, 500нг-5мг, 1мкг-5мг, 500мкг- мг або 1мг5мг і фармацевтично прийнятний носій. Згідно з переважним варіантом здійснення, кількість сполуки за винаходом знаходиться в діапазоні від приблизно 1нг до 5мг. Згідно з додатковим аспектом винаходу виявили, що введення ЕРО відновлює когнітивну функцію у тварин, що одержали травму головного мозку. Очікується, що сполуки за винаходом мають такі ж захисні ефекти стосовно клітин, як і ЕРО. Після 5 добової або 30 добової витримки ЕРО здатний відновити функціонування, на відміну від випадку псевдо-обробки тварин, що демонструє здатність ЕРО відновлювати або відтворювати активність головного мозку. Таким чином, винахід також відноситься до застосування сполуки за винаходом для приготування фармацевтичної композиції для лікування травми головного мозку та інших когнітивних дисфункцій, включаючи лікування, що надається значно пізніше одержан 37 ня пошкодження (наприклад, після трьох діб, п'яти діб, тижня, місяця або довше). Винахід також відноситься до способу лікування когнітивної дисфункції після пошкодження за допомогою введення ефективної кількості сполуки за винаходом. Для даного аспекту винаходу можна застосовувати будь-яку сполуку за винаходом, як тут описано. Крім того, даний відновлювальний аспект винаходу відноситься тут до застосування будь-якої із сполук за винаходом для приготування фармацевтичної композиції для відновлення клітинної, тканинної або органевої дисфункції, де лікування починають після і значно пізніше одержання відповідального за дисфункцію початкового пошкодження. Крім того, лікування із застосуванням сполуки за винаходом може перекривати розвиток захворювання або стану під час гострої фази, а також хронічної фази. У прикладі, де сполука має еритропоетичну активність, сполуку можна вводити системно в дозуванні на введення між приблизно 1мкг і приблизно 100мкг/кг маси тіла, переважно приблизно 550мкг/кг маси тіла, а найбільш переважно 1030мкг/кг маси тіла. Дана ефективна доза повинна бути достатньою для досягнення сироваткових концентрацій сполуки більш ніж приблизно 10000, 15000 або 20000мОд/мл сироватки після введення сполуки. Таких сироваткових концентрацій можна досягти протягом приблизно 1, 2,3, 4, 5, 6, 7, 8, 9 або 10 годин після введення. Такі дозування можна повторювати в разі необхідності. Наприклад, введення можна повторювати щодня, так тривало, наскільки це клінічно необхідно, або після відповідного інтервалу, наприклад, кожні 1-12 тижнів, але переважно кожні 1-3 тижні. Ефективна кількість сполуки і фармацевтично прийнятний носій можна фасувати в пляшечку з одноразовою дозою або інший контейнер. Проте, сполука за винаходом не є еритропоетичною, тобто, вона здатна проявляти описану тут активність без збільшення концентрації гемоглобіну або гематокриту. Така нееритропоетична сполука особливо переважна у випадках, де способи за цим винаходом направлені на хронічне застосування. Згідно з ще одним варіантом здійснення, сполуку за винаходом дають в дозі, більшій, ніж відповідна необхідна для максимальної стимуляції еритропоезу доза (мас/мас.) природного еритропоетину. Як вказано вище, сполука за винаходом не має еритропоетичної активності, і, таким чином, вище вказане дозування, виражене в одиницях, просто є типовим щодо відповідних кількостей природного еритропоетину, а наведені вище у цьому описі молярні еквіваленти дозувань застосовні до будь-якої сполуки за винаходом. Приклади Цей винахід можна краще зрозуміти з посиланням на наступні необмежувальні приклади, представлені як ілюстрація винаходу. Наступні приклади представлені для того, щоб більш повно проілюструвати переважні варіанти здійснення винаходу. Проте, їх не слід інтерпретувати як такі, що обмежують обсяг винаходу. Приклад 1 Одержання карбамілованого еритропоетину 91983 38 Початкова речовина способу в даному прикладі є очищений рекомбінантний людський ЕРО. Першу концентрацію білка коректують ультрафільтрацією з метою забезпечення невеликого об'єму реакції. Концентрацію білка доводять до 3мг/мл. Ультрафільтрацію виконують за допомогою ВіоМах (Millipore) з нижньою межею молекулярної маси від 5кДа. Після завершення стадії концентрації розчин ЕРО змішують з 0,5 Μ K-борату тетрагідратом, 0,5 Μ K-ціанатом та розчин витримують при рН9,0 при 32°С протягом 24 годин. Знесолювання реакційної суміші ЕРО і ціанату виконують гель-фільтрацією. Білок знесолюють буферним розчином 25мМ Трис, 50мМ NaCl, рН8,5. Застосовують смолу G-25 Fine (Amersham Biosciences). Виконують завантаження зразка приблизно 20% об'єму колонки, застосовуючи потік 90см/годину на колонку заввишки приблизно 15см. Знесолений карбамілований ЕРО збирають додатковою обробкою. На даному етапі вміст полімерів/агрегатів становить 7,3%. Наступною стадією є видалення агрегатів і полімерів, виконуючи стадію очищення із застосуванням аніонного обміну. Для очищення застосують смолу SOURCE 30Q (Amersham Biosciences). На колонку використовують приблизно 4,5мг/мл карбамілованого ЕРО. Буфер для розділення А: 25мМ Трис, 50мМ NaCl, рН8,5, і буфер для елюювання В: 25мМ Трис, 1 Μ NaCl, pH8,5. Градієнт виконують з 0-30% більше 20 об'ємів колонки, збирають і об'єднують основний пік карбамілованого ЕРО. Об'єднану фракцію після стадії очищення коректують до концентрації більше 0,5мг/мл і міняють буфер на буферний розчин з 20мМ цитрату, 100мМ NaCl із застосуванням установки для діа/ультрафільтрації з проточною фільтрацією уздовж потоку. Концентрування і заміну буфера виконують на 0,1м ВіоМах (Millipore) з нижньою межею молекулярної маси від 5кДа. Нарешті, очищену біофармацевтичну лікарську речовину фільтрують через фільтр з розміром пор 0,22мкм із застосуванням фільтра Millipak (Millipore) для виключення бактерій. Одержаний в результаті обробки карбамілований ЕРО має властивості, які визначають його як прийнятний біофармацевтичний засіб. Визначений за SEC-HPLC вміст полімерів/агрегатів становить 0,5%. Визначені амінокислотним аналізом карбаміловані лізини складають 100%. Концентрація становить більше 0,5мг/мл. Для визначення зміни в початковій масі обробленого PNGaзою білка і білка з N-гліканами виконують дослідження із застосуванням MALDI-TOF. Крім того, виконують MALDI-TOF аналіз пептидних мас за методом "відбитку пальців"/РХ-МС/МС аналіз, як вказано далі: 1. СЕРО і ЕРО очищають на колонці POROS R1 (обернено-фазовий колоночний матеріал POROS R1, PerSeptive Biosystems (1-1259-06)). До застосування колоночний матеріал зберігають в 39 50% HiPerSolv для HPLC VWR 152525R. Колонку R1 врівноважують і промивають 5% мурашиною кислотою (33015, Riedl de Наѐn). Зразки елююють з колонки якісним матричним розчином Agilent MALDI HCCA (G2037A). Початкову масу визначають за допомогою аналізу на приладі Bruker Reflex IV MALDI-TOF. 2. Протягом ночі 0,3пмоль СЕРО і/або ЕРО піддають обробці 1 одиницею PNGaзи F і PNGaзи F/O-глікозидази. Загальну масу визначають із застосуванням MALDI-TOF. 3. СЕРО і ЕРО (1,5пмоль) відновлюють в розчині 50мкл 10мМ DTT, 50мМ NH4CO3 з подальшим алкілуванням в 50мкл 55мМ йодацетаміду, 50мМ NH4CO3. Перед розщеплюванням трипсином зразки очищають на колонці POROS R1. Фракцію розщепленого зразка очищають на колонці POROS R2 перед аналізом MALDI-TOF (POROS 50 R2 PerSeptive Biosystems (1-1159-05)). Колонку R2 врівноважують і промивають 0,1% трифторооцтовою кислотою (99+% spectrometric grade, Aldrich 302031-100мл). Зразки елююють з колонки якісним матричним розчином Agilent MALDI HCCA (G2037A). Одержану за допомогою трипсинового розщеплювання групу пептидів обробляють PNGaзою F, очищають на колонках POROS R2 і досліджують за допомогою MALDI-TOF. 4. СЕРО і ЕРО відновлюють в розчині DTT і алкілують йодацетамідом. Перед розщеплюванням Glu-C зразки очищають на колонці POROS R1. Перед аналізом MALDI-TOF фракцію розщепленого зразка очищають на колонках POROS R2. Суміш пептидів, одержану за допомогою розщеплювання Glu-C, обробляють PNGазою F і очищають на колонках POROS R2. 5. Для виключення можливості присутності частково карбамілованого СЕРО, початковий ЕРО і СЕРО розщеплюють за допомогою Lys-C. Зразки аналізують із застосуванням MALDI-TOF. Висновок полягає в тому, що 8 лізинів і Nкінцева амінокислота є карбамілованими. Інші карбаміловані амінокислоти не визначені, і не виявлено ніяких модифікацій гліканів. Посилання: Звичайна ідентифікація білків за допомогою МС (MS): Mann M, Hojrup P, Roepstorff P. (1993) Use of mass spectrometric molecular weight information to identify proteins in sequence databases, Biol Mass Spectrom 22, 338-345. Yates, J R, Speicher S, Griffin Ρ R, Hunkapiller T. (1993) Peptide mass maps: a highly informative approach to protein identification, Anal Biochem 214, 397-408 Початкова маса: Laugesen S, Roepstorff P. (2003) Combination of two matrices results in improved performance of MALDI MS for peptide mass mapping and protein analysis. J Am Soc Mass Spectrom. 14(9), 992-1002. Розщеплювання/сполука: Larsen MR, Hojrup P, Roepstorff P. (2005) Characterization of gel-separated glycoproteins using two-step proteolytic digestion combined with sequential microcolumns and mass spectrometry. МоІ Cell Proteomics. 4(2), 107-19. 91983 40 Додаткові дослідження дозволили визначити ступінь і гомогенність карбамілування ЕРО, специфічність карбамілування та ідентичність сайтів карбамілування і присутність потенційних неспецифічних модифікацій в результаті побічних реакцій карбамілування і процесу очищення. Зразки аналізували за допомогою аналізу загальної маси зразків деглікозилованих білків і пептидного картування із застосуванням ендопротеаз LysC і трипсину для розщеплювання, а також за допомогою аналізу РХ/МС (LC/MS) для визначення пептидів. Приклад 2 Аналіз загальної маси Аналіз виконують з трьома зразками ЕРО, карбамілованими із застосуванням способу за прикладом 1. Всі три зразки очищають після реакції карбамілування із застосуванням аніонного обміну, як описано в прикладі 1. Один із зразків СЕРО (позначений СЕРО-СМС) одержують за допомогою CMC Biotech, виробництво з масштабом 1 грам (концентрація: 0,82мг/мл; буферний розчин: 20мМ цитрат Na, 0,3мМ лимонна кислота, 0,1 Μ NaCl, pH6,9-7,3). Два зразки, що залишилися, позначені СЕРО-1 і СЕРО-2, одержують з лабораторного виробництва масштабом 70 мг (концентрація: 1,1мг/мл; буферний розчин: 25мМ Трис, 0,2 Μ NaCl, pH8,3-8,7). Дані зразки СЕРО порівнюють з немодифікованим або початковим ЕРО (концентрація: 0,82мг/мл; буферний розчин: 2мМ цитрат Na, 0,3мМ лимонна кислота, 0,1 NaCl, pH6,9-7,3) і несправжнім СЕРО (тобто ЕРО, який піддали процессу карбамілування без додавання ціанату K) (концентрація: 0,38мг/мл; буферний розчин: 20мМ цитрат Na, 0,3мМ лимонна кислота, 0,1 Μ NaCl, pH6,9-7,3). ESI-мас-спектрометрія До проведення аналізу загальної маси зразки піддають ферментативному деглікозилуванню. Кожний зразок інкубують протягом ночі з 50мкг Nглікозидази F (Prozyme від Glyko), рекомбінантної нейрамінідази A. ureafaciens і О-глікозидази при концентрації білка 0,5мг/мл. Повноту реакції деглікозилування перевіряють за допомогою способу SDS-PAGE при введенні 3мкг кожного зразка в 12% Трис-гліцинові гелі. Решту речовини кожного зразка використовують для аналізу за масою. Деглікозиловані зразки довели до концентрації 4-5 Μ гідрохлориду гуанідину шляхом додавання відповідного об'єму матричного розчину гідрохлориду гуанідину, а потім знесолили в буферному розчині, що містить 2% мурашину кислоту і 40% аценітрил. Гідрохлорид гуанідину додають для того, щоб забезпечити повне відновлення деглікозилованого ЕРО і СЕРО для масспектрометричного аналізу. Визначення маси виконують із застосуванням мас-спектрометра Waters ESI-Q-Tof або Waters ESI-LCT, забезпеченого джерелом іонізації ESI-наноспрей. Оцінку даних проводять автоматичною деконволюцією і ручним визначенням конкретних піків, що представляють інтерес, за допомогою програмного забезпечення Mass Lynx 4.0. Кількісне визначення відносних співвідношень карбамілованих різними способами зразків СЕРО виконують обчисленням 41 91983 42 відносних співвідношень на підставі інтенсивностей сигналів, зареєстрованих в спектрі маса/заряд. Деглікозилування зразків приводить до утворення N-зв'язаних цукрів, що повністю видаляються. Проте, вивільнення О-зв'язаних цукрів є неповним, особливо для зразків СЕРО. Як передбачалося, в результаті карбамілування зразки СЕРО показали різні мас-спектри в порівнянні з ЕРО і зразками несправжнього СЕРО. Як показано в таблиці 2, деконволюція спектрів дала в результаті маси для основних піків для різних зразків, як очікувалося теоретично. В усіх зразках СЕРО виявили тільки в значній мірі карбаміловані молекули СЕРО з основною ізоформою, що є повністю карбамілованою ізоформою з повним карбамілуванням 8 лізинів і N-кінцевої амінокислоти, тобто 9 карбамільними залишками. Зразки СЕРО демонструють гетерогенність щодо вмісту додаткових ізоформ, які відповідають 8, 10 і 11 карбамільним залишкам, приєднаним до СЕРО. Зразки, що містять 8 карбамільних залишків, позначені як недостатньо карбаміловані - з відсутністю принаймні одного карбамільного залишку. Зразки з 10 і 11 карбамільними залишками позначені як надмірно карбаміловані, де надмірні приєднані карбамільні залишки зв'язалися в неспецифічних умовах з відмінними від лізину амінокислотами. У спектрах всіх зразків визначають декілька мінорних сигналів, але, як вважають, жоден не є неспецифічно модифікованим зразком. У зразках ЕРО і СЕРО виявили декілька мінорних сигналів, і, як вважають, домішки вже були присутні в початковому ЕРО. У таблиці 3 показані відносні співвідношення різних ізоформ. Діапазон недостатньо карбамілованого СЕРО становить від приблизно 1,5 до 5,5% від загального СЕРО в залежності від зразка, а діапазон надмірно карбамілованого СЕРО стано вить від приблизно 11 до 22% в залежності від зразка. СЕРО-1 і СЕРО-2 мають однаковий розподіл ізоформ, тоді як СЕРО-СМС має менше недостатньо карбамілованих зразків в порівнянні з двома іншими зразками. Різні масштаби виробни 43 91983 44 цтва дають вихід продуктів з різним розподілом, але, як показано в таблиці 3 для лабораторного масштабу виробництва, виробництво з подібним результатом можна повторювати. Як обговорювалося раніше, в будь-якому виконаному масштабі виробництва розподіл можна пристосувати за допомогою коректування об'єднання з аніонообмінної колонки. Числа в таблиці 3 репрезентують мінімальне співвідношення недостатньо і надмірно карбамілованого СЕРО. Причиною цього є те, що ступінь карбамілування (від 8-кратної до 11-кратної) не може визначати точний ступінь недостатньо, повністю і надмірно карбамілованого СЕРО. Напри клад, молекула СЕРО, що містить 8 карбамільних залишків, визначених аналізом за масою, може мати тільки 7 карбамільних груп, специфічно зв'язаних з лізинами, а карбамільний залишок, що залишився, може бути неспецифічно зв'язаним з іншою амінокислотою. Дану ситуацію можна розглядати тільки як недостатньо карбамілований СЕРО, оскільки існують неспецифічно зв'язані карбамільні групи. Навпаки, молекула СЕРО, що містить 10 карбамільних залишків, можливо має тільки 8 специфічно зв'язаних залишків і два залишки, зв'язані неспецифічно. У даній ситуації ізоформу СЕРО розглядається тільки як надмірно карбаміловану, навіть якщо не все лізини карбаміловані. Приклад 3 LysC пептидне картування Із застосуванням ендопротеаз LysC і трипсину для розщеплювання виконують дослідження пептидної карти зразків ЕРО і СЕРО. Дослідження всіх пептидних карт проводили з деглікозилованими пептидами. Ферментативне деглікозилування пептидів виконують одночасно з ендопротеазним розщеплюванням. Зразки ЕРО і СЕРО (приблизно 150мкг кожного) денатурують і відновлюють за допомогою інкубації з гідрохлоридом гуанідину і DTT. Вільні сульфгідрильні групи алкілують йодооцтовою кислотою. Алкіловані зразки знесолюють і виконують заміну буфера на відповідний буфер із застосуванням колонок одноразового використання для гель-фільтрації. Ендопротеазу, N-глікозидазу і нейрамінідазу одночасно додають до зразків алкілованих ЕРО і СЕРО. Зразки протягом ночі інкубують при 37°С. Після інкубації приблизно 5мкг кожної суміші використовують для аналізу RP-HPLC/MS із застосуванням Jupiter, С18 RP-колонок від Phenomenix, сполучених з ESI-LCT від Waters. У масспектрометрі реєструють УФ сигнал при 220нм і загальній кількості іонів (TIC). Для ідентифікації і кількісного аналізу одержаних пептидів оцінюють TIC. Оскільки LysC не здатний до розщеплювання карбамілованих лізинів, передбачалося, що при розщеплюванні за допомогою LysC фрагменти не утворюються, якщо карбаміловані усі лізини, що вказує на специфічність карбамілування. У разі неповного карбамілування повинні утворитися конкретні фрагменти СЕРО. У таблиці 4 перелічені фрагменти, які теоретично утворюються при розщеплюванні за допомогою LysC ЕРО, повністю і надмірно карбамілованих СЕРО і недостатньо карбамілованого СЕРО. 45 Як очікували, одержаний для розщеплених LysC зразків ЕРО і СЕРО LysC пептидний профіль повністю відрізняється. Розщеплювання LysC початкового ЕРО і несправжнього СЕРО привело до утворення очікуваного пептидного профілю. У обох зразках можна визначити всі пептиди від K1 до K9. У ЕРО і несправжньому СЕРО пептиди K5 і K1 є частково розщепленими в неспецифічних умовах. Не визначають ніяких значущих додаткових піків і не визначають піки, відсутні в LysC карті несправжнього СЕРО, в порівнянні з початковим ЕРО. Виходячи з цих даних, можна зробити висновок, що при карбамілуванні та процесі очищення не виникає значущих неспецифічних ковалентних модифікацій білка ЕРО. Пептидні карти зразків СЕРО мають відмінні пептидні профілі від початкового ЕРО. Присутній один основний пік і декілька незначних піків. Як 91983 46 показано в таблиці 5, одержані з піків маси добре корелюють з масами, очікуваними для нерозщепленого СЕРО або для фрагментів при розщеплюванні недостатньо карбамілованого СЕРО за допомогою LysC. Основний пік (А) включає початковий, деглікозилований, повністю карбамілований СЕРО (9х карбамілів) і надмірно карбамілований СЕРО (10х карбамілів) (таблиця 5). Чотири незначні піки (В-Е) включають недостатньо карбамілований СЕРО (8х карбамілів) з різними піками, що включають недостатньо карбамілований СЕРО, не карбамілований на певних лізинах. Піки В і С містять недостатньо карбамілований СЕРО, в якому відсутнє специфічне карбамілування на Lys45, тоді як піки D і Ε містять недостатньо карбамілований СЕРО, в якому відсутнє специфічне карбамілування на Lys97 (таблиця 5). 47 У відносних співвідношеннях піків для різних зразків СЕРО існує декілька відмінностей. Зразки СЕРО 1 і 2 мають більш рельєфні піки D і Е, ніж у СЕРО-СМС, показуючи, що вони містять більше зразків недостатньо карбамілованого СЕРО. Із-за технічних обмежень важко кількісно оцінити, наскільки мінорні піки пов'язані з основним піком. Проте, із застосуванням площі піків за УФдетекцією як грубого визначення відносних співвідношень різних зразків, можна визначити, що недостатньо карбамілований СЕРО може складати менше 10% ізоформ СЕРО в зразках і що СЕРО-1 і СЕРО-2 мають подвійну кількість недостатньо карбамілованих ізоформ в порівнянні з СЕРОСМС. Застосовуючи таку ж саму процедуру, яка була використана для аналізу за загальною масою, встановили, що кількість надмірно карбамілованих зразків, розташованих у піку А, становила приблизно 21% для СЕРО-СМС та 12% для СЕРО1 і СЕРО-2. В цілому, дані LysC пептидного картування добре узгоджуються з описаним в прикладі 2 аналізом за загальною масою. СЕРО-СМС містить менше недостатньо карбамілованих ізоформ СЕРО, тоді як СЕРО-1 і СЕРО-2 містять більше надмірно карбамілованих ізоформ СЕРО. Дане пептидне картування також показує, що лізин 45 і лізин 97 можуть бути сайтами неповного карбамілування. Приклад 4 91983 48 Пептидне картування за допомогою трипсину Розщеплювання зразка із застосуванням трипсину описане в прикладі 3. Розщеплювання ЕРО і несправжнього СЕРО трипсином приводить до утворення очікуваного пептидного профілю. Як очікується, при розщеплюванні трипсином в обох зразках можна визначити більшість пептидів (від Т1 до Т21), за винятком деяких невеликих ди- і трипептидів (як наприклад Т21). Дивіться таблицю 6. Як і у випадку з розщеплюванням за допомогою LysC, не виявляють значущих додаткових піків і не виявляють піків, відсутніх у несправжнього СЕРО, в порівнянні з початковим ЕРО. Виходячи з цих даних, зробили висновок, що при карбамілуванні та процесі очищення не утворюється неспецифічних ковалентних модифікацій білка ЕРО. Пептидні профілі зразків СЕРО відрізняються від немодифікованого ЕРО. Звичайно трипсин розщеплює по лізину і аргініну та, таким чином, можна припустити, що у випадку повністю карбамілованого ЕРО може відбутися фрагментація тільки за допомогою розщеплювання аргінінів. Таким чином, після одержання пептидного профілю з використанням трипсину можна визначити сайти специфічного карбамілування і неспецифічно карбаміловані пептиди. Очікувані при розщеплюванні трипсином молекул СЕРО пептиди допускають розщеплювання по аргінінах (R) тільки так, як вказано в таблиці 6. 49 Всі очікувані для розщеплювання трипсином пептиди визначали у вигляді основних піків у всіх зразках СЕРО, за винятком С-кінцевого пептиду R13. Даний пептид також не виявили в початковому ЕРО або несправжньому СЕРО. Одержані при специфічному розщеплюванні тільки по аргінінах піки від R1 до R12 розглядають як переважну більшість визначених в зразках СЕРО пептидів. Крім того, всі пептиди, що містять лізин, визначають майже виключно в повністю карбамілованій формі. Ці дані показують високий ступінь специфічного карбамілування на лізинах і N-кінцевій амінокислоті. Окрім основного пептиду у всіх зразках СЕРО також визначають шість мінорних пептидів. Аналізом за масою визначають, що три з мінорних пеп 91983 50 тидів є результатом розщеплювання трипсином надмірно карбамілованого СЕРО, а три пептиди, що залишилися, утворюються в результаті розщеплювання недостатньо карбамілованого СЕРО. У таблиці 7 перелічені всі пептиди, визначені в картах з розщеплюванням трипсином трьох проаналізованих зразків СЕРО. Високо поширені пептиди від R1 до R12, що утворені з повністю і специфічно карбамілованого ЕРО, вказані звичайним шрифтом, правильно карбамілований ЕРО додатково позначений жирним шрифтом. Пептиди, найбільш ймовірно утворені розщеплюванням недостатньо карбамілованого СЕРО, позначені курсивом, а пептиди, утворені розщеплюванням надмірно карбамілованого СЕРО, позначені підкресленим шрифтом. 51 З посиланням на таблицю 7, мінорні піки Т9 і Т10, що містять пептиди R6_a1 і R6_b1, відповідно, найімовірніше одержані при розщеплюванні молекул недостатньо карбамілованого СЕРО, які не карбаміловані на Lys97. Пептид R4_b1+1x карб, утворюється, якщо не карбамілована амінокислота Lys45. Пептид R6_a1 (пік Т9) більш виражений в зразках СЕРО-1 і СЕРО-2, в порівнянні з СЕРОСМС, показуючи, що останній може мати подвійну кількість недостатньо карбамілованого СЕРО. Пептиди R6_b1 і R4_b1+1x карб, представлені в рівних кількостях в усіх зразках СЕРО. Виконати обчислення відносного вмісту недостатньо карбамілирванного СЕРО з цих даних представляє труднощі із-за технічних обмежень. Проте, зібравши всі спостереження разом, приблизно визначили, що кількість недостатньо карбамілованих зразків становить приблизно 10%, як це слідує з аналізу по загальній масі та LysC пептидного картування. Три інші мінорні пептиди, елюйовані разом з рештою пептидів, інтерпретували за масою як такі, що містять один надмірний карбамільний залишок, тобто як надмірно карбамілований СЕРО. Пептиди R10_2x карб, і R7_1x карб, визначають в незначних кількостях, причому виявили, що R12_3x карб, 91983 52 має значущу інтенсивність сигналу. СЕРО-СМС має в два рази більший вміст надмірно карбамілованих зразків СЕРО в порівнянні з СЕРО-1 і СЕРО2. Це узгоджується з результатами аналізу за загальною масою. З цих даних також слід зробити висновок, що амінокислотна послідовність 151-62 ЕРО є сайтом для неспецифічного карбамілування. Крім того, з тих же причин, що і для кількісної оцінки неповного карбамілування, кількісна оцінка надмірно карбамілованих зразків представляє труднощі. Проте, припустивши, що ефективність іонізації пептидів, які відрізняється тільки за ступенем карбамілування, є однаковою, по відносній кількості іонів похідних R12 обчислили, що приблизно 3-7% СЕРО являють собою надмірно карбаміловані зразки. Це є меншою кількістю надмірно карбамілованих ізоформ, обчислених аналізом за загальною масою. В цілому, з аналізу за загальною масою і даних пептидного картування ЕРО і СЕРО можна зробити наступний висновок. Виходячи з аналізу за загальною масою, вважається, що зразки СЕРО є в достатньо високому ступені карбамілованими. Приблизно 95-98% всіх молекул повністю карбаміловані та містять при 53 91983 наймні 9 карбамільних залишків (дивися таблицю 3). Картування із застосуванням LysC і трипсину підтверджує високий ступінь карбамілування на специфічних сайтах і схоже, що найймовірніше більше 95% молекул СЕРО є повністю карбамілованими на 8 лізинах і N-кінцевій амінокислоті. Дані також показують чотири виявлені ізоформи СЕРО. У проаналізованих зразках СЕРО визначають зразки з 8, 9, 10 і 11 карбамільними залишками, ізоформа з 9 карбамільними залишками є домінуючими зразками. Вважають, що невелика частина молекул СЕРО, що містять 8 карбамільних залишків замість 9, є неповністю карбамілованою. Для СЕРО-1 і СЕРО-2 дані ізоформи становлять приблизно 5% від загальної кількості, а для СЕРО-СМС дана ізоформа становить приблизно 1,5% від загальної кількості молекул СЕРО. Більш значна частина молекул СЕРО є надмірно карбамілованою, тобто містить 10 або 11 карбамільних залишків. Надмірно карбамілований СЕРО знаходиться в інтервалі від приблизно 11% для СЕРО-1 і СЕРО-2 до приблизно 22% для СЕРО-СМС. Дані пептидного картування показують високий ступінь специфічності карбамілування на 8 лізинах і N-кінці. Крім того, в цілому пептидне картування підтверджує результати аналізу за загальною масою. Принаймні приблизно 90-95% молекул СЕРО є специфічно модифікованими карбамільними залишками на всіх лізинах і N-кінці. Проте, ці дані також показують неповне і надмірне карбамілування зразків СЕРО. Із-за деяких технічних обмежень, важко визначити точне співвідношення недостатньо карбамілованих зразків, але приблизно визначили, що воно становить до при Комп’ютерна верстка Т. Чепелева 54 близно 10%, що узгоджується з кількістю, виявленою за аналізом загальної маси. Крім того, на молекулі ЕРО визначили два точні положення, Lys45 і Lys97, як положення, де найймовірніше відбувається відсутність карбамілування. У обох серіях пептидного картування також виявили надмірно карбаміловані зразки. Зновтаки, із-за технічних обмежень важко кількісно оцінити точну кількість надмірно карбамілованих зразків. Виходячи з одержаних даних, можна зробити висновок, що при пептидному картуванні визначають дуже малі кількості надмірно карбамілованих зразків. Пептидним картуванням визначають тільки від однієї третини до половини кількості надмірно карбамілованих зразків в порівнянні з аналізом за загальною масою. Розумне пояснення для даної суперечності полягає в тому, що або ідентифікують взагалі не усі надмірно карбаміловані пептиди, або в неправильній кількості. На карті LysC в значних кількостях визначають нерозщеплені зразки СЕРО, що містять 10 карбамільних залишків, а в картуванні із застосуванням трипсину визначають три пептиди із вмістом одного надмірного карбамільного залишку. Два з цих фрагментів визначають тільки в слідових кількостях. Третій пептид, амінокислоти 152-162 пептиду СЕРО, межує з С-кінцем і є причиною однієї третьої частини надмірного карбамілування, і він може бути сайтом для неспецифічного карбамілування в ЕРО. За допомогою будь-якого виконаного аналізу не визначили значних кількостей інших неспецифічних (не пов'язаних з карбамідом) модифікацій в зразках СЕРО або в зразках несправжнього СЕРО. Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюNovel carbamylated erythropoietin and method for its production
Автори англійськоюChristensen Soeren, Foldager Lars, Valbjoern Jesper, Thuesen Marianne Hallberg, Pedersen Anders Hjelholt, Munk Morten
Назва патенту російськоюНовый карбамилированный эритропоэтин и способ его получения
Автори російськоюХристенсен Сёрен, Фолдагер Ларс, Валбьёрн Еспер, Туэсен Марианна Халберг, Педерсен Аннерс Елхолт, Мунк Мортен
МПК / Мітки
МПК: C07K 14/505, A61K 38/18
Мітки: еро, новий, карбамілований, одержання, спосіб
Код посилання
<a href="https://ua.patents.su/27-91983-novijj-karbamilovanijj-ero-ta-sposib-jjogo-oderzhannya.html" target="_blank" rel="follow" title="База патентів України">Новий карбамілований еро та спосіб його одержання</a>
Попередній патент: Уніфікована космічна платформа
Наступний патент: Будівельний виріб, що містить ізоляційну панель, спосіб його виготовлення, зовнішня стіна будівлі, яка його містить, спосіб його реалізації
Випадковий патент: Зовнішній стаціонарний пристрій для підйому і спуску інвалідів та людей похилого віку у висотних будинках