Похідні 1-феніламіно-1н-імідазолу та фармацевтична композиція, що їх містить
Номер патенту: 86393
Опубліковано: 27.04.2009
Автори: Дюранті Ерік, Клерк Тьєррі, Бонне Поль, Шілд Жаклін, Майо Філіпп, Дюк Ігор, Ляфей Жан, Рондо Бенуа, Пюссьйо Франсуа, Бльо Крістіан
Формула / Реферат
1. Похідна імідазолу формули (І):
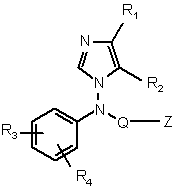 (I)
(I)
і її солі з кислотою та її стереоізомерні форми, в якій:
R1 і R2 означають, кожний незалежно, водень, (С1-С6)алкіл або (С3-С8)циклоалкіл; або R1 і R2 разом утворюють насичене або ненасичене 5-, 6- або 7-членне карбоциклічне кільце;
Q означає (СН2)m-Х-(СН2)n-А;
А означає прямий зв’язок, О, S, SO, SO2, NR5;
X означає прямий зв’язок, CF2, О, S, SO, SO2, C(O), NR5 або CR6R7;
Z означає групу, вибрану з:
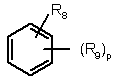 ,
, 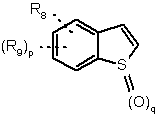 ,
, 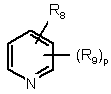 ,
, 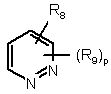 ,
, 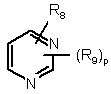 і
і 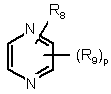 ,
,
 ,
,
m і n означають, кожний незалежно, 0, 1, 2, 3 або 4;
р означає 1, 2, 3 або 4;
q означає 0, 1 або 2;
пунктирна лінія означає, що R8 та/або R9 можуть знаходитися у будь-якому положенні бензотіофенового кільця;
R3 і R8 означають, кожний незалежно, водень або гідрокси, ціано, галоген, нітро, (С1-С6)алкіл, (С1-С6)алкокси, трифторметил, (С1-С6)алкілтіо, (С1-С6)алкілсульфоніл, ацил, (С1-С6)алкоксикарбоніл, карбоксамідо, OPO(OR10)2, NR10R11, SO2NR10R11, OSO2NR10R11, OSO2OR10, SO2OR10, SSO2NR10R11, CF2SO2OR10, CF2SO2NR10R11, СF2-тетразоліл або NR12SO2NR10R11, OSO2NR12SO2NR10R11, CO2R10, CONR10R11, OCHO, OCONR10R11, OCSNR10R11, SCONR10R11, SCSNR10R11, тетразоліл, NR12CONR10R11, NR10-CHO;
коли Q-Z означає
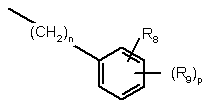 ,
,
n означає 0, 1 або 2 і
р означає 1,
один з R3 і R8 означає гідрокси, нітро, OPO(OR10)2, NR10R11, OSO2NR10R11, OSO2OR10, SO2OR10, SSO2NR10R11, CF2SO2OR10, CF2SO2NR10R11, СF2-тетразоліл, NR12SO2NR10R11, OSO2NR10SO2NR11R12, CO2R10, CONR10R11, OCHO, OCONR10R11, OCSNR10R11, SCONR10R11, SCSNR10R11, тетразоліл, NR12CONR10R11, NR10-CHO, а інший означає водень або гідрокси, ціано, галоген, нітро, (С1-С6)алкіл, (С1-С6)алкокси, трифторметил, (С1-С6)алкілтіо, (С1-С6)алкілсульфоніл, ацил, (С1-С6)алкоксикарбоніл, карбоксамідо, NR10R11, SO2NR10R11, OSO2NR10R11, OSO2OR10, SO2OR10, SSO2NR10R11, CF2SO2OR10, CF2SO2NR10R11, СF2-тетразоліл, NR12SO2NR10R11, OSO2NR12SO2NR10R11, CO2R10, CONR10R11, OCHO, OCONR10R11, OCSNR10R11, SCONR10R11, SCSNR10R11, тетразоліл, NR12CONR10R11, NR10-CHO;
R4 і R9 означають, кожний незалежно, водень або гідрокси, ціано, галоген, нітро, OPO(OR10)2, (С1-С6)алкіл, (С1-С6)алкокси, трифторметил, (С1-С6)алкілтіо, (C1-С6)алкілсульфоніл, ацил, (С1-С6)алкоксикарбоніл, карбоксамідо, NR10R11, SO2NR10R11, OSO2NR10R11, OSO2OR10, SO2OR10, SSO2NR10R11, CF2SO2OR10, CF2SO2NR10R11, СF2-тетразоліл, NR12SO2NR10R11, OSO2NR12SO2NR10R11, CO2R10, CHO, CONR10R11, OCHO, OCONR10R11, OCSNR10R11, SCONR10R11, SCSNR10R11, тетразоліл, NR12CONR10R11, NR10-CHO;
коли р означає 2, 3 або 4, R9 можуть бути однаковими або різними;
R6 i R7 означають незалежно водень, галоген, (С1-С6)алкіл або (С3-С8) циклоалкіл;
R5, R10, R11 і R12 означають, кожний незалежно, водень, гідрокси, (С1-С6)алкіл або (С3-С8)циклоалкіл; R10 може також бути сіллю; R10 і R11 можуть також утворювати, разом з атомом азоту, з яким вони зв’язані, 5-7-членний гетероцикл, який містить один або два гетероатоми, вибрані з О, S і N;
коли Z означає
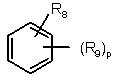
і р означає 1,
тоді R8 і R9 можуть також утворювати разом з фенільним кільцем діоксид бензоксатіазину, діоксид дигідробензоксатіазину, діоксид бензоксатіазинону, діоксид бензоксатіазолу, тетраоксид бензоксадитіадіазину, тетраоксид бензодитіазину або тетраоксид бензодіоксадитііну;
коли Z означає
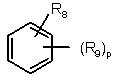 ,
,
R3 і R4 разом з фенільним кільцем, до якого вони приєднані, можуть також утворювати бензофуран або N-метилбензотриазол, за умови, що, коли р означає 1 і Q означає (СН2)n, тоді R8 і R9 означають незалежно гідрокси, нітро, ОРО(СR10)2, NR10R11, OSO2NR10R11, OSO2OR10, SO2OR10, SSO2NR10R11, CF2SO2OR10, CF2SO2NR10R11, СF2-тетразоліл, NR12SO2NR10R11, OSO2NR12SO2NR10R11, CO2R10, CONR10R11, OCHO, OCONR10R11, OCSNR10R11, SCONR10R11, SCSNR10R11, тетразоліл, NR12CONR10R11 або NR10-CHO.
2. Похідна за п. 1 і її солі з кислотою та її стереоізомерні форми, в якій: один з R3 і R8 означає гідрокси, нітро, NR10R11, OSO2NR10R11 або NR12SO2NR10R11; та
інший означає водень або гідрокси, ціано, галоген, нітро, (С1-С6)алкіл, (С1-С6)алкокси, трифторметил, (С1-С6)алкілтіо, (С1-С6)алкілсульфоніл, ацил, (С1-С6)алкоксикарбоніл, карбоксамідо, NR10R11, OSO2NR10R11, NR12SO2NR10R11.
3. Похідна за п. 1 або 2 і її солі з кислотою та її стереоізомерні форми, в якій: один з R3 і R8 означає гідрокси, ціано, (С1-С6)алкокси або OSO2NR10R11; та
інший означає водень або гідрокси, галоген, нітро, ціано, (С1-С6)алкокси, NR10R11, SO2NR10R11, OSO2NR10R11, NR12SO2NR10R11, OSO2NR10SO2NR11R12.
4. Похідна за будь-яким із пп. 1-3 і її солі з кислотою та її стереоізомерні форми, в якій:
один з R3 і R8 означає ціаногрупу; та
інший означає водень або гідрокси, галоген, нітро, (С1-С6)алкокси, NR10R11, SO2NR10R11, OSO2NR10R11, NR12SO2NR10R11.
5. Похідна за будь-яким із пп. 1-4 і її солі з кислотою та її стереоізомерні форми, в якій:
R4 і R9 означають, кожний незалежно, водень, гідрокси, ціано, галоген, нітро, (С1-С6)алкіл, (С1-С6)алкокси, трифторметил, (С1-С6)алкілтіо, (С1-С6)алкілсульфоніл, ацил, (С1-С6)алкоксикарбоніл, карбоксамідо, NR10R11, OSO2NR10R11, NR12SO2NR10R11, CO2R10 або СНО.
6. Похідна за п. 5 і її солі з кислотою та її стереоізомерні форми, в якій: один з R4 і R9 означає водень або гідрокси, ціано або OSO2NR10R11; та
інший означає водень або гідрокси, ціано, галоген, нітро, (С1-С6)алкіл, (С1-С6)алкокси, трифторметил, NR10R11, OSO2NR10R11, CO2R10, СНО, NR12SO2NR10R11.
7. Похідна за п. 6 і її солі з кислотою та її стереоізомерні форми, в якій:
R4 означає водень, гідрокси, ціано або OSO2NR10R11;
R9 означає водень або гідрокси, ціано, галоген, нітро, (С1-С6)алкіл, (С1-С6) алкокси, трифторметил, NR10R11, OSO2NR10R11, CO2R10, СНО.
8. Похідна за п. 7 і її солі з кислотою та її стереоізомерні форми, в якій:
R4 означає водень; та
R9 означає гідрокси, ціано, галоген, нітро, (С1-С6)алкіл, (С1-С6)алкокси, трифторметил, NR10R11, OSO2NR10R11, CO2R10, СНО або NR12SO2NR10R11.
9. Похідна за будь-яким із пп. 1-8 і її солі з кислотою та її стереоізомерні форми, в якій Z означає:
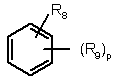 ,
, 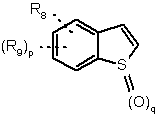 ,
, 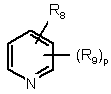 ,
,
де:
R8 означає водень, гідрокси, галоген, нітро, ціано, (С1-С6)алкокси, NR10R11, SO2NR10R11, OSO2NR10R11, NR12SO2NR10R11 або OSO2NR10SO2NR11R12;
R9 означає водень або гідрокси, ціано, галоген, нітро, (С1-С6)алкіл, (С1-С6)алкокси, трифторметил, NR10R11, OSO2NR10R11, CO2R10, СНО, NR12SO2NR10R11;
р і q мають значення, визначені у п. 1.
10. Похідна за будь-яким із пп. 1-9 і її солі з кислотою та її стереоізомерні форми, в якій Q вибране з прямого зв’язку, С(О), SO2, CONH, С(О)(СН2)n, (СН2)n(О) або (СН2)n, де n означає 0, 1 або 2.
11. Похідна за п. 1 і її солі з кислотою та її стереоізомерні форми, в якій:
Z означає
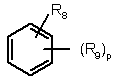 ,
,
Q означає (СН2)n, де n означає 0, 1 або 2;
один з R3 і R8 означає гідрокси, нітро, NR10R11, OSO2NR10R11 або NR12SO2NR10R11, а інший означає водень або гідрокси, ціано, галоген, нітро, (С1-С6)алкіл, (С1-С6)алкокси, трифторметил, (С1-С6)алкілтіо, (С1-С6)алкілсульфоніл, ацил, (С1-С6)алкоксикарбоніл, карбоксамідо, NR10R11, OSO2NR10R11 або NR12SO2NR10R11;
R4 і R9 означають, кожний незалежно, водень, гідрокси, ціано, галоген, нітро, (С1-С6)алкіл, (С1-С6)алкокси, трифторметил, (С1-С6)алкілтіо, (С1-С6)алкілсульфоніл, ацил, (С1-С6)алкоксикарбоніл, карбоксамідо, NR10R11, OSO2NR10R11 або NR12SO2NR10R11;
R10 і R11 означають, кожний незалежно, водень, (С1-С6)aлкіл або (С3-С8)циклоалкіл;
р означає 1, 2, 3 або 4;
R8 і R9 разом з фенільним кільцем, до якого вони приєднані, можуть також утворювати діоксид бензоксатіазину або діоксид дигідробензоксатіазину;
R3 і R4 разом з фенільним кільцем, до якого вони приєднані, можуть також утворювати бензофуран або N-метилбензотриазол.
12. Похідна за п. 11 і її солі з кислотою та її стереоізомерні форми, в якій:
Z означає
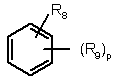 ,
,
Q означає (СН2)n, де n означає 0, 1 або 2;
R8 означає гідрокси, галоген, нітро, ціано або (С1-С6)алкокси, NR10R11, SO2NR10R11, OSO2NR10R11 або NR12SO2NR10R11;
R9 означає водень, гідрокси, ціано, галоген, нітро, (С1-С6)алкіл, (С1-С6)алкокси, трифторметил, NR10R11, OSO2NR10R11;
р має значення, визначене у п. 1.
13. Похідна за п. 12 і її солі з кислотою та її стереоізомерні форми, в якій:
n означає 0 або 1;
R4 і R9 означають, кожний незалежно, водень, галоген, (С1-С6)алкокси, ацил, NR10R11, OSO2NR10R11 або NR12SO2NR10R11.
14. Похідна за будь-яким із пп. 11-13 і її солі з кислотою та її стереоізомерні форми, в якій:
n означає 0 або 1;
R1, R2 і R4 означають, кожний, водень;
R9 означає водень, галоген, (С1-С6)алкіл або OSO2NR10R11.
15. Похідна за будь-яким із пп. 11-14 і її солі з кислотою та її стереоізомерні форми, в якій:
n і р означають 1;
R8 означає гідрокси, галоген, нітро, ціано, (С1-С6)алкокси, NR10R11, SO2NR10R11, OSO2NR10R11, NR12SO2NR10R11 aбo OSO2NR10SO2NR11R12;
R9 означає гідрокси, ціано, галоген, нітро, (С1-С6)алкіл, (С1-С6)алкокси, трифторметил, NR10R11, OSO2NR10R11, CO2R10 або СНО;
R3 означає ціано, гідрокси, OSO2NR10R11 або NR12SO2NR10R11;
R4 означає водень, гідрокси, галоген, ціано або OSO2NR10R11.
16. Похідна за будь-яким із пп. 12-15 і її солі з кислотою та її стереоізомерні форми, в якій один з R3 і R8 означає гідрокси, ціано або OSO2NR10R11, а інший означає гідрокси, нітро, NR10R11, OSO2NR10R11 або NR12SO2NR10R11.
17. Похідна за п. 16 і її солі з кислотою та її стереоізомерні форми, в якій один з R3 і R8 означає ціано або OSO2NR10R11, а інший означає гідрокси або OSO2NR10R11.
18. Похідна за пп. 1 або 2 і її солі з кислотою та її стереоізомерні форми, в якій:
Z означає
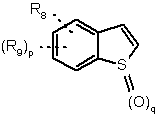 ,
,
де:
Q означає (СН2)m-Х-(СН2)n-А-;
А означає прямий зв’язок або О, S, SO, SO2, NR5;
X означає прямий зв’язок, CF2, О, S, SO, SO2, C(O), NR5 або CR6R7;
m і n означають, кожний незалежно, 0, 1, 2, 3 або 4;
R3, R4, R8 i R9 означають, кожний незалежно, водень або гідрокси, ціано, галоген, нітро, (С1-С6)алкіл, (С1-С6)алкокси, бензилокси, трифторметил, (С1-С6)алкілтіо, (С1-С6)алкілсульфоніл, ацил, (С1-С6)aлкоксикарбоніл, NR10R11, OPO(OR10)2, OCHO, COOR10, SO2NR10R11, OSO2NR10R11, SO2OR10, OSO2OR10, SSO2NR10R11, CONR10R11, OCONR10R11, OCSNR10R11, SCONR10R11, SCSNR10R11, NR12SO2NR10R11, тетразоліл, NR10CONR11OH, NR10SO2NR11OH, NOH-CHO, NOHSO2NR10R11 aбo OSO2NR10OH;
p означає 0,1 або 2;
R5, R6, R7, R10, R11 і R12 означають, кожний незалежно, водень, (С1-С6)алкіл або (С3-С8)циклоалкіл; R10 може також бути сіллю; R10 і R11 можуть також утворювати з атомом азоту, з яким вони зв’язані, 5-7-членний гетероцикл, який містить один або два гетероатоми, вибрані з О, S і N;
пунктирна лінія означає, що Q та/або R8 та/або R9 можуть знаходитися у будь-якому положенні бензотіофенового кільця.
19. Похідна за п. 18 і її солі з кислотою та її стереоізомерні форми, в якій R8 означає OSO2NR10R11 або NR12SO2NR10R11.
20. Похідна за п. 18 або 19, в якій R9 означає водень, галоген, нітро, COOR10 або ціано.
21. Похідна за будь-яким із пп. 18-20, в якій R4 означає водень, галоген, ціано, (С1-С6)алкокси, NR10R11, OSO2NR10R11 або NR12SO2NR10R11.
22. Похідна за будь-яким із пп. 18-21, в якій R10, R11 і R12 означають, кожний незалежно, водень або (С1-С6)алкіл.
23. Похідна за будь-яким із пп. 18-22, в якій Q означає (СН2)m-Х-(СН2)n-А, де m означає 0, 1 або 2 і X означає прямий зв’язок, SO2 або CO, n означає 0 і А означає прямий зв’язок.
24. Похідна за будь-яким із пп. 18-23, в якій R3 означає водень, галоген або ціано.
25. Похідна за п. 1 або 2 і її солі з кислотою та її стереоізомерні форми, в якій Z означає групу:
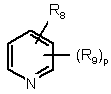 ,
,
в якій R8, R9 і р мають значення, визначені у п. 1.
26. Похідна за п. 25 і її солі з кислотою та її стереоізомерні форми, в якій:
R3 означає ціано або OSO2NR10R11;
R4 означає водень, гідроксил, галоген, ціано, OSO2NR10R11;
R8 означає гідрокси, ціано, OSO2NR10R11, NR10R11, NR12SO2NR10R11, ОСНО або тетразоліл;
R9 означає водень, галоген, нітро, ціано або CO2R10; та Q має значення, визначене у п. 10.
27. Похідна за будь-яким із пп. 1-26 і її солі з кислотою та її стереоізомерні форми, в якій R1 і R2 незалежно означають водень або (С1-С6)алкіл.
28. Похідна за будь-яким із пп. 1-27 і її солі з кислотою та її стереоізомерні форми, в якій R10 і R11 означають водень.
29. Сполука за будь-яким із пп. 1-28 або її фармацевтично прийнятна сіль для застосування як активної терапевтичної речовини.
30. Фармацевтична композиція, яка містить похідну за будь-яким із пп. 1-28 або її фармацевтично прийнятну сіль з кислотою та фармацевтично прийнятний носій.
31. Фармацевтична композиція за п. 30, яка містить від 0,1 до 400 мг вказаної похідної.
Текст
1. Похідна імідазолу формули (І): 2 3 SSO2NR10R11, CF2SO2OR10, CF2SO2NR10R11, СF2тетразоліл, NR12SO2NR10R11, OSO2NR10SO2NR11R12, CO2R10, CONR10R11, OCHO, OCONR10R11, OCSNR10R11, SCONR10R11, SCSNR10R11, тетразоліл, NR12CONR10R11, NR10CHO, а інший означає водень або гідрокси, ціано, галоген, нітро, (С1-С6)алкіл, (С1-С6)алкокси, трифторметил, (С1-С6)алкілтіо, (С1-С6)алкілсульфоніл, ацил, (С1-С6)алкоксикарбоніл, карбоксамідо, NR10R11, SO2NR10R11, OSO2NR10R11, OSO2OR10, SO2OR10, SSO2NR10R11, CF2SO2OR10, CF2SO2NR10R11, СF2-тетразоліл, NR12SO2NR10R11, OSO2NR12SO2NR10R11, CO2R10, CONR10R11, OCHO, OCONR10R11, OCSNR10R11, SCONR10R11, SCSNR10R11, тетразоліл, NR12CONR10R11, NR10CHO; R4 і R9 означають, кожний незалежно, водень або гідрокси, ціано, галоген, нітро, OPO(OR10)2, (С1С6)алкіл, (С1-С6)алкокси, трифторметил, (С1С6)алкілтіо, (C1-С6)алкілсульфоніл, ацил, (С1С6)алкоксикарбоніл, карбоксамідо, NR10R11, SO2NR10R11, OSO2NR10R11, OSO2OR10, SO2OR10, SSO2NR10R11, CF2SO2OR10, CF2SO2NR10R11, СF2тетразоліл, NR12SO2NR10R11, OSO2NR12SO2NR10R11, CO2R10, CHO, CONR10R11, OCHO, OCONR10R11, OCSNR10R11, SCONR10R11, SCSNR10R11, тетразоліл, NR12CONR10R11, NR10CHO; коли р означає 2, 3 або 4, R9 можуть бути однаковими або різними; R6 i R7 означають незалежно водень, галоген, (С1С6)алкіл або (С3-С8) циклоалкіл; R5, R10, R11 і R12 означають, кожний незалежно, водень, гідрокси, (С1-С6)алкіл або (С3С8)циклоалкіл; R10 може також бути сіллю; R10 і R11 можуть також утворювати, разом з атомом азоту, з яким вони зв’язані, 5-7-членний гетероцикл, який містить один або два гетероатоми, вибрані з О, S і N; коли Z означає R8 (R9 )p і р означає 1, тоді R8 і R9 можуть також утворювати разом з фенільним кільцем діоксид бензоксатіазину, діоксид дигідробензоксатіазину, діоксид бензоксатіазинону, діоксид бензоксатіазолу, тетраоксид бензоксадитіадіазину, тетраоксид бензодитіазину або тетраоксид бензодіоксадитііну; коли Z означає R8 (R9 )p , R3 і R4 разом з фенільним кільцем, до якого вони приєднані, можуть також утворювати бензофуран або N-метилбензотриазол, за умови, що, коли р означає 1 і Q означає (СН2)n, тоді R8 і R9 означають незалежно гідрокси, нітро, ОРО(СR10)2, NR10R11, OSO2NR10R11, OSO2OR10, SO2OR10, SSO2NR10R11, CF2SO2OR10, CF2SO2NR10R11, СF2тетразоліл, NR12SO2NR10R11, OSO2NR12SO2NR10R11, CO2R10, CONR10R11, OCHO, OCONR10R11, OCSNR10R11, SCONR10R11, 86393 4 SCSNR10R11, тетразоліл, NR12CONR10R11 або NR10CHO. 2. Похідна за п.1 і її солі з кислотою та її стереоізомерні форми, в якій: один з R3 і R8 означає гідрокси, нітро, NR10R11, OSO2NR10R11 або NR12SO2NR10R11; та інший означає водень або гідрокси, ціано, галоген, нітро, (С1-С6)алкіл, (С1-С6)алкокси, трифторметил, (С1-С6)алкілтіо, (С1-С6)алкілсульфоніл, ацил, (С1С6)алкоксикарбоніл, карбоксамідо, NR10R11, OSO2NR10R11, NR12SO2NR10R11. 3. Похідна за п.1 або 2 і її солі з кислотою та її стереоізомерні форми, в якій: один з R3 і R8 означає гідрокси, ціано, (С1-С6)алкокси або OSO2NR10R11; та інший означає водень або гідрокси, галоген, нітро, ціано, (С1-С6)алкокси, NR10R11, SO2NR10R11, OSO2NR10R11, NR12SO2NR10R11, OSO2NR10SO2NR11R12. 4. Похідна за будь-яким із пп.1-3 і її солі з кислотою та її стереоізомерні форми, в якій: один з R3 і R8 означає ціаногрупу; та інший означає водень або гідрокси, галоген, нітро, (С1-С6)алкокси, NR10R11, SO2NR10R11, OSO2NR10R11, NR12SO2NR10R11. 5. Похідна за будь-яким із пп.1-4 і її солі з кислотою та її стереоізомерні форми, в якій: R4 і R9 означають, кожний незалежно, водень, гідрокси, ціано, галоген, нітро, (С1-С6)алкіл, (С1С6)алкокси, трифторметил, (С1-С6)алкілтіо, (С1С6)алкілсульфоніл, ацил, (С1-С6)алкоксикарбоніл, карбоксамідо, NR10R11, OSO2NR10R11, NR12SO2NR10R11, CO2R10 або СНО. 6. Похідна за п.5 і її солі з кислотою та її стереоізомерні форми, в якій: один з R4 і R9 означає водень або гідрокси, ціано або OSO2NR10R11; та інший означає водень або гідрокси, ціано, галоген, нітро, (С1-С6)алкіл, (С1-С6)алкокси, трифторметил, NR10R11, OSO2NR10R11, CO2R10, СНО, NR12SO2NR10R11. 7. Похідна за п.6 і її солі з кислотою та її стереоізомерні форми, в якій: R4 означає водень, гідрокси, ціано або OSO2NR10R11; R9 означає водень або гідрокси, ціано, галоген, нітро, (С1-С6)алкіл, (С1-С6) алкокси, трифторметил, NR10R11, OSO2NR10R11, CO2R10, СНО. 8. Похідна за п.7 і її солі з кислотою та її стереоізомерні форми, в якій: R4 означає водень; та R9 означає гідрокси, ціано, галоген, нітро, (С1С6)алкіл, (С1-С6)алкокси, трифторметил, NR10R11, OSO2NR10R11, CO2R10, СНО або NR12SO2NR10R11. 9. Похідна за будь-яким із пп.1-8 і її солі з кислотою та її стереоізомерні форми, в якій Z означає: R8 R8 (R9)p (R9 )p R8 S (R9)p (O)q , де: R8 означає водень, гідрокси, галоген, нітро, ціано, (С1-С6)алкокси, NR10R11, SO2NR10R11, OSO2NR10R11, NR12SO2NR10R11 або OSO2NR10SO2NR11R12; , , N 5 R9 означає водень або гідрокси, ціано, галоген, нітро, (С1-С6)алкіл, (С1-С6)алкокси, трифторметил, NR10R11, OSO2NR10R11, CO2R10, СНО, NR12SO2NR10R11; р і q мають значення, визначені у п.1. 10. Похідна за будь-яким із пп.1-9 і її солі з кислотою та її стереоізомерні форми, в якій Q вибране з прямого зв’язку, С(О), SO2, CONH, С(О)(СН2)n, (СН2)n(О) або (СН2)n, де n означає 0, 1 або 2. 11. Похідна за п.1 і її солі з кислотою та її стереоізомерні форми, в якій: Z означає R8 (R9)p , Q означає (СН2)n, де n означає 0, 1 або 2; один з R3 і R8 означає гідрокси, нітро, NR10R11, OSO2NR10R11 або NR12SO2NR10R11, а інший означає водень або гідрокси, ціано, галоген, нітро, (С1С6)алкіл, (С1-С6)алкокси, трифторметил, (С1С6)алкілтіо, (С1-С6)алкілсульфоніл, ацил, (С1С6)алкоксикарбоніл, карбоксамідо, NR10R11, OSO2NR10R11 або NR12SO2NR10R11; R4 і R9 означають, кожний незалежно, водень, гідрокси, ціано, галоген, нітро, (С1-С6)алкіл, (С1С6)алкокси, трифторметил, (С1-С6)алкілтіо, (С1С6)алкілсульфоніл, ацил, (С1-С6)алкоксикарбоніл, карбоксамідо, NR10R11, OSO2NR10R11 або NR12SO2NR10R11; R10 і R11 означають, кожний незалежно, водень, (С1-С6)aлкіл або (С3-С8)циклоалкіл; р означає 1, 2, 3 або 4; R8 і R9 разом з фенільним кільцем, до якого вони приєднані, можуть також утворювати діоксид бензоксатіазину або діоксид дигідробензоксатіазину; R3 і R4 разом з фенільним кільцем, до якого вони приєднані, можуть також утворювати бензофуран або N-метилбензотриазол. 12. Похідна за п.11 і її солі з кислотою та її стереоізомерні форми, в якій: Z означає R8 (R9 )p , Q означає (СН2)n, де n означає 0, 1 або 2; R8 означає гідрокси, галоген, нітро, ціано або (С1С6)алкокси, NR10R11, SO2NR10R11, OSO2NR10R11 або NR12SO2NR10R11; R9 означає водень, гідрокси, ціано, галоген, нітро, (С1-С6)алкіл, (С1-С6)алкокси, трифторметил, NR10R11, OSO2NR10R11; р має значення, визначене у п.1. 13. Похідна за п.12 і її солі з кислотою та її стереоізомерні форми, в якій: n означає 0 або 1; R4 і R9 означають, кожний незалежно, водень, галоген, (С1-С6)алкокси, ацил, NR10R11, OSO2NR10R11 або NR12SO2NR10R11. 14. Похідна за будь-яким із пп.11-13 і її солі з кислотою та її стереоізомерні форми, в якій: n означає 0 або 1; R1, R2 і R4 означають, кожний, водень; R9 означає водень, галоген, (С1-С6)алкіл або OSO2NR10R11. 86393 6 15. Похідна за будь-яким із пп.11-14 і її солі з кислотою та її стереоізомерні форми, в якій: n і р означають 1; R8 означає гідрокси, галоген, нітро, ціано, (С1С6)алкокси, NR10R11, SO2NR10R11, OSO2NR10R11, NR12SO2NR10R11 aбo OSO2NR10SO2NR11R12; R9 означає гідрокси, ціано, галоген, нітро, (С1С6)алкіл, (С1-С6)алкокси, трифторметил, NR10R11, OSO2NR10R11, CO2R10 або СНО; R3 означає ціано, гідрокси, OSO2NR10R11 або NR12SO2NR10R11; R4 означає водень, гідрокси, галоген, ціано або OSO2NR10R11. 16. Похідна за будь-яким із пп.12-15 і її солі з кислотою та її стереоізомерні форми, в якій один з R3 і R8 означає гідрокси, ціано або OSO2NR10R11, а інший означає гідрокси, нітро, NR10R11, OSO2NR10R11 або NR12SO2NR10R11. 17. Похідна за п.16 і її солі з кислотою та її стереоізомерні форми, в якій один з R3 і R8 означає ціано або OSO2NR10R11, а інший означає гідрокси або OSO2NR10R11. 18. Похідна за пп.1 або 2 і її солі з кислотою та її стереоізомерні форми, в якій: Z означає R8 (R9)p S (O)q , де: Q означає (СН2)m-Х-(СН2)n-А-; А означає прямий зв’язок або О, S, SO, SO2, NR5; X означає прямий зв’язок, CF2, О, S, SO, SO2, C(O), NR5 або CR6R7; m і n означають, кожний незалежно, 0, 1, 2, 3 або 4; R3, R4, R8 i R9 означають, кожний незалежно, водень або гідрокси, ціано, галоген, нітро, (С1С6)алкіл, (С1-С6)алкокси, бензилокси, трифторметил, (С1-С6)алкілтіо, (С1-С6)алкілсульфоніл, ацил, (С1-С6)aлкоксикарбоніл, NR10R11, OPO(OR10)2, OCHO, COOR10, SO2NR10R11, OSO2NR10R11, SO2OR10, OSO2OR10, SSO2NR10R11, CONR10R11, OCONR10R11, OCSNR10R11, SCONR10R11, SCSNR10R11, NR12SO2NR10R11, тетразоліл, NR10CONR11OH, NR10SO2NR11OH, NOH-CHO, NOHSO2NR10R11 aбo OSO2NR10OH; p означає 0,1 або 2; R5, R6, R7, R10, R11 і R12 означають, кожний незалежно, водень, (С1-С6)алкіл або (С3-С8)циклоалкіл; R10 може також бути сіллю; R10 і R11 можуть також утворювати з атомом азоту, з яким вони зв’язані, 5-7-членний гетероцикл, який містить один або два гетероатоми, вибрані з О, S і N; пунктирна лінія означає, що Q та/або R8 та/або R9 можуть знаходитися у будь-якому положенні бензотіофенового кільця. 19. Похідна за п.18 і її солі з кислотою та її стереоізомерні форми, в якій R8 означає OSO2NR10R11 або NR12SO2NR10R11. 20. Похідна за п.18 або 19, в якій R9 означає водень, галоген, нітро, COOR10 або ціано. 7 21. Похідна за будь-яким із пп.18-20, в якій R4 означає водень, галоген, ціано, (С1-С6)алкокси, NR10R11, OSO2NR10R11 або NR12SO2NR10R11. 22. Похідна за будь-яким із пп.18-21, в якій R10, R11 і R12 означають, кожний незалежно, водень або (С1-С6)алкіл. 23. Похідна за будь-яким із пп.18-22, в якій Q означає (СН2)m -Х-(СН2)n-А, де m означає 0, 1 або 2 і X означає прямий зв’язок, SO2 або CO, n означає 0 і А означає прямий зв’язок. 24. Похідна за будь-яким із пп.18-23, в якій R3 означає водень, галоген або ціано. 25. Похідна за п.1 або 2 і її солі з кислотою та її стереоізомерні форми, в якій Z означає групу: R8 (R9)p , в якій R8, R9 і р мають значення, визначені у п.1. 26. Похідна за п.25 і її солі з кислотою та її стереоізомерні форми, в якій: R3 означає ціано або OSO2NR10R11; N Цей винахід відноситься до похідних 1-Nфеніламіно-1Н-імідазолу та до фармацевтичних композицій, що їх містять. Винахід у цілому відноситься до галузі гормонозалежного та гормононезалежного раку та ендокринних порушень. Ароматаза являє собою фізіологічний фермент, відповідальний за специфічне перетворення андрогенів, таких як андростендіон або тестостерон, на естрогени, такі як фолікулін та естрадіол відповідно [Сімпсон Е.Р. та ін., Endocrine Reviews, 1994, 15: 342-355]. Інгібування ароматази є, тому, вибраною стратегією впливу на нормальні або патологічні естроген індуковані або естроген залежні біологічні процеси, такі як жіноча статева диференціація, овуляція, імплантація, вагітність, проліферація клітин молочної залози та ендометрію, а також регуляція сперматогенезу або проліферації клітини простати у чоловіків або нерепродуктивних функцій, таких як остеогенез чи баланс Т-клітин і цитокінів [див. Сімпсон Е.Р. та ін., Recent Progress in Hormone Research, 1997, 52: 185-213 та усі видання Endocrine Related Cancer (1999, том б, №2) і Breast Cancer Research Treatment (1998, том 49, додаток №1)]. Фермент стероїдсульфатаза (Е.С. 3.1.6.2., STS) каталізує гідроліз сульфату фолікуліну до фолікуліну та сульфату DHEA до DHEA [Діббелт Л., Biol. Chem, Hoppe-Seyler, 1991, 372, 173-185 і Штейн С, J. Biol. Chem., 1989, 264, 13865-13872]. Шлях стероїдсульфатази був у фокусі нещодавніх досліджень у галузі раку молочної залози відносно локального внутрішньотканинного формування естрогенів з рясного циркулюючого пулу сульфату фолікуліну (Е-iS) [Паскуаліні Дж.Р., J. Steroid Biochem. Мої. Biol., 1999, 69, 287-292 і 86393 8 R4 означає водень, гідроксил, галоген, ціано, OSO2NR10R11; R8 означає гідрокси, ціано, OSO2NR10R11, NR10R11, NR12SO2NR10R11, ОСНО або тетразоліл; R9 означає водень, галоген, нітро, ціано або CO2R10; та Q має значення, визначене у п.10. 27. Похідна за будь-яким із пп.1-26 і її солі з кислотою та її стереоізомерні форми, в якій R1 і R2 незалежно означають водень або (С1-С6)алкіл. 28. Похідна за будь-яким із пп.1-27 і її солі з кислотою та її стереоізомерні форми, в якій R10 і R11 означають водень. 29. Сполука за будь-яким із пп.1-28 або її фармацевтично прийнятна сіль для застосування як активної терапевтичної речовини. 30. Фармацевтична композиція, яка містить похідну за будь-яким із пп.1-28 або її фармацевтично прийнятну сіль з кислотою та фармацевтично прийнятний носій. 31. Фармацевтична композиція за п.30, яка містить від 0,1 до 400 мг вказаної похідної. Purohit А, Мої. Cell. Endocrinol., 2001, 171, 129135]). Інгібування цього ферменту запобігло б утворенню з Е-iS вільного фолікуліну (Е-і), який може бути перетворений на естрадіол (Ег) ферментативним відновленням. На додаток до шляху сульфатази фолікуліну тепер вважають, що інший потужний естроген, андростендіол (адіол), який одержують з DHEA в результаті гідролізу DHEA-c, може бути іншим важливим компонентом, що підтримує ріст і розвиток гормонозалежних пухлин молочної залози. Формування естрогенів у жінок схематично представлене на Фіг. Для лікування хворих гормонозалежними онкологічними захворюваннями у цей час використовують інгібітори ароматази, щоб запобігти синтезу естрогену. Однак клінічні випробування показали відносний недолік ефективності для пацієнтів з пухлинами, позитивними відносно рецептору естрогену [Кастігліоне-Гертш М., Eur. J. Cancer, 1996, 32А, 393-395 і Джонат В., Eur. J. Cancer, 1996, 32A, 404-412]. Як пояснення шлях стероїдсульфатази може бути іншим важливим шляхом для формування естрогену в пухлинах молочної залози. ЕМАТЕ [Ахмед С, Curr. Med. Chem., 2002, 9, 2, 263-273], фолікулін-3-сульфамат, є традиційним стандартним стероїдним інгібітором сульфатази, але має головний недолік, який полягає у тому, що він має естрогенну природу через його механізм інгібування: сульфаматна частина розщеплюється у перебігу процесу інактивації ферментів, у результаті чого Е1 утворюється не з E1S, a безпосередньо з ЕМАТЕ [Ахмед С, J. Steroid Biochem. Мої. ВіоІ., 2002, 80, 429-440]. 9 Інші нестероїдні сульфаматні сполуки, які призводять до похідних без естрогенних властивостей, були представлені як прийнятні потенціальні лікарські засоби, такі як 6,6,7-COUMATE, стандартний неестрогенний інгібітор сульфатази, відомий з літератури [Пурохіт A., Cancer Res, 2000, 60, 3394-3396]. Карбоангідрази людини каталізують перетворення діоксиду вуглецю (СО2) на іон бікарбонату (НСО3-) та беруть участь у фізіологічних і патологічних процесах. Ці процеси мають у своєму складі гормонозалежний та гормононезалежний канцерогенез, метастатичний інвазивний процес і гіпоксичні пухлини, що експресують ці ферменти, які є менш чутливими до класичних хіміо/радіотерапевтичних інгібіторів. Зокрема, було виявлено, що ЕМАТЕ має активність інгібітору карбоангідрази людини, подібну до активності ацетазоламіду, відомого сульфонамідного інгібітору карбоангідрази людини [Вінум Дж. та ін., J. Med. Chem. 2003, 46, 2197-2204]. Тому особливо цікаво знайти сполуки, які мають принаймні один, краще принаймні два з таких видів активності: інгібування ароматази, інгібування стероїдсульфатази та інгібування карбоангідрази. Нещодавно Б. Поттер та ін. [J. Med. Chem., 46, 2003, 3193-3196] сповіщали, що сульфамоїльовані похідні інгібітору ароматази YM 511 інгібували сульфатазну та ароматазну активності у клітинах JEG-3. Сполуки, представлені як придатні для лікування естроген залежних захворювань, описані у US 2003/0008862A. Похідні імідазолу з антиароматазними властивостями [описані у WO 2004/054983]. У цей час виявлено, що похідні імідазолу, які містять 1-N-феніламіногрупу, демонструють несподівано високий потенціал відносно інгібування ароматази та/або стероїдсульфатази та/або карбоангідрази. Відповідно, однією із задач цього винаходу є одержання похідних 1-N-феніламіно-1Н-імідазолу, 86393 10 які були б потужними інгібіторами ароматази та/або стероїдсульфатази та/або карбоангідрази. Іншою задачею цього винаходу є одержання фармацевтичної композиції, яка містить як активний інгредієнт похідну 1-N-ариламіно-1H-імідазолу, як викладено нижче. Наступною задачею цього винаходу є застосування похідних 1-N-феніламіно-1Н-імідазолу для виробництва лікарського засобу для лікування або запобігання різних захворювань і для регулювання репродуктивних функцій у жінок, у чоловіків, а також у самок і самців диких або хатніх тварин. Похідні 1-N-феніламіно-1H-імідазолу за винаходом представлені такою загальною формулою (І): та їх солі з кислотою та стереоізомерні форми, де: R1 і R2 позначають, кожний незалежно, водень, (С1-С6)алкіл або (С3-С8)циклоалкіл; або R1 і R2 разом утворюють насичене або ненасичене 5-, 6- чи 7-членне карбоциклічне кільце; Q позначає (CH2)m -X-(CH2)n-A; А позначає прямий зв'язок, О, S, SO, SO2, NR5; X позначає прямий зв'язок, CF2, О, S, SO, SO2, C(O), NR5 або CR6R7; Z позначає групу, вибрану з: m і n позначають, кожний незалежно, 0, 1, 2, 3 або 4; р позначає 1, 2, 3 або 4; q позначає 0, 1 або 2; пунктирна лінія означає, що R8 та/або R9 можуть перебувати у будь-якому положенні бензотіофенового кільця; R3 і R6 позначають, кожний незалежно, водень або гідрокси, ціано, галоген, нітро, (С1-С6)алкіл, (С1-С6)алкокси, трифторметил, (С1-С6)алкілтіо, (С1С6)алкілсульфоніл, ацил, (С1-С6)алкоксикарбоніл, карбоксамідо, OPO(OR10)2, NR10R11, SO2NR10R11, OSO2NR10R11, OSO2OR10, SO2OR10, SSO2NR10R11, CF2SO2OR10, CF2SO2NR10R11, СF2-тетразоліл або NR12SO2NR10R11, OSO2NR12SO2NR10Rn, CO2R10, CONR10R11, OCHO, OCONR10R11, OCSNR10R11, SCONR10R11, SCSNR10R11, тетразоліл, NR12CONR10R11, NR10-CHO; коли Q-Z позначає 11 n позначає 0, 1 або 2 і р позначає 1, один з R3 і R8 позначає гідрокси, нітро, OPO(OR10)2, NR10R11, OSO2NR10R11, OSO2OR10, SO2OR10, SSO2NR10R11, CF2SO2OR10, CF2SO2NR10R11, СР2-тетразоліл, NR12SO2NR10R11, OSO2NR12SO2NR10R11, CO2R10, CONR10R11, OCHO, OCONR10R11, OCSNR10R11, SCONR10R11, SCSNR10R11, тетразоліл, NR12CONR10R11, NR10-CHO, а інший позначає водень або гідрокси, ціано, галоген, нітро, (С1С6)алкіл, (С1-С6)алкокси, трифторметил, (С1С6)алкілтіо, (С1-С6)алкілсульфоніл, ацил, (С1С6)алкоксикарбоніл, карбоксамідо, NR10R11, SO2NR10R11, OSO2NR10R11, OSO2OR10, SO2OR10, SSO2NR10R11, CF2SO2OR10, CF2SO2NR10Rn, СF2тетразоліл, NR12SO2NR10R11, OSO2NR12SO2NR10R11, CO2R10, CONR10R11, OCHO, OCONR10R11, OCSNR10R11, SCONR10R11, SCSNR10R11, тетразоліл, NR12CONR10R11, NR10CHO; R4 і R9 позначають, кожний незалежно, водень або гідрокси, ціано, галоген, нітро, OPO(OR10)2, (С1-С6)алкіл, (С1-С6)алкокси, трифторметил, (С1С6)алкілтіо, (С1-С6)алкілсульфоніл, ацил, (С1С6)алкоксикарбоніл, карбоксамідо, NR10R11, S02NR10R11, OSO2NR10R11, OS02OR10, SO2OR10, SSO2NR10R11, CF2SO2OR10, CF2SO2NR10R11, СF2тетразоліл, NR12SO2NR10R11, OSO2NR12SO2NR10R11, CO2R10, CHO, CONR10R11, OCHO, OCONR10R11, OCSNR10R11, SCONR10R11, SCSNR10R11, тетразоліл, NR12CONR10R11, NR10CHO; коли р позначає 2, 3 або 4, R9 можуть бути однаковими або різними; R6 і R7 позначають незалежно водень, галоген, (С1-С6)алкіл або (С3-С8) циклоалкіл; R5, R10, R11 і R12 позначають, кожний незалежно, водень, гідрокси, (С1-С6) алкіл або (С3С8)циклоалкіл; R10 може також бути сіллю; R10 і R11 можуть також утворювати, разом з атомом азоту, з яким вони пов'язані, 5-7-членний гетероцикл, який містить один або два гетероатоми, вибрані з О, S і N; коли Z позначає і р позначає 1, тоді R8 і R9 можуть також утворювати разом з фенільним кільцем діоксид бензоксатіазину, діоксид дигідробензоксатіазину, діоксид бензоксатіазинону, діоксид бензоксатіазолу, тетраоксид бензоксадитіадіазину, тетраоксид бензодитіазину або тетраоксид бензодіоксадитину; коли Z позначає R3 і R4 разом з фенільним кільцем, до якого вони приєднані, можуть також утворювати бензо 86393 12 фуран або N-метилбензотріазол, за умови, що коли р позначає 1 і Q позначає (СН2)n, тоді R8 і R9 позначають незалежно гідрокси, нітро, OPO(OR10)2, NR10R11, OSO2NR10R11, OSO2OR10, SO2OR10, SSO2NR10R11, CF2SO2OR10, CF2SO2NR10R11, СF2-тетразоліл, NR12SO2NR10R11, OSO2NR12SO2NR10R11, CO2R10, CONR10R11, OCHO, OCONR10R11, OCSNR10R11, SCONR10R11, SCSNR10R11, тетразоліл, NR12CONR10R11 або NR10CHO. Цей винахід також відноситься до солей сполук за винаходом або до їх стереоізомерних форм, якщо вони існують. В описі та формулі винаходу термін «(С1С6)алкіл» позначає прямий або розгалужений вуглеводневий ланцюг, що має 1-6 атомів вуглецю. (С1-С6)алкіл являє собою, наприклад, метил, етил, пропіл, ізопропіл, бутил, ізобутил, трет-бутил, пентил, ізопентил або гексил. Алкільними радикалами, яким надають перевагу, є такі, що мають 1, 2 або 3атоми вуглецю. Термін «галоген» позначає хлор, бром, йод або фтор. Термін «(С3-С8)циклоалкіл» позначає насичений моноциклічний вуглеводень, що має 3-8 атомів вуглецю. (С3-С8)циклоалкіл являє собою, наприклад, циклопропіл, циклобутил, циклопентил, циклогексил, циклогептил або циклооктил. Термін «(С1-С6)алкокси» позначає групу OR, в якій R є (С1-С6)алкілом, як визначено вище. (С1С6)алкокси являє собою, наприклад, метокси, етокси, пропокси, ізопропокси, бутокси, ізобутокси, трет-бутокси, н-пентилокси або ізопентилокси. Алкокси-радикалами, яким надають перевагу, є такі, що мають 1, 2 або 3 атоми вуглецю. Термін «ацил» позначає групу , в якій R' позначає водень або (С1-С4)алкіл, де термін «алкіл» визначений вище. Ацил являє собою, наприклад, форміл, ацетил, пропіоніл, бутирил або валерил. Ацильними радикалами, яким надають перевагу, є форміл та ацетил. У визначенні R10 «сіль» позначає сіль лужного металу або сіль лужноземельного металу, такого як натрій, калій, магній або кальцій, або солі амонію чи органічного аміну, такого як триетиламін, етаноламін або трис-(2-гідроксіетил)амін. У контексті винаходу це відноситься до груп, які мають залишок OR10. 5-7-членний гетероцикл може бути насиченим або ненасиченим і вміщує, наприклад, тетразол, тріазол, піразол, піразолідин, імідазол, імідазолідин, піперидин, піперазин, морфолін, піролідин. Сполуки формули (І) утворюють солі з кислотами, наприклад з неорганічними кислотами, такими як соляна кислота, бромистоводнева кислота, сірчана кислота, азотна кислота, фосфорна кислота тощо, або з органічними карбоновими кислотами, такими як оцтова кислота, пропіонова кислота, гліколева кислота, піровиноградна кислота, щавлева кислота, яблучна кислота, фумарова кислота, винна кислота, лимонна кислота, бензойна кислота, корична кислота, мигдальна кислота, метансульфонова кислота та ін. Солі, яким нада 13 ють особливу перевагу, являють собою солі, що є фармацевтично прийнятними. Серед сполук формули (І) перевагу надають сполукам, які задовольняють принаймні одній з таких умов: R3 і R8 позначають, кожний незалежно, водень або гідрокси, ціано, галоген, нітро, (С1-С6)алкіл, (С1-С6)алкокси, трифторметил, (С1-С6)алкілтіо, (С1С6)алкілсульфоніл, ацил, (С1-С6)алкоксикарбоніл, карбоксамідо, NR10R11, SO2NR10R11, OSO2NR10R11, OSO2NR12SO2NR10R11, OCHO, NR12SO2NR10R11; R4 і R9 позначають, кожний незалежно, водень або гідрокси, ціано, галоген, нітро, (С1-С6)алкіл, (С1-С6)алкокси, трифторметил, (С1-С6)алкілтіо, (С1С6) алкілсульфоніл, ацил, (С1-С6)алкоксикарбоніл, карбоксамідо, NR10R11, OSO2NR10R11, CO2R10, СНО, NR12SO2NR10R11; R1 і R2 позначають, кожний незалежно, водень або (С1-С6)алкіл; R10, R11 і R12 позначають, кожний незалежно, водень або (С1-С6)алкіл. Особливу перевагу надають сполукам формули (І), в якій: один з R3 і R8 позначає гідрокси, нітро, NR10R11, OSO2NR10R11 або NR12SO2NR10R11; та інший позначає водень або гідрокси, ціано, галоген, нітро, (С1-С6)алкіл, (С1-С6)алкокси, трифторметил, (С1-С6)алкілтіо, (С1-С6)алкілсульфоніл, ацил, (С1-С6)алкоксикарбоніл, карбоксамідо, NR10R11, OSO2NR10R11, NR12SO2NR10R11. Група цих сполук, якій надають особливу перевагу, представлена сполуками, в яких: один з R3 і R8 позначає гідрокси, ціано, (С1С6)алкокси або OSO2NR10R11; та інший позначає водень або гідрокси, галоген, нітро, ціано, (С1-С6)алкокси, NR10R11, SO2NR10R11, OSO2NR10R11, NR12SO2NR10R11, OSO2NR10SO2NR11R12. Краще, якщо сполуки формули (І) являють собою сполуки, в яких: один з R3 і R8 позначає ціаногрупу; та інший позначає водень або гідрокси, галоген, нітро, (С1-С6)алкокси, трифторметил, NR10R11, SO2NR10R11, OSO2NR10R11, NR12SO2NR10R11. Інші сполуки, яким надають перевагу, являють собою сполуки, в яких: один з R4 і R9 позначає водень або гідрокси, ціано, OSO2NR10R11; та інший позначає водень або гідрокси, ціано, галоген, нітро, (С1-С6)алкіл, (С1-С6)алкокси, трифторметил, NR10R11, OSO2NR10R11, CO2R10, CHO, NR12SO2NR10R11. Інша група сполук, яким надають перевагу, представлена сполуками, в яких: R4 позначає водень, гідрокси, ціано або OSO2NR10R11; R9 позначає водень або гідрокси, ціано, галоген, нітро, (С1-С6)алкіл, (С1-С6)алкокси, трифторметил, NR10R11, OSO2NR10R11, CO2R10, СНО. Сполуки формули (І), яким надають особливу перевагу, являють собою сполуки, де: R4 позначає водень; і R9 позначає гідроксил, ціано, галоген, нітро, (С1-С6)алкіл, (С1-С6)алкокси, трифторметил, 86393 14 NR10R11, OSO2NR10R11, CO2R10, СНО або NR12SO2NR10R11. Сполуками формули (І), яким надають особливу перевагу, є сполуки, в яких Z являє собою: в яких R8 і R9 мають визначені вище значення. У визначених вище сполуках R8 і R9 переважно мають такі значення: R8 позначає водень, гідрокси, галоген, нітро, ціано, (С1-С6)алкокси, NR10R11, SO2NR10R11, OSO2NR10R11, NR12SO2NR10R11 або OSO2NR10SO2NR11R12; R9 позначає водень або гідрокси, ціано, галоген, нітро, (С1-С6)алкіл, (С1-С6) алкокси, трифторметил, NR10R11, OSO2NR10R11, CO2R10, CHO, NR12SO2NR10R11. р і q мають визначені вище значення. Серед сполук формули (І) сполукам, в яких Q вибраний з прямого зв'язку, С(О), SO2, CONH, C(O)(CH2)n, (СН2)n(О) або (СН2)n, де n позначає 0, 1 або 2, також надають особливу перевагу. Особливу перевагу надають сполукам формули (II) в якій: Q позначає (СН2)n, де п позначає 0, 1 або 2; один з R3 і R8 позначає гідрокси, нітро, NR10R11, OSO2NR10R11 або NR12SO2NR10R11, а інший позначає водень або гідрокси, ціано, галоген, нітро, (С1-С6)алкіл, (С1-С6)алкокси, трифторметил, (С1-С6)алкілтіо, (С1-С6)алкілсульфоніл, ацил, (С1С6)алкоксикарбоніл, карбоксамідо, NR10R11, OSO2NR10R11 або NR12SO2NR10R11; R4 i R9 позначають, кожний незалежно, водень, гідрокси, ціано, галоген, нітро, (С1-С6)алкіл, (С1-С6)алкокси, трифторметил, (С1-С6)алкілтіо, (С1С6) алкілсульфоніл, ацил, (С1-С6)алкоксикарбоніл, карбоксамідо, NR10R11, OSO2NR10R11 або NR12SO2NR10R11. R10 і R11 позначають, кожний незалежно, водень, (С1-С6)алкіл або (С3-С8) циклоалкіл; р позначає 1, 2, 3 або 4; R8 і R9 разом з фенільним кільцем, до якого вони приєднані, можуть також утворювати діоксид бензоксатіазину або діоксид дигідробензоксатіазину; R3 і R4 разом з фенільним кільцем, до якого вони приєднані, можуть також утворювати бензофуран або N-метилбензотріазол. Серед цих сполук формули (II) перевагу надають сполукам, які відповідають принаймні одній з таких умов: Q позначає (CH2)n, де п позначає 0, 1 або 2; 15 R8 позначає гідрокси, галоген, нітро, ціано або (С1-С6)алкокси, NR10R11, SO2NR10R11, OSO2NR10R11 або NR12SO2NR10R11; R9 позначає водень, гідрокси, ціано, галоген, нітро, (С1-С6)алкіл, (С1-С6)алкокси, трифторметил, NR10R11, OSO2NR10R11; р позначає 1, 2, 3 або 4. Сполуками формули (II), яким надають найбільшу перевагу, є сполуки, в яких: n позначає 0 або 1; R1 і R2 позначають, кожний незалежно, водень або (С1-С6)алкіл; R4 і R9 позначають, кожний незалежно, водень, галоген, (С1-С6)алкокси, ацил, NR10R11, OSO2NR10R11 або NR12SO2NR10R11. Сполуками формули (II), яким надають особливу перевагу, є сполуки, в яких: n позначає 0 або 1; R1, R2 і R4 позначають, кожний, водень; R9 позначає водень, галоген, (С1-С6)алкокси або OSO2NR10R11. Сполуками формули (II), яким надають особливу перевагу, є сполуки, в яких: n і р позначають 1; R8 позначає гідрокси, галоген, нітро, ціано, (С1С6)алкокси, NR10R11, SO2NR10R11, OSO2NR10R11, NR12SO2NR10R11 або OSO2NR10SO2NR11R12; R9 позначає гідрокси, ціано, галоген, нітро, (С1С6)алкіл, (С1-С6)алкокси, трифторметил, NR10R11, OSO2NR10R11, CO2R10 або СНО; R3 позначає ціано, гідрокси, OSO2NR10R11 або NR12SO2NR10R11; R4 позначає водень, гідрокси, галоген, ціано або OSO2NR10R11. Серед цих сполук сполукам, які відповідають принаймні одній з таких умов, також надають перевагу: один з R3 і R8 позначає гідрокси, ціано або OSO2NR10R11, краще ціано або OSO2NR10R11; та інший позначає гідрокси, нітро, NR10R11, OSO2NR10R11 або NR12SO2NR10R11, краще гідрокси або OSO2NR10R11. Серед цих сполук формули (II) сполукам, в яких R10 і R11 позначають водень, надають найбільшу перевагу. Особливу перевагу також надають сполукам формули (III): в якій: Q позначає (CH2)m -X-(CH2)n-A-; А позначає прямий зв'язок або О, S, SO, SO2, NR5; X позначає прямий зв'язок, CF2, О, S, SO, SO2, C(O), NR5 або CR6R7; m і n позначають, кожний незалежно, 0, 1, 2, 3 або 4; R3 R4, R8 і R9 позначають, кожний незалежно, водень або гідрокси, ціано, галоген, нітро, (С1С6)алкіл, (С1-С6)алкокси, бензилокси, трифторме 86393 16 тил, (С1-С6) алкілтіо, (С1-С6)алкілсульфоніл, ацил, (С1-С6)алкоксикарбоніл, NR10R11, OPO(OR10)2, OCHO, COOR10, SO2NR10R11, OSO2NR10R11, SO2OR10, OSO2OR10, SSO2NR10R11, CONR10R11, OCONR10R11, OCSNR10R11, SCONR10R11, SCSNR10R11, NR12SO2NR10R11, тетразоліл, NR10CONR11OH, NR10SO2NR11OH, NOH-CHO, NOHSO2NR10R11 або OSO2NR10OH; p позначає 0, 1 або 2. R5, R6, R7, R10, R11 і R12 позначають, кожний незалежно, водень, (С1-С6)алкіл або (С3С8)циклоалкіл; R10 може також бути сіллю; R10 і R11 можуть також утворювати з атомом азоту, з яким вони пов'язані, 5-7-членний гетероцикл, що містить один або два гетероатоми, вибрані з О, S і N; Пунктирна лінія означає, що Q та/або R8 та/або R9 можуть перебувати у будь-якому положенні бензотіофенового кільця. Серед сполук формули (III) сполукам, які відповідають принаймні одній з таких умов, також надають перевагу: R3 позначає водень, галоген або ціано; R8 позначає OSO2NR10R11 або NR12SO2NR10R11; R9 позначає водень, галоген, нітро, COOR10 або ціано; R4 позначає водень, галоген, ціано, (С1С6)алкокси, NR10R11, OSO2NR10R11 або NR12SO2NR10R11; R10, R11 і R12 позначають, кожний незалежно, водень або (С1-С6)алкіл. Сполукам формули (III), в яких Q позначає (CH2)m-X-(CH2)n-A, де m позначає 0, 1 або 2 і X позначає прямий зв'язок, SO2 або CO, n=0 і А позначає прямий зв'язок, також надають перевагу. Особливу перевагу надають сполукам формули (IV): в якій R1, R2, R3, R4, R8, R9 і p мають такі значення, як визначено для сполук формули (І). Сполуками формули (IV), яким надають особливу перевагу, є сполуки, в яких: R3 позначає ціано або OSO2NR10R11; R4 позначає водень, гідроксил, галоген, ціано, OSO2NR10R11; R8 позначає гідрокси, ціано, OSO2NR10R11, NR10R11, NR12SO2NR10R11, OCHO, тетразоліл; R9 позначає водень, галоген, нітро, ціано або CO2R10; і Q має такі значення, як визначено вище для сполук формули (І). Завдяки здатності інгібувати ферменти ароматазу та/або стероїдсульфатазу та/або карбоангідразу, сполуки за винаходом можуть бути використані індивідуально або у комбінації з іншими активними інгредієнтами для лікування або запобігання будь-якому гормонозалежному чи гормононезалежному раку у людей, а також у диких або 17 хатніх тварин. Завдяки активності інгібування ароматази та/або стероїдсульфатази, сполуки за винаходом є приданими для керування регульованими естрогеном репродуктивними функціями у людей, а також у диких або хатніх тварин. Для лікування або запобігання вказаних станів сполуки за винаходом можуть бути використані індивідуально або у комбінації з антиестрогеном, SERM (селективний модулятор рецептору естрогену), інгібітором ароматази, інгібітором карбоангідрази, антиандрогеном, інгібітором стероїдсульфатази, інгібітором ліази, прогестином або агоністом чи антагоністом LH-RH. Сполуки за винаходом можуть також бути використані у комбінації з радіотерапевтичним засобом; хіміотерапевтичним засобом, таким як нітрований аналог іприту, такий як циклофосфамід, мельфалан, іфосфамід або трофосфамід; етиленіміном, таким як тіотепа; нітрозосечовиною, такою як кармустин; лізованим агентом, таким як темозоломід або дакарбазин; антиметаболітом фолієвої кислоти, таким як метотрексат або ралтитрексед; аналогом пурину, таким яктіогуанін, кладрибін або флударабін; аналогом піримідину, таким як фторурацил, тегафур або гемцитабін; вінка-алкалоїдом або аналогом, таким як вінбластин, вінкристин або вінорелбін; похідною подофілотоксину, такою як етопозид, таксани, доцетаксель або паклітаксель; антрацикліном чи аналогом, таким як доксорубіцин, епірубіцин, ідарубіцин або мітоксантрон; цитотоксичним антибіотиком, таким як блеоміцин чи мітоміцин; сполукою платини, такою як цисплатин, карбоплатин або оксаліплатин; моноклональним антитілом, таким як ритуксимаб; протипухлинним засобом, таким як пентостатин, мільтефозин, естрамустин, топотекан, іринотекан чи бікалутамід; або з інгібітором простагландину (СОХ 2/СОХ 1 інгібітор). Сполуки за винаходом можуть також бути використані для контролю або керування регульованими естрогеном репродуктивними функціями, такими як чоловіча або жіноча плодовитість, вагітність, переривання вагітності чи пологи, у людей, а також у різних видів диких або хатніх тварин, індивідуально або у комбінації з одним або декількома іншими терапевтичними засобами, такими як агоніст або антагоніст LH-RH, естропрогестагенний протизаплідний засіб, прогестин, антипрогестин або інгібітор простагландину. Оскільки тканина молочної залози є чутливою мішенню стимульованої естрогеном проліферації та/або диференціювання, інгібітори ароматази та/або стероїдсульфатази та/або карбоангідрази можуть бути використані для лікування або запобігання доброякісним захворюванням молочних залоз у жінок, гінекомастії у чоловіків і доброякісних чи злоякісних грудних пухлин з метастазами або без у чоловіків і жінок або у самців чи самок хатніх тварин. Сполуки за винаходом можуть також бути використані для лікування або профілактики доброякісного або злоякісного захворювання матки або яєчника. У кожному разі, сполуки за винаходом можуть бути використані індивідуально або у комбінації з одним або декількома іншими статевими ендокринними терапевтичними засобами, 86393 18 такими як антиандроген, антиестроген, прогестин або агоніст чи антагоніст LH-RH. Оскільки фермент стероїдсульфатаза трансформує сульфат DHEA у DHEA, попередник активних андрогенів (тестостерону і дигідротестостерону), сполуки за винаходом можуть бути використані для лікування або запобігання андрогенозалежним захворюванням, таким як андрогенне облисіння (облисіння за чоловічим типом) [Хоффман Р. та ін., J. Invest. Dermatol., 2001, 117, 1342-1348], гірсутизм, вугри [Білліх А. та ін., WO 9952890], доброякісні або злоякісні захворювання простати або яєчка [Рід МДж., Rev. Endocr. Relat. Cancer, 1993, 45, 51-62], індивідуально або у комбінації з одним або декількома іншими статевими ендокринними терапевтичними засобами, такими як антиандроген, антиестроген, SERM, антиароматаза, прогестин, інгібітор ліази або агоніст чи антагоніст LH-RH. Інгібітори стероїдсульфатази також можуть бути використані для лікування когнітивної дисфункції, тому що вони спроможні посилити пізнавальні процеси та просторову пам'ять у пацюка [Джонсон Д.A., Brain Res, 2000, 865, 286-290]. Сульфат DHEA як нейростероїд торкається безлічі систем нейромедіаторів, включаючи ті, що залучають ацетилхолін, глутамат і ГАМК, призводячи до збільшеної нейронної збуджуваності [Вольф О.Т., Brain Res. Rev, 1999, 30, 264-288]. Сполуки за винаходом, таким чином, також є корисними для посилення когнітивної функції, особливо для лікування старечої деменції, включаючи хворобу Альцгеймера, збільшуючи рівні DHEA у центральній нервовій системі. Крім того, естрогени беруть участь у регулюванні балансу між переважними імунними функціями Th1 і Th2 і можуть тому бути корисними для лікування або запобігання залежних від статі автоімунних захворювань, таких як вовчак, розсіяний склероз, ревматоїдний артрит тощо. [Дейнес Р.А., J. Exp. Med, 1990, 171, 979-996]. Крім того, показано, що інгібування стероїдсульфатази забезпечує захист у моделях контактної алергії та індукованого колагеном артриту у гризунів [Сьюттерс А.Дж., Immunology, 1997, 91, 314-321]. Дослідження з використанням 2-МеОЕМАТЕ показали, що інгібітори стероїдсульфатази мають потужну, незалежну від естрадіолу рістінгібувальну дію [Маккарті-Муроу Л., Cancer Research, 2000, 60, 5441-5450]. Зменшення об'єму пухлини несподівано спостерігали зі сполуками за винаходом з низьким інгібуванням стероїдсульфатази пухлини. У зв'язку з цим, сполуки за винаходом можуть призвести до зменшення поділу клітин через сильну взаємодію між такими новими хімічними структурними одиницями і мікротрубчастою сіткою у раковій клітині безвідносно тканини, включаючи молочну залозу, ендометрій, матку, простату, яєчко або метастаз, генерований з них. Сполуки за винаходом можуть тому бути корисними для лікування естроген незалежного раку. Сполуки за винаходом мають особливе значення для лікування або запобігання естрогензалежним захворюванням або порушенням, тобто індукованим естрогеном чи стимульованим естро 19 геном захворюванням або порушенням [Голоб Т., Bioorg. Med. Chem., 2002, 10, 3941-3953]. Крім того, сполуки за винаходом є інгібіторами карбоангідрази (СА). Ця властивість може пояснити інтерес до таких сполук для лікування гормононезалежного раку. Імуногістохімічні дослідження СА II показали, що вона експресується у злоякісних пухлинах головного мозку [Парккіла А.-К. та ін., Histochem. J., 1995, 27: 974-982], а також у карциномах шлунку та підшлункової залози [Парккіла С та ін., Histochem. J., 1995, 27: 133-138], і нещодавні дослідження показали, що СА IX і XII також експресується у деяких пухлинах і може бути функціонально пов'язана з онкогенезом. Іванов та ін. [Proc. Natl. Acad. Sci. USA, 1998, 95: 12596-12601] нещодавно висували гіпотезу, що асоційована з пухлиною СА IX і XII може бути залучена до окислення позаклітинного поживного середовища, яке оточує ракові клітини, що утворює мікросередовище, яке сприяє росту і розподілу пухлини. Показано, що ацетазоламід помітно інгібує інвазивну здатність у чотирьох ниркових лініях ракових клітин [Парккіла С та ін., Proc. Natl. Acad. Sci. USA, 2000, 97: 2220-2224], ефект, що відноситься до СА II, IX, і XII, які експресуються у цих клітинах. Лейкозні клітини можуть легко поширитися від кісткового мозку до інших органів через систему кровообігу, але різні лейкози відрізняються за їх здатністю утворювати екстрамедулярні пухлини, тобто метастази. Якщо б активності СА були істотними для інвазії іншими раковими клітинами, то можна було б аналогічно передбачити, що активна СА може також функціонувати у лейкозних клітинах. У межах цієї заявки термін «комбінований» або «комбінація» відноситься до будь-якого протоколу для спільного введення сполуки за винаходом та однієї або більше інших фармацевтичних речовин, незалежно від природи часу введення та зміни дози впродовж часу будь-якої з речовин. Спільне введення може, наприклад, здійснюватись паралельно, послідовно або впродовж періоду часу. Для лікування/запобігання будь-якому із вказаних захворювань або порушень сполуки за винаходом можуть бути введені, наприклад, перорально, місцево, парентерально, у лікарських сполуках, які містять звичайні нетоксичні фармацевтично прийнятні носії, ад'юванти та наповнювачі. Ці лікарські форми наведені як приклади, але спеціаліст може вибрати інші лікарські форми для введення сполук за винаходом. Термін «парентеральний» в межах цієї заявки вміщує підшкірні ін'єкції, внутрішньовенну, внутрішньом'язову, надчеревну ін'єкцію або інфузію. На додаток до лікування людей сполуки за винаходом є ефективними при лікуванні теплокровних тварин, таких як миші, пацюки, коні, вівці, собаки, кішки та ін. Фармацевтичні композиції, які містять активний інгредієнт(и), можуть бути у формі, придатній для перорального використання, наприклад, у формі таблеток, пастилок, льодяників, водних або олійних суспензій, порошків чи гранул, що диспергуються, емульсій, твердих або м'яких капсул, або сиропів чи еліксирів. Композиції, призначені для перорального використання, можуть бути одержа 86393 20 ні згідно з будь-яким відомим спеціалістові способом одержання фармацевтичних композицій, і такі композиції можуть містити один або більше засобів, вибраних з групи, яка складається з підсолоджувальних агентів, ароматизувальних речовин, барвників і консервантів, щоб одержати фармацевтично витончені та прийнятні препарати. Таблетки містять активний інгредієнт(и) у суміші з нетоксичними фармацевтично прийнятними інертними ексципієнтами, які є придатними для одержання таблеток. Ці інертні ексципієнти можуть являти собою, наприклад, інертні розріджувачі, такі як карбонат кальцію, карбонат натрію, лактоза, фосфат кальцію або фосфат натрію; гранулювальні та дезінтегрувальні агенти, наприклад кукурудзяний крохмаль або альгінова кислота; сполучні речовини, наприклад крохмаль, желатин або гуміарабік, і мастила, наприклад стеарат магнію, стеаринова кислота або тальк. Таблетки можуть бути непокритими або вони можуть мати покриття, яке наносять відомими методами, щоб затримати розклад та абсорбцію у шлунково-кишковому тракті і таким чином забезпечити уповільнену дію впродовж тривалого періоду часу. Наприклад, може бути використаний матеріал для відстрочення дії, такий як моностеарат гліцерину або дистеарат гліцерину. Порошки та гранули, що диспергуються, придатні для одержання водної суспензії додаванням води, містять активний інгредієнт(и) у суміші з диспергувальною або змочувальною речовиною, суспендувальним агентом та одним або більше консервантами. Придатні диспергувальні або змочувальні речовини та суспендувальні агенти проілюстровані вище. Додаткові ексципієнти, наприклад підсолоджувальні, ароматизувальні речовини та барвники, можуть також бути присутніми. Фармацевтичні композиції за винаходом можуть також бути у формі емульсії типу «олія у воді». Олійна фаза може бути представлена рослинною олією, наприклад оливковою олією чи арахісовою олією, або мінеральною олією, наприклад вазеліновою олією, або їх сумішшю. Придатні емульгатори можуть являти собою природні фосфатиди, наприклад сою, лецитин і складні ефіри або часткові ефіри, одержані з жирних кислот та ангідридів гекситу, наприклад сорбітан моноолеат, і продукти конденсації вказаних часткових ефірів з етиленоксидом, наприклад поліоксіетиленсорбітан моноолеат. Емульсії можуть також містити підсоложувальні та ароматизувальні речовини. Фармацевтичні композиції можуть бути у формі стерильної водної або масляної суспензії для ін'єкцій. Ця суспензія може бути складена згідно з відомими способами із використанням придатних диспергувальних або змочувальних речовин і суспендувальних агентів, які були згадані вище. Стерильний препарат для ін'єкцій може також бути стерильним розчином або суспензією для ін'єкцій у нетоксичному парентерально прийнятному розріджувачі або розчиннику, наприклад розчином у 1,3-бутандіолі. Серед прийнятних носіїв та розчинників, які можуть бути використані, можна назвати воду, розчин Рінгера та ізотонічний розчин хлориду натрію. Крім того, стерильні нелетучі олії традиційно використовують як розчинник або су 21 спендувальне поживне середовище. З цією метою може бути використане будь-яка нелетуча олія, у тому числі синтетичні моно- або дигліцериди. Крім того, при одержанні препаратів для ін'єкцій знаходять застосування жирні кислоти, такі як олеїнова кислота. Рівні дозування порядку приблизно від 0,0001мг до приблизно 20мг/кг маси тіла на добу є придатними для лікування вказаних вище станів, або альтернативно приблизно від 0,1мг до приблизно 2000мг на одного пацієнта на добу. Кількість активного інгредієнта, який може бути поєднаний з матеріалами-носіями для одержання разової лікарської форми, варіює залежно від індивідуальних особливостей пацієнта і конкретного способу введення. У цілому, лікарські форми містять приблизно від 0,1мг до приблизно 400мг сполуки за Вони можуть також мати покриття, яке наносять методом, [описаним у патентах США US 4256108, 4166452 і 4265874], щоб сформувати осмотичні терапевтичні таблетки для контрольованого вивільнення. Сполуки для перорального використання можуть також бути представлені як тверді желатинові капсули, в яких активний інгредієнт(и) змішаний з інертним твердим розріджувачем, наприклад карбонатом кальцію, фосфатом кальцію або каоліном, або як м'які желатинові капсули, в яких активний інгредієнт змішаний з водним або олійним середовищем, наприклад арахісовою олією, вазеліновою олією чи оливковою олією. Водні суспензії містять активний інгредієнт(и) у суміші з ексципієнтами, придатними для одержання водних суспензій. Такими ексципієнтами є суспендувальні агенти, наприклад карбоксиметилцелюлоза натрію, метилцелюлоза, гідроксипропілметилцелюлоза, альгінат натрію, полівінілпіролідон, трагакантова і аравійська камедь; диспергувальні або змочувальні речовини можуть бути природним фосфатидом, наприклад лецитином, або продуктами конденсації алкіленоксиду з жирними кислотами, наприклад стеаратом поліетиленоксиду, або продуктами конденсації етиленоксиду з довголанцюговими аліфатичними спиртами, наприклад гептадекаетиленоксицетанолом, або продуктами конденсації етиленоксиду з частковими ефірами, одержаними з жирних кислот і гекситу, такими як поліоксіетиленсорбіт моноолеат, або продуктами конденсації етиленоксиду з частковими ефірами, одержаними з жирних кислот і ангідридів гекситу, наприклад поліетиленсорбітан моноолеат. Водні суспензії можуть також містити один або більше консервантів, наприклад етил або н-пропіл, п-гідроксибензоат, один або більше барвників, одну або більше ароматизувальні речовини та один або більше підсолоджувальні агенти, такі як цукроза, сахарин або аспартам. Олійні суспензії можуть бути виготовлені шляхом суспендування активного інгредієнта(ів) у рослинній олії, наприклад арахісовій олії, оливковій олії, кунжутній олії або кокосовій олії, або у мінеральній олії, такій як вазелінова олія. Олійні суспензії можуть містити згущувач, наприклад бджолиний віск, твердий парафін або ацетиловий 86393 22 спирт. Підсолоджувальні агенти, такі як вказані вище, та ароматизувальні речовини можуть бути додані для одержання прийнятного перорального препарату. Ці композиції можуть бути збережені додаванням антиоксиданту, такого як аскорбінова кислота. Порошки та гранули, що диспергуються, придатні для одержання водної суспензії додаванням води, містять активний інгредієнт(и) у суміші з диспергувальною або змочувальною речовиною, суспендувальним агентом та одним або більше консервантами. Придатні диспергувальні або змочувальні речовини та суспендувальні агенти проілюстровані вище. Додаткові ексципієнти, наприклад підсолоджувальні, ароматизувальні речовини та барвники, можуть також бути присутніми. Фармацевтичні композиції за винаходом можуть також бути у формі емульсії типу «олія у воді». Олійна фаза може бути представлена рослинною олією, наприклад оливковою олією чи арахісовою олією, або мінеральною олією, наприклад вазеліновою олією, або їх сумішшю. Придатні емульгатори можуть являти собою природні фосфатиди, наприклад сою, лецитин і складні ефіри або часткові ефіри, одержані з жирних кислот та ангідридів гекситу, наприклад сорбітан моноолеат, і продукти конденсації вказаних часткових ефірів з етиленоксидом, наприклад поліоксіетиленсорбітан моноолеат. Емульсії можуть також містити підсоложувальні та ароматизувальні речовини. Фармацевтичні композиції можуть бути у формі стерильної водної або масляної суспензії для ін'єкцій. Ця суспензія може бути складена згідно з відомими способами із використанням придатних диспергувальних або змочувальних речовин і суспендувальних агентів, які були згадані вище. Стерильний препарат для ін'єкцій може також бути стерильним розчином або суспензією для ін'єкцій у нетоксичному парентерально прийнятному розріджувачі або розчиннику, наприклад розчином у 1,3-бутандіолі. Серед прийнятних носіїв та розчинників, які можуть бути використані, можна назвати воду, розчин Рінгера та ізотонічний розчин хлориду натрію. Крім того, стерильні нелетучі олії традиційно використовують як розчинник або суспендувальне поживне середовище. З цією метою може бути використане будь-яка нелетуча олія, у тому числі синтетичні моно- або дигліцериди. Крім того, при одержанні препаратів для ін'єкцій знаходять застосування жирні кислоти, такі як олеїнова кислота. Рівні дозування порядку приблизно від 0,0001мг до приблизно 20мг/кг маси тіла на добу є придатними для лікування вказаних вище станів, або альтернативно приблизно від 0,1мг до приблизно 2000 мг на одного пацієнта на добу. Кількість активного інгредієнта, який може бути поєднаний з матеріалами-носіями для одержання разової лікарської форми, варіює залежно від індивідуальних особливостей пацієнта і конкретного способу введення. У цілому, лікарські форми містять приблизно від0,1мг до приблизно 400 мг сполуки за винаходом, звичайно 0,1мг, 1мг, 2мг, 5мг, 10мг, 20мг, 40мг, 80мг, 100мг, 200мг або 400мг. 23 86393 24 Зрозуміло, однак, що конкретний рівень дози для будь-якого конкретного пацієнта залежатиме від різновиду факторів, включаючи вік, масу тіла, загальний стан здоров'я, стать, дієту, час введення, шлях введення, коефіцієнт екскреції, комбінацію лікарського засобу та серйозність конкретного захворювання, на яке спрямована терапія. Згідно з іншим об'єктом винахід відноситься до способу лікування або запобігання вказаним за хворюванням, порушенням або станам. Спосіб вміщує в себе введення пацієнтові (людині або тварині) терапевтично ефективної кількості сполуки за винаходом або її фармацевтично прийнятної солі з кислотою. Похідні 1-N-ариламіно-1Н-імідазолу формули (І) та їх солі з кислотою можуть бути одержані згідно із загальними схемами Іа, Іb, IIа, lIb, IV і V, в яких ()m позначає (СН2)m і ()n позначає (СН2)n. Згідно зі схемою Іа, N,N-двозаміщений анілін (3) може бути одержаний конденсацією анілінової похідної (1) з галогенопохідними, алкоїльними похідними, сульфонільними похідними або сульфінільними похідними (2) із використанням стандартних умов [Марч Дж., Advanced Organic Chemistry, Fourth edition, Wiley Interscience, New-York]. Більшість галогенопохідних, алкоїльних похідних, сульфонільних похідних або сульфінільних похідних (2) є комерційно доступними або синтезуються звичайними хімічними способами (див. експериментальну частину). Сполуку (3) перетворюють на її нітрозопохідну, використовуючи стандартні умови, потім відновлюють, одержуючи 1,1-двозаміщений гідразин формули (4). Альтернативно, 1,1-двозаміщений гідразин (4) може бути одержаний селективним Nалкілуванням гідразину формули (5) зі сполукою формули (2) із використанням умов, [описаних У. Лерх і Дж. Кьоніг (Synthesis, 1983, 2, 157-8), або умов, описаних Дж. Чангта ін. (Tetrahedron Letters, 1992, 33, 4717-20)]. Потім шляхом конденсації (4) з діалкілоксиалкіл-ізотіоціанатною похідною або етилендіоксиалкіл-ізоціанатною похідною одержують тіосемікарбазид (6), який перетворюють на 1-аміноімідазол2-тіон (7) шляхом обробки кислотою, такою як оцтова кислота або сірчана кислота. Десульфірування (7) в оцтовій кислоті в умовах, [описаних С Грівас та Е. Ронне в Ada Chemica Scandinavia, 1995, 49, 225-229], дає кінцевий i-Nфеніламіно-1Н-імідазол (8), який у разі необхідності перетворюють на одну з його солей з кислотою. Альтернативно, вказані сполуки (8), де R3 або R4 позначають електроноакцепторну групу, можуть бути одержані конденсацією N-імідазоланіліну (9) з галогенопохідними, алкоїльними похідними, сульфонільними похідними або сульфінільними похідними (2) із використанням стандартних умов [Марч Дж., Advanced Organic Chemistry, Fourth edition, Wiley Interscience, New-York]. 25 86393 26 Якщо R8 являє собою складний ефір, омилення сполуки (8) дає похідну карбонової кислоти звичайними способами. Якщо R8 являє собою сульфамід, він може бути безпосередньо одержаний із використанням придатної заміщеної алкоїльної похідної або галогенопохідної (2). Якщо R8 позначає ціаногрупу, реакція з азидом натрію дає тетразолільну групу (Кійото К., Synthesis, 1998, 910-14). Сполуку (9) одержують способом, подібним до способу, розкритому вище для одержання сполуки (8), виходячи зі сполуки (4). Згідно зі схемою Іb зняття захисту метоксиабо бензилокси-похідних (8) із використанням трибромборану [Макомі Дж.Ф.В., Tetrahedron, 1968, 24, 2289-92] або піперидину [Нісіока X. Synthesis, 200, 2, 243-46] або шляхом гідрування [Фелікс A., J Org Chem, 1978, 43, 4194-97] дає гідроксильну сполуку (10). Відновлення нітросполуки (8) двохлористим оловом або рутенієм і гідразином [WO 02051821] дає аміносполуку (12) [Матасса В., J Med Chem, 1990, 33, 2621-29]. Ці сполуки перетворюють на відповідні сульфамати (11) або аміносульфоніламіни (13) шляхом обробки гідридом натрію і сульфамоїлхлоридом [Нуссбаумер П., J Med Chem, 2002, 45, 4310-20] або взаємодією із сульфамоїлхлоридом у диметилацетаміді (DMAc) [Макото О., Tetrahedron letters, 2000,41,7047-51]. Ці гідроксильні сполуки можуть бути перетворені на форміатні похідні шляхом обробки формілацетатом [Шрайнер Е., Bioorg Med Chem Lett, 2004, 14, 4999-5002] або на 1Н-імідазол-1карбоксилатні похідні шляхом обробки N,N'карбонілдіімідазолом [Фішер В., Synthesis, 2002, 1, 29-30]. Сполуки (10) або (12), які мають як аміно, так і гідроксил у положенні орто, можуть бути перетворені на відповідні бензоксатіазоли в умовах, запропонованих К. К. Андерсен [J Org Chem, 1991, 56, 23, 6508-6516]. Коли X позначає CO або CS, відновлення кетону, тіокетону, аміду, тіоаміду виконують у стандартних умовах [Марч Дж., Advanced Organic Chemistry, Fourth edition, Wiley Interscience, NewYork]. Ці стадії відновлення можуть бути ефективними на будь-яких стадіях процесу синтезу. 27 Згідно зі схемою На сполуки (15) можуть бути одержані за такою самою методикою, як і сполука (3) на схемі Іа, виходячи зі сполук (1) і (14), або конденсацією N-імідазоланіліну (9) з галогенопохідними, алкоїльними похідними, сульфонільними похідними або сульфінільними похідними (14) із використанням стандартних умов [Марч Дж., Advanced Organic Chemistry, Fourth edition, Wiley Interscience, New-York]. Більшість галогенопохідних, алкоїльних похідних, сульфонільних похідних або сульфінільних похідних (14) є комерційно доступними або синтезуються звичайними способами (див. експериментальну частину). Якщо R8 являє собою складний ефір, омилення сполуки (15) дає похідну карбонової кислоти звичайними способами. Якщо R8 являє собою сульфамід, він може бути безпосередньо одержаний із використанням придатної заміщеної алкоїльної похідної або галагенопохідної (14). Якщо R8 позначає ціаногрупу, взаємодія з азидом натрію дає тетразолільну групу [Кійото К., Synthesis, 1998, 910-14]. Зняття захисту метокси- або бензилоксибензотіофену (15) із використанням трибромборану [Макомі Дж.Ф.В., Tetrahedron, 1968, 24, 2289-92] або шляхом гідрування [Фелікс A., J Org Chem, 86393 28 1978, 43, 4194-97] дає гідроксибензотіофен (16). Відновлення нітробензотіофенової сполуки (15) двохлористим оловом дає амінобензотіофен (18) [Матасса В., J Med Chem, 1990, 33, 2621-29]. Ці сполуки (16) і (18) перетворюють на відповідні сульфамати (17) або аміносульфоніламіни (19) із використанням тих самих умов, що й у синтезі сполук (11) або (13). Окислення сірки у бензотіофені перекисом водню у трифтороцтовій кислоті в умовах, описаних Грівас С. та Ронне Е. [Ada Chemica Scandinavia, 1995, 49, 225-229], або мета-хлорпербензойною кислотою в метиленхлориді дає окислені бензотіофени [ОнгХ.Х., J Med Chem, 1987, 30, 12, 22952303]. Відновлення аміду, тіоаміду, кетону, тіокетону, коли X позначає CO або CS, або відновлення окисленої сірчаної групи здійснюють в умовах, [описаних Еллефсон С (J Med Chem, 1981, 24, 110710), Хайос Дж. (Complex Hydrides, Elsevier, New York, 1979) або Драбовіч С. (Org Prep Proced Int, 1977, 9, 63-83) і Бордвелл Дж. (J Am Chem Soc, 1951, 73, 2251-53), або у стандартних умовах (Марч Дж., Advanced Organic Chemistry, Fourth edition, Wiley Interscience, New-York)]. Ці стадії окислення і відновлення можуть бути ефективними на будь-яких стадіях процесу синтезу. 29 Згідно зі схемою lIb сполуки (21) синтезують такими самими способами синтезу, що й сполуки (3), виходячи зі сполук (1) і (20) або (9) і (20). 3-галогенобензотіофенову похідну (21) обробляють водним гідроксидом металу [Свобода Дж., Collect Czech Chem comm, 2000, 65, 7, 1082-92 або Салл Д., J Med Chem, 2000, 43, 4, 649-63], одержуючи 3-гідроксибензотіофенову похідну (22), або обробляють водним аміаком в ацетоні або етанолі [Бордвелл Ф., J. A. C. S., 1948, 70, 1955-58], одержуючи 3-амінобензотіофенову похідну (24). 2-гідроксибензотіофенову похідну (22) або 2амінобензотіофенову похідну (24) одержують відповідно зняттям захисту 2метоксибензотіофенової похідної (21) із використанням гідрохлориду піридину [Канніццо С, J Heterocyclic Chem, 1990, 27, 2175-79] і шляхом відновлення 2-нітробензотіофенової сполуки (21) двохлористим оловом [Матасса В., J Med Chem, 1990, 33, 2621-29]. Ці сполуки (22) і (24) можуть бути сульфамоїльовані з одержанням (23) і (25), використовуючи ті самі умови, що й для синтезу сполук (11) або (13). Депротонування 2-Н-бензотіофенової похідної (21) із використанням амідів літію або алкілів при 86393 30 зводить до лініювання у С-2 положенні. Додавання сульфурилхлориду дає хлорсульфоніл, який обробляють водним аміаком в ацетоні [Грехем С, J Med Chem, 1989, 32, 2548-54], одержуючи 2сульфонамідбензотіофенову похідну (21), або додавання сухого льоду із подальшим гідролізом дає бензотіофенову похідну 2-карбонової кислоти (21) [Матека Д., J Med Chem, 1997, 40, 705-16]. Бензотіофенову похідну 3-карбонової кислоти або карбоксаміду (21) одержують обробкою 3-Нбензотіофенової похідної трихлорацетилхлоридом/хлоридом алюмінію із подальшим гідролізом водою [Бонжоукліан P., Synth Comm, 1985, 15, 8, 711-13] або водним аміаком [Тернбул К., J Heterocycl Chem, 2000, 37, 2, 383-88]. 3-сульфонамідну похідну (21) одержують в умовах, [описаних Чепмен Н. (J. Chem. Soc, 1970, 18, 2431-35) або Хагеман В. (Ger. Often., 3435173, 11 квітня 1985р.)]. Окислення сірки у бензотіофені та відновлення карбоксаміду, тіоаміду, кетону, тіокетону, окисленої сірчаної групи може бути здійснене на будьякій стадії синтезу в умовах, вже представлених у цьому описі. 31 86393 32 Згідно зі схемою III сполуки (27) одержують конденсацією N-імідазоланіліну (9) з ізоціанатними похідними (26), використовуючи стандартні умови [Марч Дж., Advanced Organic Chemistry, Fourth edition, Wiley Interscience, New-York]. Більшість ізоціанатних похідних (26) є комерційно доступними або синтезуються звичайними способами. Сполуки (28) і (30) синтезують такими способами синтезу, що й сполуки (10) і схемі Іb. Сполуки (29) і (31) синтезують такими способами синтезу, що й сполуки (11) і схемі Іb. самими (12) на Згідно зі схемою IV бі-арильні сполуки (33) можуть бути синтезовані такими самими способами синтезу, що й сполуки (8) з похідними (32). Похідні (32) є комерційно доступними або синтезу ються звичайними способами [як екс Буравей С, J Chem Soc, 1955, 2557; Tilley J W, J Med Chem, 1989, 32, 8, 1814]. Згідно зі схемою V сполуки (35) синтезують такими самими способами синтезу, що й сполуки (8) з гетероциклами (34) (один або два атоми азоту у будь-яких положеннях). Гетероцикли (34) є комерційно доступними або синтезуються звичайними способами (див. подальші приклади). Галагенопо самими (13) на 33 хідні піридину (34) можуть бути одержані [згідно з публікаціями (Bioorg Med Chem Lett, 1996, 6, 21, 2613; Myers A G, J Org Chem, 1996, 61, 813; Tetrahedron, 1993, 49, 19, 4085) або з карбонової кислоти (WO 0177078)]. Галагенопохідні піримідину (34) можуть бути одержані з алкілпіримідинів [Будесінскі, Collect, Czech, Chem Commun, 1968, 33, 7, 2266; Kunieda T, J Am Chem Soc, 1971, 93,3487) звичайним галогенуванням (Ісода С, Chem pharm Bull, 1980, 28, 5, 1408; Марч Дж., Advanced Organic Chemistry, Fourth edition, Wiley Interscience, New-York), або з карбальдегідів (Бредерек, Chem Ber, 1967, 100, 11, 3664; Адаме Дж.Л., Bioorg Med Chem Lett, 1998, 8, 22, 3111), і карбонові кислоти (Huffman К R, J Org Chem, 27, 1962, 551; Daves J Org Chem, 1961, 26, 2755)] можуть бути перетворені на хлорангідриди кислот (34). Галагенопохідні піразину (34) можуть бути одержані з алкілпіразинів [Лутці В.Б., J Org Chem, 1964, 29, 415] бромуванням, або з карбальдегідів [US 3558625], і карбонові кислоти [Сато Н., J Heterocycl Chem, 19, 1982, 407-408; Фельдер П, Helv Chim Acta, 1964, 47, 873] можуть бути перетворені на хлорангідриди кислот (34). Галагенопохідні піридазину (34) можуть бути [одержані згідно з Пірас С (Farmaco, 1993, 48, 9, 1249) Янай, (Heterocycles, 1976, 4, 1331), або галогенуванням алкілпіридазинів (Бекер, J Prakt Chem, 1970, 312, 591; DE 1950491), і карбонові кислоти (Богер Д.Л., J Am Chem Soc 1987, 109, 9, 2717)] можуть бути перетворені на хлорангідриди кислот (34). Для всіх схем IIа, lIb, IV, V карбоксилатну похідну, сульфамідну похідну і тетразольну похідну синтезують способами, вже описаними для схеми Іа і R8 та (R9)p виконані у тих самих умовах, які вже представлені у цьому описі. Групи, описані для R3, R4, R8 і R9, можуть бути одержані звичайними способами [див. огляд щодо сульфатази (Нуссбаумер П., Medecinal Research, 2004, 24, 4, 529-76), щодо карбоангідрази (Супуран СТ., Carbonic anhydrase, 2004, С R С press) і статті від Парк Дж. Д. (J Heterocycl Chem, 2000, 37, 2, 383-88), Шрайнер Е.П.(Bioorg Med Chem Lett, 2004, 14, 4999-5002) і Тейлор С.Д. (Bioorg Med Chem Lett, 2004, 14, 151-155)]. Подальші приклади призначені для ілюстрування, але не для обмеження обсягу винаходу. ОДЕРЖАННЯ N,N-ДBO3AMІЩEHИX ГІДРАЗИНІВ (4) Приклад 1 N1-(4ціанофентметил)-N1-(4метоксифент)гідразин Хлорметилбензонітрил (25г, 164,90ммоль) вводили при перемішуванні у колбу, яка містила толуол (200мл) і триетиламін (46,40мл, 329,80ммоль). Гідрохлорид 4метоксифенілгідразину (28,80г, 164,90ммоль) додавали порціями і реакційну суміш перемішували 3 години при кипінні зі зворотним холодильником. Після охолодження суміш фільтрували, промивали толуолом (50мл) і водою (200мл), одержуючи тверду речовину білого кольору (27,20г, 65%), т.пл: 115°С. 86393 34 1 Н-ЯМР (ДМСО-d6): 3,65 (с, 3Н), 4,30 (с, 2Н), 4,57 (с, 2Н), 6,77 (д, 2Н), 6,94 (д, 2Н), 7,48 (д, 2Н), 7,76 (д, 2Н). ОДЕРЖАННЯ ІМІДАЗОЛІВ (9) Приклад 2 4-[N-(1Н-імідазол-1-іл)аміно]бензонітрил а) 4-[N-(2,3-дипдро-1Н-імідазол-1-іл-2тіон)аміно]бензонітрил До суспензії гідрохлориду 4ціанофенілгідразину (6,00г, 35,40ммоль) в етанолі (60мл) додавали краплями 2,2диметоксіетилізотіоціанат (6,25г, 42,4ммоль) і реакційну суміш нагрівали зі зворотним холодильником впродовж 2 годин. Після охолодження розчинник випарювали у вакуумі, одержану олію розводили сумішшю оцтова кислота/вода (9/1, 32мл) і суспензію нагрівали зі зворотним холодильником впродовж 1,5 годин і при кімнатній температурі впродовж ночі. Одержаний залишок вливали у воду (300мл) і збирали коричневий осад. Після гомогенізації в етанолі з твердої речовини коричневого кольору одержували тверду речовину білого кольору (4,60г, 58%). 1 Н-ЯМР (ДМСО-d6): 6,54 (д, 2Н), 7,00 (т, 1Н), 7,23 (т, 1Н), 7,62 (д, 2Н), 9,83 (с, 1Н), 12,40 (с,1Н). b) 4-[N-(1Н-імідазол-1-іл)аміно]бензонітрил 35%-ний перекис водню (4,90мл, 55,5ммоль) додавали краплями до охолодженої льодом суспензії 4-[N-(2,3-дигідро-1Н-імідазол-1-іл-2тіон)аміно]бензонітрилу (4,00г, 18,50ммоль) в оцтовій кислоті (20мл). Коли ТСХ показала повне завершення реакції, реакційну суміш розводили водою, встановлювали рН 11 гідроксидом натрію, обробляли гідросульфітом натрію і екстрагували етилацетатом. Органічний шар сушили над сульфатом натрію і концентрували у вакуумі. Флешхроматографією на силікагелі (толуол/діоксан: 6/4) одержували чисту олію і кристалізацією з етанолу одержували білі кристали (4,40г, 58%), т.пл:162°С. 1 Н-ЯМР (ДМСО-d6): 6,50 (д, 2Н), 7,08 (с, 1Н), 7,30 (с, 1Н), 7,66 (д, 2Н), 7,83 (с, 1Н). ОДЕРЖАННЯ ПОХІДНИХ БЕНЗОТІОФЕНУ (14) І (20) Приклад 3 1-хлор-3-(3-метоксифеніл)сульфанілпропан-2он До перемішуваного розчину 1,3-дихлор-2пропанону (12,70г, 0,1моль) у суміші метанол/вода (100мл, 1:3) при 0°С додавали суспензію 3метоксибензолтіолу (14,02г, 0,1моль) і гідроксид натрію (4,00г, 0,10г) у воді (100мл). Суміш перемішували при 0°С впродовж 7 годин і при кімнатній температурі впродовж 10 годин. Осаджений продукт екстрагували дихлорметаном (100мл), промивали водою (80мл) і сушили сульфатом натрію. Після видалення розчинника одержували потрібний продукт (олія, 18,70г). 1 Н-ЯМР (CDCI3): 3,80 (с, 3Н), 3,83 (с, 2Н), 4,29 (с, 2Н), 6,78 (дд, 1Н), 6,98 (д, 1Н),6,90(дд, 1Н), 7,21 (т, 1Н). Приклад 4 3-хлорметил-6-метоксибензотіофен Розчин вказаної вище тіосполуки (17,50г, 75,85ммоль) у СН2СІ2 (1700мл) додавали краплями до розчину BF3Et2O (10,60мл, 83,44ммоль) у 35 СН2СІ2 (100мл) при кімнатній температурі в атмосфері азоту. Суміш перемішували впродовж ночі і після гідролізу водним розчином NaHCO3 реакційну суміш перемішували, поки обидві фази не стали прозорими. Шар СН2СІ2 відокремлювали і водний шар екстрагували СН2СІ2. Поєднані органічні фази сушили над Na2SO4, фільтрували і концентрували у вакуумі, одержуючи олію (18,00г). Флешхроматографія на силікагелі (толуол/петролейний спирт 40-60°С: 5/5) давала суміш 1:10 3хлорметил-4-метоксибензотіофен:3-хлорметил-6метоксибензотіофен у вигляді олії (12,35г, 58%). Головний ізомер 1Н-ЯМР (CDCI3): 3,89 (с, 3Н), 4,82 (с, 2Н), 7,08 (дд, 1Н), 7,30 (с, 1Н), 7,35 (д,1Н), 7,78 (д,1Н). Приклад 5 3-бром-6-бензилоксибензотіофен N-бромсукцинімід (15,70г, 83,92ммоль) і птолуолсульфонову кислоту (2,70г, 15,68ммоль) додавали до розчину 6-бензилоксибензотіофену (Zhengying С, комп'ютерна мережа 1370533 А, 21,2г, 88,33ммоль) у 1,2-дихлоретані (120мл). Суміш витримували при 80°С впродовж 35 хвилин, охолоджували на крижаній бані, і сукцинімід видаляли фільтруванням. Розчин екстрагували насиченим розчином бікарбонату натрію, сушили над Na2SO4, фільтрували і концентрували у вакуумі, одержуючи олію. Кристалізацією з пентану одержували тверду речовину білого кольору (21,60г, 92%, т.пл: 68°С). 1 Н-ЯМР (ДМСО-d6): 5,14 (с, 2Н), 7,08 (дд, 1Н), 7,25-7,55 (м, 6Н), 7,65 (д, 1Н), 7,76 (д, 1Н). Приклад 6 3-бром-6-бензилоксибензотіофен-1,1-діоксид До розчину 3-бром-6-бензилоксибензотіофену (2,00г, 6,27ммоль) у дихлорметані (50мл) і трифтороцтовій кислоті (1,5мл) додавали 35%-ний водний перекис водню (2,00мл, 19,54ммоль). Після 8 годин при 50°С суміш гідролізували насиченим водним №НСОз, екстрагували дихлорметаном, сушили над Na2SO4, фільтрували і концентрували у вакуумі, одержуючи сирий продукт. Флеш-хроматографією на силікагелі (толуол/етилацетат: 9/1) одержували прозору олію (1,10г, 55%). 1 Н-ЯМР (ДМСО-d6): 5,20 (с, 2Н), 7,20-7,60 (м, 7Н), 7,72 (д, 1Н), 7,83 (с, 1Н). Приклад 7 (6-бензилоксибензотієн-2-іл)метанол До розчину 6-бензилоксибензотіофен-2карбальдегіду (описаному номера Й., WO 9635688 А1, 6,50г, 24,20ммоль) у ТГФ (50мл) додавали краплями охолоджену до -30°С суспензію LiAIH4 (0,85г, 22,26ммоль). Після нагрівання до кімнатної температури суміш перемішували впродовж ночі, охолоджували до -10°С, гідролізували крижаною водою, екстрагували дихлорметаном, сушили над Na2SO4, фільтрували і концентрували у вакуумі, одержуючи сирий продукт. Флеш-хроматографією на силікагелі (толуол/етилацетат: 7/3) одержували прозору олію (4,50г, 69%). 1 Н-ЯМР (ДМСО-d6): 4,68 (с, 2Н), 5,13 (с, 2Н), 5,60 (с, 1Н), 7,00 (дд, 1Н), 7,14 (с, 1Н), 7,25-7,80 (м, 7Н). Приклад 8 86393 36 6-бензилокси-2-(хлорметил)бензотіофен Сульфонілхлорид (20мл) додавали до розчину (6-бензилоксибензотієн-2-іл)метанолу (4,20г, 15,50ммоль) у дихлорметані (40мл). Суміш витримували при кипінні зі зворотним холодильником впродовж 2 годин, охолоджували до кімнатної температури, потім концентрували у вакуумі, одержуючи 4,20г у вигляді олії. 1 Н-ЯМР (CDCI3): 4,75 (с, 2Н), 5,04 (с, 2Н), 6,95 (дд, 1Н), 7,10 (с, 1Н), 7,20-7,60 (м, 7Н). ОДЕРЖАННЯ ІМІДАЗОЛІВ ФОРМУЛИ (8, 33, 35) Використовуючи ту саму методику, як описано у прикладі 2, але замінюючи гідрохлорид 4ціанофенілгідразину на: -N1-(4-ціанофенілметил)-N1-(4метоксифеніл)гідразин, одержували таку сполуку: Приклад 9 4-[N-(1Н-імідазол-1-іл)-N-(4метоксифеніл)аміно]метилбензонітрил 1 Н-ЯМР (ДМСО-d6): 3,70 (с, 3Н), 4,90 (с, 2Н), 6,60-7,00 (м, 5Н), 7,40 (с, 1Н), 7,55 (д, 2Н), 7,70 (с, 1Н), 7,78 (д, 2Н). Кристалізацією з ефіру етанолу із соляною кислотою одержували білі кристали (5,70г, 66%). Т.пл.: 207°С 1 Н-ЯМР (ДМСО-d6): 3,70 (с, 3Н), 4,97 (с, 2Н), 6,93 (д, 2Н), 7,13 (д, 2Н), 7,45 (д, 2Н), 7,70 (с, 1Н), 7,84 (д, 2Н), 8,04 (с, 1Н), 8,18 (с, 1Н), 9,55 (с, 1Н). Приклад 10 4-[N-(4-пдроксифеніл)-N-(1Німідазол-1іл)аміно]метилбензонітрил Розчин триброміду бору (60мл, 60,00ммоль) у 20мл дихлорметану додавали до холодного (05°С) розчину 4-[N-(1Н-імідазол-1-іл)-N-(4метоксифеніл)аміно]метилбензонітрилу (4,60г, 15,11ммоль). Після 1 години при кімнатній температурі суміш гідролізували насиченим водним NaHCO3, фільтрували, промивали водою (50мл) і дихлорметаном (20мл), одержуючи тверду речовину коричневого кольору (4,00г). Кристалізацією з ацетону одержували тверду речовину коричневогокольору (3,00г, 68%). Т.пл.: 150°С. 1 Н-ЯМР (ДМСО-d6): 4,84 (с, 2Н), 6,70 (с, 4Н), 6,90 (с, 1Н), 7,45-7,62 (м, 3Н), 7,62-7,90 (м, 3Н), 9,25 (с,1Н). Приклад 11 4-[N-(4-гідроксифенілметил)-N-(1Н-імідазол-1іл)аміно]бензонітрил 4-гідроксибензилбромід (15,6г, 84,3ммоль, одержаний згідно з Вісснер А. та ін., J. Med. Chem. 1992, 35, 1650), додавали до суміші 4-[N-(1Німідазол-1-іл)аміно]бензонітрилу (10,00г, 54,30ммоль) і К2СО3 (8,20г, 59,70ммоль) у сухому ТГФ (150мл) при кімнатній температурі. Суміш потім перемішували при кімнатній температурі впродовж 2 годин і після цього вливали у воду та екстрагували етилацетатом, сушили над Na2SO4, фільтрували та концентрували у вакуумі, одержуючи сирий продукт (16,00г у вигляді твердої речовини). Кристалізацією з етилацетату з етанолом одержували очікуваний продукт (6,50г, 41%, т.пл: 180°С). 37 1 Н-ЯМР (DMCO-d6): 4,80 (с, 2Н), 6,65 (д, 2Н), 6,91 (с, 1Н), 7,04 (д, 1Н), 7,20 (с, 1Н), 7,56 (с,1Н), 7,63 (д,2Н). Використовуючи ту саму методику, але замінюючи 4-гідроксибензилбромід на: - 3-хлор-4-гідроксибензилбромід - 3-бром-4-гідроксибензилбромід -4-гідрокси-3метоксибензилбромід 2,3,5,6-тетрафтор-4-гідроксибензилхлорид (одержаний згідно з Ангіал С.Дж. та ін., J. Chem. Soc. 1950, 2141) - 3-форміл-4-гідроксибензилхлорид (одержаний згідно з Ангіал С.Дж. та ін., J. Chem. Soc. 1950, 2141) - 1-бензилокси-4-(2-брометокси)бензол (одержаний згідно Брінкмен Дж. та ін., Bioorg. Med. Chem. Lett., 1996, 6, 21, 2491-94) - 2-хлор-5-хлорметилпіридин - 4-(бромметил)бензолсульфонамід (одержаний згідно з Коулскотт Р та ін., J. Chem. Soc, 1957, 79, 4232-35) - 4-(хлорметил)-2-нітрофенол (одержаний згідно з патентом Байер: DE 132475) - 5-хлорметил-2-метоксибензойну кислоту (одержану згідно з Леонард Ф. та ін. J. Med. Chem., 1965, 8, 812-15), одержували відповідно такі сполуки: Приклад 12 4-[N-(3-хлор-4-гідроксифенілметил)-N-(1Німідазол-1-іл)аміно]бензонітрил Т.пл. 195°С 1 Н-ЯМР (ДМСО-d6): 4,88 (с, 2Н), 6,67 (д, 2Н), 6,88 (д, 2Н), 6,98 (с, 1Н), 7,05 (дд, 1Н), 7,24 (д, 1Н), 7,33 (с, 1Н), 7,70 (с, 1Н), 7,72 (д, 2Н), 10,28 (с, 1Н). Приклад 13 4-[N-(3-бром-4-гідроксифенілметил)-N-(1Німідазол-1-іл)аміно]бензонітрил Т.пл. 198°С 1 Н-ЯМР (ДМСО-d6): 4,90 (с, 2Н), 6,65 (д, 2Н), 6,85 (д, 1Н), 6,99 (с, 1Н), 7,07 (д, 1Н), 7,30 (с, 1Н), 7,40 (с, 1Н), 7,65 (с, 1Н), 7,67 (д, 2Н), 10,40 (с, 1Н). Приклад 14 4-[N-(4-гідрокси-3-метоксифенілметил)-N-(1Німідазол-1-іл)аміно]бензонітрил Т.пл. 215°С 1 Н-ЯМР (ДМСО-d6): 3,70 (с, 3Н), 4,89 (с, 2Н), 6,68 (с, 2Н), 6,70 (д, 2Н), 6,80 (с, 1Н), 6,99 (с, 1Н), 7,30 (с, 1Н), 7,63 (с, 1Н), 7,72 (д, 2Н), 9,20 (с, 1Н). Приклад 15 4-[N-(2,3,5,6-тетрафтор-4гідроксифенілметил)-N-(1Н-імідазол-1іл)аміно]бензонітрил Т.пл. 243°С 1 Н-ЯМР (ДМСО-d6): 5,09 (с, 2Н), 6,72 (д, 2Н), 7,00 (с, 1Н), 7,32 (с, 1Н), 7,69 (д,2Н), 7,77 (с,1Н), 11,80 (с,1Н). Приклад 16 4-[N-(3-форміл-4-гідроксифенілметил)-N-(1Німідазол-1-іл)аміно]бензонітрил Т.пл. 160°С 1 Н-ЯМР (DMCO-d6): 4,95 (с, 2Н), 6,70 (д, 2Н), 6,90 (с, 1Н), 6,96 (д, 1Н), 7,35 (с, 1Н), 7,44 (дд, 1Н), 7,58 (д, 1Н), 7,67 (с, 1Н), 7,71 (д, 2Н), 10,20 (с, 1Н), 10,75 (с, 1Н). Приклад 17 86393 38 4-{N-[2-(4-бензилокси-фенокси)етил]-N-(1Німідазол-1-іл)аміно]}бензонітрил 1 Н-ЯМР (ДМСО-d6): 3,95-4,10 (м, 2Н), 4,11-4,28 (м, 2Н), 5,01 (с, 2Н), 6,60 (д, 2Н), 6,82 (д, 2Н), 7,95 (д, 2Н), 7,03-7,50 (м, 7Н), 7,69 (д, 2Н), 7,88 (с, 1Н). Приклад 18 4-{N-[(6-хлорпіридин-3-іл)метил]-N-(1Німідазол-1-іл)аміно}бензонітрил Т.пл. 156°С 1 Н-ЯМР (ДМСО-d6): 5,10 (с, 2Н), 6,71 (д, 2Н), 7,00 (с, 1Н), 7,42 (с, 1Н), 7,49 (д, 1Н), 7,55-7,90 (м, 4Н), 8,34 (д, 1Н). Приклад 19 4-{[N-(4-ціанофеніл)-N-(1Н-імідазол-1іл)аміно]метил}бензол сульфамід Т.пл. 150°С 1 Н-ЯМР (ДМСО-d6): 5,15 (с, 2Н), 6,62 (д, 2Н), 7,00 (с, 1Н), 7,36 (с, 2Н), 7,45 (с, 1Н), 7,55 (д,2Н), 7,65-7,90 (м, 5Н). Приклад 20 4-[N-(4-гідрокси-3-нітрофенілметил)-N-(1Німідазол-1-іл)аміно]бензонітрил Т.пл. 205°С 1 Н-ЯМР (DMCO-d6): 4,98 (с, 2Н), 6,72 (д, 2Н), 7,00 (с, 1Н), 7,06 (д, 1Н), 7,39 (с, 1Н), 7,48 (д, 1Н), 7,60-7,78 (м, 3Н), 7,82 (с, 1Н). Приклад 21 5-{[N-(4-ціанофеніл)-N-(1Н-імідазол-1іл)аміно]метил}-2-метоксибензойнакислота Т.пл. 187°С 1 Н-ЯМР (ДМСО-d6): 3,79 (с, 3Н), 5,00 (с, 2Н), 6,69 (д, 2Н), 6,98 (с, 1Н), 7,05 (д, 1Н), 7,31 (с, 1Н), 7,39 (дд, 1Н), 7,55 (д, 1Н), 7,62-7,85 (м, 3Н). Приклад 22 4-[N-(1Н-імідазол-1-іл)-N-(4нітрофеніл)аміно]бензонітрил 4-[N-(1Н-імідазол-1-іл)аміно]бензонітрил (10,00г, 54,30ммоль) додавали порціями до суспензії трет-бутоксиду калію (6,69г, 59,73мм) у ДМСО (100мл) при (10-15°С) з перемішуванням. Суміш перемішували впродовж 30 хвилин при кімнатній температурі і потім додавали краплями 4нітрофторбензол (7,60г, 54,00мМ) у ДМСО (15мл), підтримуючи температуру нижче 30°С. Через 2год. суміш вливали у воду (800мл), і одержаний осад збирали фільтруванням та очищували кристалізацією з етанолу (1,00г, 48%, т.пл: 188°С). 1 Н-ЯМР (ДМСО-d6): 7,00 (д, 2Н), 7,17 (с, 1Н), 7,26 (д, 2Н), 7,65 (с, 1Н), 7,90 (д, 2Н), 8,20 (с, 1Н), 7,22 (д, 2Н). Використовуючи ту саму методику, але замінюючи 4-нітро-фторбензол на: - 6-хлорнікотиноїлхлорид - 4-фторфенілацетилхлорид - 4-гідроксифенілацетилхлорид - 4-гідроксифенілпропаноїлхлорид (одержаний згідно з Еліас X. та ін. Macromol. Chem. Phys., 1981, 182, 681-86) 4-фенілметоксибензолсульфонілхлорид (одержаний згідно з Тоя Е. та ін. Eur. J. Med. Chem. 1991, 26, 403-13), одержували відповідно такі сполуки: Приклад 23 6-хлор-N-(4-ціанофеніл)-N-(1Н-імідазол-1іл)нікотинамід 39 Т.пл. 132°С Н-ЯМР (ДМСО-d6): 6,98 (с, 1Н), 7,40-7,62 (м, 3Н), 7,70 (с, 1Н), 7,95 (д, 2Н), 8,00 (д, 1Н), 8,19 (с, 1Н), 8,57 (д, 1Н). Приклад 24 N-(1Н-імідазол-1-іл)-N-(4-ціанофеніл)-2-(4фторфеніл)ацетамід Т.пл. 131°С 1 Н-ЯМР (DMCO-d6): 3,57 (с, 2Н), 7,00-7,35 (м, 5Н), 7,55 (д, 2Н), 7,70 (с, 1Н), 7,93 (д, 2Н), 8,19 (с, 1Н). Приклад 25 N-(1Н-імідазол-1-іл)-N-(4-ціанофеніл)-2-(4гідроксифеніл)ацетамід 1 Н-ЯМР (ДМСО-d6): 3,32 (с, 2Н), 6,65 (д, 2Н), 6,87 (д, 2Н), 7,08 (с, 1Н), 7,50 (д, 2Н), 7,70 (с, 1Н), 7,90 (д, 2Н), 8,10 (с, 1Н), 9,30 (с, 1Н). Приклад 26 N-(4-ціанофеніл)-3-(4-гідроксифеніл)-N-(1Німідазол-1-іл)пропанамід Т.пл. 172°С 1 Н-ЯМР (DMCO-d6): 2,25-2,60 (м, 2Н), 2,65-2,90 (м, 2Н), 6,63 (д, 2Н), 6,90 (д, 2Н), 7,08 (с, 1Н), 7,51 (д, 2Н), 7,61 (с, 1Н), 7,90 (д, 2Н), 8,10 (с, 1Н), 9,20 (с, 1Н). Приклад 27 N-(4-цiанофенiл)-N-(1Н-імідазол-1-іл)-4(фенілметокси)бензолсульфонамід 1 Н-ЯМР (CDCI3): 5,14 (с, 2Н), 6,93 (т, 1Н), 7,007,15 (м, ЗН), 7,30-7,45 (м, 7Н), 7,50 (с, 1Н), 7,66 (д, 2Н), 7,68 (д, 2Н). ОДЕРЖАННЯ ІМІДАЗОЛІВ ФОРМУЛИ (15), (21) Приклад 28 5-нітро-[N-(4-ціанофеніл)-N-(1Н-імідазол-1іл)]бензотіофен-2-карбоксамід 5-нітробензотіофен-2-карбонілхлорид (промислова сполука, 10,00г, 41,00ммоль) додавали до суміші 4-[N-(1Н-імідазол-1-іл)аміно]бензонітрилу (7,55г, 41,00ммоль), TEA (20мл, 143,00ммоль) в сухому ТГФ (150мл) при кімнатній температурі. Суміш потім перемішували при кімнатній температурі впродовж ночі та осад відфільтровували, промивали ТГФ, водою, одержуючи сирий продукт у вигляді твердої речовини (9,26г). Кристалізацією з етанолом одержували білі кристали (3,50г, т.пл: 221°С). 1 Н-ЯМР (ДМСО-d6): 7,10 (с, 1Н), 7,54 (с, 1Н), 7,70 (д, 2Н), 7,82 (с, 1Н), 7,98 (д, 2Н), 8,15-8,40 (м, 3Н), 8,89 (с, 1Н). Використовуючи ту саму методику, але замінюючи 5-нітробензотіофен-2-карбонілхлорид на: 6-метоксибензотіофен-3-ацетилхлорид (описаний Саутер Ф., Monatshefte Fuer Chemie, 1968, 99, 2, 610-15), одержували таку сполуку: Приклад 29 N-(4-цiанофент)-N-(1Н-імідазол-1-іл)-2-(6метоксибензотієн-3-ілт)ацетамід Т.пл.: 104°С 1 Н-ЯМР (ДМСО-d6): 3,75-3,85 (м, 5Н), 7,02 (дд, 1Н), 7,13 (с, 1Н), 7,30 (с, 1Н), 7,50-7,75 (м, 4Н), 7,80 (с, 1Н), 7,90 (д, 2Н), 8,25 (с, 1Н). Приклад 30 4-{N-[1Н-імідазол-1-іл]-N-[(6-метоксибензотієн3-іл)метил]аміно}бензонітрил 1 86393 40 3-хлорметил-6-метоксибензотіофен (12,35г, 58,06ммоль) додавали до суміші 4-[N-(1Німідазол-1-іл)аміно]бензонітрилу (9,72г, 52,78ммоль), К2СО3 (14,60г, 105,56ммоль) і йодиду калію (0,10г, 0,60ммоль) у сухому ДМФА (70 мл) при кімнатній температурі. Суміш потім перемішували при кімнатній температурі впродовж ночі і після цього вливали у воду та екстрагували етилацетатом, сушили над Na2SO4, фільтрували і концентрували у вакуумі, одержуючи сирий продукт у вигляді твердої речовини (14,30г). Флешхроматографією на силікагелі (толуол/діоксан: 6/4) одержували очікуваний продукт (10,50г, 55%, порошок). Кристалізацією з етанолом одержували білі кристали (7,30г, т.пл: 164°С). 1 Н-ЯМР (DMCO-d6): 3,80 (с, 3Н), 5,25 (с, 2Н), 6,74 (д, 2Н), 6,93 (с, 1Н), 7,02 (дд, 1Н), 7,28 (с, 1Н), 7,40 (с, 1Н), 7,53 (с, 1Н), 7,55 (с, 1Н), 7,68 (д, 1Н), 7,75 (д, 2Н). Приклад 31 4-[N-{6-бензилокси-1,1-діоксидобензотієн-3-іл)N-(1Н-імідазол-1-іл)аміно]бензонітрил 4-[N-(1Н-імідазол-1-іл)аміно]бензонітрил (0,50г, 27,14ммоль) додавали порціями до суспензії трет-бутоксиду калію (0,35г, 31,00ммоль) у ТГФ (20мл) при (10-15°С) з перемішуванням. Суміш перемішували впродовж 30хв. при кімнатній температурі і потім додавали краплями 3-бром-6бензилоксибензотіофен-1,1-діоксид (1,10г, 31,33мМ) у ТГФ (5мл), підтримуючи температуру нижче 30°С. Після однієї ночі суміш вливали у воду (200мл) та екстрагували етилацетатом, сушили над Na2SO4, фільтрували і концентрували у вакуумі, одержуючи сирий продукт у вигляді олії (2,50г). Флеш-хроматографією на силікагелі (толуол/1,4діоксан: 7/3) і кристалізацією в етанолі одержували світло-коричневі кристали (1,20г, 95%, т.пл: 146°С). 1 Н-ЯМР (ДМСО-d6): 5,22 (с, 2Н), 6,48 (с, 1Н), 6,49 (д, 1Н), 7,05-7,20 (м, 2Н), 7,25-7,50 (м, 8Н), 7,60 (д, 1Н), 7,73 (с, 1Н), 7,94 (д, 2Н). Використовуючи ту саму методику, але замінюючи 3-бром-6-бензилоксибензотіофен-1,1діоксид на: 6-бензилокси-2-(хлорметил)бензотіофен, одержували таку сполуку: Приклад 32 4-[N-[(6-бензилоксибензотієн-2-іл)метил]-N(1Н-імідазол-1-іл)аміно]бензонітрил 1 Н-ЯМР (DMCO-d6): 5,12 (с, 2Н), 5,30 (с, 2Н), 6,72 (д, 2Н), 7,00 (с, 1Н), 7,04 (дд, 1Н), 7,23 (с, 1Н), 7,27-7,90 (м, 11Н). ОДЕРЖАННЯ ІМІДАЗОЛІВ ФОРМУЛИ (10), (16) Приклад 33 4-{N-[(6-гідроксибензотієн-3-іл)метил]-N-[1Німідазол-1-іл]аміно}бензонітрил Розчин 4-{N-[1Н-імідазол-1-іл]-N-[(6метоксибензотієн-3-іл)метил]аміно}бензонітрилу (0,50г, 1,39ммоль) у 10мл метиленхлориду додавали при кімнатній температурі до розчину 1М триброміду бору в метиленхлориді (1,50мл, 1,52ммоль). Після 2год. при кімнатній температурі суміш гідролізували насиченим водним NaHCO3, екстрагували дихлорметаном, сушили над Na2SO4, 41 фільтрували і концентрували у вакуумі. Сирий продукт очищували флеш-хроматографією на силікагелі (толуол/діоксан: 6/4), одержуючи очікуваний продукт (0,30г, 62%, порошок). Кристалізацією з етанолом одержували кристали білого кольору (0,10г, т.пл: 169°С). 1 Н-ЯМР (ДМСО-d6): 5,24 (с, 2Н), 6,72 (д, 2Н), 6,87 (дд, 1Н), 6,94 (с, 1Н), 7,27 (д, 2Н), 7,29 (с, 1Н), 7,55 (с, 1Н), 7,56 (д, 1Н), 7,75 (д, 2Н), 9,67 (с, 1Н). Використовуючи ту саму методику, але замінюючи 4-{N-[1Н-імідазол-1-іл]-N-[(6метоксибензотіофен-3-іл)метил]аміно}бензонітрил на: N-(4-ціанофеніл)-N-(1Н-імідазол-1-іл)-2-(6метоксибензотієн-3-іл)ацетамід, одержували таку сполуку: Приклад 34 N-(4-ціанофеніл)-N-(1Н-імідазол-1-іл)-2-(6гідроксибензотієн-3-іл)ацетамід Т.пл. 179°С 1 Н-ЯМР (DMCO-d6): 3,72 (с, 2Н), 6,85 (дд, 1Н), 7,10 (д, 2Н), 7,25 (д, 1Н), 7,40-7,70 (м, 3Н), 7,80 (с, 1Н), 7,91 (д, 2Н), 8,24 (с, 1Н), 9,60 (с, 1Н). Приклад 35 4-[N-(3-аміно-4-гідроксифенілметил)-N-(1Німідазол-1-іл)аміно]бензонітрил 4-[N-(4-гідрокси-3-нітрофенілметил)-N-(1Німідазол-1-іл)аміно]бензонітрил (2г, 5,97ммоль) гідрували над суспензією Pd/C (10ваг.% на вугіллі, 0,2г) в етанолі (30мл). Коли ТСХ показала повне завершення реакції, суміш фільтрували крізь celatum, промивали ЕtOH. Розчинник концентрували у вакуумі. Кристалізацією із суміші ЕtOН/петролейний ефір одержували оранжеві кристали (1,1г, 60,5%, т.пл.: 208°С). 1 Н-ЯМР (ДМСО-d6): 4,60 (с, 2Н), 4,79 (с, 2Н), 6,80 (д, 1Н), 6,40-6,80 (м, 4Н), 6,99 (с, 1Н), 7,25 (с, 1Н), 7,50-7,80 (м,3Н), 9,07 (с, 1Н). Використовуючи ту саму методику, але замінюючи 4-[N-(4-гідрокси-3-нпробензил)-N-(1Німідазол-1-іл)аміно]бензонітрил на: 4-{N-[2-(4-бензилоксифенокси)етил]-N-(1Німідазол-1-іл)аміно]}бензонітрил N-(4-ціанофеніл)-N-(1Н-імідазол-1-іл)-4(фенілметокси)бензолсульфонамід, одержували відповідно такі сполуки: Приклад 36 4-{N-[2-(4-пдроксифенокси)етил]-N-(1Німідазол-1-іл)аміно}бензонітрил Т.пл. 188°С 1 Н-ЯМР (ДМСО-d6): 4,99 (т, 2Н), 4,17 (т, 2Н), 6,40-6,85 (м, 6Н), 7,10 (с, 1Н), 7,40 (с, 1Н), 7,68 (д, 2Н), 7,86 (с, 1Н), 8,95 (с, 1Н). Приклад 37 N-(4-ціанофеніл)-N-(1Н-імідазол-1-іл)-4гідроксибензолсульфонамід Т.пл. 248°С 1 Н-ЯМР (ДМСО-d6): 6,95 (д, 2Н), 7,00 (с, 1Н), 7,24 (с, 1Н), 7,49 (д, 2Н), 7,52 (д, 2Н), 7,88 (с, 1Н), 7,92 (д, 2Н), 10,95 (с, 1Н). Приклад 38 4-[N-[(6-пдрокси-1,1-діоксидобензотієн-3-іл)]-N(1Н-імідазол-1-іл)аміно]бензонітрил Суміш 4-[N-[(6-бензилокси-1,1діоксидобензотієн-3-іл)]-N-(1Н-імідазол-1 86393 42 іл)аміно]бензонітрилу (3,00г, 6,78ммоль), 10% Pd/C (0,50г), ТГФ (30мл) і розчину форміату амонію (25% в Н2О, 30мл) перемішували при температурі навколишнього середовища впродовж 6 годин і фільтрували. Суміш вливали у воду та екстрагували етилацетатом, сушили над Na2SO4, фільтрували і концентрували у вакуумі, отримуючи сирий продукт (2,50г у вигляді твердої речовини). Кристалізацією з етанолу одержували білі кристали (0,80г, 26%, т.пл.: 260°С). 1 Н-ЯМР (ДМСО-d6): 6,25 (с, 1Н), 6,29 (д, 1Н), 6,82 (дд, 1Н), 7,10 (с, 1Н), 7,15 (с, 1Н), 7,30 (д, 2Н), 7,70 (с, 1Н), 7,91 (д, 2Н), 8,25 (с, 1Н). Використовуючи ту саму методику, але замінюючи 4-[N-[(6-бензилокси-1,1-діоксидобензотієн3-іл)]-N-(1Н-імідазол-1-іл)аміно]бензонітрил на: 4-[N-[(6-бензилоксибензотієн-2-іл)метил]-N(1Н-імідазол-1-іл)аміно]бензонітрил, одержували таку сполуку: Приклад 39 4-[N-[(6-гідроксибензотієн-2-іл)метил]-N-(1Німідазол-1-іл)аміно]бензонітрил Т.пл. 230°С 1 Н-ЯМР (ДМСО-d6): 5,28 (с, 2Н), 6,70 (д, 2Н), 6,82 (дд, 1Н), 7,00 (с, 1Н), 7,15-7,21 (м, 2Н), 7,31 (с, 1Н), 7,55 (д, 1Н), 7,69-7,80 (м, ЗН), 9,63 (с, 1Н). ОДЕРЖАННЯ ІМІДАЗОЛІВ ФОРМУЛИ (12), (18) Приклад 40 4-[N-(4-амінофеніл)-N-(1Н-імідазол-1іл)аміно]бензонітрил Гідразин (1,52мл, 49,00ммоль) додавали порціями до суспензії 4-[N-(1H-імідазол-1-іл)-N-(4нітрофеніл)аміно]бензонітрилу (3,00г, 9,80мм) і рутенію, 5ваг.% на вугіллі (0,30г, 0,15мМ) в етанолі (35мл) при кипінні зі зворотним холодильником з перемішуванням. Коли ТСХ показала повне завершення реакції, суміш охолоджували і каталізатор відфільтровували. Розчинник концентрували у вакуумі. Залишок вливали у воду та екстрагували дихлорметаном, сушили над Na2SO4, фільтрували і концентрували у вакуумі, одержуючи сирий продукт (2,50г у вигляді твердої речовини). Кристалізацією з етилацетату з етанолом одержували очікуваний продукт (1,30г, 50%, т.пл: 147°С). 1 Н-ЯМР (ДМСО-d6): 5,50 (с, 2Н), 6,30 (д, 2Н), 6,69 (д, 2Н), 7,09 (с, 1Н), 7,29 (д, 2Н), 7,63 (с, 1Н), 7,65 (д, 2Н), 8,14 (с, 1Н). Приклад 41 5-аміно-[N-(4-ціанофеніл)-N-(1Н-імідазол-1іл)]бензотіофен-2-карбоксамід Дигідрат двохлористого олова (13,10г, 58,00ммоль) додавали порціями до перемішуваного розчину 5-нітро-[N(4-ціанофеніл)-N-(1Німідазол-1-іл)]бензотіофен-2-карбоксаміду (4,50г, 11,6мм) в етанолі (100мл). Суміш нагрівали при температурі кипіння зі зворотним холодильником. Коли ТСХ показала повне завершення реакції, суміш охолоджували та перетворювали на основу за допомогою насиченого розчину бікарбонату. Суміш екстрагували етилацетатом, сушили над Na2SO4, фільтрували і концентрували у вакуумі, одержуючи сирий продукт у вигляді твердої речовини (3,90г). Кристалізацією з метанолу одержували очікуваний продукт (2,60г, 63%, т.пл: 214°С). 43 1 Н-ЯМР (ДМСО-d6): 6,70-6,98 (м, 3Н), 7,07 (с, 1Н), 7,40-7,25 (м, 4Н), 7,26-7,96 (м, 3Н). ЗАГАЛЬНА МЕТОДИКА СУЛЬФАМОЇЛЮВАННЯ ОДЕРЖАННЯ СУЛЬФАМАТІВ (11,17, 23) ТА АМІНОСУЛЬФОНІЛАМІНІВ (13,19,25) Приклад 42 4-[N-(4-цiанофенілметил)-N-(1Н-імідазол-1іл)аміно]феніловий ефір сульфамінової кислоти Сульфамоїлхлорид (2,39г, 20,69ммоль) додавали до розчину 4-[N-(4-гідроксифеніл)-N-(1Німідазол-1-іл)аміно]метилбензонітрилу (1,00г, 3,45ммоль) у сухому DMAc (36мл) з охолодженням на льоду. Суміш потім перемішували при кімнатній температурі впродовж 6 годин. Після додавання ТНЕ (3,40мл, 24,73мл) суміш вливали у холодний розсіл та екстрагували етилацетатом, сушили над Na2SO4, фільтрували та концентрували у вакуумі, одержуючи сирий продукт (0,70г у вигляді твердої речовини). Кристалізацією з етилацетату одержували очікуваний продукт (0,40г, 31%, т.пл: 60°С). 1 Н-ЯМР (ДМСО-d6): 5,00 (с, 2Н), 6,70 (д, 2Н), 6,92 (с, 1Н), 7,19 (д, 2Н), 7,40 (с, 1Н), 7,55 (д, 2Н), 7,74 (с, 1Н), 7,77 (д, 2Н), 7,91 (с, 2Н). Використовуючи ту саму методику, але замінюючи 4-[N-(4гідроксифеніл)-N-(1Н-імідазол-1іл)аміно]метилбензонітрил на: - 4-[N-(4-гідроксифенілметил)-N-(1Н-імідазол1-іл)аміно]бензонітрил 4-[N-(3-хлор-4-гідроксифенілметил)-N-(1Німідазол-1-іл)аміно]бензонітрил 4-[N-(3-бром-4-гідроксифенілметил)-N-(1Німідазол-1-іл)аміно]бензонітрил 4-[N-(3-метокси-4-гідроксифенілметил)-N(1Н-імідазол-1-іл)аміно]бензонітрил 4-[N-(2,3,5,6-тетрафтор-4гідроксифенілметил)-N-(1Н-імідазол-1іл)аміно]бензонітрил - 4-[N-(3-форміл-4-гідроксифенілметил)-N-(1Німідазол-1-іл)аміно]бензонітрил 4-[N-(4-амінофеніл)-N-(1Н-імідазол-1іл)аміно]бензонітрил N-(4-ціанофеніл)-N-(1Н-імідазол-1-іл)-4гідроксибензолсульфонамід 4-{N-[2-(4-пдроксифенокси)етил]-N-(1Німідазол-1-іл)аміно}бензонітрил N-(1Н-імідазол-1-іл)-М-(4-ціанофеніл)-2-(4гідроксифеніл)ацетамід - N-(4-ціанофеніл)-3-(4-гідроксифеніл)-N-(1Німідазол-1 -іл)пропанамід - 4-[N-(3-аміно-4-гідроксифенілметил)-N-(1Німідазол-1-іл)аміно]бензонітрил - 5-аміно-[N-(4-ціанофеніл)-N-(1Н-імідазол-1іл)]бензотіофен-2-карбоксамід - 4-[N-[(6-гідрокси-1,1-діоксидобензотієн-3-іл)]N-(1Н-імідазол-1-іл)аміно]бензонітрил N-(4-ціанофеніл)-N-(1Н-імідазол-1-іл)-2-[(6гідроксибензотієн-2-іл)]ацетамід - 4-{N-[(6-гідроксибензотієн-3-іл)метил]-N-[1Німідазол-1-іл]аміно}бензонітрил - 4-{N-[(6-гідроксибензотієн-2-іл)метил]-N-[1Німідазол-1-іл]аміно}бензонітрил, одержували відповідно такі сполуки: Приклад 43 86393 44 4-{[N-(4-ціанофеніл)-N-(1Н-імідазол-1іл)аміно]метил}феніловий ефір сульфамінової кислоти Т.пл. 172°С 1 Н-ЯМР (ДМСО-d6): 5,00 (с, 2Н), 6,65 (д, 2Н), 7,00 (с, 1Н), 7,22 (д, 2Н), 7,40 (с, 1Н), 7,42 (д, 2Н), 7,70 (с, 1Н), 7,75 (д, 2Н), 8,00 (с, 2Н). Приклад 44 2-хлор-4-{[N-(4-ціанофеніл)-N-(1Н-імідазол-1іл)аміно]метил}феніловий ефір сульфамінової кислоти 1 Н-ЯМР (ДМСО-d6): 5,05 (с, 2Н), 6,63 (д, 2Н), 7,00 (с, 1Н), 7,35-7,45 (м, 3Н), 7,54 (с, 1Н), 7,70 (д, 2Н), 7,80 (с, 1Н), 8,29 (с, 2Н). Приклад 45 2-бром-4-{[N-(4-ціанофеніл)-N-(1Н-імідазол-1іл)аміно]метил}феніловий ефір сульфамінової кислоти, гідрохлорид Кристалізацію виконували у ЕtOН/НСІ (т.пл. 145°С). 1 Н-ЯМР (ДМСО-d6): 5,15 (с, 2Н), 6,90 (д, 2Н), 7,48 (с, 2Н), 7,60-7,85 (с, 5Н), 8,08 (с, 1Н), 8,32 (с, 2Н), 9,51 (с, 1Н). Приклад 46 2-метокси-4-{[N-(4-ціанофеніл)-N-(1Н-імідазол1-іл)аміно]метил}феніловий ефір сульфамінової кислоти Т.пл. 211°С 1 Н-ЯМР (ДМСО-d6): 3,77 (с, 3Н), 5,02 (с, 2Н), 6,75 (д, 2Н), 6,92 (д, 1Н), 7,05 (с, 2Н), 7,25 (д, 1Н), 7,45 (с, 1Н), 7,71 (д, 2Н), 7,80 (с, 1Н), 7,93 (с, 2Н). Приклад 47 2,3,5,6-тетрафтор-4-{[N-(4-ціанофеніл)-N-(1Німідазол-1-іл)аміно]метил}феніловий ефір сульфамінової кислоти 1 Н-ЯМР (ДМСО-d6): 5,37 (с, 2Н), 5,83 (с, 2Н), 6,86 (д, 2Н), 7,08 (с, 1Н), 7,41 (с, 1Н), 7,79 (с, 1Н), 7,81 (д, 2Н). Приклад 48 4-[N-[(2,2-діоксидо-1,2,3-бензоксатіазин-6іл)метил]-N-{1Н-імідазол-1-іл)аміно]бензонітрил Т.пл. 180°С 1 Н-ЯМР (ДМСО-d6): 5,17 (с, 2Н), 6,67 (д, 2Н), 7,02 (с, 1Н), 7,46 (с, 1Н), 7,50 (д, 2Н), 7,74 (д, 2Н), 7,82 (дд, 1Н), 7,87 (с, 1Н), 8,02 (д, 1Н), 9,19 (с, 1Н). Приклад 49 N-{4-[N-(4-ціанофеніл)-N-(1Н-імідазол-1іл)аміно]феніл}сульфамід Т.пл. 121°С 1 Н-ЯМР(ДМСО-d6): 6,38 (д, 2Н), 7,09 (с, 1Н), 7,20 (с, 1Н), 7,22 (д, 2Н), 7,51 (д, 2Н), 7,63 (с, 1Н), 7,69 (д, 2Н), 8,19 (с, 1Н). Приклад 50 4-{[N-(4-ціанофеніл)-N-(1Н-імідазол-1іл)аміно]сульфоніл}феніловий ефір сульфамінової кислоти, гідрохлорид Кристалізацію виконували у ЕtOН/НСІ. Т.пл. 200°С 1 Н-ЯМР (ДМСО-d6): 7,57 (д, 2Н), 7,60 (с, 1Н), 7,70 (д, 2Н), 7,80-8,10 (м, 5Н), 8,40 (с, 2Н), 9,30 (с, 1Н). Приклад 51 4-{2-[N-(4-ціанофеніл)-N-(1Н-імідазол-1іл)аміно]етокси}феніловий ефір сульфамінової кислоти 45 Т.пл. 174°С Н-ЯМР (ДМСО-d6): 4,08 (т, 2Н), 4,23 (т, 2Н), 6,60 (д, 2Н), 6,95 (д, 2Н), 7,10 (с, 1Н), 7,18 (д, 2Н), 7,42 (с, 1Н), 7,70 (д, 2Н), 7,88 (с, 3Н). Приклад 52 4-{[N-(4-ціанофеніл)-N-(1Н-імідазол-1іл)карбамоїл]метил}феніловий ефір сульфамінової кислоти 1 Н-ЯМР (ДМСО-d6): 3,32 (с, 2Н), 7,12 (с, 1Н), 7,18-7,32 (м, 4Н), 7,50-7,60 (д, 2Н), 7,71 (с, 1Н), 7,85-8,05 (м, 4Н), 8,20 (с, 1Н). Приклад 53 4-{[N-(4-цiанофенiл)-N-(1Н-імідазол-1іл)аміно]-3-оксопропіл}феніловий ефір сульфамінової кислоти Т.пл. 100°С 1 Н-ЯМР (DMCO-d6): 2,45 (т, 2Н), 3,85 (т, 2Н), 7,10 (с, 1Н); 7,12-7,30 (м, 4Н), 7,55 (д, 2Н), 7,65 (с, 1Н), 7,90 (м, 4Н), 8,12 (с, 1Н). Приклад 54 3-(аміносульфоніл)аміно-4-{[N-(4-ціанофеніл)N-(1Н-імідазол-1-іл)аміно]метил}феніловий ефір сульфамінової кислоти Т.пл. 197°С 1 Н-ЯМР (ДМСО-d6): 5,00 (с, 2Н), 6,71 (д, 2Н), 6,93 (д, 1Н), 7,02 (с, 2Н), 7,21 (д, 1Н), 7,48 (с, 1Н), 7,61 (д, 2Н), 7,74 (с, 1Н), 7,92 (с, 2Н), 8,10 (с, 2Н). Приклад 55 5-(аміносульфоніл)аміно-[N-(4-ціанофеніл)-N(1Н-імідазол-1-іл)]бензотіофен-2-карбоксамід Т.пл.: 169°С 1 Н-ЯМР (DMCO-d6): 6,87 (д, 1Н), 7,05-7,30 (м, 4Н), 7,56 (с, 1Н), 7,67 (д, 2Н), 7,80-8,10 (м, 4Н), 7,86 (с, 1Н), 9,65 (с, 1Н). Приклад 56 3-[N-(4-цiанофеніл)-N-(1Н-імідазол-1-іл)аміно]1,1-діоксидобензотієн-6-іловий ефір сульфамінової кислоти Т.пл. 172°С 1 Н-ЯМР (DMCO-d6): 6,24 (с, 1Н), 6,29 (д, 1Н), 6,85 (дд, 1Н), 7,15 (с, 1Н), 7,20 (с, 1Н), 7,30 (д, 2Н), 7,65 (с, 1Н), 7,95 (д, 2Н), 8,05 (с, 2Н), 8,25 (с, 1Н). Приклад 57 3-{2-[N-(4-ціанофеніл)-N-(1Н-імідазол-1іл)аміно]-2-оксоетил}бензотієн-6-іловий ефір сульфамінової кислоти 1 Н-ЯМР (ДМСО-d6): 3,84 (с, 2Н), 7,15 (с, 1Н), 7,28-7,37 (дд, 1Н), 7,51-7,65 (м, 3Н), 7,80-7,98 (м, 5Н), 8,01 (с, 2Н), 8,29 (с, 1Н). Приклад 58 3-{[N-(4-ціанофеніл)-N-(1Н-імідазол-1іл)аміно]метил}бензотієн-6-іловий ефір сульфамінової кислоти Т.пл. 193°С 1 Н-ЯМР (ДМСО-d6): 5,30 (с, 2Н), 6,80 (д, 2Н), 6,97 (с, 1Н), 7,30-7,40 (м, 2Н), 7,56 (с, 1Н), 7,68 (с, 1Н), 7,75 (д, 2Н), 7,80-7,95 (м, 2Н), 8,05 (с, 2Н). Приклад 59 2-{[N4-ціанофеніл)-N-(1Н-імідазол-1іл)аміно]метил}бензотієн-6-іловий ефір сульфамінової кислоти Т.пл. 178°С 1 Н-ЯМР (DMCO-d6): 5,17 (с, 2Н), 6,65 (д, 2Н), 6,89 (дд, 1Н), 6,94 (с, 1Н), 7,20 (д, 2Н), 7,27 (с, 1Н), 7,45 (с, 1Н), 7,58 (д, 1Н), 7,72 (д, 2Н), 8,00 (с, 2Н). 1 86393 46 Використовуючи ту саму методику, як у прикладі 13, але замінюючи 4-[N-(4-гідроксифеніл)-N(1Н-імідазол-1-іл)аміно]метилбензонітрил на: -4-[N-(3-бром-4-гідроксифенілметил)-N-(1Німідазол-1-іл)аміно]бензонітрил, одержували як побічний продукт такі сполуки: Приклад 60 2-бром-4-{[N-(4-ціанофеніл)-N-(1Н-імідазол-1іл)аміно]метил}феніламідимідодисульфат Т.пл. 220°С 1 Н-ЯМР (ДМСО-d6): 5,00 (с, 2Н), 5,70 (с, 2Н), 6,65 (д, 2Н), 7,03 (с, 1Н), 7,42 (дд, 1Н), 7,50 (с, 1Н), 7,55 (д, 1Н), 7,65 (д, 1Н), 7,72 (д, 2Н), 7,81 (с, 1Н). ОДЕРЖАННЯ ІНШИХ СПОЛУК (8) Приклад 61 4-[N-[(2,2-дiоксидо-3,4-дигідро-1,2,3бензоксатіазин-6-іл)метил]-N-(1Н-імідазол-1іл)аміно]бензонітрил До суспензії 4-[N-[(2,2-діоксидо-1,2,3бензоксатіазин-6-іл)метил]-N-(1Н-імідазол-1іл)аміно]бензонітрилу (0,40г, 1,05ммоль) в метанолі (8мл) додавали порціями NaBH4 (0,08г, 2,11ммоль) і реакційну суміш перемішували при кімнатній температурі впродовж 3 годин. Після додавання насиченого розчину NH4CI (3мл) і води (40мл) одержаний осад відфільтровували, промивали водою і сушили, одержуючи тверду речовину білого кольору. Кристалізацією з етилацетату з етанолом одержували очікуваний продукт (0,40г, 82%, т.пл: 190°С). 1 Н-ЯМР (ДМСО-d6): 4,55 (д, 2Н), 5,04 (с, 2Н), 6,64 (д, 2Н), 7,02 (с, 1Н), 7,03 (д, 1Н), 7,27 (д, 1Н), 7,30 (с, 1Н), 7,41 (с, 1Н), 7,70 (д, 2Н), 7,85 (с, 1Н), 8,56 (т, 1Н). Приклад 62 5-{[N-(4-ціанофеніл)-N-(1Н-імідазол-1іл)аміно]метил}-2-гідроксибензойна кислота Суміш 5-{[N-(4-ціанофеніл)-N-(1Н-імідазол-1іл)аміно]метил}-2-метоксибензойної кислоти (1,00г, 2,85ммоль) і пиперидину (0,42мл, 8,57ммоль) у диметилацетаміді (DMA) (2мл) нагрівали при 150°С. Коли вихідний матеріал зникав (ТСХмоніторинг), розчинник видаляли у вакуумі. Флешхроматографією на силікагелі (МеОН/дихлорметан: 5/95) і кристалізацією з етанолу одержували білі кристали (53мг, 6%, т.пл: 260°С). 1 Н-ЯМР (ДМСО-d6): 4,85 (с, 2Н), 6,54 (д, 1Н), 6,66 (д, 2Н), 6,95 (с, 1Н), 7,05 (дд, 1Н), 7,24 (с, 1Н), 7,50-7,60 (м, 2Н), 7,68 (д, 2Н). Приклад 63 4-[N-(1Н-імідазол-1-іл)-N(феніл)аміно]бензонітрил 4-[N-(1Н-імідазол-1-іл)-N-(4нітрофеніл)аміно]бензонітрил (3,91г, 12,80ммоль) клали у колбу для гідрогенізації і розчиняли в оцтовому ангідриді (60мл) та оцтовій кислоті (60мл). Додавали паладій (10%) на С, 0,20г) і колбу приєднували до приладу для гідрогенізації Парра. Гідрогенізацію виконували зі струшуванням впродовж 3 годин при 172,37кПа Н2. Каталізатор видаляли фільтруванням і розчин охолоджували на бані впродовж 30хв. Нітрит натрію (0,97г, 14,00ммоль) додавали до суміші і посудини трохи прикривали. Колбу залишали на крижаній бані впродовж 2 годин і давали нагрітися до кімнатної 47 температури впродовж ночі. Суміш вливали у суміш лід/вода і тверду речовину відфільтровували, промивали водою (50мл), одержуючи сирий продукт. Флеш-хроматографією (толуол/діоксан: 6/4) і кристалізацією з етилацетату з етанолом одержували очікуваний продукт (0,40г, 8%, т.пл:162°С). 1 Н-ЯМР (ДМСО-d6): 6,60 (д, 2Н), 7,00-7,50 (м, 9Н), 7,69 (с, 1Н). ОДЕРЖАННЯ БЕНЗОКСАТІАЗОЛУ (8) Приклад 64 4-[N-(3-тозиламіно-4-гідроксибензил)-N-(1Німідазол-1-іл)аміно]бензонітрил Тозилхлорид (3,5г, 18,59ммоль) у СН2СІ2 (20мл) додавали краплями до розчину (ТХ 1840) (5,4г, 17,7ммоль) і піридину (19,47ммоль, 1,6мл) у СН2СІ2 (50мл) при 0°С. Суміш потім перемішували при кімнатній температурі впродовж 4год., після чого вливали у воду та екстрагували ЕtOАс, сушили над Na2SO4, фільтрували і концентрували у вакуумі, одержуючи сирий продукт (8,1г у вигляді твердої речовини оранжевого кольору). Флеш-хроматографією на силікагелі (толуол/діоксан: 7/3) одержували тверду речовину жовтого кольору. 1 Н-ЯМР (ДМСО-d6): 2,32 (с, 3Н), 4,85 (с, 2Н), 6,60 (д, 2Н), 6,62 (с, 1Н), 6,80 (дд, 1Н), 6,97 (с, 1Н), 7,10-7,30 (м, 5Н), 7,00 (д, 2Н), 7,03 (с, 1Н), 7,52 (д, 2Н), 9,45 (с, 2Н). Приклад 65 4-[N-[(2,2-діоксидо-3-тозил-3Н-1,2,3бензоксатіазол-5-іл)метил]-N-(1Н-імідазол-1іл)аміно]бензонітрил Сульфурилхлорид (0,60мл, 7,40ммоль) у дихлорметані (50мл) додавали краплями при перемішуванні впродовж 30хв. до 4-[N-(3-тозиламіно-4гідроксибензил)-N-(1Н-імідазол-1іл)аміно]бензонітрилу (3,40г, 7,40ммоль) і триетиламіну (2,10мл, 14,81ммоль) у дихлорметані (6мл) при -78°С. Після додаткових 15хв. суміші давали нагрітися до кімнатної температури впродовж 4 годин. Реакційну суміш розводили водою, екстрагували дихлорметаном. Органічний шар сушили над сульфатом натрію і концентрували у вакуумі. Флеш-хроматографією на силікагелі (толуол/діоксан: 5/5) одержували чисту олію (1,60г, 41%). 1 Н-ЯМР (ДМСО-d6): 2,39 (с, 3Н), 5,18 (с, 2Н), 6,80 (д, 2Н), 7,00-7,50 (м, 6Н), 7,60-7,85 (м, 5Н), 8,02 (с, 1Н). Приклад 66 4-[N-[(2,2-діоксидо-3Н-1,2,3-бензоксатіазол-5іл)метил]-N-(1Н-імідазол-1-іл)аміно]бензонітрил Фторид калію (0,36г, 6,14ммоль) у воді (5мл) додавали до 4-[N-[(2,2-діоксидо-3-тозил-3Н-1,2,3бензоксатіазол-5-іл)метил]-N-(1Н-імідазол-1іл)аміно]бензонітрилу (1,60г, 3,07ммоль) в ацетонітрилі (15мл) при кімнатній температурі. Розчин перемішували впродовж ночі, концентрували, екстрагували дихлорметаном. Органічний шар сушили над сульфатом натрію та концентрували у вакуумі. Флеш-хроматографією на силікагелі (толуол/діоксан: 5/5) одержували олію і кристалізацією з етанолу одержували очікуваний продукт (0,17г, 15%, т.пл: 230°С). 86393 48 1 Н-ЯМР (DMCO-d6): 4,84 (с, 2Н), 6,38 (дд, 1Н), 6,42 (д, 1Н), 6,63 (д, 1Н), 6,69 (д, 2Н), 7,15 (с, 1Н), 7,43 (с, 1Н), 7,70 (д, 2Н), 8,02 (с, 1Н). ОДЕРЖАННЯ ФЕНІЛСЕЧОВИН (27) Приклад 67 N-(4-ціанофеніл)-N-(1Н-імідазол-1-іл)-N'фенілсечовина Фенілізоціанат (3,6мл, 32,6ммоль) додавали до розчину 4-[N-(1Н-імідазол-1іл)аміно]бензонітрилу (5г, 27,17ммоль) у ТГФ (50мл). Суміш перемішували при 50°С впродовж ночі і після випарювання кристалізували у суміші ацетон/ЕtOН, одержуючи білі кристали (2,5г, 30,3%, 178°С). 1 Н-ЯМР (ДМСО-d6): 6,59 (с, 1Н), 7,05-7,40 (м, 9Н), 7,52 (д, 2Н), 7,83 (с, 1Н). РЕЗУЛЬТАТИ БІОЛОГІЧНИХ ВИПРОБУВАНЬ ІНГІБУВАННЯ СТЕРОІДСУЛЬФАТАЗИ, АРОМАТАЗИ ТА КАРБОАНГІДРАЗИ IN VITRO Сульфат фолікуліну (E1S) є основним естрогеном, що циркулює у плазмі, який перетворюється ферментом стероїдсульфатазою на фолікулін (Е1), який, у свою чергу, може бути перетворений на естрадіол (Е2) ферментативним відновленням. Клінічно доведено, що інгібування синтезу Е2 інгібіторами ароматази є гарним способом зупинити прогрес гормонозалежних пухлин молочної залози. Нещодавно як альтернатива з'явилось інгібування шляху стероїдсульфатази. Тому розробка сполук, здатних інгібувати як ароматазу, так і стероїдсульфатазу, є новим і бажаним підходом до інгібування росту пухлини. Карбоангідрази людини каталізують перетворення між діоксидом вуглецю (СО2) та бікарбонатним іоном (НСО3-) і беруть участь у численних фізіологічних і патологічних процесах. Вони вміщують гормонозалежний і гормононезалежний канцерогенез, процес метастазування і гипоксичні пухлини, які є менш чутливими до класичної хіміо/радіотерапії. Інгібування карбоангідрази людини могло б бути тому цінною додатковою активністю для сполуки, що є подвійним інгібітором ароматази і сульфатази (DASI). Зокрема, виявлено, що ЕМАТЕ має здатність інгібувати карбоангідразу людини, подібну до такої здатності ацетазоламіду, відомого сульфонаміду, що є інгібітором карбоангідрази людини. Мета цих експериментів полягала в тому, щоб оцінити in vitro інгібіторний потенціал нових сполук відносно ароматазної та/або стероїдсульфатазної активности. Крім того, інгібування активності карбоангідрази II людини (як приклад карбоангідрази людини) для деяких з них було оцінено порівняно з 6,6,7 COUMATE і ацетазоламідом. Матеріали та методи а) Активність ароматази Лінія клітини JEG-3, одержана з плацентарної хоріокарциноми людини, конститутивно суперекспресує ароматазу людини і являє собою гарну модель для аналізу передбачуваних інгібіторів ароматази in vitro. Активність ароматази визначали тритієвим водним способом. Коротко кажучи, клітини спочатку висіювали у 96-лункові мікропланшети у середовище, доповнене декомплементованою ембріональною телячою сироваткою 49 (dFCS). Через 24 години клітини промивали і свіже поживне середовище, яке містить 1b-3Нандростендіон як субстрат ароматази, додавали разом з тестованими сполуками при концентраціях у межах від 10-12М до 10-5М. Після 2 годин інкубації фракцію поживного середовища переносили на гомологічні нові 96-лункові мікропланшети і в кожну лунку додавали розчин вугілля з декстрановим покриттям. Після витримування на льоду впродовж 10 хвилин мікропланшети центрифугували (1500г; 4°С). Всі стероїди, включаючи радіоактивний субстрат і біосинтезовані естрогени, адсорбували на вугіллі; тільки 3Н-вода, специфічно утворена у перебігу ароматизації 1b -3Нандростендіону, залишається у супернатанті. Радіоактивність у супернатанті вимірювали підрахунком рідинної сцинтиляції. Паралельно, солюбілізацію клітин виконували у розчині етилендіамінтетраацетату. Вміст ДНК вимірювали стандартним фторометричним способом із використанням фторохрома Hoechst 33258. Нарешті, активність ароматази виражали у фмоль утвореної 3 Н-води/2 години/мкг ДНК та інгібування ароматази - як процент контрольної активності без інгібітору. Нелінійний фітинг-аналіз (GraphPad Prism Software) % інгібування проти концентрації інгібітору дозволяв визначити 50%-ну інгібувальну концентрацію (ІС50): найнижчі ІС5о відповідають найпотужнішим інгібіторам (таблиця 1). b) Активність стероїдсульфатази Лінії клітин JEG-3 притаманний дуже високий вміст фолікулінсульфатази людини, і тому вона є корисною біологічною системою для оцінки нових інгібіторів стероїдсульфатази in vitro. Проби виконували з клітинами у логарифмічній фазі росту на 96-лункових мікропланшетах. За 24 години до початку дослідження клітини висіювали у середовище, доповнене декомплементованою ембріональною телячою сироваткою (dFCS). Середовище видаляли через 24 години і клітини промивали PBS для видалення усіх слідів dFCS. Потім у вільне від dFCS середовище додавали 3H-E1S, потім додавали тестовані сполуки при концентраціях у межах від 10-12М до 10-5М. Після 4 годин обробки поживне середовище переносили на 96-лункові мікропланшети і центрифугували при 200×г впродовж 10 хвилин з одержанням згустків клітин перед екстракцією толуолом. Фракцію середовища використовували для екстракції толуолом, щоб відокремити кон'югований субстрат від некон'югованих продуктів. Радіоактивність в толуоловій фазі вимірювали підрахунком рідинної сцинтиляції. Паралельно, після солюбілізації клітин у розчині етилендіамінтетраацетату, вміст ДНК вимірювали стандартним флуорометричним способом із використанням фторохрома Hoechst 33258. Нарешті, активність фолікулінсульфатази виражали у пмоль утворених 3Н-Е1+3Н-Е2/4 години/мг ДНК та інгібування сульфатази фолікуліну - як процент контрольної активності без інгібітору. Нелінійний фітинганаліз (GraphPad Prism Software) інгібування % проти концентрації інгібітору дозволяв визначити 50%-ну інгібувальну концентрацію (ІС5о): найнижчі ІС50 відповідають найпотужнішим інгібіторам (таблиця 1). 86393 50 c) Подвійна активність ароматази та стероїдсульфатази Для оцінки інгібувального потенціалу сполук DASI, паралельно відносно активностей ароматази і стероїдсульфатази людини, використовували нову in vitro модель, використовуючи клітини JEG3. Експериментальні умови, описані вище для моделі стероїдсульфатази, використовували з незначними змінами: наявність обох субстратів, 3HE1S і 1b-3Н-андростендіону, у середовищі та інкубаційний період 2 години. Результати виражали у пмоль утвореного продукту (3Н-Е1+3Н-Е2 або 3 Н2О)/2 години/мг ДНК (таблиця 1). d) Активність лужної Фосфатази Клітини Ishikawa висажували у 96-лункові мікропланшети за 48 годин до початку дослідження. Наступного дня поживне середовище заміняли вільним від фенолового червоного середовища, доповненим 5% очищеної вугіллям dFCS. Через 24 години поживне середовище обновлювали і до висіяних клітин додавали сполуки і культивували впродовж додаткового чотириденного періоду. Для кожної сполуки тестовані концентрації складали від 10-12М до 10-5М, і кінцева концентрація носія не перевищувала 0,1%. В кінці інкубаційного періоду активність лужної фосфатази (APase) аналізували способом, який містить гідроліз пнітрофенілфосфату до п-нітрофенолу і спектрофотометричне визначення продукту при 405нм. Коротко кажучи, мікропланшети спочатку промивали двічі холодним фосфатним буферним розчином і потім витримували при -80°С впродовж принаймні 15 хвилин. Після розморожування при кімнатній температурі 50мкл охолоджених льодом розчинів, які містять 5мМ п-нітрофенілфосфату, додавали у кожну лунку. Після інкубаційного періоду 15-60 хвилин при кімнатній температурі інтенсивність жовтого кольору, генерована продукцією п-нітрофенолу, вимірювали у кожній лунці при 405нм. Для кожної перевіреної концентрації активність APase, виражена коефіцієнтом поглинання, спочатку виражали як кратність збільшення порівняно з контролем (FI) і потім як процент від активності Е2(10-8М), прийнятої за 100%. Були побудовані сигмоподібні криві доза-відповідь (GraphPad Prism Software), і 50%-ні ефективні концентрації (ЕС50) були обчислені для кожної сполуки (таблиця 1). є) Активність карбоангідрази II людини Цей тест проводили, як описано у літературі (Армстронг Дж. та ін. Purification and properties of human erythrocyte carbonic anhydrases, J Biol Chem, 1966, 241: 5137-5149). Коротко, у цьому тесті карбоангідраза II людини каталізує перетворення п-нітрофенілацетату на п-нітрофенол. Потенціальну інгібувальну дію тестованих сполук оцінювали колориметричним визначенням пнітрофенолу, продукованого впродовж ферментативної реакції. Рівні оптичної щільності, одержані без інгібітору, згадуються як «повна активність». Рівні, одержані без інгібітору і без ферменту, згадуються як «контроль» для оцінки будь-якого впливу на субстрат у перебігу тесту (таблиця 2). 51 86393 52 Таблиця 1 Інгібування ароматазного, фолікулінсульфатазного та естрогенного потенціалу Сполуки Летрозол Анастрозол А* Приклад 11 Приклад 13 Приклад 14 Приклад 20 Приклад 22 Приклад 26 Приклад 30 Приклад 35 Приклад 36 Приклад 37 Приклад 40 Приклад 41 Приклад 43 Приклад 45 Приклад 46 Приклад 48 Приклад 51 Приклад 61 Приклад 62 Ароматазнг активність ІС50 ((нМ)± S.E.M. n 0,47±0,08а 8 6,93±1,07а 6 2,5±0,6с 4 nda 3 ndc 4 0,17±0,01а 8 0,17±0,03а 8 0,05±0,02с 4 0,21±0,05а 4 0,3а 1 0,32±0,40а 4 50,6а 1 0,06c 1 2,2±0,7c 4 0,61±0,21с 4 52,0±9,6с 4 0,67±0,10а 8 4,3е 1 0,57±0,16а 4 0,13±0,07с 4 0,79±0,26а 4 0,82±0,12а 4 0,34±0,13c 4 1,06±0,21а 4 81,8с 1 Сульфатазна активність ІС50 ((нМ)± S.E.M. n нвb 6 нвb 6 нвс 2,5±0,5b 4 3,6±0,8с 4 нвb 4 нвс 4 нвb 1 нвb 4 нвb 1 нвс 4 нвс 4 нвс 4 5,5±1,1b 4 3,4±0,4с 4 13,8±2,5b 4 2657±257b 4 597,2±67,4c 4 нвb 4 нвс 1 А*: 3-циклогептилметилбензотіофен-6-іл-1,1-діоксид-ефір WO2004/101545) нв: не виявлено Матеріали і методи: а одна активність ароматази; b одна активністьсульфатази; с подвійна активність ароматази і сульфатази, d естрогенний потенціал. Серед тестованих сполук приклад 43, приклад 45 і приклад 46 демонстрували сильне інгібування (ІС50 приблизно 10нМ) активності фолікулінсульфатази людини. Крім того, ті самі сполуки демон сульфамінової ЕстрогенниР потенціал ІС50 ((нМ)± S.E.M. n нв 1 нв 1 нв 4 нв 4 нв 4 нв нв нв нв нв нв нв Нв Нв 4 4 1 3 4 4 4 1 1 кислоти (описаний у стрували сильне інгібування активності ароматази (ІС5090%). Приклад 45 було вибрано як потенціальний інгібітор активності фолікулінсульфатази в силу відсутності у нього естрогенних властивостей і значного інгібування стероїдсульфатази. Ці результати in vivo узгоджуються з результатами in vitro, одержаними у клітинах JEG-3. ІНГІБУВАННЯ ПІКУ ЕСТРАДІОЛУ ЯК IN VIVO МОДЕЛЬ ІНГІБУВАННЯ АРОМАТАЗИ Мета цього експерименту полягала в тому, щоб визначити дозозалежну активність тестованих сполук порівняно до анастрозолу відносно рівнів 17b-естрадіолу через 24 години після одного перорального введення самкам пацюків. Анастрозол є потужним нестероїдним інгібітором ароматази, який значно інгібує рівні естрадіолу при 3мкг/кг через 24 години після одного єдиного перорального введення самкам пацюків. Сто самок пацюків IOPS Wistar вагою 180-200г розміщували по чотири у клітках з нержавіючої сталі. Тваринам забезпечували вільний доступ до стандартної дієти у вигляді гранул Harlan Teklad 2016. Мазки з піхви 54 відбирали у кожної тварини щоранку, щоб встановити різні фази циклу. Пацюки, які не мали регулярного естрального циклу, були виключені з експерименту. Починаючи з 16.00 тваринам перорально вводили сполуки. Через 24 години брали проби сироватки і рівень естрадіолу визначали, як описано вище (таблиця 4). Таблиця 4 Інгібування піку ест радіолу Сполука Анастрозол Приклад 45 Інгібування % (пік естрадіолу) 56 28 Приклад 45 інгібував пік естрадіолу in vivo. ІНГІБУВАННЯ РОСТУ ПУХЛИНИ MCF-7 ксенотрансплантати у голих мишах Клітини MCF-7, одержані з аденокарциноми молочної залози людини, вводили підшкірно атимічним голим мишам із видаленими яєчниками, яким щоденно підшкірно вводили сульфат фолікуліну. Об'єми ксенотрансплантату визначали щотижня. Коли об'єми пухлини значно збільшуються, тестовану сполуку вводять перорально у кількості 1мг/кг/день впродовж 8 тижнів. Ксенотрансплантати вимірюють, видаляють, зважують і глибоко заморожують для визначення активності сульфатази згідно зі способами, які використовують для маток пацюків. ER+ тканина пухлини молочної залози людини, пересаджена у вигляді ксенотрансплантату голим пацюкам Клітини MCF-7 (ATCC), одержані з аденокарциноми молочної залози людини, вводили підшкірно атимічним голим мишам з видаленими яєчниками, яким щоденно вводили підшкірно естрадіол. Обсяги ксенотрансплантату визначали щотижня. Через 8 тижнів об'єми пухлини сягали 1000мм, забезпечуючи 500мг проби естрогенчутливої тканини від кожної тварини. У цей час кожну пухлину нарізали шарами і повторно трансплантували наївним голим пацюкам з видаленими яєчниками (Rnu/Rnu). Потім тварин лікували сульфатом фолікуліну як попередником естрадіолу у стероїдсульфатазному шляху. Коли об'єми пухлини досягали значного збільшення, відмінного від плацебо, тварин рандомізували і поділяли на дві групи. Тварин першої групи лікували із використанням сполуки прикладу 45 і з додатковим щоденним введенням сульфату фолікуліну. Тваринам другої групи вводили носій з додатковим введенням тієї самої дози сульфату фолікуліну. Приклад 45 перорально вводили у кількості 5мг/кг/день впродовж 5 тижнів. Ксенотрансплантати вимірювали щотижня електронним штангенциркулем і порівнювали з групою, яка одержувала сульфат фолікуліну (таблиця 5). 55 86393 Таблиця 5 Інгібування пухлини молочної залози людини Зміни об'єму (виражені у вигляді % відЕ1S-позитивної контрольної групи) День День День Лечение Время День 7 28 35 42 E1S+Пр.45 0 -26 -44 -39 Параметри Коли тварин лікували сполукою прикладу 45, об'єми пухлини не збільшувались. З іншого боку, одночасно у групах, які одержували лише сульфат фолікуліну (Е1S), об'єми пухлини були вищими. У кінці експерименту, після п'яти тижнів щоденного лікування, приклад 45 призводив до 40%-ного зменшення в об'ємі пухлини, демонструючи явну і стабільну антиканцерогенну активність. Ксенотрансплантат JEG-3 у голих мишах Лінія клітин JEG-3 суперекспресує як ароматазу людини, так і фолікулінсульфатазу. її вводять підшкірно атимічним голим мишам із видаленими яєчниками, яким щоденно додатково підшкірно вводять сульфат фолікуліну з тестованими сполуками або без них (у кількості 5мг/кг/день). У тому особливому разі, і відповідно до їх напіврідкого статусу (хоріокарциномне походження), вимірю Комп’ютерна верстка Н. Лисенко 56 вання пухлини є нерелевантними. Однак непрямий ефект естрадіолу, який головним чином синтезується тканиною пухлини, одержують на базі маси маток. З іншого боку, через суперекспресію ароматази і сульфатази у таких пухлинах ферментні рівні можуть бути виміряні. Ферментативні активності визначають згідно з вищеописаними способами. Ксенотрансплантат JEG-3 у голого пацюка з додатковим введенням сульфату фолікуліну і D4андростендіону За 15 днів до ін'єкції клітин JEG-3 пацюкам брали проби крові, щоб виміряти базальні рівні естрадіолу у плазмі. Потім клітини JEG-3 вводять підшкірно атимічним голим пацюкам з видаленими яєчниками (Rnu/Rnu). Тваринам додатково щоденно вводили підшкірно сульфат фолікуліну і А4андростендіон з тестованою сполукою або без неї (у кількості 1мг/кг/день). Після 21-денного періоду забір крові виконували через один день після введення злоякісного ксенотрансплантату і в кінці експерименту. У цьому експерименті сульфат фолікуліну і D4-андростендіон є попередниками естрадіолу. Ефект естрадіолу відображений у масі матки після умертвіння. Плазмові гормональні рівні аналізують у кінці експериментів згідно зі стандартним методом постачальника (DSL, Webster, TX, США). Підписне Тираж 28 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюNormal;heading 1;heading 2;1-n-phenyl-amino-1h-imidazole derivatives and pharmaceutical compositions containing them
Автори англійськоюLafay Jean, Rondot Benoit, Bonnet Paule, Clerc Thierry, Shields Jacqueline, Duc Igor, Duranti Eric, Puccio Francois, Blot Christian, Maillos Philippe
Назва патенту російськоюПроизводные фениламино-1н-имидазола и фармацевтическая композиция, которая их содержит
Автори російськоюЛяфей Жан, Рондо Бенуа, Бонне Поль, Клерк Тьерри, Шилд Жаклин, Дюк Игор, Дюранти Эрик, Пюссьйо Франсуа, Блё Кристиан, Майо Филипп
МПК / Мітки
МПК: A61P 5/00, A61P 35/00, A61K 31/5415, C07D 419/00, A61K 31/4164, C07D 409/12, C07D 233/56
Мітки: композиція, 1-феніламіно-1н-імідазолу, фармацевтична, похідні, містить
Код посилання
<a href="https://ua.patents.su/28-86393-pokhidni-1-fenilamino-1n-imidazolu-ta-farmacevtichna-kompoziciya-shho-kh-mistit.html" target="_blank" rel="follow" title="База патентів України">Похідні 1-феніламіно-1н-імідазолу та фармацевтична композиція, що їх містить</a>
Попередній патент: Вітроелектроустановка
Наступний патент: Спосіб упаковування кави та пакувальна машина для упаковування кави
Випадковий патент: Термостійкий чохол прасувального стола з еластичним покриттям












