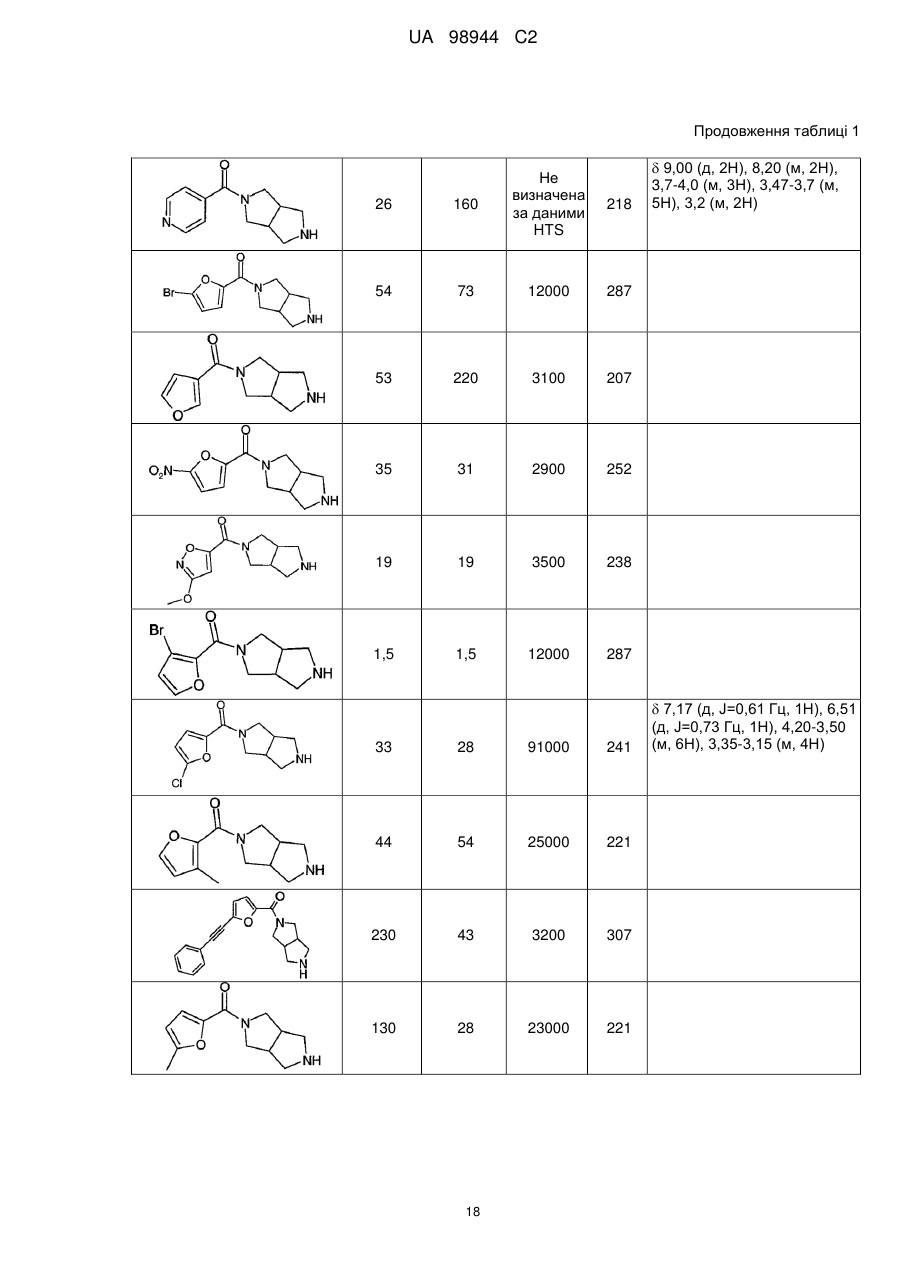
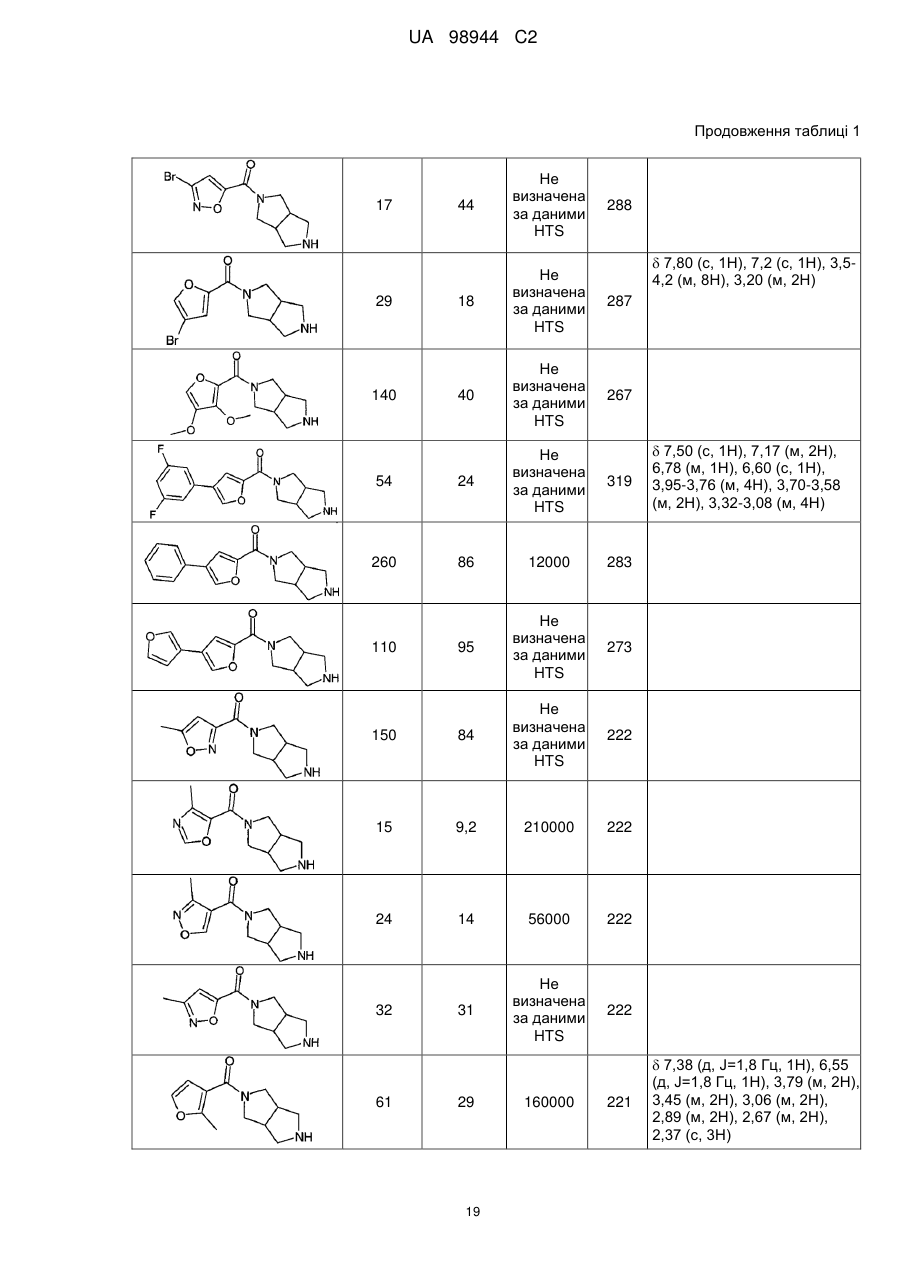
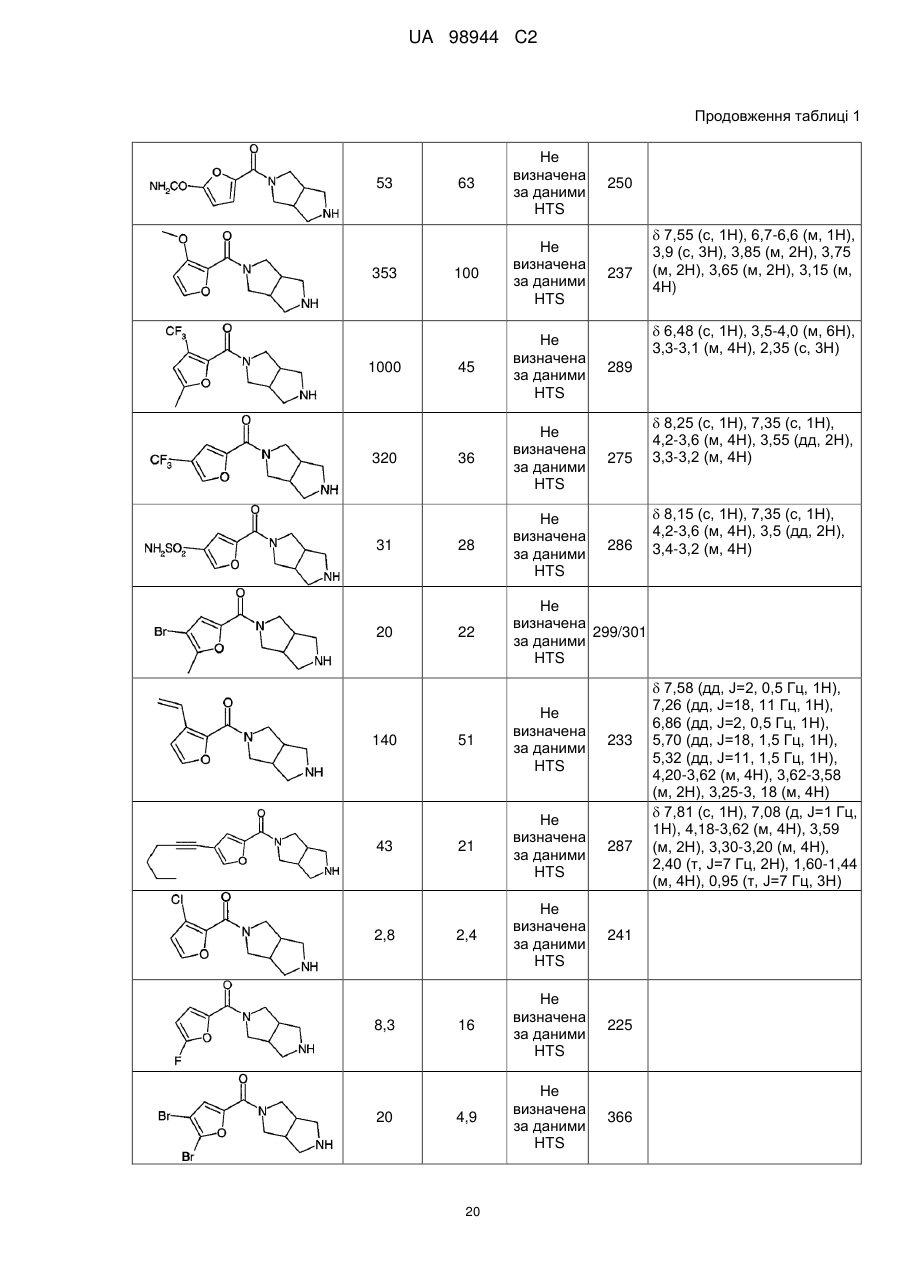
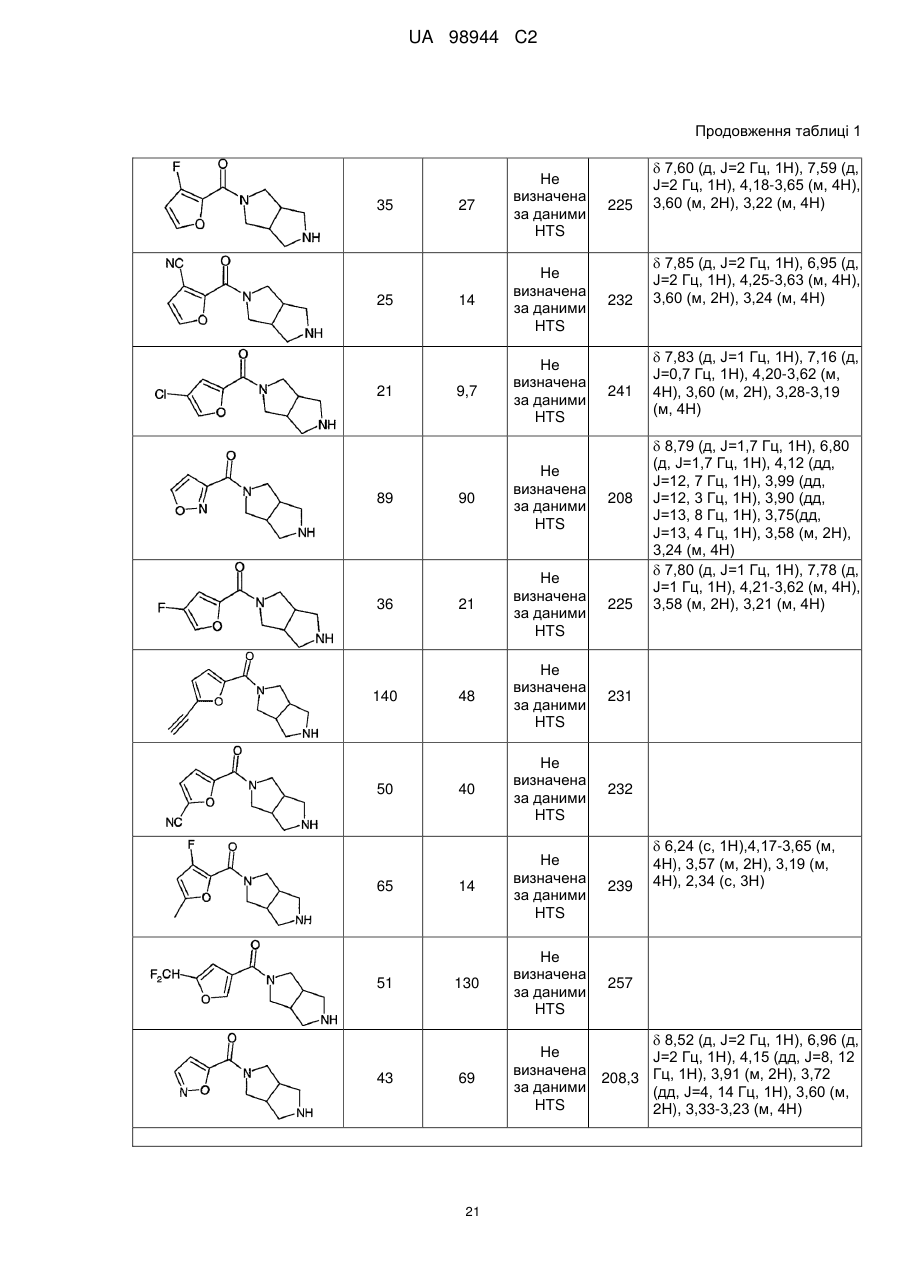
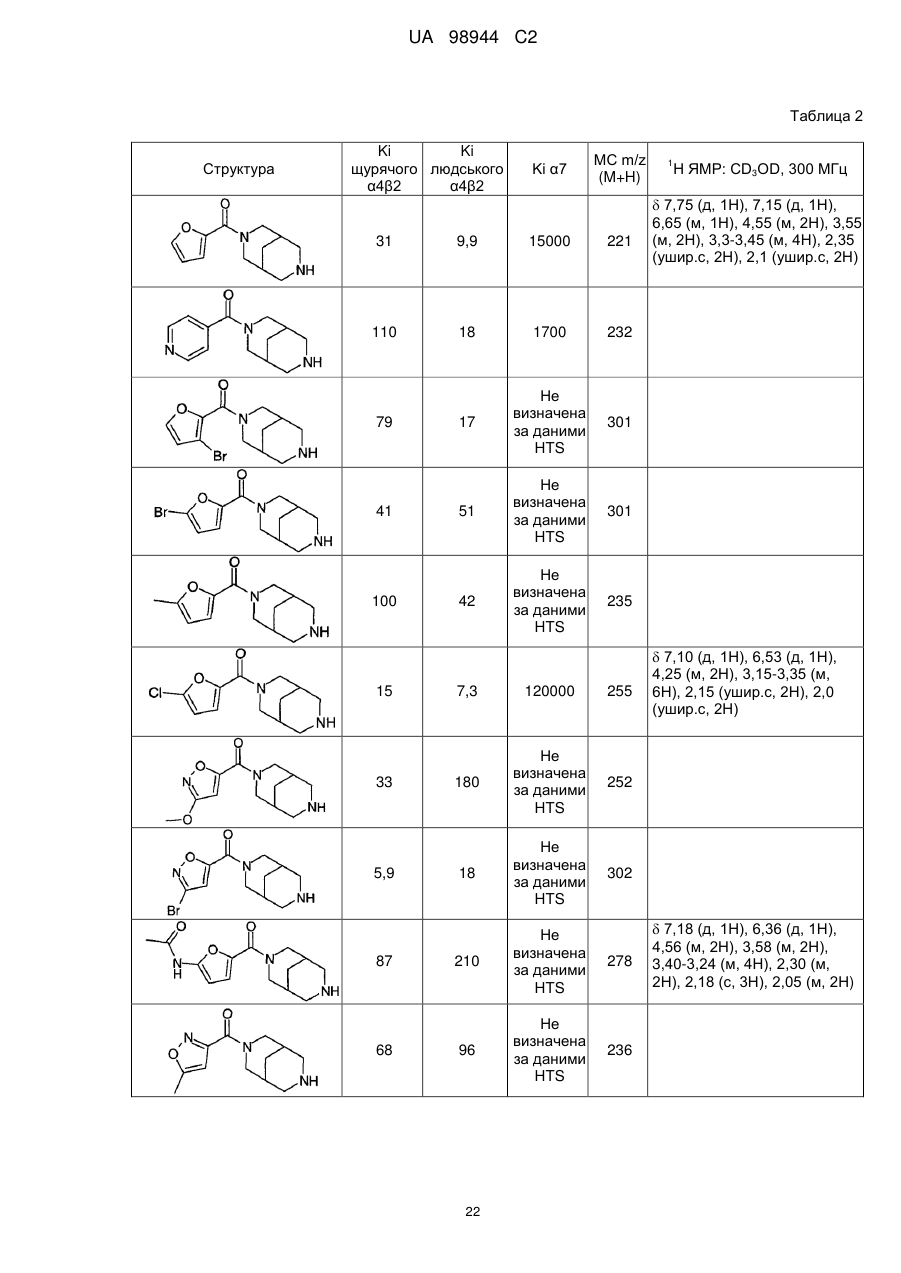
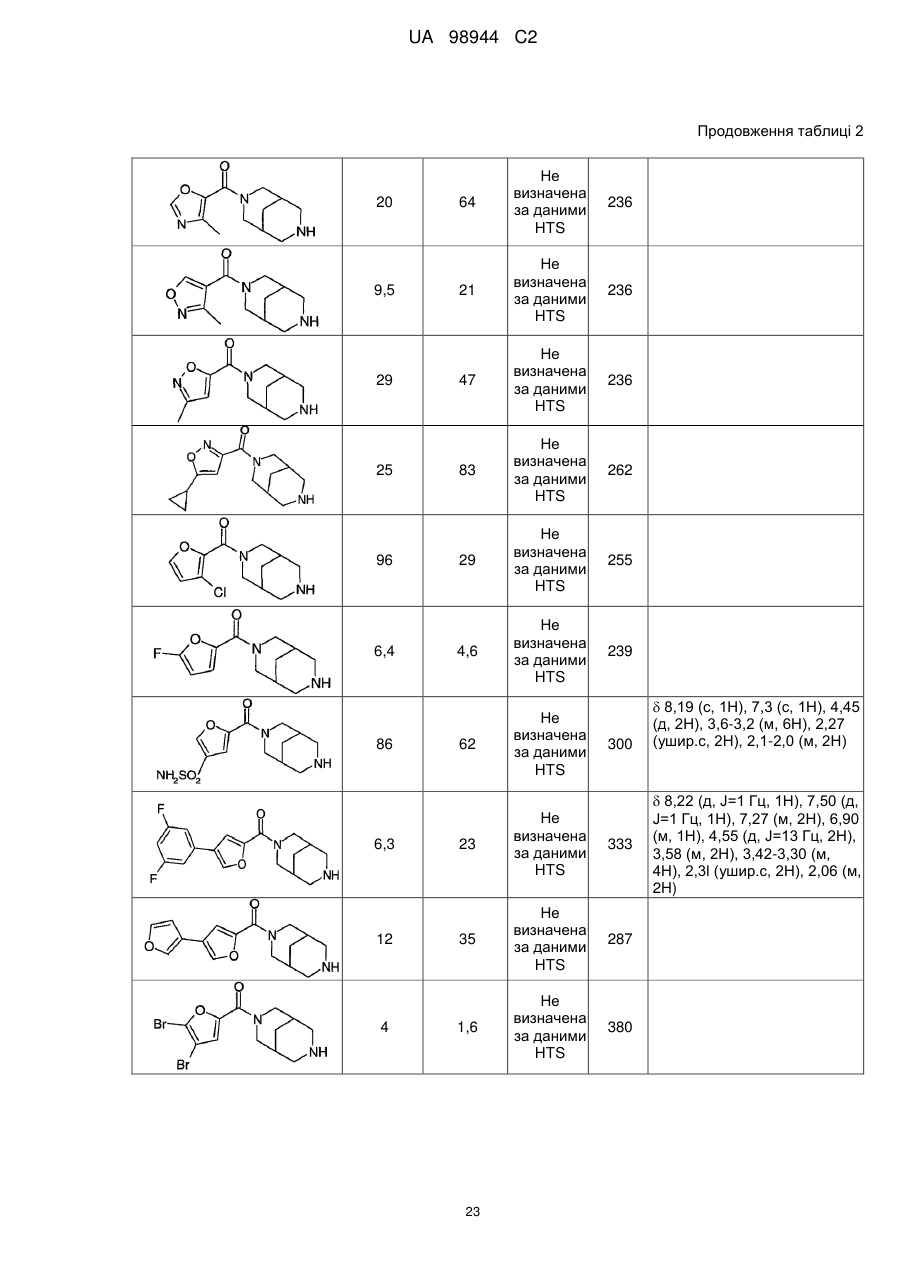
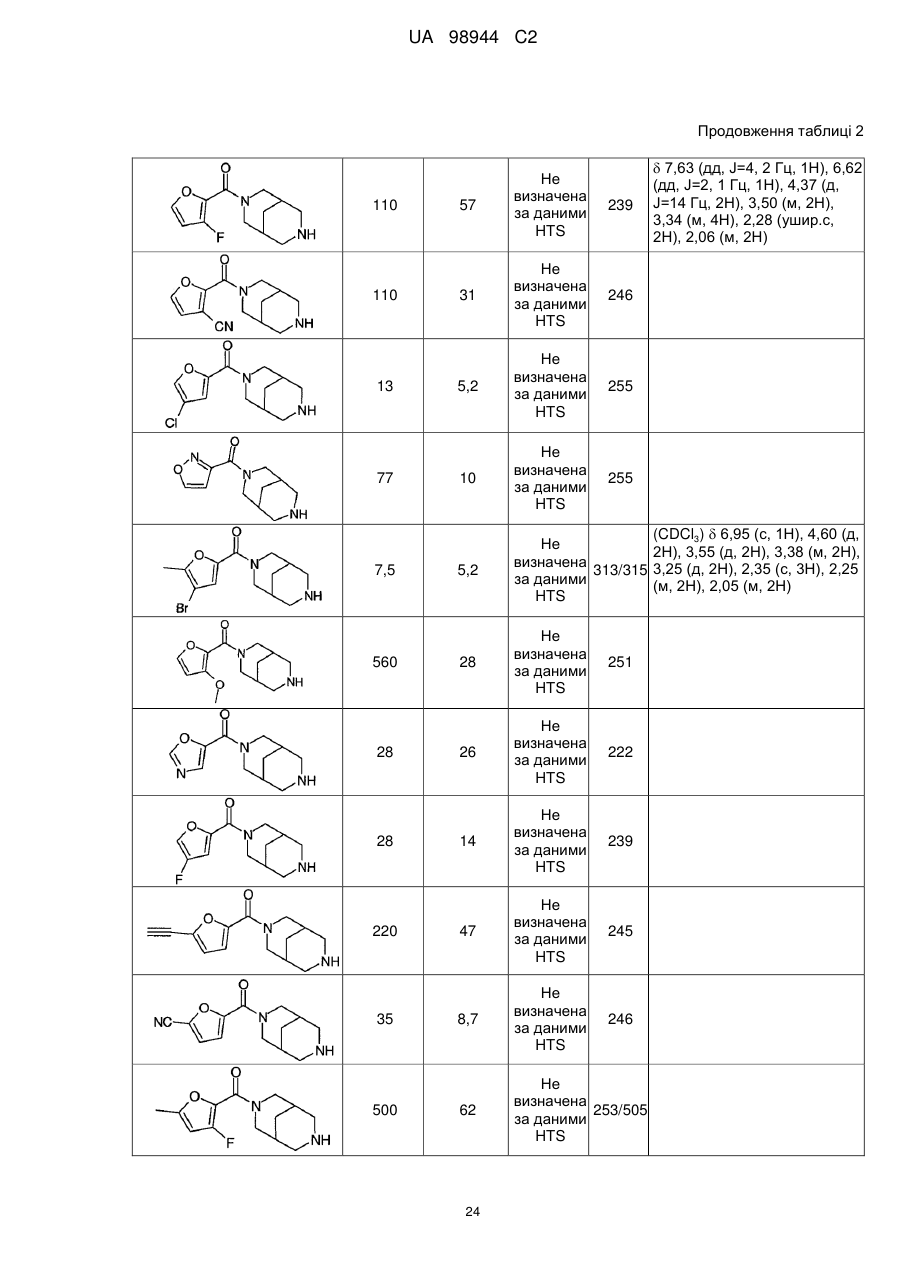
Аміди діазабіциклоалканів, селективні відносно ацетилхолінового підтипу нікотинових рецепторів
Номер патенту: 98944
Опубліковано: 10.07.2012
Автори: Брейнінг Скотт Р., Акіредді Срінівіса Рао, Міллер Крейг Х., Мазуров Анатолій, Хеммонд Філіп С., Сяо Юнь-де, Мелвін Метт С., Уітакер Реджина С., Мерті В. Срініваса, Мяо Лань
Формула / Реферат
1. Сполука N-(5-хлорфуран-2-ілкарбоніл)-3,7-діазабіцикло[3.3.0]октан або його фармацевтично прийнятні солі.
2. Спосіб лікування вікового погіршення пам'яті, слабкого порушення когнітивних здібностей, передстаречої деменції, раннього початку хвороби Альцгеймера, старечої деменції, деменції типу Альцгеймера, деменції з тільцями Леві, судинної деменції, хвороби Альцгеймера, удару, комплексу СНІД-деменція, синдрому дефіциту уваги, гіперактивного розладу з дефіцитом уваги, дислексії, шизофренії, шизофреніформного розладу, порушення пізнавальної здатності при шизофренії і шизоафективного розладу, який включає введення N-(-5-хлорфуран-2-ілкарбоніл)-3,7-діазабіцикло[3.3.0]октану або його фармацевтично прийнятної солі.
3. Спосіб лікування деменції типу Альцгеймера в ступені від слабкого до помірного, синдрому дефіциту уваги, помірного порушення когнітивних здібностей або вікового погіршення пам'яті, який включає введення N-(5-хлорфуран-2-ілкарбоніл)-3,7-діазабіцикло[3.3.0]октану або його фармацевтично прийнятної солі.
4. Спосіб лікування синдрому дефіциту уваги або гіперактивності, який включає введення N-(5-хлорфуран-2-ілкарбоніл)-3,7-діазабіцикло[3.3.0]октану або його фармацевтично прийнятної солі.
5. Спосіб лікування шизофренії, шизофреніформного розладу, порушення пізнавальної здатності при шизофренії і шизоафективного розладу, який включає введення N-(-5-хлорфуран-2-ілкарбоніл)-3,7-діазабіцикло[3.3.0]октану або його фармацевтично прийнятної солі.
6. Фармацевтична композиція, яка містить як активний інгредієнт сполуку N-(5-хлорфуран-2-ілкарбоніл)-3,7-діазабіцикло[3.3.0]октан або його фармацевтично прийнятну сіль і один або декілька фармацевтично прийнятних розріджувачів, ексципієнтів або інертних носіїв.
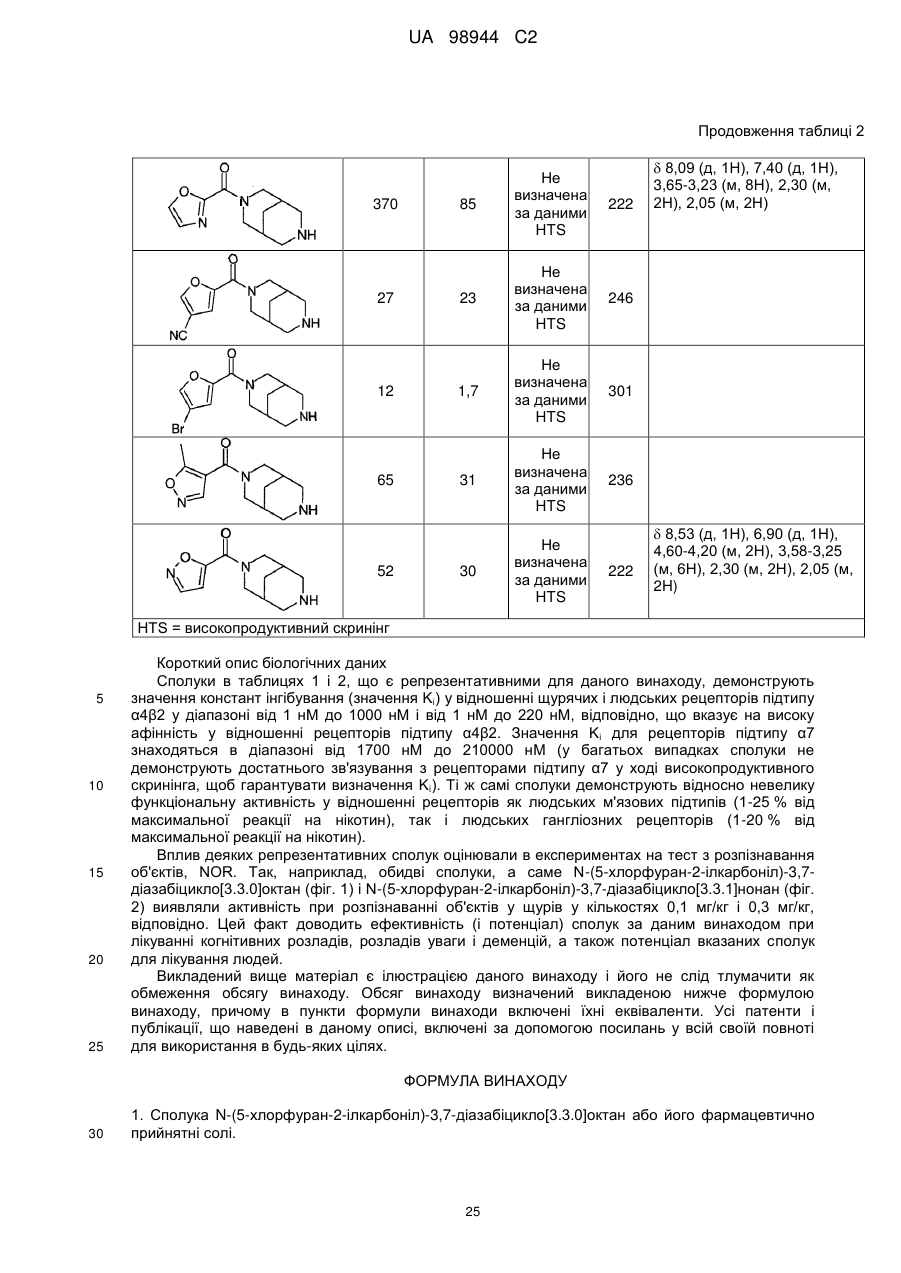
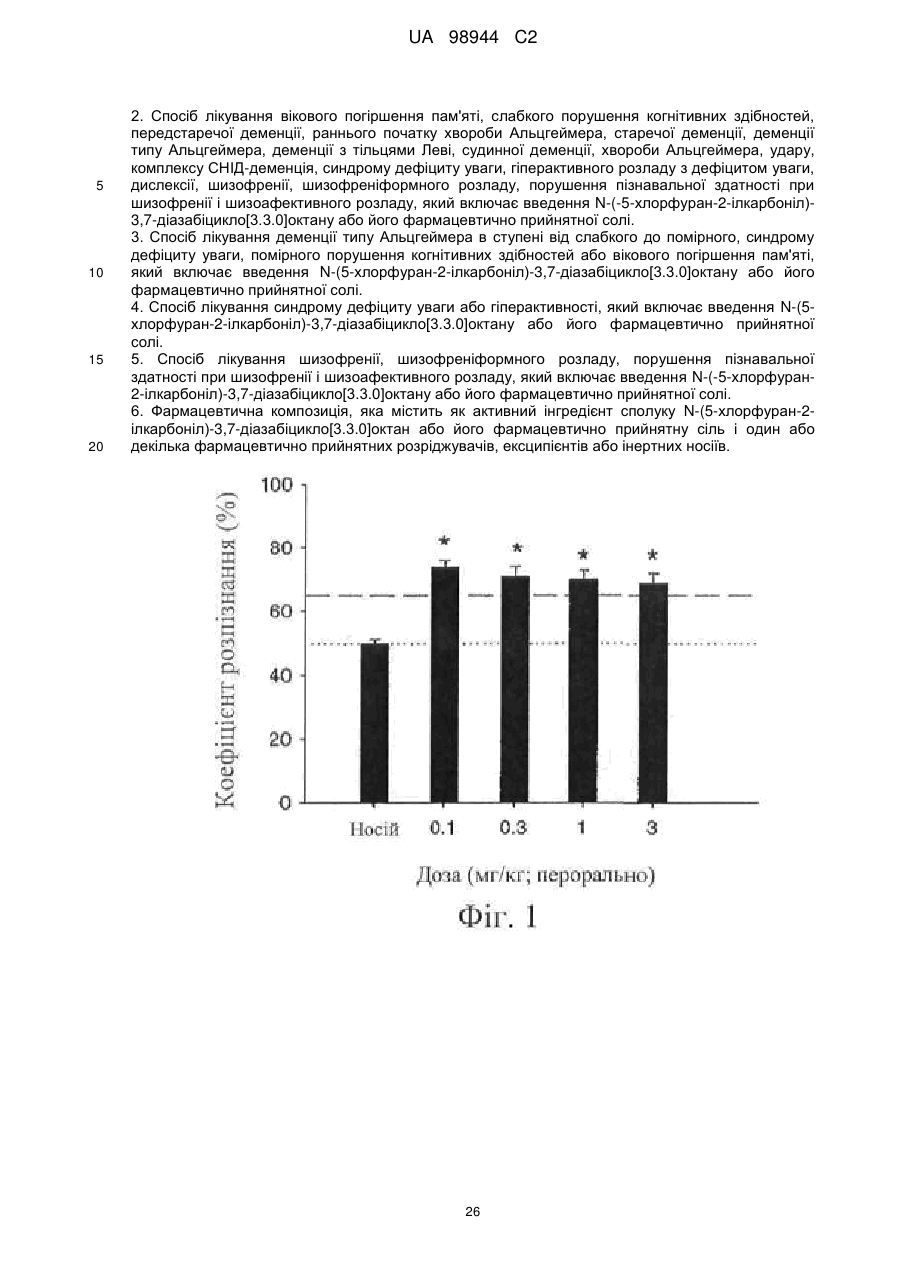
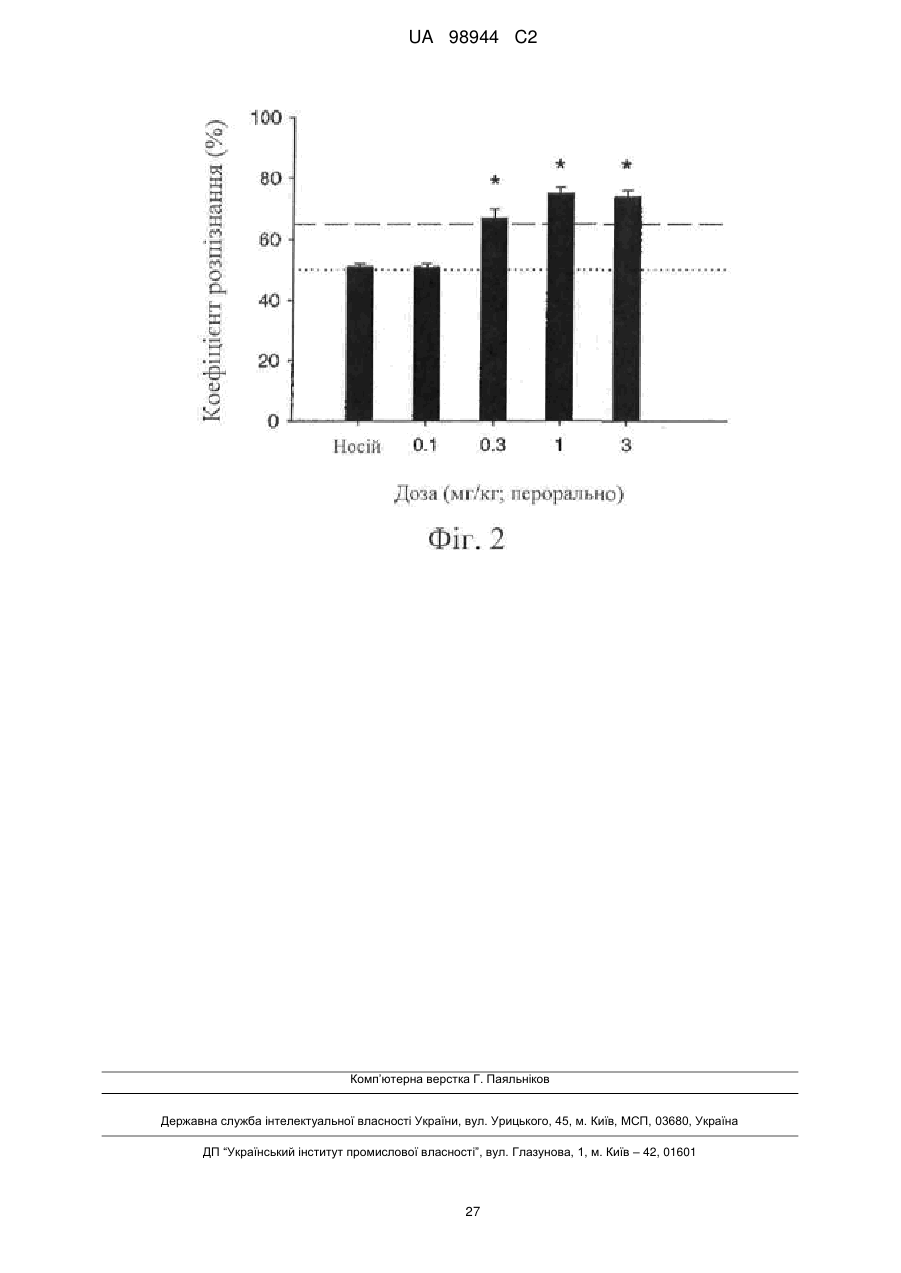
Текст
Реферат: У винаході розкриті сполуки, фармацевтична композиція, що містить такі сполуки, а також застосування вказаних сполук. Описані сполуки можуть бути одержані з деяких гетероарилвмісних карбонових кислот і визначених діазабіциклоалканів. Дані сполуки демонструють селективність у відношенні нейронних нікотинових рецепторів підтипу α4β2 у центральній нервовій системі (ЦНС) і зв'язуються з ними з високою афінністю. Описані сполуки і композиції можуть застосовуватися для лікування і/або профілактики широкого спектра захворювань і розладів, зокрема розладів ЦНС. Сполуки можуть: (і) змінювати кількість нікотинових холінергічних рецепторів у мозку пацієнта, (іі) демонструвати нейрозахисну дію і (ііі) при застосуванні в ефективних кількостях не призводити до помітних несприятливих побічних ефектів (наприклад, таких побічних ефектів, як значне збільшення кров'яного тиску і частоти серцебиття, значний негативний вплив на шлунково-кишковий тракт і значний вплив на скелетну мускулатуру). UA 98944 C2 (12) UA 98944 C2 UA 98944 C2 5 10 15 20 25 30 35 40 45 50 55 60 Даний винахід стосується сполук, що зв'язуються і модулюють активність нейронних нікотинових ацетилхолінових рецепторів, способів одержання таких сполук, фармацевтичних композицій, що містять такі сполуки, і способів застосування таких сполук для лікування різних станів і розладів, включаючи зв'язані з дисфункцією центральної нервової системи (ЦНС). Терапевтичний потенціал сполук, що націлені на нейронні нікотинові рецептори (NNR), відомі також як нікотинові ацетилхолінові рецептори (nACh), був предметом декількох сучасних оглядів (див. Breining et al., Ann. Rep. Med. Chem. 40: 3 (2005), Hogg and Bertrand, Curr. Drug Targets: CNS Neurol. Disord. 3: 123 (2004), Suto and Zacharias, Expert Opin. Ther. Targets 8: 61 (2004), Dani et al., Bioorg. Med. Chem. Lett. 14: 1837 (2004), Bencherif and Schmitt, Curr. Drug Targets: CNS Neurol. Disord. 1: 349 (2002)). У число різних захворювань, для лікування яких ліганди NNR були запропоновані як терапевтичний засіб, входять когнітивні розлади, включаючи хворобу Альцгеймера, синдром дефіциту уваги і шизофренія (Newhouse et al., Curr. Opin. Pharmacol. 4: 36 (2004), Levin and Rezvani, Curr. Drug Targets: CNS Neurol. Disord. 1: 423 (2002), Graham et al., Curr. Drug Targets: CNS Neurol. Disord. 1: 387 (2002), Ripoll et al., Curr. Med. Res. Opin. 20(7): 1057 (2004), і McEvoy and Allen, Curr. Drug Targets: CNS Neurol. Disord. 1: 433 (2002)); біль і запалення (Decker et al., Curr. Top. Med. Chem. 4(3): 369 (2004), Vincler, Expert Opin. Invest. Drugs 14(10): 1191 (2005), Jain, Curr. Opin. Inv. Drugs 5:76 (2004), Miao et al., Neuroscience 123: 777 (2004)); депресія і тривога (Shytle et al., Mol. Psychiatry 7: 525 (2002), Damaj et al., Mol. Pharmacol. 66: 675 (2004), Shytle et al., Depress. Anxiety 16:89 (2002)); нейродегенерация (O'Neill et al., Curr. Drug Targets: CNS Neurol. Disord. 1: 399 (2002), Takata et al., J. Pharmacol. Exp. Ther. 306: 772 (2003), Marrero et al., J. Pharmacol. Exp. Ther. 309:16 (2004)); хвороба Паркінсона (Jonnala and Buccafusco, J. Neurosci. Res. 66: 565 (2001)); наркоманія (Dwoskin and Crooks, Biochem. Pharmacol. 63: 89 (2002), Coe et al., Bioorg. Med. Chem. Lett. 15(22): 4889 (2005)); ожиріння (Li et al., Curr.Top.Med.Chem. 3: 899 (2003)); і синдром Туретта (Sacco et al., J. Psychopharmacol. 18(4):457 (2004), Young et al., Clin. Ther. 23(4):532 (2001)). Обмеження застосування деяких нікотинових сполук пов'язане з тим, що з ними пов'язані різні небажані побічні ефекти, наприклад, викликані стимулюванням м'язових і гангліозних рецепторів. З цієї причини, бажано мати в розпорядженні сполуки, композиції і способи профілактики і/або лікування різних станів або розладів (наприклад, розладів ЦНС), включаючи полегшення симптомів таких розладів, де сполуки будуть демонструвати характерну для нікотинових сполук фармакологію зі сприятливими ефектами (наприклад, впливом на діяльність ЦНС), але без значних пов'язаних побічних ефектів. Далі, дуже бажано розробити сполуки, композиції і способи, що будуть впливати на діяльність ЦНС, при відсутності значного впливу на рецептори тих підтипів, що потенційно можуть викликати небажані побічні ефекти (наприклад, помітну активність у серцево-судинній системі і кістякових м'язах). Даний винахід стосується таких сполук, композицій і способів. Даний винахід стосується визначених амідних сполук, що можуть бути одержані з деяких гетероарилвмісних карбонових кислот і певних діазабіциклоалканів, зокрема, 3,7діазабіцикло[3.3.0]октану і 3,7-діазабіцикло[3.3.1]нонану. Такі амідні сполуки з високою афінністю зв'язування у відношенні виявлених у ЦНС NNR підтипу α4β2, і демонструють селективність у відношенні NNR підтипу α4β2 у порівнянні з NNR підтипу α7, також виявленими в ЦНС. Крім того, даний винахід стосується фармацевтично прийнятних солей, одержуваних з даних сполук, і їх фармацевтичних композицій, що можуть застосовуватися для лікування і/або профілактики широкого спектра станів і розладів, і, зокрема, розладів, що характеризуються порушенням нікотинової холінергічної нейротрансмісії або дегенерацією нікотинових холінергічних нейронів. Крім цього, винахід стосується способів лікування і/або профілактики розладів, наприклад, розладів ЦНС, а також лікування деяких станів (наприклад, полегшення болю і запалення) у ссавців, що потребують такого лікування. Дані способи включають введення суб'єкту терапевтично ефективної кількості вказаних сполук (включаючи їх солі) або фармацевтичних композицій, що містять вказані сполуки. Далі, даний винахід забезпечує спосіб лікування розладів, вибраних із групи, що складається з вікового погіршення пам'яті, помірних когнітивних порушень, передстаречої деменції (раннього початку хвороби Альцгеймера), старечої деменції (деменції типу Альцгеймера), деменції з тільцями Леві, судинної деменції, хвороби Альцгеймера, інсульту, комплексу СНІД-деменція, синдрому дефіциту уваги, гіперактивного розладу з дефіцитом уваги, дислексії, шизофренії, шизофреніформного розладу і шизоафективного розладу. Крім того, забезпечений спосіб лікування розладів, вибраних із групи, що складається з деменції типу Альцгеймера в ступені від легкої до помірної, синдрому дефіциту уваги, легких когнітивних порушень і вікового погіршення пам'яті. Фармацевтичні композиції містять сполуку за даним винаходом, яке при застосуванні в ефективних кількостях, взаємодіє з відповідними сайтами нікотинових рецепторів суб'єкта і 1 UA 98944 C2 5 10 15 20 25 30 35 40 45 50 55 60 завдяки цьому діє як терапевтичний засіб для лікування і профілактики широкого спектра станів і розладів. Описувані фармацевтичні композиції приносять терапевтичну користь індивідуумам, що страждають вказаними захворюваннями і демонструє клінічні прояви вказаних захворювань, у тому відношенні, що, у випадку застосування в ефективних кількостях, можуть: (і) демонструвати нікотинову фармакологію і впливати на відповідні сайти нікотинових рецепторів (наприклад, діяти як фармакологічні агоністи, активуючи нікотинові рецептори) і/або (ii) викликати секрецію нейротрансмітерів і внаслідок цього запобігати і пригнічувати симптоми, пов'язані з вказаними захворюваннями. Крім цього, вказані сполуки мають потенційну можливість (і) збільшувати кількість нікотинових холінергічних рецепторів у мозку пацієнта, (ii) демонструвати нейропротективну дію і/або (iii) у випадку застосування в ефективних кількостях не викликати помітних шкідливих побічних ефектів (наприклад, помітного збільшення кров'яного тиску і частоти серцебиттів, помітного несприятливого впливу на шлунково-кишковий тракт і помітну дію на скелетні м'язи). Вважається, що фармацевтичні композиції, що містять сполуки за даним винаходом, є безпечними й ефективними при профілактиці і лікуванні широкого спектра станів і розладів. Вказані вище й інші аспекти даного винаходу детально викладені в докладному описі винаходу і прикладах, наведених нижче за текстом. Фіг. 1 являє собою графік, що показує результати дослідження з розпізнавання об'єктів щурами, яким перорально вводили N-(5-хлорфуран-2-ілкарбоніл)-3,7-діазабіцикло[3.3.0]октан. Результати показані у вигляді залежності коефіцієнта розпізнавання (%) від дози (мг/кг). Фіг. 2 являє собою графік, що показує результати дослідження з розпізнавання об'єктів щурами, яким перорально вводили N-(5-хлорфуран-2-ілкарбоніл)-3,7-діазабіцикло[3.3.1]нонан. Результати показані у вигляді залежності коефіцієнта розпізнавання (%) від дози (мг/кг). Нижче наведений докладний опис підтипу селективних сполук, фармацевтичних композицій, що містять вказані сполуки, способів одержання вказаних сполук, а також способів лікування і/або профілактики з застосуванням вказаних сполук. Більш глибоке розуміння описаних у даному описі сполук і способів буде досягнуте при звертанні до наступних переважних варіантів здійснення. При визначенні обсягу даного винаходу будуть застосовуватися наступні визначення: У даному описі, якщо не вказано інше, термін "алкіл" включає алкільні групи як з лінійними, так і з розгалуженими ланцюгами. У їх число можуть входити, але, не обмежуючи ними, метил, етил, н-пропіл, ізопропіл, н-бутил, ізобутил, втор-бутил, трет-бутил, н-пентил, ізопентил, неопентил, н-гексил або ізогексил. Таким чином, термін "C1-4алкіл" охоплює алкільні групи, що містять від 1 до 4 атомів вуглецю, включаючи, але, не обмежуючи ними, метил, етил, н-пропіл, ізопропіл або трет-бутил. Як використано в даному описі, якщо не вказано інше, термін "циклоалкіл" стосується необов'язково заміщеної, частково або цілком насиченої моноциклічної, біциклічної або місточкової вуглеводневої кільцевої системи. Термін "C 3-8циклоалкіл" може являти собою, але, не обмежуючи ними, циклопропіл, циклобутил, циклопентил, циклогексил, циклогептил і циклооктил. Як використано в даному описі, гетероциклічніе радикали є 3-10-членними, включаючи один або декілька гетероатомів, вибраних з кисню, сірки й азоту. Приклади придатних гетероциклічніх фрагментів включають, але, не обмежуючи ними, піперидиніл, морфолініл, піролідиніл, імідазолідиніл, піразолідиніл, ізотіазолідиніл, тіазолідиніл, ізоксазолідиніл, оксазолідиніл, піперазиніл, оксаніл (тетрагідропіраніл) і оксоланіл (тетрагідрофураніл). Як використано в даному описі, радикали C1-6алкокси містять від 1 до 6 атомів вуглецю в лінійному або розгалуженому ланцюзі, а також включають C 3-6циклоалкокси радикали й алкокси радикали, що містять C3-6циклоалкільні фрагменти. Приклади включають, не обмежуючи зазначеними, метокси, етокси, пропокси, ізопропокси, бутокси, трет-бутокси, ізобутокси, циклопропілметокси, алілокси або пропаргілокси. Як використано в даному описі, термін "ароматичний" стосується 3-10, переважно 5- або 6членних ароматичного і гетероароматичного кілець. Як використано в даному описі, термін "фрагменти, що містять ароматичні групи" стосується фрагментів, що являють собою або включають ароматичні групи. Відповідно, у дане визначення включені фенільна і бензильна групи, оскільки кожна з них є або включає ароматичну групу, у дане визначення включені піридинільна і піримідинільна групи, оскільки обидві є гетероароматичними, тобто підгрупою ароматичних. Як використано в даному описі, арильні радикали вибрані з фенілу, нафтилу і інденілу. Як використано в даному описі, гетероарильні радикали є 3-10-членними, переважно 5-6членними, включаючи один або декілька гетероатомів, вибраних з кисню, сірки й азоту. 2 UA 98944 C2 5 10 15 20 25 30 35 40 45 50 55 Приклади придатних 5-членних кільцевих гетероарильних фрагментів включають фураніл, тієніл, піроліл, імідазоліл, оксазоліл, тіазоліл, ізоксазоліл, ізотіазоліл, оксадіазоліл, тетразоліл, триазоліл і піразоліл. Приклади придатних 6-членних гетероарильних фрагментів включають піридиніл, піримідиніл, піразиніл і піридазиніл. Приклади 9-членних гетероарильних груп включають бензімідазоліл, індолізиніл, індоліл, пуриніл і індолініл. Приклади 10-членних гетероарильних груп включають хінолініл і ізохінолініл. Варто розуміти, що в тексті опису кількість і природа замісників на кільцях сполук за даним винаходом повинні бути вибрані таким чином, щоб уникнути стерично неприйнятних комбінацій. Назви деяких сполук за даним винаходом були генеровані за допомогою комп'ютерної програми (ACDLabs 8.0/Name (IUPAC)). Приклади придатних фармацевтично прийнятних солей включають адитивні солі неорганічних кислот, наприклад, хлориди, броміди, сульфати, фосфати і нітрати; адитивні солі органічних кислот, такі як ацетати, галактарати, пропіонати, сукцинати, лактати, гліколяти, малати, тартрати, цитрати, малеати, фумарати, метансульфонати, п-толуолсульфонати й аскорбати; солі з кислими амінокислотами, такими як аспартати і глутамати; солі лужних металів, такі як солі натрію і солі калію; солі лужноземельних металів, такі як солі магнію і солі кальцію; амонієві солі; солі органічних основ, такі як солі триметиламіну, солі триетиламіну, солі піридину, солі піколіну, солі дициклогексиламіну і солі N, N'-дибензилетилендіаміну; а також солі з основними амінокислотами, такі як солі лізину й аргініну. У деяких випадках вказані солі можуть бути гідратами або сольватами, наприклад похідними етанолу. Репрезентативні солі одержують, як описано в патентах США № 5597919, на ім'я Dull і співавторів, 5616716, на ім'я Dull і співавторів, і 5663356, на ім'я Ruecroft і співавторів. Сполуки формули (I) і їх фармацевтично прийнятні солі можуть існувати в сольватованій, наприклад, гідратованій формі, а також у несольватованій формі, і даний винахід охоплює всі такі формі. Як використано в даному описі, термін "агоніст" означає речовину, що стимулює сполуку, яка зв'язується з нею, як правило, рецептор. Стимулювання визначають у контексті конкретного дослідження або воно може бути очевидним з літератури, відповідно до наведеного в даному описі обговорення, в якому здійснюється порівняння з фактором або речовиною, яку прийнято вважати "агоністом" або "антагоністом" конкретного партнера по зв'язуванню, в основному, у подібних обставинах, відповідно до оцінки фахівця в даній галузі. Стимулювання можна визначити як посилення конкретного ефекту або функції, що викликаються взаємодією агоніста або часткового агоніста з партнером по зв'язуванню, і воно може включати алостеричні ефекти. Як використано в даному описі, "антагоніст" являє собою речовину, що інгібує зв'язану з ним сполуку, як правило, рецептор. Інгібування визначають у контексті конкретного дослідження або воно може бути очевидним з літератури, відповідно до наведеного в даному описі обговорення, в якому здійснюється порівняння з фактором або речовиною, яку прийнято вважати "агоністом" або "антагоністом" конкретного партнера по зв'язуванню, в основному, у подібних обставинах, відповідно до оцінки фахівця в даній галузі. Інгібування можна визначити як зменшення конкретного ефекту або функції, що викликаються взаємодією антагоніста з партнером по зв'язуванню, і воно може включати алостеричні ефекти. Як використано в даному описі, терміни "частковий агоніст" або "частковий антагоніст" належать до речовини, що викликає відповідно стимулювання або інгібування свого партнера по зв'язуванню, рівень якого не є повною мірою або цілком агоністичним або антагоністичним, відповідно. Варто розуміти, що стимулювання і, відповідно, інгібування визначається природою будь-якої речовини або категорії речовин, обумовлених як агоністи, антагоністи або часткові агоністи. Як використано в даному описі, термін "власна активність" або "ефективність" стосується визначеного ступеня біологічної ефективності зв'язування з партнером з комплексу. У відношенні фармакології рецепторів, тобто контексту, в якому варто визначати власну активність або ефективність, вона буде залежати від конкретних обставин зв'язування з партнером з комплексу, і розгляд активності доречний у відношенні конкретного біологічного результату. Наприклад, у деяких ситуаціях власна активність може змінюватися залежно від конкретно задіяної системи вторинного месенджера. Див. Hoyer, D. and Boddeke, H., Trends Pharmacol. Sci. 14(7): 270-5 (1993). Фахівцю в даній галузі буде зрозуміло, чи доречні такі специфічні оцінки в тих чи інших конкретних обставинах і як вони можуть співвідноситися в контексті даного винаходу. Як використано в даному описі, модулювання рецептора включає агонізм, частковий агонізм, антагонізм, частковий антагонізм або зворотний агонізм відносно рецептора. 3 UA 98944 C2 5 10 15 20 25 30 35 40 45 50 Як використано в даному описі, нейротрансмітери, вивільнення яких опосередковується описаними в даному описі сполуками, включають, але, не обмежуючи ними, ацетилхолін, дофамін, норепінефрин, серотонін і глутамат, і описані в даному описі сполуки діють як модулятори на NNR підтипу α4β2 ЦНС. Сполуки Сполуки за даним винаходом являють собою амідні сполуки, одержані з визначених гетероарильних карбонових кислот і визначених діазабіциклоалаканів. Такі сполуки можуть бути представлені формулою (I): Формула (I), де n має значення 0 або 1, і Cy являє собою гетероарильну групу, вибрану з таких груп, як 2фураніл, 3-фураніл, 2-оксазоліл, 4-оксазоліл, 5-оксазоліл, 3-ізоксазоліл, 4-ізоксазоліл, 5ізоксазоліл, 1,3,4-оксадіазол-2-іл, 1,2,4-оксадіазол-3-іл, 1,2,4-оксадіазол-5-іл, 2-тіазоліл, 4тіазоліл, 5-тіазоліл, 3-ізотіазоліл, 4-ізотіазоліл, 5-ізотіазоліл, 1,3,4-тіадіазол-2-іл, 1,2,4-тіадіазол3-іл, 1,2,4-тіадіазол-5-іл і 4-піридиніл, де вказані гетероарильні групи необов'язково заміщені аж до 3 замісниками, відмінними від водню, незалежно вибраними з C 1-6алкілу, заміщеного C16алкілу, C2-6алкенілу, заміщеного C2-6алкенілу, C2-6алкінілу, заміщеного C2-6алкінілу, C38гетероциклілу, заміщеного C3-8гетероциклілу, C3-8циклоалкілу, заміщеного C3-8циклоалкілу, C510арилу, C5-10гетероарилу, заміщеного C5-10арилу, заміщеного C5-10гетероарилу, C1-6алкіл-C510арилу, C1-6алкіл-C5-10гетероарилу, заміщеного C 1-6алкіл-C5-10арилу, заміщеного C1-6алкіл-C510гетероарилу, C5-10арил-C1-6алкілу, C5-10гетероарил-C1-6алкілу, заміщеного C5-10арил-C1-6алкілу, заміщеного C5-10гетероарил-C1-6алкілу, галогену, -OR", -NR'”, -CF3, -CN, -NO2, -C2R", -SR", -N3, -C(=O)NR'”, -NR'C(=O)R", -C(=O)R", -C(=O)OR", -OC(=O)R", -OC(=O)NR'”, -NR'C(=O)OR", -SO2R", -SO2NR'” і -NR'SO2R", де R" і R" незалежно вибрані з водню, C1-6алкілу, C3-8циклоалкілу, C38гетероциклілу, C 5-10арилу, C5-10гетероарилу або C5-10арил-C1-6алкілу, або R" і R", а також атоми, до яких вони приєднані, разом можуть утворювати C3-8гетероциклічне кільце, де термін "заміщений", застосований у відношенні алкілу, алкенілу, алкінілу, гетероциклілу, циклоалкілу, арилу, гетероарилу, алкіларилу, алкілгетероарилу, арилалкілу і гетероарилалкілу, стосується заміщення одним або декількома алкілами, арилами, гетероарилами, галогенами, групами -OR" і -NR'”, або їх фармацевтично прийнятні солі. Один з варіантів здійснення винаходу стосується сполук формули (I), де n має значення 0 або 1, і Cy являє собою C5-10гетерооарильну групу, вибрану з таких груп, як 2-фураніл або 3фураніл, 2-оксазоліл, 4-оксазоліл, 5-оксазоліл, 3-ізоксазоліл, 4-ізоксазоліл, 5-ізоксазоліл, 1,3,4оксадіазол-2-іл, 1,2,4-оксадіазол-3-іл, 1,2,4-оксадіазол-5-іл, 2-тіазоліл, 4-тіазоліл, 5-тіазоліл, 3ізотіазоліл, 4-ізотіазоліл, 5-ізотіазоліл, 1,3,4-тіадіазол-2-іл, 1,2,4-тіадіазол-3-іл, 1,2,4-тіадіазол-5іл і 4-піридиніл, де вказані гетероарильні групи необов'язково заміщені аж до 3 замісниками, відмінними від водню, незалежно вибраними з C1-6алкілу, заміщеного C1-6алкілу, галогену і C26алкінілу, заміщеного фенілом. В одному з варіантів здійснення n дорівнює 0. В іншому варіанті здійснення n дорівнює 1. У ще одному варіанті здійснення Cy являє собою 2-фураніл. У ще одному варіанті здійснення Cy являє собою 2-фураніл, заміщений галогеном. В одному з варіантів здійснення Cy являє собою 2-фураніл, заміщений хлором. У ще одному варіанті здійснення n дорівнює 0, і Cy являє собою 2-фураніл, необов'язково заміщений галогеном. В одному з варіантів здійснення n дорівнює 1, і Cy являє собою 2-фураніл, необов'язково заміщений галогеном. У ще одному варіанті здійснення, 2-фураніл заміщений по положенню 5. В іншому варіанті здійснення R' і R" незалежно вибрані з метилу, етилу, н-пропілу, ізопропілу, н-бутилу, ізобутилу, бутила або третбутилу. В іншому варіанті здійснення R' і R" незалежно вибрані з фенілу або бензилу. У деяких випадках сполуки за даним винаходом є хіральними. Даний винахід включає всі енантіомерні або діастереомерні формі вказаних сполук. Приклади конкретних сполук за даним винаходом включають наступні сполуки: N-(фуран-2-ілкарбоніл)-3,7-діазабіцикло[3.3.0]октан, N-(3-метилфуран-2-ілкарбоніл)-3,7-діазабіцикло[3.3.0]октан, N-(5-метилфуран-2-ілкарбоніл)-3,7-діазабіцикло[3.3.0]октан, 4 UA 98944 C2 5 10 15 20 25 30 35 40 45 50 55 60 N-(3-хлорфуран-2-ілкарбоніл)-3,7-діазабіцикло[3.3.0]октан, N-(5-хлорфуран-2-ілкарбоніл)-3,7-діазабіцикло[3.3.0]октан, N-(3-бромфуран-2-ілкарбоніл)-3,7-діазабіцикло[3.3.0]октан, N-(5-бромфуран-2-ілкарбоніл)-3,7-діазабіцикло[3.3.0]октан, N-(4-фенілфуран-2-ілкарбоніл)-3,7-діазабіцикло[3.3.0]октан, N-(5-(2-піридиніл)фуран-2-ілкарбоніл)-3,7-діазабіцикло[3.3.0]октан, N-(5-(фенілетиніл)фуран-2-ілкарбоніл)-3,7-діазабіцикло[3.3.0]октан, N-(фуран-3-ілкарбоніл)-3,7-діазабіцикло[3.3.0]октан, N-(оксазол-2-ілкарбоніл)-3,7-діазабіцикло[3.3.0]октан, N-(оксазол-4-ілкарбоніл)-3,7-діазабіцикло[3.3.0]октан, N-(оксазол-5-ілкарбоніл)-3,7-діазабіцикло[3.3.0]октан, N-(ізоксазол-3-ілкарбоніл)-3,7-діазабіцикло[3.3.0]октан, N-(ізоксазол-4-ілкарбоніл)-3,7-діазабіцикло[3.3.0]октан, N-(ізоксазол-5-ілкарбоніл)-3,7-діазабіцикло[3.3.0]октан, N-(3-бромізоксазол-5-ілкарбоніл)-3,7-діазабіцикло[3.3.0]октан, N-(3-метоксиізоксазол-5-ілкарбоніл)-3,7-діазабіцикло[3.3.0]октан, N-(1,2,4-оксадіазол-3-ілкарбоніл)-3,7-діазабіцикло[3.3.0]октан, N-(1,2,4-оксадіазол-5-ілкарбоніл)-3,7-діазабіцикло[3.3.0]октан, N-(1,3,4-оксадіазол-2-ілкарбоніл)-3,7-діазабіцикло[3.3.0]октан, N-(тіазол-2-ілкарбоніл)-3,7-діазабіцикло[3.3.0]октан, N-(тіазол-4-ілкарбоніл)-3,7-діазабіцикло[3.3.0]октан, N-(тіазол-5-ілкарбоніл)-3,7-діазабіцикло[3.3.0]октан, N-(ізотіазол-3-ілкарбоніл)-3,7-діазабіцикло[3.3.0]октан, N-(ізотіазол-4-ілкарбоніл)-3,7-діазабіцикло[3.3.0]октан, N-(ізотіазол-5-ілкарбоніл)-3,7-діазабіцикло[3.3.0]октан, N-(1,2,4-тіадіазол-3-ілкарбоніл)-3,7-діазабіцикло[3.3.0]октан, N-(1,2,4-тіадіазол-5-ілкарбоніл)-3,7-діазабіцикло[3.3.0]октан, N-(1,3,4-тіадіазол-2-ілкарбоніл)-3,7-діазабіцикло[3.3.0]октан, N-(піридин-4-ілкарбоніл)-3,7-діазабіцикло[3.3.0]октан, а також їх фармацевтично прийнятні солі. Приклади сполук за даним винаходом також включають наступні сполуки: N-(фуран-2-ілкарбоніл)-3,7-діазабіцикло[3.3.1]нонан, N-(3-метилфуран-2-ілкарбоніл)-3,7-діазабіцикло[3.3.1]нонан, N-(5-метилфуран-2-ілкарбоніл)-3,7-діазабіцикло[3.3.1]нонан, N-(3-хлорфуран-2-ілкарбоніл)-3,7-діазабіцикло[3.3.1]нонан, N-(5-хлорфуран-2-ілкарбоніл)-3,7-діазабіцикло[3.3.1]нонан, N-(3-бромфуран-2-ілкарбоніл)-3,7-діазабіцикло[3.3.1]нонан, N-(5-бромфуран-2-ілкарбоніл)-3,7-діазабіцикло[3.3.1]нонан, N-(4-фенілфуран-2-ілкарбоніл)-3,7-діазабіцикло[3.3.1]нонан, N-(5-(2-піридиніл)фуран-2-ілкарбоніл)-3,7-діазабіцикло[3.3.1]нонан, N-(5-(фенілетиніл)фуран-2-ілкарбоніл)-3,7-діазабіцикло[3.3.1]нонан, N-(фуран-3-ілкарбоніл)-3,7-діазабіцикло[3.3.1]нонан, N-(оксазол-2-ілкарбоніл)-3,7-діазабіцикло[3.3.1]нонан, N-(оксазол-4-ілкарбоніл)-3,7-діазабіцикло[3.3.1]нонан, N-(оксазол-5-ілкарбоніл)-3,7-діазабіцикло[3.3.1]нонан, N-(ізоксазол-3-ілкарбоніл)-3,7-діазабіцикло[3.3.1]нонан, N-(ізоксазол-4-ілкарбоніл)-3,7-діазабіцикло[3.3.1]нонан, N-(ізоксазол-5-ілкарбоніл)-3,7-діазабіцикло[3.3.1]нонан, N-(3-бромізоксазол-5-ілкарбоніл)-3,7-діазабіцикло[3.3.1]нонан, N-(3-метоксиізоксазол-5-ілкарбоніл)-3,7-діазабіцикло[3.3.1]нонан, N-(1,2,4-оксадіазол-3-ілкарбоніл)-3,7-діазабіцикло[3.3.1]нонан, N-(1,2,4-оксадіазол-5-ілкарбоніл)-3,7-діазабіцикло[3.3.1]нонан, N-(1,3,4-оксадіазол-2-ілкарбоніл)-3,7-діазабіцикло[3.3.1]нонан, N-(тіазол-2-ілкарбоніл)-3,7-діазабіцикло[3.3.1]нонан, N-(тіазол-4-ілкарбоніл)-3,7-діазабіцикло[3.3.1]нонан, N-(тіазол-5-ілкарбоніл)-3,7-діазабіцикло[3.3.1]нонан, N-(ізотіазол-3-ілкарбоніл)-3,7-діазабіцикло[3.3.1]нонан, N-(ізотіазол-4-ілкарбоніл)-3,7-діазабіцикло[3.3.1]нонан, N-(ізотіазол-5-ілкарбоніл)-3,7-діазабіцикло[3.3.1]нонан, N-(1,2,4-тіадіазол-3-ілкарбоніл)-3,7-діазабіцикло[3.3.1]нонан, 5 UA 98944 C2 5 10 15 20 25 30 35 40 45 50 55 60 N-(1,2,4-тіадіазол-5-ілкарбоніл)-3,7-діазабіцикло[3.3.1]нонан, N-(1,3,4-тіадіазол-2-ілкарбоніл)-3,7-діазабіцикло[3.3.1]нонан, N-(піридин-4-ілкарбоніл)-3,7-діазабіцикло[3.3.1]нонан, а також їх фармацевтично прийнятні солі. Один з варіантів здійснення стосується такої сполуки, як N-(5-хлорфуран-2-ілкарбоніл)-3,7діазабіцикло[3.3.0]октан або її фармацевтично прийнятних солей. Інший варіант здійснення стосується такої сполуки, як N-(5-хлорфуран-2-ілкарбоніл)-3,7-діазабіцикло[3.3.1]нонан або її фармацевтично прийнятних солей. Одержання сполук Сполуки за даним винаходом можуть бути одержані шляхом поєднання моно-захищеного діазабіциклу (тобто діазабіциклу, в якому одна з двох функціональних аміногруп приведена в нереакційноздатний стан шляхом перетворення на придатне похідне) із придатним чином функціоналізованим хлорангідридом гетероарилвмісної кислоти, групи або іншим реакційноздатним похідним такої карбонової кислоти. Існує велика кількість способів одержання моно-захищених діазабіциклів, застосовуваних для одержання сполук за даним винаходом. Способи синтезу придатним чином захищеного 3,7діазабіцикло[3.3.0]октану описані в PCT WO 02/070523 Colon-Cruz і співавторами, а також у патентній заявці США 2006/0019985 Zhenkun і співавторами, в яких N-бензилмалеїнімід конденсують або з параформальдегідом і N-бензилгліцином, або з N-(метоксиметил)-N(триметилсилілметил)бензиламіном, з одержанням 3,7-дибензил-3,7-діазабіцикло[3.3.0]октан2,4-діону (відомого також як 2,5-дибензилтетрагідропіроло[3,4-c]пірол-1,3-діон). Наступне перетворення одержаного проміжного продукту може проходити декількома шляхами. В одному випадку обробка α-хлоретилхлорформіатом призводить до одержання 3-бензил-3,7діазабіцикло[3.3.0]октан-2,4-діону (відомого також як 2-бензилтетрагідропіроло[3,4-c]пірол-1,3діон), що потім послідовно відновлюють (використовуючи комплекс боран-диметилсульфід), перетворюють у N-(трет-бутоксикарбонільне) похідне і гідрують (для видалення другої бензильної групи). Це призводить до одержання N-(трет-бутоксикарбоніл)-3,7діазабіцикло[3.3.0]октану, який можна застосовувати для поєднання з карбоновими кислотами і їх похідними, для одержання сполук за даним винаходом. Альтернативно, 3,7-дибензил-3,7діазабіцикло[3.3.0]октан-2,4-діон може бути відновлений (літійалюмінійгідридом), частково гідрований (для видалення однієї бензильної групи), перетворений у N-(третбутоксикарбонільне) похідне і гідрований (для видалення другої бензильної групи), з одержанням N-(трет-бутоксикарбоніл)-3,7-діазабіцикло[3.3.0]октану. Інші способи введення і видалення бензильної, трет-бутоксикарбонільної і інших груп для захисту аміногрупи добре відомі фахівцям у даній галузі і докладно описані в T.W.Greene and P.G. M.Wuts, Protective rd Groups in Organic Synthesis, 3 Edition, John Wiley & Sons, New York (1999). Альтернативний спосіб одержання N-(трет-бутоксикарбоніл)-3,7-діазабіцикло[3.3.0]октану був описаний у заявках на патент США 2004/0186107 Schrimpf і співавторами, і 2005/0101602 Basha і співавторами, і включає конденсацію малеїніміду і N-(метоксиметил)-N(триметилсилілметил)бензиламіну, з одержанням 7-бензил-3,7-діазабіцикло[3.3.0]октан-2,4діону (також відомого як 5-бензилтетрагідропіроло[3,4-c]пірол-1,3-діон). Наступна обробка відновним реагентом (наприклад, літійалюмінійгідридом) призводить до одержання 3-бензил3,7-діазабіцикло[3.3.0]октану, вільна аміногрупа якого може бути захищена третбутоксикарбонільною групою, з наступним видаленням бензильної захисної групи гідрогенолізом. Як альтернатива малеїнімідам, в описаних реакціях конденсації можуть бути використані ефіри малеїнової кислоти. Так, наприклад, згідно з PCT WO 96/007656, на ім'я Schaus і співавторів, конденсація N-бензилгліцину з параформальдегідом і диметилмалеатом призводить до одержання диметилового ефіру N-бензил-цис-3,4-піролідиндикарбонової кислоти. Одержана сполука може бути відновлена, наприклад, літійалюмінійгідридом, з одержанням діолу, що може бути потім підданий взаємодії з метансульфонілхлоридом у присутності триетиламіну, з одержанням відповідного димезилату. Подальша обробка аміаком і нагрівання призводить до одержання N-бензил захищеного 3,7-діазабіцикло[3.3.0]октану. Як вказано вище, одержане сполука може бути перетворена на N-(трет-бутоксикарбоніл)-3,7діазабіцикло[3.3.0]октан. Дляодержання сполук за даним винаходом можуть бути використані придатні похідні 3,7діазабіцикло[3.3.1]нонану (біспідину). Одним з таких похідних є N-(трет-бутоксикарбоніл)-3,7діазабіцикло[3.3.1]нонан, який можна одержати цілим рядом способів. Один із синтезів здійснюється через одержання проміжного N-бензил-N’-(трет-бутоксикарбоніл)-3,7діазабіцикло[3.3.1]нонану, описаного Stead і співавторами в Org.Lett. 7: 4459 (2005). Так, реакція 6 UA 98944 C2 5 10 15 20 25 30 35 40 45 50 55 60 Манніха між N-(трет-бутоксикарбоніл)піперидин-4-оном, бензиламіном і параформальдегідом призводить до одержання N-бензил-N’-(трет-бутоксикарбоніл)-3,7-діазабіцикло[3.3.1]нонан-9ону, що потім можна послідовно обробити п-толуолсульфонгідразином і боргідридом натрію (для видалення карбонільного кисню), з одержанням N-бензил-N’-(трет-бутоксикарбоніл)-3,7діазабіцикло[3.3.1]нонану. Бензильну групу можна видалити, як описано вище, з одержанням N(трет-бутоксикарбоніл)-3,7-діазабіцикло[3.3.1]нонану. Альтернативний спосіб синтезу діазабіцикло[3.3.1]нонанів, що підходять для перетворення або в N-(трет-бутоксикарбоніл)-3,7діазабіцикло[3.3.1]нонан, або інші монозаміщені похідні, був описаний Jeyaraman і Avila у Chem.Rev. 81(2):149-174(1981) і в патенті США 5468858, на ім'я Berlin і співавторів. Одним зі способів одержання амідів за даним винаходом є поєднання N-(третбутоксикарбоніл)-3,7-діазабіцикло[3.3.0]октану або N-(трет-бутоксикарбоніл)-3,7діазабіцикло[3.3.1]нонану з придатним чином функціоналізованими карбоновими кислотами, з наступним видаленням трет-бутоксикарбонільної захисної групи. Багато з таких карбонових кислот комерційно доступні, і інші можуть бути легко одержані за методиками, відомим фахівцям у даній галузі. Конденсація аміну і карбонової кислоти з утворенням аміду, як правило, вимагає використання придатного активуючого реагенту, такого як, наприклад, N, N'дициклогексілкарбодіімід (DCC), гексафторфосфат (бензотриазол-1ілокси)трис(диметиламіно)фосфонію (BOP), гексафторфосфат (бензотриазол-1ілокси)трипіролідинофосфонію (PyBOP), гексафторфосфат O-(бензотриазол-1-іл)-N, N,N',N'біс(тетраметилен)уронію (HBPy), гексафторфосфат O-(бензотриазол-1-іл)-N, N,N',N'тетраметилуронію (HBTU), тетрафторборат O-(бензотриазол-1-іл)-N, N,N',N'-тетраметилуронію (TBTU) або (1-етил-3-(3-диметиламінопропіл)карбодіімід) (EDCI), з 1-гідроксибензотриазолом (HOBt). Інші активуючі реагенти добре відомі фахівцю в даній галузі (див., наприклад, Kiso and Yajima, Peptides, pp 39-91, Academic Press, San Diego, CA (1995)). Альтернативно, амідний зв'язок може бути утворений поєданням монозаміщеного діазабіциклу з придатним чином функціоналізованим хлорангідридом кислоти, що може бути комерційно доступним або може бути одержаний із придатним чином функціоналізованої карбонової кислоти. Хлорангідрид кислоти може бути одержаний обробкою придатної карбонової кислоти, у числі інших реагентів, тіонілхлоридом або оксалілхлоридом. Після утворення аміду, видалення захисної групи (наприклад, трет-бутоксикарбонільної групи) кислотою, водною або безводною, дозволяє одержати сполуки за даним винаходом. Фахівцю в галузі органічного синтезу буде зрозуміло, що існує велика кількість способів одержання сполуки за даним винаходом, що мічені радіоактивними ізотопами і підходять для різних діагностичних застосувань. Так, наприклад, конденсація гетероароматичної карбонової 11 18 кислоти, міченої C або F, з N-(трет-бутоксикарбоніл)-3,7-діазабіцикло[3.3.0]октаном або N(трет-бутоксикарбоніл)-3,7-діазабіцикло[3.3.1]нонаном із застосуванням описаних вище способів, з наступним видаленням трет-бутоксикарбонільної групи, призведе до одержання сполуки, що підходить для застосування в позитронно-емісійній томографії. Способи лікування Сполуки за даним винаходом є модуляторами NNR підтипу α4β2, що характерні для ЦНС, і можуть застосовуватися для профілактики і/або лікування різних станів або розладів, включаючи розлади ЦНС, у суб'єктів, що мають такі стани або розлади або сприйнятливі до них, шляхом модулювання α4β2 NNR. Вказані сполуки мають здатність селективно зв'язуватися з NNR підтипу α4β2 і виявляти нікотинову фармакологію (тобто діяти як агоністи, часткові агоністи, антагоністи і т.п.). Наприклад, сполуки за даним винаходом при введенні в ефективних кількостях пацієнтам, що потребують цього, деякою мірою забезпечують профілактику прогресування розладів ЦНС (тобто забезпечують захисні ефекти), полегшення симптомів розладів ЦНС і/або зменшення імовірності повторного настання розладу ЦНС. Сполуки за даним винаходом можуть застосовуватися для лікування і/або профілактики таких типів станів і розладів, для яких як терапевтичні засоби пропонувалися нікотинові сполуки інших типів. Див., наприклад, посилання, наведені вище в розділі опису передумов створення винаходу, а також Williams et al, Drug News Perspec. 7(4): 205 (1994), Arneric et al., CNS Drug Rev. 1(1): 1-26 (1995), Arneric et al., Exp. Opin. Invest. Drugs 5(1): 79-100 (1996), Bencherif et al., J. Pharmacol. Exp. Ther. 279: 1413 (1996), Lippiello et al., J. Pharmacol. Exp. Ther. 279: 1422 (1996), Damaj et al., J. Pharmacol. Exp. Ther. 291: 390 (1999); Chiari et al., Anesthesiology 91: 1447 (1999), Lavand'homme and Eisenbach, Anesthesiology 91: 1455 (1999), Holladay et al., J. Med. Chem. 40(28): 4169-94 (1997), Bannon et al., Science 279: 77 (1998) і патенти США №№ 5583140, на ім'я Bencherif і співавторів, 5597919, на ім'я Dull і співавторів, 5604231, на ім'я Smith і співавторів, і 5852041, на ім'я Cosfort і співавторів, зміст яких включений в даний опис за допомогою посилання у всій їхній повноті. 7 UA 98944 C2 5 10 15 20 25 30 35 40 45 50 55 60 Сполуки за даним винаходом і їх фармацевтичні композиції корисні при лікуванні і/або профілактиці ряду розладів ЦНС, включаючи нейродегеративні розлади, нейропсихіатричні розлади, неврологічні розлади і залежності. Дані сполуки і їх фармацевтичні композиції можуть знайти застосування для лікування і/або профілактики когнітивних розладів (вікових або інших), розладів функції уваги і деменцій (включаючи розлади, викликані інфекційними агентами або метаболічними порушеннями); для забезпечення нейрозахисту; для лікування конвульсій і множинних церебральних інфарктів; для лікування розладів настрою, нав'язливих бажань і схильності до пагубних звичок; для забезпечення аналгезії; для регулювання запалення (наприклад, опосередкованого цитокінами і ядерним фактором каппа B) і лікування запальних розладів; для досягнення полегшення болю; а також для лікування інфекцій (як протиінфекційні засоби для лікування бактеріальних, грибкових і вірусних інфекцій). У число розладів, захворювань і станів, для лікування і/або профілактики яких можуть застосовуватися сполуки і фармацевтичні композиції за даним винаходом, входять: вікове погіршення пам'яті, легкі когнітивні порушення, передстареча деменція (ранній початок хвороби Альцгеймера), стареча деменція (деменція типу Альцгеймера), деменція з тільцями Леві, ВІЛ-деменція, судинна деменція, хвороба Альцгеймера, удар, комплекс СНІД-деменція, синдром дефіциту уваги, гіперактивний розлад з дефіцитом уваги, дислексія, шизофренія, шизофреніформний розлад, шизоафективний розлад, паркінсонізм, включаючи хворобу Паркінсона, хвороба Піка, хорея Хантінгтона, пізня дискінезія, гіперкінезія, прогресуючий супрануклеарний параліч, хвороба Крейтцфельдта-Якоба, розсіяний склероз, бічний аміотрофічний склероз, епілепсія, манія, тривога, депресія, панічні розлади, біполярні розлади, генералізований тривожний розлад, обсесивно-компульсивний розлад, напади люті, синдром Туретта, аутизм, пристрасть до наркотиків і алкоголю, потяг до тютюну, ожиріння, кахексія, псоріаз, вовчак, гострий холангіт, афтозний стоматит, астма, виразковий коліт, запальні захворювання кишечнику, паучіт, вірусний пневмоніт і артрит (наприклад, ревматоїдний артрит і остеоартрит), ендотоксикоз, сепсис, атеросклероз, ідіопатичний легеневий фіброз і неоплазії. Перевага лікування або профілактики захворювань, розладів і станів сполуками за даним винаходом полягає в тому, що воно проходить без помітних несприятливих побічних ефектів (наприклад, значного збільшення кров'яного тиску, частоти серцебиттів, значного негативного впливу на шлунково-кишковий тракт і значний вплив на скелетні м'язи). Сполуки за даним винаходом, при застосуванні в ефективних кількостях, можуть модулювати активність NNR підтипу α4β2 без помітної взаємодії з підтипами нікотинових рецепторів, що характерні для ганглій людини (що демонструється їх незначною здатністю викликати нікотинову функцію в хромафінній тканині надниркової залози) або скелетної мускулатури (що демонструється їх незначною здатністю викликати нікотинову функцію в клітинних препаратах, що експресують нікотинові рецептори м'язового типу). Так, наприклад, дані сполуки здатні лікувати і/або запобігати захворювання, розлади і стани, не викликаючи при цьому значних побічних ефектів, пов'язаних з активністю гангліозної і нейром'язової локалізації. Таким чином, введення сполук за даним винаходом забезпечує терапевтичне вікно, в якому досягається лікування певних захворювань, розладів і станів, і вдається уникнути деяких побічних ефектів. Тобто ефективна доза такої сполуки достатня для одержання бажаного впливу на захворювання, розлад або стан, але недостатня (тобто не досягається досить високий рівень) для появи небажаних побічних ефектів. Таким чином, даний винахід стосується застосування сполуки формули (I) або її терапевтично прийнятної солі в терапії (наприклад, у лікуванні описаних вище захворювань). У ще одному аспекті даний винахід стосується застосування сполуки формули (I) або її фармацевтично прийнятної солі у виробництві лікарських засобів, призначених для застосування при лікуванні розладів ЦНС (наприклад, описаних вище розладів, захворювань або станів). У ще одному аспекті винахід стосується застосування сполуки формули (I) або її фармацевтично прийнятної солі у виробництві лікарських засобів, призначених для застосування при лікуванні деменції типу Альцгеймера в ступені від легкої до помірної, синдрому дефіциту уваги, легких когнітивних порушень і вікового погіршення пам'яті. Діагностичні застосування Сполуки за даним винаходом можуть бути використані в діагностичних композиціях, наприклад зондах, особливо якщо вони модифіковані таким чином, що в них включені придатні мітки. Вказані мітки можуть використовуватися, наприклад, для визначення відносної кількості і/або функції конкретних рецепторів, особливо рецепторів підтипу α4β2. З цією метою сполуки 11 за даним винаходом найбільш переважно мітять атомами радіоактивних ізотопів, таких як C, 18 76 123 125 F, Br, I або I. 8 UA 98944 C2 5 10 15 20 25 30 35 40 45 50 55 60 Сполуки, що вводяться, можуть бути визначені з застосуванням звичайних способів детектування, що підходять для використовуваної мітки. Приклади способів детектування включають позиційну емісійну томографію (PET) і однофотонну емісійну комп'ютерну томографію (SPECT). Описані вище радіоактивні мітки корисні при одержанні зображень у PET 11 18 76 123 (наприклад, C, F або Br) і SPECT (наприклад, I), при періоді напіврозпаду приблизно 20,4 11 18 123 хвилин для C, приблизно 109 хвилин для F, приблизно 13 годин для I і приблизно 16 годин 76 для Br. Для візуалізації вибраних підтипів рецепторів при не несичувальних концентраціях бажана висока питома активність. Дозування, що вводяться, як правило, знаходяться нижче діапазону токсичності і забезпечують висококонтрастні зображення. Очікується, що сполуки можна буде вводити в нетоксичних кількостях. Визначення дозування виконують способом, відомим фахівцю в галузі одержання зображень, з використанням радіоактивних міток. Див., наприклад, патент США № 5969144, на ім'я London і співавторів. Сполуки за даним винаходом можна вводити з застосуванням відомих методик. Див., наприклад, патент США № 5969144, на ім'я London і співавторів. Дані сполуки можна вводити в складі композицій, що містять інші інгредієнти, наприклад, інгредієнти таких типів, що застосовні при одержанні діагностичних композицій. Сполуки, корисні відповідно до здійснення даного винаходу, найбільш переважно використовують у формах, що мають високу чистоту. Див. патент США № 5853696, на ім'я Elmalch і співавторів. Після того, як сполука введена суб'єкту (наприклад, людині), наявність вказаної сполуки в організмі суб'єкта може бути відображена і кількісно визначена за допомогою придатних методик, для індикації наявності, кількості і функціональності вибраних підтипів NNR. Крім людей, дані сполуки також можна вводити тваринам, наприклад мишам, щурам, собакам і мавпам. Способи SPECT і PET можуть бути реалізовані з використанням будь-яких придатних методик і апаратури. Див. Villemagne et al., In: Arneric et al. (Eds.) Neuronal Nicotinic Receptors: Pharmacology and Therapeutic Opportunities, 235-250 (1998) і патент США № 5853696, на ім'я Elmalch і співавторів, для ознайомлення з типовими методиками формування зображення. Радіоактивно мічені сполуки з високою афінністю зв'язування у відношенні визначених підтипів NNR (наприклад, α4β2) і переважно демонструють незначне неспецифічне зв'язування з іншими підтипами нікотинових холінергічних рецепторів (наприклад, рецепторами таких підтипів, що пов'язані з м'язами і гангліями). Сполуки за даним винаходом як такі можуть застосовуватися як засіб для неінвазивного формування відображення розподілу деяких підтипів нікотинових холінергічних рецепторів в організмі суб'єкта, зокрема, у мозку, для діагностики різних захворювань і розладів ЦНС. В одному з аспектів діагностичні композиції за даним винаходом можуть застосовуватися в способі діагностики захворювання у суб'єкта, наприклад, у людини. Даний спосіб включає введення пацієнту сполуки, міченої міткою, що виявляється, як описано в даному описі, і детектування зв'язування даної сполуки з вибраними підтипами NNR (наприклад, рецепторами підтипу α4β2). Фахівці в галузі застосування способів діагностики, наприклад, PET і SPECT, можуть застосовувати описані в даному описі радіоактивно мічені сполуки для діагностики широкого спектра станів і розладів, включаючи стани і розлади, пов'язані з дисфункцією центральної і автономної нервових систем. Такі розлади включають широкий спектр захворювань і розладів ЦНС, включаючи хворобу Альцгеймера, хвороба Паркінсона і шизофренію. Ці й інші конкретні захворювання і розлади, які можна досліджувати наведеним способом, включають захворювання і розлади, наведені в патенті США № 5952339, на ім'я Bencherif і співавторів. В іншому аспекті описані діагностичні композиції можуть застосовуватися в способі, призначеному для спостереження за визначеними підтипами нікотинових рецепторів в організмі суб'єкта, наприклад, людини. Даний спосіб включає введення пацієнту описаних у даному описі сполук, мічених міткою, що виявляється, і детектування зв'язування даних сполук у відношенні нікотинових рецепторів вибраного підтипу (наприклад, рецепторів підтипу α4β2). Фармацевтичні композиції Відповідно до одного з варіантів здійснення даного винаходу, надана фармацевтична композиція, що містить як активний інгредієнт терапевтично ефективну кількість сполуки за даним винаходом в комбінації з одним або декількома фармацевтично прийнятними розріджувачами, ексципієнтами і/або інертними носіями. Спосіб, яким вводяться сполуки за даним винаходом, може змінюватися. Вказані композиції переважно вводять перорально (наприклад, у вигляді рідкої формі, що містить розчинник, наприклад, водну або неводну рідину, або у твердому носії). Переважні композиції для перорального введення включають пігулки, таблетки, капсули, каплети, сиропи і розчини, включаючи тверді желатинові капсули і капсули з вивільненням за часом. Композиції можуть 9 UA 98944 C2 5 10 15 20 25 30 35 40 45 50 55 60 бути одержані у вигляді дозованих форм, що включають одну дозу або містять активний інгредієнт у кількості більше або менше однієї дози. Переважно композиції одержують у рідкій або напівтвердій формі. Можуть застосовуватися композиції, що містять рідкий фармацевтично інертний носій, такий як вода або інші фармацевтично сумісні рідини або напівтверді речовини. Застосування таких рідин і напівтвердих речовин добре відомо фахівцям у даній галузі. Сполуки за даним винаходом можна також вводити за допомогою ін'єкції, наприклад, внутрішньовенно, внутрішньом'язово, підшкірно, інтраперитонеально, внутрішньоартеріально, інтратекально і інтрацеребровентрикулярно. Внутрішньовенне введення є переважним способом ін'єкції. Придатні носії для ін'єкції добре відомі фахівцю в даній галузі і включають 5 % розчини декстрози, фізіологічний сольовий розчин і забуферений фосфатом сольовий розчин. Сполуки можуть вводитися також за допомогою інфузії або ін'єкції (наприклад, у вигляді суспензії або емульсії у фармацевтично прийнятній рідини або суміші рідин). Композиції за даним винаходом можна вводити також із застосуванням інших способів, наприклад, ректального введення. Композиції, застосовні для ректального введення, наприклад, супозиторії, добре відомі фахівцям у даній галузі. Сполуки за даним винаходом можна вводити також шляхом інгаляції (наприклад, у формі аерозолю, або назально, або з застосуванням засобів доставки, описаних у патенті США № 4922901, на ім'я Brooks і співавторів, зміст якого включене в даний опис у всій своїй повноті); місцево (наприклад, у формі лосьйону); трансдермально (наприклад, із застосуванням трансдермального пластиру, використовуючи технічні рішення, пропоновані Novartis і Alza Corporation, або ін'єкцією порошку); або за допомогою букальної, сублінгвальної або інтраназальної абсорбції. Хоча є можливість вводити описувані сполуки у формі чистої активної сполуки, переважно використовувати кожну сполуку у формі фармацевтичної композиції або сполуки для успішного й ефективного введення. Приклади способів введення сполук за даним винаходом повинні бути очевидні фахівцю в даній галузі. Застосовність композицій може залежати від конкретної застосовуваної композиції і конкретного суб'єкта, що одержує лікування. Наприклад, композиції можуть вводитися у формі таблеток, твердих желатинових капсул або у формі капсул з відстроченим за часом вивільненням. Такі композиції можуть містити рідкий носій, що може бути масляним, водним, емульсійним або містити певні розчинники, що підходять для даного способу введення. Введення фармацевтичних композицій, описаних у даному описі, може бути періодичним або вироблятися в поступово змінному, безперервному, постійному або регульованому режимі теплокровною твариною (наприклад, ссавцем, таким як миші, щури, кішки, кролики, собаки, свині, корови або мавпи); але головним чином їх переважно вводять людям. Крім того, можна змінювати час дня, в який здійснюється введення композиції, і кількість введень протягом дня. Придатним дозуванням сполук за даним винаходом є їх кількість, що ефективна для попередження появи симптомів розладу або для лікування деяких симптомів розладу, яким страждає пацієнт. Під "ефективною кількістю", "терапевтичною кількістю" або "ефективною дозою" розуміється кількість, достатня для того, щоб викликати бажані фармакологічні або терапевтичні ефекти, тим самим, що призводять до ефективного попередження або лікування розладу. Таким чином, при лікуванні розладів ЦНС ефективна кількість сполуки являє собою кількість, достатню для проходження через бар'єр кров-мозок суб'єкта, зв'язування із сайтами придатних рецепторів у мозку суб'єкта і модулювання активності нікотинових рецепторів відповідних підтипів (наприклад, модулювання секреції нейротрансмітерів, що призведе до ефективної профілактики або лікування розладу). Профілактика розладу виявляється у відстрочці настання симптомів розладу. Лікування розладу виявляється в зменшенні симптомів, пов'язаних з розладом, або полегшенні повторно наступаючих симптомів розладу. Ефективне дозування може змінюватися залежно від таких факторів, як стан пацієнта, тяжкість симптомів розладу, а також способу введення фармацевтичної композиції. Для пацієнтів з кількості людей ефективна доза конкретних сполук, як правило, відповідає введенню сполуки в кількості, достатній для модулювання рецепторів, що належать до хвороби, з метою впливу на вивільнення нейротрансмітерів (наприклад, дофаміну), але ця кількість повинна бути недостатньою для того, щоб вплинути на скелетні м'язи і ганглії в будь-якому помітному ступені. Ефективні дози сполук будуть, зрозуміло, розрізнятися для різних пацієнтів, але в цілому, вони включають кількості, з яких починається вплив на ЦНС або з'являються інші бажані терапевтичні ефекти, але нижче тієї кількості, при якій спостерігається вплив на м'язи і ганглії. Як правило, для введення ефективної дози сполук, необхідно вводити їх у кількості менше 5 мг/кг маси тіла пацієнта. Часто сполуки можна вводити в кількості від менше приблизно 1 мг/кг маси тіла пацієнта до менше приблизно 100 мкг/кг маси тіла пацієнта й іноді приблизно від 10 мкг/кг до менше 100 мкг/кг маси тіла пацієнта. Вказані вище ефективні дозування, як правило, 10 UA 98944 C2 5 10 15 20 25 30 35 40 45 50 55 60 належать до кількості активного засобу, що вводиться у вигляді однієї дози або у вигляді однієї або декількох доз протягом 24-годинного періоду. Для людей досягнення ефективної дози сполук за даним винаходом може потребувати введення сполуки в кількості не менше ніж приблизно 1, але не більше ніж приблизно 1000, і часто не більше ніж приблизно 500 мг/24 год./пацієнт. Композиції, корисні як діагностичні, можуть застосовуватися, як вказано в патентах США №№ 5853696, на ім'я Elmalch і співавторів і 5969144, на ім'я London і співавторів, зміст яких включене в даний опис за допомогою посилання. Сполуки за даним винаходом також можна вводити в складі композицій, що містять інші інгредієнти, наприклад, інгредієнти таких типів, що використовуються при створенні діагностичних композицій. Приклади, що ідуть далі, призначені для ілюстрації даного винаходу, і їх не слід тлумачити як обмеження обсягу винаходу. У даних прикладах всі частини і процентні частки наведені за масою, якщо не вказано інше. Біологічні дослідження Приклад 1: Зв'язування радіоактивних лігандів рецепторами nACh ЦНС підтипу α4β2 nACh Одержання мембран з кори головного мозку щурів: Щурів (самок щурів Sprague-Dawley), масою 150-250 г, поміщували в умовах 12 год. циклу світло/темрява при вільному доступі до води і їжі, виробництва PMI Nutrition International, Inc. Тваринам проводили анестезію 70 % CO2 і потім обезглавлювали. Мозок тварин видаляли і поміщували на охолоджену льодом площадку. Кору мозку видаляли і поміщували в 20 об'ємів (маса:об'єм) льодяного препаративного буфера (137 мМ NaCl, 10,7 мМ KCl, 5,8 мМ KH 2PO4, 8 мМ Na2HPO4, 20 мМ HEPES (вільна кислота), 5 мМ йодацетамід, 1,6 мМ EDTA, pН 7,4); додавали PMSF, розчинений у метанолі до кінцевої концентрації 100 мкМ, і одержану суспензію гомогенізували з використанням приладу Polytron. Гомогенат центрифугували при 18000×g протягом 20 хвилин при 4 °C і одержаний осад ресуспендували в 20 об'ємах льодяної води. Через 60 хвилин інкубували на льоді, знову відокремлювали осад центрифугуванням при 18000×g протягом 20 хвилин при 4 °C. Одержаний кінцевий осад ресуспендували в 10 об'ємах буфера і зберігали при -20 °C. Одержання мембран з SH-EP1/людських клональних клітин α4β2: Клітинний осад з 40150 мм культуральних чашок поєднували і гомогенізували з використанням приладу Polytron (Kinematica Gmb, Switzerland) у 20 мілілітрах льодяного препаративного буфера. Гомогенат центрифугували при 48000 g протягом 20 хвилин при 4 °C. Одержаний осад ресуспендували в 20 мл льодяного препаративного буфера і зберігали при 20 °C. У день проведення дослідження заморожені мембрани відтавали і центрифугували при 48000×g протягом 20 хвилин. Супернатант відокремлювали декантацією і відкидали. Осад ресуспендували в забуференому фосфатному сольовому розчині Dulbecco (PBS, Life Technologies) pН 7,4 і гомогенізували з використанням приладу Polytron протягом 6 секунд. Концентрацію білка визначали з використанням комплекту для аналізу білка Pierce BCA, з бичачим сироватковим альбуміном як стандартом (Pierce Chemical Company, Rockford, IL). Препарати мембран (приблизно 50 мкг для клітин людини і 200-300 мкг білка у випадку щурячого α4β2) інкубували в PBS (50 мкл і 100 мкл. відповідно) у присутності конкуруючої 3 сполуки (від 0,01 нМ до 100 мкМ) і 5 нМ [ H]нікотину протягом 2-3 годин на льоді. Інкубування переривали швидким фільтруванням на колекторі для одночасної обробки декількох зразків (Brandel, Gaithersburg, MD), використовуючи фільтри GF/B, попередньо просочені 0,33 % поліетиленіміном (маса/об'єм) для зменшення неспецифічного зв'язування. Тканина 3 рази промивали PBS, pН 7,4. До фільтрів, що містили промиту тканину, додавали сцинтиляційну рідину і давали досягти рівноваги. Потім фільтри підраховували для визначення зв'язаної мембранами радіоактивності, використовуючи методики підрахунку сцинтиляції рідин (2200CA Tri-Carb LSC, Packard Instruments, 50 % ефективність, або Wallac Trilux 1450 MicroBeta, 40 % ефективність, Perkin Elmer). Дані виражали в розпадах на хвилину (DPM). У кожному аналізі визначення даних для кожної точки повторювали 2-3 рази. Результати за кожною точкою усереднювали і наносили на графік залежності логарифма концентрації лікарського засобу. Значення IC 50, що являє собою концентрацію сполуки, що забезпечує 50 % інгібування зв'язування, визначали методом нелінійної регресії найменших квадратів. Значення Ki розраховували з застосуванням рівняння Cheng-Prusoff (1973): Ki=IC50/(1+N/Kd), 3 де N означає концентрацію [ H]нікотину, і Kd означає афінність у відношенні нікотину (3 нМ, визначено в окремому експерименті). 11 UA 98944 C2 5 10 15 20 25 30 35 40 45 50 55 60 Підтип α7 nACh Щурів (самок щурів Sprague-Dawley), масою 150-250 г, поміщували в умовах 12 год. циклу світло/темрява при вільному доступі до води і їжі, виробництва PMI Nutrition International, Inc. Тваринам проводили анестезію 70 % CO2 і потім обезглавлювали. Мозок тварин видаляли і поміщували на охолоджену льодом площадку. Гіпокамп видаляли і поміщували в 10 об'ємів (маса:об'єм) льодяного препаративного буфера (137 мМ NaCl, 10,7 мМ KCl, 5,8 мМ KH2PO4, 8 мМ Na2HPO4, 20 мМ HEPES (вільна кислота), 5 мМ йодацетамід, 1,6 мМ EDTA, pН 7,4); додавали PMSF, розчинений у метанолі до кінцевої концентрації 100 мкМ, і одержану суспензію гомогенізували з використанням приладу Polytron. Гомогенат центрифугували при 18000×g протягом 20 хвилин при 4 °C і одержаний осад ресуспендували в 20 об'ємах льодяної води. Після 60-хв інкубували на льоді, знову відокремлювали осад центрифугуванням при 18000×g протягом 20 хвилин при 4 °C. Одержаний кінцевий осад ресуспендували в 10 об'ємах буфера і зберігали при -20 °C. У день дослідження тканини відтавали, центрифугували при 18000×g протягом 20 хвилин і потім ресуспендували в льодяному PBS (забуферений фосфатному сольовий розчин Dulbecco, 138 мМ NaCl, 2,67 мМ KCl, 1,47 мМ KH2PO4, 8,1 мМ Na2HPO4, 0,9 мМ CaCl2, 0,5 мМ MgCl2, Invitrogen/Gibco, pН 7,4) до кінцевої концентрації приблизно 2 мг білка/мл. Білок визначали способом Lowry et al., J. Biol. Chem. 193: 265(1951), використовуючи бичачий сироватковий альбумін як стандарт. 3 Зв'язування [ H]MLA вимірювали з застосуванням модифікації методики Davies et al., 3 Neuropharmacol. 38: 679 (1999). [ H]MLA (з питомою активністю 25-35 Кюрі/ммоль) одержували в 3 Tocris. Зв'язування [ H]MLA визначали за допомогою 2 год. інкубували при 21 °C. Інкубування здійснювали в 48-ямкових мікротитрувальних планшетах, що містили приблизно 200 мкг білка на ямку в кінцевому об'ємі інкубували 300 мкл. Буфер для інкубування являв собою PBS, і 3 кінцева концентрація [ H]MLA складала 5 нМ. Реакцію зв'язування переривали шляхом фільтрування білка, що містив зв'язаний ліганд, на фільтрах зі скловолокна (GF/B, Brandel) з використанням Brandel Tissue Harvester при кімнатній температурі. Фільтри змочували деіонізованою водою, що містила 0,33 % поліетиленіміну для зменшення неспецифічного зв'язування. Кожен фільтр промивали PBS (3×1 мл) при кімнатній температурі. Неспецифічне зв'язування визначали шляхом внесення 50 мкМ нерадіоактивного MLA в вибрані ямки. 3 Інгібування зв'язування [ H]MLA тестованими сполуками визначали шляхом введення тестованих сполук у сімох різних концентраціях в вибрані ямки. Введення кожної з концентрацій повторювали тричі. Значення IC50 приймали рівними концентрації сполук, при якій відбувалося 3 50 % інгібування специфічного зв'язування [ H]MLA. Константи інгібування (значення Ki), виражені в нМ, розраховували, виходячи зі значень IC 50, використовуючи методику Cheng et al., Biochem. Pharmacol. 22:3099-3108 (1973). Приклад 2: Визначення виділення дофаміну Виділення дофаміну вимірювали з використанням стріарних синаптосом, одержаних з мозку щура, відповідно до методик, описаних Rapier et al., у J. Neurochem. 54: 937(1990). Щурів (самки Sprague-Dawley) масою 150-250 г, поміщували в умовах 12 год. циклу світло/темрява при вільному доступі до води і їжі, виробництва PMI Nutrition International, Inc. Тваринам проводили анестезію 70 % CO2 і потім обезглавлювали. Швидко видаляли мозок і висікали стріатум. Тканини стріатума кожних 2 щурів поєднували і гомогенізували в льодяному 0,32М розчині сахарози (5 мл), що містить 5 мМ HEPES, pН 7,4, використовуючи гомогенізатор скло/скло. Потім одержаний препарат тканини центрифугували при 1000×g протягом 10 хвилин. Осад відкидали і супернатант центрифугували при 12000×g протягом 20 хвилин. Одержаний осад ресуспендували в перфузійному буфері, що містив інгібітори моноаміноксидази (128 мМ NaCl, 1,2 мМ KH2PO4, 2,4 мМ KCl, 3,2 мМ CaCl2, 1,2 мМ MgSO4, 25 мМ HEPES, 1 мМ аскорбінову кислоту, 0,02 мМ паргілін HCl і 10 мМ глюкозу, pН 7,4) і центрифугували протягом 15 хв при 25000×g. Одержаний осад ресуспендували в перфузійному буфері (1,4 мл) для негайного використання. Суспензію синаптосом інкубували протягом 10 хвилин при 37 °C для відновлення 3 3 метаболічної активності. Додавали [ H]дофамін ([ H]DA, питома активність=28 Кюрі/ммоль, NEN Research Products) до кінцевої концентрації 0,1 мМ і суспензію інкубували при 37 °C ще 10 хв. Аліквоту тканини (50 мкл) і перфузійний буфер (100 мкл) поміщували в супрафузійні камери Brandel Suprafusion System (series 2500, Gaithersburg, MD). У камери прокачували перфузійний буфер (кімнатної температури) зі швидкістю 1,5 мл/хв протягом періоду промивання, рівного 16 хв. Потім у перфузійний потік вводили тестовану сполуку (10 мМ) або нікотин (10 мМ) протягом 48 сек. Протягом експерименту з кожної камери безперервно відбирали фракції (кожні 24 сек), для фіксації вихідного виділення і максимального виділення, індукованого агоністом, і для повторної фіксації базового рівня після введення агоніста. Перфузійну рідину збирали 12 UA 98944 C2 5 10 15 20 25 30 35 40 45 50 55 безпосередньо в сцинтиляційні флакони і до неї додавали сцинтиляційну рідину. Кількість 3 [ H]DA, що виділилася, визначали підрахунком сцинтиляції. Для кожної камери інтегровану площу піка нормалізували відносно його вихідного рівня. Вивільнення виражали у відсотках від вивільнення, одержаного при дії рівної концентрації Lнікотину. У кожному дослідженні експеримент із кожною тестованою сполукою повторювали неодноразово, використовуючи 2-3 камери; результати повторних експериментів усереднювали. Де це було доцільно, будували криві залежності доза-відповідь для тестованих сполук. Визначали максимальну активацію для індивідуальних сполук (Emax) як відсоток від максимальної активації, викликаної L-нікотином. Також визначали концентрацію сполуки, що призводила до половини максимальної активації (EC50) потоку специфічних іонів. Приклад 3: Селективність у порівнянні з периферичними nACh Взаємодія з м'язовим підтипом рецепторів nACh людини Активацію nACh м'язових типів встановлювали на прикладі клональної лінії клітин людини TE671/RD, що одержані з ембріональної рабдоміосаркоми (Stratton et al., Carcinogen 10: 899 (1989)). Такі клітини експресують рецептори, що мають фармакологічний (Lukas, J. Pharmacol. Exp. Ther. 251: 175 (1989)), електрофізіологічний (Oswald et al., Neurosci.Lett. 96: 207(1989)) і молекулярно-біологічний профілі (Luther et al., J. Neurosci. 9: 1082(1989)), подібні nACh м'язових типів. Клітини TE671/RD підтримували у фазі проліферативного росту відповідно до стандартних протоколів (Bencherif et al., Mol. Cell. Neurosci. 2:52 (1991) і Bencherif et al., J. Pharmacol. Exp. Ther. 257: 946 (1991)). Клітини культивували в середовищі Голка, модифікованому Dulbecco (Gibco/BRL) з 10 % кінською сироваткою (Gibco/BRL), 5 % фетальною телячою сироваткою (HyClone, Logan UT), 1 мМ піруватом натрію, 4 мМ L-глутаміном і 50000 одиницями пеніцилінустрептоміцину (Irvine Scientific). Коли клітини досягли 80 % конфлюентності, їх поміщували в 12ямкові планшети з полістиролу (Costar). Експерименти проводили після досягнення клітинами 100 % конфлюентності. Діяльність нікотинових ацетилхолінових рецепторів (nACh) досліджували використовуючи 86 + виділення Rb відповідно до методики, описаної Lukas et al., Anal. Biochem. 175: 212 (1988). У день експерименту обережно видаляли ростове середовище з ямок і в кожну ямку додавали 6 ростове середовище, що містить хлорид рубідію-86 (10 мкКюрі/мл). Клітини інкубували при 86 + 37 °C протягом мінімум 3 год. Після періоду поглинання ізотопу клітинами, надлишок Rb видаляли і клітини двічі промивали забуференим фосфатним сольовим розчином Dulbecco (138 мМ NaCl, 2,67 мМ KCl, 1,47 мМ KH2PO4, 8,1 мМ Na2HPO4, 0,9 мМ CaCl2, 0,5 мМ MgCl2, Invitrogen/Gibco, pН 7,4), що не містить мітки, намагаючись не скаламутити осад клітин. Потім клітини піддавали впливу або 100 мкМ тестованої сполуки, 100 мкМ L-нікотину (Acros Organics) або чистого буфера протягом 4 хв. Після такої обробки, супернатант, що містив вивільнений 86 + Rb , видаляли і переносили в сцинтиляційні посудини. Додавали сцинтиляційну рідину і вимірювали вивільнену радіоактивність шляхом підрахунку сцинтиляції рідини. У кожному з досліджень кожен експеримент повторювали по 2 рази й одержані результати 86 + усереднювали. Кількість Rb , що вивільнилася, порівнювали як з позитивним контролем (100 мкМ L-нікотин), так і з негативним контролем (чистий буфер) для визначення вивільнення у відсотках відносно L-нікотину. Коли це було доцільно, будували криві залежності доза-відповідь для тестованих сполук. Визначали максимальну активацію для індивідуальних сполук (Emax) як відсоток від максимальної активації, викликаної L-нікотином. Також визначали концентрацію сполуки, що призводила до половини максимальної активації (EC50) потоку специфічних іонів. Взаємодія з гангліозним підтипом рецепторів nACh щура Активацію гангліозних щурячих рецепторів nACh визначали на прикладі клональної лінії PC12 феохромоцитоми, що є безперервною клональною клітинною лінією з гангліонарної пластинки, одержаної з пухлини хромафінної тканини надниркової залози щура. Дані клітини експресують гангліоноподібні nACh (див. Whiting et al., Nature 327: 515(1987); Lukas, J. Pharmacol. Exp. Ther. 251: 175 (1989); Whiting et al., Mol. Brain Res. 10:61 (1990)). Щурячі клітини PC12 підтримували у фазі проліферативного росту відповідно до стандартних протоколів (Bencherif et al., Mol. Cell. Neurosci. 2:52 (1991) і Bencherif et al., J. Pharmacol. Exp. Ther. 257: 946 (1991)). Клітини культивували в середовищі Голка, модифікованому Dulbecco (Gibco/BRL) з 10 % кінською сироваткою (Gibco/BRL), 5 % фетальною телячою сироваткою (HyClone, Logan UT), 1 мМ піруватом натрію, 4 мМ L-глутаміном і 50000 одиницями пеніциліну-стрептоміцину (Irvine Scientific). Коли клітини досягли 80 % конфлюентності, їх поміщували в 12-ямкові планшети Nunc (Nunclon) і покривали 0,03 % полі-L 13 UA 98944 C2 5 10 15 20 25 30 35 40 45 50 55 60 лізином (Sigma, розчиненим у 100 мМ борній кислоті). Експерименти проводили по досягненні клітинами 80 % конфлюентності. Функцію нікотинових ацетилхолінових рецепторів (nACh) досліджували використовуючи 86 + виділення Rb відповідно до методики, описаної Lukas et al., Anal. Biochem. 175: 212 (1988). У день експерименту обережно видаляли ростове середовище з ямок і в кожну ямку додавали 6 ростове середовище, що містить хлорид рубідію-86 (10 мкКюрі/мл). Клітини інкубували при 86 + 37 °C протягом мінімум 3 год. Після періоду поглинання ізотопу клітинами, надлишок Rb видаляли і клітини двічі промивали забуференим фосфатним сольовим розчином Dulbecco (138 мМ NaCl, 2,67 мМ KCl, 1,47 мМ KH2PO4, 8,1 мМ Na2HPO4, 0,9 мМ CaCl2, 0,5 мМ MgCl2, Invitrogen/Gibco, pН 7,4), що не містить міток, намагаючись не скаламутити осад клітин. Потім клітини піддавали впливу 100 мкМ тестованої сполуки, 100 мкМ нікотину або чистого буфера 86 + протягом 4 хв. Після такої обробки, супернатант, який містив Rb , що вивільнився, видаляли і переносили в сцинтиляційні посудини. Додавали сцинтиляційну рідину і вимірювали радіоактивність, що вивільнилася, шляхом підрахунку сцинтиляції рідини. У кожному з досліджень кожен експеримент повторювали по 2 рази й одержані результати 86 + усереднювали. Кількість Rb , що вивільнився, порівнювали як з позитивним контролем (100 мкМ нікотин), так і з негативним контролем (чистий буфер) для визначення вивільнення у відсотках відносно L-нікотину. Коли це було доцільно, будували криві залежності доза-відповідь для тестованих сполук. Визначали максимальну активацію для індивідуальних сполук (Emax), як відсоток від максимальної активації, викликаної L-нікотином. Також визначали концентрацію сполуки, що призводила до половини максимальної активації (EC50) потоку специфічних іонів. Взаємодія з гангліозним підтипом рецепторів nACh людини Клітинна лінія SH-SY5Y є безперервною лінією, одержаною послідовним субклонуванням батьківської клітинної лінії, а саме SK-N-SH, що була спочатку одержана з периферичної нейробластоми людини. Клітини SH-SY5Y експресують гангліоноподібні nACh (Lukas et al., Mol. Cell. Neyrosci. 4:1 (1993)). Людські клітиниSH-SY5Y підтримували у фазі проліферативного росту відповідно до стандартних протоколів (Bencherif et al., Mol. Cell. Neurosci. 2:52 (1991) і Bencherif et al., J. Pharmacol. Exp. Ther. 257:946 (1991)). Клітини культивували в середовищі Голка, модифікованому Dulbecco (Gibco/BRL) з 10 % кінською сироваткою (Gibco/BRL), 5 % фетальною телячою сироваткою (HyClone, Logan UT), 1мМ піруватом натрію, 4 мМ L-глутаміном і 50000 одиницями пеніциліну-стрептоміцину (Irvine Scientific). Коли клітини досягли 80 % конфлюентності, їх поміщували в 12-ямкові планшети з полістиролу (Costar). Експерименти проводили по досягненні клітинами 100 % конфлюентності. Функцію нікотинових ацетилхолінових рецепторів (nACh) досліджували використовуючи 86 + виділення Rb відповідно до методики, описаної Lukas et al., Anal. Biochem. 175: 212 (1988). У день експерименту обережно видаляли ростове середовище з ямок і в кожну ямку додавали 6 ростове середовище, що містить хлорид рубідію-86 (10 мкКюрі/мл). Клітини інкубували при 86 + 37 °C протягом мінімум 3 год. Після періоду поглинання ізотопу клітинами, надлишок Rb видаляли і клітини двічі промивали забуференим фосфатному сольовим розчином Dulbecco (138 мМ NaCl, 2,67 мМ KCl, 1,47 мМ KH2PO4, 8,1 мМ Na2HPO4, 0,9 мМ CaCl2, 0,5 мМ MgCl2, Invitrogen/Gibco, pН 7,4), що не містить міток, намагаючись не скаламутити осад клітин. Потім клітини піддавали впливу 100 мкМ тестованої сполуки, 100 мкМ нікотину або чистого буфера 86 + протягом 4 хв. Після такої обробки, супернатант, що містив вивільнений Rb , видаляли і переносили в сцинтиляційні посудини. Додавали сцинтиляційну рідину і вимірювали радіоактивність, що вивільнилася, шляхом підрахунку сцинтиляції рідини. У кожному з досліджень кожен експеримент повторювали по 2 рази й одержані результати 86 + усереднювали. Кількість Rb , що вивільнився, порівнювали як з позитивним контролем (100 мкМ нікотин), так і з негативним контролем (чистий буфер) для визначення вивільнення у відсотках відносно L-нікотину. Якщо це було доцільно, будували криві залежності доза-відповідь для тестованих сполук. Визначали максимальну активацію для індивідуальних сполук (Emax) як відсоток від максимальної активації, викликаної L-нікотином. Також визначали концентрацію сполуки, що призводила до половини максимальної активації (EC50) потоку специфічних іонів. Приклад 4: Тест по розпізнаванню нових об'єктів (NOR) Тест по розпізнаванню нових об'єктів (NOR) здійснювали відповідно до опису Ennaceur and Delacour у Behav.Brain Res. 100: 85-92 (1988). Приклади синтезу Приклад 5: Синтез N-(трет-бутоксикарбоніл)-3,7-діазабіцикло[3.3.0]октану 14 UA 98944 C2 5 10 15 20 25 30 35 40 45 50 55 60 Приклад 5 стосується синтезу N-(трет-бутоксикарбоніл)-3,7-діазабіцикло[3.3.0]октану, що одержували, як описано в заявках на патент США 2004/0186107, на ім'я Schrimpf і співавторів, і 2005/0101602, на ім'я Basha і співавторів, за наступною методикою: 5-бензилтетрагідропіроло[3,4-c]пірол-1,3-діон (або 7-бензил-3,7-діазабіцикло[3.3.0]октан-2,4діон) Трифтороцтову кислоту (ТФОК, 0,50 мл, 6,5 ммоль) в атмосфері азоту додавали до холодного (0 °C) розчину малеїніміду (6,27 г, 0,0646 моль) у дихлорметані (150 мл). По краплях протягом 45 хвилин додавали розчин N-(метоксиметил)-N-(триметилсилілметил)бензиламіну (20 г, 0,084 моль) у дихлорметані (100 мл). Після того, як додавання було закінчено, суміш повільно нагрівали до кімнатної температури і перемішували протягом 16 год. Суміш концентрували, одержаний залишок розчиняли в дихлорметані (200 мл) і промивали насиченим водним розчином бікарбонату натрію (250 мл). Водний шар відокремлювали й екстрагували дихлорметаном (275 мл). Об'єднані дихлорметанові екстракти промивали насиченим розчином солі (50 мл), сушили над безводним сульфатом магнію, фільтрували і концентрували, одержуючи 12,5 г (вихід 83,9 %) світло-жовтого воскоподібної твердої речовини (МС m/z 231 (M+H)). 2-бензилоктагідропіроло[3,4-c]пірол (або 3-бензил-3,7-діазабіцикло[3.3.0]октан) Неочищений 5-бензилтетрагідропіроло[3,4-c]пірол-1,3-діон (4,9 г, 0,021 моль) розчиняли в холодному (0 °C) сухому тетрагідрофурані (ТГФ) (50 мл) в атмосфері азоту і до розчину, що безперервно перемішується, по краплях протягом 30 хв додавали літійалюмінійгідрид (63 мл 1М в ТГФ, 0,063 моль). Одержану суміш перемішували при кімнатній температурі протягом 30 хв і потім нагрівали до кипіння зі зворотним холодильником протягом 4 год. Потім суміш прохолоджували до 0 °C і гасили повільним додаванням надлишку твердого декагідрату сульфату натрію. Суміш нагрівали до кімнатної температури і перемішували протягом 16 год. Тверді речовини видаляли фільтруванням і залишок промивали етилацетатом (3×100 мл). Об'єднані фільтрати концентрували, одержуючи 4,2 г (вихід 99 %) воскоподібної речовини (МС m/z 203 (M+H)). трет-бутиловий ефір 5-бензилгексагідропіроло[3,4-c]пірол-2-карбонової кислоти (або Nбензил-N’-(трет-бутоксикарбоніл)-3,7-діазабіцикло[3.3.0]октан) Неочищений 2-бензилоктагідропіроло[3,4-c]пірол (4,2 г, 0,021 моль) розчиняли в ТГФ (50 мл). Додавали дитрет-бутилдикарбонат (5,5 г, 0,025 моль) і Водний насичений розчин NaHCO3 (10 мл) і суміш перемішували при кімнатній температурі протягом ночі. Реакційну суміш гасили водою (10 мл) і додавали етилацетат (30 мл). Водний шар екстрагували етилацетатом (2×20 мл), об'єднані органічні екстракти сушили над безводним сульфатом натрію і концентрували. Очищення колонковою хроматографією на силікагелі (1:1 гексан/етилацетат) приводили до одержання 5,07 г (вихід 79,8 %) вказаної в заголовку сполуки (МС m/z 303 (M+H)). Трет-бутиловий ефір гексагідропіроло[3,4-c]пірол-2-карбонової кислоти (або N-(третбутоксикарбоніл)-3,7-діазабіцикло[3.3.0]октан) Трет-бутиловий ефір 5-бензилгексагідропіроло[3,4-c]пірол-2-карбонової кислоти (5,07 г, 0,0168 моль) розчиняли в метанолі (50 мл) і в атмосфері азоту додавали 20 % Pd(OH)2/C (вологий) (~2 г). Одержану суміш нагрівали (45-50 °C) і струшували протягом 2 год. в атмосфері водню під тиском 40 фунт/кв.дюйм. Одержану суміш фільтрували і концентрували, одержуючи 3,49 г (вихід 97,7 %) вказаної в заголовку сполуки (МС m/z 213 (M+H)). Приклад 6: Синтез N-(фуран-2-ілкарбоніл)-3,7-діазабіцикло[3.3.0]октану Приклад 6 стосується синтезу фуран-2-іл(гексагідропіроло[3,4-c]пірол-2-іл)метанону (або N(фуран-2-ілкарбоніл)-3,7-діазабіцикло[3.3.0]октану), що одержували за наступними методиками, що є ілюстративними для реакції поєднання, використовуваної для одержання гетероатомних амідів 3,7-діазабіцикло[3.3.0]октану: Трифторацетат фуран-2-іл(гексагідропіроло[3,4-c]пірол-2-іл)метанону (або трифторацетат N-(фуран-2-ілкарбоніл)-3,7-діазабіцикло[3.3.0]октану) Фуран-2-карбонову кислоту (0,037 г, 0,33 ммоль) і триетиламін (0,125 мл, 0,99 ммоль) змішували в сухому дихлорметані (1 мл) і додавали гексафторфосфат O-(бензотриазол-1-іл)1,1,3,3-тетраметилуронію (HBTU; 0,125 г, 0,33 ммоль). Додавали розчин трет-бутилового ефіру гексагідропіроло[3,4-c]пірол-2-карбонової кислоти (0,064 г, 0,30 ммоль) у дихлорметані (0,5 мл) і суміш перемішували при кімнатній температурі протягом ночі. Суміш струшували з 10 % водним розчином гідроксиду натрію і відокремлювали органічний шар. Водний шар екстрагували хлороформом (2×2 мл). Об'єднані органічні екстракти промивали водою (2×1 мл) і концентрували. Одержаний залишок розчиняли в диметилформаміді (ДМФА) (0,3 мл) і очищували ВЕРХ (градієнт суміші ацетонітрил/вода). Фракції, що містять бажану речовину, поєднували і концентрували, залишаючи захищений трет-бутоксикарбонілом продукт. 15 UA 98944 C2 5 10 15 20 25 30 35 40 45 50 55 60 Одержану речовину розчиняли в суміші трифтороцтової кислоти (0,5 мл) і дихлорметану (0,5 мл) і суміш перемішували при кімнатній температурі протягом 1 год. Леткі речовини видаляли на роторному випарнику, з наступним витримуванням у глибокому вакуумі, одержуючи 77 мг 1 масла (вихід 80 %) ( H ЯМР (d4-метанол, 300 МГц) 3,20 (м, 2H), 3,47-4,2 (м, 8H), 6,60 (т, 1H), 7,18 (д, 1H), 7,72 (д, 1H); МС m/z 207 (M+H)). Приклад 7: Синтез трифторацетату N-(5-хлорфуран-2-ілкарбоніл)-3,7діазабіцикло[3.3.0]октану Приклад 7 стосується синтезу трифторацетату 5-хлорфуран-2-іл(гексагідропіроло[3,4c]пірол-2-іл)метанону (або трифторацетату N-(5-хлорфуран-2-ілкарбоніл)-3,7діазабіцикло[3.3.0]октану), що одержували за наступними методиками, що є ілюстративними для реакції поєднання, використовуваної для одержання гетероароматичних амідів 3,7діазабіцикло[3.3.0]октану: 5-хлорфуран-2-карбонова кислота Водний розчин гідроксиду натрію (80 мл з концентрацією 10 %) додавали до розчину нітрату срібла (8,0 г, 47 ммоль) у воді (20 мл). Одержану суспензію перемішували і повільно обробляли 30 % водним розчином гідроксиду амонію до одержання прозорого розчину. Додавали розчин 5хлорфуран-2-карбоксальдегіду (3,0 г, 23 ммоль) (Aldrich Chemical) у метанолі (5 мл) і одержану суміш перемішували при кімнатній температурі протягом 30 хвилин. Реакційну суміш фільтрували і фільтрат промивали ефіром (100 мл). Потім Водний фільтрат підкислювали (pН ~3) додаванням холодної 20 % сірчаної кислоти. Одержану суміш екстрагували етилацетатом (3×100 мл). Екстракти промивали насиченим водним розчином хлориду натрію (100 мл), сушили (безводним сульфатом натрію) і концентрували у вакуумі, одержуючи 3,2 г (вихід 95 %) білої твердої речовини (т.пл. 178-179 °C). Дана реакція може бути без зусиль проведена в більшому обсязі і її неодноразово проводили в масштабі >10 г. Трифторацетат N-(5-хлорфуран-2-ілкарбоніл)-3,7-діазабіцикло[3.3.0]октану Оксаліхлорид (12,2 г, 95,8 ммоль), що містить краплю ДМФА, по краплях додавали до льодяного розчину 5-хлорфуран-2-карбонової кислоти (6,25 г, 47,9 ммоль) у 200 мл дихлорметану. Після закінчення додавання видаляли лазню з льодом і реакційну суміш нагрівали до кімнатної температури протягом 1 години. Потім видаляли леткі речовини у вакуумі і залишок розчиняли в ТГФ (50 мл). Потім додавали одержаний розчин хлорангідриду кислоти до льодяного розчину, що перемішується, трет-бутилового гексагідропіроло[3,4-c]пірол2-каарбонової кислоти (10,2 г, 47,9 ммоль) і діізопропіламіну (25 г, ~4 еквівалентів) у ТГФ (200 мл). Одержану суміш перемішували при кімнатній температурі протягом 16 годин. Потім леткі речовини видаляли у вакуумі і залишок розподіляли між водою (100 мл) і ефіром (300 мл). Ефірний шар і два ефірних екстракти (100 мл) водного шару концентрували на роторному випарнику. Залишок піддавали колонковій хроматографії на силікагелі, елююючи 0-60 % градієнтом етилацетату в гексані. Концентрування вибраних фракцій призводило до одержання 13,9 г (вихід 85,3 %) блідо-жовтого сиропу. Частину одержаної речовини (12,9 г, 37,9 ммоль) розчиняли в суміші дихлорметану і трифтороцтової кислоти (по 100 мл кожний). Одержану суміш перемішували при кімнатній температурі протягом 2 год. і потім концентрували у вакуумі. Залишок розподіляли між хлороформом (200 мл) і 50 % водним розчином карбонату калію (200 мл) і Водний шар екстрагували хлороформом (3200 мл). Об'єднані хлороформні шари сушили над безводним сульфатом натрію і концентрували у вакуумі, одержуючи 8,66 г (вихід 95 %) 1 блідо-жовтої твердої речовини ( H ЯМР (d4-метанол, 300 МГц) 3,15-3,35 (м, 4H), 3,50-4,20 (м, 6H), 6,51 (д, 1H), 7,17 (д, 1H); МС m/z 241 (M+H)). Приклад 8: Синтез трет-бутилового ефіру 3,7-діазабіцикло[3.3.1]нонан-3-карбонової кислоти Приклад 8 стосується синтезу трет-бутилового ефіру 3,7-діазабіцикло[3.3.1]нонан-3карбонової кислоти (або N-(третбутоксикарбоніл)-3,7-діазабіцикло[3.3.1]нонану), що одержують за наступною методикою: трет-бутиловий ефір 7-бензил-3,7-діазабіцикло[3.3.1]нонан-3-карбонової кислоти (або Nбензил-N’-(трет-бутоксикарбоніл)-3,7-діазабіцикло[3.3.1]нонан) Трет-бутиловий ефір 7-бензил-3,7-діазабіцикло[3.3.1]нонан-3-карбонової кислоти одержували за методикою, викладеною Stead et al., Org. Lett. 7(20): 4459(2005). Трет-бутиловий ефір 3,7-діазабіцикло[3.3.1]-3-карбонової кислоти Трет-бутиловий ефір 7-бензил-3,7-діазабіцикло[3.3.1]нонан-3-карбонової кислоти (0,49 г, 1,6 ммоль) розчиняли в метанолі (20 мл) і в атмосфері азоту додавали 20 % Pd(OH)2/C (вологий) (~2 г). Одержану суміш нагрівали приблизно до 50 °C і струшували протягом 2 год. в атмосфері водню при тиску 55 фунтів/кв.дюйм. Одержану суміш фільтрували і концентрували, одержуючи 0,32 г (вихід 94 %) вказаної в заголовку сполуки (МС m/z 227 (M+H)). Приклад 9: Синтез трифторацетату N-(фуран-2-ілкарбоніл)-3,7-діазабіцикло[3.3.1]нонану 16 UA 98944 C2 5 10 15 20 25 30 35 40 45 Приклад 9 стосується синтезу трифторацетату (3,7-діазабіцикло[3.3.1]нон-3-іл)-фуран-2ілметанону (або трифторацетату N-(фуран-2-ілкарбоніл)-3,7-діазабіцикло[3.3.1]нонану), що одержували за наведеною нижче методикою, що є ілюстративною для реакції поєднання, використовуваної для синтезу гетероароматичних амідів 3,7-діазабіцикло[3.3.1]нонану: Трифторацетат (3,7-діазабіцикло[3.3.1]нон-3-іл)фуран-2-ілметанону (або трифторацетату N(фуран-2-ілкарбоніл)-3,7-діазабіцикло[3.3.1]нонану) Фуран-2-карбонову кислоту (0,032 г, 0,29 ммоль) і триетиламін (0,121 мл, 0,870 ммоль) змішували в сухому дихлорметані (1 мл) і додавали HBTU (0,11 г, 0,29 ммоль). Додавали розчин трет-бутилового ефіру 3,7-діазабіцикло[3.3.1]-3-карбонової кислоти (0,059 г, 0,26 ммоль) у дихлорметані (0,5 мл) і суміш перемішували при кімнатній температурі протягом ночі. Суміш обробляли 10 % водним розчином гідроксиду натрію й екстрагували хлороформом (22 мл). Об'єднані органічні екстракти промивали водою (21 мл) і концентрували. Одержаний залишок розчиняли в диметилформаміді (ДМФА) (0,3 мл) і очищували ВЕРХ (градієнт суміші ацетонітрил/вода). Фракції, що містять бажану речовину, поєднували і концентрували, залишаючи захищений трет-бутоксикарбонілом продукт. Одержану речовину розчиняли в суміші трифтороцтової кислоти (0,5 мл) і дихлорметану (0,5 мл) і суміш перемішували при кімнатній температурі протягом 1 год. Леткі речовини видаляли на роторному випарнику, з 1 наступним витримуванням у глибокому вакуумі, одержуючи 36 мг масла (вихід 41 %) ( H ЯМР (d4-метанол, 300 МГц) 2,10 (ушир.с, 2H), 2,35 (ушир.с, 2H), 3,30-3,45 (м, 4H), 3,55 (м, 2H), 6,65 (м, 1H), 7,15 (д, 1H) і 7,75 (д, 1H); МС m/z 221 (M+H)). Приклад 10: Синтез трифторацетату N-(5-хлорфуран-2-ілкарбоніл)-3,7діазабіцикло[3.3.1]нонану Приклад 10 стосується синтезу трифторацетату (3,7-діазабіцикло[3.3.1]нон-3-іл)-5хлорфуран-2-ілметанону (або трифторацетату N-(5-хлорфуран-2-ілкарбоніл)-3,7діазабіцикло[3.3.1]нонану), що одержували способом, подібно описаному в прикладі 9, відповідно до наступної методики: 5-хлорфуран-2-карбонову кислоту (0,96 г, 6,5 ммоль) змішували з триетиламіном (2,9 мл, 21 ммоль) у сухому дихлорметані (10 мл) і додавали HBTU (2,47 г, 65,1 ммоль). Додавали розчин трет-бутилового ефіру 3,7-діазабіцикло[3.3.1]-3-карбонові кислоти (1,5 г, 66 ммоль) у дихлорметані (5 мл) і суміш перемішували при кімнатній температурі протягом ночі. Суміш обробляли 10 % водним розчином гідроксиду натрію й екстрагували хлороформом (2×20 мл). Об'єднані органічні екстракти промивали водою (2×10 мл) і концентрували. Одержаний залишок очищували колонковою хроматографією на силікагелі, елююючи градієнтом етилацетату в гексані, одержуючи захищений трет-бутоксикарбонілом продукт, у вигляді в'язкого масла. Одержану речовину розчиняли в суміші трифтороцтової кислоти (20 мл) і дихлорметану (20 мл) і суміш перемішували при кімнатній температурі протягом 1 год. Леткі речовини видаляли на роторному випарнику, з наступним витримуванням продукту в глибокому вакуумі, одержуючи 1 1,38 г (вихід 57,5 %) в'язкого жовтого масла ( H ЯМР (d4-метанол, 300 МГц) 2,00 (ушир.с, 2H), 2,15 (ушир.с, 2H), 3,15-3,35 (м, 6H), 4,25 (м, 2H), 6,53 (д, 1H) і 7,10 (д, 1H); МС m/z 255 (M+H)). Приклад 11: Таблиці спектральних даних і даних про зв'язування рецепторів Описані вище методики поєднання з утворенням амідів застосовували для одержання сполук, показаних у таблицях 1 і 2. У деяких випадках, сполуки синтезували в кількості, достатній для одержання даних ядерного магнітного резонансу (ЯМР). В інших випадках сполуки одержували в меншій кількості в різних пристроях для рівнобіжного синтезу, і такі сполуки були охарактеризовані (структурно) тільки способом РХМС. Таблиця 1 Структура Ki Ki Щурячого Людського α4β2 α4β2 20 33 17 Ki α7 13000 МС m/z 1 H ЯМР: CD3OD, 300 МГц (M+H) 207 7,72 (д, 1H), 7,18 (д, 1H), 6,60 (т, 1H), 3,47-4,2 (м, 8H), 3,2 (м, 2H) UA 98944 C2 Продовження таблиці 1 26 160 Не визначена за даними HTS 54 73 12000 287 53 220 3100 207 35 31 2900 252 19 19 3500 238 1,5 1,5 12000 9,00 (д, 2H), 8,20 (м, 2H), 3,7-4,0 (м, 3H), 3,47-3,7 (м, 5H), 3,2 (м, 2H) 287 218 33 28 91000 241 44 54 25000 221 230 43 3200 307 130 28 23000 221 18 7,17 (д, J=0,61 Гц, 1H), 6,51 (д, J=0,73 Гц, 1H), 4,20-3,50 (м, 6H), 3,35-3,15 (м, 4H) UA 98944 C2 Продовження таблиці 1 44 Не визначена за даними HTS 18 Не визначена за даними HTS 287 40 Не визначена за даними HTS 267 54 24 Не визначена за даними HTS 319 260 86 12000 283 95 Не визначена за даними HTS 273 150 84 Не визначена за даними HTS 222 15 9,2 210000 222 24 14 56000 222 31 Не визначена за даними HTS 222 17 29 140 110 32 61 29 19 160000 288 7,80 (с, 1H), 7,2 (с, 1H), 3,54,2 (м, 8H), 3,20 (м, 2H) 221 7,50 (с, 1H), 7,17 (м, 2H), 6,78 (м, 1H), 6,60 (с, 1H), 3,95-3,76 (м, 4H), 3,70-3,58 (м, 2H), 3,32-3,08 (м, 4H) 7,38 (д, J=1,8 Гц, 1H), 6,55 (д, J=1,8 Гц, 1H), 3,79 (м, 2H), 3,45 (м, 2H), 3,06 (м, 2H), 2,89 (м, 2H), 2,67 (м, 2H), 2,37 (с, 3H) UA 98944 C2 Продовження таблиці 1 53 353 1000 320 31 20 140 43 2,8 8,3 20 63 Не визначена за даними HTS 100 Не визначена за даними HTS 45 Не визначена за даними HTS 36 Не визначена за даними HTS 28 Не визначена за даними HTS 22 Не визначена 299/301 за даними HTS 250 237 6,48 (с, 1H), 3,5-4,0 (м, 6H), 3,3-3,1 (м, 4H), 2,35 (с, 3H) 289 275 8,25 (с, 1H), 7,35 (с, 1H), 4,2-3,6 (м, 4H), 3,55 (дд, 2H), 3,3-3,2 (м, 4H) 286 8,15 (с, 1H), 7,35 (с, 1H), 4,2-3,6 (м, 4H), 3,5 (дд, 2H), 3,4-3,2 (м, 4H) 51 Не визначена за даними HTS 233 21 Не визначена за даними HTS 287 2,4 Не визначена за даними HTS 241 16 Не визначена за даними HTS 225 4,9 Не визначена за даними HTS 366 20 7,55 (с, 1H), 6,7-6,6 (м, 1H), 3,9 (с, 3H), 3,85 (м, 2H), 3,75 (м, 2H), 3,65 (м, 2H), 3,15 (м, 4H) 7,58 (дд, J=2, 0,5 Гц, 1H), 7,26 (дд, J=18, 11 Гц, 1H), 6,86 (дд, J=2, 0,5 Гц, 1H), 5,70 (дд, J=18, 1,5 Гц, 1H), 5,32 (дд, J=11, 1,5 Гц, 1H), 4,20-3,62 (м, 4H), 3,62-3,58 (м, 2H), 3,25-3, 18 (м, 4H) 7,81 (с, 1H), 7,08 (д, J=1 Гц, 1H), 4,18-3,62 (м, 4H), 3,59 (м, 2H), 3,30-3,20 (м, 4H), 2,40 (т, J=7 Гц, 2H), 1,60-1,44 (м, 4H), 0,95 (т, J=7 Гц, 3H) UA 98944 C2 Продовження таблиці 1 35 25 21 89 36 140 50 65 51 43 27 Не визначена за даними HTS 14 Не визначена за даними HTS 9,7 Не визначена за даними HTS 225 7,60 (д, J=2 Гц, 1H), 7,59 (д, J=2 Гц, 1H), 4,18-3,65 (м, 4H), 3,60 (м, 2H), 3,22 (м, 4H) 232 7,85 (д, J=2 Гц, 1H), 6,95 (д, J=2 Гц, 1H), 4,25-3,63 (м, 4H), 3,60 (м, 2H), 3,24 (м, 4H) 241 90 Не визначена за даними HTS 208 21 Не визначена за даними HTS 225 48 Не визначена за даними HTS 40 232 14 Не визначена за даними HTS 239 130 Не визначена за даними HTS 257 69 Не визначена за даними HTS 8,79 (д, J=1,7 Гц, 1H), 6,80 (д, J=1,7 Гц, 1H), 4,12 (дд, J=12, 7 Гц, 1H), 3,99 (дд, J=12, 3 Гц, 1H), 3,90 (дд, J=13, 8 Гц, 1H), 3,75(дд, J=13, 4 Гц, 1H), 3,58 (м, 2H), 3,24 (м, 4H) 7,80 (д, J=1 Гц, 1H), 7,78 (д, J=1 Гц, 1H), 4,21-3,62 (м, 4H), 3,58 (м, 2H), 3,21 (м, 4H) 231 Не визначена за даними HTS 7,83 (д, J=1 Гц, 1H), 7,16 (д, J=0,7 Гц, 1H), 4,20-3,62 (м, 4H), 3,60 (м, 2H), 3,28-3,19 (м, 4H) 21 6,24 (с, 1H),4,17-3,65 (м, 4H), 3,57 (м, 2H), 3,19 (м, 4H), 2,34 (с, 3H) 8,52 (д, J=2 Гц, 1H), 6,96 (д, J=2 Гц, 1H), 4,15 (дд, J=8, 12 208,3 Гц, 1H), 3,91 (м, 2H), 3,72 (дд, J=4, 14 Гц, 1H), 3,60 (м, 2H), 3,33-3,23 (м, 4H) UA 98944 C2 Таблица 2 Структура Ki Ki щурячого людського α4β2 α4β2 Ki α7 МС m/z (M+H) 31 9,9 15000 221 110 18 1700 17 51 301 42 Не визначена за даними HTS 7,75 (д, 1H), 7,15 (д, 1H), 6,65 (м, 1H), 4,55 (м, 2H), 3,55 (м, 2H), 3,3-3,45 (м, 4H), 2,35 (ушир.с, 2H), 2,1 (ушир.с, 2H) 301 Не визначена за даними HTS H ЯМР: CD3OD, 300 МГц 232 Не визначена за даними HTS 1 235 79 41 100 15 33 5,9 87 68 7,3 120000 255 180 Не визначена за даними HTS 252 18 Не визначена за даними HTS 302 210 Не визначена за даними HTS 278 96 Не визначена за даними HTS 236 7,10 (д, 1H), 6,53 (д, 1H), 4,25 (м, 2H), 3,15-3,35 (м, 6H), 2,15 (ушир.с, 2H), 2,0 (ушир.с, 2H) 22 7,18 (д, 1H), 6,36 (д, 1H), 4,56 (м, 2H), 3,58 (м, 2H), 3,40-3,24 (м, 4H), 2,30 (м, 2H), 2,18 (с, 3H), 2,05 (м, 2H) UA 98944 C2 Продовження таблиці 2 20 9,5 29 25 96 6,4 86 6,3 12 4 64 Не визначена за даними HTS 236 21 Не визначена за даними HTS 236 47 Не визначена за даними HTS 236 83 Не визначена за даними HTS 262 29 Не визначена за даними HTS 255 4,6 Не визначена за даними HTS 239 62 Не визначена за даними HTS 23 Не визначена за даними HTS 333 35 Не визначена за даними HTS 287 1,6 Не визначена за даними HTS 380 23 300 8,19 (с, 1H), 7,3 (с, 1H), 4,45 (д, 2H), 3,6-3,2 (м, 6H), 2,27 (ушир.с, 2H), 2,1-2,0 (м, 2H) 8,22 (д, J=1 Гц, 1H), 7,50 (д, J=1 Гц, 1H), 7,27 (м, 2H), 6,90 (м, 1H), 4,55 (д, J=13 Гц, 2H), 3,58 (м, 2H), 3,42-3,30 (м, 4H), 2,3l (ушир.с, 2H), 2,06 (м, 2H) UA 98944 C2 Продовження таблиці 2 110 110 13 77 7,5 560 28 28 220 35 500 7,63 (дд, J=4, 2 Гц, 1H), 6,62 (дд, J=2, 1 Гц, 1H), 4,37 (д, J=14 Гц, 2H), 3,50 (м, 2H), 3,34 (м, 4H), 2,28 (ушир.с, 2H), 2,06 (м, 2H) 57 Не визначена за даними HTS 239 31 Не визначена за даними HTS 246 5,2 Не визначена за даними HTS 255 10 Не визначена за даними HTS 255 5,2 (CDCl3) 6,95 (с, 1H), 4,60 (д, Не 2H), 3,55 (д, 2H), 3,38 (м, 2H), визначена 313/315 3,25 (д, 2H), 2,35 (с, 3H), 2,25 за даними (м, 2H), 2,05 (м, 2H) HTS 28 Не визначена за даними HTS 251 26 Не визначена за даними HTS 222 14 Не визначена за даними HTS 239 47 Не визначена за даними HTS 245 8,7 Не визначена за даними HTS 246 62 Не визначена 253/505 за даними HTS 24 UA 98944 C2 Продовження таблиці 2 370 27 12 65 52 85 Не визначена за даними HTS 222 23 Не визначена за даними HTS 246 1,7 Не визначена за даними HTS 301 31 Не визначена за даними HTS 236 30 Не визначена за даними HTS 8,09 (д, 1H), 7,40 (д, 1H), 3,65-3,23 (м, 8H), 2,30 (м, 2H), 2,05 (м, 2H) 222 8,53 (д, 1H), 6,90 (д, 1H), 4,60-4,20 (м, 2H), 3,58-3,25 (м, 6H), 2,30 (м, 2H), 2,05 (м, 2H) HTS = високопродуктивний скринінг 5 10 15 20 25 Короткий опис біологічних даних Сполуки в таблицях 1 і 2, що є репрезентативними для даного винаходу, демонструють значення констант інгібування (значення Ki) у відношенні щурячих і людських рецепторів підтипу α4β2 у діапазоні від 1 нМ до 1000 нМ і від 1 нМ до 220 нМ, відповідно, що вказує на високу афінність у відношенні рецепторів підтипу α4β2. Значення Ki для рецепторів підтипу α7 знаходяться в діапазоні від 1700 нМ до 210000 нМ (у багатьох випадках сполуки не демонструють достатнього зв'язування з рецепторами підтипу α7 у ході високопродуктивного скринінга, щоб гарантувати визначення Ki). Ті ж самі сполуки демонструють відносно невелику функціональну активність у відношенні рецепторів як людських м'язових підтипів (1-25 % від максимальної реакції на нікотин), так і людських гангліозних рецепторів (1-20 % від максимальної реакції на нікотин). Вплив деяких репрезентативних сполук оцінювали в експериментах на тест з розпізнавання об'єктів, NOR. Так, наприклад, обидві сполуки, а саме N-(5-хлорфуран-2-ілкарбоніл)-3,7діазабіцикло[3.3.0]октан (фіг. 1) і N-(5-хлорфуран-2-ілкарбоніл)-3,7-діазабіцикло[3.3.1]нонан (фіг. 2) виявляли активність при розпізнаванні об'єктів у щурів у кількостях 0,1 мг/кг і 0,3 мг/кг, відповідно. Цей факт доводить ефективність (і потенціал) сполук за даним винаходом при лікуванні когнітивних розладів, розладів уваги і деменцій, а також потенціал вказаних сполук для лікування людей. Викладений вище матеріал є ілюстрацією даного винаходу і його не слід тлумачити як обмеження обсягу винаходу. Обсяг винаходу визначений викладеною нижче формулою винаходу, причому в пункти формули винаходи включені їхні еквіваленти. Усі патенти і публікації, що наведені в даному описі, включені за допомогою посилань у всій своїй повноті для використання в будь-яких цілях. ФОРМУЛА ВИНАХОДУ 30 1. Сполука N-(5-хлорфуран-2-ілкарбоніл)-3,7-діазабіцикло[3.3.0]октан або його фармацевтично прийнятні солі. 25 UA 98944 C2 5 10 15 20 2. Спосіб лікування вікового погіршення пам'яті, слабкого порушення когнітивних здібностей, передстаречої деменції, раннього початку хвороби Альцгеймера, старечої деменції, деменції типу Альцгеймера, деменції з тільцями Леві, судинної деменції, хвороби Альцгеймера, удару, комплексу СНІД-деменція, синдрому дефіциту уваги, гіперактивного розладу з дефіцитом уваги, дислексії, шизофренії, шизофреніформного розладу, порушення пізнавальної здатності при шизофренії і шизоафективного розладу, який включає введення N-(-5-хлорфуран-2-ілкарбоніл)3,7-діазабіцикло[3.3.0]октану або його фармацевтично прийнятної солі. 3. Спосіб лікування деменції типу Альцгеймера в ступені від слабкого до помірного, синдрому дефіциту уваги, помірного порушення когнітивних здібностей або вікового погіршення пам'яті, який включає введення N-(5-хлорфуран-2-ілкарбоніл)-3,7-діазабіцикло[3.3.0]октану або його фармацевтично прийнятної солі. 4. Спосіб лікування синдрому дефіциту уваги або гіперактивності, який включає введення N-(5хлорфуран-2-ілкарбоніл)-3,7-діазабіцикло[3.3.0]октану або його фармацевтично прийнятної солі. 5. Спосіб лікування шизофренії, шизофреніформного розладу, порушення пізнавальної здатності при шизофренії і шизоафективного розладу, який включає введення N-(-5-хлорфуран2-ілкарбоніл)-3,7-діазабіцикло[3.3.0]октану або його фармацевтично прийнятної солі. 6. Фармацевтична композиція, яка містить як активний інгредієнт сполуку N-(5-хлорфуран-2ілкарбоніл)-3,7-діазабіцикло[3.3.0]октан або його фармацевтично прийнятну сіль і один або декілька фармацевтично прийнятних розріджувачів, ексципієнтів або інертних носіїв. 26 UA 98944 C2 Комп’ютерна верстка Г. Паяльніков Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 27
ДивитисяДодаткова інформація
Назва патенту англійськоюNicotinic acetylcholine receptorsub-type selective amides of diazabicycloalkanes
Автори англійськоюMazurov, Anatoly, Miao, Lan, Xiao, Yun-de, Hammond, Philip, S., Miller, Craig, H., Akireddy, Srinivisa, Rao, Murthy, V. Srinivasa, Whitaker, Regina C., Breining, Scott R., Melvin, Matt, S.
Назва патенту російськоюАмиды диазабициклоалканов, селективные относительно ацетилхолинового подтипа никотиновых рецепторов
Автори російськоюМазуров Анатолий, Мяо Лань, Сяо Юнь-де, Хеммонд Филип С., Миллер Крейг Х., Акиредди Сринивиса Рао, Мерти В. Сриниваса, Уитакер Реджина С., Брейнинг Скотт Р., Мелвин Метт С.
МПК / Мітки
МПК: C07D 487/04, C07D 471/08, A61K 31/407, A61P 25/00
Мітки: рецепторів, діазабіциклоалканів, ацетилхолінового, підтипу, аміди, селективні, відносної, нікотинових
Код посилання
<a href="https://ua.patents.su/29-98944-amidi-diazabicikloalkaniv-selektivni-vidnosno-acetilkholinovogo-pidtipu-nikotinovikh-receptoriv.html" target="_blank" rel="follow" title="База патентів України">Аміди діазабіциклоалканів, селективні відносно ацетилхолінового підтипу нікотинових рецепторів</a>
Попередній патент: Високоафінні антитіла людини до рецептора il-4 людини
Наступний патент: Водна гербіцидна композиція, спосіб її одержання та спосіб контролю небажаної рослинності
Випадковий патент: Малогабаритна переносна пічка з примусовою подачею повітря