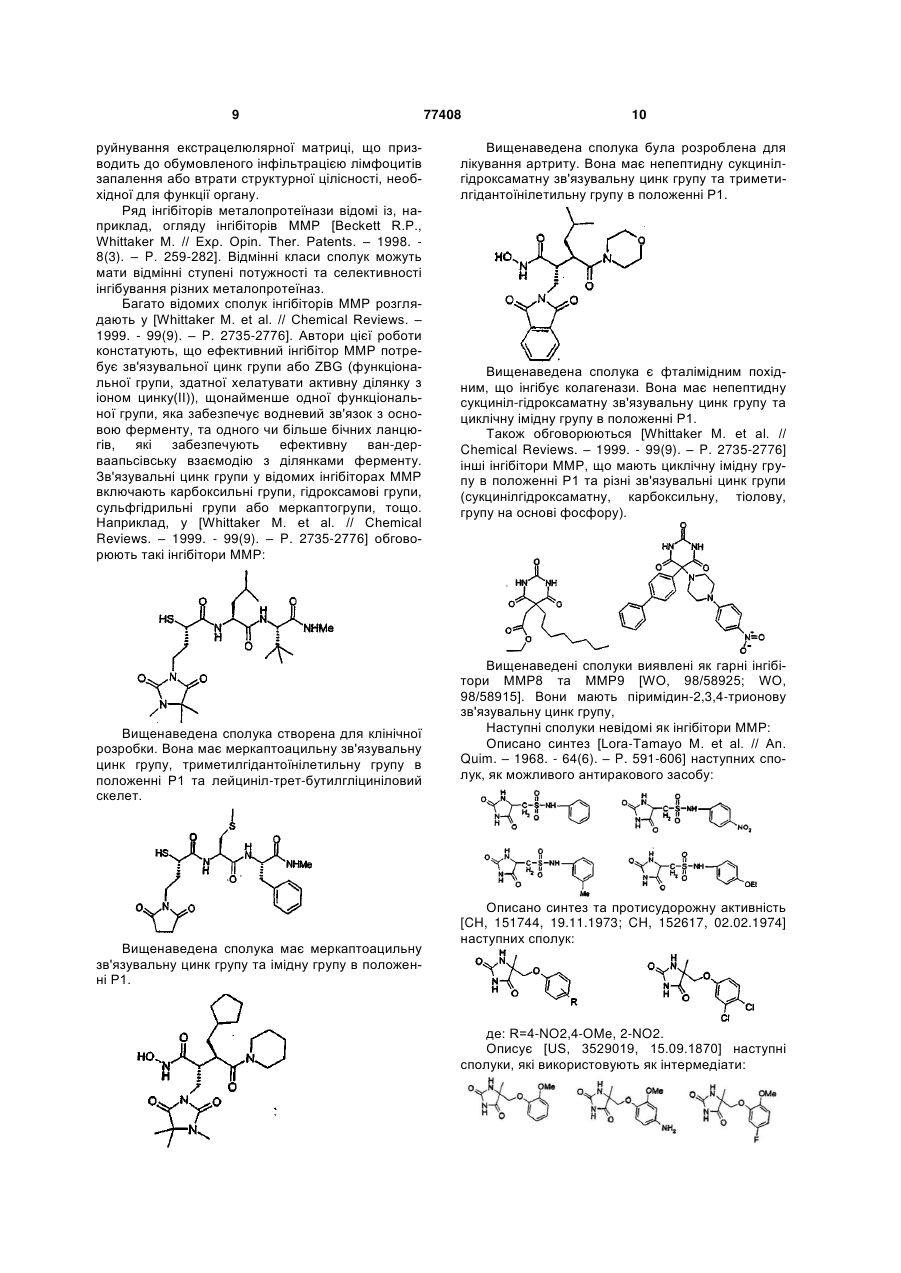
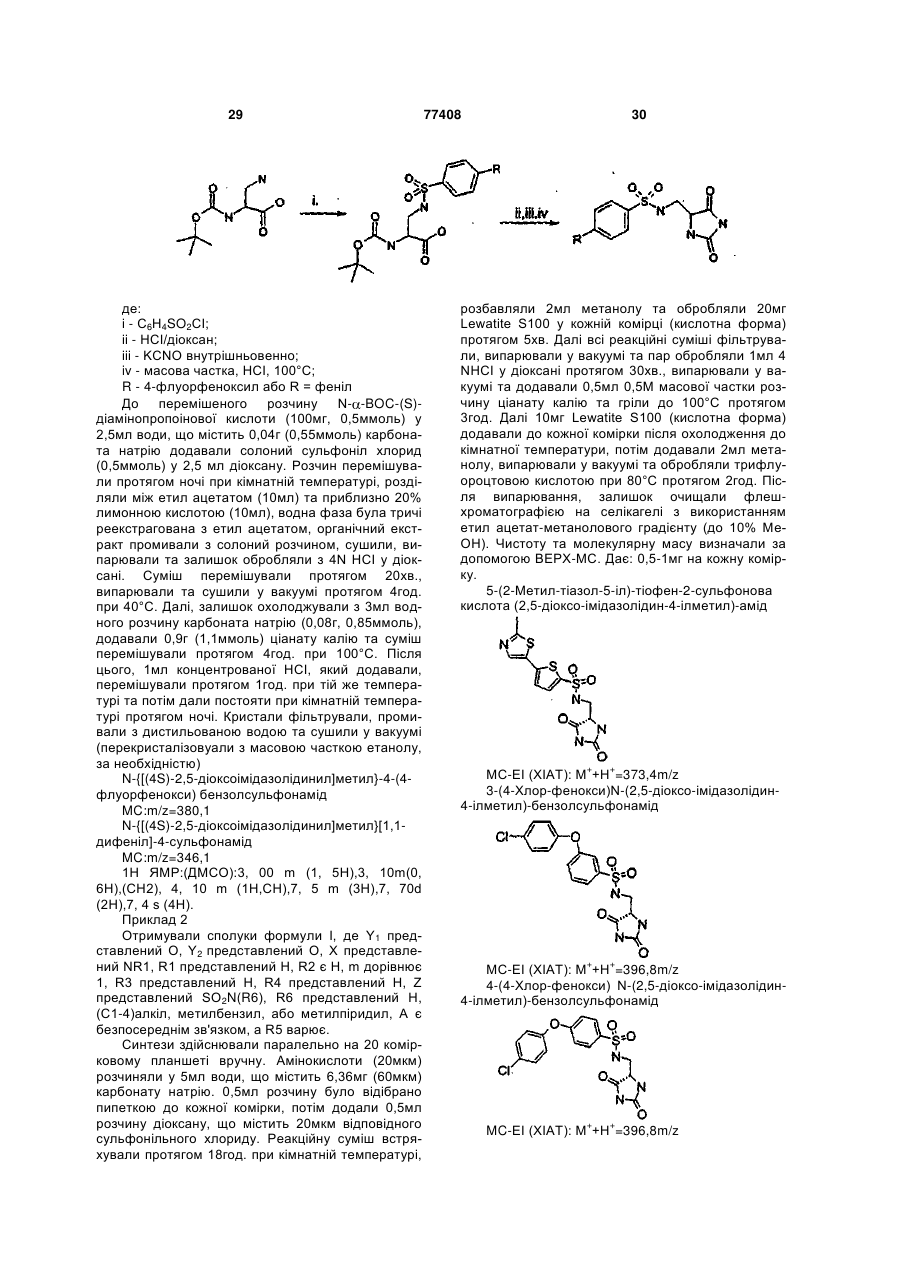
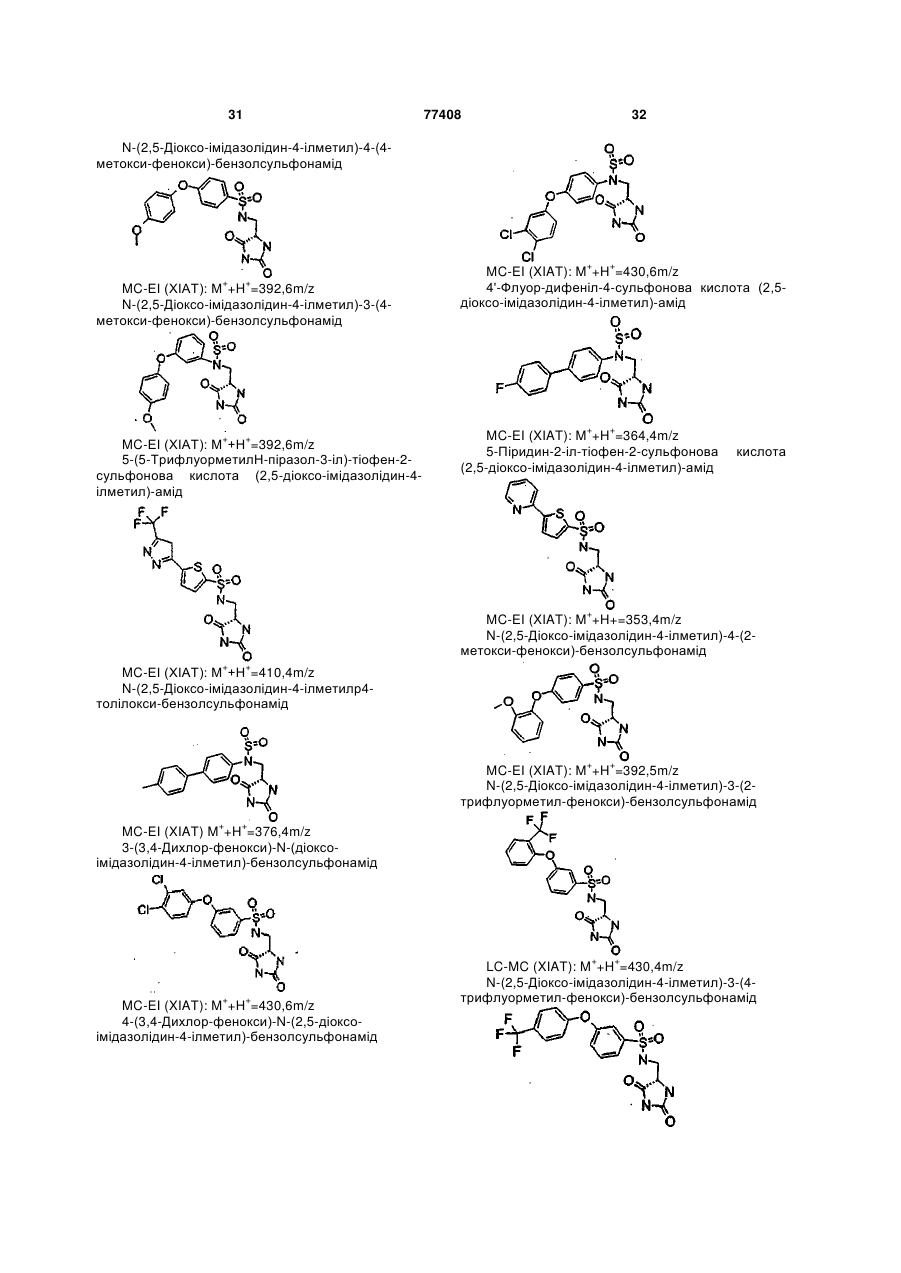
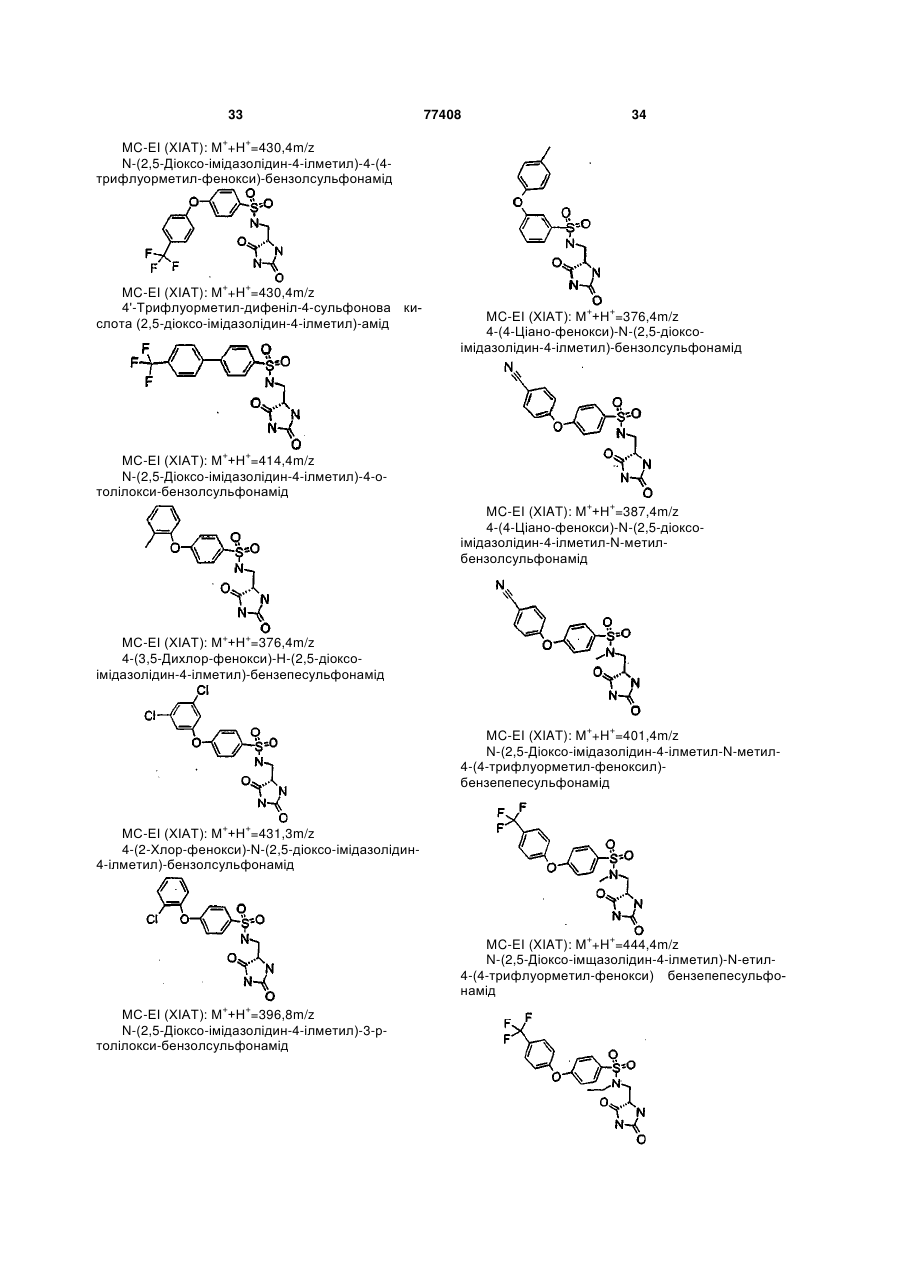
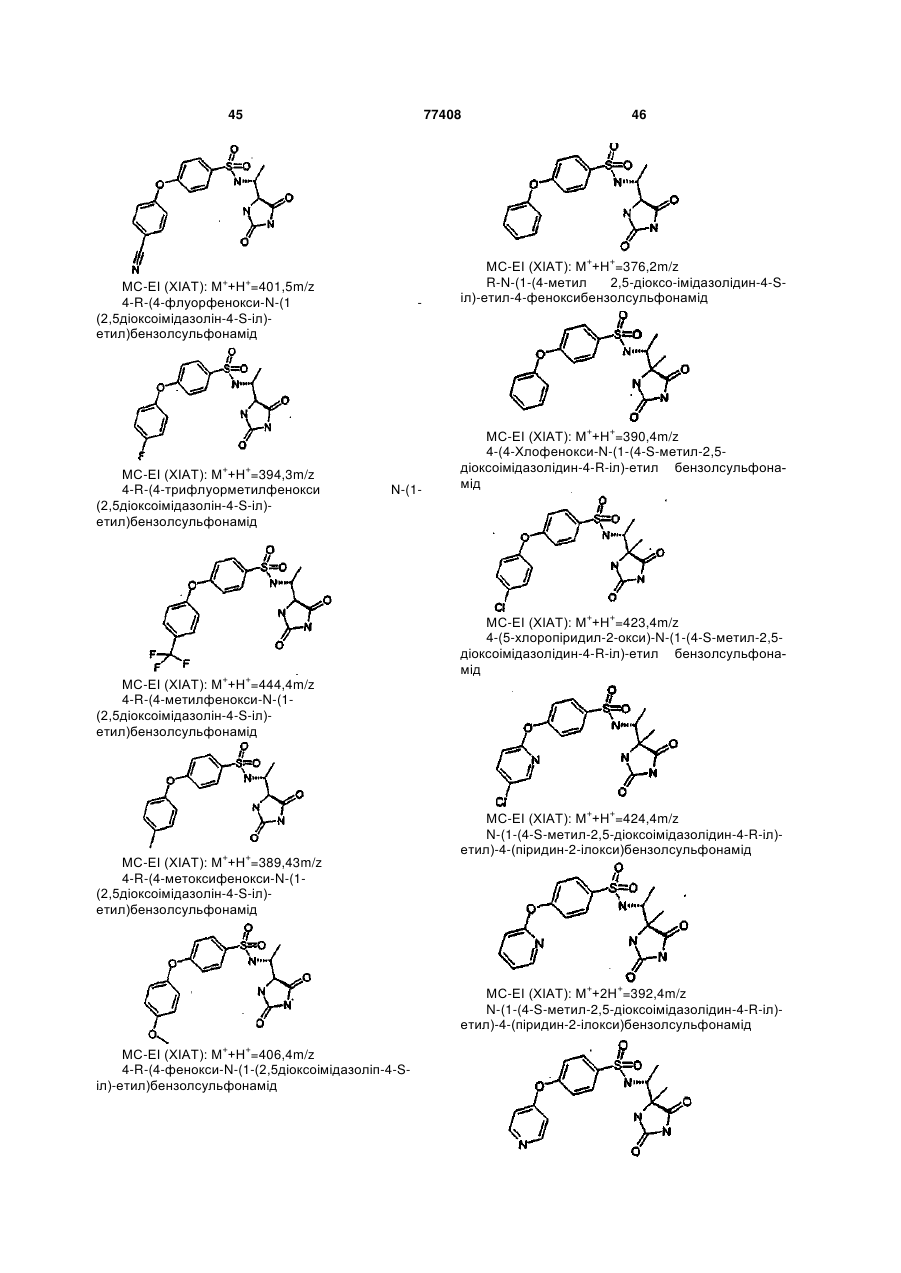
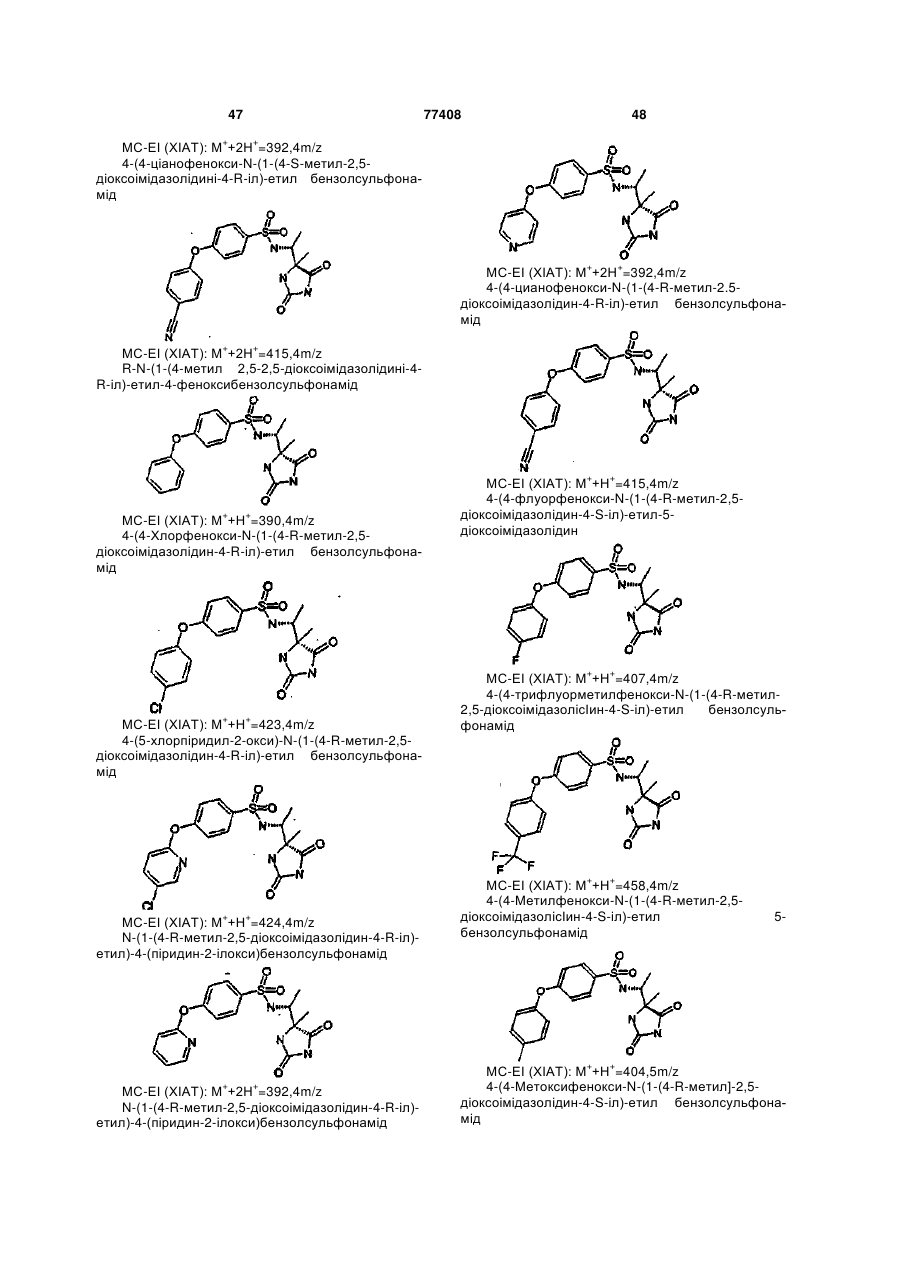
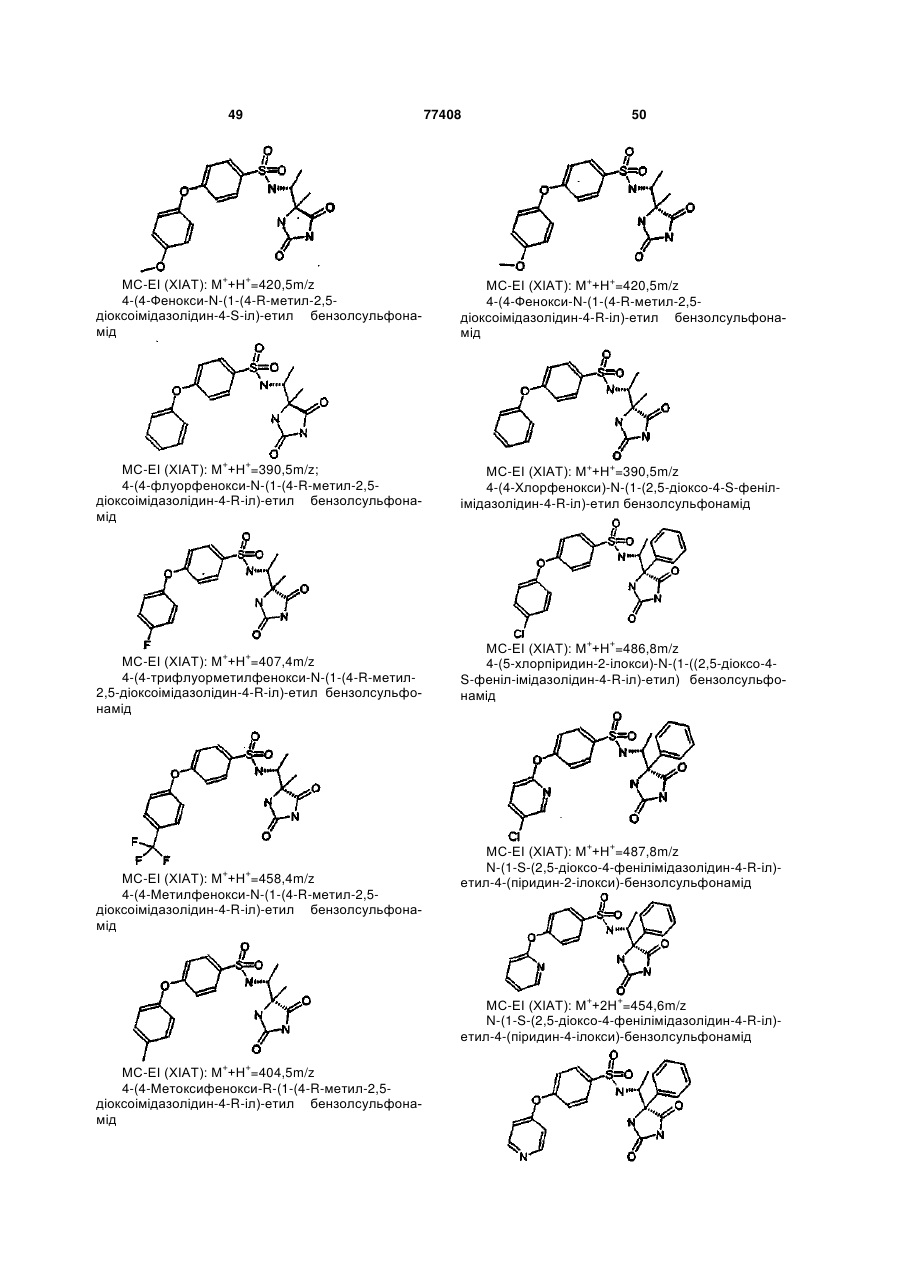
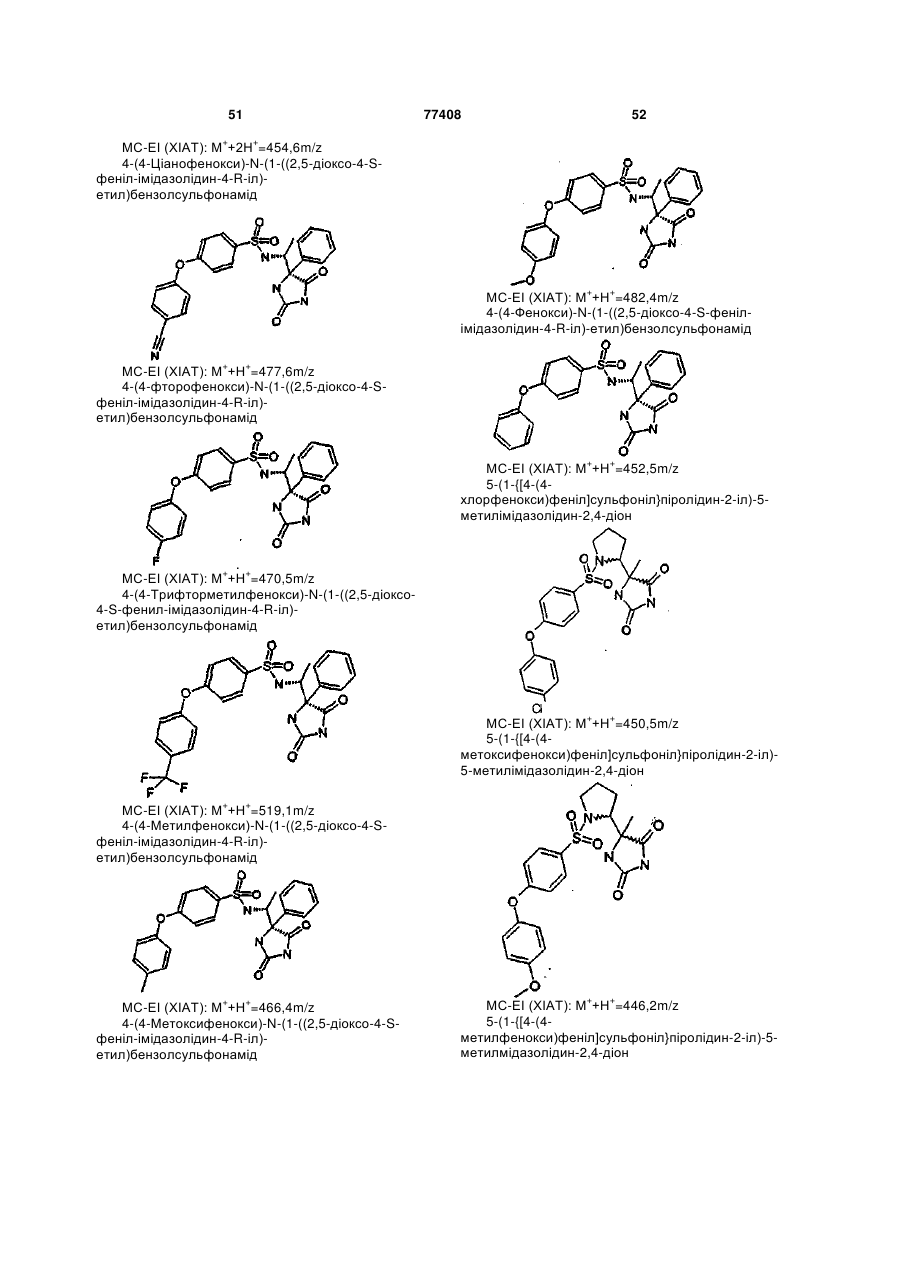
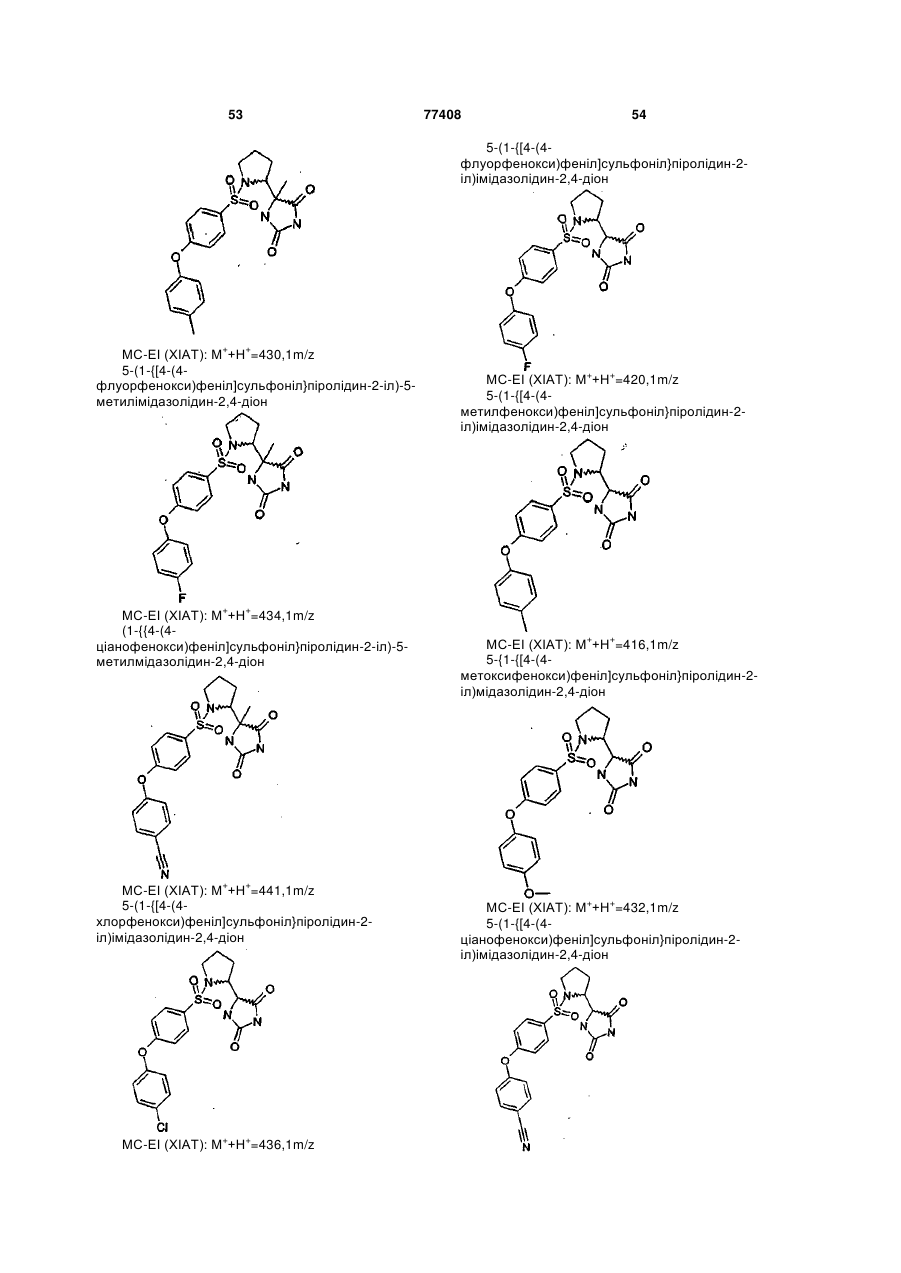
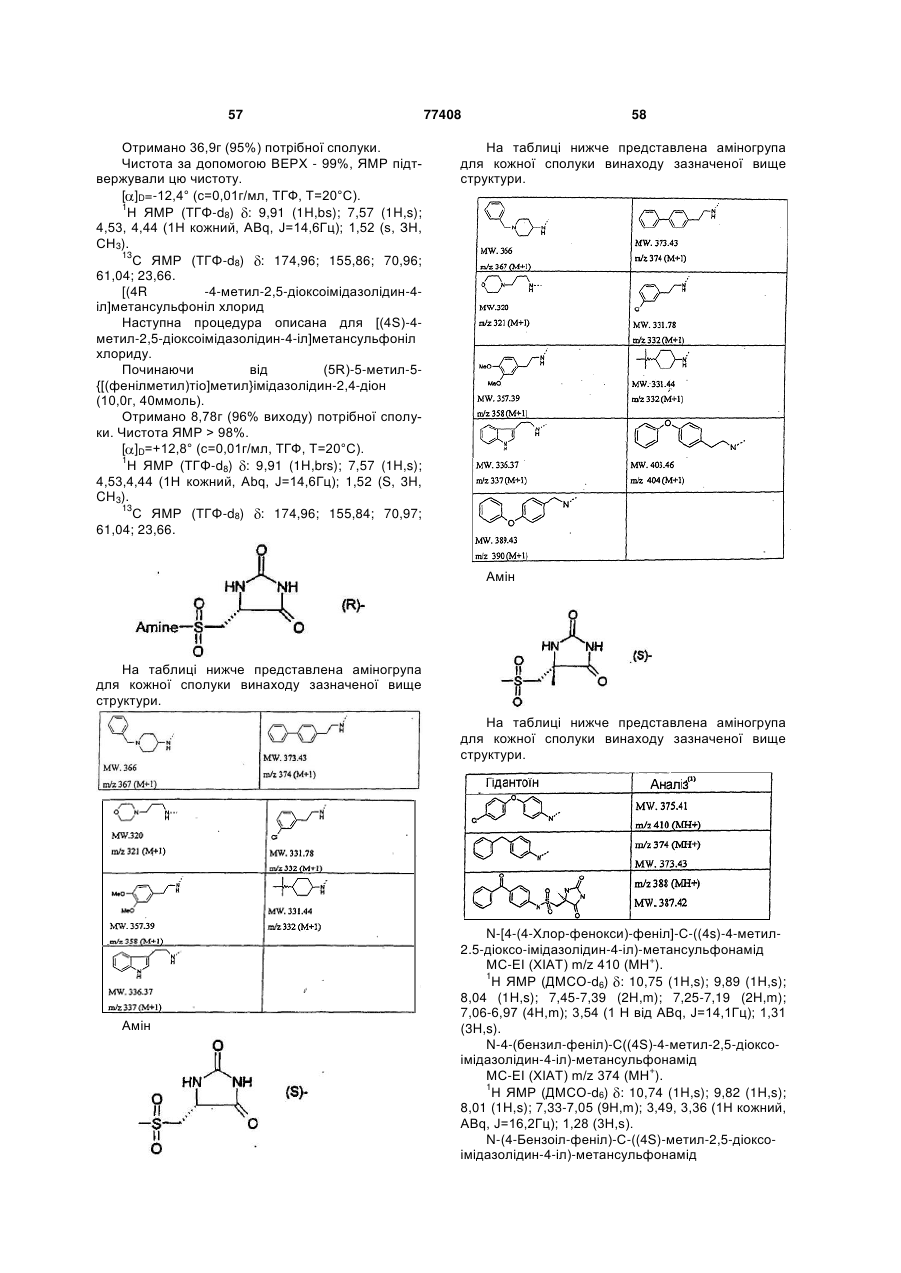
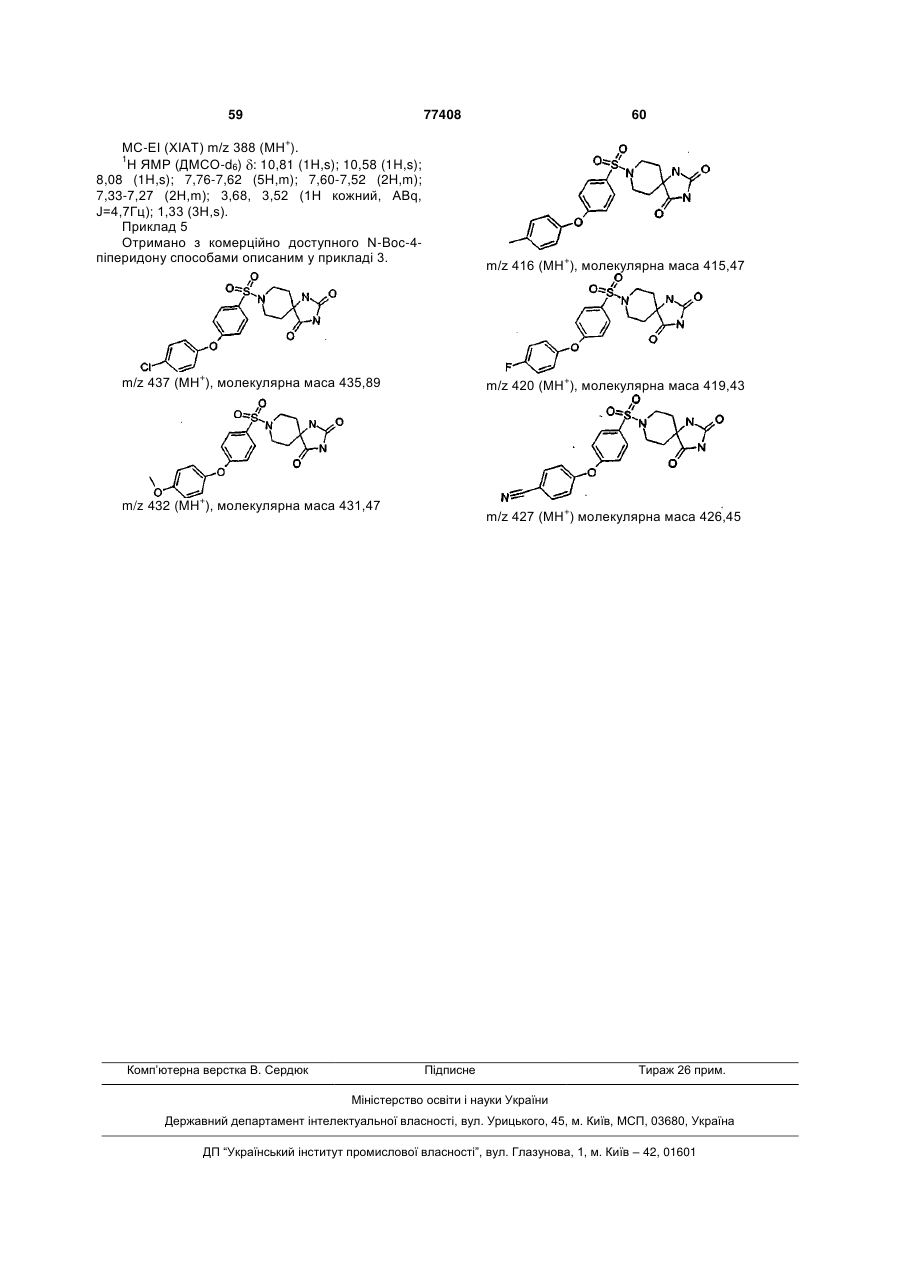
Інгібітори металопротеїнази, фармацевтична композиція на їх основі та їх застосування
Номер патенту: 77408
Опубліковано: 15.12.2006
Автори: Лундквіст Мікаель, Златоідскі Паволь, Мунк Аф Росенскельд Магнус, Лепісте Матті, Ерікссон Андерс
Формула / Реферат
1. Сполука формули І або її фармацевтично прийнятна сіль
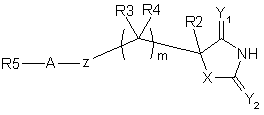 , І
, І
де
X є NR1;
Y1 та Y2 є О;
Z вибрано з групи: SО2N(R6) або N(R7)SО2;
m дорівнює 1;
А вибрано з групи: безпосередній зв'язок або (С1-6)алкіл,
R1 є Н або (С1-3)алкіл;
R2 та R3 незалежно вибрані з групи: Н, (С1-6)алкіл та феніл,
R4 є H;
R6 вибрано з групи: Н, (С1-6)алкіл, (С1-6)алкілфеніл та (С1-6)алкілгетероарил;
як варіант, R2 та R6 можуть бути об'єднаними з утворенням кільця, що містить до 6 кільцевих атомів, або R3 та R6 можуть бути об'єднаними з утворенням кільця, що містить до 6 кільцевих атомів;
R5 представляє моноциклічну або дициклічну групу, яка містить одну або дві кільцеві структури, кожна з яких містить до 6 кільцевих атомів, що незалежно вибрано з групи: циклоалкіл, феніл, гетероциклоалкіл або гетероарил, кожна кільцева структура незалежно, як варіант, заміщена одним чи більше замісниками, незалежно вибраними з групи: галоген, (С1-6)алкіл, (С1-6)алкоксил та ціаногрупа, де будь-який алкіл у будь-якому заміснику може бути сам, як варіант, заміщений однією чи більше групами, що вибрано з галогену;
коли R5 представляє дициклічну групу, кожна кільцева структура об'єднана з наступною кільцевою структурою безпосереднім зв'язком, -О-, (С1-6)алкілом або конденсована з наступною кільцевою структурою;
R7 є H;
за умови, що:
коли R1 є Н, Z представлений SО2N(R6), R6 представлений Н, R2 представлений Н, R3 представлений Н та А представлений безпосереднім зв'язком, тоді R5 не є феніл, р-етоксифеніл, m-метилфеніл; р-метилфеніл; р-хлорфеніл або 2-піримідиніл;
коли R1 є Н, Z є SO2N(R6), R6 є (С1-6)алкіл, R2 є Н, R3 є (С1-6)алкіл, R3 та R6 об'єднані з утворенням 5-членного кільця, та А є безпосереднім зв'язком, тоді R5 не є феніл.
2. Сполука формули І за п. 1 або її фармацевтично прийнятна сіль, де R1 представлений Н, a Z представлений SO2N(R6).
3. Сполука за будь-яким з п. 1 або п. 2 або її фармацевтично прийнятна сіль, де R2 є Н або (С1-6)алкіл.
4. Сполука за будь-яким з попередніх пунктів або її фармацевтично прийнятна сіль, де R3 є Н або метил.
5. Сполука формули І за будь-яким з попередніх пунктів або її фармацевтично прийнятна сіль, де R3 та R6 разом утворюють 5- або 6-членне кільце.
6. Сполука формули І за будь-яким з попередніх пунктів або її фармацевтично прийнятна сіль, де R5 містить, необов'язково, одно- або двічі заміщений феніл або гетероарильні 5- або 6-членні кільця.
7. Сполука формули І за будь-яким з попередніх пунктів або її фармацевтично прийнятна сіль, де R5 представлений дициклічною групою.
8. Сполука формули І за п. 1 або її фармацевтично прийнятна сіль, де R1 представлений Н, R2 є Н, R3 представлений Н, Z представлений SO2N(R6), R6 є Н, (С1-4)алкіл, бензил або СН2-піридил, А є безпосереднім зв'язком, та R5 представлений дициклічною групою, що містить дві, як варіант, заміщені кільцеві структури.
9. Сполука формули І за п. 1 або її фармацевтично прийнятна сіль, де R1 представлений Н, R2 є Н або метил, R3 є Н або метил, Z представлений SO2N(R6), R6 представлений Н, А є безпосереднім зв'язком, та R5 представлений дициклічною групою, що містить дві, як варіант, заміщені кільцеві структури.
10. Сполука формули II або її фармацевтично прийнятна сіль
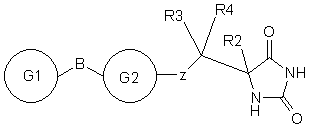 , II
, II
де
кожний з G1 та G2 є моноциклічною кільцевою структурою, що містить до 6 кільцевих атомів, що незалежно вибрані з групи: феніл, гетероциклоалкіл або гетероарил, кожна кільцева структура незалежно, як варіант, заміщена одним чи двома замісниками, незалежно вибраними з групи: галоген, ціаногрупа, (С1-6)алкіл та (С1-6)алкоксил, де будь-який алкіл у будь-якому заміснику може бути сам, як варіант, заміщений однією чи більше групами, вибраними з галогену;
Z представлений SO2N(R6);
В вибрано з групи: безпосередній зв'язок, О або -СН2;
R2 вибрано з групи: Н або (С1-6)алкіл,
R3 є Н або (С1-3)алкіл;
R6 є Н, або R6 є (С1-3)алкіл, як варіант, заміщений фенілом;
як варіант, R2 та R6 можуть бути об'єднаними з утворенням кільця, що містить до 6 кільцевих атомів, або R3 та R6 можуть бути об'єднаними з утворенням кільця, що містить до 6 кільцевих атомів.
11. Сполука формули II за п. 10 або її фармацевтично прийнятна сіль, де В є безпосереднім зв'язком або О.
12. Сполука формули II за пп. 10-11 або її фармацевтично прийнятна сіль, де R3 представлений Н.
13. Сполука формули II за будь-яким з пп. 10-12 або її фармацевтично прийнятна сіль, де R6 є Н, бензил або метиленпіридин.
14. Сполука формули II за будь-яким з пп. 10-13 або її фармацевтично прийнятна сіль, де G1 та G2, кожний, вибрано з групи: феніл або гетероарил.
15. Сполука формули II за будь-яким з пп. 10-14 або її фармацевтично прийнятна сіль, де R3 та R6 разом утворюють 5- або 6-членне кільце.
16. Фармацевтична композиція, яка містить сполуку формули І за п. 1 або її фармацевтично прийнятну сіль та фармацевтично прийнятний носій.
17. Фармацевтична композиція, яка містить сполуку формули II за п. 10 або її фармацевтично прийнятної солі та фармацевтично прийнятний носій.
18. Спосіб лікування опосередкованих металопротеїназою хвороби або стану, який включає уведення теплокровній тварині терапевтично ефективної кількості сполуки формули І або формули II або її фармацевтично прийнятну сіль.
19. Застосування сполуки формули І або формули II або її фармацевтично прийнятної солі у виробництві медикаменту для застосування при лікуванні хвороби або стану, опосередкованих одним чи більше металопротеїназними ферментами.
Текст
1. Сполука формули І або її фармацевтично прийнятна сіль R3 R4 Y R2 1 R5 A z NH m І X Y2 77408 (21) 2003098168 (22) 13.03.2002 (24) 15.12.2006 (86) PCT/SE02/00478, 13.03.2002 (31) 0100902-6 (32) 15.03.2001 (33) SE (46) 15.12.2006, Бюл. № 12, 2006 р. (72) Ерікссон Андерс , SE, Лепісте Матті , SE, Лундквіст Мікаель , SE, Мунк Аф Росенскельд, SE, Златоідскі Паволь , SE (73) АСТРАЗЕНЕКА АБ, SE (56) Chemical Abstracts, Volume 65, 1966, ABSTRACT No. 13684 h STN International, File CAPLUS, CAPLUS accession number 1968:506154, Document number 69:106154 WO 9906361 A2, 11.02.1999 WO 9924399 A1, 20.05.1999 WO 0105756 A1, 25.01.2001 2 , де X є NR1; Y1 та Y2 є О; Z вибрано з групи: SО2N(R6) або N(R7)SО2; m дорівнює 1; А вибрано з групи: безпосередній зв'язок або (С16)алкіл, R1 є Н або (С1-3)алкіл; UA 1 (11) (54) ІНГІБІТОРИ МЕТАЛОПРОТЕЇНАЗИ, ФАРМАЦЕВТИЧНА КОМПОЗИЦІЯ НА ЇХ ОСНОВІ ТА ЇХ ЗАСТОСУВАННЯ (13) C2 ДО ПАТЕНТУ НА ВИНАХІД (19) ДЕРЖАВНИЙ ДЕПАРТАМЕНТ ІНТЕЛЕКТУАЛЬНОЇ ВЛАСНОСТІ 3 R2 та R3 незалежно вибрані з групи: Н, (С1-6)алкіл та феніл, R4 є H; R6 вибрано з групи: Н, (С1-6)алкіл, (С16)алкілфеніл та (С1-6)алкілгетероарил; як варіант, R2 та R6 можуть бути об'єднаними з утворенням кільця, що містить до 6 кільцевих атомів, або R3 та R6 можуть бути об'єднаними з утворенням кільця, що містить до 6 кільцевих атомів; R5 представляє моноциклічну або дициклічну групу, яка містить одну або дві кільцеві структури, кожна з яких містить до 6 кільцевих атомів, що незалежно вибрано з групи: циклоалкіл, феніл, гетероциклоалкіл або гетероарил, кожна кільцева структура незалежно, як варіант, заміщена одним чи більше замісниками, незалежно вибраними з групи: галоген, (С1-6)алкіл, (С1-6)алкоксил та ціаногрупа, де будь-який алкіл у будь-якому заміснику може бути сам, як варіант, заміщений однією чи більше групами, що вибрано з галогену; коли R5 представляє дициклічну групу, кожна кільцева структура об'єднана з наступною кільцевою структурою безпосереднім зв'язком, -О-, (С16)алкілом або конденсована з наступною кільцевою структурою; R7 є H; за умови, що: коли R1 є Н, Z представлений SО2N(R6), R6 представлений Н, R2 представлений Н, R3 представлений Н та А представлений безпосереднім зв'язком, тоді R5 не є феніл, р-етоксифеніл, mметилфеніл; р-метилфеніл; р-хлорфеніл або 2піримідиніл; коли R1 є Н, Z є SO2N(R6), R6 є (С1-6)алкіл, R2 є Н, R3 є (С1-6)алкіл, R3 та R6 об'єднані з утворенням 5-членного кільця, та А є безпосереднім зв'язком, тоді R5 не є феніл. 2. Сполука формули І за п. 1 або її фармацевтично прийнятна сіль, де R1 представлений Н, a Z представлений SO2N(R6). 3. Сполука за будь-яким з п. 1 або п. 2 або її фармацевтично прийнятна сіль, де R2 є Н або (С16)алкіл. 4. Сполука за будь-яким з попередніх пунктів або її фармацевтично прийнятна сіль, де R3 є Н або метил. 5. Сполука формули І за будь-яким з попередніх пунктів або її фармацевтично прийнятна сіль, де R3 та R6 разом утворюють 5- або 6-членне кільце. 6. Сполука формули І за будь-яким з попередніх пунктів або її фармацевтично прийнятна сіль, де R5 містить, необов'язково, одно- або двічі заміщений феніл або гетероарильні 5- або 6-членні кільця. 7. Сполука формули І за будь-яким з попередніх пунктів або її фармацевтично прийнятна сіль, де R5 представлений дициклічною групою. 8. Сполука формули І за п. 1 або її фармацевтично прийнятна сіль, де R1 представлений Н, R2 є Н, R3 представлений Н, Z представлений SO2N(R6), R6 є Н, (С1-4)алкіл, бензил або СН2-піридил, А є безпосереднім зв'язком, та R5 представлений дициклічною групою, що містить дві, як варіант, заміщені кільцеві структури. 77408 4 9. Сполука формули І за п. 1 або її фармацевтично прийнятна сіль, де R1 представлений Н, R2 є Н або метил, R3 є Н або метил, Z представлений SO2N(R6), R6 представлений Н, А є безпосереднім зв'язком, та R5 представлений дициклічною групою, що містить дві, як варіант, заміщені кільцеві структури. 10. Сполука формули II або її фармацевтично прийнятна сіль R3 R4 O R2 G1 B G2 NH z N H II O , де кожний з G1 та G2 є моноциклічною кільцевою структурою, що містить до 6 кільцевих атомів, що незалежно вибрані з групи: феніл, гетероциклоалкіл або гетероарил, кожна кільцева структура незалежно, як варіант, заміщена одним чи двома замісниками, незалежно вибраними з групи: галоген, ціаногрупа, (С1-6)алкіл та (С1-6)алкоксил, де будь-який алкіл у будь-якому заміснику може бути сам, як варіант, заміщений однією чи більше групами, вибраними з галогену; Z представлений SO2N(R6); В вибрано з групи: безпосередній зв'язок, О або СН2; R2 вибрано з групи: Н або (С1-6)алкіл, R3 є Н або (С1-3)алкіл; R6 є Н, або R6 є (С1-3)алкіл, як варіант, заміщений фенілом; як варіант, R2 та R6 можуть бути об'єднаними з утворенням кільця, що містить до 6 кільцевих атомів, або R3 та R6 можуть бути об'єднаними з утворенням кільця, що містить до 6 кільцевих атомів. 11. Сполука формули II за п. 10 або її фармацевтично прийнятна сіль, де В є безпосереднім зв'язком або О. 12. Сполука формули II за пп. 10-11 або її фармацевтично прийнятна сіль, де R3 представлений Н. 13. Сполука формули II за будь-яким з пп. 10-12 або її фармацевтично прийнятна сіль, де R6 є Н, бензил або метиленпіридин. 14. Сполука формули II за будь-яким з пп. 10-13 або її фармацевтично прийнятна сіль, де G1 та G2, кожний, вибрано з групи: феніл або гетероарил. 15. Сполука формули II за будь-яким з пп. 10-14 або її фармацевтично прийнятна сіль, де R3 та R6 разом утворюють 5- або 6-членне кільце. 16. Фармацевтична композиція, яка містить сполуку формули І за п. 1 або її фармацевтично прийнятну сіль та фармацевтично прийнятний носій. 17. Фармацевтична композиція, яка містить сполуку формули II за п. 10 або її фармацевтично прийнятної солі та фармацевтично прийнятний носій. 18. Спосіб лікування опосередкованих металопротеїназою хвороби або стану, який включає уведення теплокровній тварині терапевтично ефективної кількості сполуки формули І або формули II або її фармацевтично прийнятну сіль. 5 77408 6 19. Застосування сполуки формули І або формули II або її фармацевтично прийнятної солі у виробництві медикаменту для застосування при ліку ванні хвороби або стану, опосередкованих одним чи більше металопротеїназними ферментами. Даний винахід стосується сполук, корисних при інгібуванні металопротеїназ та особливо фармацевтичних композицій, що їх містять, а також їх використання. Сполуки цього винаходу є інгібіторами одного чи більше металопротеїназних ферментів. Металопротеїнази є надродиною протеїназ (ферментів), число яких в останні роки різко зросло. На основі структурних та функціональних досліджень ці ферменти розподілені на родини та підродини, як описано у [Hooper N.М. // FEBS Letters. – 1994. – 354. – P. 1-6]. Приклади металопротеїназ включають матричні металопротеїнази (ММР), як-то колагенази (ММР1, ММР8, ММР13), желатинази (ММР2, ММР9), стромелінази (ММР3, ММР10, ММР11), матрилізин (ММР7), металоеластаза (ММР12), енамелізин (ММР19), МТ-ММР (ММР14, ММР15, ММР16, ММР17); репролізин або адамалізин або родина MDC, яка включає секретази та шедази, як-то перетворюючі TNF ферменти (ADAM10 та ТАСЕ); астацинова родина, що включає ферменти, як-то перетворююча проколаген протеїназа (РСР); та інші металопротеїнази, як-то агреканаза, родина перетворюючих ендотелій ферментів та родина перетворюючих ангіотензин ферментів. Металопротеїнази, можна вважати, є важливими при гіперволемії фізіологічних хворобливих процесів, що включають корекцію тканини, як-то розвиток ембріону, утворення кісток та корекцію матки при менструації. Це базується на здатності металопротеїназ розщеплювати багато матричних субстратів, як-то колаген, протеоглікан та фібронектин. Металопротеїнази, можна також вважати, є важливими при перетворенні або секреції біологічно важливих клітинних посередників, як-то фактор некрозу пухлин (TNF); та посттрансляційне протеолізне перетворення, або втрата біологічно важливих мембранних білків, як-то рецептор CD23 з низькою спорідненістю до lgЕ (для повнішого огляду дивися [Hooper N.М. et al. // Biochem J. – 1997. – 321. – P. 265-279]). Металопротеїнази було пов'язано з багатьма хворобами або станами. Інгібування активності одної чи більше металопротеїназ може бути дуже корисним при цих хворобах або станах, наприклад: різних запальних та алергічних хворобах, якто, запалення суглобів (особливо ревматоїдний артрит, остеоартрит та подагра), запалення шлунково-кишкового тракту (особливо запальна хвороба кишечнику, виразковий коліт та гастрит), запалення шкіри (особливо псоріаз, екзема, дерматит); при метастазах або інвазії пухлин; при хворобі, асоційованій з нерегульованою деградацією екстрацелюлярної матриці, як-то остеоартрит; при резорбтивній хворобі кісток (як-то остеопороз та хвороба Педжета); при хворобах, асоційованих з порушеним ангіогенезом; асоційована з діабетом посилена корекція колагену, хвороба зубів (як-то гінгівіт), покриття виразками роговиці, покриття виразками шкіри, постоперативні стани (як-то анастамоз товстої кишки) та загоєння поранень шкіри; демієлінізуючі хвороби центральної та периферійної нервових систем (як-то розсіяний склероз); хвороба Альцгеймера; корекція екстрацелюлярної матриці, яку спостерігають при серцево-судинних хворобах, як-то рестеноз та атеросклероз; астма, риніт; та хронічні обструктивні хвороби легенів (COPD). ММР12, відома також як еластаза або металоеластаза макрофагів, була спочатку клонована у мишах [Shapiro et al. // J. Biol. Chem. – 1992. – 267. – P. 4664] та у людині ними ж у 1995р. ММР12 преференційно експресується в активованих макрофагах, та показано, що вона секретується з альвеолярних макрофагів курців [Shapiro et al. // J. Biol. Chem. - . 1993. – 268. – P. 23824], а також у пінних клітинах в атеросклеротичних ураженнях [Matsumoto et al. // Am. J. Pathol. – 1998 – 153. – P. 109]. Мишача модель COPD базується на контрольному зараженні мишей сигаретним димом протягом 6 місяців, двома сигаретами 6 діб на тиждень. Після цієї обробки у диких мишей виникає емфізема легенів. Коли уражених ММР12 мишей тестували у цій моделі, у них не виникало значної емфіземи, чітко вказуючи, що ММР-12 є ключовим ферментом у патогенезі COPD. Роль ММР, як-то ММР12 у COPD (емфізема та бронхіт) обговорено у [Anderson, Shinagawa. Current Opinion у Antiinflammation and Immunomodulatory Investigational // Drugs. – 1999. – 1. – P. 29-38]. Нещодавно було виявлено, що паління збільшує інфільтрацію макрофагів та похідну від макрофагів експресію ММР12 у бляшках Кангаварі сонної артерії людини [Matetzky S., Fishbein M.C. et al. // Circulation. Suppl. S. – 2000. - 102(18). – P. 36-39]. MMP13, або колагеназа 3, була спочатку клонована з похідної з пухлин мозку бібліотеки кДНК [Freije J.М.P. et al. // J. Biol. Chem. – 1994. - 269(24). – P. 16766- 16773]. ПЛР-РНК-аналіз РНК з великого числа тканин показав, що експресія ММР13 була обмежена карциномами мозку, оскільки вона не була виявлена у фіброаденомах мозку, нормальних або спочиваючих грудних залозах, плаценті, печінці, яєчнику, матці, простаті або завушній залозі або у лініях клітин раку мозку (T47-D, MCF-7 та ZR75-1). На додаток до цього спостереження ММР13 було виявлено у трансформованих епідермальних кератиноцитах [Johansson N. et al. // Cell Growth Differ. – 1997. - 8(2). – P. 243-250], сквамозно-клітинній карциномі [Johansson Ν. et al. // Am. J. Pathol. – 1997. - 151(2). – P. 499-508] та епідермальних пухлинах [Airola К. et al. // J. Invest. Dermatol, - 1997. - 109(2). – P. 225-231]. Ці результати підт 7 верджують, що ММР13 секретується у трансформованих епітеліальних клітинах та може бути включеною у деградацію екстрацелюлярної матриці та клітино-матричну взаємодію, пов'язану з метастазом, як зокрема спостерігали при ураженнях раком мозку та при злоякісному рості епітелію при карциногенезі шкіри. Нещодавно опубліковані дані свідчать, що ММР13 грає роль в обороті інших сполучних тканин. Наприклад, сумісна з ММР13-субстратною специфічністю та перевагою стосовно розкладання колагену типу II [Mitchell P.G. et al. // J. Clin. Invest. – 1996. - 97(3). – P. 761-768; Knauper V. et al. // Biochem. J. – 1996. – 271. – P. 1544-1550], MMP13, як припущено, грає роль протягом первинного утворення кісток та корекції скелета [Stahle-Backdahl М. et al. // Lab. Invest. – 1997. 76(5). – P. 717-728; Johansson N. et al. // Dey. Dyn. – 1997. - 208(3). – P. 387-397], при деструктивних хворобах суглобів, як-то ревматоїдний та остеоартрит [Wemicke D. et al. // J. Rheumatol. – 1996. – 23. – P. 590-595; Mitchell P.G. et al. // J. Clin. Invest. – 1996. - 97(3). – P. 761-768; Lindy O. et al. // Artritis Rheum. – 1997. - 40(8). – P. 1391-1399]; та при асептичному ослабленні заміни суглобу стегна [Imai S. et al. // J. Bone Joint Surg. Br. – 1998. 80(4). – P. 701-710]. MMP13 також залучено у xpoнічному пародонтозі дорослих, оскільки вона локалізована в епітелії хронічно запаленої слизової тканини ясен людини [Uitto V.J. et al. // Am. J. Pathol. – 1998. - 152(6). – P. 1489-1499] та при корекції колагенної матриці при хронічних пораненнях [Vaalamo М. et al. // J. Invest. Dermatol. – 1997. – 1090/ - P. 96-101]. MMP9 (Желатиназа В; 92 кДа Колагеназа типу IV; 92 кДа Желатиназа) є секретованим білком, який спочатку очищали, потім клонували та секвенсували [Wilhelm S.М. et al. // J. Biol Chem. – 1989. - 264(29). – P. 17213-17221], опублікована помилка у [J. Вірі Chem. – 1990. - 265(36). – P. 22570]. Нещодавній огляд ММР9 пропонує чудове джерело детальної інформації та посилань на цю протеазу [Vu Т.Н., Werb Ζ. Matrix Metalloproteinases / Ed. by W.С.Parks, R.P.Mecham. - Academic Press, 1998. – P. 15 - 148.]. Наступні відомості взяті з цього огляду Т.Н.Vu та Ζ.Werb (1998). Експресія ММР9 звичайно обмежена кількома типами клітин, включаючи трофобласти, остеокласти, нейтрофіли та макрофаги. Однак, її експресію можна індукувати у тих же самих клітинах та у інших типах клітин кількома посередниками, включаючи обробку клітин факторами росту або цитокінами. Вони є посередниками, часто залученими у початкову запальну реакцію. Як інші секретовані ММР, ММР9 вивільняється як неактивний профермент, який далі розщеплюється з утворенням активного ферменту. Потрібні для цієї активації протеази in vivo невідомі. Баланс активної ММР9 відносно неактивного ферменту далі регулюється in vivo взаємодією з ТІМР-1 (Інгібітор тканинної металопротеїнази-1), природно існуючим білком. ТІМР-1 приєднується до С-термінального регіону ММР9, призводячи до інгібування каталітичного домену ММР9. Баланс індукованої експресії проММРЭ, розщеплення про- в активну ММР9 та ная 77408 8 вність ТІМР-1 комбінують для визначення кількості каталітично активної ММР9, яка є присутньою на локальній ділянці. Протеолітично активна ММР9 атакує субстрати, які включають желатин, еластин та природні колагени типу IV та типу V; вона не має активності проти природного колагену типу І, протеогліканів або ламінінів. З'являється багато даних стосовно ролі ММР9 у різних фізіологічних та патологічних процесах. Фізіологічні ролі включають інвазію ембріональних трофобластів через епітелій матки на ранніх етапах ембріональної імплантації; деяку роль у рості та розвитку кісток; та міграцію запальних клітин з судинної системи у тканини. Вивільнення ММР-9, виміряне з використанням ферментного імунодослідження, було значно підвищеним у тканинних рідинах та в АМнадосадкових рідинах від нелікованих астматиків порівняно з астматиками з інших популяцій [Am. J. Resp. Cell & Mol. Biol. – 1997. - 17(5). – P. 583-591]. Також, збільшену експресію ММР9 виявлено у деяких інших патологічних станах, свідчачи про залучення ММР9 у хворобливі процеси, як-то COPD, артрит, метастаз пухлин, хвороба Альцгеймера, розсіяний склероз та руйнування тромбоцитів при атеросклерозі, призводячи до гострих коронарних станів, як-то інфаркт міокарду. ММР-8 (колагеназа-2, нейтрофільна колагеназа) є ферментом розміром 53 кДа родини матричних металопротеїназ, що преференційно експресується у нейтрофілах. Останні дослідження свідчать, що ММР-8 експресується також в інших клітинах, як-то остеоартритні хондроцити [Shlopov еt аl. // Artritis Rheum. – 1997. – 40. – P. 2065]. Вироблені нейтрофілами ММР можуть викликати корекцію тканини, а тому блокування ММР-8 повинно мати позитивний вплив при фіброзних хворобах, наприклад, легенів, та при деградативних хворобах типу емфіземи легенів. ММР-8 була також виявлена як зверхрегульована при остеоартриті, що свідчить, що блокування ММР-8 може також бути корисним при цій хворобі. ММР-3 (стромеліназа-1) є ферментом розміром 53 кДа родини матричних металопротеїназ. Активність ММР-3 продемонстрована у фібробластах, виділених із запалених ясен [Uitto V.J. et al. // J. Periodontal Res. – 1981. – 16. – P. 417-424], та рівні ферменту скорельовані з суворістю хвороби ясен [Overall С.Μ. et al. // J. Periodontal Res. - 1987. – 22. – P. 81-88]. ММР-3 продукуються також у базальних кератиноцитах при багатьох хронічних виразках [Saarialho-Kere U.К. et al. // J. Clin. Invest. – 1994. – 94. – P. 79-88]. Білок та мРНК ММР-3 виявлені у базальних кератиноцитах, межуючих, але на відстані, від краю поранення, в якому можливо представлені ділянки проліферуючого епідермісу. ММР-3 може тим заважати загоєнню епідермісу. Кілька дослідників продемонстрували стійке підвищення ММР-3 у синовіальних рідинах від пацієнтів з ревматоїдним та остеоартритом порівняно з контролем [Walakovits L.A. et al. // Artritis Rheum. – 1992. – 35. – P. 35-42; Zafarullah Μ. et al. // J. Rheumatol. – 1993. – 20. – P. 693-697]. Ці дослідження дають основу для думки, що інгібітор ММР-3 лікуватиме хвороби, при яких залучено 9 руйнування екстрацелюлярної матриці, що призводить до обумовленого інфільтрацією лімфоцитів запалення або втрати структурної цілісності, необхідної для функції органу. Ряд інгібіторів металопротеїнази відомі із, наприклад, огляду інгібіторів ММР [Beckett R.P., Whittaker Μ. // Εxρ. Opin. Ther. Patents. – 1998. 8(3). – P. 259-282]. Відмінні класи сполук можуть мати відмінні ступені потужності та селективності інгібування різних металопротеїназ. Багато відомих сполук інгібіторів ММР розглядають у [Whittaker Μ. et al. // Chemical Reviews. – 1999. - 99(9). – P. 2735-2776]. Автори цієї роботи констатують, що ефективний інгібітор ММР потребує зв'язувальної цинк групи або ZBG (функціональної групи, здатної хелатувати активну ділянку з іоном цинку(ІІ)), щонайменше одної функціональної групи, яка забезпечує водневий зв'язок з основою ферменту, та одного чи більше бічних ланцюгів, які забезпечують ефективну ван-дерваапьсівську взаємодію з ділянками ферменту. Зв'язувальні цинк групи у відомих інгібіторах ММР включають карбоксильні групи, гідроксамові групи, сульфгідрильні групи або меркаптогрупи, тощо. Наприклад, у [Whittaker Μ. et al. // Chemical Reviews. – 1999. - 99(9). – P. 2735-2776] обговорюють такі інгібітори ММР: Вищенаведена сполука створена для клінічної розробки. Вона має меркаптоацильну зв'язувальну цинк групу, триметилгідантоїнілетильну групу в положенні Р1 та лейциніл-трет-бутилгліциніловий скелет. Вищенаведена сполука має меркаптоацильну зв'язувальну цинк групу та імідну групу в положенні Р1. 77408 10 Вищенаведена сполука була розроблена для лікування артриту. Вона має непептидну сукцинілгідроксаматну зв'язувальну цинк групу та триметилгідантоїнілетильну групу в положенні Р1. Вищенаведена сполука є фталімідним похідним, що інгібує колагенази. Вона має непептидну сукциніл-гідроксаматну зв'язувальну цинк групу та циклічну імідну групу в положенні Р1. Також обговорюються [Whittaker Μ. et al. // Chemical Reviews. – 1999. - 99(9). – P. 2735-2776] інші інгібітори ММР, що мають циклічну імідну групу в положенні Р1 та різні зв'язувальні цинк групи (сукцинілгідроксаматну, карбоксильну, тіолову, групу на основі фосфору). Вищенаведені сполуки виявлені як гарні інгібітори ММР8 та ММР9 [WO, 98/58925; WO, 98/58915]. Вони мають піримідин-2,3,4-трионову зв'язувальну цинк групу, Наступні сполуки невідомі як інгібітори ММР: Описано синтез [Lora-Tamayo Μ. et al. // An. Quim. – 1968. - 64(6). – P. 591-606] наступних сполук, як можливого антиракового засобу: Описано синтез та протисудорожну активність [CH, 151744, 19.11.1973; CH, 152617, 02.02.1974] наступних сполук: де: R=4-NO2,4-OMe, 2-NO2. Описує [US, 3529019, 15.09.1870] наступні сполуки, які використовують як інтермедіати: 11 77408 Заявка [WO, 00/09103] описує сполуки корисні при лікуванні порушень зору, включаючи такі: Ми виявили новий клас сполук, що є інгібіторами металопротеїназ та представляють особливий інтерес стосовно інгібування ММР, як-то ММР12. Сполуки є інгібіторами металопротеїнази, що мають зв’язувальну метал групу, якої нема у відомих інгібіторах металопротеїнази. Зокрема, ми відкрили сполуки, що є потужними інгібіторами ММР12 та мають потрібні профілі активності. Сполуки за винаходом мають корисну потужність, селективність та/або фармакокінетичні властивості. Сполуки інгібіторів металопротеїназ даного винаходу мають зв’язувальну метал групу та одну чи більше функціональних груп або бічних ланцюгів, характерних тим, що зв’язувальна метал група має форму (k) де: Х – вибрано з групи: NR1, O, S; Y1, Y2 – незалежно вибрані з групи: O, S; R1 – вибрано з групи: Н, алкіл, галогеналкіл. Будь-які вищенаведені алкіл групи можуть бути лінійними чи розгалуженими; будь-яка вищенаведена алкіл група представлена переважно (С17) алкілом та найпереважніше (С1-6) алкілом. Сполука інгібітору металопротеїнази є сполукою, що інгібує активність ферменту металопротеїнази, наприклад, ММР. Як не обмежувальний приклад, сполука інгібітору може виявляти величини ІК50 in vitro 0,1-10000нмоль/л, переважно в межах 0,1-1000нмоль/л. Зв'язувальна метал група є функціональною групою, здатною приєднувати іон металу до активної ділянки ферменту. Наприклад, зв'язувальна метал група буде зв'язувальною цинк групою в інгібіторах ММР, що зв'язують активну ділянку з іоном цинку(ІІ). Зв'язувальна метал група формули (k) базується на п'яти-членній кільцевій структурі та є переважно гідантоїновою групою, найпереважніше 5-заміщеним 1-Н,3-Н-імідазолідин-2,4діоном. Згідно з першим аспектом винаходу нами запропоновані сполуки формули І I 12 де: X - вибрано з групи: NR1, О, S; Υ1, Υ2 - незалежно вибрані з групи: О, S; Ζ - вибрано з групи: SO2N(R6), N(R7)SO2, N(R7)SO2 N(R6); m - дорівнює 1 або 2; А - вибрано з групи: безпосередній зв'язок, (С1-6) алкіл, (С1-6) галогеналкіл, або (С1-6) гетероалкіл, що містить гетерогрупу, яку вибрано з груп: N, О, S, SO, SO2, або містить дві гетерогрупи, які вибрані з груп: N, О, S, SO, SO2 та розділені щонайменше двома атомами карбону; R1 - вибрано з групи: Н, (С1-З) алкіл, галогеналкіл; R2, R3 - кожний незалежно вибрані з групи: Н, галоген (переважно фтор), алкіл, гетероалкіл, циклоалкіл, гетероциклоалкіл, арил, гетероарил, алкіларил, алкіл-гетероарил, гетероалкіл-арил, гетероалкіл- гетероарил, арил-алкіл, арил-гетероалкіл, гетероарил-алкіл, гетероарил-гетероалкіл, ариларил, арил-гетероарил, гетероарил-арил, гетероарил-гетероарил, циклоалкіл-алкіл, гетероциклоалкіл-алкіл; R4 - кожний незалежно вибрані з групи: Н, галоген (переважно фтор), (С1-З) алкіл або галоалкіл; R6 - вибрані з групи: Н, алкіл, гетероалкіл, гетероциклоалкіл, арил, гетероарил, алкіларил, алкіл-гетероарил, гетероалкіл-арил, гетероалкілгетероарил, арилалкіл, арил-гетероалкіл, гетероарил-алкіл, гетероарил-гетероалкіл, арил-арил, арил-гетероарил, гетероарил-арил, гетероарилгетероарил; Кожний з радикалів R2, R3 та R6 можуть, як варіант, бути незалежно заміщеними однією чи більше (переважно однією) групами, що вибрано з груп: алкіл, гетероалкіл, арил, гетероарил, галоген, галогеналкіл, гідроксил, алкоксил, галоалкоксил, тіол, алкілтіол, арилтіол, алкілсульфон, галогеналкілсульфон, арилсульфон, аміносульфон, Nалкіламіносульфон, Ν,Ν-діалкіламіносульфон, ариламіносульфон, аміногрупа, N-алкіламіногрупа, Ν,Ν-діалкіламіногрупа, амідогрупа, Nалкіламідогрупа, Ν,Ν-діалкіламідогрупа, ціаногрупа, сульфонаміногрупа, алкілсульфонаміногрупа, арилсульфонаміногрупа, амідиногрупа, Nаміносульфон-амідиногрупа, гуанідиногрупа, Νціано-гуанідиногрупа, тіогуанідиногрупа, 2-нітроетен-1,1-діамін, карбоксил, алкіл-карбоксил, нітро; Як варіант, R2 та R3 можуть бути об'єднаними з утворенням кільця, що містить до 7 кільцевих атомів, або R2 та R4 можуть бути об'єднаними з утворенням кільця, що містить до 7 кільцевих атомів, або R2 та R6 можуть бути об'єднаними з утворенням кільця, що містить до 7 кільцевих атомів, або R3 та R4 можуть бути об'єднаними з утворенням кільця, що містить до 7 кільцевих атомів, або R3 та R6 можуть бути об'єднаними з утворенням кільця, що містить до 7 кільцевих атомів, або R4 та R6 можуть бути об'єднаними з утворенням кільця, що містить до 7 кільцевих атомів; R5 - моноциклічна, дициклічна або трициклічна група, що містять одну, дві або три кільцеві структури, кожна з яких до 7 кільцевих атомів, що незалежно вибрані з груп: циклоалкіл, арил, гетероцик 13 лоалкіл або гетероарил, кожна кільцева структура незалежно, як варіант, заміщена одним чи більше замісниками, незалежно вибраними з групи: галоген, гідроксил, алкіл, алкоксил, галоалкоксил, аміногрупа, N-алкіламіногрупа, Ν,Ν-діалкіламіногрупа, алкілсульфонаміногрупа, алкілкарбоксіаміногрупа, ціаногрупа, нітрогрупа, тіол, алкілтіол, алкілсульфоніл, галогеналкілсульфоніл, алкіламіносульфоніл, карбоксилат, алкілкарбоксилат, амінокарбоксил, N-алкіламіно-карбоксил, Ν,Ν-діалкіламінокарбоксил, де будь-який радикал алкілу у будьякому заміснику може сам бути, як варіант, заміщеним одним чи більше групами, що вибрано з груп: галоген, гідроксил, алкоксил, галоалкоксил, аміногрупа, N-алкіламіногрупа, Ν,Νдіалкіламіногрупа, N-алкілсульфонаміногрупа, Νалкілкарбоксіаміногрупа, ціаногрупа, нітрогрупа, тіол, алкілтіол, алкілсульфоніл, Νалкіламіносульфоніл, карбоксилат, алкіл карбоксил, амінокарбоксил, N-алкіламінокарбоксил, Ν,Νдіалкіламінокарбоксил; коли R5 представляє дициклічну або трициклічну групу, де кожна кільцева структура об'єднана з наступною кільцевою структурою безпосереднім зв'язком, -О-, (С1-6) алкілом, (С1-6) галогеналкілом, (С1-6) гетероалкілом, (С1-6) алкенілом, (С16) алкінілом, сульфоном, або конденсована з наступною кільцевою структурою; R7 - вибрано з групи: (С1-6) алкіл, (С3-7) циклоалкіл, (С2-6) гетероалкіл, (С2-6) циклогетероалкіл; Будь-яка вищенаведена гетероалкільна група є заміщеною гетероатомом алкілу, що містить одну чи більше гетерогруп, незалежно вибраних з групи: Ν, О, S, SO, SO2, (гетерогрупою є гетероатом або група атомів); Будь-яка вищенаведена гетероциклоалкільна або гетероарильна група містить одну чи більше гетерогруп, незалежно вибраних з групи: N, О, S, SO, SO2; Будь-яка вищенаведена алкільна, алкенільна або алкінільна групи можуть бути лінійною чи розгалуженою; якщо не встановлено інше, будь-яка вищенаведена алкілгрупа представлена переважно (С1-7) алкілом, а найпереважніше (С1-6) алкілом; За умови, що: коли X представлений NR1, R1 представлений Η, Υ1 представлений О, Y2 представлений О, Ζ представлений SO2N(R6), R6 представлений Н, R2 представлений Н, m дорівнює 1, R3 представлений Н, R4 представлений Н, та А є безпосереднім зв'язком, тоді R5 не є фенілом, р-нітро-фенілом, ретоксифенілом або m-метилфенілом; коли X представлений S або NR1 та R1 представлений Η, Υ1 представлений О, Y2 представлений О, Ζ представлений SO2N(R6), R6 представлений алкіл, R2 представлений Н, m дорівнює 1, один з R3 та R4 представлений Η та інші представлені алкілом, R3 та R6 або R4 та R6 об'єднані з утворенням 5-членного кільця, та А є безпосереднім зв'язком, тоді як R5 не є фенілом. Переважні сполуки формули І є тими, де використано будь-що з одного чи більше з наступного: X представлений NR1; 77408 14 Ζ представлений SO2N(R6), особливо де S атом групи Ζ приєднаний до групи А у сполуці формули І; Щонайменше один з Υ1 та Υ2 представлений О; а особливо обидва Υ1 та Υ2 представлені О; m дорівнює 1; R1 представлений Н, (С1-3) алкіл, (С13) галоалкіл; особливо R1 представлений Н; R2 представлений Н, алкіл, гідроксіалкіл, аміноалкіл, циклоалкіл-алкіл, алкіл-циклоалкіл, арилалкіл, алкіларил, гетероалкіл, гетероциклоалкілалкіл, алкіл-гетероциклоалкіл, гетероарил-алкіл, гетероалкіл-арил; особливо R2 представлений алкіл, аміноалкіл або гетероарил-алкіл, R3 та/або R4 представлений Н; R3 та/або R4 представлений метил; R3 та R4 утворює 5- або 6-членне кільце (переважно 5-членне кільце) або R3 та R6 утворюють 5- або 6-членне кільце (переважно 5-членне кільце) або R4 та R6 утворюють 5-або 6-членне кільце (переважно 5-членне кільце); особливо R3 та R6 утворюють 5- або 6-членне кільце, а найпереважніше 5-членне кільце; R2 та R3 утворюють 5-членне кільце або R2 та R6 утворюють 5-членне кільце; R5 містить одне, два або три, як варіант, заміщені арильні або гетероарильні 5- або 6-членні кільця; R5 представляє дициклічну або трициклічну групу, що містить два або три, як варіант, заміщені кільцеві структури; R3 та R6 утворюють 5- або 6-членне кільце (переважно 5-членне кільце) або R4 та R6 утворюють 5- або 6-членне кільце (переважно 5членне кільце) та R5 представляє дициклічну або трициклічну групу, що містять два або три, як варіант, заміщені кільцеві структури. Особливо кращими сполуками формули І є такі, де R5 представлений дициклічну або трициклічну групу, що містять два або три, як варіант, заміщені кільцеві структури, Наприклад, особливими сполуками формули І є такі, де Y1 представлений О, Y2 представлений О, X представлений NR1, R1 представлений Н, R2 є Н, m дорівнює 1, R3 представлений Н, R4 представлений Η, Ζ представлений SO2N(R6), R6 представлений Н, (С1-4) алкіл, метилбензил, або метилпіридил, А є безпосереднім зв'язком, та R5 представляє дициклічну або трициклічну групу, що містять два або три, як варіант, заміщені кільцеві структури. Деяк так сполуки описані у прикладах 1 та 2. Іншими особливими сполуками формули І є такі, де Y1 представлений О, Y2 представлений О, X представлений NR1, R1 представлений Н, R2 представлений Н, метил, або бензил, m дорівнює 1, R3 представлений Η або метил, R4 представлений Η, Ζ є SO2N(R6), R6 представлений Н, А є безпосереднім зв'язком, та R5 представляє дициклічну або трициклічну групу, що містять два або три, як варіант, заміщені кільцеві структури. Деякі. такі сполуки описані у прикладі 3. Згідно з винаходом також запропоновано сполуки формули II 15 77408 II де: G1, G2 - кожний є моноциклічною кільцевою структурою, кожний з яких містять до 7 кільцевих атомів, що незалежно вибрані з груп: циклоалкіл, арил, гетероциклоалкіл або гетероарил, кожна кільцева структура незалежно, як варіант, заміщена одним чи двома замісниками, незалежно вибраними з групи: галоген, гідроксил, галоалкоксил, аміногрупа, N-алкіламіногрупа, Ν,Νдіалкіламіногрупа, ціаногрупа, нітрогрупа, алкіл, алкоксил, алкілсульфон, галогеналкілсульфон, алкілкарбамат, алкіламід, де будь-який радикал алкілу у будь-якому заміснику може сам, як варіант, бути заміщеним однією чи більше групами, що вибрано з груп: галоген, гідроксил, аміногрупа, Nалкіламіногрупа, Ν,Ν-діапкіламіногрупа, ціаногрупа, нітрогрупа, алкоксил, галоалкоксил; Ζ представлений SO2N(R6); В вибрано з групи: безпосередній зв'язок, О, (С1-6) алкіл, (С1-6) гетероалкіл; R2 вибрано з групи: Н, (С1-6) алкіл, галогеналкіл, гідроксіалкіл, алкоксіалкіл, аміноалкіл, (Nалкіламіно)алкіл, (N,N-діалкіламіно)алкіл, амідоалкіл, тіоалкіл, або R2 є групою формули III III де: С, D - незалежно вибрано з групи: безпосередній зв'язок, Н, (С1-С6) алкіл, (С1-С6) галогеналкіл, або (С1-С6) гетероалкіл, який містить один або два гетероатоми, що вибрано з групи: N, О або S так, що коли два гетероатоми представлені, вони розділені щонайменше двома атомами карбону; G3 - моноциклічна кільцева структура, що містять до 7 кільцевих атомів, що незалежно вибрано з групи: циклоалкіл, арил, гетероциклоалкіл або гетероарил, як варіант, заміщений одним чи двома замісниками, незалежно вибраними з групи: галоген, гідроксил, аміногрупа, N-алкіламіногрупа, Ν,Νдіалкіламіногрупа, ціаногрупа, нітрогрупа, алкіл, алкоксил, алкілсульфон, галогеналкілсульфон, або алкіл заміщений одним чи більше групами, що вибрано з групи: галоген, гідроксил, аміногрупа, Nалкіламіногрупа, Ν,Ν- · діалкіламіногрупа, ціаногрупа, нітрогрупа, алкоксил, галоалкоксил; Як варіант, R2 є заміщений замісниками, які обрано з групи: галоген, галогеналкіл, гідроксил, алкоксил, галоалкоксил, аміногрупа, аміноалкіл, Nалкіламіногрупа, Ν,Ν-діалкіламін, (^алкіламіно)алкіл, (Ч^діалкіламіно)алкіл, алкілсульфоном, аміносульфон, Ν-алкіламіно-сульфон, Ν,Ν-діалкіламіносульфон, амідогрупа, Nалкіламідогрупа, Ν,Ν-діалкіламідогрупа, ціаногрупа, сульфонаміногрупа, алкіл-сульфонаміногрупа, амідиногрупа, N-аміносульфон-амідиногрупа, гуа 16 нідиногрупа, N-ціано-гуанідиногрупа, тіогуанідиногрупа, 2-нітрогуанідиногрупа, 2-нітро-етен-1,1 діаміногрупа, карбоксил, алкілкарбоксил; R3, R4 - незалежно вибрані з групи: Η або (С13)алкіл; R6 - вибрано з групи: Н, (С1-3) алкіламіногрупа, або R6 представлений (С1-3) алкіл, як варіант, заміщений арилом, гетероарилом, гетероциклоалкілом; Як варіант, R2 та R3 можуть бути об’єднаними з утворенням кільця, що містить до 7 кільцевих атомів, або R2 та R4 можуть бути об’єднаними з утворенням кільця, що містить до 7 кільцевих атомів, або R2 та R6 можуть бути об’єднаними з утворенням кільця, що містить до 7 кільцевих атомів, або R3 та R4 можуть бути об’єднаними з утворенням кільця, що містить до 7 кільцевих атомів, або R3 та R6 можуть бути об’єднаними з утворенням кільця, що містить до 7 кільцевих атомів, або R4 та R6 можуть бути об’єднаними з утворенням кільця, що містить до 7 кільцевих атомів; Будь-яка вищенаведена гетероалкілгрупа є заміщеною гетероатомом алкілу, що містить одну чи більше гетерогруп, незалежно вибраних з групи: Ν, О, S, SO, SO2, (гетерогрупою є гетероатом або група атомів); Будь-яка вищенаведена гетероциклоалкільна або гетероарильна група містить одну чи більше гетерогруп, незалежно вибраних з групи: N, О, S, SO, SO2; Будь-яка вищенаведена алкільна, алкенільна або алкінільна група може бути лінійною чи розгалуженою; якщо не встановлено інше, будь-яка вищенаведена алкілгрупа представлена переважно (С1-7) алкілом, а найпереважніше (С1-6) алкілом. Переважні сполуки формули II є тими, де використано будь-що з одного чи більше з наступного: Ζ представлений SO2N(R6) та S атом групи Ζ приєднано до G2 кільця; В є безпосереднім зв'язком або О; R2 є, як варіант, незаміщений, або R2 вибраний з групи: Н, (С1-6)алкіл, арил-(С1-6)алкіл або гетероарил-(С1-6)алкіл, як варіант, заміщений замісниками, вибраними з групи галоген, галогеналкіл, гідроксил, алкоксил, галоалкоксил, аміногрупа, аміноалкіл, Ν-алкіламіногрупа, Ν,Νдіалкіламіногрупа, (N-алкіламіно)алкіл, (N,Nдіалкіламіно)алкіл, алкілсульфон, аміносульфон, ІМ-алкіламіносульфон, Ν,Ν-діалкіламіносульфон, амідогрупа, N-алкіламідогрупа, Ν,Νдіалкіламідогрупа, ціаногрупа, сульфонаміногрупа, алкіл-сульфонаміногрупа, амідиногрупа, Nаміносульфон-амідиногрупа, гуанідиногрупа, Nціано-гуанідиногрупа, тіогуанідиногрупа, 2нітрогуанідиногрупа, 2-нітро-етен-1,1-діаміногрупа, карбоксил, алкілкарбоксил; Кожний з R3 та R4 представлений Н; R6 представлений Н, бензил або метилепепіридин; G1 та G2, кожний, вибрано з групи: арил або гетероарил; R3 та R4 утворюють 5- або 6-членне кільце (переважно 5-членне кільце) або R3 та R6 утво 17 77408 рюють 5- або 6-членне кільце (переважно 5членне кільце) або R4 та R6 утворюють 5-або 6членне кільце (переважно 5-членне кільце); особливо R3 та R6 утворюють 5- або 6-членне кільце, а найпереважніше 5-членне кільце; R2 та R3 утворюють 5-членне кільце або R2 та R6 утворюють 5-членне кільце. Особливо кращі сполуки формули II є ті, де Ζ представлений SO2N(R6) та S атом групи Ζ приєднано до G2 кільця. Наприклад, особливі сполуки даного винаходу включають сполуки формули II де: а) В представлений безпосереднім зв'язком або О; та Ζ представлений SO2N(R6); та R2 вибрано з групи: Н, (С1-6)алкіл, арил-(С1-6)алкіл або гетероарил-(С1-6)алкіл, як варіант, заміщений галоген, галогеналкіл, гідроксил, алкоксил, галоалкоксил, аміногрупа, аміноалкіл, N-алкіламіногрупа, Ν,Ν-діалкіламіногрупа, (N-алкіламіно)алкіл, (Ν,Νдіалкіламіно)алкіл, алкілсульфоніл, аміносульфоніл, N-алкіламіно-сульфоніл, Ν,Ν-діалкіламіносульфоніл, амідогрупа, N-алкіламідогрупа, Ν,Νдіалкіламідогрупа, ціаногрупа, сульфонаміногрупа, алкіл-сульфонаміногрупа, амідиногрупа, Nаміносульфон-амідиногрупа, гуанідиногрупа, Nціано-гуанідиногрупа, тіогуанідиногрупа, 2нітрогуанідиногрупа, 2-нітро-етен-1,1-діаміногрупа, карбоксил, алкілкарбоксил; та кожний з R3 та R4 представлений Н; та R6 представлений Н, бензил або метилепепіридин; або (б) Ζ представлений SO2N(R6), та R3 представлений Η, та R4 представлений Η (сполуки формули II’) де R2 є, як варіант, незаміщений; переважно G1 та G2, кожний, вибрано з групи: арил або гетероарил: II’ Придатні значення для R2 включають наступні: Придатні значення для R5 включають наступні: 18 Треба розуміти, що певні замісники та ряд замісників у сполуках даного винаходу вибирають так, щоб попередити стерично небажані комбінації. Кожна представлена сполука представляє особливий та незалежний аспект винаходу. Коли у сполуках винаходу наявні оптично активні центри, ми виявляли усі індивідуальні оптично активні форми та їх комбінації як певні індивідуальні втілення винаходу, а також їх відповідні рацемати. Рацемати можна розділити на індивідуальні оптично активні форми з використанням відомих способів [March J. Advanced Organic Chemistry. 3rd Ed. - P. 104-107], включаючи, наприклад, утворення діастереомерних похідних, що мають звичайні оптично активні допоміжники, а потім розділенням і далі відщепленням допоміжних елементів. Треба розуміти, що сполуки згідно з даним винаходом можуть містити один чи більше асиметрично заміщених атомів карбону. Наявність одного чи більше цих асиметричних центрів (хіральні центри) у сполуці винаходу може давати стереоізомери, та у кожному випадку, як зрозуміло, поширюється на всі такі стереоізомери, включаючи енантіомери та діастереомери, та суміші, включаючи їх рацемічні суміші. Коли у сполуках винаходу наявні таутомери, ми виявили усі індивідуальні таутомерні форми та їх комбінації як певні індивідуальні втілення винаходу. Як визначено вище, сполуки представленого винаходу є інгібіторами металопротеїнази, особливо вони є інгібіторами ММР12. Кожне з вищенаведених визначень для сполуки даного винаходу представляє незалежне та особливе втілення винаходу. Деякі сполуки даного винаходу мають особливе використання як інгібітори ММР13 та/або ММР9 та/або ММР8 та/або ММР3. Сполуки даного винаходу виявляють сприятливий профіль селективності. Не вдаючись до теоретичних міркувань, сполуки даного винаходу, можна вважати, виявляють селективне інгібування для будь-якого одного з вищенаведених визначень стосовно будь-якої інгібіторної активності відносно ММР1, як необмежувальний приклад, вони можуть 19 виявляти в 100-1000 разів більшу селективність, ніж будь-яка інгібіторна активність відносно ММР1. Сполуки даного винаходу можна пропонувати як фармацевтично прийнятні солі. Вони включають кислотно-адитивні солі, як-то гідрохлорид, гідробромід, цитрат та малеат та солі, утворені з фосфатною та сульфатною кислотами. Згідно з наступним аспектом, придатними солями є солі основ, як-то сіль лужного металу, наприклад, натрію або калію, сіль лужноземельного металу, наприклад, кальцію або магнію, або сіль органічного аміну, наприклад, триетиламіну. Їх можна також пропонувати як in vivo здатні до гідролізу естери. Ними є фармацевтично прийнятні естери, що гідролізуються у тілі людини, утворюючи вихідну сполуку. Такі естери можна ідентифікувати уведенням, наприклад внутрішньовенно тестованій тварині, досліджуваної сполуки, а далі обстеженням рідин з організму тесттварини. Придатні in vivo здатні до гідролізу естери для карбоксилу включають метоксиметил та для гідроксилу включають форміл та ацетил, особливо ацетил. Для застосування сполуки інгібітору металопротеїнази винаходу (включаючи сполуку формул І або II) або її фармацевтично прийнятну сіль або здатний до гідролізу in vivo естер для терапевтичного лікування (включаючи профілактичне лікування) ссавців, включаючи людину, її звичайно формують згідно зі стандартною фармацевтичною практикою як фармацевтичну композицію. Тому згідно з наступним аспектом нами запропоновано фармацевтичну композицію, яка містить сполуку винаходу (як-то сполуку формул І або II) або її фармацевтично прийнятну сіль або здатний до гідролізу in vivo естер та фармацевтично прийнятний носій. Фармацевтичні композиції цього винаходу можна уводити стандартним чином при хворобі або стані, що треба лікувати, наприклад пероральним, локальним, парентеральним, букальним, назальним, вагінальним або ректальним уведенням або інгаляцією. Для цього сполуки цього винаходу можна формувати відомими з рівня техніки засобами, наприклад, у таблетки, капсули, водні або масляні розчини, суспензії, емульсії, креми, мазі, гелі, назальні спреї, супозиторії, високодисперсні порошки або аерозолі для інгаляції, а для парентерального застосування (включаючи внутрішньовенне, внутрішньом'язове або вливанням) стерильні водні або масляні розчини або суспензії або стерильні емульсії. На додаток до сполук представленого винаходу фармацевтична композиція цього винаходу може також містити, або бути співвживаною (одночасно або послідовно) з одним чи більше потрібними фармакологічними засобами при лікуванні одної чи більше хвороб або станів, згаданих вище. Фармацевтичні композиції цього винаходу звичайно вживатимуться людиною так, щоб, наприклад, отримати добову дозу 0,5-75мг/кг маси тіла (та переважно 0,5-30мг/кг маси тіла). Цю добову дозу можна давати поділеними дозами, якщо необхідно, точна кількість отриманої сполуки та шлях уведення залежить від маси, віку та статі 77408 20 пацієнта, якого лікують, та від певної хвороби або стану згідно з відомими з рівня техніки принципами. Звичайно одиничні дозовані форми містять приблизно 1-500мг сполуки цього винаходу. Тому згідно з наступним аспектом, нами запропоновано сполуку формули І або її фармацевтично прийнятну сіль або здатний до гідролізу in vivo естер для застосування у способі терапевтичного лікування людини або тварин або для застосування як терапевтичного засобу. Ми розкрили застосування при лікуванні хвороби або стану, опосередкованих одним чи більше металопротеїназних ферментів. Особливо ми розкрили застосування при лікуванні хвороби або стану, опосередкованих ММР12 та/або ММР13 та/або ММР9 та/або ММР8 та/або ММР3; особливо застосування при лікуванні хвороби або стану, опосередкованих ММР12 або ММР9; найкраще, застосування при лікуванні хвороби або стану, опосередкованих ММР12. Особливо нами запропоновано сполуку формули II або її фармацевтично прийнятну сіль або здатний до гідролізу in vivo естер для застосування у способі терапевтичного лікування людини або тварини або для застосування як терапевтичного засобу (як-то використання при лікуванні хвороби або стану, опосередкованих ММР 12 та/або ММР13 та/або ММР9 та/або ММР8 та/або ММР3; особливо ММР12 або ММР9; найкраще, коли ММР12). Згідно з подальшим аспектом нами запропоновано спосіб лікування опосередкованих металопротеїназою хвороби або стану, що включає уведення теплокровній тварині терапевтично ефективної кількості сполуки формули І або її фармацевтично прийнятної солі або здатного до гідролізу in vivo естеру. Ми також розкрили застосування сполуки формули І або її фармацевтично прийнятної солі або здатного до гідролізу in vivo попереднику у виробництві медикаменту для застосування при лікуванні хвороби або стану, опосередкованих одним чи більше металопротеїназних ферментів. Наприклад нами запропоновано спосіб лікування опосередкованих металопротеїназою хвороби або стану, що включає уведення теплокровній тварині терапевтично ефективної кількості сполуки формули II (або її фармацевтично прийнятної солі або здатного до гідролізу in vivo естеру). Також нами запропоновано застосування сполуки формули II (або її фармацевтично прийнятної солі або здатного до гідролізу in vivo попередника) у виробництві медикаменту для застосування при лікуванні хвороби або стану, опосередкованих одним чи більше металопротеїназних ферментів. Опосередковані металопротеїназою хвороби або стани включають астму, риніт, хронічні обструктивні хвороби легенів (COPD), артрит (так ревматоїдний артрит та остеоартрит), атеросклероз та рестеноз, рак, інвазію та метастаз, хвороби, при яких залучено деструкцію тканин, послаблення заміни суглобу стегна, хворобу зубів, фіброзну хворобу, інфаркт та хворобу серця, фіброз печінки та нирок, ендометріоз, хвороби, пов'язані з ослаб 21 77408 22 ленням екстрацелюлярної матриці, серцеву нестачу, аневрізми аорти, хвороби центральної нервової системи, як-то хвороба Альцгеймера та розсіяний склероз (МС), гематологічні розлади. Отримання сполук винаходу Згідно з наступним аспектом винаходу даний винахід стосується процесу отримання сполук формули І або II або її фармацевтично прийнятної солі або здатного до гідролізу in vivo естеру, як описано у (а) до (в) нижче. Треба розуміти, що багато потрібних вихідних матеріалів є комерційно або інакше доступними або їх можна синтезувати відомими способами чи знайти у науковій літературі. (а) Сполуки формули І, в яких кожний з Y1 та Y2 є О, Ζ представлений SO2N(R6), А є безпосереднім зв'язком, X представлений NR1, R1 представлений Н, R2 є Н, m дорівнює 1, R3 представлений Н, R4 представлений Н, та R5 та R6 визначені для формули І можна отримати згідно зі схемою 1. Коли R6 представлений Н, N1-ВОС-Рдіамінопропіонові похідні формули IV реагують з придатними сульфонільними хлоридами формули V у лужному середовищі до утворення сульфонамідів формули VI. Позбавлення захисту у кислотному середовищі, реакція з ціанатом калію до відповідної сечовини та кінцевої кільцизації у кислотному середовищі дає сполуки формули І. Коли R6 представлений алкіл, як-то метил, етил, пропіл, ізопропіл та н-бутил, N2-алкіл-N'ВОС-О-діамінопропіонінову кислоту формули IV отримують згідно з [Andruszkiewics R. // Pol. J. Chem. – 1988. – 62. – P. 257]. Коли R6 є, як варіант, заміщений бензил, метилбензил, метилпіридил, метил гетероарил, N2заміщену амінокислоту формули IV отримують згідно з [Helv. Chim. Acta. - 1963. – 46. – P. 327]. Схема 1: Реакції IV-VI переважно здійснили у придатному розчиннику, як варіант, у присутності основи протягом 1-24год. при температурі в межах від температури навколишнього середовища до температури кипіння під зворотним холодильником. Переважно, розчинники, як-то піридин, диметилформамід, тетрагідрофуран, ацетонітрил або дихлорметан використовують з такими основами як триетиламін, N-метилморфолін, піридин або лужні метали карбонатів при температурі зовнішнього середовища протягом часу реакції 2-16год., або докі не закінчиться реакція як визначено хроматографічним або спектроскопічним способами. Реакції сульфонільних хлоридів формули V з різними вторинними амінами попередньо описані у літературі, та варіації умов будуть очевидними фахівцям. Різні сполуки формули V є комерційно доступними або їх синтез описаний у літературі. Специфічні похідні формули VI можнуть бути отримані згідно зі способами, що відомі фахівцям. (б) Сполуки формули І, в яких кожний з Y1 та Y2 є 0, Ζ представлений SO2N(R6), R6 представлений Н, А є безпосереднім зв'язком, X представ лений NR1, R1 представлений Н, m дорівнює 1, та R2, R3, R4 та R5 визначені для формули І можна отримати згідно зі схемою 1. Сполуки, в яких R2 представлений Н, R3 представлений Η та R4 представлений алкіл або арил, можна отримати починаючи від відповідних ВОС N-захищених -аміно альдегидів формули VII, отриманих згідно з [Fehrentz J.A., Castro B. // Synthesis/ - 1983. – P. 676]. Сполуки, в як R2 є алкіл або арил, R3 представлений Η та R4 представлений алкілом або арилом, можна отримати починаючи від відповідних ВОС N-захищених -аміно кетонів формули VII, як представлено у схемі 2. ВОС N-захищені осаміно кетони отримують згідно з [Nahm S., Weinreb S.M. // Тетраhеdгоn Letl. – 1981. – 22. – P. 3815], як варіант коли R6 не представлений Н, згідно з [US, 4448717, A, 15.05.1984]. Деяк сполуки, які отримані способами представленим на схемі 2, описані у прикладі 3. Схема 2: 23 77408 Сполуки формули VII реагують з лужним ціанідом та карбонатом амонію (Strecker реакція), отримавши відповідні гідантоїни формули VIla. Діастеріоізомери можуть, як варіант, бути розділені після будь-яких трьох залишившихся стадій синтезу: карбамати формули VIla та сульфонамід сполуки формули І на силікагель хроматографії, після позбавлення захисту амінних інтермедіатів кристалізацією. Амінні інтермедіати, як варіант, використовують для безпосереднього сполучення з сульфонільними хлоридами формули V, як описано у сульфонілазації у (а) вище, у лужному середовищі до утворення сполуки формули І. Реакці VII до VIla переважно проходять у закритій сталевій посудині у водно-спиртовому розчиннику при 90-130°С протягом 3-16год. або доки не закінчиться реакція, що визначається хроматографічними або спектроскопічними способами. Обробка 1-4-кратним надлишком ціаніду, переважно 1-2 еквівалентого, та 2-6 кратним надлишком карбонату амонію, переважно 4-6 еквівалентним дає гідантоїни формули Vila. Позбавлення захисту та сульфонілазація, як у схемі 1 далі, дає сполуки формули І. Аміноальдегіди або кетони формули VII та їх захищені похідні є комерційно доступними або їх можна синтезувати способами для α-аміно альдегідів та кетонів формули VII. Специфічні похідні формули VIla можна отримати згідно зі способами, що відомі фахівцям. (в) Сполуки формули І, в яких кожний Y1 та Y2 представлений О, X представлений NR1 (R1=H), Z=N(R7)SO2, m=1, R4=H та R2, R3, R5 та R7 представлений, як описано у формулі І можна отримати реакцією сполуки формули VIII, в якій R2, R3, R5.R7 та А представлений, як описано формул І, з сульфоніл хлоридами формули IX у полярних апротонних розчинниках, як-то ТГФ або ДМФ у присутності основ, як-то лужні карбонати або третинні алкіл аміни або полімерні аміни. VIII IX Процент інгібування 24 Аміни формули VIII добре відомі з літератури та доступні з багатьох комерційних джерел. Специфічні нові варіанти сполук формули VIII можна отримати згідно зі способами, що відомі фахівцям. Сульфоніл хлориди формули IX можна отримати хлорним окисненням сульфідів або дисульфідів формули X, де R8 представлений групою, як-то гідроген, ізопропіл, бензил або сульфід так, що формула X містить симетричний дисульфід. X XI Сульфіди формули X можна отримати від цистеїну або цистину (R2, R3=H), а їх естери наступною обробкою лужного ціанату та сильною кислотою як-то ціанат калію та гідрохлоридна кислота. Альтернативно, сульфіди формули X можна отримати піддаючи кетони формули XI умовам, як описано вище у (а) при перетворенні VII до Vila. Сполуки даного винаходу можна оцінювати, наприклад, у таких аналізах: Аналізи виділених Ферментів Родина матричних металопротеїназ, включаючи, наприклад, ММР12, ММР13 Рекомбінантний каталітичний домен ММР12 людини можна експресувати та очищати, як описано [Parkar A.A. et al. // Protein Expression and Purification. – 2000. – 20. – P. 152]. Очищений фермент можна використовувати для контролю активності інгібіторів таким чином: ММР12 (50нг/мл кінцева концентрація) інкубують протягом 30хв. при кімнатній температурі у буфері для аналізу (0,1 Μ Трис-НСІ, рН 7,3, що містить 0,1М NaCI, і 20мМ СаСІ2, 0,040мМ ZnCI та 0,05% (за масою/об'ємом) Brij 35) з використанням синтетичного субстрату Mac-Pro-Cha-Gly-Nva-His-Ala-Dpa-NH2 при наявності чи відсутності інгібіторів. Активність визначають вимірюванням флуоресценції при екс=328нм та ем=393нм. Процент інгібування розраховують таким чином: Флуоресцен ція з інгібітором Флуоресцен ція фонова 100% Флуоресцен ція без інгібітору Флуоресцен ція фонова Рекомбінантний ргоММР13 людини можна експресувати та очищати, як описано [Knauper V. et al. // Biochem. J. – 1996. – 271. – P. - 1544-1550]. Очищений фермент можна використовувати для контролю активності інгібіторів таким чином: очищений ргоММР13 активують з використанням 1мМ амінофенілртутної кислоти (АРМА), 20год. при 21°С; активований ММР13 (11,25нг на аналіз) інкубують протягом 4-5год. при 35°С у буфері для аналізу (0,1 Μ Трис-НСІ, рН 7,5, що містить 0,1Μ NaCI, 20мМ СаСІ2, 0,02мМ ZnCI та 0,05% (за масою/об'ємом) Brij 35) з використанням синтетичного субстрату 7-метоксикумарин-4іл)ацетил.Рго.Leu.Gly.Leu.N-3-(2,4-динітрофеніл)L-2,3-діамінопропіоніл.Ala.Arg.NH2 при наявності чи відсутності інгібіторів. Активність визначають вимірюванням флуоресценції при екс=328нм та 25 ем=393нм. 77408 Процент інгібування розраховують та Процент інгібування 26 ким чином: Флуоресцен ція з інгібітором Флуоресцен ція фонова 100% Флуоресцен ція без інгібітору Флуоресцен ція фонова Подібний протокол можна застосовувати для інших експресованих та очищених ргоММР з використанням субстратів та буферів, оптимальних для певних ММР, наприклад, як описано [Graham Knight С. et al. // FBS Lett. - 1992. - 296(3). – P. 263266]. Адамалізинова родина, включаючи, наприклад, TNF-конвертазу Здатність сполук інгібувати фермент proTNF конвертази можна визначити з використанням аналізу частково очищеного, виділеного ферменту. Фермент отримано з мембран ТНР-1, як описано [Mohler К.М. et al. // Nature. – 1994. – 370. – P. 218-220]. Активність очищеного ферменту та його інгібування визначають інкубуванням частково очищеного ферменту при наявності чи відсутності тест-сполук з використанням субстрату 4’,5’,диметоксифлуорецеїніл Ser.Pro.Leu.Ala.Gin.Ala.Val.Arg.Ser.Ser.Ser.Arg.Cys( 4-(3-сукцинімід-1-іл)-флуорецеїн)-NН2 у буфері для аналізу (50мМ Трис-НСІ, рН 7,4, що містить 0,1% (за масою/об'ємом) Triton Х-100 та 2мМ СаСІ2), при 26°С протягом 18год. Ступінь інгібування визначають як для ММР13 за винятком того, що використовували екс=490нм та ем=530нм. Субстрат синтезували таким чином. Пептидну частину субстрату сажали на Fmoc-NH-Rink-MBHAполістирольну смолу вручну або на автоматичному синтезаторі пептидів стандартними способами, в яких залучено використання Fmoc-амінокислоти та гексафлуорфосфату О-бензотриазол-1-ілN,N,N’,N’-тетраметилуронію (HBTU) як засобу сполучення з щонайменше 4- або 5-кратним надлишком Fmoc-амінокислоти та HBTU. Ser1 та Pro2 були подвійно сполучені. Застосовували наступну стратегію захисту бічного ланцюга: Ser1 (But), Gen5(Trityl), Arg8,12(Pmc або Pbf), Ser9,10,11(Trityl), Cys13(Trityl). Після приєднання, N-термінальну Fmoc-захисну групу видаляли обробкою Fmocпептидильної смоли у ДМФ. Отриману так амінопептидильну смолу активували обробкою протягом 1,5-2год. при 70°С з 1,5-2 еквавалентами 4',5'диметокси-флуорецеїн-4(5)-карбонової кислоти [Khanna, Ullman // Anal. Biochem. – 1980. – 108. – P. 156-161], яка попередньо активована діізопропілкарбодіімідом та 1-гідроксибензотриазолом у ДМФ. Далі диметоксифлуорецеїніл-пептид одночасно позбавляли захисту та відщеплювали від смоли обробкою трифлуороцтовою кислотою, що містить по 5% кожного з води та триетилсилану. Диметоксифлуорецеїніл-пептид виділяли випарюванням, розтиранням з діетиловим етером та фільтруванням. Виділений пептид реагував з 4-(Nмалеїнімідо)-флуорецеїном у ДМФ, що містить діізопропілетиламін, продукт очищали за допомогою ОФ-ВЕРХ та під кінець виділяли сублімацією з водної оцтової кислоти. Продукт характеризували за допомогою МС MALDI-TOF та амінокислотного аналізу. Природні субстрати Активність сполук представленого винаходу як інгібіторів деградації агрекану можна аналізувати з використанням способів, основаних, наприклад, на відкритті та антитілах, описаних у [Arner Е.С. et al. // Osteoarthritis and Cartilage. – 1998. - 6. – P. 214228; Arner Е.С. et al. // J. Biol. Chem. – 1999. 274(10). – P. 6594-6601]. Потужність сполук як інгібіторів проти колагенази можна визначити, як описано [Cawston Т., Barrett A. // Anal. Biochem. – 1979. – 99. – P. - 340-345]. Інгібування активності металопротеїнази в активності на базі клітин/тканин Тест як засіб інгібування мембранних шедаз, як-то TNF-конвертази Здатність сполук цього винаходу інгібувати клітинне перетворення продукування TNF можна визначити у клітинах ТНР-1 з використанням ELISA для детектування вивільненого TNF, як описано по суті [Mohler К.М. et al. // Nature. – 1994. – 370. – P. 218-220]. Подібним чином перетворення або втрату інших мембранних молекул, як-то описаних у [Hooper N.М. et al. // Biochem. J. – 1997. - 32J. P. - 265-279], можна тестувати, застосовуючи прийнятні лінії клітин та придатні антитіла для визначення відкинутого білку. Тест як засіб інгібування інвазії на базі клітин Здатність сполуки цього винаходу інгібувати міграцію клітин у аналізі інвазії можна визначити, як описано [Albinie A. et al. // Cancer Research. – 1987. – 47. – P. -3239-3245]. Тест як засіб інгібування шедазної активності TNF суцільної крові Здатність сполук цього винаходу інгібувати продукування TNF визначають у аналізі суцільної крові людини, де для стимуляції вивільнення TNF використовують LPS. Гепаризовану (10од./мл) кров людини, отриману від волонтерів, розбавляли 1:5 середовищем (RPMI1640 + гідрокарбонат, пеніцилін, стрептоміцин та глутамін) та інкубують (160мкп) з 20мкл тест-сполуки (при потроєнні), у ДМСО або прийнятному носії, протягом 30хв. при 37°С у зволоженому (5%СO2/95% повітря) інкубаторі, перед додаванням 20мкл LPS (Е. coli. 0111:В4; кінцева концентрація 10мкг/мл). Кожний аналіз включає контролі розбавленої крові, інкубованої із одним середовищем (6 комірок/планшет) або з відомим інгібітором TNF як стандартом. Планшети далі інкубують протягом 6год. при 37°С (зволожений інкубатор), центрифугують (2000об/хв. протягом 10хв.; 4°С), плазму збирають (50-100мкл) та зберігають у 96-коміркових планшетах при -70°С до наступного аналізу концентрації TNF за допомогою ELISA. Тест як засіб інгібування in vitro деградації хряща Здатність сполук цього винаходу інгібувати деградацію агреканового або колагенового компонентів хряща можна визначити, як описано по суті 27 77408 [Bottomley К. М. et al. // Biochem. J. – 1997. – 323. – P. - 483-488]. Фармакодинамічний тест Для оцінки здатності до виведення та біозасвоюваності сполук цього винаходу ex vivo застосовують фармакодинамічний тест, який використовує вищенаведені аналізи з синтетичним субстратом або альтернативно ВЕРХ або масспектрометричний аналіз. Це є загальним тестом, який можна використовувати для оцінки швидкості виведення сполук через ряд видів. Тварин (наприклад, щурів, мавп) дозують внутрішньовенно або перорально розчинною композицією сполуки (як-то 20% за масою/об'ємом ДМСО, 60% за масою/об'ємом PEG400) та у наступний момент часу (наприклад, 5, 15, 30, 60, 120, 240, 480, 720, 1220хв.) зразки крові переносять з прийнятної посудини у 10U гепарину. Фракції плазми отримують, центрифугують та білки плазми осаджують ацетонітрилом (80% за масою/об'ємом кінцева концентрація). Після 30хв. при -20°С білки плазми осаджують центрифугуванням та надосадкову фракцію випарюють досуха з використанням апарату Savant speed vac. Осад відтворюють у буфері для аналізу досліджуваної сполуки, а далі аналізують на вміст сполуки аналізом з синтетичним субстратом. Коротше, для оцінюваних сполук будують криву концентрація сполуки - реакція. Серійні розбавлення екстрактів відтвореної плазми аналізують на активність, та кількість сполуки, представленої у вихідному зразку плазми, розраховують з використанням кривої концентрація сполуки - реакція, зважаючи на фактор розбавлення загальної плазми. Процент інгібування TNF Значення TNF Тест як засобу проти артриту Активність сполуки як засобу проти артриту тестують у індукованому колагеном артриті (СІА) як визначено у [Trentham D.Е. et al. // J. Exp. Med. – 1977. – 146. – P. 857]. У цій моделі кислотний розчинний природний колаген типу II викликає поліартрит у щурів при застосуванні у неповному ад'юванті Фрейнда. Подібні умови можна використовувати для виклику артриту у мишей та приматів. Тест як засобу проти раку Активність сполуки як засобу проти раку можна визначити, як описано по суті [Fidler І.J. // Meth. Cancer Res. – 1978. – 15. – P. - 399-439], застосовуючи, наприклад, лінію клітин В16 [Hibner В. et al. // 10th NCI-EORTC Symposium. Amsterdam, June 16 -19 1998. – P. 75]. Тест як засобу проти емфіземи Активність сполуки як засобу проти емфіземи можна визначити, як описано по суті [Hautamaki et al. // Science. – 1997. – 277. – P. – 2002]. 28 Дослідження in vivo Тест як засобу проти TNF Здатність сполук даного винаходу як ex vivo TNF інгібіторів визначають на щурах. Коротше, групи самців щурів Wistar Alderley Park (АР) (180210г) дозують сполукою (6 щурів) або носієм ліків (10 щурів) прийнятним шляхом, наприклад, пероральним, інтраперитональним, підшкірним. Через 90хв. щурів вбивали з використанням збільшеної концентрації СО2 та позбавляли крові через сідничну вену у 5 одиниць натрій-гепарину/мл крові. Зразки крові негайно поміщали на лід та центрифугують при 2000об./хв. протягом 10хв. при 4°С та зібрані плазми заморожують при -20°С для наступного аналізу їх дії на продукування TNF стимульованою LPS кров'ю людини. Зразки плазми щурів розтоплюють та 175мкл кожного зразку додають у 96-комірковий планшет. 50мкл гепаризованої крові людини далі додають до кожної комірки, змішують та планшет інкубують протягом 30хв. при 37°С (зволожений інкубатор). LPS (25мкл; кінцева концентрація 10мкг/мл) додають до комірок та інкубування продовжують ще 5,5год. Контрольні комірки інкубують з 25мкл одного середовища. Планшети далі центрифугують протягом 10хв. при 2000об./хв.. та 200мкл надосадкової рідини переносять у комірковий планшет та заморожують при -20°С для наступного аналізу концентрації TNF за допомогою ELISA. Результати аналізу розраховують за допомогою програмного забезпечення для кожної сполуки/дози: (контролі ) Значення TNF Значення TNF (контролі ) (оброблені ) 100% Винахід ілюстровано, але без обмеження наступними прикладами: Загальні аналітичні способи: спектри 1Н-ЯМР реєстрували на приладі VarianUnitylnova 400МГц або Varian Меrcury-VХ 300МГц. Центральний пік розчиннику хлороформу-d ( н 7,27млн-1), диметилсульфоксиду-d6 ( н 2,50 млн-1) або метанолу-d4 ( н 3,31млн-1) використовували як внутрішні стандарти. Мас-спектри низького розділення отримували на системі МС-ЕІ (з електророзпилювальним інтерфейсом - El) Agilent 1100 з іонізаційною камерою ХІАТ (хімічна іонізація при атмосферному тиску ХІАТ). Приклад 1 N-{[(4S)-2,5-діоксоімідазолідинил]метил}-4-(4флуорфенокси) бензолсульфонамід та N-{[(4S)-2,5-діоксоімідазолідиніл]метил}[1,1'дифеніл ]-4-сульфонамід 29 де: і - С6Н4SO2СІ; iі - НСІ/діоксан; ііі - KCNO внутрішньовенно; iv - масова частка, НСІ, 100°С; R - 4-флуорфеноксил або R = феніл До перемішеного розчину N- -BOC-(S)діамінопропоінової кислоти (100мг, 0,5ммоль) у 2,5мл води, що містить 0,04г (0,55ммоль) карбоната натрію додавали солоний сульфоніл хлорид (0,5ммоль) у 2,5 мл діоксану. Розчин перемішували протягом ночі при кімнатній температурі, розділяли між етил ацетатом (10мл) та приблизно 20% лимонною кислотою (10мл), водна фаза була тричі реекстрагована з етил ацетатом, органічний екстракт промивали з солоний розчином, сушили, випарювали та залишок обробляли з 4N НСІ у діоксані. Суміш перемішували протягом 20хв., випарювали та сушили у вакуумі протягом 4год. при 40°С. Далі, залишок охолоджували з 3мл водного розчину карбоната натрію (0,08г, 0,85ммоль), додавали 0,9г (1,1ммоль) ціанату калію та суміш перемішували протягом 4год. при 100°С. Після цього, 1мл концентрованої НСІ, який додавали, перемішували протягом 1год. при тій же температурі та потім дали постояти при кімнатній температурі протягом ночі. Кристали фільтрували, промивали з дистильованою водою та сушили у вакуумі (перекристалізовуали з масовою часткою етанолу, за необхідністю) N-{[(4S)-2,5-діоксоімідазолідинил]метил}-4-(4флуорфенокси) бензолсульфонамід MC:m/z=380,1 N-{[(4S)-2,5-діоксоімідазолідинил]метил}[1,1дифеніл]-4-сульфонамід MC:m/z=346,1 1Н ЯМР:(ДМСО):3, 00 m (1, 5Н),3, 10m(0, 6Н),(СН2), 4, 10 m (1Н,СН),7, 5 m (3H),7, 70d (2Н),7, 4 s (4H). Приклад 2 Отримували сполуки формули І, де Y1 представлений О, Y2 представлений О, X представлений NR1, R1 представлений Н, R2 є Н, m дорівнює 1, R3 представлений Н, R4 представлений Η, Ζ представлений SO2N(R6), R6 представлений Н, (С1-4)алкіл, метилбензил, або метилпіридил, А є безпосереднім зв'язком, a R5 варює. Синтези здійснювали паралельно на 20 комірковому планшеті вручну. Амінокислоти (20мкм) розчиняли у 5мл води, що містить 6,36мг (60мкм) карбонату натрію. 0,5мл розчину було відібрано пипеткою до кожної комірки, потім додали 0,5мл розчину діоксану, що містить 20мкм відповідного сульфонільного хлориду. Реакційну суміш встряхували протягом 18год. при кімнатній температурі, 77408 30 розбавляли 2мл метанолу та обробляли 20мг Lewatite S100 у кожній комірці (кислотна форма) протягом 5хв. Далі всі реакційні суміші фільтрували, випарювали у вакуумі та пар обробляли 1мл 4 NHCI у діоксані протягом 30хв., випарювали у вакуумі та додавали 0,5мл 0,5Μ масової частки розчину ціанату калію та гріли до 100°С протягом 3год. Далі 10мг Lewatite S100 (кислотна форма) додавали до кожної комірки після охолодження до кімнатної температури, потім додавали 2мл метанолу, випарювали у вакуумі та обробляли трифлуороцтовою кислотою при 80°С протягом 2год. Після випарювання, залишок очищали флешхроматографією на селікагелі з використанням етил ацетат-метанолового градієнту (до 10% МеОН). Чистоту та молекулярну масу визначали за допомогою ВЕРХ-МС. Дає: 0,5-1мг на кожну комірку. 5-(2-Метил-тіазол-5-іл)-тіофен-2-сульфонова кислота (2,5-діоксо-імідазолідин-4-ілметил)-амід МС-ЕІ (ХІАТ): М++Н+=373,4m/z 3-(4-Хлор-фенокси)N-(2,5-діоксо-імідазолідин4-ілметил)-бензолсульфонамід МС-ЕІ (ХІАТ): М++Н+=396,8m/z 4-(4-Хлор-фенокси) N-(2,5-діоксо-імідазолідин4-ілметил)-бензолсульфонамід MC-EI (ХІАТ): Μ++Η+=396,8m/z 31 77408 32 N-(2,5-Дioкco-iмiдaзoлiдин-4-iлмeтил)-4-(4мeтoкcи-фeнoкcи)-бeнзoлcyльфoнaмід + + MC-EI (ХІАТ): M +H =392,6m/z N-(2,5-Дioкco-iмiдaзoлiдин-4-iлмeтил)-3-(4мeтoкcи-фeнoкcи)-бeнзoлcyльфoнaмід MC-EI (ХІАТ): Μ++Η+=392,6m/z 5-(5-ТрифлуорметилН-піразол-3-іл)-тіофен-2сульфонова кислота (2,5-діоксо-імідазолідин-4ілметил)-амід MC-EI (XIAT): M++H+=430,6m/z 4'-Флуор-дифеніл-4-сульфонова кислота (2,5діоксо-імідазолідин-4-ілметил)-амід MC-EI (XIAT): M++H+=364,4m/z 5-Піридин-2-іл-тіофен-2-сульфонова (2,5-діоксо-імідазолідин-4-ілметил)-амід кислота MC-EI (XIAT): M++H+=353,4m/z N-(2,5-Діоксо-імідазолідин-4-ілметил)-4-(2метокси-фенокси)-бензолсульфонамід MC-EI (XIAT): М++Н+=410,4m/z N-(2,5-Діоксо-імідазолідин-4-ілметилр4толілокси-бензолсульфонамід MC-EI (XIAT): M++H+=392,5m/z N-(2,5-Діоксо-імідазолідин-4-ілметил)-3-(2трифлуорметил-фенокси)-бензолсульфонамід MC-EI (XIAT) M++H+=376,4m/z 3-(3,4-Дихлор-фенокси)-N-(діоксоімідазолідин-4-ілметил)-бензолсульфонамід MC-EI (XIAT): M++H+=430,6m/z 4-(3,4-Дихлор-фенокси)-N-(2,5-діоксоімідазолідин-4-ілметил)-бензолсульфонамід LC-MC (XIAT): M++H+=430,4m/z N-(2,5-Діоксо-імідазолідин-4-ілметил)-3-(4трифлуорметил-фенокси)-бензолсульфонамід 33 77408 34 MC-EI (XIAT): M++H+=430,4m/z N-(2,5-Діоксо-імідазолідин-4-ілметил)-4-(4трифлуорметил-фенокси)-бензолсульфонамід MC-EI (XIAT): M++H+=430,4m/z 4'-Трифлуорметил-дифеніл-4-сульфонова кислота (2,5-діоксо-імідазолідин-4-ілметил)-амід MC-EI (ХІАТ): М++Н+=376,4m/z 4-(4-Ціано-фенокси)-N-(2,5-діоксоімідазолідин-4-ілметил)-бензолсульфонамід МС-ЕІ (XIAT): М++Н+=414,4m/z N-(2,5-Діоксо-імідазолідин-4-ілметил)-4-отолілокси-бензолсульфонамід MC-EI (XIAT): M++Η+=387,4m/z 4-(4-Ціано-фенокси)-N-(2,5-діоксоімідазолідин-4-ілметил-N-метилбензолсульфонамід МС-ЕІ (ХІАТ): М++Н+=376,4m/z 4-(3,5-Дихлор-фенокси)-Н-(2,5-діоксоімідазолідин-4-ілметил)-бензепесульфонамід MC-EI (XIAT): M++H+=401,4m/z N-(2,5-Діоксо-імідазолідин-4-ілметил-N-метил4-(4-трифлуорметил-феноксил)бензепепесульфонамід МС-ЕІ (ХІАТ): М++Н+=431,3m/z 4-(2-Хлор-фенокси)-N-(2,5-діоксо-імідазолідин4-ілметил)-бензолсульфонамід MC-EI (XIAT): M++H+=444,4m/z N-(2,5-Діоксо-імщазолідин-4-ілметил)-N-етил4-(4-трифлуорметил-фенокси) бензепепесульфонамід МС-ЕІ (ХІАТ): М++Н+=396,8m/z N-(2,5-Діоксо-імідазолідин-4-ілметил)-3-ртолілокси-бензолсульфонамід 35 MC-EI (XIAT): M++H+=458,4m/z N-(2,5-Діоксо-імідазолідин-4-ілметил)-Nізопропіл-4-(4-трифлуорометил-фенокси)бензолсульфонамід 77408 36 N-(2,5-Діоксо-імідазолідин-4-ілметил)-N-етил4-(4-флуор-фенокси)-бензолсульфонамід МС-ЕІ (ХІАТ): М++Н+=408,4m/z N-бензил-N-(2,5-діоксо-імідазолідин-4ілметил)-4-(4-флуор-фенокси)-бензолсульфонамід MC-EI (XIAT): M++H+=472,4m/z N-(2,5-Діоксо-імідазолідин-4-ілметил)-Nізобутил-4-(4-трифлуорметил-фенокси)бензолсульфонамід МС-ЕІ (ХІАТ): М++Н+=470,5m/z N-(2,5-Діоксо-імідазолідин-4-ілметил)-4-(4флуор-фенокси)-N-піридин-3-ілметилбензолсульфонамід MC-EI (XIAT): M++H+=486,5m/z N-Бензил-N-(2,5-діоксо-імідазолідін-4-ілметил)4-(4-трифлуорметил-фенокси)-бензолсульфонамід МС-ЕІ (ХІАТ): М++Н+=471,5m/z 4-(4-Хлор-фенокси)-N-(2,5- Діоксо-імідазолідин -4-тметил)-N-метил-бензолсульфонамід MC-EI (XIAT): M++H+=520,5m/z N-(2,5-Діоксо-імідазолідин-4-ілметил)-Nпіридин-3-ілметил-4-(4-трифлуорметил-фенокси)бензол МС-ЕІ (ХІАТ): М++Н+=410,5m/z 4-(4-Хлор-фенокси)-N-(2,5-діоксо-імідазолідин4-ілметил)-етил-бензолсульфонамід MC-EI (XIAT) M++H+=521,5m/z N-(2,5-Діоксо-імідазолідин-4-ілметил)-4-(4флуор-фенокси)-N-метил-бензолсульфонамід МС-ЕІ (ХІАТ): М++Н+=424,88m/z 4-(4-Xлop-фeнoкcи)-N-(2,5-дioкco-iмiдaзoлiдин4-iлмeтил)-N-iзoпpoпiл-бeнзoлcyльфoнaмiд MC-EI (XIAT): M++H+=394,4m/z 37 МС-ЕІ (ХІАТ): М++Н+=424,88m/z N-Бeнзил·4-(4-xпop-фeнoкcи)-N-(2,5-дioкcoiмiдaзoлiдинiл-4-iлмeтил)-бeнзoлcyльфoнaмід МС-ЕІ (ХІАТ): М++Н+=486,9m/z 4-(4-Хлор-фенокси)-N-(2,5-діоксо-імідазолідин4-ілметил)-N-піридин-3-ілметилбензолсульфонамід МС-ЕІ (ХІАТ): М++Н+=487,9m/z N-(2,5-Діоксо-імідазолідин-4-ілметил)-N-метил4-p-толілокси-бензолсульфонамід MC-EI (XIAT): M++H+=390,4m/z N-(2,5-Діоксо-імідазолідин-4-ілметил)-N-етил4-р-долілокси-бензолсульфонамід MC-EI (XIAT): M++H+=404,5m/z N-(2,5-Діоксо-імідазолідин-4-ілметил)-Nізопропіл-4-р-толілокси-бензолсульфонамід 77408 38 MC-EI (XIAT): M++H+=418,5m/z N-бензил-N-(2,5-діоксо-імідазолідин-4ілметил)-4-р-толілокси-бензепесульфонамід MC-EI (XIAT): M++H+=466,5m/z N-(2,5- діоксо-імідазолідин-4-ілметил)-N- піридин-3-iлмeтил-4-p-тoлiлoкcи-бeнзoлcyльфoнaмiд MC-EI (ХІАТ): M++H+=467,5m/z N-(2,5-Діоксо-імідазолідин-4-ілметил)-4-(4метокси-фенокси)-N-метил-бензолсульфонамід MC-EI (ХІАТ): M++H+=406,5m/z N-(2,5-Діоксо-імідазолідин-4-ілметил)-Nізопропіл-4-(4-метокси-фенокси)бензолсульфонамід + + MC-EI (ХІАТ): M +H =420,5m/z N-(2,5-Діоксо-імідазолідин-4-ілметил)-Nізопропіл-4-(4-метокси-фенокси)бензолсульфонамід 39 + 77408 + MC-EI (ХІАТ): M +H =433,5m/z N-бензил-N-(2,5-діоксо-імідазолідин-4ілметил)-4-(4-метокси-фенокси)бензолсульфонамід 40 MC-EI (ХІАТ): M++H+=363,4m/z N-(2,5-Діоксо-імідазолідин-4-ілметил)-4(піридин-4-ілокси)-бензолсульфонамід MC-EI (ХІАТ): M++H+=363,5m/z N-(2,5-Діоксо-імідазолідин-4-ілметил)-4(піридин-2-ілокси)-бензолсульфонамід MC-EI (ХІАТ): M++H+=482,5m/z N-(2,5-Діоксо-імідазолідин-4-ілметил)-4-(4метокси-фенокси)-N-піридин-3-ілметилбензолсульфонамід MC-EI (ХІАТ): M++H+=376,4m/z N-(2,5-Діоксо-імідазолідин-4-ілметил)-Nетил-4(пірцдин-2-ілокси)-бензолсульфонамід MC-EI (ХІАТ): M++H+=483,5m/z N-(2,5-Діоксо-імідазолідин-4-ілметил)-4(піридин-4-ілокси)-бензолсульфонамід N O MC-EI (ХІАТ): M++H+=391,4m/z 4-(5-Хлор-піридин-2-ілокси)-N-(2,5-діоксоімідазолідин-4-ілметил)-N-метилбензолсульфонамід S O O N O N N O MC-EI (ХІАТ): M++H+=363,5m/z N-(2,5-Діоксоімідазолідин-4-ілметил)-Nметил-4-(піридин-4-ілокси)-бензолсульфонамід N O S O O N O N N O MC-EI (ХІАТ): M++H+=377,4m/z N-(2,5-Діоксо-імідазолідин-4-ілметил)-N-етил4-(піридин-4-ілокси)-бензолсульфонамід MC-EI (ХІАТ): Μ++Η+=397,8m/z 4-(5-Хлор-піридин-2-ілокси)-N-(2,5-діоксоімідазолідин-4-ілметил)-бензолсульфонамід 41 МС-ЕІ (ХІАТ): М++Н+=410,8m/z 4-(5-хлоро-піридин-2-ілокси)-N-(2,5-діоксоімідазолідин-4-ілметил)-N-етилбензолсульфонамід 77408 42 арі до 80°С протягом 6год. Далі суміш охолоджували, рН доводили до 4 та суміш випарювали у вакуумі. Залишок був розподілений між водою (10мл) та етилацетатом та водна фаза була повторно екстрасгована тричі з етилацетатом, далі випарювали та діастереоізомери були розділені хроматографією на силікагелі (град. ТВМЕметанол 0-10% МеОН). Наступні гідантоїни отримували. R-1-(2,5-діоксоімідазолідин-4-S-іл)-етил карбамова кислота трет-бутилестер МС-ЕІ (ХІАТ): М++Н+=425,8m/z N-(2,5-Діоксо-імідазолідин-4-ілметил-N-етил-4(5-флуор-піримідин-2-ілокси)-бензолсульфонамід МС-ЕІ (ХІАТ): М++Н+=409,8m/z N-(2,5-Діоксо-імідазолідиніл-4-ілметил)-4-(5флуор-піримідин-2-ілокси)-N-метилбензолсульфонамід MC-EI (ХІАТ): M++H+=396,4m/z N-(2,5-Діоксо-імідазолідин-4-ілметил)-4-(5флуор-піримідин-2-ілокси)-бензолсульфонамід MC-EI (XIAT): M++H+=382,4m/z Приклад 3 Сполуки отримували згідно зі схемою 2 як показано у описі вище. (а) Отримання вихідних матеріалів (альдегіди або кетони) Альдегіди отримували способом, описаним [Fehrentz J.A., Castro В. // Synthesis. – 1983. – 676]. Кетони отримували способом, описаним [NahmSand Weinreb S.M. // Tetpahedron Lett. – 1981. – 22. – P. 3815]. (б) Отримання проміжних гідантоїнів Альдегід або кетон (5ммоль) розчиняли у 50% розчині вода/етанол (10мл) та 0,55г (10ммоль) ціаніді натрію, додавали 2,7г (25ммоль) карбонату амонію та суміш нагріли у герметичному резерву MC-EI (XIAT): M++H+=244,4; М+-56 (+ ізобутилен) 188,6; М -ВОС=144,4 (головний пік) Н-ЯМР (CDCI3, ppm): 1,23d (3H), 1,45s (9,1Н), 4,36m (1,1H), 5,30bs (1,1H), 10,1bs (1,3H) R1-(4-Метил-2,5діоксоімідазолін-4-S-іл)етил карбамова кислота MC-EI (XIAT): M++H+=258,3; М+-56 (+ ізобутилен) 202,3; М -ВОС=158,3 (головний пік) Н-ЯМР (CDCI3, ppm): 1,22d (3Н), 1,44s (9,2Н), 1,58s (3,1H), 3,95m (0,9H), 5,5bs (1,5Н), 7,9bs (0,8H) R-1-(4-Метил-2,5діоксоімідазолін-4-R-іл)етил карбамова кислота трет-бутилестер МС-ЕІ (ХІАТ): М++Н+=258,3; М+-56 (+ ізобутилен) 202,3; М -ВОС=158,3 (головний пік) Н-ЯМР (CDCI3, ppm): 1,29d (3H),1,54s (9,1H), 1,50s (2,95H), 4,25m (1,1H), 5,5bs (1,8H), 7,9bs (0,6H) R-1-(2,5-діоксо-4-фенілімідазолін-4-S-іл)-етил карбамонова кислота трет-бутилестер 43 MC-EI (XIAT): M++H+=320,3; М+-56 (ізобутилен) 264,3; М+-ВОС=230,3 (головний пік) Н-ЯМР (CDCI3,ppm): 1,31d(3H), 1,35s (9,2H), 4,65m (0,9H), 6,10d (0,94H), 7,25m (3,2H), 7,60d (2,05H) трет-бутил (2S)-2-[(4R)-2,5-діоксоімідазолідин4-іл]піролідин-1-карбоксилат MC-EI (XIAT): M++H+=170,0 (M+-BOC) ЯМР (CDCI3, ppm): 1,26 S (9H), 1,7-1,9m (3,37Н), 2,1-2,2m (0,84H), 3,35-3,44m (1,82H), 4,1bs (1,1H) трет-бутил (2S)-2-[(4S)-2,5-діоксоімідазолідин4-іл]піролідин-1-карбоксилат MC-EI (XIAT): M++H+=170,0 (M+-BOC) Н-ЯМР (CDCI3, ppm): 1,27 s (9H),1,65-2,0m (широкий) (4,47Н), 3,55m (1,15Н), 3,62m (0,55H), 4,4m (0,87H) трет-бутил (2R)-2-[(4S)-2,5-діоксоімідазолідин4-іл]піролідин-1-карбоксилат MC-EI (XIAT): M++H+=170,0 (M+-BOC) Н-ЯМР (CDCI3, ppm): 1,47s (9H),1,7-2,2m (широкий) (4,30Н) 3,6m (1,12H), 3,8m (078H), 3,6m (1,1H) трет-бутил (2R)-2-[(4R)-2,5-діоксоімідазолідин4-іл]піролідин-1-карбоксилат MC-EI (XIAT): M++H+=170,0 (M+-BOC) Н-ЯМР (CDCI3, ppm): 1,47s (9H),1,7-2,2m (широкий) (4,30Н), 3,6m (1,12H), 3,8m (078H), 3,6m (1,1H) трет-бутил (2R)-2-[(4S)-4-метил-2,5діоксоімідазолідин-4-іл]піролідин-1-карбоксилат + + + МС-ЕІ (XIAT): M +H =183,1 (М -ВОС) Н-ЯМР (CDCI3, ppm): 1,4s (9H), 1,50s (3,2H), 1,65-2,1m (широкий) (4,20Н), 3,4m (1,1H), 3,5bs (0,78H), 4,4m (0,94Н) Позбавлення захисту ВОС-захищених гідантоїнів здійснили через 40% трифлуороцтову кислоту у DCM та кінцева сполука 5-(1-аміноетил) 5алкілімідазолін-2,4 діон трифлуорацетат осаджували етером після випарювали досуха. R-5-(S-1-аміноетил)-імідазолін-2,4-діон трифлуорацетат МС-ЕІ (ХІАТ): М++Н+=144,2m/z R-5-(1-аміноетил)-5-S-метилімідазолідин-2,4діон трифлуорацетат МС-ЕІ (ХІАТ): М++Н+=158,2m/z R-5-(1-аміноетил)-5-R-метилімідазолідин-2,4діон трифлуорацетат MC-EI (XIAT): М++Н+=158,2m/z R-5-(1-аміноетил)-5-S-фенілімідазолідин-2,4діонтрифлуорацетат MC-EI (XIAT): М++Н+=220,3m/z (5R)-5-[(2S)-піролідин-2-іл]мідазолідин-2,4діонтрифлуорацетат MC-EI (XIAT): М++Н+=169,1m/z (5R)-5-[(2R)-піролідин-2-іл]мідазолідин-2,4-діон MC-EI (XIAT): М++Н+=169,1m/z (5R)-5-[(2S)-піролідин-2-іл]імідазолідин-2,4діон MC-EI (XIAT): М++Н+=169,1m/z (5S)-5-[(2S)-піролідин-2-іл]імідазолідин-2,4діон MC-EI (XIAT): М++Н+=169,1m/z (5S)-5-метил-5-[(2R)-піролідин-2іл]мідазолідин-2,4-діон 77408 44 MC-EI (XIAT): М++Н+=183,21m/z Отримання гідантоїнів формули І Синтез здійснювали паралельно, на 20 коміркових планшетах, вручну. У кожну комірку поміщали приблизно 7,5ммоль відповідного сульфоніл хлориду у 0,5мл DCM, потім приблизно 1520ммоль 5-(1-аміноетил) 5-алкілімідазолін-2,4-діон трифлуорацетату у 0,5мл DCM (невелику кількість ДМФ додавали, за необхідністю, для повного розчинення) та додавали 10мг діетиламінометил полістирольну смолу. Суміш встряхували протягом ночі, фільтрували через 200мг силікагелю (промивали з 3-5мл етил ацетату та чистоту контролювали МС-ЕІ. Розчини випарювали досуха для досягнення чистоти всіх очікуваних сполук. 4-R-(4-xлopфeнoкcи-N-(1-(2,5дioкcoiмiдaзoлiн4-S-iл)-eтил)бeнзoлcyльфoнaмiд МС-ЕІ (ХІАТ): М++Н+=411,1m/z 4-R-(5-хлоропіридин-2-окси)-N-(1-(2,5діоксоімідазолін-4-S-іл)-етил)бензолсульфонамід МС-ЕІ (ХІАТ): М++Н+=412,1m/z R-N-(1-(2,5-діоксо-імідазолідин-S-4-іл)етил)-4(піридин-2-ілокси)бензолсульфонамід МС-ЕІ (ХІАТ): М++Н+=378,9m/z R-N-4-(1-(2,5-діоксо-імідазолідин-S-4-іл) етил)4-(піридин-4-ілокси)бензолсульфонамід МС-ЕІ (ХІАТ): М++Н+=378,9m/z 4-R-(4-ціанофенокси-N-(1 (2,5діоксоімідазолін-4-S-іл)етил)бензолсульфонамід 45 77408 МС-ЕІ (ХІАТ): М++Н+=401,5m/z 4-R-(4-флуорфенокси-N-(1 (2,5діоксоімідазолін-4-S-іл)етил)бензолсульфонамід МС-ЕІ (ХІАТ): М++Н+=394,3m/z 4-R-(4-трифлуорметилфенокси (2,5діоксоімідазолін-4-S-іл)етил)бензолсульфонамід N-(1 МС-ЕІ (ХІАТ): М++Н+=444,4m/z 4-R-(4-метилфенокси-N-(1(2,5діоксоімідазолін-4-S-іл)етил)бензолсульфонамід МС-ЕІ (ХІАТ): М++Н+=389,43m/z 4-R-(4-метоксифенокси-N-(1(2,5діоксоімідазолін-4-S-іл)етил)бензолсульфонамід 46 МС-ЕІ (ХІАТ): М++Н+=376,2m/z R-N-(1-(4-метил 2,5-діоксо-імідазолідин-4-Sіл)-етил-4-феноксибензолсульфонамід МС-ЕІ (ХІАТ): М++Н+=390,4m/z 4-(4-Хлофенокси-N-(1-(4-S-метил-2,5діоксоімідазолідин-4-R-іл)-етил бензолсульфонамід МС-ЕІ (ХІАТ): М++Н+=423,4m/z 4-(5-хлоропіридил-2-окси)-N-(1-(4-S-метил-2,5діоксоімідазолідин-4-R-іл)-етил бензолсульфонамід МС-ЕІ (ХІАТ): М++Н+=424,4m/z N-(1-(4-S-метил-2,5-діоксоімідазолідин-4-R-іл)етил)-4-(піридин-2-ілокси)бензолсульфонамід МС-ЕІ (ХІАТ): М++2Н+=392,4m/z N-(1-(4-S-метил-2,5-діоксоімідазолідин-4-R-іл)етил)-4-(піридин-2-ілокси)бензолсульфонамід МС-ЕІ (ХІАТ): М++Н+=406,4m/z 4-R-(4-фенокси-N-(1-(2,5діоксоімідазоліп-4-Sіл)-етил)бензолсульфонамід 47 77408 48 МС-ЕІ (ХІАТ): М++2Н+=392,4m/z 4-(4-ціанофенокси-N-(1-(4-S-метил-2,5діоксоімідазолідині-4-R-іл)-етил бензолсульфонамід МС-ЕІ (ХІАТ): М++2Н+=392,4m/z 4-(4-цианофенокси-N-(1-(4-R-метил-2.5діоксоімідазолідин-4-R-іл)-етил бензолсульфонамід МС-ЕІ (ХІАТ): М++2Н+=415,4m/z R-N-(1-(4-метил 2,5-2,5-діоксоімідазолідині-4R-іл)-етил-4-феноксибензолсульфонамід МС-ЕІ (ХІАТ): М++Н+=390,4m/z 4-(4-Хлорфенокси-N-(1-(4-R-метил-2,5діоксоімідазолідин-4-R-іл)-етил бензолсульфонамід МС-ЕІ (ХІАТ): М++Н+=423,4m/z 4-(5-хлорпіридил-2-окси)-N-(1-(4-R-метил-2,5діоксоімідазолідин-4-R-іл)-етил бензолсульфонамід МС-ЕІ (ХІАТ): М++Н+=424,4m/z N-(1-(4-R-метил-2,5-діоксоімідазолідин-4-R-іл)етил)-4-(піридин-2-ілокси)бензолсульфонамід МС-ЕІ (ХІАТ): М++2Н+=392,4m/z N-(1-(4-R-метил-2,5-діоксоімідазолідин-4-R-іл)етил)-4-(піридин-2-ілокси)бензолсульфонамід МС-ЕІ (ХІАТ): М++Н+=415,4m/z 4-(4-флуорфенокси-N-(1-(4-R-метил-2,5діоксоімідазолідин-4-S-іл)-етил-5діоксоімідазолідин МС-ЕІ (ХІАТ): М++Н+=407,4m/z 4-(4-трифлуорметилфенокси-N-(1-(4-R-метил2,5-діоксоімідазолісІин-4-S-іл)-етил бензолсульфонамід МС-ЕІ (ХІАТ): М++Н+=458,4m/z 4-(4-Метилфенокси-N-(1-(4-R-метил-2,5діоксоімідазолісІин-4-S-іл)-етил бензолсульфонамід 5 МС-ЕІ (ХІАТ): М++Н+=404,5m/z 4-(4-Метоксифенокси-N-(1-(4-R-метил]-2,5діоксоімідазолідин-4-S-іл)-етил бензолсульфонамід 49 77408 50 МС-ЕІ (ХІАТ): М++Н+=420,5m/z 4-(4-Фенокси-N-(1-(4-R-метил-2,5діоксоімідазолідин-4-S-іл)-етил бензолсульфонамід МС-ЕІ (ХІАТ): М++Н+=420,5m/z 4-(4-Фенокси-N-(1-(4-R-метил-2,5діоксоімідазолідин-4-R-іл)-етил бензолсульфонамід МС-ЕІ (ХІАТ): М++Н+=390,5m/z; 4-(4-флуорфенокси-N-(1-(4-R-метил-2,5діоксоімідазолідин-4-R-іл)-етил бензолсульфонамід МС-ЕІ (ХІАТ): М++Н+=390,5m/z 4-(4-Хлорфенокси)-N-(1-(2,5-діоксо-4-S-фенілімідазолідин-4-R-іл)-етил бензолсульфонамід + + МС-ЕІ (ХІАТ): М +Н =407,4m/z 4-(4-трифлуорметилфенокси-N-(1-(4-R-метил2,5-діоксоімідазолідин-4-R-іл)-етил бензолсульфонамід МС-ЕІ (ХІАТ): М++Н+=458,4m/z 4-(4-Метилфенокси-N-(1-(4-R-метил-2,5діоксоімідазолідин-4-R-іл)-етил бензолсульфонамід МС-ЕІ (ХІАТ): М++Н+=486,8m/z 4-(5-хлорпіридин-2-ілокси)-N-(1-((2,5-діоксо-4S-феніл-імідазолідин-4-R-іл)-етил) бензолсульфонамід МС-ЕІ (ХІАТ): М++Н+=487,8m/z N-(1-S-(2,5-діоксо-4-фенілімідазолідин-4-R-іл)етил-4-(піридин-2-ілокси)-бензолсульфонамід МС-ЕІ (ХІАТ): М++2Н+=454,6m/z N-(1-S-(2,5-діоксо-4-фенілімідазолідин-4-R-іл)етил-4-(піридин-4-ілокси)-бензолсульфонамід МС-ЕІ (ХІАТ): М++Н+=404,5m/z 4-(4-Метоксифенокси-R-(1-(4-R-метил-2,5діоксоімідазолідин-4-R-іл)-етил бензолсульфонамід 51 77408 52 МС-ЕІ (ХІАТ): М++2Н+=454,6m/z 4-(4-Ціанофенокси)-N-(1-((2,5-діоксо-4-Sфеніл-імідазолідин-4-R-іл)етил)бензолсульфонамід МС-ЕІ (ХІАТ): М++Н+=482,4m/z 4-(4-Фенокси)-N-(1-((2,5-діоксо-4-S-фенілімідазолідин-4-R-іл)-етил)бензолсульфонамід МС-ЕІ (ХІАТ): М++Н+=477,6m/z 4-(4-фторофенокси)-N-(1-((2,5-діоксо-4-Sфеніл-імідазолідин-4-R-іл)етил)бензолсульфонамід МС-ЕІ (ХІАТ): М++Н+=452,5m/z 5-(1-{[4-(4хлорфенокси)феніл]сульфоніл}піролідин-2-іл)-5метилімідазолідин-2,4-діон МС-ЕІ (ХІАТ): М++Н+=470,5m/z 4-(4-Трифторметилфенокси)-N-(1-((2,5-діоксо4-S-фенил-імідазолідин-4-R-іл)етил)бензолсульфонамід МС-ЕІ (ХІАТ): М++Н+=450,5m/z 5-(1-{[4-(4метоксифенокси)феніл]сульфоніл}піролідин-2-іл)5-метилімідазолідин-2,4-діон МС-ЕІ (ХІАТ): М++Н+=519,1m/z 4-(4-Метилфенокси)-N-(1-((2,5-діоксо-4-Sфеніл-імідазолідин-4-R-іл)етил)бензолсульфонамід МС-ЕІ (ХІАТ): М++Н+=466,4m/z 4-(4-Метоксифенокси)-N-(1-((2,5-діоксо-4-Sфеніл-імідазолідин-4-R-іл)етил)бензолсульфонамід МС-ЕІ (ХІАТ): М++Н+=446,2m/z 5-(1-{[4-(4метилфенокси)феніл]сульфоніл}піролідин-2-іл)-5метилмідазолідин-2,4-діон 53 77408 54 5-(1-{[4-(4флуорфенокси)феніл]сульфоніл}піролідин-2іл)імідазолідин-2,4-діон МС-ЕІ (ХІАТ): М++Н+=430,1m/z 5-(1-{[4-(4флуорфенокси)феніл]сульфоніл}піролідин-2-іл)-5метилімідазолідин-2,4-діон МС-ЕІ (ХІАТ): М++Н+=434,1m/z (1-{{4-(4ціанофенокси)феніл]сульфоніл}піролідин-2-іл)-5метилмідазолідин-2,4-діон МС-ЕІ (ХІАТ): М++Н+=441,1m/z 5-(1-{[4-(4хлорфенокси)феніл]сульфоніл}піролідин-2іл)імідазолідин-2,4-діон МС-ЕІ (ХІАТ): М++Н+=436,1m/z МС-ЕІ (ХІАТ): М++Н+=420,1m/z 5-(1-{[4-(4метилфенокси)феніл]сульфоніл}піролідин-2іл)імідазолідин-2,4-діон МС-ЕІ (ХІАТ): М++Н+=416,1m/z 5-{1-{[4-(4метоксифенокси)феніл]сульфоніл}піролідин-2іл)мідазолідин-2,4-діон МС-ЕІ (ХІАТ): М++Н+=432,1m/z 5-(1-{[4-(4ціанофенокси)феніл]сульфоніл}піролідин-2іл)імідазолідин-2,4-діон 55 МС-ЕІ (ХІАТ): М++Н+=427,1m/z Приклад 4 [(4R)-2,5-діоксоімідазолідиніл]метансульфоніл хлорид, [(4S)-2,5діоксоімідазолідиніл]метансульфоніл хлорид або [(R)-2,5-Діоксоімідазолідиніл]-метансульфоніл хлорид реагував з прийнятним первинним або вторинним аміном до отримання сполуки описаної нижче. Всі застосовані аміни є комерційно доступними. Сульфоніл хлорид (0,060ммоль), амін (0,060ммоль), триетиламін (0,0084мл, 0,060ммоль) у сухому тетрагідрофурані (0,70мл) перемішували при кімнатній температурі протягом ночі. Додавали полістерини метилізоціанату (0,025г, 0,030 ммоль) та суміш перемішували протягом ночі. Білу суспензію фільтрували та сухий залишок промивали з тетрагідрофураном (2x1мл). Фільтрати випарювали,білий сухий залишок суспендували у воді (5 мл), збирали на фільтрі, промивали водою (2x1 мл), поглинули вільну воду та сушили у вакуумі при 45°С протягом ночі до отримання потрібних сполук. Вихідні матеріали отримували таким чином: 5-метил-5{[(фенілметил)тіо]метил}імідазолідин-2,4-діон У стальний резервуар поміщали етанол та воду (315мл/135мл). Додавали 31,7г (0,175моль) бензилтіоацетону, 22,9г (0,351моль) ціанід калію та 84,5г (0,879моль) карбонат амонію. Закритий реакційний резервуар тримали у масляній бані (температура бані - 90°С) при енергійному перемішуванні протягом 3год. Реакційний резервуар охолоджували з льодом (0,5год.), жовтувату кашицю випарювали досуха та твердий залишок розділяли між 400мл води та 700мл етилацетату та видаляли. Водну фазу екстрагували з етилацетатом (300мл). Комбіновані ι органічні фази промивали з насиченим соляним розчином (150мл), сушили (Na2SO4), фільтрували та випарювали досуха. Якщо продукт не кристалізувався, до масла додавали 300мл дихлорметану. В результаті випарювання отримували продукт у вигляді злегка жовтуватого порошоку, 43,8г (90%). МС-ЕІ (ХІАТ) m/z 251,1 (МН+). 1 Н ЯМР (ДМСО-d6) : 10,74 (1H,s); 8,00 (1H,s); 7,35-7,20 (5H,m); 3,76 (2H,s); 2,72, 2,62 (1H кожний, Abq, J=14,0Гц); 1,29 (3H,s). 13 C ЯМР (ДМСО-d6) : 177,30, 156,38,138,11, 128,74, 128,24, 126,77, 62,93, 37,96, 36,39, 23,15. (5S)-5-метил-5{[(фенілметил)тіо]метил}імідазолідин-2,4-діон Потрібну сполуку отримували хіральним розділенням рацемічного матеріалу з використанням 250x50мм колонки на Dynamic Axial Compression Preparative ВЕРХ системі. Використовували: стаціонарну фазу CHIRALPAK-AD; елюент – Метанол; потік 89мл/хв.; температура - навколишнього середовища; ультрафіолет - 220нм, зразок концентрації 150мг/мл; об'єм введення - 20мл; тривалість відстоювання для потрібних сполук - 6хв. Аналіз хірального очищення робили з використанням: 250x4,6мм колонки CHIRALPAK-AD від Daicel; потік - 0,5мл/хв.; елюент – Етанол; ультра 77408 56 фіолет - 220нм; температура - навколишнього середовища; тривалість відстоювання для потрібних сполук - 9,27хв. Чистоту визначали до >99%. + МС-ЕІ (ХІАТ) m/z 251,1 (МН ). [ ]D= -30,3° (с=0,01г/мл, МеОН, Т=20°С). 1 Н ЯМР (ДМСО-d6) : 10,74 (1H,s); 8,00 (1H,s); 7,35-7,20 (5H,m); 3,76 (2H,s); 2,72, 2,62 (1Η кожний, Abq J=14,0Гц); 1,29 (3H,s). 13 C ЯМР (ДМСО-d6) : 177,30, 156,28, 138,11, 128,74, 128,24, 126,77, 62,93, 37,96, 36,39, 23,15. (5R)-5-метил-5-{[(феніл метил )тіо]метил}імідазолідин-2,4-діон Потрібну сполуку отримували хіральним розділенням рацемічного матеріалу з використанням 250x50мм колонки на Dynamic Axial Compression Preparative ВЕРХ системі. Використовували: стаціонарна фаза CHIRALPAK-AD; елюент – Метанол; потік 89мл/хв.; температура - навколишнього середовища; ультрафіолет - 220нм, зразок концентрації 150мг/мл; об'єм введення - 20мл; тривалість відстоювання для потрібних сполук - 10хв. Аналіз хірапьного очищення робили з використанням: 250x4,6мм колонки CHIRALPAK-AD від Daicel, потік - 0,5мл/хв.; елюент – Етанол; ультрафіолет - 220нм; температура - навколишнього середовища; тривалість відстоювання для потрібних сполук - 17,81хв. Чистоту визначали до >99%. МС-ЕІ (ХІАТ) m/z 251,0 (МН+), [ ]D=+30,3° (с=0,01г/мл, МеОН, Т=20°С). 1 Н ЯМР (ДМСО-d6) : 10,74 (1H,s); 8,00 (1H,s); 7,35-7,20 (5H,m); 3,76 (2H,s); 2,72, 2,62 (1H кожний, Abq J=14,0 Гц); 1,29 (3H,s). 13 C ЯМР (ДМСО-d6) : 177,31, 156,30, 138,11, 128,74, 128,25, 126,77, 62,94, 37,97, 36,40, 23,16. [(4S)-4-метил-2,5-діоксоімідазолідин-4іл]метансульфоніл хлорид (5S)-5-метил-5{[фенілметил)тіо]метил}імідазолідин-2,4-діон (42,6г; 0,17моль) розчиняли у суміші АсОН (450мл) та Н2О (50мл). Суміш занурювали у льод/водяну баню, СІ2 (газ) виділявся у вигляді бульбашок по розчину, потік газу встановлювали таким чином, щоб температура трималася нижче +15°С. Після 25хв. розчин ставав жовто-зеленого кольору та зразок видаляли для МС-Е та ВЕРХ аналізу. Ці дані показали, що вихідний матеріал був витрачений. Чисто жовтий розчин перемішували протягом 30хв. та утворювали непрозорий розчин/кашицю. Розчинник видаляли на роторному випарнику з використанням водяної бані при температурі, яку утримували на рівні +37°С. Жовтувату тверду масу суспендували у Toluene (400мл) та розчинник видаляли на тому-ж роторному випарнику. Це повторювали ще раз. Сирий продукт далі суспендували у ізо-Гексані (400мл) та нагрівали до +40°С поки переміщували, кашиця охолонула до кімнатної температури до того, як видаляли нерозчинний продукт фільтруванням, промивали з ізо-Гексаном (6х100мл), та сушили під зниженим тиском при +50°С протягом ночі. В результаті було отримано продукт у вигляді злегка жовтого порошку. 57 Отримано 36,9г (95%) потрібної сполуки. Чистота за допомогою ВЕРХ - 99%, ЯМР підтвержували цю чистоту. [ ]D=-12,4° (с=0,01г/мл, ТГФ, Т=20°С). 1 Н ЯМР (ΤΓΦ-d8) : 9,91 (1H,bs); 7,57 (1H,s); 4,53, 4,44 (1Н кожний, ABq, J=14,6Гц); 1,52 (s, ЗН, СН3). 13 C ЯМР (ΤΓΦ-d8) : 174,96; 155,86; 70,96; 61,04; 23,66. [(4R -4-метил-2,5-діоксоімідазолідин-4іл]метансульфоніл хлорид Наступна процедура описана для [(4S)-4метил-2,5-діоксоімідазолідин-4-іл]метансульфоніл хлориду. Починаючи від (5R)-5-метил-5{[(фенілметил)тіо]метил}імідазолідин-2,4-діон (10,0г, 40ммоль). Отримано 8,78г (96% виходу) потрібної сполуки. Чистота ЯМР > 98%. [ ]D=+12,8° (с=0,01г/мл, ТГФ, Т=20°С). 1 Н ЯМР (ΤΓΦ-d8) : 9,91 (1H,brs); 7,57 (1H,s); 4,53,4,44 (1Η кожний, Abq, J=14,6Гц); 1,52 (S, 3H, CH3). 13 C ЯМР (ΤΓΦ-d8) : 174,96; 155,84; 70,97; 61,04; 23,66. 77408 58 На таблиці нижче представлена аміногрупа для кожної сполуки винаходу зазначеної вище структури. Амін На таблиці нижче представлена аміногрупа для кожної сполуки винаходу зазначеної вище структури. На таблиці нижче представлена аміногрупа для кожної сполуки винаходу зазначеної вище структури. Амін N-[4-(4-Хлор-фенокси)-феніл]-С-((4s)-4-метил2.5-діоксо-імідазолідин-4-іл)-метансульфонамід МС-ЕІ (ХІАТ) m/z 410 (МН+). 1 Н ЯМР (ДМСО-d6) : 10,75 (1H,s); 9,89 (1H,s); 8,04 (1H,s); 7,45-7,39 (2H,m); 7,25-7,19 (2H,m); 7,06-6,97 (4H,m); 3,54 (1 Η від ABq, J=14,1Гц); 1,31 (3H,s). N-4-(бензил-феніл)-С((4S)-4-метил-2,5-діоксоімідазолідин-4-іл)-метансульфонамід МС-ЕІ (ХІАТ) m/z 374 (МН+). 1 Н ЯМР (ДМСО-d6) : 10,74 (1H,s); 9,82 (1H,s); 8,01 (1H,s); 7,33-7,05 (9Η,m); 3,49, 3,36 (1H кожний, ABq, J=16,2Гц); 1,28 (3Н,s). N-(4-Бензоіл-феніл)-С-((4S)-метил-2,5-діоксоімідазолідин-4-іл)-метансульфонамід 59 77408 МС-ЕІ (ХІАТ) m/z 388 (МН+). 1 Н ЯМР (ДМСО-d6) : 10,81 (1H,s); 10,58 (1H,s); 8,08 (1H,s); 7,76-7,62 (5H,m); 7,60-7,52 (2H,m); 7,33-7,27 (2H,m); 3,68, 3,52 (1Η кожний, ABq, J=4,7Гц); 1,33 (3H,s). Приклад 5 Отримано з комерційно доступного N-Boc-4піперидону способами описаним у прикладі 3. m/z 416 (ΜΗ+), молекулярна маса 415,47 m/z 437 (МН+), молекулярна маса 435,89 m/z 420 (МН+), молекулярна маса 419,43 m/z 432 (MH+), молекулярна маса 431,47 Комп’ютерна верстка В. Сердюк 60 m/z 427 (МН+) молекулярна маса 426,45 Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюMetalloproteinase inhibitors, pharmaceutical composition on its base, and use thereof
Автори англійськоюEriksson, Anders, Lepistoe Matti, Lundkvist Michael
Назва патенту російськоюИнгибиторы металлопротеиназ, фармацевтическая композиция на их основе и их применение
Автори російськоюЛеписте Матти, Лундквист Микаэль
МПК / Мітки
МПК: A61P 17/04, A61P 11/02, C07D 417/14, A61P 9/04, A61K 31/444, A61P 13/12, A61P 37/08, A61K 31/496, C07D 401/04, C07D 471/04, C07D 403/06, C07D 401/14, A61P 27/02, A61K 31/4439, A61P 7/02, A61K 31/4178, A61P 19/10, C07D 409/12, C07D 233/78, C07D 405/12, A61P 25/00, A61K 31/506, A61P 1/16, A61K 31/454, C07D 403/12, A61P 1/04, A61K 31/427, A61P 19/08, C07D 471/10, C07D 403/04, A61P 9/10, A61P 19/02, A61P 25/28, C07D 405/14, C07D 401/12, A61P 1/02, A61P 43/00, A61K 31/4166, A61P 11/00, A61P 35/00, A61P 15/00, C07D 409/14, A61K 31/438, A61P 19/06, A61P 19/04, A61P 9/00, A61P 19/00, A61P 35/04, A61P 11/06, A61P 25/02, A61K 31/5377, A61P 29/00, C07D 223/00, C07D 233/76, A61P 17/06
Мітки: застосування, інгібітори, металопротеїнази, фармацевтична, основі, композиція
Код посилання
<a href="https://ua.patents.su/30-77408-ingibitori-metaloprotenazi-farmacevtichna-kompoziciya-na-kh-osnovi-ta-kh-zastosuvannya.html" target="_blank" rel="follow" title="База патентів України">Інгібітори металопротеїнази, фармацевтична композиція на їх основі та їх застосування</a>
Попередній патент: Комбінація гербіцид-антидот на основі ізоксозолінкарбоксилатного антидоту, спосіб знищення бур’янів та спосіб зниження фітотоксичності гербіциду
Наступний патент: Фільтруючий елемент для очистки рідин, переважно металічних розплавів
Випадковий патент: Захисний елемент