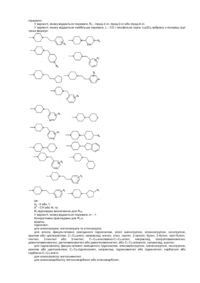
Інгібітори серинових протеаз, фармацевтична композиція на їх основі
Номер патенту: 74372
Опубліковано: 15.12.2005
Автори: Мастерз Джон Джозеф, Гуццо Пітер Роберт, Уайлі Уільм Александер, Енджел Дейвід Біренбаум, Уотсон Брайан Морган, Шіхан Скотт Мартін, Маррі Крістофер Уільям, Мейер Майкл Джон, Джоунз Стьюарт Доналд, Лібешюц Джон Уолтер, Янг Стівен Клінтон, Уайлі Майкл Роберт, Камп Ніколас Пол
Формула / Реферат
1. Інгібітор серинових протеаз – сполука формули (I)
,
де
R2 є:
(i) феніл, факультативно заміщений у положенні 3 та/або 4 галогеном, нітрогрупою, тіолом, галогеналкоксигрупою, гідразидогрупою, алкілгідразидогрупою, аміногрупою, ціаном, галогеналкілом, алкілтіогрупою, алкенілом, алкінілом, ациламіногрупою, три- або дифторметоксигрупою, карбоксилом, ацилоксигрупою, MeSO2- або R1, та факультативно заміщений у положенні 6 аміногрупою, гідроксилом, галогеном, алкілом, карбоксилом, алкоксикарбонілом, ціаном, амідогрупою, аміноалкілом, алкоксигрупою або алкілтіогрупою;
(ii) нафт-2-ил, факультативно заміщений у положенні 6 або 7 галогеном, галогеналкоксигрупою, галогеналкілом, ціаном, нітрогрупою, аміногрупою, гідразидогрупою, алкілтіогрупою, алкенілом, алкінілом або R1j, та факультативно заміщений у положенні 3 аміногрупою, гідроксигрупою, галогеном, алкілом, карбоксилом, ціаном, амідогрупою, аміноалкілом, алкоксигрупою або алкілтіогрупою;
(iii) ізохінолін-7-іл, індол-5-іл, індол-6-іл, індазол-5-іл, індазол-6-іл, бензотіазол-6-іл або бензизоксазол-5-іл, факультативно заміщений у положенні 3 галогеном, галогеналкоксигрупою, галогеналкілом, ціаном, нітрогрупою, аміногрупою, гідразидогрупою, алкілтіогрупою, алкенілом, алкінілом або R1j;
(iv) бензимідазол-5-іл або бензотіазол-6-іл, факультативно заміщений у положенні 2 аміногрупою;
(v) тієн-2-іл або тієн-3-іл, факультативно заміщений у положенні 4 або 5 галогеном, галогеналкоксигрупою, галогеналкілом, ціаном, нітрогрупою, аміногрупою, гідразидогрупою, алкілтіогрупою, алкенілом, алкінілом або R1;
(vi) 3,4-метилендіоксифеніл, 2,3-дигідроіндол-6-іл, 3,3-дихлор-2-оксоіндол-6-іл або 1-метил-3-аміноіндазол-5-іл;
(vii) бензотіазол-2-іл, імідазо[1,2-a]піримідин-2-іл або тетрагідроімідазо-[1,2-a]піримідин-2-іл;
(viii) піразол-2-іл, факультативно заміщений у положенні 5 галогеном, галогеналкоксигрупою, галогеналкілом, ціаном, нітрогрупою, аміногрупою, гідразидогрупою, алкілтіогрупою, алкенілом, алкінілом або R1;
(ix) пірид-2-ил, факультативно заміщений у положенні 5 галогеном, галогеналкоксигрупою, галогеналкілом, ціаном, нітрогрупою, аміногрупою, гідразидогрупою, алкілтіогрупою, алкенілом, алкінілом або R1;
(x) пірид-3-ил, факультативно заміщений у положенні 6 галогеном, галогеналкоксигрупою, галогеналкілом, ціаном, нітрогрупою, аміногрупою, гідразидогрупою, алкілтіогрупою, алкенілом, алкінілом або R1;
(xi) бензофур-2-ил, факультативно заміщений у положенні 3 аміногрупою, гідроксилом, галогеном, алкілом, карбоксилом, ціаном, амідогрупою, аміноалкілом, алкоксигрупою або алкілтіогрупою, та у положенні 5 або 6 галогеном, галогеналкоксигрупою, галогеналкілом, ціаном, нітрогрупою, аміногрупою, гідразидогрупою, алкілтіогрупою, алкенілом, алкінілом або R1j;
(xii) індол-2-іл, факультативно заміщений при атомі азоту індолу алкілом та факультативно заміщений у положенні 5 або 6 галогеном, галогеналкоксигрупою, галогеналкілом, ціаном, нітрогрупою, аміногрупою, гідразидогрупою, алкілтіогрупою, алкенілом, алкінілом або R1j;
(xiii) індол-6-іл, заміщений у положенні 5 аміногрупою, гідроксилом, галогеном, алкілом, карбоксилом, алкоксикарбонілом, ціаном, амідогрупою, аміноалкілом, алкоксигрупою або алкілтіогрупою, та факультативно заміщений у положенні 3 галогеном, галогеналкоксигрупою, галогеналкілом, ціаном, нітрогрупою, аміногрупою, гідразидогрупою, алкілтіогрупою, алкенілом, алкінілом або R1j;
(xiv) бензо[b]тіофен-2-іл, факультативно заміщений у положенні 3 аміногрупою, гідроксилом, галогеном, алкілом, карбоксилом, ціаном, амідогрупою, аміноалкілом, алкоксигрупою або алкілтіогрупою, та у положенні 5 або 6 галогеном, галогеналкоксигрупою, галогеналкілом, ціаном, нітрогрупою, аміногрупою, гідразидогрупою, алкілтіогрупою, алкенілом, алкінілом або R1j; за умови, що R2 не може бути аміноізохінолілом;
R1 є водень, гідроксил, алкоксигрупа, алкіл, алкіламіноалкіл, алканоїл, гідроксіалкіл, алкоксіалкіл, алкоксикарбоніл, алкіламінокарбоніл, алкіламіногрупа, карбоксил, карбоксиметил, амідогрупа або амідометил;
R1j є водень, гідроксил, алкоксигрупа, алкіл, алканоїл, гідроксіалкіл, алкоксіалкіл, алкоксикарбоніл, алкіламіногрупа, карбоксил, карбоксиметил, амідогрупа або амідометил;
-X-X- – -CONH;
Y (-атом) – CH;
Cy – факультативно заміщений R3a феніл, піридил, тієніл, тіазоліл, нафтил, піперидиніл, фураніл, піроліл, ізоксазоліл, ізотіазоліл, піразоліл, оксазоліл, імідазоліл, 1,2,4-тіадіазоліл, 1,3,4-тіадіазоліл, піримідиніл, піридазиніл, хіноліл, ізохіноліл, бензофурил, бензотієніл або циклоалкіл, або феніл, заміщений R3iXi, де Xi – зв’язок, O, NH або CH2, та R3i – феніл, піридил або піримідил, факультативно заміщений R3a; та
кожний R3a незалежно від інших є водень; гідроксил; алкоксигрупа; аралкілоксигрупа; алкіл; алкіламіноалкіл; гідроксиметил; карбоксил; алкоксіалкіл; алкоксикарбоніл; алкіламінокарбоніл; амінометил; CONH2; CH2CONH2; С1-С6-алканоїламіногрупа; алкоксикарбоніламіногрупа; аміногрупа; галоген; ціаногрупа; нітрогрупа; тіол; алкілтіогрупа; алкільсульфоніл; алкілсульфеніл; алкілсульфонамідогрупа; алкіламіносульфоніл; аміносульфоніл; галогеналкоксигрупа; галогеналкіл; група формули -C(X3)N(R11)R12 (де X3 – О або S та R11 і R12 незалежно один від одного вибрані із групи, до якої входять водень, метил, етил, або разом з атомом азоту, до якого вони приєднані, утворюють піролідин-1-іл, піперидин-1-іл або морфоліногрупу); або -OCH2O-, зв’язана із двома суміжними атомами циклу у Cy; та
-L-Lp(D)n має формулу:
,
де Rr – -(CH2)c-Rc, -CHReRf, -CH2-CHReRf, -CH2-CH2-CHReRf або Rg, де c – 1 або 2; Rc – тієніл, тіазоліл (який може бути заміщений аміногрупою), ізотіазоліл, оксазоліл, ізоксазоліл, піразоліл, імідазоліл, піридил (який може бути заміщений замісником, вибраним із групи, до якої входять алкілсульфоніл, аміносульфоніл, алкіламіносульфоніл, алкіламінокарбоніл, аміногрупа, амідогрупа, С1-С4-алкоксикарбоніл, карбоксил, ацетиламіногрупа, хлор, фтор, ціаногрупа, С1-С3-алкіл, трифторметил, метоксигрупа, етоксигрупа, нітрогрупа, гідроксил, алкілсульфоніламіногрупа, триазоліл або тетразоліл), піримідиніл, піридазиніл, піразиніл або феніл (який може бути заміщений замісником, вибраним із групи, до якої входять метил, метиламіногрупа, диметиламіногрупа, карбоксил, діалкіламіносульфоніл, алкілсульфоніл, аміносульфоніл, алкіламіносульфоніл, алкіламінокарбоніл, аміногрупа, амідогрупа, алкоксикарбоніл, ацетиламіногрупа, хлор, фтор, ціан, метоксигрупа, етоксигрупа, нітрогрупа, гідроксил, алкілсульфоніламіногрупа, триазоліл або тетразоліл); кожен із Re та Rf незалежно від іншого є водень або С1-С3-алкіл; або CHReRf – циклопентил (який може бути заміщений у положенні 3 або 4 замісником, вибраним із групи, до якої входять гідроксил, аміногрупа, С1-С3-алкоксигрупа, С1-С3-гідроксіалкіл, С1-С3-алкіл, карбоксил, метоксикарбоніл або етоксикарбоніл), циклогексил (який може бути заміщений у положенні 3 або 4 замісником, вибраним із групи, до якої входять гідроксил, аміногрупа, С1-С3-алкоксигрупа, С1-С3-гідроксіалкіл, С1-С3-алкіл, карбоксил, метоксикарбоніл або етоксикарбоніл), тетрагідропіран-4-іл, тетрагідротіопіран-4-іл, піролідин-3-іл (який може бути заміщений у положенні 1 замісником, вибраним із групи, до якої входять гідроксил, аміногрупа, С1-С3-алкоксигрупа, С1-С3-гідроксіалкіл, С1-С3-алкіл, карбоксил, метоксикарбоніл або етоксикарбоніл), піперидин-4-іл (який може бути заміщений у положенні 1 замісником, вибраним із групи, до якої входять гідроксил, аміногрупа, С1-С3-алкоксигрупа, С1-С3-гідроксіалкіл, С1-С3-алкіл, карбоксил, метоксикарбоніл або етоксикарбоніл) або індан-2-іл; та Rg – 2-метилсульфонілфеніл, який може бути заміщений фтором у положенні 4, або Rg – l6-1,1-діоксобензо[b]тіофен-7-іл;
або її фізіологічно прийнятна сіль; за умови, що Lp(D)n не має формули (K):
,
де X2 – фтор або водень.
2. Сполука за п. 1, де:
Cy – факультативно заміщений R3a: феніл, піридил, тієніл, тіазоліл, нафтил, піперидиніл або циклоалкіл;
кожний R3a незалежно від інших вибраний із групи, до якої входять водень, гідроксил, метоксигрупа, етоксигрупа, метил, етил, метиламінометил, диметиламінометил, гідроксиметил, карбоксил, метоксиметил, метоксикарбоніл, етоксикарбоніл, метиламінокарбоніл, диметиламінокарбоніл, амінометил, CONH2, CH2CONH2, ацетиламіногрупа, метоксикарбоніламіногрупа, етоксикарбоніламіногрупа, трет-бутоксикарбоніламіногрупа, аміногрупа, фтор, хлор, ціан, нітрогрупа, тіол, метилтіогрупа, метилсульфоніл, етилсульфоніл, метилсульфеніл, метилсульфоніламідогрупа, етилсульфоніламідогрупа, метиламіносульфоніл, етиламіносульфоніл, аміносульфоніл, трифторметоксигрупа та трифторметил; та
-L-Lp(D)n має формулу:
,
де Rr – -(CH2)c-Rc, -CHReRf, -CH2-CHReRf або Rg, де c – 1 або 2; Rc – піридил або феніл (де феніл може бути заміщений замісником, вибраним із групи, до якої входять фтор, хлор, метил, CONH2, SO2NH2, метиламіносульфоніл, диметиламіносульфоніл, метоксигрупа або метилсульфоніл); кожен із Re та Rf незалежно від іншого є водень або С1-С3-алкіл; або CHReRf – циклопентил (який може бути заміщений у положенні 3 або 4 замісником, вибраним із групи, до якої входять метил, етил або гідроксиметил), циклогексил (який може бути заміщений у положенні 3 або 4 замісником, вибраним із групи, до якої входять метил, етил або гідроксиметил), тетрагідропіран-4-іл, тетрагідротіопіран-4-іл, піролідин-3-іл (який може бути заміщений метилом в положенні 1), піперидин-4-іл (який може бути заміщений метилом в положенні 1) або індан-2-іл; та Rg – 2-метилсульфонілфеніл, який може бути заміщений фтором в положенні 4, або Rg – 6-1,1-діоксобензо[b]тіофен-7-іл.
3. Сполука за п. 1 або п. 2, де R2 є:
(i) феніл, факультативно заміщений у положенні 3 та/або 4 фтором, хлором, бромом, йодом, нітрогрупою, дифторметоксигрупою, трифторметоксигрупою, аміногрупою, ціаном, трифторметилом, метилтіогрупою, вінілом, карбоксилом, ацетоксигрупою, MeSO2-, гідроксилом, метоксигрупою, етоксигрупою, метилом, метоксикарбонілом, метиламіногрупою, етиламіногрупою або амідогрупою, та факультативно заміщений у положенні 6 аміногрупою, гідроксилом, фтором, метоксикарбонілом, ціаном або амінометилом (у варіанті, якому віддається перевага, феніл, заміщений у положенні 4 хлором, аміногрупою, вінілом, метиламіногрупою, метилом або метоксигрупою, факультативно заміщений у положенні 3 аміногрупою або гідроксилом та факультативно заміщений у положенні 6 аміногрупою або гідроксилом);
(ii) нафт-2-ил, факультативно заміщений у положенні 6 гідроксилом та факультативно заміщений у положенні 3 аміногрупою або гідроксилом;
(iii) ізохінолін-7-іл, індол-5-іл, індол-6-іл, індазол-5-іл, індазол-6-іл, бензотіазол-6-іл або бензізоксазол-5-іл, факультативно заміщений у положенні 3 хлором, бромом, аміногрупою, метилом або метоксигрупою (у варіанті, якому віддається перевага, індол-6-іл, факультативно заміщений у положенні 3 хлором, бромом, метилом або метоксигрупою);
(iv) бензимідазол-5-іл або бензотіазол-6-іл, факультативно заміщений у положенні 2 аміногрупою;
(v) тієн-2-іл або тієн-3-іл, факультативно заміщений у положенні 4 або 5 метилтіогрупою, метилом або ацетилом;
(vi) 3,4-метилендіоксифеніл, 2,3-дигідроіндол-6-іл, 3,3-дихлор-2-оксо-індол-6-іл або 1-метил-3-аміноіндазол-5-іл;
(vii) бензотіазол-2-іл, імідазо[1,2-a]піримідин-2-іл або тетрагідроімідазо-[1,2-a]піримідин-2-іл;
(viii) піразол-2-іл, заміщений у положенні 5 метилом;
(ix) 5-хлорпірид-2-ил;
(x) пірид-3-ил або 6-хлорпірид-3-ил;
(xi) бензофур-2-ил, 5-хлорбензофур-2-ил, 3-метилбензофур-2-ил, 5-метилбензофур-2-ил або 6-метоксибензофур-2-ил;
(xii) індол-2-іл, факультативно заміщений при атомі азоту індолу метилом та факультативно заміщений у положенні 5 або 6 фтором, хлором, бромом, метилом або метоксигрупою;
(xiii) індол-6-іл, заміщений у положенні 5 хлором, фтором або гідроксилом та факультативно заміщений у положенні 3 хлором або метилом; або
(xiv) бензо[b]тіофен-2-іл, факультативно заміщений у положенні 3 фтором, хлором або метилом та факультативно заміщений у положенні 5 або 6 фтором, хлором, метилом, гідроксилом або метоксигрупою.
4. Сполука за п. 3, де R2:
(i) феніл, 2-амінофеніл, 3-амінофеніл, 2-аміно-4-фторфеніл, 2-аміно-4-хлорфеніл, 2-аміно-4-нітрофеніл, 2-аміно-4-метилфеніл, 3,4-діамінофеніл, 3-аміно-4-фторфеніл, 3-аміно-4-хлорфеніл, 3-аміно-4-бромфеніл, 3-аміно-4-гідроксифеніл, 3-аміно-4-карбоксиметилфеніл, 3-аміно-4-метилфеніл, 3-аміно-4-метоксифеніл, 2-фторфеніл, 4-фтор-3-ціанфеніл, 3-хлорфеніл, 3-хлор-4-гідроксифеніл, 4-хлорфеніл, 4-хлор-2-гідроксифеніл, 4-хлор-3-гідроксифеніл, 4-хлор-3-метилфеніл, 4-хлор-3-метоксифеніл, 4-бромфеніл, 4-бром-3-метилфеніл, 4-йодфеніл, 2-ціанфеніл, 3-ціанфеніл, 4-ціанфеніл, 2-гідроксифеніл, 2-гідрокси-4-метоксифеніл, 3-гідроксифеніл, 3-гідрокси-4-метилфеніл, 2,4-дигідроксифеніл, 3,4-дигідроксифеніл, 3-гідрокси-4-метоксифеніл, 4-дифторметоксифеніл, 4-трифторметоксифеніл, 4-трифторметилфеніл, 4-метилтіофеніл, 4-метоксикарбонілфеніл, 4-ацетоксифеніл, 4-метансульфонілфеніл, 3-метилфеніл, 4-метилфеніл, 4-вінілфеніл, 4-метоксифеніл, 4-етоксифеніл, 4-метокси-3-хлорфеніл, 4-метокси-3-метилфеніл, 3-метиламінофеніл, 4-метиламінофеніл, 4-етиламінофеніл або 2-амінометилфеніл;
(ii) нафт-2-ил, 3-амінонафт-2-ил, 3-гідроксинафт-2-ил або 6-гідроксинафт-2-ил;
(iii) ізохінолін-7-іл, індол-5-іл, індол-6-іл, 3-хлоріндол-6-іл, 3-броміндол-6-іл, 3-метиліндол-6-іл, 3-метоксііндол-6-іл, індазол-5-іл, 3-аміноіндазол-5-іл, індазол-6-іл, бензотіазол-6-іл, 3-амінобензізоксазол-5-іл;
(iv) бензімідазол-5-іл, 2-амінобензимідазол-5-іл або бензотіазол-6-іл;
(v) тієн-2-іл, 5-метилтієн-2-іл, 5-метилтіотієн-2-іл, 5-ацетилтієн-2-іл або тієн-3-іл;
(vi) 3,4-метилендіоксифеніл, 2,3-дигідроіндол-6-іл, 3,3-дихлор-2-оксоіндол-6-іл або 1-метил-3-аміноіндазол-5-іл;
(vii) бензотіазол-2-іл, імідазо[1,2-a]піримідин-2-іл або тетрагідроімідазо-[1,2-a]піримідин-2-іл;
(viii) 5-метилпіразол-2-іл;
(ix) 5-хлорпірид-2-ил;
(x) пірид-3-ил, 6-хлорпірид-3-ил;
(xi) бензофур-2-ил, 5-хлорбензофур-2-ил, 3-метилбензофур-2-ил, 5-метилбензофур-2-ил, 6-метоксибензофур-2-ил;
(xii) індол-2-іл, 5-фторіндол-2-іл, 5-хлоріндол-2-іл, 5-метиліндол-2-іл, 5-метоксііндол-2-іл, 6-метоксііндол-2-іл та 1-метиліндол-2-іл;
(xiii) 5-фторіндол-6-іл; або
(xiv) бензо[b]тіофен-2-іл, 5-хлорбензо[b]тіофен-2-іл або 6-хлорбензо[b]тіофен-2-іл.
5. Сполука за п. 2 або п. 3, де R2 відповідає одній з формул, вибраній з вказаних нижче формул (A¢)-(G¢):
,
де X4 – O або S, R13 вибраний із групи, до якої входять водень, фтор [за винятком (C¢)], хлор або метил, R14 вибраний із групи, до якої входять водень, метил, етил, фтор, хлор та метоксигрупа, і R15 вибраний із групи, до якої входять водень, метил, фтор, хлор та аміногрупа.
6. Сполука за п. 5, де R2 – 4-хлорфеніл, 4-метоксифеніл, 3-аміно-4-хлорфеніл, індол-2-іл, 5-хлоріндол-2-іл, індол-6-іл, 3-хлоріндол-6-іл або 3-метиліндол-6-іл.
7. Сполука за будь-яким із пп. 1-6, де Cy вибраний з:
,
де
X¢ вибраний з O, S та NMe;
X¢¢ вибраний з O та S;
X¢¢¢ вибраний з O, S, NH та NMe;
Y¢ вибраний із групи, до якої входять водень, аміногрупа та метил;
Ro вибраний із групи, до якої входять водень, метил, фтор, хлор, трифторметил, метоксигрупа, метилтіогрупа, метилсульфініл та метилсульфоніл;
Rm вибраний із групи, до якої входять водень, метил, фтор, хлор, трифторметил, метоксигрупа, метилтіогрупа, метилсульфініл, метилсульфоніл, карбоксил, метоксикарбоніл та група формули -C(X3)N(R11)R12, (де X3 - О або S та R11 і R12 незалежно один від одного вибрані із групи, до якої входять водень, метил та етил, або спільно з атомом азоту, до якого вони приєднані, утворюють піролідин-1-іл, піперидин-1-іл або морфоліногрупу);
Rp вибраний із групи, до якої входять водень та фтор; або
Ro та Rm або Rm та Rp утворюють групу -OCH2O-; або
Ro та Rm спільно із циклом, до якого вони приєднані, утворюють 5- або 6-членний арил або гетероарил (де до складу згаданого гетероарилу входить 1 або 2 гетероатоми, вибрані із групи, до якої входять азот, кисень та сірка);
один із Ro1 та Ro2 є водень, інший є Ro.
8. Сполука за будь-яким із пп. 1-7, де Cy вибраний із групи, до якої входять феніл, 2-хлорфеніл, 2-метоксифеніл, 4-карбамоїлфеніл, пірид-2-ил, пірид-4-ил, тієн-2-іл, тієн-3-іл, фуран-2-іл, фуран-3-іл, імідазол-2-іл, тіазол-2-іл, тіазол-4-іл, тіазол-5-іл та хінолін-4-іл.
9. Сполука за будь-яким із пп. 1-8, де Rr – група -CHReRf, -CH2-CHReRf або -CH2-CH2-CHReRf.
10. Сполука за п. 9, де -CHReRf – 2-пропіл, 3-пентил, циклопентил, циклогексил, 4-метилциклогексил, тетрагідротіопіран-4-іл, піролідин-3-іл, 1-метилпіролідин-3-іл, 1-(2-пропіл)піролідин-3-іл, піперидин-4-іл, 1-метилпіперидин-4-іл, 1-(2-пропіл)піперидин-4-іл або індан-2-іл.
11. Сполука за п. 10, де Rr є 1-метилпіперидин-4-іл.
12. Сполука за будь-яким із пп. 1-11, де альфа-атомом у Y є вуглець, що має конформацію, яка є наслідком побудови з D--амінокислоти NH2-CH(Cy)-COOH, де NH2 є частиною X-X.
13. Сполука за п. 1, вибрана із групи, до якої входять:
1-(індол-6-карбоніл-D-фенілгліциніл)-4-[2-(4-піридиніл)етил]піперазин;
1-(3-хлоріндол-6-карбоніл-D-фенілгліциніл)-4-[2-(4-піридиніл)етил]піперазин;
1-(4-метоксибензоїл-D-фенілгліциніл)-4-(1-метилпіперидин-4-іл)піперазин;
1-(індол-6-карбоніл-D-фенілгліциніл)-4-(1-метилпіперидин-4-іл)піперазин;
1-(4-метоксибензоїл-D-(2-хлорфеніл)гліциніл)-4-(1-метилпіперидин-4-іл)піперазин;
1-(індол-6-карбоніл-D-(2-хлорфеніл)гліциніл)-4-(1-метилпіперидин-4-іл)піперазин; та
1-(4-метоксибензоїл-D-(2-трифторметилфеніл)гліциніл)-4-(1-метилпіперидин-4-іл)піперазин;
та її фізіологічно прийнятні солі.
14. Сполука за п. 13, яка являє собою 1-(індол-6-карбоніл-D-фенілгліциніл)-4-(1-метилпіперидин-4-іл)піперазин, або її фізіологічно прийнятна сіль.
15. Фармацевтична композиція, яка містить сполуку за будь-яким із пп. 1-14 разом із щонайменше одним фармацевтично прийнятним носієм або наповнювачем.
16. Сполука за будь-яким із пп. 1-14 для застосування у терапії.
17. Застосування сполуки за будь-яким із пп. 1-14 для виготовлення лікарського засобу для лікування тромботичних захворювань.
18. Спосіб лікування людей або тварин для боротьби із тромботичними захворюваннями, який включає введення в організм пацієнта ефективної кількості сполуки за п. 1.
19. Фармацевтична композиція, яка містить сполуку за будь-яким із пп. 1-14, для застосування для боротьби із тромботичними захворюваннями.
20. Сполука формули
або її сіль, де Cy відповідає визначенню, наведеному в п. 1.
Текст
Цей винахід стосується сполук, що є інгібіторами серинових протеаз, фармацевтичних композицій, що містять такі сполуки, та їх застосування при лікуванні людей або тварин. Серинові протеази складають групу протеолітичних ферментів, які мають спільний каталітичний механізм, характерною особливістю якого є особливо висока реакційна здатність серинового залишку (Ser). Прикладами серинових протеаз є трипсин, триптаза, хімотрипсин, еластаза, тромбін, плазмін, калікреїн, комплемент СІ, акросомна протеаза, лізосомна протеаза, коконаза, α-літична протеаза, протеаза А, протеаза В, серинкарбоксипептидаза II, субтилізин, урокіназа, фактор Vlla, фактор ІХа та фактор Ха. Серинові протеази широко досліджувалися протягом кількох десятиріч, і терапевтична цінність інгібіторів серинових протеаз є добре зрозумілою. Інгібітори серинових протеаз відіграють центральну роль у регулюванні найрізноманітніших фізіологічних процесів, у тому числі коагуляції, фібринолізу, запліднення, розвитку, утворення злоякісних пухлин, розвитку нервово-м'язових стр уктур та запальних процесах. Добре відомо, що ці сполуки пригнічують цілий ряд циркулюючих протеаз, а також протеаз, які активуються або виділяються у тканинах. Стає зрозумілим, що інгібітори серинових протеаз пригнічують важливі клітинні процеси, наприклад, адгезію, міграцію, продукування вільних радикалів та апоптоз. Крім того, експерименти на тваринах свідчать про те, що введені внутрішньовенно інгібітори серинових протеаз, їхні модифікації або клітини, що експресують інгібітори серинових протеаз, забезпечують захисний ефект проти пошкодження тканин. Припускають також, що інгібітори серинових протеаз знайдуть потенційне корисне застосування при лікуванні захворювань у різноманітних клінічних галузях, наприклад, онкології, неврології, гематології, пульмонології, імунології, а також запальних та інфекційних хвороб. Зокрема, інгібітори серинових протеаз можуть відіграти благотворну роль при лікуванні тромботичних захворювань, астми, емфіземи, цирозу, артриту, карциноми, меланоми, рестенозу, атероми, травми, шоку та пошкоджень, спричинених реперфузією. Так, наприклад, інгібітор фактора Ха є цінним терапевтичним засобом як антикоагулянт, наприклад, при лікуванні та профілактиці тромботичних захворювань. Застосування інгібітора фактора Ха як антикоагулянта є бажаним з огляду на селективність його дії. Багато допущених до клінічного застосування антикоагулянтів пов'язані з негативними явищами внаслідок неспецифічної природи їхнього впливу на систему згортання крові. Добре відомим є також зв'язок дефіциту інгібітора α1-протеази з емфіземою та цирозом, і дефіциту інгібітора Cl-естераз з ангіоневротичним набряком. Як виявлено винахідниками, певні ароматичні сполуки, які несуть об'ємні ліпофільні бічні ланцюги, є особливо ефективними як інгібітори серинових протеаз, зокрема, протеаз із негативно зарядженими "зонами" Р1-специфічності, особливо тромбіну і, що найважливіше, фактора Ха. Інгібітори фактора Ха за цим винаходом потенційно придатні для профілактики або лікування тромботичних захворювань, наприклад, опріч інших, венозного тромбозу, емболії легеневої артерії, артеріального тромбозу, ішемії міокарда, інфаркту міокарда та церебрального тромбозу. Вони потенційно забезпечують сприятливий ефект при лікуванні гострої оклюзії судин, пов'язаної з тромболітичною терапією та рестенозом, наприклад, після транслюмінальної коронарної ангіопластики або шунтування коронарних чи периферичних артерій, а також при підтриманні судинної прохідності у пацієнтів, яких піддають тривалому гемодіалізу. Інгібітори фактора Ха за цим винаходом можна, із сприятливим ефектом, застосовувати при комбінованій терапії разом з антикоагулянтами різного типу дії або з тромболітичними засобами. У WO 99/11658 та WO 99/11657 повідомляється, що певні похідні бензамідину та аміноізохіноліну, які несуть об'ємний ліпофільний бічний ланцюг, є високоефективними інгібіторами серинових протеаз. На жаль, встановлено також, що бензамідинові сполуки, розкритні у WO 99/11658 мають, як правило, низьку пероральну біодоступність. Несподівано встановлено, що деякі інші ароматичні сполуки також виявляють інгібіторну активність щодо серинових протеаз, зокрема, фактора Ха, незважаючи на відсутність амідинової або 1-аміноізохінолінової функціональної групи, яка раніше вважалася вирішальною для активності як інгібітора фактора Ха. Багато з цих сполук мають також інші структурні особливості, які додатково відрізняють їх від сполук за WO 99/11658 та WO 99/11657. При випробуваннях сполук за цим винаходом, вони, як правило, виявляли кращу пероральну біодоступність, порівняно з бензамідинами, розкритими в WO 99/11658. Встановлено також, що сполуки за цим винаходом у пробі на протромбіновий час (РТ) демонструють кращу ефективність у порівнянні з аміноізохінолінами, які мають аналогічну активність щодо фактора Ха та схожу структур у. Проба на РТ є пробою на коагуляцію, і, за загальноприйнятими поглядами, інгібітори фактора Ха безпосередньої дії, які демонструють високу ефективність при пробі на РТ, є, імовірніше, кращими антитромботичними засобами. У WO 99/09053 розкрито деякі сполуки 2-амінобензаміду як потенційні антагоністи рецептора мотиліну, і в патенті США №3268513 висунуто припущення, що аналогічні сполуки 2-амінобензаміду є потенційними антибактеріальними засобами. Щодо нових сполук за цим винаходом, однак, раніше не висувалось припущення, що вони є потенційними інгібіторами серинових протеаз. Таким чином, цей винахід, згідно з одним зі своїх аспектів, пропонує як інгібітор серинових протеаз сполуку формули (І) де: R2 - 5- або 6-членний ароматичний вуглецевий цикл, факультативно перерваний атомом азоту, кисню або сірки в циклі, факультативно заміщений у положенні 3 та/або 4 (відносно точки приєднання Х-Х) галогеном, нітрогрупою, тіолом, галогеналкоксигрупою, гідразидогрупою, алкілгідразидогрупою, аміногрупою, ціаном, галогеналкілом, алкілтіогрупою, алкенілом, алкінілом, ациламіногрупою, три- або дифторметоксигрупою, карбоксилом, ацилоксигрупою, MeSO2- або R1, або замісники у положеннях 3 та 4 спільно утворюють конденсований цикл, який являє собою 5- або 6-членний карбоцикл або гетероцикл, факультативно заміщений галогеном, галогеналкоксигрупою, галогеналкілом, ціаном, нітрогрупою, аміногрупою, гідразидогрупою, алкілтіогрупою, алкенілом, алкінілом або R1j, і факультативно заміщений у альфа-положенні відносно Х-Х групи (наприклад, у положенні 6 для шестичленного ароматичного циклу тощо) аміногрупою, гідроксилом, галогеном, алкілом, карбоксилом, алкоксикарбонілом, ціаном, амідогрупою, аміноалкілом, алкоксигрупою або алкілтіогрупою за умови, що R2 не може бути аміноізохінолілом; кожний з X незалежно від інших є атомом С, N, О чи S або групою CO, CR1a, C(R1a)2 чи NR1a, причому щонайменше один із X є С, CO, CR 1a або C(R 1a)2 ; кожний з R1a незалежно від інших являє собою водень або гідроксил, алкоксигрупу, алкіл, аміноалкіл, гідроксіалкіл, алкоксіалкіл, алкоксикарбоніл, алкіламінокарбоніл, алкоксикарбоніламіногрупу, ацилоксиметоксикарбоніл або алкіламіногрупу, факультативно заміщену гідроксилом, алкіламіногрупою, алкоксигрупою, оксогрупою, арилом або циклоалкілом; R1 відповідає визначенню для R1a, за умови, що R 1 не є незаміщеним аміноалкілом; Υ (α-атом) є атомом азоту або гр упою CR1b; Су - насичена або ненасичена, моно- або поліциклічна, гомо- або гетероциклічна група, яка у варіанті, якому віддається перевага, містить від 5 атомів до 10 атомів у циклі та факультативно заміщена групами R3a або R3iXi; кожен з R3a незалежно від інших - R1c, аміногрупа, галоген, ціан, нітрогрупа, тіол, алкілтіогрупа, алкілсульфоніл, алкілсульфеніл, триазоліл, імідазоліл, тетразоліл, гідразидогрупа, алкілімідазоліл, тіазоліл, алкілтіазоліл, алкілоксазоліл, оксазоліл, алкілсульфонамідогрупа, алкіламіносульфоніл, аміносульфоніл, галогеналкоксигрупа, галогеналкіл, група формули -C(X3)N(R11)R12 (де X3 - О або S; та R11 і R12 незалежно один від одного вибрані із групи, до якої входять водень, метил та етил, або разом з атомом азоту, до якого вони приєднані, утворюють піролідин-1-іл, піперидин-1-іл або морфоліногрупу), або -ОСН2О-, яка зв'язана із двома суміжними атомами циклу у Су; Хі - зв'язок, О, NH або СН 2; R3i - феніл, піридил або піримідиніл, факультативно заміщений R3a; R1b, R1c та R1j відповідають визначенню для R1a; і -L-Lp(D)n має формулу: де Rr - -(CH2)c-Rc, -CHR eRf, -CH2-CHReRf, -CH2-CH2-CHReRf або Rg , де с - 1 або 2; Rc - тієніл, тіазоліл (який може бути заміщений аміногрупою), ізотіазоліл, оксазоліл, ізоксазоліл, піразоліл, імідазоліл, піридил (який може бути заміщений замісником, вибраним із групи, до якої входять алкілсульфоніл, аміносульфоніл, алкіламіносульфоніл, алкіламінокарбоніл, аміногрупа, амідогрупа, С1-С4-алкоксикарбоніл, карбоксил, ацетиламіногрупа, хлор, фтор, ціан, C1-С3-алкіл, трифторметил, метоксигрупа, етоксигрупа, нітрогрупа, гідроксил, алкілсульфоніламіногрупа, триазоліл або тетразоліл), піримідиніл, піридазиніл, піразиніл або феніл (який може бути заміщений замісником, вибраним із групи, до якої входять метил, метиламіногрупа, диметиламіногрупа, карбоксил, діалкіламіносульфоніл, алкілсульфоніл, аміносульфоніл, алкіламіносульфоніл, алкіламінокарбоніл, аміногрупа, амідогрупа, алкоксикарбоніл, ацетиламіногрупа, хлор, фтор, ціан, метоксигрупа, етоксигрупа, нітрогрупа, гідроксил, алкілсульфоніламіногрупа, триазоліл та тетразоліл); кожен з Re та Rf незалежно від іншого є воднем або С 1-С3-алкілом; або CHReRf є циклопентил (який може бути заміщений у положенні 3 або 4 замісником, вибраним із групи, до якої входять гідроксил, аміногрупа, С1-С3алкоксигрупа, С1-С3-гідроксіалкіл, С1-С3-алкіл, карбоксигрупа, метоксикарбоніл та етоксикарбоніл), циклогексил (який може бути заміщений у положенні 3 або 4 замісником, вибраним із групи, до якої входять гідроксил, аміногрупа, С1-С3-алкоксигрупа, С1-С3-гідроксіалкіл, С1-С3-алкіл, карбоксил, метоксикарбоніл або етоксикарбоніл), тетрагідропіран-4-іл, тетрагідротіопіран-4-іл, піролідин-3-іл (який може бути заміщений у положенні 1 замісником, вибраним із групи, до якої входять гідроксил, аміногрупа, С1-С3-алкоксигрупа, С1-С3гідроксіалкіл, С1-С3-алкіл, карбоксил, метоксикарбоніл та етоксикарбоніл), піперидин-4-іл (який може бути заміщений у положенні 1 замісником, вибраним із групи, до якої входять гідроксил, аміногрупа, С1-С3алкоксигрупа, C1-С3-гідроксіалкіл, С1-С3-алкіл, карбоксил, метоксикарбоніл та етоксикарбоніл) або індан-2-іл; і Rg - 2-метилсульфонілфєніл, який може бути заміщений у положенні 4 фтором, або Rg - l6-1,1діоксобензо[b]тіофен-7-іл; або її фізіологічно прийнятну сіль (наприклад, галогенід, фосфат або сульфат або сіль з амонієм або органічним аміном, наприклад, етиламіном або меглуміном); за умови, що Lp(D)n не є гр упою формули (К): де Х2 - фтор або водень. Згідно з іншим аспектом цей винахід стосується інгібітора серинових протеаз - сполуки формули (І) де: R2 - 5- або 6-членний ароматичний вуглецевий цикл, факультативно перерваний атомом азоту, кисню або сірки в циклі, факультативно заміщений у положенні 3 та/або 4 (відносно точки приєднання Х-Х) галогеном, нітрогрупою, тіолом, галогеналкоксигрупою, гідразидогрупою, алкілгідразидогрупою, аміногрупою, ціаном, галогеналкілом, алкілтіогрупою, алкенілом, алкінілом, ациламіногрупою, три- або дифторметоксигрупою, карбоксилом, ацилоксигрупою, MeSO2- або R1, або замісники у положеннях 3 та 4 спільно утворюють конденсований цикл, який являє собою 5- або 6-членний карбоцикл або гетероцикл, факультативно заміщений галогеном, галогеналкоксигрупою, галогеналкілом, ціаном, нітрогрупою, аміногрупою, гідразидогрупою, алкілтіогрупою, алкенілом, алкінілом або R1j, і факультативно заміщений у альфа-положенні відносно Х-Х групи (наприклад, у положенні 6 для шестичленного ароматичного циклу тощо) аміногрупою, гідроксилом, галогеном, алкілом, карбоксилом, алкоксикарбонілом, ціаном, амідогрупою, аміноалкілом, алкоксигрупою або алкілтіогрупою за умови, що R2 не може бути аміноізохінолілом; кожний з X незалежно від іншого є атомом С, N, О чи S або групою CO, CR1a, C(R1a)2 чи NR1a, причому щонайменше один із X є С, CO, CR 1a або C(R 1a)2 ; кожний з R1a незалежно від іншого являє собою водень або гідроксил, алкоксигрупу, алкіл, аміноалкіл, гідроксіалкіл, алкоксіалкіл, алкоксикарбоніл, алкіламінокарбоніл, алкоксикарбоніламіногрупу, ацил оксиметоксикарбоніл або алкіламіногрупу, факультативно заміщену гідроксилом, алкіл аміногрупою, алкоксигрупою, оксогрупою, арилом або циклоалкілом; R1 відповідає визначенню для R1a, за умови, що R 1 не є незаміщеним аміноалкілом; Υ (α-атом) є атомом азоту або гр упою CR1b; Су - насичена або ненасичена, моно- або поліциклічна, гомо- або гетероциклічна група, яка у варіанті, якому віддається перевага, містить від 5 атомів до 10 атомів у циклі та факультативно заміщена групами R3a або фенілом, факультативно заміщеним R3a; кожен R3a незалежно від інших - R1c, аміногрупа, галоген, ціан, нітрогрупа, тіол, алкілтіогрупа, алкілсульфоніл, алкілсульфеніл, триазоліл, імідазоліл, тетразоліл, гідразидогрупа, алкілімідазоліл, тіазоліл, алкілтіазоліл, алкілоксазоліл, оксазоліл, алкілсульфонамідогрупа, алкіламіносульфоніл, аміносульфоніл, галогеналкоксигрупа, галогеналкіл; R1b, R1c та R1j відповідають визначенню для R1a; та -L-Lp(D)n має формулу: де Rr - -(CH2)c-Rc, -CHR eRf, -CH2-CHReRf або Rg , де с - 1 або 2; Rc - піридил або феніл (де феніл може бути заміщений замісником, вибраним із групи, до якої входять фтор, хлор, метил, CONH2, SO2NH2, метиламіносульфоніл, диметиламіносульфоніл, метоксигрупа або метилсульфоніл); кожен із Re та Rf незалежно від іншого є воднем або С1-С3-алкілом; або CHReRf є циклопентил (який може бути заміщений у положенні 3 або 4 замісником, вибраним із групи, до якої входять метил, етил та гідроксиметил), циклогексил (який може бути заміщений у положенні 3 або 4 замісником, вибраним із групи, до якої входять метил, етил або гідроксиметил), тетрагідропіран-4-іл, тетрагідротіопіран-4-іл, піролідин-3-іл (який може бути заміщений метилом у положенні 1), піперидин-4-іл (який може бути заміщений метилом у положенні 1) або індан-2-іл; та Rg - 2-метилсульфонілфеніл, який може бути заміщений фтором у положенні 4, або Rg - λ6-1,1діоксобензо[b]тіофен-7-іл; або її фізіологічно прийнятної солі; за умови, що Lp(D)n не є гр упою формули (К): де Х2 - фтор або водень. У сполуках за цим винаходом, де альфа-атомом є вуглець, він у варіанті, якому віддається перевага, має конформацію, що є наслідком побудови з D-a-амінокислоти NH2-CR1b(Cy)-COOH, де NH2 є частиною Х-Х. Аналогічно, четвертим замісником R1b при альфа-вуглеці у варіанті, якому віддається перевага, є метил чи гідроксиметил або водень. Слід розуміти, що сполуки формули (І) можуть існувати у рацемічній або хіральній формі і що D-ізомер, якому віддається перевага, можна вводити в організм пацієнта у рацемічній суміші з Lізомером або окремо. У сполуках за цим винаходом, якщо не обумовлено інше, арильні групи у варіанті, якому віддається перевага, містять у циклі від 5 атомів до 10 атомів, і вони факультативно містять 1 гетероатом, 2 гетероатоми або 3 гетероатоми, вибрані з О, N або S; алкільні, алкенільні або алкінільні групи або алкіленові фрагменти у варіанті, якому віддається перевага, містять до 6 атомів вуглецю, наприклад, C1-C6 або С1-С3; циклічні групи у варіанті, якому віддається перевага, містять у циклі від 3 атомів до 8 атомів; і конденсовані поліциклічні групи у варіанті, якому віддається перевага, містять у циклі від 8 атомів до 16 атомів. Конкретними прикладами R1a є: водень, метил або етил. У варіанті, якому віддається перевага, R1a є атомом водню. Місточкова група (Х-Х) між групою R2 та альфа-атомом у варіанті, якому віддається перевага, вибрана з груп -СН=СН-, -CONH-, -CONR1a-, -NH-CO-, -NH-CH 2-, -CH2-NH-, -CH2O-, -OCH 2, -COO-, -OC=O- та -CH 2-CH2-. У варіанті, якому віддається перевага, фрагментом X, найближчим до альфа-атома, є NH або атом О, у варіанті, якому віддається найбільша перевага, NH група. Фрагментом X у альфа-положенні відносно ароматичного кільця у варіанті, якому віддається перевага, є група на основі вуглецю, наприклад, СН2- або СО, у варіанті, якому віддається перевага, CO. Таким чином, місточковою групою Х-Х, якій віддається особлива перевага, є CONH-. За альтернативним варіантом втілення цього винаходу місточковою групою є гр упа -ОСН2-. Конкретними прикладами R1b є: водень, С1-С4-алкіл, наприклад, метил, або гідрокси С 1-С4-алкіл, наприклад, гідроксиметил. У варіанті, якому віддається перевага, R1b є атомом водню. Альфа-атомом (Y) у варіанті, якому віддається перевага, є СН або С(СН 3) група. Альфа-атомом (Y) є, зокрема, СН. Конкретними прикладами -CHReRf у групі -CHReRf, -CH 2-CHReRf або -CH 2-CH2-CHReRf є 2-пропіл, 3-пентил, циклопентил, циклогексил, 4-метилциклогексил, тетрагідротіопіран-4-іл, піролідин-3-іл, 1-метилпіролідин-3-іл, 1-(2-пропіл)піролідин-3-іл, піперидин-4-іл, 1-метилпіперидин-4-іл, 1-(2-пропіл)піперидин-4-іл та індан-2-іл. Якщо Rr має формулу -CHReRf, то прикладом Rr, якому віддається перевага, є 1-метилпіперидин-4-іл. Rr у варіанті, якому віддається перевага, має формулу -(CH2)c-Rc.· У варіанті, якому віддається перевага, с - 2. У варіанті, якому віддається перевага, -L-Lp(D)n має формулу: де Rr - -(CH2)c-Rc; де с - 2; Rс - тієніл, тіазоліл (який може бути заміщений аміногрупою), ізотіазоліл, оксазоліл, ізоксазоліл, піразоліл, імідазоліл, піридил (який може бути заміщений замісником, вибраним із групи, до якої входять аміногрупа, метоксикарбоніл, карбоксил, фтор, ціан, метил, метилсульфоніл, аміносульфоніл, метиламіносульфоніл, диметиламіносульфоніл або трифторметил), піримідиніл, піридазиніл, піразиніл або феніл (де феніл може бути заміщений замісником, вибраним із групи, до якої входять фтор, хлор, ціан, метил, аміногрупа, метилсульфоніл, аміносульфоніл, метиламіносульфоніл, диметиламіносульфоніл, метиламіногрупа, диметиламіногрупа, карбоксил, метоксикарбоніл або метоксигрупа). У варіанті, якому віддається перевага, Rс - тіазоліл (який може бути заміщений аміногрупою), піразоліл, імідазоліл, піридил (який може бути заміщений замісником, вибраним із групи, до якої входять метил сульфоніл, аміносульфоніл, метиламіносульфоніл, диметиламіносульфоніл, фтор, ціан, метил або трифторметил), піримідиніл, піридазиніл, піразиніл або феніл (де феніл може бути заміщений замісником, вибраним із групи, до якої входять фтор, хлор, ціан, метил, аміногрупа, метиламіногрупа, диметиламіногрупа, карбоксил, метоксикарбоніл, метилсульфоніл, аміносульфоніл, метиламіносульфоніл, диметиламіносульфоніл або метоксигрупа). У варіанті, якому віддається більша перевага, Rс - тіазоліл (який може бути заміщений аміногрупою), піразоліл, імідазоліл, піридил (який може бути заміщений замісником, вибраним із групи, до якої входять фтор, ціан, метил або трифторметил), піридазиніл або піразиніл. У варіанті, якому віддається ще більша перевага, Rс - тіазол-2-іл, 2-амінотіазол-4-іл, піразол-1-іл, піразол4-іл, піридазин-3-іл, імідазол-1-іл, імідазол-4-іл, піразин-2-іл, пірид-2-іл, пірид-3-іл, пірид-4-іл, 3-фторпірид-4-іл, 2-ціанпірид-4-іл, 2-метилпірид-4-іл або 2-трифторметилпірид-6-іл. І у варіанті, якому віддається ще більша перевага, Rс - піразоліл, імідазоліл, піридил, піридазиніл або піразиніл. У варіанті, якому віддається перевага, Rс - пірид-2-іл, пірид-3-іл або пірид-4-іл. У варіанті, якому віддається найбільша перевага, L - CO і ліпофільна група -Lp(D)n вибрана з-посеред груп таких формул: де: m - 0 або 1; Х0 - СН або Ν; та R3 відповідає визначенню для R3a. У варіанті, якому віддається перевага, m - 1. Конкретними прикладами для R3 є: водень; гідроксил; для алкоксигрупи: метоксигрупа та етоксигрупа; для алкілу, факультативно заміщеного гідроксилом, алкіл аміногрупою, алкоксигрупою, оксогрупою, арилом або циклоалкілом: С1-С6-алкіл, наприклад, метил, етил, пропіл, 2-пропіл, бутил, 2-бутил, трет-бутил, пентил, 2-пентил або 3-пентил, С1-С6-алкіламіно-С1-С6-алкіл, наприклад, ізопропіламінометил, диметиламінометил, діетиламінометил або диметиламіноетил, або С1-С6-алканоїл, наприклад, ацетил; для гідроксіалкілу, факультативно заміщеного гідроксилом, алкіламіногрупою, алкоксигрупою, оксогрупою, арилом або циклоалкілом: С1-С6-гідроксіалкіл, наприклад, гідроксиметил або гідроксіетил, карбоксил або карбокси-С 1-С5-алкіл; для алкоксіалкілу: метоксиметил; для алкоксикарбонілу: метоксикарбоніл або етоксикарбоніл; для алкіламінокарбонілу: метиламінокарбоніл або диметиламінокарбоніл; для аміноалкілу, факультативно заміщеного гідроксилом, алкіламіногрупою, алкоксигрупою, оксогрупою, арилом або циклоалкілом: амінометил, амінокарбоніл або амінокарбоніл-С1-С5-алкіл; для алкіламіногрупи, факультативно заміщеної гідроксилом, алкіламіногрупою, алкоксигрупою, оксогрупою, арилом або циклоалкілом: метиламіногрупа, диметиламіногрупа, етиламіногрупа, форміламіногрупа або ацетиламіногрупа; аміногрупа; для галогену: фтор або хлор; ціан; нітрогрупа; тіол; для алкілтіогрупи: метилтіогрупа; для алкілсульфонілу: метилсуль фоніл, етилсульфоніл або ізопропілсульфоніл; для алкілсульфенілу: метилсуль феніл (CH3SO); для триазолілу: 1,2,4-триазол-2-іл, 1,2,4-триазол-4-іл або 1,2,3-триазол-4-іл; для імідазолілу: 1,3-імідазол-1-іл або 1,3-імідазол-4-іл; для тетразолілу: тетразол-1-іл або тетразол-5-іл; для алкілсульфонамідогрупи: метилсульфонамідогрупа, етилсульфонамідогрупа або пропілсульфонамідогрупа; для алкіламіносульфонілу: метиламіносульфоніл, етиламіносульфоніл або пропіламіносульфоніл; аміносульфоніл; для галогеналкоксигрупи: трифторметоксигрупа; та для галогеналкілу: трифторметил або трихлорметил. У разі присутності R3 як замісника при ароматичному циклі, він у варіанті, якому віддається перевага, вибраний із групи, до якої входять водень, алкілсульфоніл, аміносульфоніл, алкіламіносульфоніл, алкіламінокарбоніл, аміногрупа, амідогрупа, алкоксикарбоніл, ацетиламіногрупа, хлор, фтор, ціан, метоксигрупа, етоксигрупа, нітрогрупа, гідроксил, алкілсульфоніламіногрупа, триазоліл та тетразоліл. У разі присутності R3 як замісника при насиченому циклі, він у варіанті, якому віддається перевага, вибраний з групи, до якої входять водень, гідроксил, аміногрупа, C1-С3-алкоксигрупа, С1-С3-гідроксіалкіл, C1C3-алкіл, карбоксил, метоксикарбоніл та етоксикарбоніл. Прикладами конкретних Lp(D)n груп є де Rі - водень або С 1-С6-алкіл. У варіанті, якому віддається перевага, Rі - водень, метил або етил. У варіанті, якому віддається більша перевага, Ri - водень або метил. Циклічною групою (Су), приєднаною до альфа-вуглецю, у варіанті, якому віддається перевага, є факультативно заміщений R3a: феніл, піридил, тієніл, тіазоліл, нафтил, піперидиніл, фураніл, піроліл, ізоксазоліл, ізотіазоліл, піразоліл, оксазоліл, імідазоліл, 1,2,4-тіадіазоліл, 1,3,4-тіадіазоліл, піримідиніл, піридазиніл, хіноліл, ізохіноліл, бензофурил, бензотієніл або циклоалкіл, або феніл, заміщений R3іXi, де Xі зв'язок, О, NH або СН 2, та R3i - феніл, піридил або піримідил, факультативно заміщений R3a. Циклічною групою (Су), приєднаною до альфа-вуглецю, у варіанті, якому віддається більша перевага, є факультативно заміщений R3a: феніл, піридил (наприклад, пірид-2-іл, пірид-3-іл або пірид-4-іл), тієніл (наприклад, тієн-2-іл або тієн-3-іл), тіазоліл (наприклад, тіазол-2-іл, тіазол-4-іл або тіазол-5-іл), нафтил (наприклад, нафт-1-іл), піперидиніл (наприклад, піперидин-4-іл) або циклоалкіл, наприклад, циклогексил. Конкретними прикладами для R3a є: водень; гідроксил; для алкоксигрупи, факультативно заміщеної гідроксилом, алкіламіногрупою, алкоксигрупою, оксогрупою, арилом або циклоалкілом: алкоксигрупа, наприклад, метоксигрупа або етоксигрупа, або аралкілоксигрупа, наприклад, бензилоксигрупа; для алкілу, факультативно заміщеного гідроксилом, алкіламіногрупою, алкоксигрупою, оксогрупою, арилом або циклоалкілом: алкіл, наприклад, метил або етил, або алкіламіноалкіл, наприклад, метиламінометил або диметиламінометил; для гідроксіалкілу, факультативно заміщеного гідроксилом, алкіламіногрупою, алкоксигрупою, оксогрупою, арилом або циклоалкілом: гідроксиметил або карбоксил; для алкоксіалкілу: метоксиметил; для алкоксикарбонілу: метоксикарбоніл або етоксикарбоніл; для алкіламінокарбонілу: метиламінокарбоніл або диметиламінокарбоніл; для аміноалкілу, факультативно заміщеного гідроксигрупою, алкіламіногрупою, алкоксигрупою, оксогрупою, арилом або циклоалкілом: амінометил, CONH2 або CH2CONH2; для алкіламіногрупи, факультативно заміщеної гідроксилом, алкіламіногрупою, алкоксигрупою, оксогрупою, арилом або циклоалкілом: С1-С6-алканоїламіногрупа, наприклад, ацетиламіногрупа; для алкоксикарбоніламіногрупи: метоксикарбоніламіногрупа, етоксикарбоніламіногрупа або третбутоксикарбоніламіногрупа; аміногрупа; для галогену: фтор або хлор; ціан; нітрогрупа; тіол; для алкілтіогрупи: метилтіогрупа; для алкіл сульфонілу: метил сульфоніл або етилсульфоніл; для алкілсульфенілу: метил сульфеніл; для алкілсульфонамідогрупи: метилсульфоніламідогрупа або етилсульфоніламідогрупа; для алкіламіносульфонілу: метиламіносульфоніл або етиламіносульфоніл; аміносульфоніл; для галогеналкоксигрупи: трифторметоксигрупа; для галогеналкілу: трифторметил; для групи формули -C(X3)N(R11)R12 (де Χ3 - О або S, і R 11 та R12 незалежно один від одного вибрані з групи, до якої входять водень, метил, етил, або спільно з атомом азоту, до якого вони приєднані, утворюють піролідин-1-іл, піперидин-1-іл або морфоліногрупу): -CONH2, -CONHMe, -CON(Me)2, -C(S)NH2, -C(S)NHMe, C(S)N(Me)2, піролідин-1-ілкарбоніл, піперидин-1-ілкарбоніл або морфолінокарбоніл; та -ΟΟΗ2Ο-, яка є зв'язаною із двома суміжними атомами циклу у Су. Згідно з іншим аспектом R3a вибраний із групи, до якої входять водень, гідроксил, алкоксигрупа, алкіл (факультативно заміщений гідроксилом, алкіл аміногрупою, алкоксигрупою, оксогрупою, арилом або циклоалкілом), гідроксіалкіл (факультативно заміщений гідроксилом, алкіламіногрупою, алкоксигрупою, оксогрупою, арилом або циклоалкілом), алкоксіалкіл, алкоксикарбоніл, алкіламінокарбоніл, алкоксикарбоніламіногрупа, алкіламіногрупа (факультативно заміщена гідроксилом, алкіламіногрупою, алкоксигрупою, оксогрупою, арилом або циклоалкілом), аміноалкіл (заміщений гідроксилом, алкіламіногрупою, алкоксигрупою, оксогрупою, арилом або циклоалкілом), аміногрупа, галоген, ціан, нітрогрупа, тіол, алкілтіогрупа, алкілсульфоніл, алкіл сульфеніл, алкілсульфонамідогрупа, алкіламіносульфоніл, аміносульфоніл, галогеналкоксигрупа та галогеналкіл. У варіанті, якому віддається перевага, X3 - О. Більш конкретними прикладами R3a є водень, гідроксил, метоксигрупа, етоксигрупа, метил, етил, гідроксиметил, карбоксил, метоксиметил, метоксикарбоніл, етоксикарбоніл, метиламінокарбоніл, диметиламінокарбоніл, амінометил, CONH2, CH2CONH2, ацетиламіногрупа, метоксикарбоніл аміногрупа, етоксикарбоніламіногрупа, трет-бутоксикарбоніламіногрупа, аміногрупа, фтор, хлор, бром, ціан, нітрогрупа, тіол, метилтіогрупа, метил сульфоніл, етилсульфоніл, метил сульфеніл, метилсульфоніламідогрупа, етилсульфоніламідогрупа, метил аміносульфоніл, етиламіносульфоніл, аміносульфоніл, трифторметоксигрупа, трифторметил, бром, -ОСН2О- (зв'язана із двома суміжними атомами кільця у Су) та C(X3)N(R11)R12 (де X3 - О або S та R11 і R12 незалежно один від одного вибрані із групи, до якої входять водень, метил та етил, або спільно з атомом азоту, до якого вони приєднані, утворюють піролідин-1-іл, піперидин-1-іл або морфоліногрупу). Додатковими конкретними прикладами R3а є водень, гідроксил, метоксигрупа, етоксигрупа, метил, етил, гідроксиметил, карбоксил, метоксиметил, метоксикарбоніл, етоксикарбоніл, метил амінокарбоніл, диметиламінокарбоніл, амінометил, CONH2, CH2CONH2, ацетиламіногрупа, метоксикарбоніламіногрупа, етоксикарбоніламіногрупа, трет-бутоксикарбоніламіногрупа, аміногрупа, фтор, хлор, ціан, нітрогрупа, тіол, метилтіогрупа, метилсульфоніл, етилсульфоніл, метилсульфеніл, метилсульфоніламідогрупа, етилсульфоніламідогрупа, метиламіносульфоніл, етиламіносульфоніл, аміносульфоніл, трифторметоксигрупа та трифторметил. У варіанті, якому віддається перевага, R3а - водень, гідроксил, метоксигрупа, метил, аміногрупа, фтор, хлор, етилсульфоніламіногрупа, амідогрупа або метиламінокарбоніл. У варіанті, якому віддається перевага, Су вибраний із: де X' вибраний з О, S та N Me; X" вибраний з О та S; X'" вибраний з О, S, NH та N Me; Υ' вибраний із групи, до якої входять водень, аміногрупа та метил; Ro вибраний із групи, до якої входять водень, метил, фтор, хлор, три фторметил, метоксигрупа, метилтіогрупа, метилсульфініл та метилсульфоніл; Rm вибраний із групи, до якої входять водень, метил, фтор, хлор, трифторметил, метоксигрупа, метилтіогрупа, метилсульфініл, метилсульфоніл, карбоксигрупа, метоксикарбоніл та група формули C(X3)N(R11)R12 (де X3 - О або S, та R11 і R12 незалежно один від одного вибрані із групи, до якої входять водень, метил та етил, або спільно з атомом азоту, до якого вони приєднані, утворюють піролідин-1-іл, піперидин-1-іл або морфоліногрупу); Rp вибраний із групи, до якої входять водень та фтор; або Ro та Rm або Rm та R p утворюють груп у -OCH 2 O-; або Ro та Rm разом із циклом, до якого вони приєднані, утворюють 5- або 6-членний арильний або гетероарильний цикл (де згаданий гетероарильний цикл містить 1 гетероатом або 2 гетероатоми, вибрані із групи, до якої входять азот, кисень та сірка); один з Ro1 та Ro2 є воднем, інший є Ro. У варіанті, якому віддається більша перевага, Су вибраний із групи, до якої входять феніл (факультативно заміщений метилом, етилом, проп-2-ілом, феноксигрупою, гідроксилом, етоксигрупою, бензилоксигрупою, проп-2-ілоксигрупою, нітрогрупою, аміногрупою, ацетиламіногрупою, метилсульфоніламіногрупою, диметиламіногрупою, хлором, метоксигрупою, трифторметилом, метилтіогрупою, метилсульфонілом, третбутилтіогрупою, трет-бутилсульфонілом, аміносульфонілом або карбамоїлом), піридил, тієніл, фураніл, імідазоліл, тіазоліл (факультативно заміщений аміногрупою), нафтил, ізохінолініл та хінолініл. У варіанті, якому віддається ще більша перевага, Су вибраний із групи, до якої входять феніл, 2хлорфеніл, 2-метоксифеніл, 4-карбамоїлфеніл, пірид-2-іл, пірид-3-іл, пірид-4-іл, тієн-2-іл, тієн-3-іл, фуран-2-іл, фуран-3-іл, імідазол-2-іл, тіазол-2-іл, тіазол-4-іл, тіазол-5-іл, нафтил, ізохінолін-5-іл, ізохінолін-8-іл, хінолін-4-іл, хінолін-5-іл та хінолін-8-іл. Іншими прикладами Су є 4-амінофеніл, 4-N-метиламідофеніл, 4-(N,N-диметил)амідофеніл, 2-метилфеніл, 2-фторфеніл, 3-фторфеніл, 4-фтор феніл, 4-гідроксифеніл, 4-метоксифеніл, 4-карбоксифеніл, 3-етилсульфоніламінофеніл, 2-метилтіазол-4-іл, 1-метилпіперидин-4-іл, циклопентил, циклогексил, нафт-1-іл, 2амінотіазол-4-іл, 2-трифторметилфеніл, 3-метилтіофеніл, 2-метилсульфонілфеніл, 3-бромфеніл, 3-ціанфеніл та бензо[b]тіофен-3-іл. У варіанті, якому віддається ще більша перевага, Су вибраний із групи, до якої входять феніл, 2хлорфеніл, 2-метоксифеніл, 4-карбамоїлфеніл, пірид-2-іл, пірид-4-іл, тієн-2-іл, тієн-3-іл, фуран-2-іл, фуран-3іл, імідазол-2-іл, тіазол-2-іл, тіазол-4-іл, тіазол-5-іл та хінолін-4-іл. У варіанті, якому віддається найбільша перевага, Су вибраний із групи, до якої входять феніл, 2метоксифеніл, 4-карбамоїлфеніл та пірид-2-іл. У варіанті, якому віддається найбільша перевага, Су є фенілом. Конкретними прикладами для R1c є: водень; гідроксил; для алкоксигрупи: метоксигрупа або етоксигрупа; для алкілу, факультативно заміщеного гідроксилом, алкіламіногрупою, алкоксигрупою, оксогрупою, арилом або циклоалкілом: алкіл, наприклад, метил або етил, або алкіламіноалкіл, наприклад, метиламінометил або диметил амінометил; для гідроксіалкілу: гідроксиметил; для алкоксіалкілу: метоксиметил; для алкоксикарбонілу: метоксикарбоніл або етоксикарбоніл; для алкіламінокарбонілу: метиламінокарбоніл або диметиламінокарбоніл; для алкоксикарбоніламіногрупи: метоксикарбоніламіногрупа, етоксикарбоніл аміногрупа або третбутоксикарбоніламіногрупа; для алкіламіногрупи, факультативно заміщеної гідроксилом, алкіламіногрупою, алкоксигрупою, оксогрупою, арилом або циклоалкілом: С1-С6-алканоїламіногрупа, наприклад, ацетиламіногрупа; та для аміноалкілу, заміщеного гідроксилом, алкіламіногрупою, алкоксигрупою, оксогрупою, арилом або циклоалкілом: амінометил, CONH2 або CH2CONH2. Щодо R2, прикладами 5- або 6-членного ароматичного вуглецевого циклу, факультативно перерваного атомом азоту, кисню або сірки у циклі R2, є феніл; піроліл, наприклад, 2-піроліл; піридил, наприклад, 3піридил; піразиніл, наприклад, 2-піразиніл; фурил, наприклад, 2-фурил; та тієніл, наприклад, 2-тієніл або 3тієніл. У варіанті, якому віддається перевага, цикл перерваний (тобто атом вуглецю замінений) щонайбільше одним гетероатомом. Згідно з іншим аспектом цикл є фенілом, 2-тієнілом або 2-піролілом. Згідно із ще одним аспектом цикл є фенілом. Якщо цикл є фенілом, група R2 може бути групою формули де R5 - аміногрупа, гідроксил або водень, а кожний з R6 і R7, які можуть бути однаковими або різними, є галоген, нітрогрупа, тіол, ціан, галогеналкіл, галогеналкоксигрупа, амідогрупа, гідразидогрупа, аміногрупа, алкілтіогрупа, алкеніл, алкініл або R1, або R6 і R7 спільно утворюють 5- або 6-членний конденсований карбоцикл або 5-членний гетероцикл, який може, в свою чергу, бути заміщеним R1j, аміногрупою, галогеном, ціаном, нітрогрупою, тіолом, алкілтіогрупою, галогеналкілом, галогеналкоксигрупою. У разі, коли замісники у 3 та 4 положеннях спільно утворюють конденсований цикл, котрий являє собою 5або 6-членний карбоцикл або гетероцикл, прикладами утвореної біциклічної системи є нафтил, наприклад, 2нафтил; бензимідазоліл, наприклад, бензимідазол-5-іл або бензимідазол-6-іл; ізохінолініл, наприклад, ізохінолін-7-іл; індоліл, наприклад, індол-2-іл, індол-5-іл або індол-6-іл; індазоліл, наприклад, індазол-5-іл; індазол-6-іл; 3,4-метилендіоксифеніл; дигідроіндоліл, наприклад, 2,3-дигідроіндол-6-іл; бензотіазоліл, наприклад, бензотіазол-2-іл або бензотіазол-6-іл; бензо[b]тіофеніл, наприклад, бензо[b]тіофен-2-іл; бензофурил, наприклад, бензофур-2-іл; імідазо[1,2-а]піримідиніл, наприклад, імідазо[1,2-а]піримідин-2-іл; тетрагідроімідазо[1,2-а]піримідиніл, наприклад, тетрагідроімідазо[1,2-а]піримідин-2-іл; та бензізоксазоліл, наприклад, бензізоксазол-5-іл. У варіанті, якому віддається перевага, R2 - феніл, тієн-2-іл, нафтил, індол-2-іл, індол-6-іл, бензо[b]фуран-5іл, бензо[b]тіофен-2-іл або бензимідазол-2-іл (кожен з яких факультативно заміщений згідно з поданими вище визначеннями). Перевага віддається варіанту, за яким щонайменше один із R6 та R7 не є воднем і R6, у разі його присутності, у варіанті, якому віддається перевага, є замісником, який містить один або кілька полярних атомів водню, наприклад, гідроксил, аміногрупу, алкіламіногрупу, алкіламіноалкіл, амінокарбоніл, алкіламінокарбоніл, гідразогрупу або алкілгідразогрупу; у альтернативному варіанті R6 та R7 з'єднані один з одним і утворюють нафтил або індоліл, або азаіндоліл, або діазаіндоліл. Особлива перевага віддається варіанту, де R6 є аміногрупою, a R7 - хлор, бром, метил, метоксигрупа або вініл; або R6 та R7 спільно утворюють індолільний цикл з NH у 6 положенні або нафтильний цикл. Згідно з іншим аспектом R2 являє собою: (і) феніл, факультативно заміщений у положенні 3 та/або 4 галогеном, нітрогрупою, тіолом, галогеналкоксигрупою, гідразидогрупою, алкілгідразидогрупою, аміногрупою, ціаном, галогеналкілом, алкілтіогрупою, алкенілом, алкінілом, ациламіногрупою, три- або дифторметоксигрупою, карбоксилом, ацилоксигрупою, MeSO2- або R1, та факультативно заміщений у положенні 6 аміногрупою, гідроксилом, галогеном, алкілом, карбоксилом, алкоксикарбонілом, ціаном, амідогрупою, аміноалкілом, алкоксигрупою або алкілтіогрупою; (іі) нафт-2-іл, факультативно заміщений у положенні 6 або 7 галогеном, галогеналкоксигрупою, галогеналкілом, ціаном, нітрогрупою, аміногрупою, гідразидогрупою, алкілтіогрупою, алкенілом, алкінілом або R1j, та факультативно заміщений у положенні 3 аміногрупою, гідроксилом, галогеном, алкілом, карбоксилом, ціаном, амідогрупою, аміноалкілом, алкоксигрупою або алкілтіогрупою; (ііі) ізохінолін-7-іл, індол-5-іл, індол-6-іл, індазол-5-іл, індазол-6-іл, бензотіазол-6-іл або бензізоксазол-5-іл, факультативно заміщений у положенні 3 галогеном, галогеналкоксигрупою, галогеналкілом, ціаном, нітрогрупою, аміногрупою, гідразидогрупою, алкілтіогрупою, алкенілом, алкінілом або R1j; (iv) бензимідазол-5-іл або бензотіазол-6-іл, факультативно заміщений у положенні 2 аміногрупою; (ν) тієн-2-іл або тієн-3-іл, факультативно заміщений у положенні 4 або 5 галогеном, галогеналкоксигрупою, галогеналкілом, ціаном, нітрогрупою, аміногрупою, гідразидогрупою, алкілтіогрупою, алкенілом, алкінілом або R1; (vi) 3,4-метилендіоксифеніл, 2,3-дигідроіндол-6-іл, 3,3-дихлор-2-оксо-індол-6-іл або 1-метил-3аміноіндазол-5-іл; (vii) бензотіазол-2-іл, імідазо[1,2-а]піримідин-2-іл або тетрагідроімідазо[1,2-а]піримідин-2-іл; (viii) піразол-2-іл, факультативно заміщений у положенні 5 галогеном, галогеналкоксигрупою, галогеналкілом, ціаном, нітрогрупою, аміногрупою, гідразидогрупою, алкілтіогрупою, алкенілом, алкінілом або R1; (ix) пірид-2-іл, факультативно заміщений у положенні 5 галогеном, галогеналкоксигрупою, галогеналкілом, ціаном, нітрогрупою, аміногрупою, гідразидогрупою, алкілтіогрупою, алкенілом, алкінілом або R1; (x) пірид-3-іл, факультативно заміщений у положенні 6 галогеном, галогеналкоксигрупою, галогеналкілом, ціаном, нітрогрупою, аміногрупою, гідразидогрупою, алкілтіогрупою, алкенілом, алкінілом або R1; (хі) бензофур-2-іл, факультативно заміщений у положенні 3 аміногрупою, гідроксилом, галогеном, алкілом, карбоксилом, ціаном, амідогрупою, аміноалкілом, алкоксигрупою або алкілтіогрупою, та у положенні 5 або 6 галогеном, галогеналкоксигрупою, галогеналкілом, ціаном, нітрогрупою, аміногрупою, гідразидогрупою, алкілтіогрупою, алкенілом, алкінілом або R1j; (хіі) індол-2-іл, факультативно заміщений при атомі азоту індолу алкілом та факультативно заміщений у положенні 5 або 6 галогеном, галогеналкоксигрупою, галогеналкілом, ціаном, нітрогрупою, аміногрупою, гідразидогрупою, алкілтіогрупою, алкенілом, алкінілом або R1j; (хііі) індол-6-іл, заміщений у положенні 5 аміногрупою, гідроксилом, галогеном (наприклад, фтором або хлором), алкілом, карбоксилом, алкоксикарбонілом, ціаном, амідогрупою, аміноалкілом, алкоксигрупою або алкілтіогрупою, та факультативно заміщений у положенні 3 галогеном (наприклад, хлором), галогеналкоксигрупою, галогеналкілом, ціаном, нітрогрупою, аміногрупою, гідразидогрупою, алкілтіогрупою, алкенілом, алкінілом або R1j; (xi v) бензо[b]тіофен-2-іл, факультативно заміщений у положенні 3 аміногрупою, гідроксилом, галогеном, алкілом, карбоксилом, ціаном, амідогрупою, аміноалкілом, алкоксигрупою або алкілтіогрупою, та у положенні 5 або 6 галогеном, галогеналкоксигрупою, галогеналкілом, ціаном, нітрогрупою, аміногрупою, гідразидогрупою, алкілтіогрупою, алкенілом, алкінілом або R1j. Конкретними прикладами замісників, які можуть бути присутніми при R2, є: для галогену: фтор, хлор, бром або йод; нітрогрупа; тіол; для галогеналкоксигрупи: дифторметоксигрупа або трифторметоксигрупа; гідразидогрупа; для алкілгідразидогрупи: метилгідразидогрупа; аміногрупа; ціан; для галогеналкілу: трифторметил; для алкілтіогрупи: метилтіогрупа; для алкенільної групи: вініл; для алкінілу: етиніл; для ациламіногрупи: ацетиламіногрупа; карбоксил; для ацилоксигрупи: ацетоксигрупа; гідроксил; для алкілу: метил або етил; амідогрупа (CONH2); для аміноалкілу: амінометил; та для алкоксигрупи: метоксигрупа або етоксигрупа. У варіанті, якому віддається перевага, R2 факультативно заміщений одним або двома замісниками, вибраними із групи, до якої входять фтор, хлор, аміногрупа, метил, етил та метоксигрупа. Конкретними прикладами для R1 є: водень; гідроксил; для алкоксигрупи: метоксигрупа або етоксигрупа; для алкілу, факультативно заміщеного гідроксилом, алкіламіногрупою, алкоксигрупою, оксогрупою, арилом або циклоалкілом: алкіл, наприклад, метил або етил, або алкіламіноалкіл, наприклад, диметиламінометил, або алканоїл, наприклад, ацетил; для гідроксіалкілу: гідроксиметил; для алкоксіалкілу: метоксиметил; для алкоксикарбонілу: метоксикарбоніл; для алкіламінокарбонілу: метиламінокарбоніл; для алкіламіногрупи: метиламіногрупа, етиламіногрупа або диметиламіногрупа; для гідроксіалкілу, факультативно заміщеного гідроксилом, алкіламіногрупою, алкоксигрупою, оксогрупою, арилом або циклоалкілом: карбоксил або карбоксиметил; та для аміноалкілу, заміщеного гідроксилом, алкіл аміногрупою, алкоксигрупою, оксогрупою, арилом або циклоалкілом: амідогрупа (CONH2) або амідометил. Конкретними прикладами R1j є: водень; гідроксил; для алкоксигрупи: метоксигрупа або етоксигрупа; для алкілу, факультативно заміщеного гідроксилом, алкіламіногрупою, алкоксигрупою, оксогрупою, арилом або циклоалкілом: алкіл, наприклад, метил або етил, або алканоїл, наприклад, ацетил; для гідроксіалкілу: гідроксиметил; для алкоксіалкілу: метоксиметил; для алкоксикарбонілу: метоксикарбоніл; для алкіламіногрупи: метиламіногрупа, етиламіногрупа або диметил аміногрупа; для гідроксіалкілу, факультативно заміщеного гідроксилом, алкіламіногрупою, алкоксигрупою, оксогрупою, арилом або циклоалкілом: карбоксил або карбоксиметил; та для аміноалкілу, заміщеного гідроксилом, алкіламіногрупою, алкоксигрупою, оксогрупою, арилом або циклоалкілом: амідогрупа (CONH2) або амідометил. Згідно із ще одним аспектом R2 являє собою: (і) феніл, факультативно заміщений у положенні 3 та/або 4 фтором, хлором, бромом, йодом, нітрогрупою, дифторметоксигрупою, трифторметоксигрупою, аміногрупою, ціаном, трифторметилом, метилтіогрупою, вінілом, карбоксилом, ацетоксигрупою, MeSO2-, гідроксилом, метоксигрупою, етоксигрупою, метилом, метоксикарбонілом, метиламіногрупою, етиламіногрупою або амідогрупою, та факультативно заміщений у положенні 6 аміногрупою, гідроксилом, фтором, метоксикарбонілом, ціаном або амінометилом (у варіанті, якому віддається перевага, феніл, заміщений у положенні 4 хлором, аміногрупою, вінілом, метиламіногрупою, метилом або метоксигрупою, факультативно заміщений у положенні 3 аміногрупою або гідроксилом, та факультативно заміщений у положенні 6 аміногрупою або гідроксилом); (іі) нафт-2-іл, факультативно заміщений у положенні 6 гідроксилом та факультативно заміщений у положенні 3 аміногрупою або гідроксигрупою; (ііі) ізохінолін-7-іл, індол-5-іл, індол-6-іл, індазол-5-іл, індазол-6-іл, бензотіазол-6-іл або бензізоксазол-5-іл, факультативно заміщений у положенні 3 хлором, бромом, аміногрупою, метилом або метоксигрупою (у варіанті, якому віддається перевага, індол-6-іл, факультативно заміщений у положенні 3 хлором, бромом, метилом або метоксигрупою); (iv) бензимідазол-5-іл або бензотіазол-6-іл, факультативно заміщений у положенні 2 аміногрупою; (ν) тієн-2-іл або тієн-3-іл, факультативно заміщений у положенні 4 або 5 метилтіогрупою, метилом або ацетилом; (vi) 3,4-метилендіоксифеніл, 2,3-дигідроіндол-6-іл, 3,3-дихлор-2-оксо-індол-6-іл або 1-метил-3аміноіндазол-5-іл; (vii) бензотіазол-2-іл, імідазо[1,2-а]піримідин-2-іл або тетрагідроімідазо [1,2-а] піримідин-2-іл; (viii) піразол-2-іл, заміщений у положенні 5 метилом; (іх) пірид-2-іл, факультативно заміщений у положенні 6 хлором; (х) пірид-3-іл, факультативно заміщений у положенні 4 хлором; (хі) бензофур-2-іл, факультативно заміщений у положенні 3 хлором, метилом або метоксигрупою, та у положенні 5 або 6 метилом і у положенні 6 метоксигрупою; (хіі) індол-2-іл, факультативно заміщений при атомі азоту індолу метилом та факультативно заміщений у положенні 5 або 6 фтором, хлором, бромом, метилом або метоксигрупою; (хііі) індол-6-іл, заміщений у положенні 5 хлором, фтором або гідроксилом та факультативно заміщений у положенні 3 хлором або метилом; (xi v) бензо[b]тіофен-2-іл, факультативно заміщений у положенні 3 фтором, хлором або метилом та факультативно заміщений у положенні 5 або 6 фтором, хлором, метилом, гідроксилом або метоксигрупою. Конкретними прикладами R2 є: (і) феніл, 2-амінофеніл, 3-амінофеніл, 2-аміно-3-фторфеніл, 2-аміно-4-фторфеніл, 2-аміно-4-хлорфеніл, 2аміно-3-бромфеніл, 2-аміно-3-нітрофеніл, 2-аміно-4-нітрофеніл, 3,4-диметокси-5-амінофеніл, 2-аміно-4метилфеніл, 2-аміно-3-метилфеніл, 2-аміно-3-метоксифеніл, 3,4-діамінофеніл, 3,5-діамінофеніл, 3-аміно-4фтор феніл, 3-аміно-4-хлорфеніл, 3-аміно-4-бромфеніл, 3-аміно-4-гідроксифеніл, 3-аміно-4карбоксиметилфеніл, 3-аміно-4-метилфеніл, 3-аміно-4-метоксифеніл, 2-фторфеніл, 4-фтор-3-ціанфеніл, 3хлорфеніл, 3-хлор-4-гідроксифеніл, 3-хлор-5-гідроксифеніл, 4-хлорфеніл, 4-хлор-2-гідроксифеніл, 4-хлор-3гідроксифеніл, 4-хлор-3-метилфеніл, 4-хлор-3-метоксифеніл, 4-бромфеніл, 4-бром-3-метилфеніл, 4-йодфеніл, 2-ціанфеніл, 3-ціанфеніл, 4-ціанфеніл, 3-ціан-5-амінофеніл, 2-гідроксифеніл, 2-гідрокси-4-метоксифеніл, 3гідроксифеніл, 3-гідрокси-4-метилфеніл, 2,4-дигідроксифеніл, 3,4-дигідроксифеніл, 3-гідрокси-4-метоксифеніл, 4-дифторметоксифеніл, 4-трифторметоксифеніл, 4-трифторметилфеніл, 4-метилтіофеніл, 4метоксикарбонілфеніл, 4-ацетоксифеніл, 4-метансульфонілфеніл, 3-метилфеніл, 3-метил-5-амінофеніл, 4метилфеніл, 4-вінілфеніл, 4-метоксифеніл, 4-етоксифеніл, 4-метокси-3-хлорфеніл, 4-метокси-3-метилфеніл, 3метиламінофеніл, 4-метиламінофеніл, 4-етиламінофеніл або 2-амінометилфеніл; (іі) нафт-2-іл, 3-амінонафт-2-іл, 3-гідроксинафт-2-іл або 6-гідроксинафт-2-іл; (ііі) ізохінолін-7-іл, індол-5-іл, індол-6-іл, 3-хлоріндол-6-іл, 3-броміндол-6-іл, 3-метиліндол-6-іл, 3метоксііндол-6-іл, індазол-5-іл, 3-аміноіндазол-5-іл, індазол-6-іл, бензотіазол-6-іл, 3-амінобензізоксазол-5-іл; (iv) бензимідазол-5-іл, 2-амінобензимідазол-5-іл або бензотіазол-6-іл; (ν) тієн-2-іл, 5-метилтієн-2-іл, 5-метилтіотієн-2-іл, 5-ацетилтієн-2-іл або тієн-3-іл; (vi) 3,4-метилендіоксифеніл, 2,3-дигідроіндол-6-іл, 3,3-дихлор-2-оксоіндол-6-іл або 1-метил-3аміноіндазол-5-іл; (vii) бензотіазол-2-іл, імідазо[1,2-а]піримідин-2-іл або тетрагідроімідазо[1,2-а]піримідин-2-іл; (viii) 5-метилпіразол-2-іл; (іх) 5-хлорпірид-2-іл; (х) пірид-3-іл, 6-хлорпірид-3-іл; (хі) бензофур-2-іл, 5-хлорбензофур-2-іл, 3-метилбензофур-2-іл, 5-метилбензофур-2-іл, 6 метоксибензофур-2-іл; (хіі) індол-2-іл, 5-фторіндол-2-іл, 5-хлоріндол-2-іл, 5-метиліндол-2-іл, 5-метоксііндол-2-іл, 6-метоксііндол-2іл та 1-метиліндол-2-іл; (хііі) 5-фторіндол-6-іл; або (xi v) бензо[b]тіофен-2-іл, 5-хлорбензо[b]тіофен-2-іл або 6-хлорбензо[b]тіофен-2-іл. У варіанті, якому віддається перевага, R2 відповідає одній з формул, вибраній з групи, до якої входять (А')(Н'): де Х4 - О або S, R13 вибраний із групи, до якої входять водень, фтор [за винятком (C¢)], хлор або метил, R14 вибраний із групи, до якої входять водень, метил, етил, фтор, хлор та метоксигрупа, і R15 вибраний із групи, до якої входять водень, метил, фтор, хлор та аміногрупа. У варіанті, якому віддається більша перевага, R2 має формулу (А') (де R14 вибраний із групи, до якої входять водень, метил, етил, фтор, хлор та метоксигрупа, і R15 вибраний із групи, до якої входять водень, метил, фтор, хлор та аміногрупа) або формулу (В') (де R13 - хлор), або формулу (C¢) (де R13 вибраний із групи, до якої входять водень, метил та хлор), або формулу (D') (де R13 вибраний із групи, до якої входять водень, метил, фтор та хлор), або формулу (Е') (де R 13 - водень), або формулу (G') (де R 13 - хлор). У варіанті, якому віддається ще більша перевага, R2 - 4-хлорфеніл, 4-метоксифеніл, 3-аміно-4-хлорфеніл, індол-2-іл, 5-хлоріндол-2-іл, індол-6-іл, 3-хлоріндол-6-іл або 3-метиліндол-6-іл. Іншою групою R2 , яка становить особливий інтерес, є 3-амінобензізоксазол-5-іл. У варіанті, якому віддається ще більша перевага, R2 має формулу (А') або (С) та R 13, R14 та R15 відповідають наведеним вище визначенням. У варіанті, якому віддається найбільша перевага, R2 має формулу (А') і R14 є метоксигрупою та R15 є воднем, або формулу (C¢) і R13 є воднем, метилом або хлором. Іншою сполукою за цим винаходом, якій віддається перевага, є сполука, яка має формулу: де Су та R2 відповідають наведеним вище визначенням. Сполука за цим винаходом, якій віддається перевага, має формулу: де Су, R2 та Rc відповідають наведеним вище визначенням. Зокрема, можна згадати перелічені нижче сполуки: 1-(індол-6-карбоніл-D-фенілгліциніл)-4-[2-(4-піридиніл)-етил]піперазин; 1-(3-хлоріндол-6-карбоніл-D-фенілгліциніл)-4-[2-(4-піридиніл)-етил]піперазин; 1-(4-метоксибензоїл-D-фенілгліциніл)-4-(1-метилпіперидин-4-іл)піперазин; 1-(індол-6-карбоніл-D-фенілгліциніл)-4-(1-метилпіперидин-4-іл)піперазин; 1-(4-метоксибензоїл-D-(2-хлорфеніл)гліциніл)-4-(1-метилпіперидин-4-іл)піперазин; 1-(індол-6-карбоніл-D-(2-хлорфеніл)гліциніл)-4-(1-метилпіперидин-4-іл)піперазин; та 1-(4-метоксибензоїл-D-(2-трифторметилфеніл)гліциніл)-4-(1-метилпіперидин-4-іл)піперазин; та їхні фізіологічно прийнятні солі. Встановлено, що сполуки цієї групи мають добру пероральну доступність та бажаний фармакологічний/токсикологічний профіль. Сполуки за цим винаходом можна одержати традиційними способами хімічного синтезу або способами, які ілюструються наведеними нижче прикладами. Сполуки формули (І) можна одержати шляхом утворення -Х-Х- зв'язку з відповідних проміжних продуктів. Наприклад, у разі, коли -Х-Х- є -CONH- або -CO-NR 1a-, шляхом проведення реакції сполуки формули (10): H2NY-(C y)-L-Lp(D)n зі сполукою формули R2-COOH, у відомих умовах утворення амідного зв'язку. Ця реакція легко здійснюється у присутності реактиву на основі бензотриазолу, наприклад, 1-гідроксибензотриазолу або 1гідрокси-7-азабензотриазолу, в інертному органічному розчиннику, наприклад, у диметилформаміді та/або метиленхлориді. Реакційну суміш, як правило, доводять до температури 0°С, після чого додають дегідратувальний реагент, наприклад, дициклогексилкарбодіімід або 1-(3-диметиламінопропіл)-3етилкарбодіімід. У цій галузі відомі інші придатні реактиви та розчинники, наприклад, галогенангідриди кислот, наприклад, R2-COCl. Сполуки, де -Х-Х- є -NHCO- або -NHCH2-, можна одержувати з придатних проміжних сполук в умовах реакцій утворення амідного зв'язку, як описано вище, з подальшим відновленням утвореного амідного зв'язку в разі необхідності. Сполуки формули (І), де -Х-Х- має формулу -CH2NH-, можна одержати шляхом відновлення відповідної сполуки формули (І), де -Х-Х- є -CONH-, або шляхом проведення реакції сполуки формули (10): H2N-Y-(Cy)-LLp(D)n зі сполукою формули R2CHO і відновлення проміжної сполуки формули (І), де -Х-Х- є -C=N-, за допомогою, наприклад, ціанборгідриду натрію. У разі, коли -Х-Х- є -СН=СН -, сполуки формули (І) можна одержати за допомогою реакцій Віттіга або Хорнера-Еммонса. Відповідну сполуку, де -Х-Х- є -СН2СН2-, можна одержати шляхом відновлення групи СН=СН-, наприклад, воднем із використанням паладію на вуглеці як каталізатора. -Х-Х- зв'язок формули -СОО- або -ОС(О)- можна одержати шляхом проведення реакції придатної гідроксисполуки з активованою похідною карбонової кислоти (наприклад, хлорангідриду або реакційноздатного складного ефіру) у відомих умовах утворення складноефірного зв'язку. У альтернативному варіанті взаємна реакція гідроксисполуки та похідної карбонової кислоти може відбуватись у присутності діетилазодикарбоксилату та трифенілфосфін у. -Х-Х- зв'язок формули -СН2О- або -ОСН2- можна одержати шляхом проведення реакції придатної проміжної гідроксисполуки з придатним алкілгалогенідом у присутності основи. Умови утворення ефірного зв'язку відомі в цій галузі. Ці реакції можуть використовуватись також для одержання проміжних сполук, які містять один із вищезгаданих -Х-Х- зв'язків. Сполуки формули (І), де Rr - -(CH2)c-Rc, можна одержати також шляхом відновного сполучення сполуки формули (11): зі сполукою формули (12) OHC-(CH2)c-1-Rc. Ця реакція легко здійснюється у присутності відновника, наприклад, ціанборгідриду натрію. Традиційними розчинниками є спирти, наприклад, метанол, з факультативним використанням у ролі розчинника галогенованого вуглеводню, наприклад, 1,2-дихлоретану, та оцтової кислоти. Згадане сполучення легко здійснюється при температурі у межах від 0°С до 100°С. Вважається, що проміжні сполуки формули (11) є новими і вони пропонуються як додатковий аспект цього винаходу. Проміжні сполуки формули (11), де -Х-Х- є CONH, можна одержати шляхом проведення реакції сполуки формули (13) де Pg1 є гр упа захисту аміну, наприклад, трет-бутоксикарбоніл, зі сполукою формули R2-COOH у відомих умовах утворення амідного зв'язку, наприклад, згідно з наведеним вище описом одержання сполуки формули (І), з подальшим відщепленням захисної групи. Сполуки формули (13) можна одержати шляхом проведення реакції придатного N-захищеного гліцину формули (14) де Pg2 є група захисту аміну, яку можна селективно видаляти у присутності Pg1 (наприклад, у разі, коли Pg - трет-бутоксикарбоніл, Pg2 може бути бензилоксикарбонілом), зі сполукою формули (15) 1 в умовах утворення амідного зв'язку, з подальшим селективним відщепленням захисної групи Pg2. Сполуки формули (10), де X - CONH, можна одержати шляхом відщеплення захисної групи від сполуки формули (16): де Pg3 є гр упа захисту аміну, наприклад, трет-бутоксикарбоніл. Вважається, що проміжні сполуки формули (16) та відповідні аміни без Pg3 є новими, і вони пропонуються як додатковий аспект цього винаходу. Сполуки формули (16) можна одержати шляхом проведення реакції сполуки формули (14) зі сполукою формули (17) в умовах утворення амідного зв'язку. Реакція легко здійснюється у присутності діетилціанфосфонату. Традиційними розчинниками є аміди, наприклад, диметилформамід. Придатною є температура у межах від 0°С до 100°С. Сполуки формули (17), де Rr - -(CH2)с-Rc, можна одержати шляхом проведення реакції сполуки формули (18) де Pg4 є гр упа захисту аміну, наприклад, трет-бутоксикарбоніл, зі сполукою формули (19) з подальшим відщепленням захисної групи Pg4. Реакція легко здійснюється у присутності кислоти, наприклад, оцтової кислоти. Придатними розчинниками є спирти, наприклад, етанол. Сполуки формули (17), де Rr є -(CH2)с-Rc, можна також одержати шляхом проведення реакції сполуки формули (18) зі сполукою формули (19а) Z-(CH2)с-Rс, де Ζ є відщеплюваний атом або група, наприклад, метансульфонілоксигрупа або бензолсульфонілоксигрупа, з подальшим відщепленням захисної групи Pg4. Сполуки формули (17), де Rr є -(CH2)c-Rc, можна також одержати шляхом відновлення сполук формули (20) або формули (20А) де кожен з Pg5 та Pg6 є група захисту аміну, наприклад, трет-бутоксикарбоніл, з подальшим відщепленням захисної групи Pg5. Реакція легко здійснюється у присутності відновника, наприклад, борану, в простому ефірі, наприклад, у тетрагідрофурані. Сполуки формули (20) можна одержати шляхом проведення реакції сполуки формули (18) зі сполукою формули (21) HOOC-(CH2)c-1-Rc в умовах утворення амідного зв'язку. У альтернативному варіанті сполуки формули (20) можна одержати шляхом проведення реакції сполуки формули (18) зі сполукою формули (21а) НООС-(СН)с-1Х', (21а) де X' - атом галогену, наприклад, бром, із подальшим проведенням реакції зі сполукою формули (21b) HRc у присутності сильної основи, наприклад, гідриду натрію. Таким чином, цей винахід пропонує також спосіб одержання сполуки формули (І), який включає: а) у разі, коли -Х-Х- є -CONH-, проведення реакції сполуки формули (10) зі сполукою формули R 2-COOH в умовах утворення амідного зв'язку; або b) у разі, коли Rr є -(CH2)c-Rc, проведення реакції сполуки формули (11) зі сполукою (12); де R2, Χ, Υ, Су, с та Rr відповідають наведеним вище визначенням і формули (10), (11) та (12) відповідають наведеним вище визначенням, із подальшим одержанням, у разі потреби у солі, фізіологічно прийнятної солі. Амінокислоту формули (23) або N-захищений гліцин формули (14) можна одержати, наприклад, за допомогою одного або кількох із поданих нижче способів: (і) з арил- або гетероарилальдегідів шляхом синтезу за Штреккером (Strecker) або його модифікацій, шляхом синтезу гідантоїнів за Бухерером-Бергсом (Bucherer-Bergs) або за методикою Угі (Ugi) ["Isonitrile Chemistry", Ed. by I.Ugi, Academic: New York, 1971; 145-1999, "Multicomponent Reactions with Isocyanides", А. Домлінг (Α. Domling ); 1. Угі, Angew. Chem. Int. Ed. 2000, 39, 3168; "Amino Acid Derivatives by Multicomponent Reactions", Дж. Дайкер (G. Dyker), Angew. Chem. Int. Ed. Engl. 1997, 36, 1700; а також дивись "A new Class of Convertible Isocyanides in the Ugi Four-Component Reaction", T. Ліндхорст (Т. Lindhorst); Г. Бок (Η. Bock); І. Угі, Tetrahedron, 1999, 55, 7411] з відщепленням та заміною захисних гр уп; (іі) зі стиролів за методикою Шарплесс (Sharpless) (J. Am. Chem. Soc. 1998, 120, 1207-1217); (iii) з арилборних кислот за методикою Петасіс (Petasis) (Tetrahedron, 1997, 53, 16463-16470) з відщепленням та заміною захисних груп; (iv) із арил- та гетероарилоцтових кислот - шля хом азидування за Еваном (Evan) (Synthesis, 1997, 536-540) або оксимуванням із подальшим відновленням та доданням захисних груп; або (ν) з існуючи х арилгліцинів шляхом відповідних операцій з функціональними групами, наприклад, алкілуванням гідроксильних груп, карбонілуванням (з застосуванням паладію) трифлатів, які були одержані з гідроксильних груп, та подальшими операціями зі складними ефірами карбонових кислот з одержанням карбонових кислот шля хом гідролізу, карбоксамідів шляхом активування карбонової кислоти та сполучення з амінами, амінів за допомогою реакції Курціуса (Curtius) із карбоновою кислотою; (vi) з аліфатичних, карбоциклічних та неароматичних гетероциклічних альдегідів та кетонів за допомогою реакції Хорнера-Еммонса (Horner-Emmons) із триметиловим складним ефіром N-бензилоксикарбоніл-афосфоногліцину (Synthesis, 1992, 487-490); або (vii) з оксимів формули де Pg - група захисту карбоксилу, шляхом відновлення. (Оксими, де Су - гетероарильна група, можна одержати зі сполук формули У альтернативному варіанті оксими можна одержати шляхом нітрозування сполуки формули Cy-CH2COOPg або за допомогою реакції гідроксиламіну зі сполукою формули Cy-CO-COOPg). Вихідний матеріал для одержання сполуки формули (І), де альфа-атомом є азот, можна одержати, наприклад, шляхом проведення реакції бета-захищеного гідразину (такий захист вибраний для сумісності з подальшими реактивами, які будуть застосовуватись) із фосгеном, дифосгеном, трифосгеном або Ν,Ν' карбонілдіімідазолом, з одержанням хімічно активної сполуки типу PGNHN(Cy)COCl або РGNHN(Су)СОімідазолу (де PG -за хисна група). Цю проміжну сполуку можна використовувати згідно з наведеним вище описом для одержання карбоксилвмісних вихідних реагентів, де альфа-атомом є вуглець. Пересічному фа хівцю зрозуміло, що на певних етапах синтезу сполуки формули (І) може виникнути необхідність захисту реакційноздатної функціональної групи молекули для уникнення небажаних побічних реакцій. Опис захисту аміногруп та карбоксильних гр уп наведено у Макомі (McOmie), Protecting Groups in Organic Chemistry, Plenum Press, NY, 1973, та у Гріні (Greene) та Вутса (Wuts), Protecting Groups in Organic Synthesis, 2 видання, John Wiley&Sons, NY, 1991. Прикладами груп захисту карбоксилу є С 1-С6-алкіли, наприклад, метил, етил, трет-бутил та трет-аміл; арил-(С1-С4)-алкіли, наприклад, бензил, 4-нітробензил, 4-метоксибензил, 3,4диметоксибензил, 2,4-диметоксибензил, 2,4,6-триметоксибензил, 2,4,6-триметилбензил, бензгідрил та тритил; силіли, наприклад, триметилсиліл та трет-бутилдиметилсиліл; та аліли, наприклад, аліл та 1(триметилсилілметил)-проп-1-ен-3-іл. Прикладами груп захисту аміну (PG) є ацили, наприклад, групи формули RCO, де R - С1-С6-алкіл, С3-С10циклоалкіл, феніл-С 1-С6-алкіл, феніл, С1-С6-алкоксигрупа, феніл-С 1-С6-алкоксигрупа або С 3-С10циклоалкоксигрупа, де феніл може бути факультативно заміщений, наприклад, одним або двома замісниками, вибраними з групи, до якої входять галоген, С1-С4-алкіл та C1-С4-алкоксигрупа. Групами захисту аміну, яким віддається перевага, є бензилоксикарбоніл (CBz), трет-бутоксикарбоніл (Вос) та бензил. Згідно з іншим аспектом винахід стосується способу одержання сполуки формули І, який включає відщеплення захисної групи від сполуки формули (І¢): R2'-X-X-Y(C y')-L-Lp(D)n', (l¢) де R2' - R2 (згідно з наведеним вище визначенням) або захищений R 2, Су' є С у (згідно з наведеним вище визначенням) або захищена Су і Lp(D)n' є Lp(D)n (згідно з наведеним вище визначенням) або захищена Lp(D)n; за умови присутності щонайменше однієї захисної групи. Фізіологічно прийнятні солі в разі потреби можна одержати за допомогою способів, відомих у галузі. Слід розуміти, що сполуки формули (І) можна виділяти у формі солей або сольватів (які можуть бути або можуть не бути фізіологічно прийнятними), і що усі такі солі та сольвати, таким чином, включені до обсягу цього винаходу. Усі нові проміжні сполуки, опис яких наведено в цьому документі, наприклад, сполуки формули та їхні солі, пропонуються як додаткові аспекти винаходу. Сполуки за цим винаходом можна вводити в організм пацієнта будь-яким зручним шляхом, наприклад, у шлунково-кишковий тракт (наприклад, ректально або перорально), у ніс, в легені, м'язи, судини або черезшкірно. Сполуки можна вводити у будь-якій зручній для введення формі, наприклад, у формі таблеток, порошків, капсул, розчинів, дисперсій, суспензій, сиропів, спреїв, супозиторіїв, гелів, емульсій, пластирів тощо. До складу таких композицій можуть входити компоненти, традиційні у фармацевтичних препаратах, наприклад, розріджувачі, носії, модифікатори pH, підсолоджувачі, наповнювачі та додаткові активні речовини. У варіанті, якому віддається перевага, композиції є стерильними і мають форму розчинів або суспензій, придатних для ін'єкцій або вливань. Такі композиції становлять додатковий аспект винаходу. Нижче наведено приклади фармацевтичних композицій сполук за цим винаходом. Композиція 1 Тверді желатинові капсули виготовляються з використанням перелічених нижче інгредієнтів: Активний інгредієнт Крохмаль, сухий Стеарат магнію Разом Кількість (мг/капсулу) 250 200 10 460мг Вищезгадані інгредієнти змішують і насипають у тверді желатинові капсули в кількості 460мг. Композиція 2 Таблетки, кожна з яких містить 60мг активного інгредієнта, виготовляють таким чином: Активний інгредієнт 60мг Крохмаль 45мг Мікрокристалічна целюлоза 35мг Полівінілпіролідон 4мг Натрійкарбоксиметильований крохмаль 4,5мг Стеарат магнію 0,5мг Тальк 1мг Разом 150мг Активний інгредієнт, крохмаль та целюлозу пропускають через сито 45 меш за стандартом США (розмір отворів 0,35мм) і ретельно змішують. Одержану суміш порошків змішують із розчином полівінілпіролідону і пропускають через сито 14 меш (1,4мм). Одержані таким чином гранули висушують при температурі 50°С і пропускають через сито 18 меш (1,0мм). Після цього до одержаних гранул додають натрійкарбоксиметильований крохмаль, стеарат магнію і тальк, попередньо пропущені через сито 60 меш (0,25мм), і після перемішування пресують на таблетувальній машині з одержанням таблеток, маса кожної з яких дорівнює 150мг. Виходячи із цього аспекту, винахід пропонує фармацевтичну композицію, що містить інгібітор серинових протеаз за цим винаходом разом із щонайменше одним фармацевтично прийнятним носієм або наповнювачем. Фармацевтична композиція може також факультативно містити щонайменше один додатковий антитромботичний та/або тромболітичний засіб. Згідно з ще одним аспектом винахід пропонує застосування інгібітора серинових протеаз за цим винаходом для виготовлення лікарського засобу для застосування у способі лікування людей або тварин (наприклад, ссавців, птахів або рептилій) для боротьби (наприклад, лікування або профілактики) зі станом, на який впливає згаданий інгібітор. Згідно з ще одним аспектом винахід пропонує спосіб лікування людей або тварин (наприклад, ссавців, птахів або рептилій) для боротьби зі станом, на який впливає інгібітор серинових протеаз (наприклад, таким станом, як тромботичне захворювання, на яке впливає інгібітор фактора Ха), який включає введення в організм пацієнта ефективної кількості інгібітора серинових протеаз за цим винаходом. Доза сполуки-інгібітора за цим винаходом залежить від природи та тяжкості стану, який підлягає лікуванню, шляху введення, розміру та виду пацієнта. Однак, як правило, застосовуються кількості від 0,01мкмоль/кг маси тіла до 100мкмоль/кг маси тіла. Усі публікації, на які є посилання в цьому описі, включені до нього шляхом посилання. Нижче подано більш детальний опис винаходу з посиланнями на наведені Приклади, які мають суто ілюстративний характер. Експериментальна частина Скорочення, які використовуються у цьому описі, відповідають номенклатурі lUРАС-lUB (Міжнародна спілка теоретичної та прикладної хімії - Міжнародна біохімічна спілка). В описі використовуються наведені далі скорочення: вод. (водний); екв. ([молярний] еквівалент); Вос (трет-бутилоксикарбоніл); СМА (суміш хлороформ: метанол: концентрований гідроксид амонію 80:18:2); DCC (1,3-дициклогексилкарбодіімід); DCM (дихлорметан); DEPC (діетилціанфосфонат); DIPEA (діізопропілетиламін); DMEA (диметилетиламін)4 DMF (диметилформамід); DMSO (диметилсульфоксид, для ЯМР - дейтерований); EDCI (і-(3-диметиламінопропіл)-3-етил карбодііміду гідрохлорид); EtOAc (етилацетат); EtOH (етанол); HATU ([О-(7-азабензотриазол-1-іл)-1,1,3,3-тетраметилуронію гексафторофосфат]); HOAt (1-гідрокси-7-азабензотриазол); HOBt (1-гідрокси-бензотриазол); HPLC (високоефективна рідинна хроматографія); IS-MS (мас-спектр із розсіюванням іонів); RPHPLC (високоефективна рідинна хроматографія з оберненою фазою); SCX (сильна катіонообмінна смола); TFA (трифтороцтова кислота); THF (тетрагідрофуран); TLC (хроматографія в тонкому шарі, Rf=відносна рухомість); DSC (диференційна сканувальна калориметрія); TGA (термогравіметричний аналіз). Концентрації усіх розчинів, якщо не обумовлено інше, виражено як % (об'ємн.)/% (об'єми.). Реагенти були одержані з різноманітних комерційних джерел. ІЧ означає інфрачервоний спектр. 1ЯМР, ЯМР, 1Н-ЯМР або 1Н ЯМР означає спектр протонного магнітного резонансу. HPLC аналіз (Методики А - D): (Методика А): колонка Vydac C18 (4,6x250мм), елюювання лінійним градієнтом 90/10-50/50 (0,1% TFA у воді/0,1% TFA в ацетонітрилі) протягом 40хв, 1мл/хв. (Методика В): колонка Waters Symmetry, C18 (4,6x250мм). Схема елюювання включає лінійний градієнт від 95:5 (0,2% TFA у Н2О)/(0,2% TFA у CH3CN) до 5:95 (0,2% TFA у Н2О)/(0,2% TFA у CH3CN) протягом 20хв із подальшим елююванням (0,2% TFA у CH3CN), яке відбувалось подібним чином протягом 15хв. Швидкість потоку становить 1мл/хв. УФ-детектування, у разі відсутності інших зауважень, здійснюється на довжині хвилі 254нм. (Методика С): градієнтна система Shimadzu LC6, споряджена автоматичним пробовідбірником, детектором зі змінною довжиною хвилі при швидкості потоку 0,4мл/хв. Елюент А являє собою водний розчин TFA (0,1%), елюент В - 90% розчин MeCN у водному розчині TFA (0,1%) із градієнтним елююванням (0хв 20% В, потім від 20% до 100% протягом 15хв); колонка Luna C18 (2,1x150мм, розмір частинок 5мкм). (Методика D): колонка Microsorb-MV C18 (4,6x250мм). Схема елюювання включає лінійний градієнт від 90:10 (2,5% TFA у Н2О):(2,5% TFA у ацетонітрилі) до 10:90 (2,5% TFA у Н2О):(2,5% TFA у ацетонітрилі) протягом 25хв при температурі 30°С та швидкості потоку 1мл/хв. УФ-детектування, у разі відсутності інших зауважень, здійснюється на довжині хвилі 254нм. API-MS (мас-спектрометрія з розпилювальною іонізацією під атмосферним тиском) здійснювалась на масспектрометрі PESciex API 150EX із нагрітим розпилювачем та азотом у ролі хімічно активного газу в режимі реєстрації позитивно заряджених іонів. СІ-MS (мас-спектрометрія з хімічною іонізацією) здійснювалась на мас-спектрометрі з безпосереднім введенням Shimadzu 5000 у режимі хімічної іонізації з використанням метану у ролі хімічно активного газу. MALDI-TOF, мас-спектрометрія з іонізацією методом лазерної десорбції у матричному розчині з часопролітним аналізатором; RT, час затримання. Взагалі у цьому описі "D-" або "R-" у назві продукту вказує на те, що цей продукт одержали із хірального вихідного матеріалу, наприклад, D-фенілгліцину. Одержання вихідних матеріалів та проміжних сполук Проміжні заміщені гліцинові сполуки для вихідних матеріалів та проміжних сполук, у тому числі ті, в яких аміногрупа та/або карбоксил є захищеними, можна легко одержувати за одним з описаних нижче способів або аналогічних способів. Може виявитися зручною або доцільною зміна порядку стадій процесу одержання сполуки за цим винаходом та застосування аналогічного способу з використанням іншої проміжної сполуки. Зокрема, на початковому етапі одержання зручним може виявитись використання ацильної групи R2-CO-, а не групи захисту аміну. Скорочення, на додаток до вищезазначених: TEMPO: 2,2,6,6-те траметил-1-піперидинілокси, вільний радикал; (DHQD)2PHAL: простий діефір гідрохінідін-1,4-фталазиндіілу, r.b. або rb: круглодонний; РРh3: трифенілфосфін; Вос2 О або Вос ангідрид: ди-трет-бутилдикарбонат. Одержання проміжних сполук КЕ-1-КЕ-5 Описані нижче сполуки, якщо не обумовлено інше, одержали за вказаним методом (Метод КЕ-А) із вказаних вихідних матеріалів. Проміжна сполука КЕ-1 Етилоксо-хінолін-8-ілацетат Метод КЕ-А До розчину 8-бромхіноліну (10,1г, 48,5ммоль) у тетрагідрофурані (500мл) при температурі -78°С крапля за краплею додавали при перемішуванні 1,3Μ розчин втор-бутиллітію (37,3мл, 48,5ммоль) у циклогексані. Через 5хв додавали діетилоксалат (8мл, 58,3ммоль); одержаний розчин витримували протягом ночі, даючи йому повільно нагріватися до кімнатної температури. Наступного ранку реакцію гасили доданням холодного насиченого водного розчину NH4Cl; розчинник видаляли у вакуумі. Залишок розподіляли між етилацетатом та насиченим водним розчином NaHCO3; шари розділяли; після цього водну фазу промивали розсолом, сушили над MgSO4, фільтрували та концентрували у вакуумі. Залишок хроматографували на силікагелі з елююванням розчином етилацетату в гексані зі зміною кількості етилацетату від 20% до 25%. Фракції, що містили продукт, об'єднували та концентрували у вакуумі з одержанням 5,88г (53%) цільової сполуки. 1 H-ЯМР IS-MS, m/e 230,1 (М+1). Проміжна сполука КЕ-2 Етилоксо-хінолін-5-ілацетат Одержали з 5-бромхіноліну та діетилоксалату за Методом КЕ-А. 1 Н-ЯМР IS-MS, m/e 230,0 (М+1). Проміжна сполука КЕ-3 Етилоксо-тіазол-5-ілацетат У круглодонну колбу (500см 3), обладнану етанольним термометром, мембранним ковпачком та краплинною лійкою, в атмосфері аргону при перемішувані завантажували безводний ефір (100см 3). Колбу охолоджували до температури -78°С і додавали 2Μ розчин н-бутиллітію (60см 3, 120ммоль). Після цього в колбу за допомогою краплинної лійки протягом 30хв додавали розчин силілтіазолу (16г, 16см 3, 100ммоль) у безводному ефірі (100см 3). Суміш перемішували протягом 1год, при цьому утворювалася суспензія персикового кольору. До суспензії швидко додавали діетилоксалат (16,3см 3, 17,5г, 120ммоль) з одержанням розчину коричневого кольору, температура підвищувалася до -30°С. Вміст витримували з охолодженням до температури -78°С і перемішували протягом 30хв. Проходження реакції контролювали за допомогою 1Н ЯМР (CDCI3). Розчин коричневого кольору протягом 30хв вливали при енергійному перемішуванні в 5% розчин хлористоводневої кислоти (300см 3). Шар ефіру відділяли та промивали насиченим розчином бікарбонату (приблизно 80см 3), сушили над сульфатом магнію та концентрували у вакуумі з одержанням масла оранжевого кольору. Одержане масло очищали флеш-хроматографією (10% розчин етилацетату у гексані) з одержанням масла жовтого кольору (7,31г, 39,47ммоль) [вихід 40%]. 1 Н ЯМР (CDCl3); 1,42 (3Н, t), 4,45 (2Н, q), 8,89 (1Н, s), 9,10 (1H, s). Проміжна сполука КЕ-4 Етилоксо-тіазол-2-ілацетат Одержали з тіазолу та діетилоксалату за Методом КЕ-А. У цьому разі температур у підтримували на рівні 35°С і замість розчину втор-бутиллітію у циклогексані використовували розчин н-бутиллітію у гексані. 1 ЯМР. IS-MS, m/e 165,0 (М+1). Проміжна сполука КЕ-5 Етилоксо-ізохінолін-8-ілацетат Одержали з 8-бромізохіноліну та діетилоксалату за Методом КЕ-А з використанням розчину н-бутиллітію у гексані замість розчину втор-бутиллітію у циклогексані. 1 ЯМР. IS-MS, m/e 230,0 (М+1). Аналіз для С 13Н11NO3 : Обчислено: С, 68,11; Н, 4,84; N,6,11; Встановлено: С, 68,11; Н, 5,00; N, 6,14. Одержання проміжних сполук ОХ-1-ОХ-9 Описані нижче сполуки, якщо не обумовлено інше, одержали за вказаним методом (Метод OX-Α або Метод ОХ-В) із вказаних ви хідних матеріалів. Проміжна сполука ОХ-1 Етилгідроксііміно-піридин-2-ілацетат Метод ОХ-А До розчину етил-2-піридилацетату (12,6 г, 76,3моль) у оцтовій кислоті (19мл) при температурі 5°С додавали при перемішуванні розчин нітриту натрію (6,05г, 87,7ммоль) у воді (12мл) зі швидкістю, достатньою для підтримування температури в масі нижче 15°С. Через 30хв після завершення додавання додатково додавали 30мл води. Одержаний осад білого кольору відфільтровували, промивали водою, насиченим водним розчином NaHCO3 і знову водою. Після цього тверду речовину сушили у вакуумі з одержанням 14,1г (95%) цільової сполуки. 1 H-ЯМР. IS-MS, m/e 194,9 (М+1). Аналіз для C9H10N2O3 : Обчислено: С, 55,67; Η, 5,19; Ν, 14,43; Встановлено: С, 55,79; Η, 5,14; Ν, 14,13. Проміжна сполука ОХ-2 Етилгідроксііміно-піридин-3-ілацетат Суміш етилгідроксіімінопіридин-3-іл-ацетату та н-бутилгідроксііміно-піридин-3-ілацетату одержували з суміші етил-3-піридинілацетату та н-бутилнітриту за способом Тікк (Tikk) та ін. [Acta Chimica, Hungarica, 114 (34), 355]. 1 Н-ЯМР. IS-MS, m/e 195 (M+1), 223,1 (M+1). Проміжна сполука ОХ-3 Етилгідроксііміно-хінолін-8-ілацетат Метод ОХ-В До розчину етилоксо-хінолін-8-іл-ацетату (5,5г, 24ммоль) в етанолі (140мл) додавали при перемішуванні спочатку ацетат натрію (2,16г, 26,4ммоль), потім гідрохлорид гідроксиламіну (2,67г, 38,4ммоль). Суміш нагрівали зі зворотним холодильником до температури кипіння; через 7год нагрівальний пристрій відстороняли, і розчин перемішували протягом ночі при кімнатній температурі. Наступного ранку розчинник видаляли у вакуумі, і залишок розподіляли між етилацетатом та насиченим водним розчином NaHCO3. Шари розділяли, органічну фазу промивали розсолом, сушили за допомогою Na2SO4, фільтр ували та концентрували у вакуумі. Одержану піну перекристалізовували із суміші дихлорметан/гексан з одержанням першої порції 2,5г цільової сполуки у вигляді жовтуватої твердої речовини з подальшим одержанням другої порції 0,31г. Маточний розчин після цього концентрували у вакуумі, залишок розчиняли у мінімальній кількості дихлорметану. Після цього розчин хроматографували на силікагелі з елююванням спочатку 30% розчином етилацетату в гексані, потім 40% розчином етилацетату в гексані і, нарешті, етилацетатом. Фракції, що містили продукт, об'єднували та концентрували у вакуумі з одержанням 1,94г цільової сполуки із загальним виходом 4,75г (81%). 1 Н-ЯМР. IS-MS, m/e 245,0 (М+1). Проміжна сполука ОХ-4 Етилгідроксііміно-хінолін-5-ілацетат Одержали з етилоксо-хінолін-5-іл-ацетату за Методом ОХ-В. 1 H-ЯМР. IS-MS, m/е 245,0 (М+1). Проміжна сполука ОХ-5 Етилгідроксііміно-тіазол-5-ілацетат У круглодонну колбу (500см 3) з етанолом (приблизно 180см 3) додавали при перемішуванні етилоксотіазол-5-ілацетат (6,30г, 34,02ммоль). Після цього додавали ацетат натрію (3,06г, 37,30ммоль) та гідрохлорид гідроксиламіну (3,78г, 54,43ммоль) з одержанням жовтува тої суспензії. Реакційну суміш нагрівали зі зворотним холодильником при температурі 85°С протягом 1год. Проходження реакції контролювали хроматографуванням у тонкому шарі (60% розчин гексану в етилацетаті; відносна рухомість розчину 0,5, відносна рухомість продукту 0,3). Реакційну суміш охолоджували та концентрували у вакуумі. Продукт розчиняли в етилацетаті (приблизно 200см 3) і промивали 5% розчином хлористоводневої кислоти. Етилацетатний шар сушили над сульфатом магнію та випаровували досуха з одержанням твердої речовини кремового кольору (6,372г, 31,825ммоль) [94% вихід]. 1 H ЯМР (CDCl3); 1,40 (3Н, m), 4,40 (2Н, m), 8,06 (1/3Н, s), 8,78 (1/3Н, s), 8,95 (2/3Н, s), 8,98 (2/3Н, s). Проміжна сполука ОХ-6 Етил-a-оксиміно-тіазол-4-ацетат У двогорлу круглодонну колбу (100см 3) з етанольним термометром вносили концентровану сірчану кислоту (25см 3) і охолоджували до температури 0°С при перемішуванні. До цього розчину додавали етил-aоксиміно-2-амінотіазол-4-ацетат (5,00г, 23,231ммоль). Після цього додавали воду (10см 3) і охолоджували до температури -10°С. Після цього протягом 1 год повільно додавали розчин нітриту натрію (1,683г, 24,393ммоль) у воді (5см 3) із підтримуванням температури нижче -5°С. В окрему круглодонну колбу (500см 3) вносили воду (180см 3) і охолоджували до температури 3°С. Реакційний розчин виливали при перемішуванні в холодну воду з подальшим охолодженням до температури 5°С. До цього розчину протягом 10хв додавали крапля за краплею 50% розчин фосфорноватистої кислоти (90см 3) із підтримуванням температури на рівні -5°С. Розчину давали нагріватися до кімнатної температури при перемішуванні протягом ночі. Продукт екстрагували за допомогою діетилового ефіру (приблизно 3x150см 3) і промивали водою. Шар ефіру концентрували у вакуумі та піддавали флеш-хроматографуванню (50% розчин етилацетату в н-гексані) з одержанням масла оранжевого кольору після концентрування у вакуумі (0,60г, 3,00ммоль) [вихід 13%]. 1 Н ЯМР (CDCl3) 1,35 (3Н, m), 4,35 (2Н, m), 8,4 (1Н, s), 8,9 (1Н, s), 14,4 (1Н, s). Проміжна сполука ОХ-7 Етил-a-оксиміно-2-метилтіазол-4-ацетат Цю проміжну сполуку одержували з етил-g-хлор-a-оксиміноацетоацетату (1,44г) за способом Хатанака (Hatanaka) та ін. (Journal of Medicinal Chemistry, 1973, 16 (9), 978-984) з одержанням цільової сполуки (0,64г). 1 H ЯМР (CDCl3) 1,35 (3Н, t), 2,7 (3Н, s), 4,35 (2Н, q), 8,2 (1Н, s). Етил-g-хлор-a-оксиміноацетоацетат Цю проміжну сполуку одержували з етилоксиміноацетоацетату (1,73г) за способом Хатанака (Hatanaka) та ін. (Journal of Medicinal Chemistry, 1973, 16 (9), 978-984) з одержанням цільової сполуки (1,44г). 1 H ЯМР (CDCl3) 1,25 (3Н, t), 4,3 (2Н, q), 4,55 (2Н, s), 9,45 (1Н, s), містить 20% початкового матеріалу за даними ЯМР. Етилоксиміноацетоацетат Цю проміжну сполуку одержали з етилацетоацетату (10,00г) за способом Фішера (Fischer) (Organic Synthesis Coll. том 3, 513-516) з одержанням цільової сполуки (12,45г). 1 H ЯМР (CDCl3) 1,25 (3Н, t), 2,35 (3Н, s), 4,3 (2Н, q), 8,8 (1Н, br). Проміжна сполука ОХ-8 Етилгідроксііміно-тіазол-2-ілацетат Одержали з етилоксо-тіазол-2-ілацетату за Методом ОХ-В. 1 ЯМР. IS-MS, m/e 198,9 (М-1). Проміжна сполука ОХ-9 Етилгідроксііміно-ізохінолін-8-ілацетат Одержали з етилоксо-ізохінолін-8-ілацетату за Методом ОХ-В. 1 ЯΜΡ. IS-MS, m/e 245,0 (M+1). Аналіз для C13H12N2O 3: Обчислено: С, 63,93; Η, 4,95; Ν, 11,47; Встановлено: С, 63,68; Η, 4,60; Ν, 11,34. Одержання проміжних сполук AL-1-AL-3 Описані нижче сполуки, якщо не обумовлено інше, одержали за вказаним методом (Метод AL-A або Метод AL-B) із вказаних вихідних матеріалів. Проміжна сполука AL-1 R-3-бром-(1-трет-бутоксикарбоніламіно-2-гідроксіетил)бензол Метод AL-A Розчиняли гідроксид натрію (3,33г, 83,25ммоль) у воді (220мл). 20мл одержаного розчину відбирали і додавали до осміату калію (410мг, 1,11ммоль). Залишок розчину гідроксиду натрію (200мл) додавали при перемішуванні до розчину трет-бутилкарбамату (9,9г, 84,5ммоль) в н-пропанолі (110мл), після чого додавали свіжоодержаний розчин трет-бутилгіпохлориту (9,65мл; 83,5ммоль). Після перемішування протягом 5хв розчин охолоджували до температури 0°С. Додавали розчин (DHQD)2PHAL (1,30г, 1,67ммоль) в н-пропанолі (110мл), потім розчин 3-бромстиролу (5г, 27,31ммоль) в н-пропанолі (220мл), після чого додавали крапля за краплею розчин осміату калію/гідроксиду натрію. Реакційну суміш перемішували протягом ночі. Додавали насичений водний розчин сульфіту натрію (150мл), і реакційну суміш перемішували протягом 15хв. Водний шар відділяли та екстрагували етилацетатом (3x200мл). Об'єднані органічні шари промивали розсолом та сушили над MgSO4 . Після видалення розчинника у вакуумі одержали неочищений продукт, який очищали шляхом хроматографування (діоксид кремнію, 3:2 гексан:етилацетат, після чого знов хроматографували при завантаженні в колонку в толуолі та градієнтному елююванні гексаном - 4:1 гексан:етилацетат) з одержанням цільового продукту (4,18г, 49%). Температура плавлення=90-91°С. 1 Н ЯМР (CDCl3). Проміжна сполука AL-2 R-3-метоксикарбоніл-(1-трет-бутоксикарбоніламіно-2-гідроксіетил)бензол Метод AL-B У скляний циліндр з мішалкою вносили Pd(OAc)2 (871мг, 3,88ммоль), РРhз (1,96г, 7,47ммоль), NaOAc (1,48г, 18,04ммоль) та DMF (82мл). До цього розчину додавали при перемішуванні розчин R-3-бром-(1-третбутоксикарбоніламіно-2-гідроксіетил)бензолу (4,27г, 13,5ммоль) у МеОН (82мл). Одержаний розчин продували азотом і переносили в апарат високого тиску з мішалкою. Систему заповнювали CO під тиском 4,1 бар (60 фунт/дюйм 2=0,41МПа) і нагрівали при температурі 95°С протягом 36год. Суміш охолоджували до кімнатної температури, фільтрували через діатомову землю і розподіляли між етилацетатом та водою. Органічний шар промивали водою (3х) та розсолом (1х) і сушили над MgSO4. Після видалення розчинника у вакуумі одержали неочищений продукт, який очищали шляхом хроматографування (силікагель, градієнтне елюювання 30-35% розчином етилацетату у гексані) з одержанням цільового продукту (3,53г, 89%). Температура плавлення=73-75°С із розкладом. 1 Н ЯМР (CDCl3). API-MS, m/e=240 (M-C 4H9+1). Проміжна сполука AL-3 R-3-ціан-(1-трет-бутоксикарбоніламіно-2-гідроксіетил)бензол Одержали з 3-ціанстиролу за Методом AL-A. 3-ціанстирол одержували за методом, опис якого наведено нижче. Температура плавлення=76°С. 1 Н ЯМР (CDCl3). Одержання 3-ціанстиролу До суспензії метилтрифенілфосфоній-броміду (75г, 209,71ммоль) у безводному THF (750мл) при температурі 0°С у атмосфері азоту додавали при перемішуванні крапля за краплею розчин n-BuLi (83мл, 2,5Μ у гексані, 207,50ммоль). Суміш нагрівали до кімнатної температури. 3-ціанбензальдегід (25г, 190,65ммоль) у вигляді твердої речовини додавали порціями по 5г, і суміш перемішували при кімнатній температурі протягом ночі. Реакцію гасили доданням холодної води, і видаляли розчинник у вакуумі. Залишок розчиняли у мінімальній кількості THF, і осаджували оксид трифенілфосфіну за допомогою ефіру. Тверду речовину відфільтровували через діатомову землю, і фільтрат концентрували. Шляхом дистиляції через трубку з кульовим розширенням при температурі 90°С/33 Па (0,25мм рт.ст.) одержали продукт у вигляді безбарвного масла (15,5г, 62%). Температура кипіння=90°С при 0,25мм рт.ст. 1 Н ЯМР (CDCl3). Одержання проміжних сполук РАЕ-1 - РАЕ-18 Описані нижче сполуки, якщо не обумовлено інше, одержали за вказаним методом (Метод РАЕ-А, Метод РАЕ-B, Метод РАЕ-С, Метод РАЕ-D або РАЕ-Е) із вказаних вихідних матеріалів. Проміжна сполука РАЕ-1 Вос-D,L-(2-піридиніл)гліцинетиловий складний ефір Метод РАЕ-А До розчину етилгідроксііміно-піридин-2-іл-ацетату (7,8г, 40,15г) в етанолі (175мл) та льодяній оцтовій кислоті (20мл) додавали 5% Pd/C, і суміш збовтували у гідрогенізаторі у атмосфері водню під тиском 3,1бар (45 фунт/дюйм 2=0,31МПа) протягом 4год. Суміш фільтрували через діатомову землю та концентрували у вакуумі. Залишок розчиняли у THF/H2 O (1/1, 240мл) і обробляли ди-трет-бутилдикарбонатом (14,23г, 65,2ммоль) та бікарбонатом натрію (27,4г, 326ммоль). Після перемішування при кімнатній температурі протягом 2год розчин концентрували у вакуумі, і залишок розподіляли між EtOAc та водою. Органічну фазу промивали розсолом, сушили над сульфатом магнію, фільтрували та концентрували у вакуумі. Неочищений матеріал очищали шляхом хроматографування на силікагелі з елююванням ступінчастим градієнтом 10-20% розчином етилацетату у ди хлорметані з одержанням 8,11г (72%) цільової сполуки у вигляді масла жовтого кольору. 1 Н-ЯМР. IS-MS, m/e 281,1 (М+1). Проміжна сполука РАЕ-2 Вос-D,L-(3-піридиніл)гліцинетиловий складний ефір Одержали з етилгідроксііміно-піридин-3-ілацетату за Ме тодом РАЕ-А. 1 H-ЯМР. IS-MS, m/e 281,1 (М+1). Проміжна сполука РАЕ-3 Вос-D,L-(8-хінолініл)гліцинетиловий складний ефір Метод РАЕ-B До розчину етилгідроксііміно-хінолін-8-ілацетату (2,4г, 9,8ммоль) у 50% водному розчині мурашиної кислоти (50мл) при температурі 0°С додавали при перемішуванні цинковий пил (2г, 31ммоль). Через 1хв суміш фільтрували через діатомову землю, і фільтрат вносили в колонку з SCX. Після промивання колонки метанолом продукт елюювали сумішшю (3:1) дихлорметану та 2-н. розчину NH3 в метанолі. Фракції, що містили продукт, об'єднували та концентрували у вакуумі з одержанням 2,24г масла світло-оранжевого кольору (IS-MS, m/e 231,0 (М+1)). Масло (2,14г, 9,3ммоль) розчиняли у THF (40мл), і до цього розчину додавали при перемішуванні спочатку триетиламін (1,4мл, 10,2ммоль), потім ди-трет-бутилдикарбонат (2,1г, 9,8ммоль). Через 45хв розчинник видаляли у вакуумі, залишок розподіляли між етилацетатом та водою. Після цього органічну фазу промивали насиченим водним розчином NaHCO3, сушили за допомогою Na2SО4, фільтрували та концентрували у вакуумі. Залишок розчиняли у мінімальному об'ємі дихлорметану та хроматографували на силікагелі з елююванням 5% розчином етилацетату в гексані. Фракції, що містили продукт, об'єднували та концентрували з одержанням 2,5г (81%) цільової сполуки. 1 Н-ЯМР. IS-MS, m/e 331,0 (М+1). Проміжна сполука РАЕ-4 Вос-D,L-(5-хінолініл)гліцинетиловий складний ефір Одержали з етилгідроксііміно-хінолін-5-ілацетату за Методом РАЕ-В. 1 H-ЯМР. IS-MS, m/e 331,0 (М+1). Проміжна сполука РАЕ-5 N-4-метоксибензоїл-N-2,4-диметоксибензил-D,L-(2-трифторметилфеніл)гліцинметиловий складний ефір Метод РАЕ-С До 2-трифторметилбензальдегіду (1г, 5,7ммоль) додавали при перемішуванні 2,4-диметоксибензиламін (0,86мл, 5,7ммоль) та метанол (2мл). Через 5хв розчин розбавляли толуолом (100мл) та концентрували у вакуумі (двічі). Після цього залишок розчиняли у безводному метанолі (12мл) і додавали спочатку 1,1диметил-2-(метоксикарбонілокси)етилізонітрил [Tetrahedron, 55 (1999) 7411-7420] (0,9г, 5,7ммоль), потім 4метоксибензойну кислоту (0,87г, 5,7ммоль). Після перемішування протягом 72год розчинник видаляли у вакуумі, залишок хроматографували на силікагелі з елююванням ступінчастим градієнтом від 30% до 50% розчину етилацетату у гексані. Фракції, які містили продукт, об'єднували та концентрували у вакуумі; після цього залишок розчиняли у етилацетаті, промивали насиченим водним розчином NaHCO3, сушили за допомогою Na2SO4, фільтр ували та концентрували з одержанням 1,76г (48%) густого масла (ЯМР, IS-MS, m/e 633,0 (М+1)). Після цього масло (0,5г, 0,79ммоль) розчиняли у толуолі (5мл) та концентрували у вакуумі (двічі) з одержанням піни білого кольору. Після цього залишок розчиняли у THF (3мл), і додавали трет-бутилат калію (0,11г, 0,95ммоль). Через 15хв додавали 12-н. розчин НСl (0,079мл, 0,95ммоль), і розчин витримували протягом ночі у холодильнику. Наступного ранку розчинник видаляли, і залишок хроматографували на силікагелі з елююванням 30% розчином етилацетату в гексані. Фракції, що містили продукт, об'єднували та концентрували з одержанням 0,32г (79%) цільової сполуки. 1 H-ЯМР. IS-MS, m/e 518,0 (М+1). Проміжна сполука РАЕ-6 ВОС-D,L-(5-тіазоліл)гліцинетиловий складний ефір У круглодонну колбу (250см 3) з тетрагідрофураном (приблизно 100см 3) додавали при перемішуванні D,L(5-тіазоліл)гліцинетиловий складний ефір (4,60г, 24,7ммоль) з одержанням розчину жовтого кольору. Після цього при перемішуванні додавали протягом 1год ВОС ангідрид (5,439г, 24,948ммоль) та триетиламін (3,79см 3, 2,75г, 27,17ммоль). Проходження реакції контролювали хроматографуванням у тонкому шарі (60% розчин гексану у е тилацетаті; відносна рухомість вихідного матеріалу 0,05, відносна рухомість продукту 0,5). Реакційну суміш концентрували у вакуумі, продукт розчиняли в етилацетаті (приблизно 150см 3), промивали 5% розчином хлористоводневої кислоти (приблизно 30см 3) та насиченим розчином бікарбонату (приблизно 30см 3). Етилацетатний шар сушили над сульфа том магнію та випаровували досуха з одержанням масла оранжевого кольору (7,42г, ~24,70ммоль) [вихід ~100%]. 1 Н ЯМР (CDCl3); 1,30 (3H, t), 1,48 (9H, s), 4,28 (2H, q), 5,68 (1H, br), 7,88 (1H, s), 8,78 (1H, s). D,L-(5-тіазоліл)гліцинетиловий складний ефір У круглодонну колбу (250см 3) з етанолом (приблизно 80см 3) додавали при перемішуванні етиловий складний ефір 5-тіазоліл-оксимінооцтової кислоти (6,37г, 31,825ммоль). Додавали 50% розчин мурашиної кислоти (50см 3) із цинковим пилом (5,10г, 81,83ммоль) і перемішували протягом ночі. Проходження реакції контролювали хроматографуванням у тонкому шарі (60% розчин гексану у етилацетаті; відносна рухомість вихідного матеріалу 0,3, відносна рухомість продукту 0,05). Реакційний розчин фільтрували через діатомову землю, і фільтрат концентрували у вакуумі. Реакцію концентрованого фільтрату доводили до основної (pH 9) за допомогою безводного карбонату калію, і продукт розчиняли у розчині (3:1) хлороформу/ізопропанолу (приблизно 200см 3). Одержаний розчин промивали насиченим розчином бікарбонату (приблизно 50см 3), сушили над сульфатом магнію та концентрували у вакуумі з одержанням масла коричневого кольору (4,60г, 24,70ммоль) [вихід 78%]. 1 H ЯМР (CDCl3); 1,25 (3Н, t), 1,95 (2Н, br), 4,22 (2Н, q), 4,85 (1Н, s), 7,80 (1H, s), 8,70 (1Н, s). Проміжна сполука РАЕ-7 N-ВОС-D,L-(4-тіазоліл)гліцинетиловий складний ефір До розчину D,L-(4-тіазоліл)гліцинетилового складного ефіру (0,460г, 2,470ммоль) у тетрагідрофурані (20см 3) додавали ди-трет-бутилдикарбонат (0,530г, 2,470ммоль) та триетиламін (0,344см 3, 2,470ммоль). Розчин перемішували протягом1год і концентрували у вакуумі. Одержане масло розчиняли в етилацетаті (приблизно 50см 3), промивали 0,5% розчином хлористоводневої кислоти (приблизно 20см 3) та насиченим розчином бікарбонату натрію (приблизно 20см 3). Після цього розчин сушили над сульфатом магнію та концентрували у вакуумі з одержанням масла оранжевого кольору (0,709г, 2,477ммоль [~100% вихід]. 1 H ЯМР (CDCl3) 1,15 (3Н, t), 1,35 (9Н, s), 4,1 (2Н, m), 5,45 (1H, d), 5,75 (1Н, d), 7,3 (1H, d), 8,7 (1Н, d). D,L-(4-тіазоліл)гліцинетиловий складний ефір Цю проміжну сполуку одержали з етил-a-оксиміно-тіазол-4-ацетату (0,60г) за способом Хатанака (Hatanaka) та ін. (Journal of Medicinal Chemistry, 1973, 16 (9), 978-984) з одержанням цільової сполуки (0,46г). 1 H ЯМР (CDCl3) 1,25 (3Н, t), 1,8-2,3 (2Н, br), 4,1 (2Н, m), 4,75 (1Н, s), 7,25 (1Н, d), 8,7 (1Н, d). Проміжна сполука РАЕ-8 N-Вос-D,L-(2-метилтіазол-4-іл)гліцинетиловий складний ефір До розчину D,L-(2-метилтіазол-4-іл)гліцинетилового складного ефіру (0,397г, 1,982ммоль) у тетрагідрофурані (20см 3) додавали ди-трет-бутилдикарбонат (0,475г, 2,180ммоль) та триетиламін (0,304см 3, 2,180ммоль). Розчин перемішували протягом 1год і концентрували у вакуумі. Одержане масло розчиняли у етилацетаті (приблизно 50см 3), промивали 0,5% розчином хлористоводневої кислоти (приблизно 20см 3) та насиченим розчином натрію бікарбонату (приблизно 20см 3). Після цього розчин сушили над сульфатом магнію та концентрували у вакуумі з одержанням масла жовтого кольору (0,654г, 2,177ммоль [вихід ~100%]. 1 Н ЯМР (CDCl3) 1,1 (3Н, s), 1,35 (9Н, s), 2,6 (3Н, s), 4,15 (3Н, m), 5,3 (1Н, d), 5,7 (1Н, s), 7,0 (1Н, s). D,L-(2-метилтіазол-4-іл)гліцинетиловий складний ефір Цю проміжну сполуку одержали з етил-a-оксиміно-2-метилтіазол-4-ацетату (0,62г) за способом Хатанака (Hatanaka) та ін. (Journal of Medicinal Chemistry, 1973, 16 (9), 978-984) з одержанням цільової сполуки (0,40г). 1 H ЯМР (CDCl3) 1,15 (3Н, t), 1,95 (2Н, br), 2,6 (3Н, s), 4,15 (2Н, m), 4,65 (1Н, s), 6,95 (1Н, s). Проміжна сполука РАЕ-9 Вос-R-(4-гідроксифеніл)гліцинметиловий складний ефір До суміші гідрохлориду R-(4-гідроксифеніл)гліцинметилового складного ефіру (14г) та бікарбонату натрію (11,7г) у тетрагідрофурані (150мл) та воді (50мл) додавали при перемішуванні однією порцією ди-третбутилдикарбонат (15,9г). Суміш інтенсивно перемішували протягом 4год для забезпечення ретельного перемішування. Додавали гексан (75мл), органічний шар відділяли та промивали спочатку насиченим розчином бікарбонату натрію, потім розсолом, після чого сушили над сульфатом магнію. Висушений розчин відфільтровували, промивали невеликою кількістю тетрагідрофурану, випаровували досуха, і видаляли останні сліди ди-трет-бутилдикарбонату в високому вакуумі. Ви хід 19,7г, 96%. 1 Н ЯМР. Гідрохлорид R-(4-гідроксифеніл)гліцинметилового складного ефіру В суху тригорлу круглодонну колбу (250мл), споряджену низькотемпературним термометром, мембраною для заповнення азотом та ще однією мембраною для введення тіонілхлориду за допомогою шприца, вносили R-4-гідроксифенілгліцин (12,5г) та безводний метанол (24мл). Суміш перемішували (магнітна мішалка) та охолоджували до внутрішньої температури -20°С за допомогою суміші сухої вуглекислоти/ацетону. До холодної суміші за допомогою шприца протягом 10хв додавали крапля за краплею тіонілхлорид. (Увага: реакція тіонілхлориду з метанолом є дуже екзотермічною, і швидкість додавання повинна бути такою, щоб тіонілхлорид встигав ефективно змішуватись із сумішшю і щоб температура не перевищувала -20°С). Після закінчення додавання суміші давали нагріватися до кімнатної температури протягом ночі (16-18год). Додавали безводний диетиловий ефір (150мл), і одержаний осад білого кольору відфільтровували, промивали дещо більшою кількістю ефіру та сушили. Ви хід 15,5г, 95%. 1 H ЯМР. Проміжна сполука РАЕ-10 Гідрохлорид Вос-R-(4-трифторметансульфонілоксифеніл)гліцинметилового складного ефіру До розчину Вос-R-(4-гідроксифеніл)гліцинметилового складного ефіру (19г) у дихлорметані (400мл) додавали при перемішуванні 2,6-лутидин (9,44мл) та 4-диметиламінопіридин (1,65г), і суміш охолоджували на льодяній бані. Протягом 5хв додавали трифторметансульфоновий ангідрид (13,74мл), після чого реакційну суміш залишали на 4год для нагрівання до кімнатної температури. Органічний розчин промивали водою (2x150мл), 1-н. НСl (2x150мл), потім насиченим розчином бікарбонату натрію (150мл). Органічну речовину сушили за допомогою сульфату магнію, після чого випаровували з одержанням масла. Одержану суміш очищали флеш хроматографуванням (SiO2 250г, елюювання сумішшю гексан/дихлорметан (1:1), потім нерозбавленим дихлорметаном). Фракції, що містили чистий продукт, об'єднували, випаровували, і видаляли усі сліди розчинника у високому вакуумі, одержуючи тверду речовину білого кольору, 19г, 77%. 1 H ЯМР. Проміжна сполука РАЕ-11 Вос-R-(4-метоксикарбонілфеніл)гліцинметиловий складний ефір Метод PAE-D У скляний циліндр реактора високого тиску (реактор Парра) вносили Boc-R-4трифторметансульфонілоксифенілгліцинметиловий складний ефір (15г), метанол (32,6мл), біс-1,3-дифенілфосфінілпропан (448мг), ацетат паладію (II) (255мг), триетиламін (10,2мл) та диметилформамід (72мл) і реактор складали. Тиск у реакторі за допомогою азоту підвищували до ~0,68 бар (10 фунт/дюйм 2=68кПа), після чого газ видаляли (повторювали п'ять разів для повного видалення кисню з системи). Після цього тричі обережно вводили газоподібний моноксид вуглецю (робити це треба з надзвичайною обережністю - тиск у газовому балоні набагато перевищує розрахунковий тиск розривної пластинки реактора Парра; найкращим варіантом є використання регулятора тиску для зниження тиску до ~6,8 бар, 100 фунт/дюйм 2=0,68МПа) до тиску приблизно 1,4 бар (20 фунт/дюйм 2=0,14МПа), і газ видаляли (спрямовуючи до задньої частини витяжної шафи). Після цього вводили моноксид вуглецю до ~6,8 бар (100 фунт/дюйм 2=0,68МПа), і починали перемішування. Внутрішню температур у реактора повільно підвищували до 65°С, і здійснювали перемішування при температурі 65°С протягом ночі. (На початкових етапах додавали моноксид вуглецю з метою утримування тиску на рівні ~6,8 бар, 100 фунт/дюйм 2=0,68МПа). Через 18год відбирали пробу і аналізували хроматографуванням у тонкому шарі. Після завершення реакції суміш охолоджували до температури ~30°С, газ випускали в атмосферу, і реактор п'ять разів продували азотом, як раніше. Реакційну суміш розподіляли між етилацетатом та водою, органічний шар промивали спочатку 1Μ розчином хлористоводневої кислоти, потім насиченим розчином натрію бікарбонату. Розчин сушили за допомогою MgSO4 та випаровували. Одержане масло піддавали флеш-хроматографуванню з одержанням продукту, чистого за даними тонкошарової хроматографії, 10,6г, 90%. 1 H ЯМР. Проміжна сполука РАЕ-12 Вос-R-(4-бензилоксикарбонілфеніл)гліцинметиловий складний ефір Одержали з Boc-R-4-трифторметансульфонілоксифенілгліцинметилового складного ефіру та бензилового спирту за Методом PAE-D. 1 H ЯМР. Проміжна сполука РАЕ-13 Вос-R-(4-карбоксифеніл)гліцинметиловий складний ефір Вос-R-(4-бензилоксикарбонілфеніл)гліцинметиловий складний ефір (500мг) розчиняли у тетрагідрофурані, до якого попередньо додавали Pd/C 10% (100мг), і гідрували під тиском 1атм протягом 2год. Після відфільтровування каталізатора та випаровування розчинника одержали Boc-R-(4карбоксифеніл)гліцинметиловий складний ефір (330мг, 87%). 1 Н ЯМР. Проміжна сполука РАЕ-14 Вос-R-(4-карбоксамідофеніл)гліцинметиловий складний ефір Метод РАЕ-Е До розчину Вос-R-(4-карбоксифеніл)гліцинметилового складного ефіру (3,5г) у диметилформаміді (30мл) додавали EDCI (2,60г, 1,36ммоль) та HOBt (1,4г, 10,4ммоль), і суміш перемішували протягом 10хв, після чого охолоджували на льодяній бані і барботували газоподібним аміаком протягом 5хв. Суміш перемішували протягом 2год при кімнатній температурі, після чого розбавляли етилацетатом та промивали водою. Водний розчин екстрагували невеликою кількістю етилацетату, і об'єднані органічні фази промивали розсолом. Органічний розчин випаровували з одержанням масла, яке очищали флеш хроматографуванням (SiO2 дихлорметан/етилацетат 0-25%) з одержанням Вос-R-(4-карбоксамідофеніл)гліцинметилового складного ефіру (1,7г, 48%). 1 H ЯМР. Проміжна сполука РАЕ-15 Вос-R-(4-метилкарбоксамідофеніл)гліцинметиловий складний ефір Одержали з Вос-R-(4-карбоксифеніл)гліцинметилового складного ефіру та метиламіну за Методом РАЕ-Е. 1 H ЯМР. Проміжна сполука РАЕ-16 N-4-метоксибензоїл-N-2,4-диметоксибензил-D,L-(хінолін-4-іл)гліцинметиловий складний ефір Одержали з хінолін-4-карбоксальдегіду за Методом РАЕ-С. 1 H ЯМР. Проміжна сполука РАЕ-17 Етил-Вос-D,L-тіазол-2-ілгліцин Одержали з етилгідроксііміно-тіазол-2-ілацетату за Методом РАЕ-B. У цьому разі реакцію з Zn/мурашиною кислотою здійснювали протягом 15хв. 1 ЯМР. IS-MS, m/e 287,0 (М+1). Проміжна сполука РАЕ-18 Етил-Вос-D,L-ізохінолін-8-ілгліцин Одержали з етилгідроксііміно-ізохінолін-8-ілацетату за Методом РАЕ-B. У цьому разі реакцію з Zn/мурашиною кислотою здійснювали протягом 30хв із подальшим концентруванням та розподіленням залишку між сумішшю хлороформ/ізопропанол (3:1) та насиченим водним розчином NaHCO3. За хист Вос здійснювали, як описано вище. Очищення здійснювали гель-хроматографуванням (Biotage Quad System) з елююванням 10% розчином етилацетату у метиленхлориді. 1 ЯМР. IS-MS, m/e 331,0 (М+1). Аналіз для C18H22N2O 4: Обчислено: С, 65,44; Н, 6,71; N, 8,48; Встановлено: С, 65,05; Н, 6,67; N, 8,49. Одержання проміжних сполук РАА-1 - РАА-28 Описані нижче сполуки, якщо не обумовлено інше, одержали за вказаним методом (Метод РАА-А, Метод РАА-В, Метод РАА-С, Метод PAA-D, Метод РАА-Е або Метод PAA-F) із вказаних ви хідних матеріалів. Проміжна сполука РАА-1 Вос-D,L-(2-хлорфеніл)гліцин Метод РАА-А 2-хлорбензальдегід (20ммоль, 2,252мл) та 2,4-диметоксибензиламін (20ммоль, 3,004мл) змішували та перемішували протягом 2год. Додавали DCM (5мл), наявну воду відділяли та видаляли. Додавали третбутилізонітрил (20ммоль, 2,262мл) і перемішували протягом 10хв, після чого додавали оцтову кислоту (20ммоль, 1,145мл). Перемішування продовжували протягом 3 днів. Після цього реакційну суміш обробляли TFA (30мл) та триетилсиланом (5мл). Через 3год суміш випаровували досуха, додавали 6Μ НСl (100мл), і суміш нагрівали зі зворотним холодильником при температурі 130°С протягом ночі при інтенсивному перемішуванні. Суміші давали охолодитися та екстрагували EtOAc (50млх2); водну фракцію випаровували досуха та обробляли 2Μ розчином NaOH. Суміш екстрагували EtOAc (50млх2); до водної фракції додавали надлишкову кількість ВОС ангідриду (5,2г) у діоксані (20мл) і перемішували протягом ночі. Суміш екстрагували діетиловим ефіром (100млх2), підкислювали до pH 1 (концентрована НСl) та екстрагували EtOAc (50млх2). Об'єднані органічні фракції промивали водою та випаровували досуха під високим вакуумом. Продукт Вос-2хлорфенілгліцин (4,252г, 74,5%). 1 H ЯМР (CD3CN/D2O) 7,3 (4Н, m); 5,5 (1H, s); 1,3 (9Н, s). MS 286 (M+1). Проміжна сполука РАА-Г (R)-бензилоксикарбоніл-(2-хлорфеніл)гліцин Одержали з 2-хлорстиролу за способом Шарплесс (Sharpless) та інших, J.A.C.S. (1998), том 120, №6, 1207-1217. Проміжна сполука РАА-1, альтернативний варіант одержання Вос-D,L-(2-хлорфеніл)гліцин Одержали з 2-хлорбензальдегіду за методом PAA-F. У цьому разі температур у під час додавання 2хлорбензальдегіду не контролювали, і реакційну суміш перемішували протягом 2 год. Екстрагування проміжного продукту (амінонітрилу) здійснювали етиловим ефіром замість етилацетату і додатково очищали шляхом додавання газоподібної НСl до ефірних екстрактів із подальшим зливанням маточного розчину для виділення напівтвердої хлористоводневої солі. Захист амінокислоти за допомогою Вос здійснювали у межах температур від 0°С до кімнатної температури протягом 1год, і кінцеве екстрагування здійснювали за допомогою етилацетату, а не етилового ефіру. 1 H-ЯМР. IS-MS m/e 284 (М-1). Проміжна сполука РАА-2 Вос-D,L-(3-фторфеніл)гліцин Одержали з 3-фторбензальдегіду за Методом РАА-А. 1 H ЯМР (CD3CN/D2O) 7,3 (1Н, m), 7,1 (3Н, m); 5,2 (1Н, s); 1,3 (9Н, s). MS 270 (M+1). Проміжна сполука РАА-3 Вос-D,L-(4-фторфеніл)гліцин Одержали з 4-фторбензальдегіду за Методом РАА-А. 1 H ЯМР (CD3CN/D2O) 7,3 (2Н, m); 6,9 (2Н, m), 5,0 (1Н, s); 1,3 (9Н, s). MS 270 (M+1). Проміжна сполука РАА-4 Вос-D,L-(2-метилфеніл)гліцин Одержали з 2-метилбензальдегіду за Ме тодом РАА-А. 1 H ЯМР (CD3CN/D2O) 7,3 (4Н, m); 5,5 (1H, s); 2,5 (3Н, s); 1,3 (9Н, s). MS 266 (M+1). Проміжна сполука РАА-5 Вос-D,L-(3-тієніл)гліцин Одержали з 3-тіофенкарбоксальдегіду за Методом РАА-А. 1 H ЯМР (CD3CN/D2O) 7,5 (2Н, m); 7,1 (1H, d); 5,3 (1Н, s); 1,3 (9Н, s). MS 258 (M+1). Проміжна сполука РАА-6 Вос-D,L-(2-фторфеніл)гліцин Одержали шляхом обробки D,L-2-фторфенілгліцину (продукт фірми Aldrich) Вое ангідридом (1,1екв.) та 2Μ NaOH (1екв.) у етанолі. Шляхом обробки водою, як описано вище, одержали захищену амінокислоту. 1 Н ЯМР. Проміжна сполука РАА-7 Вос-D,L-(2-метоксифеніл)гліцин Одержали з 2-метоксибензальдегіду за Методом РАА-А. 1 Н ЯМР. Проміжна сполука РАА-7, альтернативний варіант одержання Вос-D,L-(2-метоксифеніл)гліцин Одержали з 2-метоксибензальдегіду за Методом PAA-F. У цьому разі реакційну суміш перед додаванням 2-метоксибензальдегіду охолоджували до температури 0°С, після чого перемішували при кімнатній температурі протягом ночі. Екстрагування проміжного амінонітрилу здійснювали етиловим ефіром замість етилацетату і додатково очищали шляхом додавання 1Μ НСl у етиловому ефірі з подальшим відфільтровуванням кристалічної хлористоводневої солі. Захист амінокислоти за допомогою Вос здійснювали у межах температур від 0°С до кімнатної температури протягом 3год, і кінцеве екстрагування здійснювали дихлорметаном, а не етиловим ефіром. 1 H ЯМР. IS-MS m/e 280,1 (М-1). Аналіз для C14H19NO5 . Обчислено: С, 59,78; Н, 6,81; N, 4,98; Встановлено: С, 59,68; Н, 6,78; N, 4,95. Проміжна сполука РАА-8 Вос-D,L-(2-трифторметил)фенілгліцин Одержали з 2-трифторметилбензальдегіду за Методом РАА-А. 1 Н ЯМР. Проміжна сполука РАА-8, альтернативний варіант одержання Вос-D,L-(2-трифторметилфеніл)гліцин Одержали з 2-трифторметилбензальдегіду за Методом PAA-F. У цьому разі реакційну температур у під час додавання 2-трифторметилбензальдегіду не контролювали, і реакційну суміш перемішували протягом 2год. Екстрагування проміжного амінонітрилу здійснювали етиловим ефіром замість етилацетату і додатково очищали шляхом додавання газоподібної НСl до ефірних екстрактів із подальшим зливанням маточного розчину для виділення напівтвердої хлористоводневої солі. Захист амінокислоти за допомогою Вос здійснювали у межах температур від 0°С до кімнатної температури протягом 1год, і кінцеве екстрагування здійснювали етилацетатом, а не етиловим ефіром. 1 Н-ЯМР. IS-MS m/e 318 (М-1). Проміжна сполука РАА-9 Вос-D,L-(8-хінолініл)гліцин Метод РАА-В До розчину Вос-D,L-(8-хінолініл)гліцинетилового складного ефіру (2,29г, 6,93ммоль) у 1,4-діоксані (11мл) додавали при перемішуванні розчин гідрату LiOH (0,32г, 7,6ммоль) у воді. Через 2год розчинники видаляли у вакуумі, залишок розчиняли у воді та промивали діетиловим ефіром. Після цього водну фазу підкислювали до pH 3 за допомогою твердої лимонної кислоти та екстрагували етилацетатом. Після цього органічну фазу промивали розсолом, сушили за допомогою Na2SO4, фільтрували та концентрували з одержанням 2,06г (98%) цільової сполуки. 1 Н ЯМР. IS-MS, m/e 303,0 (М+1). Проміжна сполука РАА-10 Вос-D,L-(5-хінолініл)гліцин Одержали з Вос-D,L-(5-хінолініл)гліцинетилового складного ефіру за Методом РАА-В. 1 Н ЯМР. IS-MS, m/e 303,0 (М+1). Проміжна сполука РАА-11 Вос-D-(3-бромфеніл)гліцин Одержали з R-3-бром-(1-трет-бутоксикарбоніламіно-2-гідроксіетил)бензолу за Методом РАА-С. Температура плавлення=130-132°С із розкладом. 1 Н ЯМР (CDCl3). API-MS, m/e=286 (M-CO2H+1). Проміжна сполука РАА-12 Boc-D-(3-метоксикарбонілфеніл)гліцин Метод РАА-С До розчину R-3-метоксикарбоніл-(1-трет-бутоксикарбоніламіно-2-гідроксіетил)бензолу (338мг, 1,14ммоль) в ацетоні (7,2мл) додавали при перемішуванні 5% NaHCO3 (3мл). Реакційну суміш о холоджували до температури 0°С. До суспензії додавали крапля за краплею при перемішуванні КВr (14мг, 0,12ммоль), TEMPO (181мг, 1,16ммоль) та NaOCl (2,81мл, 5,25%). Через 1год при температурі 0°С додавали TEMPO (136мг, 0,88ммоль) та NaOCl (1,09мл; 5,25%). Реакційну суміш додатково перемішували протягом 0,5год при температурі 0°С, і додавали 5% NaHCO3 (4,3мл). Реакційну суміш витримували протягом ночі і давали нагріватися до кімнатної температури. Ацетон видаляли у вакуумі, і неочищений продукт розподіляли між етилацетатом та водою. Водний шар промивали етилацетатом (2х), підкислювали до pH 5 за допомогою 10% лимонної кислоти та екстрагували етилацетатом (4х). Об'єднані органічні екстракти сушили над MgSO4. Після видалення розчинника у вакуумі одержали продукт (305мг, 86%). 1 H ЯМР (CDCl3). API-MS, m/e=254 (M-C 4H9+1). Проміжна сполука РАА-13 Вос-D-(3-ціанфеніл)гліцин Одержали з R-3-ціан-(1-трет-бутоксикарбоніламіно-2-гідроксіетил)бензолу за Методом РАА-С. 1 H ЯМР (CDCl3). API-MS, m/e=221 (M-C 4H9+1). Проміжна сполука РАА-14 Вос-D-(3-етансульфоніламінофеніл)гліцин До розчину 3-(етансульфоніламінофеніл)гліцину (20г, 77,43ммоль) та карбонату натрію (8,2г, 77,43ммоль) у тетрагідрофурані:воді (3:1) (200мл) при температурі 0°С додавали при перемішуванні ди-третбутилдикарбонат (18,5г, 85,17ммоль). Після перемішування протягом 30хв охолоджувальну баню відстороняли; після додаткових 30хв при кімнатній температурі розчинник видаляли; залишок розподіляли між етилацетатом та водою. Водний шар підкислювали до pH 2 за допомогою KHSO4 та двічі екстрагували етилацетатом. Об'єднані етилацетатні екстракти промивали водою, сушили за допомогою Na2SO4, фільтрували і концентрували у вакуумі з одержанням 17,51г (63%) твердої речовини білого кольору. 1 Н ЯМР. IS-MS, m/е 357,0 (М-1). Проміжна сполука РАА-15 N-Вос-D,L-(5-тіазоліл)гліцин У круглодонну колбу (150см 3) з етанолом (приблизно 100см 3) при перемішуванні додавали Вос-D,L-(5тіазоліл)гліцинетиловий складний ефір (7,00г, 24,70ммоль). Додавали 2Μ розчин гідроксиду натрію (25см 3, 50ммоль) і перемішували протягом 1год. Проходження реакції контролювали хроматографуванням у тонкому шарі (60% розчин гексану у етилацетаті; відносна рухомість вихідного матеріалу 0,5, відносна рухомість продукту 0.). Реакційну суміш концентрували у вакуумі, продукт розчиняли у насиченому розчині бікарбонату (приблизно 50см 3) і промивали етилацетатом (приблизно 30см 3). Водний шар підкислювали до pH 2 за допомогою концентрованої хлористоводневої кислоти, і продукт екстрагували сумішшю хлороформу з ізопропанолом (3:1) (приблизно 3x60см 3). Органічний шар сушили над сульфатом магнію та випаровували досуха з одержанням твердої речовини оранжевого кольору (4,47г, 17,30ммоль) [вихід 74%]. 1 H ЯМР (CDCl3); 1,35 (9Н, s), 5,60 (1Н, d), 5,83 (1Н, d), 7,88 (1Н, s), 8,80 (1H, s). Проміжна сполука РАА-16 N-Вос-D,L-(4-тіазоліл)гліцин Метод PAA-D До розчину N-Вос-D,L-(4-тіазоліл)гліцинетилового складного ефіру (0,700 г, 2,470ммоль) у метанолі (приблизно 15см 3) додавали 2Μ розчин гідроксиду натрію (2,47см 3, 4,940ммоль) і перемішували протягом 90хв. Розчин концентрували у вакуумі і розчиняли у воді (приблизно 20см 3). Водний розчин промивали етилацетатом (приблизно 20см 3), після чого підкислювали до pH 2 за допомогою 5% розчину хлористоводневої кислоти (приблизно 50см 3). Продукт екстрагували етилацетатом (приблизно 3x30см 3), сушили над сульфатом магнію і концентрували у вакуумі з одержанням масла блідо-жовтого кольору (0,582г, 2,254ммоль) [91% вихід]. 1 H ЯМР (CDCl3) 1,35 (9Н, s), 5,5 (1Н, d), 5,8 (1H, d), 7,35 (1H, d), 8,75 (1H,d), 9,8-10,2 (1Н, br). Проміжна сполука РАА-17 N-Вос-D,L-(2-метилтіазол-4-іл)гліцин Одержали з N-Вос-D,L-(2-метилтіазол-4-іл)гліцинетилового складного ефіру за Методом PAA-D. 1 H ЯМР (CDCl3) 1,35 (9Н, s), 2,6 (3Н, s), 5,4 (1Н, d), 5,9 (1H, S), 7,1 (1Н, s). Проміжна сполука РАА-18 N-Вос-D,L-(2-бензилоксикарбоніламіно-4-тіазоліл)гліцин Одержали з D,L-(2-бензилоксикарбоніламіно-4-тіазоліл)гліцину. Бензилоксикарбонільну захисну гр упу відщеплювали від тіазоліламіногрупи на відповідному етапі одержання кінцевої сполуки звичайним способом, наприклад, шляхом нагрівання розчину проміжної сполуки у суміші HBr/оцтова кислота при температурі 60°С із подальшим випаровуванням та звичайним виділенням, наприклад, іонообмінним хроматографуванням на SCX. D,L-(2-бензилоксикарбоніламіно-4-тіазоліл)гліцин Одержали за методом Харді К. (Hardy К.); Харрінгтон Φ. (Harrington F.) та Стахульскі A. (Stachulski A.) - J. Chem. Soc. Perkin Trans I (1984) 1227-1235. Проміжна сполука РАА-19 Вос-R-(4-метоксикарбонілфеніл)гліцин До розчину Вос-R-(4-метоксикарбонілфеніл)гліцинметилового складного ефіру (692мг) у тетрагідрофурані (10мл) додавали розчин гідроксиду літію (90мг) у воді (7мл). Суміш одразу ж ставала каламутною, через 15хв вона ставала прозорою. Реакція, за даними хроматографування в тонкому шарі, завершувалась через 30хв. Додавали етилацетат (20мл) та воду (20мл), і водний шар відділяли. Водний розчин підкислювали за допомогою 2Μ хлористоводневої кислоти та екстрагували етилацетатом (3x20мл). Після цього органічний розчин промивали водою (х2) та розсолом (х2), сушили за допомогою MgSO4 та випаровували з одержанням складного моноефіру (650мг, 98%), чистого за даними хроматографування в тонкому шарі. 1 Н ЯМР. Проміжна сполука РАА-20 Boc-R-(4-метоксифеніл)гліцин Вос-R-(4-гідроксифеніл)гліцинметиловий складний ефір перетворили в Boc-R-4-метоксифенілгліцин методом алкілування, описаним Басак (Basak) та іншими (Tetrahedron Lett. 1998, 39 (27), 4883-4886), з подальшим гідролізом метилового складного ефіру гідроксидом літію у водному розчині тетрагідрофурану. 1 Н ЯМР. Проміжна сполука РАА-21 N-4-метоксибензоїл-N-2,4-диметоксибензил-D,L-(2-трифторметилфеніл)гліцин Одержали з N-4-метоксибензоїл-N-2,4-диметоксибензил-D,L-(2-трифторметилфеніл)гліцинметилового складного ефіру за Ме тодом РАА-В (3екв. LiOH гідрату). 1 Н ЯМР. IS-MS, m/e 503,9 (m+1). Проміжна сполука РАА-22 N-4-мeтoкcибeнзoїл-N-2,4-димeтoкcибeнзил-D,L-(тiєн-2-iл)гліцин Метод РАА-Е До розчину 2-тіофенборної кислоти (5,0г, 39,0ммоль, 1екв.) у 275мл метиленхлориду при кімнатній температурі додавали спочатку 3,4-диметоксибензиламін (5,89мл, 39,0ммоль, 1екв.), потім моногідрат гліоксилової кислоти (3,6г, 39ммоль, 1екв.). Реакційну суміш перемішували протягом 56год при кімнатній температурі, після чого одержаний осад відфільтровували та промивали метиленхлоридом з одержанням 9,3г (78%) N-2,4-диметоксибензил-D,L-(тієн-2-іл)гліцину у вигляді жовтуватої твердої речовини. (IS-MS, m/e 308 (m+1)). Частину твердого продукту (5,0г, 16,3ммоль, 1екв.) розчиняли у ацетоні (20мл) та 1-н. розчині гідроксиду натрію (20мл) при кімнатній температурі. До цього розчину одночасно додавали крапля за краплею хлорид анізоїлу (2,78г, 16,3ммоль, 1екв.) у 20мл ацетону та 2-н. розчин гідроксиду натрію. Після перемішування при кімнатній температурі протягом 1год реакційну суміш охолоджували до 0°С та підкислювали до pH 2-3. Додавали діетиловий ефір, і продукт екстрагували в органічну фаз у. Об'єднані органічні фази промивали розсолом, сушили над сульфатом натрію, фільтрували та концентрували з одержанням 5,1г (71%) цільової сполуки у вигляді твердої речовини білого кольору. IS-MS, m/e 440 (m+1). Проміжна сполука РАА-23 N-Boc-N-2,4-димeтoкcибeнзил-D,L-(тiєн-2-iл)глiцин До розчину N-2,4-диметоксибензил-D,L-(тієн-2-іл)гліцину (1,0г, 3,2ммоль, 1екв.) у 6мл ацетону та 6мл води при кімнатній температурі додавали спочатку триетиламін (0,97мл, 7,0ммоль, 2,1екв.), потім 2-(третбутоксикарбонілоксііміно)-2-фенілацетонітрил (BOC-ON) (0,76г, 3,1ммоль, 0,95екв.). Після перемішування при кімнатній температурі протягом ночі реакційну суміш розбавляли водою та промивали ефіром. Після цього водну фаз у підкислювали 0,5Μ лимонною кислотою, і продукт екстрагували діетиловим ефіром. Об'єднані органічні фази промивали розсолом, сушили над сульфатом натрію, фільтрували та концентрували з одержанням 0,38г (29%) цільової сполуки у вигляді неочищеного масла жовтого кольору. IS-MS, m/e 408 (m+1). Проміжна сполука РАА-24 Вос-D,L-ізохінолін-8-ілгліцин Одержали з етил-Вос-D,L-ізохінолін-8-ілгліцину за Методом РАА-В. Продукт осаджували з основного водного розчину шля хом доведення pH до З за допомогою твердої лимонної кислоти. 1 ЯМР. IS-MS, m/e 303,0 (М+1). Аналіз для C16H18N2O 4×0,5 H 2O: Обчислено: С, 61,73; Н, 6,15; N, 9,00; Встановлено: С, 61,62; Н, 5,66; N, 8,84. Проміжна сполука РАА-25 Вос-D,L-нафталін-1-ілгліцин Метод PAA-F Стадія А: Гідрохлорид D,L-нафталін-1-ілгліцину До розчину ціаніду натрію (10,0г, 0,22ммоль) у 40мл води додавали хлорид амонію (11,4г, 0,22ммоль), і суміш перемішували до повного розчинення. Після цього додавали розчин 1-нафтальдегіду (31,0г, 0,22ммоль) у 40мл метанолу, і одержану суміш перемішували при кімнатній температурі протягом двох днів. Після цього додатково додавали 150мл води, і неочищений продукт екстрагували EtOAc. Об'єднані органічні шари промивали водою, сушили над Na2SO4, фільтрували та концентрували з одержанням неочищеного масла. Неочищений залишок хроматографували на силікагелі з елююванням сумішшю (10:1) EtOAc:CH2Cl2 з одержанням 35г масла світло-коричневого кольору. Після цього цей матеріал розчиняли у 250мл 5-н. НСl і нагрівали зі зворотним холодильником при температурі кипіння протягом 9год. Реакційній суміші давали охолодитися до кімнатної температури, і продукт кристалізувався протягом ночі. Суміш фільтрували з одержанням 13,6г (29%) цільової сполуки у вигляді кристалів світло-коричневого кольору. 1 ЯМР. IS-MS, m/e 201,9 (М+1). Стадія В: Вос-D,L-нафталін-1-ілгліцин До розчину гідрохлориду D,L-нафталін-1-ілгліцину (13,6г, 57,2ммоль) та 2-н. гідроксиду натрію (57мл, 115ммоль) у 120мл 1,4-діоксану та 60мл води додавали (Вос)2О (15г, 69ммоль). Реакційну суміш перемішували при кімнатній температурі протягом 3год, після чого розчин доводили до pH 5 шляхом додання 1-н. сірчаної кислоти. Після цього продукт екстрагували EtOAc; об'єднані органічні екстракти сушили над Na2SO4, фільтрували та концентрували з одержанням 14г (81%) цільової сполуки у вигляді піни світлокоричневого кольору. 1 ЯМР. IS-MS, m/e 300,1 (М-1). Проміжна сполука РАА-26 Вос-D,L-(2-метилтіофеніл)гліцин До розчину 2-(метилтіо)бензальдегіду (15г, 98,7ммоль) у 100мл етанолу додавали карбонат амонію (23,1г, 296ммоль) та розчин ціаніду калію (12г, 148ммоль) у 100мл води. Реакційну суміш нагрівали та перемішували при температурі 70°С протягом 3год, після чого концентрували під зниженим тиском. Продукт екстрагували етилацетатом; об'єднані органічні фази промивали розсолом, сушили над Na2SO4, фільтрували та концентрували. Одержаний неочищений залишок розчиняли у 70мл етилацетату, і додавали 70мл 5-н. розчину гідроксиду натрію. Реакційну суміш нагрівали зі зворотним холодильником при температурі кипіння протягом трьох днів, після чого етилацетат видаляли під зниженим тиском. До водної суміші послідовно додавали 100мл діоксану, Вос2О (42г, 192ммоль) та 100мл 2,5-н. розчину гідроксиду натрію. Після цього реакційну суміш нагрівали зі зворотним холодильником при температурі кипіння протягом 48год. Після охолодження до кімнатної температури реакційну суміш розбавляли водою, і водну фазу промивали етиловим ефіром. Після цього водний шар підкислювали до pH 2, і продукт екстрагували етилацетатом. Об'єднані органічні екстракти промивали розсолом, сушили над MgSO4 , фільтрували та концентрували з одержанням 21,7г неочищеного залишку. Після очищення гель-хроматографуванням (градієнтне елюювання, від 97:2:1 до 95:4:1 дихлорметан:метанол:оцтова кислота) одержали 5,0г (17%) цільової сполуки. 1 Н ЯМР. ES-MS m/e 296 (M-1). Проміжна сполука РАА-27 Вос-D,L-(2-метилсульфонілфеніл)гліцин До розчину Вос-D,L-(2-метилтіофеніл)гліцину (4,5г, 15,2ммоль) у 75мл метанолу додавали розчин оксону (14г, 23ммоль) у воді. Реакційну суміш перемішували при кімнатній температурі протягом 2год, після чого метанол видаляли під зниженим тиском. Продукт екстрагували етилацетатом; об'єднані органічні шари промивали розсолом, сушили над MgSO4, фільтрували та концентрували з одержанням 4,35г (87%) цільової сполуки. 1 Н-ЯМР. ES-MS m/e 230 (М+1-С5Н9О 2). Проміжна сполука РАА-28 Вос-D,L-(бензо[b]тіофен-3-іл)гліцин Можна одержати за методом С. Куколья (S. Kukolja) та інших, /. Med. Chem. 1985, 28, 1886-1896. Одержання проміжних сполук А-1-А-12 Описані нижче сполуки, якщо не обумовлено інше, одержали за вказаним методом (Метод А-А або Метод А-В) із вказаних вихідних матеріалів. Проміжна сполука А-1 Гідрохлорид 1-[2-(4-піридиніл)етил]піперазину Метод А-А А. 1-Вос-піперазин (30г, 285ммоль), 4-вінілпіридин (40г, 216ммоль) та оцтову кислоту (12,9г, 215ммоль) змішували у етанолі (400мл) та нагрівали зі зворотним холодильником при температурі кипіння протягом 18год. Суміш охолоджували до кімнатної температури та концентрували у вакуумі. Залишок розчиняли у воді та етилацетаті і нейтралізували насиченим розчином NaHCO3. Шари розділяли. Водний шар екстрагували етилацетатом. Органічні шари об'єднували, промивали розсолом, сушили (Na2SO4), фільтрували та концентрували. Неочищений продукт очищали хроматографуванням на SiO2 з одержанням 1-Вос-4-[2-(4піридиніл)-етил]піперазину (55,9г, 87%) у вигляді жовтуватої твердої речовини. 1 H-ЯМР (CDCl3). СІ-MS, m/e=292 (M+1). В. 1-Вос-4-[2-(4-піридиніл)етил]піперазин (25г, 85,8ммоль) розчиняли у метанолі (100мл) і охолоджували до температури 0°С. Додавали насичений розчин НСl у метанолі (100мл), і суміш витримували при нагріванні до кімнатної температури протягом 1год. Суміш концентрували у вакуумі і одержали гідрохлорид 1-[2-(4піридиніл)етил]піперазину (23,8г, 92%) у вигляді твердої речовини білого кольору. 1 H-ЯМР (CD3OD). СІ-MS, m/e=192 (M+1). За альтернативним варіантом, 1-Вос-4-[2-(4-піридиніл)етил]піперазин (1,0г, 3,43ммоль) розчиняли у етиловому ефірі. Додавали етилацетат (15мл), насичений НСl, і суміш перемішували при кімнатній температурі протягом 30хв. Суміш концентрували у вакуумі, і одержали гідрохлорид 1-[2-(4піридиніл)етил]піперазину (900мг, 87%) у вигляді твердої речовини жовто-коричневого кольору. 1 H-ЯМР (CD3OD). СІ-MS, m/e=192 (M+1). Проміжна сполука А-2 1-[2-(2-піридиніл)етил]піперазин Одержали з Вос-піперазину та 2-вінілпіридину за Методом А-А. 1 H-ЯМР (CD3OD). СІ-MS, m/e=192 (M+1). Проміжна сполука А-3 1-[2-(2-піразиніл)етил]піперазин Одержали з Вос-піперазину та 2-вінілпіразину за Методом А-А. 1 H-ЯМР (CD3OD). СІ-MS, m/e=193 (M+1). Проміжна сполука А-4 1-[2-(3-піридазиніл)етил]піперазин Одержали з Вос-піперазину та 3-вінілпіридазину (одержаного за методом, опис якого наведено у /. Chem. Soc, Chem. Commun. 1985, 1632-1633) за Методом А-А. 1 H ЯМР (CD3 OD). API-MS, m/e=193 (M+1). Проміжна сполука А-5 1-[2-(3-піридиніл)етил]піперазин Метод А-В 1-Вос-4-[(3-піридиніл)ацетил]піперазин (8,0г, 26,2ммоль) додавали до розчину комплексу борану з THF (2,0Μ у THF, 39,5мл, 78,6ммоль) у THF (200мл) при температурі 0°С. Суміш нагрівали зі зворотним холодильником при температурі кипіння протягом 8год і охолоджували до кімнатної температури. Реакцію з надлишком борану гасили доданням холодного метанолу та 3-н. НСl. Суміш перемішували протягом 3год при кімнатній температурі, і розчинники видаляли у вакуумі. Неочищений продукт очищали шляхом хроматографування (SiO2, CH2Cl2:CMA (4:1)) з одержанням 1-[2-(3-піридиніл)етил]піперазину (2,82г, 36%) у вигляді масла світло-жовтого кольору. 1 H ЯМР (CD3 OD). API-MS, m/e=192 (M+1). Проміжна сполука А-6 1-[2-(4-імідазоліл)етил]піперазин Одержали з 1-Вос-4-[(4-імідазоліл)ацетил]піперазину за Методом А-В. 1 Н ЯМР. IS-MS, m/e 181,2 (М+1). Проміжна сполука А-7 1-[2-(1-імідазоліл)етил]піперазин Одержали з 1-Вос-4-[(1-імідазоліл)ацетил]піперазину за Методом А-В. 1 Н ЯМР. IS-MS, m/e 181,4 (М+1). Проміжна сполука А-8 1-[2-(1-піразоліл)етил]піперазин Одержали з 1-Вос-4-[(1-піразоліл)ацетил]піперазину за Методом А-В. 1 Н ЯМР. IS-MS, m/e 181,4 (М+1). Проміжна сполука А-9 1-(2-тіазол-2-ілетил)піперазин А. Розчин Вос2О (26г, 120ммоль) у метиленхлориді (50мл) повільно додавали до розчину етилпіперазин-1ілацетату (20г, 116ммоль) у СН2Сl2 (500мл). Суміш перемішували протягом 1год при кімнатній температурі. Розчинник видаляли у вакуумі з одержанням 4-Вос-піперазин-1-ілацетату (31,9г, 100%) у вигляді твердої речовини білого кольору. 1 H ЯМР (CDCl3). СІ-MS, m/e=273 (M+1). B. Гідрохлорид N-метокси-N-метиламіну (4,3г, 44,1ммоль) розчиняли у метиленхлориді (25мл) Розчин охолоджували до температури -78°С, і повільно додавали розчин триметилалюмінію (44,1мл, 44,1ммоль, 1Μ у гептані). Суміш перемішували при температурі 0°С протягом 30хв, давали нагрітися до кімнатної температури та перемішували протягом 30хв. Після цього суміш охолоджували до температури 0°С, і додавали крапля за краплею розчин етил-4-Вос-піперазин-1-ілацетату (10г, 36,8ммоль). Через 15хв охолоджувальну баню відстороняли, і перемішування продовжували на протязі ночі. Суміш розбавляли етилацетатом та водою. Шари розділяли, і водний шар екстрагували етилацетатом. Органічні шари об'єднували, промивали розсолом, сушили (Na2SO4), фільтрували та концентрували з одержанням N-метокси-N-метил-4-Вос-піперазин-1ілацетаміду у вигляді масла світло-жовтого кольору (6,02г, 57%), яке тверділо при відстоюванні. Продукт використовували без додаткового очищення. 1 H ЯМР (CDCl3). СІ-MS, m/e=288 (M+1). C. н-бутиллітій (1Μ у гексані, 12,2мл, 12,2ммоль) повільно додавали до розчину 2-бромтіазолу (2,0г, 12,2ммоль) у діетиловому ефірі (50мл) при температурі -78°С. Суміш перемішували при температурі -78°С протягом 1год. Після цього повільно додавали розчин N-метокси-N-метил-4-Вос-піперазин-1-ілацетаміду (3,0г, 10,4ммоль) у тетрагідрофурані. Суміші давали повільно нагрітися до температури -20°С і перемішували протягом 4год. Після цього суміш розбавляли спочатку водою, потім етилацетатом. Водний шар екстрагували етилацетатом, органічні шари об'єднували, промивали розсолом, сушили (Na2SO4), фільтрували та концентрували. Неочищений продукт очищали шляхом хроматографування (SiO2, СН2Сl2:СМА (20:1-6:1)) з одержанням 1-Вос-4-(2-оксо-2-тіазол-2-ілетил)піперазину (2,2г, 68%) у вигляді безбарвного масла. 1 H ЯМР (CDCl3). СІ-MS, m/e =312 (M+1). D. 1-Вос-4-(2-оксо-2-тіазол-2-ілетил)піперазин (5,0г, 16,1ммоль) розчиняли у метанолі (25мл). До цього розчину додавали спочатку сульфат магнію (2г), потім n-тозилгідразин (3,9г, 20,2ммоль). Суміш перемішували протягом 48год, після чого фільтрували, і фільтрат концентрували у вакуумі. Залишок (6,0г, приблизно 12ммоль) повторно розчиняли у метанолі (120мл), і додавали триацетоксиборгідрид натрію (10,1г, 48ммоль). Суміш нагрівали зі зворотним холодильником при температурі кипіння протягом ночі. Суміш охолоджували до температури 0°С, і повільно додавали концентровану НСl (15мл). Суміші давали нагрітися до кімнатної температури і перемішували протягом 1год. Суміш концентрували до половини об'єму, вносили в колонку з SCX (30г, попередньо оброблена 5% розчином оцтової кислоти у метанолі) і промивали метанолом (500мл). Продукт елюювали насиченим розчином гідроксиду амонію у метанолі (500мл), і розчинник видаляли у вакуумі. Після цього неочищений продукт очищали шля хом хроматографування (SiO2, СН2Сl2:С МА (12:1-4:1)) з одержанням 1-(2-тіазол-2-ілетил)піперазину (1,9г, 57%). 1 H ЯМР (CDCl3). СІ-MS, m/e=198 (M+1). Проміжна сполука А-10 Гідрохлорид 1-[2-(2-бензилоксикарбоніламінотіазол-4-іл)етил]піперазину Цільову сполуку одержали з 1-Вос-4-[2-(2-бензилоксикарбоніл-амінотіазол-4-іл)ацетил]піперазину за методиками, в основному еквівалентними описаним у Методі А-В (85%). 1 H ЯМР (CD3 OD). СІ-MS, m/e=347 (M+1). Проміжна сполука А-11 Тригідрохлорид 1-[2-(3-фторпіридин-4-іл)етил]піперазину А. н-бутиллітій (1,8Μ у гексані, 35мл, 64,4ммоль) завантажували у круглодонну колбу та розбавляли тетрагідрофураном (25мл). Розчин охолоджували до температури 0°С, і повільно додавали розчин Ν,Νдіізопропіламіну (9,0мл, 65ммоль) у тетрагідрофурані (25мл). Суміш перемішували при температурі 0°С протягом 20хв і охолоджували до температури -78°С. Додавали крапля за краплею розчин 3-фторпіридину (20г, 206ммоль) (температуру суміші підтримували нижче -70°С), наслідком чого було утворення осаду червоного кольору. Суміш перемішували при температурі -78°С протягом 4год. Повільно додавали оксид етилену (4,6Μ у тетрагідрофурані, 67,2мл, 309ммоль), і суміші давали нагрітися до кімнатної температури протягом ночі. Суміш розбавляли водою та СН 2Сl2. Шари відділяли, і водний шар екстрагували за допомогою СН2Сl2. Органічні шари об'єднували, промивали розсолом, сушили (Na2SO4), фільтрували та концентрували з одержанням масла темно-коричневого кольору. Залишок очищали шляхом хроматографування (SiO2, CH2Cl2:CMA (19:1-6:1)) з одержанням 3-фтор-4-(2-гідроксіетил)піридину (6,7г, 23%) у вигляді масла жовтокоричневого кольору. 1 H ЯМР (CDCl3). СІ-MS, m/e=142 (M+1). B. 3-фтор-4-(2-гідроксіетил)піридин (4,0г, 28,3ммоль) та триетиламін (8,3мл, 60ммоль) розчиняли у СН 2Сl2 (40мл) та охолоджували до температури 0°С. До цього розчину додавали крапля за краплею метансульфонілхлорид (2,0мл, 31,2ммоль). Суміш перемішували при температурі 0°С протягом 1год. Суміш розбавляли водою, і шари розділяли. Водний шар екстрагували СН 2Сl2. Органічні шари об'єднували, промивали розсолом, сушили (Na2SO4), фільтрували та концентрували у вакуумі з одержанням 3-фтор-4-(2метансульфонілоксіетил)піридину (5,2г, 83%) у вигляді масла рожевого кольору. 1 Н ЯМР (CDCl3). СІ-MS, m/e=220 (M+1). C. 3-фтор-4-(2-метансульфонілоксіетил)піридин (5,2г, 23,7ммоль) розчиняли у диметилсульфоксиді (65мл). Додавали 1-Вос-піперазин (8,85г, 47,4ммоль), К2СО3 (3,3г, 23,7ммоль), Nal (3,6г, 23,7ммоль) та Cs 2CO3 (7,7г, 23,7ммоль), і суміш нагрівали до температури 55°С протягом 18год. Суміш охолоджували до кімнатної температури та розбавляли водою і етилацетатом. Шари розділяли, і водний шар екстрагували за допомогою етилацетату. Органічні шари об'єднували, промивали розсолом, сушили (Na2SO4), фільтрували та концентрували у вакуумі з одержанням розчину продукту та диметилформаміду. Залишок розчиняли у діетиловому ефірі та воді. Шари розділяли, і водний шар екстрагували діетиловим ефіром. Органічні шари об'єднували, промивали розсолом, сушили (Na2SO4), фільтрували та концентрували у вакуумі. Неочищений продукт очищали шляхом хроматографування (SiO2, CH2Cl2:CMA (15:1-6:1)) з одержанням I-Вос-4-[2-(3фторпіридин-4-іл)етил]піперазину (6,2г, 84%). 1 Н ЯМР (CDCl3). СІ-MS, m/e=310 (M+1). D. 1-Вос-4-[2-(3-фторпіридин-4-іл)етил]піперазин (6,0г, 19,4ммоль) розчиняли у метанолі (20мл) та анізолі (6мл). До цього розчину додавали концентровану хлористоводневу кислоту (15мл), і суміш перемішували протягом 1год. Розчинники видаляли у вакуумі з одержанням твердої речовини жовтого кольору. Залишок суспендували у діетиловому ефірі та піддавали обробці ультразвуком протягом 1год. Продукт виділяли шляхом фільтрації у вакуумі, і тверду речовину сушили у вакуумі з одержанням тригідрохлориду 1-[2-(3
ДивитисяДодаткова інформація
Назва патенту англійськоюInhibitors of the serine proteases, pharmaceutical composition based thereon
Автори англійськоюMasters John Joseph, Sheenan, Scott, Martin, Watson, Brian, Morgan
Назва патенту російськоюИнгибиторы сериновых протеаз, фармацевтическая композиция на их основе
Автори російськоюМастерз Джон Джозеф
МПК / Мітки
МПК: C07D 207/12, A61K 31/497, A61P 43/00, C07D 401/14, C07D 211/46, C07D 309/14, C07D 403/12, A61P 9/00, A61P 9/10, C07D 521/00, C07D 335/00, A61P 29/00, A61K 31/495, C07D 213/56, A61P 35/00, C07D 409/12, A61P 11/06, A61P 17/02, C07D 211/26, A61P 19/02, A61P 11/00, A61P 1/16, A61K 31/501, C07D 401/12, C07D 213/36, C07D 213/38, C07D 417/12, C07D 417/14, C07D 207/14, C07D 295/16, C07D 309/34, C07D 295/185, A61P 7/02, A61K 31/496
Мітки: інгібітори, протеаз, основі, фармацевтична, серинових, композиція
Код посилання
<a href="https://ua.patents.su/56-74372-ingibitori-serinovikh-proteaz-farmacevtichna-kompoziciya-na-kh-osnovi.html" target="_blank" rel="follow" title="База патентів України">Інгібітори серинових протеаз, фармацевтична композиція на їх основі</a>
Попередній патент: Процес прогнозування поліорганної недостатності при гострій кишковій непрохідності
Наступний патент: Спосіб окислення вуглеводнів, спиртів та/або кетонів
Випадковий патент: Спосіб прогнозування зрощення перелому