Інгібітори гістондезацетилази
Номер патенту: 78031
Опубліковано: 15.02.2007
Автори: Тен Хольте Петер, Анжибо Патрік Рене, Вердонк Марк Густааф Селін, Дяткін Олексій Борисович, Меерпоель Лівен, ван Брандт Свен Францискус Анна, Рю Бруно, Пілатт Ізабель Ноель Констанс
Формула / Реферат
1. Сполука формули (І)
 ,(I)
,(I)
її N-оксидні форми, фармацевтично прийнятні солі приєднання та стереохімічно ізомерні форми, де
n дорівнює 0, 1, 2 чи 3, і якщо n дорівнює 0, то означає простий зв’язок,
t дорівнює 0, 1, 2, 3 чи 4, і якщо t дорівнює 0, то означає простий зв’язок,
кожний з Q означає нітроген або 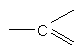 ,
,
кожний з Х означає нітроген або 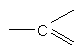 ,
,
кожний з Y означає нітроген або 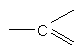 ,
,
кожний з Z означає нітроген або  ,
,
R1 означає -C(O)NR7R8, -NHC(O)R9, -С(O)-С1-6-алкандіїл-SR9, -NR10C(O)N(OH)R9, -NR10C(O)C1-6-aлкaндiїл-SR9, -NR10С(О)С=N(OH)R9 або іншу Zn-хелатуючу групу,
де R7 та R8 кожний незалежно вибираютьз гідрогену, гідроксильної групи, С1-6-алкілу, гідроксі-С1-6-алкілу, аміно-С1-6-алкілу чи аміноарилу, R9 незалежно вибирають з гідрогену, С1-6-алкілу, С1-6-алкілкарбонілу, арил-С1-6-алкілу, С1-6-алкілпіразинілу, піридинону, піролідинону чи метилімідазолілу,
R10 незалежно вибирають з гідрогену чи С1-6-алкілу,
R2 означає гідроген, галоїд, гідроксильну групу, аміногрупу, нітрогрупу, С1-6-алкіл, С1-6-алкоксигрупу, трифлуорметил, ді-(С1-6-алкіл)аміногрупу, гідроксіаміногрупу чи нафталінілсульфонілпіразиніл,
-L- означає простий зв’язок чи бівалентний радикал, вибраний з С1-6-алкандіїлу,
С1-6-алкандіїлоксигрупи, аміногрупи, карбонілу чи амінокарбонілу,
кожний з R3 незалежно означає атом гідрогену, причому один атом гідрогену може бути заміщений замісником, вибраним з арилу,
R4 означає гідроген, гідроксильну групу, аміногрупу, гідроксі-С1-6-алкіл, С1-6-алкіл, С1-6-алкоксигрупу, арил-С1-6-алкіл, амінокарбоніл, гідроксікарбоніл, аміно-С1-6-алкіл, амінокарбоніл-С1-6-алкіл, гідроксикарбоніл-С1-6-алкіл, гідроксіамінокарбоніл, С1-6-алкоксикарбоніл, С1-6-алкіламіно-С1-6-алкіл чи ді-(С1-6-алкіл)аміно-С1-6-алкіл,
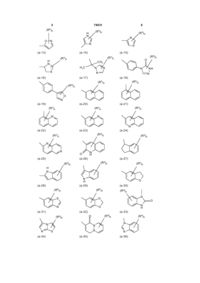
![]() означає радикал, вибраний з
означає радикал, вибраний з
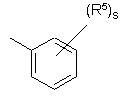

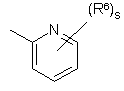
(a-1)
(a-2)
(a-3)


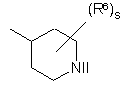
(a-4)
(a-5)
(a-6)
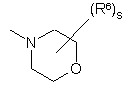


(a-7)
(a-8)
(a-9)
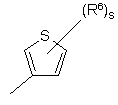

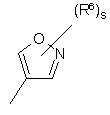
(a-10)
(a-11)
(a-12)
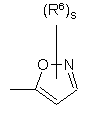
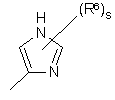

(a-13)
(a-14)
(a-15)
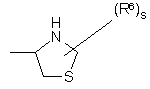

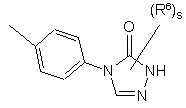
(a-16)
(a-17)
(a-18)

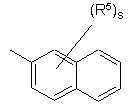
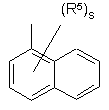
(a-19)
(a-20)
(a-21)
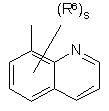


(a-22)
(a-23)
(a-24)
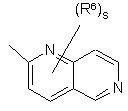
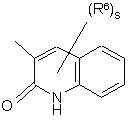

(a-25)
(a-26)
(a-27)



(a-28)
(a-29)
(a-30)
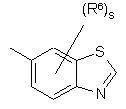
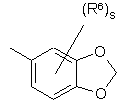

(a-31)
(a-32)
(a-33)
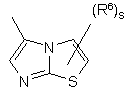
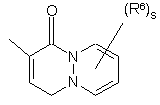
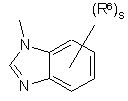
(a-34)
(a-35)
(a-36)


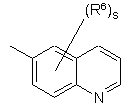
(a-37)
(a-38)
(a-39)



(a-40)
(a-41)
(a-42)


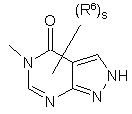
(a-43)
(a-44)
(a-45)
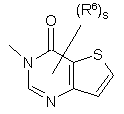


(a-46)
(a-47)
(a-48)


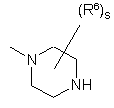 ,
,
(a-49)
(a-40)
(a-51)
де кожний s незалежно дорівнює 0, 1, 2, 3, 4 чи 5,
кожний з R5 та R6 незалежно являє собою гідроген, галоїд, гідроксильну групу, аміногрупу, нітрогрупу, тригалоїд-С1-6-алкіл, тригалоїд-С1-6-алкоксигрупу, С1-6-алкіл, С1-6-алкіл, заміщений арилом та С3-10-циклоалкілом, С1-6-алкоксигрупу, С1-6-алкоксі-С1-6-алкоксигрупу, С1-6-алкілкарбоніл, С1-6-алкоксикарбоніл, С1-6-алкілсульфоніл, ціано-С1-6-алкіл, гідроксі-С1-6-аілкіл, гідроксі-С1-6-алкоксигрупу, гідроксі-С1-6-алкіламіногрупу, аміно-С1-6-алкоксигрупу, ді-(С1-6-алкіл)амінокарбоніл, ди(гідроксі-С1-6-алкіл)аміногрупу, (арил)-(С1-6-алкіл)аміногрупу, ді-(С1-6-алкіл)аміно-С1-6-алкоксигрупу, ді-(С1-6-алкіл)аміно-С1-6-алкіламіногрупу, ді-(С1-6-алкіл)аміно-С1-6-алкіламіно-С1-6-алкіл, арилсульфоніл, арилсульфоніламіногрупу, арилоксигрупу, арилоксі-С1-6-алкіл, арилС2-6-алкендіїл, ді-(С1-6-алкіл)аміногрупу, ді-(С1-6-алкіл)аміно-С1-6-алкіл, ді-(С1-6-алкіл)аміно-(С1-6-алкіл)аміногрупу, ді-(С1-6-алкіл)аміно-(С1-6-алкіл)аміно-С1-6-алкіл, ді-(С1-6-алкіл)аміно-С1-6-алкіл-(С1-6-алкіл)аміногрупу, ді-(С1-6-алкіл)аміно-С1-6-алкіл-(С1-6-алкіл)аміно-С1-6-алкіл, аміносульфоніламіно-(С1-6-алкіл)аміногрупу, аміносульфоніламіно-(С1-6-алкіл)аміно-С1-6-алкіл, ді-(С1-6-алкіл)аміносульфоніламіно-(С1-6-алкіл)аміногрупу, ді-(С1-6-алкіл)аміносульфоніламіно-(С1-6-алкіл)аміно-С1-6-алкіл, ціаногрупу, тіофеніл, тіофеніл, заміщений ді-(С1-6-алкіл)аміно-С1-6-алкіл-(С1-6-алкіл)аміно-С1-6-алкілом, ді-(С1-6-алкіл)аміно-С1-6-алкілом, С1-6-алкілпіперазиніл-С1-6-алкілом, гідроксі-С1-6-алкілпіперазиніл-С1-6-алкілом, гідроксі-С1-6-алкоксі-С1-6-алкілпіперазиніл-С1-6-алкілом, ді-(С1-6-алкіл)аміносульфонілпіперазиніл-С1-6-алкілом, С1-6-алкоксипіперидинілом, С1-6-алкоксипіперидиніл-С1-6-алкілом, морфолініл-С1-6-алкілом, гідроксі-С1-6-алкіл-(С1-6-алкіл)аміно-С1-6-алкілом або ди(гідроксі-С1-6-алкіл)аміно-С1-6-алкілом, фураніл, фураніл, заміщений гідроксі-С1-6-алкілом, бензофураніл, імідазоліл, оксазоліл, оксазоліл, заміщений арилом та С1-6-алкілом, С1-6-алкілтриазоліл, тетразоліл, піролідиніл, піроліл, піперидиніл-С1-6-алкоксигрупу, морфолініл, С1-6-алкілморфолініл, морфолініл-С1-6-алкоксигрупу, морфолініл-С1-6-алкіл, морфолініл-С1-6-алкіламіногрупу, морфолініл-С1-6-алкіламіно-С1-6-алкіл, піперазиніл, С1-6-алкілпіперазиніл, С1-6-алкілпіперазиніл-С1-6-алкоксигрупу, піперазиніл-С1-6-алкіл нафталінілсульфонілпіперазиніл, нафталінілсульфонілпіперидиніл, нафталінілсульфоніл С1-6-алкілпіперазиніл-С1-6-алкіл, С1-6-алкілпіперазиніл-С1-6-алкіламіногрупу, С1-6-алкілпіперазиніл-С1-6-алкіламіно-С1-6-алкіл, С1-6-алкілпіперазинілсульфоніл, аміносульфонілпіперазиніл-С1-6-алкоксигрупу, аміносульфонілпіперазиніл, аміносульфонілпіперазиніл-С1-6-алкіл, ді-(С1-6-алкіл)аміносульфонілпіперазиніл, ді-(С1-6-алкіл)аміносульфонілпіперазиніл-С1-6-алкіл, гідроксі-С1-6-алкілпіперазиніл, гідроксі-С1-6-алкілпіперазиніл-С1-6-алкіл, С1-6-алкоксипіперидиніл, С1-6-алкоксипіперидиніл-С1-6-алкіл, піперидиніламіно-С1-6-алкіламіногрупу, піперидиніламіно-С1-6-алкіламіно-С1-6-алкіл, (С1-6-алкілпіперидиніл)(гідроксі-С1-6-алкіл)аміно-С1-6-алкіламіногрупу, (С1-6-алкілпіперидиніл)(гідроксі-С1-6-алкіл)аміно-С1-6-алкіламіно-С1-6-алкіл, гідроксі-С1-6-алкоксі-С1-6-алкілпіперазиніл, гідроксі-С1-6-алкоксі-С1-6-алкілпіперазиніл-С1-6-алкіл, (гідроксі-С1-6-алкіл)-(С1-6-алкіл)аміногрупу, (гідроксі-С1-6-алкіл)-(С1-6-алкіл)аміно-С1-6-алкіл, гідроксі-С1-6-алкіламіно-С1-6-алкіл, ди(гідроксі-С1-6-алкіл)аміно-С1-6-алкіл, піролідиніл-С1-6-алкіл, піролідиніл-С1-6-алкоксигрупу, піразоліл, тіопіразоліл, піразоліл, заміщений двома замісниками, вибраними з С1-6-алкілу чи тригалоїд-С1-6-алкілу, піридиніл, піридиніл, заміщений С1-6-алкоксигрупою, арилоксигрупою чи арилом, піримідиніл, тетрагідропіримідинілпіперазиніл, тетрагідропіримідинілпіперазиніл-С1-6-алкіл, хінолініл, індол, феніл, феніл, заміщений одним, двома чи трьома замісниками, незалежно вибраними з галоїду, аміногрупи, нітрогрупи, С1-6-алкілу, С1-6-алкоксигрупи, гідроксі-С1-4-алкілу, трифлуорметилу, трифлуорметилоксигрупи, гідроксі-С1-4-алкоксигрупи, С1-4-алкілсульфонілу, С1-4-алкоксі-С1-4-алкоксигрупи, С1-6-алкоксикарбонілу, аміно-С1-4-алкоксигрупи, ді-(С1-4-алкіл)аміно-С1-4-алкоксигрупи, ді-(С1-4-алкіл)аміногрупи, ді-(С1-4-алкіл)амінокарбонілу, ді-(С1-4-алкіл)аміно-С1-4-алкілу, ді-(С1-4-алкіл)аміно-С1-4-алкіламіно-С1-4-алкілу, ді-(С1-4-алкіл)аміно-(С1-4-алкіл)аміногрупи, ді-(С1-4-алкіл)аміно-(С1-4-алкіл)аміно-С1-4-алкілу, ді-(С1-4-алкіл)аміно-С1-4-алкіл-(С1-4-алкіл)аміногрупи, ді-(С1-4-алкіл)аміно-С1-4-алкіл-(С1-4-алкіл)аміно-С1-4-алкілу, аміносульфоніламіно-(С1-4-алкіл)аміногрупи, аміносульфоніламіно-(С1-4-алкіл)аміно-С1-4-алкілу, ді-(С1-4-алкіл)аміносульфоніламіно-(С1-4-алкіл)аміногрупи, ді-(С1-4-алкіл)аміносульфоніламіно-(С1-4-алкіл)аміно-С1-6-алкілу, ціаногрупи, піперидиніл-С1-6-алкоксигрупи, піролідиніл-С1-6-алкоксигрупи, аміносульфонілпіперазинілу, аміносульфонілпіперазиніл-С1-4-алкілу, ді-(С1-4-алкіл)аміносульфонілпіперазинілу, ді-(С1-4-алкіл)аміносульфонілпіперазиніл-С1-4-алкілу, гідроксі-С1-4-алкілпіперазинілу, гідроксі-С1-4-алкілпіперазиніл-С1-4-алкілу, С1-4-алкоксипіперидинілу, С1-4-алкілоксипіперидиніл-С1-4-алкілу, гідроксі-С1-4-алкоксі-С1-4-алкілпіперазинілу, гідроксі-С1-4-алкоксі-С1-4-алкілнілпіперазиніл-С1-4-алкілу, (гідроксі-С1-4-алкіл)-(С1-4-алкіл)аміногрупи, (гідроксі-С1-4-алкіл)-(С1-4-алкіл)аміно-С1-4-алкілу, ди(гідроксі-С1-4-алкіл)аміногрупи, ди(гідроксі-С1-4-алкіл)аміно-С1-4-алкілу, фуранілу, фуранілу, заміщеного -СН=СН-СН=СН-, піролідиніл-С1-4-алкілу, піролідиніл-С1-4-алкоксигрупи, морфолінілу, морфолініл-С1-4-алкоксигрупи, морфолініл-С1-4-алкілу, морфолініл-С1-4-алкіламіногрупи, морфолініл-С1-4-алкіламіно-С1-4-алкілу, піперазинілу, С1-4-алкілпіперазинілу, С1-4-алкілпіперазиніл-С1-4-алкоксигрупи, піперазиніл-С1-4-алкілу, С1-4-алкілпіперазиніл-С1-4-алкілу, С1-4-алкілпіперазиніл-С1-4-алкіламіногрупи, С1-4-алкілпіперазиніл-С1-4-алкіламіно-С1-6-алкілу, тетрагідропіримідинілпіперазинілу, тетрагідропіримідинілпіперазиніл-С1-4-алкілу, піперидиніламіно-С1-4-алкіламіногрупи, піперидиніламіно-С1-4-алкіламіно-С1-4-алкілу, (С1-4-алкілпіперидиніл)(гідроксі-С1-4-алкіл)аміно-С1-4-алкіламіногрупи, (С1-4-алкілпіперидиніл)(гідроксі-С1-4-алкіл)аміно-С1-4-алкіламіно-С1-4-алкілу, піридиніл-С1-4-алкоксигрупи, гідроксі-С1-4-алкіламіногрупи, гідроксі-С1-4-алкіламіно-С1-4-алкілу, ді-(С1-4-алкіл)аміно-С1-4-алкіламіногрупи, амінотіадіазолілу, аміносульфонілпіперазиніл-С1-4-алкоксигрупи чи тіофеніл-С1-4-алкіламіногрупи, кожний з R5 та R6 може бути розміщений на атомі нітрогену замість гідрогену, арил у наведеному вище визначенні означає феніл або феніл, заміщений одним чи кількома замісниками, кожний з яких незалежно вибраний з галоїду, С1-6-алкілу, С1-6-алкоксигрупи, трифлуорметилу, ціаногрупи чи гідроксикарбонілу.
2. Сполука за п. 1, у якій n дорівнює 1 чи 2, t дорівнює 0, 1, 2,чи 4, кожний з Q означає  , R1 означає -C(O)NH(OH), R2 означає гідроген чи нітрогрупу, -І- означає простий зв’язок чи бівалентній радикал, вибраний з С1-6-алкандіїлу, R4 означає гідроген,
, R1 означає -C(O)NH(OH), R2 означає гідроген чи нітрогрупу, -І- означає простий зв’язок чи бівалентній радикал, вибраний з С1-6-алкандіїлу, R4 означає гідроген, ![]() означає радикал, вибраний з (а-1), (а-2), (а-3), (а-5), (а-6), (а-11), (а-18), (а-20), (а-21), (а-32), (а-32), (а-47) чи (а-51), кожний s незалежно дорінює 0, 1, 2 чи 4, кожний з R5 та R6 є незалежно вибраним з гідрогену, галоїду, тригалоїд-С1-6-алкілу, С1-6-алкілу, С1-6-алкілу, заміщеного арилом та С3-10-циклоалкілом, С1-6-алкоксигрупи, С1-6-алкілкарбонілу, бензофуранілу, нафталінілсульфонілу, піридинілу, заміщеного арилоксигрупою, фенілу або фенілу, заміщеного одним замісником, незалежно вибраним з гідроксі-С1-4-алкілу чи морфолініл-С1-4-алкілу.
означає радикал, вибраний з (а-1), (а-2), (а-3), (а-5), (а-6), (а-11), (а-18), (а-20), (а-21), (а-32), (а-32), (а-47) чи (а-51), кожний s незалежно дорінює 0, 1, 2 чи 4, кожний з R5 та R6 є незалежно вибраним з гідрогену, галоїду, тригалоїд-С1-6-алкілу, С1-6-алкілу, С1-6-алкілу, заміщеного арилом та С3-10-циклоалкілом, С1-6-алкоксигрупи, С1-6-алкілкарбонілу, бензофуранілу, нафталінілсульфонілу, піридинілу, заміщеного арилоксигрупою, фенілу або фенілу, заміщеного одним замісником, незалежно вибраним з гідроксі-С1-4-алкілу чи морфолініл-С1-4-алкілу.
3. Сполука за п. 1, у якій t дорівнює 1, 2, 3 чи 4,
R1 означає –C(О)NR7R8, -С(O)-С1-6-алкандіїл-SR9, -NR10C(O)N(OH)R9, -NR10C(O)C1-6-aлкaндiїл-SR9, -NR10С(O)С=N(ОН)R9 чи іншу Zn-хелатуючу групу, де R7 та R8 кожний незалежно вибирають з гідрогену, гідроксильної групи, гідроксі-С1-6-алкілу чи аміно-С1-6-алкілу,
R2 означає гідроген, галоїд, гідроксильну групу, аміногрупу, нітрогрупу, С1-6-алкіл, С1-6-алкоксигрупу, трифлуорметил чи ді-(С1-6-алкіл)аміногрупу,
-L- означає простий зв’язок чи бівалентний радикал, вибраний з С1-6-алкандіїлу, С1-6-алкандіїлоксигрупи, аміногрупи чи карбонілу,
R4 означає гідроген, гідроксильну групу, аміногрупу, гідроксі-С1-6-алкіл, С1-6-алкіл, С1-6-алкоксигрупу, арил-С1-6-алкіл, амінокарбоніл, аміно-С1-6-алкіл, С1-6-алкіламіно-С1-6-алкіл чи ді-(С1-6-алкіл)аміно-С1-6-алкіл,
![]() означає радикал, вибраний з (а-1), (а-3), (а-4), (а-5), (а-6), (а-7), (а-8), (а-9), (а-10), (а-11), (а-12), (а-13), (а-14), (а-15), (а-16), (а-17), (а-18), (а-19), (а-20), (а-21), (а-22), (а-23), (а-24), (а-25), (а-26), (а-28), (а-29), (а-30), (а-31), (а-32), (а-33),-(а-34), (а-35), (а-36), (а-37), (а-38), (а-39), (а-40), (а-41), (а-42), (а-44), (а-45), (а-46), (а-47), (а-48) та (а-51),
означає радикал, вибраний з (а-1), (а-3), (а-4), (а-5), (а-6), (а-7), (а-8), (а-9), (а-10), (а-11), (а-12), (а-13), (а-14), (а-15), (а-16), (а-17), (а-18), (а-19), (а-20), (а-21), (а-22), (а-23), (а-24), (а-25), (а-26), (а-28), (а-29), (а-30), (а-31), (а-32), (а-33),-(а-34), (а-35), (а-36), (а-37), (а-38), (а-39), (а-40), (а-41), (а-42), (а-44), (а-45), (а-46), (а-47), (а-48) та (а-51),
кожний s незалежно дорівнює 0, 1, 2, 3 чи 4,
R5 означає гідроген, галоїд, гідроксильну групу, аміногрупу, нітрогрупу, тригалоїд-С1-6-алкіл, тригалоїд-С1-6-алкоксигрупу, С1-6-алкіл, С1-6-алкоксигрупу, С1-6-алкілкарбоніл, С1-6-алкоксикарбоніл, С1-6-алкілсульфоніл, гідроксі-С1-6-алкіл, арилоксигрупу, ді-(С1-6-алкіл)аміногрупу, ціаногрупу, тіофеніл, фураніл, фураніл, заміщений гідроксі-С1-6-алкілом, бензофураніл, імідазоліл, оксазоліл. оксазоліл, заміщений арилом та С1-6-алкілом, С1-6-алкілтриазоліл, тетразоліл, піролідиніл, піроліл, морфолініл, С1-6-алкілморфолініл, піперазиніл, С1-6-алкілпіперазиніл, гідроксі-С1-6-алкілпіперазиніл, С1-6-алкоксипіперидиніл, піразоліл, піразоліл, заміщений одним чи двома замісниками, вибраними з С1-6-алкілу чи тригалоїд-С1-6-алкілу, піридиніл, піридиніл, заміщений С1-6-алкоксигрупою, арилоксигрупою чи арилом, піримідиніл, хінолініл, індол, феніл або феніл, заміщений одним чи двома замісниками, незалежно вибраними з галоїду, С1-6-алкілу, С1-6-алкоксигрупи чи трифлуорметилу,
R6 означає гідроген, галоїд, гідроксильну групу, аміногрупу, нітрогрупу, тригалоїд-С1-6-алкіл, тригалоїд-С1-6-алкоксигрупу, С1-6-алкіл, С1-6-алкоксигрупу, С1-6-алкілкарбоніл, С1-6-алкоксикарбоніл, С1-6-алкілсульфоніл, гідроксі-С1-6-алкіл, арилоксигрупу, ді-(С1-6-алкіл)аміногрупу, ціаногрупу, піридиніл, феніл або феніл, заміщений одним чи двома замісниками, незалежно вибраними з галоїду, C1-6-алкілу, С1-6-алкоксигрупи чи трифлуорметилу.
4. Сполука за будь-яким з пп. 1 чи 2, у якій n дорівнює 1, t дорівнює 0 чи 1, кожний з Q означає  , кожний з Х означає нітроген, кожний з Y означає нітроген, R1 означає -C(O)NH(OH), R2 означає гідроген, -L- означає простий зв’язок, кожний з R3 незалежно означає атом гідрогену, R4 означає гідроген,
, кожний з Х означає нітроген, кожний з Y означає нітроген, R1 означає -C(O)NH(OH), R2 означає гідроген, -L- означає простий зв’язок, кожний з R3 незалежно означає атом гідрогену, R4 означає гідроген, ![]() означає радикал, вибраний з (а-6), (а-11), (а-20), (а-47) чи (а-51), кожний s незалежно дорівнює 0, 1 чи 4, і кожний з R5 та R6 незалежно вибраний з гідрогену, С1-6-алкілу, С1-6-алкоксигрупи, нафталінілсульфонілу чи фенілу, заміщеного гідроксі-С1-4-алкілом чи морфолініл-С1-4-алкілом.
означає радикал, вибраний з (а-6), (а-11), (а-20), (а-47) чи (а-51), кожний s незалежно дорівнює 0, 1 чи 4, і кожний з R5 та R6 незалежно вибраний з гідрогену, С1-6-алкілу, С1-6-алкоксигрупи, нафталінілсульфонілу чи фенілу, заміщеного гідроксі-С1-4-алкілом чи морфолініл-С1-4-алкілом.
5. Сполука за будь-яким з пп. 1, 2 чи 4, вибрана зі сполук № 3, № 4, № 8, № 5, № 7, № 6 та №9
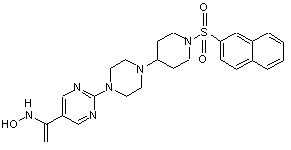 ,
,
0,91 C2HF3O2, Сп. №3
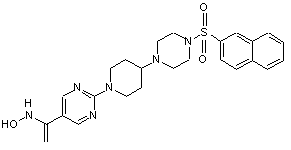 ,
,
0,86 С2HFзО2, Сп. №4
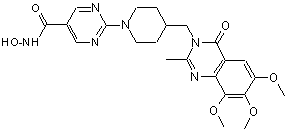 ,
,
С2НF3O2 (1:1), Сп. №8
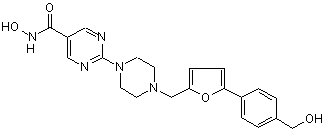 ,
,
0,83 С2НF3O2, Сп. №5
 ,
,
0,79 С2НF3О2, Сп. №7
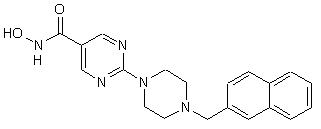 ,
,
0,83 С2НF3О2, Сп. №6
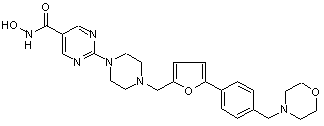 .
.
0,47 H2O 1,99 C2HF3O2, Сп. №9
6. Фармацевтична композиція, яка містить фармацевтично прийнятні носії та як активний інгредієнт терапевтично ефективну кількість сполуки за пп. 1-5.
7. Спосіб приготування фармацевтичної композиції за п. 6, у якому фармацевтично прийнятні носії та сполуку за пп. 1-5 ретельно змішують.
8. Сполука за будь-яким з пп. 1-5, призначена для використання як лікарський засіб.
9. Використання сполуки за будь-яким з пп. 1-5 у виробництві лікарського засобу для лікування проліферативних хвороб.
10. Спосіб одержання сполуки за п. 1, який характеризується проведенням реакції проміжної сполуки формули (ІІ) з відповідною кислотою, такою як, наприклад, трифлуороцтова кислота, з одержанням гідроксамової кислоти формули (1-а), у якій R1 означає -C(О)NН(ОН)
 .
.
11. Спосіб детектування чи ідентифікації HDAC у біологічному зразку, який включає детектування чи вимірювання утворення комплексу між міченою сполукою, визначеною у п. (І), та HDAC.
12. Комбінація протиракових агентів та інгібітора HDAC за будь-яким з пп. 1-5.
Текст
1. Сполука формули (І) 78031 4 aлкaндiїл-SR9, -NR10С(О)С=N(OH)R 9 або іншу Znхелатуючу гр упу, R4 де R7 та R8 кожний незалежно вибирають з гідрогену, гідроксильної групи, С1-6-алкілу, гідроксі-С 1-6R1 алкілу, аміно-С1-6-алкілу чи аміноарилу, R9 неза(CH2 )n Q X лежно вибирають з гідрогену, С1-6-алкілу, С1-6A (CR 3)2)t L N z алкілкарбонілу, арил-С 1-6-алкілу, С1-6Y алкілпіразинілу, піридинону, піролідинону чи метилімідазолілу, R2 ,(I) R10 незалежно вибирають з гідрогену чи С 1-6її N-оксидні форми, фармацевтично прийнятні солі алкілу, приєднання та стереохімічно ізомерні форми, де R2 означає гідроген, галоїд, гідроксильну групу, n дорівнює 0, 1, 2 чи 3, і якщо n дорівнює 0, то аміногрупу, нітрогруп у, С1-6-алкіл, С1-6означає простий зв’язок, алкоксигрупу, трифлуорметил, ді-(С1-6t дорівнює 0, 1, 2, 3 чи 4, і якщо t дорівнює 0, то алкіл)аміногрупу, гідроксіаміногрупу чи нафталініозначає простий зв’язок, лсульфонілпіразиніл, -L- означає простий зв’язок чи бівалентний радикал, вибраний з С 1-6-алкандіїлу, C С1-6-алкандіїлоксигрупи, аміногрупи, карбонілу чи кожний з Q означає нітроген або , амінокарбонілу, кожний з R3 незалежно означає атом гідрогену, C причому один атом гідрогену може бути заміщений кожний з Х означає нітроген або , замісником, вибраним з арилу, R4 означає гідроген, гідроксильну гр упу, аміногрупу, гідроксі-С 1-6-алкіл, С1-6-алкіл, С1-6-алкоксигрупу, C арил-С 1-6-алкіл, амінокарбоніл, гідроксікарбоніл, кожний з Y означає нітроген або , аміно-С1-6-алкіл, амінокарбоніл-С 1-6-алкіл, гідроксикарбоніл-С 1-6-алкіл, гідроксіамінокарбоніл, С1-6CH алкоксикарбоніл, С1-6-алкіламіно-С 1-6-алкіл чи дікожний з Z означає нітроген або , (С1-6-алкіл)аміно-С 1-6-алкіл, 1 7 8 9 R означає -C(O)NR R , -NHC(O)R , -С(O)-С1-6A алкандіїл-SR9, -NR10C(O)N(OH)R9, -NR10C(O)C1-6означає радикал, вибраний з (R5)S (R5)S (R6)S N (a-1) (a-2) (a-3) (R6)S (R6)S (R 6)S N N NII N (a-4) (a-5) (R6)S (a-6) H N N (R6)S (R6)S S O (a-7) (a-8) (a-9) (R6)S (R6)S S (a-10) O (a-11) (R6)S O (a-12) N 5 78031 (R6 )S (R 6)S H N O N 6 (R 6)S N N (a-13) S (a-14) (a-15) (R )S (R 6)S H N (R6)S 6 O CH3 H 3C N S N N N (a-16) NH N (a-17) (a-18) (R5 )S (R5 )S 6 (R )S O N (a-19) (a-20) (a-21) (R 6)S N (R 6)S (R 6)S N N (a-22) (a-23) (a-24) (R 6)S (R 6)S (R 5)S N N O (a-25) N H (a-26) (a-27) (R 6)S 6 (R )S (R6 )S H N N H (a-29) (a-28) O (a-30) (R6 )S (R6 )S S O N (a-31) O N H (a-32) (a-33) (R 6)S O N (a-34) N O (R6)S N (R 6)S N N S (a-35) (R 6)S N N (a-36) 7 78031 8 (R6 )S (R 6)S (R6)S N N N H (a-37) O (a-38) N (a-39) (R6)S (R6)S O (R6)S N N (a-40) (a-41) (a-42) (R5 )S (R 6)S O (R6)S N N NH N N (a-43) (a-44) O (R6 )S S N (a-45) O (R 6)S (R6 )S N N H N N (a-46) (a-47) (a-48) (R6 )S (R6 )S S O (R 6)S N NH , (a-49) (a-40) де кожний s незалежно дорівнює 0, 1, 2, 3, 4 чи 5, кожний з R5 та R6 незалежно являє собою гідроген, галоїд, гідроксильну групу, аміногрупу, нітрогр упу, тригалоїд-С 1-6-алкіл, тригалоїд-С 1-6-алкоксигрупу, С1-6-алкіл, С1-6-алкіл, заміщений арилом та С 3-10циклоалкілом, С1-6-алкоксигрупу, С1-6-алкоксі-С 1-6алкоксигрупу, С1-6-алкілкарбоніл, С1-6алкоксикарбоніл, С1-6-алкілсульфоніл, ціано-С 1-6алкіл, гідроксі-С1-6-аілкіл, гідроксі-С1-6алкоксигрупу, гідроксі-С 1-6-алкіламіногрупу, аміноС1-6-алкоксигрупу, ді-(С1-6-алкіл)амінокарбоніл, ди(гідроксі-С 1-6-алкіл)аміногрупу, (арил)-(С1-6алкіл)аміногрупу, ді-(С1-6-алкіл)аміно-С 1-6алкоксигрупу, ді-(С1-6-алкіл)аміно-С 1-6алкіламіногрупу, ді-(С1-6-алкіл)аміно-С 1-6алкіламіно-С1-6-алкіл, арилсульфоніл, арилсульфоніламіногрупу, арилоксигрупу, арилоксі-С1-6алкіл, арилС2-6-алкендіїл, ді-(С1-6-алкіл)аміногрупу, ді-(С1-6-алкіл)аміно-С 1-6-алкіл, ді-(С1-6-алкіл)аміно(С1-6-алкіл)аміногрупу, ді-(С1-6-алкіл)аміно-(С1-6алкіл)аміно-С1-6-алкіл, ді-(С1-6-алкіл)аміно-С 1-6алкіл-(С1-6-алкіл)аміногрупу, ді-(С1-6-алкіл)аміно-С 16-алкіл-(С 1-6-алкіл)аміно-С 1-6-алкіл, аміносульфоніламіно-(С1-6-алкіл)аміногрупу, аміносульфоніламіно-(С1-6-алкіл)аміно-С 1-6-алкіл, ді-(С1-6 (a-51) алкіл)аміносульфоніламіно-(С1-6-алкіл)аміногрупу, ді-(С1-6-алкіл)аміносульфоніламіно-(С1-6алкіл)аміно-С1-6-алкіл, ціаногрупу, тіо феніл, тіофеніл, заміщений ді-(С1-6-алкіл)аміно-С 1-6-алкіл-(С1-6алкіл)аміно-С1-6-алкілом, ді-(С1-6-алкіл)аміно-С 1-6алкілом, С1-6-алкілпіперазиніл-С 1-6-алкілом, гідроксі-С1-6-алкілпіперазиніл-С 1-6-алкілом, гідроксі-С 1-6алкоксі-С 1-6-алкілпіперазиніл-С 1-6-алкілом, ді-(С1-6алкіл)аміносульфонілпіперазиніл-С 1-6-алкілом, С1С1-6-алкоксипіперидиніл6-алкоксипіперидинілом, С1-6-алкілом, морфолініл-С 1-6-алкілом, гідроксі-С 1-6алкіл-(С1-6-алкіл)аміно-С 1-6-алкілом або ди(гідроксіС1-6-алкіл)аміно-С 1-6-алкілом, фураніл, фураніл, заміщений гідроксі-С 1-6-алкілом, бензофураніл, імідазоліл, оксазоліл, оксазоліл, заміщений арилом та С1-6-алкілом, С1-6-алкілтриазоліл, тетразоліл, піролідиніл, піроліл, піперидиніл-С 1-6алкоксигрупу, морфолініл, С1-6-алкілморфолініл, морфолініл-С 1-6-алкоксигрупу, морфолініл-С 1-6алкіл, морфолініл-С 1-6-алкіламіногрупу, морфолініл-С1-6-алкіламіно-С 1-6-алкіл, піперазиніл, С1-6алкілпіперазиніл, С1-6-алкілпіперазиніл-С 1-6алкоксигрупу, піперазиніл-С1-6-алкіл нафталінілсульфонілпіперазиніл, нафталінілсульфонілпіперидиніл, нафталінілсульфоніл С 1-6-алкілпіперазиніл 9 78031 10 С1-6-алкіл, С1-6-алкілпіперазиніл-С 1-6алкоксигрупи, морфолініл-С 1-4-алкілу, морфолінілалкіламіногрупу, С1-6-алкілпіперазиніл-С 1-6С1-4-алкіламіногрупи, морфолініл-С1-4-алкіламіноалкіламіно-С1-6-алкіл, С1-6С1-4-алкілу, піперазинілу, С1-4-алкілпіперазинілу, алкілпіперазинілсульфоніл, аміносульфонілпіпеС1-4-алкілпіперазиніл-С 1-4-алкоксигрупи, піперазиразиніл-С 1-6-алкоксигрупу, аміносульфонілпіпераніл-С1-4-алкілу, С1-4-алкілпіперазиніл-С 1-4-алкілу, зиніл, аміносульфонілпіперазиніл-С 1-6-алкіл, ді-(С1С1-4-алкілпіперазиніл-С 1-4-алкіламіногрупи, С1-4ді-(С1-6алкілпіперазиніл-С1-4-алкіламіно-С1-6-алкілу, тетра6-алкіл)аміносульфонілпіперазиніл, алкіл)аміносульфонілпіперазиніл-С 1-6-алкіл, гідрогідропіримідинілпіперазинілу, тетрагідропіримідиксі-С1-6-алкілпіперазиніл, гідроксі-С 1-6нілпіперазиніл-С1-4-алкілу, піперидиніламіно-С 1-4алкілпіперазиніл-С1-6-алкіл, С1-6алкіламіногрупи, піперидиніламіно-С1-4-алкіламіноалкоксипіперидиніл, С1-6-алкоксипіперидиніл-С 1-6С1-4-алкілу, (С1-4-алкілпіперидиніл)(гідроксі-С 1-4алкіл, піперидиніламіно-С1-6-алкіламіногрупу, піпеалкіл)аміно-С1-4-алкіламіногрупи, (С1-4ридиніламіно-С 1-6-алкіламіно-С 1-6-алкіл, (С1-6алкілпіперидиніл)(гідроксі-С 1-4-алкіл)аміно-С 1-4алкілпіперидиніл)(гідроксі-С 1-6-алкіл)аміно-С 1-6алкіламіно-С1-4-алкілу, піридиніл-С 1-4-алкоксигрупи, алкіламіногрупу, (С1-6-алкілпіперидиніл)(гідроксігідроксі-С 1-4-алкіламіногрупи, гідроксі-С 1-4С1-6-алкіл)аміно-С 1-6-алкіламіно-С 1-6-алкіл, гідроксіалкіламіно-С1-4-алкілу, ді-(С1-4-алкіл)аміно-С 1-4С1-6-алкоксі-С 1-6-алкілпіперазиніл, гідроксі-С1-6алкіламіногрупи, амінотіадіазолілу, аміносульфоалкоксі-С 1-6-алкілпіперазиніл-С 1-6-алкіл, (гідроксінілпіперазиніл-С1-4-алкоксигрупи чи тіофеніл-С 1-4С1-6-алкіл)-(С1-6-алкіл)аміногрупу, (гідроксі-С 1-6алкіламіногрупи, кожний з R5 та R6 може бути розалкіл)-(С1-6-алкіл)аміно-С 1-6-алкіл, гідроксі-С 1-6міщений на атомі нітрогену замість гідрогену, арил алкіламіно-С1-6-алкіл, ди(гідроксі-С 1-6-алкіл)аміноу наведеному вище визначенні означає феніл або С1-6-алкіл, піролідиніл-С 1-6-алкіл, піролідиніл-С 1-6феніл, заміщений одним чи кількома замісниками, алкоксигрупу, піразоліл, тіопіразоліл, піразоліл, кожний з яких незалежно вибраний з галоїду, С1-6заміщений двома замісниками, вибраними з С 1-6алкілу, С1-6-алкоксигрупи, трифлуорметилу, ціаноалкілу чи тригалоїд-С 1-6-алкілу, піридиніл, піридигрупи чи гідроксикарбонілу. ніл, заміщений С1-6-алкоксигрупою, арилоксигру2. Сполука за п. 1, у якій n дорівнює 1 чи 2, t дорівпою чи арилом, піримідиніл, тетрагідропіримідинілпіперазиніл, тетрагідропіримідинілпіперазиніл-С1C 6-алкіл, хінолініл, індол, феніл, феніл, заміщений нює 0, 1, 2,чи 4, кожний з Q означає , R1 одним, двома чи трьома замісниками, незалежно 2 означає -C(O)NH(OH), R означає гідроген чи нітвибраними з галоїду, аміногрупи, нітрогрупи, С1-6рогрупу, -І- означає простий зв’язок чи бівалентній алкілу, С1-6-алкоксигрупи, гідроксі-С 1-4-алкілу, трирадикал, вибраний з С 1-6-алкандіїлу, R4 означає флуорметилу, трифлуорметилоксигрупи, гідроксіС1-4-алкоксигрупи, С1-4-алкілсульфонілу, С1-4A алкоксі-С 1-4-алкоксигрупи, С1-6-алкоксикарбонілу, гідроген, означає радикал, вибраний з аміно-С1-4-алкоксигрупи, ді-(С1-4-алкіл)аміно-С 1-4(а-1), (а-2), (а-3), (а-5), (а-6), (а-11), (а-18), (а-20), алкоксигрупи, ді-(С1-4-алкіл)аміногрупи, ді-(С1-4(а-21), (а-32), (а-32), (а-47) чи (а-51), кожний s неалкіл)амінокарбонілу, ді-(С1-4-алкіл)аміно-С 1-4залежно дорінює 0, 1, 2 чи 4, кожний з R5 та R6 є алкілу, ді-(С1-4-алкіл)аміно-С 1-4-алкіламіно-С 1-4незалежно вибраним з гідрогену, галоїду, тригалоалкілу, ді-(С1-4-алкіл)аміно-(С1-4-алкіл)аміногрупи, їд-С1-6-алкілу, С1-6-алкілу, С1-6-алкілу, заміщеного ді-(С1-4-алкіл)аміно-(С1-4-алкіл)аміно-С 1-4-алкілу, діарилом та С 3-10-циклоалкілом, С1-6-алкоксигрупи, (С1-4-алкіл)аміно-С 1-4-алкіл-(С1-4-алкіл)аміногрупи, С1-6-алкілкарбонілу, бензофуранілу, нафталінілсуді-(С1-4-алкіл)аміно-С 1-4-алкіл-(С1-4-алкіл)аміно-С 1-4льфонілу, піридинілу, заміщеного арилоксигрупою, алкілу, аміносульфоніламіно-(С1-4фенілу або фенілу, заміщеного одним замісником, алкіл)аміногрупи, аміносульфоніламіно-(С1-4незалежно вибраним з гідроксі-С 1-4-алкілу чи моралкіл)аміно-С1-4-алкілу, ді-(С1-4фолініл-С 1-4-алкілу. алкіл)аміносульфоніламіно-(С1-4-алкіл)аміногрупи, 3. Сполука за п. 1, у якій t дорівнює 1, 2, 3 чи 4, ді-(С1-4-алкіл)аміносульфоніламіно-(С1-4R1 означає –C(О)NR7R8, -С(O)-С1-6-алкандіїл-SR9, алкіл)аміно-С1-6-алкілу, ціаногрупи, піперидиніл-С1NR10C(O)N(OH)R9, -NR10C(O)C1-6-aлкaндiїл-SR9, 6-алкоксигрупи, піролідиніл-С 1-6-алкоксигрупи, аміNR10С(O)С=N(ОН)R9 чи іншу Zn-хелатуючу гр упу, носульфонілпіперазинілу, аміносульфонілпіпераде R7 та R8 кожний незалежно вибирають з гідрозиніл-С 1-4-алкілу, ді-(С1-4гену, гідроксильної групи, гідроксі-С1-6-алкілу чи алкіл)аміносульфонілпіперазинілу, ді-(С1-4аміно-С1-6-алкілу, алкіл)аміносульфонілпіперазиніл-С 1-4-алкілу, гідR2 означає гідроген, галоїд, гідроксильну групу, роксі-С1-4-алкілпіперазинілу, гідроксі-С 1-4аміногрупу, нітрогруп у, С1-6-алкіл, С1-6алкілпіперазиніл-С1-4-алкілу, С1-4алкоксигрупу, трифлуорметил чи ді-(С1-6алкоксипіперидинілу, С1-4-алкілоксипіперидиніл-С 1алкіл)аміногрупу, гідроксі-С 1-4-алкоксі-С1-44-алкілу, -L- означає простий зв’язок чи бівалентний радиалкілпіперазинілу, гідроксі-С1-4-алкоксі-С1-4кал, вибраний з С1-6-алкандіїлу, С1-6алкілнілпіперазиніл-С1-4-алкілу, (гідроксі-С 1-4алкандіїлоксигрупи, аміногрупи чи карбонілу, алкіл)-(С1-4-алкіл)аміногрупи, (гідроксі-С 1-4-алкіл)R4 означає гідроген, гідроксильну гр упу, аміногру(С1-4-алкіл)аміно-С 1-4-алкілу, ди(гідроксі-С 1-4пу, гідроксі-С 1-6-алкіл, С1-6-алкіл, С1-6-алкоксигрупу, алкіл)аміногрупи, ди(гідроксі-С 1-4-алкіл)аміно-С 1-4арил-С 1-6-алкіл, амінокарбоніл, аміно-С 1-6-алкіл, С1алкілу, фуранілу, фуранілу, заміщеного -СН=СН 6-алкіламіно-С 1-6-алкіл чи ді-(С 1-6-алкіл)аміно-С 1-6СН=СН -, піролідиніл-С1-4-алкілу, піролідиніл-С 1-4алкіл, алкоксигрупи, морфолінілу, морфолініл-С1-4 11 78031 12 O A означає радикал, вибраний з (а-1), (а3), (а-4), (а-5), (а-6), (а-7), (а-8), (а-9), (а-10), (а-11), (а-12), (а-13), (а-14), (а-15), (а-16), (а-17), (а-18), (а19), (а-20), (а-21), (а-22), (а-23), (а-24), (а-25), (а26), (а-28), (а-29), (а-30), (а-31), (а-32), (а-33),-(а34), (а-35), (а-36), (а-37), (а-38), (а-39), (а-40), (а41), (а-42), (а-44), (а-45), (а-46), (а-47), (а-48) та (а51), кожний s незалежно дорівнює 0, 1, 2, 3 чи 4, R5 означає гідроген, галоїд, гідроксильну групу, аміногрупу, нітрогрупу, тригалоїд-С1-6-алкіл, тригалоїд-С1-6-алкоксигрупу, С1-6-алкіл, С1-6алкоксигрупу, С1-6-алкілкарбоніл, С1-6алкоксикарбоніл, С1-6-алкілсульфоніл, гідроксі-С 1-6алкіл, арилоксигрупу, ді-(С1-6-алкіл)аміногрупу, ціаногрупу, тіофеніл, фураніл, фураніл, заміщений гідроксі-С 1-6-алкілом, бензофураніл, імідазоліл, оксазоліл. оксазоліл, заміщений арилом та С 1-6алкілом, С1-6-алкілтриазоліл, тетразоліл, піролідиніл, піроліл, морфолініл, С1-6-алкілморфолініл, піперазиніл, С1-6-алкілпіперазиніл, гідроксі-С1-6алкілпіперазиніл, С1-6-алкоксипіперидиніл, піразоліл, піразоліл, заміщений одним чи двома замісниками, вибраними з С1-6-алкілу чи тригалоїд-С 1-6алкілу, піридиніл, піридиніл, заміщений С1-6алкоксигрупою, арилоксигрупою чи арилом, піримідиніл, хінолініл, індол, феніл або феніл, заміщений одним чи двома замісниками, незалежно вибраними з галоїду, С1-6-алкілу, С1-6-алкоксигрупи чи трифлуорметилу, R6 означає гідроген, галоїд, гідроксильну групу, аміногрупу, нітрогрупу, тригалоїд-С1-6-алкіл, тригалоїд-С1-6-алкоксигрупу, С1-6-алкіл, С1-6алкоксигрупу, С1-6-алкілкарбоніл, С1-6алкоксикарбоніл, С1-6-алкілсульфоніл, гідроксі-С 1-6алкіл, арилоксигрупу, ді-(С1-6-алкіл)аміногрупу, ціаногрупу, піридиніл, феніл або феніл, заміщений одним чи двома замісниками, незалежно вибраними з галоїду, C1-6-алкілу, С1-6-алкоксигрупи чи трифлуорметилу. 4. Сполука за будь-яким з пп. 1 чи 2, у якій n дорівнює 1, t дорівнює 0 чи 1, кожний з Q означає C , кожний з Х означає нітроген, кожний з Y означає нітроген, R1 означає -C(O)NH(OH), R2 означає гідроген, -L- означає простий зв’язок, кожний з R3 незалежно означає атом гідрогену, R4 A означає гідроген, означає радикал, вибраний з (а-6), (а-11), (а-20), (а-47) чи (а-51), кожний s незалежно дорівнює 0, 1 чи 4, і кожний з R5 та R6 незалежно вибраний з гідрогену, С1-6алкілу, С1-6-алкоксигрупи, нафталінілсульфонілу чи фенілу, заміщеного гідроксі-С 1-4-алкілом чи морфолініл-С 1-4-алкілом. 5. Сполука за будь-яким з пп. 1, 2 чи 4, вибрана зі сполук № 3, № 4, № 8, № 5, № 7, № 6 та №9 S N O N N HO H N N N , 0,91 C2HF3O2, Сп. №3 O S N O N N HO H N N N , 0,86 С2HFзО2, Сп. №4 O N HO-NH N N O N N O O O , С2НF3O2 (1:1), Сп. №8 O HO N H N N N N O OH , 0,83 С2НF3O2, Сп. №5 O HO N H N N N N , 0,79 С2НF3О2, Сп. №7 O HO N H N N N N , 0,83 С2НF3О2, Сп. №6 O HO N H N N N N O O N . 0,47 H2O 1,99 C 2HF3O 2, Сп. №9 6. Фармацевтична композиція, яка містить фарма 13 78031 14 R O цевтично прийнятні носії та як активний інгредієнт O (CH ) O терапевтично ефективну кількість сполуки за пп. 1CF COOH Q X N H L N A Z (C(R ) ) 5. Y 7. Спосіб приготування фармацевтичної компози(II) R ції за п. 6, у якому фармацевтично прийнятні носії та сполуку за пп. 1-5 ретельно змішують. R 8. Сполука за будь-яким з пп. 1-5, призначена для R (CH ) Q X використання як лікарський засіб. Z (C(R ) ) A L N Y 9. Використання сполуки за будь-яким з пп. 1-5 у ( I-a) R виробництві лікарського засобу для лікування про. ліферативних хвороб. 11. Спосіб детектування чи ідентифікації HDAC у 10. Спосіб одержання сполуки за п. 1, який харакбіологічному зразку, який включає детектування чи теризується проведенням реакції проміжної сполувимірювання утворення комплексу між міченою ки формули (ІІ) з відповідною кислотою, такою як, сполукою, визначеною у п. (І), та HD AC. наприклад, трифлуороцтова кислота, з одержан12. Комбінація протиракових агентів та інгібітора ням гідроксамової кислоти формули (1-а), у якій R1 HDAC за будь-яким з пп. 1-5. означає -C(О)NН(ОН) 4 2 n 3 3 2t 2 4 1 2 n 3 2t 2 Даний винахід стосується сполук, які виявляють здатність інгібувати ферментативну активність гістондезацетилази (НDAС). Він далі стосується способів їхньою одержання, композицій, що їх містять, а також їхнього використання, як in vitro, так і in vivo, для інгібування HDAC та як лікарських засобів, наприклад, як лікарських засобів для інгібування проліферативних станів, таких як рак та псоріаз. В усі х е укаріотичних клітинах, геномна ДНК у хроматині асоціює з гістонами з утворенням нуклеосом. Кожна нуклеосома складається з протеїновою октамера, який містить по дві копії кожного з гістонів Н2А. Н2В, Н3 та Н4. ДНК закручується навколо цієї протеїнової серцевини, причому основні амінокислоти гістонів взаємодіють з негативно зарядженими фосфатними групами ДНК. Найбільш звичайною посттрансляційною модифікацією цих серцевинних гістонів є зворотне ацетилювання e-аміногруп консервативних, сильно основних N-термінальних лізинових залишків. Стійкий стан ацетилювання гістону встановлюється шляхом досягнення динамічної рівноваги між конкуруючими гістон-ацетилтрансферазою (гістонацетилтрансферазами) та гістондезацетилазою (гістондезацетилазами), яка далі позначається "HDAC". Ацетилювання тa дезацетилювання гістону вже давно пов'язують з транскрипційним контролем. Недавнє клонування генів, що кодують різні гістон-ацетилтрансферази та гістондезацетилази, дало можливе пояснення співвідношення між ацетилюванням гістону та транскрипційним контролем. Зворотне ацетилювання гістонів може приводити до ремоделювання хроматину і бути, як таке, контрольним механізмом генної транскрипції. Загалом, гіперацетилювання гістонів сприяє експресії геній, у той час як гістондезацетилювання корелює з пригніченням транскрипції. Було показано, що гістон-ацетилтрансферази діють як коактиватори транскрипції, Тоді як гістондезацетилази належать до шляхів пригнічення транскрипції. Динамічна рівновага між ацетилюванням та дезацетилюванням гістону є суттєвою для нормальною росту клітин. Інгібування гістондезацетила зи приводить до зупинки клітинного циклу, клітинної диференціації, апоптозу та обернення трансформованого фенотипу. Тому інгібітори НDAC можуть мати великий терапевтичний потенціал для лікування проліферативних хвороб чи станів клітин [Marks et al., Nature Reviews: Cancer 1:194-202. 2001]. Дослідження інгібітори гістондезацетилази (HDАС) свідчать, що ці ферменти справді відіграють важливу роль у проліферації та диференціації клітин. Інгібітор трихостатин А (ТSA) спричинює зупинку клітинного циклу па фазах G1 та G2, обертає трансформований фенотип різних клітинних ліній та індукує диференціацію клітин лейкозу Фрейнда та інших. Повідомлялося, що ISA (та субероїланілідгідроксамова кислота, SAНA) інгібують клітинний ріст, індукують термінальну диференціацію та запобігають утворенню пухлин у мишей [Finnin et al., Nature, 401: 188-193, 1999]. Повідомлялося також, що трихостатин А є корисним для лікування фіброзу, наприклад, фіброзу печінки та цирозу печінки [Geerts et al., Європейська патентна заявка ЕР 0827742, опублікована 11 березня 1998p.]. [Патентна заявка WO 01/38322, опублікована 31 травня 2001p.], розкриває, поміж інших, інгібітори гістондезацетилази загальної формули Cy-L1Ar-Y1-C(O)-NH-Z і пропонує композиції та способи лікування проліферативних хвороб та станів клітин. [Патентна заявка WO 01/70675, опублікована 27 вересня 2001р.], розкриває інгібітори гістондезацетилази формули Cy2-C y1-X-Y1-W, а також пропонує композиції та способи лікування проліферативних хвороб та станів клітин. Проблема, що потребує вирішення, полягає у створенні інгібіторів гістондезацетилази із високою ферментативною активністю, які також виявляють корисні властивості, такі як клітинна активність та підвищена біодоступність, краще, біодоступність при оральному введенні, і не мають чи мають незначні побічні ефекти. Нові сполуки за даним винаходом вирішують вказану вище проблему. Сполуки відрізняються 15 78031 16 від відомого рівня техніки структурою. алкіл чи ді-(С1-6-алкіл)аміно-С 1-6-алкіл; Сполуки за даним винаходом виявляють чудопозначає радикал, вибраний з ву здатність інгібувати in vitro ферментативну активність гістондезацетилази. Ці сполуки мають корисні .властивості, що стосуються клітинної активності, та специфічні властивості з інгібування розвитку клітинного циклу в обох контрольних точках G1 та G2 (здатність до індукування р21). Сполуки за даним винаходом мають добру метаболічну стабільність та високу біодоступність, конкретніше, вони виявляють біодоступність при оральному введенні. Даний винахід стосується сполуки формули (І) її N-оксидних форм, фармацевтично прийнятних солей приєднання та стереохімічно ізомерних форм, де n дорівнює 0, 1, 2 чи 3, і якщо n дорівнює 0, позначає простий зв'язок; t дорівнює 0, 1, 2, 3 чи 4, і якщо t дорівнює 0, позначає простий зв'язок; кожний з Q позначає нітроген або ; кожний з X позначає нітроген або ; кожний з Υ позначає нітроген або ; кожний з Ζ позначає нітроген або ; R1 позначає -C(O)NR7R8, -NHC(O)R9, -С(О)-С19 10 10 6-алкандіїл-SR , -NR C(O)N(OH)R , -NR C(O)С 1-69 10 9 алкандіїл-SR , -NR C(O)C=N(OH)R або іншу Znхeлатуючу гр упу. де R7 та R8 кожний незалежно вибирають з гідрогену, гідроксильної групи. С1-6-алкілу, гідроксі-С 1-6-алкілу, аміно-С 1-6алкілу чи аміноарилу; R9 незалежно вибирають з гідрогену, С1-6алкілу, С1-6-алкілкарбонілу, арил-С 1-6-алкілу, С1-6алкілпіразинілу, піридииону, піролідинону чи метилімідазолілу; R10 незалежно вибирають з гідрогену чи С 1-6алкілу; R2 позначає гідроген, галоїд, гідроксильну гр упу, аміногрупу, нітрогрупу, С1-6-алкіл, С1-6алкоксигрупу, трифлюорметил, ді-(С1-6алкіл)аміногрупу, гідроксіаміногрупу чи нафталінілсульфонілпіразиніл; -L- позначає простий зв’язок чи бівалентний радикал, вибраний з С 1-6-алкандіїлу С 1-6алкоксигрупи, аміногрупи, карбонілу чи амінокарбонілу; кожний з R3 незалежно позпачає атом гідрогену, причому один атом гідрогену може бути заміщений замісником, вибраним і арилу; R4 позначає гідроген, гідроксильну групу, аміногрупу, гідроксі-С1-6-алкіл, С1-6-алкіл, С1-6алкоксигрупу, арил-С 1-6-алкіл, амінокарбоніл, гідроксікарбоніл, аміно-С1-6-алкіл, амінокарбоніл-С 1-6алкіл, гідроксікарбоніл-С 1-6-алкіл, гідроксіамінокарбоніл, С1-6-алкоксикарбоніл, С1-6-алкіламіно- С1-6 17 78031 18 алкілпіперазинілсульфонілу; аміносульфонілиінеразиніл-С 1-6-алкоксигрупи; аміносульфонілпіперазинілу; аміносульфонілпіперазиніл-С 1-6-алкілу; ді(С1-6-алкіл)аміносульфонілпіперазинілу; ді-(С1-6алкіл)аміносульфонілпіперазиніл-С 1-6-алкілу; гідроксі-С1-6-алкілпіперазинілу; гідроксі-С 1-6алкілпіперазиніл-С1-6-алкілу; С1-6алкоксипіперидинілу; С1-6-алкоксипіперидипіл-С 1-6алкілу; піперидиніламіно-С1-6-алкіламіногрупи; піперидиніламіно-С1-6-алкіламіно-С 1-6-алкілу; (С1-6алкілпіперидиніл)(гідроксі-С 1-6-алкіл)аміно-С 1-6алкіламіногрупи; (С1-6-алкілпіперидиніл)(гідроксіде кожний s незалежно дорівнює 0, 1, 2, 3, 4 чи С1-6-алкіл)аміно-С 1-6-алкіламіно-С 1-6-алкілу; гідро5; 5 6 ксі-С1-6-алкоксі-С 1-6-алкілпіперазинілу; гідроксі-С 1-6кожний з R та R незалежно вибраний з гідроалкоксі-С 1-6-алкілпіперазиніл-С 1-6-алкілу; (гідроксігену; галоїду; і гідроксильної групи; аміногрупи; С1-6-алкіл)-(С1-6-алкіл)аміногрупи; (гідроксі-С 1-6нітрогрупи; тригалоїд-С1-6-алкілу; григалоїд-С 1-6алкіл)-(С1-6-алкіл)аміно-С 1-6-алкілу; гідроксі-С 1-6алкоксигруни; С1-6-алкілу; С1-6-алкілу, заміщеного алкіламіно-С1-6-алкілу; ди(гідроксі-С 1-6-алкіл)аміноарилом та C3-10-циклоалкілом; С1-6-алкоксигрупи; С1-6-алкілу; піролідиніл-С 1-6-алкілу; піролідиніл-С 1С1-6-алкоксі-С 1-6-алкоксигрупи; С1-6-алкілкарбонілу; 6-алкоксигрупи; піразолілу; тіопіразолілу; піразоліС1-6-алкоксикарбонілу; С1-6-алкілсульфонілу; ціанолу, заміщеного двома замісниками, вибраними і С1-6-алкілу; гідроксі-С 1-6-алкілу; гідроксі-С 1-6С1-6-алкілу чи тригалоїд-С 1-6-алкілу; піридинілу; алкоксигрупи; гідроксі-С 1-6-алкіламіногрупи; амінопіридинілу, заміщеного С1-6-алкоксигрупою, арилоС1-6-алкоксигрупи; ді-(С1-6-алкіл)-амінокарбонілу; ксигрупою чи арилом; піримідинілу; тетрагідропіди(гідроксі-С 1-6-алкіл)аміногрупи; (арил)-(С1-6римідинілпіперазинілу; тетрагідропіримідинілпіпеалкіл)аміногрупи; ді-(С1-6-алкіл)аміно-С 1-6разиніл-С 1-6-алкілу; хінолінілу; індолу; фенілу; алкоксигрупи; ді-(С1-6-алкіл)аміно-С 1-6фенілу, заміщеного одним, двома чи трьома заміалкіламіногрупи; ді-(С1-6-алкіл)аміно-С 1-6сниками, незалежно вибраними з галоїду, аміноалкіламіно-С1-6-алкілу; арилсульфонілу; арилсугрупи, нітрогрупи, С1- 6-алкілу, С1-6-алкоксигрупи, льфоніламіногрупи; арилоксигрупи; арилоксі-С1-6гідроксі-С 1-4-алкілу, трифлюорметилу, трифлюоралкілу; арил-С 2-6-алкендіїлу; ді-(С1-6метилоксигрупи, гідроксі-С 1-4-алкоксигрупи, С1-4алкіл)аміногрупи; ді-(С1-6-алкіл)аміно-С 1-6-алкілу; алкілсульфоніл-С 1-4-алкоксі-С 1-4-алкоксигрупи. С1ді-(С1-6-алкіл)аміно-(С1-6-алкіл)аміноірупи; ді-(С1-64-алкоксикарбонілу, аміно-С 1-4-алкоксигрупи, ді-(С 1алкіл)аміно-(С1-6-алкіл)аміно-С 1-6-алкілу; ді-(С1-6ді-(С1-44-алкіл)аміно-С 1-4-алкоксигрупи, алкіл)аміно-С1-6-алкіл-(С1-6-алкіл)аміногрупи; ді-(С1алкіл)аміногрупи, ді-(С1-4-алкіл)амінокарбонілу, ді6-алкіл)аміно-С 1-6-алкіл-(С 1-6-алкіл)аміно-С 1-6(С1-4-алкіл)аміно-С 1-4-алкілу. ді-(С1-4-алкіл)аміно-С1алкілу; аміносульфоніламіно-(С1-6ді-(С1-4-алкіл)аміно-(С1-44-алкіламіно-С 1-4-алкілу, алкіл)аміногрупи; аміносульфоніламіно-(С1-6алкіл)амімогрупи, ді-(С1-4-алкіл)аміно-(С1-4алкіл)аміно-С1-6-алкілу; ді-(С1-6алкіл)аміно-С1-4-алкілу, ді-(С1-4-алкіл)аміно-С 1-4алкіл)аміносульфоніл-аміно-(С1-6-алкіл)аміногрупи; алкіл-(С1-4-алкіл)аміногрупи, ді-(С1-4-алкіл)аміно-С1ді-(С1-6-алкіл)аміносульфоніламіно-(С1-64-алкіл-(С 1-4-алкіл)аміно-С 1-4-алкілу, аміносульфоалкіл)аміно-С1-6-алкілу; ціаногрупи; тіофенілу; тіоніламіно-(С1-4алкіл)аміногрупи, аміносульфонілафенілу, заміщеного ді-(С1-6-алкіл)аміно-С 1-6-алкілміно-(С1-4-алікіл)аміно-С1-4-алкілу, ді-(С1-4(С1-6-алкіл)аміно-С 1-6-алкілом, ді-(С1-6-алкіл)аміноалікіл)аміносульфоніламіно-(С1-4алкіл)аміногрупи, С1-6-алкілом, С1-6-алкілпіперазиніл-С 1-6-алкілом, ді-(С1-4-алкіл)аміносульфоніламіно-(С1-4гідроксі-С 1-6-алкілпіперазиніл-С 1-6-алкілом. гідроксіалікіл)аміно-С 1-6-алкілу, ціаногрупи, піперидинілС1-6-алкоксі-С 1-6-алкілпіперазиніл-С 1-6-алкілом, діС1-4-алкоксигрупи, піролідиніл-С 1-4-алкоксигрупи, (С1-6-алкіл)аміносульфоніл-піперазиніл-С 1-6аміносульфонілпіперазинілу, аміносульфонілпіпеалкілом, С1-6-алікоксипіперидинілом, С1-6разинілу-С 1-4-алкілу, ді-(С1-4алікоксипіперидиніл-С 1-6-алкілом, морфолініл-С 1-6алкіл)аміносульфонілпіперазинілу, ді-(С1-4алкілом, гідроксі-С 1-6-алкіл-(С1-6-алкіл)аміно-С 1-6алкіл)аміиосульфонілпіперазиніл-С 1-4-алкілу, гідалкілом чи ди(гідроксі-С 1-6-алкіл)аміно-С 1-6роксі-С1-4-алкілпіперазинілу, гідроксі-С 1-4алкілом; фуранілу; фуранілу, заміщеного гідроксіалкілпіперазиніл-С1-4-алкілу, С1-4С1-6-алкілом; бензофуранілу; імідазолілу; оксазоліалкоксипіперидинілу, С1-4-алкоксипіперидиніл-С 1-4лу; оксазолілу, заміщеного арилом та С 1-6-алкілом; алкілу. гідроксі-С 1-4-алкоксі-С 1-4-алкілпіперазинілу. С1-6-алкілтриазолілу; тетразолілу; піролідинілу; гідроксі-С 1-4-алкоксі-С 1-4-алкілпіперазиніл-С 1-4піролілу; перидиніл-С 1-6-алкоксигрупи; морфолініалкілу, (гідроксі-С 1-4-алкіл)-(С1-4-алкіл)аміногрупи, лу; С 1-6-алкілморфолінілу; морфолініл-С 1-6(гідроксі-С 1-4-алкіл)-(С1-4-алкіл)аміно-С 1-4-алкілу, діалкоксигрупи; морфолініл-С 1-6-алкілу; морфолініл(гідроксі-С 1-4-алкіл)аміногрупи, ди(гідроксі-С 1-4С1-6-алкіламіногрупи; морфолініл-С1-6-алкіламіноалкіл)аміно-С1-4-алкілу, фуранілу, уранілу, заміщеС1-6-алкілу; піперазинілу; С1-6-алкілпіперазинілу; ного -СН=СН-СН=СН -, піролідиніл-С1-4-алкілу, піС1-6-алкілпіперазиніл-С 1-6-алкоксигрупи; піперазиролідиніл-С 1-4-алкоксигрупи, морфолінілу, морфоніл-С1-6-алкілу; нафталінілсульфоніліперазинілу; лініл-С 1-4-алкоксигрупи, морфолініл-С 1-4-алкілу, нафталінілсульфонілпіперидинілу; нафталінілсуморфолініл-С 1-4-алкіламіногрупи, морфолініл-С1-4льфонілу; С1-6-алкілпіперазиніл-С 1-6-алкілу; С1-6алкіламіно-С1-4-алкілу, піперазинілу. С1-4алкілпіперазиніл-С1-6-алкіламіногрупи; С1-6алкілпіперазинілу, С1-4-алкілпіперазиніл-С 1-4алкілпіперазиніл-С1-6-алкіламіно-С1-6-алкілу; С1-6 19 78031 20 алкоксигрупи, піперазиніл-С 1-4-алкілу, С1-4ксил, циклогексеніл, циклогептил, циклооктил і т.п. алкілпіперазиніл-С1-4-алкілу, С1-4-алкілпіперазинілТермін "інша Zn-хелатуюча гр упа" стосується С1-4-алкіламіногрупою, С1-4-алкілпіперазиніл-С 1-4групи, здатної взаємодіяти з іоном Zn, яка може алкіламіно-С1-6-алкілу, тетрагідропіримідинілпіпезнаходитися на ділянці зв’язування ферменту. разинілу, тетрагідропіримідинілпіперазиніл-С 1-4Фармацевтично прийнятні солі приєднання алкілу, піперидиніламіно-С1-4-алкіламіногрупи, піохоплюють фармацевтично прийняті солі приєдперидиніламіно-С1-4-алкіламіно-С 1-4-алкілу, (С1-4нання кислоти та фармацевтично прийняті солі алкілпіперидиніл)(гідроксі-С 1-4-алкіл)аміно-С 1-4приєднання основи. Фармацевтично прийнятні алкіламіногрупи, (С1-4-алкілпіперидиніл)(гідроксісолі приєднання кислоти, що згадувалися вище, С1-4-алкіл)аміно-С 1-4-алкіламіно-С 1-4-алкілу, піримають включати терапевтично активні нетоксичні диніл-С 1-4-алкоксигрупи, гідроксі-С 1-4сольові форми приєднання кислоти, що можуть алкіламіногрупи, гідроксі-С1-4-алкіламіно-С 1-4бути утворені сполуками формули (І). Сполуки алкілу, ді-(С1-4-алкіл)аміно-С1-4-алкіламіногрупи,. формули (І), які мають основні властивості, можуть амінотіадіазолілу, аміносульфонілпіперазиніл-С1-4бути перетворені на їхні фармацевтично прийняті алкоксигрупи чи тіофеніл-С 1-4-алкіламіногрупи; солі приєднання кислоти шляхом обробки зазнакожний з R5 та R6 може бути розміщений па нітроченої основної форми відповідною кислотою. Відгені замість гідрогену; арил у наведеному виїде повідні кислоти включають, наприклад, неорганічні визначенні позначає феніл або феніл, заміщений кислоти, такі як галоїдводневі кислоти, наприклад, одним чи кількома замісниками, кожний з яких нехлористоводнева чи бромистоводнева кислота; залежно вибраний з галоїду, С1-6-алкілу. С1-6сірчану: азотну; фосфорну і т.п. кислоти; або оргаалкоксиіруни, трифлюорметилу, ціаногрупи чи гіднічні кислоти, такі як, наприклад, оцтову, трифлюроксікарбонілу. ороцтову, пропіонову, оксіоцтову, молочну. піроТермін "інгібітор гістондезацетилази" викорисвиноградну. щавлеву, малонову, бурштинову товується для позначення сполуки, здатної взає(тобто, бутандикислоту), малеїнову, фумарову. модіяти з гістондезацетилазою та інгібувати її акяблучну, винну, лимонну, метансульфонову, етантивність, конкретніше, її ферментативну сульфонову. бензолсульфонову, пактивність. Інгібування ферментативної активності толуолсульфонову, цикламову, саліцилову, пгістондезацетилази означає зниження здатності аміносаліцилову, памоєву і т.п. кислоти. гістондезацетилази видаляти ацетильну груп у з Сполуки формули (І), що мають кислотні власгістону. Краще, таке інгібування є специфічним, тивості, можуть бути перетворені на їхні фармацетобто, інгібітор гістондезацетилази знижує здатвтично прийнятні солі приєднання основи шляхом ність гістондезацетилази видаляти ацетильну груобробки зазначеної кислотної форми придатною пу з гістону при концентрації, нижчій за концентраорганічною чи неорганічною основою. Придатні цію інгібітора, потрібну для створення будь-якого основні сольові форми включають, наприклад, іншого неспорідненого біологічного ефекту. амонієві солі, солі лужних та лужноземельних меВ тому значенні, що використовується у наветалів, наприклад, солі літію, натрію, калію, магнію, дених вище визначеннях та далі, галоїд є родовою кальцію і т.п., солі з органічними основами, наприназвою флюору, хлор у, брому та йоду; С 1-4-алкіл клад, бензатином, N-метил-D-глюкаміном, солі позначає насичені вуглеводневі радикали з лінійгідрабаміну та солі з амінокислотами, такими як, ним та розгалуженим ланцюгом, які містять від 1 наприклад, аргінін, лізин і т.п. до 4 атомів карбону, такі як, наприклад, метил, Термін "солі приєднання кислоти чи основи" етил, пропіл, бутил, 1-метилетил, 2-метилпропіл і також включає гідрати та форми приєднання розт.п.; С1-6-алкіл включає С 1-4-алкіл та його вищі гочинника, що можуть бути утворені сполуками фомологи, які містять 5-6 атомів карбону, такі як, нармули (І). Прикладами таких форм є. наприклад, приклад, пентил, 2-метилбутил, гексил, 2гідрати, алкоголяти і т.п. метилпентил і т.п.; С1-6-алкандіїл позначає бівалеТермін "стереохімічно ізомерні форми сполуки нтні насичені вуглеводневі радикали з лінійним та формули (І)", в тому значенні, що використовуєтьрозгалуженим ланцюгом, які містять від 1 до 6 ся тут, позначає всі можливі сполуки, які складаатомів карбону, такі як. наприклад, метилен, 1,2ються з тих самих атомів, зв'язаних такою саме етандіїл, 1,3-пропандіїл, 1,4-бутандіїл, 1,5послідовністю зв'язків, але мають різні тривимірні пентандіїл, 1,6-гександіїл та їхні розгалужені ізоструктури, що не є взаємозамінними, які можуть мери, такі як 2-метилпентандіїл, 3мати сполуки формули (І). Якщо не зазначено чи метилпептандіїл, 2,2-диметилбутандіїл, 2,3вказано інше, хімічна назва сполуки охоплює судиметилбутандіїл і т.п.; тригалоїд-С 1-6-алкіл познаміш всіх можливих стереохімічно ізомерних форм, чає С1-6-алкіл, який містить три однакові чи різні які може мати зазначена сполука. Зазначена сугалоїдні замісники, наприклад, трифлюорметил; міш може містити всі діастереомери та/або епантіС1-6-алкендіїл позначає бівалентні вуглеводневі омери основної молекулярної структури зазначерадикали з лінійним та розгалуженим ланцюгом, ної сполуки. Передбачаться, що всі стереохімічно які мають один подвійний зв'язок та від 2 до 6 атоізомерні форми сполук формули (І), як у чистій мів карбону, такі як, наприклад, етендіїл, 2формі, так і у суміші одна з одною, входять до обпропендіїл, 3-бутендіїл, 2-пентендіїл, 3-пентендіїл, сягу даного винаходу. 3-метил-2-бутендіїл і т.п.; аміноарил позначає N-оксидні форми сполук формули (І) мають арил, заміщений аміногрупою; C3-10-циклоалкіл включати такі сполуки формули (І), у яких один чи включає циклічні вуглеводневі групи, які містять кілька атомів нігрогену окислені до так званого Nвід 3 до 10 атомів карбону, такі як циклопропіл, оксиду. зокрема, такі N-оксиди, у яких один чи кіциклобутил, циклопентил, циклопентеніл, циклогелька атомів нітрогену піперидину, піперазину чи 21 78031 22 піридазинілу с N-окисленими. (а-11), (а-20), (а-47) чи (а-51); Деякі сполуки формули (І) можуть також існуl) кожний s незалежно дорівнює 0, 1 чи 4; ватиу таутомерних формах. Хоч такі форми не m) кожний з R5 та R6 незалежно вибраний з гівказані явно у наведеній вище формулі, вони ввадрогену; С1-6-алкілу; С 1-6-аггкоксигрупи; нафталініжаються такими, що входять до обсягу даного вилсульфонілу; або фенілу, заміщеного гідроксі-С 1-4находу. алкілом чи морфолініл-С1-4-алкілом. Термін "сполуки формули (І)", що використоТретя група цікавих сполук складається зі сповується надалі, має включати також всі фармацелук формули (І), до яких є застосовними одне чи втично прийнятні солі приєднання та всі стереокілька з таких обмежень: ізомерні форми. a) R 1 позначає -C(O)NH(OI I); В тому значенні, що використовується тут, теb) -L- позначає простий зв'язок. рміни "гістондезацетилаза" та "HDAC" мають стоЧетверга група цікавих сполук складається зі сува тися будь-якого з сімейства ферментів, які сполук формули (І) до яких є застосовними одне чи кілька з таких обмежень: видаляють ацетильні групи з e-аміногруп лізинових a) 1 дорівнює 1, 2, 3 чи 4; залишків на N-термінальному кінці гістону. Якщо b) R1 позначає -C(О)NR7R8, -С(О)-С1-6інше не випливає з контексту, термін "гістон" має алкандіїл-SR9, -NR10C(O)N(OH)R9, -NR10C(O)-С1-6стосуватися будь-якого гістонового протеїну, включаючи Н1, Η2А Н2В, Н3, Н4 та Н5, що мають алкандіїл-SR9, -NR10C(O)C=N(ОН)R9 чи іншу Znхелатуючу груп у, де R7 та R8 кожний незалежно будь-яке походження. Протеїни чи генні продукти вибирають з гідрогену, гідроксильної групи, гідроHDAC людини включають, без обмеження. HDACксі-С1-6-алкілу чи аміно-С 1-6-алкілу; 1, HDAC-2, НDAC-3, HD AC-4, HDAC-5, HD AC-6, c) R2 позначає гідроген, галоїд, гідроксильну HDAC-7, HDAC-8, HDAC-9 та HDAC-10. Гістондезацетилаза може бути також одержана з протогруп у, аміногрупу, нітрогруп у, С1-6-алкіл, С1-6алкоксигрупу, трифлюорметил чи ді-(С1-6зойного чи грибкового джерела. алкіл)аміногрупу; Перша група цікавих сполук складається зі d) -L- позначає простий зв'язок чи бівалентний сполук формули (І), до яких є застосовними одне радикал, вибраний з С1-6-алкандіїлу, С1-6чи кілька з таких обмежень: а) n дорівнює 1 чи 2; алкандіїлоксигрупи, аміногрупи чи карбонілу; e) R4 позначає гідроген, гідроксильну гр упу, b) t дорівнює 0, 1, 2 чи 4; аміногрупу, гідроксі-С1-6-алкіл, С1-6-алкіл, С1-6c) кожний з Q позначає ; алкоксигрупу, арил-С 1-6-алкіл, амінокарбоніл, амі1 d) R позначає-C(O)NH(OH); но-С 1-6-алкіл, С1-6-алкіламіно-С 1-6-алкіл чи ді-(С1-62 e) R позначає гідроген чи нітрогрупу; алкіл)аміно-С1-6-алкіл; і) -L- позначає простий зв'язок чи бівалентний радикал, вибраний з С1-6-алкандіїлу; f) позначає радикал, вибраний з (а-1), g) R 4 позначає гідроген; (а-3), (а-4), (а-5), (а-6), (а-7), (а-8), (а-9), (а-10), (аh) позначає радикал, вибраний з (а-1), (а-2), (а-3), (а-5), (а-6), (а-11), (а-18), (а-20), (а-21), (а-32), (а-33), (а-47) чи (а-51); і) кожний s незалежно дорівнює 0, 1, 2, чи 4; j) кожний з R5 та R6 незалежно вибраний з гідрогену; галоїду; тригалоїд-С1-6-алкілу; С1-6-алкілу; С1-6-алкілу, заміщеного арилом та C3-10циклоалкілом; С1-6-алкоксигрупи; С1-6алкілкарбонілу; бензофуранілу; нафталінілсульфонілу; піридинілу, заміщеного арилоксигрупою; фенілу; або фенілу, заміщеного одним замісником, незалежно вибраним з гідроксі-С 1-4-алкілу чи морфолініл-С 1-6-алкілу. Друга гр упа цікавих сполук складається зі сполук формули (І), до яких є застосовними одне чи кілька з таких обмежень: a) n дорівнює 1; b) t дорівнює 0, 1 чи 2; c) кожний з Q позначає ; d) кожний з X позначає нітроген; e) кожний з Υ позначає нітроген; f) R1 позначає -C(O)NH(OH); g) R позначає гідроген; h) -L- позначає простий зв'язок; і) кожний з R3 незалежно позначає атом гідрогену; j) R 4 позначає гідроген; k) позначає радикал, вибраний з (а-6), 11), (а-12), (а-13), (а-14), (а-15), (а-16), (а-17), (а18), (а-19), (а-20), (а-21), (а-22), (а-23), (а-24), (а25), (а-26), (а-28), (а-29), (а-30), (а-31), (а-32), (а33), (а-34), (а-35), (а-36), (а-37), (а-38), (а-39), (а40), (а-41), (а-42), (а-44), (а-45), (а-46), (а-47), (а48) та (а-51); g) кожний s незалежно дорівнює 0, 1, 2, 3 чи 4; h) R5 позначає гідроген; галоїд; гідроксильну груп у; аміногрупу; нітрогруп у; тригалоїд-С1-6-алкіл; тригалоїд-С 1-6-алкоксигрупу; С1-6-алкіл; С1-6алкоксигрупу; С1-6-алкілкарбоніл; С1-6алкоксикарбоніл; С1-6-алкілсульфоніл; гідроксі-С 1-6алкіл; арилоксигрупу; ді-(С1-6-алкіл)аміногрупу; ціаногрупу; тіофеніл; фураніл; фураніл, заміщений гідроксі-С 1-6-алкілом; бензофураніл; імідазоліл; оксазоліл; оксазоліл, заміщений арилом та С 1-6алкілом; С1-6-алкілтриазоліл; тетразоліл; піролідиніл; піроліл; морфолініл; С1-6-алкілморфолініл; піперазиніл; С1-6-алкілпіперазиніл; гідроксі-С 1-6алкілпіперазиніл; С1-6-алкоксипіперидиніл; піразоліл; піразоліл, заміщений одним чи двома замісниками, вибраними з С1-6-алкілу чи тригалоїд-С 1-6алкілу; піридиніл; піридиніл, заміщений С1-6алкоксигрупою, арилоксигрупою чи арилом; піримідиніл; хінолініл; індол; феніл; або феніл, заміщений одним чи двома замісниками, незалежно вибраними з галоїду, С1-6-алкілу, С1-6-алкоксігрупи чи трифлюорметилу; і) R6 позначає гідроген; галоїд; гідроксильну груп у; аміногрупу; нітрогруп у; тригалоїд-С1-6-алкіл; 23 78031 24 тригалоїд-С 1-6-алкоксигрупу; С1-6-алкіл; С1-6ціаногрупу; піридиніл; феніл; або феніл, заміщений алкоксигрупу; С1-6-алкілкарбоніл; С1-6одним чи двома замісниками, незалежно вибраалкоксикарбоніл; С1-6-алкілсульфоніл; гідроксі-С 1-6ними з, галоїду, С1-6-алкілу, С1-6-алкоксигрупи чи алкіл; арилоксигрупу; ді-(С1-6-алкіл)аміногрупу; трифлюорметилу. ціаногрупу; піридиніл; феніл; або феніл, заміщений Іншою групою кращих сполуки є такі сполуки одним чи двома замісниками, незалежно вибраформули (І), у яких n дорівнює 1 чи 2; t дорівнює 0, ними з галоїду, С1-6-алкілу, С1-6-алкоксигрупи чи 1,2 чи 4; кожний з Q позначає ; R1 позначає трифлюорметилу. 2 C(O)NH(OH); R позначає гідроген чи нітрогрупу; Група кращих сполук складається з таких споL- позначає простий зв'язок чи бівалентний радилук формули (І), кал, вибраний з С1-6-алкандіїлу; R4 позначає гідроу яких t дорівнює 1, 2, 3 чи 4; R1 позначає -C(O)NR7R8, -С(О)С1-6-алкандіїлген; позначає радикал, вибраний з (а-1), (аSR9, -NR10C(O)N(OH)R9, -NR10C(O)C1-6-алкандіїл2), (а-3), (а-5), (а-6), (а-11), (а-18), (а-20), (а-21), (а9 10 9 SR , -NR C(O)C=N(OH)R чи іншу Zn-хелатуючу 32), (а-33), (а-47) чи (а-51); кожний s незалежно груп у, де R 7 та R8 кожний незалежно вибирають з дорівнює 0, 1, 2 чи 4; кожний з R5 та R6 незалежно гідрогену, гідроксильної групи, гідроксі-С1-6-алкілу вибраний з гідрогену; галоїду; тригалоїд-С1-6чи аміно-С1-6-алкілу; алкілу; С1-6-алкілу; С1-6-алкілу, заміщеного арилом 2 R позначає гідроген, галоїд, гідроксильну гр ута C3-10-циклоалкілом; С1-6-алкоксигрупи; С1-6пу, аміногрупу, нігрогрупу, С1-6-алкіл, С1-6алкілкарбонілу; бензофуранілу; нафталінілсульалкоксигрупу, трифлюорметил чи ді-(С1-6фонілу; піридинілу, заміщеного арилоксигрупою; алкіл)аміногрупу; фенілу; або фенілу, заміщеного одним замісником, -L- позначає простий зв'язок чи бівалентний незалежно вибраним з гідроксі-С 1-4-алкілу чи моррадикал, вибраний з С1-6-алкандіїлу, С1-6фолініл-С 1-4-алкілу. алкандіїлоксигрупи, аміногрупи чи карбонілу; Групою ще кращих сполук є такі сполуки фор4 R позначає гідроген, гідроксильну групу, амімули (І), у яких n дорівнює 1: t дорівнює 0 чи 1; ногрупу, гідроксі-С1-6-алкіл, С1-6-алкіл, С1-6кожний з Q позначає ; кожний з X позначає алкоксигрупу, арил-С 1-6-алкіл, амінокарбоніл, амінітроген; кожний з Υ позначає нітроген; R1 познано-С1-6-алкіл, С1-6-алкіламіно-С 1-6-алкіл або ді-(С1-6чає -C(O)NН(ОН); R2 позначає гідроген; -L- познаалкіл)аміно-С1-6-алкіл; чає простий зв'язок; кожний з W незалежно познапозначає радикал, вибраний з (а-1), (ачає атом гідрогену; R4 позначає гідроген; 3), (а-4), (а-5), (а-6), (а-7), (а-8), (а-9), (а-10), (а-11), позначає радикал, вибраним з (а-6), (а-11), (а-20), (а-12), (а-13), (а-14), (а-15), (а-16), (а-17), (а-18), (а(а-47) чи (а-51); кожний s незалежно дорівнює 0, 1 19), (а-20), (а-21), (а-22), (а-23), (а-24), (а-25), (ачи 4; і кожний з R5 та R6 є незалежно вибраним з 26), (а-28), (а-29), (а-30), (а-31), (а-32), (а-33), (агідрогену; С1-6-алкілу; С1-6-алкоксигрупи; нафталі34), (a-35), (a-36), (a-37), (a-38), (a-39), (a-40), (aнілсульфонілу; або арилу, заміщеного гідроксі-С1-441), (a-42), (a-44), (a-45), (a-46), (a-47), (а-48) та (аалкілом чи морфолініл-С1-4-алкілом. 51); Найкращими сполуками є сполуки №3, №4, кожний s незалежно дорівнює 0, 1, 2, 3 чи 4; №8, №5, №7, №6 та №9. R5 позначає гідроген; галоїд; гідроксильну гр упу; аміногрупу; нітрогрупу; тригалоїд-С1-6-алкіл; тригалоїд-С 1-6-алкоксигрупу; С1-6-алкіл; С1-6алкоксигрупу; С1-6-алкілкарбоніл; С1-6алкоксикарбоніл; С1-6-алкілсульфоніл; гідроксі-С 1-6алкіл; арилоксигрупу; ді-(С1-6-алкіл)аміногрупу; ціаногрупу; тіофеніл; фураніл; фураніл, заміщений гідроксі-С 1-6-алкілом; бензофураніл; імідазоліл; оксазоліл; оксазоліл, заміщений арилом та С 1-6алкілом; С1-6-алкілтриазоліл; тетразоліл; піролідиніл; піроліл; морфолініл; С1-6-алкілморфолініл; піперазиніл; С1-6-алкілпіперазинілгідроксі-С 1-6алкілпіперазиніл; С1-6-алкоксипіперидиніл; піразоліл; піразоліл, заміщений одним чи двома замісниками, вибраними з С1-6-алкілу чи тригалоїд-С 1-6алкілу; піридиніл; піридиніл, заміщений С1-6алкоксигрупою, арилоксигрупою чи арилом; піримідиніл; хінолініл; індол; феніл; або феніл, заміщений одним чи двома замісниками, незалежно вибраними з галоїду, С1-6-алкілу, С1-6-алкоксигрупи чи трифлюорметилу; R6 позначає гідроген; галоїд; гідроксильну гр уСполуки формули (І) та їхні фармацевтично пу; аміногрупу; нітрогрупу; тригалоїд-С1-6-алкіл; прийнятні солі та N-оксиди і їхні стереохімічно ізотригалоїд-С 1-6-алкоксигрупу; С1-6-алкіл; С1-6мерні форми можуть бути одержані у звичайний алкоксигрупу; С1-6-алкілкарбоніл; С1-6спосіб. Винахід охоплює загальний шлях синтезу, алкоксикарбоніл; С1-6-алкілсульфоніл; гідроксі-С 1-6наприклад: алкіл; арилоксигрупу; ді-(С1-6-алкіл)аміногрупу; a) Гідроксамові кислоти формули (І), де R1 по 25 78031 26 значає -C(O)NH(OH), що позначаються як сполуки хімії, наведено, наприклад, у [книзі "The формули (I-а), можуть бути одержані шляхом проCombinatorial Index" (B.Bunin, Academic Press) та ведення реакції проміжної сполуки формули (II) з Novabiochem's 1999 Catalogue & Peptide Synthesis відповідною кислотою, такою як, наприклад, трифHandbook (Novabiochem AG, Switzerland), які обидлюороцтова кислота. Зазначену реакцію провові включені сюди за посиланням]. дять у придатному розчиннику, такому як, наприСполуки формули (І) та деякі з проміжних споклад, метанол. лук можуть мати у своїй структурі щонайменше один стереогенний центр. Цей стереогенний центр може находитися у R- чи S-конфігурації. Сполуки формули (І), одержані описаними вище способами, можуть бути рацемічними сумішами енантіомерів, які можуть бути розділені з використанням відомих фа хівцям методик розділення. Рацемічні сполуки формули (І) можуть бути перетворені на відповідні діастереомерні сольові форми шляхом проведення реакції з придатною хіральною кислотою. Зазначені діастереомерні сольові b) проміжні сполуки формули (II) можуть бути форми згодом розділяють, наприклад, шляхом одержані шляхом проведення реакції проміжної селективної чи фракційної кристалізації, і енантіосполуки формули (III) з проміжною сполукою формери вивільняють з них за допомогою лугів. Альмули (IV) у присутності придатних реагентів, таких тернативний спосіб розділення енантіомерних як моногідрохлорид Ν’-(етилкарбонімідоїл)-N,Nформ сполук формули (І) включає рідинну хромадимстил-1,3-пропандіаміну (EDC) та 1-гідрокси-1Hтографію з використанням хіральної нерухомої бензотриазол (НОВТ). Реакція може бути провефази. Зазначені чисті стереохімічно ізомерні фордена у придатному розчиннику, такому як суміш ми можуть бути також одержані з відповідних чисдихлорметану (ДХМ) та тетрагідрофурану (ТГФ). тих стереохімічно ізомерних форм придатних вихідних матеріалів, за умови, що реакція протікає стереоспецифічно. Краще, якщо потрібний конкретний стереоізомер, зазначену сполуку синтезують стереоспецифічними методами синтезу. В цих методах краще використовуються енантіомерно чисті ви хідні матеріали. Сполуки формули (І), фармацевтично прийняті солі приєднання кислоти та їхні стереоізомерні форми мають цінні фармакологічні властивості, а саме, виявляють ефект інгібування гістондезацес) проміжні сполуки формули (III) можуть бути тилази (HDAC). одержані шляхом проведення реакції проміжної Даний винахід пропонує спосіб інгібування сполуки формули (V) з придатною основою, такою аномальною росту клітин, включаючи трансфоряк NaOH, у присутності придатного розчинника, мовані клітини, шляхом введення ефективної кільтакого як етанол. кості сполуки за винаходом. Аномальний ріст клітин позначає клітинний ріст, незалежний від нормальних регуляторних механізмів (наприклад, втрата контактного інгібування). Це включає інгібування пухлинного росту як шляхом прямого викликання зупинки росту, термінальної диференціації та/або апоптозу ракових клітин, так і опосередковано, шляхом інгібування реваскуляризації пухлин. Даний винахід також пропонує спосіб інгібуСполуки формули (І) можуть також бути зручвання росту пухлин шляхом введення ефективної но одержані з використанням методів твердофакількості сполуки за даним винаходом суб'єкту, зового синтезу. Загалом, твердофазовий синтез наприклад, ссавцю (більш конкретно, людині), що включає проведення реакції проміжної сполуки погребує такого лікування. Зокрема, даний винахід синтезу з полімерним носієм. Ця проміжна сполука пропонує спосіб інгібування росту пухлин шляхом на полімерному носії може потім бути використана введення ефективної кількості сполуки за даним у ряді стадій синтезу. Після кожної стадії смолу винаходом. Приклади пухлин, що можуть інгібувавідокремлюють фільтруванням та багатократно тися, включають, без обмеження, рак легень (напромивають різними розчинниками для видалення приклад, аденокарциному, включаючи недрібнокдомішок. На кожній стадії смола може бути відщелітинний рак легень), раки підшлункової залози плена для проведення реакції з різними проміж(наприклад, карциному підшлункової залози, таку ними сполуками на наступній стадії, що дозволяє як. наприклад, екзокринна карцинома підшлункопроводити синтез великої кількості сполук. Після вої залози), раки товстої кишки (наприклад, колоостанньої стадії процедури проводять обробку ректальні карциноми, такі як, наприклад, аденокасмоли за допомогою реагенту чи способу для відрцинома товстої кишки та аденома товстої кишки), щеплення смоли від зразка. Більш детальне поясрак простати, включаючи піші стадії хвороби, генення методів, використовуваних у твердофазовій моноетичні пухлини лімфоїдного походження (на 27 78031 28 приклад, гостру лімфоцитарну лейкемію, Вдля лікування одного чи кількох з вищезгаданих клітинну лімфому, лімфому Беркітта), мієлоїдні станів. лейкози (наприклад, гострий мієлобластний ЛейСполуки формули (І), їхні фармацевтично прикоз (AМL)), фолікулярний рак щитовидної залози, йнятні солі приєднання кислоти та стереоізомерні мієлодиспластичний синдром (MDS), пухлини меформи можуть мати цінні діагностичні властивості, зенхімального походження (наприклад, фібросара саме, вони можуть бути використані для детеккоми та рабдоміосаркоми), меланоми, тератокартування чи ідентифікації HDAC у біологічному зрациноми, нейробластоми, гліоми, доброякісні зку, що включає детектування чи вимірювання пухлини шкіри (наприклад, кератоакантоми), карутворення комплексу між міченою сполукою та циному молочної залози (наприклад, пізні стадії HDAC. раку молочної залози), карциному нирок, карциноСпособи детектування чи ідентифікації можуть му яєчників, карциному сечового міхура та епідервикористовува ти сполуки, мічені агентами для мальну карциному. мічення, такими як радіоізотопи, ферменти, флуоСполука за винаходом може бумі використана ресцентні речовини, світні речовини і т.д. Приклав інших терапевтичних цілях, наприклад: ди радіоізотопів включають І25І, 131І, 3H та 14С. Феa) для сенсибілізації пухлин при радіотерапії рменти звичайно роблять придатними для шляхом введення сполуки за винаходом перед, детектування шляхом кон'югації з придатним субпід час чи після опромінення пухлини з метою лістратом, який, у свою чергу, каталізує детектовану кування раку; реакцію. Їхні приклади включають, наприклад, беb) для лікування артропатій та остеопатологіта-галактозидазу, бета-глюкозидазу, лужну фосчиих станів, таких як ревматоїдний артрит, остеофатазу, пероксидазу та малатдегідрогеназу, краартрит, ювенільний артрит, подагра, поліартрит, ще, пероксидазу хрону. Світні речовини псоріатичний артрит, анкілозивний спондилоартвключають, наприклад, лумінол, похідні лумінолу, рит та системний червоний вовчак; люциферин, екворин та люциферазу. c) для інгібування проліферації клітин гладких Біологічні зразки можуть бути тканинами оргам'язів, включаючи судинні проліферативні хворонізму чи рідинами організму. Прикладами рідин би, атеросклероз та рестеноз; організму є спинномозкова рідина, кров, плазма, d) для лікування запальних станів та розладів сироватка, сеча, харкотиння, слина і т.п. шкіри, таких як виразковий коліт, хвороба Крона, З ура хуванням їхніх корисних фармакологічалергічний риніт, хвороба «трансплантат проти них властивостей, сполуки за винаходом можуть хазяїна», кон'юнктивіт, астма, гострий респіраторбути введені до різних фармацевтичних форм, ний дистрес-синдром (ARDS), хвороба Бехчета, призначених для введення. відторгнення трансплантата, кропив'янка, алергічДля виготовлення фармацевтичної композиції ний дерматит, кругова алопеція, склеродерма, за даним винаходом, ефективну кількість конкретекзантема, екзема, дерматоміозит, акне, діабет, ної сполуки, у формі солі приєднання основи чи системний червоний вовчак, хвороба Кавасакі, кислоти, узяту як активний інгредієнт, ретельно розсіяний склероз, емфізема, кістозний фіброз та змішують з фармацевтично прийнятним носієм, хронічний бронхіт; який може маги різноманітні форми у залежності е) для лікування ендометріозу, фібром матки, від бажаної для введення форми препарату. Ці маткової дисфункціональної кровотечі та ендомефармацевтичні композиції є. краще, дозованими тріальної гіперплазії; лікарськими формами, придатними, краще, для f) для лікування очної васкуляризації, включавведення перорально, ректально, черезшкірно чи ючи васкулопатію з ураженням судин сітківки та шляхом парентеральної ін'єкції. Наприклад, при судинної оболонки; виготовленні композиції у вигляді дозованої лікарg) для лікування серцевої дисфункції; ської форми для орального введення можуть бути h) для інгібування імунодепрссивних станів, використані будь-які звичайні фармацевтичні сетаких як лікування інфекції ВІЛ; редовища, такі як, наприклад, вода, гліколі, масла, і) .для лікування дисфункції нирок; спирти і т.п. у випадку рідких препаратів для ораІ) для пригнічення ендокринних розладів; льного введення, таких як суспензії, сиропи, елікk) для інгібування дисфункції гліоконеогенезу; сири та розчини; або тверді носії, такі як крохмалі, І) для лікування нейропатології, наприклад, цукри, каолін, змащувальні речовини, зв'язуючі, хвороби Паркінсона чи нейропатології, яка сприрозпушувальні агенти і т.п. у випадку порошків, чинює розлад пізнавальної функції, наприклад, пілюль, капсул та таблеток. хвороби Альцгеймера чи поліглутамінВнаслідок зручності введення, таблетки та каасоційованої нейрональної хвороби; псули є найкращими дозованими лікарськими фоm) для інгібування нейром'язової патології, рмами для орального введення, у яких, очевидно, наприклад, аміотрофічного бічного склерозу; використовуються тверді фармацевтичні носії. Для n) для лікування атрофії спинних м'язів; парентеральних композицій носій буде звичайно о) для лікування інших патологічних станів, що включати стерильну воду, принаймні здебільшого, піддаються лікуванню шляхом потенціювання ексхоч можуть бути включені інші інгредієнти, наприпресії гена; клад, для поліпшення розчинності. Можу ε ь бути р) для посилення генної терапії. виготовлені, наприклад, розчини для ін'єкцій, у Таким чином, даний винахід розкриває сполуяких носій включає сольовий розчин, розчин глюки формули (І) для використання як лікарські засокози чи суміш сольового та глюкозного розчинів. би, а також використання цих сполук формули (l) Можуть бути також виготовлені суспензії для ін'єкдля виробництва лікарського засобу, призначеного цій, у яких можуть бути використані відповідні рідкі 29 78031 30 носії, суспендувальні агенти і т.п. В композиціях, - протипухлинні нуклеозидні похідні, наприпридатних для черезшкірного введення, носій неклад, 5-флюорурацил, гемцитабін чи капецитабін; обов'язково включає агент посилення проникності - алкілувальні агенти, такі як мехлоретамин та/або придатний змочувальний агент, необов'яз(nitrogen mustard, 2-xлop-N-|2-хлоретил]-Nково, у поєднанні з придатними добавками будьметилетанамiн) чи нітрозосечовина, наприклад, якої природи, які не викликають небажаного шкідциклофосфамід, хлорамбуцил, кармустин чи лоливою ефекту для шкіри, узятими у невеликій кільмустин; кості. Зазначені добавки можуть сприяти введен- протипухлинні антрациклінові похідні, наприню до шкіри та/або можуть бути корисними для клад, даунорубіцин, доксорубіцин, ідарубіцин чи виготовлення бажаної композиції. Ці композиції мітоксантрон; можуть бути введені різними шляхами, наприклад, - антитіла HЕR2, наприклад, трастузумаб; у вигляді трансдермального пластиру, композиції - антагоністи естрогенових рецепторів чи седля точкового нанесення чи рідкої мазі. лективні модулятори естрогенових рецепторів, Особливо зручно виготовляти вищезгадані наприклад, тамоксифен, тореміфен, дролоксифен, фармацевтичні композиції у вигляді дозованих фаслодекс чи ралоксифен; лікарських форм для зручності введення та одна- інгібітори ароматази, такі як ексеместан, анаковості доз. Дозовані лікарські форми, у тому знастрозол, летразол та ворозол; ченні, що використовується в описі та формулі - диференціювальні агенти, такі як ретиноїди. винаходу, стосуються фізично відокремлених одивітамін D та агенти, що блокують метаболізм рениць, придатних для використання як разові дози, тиноєвої кислоти (RAMBA), наприклад, аккутан; причому кожна одиниця містить попередньо ви- інгібітори ДНК-метилтрансферази, напризначену кількість активного інгредієнта, розрахоклад, азацитидін; вану на досягнення бажаного терапевтичного - інгібітори кінази, наприклад, флавоперидол, ефекту, у поєднанні з потрібним фармацевтичним іматинібмезилат чи гефітиніб; носієм. Прикладами таких дозованих лікарських - інгібітори фарнезилтрансферази; або форм є таблетки (включаючи таблетки з надрізом - інші інгібітори HDАС. чи з покриттям), капсули, пілюлі, пакетики з пороТермін "координаційні сполуки платини" викошками, облатки, розчини чи суспензії для ін'єкцій, ристовується тут для позначення будь-яких коорпакетики з 5мл чи 15мл рідкого препарату і т.п., та динаційних сполук платини, що інгібують ріст пухїхні кратні частки. линних клітин, які містять платину у формі іона. Фахівці в цій області техніки можуть легко виТермін "таксанові сполуки" позначає клас спозначити ефективну кількість на основі представлелук, які мають таксаноиу кільцеву систему і с споних тут результатів випробувань. Загалом передрідненими з чи видобутими з екстрактів певних бачається, що терапевтично ефективна кількість видів тиса (Ta xus). буде становити від 0,005мг/кг до 100мг/кг ваги тіла, Термін "інгібітори топоізомерази" використовузокрема, від 0,005мг/кг до 10мг/кг ваги тіла. Може ється для позначення ферментів, здатних змінювиявитися зручним введення потрібної дози як вати топологію ДНК в е укаріотичних клітинах. Вони двох, трьох, чотирьох чи більше субдоз з належє критичними для важливих клітинних функцій та ними інтервалами часу протягом доби. Зазначені проліферації клітин. Існує два класи топоізомераз субдози можуть бути виготовлені у вигляді разов еукаріотичних клітинах, а саме тип І та тип II. вих дозованих форм, наприклад, містити 0,5Топоізомераза І є мономерним ферментом з мо500мг, зокрема, від 10мг до 500мг активного інгрелекулярною вагою близько 100000. Фермент зв'ядієнта на разову дозовану форму. зується з ДНК та тимчасово розриває один ланІнший аспект даного винаходу передбачає цюг, розплітає подвійну спіраль (чи дозволяє їй комбінацію інгібітора HDАС з іншим протираковим розкрутитися), а згодом ре-лігує розрив та дисоціагентом, особливо, призначену для використання юється з ниткою ДНК. Торізомераза II має аналогіяк лікарський засіб, конкретніше, для лікування чний механізм дії, який включає індукування розраку чи споріднених хвороб. ривів нитки ДНК чи утворення вільних радикалів. Для лікування вищезгаданих станів, сполуки Термін "камптотецинові сполуки" використовуза винаходом можуть бути зручно використані у ється для позначення сполук, споріднених з чи комбінації з одним чи кількома іншими лікарськими похідними від вихідної сполуки камптотецину, який агентами, більш конкретно, з іншими протиракоє нерозчинним у воді алкалоїдом, що видобувавими агентами. Прикладами протиракових агентів ється з китайського дерева Camptothecin є: acuminata та індійського дерева Nothapodytes - координаційні сполуки платини, наприклад, foetida. цисплатиy, карбоплатин чи оксаліплатин; Термін "подофілотоксинові сполуки" викорис- таксанові сполуки, наприклад, паклітаксел чи товується для позначення сполук, споріднених з доцетаксел; чи похідних від вихідного подофілотоксину, який - інгібітори топоізомерази І, такі як камптотеекстрагують з рослини мандрагори. цинові сполуки, наприклад, іринотекан чи топотеТермін "протипухлинні алкалоїди барвінку" викан; користовується для позначення сполук, спорідне- інгібітори топоізомерази II, такі як протипухних з чи одержуваних з екстрактів рослини барвінлинні похідні нодофілотоксину, наприклад, стоноку (Vinca rosea). зид чи тенінозід; Термін "алкілувальні агенти" охоплює груп у - протипухлинні алкалоїди барвнику (Vinca), несхожих хімікатів, спільною ознакою яких є те. що наприклад, вінбластин, вінкріетин чи вінорелбін, вони здатні вводити, в фізіологічних умовах, алкі 31 78031 32 льні групи до біологічно важливих макромолекул, лот. таких як ДНК. Для більшості найважливіших агенЗміни у метилюванні ДНК належать до найпотів, таких як мехлоретаміни та нітрозосечовини, ширеніших аномалій у неоплазмах людини. Гіперактивні алкілувальні фрагменти утворюються in метилювання промоторів вибраних генів звичайно vi vo після комплексу деструктивних реакцій, часасоційоване з інактивацією зазначених генів. Тертина яких є ферментативними. Найважливішими мін "інгібітори ДНК-метилтрансферази" використофармакологічними ефектами алкілувальних агенвується для позначення сполук, які діють шляхом тів є ті, що порушують фундаментальні механізми, фармакологічного інгібування ДНКпов'язані з проліферацією клітин, зокрема, синтез метилтрансферази та реактивації експресії гена ДНК та клітинний поділ. Здатність алкілувальних супресора пухлини. агентів втр учатися в функціонування та цілісність Термін "інгібітори кінази" включає сильнодіючі ДНК у тканинах, що швидко проліферують, ствоінгібітори кіназ, які беруть участь у розвитку клірює основи для їхнього терапевтичного застосутинного циклу та запрограмованій загибелі клітин вання та спричинює багато з їхніх токсичних влас(апоптозі). тивостей. Термін "інгібітори фарнезилтрансферази" виТермін "протипухлинні антрациклінові похідні" користовується для позначення сполук, призначевключає антибіотики, одержувані з грибка Strep, них для запобігання фарнезилюванню Ras та інpeuticus var. caesius та їхні похідні, які характериших вн утрішньоклітинних протеїнів. Було зуються наявністю тетрациклінової кільцевої струпоказано, що вони мають вплив па проліферацію ктури з незвичайним цукром дауносаміном, приєдта виживання злоякісних клітин. наним глікозидним зв'язком. Термін "інші інгібітори HDAC" включає, без Було показано, що ампліфікація протеїну реобмеження: цептора 2 епідермального фактора росту людини - коротколанцюгові жирні кислоти, наприклад, (HER2) у первинних карциномах молочної залози бутират, 4-фенілбутират чи вальпроєву кислоту; корелює з поганим клінічним прогнозом для пев- гідроксамові кислоти, наприклад, субероїланих пацієнтів. Трастузумаб є рекомбінантним ДНКнілідгідроксамову кислоту (SAН A), біарилгідроксапохідним гуманізованим моноклональним ΙgG1 мат А-161906, біциклічні арил-Nканна антитілом високого ступеня очистки, яке гідроксикарбоксаміди, ніроксамід, CG-1521, PXDзв'язується з високою афінністю та специфічністю 101, сульфонамід гідроксамової кислоти, LAQ-824, з позаклітинним доменом рецептора HER2. трихостатин А (TSA), оксамфлатин, скриптайд Багато раків молочної залози мають естроге(scriptaid), м-карбоксикоричну кислоту, біснові рецептори і ріст цих пухлий може стимулювагідроксамову кислоту або аналог трапоксинтися естрогеном. Терміни "антагоністи естрогеногідроксамової кислоти; вих рецепторів" та "селективні модулятори - циклічні тетрапептиди, наприклад, трапоксин, естрогенових рецепторів" використовуються для апідицин чи депсіпептид; позначення конкурентних інгібіторів зв'язування - бензаміди, наприклад, MS-275 чи СІ-994, або естрадіолу з естрогеновими рецепторами (ER). депудецин. Селективні модулятори естрогенових рецепторів Для лікування раку сполуки за даним винахопри зв'язуванні з ER індукують зміну тривимірної дом можуть бути введені пацієнту, як описано виформи рецептора, інгібуючи його зв'язування з ще, у поєднанні з опромінюванням. Опромінюванестроген-реактивним елементом (ERE) ДНК. ня позначає іонізувальне випромінювання і, У жінок в постменопаузі основним джерелом зокрема, гамма-випромінювання, особливо таке, циркулюючого естрогену є перетворення андрогещо випромінюється лінійними прискорювачами чи нів надниркової залози та яєчників (андростендіон радіонуклідами, які широко застосовуються зараз. та тестостерон) на естрогени (естрон та естрадіол) Опромінювання пухлини радіонуклідами може буферментом ароматазою у периферичних тканити зовнішнім чи внутрішнім. нах. Зниження рівня естрогенів шляхом інгібуванДаний винахід також стосується комбінації за ня чи інактивації ароматази є ефективним та селевинаходом протиракового агента та інгібітора ктивним лікуванням для деяких пацієнтів у HDАС зa винаходом. постменопаузі з гормонзалежним раком молочної Даний винахід також стосується комбінації за залози. винаходом, призначеної для використання у медиТермін "антіестрогеновий агент" використовучній терапії, наприклад, для інгібування росту пухється тут для позначення не лише антагоністів линних клітин. естрогенових рецепторів та селективних модуляДаний винахід також стосується комбінацій за торів естрогенових рецепторів, але також інгібітовинаходом, призначених для інгібування росту рів ароматази, як описано вище. пухлинних клітин. Термін "диференціювальні агенти" охоплює Даний винахід також стосується способу інгісполуки, які можуть, різними шляхами, інгібувати бування росту п ухлинних клітин у суб’єкта-людини, проліферацію клітин та індукувати ди ференціацію. який включає введення суб'єкту ефективної кільВідомо, що вітамін D та ретиноїди відіграють важкості комбінації за винаходом. ливу роль у регулюванні росту та ди ференціації Даний винахід далі пропонує спосіб інгібуванширокою спектра нормальних та злоякісних типів ня аномального росту клітин, включаючи трансклітин. Агенти, що блокують метаболізм ретиноєформовані клітини, шляхом введення ефективної вої кислот (RAMВA), підвищують, рівні ендогенної кількості комбінації за винаходом. ретиноєвої кислоти шляхом інгібування цитохром Іншій лікарський агент та інгібітор НDAC мо1450-медійованого катаболізму ретиноєвих кисжуть бути введені одночасно (наприклад, в окре 33 78031 34 мих чи в єдиній композиції) або послідовно у будь60мг/м 2, зокрема, для доксорубіцину - в дозі блиякому порядку. В останньому випадку, дві сполуки зько 40-75мг/м 2, для даунорубіцину - в дозі близьвводяться протягом такого періоду часу та у такій ко 25-45мг/м 2, і для ідарубіцину - в дозі близько 10кількості і у такий спосіб, що є достатніми для за15мг/м 2 за курс лікування. безпечення досягнення корисного чи синергічного Трастуз умаб краще вводиться в дозі від 1 до ефекту. Слід розуміти, що кращий спосіб та поря5мг на квадратний метр (мг/м 2) площі поверхні док введення і відповідні дози та схеми введення тіла, зокрема, 2-4мг/м 2 за курс лікування. кожного компонента комбінації будуть залежати Антіестрогеновий агент краще вводиться в довід конкретного виду іншого лікарського агента та зі близько 1-100мг на добу у залежності від конкінгібітора HDAC, що вводяться, шляху їхнього ретного агента та стану, що лікується. Тамоксивведення, виду пухлини, лікування якої провофен краще вводиться перорально в дозі від 5 до диться, та конкретного організма-хазяїна, що оде50мг, краще, 10-20мг двічі на день, причому тераржує лікування. Оптимальний спосіб та порядок пія проводиться протягом часу, достатнього для введення і величини доз та схеми введення модосягнення та підтримання терапевтичного ефекжуть бути легко визначені фахівцями в цій області ту. Тореміфен краще вводиться перорально в дозі з використанням звичайних методів та з урахуванблизько 60мг один раз на добу, причому терапія ням наведеної тут інформації. проводиться протягом часу, достатнього для досяКоординаційна сполука платини краще ввогнення та підіримання терапевтичного ефекту. диться в дозі від 1 до 500мг на квадратний метр Анастрозол краще вводиться перорально в дозі (мг/м 2) площі поверхні тіла, наприклад, від 50 до близько 1мг один раз на добу. Дролоксифен кра400мг/м, зокрема, для цисплатину - в дозі близько ще вводиться перорально в дозі близько 20-100мг 75мг/м 2, і для карбоплатину - близько 300мг/м за раз на добу. Ралоксифен краще вводиться перокурс лікування. рально в дозі близько 60мг раз на добу. ЕксемесТaксанова сполука краще вводиться в дозі від тан краще вводиться перорально в дозі близько 50 до 400мг на квадратний метр (мг/м 2) площі по25мг раз на добу. верхні тіла, наприклад, під 75 до 250мг/м 2, зокреЦі дози можуть вводитися, наприклад, один, ма, для паклітакселя - в дозі близько 175-250мг/м 2, два чи більше раз за курс лікування, який може і для доцетакесля - близько 75-150мг/м 2 за курс повторюватися, наприклад, кожні 7, 14, 21 чи 28 лікування. днів. Камптотецинова сполука краще вводиться в З ура хуванням їхніх корисних фармакологічдозі від 0,1 до 400мг на квадратний метр (мг/м 2) них властивостей, компоненти комбінацій за винаплощі поверхні тіла, наприклад, від 1 до 300мг/м 2, ходом, тобто, інший лікарський агент та інгібітор зокрема, для іринотекану - в дозі близько 100HDAC, можуть бути виго товлені у вигляді різних 350мг/м 2, і для топотекану - близько 1-2мг/м 2 за фармацевтичних форм, призначених для введенкурс лікування. ня. Композиції компонентів можуть бути виготовПротипухлинне подофілотоксинове похідне лені окремо як індивідуальні фармацевтичні комкраще вводиться в дозі від 30 до 300мг на квадрапозиції чи як єдина фармацевтична композиція, тний метр (мг/м 2) площі поверхні тіла, наприклад, що містить обидва компоненти. від 50 до 250мг/м 2, зокрема, для етопозиду - в дозі Таким чином, даний винахід також стосується близько 35-100мг/м 2, і для теніпозиду - близько 50фармацевтичної композиції, яка включає інший 250мг/м 2 за курс лікування. лікарський агент та інгібітор HDAC разом з одним Протипухлинний алкалоїд барвінку краще чи кількома фармацевтичними носіями. вводиться в дозі від 2 до 30мг на квадратний метр Даний винахід також стосується комбінації за (мг/м 2) площі поверхні тіла, зокрема, для вінбласвинаходом у формі фармацевтичної композиції, тину - в дозі близько 3-12мг/м 2, для вінкристииу - в що включає протираковий агент та інгібітор HDAC дозі близько 1-2мг/м 2, і для вінорелбіну - в дозі за винаходом разом з одним чи кількома фармаблизько 10-30мг/м 2 за курс лікування. цевтичними носіями. Протипухлинне похідне нуклеозиду краще Даний винахід далі стосується використання вводиться в дозі від 200 до 2500мг на квадратний комбінації за винаходом у виробництві фармацевметр (мг/м 2) площі поверхні тіла, наприклад, 700тичної композиції для інгібування росту п ухлинних 1500мг/м 2, зокрема, для 5-FU в дозі від 200 до клітин. 500мг/м 2, для гемцитабіну в дозі близько 800Даний винахід далі стосується продукту, що 1200мг/м 2, і для капецитабіну - близько 1000містить як перший активний інгредієнт інгібітор 2500мг/м 2 за курс лікування. HDАС за винаходом і як другий активний інгредіАлкілувальні агенти, такі як мехлоретамін чи єнт - протираковий агент, призначеного для виконітрозосечовина, краще вводиться в дозі від 100 ристання як комбінований препарат дія одночасдо 500мг на квадратний метр (мг/м 2) площі поверного, роздільного чи послідовного застосування хні тіла, наприклад, 120 до 200мг/м 2, зокрема, для при лікуванні пацієнтів, хворих на рак. циклофосфаміду - в дозі близько 100-500мг/м 2, Експериментальна частина для хлорамбуцилу - в дозі близько 0,1-0,2мг/кг, Наведені далі приклади даються для ілюстрадля кармустину - в дозі близько 150-200мг/м 2, і для ції. ломустину - в дозі близько 100-150мг/м 2 за курс Тут та надалі "EDC" позначає моногідрохлолікування. рид N'-(етилкарбонімідоїл)-N,N-диметил-1,3Протипухлинне антрацикліиове похідне краще пропандіаміну, "ДХМ" позначає дихлорметан, вводиться в дозі від 10 до 75мг на квадратний "DIEA" позначає діізопропілетиламін, "DIPE" пометр (мг/м 2) площі поверхні тіла, наприклад, 15значає діізопропіловий ефір, "ДМФ" позначає ди 35 78031 36 метилформамід, "ЕtOАс" позначає етилацетат, е) Реакція під атмосферою Аr. Натрієву сіль "іРrOH" позначає ізопропіл, "МеОН" позначає ме1,1,1-триметил-N-(триметилсиліл)силанаміну танол, "ЕtOH" позначає етанол, "РуВrОР" позначає (0,01моль; 10мл, 1М/ТГФ) додають (шприцом) до гсксафлюорфосфат бром-триспроміжн. сп. 4 (0,01моль) у ДМФ (200мл) при кімпіролідинофосфонію, "ТЕΑ" позначає триетиламін, натній температурі. Починає утворюватися тверда "NFA" позначає трифлюороцтову кислоту і "TГФ" натрієва сіль. Її енергійно перемішують і додають позначає тетрагідрофуран. ще ДМФ (200мл). Додають повільно розчин 2А. Синтез проміжних сполук бромбутану (0,02моль) у ДМФ (100мл) при кімнатПриклад А1 ній температурі. Реакційну суміш перемішують при a) Розчин гсксагідро-1Н-1,4-діазспіну кімнатній температурі протягом 18 годин. Розчин(0,20моль) та 1-флюор-4-нітробензолу (0,10моль) ник ДМФ видаляють (вакуумна помпа). Додають у ДХМ (300мл) перемішують при кімнатній темпеводу до залишку і одержаний маслянистий продукт ратурі протягом 24 годин під атмосферою азоту. розводять ефіром (500мл). Ефірний розчин концеУтворюється осад жовтих кристалів. Осад збирантрують, одержуючи 2,70г продукту (маслянистий ють на фільтрі, промивають ефіром та висушують. матеріал, який твердіє при зберіганні; вихід 62%), Залишок (21,1г, 87%) розводять у воді та обробякий далі очищають флеш-хроматографією на ляють 3Н розчином NaOН. Цю суміш екстрагують колонці з силікагелем (елюент: 1% (10% ДХМ (3 x500мл), осушають (Na2SO4), фільтрують і NН4OН/CH3OН/CН2CI2), одержуючи 0,55г 1,1розчинник видаляють при зниженому тиску та видиметилетилового складного ефіру 4-[4-[1,5сушують під вакуумом при кімнатній температурі дигідро-3-метил-1-(1-метилпропіл)-5-оксо-4Н-1,2,4протягом 16 годин, одержуючи 18,3г гексагідро-1триазол-4-іл]феніл]гексагідро-1Н-1,4-дїазепін-1(4-нітрофеніл)-1Н-1,4-діазепіну (проміжн. сп. 1), карбонової кислоти (проміжн. сп. 5), точка плавточка плавлення 115-116°С. лення: 119-120°С. b) Складний ефір біс-(1,1f) Проміжн. сп. 5 (0,0014моль) додають до диметилетил)дикарбонової кислоти (0,090моль) у охолодженою розчину ТFA (5мл; льодяна баня) ДХМ (100мл) додають до охолодженого (льодяна протягом 30хв. Розчинник видаляють при знижебаня) розчину проміжн. сп. 1 . (0,090моль) у ДХМ ному тиску. Додають воду та суміш насичують ка(200мл) при перемішуванні. Спостерігається видірбонатом калію. Цю суміш екстрагують етилацеталення газу. Після припинення виділення СО2 льотом (2x50мл), осушають над суль фатом нагрію, дяну баню забирають і продовжують перемішуфільтрують та видаляють розчинник, одержуючи вання протягом 3 годин при кімнатній температурі. 0,35г (65%) 4-[4-(гeксагідро-1H-1,4-діазепін-1Реакційну суміш промивають 1Н розчином НСІ та іл)феніл]-2,4-дигідро-5-метил-2-(1-метилпропіл)водою, а потім висушують. Розчинник випарову3H-1,2,4-триазол-3-ону (проміжн. сп. 6). ють, одержуючи 20,5г (70%) 1,1-диметилетилового g) Суміш проміжн. сп. 6 (0,00076моль), метилскладного ефіру гексагідро-4-(4-нітрофеніл)-1Ηового складною ефіру 4-бромбензойної кислоти 1,4-діазепін-1-карбонової кислоти (проміжн. сп. 2), (0,00304моль), (1R)-[1,1'-бінафталін]-2,2'-діїлточка плавлення 128-130°С. біс[дифенілфосфіну (0,016г), Pd2(dba)3 (0,008г) ι a c) Проміжн. сп. 2 (0,047моль) додають порціяCs 2CO3 (0,40г) у толуолі (10мл) поміщають до ми (протягом 20хв.) до киплячої під зворотним пробірки високого тиску (у якій находиться малехолодильником суміші гідразинмоногідрату (15мл) нький стрижень для магнітної мішалки) у герметиу метанолі (700мл) та нікелю Ренея (16,1г). Реакчній камері з рукавичками під аргоном. Пробірку ційну суміш перемішують та кип'ятять зі зворотним високого тиску щільно закупорюють та нагрівають холодильником до зникнення жовтого кольору. на масляній бані при 120°С .протягом 12 годин при Суміш продовжували кип'ятити зі зворотним холоперемішуванні). Додають ще (1R)-[1,1'дильником протягом ще півгодини. Каталізатор бінафталін]-2,2'-діїл-біс[дифенілфосфін (0,016г), видаляють фільтрацією. Розчинник випаровують, Pd2(dba)3 (0,008г) та Cs 2CO3 (0,40г). Суміш нагріодержуючи 13,0г 1,1-диметилетилового складного вають при 120°С на масляній бані протягом 24 ефіру 4-(4-амінофеніл)гексагідро-1Н-1,4-діазепінгодин. Реакційну суміш фільтрують для видалення 1-карбонової кислоти (проміжн. сп. 3). неорганічного твердого матеріалу та промивають d) Нерозведену суміш проміжн. сп. 3 приблизно 20мл СНСI3. Фільтрат концентрують (0,045моль) та етилового складного ефіру (1при зниженому тиску до сухого стану. Залишок етоксіетиліден)гідразинкарбонової кислоти очищають флеш-хроматографією на силікагелі (0,090моль) нагрівають на масляній бані при 130°С (елюент: NН4OН/CH3OН/CН2CI2 0,1/0,9/99). Бажані протягом 1 години при перемішуванні. Ще через фракції об'єднують, розчинник випаровують та дві години реакційну суміш охолоджують та додависушують при кімнатній температурі під вакуумом ють 2-пропанол (приблизно 100мл) при тритурупротягом 16 годин, одержуючи 0,21г (60%) метилванні. Тверду речовину фільтрують та висушують, ового складного ефіру 4-[4-[4-[1,5-дигідро-3-мtтилодержуючи 14г твердої речовини. Цю тверду ре1-(1-метилпропіл)-5-оксо-4Н-1,2,4-триазол-4човину тритур ують з ефіром, фільтрують та висуіл]феніл]гексагідро-1Н-1,4-діазепін-1-іл]бензойної шують, одержуючи 13,0г (77%) 1,1кислоти (проміжн. сп. 7), точка плавлення 152°Сдимегилетилового складного ефіру 1Н-1,4153°С. діазепін-1-карбонової кислоти, 4-[4-(1,5-дигідро-3Приклад A2 метил-5-оксо-4Н-1,2,4-триазол-4Суміш 4-[4-(фенілметил)-1іл)феніл]гексагідро-1Н-1,4-діазепін-1-карбонової піперазиніл]бензойної кислоти (0,0145моль), Окислоти (проміжн. сп. 4), точка плавлення 238(тетрагідро-2Н-піран-2-іл)-гідроксиламіну 240°С. (0,029моль), Ν,Ν'-метантетраїл 37 78031 38 бісциклогексанаміну (0,0145моль) та 1-гідрокси1Н-бензотриазолу (0,021моль) у ДХМ ч.д.а. (200мл) перемішують при кімнатній температурі протягом вихідних. Реакційну еуміш промивають водою, осушають (MgSО 4), фільтрують та розчинник випаровують. Залишок кристалізують з ЕtOАс, фільтрують та висушують, одержуючи 3,5г, та як другий ви хід - 2,0г. загалом одержуючи 5,5г (95%) 4-[4-(фенілметил)-1-[піперазиніл]-Ν-[(теірагідро2Н-піран-2-іл)окси]бензаміду (проміжн. сп. 8). Приклад А3 a) Синтез Тетракіс(етоксид) титану (0,0029моль) додають до суміші проміжної сполуки 10 (0,0022моль) та 1,1-диметилетилового складного ефіру 4-оксо1-піперидинкарбонової кислоти (0,0027моль) у 1,2дихлоретані (6мл). Суміш перемішують при 50°С протягом 18 годин, а потім охолоджують до кімнатної температури. Додають порціями NaBH(OAc)3 (0,0029моль). Суміш перемішують при кімнатній температурі протягом 2 годин. Додають воду. СуРозчин 1-(фенілметил)-піперазину (0,068моль) міш екстрагують ДХМ та фільтрують крізь целіт. у ацетонітрилі ч.д.а. (135мл) додають поступово Органічний шар відокремлюють, осушають до розчину карбонату калію (0,18моль) та етило(MgSО4), фільтрують та розчинник випаровують до вого складною ефіру 2-(метилсульфоніл)-5сухого залишку. Залишок (1,1г) кристалізують з піримідинкарбонової кислоти (0,082моль) у ацетодіетилового ефіру/DIPE. Осад відокремлюють на нітрилі ч.д.а. (135мл) і реакційну суміш перемішуфільтрі та висушують, одержуючи 0,49г (51%) ють протягом 45хв. при кімнатній температурі. Попроміжної сполуки 11. тім реакційну суміш залишають на ніч. Додають d) Синтез ДХМ (400мл). Додають воду (300мл) і органічний шар відокремлюють, осушають (MgSО 4), фільтрують і розчинник випаровують. Залишок (28г) очищають хроматографією на колонці з силікагелем (елюент: ДХМ/МеОН 95/5). Чисті фракції збирають та розчинник випаровують. Залишок кристалізують з ацетонітрилу, фільтрують та висушують під вакуумом, одержуючи 15,1г проміжної сполуки 9. b) Синтез Суміш проміжної сполуки 9 (0,03моль) у ЕtOН (250мл) гідрують при 50°С з Pd/C 10% (2г) як каталізатором. Після поглинання Н 2 (1еквів.), каталізатор відокремлюють на фільтрі та фільтрат випаровують. Залишок очищають хроматографією на колонці з силікагелем (елюент: ДХМ/(МеОН/NН3) 90/10). Фракції продукту збирають і розчинник випаровують, одержуючи 6,8г (>96%) проміжної сполуки 10. c) Синтез Суміш проміжної сполуки 11 (0,0011моль) у НСІ/іРrOН (5мл) перемішують при 50°С протягом 1 години, а потім охолоджують до кімнатної температури. Осад фільтрують, промивають Еон, а потім діетиловим ефіром, та висушують, одержуючи 0,38г (94%) проміжної сполуки 12 (НСІ-сіль). e) Синтез Розчин 2-нафталінсульфонілхлориду (0,0011моль) у ДХМ (1мл) додають при 5°С до суміші проміжної сполуки 12 (0,001моль) та TEA (0,0032моль) у ДХМ (4мл) під током N2. Суміш перемішують при кімнатній температурі протягом ночі. Додають 10%-ний карбонат калію. Суміш екстрагують ДХМ. Органічний шар відокремлюють, 39 78031 40 осушають (MgSO 4), фільтрують і розчинник випа(0,0171моль) у 1,2-диметоксіетані (15мл) додають ровують до сухого залишку. Залишок (0,53г) розпо краплях при кімнатній температурі до розчину водять у діетиловому eфірі/DIPE. Осад відокремтетракіс(трифенілфосфін)паладію (0,0045моль) у люють на фільтрі та висушують, одержуючи 0,42г 1,2-диметоксіетані (50мл) під током N2. Суміш пе(77%) проміжної сполуки 13. ремішують протягом 20 хвилин. Додають суспенПриклад А4 зію [4-(гідроксиметил)феніл]боронової кислоти а) Синтез (0,0257моль) у ЕtOН (18мл). Суміш перемішують протягом 20 хвилин. Додають карбонат натрію (0,15моль). Суміш перемішують та кип'ятять зі зворотним холодильником протягом 4 годин, а потім доводять до кімнатної температури. Органічний шар упарюють. Залишок розводять у ДХМ та промивають водою. Органічний шар відокремлюють, осушають (MgSO 4), фільтр ують і розчинник випаровують. Залишок (4,1г) очищають хроматографією на колонці з силікагелем (15-40мкм) (елюент: ДХМ/МеОН 99/1). Чисті фракції збирають та розчинник випаровують, одержуючи 2,8г (82%) Тетракіс-(2-пропанолато)титан (0,0023моль) проміжної сполуки 16. додають до суміші 1-(2Приклад А6 нафталінілсульфоніл)піперазину (0,0018моль) та a) Синтез 1,1-диметилетилового складного ефіру 4-оксо-1піперидинкарбонової кислоти (0,0021моль) у 1,2дихлоретані (6мл) під током N2. Суміш перемішують при 50°С протягом 18 годин, а потім охолоджують до кімнатної температури. Додають порціями NaBH(OAc)3 (0,0023моль). Суміш перемішують при кімнатній температурі протягом 4 годин. Додають воду. Суміш фільтрують крізь целіт. Суміш екстрагують ДХМ. Фільтрат декантують. Органічний шар відокремлюють, осушають (MgSO4), фільтрують і розчинник випаровують до Розчин етилового складною ефіру 2сухого залишку. Залишок (1,3г) очищають хрома(метилсульфоніл)-5-піримідинкарбонової кислоти тографією на колонці з силікагелем (70-200мкм) (0,0434моль) у ацетонітрилі (100мл) додають по (елюент: від ДХМ 100 до ДХМ/МеОН 99/1). Чисті краплях при 10°С до розчину 4фракції збирають та розчинник випаровують, одепіперидинметанаміну (0,0868моль) та карбонату ржуючи 0,72г (86%) проміжної сполуки 14. калію (0,0434моль) у ацетонітрилі (200мл) під тоb) Синтез ком N2. Суміш перемішують при кімнатній температурі протягом 2 годин, виливають у воду з льодом та екстрагують ДХМ. Органічний шар відокремлюють, осушають (MgSО 4), фільтрують та розчинник випаровують. Залишок (14,18г) очищають хроматографією на колонці з силікагелем (2045мкм) (елюент: ДХМ/МеОН/NH4ОН від 90/10/1 до 80/20/2). Чисті фракції збирають та розчинник випаровують, одержуючи 3,7г (32%) проміжної сполуки 17. b) Синтез Суміш проміжної сполуки 14 (0,0014моль) у НСІ/іРrOН 5Н (10мл) перемішують при 50°С протягом 18 годин, а потім охолоджують до кімнатної температури, фільтрують, промивають діетиловим ефіром та висушують, одержуючи 0,53г (95%) проміжної сполуки 15 (НСІ-сіль), точка плавлення 260°С. Приклад А5 Синтез Розчин 5-бром-2-фуранкарбоксальдегіду До N-циклогексилкарбодііміду, N'метилполістиролу (153мг) (NovaBiochem Cat. Nr. 01-64-0211) додають Ν-ацетил-3,4,5триметоксиантранілову кислоту (0,2ммоль), розчинену у ТГФ (0,5мл), а потім 1-гідрокси-1Нбензотриазол, розчинений у ТГФ (0,5мл). Цю суміш струшують протягом 10 хвилин при кімнатній температурі. Згодом до суспензії додають проміж 41 78031 ну сполуку 17 (0,1ммоль), розчинену у ДХМ (1мл), після чого розчинники випаровують у потоці азоту при 50°С, а реакційну суміш згодом залишають нерозведеною на ніч при 90°С під потоком азоту. Продукт розчиняють у дихлорметані (2мл) та фільтрують крізь скляний фільтр. Залишок промивають ДХМ (2 x2мл) і фільтрат концентрують. Продукт потім обробляють сумішшю ТГФ (1мл) та водного гідроксиду нагрію (1мл, 1Н) протягом 48 годин при кімнатній температурі. Зрештою, суміш нейтралізують додаванням водної НСІ (1мл, 1Н) та висушують при 70°С під потоком азоту, одержуючи проміжну сполуку 18. с) Синтез До одержаної проміжної сполуки 18 (0,1ммоль) додають розчин 1-гідрокси-1Н-бензотриазолу (0,1ммоль), EDC (0,1ммоль) та TEA (0,12ммоль) у суміші ДХМ/ТГФ (3/4, 7мл). Реакційну суміш струшують протягом 5 хвилин при кімнатній температурі, після чого додають О-(тетрагідро-2Н-піран-2іл)-гідроксиламін (0,1ммоль). Одержаний розчин залишають при струшуванні на ніч при кімнатній температурі. Реакційну суміш потім концентрують під потоком азоту при 50°С до об'єму 5мл, додають метилізоціанат (1,25ммоль/г, 0,25ммоль. Argonaut, Cat. Nr. 800261) та бікарбонат (полістирилметил)триметиламонію (0,6ммоль) (NovaBiochem Cat. Nr. 01-64-0419) на полімерному носії і цю суміш струшують протягом ще 2 годин. Реакційну суміш фільтрують і фільтрат концентрують. Очи щення продукту методом препаративної ВЕРХ дає 29мг проміжної сполуки 19. Приклад А7 Синтез Метансуль фонілхлорид (0,006моль) додають при 0°С до розчину проміжної сполуки 27 (0,001моль) та TEA (0,008моль) у ДХМ (10мл) під током N2. Суміш перемішують при 0°С протягом 3 годин, виливають у воду з льодом та екстрагують ДХМ. Органічний шар відокремлюють, осушають (MgSO4), фільтрують та розчинник випаровують, одержуючи 0,44г проміжної сполуки 20. Цей продукт використовують безпосередньо на наступній стадії реакції. 42 Приклад А8 a) Синтез Зразок проміжної сполуки (0,1ммоль) та 2феніл-4Н-3,1-бензоксазин-4-ону (0,1ммоль) зважують у посудину та додають толуол (мл). Посудину герметизують і суміш нагрівають протягом 10 годин при 90°С. Потім розчинник . випаровують і залишок розводять у ДХМ (4мл), після чого додають етандіоїлдихлорид (1ммоль) та ДМФ (1ммоль). Одержану суміш стр ушують протягом ночі при 90°С. Реакційну суміш потім промивають 10%-ним водним розчином бікарбонату нагрію (2´1мл), фази розділяють і органічний шар концентрують, одержуючи проміжну сполуку 21. b) Синтез Проміжну сполуку 21 (неочищену) обробляють сумішшю ТГФ/1Н водн. NaOH/MeOH (1/1/0,2, 2,2мл) при енергійному перемішуванні протягом ночі при кімнатній температурі. Потім додають водну НСІ (1Н, 1мл) для нейтралізації розчину. Розчинники упарюють під вакуумом, одержуючи проміжну сполуку 22. c) Синтез До проміжної сполуки 22 додають по черзі 1гідрокси-1Н-бензотриазол (0,13ммоль), розчинений у ТГФ (сухий, 1мл), ЕDC (0,13ммоль), розчинений у ДХМ (сухий, 1мл) та TEA (0,15ммоль). Суміш перемішують при кімнатній температурі протягом 10 хвилин. Додають О-(тетрагідро-2Нпіран-2-іл)гідроксиламін (0,13ммоль), розчинений у ТГФ (сухий, 1мл) і реакційну суміш перемішують при кімнатній температурі протягом ночі. Розчин 43 78031 44 ники упарюють і продукт очищають методом обер(5мл, 2х). Відокремлений органічний шар осушаненофазової ВЕРХ, одержуючи проміжну сполуку ють (MgSО 4), фільтрують і розчинник упарюють 23. точка плавлення 219°С. (до сухого залишку під .током N2 при 50°С). ЗалиВ. Синтез кінцевих сполук шок висушують (вакуум, 50°С), одержуючи 0,018г Приклад 131 (65%) сполуки 2, точка плавлення 196°С. Видаляють захисні групи Ν-FmосПриклад В4 гідроксиламін-2-хлортритильної смоли а) Синтез (Novabiochem, 01-64-0165) за допомогою 50% піперидину у ДМФ (кімната температура, 24год.). Смолу промивають кілька разів ДХМ та ДМФ і залишають набухати у ДМФ. Додають однією порцією два еквіваленти кислоти1 (1. У розрахунку на наважку смоли), РуВrOР та 4 еквіваленти DIEA. Суміш струшують протягом 24год., рідину зливають і смолу промивають кілька разів ДХМ та ДМФ. Смола набухає у ДМФ, що містить 2 еквіваленти аміну, її струшують 24год. при кімнатній температурі, рідину зливають і смолу промивають ДХМ та ДМФ. Кінцевий продукт відщеплюють за допомогою 5% TFA у ДХМ, аналізують методом ВЕРХ та МС і упарюють у попередньо зважених пробірках. Суміш проміжної сполуки 13 (0,0008моль) та Приклад В2 гідроксиду натрію (0,0016моль) у ЕtOН (10мл) пеСинтез ремішують та кип'ятять зі зворотним холодильником протягом 2 годин, а потім охолоджують до кімнатної температури. Осад фільтрують, промивають Еон, а потім діетиловим ефіром, та висушують, одержуючи 0,425г (100%) проміжної сполуки 24 (натрієва сіль). b) Синтез Суміш проміжн. сп. 7 (0,00075моль), NН2ΟН/Н2О 50% (5мл), KCN (0,001моль), МеОН (10мл) та ТГФ (10мл) перемішують при кімнатній температурі протягом 48 годин. Розчинник випаровують. Залишок екстрагують ДХМ та промивають водою. Розчинник видаляють і маслянистий залишок (0,225г) очищають хроматографією на колонці з силікагелем (елюент: NН4OН/CH3OН/CН2CI2 0,05/0,95/99; потім NH4OH/CH3OH/CH2CІ2 0,1/0,9/99). Чисті фракції збирають та розчинник випаровують, одержуючи 0,114г сполуки 1, ·Н2О, точка плавлення 182184°С, та 0,040г 4-[4-[4-[1,5-дигідро-3-метил-1-(1метилпропіл)-5-оксо-4Н-1,2,4-триазол-4іл]феніл]гексагідро-1Н-1,4-діазепін-1-іл]-бензойної кислоти, точка плавлення 244-245°С. Приклад В3 Синтез Проміжн. сп. 8 (0,000088моль) перемішують у 5% TFA/MeOH (5мл) протягом 24 годин при 25°С. Потім реакційну суміш виливають у воду (5мл)+1еквів. ΝаНСО3. Цю суміш екстрагують ДХМ Додають EDC (0,001моль) до суміші проміжної сполуки 24 (0,0008моль), О-(тетрагідро-2Н-піран-2іл)гідроксиламіну (0,001моль) та 1-гідрокси-1Нбензотриазолу (0,001моль) у ДХМ/ТГФ (10мл) під током N2. Суміш перемішують при кімнатній температурі протягом 18 годин. Осад фільтрують, промивають ТГФ, а потім діетиловим ефіром, та висушують, одержуючи 0,4г (83%) проміжної сполуки 25, точка плавлення 260°С. с) Синтез Додають TFA (0,5мл) до суміші проміжної сполуки 25 (0,0006моль) у МеОН (10мл). Суміш перемішують при кімнатній температурі протягом 5 днів. Осад фільтрують, промивають діетиловим 45 78031 46 ефіром та висушують. Залишок розводять у воді, від 97/3/0,1 до 95/5/0,1). Чисті фракції збирають та перемішують протягом 30 хвилин, фільтрують та розчинник випаровують, одержуючи 0,28г (45%) висушують, одержуючи 0,143 і (38%) сполуки 3 проміжної сполуки 27. (·0,91 СF3СООH), точка плавлення 210°С. Проміжну сполуку 27 обробляють аналогічно Приклад В5 чому, як описано у Прикладі В4, одержуючи 0,143г Синтез (89%) сполуки 5 (·0,83 CF3COOH), точка плавлення 219°С. Суміш проміжної сполуки 15 (0,0013моль), етилового складного ефіру 2-(метилсульфоніл)-5піримідинкарбонової кислоти (0,0017моль) та карбонату калію (0,0039моль) у ацетонітрилі (10мл) перемішують при 80°С протягом 18 годин. Додають воду. С уміш екстрагують ДХМ. Органічний шар відокремлюють, осушають (MgSО 4), фільтрують та розчинник випаровують до сухого залишку. Залишок (0,5г) кристалізують з CН3CN/DIPE. Осад відокремлюють на фільтрі та висушують, одержуючи 0,25г (37%) проміжної сполуки 26. Проміжну сполуку 26 обробляють аналогічно тому, як описано у Прикладі В4, одержуючи 0,126г (74%) сполуки 4 (·0,86 CF3COOH), точка плавлення 230°С. Приклад В6 Синтез Суміш проміжної сполуки 10 (0,0015моль) та проміжної сполуки 16 (0,0015моль) у МеОН (6мл) перемішують при 60°С протягом 20 годин, а потім охолоджують до 0°С. Додають гідроборат натрію (0,0022моль). Суміш доводять до кімнатної температури, потім перемішують протягом 1 годин, виливають у воду з льодом та екстрагують ДХМ. Органічний шар відокремлюють, осушають (MgSО4), фільтрують та розчинник випаровують. Залишок (0,8г) очищають хроматографією на колонці з силікагелем (15-40мкм) (елюент: ДХМ/МеОН/ΝН 4ОН, Приклад В7 Синтез Суміш проміжної сполуки 10 (0,0042моль) та 2нафталінкарбоксальдегіду (0,005моль) у 1,2дихлоретані (10мл) перемішують при 50°С протягом 3 годин, а потім охолоджують до кімнатної температури. Додають порціями NaBH(OAc)3 (0,0055моль). Суміш перемішують при кімнатній температурі протягом 2 годин. Додають воду. Суміш екстрагують ДХМ. Органічний шар відокремлюють, осушають (MgSO4), фільтрують та розчинник випаровують до сухого залишку. Залишок (2г) розводять у CH3CN/DIPE. Осад відокремлюють на фільтрі та висушують, одержуючи 1,2г (75%) проміжної сполуки 28, точка плавлення 147°С. Проміжну сполуку 28 обробляють аналогічно тому, як описано у Прикладі В4, одержуючи 0,724г (88%) сполуки 6 (·0,83 CF3COOH), точка плавлення 260°С. Приклад В8 Синтез 47 78031 48 Розчин метансульфонату 2-нафталінетанолу (0,0029моль) у ацетонітрилі (3мл) додають при 5°С до суміші проміжної сполуки 10 (0,0024моль) та карбонату калію (0,0048моль) у ацетонітрилі (6мл). Суміш перемішують при кімнатній температурі протягом 18 годин, а потім перемішують та кип'я тять зі зворотним холодильником протягом ночі і охолоджують до кімнатної температури. Додають воду. С уміш фільтрують, промивають водою, а потім діетиловим ефіром та висушують, одержуючи 0,45г (48%) проміжної сполуки 29, точка плавлення 128°С. Проміжну сполуку 29 обробляють аналогічно тому, як описано у Прикладі В4, одержуючи 0,254г (86%) сполуки 7 (·0,79 CF3COOH), точка плавлення 209°С. Приклад В9 Синтез Проміжну сполуку 19 (0,05ммоль) обробляють TFA (2мл, у ДХМ/МеОН 1/1) протягом 10 днів при кімнатній температурі. Потім розчинники упарюють при кімнатній температурі під потоком азоту, після чого додають 1,4-діоксан та повторюють процедуру упарювання. Потім зразок висушують під потоком азоту протягом ночі при 40°С, одержуючи сполуку 8 (·CF3COOH). Приклад В10 Синтез Суміш проміжної сполуки 20 (0,001моль), морфоліну (0,0013моль) та карбонату калію (0,002моль) у ацетонітрилі (6мл) перемішують та кип'ятять зі зворотним холодильником протягом ночі, а потім охолоджують, виливають у воду з льодом та екстрагують EtOAc. Органічний шар відокремлюють, осушають (MgSO 4), фільтрують та розчинник випаровують. Залишок (0,79г) очищають хроматографією на колонці з силікагелем (10мкм) (елюент: ДХМ/МеОН/ΝН4ОН 96/4/0,1). Чисті фракції збирають та розчинник випаровують. Залишок (0,183г) кристалізують з DIPE. Осад відокремлюють на фільтрі та висушують, одержуючи 0,086г (47%) проміжної сполуки 30, точка плавлення 120°С. Проміжну сполуку 30 обробляють аналогічно тому, як описано у Прикладі В4, одержуючи 0,432г (87%) сполуки 9 (·0,47Η2Ο·1,99CF3COOH), точка плавлення 140°С. Приклад В11 Синтез Розчин TFA (5% у ДХМ/МеОH 1/1,2мл) додають до проміжної сполуки 23 і реакційну суміш перемішують протягом 5 днів при кімнатній температурі. Потім розчинники упарюють при кімнатній температурі у потоці азоту, після чого додають 1,4діоксан та повторюють процедуру концентрування. Потім зразок висушують у потоці азоту протягом ночі при 40°С, одержуючи сполуку 10 (·CF 3COOH). У Таблиці F-1 наведені сполуки, які були одержані згідно до одного з описаних вище Прикладів. У Таблицях використовувалися такі скорочення: ·C2HF3O 2 позначає трифлюорацетатну сіль. 49 78031 50 51 78031 52 (див. приклад С.4) може бути виміряна шляхом утворення іммобілізованого на фільтрі фосфоліпідного бішару штучної мембрани. При аналізі з іммобілізованою на фільтрі штучною мембраною створюється "сендвіч" з 96-лункового мікротитрувального планшета та 96-лункового фільтрувального планшета, гак що кожна складена лунка розділена на дві камери, у нижній з яких знаходиться донорний розчин, а у верхній - акцепторний розчин, розділені 125-мікропним мікрофільтрувальним диском (пори 0,45мкм), покритим 2% (мас/об.), додекановим розчином діолеоїлфосфатидилхоліну, в умовах, при яких усередині каналів фільтра при контакті системи з водним буферним розчином утворюються мультіламелярні бішари. Проникність сполуки крізь цю штучн у мембрану вимірюють у см/с. Метою аналізу є визначення проникності лікарських засобів крізь плоскопаралельну штучну мембрану при 2 різних значеннях рН: 4,0 та 7,4. Детектування сполуки здійснюють методом УФ-спектрометрії при оптимальній довжині хвилі від 250 до 500нм. Метаболізм лікарських засобів означає, що жиророзчинні ксенобіотичні чи ендобіотичні сполуки ферментативно трансформуються у (а) полярні водорозчинні та придатні для виведення метаболіт(и). Основним органом, що відповідає за метаболізм лікарських засобів, є печінка. Продукти метаболізму часто є менш активними, ніж вихідний лікарський засіб, чи інактивованими. Однак, деякі метаболіти можуть мати підвищену активність чи токсичні ефекти. Таким чином, метаболізм лікарського засобу може включати як процеси "детоксикації", так і "токсикації". Одна з основних ферментних систем, що визначають здатність організму перетворювати лікі та хімікати, представлена цитохром Р450-монооксигеназами. які є NADPHзалежними ферментами. Метаболічна стабільність сполуки може бути визначена in vitro з використанням субклітинних тканин людини (див. приклад С.5). Тут метаболічна стабільність сполуки виражається як % лікарського засобу, що зазнав метаболізму після 15 хвилин інкубування цих сполук з С. Фармакологічний приклад: мікросомами. Кількість сполуки вимірюють за доАналіз інгібування гістондезанетилази in vitro помогою аналізу методом РХ-МС. (див. приклад С.1) вимірює інгібування ферментаСупресор пухлини р53 транскрипційно активує тивної активноеті HDАС, що досягається при заряд генів, включаючи ген WAF1/CIP1, у відповідь стосуванні сполук формули (І). на ушкодження ДНК. Продукт гена WAF1 розміром Клітинну активність сполук формули (І) визна21кДа був знайдений у комплексі, що включає цичають на пухлинних клітинах А2780 з використанкліни, циклін-залежні кінази (CDKs) та ядерний ням колориметричного методу аналізу для визнаантиген проліферуючих клітин (PCNA) у нормальчення клітинної токсичності чи виживання них клітинах, але не в трансформованих клітинах і, [Mosmann Tim, Journal of Immunological Methods по-видимому, є універсальним інгібітором актив65: 55-63, 1983] (див. приклад С.2). ності CDK. Одним з наслідків зв'язування Кінетична розчинність у водному середовищі p21WAF1 з CDKs та його інгібування с поперевимірює здатність сполук залишатися у водному дження CDK-залежного фосфорилювання та порозчині при розведенні (див. приклад С.3). дальшої інактивації протеїну Rb, який має істотне Маточні розчини у ДМСО розводять одним возначення для розвитку клітинного циклу. Тому індним буферизованим розчинником у 3 послідовні дукування р21 WAF1 у відповідь на клітинний констадії. Для кожного розведення вимірюють муттакт з інгібітором НDAC (переконливим та специність за допомогою нефелометра. фічним індікатором інгібування розвитку клітинного Проникність лікарського засобу виражає його циклу в обох контрольних точках G1 та G2. здатність переміщатися з одного середовища до Здатність сполук індукувати p21WAF1 вимірюіншого чи крізь інше. Конкретніше, його здатність вали методом твердофазового імуноферментного проходити крізь кишкову мембрану до кровотоку аналізу р21WAF1 (WAF1 ELISA фірми Oneogene). та/або з кровотоку до органа-мішені. Проникність Аналіз р21WAF1 є "сандвіч" методом імуноферме 53 78031 54 нтного аналізу з використанням мишачих монокзниження кількості метаболітів до 50% від контролональних та кролячих поліклональних антитіл. льного досліда) методом пробіт-аналізу для граКроляче поліклональне антитіло, специфічне до дуйованих даних. Тут е фект дослідної сполуки протеїну WAF1 людини, було іммобілізованим на виражають як рІС 50 (негативний логарифм значенповерхні пластикових лунок, що входять до набоня величини ІС50). Всі дослідні сполуки виявили ру. Будь-який p21WAF, присутній у дослідному ферментативну активність у дослідній концентразразку, буде зв'язуватися з імобілізованим антитіції 10-5М, і 28 сполук мали рІС 50³5 (див. Таблицю лом. Біотинільоване ідентифікувальне моноклонаF-2). льне антитіло також розпізнає протеїн p21WAF1 Приклад С.2: Визначення антипроліферативлюдини і буде зв'язуватися з будь-яким p21WAF1, ної активності на клітинах А2780 що утримується імобілізованим антитілом. ІденВсі досліджувані сполуки розчиняли у ДМСО тифікувальнє антитіло, у свою чергу, зв'язується та робили подальші розведення у культуральному пероксидаза хрону-кон'югованим стрептавідином. середовищі. Кінцеві концентрації ДМСО при проПероксидаза хрону каталізує перетворення хромоведенні аналізів проліферації клітин ніколи не пегенного субстрату те траметилбензидину з безбарревищували 0,1% (об./об.). Контрольні зразки місвного розчину на синій розчин (або жовтий після тили клітини А2780 та ДМСО без сполук, а холості додавання зупиняючого реагента), інтенсивність досліди містили ДМСО без клітин. МТТ розчиняли забарвлення якого пропорційна кількості протеїну до концентрації 5мг/мл у фосфато-сольовому буp21WAF1, зв'язаного з планшетом. Кольоровий фері (PBS). Готували гліциновий буфер, який міспродукт реакції кількісно вимірюють за допомогою тить 0,1Μ гліцину та 0,1Μ NaCI, забуференого до спектрофотометра. Кількісне визначення здійснюpН 10,5 за допомогою NaOН (III) (всі реагенти фірють шляхом побудови калібрувальної кривої по ми Merck). відомим концентраціям p2FWAF1 (набір включає Клітин А2780 карциноми яєчників людини (даліофілізований зразок) (див. приклад С.6). рунок від Dr. T.C. HаmіІtоn [Fox Chase Cancer Приклад С.1: Аналіз інгібування гістондезацеCentre, Pennsylvania, USA]) культувують, у серетилази in vitro: довищі RPMI1640 з добавкою 2мМ 1-глуіаміну, Ядерні екстракти HeLa (постачальник: Biomol) 50мкг/мл гентаміцину та 10% сироватки плоду корови. Клітини звичайно утримують у вигляді моінкубують в кількості 60мкг/мл з 2´10-8Μ радіоміченого пептидного субстрату. Як субстрат для виміношарових культур при 37°С у зволоженій атмосрювання активності HDАС використовують синтефері з 5% СО2. Клітини пересівають раз на тичний пептид, а саме, амінокислоти 14-21 гістону тиждень з використанням розчину трипсин/BDT Н4. Субстрат біотинілюють з ΝН 2-термінального при коефіцієнті розведення 1:40. Всі середовища кінця за допомогою спейсера 6-аміногексанової та добавки були одержані від фірми Life кислоти, захищають з СООН-термінального кінця Technologies. Клітини не мали забруднення мікопамідною групою та специфічно [3Н]-ацетилюють по лазмою за результатами аналізу з використанням лізину 16. Субстрат, біотин-(6-аміногсксановий аналітичного набору Gen-Probe Mycoplasma Tissue радикал)-GIу-AIа-([3H]-ацетил-L ys-Arg-His-Arg-LysCulture (постачальник: BioMerieux). VaI-NH2), додають до буфера, що містить 25мМ Клітини висівають у 96-лункові культуральні Hcpcs, 1М цукрози, 0,1мг/мл BSA та 0,01% Triton планшети NUNCÔ (постачальник: Life Х-100 при рН 7,4. Через 30хв. реакцію дезацетиTechnologies) та залишають для адгезії до пластилювання зупиняють додаванням НСІ та оцтової ку на ніч. Щільність висівання на планшети - 1500 кислоти (кінцева концентрація 0,035мМ та 3,8мМ, клітин на лунку у загальному об'ємі середовища відповідно). Після зупинення реакції вільний 3Н200мкл. Після адгезії клітин до планшетів середоацетат екстрагують, етилацетатом. Пісня перемівище змінюють та додають лікарські засоби та/або шування та центрифугування, радіоактивність у розчинники до кінцевого об'єму 200мкл. Через чоаліквоті верхньої (органічної) фази підраховують тири дні інкубування середовище замінюють на за допомогою b-лічильника. 200мкл свіжого середовища і щільність та життєУ кожному експерименті проводять паралельні здатність клітин оцінюють шляхом проведення виміри для контрольних дослідів (які містять ядераналізу з використанням МТТ. До кожної лунки ний екстракт HеLa та ДМСО без сполуки), досліду додають 25мкл розчину МТТ і клітини інкубують з холостим інкубуванням (який містить ДМСО без далі протягом 2 годин при 37°С. Середовище поядерного екстракту НeLa чи сполуки) та зразків (які тім обережно відсмоктують і синій продукт МТТмістять сполуку, розчинену у ДМСО, та ядерний формазан солюбілізують шляхом додавання екстракт HeLa). У першу чергу проводять випробу25мкл гліцинового буфера, а потім 100мкл ДМСО. вання сполук у концентрації 10-5М. Якщо сполуки Мікротитрувальні планшети струшують протягом виявляють активність при 10-5М, то будують криву 10хв. на струшувачі для мікропланшетів і вимірюконцентрація-відповідь, для якої проводять випроють оптичну густину на 540нм за допомогою 96бування сполуки у концентраціях від 10-5М до 10лункового спектрофотометра Еmах (постачальник: 12 Μ. У кожному досліді віднімають значення для Sopachem). При проведенні експеримента резульхолостого досліду з величин, одержаних для конттати для кожного набору експериментальних умов рольного досліду та зразків. Контрольний зразок визначаються як середнє для 3 лунок з паралельвідповідає 100% дезацетилювання субстрату. Для ними дослідами. Для первинного скринінгу сполуки кожного зразка радіоактивність виражають у провипробовують при єдиній фіксованій концентрації центах від середнього значення для контрольних 10-6Μ. Для активних сполук експерименти повтодослідів. Якщо треба, обчислюють значення ІС 50 рюють з метою побудови повних кривих концент(концентрація лікарського засобу, потрібна для рація-відповідь. У кожному експерименті прово 55 78031 56 дять паралельно контрольні досліди (не містять Після проведення вимірів для холостою дослілікарських засобів) та дослід з холостим інкубуду па еталонному планшеті, додають до еталоннованням (не містить клітин чи лікарських засобів). го планшета по 150мкл розведених зразків, і Значення для холостого досліду віднімають з усіх 200мкл розведених зразків додають до донорного величин для контрольних та дослідних зразків. планшета 1. Акцепторний фільтрувальний планДля кожного зразка, середню величину клітинного шет 1 (постачальник: Millipore, тип: МАІР N45) має росту (в одиницях оптичної густини) виражають у нанесене покриття з 4мкл розчину для утворення процентах від середнього значення для клітинного штучної мембрани (1,2-діолеоїл-sn-гліцер-3росту контрольного зразка. Коли це було можливо, фосфо холін у додекані, що містить 0,1% 2,6-диобчислюють значення ІС 50 (концентрація лікарсьтрет-бутил-4-метилфенолу) та встановлюється кого засобу, погрібна для зменшення клітинного зверху на донорний планшет 1 для створення "серосту до 50% від контрольного досліду) методом ндвіча". Буфер (200мкл) дозують у розташовані пробіт-аналізу для градуйованих даних [Finney, зверху акценторні лунки. Сендвіч накривають D.J., Probit Analyses, 2 nd Ed., Chapter 10, Graded кришкою та вигримують протягом 18год. при кімResponses, Cambridge University Press, Cambridge натній температурну темряві. 1962]. Eфект дослідних сполук виражають тут як Вимірювання для холостого досліду на акцепрІС50 (величина негативного логарифму значення торному планшеті 2 проводять шляхом додавання IC50). Більшість дослідних сполук виявляють клів лунки 150мкл буферу з наступним проведенням тинну активність у дослідній концентрації 10-6М, а УФ-вимірів. Після проведення вимірів для холостого досліду на акцепторному планшеті 2 буфер ви9 сполук мають рІС 50³5 (див. Таблицю F-2). кидають і 150мкл акцепторного розчину переноПриклад С.3: Кінетична розчинність у водному сять з акцепторного фільтрувального планшета 1 середовищі На першій стадії розведення, 10мкл концентна акцепторний планшет 2. Потім акцепторний фільтрувальний планшет 1 видаляють із сендвіча. рованого маточного розчину активної сполуки, Після проведення вимірів для холостого досліду солюбілізованої у ДМСО (5мМ), додають до на донорному планшеті 2 (див. вище), 150мкл до100мкл фосфат-цитратного буфера, рН 7,4, та норною розчину переносять з донорного планшета перемішують. На другій стадії розведення, аліквоту (20мкл) першого розведення дозують до 100мкл 1 на донорний планшет 2. Здійснюють сканування УФ-спектрів для лунок донорного планшета 2, акфосфа т-цитратного буфера, рН 7,4, та перемішуцепторного планшета 2 та еталонного планшета ють. Зрештою, на третій стадії розведення, зразок (за допомогою SpectraMAX 190). Всі спектри обро(20мкл) другого розведення далі розводять у бляють з метою обчислення проникності з викори100мкл фосфат-цитратного буфера, рН 7,4, і а перемішують. Всі розведення здійснюють у 96станням комп'ютерної програми PSR4p Command. Виміри для всіх сполук проводять з трьома паралункових планшетах. Негайно після останньої сталельними дослідами. Як стандарти у кожному ексдії розведення вимірюють за допомогою нефелоперименті використовують карбамазепін, гризеометра мутність для трьох послідовних стадій розфулвін, ациклогуанізин, атенолол, фуросемід та ведення. Розведення здійснюють у трьох паралельних дослідах для кожної сполуки для хлортіазид. Сполуки розподіляють на 3 категорії як такі, що мають низьку проникність (середній ефект виключення випадкових помилок. На основі вимірів мутності проводять ранжування на 3 класи. середній ефект >0,5´10-6см/с; 2 бали) чи 3; для цих сполук розчин першого розведення с високу проникність (
ДивитисяДодаткова інформація
Назва патенту англійськоюHistone deacetylase inhibitors
Автори англійськоюPilatte Isabelle Noelle Constance, van Brandt Sven Franciscus Anna, Roux Bruno, Ten Holte Peter, Verdonck Marc Gustaaf Celine, Meerpoel Lieven
Назва патенту російськоюИнгибиторы гистондезацетилазы
Автори російськоюПилатт Изабель Ноэль Констанс, ван Брандт Свен Францискус Анна, Рю Бруно, Тен Хольте Петер, Вердонк Марк Густааф Селин, Меерпоель Ливен
МПК / Мітки
МПК: A61K 31/495, C07D 409/12, A61P 27/06, A61P 9/00, C07D 401/06, A61P 19/06, A61K 31/40, C07D 295/22, A61P 17/00, A61K 31/517, A61P 9/10, C07D 403/04, A61P 25/28, A61K 31/445, C07D 241/04, A61P 35/02, A61K 31/551, A61K 31/5377, A61P 17/06, A61P 25/00, A61P 29/00, C07D 249/12, C07D 317/58, A61K 31/506, A61K 31/4545, A61P 35/00, C07D 217/04, A61P 17/14, A61P 21/04, A61P 27/02, C07D 213/78, C07D 307/68, C07D 211/58, A61P 17/16, A61P 43/00, A61P 13/10, A61K 31/4427, A61P 37/04, A61P 37/08, C07D 207/14, C12Q 1/48, A61P 1/04, C07D 211/26, A61P 11/00, C07D 295/20, A61P 11/06, A61P 9/08, A61P 25/16, C07D 295/155, A61K 45/00, C07D 401/14, A61P 19/02, A61K 31/496, C07D 217/02, A61P 13/12, A61P 17/04, A61P 9/02, C07D 295/26, A61P 11/02, A61P 31/18, C07D 403/12, C07D 413/04, C07D 213/74, A61P 13/08, A61P 15/00, A61K 31/472, A61K 31/438, C07D 413/12, C07D 405/14, C07D 239/42, C07D 405/12, C07D 401/04, A61P 5/00, C07D 401/12, C07D 295/14, A61P 37/06, A61P 37/02, A61P 3/10, A61P 17/10, A61K 31/55, C07D 207/09, C07D 471/10
Мітки: інгібітори, гістондезацетилази
Код посилання
<a href="https://ua.patents.su/30-78031-ingibitori-gistondezacetilazi.html" target="_blank" rel="follow" title="База патентів України">Інгібітори гістондезацетилази</a>
Попередній патент: Обертове з’єднання трубопроводів та гідроапаратури
Наступний патент: Сульфонілпохідні як інгібітори гістондезацетилази
Випадковий патент: Шарошечне долото