Пептидоміметик з фотоконтрольованою біологічною активністю
Номер патенту: 113685
Опубліковано: 27.02.2017
Автори: Комаров Ігор Володимирович, Афонін Сергій Едуардович, Михайлюк Павло Костянтинович, Ульріх Анне, Бабій Олег Петрович
Формула / Реферат
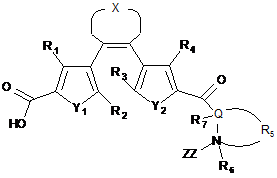
1. Сполука-пептидоміметик, представлена загальною формулою Іа, і її солі:
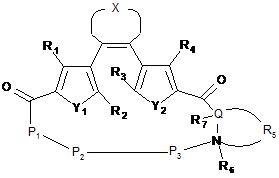 , Ia
, Ia
де R1 та R4 незалежно вибирають з Н-, алкіл-, алкеніл-, алкініл-, алкокси-, арил-, гетероарил, ціано-, нітро-, фосфатної, сульфоксильної груп;
R2 та R3 незалежно вибирають з алкіл-, алкеніл-, алкініл-, алкокси-, арил-, гетероарил, ціано-, нітро-, фосфатної, сульфоксильної груп;
X означає -(CHxFy)z-, де х+у=2, х = 0, 1 чи 2, у = 0, 1 чи 2, z=2, 3, чи 4;
Y1 та Y2 незалежно вибирають з S, SO2, N, N-алкіл чи О;
Р1 та Р3 кожний незалежно є залишком амінокислоти чи поліпептидною послідовністю з двох чи більше залишків амінокислот;
Р2 - відсутній або є залишком амінокислоти чи поліпептидною послідовністю з двох чи більше залишків амінокислот;
Q є C чи N;
R5 вибирають з Н-, алкіл-, гетероалкіл-, алкеніл-, гетероалкеніл-, алкініл-, гетероалкінілгруп і є зв'язаним з Q, чи може утворювати кільце разом з Q та N, або R5 є відсутнім;
R6 вибирають з Н-, алкіл-, гетероалкіл-, алкеніл-, гетероалкеніл-, алкініл-, гетероалкініл-, алкокси-, арил-, гетероарилгруп чи є відсутнім, та
R7 вибирають з Н-, бічної групи амінокислоти, алкіл-, гетероалкіл-, алкеніл-, гетероалкеніл-, алкініл-, гетероалкініл-, алкокси-, арил-, гетероарилгруп;
за умови, якщо Р2 відсутній, Р1 та Р3 є незв'язаними одне з одним;
за умови коли Q є N, R5 відсутній та
за умови, коли R5 утворює кільце разом з Q та N, R6 відсутній.
2. Сполука-пептидоміметик, представлена загальною формулою Iб, і її солі,
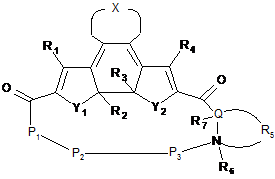 , Iб
, Iб
де R1-R4, X, Y1, Y2 та Р1-Р3, Q, R5-R7 є такими ж, як визначено в п. 1, за умови, якщо Р2 відсутній, Р1 та Р3 є не зв'язаними одне з одним, за умови, що Q є N, R5 є відсутнім, і за умови, коли R5 утворює кільце з Q та N, R6 відсутній.
3. Сполука-пептидоміметик, що визначена відповідно до пп. 1, 2, де R1 та R4 незалежно вибрані з Н чи С1-С6 алкільних груп, R2 та R3 є незалежно вибраними з метильної групи і етильної групи, а X є -СН2СН2СН2- чи -CF2CF2CF2-.
4. Сполука-пептидоміметик відповідно до будь-якого з пп. 1, 2, 3, де кожна з груп R1 та R4 є Н, R2 та R3 є метильною групою, X є -СН2СН2СН2- чи -CF2CF2CF2-, і кожний з Y1 та Y2 є S.
5. Сполука-пептидоміметик відповідно до п. 1, представлена наступними формулами GS-Sw(LF), GS-Sw(FP) і GS-Sw(PV):
 ,
,
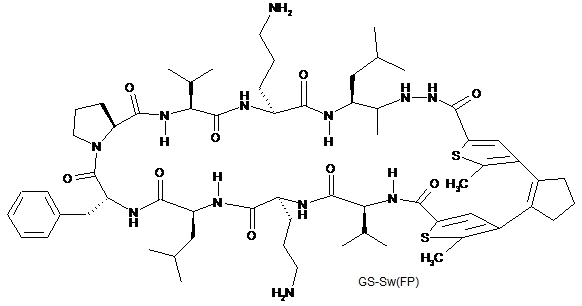 ,
,
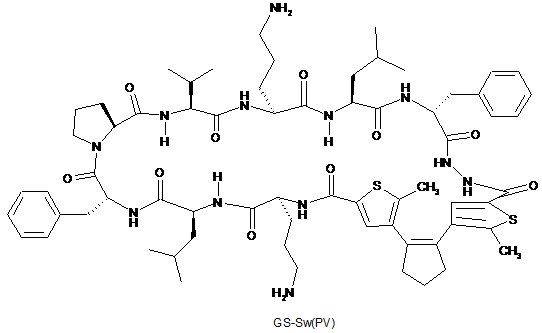 .
.
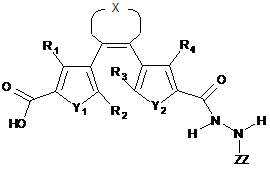
6. Проміжна сполука, представлена загальною формулою II, чи її солі, що використовуються для синтезу сполуки-пептидоміметику, відповідно до будь-якого з пп. 1-5:
 , II
, II
де ZZ означає захисну групу;
R1 та R4 незалежно вибирають з Н-, алкіл-, алкеніл-, алкініл-, алкокси-, арил-, гетероарил, ціано-, нітро-, фосфатної, сульфоксильної груп;
R2 та R3 незалежно вибирають з алкіл-, алкеніл-, алкініл-, алкокси-, арил-, гетероарил, ціано-, нітро-, фосфатної, сульфоксильної груп;
X означає -(CHxFy)z-, де х+у = 2, х = 0, 1 чи 2, у = 0, 1 чи 2, z=2, 3, чи 4;
Y1 та Y2 незалежно вибирають з S, SO2, N, N-алкіл чи О;
Q є С чи N;
R5 вибирають з Н-, алкіл-, гетероалкіл-, алкеніл-, гетероалкеніл-, алкініл-, гетероалкінілгруп і є зв'язаним з Q, чи може утворювати кільце з Q та N, або R5 є відсутнім;
R6 вибирають з Н-, алкіл-, гетероалкіл-, алкеніл-, гетероалкеніл-, алкініл-, гетероалкініл-, алкокси-, арил-, гетероарилгруп чи є відсутнім, та
R7 вибирають з Н-, бічної групи амінокислоти, алкіл-, гетероалкіл-, алкеніл-, гетероалкеніл-, алкініл-, гетероалкініл-, алкокси-, арил-, гетероарилгруп;
за умови, коли Q є N, R5 відсутній, та
за умови, коли R5 утворює кільце разом з Q та N, R6 відсутній.
7. Проміжна сполука відповідно до п. 6, де ZZ вибирають з t-бутоксикарбоніл- (Вос) і флуоренілметоксикарбоніл (Fmoc).
8. Проміжна сполука відповідно до п. 6 або 7, де R1 та R4 незалежно вибирають з Н та С1-С6алкільних груп, R2 і R3 незалежно вибираються з метильної та етильної груп, і X є -СН2СН2СН2- або -CF2CF2CF2-.
9. Проміжна сполука відповідно до пп. 6-8, де кожна з R1 та R4 є Н, кожна з R2 та R3 є метильною групою, X є -СН2СН2СН2- чи -CF2CF2CF2-, і кожний з Y1 та Y2 є S.
10. Метод виробництва проміжних сполук ІІ-1 чи їх солей, визначених в пп. 6-9, представлених загальною формулою II, де Q є N, R6 тa R7 є Н і R5 відсутній:
 ,
,
де ZZ означає захисну групу;
R1 та R4 незалежно вибирають з Н-, алкіл-, алкеніл-, алкініл-, алкокси-, арил-, гетероарил, ціано-, нітро-, фосфатної, сульфоксильної груп;
R2 та R3 незалежно вибирають з алкіл-, алкеніл-, алкініл-, алкокси-, арил-, гетероарил, ціано-, нітро-, фосфатної, сульфоксильної груп;
X означає -(CHxFy)z-, де х+у = 2, х = 0, 1 чи 2, у = 0, 1 чи 2, z=2, 3, чи 4;
Y1 та Y2 незалежно вибирають з S, SO2, N, N-алкіл чи О;
що складається з таких стадій:
а) розчинення дикарбонової кислоти загальної формули IIІ-1, реагенту сполучення, основи та ZZ-гідразину в розчиннику;
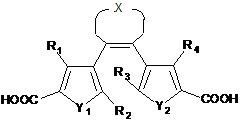 , III-1
, III-1
де кожна з R1-R4, X, Y1 та Y2 є такими, як визначено вище;
б) перемішування суміші протягом часу від 30 хвилин до 24 годин;
в) вливанням реакційної суміші у надлишок води для отримання сполуки формули ІІ-1 чи відповідних солей у вигляді осаду; та
г) необов'язково розчинення осаду в органічному розчиннику та промивання розчину водним бікарбонатом натрію і розчином хлориду натрію.
11. Метод відповідно до п. 10, де
розчинник вибирають з диметилформаміду, диметилсульфоксиду, гексаметилфосфотриаміду; і/або
захисну групу вибирають з t-бутоксикарбоніл- (Вос) і флуоренілметоксикарбоніл (Fmoc); і/або
реагент сполучення вибирається з карбодіімідів, TBTU, HBTU, HATU та РуВор; і/або основу вибирають з триетиламіну і діізопропілетиламіну.
12. Використання молекулярної системи, що фотоперемикається, що зображена на наступній схемі, включаючи загальну формулу IVa та IVб, як фрагмента у фармацевтично і/або діагностично активній сполуці, що дозволяє її перемикання між активованим та неактивованим станами:
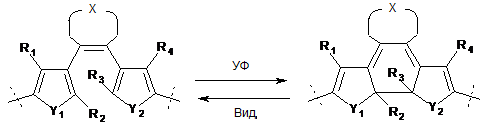
IVa IVб ,
де R1 та R4 незалежно вибирають з Н-, алкіл-, алкеніл-, алкініл-, алкокси-, арил-, гетероарил, ціано-, нітро-, фосфатної, сульфоксильної груп;
R2 та R3 незалежно вибирають з алкіл-, алкеніл-, алкініл-, алкокси-, арил-, гетероарил, ціано-, нітро-, фосфатної, сульфоксильної груп;
X означає -(CHxFy)z-, де х+у = 2, х = 0, 1 чи 2, у = 0, 1 чи 2, z=2, 3, чи 4;
Y1 та Y2 незалежно вибирають з S, SO2, N, N-алкіл чи О.
13. Сполука-пептидоміметик відповідно до будь-якого з пп. 1-5 для використання в медицині.
14. Сполука-пептидоміметик відповідно до будь-якого з пп. 1-5 для використання як антибактеріального агента.
15. Сполука-пептидоміметик відповідно до будь-якого з пп. 1-5 для використання в методах лікування розладів, вибраних з вірусних, бактеріальних, паразитних чи грибкових інфекцій, запалень, ран, крововиливів, гіперпластичних, неопластичних, склеротичних, тромботичних чи некротичних розладів.
Текст
Реферат: Винахід належить до фармацевтично і/або діагностично активних сполук, пептидоміметиків, перехід між активним і неактивним станом яких можна зворотно здійснювати шляхом опромінення світлом різної довжини хвиль, а також проміжної сполуки, що використовується у UA 113685 C2 (12) UA 113685 C2 виробництві таких фармацевтично і/або діагностично активних сполук, а також до методу їх одержання. UA 113685 C2 5 10 15 20 25 30 35 40 45 Даний винахід стосується фармацевтично і/або діагностично активних сполук, зокрема аналогів пептидів (пептидоміметиків), перехід між активним і неактивним станом яких можна оборотно здійснювати шляхом опромінення світлом різної довжини хвиль. Даний винахід також стосується проміжних сполук, що використовуються у виробництві таких фармацевтично і/або діагностично активних сполук, а також методу їх виробництва. Однією з головних проблем у хіміотерапії та у діагностиці є обмежена специфічність фармацевтично і/або діагностично активних сполук, які можуть спричинити небажані побічні ефекти, особливо в здорових ділянках тканин чи біологічних рідинах пацієнта. Результатом цих побічних ефектів є низькі терапевтичні індекси, що обмежує ефективне використання відповідних лікарських засобів. Тому були прикладені зусилля задля знаходження таких лікарських засобів, які б діяли специфічно у місцях бажаного застосування, таких як локалізовані вірусні, бактеріальні, грибкові чи паразитні інфекції, запалення, рани, крововиливи, чи гіперпластичні, неопластичні, склеротичні, тромботичні і некротичні розлади. Одна з концепцій досягнення цієї мети полягає у дизайні таких лікарських засобів, які переважно накопичуються у цільових тканинах, так, що їхня концентрація, а через це - і небажані побічні ефекти, були б значно знижені в здорових тканинах чи біологічних рідинах. Інший підхід до зменшення вказаних вище побічних ефектів і збільшення терапевтичного індексу лікарського засобу полягає у введенні неактивної форми лікарського засобу, наприклад, у вигляді проліку, і перетворенні вказаної неактивної форми у бажаному місці його дії, використовуючи, наприклад, електромагнітне випромінювання. Наприклад, в літературі були описані пептидоміметики, біологічну активність яких можна змінювати світлом різної довжини хвиль [Willner, I; Rubin, I. Control of the structure and functions of biomaterials by light. Angew. Chem. Int. Ed. Engl. 1996, 35, 367-385]. Більшість з цих пептидоміметиків містять азобензенові фотоізомеризуючі фрагменти (Схема 1), які можуть змінювати свою конформацію з термодинамічно більш стабільної транс- на менш стабільну цисконформацію при експозиції до ультрафіолетового світла, та з цис- на транс- – під дією опромінення при експозиції до видимого світла. Схема 1. Фоточутливі пептидоміметики - похідні азобензену, загальна формула. Молекулярний фрагмент, здатний оборотно ізомеризуватися під дією світла (між пунктирними лініями), вбудований у поліпептидний ланцюг (РР). Фотоізомеризація азобензенових фрагментів приводить до зміни в загальній будові і біологічній активності відповідних пептидоміметиків. Недоліком пептидоміметиків, що містять азобензеновий фрагмент, є термічна нестабільність цього фоточутливого фрагменту: цисконфігурація азобензенового залишку перетворюється на транс- не тільки при освітленні видимим світлом, а також і спонтанно при кімнатній температурі (10-30 °C). Іншими недоліками пептидоміметиків - похідних азобензену - є їх низька ефективність фотоконверсії, низька фотостабільність та потенційна токсичність [Н. Mori, Υ. Mori, S. Sugie, N. Yoshimi, M. Takahashi, H. Ni-i, H. Yamazaki, K. Toyoshi, G. M. Williams. Genotoxicity of a variety of azobenzene and aminoazobenzene compounds in the hepatocyte/DNA repair test and the Salmonella/mutagenicity test. Cancer Res. 1986, 46, 1654-1658]. Принцип фотоактивації біологічної активності був також використаний в так званих "замкнених пептидах" ("caged peptides") [Yasushi Shigeri, Yoshiro Tatsu, Noboru Yumoto. Synthesis and application of caged peptides and proteins. Pharmacology & Therapeutics 2001, 91, 85-92]. "Замкнені пептиди" містять ковалентно зв'язані групи, які швидко відщеплюються при опроміненні світлом певної довжини хвиль. Зв'язування з фотолабільною групою робить молекулу інертною до тих пір, поки фотоліз не перетворить її в біологічно активне похідне. Коли "замкнені пептиди" необхідно активувати, різке зростання концентрації біологічно активних речовин може бути досягнуто миттєво в обмеженій частині простору за допомогою імпульсного і 1 UA 113685 C2 5 10 15 20 25 30 35 40 сфокусованого випромінювання певної довжини хвиль. Фотоактивація "замкнених пептидів" є необоротною. Вона може привести не лише до бажаної біологічної активності (наприклад, антимікробної, антинеопластичної, імуностимулюючої чи модулюючої дію ензимів), а також і до деяких небажаних ефектів (наприклад, токсичних, запальних чи стрес-індукуючих), які можуть спричиняти побічні ефекти при використанні пептидів як хемотерапевтичних засобів. Тому необхідна розробка стратегій видалення сполуки після терапії. Всі вищеназвані сполуки мають низку недоліків, такі як термічна нестабільність, низька ефективність конверсії, низька фотостабільність та потенційна токсичність. Як наслідок, постійно існує потреба в нових сполуках, які б уникали описані вище проблеми і дозволяли б специфічно лікувати локалізовані розлади. Таким чином, підґрунтям для даного винаходу є проблема створення фармацевтично і/або діагностично активних сполук, таких як пептидоміметики, які дозволяють ефективне і оборотне перетворення між їхніми фармацевтично і/або діагностично активною та неактивною формами, та які є термічно стабільними в обидвох формах та стійкими до фотодеструкції і дії протеаз. Ця проблема розв'язується, відповідно до даного винаходу, шляхом створення сполукипептидоміметику загальної формули Іа чи її солей, що є першим аспектом даного винаходу, де R1 та R4 незалежно обираються з Н-, алкіл-, алкеніл-, алкініл-, алкокси-, арил-, гетероарил, ціано-, нітро-, фосфатної, сульфоксильної груп, чи будь-яких інших довільно заміщених груп; R2 та R3 незалежно обираються з алкіл-, алкеніл-, алкініл-, алкокси-, арил-, гетероарил, ціано-, нітро-, фосфатної, сульфоксильної груп, чи будь-яких інших довільно заміщених груп; X означає -(CHxFy)z-, де х+у=2, х=0, 1 чи 2, у=0, 1 чи 2, та z=2, 3 чи 4; Υ1 та Υ2 незалежно обираються з S, О та N, чи їх похідних, таких як SO2 чи N-алкіл; Р1 та Р3 кожний незалежно є залишком амінокислоти чи поліпептидним ланцюгом з двох чи більше залишків амінокислот; Р2 - відсутній або є залишком амінокислоти чи поліпептидним ланцюгом з двох чи більше залишків амінокислот; Q є С чи Ν; R5 обирається з Η-, алкіл-, гетероалкіл-, алкеніл-, гетероалкеніл-, алкініл-, гетероалкінілгруп і є зв'язаним з Q, чи може утворювати кільце разом з Q та Ν, або R5 є відсутнім; R6 обирається з Н-, алкіл-, гетероалкіл-, алкеніл-, гетероалкеніл-, алкініл-, гетероалкініл-, алкокси-, арил-, гетероарил- груп чи є відсутнім, та R7 обирається з Н-, бічної групи амінокислоти, алкіл-, гетероалкіл-, алкеніл-, гетероалкеніл-, алкініл-, гетероалкініл-, алкокси-, арил-, або гетероарил- груп; За умови, якщо P2 відсутній, Р1 та Р3 є незв'язаними одне з одним; За умови коли Q є N, R5 відсутній та за умови, коли R5 утворює кільце з Q та N, R6 відсутній. Відповідно до даного винаходу, пептидоміметики формули Іа додатково включають в себе всі можливі стерео- та регіоізомери по відношенню до положення груп R5, R6, R7, Q, Р1, Р2, Р3. В подальшому, загальна група 2 UA 113685 C2 5 буде йменуватися "лінкерна група". Відповідно до даного винаходу, R5 є моновалентною групою, зв'язаною з Q або є бівалентною групою, що може утворювати кільце разом з Q та N. Як такий, структурний фрагмент 10 включає обидва визначені вище випадки, де R5 є зв'язаною з Q як моновалентна група, чи з'єднує містком Q та N з утворенням кільця, яке містить Q, R5, та N. Тому, показаний вище структурний елемент може бути відображений як дві індивідуальні форми, які він може представляти: 15 Наприклад, R5 може бути Η в лінкерній групі, що представляє амінокислоту валін, чи може утворювати кільце разом з Q та Ν, наприклад, у лінкерній групі, що представляє амінокислоту пролін. В останньому випадку, де R5 утворює кільце разом з Q та N, R6 є відсутньою. Приклади наведено нижче: Тут група R6 зв'язана з Ν, або, коли R5 утворює кільце разом з Q та N, є відсутньою. 20 25 Відповідно до даного винаходу, група R7 є зв'язаною з Q і може, зокрема, представляти бічну групу амінокислоти. У цьому контексті, термін "бічна група амінокислоти" не є особливо обмеженим і включає бічні групи неприродних і природних амінокислот. Відповідно до переважного втілення даного винаходу, R7 представляє бічну групу природної амінокислоти, таку як гідроксиметильна група (серин) чи ізопропільна група (валін). Даний винахід додатково влючає всі стереоізомери групи Q, тобто, наприклад, коли R7 представляє бічну групу амінокислоти, відповідні D- та L-конфігурації містяться в рамках даного винаходу. 3 UA 113685 C2 5 Відповідно до прикладу, якому надається особлива перевага, R1 та R4 є Н. Відповідно до іншого прикладу, якому надається особлива перевага, R2 та R3 є метильними групами. Відповідно до іншого прикладу, якому надається особлива перевага, X є -СН2СН2СН2- або CF2CF2CF2-. Відповідно до іншого прикладу, якому надається особлива перевага, Y1 та Y2 є S. Відповідно до іншого прикладу, якому надається особлива перевага, Q є С. Відповідно до іншого прикладу, якому надається особлива перевага, Q є N, R6 та R7 є Н, a R5 є відсутнім. Відповідно до наступного переважного втілення даного винаходу, Q є С, R5 є Η та R7 є бічною групою амінокислоти. Предметом даного винаходу є сполуки-пептидоміметики загальної формули Iб чи їх солі, 10 15 20 25 30 де R1-R4, Χ, Υ1, Υ2, Р1-Р3, Q, та R5-R7 є такими ж, як описано вище, за умови, якщо P2 відсутній, Р1 та Р3 є незв'язаними одне з одним, за умови, що Q є N, R5 є відсутнім, і за умови, коли R5 утворює кільце разом з Q та N, R6 відсутній. Визначена вище сполука-пептидоміметик, зображена формулою Iб, додатково до того, що було вказано вище для формули Іа, включає в себе також всі можливі стереоізомери, що відповідають положенню груп R2 тa R3. Відповідно до даного винаходу, вищевизначені сполуки Іа та Iб представляють дві ізомерні форми, що взаємно перетворюються, вони можуть бути перетворені одна в одну опроміненням світлом різних довжин хвиль і існують в "закритій" та "відкритій" формах (див. наступну схему 2). Важливо, що "відкрита" форма є більш рухливою, ніж конформаційно утруднена "закрита" форма. Схема 2. Діарилетиленова молекулярна система, що фотоперемикається, вбудована в поліпептидний ланцюг. Це досягається вбудовуванням в поліпептидний ланцюг діарилетиленової молекулярної системи, що фотоперемикається, яка показана на наступній схемі 3, причому активністю вказаних сполук-пептидоміметиків можна ефективно керувати. 4 UA 113685 C2 Схема 3. Діарилетиленова фотоперемикається. 5 10 15 20 25 30 35 40 45 50 молекулярна система (між пунктирними лініями), що Вирази "молекулярна система, що фотоперемикається", "фрагмент, що фотоперемикається", "будівельний блок, що фотоперемикається", "діарилетиленовий фрагмент, що фотоперемикається", "діарилетиленова група, що фотоперемикається" тут використовуються як синонімічні і відносяться до діарилетиленового фрагмента, що може взаємоперетворюватися, як показано вище на схемі 3, і може існувати у згаданих вище "відкритій" або "закритій" формах. Відповідно до даного винаходу, фотоізомеризація фотоперемикаючого діарилетиленового фрагменту з "відкритої" в "закриту" форму може бути здійснена опроміненням ультрафіолетовим (УФ) світлом. Наприклад, перетворення "відкритої" форми в "закриту" форму може бути проведено опроміненням світлом, що має довжину хвиль в діапазоні від 100 до 500 нм, таку як 200-300 нм, 250-380 нм, чи 300-500 нм, залежно від конкретної хімічної природи фотоперемикача. З іншого боку, фотоізомеризація діарилетиленового фрагменту, що фотоперемикається з "закритої" у "відкриту" форму може бути здійснена опроміненням світлом з більшою довжиною хвилі, таким як видиме (Вид) чи інфрачервоне, залежно від конкретної хімічної природи фотоперемикача. Наприклад, перетворення "закритої" форми у "відкриту" форму може бути проведено опроміненням світлом, що має довжину хвиль в діапазоні від 300 до 12000 нм, таку як 300-400 нм, 350-8000 нм, чи 500-5000 нм. Відповідно до втілення даного винаходу, якому надається перевага, перетворення "відкритої" форми в "закриту" форму можна провести опроміненням світлом з довжиною хвилі в інтервалі від 380 до 740 нм, такому як 420680 нм, 480-600 нм. Термін "пептидоміметик" вживається тут без особливих обмежень і в загальному випадку включає як циклічні, так і лінійні сполуки, що містять діарилетиленовий фрагмент, що фотоперемикається, як частину поліпептидного ланцюга, та один чи більше залишків природних чи неприродних амінокислот, і які проявляють-фармацевтичну і/або діагностичну активність в одній з їхніх "закритих" чи "відкритих" форм. Наприклад, відповідно до даного винаходу, пептидоміметики можуть базуватися на природних чи штучних пептидах, що були змінені, наприклад модифікацією, видаленням і/або включенням одного чи більше залишків амінокислот. Вираз "фармацевтично і/або діагностично активний" вживається тут без особливих обмежень і включає в себе будь-яку активність, яка може бути використана в терапії, профілактиці чи діагностиці розладів у пацієнта, таку як антимікробна, антивірусна, протигрибкова, протипаразитна, антипроліферативна, цитостатична, цитотоксична, цитолітична, протипухлинна, протиревматична, кардіоваскулярна, контролююча репродуктивні функції, жарознижуюча/жарогінна, активаційна, інгібіторна, агоністична, антагоністична, сенсибілізуюча, чи активність, що дозволяє візуалізацію специфічних тканин чи біологічних рідин, наприклад, шляхом забарвлення, чи отримання зображень в методах медичної візуалізації.Вирази "фармацевтично активний" та "біологічно активний" вживаються тут як синоніми. Відповідно до даного винаходу, визначені вище сполуки-пептидоміметики можуть в загальному випадку базуватися на будь-якому підходящому пептиді-шаблоні, наприклад, на бета-шпильках чи петлях, включно з лінійними чи циклічними пептидами-антибіотиками, такими як граміцидин С, різні тироцидини, поліміксини (наприклад, поліміксин Б), бацитрацини, актиноміцини, тахіплезіни, протергіни, поліфемузини, дефензини, антимікробні глікопептиди (наприклад, ванкоміцин), лантибіотики (наприклад, нізин), ліпопептидні антибіотики (наприклад, даптоміцин); протипухлинні пептиди, такі як гомезин, лактоферіцин Б і криптофіцини; імуносупресорні циклоспорини; гепатотоксичні мікроцистини; протигрибкові лаксафіцини; противірусні (йонофори) валіноміцин і інші (бактеріостатичні) стрептограміни; інгібітори ензимів, такі як циклотеонаміди, інгібітори трипсину соняшника, мікропептини, аманітини, мікровірідини; 5 UA 113685 C2 5 10 15 20 25 30 35 40 45 50 55 інтегрин-антагоністичні RGD-пептиди; антиангіогенічні NGR-пептиди; фосфопептиди, що зв'язуються з SН2-доменами; пептидні гормони (наприклад, соматостатин, окситоцин, меланінконцентруючий гормон); різні циклопептиди і їх похідні, і таке інше. Термін "алкіл" використовується тут для позначення залишку, що в загальному включає лінійний чи розгалужений вуглецевий ланцюг, який може бути також (необов'язково) заміщеним. Алкільна група є переважно С1-С12 алкільною групою, C1-C8 алкільною групою, C1-С6 алкільною групою, чи С1-С4 алкільною групою. Те ж саме визначення застосовується для термінів "алкеніл" та "алкініл", за виключенням того, що "алкеніл" включає в себе хоча б один подвійний зв'язок вуглець-вуглець, тоді як "алкініл" включає в себе хоча б один потрійний зв'язок вуглець-вуглець. Відповідно до даного винаходу, алкільні, алкенільні та алкінільні групи можуть бути також в циклічній формі. Під терміном "(необов'язково) заміщений" тут мається на увазі такий, що включає заміщення атома водню іншими функціональними групами чи радикалами, що (необов'язково) заміщені. Такими функціональними групами можуть бути аміногрупи, гідроксигрупи, галоген-, тіольні групи, алкільні групи, галоалкільні групи, гетероалкільні групи, арильні групи, арилалкільні групи, арилгетероалкільні групи, нітрогрупи, сульфогрупи та їх похідні, а також карбоксильні групи та їх похідні. Більше того, кожна із зазначених вище аміно-, гідрокси-, галоген-, тіол-, алкіл-, галоал-, гетероалкіл, арил-, арилалкіл-, арилгетероал-, нітро-, сульфаніл- і/або карбоксильна група може бути (необов'язково) заміщена. Вживаний тут термін "гетероалкіл" означає нормальний чи розгалужений ланцюг атомів вуглецю, а також моно- чи полікарбоцикли, що містить хоча б один гетероатом та може бути (необов'язково) заміщений. Прикладами таких гетероатомів є азот, кисень, фосфор та сірка. Гетероалкільні групи є переважно С1-С12 гетероалкільними групами, С1-C8 гетероалкільними групами, С1-С6 гетероалкільними групами, або С1-С4 гетероалкільними групами. Те ж саме визначення застосовується для термінів "гетероалкеніл" та "гетероалкініл", за виключенням того, що "гетероалкеніл" включає в себе хоча б один подвійний зв'язок вуглець-вуглець, тоді як "гетероалкініл" включає в себе хоча б один потрійний зв'язок вуглець-вуглець. Більше того, термін "арильна група" не є тут специфічно обмеженим і включає моно-, бі- та поліциклічні арильні групи, такі як феніл-, нафтил- і антрацильні групи, що можуть бути (необов'язково) заміщеними. Арильна група є переважно С3-С24 арильною групою, С5-С18 арильною групою чи С6-С12 арильною групою. Вживаний тут термін "гетероарил" не є специфічно обмеженим і включає моно-, бі- та поліциклічні арильні групи, які містять як мінімум один гетероатом і можуть бути (необов'язково) заміщеними. Гетероарильна група є переважно С3-С24 гетероарильною групою, С5-С18 гетероарильною групою чи С6-С12 гетероарильною групою. Термін "амінокислота" не є тут специфічно обмеженим і включає будь-які природні чи неприродні амінокислоти, а також будь-які інші сполуки, що містять хоча б одну аміногрупу та хоча б одну карбоксильну групу, наприклад, для утворення пептидного зв'язку. Відповідно до даного винаходу, кожний з Р1, Р2 і Р3 незалежно означає амінокислотний залишок чи послідовність з двох чи більше залишків амінокислот, таку як послідовність від 2 до 36 залишків амінокислот, 4-30 залишків амінокислот, чи від 6 до 24 залишків амінокислот, які зв'язані між собою пептидними зв'язками. Кількість залишків амінокислот, що утворюють кожний з Ρ1, Р2 і Р3 може бути однаковою чи різною. Наприклад, кожний з Р1-Р3 може містити 3 залишки амінокислот, або Ρ1 може містити 2 залишки амінокислот, а кожен з Р 2 та Р3 може містити 3 чи 4 залишки амінокислот. Більше того, відповідно до даного винаходу, групи Р1, Р2 і Р3, наприклад, взяті разом як -Р1Р2-Р3-, можуть переважно утворювати одиночну нерозривну пептидну послідовність з довжиною від 6 до 78 залишків амінокислот, таку як від 8 до 48 залишків амінокислот, від 10 до 36 залишків амінокислот, чи від 12 до 30 залишків амінокислот. У випадку, коли Р 2 відсутній, кожний з Ρ1 та Р3 можуть бути пептидними послідовностями одинакової чи різної довжини і/або вторинної структури, наприклад, містити пептидні ланцюги довжиною від 2 до 36 залишків амінокислот, від 4 до 30 залишків амінокислот, від 6 до 24 залишків амінокислот. В даному винаході, Р1, Р2 та Р3 можуть містити тільки природні залишки амінокислот, чи можуть містити хоча б одну неприродну амінокислоту, таку як D-енантіомери альфа-амінокислот чи бета-, гамма- чи заміщені амінокислоти, чи амінокислоти з модифікованоючи ізомеризованою бічною групою. Вираз "Р1 та P3 не зв'язані одне з одним" тут означає, що кінцеві амінокислотні залишки Р 1 та Р3 не поєднані одне з одним ковалентними зв'язками. Наприклад, кінцеві амінокислотні залишки, як Р1, так і Р3, можуть мати вільну аміногрупу, ацильовану чи заміщену іншим чином 6 UA 113685 C2 5 10 15 20 25 30 35 40 45 50 групу, вільну карбоксильну групу, амідну чи іншим чином довільно заміщену групу, чи їхні солі/йони. В іншому втіленні винаходу, сполуки-пептидоміметики, що були визначені вище, можуть мати групи R1 та R4 незалежно обрані з Η чи С1-С6 алкільних груп, R2 та R3 є незалежно вибраними з метальної групи або етильної групи, а X є СН2СН2СН2- чи -CF2CF2CF2-. Відповідно до конкретного втілення даного винаходу, у сполуках-пептидоміметиках, що були визначені вище, кожна з груп R1 та R4 є Н, R2 та R3 є метильною групою, X є -СН2СН2СН2- чи CF2CF2CF2-, і кожний з Y1 та Y2 є S. Відповідно до конкретного втілення даного винаходу, у вищевизначених сполукахпептидоміметиках Q є С. Відповідно до іншого конкретного втілення даного винаходу, у вищевизначених пептидоміметиках Q є N, R6 та R7 є Н, і R5 відсутній. Відповідно до конкретного втілення даного винаходу, вищеозначені сполукипептидоміметики представлені формулами GS-Sw (LF), GS-Sw (FP)iGS-Sw (PV), як показано у формулі винаходу, п. 5. У даному винаході, діарилетиленовий фрагмент, що фотоперемикається, може бути міметиком двох чи більше послідовних залишків амінокислот (переважно альфа-амінокислотних залишків з незарядженою бічною групою), таким чином, пептидоміметики з фотоконтрольованою фармацевтичною і/або діагностичною активністю можуть бути отримані шляхом вбудовування діарилетиленового фрагменту, що фотоперемикається в пептидипрототипи чи в інші шаблони, включаючи будь-які відомі природні або штучні фармацевтично, профілактично і/або діагностично активні пептиди замість одного чи декількох природних неполярних амінокислотних залишків. Бажано, щоб ці залишки були, але цим винахідне обмежено, частиною конформації пептидного ланцюга (альфа-, бета-, гамма-, дельта-вигинів тощо), оскільки в такому випадку структура діарилетиленового фрагменту, що фотоперемикається (в його "закритій" чи "відкритій" формі) може збігатися з пептидомшаблоном. Важливим є те, що в одній з фото-форм ("закритій" чи "відкритій") діарилетиленовий фрагмент збігається краще з пептидним ланцюгом в його біологічно активній конформації, так що структура і біологічна активність отриманого пептидоміметика близька до вихідної, коли введений фрагмент знаходиться саме в цій формі. Опромінення отриманого пептидоміметика світлом з довжинами хвиль, оптимальними для фотоізомеризації фрагмента приводить до значних змін в загальній структурі і конформаційній рухливості пептидоміметика, і, відповідно, в його фармацевтичній і/або діагностичній активності. Дією світла іншої довжини хвиль діарилетиленовий фрагмент, що фотоперемикається може ізомеризуватися назад в початкову форму (див. схеми 2 і 3 вище). Структура та відповідно фармацевтична і/або діагностична активність пептидоміметика може бути таким чином відновлена. Відповідно до даного винаходу, фотоізомеризація може бути проведена з однієї форми в іншу багато разів без фотодеструкції діарилетиленового фрагмента. "Закрита" та "відкрита" форми пептидоміметиків є стабільними в температурному інтервалі, оптимальному для більшості живих організмів (тобто, в інтервалі від 0 до 70 °C), так що вони можуть бути використані як фармацевтичні, профілактичні чи діагностичні агенти у відповідній формі, яка залишатиметься незмінною до тих пір, поки не буде ініційована фотоізомеризація локальним опроміненням світлом підходящої довжини хвиль. Базуючись на цій гнучкій системі, можливо специфічно лікувати чи діагнозувати бажаний фрагмент тіла, локалізовану тканину, ділянку тканини чи біологічну рідину шляхом введення пептидоміметику даного винаходу в його неактивній формі та опромінення відповідної ділянки у пацієнті світлом підходящої довжини хвиль для ізомеризації пептидоміметика у його активну форму. Відповідно до наступного аспекту, даний винахід стосується проміжної сполуки загальної формули II чи її солей, що використовуються для синтезу сполуки-пептидоміметику, яка описана вище: 7 UA 113685 C2 5 10 15 20 25 30 де ZZ означає захисну групу; R1 та R4 незалежно обираються з Н-, алкіл-, алкеніл-, алкініл-, алкокси-, арил-, гетероарил, ціано-, нітро-, фосфатної та сульфоксильної груп; R2 та R3 незалежно обираються з алкіл-, алкеніл-, алкініл-, алкокси-, арил-, гетероарил, ціано-, нітро-, фосфатної та сульфоксильної груп; X означає -(CHxFy)z-, де х+у=2, x=0, 1 чи 2, у=0, 1 чи 2, z=2-4; Υ1 та Υ2 незалежно обираються з S, О та N, SO2 чи N-алкіл; Q є С чи N; R5 обирається з Н-, алкіл-, гетероалкіл-, алкеніл-, гетероалкеніл-, алкініл-, гетероалкінілгруп і є зв'язаним з Q, чи може утворювати кільце разом з Q та N, або R5 є відсутнім; R6 обирається з Н-, алкіл-, гетероалкіл-, алкеніл-, гетероалкеніл-, алкініл-, гетероалкініл,алкокси-, арил-, гетероарил- груп чи є відсутнім, та R7 обирається з Н-, бічної групи амінокислоти, алкіл-, гетероалкіл-, алкеніл-, гетероалкеніл-, алкініл-, гетероалкініл-, алкокси-, арил-, гетероарил- груп; За умови коли Q є N, R5 відсутній, та За умови, коли R5 утворює кільце разом з Q та N, R6 відсутній. Відповідно до даного винаходу, проміжна сполука формули II додатково включає в себе всі можливі стерео- та регіоізомери по відношенню до груп R5, R6, R7 та Q. Відповідно до наступного втілення, даний винахід відноситься також до визначеної вище проміжної сполуки в її "закритій" формі. У такому випадку, зазначена проміжна сполука включає також, додатково до названих вище для «відкритої» форми всі можливі стерео- та регіоізомери, по відношенню до R2 та R3. Якщо не вказано інше, всі визначення, наведені вище, включаючи конкретні втілення R1-R4, X, Υ1та Y2, Q, R5-R7 стосуються також проміжної сполуки даного винаходу. В іншому втіленні даної проміжної сполуки як визначено вище, групи ZZ обираються з tбутоксикарбоніл- (Вос) і флуоренілметоксикарбоніл (Fmoc). Відповідно до іншого втілення даного винаходу, для проміжної сполуки, як визначено вище, групи R1 та R4 незалежно обираються з Η та С1-С6 алкільних груп, R2 і R3 незалежно обираються з метильної та етильної груп, і X є -СН2СН2СН2- або -CF2CF2CF2-. Відповідно до іншого втілення даного винаходу, у визначеній вище проміжній сполуці R1 та R4 є Н, кожна з R2 та R3 є метильною групою, X є СН2СН2СН2- чи -CF2CF2CF2-, і кожний з Y1 та Y2 є S. Відповідно до ще іншого втілення даного винаходу, у вищевизначеній проміжній сполуці Q є N, а R5 відсутній. Відповідно, визначена сполука представлена формулою ІІ-1: 35 8 UA 113685 C2 Відповідно до подальшого втілення даного винаходу, у вищевизначеній проміжній сполуці Q є С. Відповідно, зазначена сполука представлена формулою ІІ-2 наступним чином: 5 10 15 20 25 30 35 Приклади відповідних сполук загальної формули II-2, яким надається особлива перевага, показані на Фіг. 6 (сполуки 4а, 4б і 4в). Проміжна сполука II (що включає, наприклад, сполуки ІІ-1 і ІІ-2) інколи називається також "будівельним блоком"; вона сконструйована так, щоб замінити один чи більше залишків природних чи неприродних амінокислот в циклічному чи лінійному поліпептидному ланцюгу та містить діарилетиленовий фрагмент, що фотоперемикається, який може існувати в "закритій" чи "відкритій" формі, що можуть взаємно перетворюватися дією світла різних довжин хвиль (див. також схеми 2 і 3). Такий будівельний блок має особливу перевагу в тому, що в ньому аміногрупа імітується, наприклад, фрагментом гідразиду карбонової кислоти (Q=N, R5 відсутній, R6 та R7=Н), що забезпечує сумісність з пептидним синтезом. Будівельний блок може бути введений в скелети пептидоміметиків, наприклад, методами стандартного пептидного синтезу, такими як Fmoc чи Вос твердофазний пептидний синтез. Діарилетиленовий фрагмент, що фотоперемикається, може бути в "закритій" чи "відкритій" формі під час синтезу, наприклад, залежно від того, яка форма є оптимальнішою для досягнення кращого хімічного виходу пептидоміметиків. У випадку, якому надається перевага, коли в проміжній сполуці II Q є С (див. зображену вище формулу ІІ-2), а також у випадку, якому надається перевага, коли в сполуках Іа та Iб Q є С, вказані сполуки можуть переважно містити залишок альфа-амінокислоти (Q=С, R7=бічна група амінокислоти), як показано нижче: Як вказано вище, коли R7 є бічною групою амінокислоти лінкерна група може утворювати амінокислотний залишок, що може бути ефективно використано у синтезі пептидоміметиків даного винаходу. Зокрема, характерною перевагою відповідних сполук є підвищена стабільність фрагменту даного винаходу, що фотоперемикається, а також те, що вони можуть бути більш легко використані у твердофазному пептидному синтезі. Більше того, можливо також корегувати відповідну геометрію N-кінця проміжної сполуки ІІ-2 шляхом варіювання залишку альфаамінокислоти. Найважливішим є те, що оскільки альфа-амінокислота (замість гідразиду) може бути обрана такою, що буде частиною цільової поліпептидної послідовності (наприклад, Р3), ефективний розмір фотоконтролюючого елемента, невластивого поліпептиду, який модифікується, може бути зменшений аж до розміру молекулярної фотоперемикаючої системи (див. Схему 3), і сумісність штучного контролюючого елемента з цільовим поліпептидом буде підвищено. Іншим аспектом даного виходу є метод виробництва проміжної сполуки ll-1 чи її солей, що представлені загальною формулою II, де Q є N, R6 та R7 є Η і R5 відсутній 9 UA 113685 C2 5 10 15 20 25 30 35 де ZZ означає захисну групу; R1 та R4 незалежно обираються Н-, алкіл-, алкеніл-, алкініл-, алкокси-, арил-, гетероарил, ціано-, нітро-, фосфатної, сульфоксильної груп; R2 та R3 незалежно обираються з алкіл-, алкеніл-, алкініл-, алкокси-, арил-, гетероарил, ціано-, нітро-, фосфатної, сульфоксильної груп; X означає -(CHxFy)z-, де х+у=2, x=0, 1 чи 2, у=0, 1 чи 2, z=2, 3 чи 4; Υ1 та Y2 незалежно обираються з S, SO2, N,N-алкіл aбo О; що складається з таких стадій: а) розчинення дикарбонових кислот загальної формули Іll-1, реагента сполучення, основи та ZZ-гідразину в розчиннику; де кожна з R1-R4, Χ, Υ1 та Y2 є такими, як визначено вище; б) перемішування суміші протягом часу від 30 хвилин до 24 годин; в) вливанням реакційної суміші у надлишок води для отримання сполуки вищенаведеної формули ІІ-1 чи відповідної солі у вигляді осаду; та г) (необов'язково) розчиненням осаду в органічному розчиннику та промивання розчину водним бікарбонатом натрію і насиченим розчином хлориду натрію. Відповідно до наступного конкретного втілення даного винаходу, метод виробництва проміжної сполуки може далі включати стадію д) випарювання розчинника та висушування продукту. Відповідно до іншого конкретного втілення, даний винахід також відноситься до визначеного вище методу виробництва проміжної сполуки в її "закритій" формі. Якщо не вказано інше, всі визначення вище, включаючи конкретні втілення R1-R4, Χ, Υ1 та Y2, Q, R5-R7 застосовуються також до методу виробництва проміжної сполуки даного винаходу. В іншому втіленні методу, який визначено вище, розчинник обирається з диметилформаміду, диметилсульфоксиду, гексаметилфосфотриаміду, і/або захисна група обирається з t-бутоксикарбоніл- (Вос) і флуоренілметоксикарбоніл (Fmoc); і/або реагент сполучення обирається з карбодіімідів, N,N,N',N'-тетраметил-О-(бензотріазол-1-іл)уронію тетрафтороборату (TBTU), 2-( 1 Н-бензотріазол-1-іл)-1,1,3,3-тетраметилуронію гексафторфосфату (HBTU), 1-[біс(диметиламіно)метилен]-1 Н-1,2,3-тріазоло[4,5-b]піридинію 3оксид гексафторфосфату (HATU) та (бензотріазол-1-ілокси)трипірролідінофосфонію гексафторфосфату (РуВор); і/або основа обирається з триетиламіну і диізопропілетиламіну. Іншим аспектом даного винаходу є використання молекулярної системи, що фотоперемикається, зображеної на наступній схемі, включаючи загальні формули IVa та IVб, як фрагмента у фармацевтично і/або діагностично активної сполуки, що дозволяє її перемикання між активованим та деактивованим станами 10 UA 113685 C2 5 10 15 20 25 30 35 40 45 50 R1 та R4 незалежно обираються з Н-, алкіл-, алкеніл-, алкініл-, алкокси-, арил-, гетероарил, ціано-, нітро-, фосфатної, сульфоксильної груп; R2 та R3 незалежно обираються з алкіл-, алкеніл-, алкініл-, алкокси-, арил-, гетероарил, ціано-, нітро-, фосфатної, сульфоксильної груп; X означає -(CHxFy)z-, де х+у=2, х=0, 1 чи 2, у=0, 1 чи 2, z=2, 3, чи 4; Υ1 та Υ2 незалежно обираються з S, SO2, N,N-алкіл, або О. Якщо не вказано інше, всі визначення вище, включаючи конкретні втілення R1-R4, Χ, Υ1 та Υ2, застосовуються також до молекулярної системи даного винаходу, що фотоперемикається. Інший аспект даного винаходу відноситься до сполуки-пептидоміметика відповідно до даного винаходу для її використання в медицині. Переважно, сполука-пептидоміметик відповідно до даного винаходу використовується у фотодинамічній терапії для лікування локалізованих розладів, тобто розладів, що обмежуються специфічними ділянками у пацієнті. Термін "пацієнт" тут вживається без особливих обмежень і означає будь-яку тварину, зокрема людську істоту, що отримує медичне лікування. Далі, даний винахід відноситься до сполуки-пептидоміметика, як визначено вище, для її використання в методах лікування розладів, обраних з вірусних, бактеріальних, паразитних чи грибкових інфекцій, запалень, ран, крововиливів, гіперпластичних, неопластичних, склеротичних, тромботичних чи некротичних розладів. В подальшому втіленні, даний винахід відноситься до фармацевтичних композицій, що містять сполуку-пептидоміметик, як визначено вище та (необов'язково) один чи більше допоміжних компонентів, розбавлювач чи інший допоміжний агент. Визначені вище сполука-пептидоміметик чи фармацевтична композиція можуть формулюватись в будь-якій бажаній формі, такій як таблетки, розчини, гелі, спреї (аерозолі) чи мазі. В залежності від лікарської форми та захворювання, сполука чи фармацевтична композиція можуть вводитись, наприклад, перорально, зовнішньо, внутрішньовенозно, внутрішньом'язово, перитонально, назально, підшкірно і таке інше. Дозування сполук-пептидоміметиків відповідно до даного винаходу може залежати від природи пептидоміметика, симптомів, стану та віку пацієнта, способу введення і ін. Підходящі дози можуть бути визначені особами-експертами в даній області. Даний винахід відноситься також до методу лікування, в якому сполука-пептидоміметик даного винаходу вводиться пацієнту для лікування розладів, обраних серед вірусних, бактеріальних, паразитарних чи грибкових інфекцій, запалень, ран, крововиливів, гіперпластичних, неопластичних, склеротичних, тромботичних чи некротичних розладів. Фігури демонструють: Фіг. 1 показує циклічний антибіотик Граміцидин С (GS) та три фоточутливі пептидоміметики, його похідні. Аналоги GS показані в їх "відкритій" формах. Фіг. 2 показує кінетику фотоконверсії GS-Sw(FP) з його "закритої" форми у "відкриту" форму в суміші вода:ацетонітрил (3:1) при 25 °C, концентрація -100 мкг/мл. Фіг. 3 показує аналітичні хроматограми оберненофазової ВЕРХ для GS-Sw(FP), отримані в процесі опромінення пептидоміметика, розчиненого в суміші вода:ацетонітрил (3:1) при 25 °C, концентрація 100 мкг/мл, УФ та видимим світлом. Два близькорозташовані піки відповідають двом діастереомерам "закритої" форми пептидоміметика (вказано). Фіг. 4 показує спектри поглинання УФ/Вид пептидоміметика GS-Sw(FP) у "відкритій" (пунктирна лінія) та "закритій" (суцільна лінія) формах. Сигнал при 400 нм є інструментальним артефактом. Фіг. 5 показує антимікробний ефект пептидоміметика GS-Sw(FP) у "відкритій" формі на ріст Staphylococcus xylosus. Сполука була внесена до бактеріального газону в різних концентраціях і потім опромінена видимим світлом. Геометричні форми були вирізані у папері, що повністю покривав чашку Петрі, так що фотоперемикаюча сполука була перетворена у "відкриту" форму 11 UA 113685 C2 5 10 15 20 25 30 35 40 тільки в тих невеликих областях, що були опромінені світлом. а) Концентрація "закритої" форми 6 мкг/мл, конверсія у "відкриту" форму - 60% (як вираховано з кривої на Фіг. 2 і описано в прикладі 3); b) Концентрація 6 мкг/мл, конверсія у активну форму - 80%; с) Концентрація неактивної форми 8 мкг/мл, конверсія у активну форму - 60%; d) Концентрація 8 мкг/мл, конверсія у активну форму - 80%. У тих місцях, де фотоперемикаючий аналог GS був успішно активований, він проявив значну антимікробну активність, як видно з наявності прозорих ділянок, де бактеріальний ріст не відбувався протягом інкубації 18 год. при 37 °C. Фіг. 6 показує проміжну сполуку ІІ-2 (сполука 4), та приклад, якому з них надається особлива перевага (сполуки 4а, 4б, 4в). Сполука 4а містить залишок l-проліну і є прикладом будівельного блоку з амінокислотним фрагментом, що містить циклічне аліфатичне кільце; сполука 4б містить залишок N-метилгліцину і є прикладом фотоперемикаючого будівельного блоку з Nзаміщеним амінокислотним фрагментом; сполука 4в містить залишок гліцину (бічна група амінокислоти=Н) і є найближчим прикладом будівельного блоку, де -NH- фрагмент заміщено на -СН2-. 1 Фіг. 7 показує Н-ЯМР спектр сполуки 4а. 1 Фіг. 8 показує Н-ЯМР спектр сполуки 14. 1 Фіг. 9 показує Н-ЯМР спектр сполуки 7. 1 Фіг. 10 показує Н-ЯМР спектр сполуки 8. Сполуки-пептидоміметики даного винаходу є хімічно та термічно стабільними і можуть оборотно перетворюватися між їхніми біологічно активними і неактивними (менш активними) формами з високою ефективністю конверсії при опроміненні світлом, що має відповідні довжини хвиль. Більше того, сполуки-пептидоміметики даного винаходу є біосумісними та стійкими до фотодеструкції і до дії протеаз. Як наслідок, фармацевтична і/або діагностична активність пептидоміметиків даного винаходу може бути ефективно "увімкнена" чи "вимкнена", що надає сполукам-пептидоміметикам даного винаходу переваги в специфічному лікуванні локалізованих розладів у пацієнтах. Лише активацією фармацевтичних і/або діагностичних властивостей у бажаному місці дії (і деактивацією за межами цього місця) побічні ефекти зменшуються і терапевтичний індекс істотно зростає. Зокрема, сполуки-пептидоміметики даного винаходу можуть бути легко використані в різних вже розроблених застосуваннях, включаючи фотодинамічну терапію. На додаток до цього, проміжна сполука даного винаходу дозволяє легко приготувати велике різноманіття сполук-пептидоміметиків, наприклад, використовуючи природні пептиди як шаблони. Синтез таких пептидоміметиків є простим і може бути досягнутий використанням стандартних методів, таких як конвергентний синтез, паралельний синтез, автоматизований твердофазний синтез тощо. Надалі, даний винахід додатково проілюстровано наступними прикладами, якими він не обмежується. Вихідна дикарбонова кислота 2, що використовувалася для синтезу lб, була отримана як описано в літературі [S. Gronowitz, Κ. Stenhamar, L. Svensson, Heterocycles 1981,15, 947; T.B. Norsten, N.R. Branda, J. Am. Chem. Soc. 2001,123, 1784]. 12 UA 113685 C2 5 10 15 20 25 30 35 40 45 50 55 60 Сполука 2 (5 г, 14,3 ммоль) була розчинена в диметилформаміді (25 мл). До розчину добавили Ν,Ν-диізопропілкарбодіімід (DIC, 1,76 г, 14 ммоль), а потім - Ν,Ν-диізопропілетиламін (DIPEA, 3,7 г, 28,6 ммоль). Негайно після цього добавили Fmoc-гідразин (Fmoc-NH-NH2; 3,56 г, 14 ммоль). Після перемішування реакційної суміші протягом ночі, її влили до води (100 мл). Осад відфільтрували, розчинили у дихлорметані (200 мл) і промили двічі 0,5 Μ водним розчином бікарбонату натрію (100 мл), після цього - 0,5 Μ водним розчином НСl (100 мл) для видалення дикарбонової кислоти, що не прореагувала. Органічну фазу висушили сульфатом магнію. Випарювання дихлорметану при пониженому тиску надало сирий матеріал, що містив, поряд з бажаною сполукою lб, також домішку 3. Домішка не заважала твердофазному пептидному синтезові, тому отриманий матеріал використовували без додаткової очистки. Аналітично чистою сполука lб може бути отримана, використовуючи високоефективну рідинну хроматографію на колонці з оберненою фазою (суміш ацетонітрил-вода використовували як 1 елюент). Н-NMR (500 MHz, DMSO-d6), δ = 1,90 (s, 3H, CH3), 1,94 (s, 3Н, СН3), 1,95-2,05 (m, 2Н), 2,79 (t, J = 7,8 Hz, 4H), 4,2-4,4 (система СН2СН, два ротамери 4:1), 7,17-7,91 (m, ароматичні протони, 10Н), 9,00 та 9,36 (ротамери 1:4, 1Н), 10,22-10,46 (ротамери 4:1, 1H). Приклад 2: Синтез і виділення аналогів GS (загальна процедура). D D D D Синтез аналогів GS: cyclo( FPVO-lб-PVOL),cyclo( FPVOL-lб-VOL) та cyclo( FPVOL F-Іб-OL) (GS-Sw(LF), GS-Sw(FP), GS-Sw(PV)). Відомий пептидний антибіотик Граміцидин С (GS) був взятий як шаблон. Відомо, що цей циклічний декапептид існує як антипаралельний складчатий лист з вітками, що фіксовані двома D D D бета-вигинами ([PVOL FPVOL F]cyclo, О = орнітин, F=D-фенілаланін). Чотири водневі зв'язки стабілізують загальну амфіпатичну конформацію молекули (див. Фіг. 1). GS є сильно мембраноактивним проти Грам-позитивних бактерій, однак він має небажаний гемолітичний побічний ефект на червоних кров'яних тільцях і є значно резистентним до дії протеаз. Неполярні діарилетиленові фотоперемикаючі фрагменти у "відкритій" формі добре пасують для заміни D D неполярних дипептидних фрагментів в одному з бета-вигинів - L F, FP, чи PV, таким чином даючи відповідні пептидоміметики GS-Sw(LF), GS-Sw(FP) тa GS-Sw(PV) (див. також Фіг. 1). Стандартний Fmoc твердофазний пептидний синтез і комерційно доступні реагенти були використані для синтезу усіх аналогів GS. Попередньо навантажена D-фенілаланіном хлоротритильна смола з загрузкою на смолу 0,73 ммоль/г (200 мг, 1 еквівалент) використовувалась для синтезу лінійних прекурсорів. Сполучення амінокислот проводилось з використанням наступних молярних співвідношень реагентів: Fmoc-амінокислота (4 еквіваленти), HOBt (4 еквіваленти), HBTU (3,9 еквівалентів), DIPEA (8 еквівалентів). Введення діарилетиленового будівельного блоку здійснювали сполученням з lб (у формі сирої суміші, як отримано в Прикладі 1, що описаний вище; було взято таку її кількість, щоб мати 1,5 еквівалентів lб, з фотоперемикаючим фрагментом у "відкритій" формі), HOBt (1,5 еквівалентів), HBTU (1,45 еквівалентів), DIPEA (3 еквіваленти). У всіх випадках час реакції сполучення становив 1 год. Зняття захисту N-Fmoc проводили обробкою смоли 20% розчином піперидину в диметилсульфоксиді протягом 20 хв. Після закінчення синтезу смолу промивали дихлорметаном і висушували у вакуумі протягом 24 год. Лінійні прекурсори знімали зі смоли сумішшю гексафторізопропанолу та дихлорметану (1:3) (при цьому захист бічних груп орнітинових залишків лишався). Леткі продукти були видалені з фільтрату потоком аргону. Після розчинення залишку у суміші ацетонітрил:вода (1:1) і наступної ліофілізації отримували неочищені лінійні прекурсори, які були використані для циклізації без подальшої очистки. Перетворення лінійних прекурсорів у цільові циклічні пептидоміметики проводили у дихлорметані (1л, прекурсори не розчинялись повністю) добавлянням розчину РуВор (3 еквіваленти) та HOBt (3 еквіваленти) в диметилформаміді (1 мл), з наступним добавлянням DIPEA (6 еквівалентів) до суспензії відповідного прекурсора. Реакційну суміш перемішували протягом 8 год., після чого добавляли додаткові кількості (як вище) реагентів (РуВор, HOBt, DIPEA). Через 16 год. розчинник випаровували при пониженому тиску, а залишок ліофілізували. До залишку добавляли коктейль для депротекції (трифтороцтова кислота, триізопропілсилан і вода, в суміші 92,5:2,5:5 за об'ємом, 10 мл). Через 15 хв. леткі продукти видаляли потоком аргону, а залишок ліофілізували. Неочищені циклічні пептидоміметики очищали, використовуючи оберненофазову високоефективну рідинну хроматографію у дві стадії: спочатку - на препаративній С18 колонці (Vydac®, 22x250 мм) з лінійним градієнтом А:Б, 8% Б/хв., зі швидкістю потоку 17 мл/хв., потім - на С18 напівпрепаративній колонці (Vydac®, 10x250 мм) з лінійним градієнтом А:Б, 4% Б/хв., зі швидкістю потоку 6 мл/хв., де А - суміш 10% ацетонітрилу і 90% 5 мМ НСl; Б - суміш 90% ацетонітрилу і 10% 5 мМ НСl. Чистоту пептидоміметиків перевіряли на аналітичній С18 колонці (Vydac®, 4,6x250 мм) з лінійним градієнтом А:Б, 1% Б/хв., зі швидкістю потоку 1,5 мл/хв. Ідентичність пептидоміметиків була 13 UA 113685 C2 5 10 15 20 25 30 35 40 підтверджена MALDI-TOF мас-спектрометрією; m/z = 1225,4 [GS-Sw(LF)], 1241,5 [GS-Sw(FP)], 1289,5 [GS-Sw(PV)]. Приклад 3: Характеризація фотохромних властивостей аналогів GS. Кожний з аналогів GS був вивчений на предмет ефективності фотоперетворення з більш рухливого стану діарилетиленового фрагмента ("відкрита" форма) у жорсткий стан ("закрита" форма) при опроміненні УΦ світлом. Готувались розчини кожного пептидоміметика, GS-Sw(LF), GS-Sw(FP), GS-Sw(PV), з концентрацією 100 мкг/мл (у суміші ацетонітрил:вода, 3:1). Після цього рівень конверсії з "відкритого" стану в "закритий" стан при опроміненні УФ світлом визначали, використовуючи оберненофазову високоефективну рідинну хроматографію (аналітична колонка С18, з лінійним градієнтом А:Б, 4% Б/хв., зі швидкістю потоку 1,5 мл/хв.) кожні 0, 5, 25, 50 і 75 хв. після початку експозиції до світла. Використовували стандартну короткохвильову УФ лампу (Spectroline®XX-15F/F), розчини поміщали на відстані 10 см від лампи при 25 °C. Перетворення відбувалось на 35%-80%, в залежності від умов (див. Мал. 2 і 3, де зображено результати для GS-Sw(FP)). Рівень конверсії може бути значно підвищено добавлянням до розчинів хаотропних агентів, коли аналоги GS перемикалися у "закриту" форму в 1М водному розчині сечовини (див. нижче). Також було вивчене зворотне фотоперетворення пептидоміметика GS-Sw(FP) із "закритої" у "відкриту" форму видимим світлом. Для цього використовували забарвлений у розовий колір розчин "закритої" форми (у суміші вода-ацетонітрил, 3:1, 100 мкг/мл). Перетворення пептидоміметика із "закритої" у "відкриту" форму визначали за допомогою високоефективної рідинної хроматографії на колонці з оберненою фазою (аналітична С18 колонка, з лінійним градієнтом А:Б, 4% Б/хв., зі швидкістю потоку 1,5 мл/хв.) кожні 0,25, 1,5, 5,5, 7,5 хв після початку опромінення видимим світлом. Використовували яскраву галогенну лампу (250 Вт), розчини тримали на відстані 10 см від джерела світла. Отримані дані добре апроксиміювалися експоненціальним рівнянням у=1-ехр(t/т), де у - ступінь конверсії "закритої" форми у "відкриту" форму, t - час опромінення і τ - час напівперетворення. Для того, щоб досягти перетворення на 60%, час опромінення має бути 7,5 хв., тоді як для перетворення на 80% необхідно 12,5 хв., і т.д. Може бути досягнуте стовідсоткове перетворення "закритої" форми у "відкриту". Готували стокові розчини для всіх семи сполук, очищених за допомогою високоефективної рідинної хроматографії (дикий тип GS, "відкриті" і "закриті" форми трьох пептидоміметиків), з концентрацією 1 мг/мл, що було перевірено високоефективною рідинною хроматографією розчинів на колонці з оберненою фазою. Для приготування стокових розчинів GS та його аналогів у "відкритій" формі брали наважку відповідної сполуки і розчиняли в 50% етанолі, так щоб отримати бажану концентрацію 1 мг/мл. Для приготування стокових розчинів аналогів GS у "закритій" формі використовували наступну методику: сполуки розчиняли в концентрації 100 мкг/мл у 1М водному розчині сечовини і опромінювали УΦ світлом як описано вище протягом 25 хв. "Відкриту" та "закриту" форми розділяли високоефективною рідинною хроматографією на колонці з оберненою фазою (на препаративній С18 колонці з лінійним градієнтом А:Б, 8% Б/хв., зі швидкістю потоку 17 мл/хв.) і ліофілізували. Відповідні часи утримання наведені в Табл. 1. Ліофілізовані фракції, які відповідали "закритим" формам пептидоміметиків, розчиняли в невеликій кількості 50% етанолу, і визначали концентрації аналітичною високоефективною рідинною хроматографією розчинів на колонці з оберненою фазою. Всі маніпуляції проводили у темряві. 45 50 Дві виділені форми пептидоміметиків мають різні спектри поглинання, проявляють характеристичні ознаки сполук, що містять діарилетиленові хромофори [М. Ігіе. Photochromism of diarylethene single molecules and single crystals. Photochem.Photobiol. Sci. 2010, 9, 1535-1542]. Поглинання одного з пептидоміметиків, GS-Sw(FP), у видимій та ультрафіолетовій областях, у "закритому" та "відкритому" станах показано на Фіг. 4. 14 UA 113685 C2 5 10 15 20 25 30 35 40 Приклад 4. Фотоперемикання антимікробної активності. Антимікробну активність GS та його аналогів вимірювали методом серійних мікророзведень в бульйоні з використанням стандартної методики [Daniel Amsterdam (1996). Susceptibility testing th of antimicrobials in liquid media. In: Antibiotics in laboratory medicine, Loman, V., ed., 4 ed. Williams and Wilkins, Baltimore, MD, pp. 52-111]. Пептидоміметики були протестовані на штамах бактерій Escherichia coli DSM 1103, Staphylococcus aureus DSM 1104, Staphylococcus epidermidis DSM 1708, Staphylococcus xylosus DSM 20267. Аналоги GS були приготовлені заздалегідь високоефективною рідинною хроматографією на колонках з оберненою фазою і зберігались в недоступному для світла місці. Відповідні мінімальні інгібуючі концентрації (МІК) наведені в Табл. 2, де менші значення МІК означають вищу антимікробну активність, і навпаки. Так, можна бачити, що всі аналоги GS мають добру антимікробну активність у "відкритій" формі, тоді як їхня активність є значно меншою, коли фрагмент, що фотоперемикається знаходиться у жорсткому "закритому" стані. Як можна бачити з Табл. 2, можливо визначити терапевтично важливі інтервали концентрацій, при яких пептидоміметики у "відкритій" формі пригнічують ріст бактерій, тоді як у "закритій" формі - неактивні. Ще один експеримент, який мав на меті знайти ці оптимальні умови для дії пептидоміметиком GS-Sw(FP), проілюстровано на Фіг. 5. Приклад 5: Фотоперемикання гемолітичної активності. Іншою біологічною активністю GS, GS-Sw(LF), GS-Sw(FP), GS-Sw(PV), що є важливою для практичних (in vivo) застосувань, є гемолітична активність, і вона також може бути оборотно активована чи деактивована дією світла. Слід зазначити, що гемолітична активність є головним побічним ефектом багатьох антимікробних пептидів при системному застосуванні, що перешкоджає їх використанню як лікарських засобів. Зразки людської крові для тестування гемолітичної активності GS та його аналогів були отримані з Муніципального госпіталю м. Карлсруе, та промиті чотири рази в буферному розчині TRIS, рН 7,6, при 4 °C. Аліквоти клітин крові витримували в розчинах пептиду/пептидоміметиків у різних концентраціях протягом 30 хв. при 37 °C, після чого їх центрифугували. Абсорбція супернатанту при 540 нм давала змогу вирахувати величину гемолізу по відношенню до 0%, визначеного у контрольному досліді без пептиду/пептидоміметиків і 100% - у присутності TritonX-100 (щоб запобігти небажаному впливу на результат аналізу, зразки з аналогами GS у їх "закритій" формі були опромінені видимим світлом протягом 30 хв. для перетворення пептидоміметиків у їх "відкриту" форму). Значення HC50, при яких лізується 50% еритроцитів, були визначені з кривих концентраційних залежностей і наведені в Табл. 3. Малі значення HC50 означають високу гемолітичну активність, і навпаки. Всі аналоги GS у "закритому" стані проявляли значно меншу гемолітичну дію, ніж у "відкритому" стані, аналогічно тому, як спостерігалось для їх антимікробної активності. Це доказує декількома незалежними методиками, що біологічна активність фотоперемикаючих аналогів GS може бути керована дією світла. 15 UA 113685 C2 5 10 15 20 25 30 35 40 45 50 Приклад 6: Синтез фотоперемикаючого будівельного блоку 4а. Синтез сполуки 6. Сполуку 5 (15 г, 0,0456 моль) розчиняли у 250 мл сухого тетрагідрофурану в інертній атмосфері аргону. Розчин охолоджували до -78 °C охолоджуючою банею з сухим льодом. До охолодженого розчину добавляли 20 мл (0,051 моль) 2,5Μ розчину бутиллітію в гексані. Реакційну суміш залишали нагріватись до температури -10 °C, потім знову охолоджували до -78 °C. Диметилформамід (4 г, 0,0548 моль) добавляли до розчину при -78 °C. Розчин повільно (протягом півгодини) нагрівали до 0 °C і перемішували при цій температурі ще протягом години. Після цього розчин виливали у 200 мл води, в отриману суміш добавляли 55 мл (0,055 моль) 1М розчину НСl. Продукт 6 екстрагували діетиловим етером (200 мл). Відокремлену органічну фазу висушували безводним сульфатом магнію і леткі продукти видаляли випарюванням при пониженому тиску. Отримали 15 г сирого матеріалу, який без очистки використовували у наступній синтетичній стадії. Синтез сполуки 7. 15 г неочищеної сполуки 6 (приблизно 0,0456 моль) розчиняли в 250 мл толуолу; до розчину добавляли 7,1 г (0,0684 моль) 2,2-диметил-1,3-пропандіолу і 0,1 г птолуолсульфокислоти. Після цього розчин кип'ятили з насадкою Діна-Старка до закінчення видалення всієї води, що утворювалась в процесі реакції (0,82 г). Толуол видаляли при пониженому тиску. Чистий продукт 7 отримували після колонкової хроматографії на силікагелі з використанням суміші н-гексану з етилацетатом 10:1 як елюенту. Вихід становив 14,2 г (76% від теоретичного) за дві стадії, від 5 до 7. Синтез сполуки 9. Розчиняли 3 г (0,00733 моль) сполуки 7 в 50 мл сухого тетрагідрофурану в інертній атмосфері аргону. Розчин охолоджували до -78 °C охолоджуючою банею з сухим льодом. До охолодженого розчину добавляли 3,52 мл (0,0088 моль) 2,5 Μ розчину бутиллітію в гексані. Реакційну суміш залишали нагріватись до температури -10 °C, потім знову охолоджували до -78 °C. Сполуку 8 (2,27 г, 0,0088 моль) добавляли до розчину при -78 °C. Сполуку 8 синтезували аналогічно до методики, що описана Z.H. Zhoui співавт. Heteroatom Chemistry, 2003, 7, 603-606. DOI: 10.1002/hc. 10195. Розчин повільно (протягом півгодини) нагрівали до 0 °C і перемішували при цій температурі ще протягом години. Після цього розчин виливали у 100 мл води, в отриману суміш добавляли 9 мл (0,009 моль) 1М розчину НСl. Продукт 9 екстрагували діетиловим етером (200 мл). Відокремлену органічну фазу висушували безводним сульфатом магнію і леткі продукти видаляли випарюванням при пониженому тиску. Чистий продукт 9 отримували після колонкової хроматографії на силікагелі з використанням суміші н-гексану з етилацетатом 5:1 як елюенту. Вихід становив 3,1 г (73% від теоретичного). Синтез сполуки 10. Розчиняли 3,1 г (0,0064 моль) сполуки 9 в 40 мл етанолу. Потім до розчину добавляли 7,42 г (0,032 моль) свіжоприготовленого оксиду срібла і 0,5 г (0,0128 моль) гідроксиду натрію і суміш інтенсивно перемішували протягом двох годин. Після цього добавляли 20 мл (0,02 моль) 1М соляної кислоти та 40 мл етанолу. Утворений осад відфільтровували на паперовому фільтрі і фільтрат з продуктом 10 екстрагували двічі 100 мл діетилового етеру. Відокремлені органічні фракції висушували безводним сульфатом магнію і леткі продукти видаляли випарюванням при пониженому тиску. Вихід продукту 10 становив 3,2 г (100% від теоретичного). Синтез сполуки 4а. Сполуку 10 (3,2 г, 0,0064 моль) розчиняли в 20 мл дихлорметану. До розчину добавляли 2 мл трифтороцтової кислоти і утворену суміш залишали при кімнатній температурі протягом 2 годин. Потім леткі розчинники видаляли при пониженому тиску. Отримана жовта олія була розчинена у 50 мл суміші води і ацетонітрилу (1:1). До розчину добавляли 1,075 г (0,0128 моль) бікарбонату натрію і 3,3 г (0.0128 моль) флуоренілметоксикарбонілхлориду. Розчин перемішували при кімнатній температурі протягом 4 годин. Після цього повільно добавляли 12,8 г (0,0128 моль) 1М соляної кислоти і продукт 4а екстрагували двічі 100 мл діетилового етеру. Відокремлені органічні фракції висушували безводним сульфатом магнію і леткі продукти видаляли випарюванням при пониженому тиску. 16 UA 113685 C2 Чистий продукт 4а отримували після колонкової хроматографії на силікагелі з використанням суміші н-гексану з етилацетатом 5:1 як елюенту. Вихід становив 4 г (91% від теоретичного). 5 Приклад 7: Синтез сполуки 4б. Сполука 4б була синтезована, використовуючі ті ж самі методики, що використовувалися 17 UA 113685 C2 для синтезу 4а. 5 10 15 20 Приклад 8: Синтез сполуки 4в. Синтез сполуки 14. Сполуку 7 (3 г, 0,0073 моль) розчиняли у 75 мл сухого тетрагідрофурану в інертній атмосфері аргону. Розчин охолоджували до -78 °C охолоджуючою банею з сухим льодом. До охолодженого розчину добавляли 3,52 мл (0,0088 моль) 2,5М розчину бутиллітію в гексані. Реакційну суміш залишали нагріватись до температури -10 °C, потім знову охолоджували до -78 °C. Етилхлороацетат (1,08 г, 0,0088 моль) добавляли до розчину при 78 °C. Розчин повільно (протягом півгодини) нагрівали до 0 °C і перемішували при цій температурі ще протягом години. Після цього розчин вливали у 200 мл води, в отриману суміш добавляли 55 мл (0,055 моль) 1М розчину НСl. Продукт 14 екстрагували діетиловим етером (200 мл). Відокремлену органічну фазу висушували безводним сульфатом магнію і леткі продукти видаляли випарюванням при пониженому тиску. Чистий продукт 14 отримували після колонкової хроматографії на силікагелі з використанням суміші н-гексану з етилацетатом 4:1 як елюенту. Вихід становив 1,8 г (54% від теоретичного). Синтез сполуки 15. Перетворення сполуки 14 в 15 було здійснено з використанням таких самих методик, як і для перетворення сполуки 9 в 10 з виходом 100%. Синтез сполуки 16. Сполуку 15 (1,8 г, 0,00472 моль) розчиняли в 20 мл суміші вода-етанол (1:1) і до розчину добавляли 0,5 г (0,0076 моль) азиду натрію. Реакційну суміш перемішували при 40 °C протягом 24 годин. Потім добавляли 50 мл води і екстрагували продукт 16 100 мл діетилового етеру. Органічну фазу сушили безводним сульфатом магнію і леткі розчинники видаляли при пониженому тиску. Отримано 1,81 г неочищеного матеріалу, який був використаний у наступній синтетичній стадії без очистки. 18 UA 113685 C2 5 10 Синтез сполуки 4в. Сполуку 16 (1,81 г, 0,00470 моль) розчиняли в 20 мл метанолу в 500 мл колбі, куди помістили також 100 мг паладію на вугіллі (10%). Повітря з колби відкачали, і заповнили її воднем. Після цього колба була з'єднана з камерою, наповненою воднем, і суміш перемішували протягом 4 годин при кімнатній температурі. Потім колба була вакуумована для видалення водню і розчин було профільтровано. Метанол видаляли, отримуючи жовту олію. Отриману жовту олію розчиняли в суміші води з ацетоном у співвідношенні 1:1. До розчину добавляли 0,79 (0,0094 моль) бікарбонату натрію і 2,4 г (0,0094 моль) флуоренілметоксикарбонілхлориду. Розчин інтенсивно перемішували при кімнатній температурі протягом 4 годин. Після цього повільно добавляли 9,4 мл (0,0094 моль) 1М соляної кислоти і продукт 4в екстрагували двічі 100 мл діетилового етеру. Відокремлені органічні фракції висушували безводним сульфатом магнію і леткі продукти видаляли випарюванням при пониженому тиску. Чистий продукт 4в отримували після колонкової хроматографії на силікагелі з використанням суміші н-гексану з етилацетатом 5:1 як елюенту. Вихід становив 2,74 г (90% від теоретичного). 15 19 UA 113685 C2 20 UA 113685 C2 21 UA 113685 C2 ФОРМУЛА ВИНАХОДУ 5 1. Сполука-пептидоміметик, представлена загальною формулою Іа, і її солі: 22 UA 113685 C2 X R4 R1 R3 O Y1 R2 O Y2 R7 P1 5 10 15 20 N P3 P2 Q R5 R6 , Ia де R1 та R4 незалежно вибирають з Н-, алкіл-, алкеніл-, алкініл-, алкокси-, арил-, гетероарил, ціано-, нітро-, фосфатної, сульфоксильної груп; R2 та R3 незалежно вибирають з алкіл-, алкеніл-, алкініл-, алкокси-, арил-, гетероарил, ціано-, нітро-, фосфатної, сульфоксильної груп; X означає -(CHxFy)z-, де х+у=2, х=0, 1 чи 2, у=0, 1 чи 2, z=2, 3, чи 4; Y1 та Y2 незалежно вибирають з S, SO2, N, N-алкіл чи О; Р1 та Р3 кожний незалежно є залишком амінокислоти чи поліпептидною послідовністю з двох чи більше залишків амінокислот; Р2 - відсутній або є залишком амінокислоти чи поліпептидною послідовністю з двох чи більше залишків амінокислот; Q є C чи N; R5 вибирають з Н-, алкіл-, гетероалкіл-, алкеніл-, гетероалкеніл-, алкініл-, гетероалкінілгруп і є зв'язаним з Q, чи може утворювати кільце разом з Q та N, або R5 є відсутнім; R6 вибирають з Н-, алкіл-, гетероалкіл-, алкеніл-, гетероалкеніл-, алкініл-, гетероалкініл-, алкокси-, арил-, гетероарилгруп чи є відсутнім, та R7 вибирають з Н-, бічної групи амінокислоти, алкіл-, гетероалкіл-, алкеніл-, гетероалкеніл-, алкініл-, гетероалкініл-, алкокси-, арил-, гетероарилгруп; за умови, якщо Р2 відсутній, Р1 та Р3 є незв'язаними одне з одним; за умови коли Q є N, R5 відсутній та за умови, коли R5 утворює кільце разом з Q та N, R6 відсутній. 2. Сполука-пептидоміметик, представлена загальною формулою Iб, і її солі, X R4 R1 R3 O Y1 R2 O Y2 R7 P1 P2 25 30 P3 Q N R5 R6 , Iб де R1-R4, X, Y1, Y2 та Р1-Р3, Q, R5-R7 є такими ж, як визначено в п. 1, за умови, якщо Р 2 відсутній, Р1 та Р3 є не зв'язаними одне з одним, за умови, що Q є N, R 5 є відсутнім, і за умови, коли R5 утворює кільце з Q та N, R6 відсутній. 3. Сполука-пептидоміметик, що визначена відповідно до пп. 1, 2, де R 1 та R4 незалежно вибрані з Н чи С1-С6 алкільних груп, R2 та R3 є незалежно вибраними з метильної групи і етильної групи, а X є -СН2СН2СН2- чи -CF2CF2CF2-. 4. Сполука-пептидоміметик відповідно до будь-якого з пп. 1, 2, 3, де кожна з груп R1 та R4 є Н, R2 та R3 є метильною групою, X є -СН2СН2СН2- чи -CF2CF2CF2-, і кожний з Y1 та Y2 є S. 5. Сполука-пептидоміметик відповідно до п. 1, представлена наступними формулами GSSw(LF), GS-Sw(FP) і GS-Sw(PV): 23 UA 113685 C2 NH2 O O O H N N O H N O O N CH3 H N CH3 S O O H N H S NH H N N N H O O GS-Sw(LF) H2N , NH2 O O N H N H N H N H N O N O H S O O O H N N H H O H3C N N H O S H3C GS-Sw(FP) H2N , NH2 O O H N N H N O O N H H N N O H HN O H S N N H O O CH3 N H O S O CH3 H2 N 5 GS-Sw(PV) . 6. Проміжна сполука, представлена загальною формулою II, чи її солі, що використовуються для синтезу сполуки-пептидоміметику, відповідно до будь-якого з пп. 1-5: 24 UA 113685 C2 X R4 R1 R3 O Y1 HO R2 O Y2 R7 ZZ 5 10 15 20 25 Q R5 N R6 , II де ZZ означає захисну групу; R1 та R4 незалежно вибирають з Н-, алкіл-, алкеніл-, алкініл-, алкокси-, арил-, гетероарил, ціано-, нітро-, фосфатної, сульфоксильної груп; R2 та R3 незалежно вибирають з алкіл-, алкеніл-, алкініл-, алкокси-, арил-, гетероарил, ціано-, нітро-, фосфатної, сульфоксильної груп; X означає -(CHxFy)z-, де х+у=2, х=0, 1 чи 2, у=0, 1 чи 2, z=2, 3, чи 4; Y1 та Y2 незалежно вибирають з S, SO2, N, N-алкіл чи О; Q є С чи N; R5 вибирають з Н-, алкіл-, гетероалкіл-, алкеніл-, гетероалкеніл-, алкініл-, гетероалкінілгруп і є зв'язаним з Q, чи може утворювати кільце з Q та N, або R5 є відсутнім; R6 вибирають з Н-, алкіл-, гетероалкіл-, алкеніл-, гетероалкеніл-, алкініл-, гетероалкініл-, алкокси-, арил-, гетероарилгруп чи є відсутнім, та R7 вибирають з Н-, бічної групи амінокислоти, алкіл-, гетероалкіл-, алкеніл-, гетероалкеніл-, алкініл-, гетероалкініл-, алкокси-, арил-, гетероарилгруп; за умови, коли Q є N, R5 відсутній, та за умови, коли R5 утворює кільце разом з Q та N, R6 відсутній. 7. Проміжна сполука відповідно до п. 6, де ZZ вибирають з t-бутоксикарбоніл- (Вос) і флуоренілметоксикарбоніл (Fmoc). 8. Проміжна сполука відповідно до п. 6 або 7, де R 1 та R4 незалежно вибирають з Н та С1С6алкільних груп, R2 і R3 незалежно вибираються з метильної та етильної груп, і X є СН2СН2СН2- або -CF2CF2CF2-. 9. Проміжна сполука відповідно до пп. 6-8, де кожна з R1 та R4 є Н, кожна з R2 та R3 є метильною групою, X є -СН2СН2СН2- чи -CF2CF2CF2-, і кожний з Y1 та Y2 є S. 10. Метод виробництва проміжних сполук ІІ-1 чи їх солей, визначених в пп. 6-9, представлених загальною формулою II, де Q є N, R6 тa R7 є Н і R5 відсутній: X R4 R1 R3 O HO Y1 R2 O Y2 H N N H ZZ 30 35 , де ZZ означає захисну групу; R1 та R4 незалежно вибирають з Н-, алкіл-, алкеніл-, алкініл-, алкокси-, арил-, гетероарил, ціано, нітро-, фосфатної, сульфоксильної груп; R2 та R3 незалежно вибирають з алкіл-, алкеніл-, алкініл-, алкокси-, арил-, гетероарил, ціано-, нітро-, фосфатної, сульфоксильної груп; X означає -(CHxFy)z-, де х+у=2, х=0, 1 чи 2, у=0, 1 чи 2, z=2, 3, чи 4; Y1 та Y2 незалежно вибирають з S, SO2, N, N-алкіл чи О; що складається з таких стадій: а) розчинення дикарбонової кислоти загальної формули IIІ-1, реагенту сполучення, основи та ZZ-гідразину в розчиннику; 25 UA 113685 C2 X R4 R1 R3 HOOC 5 10 15 Y1 R2 Y2 COOH , III-1 де кожна з R1-R4, X, Y1 та Y2 є такими, як визначено вище; б) перемішування суміші протягом часу від 30 хвилин до 24 годин; в) вливанням реакційної суміші у надлишок води для отримання сполуки формули ІІ-1 чи відповідних солей у вигляді осаду; та г) необов'язково розчинення осаду в органічному розчиннику та промивання розчину водним бікарбонатом натрію і розчином хлориду натрію. 11. Метод відповідно до п. 10, де розчинник вибирають з диметилформаміду, диметилсульфоксиду, гексаметилфосфотриаміду; і/або захисну групу вибирають з t-бутоксикарбоніл- (Вос) і флуоренілметоксикарбоніл (Fmoc); і/або реагент сполучення вибирається з карбодіімідів, TBTU, HBTU, HATU та РуВор; і/або основу вибирають з триетиламіну і діізопропілетиламіну. 12. Використання молекулярної системи, що фотоперемикається, що зображена на наступній схемі, включаючи загальну формулу IVa та IVб, як фрагмента у фармацевтично і/або діагностично активній сполуці, що дозволяє її перемикання між активованим та неактивованим станами: X X УФ R3 Y1 20 25 30 R2 R4 R1 R4 R1 Y2 R3 Y1 Вид IVa R2 Y2 IVб , де R1 та R4 незалежно вибирають з Н-, алкіл-, алкеніл-, алкініл-, алкокси-, арил-, гетероарил, ціано-, нітро-, фосфатної, сульфоксильної груп; R2 та R3 незалежно вибирають з алкіл-, алкеніл-, алкініл-, алкокси-, арил-, гетероарил, ціано-, нітро-, фосфатної, сульфоксильної груп; X означає -(CHxFy)z-, де х+у=2, х=0, 1 чи 2, у=0, 1 чи 2, z=2, 3, чи 4; Y1 та Y2 незалежно вибирають з S, SO2, N, N-алкіл чи О. 13. Сполука-пептидоміметик відповідно до будь-якого з пп. 1-5 для використання в медицині. 14. Сполука-пептидоміметик відповідно до будь-якого з пп. 1-5 для використання як антибактеріального агента. 15. Сполука-пептидоміметик відповідно до будь-якого з пп. 1-5 для використання в методах лікування розладів, вибраних з вірусних, бактеріальних, паразитних чи грибкових інфекцій, запалень, ран, крововиливів, гіперпластичних, неопластичних, склеротичних, тромботичних чи некротичних розладів. 26 UA 113685 C2 27 UA 113685 C2 28
ДивитисяДодаткова інформація
Назва патенту англійськоюPeptidomimetics possessing photo-controlled biological activity
Автори англійськоюAfonin, Sergiy, Babii, Oleg, Komarov, Igor, Mykhailiuk, Pavlo, Ulrich, Anne
Автори російськоюАфонин Сергей Эдуардович, Бабий Олег Петрович, Комаров Игорь Владимирович, Михайлюк Павел Константинович, Ульрих Анне
МПК / Мітки
МПК: C07K 7/06, C07K 7/66, A61K 38/03
Мітки: пептидоміметик, біологічною, активністю, фотоконтрольованою
Код посилання
<a href="https://ua.patents.su/33-113685-peptidomimetik-z-fotokontrolovanoyu-biologichnoyu-aktivnistyu.html" target="_blank" rel="follow" title="База патентів України">Пептидоміметик з фотоконтрольованою біологічною активністю</a>
Попередній патент: Очисник головок коренеплодів
Наступний патент: Спосіб дезактивації радіоактивних донних шламових відкладень витісненням
Випадковий патент: Пристрій усунення надмірності цифрового телевізійного сигналу












