Амідні похідні піперидинкарбонової кислоти
Номер патенту: 95909
Опубліковано: 26.09.2011
Автори: Сіфферлен Т'єррі, Дюб Даніель, Рішар-Білдштайн Сільвія, Кормінбеф Олів'є, Ремен Любош, Грізостомі Корінна, Фішлі Вальтер, Чень Остін Чинь-Ой, Беценкон Олів'є, Бур Даніель, Веллер Томас, Тер'єн Мішель, Босс Крістоф
Формула / Реферат
1. Сполука, вибрана з групи, яка складається з амідів піперидинкарбонової кислоти формули (І)
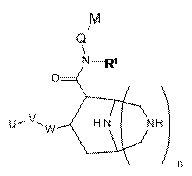 ,
,
в якій
W являє собою фенільний цикл або шестичленний, небензоконденсований ароматичний цикл, що містить від одного до чотирьох атомів азоту, де зазначені цикли заміщені у пара-положенні за допомогою V;
V являє собою зв'язок; -(CH2)r-; -A-(CH2)s-; -СН2-А-(СН2)t; -(CН2)s-А-; -(СН2)2-А-(СН2)u-; -А-(СН2)v-В-; -СН2-СН2-СН2-А-СН2-; -А-СН2-СН2-В-СН2-; -СН2-А-СН2-СН2-В-; -СН2-СН2-СН2-А-СН2-СН2-; -СН2-СН2-СН2-СН2-А-СН2-; -А-СН2-СН2-В-СН2-СН2-; -СН2-А-СН2-СН2-В-СН2-; -СН2-А-СН2-СН2-СН2-В-; -СН2-СН2-А-СН2-СH2-В-; -O-СН2-СН(ОСН3)-СH2-O-; -O-СН2-СН(СН3)-СН2-O-; -O-СН2-СН(СF3)-СН2-O-; -O-СН2-С(СН3)2-СН2-O-; -O-СН2-С(СН3)2-O-; -O-С(СН3)2-СН2-O-; -O-СН2-СН(СН3)-O-; -O-СН(СН3)-СН2-O-; -O-СН2-С(СН2СН2)-O- або -O-С(СН2СН2)-СН2-O-;
А і В незалежно являють собою -О- або -S-;
U являє собою незаміщений арил; моно-, ди-, три- або тетразаміщений арил, в якому замісники незалежно вибрані з групи, яка складається з галогену, алкілу, алкокси і СF3; або моно-, ди- або тризаміщений гетероарил, в якому замісники незалежно вибрані з групи, яка складається з галогену, алкілу, алкокси і -СF3;
Q являє собою метилен або етилен;
М являє собою арильну, хінолінільну, ізохінолінільну, дигідрохінолінільну або тетрагідрохінолінільну групу, де зазначені групи можуть бути необов'язково моно- або дизаміщеними замісниками, незалежно вибраними з групи, яка складається з алкілу; алкокси; -ОСF3; -СF3; гідроксіалкілу; галогену; алкіл-O-(СН2)0-4-СН2-; алкіл-O-(СН2)2-4-O-; R'2N-(CH2)0-4-CH2-, де R' незалежно вибраний із групи, яка складається з водню, алкілу (необов'язково заміщеного одним, двома або трьома атомами фтору), циклопропілу, циклопропілметилу, -C(=O)O-R" і -C(=O)-R", де R" означає С1-С4-алкіл, -СF3, -СН2-СF3 або циклопропіл; і R"'NH-С(=O)-(O)0-1-(СН2)0-4-СН2-, де R'" означає алкіл або циклопропіл;
R1 являє собою алкіл або циклоалкіл;
n являє собою ціле число 0 або 1;
r являє собою ціле число 3, 4, 5 або 6;
s являє собою ціле число 2, 3, 4 або 5;
t являє собою ціле число 1, 2, 3 або 4;
u являє собою ціле число 1, 2 або 3; і
v являє собою ціле число 2, 3 або 4;
і де замісники у циклі, -CON(R1)-Q-M і -W-V-U, знаходяться в транс- положенні один до одного, якщо n являє собою ціле число 1, і де конфігурації в положеннях 3 і 4 піперидинового циклу формули (І) являють собою 3R і 4S відповідно, якщо n являє собою ціле число 0;
і необов'язково оптично чисті енантіомери, суміші енантіомерів, такі як рацемати, діастереомери, суміші діастереомерів, діастереомерні рацемати, суміші діастереомерних рацематів, і мезоформи, а також солі і сольвати таких сполук, і морфологічні форми;
і де термини “алкіл”, “алкокси”, “гідроксіалкіл”, “циклоалкіл”, “арил” і
“гетероарил” мають наступні значення:
“алкіл” сам по собі або у комбінації з іншими групами, означає насичені, групи з лінійним і розгалуженим ланцюгом з одним-сімома атомами вуглецю,
“алкокси” сам по собі або у комбінації з іншими групами, належить до R-O- групи, в якій R означає алкільну групу,
“гідроксіалкіл” сам по собі або у комбінації з іншими групами, належить до HO-R-групи, в якій R означає алкільну групу,
“циклоалкіл” сам по собі або у комбінації, означає насичену циклічну вуглеводневу кільцеву систему з 3-7 атомами вуглецю,
“арил” сам по собі або у комбінації, належить до фенільної, нафтильної або інданільної групи,
“гетероарил” сам по собі або у комбінації, означає шестичленні ароматичніцикли, які містять від одного до чотирьох атомів азоту; бензоконденсовані шестичленні ароматичні цикли, які містять від одного до трьох атомів азоту; п'ятичленні ароматичні цикли, які містять один атом кисню, один атом азоту або один атом сірки; бензоконденсовані п'ятичленні ароматичні цикли, які містять один атом кисню, один атом азоту або один атом сірки; п'ятичленні ароматичні цикли, які містять два гетероатоми, незалежно вибрані з кисню, азоту і сірки, і бензоконденсовані похідні таких циклів; п'ятичленні ароматичні цикли, які містять три атома азоту і їх бензоконденсовані похідні; тетразолільний цикл; триазинільний цикл; або кумариніл.
2. Сполука за п. 1, в якій М являє собою арильну, хінолінільну, ізохінолінільну, дигідрохінолінільну або тетрагідрохінолінільну групу, де зазначені групи можуть бути необов'язково моно- або дизаміщеними замісниками, незалежно вибраними з групи, яка складається з алкілу; алкокси; -ОСF3; -СF3; гідроксіалкілу; галогену; алкіл-O-(СН2)0-4-СН2-; алкіл-O-(СН2)2-4-O- і R'2N-(CH2)0-4-CH2-; де R' незалежно вибраний із групи, яка складається з водню, алкілу, циклопропілу і -C(=O)O-R", де R" означає С1-С4-алкіл, -СF3, -СН2-СF3 або циклопропіл; або її сіль.
3. Сполука за п. 1, в якій М являє собою наступний радикал:
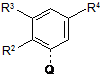 ,
,
де R2 означає метил або хлор, R3 означає водень, і R4 означає водень, -СН2СН2-О-СН3, -СН2СН2СН2-O-СН3 або R'NH-(CH2)0-1-CH2-, де R' означає CH2-CHF2, -СН2-СF3, циклопропіл, -СО-СН3, -СО-СН2-СF3, -СО-СН2-СН3 або циклопропілкарбоніл, за умови, коли R4 означає водень, то R3 являє собою метил, метокси, хлор або O-СН2СН2-O-СН3; або її сіль.
4. Сполука за будь-яким одним із пп. 1-3, в якій Q являє собою метилен; або її сіль.
5. Сполука за будь-яким одним із пп. 1-4, в якій W являє собою феніл, заміщений на V у пара-положенні, або наступний радикал:
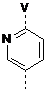 ,
,
або її сіль.
6. Сполука за будь-яким одним із пп. 1-5, в якому V являє собою СН2СН2O- або -СН2СН2СН2O-, де в обох випадках бівалентний радикал приєднаний до групи U формули (І) через їхній атом кисню, або -ОСH2СН2О-; або її сіль.
7. Сполука за будь-яким одним із пп. 1-6, в якій U являє собою моно-, ди- або тризаміщений феніл, де замісники незалежно вибрані з групи, яка складається з галогену, алкілу, алкокси і -СF3, або її сіль.
8. Сполука за будь-яким одним із пп. 1-7, в якій R1 являє собою циклопропіл.
9. Сполука за п. 1, вибрана з групи, що включає:
циклопропіл(2,3-дихлорбензил)амід (1R*,5S*,6R*,7S*)-7-{4-[3-(2-хлор-3,6-дифторфенокси)-пропіл]феніл}-3,9-діазабіцикло[3.3.1]нонан-6-карбонової кислоти,
циклопропіл(3-метокси-2-метилбензил)амід 4-{4-[3-(2-хлор-3,6-дифторфенокси)пропіл]феніл}-піперидин-3-карбонової кислоти,
циклопропіл(3-метокси-2-метилбензил)амід 4-{4-[3-(2,6-дихлор-4-метилфенокси)пропіл]феніл}-піперидин-3-карбонової кислоти,
циклопропіл(3-метокси-2-метилбензил)амід 4-{4-[3-(2,3,6-трифторфенокси)пропіл]феніл}-піперидин-3-карбонової кислоти,
циклопропіл(2,3-диметилбензил)амід 4-{4-[3-(2-хлор-3,6-дифторфенокси)пропіл]феніл}-піперидин-3-карбонової кислоти,
циклопропіл(2,3-диметилбензил)амід 4-{4-[3-(2,6-дихлор-4-метилфенокси)пропіл]феніл}-піперидин-3-карбонової кислоти,
циклопропіл(2,3-диметилбензил)амід 4-{4-[3-(2-хлор-6-фтор-3-метилфенокси)пропіл]феніл}-піперидин-3-карбонової кислоти і
циклопропіл(2,3-диметилбензил)амід 4-{4-[3-(2,3,6-трифторфенокси)пропіл]феніл}піперидин-3-карбонової кислоти.
10. Сполука за п. 1, вибрана з групи, що включає:
циклопропіл(2,3-диметилбензил)амід (3R*,4S*)-4-{4-[2-(2,6-дихлор-4-метилфеноксі)етокси]-феніл}піперидин-3-карбонової кислоти,
[2-хлор-5-(3-метоксипропіл)бензил]циклопропіламід (3R,4S)-4-{4-[2-(2,6-дихлор-4-метилфеноксі)етокси]феніл}піперидин-3-карбонової кислоти,
[2-хлор-5-(2-метоксіетил)бензил]циклопропіламід (3R,4S)-4-{4-[2-(2,6-дихлор-4-метилфеноксі)етокси]феніл}піперидин-3-карбонової кислоти,
[2-хлор-5-(3-метоксипропіл)бензил]циклопропіламід (3R,4S)-6-[2-(2,6-диxлop-4-мeтилфeнoкci)eтoкcи]-1',2',3',4',5',6'-гeкcaгiдpo[3,4']бiпipидинiл-3'-карбонової кислоти і
[2-хлор-5-(2-метоксіетил)бензил]циклопропіламід (3R,4S)-6-[2-(2,6-дихлор-4-метилфеноксі)-етокси]-1',2',3',4',5',6'-гексагідро[3,4']біпіридиніл-3'-карбонової кислоти.
11. Сполука за п. 1, вибрана з групи, що включає:
{2-хлор-5-[(2,2-дифторетиламіно)метил]бензил}циклопропіламід (3R,4S)-4-{4-[2-(2,6-дихлор-4-метилфеноксі)етокси]феніл}піперидин-3-карбонової кислоти,
{2-хлор-5-[(3,3,3-трифторпропіоніламіно)метил]бензил}циклопропіламід (3R,4S)-4-{4-[2-(2,6-дихлор-4-метилфеноксі)етокси]феніл}піперидин-3-карбонової кислоти,
{2-хлор-5-[(циклопропілметиламіно)метил]бензил}циклопропіламід (3R,4S)-4-{4-[2-(2,6-дихлор-4-метилфеноксі)етокси]феніл}піперидин-3-карбонової кислоти,
[5-(ацетиламінометил)-2-хлорбензил]циклопропіламід (3R,4S)-4-{4-[2-(2,6-дихлор-4-мстилфеноксі)етокси]феніл}піперидин-3-карбонової кислоти,
[2-хлор-5-(2-метиламіноетил)бензил]циклопропіламід (3R,4S)-4-{4-[2-(2,6-дихлор-4-метилфеноксі)етокси]феніл}піперидин-3-карбонової кислоти,
(2-хлор-5-метиламінометилбензил)циклопропіламід (3R,4S)-4-{4-[2-(2,6-дихлор-4-метилфеноксі)етокси]феніл}піперидин-3-карбонової кислоти,
{2-хлор-5-[2-(3,3,3-трифторпропіоніламіно)етил]бензил}циклопропіламід (3R,4S)-4-{4-[2-(2,6-дихлор-4-метилфеноксі)етокси]феніл}піперидин-3-карбонової кислоти,
[2-хлор-5-(2-етиламіноетил)бензил]циклопропіламід (3R,4S)-4-{4-[2-(2,6-дихлор-4-метилфеноксі)етокси]феніл}піперидин-3-карбонової кислоти,
[5-(2-ацетиламіноетил)-2-хлорбензил]циклопропіламід (3R,4S)-4-{4-[2-(2,6-дихлор-4-метилфеноксі)етокси]феніл}піперидин-3-карбонової кислоти,
{2-хлор-5-[(2-фторетиламіно)метил]бензил}циклопропіламід (3R,4S)-4-{4-[2-(2,6-дихлор-4-метилфеноксі)етокси]феніл}піперидин-3-карбонової кислоти,
(2-хлор-5-етиламінометилбензил)циклопропіламід (3R,4S)-4-{4-[2-(2,6-дихлор-4-метилфеноксі)-етокси]феніл}піперидин-3-карбонової кислоти,
(2-хлор-5-циклопропіламінометилбензил)циклопропіламід (3R,4S)-4-{4-[2-(2,6-дихлор-4-метилфеноксі)етокси]феніл}піперидин-3-карбонової кислоти і
[2-хлор-5-(2-циклопропіламіноетил)бензил1циклопропіламід (3R,4S)-4-{4-[2-(2,6-дихлор-4-метилфеноксі)етокси]феніл}піперидин-3-карбонової кислоти.
12. Фармацевтична композиція, що містить сполуку за будь-яким одним із пп. 1-11 або її фармацевтично прийнятну сіль, і фармацевтично прийнятний продукт у вигляді носія.
13. Сполука за пп. 1-11, або або її фармацевтично прийнятна сіль для застосування як лікарського засобу.
14. Застосування сполуки за будь-яким одним із пп. 1-11 або її фармацевтично прийнятної солі для приготування фармацевтичної композиції для лікування і/або профілактики захворювань, таких як (або пов'язаних із ними) гіпертонія, застійна серцева недостатність, легенева гіпертензія, ниркова недостатність, ниркова ішемія, ниркова декомпенсація, фіброз нирок, серцева недостатність, гіпертрофія серця, фіброз серця, міокардіальна ішемія, кардіоміопатія, гломерулонефрит, ниркова коліка, ускладнення, пов'язані з діабетом, а саме нефропатія, васкулопатія і невропатія, глаукома, підвищений внутрішньоочний тиск, атеросклероз, рестеноз після пластичної операції на судинах, ускладнення після хірургічної операції на судинах і серці, еректильна дисфункція, гіперальдостеронізм, пневмофіброз, склеродерма, страх, розлад пізнавальної здатності, ускладнення від лікування імунодепресантами, та інших захворювань, які відомі як пов'язані з системою ренін-ангіотензин.
Текст
1. Сполука, вибрана з групи, яка складається з амідів піперидинкарбонової кислоти формули (І) C2 2 (19) 1 3 n являє собою ціле число 0 або 1; r являє собою ціле число 3, 4, 5 або 6; s являє собою ціле число 2, 3, 4 або 5; t являє собою ціле число 1, 2, 3 або 4; u являє собою ціле число 1, 2 або 3; і v являє собою ціле число 2, 3 або 4; 1 і де замісники у циклі, -CON(R )-Q-M і -W-V-U, знаходяться в транс-положенні один до одного, якщо n являє собою ціле число 1, і де конфігурації в положеннях 3 і 4 піперидинового циклу формули (І) являють собою 3R і 4S відповідно, якщо n являє собою ціле число 0; і необов'язково оптично чисті енантіомери, суміші енантіомерів, такі як рацемати, діастереомери, суміші діастереомерів, діастереомерні рацемати, суміші діастереомерних рацематів, і мезоформи, а також солі і сольвати таких сполук, і морфологічні форми; і де терміни “алкіл”, “алкокси”, “гідроксіалкіл”, “циклоалкіл”, “арил” і “гетероарил” мають наступні значення: “алкіл”, сам по собі або у комбінації з іншими групами, означає насичені групи з лінійним і розгалуженим ланцюгом з одним-сімома атомами вуглецю, “алкокси”, сам по собі або у комбінації з іншими групами, належить до R-O-групи, в якій R означає алкільну групу, “гідроксіалкіл”, сам по собі або у комбінації з іншими групами, належить до HO-R-групи, в якій R означає алкільну групу, “циклоалкіл”, сам по собі або у комбінації, означає насичену циклічну вуглеводневу кільцеву систему з 3-7 атомами вуглецю, “арил”, сам по собі або у комбінації, належить до фенільної, нафтильної або інданільної групи, “гетероарил”, сам по собі або у комбінації, означає шестичленні ароматичні цикли, які містять від одного до чотирьох атомів азоту; бензоконденсовані шестичленні ароматичні цикли, які містять від одного до трьох атомів азоту; п'ятичленні ароматичні цикли, які містять один атом кисню, один атом азоту або один атом сірки; бензоконденсовані п'ятичленні ароматичні цикли, які містять один атом кисню, один атом азоту або один атом сірки; п'ятичленні ароматичні цикли, які містять два гетероатоми, незалежно вибрані з кисню, азоту і сірки, і бензоконденсовані похідні таких циклів; п'ятичленні ароматичні цикли, які містять три атоми азоту і їх бензоконденсовані похідні; тетразолільний цикл; триазинільний цикл; або кумариніл. 2. Сполука за п. 1, в якій М являє собою арильну, хінолінільну, ізохінолінільну, дигідрохінолінільну або тетрагідрохінолінільну групу, де зазначені групи можуть бути необов'язково моно- або дизаміщеними замісниками, незалежно вибраними з групи, яка складається з алкілу; алкокси; -ОСF3; -СF3; гідроксіалкілу; галогену; алкіл-O-(СН2)0-4-СН2-; алкіл-O-(СН2)2-4-O- і R'2N-(CH2)0-4-CH2-; де R' незалежно вибраний із групи, яка складається з водню, алкілу, циклопропілу і -C(=O)O-R", де R" означає С1-С4-алкіл, -СF3, -СН2-СF3 або циклопропіл; або її сіль. 3. Сполука за п. 1, в якій М являє собою наступний радикал: 95909 4 R3 R4 R2 Q , 2 3 де R означає метил або хлор, R означає водень, 4 і R означає водень, -СН2СН2-О-СН3, -СН2СН2СН2O-СН3 або R'NH-(CH2)0-1-CH2-, де R' означає CH2CHF2, -СН2-СF3, циклопропіл, -СО-СН3, -СО-СН2СF3, -СО-СН2-СН3 або циклопропілкарбоніл, за 4 3 умови, коли R означає водень, то R являє собою метил, метокси, хлор або O-СН2СН2-O-СН3; або її сіль. 4. Сполука за будь-яким одним із пп. 1-3, в якій Q являє собою метилен; або її сіль. 5. Сполука за будь-яким одним із пп. 1-4, в якій W являє собою феніл, заміщений на V у параположенні, або наступний радикал: V N , або її сіль. 6. Сполука за будь-яким одним із пп. 1-5, в якому V являє собою СН2СН2O- або -СН2СН2СН2O-, де в обох випадках бівалентний радикал приєднаний до групи U формули (І) через їхній атом кисню, або -ОСH2СН2О-; або її сіль. 7. Сполука за будь-яким одним із пп. 1-6, в якій U являє собою моно-, ди- або тризаміщений феніл, де замісники незалежно вибрані з групи, яка складається з галогену, алкілу, алкокси і -СF3, або її сіль. 1 8. Сполука за будь-яким одним із пп. 1-7, в якій R являє собою циклопропіл. 9. Сполука за п. 1, вибрана з групи, що включає: циклопропіл(2,3-дихлорбензил)амід (1R*,5S*,6R*,7S*)-7-{4-[3-(2-хлор-3,6дифторфенокси)-пропіл]феніл}-3,9діазабіцикло[3.3.1]нонан-6-карбонової кислоти, циклопропіл(3-метокси-2-метилбензил)амід 4-{4[3-(2-хлор-3,6-дифторфенокси)пропіл]феніл}піперидин-3-карбонової кислоти, циклопропіл(3-метокси-2-метилбензил)амід 4-{4[3-(2,6-дихлор-4-метилфенокси)пропіл]феніл}піперидин-3-карбонової кислоти, циклопропіл(3-метокси-2-метилбензил)амід 4-{4[3-(2,3,6-трифторфенокси)пропіл]феніл}піперидин-3-карбонової кислоти, циклопропіл(2,3-диметилбензил)амід 4-{4-[3-(2хлор-3,6-дифторфенокси)пропіл]феніл}-піперидин3-карбонової кислоти, циклопропіл(2,3-диметилбензил)амід 4-{4-[3-(2,6дихлор-4-метилфенокси)пропіл]феніл}-піперидин3-карбонової кислоти, циклопропіл(2,3-диметилбензил)амід 4-{4-[3-(2хлор-6-фтор-3-метилфенокси)пропіл]феніл}піперидин-3-карбонової кислоти і циклопропіл(2,3-диметилбензил)амід 4-{4-[3-(2,3,6трифторфенокси)пропіл]феніл}піперидин-3карбонової кислоти. 5 95909 6 10. Сполука за п. 1, вибрана з групи, що включає: циклопропіл(2,3-диметилбензил)амід (3R*,4S*)-4{4-[2-(2,6-дихлор-4-метилфеноксі)етокси]феніл}піперидин-3-карбонової кислоти, [2-хлор-5-(3метоксипропіл)бензил]циклопропіламід (3R,4S)-4{4-[2-(2,6-дихлор-4метилфеноксі)етокси]феніл}піперидин-3карбонової кислоти, [2-хлор-5-(2-метоксіетил)бензил]циклопропіламід (3R,4S)-4-{4-[2-(2,6-дихлор-4метилфеноксі)етокси]феніл}піперидин-3карбонової кислоти, [2-хлор-5-(3метоксипропіл)бензил]циклопропіламід (3R,4S)-6[2-(2,6-диxлop-4-мeтилфeнoкci)eтoкcи]1',2',3',4',5',6'-гeкcaгiдpo[3,4']бiпipидинiл-3'карбонової кислоти і [2-хлор-5-(2-метоксіетил)бензил]циклопропіламід (3R,4S)-6-[2-(2,6-дихлор-4-метилфеноксі)-етокси]1',2',3',4',5',6'-гексагідро[3,4']біпіридиніл-3'карбонової кислоти. 11. Сполука за п. 1, вибрана з групи, що включає: {2-хлор-5-[(2,2дифторетиламіно)метил]бензил}циклопропіламід (3R,4S)-4-{4-[2-(2,6-дихлор-4метилфеноксі)етокси]феніл}піперидин-3карбонової кислоти, {2-хлор-5-[(3,3,3трифторпропіоніламіно)метил]бензил}циклопропіламід (3R,4S)-4-{4-[2(2,6-дихлор-4метилфеноксі)етокси]феніл}піперидин-3карбонової кислоти, {2-хлор-5[(циклопропілметиламіно)метил]бензил}циклопропіламід (3R,4S)-4-{4-[2(2,6-дихлор-4метилфеноксі)етокси]феніл}піперидин-3карбонової кислоти, [5-(ацетиламінометил)-2хлорбензил]циклопропіламід (3R,4S)-4-{4-[2-(2,6дихлор-4-метилфеноксі)етокси]феніл}піперидин-3карбонової кислоти, [2-хлор-5-(2метиламіноетил)бензил]циклопропіламід (3R,4S)4-{4-[2-(2,6-дихлор-4метилфеноксі)етокси]феніл}піперидин-3карбонової кислоти, (2-хлор-5метиламінометилбензил)циклопропіламід (3R,4S)4-{4-[2-(2,6-дихлор-4метилфеноксі)етокси]феніл}піперидин-3карбонової кислоти, {2-хлор-5-[2-(3,3,3трифторпропіоніламіно)етил]бензил}циклопропіламід (3R,4S)-4-{4-[2 (2,6-дихлор-4метилфеноксі)етокси]феніл}піперидин-3карбонової кислоти, [2-хлор-5-(2етиламіноетил)бензил]циклопропіламід (3R,4S)-4{4-[2-(2,6-дихлор-4метилфеноксі)етокси]феніл}піперидин-3карбонової кислоти, [5-(2-ацетиламіноетил)-2хлорбензил]циклопропіламід (3R,4S)-4-{4-[2-(2,6дихлор-4-метилфеноксі)етокси]феніл}піперидин-3карбонової кислоти, {2-хлор-5-[(2фторетиламіно)метил]бензил}циклопропіламід (3R,4S)-4-{4-[2-(2,6-дихлор-4метилфеноксі)етокси]феніл}піперидин-3карбонової кислоти, (2-хлор-5-етиламінометилбензил)циклопропіламід (3R,4S)-4-{4-[2-(2,6-дихлор-4-метилфеноксі)етокси]феніл}піперидин-3-карбонової кислоти, (2-хлор-5циклопропіламінометилбензил)циклопропіламід (3R,4S)-4-{4-[2-(2,6-дихлор-4метилфеноксі)етокси]феніл}піперидин-3карбонової кислоти і [2-хлор-5-(2циклопропіламіноетил)бензил1циклопропіламід (3R,4S)-4-{4-[2-(2,6-дихлор-4метилфеноксі)етокси]феніл}піперидин-3карбонової кислоти. 12. Фармацевтична композиція, що містить сполуку за будь-яким одним із пп. 1-11 або її фармацевтично прийнятну сіль і фармацевтично прийнятний продукт у вигляді носія. 13. Сполука за пп. 1-11 або її фармацевтично прийнятна сіль для застосування як лікарського засобу. 14. Застосування сполуки за будь-яким одним із пп. 1-11 або її фармацевтично прийнятної солі для приготування фармацевтичної композиції для лікування і/або профілактики захворювань, таких як (або пов'язаних із ними) гіпертонія, застійна серцева недостатність, легенева гіпертензія, ниркова недостатність, ниркова ішемія, ниркова декомпенсація, фіброз нирок, серцева недостатність, гіпертрофія серця, фіброз серця, міокардіальна ішемія, кардіоміопатія, гломерулонефрит, ниркова коліка, ускладнення, пов'язані з діабетом, а саме нефропатія, васкулопатія і невропатія, глаукома, підвищений внутрішньоочний тиск, атеросклероз, рестеноз після пластичної операції на судинах, ускладнення після хірургічної операції на судинах і серці, еректильна дисфункція, гіперальдостеронізм, пневмофіброз, склеродерма, страх, розлад пізнавальної здатності, ускладнення від лікування імунодепресантами, та інших захворювань, які відомі як пов'язані з системою ренін-ангіотензин. Винахід стосується нових сполук формули (І). Винахід також стосується споріднених аспектів, що включають способи одержання сполук, фармацев тичні композиції, що містять сполуку формули (І), і особливо їхнього застосування як інгібіторів реніну 7 на випадок серцево-судинних порушень і ниркової недостатності. У системі ренін-ангіотензин (RAS) біологічно активний ангіотензин II (Ang II) утворюється за двоступінчастим механізмом. Високоспецифічний фермент ренін розщеплює ангіотензиноген до ангіотензину І (Ang І), який потім додатково зазнає обробки до Ang II менш специфічним ферментом (АСЕ), що перетворює ангіотензин. Відомо, що Ang II впливає, принаймні, на два підтипи рецепторів, які називають AT1 і АТ2. У той час як АТ1, мабуть, передає більшість відомих функцій Ang II, роль АТ2 є ще невідомою. Модуляція RAS-системи являє собою головне досягнення в лікуванні серцево-судинних захворювань. АСЕ-інгібітори і АТ1-блокатори були прийняті для лікування гіпертонії (Waeber В. et al., "The renin-angiotensin system: role in experimental and human hypertension", in Birkenhager W. H., Reid J. L., (eds): Hypertension, Amsterdam, Elsevier Science Publishing Co., 1986, 489-519; Weber Μ. Α., Am. J. Hypertens., 1992, 5, 247S). Крім того, АСЕінгібітори застосовуються для захисту нирок (Rosenberg Μ. Ε. et al., Kidney International, 1994, 45, 403; Breyer J. A. et al., Kidney International, 1994, 45, S156), для профілактики застійної серцевої недостатності (Vaunghan D. E. et al., Cardiovasc. Res., 1994, 28, 159; Fouad-Tarazi F. et al., Am. J. Med., 1988, 84 (Suppl. ЗА), 83) та інфаркту міокарда (Pfeffer Μ. Α. et al., N. Engl. J. Med., 1992, 327, 669). Раціональний підхід для розробки інгібіторів реніну полягає в специфічності реніну (Kleinert Η. D., Cardiovasc. Drugs, 1995, 9, 645). Єдиний субстрат, відомий для реніну, являє собою ангіотензиноген, який може бути оброблений тільки реніном (за фізіологічних умов). Навпаки, АСЕ може також розщеплювати брадикінін крім Ang І і кружним шляхом може бути дубльована хімазою, серинпротеазою (Husain Α., J. Hypertens., 1993, 11, 1155). У пацієнтів інгібування АСЕ тим самим призводить до акумуляції брадикініну, що викликає кашель (5-20%) і ангіоневротичний набряк (0,10,2%), що потенційно загрожує життю (Israili Ζ. Η. et al., Annals of Internal Medicine, 1992, 117, 234). Хімаза не інгібується ACE-інгібіторами. Тому утворення Ang II все ж є можливим у пацієнтів, які проліковані АСЕ-інгібіторами. Блокада АТ1-рецептора (наприклад, лозартаном), з іншого боку, надмірно впливає на інші підтипи АТ-рецепторів (наприклад, АТ2) до Ang II, концентрація яких значно підвищується блокадою AT1-рецепторів. У результаті, інгібітори реніну, як чекають, будуть демонструвати фармацевтичний профіль, який відрізняється від профілю інгібіторів АСЕ і блокаторов AT1 із точки зору ефективності в блокуванні RAS і аспектів безпеки. Тільки обмежений клінічний досвід (Azizi Μ. et al., J. Hypertens., 1994, 12, 419; Neutel J. M. et al., Am. Heart, 1991, 122, 1094) був створений з інгібіторами реніну внаслідок їхньої недостатньої пероральної активності через їхню пептидоміметичну природу (Kleinert Η. D., Cardiovasc. Drugs, 1995, 9, 645). Клінічна розробка декількох сполук була припинена через дану проблему і високу вартість 95909 8 продуктів. Тільки одна сполука, що містить чотири хіральні центри, увійшла в клінічні випробування (Rahuel J. et al., Chem. Biol., 2000, 7, 493; Mealy N. E., Drugs of the Future, 2001, 26, 1139). Таким чином, є необхідними інгібітори реніну з хорошою пероральною біодоступністю і тривалим періодом дії. Недавно були описані перші непептидні інгібітори реніну, які показують високу активність in vitro (Oefher C. et al., Chem. Biol., 1999, 6, 127; Patent Application WO 97/09311; Marki H. P. et al., ll Farmaco, 2001, 56, 21). Однак стан розробки даних сполук невідомий. Даний винахід стосується інгібіторів реніну непептидної природи і низької молекулярної маси. Описані перорально активні інгібітори реніну формули (І), які мають тривалий період дії та які є активними при симптомах за межами регулювання кров'яного тиску, де тканинна система ренін/хімаза може бути активована, що призводить до патофізіологічно змінених локальних функцій, таких як ниркова, кардіальна і судинна перебудова, атеросклероз і можливо рестеноз. Таким чином, даний винахід описує дані непептидні інгібітори реніну формули (І). Зокрема, даний винахід стосується нових сполук формули (І) (I) в якій W являє собою фенільний цикл або шестичленний, не бензоконденсований ароматичний цикл, що містить від одного до чотирьох атомів азоту, де зазначені цикли заміщені в параположенні за допомогою V; V являє собою зв'язок; -(CH2)r-; -A-(CH2)s-; CH2-A-(CH2)r; -(CH2)s-A-; -(CH2)2-A-(CH2)u-; -A(CH2)v-B-; -СН2-СН2-СН2-A-СН2-; -A-CH2-CH2-BCH2-; -СН2-А-СН2-СН2-В-; -СН2-СН2-СН2-А-СН2СН2-; -CH2-CH2-CH2-CH2-A-CH2-; -А-СН2-СН2-ВСН2-СН2-; -СН2-А-СН3-СН2-В-СН2-; -СН2-А-СН2СН2-СН2-В-; -СН2-СН2-А-СН2-СН2-В-; -О-СН2СН(ОСН3)-СН2-О-; -О-СН2-СН(СН3)-СН2-О-; -ОСН2-CH(CF3)-CH2-O-; -О-СН2-С(СН3)2-СН2-О-; -ОСН2-С(СН3)2-О-; -О-С(СН3)2-СН2-О-; -О-СН2СН(СН3)-О-; -О-СН(СН3)-СН2-О-; -О-СН2С(СН2СН2)-О-; або -О-С(СН2СН2)-СН2-О-; А і В незалежно являють собою -О- або -S-, переважно -О-; U являє собою незаміщений арил; моно-, ди-, три- або тетразаміщений арил, в якому замісники незалежно вибрані з групи, яка складається з галогену, алкілу, алкокси і CF3; або моно-, ди-, тризаміщений гетероарил, в якому замісники незалежно вибрані з групи, яка складається з галогену, алкілу, алкокси і CF3; Q являє собою метилен або етилен, переважно метилен; 9 Μ являє собою арильну, хінолінільну, ізохінолінільну, дигідрохінолінільну або тетрагідрохінолінільну групу, де зазначені групи можуть бути необов'язково моно- або дизаміщеними замісниками, незалежно вибраними з групи, яка складається з алкілу; алкокси; -OCF3; -CF3; гідроксіалкілу; галогену; алкіл-О-(СН2)0-4-СН2-; алкіл-О-(СН2)2-4-О-; R'2N-(CH2)0-4-CH2-, де R' незалежно вибраний із групи, яка складається з водню, алкілу (необов'язково заміщеного одним, двома або трьома атомами фтору), циклопропілу, циклопропілметилу, C(=O)O-R", і -C(=O)-R", де R" означає С1-C4-алкіл, CF3, -CH2-CF3 або циклопропіл; і R'"NH-С(=O)-(O)01-(СН2)0-4-СН2-, де R"' означає алкіл або циклопропіл; 1 R являє собою алкіл або циклоалкіл, переважно циклоалкіл, а саме, особливо циклопропіл; n являє собою ціле число 0 або 1; r являє собою ціле число 3, 4, 5 або 6; s являє собою ціле число 2, 3, 4 або 5; t являє собою ціле число 1, 2, 3 або 4; u являє собою ціле число 1, 2 або 3; і ν являє собою ціле число 2, 3 або 4; та оптично чистих енантіомерів, сумішей енантіомерів, таких як рацемати, діастереомерів, сумішей діастереомерів, діастереомерних рацематів, сумішей діастереомерних рацематів, і мезоформ, а також солей і сольватів таких сполук і морфологічних форм. Загальні терміни, використані вище і нижче в даному документі, мають у рамках даного розкриття наступні значення, якщо не обумовлено особливо. Там, де застосовується форма множини для сполук, солей, фармацевтичних композицій, захворювань і тощо, вона передбачається також для позначення окремої сполуки, солі або тощо. Будь-яке посилання на сполуку формули (І) повинно бути сприйняте як таке, що стосується також оптично чистих енантіомерів, сумішей енантіомерів, таких як рацемати, діастереомерів, сумішей діастереомерів, діастереомерних рацематів, сумішей діастереомерних рацематів і мезоформ, а також солей (особливо фармацевтично прийнятних солей) і сольватів (що включають гідрати) таких сполук і морфологічних форм, як доречних і практично доцільних. У визначеннях формули (І) - якщо не обумовлено особливо - термін алкіл, сам по собі або в комбінації з іншими групами, означає насичені, прямі і розгалужені ланцюгові групи з однимсімома атомами вуглецю, переважно з однимичотирма атомами вуглецю, тобто, С1-С4-алкіл. Приклади алкільних груп являють собою метил, етил, н-пропіл, ізопропіл, н-бутил, ізобутил, вторбутил, трет-бутил, пентил, гексил і гептил. Надають перевагу метильним, етильним та ізопропільним групам. Термін алкокси, сам по собі або в комбінації з іншими групами, стосується R-O-групи, в якій R означає алкільну групу. Приклади алкоксигруп являють собою метокси, етокси, пропокси, ізопропокси, ізобутокси, втор-бутокси і трет-бутокси. Термін гідроксіалкіл, сам по собі або в комбінації з іншими групами, стосується HO-R-групи, в 95909 10 якій R означає алкільну групу. Приклади гідроксіалкільних груп являють собою НО-СН2-, HOCH2CH2-, HO-CH2CH2CH2- і СН3СН(ОН)-. Термін галоген означає фтор, хлор, бром або йод, переважно фтор, хлор або бром, особливо фтор або хлор. Термін циклоалкіл, сам по собі або в комбінації, означає насичену циклічну вуглеводневу кільцеву систему з 3-7 атомами вуглецю, наприклад, циклопропіл, циклобутил, циклопентил, циклогексил і циклогептил. Циклопропільна група є переважною групою. Термін арил, сам по собі або в комбінації, стосується фенільної, нафтильної або інданільної групи, переважно фенільної групи. Термін гетероарил, сам по собі або в комбінації, означає шестичленні ароматичні цикли, що містять від одного до чотирьох атомів азоту; бензоконденсовані шестичленні ароматичні цикли, що містять від одного до трьох атомів азоту; п'ятичленні ароматичні цикли, що містять один атом кисню, один атом азоту або один атом сірки; бензоконденсовані п'ятичленні ароматичні цикли, що містять один атом кисню, один атом азоту або один атом сірки; п'ятичленні ароматичні цикли, що містять два гетероатоми, незалежно вибрані з кисню, азоту і сірки, і бензоконденсовані похідні таких циклів; п'ятичленні ароматичні цикли, що містять три атоми азоту та їх бензоконденсовані похідні; тетразолільний цикл; триазинільний цикл; або кумариніл. Приклади таких циклічних систем являють собою фураніл, тієніл, піроліл, піридиніл, піримідиніл, індоліл, хінолініл, ізохінолініл, імідазоліл, триазиніл, тіазоліл, ізотіазоліл, піридазиніл, піразоліл, оксазоліл, ізоксазоліл, бензотієніл, хіназолініл і хіноксалініл. Солі переважно являють собою фармацевтично прийнятні солі сполук формули (І). Вислів фармацевтично прийнятні солі охоплює солі як із неорганічними кислотами або з органічними кислотами, такими як хлористоводнева кислота, бромистоводнева кислота, йодистоводнева кислота, сірчана кислота, сульфамінова кислота, фосфорна кислота, азотна кислота, фосфориста кислота, азотиста кислота, лимонна кислота, мурашина кислота, оцтова кислота, щавлева кислота, малеїнова кислота, молочна кислота, винна кислота, фумарова кислота, бензойна кислота, мигдалева кислота, корична кислота, пальмітинова кислота, стеаринова кислота, глутамінова кислота, аспарагінова кислота, метансульфонова кислота, етансульфонова кислота, етандисульфонова кислота, п-толуолсульфонова кислота, саліцилова кислота, бурштинова кислота, трифтороцтова кислота і таке інше, які нетоксичні для живих організмів або, у разі сполуки формули (І), є кислотними за природою, так і з неорганічною основою, такою як основа лужного або лужноземельного елемента, наприклад, гідроксид натрію, гідроксид калію, гідроксид кальцію і таке інше. На інші приклади фармацевтично прийнятних солей можна зробити посилання на "Salt selection for basic drugs", Int. J. Pharm. (1986), 33, 201-217. Сполуки формули (І) можуть містити асиметричні атоми вуглецю і можуть бути приготовані у 11 95909 формі оптично чистих енантіомерів, сумішей енантіомерів, таких як рацемати, діастереомерів, сумішей діастереомерів, діастереомерних рацематів, сумішей діастереомерних рацематів, або мезоформ. Даний винахід охоплює всі дані форми. Суміші розділяють способом, відомим для розділення речовин у чистому вигляді, наприклад, колонковою хроматографією, тонкошаровою хроматографією (ТШХ/TLC), високоефективною рідинною хроматографією (BEPX/HPLC), або кристалізацією. Сполуки винаходу також включають нітрозовані сполуки формули (І), які були нітрозовані за одним або декількома сайтами, такими як кисень (гідроксильна конденсація), сірка (сульфгідрильна конденсація) і/або азот. Нітрозовані сполуки даного винаходу можуть бути приготовані традиційними способами, відомими фахівцеві в даній галузі. Наприклад, відомі способи з нітрозуючих сполук описані в U.A. Pat. Nos. 5380758, 5703073, 5994294, 6242432 і 6218417; WO 98/19672; і Оае et al., Org. Prep. Proc. Int., 15(3): 165-198 (1983). Група переважних сполук формули (І) є групою, в якій η являє собою ціле число 1 і замісники 1 в циклі, -CON(R )-Q-M і -W-V-U, знаходяться в транс-положенні один до одного. Група особливо переважних сполук формули (І) є групою, в якій η являє собою ціле число 0 і конфігурації в положеннях 3 і 4 піперидинового циклу формули (І) являють собою 3R і 4S, відповідно. Група переважних сполук формули (І) є групою, в якій Μ являє собою арильну, хінолінільну, ізохінолінільну, дигідрохінолінільну або тетрагідрохінолінільну групу, де зазначені групи необов'язково можуть бути моно-або дизамещені замісниками, незалежно вибраними з групи, яка складається з алкілу; алкокси; -OCF3; -CF3; гідроксіалкілу; галогену; алкіл-O-(СН2)0-4-СН2-; алкіл-О(СН2)2-4-О-; і R'2N-(CH2)0-4-CH2-, де R' незалежно вибраний із групи, яка складається з водню, алкілу, циклопропілу, і -C(=O)-R", де R" означає С1-С4алкіл, -CF3, -CH2-CF3 або циклопропіл. Інша група переважних сполук формули (І) є групою, в якій Μ являє собою арил, переважно феніл, який, зокрема, необов'язково моно- або дизаміщений замісниками, незалежно вибраними з групи, яка складається з алкілу, алкокси, -OCF3, CF3, гідроксіалкілу і галогену, переважно з групи, яка складається з алкілу, алкокси і галогену. Інша група особливо переважних сполук формули (І) є групою, в якій Μ являє собою наступний радикал: 2 3 де R означає метил або хлор, R означає во4 день, і R означає водень, -СН2СН2-О-СН3, СН2СН2СН2-О-СН3, або R'NH-(CH2)0-1-CH2-, де R' означає CH2-CHF2, -CH2-CF3, циклопропіл, -СОСН3, -СО-СН2-СF3, -СО-СН2-СН3, або циклопропіл 12 4 3 карбоніл, за умови, коли R означає водень, то R являє собою метил, метокси, хлор, або ОСН2СН2О-СН3. Дуже переважною групою сполук формули (І) є група, в якій Μ являє собою наступний радикал: 2 3 4 де R означає хлор, R означає водень і R означає -CH2CH2-O-CH3. Дуже переважною групою сполук формули (І) є група, в якій Μ являє собою наступний радикал: 2 3 де R означає водень, R означає метоксіеток4 си і R означає СН2СН2СН2-О-СН3. Наступна група переважних сполук формули (І) є групою, в якій Q являє собою метилен. Наступна група переважних сполук формули 1 (І) є групою, в якій R являє собою циклопропіл. Інша група переважних сполук формули (І) є групою, в якій W являє собою феніл, заміщений на V у пара-положенні, або наступний радикал: Інша група переважних сполук формули (І) є групою, в якій W являє собою феніл, заміщений на V у пара-положенні. Інша група особливо переважних сполук формули (І) є групою, в якій W являє собою наступний радикал: Наступна група переважних сполук формули (І) є групою, в якій V являє собою -СН2СН2О- або СН2СН2СН2О-, де в обох випадках бівалентний радикал приєднаний до групи U формули (І) через атом кисню, або -ОСН2СН2О-. Дуже переважна група сполук формули (І) є групою, в якій V являє собою -ОСН2СН2О-. Інша група переважних сполук формули (І) є групою, в якій V являє собою -ОСН2СН2О- або особливо -СН2СН2СН2О- [переважно де -СН2 13 95909 частина -СН2СН2СН2О-фрагмента приєднана до групи W формули (І)]. Наступна група переважних сполук формули (І) є групою, в якій U являє собою моно-, ди-, триабо тетразаміщений арил, переважно моно-, ди-, або тризаміщений феніл, де замісники незалежно вибрані з групи, яка складається з галогену, алкілу, алкокси і -CF3, особливо з групи, яка складається з галогену або алкілу. Інша група особливо переважних сполук формули (І) є групою, в якій U являє собою 2,6-дихлор4-метилфеніл. Інша група особливо переважних сполук формули (І) є групою, в якій U являє собою 2-хлор-3,6дифторфеніл. Переважний варіант здійснення даного винаходу стосується сполук формули (І), де W являє собою феніл, заміщений на V у пара-положенні, або наступний радикал: V являє собою -ОСН2СН2Оабо СН2СН2СН2О-, де СН2-частина -СН2СН2СН2Офрагмента приєднана до групи W формули (І); U являє собою тризаміщений феніл, в якому замісники незалежно вибрані з атомів галогену (зокрема, фтору і хлору) і алкілу (зокрема, метилу); Q являє собою метилен; Μ являє собою наступний радикал: 2 3 де R означає метил або хлор, R означає во4 день, і R означає водень, -СН2СН2-О-СН3, СН2СН2СН2-О-СН3, або R'NH-(CH2)0-1-CH2-, де R' означає алкіл (необов'язково заміщений одним або двома атомами фтору), циклопропіл, циклопропілметил, -СО-СН3, або -CO-CH2-CF3, за умови, 4 3 коли R означає водень, то R являє собою метил, метокси, або хлор; 1 R являє собою циклопропіл; і n являє собою ціле число 0 або 1. Даний винахід також стосується сполук формули (І), де значення одного або декількох замісників або символів, визначені для формули (І), або переважного варіанту формули (І), замінені на їх переважні значення, визначені тут, а саме, значення, визначені для вищенаведених переважних груп сполук. Особливо переважні сполук формули (І) являють собою сполуки, вибрані з групи, що включає: циклопропіл(2,3-дихлорбензил)амід (1R*,5S*,6R*,7S*)-7-{4-[3-(2-хлор-3,6 14 дифторфенокси)пропіл]феніл}-3,9-діазабіцикло[3.3.1]нонан-6-карбонової кислоти, цикл опропіл(3-метокси-2-метил бензил)амід 4-{4-[3-(2-хлор-3,6-дифторфенокси)пропіл]феніл} піперидин-3-карбонової кислоти, циклопропіл(3-метокси-2-метилбензил)амід 4{4-[3-(2,6-дихлор-4-метилфенокси)пропіл]феніл} піперидин-3-карбонової кислоти, циклопропіл(3-метокси-2-метилбензил)амід 4{4-[3-(2,3,6-трифторфенокси)пропіл]феніл}піперидин-3-карбонової кислоти, циклопропіл(2,3-диметилбензил)амід 4-{4-[3(2-хлор-3,6-дифторфенокси)пропіл]феніл}піперидин-3-карбонової кислоти, циклопропіл(2,3-диметилбензил)амід 4-{4-[3(2,6-дихлор-4-метилфенокси)пропіл]феніл}піперидин-3-карбонової кислоти, циклопропіл(2,3-диметилбензил)амід 4-{4-[3(2-хлор-6-фтор-3-метилфенокси)пропіл]феніл}піперидин-3-карбонової кислоти, і циклопропіл(2,3-диметилбензил)амід 4-{4-[3(2,3,6-трифторфенокси)пропіл]феніл}піперидин-3карбонової кислоти. Наступні особливо переважні сполуки формули (І) являють собою сполуки, вибрані з групи, що включає: циклопропіл(2,3-диметилбензил)амід (3R*,4S*)-4-{4-[2-(2,6-дихлор-4-метил феноксі)етокси]феніл}піперидин-3-карбонової кислоти, [2-хлор-5-(3-метоксипропіл)бензил]циклопропіламід (3R,4S)-4-{4-[2-(2,6-дихлор-4метилфеноксі)етокси]феніл}піперидин-3карбонової кислоти, [2-хлор-5-(2-метоксіетил)бензил]циклопропіламід (3R,4S)-4-{4-[2-(2,6-дихлор-4-метилфеноксі) етокси]феніл}піперидин-3-карбонової кислоти, [2-хлор-5-(3-метоксипропіл)бензил]циклопропіламід (3R,4S)-6-[2-(2,6-дихлор-4метилфеноксі)етокси]-1',2',3',4',5',6'гексагідро[3,4']біпіридиніл-3'-карбонової кислоти, і [2-хлор-5-(2-метоксіетил)бензил]циклопропіламід (3R,4S)-6-[2-(2,6-дихлор-4метилфеноксі)етокси]-1',2',3',4',5',6'гексагідро[3,4']біпіридиніл-3'-карбонової кислоти. Інша група особливо переважних сполук формули (І) являє собою сполуки, вибрані з групи, що включає: {2-хлор-5-[(2,2-дифторетиламіно)метил]бензил}циклопропіламід (3R,4S)-4-{4-[2-(2,6-дихлор-4метилфеноксі)етокси]феніл}піперидин-3карбонової кислоти, {2-хлор-5-[(3,3,3-трифторпропіоніламіно)метил]бензил}циклопропіламід (3R,4S)-4-{4-[2-(2,6дихлор-4-метилфеноксі)етокси]феніл}піперидин-3карбонової кислоти, {2-хлор-5-[(циклопропілметиламіно)метил]бензил}циклопропіламід (3R,4S)-4-{4-[2-(2,6-дихлор-4метилфеноксі)етокси]феніл}піперидин-3карбонової кислоти, [5-(ацетиламінометил)-2-хлорбензил]циклопропіламід (3R,4S)-4-{4-[2-(2,6-дихлор-4метилфеноксі)етокси]феніл}піперидин-3карбонової кислоти, [2-хлор-5-(2-метиламіноетил)бензил]циклопропіламід (3R,4S)-4-{4-[2-(2,6-дихлор-4 15 метилфеноксі)етокси]феніл}піперидин-3карбонової кислоти, (2-хлор-5-метиламінометилбензил)циклопропіламід (3R,4S)-4-{4-[2-(2,6-дихлор-4метилфеноксі)етокси]феніл}піперидин-3карбонової кислоти, {2-хлор-5-[2-(3,3,3-трифторпропіоніламіно) етил]бензил}циклопропіламід (3R,4S)-4-{4-[2-(2,6дихлор-4-метилфеноксі)етокси]феніл}піперидин-3карбонової кислоти, [2-хлор-5-(2-етиламіноетил)бензил]циклопропіламід (3R,4S)-4-{4-[2-(2,6-дихлор-4метилфеноксі)етокси]феніл}піперидин-3карбонової кислоти, [5-(2-ацетиламіноетил)-2-хлорбензил]циклопропіламід (3R,4S)-4-{4-[2-(2,6-дихлор-4метилфеноксі)етокси]феніл}піперидин-3карбонової кислоти, {2-хлор-5-[(2-фторетиламіно)метил]бензил} циклопропіламід (3R,4S)-4-{4-[2-(2,6-дихлор-4метилфеноксі)етокси]феніл}піперидин-3карбонової кислоти, (2-хлор-5-етиламінометилбензил)циклопропіламід (3R,4S)-4-{4-[2-(2,6-дихлор-4метилфеноксі)етокси]феніл}піперидин-3карбонової кислоти, (2-хлор-5-циклопропіламінометилбензил)циклопропіламід (3R,4S)-4-{4-[2-(2,6-дихлор-4метилфеноксі)етокси]феніл}піперидин-3карбонової кислоти, і [2-хлор-5-(2-циклопропіламіноетил)бензил]циклопропіламід (3R,4S)-4-{4-[2-(2,6-дихлор-4метилфеноксі)етокси]феніл}піперидин-3карбонової кислоти. Сполуки формули (І) є застосовними для лікування і/або профілактики захворювань, таких як (або пов'язаних із ними) гіпертонія, застійна серцева недостатність, легенева гіпертензія, ниркова недостатність, ниркова ішемія, ниркова декомпенсація, фіброз нирок, серцева недостатність, гіпертрофія серця, фіброз серця, міокардіальна ішемія, кардіоміопатія, гломерулонефрит, ниркова коліка, ускладнення, пов'язані з діабетом, а саме, нефропатія, васкулопатія і невропатія, глаукома, підвищений внутрішньоочний тиск, атеросклероз, рестеноз після пластичної операції на судинах, ускладнення після хірургічної операції на судинах і серці, еректильна дисфункція, гіперальдостеронізм, пневмофіброз, склеродерма, страх, розлад пізнавальної здатності, ускладнення від лікування імунодепресантами, та інших захворювань, які відомі, як пов'язані з системою ренін-ангіотензин. Сполуки формули (І) є особливо застосовними для лікування і/або профілактики захворювань, таких як (або пов'язаних із ними) гіпертонія, застійна серцева недостатність, легенева гіпертензія, ниркова недостатність, ниркова ішемія, ниркова декомпенсація, фіброз нирок, серцева недостатність, гіпертрофія серця, фіброз серця, міокардіальна ішемія, кардіоміопатія, ускладнення, пов'язані з діабетом, а саме, нефропатія, васкулопатія і невропатія. В одному варіанті здійснення винахід стосується способу лікування або профілактики захворювань, які пов'язані з порушенням регулювання 95909 16 системи ренін-ангіотензин, зокрема, способу лікування або профілактики вищезазначених захворювань, при цьому зазначений спосіб включає введення пацієнтові фармакологічно активної кількості сполук формули (І). Наступний аспект даного винаходу стосується фармацевтичних композицій, що містять сполуку формули (І) і фармацевтично прийнятний матеріал як носій. Дані фармацевтичні композиції можна застосовувати для лікування і/або профілактики вищезазначених захворювань. Фармацевтичні композиції можна застосовувати для ентерального, парентерального або місцевого введення. їх можна вводити, наприклад, перорально, наприклад, у вигляді таблеток, таблеток із покриттям, драже, твердих і м'яких желатинових капсул, розчинів, емульсій або суспензій, ректально, наприклад, у вигляді супозиторіїв, парентерально, наприклад, у вигляді розчинів для ін'єкцій або розчинів для інфузій, або локально, наприклад, у вигляді мазей, кремів або олій. Винахід також стосується застосування сполуки формули (І) для приготування фармацевтичних композицій для лікування або профілактики вищезазначених захворювань. Виготовлення фармацевтичних композицій може бути здійснене способом, який буде відомий будь-якому фахівцеві в даній галузі (див., наприклад, Mark Gibson, Editor, Pharmaceutical Preformulation and Formulation, IHS Health Group, Englewood, CO, USA, 2001; Remington, The Science th and Practice of Pharmacy, 20 Edition, Philadelphia College of Pharmacy and Science), внесенням описаних сполук формули (І) або їх фармацевтично прийнятних солей, необов'язково в комбінації з іншими терапевтично корисними речовинами, у галенову форму для введення разом із придатними, нетоксичними, інертними терапевтично сумісними твердими або рідкими носіями і, якщо бажано, корисними фармацевтичними ад'ювантами. Сполуки формули (І) або вищезазначені фармацевтичні композиції також є застосовними в комбінації з іншими фармакологічно активними сполуками, такими як АСЕ-інгібітори, інгібітори нейтральної ендопептидази, антагоністи альдостерону, антагоністи рецептора ангіотензину II, антагоністи рецепторів ендотеліну, вазодилататори, антагоністи кальцію, активатори калію, діуретики, симпатолітики, бета-адренергічні антагоністи, альфа-адренергічні антагоністи та/або інші лікарські засоби, корисні для запобігання або лікування вищезазначених захворювань, такі як інгібітори 11бета-гідроксистероїдної дегідрогенази типу 1 і активатори розчинної гуанілатциклази. Даний винахід також стосується проліків сполуки формули (І), які перетворюються in vivo у сполуку формули (І) як таку. Будь-яке посилання на сполуку формули (І) тому повинно бути сприйняте як таке, що стосується також відповідних проліків сполуки формули (І), як доречних і практично доцільних. Сполуки формули (І) можуть бути приготовані зі сполуки вигляду А (WO 03/093267; WO 04/002957), як описано на схемі 1, де W, V, U і n приймають значення, визначені для формули (І). 17 95909 b 18 PG означає придатну захисну групу. R означає придатний складний ефір, який потім можна розкласти, наприклад, омиленням або гідруванням. Протягом омилення сполуки вигляду А утворюється сполука вигляду В із 20-100% виходом залежно від умов, в якій подвійний зв'язок частково зміщений до декон'югованого положення. Дану сполуку можна відділяти або можна не відділяти від відповідного аналога з подвійним ще кон'югованим зв'язком, і потім, наприклад, амідна конденсація, при1 зводить до сполуки вигляду С, де R , Q і Μ приймають значення, визначені для формули (І). Протягом амідної конденсації за допомогою оптимізації умов подвійний зв'язок може зміщуватися майже повністю. Сполука вигляду С потім відновлюється в сполуку вигляду D. Нарешті, видалення захисту призводить до сполуки формули (І). Звичайно, відновлення може також відбуватися зі сполукою вигляду В, яку в цьому випадку відділя ють від її регіоізомеру з ще кон'югованим подвійним зв'язком. У цьому випадку виходить сполука вигляду Е, яка перетворюється в сполуку вигляду D після амідної конденсації. Якщо n=0, то кон'югована сполука вигляду А або В може відновлюватися до відповідної насиченої сполуки магнієм у метанолі. Після рівноваги виділяється транспросторово розташований стереоізомер. Омилення (якщо необхідно) призводить до сполуки вигляду Е. Фахівцеві в даній галузі буде очевидно, що послідовність даних стадій може бути змінена або модифікована в більшості випадків. Зміщення подвійного зв'язку у сполуці вигляду В та її відновлення в сполуки D і Ε призводять до сумішей стереоізомерів. Дані стереоізомери можуть бути виділені стандартними методами, такими як флеш-колонкова хроматографія, ВЕРХ або хіральна ВЕРХ. Іншу сполуку вигляду F можна використати, як b описано на схемі 2, де R означає придатний a складноефірний замісник, і R означає попередник замісника V, визначеного для формули (І). Дана сполука вигляду F перетворюється в сполуку вигляду G, яка, у свою чергу, перетворюється в сполуку вигляду Н, при застосуванні умов амідної конденсації, які сприяють зміщенню подвійного зв'язку. Відновлення подвійного зв'язку призводить до сполуки вигляду J, яка потім перетворюється в сполуку формули (І). Також сполука вигляду F може відновлюватися в сполуку вигляду K. U-V-Wланцюг завершується з утворенням сполуки вигляду L, потім складний ефір гідролізується до сполуки вигляду Е. 19 Приклади Скорочення (використані в даному документі): Ас АсОН Ang вод. 9-BBN Вос BSA Вu BuLi cone. Су DIPEA DMAP ДМФА ДМСО EDC.HCI EIA ELSD єкв. ES Et EtOAc EtOH Ас оцтова кислота ангіотензин водний 9-борабіцикло[3.3.1]нонан трет-бутилоксикарбоніл альбумін бичачої сироватки бутил н-бутиллітій концентрований циклогексил діізопропілетиламін 4-N,N-диметиламінопіридин Ν,Ν-диметилформамід диметилсульфоксид етил-N,Nдиметиламінопропілкарбодіімід гідрохлорид імуноферментний аналіз детектування світлорозсіювання пари еквівалент(и) електроспрей етил етилацетат етанол 95909 20 FC г Hex HOBt ВЕРХ PX-MC Me MeOH xb MC NMO OAc OD Орг. PBS PG Ph Rf к.т. нас. розч. ТВАС TBAF TBDMS TBTU флеш-хроматографія година(и) гексан гідроксибензотриазол високоефективна рідинна хроматографія рідинна хроматографія-масспектроскопія метил метанол хвилина(и) мас-спектроскопія/МС N-метилморфоліноксид ацетат оптична густина органічний фосфатно-сольовий буферний розчин захисна група феніл показник утримування (для ТШХ) кімнатна температура/к.т. насичений розчин тетрабутиламоній хлорид тетрабутиламоній фторид тригідрат трет-бутилдиметилсиліл О-(бензотриазол-1-іл)-N,N,N',N'тетраметилуроній тетрафторборат 21 tBu Tf TFA ТГФ ТШХ tR УФ вид. трет-бутил трифторметилсульфоніл трифтороцтова кислота тетрагідрофуран тонкошарова хроматографія час утримування ультрафіолетовий видимий ВЕРХ- або РХ-МС-умови (якщо не обумовлено особливо) Аналітичні: Zorbax 59 SB Aqua колонка, 4,6×50 мм від Agilent Technologies. Елюент: А: ацетонітрил; В: Н2О + 0,5% TFA. Градієнт: 90% В → 5% В протягом 2 хв. Потік: 1 мл/хв. Детектування: УФ/вид. + МС. Препаративні: Zorbax SB Aqua колонка, 20×500 мм від Agilent Technologies. Елюент: А: ацетонітрил; В: Н2О + 0,05% амоній гідроксид (25% водним). Градієнт: 80% В → 10% В протягом 6 хв. Потік: 40 мл/хв. Детектування: УФ + МС, або УФ + ELSD. Хіральні, аналітичні: Regis Whelk колонка, 4,6×250 мм, 10 мкм. Елюент А: ЕtOН + 0,05% Et3N. Елюент В: гексан. Ізократичні умови, 1 мл/хв. Ізократична суміш може змінюватися залежно від сполук. Хіральні, препаративні: такі як аналітичні умови, але на Regis Whelk 01 колонці, 50×250 мм, на потоці при 100 мл/хв. Загальна методика для Mitsunobu конденсації і видалення Вос-захисту Необхідний фенол (2 екв.) вміщують у реакційну колбу. Додають сполуку J3 або J4 (приблизно 80 мг, 1 екв.), розчинену в толуолі (1 мл), із подальшим додаванням дипіперидиду азодикарбонової кислоти (2 екв.), розчиненого в толуолі (1 мл). Реакційну суміш дегазують за допомогою N2 і в кінці додають РВu3 (3 екв.). Реакційну суміш нагрівають при 90°С (у попередньо нагрітій системі) протягом 1 години, потім охолоджують знову до к.т. Додають Et2O (5 мл), суміш фільтрують, і розчинники випарюють при зниженому тиску. Сирий проміжний продукт очищають ВЕРХ зі оберненими фазами. Очищений продукт розчиняють у діоксані (1 мл) і додають НСI у діоксані (4 М; 1 мл). Суміш перемішують при к.т. протягом 2 годин. Розчинники видаляють при зниженому тиску, одержуючи гідрохлоридну сіль кінцевої сполуки формули (І). Загальні умови А для амідної конденсації HOBt (16,9 мг, 0,125 ммоль), DMAP (3,05 мг, 0,025 ммоль), DIPEA (0,068 мл, 0,40 ммоль) і EDC.HCI (28,8 мг, 0,150 ммоль) додавали до суміші карбонової кислоти (0,100 ммоль) й аміну (0,100 ммоль) у СН2СІ2 (1,00 мл). Суміш перемішували протягом 4 днів при к.т. Суміш фільтрували через Isolute® (0,6 г сорбенту, приготованого з 1 мл водної 1 Μ НСI. Органічний шар упарювали при зниженому тиску. Сирий продукт потім використовували без очищення. Загальні умови В для видалення Вос-захисту Вихідний продукт розчиняли в СН2СІ2 (1 мл), і розчин охолоджували до 0°С. НСI (4 Μ у діоксані, 0,5 мл), і суміш перемішували протягом 1 години, у 95909 22 той час як суміш нагрівалася до к.т. Додавали водний 1 Μ NaOH, і суміш перемішували ще протягом 5 хв. Шари розділяли, і органічний шар упарювали при зниженому тиску. Очищення за допомогою ВЕРХ (ацетонітрил із 0,05% водним концентрованим NН3/вода 10:90→90:10 по всій Хмісточковій колонці) давало зазначену в заголовку сполуку. Загальні умови С для амідної конденсації через хлорангідрид кислоти Початкову карбонову кислоту (1,00 екв.) розчиняли в толуолі (14 мл/ммоль карбонової кислоти) і додавали ДМФА (каталітичну кількість). Додавали оксалілхлорид (1,30 екв.), і суміш перемішували протягом 1 години при к.т. Розчинники видаляли при зниженому тиску, і сирий хлорангідрид кислоти розділяли на 0,100 ммоль-порції для подальших амідних конденсацій. Таку порцію хлорангідриду кислоти (0,100 ммоль) розчиняли в СН2Сl2 (1,00 мл), і до даного розчину додавали Et3N (0,014 мл, 0,10 ммоль) і розчин цільового аміну (0,100 ммоль) у СН2Сl2 (0,50 мл). Суміш перемішували протягом 1 години при к.т. і фільтрували через Isolute®, попередньо промитий водною 1Μ НСI. Після елюювання за допомогою СН2СІ2 органічний шар упарювали при зниженому тиску і залишок використовували на наступній стадії без очищення. 3-трет-Бутиловий ефір 6-етиловий ефір (рац.)(1R*,5S*)-9-метил-7-трифторметансульфонілокси3,9-діазабіцикло[3.3.1]нон-6-ен-3,6-дикарбонової кислоти 3-трет-Бутиловий ефір 6-етиловий ефір (рац.)(1R*,5S*)-9-метил-7-оксо-3,9діазабіцикло[3.3.1]нонан-3,6-дикарбонової кислоти (WO 2003/093267, 99,58 г, 305 ммоль) розчиняють у сухому ТГФ (1450 мл) в атмосфері азоту і суміш охолоджують до 0°С. NaH (16,64 г; 55% дисперсія в мінеральному маслі, 381 ммоль) додають порціями по 2 г протягом 35 хв, підтримуючи температуру в інтервалі від 0 до 4°С. Виділяється Н2 газ. Після додавання суміш стає жовто-зеленою і являє собою слабку суспензію. Реакційну суміш перемішують протягом 75 хв при температурі від 0 до 4°С. Потім додають Tf2NPh (128,6 г, 360 ммоль) у вигляді твердої речовини протягом 5 хв. Реакційна суміш стає коричневою. Охолоджуючу баню видаляють і реакційну суміш перемішують протягом вихідного дня при к.т. Реакційну суміш виливають в 1 л суміші лід/вода і розчинники видаляють при зниженому тиску. Водну фазу, що залишилася, екстрагують за допомогою ЕtOАс (3×500 мл). Об'єднані органічні шари промивають водою (500 мл) і насиченим сольовим розчином (500 мл). Органічну фазу потім сушать над MgSO4, фільтрують і упарюють при зниженому тиску. До сирого коричневого залишку (174 г) додають 50 мл пентану і суміш перемішують при 4°С протягом ночі. Кристали відфільтровують і промивають холодним гексаном (70 мл) і холодною сумішшю гексан/Еt2О (4:1, 100 мл). Це призводить до 84 г продукту, що містить деяку кількість TfNHPh. Даний продукт фільтрують через силікагель (75 г). TfNHPh вимивають із СН2СІ2. Даний продукт потім вимивають за допомогою EtOAc (3 рази 1 л), оде 23 ржуючи зазначену в заголовку сполуку після упарювання при зниженому тиску. Зазначену в заголовку сполуку одержують у трьох фракціях: а) 44,45 г не зовсім білих кристалів, b) 27,98 г злегка коричневих кристалів і с) 15г жовтого масла, що містить продукт і TfNHPh. Через 2 дні TfNHPh, що міститься у фракції с), кристалізується. її фільтрують, одержуючи 9,43 г продукту у вигляді коричневого масла. Обробка маточних розчинів Об'єднані маточні розчини, одержані вище, концентрують у вакуумі. Коричневий маслянистий залишок (75 г) очищають за допомогою FC (1500 г силікагелю), застосовуючи градієнтне елюювання (ЕtOАс/гептан 1-9 → ЕtOАс). Колонку потім промивають сумішшю ЕtOАс/МеОН 9:1. Зазначену в заголовку сполуку виділяють у вигляді 25,44 г не зовсім білої твердої речовини як чистий продукт. РХ-МС: tR = 0,87 хв; ES+: 459,24. 1-Аліл-4-бромбензол Mg (8,76 г, 360 ммоль) суспендують у ТГФ (90 мл) в атмосфері азоту в тригорлій колбі, оснащеній холодильником і краплинною лійкою. Краплинну лійку наповнюють 1,4-дибромбензолом (77,3 г, 327 ммоль) у ТГФ (40 мл). Приблизно 5% розчину 1,4-дибромбензолу обережно додають до суспензії Mg і реакцію запускають за допомогою теплового металізатора. Коли реакція починається, додають розчин 1,4-дибромбензолу з такою швидкістю, щоб реакційна суміш слабко кипіла зі зворотним холодильником (приблизно 20 хв). Суміш перемішують протягом ще 30 хв і охолоджують до 0°С. Додають ТГФ (100 мл) і краплинну лійку наповнюють розчином алілброміду (30,5 мл, 360 ммоль) у ТГФ (50 мл). Алілбромід додають повільно, підтримуючи температуру реакційної суміші нижче за 20°С. Коли додавання закінчується, суміш перемішують протягом ще 30 хв, при одночасному охолодженні до 0°С. Додають водну 1 Μ НСI. Суміш розводять Et2O і промивають водною 1 Μ НСI і насиченим сольовим розчином. Об'єднані водні екстракти знову екстрагують ЕігО. Об'єднані органічні екстракти сушать над MgSO4, фільтрують і розчинники видаляють при зниженому тиску. Перегонка залишку (11 мбар, 88-92°С) дає зазначену в заголовку сполуку (39,3 г, приблизно 61%) разом з іншою неідентифікованою домішкою. 3-(4-Бромфеніл)пропан-1-ол ВН3 (1 Μ у ТГФ, 412 мл, 412 ммоль) додають до розчину 1-аліл-4-бромбензолу (204 г, 1,03 ммоль) у ТГФ (1,00 л) в атмосфері азоту при 0°С. Суміш перемішують протягом ночі, у той час як вона нагрівається до к.т. Додають водний NaOH (2,5 Μ, 1,65 л, 4,12 моль) і суміш охолоджують до 0°С. Обережно додають по краплях Н2О2 (35%, 480 мл, 5,15 мол), і суміш перемішують протягом 3 годин. Додають Еt2О і фази відділяють. Органічний шар промивають водою (1×) і насиченим сольовим розчином (1×). Органічний шар сушать над MgSO4, фільтрують і розчинники видаляють при зниженому тиску. Очищення за допомогою FC (Еt2О/петролейний ефір 1:1 → Et2O) дає зазначену в заголовку сполуку (97,4 г, 44%). [3-(4-Бромфеніл)пропокси]трет-бутилдиметилсилан 95909 24 Розчин 3-(4-бромфеніл)пропан-1-олу (49,4 г, 230 ммоль) у ДМФА (500 мл) охолоджують до 0°С і додають імідазол (23,77 г, 349 ммоль) і TBDMS-Cl (52,6 г, 349 ммоль). Суміш перемішують протягом ночі, у той час як вона нагрівається до к.т. Суміш розводять гептаном (1,0 л) і водним насиченим NH4Cl (800 мл), і суміш струшують. Шари розділяють. Водний шар екстрагують гептаном, і об'єднані органічні екстракти промивають насиченим сольовим розчином. Органічні екстракти сушать над MgSO4, фільтрують і розчинники видаляють при зниженому тиску. Очищення за допомогою FC (Еt2О/гептан 1:99 → 1:19) дає зазначену в заголовку сполуку (68,1 г, 90%). РХ-МС: tR = 1,24 хв. 2-(2,6-Дихлор-4-метилфеноксі)етанол У тригорлій колбі, оснащеній газовим краплинним лічильником і ефективною системою охолодження, нагрівали суміш 2,6-дихлор-п-крезолу (20,0 г, 113 ммоль), [1,3]діоксолан-2-ону (9,95 г, 113 ммоль) та імідазолу (115 мг, 1,70 ммоль) при 160°С протягом 25 годин. Суміші давали змогу охолоджуватися до к.т. Очищення за допомогою FC (Еt2О/гептан 1:1) давало зазначену в заголовку сполуку (18,7 г, 75%). РХ-МС: tR = 0,88 хв. 5-Бром-2-[2-(2,6-дихлор-4-метиліфеноксі)етокси]піридин Розчин 2-(2,6-дихлор-4-метилфенокси)етанолу (18,6 г, 84 ммоль) у ТГФ (360 мл) охолоджували до 0°С. NaH (приблизно 55% у маслі, 6,60 г, приблизно 153 ммоль) додавали порціями, і суміш перемішували при к.т. протягом 30 хв. Розчин 2,5дибромпіридину (18,0 г, 76,3 ммоль) у ТГФ (60 мл) додавали по краплях, і суміш нагрівали при кипінні зі зворотним холодильником протягом 90 хв. Суміші давали змогу охолоджуватися до к.т., і до неї обережно додавали лід. Розчинники частково видаляли при зниженому тиску, і залишок розводили за допомогою ЕtOАс. Дану суміш промивали водним насиченим NH4Cl. Водний шар екстрагували знову за допомогою ЕtOАс (2×). Об'єднані органічні екстракти промивали насиченим сольовим розчином, сушили над MgSO4, фільтрували і розчинники видаляли при зниженому тиску. Очищення сирого продукту за допомогою FC (ЕtOАс/гептан 3:97) давало зазначену в заголовку сполуку (22,7 г, 79%). РХ-МС: tR= 1,13 хв; ES+: 378,08. 5-Бром-2-хлор-N-циклопропілбензамід До суспензії 5-бром-2-хлорбензойної кислоти (17,6 г, 75 ммоль) у СН2СІ2 (180 мл) додавали оксалілхлорид (7,0 мл, 83 ммоль). Додавали ДМФА (8 крапель), і суміш перемішували протягом 2 годин при к.т. Суміш концентрували при зниженому тиску, і сирий залишок розводили за допомогою СН2Сl2 (530 мл). Суміш охолоджували до 0°С, і розчин циклопропіламіну (5,8 мл, 83 ммоль) у СН2Сl2 (45 мл) додавали по краплях. Суміш перемішували протягом 10 хв при 0°С і давали змогу нагріватися до к.т. Додавали DIPEA (14,3 мл, 84 ммоль), і суміш перемішували протягом 2 годин при к.т. Суміш розводили великою кількістю СН2Сl2 і промивали водною 10% НСI, водою і насиченим сольовим розчином. Органічний шар сушили над MgSO4, фільтрували і розчинники видаляли при зниженому тиску. Залишок розтирали в гексані, фільтрували і сушили у високому вакуумі, одер 25 жуючи зазначену в заголовку сполуку (19,3 г, 94%). РХ-МС: tR = 0,84 xв; ES+: 316,89. 2-Хлор-N-циклопропіл-5-(3-метоксипропеніл) бензамід 5-Бром-2-хлор-N-циклопропілбензамід (19,3 г, 70,5 ммоль) розчиняли в суміші ДМФА (350 мл) і 1пропанолу (210 мл). Додавали Pd(OAc)2(PPh3)3 (2,64 г, 3,53 ммоль). Додавали за допомогою шприца (Е)-2-(3-метоксипропеніл)-4,4,5,5тетраметил-1,3,2-діоксаборолан (15 мл, 70,5 ммоль) і додавали водний 2 Μ Na2СО3 (123 мл). Суміш перемішували протягом 2 годин при 80°С, і їй давали змогу нагріватися до к.т. Водну 10% НСI обережно додавали доти, поки рН не дорівнював 2. Розчинники частково видаляли при зниженому тиску, і залишок екстрагували за допомогою Et2O (3×). Об'єднані органічні екстракти промивали водою і насиченим сольовим розчином, сушили над MgSO4, фільтрували і розчинники видаляли при зниженому тиску. Очищення залишку за допомогою FC (ЕtOАс/гептан 1:2 → 1:1 → ЕtOАс) давало зазначену в заголовку сполуку (12,7 г, 68%). РХМС: tR = 0,82 хв; ES+: 266,17. 2-Хлор-N-циклопропіл-5-(3метоксипропіл)бензамід 2-Хлор-N-циклопропіл-5-(3метоксипропеніл)бензамід (12,6 г, 47,6 ммоль) розчиняли в сухому толуолі (650 мл). Додавали сухий ДМФА (70 мл) і суміш нагрівали до 110°С. Бензолсульфонілгідразин (24,5 г, 143 ммоль) додавали трьома порціями протягом 3 годин. Суміш нагрівали протягом загального періоду часу 3 години, і їй давали змогу охолоджуватися до к.т. Розчинники видаляли при зниженому тиску і залишок розводили Et2O. Суміш промивали водою і водну фазу екстрагували знову Еt2О (3×). Об'єднані органічні екстракти промивали водою і насиченим сольовим розчином, сушили над MgSO4, фільтрували і розчинники видаляли при зниженому тиску. Очищення залишку за допомогою FC (ЕtOАс/гептан 1:9 → 1:4 → 1:3 → 1:1) давало зазначену в заголовку сполуку (10,0 г, 78%). РХ-МС: tR = 0,83 хв; ES+: 268,19. [2-Хлор-5-(3метоксипропіл)бензил]циклопропіламін LiAIH4 (5,70 г, 151 ммоль) додавали порціями до розчину 2-хлор-Ν-циклопропіл-5-(3метоксипропіл)бензаміду (10 г, 37,7 ммоль) у ТГФ (230 мл) при 0°С. Льодяну баню видаляли, і суміш нагрівали при кипінні зі зворотним холодильником протягом 4 годин. Суміші давали змогу охолоджуватися до к.т., і охолоджували її до 0°С. Обережно додавали воду (7,5 мл), водний 15% NaOH (17 мл) і воду (5,7 мл). Суміш фільтрували, і осад промивали за допомогою ЕtOАс. Фільтрат упарювали при зниженому тиску. Залишок розводили ЕtOАс, і одержану суміш промивали водою і насиченим сольовим розчином. Органічний шар сушили над MgSO4, фільтрували і розчинники видаляли при зниженому тиску. Очищення залишку за допомогою FC (ЕtOАс/гептан 1:4 → 1:3 → 1:2) давало зазначену в заголовку сполуку (5,60 г, 59%). РХ-МС: tR= 0,86 хв; ES+: 254,19. Загальна методика для відновного амінування заміщених бензальдегідів з циклопропіламіном 95909 26 X = галоген, зокрема, Вr Розчин заміщеного бензальдегіду (17,8 ммоль, 1,0 екв.), циклопропіламіну (3,13 мл, 44,5 ммоль, 2,5 екв.) і ціаноборогідриду натрію (1,34 г, 21,4 ммоль, 1,2 екв.) у МеОН (100 мл) обробляли краплинним додаванням льодяної оцтової кислоти (3,06 мл, 53,4 ммоль, 3,0 екв.). Одержаний розчин перемішували при к.т. протягом 16 годин протягом ночі. Реакційну суміш гасили краплинним додаванням насиченого водного NaHCO3 і концентрували при зниженому тиску для видалення МеОН. Сирий залишок виливали у 250 мл ділильну лійку, що містить насичений водний розчин NаНСО3 (150 мл), та екстрагували за допомогою ЕtOАс (3×50 мл). Об'єднані органічні шари промивали насиченим сольовим розчином, сушили над MgSO4, фільтрували і концентрували при зниженому тиску. Очищення за допомогою FC давало бензаміновий продукт. Загальна методика для Вос-захисту циклопропілбензамінів X = галоген, зокрема, Вr Розчин циклопропілбензаміну (43,7 ммоль, 1,0 екв.) у біфазній суміші СН2СІ2 (50 мл) і 1 Μ водного NaOH (50 мл) обробляли за допомогою Вос 2О (15,1 мл, 65,6 ммоль, 1,5 екв.). Суміш інтенсивно перемішували при к.т. протягом 16 годин. Суміш виливали в 500 мл ділильну лійку, що містить Н 2О (300 мл), та екстрагували за допомогою СН2СІ2 (3×100 мл). Об'єднані органічні шари промивали насиченим сольовим розчином, сушили над MgSO4, фільтрували і концентрували при зниженому тиску. Очищення за допомогою FC давало амін, захищений Вос-групою. Загальна методика для алілування Восзахищених циклопропілбензамінів X = галоген, зокрема, Вr У круглодонну колбу, висушену полум'ям, або посудину Шленка, в атмосфері N2 додавали Pd[PCy3]2 (0,05 екв.), CsF (2,0 екв.) і відповідний арилбромід (1,0 екв.). Якщо використовували арилхлорид як початковий продукт, то застосовували (Pd[PtBu3]Br)2 димер (0,025 екв.) замість Pd[PCy3]2 каталізатора. Колбу відкачували при зниженому тиску (0,1 мм Hg) і знову наповнювали N2 (повторювали 3 рази). Одержані тверді речовини розчиняли в безводному ТГФ або діоксані (0,15 Μ розчин), і до даного розчину додавали три-н 27 бутилалілолово (1,5 екв.), потім одержану суміш кип'ятили зі зворотним холодильником протягом 816 годин, поки ТШХ не показувала повне споживання початкового продукту. Реакційну суміш охолоджували до к.т. і фільтрували через шар силікагелю на лійці зі спеченим склом, промиваючи за допомогою Et2O. Фільтрат концентрували та очищали за допомогою FC, одержуючи відповідну алілбензамідну похідну. Загальна методика для гідроборування/окислення алілбензамінів У висушену полум'ям круглодонну колбу, оснащену магнітною мішалкою, додавали алілбензамін (1,0 екв.) і безводний ТГФ (0,3 Μ розчин). Розчин охолоджували до 0°С і борандиметилсульфідний комплекс (1,1 екв.) додавали по краплях протягом 20 хв. Розчин перемішували при 0°С протягом 1 години, потім йому давали змогу нагріватися до к.т., і перемішували протягом додаткових 2 годин. Розчин охолоджували до 0°С, і до нього додавали по краплях 1 Μ водний NaOH (ЗАСТЕРЕЖЕННЯ - ЕКЗОТЕРМІЧНА РЕАКЦІЯ) із подальшим додаванням по краплях 30% водної Н2О2. Суміші давали змогу нагріватися до к.т. і перемішували її протягом 2 годин. Суміш виливали в ділильну лійку, що містить Н2О та екстрагували за допомогою Et2O (3 рази). Об'єднані органічні шари промивали насиченим сольовим розчином, сушили над MgSO4, фільтрували і концентрували при зниженому тиску. Очищення за допомогою FC давало цільовий спиртовий продукт. Загальна методика для окислювального розщеплення/відновлення алілбензамінів Розчин алілбензаміну (1,0 екв.) у СН2Сl2 (0,4 Μ розчин) охолоджували до -78°С і вводили в розчин О3 газ, застосовуючи трубку для розподілу газу. Озоновий газ вводили доти, поки не був витрачений вихідний продукт, що визначається за допомогою ТШХ, і реакційна суміш зберігала слабко блакитне забарвлювання. Реакційну суміш перемішували при -78°С протягом 20 хв, потім до неї додавали ЕtOН (0,5 Μ розчин) і NaBH4 (2,5 екв.). Суміші давали змогу нагріватися при к.т. протягом ночі (16 годин). Реакційну суміш гасили краплинним додаванням насиченого водного NH4Cl (5 мл) і виливали в ділильну лійку, що містить насичений водний NH4Cl. Суміш екстрагували за допомогою Et2O (3 рази). Об'єднані органічні шари промивали насиченим сольовим розчином, сушили над MgSO4, фільтрували і концентрували при зниженому тиску. Очищення за допомогою FC давало цільовий спирт. 95909 28 Загальна методика для етерифікації ароматичних первинних спиртів із метилйодидом Суспензію первинного спирту (1,0 екв.) у ТГФ (0,25 Μ розчин) охолоджували до 0°С та обробляли за допомогою NaH (60% у маслі, 2,0 екв.). Одержану суміш перемішували при 0°С протягом 30 хв і потім при к.т. ще протягом 30 хв. Суспензію знову охолоджували до 0°С і потім МеІ (8,0 екв.) додавали однією порцією. Реакційну суміш перемішували при 0°С протягом 30 хв, при к.т. протягом 30 хв, і потім нагрівали при кипінні зі зворотним холодильником протягом 4 годин доти, поки не був витрачений вихідний продукт, що визначається за допомогою ТШХ. Охолоджену реакційну суміш гасили краплинним додаванням насиченого водного NH4CI і виливали в ділильну лійку, що містить насичений водний NH4Cl, і екстрагували за допомогою ЕtOАс (3 рази). Об'єднані органічні шари промивали насиченим сольовим розчином, сушили над MgSO4, фільтрували і концентрували при зниженому тиску. Очищення за допомогою FC давало метиловий ефір. Загальна методика для видалення захисту з циклопропілбензамінів, захищених Вос-групою До розчину циклопропілбензаміну (1,0 екв.), захищеного Вос-групою, у СН2Сl2 (0,1-0,5 Μ розчин) додавали 4 Μ НСI у діоксані (5,0 екв.). Реакційну суміш перемішували при к.т. протягом 8-16 годин доти, поки ТШХ не показувала повне перетворення початкового продукту. Реакційну суміш виливали в ділильну лійку, що містить 1 Μ водний NaOH, та екстрагували за допомогою СН2СІ2 (3 рази). Очищення за допомогою FC давало відповідний вільний амін. (5-Бром-2-хлорбензилокси)трет-бутилдиметилсилан TBDMS-Cl (10,6 г, 66,7 ммоль) додавали до розчину (5-бром-2-хлорфеніл)метанолу (12,8 г, 55,6 ммоль) та імідазолу (9,42 г, 138 ммоль) у ДМФА (190 мл) при 0°С. Суміш перемішували протягом 2 годин при 0°С, і до неї додавали водний насичений NH4Cl. Суміш екстрагували гептаном (2×). Об'єднані органічні екстракти сушили над MgSO4, фільтрували, і розчинники видаляли при зниженому тиску. Очищення залишку за допомогою FC (гептан → ЕtOАс/гептан 1:49) давало зазначену в заголовку сполуку (18,0 г, 96%). РХ-МС: tR = 1,22 хв. 3-(трет-Бутилдиметилсиланілоксиметил)-4хлорбензальдегід BuLi (1,6 Μ у гексані, 46,6 мл, 74,6 ммоль) додають до розчину (5-бром-2-хлорбензилокси)трет 29 бутилдиметилсилану (16,7 г, 49,7 ммоль) у ТГФ (500 мл). Суміш перемішували протягом 30 хв при -78°С, і до неї додавали ДМФА (19,2 мл, 249 ммоль) із такою швидкістю, щоб температура не підіймалася вище за -70°С. Суміш перемішували протягом 30 хв при -78°С, і їй давали змогу нагріватися до к.т. Суміш виливали у водний насичений NH4CІ. Одержану суміш екстрагували декілька разів за допомогою ЕtOАс. Об'єднані органічні екстракти сушили над MgSO4, фільтрували, і розчинники видаляли при зниженому тиску. Очищення залишку за допомогою FC (ЕtOАс/гептан 1:4) давало зазначену в заголовку сполуку (11,2 г, 79%). РХ-МС: tR = 1,15 хв. трет-Бутиловий ефір [3-(третбутилдиметилсиланілоксиметил)-4-хлорбензил](2,2-дифторетил)карбамінової кислоти 2,2-Дифторетиламін (660 мг, 7,90 ммоль) додавали до розчину 3-(третбутилдиметилсиланілоксиметил)-4хлорбензальдегіду (1,50 г, 5,27 ммоль) у МеОН (53 мл). Суміш нагрівали при кипінні зі зворотним холодильником протягом 4 годин, і давали змогу їй охолоджуватися до температури нижче за к.т. До суміші порціями обережно додавали NaBH4 (300 мг, 7,90 ммоль), і суміш перемішували протягом 1 години. Розчинники видаляли при зниженому тиску, і масло, що залишилося розводили за допомогою EtOAc. Суміш промивали водним насиченим NаНСО3 і насиченим сольовим розчином. Органічний шар сушили над MgSO4, фільтрували і розчинники видаляли при зниженому тиску, одержуючи [3-(трет-бутилдиметилсиланілоксиметил)-4хлорбензил]-(2,2-дифторетил)амін (1,86 г) у вигляді світлого сирого масла, яке потім використовували безпосередньо. Сирий продукт розчиняли в СН2СІ2 (53 мл), і до розчину додавали DIPEA (2,7 мл, 15,6 ммоль), потім Вос2О (1,70 г, 7,90 ммоль). Суміш перемішували при к.т. протягом 1 години. Суміш розводили за допомогою СН2CІ2 (50 мл) і промивали водною 1 Μ НСI, водним насиченим NаНСО3 і насиченим сольовим розчином. Органічний шар сушили над MgSO4, фільтрували і розчинники видаляли при зниженому тиску. Очищення сирого продукту за допомогою FC (ЕtOАс/гептан 5:95) давало зазначену в заголовку сполуку (2,27 г, 96%). РХ-МС: tR = 1,22 хв. трет-Бутиловий ефір (4-хлор-3-гідроксиметилбензил)-(2,2-дифторетил)карбамінової кислоти TBAF (1 Μ у ТГФ, 9,57 мл, 9,57 ммоль) додавали по краплях до розчину трет-бутилового ефіру [3-(трет-бутилдиметилсиланілоксиметил)-4хлорбензил]-(2,2-дифторетил)карбамінової кислоти (2,15 г, 4,78 ммоль) у ТГФ (48 мл) при 0°С. Суміш перемішували протягом 1 години, у той час як вона нагрівалася до к.т. Суміш розводили за допомогою ЕtOАс і одержану суміш промивали водним насиченим NH4CІ (×2) і насиченим сольовим розчином (×1). Органічний шар сушили над MgSO4, фільтрували, і розчинники видаляли при зниженому тиску. Очищення сирого продукту за допомогою FC (ЕtOАс/гептан 30:70) давало зазначену в заголовку сполуку (591 мг, 37%). РХ-МС: tR = 0,97 хв; ES+: 336,09. 95909 30 трет-Бутиловий ефір (4-хлор-3формілбензил)-(2,2-дифторетил)карбамінової кислоти МnО2 (830 мг, 8,59 ммоль) додавали до розчину трет-бутилового ефіру (4-хлор-3гідроксиметилбензил)-(2,2дифторетил)карбамінової кислоти (577 мг, 1,72 ммоль) у CH3CN (35 мл). Суміш перемішували при к.т. протягом 4,5 годин, і до неї знову додавали МnО2 (830 мг, 8,59 ммоль). Суміш перемішували протягом 1 години. Суміш фільтрували через целіт, і осад промивали за допомогою CH3CN і СН2CІ2. Фільтрат упарювали при зниженому тиску, одержуючи сиру зазначену в заголовку сполуку (563 мг, 98%), яку потім використовували без очищення. РХ-МС: tR = 1,03 хв. трет-Бутиловий ефір (4-хлор-3циклопропіламінометилбензил)-(2,2дифторетил)карбамінової кислоти Суміш трет-бутилового ефіру (4-хлор-3формілбензил)-(2,2-дифторетил)карбамінової кислоти (563мг, 1,69 ммоль) і циклопропіламіну (0,180 мл, 2,52 ммоль) у МеОН (18 мл) нагрівали при кипінні зі зворотним холодильником протягом 4 годин. Суміші давали змогу охолоджуватися до к.т. Додавали порціями NaBH4 (96 мг, 2,53 ммоль), і реакційну суміш перемішували протягом 1 години. Розчинники видаляли при зниженому тиску, і одержане масло розводили за допомогою ЕtOАс. Суміш промивали водним насиченим NаНСО3 і насиченим сольовим розчином. Органічний шар сушили над MgSO4, фільтрували, і розчинники видаляли при зниженому тиску. Очищення сирого продукту за допомогою FC (СН2Сl2/МеОН 95:5) давало зазначену в заголовку сполуку (558 мг, 88%). РХ-МС: tR = 0,76 хв; ES+: 375,17. Оксим 3-(трет-бутилдиметилсиланілоксиметил)-4-хлорбензальдегіду 3-(Бутилдиметилсиланілоксиметил)-4хлорбензальдегід (12,7 г, 44,6 ммоль) розчиняли в CH3CN (53 мл). До даного розчину додавали NaHCO3 (11,2 г, 134 ммоль), і суміш перемішували інтенсивно протягом 5 хв. Додавали воду (96 мл) і суміш перемішували протягом 10 хв. NH2OH.HCI (6,20 г, 89,2 ммоль) додавали по краплях, потім додавали ТВАС (622 мг, 2,24 ммоль). Суміш перемішували при к.т. протягом 1 години, і до неї додавали по краплях АсОН (4,00 мл) до рН 6-7. Суміш розводили водою (100 мл), і дану суміш екстрагували за допомогою Еt2О (×3). Об'єднані органічні екстракти сушили над MgSO4, фільтрували і розчинники видаляли при зниженому тиску. Сушіння залишку у високому вакуумі давало неочищену зазначену в заголовку сполуку (15,1 г, 98%), яку потім використовували без очищення. РХ-МС: tR = 1,09 хв; ES+: 341,13. 3-(трет-Бутилдиметилсиланілоксиметил)-4хлорбензиламін LiAlH4 (4,11 г, 108 ммоль) додавали порціями до розчину оксиму 3-(третбутилдиметилсиланілоксиметил)-4хлорбензальдегіду (13,0 г, 43,4 ммоль) в Еt2О (433 мл). Суміш перемішували при к.т. протягом 1 години. Водний насичений розчин тартрату калію натрію (400 мл) обережно додавали до суміші. 31 Суміш перемішували протягом 3 годин і екстрагували за допомогою Et2O (3×). Об'єднані органічні екстракти сушили над MgSO4, фільтрували, і розчинники видаляли при зниженому тиску. Сушіння залишку у високому вакуумі давало неочищену зазначену в заголовку сполуку (12,4 г, кількісний вихід), яку потім використовували без очищення. РХ-МС: tR = 0,84 хв; ES+: 327,37. N-[3-(трет-Бутилдиметилсиланілоксиметил)-4хлорбензил]-3,3,3-трифторпропіонамід TBTU (3,37 г, 10,5 ммоль) додавали до розчину 3-(трет-бутилдиметилсиланілоксиметил)-4хлорбензиламіну (2,00 г, 7,00 ммоль), DIPEA (4,80 мл, 28,0 ммоль) і 3,3,3-трифторпропіонової кислоти (0,927 мл, 10,5 ммоль) у СН2СІ2 (70 мл). Суміш перемішували при к.т. протягом 1 години. СН2СІ2 (30 мл) додавали, і суміш промивали водним насиченим NH4CІ (2×), водним 1 Μ NaOH (×1) і насиченим сольовим розчином (×1). Органічний шар сушили над MgSO4, фільтрували і розчинники видаляли при зниженому тиску. Очищення сирого продукту за допомогою FC (ЕtOАс/гептан 40:60) давало зазначену в заголовку сполуку (1,80 г, 65%). РХ-МС: tR = 1,10 хв; ES+: 396,15. N-(4-хлор-3-гідроксиметилбензил)-3,3,3трифторпропіонамід TBAF (1 Μ у ТГФ, 9,10 мл, 9,10 ммоль) додавали до розчину Ν-[3-(третбутилдиметилсиланілоксиметил)-4-хлорбензил]3,3,3-трифторпропіонаміду (1,80 г, 4,55 ммоль) у ТГФ (45 мл) при 0°С. Суміш перемішували протягом 1 години, у той час як вона нагрівалася до к.т. ЕtOАс (100 мл) додавали, і суміш промивали водним насиченим NH4CI (3×) і водою (4×). Органічний шар сушили над MgSO4, фільтрували, і розчинники видаляли при зниженому тиску. Очищення сирого продукту за допомогою FC (ЕtOАс/гептан 70:30) давало зазначену в заголовку сполуку (835 мг, 65%). РХ-МС: tR = 0,76 хв; ES+: 323,02. N-(4-Хлор-3-формілбензил)-3,3,3-трифторпропіонамід МnО2 (1,44 г, 14,9 ммоль) додавали до розчину Ν-(4-хлор-3-гідроксиметилбензил)-3,3,3трифторпропіонаміду (841 мг, 2,99 ммоль) у CH3CN (60 мл). Суміш перемішували при к.т. протягом 3 годин. Знов додавали МnО2 (1,44 г, 14,9 ммоль), і суміш перемішували протягом 90 хв. Суміш фільтрували через целіт, і осад промивали за допомогою CH3CN і СН2CІ2. Розчинники видаляли при зниженому тиску, і залишок сушили у високому вакуумі, одержуючи сиру зазначену в заголовку сполуку (840 мг, кількісний вихід), яку використовували без очищення. РХ-МС: tR = 0,84 хв; ES+: 341,21. N-(4-Хлор-3-цикпопропіламінометилбензил)3,3,3-трифторпропіонамід Суміш N-(4-хлор-3-формілбензил)-3,3,3трифторпропіонаміду (840 мг, 3,00 ммоль) і циклопропіламіну (0,320 мл, 4,51 ммоль) у МеОН (30 мл) нагрівали при кипінні зі зворотним холодильником протягом 4 годин. Суміші давали змогу охолонути до к.т. Додавали порціями NaBH4 (170 мг, 4,51 ммоль). Суміш перемішували протягом 1 години, і розчинники видаляли при зниженому тиску. Залишок розводили за допомогою ЕtOАс, і одержану 95909 32 суміш промивали водним насиченим NaНСО3 і насиченим сольовим розчином. Органічний шар сушили над MgSO4, фільтрували, і розчинники видаляли при зниженому тиску. Очищення сирого продукту за допомогою FC (СН2CІ2/МеOН 90:10) давало зазначену в заголовку сполуку (929 мг, 96%). РХ-МС: tR = 0,64 хв; ES+: 321,05. трет-Бутиловий ефір [3-(трет-бутилдиметилсиланілоксиметил)-4-хлорбензил]циклопропілметилкарбамінової кислоти Суміш 3-(третбутилдиметилсиланілоксиметил)-4хлорбензиламіну (2,00 г, 7,00 ммоль) і циклопропанкарбоксальдегіду (0,784 мл, 10,5 ммоль) у МеОН (70 мл) нагрівали при кипінні зі зворотним холодильником протягом 4 годин. Суміші давали змогу охолонути до к.т. До суміші порцією додавали NaBH4 (397 мг, 10,5 ммоль), і суміш перемішували протягом 1 години при к.т. Розчинники видаляли при зниженому тиску, і одержане масло розводили за допомогою ЕtOАс. Одержану суміш промивали водним насиченим NаНСО3 і насиченим сольовим розчином. Органічний шар сушили над MgSO4, фільтрували, і розчинники видаляли при зниженому тиску, одержуючи сирий продукт [3(трет-бутилдиметилсиланілоксиметил)-4хлорбензил]циклопропілметиламін. Даний сирий продукт розчиняли в СН2СІ2 (70 мл). До розчину додавали DIPEA (3,60 мл, 21,0 ммоль) і Вос2О (2,30 г, 10,5 ммоль). Суміш перемішували при к.т. протягом 2 годин, і суміш розводили за допомогою СН2СІ2 (30 мл). Одержану суміш промивали водною 1 Μ НСI, водним насиченим NаНСО3 і насиченим сольовим розчином. Органічний шар сушили над MgSO4, фільтрували і розчинники видаляли при зниженому тиску. Очищення сирого продукту за допомогою FC (гептан → ЕtOАс/гептан 10:90) давало зазначену в заголовку сполуку з домішкою Вос2О (3,60 г, кількісний вихід). РХ-МС: tR = 1,25 хв; ES+: 440,80. трет-Бутиловий ефір (4-хлор-3гідроксиметилбензил)циклопропілметилкарбамінової кислоти TBAF (1 Μ у ТГФ, 14,0 мл, 14,0 ммоль) додавали до розчину трет-бутилового ефіру [3-(третбутилдиметилсиланілоксиметил)-4хлорбензил]циклопропілметилкарбамінової кислоти (3,08 г, 7,00 ммоль) у ТГФ (68 мл) при 0°С. Суміш перемішували протягом 1 години, у той час як вона нагрівалася до к.т. Додавали ЕtOАс, і суміш промивали водним насиченим NH4CI і насиченим сольовим розчином. Органічний шар сушили над MgSO4, фільтрували, і розчинники видаляли при зниженому тиску. Очищення сирого продукту за допомогою FC (СН2CІ2 → СН2CІ2/МеOН 9:1) давало зазначену в заголовку сполуку (1,00 г, 44%). РХ-МС: tR = 0,99 хв; ES+: 326,10. трет-Бутиловий ефір (4-хлор-3формілбензил)циклопропілметилкарбамінової кислоти МnО2 (1,48 г, 15,3 ммоль) додавали до розчину трет-бутилового ефіру (4-хлор-3гідроксиметилбензил)циклопропілметилкарбамінової кислоти (1,00 г, 3,07 ммоль) у CH3CN (61 мл). Суміш перемішу 33 вали при к.т. протягом 4 годин, і до неї знов додавали МnО2 (1,48 г, 15,3 ммоль). Суміш перемішували протягом 1 години і фільтрували через целіт. Осад промивали за допомогою CH3CN і СН2CІ2. Фільтрат упарювали при зниженому тиску. Сушіння залишку у високому вакуумі давало сиру зазначену в заголовку сполуку (1,00 г, кількісний вихід), яку потім використовували без очищення. РХ-МС: tR = 1,06 хв. трет-Бутиловий ефір (4-хлор-3-циклопропіламінометилбензил)циклопропілметилкарбамінової кислоти Суміш трет-бутилового ефіру (4-хлор-3формілбензил)циклопропілметилкарбамінової кислоти (1,00 г, 3,09 ммоль), Et3N (0,646 мл, 4,64 ммоль) і циклопропіламіну (0,325 мл, 4,64 ммоль) у МеОН (10,5 мл) нагрівали при кипінні зі зворотним холодильником протягом 4 годин. Суміші давали змогу охолонути до к.т., і до неї додавали NaBH4 (292 мг, 7,71 ммоль). Суміш перемішували протягом 1 години, і до неї додавали водний насичений NaHCO3. Суміш екстрагували за допомогою EtOAc (2×). Об'єднані органічні екстракти сушили над MgSO4, фільтрували, і розчинники видаляли при зниженому тиску. Очищення сирого продукту за допомогою FC (МеОН/СН2СІ2 1:49) давало зазначену в заголовку сполуку (535 мг, 48%). РХ-МС: tR = 0,81 хв; ES+: 406,20. N-[3-(трет-Бутилдиметилсиланілоксиметил)-4хлорбензил]ацетамід АсСІ (0,547 мл, 7,70 ммоль) додавали до розчину 3-(трет-бутилдиметилсиланілоксиметил)-4хлорбензиламіну (2,00 г, 7,00 ммоль) і DIPEA (4,80 мл, 28,0 ммоль) у СН2CІ2 (70 мл) при 0°С. Суміш перемішували протягом 1 години, у той час як вона нагрівалася до к.т. СН2CІ2 (30 мл) додавали і суміш промивали водним насиченим NH4CІ (2×), водним 1 Μ NaOH (×1) і насиченим сольовим розчином (×1). Органічний шар сушили над MgSO4, фільтрували, і розчинники видаляли при зниженому тиску. Очищення сирого продукту за допомогою FC (ЕtOАс/гептан 60:40) давало зазначену в заголовку сполуку (2,10 г, 91%). РХ-МС: tR = 1,07 хв; ES+: 369,19. N-(4-Хлор-3-гідроксиметилбетил)ацетамід TBAF (1 Μ у ТГФ, 12,0 мл, 12,0 ммоль) додавали до розчину Ν-[3-(третбутилдиметилсиланілоксиметил)-4хлорбензил]ацетаміду (2,05 г, 6,00 ммоль) у ТГФ (60 мл) при 0°С. Суміш перемішували протягом 2 годин, у той час як вона нагрівалася до к.т. ЕtOАс (100 мл) додавали і суміш промивали водним насиченим NH4CI (×1) і водою (4×1). Органічний шар сушили над MgSO4, фільтрували, і розчинники видаляли при зниженому тиску. Очищення сирого продукту за допомогою FC (СН2CІ2/МеOН 90:10) давало зазначену в заголовку сполуку (750 мг, 59%). РХ-МС: tR = 0,63 хв; ES+: 237,09. N-(4-Хлор-3-формілбетил)ацетамід NMO (1,15 г, 8,26 ммоль) додавали до розчину Ν-(4-хлор-3-гідроксиметилбензил)ацетаміду (588 мг, 2,75 ммоль) у CH3CN (27 мл). Суміш перемішували при к.т. протягом 30 хв, і до неї додавали перутенат тетрапропіламонію (97 мг, 0,28 ммоль). Суміш перемішували протягом 1 години при к.т. і 95909 34 фільтрували через целіт. Осад промивали за допомогою CH3CN. Фільтрат упарювали при зниженому тиску. Очищення сирого продукту за допомогою FC (СН2CІ2/МеOН 95:5) давало зазначену в заголовку сполуку (382 мг, 66%). РХ-МС: tR = 0,71 хв; ES+: 253,07. N-(4-Хлор-3-циклопропіламінометилбензил) ацетамід Суміш N-(4-хлор-3-формілбензил)ацетаміду (382 мг, 1,81 ммоль) і циклопропіламіну (0,194 мл, 2,71 ммоль) у МеОН (18 мл) нагрівали при кипінні зі зворотним холодильником протягом 4 годин. Суміші давали змогу охолонути до к.т., і до неї додавали порціями NaBH4 (102 мг, 2,71 ммоль). Суміш перемішували протягом 1 години, і розчинники видаляли при зниженому тиску. Додавали ЕtOАс (50 мл), і одержану суміш промивали водним насиченим NаНСО3 і насиченим сольовим розчином. Органічний шар сушили над MgSO4, фільтрували, і розчинники видаляли при зниженому тиску. Очищення сирого продукту за допомогою FC (СН2CІ2/МеOН 95:5) давало зазначену в заголовку сполуку (371 мг, 81%). РХ-МС: tR = 0,53 хв; ES+: 253,11. трет-Бутил-[2-хлор-5-(2-нітровініл)бензилокси] диметилсилан Суміш 3-(третбутилдиметилсиланілоксиметил)-4хлорбензальдегіду (14,0 г, 49,1 ммоль) і ацетату амонію (3,79 г, 49,1 ммоль) у нітрометані (8,19 мл, 152ммоль) і АсОН (39 мл) нагрівали при кипінні зі зворотним холодильником протягом 3 годин. Суміші давали змогу охолонути до к.т., і суміш виливали у воду. Одержану суміш екстрагувати декілька разів за допомогою ЕtOАс. Об'єднані органічні екстракти промивали водою і водним насиченим NaHCO3 декілька разів. Органічний шар сушили над MgSO4, фільтрували, і розчинники видаляли при зниженому тиску. Залишок сушили у високому вакуумі протягом ночі і розчиняли в ДМФА (217 мл). Розчин охолоджували до 0°С, і до нього додавали імідазол (8,36 г, 123 ммоль) і TBDMS-CІ (8,84 г, 58,6 ммоль). Суміш перемішували протягом 2 годин при 0°С і виливали у водний насичений NH4CI. Одержану суміш екстрагували декілька разів за допомогою ЕtOАс. Об'єднані органічні екстракти промивали водою і насиченим сольовим розчином. Органічний шар сушили над MgSO4, фільтрували, і розчинники видаляли при зниженому тиску. Очищення сирого продукту за допомогою FC (ЕtOАс/гептан 2:8) давало зазначену в заголовку сполуку (9,50 г, 59%). РХ-МС: tR = 1,18 хв. 2-[3-(Бутилдиметилсиланілоксиметил)-4хлорфеніл]етиламін LiАІH4 (1,09 г, 28,7 ммоль) додавали до розчину трет-бутил-[2-хлор-5-(2нітровініл)бензилокси]диметилсилану (3,95 г, 11,5 ммоль) в Et2O (115 мл). Суміш перемішували при к.т. протягом 1 години, і до неї додавали водний насичений розчин тартрату калію натрію. Суміш перемішували протягом 1 години, і шари розділяли. Водний шар екстрагували декілька разів за допомогою Еt2О. Об'єднані органічні екстракти сушили над MgSO4, фільтрували, і розчинники видаляли при зниженому тиску. Сушіння залишку у 35 високому вакуумі давало неочищену зазначену в заголовку сполуку (3,20 г, 93%), яку потім використовували без очищення. РХ-МС: tR = 0,90 хв; ES+: 341,18. трет-Бутиловий ефір {2-[3-(третбутилдиметилсиланілоксиметил)-4хлорфеніл]етил}метилкарбамінової кислоти K2СО3 (728 мг, 5,27 ммоль) і метилхлорформіат (0,405 мл, 5,27 ммоль) додавали до розчину 2[3-(трет-бутилдиметилсиланілоксиметил)-4хлорфеніл]етиламіну (1,05 г, 3,51 ммоль) у СН2СІ2 (36 мл). Суміш перемішували при к.т. протягом 1 години і знову додавали метилхлорформіат (0,304 мл, 3,95 ммоль). Суміш перемішували при к.т. протягом 1 години і знову додавали метилхлорформіат (0,304 мл, 3,95 ммоль). Суміш перемішували при к.т. протягом 1 години і додавали СН2СІ2 (30 мл). Одержану суміш промивали водним насиченим NH4CІ (2×), водним 10% K2СО3 (×1) і насиченим сольовим розчином (×1). Органічний шар сушили над MgSO4, фільтрували, і розчинники видаляли при зниженому тиску, одержуючи сирий метиловий ефір {2-[3-(третбутилдиметилсиланілоксиметил)-4хлорфеніл]етил}карбамінової кислоти. Сирий продукт розчиняли в ТГФ (36 мл). Розчин охолоджували до 0°С, і до нього обережно порціями додавали ІлА1Н4 (400 мг, 10,5 ммоль). Суміші давали змогу нагріватися до к.т., і перемішували її при к.т. протягом ночі. Суміш виливали у водний насичений тартрат калію натрію (50 мл), і суміш перемішували при к.т. протягом 2 годин. Суміш екстрагували за допомогою Et2O (3×). Об'єднані органічні екстракти сушили над MgSO4, фільтрували, і розчинники видаляли при зниженому тиску, одержуючи сирий {2-[3-(третбутилдиметилсиланілоксиметил)-4хлорфеніл]етил}метиламін. Даний сирий продукт розчиняли в СН2CІ2 (36 мл). До розчину додавали DIPEA (1,80 мл, 10,5 ммоль), потім Вос 2О (2,30 г, 10,5 ммоль). Суміш перемішували при к.т. протягом 1 години, і до неї додавали СН2CІ2 (50 мл). Суміш промивали водною 1 Μ НСI, насиченим сольовим розчином, водним насиченим NaHCO3 і насиченим сольовим розчином. Органічний шар сушили над MgSO4, фільтрували, і розчинники видаляли при зниженому тиску. Очищення сирого продукту за допомогою FC (ЕtOАс/гептан 4:1) давало зазначену в заголовку сполуку (1,00 г, 91%). РХ-МС: tR = 0,84 хв; ES+: 355,23. трет-Бутиловий ефір [2-(4-хлор-3гідроксиметилфеніл)етил]метилкарбамінової кислоти TBAF (1 Μ у ТГФ, 2,90 мл, 2,90 ммоль) додавали до розчину трет-бутилового ефіру {2-[3-(третбутилдиметилсиланілоксиметил)-4хлорфеніл]етил}метилкарбамінової кислоти (600 мг, 1,45 ммоль) у ТГФ (14,2 мл) при 0°С. Суміш перемішували протягом 1 години, у той час як вона нагрівалася до к.т. ЕtOАс додавали і суміш промивали водним насиченим NH4CI і насиченим сольовим розчином. Органічний шар сушили над MgSO4, фільтрували, і розчинники видаляли при зниженому тиску. Очищення сирого продукту за допомогою FC (СН2CІ2/МеOН 19:1) давало зазна 95909 36 чену в заголовку сполуку (435 мг, кількісний вихід). РХ-МС: tR = 0,93 хв. трет-Бутиловий ефір [2-(4-хлор-3формілфеніл)етил]метилкарбамінової кислоти NMO (607 мг, 4,35 ммоль) додавали до розчину трет-бутилового ефіру [2-(4-хлор-3гідроксиметилфеніл)етил]метилкарбамінової кислоти (435 мг, 1,45 ммоль) у СН2CІ2 (30 мл). Суміш перемішували протягом 30 хв, і до неї додавали перутенат тетрапропіламонію (51,0 мг, 0,145 ммоль). Суміш перемішували протягом 1 години і фільтрували через целіт. Фільтрат упарювали при зниженому тиску. Очищення сирого продукту за допомогою FC (СН2CІ2/МеOН 19:1) давало зазначену в заголовку сполуку (330 мг, 76%). РХ-МС: tR = 1,00 хв. трет-Бутиловий ефір [2-(4-хлор-3циклопропіламінометилфеніл)етил]метилкарбамінової кислоти Суміш трет-бутилового ефіру [2-(4-хлор-3формілфеніл)етил]метилкарбамінової кислоти (325 мг, 1,09 ммоль), Et3N (0,228 мл, 1,64 ммоль) і циклопропіламіну (0,115 мл, 1,64 ммоль) у МеОН (3,66 мл) нагрівали при кипінні зі зворотним холодильником протягом 4 годин. Суміші давали змогу охолонути до к.т., і до неї додавали NaBH4 (103 мг, 2,73 ммоль). Суміш перемішували протягом 1 години при к.т., і до неї додавали водний насичений NаНСО3. Суміш екстрагували за допомогою EtOAc декілька разів. Об'єднані органічні екстракти сушили над MgSO4, фільтрували, і розчинники видаляли при зниженому тиску. Очищення сирого продукту за допомогою FC давало зазначену в заголовку сполуку (186 мг, 50%). РХ-МС: tR = 0,79 хв; ES+: 339,39. трет-Бутиловий ефір [3-(трет-бутилдиметилсиланілоксиметил)-4-хлорбензил]метилкарбамінової кислоти K2СО3 (363 мг, 2,63 ммоль) і метилхлорформіат (0,202 мл, 2,63 ммоль) додавали до розчину 3(трет-бутилдиметилсиланілоксиметил)-4хлорбензиламіну (500 мг, 1,76 ммоль) у СН2CІ2 (18 мл). Суміш перемішували при к.т. протягом 1 години, і до неї знову додавали метилхлорформіат (0,151 мл, 1,97 ммоль). Суміш перемішували при к.т. протягом 1 години, і до неї додавали СН2CІ2 (30 мл). Одержану суміш промивали водним насиченим NH4CІ (2×), водним 10% K2СО3 (×1) і насиченим сольовим розчином (×1). Органічний шар сушили над MgSO4, фільтрували, і розчинники видаляли при зниженому тиску, одержуючи сирий метиловий ефір [3-(третбутилдиметилсиланілоксиметил)-4хлорбензил]карбамінової кислоти. Даний сирий продукт розчиняли у ТГФ (18 мл). Розчин охолоджували до 0°С, і до нього обережно порціями додавали LiAlH4 (200 мг, 5,27 ммоль). Суміші давали змогу нагріватися до к.т., і перемішували її при к.т. протягом ночі. Суміш виливали у водний насичений тартрат калію натрію (50 мл), і суміш перемішували при к.т. протягом 2 годин. Суміш екстрагували за допомогою Еt2О (3×). Об'єднані органічні екстракти сушили над MgSO4, фільтрували, і розчинники видаляли при зниженому тиску, одержуючи сирий [3-(трет 37 бутилдиметилсиланілоксиметил)-4хлорбензил]метиламін. Даний сирий продукт розчиняли в СН2CІ2 (18 мл). До розчину додавали DIPEA (0,900 мл, 5,26 ммоль), потім Вос2О (1,15 г, 5,27 ммоль). Суміш перемішували при к.т. протягом ночі, і до неї додавали СН2CІ2 (50 мл). Суміш промивали водною 1 Μ НСI, водним насиченим NaHCO3 і насиченим сольовим розчином. Органічний шар сушили над MgSO4, фільтрували, і розчинники видаляли при зниженому тиску. Очищення сирого продукту за допомогою FC (ЕtOАс/гептан 50:50) давало суміш (0,900 г) зазначеної в заголовку сполуки, Вос2О і трет-бутиловий ефір [3-(третбутилдиметилсиланілоксиметил)бензил]метилкарбамінової кислоти. Дану сиру суміш, в якій на зазначену в заголовку сполуку доводилося 439 мг (83%), потім використовували без очищення. РХ-МС: tR = 1,10 хв; ES+: 344,13. трет-Бутиловий ефір (4-хлор-3гідроксиметилбензил)метилкарбамінової кислоти TBAF (1 Μ у ТГФ, 2,25 мл, 2,25 ммоль) додавали до розчину трет-бутилового ефіру [3-(третбутилдиметилсиланілоксиметил)-4хлорбензил]метилкарбамінової кислоти (450 мг, 1,13 ммоль) у ТГФ (11 мл) при 0°С. Суміш перемішували протягом 1 години, у той час як вона нагрівалася до к.т. ЕtOАс (50 мл) додавали, та одержану суміш промивали водним насиченим NH4CI (2×) і насиченим сольовим розчином (×1). Органічний шар сушили над MgSO4, фільтрували, і розчинники видаляли при зниженому тиску. Очищення сирого продукту за допомогою FC (ЕtOАс/гептан 40:60) давало зазначену в заголовку сполуку (110 мг, 34%). РХ-МС: tR = 0,91 xв; ES+: 271,10. трет-Бутиловий ефір (4-хлор-3формілбензил)метилкарбамінової кислоти МnО2 (372 мг, 3,85 ммоль) додавали до розчину трет-бутилового ефіру (4-хлор-3гідроксиметилбензил)метилкарбамінової кислоти (110 мг, 0,385 ммоль) у CH3CN (7,70 мл). Суміш перемішували при к.т. протягом 4,5 годин, і до неї знову додавали МnО2 (186 мг, 1,93 ммоль). Суміш перемішували протягом 1 години, і суміш фільтрували через целіт. Осад промивали за допомогою CH3CN і СН2СІ2. Фільтрат упарювали при зниженому тиску. Сушіння залишку у високому вакуумі давало сиру зазначену в заголовку сполуку (95 мг, 87%), яку потім використовували без очищення. РХ-МС: tR = 0,99 хв. трет-Бутиловий ефір (4-хлор-3циклопропіламінометилбензил)метилкарбамінової кислоти Суміш трет-бутилового ефіру (4-хлор-3формілбензил)метилкарбамінової кислоти (95 мг, 0,335 ммоль) і циклопропіламіну (0,036 мл, 0,50 ммоль) у МеОН (3,30 мл) нагрівали при кипінні зі зворотним холодильником протягом 4 годин. Суміші давали змогу охолонути до к.т., і до неї додавали порціями NaBH4 (19 мг, 0,50 ммоль). Суміш перемішували протягом 1 години, і розчинники видаляли при зниженому тиску. Одержане масло розводили ЕtOАс (20 мл), і дану суміш промивали водним насиченим NaHCO3 і насиченим сольовим розчином. Органічний шар сушили над MgSO4, 95909 38 фільтрували, і розчинники видаляли при зниженому тиску. Очищення залишку за допомогою FC (СН2CІ2/МеOН 90:10) давало зазначену в заголовку сполуку (81 мг, 75%). РХ-МС: tR = 0,73 хв; ES+: 366,20. N-{2-[3-(трет-Бутилдиметилсиланілоксиметил)4-хлорфеніл]етил}-3,3,3-трифторпропіонамід TBTU (2,09 г, 6,50 ммоль) додавали до розчину 2-[3-(трет-бутилдиметилсиланілоксиметил)-4хлорфеніл]етиламіну (1,30 г, 4,33 ммоль), 3,3,3трифторпропіонової кислоти (0,574 мл, 6,5 ммоль) і DIPEA (2,97 мл, 17,3 ммоль) у СН2CІ2 (43 мл). Суміш перемішували протягом 1 години, і до неї додавали СН2CІ2. Суміш промивали водним насиченим NH4CI, водним 10% Na2CO3 і насиченим сольовим розчином. Органічний шар сушили над MgSO4, фільтрували, і розчинники видаляли при зниженому тиску. Очищення сирого продукту за допомогою FC (ЕtOАс/гептан 60:40) давало зазначену в заголовку сполуку (500 мг, 28%). РХ-МС: tR = 1,12 хв; ES+: 410,14. N-[2-(4-Хлор-3-гідроксиметилфеніл)етил]3,3,3-трифторпропіонамід TBAF (1 Μ у ТГФ, 2,46 мл, 2,46 ммоль) додавали до розчину Ν-{2-[3-(третбутилдиметилсиланілоксиметил)-4хлорфеніл]етил}-3,3,3-трифторпропіонаміду (500 мг, 1,22 ммоль) у ТГФ (15,8 мл) при 0°С. Суміш перемішували протягом 1 години при 0°С, і додавали до неї водний насичений NH4CІ. Суміш екстрагували за допомогою ЕtOАс (3×). Об'єднані органічні екстракти промивали водою (4×), сушили над MgSO4, фільтрували, і розчинники видаляли при зниженому тиску. Очищення залишку за допомогою FC (СН2CІ2/МеOН 19:1) давало зазначену в заголовку сполуку (230 мг, 64%). РХ-МС: tR = 0,79 хв. N-[2-(4-Хлор-3-формілфеніл)етил]-3,3,3трифторпропіонамід NMO (318 мг, 2,28 ммоль) додавали до розчину Ν-[2-(4-хлор-3-гідроксиметилфеніл)етил]-3,3,3трифторпропіонаміду (225 мг, 0,761 ммоль) у СН2CІ2 (16 мл). Суміш перемішували протягом 30 хв, і до неї додавали перутенат тетрапропіламонію (26,7 мг, 0,076 ммоль). Суміш перемішували протягом 1 години при к.т. і фільтрували через целіт. Фільтрат упарювали при зниженому тиску. Очищення сирого продукту за допомогою FC (СН2CІ2/МеOН 19:1) давало зазначену в заголовку сполуку (180 мг, 81%). РХ-МС: tR = 0,88 хв; ES+: 335,28. N-[2-(4-Хлор-3-циклопропіламінометилфеніл) етил]-3,3,3-трифторпропіонамід Суміш N-[2-(4-хлор-3-формілфеніл)етил]-3,3,3трифторпропіонаміду (175 мг, 0,596 ммоль), Et3N (0,125 мл, 0,896 ммоль) і циклопропіламіну (0,063 мл, 0,90 ммоль) у МеОН (2,00 мл) нагрівали при кипінні зі зворотним холодильником протягом 4 годин. Суміші давали змогу охолонути до к.т., і до неї додавали порціями NaBH4 (56,4 мг, 1,49 ммоль). Суміш перемішували протягом 1 години і додавали водний насичений NaHCO3. Суміш екстрагували за допомогою ЕtOАс декілька разів, і об'єднані органічні екстракти промивали насиченим сольовим розчином. Органічний шар сушили 39 над MgSO4, фільтрували, і розчинники видаляли при зниженому тиску. Очищення залишку за допомогою FC (СН2CІ2/МеOН 95:5) давало зазначену в заголовку сполуку (130 мг, 65%). РХ-МС: tR = 0,65 xв; ES+: 335,12. {2-[3-(Бутилдиметилсиланілоксиметил)-4хлорфеніл]етил}етиламін Суміш 2-[3-(трет-бутилдиметилсиланілоксиметил)-4-хлорфеніл]етиламіну (1,05 г, 3,50 ммоль) і ацетальдегіду (1,19 мл, 21,0 ммоль) у МеОН (35 мл) нагрівали при кипінні зі зворотним холодильником протягом 4 годин. Суміші давали змогу охолонути до к.т., і до неї порціями додавали NaBH4 (198 мг, 5,25 ммоль). Суміш перемішували при к.т. протягом 1 години, і розчинники видаляли при зниженому тиску. Одержане масло розводили за допомогою ЕtOАс, і дану суміш промивали водним насиченим NaHCO3 і насиченим сольовим розчином. Органічний шар сушили над MgSO4, фільтрували і розчинники видаляли при зниженому тиску. Очищення сирого продукту за допомогою FC (СН2CІ2/МеOН 19:1 →· 9:1) давало зазначену в заголовку сполуку (320 мг, 28%). РХ-МС: tR = 0,90 хв; ES+: 369,22. трет-Бутиловий ефір {2-[3-(трет-бутилдиметилсиланілоксиметил)-4-хлорфеніл]етил}етилкарбамінової кислоти Суміш {2-[3-(третбутилдиметилсиланілоксиметил)-4хлорфеніл]етил}етиламіну (320 мг, 0,976 ммоль), DIPEA (0,501 мл, 2,93 ммоль) і Вос2О (320 мг, 1,47 ммоль) у СН2CІ2 (10 мл) перемішували при к.т. протягом 2 годин. Додавали СН2CІ2 (30 мл), і суміш промивали водною 1 Μ НСI, водним насиченим NaHCO3 і насиченим сольовим розчином. Органічний шар сушили над MgSO4, фільтрували, і розчинники видаляли при зниженому тиску. Очищення сирого продукту за допомогою FC (ЕtOАс/гептан 20:80) давало зазначену в заголовку сполуку (298 мг, 71%). РХ-МС: tR = 1,25 хв; ES+: 428,19. трет-Бутиловий ефір [2-(4-хлор-3гідроксиметилфеніл)етил]етилкарбамінової кислоти TBAF (1 Μ у ТГФ, 1,39 мл, 1,39 ммоль) додавали до розчину трет-бутилового ефіру {2-[3-(третбутилдиметилсиланілоксиметил)-4хлорфеніл]етил}етилкарбамінової кислоти (298 мг, 0,696 ммоль) у ТГФ (6,82 мл) при 0°С. Суміш перемішували протягом 1 години, у той час як вона нагрівалася до к.т. ЕtOАс додавали, і суміш промивали водним насиченим NH4CI і насиченим сольовим розчином. Органічний шар сушили над MgSO4, фільтрували, і розчинники видаляли при зниженому тиску. Очищення сирого продукту за допомогою FC (СН2Сl2/МеОН 19:1) давало зазначену в заголовку сполуку (110 мг, 50%). РХ-МС: tR = 0,97 хв; ES+: 314,11. трет-Бутиловий ефір [2-(4-хлор-3формілфеніл)етил]етилкарбамінової кислоти NMO (133 мг, 0,956 ммоль) додавали до розчину трет-бутилового ефіру [2-(4-хлор-3гідроксиметилфеніл)етил]етилкарбамінової кислоти (110 мг, 0,319 ммоль) у СН2CІ2 (7,0 мл). Суміш перемішували протягом 30 хв, і до неї додавали 95909 40 перутенат тетрапропіламонію (11,2 мг, 0,032 ммоль). Суміш перемішували протягом 1 години і фільтрували через целіт. Фільтрат упарювали при зниженому тиску. Очищення сирого продукту за допомогою FC (СН2Сl2/МеОН 49:1) давало зазначену в заголовку сполуку (80 мг, 80%). РХ-МС: tR = 1,07 хв. трет-Бутиловий ефір [2-(4-хлор-3циклопромламінометилфеніл)етил]етилкарбамінової кислоти Суміш трет-бутилового ефіру [2-(4-хлор-3формілфеніл)етил]етилкарбамінової кислоти (80,1 мг, 0,257 ммоль), Et3N (0,054 мл, 0,386 ммоль) і циклопропіламіну (0,027 мл, 0,386 ммоль) у МеОН (0,86 мл) нагрівали при кипінні зі зворотним холодильником протягом 4 годин. Суміші давали змогу охолонути до к.т., і до неї додавали порціями NaBH4 (24,2 мг, 0,642 ммоль). Суміш перемішували протягом 1 години, і до неї додавали водний насичений NaHCO3. Суміш екстрагували за допомогою ЕtOАс декілька разів, і об'єднані органічні екстракти промивали насиченим сольовим розчином. Органічний шар сушили над MgSO4, фільтрували, і розчинники видаляли при зниженому тиску. Очищення залишку за допомогою FC (СН2CІ2/МеOН 95:5) давало зазначену в заголовку сполуку (40 мг, 44%). РХ-МС: tR = 0,81 хв; ES+: 353,22. N-{2-[3-(трет-бутилдиметилсиланілоксиметил)4-хлорфеніл]етил}ацетамід АсСІ (0,063 мл, 0,88 ммоль) додавали до розчину 2-[3-(трет-бутилдиметилсиланілоксиметил)-4хлорфеніл]етиламіну (252 мг, 0,840 ммоль) і DIPEA (0,575 мл, 3,36 ммоль) у СН2CІ2 (8,4 мл). Суміш перемішували при к.т. протягом 30 хв, і до неї додавали водний насичений NH4CI. Шари розділяли, і органічний шар промивали водним 1 Μ NaOH, сушили над MgSO4, фільтрували, і розчинники видаляли при зниженому тиску. Очищення сирого продукту за допомогою FC (СН2CІ2/МеOН 19:1) давало зазначену в заголовку сполуку (190 г, 66%). РХ-МС: tR = 1,09 хв; ES+: 342,19. N-[2-(4-Хлор-3-гідроксиметилфеніл)етил]ацетамід TBAF (1 Μ у ТГФ, 1,12 мл, 1,12 ммоль) додавали до розчину N-{2-[3-(тpeтбутилдиметилсиланілоксиметил)-4хлорфеніл]етил}ацетаміду (190 мг, 0,555 ммоль) у ТГФ (7,10 мл) при 0°С. Суміш перемішували протягом 1 години, у той час як вона нагрівалася до к.т. Водний насичений NH4CІ додавали, і суміш екстрагували за допомогою ЕtOАс (3×). Органічний шар сушили над MgSO4, фільтрували, і розчинники видаляли при зниженому тиску. Очищення сирого продукту за допомогою FC (СН2CІ2/МеОН 19:1) давало зазначену в заголовку сполуку (100 мг, 79%). РХ-МС: tR = 0,67 хв; ES+: 284,11. N-[2-(4-Хлор-3-формілфеніл)етил]ацетамід NMO (184 мг, 1,32 ммоль) додавали до розчину N-[2-(4-хлор-3-гідроксиметилфеніл)етил]ацетаміду (100 мг, 0,439 ммоль) у СН2CІ2 (9,22 мл). Суміш перемішували протягом 30 хв, і до неї додавали перутенат тетрапропіламонію (15,5 мг, 0,044 ммоль). Суміш перемішували протягом 1 години при к.т. і фільтрували через целіт. Фільтрат упа 41 рювали при зниженому тиску. Очищення сирого продукту за допомогою FC (СН2СІ2/МеOН 49:1) давало зазначену в заголовку сполуку (50 мг, 50%). РХ-МС: tR = 0,75 хв; ES+: 267,10. N-[2-(4-Хлор-3-циклопропіламінометилфеніл) етил]ацетамід Суміш N-[2-(4-хлор-3формілфеніл)етил]ацетаміду (50,1 мг, 0,222 ммоль), Et3N (0,046 мл, 0,332 ммоль) і циклопропіламіну (0,023 мл, 0,332 ммоль) у МеОН (0,50 мл) нагрівали при кипінні зі зворотним холодильником протягом 4 годин. Суміші давали змогу охолонути до к.т., і до неї додавали порціями NaBH4 (21,0 мг, 0,554 ммоль). Суміш перемішували протягом 1 години і додавали водний насичений NaHCO3. Суміш екстрагували за допомогою ЕtOАс декілька разів, і об'єднані органічні екстракти промивали насиченим сольовим розчином. Органічний шар сушили над MgSO4, фільтрували, і розчинники видаляли при зниженому тиску. Очищення залишку за допомогою FC (СН2CІ2/МеOН 95:5) давало зазначену в заголовку сполуку (35 мг, 59%). РХМС: tR = 0,59 хв; ES+: 267,17. трет-Бутиловий ефір [3-(третбутилдиметилсиланілоксиметил)-4-хлорбензил](2-фторетил)карбамінової кислоти Суміш 3-(трет-бутилдиметилсиланілоксиметил)-4-хлорбензальдегіду (1,50 г, 5,27 ммоль), DIPEA (1,80 мл, 10,5 ммоль) і гідрохлориду 2фторетиламіну (873 мг, 7,90 ммоль) у МеОН (53 мл) нагрівали при кипінні зі зворотним холодильником протягом 4 годин. Реакційній суміші давали змогу охолонути до к.т., і до неї обережно порціями додавали NaBH4 (300 мг, 7,91 ммоль). Суміш перемішували протягом 1 години, і розчинники видаляли при зниженому тиску. До залишку додавали ЕtOАс (100 мл), і суміш промивали водним насиченим NaHCO3 і насиченим сольовим розчином. Органічний шар сушили над MgSO4, фільтрували, і розчинники видаляли при зниженому тиску, одержуючи сирий [3-(третбутилдиметилсиланілоксиметил)-4-хлорбензил](2-фторетил)амін. Даний сирий продукт розчиняли в СН2CІ2 (70 мл). До розчину додавали DIPEA (2,70 мл, 15,8 ммоль), потім Вос2О (1,70 г, 7,91 ммоль). Суміш перемішували при к.т. протягом 1 години. Суміш розводили за допомогою СН2CІ2 (50 мл) і промивали водною 1 Μ НСI, водним насиченим NaHCO3 і насиченим сольовим розчином. Органічний шар сушили над MgSO4, фільтрували, і розчинники видаляли при зниженому тиску. Очищення сирого продукту за допомогою FC (ЕtOАс/гептан 10:90) давало зазначену в заголовку сполуку (1,92 г, 85%). РХ-МС: tR = 1,22 хв; ES+: 417,17. трет-Бутиловий ефір (4-хлор-3гідроксиметилбензил)-(2-фторетил)карбамінової кислоти TBAF (1 Μ у ТГФ, 8,84 мл, 8,84 ммоль) додавали до розчину трет-бутилового ефіру [3-(третбутилдиметилсиланілоксиметил)-4-хлорбензил](2-фторетил)карбамінової кислоти (1,91 г, 4,42 ммоль) у ТГФ (44,2 мл) при 0°С. Суміш перемішували протягом 1 години, у той час як вона нагрівалася до к.т. Додавали ЕtOАс (100 мл), і одержану 95909 42 суміш промивали водним насиченим NH4CІ (2×) і насиченим сольовим розчином (×1). Органічний шар сушили над MgSO4, фільтрували, і розчинники видаляли при зниженому тиску. Очищення сирого продукту за допомогою FC (ЕtOАс/гептан 30:70) давало зазначену в заголовку сполуку (901 мг, 64%). РХ-МС: tR = 0,64 хв; ES+: 318,07. трет-Бутиловий ефір (4-хлор-3формілбензил)-(2-фторетил)карбамінової кислоти МnО2 (1,22 г, 12,6 ммоль) додавали до розчину трет-бутилового ефіру (4-хлор-3гідроксиметилбензил)-(2-фторетил)карбамінової кислоти (801 мг, 2,52 ммоль) у CH3CN (50 мл). Суміш перемішували при к.т. протягом 4,5 годин, і до неї знов додавали МnО2 (1,22 г, 12,6 ммоль). Суміш перемішували протягом 1 години і фільтрували через целіт. Осад промивали за допомогою CH3CN і СН2CІ2. Фільтрат упарювали при зниженому тиску. Сушіння залишку у високому вакуумі давало сиру зазначену в заголовку сполуку (800 мг, кількісний вихід), яку потім використовували без очищення. РХ-МС: tR = 1,01 хв. трет-Бутиловий ефір (4-хлор-3циклопропіламінометилбензил)-(2-фторетил)карбамінової кислоти Суміш трет-бутилового ефіру (4-хлор-3формілбензил)-(2-фторетил)карбамінової кислоти (850 мг, 2,69 ммоль) і циклопропіламіну (0,290 мл, 4,05 ммоль) у МеОН (27 мл) нагрівали при кипінні зі зворотним холодильником протягом 4 годин. Суміші давали змогу охолонути до к.т., і до неї додавали порціями NaBH4 (153 мг, 4,40 ммоль). Суміш перемішували протягом 1 години. Розчинники видаляли при зниженому тиску, і до залишку додавали ЕtOАс. Одержану суміш промивали водним насиченим NаНСО3 і насиченим сольовим розчином. Органічний шар сушили над MgSO4, фільтрували, і розчинники видаляли при зниженому тиску. Очищення сирого продукту за допомогою FC (СН2CІ2/МеOН 95:5) давало зазначену в заголовку сполуку (845 мг, 88%). РХ-МС: tR = 0,76 xв; ES+: 357,19. трет-Бутиловий ефір [3-(трет-бутилдиметилсиланілоксиметил)-4-хлорбензил]етилкарбамінової кислоти Ацетальдегід (2,4 мл, 42 ммоль) додавали до розчину 3-(трет-бутилдиметилсиланілоксиметил)4-хлорбензиламіну (2,00 г, 7,00 ммоль) у МеОН (70 мл). Суміш нагрівали при кипінні зі зворотним холодильником протягом 4 годин, та їй давали змогу охолонути до к.т. До суміші обережно порціями додавали NaBH4 (397 мг, 10,5 ммоль) протягом 1 години. Розчинники видаляли при зниженому тиску. Залишок розводили за допомогою ЕtOАс (100 мл), і одержану суміш промивали водним насиченим NaHCO3 і насиченим сольовим розчином. Органічний шар сушили над MgSO4, фільтрували, і розчинники видаляли при зниженому тиску, одержуючи сирий [3-(третбутилдиметилсиланілоксиметил)-4-хлорбензил] етил амін (3,07 г). Даний сирий продукт розчиняли в СН2CІ2 (70 мл). До даного розчину додавали DIPEA (3,60 мл, 21,0 ммоль), потім Вос 2О (2,29 г, 10,5 ммоль). Суміш перемішували при к.т. протягом 2 годин. Суміш розводили за допомогою 43 СН2CІ2 (30 мл) і промивали водною 1 Μ НСI, водним насиченим NаНСО3 і насиченим сольовим розчином. Органічний шар сушили над MgSO4, фільтрували, і розчинники видаляли при зниженому тиску. Очищення сирого продукту за допомогою FC (ЕtOАс/гептан 5:95) давало зазначену в заголовку сполуку (850 мг, 29%). РХ-МС: tR = 1,23 хв; ES+: 414,23. трет-Бутиловий ефір (4-хлор-3гідроксиметилбензил)етилкарбамінової кислоти TBAF (1 Μ у ТГФ, 3,03 мл, 3,03 ммоль) додавали по краплях до розчину трет-бутилового ефіру [3-(трет-бутилдиметилсиланілоксиметил)-4хлорбензил]етилкарбамінової кислоти (628 мг, 1,52 ммоль) у ТГФ (14,9 мл) при 0°С. Суміш перемішували протягом 1 години, у той час як вона нагрівалася до к.т. Додавали ЕtOАс, і суміш промивали водним насиченим NH4CІ і насиченим сольовим розчином. Органічний шар сушили над MgSO4, фільтрували, і розчинники видаляли при зниженому тиску. Очищення сирого продукту за допомогою FC (МеОН/СН2Сl2 19:1) давало зазначену в заголовку сполуку (300 мг, 66%). РХ-МС: tR = 0,98 хв; ES+: 300,28. трет-Бутиловий ефір (4-хлор-3формілбензил)етилкарбамінової кислоти МnО2 (475 мг, 4,92 ммоль) додавали до розчину трет-бутилового ефіру (4-хлор-3гідроксиметилбензил)етилкарбамінової кислоти (295 мг, 0,984 ммоль) у CH3CN (20 мл). Суміш перемішували при к.т. протягом 5 годин, і до неї знову додавали МnО2 (475 мг, 0,984 ммоль). Суміш перемішували протягом 1 години, і суміш фільтрували через целіт і промивали за допомогою CH3CN і СН2СІ2. Випарювання розчинників при зниженому тиску давало сиру зазначену в заголовку сполуку (240 мг, 82%), яку потім використовували без очищення. РХ-МС: tR = 1,02 хв. трет-Бутиловий ефір (4-хлор-3циклопропіламінометилбензил)етилкарбамінової кислоти Суміш трет-бутилового ефіру (4-хлор-3формілбензил)етилкарбамінової кислоти (240 мг, 0,806 ммоль), циклопропіламіну (0,085 мл, 1,2 ммоль) і Et3N (0,169 мл, 1,21 ммоль) у МеОН (2,7 мл) нагрівали при кипінні зі зворотним холодильником протягом 4 годин. Суміші давали змогу охолонути до к.т., і до неї додавали NaBH4 (76,2 мг, 2,01 ммоль). Суміш перемішували протягом 1 години при к.т., і до неї додавали водний насичений NаНСО3. Суміш декілька разів екстрагували за допомогою ЕtOАс. Об'єднані органічні екстракти сушили над MgSO4, фільтрували, і розчинники видаляли при зниженому тиску. Очищення сирого продукту за допомогою FC (МеОН/СН2CІ2 1:49) давало зазначену в заголовку сполуку (125 мг, 46%). РХ-МС: tR = 0,78 хв; ES+: 380,20. трет-Бутиловий ефір [3-(третбутилдиметилсиланілоксиметил)-4хлорбензил]циклопропілкарбамінової кислоти Суміш 3-(трет-бутилдиметилсиланілоксиметил)-4-хлорбензальдегіду (1,73 г, 6.06 ммоль) і циклопропіламіну (0,64 мл, 9,1 ммоль) у МеОН (60 мл) нагрівали при кипінні зі зворотним холодильником протягом 4 годин. Суміші давали змогу охо 95909 44 лонути до к.т., і до неї порціями додавали NaBH4 (344 мг, 9,09 ммоль). Суміш перемішували, і до неї додавали воду (20 мл). Розчинники частково видаляли при зниженому тиску. Одержану водну суспензію розводили водою (50 мл) та екстрагували за допомогою ЕtOАс. Органічні екстракти промивали водним насиченим NaHCO3 і насиченим сольовим розчином. Органічний шар сушили над MgSO4, фільтрували, і розчинники видаляли при зниженому тиску, одержуючи сирий [3-(третбутилдиметилсиланілоксиметил)-4хлорбензил]циклопропіламін (1,54 г). Даний сирий продукт розчиняли в СН2СІ2 (60 мл). До розчину додавали DIPEA (3,1 мл, 18 ммоль), потім Вос 2О (1,98 г, 9,09 ммоль). Суміш перемішували при к.т. протягом 2 годин. Додавали СН2СІ2 (40 мл), і суміш промивали водною 1 Μ НСI, водним насиченим NаНСО3 і насиченим сольовим розчином. Органічний шар сушили над MgSO4, фільтрували і розчинники видаляли при зниженому тиску. Очищення сирого продукту за допомогою FC (гептан → EtOАс/гептан 5:95) давало зазначену в заголовку сполуку (1,54 г, 78%). РХ-МС: tR = 1,26 хв; ES+: 426,14. трет-Бутиловий ефір (4-хлор-3гідроксиметилбензил)циклопропілкарбамінової кислоти Водний 1 Μ NaOH (16 мл) додавали до розчину трет-бутилового ефіру [3-(третбутилдиметилсиланілоксиметил)-4хлорбензил]циклопропілкарбамінової кислоти (700 мг, 1,64 ммоль) у МеОН (32 мл). Суміш нагрівали при кипінні зі зворотним холодильником протягом 2 годин, і давали змогу їй охолоджуватися до к.т. Розчинники частково видаляли при зниженому тиску, і одержаний водний шар розводили водою (100 мл). Суміш екстрагували за допомогою Et2O (3×). Об'єднані органічні шари сушили над MgSO4, фільтрували, і розчинники видаляли при зниженому тиску. Очищення сирого продукту за допомогою FC (ЕtOАс/гептан 40:60) давало зазначену в заголовку сполуку (550 мг, кількісний вихід). РХ-МС: tR = 0,98 xв; ES+: 312,04. трет-Бутиловий ефір (4-хлор-3-формілбензил) циклопропілкарбамінової кислоти МnО2 (815 мг, 8,44 ммоль) додавали до розчину трет-бутилового ефіру (4-хлор-3гідроксиметилбензил)циклопропілкарбамінової кислоти (526 мг, 1,69 ммоль) у CH3CN (34 мл). Суміш перемішували при к.т. протягом 3 годин, фільтрували через целіт і промивали за допомогою CH3CN і СН2СІ2. Випарювання розчинників при зниженому тиску давало сиру зазначену в заголовку сполуку (563 мг, кількісний вихід), яку потім використовували без очищення. РХ-МС: tR = 1,05 xв; ES+: 310,04. трет-Бутиловий ефір (4-хлор-3циклопропіламінометилбензил)циклопропілкарбамінової кислоти Суміш трет-бутилового ефіру (4-хлор-3формілбензил)циклопропілкарбамінової кислоти (563 мг, 1,82 ммоль) і циклопропіламіну (0,195 мл, 2,73 ммоль) у МеОН (18 мл) нагрівали при кипінні зі зворотним холодильником протягом 4 годин. Суміші давали змогу охолонути до к.т., і до неї 45 додавали порціями NaBH4 (103 мг, 2,73 ммоль). Суміш перемішували протягом 1 години, і розчинники видаляли при зниженому тиску. Одержане масло розводили за допомогою ЕtOАс (100 мл), і одержану суміш промивали водним насиченим NаНСО3 і насиченим сольовим розчином. Органічний шар сушили над MgSO4, фільтрували, і розчинники видаляли при зниженому тиску. Очищення сирого продукту за допомогою FC (СН2СІ2/МеOН 95:5) давало зазначену в заголовку сполуку (343 мг, 54%). РХ-МС: tR = 0,78 хв; ES+: 351,39. трет-Бутил-(2-хлор-5-вінілбензилокси)диметилсилан Pd(PPh3)4 (173 мг, 0,149 ммоль) додавали до розчину (5-бром-2-хлорбензилокси)третбутилдиметилсилану (1,00 г, 2,98 ммоль) у диметоксіетані (30 мл). Суміш перемішували при к.т. протягом 20 хв, і до неї додавали K2СО3 (411 мг, 2,98 ммоль), воду (10 мл) і 4,4,5,5-тетраметил-2вініл-1,3,2-діоксаборолан (0,53 мл, 2,98 ммоль). Суміш швидко нагрівали до кипіння зі зворотним холодильником і перемішували при кипінні зі зворотним холодильником протягом 2 годин. Суміші давали змогу охолонути до к.т., і розводили її за допомогою Et2O (100 мл). Суміш промивали водою, і водний шар екстрагували знову за допомогою Et2O (3×). Об'єднані органічні екстракти сушили над MgSO4, фільтрували, і розчинники видаляли при зниженому тиску. Очищення сирого продукту за допомогою FC (ЕtOАс/гептан 5:95) давало зазначену в заголовку сполуку (822 мг, 98%). РХ-МС: tR = 1,22 хв. 2-[3-(трет-Бутилдиметилсиланілоксиметил)-4хлорфеніл]етанол 9-BBN (0,5 Μ у ТГФ, 34,0 мл, 17,0 ммоль) додавали по краплях протягом 30 хв до розчину трет-бутил-(2-хлор-5вінілбензилокси)диметилсилану (800 мг, 2,83 ммоль) у ТГФ (28 мл) при 0°С. Суміш перемішували протягом 30 хв при 0°С і протягом 4 годин при к.т. Суміш знову охолоджували до 0°С, і до неї додавали по краплях водний 1 Μ NaOH (39,0 мл) і Н2О2 (33%, 9,8 мл, 113 ммоль). Суміш перемішували протягом 2 годин, у той час як вона нагрівалася до к.т., і охолоджували до 0°С. Обережно додавали водний насичений Na2S2O3 (100 мл), і даній суміші давали змогу обережно нагріватися при к.т. протягом ночі. Розчинники частково видаляли при зниженому тиску, і водний залишок екстрагували за допомогою ЕtOАс (3×). Об'єднані органічні екстракти промивали насиченим сольовим розчином. Органічний шар сушили над MgSO4, фільтрували, і розчинники видаляли при зниженому тиску. Очищення сирого продукту за допомогою FC (ЕtOАс/гептан 40:60) давало зазначену в заголовку сполуку (677 мг, 80%). PX-MC:tR = 1,10 хв; ES+: 301,08. 2-[3-(трет-Бутилдиметилсиланілоксиметил)-4хлорфеніл]етиловий ефір метансульфонової кислоти До розчину 2-[3-(трет-бутилдиметилсиланілоксиметил)-4-хлорфеніл]етанолу (2,00 г, 6,65 ммоль) у СН2CІ2 (66 мл) при 0°С додавали по краплях Et3N (1,02 мл, 7,31 ммоль) і метансульфоніл 95909 46 хлорид (0,57 мл, 7,31 ммоль). Реакційну суміш перемішували при 0°С протягом 1 години і розводили за допомогою СН2CІ2 (40 мл). Одержану суміш промивали водним насиченим NH4CІ (2×). Органічний шар сушили над MgSO4, фільтрували, і розчинники видаляли при зниженому тиску, одержуючи сиру зазначену в заголовку сполуку (2,55 г, кількісний вихід), яку потім використовували без очищення. РХ-МС: tR = 1,13 хв; ES+: 379,29. {2-[3-(трет-Бутилдиметилсиланілоксиметил)-4хлорфеніл]етил}циклопропіламін Циклопропіламін (1,14 мл, 16,3 ммоль) додавали до розчину 2-[3-(третбутилдиметилсиланілоксиметил)-4хлорфеніл]етилового ефіру метансульфонової кислоти (1,76 г, 4,65 ммоль) в ЕtOН (46 мл). Суміш нагрівали при кипінні зі зворотним холодильником протягом 2 годин і знову додавали циклопропіламін (0,57 мл, 8,2 ммоль). Суміш нагрівали при кипінні зі зворотним холодильником протягом ночі, і їй давали змогу охолонути до к.т. Розчинники видаляли при зниженому тиску, і залишок очищали за допомогою FC (ЕtOАс/гептан 50:50 → 7 Μ NaH3/МеОН), одержуючи зазначену в заголовку сполуку (865 мг, 68%). РХ-МС: tR = 0,92 хв; ES+: 340,39. трет-Бутиловий ефір {2-[3-(третбутилдиметилсиланілоксиметил)-4-хлорфеніл] етил}циклопропілкарбамінової кислоти DIPEA (2,61 мл, 5,60 ммоль) і Вос2О (1,22 г, 5,60 ммоль) додавали до розчину {2-[3-(третбутилдиметилсиланілоксиметил)-4хлорфеніл]етил}циклопропіламіну (1,73 г, 5,09 ммоль) у СН2CІ2 (50 мл). Суміш перемішували при к.т. протягом 4 годин. Суміш розводили СН2CІ2 (50 мл), промивали водним насиченим NaHCO3, водним насиченим NH4CI і насиченим сольовим розчином. Органічний шар сушили над MgSO4, фільтрували і розчинники видаляли при зниженому тиску. Очищення сирого продукту за допомогою FC (ЕtOАс/гептан 10:90) давало зазначену в заголовку сполуку (2,14 г, 96%). РХ-МС: tR = 1,26 хв. трет-Бутиловий ефір [2-(4-хлор-3гідроксиметилфеніл)етил]циклопропілкарбамінової кислоти Водний 1 Μ NaOH (48 мл) додавали до суспензії трет-бутилового ефіру {2-[3-(третбутилдиметилсиланілоксиметил)-4хлорфеніл]етил}циклопропілкарбамінової кислоти (2,10 г, 4,77 ммоль) у МеОН (96 мл). Суміш нагрівали при кипінні зі зворотним холодильником протягом 90 хв. Суміші давали змогу охолонути до к.т., і розчинники частково видаляли при зниженому тиску. Одержану водну суміш розводили водою (100 мл) і екстрагували за допомогою Et2O (3×). Об'єднані органічні екстракти сушили над MgSO4, фільтрували і розчинники видаляли при зниженому тиску. Очищення сирого продукту за допомогою FC (ЕtOАс/гептан 40:60) давало зазначену в заголовку сполуку (1,34 г, 86%). РХ-МС: tR = 0,98 хв; ES+: 326,30. трет-Бутиловий ефір [2-(4-хлор-3формілфеніл)етил]циклопропілкарбамінової кислоти 47 МnО2 (1,97 г, 20,4 ммоль) додавали до розчину трет-бутилового ефіру [2-(4-хлор-3гідроксиметилфеніл)етил]циклопропілкарбамінової кислоти (1,33 г, 4,08 ммоль) у CH3CN (41 мл). Суміш перемішували при к.т. протягом ночі. Суміш фільтрували через целіт і промивали за допомогою CH3CN і СН2CІ2. Упарювання фільтрату при зниженому тиску давало сиру зазначену в заголовку сполуку (1,32 г, кількісний вихід), яку потім використовували без очищення. РХ-МС: tR = 1,05 хв. трет-Бутиловий ефір [2-(4-хлор-3циклопропіламінометилфеніл)етил]циклопропілкарбамінової кислоти Суміш трет-бутилового ефіру [2-(4-хлор-3формілфеніл)етил]циклопропілкарбамінової кислоти (1,32 г, 4,08 ммоль) і циклопропіламіну (0,438 мл, 6,1 ммоль) у МеОН (41 мл) нагрівали при кипінні зі зворотним холодильником протягом 4 годин. Суміші давали змогу охолонути до к.т., і до неї додавали порціями NaBH4 (232 мг). Суміш перемішували протягом 1 години, і розчинники видаляли при зниженому тиску. Додавали ЕtOАс (100 мл), і суміш промивали водним насиченим NаНСО3 і насиченим сольовим розчином. Органічний шар сушили над MgSO4, фільтрували і розчинники видаляли при зниженому тиску. Очищення сирого продукту за допомогою FC (СН2Сl2/МеОН 95:5) давало зазначену в заголовку сполуку (883 мг, 59%). РХ-МС: tR = 0,82 хв; ES+: 365,38. 3,9-Ди-трет-бутиловий ефір 6-етиловий ефір (рац.)-(1R*,5S*)-7-{4-[3-(2-хлор-3,6-дифторфенокси)пропіл]феніл}-3,9-діазабіцикло[3.3.1]нон-6-ен3,6,9-трикарбонової кислоти (А1) Суміш сполуки F3 (56,0 г, 106 ммоль), 2-хлор3,6-дифторфенолу (34,8 г, 211 ммоль), дипіперидиду азадикарбонової кислоти (53,4 г, 211 ммоль) і РВu3 (85%, 83 мл, 317 ммоль) у толуолі (1,20 л) нагрівають при кипінні зі зворотним холодильником в атмосфері азоту протягом 1 години. Суміші дають змогу охолонути до к.т. Суміш розводять за допомогою ЕtOАс (2,00 л), і суміш промивають водним 1 Μ NaOH (2×900 мл). Органічні екстракти сушать над MgSO4, фільтрують, і розчинники видаляють при зниженому тиску. Очищення залишку за допомогою FC (ЕtOАс/гептан 1:19 → 1:1) дає зазначену в заголовку сполуку (67,5 г, 94%). РХМС: tR = 1,24 хв; ES+: 617,25. 1-трет-Бутиловий ефір 3-метиловий ефір 6-[2(2,6-дихлор-4-метилфеноксі)етокси]-5',6'-дигідpo2'Н-[3',4']біпіридиніл-1',3'-дикарбонової кислоти (А2) BuLi (1,6 Μ у гексані, 39,3 мл, 45,2 ммоль) додавали до розчину 5-бром-2-[2-(2,6-дихлор-4метилфеноксі)етокси]піридин (13,0 г, 34,5 ммоль) у ТГФ (700 мл) при -78°С. Суміш перемішували протягом 1 години при -78°С, і до неї додавали ZnCl2 (0,72 Μ у ТГФ, 78,6 мл, 56,5 ммоль). Суміші давали змогу нагріватися до к.т. До суміші додавали 1трет-бутиловий ефір 3-метиловий ефір 4трифторметансульфонілокси-5,6-дигідро-2Нпіридин-1,3-дикарбонової кислоти (WO 2004/002957, 11,0 г, 28,3 ммоль) і Pd(PPh 3)4 (813 мг, 0,704 ммоль). Суміш перемішували протягом 30 хв при 70°С, потім протягом ночі при к.т. До 95909 48 суміші додавали водний насичений NH4CІ, і суміш екстрагували за допомогою ЕtOАс (2×). Органічні екстракти сушили над MgSO4, фільтрували, і розчинники видаляли при зниженому тиску. Очищення сирого продукту за допомогою FC (гептан/ЕtOАс 9:1 → 5:5) давало зазначену в заголовку сполуку (10,7 г, 70%). РХ-МС: tR = 1,16 хв; ES+: 537,33. 3,9-Ди-трет-бутиловий ефір (рац.)-(1R*, 5S*)-7{4-[3-(2-хлop-3,6-дифторфенокси)пропіл]феніл}3,9-діазабіцикло[3.3.1]нон-7-ен-3,6,9трикарбонової кислоти (В1) У 250 мл круглодонній колбі, оснащеній магнітною мішалкою, розчиняють сполуку А1 (4,72 г, 6,97 ммоль) в ЕtOН (100 мл). До даної суміші додають водний 1 Μ NaOH (50 мл), і одержаний безбарвний розчин нагрівають при 80°С протягом 14 годин. Одержаному ясно-рожевому розчину дають змогу охолонути до к.т., і розчин обережно підкисляють до рН 1,5. Леткі компоненти видаляють у вакуумі, і одержаний залишок розподіляють між ЕtOАс (300 мл) і водою (300 мл). Водну фазу відділяють і знову екстрагують за допомогою ЕtOАс (3×300 мл). Об'єднані органічні екстракти потім промивають насиченим сольовим розчином (500 мл), знебарвлюють активованим вугіллям і сушать над MgSO4. Фільтрування через шар целіту і концентрування безбарвного фільтрату у вакуумі дає білу пінисту речовину. Розділення 3,9-ди-третбутилового ефіру (рац.)-(1R*,5S*)-7-{4-[3-(2-хлор3,6-дифторфенокси)пропіл]феніл}-3,9діазабіцикло[3.3.1]нон-6-ен-3,6,9-трикарбонової кислоти [1,01 г, 22%; Rf = 0,55 (гексан:ЕtOАс +1% АсОН)] і зазначеної в заголовку сполуки (2,77 г, 61%) може бути досягнуто за допомогою FC (SiO2, 2:1 гексан: ЕtOАс + 1% АсОН). Залишкова АсОН може бути видалена кількісно спочатку азеотропною відгонкою з гептаном і потім із толуолом. Rf = 0,50 (1:1 гексан: ЕtOАс + 1% АсОН); ES- = 646,8. Суміш чотирьох можливих діастереоізомерів 3,9-ди-трет-бутилоеого ефіру 7-{4-[3-(2-хлор-3,6дифторфенокси)пропіл]феніл}-3,9діазабіцикло[3.3.1]нонан-3,6,9-трикарбонової кислоти (Е1) У 250 мл круглодонній колбі, оснащеній магнітною мішалкою, суспендують сполуку В1 (1,17 г, 1,80 ммоль) і Pd/C (10% мас/мас, 1,20 г) у МеОН (100 мл). Одержану суспензію дезоксигенують і потім через неї пропускають Н2 газ протягом 15 хв. Нарешті, реакційну суміш ефективно перемішують при к.т. у статичній атмосфері Н2, регульованій балоном. Через 2 години може бути відмічене кількісне споживання сполуки В1. Потім реакційну посудину ефективно продувають за допомогою N2, і суспензію фільтрують через шар целіту і SiO2. Після промивання нерозчинних речовин великими кількостями СН2СІ2 і ЕtOАс фільтрат концентрують у вакуумі до одержання зазначеної у заголовку сполуки у вигляді суміші чотирьох діастереомерів (1,116 г, 95% вихід сирого продукту, ES- = 648,9). Даний продукт використовують потім без очищення. Ди-трет-бутиловий ефір (рац.)(1R*,5S*,6R*,7S*)-7-{4-[3-(2-хлор-3,6дифторфенокси)пропіл]феніл}-6-[циклопропіл-(2,3 49 дихлорбензил)карбамоїл]-3,9-діазабіцикло[3.3.1] нонан-3,9-дикарбонової кислоти (D2) і ди-третбутиловий ефір (рац.)-(1R*,5S*,6R*,7R*)-7-{4-[3-(2хлор-3,6-дифторфенокси)пропіл]феніл}-6[циклопропіл-(2,3-дихлорбензил)карбамоїл]-3,9діазабіцикло[3.3.1]нонан-3,9-дикарбонової кислоти (D1). У 100 мл круглодонній колбі, оснащеній магнітною мішалкою, змішують сполуку Е1 (905 мг, 1,39 ммоль), циклопропіл-(2,3-дихлорбензил)амін (одержаний із 2,3-дихлорбензальдегіду і циклопропіламіну відновним амінуванням, 600 мг, 2,78 ммоль), HOBt (282 мг, 2,08 ммоль) і DMAP (509 мг, 4,17 ммоль) у ДМФА (10 мл). Потім додають EDC.HCІ (400 мг, 2,08 ммоль), і одержаний жовтий розчин перемішують при к.т., і хід реакції відстежують за допомогою РХ-МС. Після реакції, що повністю завершилася через 56 годин із 86% конверсією, реакційну суміш розводять 150 мл Et2O і гасять холодною 10% водною НСI (150 мл). Органічну фракцію відділяють, і водну фракцію знову екстрагують за допомогою Et2O (3×100 мл). Об'єднані органічні екстракти послідовно промивають водним 1 Μ NaOH (100 мл), водою (150 мл) і насиченим сольовим розчином (150 мл). Сушіння над MgSO4, фільтрування і концентрування фільтрату у вакуумі дає білий пінистий продукт. Подальше очищення методом колонкової хроматографії (SiO2, 1,5:1 гексан: Еt2О) дає зазначену в заголовку сполуку (0,8591 г, 73%) у вигляді 16:80:4 суміші діастереомерів. 200 мг суміші, одержаної таким чином, потім розчиняють у суміші 10 мл 95% CH3CN + 4,9% Н2О + 0,1% мурашина кислота. Даний розчин потім вводять 500 мкл пробами на ВЕРХ, оснащену Phenomenex Synes 4 мк max RP 80 ангстрем 100x21,20 мм колонкою. Елюювання при швидкості 20 мл/хв ізократичною сумішшю 95% CH3CN + 4,9% Н2О + 0,1% мурашина кислота дає два основних діастереомери: сполуку D1: tR = 5,04 хв, ES- = 848,1, біла піниста речовина, 40,0 мг (виділено з виходом 20%); сполуку D2: tR = 6,64 хв, ES- = 848,1, біла піниста речовина, 140,4 мг (виділено з виходом 70%). трет-Бутиловий ефір (рац.)-(3R*,4S*)-3[циклопропіл-(2,3-диметилбензил)карбамоїл]-4-{4[2-(2,6-дихлор-4-метилфеноксі)етокси]феніл}піперидин-1-карбонової кислоти (D3) Розчин сполуки Е2 (90 мг, 0,17 ммоль), (2,3диметилбензил)циклопропіламіну (приготованого відновним амінуванням 2,3-диметилбензальдегіду і циклопропіламіну, 90 мг, 0,51 ммоль), DMAP (5 мг, 0,04 ммоль), DIPEA (0,118 мл, 0,69 ммоль), HOBt (29 мг, 0,21 ммоль) і EDC.HCІ (49 мг, 0,26 ммоль) у СН2CІ2 (3 мл) перемішували протягом 18 годин. Суміш розводили за допомогою ЕtOАс, промивали водною 1 Μ НСI і насиченим сольовим розчином. Органічну фазу сушили над MgSO4, фільтрували, і розчинники видаляли при зниженому тиску. Зазначену в заголовку сполуку далі не очищали. РХ-МС: tR = 1,25 хв, ES+ = 681,37. трет-Бутиловий ефір (3R,4S)-3-{[5-хлор-2-(3метоксипропіл)бензил]циклопропілкарбамоїл}-4-{4[2-(2,6-дихлор-4-метилфеноксі)етокси]феніл}піперидин-1-карбонової кислоти (D4) 95909 50 Розчин сполуки Е3 (0,052 г, 0,10 ммоль), [5хлор-2-(3-метоксипропіл)бензил]циклопропіламіну (0,073 г, 0,30 ммоль), DMAP (0,003 г, 0,03 ммоль), DIPEA (0,068 мл, 0,40 ммоль), HOBt (0,017 г, 0,13 ммоль) і EDC.HCІ (0,029 г, 0,15 ммоль) у СН2CІ2 (2 мл) перемішували протягом 48 годин. Суміш розводили за допомогою ЕtOАс, промивали водною 1 Μ НСI і насиченим сольовим розчином. Органічну фазу сушили над MgSO4, фільтрували і розчинники видаляли при зниженому тиску. Зазначену в заголовку сполуку далі не очищали. РХ-МС: tR = 1,27 xв, ES+: = 761,44. трет-Бутиловий ефір (3R,4S)-3-{[2-xriop-5-(2метоксіетил)бензил]циклопропілкарбамоїл}-4-{4-[2(2,6-дихлор-4-метилфеноксі)етокси]феніл}піперидин-1-карбонової кислоти (D5) Суміш сполуки Е3 (200 мг, 0,383 ммоль), [2хлор-5-(2-метоксіетил)бензил]циклопропіламіну (120 мг, 0,473 ммоль), HOBt (64,7 мг, 0,479 ммоль), DMAP (11,7 мг, 0,096 ммоль), DIPEA (0,262 мл, 1,53 ммоль) і EDC.HCІ (110 мг, 0,574 ммоль) у СН2CІ2 (4 мл) перемішували протягом 48 годин при к.т. Суміш фільтрували через Isolute®, попередньо промитий водною 1 Μ НСI. Органічний шар сушили над MgSO4, фільтрували, і розчинники видаляли при зниженому тиску. Очищення за допомогою FC (ЕtOАс) давало зазначену в заголовку сполуку (280 мг, 98%). РХ-МС: tR = 1,26 хв, ES+: = 747,54. трет-Бутиловий ефір (рац.)-(3R*,4S*)-3'-{[2хлор-5-(3метоксипропіл)бензил]циклопропілкарбамоїл}-6-[2(2,6-дихлор-4-метилфеноксі)етокси]-3',4',5',6 тетрагідро-2'H-[3,4']біпіридиніл-1'-карбонової кислоти (D6) Суміш сполуки Е4 (1,00 г, 1,90 ммоль), [5-хлор2-(3-метоксипропіл)бензил]циклопропіламіну (531 мг, 2,09 ммоль), DIPEA (1.30 мл, 7,61 ммоль), DMAP (58,1 мг, 0,476 ммоль), HOBt (321 мг, 2,38 ммоль) і EDC.HCІ (547 мг, 2,86 ммоль) у СН2CІ2 (4 мл) перемішували протягом 4 днів при к.т. EDC.HCІ (100 мг, 0,506 ммоль) додавали знов, і суміш перемішували протягом 24 годин. Додавали СН2Сl2, і суміш промивали водною 1 Μ НСI (×1), водою (×1) і насиченим сольовим розчином (×1). Органічний шар сушили над MgSO4, фільтрували і розчинники видаляли при зниженому тиску. Очищення сирого продукту за допомогою FC (СН2CІ2 → СН2CІ2/МеOН 97:3) давало зазначену в заголовку сполуку (1,14 г, 79%). РХ-МС: tR = 1,26 хв, ES+: = 762,50. трет-Бутилоеий ефір (pац.)-(3R*,4S*)-3'-{[2хлор-5-(2-метоксіетил)бензил]циклопропілкарбамоїл}-6-[2-(2,6-дихлор-4-метилфеноксі)етокси]3',4',5',6'-тетрагідро-2'H-[3,4']біпіридиніл-1'карбонової кислоти (D7) Суміш сполуки Е4 (1,00 г, 1,90 ммоль), [5-хлор2-(3-метоксіетил)бензил]циклопропіламіну (533 мг, 2,09 ммоль), DIPEA (1,30 мл, 7,61 ммоль), DMAP (58,1 мг, 0,476 ммоль), HOBt (321 мг, 2,38 ммоль) і EDC.HCІ (547 мг, 2,86 ммоль) у СН2СІ2 (4 мл) перемішували протягом 5 днів при к.т. EDC.HCІ (100 мг, 0,506 ммоль) додавали знову, і суміш перемішували протягом 24 годин. Додавали СН2CІ2, і суміш промивали водною 1 Μ НСI (×1), водою (×1) і насиченим сольовим розчином (×1). Органічний 51 шар сушили над MgSO4, фільтрували, і розчинники видаляли при зниженому тиску. Очищення сирого продукту за допомогою FC (СН2СІ2 → СН2Сl2/МеОН 97:3) давало зазначену в заголовку сполуку (1,12 г, 79%). РХ-МС: tR = 1,24 хв, ES+: = 746,16. трет-Бутиловий ефір (3R,4S)-3-[(5-{[третбутоксикпрбоніл-(2,2-дифторетил)аміно]метил}-2хлорбензил)циклопропілкарбамоїл]-4-{4-[2-(2,6дихлор-4-метилфеноксі)етокси]феніл}піперидин-1карбонової кислоти (D8) Одержували, виходячи із загальних умов А, зі сполуки Е3 і трет-бутилового ефіру (4-хлор-3циклопропіламінометилбензил)-(2,2дифторетил)карбамінової кислоти. РХ-МС: tR = 1,28 хв, ES+: = 880,26. трет-Бутиловий ефір (3R,4S)-3-({2-хлор-5[(3,3,3-трифторпропіоніламіно)метил]бензил}циклопропілкарбамоїл)-4-{4-[2-(2,6-дихлор-4метилфеноксі)етокси]феніл}піперидин-1карбонової кислоти (D9) Одержували, виходячи із загальних умов А, зі сполуки Е3 і N-(4-хлор-3циклопропіламінометилбензил)-3,3,3трифторпропіонаміду. РХ-МС: tR = 1,21 хв, ES+: = 828,20. трет-Бутиловий ефір (3R,4S)-3-({5-[(третбутоксикарбонілциклопропілметиламіно)метил]-2хлорбензил}циклопропілкарбамоїл)-4-{4-[2-(2,6дихлор-4-метилфеноксі)етокси]феніл}піперидин-1карбонової кислоти (D10) Одержували, виходячи із загальних умов А, зі сполуки Е3 і трет-бутилового ефіру (4-хлор-3циклопропіламінометилбензил)циклопропілметилкарбамінової кислоти. РХМС: tR = 1,31 хв, ES+: = 872,31. трет-Бутиловий ефір (3R,4S)-3-{[5(ацетиламінометил)-2-хлорбензил]циклопропілкарбамоїл}-4-{4-[2-(2,6-дихлор-4метилфеноксі)етокси]феніл}піперидин-1карбонової кислоти (D11) Одержували, виходячи із загальних умов А, зі сполуки Е3 і N-(4-хлор-3циклопропіламінометилбензил)ацетаміду. РХ-МС: tR = 1,19 хв, ES+: = 758,22. трет-Бутиловий ефір (3R,4S)-3-({5-[2-(третбутоксикарбонілметиламіно)етил]-2хлорбензил}циклопропілкарбамоїл)-4-{4-[2-(2,6дихлор-4-метилфеноксі)етокси]феніл}піперидин-1карбонової кислоти (D12) Одержували, виходячи із загальних умов А, зі сполуки Е3 і трет-бутилового ефіру [2-(4-хлор-3циклопропіламінометилфеніл)етил]метилкарбамінової кислоти. РХ-МС: tR = 1,29 хв, ES+: = 844,33. трет-Бутиловий ефір (3R,4S)-3-({5-[(третбутоксикарбонілметиламіно)метил]-2хлорбензил}циклопропілкарбамоїл)-4-{4-[2-(2,6дихлор-4-метилфеноксі)етокси]феніл}піперидин-1карбонової кислоти (D13) Одержували, виходячи із загальних умов А, зі сполуки Е3 і трет-бутилового ефіру (4-хлор-3циклопропіламінометилбензил)метилкарбамінової кислоти. РХ-МС: tR = 1,28 хв, ES+: = 832,31. 95909 52 трет-Бутиловий ефір (3R,4S)-3-({2-хлор-5-[2(3,3,3трифторпропіоніламіно)етил]бензил}циклопропілкарбамоїл)-4-{4-[2(2,6-дихлор-4метилфеноксі)етокси]феніл}піперидин-1карбонової кислоти (D14) Одержували, виходячи із загальних умов А, зі сполуки Е3 і Ν-[2-(4-хлор-3циклопропіламінометилфеніл)етил]-3,3,3трифторпропіонаміду. РХ-МС: tR = 1,22 xв, ES+: = 840,25. трет-Бутиловий ефір (3R,4S)-3-({5-[2-(третбутоксикарбонілетиламіно)етил]-2хлорбензил}циклопропілкарбамоїл)-4-{4-[2-(2,6дихлор-4-метилфеноксі)етокси]феніл}піперидин-1карбонової кислоти (D15) Одержували, виходячи із загальних умов А, зі сполуки Е3 і трет-бутилового ефіру [2-(4-хлор-3циклопропіламінометилфеніл)етил]етилкарбамінової кислоти. РХ-МС: tR = 1,30 хв. трет-Бутиловий ефір (3R,4S)-3-{[5-(2ацетиламіноетил)-2хлорбензил]циклопропілкарбамоїл}-4-{4-[2-(2,6дихлор-4-метилфеноксі)етокси]феніл}піперидин-1карбонової кислоти (D16) Одержували, виходячи із загальних умов А, зі сполуки Е3 і Ν-[2-(4-хлор-3циклопропіламінометилфеніл)етил]ацетаміду. РХМС: tR = 1,22 хв, ES+: = 774,29. трет-Бутиловий ефір (3R,4S)-3-[(5-{[третбутоксикарбоніл-(2-фторетил)аміно]метил}-2хлорбензил)циклопропілкарбамоїл]-4-{4-[2-(2,6дихлор-4-метилфеноксі)етокси]феніл}піперидин-1карбонової кислоти (D17) Одержували, виходячи із загальних умов А, зі сполуки Е3 і трет-бутилового ефіру (4-хлор-3циклопропіламінометилбензил)-(2фторетил)карбамінової кислоти. РХ-МС: tR = 1,28 хв, ES+: = 864,27. трет-Бутиловий ефір (3R,4S)-3-({5-[(третбутоксикарбонілетиламіно)метил]-2хлорбензил}циклопропілкарбамоїл)-4-{4-[2-(2,6дихлор-4-метилфеноксі)етокси]феніл}піперидин-1карбонової кислоти (D18) Одержували, виходячи із загальних умов С, зі сполуки Е3 і трет-бутилового ефіру (4-хлор-3циклопропіламінометилбензил)етилкарбамінової кислоти. РХ-МС: tR = 1,30 xв, ES+: = 846,32. трет-Бутиловий ефір (3R,4S)-3-({5-[(третбутоксикарбонілциклопропіламіно)метил]-2хлорбензил}циклопропілкарбамоїл)-4-{4-[2-(2,6дихлор-4-метилфеноксі)етокси]феніл}піперидин-1карбонової кислоти (D19) Одержували, виходячи із загальних умов С, зі сполуки Е3 і трет-бутилового ефіру (4-хлор-3циклопропіламінометилбензил)циклопропілкарбамінової кислоти. РХ-МС: tR = 1,31 хв, ES+: = 856,37. трет-Бутиловий ефір (3R,4S)-3-({5-[2-(третбутоксикарбонілциклопропіламіно)етил]-2хлорбензил}циклопропілкарбамоїл)-4-{4-[2-(2,6дихлор-4-метилфеноксі)етокси]феніл}піперидин-1карбонової кислоти (D20) 53 Одержували, виходячи із загальних умов С, зі сполуки Е3 і трет-бутилового ефіру [2-(4-хлор-3циклопропіламінометилфеніл)етил]циклопропілкарбамінової кислоти. РХ-МС: tR = 1,31 хв, ES+: - 872,35. 1-трет-Бутиловий ефір (рац.)-(3R*,4S*)-4-{4-[2(2,6-дихлор-4метилфеноксі)етокси]феніл}піперидин-1,3дикарбонової кислоти (Е2) До розчину сполуки L2 (0,15 г, 0,27 ммоль) у МеОН (1 мл) додавали водний 1 Μ NaOH (1 мл). Суміш перемішували при 70°С протягом 2 годин. Додавали воду, і суміш екстрагували за допомогою EtOAc. Органічну фазу промивали насиченим сольовим розчином, сушили над MgSO4, фільтрували і розчинники видаляли при зниженому тиску. Сирий залишок очищали на силікагелі, одержуючи зазначену в заголовку сполуку (93 мг, 65%). РХМС: tR = 1,12 хв, ES+: = 524,24. 1-трет-Бутиловий ефір (3R,4S)-4-{4-[2-(2,6дихлор-4-метилфеноксі)етокси]феніл}піперидин1,3-дикарбонової кислоти (Е3) Сполуку Е2 (4,46 г, 8,5 ммоль) розділяли, використовуючи препаративну ВЕРХ, оснащену хіральною колонкою, описаною в даному документі вище. Застосовували ізократичний елюент, що складається з 97% гексану, 3% етанолу і 0,1% ТГФ. Одержували зазначену в заголовку сполуку (1,35 г, 30%). Аналітична хіральна ВЕРХ (елюент, тотожний препаративному): tR = 29,00 хв. 1'-трет-Бутиловий ефір (рац.)-(3R*,4S*)-6-[2(2,6-дихлор-4-метилфеноксі)етокси]-3',4',5',6'тетрагідро-2'H-[3,4']біпіридиніл-1',3'-дикарбонової кислоти (Е4) Суміш сполуки L4 (4,92 г, 9,12 ммоль) у водному 1 Μ NaOH (75 мл) і МеОН (75 мл) перемішували при 70°С протягом 4,5 годин. Додавали водну 1 Μ НСI доти, поки рН не досягав 4. Суміш екстрагували за допомогою ЕtOАс (3×). Об'єднані органічні екстракти промивали насиченим сольовим розчином, сушили над MgSO4, фільтрували, і розчинники видаляли при зниженому тиску. Сушіння залишку у високому вакуумі давало сиру зазначену в заголовку сполуку (4,63 г, 97%), яку потім використовували без очищення. РХ-МС: tR = 1,08 хв, ES+: = 525,40. 1-трет-Бутиловий ефір 3-метиловий ефір 4-{4[2-(трет-бутилдиметилсиланілокси)етокси]феніл}5,6-дигідро-2Н-піридин-1,3-дикарбонової кислоти (F1) До розчину 4-[2-(трет-бутилдиметилсиланілокси)етокси]бромбензолу (WO 03/093267, 7,95 г, 24 ммоль) у ТГФ (200 мл) при -78°С додавали BuLi (1,6 Μ у гексані, 17,12 мл, 27,4 ммоль). Розчин перемішували при -78°С протягом 30 хв, потім додавали ZnCl2 (1 Μ у ТГФ, 30 мл, 30 ммоль). Одержаному розчину давали змогу охолоджуватися до к.т., і до нього додавали 1-трет-бутиловий ефір 3-метиловий ефір 4трифторметансульфонілокси-5,6-дигідро-2Нпіридин-1,3-дикарбонової кислоти (WO 2004/002957, 7,79 г, 20 ммоль) у ТГФ (20 мл) і Pd(PPh3)4 (0,69 г, 0,60 ммоль). Реакційну суміш нагрівали при 50°С протягом 1 години і перемішували 16 годин при к.т. Суміш охолоджували до 95909 54 0°С, і до неї додавали водний насичений NH4CI. Додавали ЕtOАс, і органічну фазу промивали насиченим сольовим розчином, сушили над MgSO4, фільтрували, і розчинники видаляли при зниженому тиску. Очищення залишку за допомогою FC (ЕtOАс/гептан 2:8 → 1:0) давало зазначену в заголовку сполуку (8,1 г, 82%). РХ-МС: tR = 1,23 хв, ES+: = 506,47. 3-трет-Бутиловий ефір 6-етиловий ефір (рац.)(1R*,5S*)-7-{4-[3-(третбутилдиметилсиланілокси)пропіл]феніл}-9-метил3,9-діазабіцикло[3.3.1]нон-6-ен-3,6-дикарбонової кислоти (F2) Розчин [3-(4-бромфеніл)пропокси]третбутилдиметилсилану (102,1 г, 310 ммоль) у ТГФ (1,50 л) в атмосфері азоту охолоджують до -78°С. Додають BuLi (1,5 Μ у гексані, 212 мл, 318 ммоль). Через 30 хв додають ZnCl2 (1 Μ у ТГФ, 465 мл, 465 ммоль). Суміші дозволяють нагрітися до к.т. До неї додають 3-трет-бутиловий ефір 6-етиловий ефір (рац.)-(1R*,5S*)-9-метил-7трифторметансульфонілокси-3,9діазабіцикло[3.3.1]нон-6-ен-3,6-дикарбонової кислоти (83,6 г, 155 ммоль) у ТГФ (100 мл) і потім Pd(PPh3)4 (4,48 г, 3,87 ммоль). Суміш нагрівають при кипінні зі зворотним холодильником протягом 30 хв, і дають змогу їй охолоджуватися до к.т. Суміш розводять за допомогою ЕtOАс і промивають водним 1 Μ NaOH (×1). Органічні екстракти сушать над MgSO4, фільтрують, і розчинники видаляють при зниженому тиску. Очищення залишку за допомогою FC (МеОН/СН2CІ2 1:49 → 1:24 → 3:47 → 2:23) дає зазначену в заголовку сполуку (88,6 г, фактично кількісний вихід). РХ-МС: tR = 0,98 хв, ES+: = 559,24. 3,9-Ди-трет-бутиловий ефір 6-етиловий ефір (рац.)-(1R*,5S*)-7-[4-(3-гідроксипропіл)феніл]-3,9діазабіцикло[3.3.1]нон-6-ен-3,6,9-трикарбонової кислоти (F3) Сполуку F2 (32,0 г, 57,3 ммоль) розчиняють у сухому 1,2-дихлоретані (590 мл). До даного розчину додають NaHCO3 (48,2 г, 573 ммоль) і 1хлоретилхлорформіат (62,5 мл, 573 ммоль), і суспензію нагрівають при 80°С. Через 3 години реакційній суміші дають змогу охолонути до к.т. Суміш фільтрують, і фільтрат упарюють при зниженому тиску. Залишок сушать 15 хв у високому вакуумі. Продукт розводять за допомогою МеОН (400 мл), і суміш нагрівають при 50°С протягом 20 хв. Реакційній суміші дають змогу охолонути до к.т., і розчинники видаляють при зниженому тиску. Жовту тверду речовину сушать у високому вакуумі протягом 1 години. Тверду речовину розчиняють у СН2СІ2 (190 мл), і розчин охолоджують до 0°С. Додають DIPEA (49,1 мл, 287 ммоль) і Вос 2О (37,5 г, 172 ммоль). Суміш перемішують протягом ночі, у той час як вона нагрівається до к.т. Реакційну суміш розводять за допомогою СН2CІ2 (110 мл). Органічний шар промивають водної 1 Μ НСI (2×300 мл) і водним насиченим NaHCO3 (300 мл). Органічний шар сушать над MgSO4, фільтрують, і розчинники видаляють при зниженому тиску. Очищення залишку за допомогою FC (СН2CІ2/МеOН 100:0 → 2:98 → 5:95) дає зазначену в заголовку 55 сполуку (26,2 г, 86%). РХ-МС: tR = 1,05 хв, ES+: = 531,33. 1-трет-Бутиловий ефір 4-{4-[3-(третбутилдиметилсиланілокси)пропіл]феніл}-5,6дигідро-2Н-піридин-1,3-дикарбонової кислоти (G1) 1-трет-Бутиловий ефір 3-метиловий ефір 4-{4[3-(трет-бутилдиметилсиланілокси)пропіл]феніл}5,6-дигідро-2Н-піридин-1,3-дикарбонової кислоти (WO 2004/002957, 17,1 г 35,0 ммоль) розчиняють у суміші ДМСО (300 мл) і ТГФ (100 мл). Додають водний NaOH (1 Μ, 70 мл і 2 Μ, 50 мл). Суміш нагрівають при 50°С протягом 7 годин, потім охолоджують до 0°С і додають воду (100 мл). рН доводять до 2 додаванням водної НСI (1 М, 100 мл), і реакційну суміш екстрагують за допомогою EtOAc (2×250 мл). Об'єднані органічні шари сушать над MgSO4, фільтрують, і розчинники видаляють при зниженому тиску. Ясно-коричневе масло сушать у високому вакуумі (18 г). РХ-МС: tR = 0,86 хв, [М+Н]+: = 362,05. Дану сиру сполуку (17,98 г) розчиняють у ДМФА (300 мл) із подальшим додаванням імідазолу (6,84 г, 97,7 ммоль) і TBDMS-CІ (11,1 г, 73,8 ммоль). Суміш перемішують при к.т. протягом 14 годин. Додають насичений водний NH4CI (250 мл) і воду (250 мл), і суміш екстрагують за допомогою Et2O (2×250 мл). Об'єднані органічні шари сушать над MgSO4, фільтрують, і розчинники випарюють при зниженому тиску. Залишок розчиняють у ТГФ (300 мл) і додають МеОН (125 мл), воду (125 мл) і K2СО3 (3,00 г). Суміш перемішують при к.т. протягом 10 хв. Додають насичений водний NH4CI (250 мл) і воду (25 мл), і суміш екстрагують за допомогою ЕtOАс (2×250 мл). Об'єднані органічні шари сушать над MgSO4, фільтрують, і розчинники випарюють при зниженому тиску. Очищення залишку за допомогою FC (гексан/ЕtOАс = 4/1-1/1) дає зазначену в заголовку сполуку (5,1 г, 32%). РХ-МС: tR = 1,16 хв; ES+: = 476,35. трет-Бутиловий ефір 4-{4-[3-(трeтбутилдиметилсиланілокси)пропіл]феніл}-3[циклопропіл-(3-метокси-2метилбензил)карбамоїл]-3,6-дигідро-2Н-піридин-1карбонової кислоти (Н1) Сполуку G1 (2 г, 4,21 ммоль) розчиняють у СН2CІ2 (30 мл), і до розчину додають (1-хлор-2метилпропеніл)диметиламін (618 мг, 4,63 ммоль). Суміш перемішують при к.т. протягом 5 хв, і до неї додають циклопропіл(3-метокси-2метилбензил)амін (одержаний відновним амінуванням із 3-метокси-2-метилбензальдегіду, Comins, Brown, J. D., J. Org. Chem., 1989, 54, 3730, і циклопропіламіну, 844 мг, 4,42 ммоль) і DIPEA (815 мг, 6,32 ммоль). Суміш перемішують при к.т. протягом 15 хв, розводять за допомогою СН2СІ2 (100 мл) і екстрагують водною 10% лимонною кислотою (100 мл). Водний шар промивають за допомогою СН2СІ2 (50 мл). Об'єднані органічні шари сушать над MgSO4, фільтрують, і розчинники випарюють при зниженому тиску. Очищення сирого продукту за допомогою FC (СН2СІ2/МеOН 19/1) дає зазначену в заголовку сполуку (3,36 г, кількісний вихід). РХ-МС: tR = 1,28 хв; ES+: = 649,42. трет-Бутиловий ефір 4-{4-[3-(третбутилдиметилсиланілокси)пропіл]феніл}-3 95909 56 [циклопропіл-(2,3-диметилбензил)карбамоїл]-3,6дигідро-2Н-піридин-1-карбонової кислоти (Н2) Виходячи із методики для сполуки Н1, але використовуючи циклопропіл-(2,3диметилбензил)амін (одержаний відновним амінуванням 2,3-диметилбензальдегіду і циклопропіламіну) замість циклопропіл-(3-метокси-2метилбензил)аміну, сполуку Н2 (2,84 г, кількісний вихід) одержували зі сполуки G1 (2,00 г). РХ-МС: tR = 1,30 xв; ES+: = 633,45. трет-Бутиловий ефір 4-{4-[3-(третбутилдиметилсиланілокси)пропіл]феніл}-3[циклопропіл-(3-метокси-2метилбензил)карбамоїл]піперидин-1-карбонової кислоти (J1) Pd/C (10%; 340 мг) суспендують в атмосфері азоту в ЕtOН (25 мл). Додають розчин сполуки Н1 (3,36 г, 5,19 ммоль) в ЕtOН (25 мл). Суміш витримують в атмосфері Н2 (3 бар) протягом 3 годин, фільтрують через целіт і концентрують у вакуумі. Залишок сушать у високому вакуумі, що дає зазначену в заголовку сполуку (2,20 г, 65%), яку потім використовують без очищення. РХ-МС: tR = 1,31 xв; ES+: = 651,46. трет-Бутиловий ефір 4-{4-[3-(третбутилдиметилсиланілокси)пропіл]феніл}-3[циклопропіл-(2,3диметилбензил)карбамоїл]піперидин-1-карбонової кислоти (J2) Виходячи із методики для сполуки J1, одержують зазначену в заголовку сполуку (2,42 г, 85%) зі сполуки Н2 (2,84 г, 4,47 ммоль). РХ-МС: tR = 1,32 хв; ES+: = 635,47. трет-Бутиловий ефір 3-[циклопропіл-(3метокси-2-метилбензил)карбамоїл]-4-[4-(3гідроксипропіл)феніл]піперидин-1-карбонової кислоти (J3) Сполуку J1 (2,20 г, 3,38 ммоль) розчиняють у ТГФ (50 мл) із подальшим додаванням TBAF (1,21 г, 3,84 ммоль). Реакційну суміш перемішують при к.т. протягом 2,5 годин, розводять за допомогою ЕtOАс (250 мл) і промивають водою (200 мл). Органічний шар сушать над MgSO4, фільтрують і концентрують у вакуумі. Очищення залишку за допомогою FC (гексан/ЕtOАс 1/1) дає зазначену в заголовку сполуку (0,91 г, 50%). РХ-МС: tR = 1,07 хв; ES+: = 537,37. трет-Бутиловий ефір 3-[циклопропіл-(2,3диметилбензил)карбамоїл]-4-[4-(3гідроксипропіл)феніл]піперидин-1-карбонової кислоти (J4) Виходячи із методики для сполуки J3, одержують зазначену в заголовку сполуку (0,91 г, 46%) зі сполуки J2 (2,42 г). РХ-МС: tR = 1,08 хв; ES+: = 521,36. 1-трет-Бутиловий ефір 3-метиловий ефір 4-{4[2-(третбутилдиметилсиланілокси)етокси]феніл}піперидин-1,3-дикарбонової кислоти (K1) Mg (1,40 г, 58 ммоль) додавали до розчину сполуки F1 (8,10 г, 17 ммоль) у МеОН (40 мл) в атмосфері Аr. Суміш перемішували протягом 1 години, у той час як температура підтримувалася нижче за 30°С. Додавали по краплях водну 1 Μ 57 НСI (115 мл, 115 ммоль), і суміш перемішували протягом 1 години. Дану суміш екстрагували за допомогою ЕtOАс (2×). Об'єднані органічні шари промивали водою, насиченим сольовим розчином, сушили над MgSO4, фільтрували, і розчинники видаляли при зниженому тиску. Очищення залишку за допомогою FC (ЕtOАс/гептан 2:1) давало 2:3 транс/цис суміш зазначеної в заголовку сполуки (7,6 г, 93%). РХ-МС: tR = 1,23 хв; ES+: - 508,47. 1-трет-Бутиловий ефір 3-метиловий ефір 4-[4(2-(гідроксіетокси)феніл]піперидин-1,3дикарбонової кислоти (K2) До розчину сполуки K1 (7,60 г, 15,4 ммоль) у ТГФ (150 мл) при 0°С і в атмосфері Аг додавали TBAF (4,86 г, 15,4 ммоль). Після перемішування суміші протягом 1 години додавали водний насичений NH4CІ (100 мл), і реакційну суміш екстрагували за допомогою ЕtOАс (2×). Органічний шар промивали водою, насиченим сольовим розчином, сушили над MgSO4, фільтрували, і розчинники видаляли при зниженому тиску. Очищення залишку за допомогою FC (ЕtOАс/гептан 2:1 → 1:0) давало зазначену в заголовку сполуку (5,06 г, 87%). РХ-МС: tR = 0,91 хв; ES+: = 380,30. 1-трет-Бутиловий ефір 3-метиловий ефір 4-{4[2-(2,6-дихлор-4-метилфеноксі)етокси]феніл}піперидин-1,3-дикарбонової кислоти (L1) Суміш сполуки K2 (5,50 г, 15 ммоль), 2,6дихлор-п-крезолу (3,08 г, 18 ммоль), дипіперидиду азодикарбонової кислоти (7,31 г, 29 ммоль) і РВu3 (14 мл, 58 ммоль) у толуолі (150 мл) нагрівали при 50°С протягом 16 годин. Суміші давали змогу охолоджуватися до к.т., фільтрували, і осад промивали толуолом. Фільтрат розводили за допомогою ЕtOАс, промивали водою (2×) і насиченим сольовим розчином. Органічний шар сушили над MgSO4, фільтрували, і розчинники видаляли при зниженому тиску. Очищення сирого продукту за допомогою FC (ЕtOАс/гептан 0:1 → 1:9 → 2:8) давало зазначену в заголовку сполуку у вигляді безбарвного масла (7,3 г, 90%). РХ-МС: tR = 1,18 хв; ES+: = 538,34. 1-трет-Бутиловий ефір 3-метиловий ефір (рац.)-(3R*,4S*)-4-{4-[2-(2,6-дихлор-4метилфеноксі)етокси]феніл}піперидин-1,3дикарбонової кислоти (L2) До розчину сполуки L1 (0,21 г, 0,38 ммоль) у МеОН (2 мл) в атмосфері Аr додавали NaOMe (6 мг, 0,11 ммоль). Суміш перемішували протягом 3 діб при 70°С. Додавали воду, і суміш екстрагували за допомогою ЕtOАс. Органічну фазу промивали насиченим сольовим розчином, сушили над MgSO4, фільтрували і розчинники видаляли при зниженому тиску. Зазначену в заголовку сполуку (150 мг, 72%) додатково не очищали. РХ-МС: tR = 1,18 хв; ES+: = 538,32. Суміш всіх можливих стереоізомерів 1-третбутилового ефіру 3-метилового ефіру 6-[2-(2,6дихлор-4-метилфеноксі)етокси]-3',4',5',6'тетрагідро-2'H-[3,4']біпіридиніл-1',3'-дикарбонової кислоти (L3) Сполуку А2 (7,00 г, 13,0 ммоль) розчиняли в МеОН (130 мл). До даного розчину повільно додавали Mg (500 мг, 20,6 ммоль). Суміш перемішували протягом 1 години, і до неї знову додавали Mg 95909 58 (608 мг, 25,0 ммоль). Суміш перемішували 3 години. Повільно додавали водну 1 Μ НСI, і суміш перемішували протягом 1 години при к.т. Розчинники випарювали при зниженому тиску, і суміш екстрагували за допомогою ЕtOАс. Органічні екстракти сушили над MgSO4, фільтрували, і розчинники видаляли при зниженому тиску. Сушіння у високому вакуумі давало сиру зазначену в заголовку сполуку (4,92 мг, 70%). РХ-МС: tR = 1,16 xв; ES+: = 539,43. 1-трет-Бутиловий ефір 3-метиловий ефір (paц.)-(3R*,4S*)-6-[2-(2,6-дихлор-4метилфеноксі)етокси]-3',4',5',6'-тетрагідро-2'H[3,4']біпіридиніл-1',3'-дикарбонової кислоти (L4) Суміш сполуки L3 (5,40 г, 10,0 ммоль) і MeONa (540 мг, 10,0 ммоль) у МеОН (250 мл) перемішували протягом ночі при 70°С. MeONa (54 мг, 1,00 ммоль) додавали знову, і суміш перемішували протягом 5 годин при 70°С. MeONa (54 мг, 1,00 ммоль) додавали знову, і суміш перемішували протягом ночі при 70°С. Водну 1 Μ НСI додавали до встановлення рН 6-7. Розчинники випарювали при зниженому тиску, і суміш екстрагували за допомогою ЕtOАс. Об'єднані органічні екстракти промивали водою і насиченим сольовим розчином. Органічний шар сушили над MgSO4, фільтрували, і розчинники видаляли при зниженому тиску. Очищення залишку за допомогою FC (гептан/ЕtOАс 8:2 із 1% Et3N) давало зазначену в заголовку сполуку (4,92 г, 91%). РХ-МС: tR = 1,16 хв; ES+: = 539,43. Приклад 1 Циклопропіл-(2,3-дихлорбензил)амід (рац.)(1R*,5S*,6R*,7R*)-7-{4-[3-(2-хлор-3,6-дифторфенокси)пропіл]феніл}-3,9-діазабіцикло[3.3.1]нонан6-карбонової кислоти У 25 мл круглодонній колбі, оснащеній магнітною мішалкою, розчиняють сполуку D1 (31 мг, 0,037 ммоль) у СН2CІ2 (1 мл). При 0°С додають по краплях 4 Μ НСI (діоксан, 0,36 мл), і одержаний розчин нагрівають при к.т. протягом 2 годин, і потім перемішують при к.т. протягом наступних 8 годин. Леткі компоненти видаляють у вакуумі, і одержаний залишок розподіляють між СН2СІ2 (10 мл) і водним 1 Μ NaOH (10 мл). Органічний шар відділяють і водну промивку знову екстрагують за допомогою СН2СІ2 (3×10 мл). Об'єднані органічні екстракти промивають насиченим сольовим розчином (10 мл), сушать над MgSO4, фільтрують, і фільтрат концентрують у вакуумі. Одержаний таким чином продукт потім очищають колонковою хроматографією (SiO2, 95:5 СН2CІ2:2М NH3 у МеОН), виділяючи зазначену в заголовку сполуку (15,2 мг, 63%). tR = 2,0 хв на Agilent Zorbax RX-C18 4,6×150 мм ВЕРХ колонці (ізократична суміш 49,8% CH3CN + 49,9% Н2О + 0,1% мурашина кислота); ES+: = 648,1. Приклад 2 Циклопропіл-(2,3-дихлорбензил)амід (рац.)(1R*,5S*,6R*,7S*)-7-{4-[3-(2-хлор-3,6-дифторфенокси)пропіл]феніл}-3,9-діазабіцикло[3.3.1]нонан6-карбонової кислоти У 25 мл круглодонній колбі, оснащеній магнітною мішалкою, розчиняють сполуку D2 (54 мг, 0,064 ммоль) у СН2CІ2 (1 мл). При 0°С додають по 59 краплях 4 Μ НСI (діоксан, 0,47 мл), і одержаний розчин нагрівають при к.т. протягом 2 годин, і потім перемішують при к.т. протягом наступних 8 годин. Леткі компоненти видаляють у вакуумі, і одержаний залишок розподіляють між СН2CІ2 (10 мл) і водним 1 Μ NaOH (10 мл). Органічний шар відділяють, і водну промивку знову екстрагують за допомогою СН2СІ2 (3×10 мл). Об'єднані органічні екстракти промивають насиченим сольовим розчином (10 мл), сушать над MgSO4, фільтрують, і фільтрат концентрують у вакуумі. Сирий продукт потім очищають колонковою хроматографією (SiO2, 95:5 СН2CІ2:2 Μ ΝΗ3 у МеОН), одержуючи зазначену в заголовку сполуку (36,1 мг, 87%). t R = 3,1 хв на Agilent Zorbax RX-C18 4,6×150 мм ВЕРХ колонці (ізократична суміш 49,8% CH3CN + 49,9% Н2О + 0,1% мурашина кислота); ES+: 648,1. Приклад 3 Циклопропіл(3-метокси-2-метилбензил)амід 4{4-[3-(2-хлор-3,6-дифторфенокси)пропіл]феніл}піперидин-3-карбонової кислоти Зазначену в заголовку сполуку одержують за загальною методикою, описаною вище, зі сполуки J3 і 2-хлор-3,6-дифторфенолу. РХ-МС: tR = 0,99 хв; ES+: 583,23. Приклад 4 Циклопропіл(3-метокси-2-метилбензил)амід 4{4-[3-(2,6-дихлор-4-метилфенокси)пропіл]феніл}піперидин-3-карбонової кислоти Зазначену в заголовку сполуку одержують за загальною методикою, описаною вище, зі сполуки J3 і 2,6-дихлор-п-крезолу. РХ-МС: tR = 1,02 хв; ES+: 595,43. Приклад 5 Циклопропіл(3-метокси-2-метилбензил)амід 4{4-[3-(2,3,6-трифторфенокси)пропіл]феніл}піперидин-3-карбонової кислоти Зазначену в заголовку сполуку одержують за загальною методикою, описаною вище, зі сполуки J3 і 2,3,6-трифторфенолу. РХ-МС: tR = 0,98 хв; ES+: 567,48. Приклад 6 Циклопропіл(2,3-диметилбензил)амід 4-{4-[3(2-хлор-3,6-дифторфенокси)пропіл]феніл}піперидин-3-карбонової кислоти Зазначену в заголовку сполуку одержують за загальною методикою, описаною вище, зі сполуки J4 і 2-хлор-3,6-дифторфенолу. РХ-МС: tR = 1,00 хв; ES+: 567,26. Приклад 7 Циклопропіл(2,3-диметилбензил)амід 4-{4-[3(2,6-дихлор-4-метилфенокси)пропіл]феніл}піперидин-3-карбонової кислоти Зазначену в заголовку сполуку одержують за загальною методикою, описаною вище, зі сполуки J4 і 2,6-дихлор-п-крезолу. РХ-МС: tR = 1,04 хв; ES+: 579,44. Приклад 8 Циклопропіл(2,3-диметилбензил)амід 4-{4-[3(2-хлор-6-фтор-3-метилфенокси)пропіл]феніл}піперидин-3-карбонової кислоти Зазначену в заголовку сполуку одержують за загальною методикою, описаною вище, зі сполуки J4 і 2-хлор-6-фтор-3-метилфенолу. РХ-МС: tR = 1,04 хв; ES+: 563,47. 95909 60 Приклад 9 Циклопропіл(2,3-диметилбензил)амід 4-{4-[3(2,3,6-трифторфенокси)пропіл]феніл}піперидин-3карбонової кислоти Зазначену в заголовку сполуку одержують за загальною методикою, описаною вище, зі сполуки J4 і 2,3,6-трифторфенолу. РХ-МС: tR = 1,00 хв; ES+: 551,48. Приклад 10 Циклопропіл(2,3-диметилбензил)амід (рац.)(3R*,4S*)-4-{4-[2-(2,6-дихлор-4-метилфеноксі) етокси]феніл}піперидин-3-карбонової кислоти Сполуку D3 (0,068 г, 0,10 ммоль) розчиняли в СН2СІ2 (1 мл), і даний розчин охолоджували до 0°С. Додавали 4 Μ НСI у діоксані (1 мл), і реакційну суміш перемішували протягом 1 години при к.т. Розчинники випарювали при зниженому тиску. Очищення залишку за допомогою ВЕРХ давало зазначену в заголовку сполуку (37 мг, 63%). РХМС: tR = 0,95 хв; ES+: 581,44. Приклад 11 [2-хлор-5-(3метоксипропіл)бензил]циклопропіламід (3R,4S)-4{4-[2-(2,6-дихлор-4-метилфеноксі)етокси]феніл}піперидин-3-карбонової кислоти Сполуку D4 (0,076 г, 0,10 ммоль) розчиняли в СН2CІ2 (1 мл), і даний розчин охолоджували до 0°С. Додавали 4 Μ НСI у діоксані (1 мл), і реакційну суміш перемішували протягом 1 години при к.т. Розчинники випарювали при зниженому тиску. Очищення залишку за допомогою ВЕРХ давало зазначену в заголовку сполуку (44 мг, 67%). РХМС: tR = 0,99 хв; ES+: 661,41. Приклад 12 [2-хлор-5-(2метоксіетил)бензил]циклопропіламід (3R,4S)-4-{4[2-(2,6-дихлор-4-метилфеноксі)етокси]феніл}піперидин-3-карбонової кислоти Сполуку D5 (279 мг, 0,375 ммоль) розчиняли у СН2CІ2 (3 мл). Даний розчин охолоджували до 0°С, і до нього додавали НСI (4 Μ у діоксані, 1,00 мл). Суміш перемішували при 0°С протягом 1 години. Знову додавали НСI (4 Μ у діоксані, 1,00 мл), і суміш перемішували при к.т. протягом 2 годин. Знову додавали НСI (4 Μ у діоксані, 1,00 мл), і суміш перемішували при к.т. протягом 3 годин. Водний 1 Μ NaOH додавали доти, поки суміш не стала слабко лужною. Суміш фільтрували через Isolute®. Органічний шар сушили над MgSO4, фільтрували, і розчинники видаляли при зниженому тиску. Очищення залишку за допомогою FC (МеОН/СН2CІ2 1:19) давало зазначену в заголовку сполуку (120 мг, 50%). РХ-МС: tR = 0,96 хв; ES+: 645,49. Приклад 13 [2-хлор-5-(3метоксипропіл)бензил]циклопропіламід (3R,4S)-6[2-(2,6-дихлор-4-метилфеноксі)етокси]-1',2',3',4',5', 6'-гексагідро[3,4']біпіридиніл-3-карбонової кислоти Розчин сполуки D6 (1,14 г, 1,50 ммоль) у СН2CІ2 (4,13 мл) охолоджували до 0°С, і до нього додавали НСI (4 Μ у діоксані, 3,75 мл). Суміш перемішували при к.т. протягом 3 годин, і розчинники видаляли при зниженому тиску. Додавали СН2CІ2 і суміш промивали водним 1 Μ NaOH. Органічний шар сушили над MgSO4, фільтрували, і розчинни
ДивитисяДодаткова інформація
Назва патенту англійськоюPiperidine carboxylic acid amide derivatives
Автори англійськоюBezencon Olivier, Boss Christoph, Bur Daniel, Chen Austin Chih-Yu, Corminboeuf Olivier, Dube, Daniel, Fischli Walter, Grisostomi Corinna, Remen Lubos, Richard-Bildstein Sylvia, Sifferlen Thierry, Therien Michel, WELLER THOMAS
Назва патенту російськоюАмидные производные пиперидинкарбоновой кислоты
Автори російськоюБеценкон Оливье, Босс Кристоф, Бур Даниэль, Чень Остин Чинь-Ой, Корминбеф Оливье, Дюб Даниэль, Фишли Вальтер, Гризостоми Коринна, Ремен Любош, Ришар-Билдштайн Сильвия, Сифферлен Тьерри, Терьен Мишель, Веллер Томас
МПК / Мітки
МПК: C07D 211/78, C07D 401/10, C07D 471/08, A61K 31/451, A61P 9/00, C07D 401/12
Мітки: кислоти, похідні, амідні, піперидинкарбонової
Код посилання
<a href="https://ua.patents.su/33-95909-amidni-pokhidni-piperidinkarbonovo-kisloti.html" target="_blank" rel="follow" title="База патентів України">Амідні похідні піперидинкарбонової кислоти</a>
Попередній патент: Залізнична гальмівна колодка та металева вставка для неї
Наступний патент: Вимірювальний пристрій для шліфувального верстата та шліфувальний верстат
Випадковий патент: Підводний апарат з плавцевим рушієм












