Амідні похідні
Номер патенту: 88777
Опубліковано: 25.11.2009
Автори: Каммінґ Джон Ґрем, Неш Айен Алан, Браун Дірґ Сазерленд
Формула / Реферат
1. Сполука формули І
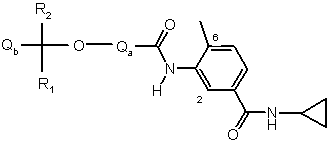 , І
, І
де
Qa - феніл або гетероарил, та Qa може, як варіант, нести 1 або 2 замісники, вибрані із групи: гідрокси, галоген, трифлуорметил, ціано, аміно, (1-6С)алкіл, (2-6С)алкеніл, (2-6С)алкініл, (1-6С)алкокси, (1-6С)алкіламіно, ді-[(1-6С)алкіл]аміно та (1-6С)алкоксикарбоніл;
R1 та R2 кожний незалежно вибрано із групи: гідроген, (1-6С)алкіл, (2-6С)алкеніл та (2-6С)алкініл; а
Qb - феніл, гетероарил або гетероцикліл, та Qb може, як варіант, нести 1 або 2 замісники, вибрані із групи: гідрокси, галоген, (1-6С)алкіл, (2-6С)алкеніл, (2-6С)алкініл, (3-6С)циклоалкіл, (3-6С)циклоалкіл-(1-6С)алкіл, (1-6С)алкокси, (3-6С)циклоалкокси, (3-6С)циклоалкіл-(1-6С)алкокси, карбокси, (1-6С)алкоксикарбоніл, N-(1-6С)алкілкарбамоїл, N,N-ді-[(1-6С)алкіл]карбамоїл, (2-6С)алканоїл, аміно, (1-6С)алкіламіно, ді-[(1-6С)алкіл]аміно, галоген-(1-6С)алкіл, гідроксі-(1-6С)алкіл, (1-6С)алкоксі-(1-6С)алкіл, ціано-(1-6С)алкіл, аміно-(1-6С)алкіл, (1-6С)алкіламіно-(1-6С)алкіл, ді-[(1-6С)алкіл]аміно-(1-6С)алкіл, (1-6С)алкілтіо, (1-6С)алкілсульфініл, (1-6С)алкілсульфоніл, аміносульфоніл, N-(1-6С)алкілсульфамоїл, N,N-ді-[(1-6С)алкіл]сульфамоїл та (3-6С)циклоалкілсульфоніл;
та де будь-який із замісників на визначених вище Qa або Qb, котрий містить групу СН2, котра приєднана до 2 атомів карбону, або групу СН3, котра приєднана до атома карбону, може, як варіант, нести на кожній названій групі СН2 або СН3 один або більше замісників, вибраних із групи: гідрокси, ціано, аміно, (1-6С)алкіл, (1-6С)алкокси, (1-6С)алкіламіно та ді-[(1-6С)алкіл]аміно;
або її фармацевтично прийнятна сіль.
2. Сполука формули І за п. 1, де
Qa - феніл, піридил, піримідиніл, піразиніл або піридазиніл, та Qa може, як варіант, нести 1 або 2 замісники, вибрані із групи: галоген, (1-6С)алкіл та (1-6С)алкокси;
R1 та R2, кожний незалежно, вибрано із групи: гідроген, (1-6С)алкіл, (2-6С)алкеніл та (2-6С)алкініл; а
Qb - феніл, гетероарил або гетероцикліл, та Оb може, як варіант, нести 1 або 2 замісники, вибрані із групи: гідрокси, галоген, (1-6С)алкіл, (2-6С)алкеніл, (2-6С)алкініл, (3-6С)циклоалкіл, (3-6С)циклоалкіл-(1-6С)алкіл, (1-6С)алкокси, (3-6С)циклоалкокси, (3-6С)циклоалкіл-(1-6С)алкокси, карбокси, (1-6С)алкоксикарбоніл, N-(1-6С)алкілкарбамоїл, N,N-ді-[(1-6С)алкіл]карбамоїл, (2-6С)алканоїл, аміно, (1-6С)алкіламіно, ді-[(1-6С)алкіл]аміно, галоген-(1-6С)алкіл, гідроксі-(1-6С)алкіл, (1-6С)алкоксі-(1-6С)алкіл, ціано-(1-6С)алкіл, аміно-(1-6С)алкіл, (1-6С)алкіламіно-(1-6С)алкіл, ді-[(1-6С)алкіл]аміно-(1-6С)алкіл, (1-6С)алкілтіо, (1-6С)алкілсульфініл, (1-6С)алкілсульфоніл, аміносульфоніл, N-(1-6С)алкілсульфамоїл, N,N-ді-[(1-6С)алкіл]сульфамоїл та (3-6С)циклоалкілсульфоніл;
та де будь-який із замісників на визначених вище Qa або Qb, котрий містить групу СН2, котра приєднана до 2 атомів карбону, або групу СН3, котра приєднана до атома карбону, може, як варіант, нести на кожній названій групі СН2 або СН3 один або більше замісників, вибраних із групи: гідрокси, ціано, аміно, (1-6С)алкіл, (1-6С)алкокси, (1-6С)алкіламіно та ді-[(1-6С)алкіл]аміно;
або її фармацевтично прийнятна сіль.
3. Сполука формули І за п. 1 або п. 2, де
Qa - феніл, піридил, піримідиніл, піразиніл або піридазиніл, та Qa може, як варіант, нести 1 або 2 замісники, вибрані із групи: гідрокси, галоген, (1-6С)алкіл та (1-6С)алкокси; або її фармацевтично прийнятна сіль.
4. Сполука формули І за п. 1 або п. 2, де
Qb - феніл або гетероарил, та Qb може, як варіант, нести 1 або 2 замісники, вибрані із групи: гідрокси, галоген, (1-6С)алкіл, (2-6С)алкеніл, (2-6С)алкініл, (3-6С)циклоалкіл, (3-6С)циклоалкіл-(1-6С)алкіл, (1-6С)алкокси, (3-6С)циклоалкокси, (3-6С)циклоалкіл-(1-6С)алкокси, карбокси, (1-6С)алкоксикарбоніл, N-(1-6С)алкілкарбамоїл, N,N-ді-[(1-6С)алкіл]карбамоїл, (2-6С)алканоїл, аміно, (1-6С)алкіламіно, ді-[(1-6С)алкіл]аміно, галоген-(1-6С)алкіл, гідроксі-(1-6С)алкіл, (1-6С)алкоксі-(1-6С)алкіл, ціано-(1-6С)алкіл, аміно-(1-6С)алкіл, (1-6С)алкіламіно-(1-6С)алкіл, ді-[(1-6С)алкіл]аміно-(1-6С)алкіл, (1-6С)алкілтіо, (1-6С)алкілсульфініл, (1-6С)алкілсульфоніл, аміносульфоніл, N-(1-6С)алкілсульфамоїл, N,N-ді-[(1-6С)алкіл]сульфамоїл та (3-6С)циклоалкілсульфоніл;
та де будь-який із замісників на Qb, котрий містить групу СН2, котра приєднана до 2 атомів карбону, або групу СН3, котра приєднана до атома карбону, може, як варіант, нести на кожній названій групі СН2 або СН3 один або більше замісників, вибраних із групи: гідрокси, ціано, аміно, (1-6С)алкіл, (1-6С)алкокси, (1-6С)алкіламіно та ді-[(1-6С)алкіл]аміно;
або її фармацевтично прийнятна сіль.
5. Сполука формули І за п. 1 або п. 2, де
Qb - феніл, піридил, піримідиніл, піразиніл, піридазиніл, тіазоліл, тіадіазоліл, імідазоліл, ізоксазоліл, оксазоліл, фураніл, тієніл, бензімідазоліл, ізохінолініл, хінолініл, бензотіазоліл або піридо[1,2-а]імідазоліл, та Qb може, як варіант, нести 1 або 2 замісники, вибрані із групи: гідрокси, галоген, (1-6С)алкіл, (2-6С)алкеніл, (2-6С)алкініл, (3-6С)циклоалкіл, (3-6С)циклоалкіл-(1-6С)алкіл, (1-6С)алкокси, (3-6С)циклоалкокси, (3-6С)циклоалкіл-(1-6С)алкокси, карбокси, (1-6С)алкоксикарбоніл, N-(1-6С)алкілкарбамоїл, N,N-ді-[(1-6С)алкіл]карбамоїл, (2-6С)алканоїл, аміно, (1-6С)алкіламіно, ді-[(1-6С)алкіл]аміно, галоген-(1-6С)алкіл, гідроксі-(1-6С)алкіл, (1-6С)алкоксі-(1-6С)алкіл, ціано-(1-6С)алкіл, аміно-(1-6С)алкіл, (1-6С)алкіламіно-(1-6С)алкіл, ді-[(1-6С)алкіл]аміно-(1-6С)алкіл, (1-6С)алкілтіо, (1-6С)алкілсульфініл, (1-6С)алкілсульфоніл, аміносульфоніл, N-(1-6С)алкілсульфамоїл, N,N-ді-[(1-6С)алкіл]сульфамоїл та (3-6С)циклоалкілсульфоніл;
та де будь-який із замісників на Qb, котрий містить групу СН2, котра приєднана до 2 атомів карбону, або групу СН3, котра приєднана до атома карбону, може, як варіант, нести на кожній названій групі СН2 або СН3 один або більше замісників, вибраних із групи: гідрокси, ціано, аміно, (1-6С)алкіл, (1-6С)алкокси, (1-6С)алкіламіно та ді-[(1-6С)алкіл]аміно;
або її фармацевтично прийнятна сіль.
6. Сполука формули І за п. 1 або п. 2, де
R1 та R2 кожний незалежно вибрано із групи: гідроген, (1-6С)алкіл, (2-6С)алкеніл та (2-6С)алкініл;
або її фармацевтично прийнятна сіль.
7. Сполука формули І за п. 1 або п. 2, де кожний R1 та R2 незалежно вибрано із групи: гідроген та (1-6С)алкіл;
або її фармацевтично прийнятна сіль.
8, Сполука формули І за п. 1, де
Qa - феніл, піридил, піримідиніл, піразиніл або піридазиніл, та Qa може, як варіант, нести 1 або 2 замісники, вибрані із групи: галоген, (1-6С)алкіл та (1-6С)алкокси;
R1 та R2, кожний незалежно, вибрано із групи: гідроген та (1-6С)алкіл; а
Qb - феніл, піридил, піримідиніл, піразиніл, піридазиніл, тіазоліл, тіадіазоліл, імідазоліл, ізоксазоліл, оксазоліл, фураніл, тієніл, бензімідазоліл, ізохінолініл, хінолініл, бензотіазоліл або піридо[1,2-а]імідазоліл, та Qb може, як варіант, нести 1 або 2 замісники, вибрані із групи: гідрокси, галоген, (1-6С)алкіл, (2-6С)алкеніл, (2-6С)алкініл, (3-6С)циклоалкіл, (3-6С)циклоалкіл-(1-6С)алкіл, (1-6С)алкокси, (3-6С)циклоалкокси, (3-6С)циклоалкіл-(1-6С)алкокси, карбокси, (1-6С)алкоксикарбоніл, N-(1-6С)алкілкарбамоїл, N,N-ді-[(1-6С)алкіл]карбамоїл, (2-6С)алканоіл, аміно, (1-6С)алкіламіно, ді-[(1-6С)алкіл]аміно, галоген-(1-6С)алкіл, гідроксі-(1-6С)алкіл, (1-6С)алкоксі-(1-6С)алкіл, ціано-(1-6С)алкіл, аміно-(1-6С)алкіл, (1-6С)алкіламіно-(1-6С)алкіл, ді-[(1-6С)алкіл]аміно-(1-6С)алкіл, (1-6С)алкілтіо, (1-6С)алкілсульфініл, (1-6С)алкілсульфоніл, аміносульфоніл, N-(1-6С)алкілсульфамоїл, N,N-ді-[(1-6С)алкіл]сульфамоїл та (3-6С)циклоалкілсульфоніл;
та де будь-який із замісників на Qb, котрий містить групу СН2, котра приєднана до 2 атомів карбону, або групу СН3, котра приєднана до атома карбону, може, як варіант, нести на кожній названій групі СН2 або СН3 один або більше замісників, вибраних із групи: гідрокси, ціано, аміно, (1-6С)алкіл, (1-6С)алкокси, (1-6С)алкіламіно та ді-[(1-6С)алкіл]аміно;
або її фармацевтично прийнятна сіль.
9. Сполука формули І за п. 1 або п. 2, вибрана із групи:
3-{[4-(бензилокси)бензоїл]аміно}-N-циклопропіл-4-метилбензамід;
3-{[3-(бензилокси)бензоїл]аміно}-N-циклопропіл-4-метилбензамід;
4-(бензилокси)-N-{5-[(циклопропіламіно)карбоніл]-2-метилфеніл}-3-метилбензамід;
4-(бензилокси)-3-флуор-N-{5-[(циклопропіламіно)карбоніл]-2-метилфеніл}бензамід;
4-(бензилокси)-3-хлор-N-{5-[(циклопропіламіно)карбоніл]-2-метилфеніл}бензамід;
N-циклопропіл-4-метил-3-{[4-(піридин-2-ілметокси)бензоїл]аміно}бензамід;
N-циклопропіл-4-метил-3-{[4-(1,3-тіазол-4-ілметокси)бензоїл]аміно}бензамід;
N-циклопропіл-4-метил-3-{[4-(піридин-3-ілметокси)бензоїл]аміно}бензамід;
N-циклопропіл-4-метил-3-({4-[(5-метилізоксазол-3-іл)метокси]бензоїл}аміно)бензамід;
3-({4-[(5-хлор-1,2,3-тіадіазол-4-іл)метокси]бензоїл}аміно)-N-циклопропіл-4-метилбензамід;
N-циклопропіл-3-{[4-(імідазо[1,2-а]піридин-2-ілметокси)бензоїл]аміно}-4-метилбензамід;
N-циклопропіл-4-метил-3-({4-[(2-метил-1,3-тіазол-4-іл)метокси]бензоїл}аміно)бензамід;
N-циклопропіл-3-({4-[(3,5-диметилізоксазол-4-іл)метокси]бензоїл}аміно)-4-метилбензамід;
N-циклопропіл-4-метил-3-{[4-(1,2,5-тіадіазол-3-ілметокси)бензоїл]аміно}бензамід;
метил 5-({4-[({5-[(циклопропіламіно)карбоніл]-2-метилфеніл}аміно)карбоніл]фенокси}-метил)-2-фуроат;
3-({4-[(2-хлор-1,3-тіазол-5-іл)метокси]бензоїл}аміно)-N-циклопропіл-4-метилбензамід;
4-(бензилокси)-N-{5-[(циклопропіламіно)карбоніл]-2-метилфеніл}-3-метоксибензамід;
N-{5-[(циклопропіламіно)карбоніл]-2-метилфеніл}-3-метокси-4-(піридин-2-ілметокси)бензамід;
N-{5-[(циклопропіламіно)карбоніл]-2-метилфеніл}-3-метокси-4-(1,3-тіазол-4-ілметокси)бензамід;
N-циклопропіл-4-метил-3-{[3-метил-4-(піридин-2-ілметокси)бензоїл]аміно}бензамід;
N-циклопропіл-4-метил-3-{[3-метил-4-(1,3-тіазол-4-ілметокси)бензоїл]аміно}бензамід;
N-{5-[(циклопропіламіно)карбоніл]-2-метилфеніл}-3-флуор-4-(піридин-2-ілметокси)бензамід;
N-{5-[(циклопропіламіно)карбоніл]-2-метилфеніл}-3-флуор-4-[(2-метил-1,3-тіазол-4-іл)метокси]бензамід;
N-{5-[(циклопропіламіно)карбоніл]-2-метилфеніл}-4-[(3,5-диметилізоксазол-4-іл)метокси]-3-флуорбензамід;
N-{5-[(циклопропіламіно)карбоніл]-2-метилфеніл}-3-флуор-4-(1,2,5-тіадіазол-3-ілметокси)бензамід;
N-циклопропіл-4-метил-3-{[3-(1,3-тіазол-4-ілметокси)бензоїл]аміно}бензамід;
N-циклопропіл-4-метил-3-({3-[(2-метил-1,3-тіазол-4-іл)метокси]бензоїл}аміно)бензамід;
N-циклопропіл-4-метил-3-{[3-(пiридин-2-ілметокси)бензоїл]аміно}бензамід;
N-{5-[(циклопропіламіно)карбоніл]-2-метилфеніл}-3-флуор-4-(1,3-тіазол-4-ілметокси)бензамід;
N-циклопропіл-4-метил-3-({3-метил-4-[(2-метил-1,3-тіазол-4-іл)метокси]бензоїл}аміно)бензамід;
N-{5-[(циклопропіламіно)карбоніл]-2-метилфеніл}-4-[(3,5-диметилізоксазол-4-іл)метокси]-3-метилбензамід;
N-циклопропіл-4-метил-3-{[3-метил-4-(1,2,5-тіадіазол-3-ілметокси)бензоїл]аміно}бензамід;
метил 5-({4-[({5-[(циклопропіламіно)карбоніл]-2-метилфеніл}аміно)карбоніл]-2-метилфенокси}метил)-2-фуроат;
3-хлор-N-{5-[(циклопропіламіно)карбоніл]-2-метилфеніл}-4-(піридин-2-ілметокси)бензамід;
3-хлор-N-{5-[(циклопропіламіно)карбоніл]-2-метилфеніл}-4-(1,3-тіазол-4-ілметокси)бензамід;
N-циклопропіл-3-({3-[(3,5-диметилізоксазол-4-іл)метокси]бензоїл}аміно)-4-метилбензамід;
N-циклoпpoпiл-4-мeтил-3-{[3-(1,2,5-тiaдiaзoл-3-iлмeтoкcи)бeнзoїл]aмiнo}бeнзaмiд;
3-({3-[(2-хлор-1,3-тіазол-5-іл)метокси]бензоїл}аміно)-N-циклопропіл-4-метилбензамід;
N-{5-[(циклопропіламіно)карбоніл]-2-метилфеніл}-3-флуор-4-(імідазо[1,2-а]піридин-2-ілметокси)бензамід;
N-циклопропіл-3-({4-[(4-метоксипіридин-2-іл)метокси]бензоїл}аміно)-4-метилбензамід;
N-циклопропіл-4-метил-3-{[4-(1-піридин-2-ілетокси)бензоїл]аміно}бензамід;
N-циклопропіл-3-({3-[(4-метоксипіридин-2-іл)метокси]бензоїл}аміно)-4-метилбензамід;
N-циклoпpoпiл-3-[(4-{[5-(гiдpoкcимeтил)пipидин-2-iл]мeтoкcи}бeнзoїл)aмiнo]-4-метилбензамід;
N-циклопропіл-3-[(4-{[5-(1-гідрокси-1-метилетил)піридин-2-іл]метокси}бензоїл)аміно]-4-метилбензамід;
N-циклопропіл-3-{[4-({5-[(ізопропіламіно)метил]піридин-2-іл}метокси)бензоїл]аміно}-4-метилбензамід;
N-циклопропіл-3-{[4-({5-[(диметиламіно)метил]піридин-2-іл}метокси)бензоїл]аміно}-4-метилбензамід;
метил 6-({4-[({5-[(циклопропіламіно)карбоніл]-2-метилфеніл}аміно)карбоніл]фенокси}-метил)нікотинат;
N-циклопропіл-3-{[4-({5-[2-(диметиламіно)етокси]піридин-2-іл}метокси)бензоїл]аміно}-4-метилбензамід;
N-циклопропіл-3-[(4-{[5-(1,3-діоксолан-2-ілметокси)піридин-2-іл]метокси}бензоїл)аміно]-4-метилбензамід;
N-циклопропіл-3-({4-[(5-гідроксипіридин-2-іл)метокси]бензоїл}аміно)-4-метилбензамід;
метил 6-({4-[({5-[(циклопропіламіно)карбоніл]-2-метилфеніл}аміно)карбоніл]-фенокси}метил)піридин-2-карбоксилат;
N-циклопропіл-3-[(4-{[6-(гідроксиметил)піридин-2-іл]метокси}бензоїл)аміно]-4-метилбензамід;
N-циклопропіл-3-[(4-{[6-(1-гідрокси-1-метилетил)піридин-2-іл]метокси}бензоїл)аміно]-4-метилбензамід;
N-циклопропіл-3-({4-[(6-{[2-(діетиламіно)етокси]метил}піридин-2-іл)метокси]бензоїл}аміно)-4-метилбензамід;
N-циклопропіл-3-({4-[(6-{[2-(диметиламіно)етокси]метил}піридин-2-іл)метокси]бензоїл}аміно)-4-метилбензамід;
N-циклопропіл-4-метил-3-({4-[(1-оксидопіридин-2-іл)метокси]бензоїл}аміно)бензамід;
N-{5-[(циклoпpoпiлaмiнo)кapбoнiл]-2-мeтилфeнiл}-2-(iмiдaзo[1,2-a]пipидин-2-ілметокси)піримідин-5-карбоксамід;
N-{5-[(циклопропіламіно)карбоніл]-2-метилфеніл}-2-(1,3-тіазол-2-ілметокси)піримідин-5-карбоксамід;
N-{5-[(циклопропіламіно)карбоніл]-2-метилфеніл}-2-(піримідин-2-ілметокси)піримідин-5-карбоксамід;
N-{5-[(циклопропіламіно)карбоніл]-2-метилфеніл}-2-[(1-метил-1Н-імідазол-2-іл)метокси]піримідин-5-карбоксамід;
N-{5-[(циклопропіламіно)карбоніл]-2-метилфеніл}-2-[(1,5-диметил-1Н-піразол-3-іл)метокси]піримідин-5-карбоксамід;
N-{5-[(циклопропіламіно)карбоніл]-2-метилфеніл}-2-[(1,3-диметил-1Н-піразол-5-іл)метокси]піримідин-5-карбоксамід;
N-{5-[(циклопропіламіно)карбоніл]-2-метилфеніл}-2-[(3-метилпіридин-2-іл)метокси]піримідин-5-карбоксамід;
N-{5-[(циклопропіламіно)карбоніл]-2-метилфеніл}-2-[(1-метил-1Н-бензімідазол-2-іл)метокси]піримідин-5-карбоксамід;
N-{5-[(циклопропіламіно)карбоніл]-2-метилфеніл}-2-(ізоксихінолін-1-ілметокси)піримідин-5-карбоксамід;
N-{5-[(циклопропіламіно)карбоніл]-2-метилфеніл}-2-(хінолін-2-ілметокси)піримідин-5-карбоксамід;
2-(1,3-бензотіазол-2-ілметокси)-N-{5-[(циклопропіламіно)карбоніл]-2-метилфеніл}піримідин-5-карбоксамід;
N-{5-[(циклопропіламіно)карбоніл]-2-метилфеніл}-2-(1-піридин-2-ілетокси)піримідин-5-карбоксамід;
N-{5-[(циклопропіламіно)карбоніл]-2-метилфеніл}-2-(1,3-тіазол-4-ілметокси)піримідин-5-карбоксамід;
N-{5-[(циклoпpoпiлaмiнo)кapбoнiл]-2-мeтилфeнiл}-2-(пipидин-2-ілметокси)піримідин-5-карбоксамід;
N-циклопропіл-3-({4-[(5-циклопропіл-1,3,4-тіадіазол-2-іл)метокси]бензоїл}аміно)-4-метилбензамід;
N-{5-[(циклопропіламіно)карбоніл]-2-метилфеніл}-6-(піридин-2-ілметокси)нікотинамід;
N-{5-[(циклопропіламіно)карбоніл]-2-метилфеніл}-5-(піридин-2-ілметокси)піразин-2-карбоксамід;
3-({4-[(6-бромпіридин-2-іл)метокси]бензоїл}аміно)-N-циклопропіл-4-метилбензамід;
N-{5-[(циклопропіламіно)карбоніл]-2-метилфеніл}-3,5-дифлуор-4-(піридин-2-ілметокси)бензамід;
N-циклопропіл-4-метил-3-({4-[(6-метилпіридин-2-іл)метокси]бензоїл}аміно)бензамід;
N-циклопропіл-4-метил-3-({4-[(3-метилпіридин-2-іл)метокси]бензоїл}аміно)бензамід;
N-циклопропіл-4-метил-3-{[4-(піримідин-2-ілметокси)бензоїл]аміно}бензамід;
N-циклопропіл-4-метил-3-{[4-(піридазин-3-ілметокси)бензоїл]аміно}бензамід;
N-циклопропіл-3-{[4-({6-[(2-метоксіетил)аміно]піридин-2-іл}метокси)бензоїл]аміно}-4-метилбензамід;
N-циклопропіл-3-({4-[(6-{[2-(диметиламіно)етил]аміно}піридин-2-іл)метокси]бензоїл}аміно)-4-метилбензамід;
5-(бензилокси)-N-{5-[(циклопропіламіно)карбоніл]-2-метилфеніл}піридин-2-карбоксамід;
N-{5-[(циклопропіламіно)карбоніл]-2-метилфеніл}-5-(піридин-2-ілметокси)піридин-2-карбоксамід та
N-циклопропіл-4-метил-3-[(4-{[4-(метилсульфоніл)бензил]окси}бензоїл)аміно]бензамід;
або її фармацевтично прийнятна сіль.
10. Спосіб отримання сполуки формули І або її фармацевтично прийнятної солі, в якому здійснюють:
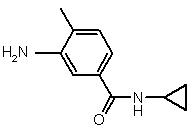
(а) реакцію бензойної кислоти формули II або її активованої похідної
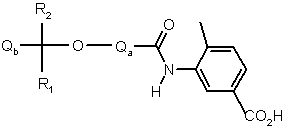 II
II
з аміном формули III
![]() III
III
у звичайних умовах утворення амідного зв’язку, де Qa, Qb, R1 та R2 визначено у п. 1 або п. 2, та де будь-яка функціональна група, як варіант, є захищеною, та:
(і) видалення будь-якої захисної групи; та
(іі) як варіант, утворення фармацевтично прийнятної солі;
(b) реакцію кислоти формули IV або її активованої похідної
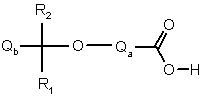 IV
IV
з аніліном формули VI
 VI
VI
у звичайних умовах утворення амідного зв’язку, де Qa, Qb, R1 та R2 визначено у п. 1 або п. 2, та де будь-яка функціональна група є, як варіант, захищеною, та:
(і) видалення будь-якої захисної групи;
(іі) як варіант, утворення фармацевтично прийнятної солі;
(с) для отримання сполуки формули І, де замісник на Qa або Qb є (1-6С)алкоксигрупою або заміщеною (1-6С)алкоксигрупою, (1-6С)алкіламіногрупою, ді-[(1-6С)алкіл]аміногрупою або заміщеною (1-6С)алкіламіногрупою, здійснюють алкілування амідного похідного формули І, де замісник на Qa або Qb є гідроксигрупою або аміногрупою.
11. Фармацевтична композиція для застосування у лікуванні опосередкованих цитокінами хвороб, котра містить сполуку формули І за будь-яким із пунктів 1-9 або її фармацевтично прийнятну сіль, у поєднанні з фармацевтично прийнятним розріджувачем або носієм.
12. Сполука формули І за будь-яким із пунктів 1-9 або її фармацевтично прийнятна сіль для застосування у способі терапевтичного лікування людини або тварини.
13. Сполука формули І за будь-яким із пунктів 1-9 або її фармацевтично прийнятна сіль для застосування у виробництві медикаменту.
14. Сполука формули І за будь-яким із пунктів 1-9 або її фармацевтично прийнятна сіль у виробництві медикаменту для застосування у лікуванні терапевтичних станів, опосередкованих цитокінами.
15. Застосування сполуки формули І за будь-яким із пунктів 1-9 або її фармацевтично прийнятної солі у виробництві медикаменту для застосування у лікуванні ревматоїдного артриту, астми, хронічної обструктивної хвороби легень, запальної хвороби кишечнику, розсіяного склерозу, СНІД, септичного шоку, застійної серцевої недостатності, ішемічної хвороби серця або псоріазу.
Текст
1. Сполука формули І R2 O 6 Qb O Qa N R1 H 2 N H O ,І де Qa - феніл або гетероарил, та Qa може, як варіант, нести 1 або 2 замісники, вибрані із групи: гідрокси, галоген, трифлуорметил, ціано, аміно, (1-6С)алкіл, (2-6С)алкеніл, (2-6С)алкініл, (1-6С)алкокси, (16С)алкіламіно, ді-[(1-6С)алкіл]аміно та (16С)алкоксикарбоніл; R1 та R2 кожний незалежно вибрано із групи: гідроген, (1-6С)алкіл, (2-6С)алкеніл та (2-6С)алкініл; а Qb - феніл, гетероарил або гетероцикліл, та Qb може, як варіант, нести 1 або 2 замісники, вибрані із групи: гідрокси, галоген, (1-6С)алкіл, (26С)алкеніл, (2-6С)алкініл, (3-6С)циклоалкіл, (36С)циклоалкіл-(1-6С)алкіл, (1-6С)алкокси, (36С)циклоалкокси, (3-6С)циклоалкіл-(1-6С)алкокси, 2 (19) 1 3 88777 4 6С)алкіл, (1-6С)алкоксі-(1-6С)алкіл, ціано-(16С)алкіламіно-(1-6С)алкіл, ді-[(1-6С)алкіл]аміно-(16С)алкіл, аміно-(1-6С)алкіл, (1-6С)алкіламіно-(16С)алкіл, (1-6С)алкілтіо, (1-6С)алкілсульфініл, (16С)алкіл, ді-[(1-6С)алкіл]аміно-(1-6С)алкіл, (16С)алкілсульфоніл, аміносульфоніл, N-(16С)алкілтіо, (1-6С)алкілсульфініл, (16С)алкілсульфамоїл, N,N-ді-[(16С)алкілсульфоніл, аміносульфоніл, N-(16С)алкіл]сульфамоїл та (36С)алкілсульфамоїл, N,N-ді-[(16С)циклоалкілсульфоніл; 6С)алкіл]сульфамоїл та (3та де будь-який із замісників на Qb, котрий містить 6С)циклоалкілсульфоніл; групу СН2, котра приєднана до 2 атомів карбону, та де будь-який із замісників на визначених вище або групу СН3, котра приєднана до атома карбону, Qa або Qb, котрий містить групу СН2, котра приєдможе, як варіант, нести на кожній названій групі нана до 2 атомів карбону, або групу СН3, котра СН2 або СН3 один або більше замісників, вибраних приєднана до атома карбону, може, як варіант, із групи: гідрокси, ціано, аміно, (1-6С)алкіл, (1нести на кожній названій групі СН2 або СН3 один 6С)алкокси, (1-6С)алкіламіно та ді-[(1або більше замісників, вибраних із групи: гідрокси, 6С)алкіл]аміно; ціано, аміно, (1-6С)алкіл, (1-6С)алкокси, (1або її фармацевтично прийнятна сіль. 6С)алкіламіно та ді-[(1-6С)алкіл]аміно; 6. Сполука формули І за п. 1 або п. 2, де або її фармацевтично прийнятна сіль. R1 та R2 кожний незалежно вибрано із групи: гідро3. Сполука формули І за п. 1 або п. 2, де ген, (1-6С)алкіл, (2-6С)алкеніл та (2-6С)алкініл; Qa - феніл, піридил, піримідиніл, піразиніл або піабо її фармацевтично прийнятна сіль. ридазиніл, та Qa може, як варіант, нести 1 або 2 7. Сполука формули І за п. 1 або п. 2, де кожний R1 та R2 незалежно вибрано із групи: гідроген та (1замісники, вибрані із групи: гідрокси, галоген, (16С)алкіл; 6С)алкіл та (1-6С)алкокси; або її фармацевтично або її фармацевтично прийнятна сіль. прийнятна сіль. 8. Сполука формули І за п. 1, де 4. Сполука формули І за п. 1 або п. 2, де Qa - феніл, піридил, піримідиніл, піразиніл або піQb - феніл або гетероарил, та Qb може, як варіант, ридазиніл, та Qa може, як варіант, нести 1 або 2 нести 1 або 2 замісники, вибрані із групи: гідрокси, замісники, вибрані із групи: галоген, (1-6С)алкіл та галоген, (1-6С)алкіл, (2-6С)алкеніл, (2-6С)алкініл, (1-6С)алкокси; (3-6С)циклоалкіл, (3-6С)циклоалкіл-(1-6С)алкіл, (1R1 та R2, кожний незалежно, вибрано із групи: гід6С)алкокси, (3-6С)циклоалкокси, (3-6С)циклоалкілроген та (1-6С)алкіл; а (1-6С)алкокси, карбокси, (1-6С)алкоксикарбоніл, N(1-6С)алкілкарбамоїл, N,N-ді-[(1Qb - феніл, піридил, піримідиніл, піразиніл, пірида6С)алкіл]карбамоїл, (2-6С)алканоїл, аміно, (1зиніл, тіазоліл, тіадіазоліл, імідазоліл, ізоксазоліл, 6С)алкіламіно, ді-[(1-6С)алкіл]аміно, галоген-(1оксазоліл, фураніл, тієніл, бензімідазоліл, ізохіно6С)алкіл, гідроксі-(1-6С)алкіл, (1-6С)алкоксі-(1лініл, хінолініл, бензотіазоліл або піридо[1,26С)алкіл, ціано-(1-6С)алкіл, аміно-(1-6С)алкіл, (1а]імідазоліл, та Qb може, як варіант, нести 1 або 2 6С)алкіламіно-(1-6С)алкіл, ді-[(1-6С)алкіл]аміно-(1замісники, вибрані із групи: гідрокси, галоген, (16С)алкіл, (1-6С)алкілтіо, (1-6С)алкілсульфініл, (16С)алкіл, (2-6С)алкеніл, (2-6С)алкініл, (36С)алкілсульфоніл, аміносульфоніл, N-(16С)циклоалкіл, (3-6С)циклоалкіл-(1-6С)алкіл, (16С)алкілсульфамоїл, N,N-ді-[(16С)алкокси, (3-6С)циклоалкокси, (3-6С)циклоалкіл6С)алкіл]сульфамоїл та (3(1-6С)алкокси, карбокси, (1-6С)алкоксикарбоніл, N6С)циклоалкілсульфоніл; (1-6С)алкілкарбамоїл, N,N-ді-[(1та де будь-який із замісників на Qb, котрий містить 6С)алкіл]карбамоїл, (2-6С)алканоіл, аміно, (1групу СН2, котра приєднана до 2 атомів карбону, 6С)алкіламіно, ді-[(1-6С)алкіл]аміно, галоген-(1або групу СН3, котра приєднана до атома карбону, 6С)алкіл, гідроксі-(1-6С)алкіл, (1-6С)алкоксі-(1може, як варіант, нести на кожній названій групі 6С)алкіл, ціано-(1-6С)алкіл, аміно-(1-6С)алкіл, (1СН2 або СН3 один або більше замісників, вибраних 6С)алкіламіно-(1-6С)алкіл, ді-[(1-6С)алкіл]аміно-(1із групи: гідрокси, ціано, аміно, (1-6С)алкіл, (16С)алкіл, (1-6С)алкілтіо, (1-6С)алкілсульфініл, (16С)алкокси, (1-6С)алкіламіно та ді-[(16С)алкілсульфоніл, аміносульфоніл, N-(16С)алкіл]аміно; 6С)алкілсульфамоїл, N,N-ді-[(1або її фармацевтично прийнятна сіль. 6С)алкіл]сульфамоїл та (35. Сполука формули І за п. 1 або п. 2, де 6С)циклоалкілсульфоніл; Qb - феніл, піридил, піримідиніл, піразиніл, піридата де будь-який із замісників на Qb, котрий містить зиніл, тіазоліл, тіадіазоліл, імідазоліл, ізоксазоліл, групу СН2, котра приєднана до 2 атомів карбону, оксазоліл, фураніл, тієніл, бензімідазоліл, ізохіноабо групу СН3, котра приєднана до атома карбону, лініл, хінолініл, бензотіазоліл або піридо[1,2може, як варіант, нести на кожній названій групі а]імідазоліл, та Qb може, як варіант, нести 1 або 2 СН2 або СН3 один або більше замісників, вибраних замісники, вибрані із групи: гідрокси, галоген, (1із групи: гідрокси, ціано, аміно, (1-6С)алкіл, (16С)алкіл, (2-6С)алкеніл, (2-6С)алкініл, (36С)алкокси, (1-6С)алкіламіно та ді-[(16С)циклоалкіл, (3-6С)циклоалкіл-(1-6С)алкіл, (16С)алкіл]аміно; 6С)алкокси, (3-6С)циклоалкокси, (3-6С)циклоалкілабо її фармацевтично прийнятна сіль. (1-6С)алкокси, карбокси, (1-6С)алкоксикарбоніл, N9. Сполука формули І за п. 1 або п. 2, вибрана із групи: (1-6С)алкілкарбамоїл, N,N-ді-[(13-{[4-(бензилокси)бензоїл]аміно}-N-циклопропіл-46С)алкіл]карбамоїл, (2-6С)алканоїл, аміно, (16С)алкіламіно, ді-[(1-6С)алкіл]аміно, галоген-(1метилбензамід; 6С)алкіл, гідроксі-(1-6С)алкіл, (1-6С)алкоксі-(13-{[3-(бензилокси)бензоїл]аміно}-N-циклопропіл-46С)алкіл, ціано-(1-6С)алкіл, аміно-(1-6С)алкіл, (1метилбензамід; 5 88777 6 4-(бензилокси)-N-{5-[(циклопропіламіно)карбоніл]N-циклопропіл-4-метил-3-{[3-метил-4-(1,2,52-метилфеніл}-3-метилбензамід; тіадіазол-3-ілметокси)бензоїл]аміно}бензамід; 4-(бензилокси)-3-флуор-N-{5метил 5-({4-[({5-[(циклопропіламіно)карбоніл]-2[(циклопропіламіно)карбоніл]-2метилфеніл}аміно)карбоніл]-2метилфеніл}бензамід; метилфенокси}метил)-2-фуроат; 4-(бензилокси)-3-хлор-N-{53-хлор-N-{5-[(циклопропіламіно)карбоніл]-2[(циклопропіламіно)карбоніл]-2метилфеніл}-4-(піридин-2-ілметокси)бензамід; метилфеніл}бензамід; 3-хлор-N-{5-[(циклопропіламіно)карбоніл]-2N-циклопропіл-4-метил-3-{[4-(піридин-2метилфеніл}-4-(1,3-тіазол-4-ілметокси)бензамід; ілметокси)бензоїл]аміно}бензамід; N-циклопропіл-3-({3-[(3,5-диметилізоксазол-4N-циклопропіл-4-метил-3-{[4-(1,3-тіазол-4іл)метокси]бензоїл}аміно)-4-метилбензамід; ілметокси)бензоїл]аміно}бензамід; N-циклoпpoпiл-4-мeтил-3-{[3-(1,2,5-тiaдiaзoл-3N-циклопропіл-4-метил-3-{[4-(піридин-3iлмeтoкcи)бeнзoїл]aмiнo}бeнзaмiд; ілметокси)бензоїл]аміно}бензамід; 3-({3-[(2-хлор-1,3-тіазол-5N-циклопропіл-4-метил-3-({4-[(5-метилізоксазол-3іл)метокси]бензоїл}аміно)-N-циклопропіл-4іл)метокси]бензоїл}аміно)бензамід; метилбензамід; 3-({4-[(5-хлор-1,2,3-тіадіазол-4N-{5-[(циклопропіламіно)карбоніл]-2-метилфеніл}іл)метокси]бензоїл}аміно)-N-циклопропіл-43-флуор-4-(імідазо[1,2-а]піридин-2метилбензамід; ілметокси)бензамід; N-циклопропіл-3-{[4-(імідазо[1,2-а]піридин-2N-циклопропіл-3-({4-[(4-метоксипіридин-2ілметокси)бензоїл]аміно}-4-метилбензамід; іл)метокси]бензоїл}аміно)-4-метилбензамід; N-циклопропіл-4-метил-3-({4-[(2-метил-1,3-тіазолN-циклопропіл-4-метил-3-{[4-(1-піридин-24-іл)метокси]бензоїл}аміно)бензамід; ілетокси)бензоїл]аміно}бензамід; N-циклопропіл-3-({4-[(3,5-диметилізоксазол-4N-циклопропіл-3-({3-[(4-метоксипіридин-2іл)метокси]бензоїл}аміно)-4-метилбензамід; іл)метокси]бензоїл}аміно)-4-метилбензамід; N-циклопропіл-4-метил-3-{[4-(1,2,5-тіадіазол-3N-циклoпpoпiл-3-[(4-{[5-(гiдpoкcимeтил)пipидин-2ілметокси)бензоїл]аміно}бензамід; iл]мeтoкcи}бeнзoїл)aмiнo]-4-метилбензамід; метил 5-({4-[({5-[(циклопропіламіно)карбоніл]-2N-циклопропіл-3-[(4-{[5-(1-гідрокси-1метилфеніл}аміно)карбоніл]фенокси}-метил)-2метилетил)піридин-2-іл]метокси}бензоїл)аміно]-4фуроат; метилбензамід; 3-({4-[(2-хлор-1,3-тіазол-5N-циклопропіл-3-{[4-({5іл)метокси]бензоїл}аміно)-N-циклопропіл-4[(ізопропіламіно)метил]піридин-2метилбензамід; іл}метокси)бензоїл]аміно}-4-метилбензамід; 4-(бензилокси)-N-{5-[(циклопропіламіно)карбоніл]N-циклопропіл-3-{[4-({52-метилфеніл}-3-метоксибензамід; [(диметиламіно)метил]піридин-2N-{5-[(циклопропіламіно)карбоніл]-2-метилфеніл}іл}метокси)бензоїл]аміно}-4-метилбензамід; 3-метокси-4-(піридин-2-ілметокси)бензамід; метил 6-({4-[({5-[(циклопропіламіно)карбоніл]-2N-{5-[(циклопропіламіно)карбоніл]-2-метилфеніл}метилфеніл}аміно)карбоніл]фенокси}3-метокси-4-(1,3-тіазол-4-ілметокси)бензамід; метил)нікотинат; N-циклопропіл-4-метил-3-{[3-метил-4-(піридин-2N-циклопропіл-3-{[4-({5-[2ілметокси)бензоїл]аміно}бензамід; (диметиламіно)етокси]піридин-2N-циклопропіл-4-метил-3-{[3-метил-4-(1,3-тіазол-4іл}метокси)бензоїл]аміно}-4-метилбензамід; ілметокси)бензоїл]аміно}бензамід; N-циклопропіл-3-[(4-{[5-(1,3-діоксолан-2N-{5-[(циклопропіламіно)карбоніл]-2-метилфеніл}ілметокси)піридин-2-іл]метокси}бензоїл)аміно]-43-флуор-4-(піридин-2-ілметокси)бензамід; метилбензамід; N-{5-[(циклопропіламіно)карбоніл]-2-метилфеніл}N-циклопропіл-3-({4-[(5-гідроксипіридин-23-флуор-4-[(2-метил-1,3-тіазол-4іл)метокси]бензоїл}аміно)-4-метилбензамід; іл)метокси]бензамід; метил 6-({4-[({5-[(циклопропіламіно)карбоніл]-2N-{5-[(циклопропіламіно)карбоніл]-2-метилфеніл}метилфеніл}аміно)карбоніл]4-[(3,5-диметилізоксазол-4-іл)метокси]-3фенокси}метил)піридин-2-карбоксилат; флуорбензамід; N-циклопропіл-3-[(4-{[6-(гідроксиметил)піридин-2N-{5-[(циклопропіламіно)карбоніл]-2-метилфеніл}іл]метокси}бензоїл)аміно]-4-метилбензамід; 3-флуор-4-(1,2,5-тіадіазол-3-ілметокси)бензамід; N-циклопропіл-3-[(4-{[6-(1-гідрокси-1N-циклопропіл-4-метил-3-{[3-(1,3-тіазол-4метилетил)піридин-2-іл]метокси}бензоїл)аміно]-4ілметокси)бензоїл]аміно}бензамід; метилбензамід; N-циклопропіл-4-метил-3-({3-[(2-метил-1,3-тіазолN-циклопропіл-3-({4-[(6-{[24-іл)метокси]бензоїл}аміно)бензамід; (діетиламіно)етокси]метил}піридин-2N-циклопропіл-4-метил-3-{[3-(пiридин-2іл)метокси]бензоїл}аміно)-4-метилбензамід; ілметокси)бензоїл]аміно}бензамід; N-циклопропіл-3-({4-[(6-{[2N-{5-[(циклопропіламіно)карбоніл]-2-метилфеніл}(диметиламіно)етокси]метил}піридин-23-флуор-4-(1,3-тіазол-4-ілметокси)бензамід; іл)метокси]бензоїл}аміно)-4-метилбензамід; N-циклопропіл-4-метил-3-({3-метил-4-[(2-метилN-циклопропіл-4-метил-3-({4-[(1-оксидопіридин-21,3-тіазол-4-іл)метокси]бензоїл}аміно)бензамід; іл)метокси]бензоїл}аміно)бензамід; N-{5-[(циклопропіламіно)карбоніл]-2-метилфеніл}N-{5-[(циклoпpoпiлaмiнo)кapбoнiл]-2-мeтилфeнiл}4-[(3,5-диметилізоксазол-4-іл)метокси]-32-(iмiдaзo[1,2-a]пipидин-2-ілметокси)піримідин-5метилбензамід; карбоксамід; 7 88777 8 N-{5-[(циклопропіламіно)карбоніл]-2-метилфеніл}10. Спосіб отримання сполуки формули І або її 2-(1,3-тіазол-2-ілметокси)піримідин-5-карбоксамід; фармацевтично прийнятної солі, в якому здійснюN-{5-[(циклопропіламіно)карбоніл]-2-метилфеніл}ють: 2-(піримідин-2-ілметокси)піримідин-5-карбоксамід; (а) реакцію бензойної кислоти формули II або її N-{5-[(циклопропіламіно)карбоніл]-2-метилфеніл}активованої похідної 2-[(1-метил-1Н-імідазол-2-іл)метокси]піримідин-5R2 O карбоксамід; N-{5-[(циклопропіламіно)карбоніл]-2-метилфеніл}Qb O Qa 2-[(1,5-диметил-1Н-піразол-3-іл)метокси]піримідинN 5-карбоксамід; R1 H N-{5-[(циклопропіламіно)карбоніл]-2-метилфеніл}2-[(1,3-диметил-1Н-піразол-5-іл)метокси]піримідинCO2H II 5-карбоксамід; з аміном формули III N-{5-[(циклопропіламіно)карбоніл]-2-метилфеніл}2-[(3-метилпіридин-2-іл)метокси]піримідин-5H2N карбоксамід; III N-{5-[(циклопропіламіно)карбоніл]-2-метилфеніл}у звичайних умовах утворення амідного зв’язку, де 2-[(1-метил-1Н-бензімідазол-2Qa, Qb, R1 та R2 визначено у п. 1 або п. 2, та де іл)метокси]піримідин-5-карбоксамід; будь-яка функціональна група, як варіант, є захиN-{5-[(циклопропіламіно)карбоніл]-2-метилфеніл}щеною, та: 2-(ізоксихінолін-1-ілметокси)піримідин-5(і) видалення будь-якої захисної групи; та карбоксамід; (іі) як варіант, утворення фармацевтично прийнятN-{5-[(циклопропіламіно)карбоніл]-2-метилфеніл}ної солі; 2-(хінолін-2-ілметокси)піримідин-5-карбоксамід; (b) реакцію кислоти формули IV або її активованої 2-(1,3-бензотіазол-2-ілметокси)-N-{5похідної [(циклопропіламіно)карбоніл]-2R2 метилфеніл}піримідин-5-карбоксамід; O N-{5-[(циклопропіламіно)карбоніл]-2-метилфеніл}Qb O Qa 2-(1-піридин-2-ілетокси)піримідин-5-карбоксамід; O H N-{5-[(циклопропіламіно)карбоніл]-2-метилфеніл}R1 2-(1,3-тіазол-4-ілметокси)піримідин-5-карбоксамід; IV N-{5-[(циклoпpoпiлaмiнo)кapбoнiл]-2-мeтилфeнiл}з аніліном формули VI 2-(пipидин-2-ілметокси)піримідин-5-карбоксамід; N-циклопропіл-3-({4-[(5-циклопропіл-1,3,4тіадіазол-2-іл)метокси]бензоїл}аміно)-4H2N метилбензамід; N-{5-[(циклопропіламіно)карбоніл]-2-метилфеніл}6-(піридин-2-ілметокси)нікотинамід; N N-{5-[(циклопропіламіно)карбоніл]-2-метилфеніл}H O 5-(піридин-2-ілметокси)піразин-2-карбоксамід; VI 3-({4-[(6-бромпіридин-2-іл)метокси]бензоїл}аміно)у звичайних умовах утворення амідного зв’язку, де N-циклопропіл-4-метилбензамід; Qa, Qb, R1 та R2 визначено у п. 1 або п. 2, та де N-{5-[(циклопропіламіно)карбоніл]-2-метилфеніл}будь-яка функціональна група є, як варіант, захи3,5-дифлуор-4-(піридин-2-ілметокси)бензамід; щеною, та: N-циклопропіл-4-метил-3-({4-[(6-метилпіридин-2(і) видалення будь-якої захисної групи; іл)метокси]бензоїл}аміно)бензамід; (іі) як варіант, утворення фармацевтично прийнятN-циклопропіл-4-метил-3-({4-[(3-метилпіридин-2ної солі; іл)метокси]бензоїл}аміно)бензамід; (с) для отримання сполуки формули І, де замісник N-циклопропіл-4-метил-3-{[4-(піримідин-2на Qa або Qb є (1-6С)алкоксигрупою або заміщеілметокси)бензоїл]аміно}бензамід; ною (1-6С)алкоксигрупою, (1-6С)алкіламіногрупою, N-циклопропіл-4-метил-3-{[4-(піридазин-3ді-[(1-6С)алкіл]аміногрупою або заміщеною (1ілметокси)бензоїл]аміно}бензамід; 6С)алкіламіногрупою, здійснюють алкілування N-циклопропіл-3-{[4-({6-[(2амідного похідного формули І, де замісник на Qa метоксіетил)аміно]піридин-2або Qb є гідроксигрупою або аміногрупою. іл}метокси)бензоїл]аміно}-4-метилбензамід; 11. Фармацевтична композиція для застосування у N-циклопропіл-3-({4-[(6-{[2лікуванні опосередкованих цитокінами хвороб, (диметиламіно)етил]аміно}піридин-2котра містить сполуку формули І за будь-яким із іл)метокси]бензоїл}аміно)-4-метилбензамід; пунктів 1-9 або її фармацевтично прийнятну сіль, у 5-(бензилокси)-N-{5-[(циклопропіламіно)карбоніл]поєднанні з фармацевтично прийнятним розріджу2-метилфеніл}піридин-2-карбоксамід; вачем або носієм. N-{5-[(циклопропіламіно)карбоніл]-2-метилфеніл}12. Сполука формули І за будь-яким із пунктів 1-9 5-(піридин-2-ілметокси)піридин-2-карбоксамід та або її фармацевтично прийнятна сіль для застосуN-циклопропіл-4-метил-3-[(4-{[4вання у способі терапевтичного лікування людини (метилсульфоабо тварини. ніл)бензил]окси}бензоїл)аміно]бензамід; або її фармацевтично прийнятна сіль. 9 88777 10 13. Сполука формули І за будь-яким із пунктів 1-9 15. Застосування сполуки формули І за будь-яким або її фармацевтично прийнятна сіль для застосуіз пунктів 1-9 або її фармацевтично прийнятної вання у виробництві медикаменту. солі у виробництві медикаменту для застосування 14. Сполука формули І за будь-яким із пунктів 1-9 у лікуванні ревматоїдного артриту, астми, хронічабо її фармацевтично прийнятна сіль у виробницної обструктивної хвороби легень, запальної хвотві медикаменту для застосування у лікуванні тероби кишечнику, розсіяного склерозу, СНІД, сепрапевтичних станів, опосередкованих цитокінами. тичного шоку, застійної серцевої недостатності, ішемічної хвороби серця або псоріазу. Цей винахід стосується амідних похідних або їх фармацевтично прийнятних солей, котрі є корисними як інгібітори хвороб, опосередкованих цитокіном. Винахід також стосується способів виробництва названих амідних похідних, фармацевтичних композицій, які містять названі амідні похідні та їх застосування у терапевтичних способах, наприклад, на основі інгібування хвороб, опосередкованих цитокіном. Амідними похідними, розкритими в заявленому винаході, є інгібітори продукування цитокінів, як-то фактору некрозу пухлини (далі TNF), наприклад, TNFa, та різних представників сімейства інтерлейкінів (далі IL), наприклад, IL-1, IL-6 та IL-8. Відповідно амідні похідні винаходу повинні бути корисними у лікуванні хвороб або медичних станів, де відбувається підвищене продукування цитокінів, наприклад, підвищене продукування TNFa або IL-1. Відомо, що цитокіни продукуються широким розмаїттям клітин, як-то моноцитами та макрофагами, та тими, що викликають розмаїття фізіологічних ефектів, котрі, можна вважати, є важливими у хворобах або медичних станах, як-то запалення та імунорегуляція. Наприклад, TNFa та IL-1 залучено у сигнальний каскад клітин, котрий, як вважають, сприяє патології хворобливих станів, як-то запальних та алергічних хвороб та індукованої цитокіном токсичності,. Також відомо, що у деяких клітинних системах продукування TNFa передує та опосередковує продукування інших цитокінів, як-то IL-1. Аномальні рівні цитокінів також залучено, наприклад, у продукування фізіологічно активних ейкозаноїдів, як-то простагландинів та лейкотриєнів, стимуляцію вивільнення протеолітичних ферментів, як-то колагенази, активацію імунної системи, наприклад, стимуляцією Т-хелперних клітин, активацію активності остеокластів, призводячи до резорбції кальцію, стимуляцію вивільнення пртеогліканів, наприклад, із хряща, стимуляцію проліферації клітин та ангіогенезу. Цитокіни також, можна вважати, є залученими у продукування та розвиток хворобливих станів, як-то запальних та алергічних хвороб, наприклад, запалення суглобів (особливо ревматоїдного артриту, остеоартриту та подагри), запалення шлунково-кишкового тракту (особливо запальної хвороби кишковику, виразкового коліту, хвороби Крона та гастриту), хвороб шкіри (особливо псоріазу, екземи та дерматиту) та респіраторної хвороби (особливо астми, бронхіту, алергічного риніту, хронічної обструктивної хвороби легень та респіраторного дистрес-синдрому дорослих), та у продукування та розвиток різних серцево-судинних та церебрально-васкулярних розладів, як-то застійної серцевої недостатності, гострої серцевої недостатності, інфаркту міокарду, утворення атеросклеротичних бляшок, гіпертензії, агрегації тромбоцитів, стенокардії, інсульту, реперфузійного пошкодження, пошкодження судин, яке охоплює рестеноз та хворобу переферийних судин, та, наприклад, різних розладів метаболізму кісток, як-то остеопорозу (який охоплює старечий та постклімактеричний остеопороз), хвороби Педжета, метастазів кісток, гіперкальціємії, гіперпаратиреозу, остеосклерозу, остеопорозу та періодонтиту, та аномальних змін у метаболізмі кісток, котрі можуть супроводжувати ревматоїдний артрит та остеоартрит. Підвищене продукування цитокіну також залучено до опосередкування деяких ускладнень бактеріальних, грибкових та/або вірусних інфекцій, як-то ендотоксичного шоку, септичного шоку та токсичного шоку, та до опосередкування деяких ускладнень хірургії або пошкодження ЦНС, як-то нейротравми та ішемічного нападу. Підвищене продукування цитокіну також залучено до опосередкування або загострення розвитку хвороб, які охоплюють резорбцію хрящів або м'язів, фіброз легень, цироз печінки, фіброз нирок, кахексію, знайдену при деяких хронічних хворобах, як-то злоякісній хворобі та синдромі набутого імунодефіциту (СНІД), хронічну обструктивну хворобу легень, інвазивність пухлини та метастаз пухлини, та розсіяний склероз. Підвищене продукування цитокіну також залучено у біль. Доказ центральної ролі TNFa у клітинному сигнальному каскаді, котрий призводить до появи ревматоїдного артриту, надається ефективністю у клінічних дослідженнях антитіл TNFa (The Lancet. 1994, 344, 1125 та British Journal of Rheumatology. 1995, 34, 334). Таким чином, цитокіни, як-то TNFa та IL-1, є можна вважати, важливими медіаторами великого ряду хвороб та медичних станів. Відповідно очікують, що інгібування продукування та/або дії цих цитокінів повинні бути переважними у профілактиці, контролі або лікуванні таких хвороб та медичних станів. Не припускаючи, що амідні похідні, розкриті в заявленому винаході, володіють фармакологічною активністю тільки завдяки дії на один біологічний процес, вважають, що амідні похідні інгібують дію цитокінів, завдяки інгібуванню ферменту кінази р38. Кіназа р38, інакше відома як білок супресивного зв'язування цитокіну (далі CSBP) та реактивуюча кіназа (далі RK), є представником мітогенактивованого білку (далі МАР) сімейства фермен 11 88777 12 тів кіназ, котра, як відомо, активується фізіологіч6С)алкіл]аміно, галоген-(1-6С)алкіл, гідрокси-(1ним стресом, як-то індукованим іонізуючою радіа6С)алкіл, (1-6С)алкокси-(1-6С)алкіл, ціано-(1цією, цитотоксичними агентами та токсинами, на6С)алкіл, аміно-(1-6С)алкіл, (1-6С)алкілаіиіно-(1приклад, ендотоксинами, як-то бактеріальним 6С)алкіл, ди-[(1-6С)алкіл]аміно-(1-6С)алкіл, (1ліпополісахаридом, та розмаїттям агентів, як-то 6С)алкілтіо, (1-6С)алкілсульфініл, (16С)алкілсульфоніл, аміносульфоніл, N-(1цитокінами, наприклад, TNFa та IL-1. Відомо, що 6С)алктсульфамоїл, N,N-ди-[(1кіназа р38 фосфорилує деякі внутрішньоклітинні 6С)алкіл]сульфамоїл та (3білки, котрі включаються у каскад ферментативних 6С)циклоалкілсульфоніл; етапів, що призводить до біосинтезу та екскреції та де будь-який із замісників на визначених цитокінів, як-то TNFa та IL-1. Відомі інгібітори кінавище Qa або Qb, котрі містять СН2-групу, котра зи р38 були розглянуті у Ехр. Оріп. Then Patents. приєднана до 2 атомів карбону, або СН3-групу, 2000, 10(1), 25-37. Кіназа р38, як відомо, існує в котра приєднана до атому карбону, може, як варіізоформах, ідентифікованих як р38а та ρ38β. ант, нести на кожній названій СН2- або СН3-групі Амідні похідні, розкриті в заявленому винаході, один або більше замісників, вибраних із групи: є інгібіторами продукування цитокінів, як-то TNF, гідрокси, ціано, аміно, (1-6С)алкіл, (1-6С)алкокси, зокрема, TNFa, та різних інтерлейкінів, зокрема, (1-6С)алкіламіно та ди-[(1-6С)алкіл]аміно; IL-1. або її фармацевтично прийнятну сіль. Відомо із заявки на Міжнародний патент WO Згідно з подальшим аспектом заявленого ви00/07980, що деякі амідні похідні є інгібіторами находу запропоновано сполуку формули І, де продукування цитокінів, як-то TNF, та різних інтерQa - феніл, піридил, піримідиніл, піразиніл або лейкінів. Одною з розкритих сполук є Nпіридазиніл, ї Qa може, як варіант, нести 1 або 2 циклобутил-3-(3,4-диметоксибензамідо)-4замісники, вибрані із групи: галоген, (1-6С)алкіл та метилбензамід (Порівняльна сполука X). (1-6С)алкокси; У цьому документі нема розкриття амідого поR1 та R2 кожний незалежно вибрано із групи: хідного, котрий несе циклопропіламінокарбонільгідроген, (1-6С)алкіл, (2-6С)алкеніл та (2ний замісник на 3-позиції центрального 66С)алкініл; та метилфенілу. Ми зараз виявили, що такі сполуки Qb - феніл, гетероарил або гетероцикліл, та Qb мають сильну інгібіторну активність цитокіну та може, як варіант, нести 1 або 2 замісники, вибрані мають бажані профілі активності. із групи: гідрокси, галоген, (1-6С)алкіл, (2Далі, у заявці на Міжнародний патент WO 6С)алкеніл, (2-6С)алкініл, (3-6С)циклоалкіл, (32004/071440 розкрито амідні похідні, які несуть 6С)циклоалкіл-(1-6С)алкіл, (1-6С)алкокси, (3замісник циклоалкіламінокарбонілу на 3-позиції 6С)циклоалкокси, (3-6С)циклоалкіл-(1-6С)алкокси, центрального 6-метилфенілу. Однак, ця заявка карбокси, (1-6С)алкоксикарбоніл, N-(1розкриває сполуки на основі тіазолілу, де кільце 6С)алкілкарбамоїл, N,N-ди-[(1-6С)алкіл]карбамоїл, тіазолу переважно заміщено аміногрупою. (2-6С)алканоїл, аміно, (1-6С)алкіламіно, ди-[(1Згідно з заявленим винаходом запропоновано 6С)алкіл]аміно, галоген-(1-6С)алкіл, гідрокси-(1сполуку формули І 6С)алкіл, (1-6С)алкокси-(1-6С)алкіл, ціано-(16С)алкіл, аміно-(1-6С)алкіл, (1-6С)алкіламіно-(16С)алкіл, ди-[(1-6С)алкіл]аміно-(1-6С)алкіл, (16С)алкілтіо, (1-6С)алкілсульфініл, (16С)алкілсульфоніл, аміносульфоніл, N-(16С)алкілсульфамоїл, N,N-ди-[(16С)алкiл]сульфамоїл та (36С)циклоалкілсульфоніл; та де будь-який із замісників на визначених вище Qa або Qb, котрі містять СН2-групу, котра приєднана до 2 атомів карбону, або СН3-групу, де котра приєднана до атому карбону, може, як варіQa - феніл або гетероарил, та Qa може, як ваант, нести на кожній названій СН2- або СН3-групі ріант, нести 1 або 2 замісники, вибрані із групи: один або більше замісників, вибраних із групи: гідроксил, галоген, трифлуорметил, ціано, аміно, гідрокси, ціано, аміно, (1-6С)алкіл, (1-6С)алкокси, (1-6С)алкіл, (2-6С)алкеніл, (2-6С)алкініл, (1(1-6С)алкіламіно та ди-[(1-6С)алкіл]аміно; 6С)алкокси, (1-6С)алкіламіно, ди-[(1або її фармацевтично прийнятну сіль. 6С)алкіл]аміно та (1-6С)алкоксикарбоніл; У цьому описі термін (1-6С)алкіл охоплює алR1 та R2 кожний незалежно вибрано із групи: кіли із лінійним та розгалуженим ланцюгом, як-то гідроген, (1-6С)алкіл, (2-6С)алкеніл та (2пропіл, ізопропіл та трет-бутил. Посилання на ал6С)алкініл; а кіли, як-то "пропіл", стосуються тільки варіанту з Qb - феніл, гетероарил або гетероцикліл, та Qb лінійним ланцюгом, посилання на конкретні алкіли може, як варіант, нести 1 або 2 замісники, вибрані із розгалуженим ланцюгом, як-то "ізопропіл", стоіз групи: гідрокси, галоген, (1-6С)алкіл, (2суються тільки варіанту з розгалуженим ланцюгом. 6С)алкеніл, (2-6С)алкініл, (3-6С)циклоалкіл, (3У цьому описі термін (3-6С)циклоалкокси охоплює 6С)циклоалкіл-(1-6С)алкіл, (1-6С)алкокси, (3циклопропілокси, циклобутилокси, циклопентилок6С)циклоалкокси, (3-6С)циклоалкіл-(1-6С)алкокси, си та циклогексилокси. Посилання на конкретні карбокси, (1-6С)алкоксикарбоніл, N-(1циклоалкіли, як-то "циклопентил", стосуються тіль6С)алкілкарбамоїл, N,N-ди-[(1-6С)алкіл]карбамоїл, ки 5-членних кілець. (2-6С)алканоїл, аміно, (1-6С)алкіламіно, ди-[(1 13 88777 14 або 2 оксо- або тіоксо-замісників, є, наприклад, 2Зрозуміло, якщо деякі визначені вище сполуки оксопіролідиніл, 2-тіоксопіролідиніл, 2формули І можуть існувати у оптично активних або оксоімідазолідиніл, 2-тіоксоімідазолідиніл, 2рацемічних формах завдяки одному або більше оксопіперидиніл, 2,5-діоксопіролідиніл, 2,5асиметричним атомам карбону, винахід охоплює діоксоімідазолідиніл або 2,6-діоксопіперидиніл. будь-яку таку оптично активну або рацемічну фоПридатні значення різних замісників на Qa або рму, котра володіє властивістю інгібування цитокіQb або для R1 та R2 охоплюють: нів, зокрема, TNF. Синтез оптично активних форм для галогену: флуор, хлор, бром та йод; можна виконувати звичайними способами органічдля (1-6С)алкілу: метил, етил, пропіл, ізопроної хімії, добре відомими в рівні техніки, наприпіл та трет-бутил; клад, синтезом з оптично активних вихідних матедля (2-6С)алкенілу: вініл та аліл; ріалів або розділенням рацемічної форми. для (2-6С)алкінілу: етиніл та 2-пропініл; Аналогічно, інгібіторні властивості супроти TNF для (1-6С)алкоксилу: метокси, етокси, пропокможна оцінювати, застосовуючи звичайні лабораси, ізопропокси та бутокси; торні способи, визначені далі. для (1-6С)алкоксикарбонілу: метоксикарбоніл, Придатні значення визначених вище характеетоксикарбоніл, пропоксикарбоніл та третрних радикалів викладено нижче. бутоксикарбоніл; Придатним значенням гетероарилу Qa або Qb є, наприклад, ароматичне 5- або 6-членне макродля N-(1-6С)алкілкарбамоїлу: N метилкарбациклічне кільце, 9- або 10-членне біциклічне кільмоїл, N-етилкарбамоїл та N-пропілкарбамоїл; це, або 13- або 14-членне трициклічне кільце, кождля N,N-ди-[(1-6С)алкіл]карбамоїлу: N,Nне з кільцевими гетероатомами, числом до п'яти, диметилкарбамоїл, N-етил-N-метилкарбамоїл та вибраними із групи: оксиген, нітроген та сульфур, N,N-діетилкарбамоїл; наприклад, фурил, піроліл, тієніл, оксазоліл, ізодля (2-6С)алканоїлу: ацетилта пропіоніл; ксазоліл, імідазоліл, піразоліл, тіазоліл, ізотіазоліл, для (1-6С)алкіламіно: метиламіно, етиламіно оксадіазоліл, тіадіазоліл, триазоліл, тетразоліл, та пропіламіно; піридил, піридазиніл, піримідиніл, піразиніл, 1,3,5для ди-[(1-6С)алкіл]аміно: диметиламіне діетриазеніл, бензофураніл, індоліл, бензотієніл, бентиламіно та N-етил- -метиламіно; зоксазоліл, бензімідазоліл, бензотіазоліл, індазодля галоген-(1-6С)алкілу: флуорметил, хлорліл, бензофуразаніл, хіноліл, ізоксіноліл, хіназоліметил, бромметил, дифлуорметил, дихлорметил, ніл, хіноксалініл, цинолініл, нафтиридиніл, дибромметил, 2-флуоретил, 2-хлоретил та 2карбазоліл, дибензофураніл, дибензотіофеніл, брометил; S,S-діоксодибензотіофеніл, ксантеніл, дибензодля гідрокси-(1-6С)алкілу: гідроксиметил, 21,4-діоксиніл, феноксатіїніл, феноксазиніл, дибенгідроксіетил, 1-гідроксіетил та 3-гідроксипропіл; зотіїніл, фенотіазиніл, тіантреніл, бензофуропіридля (1-6С)алкокси-(1-6С)алкілу: метоксиметил, дил, піридоіндоліл, акридиніл або фенантридиніл, етоксиметил, 1-метоксіетил, 2-метоксіетил, 2переважно фурил, тієніл, оксазоліл, ізоксазоліл, етоксіетил та 3-метоксипропіл; імідазоліл, піридо[1,2-а]імідазоліл, піразоліл, тіадідля ціано-(1-6С)алкілу: ціанометил, 2азоліл, ізотіазоліл, піридил, піридазиніл, піримідиціаноетил, 1-ціаноетил та 3-ціанопропіл; для амініл або піразиніл, більш переважно - фурил, ізоно-(1-6С)алкілу: амінометил, 2-аміноетил, 1ксазоліл, тіазоліл, піридо[1,2-а]імідазоліл, аміноетил та 3-амінопропіл; тіадіазоліл або піридил, піридазиніл, піримідиніл для (1-6С)алкіламіно-(1-6С)алкілу: метиламіабо піразиніл. нометил, етиламінометил, 1-метиламіноетил, 2Придатним значенням гетероциклілу Qb є, наметиламіноетил, 2-етиламіноетил та 3приклад, неароматичне насичене або частково метиламінопропіл; насичене 3-10-членне макроциклічне або біциклічдля ди-[(1-6С)алкіл]аміно-(1-6С)алкілу: димене кільце або 5-7-членне макроциклічне кільце, тиламінометил, діетиламінометил, 1кожне з кільцевими гетероатомами, числом до диметиламіноетил, 2-диметиламіноетил та 3п'яти, вибраними із групи: оксиген, нітроген та судиметиламінопропіл. льфур, наприклад, оксираніл, оксіетаніл, азетидидля (2-6С)алканоїлокси: ацетокси та пропіонініл, тетрагідрофураніл, тетрагідропіраніл, піролілокси: ніл, піролідиніл, імідазолініл, імідазолідиніл, для (1-6С)алканоїламіно: формамідо, ацетаміпіразолініл, піразолідиніл, 1,1до та пропіонамідо; діоксидоізотіазолідиніл, морфолініл, тіоморфолідля карбокси-(1-6С)алкілу: карбоксиметил, 1ніл, тетрагідро-1,4-тіазиніл, 1,1-діоксотетрагідрокарбоксіетил, 2-карбоксіетил, 3-карбоксипропіл та 1,4-тіазиніл, піперидиніл, гомопіперидиніл, піпера4-карбоксибутил; зиніл, гомопіперазиніл, дигідропіридиніл, тетрагіддля (1-6С)алкоксикарбоніл-(1-6С)алкілу: меторопіридиніл, дигідропіримідиніл або тетрагідропіксикарбонілметил, римідиніл або його бензопохідні, як-то 2,3етоксикарбонілметил, третдигідробензофураніл, 2,3-дигідробензотієніл, індобутоксикарбонілметил, 1-метоксикарбонілетил, 1лініл, ізоіндолініл, хроманіл та ізохроманіл, переетоксикарбонілетил, 2-метоксикарбонілетил, 2важно - азетидин-1-іл, 3-піроліп-1-іл, піролідин-1етоксикарбонілетил, 3-метоксикарбонілпропіл та іл, піролідин-2-іл, 1,1-діоксидоізотіазолідин-2-іл, 3-етоксикарбонілпропіл; морфоліно, 1,1 -діоксотетрагідро-4Н-1,4-тіазин-4для (1-6С)алкілтіо: метилтіо, етилтіо та пропііл, піперидин-3-іл, піперидин-4-іл, гомопіперидин-1лтіо; іл, піперидино, піперазин-1-іл або гомопіперазин-1для (1-6С)алкілсульфінілу: метилсульфініл, іл. Придатним значенням такої групи, котра несе 1 етилсульфініл та пропілсульфініл; 15 88777 16 для (1-6С)алкілсульфонілу: метилсульфоніл, Qa - феніл, піридил або піримідиніл, та Qa моетилсульфоніл та пропілсульфоніл; же, як варіант, нести 1 або 2 замісники, вибрані із для N-(1-6С)алкілсульфамоїлу: Nгрупи: галоген, (1-6С)алкіл та (1-6С)алкокси. метилсульфамоїл та N-етилсульфамоїл; Qa - феніл, піридил, піримідиніл, піразиніл або піридазиніл, та Qa може, як варіант, нести 1 або 2 для N,N-ди-[(1-6С)алкіл]сульфамоїлу: N,Nдиметилсульфамоїл; замісники, вибрані із групи: гідрокси та галоген. Придатними значеннями замісника (3Qa - феніл, піридил, піримідиніл, піразиніл або 6С)циклоалкілу на Qb є, наприклад, насичене макпіридазиніл, та Qa може, як варіант, нести 1 або 2 роциклічне 3-6-членне карбонове кільце, як-то замісники, вибрані із групи: гідрокси, хлор та флуциклопропіл, циклобутил, циклопентил або циклоор. гексил, переважно циклопропіл, циклопентил або Qa - феніл, та Qa може, як варіант, нести 1 або циклогексил, більш переважно циклопропіл. 2 замісники, вибрані із групи: гідрокси, хлор та Придатними значеннями замісника (3флуор. 6С)циклоалкіл-(1-6С)алкілу на Qb є, наприклад, Qa - феніл, та Qa може, як варіант, нести 1 або циклопропілметил, циклобутилметил, циклопенти2 флуор-замісники. лметил, циклогексилметил, циклопропілетил, пеQa - феніл, котрий, як варіант, несе1 або 2 зареважно циклопропілметил або циклопропілетил, місники, вибрані із групи: галоген, (1-6С)алкіл та більш переважно - циклопропілметил. (1-6С)алкокси. Придатною фармацевтично прийнятною сіллю Qa - гетероарил, котрий, як варіант, несе 1 або сполуки формули І, наприклад, є кислотно2 замісники, вибрані із групи: галоген, (1-6С)алкіл адитивна сіль сполуки формули І, котра є достатта (1-6С)алкокси. ньо основною, наприклад, кислотно-адитивна сіль Qa - феніл або гетероарил, та Qa може, як ваіз неорганічною або органічною кислотою, як-то ріант, нести 1 або 2 замісники, вибрані із групи: хлоридна, бромідна, сульфатна, фосфатна, триффлуор, хлор, метил та метокси. луорацетатна, лимонна, малеїнова, винна, фумаQa - феніл, котрий, як варіант, несе 1 або 2 зарова, геміфумарова, бурштинова, гемібурштинова, місники, вибрані із групи: флуор, хлор, метил та мигдалева, метансульфонова, диметансульфонометокси. ва, етан-1,2-сульфонова, бензолсульфонова, саQa - гетероарил, котрий, як варіант, несе 1 або ліцилова або 4-толуолсульфонова кислота. 2 замісники, вибрані із групи: флуор, хлор, метил Подальшими значеннями Qa, Qb, R1 та R2 є тата метокси. кі. Ці величини можна застосовувати, де прийнятQa - феніл, піридил або піримідиніл, котрий нено, з будь-якими визначеннями, пунктами патентсе 1 або 2 замісники, вибрані із групи: флуор, ної формули або втіленнями, визначеним вище, хлор, метил та метокси. або далі. Qa - феніл або гетероарил, котрий несе 1 або Qa - феніл або гетероарил, та Qa може, як ва2 замісники, вибрані із групи: флуор, хлор, метил ріант, нести 1 або 2 замісники, вибрані із групи: та метокси. гідрокси, галоген, трифлуорметил, ціано, аміно, (1Qb - феніл, гетероарил або гетероцикліл, та Оb може, як варіант, нести 1 або 2 замісники, вибрані 6С)алкіл, (2-6С)алкеніл, (2-6С)алкініл, (1із групи: гідрокси, галоген, (1-6С)алкіл, (26С)алкокси, (1-6С)алкіламіно, ди-[(16С)алкеніл, (2-6С)алкініл, (3-6C)циклоалкіл, (36С)алкіл]аміно та (1-6С)алкоксикарбоніл. 6С)циклоалкіл-(1-6С)алкіл, (1-6С)алкокси, (3Qa - гетероарил, та Qa може, як варіант, нести 6C)циклоалкокси, (3-6С)циклоалкіл-(1-6С)алкокси, 1 або 2 замісники, вибрані із групи: гідрокси, галокарбокси, (1-6С)алкоксикарбоніл, N-(1ген, трифлуорметил, ціано, аміно, (1-6С)алкіл, (26С)алкеніл, (2-6С)алкініл, (1-6С)алкокси, (16С)алкілкарбамоїл, N,N-ди-[(1-6С)алкіл]карбамоїл, 6С)алкіламіно, ди-[(1-6С)алкіл]аміно та (1(2-6С)алканоїл, аміно, (1-6С)алкіламіно, ди-[(16С)алкоксикарбоніл. 6С)алкіл]аміно, галоген-(1-6С)алкіл, гідрокси-(1Qa - феніл, піридил, піримідиніл, піразиніл або 6С)алкіл, (1-6С)алкокси-(1-6С)алкіл, ціано-(1піридазиніл, та Qa може, як варіант, нести 1 або 2 6С)алкіл, аміно-(1-6С)алкіл, (1-6С)алкіламіно-(1замісники, вибрані із групи: гідрокси, галоген, три6С)алкіл та ди-[(1-6С)алкіл]аміно-(1-6С)алкіл. флуорметил, ціано, аміно, (1-6С)алкіл, (2Qb - феніл або гетероарил, та Qb може, як ва6С)алкеніл, (2-6С)алкініл, (1-6С)алкокси, (1ріант, нести 1 або 2 замісники, вибрані із групи: 6С)алкіламіно, ди-[(1-6С)алкіл]аміно та (1гідрокси, галоген, (1-6С)алкіл, (2-6С)алкеніл, (26С)алкоксикарбоніл. 6С)алкініл, (3-6С)циклоалкіл, (3-6С)циклоалкіл-(1Qa - феніл або гетероарил, та Qa може, як ва6С)алкіл, (1-6С)алкокси, (3-6C)циклоалкокси, (3ріант, нести 1 або 2 замісники, вибрані із групи: 6С)циклоалкіл-(1-6С)алкокси, карбокси, (1галоген, (1-6С)алкіл та (1-6С)алкокси. 6С)алкоксикарбоніл, N-(1-6С)алкілкарбамоїл, N,NQa - феніл, піридил, піримідиніл, піразиніл або ди-[(1-6С)алкiл]карбамоїл, (2-6С)алканоїл, аміно, піридазиніл, та Qa може, як варіант, нести 1 або 2 (1-6С)алкіламіно, ди-[(1-6С)алкіл]аміно, галоген-(1замісники, вибрані із групи: гідрокси, галоген, (16С)алкіл, гідрокси-(1-6С)алкіл, (1-6С)алкокси-(16С)алкіл та (1-6С)алкокси. 6С)алкіл, ціано-(1-6С)алкіл, аміно-(1-6С)алкіл, (1Qa - феніл, піридил, піримідиніл, піразиніл або 6С)алкіламіно-(1-6С)алкіл, ди-[(1-6С)алкіл]амінопіридазиніл, та Qa може, як варіант, нести 1 або 2 (1-6С)алкіл, (1-6С)алкілтіо, (1-6С)алкілсульфініл, замісники, вибрані із групи: галоген, (1-6С)алкіл та (1-6C)алкілсульфоніл, аміносульфоніл, N-(1(1-6С)алкокси. 6С)алкілсульфамоїл, N,N-ди-[(16С)алкіл]сульфамоїл та (36С)циклоалкілсульфоніл; 17 88777 18 та де будь-який із замісників на Qb, котрий місQb - феніл, піридил, тіазоліл, фураніл, піритить СН2-групу, котра приєднана до 2 атомів кардо[1,2-а]імідазоліл, тіадіазоліл, оксазоліл або ізобону, або СН3-групу, котра приєднана до атому ксазоліл, та Qb може, як варіант, нести 1 або 2 карбону, може, як варіант, нести на кожній назвазамісники, вибрані із групи: гідрокси, галоген, (1ній СН2- або СН3-групі один або більше замісників, 6С)алкіл, (2-6С)алкеніл, (2-6С)алкініл, (3вибраних із групи: гідрокси, ціано, аміно, (16C)циклоалкіл, (3-6С)циклоалкіл-(1-6С)алкіл, (16С)алкіл, (1-6С)алкокси, (1-6С)алкіламіно та ди-[(16С)алкокси, (3-6C)циклоалкокси, (3-6С)циклоалкіл6С)алкіл]аміно. (1-6С)алкокси, карбокси, (1-6С)алкоксикарбоніл, N(1-6С)алкілкарбамоїл, N,N-ди-(1Qb - феніл або гетероарил, та Qb може, як варіант, нести 1 або 2 замісники, вибрані із групи: 6С)алкіл]карбамоїл, (2-6С)алканоїл, аміно, (1гідрокси, галоген, (1-6С)алкіл, (2-6С)алкеніл, (26С)алкіламіно, ди-[(1-6С)алкіл]аміно, галоген-(16С)алкініл, (3-6С)циклоалкіл, (3-6С)циклоалкіл-(16С)алкіл, гідрокси-(1-6С)алкіл, (1-6С)алкокси-(16С)алкіл, (1-6С)алкокси, (3-6C)циклоалкокси, (36С)алкіл, ціано-(1-6С)алкіл, аміно-(1-6С)алкіл, (16С)циклоалкіл-(1-6С)алкокси, карбокси, (16С)алкіламіно-(1-6С)алкіл та ди-[(1-6С)алкіл]аміно6С)алкоксикарбоніл, N-(1-6С)алкткарбамоїл, N,N(1-6С)алкіл. ди-[(1-6С)алкіл]карбамоїл, (2-6С)алканоїл, аміно, Qb - феніл, піридил, тіазоліл, фураніл, піри(1-6С)алкіламіно, ди-[(1-6С)алкіл]аміно, галоген-(1до[1,2-а]імідазоліл, тіадіазоліл, оксазоліл або ізо6С)алкіл, гідрокси-(1-6С)алкіл, (1-6С)алкокси-(1ксазоліл, та Qb може, як варіант, нести 1 або 2 6С)алкіл, ціано-(1-6С)алкіл, аміно-(1-6С)алкіл, (1замісники, вибрані із групи: гідрокси, флуор, хлор, 6С)алкіламіно-(1-6С)алкіл та ди-[(1-6С)алкіл]амінометил, етил, ізопропіл, метокси, етокси, метокси(1-6С)алкіл. карбоніл та етоксикарбоніл. Qb - феніл, піридил, піримідиніл, піразиніл, піR1 та R2 кожний незалежно вибрано із групи: ридазиніл, тіазоліл, тіадіазоліл, імідазоліл, ізоксагідроген, (1-6С)алкіл, (2-6С)алкеніл та (2золіл, оксазоліл, фураніл, тієніл, бензімідазоліл, 6С)алкініл; ізохінолініл, хінолініл, бензотіазоліл або піридо[1,2R1 та R2 кожний незалежно вибрано із групи: а]імідазоліл, та Qb може, як варіант, нести 1 або 2 гідроген та (1-6С)алкіл. замісники, вибрані із групи: гідрокси, галоген, (1R1 та R2 - гідрогени. 6С)алкіл, (2-6С)алкеніл, (2-6С)алкініл, (3Конкретні нові сполуки винаходу охоплюють, 6C)циклоалкіл, (3-6C)циклоалкіл-(1-6С)алкіл, (1наприклад, амідні похідні формули І або їх фарма6С)алкокси, (3-6C)циклоалкокси, (3-6С)циклоалкілцевтично прийнятні солі, де: (1-6С)алкокси, карбокси, (1-6С)алкоксикарбоніл, N(a) Qa - феніл або гетероарил, та Qa може, як (1-6С)алкілкарбамоїл, N,N-ди-[(1варіант, нести 1 або 2 замісники, вибрані із групи: 6С)алкіл]карбамоїл, (2-6С)алканоїл, аміно, (1гідрокси, галоген, трифлуорметил, ціано, аміно, (16С)алкіламіно, ди-[(1-6С)алкіл]аміно, галоген-(16С)алкіл, (2-6С)алкеніл, (2-6С)алкініл, (16С)алкіл, гідрокси-(1-6С)алкіл, (1-6С)алкокси-(16С)алкокси, (1-6С)алкіламіно, ди-[(16С)алкіл, ціано-(1-6С)алкіл, аміно-(1-6С)алкіл, (16С)алкіл]аміно та (1-6С)алкоксикарбоніл; 6С)алкіламіно-(1-6С)алкіл, ди-[(1-6С)алкіл]аміноQb - феніл, гетероарил або гетероцикліл, та Qb (1-6С)алкіл, (1-6С)алкілтіо, (1-6С)алкілсульфініл, може, як варіант, нести 1 або 2 замісники, вибрані (1-6С)алкілсульфоніл, аміносульфоніл, N-(1із групи: гідрокси, галоген, (1-6С)алкіл, (26С)алкілсульфамоїл, N,N-ди-[(16С)алкеніл, (2-6С)алкініл, (3-6C)циклоалкіл, (36С)алкіл]сульфамот та (36С)циклоалкіл-(1-6С)алкіл, (1-6С)алкокси, (36С)циклоалкілсульфоніл; 6C)циклоалкокси, (3-6С)циклоалкіл-(1-6С)алкокси, та де будь-який із замісників на Qb, котрий міскарбокси, (1-6С)алкоксикарбоніл, N-(1тить СН2-групу, котра приєднана до 2 атомів кар6С)алкілкарбамоїл, N,N-ди-[(1-6С)алкт]карбамоїл, бону, або СН3-групу, котра приєднана до атому (2-6С)алканоїл, аміно, (1-6С)алкіламіно, ди-[(1карбону, може, як варіант, нести на кожній назва6С)алкіл]аміно, галоген-(1-6С)алкіл, гідрокси-(1ній СН2- або СН3-групі один або більше замісників, 6С)алкіл, (1-6С)алкокси-(1-6С)алкіл, ціано-(1вибраних із групи: гідрокси, ціано, аміно, (16С)алкіл, аміно-(1-6С)алкіл, (1-6С)алкіламіно-(16С)алкіл, (1-6С)алкокси, (1-6С)алкіламіно та ди-[(16С)алкіл та ди-[(1-6С)алкіл]аміно-(1-6С)алкіл та R1 6С)алкіл]аміно. та R2 - гідрогени. Qb - феніл, піридил, тіазоліл, фураніл, піри(b) Qa - феніл, піридил, піримідиніл, піразиніл до[1,2-а]імідазоліл, тіадіазоліл, оксазоліл, ізоксаабо піридазиніл, та Qa може, як варіант, нести 1 золіл, піперидиніл, піперизиніл або піролідиніл, та або 2 замісники, вибрані із групи: гідрокси, галоген, Qb може, як варіант, нести 1 або 2 замісники, вибтрифлуорметил, ціано, аміно, (1-6С)алкіл, (2рані із групи: гідрокси, галоген, (1-6С)алкіл, (26С)алкеніл, (2-6С)алкініл, (1-6С)алкокси, (16С)алкеніл, (2-6С)алкініл, (3-6C)циклоалкіл, (36С)алкіламіно, ди-[(1-6С)алкіл]аміно та (16С)циклоалкіл-(1-6С)алкіл, (1-6С)алкокси, (36С)алкоксикарбоніл; 6С)циклоалкокси, (3-6С)циклоалкіл-(1-6С)алкокси, Qb - феніл, піридил, тіазоліл, фураніл, пірикарбокси, (1-6С)алкоксикарбоніл, N-(1до[1,2-а]імідазоліл, тіадіазоліл, оксазоліл, ізоксазоліл, піперидиніл, піперизиніл або піролідиніл, та 6С)алкілкарбамоїл, N,N-ди-[(1-6С)алкіл]карбамоїл, Qb може, як варіант, нести 1 або 2 замісники, виб(2-6С)алканоїл, аміно, (1-6С)алкіламіно, ди-[(1рані із групи, гідрокси, галоген, (1-6С)алкіл, (26С)алкіл]аміно, галоген-(1-6С)алкіл, гідрокси-(16С)алкеніл, (2-6С)алкініл, (3-6C)циклоалкіл, (36С)алкіл, (1-6С)алкокси-(1-6С)алкіл, ціано-(16С)циклоалкіл-(1-6С)алкіл, (1-6С)алкокси, (36С)алкіл, аміно-(1-6С)алкіл, (1-6С)алкіламіно-(16С)циклоалкокси, (3-6С)циклоалкіл-(1-6С)алкокси, 6С)алкіл та ди-[(1-6С)алкіл]аміно-(1-6С)алкіл. карбокси, (1-6С)алкоксикарбоніл, N-(1 19 88777 20 6С)алкілкарбамоїл, N,N-ди-[(1-6С)алкіл]карбамоїл, N-циклопропіл-4-метил-3-{[4-(1,2,5-тіадіазол-3(2-6С)алканоїл, аміно, (1-6С)алкіламіно, ди-[(1ілметокси)бензоїл]аміно}бензамід; 6С)алкіл]аміно, галоген-(1-6С)алкіл, гідрокси-(1метил 5-({4-[({5-[(циклопропіламіно)карбоніл]6С)алкіл, (1-6С)алкокси-(1-6С)алкіл, ціано-(12-метилфеніл}аміно)карбоніл]фенокси}метил)-26С)алкіл, аміно-(1-6С)алкіл, (1-6С)алкіламіно-(1фуроат; 6С)алкіл та ди-[(1-6С)алкіл]аміно-(1-6С)алкіл та R1 3-({4-[(2-хлор-1,3-тіазол-5та R2 - гідрогени. іл)метокси]бензоїл}аміно)-N-циклопропіл-4(c) Qa - феніл котрий, як варіант, несе 1 або 2 метилбензаіиід; замісники, вибрані із групи: галоген, (1-6С)алкіл та 4-(бензилокси)-N-{5(1-6С)алкокси; Qb - феніл, піридил, тіазоліл, фура[(циклопропіламіно)карбоніл]-2-метилфеніл}-3ніл, піридо[1,2-а]імідазоліл, тіадіазоліл, оксазоліл метоксибензамід; або ізоксазоліл, та Qb може, як варіант, нести 1 N-{5-[(циклопропіламіно)карбоніл]-2або 2 замісники, вибрані із групи: гідрокси, галоген, метилфеніл}-3-метокси-4-(піридин-2(1-6С)алкіл, (2-6С)алкеніл, (2-6С)алкініл, (3ілметокси)бензамід; 6C)циклоалкіл, (3-6С)циклоалкіл-(1-6С)алкіл, (1N-{5-[(циклопропіламіно)карбоніл]-26С)алкокси, (3-6C)циклоалкокси, (3-6С)циклоалкілметилфеніл}-3-метокси-4-(1,3-тіазол-4(1-6С)алкокси, карбокси, (1-6С)алкоксикарбоніл, Nілметокси)бензамід; (1-6С)алкілкарбамоїл, N,N-ди-[(1N-циклопропіл-4-метил-3-{[3-метил-4-(піридин6С)алкіл]карбамоїл, (2-6С)алканоїл, аміно, (12-ілметокси)бензоїл]аміно}бензамід; 6С)алкіламіно, ди-[(1-6С)алкіл]аміно, галоген-(1N-циклопропіл-4-метил-3-{[3-метил-4-(1,3тіазол-4-ілметокси)бензоїл]аміно}бензамід; 6С)алкіл, гідрокси-(1-6С)алкіл, (1-6С)алкокси-(1N-{5-[(циклопропіламіно)карбоніл]-26С)алкіл, ціано-(1-6С)алкіл, аміно-(1-6С)алкіл, (1метилфеніл}-3-флуор-4-(піридин-26С)алкіламіно-(1-6С)алкіл та ди-[(1-6С)алкіл]аміноілметокси)бензамід; (1-6С)алкіл та R1 та R2 - гідрогени. N-[-{5-[(циклопропіламіно)карбоніл]-2(d) Qa - феніл, котрий, як варіант, несе 1 або 2 метилфеніл}-3-флуор-4-[(2-метил-1,3-тіазол-4-іл) замісники, вибрані із групи: флуор, хлор, метил та метокси]бензамід; метокси; Qb - феніл, піридил, тіазоліл, фураніл, N-{5-[(циклопропіламіно)карбоніл]-2піридо[1,2-а]імідазоліл, тіадіазоліл, оксазоліл або метилфеніл}-4-[(3,5-диметилізоксазол-4ізоксазоліл, та Qb може, як варіант, нести 1 або 2 іл)метокси]-3-флуорбензамід; замісники, вибрані із групи: гідрокси, флуор, хлор, N-{5-[(циклопропіламіно)карбоніл]-2метил, етил, ізопропіл, метокси, етокси, метоксиметилфеніл}-3-флуор-4-(1,2,5-тіадіазол-3карбоніл та етоксикарбоніл та R1 та R2 є гідрогеілметокси)бензамід; нами. N-циклопропіл-4-метил-3-{[3-(1,3-тіазол-4Конкретними переважними сполуками винахоіліиетокси)бензоїл]аміно}бензамід; ду є, наприклад: N-циклопропіл-4-метил-3-({3-[(2-метил-1,33-{[4-(бензилокси)бензоїл]аміно}-Nциклопропіл-4-метилбензамід; тіазол-4-іл)метокси]бензоїл}аміно)бензамід; 3-{[3-(бензилокси)бензоїл]аміно}-NN-циклопропіл-4-метил-3-{[3-(піридин-2циклопропіл-4-метилбензамід; ілметокси)бензоїл]аміно}бензамід; 4-(бензилокси)-N-{5N-{5-[(циклопропіламіно)карбоніл]-2[(циклопропіламіно)карбоніл]-2-метилфеніл}-3метилфеніл}-3-флуор-4-(1,3-тіазол-4метилбензамід; ілметокси)бензамід; 4-(бензилокси)-3-флуор-N-{5N-циклопропіл-4-метил-3-({3-метил-4-[(2[(циклопропіламіно)карбоніл]-2метил-1,3-тіазол-4метилфеніл}бензамід; іл)метокси]бензоїл}аміно)бензамід; 4-(бензилокси)-3-хлор-N-{5N-{5-[(циклопропіламіно)карбоніл]-2[(циклопропіламіно)карбоніл]-2метилфеніл}-4-[(3,5-диметилізоксазол-4метилфеніл}бензамід; іл)метокси]-3-іиетилбензамід; N-циклопропіл-4-метил-3-{[4-(піридин-2N-циклопропіл-4-метил-3-{[3-метил-4-(1,2,5ілметокси)бензоїл]аміно}бензамід; тіадіазол-3-ілметокси)бензоїл]аміно}бензамід; N-циклопропіл-4-метил-3-{[4-(1,3-тіазол-4метил 5-({4-[({5-[(циклопропіламіно)карбоніл]2-метилфеніл}аміно)карбоніл]-2ілметокси)бензоїл]аміно}бензамід; метилфенокси}метил)-2-фуроат; N-циклопропіл-4-метил-3-{[4-(піридин-3ілметокси)бензоїл]аміно}бензамід; 3-хлор-N-{5-[(циклопропіламіно)карбоніл]-2N-циклопропіл-4-метил-3-({4-[(5метилфеніл}-4-(піридин-2-ілметокси)бензамід; 3-хлор-N-{5-[(Циклопропіламіно)карбоніл]-2метилізоксазол-3іл)метокси]бензоїл}аміно)бензамід; метилфеніл}-4-(1,3-тіазол-4-ілметокси)бензамід; 3-({4-[(5-хлор-1,2,3-тіадіазол-4N-циклопропіл-3-({3-[(3,5-диметилізоксазол-4іл)метокси]бензоіл}аміно)-4-метилбензамід; іл)метокси]бензоїл}аміно)-N-циклопропіл-4метилбензамід; N-циклопропіл-4-метил-3-{[3-(1,2,5-тіадіазол-3N-циклопропіл-3-{[4-(імідазо[1,2-а]піридин-2ілметокси)бензоїл]аміно}бензамід; ілметокси)бензоїл]аіиіно}-4-метилбензамід; 3-({3-[(2-хлор-1,3-тіазол-5N-циклопропіл-4-метил-3-({4-[(2-метил-1,3іл)метокси]бензоїл}аміно)-N-циклопропіл-4тіазол-4-іл) метокси]бензоїл}аміно)бензамід; метилбензамід; N-циклопропіл-3-({4-[(3,5-диметилізоксазол-4іл)метокси]бензоїл}аміно)-4-метилбензамід; 21 88777 22 N-{5-[(циклопропіламіно)карбоніл]-2N-{5-[(циклопропіламіно)карбоніл]-2метилфеніл}-3-флуор-4-(імідазо[1,2-а]піридин-2метилфеніл}-2-[(1,5-диметил-1Н-піразол-3ілметокси)бензамід; іл)метокси]піримідин-5-карбоксамід; N-циклопропіл-3-({4-[(4-метоксипіридин-2N-{5-[(циклопропіламіно)карбоніл]-2іл)метокси]бензоїл}аміно)-4-метилбензамід; метилфеніл}-2-[(1,3-диметил-1Н-піразол-5N-циклопропіл-4-метил-3-{[4-(1-піридин-2іл)метокси]піримідин-5-карбоксамід; ілетокси)бензоїл]аміно}бензамід; N-{5-[(циклопропіламіно)карбоніл]-2метилфеніл}-2-[(3-метилпіридин-2N-циклопропіл-3-({3-[(4-метоксипіридин-2іл)метокси]бензоїл}аміно)-4-метилбензамід; іл)метокси]піримідин-5-карбоксамід; N-циклопропіл-3-[(4-{[5N-{5-[(циклопропіламіно)карбоніл]-2(гідроксиметил)піридин-2метилфеніл}-2-[(1-метил-1Н-бензімідазол-2іл]метокси}бензоїл)аміно]-4-метилбензамід; іл)метокси]піримідин-5-карбоксамід; N-циклопропіл-3-[(4-{[5-(1-гідрокси-1N-{5-[(циклопропіламіно)карбоніл]-2метилетил)піридин-2-іл]метокси}бензоїл)аміно]-4метилфеніл}-2-(ізоксихінолін-1метилбензамід; ілметокси)піримідин-5-карбоксамід; N-циклопропіл-3-{[4-({5N-{5-[(циклопропіламіно)карбоніл]-2[(ізопропіламіно)метил]піридин-2метилфеніл}-2-(хінолін-2-ілметокси)піримідин-5іл}метокси)бензоїл]аміно}-4-метилбензамід; карбоксамід; N-циклопропіл-3-{[4-({52-(1,3-бензотіазол-2-ілметокси)-N-{5[(диметиламіно)метил]піридин-2[(циклопропіламіно)карбоніл]-2іл}метокси)бензоїл]аміно}-4-метилбензамід; метилфеніл}піримідин-5-карбоксамід; метил 6-({4-[({5-[(циклопропіламіно)карбоніл]N-{5-[(циклопропіламіно)карбоніл]-22метилфеніл}-2-(1-піридин-2-ілетокси)піримідин-5метилфекарбоксамід; ніл}аміно)карбоніл]фенокси}метил)нікотинат; N-{5-[(циклопропіламіно)карбоніл]-2N-циклопропіл-3-{[4-({5-[2метилфеніл}-2-(1,3-тіазол-4-ілметокси)піримідин-5(диметиламіно)етокси]піридин-2карбоксамід; іл}метокси)бензоїл]аміно}-4-метилбензамід; N-{5-[(циклопропіламіно)карбоніл]-2метилфеніл}-2-(піридин-2-ілметокси)піримідин-5N-циклопропіл-3-[(4-{[5-(1,3-діоксолан-2ілметокси)піридин-2-іл]метокси}бензоїл)аміно]-4карбоксамід; метилбензамід; N-циклопропіл-3-({4-[(5-циклопропіл-1,3,4N-циклопропіл-3-({4-[(5-гідроксипіридин-2тіадіазол-2-іл)метокси]бензоїл}аміно)-4іл)метокси]бензоїл}аміно)-4-метилбензамід метилбензамід; метил 6-({4-[({5-[(циклопропіламіно)карбоніл]N-{5-[(циклопропіламіно)карбоніл]-22метилфеніл}-6-(піридин-2-ілметокси)нікотинамід; метилфеN-{5-[(циклопропіламіно)карбоніл]-2ніл}аміно)карбоніл]фенокси}метил)піридин-2метилфеніл}-5-(піридин-2-ілметокси)піразин-2карбоксилат; карбоксамід; N-цикпопропіл-3-[(4-{[63-({4-[(6-бромпіридин-2(гідроксиметил)піридин-2іл)метокси]бензоїл}аміно)-N-цикпопропіл-4іл]метокси}бензоїл)аміно]-4-метилбензамід; метилбензамід N-циклопропіл-3-[(4-{[6-(1-гідрокси-1N-{5-[(циклопропіламіно)карбоніл]-2метилетил)піридин-2-іл]метокси}бензоїл)аміно]-4метилфеніл}-3,5-дифлуор-4-(піридин-2метилбензамід; ілметокси)бензамід; N-циклопропіл-3-({4-[(6-{[2N-циклопропіл-4-метил-3-({4-[(6-метилпіридин(діетиламіно)етокси]метил}піридин-22-іл)метокси]бензоїл}аміно)бензамід; іл)метокси]бензоїл}аміно)-4-метилбензамід; N-циклопропіл-4-метил-3-({4-[(3-метилпіридин2-іл)метокси]бензоїл}аміно)бензамід; N-циклопропіл-3-({4-[(6-{[2(диметиламіно)етокси]метил}піридин-2N-циклопропіл-4-метил-3-{[4-(піримідин-2іл)метокси]бензоїл}аміно)-4-метилбензамід; ілметокси)бензоїл]аміно}бензамід; N-циклопропіл-4-метил-3-({4-[(1N-циклопропіл-4-метил-3-{[4-(піридазин-3оксидопіридин-2ілметокси)бензоїл]аміно}бензамід; іл)метокси]бензоїл}аміно)бензамід; N-циклопропіл-3-{[4-({6-[(2метоксіетил)аміно]піридин-2N-{5-[(циклопропіламiно)карбоніл]-2метилфеніл}-2-(імідазо[1,2-а]пiридин-2іл}метокси)бензоїл]аміно}-4-метилбензамід; ілметокси)піримідин-5-карбоксамід; N-циклопропіл-3-({4-[(6-{[2N-{5-[(циклопропіламіно)карбоніл]-2(диметиламіно)етил]аміно}піридин-2метилфеніл}-2-(1,3-тіазол-2-ілметокси)піримідин-5іл)метокси]бензоїл}аміно)-4-метилбензамід; карбоксамід; 5-(бензилокси)-N-{5N-{5-[(циклопропіламіно)карбоніл]-2[(циклопропіламіно)карбоніл]-2метилфеніл}-2-(піримідин-2-ілметокси)піримідин-5метилфеніл}піридин-2-карбоксамід карбоксамід; N-{5-[(циклопропіламіно)карбоніл]-2метилфеніл}-5-(піридин-2-ілметокси)піридин-2N-{5-[(циклопропіламіно)карбоніл]-2карбоксамід та метилфеніл}-2-[(1-метил-1Н-імідазол-2іл)метокси]піримідин-5-карбоксамід; 23 88777 24 алкоголяту, гідроксиду або гідриду лужного або N-циклопропiл-4-метил-3-[(4-{[4лужноземельного металу, наприклад, натрій кар(метилсульфобонату, калій карбонату, натрій етоксиду, калій ніл)бензил]окси}бензоїл)аміно]бензамід; бутоксиду, натрій гідроксиду, калій гідроксиду, наабо її фармацевтично прийнятна сіль. трій гідриду або калій гідриду, або металоорганічСполуки формули І або їх фармацевтично ної основи, як-то алкіллітію, наприклад, нприйнятні солі, можна отримувати будь-яким відобутиллітію або діалкіламінолітію, наприклад, літій мим способом, придатним для отримання хімічних ді-ізопропіламіду, або, наприклад, основного оргасполук. Придатні способи ілюструється, напринічного аміну, як-то, наприклад, піридину, 2,6клад, у WO 00/07980. Такі способи, де застосовано лутидину, колідину, 4-диметиламінопіридину, триотримання нової сполуки формули І, пропонуютьетиламіну, морфоліну або діазабіцикся як подальша ознака винаходу та ілюструється ло[5,4,0]ундец-7-ену. Також реакцію переважно супроводжуючими типовими варіантами способів, проводять у придатному інертному розчиннику або у котрих, якщо не вказано інакше, Qa, Qb, R1 та R2 мають будь-які значення, визначені вище. Потрібні розріджувачі, наприклад, тетрагідрофурані, метивихідні матеріали можна отримувати звичайними ленхлориді, 1,2-диметоксіетані, N,Nспособами органічної хімії. Отримання таких вихідиметилформаміді, N,N-диметилацетаміді, Nдних матеріалів описується в поєднанні із супрометилпіролідин-2-оні, диметилсульфоксиді або воджуючими типовими варіантами способів та в ацетоні, та при температурі в діапазоні, наприсупроводжуючих Прикладах. Альтернативно поклад, -78 - 150°С, або, звичайно приблизно при трібні вихідні матеріали досягаються аналогічними температурі навколишнього середовища. ілюстрованим способами, котрі є в рівні техніки Звичайно карбодіімідний сполучувальний реазвичайного хіміка-органіка. гент застосовують у присутності органічного роз(а) Сполуку формули І або її фармацевтично чиннику (переважно безводного полярного апроприйнятну сіль можна отримувати реакцією бензотонного органічного розчиннику) при помірній йної кислоти формули II або її активованої похідтемпературі, наприклад, в області -10 - 40°С, звиної, чайно при температурі навколишнього середовища, приблизно при 20°С. Захисні групи взагалі можна вибирати з будьяких груп, описаних у літературі або відомих кваліфікованим хімікам як прийнятні для захисту потрібної групи, та їх можна вводити звичайними способами. Захисні групи можна видаляти будьяким зручним способом, описаним у літературі або відомим кваліфікованим хімікам як прийнятним для видалення потрібної захисної групи, такі споз аміном формули III соби вибрано для того, щоб видаляти захисну групу з мінімальним порушенням груп в іншому місці молекули. Конкретні приклади захисних груп надано нижче для зручності, де "нижчий", як, наприклад, у нижчому алкілі, означає, що група, на котру її нау звичайних умовах утворення амідного зв'язнесено, переважно має 1-4 атоми карбону. Треба ку, де Qa, Qb, R1 та R2 визначено вище, та де будьрозуміти, що ці приклади не є вичерпними. Подібяка функціональна група, як варіант, є захищеною но, надані нижче конкретні приклади способів вита: далення захисних груп не є вичерпними. Застосу(і) видаленням будь-яких захисних груп, та вання захисних груп та не згадані конкретно (іі) як варіант, утворенням фармацевтично способи зняття захисту, звичайно, є в межах винаприйнятної солі. ходу. Придатною активованою похідною кислоти Карбокси-захисна група може бути залишком формули II є, наприклад, ацилгалогенід, наприутворюючого естер аліфатичного або арилаліфаклад, ацилхлорид, утворений реакцією кислоти та тичного спирту або утворюючого естер силанолу хлорангідриду неорганічної кислоти, наприклад, (названий спирт або силанол переважно містять 1тіонілхлориду; змішаний ангідрид, наприклад, ан20 атомів карбону). Приклади карбокси-захисних гідрид, утворений реакцією кислоти та хлорформігруп охоплюють (1-12С)алкіли із лінійним чи розату, як-то ізобутилхлорформіату; активний естер, галуженим ланцюгом (наприклад, ізопропіл, третнаприклад, естер, утворений реакцією кислоти та бутил): нижчі алкоксіалкіли (наприклад, метоксифенолу, як-то пентафлуорфенолу, естер, як-то метил, етоксиметил, ізобутоксиметил); нижчі аліпентафлуорфеніл трифлуорацетат або спирт, якфатичні ацилоксіалкіли, (наприклад, ацетоксимето N-гідроксибензотриазол; ацилазид, наприклад, тил, пропіонілоксиметил, бутирилоксиметил, азид, утворений реакцією кислоти та азиду, як-то півалоїлоксиметил); нижчі алкоксикарбонілоксіалдифенілфосфорилазиду; ацилціанід, наприклад, кіли (наприклад, 1-метоксикарбонілоксіетил, 1ціанід, утворений реакцією кислоти та ціаніду, якетоксикарбонілоксіетил); арилалкіли (алкіли - нижто діетилфосфорилціаніду; або продукт реакції чі) (наприклад, бензил, п-метоксибензил, окислоти та карбодііміду, як-то дициклогексилкарнітробензил, п-нітробензил, бензгідрил та фталібодііміду. дил); три(нижчий алкіл)силіли (наприклад, тримеРеакцію переважно проводять у присутності тилсиліл та трет-бутилдиметилсиліл); три(нижчий придатної основи, як-то, наприклад, карбонату, 25 88777 26 алкіл)силілалкіли (алкіли - нижчі) (наприклад, триметилсилілетил) та (2-6С)алкеніли (наприклад, аліл та вінілетил). Відповідні конкретні способи видалення карбоксильних захисних груп охоплюють, наприклад, кислотно-, основно-, метало- або ферментативно-каталізований гідроліз. Приклади гідрокси-захисних груп охоплюють де R є, наприклад, нижчим алкілом або бензинижчі алкіли (наприклад, трет-бутил), нижчі алкелом, в придатних умовах утворення амідного зв'яніли (наприклад, аліл); нижчі алканоїли (напризку, як визначено вище. клад, ацетил); нижчі алкоксикарбоніли (наприклад, Звичайні умови охоплюють активацію карбоктрет-бутоксикарбоніл); нижчі алкенілоксикарбоніли сильної групи сполуки формули IV, наприклад, (наприклад, алілоксикарбоніл); обробку галоген-реагентом (наприклад, оксалілхарил(нижчі)алкоксикарбоніли (наприклад, бензолоридом) для утворення ацилгалогеніду у органічїлоксикарбоніл, п-метоксибензилоксикарбоніл, оному розчиннику при температурі навколишнього нітробензилоксикарбоніл, псередовища, а тоді реакцію активованої сполуки з нітробензилоксикарбоніл); три(нижчі)алкілсиліли аніліном формули V. Будь-які функціональні групи (наприклад, триметилсиліл, третзахищають та позбавляють захисту, за потребою. бутилдиметилсиліл) та арил(нижчі)алкіли (напри(b) Сполуку формули І або її фармацевтично клад, бензил). прийнятну сіль, можна отримувати реакцією кисПриклади аміно-захисних груп охоплюють фолоти формули IV, або її активованої похідної, як рміли, аралкіли (наприклад, бензил та заміщений визначено вище, бензил, п-метоксибензил, нітробензил та 2,4диметоксибензил, та трифенілметил); ди-панізилметил та фурилметил; нижчі алкоксикарбоніли (наприклад, трет-бутоксикарбоніл); нижчі алкенілоксикарбоніли (наприклад, алілоксикарбоніл); арил(нижчі)алкоксикарбоніли (наприклад, бензилоксикарбоніл, п-метоксибензилоксикарбоніл, онітробензилоксикарбоніл, пз аніліном формули VI нітробензилоксикарбоніл; триалкілсиліли (наприклад, триметилсиліл та трет-бутилдиметилсиліл); алкіліден (наприклад, метиліден); бензиліден та заміщені бензилідени. Відповідні способи видалення гідрокси- та аміно-захисних груп охоплюють, наприклад, каталізований кислотами, основами, металами або ферментами гідроліз груп, як-то пнітробензилоксикарбонілу, гідрогенізацію груп, якто бензилу, та фотолітичну гідрогенізацію груп, яку звичайних умовах утворення амідного зв'язто о-нітробензилоксикарбонілу. ку, які визначено вище, де Qa, Qb, R1 та R2 визнаЧитач посилається до Advanced Organic чено вище та де будь-яка функціональна група є, Chemistry, 4th Edition, by Jerry March, published by як варіант, захищеною та: JohH-Wiley & Sons 1992, для загального керівниц(і) видаленням будь-яких захисних груп; тва по умовам реакції та реагентам. Читач поси(іі) як варіант, утворенням фармацевтично лається до Protective Groups in Organic Synthesis, прийнятної солі. 3rd Edition, by Green and Wuts, published by JohHАнілін формули VI можна отримувати відновWiley & Sons для загального керівництва по захисленням відповідної нітросполуки, застосовуючи ним групам. відповідні способи, ілюстровані у Прикладах. ЗвиБензойну кислоту формули II можна отримучайні умови реакції охоплюють застосування амовати розщепленням її відповідного естеру, котрий, ній форміату або газуватого водню у присутності у свою чергу, можна отримувати реакцією кислоти каталізатору (наприклад, паладію-на-вуглеці) у формули IV, де Qa, Qb, R1 та R2 визначено вище, присутності органічного розчиннику (переважно або її активованої похідної, як визначено вище, полярного протоновмісного розчиннику), переважно з нагріванням, наприклад, приблизно до 60°С. Будь-які функціональні групи захищають та позбавляють захисту, за потребою. (c) Сполуку формули І, де замісник на Qa або Qb - (1-6С)алкоксил або заміщений (1-6С)алкоксил, (1-6С)алкіламіно, ди-[(1-6С)алкіл]аміно або заміщений (1-6С)алкіламіно, можна отримувати алкіз аніліном формули V, луванням, звичайно, у присутності придатної основи, як визначено вище, амідого похідного формули І, де замісник на Qa або Qb - гідроксил або аміно, відповідно. Реакцію переважно проводять у присутності придатного інертного розчиннику або розріджува 27 88777 28 чу, наприклад, галогенованого розчиннику, як-то Придатною переносною групою Ζ є, наприметиленхлориду, хлороформу або карбонілетрахклад, галоген, як-то флуор, хлор або бром, (1лориду, етеру, як-то тетрагідрофурану або 1,46С)алкансульфонілоксил, як-то метансульфонілодіоксану, ароматичного розчиннику, як-то толуолу, ксил або арилсульфонілоксил, як-то 4або диполярного апротонного розчиннику, як-то толуолсульфонілоксил. N,N-диметилформаміду, N,N-диметилацетаміду, Реакцію звичайно проводять у присутності придатної основи, як визначено вище, та у присутN-метилпіролідин-2-ону або диметилсульфоксиду. Звичайно, реакцію проводять при температурі в ності придатного інертного розріджувачу або носія, діапазоні, наприклад, 10-150°С, переважно в діаякі визначено вище. Реакцію звичайно проводять пазоні 20-80°С. при температурі в діапазоні 10-150°С, переважно Придатним алкілувальним засобом є, наприпри приблизно 50°С. клад, будь-який засіб, відомий у рівні техніки для (g) Сполуку формули І, де замісник на Qa або алкілування гідроксилу до алкоксилу або заміщеQb - аміногрупа, можна отримувати відновленням ного алкоксилу, або для алкілування меркапто- до сполуки формули І, де замісник на Qa або Qb - ніталкілтіо-групи, або для алкілування аміно до алкірогрупа. ламіно або заміщеного алкіламіно, або для алкілуЗвичайні умови реакції охоплюють застосування гідрокси до гетероциклілокси, наприклад, вання амоній форміату або газуватого водню у алкілу або заміщеного алкілгалогеніду, наприклад, присутності каталізатору, наприклад, металевого (1-6С)алкілхлориду, броміду, або йодиду, або закаталізатору, як-то паладій-на-вуглеці. Альтернаміщеного (1-6С)алкілхлориду, бромід або йодиду, тивно відновлення розчиненням металу можна або гетероциклілхлориду, броміду або йодиду у виконувати, наприклад, застосовуючи залізо у присутності придатної основи, як визначено вище. присутності кислоти, наприклад, неорганічної або (d) Сполуку формули І, де замісник на Qa або органічної кислоти, як-то хлоридної, бромідної, Qb - (1-6С)алканоїламіно або заміщений (2сульфатної, або оцтової кислоти. Реакцію звичай6С)алканоїламіно, можна отримувати ацилуванно проводять у присутності органічного розчиннику ням сполуки формули І, де замісник на Qa або Qb (переважно полярного протоновмісного розчинниаміно. ку) та переважно з нагріванням, наприклад, приПридатним ацилувальним засобом є, наприблизно до 60°С. Будь-які функціональні групи заклад, будь-який засіб, відомий у рівні техніки для хищають та позбавляють захисту, за потребою. ацилуванням аміно до ациламіно, наприклад, ациСупроводжуючі біологічні аналізи та приклади лгалогеніду, наприклад, (1-6С)алканоїлхлориду служать для ілюстрування заявленого винаходу. або броміду, звичайно, у присутності придатної Біологічні Аналізи основи, як визначено вище, ангідрид алканової Наступні аналізи можна застосовувати для викислоти, або змішаного ангідриду, наприклад, анзначення дії сполуки формули І як інгібітору кінази гідриду (1-6С)алканової кислоти, як-то оцтового р38, інгібітору TNF та протиартритного засобу: ангідриду або змішаного ангідриду, утвореного Аналіз Ферменту in-vitro реакцією алканової кислоти та (1Аналізувалась здатність сполуки тесту до інгі6С)алкоксикарбонілгалогеніду, наприклад, (1бування ферменту кінази р38. Визначалась актив6С)алкоксикарбонілхлориду, у присутності приданість тест-сполуки супроти кожної ізоформи р38a тної основи, як визначено вище. Взагалі ацилута p38b ферменту. вання проводять у придатному інертному розчинРекомбінантний МKK6 людини (GenBank нику або розріджувачі, як визначено вище, та при Accesiрн-Number G1209672) відокремлювали від температурі, у діапазоні, наприклад, -30 до 120°С, відображеного клону 45578 (Genomics. 1996, 33, звичайно, при, або близько температури навколи151) та використовували для отримування білку у шнього середовища. формі гібридного білку GST у векторі pGEX, засто(e) Сполуку формули І, де замісник на Qb - (1совуючи способи, аналогічні розкритим у J. Нан-et 6С)алкансульфоніламіно можна отримувати реакal., Journal of Biological Chemistry, 1996, 271, 2886цією сполуки формули І, де замісник на Qb - аміно 2891. р38a (GenBank AccessiOH-Number G529039) з (1-6С)алкансульфоновою кислотою або її актита p38b (GenBank AccessiOH-Number G1469305) вованим похідним. виділяли PCR-ампліфікацією лімфобластоїдної Придатним активованим похідним (1кДНК людини (GenBank AccessiOH-Number 6С)алкансульфонової кислоти є, наприклад, алкаGM1416) та кДНК мозку ембріону людини [синтенсульфонілгалогенід, наприклад, алкансульфонілзованого з мРНК (Clontech, catalogue no. 6525-1), хлорид, утворений реакцією сульфонової кислоти застосовуючи комплект superscript Gibco для синта неорганічної хлоридної кислоти, наприклад, тезу кДНК], відповідно застосовуючи олігонуклеотіонілхлориду. Реакцію переважно проводять у тиди, призначені для 5' та 3' кінців генів р38a та присутності придатної основи, як визначено вище, p38b людини, застосовуючи способи аналогічні конкретно - піридину, та у придатному інертному описаним у J. Нан-et al., Biochimica et Biophvsica розчиннику або розріджувачі, як визначено вище, Acta, 1995, 1265, 224-227 та Υ. Jiang et al., Journal конкретно - метиленхлориді. of Biological Chemistry. 1996, 271, 17920-17926. (f) Сполуку формули І, де замісник на Qa або Обидві ізоформи білку р38 експресували у Qb аміно-(1-6С)алкіл, (1-6С)алкіламіно-(1Е.coli у векторах PET. Ізоформи рекомбінантних 6С)алкіл, ди-[(1-6С)алкіл]аміно-(1-6С)алкіл, можна р38a та p38b людини отримували, як мічені 6His отримувати реакцією сполуки формули І, де замісбілки 5' с-mус. Білки МKK6 та р38 очищали, застоник на Qb - група формули -(1-6С)алкілен-Z, де Ζ є совуючи звичайні способи: GST MKK6 очищали, переносною групою з відповідним аміном. застосовуючи колонку з глутатіон-сефарозою, а 29 88777 30 створювали, застосовуючи фірмовий автоматизобілки р38 очищали, застосовуючи колонки з хелаваний блок аналізу даних та блок підгонки кривих. том нікелю. Аналізи in-vitro на клітинах Ферменти р38 активували точно перед засто(і) РВМС суванням інкубацією з MKK6 протягом 3 годин при Здатність тест-сполуки інгібувати продукуван30°С. Неактивований експресований в Е.coli MKK6 утримував достатню активність до повної активації ня TNFa аналізували застосуванням мононуклєарних клітин периферійної крові людини, які синтеобох ізоформ р38. Інкубат для активації р38a місзують та секретують TNFa при стимулюванні тив р38a (50мкл 10мг/мл), MKK6 (5мкл 12мг/мл), ліпополісахаридом (LPS). 'буфер кінази' [550 кл; буфер з рН 7,4, який містить Мононуклєарні клітини периферійної крові Трис НСІ (50ммоль), ΕГΤΑ (0,1ммоль), натрій ор(РВМС) відокремлювали від гепаринизованої тованадат (0,1ммоль) та b-меркаптоетанол (10одиниць/мл гепарину) крові людини центрифу(0,1%)], Мg [75мкл 100ммоль Мg(ОСОСН3)2] та гуванням за густиною (LymphoprepÔ; Nycomed). АТФ (75мкл 1ммоль). Інкубат для активації р38a Мононуклєарні клітини ресуспендували у культубув подібним до вищезгаданого за винятком вмісральному середовищі [середовище RPMI 1640 ту ферменту р38a (82мкл при 3,05мг/мл) та (Sigma R0883), яке містить 50одиниць/мл пеніци518мкл "буферу кінази". Інкубати для активації ліну, 50мкг/мл стрептоміцину та 2ммоль глутамір38a та p38b були або застосовували свіжими або ну], доповненому 1% інактивованою теплом сиророзподіляли на аліквоти та зберігали при -80°C. ваткою АВ людини (Sigma H-1513)]. Сполуки Тест-сполуку розчиняли у ДМСО (10ммоль) та розчиняли у ДМСО при концентрації 20ммоль, серійні розбавлення 1:3 у ДМСО поміщали у полірозбавляли 1:100 у культуральному середовищі і пропіленові планшети (Costar 3365). Розчини споготували серійні розчини у культуральному серелуки тоді розбавляли 1:10 у "буфері кінази" та довищі, яке містило 1% ДМСО. РВМС (2,2x105 клі10мкл переносили до планшету для аналізу мікротин у 160мкл культурального середовища) інкубутитруванням (Costar 3596). Комірки для контролю вали з 20мкл різних концентрацій тест-сполуки містили 10мкл (розчин 1:10 у буфері кінази) (дублікатні культури) або 20мкл культурального ДМСО. Тоді додавали 'Суміш для аналізу кінази' середовища, яке містить 1% ДМСО (комірки для [30мкл; яка містила Основний Білок Мієліну (Sigma контролю), протягом 30 хвилин при 37°С у зволоM-1891; 0,5мл при 6,66мг/мл розчину у "буфері женому (5%СО2/95% повітря) інкубаторі (Corning кінази"), активований фермент р38a (3,8мкл) та 3595; 96-коміркові плоскодонні планшети для 'Буфер кінази' (2,55мл)]. Комірки для контролю на культури тканини). До призачених комірок додавакожному планшеті або містили вищезгадану "Сули 20мкл ліпополісахариду [LPS E.Coli 0111:B4 міш для аналізу кінази" (n=6 реплікатів), або міс(Sigma L-4130), кінцева концентрація 0,1мкг/мл], тили "Суміш для аналізу кінази", де активований розчиненого у культуральному середовищі. До фермент р38 заміщали буфером кінази (n=6 реплікомірок контролю тільки із середовищем додавали катів). Тоді до усіх комірок додавали 'Мічений АТФ' 20мкл культурального середовища. На кожному [10мкл; який містить 50мкмоль АТФ, 5мкКі 33Р АТФ 96-комірковому планшеті було шість контрольних (Amersham International cat. no. AH9968) та комірок тільки із LPS та шість тільки із середови50ммоль Mg(OCOCH3)2]. Для p38b у "Суміши для щем. аналізу кінази" містилося 23мкл активованого феТест-сполуку тестували на інгібіторну активрменту p38b та "буфер кінази" (2,53мл). Кінцева ність TNFa у діапазоні кінцевої концентрації доз концентрація тест-сполуки була 2,4мкмоль20мкмоль-0,0001 мкмоль. Кожний тест містив ві0,001мкмоль (n=2 реплікати). Планшети для мікродомий інгібітор TNFa, тобто МАРK-інгібітор р38, титрування інкубували при температурі навколишSB203580 (Lee, J.C., et аl (1994) Nature 372 р.739нього середовища (з слабким пермішуванням) 746). Планшети інкубували протягом 24 годин при протягом 60 хвилин та реакцію зупиняли додаван37°С (зволожений інкубатор), після чого 100мкл ням 20% трихлороцтової кислоти (ТСА) (50мкл). надосадової рідини видаляли з кожної комірки та Осадковий білок збирали на фільтр-платах зберігали при -80°С (96-коміркові круглодонні (PerkinElmer 6005174), застосовуючи збирач планшети; Corning 3799). У кожному зразку визнаPackard Filtermate (промивання - 2% ТСА), котрий чали рівні TNFa, застосовуючи ELISA для TNFa тоді сушили протягом ночі, та до кожної комірки людини (застосовуючи системи спарених антитіл додавали 25мкл MICROSCINT О (Packard R&D, MAB610TaBAF210. 06013611). Планшети підраховували на сцинтиляційному лічильнику Top Count. Криві відгуку дози % інгібування = (тільки LPS - тільки середовище ) - (тест - концентрація - тільки середовище) ´ 100 (тільки LPS - тільки середовище) (іі) Суцільна кров людини Здатність тест-сполуки до інгібування продукування TNFa також визначали у повному аналізі крові людини. Суцільна кров людини секретує TNFa при стимуляції LPS. Гепаринизовану (10одиниць/мл) кров людини отримували від волонтерів. До 96-коміркових круглодонних планшетів (Corning 3799) додавали 160мкл суцільної крові. Сполуки розчиняли у ДМСО при концентрації 10ммоль, розбавляли 1:100 у "культуральному середовищі" [середовище RPMI 1640 (Sigma), яке містило 50одиниць/мл пеніциліну, 50мкг/мл стрептоміцину та 2ммоль глутаміну], та далі робили серійні розбавлення культуральним середовищем, яке містило 1% ДМСО. До призначеної комірки (потроєні культури) дода 31 88777 32 розчину). Сполуку дозували перорально (50-1мг/кг вали 20мкл кожної тест-концентрації (діапазон один раз щодоби) (4мл/кг) перед (доба -1) або піскінцевої концентрації доз 10мкмольля появи хвороби (доба +1) (10 тварин на тест0,0001мкмоль). До комірки контролю додавали групу; наповнювач 0,5% (за масою/об'ємом) НРМС 20мкл культурального середовища RPMI, яке міста 0,1% (за масою/об'ємом) естеру поліоксіетилетило 1% ДМСО. нової кислоти 80). Тварини контролю (n=10) отриТочно перед додавання 20мкл LPS (кінцева мували тільки наповнювач. Охоплено також "неінконцентрація 10мкг/мл) планшети інкубували продукованих" тварин (5 тварин на контрольну групу), тягом 30 хвилин при 37°С (зволожений інкубатор). котрим давали наповнювач. Тварин зважували До комірки контролю додавали культуральне сещоденно від доби -1 та вимірювали діаметри щиредовище. На кожному планшеті було шість контколотки кронциркулем із ноніусом щодоби від доби рольних комірок тільки із LPS та шість тільки із -1. Після завершення доби 6, видаляли ліві задні середовищем. У кожний тест уводили відомий інгікінцівки та розміщали у 10% формаліні для гістобітор синтезу/секреції TNFa. Планшети інкубували логічного визначення. протягом 6 годин при 37°С (зволожений інкубатор). Хоч фармакологічні властивості сполук форПланшети центрифугували (2000обертів/хвилину мули І змінювалися зі зміною структури, як очікупротягом 10 хвилин) і видаляли 80мкл плазми та вали, взагалі сполука формули дає вище 50% інгізберігали при -80°С (планшети Corning 3799). Рівні бування р38a та/або p38b при концентраціях TNFa вимірювали ELISA, застосовуючи спарені менше 1мкмоль. Не спостерігали фізіологічно неантитіла із системи R&D (номер каталогу. МАВ610 прийнятної токсичності при ефективній дозі тестота BAF210). ваної сполуки заявленого винаходу. Оцінка in vivo Наступна таблиця демонструє дані ІК50 для Здатність тест-сполуки інгібувати синтез TNFa типового вибору сполук згідно з винаходом, а таin vivo аналізували у моделі відгуку від уведення кож порівняльної сполуки X, розкритої у WO ліпополісахариду (LPS) щура. Коротше, сполуку 00/07980, при тестуванні у вищезгаданих аналізах: дозували перорально (100-0,3мг/кг у 20% ДМСО (Sigma D-2650)/60% ПЕГ 400 (Fisher Scientific р38а Суцільна кров людини Ρ/3676/08)/20% стерильна деіонізована вода; 5 Приклад (мкмоль) (мкмоль) тварин на групу) самицям щурів Wistar Alderley Park (АР) (80-100г) у призначені моменти часу тоПорівняльна 4,4 >10 чно перед уведенням LPS. Контрольним тваринам сполука X (10 на групу) давали тільки наповнювач. LPS (LPS 5[ас] 0,007 0,07 E.Coli 0111:B4; Sigma L-4130) уводили внутріш5[е] 0,01 0,52 ньовенно (30мкг у 0,2мл стерильного фізіологічно5[у] 0,006 0,14 го розчину (Phoenix Pharma Ltd). Контрольній групі 5И 0,007 0,30 уводили 0,2мл стерильного фізіологічного розчи8 0,059 1,8 ну. Через 60 хвилин у анестезованих тварин отри23[а] 0,17 1,7 мували кров, і сироватку відокремлювали після 2 годин інкубації при температурі навколишнього Згідно з подальшим аспектом винаходу запросередовища (сепаратор сироватки Sarstedt, мікропоновано фармацевтичну композицію, котра містуби 1мл, ref 41,1500,005) та центрифугували. тить сполуку формули І або її фармацевтично Зразки сироватки зберігали при -80°С точно перед прийнятну сіль, у поєднанні з фармацевтично привизначенням вмісту TNFa за допомогою ELISA йнятним розріджувачем або носієм. (R&D Systems rat TNFa Quantiikine kit, catalogue Згідно з подальшим аспектом винаходу запроno. SRTA00) % інгібування TNFD розраховано як поновано фармацевтичну композицію для застосування у лікуванні хвороб, опосередкованих ци100-[(ліковані сполукою-контроль із фізрозчитокінами, котра містить сполуку формули І або її ном)/контроль LPS-контроль із фізрозчином)х100] фармацевтично прийнятну сіль у поєднанні з фармацевтично прийнятним розріджувачем або носіТестування як засобу проти артриту єм. Сполуку тестували на активність у моделі інКомпозиції винаходу можуть бути у формі, дукованого стінками стрептококових клітин у артпридатній для перорального застосування (напририту (SCW) у щурів [для подальшої інформаці диклад, як таблетки, коржі, тверді або м'які капсули, вись Carlson,R.Ρ та Jacobsen, P.B. (1999) водні або олійні суспензії, емульсії, дисперсні поЗіставлення ад'юванту та індукованого стінками рошки або гранули, сиропи або еліксири), для місстрептококових клітин у артриту у щурів. У In цевого застосування (наприклад, як креми, мазі, Models щі Inflammation in vivo, eds Morgan, D.W. та гелі або водні або олійні розчини або суспензії), Marshall, LA., BirkhauserVerlag, Basel, Switzerland]. для застосування інгаляцією (наприклад, як мілко Коротше, самиць щурів Lewis (160-180г) сенподрібнений порошок або рідкий аерозоль), для сибілізували внутрішньосуглобовою ін'єкцією 5мкг застосування інсуфляцією (наприклад, як мілко стінок стрептококових клітин (Lee Labs, PG-PS подрібнений порошок) або для парентерального 100P) у 20мкл стерильного фізіологічного розчину застосування (наприклад, як стерильний водний в ліву щиколотку. Швидкість реагування аналізуабо олійний розчин для внутрішньовенного, підвали через 3 доби і тварин рандомізували. Артрит шкірного або внутрішньом'язового дозування, або індукували через 21 добу після сенсибілізації (пояк супозиторій для ректального дозування). значено добою 0) внутрішньовенною ін'єкцією 100мкг SCW (у 500мкл стерильного фізіологічного 33 88777 34 Композиції винаходу можна отримувати звиЗгідно з подальшим аспектом заявленого вичайними способами, застосовуючи звичайні фарнаходу запропоновано спосіб лікування опосередмацевтичні наповнювачі, добре відомі в рівні техкованих продукуванням або дією цитокінів хвороб ніки. Таким чином, композиції призначені для або терапевтичних станів, котрий полягає в увеперорального застосування, можуть містити, наденні теплокровній тварині, яка цього потребує, приклад, один або більше барвників, підсолоджуінгібуючої цитокін кількості сполуки формули І або вачів, ароматизаторів та/або консервантів. її фармацевтично прийнятної солі. Кількість активної складової, що комбінується Згідно з подальшим аспектом заявленого виз одним або більше наповнювачами для отриманнаходу запропоновано спосіб інгібування продукуня одиничної форми дозування, слід обов'язково вання або дії цитокіну у теплокровної тварини, яка змінювати залежно від лікованого пацієнта та концього потребує, інгібуючою кіназу р38 кількістю кретного способу застосування. Наприклад, комсполуки формули І або її фармацевтично прийнятпозиція, призначена для перорального застосуної солі. вання людям, звичайно повинна містити, Згідно з подальшим аспектом заявленого винаприклад, 0,5мг-0,5г активного засобу, сполученаходу запропоновано застосування сполуки фоного з прийнятною та зручною кількістю наповнюрмули І або її фармацевтично прийнятної солі у вачів, котрі можуть змінюватися у межах приблизвиробництві медикаменту для застосування у ліно від 5 до 98 відсотків маси загальної композиції. куванні хвороб або терапевтичних станів, опосеДля терапевтичних або профілактичних цілей редкованих TNF, IL-1, IL-6 або lL-8. розмір дози сполуки винаходу формули І слід заЗгідно з подальшим аспектом заявленого викономірно змінювати згідно з природою та тяжкіснаходу запропоновано спосіб лікування хвороб тю станів, віком та статтю тварини або пацієнта та або терапевтичних станів, опосередкованих TNF, способом застосування згідно з добре відомими IL-1, IL-6 або IL-8, котрий полягає в уведенні теппринципами медицини. локровній тварині ефективної кількості сполуки При застосуванні сполуки формули І для тераформули І або її фармацевтично прийнятної солі. певтичних або профілактичних цілей її, звичайно, Згідно з подальшим аспектом заявленого вислід призначати таким чином, щоб денна доза бунаходу запропоновано застосування сполуки фола в діапазоні, наприклад, 0,5мг-75мг на кг маси рмули І або її фармацевтично прийнятної солі у тіла, і надавалася, якщо потрібно, у розділених виробництві медикаменту для застосування у лідозах. Взагалі, коли застосовується парентералькуванні хвороб або терапевтичних станів, опосений шлях, слід застосовувати нижчі дози. Таким редкованих TNF. чином, наприклад, внутрішньовенно, звичайно слід Згідно з подальшим аспектом заявленого визастосовувати дозу в діапазоні, наприклад, 0,5мгнаходу запропоновано спосіб лікування хвороб 30мг на кг маси тіла. Аналогічно для застосування або терапевтичних станів, опосередкованих TNF, інгаляцією слід застосовувати дозу в діапазоні, котрий полягає в уведенні теплокровній тварині наприклад, 0,5мг-25мг на кг маси тіла. Однак, пеефективної кількості сполуки формули І або її фароральне застосування є переважним, конкретно у рмацевтично прийнятної солі. формі таблетки. Звичайно, одиничні форми дозуЗгідно з подальшим аспектом заявленого вивання повинні містити приблизно 1мг-500мг сполунаходу запропоновано застосування сполуки фоки цього винаходу. рмули І або її фармацевтично прийнятної солі у Згідно з подальшим аспектом винаходу запровиробництві медикаменту для застосування у інгіпоновано сполуку формули І або її фармацевтичбуванні TNF, IL-1, IL-6 або IL-8. но прийнятна сіль для застосування у способі теЗгідно з подальшим аспектом заявленого вирапевтичного лікування людини або тварини. находу запропоновано спосіб інгібування TNF, ILЗгідно з подальшим аспектом винаходу запро1, IL-6 або IL-8, котрий полягає в уведенні теплопоновано застосування сполуки формули І або її кровній тварині ефективної кількості сполуки форфармацевтично прийнятної солі у виробництві мули І або її фармацевтично прийнятної солі. медикаменту. Згідно з подальшим аспектом заявленого виЗгідно з подальшим аспектом винаходу запронаходу запропоновано застосування сполуки фопоновано застосування сполуки формули І або її рмули І або її фармацевтично прийнятної солі у фармацевтично прийнятної солі у виробництві виробництві медикаменту для застосування у інгімедикаменту для застосування у лікуванні терапебуванні TNF. втичних станів, опосередкованих цитокінами. Згідно з подальшим аспектом заявленого виЗгідно з подальшим аспектом заявленого винаходу запропоновано спосіб інгібування TNF, находу запропоновано спосіб лікування опосередкотрий полягає в уведенні теплокровній тварині кованих цитокінами хвороб або терапевтичних ефективної кількості сполуки формули І або її фастанів, котрий полягає в уведенні теплокровній рмацевтично прийнятної солі. тварині ефективної кількості сполуки формули І Згідно з подальшим аспектом заявленого виабо її фармацевтично прийнятної солі. находу запропоновано сполуку формули І або її Згідно з подальшим аспектом заявленого вифармацевтично прийнятна сіль у виробництві менаходу запропоновано спосіб лікування опосереддикаменту для застосування у лікуванні хвороб кованих цитокінами хвороб або терапевтичних або терапевтичних станів, опосередкованих кінастанів, котрий полягає в уведенні теплокровній зою р38. тварині, яка цього потребує, інгібуючої цитокін кіЗгідно з подальшим аспектом заявленого вилькості сполуки формули І або її фармацевтично находу запропоновано спосіб лікування хвороб прийнятної солі. або терапевтичних станів, опосередкованих кіна 35 88777 36 зою р38, котрий полягає в уведенні теплокровній Сполуку формули І також можна застосовуватварині ефективної кількості сполуки формули І ти у лікуванні таких станів, як ревматоїдного артабо її фармацевтично прийнятної солі. риту, у комбінації із протиартритними засобами, Згідно з подальшим аспектом заявленого вияк-то золотом, метотрексатом, стероїдами та пенінаходу запропоновано застосування сполуки фоцилінаміном, та у таких станах, як остеоартрит, у рмули І або її фармацевтично прийнятної солі у комбінації зі стероїдами. виробництві медикаменту для застосування у проСполуку формули І також можна застосовувадукуванні інгібіторної дії кінази р38. ти у деградативних хворобах, наприклад, остеоарЗгідно з подальшим аспектом заявленого витриті, з хондрозахисними, протидеградативними находу запропоновано спосіб забезпечення інгібіта/або репаративними засобами, як-то діацерхін, торної дії кінази р38, котрий полягає в уведенні композиції гіалуронової кислоти, як-то гіалан, рутеплокровній тварині ефективної кількості сполуки малон, артепарон, та солями глюкозаміну, як-то формули І або її фармацевтично прийнятної солі. антрил. Згідно з подальшим аспектом заявленого виСполуку формули І можна застосовувати у лінаходу запропоновано застосування сполуки фокуванні астми у комбінації із протиастматичними рмули І або її фармацевтично прийнятної солі у засобами, як-то стероїдами, бронходилататорами виробництві медикаменту для застосування у літа антагоністами лейкотриєну. куванні ревматоїдного артриту, астми, хронічної Зокрема, для лікування запальних хвороб реобструктивної хвороби легень, запальної хвороби вматоїдного артриту, псоріазу, запальної хвороби кишковику, розсіяного склерозу, СНІД, септичного кишковику, хронічної обструктивної хвороби лешоку, застійної серцевої недостатності, ішемічної гень, астми та алергічного риніту сполуку заявлехвороби серця або псоріазу. ного винаходу можна комбінувати із засобами із Згідно з подальшим аспектом заявленого вигрупи: інгібітори TNF-a, анти-TNF моноклональні находу запропоновано спосіб лікування ревматоїантитіла (як-то ремікад, CDП-870 та дного артриту, астми, хронічної обструктивної хвоD.sub2.E.sub7.) та молекули TNF-рецептору імунороби легень, запальної хвороби кишковику, глобуліну (як-то Ембрел.рег.), неселективні інгібірозсіяного склерозу, СНІД, септичного шоку, затори СОХ-1/СОХ-2 (як-то піроксикам, диклофенак, стійної серцевої недостатності, ішемічної хвороби пропіонові кислоти, як-то напроксен, флубіпрофен, серця або псоріазу, котрий полягає в уведенні тефенопрофен, кетопрофен та ібупрофен, фенамаплокровній тварині ефективної кількості сполуки ти, як-то мефенамінова кислота, індометацин, суформули І або її фармацевтично прийнятної солі. ліндак, апазон, піразолони, як-то фенілбутазон, Сполуку формули І можна застосовувати у саліцилати, як-то аспірин), інгібітори СОХ-2 (як-то комбінації з іншими ліками та лікуваннями хворобмелоксикам, селекоксиб, рофекоксиб, валдекоксиб ливих станів, котрі, звичайно, могли б бути користа еторикоксиб) низька доза метотрексату, лефуними внаслідок інгібування цитокінів, зокрема, TNF номід; циклезонід; гідроксихлорхін, d-пеніциламін, та IL-1. Наприклад, сполуку формули І можна було ауранофін або парентеральне або пероральне б застосовувати у комбінації з ліками та лікуванзолото. нями ревматоїдного артриту, астми, хронічної обЗаявлений винахід також стосується комбінації структивної хвороби легень, запальної хвороби сполуки формули І з інгібітором біосинтезу лейкокишковику, розсіяного склерозу, СНІД, септичного триєну, інгібітором 5-ліпоксигенази (5-LO) або аншоку, застійної серцевої недостатності, ішемічної тагоністом активації білку 5-ліпоксигенази (FLAP), хвороби серця, псоріазу та інших хворобливих як-то леутоном; АВТ-761; фенлеутоном; тепоксастанів, названих раніше в цьому переліку. ліном; Abbott-79175; Abbott-85761; N-(5Наприклад, завдяки її здатності інгібувати цизаміщеними)-тіофен-2-алкілсульфонамідами; 2,6токіни, сполука формули І є цінною у лікуванні деди-трет-бутилфенолгідразонами; метокситетрагідяких запальних та незапальних хвороб, котрі тепер ропіранами, як-то Zeneca ZD-2138; сполукою SBлікуються нестероїдними протизапальними ліками 210661; сполуками піридиніл-заміщеного 2(NSAID) - інгібіторами циклооксигенази, як-то інціанонафталіну, як-то L-739,010; сполуками 2дометацином, кеторолаком, ацетилсиліциловою ціанохіноліну, як-то L-746,530; сполуками індолу та кислотою, ібупрофеном, суліндаком, толметином хіноліну, як-то МK-591, МK-886, та BAY x 1005. та піроксикамом. Співзастосування сполуки форЗаявлений винахід також стосується комбінації мули І заявленого винаходу з NSAID може призвосполуки формули І з антагоністом рецептору лейдити до зниження кількості останнього засобу, котриєнів LTB.sub4., LTC.sub4., LTD.sub4., та потрібного для отримання терапевтичної дії. ТаLTE.sub4., вибраним із групи: фенотіазін-3-они, якким чином, вірогідність несприятливої побічної дії то L-651,392; амідино-сполуками, як-то CGSвід NSAID, як-то шлунково-кишкової дії, зменшу25019c; бензоксаламінами, як-то онтазоластом; ється. Таким чином, згідно з подальшою ознакою бензолкарбохімідамідами, як-то BIIL 284/260; та винаходу запропоновано фармацевтичну компосполуками, як-то зафірлукастом, аблукастом, монзицію, котра містить сполуку формули І або її фателукастом, пранлукастом, верлукастом (МK-679), рмацевтично прийнятну сіль у поєднанні або суRG-12525, Ro-245913, іралукастом (CGP 45715A), міші з нестероїдним протизапальним засобом та BAY x 7195. інгібітором циклооксигенази та фармацевтично Заявлений винахід також стосується комбінації прийнятним розріджувачем або носієм. сполуки формули І з інгібітором PDE4, охоплюючи Сполуку формули І також можна застосовуваінгібітори ізоформи PDE4D. ти із протизапальними засобами, як-то інгібітором Заявлений винахід також стосується комбінації ферменту 5-ліпоксигенази. сполуки формули І з антагоністами антигістамино 37 88777 38 вого рецептору H.sub1. із групи: цетиризин, лораїп, мірапекс, інгібітори МАОВ, як-то селегін та ратадин, дезлоратадин, фексофенадин, астемізол, сагілін, інгібітори соmР, як-то тасмар, інгібітори Аазеластин та хлорфенірамін. 2, інгібітори ресорбції допаміну, антагоністи NMDA, Заявлений винахід також стосується комбінації агоністи нікотину, агоністи допаміну та інгібітори сполуки формули І з антагоністом гастрозахисного нейронної синтази оксиду нітрогену) та ліки проти рецептору H.sub2. хвороби Альцгеймера, як-то донепезил, такрин, Заявлений винахід також стосується комбінації інгібітори СОХ-2, пропентофілін або метрифонат. сполуки формули І з судинозвужувальним симпаЗаявлений винахід також стосується комбінації сполуки формули І із сполуками з групи: (і) інгібітотоміметичним засобом a.sub1.- та a.sub2.ри триптази; (іі) антагоністи фактору активації адреноміметиком з групи: пропілгекседрин, фенітромбоцитів (PAF); (iiі) інгібітори ферменту перелеприн, фенілпропаноламін, псевдоефедрин, натворення інтерлейкіну (ICE); (iv) інгібітори IMPDH; фазолін гідрохлорид, оксиметазолін гідрохлорид, (ν) інгібітори адгезії молекул, які охоплюють антатетрагідрозолін гідрохлорид, ксилометазолін гідгоністи VLA-4; (vi) катепсини; (vii) інгібітори кінази рохлорид, та етилнорепінефрин гідрохлорид. MAP; (viii) інгібітори глюкоза-6-фосфатЗаявлений винахід також стосується комбінації дегідрогенази; (іх) антагоністи кінін-B.sub1.- та сполуки формули І із протихолінергічними засобаB.sub2.-рецептору; (х) засоби проти подагри, нами із групи: іпратропіум бромід; тіотропіум бромід; приклад, колхіцин; (хі) інгібітори ксантиноксидази, окситропіум бромід; пірензепін; та телензепін. наприклад, алопуринол; (хіі) урикозуричні засоби, Заявлений винахід також стосується комбінації наприклад, пробенецид, сулфінпіразон, та бензбсполуки формули І з b.sub1 - до b.sub4.ромарон; (хііі) засоби посилення секреції гормонів адреноміметиками із групи: метапротеренол, ізоросту; (xiv) фактор транформування росту (TGFb); протеренол, ізопреналін, албутерол, салбутамол, (xv) похідний від тромбоцитів фактор росту формотерол, салметерол, тербуталін, орципрена(PDGF); (xvi) фактор росту фібробластів, наприлін, бутолтерол метилсульфонат та пірбутерол; клад, основний фактор росту фібробластів (bFGF); або метилксанінами, які охоплюють теофілін та (xvii) фактор стимуляції колоній макрофагівамінофілін; натрій хромоглікатом; або антагонісгранулоцитів (GM-CSF); (xviii) капсациновий крем; том мускаринового рецептору (М1, М2, та М3). (хіх) антагоністи рецептору тахікініну NK.sub1. та Заявлений винахід також стосується комбінації NK.sub3., вибрані із групи: ΝΚΠ-608С; SB-233412 сполуки формули І з миметиком інсулінподібного (талнетант); та D-4418; (хх) інгібітори еластази, фактору росту типу І (IGF-1). вибрані із групи: UT-77 та ZD-0892; (ххі) інгібітори Заявлений винахід також стосується комбінації перетворення ферменту TNF?- (ТАСЕ); (ххіі) інгібісполуки формули І із дихальним глюкокортикоїдом тори індукованої синтази оксиду нітрогену (iNOS) зі зниженою системною побічною дією із групи: або (ххііі) гомологічна рецептору молекула хемоапреднізон, преднізолон, флунізолід, триамцинолон трактанту, експресована на клітинах ТН2, (антагоацетонід, беклометазон дипропіонат, будезонід, ністи CRTH2). флутіказон пропіонат та мометазон фуроат. Сполуку формули І також можна застосовуваЗаявлений винахід також стосується комбінації ти у комбінації із засобами проти остеопорозу, яксполуки формули І з інгібітором матриксних метато ролоксифеном, дролоксифеном, лазофоксифелопротеаз (ММР), тобто, стромелізинів, колагеназ ном або фосомаксом та імунодепресантними зата желатиназ, а також агреканаз; особливо коласобами, як-то FK-506, рапаміцином, циклоспоригенази-1 (ММП-1), колагенази-2 (ММП-8), колагеном, азатіоприном та метотрексатом. назази-3 (ММП-13), стромелізину-1 (ММП-3), Сполуку формули І також можна застосовувастромелізину-2 (ММП-10), та стромелізину-3 ти у комбінації з існуючими терапевтичними засо(ММП-11) та ММП-12. бами для лікування остеоартриту. Придатні засоЗаявлений винахід також стосується комбінації би, застосовані у комбінації, охоплюють звичайні сполуки формули І з іншими модуляторами функнестероїдні протизапальні засоби (далі NSAID's), ції рецептору хемокіну, як-то CCR1, CCR2, CCR2A, як-то піроксикам, диклофенак, пропіоноові кислоCCR2B, CCR3, CCR4, CCR5, CCR6, CCR7, CCR8, ти, як-то напроксен, флубіпрофен, фенопрофен, CCR9, CCR10 та CCR11 (для сімейства С-С); кетопрофен та ібупрофен, фенамати, як-то мефеCXCR1, CXCR3, CXCR4 та CXCR5 (для сімейства намінову кислоту, індометацин, суліндак, апазон, С-Х-С) та CX3CR1 для сімейства С-Х3-С. піразолони, як-то фенілбутазон, саліцилати, як-то Заявлений винахід також стосується комбінації аспірин, інгібітори СОХ-2, як-то селекоксиб, валдесполуки формули І із противірусними засобами, коксиб, рофекоксиб та еторикоксиб, анальгетики як-то вірацептом, AZT, ацикловіром та фамциклота внутрішньосуглобове лікування, як-то кортиковіром та сполуками проти сепсису, як-то валантом. стероїди та гіалуронові кислоти, як-то хіалган та Заявлений винахід також стосується комбінації синвіск, та антагоністи рецептору Р2Х7. сполуки формули І із серцево-судинними засобаСполуку формули І також можна застосовувами, як-то блокаторами каналу кальцію, ліпідзнижути у комбінації з існуючими терапевтичними засовальними засобами, як-то статінами, фібратами, бами для лікування раку. Придатні засоби, застобета-блокаторами, інгібіторами Асе, антагоністами совані у комбінації, охоплюють: рецептору Ангіотензину-2 та інгібіторами агрегації (і) антиппрофілеративні/антинеопластичні ліки тромбоцитів. та їх комбінації, які застосовано у медичній онкоЗаявлений винахід також стосується комбінації логії, як-то алкілувальні засоби (наприклад, циссполуки формули І разом зі ЦНС-засобами із груплатин, карбоплатин, циклофосфамід, мустард, пи: антидепресанти (як-то сертралін), ліки проти мелфалан, хлорамбуцил, бусульфан та нітрозосехвороби Паркінсона (як-то депреніл, L-допа, реку 39 88777 40 (viii) підходи генної терапії, які містять, напричовини); антіметаболіти (наприклад, антифолати, клад, підходи до заміни аберантних генів, як-то як-то флуорпіримідини, типу 5-флуорурацилу та аберантного р53 або аберантного BRCA1 або тегафуру, ралтитрекседу, метотрексату, цитозиBRCA2, GDEPT (ген-спрямована ферментна теранарабінозиду, гідроксисечовині, геміцитабіну та пія проліками), підходи, що застосовують цитозинпаклітакселу (ТаксолÒ); протиракові антибіотики деаміназу, тимідинкіназу або фермент бактеріаль(наприклад, антрацикліни, подібні адріаміцину, ної нітроредуктази, та підходи до підвищення блеоміцину, доксорубіцину, дауноміцину, епірубітолерантності пацієнта до хіміотерапії або радіоцину, ідарубіцину, мітоміцину С, дактиноміцину та терапії, як-то генна терапія полірезистентності до мітраміцину); антимітотичні засоби (наприклад, ліків; та алкалоїди vinca, подібні вінкристину, вінбластину, (іх) імунотерапевтичні підходи, які охоплюють, віндезину та вінорелбіну, та таксоіди, подібні такнаприклад, підходи ex-vivo та in-vivo для підвисолу та таксотрену); та інгібітори топоізомерази щення імуногенності клітин пухлин пацієнта, як-то (наприклад, епіподофілотоксини, подібні етопоситрансфекція цитокінами, як-то інтерлейкіном 2, ду та теніпосиду, амсакрину, топотекану та кампінтерлейкіном 4 або фактором стимулювання кототецину); лоній грнулоцитів-макрофагів, підходи для змен(іі) цитостатичні засоби, як-то антіоестрогени шення анергії Т-клітин, підходи із застосуванням (наприклад, тамоксіфен, тореміфен, ралоксифен, трансфектованих імунних клітин, як-то цитокіндролоксифен та іодоксифен), регулятори знижентрансфектованих дендритних клітин, підходи із ня рецептору оестрогену (наприклад, фулвестзастосуванням ліній цитокін-трансфектованих клірант), антиандрогени (наприклад, бікалутамід, тин пухлин та підходи із застосуванням антиідіотифлутамід, нілутамід та ципротерон ацетат), антапічних антитіл. гоністи LHRH або агоністи LHRH (наприклад, госеПри формуванні фіксованої дози у такій комбірелін, леупрорелін та бусерелін), прогестогени нації продуктів застосовують сполуку формули І у (наприклад, мегестрол ацетат), інгібітори ароматамежах дозування, описаних тут, а інший фармацези (наприклад, як анастрозол, летрозол, воразол втично активний засіб -у межах його апробованого та ексеместан) та інгібітори 5a-редуктази, якдозування. Послідовне застосування розглядають, тофінастерид; коли комбінація композиції є неприйнятною. (ііі) Засоби, котрі інгібують інвазію клітин раку Хоч сполука формули І є корисною, головним (наприклад, інгібітори металопротеїнази, подібні чином, як терапевтичний засіб для застосування у марімастату, та інгібітори функції активатору ретеплокровних тварин (охоплюючи людину), вона цептору плазміногену урокінази); також є корисною завжди, коли є потреба інгібу(iv) інгібітори функції фактору росту, напривання дії цитокінів. Таким чином, вона є корисною клад, такі інгібітори охоплюють фактор росту антияк фармакологічний стандарт для застосування у тіла, рецептор фактору росту антитіла (наприклад, розробці нових біологічних тестів та у пошуку ноанти-еrbb2 антитіло трастузумаб [ГерцептинÔ] та вих фармакологічних засобів. антитіло анти-еrbb1 цетуксимаб [С225]), інгібітори Винахід далі ілюстровано наступними необфарнезилтрансферази, інгібітори тирозинкінази та межувальними прикладами, де, якщо не вказано інгібітори серин/треонінкінази, наприклад, інгібітоінше: ри сімейства фактору епідермального росту (на(і) операції виконували при температурі навкоприклад, інгібітори сімейства EGFR тирозинкінази, лишнього середовища, тобто в діапазоні 17-25°С як-то N-(3-хлор-4-флуорфеніл)-7-метокси-6-(3та під атмосферою інертного газу, як-то аргону, морфолінопропокси)хіназоліп-4-амін (гефітиніб, якщо не вказано інше; ZD1839), N-(3-етинілфеніл)-6,7-біс(2(іі) випарювання виконували роторним випарметоксіетокси)хіназоліп-4-амін (ерлотиніб, OSIником у вакуумі та процедури змішування викону774) та 6-акриламідо-N-(3-хлор-4-флуорфеніл)-7вали після видалення твердих залишків фільтра(3-морфолінопропокси)хіназоліп-4-амін (СІ 1033)), цією; наприклад, інгібітори сімейства похідного від (ііі) хроматографію на колонці (флештромбоцитів фактору росту, та наприклад, інгібітоспособом) та рідинна хроматографія середнього ри сімейства гепатоцитного фактору росту; тиску (СТРХ) виконували на Merck Kieselgel silica (ν) антиангіогенні засоби, як-то такі, що інгібу(Art. 9385) або Merck Lichroprep Rn-18 (Art. 9303), ють дію судинного ендотеліального фактору росту, ревесно-фазовий діоксид силіцію отримували від (наприклад, протисудинне антитіло фактору росту Ε. Merck, Darmstadt, Germany або високоефективендотеліальних клітин бевацизумаб [АвастинÔ], ну рідинну хроматографію (ВЕРХ) виконували на сполуки, розкриті у Міжнародних заявках на патент ревесно-фазовому діоксиді силіцію С18, наприWO 97/22596, WO 97/30035, WO 97/32856 та WO клад, на препаративній реверсно-фазовій колонці 98/13354) та сполуки, що діють за іншими механіDynamax С-18 60Å; змами (наприклад, ліномід, інгібітори функції aνb3 (iv) виходи надано тільки для ілюстрації і вони інтегріну та ангіостатін); не обов'язково є максимально досяжними; (vi) засоби пошкодження судин, як-то комбре(ν) структуру сполуки формули І винаходу підтастатін А4 та сполуки, розкриті у Міжнародних тверджували способами ядерного магнітного резаявках на патент WO 99/02166, WO 00/40529, WO зонансу (ЯМР) та Мас-спектрометрії; Mac00/41669, WO 01/92224, WO 02/04434 та WO спектрометричні дані бомбардуванням швидкими 02/08213; атомами (FAB) отримували, застосовуючи спект(vii) антисенсове лікування, наприклад, ті, що рометр Platform та де доцільно, отримували дані спрямовуються на цілі, описані вище, як-то ISIS позитивного або негативного іону; величини хіміч2503, анті-рас антисенс; 41 88777 42 них зсувів ЯМР вимірювали на дельта-шкалі [спектри рази ДХМ, що дає названу сполуку як білу три протонного магнітного резонансу визначали, тверду речовину (13,9г, 87%); застосовуючи спектрометр Varian Gemini 2000, що Спектр ЯМР: (ДMCOd6) 0,60 (m, 4Н), 2,25 (s, працює при силі поля 300МГц або спектрометр 3H), 2,84 (m, 1Н), 5,20 (s, 2Η), 7,14 (d, 2Н), 7,39 (m, Bruker AM250, що працює при силі поля 250МГц]; 6Н), 7,63 (d, 1Н), 7,79 (s, 1Н), 7,97 (d, 2Н), 8,37 (s, застосовували наступні абревіатури: s, синглет; d, 1Н), 9,82 (s, 1Н); Мас-спeктр: М+Н+ 399. дублет; t, триплет; q, квартет; m, мультиплет; br, 3-амiно-N-циклопропіл-4-метилбензамід, як широкий; вихідний матеріал, отримували наступним чином: (vi) точки плавлення є некорельованими та їх А) До перемішуваного розчину 4-метил-3 нітвизначали, застосовуючи прилад автоматичного робензоїлхлориду (20г) у метиленхлориді (200мл) визначення точок плавлення Mettler SP62 або мапри 0°С додавали суміш циклопропіламіну сляну баню; та (7,62мл) та триетиламіну (28мл). Суміші дозволя(vii) застосовували наступні абревіатури: ли нагріватися до кімнатної температури та переДМА Ν,Ν-диметилацетамід мішували протягом наступних 16 годин. Реакційну ДМФ Ν,Ν-диметилформамід суміш випарювали у вакуумі та додавали насичеДХМ дихлорметан ний водний розчин натрій гідрокарбонату. ОсаДМСО диметилсульфоксид джену тверду складову відфільтровували та проТГФ тетрагідрофуран мивали ізо-гексаном та сушили (магній HATU О-(7-азабензотриазол-1-іл)-N,Ν,Ν',N'сульфатом), що дає N-циклопропіл-4-метил-3тетраметилуроній гексафлуорфосфат нітробензамід як безбарвну тверду речовину DIPEA Ν,Ν'-діізопропілетиламін (22,9г); Спектр ЯМР: (ДMCOd6) 0,60 (m, 2Н), 0,72 НОВТ 1-гідроксибензотриазол гідрат (m, 2Н), 2,56 (s, 3H), 2,87 (m, 1Н), 7,60 (d, 1H), 8,06 EDAC 1-(3-диметиламінопропіл)-3(m, 1Н), 8,41 (d, 1H), 8,67 (d, 1H); Мас-спектр: М+Н+ етилкарбодіімід 221. Приклад 1 В) Суспензія N-циклопропіл-4-метил-33-{[4-(бензилокси)бензоїп]аміно}-Nнітробензаміду (22,92г) та 10% паладію на вугіллі циклопропіл-4-метилбензамід (2г) у абсолютному спирті (500мл) перемішували До розчину 4-бензилоксибензойної кислоти під атмосферою водню протягом 16 годин. Реак(11,0г, 48ммоль) у ДХМ (100мл) при 0°С додавали ційну суміш фільтрували через діатомову землю оксалілхлорид (8,4мл, 96ммоль), а потім ДМФ (CeliteÒ) та фільтрат випарювали до сухого стану, (двома краплями). Утворену суміш перемішували що дало названу сполуку як безбарвну тверду при кімнатній температурі протягом 2 годин. Суміш речовину (17,1г); Спектр ЯМР: (ДMCOd6) 0,53 (m, випарювали, що дало білу тверду речовину, котру 2Н), 0,65 (m, 2Н), 2,07 (s, 3H), 2,80 (m, 1Н), 6,92 (m, розчиняли у ДХМ (50мл). Утворений розчин дода2Н), 7,06 (d, 1H), 8,09 (d, 1H); Мас-спектр: вали порціями до перемішуваного розчину 3М+Н+191. аміно-N-циклопропіл-4-метилбензаміду (7,61г, Приклад 2 40ммоль) та піридину (7,76мл, 96ммоль) у ДХМ Згідно процедурі, аналогічній тій, що описана у (100мл) при 0°С. Утворену суміш перемішували Прикладі 1, відповідний вихідний матеріал реагупри кімнатній температурі протягом 2 годин. Твервав з оксаліл хлоридом, а потім 3-аміно-Nду складову збирали фільтрацією та промивали циклопропіл-4-метилбензамідом, що дає сполуки, описані у Таблиці 1. 43 Зауваження а) Продукт виявив наступні дані; Спектр ЯМР: (ДМСОd6) 0,57 (m, 2H), 0,69 (m, 2H), 2,29 (s, 3H), 2,86 (m, 1Н), 5,22 (s, 2Н), 7,25 (m, 1Н), 7,42 (m, 7Н), 7,62 (m, 2Н), 7,83 (s, 1Н), 8,41 (s, 1Н), 9,99 (s, 1Н); Мас-спектр: М-Н- 399. b) Продукт виявив наступні дані; Спектр ЯМР: (ДМСОd6) 0,57 (m, 2Н), 0,69 (m, 2Н), 2,28 (s, 3H), 2,86 (m, 1Н), 3,86 (m, 3H), 5,22 (s, 2Н), 7,17 (m, 1Н), 7,41 (m, 6Н), 7,63 (m, 3H), 7,79 (m, 1Н), 8,37 (m, 1Н), 9,86 (s, 1Н); Мас-спектр: М-Н- 429. Застосовану як вихідний матеріал 4(бензилокси)-3-метоксибензойну кислоту отримували наступним чином: До перемішуваного розчину 4-гідрокси-3метоксибензойної кислоти (5г, 30ммоль) у ТГФ (15мл) додавали розчин натрій гідроксиду (3г) у воді (37,5мл). Утворену суміш охолоджували до 0°С та додавали розчин бензилхлориду (4,1мл, 34,8ммоль) у ТГФ (15мл). Утвореній суміші дозволяли нагріватися до кімнатної температури, тоді нагрівали до 70°С протягом 18 годин, а тоді до 90°С протягом 4 годин. Суміш охолоджували та випарювали. Залишкову водну суміш промивали ізогексаном, тоді підкислювали 2М розчином хлоридної кислоти. Утворений осад збирали фільтрацією, промивали ізогексаном та сушили, що дало названу сполуку (5,76г, 74%); Спектр ЯМР: (ДMCOd6) 3,83 (s, 3H), 5,19 (s, 2Н), 7,14 (m, 1Н), 7,40 (m, 6Н), 7,55 (dd, 1Н), 12,69 (m, 1Н); Масспєктр: М-H- 257. c) Продукт виявив наступні дані; Спектр ЯМР: (ДМСОd6) 0,57 (m, 2H), 0,68 (m, 2H), 2,26 (m, 6H), 2,85 (m, 1H), 5,27 (β, 2Η), 7,15 (m, 1H), 7,34 (m, 2H), 7,42 (m, 2H), 7,50 (m, 2Н), 7,63 (m, 1Н), 7,78 (m, 1Н), 7,85 (m, 2Н), 8,40 (m, 1Н), 9,84 (s, 1Н): Масспектр: М+Н+ 415. d) Продукт виявив наступні дані; Спектр ЯМР: (ДMCOd6) 0,57 (m, 2H), 0,68 (m, 2H), 2,25 (s, 3H), 2,85 (m, 1Н), 5,32 (s, 2Н), 7,42 (m, 7Н), 7,65 (dd, 1H), 7,83 (m, 3H), 8,41 (d, 1Н), 9,97 (s, 1Н)); Масспектр: М+Н+ 419. 4-(бензилокси)-3-флуорбензойну кислоту, застосовану як вихідний матеріал, отримували з 4гідрокси-3-флуорбензойної кислоти, застосовуючи процедуру, аналогічну той, що застосовували для отримання 4-(бензилокси)-3-метоксибензойної кислоти; Спектр ЯМР: (ДМСОd6) 5,24 (s, 2H), 7,21 (m, 1H), 7,45 (m, 5H), 7,71 (m, 2H); Мас-спектр: МН- 245. Приклад 3 4-(бензилокси)-3-хлор-N-{5[(циклопропіламіно)карбоніл]-2метилфеніл}бензамід До розчину 4-(бензилокси)-3-хлорбензойної кислоти (1,5г, 5,73ммоль) у ДМФ (11,5мл) додавали 1-(3-диметиламінопропіл)-3-етилкарбодіімід гідрохлорид (2,2г, 11,5ммоль), гідроксибензтриазол (1,55г, 11,5ммоль) та N-метил-морфолін (2,28мл), супроводжуваний 3-аміно-N-циклопропіл4-метилбензамідом (1,09г, 5,73ммоль). Утворену суміш перемішували при кімнатній температурі протягом 48 годин. Суміш випарювали. Додавали насичений водний розчин калій карбонату, утворений осад збирали фільтрацією, промивали роз 88777 44 бавленою хлоридною кислотою, потім насиченим водним розчином калій карбонату, тоді розтирали з діетиловим етером, що дало названу сполуку як тверду речовину (2,0г, 81%); Спектр ЯМР: (ДМСОd6) 0,57 (m, 2H), 0,69 (m, 2Н), 2,27 (s, 3H), 2,85 (m, 1H), 5,35 (s, 2H), 7,39 (m, 5H), 7,51 (m, 2H), 7,65 (m, 1Н), 7,78 (m, 1Н), 7,97 (m, 1Н), 8,10 (m, 1Н), 8,40 (m, 1Н), 10,01 (s, 1Н); Мас-спектр: М+Н+ 435. 4-(бензилокси)-3-хлорбензойну кислоту, застосовану як вихідний матеріал, отримували з 4гїдрокси-3-хлорбензойної кислоти, застосовуючи процедуру, аналогічну той, що застосовували для отримання 4-(бензилокси)-3-метоксибензойної кислоти (пункт (b) у розділі Приміток Прикладу 2). Спектр ЯМР: (ДМСОd6) 5,21 (s, 2H), 7,14 (d, 1Н), 7,34 (m, 1Н), 7,41 (m, 2Н), 7,48 (m, 2Н), 7,80 (dd, 1Н), 7,92 (d, 1Н); Мас-спектр: М-Н- 261. Приклад 4 N-циклопропіл-4-метил-3-{[4-(піридин-2ілметокси)бензоїл]аміно}бензамід До перемішуваного розчину N-циклопропіл-3[(4-гідроксибензоїл)аміно]-4-метилбензаміду (500мг, 1,61ммоль) у ДМФ (2,5мл) додавали калій карбонат (446мг, 3,22ммоль). Утворену суміш перемішували при кімнатній температурі протягом 5 хвилин, додавали 2-хлорметил-піридин гідрохлорид (291мг, 1,78ммоль) та утворену суміш перемішували й нагрівали до 50°С протягом 18 годин. Суміш охолоджували до кімнатної температури та додавали насичений водний розчин калій карбонату (15мл) та етилацетат (5мл). Утворену суміш перемішували протягом 20 хвилин. Тверду речовину збирали фільтрацією, промивали насиченим водним розчином калій карбонату, етилацетатом та ізогексаном і сушили, що дало названу сполуку як тверду речовину (425мг, 60%); Спектр ЯМР: (ДМСОd6) 0,56 (m, 2Н), 0,68 (m, 2Н), 2,29 (s, 3H), 2,86 (m, 1Н), 5,33 (s, 2Н), 7,16 (m, 2Н), 7,34 (m, 2Н), 7,55 (m, 1Н), 7,62 (m, 1Н), 7,81 (s, 1H), 7,86 (m, 1Н), 7,98 (m, 2Н), 8,36 (s, 1Η), 8,60 (m, 1Η), 10,00 (s, 1Η); Мас-спектр: М+Н+ 401. N-циклопропіл-3-[(4-гідроксибензоїл)аміно]-4метилбензамід, застосований як вихідний матеріал, отримували наступним чином: До перемішуваного розчину 3-{[4(бензилокси)бензоїл]аміно}-N-циклопропіл-4метилбензаміду (11,5г, 28,8ммоль) у метанолі (250мл) додавали 10% паладій на вугіллі (1,1г) під аргоном. Атмосферу аргону заміщували гідрогеном (балон) та утворену суміш перемішували при кімнатній температурі протягом 18 годин. Суміш фільтрували через діатомову землю (ЦелітÒ) та фільтрат випарювали до сухого стану, що дало названу сполуку як безбарвну тверду речовину (8,26г, 92%); Спектр ЯМР: (ДMCOd6) 0,57 (m, 2Н), 0,68 (m, 2Н), 2,28 (s, 3H), 2,86 (m, 1Н), 6,87 (m, 2Н), 7,32 (m, 1Н), 7,62 (m, 1Н), 7,81 (s, 1Н), 7,88 (m, 2Н), 8,36 (m, 1Н), 9,74 (s, 1Н), 10,31 (s, 1Н); Мас-спeктр: М-H- 309. Приклад 5 Відповідні вихідні матеріали реагували із застосуванням процедури, аналогічній описаній у Прикладі 4, що дає сполуки, описані у Таблиці 2. 45 88777 46 47 88777 48 49 Зауваження a) Продукт виявив наступні дані; Спектр ЯМР: (ДMCOd6) 0,58 (m, 2H), 0,68 (m, 2H), 2,30 (s, 3H), 2,85 (m, 1Н), 5,37 (s, 2Н), 7,18 (m, 2Н), 7,33 (m, 1Н), 7,64 (m, 1Н), 7,83 (m, 2Н), 7,99 (m, 2Н), 8,39 (m, 1Н), 9,17 (s, 1Н), 9,90 (s, 1Н); Мас-спектр: М-Н406. b) Продукт виявив наступні дані; Спектр ЯМР: (ДMCOd6) 0,58 (m, 2H), 0,69 (m, 2H), 2,30 (s, 3H), 2,86 (m, 1Н), 5,31 (s, 2Н), 7,17 (m, 2Н), 7,33 (m, 1Н), 7,45 (m, 1Н), 7,63 (m, 1Н), 7,83 (s, 1Н), 7,91 (m, 1Н), 8,00 (m, 2Н), 8,36 (m, 1Н), 8,57 (m, 1Н), 8,71 (m, 1Н), 9,85 (s, 1H); Мас-спектр: М+Н+ 402. c) Продукт виявив наступні дані; Спектр ЯМР: (ДMCOd6) 0,57 (m, 2H), 0,68 (m, 2H), 2,28 (s, 3H), 2,44 (s, 3H), 2,85 (m, 1Н), 5,28 (s, 2Н), 6,37 (s, 1Н), 7,15 (m, 2Н), 7,31 (m, 1Н), 7,60 (m, 1Н), 7,82 (s, 1Н), 7,99 (m, 2Н), 8,41 (s, 1H), 10,40 (s, 1Η); Мас-спекгр: М-Н- 404. d) Продукт виявив наступні дані; Спектр ЯМР: (ДMCOd6) 0,58 (m, 2H), 0,68 (m, 2H), 2,29 (s, 3H), 2,86 (m, 1Н), 5,62 (s, 2Н), 7,24 (m, 2Н), 7,34 (m, 1Н), 7,64 (m, 1Н), 7,83 (s, 1Н), 8,01 (m, 2Н), 8,37 (m, 1Н), 9,95 (s, 1Н); Мас-спектр: М-Н- 441. e) Продукт виявив наступні дані; Спектр ЯМР: (ДMCOd6) 0,56 (m, 2H), 0,66 (m, 2H), 2,27 (s, 3H), 2,84 (m, 1Н), 5,32 (s, 2Н), 6,89 (m, 1Н), 7,24 (m, 4Н), 7,56 (m, 2Н), 7,81 (s, 1 Η), 7,98 (m, 3H), 8,38 (m, 1Н), 8,53 (m, 1Н), 9,94 (s, 1Η); Мас-спекгр: М+Н+ 441. f) Продукт виявив наступні дані; Спектр ЯМР: (ДМСОd6) 0,56 (m, 2Н), 0,67 (m, 2H), 2,28 (s, 3H), 2,68 (s, 3H), 2,84 (m, 1Н), 5,21 (s, 2Н), 7,15 (m, 2Н), 7,32 (m, 1Н), 7,61 (m, 2Н), 7,81 (s, 1Н), 7,97 (d, 2Н), 8,37 (m, 1Н), 9,88 (s, 1H); Мас-спектр: М+Н+ 422. g) Продукт виявив наступні дані; Спектр ЯМР: (ДМСОd6) 0,58 (m, 2H), 0,69 (m, 2H), 2,25 (s, 3H), 2,26 (m, 3H), 2,45 (s, 3H), 2,85 (m, 1Н), 5,04 (s, 2H), 7,15 (d, 2H), 7,34 (d, 1H), 7,64 (m, 1Н), 7,82 (s, 1Н), 88777 50 8,00 (d, 2Н), 8,37 (m, 1Н), 9,85 (s, 1H); Мас-спектр: М+Н+ 420. h) Продукт виявив наступні дані; Спектр ЯМР: (ДМСОd6) 0,57 (m, 2H), 0,69 (m, 2Н), 2,29 (s, 3H), 2,86 (m, 1Н), 5,58 (s, 2Н), 7,20 (d, 2Н), 7,34 (d, 1Н), 7,64 (m, 1Н), 7,82 (s, 1Н), 8,00 (d, 2H), 8,37 (d, 1H), 9,01 (s, 1H), 9,87 (s, 1H); Мас-спектр: М-Н- 407. і) Продукт виявив наступні дані; Спектр ЯМР: (ДМСОd6) 0,58 (m, 2H), 0,69 (m, 2H), 2,29 (s, 3H), 2,86 (m, 1Н), 3,85 (s, 3H), 5,30 (s, 2Н), 6,84 (d, 1Н), 7,18 (d, 2Н), 7,33 (m, 2Н), 7,64 (m, 1Н), 7,82 (s, 1Н), 7,99 (d, 2Н), 8,37 (m, 1Н), 9,88 (s, 1Н); Мас-спектр: М-Н- 447. j) Продукт виявив наступні дані; Спектр ЯМР: (ДМСОd6) 0,57 (m, 2H), 0,69 (m, 2H), 2,28 (s, 3H), 2,86 (m, 1Н), 5,47 (s, 2Н), 7,17 (d, 2Н), 7,34 (d, 1Н), 7,64 (d, 1Н), 7,80 (m, 1Н), 7,85 (m, 1Н), 7,99 (m, 2Н), 8,37 (m, 1Н), 9,87 (s, 1H); Мас-спектр: М-Н- 440. k) Продукт виявив наступні дані; Спектр ЯМР: (ДМСОd6) 0,58 (m, 2H), 0,69 (m, 2H), 2,29 (s, 3H), 2,86 (m, 1Н), 5,34 (s, 2Н), 7,29 (m, 1Н), 7,35 (m, 1Н), 7,47 (m, 1Н), 7,60 (m, 1Н), 7,66 (m, 2Н), 7,82 (m, 2Н), 8,38 (m, 1Н), 9,15 (m, 1Н), 9,99 (s, 1Н); Масспектр: М+Н+ 408. N-циклопропіл-3-[(3-гідроксибензоїл)аміно]-4метилбензамід, застосований як вихідний матеріал, отримували з 3-{[3-(бензилокси)бензоїл]аміно}N-циклопропіл-4-метилбензаміду, застосовуючи процедуру, аналогічну той, що застосовували для отримання N-циклопропіл-3-[(4гідроксибензоїл)аміно]-4-метилбензаміду (Спосіб розділу Прикладу 4). Продукт виявив наступні дані; Спектр ЯМР: (ДМСОd6) 0,57 (m, 2H), 0,69 (m, 2Н), 2,26 (s, 3H), 2,86 (m, 1H), 6,99 (dd, 1H), 7,37 (dd, 4H), 7,64 (dd, 1H), 7,80 (d, 1Н), 8,37 (d, 1Н), 9,80 (d, 2Н); Мас-спектр: М-Н- 309. І) Продукт виявив наступні дані; Спектр ЯМР: (ДMCOd6) 0,58 (m, 2H), 0,69 (m, 2H), 2,29 (s, 3H), 2,67 (m, 3H), 2,86 (m, 1Н), 5,22 (s, 2Н), 7,27 (m, 1Н), 51 88777 52 7,35 (m, 1Н), 7,46 (m, 1Н), 7,58 (m, 2Н), 7,65 (m, 8,40 (m, 1Н), 9,72 (s, 1H), 10,02 (s, 1H); Мас-спектр: 2Н), 7,81 (m, 1Н), 8,38 (m, 1Н), 9,99 (s, 1Н): МасМ+Н+ 325. + спектр: М+Н 422. t) Продуют виявив наступні дані; Спектр ЯМР: m) Продукт виявив наступні дані; Спектр ЯМР: (ДMCOd6) 0,57 (m, 2Н), 0,69 (m, 2Н), 2,26 (m, 6Н), (ДМСОd6) 0,57 (m, 2H), 0,69 (m, 2H), 2,29 (s, 3H), 2,86 (m, 1Н), 5,38 (s, 2Н), 7,24 (m, 1Н), 7,33 (m, 1Н), 2,86 (m, 1Н), 5,30 (s, 2Н), 7,27 (m, 1Н), 7,36 (m, 2Н), 7,63 (m, 1Н), 7,83 (m, 4Н), 8,37 (m, 1Н), 9,15 (m, 7,47 (m, 1Н), 7,61 (m, 4Н), 7,81 (m, 1Н), 7,86 (m, 1Н), 9,84 (s, 1H); Мас-спектр: М+Н+ 422. 1Н), 8,38 (m, 1Н), 8,60 (m, 1Н), 9,98 (m, 1Н); Масu) Продукт виявив наступні дані; Спектр ЯМР: спектр: М+Н+ 402. (ДMCOd6) 0,57 (m, 2H), 0,68 (m, 2H), 2,24 (m,6Н), n) Продукт виявив наступні дані; Спектр ЯМР: 2,68 (m, 3H), 2,86 (m, 1Н), 5,25 (s, 2Н), 7,22 (m, 1Н), (ДМСОd6) 0,57 (m, 2H), 0,69 (m, 2H), 2,25 (s, 3H), 7,33 (m, 1Н), 7,59 (s, 1Н), 7,64 (m, 1Н), 7,79 (m, 1Н), 2,27 (s, 3H), 2,44 (s, 3H), 2,86 (m, 1Н), 5,02 (s, 2Н), 7,85 (m, 2Н), 8,40 (m, 1 Η), 9,85 (s, 1H); Мас-спектр: 6,90 (s, 1Н), 7,24 (m, 1Н), 7,35 (d, 1Н), 7,47 (t, 1Н), М+Н+ 436. 7,63 (m, 2Н), 7,80 (d, 1H), 8,38 (d, 1H), 9,97 (s, 1H); ν) Продукт виявив наступні дані; Спектр ЯМР: Мас-спектр: М+Н+ 442. (ДMCOd6) 0,57 (m, 2H), 0,70 (m, 2H), 2,22 (s, 3H), о) Продукт виявив наступні дані; Мас-спектр: 2,28 (s, 6Н), 2,46 (s, 3H), 2,85 (m, 1Н), 5,06 (s, 2Н), 7,19 (m, 1Н), 7,34 (m, 1Н), 7,64 (m, 1Н), 7,85 (m, М-Н- 407. 3H), 8,43 (m, 1Н), 9,84 (m, 1Н); Мас-спектр: М+Н+ р) Продукт виявив наступні дані; Спектр ЯМР: 434. (ДМСОd6) 0,57 (m, 2H), 0,69 (m, 2H), 2,27 (s, 3H), w) Продукт виявив наступні дані; Спектр ЯМР: 2,86 (m, 1Н), 5,46 (s, 2Н), 7,27 (dd, 1Н), 7,35 (d, 1Н), (ДМСОd6) 0,57 (m, 2H), 0,68 (m, 2H), 2,27 (s, 3H), 7,48 (m, 1Н), 7,64 (m, 3H), 7,82 (m, 2Н), 8,38 (d, 1Н), 2,31 (s, 3H), 2,85 (m, 1Н), 5,60 (s, 2Н), 7,20 (m, 1Н), 9,98 (s, 1Н); Мас-спектр: М+Н+ 409. 7,33 (m, 1Н), 7,63 (m, 1Н), 7,79 (m, 1Н), 7,86 (m, q) Продукт виявив наступні дані; Спектр ЯМР: 2Н), 8,41 (m, 1Н), 9,03 (s, 1Н), 9,87 (s, 1Н); Мас(ДМСОd6) 0,57 (m, 2H), 0,68 (m, 2H), 2,27 (s, 3H), спектр: М+Н+ 423. 2,86 (m, 1Н), 3,90 (s, 3H), 5,29 (s, 2Н), 7,17 (d, 1Н), х) Продукт виявив наступні дані; Спектр ЯМР: 7,36 (m, 2Н), 7,59 (m, 4Н), 7,79 (m, 1Н), 7,87 (m, (ДMCOd6) 0,57 (m, 2H), 0,69 (m, 2H), 2,23 (s, 3H), 1Н), 8,42 (m, 1Н), 8,60 (m, 1Н), 9,98 (s, 1Н): Мас2,25 (m, 3H), 2,85 (m, 1Н), 3,81 (m, 3H), 5,31 (s, 2Н), спектр: М+Н+ 432. 6,84 (m, 1Н), 7,24 (m, 1Н), 7,33 (m, 2Н), 7,64 (m, N-{5-[(циклопропіламіно)карбоніл]-21Н), 7,78 (m, 1Н), 7,86 (m, 2Н), 8,40 (m, 1Н), 9,87 (s, метилфеніл}-4-гідрокси-3-метоксибензамід, засто1Н): Мас-спєктр: М+Н+ 463. сований як вихідний матеріал, отримували з 4у) Продукт виявив наступні дані; Спектр ЯМР: (бензилокси)-N-{5-[(циклопропіламіно)карбоніл]-2(ДМСОd6) 0,57 (m, 2H), 0,68 (m, 2H), 2,28 (s, 3H), метилфеніл}-3-метоксибензаміду, застосовуючи 2,86 (m, 1Н), 5,41 (s, 2Н), 7,38 (m, 3H), 7,56 (m, 1Н), процедуру, аналогічну той, що застосовували для 7,64 (m, 1Н), 7,84 (m, 4Н), 8,40 (m, 1Н), 8,61 (m, отримання N-циклопропіл-3-[(41Н), 10,04 (m, 1Н): Мас-спектр: М+Н+ 420. гідроксибензоїл)аміно]-4-метилбензаміду (Способи N-{5-[(циклопропіламіно)карбоніл]-2розділу Прикладу 4). Продукт виявив наступні дані; метилфеніл}-3-флуор-4-гідроксибензамід, застоСпектр ЯМР: (ДМСОd6) 0,57 (m, 2Н), 0,69 (m, 2Н), сований як вихідний матеріал, отримували з 42,28 (s, 3H), 2,86 (m, 1Н), 3,85 (s, 3H), 6,88 (d, 1H), (бензилокси)-3-флуор-N-{57,33 (d, 1H), 7,52 (dd, 1H), 7,57 (d, 1H), 7,64 (dd, [(циклопропіламіно)карбоніл]-21H), 7,79 (d, 1Н), 8,36 (d, 1Н), 9,63 (s, 1Н), 9,74 (s, метилфеніл}бензаміду, застосовуючи процедуру, 1Н); Мас-спектр: М+Н+ 341. аналогічну той, що застосовували для отримання r) Продукт виявив наступні дані; Спектр ЯМР: N-циклопропіл-3-[(4-гідроксибензоїл)аміно]-4(ДМСОd6) 0,57 (m, 2H), 0,68 (m, 2H), 2,28 (s, 3H), метилбензаміду (Способи розділу Прикладу 4). 2,86 (m, 1Н), 3,87 (s, 3H), 5,32 (s, 2Н), 7,25 (d, 1Н), Продукт виявив наступні дані; Спектр ЯМР: 7,33 (m, 1Н), 7,62 (m, 3H), 7,81 (m, 2Н), 8,42 (m, (ДМСОd6) 0,57 (m, 2Н), 0,68 (m, 2Н), 2,28 (s, 3H), 1Н), 9,16 (m, 1Н), 10,04 (s, 1H): Мас-спектр: М+Н+ 2,85 (m, 1Н), 7,08 (m, 1H), 7,33 (m, 1H), 7,64 (m, 438. 1H), 7,72 (m, 1H), 7,80 (m, 2H), 8,37 (m, 1H), 9,84 (s, s) Продукт виявив наступні дані; Спектр ЯМР: 1Н), 10,60 (m, 1Н); Мас-спектр: М-Н- 327. (ДМСОd6) 0,57 (m, 2H), 0,69 (m, 2H), 2,28 (s, 3H), 2,35 (s, 3H), 2,86 (m, 1Н), 5,33 (s, 2Н), 7,14 (m, 1Н), z) Продукт виявив наступні дані; Спектр ЯМР: 7,35 (m, 2Н), 7,56 (m, 2Н), 7,64 (m, 2Н), 7,83 (m, (ДМСОd6) 0,57 (m, 2H), 0,68 (m, 2H), 2,28 (s, 3H), 4Н), 8,36 (m, 1Н), 8,61 (m, 1Н), 9,81 (s, 1Н); Мас2,67 (m, 4Н), 2,85 (m, 1Н), 5,31 (s, 2Н), 7,35 (m, 1Н), спектр: М+Н+ 416. 7,48 (m, 1Н), 7,65 (m, 2Н), 7,80 (s, 1Н), 7,86 (m, 2Н), N-{5-[(циклопропіламіно)карбоніл]-29,99 (s, 1H); Мас-спектр: М+Н+ 440. метилфеніл}-4-гідрокси-3-метилбензамід, застосоaa) Продукт виявив наступні дані; Спектр ЯМР: ваний як вихідний матеріал, отримували з 4(ДMCOd6) 0,57 (m, 2H), 0,69 (m, 2Н), 2,28 (s, 6Н), (бензилокси)-N-{5-[(циклопропіламіно)карбоніл]-22,46 (s, 3H), 2,86 (m, 1Н), 5,15 (s, 2Н), 7,34 (d, 1H), метилфеніл}-3-метилбензаміду, застосовуючи 7,44 (t, 1H), 7,64 (m, 1Н), 7,80 (m, 1Н), 7,87 (m, 2Н), процедуру, аналогічну той, що застосовували для 8,37 (m, 1Н), 9,95 (m, 1Н); Мас-спектр: М+Н+ 438. отримання N-циклопропіл-3-[(4ab) Продукт виявив наступні дані; Спектр ЯМР: гідроксибензоїл)аміно]-4-метилбензаміду (Способи (ДMCOd6) 0,57 (m, 2Н), 0,69 (m, 2Н), 2,28 (s, 3H), розділу Прикладу 4). Продукт виявив наступні дані; 2,85 (m, 1Н), 5,68 (s, 2Н), 7,35 (m, 1Н), 7,47 (m, 1Н), Спектр ЯМР: (ДМСОd6) 0,56 (m, 2H), 0,68 (m, 2H), 7,65 (m, 1Н), 7,81 (s, 1Н), 7,87 (m, 2Н), 8,37 (m, 1Н), 2,21 (s, 3H), 2,27 (s, 3H), 2,85 (d, 1Н), 6,87 (m, 1Н), 9,01 (s, 1Н), 9,97 (s, 1Н); Мас-спектр: М-Н- 425. 7,32 (m, 1Н), 7,62 (m, 1Н), 7,70 (m, 1Н), 7,79 (s, 2H), 53 88777 54 ac) Продукт виявив наступні дані; Спектр ЯМР: 7,62 (dd, 1H), 7,69 (d, 1Н), 7,98 (d, 2Н), 8,35 (m, 2Н), (ДMCOd6) 0,57 (m, 2H), 0,69 (m, 2Н), 2,28 (s, 3H), 9,09 (s, 1H), 9,82 (s, 1H); Мас-спектр: М+Н+ 460. 2,86 (m, 1Н), 5,44 (s, 2Н), 7,34 (m, 1Н), 7,50 (m, 1Н), Метил 2-хлорметилнікотинат, застосований як 7,65 (m, 1Н), 7,79 (m, 1Н), 7,86 (m, 3H), 8,37 (m, вихідний матеріал, отримували згідно з Chem. Ber. (1987) 120, 649. 1Н), 9,16 (m, 1Н), 9,94 (m, 1Н); Мас-спектр: М-НПриклад 6 424. N-циклопропіл-3-({4-[(4-метоксипіридин-2ad) Продукт виявив наступні дані; Спектр ЯМР: іл)метокси]бензоїл}аміно)-4-метилбензамід (ДМСОd6) 0,57 (m, 2H), 0,69 (m, 2Н), 2,26 (s, 3H), До перемішуваного розчину N-циклопропіл-32,86 (m, 1Н), 5,40 (s, 2Н), 6,91 (td, 1Н), 7,27 (ddd, [(4-гідроксибензоїл)аміно]-4-метилбензаміду 1Н), 7,34 (m, 1Н), 7,55 (t, 2Н), 7,65 (dd, 1Н), 7,79 (d, (200мг, 0,64ммоль) та 4-метокси-21Н), 7,85 (m, 2Н), 8,08 (s, 1Н), 8,37 (d, 1Н), 8,55 (m, гідроксиметилпіридину (500мг, 3,6ммоль) у сухому 1Н), 9,91 (s, 1H); Мас-спектр: М+Н+ 459 ТГФ (25мл) під атмосферою аргону додавали поae) Продукт виявив наступні дані; Спектр ЯМР: слідовно трибутилфосфін (500мг, 2,5ммоль) та ди(ДМСОd6) 0,57 (m, 2H), 0,68 (m, 2Н), 2,27 (s, 3H), ізопропіл азодикарбоксилат (500мг, 2,5ммоль). 2,86 (m, 1Н), 5,42 (s, 2Н), 7,33 (m, 1Н), 7,39 (m, 2Н), Суміш перемішували при 20°С протягом 16 годин, 7,61 (m, 2Н), 7,79 (m, 1Н), 7,89 (m, 1Н), 7,97 (m, тоді розчинник випарювали під зниженим тиском 1Н), 8,12 (m, 1Н), 8,36 (m, 1Н), 8,61 (m, 1Н), 9,98 та осад очищали хроматографією на колонці з (m, 1Н); Мас-спектр: М+Н+ 436. оксидом силіцію, елюючи з градієнтом 0-10% ме3-хлор-N-{5-[(циклопропіламіно)карбоніл]-2танолу у етилацетаті, що дало названу сполуку як метилфеніл}-4-гідроксибензамід, застосований як білу тверду речовину (100мг); Спектр ЯМР: вихідний матеріал, отримували з 4-(бензилокси)-3(ДМСОd6) 1,55 (m, 2Н), 1,65 (m, 2Н), 2,25 (s, 3H), хлор-N-{5-[(циклопропіламіно)карбоніл]-22,85 (m, 1Н), 3,85 (s, 3H), 5,20 (s, 2H), 6,95 (dd, 1H), метилфеніл}бензаміду, застосовуючи процедуру, 7,05 (d, 1H), 7,15 (d, 2H), 7,30 (d, 1H), 7,60 (dd, 1H), аналогічну той, що застосовували для отримання 7,80 (s, 1H), 7,95 (d, 2H), 8,35 (d, 1H), 8,40 (широN-циклопропіл-3-[(4-гідроксибензоїл)аміно]-4кий s, 1H), 9,80 (s, 1H); Мас-спектр: М+Н+ 432. метилбензаміду (Способи розділу Прикладу 4) за 4-метокси-2-гідроксиметилпіридин, застосовавинятком застосування етилацетату як розчиннику ний як вихідний матеріал, отримували згідно з J. замість метанолу Продукт виявив наступні дані; Med. Chem. (1995) 38, 4910. Спектр ЯМР: (ДМСОd6) 0,57 (m, 2Н), 0,69 (m, 2Н), Приклад 7 2,28 (s, 3H), 2,86 (m, 1H), 7,08 (m, 1Н), 7,33 (m, 1H), N-{5-[(циклопропіламіно)карбоніл]-27,64 (m, 1H), 7,80 (m, 2H), 8,03 (m, 1H), 8,36 (m, метилфеніл}-3,5-дифлуор-4-(піридин-21H), 9,87 (s, 1H), 10,79 (m, 1Н); Мас-спектр: М-Нілметокси)бензамід 343. Суміш N-{5-[(циклопропіламіно)карбоніл]-2af) Продукт виявив наступні дані; Спектр ЯМР: метилфеніл}-3,4,5-трифлуорбензаміду (100мг, (ДМСОd6) 0,57 (m, 2H), 0,68 (m, 2H), 2,28 (s, 3H), 0,29ммоль), 2-піридинілметанолу (400мкл) та калій 2,86 (m, 1H), 5,46 (s, 2H), 7,33 (d, 1H), 7,48 (d, 1H), т-бутоксиду (32мг, 0,29ммоль) у ΝΜΡ (600мкл) 7,62 (dd, 1H), 7,79 (d, 1H), 7,86 (d, 1H), 7,98 (dd, нагрівали в мікроволновій печі при 180°С протягом 1H), 8,10 (d, 1H), 8,36 (d, 1H), 9,16 (d, 1H), 9,98 (s, 5 годин. Реакційну суміш охолоджували та розпо1H); Мас-спектр: М-Н- 424. діляли між насиченим водним натрій гідрокарбоаg) Продукт виявив наступні дані: Спектр ЯМР: натом та етилацетатом. Органічну фазу промива(ДМСОd6) 0,57 (m, 2H), 0,68 (m, 2Н), 1,04 (m, 2Н), ли розбавленою водною лимонною кислотою. 1,23 (m, 2Н), 2,33 (s, 3H), 2,85 (m, 1H), 5,68 (s, 1H), Випарювання етилацетату дало забруднений про5,77 (s, 1H), 7,20 (d, 2Н), 7,34 (d, 1Н), 7,64 (d, 1Н), дукт, котрий очищали на хроматографічній колонці 7,80 (s, 1Н), 7,98 (d, 2Н), 8,41 (d, 1Н), 8,42 (s, 1Н), з оксидом силіцію, з елюванням 0-100% етилаце9,90 (s, 1Н); Мас-спектр: М+Н+ 449. татом в ізогексані. Розчинники випарювали, що ah) Продукт виявив наступні дані: Спектр ЯМР: дає осад, котрий розчиняли у етилацетаті, тоді (ДMCOd6) 0,57 (m, 2H), 0,69 (m, 2Н), 2,26 (s, 3H), екстрагували розбавленою хлоридною кислотою. 2,86 (m, 1Н), 5,29 (s, 2Н), 7,18 (d, 2Н), 7,33 (d, 1Н), Водні екстракти підлужували насиченим водним 7,59 (m, 1Н), 7,64 (m, 2Н), 7,82 (m, 2Н), 8,00 (m, розчином натрій гідрокарбонату та тоді екстрагу2Н), 8,37 (m, 1Н), 9,86 (s, 1H); Мас-спектр: М+Н+ вали етилацетатом, що дало названу сполуку як 482. тверду речовину (29мг, 23%); Спектр ЯМР: аі) Продукт виявив наступні дані: Спектр ЯМР: (ДMCOd6) 0,58 (m, 2Н), 0,69 (m, 2Н), 2,25 (s, 3H), (ДМСОd6) 0,57 (m, 2H), 0,69 (m, 2H), 2,26 (s, 3H), 2,85 (m, 1Н), 5,36 (s, 2Н), 7,37 (m, 2Н), 7,64 (m, 2Н), 2,86 (m, 1Н), 5,23 (s, 2Н), 7,16 (d, 2Н), 7,23 (d, 1Н), 7,84 (m, 4Н), 8,40 (m, 1Н), 8,56 (m, 1Н), 10,14 (s, 7,33 (m, 2Н), 7,64 (m, 1Н), 7,73 (m, 1Н), 7,80 (d, 1Н), 1H); Мас-спектр: М-Н- 436. 8,37 (m, 1Н), 9,83 (s, 1Н); Мас-спектр: М+Н+ 416. N-{5-[(циклопропіламіно)карбоніл]-2aj) Продукт виявив наступні дані: Спектр ЯМР: метилфеніл}-3,4,5-трифлуорбензамід, застосова(ДМСОd6) 0,62 (m, 2H), 0,85 (m, 2H) 2,40 (s, 3H), ний як вихідний матеріал, отримували наступним 2,88 (m, 1Н), 3,07 (s, 3H), 5,25 (s, 1Н), 6,40 (s, 1Н), чином: 7,08 (d, 2Н), 7,28 (m, 1Н), 7,62 (d, 1Н), 7,65 (d, 2Н), До розчину 3-аміно-N-циклопропіл-47,70 (s, 1Н), 7,88 (d, 2Н), 7,98 (d, 2Н), 8,40 (s, 1Н); метилбензаміду (1,06г, 5,58ммоль) у ДМФ (11mL) Мас-спектр: M+Na+ 501. додавали трифлуорбензойну кислоту (0,983мг, ak) Продукт виявив наступні дані: Спектр ЯМР: 5,58ммоль), НОВТ (1,51г, 11,2ммоль) та EDAC (ДМСОd6) 0,56 (m, 2H), 0,68 (m, 2Н), 2,24 (s, 3H), гідрохлорид (2,14г, 11,2ммоль) та утворену суміш 2,84 (m, 1H), 5,38 (s, 2H), 7,16 (d, 2H), 7,31 (d, 1H), перемішували протягом 16 годин. Додавали наси 55 88777 56 чений водний натрій гідрокарбонат та названу N-циклопропіл-3-({3-[(4-метоксипіридин-2сполуку відфільтровували (1,70г, 88%). іл)метокси]бензоїл}аміно)-4-метилбензамід Приклад 8 До перемішуваного розчину N-циклопропіл-3N-циклопропіл-4-метил-3-({4-[(3-метилпіридин[(3-гідроксибензоїл)аміно]-4-метилбензаміду 2-іл)метокси]бензоїл}аміно)бензамід (200мг, 0,65ммоль) в ацетонітрилі (50мл) додаваДо (3-метилпіридин-2-іл)метанолу (157мг, ли безводний калій карбонат (220мг, 1,59ммоль) 1,272ммоль) у ДХМ (5мл) додавали тіонілхлорид та 4-метокси-2-хлорметил-піридин гідрохлорид (200мкл) та суміш перемішували й нагрівали з де(150мг, 0,75ммоль). Суміш перемішували під дефлегматором протягом 4 годин. Суміш випарювафлегматором протягом 16 годин, тоді фільтрували ли до сухого стану. До осаду додавали Nта розчинник випарювали під зниженим тиском, циклопропіл-3-[(4-гідроксибензоїл)аміно]-4що дає смолу, котру розчиняли у етилацетаметилбензамід (197мг, 0,636ммоль) та калій карті/метанолі (19:1, 20мл) та очищали хроматографібонат (176мг, 1,27ммоль) у в ацетонітрилі (5мл) та єю на оксиді силіцію, елюючи етилацетаутворену суміш нагрівали при 80°С протягом 16 том/метанолом (9:1), що дає сполук як білу тверду годин. Реакційну суміш охолоджували та розподіречовину (250мг, 90%); Спектр ЯМР: (CDCI3) 0,60 ляли між насиченим водним натрій гідрокарбона(m, 2Н), 0,80 (m, 2Н), 2,32 (s, 3H), 2,86 (m, 1Н), 3,85 том та етилацетатом. Органічну фазу концентру(s, 3H), 5,19 (s, 2H), 6,67 (s, 1H), 6,75 (dd, 1H), 7,04 вали під зниженим тиском. Осадження із ДХМ у (d, 1H), 7,17 (dd, 1Н), 7,21 (d, 1H), 7,38 (dd, 1H), діетиловому етері дало названу сполуку як тверду 7,48 (d, 1H), 7,54 (m, 2H), 8,02 (s, 1H), 8,14 (s, 1H), речовину (270мг); Спектр ЯМР: (ДМСОd6) 0,57 (m, 8,40 (d, 1Н); Мас-спектр: М+Н+ 432. 2Н), 0,68 (m, 2Н), 2,26 (s, 3H), 2,40 (s, 3H), 2,86 (m, 4-метокси-2-хлорметил-піридин гідрохлорид, 1Н), 5,30 (s, 2H), 7,17 (d, 2H), 7,33 (m, 2H), 7,65 (m, застосований як вихідний матеріал, отримували 2H), 7,82 (s, 1H), 7,97 (d, 2H), 8,39 (m, 2Н), 9,81 (s, згідно з J. Med. Chem. (1995) 38,4913. 1H); Мас-спекгр: М+Н+ 416. Приклад 12 Приклад 9 N-циклопропіл-3-({4-[(5-гідроксипіридин-2N-циклопропіл-4-метил-3-{[4-(піримідин-2іл)метокси]бензоїл}аміно)-4-метилбензамід гідроілметокси)бензоїл]аміно}бензамід бромід Названу сполуку отримували з 2До перемішуваного розчину N-циклопропіл-4піримідинметанолу та N-циклопропіл-3-[(4метил-3-{[4-(5-бензилоксипіридин-2гідроксибензоїл)аміно]-4-метилбензаміду згідно зі ілметокси)бензоїл]аміно}бензаміду (1,0г, способом, застосованим для отримання в Прикла1,97ммоль) у льодяній оцтовій кислоті (10мл) доді 8, що дало названу сполуку як тверду речовину давали розчин HBr (48% у оцтовій кислоті, 30мл). (149мг, 58%); Спектр ЯМР: (ДМСОd6) 0,56 (m, 2Н), Через 6 годин при 25°С розчин розбавляли етером 0,67 (m, 2Н), 2,24 (s, 3H), 2,84 (m, 1H), 5,37 (s, 2H), (100мл) та утворений осад відфільтровували та 7,09 (d, 2H), 7,31 (d, 1H), 7,47 (m, 1H), 7,61 (m, 1H), сушили, що дало названу сполуку як блідо-жовту 7,78 (d, 1H), 7,93 (d, 2H), 8,35 (m, 1H), 8,83 (m, 2H), тверду речовину (610мг, 62%); Спектр ЯМР: 9,80 (s, 1H); Мас-спектр: М+Н+ 403. (ДМСОd6) 0,56 (m, 2Н), 0,68 (m, 2Н), 2,25 (s, 3H), Приклад 10 2,84 (m, 1H), 5,36 (s, 2H), 7,18 (d, 2H), 7,31 (d, 1H), N-циклопропіл-4-метил-3-{[4-(піридазин-37,63 (dd, 1Н), 7,78-7,84 (m, 3H), 8,00 (d, 2Н), 8,36 ілметокси)бензоїл]аміно}бензамід (m, 2Н), 9,86 (s, 1Н); Мас-спектр: М+Н+ 418. До розчину 3-піридазинілметанолу (140мг, N-циклопропіл-4-метил-3-{[4-(51,27ммоль) у ДХМ (5мл) додавали тіонілхлорид бензилоксипіридин-2(103мкл, 1,42ммоль) та утворену суміш перемішуілметокси)бензоїл]аміно}бензамід, застосований вали при кімнатній температурі протягом 4 годин. як вихідний матеріал, отримували з 5Розчинник випарювали під зниженим тиском та бензилоксипірид-2-ілметанолу (отриманого згідно тоді до осаду у ДМСО (4мл) додавали Мз J.Med. Chem. (1977), 20, 1261) та N-циклопропілциклопропіл-3-[(4-гідроксибензоїл)аміно]-43-[(4-гідроксибензоїл)аміно]-4-метилбензаміду метилбензамід (197мг, 0,636ммоль), цезій карбоспособом, застосованим для отримання Nнат (621мг, 1,91ммоль) та тетрабутиламоній йодид циклопропіл-3-[(4-{[5-(1,3-діоксолан-2(235мг, 0,636ммоль), і утворену суміш перемішуілметокси)піридин-2-іл]метокси}бензоїл)аміно]-4вали при 60°С протягом 16 годин. Реакційну суміш метилбензаміду (Приклад 14). додавали до 20г SCX-колонки та продукт елювали Приклад 13 метанолом. Концентрування під зниженим тиском N-циклопропіл-4-метил-3-({4-[(1дало забруднений продукт, котрий подалі очищали оксидопіридин-2на хроматографічній колонці з оксидом силіцію, іл)метокси]бензоїл}аміно)бензамід елюючи 0-20% метанолом/1% амоній гідроксидом N-циклопропіл-4-метил-3-{[4-(піридин-2SG 0,88 у етилацетаті. Випарювання та розтиранілметокси)бензоіл]аміно}бензамід (200мг, ня із ДХМ та діетиловим етером і фільтрація дало 0,5ммоль) розчиняли в дихлорметані (50мл) та названу сполуку як тверду речовину (15мг, 5,9%); перемішували поки додавали 3-хлорпербензойну Спектр ЯМР: (ДМСОd6) 0,57 (m, 2Н), 0,68 (m, 2Н), кислоту (85%, 200мг). Розчин перемішували протя2,26 (s, 3H), 2,86 (m, 1H), 5,54 (s, 2Н), 7,21 (d, 2Н), гом однієї години при 25°С, тоді промивали двічі 7,34 (d, 1Н), 7,64 (m, 1Н), 7,79 (m, 2Н), 7,86 (m, 1Н), розчином натрій гідрокарбонату та сушили. Роз7,99 (m, 2Н), 8,37 (m, 1Н), 9,24 (m, 1Н), 9,86 (s, 1Н); чинник випарювали, що дало названу сполуку як білу тверду речовину (120мг); Спектр ЯМР: Мас-спектр: М-Н- 401. (ДМСОd6) 0,56 (m, 2Н), 0,68 (m, 2Н), 2,24 (s, 3H), Приклад 11 2,84 (m, 1H), 5,35 (s, 2H), 7,18 (d, 2H), 7,31 (d, 1H), 57 88777 58 7,42 (m, 2H), 7,60 (m, 2H), 7,78 (m, 1H), 7,99 (d, 2H), (s, 3H), 3,83 (m, 2Н), 3,93 (m, 2Н), 4,05 (m, 1Н), 5,16 8,36 (m, 2H), 9,84 (s, 1H); Мас-спектр: М+Н+ 418. (t, 1Н), 6,97 (dd, 1Н), 7,34 (d,1Н), 8,08 (d, 1Н); MacПриклад 14 спектр: М+Н+ 212. N-циклопропіл-3-[(4-{[5-(1,3-діоксолан-25-(1,3-діоксолан-2-ілметокси)-2-метилпіридин, ілметокси)піридин-2-іл]метокси}бензоїл)аміно]-4застосований як вихідний матеріал, отримували метилбензамід наступним чином: До перемішуваного розчину N-циклопропіл-3До перемішуваного розчину 2-метил-5[(4-гідроксибензоїл)аміно]-4-метилбензаміду (3,1г, гідроксипіридину (16,0г, 0,147 моль) у сухому ДМФ 10ммоль) у сухому ТГФ (200мл) при 25°С додава(100мл) при 25°С додавали порціями натрій гідрид ли [5-(1,3-діоксолан-2-ілметокси)-піридин-2(60% дисперсію у олії, 6,0г, 0,15 моль) протягом 10 іл]метанол (2,4г, 11ммоль), трифенілфосфін (2,9г, хвилин. До суміші додавали 2-бромметил-1,311ммоль) та ди-трет-бутилазодикарбоксилат (2,6г, діоксолан (16,0мл, 0,154 моль) та утворену суміш 11ммоль). Розчин перемішували протягом 16 гонагрівали при 100°С протягом 2 годин, охолоджудин, тоді розчинник випарювали та осад розчинявали до 25°С та розбавляли льодом/водою (400г). ли у етилацетаті/метанолі (19:1, 50мл) та очищали Продукт екстрагували в діетиловий етер (400мл), хроматографією на оксиді силіцію, елюючи із грасушили над безводним магній сульфатом, та роздієнтом 5-20% метанолу у етилацетаті, що дало чинник випарювали під зниженим тиском, що дало названу сполуку як білу тверду речовину (3,8г, названу сполуку як олію (25г, 87%); Спектр ЯМР: 76%). Спектр ЯМР: (ДМСОd6) 0,56 (m, 2Н), 0,68 (m, (CDCI3) 2,50 (s, 3H), 3,94-4,04 (m, 6H), 5,27 (t, 1H), 2Н), 2,24 (s, 3H), 2,84 (m, 1Н), 3,85 (m, 2Н), 3,92 (m, 7,05 (d, 1H), 7,15 (dd, 1H), 8,22 (d, 1H); Мас-спектр: 2Н), 4,10 (m, 2Н), 5,20 (m, 3H), 7,12 (d, 2H), 7,30 (d, М+Н+ 196. 1H), 7,45 (s, 2H), 7,62 (dd, 1H), 7,78 (s, 1H), 7,95 (d, Приклад 15 2H), 8,30 (s, 1H), 8,35 (d, 1H), 9,80 (s, 1H); МасN-циклопропіл-3-{[4-({5-[2спектр: М+Н+ 504. (диметиламіно)етокси]піридин-2[5-(1,3-діоксолан-2-ілметокси)-піридин-2іл}метокси)бензоїл]аміно}-4-метилбензамід іл]метанол, застосований як вихідний матеріал, До перемішуваного розчину N-циклопропіл-3отримували наступним чином: [(4-{[5-(1,3-діоксолан-2-ілметокси)піридин-2До перемішуваного розчину [5-(1,3-діоксолан-2іл]метокси}бензоїл)аміно]-4-метилбензаміду (1,0г, ілметокси)піридин-2-іл]метилацетату (6,5г, 2ммоль) у метанолі (20мл) додавали хлоридну 25,7ммоль) у етанолі (100мл) додавали натрій кислоту (36% водний розчин, 10мл). Через 2 годигідроксид (1,2г, 30ммоль) та суміш нагрівали під ни розчин підлужували додаванням 2N натрій гіддефлегматором протягом години. Розчинник вироксиду (55мл). Осад відфільтровували та розчипарювали під зниженим тиском та осад розподіляняли у ТГФ (100мл), тоді перемішували поки ли між водою (100мл) та етилацетатом (100мл). додавали розчин диметиламіну (2М у ТГФ, 2мл, Органічний шар відокремлювали, сушили та випа4ммоль), титан ізопропоксиду (3мл, 10ммоль) та рювали, що дало названу сполуку як тверду речонатрій три-ацетоксиборгідриду (2,2г, 10ммоль). вину (5,4г, 99%); Спектр ЯМР: (ДМСОd6) 3,84 (m, Через 16 годин суміш підлужували 2N натрій гідро2Н), 3,95 (m, 2H), 4,06 (m, 2H), 4,48 (d, 2H), 5,19 (t, ксидом, перемішували протягом 10 хвилин і верх1H), 5,28 (широкий t, 1H), 7,37 (m, 2H), 8,18 (s, 1H); ній шар декантували. Нижчий шар перемішували із Мас-спектр: М+Н+ 212. ТГФ (50мл) та декантували знов, комбіновані вер[5-(1,3-діоксолан-2-ілметокси)піридин-2хні шари висушували над магній сульфатом. Наіл]метилацетат, застосований як вихідний матерізвану сполуку відокремлювали хроматографією на ал, отримували наступним чином: оксиді силіцію, елюючи із градієнтом 0-30% метаРозчин 5-(1,3-діоксолан-2-ілметокси)-2нолу у етилацетаті, що дає смолу (120мг); Спектр метилпіридин 1-оксиду (10г, 47,4ммоль) у оцтовоЯМР: (CDCI3) 0,60 (m, 2Н), 0,83 (m, 2Н), 2,32 (s, му ангідриді (100мл) перемішували з дефлегмато3H), 2,40 (s, 6H), 2,82 (t, 2Н), 2,90 (m, 1H), 4,17 (t, ром протягом 2 годин. Реакцію охолоджували та 2H), 5,20 (s, 2H), 6,60 (s, 1H), 7,06 (d, 2H), 7,26 (dd, розчинник випарювали під зниженим тиском За2H), 7,42 (d, 1Н), 7,56 (d, 1H), 7,86 (d, 2H), 7,90 (s, лишок очищали хроматографією на оксиді силіцію, 1H), 8,10 (s, 1H), 8,32 (s, 1H); Мас-спектр: М+Н+ елюючи 50% гексаном/етилацетатом, що дає олію 489. (6,8г, 57%); Спектр ЯМР: (CDCI3) 2,12 (s, 3H), 3,94Приклад 16 4,10 (m, 6H), 5,15 (s, 2H), 5,28 (t, 1H), 7,16 (m, 2H), 5-(бензилокси)-N-{58,32 (d, 1H); Мас-спектр: М+Н+ 254. [(циклопропіламіно)карбоніл]-25-(1,3-діоксолан-2-ілметокси)-2-метилпіридин метилфеніл}піридин-2-карбоксамід 1-оксид, застосований як вихідний матеріал, отриНазвану сполуку отримували з 5мували наступним чином: (бензилокси)піридин-2-карбоксильної кислоти та 3До перемішуваного розчину 5-(1,3-діоксолан-2аміно-N-циклопропіл-4-метилбензаміду згідно зі ілметокси)-2-метилпіридину (20г, 0,1 mole) у дихспособом, описаним у Прикладі 1; Спектр ЯМР: лорметані (200мл) додавали порціями 3(ДМСОd6) 0,58 (m, 2Н), 0,69 (m, 2Н), 2,32 (s, 3H), хлорпербензойну кислоту (~80% надкислота, 24г, 2,86 (m, 1H), 5,32 (s, 2H), 7,39 (m, 4H), 7,51 (m, 2H), 0,11моль) протягом 10 хвилин. Суміш перемішу7,57 (m, 1H), 7,71 (m, 1H), 8,13 (m, 1H), 8,22 (m, вали протягом години, промивали двічі 2N натрій 1H), 8,36 (m, 1Н), 8,48 (s, 1 Η), 10,16 (s, 1H); Масгідроксид (100мл) та органічний шар сушили над спектр: M+Na+ 424. безводним магній сульфатом. Випарювання розПриклад 17 чиннику дало названу сполуку як білу тверду речовину (15,4г, 73%); Спектр ЯМР: (ДMCOd6) 2,24 59 88777 60 N-{5-[(циклопропіламіно)карбоніл]-2з 20г оксиду силіцію, елюючи 20 метанолом/1% метилфеніл}-5-(піридин-2-ілметокси)піридин-2амоній гідроксидом SG 0,88 у етилацетаті. Сир карбоксамід продукт розчиняли у ДХМ та промивали насичеНазвану сполуку отримували з N-{5ним водним натрій гідрокарбонатом та випарюва[(циклопропіламіно)карбоніл]-2-метилфеніл}-5ли до сухого стану, що дало названу сполуку як гідроксипіридин-2-карбоксаміду та 2-хлорметилтверду речовину (1,24г, 52,6%); Спектр ЯМР: піридин гідрохлориду згідно зі способом, описаним (ДMCOd6) 0,62 (m, 2Н), 0,74 (m, 2Н), 2,37 (s, 3H), у прикладі 4; Спектр ЯМР: (ДМСОd6) 0,58 (m, 2H), 2,91 (m, 1Н), 7,41 (m, 1Н), 7,70 (m, 1Н), 8,05 (m, 0,69 (m, 2H), 2,32 (s, 3H), 2,86 (m, 1Н), 5,40 (s, 2Н), 1Н), 8,44 (m, 1Н), 9,02 (m, 1Н), 9,18 (m, 1Н), 10,44 7,33 (m, 1Н), 7,39 (m, 1Н), 7,58 (m, 2Н), 7,72 (m, (s, 1H); Мас-спектр: М-Н- 329. 1Н), 7,88 (m, 1Н), 8,13 (m, 1Н), 8,21 (m, 1Н), 8,36 Приклад 19 (m, 1Н), 8,51 (m, 1Н), 8,61 (m, 1Н), 10,14 (s, 1Н); N-{5-[(циклопропіламіно)карбоніл]-2Мас-спектр: М+Н+ 403. метилфеніл}-6-(піридин-2-ілметокси)нікотинамід N-{5-[(циклопропіламіно)карбоніл]-2До 2-піридинілметанолу (1мл) додавали натрій метилфеніл}-5-гідроксипіридин-2-карбоксамід, загідрид 60% дисперсію у олії (122мг, 3,05ммоль) під стосований як вихідний матеріал, отримували з 5інертною атмосферою та утворену суміш перемі(бензилокси)-N-{5-[(циклопропіламіно)карбоніл]-2шували протягом 10 хвилин, тоді додавали до суметилфеніл}піридин-2-карбоксаміду згідно зі споміші 6-хлор-N-{5-[(циклопропіламіно)карбоніл]-2собом, застосованим для отримання Nметилфеніл}нікотинамід (334мг, 1,02ммоль) та циклопропіл-3-[(4-гідроксибензоїл)аміно]-4мідь (І) йодид у колідині (3мл). Утворену суміш метилбензаміду з 3-{[4перемішували при кімнатній температурі протягом (бензилокси)бензоїл]аміно}-N-циклопропіл-430 хвилин, тоді - при 100°С протягом 4 годин. Суметилбензаміду (Способи розділу Прикладу 4). міш охолоджували до кімнатної температури, доПриклад 18 давали етилацетат та суміш фільтрували. ФільтN-{5-[(циклопропіламіно)карбоніл]-2рати концентрували під зниженим тиском та метилфеніл}-5-(піридин-2-ілметокси)піразин-2очищали хроматографією на колонці з оксидом карбоксамід силіцію, елюючи 0-100% етилацетатом у ізогексаДо 2-піридинілметанолу (300мкл) додавали ні. Розтирання з діетиловим етером дало названу натрій гідрид 60% дисперсію у олії (20мг, сполук як безбарвну тверду речовину (105,6мг, 1,39ммоль) під інертною атмосферою й суміш пе26%); Спектр ЯМР: (ДMCOd6) 0,59 (m, 2H), 0,67ремішували при кімнатній температурі протягом 10 0,71 (m, 2H), 2,27 (s, 3H), 2,86 (m, 1Н), 5,53 (s, 2Н), хвилин. Тоді додавали NMP (600мкл), супрово7,10 (d, 1Н), 7,35 (m, 2Н), 7,48 (m, 1Н), 7,65 (m, 1Н), джуваний 5-хлор-N-{57,82 (m, 2Н), 8,29 (m, 1Н), 8,37 (m, 1Н), 8,58 (m, [(циклопропіламіно)карбоніл]-2-метилфеніл}-21Н), 8,80 (d, 1Н), 9,99 (s, 1Н); Мас-спeктр: М+Н+ піразинкарбоксамід (100мг, 0,303ммоль) та утво403. рену суміш перемішували протягом 48 годин. Роз6-хлор-N-{5-[(циклопропіламіно)карбоніл]-2чинник випарювали під зниженим тиском і осад метилфеніл}нікотинамід, застосований як вихідний розподіляли між насиченим водним натрій гідроматеріал, отримували наступним чином: карбонатом та ДХМ. Випарювання ДХМ, осадженДо розчину 6-хлорнікотинілхлориду (7,5г, ня діетиловим етером та ізогексанами та фільтру42,61ммоль) у ДХМ (125мл), охолодженому у льовання дало названу сполуку як тверду речовину ді, додавали суміш 3-аміно-N-циклопропіл-4(25мг, 20%); Спектр ЯМР: (ДMCOd6) 0,58 (m, 2Н), метилбензаміду (5г, 26,31ммоль) та триетиламіну 0,69 (m, 2Н), 2,31 (s, 3H), 2,86 (m, 1Н), 5,59 (s, 2H), (11,30мл, 81,07ммоль) у ДХМ (125мл). Утворену 7,36 (m, 2Н), 7,55 (m, 1Н), 7,62 (d, 1Н), 7,86 (m, 1Н), суміш перемішували протягом 16 годин при кімна8,08 (m, 1Н), 8,37 (m, 1Н), 8,58 (m, 2Н), 8,89 (s, 1H), тній температурі. Суміш концентрували під зниже9,76 (s, 1H); Мас-спектр: М+Н+ 404. ним тиском та осад розподіляли між ДХМ та наси5-хлор-N-{5-[(циклопропіламіно)карбоніл]-2ченим водним розчином калій карбонату. метилфеніл}-2-піразинкарбоксамід, застосований Органічну фазу концентрували під зниженим тисяк вихідний матеріал, отримували наступним чиком та осад розтирали діетиловим етером та ізоном: гексаном та фільтрували, що дало названу сполуДо 5-гідроксипіразин-2-карбонової кислоти (1г, ку як тверду речовину (10,56г); Спектр ЯМР: 1,14ммоль) додавали фосфористий оксихлорид (ДMCOd6) 0,57 (m, 2Н), 0,69 (m, 2Н), 2,28 (s, 3H), (10мл) та фосфористий пентахлорид (4,91г). Після 2,85 (m, 1H), 7,36 (m, 1H), 7,70 (m, 2H), 7,83 (s, 1H), послаблення початкової реакції суміш нагрівали 8,38 (m, 2H), 8,98 (s, 1H), 10,24 (s, 1H); Мас-спектр: до 100°С та перемішували протягом 16 годин. СуМ-Н- 328. міш охолоджували та додавали мурашину кислоту Приклад 20 (347мл, 9,19ммоль) до перетворення всього надN-{5-[(циклопропіламіно)карбоніл]-2лишку фосфористого пентахлориду до фосфорисметилфеніл}-2-(піридин-2-ілметокси)піримідин-5того оксихлориду, тоді надлишок фосфористого карбоксамід оксихлориду ретельно випарювали, що дає осад, До розчину 2-піридинілметанолу (258мкл, котрий розчиняли у ДХМ (50мл). Додавали три2,67ммоль) у ТГФ (50мл), охолодженого в льодяетиламін (10мл) та 3-аміно-N-циклопропіл-4ній бані до 0°С, додавали краплями літій гексамеметилбензамід (1,307г) та утворену суміш перемітилдисилазид (1М розчин у ТГФ, 2,67мл, шували при кімнатній температурі протягом 16 2,67ммоль), і утворену суміш перемішували протягодин. Розчинник випарювали під зниженим тисгом 30 хвилин при 0°С. Додавали N-{5ком та осад очищали на хроматографічний колонці [(циклопропіламіно)карбоніл]-2-метилфеніл}-2
ДивитисяДодаткова інформація
Назва патенту англійськоюAmide derivatives
Автори англійськоюBrown Dearg Sutherland, Cumming John Graham, Nash Ian Alun
Назва патенту російськоюАмидные производные
Автори російськоюБраун Дирг Сазерленд, Камминг Джон Грем, Неш Айен Алан
МПК / Мітки
МПК: C07D 285/06, A61K 31/426, A61K 31/167, C07D 239/34, A61P 19/02, A61K 31/395, C07D 277/24, A61K 31/433, C07D 213/30
Код посилання
<a href="https://ua.patents.su/36-88777-amidni-pokhidni.html" target="_blank" rel="follow" title="База патентів України">Амідні похідні</a>
Попередній патент: Спосіб зниження витрати вапна при очищенні соку цукрового буряку
Наступний патент: Будівельний елемент, будівельна конструкція, спосіб виготовлення будівельного елемента і спосіб виготовлення будівельної конструкції
Випадковий патент: Спосіб підвищення відтворювальної здатності свиноматок












