Триазолзаміщені амінобензофенонові сполуки
Формула / Реферат
1. Сполука загальної формули Іа або Іb
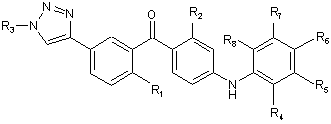 , (Ia)
, (Ia)
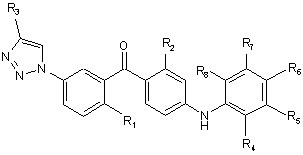 (Ib),
(Ib),
де
R1 - це метил, хлор, бром або метокси;
R2 - це хлор або метил;
R3 являє собою С1-6алкіл, С2-6алкеніл, С2-6алкініл, С1-6гідроксіалкіл, C1-6галогеналкіл, С1-6алкокси, С1-6алкоксикарбоніл, С1-6аміно, уреїдо, тіоуреїдо, С1-6алкілкарбонілокси, С1-6алкілкарбоніл, С1-6алкоксикарбонілокси, С1-6алкоксисульфонілокси, С1-6алкоксикарбамоїл або С1-6амінокарбоніл,
кожний з яких необов'язково заміщений одним або більше однаковими або різними замісниками, вибраними із групи, яка складається з галогену, гідрокси, меркапто, трифторметилу, ціано, карбокси, CONH2, нітро, оксо, -S(O)2NH2, С1-4алкілу, С2-4алкенілу, С2-4алкінілу, С1-4гідроксіалкілу, С1-6галогеналкілу, С1-4алкокси, С1-4алкоксикарбонілу, уреїдо, тіоуреїдо, С1-4алкілкарбонілокси, С1-4алкоксикарбонілокси, С1-4алкоксисульфонілокси, С1-4алкоксикарбамоїлу, С1-4амінокарбонілу, С1-4алкілтіо, С3-6циклоалкілу, С3-6циклоалкенілу, аміно, іміно, С1-4аміносульфонілу, С1-4амінокарбонілокси, С1-4алкілсульфоніламіно, С1-4алкоксііміно, С1-4алкілкарбоніламіно, С1-4алкілсульфонілу, С1-6гетероарилу, С1-6гетероциклоалкілу або С2-6гетероциклоалкенілу,
де С1-4алкіл, С2-4алкеніл, С2-4алкініл, С1-4гідроксіалкіл, С1-6галогеналкіл, С1-4алкокси, С1-4алкоксикарбоніл, уреїдо, тіоуреїдо, С1-4алкілкарбонілокси, С1-4алкоксикарбонілокси, С1-4алкоксисульфонілокси, С1-4алкоксикарбамоїл, С1-4амінокарбоніл, С1-4алкілтіо, С3-6циклоалкіл, С3-6циклоалкеніл, аміно, іміно, С1-4аміносульфоніл, С1-4амінокарбонілокси, С1-4алкілсульфоніламіно, С1-4алкоксііміно, С1-4алкілкарбоніламіно, С1-4алкілсульфоніл, С1-6гетероарил, С1-6гетероциклоалкіл або С2-6гетероциклоалкеніл необов'язково додатково заміщені одним або більше, однаковими або різними замісниками, вибраними із групи, яка складається з галогену, гідрокси, -NH2, меркапто, трифторметилу, ціано, карбокси, CONH2, нітро, оксо, -S(O)2NH2, С1-4алкілу або С1-4гідроксіалкілу,
або R3 являє собою водень, гідрокси або карбокси;
R4, R5, R6, R7 і R8 незалежно один від одного являють собою водень, галоген, -NH2, гідрокси, трифторметил, метокси, етокси, ціано, ацетил, ацетамідо, метил або етил;
за умови, що сполука не є
[4-[(2-амінофеніл)аміно]-2-хлорфеніл]-[2-метил-5-[1-[2-[(тетрагідро-2Н-піран-2-іл)оксі]етил]-1H-1,2,3-триазол-4-іл]феніл]метаноном або
[4-[(2-амінофеніл)аміно]-2-хлорфеніл]-[5-[1-(2-гідроксіетил)-1Н-1,2,3-триазол-4-іл]-2-метилфеніл]метаноном;
або її фармацевтично прийнятна сіль, сольват або складний ефір.
2. Сполука за п. 1, у якій R3 являє собою С1-6алкіл, С2-6алкеніл, С2-6алкініл, С1-6гідроксіалкіл, С1-6алкоксикарбоніл, С1-6алкілкарбоніл, уреїдо або С1-6амінокарбоніл, кожний з яких необов'язково заміщений одним або більше однаковими або різними замісниками, вибраними із групи, яка складається з галогену, гідрокси, меркапто, трифторметилу, ціано, карбокси, CONH2, нітро, оксо, -S(O)2NH2, С1-4алкілу, С2-4алкенілу, С2-4алкінілу, С1-4гідроксіалкілу, С1-4алкокси, С1-4алкоксикарбонілу, уреїдо, тіоуреїдо, С1-4алкілкарбонілокси, С1-4алкоксикарбонілокси, С1-4алкоксисульфонілокси, С1-4алкоксикарбамоїлу, С1-4амінокарбонілу, С1-4алкілтіо, С3-6циклоалкілу, С3-6циклоалкенілу, аміно, іміно, С1-4аміносульфонілу, С1-4амінокарбонілокси, С1-4алкілсульфоніламіно, С1-4алкоксііміно, С1-4алкілкарбоніламіно, С1-4алкілсульфонілу, С1-6гетероарилу, С1-6гетероциклоалкілу або С2-6гетероциклоалкенілу,
останні 27 з яких необов'язково додатково заміщені одним або більше однаковими або різними замісниками, вибраними із групи, яка складається з галогену, гідрокси, -NH2, меркапто, трифторметилу, ціано, карбокси, CONH2, нітро, оксо, -S(O)2NH2, С1-4алкілу або С1-4гідроксіалкілу, або
R3 являє собою водень, гідрокси або карбокси.
3. Сполука за пп. 1 або 2, у якій R4, R5, R6, R7 і R8 незалежно один від одного являють собою водень, галоген, гідрокси, трифторметил, метокси, етокси, метил або етил.
4. Сполука за пп. 1 або 2, у якій R5, R6 і R7 незалежно один від одного являють собою водень, галоген, -NH2, гідрокси, трифторметил, метокси, етокси, ціано, ацетил, ацетамідо, метил або етил, і R4 і R8 незалежно один від одного являють собою водень, галоген, гідрокси, трифторметил, метокси, етокси, ціано, ацетил, ацетамідо, метил або етил.
5. Сполука за пп. 1 або 2, у якій R4, R5, R6, R7 і R8 незалежно один від одного являють собою водень, фтор або хлор.
6. Сполука за будь-яким із пп. 1-5, у якій щонайменше три з R4, R5, R6, R7 або R8 являють собою водень.
7. Сполука за будь-яким із пп. 1-6, у якій R5, R7 і R8 являють собою водень, або в якій R5, R6, R7 і R8 являють собою водень, або в якій R4, R5, R7 і R8 являють собою водень.
8. Сполука за будь-яким із пп. 1-6, у якій R4, R7 і R8 або R6, R7 і R8, або R4, R6, R7 і R8, або R4, R6 і R8, або R4, R6 і R7 являють собою водень.
9. Сполука за будь-яким із пп. 1-8, у якій R1 являє собою метил і R2 являє собою хлор.
10. Сполука за будь-яким із пп. 1-9, у якій R3 являє собою С1-4алкіл, С1-4алкеніл або С1-4гідроксіалкіл, кожний з яких необов'язково заміщений одним або більше однаковими або різними замісниками, вибраними із групи, яка складається з галогену, гідрокси, меркапто, -NH2, карбокси, CONH2, нітро, оксо, -S(O)2NH2, С1-2гідроксіалкілу, С1-2алкокси, С1-2алкоксикарбонілу, С1-2уреїдо, С1-2тіоуреїдо, С1-2алкілкарбонілокси, С1-2алкоксикарбонілокси, С1-2алкоксисульфонілокси, С1-2алкоксикарбамоїлу, С1-2амінокарбонілу, С1-2алкілтіо, С1-2аміно, С1-2іміно, С1-2аміносульфонілу, С1-2амінокарбонілокси, С1-2алкілсульфоніламіно, С1-2алкоксііміно, С1-2алкілкарбоніламіно, С1-2алкілсульфонілу, С2-5гетероарилу, С2-5гетероциклоалкілу або С3-5гетероциклоалкенілу,
останні 22 з яких необов'язково додатково заміщені одним або більше однаковими або різними замісниками, вибраними із групи, що включає гідрокси, -NH2, карбокси, CONH2, оксо або С1-3алкіл.
11. Сполука за будь-яким із пп. 1-10, у якій R3 являє собою С1-3алкіл, С1-3алкеніл або С1-3гідроксіалкіл, кожний з яких необов'язково заміщений одним або більше однаковими або різними замісниками, вибраними із групи, яка складається з гідрокси, -NH2, карбокси, хлору, CONH2, оксо, -S(O)2NH2, С1-2гідроксіалкілу, С1-2алкокси, С1-2алкоксикарбонілу, С0-2уреїдо, С1-2амінокарбонілу, С1-2аміно, С1-2алкілсульфоніламіно, С2-5гетероциклоалкілу, останні 8 з яких додатково заміщені одним або більше однаковими або різними замісниками, вибраними із групи, яка складається з гідрокси або С1-2алкілу.
12. Сполука за будь-яким із пп. 1-11, у якій R3 являє собою метил, етил, пропіл, пропеніл, і всі вони заміщені одним, двома, трьома або чотирма однаковими або різними замісниками, вибраними із групи, яка складається з гідрокси, CONH2, оксо, діетиламіно, етиламінокарбонілу, метилу, гідроксиметилу, піролідинілу, морфолінілу, хлору, H2N-C(O)-NH-, метоксикарбонілу, метокси, -NH2, етоксикарбонілу, етокси, метилсульфоніламіно, -S(O)2NH2, тетрагідропіранілу, [1,3]-діоксоланілу, етиламіно, піперазинілу, останні чотири додатково заміщені одним, двома, трьома або чотирма однаковими або різними замісниками, вибраними із групи, яка складається з метилу або етилу.
13. Сполука за будь-яким із пп. 1-12, у якій R3 являє собою 2-гідроксіетил, 3-гідроксипропіл, карбамоїлметил, 2,3-дигідроксипропіл, 2-(метилсульфоніламіно)етил, сульфоніламінопропіл, 2,2-диметил-[1,3]діоксолан-4-ілметил, 2-(тетрагідропіран-2-ілокси)етил, 3-(тетрагідропіран-2-ілокси)пропіл, етоксикарбонілметил, карбоксиметил, етиламінокарбонілметил, (2-гідрокси-1,1-диметилетил)амінокарбонілметил, 1-піролідин-1-ілетанон, 1-морфолін-4-ілетанон, 2-хлоретил, 1-гідрокси-1-метилетил, ацетил, 1-аміно-1-метилетил, метоксикарбоніл, карбокси, гідроксиметил, 3-гідроксипропеніл, 2-аміноетил, метилсечовина, 2-морфолін-4-ілетил, (4-метилпіперазин-1-іл)етил, 2-діетиламіноетил, 2-(2-гідроксіетиламіно)етил, пропіламіноетил або діетиламін.
14. Сполука за будь-яким із пп. 1-13 загальної формули Іа.
15. Сполука за будь-яким із пп. 1-13 загальної формули Іb.
16. Фармацевтична композиція, що має властивості інгібувати або пригнічувати активність р38 МАР кінази, яка містить сполуку за будь-яким із пп. 1-15 або її фармацевтично прийнятну сіль або складний ефір разом з фармацевтично прийнятним носієм або наповнювачем.
17. Композиція за п. 16, яка додатково містить інший активний компонент, вибраний із групи, яка включає глюкокортикоїди, аналоги вітаміну D, антигістаміни, антагоністи фактора активації тромбоцитів (PAF), антихолінергічні агенти, метилксантини, β-адренергічні речовини, інгібітори СОХ-2, саліцилати, індометацин, флюфенамат, напроксен, тимегадин, золото-хлористоводневий натрій, пеніциламін, речовини, що знижують вміст сироваткового холестерину, ретиноїди, солі цинку й саліцилазосульфапіридин.
18. Сполука за будь-яким із пп. 1-15, що має властивості інгібувати або пригнічувати активність р38 МАР кінази, для застосування як лікарського препарату.
19. Сполука за будь-яким із пп. 1-15, що має властивості інгібувати або пригнічувати активність р38 МАР кінази, для застосування як протизапального засобу або протипухлинного засобу.
20. Застосування сполуки за будь-яким із пп. 1-15 для одержання лікарського препарату для профілактики, лікування й покращення стану у випадку запальних захворювань або станів, таких як астма, алергія, артрит, ревматоїдний артрит і спондилоартрит, подагра, атеросклероз, запальне захворювання травного тракту, хвороба Крона, неврологічне запалення, запальне захворювання очей, проліферативні й запальні шкірні порушення, псоріаз, атопічний дерматит, вугри, увеїт, сепсис, септичний шок або акне, остеопороз, або офтальмологічних захворювань або станів.
21. Застосування сполуки за будь-яким із пп. 1-15 для одержання лікарського препарату для лікування або покращення стану у випадку ракових пухлин.
22. Застосування за п. 20, у якому лікарський препарат призначений для введення разом з іншим активним компонентом, вибраним із групи, яка складається із глюкокортикоїдів, аналогів вітаміну D, антигістамінів, антагоністів фактора активації тромбоцитів (PAF), антихолінергічних агентів, метилксантинів, β-адренергічних агентів, інгібіторів СОХ-2, саліцилатів, індометацину, флюфенамату, напроксену, тимегадину, золото-хлористоводневого натрію, пеніциламіну, агентів, що знижують вміст сироваткового холестерину, ретиноїдів, солі цинку й саліцилазосульфапіридину.
23. Застосування за п. 20, у якому офтальмологічне захворювання являє собою гостру дегенерацію жовтої плями або вікову дегенерацію жовтої плями.
24. Спосіб запобігання, лікування або покращення стану у випадку запальних захворювань або станів, таких як астма, алергія, артрит, ревматоїдний артрит і спондилоартрит, подагра, атеросклероз, запальне захворювання травного тракту, хвороба Крона, неврологічне запалення, запальне захворювання очей, проліферативні й запальні шкірні порушення, псоріаз, атопічний дерматит, вугри, увеїт, сепсис, септичний шок або акне, остеопороз, або офтальмологічних захворювань або станів, який включає введення потребуючому цього пацієнту ефективної кількості сполуки за будь-яким із пп. 1-15.
25. Спосіб за п. 24, який додатково включає введення іншого активного компонента, вибраного із групи, яка складається із глюкокортикоїдів, аналогів вітаміну D, антигістамінів, антагоністів фактора активації тромбоцитів (PAF), антихолінергічних агентів, метилксантинів, β-адренергічних агентів, інгібіторів СОХ-2, саліцилатів, індометацину, флюфенамату, напроксену, тимегадину, золото-хлористоводневого натрію, пеніциламіну, агентів, що знижують вміст сироваткового холестерину, ретиноїдів, солі цинку й саліцилазосульфапіридину.
26. Спосіб за п. 24, у якому офтальмологічне захворювання являє собою гостру дегенерацію жовтої плями або вікову дегенерацію жовтої плями.
Текст
1. Сполука загальної формули Іа або Іb C2 2 (19) 1 3 [4-[(2-амінофеніл)аміно]-2-хлорфеніл]-[2-метил-5[1-[2-[(тетрагідро-2Н-піран-2-іл)оксі]етил]-1H-1,2,3триазол-4-іл]феніл]метаноном або [4-[(2-амінофеніл)аміно]-2-хлорфеніл]-[5-[1-(2гідроксіетил)-1Н-1,2,3-триазол-4-іл]-2метилфеніл]метаноном; або її фармацевтично прийнятна сіль, сольват або складний ефір. 2. Сполука за п.1, у якій R3 являє собою С1-6алкіл, С2-6алкеніл, С2-6алкініл, С1-6гідроксіалкіл, С16алкоксикарбоніл, С1-6алкілкарбоніл, уреїдо або С16амінокарбоніл, кожний з яких необов'язково заміщений одним або більше однаковими або різними замісниками, вибраними із групи, яка складається з галогену, гідрокси, меркапто, трифторметилу, ціано, карбокси, CONH2, нітро, оксо, -S(O)2NH2, С1С2-4алкенілу, С2-4алкінілу, С14алкілу, 4гідроксіалкілу, С1-4алкокси, С1-4алкоксикарбонілу, уреїдо, тіоуреїдо, С1-4алкілкарбонілокси, С1С1-4алкоксисульфонілокси, 4алкоксикарбонілокси, С1-4алкоксикарбамоїлу, С1-4амінокарбонілу, С14алкілтіо, С3-6циклоалкілу, С3-6циклоалкенілу, аміно, іміно, С1-4аміносульфонілу, С14амінокарбонілокси, С1-4алкілсульфоніламіно, С1С1-4алкілкарбоніламіно, С14алкоксііміно, С1-6гетероарилу, С14алкілсульфонілу, 6гетероциклоалкілу або С2-6гетероциклоалкенілу, останні 27 з яких необов'язково додатково заміщені одним або більше однаковими або різними замісниками, вибраними із групи, яка складається з галогену, гідрокси, -NH2, меркапто, трифторметилу, ціано, карбокси, CONH2, нітро, оксо, S(O)2NH2, С1-4алкілу або С1-4гідроксіалкілу, або R3 являє собою водень, гідрокси або карбокси. 3. Сполука за пп.1 або 2, у якій R4, R5, R6, R7 і R8 незалежно один від одного являють собою водень, галоген, гідрокси, трифторметил, метокси, етокси, метил або етил. 4. Сполука за пп.1 або 2, у якій R5, R6 і R7 незалежно один від одного являють собою водень, галоген, -NH2, гідрокси, трифторметил, метокси, етокси, ціано, ацетил, ацетамідо, метил або етил, і R4 і R8 незалежно один від одного являють собою водень, галоген, гідрокси, трифторметил, метокси, етокси, ціано, ацетил, ацетамідо, метил або етил. 5. Сполука за пп.1 або 2, у якій R4, R5, R6, R7 і R8 незалежно один від одного являють собою водень, фтор або хлор. 6. Сполука за будь-яким із пп.1-5, у якій щонайменше три з R4, R5, R6, R7 або R8 являють собою водень. 7. Сполука за будь-яким із пп.1-6, у якій R5, R7 і R8 являють собою водень, або в якій R5, R6, R7 і R8 являють собою водень, або в якій R4, R5, R7 і R8 являють собою водень. 8. Сполука за будь-яким із пп.1-6, у якій R4, R7 і R8 або R6, R7 і R8, або R4, R6, R7 і R8, або R4, R6 і R8, або R4, R6 і R7 являють собою водень. 9. Сполука за будь-яким із пп.1-8, у якій R1 являє собою метил і R2 являє собою хлор. 10. Сполука за будь-яким із пп.1-9, у якій R3 являє собою С1-4алкіл, С1-4алкеніл або С1-4гідроксіалкіл, кожний з яких необов'язково заміщений одним або більше однаковими або різними замісниками, вибраними із групи, яка складається з галогену, гідро 90698 4 кси, меркапто, -NH2, карбокси, CONH2, нітро, оксо, -S(O)2NH2, С1-2гідроксіалкілу, С1-2алкокси, С12алкоксикарбонілу, С1-2уреїдо, С1-2тіоуреїдо, С12алкілкарбонілокси, С1-2алкоксикарбонілокси, С12алкоксисульфонілокси, С1-2алкоксикарбамоїлу, С12амінокарбонілу, С1-2алкілтіо, С1-2аміно, С1-2іміно, С1-2аміносульфонілу, С1-2амінокарбонілокси, С1С1-2алкоксііміно, С12алкілсульфоніламіно, С1-2алкілсульфонілу, С22алкілкарбоніламіно, С2-5гетероциклоалкілу або С35гетероарилу, 5гетероциклоалкенілу, останні 22 з яких необов'язково додатково заміщені одним або більше однаковими або різними замісниками, вибраними із групи, що включає гідрокси, -NH2, карбокси, CONH2, оксо або С1-3алкіл. 11. Сполука за будь-яким із пп.1-10, у якій R3 являє собою С1-3алкіл, С1-3алкеніл або С1-3гідроксіалкіл, кожний з яких необов'язково заміщений одним або більше однаковими або різними замісниками, вибраними із групи, яка складається з гідрокси, -NH2, карбокси, хлору, CONH2, оксо, -S(O)2NH2, С12гідроксіалкілу, С1-2алкокси, С1-2алкоксикарбонілу, С0-2уреїдо, С1-2амінокарбонілу, С1-2аміно, С1С2-5гетероциклоалкілу, 2алкілсульфоніламіно, останні 8 з яких додатково заміщені одним або більше однаковими або різними замісниками, вибраними із групи, яка складається з гідрокси або С12алкілу. 12. Сполука за будь-яким із пп.1-11, у якій R3 являє собою метил, етил, пропіл, пропеніл, і всі вони заміщені одним, двома, трьома або чотирма однаковими або різними замісниками, вибраними із групи, яка складається з гідрокси, CONH2, оксо, діетиламіно, етиламінокарбонілу, метилу, гідроксиметилу, піролідинілу, морфолінілу, хлору, H2NC(O)-NH-, метоксикарбонілу, метокси, -NH2, етоксикарбонілу, етокси, метилсульфоніламіно, S(O)2NH2, тетрагідропіранілу, [1,3]-діоксоланілу, етиламіно, піперазинілу, останні чотири додатково заміщені одним, двома, трьома або чотирма однаковимиабо різними замісниками, вибраними із групи, яка складається з метилу або етилу. 13. Сполука за будь-яким із пп.1-12, у якій R3 являє собою 2-гідроксіетил, 3-гідроксипропіл, карбамоїлметил, 2,3-дигідроксипропіл, 2(метилсульфоніламіно)етил, сульфоніламінопропіл, 2,2-диметил-[1,3]діоксолан-4-ілметил, 2(тетрагідропіран-2-ілокси)етил, 3-(тетрагідропіран2-ілокси)пропіл, етоксикарбонілметил, карбоксиметил, етиламінокарбонілметил, (2-гідрокси-1,1диметилетил)амінокарбонілметил, 1-піролідин-1ілетанон, 1-морфолін-4-ілетанон, 2-хлоретил, 1гідрокси-1-метилетил, ацетил, 1-аміно-1метилетил, метоксикарбоніл, карбокси, гідроксиметил, 3-гідроксипропеніл, 2-аміноетил, метилсечовина, 2-морфолін-4-ілетил, (4-метилпіперазин-1іл)етил, 2-діетиламіноетил, 2-(2гідроксіетиламіно)етил, пропіламіноетил або діетиламін. 14. Сполука за будь-яким із пп.1-13 загальної формули Іа. 15. Сполука за будь-яким із пп.1-13 загальної формули Іb. 16. Фармацевтична композиція, що має властивості інгібувати або пригнічувати активність р38 МАР 5 90698 6 кінази, яка містить сполуку за будь-яким із пп.1-15 або її фармацевтично прийнятну сіль або складний ефір разом з фармацевтично прийнятним носієм або наповнювачем. 17. Композиція за п.16, яка додатково містить інший активний компонент, вибраний із групи, яка включає глюкокортикоїди, аналоги вітаміну D, антигістаміни, антагоністи фактора активації тромбоцитів (PAF), антихолінергічні агенти, метилксантини, β-адренергічні речовини, інгібітори СОХ-2, саліцилати, індометацин, флюфенамат, напроксен, тимегадин, золото-хлористоводневий натрій, пеніциламін, речовини, що знижують вміст сироваткового холестерину, ретиноїди, солі цинку й саліцилазосульфапіридин. 18. Сполука за будь-яким із пп.1-15, що має властивості інгібувати або пригнічувати активність р38 МАР кінази, для застосування як лікарського препарату. 19. Сполука за будь-яким із пп.1-15, що має властивості інгібувати або пригнічувати активність р38 МАР кінази, для застосування як протизапального засобу або протипухлинного засобу. 20. Застосування сполуки за будь-яким із пп.1-15 для одержання лікарського препарату для профілактики, лікування й покращення стану у випадку запальних захворювань або станів, таких як астма, алергія, артрит, ревматоїдний артрит і спондилоартрит, подагра, атеросклероз, запальне захворювання травного тракту, хвороба Крона, неврологічне запалення, запальне захворювання очей, проліферативні й запальні шкірні порушення, псоріаз, атопічний дерматит, вугри, увеїт, сепсис, септичний шок або акне, остеопороз, або офтальмологічних захворювань або станів. 21. Застосування сполуки за будь-яким із пп.1-15 для одержання лікарського препарату для лікування або покращення стану у випадку ракових пухлин. 22. Застосування за п.20, у якому лікарський препарат призначений для введення разом з іншим активним компонентом, вибраним із групи, яка складається із глюкокортикоїдів, аналогів вітаміну D, антигістамінів, антагоністів фактора активації тромбоцитів (PAF), антихолінергічних агентів, метилксантинів, β-адренергічних агентів, інгібіторів СОХ-2, саліцилатів, індометацину, флюфенамату, напроксену, тимегадину, золотохлористоводневого натрію, пеніциламіну, агентів, що знижують вміст сироваткового холестерину, ретиноїдів, солі цинку й саліцилазосульфапіридину. 23. Застосування за п.20, у якому офтальмологічне захворювання являє собою гостру дегенерацію жовтої плями або вікову дегенерацію жовтої плями. 24. Спосіб запобігання, лікування або покращення стану у випадку запальних захворювань або станів, таких як астма, алергія, артрит, ревматоїдний артрит і спондилоартрит, подагра, атеросклероз, запальне захворювання травного тракту, хвороба Крона, неврологічне запалення, запальне захворювання очей, проліферативні й запальні шкірні порушення, псоріаз, атопічний дерматит, вугри, увеїт, сепсис, септичний шок або акне, остеопороз, або офтальмологічних захворювань або станів, який включає введення потребуючому цього пацієнту ефективної кількості сполуки за будьяким із пп.1-15. 25. Спосіб за п.24, який додатково включає введення іншого активного компонента, вибраного із групи, яка складається із глюкокортикоїдів, аналогів вітаміну D, антигістамінів, антагоністів фактора активації тромбоцитів (PAF), антихолінергічних агентів, метилксантинів, β-адренергічних агентів, інгібіторів СОХ-2, саліцилатів, індометацину, флюфенамату, напроксену, тимегадину, золотохлористоводневого натрію, пеніциламіну, агентів, що знижують вміст сироваткового холестерину, ретиноїдів, солі цинку й саліцилазосульфапіридину. 26. Спосіб за п.24, у якому офтальмологічне захворювання являє собою гостру дегенерацію жовтої плями або вікову дегенерацію жовтої плями. Даний винахід належить до нового типу триазолзаміщених амінобензофенонів і до їхнього застосування в терапії. Амінобензофенони відомі як з наукової, так і з патентної літератури. Наприклад, всі патенти WO 98/32730, WO 01/05746, WO 01/05749, WO 01/05751, WO 01/05744 і WO 01/05745 розкривають сполуки із спільною базовою структурою Сполуки, розкриті в цій заявці на патент, позначені як інгібітори секреції інтерлейкіну 1β (IL-1β) і фактора некрозу пухлини α (TNF-α) in vitro, що робить сполуки потенційно придатними для лікування запальних захворювань, у яких утворення цитокінів включене в патогенез. Приблизно, амінобензофенони проявляють свій вплив шляхом інгібування р38 МАР кінази, яка, у свою чергу, інгібує утворення IL-1β і TNF-α. Одержання структурно родинних амінобензофенонів, застосовуваних, коли фарбують тканини, розкрите в Маn-Made Text. India (1987), 30(6), 2756, Man-Made Text. India (1986), 29(5), 224-30, і в Man-Made Text. India (1985), 28(11), 425, 427-9, 431. Було виявлено, що нові похідні триазолзаміщених амінобензофенонів є активними інгібіторами секреції інтерлейкіну 1β (IL-1β) і фактора некрозу пухлини α (TNF-α) in vitro i in vivo, що дозволяє припустити їхню придатність для ліку у якій фенільне кільце С заміщене амінопохідними. Крім того, патенти WO 01/42189 і WO 02/076447 розкривають сполуки зі схожою структурою, але без азотвмісного замісника у фенільному кільці С. І, нарешті, патенти WO 01/90074 і WO 02/083622 розкривають сполуки, у яких фенільні кільця А і С відповідно замінені гетероциклами. 7 вання і/або профілактики запальних захворювань і інших патологічних станів, при яких секреція й модуляція передзапальних цитокінів включена в патогенез. Було встановлено, що похідні триазолзаміщених амінобензофенонів даного винаходу проявляють свій протизапальний вплив шляхом інгібування або придушення МАР кіназ, більш специфічно р38 МАР кінази, активованого стресом білка, який є важливим елементом шляху передачі сигналу, що приводить до вироблення протизапальних цитокінів. Похідні триазолзаміщених амінобензофенонів даного винаходу, крім того, можуть бути придатні для лікування ракової пухлини, офтальмологічних захворювань або станів. Таким чином, даний винахід належить до сполуки загальної формули Іа або Іb дe R1 - це метил, хлор, бром або метокси; R2 - це хлор або метил; R3 являє собою С1-6алкіл, С2-6алкеніл, С2С1-6гідроксіалкіл, С1-6галогеналкіл, С16алкініл, 6алкокси, С1-6алкоксикарбоніл, С1-6аміно, уреїдо, тіоуреїдо. С1-6алкілкарбонілокси, С1-6алкілкарбоніл, С1-6алкоксикарбонілокси, С16алкоксисульфонілокси, С1-6алкоксикарбамоїл або С1-6амінокарбоніл, кожний з яких необов'язково заміщений одним або більше, однаковими або різними замісниками, вибраними із групи, яка складається з галогену, гідрокси, меркапто, трифторметилу, ціано, карбокси, CONH2, нітро, оксо, -S(O)2NH2, C1-4алкілу, С2С2-4алкінілу, C1-4гідроксіалкілу, С14алкенілу, 6галогеналкілу, C1-4алкокси, C1-4алкоксикарбонілу, уреїдо, тіоуреїдо, C1-4алкілкарбонілокси, C1C1-4алкоксисульфонілокси, 4алкоксикарбонілокси, C1-4алкоксикарбамоїлу, C1-4амінокарбонілу, C14алкілтіо, С3-6циклоалкілу, С3-6циклоалкенілу, аміно, іміно, C1-4аміносульфонілу, C14амінокарбонілокси, C1-4алкілсульфоніламіно, C1C1-4алкілкарбоніламіно, C14алкоксііміно, С1-6гетероарилу, С14алкілсульфонілу, 6гетероциклоалкілу або С2-6гетероциклоалкенілу, де згадані C1-4алкіл, С2-4алкеніл, С2-4алкініл, C1-4гідроксіалкіл, C1-6галогеналкіл, C1-4алкокси, C1уреїдо, тіоуреїдо, C14алкоксикарбоніл, 4алкілкарбонілокси, C1-4алкоксикарбонілокси, C14алкоксисульфонілокси, C1-4алкоксикарбамоїл, C14амінокарбоніл, C1-4алкілтіо, С3-6циклоалкіл, С36циклоалкеніл, аміно, іміно, C1-4аміносульфоніл, 90698 8 C1-4амінокарбонілокси, C1-4алкілсульфоніламіно, C1-4алкоксііміно, C1-4алкілкарбоніламіно, C1С1-6гетероарил, С14алкілсульфоніл, або С2-6гетероциклоалкеніл, 6гетероциклоалкіл необов'язково додатково заміщені одним або більше, однаковими або різними замісниками, вибраними із групи, яка складається з галогену, гідрокси, -NH2, меркапто, трифторметилу, ціано, карбокси, CONH2, нітро, оксо, -S(O)2NH2, C1-4алкілу або C1-4гідроксіалкілу, або R3 являє собою водень, гідрокси або карбокси; R4, R5, R5, R7 і R8 незалежно один від одного являють собою водень, галоген, -NH2, гідрокси, трифторметил, метокси, етокси, ціано, ацетил, ацетамідо, метил або етил; за умови, що сполука не є [4-(2амінофеніл)аміно)-2-хлорфеніл]-[2-метил-5-[1-[2[(тетрагідро-2Н-піран-2-іл)окси]етил]-1Н-1,2,3триазол-4-іл]феніл]метаноном або [4-[(2амінофеніл)аміно]-2-хлорфеніл]-[5-[1-(2гідроксіетил)-1Н-1,2,3-триазол-4-іл]-2-метил феніл] метаноном; або її фармацевтично прийнятна сіль, сольват або складний ефір. В іншому аспекті, винахід належить до фармацевтичної композиції, що включає сполуку формули Іа або Іb або фармацевтично прийнятну сіль, сольват або складний ефір їх разом з фармацевтично прийнятним носієм або наповнювачем. У додатковому аспекті, винахід належить до способу профілактики, лікування або поліпшення стану у випадку запальних захворювань або станів, або у випадку офтальмологічних захворювань або станів, спосіб включає введення потребуючому цього пацієнту ефективної кількості сполуки формули Іа або Іb. У додатковому аспекті, винахід належить до способу лікування або поліпшення стану у випадку ракових пухлин, спосіб включає введення потребуючому цього пацієнту ефективної кількості сполуки формули Іа або Іb. Ще в додатковому аспекті, винахід належить до застосування сполуки формули Іа або Іb для виготовлення лікарських препаратів для профілактики, лікування або поліпшення стану у випадку запальних захворювань або станів, або офтальмологічних захворювань або станів. Ще в додатковому аспекті, винахід належить до застосування сполуки формули Іа або Іb для виготовлення лікарських препаратів для лікування або поліпшення стану у випадку ракових пухлин. У даному контексті термін «алкіл» призначений для позначення радикалу, отриманого, якщо один атом водню видалений з вуглеводню. Згаданий алкіл включає 1-6, переважно, 1-4, а також 2-3 атома вуглецю. Термін включає підкласи: нормальний алкіл (н-алкіл), вторинний і третинний алкіл, такі, як метил, етил, н-пропіл, ізопропіл, н-бутил, ізобутил, втор-бутил, трет-бутил, пентил, ізопентил, гексил і ізогексил. Термін «циклоалкіл» призначений для позначення насиченого циклоалканового радикалу, що включає 3-6 атомів вуглецю, а також 4-5 атомів 9 вуглецю, наприклад, циклопропіл, циклобутил, циклопентил і циклогексил. Термін «циклоалкеніл» призначений для позначення моно- або диненасичених неароматичних циклічних вуглеводневих радикалів, які включають 3-6 атомів вуглецю, а також 4-5 атомів вуглецю, наприклад, циклопропеніл, циклобутеніл, циклопентеніл або циклогексеніл. Термін «гетероарил» призначений для позначення радикалів гетероциклічних ароматичних кілець, що включають 1-4 гетероатоми (вибраних з О, S і N) і 1-6 атомів вуглецю, таких як 1-3 гетероатоми й 1-6 атомів вуглецю, таких як 1-2 гетероатоми й 1-5 атомів вуглецю, таких як 1-2 гетероатоми й 2-4 атома вуглецю, зокрема, 5- або 6-членних кілець із 1-4 гетероатомами або 1-2 гетероатомами, вибраними із О, S і N, наприклад, піридил, тетразоліл, тіазоліл, імідазоліл, піразоліл, оксазоліл, оксадіазоліл, тіофеніл, 1,2,4-триазоліл, ізоксазоліл, піролідиніл, тієніл, піразиніл, піримідиніл, [1,2,3]триазоліл або ізотіазоліл. Термін «гетероциклоалкіл» призначений для позначення циклоалкільного радикалу, як визначено вище, зокрема, 5-або 6-членних кілець, включаючи поліциклічні радикали, що включають 1-4 гетероатоми, переважно, 1-3 гетероатоми, вибраних з О, N або S, наприклад, тетрагідропіраніл, морфолін, імідазолідиніл, діоксоланіл або піперидиніл. Термін «гетероциклоалкеніл» призначений для позначення циклоалкенільного радикалу, як визначено вище, включаючи поліциклічні радикали, які включають 1-4 гетероатоми, переважно, 1-3 гетероатоми, вибраних з О, N або S, наприклад, 1,6-дигідропіридиніл, 4,5-дигідро-1Н[1,2,4]триазоліл, 4,5-дигідрооксазоліл, 1-нпіразоліл або 4,5-дигідроізоксазоліл. Термін «алкеніл» призначений для позначення моно-, ди- або триненасичених вуглеводневих радикалів, що включають 2-6 атомів вуглецю, зокрема, 2-4 атоми вуглецю, а також 2-3 атоми вуглецю, наприклад, етеніл, аліл, пропеніл, бутеніл, пентеніл або гексеніл. Термін «алкініл» призначений для позначення вуглеводневого радикалу, який включає 1-5 вуглець-вуглецевих потрійних зв'язків, наприклад, 2 або 3 потрійні зв'язки й 2-6 атомів вуглецю, алкановий ланцюжок звичайно включає 2-5 атомів вуглецю, зокрема, 2-4 атоми вуглецю, а також 2-3 атоми вуглецю, наприклад, етиніл, пропініл, бутиніл, пентиніл або гексиніл. Термін «галоген» призначений для позначення замісника з 7-ої основної групи періодичної таблиці, переважно, фтор, хлор і бром. Термін «гідроксіалкіл» призначений для позначення алкільного радикалу, як визначено вище, у якому один або декілька водневих атомів замінені на гідроксил. Термін «галогеналкіл» призначений для позначення алкільного радикалу, як визначено вище, у якому один або декілька водневих атомів замінені на галоген, однаковий або різний, такий як бром, йод, хлор і/або фтор. Термін «аміно» призначений для позначення радикалу формули -NR2, у якому кожний R неза 90698 10 лежно один від одного являє собою водень, алкіл, алкеніл або циклоалкіл, як зазначено вище, наприклад, -NH2, метиламіно, діетиламіно, циклогексиламіно, трет-бутиламіно або етиламіно. Термін «іміно» призначений для позначення радикалу формули =N-R, у якому R являє собою водень або алкіл, як зазначено вище. Термін «алкокси» призначений для позначення радикалу формули -OR, у якому R є алкілом або алкенілом, як зазначено вище, наприклад, метокси, етокси, н-пропокси, ізопропокси, бутокси і ін. Термін «алкілтіо» призначений для позначення радикалу формули -S-R, у якому R є алкілом, як зазначено вище. Термін «алкоксикарбоніл» призначений для позначення радикалу формули -C(O)-O-R, у якому R є алкілом, як зазначено вище, наприклад, метоксикарбоніл, етоксикарбоніл, н-пропоксикарбоніл, ізопропоксикарбоніл і ін. Термін «алкілкарбонілокси» призначений для позначення радикалу формули -C(O)-R, у якому R є алкілом, як зазначено вище, наприклад, метилкарбонілокси або етилкарбонілокси. Термін «алкоксикарбонілокси» призначений для позначення радикалу формули -C(O)-O-R, у якому R є алкілом, як зазначено вище. Термін «алкілкарбоніл» призначений для позначення радикалу формули -C(O)-R, у якому R є алкілом, як зазначено вище, наприклад, ацетил. Термін «уреїдо» призначений для позначення радикалу формули -NR'-C(O)-NH-R, у якому R' є воднем або алкілом, як зазначено вище, і R є воднем, алкілом, алкенілом, алкінілом або циклоалкілом, як зазначено вище, наприклад, -NH-C(O)-NH2, метилуреїдо, етилуреїдо, трет-бутилуреїдо, циклогексилуреїдо, метилтіоуреїдо, ізопропілуреїдо або н-пропілуреїдо. Термін «тіоуреїдо» призначений для позначення радикалу формули -NR'-C(S)-NH-R, у якому R' є воднем або алкілом, як зазначено вище, і R є воднем, алкілом або циклоалкілом, як зазначено вище, наприклад, -NH-C(S)-NH2· Термін «алкоксисульфонілокси» призначений для позначення радикалу формули -O-S(O)2-O-R, у якому R є алкілом, як зазначено вище. Термін «аміносульфоніл» призначений для позначення радикалу формули -S(O)2-NR2, у якому R незалежно один від одного являють собою водень або алкіл, як зазначено вище. Термін «амінокарбонілокси» призначений для позначення радикалу формули -NR'-C(O)-O-R, у якому R' є воднем або алкілом, як зазначено вище, і R є алкілом, як зазначено вище, наприклад, амінокарбоніл-трет-бутокси. Термін «алкілсульфоніламіно» призначений для позначення радикалу формули -NR'-S(O)2-R, у якому R є алкілом, як зазначено вище, і R' є воднем або алкілом, як зазначено вище, наприклад, метилсульфоніламіно. Термін «алкоксііміно» призначений для позначення радикалу формули =N-O-R, у якому R є воднем або алкілом, як зазначено вище, наприклад, метоксііміно. 11 Термін «алкоксикарбамоїл» призначений для позначення радикалу формули -C(O)NR'-O-R, у якому R' є воднем або алкілом, як зазначено вище, і R є алкілом, як зазначено вище. Термін «амінокарбоніл» призначений для позначення радикалу формули -C(O)NR'2, у якому кожний R', незалежно один від одного, є воднем, алкілом або алкенілом, як зазначено вище, наприклад, карбамоїл, метиламінокарбоніл, етиламінокарбоніл, пропіламінокарбоніл або бутиламінокарбоніл. Термін «алкілкарбоніламіно» призначений для позначення радикалу формули -NR'-C(O)-R, у якому R' є воднем або алкілом, як зазначено вище, і R є алкілом, як зазначено вище, наприклад, ацетиламіно. Термін «фармацевтично прийнятна сіль» призначений для позначення солей, отриманих реакцією сполуки формули І з прийнятною неорганічною або органічною кислотою, такою як хлористоводнева, бромистоводнева, йодистоводнева, сірчана, азотна, фосфорна, мурашина, оцтова, 2,2-дихлороцтова, адипінова, аскорбінова, Lаспарагінова, L-глутамінова, галактарова, молочна, малеїнова, L-оксиянтарна, фталева, лимонна, пропіонова, бензойна, глутарова, глюконова, Dглюкуронова, метансульфонова, саліцилова, бурштинова, малонова, виноградна, бензолсульфонова, етан-1,2-дисульфонова, 2гідроксіетансульфонова, толуолсульфонова, сульфамова або фумарова кислота. Фармацевтично прийнятні солі сполуки формули І також можуть бути отримані реакцією з прийнятною основою, такою як гідроксид натрію, гідроксид калію, гідроксид магнію, гідроксид кальцію, аміак або прийнятні нетоксичні аміни, такі як нижчі алкіламіни, наприклад, триетиламін, гідрокси-нижчі алкіламіни, наприклад, 2-гідроксіетиламін, біс-(2гідроксіетил)амін, циклоалкіламіни, наприклад, дициклогексиламін, або бензиламіни, наприклад, Ν,Ν'-дибензилетилендиамін і дибензиламін, або Lаргінін, або L-лізин. Термін «сольват» призначений для позначення продукту, утвореного взаємодією між сполукою, наприклад, сполукою формули І, і розчинником, наприклад, спиртом, гліцерином або водою, де згаданий продукт знаходиться у твердій формі. У тому випадку, коли вода є розчинником, згаданий продукт належить до гідрату. Термін «фармацевтично прийнятний складний ефір» призначений для позначення легко гідролізованих складних ефірів, таких, як алканоїлоксіалкіл, аралканоїлоксіалкіл, арилоїлоксіалкіл, наприклад, ацетоксиметилові, півалоїлоксиметилові, бензоїлоксиметилові складні ефіри й відповідні 1'оксиетилові похідні, або складні ефіри молочної кислоти, наприклад, фталідилові складні ефіри або діалкіламіноалкілові складні ефіри, наприклад, диметиламіноетилові складні ефіри. Легко гідролізовані складні ефіри включають in vivo гідролізовані складні ефіри сполук формули І. Такі складні ефіри можуть бути отримані стандартними способами, відомими фахівцеві, такими як спосіб, розкритий у патенті Великобританії №1490852, включеному в опис як посилання. 90698 12 Термін «сполука І» або «сполука формули І» включає як сполуку Іа, так і сполуку Іb. «р38 МАР кіназа» є активованою стресом білковою кіназою, що існує в декількох ізоформах (р38α, р38β, р38β2, р38γ і р38δ). Р38 МАР кіназа активується різними стимулюючими впливами, включаючи теплові, хімічні, нюхові, рН і окисний стрес, видалення фактора росту, високий або низький рівень глюкози й ультрафіолетове випромінювання. Р38 також стимулюється агентами, які є посередниками ініціації фізіологічної відповіді на рану, інфекцію й запалення, такими як LPS і прозапальними цитокінами IL-1β, TNF-α, Fas, CD40L і TGF-β. Як і інші МАР кінази, р38 фосфорилюється кіназами, включаючи МККЗ, МЕК6 і МКК6, по треоніну й тирозину в активаційній петлі (Thr-Xaa-Tyr), зближеній з АТР і ділянкою зв'язування субстрату. У свою чергу, р38 фосфорилює і активує серинтреонін білкові кінази МАРКАР кіназа-2, МАРКАР кіназа-3 МАРКАР кіназа-5, MNK-1 і MSK-1. Було встановлено, що активація біосинтезу цитокінів, регульованого р38, у клітинах різних типів або безпосередньо зв'язана шляхом фосфорилування й активації факторів транскрипції з експресією цитокінів, або опосередковано, наприклад, шляхом фосфорилування MSK-1, що, будучи активованою, активує фактор транскрипції CREB. Також було показано, що певні піридинілімідазоли, наприклад, SB203580, які інгібують р38, інгібують утворення IL-1β і TNF-α з LPS-оброблених людських моноцитів. Тому був зроблений висновок, що р38 являє собою потенційно дуже цікаву мішень для розробки протизапальних сполук (порівн. J.C. Lee et al, Immunopharmacology 47, 2000, pp.185-201 і посилання, огляд яких дається там; P.R. Young, "Specific Inhibitors of p38 MAP kinase" in Signaling Networks and Cell Cycle Control: The Molecular Basis of Cancer and Other Diseases, J.S. Gutkind (Ed.), Humana Press, Inc., Totowa, N.J. і посилання, огляд яких дається там). Існує декілька повідомлень про р38 МАР кіназу й запальні цитокіни у зв'язку із клітинним ростом і апоптозом, а саме проліферацією пухлини й метастаз. Незважаючи на те, що точний механізм опосередкованої регуляції р38МАР кіназою клітинного росту невідомий, думають, що р38МАР кіназа являє собою потенційно дуже цікаву мішень для розробки протиракових лікарських препаратів (S. Nakada et al., Anticancer Research 21(1A), 2001, pp.167-171 і посилання, цитовані там; С. Denkert et al., Cancer Letters 195(1), 2003, pp.101-109 і посилання, цитовані там). Сполуки формули Іа і Іb можуть містити асиметрично заміщені (хіральні) атоми вуглецю й вуглець=вуглець подвійні зв'язки, що збільшує можливість існування ізомерних форм, наприклад, енантіомери, діастереомери й геометричні ізомери. Даний винахід належить до всіх таких ізомерів, як у чистій формі, так і в їхній суміші. Чисті стереоізомерні форми сполук і проміжних продуктів цього винаходу можуть бути отримані застосуванням методик, відомих з рівня техніки. Діастереомери можуть бути розділені фізичними методами сепарації, такими як селективна кристалізація й хроматографічні методи, наприклад, рідинна хроматог 13 рафія з використанням хіральної стаціонарної фази. Енантіомери можуть бути розділені один від одного селективною кристалізацією їх діастереомерних солей з оптично активними кислотами. Як альтернатива, енантіомери можуть бути розділені хроматографічними методами з використанням хіральних стаціонарних фаз. Згадані чисті стереоізомерні форми можуть також бути отримані з відповідних чистих стереоізомерних форм прийнятних вихідних речовин, за умови, що реакція протікає стереоселективно або стереоспецифічно. Переважно, якщо потрібен специфічний стереоізомер, згадану сполуку варто синтезувати стереоселективними або стереоспецифічними способами одержання. У цих способах будуть успішно застосовуватися хірально чисті вихідні речовини. Подібним чином, чисті геометричні ізомери можуть бути отримані з відповідних чистих геометричних ізомерів прийнятних вихідних речовин. Суміш геометричних ізомерів звичайно буде проявляти різні фізичні властивості, і тому вони можуть бути розділені стандартними хроматографічними методами, добре відомими з рівня техніки. Триазольний фрагмент може розглядатися як ізостер аміду, але не піддається гідролітичному розщепленню амідазоподібними ферментами. Сполуки формули Іа або Іb у такий спосіб вважаються більш метаболічно стабільними, ніж їх відповідні амідні похідні. Прийнятні приклади сполуки формули Іа і Іb У даному прийнятному прикладі сполуки формули Іа або Ib R3 являє собою С1-6алкіл, С2С2-6алкініл, С1-6гідроксіалкіл, С16алкеніл, 6алкоксикарбоніл, С1-6алкілкарбоніл, уреїдо або С16амінокарбоніл, кожний з яких необов'язково може бути заміщений одним або більше, однаковими або різними замісниками, вибраними із групи, яка складається з галогену, гідрокси, меркапто, трифторметилу, ціано, карбокси, CONH2, нітро, оксо, S(O)2NH2, С1-4алкілу, С2-4алкенілу, С2-4алкінілу, С14гідроксіалкілу, С1-4алкокси, С1-4алкоксикарбонілу, уреїдо, тіоуреїдо, С1-4алкілкарбонілокси, С1С1-4алкоксисульфонілокси, 4алкоксикарбонілокси, С1-4алкоксикарбамоїлу, С1-4амінокарбонілу, С14алкілтіо, С3-6циклоалкілу, С3-6циклоалкенілу, аміно, іміно, С1-4аміносульфонілу, С14амінокарбонілокси, С1-4алкілсульфоніламіно, С1С1-4алкілкарбоніламіно, С14алкоксііміно, С1-6гетероарилу, С14алкілсульфонілу, 6гетеропиклоалкілу або С2-6гетероциклоалкенілу, останні 27 з яких, крім того, необов'язково додатково заміщені одним або більше, однаковими або різними замісниками, вибраними із групи, яка складається з галогену, гідрокси, -NH2, меркапто, трифторметилу, ціано, карбокси, CONH2, нітро, оксо, -S(O)2NH2, С1-4алкілу або С1-4гідроксіалкілу, або R3 являє собою водень, гідрокси або карбокси; за умови, що сполука не є [4-(2амінофеніламіно)-2-хлорфеніл]-(2-метил-5-{1-[2[(тетрагідропіран-2-ілокси)етил]-1Н-[1,2,3]триазол4-іл}феніл]метаноном або [4-[(2-амінофеніламіно)2-хлорфеніл]-{5-[1-(2-гідроксіетил)-1Н[1,2,3]триазол-4-іл]-2-метилфеніл}метаноном. 90698 14 У наступному переважному прикладі сполук формули Іа або Ib R4, R5, R6, R7 і R8 незалежно один від одного являють собою водень, галоген, гідрокси, трифторметил, метокси, етокси, метил або етил. В іншому прикладі даного винаходу R5, R6, і R7 незалежно один від одного являють собою водень, галоген, -NH2, гідрокси, трифторметил, метокси, етокси, ціано, ацетил, ацетамідо, метил або етил, і R4 і R8 незалежно один від одного являють собою водень, галоген, гідрокси, трифторметил, метокси, етокси, ціано, ацетил, ацетамідо, метил або етил. У ще одному прикладі сполук формули Іа або Ib R4, R5, R6, R7 і R8 незалежно один від одного являють собою водень, фтор або хлор. У ще одному прикладі сполук формули Іа або Іb, принаймні три з R4, R5, R6, R7 або R8 являють собою водень. В наступному наданому прийнятному прикладі сполук формули Іа або Ib R5, R7 і R8 являють собою водень. У наступному наданому переважному прикладі сполук формули Іа або Ib R5, R6, R7 і R8 являють собою водень. В наступному наданому переважному прикладі сполук формули Іа або Ib R4, R5, R7 і R8 являють собою водень. У ще одному прикладі сполук формули Іа або Ib R4, R7 і R8 або R6, R7 і R8, або R4, R6, R7 і R8, або R4, R6 і R8, або R4, R6 і R7 являють собою водень. У наступному наданому переважному прикладі сполук формули Іа або Ib R1 являє собою метил і R2 являє собою хлор. В наступному наданому переважному прикладі сполук формули Іа або Ib R3 являє собою С14алкіл, С1-4алкеніл або С1-4гідроксіалкіл, кожний з яких необов'язково може бути заміщений одним або більше, однаковими або різними замісниками, вибраними із групи, яка складається з галогену, гідрокси, меркапто, -NH2, карбокси, CONH2, нітро, оксо, -S(O)2NH2, С1-2гідроксіалкілу, С1-2алкокси, С12алкоксикарбонілу, С1-2уреїдо, С1-2тіоуреїдо, С12алкілкарбонілокси, С1-2алкоксикарбонілокси, С12алкоксисульфонілокси, С1-2алкоксикарбамоїлу, С12амінокарбонілу, С1-2алкілтіо, С1-2аміно, С1-2іміно, С1-2аміносульфонілу, С1-2амінокарбонілокси, С1С1-2алкоксііміно, С12алкілсульфоніламіно, С1-2алкілсульфонілу, С22алкілкарбоніламіно, С2-5гетероциклоалкілу, С35гетероарилу, 5гетероциклоалкенілу, останні 22 з яких необов'язково додатково можуть бути, крім того, заміщені одним або більше, однаковими або різними замісниками, вибраними із групи, яка складається з гідрокси, -NH2, карбокси, CONH2, оксо або С1-3алкілу, за умови, що сполука не є [4-(2амінофеніламіно)-2-хлорфеніл]-[2-метил-5-{1-[2(тетрагідропіран-2-ілокси)етил]-1Н-[1,2,3]триазол4-іл}феніл]метаноном або [4-(2-амінофеніламіно)2-хлорфеніл]-{5-[1-(2-гідроксіетил)-1Н[1,2,3]триазол-4-іл]-2-метилфеніл}метаноном. У наступному переважному прикладі сполук формули Іа або Ib R3 являє собою С1-3алкіл, С13алкеніл або С1-3гідроксіалкіл, кожний з яких необов'язково заміщений одним або більше, однако 15 вими або різними замісниками, вибраними із групи, яка складається з гідрокси, -NH2, карбокси, хлору, CONH2, оксо, -S(O)2NH2, С1-2гідроксіалкілу, С1-2алкокси, С1-2алкоксикарбонілу, С0-2уреїдо, С1С1-2аміно, С12амінокарбонілу, С2-5гетероциклоалкілу, 2алкілсульфоніламіно, останні 8 з яких додатково можуть бути, крім того, заміщені одним або більше, однаковими або різними замісниками, вибраними із групи, яка складається з гідрокси або С1-2алкілу, за умови, що сполука не є [4-(2амінофеніламіно)-2-хлорфеніл]-(2-метил-5-{1-[2(тетрагідропіран-2-ілокси)етил]-1Н-[1,2,3]триазол4-іл}феніл]метаноном або [4-(2-амінофеніламіно)2-хлорфеніл]-{5-[1-(2-гідроксіетил)-1Н[1,2,3]триазол-4-іл]-2-метилфеніл}метаноном. У наступному переважному прикладі сполук формули Іа або Ib R3 являє собою метил, етил, пропіл, пропеніл, всі вони заміщені одним, двома, трьома або чотирма однаковими або різними замісниками, вибраними із групи, яка складається з гідрокси, CONH2, оксо, діетиламіно, етиламінокарбонілу, метилу, гідроксиметилу, піролідинілу, морфолінілу, хлору, H2N-C(O)-NH-, метоксикарбонілу, метокси, -NH2, етоксикарбонілу, етокси, метилсульфоніламіно, -S(O)2NH2, тетрагідропіранілу, [1,3]діоксоланілу, етиламіно, піперазинілу, останні чотири додатково заміщені одним, двома, трьома або чотирма однаковими або різними замісниками, вибраними із групи, яка складається з метилу або етилу. У наступному переважному прикладі сполук формули Іа або Ib R3 являє собою 2-гідроксіетил, 3-гідроксипропіл, карбамоїлметил, 2,3дигідроксипропіл, 2-(метилсульфоніламіно)етил, сульфоніламінопропіл, 2,2-диметил-[1,3]діоксолан4-ілметил, 2-(тетрагідропіран-2-ілокси)етил, 3(тетрагідропіран-2-ілокси)пропіл, етоксикарбонілметил, карбоксиметил, етиламінокарбонілметил, (2-гідрокси-1,1-диметилетил)амінокарбонілметил, 1-піролідин-1-ілетанон, 1-морфолін-4-ілетанон, 2хлоретил, 1-гідрокси-1-метил етил, ацетил, 1аміно-1-метилетил, метоксикарбоніл, карбокси, гідроксиметил, 3-гідроксипропеніл, 2-аміноетил, метилсечовина, 2-морфолін-4-ілетил, (4метилпіперазин-1-іл)етил, 2-діетиламіноетил, 2-(2гідроксіетиламіно)етил, пропіламіноетил або діетиламін. Конкретні приклади сполук формули І можуть бути вибрані із групи, яка складається з [2-хлор-4-(2,4-дифторфеніламіно)феніл]-(2метил-5-{1-[2-(тетрагідропіран-2-ілокси)етил]-1Н[1,2,3]триазол-4-іл}феніл)метанону (сполука 101), [2-хлор-4-(2,4-дифторфеніламіно)феніл]-{5-[1(2-гідроксіетил)-1Н-[1,2,3]триазол-4-іл]-2метилфеніл}метанону (сполука 102), [2-хлор-4-(2,4-дифторфеніламіно)феніл]-(2метил-5-{1-[3-(тетрагідропіран-2-ілокси)пропіл]-1Н[1,2,3]триазол-4-іл}феніл)метанону (сполука 103), [2-хлор-4-(2,4-дифторфеніламіно)феніл]-{5-[1(3-гідроксипропіл)-1Н-[1,2,3]триазол-4-іл]-2метилфеніл}метанону (сполука 104), [2-хлор-4-(2,4-дифторфеніламіно)феніл]-{5-[1(2,2-диметил-[1,3]діоксолан-4-ілметил)-1Н 90698 16 [1,2,3]триазол-4-іл]-2-метилфеніл}метанону (сполука 105), [2-хлор-4-(2,4-дифторфеніламіно)феніл]-{5-[1(2,3-дигідроксипропіл)-1Н-[1,2,3]триазол-4-іл]-2метилфеніл}метанону (сполука 106), 2-(4-{3-[2-хлор-4-(2,4дифторфеніламіно)бензоїл]-4-метилфеніл}[1,2,3]триазол-1-іл)ацетаміду (сполука 107), аміду 3-(4-{3-[2-хлор-4-(2,4дифторфеніламіно)бензоїл]-4-метилфеніл}[1,2,3]триазол-1-іл)пропан-1-сульфонової кислоти (сполука 108), N-[2-(4-{3-[2-хлор-4-(2,4дифторфеніламіно)бензоїл]-4-метилфеніл}[1,2,3]триазол-1-іл)етил]метансульфонаміду (сполука 109), етилового ефіру (4-{3-[2-хлор-4-(2,4дифторфеніламіно)бензоїл]-4-метилфеніл}[1,2,3]триазол-1-іл)оцтової кислоти (сполука 110), (4-{3-[2-хлор-4-(2,4дифторфеніламіно)бензоїл]-4-метилфеніл}[1,2,3]триазол-1-іл)оцтової кислоти (сполука 111), 2-(4-{3-[2-хлор-4-(2,4дифторфеніламіно)бензоїл]-4-метилфеніл}[1,2,3]триазол-1-іл)-N-етилацетаміду (сполука 112), 2-(4-{3-[2-хлор-4-(2,4дифторфеніламiно)бензоїл]-4-метилфеніл}[1,2,3]триазол-1-іл)-N-(2-гідрокси-1,1диметилетил)ацетаміду (сполука 113), 2-(4-{3-[2-хлор-4-(2,4дифторфеніламіно)бензоїл]-4-метилфеніл}[1,2,3]триазол-1-іл)-1-піролідин-1-ілетанону (сполука 114), 2-(4-{3-[2-хлор-4-(2,4дифторфеніламіно)бензоїл]-4-метилфеніл}[1,2,3]триазол-1-іл)-1-морфолін-4-ілетанону (сполука 115), [2-хлор-4-(4-трифторметилфеніламіно)феніл]{5-[4-(2-гідроксіетил)-[1,2,3]триазол-1-іл]-2метилфеніл}метанону (сполука 116), [2-хлор-4-о-толіламінофеніл]-{5-[4-(2гідроксіетил)-[1,2,3]триазол-1-іл]-2метилфеніл}метанону (сполука 117), [2-хлор-4-(2-хлор-4-фторфеніламіно)феніл]-{5[4-(2-гідроксіетил)-[1,2,3]триазол-1-іл]-2метилфеніл}метанону (сполука 118), [2-хлор-4-(2,4-дифторфеніламіно)феніл]-(2метокси-5-{1-[2-(тетрагідропіран-2-ілокси)етил]-1Н[1,2,3]триазол-4-іл}феніл)метанону (сполука 119), [2-хлор-4-(2,4-дифторфеніламіно)феніл]-{5-[1(2-гідроксіетил)-1Н-[1,2,3]триазол-4-іл]-2метоксифеніл}метанону (сполука 120), [2-хлор-4-(4-фторфеніламіно)феніл]-(2-метил5-{1-[2-(тетрагідропіран-2-ілокси)етил]-1Н[1,2,3]триазол-4-іл}феніл)метанону (сполука 121), [2-хлор-4-(4-фторфеніламіно)феніл]-{5-[1-(2гідроксіетил)-1H-[1,2,3]триазол-4-іл]-2метилфеніл}метанону (сполука 122), [2-хлор-4-(4-фторфеніламіно)феніл]-{5-[1-(2,2диметил[1,3]діоксолан-4-ілметил)-1Н[1,2,3]триазол-4-іл]-2-метилфеніл}метанону (сполука 123), 17 [2-хлор-4-(4-фторфеніламіно)феніл]-{5-[1-(2,3дигідроксипропіл)-1Н-[1,2,3]триазол-4-іл]-2метилфеніл}метанону (сполука 124), 2-(4-{3-[2-хлор-4-(4-фторфеніламіно)бензоїл]4-метилфеніл}-[1,2,3]триазол-1-іл)ацетаміду (сполука 125), [2-хлор-4-(2,4-дифторфеніламіно)феніл]-{5-[1(2-хлоретил)-1Н-[1,2,3]триазол-4-іл]-2метилфеніл}метанону (сполука 126), [2-хлор-4-(4-фторфеніламіно)феніл]-{5-[4-(2гідроксіетил)-[1,2,3]триазол-1-іл]-2метилфеніл}метанону (сполука 127), [2-хлор-4-(2,4-дифторфеніламіно)феніл]-{5-[4(2-гідроксіетил)-[1,2,3]триазол-1-іл]-2метилфеніл}метанону (сполука 128), [2-хлор-4-(2,4-дифторфеніламіно)феніл]-{5-[4(1-гідрокси-1-метилетил)-[1,2,3]триазол-1-іл]-2метилфеніл}метанону (сполука 129), 1-(1-{3-[2-хлор-4-(2,4дифторфеніламіно)бензоїл]-4-метилфеніл}-1Н[1,2,3]триазол-4-іл)етанону (сполука 130), {5-[4-(1-аміно-1-метилетил)-[1,2,3]триазол-1іл]-2-метилфеніл}-[2-хлор-4-(2,4дифторфеніламіно)феніл]метанону (сполука 131), 1-{3-[2-хлор-4-(2,4дифторфеніламіно)бензоїл]-4-метилфеніл}-1Н[1,2,3]триазол-4-карбоксикислоти метилового ефіру (сполука 132), 1-{3-[2-хлор-4-(2,4дифторфеніламіно)бензоїл]-4-метилфеніл}-1Н[1,2,3]триазол-4-карбоксикислоти (сполука 133), [2-хлор-4-(2,4-дифторфеніламіно)феніл]-[5-(4гідроксиметил-[1,2,3]триазол-1-іл)-2метилфеніл]метанону (сполука 134), [2-хлор-4-(2,4-дифторфеніламіно)феніл]-{5-[4(3-гідроксипропеніл)-[1,2,3]триазол-1-іл]-2метилфеніл}метанону (сполука 135), {5-[4-(2-аміноетил)-[1,2,3]триазол-1-іл]-2метилфеніл}-[2-хлор-4-(2,4дифторфеніламіно)феніл]метанону (сполука 136), (1-{3-[2-хлор-4-(2,4дифторфеніламіно)бензоїл]-4-метилфеніл-1Н[1,2,3]триазол-4-ілметил)сечовини (сполука 137), [2-хлор-4-(2,4-дифторфеніламіно)феніл]-{2метил-5-[4-(2-морфолін-4-ілетил)-[1,2,3]триазол-1іл]феніл}метанону (сполука 138), [2-хлор-4-(2,4-дифторфеніламіно)феніл]-(2метил-5-{4-[2-(4-метилпіперазин-1-іл)етил][1,2,3]триазол-1-іл}феніл}метанону (сполука 139), [2-хлор-4-(2,4-дифторфеніламіно)феніл]-{5-[4(2-діетиламіноетил)-[1,2,3]триазол-1-іл]-2метилфеніл}метанону (сполука 140), [2-хлор-4-(2,4-дифторфеніламіно)феніл]-(5-{4[2-(2-гідроксіетиламіно)етил]-[1,2,3]триазол-1-іл}-2метилфеніл)метанону (сполука 141), [2-хлор-4-(2,4-дифторфеніламіно)феніл]-{2метил-5-[4-(2-пропіламіноетил)-[1,2,3]триазол-1іл]феніл}метанону (сполука 142), [2-хлор-4-(4-фтор-2-метилфеніламіно)феніл]{5-[4-(2-гідроксіетил)-[1,2,3]триазол-1-іл]-2метилфеніл}метанону (сполука 143), [2-хлор-4-(2-метоксифеніламіно)феніл]-{5-[4(2-гідроксіетил)-[1,2,3]триазол-1-іл]-2метилфеніл}метанону (сполука 144), 90698 18 [2-хлор-4-(4-хлор-2-метилфеніламіно)феніл]{5-[4-(2-гідроксіетил)-[1,2,3]триазол-1-іл]-2метилфеніл}метанону (сполука 145), [2-хлор-4-(4-метоксифеніламіно)феніл]-{5-[4(2-гідроксіетил)-[1,2,3]триазол-1-іл]-2метилфеніл}метанону (сполука 146), [2-хлор-4-(2,4-дифторфеніламіно)феніл]-{5-[4(2-етиламіноетил)-[1,2,3]триазол-1-іл]-2метилфеніл}метанону (сполука 147), [4-(2,4-дифторфеніламіно)-2-метилфеніл]-{5[4-(2-гідроксіетил)-[1,2,3]триазол-1-іл]-2метилфеніл}метанону (сполука 148), [4-(3-хлор-4-фторфеніламіно)-2-метилфеніл]{5-[4-(2-гідроксіетил)-[1,2,3]триазол-1-іл]-2метилфеніл}метанону (сполука 149), {5-[4-(2-гідроксіетил)-[1,2,3]триазол-1-іл]-2метилфеніл}-(2-метил-4феніламінофеніл)метанону (сполука 150), 1-[3-(4-{5-[4-(2-гідроксіетил)-[1,2,3]триазол-1іл]-2-метилбензоїл}-3метилфеніламіно)феніл]етанону (сполука 151), 3-(4-{5-[4-(2-гідроксіетил)-[1,2,3]триазол-1-іл]-2метилбензоїл}-3-метилфеніламіно)бензонітрилу (сполука 152), {5-[4-(2-гідроксіетил)-[1,2,3]триазол-1-іл]-2метилфеніл}-[2-метил-4-(3трифторметилфеніламіно)феніл]метанону (сполука 153), [4-(3,4-дифторфеніламіно)-2-метилфеніл]-{5[4-(2-гідроксіетил)-[1,2,3]триазол-1-іл]-2метилфеніл}метанону (сполука 154), [4-(3,4-диметилфеніламіно)-2-метилфеніл]-{5[4-(2-гідроксіетил)-[1,2,3]триазол-1-іл]-2метилфеніл}метанону (сполука 155), [4-(3-хлор-2-метилфеніламіно)-2-метилфеніл]{5-[4-(2-гідроксіетил)-[1,2,3]триазол-1-іл]-2метилфеніл}метанону (сполука 156), [4-(3,4-дихлорфеніламіно)-2-метилфеніл]-{5-[4(2-гідроксіетил)-[1,2,3]триазол-1-іл]-2метилфеніл}метанону (сполука 157), N-[3-(4-{5-[4-(2-гідроксіетил)-[1,2,3]триазол-1іл]-2-метилбензоїл}-3метилфеніламіно)феніл]ацетаміду (сполука 158), [2-хлор-4-(2,4-дифторфеніламіно)феніл]-{2хлор-5-[4-(2-гідроксіетил)-[1,2,3]триазол-1іл]феніл}метанону (сполука 159), [2-хлор-4-(3-фторфеніламіно)феніл]-{5-[4-(2гідроксіетил)-[1,2,3]триазол-1-іл]-2метилфеніл}метанону (сполука 160), [2-хлop-4-(3-хлорфеніламіно)феніл]-{5-[4-(2гідроксіетил)-[1,2,3]триазол-1-іл]-2метилфеніл}метанону (сполука 161), [2-хлор-4-т-толіламінофеніл]-{5-[4-(2гідроксіетил)-[1,2,3]триазол-1-іл]-2метилфеніл}метанону (сполука 162), [2-хлор-4-(3-метоксифеніламіно)феніл]-{5-[4(2-гідроксіетил)-[1,2,3]триазол-1-іл]-2метилфеніл}метанону (сполука 163), [2-хлор-4-(2,3-дихлорфеніламіно)феніл]-{5-[4(2-гідроксіетил)-[1,2,3]триазол-1-іл]-2метилфеніл}метанону (сполука 164), [2-хлор-4-(3,5-диметилфеніламіно)феніл]-{5-[4(2-гідроксіетил)-[1,2,3]триазол-1-іл]-2метилфеніл}метанону (сполука 165), 19 90698 20 [2-хлор-4-(2,5-дифторфеніламіно)феніл]-{5-[4(2-гідроксіетил)-[1,2,3]триазол-1-іл]-2метилфеніл}метанону (сполука 166) і [2-хлор-4-(3,5-дифторфеніламіно)феніл]-{5-[4(2-гідроксіетил)-[1,2,3]триазол-1-іл]-2метилфеніл}метанону (сполука 167). У ще одному прикладі даного винаходу сполук формули Іа, принаймні, один з R5, R6, R7, або R8 не є воднем у тому випадку, коли R4 являє собою NH2, або, принаймні, один з R4, R5, R6, або R7 не є воднем у тому випадку, коли R8 являє собою ΝΗ2. Способи одержання Сполуки даного винаходу можуть бути отримані декількома шляхами, добре відомими фахівцеві в галузі техніки, пов'язаній з органічним синтезом. Сполуки даного винаходу можуть бути синтезовані з використанням способів, викладених нижче, у сукупності зі способами, відомими в галузі техніки синтетичної органічної хімії, або варіацій їх, які приймаються в увагу фахівцями в даній галузі техніки. Прийнятні методи включають ті, які описані нижче, але ними не обмежуються. Сполуки формули Іа і Іb можуть бути отримані з використанням реакцій і технологічного обладнання, описаного в цьому розділі. Реакції здійснюються в розчинниках, які є прийнятними для застосовуваних реагентів і матеріалів і які придатні для того, щоб перетворення були здійснені. Також, в описаних нижче синтетичних методах, варто розуміти, що всі запропоновані реакційні умови, включаючи вибір розчинника, що оточує газоподібне середовище реакції, реакційна температура, тривалість експерименту й процедури обробки вибрані як стандартні умови реакції, які повинні бути повністю визнані кожним фахівцем у цій галузі техніки. Кожному фахівцеві в галузі техніки органічного синтезу зрозуміло, що функціональні можливості, які існують для різних положень молекул, використовуваних як вихідні сполуки або як проміжні сполуки в синтезі, повинні поєднуватися із запропонованими реагентами й реакціями. Не всі сполуки формули І, що попадають під даний клас, можуть поєднуватися з деякими умовами реакції, необхідними в деяких описаних способах. Такі обмеження в замісниках або у функціональних групах, які поєднуються з умовами реакції повинні бути цілком очевидними кожному фахівцеві в цій галузі техніки й можуть застосовуватися альтернативні способи. Сполуки відповідно до даного винаходу можуть бути отримані в процесі, який включає сполучення алкіну, що має кінцеву алкінільну групу, формули ІІа з азидом формули ІІІа, з утворенням сполуки формули Іа, як це показано на схемі 1; або подібним чином у процесі, що включає сполучення азиду формули lІb з алкіном, що має кінцеву алкінільну групу, формули lllb, з утворенням сполуки формули Іb, як це показано на схемі 1; де R1b, R2, R3, R4, R5, R6, R7 i R8 такі, як це визначено вище, за винятком тих випадків, коли які-небудь замісники або функціональні групи, які потенційно реакційноздатні в реакції сполучення, можуть бути захищені до здійснення реакції сполучення, і захисні групи видаляються згодом. FGI: взаємоперетворення функціональних груп R'b R'2, R'3, R'4, R'5, R'6, R'7 і R'8 заміщаються на R1, R2, R3, R4, R5, R6, R7 і R8 відповідно або на якунебудь прийнятну FG (функціональну групу), що може бути перетворена в R1, R2, R3, R4, R5, R6, R7 і R8. Схема 1 Вищезгадана реакція сполучення здійснюється шляхом використання способу утворення 1,4дизаміщених триазолів, добре відомого будьякому фахівцеві в галузі техніки органічного синтезу (див., наприклад, WO 03/101972, Angew. Chem. Int. Ed. 2002, 41, No. 14, JOC 2002, 67, 3057-3064, і посилання, там вміщені). Прийнятним способом є каталізований міддю (І) спосіб, що включає сполу чення азиду з алкіном. що має кінцеву алкінільну групу, при кімнатній температурі або більш високій температурі (наприклад, до 80°С). Різні джерела міді можуть бути використані в процесі, прикладами яких, не обмежуючими об'єм винаходу, є Cu(I)I, Cu(I)Br, Cu(I)Cl, Cu(I)OAc і Cu(0). У цей час переважним джерелом є Cu(II)SO4·5H2O у присутності прийнятного відновлювального агента типу аскорбату натрію. Кількість джерела міді, використовуваного в цьому каталітичному процесі, звичайно знаходиться в межах від 0,1 до 10% по молях відносно кількості використовуваного алкіну або азиду. Реакція звичайно здійснюється при невисоких температурах (наприклад, 25°С) у таких розчинни 21 90698 22 ках, як метанол, етанол, трет-бутанол, 1,4-діоксан, ацетонітрил, диметилсульфоксид (DMSO), ацетон, Ν,Ν-диметилформамід (DMF), N-метилпіролідон (NMP) або тетрагідрофуран (THF). Коли як каталітична система використовується Cu(II)SO4·5H2O в присутності відновлювального агента, тоді в реакцію звичайно додаються мінорні кількості води (240%, об./об.)· Вищезгадана взаємодія також може бути здійснена некаталітично (без Сu), але термічно, просто шляхом нагрівання. Однак, процес також може приводити до 1,5-дизаміщених триазолів. Сполуки, відповідно доданого винаходу, загальної формули llа можуть бути приготовлені декількома способами, відомими фахівцеві в галузі техніки органічного синтезу. Одна зі зручних послідовностей перетворень показана на схемі 2. Ключова стадія включає сполучення йодиду загальної формули IV з етинілтриметилсиланом, що забезпечує утворення сполуки загальної формули III. Сполучення звичайно здійснюється в присутності каталітичних кількостей джерела паладію (0), наприклад, pd2(dba)3; каталітичних кількостей солі міді (І), наприклад, йодид міді(І); і ліганду, наприклад, трифенілфосфіну для стабілізації каталітичної системи. Реакція добре описана в літературі, яка також називається реакцією Соногашира (Sonogashira) (див., наприклад,: Sonogashira, K. In Metal-Catalyzed Reactions, Diederich, F., Stang, P.J., Eds.; Wiley-VCH: New York, 1998). Захищена сполука III потім може бути піддана зняттю захисних груп і перетворенню у відповідну сполуку з кінцевою ацетиленовою групою загальної формули llа за допомогою обробки, наприклад, K2СО3 у метанолі, при кімнатній температурі. Йодид загальної формули IV може бути отриманий стандартним діазотуванням аміну загальної формули V, за яким йде обробка утвореної діазонієвої солі йодидом калію (див. одержання 5 як не обмежуючого об'єму винаходу прикладу для загальних застосовуваних подробиць проведення експерименту). Амін загальної формули V може бути утворений шляхом відновлення нітросполуки загальної формули VI з використанням стандартних відновлюваних агентів. Приклади таких відновлюваних агентів, у цей час включають, але не обмежуються ними, дигідрат хлориду олова, водень, форміат амонію або гідразингідрат і каталітичну кількість паладію-на-вугіллі. Азид загальної формули llb може бути отриманий з аміну загальної формули V шляхом обробки трифторметансульфонілазидом у присутності каталітичних кількостей солі міді, наприклад, пентагідрату сульфату міді(ІІ), як це описано в літературі, наприклад, Liu, Q.; Yitzhak, Т.; Org. Lett. 2003, 5, 2571-2572. FGI: взаємоперетворення функціональних груп R'b R'2, R'3, R'4, R'5, R'6, R'7 і R'8 заміщаються на R1, R2, R3, R4, R5, R6, R7 і R8 відповідно або на якунебудь прийнятну FG (функціональну групу), що може бути перетворена в R1, R2, R3, R4, R5, R6, R7 і R8. Схема 2 Сполуки, відповідно до даного винаходу, загальної формули VI можуть бути отримані декількома способами, відомими фахівцеві в галузі техніки органічного синтезу. Одна зі зручних послідовностей перетворень показана на схемі 3. Перша ключова стадія включає сполучення йодиду загальної формули IX з ефіром (активованою кислотою) загальної формули X з утворенням бензофенону загальної формули VII, наприклад, шляхом використання способу, описаного для одержання інших кетонів в J. Am. Chem. Soc. 1973, 95:14, 4763-4765. Реакція сполучення може бути активована шляхом перетворення йодиду IX у реакційноздатний металоорганічний інтермедіат, 23 таким чином, як обробка ізопропілмагнійхлоридом з утворенням відповідного магнійпохідного. Змішування реакційноздатного магнійпохідного з ефіром загальної формули X дає продукт загальної формули VII. Альтернативно, реакційноздатне магнійпохідне може бути трансметальоване в похідне, яке містить цинк, шляхом обробки цинковою сіллю, наприклад, хлоридом цинку або ZnBr2 або Zn2, і потім з'єднано з галогенідом кислоти, таким як хлорид кислоти для кислоти загальної формули XI, у присутності каталітичної кількості системи Рсі(О)/ліганд. Приклади таких паладієвих каталізаторів включають, але не обмежуються ними, тетракіс(трифенілфосфін)паладій(0), тетракіс(трифеніларсин)паладій(0), дихлорбіс(трифенілфосфін)паладій(ll) або бензилхлорбіс(трифенілфосфін)паладій(ІІ). Альтернативно, цинкорганічна сполука з'єднується з галогенідом кислоти, таким як хлорид кислоти, у присутності або за посередництвом еквімолярного або субстехіометричного, або каталітичної кількості солі міді (І) або (II), такої, як ацетат міді(ІІ) або розчинний комплекс CuCN·2LiCl або CuCN·2LiBr. Реакція сполучення звичайно може бути проведена при кімнатній температурі в інертних розчинниках, таких як 1,4-діоксан, толуол, бензол і тетрагідрофуран, в інертній атмосфері, наприклад, під аргоном або азотом. Друга ключова стадія включає реакцію взаємодії броміду загальної формули VII з аміном загальної формули VIII з утворенням амінобензофенону загальної формули VI. Реакція сполучення здійснюється шляхом використання способу утворення дифеніламінів, добре відомого будь-якому фахівцеві в галузі техніки органічного синтезу. Прийнятним способом є каталізований паладієм спосіб амінування, що включає сполучення аміну з арилгалогенідом (або арилтрифталатом) у присутності основи, прийнятного джерела Pd і прийнятного фосфінового ліганду в інертному розчиннику. Різні паладієві сполуки можуть використовуватися в процесі, не обмежуючими їх прикладами є ацетат паладію(ll), хлорид паладію(ll), бромід паладію(ll), дихлорбіс(трифенілфосфш)паладію(ll), тетракіс(трифенілфосфін)паладію(0), трис(дибензилиденацетон)дипаладій(0). Прийнятні фосфінові ліганди включають, але не обмежуються ними, рацемічний або нерацемічний 2,2'біс(дифенілфосфіно)-1,1'-бінафтил (тут і далі згадується як BINAP), три-о-толілфосфін, три-третбутилфосфін, 1,1'-біс(дифенілфосфіно)фероцен, біс[(2-дифенілфосфіно)феніл]ефір (DPEphos), 2дициклогенсилфосфаніл-2'-диметиламінобіфеніл, 2-(ди-трет-бутилфосфіно)дифеніл і 9,9-диметил4,6-біс(дифенілфосфіно)ксантен (Xantphos). Кількість паладію й ліганду, застосовувана в каталітичному процесі, звичайно може бути в межах від 0,1 до 10% по молях щодо кількості використовуваного ароматичного галогеніду (або трифлату). Особливо переважними апробованими основами в цьому процесі є натрій-трет-бутоксид (NaO·Bu) і карбонат цезію (Cs2CO3), але інші основи також можуть застосовуватися. Реакція звичайно здійснюється при підвищених температурах (80-120°С) 90698 24 в інертних розчинниках, таких як 1,4-діоксан, толуол, бензол і тетрагідрофуран, в інертній атмосфері, наприклад, аргону або азоту. Тіоефіри загальної формули X, наприклад, можуть бути отримані з кислот загальної формули XI шляхом обробки 2,2'-дитіопіридином у присутності трифенілфосфіну (див., наприклад, одержання 1 для загальних відповідних неосвітлених експериментальних подробиць), як це описано в Tetrahedron Letters Vol. 22, No.46, pp.4647-4650, 1981. Інші загальні методи для одержання тіоефірів загальної формули X можуть бути знайдені, наприклад, в Tetrahedron Letters No.31, рр.28752878, 1979 і Org. Letters 2003, Vol.5, No.10, pp.1633-1635 і у вміщені там посиланнях. FGI: взаємоперетворення функціональних груп R'b R'2, R'3, R'4, R'5, R'6, R'7 і R'8 заміщаються на R1, R2, R3, R4, R5, R6, R7 і R8 відповідно або на якунебудь прийнятну FG (функціональну групу), що може бути перетворена в R1, R2, R3, R4, R5, R6, R7 і R8. Схема 3 Сполуки, відповідно до даного винаходу, у спеціальних випадках можуть бути отримані простим взаємоперетворенням функціональних груп (FGI), що означає стандартний процес, відомий фахівцеві в галузі техніки органічного синтезу, де функціональна група в сполуках загальної формули І або І' трансформується в іншу функціональну групу за одну або декілька синтетичних стадій, що приводить до нової сполуки загальної формули І. Приклади таких процесів включають, але не обмежуються ними, гідроліз складного ефіру в основних умовах, що приводить до утворення кислоти, зняття метилефірної захисної групи, що приводить до утворення фенолу, шляхом обробки, наприклад, бортрибромідом (ВВr3) і, наприклад, каталітичне гідрування олефіну з утворенням насиченого вуглеводню. Не обмежуваними тільки ними прикладами таких трансформацій є описані в "Comprehensive Organic Transformations" R.C. Larock, VCH 1989 і вміщені там посилання, які в такий спосіб включені як посилання в загальні методики. Зокрема, застосування звичайних захисних груп в одній або в декількох синтетичних стадіях може виявитися доцільним у синтезах сполук загальної формули І. Приклади таких загальних захисних груп включають, але не обмежуються ними, метилові, етилові, трет-бутилові або бензилові ефіри як захисні групи для гідроксильної гру 25 пи; тетрагідропіранільні або силільні ефіри як захисні групи гідроксильної групи або кінцевої алкінової. Як показано на схемі 1, 2 або 3, кожна проміжна сполука може бути трансформована за допомогою FGI процесу, як описано вище, з утворенням нових сполук із такою ж загальною формулою (наприклад, гідроксигрупа може бути захищена третбутилдиметилсиліловим ефіром). Це тільки для ілюстрації універсальності в синтезах, і, загалом, описана послідовність процесів є однієї з декількох можливих стратегій синтезів сполук даного винаходу. Це означає, що може бути більш переважно в деяких випадках змінити послідовність процесів, описаних вище. Описані послідовності процесів не повинні розглядатися як обмеження процесів одержання сполук даного винаходу загальної формули Іа або Іb, і зміна реакційної послідовності може бути альтернативою для фахівців в галузі техніки органічного синтезу. Легко доступні інтермедіати можуть бути вихідною одиницею для синтезу різних серій сполук, які належить до загальної формули Іа і Іb. Синтези різних амінобензофенонів і загальні способи, застосовні в синтезах інтермедіатів і бензофенонів даного винаходу, можуть бути знайдені, наприклад, у патентах WO 98/32730, WO 01/05744, WO 01/05746, WO 01/05749, WO 01/05751, WO 01/05745, WO 01/42189, WO 01/90074, WO 02/083622, WО 03/018535, WO 02/076447 і WO 04/056762, і вміщені там посилання, кожна з яких, таким чином, включена в даний опис як посилання. Фармацевтичні композиції В іншому аспекті винахід належить до фармацевтичної композиції, яка включає як активний компонент сполука формули Іа або Іb разом з фармацевтично прийнятними допоміжною формотворною речовиною, носієм або наповнювачем. Крім того, винахід належить до застосування сполуки формули Іа або Іb для приготування лікарських засобів для профілактики, лікування або поліпшення стану при запальних захворюваннях або патологічних станах. Фармацевтичні композиції винаходу можуть бути у вигляді стандартних лікарських форм, таких як таблетки, пігулки, капсули, порошки, гранули, еліксири, сиропи, емульсії, ампули, супозиторії або парентеральні розчини, або суспензії для перорального, парентерального, офтальмічного, трансдермального, інтраартикулярного, локального, пульмонального, назального, букального або ректального введення, або для якого-небудь іншого методу, призначеного для технології приготування лікарських засобів на основі протизапальних сполук і відповідно до прийнятної лікарської практики, як це розкрито в Remington: The Science and Practice of Pharmacy. 19th Ed., Mack Publishing Company, 1995. У композиції винаходу активний компонент може бути присутнім у кількостях від приблизно 0,01 до приблизно 99%, а також від 0,1 до приблизно 10% від маси композиції. Для перорального введення у формі таблеток або капсули сполуку формули І доцільно комбінувати з пероральним, нетоксичним, фармацевтично 90698 26 прийнятним носієм, таким як етанол, гліцерин, вода або їм подібні. Крім того, до суміші можуть бути додані прийнятні зв'язувальні речовини, змащувальні речовини, дезінтегруючі речовини, ароматизатори й барвники, оскільки це доцільно. Прийнятні зв'язувальні речовини включають, наприклад, лактозу, глюкозу, крохмаль, желатин, аравійську камедь, трагакантову камедь, альгінат натрію, карбоксиметилцелюлозу, поліетиленгліколь, воски або їм подібні. Змащувальні речовини включають, наприклад, олеат натрію, стеарат натрію, стеарат магнію, бензоат натрію, ацетат натрію, хлорид натрію або т.п.Дезінтегруючі агенти включають, наприклад, крохмаль, метилцелюлозу, агар, бентоніт, ксантанову камедь або їм подібні. Додаткові допоміжні речовини для капсул включають макроголи або ліпіди. Для приготування твердих композицій, таких як таблетки, активна сполука формули І змішується з однією або більше допоміжними речовинами, такими як описані вище, і іншими фармацевтичними розріджувачами, такими, як вода, щоб зробити попередню приготовлену композицію твердого лікарського засобу, що містить гомогенну суміш, у якій сполука формули І рівномірно диспергована по всій композиції, так, що композиція легко може бути розділена на однакові ефективні стандартні лікарські форми, такі як таблетки й капсули. Попередньо приготовлена композиція потім може бути розділена на стандартні лікарські форми, що містять від приблизно 0,05 до приблизно 1000мг, зокрема, від приблизно 0,1 до приблизно 500мг активної сполуки винаходу. Рідкі лікарські форми як для перорального, так і для перентерального введення сполуки винаходу включають, наприклад, водяні розчини, сиропи, водні або масляні суспензії й емульсії з харчовими маслами, такими як бавовняне масло, кунжутна олія, кокосове або арахісове масло. Прийнятні диспергуючі або суспендуючі речовини для водних суспензій включають синтетичні або натуральні камеді, такі як трагакант, альгінат, аравійська камедь, декстран, натрій-карбоксиметилцелюлоза, желатин, метилцелюлоза або полівінілпіролідон. Для парентерального введення, наприклад, внутрішньом'язової, внутрішньочеревинної, підшкірної або внутрішньовенної ін'єкції або інфузії, фармацевтична композиція переважно включає сполуку формули І, розчинену або солюбілізовану в прийнятному фармацевтично прийнятному розчиннику. Для парентерального введення композиція винаходу може включати стерильний водний або неводний розчинник, зокрема, воду, ізотонічний сольовий розчин, ізотонічний розчин глюкози, буферний розчин або інший розчинник, стандартно використовуваний для парентерального введення терапевтично активних речовин. Композиція може бути стерилізована, наприклад, шляхом фільтрації через затримуючий бактерії фільтр, шляхом додавання стерилізуючої речовини до композиції, опромінення композиції або нагрівання композиції. Альтернативно, для сполуки винаходу може бути передбачене стерильне тверде приготування, наприклад, ліофілізований порошок, що 27 розчиняють у стерильному розчиннику безпосередньо перед використанням. Композиція, призначена для парентерального введення, може додатково включати у свій склад стандартні добавки, такі як стабілізатори, буфери або консерванти, наприклад, антиоксиданти, такі як метилгідроксибензоат або йому подібні. Композиції для ректального введення можуть бути у формі супозиторіїв, що включають активний інгредієнт і носій, такий як какао-масло, або у формі клізми. Композиції, придатні для інтраартикулярного введення можуть бути у формі стерильних водних препаратів активного інгредієнта, що може бути в мікрокристалічній формі, наприклад, у формі водної мікрокристалічної суспензії. Ліпосомальні лікарські форми або системи з біодеградованим полімером також можуть застосовуватися для даного активного інгредієнта як для інтраактикулярного, так і для офтальмічного введення. Композиції, придатні для топічного введення, включаючи офтальмологічне лікування, включають рідкі або напіврідкі препарати, такі як лініменти, лосьйони, гелі, апліканти, емульсії типу маслоу-воді або вода-у-маслі, такі як креми, мазі й пасти; або розчини або суспензії, такі як краплі. Для топічного введення сполука формули І звичайно може бути присутньою у кількостях від 0,01 до 20% від маси композиції, так, від 0,1 до приблизно 10%, але також може бути присутньою і в кількостях аж до приблизно 50% від композиції. Композиції для офтальмологічного лікування переважно можуть додатково містити циклодекстрин. Композиції, придатні для введення в носову або ротову порожнину, або для інгаляції, включають порошок, саморозприскувані або розпилювані лікарські форми, такі як аерозолі й пульверизатори. Такі композиції можуть включати сполуку формули І у кількостях 0,01-20%, наприклад, 2% від маси композиції. Композиція може додатково містити один або декілька інших активних компонентів, звичайно застосовуваних у лікуванні різних інфекційних захворювань і патологічних станів. Прикладами таких додаткових активних компонентів можуть бути наступні, вибрані із групи, яка складається із глюкокортикоїдів, вітаміну D і аналогів вітаміну D, антигістамінів, антагоністів фактора активації тромбоцитів (PAF), антихолінергічних агентів, метилксантинів, β-адренергічних агентів, інгібіторів СОХ-2, саліцилатів, індометацину, флюфенаматів, напроксену, тимегадину, золотохлористоводневого натрію, пеніциламіну, речовин, що знижують вміст сироваткового холестерину, ретиноїдів, солей цинку й саліцилазосульфапіридину. У додатковому аспекті, винахід зв'язаний зі способом лікування запальних захворювань і патологічних станів, або офтальмологічних захворювань і патологічних станів, або раку, спосіб полягає у введенні потребуючому цього пацієнту ефективних кількостей сполуки формули І. Прийнятні дози сполуки винаходу будуть залежати, між іншим, від віку й стану пацієнта, від 90698 28 серйозності захворювання, яке треба вилікувати, і від інших факторів, добре відомих практикуючому лікарю. Сполука може вводитися або перорально, парентерально, або топічно, відповідно до різних схем застосування, наприклад, із щоденною, або щотижневою періодичністю. Звичайно, однократна доза вибирається в межах від 0,01 до 400мг/кг маси тіла. Сполука може вводитися як болюс (тобто повна денна доза вводиться однократно) або дробовими дозами два або декілька разів на день. Запальні захворювання або патологічні стани, лікування яких передбачено даними сполуками, це запальні захворювання, при яких модуляція експресії й секреції цитокінів може бути опосередкована МАР кіназами, такими як р38 МАР кіназа, як це обговорювалося вище. Приклади запальних захворювань і патологічних станів, для яких передбачається опосередкована дія р38 МАР кінази, вибираються із групи, яка складається з астми, артриту, включаючи ревматоїдний артрит і спондилоартрит, подагри, атеросклерозу, запального захворювання травного тракту, хвороби Крона, неврологічних запалень, запальних захворювань око, проліферативних і запальних шкірних порушень, таких як псоріаз, атопічний дерматит і звичайні вугри, увеїт, сепсис, септичний шок і остеопороз. Лікування додатково може включати введення одного або декількох протизапальних активних компонентів, таких як глюкокортикоїди, вітамін D і аналоги вітаміну D, антигістаміни, антагоністи фактора активації тромбоцитів (PAF), антихолінергічні речовини, метилксантини, β-адренергічні речовини, інгібітори СОХ-2, саліцилати, індометацин, флюфенамати, напроксен, тимегадин, золотохлористоводневий натрій, пенициламін, речовини, що знижують вміст сироваткового холестерину, ретиноїди, солі цинку й саліцилазосульфапіридин. Введення сполуки даного винаходу й іншого протизапального компонента може бути або одночасним, або послідовним. Передбачається лікування даними сполуками офтальмологічних захворювань і паталогічних станів, включаючи офтальмологічні захворювання й патологічні стани неінфекційні (наприклад, алергійні) кон'юнктивіт, ірит, кератит, увеїт, склерит, епісклерит, симпатичний офтальміт, блефарит або сухий кератокон'юнктивіт. Фармакологічні способи Для вивчення впливу сполук даного винаходу in vitro, інгібування секреції IL-1β і TNF-α визначали з використанням наступної методики: Продукування цитокінів вимірювали в середовищі стимульованих ліпополісахаридом (LPS) периферичних кров'яних моноядерних клітин. Моноядерні клітини були ізольовані з людської периферичної крові шляхом фракціонування з використанням Lymphoprep® (Nycomed, Norway) і суспендування в RPMI 1649 (середовище для культивування) із сироваткою зародка теляти (FCS, 2%) у концентрації 5 105клітин/мл. Клітини інкубували на планшетах з 24 ямками у вигляді тихорєцької культури, в 1-мл аліквотах. Тестовані сполуки розчиняли в диметилсульфоксиді (DMSO, 10мМ) і розбавляли середовищем. Сполуки дода 29 90698 30 вали до клітин за 30хв., потім додавали LPS (1мг/мл кінцева концентрація). Планшети інкубували 18 годин і визначали концентрацію IL-1β і TNF-α у середовищі шляхом ферментзв'язаного імуносорбентного аналізу. Половинні інгібуючі концентрації (ІС50) сполук були підраховані. Результати показані в таблиці 1. Посилання на сполуку а: (4-(2амінофеніламіно)-2-хлор-2'-метилбензофенон, сполука 156, розкрита в патенті WO 98/32730. Посилання на сполуку b: 2'-[3-хлор-4-(2метилбензоїл)феніламіно]октананілід, сполука 102, розкрита в патенті WO 01/05746. Посилання на сполуку с: 1-ацетоксиметил Ν[2-[3-хлор-4-(2метилбензоїл)феніламіно]феніл]карбамат, сполука 109, розкрита в патенті WO 01/05749. Посилання на сполуку d: 1-етил-3-[2-[3-хлор-4(2-метилбензоїл)феніламіно]-5фторфеніл]сечовина, сполука 114, розкрита в патенті WO 01/05751. Посилання на сполуку e: 2,2,2-трифтор-Ν-[2-[3хлор-4-(2-метилбензоїл)феніламіно]-5фторфеніл]ацетамід, сполука 102, розкрита в патенті WO 01/05745. Посилання на сполуку f: 2-хлор-4-(3-фтор-2метилфеніламіно)-2'-метилбензофенон, сполука 131, розкрита в патенті WO 01/42189. 31 Ці результати показують, що сполука даного винаходу є сильнодіючими інгібіторами продукування IL-1β і TNF-α і проявляють несподівано більш високу активність в інгібуванні цитокінів, ніж сполуки, на які посилаються, це робить їх потенційно застосовними в лікуванні запальних захворювань. Крім того, нові похідні амінобензофенону можуть мати несподівано корисні фармакокінетичні властивості, такі, як абсорбція й метаболічна стабільність. Аналіз р38 а МАР кінази Клітинна культура COS-1 клітини (отримані з фібробластоподібних клітин нирок африканської зеленої мавпи, що містять Τ антиген дикого типу під контролем SV40 промотору) отримані від АТСС (АТСС №CRL-1650) і вирощені на середовищі для культивування (DMEM без фенолового червоного, 10% FCS, 2мМ L-глутаміну, 100U пеніциліну і 100мкг стрептоміцину/мл) при 37°С з 5% С2. Клітини двічі в тиждень пересівали із трипсинацією (0,25% трипсину, 1мМ EDTA в PBS) і розподіляли 1:10. Середовище міняли кожні два або три дні. Клітинна лінія регулярно тестувалась за допомогою включення PCR праймера мікоплазми (Stratagene) і виявлення відсутності вмісту Mycoplasma. Середовище тихорєцької клітинної культури, FCS, L-глутамін і пеніцилін, і стрептоміцин отримані від Bribco BRL Gaithersburg, MD, USA. Транзисторна експресія COS-1 клітин Протягом дня однакові COS-1 клітини висівали в 143см2 чашки Петрі із щільністю 2 104клітин/см2 середовища культивування. На день 2 клітини були піддані котрансфекції з 5мкг (загальна кількість) експериментальної плазмідної ДНК, яка експресує FLAG-p38a і FLAG-MKK6 (ЕЕ). Плазміди були уведені в COS-1 клітини в безсироваткове середовище з використанням DOTAP™ (Boehringer-Mannheim, Mannheim, Germany). Плазмідна ДНК була приготовлена й очищена з використанням набору QIAGEN EndoToxin-free Maxiprep-500 (Hilden, Germany). Коротко, ДНК і DOTAP™ перемішували рівно 15хв. при 37°С у середовищі СО2 в iнкубаторі. Трансфекційну суміш потім переносили в пробірки об'ємом15мл і додавали до трансфекційної суміші трансфекційне середовище (DMEM з L-глутаміном і пін.-стреп., але без сироватки), з наступним додаванням клітинного моношару. Після 4 годин інкубації з DOTAP™ і плазмідами до клітин додавали середовище з подвоєним вмістом сироватки, доводячи кінцеву концентрацію сироватки до 10%. Клітини потім інкубували 24 години до проведення реакції з кіназою. Імунопреципітація Після 24 інкубації реакцію зупиняли, вміщуючи чашки Петрі в баню з льодом. Середовище видаляли за допомогою аспіратора й клітинний моношар промивали однократно охолодженим у льоді PBS (137мМ NaCl, 1,5мМ KН2РО4, 2,7мМ KСl, 8,1мМ Nа2НРO·2Н2гО) і потім солюбілізували протягом 10хв. в 1,5мл доданого лізуючого буфера (50мМ HEPES, р7,5, 150мМ NaCl, 10мМ EDTA, 10мМ Na4P2O7, 100мМ Na, 2мМ Na3VO4, 1% Три 90698 32 тон-Х-100, Пефаблок 500мкМ, Лейпептин 10мкг/мкл, Апротинін 10мкг/мкл). Клітинний моношар зскрібали гумовим шкребком і переносили в пробірку Еппендорф. Солюбілізовані клітини відділяли від домішок центрифугуванням при 10000 g 10хв. при 4°С. Супернатант переносили в 50мкл гранул промитої протеїн G сефарози в HNTбуфері (30мМ HEPES, р7,5, 30мМ NaCl, 0,1% Тритон Х-100) і інкубували з 2мкг/зразок моноклональних антитіл анти-FLAG™ М2 (індукованих проти FLAG-епітопу, NH2-Asp-Tyr-Lys-Asp-Asp-Asp-AspLys-COOH) 1 годину при кімнатній температурі. Моноклональні антитіла анти-FLAG™ М2 були отримані від Sigma (cat. №F-3165). Приблизно 60мкг білка з очищеного клітинного лізату додавали для попередньої абсорбції антитіл анти-FLAG™ на гранулах протеїн G сефарози й інкубували 90хв. при 4°С у змішувачі проби крові. Після періоду імунопреципітації гранули сефарози двічі промивали лізуючим буфером і двічі - буфером для кіназної реакції (25мМ HEPES pH7,5, 10мМ ацетату магнію, 50мкМ АТФ). Інкубація сполук із очищеною р38а кіназою Попередньо промиті імунопреципітовані aнтиFLAG-p38, абсорбовані на гранулах протеїн G сефарози, двічі промивали в 1 кіназному буфері (25мм HEPES рН7,5, 10мм ацетату магнію, 50мкм АТФ) і супернатант видаляли за допомогою аспіратора. Сполука розбавляли 1 кіназним буфером до доцільної концентрації. Сполуки додавали до промитих імунопреципітованих і активованих FLAG-p38, абсорбованих на гранулах протеїн G сефарози, на 30хв. при 30°С в об'ємі 100 кл. Кожні 10хв. пробірки Еппіндорф перевірялися, щоб переконатися, що гранули й сполуки знаходяться у розчині. Після 30хв. інкубації гранули осаджували й супернатант видаляли аспіратором. р38а МАР кіназна реакція Кіназна реакція починалася додаванням 1мкг GST-ATF-2 (Santa Cruz, LaJolla, CA USA, cat. №sc4114) разом з 2мкКюрі -32Ρ-ΑΤΡ в 1 кіназному буфері на кожний зразок. Реакцію проводили 30хв. при 30°С і її зупиняли додаванням 40мкл 2 SDSзразка буфера до кіназної реакції. Зразки кип'ятили, струшували й розділяли на 15% SDS-PAGE. Висушений SDS-PAGE гель експонували на екрані візуалізації фосфору й радіоактивні PNAS-1 смуги кількісно аналізували за допомогою STORM860 Phospho-Imager (Molecular Dynamics, Sunnyvale, CA, USA) з використанням ImageQuaNT програмного забезпечення. За даними цього кількісного аналізу було встановлено, що сполука 102 є сильним інгібітором р38 МАР кінази. In vivo скринінгова модель LPS-індукованого утворення TNF-α у мишей Вивчення впливу сполук даного винаходу in vivo, in vivo скринінгова модель LPS-індукованого вироблення TNF-α у мишей були організовані в такий спосіб: групи з 6 мишей (С3Н/Не, самки, 8 тижнів (20г), Bomholtgaard) одержували дози тестованих сполук у суспензійному середовищі за 1 годину до введення LPS (LPS з Е.соІі 055:В5, L4005, Sigma). У момент часу 0 миші одержували ініціюючу продукування дозу 1,0мг LPS/кг. Після 33 90698 34 анестезії з Hypnorm/Dormicum у мишей відбирали кров з періорбітального венозного сплетення через 80-90хв. після введення LPS. Зразки крові відбиралися в стабілізовані EDTA пробірки й центрифугувались при 4000об./хв. протягом 10хв. при 4°С. Рівень TNF-α у плазмі аналізували за допомогою методу твердофазного імуноферментного аналізу ELISA. Як речовину порівняння використовували сполуку 156 патенту WO 98/32730. Рівень TNF-α у плазмі визначали з використанням багатошарового методу ELISA. Титраційні мікропланшети покривали моноклональними антитілами проти мишачого TNF-α, промивали й блокували казеїновим буфером. Зразки стандартного рекомбінантного TNF-α додавали в осередки титраційних мікропланшет і інкубували. Всі стандарти тестували в трьох екземплярах, всі зразки плазми - в одному. Після інкубації зразка й стандарту планшети промивали й інкубували з біотинільованими поліклональними вторинними антитілами проти мишачого TNF-α і промивали. Ферментний кон'югат додавали в усі осередки й інкубували. Додавали субстрат і ферментативно/субстратну реакцію зупиняли через 15хв. при кімнатній температурі за допомогою 1М H2SO4. Прояв кольорів (оптичну густину OD) вимірювали при 450нм методом ELISA планшет-рідер і базове фонове значення OD при 620нм віднімали. Експерименти вважалися апробованими, якщо група, оброблена згаданою сполукою, показувала істотне інгібування (р1:1->1:0, з наступним використанням EtOAc як елюенту для виділення зазначеної в заголовку сполуки у вигляді кристалічної сполуки жовтого кольору. Одержання 4: (5-аміно-2-метилфеніл)-[2-хлор-4-(2,4дифторфеніламіно)феніл]метанон (сполука 404) Сполуку 403 (6,0г, 14,9ммоль) розчиняли в МеОН (350мл). Додавали цинковий пил (12,69г, 194ммоль) і NH4CI (5,59г, 104ммоль). Реакційну суміш нагрівали до температури кипіння зі зворотним холодильником протягом 1 години. Суміш фільтрували й промивали МеОН. Фільтрат концентрували й твердий залишок розчиняли в ЕtOАс (150мл) і насиченому водному розчині Na2CO3 (100мл). Водну фазу екстрагували EtOAc і об'єднані органічні фази сушили (MgSO4), фільтрували й концентрували у вакуумі. Неочищений продукт очищали флеш-хроматографією, використовуючи СН2Сl2/петролейний ефір (40-60) 1:2 як елюент для виділення зазначеної в заголовку сполуки у вигляді злегка забарвленої кристалічної сполуки. Одержання 5: [2-хлор-4-(2,4-дифтор-феніламіно)-феніл]-(5йод-2-метилфеніл)метанон (сполука 405) Сполуку 404 (0,62г, 1,66ммоль) розчиняли в ацетоні (14мл). Концентровану НСІ (37%, 0,69мл, 8,3ммоль) додавали й розчин охолоджували на бані з льодом. NaNO2 (0,14г, 1,99ммоль) розчиняли в Н2О (1мл) і додавали до вищезгаданого розчину протягом 15хв. Внутрішня температура підтримувалася при 0-2°С у процесі додавання. Суспензію перемішували на крижаній бані протягом 0,5 години, після чого додавали по краплях розчин КІ (0,41г, 2,45ммоль) і І2 (0,31г, 1,22ммоль) в Н2О (4мл) протягом 5хв. Суміш перемішували при 0°С протягом 2 годин. Н2О (20мл) і EtOAc (20мл) додавали й перемішували, і фази розділяли. Органічні фази промивали водним NaHSO3, потім водним Na2CO3, сушили (MgSO4), фільтрували й концентрували у вакуумі. Неочищений про 90698 42 дукт очищали флеш-хроматографією, використовуючи СН2СІ2/петролейний ефір (40-60) 1:5 для виділення зазначеної в заголовку сполуки у вигляді злегка забарвленої кристалічної сполуки. Одержання 6: [2-хлор-4-(2,4-дифторфеніламіно)феніл]-(2метил-5-триметилсиланілетинілфеніл)метанон (сполука 405) Сполуку 405 (400мг, 0,83ммоль) і етинілтриметилсилан (115мл, 0,83ммоль) розчиняли в дегазованому триетиламіні (11мл). Трифенілфосфін (21,7мг, 0,083ммоль), рd2((dbа)3з (15мг, 0,017ммоль) і йодид міді (І) (3мг, 0,017ммоль) додавали потім до розчину. Колбу закривали, наповнивши аргоном, і потім перемішували при 90°С протягом 18 годин. Реакційну суміш фільтрували через декалін і концентрували у вакуумі. Неочищений продукт очищали флеш-хроматографією у постійному градієнті, використовуючи EtOAc/петролейний ефір (40-60) від 0:100 до 25:75 як елюент для виділення зазначеної в заголовку сполуки у вигляді сиропу. Одержання 7: [2-хлор-4-(2,4-дифторфеніламіно)феніл]-(5етиніл-2-метилфеніл)метанон (сполука 407) Розчин сполуки 406 (426мг, 0,94ммоль) і K2СО3 (195мг, 1,41ммоль) у метанолі (4,0мл) перемішували при кімнатній температурі протягом 5 годин. Реакційну суміш виливали в суміш EtOAc/вода. Органічну фазу промивали водою, сольовим розчином і потім сушили (MgSO4), фільтрували й концентрували у вакуумі з одержанням неочищеної зазначеної в заголовку сполуки. Продукт використовували без подальшого очищення. 2-(2-азидоетокси)тетрагідропіран (сполука 108) Суміш 2-(2-брометокси)тетрагідропірану (1,00мл, 6,62ммоль), NaN3 (4,34г, 66ммоль) і тетрабутиламоніййодиду (245мг, 0,66ммоль) в DMF (7,0мл) перемішували при кімнатній температурі протягом 18 годин. Реакційну суміш виливали в суміш EtOAc/вода. Органічну фазу промивали водою, сольовим розчином і потім сушили (MgSO4), фільтрували й концентрували у вакуумі з одержанням неочищеного продукту. Неочищений продукт очищали флеш-хроматографією у постійному градієнті, використовуючи EtOAc/петролейний ефір (40-60) від 0:100 до 20:80 як елюент для виділення зазначеної в заголовку сполуки у вигляді безбарвного масла. Приклад 1: [2-Хлор-4-(2,4-дифторфеніламіно)феніл]-(2метил-5-{1-[2-(тетрагідропіран-2-ілокси)етил]-1Н[1,2,3]триазол-4-іл|феніл)метанон (сполука 101) Сполуку 407 (300мг, 0,79ммоль) і сполуку 408 (135мг, 0,79ммоль) розчиняли в етанолі (6,0мл). Свіжоприготовлений розчин пентагідрату сульфату міді(ІІ) (7,8мг, 0,031ммоль) і аскорбату натрію (31мг, 0,16ммоль) у воді (0,9мл) додавали до реакційної суміші. Колбу закривали й перемішували протягом 48 годин при кімнатній температурі. Реакційну суміш виливали в суміш ЕtOАс/вода. Органічну фазу промивали водою, сольовим розчином і потім сушили (MgSO4), фільтрували й концентрували у вакуумі з одержанням неочищеного продук 43 ту. Неочищений продукт очищали флешхроматографією у постійному градієнті, використовуючи ЕtOАс/петролейний ефір (40-60) від 0:100 до 50:50 як елюент для виділення зазначеної в заголовку сполуки у вигляді сиропу світлокоричневого кольору. 13 С ЯМР (CDCI3) δ 196,1, 159,1 (дд), 155,5 (дд), 147,8, 146,9, 139,8, 137,7, 135,3, 133,7, 131,9, 129,4, 128,3, 127,9, 126,5, 124,4 (дд), 124,3 (дд), 120,8, 116,3, 112,8, 111,6 (дд), 104,9 (дд), 99,1, 65,8, 62,4, 50,5, 30,4, 25,2, 20,2, 19,4. Приклад 2: [2-Хлор-4-(2,4-дифторфеніламіно)феніл]-{5-[1(2-гідроксіетил)-1H-[1,2,3]триазол-4-іл]-2метилфеніл}метанон (сполука 102) Розчин сполуки 101 (350мг, 0,63ммоль) у метанолі (4,0мл) додавали до толуол-4-сульфонової кислоти (60мг, 0,32ммоль) і суміш перемішували протягом 7 годин при кімнатній температурі. Реакційну суміш виливали в суміш EtOAc/вода. Органічну фазу промивали NaOH (водним, 2М), водою, сольовим розчином і потім сушили (MgSO4), фільтрували й концентрували у вакуумі з одержанням неочищеного продукту. Неочищений продукт очищали флеш-хроматографією, використовуючи ЕtOАс/петролейний ефір (40-60) 25:75 як елюент для виділення зазначеної в заголовку сполуки у вигляді піни жовтого кольору. 13 С ЯМР (CDCI3) δ 196,2, 159,2 (дд), 155,6 (дд), 148,1, 146,7, 139,9, 137,6, 135,2, 133,8, 131,8, 128,9, 127,8, 126,2, 124,6 (дд), 124,3 (дд), 121,1, 116,2, 112,7, 111,6 (дд), 104,9 (дд), 61,1, 52,8, 20,1. Одержання 9: 2-(3-Азидопропокси)тетрагідропіран (сполука 409) Суміш 2-(3-хлорпропокси)тетрагідропірану (6,28г, 35,2ммоль), NaN3 (11,4г, 176ммоль) і йодиду калії (584мг, 3,52ммоль) в DMF (50мл) перемішували при кімнатній температурі протягом 18 годин. Реакційну суміш виливали в суміш ЕtOАс/вода. Органічну фазу промивали водою, сольовим розчином і потім сушили (MgSO4), фільтрували й концентрували у вакуумі з одержанням неочищеного продукту. Неочищений продукт очищали флеш-хроматографією у постійному градієнті, використовуючи ЕtOАс/петролейний ефір (4060) від 0:100 до 15:85 як елюент для виділення зазначеної в заголовку сполуки у вигляді безбарвного масла. Приклад 3: [2-Хлор-4-(2,4-дифторфеніламіно)феніл]-(2метил-5-{1-[3-(тетрагідропіран-2-ілокси)пропіл]-1H[1,2,3]триазол-4-іл}феніл)метанон (сполука 103) Реакцію здійснювали подібно до того, як описано в одержанні сполуки 101, використовуючи сполуку 407 (0,44ммоль) і сполуку 409 (0,44ммоль). Неочищений продукт очищали флешхроматографією у постійному градієнті, використовуючи EtOAc/петролейний ефір (40-60) від 10:90 до 50:50 як елюент для виділення зазначеної в заголовку сполуки у вигляді безбарвної піни. 13 СЯМР (CDCI3) δ 196,1, 147,8, 146,9, 139,8, 137,6, 135,3, 133,7, 131,9, 129,4, 128,2, 127,9, 126,4, 124,4 (дд), 124,3 (дд), 120,2, 116,3, 112,8, 90698 44 111,6 (дд), 104,9 (дд), 99,4, 63,8, 62,9, 47,5, 30,7, 30,5, 25,4, 20,2, 19,9. Приклад 4: [2-Хлор-4-(2,4-дифторфеніламіно)феніл]-{5-[1(3-гідроксипропіл)-1H-[1,2,3]триазол-4-іл]-2метилфеніл}метанон (сполука 104) Реакцію здійснювали подібно до того, як описано в одержанні сполуки 102, використовуючи сполуку 103 (0,2ммоль). Неочищений продукт очищали флеш-хроматографією у постійному градієнті, використовуючи EtOAc/петролейний ефір (40-60) від 50:50 до 100:0 як елюент з одержанням зазначеної в заголовку сполуки у вигляді безбарвної піни. 13 С ЯМР (CDCI3) δ 196,1, 159,2 (дд), 155,6 (дд), 148,05 146,9, 139,9, 137,7, 135,3, 133,8, 131,9, 129,1, 128,0, 127,9, 126,4, 124,5 (дд), 124,3 (дд), 120,3, 116,3, 112,8, 111,6 (дд), 104,9 (дд), 58,8, 47,0, 32,6, 20,2. Одержання 10 4-Азидометил-2,2-диметил-[1,3]діоксолан (сполука 410) Реакцію здійснювали подібно до того, як описано в одержанні сполуки 408, використовуючи 2,2-диметил-[1,3]діоксолан-4-ілметиловий ефір толуол-4-сульфонової кислоти (37,8ммоль). Неочищений продукт очищали флешхроматографією у постійному градієнті, використовуючи EtOAc/петролейний ефір (40-60) від 0:100 до 20:80 як елюент з одержанням зазначеної в заголовку сполуки у вигляді безбарвної піни. Приклад 5: [2-Хлор-4-(2,4-дифторфеніламіно)феніл]-{5-[1(2,2-диметил-[1,3]діоксолан-4-ілметил)-1Н[1,2,3]триазол-4-іл]-2-метилфеніл}метанон (сполука 105) Реакцію здійснювали подібно до того, як описано в одержанні сполуки 101, використовуючи сполуку 407 (1,37ммоль) і сполуку 410 (1,62ммоль). Неочищений продукт очищали флешхроматографією у постійному градієнті, використовуючи ЕtOАс/петролейний ефір (40-60) від 20:80 до 35:65 як елюент з одержанням зазначеної в заголовку сполуки у вигляді піни жовтого кольору. 13 СЯМР (ДМСО-d6) δ 194,9, 158,7 (дд), 155,7 (дд), 149,4, 145,2, 139,8, 135,9, 133,7, 133,7, 131,7, 128,2, 127,1, 126,5, 126,5 (дд), 125,0, 124,2 (дд), 122,3, 114,8, 111,9 (дд), 111,8, 109,0, 105,0 (дд), 73,7, 65,8, 52,0, 26,4, 25,1, 19,4. Приклад 6: [2-Хлор-4-(2,4-дифторфеніламіно)феніл]-{5-[1(2,3-дигідроксипропіл)-1Н-[1,2,3]триазол-4-іл]-2метилфеніл}метанон (сполука 106) Розчин сполуки 105 (535мг, 1,16ммоль) у ТГФ (6,0мл) додавали до водного НСІ (1М, 6мл) і суміш перемішували протягом 24 годин при кімнатній температурі. Реакційну суміш виливали в суміш EtOАс/насичений NaHCO3. Водну фазу промивали додатковою кількістю ЕtOАс. Об'єднану органічну фазу промивали водою, сольовим розчином і потім сушили (MgSO4), фільтрували й концентрували у вакуумі з одержанням неочищеного продукту. Неочищений продукт очищали флешхроматографією у постійному градієнті, використовуючи MeOH/DCM від 2:98 до 10:90 як елюент з 45 одержанням зазначеної в заголовку сполуки у вигляді піни жовтого кольору. 13 СЯМР (ДМСО-d6) δ 194,9, 158,7 (дд), 155,7 (дд), 149,3, 145,0, 139,8, 135,7, 133,7, 133,7, 131,6, 128,4, 127,1, 126,6, 126,5 (дд), 124,9, 124,2 (дд), 122,3, 114,8, 112,0 (дд), 111,8, 105,0 (дд), 70,3, 63,2, 53,0, 19,4. Одержання 11: 2-Азидоацетамід (сполука 411) Суміш 2-хлорацетаміду (2,00г, 21,4ммоль), NaN3 (6,95г, 107ммоль) і тетрабутиламоніййодиду (790мг, 2,14ммоль) в DMF (30,0мл) перемішували при 50°С протягом 48 годин. Реакційну суміш виливали в суміш EtOAc/вода. Органічну фазу промивали водою, сольовим розчином і потім сушили (MgSO4), фільтрували й концентрували у вакуумі з одержанням неочищеного продукту. Неочишений продукт використовували без подальшого очищення. Неочищений продукт містив значні кількості DMF (приблизно 6екв.). Приклад 7: 2-(4-{3-[2-Хлор-4-(2,4дифторфеніламіно)бензоїл]-4-метилфеніл}[1,2,3]триазол-1-іл]ацетамід (сполука 107) Реакцію здійснювали подібно до того, як описано в одержанні сполуки 101, використовуючи сполуку 407 (0,44ммоль) і сполуку 411. Неочищений продукт очищали флеш-хроматографією у постійному градієнті, використовуючи MeOH/DCM від 0:100 до 10:90 як елюент з одержанням зазначеної в заголовку сполуки у вигляді твердої речовини жовтого кольору. 13 СЯМР (ДМСО-d6) δ 194,9, 167,1, 158,7 (дд), 155,7 (дд), 149,3, 145,2, 139,8, 135,9, 133,7, 133,7, 131,7, 128,2, 127,1, 126,6, 126,4 (дд), 125,0, 124,2 (дд), 123,0, 114,9, 112,0 (дд), 111,8, 105,0 (дд), 51,5, 19,4. Одержання 12: З-Азидопропан-1-сульфонової кислоти амід (сполука 412) Реакцію здійснювали подібно до того, як описано в одержанні сполуки 411, використовуючи амід 3-хлорпропан-1-сульфонової кислоти (19,0ммоль). Неочищений продукт очищали флешхроматографією у постійному градієнті, використовуючи ЕtOАс/петролейний ефір (40-60) від 35:65 до 65:35 як елюент з одержанням зазначеної в заголовку сполуки у вигляді безбарвного масла. Приклад 8: 3-(4-{3-[2-Хлор-4-(2,4дифторфеніламіно)бензоїл]-4-метилфеніл}[1,2,3]триазол-1-іл]пропан-1-сульфонової кислоти амід (сполука 108) Реакцію здійснювали подібно до того, як описано в одержанні сполуки 101, використовуючи сполуку 407 (1,37ммоль) і сполуку 412 (2,79ммоль). Неочищений продукт очищали флешхроматографією у постійному градієнті, використовуючи ЕtOАс/петролейний ефір (40-60) від 65:35 до 85:15 як елюент з одержанням зазначеної в заголовку сполуки у вигляді майже білої твердої речовини. 13 С ЯМР (ДМСО-d6) δ 194,9, 158,8 (дд), 155,7 (дд), 149,4, 145,5, 139,9, 135,9, 133,7, 133,7, 131,7, 128,2, 127,1, 126,5, 126,4 (дд), 124,9, 124,1 (дд), 90698 46 121,6, 114,8, 111,9 (дд), 111,8, 105,0 (дд), 51,4, 47,9, 24,6, 19,4. Одержання 13: N-(2-Азидоетил)метансульфонамід (сполука 413) В 100-мл колбу вміщували гідрохлорид 2хлоретиламіну (5,0г, 43,1ммоль) і дихлорметан (50мл). До суспензії додавали N-метилморфолін (10мл, 91ммоль), при цьому підтримуючи температуру від -3 до 5°С. Метансульфонілхлорид (4,0мл, 51,7ммоль) повільно додавали до реакційної суміші. Через 2 години реакційну суміш промивали водою, 4Ν НСІ і водою. Органічний шар сушили над Na2SO4, фільтрували й концентрували у вакуумі. Неочищений сульфонамід (3,1г) перерозчиняли в DMF (8,0мл). Nal (327мг, 1,97ммоль) і NaN3 (1,92г, 29,5ммоль) додавали до розчину. Реакційну суміш перемішували протягом 48 годин при 50°С і потім виливали в суміш EtOAc/вода. Органічну фазу промивали водою, сольовим розчином і потім сушили (MgSO4), фільтрували й концентрували у вакуумі з одержанням неочищеного продукту. Неочищений продукт використовували без подальшого очищення. Приклад 9: N-[2-(4-{3-[2-хлор-4-(2,4дифторфеніламіно)бензоїл]-4-метилфеніл}[1,2,3]триазол-1-іл]етил]метансульфонамід (сполука 109) Реакцію здійснювали подібно до того, як описано в одержанні сполуки 101, використовуючи сполуку 407 (0,87ммоль) і сполуку 413 (1,3ммоль). Неочищений продукт очищали флешхроматографією у постійному градієнті, використовуючи ЕtOАс/петролейний ефір (40-60) від 65:35 до 85:15 як елюент з одержанням зазначеної в заголовку сполуки у вигляді твердої речовини майже білого кольору. 13 С ЯМР (ДМСО-d6) δ 194,9, 158,7 (дд), 155,7 (дд), 149,4, 145,3, 139,8, 135,9, 133,7, 133,7, 131,7, 128,2, 127,1, 126,5, 126,4 (дд), 124,9, 124,1 (дд), 121,9, 114,8, 111,9 (дд), 111,8,105,0 (дд), 49,8, 42,2, 39,5, 19,4. Приклад 10: Етиловий ефір (4-{3-[2-хлор-4-(2,4дифторфеніламіно)бензоїл]-4-метилфеніл}[1,2,3]триазол-1-іл]оцтової кислоти (сполука 110) Сполуку 407 (243мг, 0,64ммоль) і розчин етилового ефіру азидооцтової кислоти (0,7ммоль) у толуолі (0,60мл) розчиняли в ацетоні (3,5мл). Свіжоприготовлений розчин пентагідрату сульфату міді(ІІ) (7,0мг, 0,026ммоль) і аскорбату натрію (25мг, 0,13ммоль) у воді (0,5мл) додавали до реакційної суміші. Колбу закривали й перемішували протягом 24 годин при кімнатній температурі в атмосфері аргону. Реакційну суміш виливали в суміш ЕtOАс/вода. Органічну фазу промивали водою, сольовим розчином і потім сушили (MgSO4), фільтрували й концентрували у вакуумі з одержанням неочищеного продукту. Неочищений продукт очищали флеш-хроматографією у постійному градієнті, використовуючи EtOAc/петролейний ефір (4060) від 5:95 до 60:40 як елюент з одержанням за 47 значеної в заголовку сполуки у вигляді піни світложовтого кольору. 13 С ЯМР (CDCI3) δ 196,0, 166,3, 159,1 (дд), 155,5 (дд), 147,8, 147,5, 139,9, 137,9, 135,3, 133,7, 131,9, 129,3, 128,0, 127,9, 126,6, 124,4 (дд), 124,3 (дд), 121,0, 116,4, 112,9, 111,6 (дд), 104,9 (дд), 62,5, 51,0, 20,2, 14,1. Приклад 11: (4-{3-[2-хлор-4-(2,4дифторфеніламіно)бензоїл]-4-метилфеніл}[1,2,3]триазол-1-іл]оцтова кислота (сполука 111) Розчин сполуки 110 (236мг, 0,46ммоль) у МеОН (3,0мл) додавали до LiOH (55мг, 2,31ммоль) і води (0,3мл). Реакційну суміш перемішували протягом 2 годин зі зворотним холодильником. Реакційну суміш виливали в суміш ЕtOАс/насичений розчин NaCl. Додавали водну НСІ (1N, 0,5мл). Водну фазу промивали додатковою кількістю ЕtOАс. Об'єднану органічну фазу промивали водою, сольовим розчином і потім сушили (MgSO4), фільтрували й концентрували у вакуумі з одержанням неочищеного продукту. Неочищений продукт очищали флеш-хроматографією, використовуючи суміш MeOH/DCM/оцтова кислота 400:2:1 як елюент з одержанням зазначеної в заголовку сполуки у вигляді піни жовтого кольору. 13 С ЯМР (ДМСО-d6) δ 194,9, 168,4, 158,7, (дд), 155,7 (дд), 149,3, 145,3, 139,8, 136,0, 133,7, 133,7, 131,7, 128,1, 127,1, 126,5, 126,4 (дд), 125,0, 124,2 (дд), 122,8, 114,8, 112,0 (дд), 111,8, 105,0 (дд), 50,9, 19,4. Приклад 12: 2-(4-(3-[2-Хлор-4-(2,4дифторфеніламіно)бензоїл]-4-метилфеніл)[1,2,3]триазол-1-іл]-N-етилацетамід (сполука 112) До розчину сполуки 111 (39мг, 0,08ммоль) в DMF (1,0мл) додавали етиламінгідрохлорид (20мг, 0,08ммоль), FDPP (43мг, 0,11ммоль) і DIEA (68мкл, 0,4ммоль). Колбу продували аргоном і реакційною сумішшю перемішували при кімнатній температурі протягом 72 годин й потім виливали в суміш води (4мл), НСІ (4Ν, 2мл) і ЕtOАс. Фази розділяли. Органічну фазу концентрували на силікагелі у вакуумі. Неочищений продукт очищали флеш-хроматографією, елююючи ЕtOАс/петролейний ефір (40-60) від 50:50 до 100:0 як елюент з одержанням зазначеної в заголовку сполуки у вигляді піни білого кольору. 13 С ЯМР (ДМСО-d6) δ 194,9, 164,8, 149,3, 145,2, 139,8, 135,9, 133,7, 133,7, 131,7, 128,2, 127,1, 126,6, 126,4 (дд), 125,0, 124,2 (дд), 123,0, 114,8, 111,9 (дд), 111,8, 105,0 (дд), 51,7, 33,6, 19,4, 14,4. Приклад 13: 2-(4-{3-[2-Хлор-4-(2,4дифторфеніламіно)бензоїл]-4-метилфеніл}[1,2,3]триазол-1-іл]-N-(2-гідрокси-1,1диметилетил)ацетамід (сполука 113) Реакцію здійснювали подібно до того, як описано в одержанні сполуки 112, використовуючи сполуку 111 (0,08ммоль) і 2-аміно-2-метил-1пропанол (0,08ммоль). Неочищений продукт очищали флеш-хроматографією у постійному градієнті, використовуючи ЕtOАс/петролейний ефір (4060) від 50:50 до 100:0 як елюент з одержанням 90698 48 зазначеної в заголовку сполуки у вигляді твердої речовини майже жовтого кольору. 13 С ЯМР (ДМС-d6) δ 8,74 (с, 1Н), 8,50 (с, 1Н), 7,90 (дд, 1H), 7,85 (ушир.с, 1Н), 7,75 (д, 1Н), 7,507,33 (м, 4Н), 7,11 (м, 1Н), 6,83 (м, 1H), 6,78 (м, 1H), 5,07 (с, 2Н), 4,80 (т, 1H), 3,40 (д, 2Н), 2,33 (с, 3Н), 1,21 (с, 6Н). Приклад 14: 2-(4-{3-[2-Хлор-4-(2,4дифторфеніламіно)бензоїл]-4-метилфеніл}[1,2,3]триазол-1-іл]-1-піролідин-1-ілетанон (сполука 114) Реакцію здійснювали подібно до того, як описано в одержанні сполуки 112, використовуючи сполуку 111 (0,12ммоль) і піролідин (0,12ммоль). Неочищений продукт очищали флешхроматографією у постійному градієнті, використовуючи МеОН/EtOAc від 0:100 до 5:95 як елюент з одержанням зазначеної в заголовку сполуки у вигляді сиропу майже жовтого кольору. 13 С ЯМР (CDCI3) δ 196,0, 163,1, 159,0 (дд), 155,4 (дд), 147,8, 147,1, 139,7, 137,9, 135,2, 133,7, 131,9, 129,3, 128,0, 127,8, 126,6, 124,5 (дд), 124,2 (дд), 121,5, 116,4, 112,9, 111,5 (дд), 104,9 (дд), 51,9, 46,4, 46,4, 26,1, 24,1, 20,2. Приклад 15: 2-(4-{3-[2-Хлор-4-(2,4дифторфеніламіно)бензоїл]-4-метилфеніл}[1,2,3]триазол-1-іл]-1-морфолін-4-ілетанон (сполука 115) Реакцію здійснювали подібно до того, як описано в одержанні сполуки 112, використовуючи сполуку 111 (0,12ммоль) і гідрохлорид морфоліну (0,12ммоль). Неочищений продукт очищали флешхроматографією у постійному градієнті, використовуючи МеОН/EtOAc від 0:100 до 5:95 як елюент з одержанням зазначеної в заголовку сполуки у вигляді сиропу майже жовтого кольору. 13 СЯМР (CDCI3) δ 196,0, 163,5, 147,9, 147,3, 139,8, 138,0, 135,3, 133,7, 131,9, 129,2, 128,0, 127,7, 126,5, 124,4 (дд), 124.2 (дд), 121,4, 116,3. 112,8, 111,6 (дд), 104,9 (дд), 66,6, 66,4, 50,9, 45,9, 42,6, 20,2. Одержання 14 [2-Хлор-4-(4-трифторметилфеніламіно)феніл](2-метил-5-нітрофеніл)метанон (сполука 414) Сполуку 402 (100мг, 0,28ммоль) розчиняли в сухому 1,4-діоксані (2мл) в 8-мл пробірці із кришкою, що загвинчується. 4-Трифторметилфеніламін (35мкл, 0,28ммоль), Cs2CO3 (276мг, 0,85ммоль), BINAP (7мг, 0,011ммоль) і Pd(OAc)2 (3мг, 0,011ммоль) додавали й продували аргон через реакційну суміш, закривали пробкою, що загвинчується, реакційну посудину. Суміш перемішували при 100°С протягом 18 годин. Реакційну суміш фільтрували через Decalite і концентрували на силікагелі. Неочищений продукт очищали флешхроматографією у постійному градієнті, використовуючи ЕtOАс/петролейний ефір (40-60) від 0:100 до 25:75 як елюент з одержанням зазначеної в заголовку сполуки у вигляді піни жовтого кольору. Одержання 15 (5-Аміно-2-метилфеніл)-[2-хлор-4-(4трифторметилфеніламіно)феніл]метанон (сполука 415) 49 Сполуку 414 (134мг, 0,31ммоль) розчиняли в МеОН (4мл). Додавали цинковий порошок (203мг, 3,1ммоль) і NH4CI (84мг, 1,57ммоль). Реакційну суміш нагрівали до температури кипіння зі зворотним холодильником протягом 3 годин. Суміш фільтрували через Decalite і промивали МеОн. Фільтрат концентрували у вакуумі з одержанням зазначеної в заголовку сполуки у вигляді піни. Одержання 16 (5-Азидо-2-метилфеніл)-[2-хлор-4-(4трифторметилфеніламіно)феніл]метанон (сполука 416) СполукУ 415 (134мг, 0,31ммоль) розчиняли в ацетоні (2мл). Концентровану НСІ (37%, 0,113мл, 1,36ммоль) додавали й розчин охолоджували на крижаній бані. NaNO2 (22мг, 0,32ммоль) розчиняли в Н2О (0,18мл) і додавали до вищевказаного розчину протягом 5хв. Внутрішню температуру підтримували рівною 0-2°С при додаванні. Суспензію перемішували на крижаній бані протягом 1 години, після чого додавали розчин NaN3 (27мг, 0,41ммоль) у Н2О (0,56мл) по краплях протягом 5хв. Суміш перемішували при 0°С протягом 4 годин. Н2О (5мл) і ЕtOАс (10мл) додавали й перемішували, і фази розділяли. Органічну фазу концентрували у вакуумі з одержанням зазначеної в заголовку сполуки. Неочищений продукт використовували без подальшого очищення. Приклад 16: [2-Хлор-4-(4-трифторметилфеніламіно)феніл]{5-[4-(2-гідроксіетил)-[1,2,3]триазол-1-іл]-2метилфеніл}метанон (сполука 116) Бут-3-ин-1-ол (23мкл, 0,30ммоль) і сполуку 416 (116мг, 0,27ммоль) розчиняли в ацетоні (2,6мл) у пробірці. Свіжоприготовлений розчин пентагідрату сульфату міді(ІІ) (7,0мг, 0,028ммоль) і аскорбату натрію (27мг, 0,14ммоль) у воді (0,135мл) додавали до реакційної суміші. Пробірку закривали й перемішували протягом 24 годин при кімнатній температурі в атмосфері аргону. Реакційну суміш виливали в суміш ЕtOАс/вода. Органічну фазу промивали водою, сольовим розчином, фільтрували й концентрували у вакуумі з одержанням неочищеного продукту. Неочищений продукт очищали флеш-хроматотрафією у постійному градієнті, використовуючи ЕtOАс/петролейний ефір (40-60) від 20:80 до 0:100 як елюент з одержанням зазначеної в заголовку сполуки у вигляді піни світложовтого кольору. 13 С ЯМР (ДМСО-d6) δ 194,1, 147,1, 145,8, 144,6, 140,4, 136,5, 134,6, 134,0, 133,8, 132,6, 127,8, 126,7 (кв), 121,7, 120,8, 119,4, 118,2, 117,3, 114,2, 60,2, 29,2, 19,3. Одержання 17 (2-Хлор-4-о-толіламінофеніл)-(2-метил-5нітрофеніл)метанон (сполука 417) Реакцію здійснювали подібно до того, як описано в одержанні сполуки 414, використовуючи сполуку 402 (0,28ммоль) і 2-метиланілін (0,28ммоль). Неочищений продукт очищали флешхроматографією у постійному градієнті, використовуючи МеОН/ЕtOАс від 0:100 до 25:75 як елюент з одержанням зазначеної в заголовку сполуки у вигляді піни жовтого кольору. Одержання 18 90698 50 (5-Аміно-2-метилфеніл)-(2-хлор-4-отоліламінофеніл)метанон (сполука 418) Реакцію здійснювали подібно до того, як описано в одержанні сполуки 415, використовуючи сполуку 417 (0,39ммоль). Неочищений продукт використовувався без подальшого очищення. Одержання 19 (5-Азидо-2-метилфеніл)-(2-хлор-4-отоліламінофеніл)метанон (сполука 419) Реакцію здійснювали подібно до того, як описано в одержанні сполуки 416, використовуючи сполуку 418 (0,39ммоль). Неочищений продукт використовувався без подальшого очищення. Приклад 17: (2-Хлор-4-о-толіламінофеніл)-{5-[4-(2гідроксіетил)-[1,2,3]триазол-1-іл]-2метилфеніліметанон (сполука 117) Реакцію здійснювали подібно до того, як описано в одержанні сполуки 116, використовуючи сполуку 419 (0,40ммоль) і бут-3-ин-1-ол (0,40ммоль). Неочищений продукт очищали флешхроматографією у постійному градієнті, використовуючи ЕtOАс/петролейний ефір (40-60) від 20:80 до 0:100 як елюент з одержанням зазначеної в заголовку сполуки у вигляді піни світло-жовтого кольору. 13 С ЯМР (CDCI3) δ 194,7, 149,9, 146,2, 141,2, 138,0, 137,7, 135,7, 134,7, 134,2, 132,8, 132,5, 131,4, 127,1, 126,9, 125,8; 124,4, 122,1, 120,6, 120,0, 115,7, 112,3, 61,5, 28,7, 19,9, 17,9. Одержання 20 [2-Хлор-4-(2-хлор-4-фторфеніламіно)феніл]-(2метил-5-нітрофеніл)метанон (сполука 420) Реакцію здійснювали подібно до того, як описано в одержанні сполуки 414, використовуючи сполуку 402 (0,28ммоль) і 2-хлор-4-фторанілін (0,28ммоль). Неочищений продукт очищали флешхроматографією у постійному градієнті, використовуючи МеОН/EtOAc від 0:100 до 25:75 як елюент з одержанням зазначеної в заголовку сполуки у вигляді піни жовтого кольору. Одержання 21 (5-Аміно-2-метилфеніл)-[2-хлор-4-(2-хлор-4фторфеніламіно)феніл]метанон (сполука 421) Реакцію здійснювали подібно до того, як описано в одержанні сполуки 415, використовуючи сполуку 420 (0,21ммоль). Неочищений продукт використовувався без подальшого очищення. Одержання 22 (5-Азидо-2-метилфеніл)-[2-хлор-4-(2-хлор-4фторфеніламіно)феніл]метанон (сполука 422) Реакцію здійснювали подібно до того, як описано в одержанні сполуки 416, використовуючи сполуку 421 (0,21ммоль). Неочищений продукт використовувався без подальшого очищення. Приклад 18: [2-Хлор-4-(2-хлор-4-фторфеніламіно)феніл]-(5[4-(2-гідроксіетил)-[1,2,3]триазол-1-іл]-2метилфеніл)метанон (сполука 118) Реакцію здійснювали подібно до того, як описано в одержанні сполуки 116, використовуючи сполуку 422 (0,21ммоль) і бут-3-ин-1-ол (0,21ммоль). Неочищений продукт очищали флешхроматографією у постійному градієнті, використовуючи ЕtOАс/петролейний ефір (40-60) від 30:70 51 до 100:0 як елюент з одержанням зазначеної в заголовку сполуки у вигляді піни світло-жовтого кольору. 13 С ЯМР (CDCI3) δ 194,8, 158,7 (д), 147,9, 146,3, 140,7, 138,4, 135,4, 134,8, 133,8, 133,3 (д), 132,6, 128,8, 127,5 (д), 123,4 (д), 122,4, 120,9, 120,0, 117,6 (д), 116,9, 114,9 (д), 113,5, 61,5, 28,7, 20,0. Одержання 23 (5-Бром-2-метоксифеніл)-(2-хлор-4нітрофеніл)метанон (сполука 423) Суміш 1-бром-4-метоксибензолу (7,48г, 40ммоль), 2-хлор-4-нітробензоїлхлориду (8,79г, 40ммоль) і трифлату вісмуту (1,31г, 2,0ммоль) в атмосфері аргону перемішували при кімнатній температурі протягом 20хв. Температуру піднімали до 80°С і перемішування продовжували протягом 90хв. DCM додавали до реакційної суміші й органічну фазу промивали водною НСІ (1N, 0,5мл) і NaHCO3 (водним). Органічну фазу сушили (MgSO4), фільтрували й концентрували у вакуумі з одержанням неочищеного продукту. Неочищений продукт кристалізували із суміші DCM і пентану з одержанням зазначеної в заголовку сполуки у вигляді кристалів жовтого кольору. Одержання 24 (4-Аміно-2-хлорфеніл)-(5-бром-2метоксифеніл)метанон (сполука 424) Реакцію здійснювали подібно до того, як описано в одержанні сполуки 404, використовуючи сполуку 423 (16,1ммоль). Неочищений продукт очищали флеш-хроматографією у постійному градієнті, використовуючи ЕtOАс/петролейний ефір (40-60) від 20:80 до 45:55 як елюент з одержанням зазначеної в заголовку сполуки у вигляді твердої речовини жовтого кольору. Одержання 25 (5-Бром-2-метоксифеніл)-[2-хлор-4-(2,4дифторфеніламіно)феніл]метанон (сполука 425) Сполуку 424 (4,39г, 12,9ммоль) суспендували в сухому толуолі (100мл) в 200-мл посудині із пробкою, що загвинчується. 1-Бром-2,4-дифторбензол (1,75мл, 15,5ммоль) додавали й аргон продували через суміш. Cs2CO3 (5,88г, 18,1ммоль), 4,5-бісдифенілфосфанил-9,9-диметил-9Н-ксантен (0,22г, 0,39ммоль) і Pd(OAc)2 (58мг, 0,26ммоль) додавали, аргон продували через суміш і посудину із пробкою, що загвинчується, закривали. Суміш перемішували при 120°С протягом 72 год. Реакційну суміш фільтрували через Decalite і потім концентрували на силікагелі у вакуумі. Неочищений продукт очищали флеш-хроматографією у постійному градієнті, використовуючи ЕtOАс/петролейний ефір (40-60) від 5:95 до 30:70 як елюент з одержанням зазначеної в заголовку сполуки у вигляді твердої речовини жовтого кольору. Одержання 26 [2-Хлор-4-(2,4-дифторфеніламіно)феніл]-(2метокси-5-триметилсиланілетинілфеніл)метанон (сполука 426) Реакцію здійснювали подібно до того, як описано в одержанні сполуки 406, використовуючи сполуку 425 (0,99ммоль) і етинілтриметилсилан (0,99ммоль). Неочищений продукт очищали флеш 90698 52 хроматографією у постійному градієнті, використовуючи EtOАс/петролейний ефір (40-60) від 0:100 до 10:90 як елюент з одержанням зазначеної в заголовку сполуки у вигляді сиропу світложовтогарячого кольору. Одержання 27 [2-Хлор-4-(2,4-дифторфеніламіно)феніл]-(5етиніл-2-метоксифеніл)метанон (сполука 427) Реакцію здійснювали подібно до того, як описано в одержанні сполуки 407, використовуючи сполуку 426 (0,44ммоль). Неочищений продукт негайно використовували в наступній реакції без подальшого очищення. Приклад 19: [2-Хлор-4-(2,4-дифторфеніламіно)феніл]-(2метокси-5-{1-[2-(тетрагідропіран-2-ілокси)етил]-1Н[1,2,3]триазол-4-іл}феніл)метанон (сполука 119) Реакцію здійснювали подібно до того, як описано в одержанні сполуки 101, використовуючи сполуку 427 (0,42ммоль) і сполуку 408 (0,42ммоль). Неочищений продукт очищали флешхроматографією у постійному градієнті, використовуючи EtOАс/петролейний ефір (40-60) від 20:80 до 60:40 як елюент з одержанням зазначеної в заголовку сполуки у вигляді піни світложовтогарячого кольорів. 13 С ЯМР (CDCI3) δ 193,2, 159,0 (дд), 158,1, 155,4 (дд), 147,3, 146,9, 134,8, 133,3, 130,2, 127,7, 124,8 (дд), 123,9 (дд), 123,8, 120,3, 116,2, 113,0, 112,3, 111,5 (дд), 104,9 (дд), 99,2, 65,8, 62,5, 56,1, 50,6, 30,5, 25,3, 19,4. Приклад 20: [2-Хлор-4-(2,4-дифторфеніламіно)феніл]-{5-[1(2-гідроксіетил)-1Н-[1,2,3]триазол-4-іл]-2метоксифеніл)метанон (сполука 120) Реакцію здійснювали подібно до того, як описано в одержанні сполуки 101, використовуючи сполуку 119 (0,11ммоль). Неочищений продукт очищали флеш-хроматографією у постійному градієнті, використовуючи ЕtOАс/петролейний ефір (40-60) від 20:80 до 100:0 як елюент з одержанням зазначеної в заголовку сполуки у вигляді піни жовтого кольору. 13 С ЯМР (CDCI3) δ 193,3, 158,1, 147,4, 146,7, 134,8, 133,4, 130,1, 127,6, 124,6 (дд), 123,9 (м), 123,7, 123,3, 120,5, 116,1, 112,1, 111,5 (дд), 104,9 (дд), 61,3, 56,0, 52,8. Одержання 28 [2-Хлор-4-(4-фторфеніламіно)феніл]-(2-метил5-нітрофеніл)метанон (сполука 428) Реакцію здійснювали подібно до того, як описано в одержанні сполуки 403, використовуючи сполуку 402 (22,6ммоль) і 4-фтораналін (24,8ммоль), за винятком того, що час реакції становив 16 год. Неочищений продукт очищали флеш-хроматографією, використовуючи ЕtOАс/петролейний ефір (40-60) 1:5 як елюент з одержанням зазначеної в заголовку сполуки у вигляді твердої речовини жовтого кольору. Одержання 29 (5-Аміно-2-метилфеніл)-[2-хлор-4-(4фторфеніламіно)феніл]метанон (сполука 429) Реакцію здійснювали подібно до того, як описано в одержанні сполуки 404, використовуючи сполуку 428 (19,2ммоль). Неочищений продукт 53 очищали флеш-хроматографією, використовуючи ЕtOАс/петролейний ефір (40-60) 1:2, потім 2:3 як елюент з одержанням зазначеної в заголовку сполуки у вигляді твердої речовини. Одержання 30 [2-Хлор-4-(4-фторфеніламіно)феніл]-(5-йод-2метилфеніл)метанон (сполука 430) Реакцію здійснювали подібно до того, як описано в одержанні сполуки 405, використовуючи сполуку 429 (8,46ммоль). Неочищений продукт очищали флеш-хроматографією, використовуючи ЕtOАс/петролейний ефір (40-60) 2:8, потім 3:7 як елюент з одержанням зазначеної в заголовку сполуки у вигляді твердої речовини. Одержання 31 [2-Хлор-4-(4-фторфеніламіно)феніл]-(2-метил5-триметилсиланілетинілфеніл)метанон (сполука 431) Реакцію здійснювали подібно до того, як описано в одержанні сполуки 406, використовуючи сполуку 430 (7,17ммоль) і етинілтриметилсилан (7,17ммоль). Неочищений продукт очищали флешхроматографією, використовуючи EtOАс/петролейний ефір (40-60) 1:8 як елюент з одержанням зазначеної в заголовку сполуки у вигляді твердої речовини. Одержання 32 [2-Хлор-4-(4-фторфеніламіно)феніл]-(5-етиніл2-метилфеніл)метанон (сполука 432) Реакцію здійснювали подібно до того, як описано в одержанні сполуки 407, використовуючи сполуку 431 (5,95ммоль). Неочищений продукт використовували без подальшого очищення. Приклад 21: [2-Хлор-4-(4-фторфеніламіно)феніл]-(2-метил5-{1-[2-(тетрагідропіран-2-ілокси)етил]-1Н[1,2,3]триазол-4-іл}феніл)метанон (сполука 121) Реакцію здійснювали подібно до того, як описано в одержанні сполуки 101, використовуючи сполуку 432 (2,06ммоль) і сполуку 408 (2,06ммоль). Неочищений продукт очищали флешхроматографією у постійному градієнті, використовуючи ЕtOАс/петролейний ефір (40-60) від 50:50 до 50:50 як елюент з одержанням зазначеної в заголовку сполуки. 13 С ЯМР (CDCI3) δ 196,1, 159,6 (д), 148,8, 147,0, 140,0, 137,5, 135,9 (д), 135,4, 134,0, 131,8, 128,4, 128,2, 127,8, 126,4, 124,2 (д), 120,8, 116,4 (д), 115,8, 112,3, 99,1, 65,8, 62,4, 50,6, 30,4, 25,2, 20,2, 19,4. Приклад 22: [2-Хлор-4-(4-фторфеніламіно)феніл]-(5-[1-(2гідроксіетил)-1Н-[1,2,3]триазол-4-іл]-2метилфеніл}метанон (сполука 122) Реакцію здійснювали подібно до того, як описано в одержанні сполуки 102, використовуючи сполуку 121 (1,63ммоль). Неочищений продукт очищали флеш-хроматографією у постійному градієнті, використовуючи ЕtOАс/петролейний ефір (40-60) від 50:50 до 100:0 як елюент з одержанням зазначеної в заголовку сполуки у вигляді сиропу жовтого кольору. 13 С ЯМР (ДМСО-d6) δ 194,8, 158,1 (д), 149,1, 145,2, 139,9, 136,6 (д), 135,7, 134,0, 133,9, 131,6, 90698 54 128,4, 127,0, 126,3, 124,8, 122,7 (д), 121,9, 116,1 (д), 114,9, 111,8, 59,7, 52,3, 19,4. Приклад 23: [2-Хлор-4-(4-фторфеніламіно)феніл]-{5-[1-(2,2диметил-[1,3]діоксолан-4-ілметил)-1Н[1,2,3]триазол-4-іл]-2-метилфеніл}метанон (сполука 123) Реакцію здійснювали подібно до того, як описано в одержанні сполуки 101, використовуючи сполуку 432 (2,75ммоль) і сполуку 410 (2,75ммоль). Неочищений продукт очищали флешхроматографією у постійному градієнті, використовуючи ЕtOАс/петролейний ефір (40-60) від 20:80 до 65:35 як елюент з одержанням зазначеної в заголовку сполуки у вигляді піни. 13 СЯМР (CDCI3) δ 196,1, 159,7 (д), 148,9, 147,1, 140,1, 137,6, 135,9 (д), 135,5, 134,0, 131,8, 128,4, 128,0, 127,8, 126,4, 124,2 (д), 121,0, 116,4 (д), 115,8, 112,3, 110,3, 74,1, 66,5, 52,4, 26,7, 25,2, 20,2. Приклад 24: [2-Хлор-4-(4-фторфеніламіно)феніл]-{5-[1-(2,3дигідроксипропіл)-1Н-[1,2,3]триазол-4-іл]-2метилфеніл}метанон (сполука 124) Розчин сполуки 123 (1,05г, 2,02ммоль) у ТГФ (10мл) додавали до НСІ (10мл, водної, 1N) і суміш перемішували протягом 16 годин при кімнатній температурі. Реакційну суміш виливали в суміш ЕtOАс/вода/NaHСО3. Органічну фазу промивали водою, сольовим розчином і потім сушили (MgSO4), фільтрували й концентрували у вакуумі з одержанням неочищеного продукту. Неочищений продукт очищали флеш-хроматографією у постійному градієнті, використовуючи MeOH/DCM від 0:100 до 10:90 як елюент з одержанням зазначеної в заголовку сполуки у вигляді твердої речовини білого кольору. 13 С ЯМР (ДМСО-d6) δ 194,8, 158,1 (д), 149,1, 145,1, 139,9, 136,6 (д), 135,7, 134,0, 133,9, 131,6, 128,4, 127,0, 126,3, 124,8, 122,7 (д), 122,3, 116,0 (д), 114,9, 111,8, 70,3, 63,2, 53,0, 19,4. Приклад 25: 2-(4-{3-[2-Хлор-4-(4-фторфеніламіно)бензоїл]4-метилфеніл}-[1,2,3]триазол-1-іл)ацетамід (сполука 125) Реакцію здійснювали подібно до того, як описано в одержанні сполуки 101, використовуючи сполуку 432 (1,04ммоль) і сполуку 411 (1,5ммоль). Неочищений продукт очищали флешхроматографією у постійному градієнті, використовуючи ЕtOАс/DСМ/петролейний ефір (40-60) від 0:80:20, 0:100:0 і 10:90:0 як елюент з одержанням зазначеної в заголовку сполуки у вигляді твердої речовини жовтого кольору. 13 С ЯМР (ДМСО-d6) δ 194,8, 167,1, 158,0 (д), 149,1, 145,2, 139,9, 136,6 (д), 135,8, 134,0, 133,9, 131,6, 128,2, 127,0, 126,3, 124,9, 123,0, 122,7 (д), 116,0 (д), 114,8, 111,8, 51,5, 19,4. Приклад 26: [2-Хлор-4-(2,4-дифторфеніламіно)феніл]-{5-[1(2-хлоретил)-1H-[1,2,3]триазол-4-іл]-2-метил феніл}метанон (сполука 126) У колбу, що містить перемішувану суміш трифенілфосфіну (39мг, 0,15ммоль) і 4,5-дихлор-3,6діоксоциклогекса-1,4-дієн-1,2-дикарбонітрилу (44,5мг, 0,20ммоль) у сухому DCM (3,0мл), дода 55 вали тетра-N-бутиламонійазид (56мг, 0,20ммоль) при кімнатній температурі. Сполуку 102 (46мг, 0,10ммоль) потім додавали й реакційну суміш перемішували протягом 1 години. Реакційну суміш концентрували у вакуумі й очищали флешхроматографією у постійному градієнті, використовуючи ЕtOАс/петролейний ефір (40-60) від 0:100 до 50:50 як елюент з одержанням зазначеної в заголовку сполуки у вигляді піни. 13 С ЯМР (CDCI3) δ 196,1, 159,2 (дд), 155,6 (дд), 148,0, 147,0, 139,9, 137,8, 135,3, 133,8, 131,9, 129,0, 127,9, 127,8, 126,4, 124,5 (дд), 124,3 (дд), 120,8, 116,3, 112,7, 111,6 (дд), 104,9 (дд), 51,8, 42,4, 20,2. Одержання 33 (5-Азидо-2-метилфеніл)-[2-хлор-4-(4фторфеніламіно)феніл]метанон (сполука 433) Суміш NaN3 (3,3г), Н2О (8мл) і DCM (2,8мл) охолоджували до 0°С при перемішуванні. Трифторметансульфоновий ангідрид (1,34мл, 8,46ммоль) повільно додавали, підтримуючи температуру в інтервалі від -2 до 1°С. Через 2 години реакційну суміш розділяли в ділильній лійці. Водну фазу промивали EtOAc. Органічну фазу промивали насиченим NaHCO3 і концентрували у вакуумі з одержанням неочищеного трифторметансульфоназиду, який використовували надалі. До суспензії сполуки 429 (1,00г, 2,82ммоль) в DCM (5,0мл) додавали розчин пентагідрату сульфату міді(ІІ) (35,2мг,0,4ммоль) в Н2О (4,0мл) і TEА (1,18мл, 8,45ммоль). Неочищений трифторметансульфоназид додавали повільно при перемішуванні до реакційної суміші з наступним додаванням МеОН (5мл). Через 18 годин при кімнатній температурі реакційну суміш виливали в суміш ЕtOАс/NaНСО3 (водну). Органічну фазу промивали водою, сольовим розчином, фільтрували й концентрували у вакуумі з одержанням неочищеного продукту. Неочищений продукт очищали флешхроматографією у постійному градієнті, використовуючи EtOАс/петролейний ефір (40-60) від 0:100 до 25:75 як елюент з одержанням зазначеної в заголовку сполуки у вигляді твердої речовини жовтого кольору. Приклад 27: [2-Хлор-4-(4-фторфеніламіно)феніл]-{5-[4-(2гідроксіетил)-[1,2,3]триазол-1-іл]-2метилфеніл}метанон(сполука 127) Реакцію здійснювали подібно до того, як описано в одержанні сполуки 101, використовуючи сполуку 433 (1,10ммоль) і 3-бутин-1-ол (1,10ммоль). Неочищений продукт очищали флешхроматографією у постійному градієнті, використовуючи ЕtOАс/петролейний ефір (40-60) від 50:50 до 100:0 як елюент з одержанням зазначеної в заголовку сполуки у вигляді піни. 13 СЯМР (CDCI3) δ 194,8, 159,8 (д), 149,5, 146,3, 141,1, 138,1, 135,7 (д), 135,6, 134,8, 134,0, 132,5, 127,6, 124,5 (д), 122,2, 120,8, 119,9, 116,5 (д), 115,8, 112,4, 61,6, 28,8, 19,9. Одержання 34 (5-Азидо-2-метилфеніл)-[2-хлор-4-(2,4дифторфеніламіно)феніл]-метанон (сполука 434) Сполуку 404 (5,40г, 14,5ммоль) розчиняли в ацетоні (100мл). Концентровану НСІ (37%, 6,04мл, 90698 56 72ммоль) додавали й розчин охолоджували на крижаній бані. NaNO2 (1,20г, 17,4ммоль) розчиняли в Н2О (9мл) і додавали до вищевказаного розчину протягом 20хв. Внутрішню температуру підтримували рівною 0-2°С під час додавання. Суспензію перемішували на крижаній бані протягом 1 години, після чого додавали розчин NaN3 (1,20г, 17,4ммоль) у Н2О (12мл) по краплях протягом 5хв. Суміш перемішували при 0°С протягом 2 годин. H2О (50мл) і ЕtOАс (100мл) додавали й перемішували, і фази розділяли. Органічну фазу концентрували у вакуумі з одержанням зазначеної в заголовку сполуки. Неочищений продукт використовували без подальшого очищення. Неочищений продукт очищали флеш-хроматографією у постійному градієнті, використовуючи ЕtOАс/петролейний ефір (40-60) від 0:100 до 50:50 як елюент з одержанням зазначеної в заголовку сполуки у вигляді твердої речовини коричневого кольору. Приклад 28: [2-Хлор-4-(2,4-дифторфеніламіно)феніл]-{5-[4(2-гідроксіетил)-[1,2,3]триазол-1-іл]-2метилфеніл}метанон (сполука 128) Реакцію здійснювали подібно до того, як описано в одержанні сполуки 110, використовуючи сполуку 434 (6,87ммоль) і 3-бутин-1-ол (8,24ммоль). Неочищений продукт очищали флешхроматографією у постійному градієнті, використовуючи ЕtOАс/петролейний ефір (40-60) від 50:50 до 100:0 як елюент з одержанням зазначеної в заголовку сполуки у вигляді піни жовтого кольору. 13 С ЯМР (CDCI3) δ 194,8, 159,4 (дд), 155,7 (дд), 148,4, 146,3, 140,8, 138,3, 135,5, 134,8, 133,8, 132,6, 128,4, 124,8 (дд), 124,1 (дд), 122,3, 120,9, 119,9, 116,2, 112,8, 111,7 (дд), 105,0 (дд), 61,6, 28,7, 20,0. Приклад 29: [2-Хлор-4-(2,4-дифторфеніламіно)феніл]-{5-[4(1-гідрокси-1-метилетил)-[1,2,3]триазол-1-іл]-2метилфеніл|метанон (сполука 129) Реакцію здійснювали подібно до того, як описано в одержанні сполуки 116, використовуючи сполуку 434 (0,125ммоль) і 2-метилбут-3-ин-2-ол (0,125ммоль). Неочищений продукт очищали флеш-хроматографією у постійному градієнті, використовуючи ЕtOАс/петролейний ефір (40-60) від 30:70 до 70:30 як елюент з одержанням зазначеної в заголовку сполуки. 13 С ЯМР (CDCI3) δ 194,9, 159,4 (дд), 156,4, 155,8 (дд), 148,6, 140,8, 138,2, 135,5, 134,8, 133,8, 132,6, 128,2, 125,0 (дд), 124,1 (дд), 122,4, 120,9, 117,6, 116,1, 112,7, 111,7 (дд), 105,0 (дд), 68,7, 30,5, 19,9. Приклад 30: 1-(1-{3-[2-Хлор-4-(2,4дифторфеніламіно)бензоїл]-4-метилфеніл}-1Н[1,2,3]триазол-4-іл]етанон (сполука 130) Реакцію здійснювали подібно до того, як описано в одержанні сполуки 116, використовуючи сполуку 434 (0,125ммоль) і бут-3-ин-2-ол (0,125ммоль). Неочищений продукт очищали флеш-хроматографiєю у постійному градієнті, використовуючи EtOAc/петролейний ефір (40-60) від 57 0:100 до 50:50 як елюент з одержанням зазначеної в заголовку сполуки. 13 СЯМР (ДМСО-d6) 6 193,6, 191,2, 159,0 (дд), 155,8 (дд), 149,9, 147,6, 140,9, 137,3, 134,3, 134,2, 133,8, 132,5, 126,7 (дд), 125,6, 125,5, 124,0 (дд), 122,0, 119,8, 115,0, 112,0 (дд), 111,8, 105,1 (дд), 27,3, 19,1. Приклад 31: {5-[4-(1-Аміно-1-метилетил)-[1,2,3]триазол-1іл]-2-метилфеніл}-[2-хлор-4-(2,4дифторфеніламіно)феніл]метанон (сполука 131) Реакцію здійснювали подібно до того, як описано в одержанні сполуки 116, використовуючи сполуку 434 (0,125ммоль) і 1,1-диметилпроп-2ініламін (0,125ммоль). Неочищений продукт очищали флеш-хроматографією у постійному градієнті, використовуючи MeOH/DCM від 0:100 до 5:95 як елюент з одержанням зазначеної в заголовку сполуки. 13 С ЯМР (CDCI3) δ 194,9, 159,4 (дд), 155,8 (дд), 148,5, 140,8, 138,1, 135,4, 134,9, 133,8, 132,6, 128,3, 124,9 (дд), 124,1 (дд), 122,4, 120,8, 117,1, 116,1, 112,8, 111,7 (дд), 105,0 (дд), 31,2 (ушир.с), 20,0. Приклад 32: Метиловий ефір 1-{3-[2-хлор-4-(2,4дифторфеніламіно)бензоїл-4-метилфеніл}-1Н[1,2,3]триазол-4-карбонової кислоти (сполука 132) Реакцію здійснювали подібно до того, як описано в одержанні сполуки 116, використовуючи сполуку 434 (0,50ммоль) і метиловий ефір пропінової кислоти (0,50ммоль). Неочищений продукт очищали флеш-хроматографією у постійному градієнті, використовуючи ЕtOАс/петролейний ефір (40-60) від 0:100 до 50:50 як елюент з одержанням зазначеної в заголовку сполуки. 13 С ЯМР (CDCI3) δ 194,4, 161,0, 159,5 (дд), 155,8 (дд), 148,6, 141,1, 140,6, 139,3, 135,5, 134,0, 133,9, 132,8, 128,1, 125,6, 124,9 (дд), 124,0 (дд), 122,6, 121,0, 116,1, 112,9, 111,7 (дд), 105,0 (дд), 52,4, 20,0. Приклад 33: 1-{3-[2-Хлор-4-(2,4дифторфеніламіно)бензоїл]-4-метилфеніл}-1Н[1,2,3]триазол-4-карбонова кислота (сполука 133) Суспензію сполуки 132 (100мг, 0,21ммоль) у МеОН (5,0мл) додавали до H2O (0,6мл) і LiOH (25мг, 1,0ммоль) і отриману реакційну суміш кип'ятили зі зворотним холодильником протягом 1 години. ЕtOАс додавали до^реакції й рН доводили до 1-2 концентрованої НСІ (37%, 6 краплі). Органічну фазу відділяли й водний шар екстрагували додатковою кількістю EtOAc. Органічні фази поєднували й промивали водою, сольовим розчином, сушили (MgSO4), фільтрували й концентрували у вакуумі з одержанням зазначеної в заголовку сполуки у вигляді твердої речовини білого кольору. 13 СЯМР (ДМСО-d6) δ 193,6, 161,3, 159,0 (дд), 155,7 (дд), 149,8, 140,8, 140,7, 137,1, 134,3, 134,1, 133,8, 132,4, 127,0, 126,7 (дд), 125,5, 124,0 (дд), 121,9, 119,7, 114,9, 112,0 (дд), 111,8, 105,0 (дд), 19,1. Приклад 34: 90698 58 [2-Хлор-4-(2,4-дифторфеніламіно)феніл]-4метилфеніл]-[5-(4-гідроксиметил-[1,2,3]триазол-1іл)-2-метилфеніл]метанон (сполука 134) Реакцію здійснювали подібно до того, як описано в одержанні сполуки 116, використовуючи сполуку 434 (0,125ммоль) і проп-2-ін-1-ол (0,125ммоль). Неочищений продукт очищали флеш-хроматографією у постійному градієнті, використовуючи EtOАс/петролейний ефір (40-60) від 0:100 до 60:40 як елюент з одержанням зазначеної в заголовку сполуки. 13 С ЯМР (CDCI3) δ 194,8, 159,4 (дд), 155,8 (дд), 148,5, 148,4, 140,8, 138,5, 135,5, 134,7, 133,8, 132,7, 128,2, 124,8 (дд), 124,0 (дд), 121,0, 120,1, 116,1, 112,8, 111,8, 111,7 (дд), 105,0 (дд), 56,6, 20,0. Приклад 35: [2-Хлор-4-(2,4-дифторфеніламіно)феніл]-{5-[4(3-гідроксипропеніл)-[1,2,3]триазол-1-іл]-2метилфеніл}метанон (сполука 135) Реакцію здійснювали подібно до того, як описано в одержанні сполуки 116, використовуючи сполуку 434 (0,15ммоль) і пент-2-ен-4-ин-1-ол (0,30ммоль). Неочищений продукт очищали флешхроматографією у постійному градієнті, використовуючи EtOAc/петролейний ефір (40-60) від 30:70 до 50:50 як елюент з одержанням зазначеної в заголовку сполуки у вигляді твердої речовини жовтого кольору. 13 С ЯМР (ДМСО-d6) δ 193,7, 158,9, 155,8, 149,8, 145,9, 140,8, 136,3, 134,3, 134,0, 133,2, 132,4, 126,6 (дд), 125,6, 124,0 (дд), 121,3, 119,3, 119,0, 116,8, 114,9, 112,0 (дд), 111,8, 105,0 (дд), 60,9, 19,1. Одержання 35: 2-(1-{3-[2-[Хлор-4-(2,4дифторфеніламіно)бензоїл]-4-метилфеніл}-1Н[1,2,3]триазол-4-іл)етиловий ефір толуол-4сульфонової кислоти (сполука 435) Розчин сполуки 128 (250мг, 0,53ммоль) у сухому піридині (2,0мл) продували аргоном і охолоджували до 0°С. 4-Метилбензолсульфонілхлорид (102мг, 0,53ммоль) додавали й реакцію залишали нагріватися до кімнатної температури протягом ночі при перемішуванні. Реакційну суміш виливали в суміш EtOAc/вода. Органічну фазу промивали водою, розсолом, фільтрували й концентрували у вакуумі з одержанням неочищеного продукту. Неочищений продукт очищали флешхроматографією у постійному градієнті, використовуючи ЕtOАс/петролейний ефір (40-60) від 25:75 до 50:50 як елюент з одержанням зазначеної в заголовку сполуки. Одержання 36: {5-[4-(2-Азидоетил)-[1,2,3]триазол-1-іл]-2метилфеніл}-2-хлор-4-(2,4дифторфеніламіно)феніл (сполука 436) Суміш сполуки 435 (167мг, 0,27ммоль), NaN3 (26мг, 0,40ммоль) і йодиду калію (4,4мг, 0,027ммоль) в DMF (5мл) перемішували при 50°С протягом 18 годин в атмосфері аргону. Реакційну суміш виливали в суміш ЕtOАс/вода. Органічну фазу промивали сольовим розчином, сушили (MgSO4). фільтрували й концентрували у вакуумі з одержанням неочищеного продукту. Неочищений 59 продукт очищали флеш-хроматографією у постійному градієнті, використовуючи ЕtOАс/петролейний ефір (40-60) від 0:100 до 50:50 як елюент з одержанням зазначеної в заголовку сполуки у вигляді масла жовтого кольору. Приклад 36: {5-[4-(2-Аміноетил)-[1,2,3]триазол-1-іл]-2метилфеніл}-[2-хлор-4-(2,4дифторфеніламіно)феніл]метанон (сполука 136) До розчину сполуки 436 (96мг, 0,20ммоль) у ТГФ (2,5мл) додавали 3 краплі води й трифенілфосфін (102мг, 0,39ммоль) і потім перемішували протягом 18 годин при кімнатній температурі. Реакційну суміш виливали в суміш ЕtOАс/вода. Органічну фазу промивали водою, сольовим розчином, фільтрували, концентрували у вакуумі з утворенням неочищеного продукту. Неочищений продукт очищали флеш-хроматографією, використовуючи МеОН як елюент з одержанням зазначеної в заголовку сполуки. 13 С ЯМР (CDCI3) δ 194,8, 159,4 (дд), 155,8 (дд), 148,4, 146,8, 140,8, 138,1, 135,5, 134,9, 133,8, 132,6, 128,4, 124,8 (дд), 124,1 (дд), 122,3, 120,8, 119,6, 116,2, 112,8, 111,7 (дд), 105,0 (дд), 41,6, 29,7, 20,0. Приклад 37: (1-{3-[2-Хлор-4-(2,4дифторфеніламіно)бензоїл]-4-метилфеніл}-1H[1,2,3]триазол-4-ілметил)сечовина (сполука 137) Реакцію здійснювали подібно до того, як описано в одержанні сполуки 116, використовуючи сполуку 434 (0,15ммоль) і проп-2-інілсечовину (0,30ммоль). Неочищений продукт очищали флешхроматографією, використовуючи EtOAc як елюент, для виділення твердої речовини. Ресуспендуванням у МеОН і осадженням одержували зазначену в заголовку сполуку у вигляді твердої речовини білого кольору. 13 СЯМР (ДМСО-d6) δ 193,7, 158,9 (дд), 158,3, 155,8 (дд), 149,7, 147,2, 140,7, 136.3, 134,3, 134,2, 134,0, 132,4, 126,6 (дд), 125,6, 124,0 (дд), 121,4, 120,7, 119,2, 114,9, 112,0 (дд), 111,8, 105,0 (дд), 34,7, 19,1. Приклад 38: [2-Хлор-4-(2,4-дифторфеніламіно)феніл]-{2метил-5-[4-(2-морфолін-4-іл-етил)-[1,2,3]триазол-1іл]феніл}метанон (сполука 138) Сполуку 435 (150мг, 0,24ммоль), K2СО3 (50мг, 0,36ммоль) і морфолін (0,5мл) вміщували в пробірку (8мл). DMF (0,5мл) додавали й отриману реакційну суміш перемішували при 50°С протягом 18 годин. До реакційної суміші додавали НСІ (4мл, 0,5Ν) і потім двічі екстрагували ЕtOАс (2мл). Органічні фази концентрували на силікагелі й очищали флеш-хроматографією у постійному градієнті, використовуючи MeOH/DCM від 0:100 до 10:90 як елюент з одержанням зазначеної в заголовку сполуки у вигляді піни білого кольору. 13 С ЯМР (CDCI3) δ 194,8, 159,4 (дд), 155,8 (дд), 148,4, 146,7, 140,7, 138,1, 135,4, 134,9, 133,8, 132,6, 128,4, 124,8 (дд), 124,1 (дд), 122,3, 120,9, 119,6, 116,2, 112,8, 111,7 (дд), 105,0 (дд), 66,8, 57,9, 53,5, 23,0, 20,0. Приклад 39: 90698 60 [2-Хлор-4-(2,4-дифторфеніламіно)феніл]-(2метил-5-{4-[2-(4-метилпіперазин-1іл)етил[1,2,3]триазол-1-іл}феніл)метанон (сполука 139) Реакцію здійснювали подібно до того, як описано в одержанні сполуки 138, використовуючи сполуку 435 (0,24ммоль) і 1-метилпіперазин (0,5мл). Неочищений продукт очищали флешхроматографією у постійному градієнті, використовуючи MeOH/DCM від 0:100 до 15:85 як елюент з одержанням зазначеної в заголовку сполуки у вигляді піни жовтого кольору. 13 СЯМР (CDCI3) δ 194,8, 148,4, 146,9, 140,8, 138,1, 135,5, 134,9, 133,8, 132,6, 128,4, 124,8 (дд), 124,1 (дд), 122,3, 120,9, 119,5, 116,2, 112,8, 111,7 (дд), 105,0 (дд), 57,5, 55,0, 52,7, 45,8, 23,4, 20,0. Приклад 40: [2-Хлор-4-(2,4-дифторфеніламіно)феніл]-{5-[4(2-діетиламіноетил)-[1,2,3]триазол-1-іл]-2метилфеніл}метанон (сполука 140) Реакцію здійснювали подібно до того, як описано в одержанні сполуки 138, використовуючи сполуку 435 (0,24ммоль) і діетиламін (0,5мл). Неочищений продукт очищали флешхроматографією у постійному градієнті, використовуючи MeOH/DCM від 0:100 до 15:85 як елюент з одержанням зазначеної в заголовку сполуки у вигляді піни жовтого кольору. 13 С ЯМР (CDCI3) δ 194,9, 159,4 (дд), 155,8 (дд), 148,5, 147.0, 140,8, 138,0, 135,4, 134,9, 133,8, 132,5, 128,3, 124,9 (дд), 124,1 (дд), 122,3. 120,8, 119,6, 116,2, 112,8, 111,7 (дд), 105,0 (дд), 52,2, 46,9, 23,4, 20,0, 11,5. Приклад 41: [2-Хлор-4-(2,4-дифторфеніламіно)феніл]-(5-(4[2-(2-гідроксіетиламіно)етил]-[1,2,3]триазол-1-іл}-2метилфеніл)метанон (сполука 141) Реакцію здійснювали подібно до того, як описано в одержанні сполуки 138, використовуючи сполуку 435 (0,24ммоль) і 2-аміноетанол (0,5мл). Неочищений продукт очищали флешхроматографією у постійному градієнті, використовуючи MeOH/DCM від 0:100 до 15:85 як елюент з одержанням зазначеної в заголовку сполуки у вигляді піни жовтого кольору. 13 СЯМР (CDCI3) δ 194,8, 148,6, 146,1, 140,8, 138,2, 135,4, 134,7, 133,9, 132,6, 128,2, 124,9 (дд), 124,1 (дд), 122,2, 120,8, 119,9, 116,1, 112,8, 111,8 (дд), 105,0 (дд), 60,0, 50,7, 48,1, 25,3, 19,9. Приклад 42: [2-Хлор-4-(2,4-дифторфеніламінд)феніл]-{2метил-5-[4-(2-пропіламіноетид)-[1,2,3]триазол-1іл]феніл}метанон (сполука 142) Реакцію здійснювали подібно до того, як описано в одержанні сполуки 138, використовуючи сполуку 435 (0,24ммоль) і пропіламін (0,5мл). Неочищений продукт очищали флешхроматографією у постійному градієнті, використовуючи MeOH/DCM від 0:100 до 15:85 як елюент з одержанням зазначеної в заголовку сполуки у вигляді піни жовтого кольору. 13 С ЯМР (CDCI3) δ 194,8, 159,4 (дд), 155,8 (дд), 148,5, 146,3, 140,8, 138,2, 135,4, 134,8, 133,8, 132,6, 128,3, 124,8 (дд), 124,1 (дд), 122,3, 120.8,
ДивитисяДодаткова інформація
Назва патенту англійськоюTriazole substituted aminobenzophenone compounds
Автори англійськоюOttosen Erik Rytter
Назва патенту російськоюТриазолзамещеные аминобензофеноновые соединения
Автори російськоюОттосен Эрик Рюттер
МПК / Мітки
МПК: A61P 29/00, A61P 27/02, C07D 249/06, A61P 35/00, C07D 405/06, C07D 405/12, A61K 31/4192
Мітки: амінобензофенонові, сполуки, триазолзаміщені
Код посилання
<a href="https://ua.patents.su/37-90698-triazolzamishheni-aminobenzofenonovi-spoluki.html" target="_blank" rel="follow" title="База патентів України">Триазолзаміщені амінобензофенонові сполуки</a>
Попередній патент: Спосіб вимірювання анізотропії індексу заломлення атмосфери землі
Наступний патент: Багатошарова панель
Випадковий патент: Спосіб очищення води від іонів нікелю












