Сполуки 1,2,4,5-тетрагідро-3н-бензазепіну, спосіб їх одержання і фармацевтична композиція, яка їх містить
Номер патенту: 100003
Опубліковано: 12.11.2012
Автори: Пегліон Жан-Луі, Толлон Катрін, Гуман Бертран, Кеньяр Паскаль, Шіманті Стефано, Вільньов Ніколь, Десенж Еме
Формула / Реферат
1. Сполука формули (І):
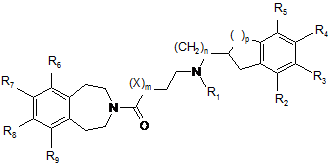 , (І)
, (І)
в якій:
- R1 являє собою атом водню або групу, яку вибирають з С3-С7циклоалкілу, бензилу і лінійного або розгалуженого С1-С6алкілу, алкільна група є насиченою або ненасиченою і необов'язково замішена гідрокси або С3-С7циклоалкільною групою або одним або більше атомами галогену,
- R2, R3, R4 і R5, які можуть бути однаковими або відрізнятись, кожний являє собою атом водню або гідроксигрупу; метильну групу; -OSО2R10; -OCOR10 групу або лінійну або розгалужену, насичену або ненасичену С1-С6алкоксигрупу, необов'язково заміщену метокси або -(CO)-NR12R'12; або R2 і R3 або R3 і R4, або R4 і R5 разом утворюють групу -O-(CH2)q-O-, -O-CH=CH-O- або -O-CH=CH-,
- R6, R7, R8 і R9, які можуть бути однаковими або відрізнятись, кожний являє собою атом водню або лінійну або розгалужену, насичену або ненасичену С1-С6алкоксигрупу, або R6 і R7 або R7 і R8, або R8 і R9 разом утворюють групу -О-(СН2)q-О-,
- R10 являє собою групу, яку вибирають з лінійного або розгалуженого С1-С6алкокси, NR11R'11 і лінійного або розгалуженого С1-С6алкілу, необов'язково заміщеного одним або більше атомами галогену,
- R11 і R'11, які можуть бути однаковими або відрізнятись, кожний являє собою атом водню або лінійну або розгалужену С1-С6алкільну групу, або R11 і R'11 разом з атомом азоту, до якого вони приєднані, утворюють моноциклічний або біциклічний 5-8-членний азотовмісний гетероцикл, який необов'язково містить інший гетероатом, який вибирають з О і N, вказаний гетероцикл необов'язково заміщений одним або більше атомами галогену,
- R12 і R'12, які можуть бути однаковими або відрізнятись, кожний являє собою атом водню або лінійну або розгалужену С1-С6алкільну групу,
- X являє собою О, NH або СН2,
- m і р, які можуть бути однаковими або відрізнятись, кожний являє собою 0 або 1,
- n і q, які можуть бути однаковими або відрізнятись, кожний являє собою 1 або 2,
її оптичні ізомери, коли вони існують, а також її адитивні солі з фармацевтично прийнятною кислотою.
2. Сполука формули (І) за п. 1, в якій R1 являє собою атом водню або лінійну або розгалужену С1-С6алкільну групу, її оптичні ізомери, коли вони існують, а також її адитивні солі з фармацевтично прийнятною кислотою.
3. Сполука формули (І) за п. 1, в якій R1 являє собою С3-С7циклоалкільну групу або циклоалкілалкільну групу, де циклоалкільна частина містить від 3 до 7 атомів вуглецю і алкільна частина містить від 1 до 6 атомів вуглецю і є лінійною або розгалуженою, її оптичні ізомери, коли вони існують, а також її адитивні солі з фармацевтично прийнятною кислотою.
4. Сполука формули (І) за будь-яким з пп. 1-3, в якій R2, R3, R4 і R5, які можуть бути однаковими або відрізнятись, кожний являє собою атом водню або лінійну або розгалужену, насичену або ненасичену С1-С6алкоксигрупу або -OCOR10, де R10 являє собою групу NR11R'11, як визначено в п. 1, її оптичні ізомери, коли вони існують, а також її адитивні солі з фармацевтично прийнятною кислотою.
5. Сполука формули (І) за будь-яким з пп. 1-4, в якій R6, R7, R8 і R9, які можуть бути однаковими або відрізнятись, кожний являє собою атом водню або лінійну або розгалужену, насичену або ненасичену С1-С6алкоксигрупу, її оптичні ізомери, коли вони існують, а також її адитивні солі з фармацевтично прийнятною кислотою.
6. Сполука формули (І) за будь-яким з пп. 1-5, в якій m являє собою 0, її оптичні ізомери, коли вони існують, а також її адитивні солі з фармацевтично прийнятною кислотою.
7. Сполука формули (І) за будь-яким з пп. 1-5, в якій m являє собою 1 і X являє собою СН2, її оптичні ізомери, коли вони існують, а також її адитивні солі з фармацевтично прийнятною кислотою.
8. Сполука формули (І) за будь-яким з пп. 1-7, в якій р являє собою 0, її оптичні ізомери, коли вони існують, а також її адитивні солі з фармацевтично прийнятною кислотою.
9. Сполука формули (І) за будь-яким з пп. 1-7, в якій р являє собою 1, її оптичні ізомери, коли вони існують, а також її адитивні солі з фармацевтично прийнятною кислотою.
10. Сполука формули (І) за п. 1, в якій R1 являє собою атом водню або лінійну або розгалужену С1-С6алкільну групу, R2, R3, R4 і R5, які можуть бути однаковими або відрізнятись, кожний являє собою атом водню або лінійну або розгалужену, насичену або ненасичену С1-С6алкоксигрупу, R6, R7, R8 і R9, які можуть бути однаковими або відрізнятись, кожний являє собою атом водню або лінійну або розгалужену, насичену або ненасичену С1-С6алкоксигрупу, m являє собою 0, n являє собою 1 і р являє собою 0, її оптичні ізомери, коли вони існують, а також її адитивні солі з фармацевтично прийнятною кислотою.
11. Сполука формули (І) за п. 1, яку вибирають з:
N-{[3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл]метил}-3-(7,8-диметокси-1,2,4,5-тетрагідро-3Н-3-бензазепін-3-іл)-N-метил-3-оксопропан-1-аміну, його оптичних ізомерів, а також його адитивних солей з фармацевтично прийнятною кислотою;
N-{[3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл]метил}-3-(7,8-диметокси-1,2,4,5-тетрагідро-3Н-3-бензазепін-3-іл)-3-оксопропан-1-аміну, його оптичних ізомерів, а також його адитивних солей з фармацевтично прийнятною кислотою;
N-[2-(5,6-диметокси-2.3-дигідро-1Н-інден-2-іл)метил]-3-(7,8-диметокси-1,2,4,5-тетрагідро-3Н-3-бензазепін-3-іл)-3-оксопропан-1-аміну, а також його адитивних солей з фармацевтично прийнятною кислотою;
N-{[3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл]метил}-3-(7,8-диметокси-1,2,4,5-тетрагідро-3Н-3-бензазепін-3-іл)-N-метил-4-оксобутан-1-аміну, його оптичних ізомерів, а також його адитивних солей з фармацевтично прийнятною кислотою;
N-{[3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл]метил}-3-(7,8-диметокси-1,2,4,5-тетрагідро-3Н-3-бензазепін-3-іл)-4-оксобутан-1-амін, його оптичних ізомерів, а також його адитивних солей з фармацевтично прийнятною кислотою; і
7-{[[3-(7,8-диметокси-1,2,4,5-тетрагідро-3Н-3-бензазепін-3-іл)-3-оксопропіл](метил)аміно]метил}біцикло[4.2.0]окта-1,3,5-триєн-3-ілу диметилкарбамату, його оптичних ізомерів, а також його адитивних солей з фармацевтично прийнятною кислотою.
12. Спосіб синтезу сполук формули (І), вказаних у п. 1, починаючи зі сполуки формули (II):
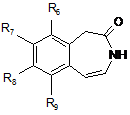 , (II)
, (II)
в якій R6, R7, R8 і R9 є такими ж, як визначено у п. 1,
яку піддають реакції гідрогенізації з одержанням сполуки формули (III):
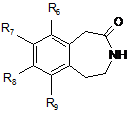 , (III)
, (III)
в якій R6, R7, R8 і R9 є такими ж, як визначено у п. 1,
яку відновлюють з одержанням сполуки формули (IV):
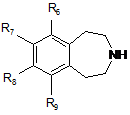 , (IV)
, (IV)
в якій R6, R7, R8 і R9 є такими ж, як визначено у п. 1,
яку піддають реакції
- або, коли бажано одержати сполуку формули (І), в якій m являє собою нуль, з акрилоїлхлоридом з одержанням сполуки формули (V):
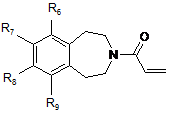 , (V)
, (V)
в якій R6, R7, R8 і R9 є такими ж, як визначено у п. 1,
яку піддають реакції з'єднання зі сполукою формули (VI):
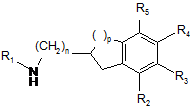 , (VI)
, (VI)
в якій n, p, R1, R2, R3, R4 і R5 є такими ж, як визначено у п. 1,
з одержанням сполук формули (Іа), часткового випадку сполук формули (І), де m являє собою нуль:
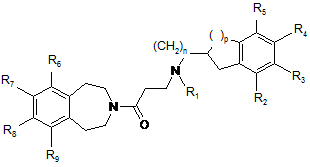 , (Ia)
, (Ia)
в якій n, p, R1, R2, R3, R4, R5, R6, R7, R8 і R9 є такими ж, як визначено у п. 1,
- або, коли бажано одержати сполуку формули (І), в якій (Х)m являє собою О або NH, з дифосгеном з одержанням сполуки формули (VII):
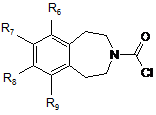 , (VII)
, (VII)
в якій R6, R7, R8 і R9 є такими ж, як визначено у п. 1,
яку піддають реакції зі сполукою формули (VIII):
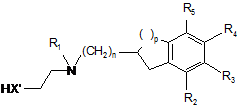 , (VIII)
, (VIII)
в якій n, р, R1, R2, R3, R4 і R5 є такими ж, як визначено у п. 1, і X' являє собою О або NH,
з одержанням сполуки формули (Іb), часткового випадку сполук формули (І), в якій m являє собою 1 і X являє собою О або NH:
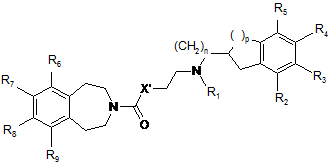 , (Ib)
, (Ib)
в якій n, p, R1, R2, R3, R4, R5, R6, R7, R8 і R9 є такими ж, як визначено у п. 1, і X' являє собою О або NH,
- або, коли бажано одержати сполуку формули (І), в якій (Х)m являє собою СН2, з гамма-бутиролактоном з одержанням сполуки формули (IX):
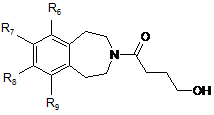 , (IX)
, (IX)
в якій R6. R7, R8 і R9 є такими ж, як визначено у п. 1,
яку окислюють, щоб утворити сполуку формули (X):
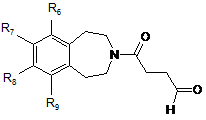 , (X)
, (X)
в якій R6, R7, R8 і R9 є такими ж, як визначено у п. 1,
яку піддають реакції зі сполукою формули (VI) з одержанням сполук формули (Іс), часткового випадку сполуки формули (І), в якій m являє собою 1 і X являє собою СН2:
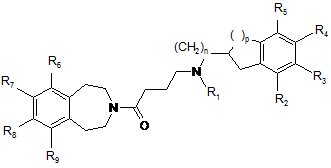 , (Ic)
, (Ic)
в якій n, p, R1, R2, R3, R4, R5, R6, R7, R8 і R9 є такими ж, як визначено у п. 1.
13. Фармацевтична композиція, яка містить як активний інгредієнт сполуку формули (І) за будь-яким з пп. 1-11, в комбінації з одним або більше фармацевтично прийнятним, інертним, нетоксичним наповнювачем або носієм.
14. Фармацевтична композиція за п. 13 для застосування у лікуванні або запобіганні патологіям, при яких прискорена частота серцевих скорочень діє як механізм приведення в дію або має роль загострення стану.
15. Фармацевтична композиція за п. 14 для застосування у лікуванні або запобіганні ішемічним кардіопатіям, серцевій недостатності, систолічній або діастолічній і/або у її хронічній або гострій формах; вентрикулярному або суправентрикулярному порушенням серцевого ритму або патологіям, які складають васкулярний фактор ризику.
16. Фармацевтична композиція за п. 15 для застосування у лікуванні або запобіганні стабільній стенокардії, нестабільній стенокардії, синдромам загрози інфаркту міокарда або пост-інфаркту.
17. Фармацевтична композиція за п. 15 для застосування у лікуванні або запобіганні артеріальній гіпертензії, діабету або гіперхолестеринемії.
18. Фармацевтична композиція за п. 13 для застосування в лікуванні або превентивному лікуванні болю, підвищеної активності сечового міхура і відчуття сухості ока.
Текст
Реферат: Сполука формули (І): R5 (CH2)n R6 R7 (X)m N R4 ( )p N R3 R1 R2 O R8 R9 , (І) в якій: - R1 являє собою атом водню або групу, яку вибирають з циклоалкілу, бензилу і необов'язково заміщеного алкілу, - R2, R3, R4 і R5 кожний являє собою атом водню або гідрокси, метильну, -OSO2R10, -OCOR10 або необов'язково заміщену алкоксигрупу; або R2 і R3 або R3 і R4, або R4 і R5 разом утворюють групу -O-(CH2)q-O-, -О-СН=СН-О- або -О-СН=СН-, UA 100003 C2 (12) UA 100003 C2 - R6, R7, R8 і R9 кожний являє собою атом водню або алкоксигрупу, або R6 і R7 або R7 і R8, або R8 і R9 разом утворюють групу -O-(CH2)q-О-, - R10 являє собою групу, яку вибирають з лінійного або розгалуженого С 1-С6алкокси, NR11R'11 і необов'язково заміщеного алкілу, - R11 і R'11 кожний являє собою атом водню або алкільну групу, або R11 і R'11 разом з атомом азоту, до якого вони приєднані, утворюють необов'язково заміщений, моноциклічний або біциклічний, азотовмісний гетероцикл, - X являє собою О, NH або СН2, - m і р кожний являє собою 0 або 1, - n і q кожний являє собою 1 або 2, у рацемічній формі або у формі оптичних ізомерів, а також її адитивні солі з фармацевтично прийнятною кислотою. Лікарські засоби. R5 (CH2)n R6 R7 (X)m N O R8 R9 R4 ( )p N R3 R1 R2 UA 100003 C2 5 10 15 20 25 30 35 40 45 50 55 60 Даний винахід стосується нових сполук 1,2,4,5-тетрагідро-3Н-бензазепіну, способу їх одержання і фармацевтичних композицій, які їх містять. Сполуки за даним винаходом блокують HCN-канали (активовані при гіперполяризації канали, ступінь відкритості яких регулюється циклічним нуклеотидом). Блокування HCN-каналів, яке спричиняється за допомогою сполук за даним винаходом, дозволяє використовувати останні у лікуванні і превентивному лікуванні будь-якої патології, в якій активність або експресія HCN-каналів є зниженою і атиповою. Вказані сполуки за даним винаходом можуть бути особливо корисними у лікуванні або превентивному лікуванні болю, зокрема нейропатичного і запального болю (Chaplan S.R., Quo H.Q., Lee D.H., Luo L., Liu C., Kuei C., Velumian A.A., Butler M.P., Brown S.M., Dub in AE. Neuronal hyperpolarization-activatedpacemaker channels drive neuropathic pain. JNeurosci 2003; 23(4): 116978; Luo L., Chang L., Brown S.M., Аo H, Lee D.H., Higuera E.S., Dubin A.E., Chaplan S.R. Role of peripheral hyperpolarization-activated cyclic nucleotide-modulated channel pacemaker channels in acute and chronic pain models in the rat. Neuroscience 2007; 144(4): 1477-85; Jiang Y.Q., Sun Q., Тu H.Y., Wan Y. Characteristics of HCN Channels and Their Participation in Neuropathic Pain. Neurochem Res. 2008 May 7), підвищеної активності сечового міхура (Stamatiou K., Heretis I, Skoumbourdis E. Does ivabradine exhibit a role in the reduction of bladder overactivity? Int Urol Nephrol. 2008 Feb 1.), і відчуття сухості ока (Ingram S.L., Williams J.T. Modulation of the hyperpolarization-activated current (Ih) by cyclic nucleotides in guinea-pig primary afferent neurons. J Physiol. 1996; 492: 97-106; Belmonte C. Eye dry ness sensations after refractive surgery: impaired tear secretion or "phantom" cornea? J Refract Surg 2007; 23 (6): 598-602). Сполуки за даним винаходом знижують активність пейсмекера безпосередньо або вибірково. Вибіркове зниження частоти серцевих скорочень, що викликається сполуками за даним винаходом, дає можливість застосовувати останні у лікуванні або превентивному лікуванні різних патологій, при яких прискорена частота серцевих скорочень діє як механізм приведення в дію або має роль загострення стану. Згадані сполуки можуть особливо покращувати лікування і віддалений прогноз ішемічних кардіопатій (Dyer A.R., Persky V., Stamler J. and al. Heart rate as a prognostic factor for coronary heart disease and mortality: findings in three Chicago epidemiologic studies. Am J Epidemiol 1980; 112: 736-749; Kannel W.B., Kannel C., Paffengarger R.S. Jr., and al. Heart rate and cardiovascular mortality: the Framingham Study. Am Heart J. 1987; 113: 1489-1494; Gillum R.F., Mahuc D.M., Feldman J.J. Pulse rate, coronary heart disease, and death: the NHANES I epidemiologic follow-up study. Am Heart J. 1991; 121; 172-177; Greenland P., Daviglus M.L., Dyer A.R. and al. Resting heart rate is a risk factor for cardiovascular and noncardiovascular mortality: the Chicago Heart Association Detection Project in Industry. Am J Epidemiol 1999; 149; 853-862; KristalBoneh E., Silber H., Harari G. and al. The association of resting heart rate with cardiovascular, cancer and all-cause mortality. Eight year follow-up of 3527 male Israeli employees (the CORD1S Study). Eur Heart J 2000; 21: 116-124; Palatini P. Heart rate as a cardiovascular risk factor: do women differ from men? Ann Med. 2001; 33: 213-221; Aronow W.S., Ahn C., Mercando A.D. and al. Association of average heart rate on 24-hour ambulatory electrocardiograms with incidence of new coronary events at 48-month follow-up in 1,311 patients (mean age 81 years) with heart disease and sinus rhythm. Am J Cardiol. 1996; 78: 1175-1176) у їх різних клінічних проявах: стабільна стенокардія (Borer J.S., Fox K., Jaillon P. and al. Antianginal and antiischemic effects of ivabradine, an If inhibitor, in stable angina. A randomized, double-blind, multicentered, placebo-controlled trial. Circulation 2003; 107:81723; Diaz A., Bourassa M.G., Guertin M.C., Tardif J.C. Long-term prognostic value of resting heart rate in patients with suspected or proven coronary artery disease. Eur Heart J 2005; 26: 967-974), нестабільна стенокардія, інфаркт міокарда (Hjalmarson A., Gilpin E.A., Kjehshus J., Schieman G., Nicod P., Henning H., Ross J. Jr. Influence of heart rate on mortality after acute myocardial infarction. Am J Cardiol 1990; 65: 547-553; Disegni E., Goldbourt V., Reicher-Reiss H., Kaplinsky E., Zion M., Boyko V., Behar S. The predictive value of admission heart rate on mortality in patients with acute myocardial infarction. SPRINT Study Group. Secondary Prevention Reinfarction Israeli Nifedipine Trial. J Clin Epidemiol 1995; 48: 1197-1205; Zuanetti G., Mantini L., Hernandez-Bernal F., Barlera S., di Gregorio D., Latini R., Maggioni A.P. Relevance of heart rate as a prognostic factor in patients with acute myocardial infarction: insights from the G1SS1-2 study. Eur Heart J 1998; 19(suppl F): F19-F26;Lee K.L., Woodlief L.H., Topol E.J., Weaver W.D., Betriu A., Col J., Simoons M., Aylward P., Van de Werf F., Catiff R.M. Predictors of 30-day mortality in the era of reperfusion for acute myocardial infarction. Results from an international trial of 41,021 patients. GUSTO-I Investigators. Circulation 1995; 91: 1659-1668; Steffenino G., Santoro G.M., Maras P., Mauri F., Ardissino D., Violini R., Chiarella F., Lucci D., Marini M., Baldasseroni S., Maggioni A.P. In-hospital and one-year outcomes of patients with high-risk acute myocardial infarction treated with thrombolysis or primary coronary 1 UA 100003 C2 5 10 15 20 25 30 angioplasty. Hal Heart J 2004; 5: 136-145; Mauss O., Klingenheben T., Ptaszynski P., Hohnloser S.H. Bedside risk stratification after acute myocardial infarction: prospective evaluation of the use of heart rate and left ventricular function. J Electrocardiol 2005; 38: 106-112), пост-інфаркт; серцева недостатність, систолічна або діастолічна (Aaronson K.D., Schwartz J.S., Chen T.M., Wong K.L., Gain J.E., Mancinі DM: Development and prospective validation of a clinical index to predict survival in ambulatory patients referred for cardiac transplant evaluation. Circulation 1997; 95: 2660-2667; CIBIS-II Investigators and Committees: The cardiac Insufficiency Bisoprolol Study II (CIBIS-II): a randomised trial. Lancet 1999:353:9-13; Mulder P., Barbier S., Chagraoui A. and al. Long-term heart rate reduction induced by the selective If current inhibitor ivabradine improves left ventricular function and intrinsic myocardial structure in congestive heart failure. Circulation 2004; 109: 1674-9); вентрикулярне або суправентрикулярне порушення серцевого ритму (James R., Arnold J., Alien J. and al. The effects of heart rate, myocardial ischemia and vagal stimulation on the threshold of ventricular fibrillation. Circulation. 1977; 55: 311-7; Bernier M., Curtis J.M., Hearse D.J. Ischemiainduced and reperfiision-induced arrhythmias: importance of heart rate. Am J Physiol 1989; 256: H21H31), патології, які складають васкулярний фактор ризику: артеріальна гіпертензія, діабет, гіперхолестеринемія, шляхом зменшення, особливо, розвитку атеросклеротичних ушкоджень і їх ускладнень (Beere P.A., Glagov S., Zarins С.K. Retarding effect of lowered heart rate on coronary atherosclerosis. Science 1984; 226: 180-2; Kaplan J.R., Manuck S.B., Clarkson Т.В. The influence of heart rate on coronary atherosclerosis. J Cardiovasc Pharmacol 1987; 10: S100-S102; Beere P.A., Glagov S., Zarins C.K. Experimental atherosclerosis at the carotid bifurcation of the cynomolgus monkey. Localization, compensatory enlargement, and the sparing effect of lowered heart rate. Atheroscler Thromb 1992; 12, 1245-53; Perski A., Hamsten A., Linvall K. and al. Heart rate correlates with severity of coronary artery atherosclerosis in youngpostinfarction patients. Am Heart J 1988; 116: 1369-73; Perski A Ollson G, Landou С. and al. Minimum heart rate and coronary atherosclerosis: Independent relations to global severity and rate of progression of angiographic lesions in men with myocardial infarction at a young age. Am Heart J 1992; 123: 609-16; Heidland U.E., Strauer B.E. Left ventricular muscle mass and elevated heart rate are associated-with coronary plaque disruption. Circulation. 2001; 104: 1477-82). Сполуки, які зменшують частоту серцевих скорочень безпосередньо або вибірково, відомі, особливо, із заявки на видачу патенту ЕР 0 534 859. Задачею даного винаходу є одержати нові сполуки, які зменшують частоту серцевих скорочень, які одночасно є потужними, селективними і безпечними для застосування. У цьому відношенні цінним є одержати сполуки, які мають невисокий ризик взаємодії ліків. Більш конкретно, даний винахід стосується сполук формули (І): R5 (CH2)n R6 R7 (X)m N 40 45 N R3 R1 R2 O R8 35 R4 ( )p R9 , (І) в якій: - R1 являє собою атом водню або групу, яку вибирають з С3-С7циклоалкілу, бензилу і лінійного або розгалуженого С1-С6алкілу, алкільна група є насиченою або ненасиченою і необов'язково заміщена гідрокси або С3-С7циклоалкільною групою або одним або більше атомами галогену, - R2, R3, R4 і R5, які можуть бути однаковими або відрізнятись, кожний являє собою атом водню або гідроксигрупу; метильну групу; -OSO2R10; -OCOR10 групу або лінійну або розгалужену, насичену або ненасичену С1-С6алкоксигпрупу, необов'язково заміщену метокси або -(CO)-NR12R'12; або R2 і R3 або R3 і R4, або R4 і R5 разом утворюють групу -О-(СН2)q-О-, -ОСН=СН-О- або -О-СН=СН-, - R6, R7, R8 і R9, які можуть бути однаковими або відрізнятись, кожний являє собою атом водню або лінійну або розгалужену, насичену або ненасичену С 1-С6алкоксигрупу, або R6 і R7 або R7 і R8, або R8 і R9 разом утворюють групу -О-(СН2)q-О-, 2 UA 100003 C2 5 10 15 20 25 30 35 40 45 50 55 60 - R10 являє собою групу, яку вибирають з лінійного або розгалуженого С 1-С6алкокси, NR11R'11 і лінійного або розгалуженого С1-С6алкілу, необов'язково заміщеного одним або більше атомами галогену, - R11 і R'11, які можуть бути однаковими або відрізнятись, кожний являє собою атом водню або лінійну або розгалужену С 1-С6алкільну групу, або R11 і R'11 разом з атомом азоту, до якого вони приєднані, утворюють моноциклічний або біциклічний 5-8-членний азотовмісний гетероцикл, який необов'язково містить інший гетероатом, який вибирають з О і N, вказаний гетероцикл необов'язково заміщений одним або більше атомами галогену, - R12 і R'12, які можуть бути однаковими або відрізнятись, кожний являє собою атом водню або лінійну або розгалужену С1-С6алкільну групу, - X являє собою О, NH або СН2, - m і р, які можуть бути однаковими або відрізнятись, кожний являє собою 0 або 1, - n і q, які можуть бути однаковими або відрізнятись, кожний являє собою 1 або 2, їх оптичних ізомерів, коли вони існують, а також їх адитивних солей з фармацевтично прийнятною кислотою. Серед фармацевтично прийнятних кислот можуть бути згадані, без будь-якого обмеження, хлористоводнева кислота, бромистоводнева кислота, сірчана кислота, фосфорна кислота, оцтова кислота, трифтороцтова кислота, молочна кислота, піровиноградна кислота, малонова кислота, янтарна кислота, глутарова кислота, фумарова кислота, винна кислота, малеїнова кислота, лимонна кислота, аскорбінова кислота, щавлева кислота, метансульфонова кислота, бензолсульфонова кислота, камфорна кислота, памова кислота, 1,5-нафталіндисульфонова кислота і т. д. Один аспект даного винаходу стосується сполук формули (І), в якій R1 являє собою атом водню або лінійну або розгалужену С1-С6алкільну групу, їх оптичних ізомерів, коли вони існують, а також їх адитивних солей з фармацевтично прийнятною кислотою. Інший аспект винаходу стосується сполук формули (І), в якій R1 являє собою С3С7циклоалкільну групу або циклоалкілалкільну групу, де циклоалкільна частина містить від 3 до 7 атомів вуглецю і алкільна частина містить від 1 до 6 атомів вуглецю і є лінійною або розгалуженою, їх оптичних ізомерів, коли вони існують, а також їх адитивних солей з фармацевтично прийнятною кислотою. Інший аспект винаходу стосується сполук формули (І), в якій R2, R3, R4 і R5, які можуть бути однаковими або відрізнятись, кожний являє собою атом водню або лінійну або розгалужену, насичену або ненасичену С1-С6алкоксигрупу або -ОСOR10, де R10 являє собою групу NR11R'11, як визначено тут вище, їх оптичних ізомерів, коли вони існують, а також їх адитивних солей з фармацевтично прийнятною кислотою. Переважно, R11 і R'11 кожний являє собою лінійну або розгалужену С1-С6алкільну групу. Інший аспект винаходу стосується сполук формули (І), в якій R6, R7, R8 і R9, які можуть бути однаковими або відрізнятись, кожний являє собою атом водню або лінійну або розгалужену, насичену або ненасичену С1-С6алкоксигрупу, їх оптичних ізомерів, коли вони існують, а також їх адитивних солей з фармацевтично прийнятною кислотою. Інший аспект винаходу стосується сполук формули (І), в якій m являє собою 0, їх оптичних ізомерів, коли вони існують, а також їх адитивних солей з фармацевтично прийнятною кислотою. Інший аспект винаходу стосується сполук формули (І), в якій m являє собою 1 і X являє собою СН2, їх оптичних ізомерів, коли вони існують, а також їх адитивних солей з фармацевтично прийнятною кислотою. Інший аспект винаходу стосується сполук формули (1), в якій р являє собою 0, їх оптичних ізомерів, коли вони існують, а також їх адитивних солей з фармацевтично прийнятною кислотою. Інший аспект винаходу стосується сполук формули (І), в якій р являє собою 1, їх оптичних ізомерів, коли вони існують, а також їх адитивних солей з фармацевтично прийнятною кислотою. Інший аспект винаходу стосується сполук, де R1, являє собою атом водню або лінійну або розгалужену С1-С6алкільну групу, R2, R3, R4 і R5, які можуть бути однаковими або відрізнятись, кожний являє собою атом водню або лінійну або розгалужену, насичену або ненасичену С 1С6алкоксигрупу, R6, R7, R8 і R9, які можуть бути однаковими або відрізнятись, кожний являє собою атом водню або лінійну або розгалужену, насичену або ненасичену С 1-С6алкоксигрупу, m являє собою 0, n являє собою 1 і р являє собою 0, їх оптичних ізомерів, а також їх адитивних солей з фармацевтично прийнятною кислотою. Інший аспект винаходу стосується наступних сполук: 3 UA 100003 C2 5 10 15 20 N-([3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл]метил)-3-(7,8-диметокси-1,2,4,3тетрагідро-3Н-3-бензазепін-3-іл)-N-метил-3-оксопропан-1-амін, його оптичні ізомери, а також його адитивні солі з фармацевтично прийнятною кислотою; N-{[3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл]метил}-3-(7,8-диметокси-1,2,4,5тетрагідро-3Н-3-бензазепін-3-іл)-3-оксопропан-1-амін, його оптичні ізомери, а також його адитивні солі з фармацевтично прийнятною кислотою; N-[2-(5,6-диметокси-2,3-дигідро-1Н-інден-2-іл)метил]-3-(7,8-диметокси-1,2,4,5-тетрагідро3Н-3-бензазепін-3-іл)-3-оксопропан-1-амін, а також його адитивні солі з фармацевтично прийнятною кислотою; N-[[3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл]метил]-3-(7,8-диметокси-1,2,4,5тетрагідро-3Н-3-бензазепін-3-іл)-N-метил-4-оксобутан-1-амін, його оптичні ізомери, а також його адитивні солі з фармацевтично прийнятною кислотою; N-{[3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл]метил}-3-(7,8-диметокси-1,2,4,5тетрагідро-3Н-3-бензазепін-3-іл)-4-оксобутан-1-амін, його оптичні ізомери, а також його адитивні солі з фармацевтично прийнятною кислотою; 7-{[[3-(7,8-диметокси-1,2,4,5-тетрагідро-3Н-3-бензазепін-3-іл)-3-оксопропіл](метил)аміно]метил}біцикло[4.2.0]окта-1,3,5-триєн-3-ілу диметилкарбамат, його оптичні ізомери, а також його адитивні солі з фармацевтично прийнятною кислотою. Даний винахід стосується також способу одержання сполук формули (І), починаючи зі сполуки формули (II): R6 O R7 NH R8 R9 , (II) в якій R6, R7, R8 і R9 є такими ж, як визначено для формули (І), яку піддають реакції гідрогенізації для одержання сполуки формули (III): R6 O R7 NH R8 R9 25 , (III) в якій R6, R7, R8 і R9 є такими ж, як визначено тут вище, яку відновлюють для одержання сполуки формули (IV): R6 R7 NH R8 R9 30 , (IV) в якій R6, R7, R8 і R9 є такими ж, як визначено тут вище, яку піддають реакції - або, коли бажано одержати сполуки формули (І), в якій m являє собою нуль, з акрилоїлхлоридом для одержання сполуки формули (V): R6 R7 O N R8 R9 , (V) в якій R6, R7, R8 і R9 є такими ж, як визначено тут вище, яку піддають реакції з'єднання зі сполукою формули (VI): 4 UA 100003 C2 R5 R1 (CH2)n R4 ( )p N H R3 R2 , (VI) в якій n, p, R1, R2, R3, R4 і R5 є такими ж, як визначено для формули (І), для одержання сполук формули (Іа), часткового випадку сполук формули (І), де m являє собою нуль: R5 (CH2)n R6 R4 ( )p N R7 R3 R1 R2 N O R8 5 R9 , (Ia) в якій n, р, R1, R2, R3, R4, R5, R6, R7, R8 і R9 є такими ж, як визначено для формули (І), - або, коли бажано одержати сполуки формули (І), в якій (Х)m являє собою О або NH, з дифосгеном для одержання сполуки формули (VII): R6 R7 O N Cl R8 R9 10 , (VII) в якій R6, R7, R8 і R9 є такими ж, як визначено тут вище, яку піддають реакції зі сполукою формули (VIII): R5 R4 ( )p R1 (CH2)n N R3 HX' 15 R2 , (VIII) в якій n, р, R1, R2, R3, R4 і R5 є такими ж, як визначено для формули (І), і X' являє собою О або NH, для одержання сполук формули (Іb), часткового випадку сполук формули (І), в якій m являє собою 1 і X являє собою О або NH: R5 (CH2)n R6 R4 ( )p N R7 X' N R3 R1 R2 O R8 R9 20 , (Ib) в якій n, p, R1, R2, R3, R4, R5, R6, R7, R8 і R9 є такими ж, як визначено для формули (І), і X' являє собою О або NH, - або, коли бажано одержати сполуки формули (І), в якій (Х) m являє собою СН2, з гаммабутиролактоном для одержання сполуки формули (IX): 5 UA 100003 C2 R6 R7 O N R8 OH R9 , (IX) в якій R6, R7, R8 і R9 є такими ж, як визначено тут вище, яку окислюють, щоб утворити сполуку формули (X): R6 R7 O N R8 O R9 5 H , (X) в якій R6, R7, R8 і R9 є такими ж, як визначено тут вище, яку піддають реакції зі сполукою формули (VI), для одержання сполук формули (Іс), часткового випадку сполук формули (І), в якій m являє собою 1 і X являє собою СН2: R5 (CH2)n R6 R4 ( )p N R7 R3 R1 N R2 O R8 R9 10 15 20 25 30 35 , (Ic) в якій n, р, R1, R2, R3, R4, R5, R6, R7, R8 і R9 є такими ж, як визначено для формули (І). Оптично активні форми сполук формули (І) одержують, або починаючи з оптично активних форм проміжних сполук синтезу формул (VI) і (VIII), або за допомогою розкладання рацемічних форм сполук формули (І), відповідно до способів, відомих з літератури. Сполуки за даним винаходом блокують HCN-канали (активовані при гіперполяризації канали, ступінь відкритості яких регулюється циклічним нуклеотидом). Блокування HCN-каналів, яке спричиняється за допомогою сполук за даним винаходом, дозволяє використовувати останні у лікуванні і превентивному лікуванні будь-якої патології, в якій активність або експресія HCN-каналів є зниженою і атиповою. Вказані сполуки за даним винаходом можуть бути особливо корисними у лікуванні або превентивному лікуванні болю, зокрема нейропатичного і запального болю, підвищеної активності сечового міхура і відчуття сухості ока. Сполуки за даним винаходом знижують активність пейсмекера безпосередньо або вибірково. Вибіркове зниження частоти серцевих скорочень, що викликається сполуками за даним винаходом, дає можливість застосовувати останні у лікуванні або превентивному лікуванні різних патологій, при яких прискорена частота серцевих скорочень діє як механізм приведення в дію або має роль загострення стану. Згадані сполуки можуть особливо покращувати лікування і віддалений прогноз ішемічних кардіопатій у їх різних клінічних проявах: стабільна стенокардія, гострий коронарний синдром: нестабільна стенокардія, синдроми загрози та інфаркт міокарда, пост-інфаркт; серцева недостатність, систолічна або діастолічна і або у її хронічній або гострій формах; вентрикулярне або суправентрикулярне порушення серцевого ритму, патології, які складають васкулярний фактор ризику: артеріальна гіпертензія, діабет, гіперхолестеринемія, шляхом зменшення, особливо, ендотеліальної дисфункції, розвитку атеросклеротичних ушкоджень і їх ускладнень. Вказані сполуки дають можливість гарантувати міокардіальний захист у пацієнтів з підвищеним ризиком, в ході оперативного втручання або септичного шоку. Зменшення частоти серцевих скорочень може, крім того, складати частину лікування таких захворювань, як гіпертиреоз, що супроводжується синусовою тахікардією. 6 UA 100003 C2 5 10 15 20 25 30 35 40 45 50 55 Даний винахід стосується також фармацевтичних композицій, які містять як активний інгредієнт сполуку формули І або її адитивну сіль з фармацевтично прийнятною кислотою, в комбінації з одним або більше фармацевтично прийнятними, інертними, нетоксичними наповнювачами або носіями. Серед фармацевтичних композицій за даним винаходом можуть бути згадані більш конкретно ті, які придатні для орального, парентерального (внутрішньовенного, внутрішньом'язового або підшкірного), під- або черезшкірного, назального, ректального. під'язикового, очного або респіраторного введення, і, особливо, таблетки або драже, під'язикові таблетки, тверді желатинові капсули, капсули, супозиторії, креми, мазі, шкірні гелі, препарати, придатні для ін'єкцій або пиття, аерозолі, очні краплі і краплі для носу. В доповнення до сполуки формули (І) фармацевтичні композиції відповідно до даного винаходу включають один або більше наповнювачів або носіїв, таких як розріджувачі, змащувальні речовини, зв'язувальні речовини, дезінтегруючі речовини, абсорбенти, барвники, підсолоджувачі. З метою прикладу наповнювачів або носіїв можуть бути згадані: - як розріджувачі: лактоза, глюкоза, сахароза, маніт, сорбіт, целюлоза, гліцерин, - як змащувальні речовини: кремнезем, тальк, стеаринова кислота і її магнієві і кальцієві солі, поліетиленгліколь, - як зв'язувальні речовини: силікат алюмінію, силікат магнію, крохмаль, желатин, трагакант, метилцелюлоза, натрійкарбоксиметилцелюлоза і полівінілпіролідон, - як дезінтегруючі речовини: агар, альгінова кислота і її натрієві солі, шипучі суміші. Процент активного інгредієнта формули (І) у фармацевтичній композиції переважно складає від 5 % до 50 % за вагою. Корисне дозування змінюється відповідно до віку і ваги пацієнта, шляху введення, природи і тяжкості захворювання, і проведення будь-якого пов'язаного лікування і знаходиться в діапазоні від 0,5 мг до 500 мг на день за одне або більше введень. Наступні Приклади ілюструють даний винахід. Структури сполук, розкритих у Прикладах, були визначені відповідно до звичайних спектрофотометричних методик (інфрачервоний, ядерно-магнітний резонанс, мас-спектрометрія). Приготування розкривають одержання проміжних сполук синтезу. Скорочення: BINAP-2,2'-біс(дифенілфосфіно)-1,1'-бінафтил, ТШХ - тонкошарова хроматографія, DMF-N, N-диметилформамід, DMSO - диметилсульфоксид, екв. - еквівалент, ІЧ - інфрачервоний, PEG 300 - поліетиленгліколь, який має середню молекулярну вагу 300 г/моль, THF - тетрагідрофуран. Приготування 1: [(4,5-Диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл)-метил]амін Стадія 1: 8,8-Діетокси-2,3-диметоксибіцикло[4.2.0]окта-1,3,5-триєн 24 г (107 ммоль) бромовератролу виливають на 8,4 г (215 ммоль)/2 екв.) аміду натрію в 10 мл толуолу, з наступним додаванням 25 г (215 ммоль/2 екв.) 1,1-діетоксіетилену. Нагрівання проводять при 80 °C протягом 4 годин 30 хвилин; проводять охолодження до -10 °C і вливають 50 мл води і потім 50 мл толуолу. Фази відокремлюють і водну фазу екстрагують знову з толуолом. Об'єднані фази толуолу промивають водою до нейтрального рН і потім концентрують. Залишок хроматографують над 600 г кремнезему (елюент: дихлорметан) для одержання бажаного продукту. Стадія 2: 4,5-Диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-он До 7,5 г (29,7 ммоль) попередньої сполуки, розчиненої в 120 мл THF, додають 30 мл 1М водного розчину хлористоводневої кислоти. Перемішування проводять при температурі навколишнього середовища протягом 19 годин і потім максимальну кількість THF випаровують. Білу масу, яку одержують, додають в 150 мл води і перемішують протягом 1 години при 5 °C. Після фільтрування, трьох промивань 15 мл води і висушування у вакуумі збирають бажаний продукт. Стадія 3: 4,5-Диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-ол До 4,73 г (26,5 ммоль) попередньої сполуки, суспендованої у 138 мл метанолу при 0 °C, додають, двічі, протягом 5 хвилин 1,21 г (31,8 ммоль) боргідриду натрію. Після перемішування протягом 1 години при 0 °C суміш виливають в 350 мл води і потім екстрагують 3 рази з 100 мл 7 UA 100003 C2 5 10 15 20 25 30 35 40 45 50 55 дихлорметану. Об'єднані органічні фази промивають двічі 50 мл води, і потім висушують над сульфатом магнію і концентрують, для одержання бажаного продукту. Стадія 4: 8-Бром-2,3-диметоксибіцикло[4.2.0]окта-1,3,5-триєн 4,55 г (25,3 ммоль) попередньої сполуки, 11,9 г (45,5 ммоль/1,8 екв.) трифенілфосфіну і 10,05 г (30,3 ммоль/1,2 екв.) тетраброметану в 150 мл ефіру нагрівають зі зворотним холодильником протягом 2 годин 30 хвилин. Після охолодження нерозчинний матеріал фільтрують через фриту і промивають 5 разів 50 мл ефіру. Після концентрування фільтратів, залишок хроматографують над 550 г кремнезему (елюент: дихлорметан) для одержання бажаного продукту. Стадія 5: 4,5-Диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-карбонітрил 6,0 г (24,8 ммоль) попередньої сполуки і 8,64 г (32,2 ммоль/1,3 екв.) тетрабутиламонію ціаніду в 125 мл THF перемішують при температурі навколишнього середовища протягом 21 годин. Після концентрування реакційної суміші, залишок хроматографують над 350 г кремнезему (елюент: дихлорметан) для одержання бажаного продукту. Стадія 6: 1-(4,5-Диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл)метил]амін До 4,01 г (21,2 ммоль) попередньої сполуки, розчиненої в 60 мл метанолу і 60 мл 7N амонійного метанолу, додають 2 мл нікелю Ренея. Гідрогенізацію проводять при температурі навколишнього середовища і звичайному тиску протягом 6 годин 30 хвилин. Суміш потім фільтрують над целітом, промивають метанолом і концентрують, для одержання бажаного продукту. Приготування 2: [(2-Метоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл)-метил]амін Стадія 1: 3-(2,6-Дибромфеніл)-2-хлорпропаннітрил До 62,4 г (464 ммоль/1,2 екв.) хлориду міді, 76 мл (580 ммоль/1,5 екв.) трет-бутилнітрилу і 483 мл (7,34 моль/19 екв.) акрилонітрилу в 475 мл ацетонітрилу, при температурі навколишнього середовища, виливають, краплями, протягом 1 години, 100 г (386 ммоль) 2,6диброманіліну, розчиненого в 380 мл ацетонітрилу. Перемішування проводять протягом наступної 1 години при температурі навколишнього середовища, і потім реакційну суміш вливають в 1 літр 20 % водного розчину хлористоводневої кислоти. Водну фазу екстрагують толуолом і об'єднані фази толуолу промивають водним насиченим розчином хлориду натрію. Після концентрування, одержують бажаний продукт і використовують як такий на наступній Стадії. Стадія 2: 3-(2,6-Дибромфеніл)-пропаннітрил Попередню сполуку розчиняють в 1400 мл оцтової кислоти. Одразу додають 68 г (1,40 моль/2,7 екв.) порошкоподібного цинку. Екзотермічний ефект до 58 °C розвивається повільно. Через 1 годину реакції, реакційну суміш виливають на 3 кг льоду. Водну фазу, яку одержують, екстрагують з 1 літром і потім 500 мл толуолу. Об'єднані фази толуолу промивають водним насиченим розчином хлориду натрію. Після концентрування залишок хроматографують над кремнеземом, для одержання бажаного продукту. Стадія 3: 2-Бромбіцикло[4.2.0]окта-1,3,5-триєн-7-карбонітрил 138 г (477 ммоль) попередньої сполуки у твердій формі додають до аміду натрію (1,91 моль/4 екв.) в 3 літрах рідкого аміаку. Після перемішування протягом 2 годин при кип'ятінні зі зворотним холодильником аміаку, реакцію зупиняють додаванням 102 г (4 екв.) твердого хлориду амонію і потім аміаку дають випаритись. Залишок додають в 1 літр ефіру і перемішують; тверду речовину відфільтровують і промивають ефіром. Після концентрування об'єднаних фільтратів, залишок хроматографують над 2 кг кремнезему (елюент: дихлорметан) для одержання бажаного продукту. Стадія 4: 2-Бромбіцикло[4.2.0]окта-1,3,5-триєн-7-карбонова кислота До 75 г (360 ммоль) попередньої сполуки, в 375 мл етанолу, при температурі навколишнього середовища, додають розчин 38 г (612 ммоль, 1,7 екв.) гідроксиду калію, розчиненого в 125 мл води. Нагрівання зі зворотним холодильником проводять протягом 16 годин, і потім етанол випаровують. Додають 1 літр води, водну фазу промивають двічі 250 мл ефіру, і потім проводять окислення до рН 1, використовуючи концентровану хлористоводневу кислоту. Утворений осад відфільтровують, промивають водою і висушують, для одержання бажаного продукту. Стадія 5: 2-(2-Бромбіцикло[4.2.0]окта-1,3,5-триєн-7-іл)-4,4-диметил-4,5-дигідрооксазол 79 г (348 ммоль) попередньої сполуки і 39 г (417 ммоль/1,2 екв.) 1,1-диметил-2гідроксіетиламіну в 800 мл ксилолу змішують разом. Суміш нагрівають при 140 °C протягом 6 годин, проводячи азеотропну відгонку води. Суміші потім дають охолонути і перемішування при температурі навколишнього середовища підтримують протягом ночі. Осад, який утворюється 8 UA 100003 C2 5 10 15 20 25 30 35 40 45 50 55 60 (по суті вихідна кислота), відфільтровують і промивають толуолом. Об'єднані фільтрати концентрують, для одержання бажаного продукту. Стадія 6: [7-(4,4-Диметил-4,5-дигідро-1,3-оксазол-2-іл)біцикло[4.2.0]окта-1,3,5-триєн-2-іл(дифенілметилен)амін При температурі навколишнього середовища 48 г (171 ммоль) попередньої сполуки, 37,3 г (205 ммоль/1,2 екв.) бензофеноніміну, 1,57 г (1,71 ммоль/0,01 екв.) дипаладію трис(дибензиліденацетону), 3,2 г (5,14 ммоль/0,03 екв.) BINAP і 23 г (240 ммоль/1,4 екв.) третбутилату натрію вмішують у 800 мл толуолу. Нагрівання при 85 °C проводять протягом 24 годин, додаючи 9,3 г (0,3 екв.) бензофенонаміну через 4 години. Після припинення нагрівання, нерозчинний матеріал відфільтровують при близько 50 °C, і фільтрат потім концентрують, щоб одержати бажаний продукт, який використовують як такий на наступній Стадії. Стадія 7: 2-Амінобіцикло[4.2.0]окта-1,3,5-триєн-7-карбонової кислоти етиловий ефір 111 г (близько 171 ммоль) попередньої сполуки в 2400 мл етанолу, який містить 200 мл концентрованої сірчаної кислоти, нагрівають зі зворотним холодильником протягом 1 години 30 хвилин. Розчинник концентрують максимально і матеріал додають в 1,5 літри води. Водну фазу промивають ефіром, зробленим основним, використовуючи змішаний вуглекислий калій-натрій, і потім екстрагують ефіром. Після висушування над сульфатом магнію і концентрування об'єднаних ефірних фаз, бажаний продукт збирають. Стадія 8: 2-Гідроксибіцикло[4.2.0]окта-1,3,5-триєн-7-карбонова кислота У холодному стані, 18,6 мл (345 ммоль/6 екв.) концентрованої сірчаної кислоти вливають в 11 г (57,5 ммоль) попередньої сполуки, суспендованої у 220 мл води, підтримуючи температуру нижче 15 °C. Проводять охолодження до близько від 0 до 5 °C і, протягом 15 хвилин, розчин 4,36 г (63,3 ммоль/1,1 екв.) нітрилу натрію в 25 мл води вливають краплями; перемішування проводять протягом 5 хвилин при 0 °C і потім, протягом 10 хвилин і підтримуючи температуру нижче 10 °C, розчин 144 мг (0,57 ммоль/0,01 екв.) пентагідрату сульфату міді в 166 мл 1М водної сірчаної кислоти вливають краплями. Нагрівання при 80 °C потім проводять протягом 1 години і потім перемішування проводять протягом ночі при температурі навколишнього середовища. Водну фазу екстрагують ефіром, об'єднані ефірні фази промивають водним насиченим розчином хлориду натрію, висушують над сульфатом магнію і концентрують. Залишок хроматографують над 500 г кремнезему (елюент: дихлорметан/етанол 90/10) для одержання бажаного продукту. Стадія 9: 2-Метоксибіцикло[4.2.0]окта-1,3,5-триєн-7-карбонової кислоти етиловий ефір 6 г (33 ммоль) попередньої сполуки і 2,7 г (8,3 ммоль/0,25 екв.) карбонату цезію в 330 мл диметилкарбонату нагрівають при 130 °C протягом 45 годин. Після фільтрування і концентрування реакційної суміші, збирають бажаний продукт. Стадія 10: 2-Метоксибіцикло[4.2.0]окта-1,3,5-триєн-7-карбоксамід До 6 г (31 ммоль) попередньої сполуки, в 50 мл THF при 0 °C додають, краплями, 120 мл 28 % гідроксиду амонію. Перемішування проводять при температурі навколишнього середовища протягом 2 днів, і потім THF випаровують максимально. Водну фазу екстрагують етилацетатом. Об'єднані органічні фази висушують над сульфатом магнію і концентрують, для одержання бажаного продукту. Стадія 11: 1-(2-Метоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл)метанамін 1,39 мл (14,7 ммоль/3 екв.) борандиметилсульфіду вливають, краплями, протягом 10 хвилин, в 0,87 г (4,9 ммоль) попередньої сполуки, розчиненої в 20 мл THF, при температурі навколишнього середовища, і потім нагрівання при 70 °C проводять протягом 24 годин. Суміш повертають назад до температури навколишнього середовища, піддають сольволізу, використовуючи 7,5 мл безводного метанолу, і нагрівають знову зі зворотним холодильником протягом 1 години. Після випаровування, залишок (0,99 г) хроматографують на колонці 50 г кремнезему (елюент: дихлорметан/етанол/аміак 95/5/0,5) для одержання першої частини бажаного продукту, а іншу частину цього ж продукту у формі бор комплексів. Остання частина, після обробки етанольною НСl і потім кислотно-основного екстрагування, забезпечує додаткову частину бажаного продукту. Приготування 3: 7-(Амінометил)біцикло[4.2.0]окта-1,3,5-триєн-3-ол Стадія 1: 3-Гідроксибіцикло[4.2.0]окта-1,3,5-триєн-7'-карбонітрил 68,7 г (431,6 ммоль) 3-метоксибіцикло[4.2.0]окта-1,3,5-триєн-7-карбонітрилу, розчиненого в 1500 мл дихлорметану. доводять до 0 °C. Потім до нього додають, краплями, протягом 1 години 15 хвилин, 863 мл 1М розчину триброміду бору в дихлорметані (863 ммоль/2 екв.). Суміші потім дають повернутись до температури навколишнього середовища протягом ночі. Суміш повертають до близько 0 °C і виливають на 1 кг льоду. Перемішування проводять протягом 30 хвилин при температурі навколишнього середовища, фази відокремлюють і водну фазу 9 UA 100003 C2 5 10 15 20 25 30 35 40 45 50 55 екстрагують знову двічі з 500 мл дихлорметану. Об'єднані органічні фази промивають 600 мл води і потім висушують над сульфатом магнію. Після фільтрування і концентрування, одержують бажаний продукт. Стадія 2: 7-(Амінометил)біцикло[4.2.0]окта-1,3,5-триєн-3-ол До 8,0 г (55,1 ммоль) попереднього нітрилу, розчиненого в 170 мл метанолу і 170 мл 7N амонійного метанолу, додають 8 мл нікелю Ренея. Гідрогенізацію проводять при температурі навколишнього середовища і звичайному тиску доти, доки не абсорбується теоретичний об'єм водню. Суміш потім фільтрують над целітом, промиваючи метанолом і концентрують, щоб одержати бажаний амін. Приготування 4: 8-(Амінометил)біцикло[4.2.0]окта-1,3,5-триєн-3-ол Методика є такою ж як і для продукту Приготування 3, але починаючи з 4метоксибіцикло[4.2.0]окта-1,3,5-триєн-7-карбонітрилу. Приготування 5: [(3-Етоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл)метил]амін Стадія 1: 3-Етоксибіцикло[4.2.0]окта-1,3,5-триєн-7-карбонітрил: 1,5 г (10,19 ммоль) продукту Стадії 1 Приготування 3 розчиняють в 15 мл диметилформаміду (DMF). Додають 2,8 г (2 еквіваленти) карбонату калію, і потім 2,3 мл (3 еквіваленти) етилброміду і 100 мг (0,06 еквівалента) йодиду калію. Реакційну суміш нагрівають при 80 °C протягом 3 годин. Потім проводять охолодження і DMF випаровують, використовуючи роторний випарник. Залишок, який одержують, додають у воду і екстрагують дихлорметаном (СН 2Сl2). Органічну фазу висушують над MgSO4, фільтрують і потім випаровують для одержання 1,8 г олії. Олію очищують флеш-хроматографією над 100 г кремнезему (елюент: СН2Сl2 100 %) для одержання очікуваного продукту, який кристалізується при температурі навколишнього середовища. Точка плавлення: 50-52 °C. Стадія 2: [(3-Етоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл)метил]амін 1,5 г (8,65 ммоль) продукту Стадії 1 розчиняють в 30 мл метанолу (МеОН). Додають 30 мл (7N) розчину амонійного метанолу і 0,5 г нікелю Ренея. Реакційну суміш потім гідрогенізують протягом ночі під тиском 1 бар, при температурі навколишнього середовища. Каталізатор потім відфільтровують і фільтрат випаровують досуха. Очікуваний продукт одержують у формі олії. Приготування 6: [(3-Трет-бутоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл)метил]амін Стадія 1: 3-Трет-бутоксибіцикло[4.2.0]окта-1,3,5-триєн-7-карбонітрил 2,0 г (13,59 ммоль) продукту Стадії 1 Приготування 3 розчиняють в 100 мл дихлорметану (СН2Сl2). Проводять охолодження до 0 °C і ізобутен барботують через розчин доти, доки він не стане насиченим. Потім додають 0,2 мл концентрованої сірчаної кислоти і перемішування при температурі навколишнього середовища проводять протягом 24 годин. Розчин нейтралізують додаванням NaOH (1N). Проводять екстрагування СН2Сl2, промивання водою і висушування над MgSO4, з наступним фільтруванням і випаровуванням фільтрату досуха. Одержаний залишок очищують флеш-хроматографією над 150 г кремнезему (елюент: СН2Сl2 100 %) для одержання очікуваного продукту у формі олії. Стадія 2: [(3-Трет-бутоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл)метил]-амін 1,1 г (5,46 ммоль) продукту Стадії 1 розчиняють в 30 мл метанолу (МеОН). Додають 30 мл (7N) розчину амонійного метанолу і 0,5 г нікелю Ренея. Реакційну суміш гідрогенізують протягом ночі під тиском 1 бар, при температурі навколишнього середовища. Каталізатор потім відфільтровують і фільтрат випаровують досуха. Очікуваний продукт одержують у формі олії. Приготування 7: 5,6-Дигідроциклобута[f][1,3]бензодіоксол-5-ілметиламін Стадія 1: Етил-(5,6-дигідроциклобута[4,5]бензо[1,2-d][1,3]діоксол-5-ілметил)карбамат 7,9 г (44,6 ммоль) (5,6-дигідроциклобута[4,5]бензо[1,2-d][1,3]діоксол-5-ілметил)аміну розчиняють в 80 мл дихлорметану. Додають 80 мл води і 6 мл (1,6 еквівалентів) (12N) водного розчину гідроксиду натрію. Протягом 15 хвилин додають 3,95 мл (1,1 еквівалента) етилхлорформіату і перемішування проводять при 25 °C протягом 2 годин. Суміш відокремлюють і органічні фази промивають насиченим водним розчином NaHCO3. Проводять висушування над MgSO4, фільтрування і випаровування досуха. Очікуваний продукт одержують у формі твердої речовини коричневого кольору. Стадія 2: 5,6-Дигідроциклобута[f][1,3]бензодіоксол-5-ілметиламін 7,5 г (30 ммоль) продукту Стадії 1 розчиняють в 15 мл безводного тетрагідрофурану. Розчин виливають краплями у суспензію, яка містить 1,48 г (1,3 еквівалентів) AlLiH4, суспендованого в 38 мл безводного тетрагідрофурану. Перемішування проводять при 25 °C протягом 2 годин. Суміш гідролізують в холодному стані, використовуючи 2,7 мл води, 2,7 мл NaOH (20 %) і потім 2,7 мл води. Проводять фільтрування і випаровування фільтрату досуха. Одержують 2,4 г 10 UA 100003 C2 5 10 15 20 25 30 35 40 45 50 55 залишку, який очищують колонковою хроматографією над кремнеземом (елюент: СН2Сl2/етанол/NН4ОН 95/5/0,5). Очікуваний продукт одержують у формі коричневої олії. Приготування 8: [2-(5,6-Диметокси-2,3-дигідро-1Н-інден-2-іл)етил]амін 5 г (2,3 ммоль) (5,6-диметокси-2,3-дигідро-1Н-інден-2-іл)ацетонітрилу розчиняють в 50 мл метанолу. Потім додають 50 мл (7N) розчину MeOH-NH3 і 0,5 г нікелю Ренея. Гідрогенізацію проводять протягом 4 днів під тиском 5 бар, при 25 °C. Проводять фільтрування над целітом і випаровуванням фільтрату досуха. Залишок одають в 50 мл НСl (1N) і промивають етилацетатом, водну фазу потім доводять до рН=10 за допомогою додавання NaOH (20 %). Проводять екстрагування з Et2O, промивання водою, висушування над MgSO4, фільтрування і випаровування досуха. Очікуваний продукт одержують у формі олії. Приготування 9: 2-(5-Метоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл)метиламін 3 г (19 ммоль) 5-метоксибіцикло[4.2.0]окта-1,3,5-триєн-7-карбонітрилу в 45 мл метанолу і 45 мл 7М розчину амонійного метанолу гідрогенізують у присутності 1,5 г нікелю Ренея 50 % у воді при атмосферному тиску. Після реагування протягом двох годин, реакційну суміш відфільтровують і випаровують, для одержання очікуваного продукту. Приготування 10: 2-(2,3-Диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл)метиламін Одержують таким же чином, як і продукт Приготування 9, але використовуючи 2,3диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-карбонітрил. Приготування 11: 2-(2,3,4-Триметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл)метиламін Одержують таким же чином, як і продукт Приготування 9, але використовуючи 2,3,4триметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-карбонітрил. Приготування 12: (Циклопропілметил){[(7S)-3,4-диметоксибіцикло-[4.2.0]окта-1,3,5-триєн-7іл]метил}амін Стадія 1: {[(7S)-3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл]метил}циклопропінкарбоксамід До 4,6 г (20 ммоль) {[(7S)-3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл]метил}аміну гідрохлориду в 60 мл дихлорметану, при температурі навколишнього середовища, додають, одразу, 6,1 мл (44 ммоль/2,2 екв.) триетиламіну і перемішування проводять протягом близько 30 хвилин. Потім додають краплями, протягом 40 хвилин, 2 мл (22 ммоль/1,1 екв.) хлориду циклопропанкарбонової кислоти. Суміш потім перемішують при температурі навколишнього середовища протягом 1 години 30 хвилин і потім переміщують в окрему ділильну лійку; додають 60 мл дихлорметану і проводять послідовне промивання 40 мл води, двома 40 мл кількостями 1N хлористоводневої кислоти, двома 40 мл кількостями насиченого водного розчину гідрокарбонату натрію і 40 мл води. Після висушування над сульфатом магнію, фільтрування і концентрування збирають бажаний продукт. Стадія 2: (Циклопропілметил){[(7S)-3,4-диметоксибіцикпо[4.2.0]окта-1,3,5-триєн-7іл]метил}амін До 1,2 г (30 ммоль) алюмогідриду літію, суспендованого в 40 мл THF, при температурі навколишнього середовища, додають, краплями, розчин 5,2 г (20 ммоль) попередньої сполуки, в 80 мл THF, з наступним нагріванням зі зворотним холодильником протягом 4 годин 30 хвилин. Проводять охолодження до близько 0 °C і потім додають, обережно, підряд, 0,79 мл води, 0,63 мл 20 % водного розчину гідроксиду натрію і 2,9 мл води. Проводять перемішування при температурі навколишнього середовища, і потім солі відфільтровують над фритою, промиваючи THF. Об'єднані фільтрати концентрують для одержання бажаного продукту. Приготування 13: ([(7S)-3,4-Диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл]метил}етанамін Методика є такою ж, як і у Приготуванні 12, Стадіях А і В, але використовуючи ацетилхлорид на Стадії А замість хлориду циклопропанкарбонової кислоти. Приготування 14: N-бензил-1-[(7S)-3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7іл]метанамін Методика є такою ж, як і у Приготуванні 12, Стадіях А і В, але використовуючи бензоїлхлорид на Стадії А замість хлориду циклопропанкарбонової кислоти. Приготування 15: (Циклопентилметил)([(7S)-3,4-диметоксибіцикло-[4.2.0]окта-1,3,5-триєн-7іл]метил}амін Методика є такою ж, як і у Приготуванні 12, Стадіях А і В, але використовуючи хлорид циклопентанкарбонової кислоти на Стадії А замість хлориду циклопропанкарбонової кислоти. Приготування 16: (Циклобутилметил){[(7S)-3,4-диметоксибіцикло-[4.2.0]окта-1,3,5-триєн-7іл]метил}амін Методика є такою ж, як і у Приготуванні 12. Стадіях А і В, але використовуючи хлорид циклобутанкарбонової кислоти на Стадії А замість хлориду циклопропанкарбонової кислоти. 11 UA 100003 C2 5 10 15 20 25 30 35 40 45 50 55 60 Приготування 17: N-{[(7S)-3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл]-метил}-2,2,2трифторетанамін Стадія 1: N-{[(7S)-3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл]-метил}-2,2,2трифторацетамід До 2,9 г (15 ммоль) {[(7S)3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл]метил}аміну в 7,5 мл метанолу, при температурі навколишнього середовища, додають, одразу, 2,1 мл (15 ммоль/1 екв.) триетиламіну, і потім, краплями, протягом 20 хвилин, 2,3 мл (19 ммоль/1,25 екв.) етилтрифторацетату. Перемішування проводять при температурі навколишнього середовища протягом 2 годин, з наступним випаровуванням досуха. Залишок додають в 100 мл дихлорметану, і проводять промивання 50 мл 1N хлористоводневої кислоти і потім 50 мл води і висушування над сульфатом магнію. Після фільтрування і концентрування збирають бажаний продукт. Стадія 2: N-{[(7S)-3,4-диметоксибіцикло[4.2.0]]окта-1,3,5-триєн-7-iл]метил}-2,2,2трифторетанамін До 4,07 г (14,0 ммоль) сполуки Стадії 1 в 28 мл THF, при близько 0 °C, додають краплями, протягом 10 хвилин, 21 мл (21 ммоль/1,5 екв.) 1N розчину борану в THF, і потім проводять нагрівання зі зворотним холодильником протягом 18 годин. Суміші дають охолонути і краплями додають 14 мл 2,6N етанольного розчину НСl; потім суміш нагрівають зі зворотним холодильником знову протягом 2 годин. Сумі дають охолонути, тверду речовину відфільтровують над фритою, промивають ефіром і висушують у вакуумі, щоб одержати гідро хлорид, і, після обробки в основному середовищі, очікуваний продукт. Приготування 18: N-{[(7S)-3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл]метил}проп-2-ен1-амін До 3,9 г (20 ммоль) {[(7S)-3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл]метил}аміну в 40 мл ацетону, при температурі навколишнього середовища, додають, одразу, 4,1 г (30 ммоль/1,5 екв.) карбонату калію, і потім швидко додаються краплями 1,9 мл (22 ммоль/1,1 екв.) алілброміду. Перемішування проводять при температурі навколишнього середовища протягом 60 годин; солі потім відфільтровують і фільтрат концентрують. Залишок (4,8 г) хроматографують над 300 г кремнезему (елюент: дихлорметан/етанол/аміак 98/2/0,2) для одержання бажаного продукту. Приготування 19: N-{[(7S)-3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7іл]метил}циклопентанамін При температурі навколишнього середовища, 2,9 г (15 ммоль) {[(7S)-3,4диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл]метил)аміну і 1,3 мл (15 ммоль/1 екв.) циклопентанону вмішують в 60 мл дихлорметану. Потім додають 4,8 г (22,5 ммоль/1,5 екв.) триацетоксибогідриду натрію і потім 0,86 мл (15 ммоль/1 екв.) оцтової кислоти, і перемішування проводять при температурі навколишнього середовища протягом 4 годин. Потім вливають 90 мл 1N розчину гідроксиду натрію; потім проводять екстрагування двома 120 мл кількостями ефіру. Об'єднані органічні фази промивають 90 мл води і потім 90 мл насиченого водного розчину хлориду натрію і потім висушують над сульфатом магнію. Після фільтрування і концентрування збирають бажаний продукт. Приготування 20: N-{[(7S)-3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7іл]метил}циклобутанамін Методика є такою ж, як і у Приготуванні 19, але використовуючи циклобутанон замість циклопентанону. Приготування 21: (7-Амінометил)-біцикло[4.2.0]окта-1,3,5-триєн-3ілтрифторметилсульфонат. Стадія 1: 7-Ціанобіцикло[4.2.0]окта-1,3,5-триєн-3-ілтрифторметансульфонат 2,4 мл трифлатного ангідриду (1,2 еквівалента) виливають при 0 °C, протягом 1 години, у розчин 2 г (13,8 ммоль) 3-гідроксибіцикло[4.2.0]окта-1,3,5-триєн-7-карбонітрилу в 40 мл дихлорметану і 3,9 мл (2 еквіваленти) триетиламіну. Перемішування проводять протягом 3 днів при 25 °C. Реакційну суміш виливають у воду, екстрагують дихлорметаном, висушують над MgSO4, фільтрують і випаровують, щоб одержати 3,8 г олії. Цей залишок очищують флешхроматографією над 150 г кремнезему; елюент =100 % толуол. Очікуваний продукт одержують у формі олії. Стадія 2: (7-Амінометил)-біцикло[4.2.0]окта-1,3,5-триєн-3-ілтрифторметилсульфонат 2,7 г (9,74 ммоль) продукту Стадії 1 розчиняють в 40 мл метанолу. Додають 40 мл (7N) розчину МеОН-NН3 і 1 г нікелю Ренея. Гідрогенізацію проводять під тиском 5 бар, при 25 °C, протягом 4 днів. Проводять фільтрування над целітом і випаровуванням фільтрату досуха. Очікуваний продукт одержують у формі олії. 12 UA 100003 C2 5 10 15 20 25 30 35 40 45 50 55 60 Приготування 22: (7-Амінометил)біцикло[4.2.0]окта-1,3,5-триєн-3-ілдиметилсульфамат Стадія 1: 7-Ціанобіцикло[4.2.0]окта-і, 3,5-триєн-3-ілдиметилсульфамат 2 г (13,8 ммоль) 3-гідроксибіцикло[4.2.0]окта-1,3,5-триєн-7-карбонітрилу вмішують в 40 мл дихлорметану, 3,9 г (2 еквіваленти) триетиламіну і 1,63 мл (1,1 еквівалента) диметилсульфамоїлу. Перемішування проводять при 25 °C протягом 4 днів. Реакційну суміш виливають у воду, екстрагують дихлорметаном, висушують над MgSO4, фільтрують і випаровують, щоб одержати олію. Цей залишок очищують флеш-хроматографією над 70 г кремнезему (елюент: дихлорметан/толуол 50/50). Очікуваний продукт одержують у формі твердої речовини білого кольору. Точка плавлення (М.К.): 78-79 °C. Стадія 2: (7-Амінометил)біцикло[4.2.0]окта-1,3,5-триєн-3-ілдиметилсульфамат 1,8 г (7,1 ммоль) продукту Стадії 1 розчиняють в 40 мл метанолу. Додають 40 мл (7N) розчину MeOH-NH3 і додають 1 г нікелю Ренея. Гідрогенізацію проводять під тиском 5 бар, при 25 °C, протягом 4 днів. Проводять фільтрування над целітом і випаровування фільтрату досуха. Одержують олію, яку очищують флеш-хроматографією над 50 г кремнезему (елюент: дихлорметан/етанол 90/10). Очікуваний продукт одержують у формі олії. Приготування 23: (5,6-Дигідроциклобута[4,5]бензо[1,2-b]фуран-6-ілметил)амін 7 г (41,3 ммоль) 5,6-дигідроциклобута[4,5]бензо[1,2-b]фуран-6-карбонітрилу розчиняють в 490 мл етанолу. Додають 70 мл 28 % розчину NH4OH і 1 г нікелю Ренея. Гідрогенізацію проводять під тиском 5 бар, при 25 °C, протягом 3 днів. Проводять фільтрування над целітом і випаровування фільтрату досуха. Очікуваний продукт одержують у формі жовтої олії. Приготування 24: 2-(Бромметил)-5,6-диметоксііндан 1 г (4,8 ммоль) (5,6-диметокси-2,3-дигідро-1Н-інден-2-іл)метанолу розчиняють в 20 мл дихлорметану і 1 мл триетиламіну. Проводять охолодження до 0 °C і вливають 0,41 мл (1,1 еквівалента) мезилхлориду. Перемішування проводять при 25 °C протягом 1 години. Гідроліз проводять, використовуючи 30 г льоду. Проводять відокремлення, і промивання НСl (1N) і потім Н2О. Проводять висушування над MgSO4, фільтрування і випаровування. Одержують 1,2 г твердої речовини бежевого кольору, яку розчиняють в 30 мл ацетону. Додають 0,83 г LіВr (2 еквіваленти) і перемішування проводять при 25 °C протягом 12 годин. Ацетон випаровують, залишок додають у воду і екстрагують діетиловим ефіром. Органічну фазу відокремлюють, висушують над MgSO4, фільтрують і випаровують. Очікуваний продукт одержують у формі олії. Приготування 25: 2-[{[(7S)-3,4-Диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл] метил}(метил)аміно]етанол При температурі навколишнього середовища, 1,04 г (5 ммоль) {[(7S)-3,4диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл]метил}метиламіну, 0,44 мл (6 ммоль/1,2 екв.) 2брометанолу і 2,07 г (15 ммоль/3 екв.) карбонату калію вмішують в 10 мл ацетонітрилу. Нагрівання зі зворотним холодильником проводять протягом ночі, з наступним висушуванням. Залишок додають в дихлорметан, промивають водою і висушують над сульфатом магнію, щоб одержати, після концентрування, бажаний продукт. Приготування 26: 2-[{[(7R)-3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7іл]метил}(метил)аміно]етанол Одержують як у Приготуванні 25, але замінюючи {[(7S)-3,4-диметоксибіцикло[4.2.0]окта1,3,5-триєн-7-іл] метил}метиламін на {[(7R)-3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл] метил}метиламін. Приготування 27: N-{[(7S)-3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл]метил}-Nметилетан-1,2-діамін Стадія 1: [{[(7S)-3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл]метил}(метил)аміно]ацетонітрил При температурі навколишнього середовища, 1,04 г (5 ммоль) {[(7S)-3,4диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл]метил}метиламіну, 0,35 мл (5 ммоль/1 екв.) бромацетонітрилу і 2,16 г (20 ммоль/4 екв.) карбонату натрію вмішують в 16 мл метилізобутилкетону. Нагрівання зі зворотним холодильником проводять протягом ночі, з наступним висушуванням. Залишок додають у воду і водну фазу екстрагують дихлорметан. Об'єднані органічні фази висушують над сульфатом магнію, щоб одержати, після концентрування, очікуваної продукту. Стадія 2: N-{[(7S)-3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл]метил}-N-метил-етан-1,2діамін Розчин 1,1 г (4,5 ммоль) сполуки Стадії 1 в 10 мл THF вливають краплями в 0,21 г (5,4 ммоль) алюмогідриду літію, суспендованого в 5 мл THF, при температурі навколишнього середовища, і потім перемішують при температурі навколишнього середовища протягом 5 13 UA 100003 C2 5 10 15 20 25 30 35 40 45 50 55 годин. Проводять охолодження до близько 0 °C і потім додають, обережно, підряд, 0,14 мл води, 0,11 мл 20 % водного розчину гідроксиду натрію і 0,51 мл води. Перемішування проводять протягом ночі при температурі навколишнього середовища, і потім солі відфільтровують над фритою і промивають THF. Об'єднані фільтрати концентрують для одержання бажаного продукту. Приготування 28: N-{[(7R)-3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл]метил}-Nметилетан-1,2-діамін Одержують як у Приготуванні 27, але замінюючи {[(7S)-3,4-диметоксибіцикло[4.2.0]окта1,3,5-триєн-7-іл]метил}метиламін на {[(7R)-3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7іл]метил}метиламін. Приготування 29: [(4-Метокси-3-метилбіцикло[4.2.0]окта-1,3,5-триєн-7-іл)метил]амін Стадія 1: 3-(3-Бром-4-метокси-5-метилфеніл)пропаннітрил 62,8 г (358,4 ммоль) 3-(4-метокси-5-метилфеніл)пропаннітрилу розчиняють в 390 мл оцтової кислоти. Потім додають, одразу, 58,8 г (716,8 ммоль/2 екв.) ацетату натрію і потім, краплями, 20,2 мл (394,2 ммоль/1,1 екв.) брому, і перемішування проводять при температурі навколишнього середовища протягом ночі. Реакційну суміш потім вливають в 2 літри води, і водну фазу екстрагують 3 рази з 500 мл дихлорметану. Об'єднані органічні фази промивають послідовно 500 мл води, 500 мл насиченого водного розчину карбонату водню натрію і 500 мл води, і висушують над сульфатом магнію. Після концентрування збирають очікуваний продукт. Стадія 2: 4-Метокси-3-метилбіцикло[4.2.0]окта-1,3,5-триєн-7-карбонітрил 94 г (370 ммоль) попередньої сполуки, розчиненої в 230 мл ефіру, вливають в амід натрію (925 ммоль/2,5 екв.) в 1850 мл рідкого аміаку. Після перемішування протягом 3 годин при кип'ятінні аміаку зі зворотним холодильником, реакцію зупиняють додаванням 99 г (5 екв.) твердого хлориду амонію, і аміаку потім дають випаритись. Залишок додають в 500 мл води і 500 мл дихлорметану, проводять перемішування, фази відокремлюють, і водну фазу екстрагують знову двічі з 500 мл дихлорметану. Об'єднані органічні фази висушують над сульфатом магнію і концентрують. Залишок (68 г) хроматографують над 800 г кремнезему (елюент: дихлорметан/циклогексан 50/50) для одержання, після перекристалізації з 150 мл ізопропілового ефіру, бажаного продукту. Стадія 3: [(4-Метокси-3-метилбіцикло[4.2.0]окта-1,3,5-триєн-7-іл)метил]амін До 4,0 г (23,1 ммоль) попередньої сполуки, розчиненої в 75 мл метанолу і 75 мл 7N амонійного метанолу, додають 3,3 мл нікелю Ренея. Гідрогенізацію проводять при температурі навколишнього середовища і звичайному тиску протягом 2 годин. Проводять фільтрування над целітом, промивання метанолом і концентрування, щоб одержати бажаний продукт. Приготування 30: [(3-Метокси-4-метилбіцикло[4.2.0]окта-1,3,5-триєн-7-іл)метил]амін Стадія 1: 5-Метокси-4-метилбензальдегід При температурі навколишнього середовища, 36,35 г (238,8 ммоль) (3-метокси-4метилфеніл)метанолу і 207,6 г (2,4 моль/10 екв.) оксиду марганцю змішують в 730 мл дихлорметану. Перемішування проводять при температурі навколишнього середовища протягом ночі, з наступним фільтруванням над целітом і промиванням дихлорметаном. Після концентрування об'єднаних фільтратів одержують бажаний продукт. Стадія 2: 2-Бром-5-метокси-4-метилбензальдегід При температурі навколишнього середовища, 35,5 г (238,7 ммоль) попередньої сполуки розчиняють в 290 мл дихлорметану, додають одразу 29,4 г (358 ммоль/1,5 екв.) ацетату натрію і потім розчин 15 мл (286,4 ммоль/1,2 екв.) брому в 130 мл дихлорметану вливають краплями. Перемішування проводять при температурі навколишнього середовища протягом 4 годин і нерозчинний матеріал відфільтровують; фільтрат промивають 1N розчином тіосульфату натрію і висушують над сульфатом магнію. Після концентрування залишок перекристалізовують з 130 мл гептану для одержання бажаного продукту. Стадія 3: 3-(2-Бром-5-метокси-4-метилфеніл)акрилонітрил 4,22 г (183,6 ммоль/1 екв.) натрію розчиняють в 180 мл безводного етанолу і розчин доводять до близько 0 °C. Потім додають краплями 29,7 мл (183,6 ммоль/1 екв.) діетоксисофоноацетонітрилу. Перемішування проводять при 0 °C протягом 30 хвилин; 42,05 г (183,6 ммоль) попередньої сполуки додають порціями і потім перемішування проводять знову при 0 °C протягом 30 хвилин і потім при температурі навколишнього середовища протягом 1 години. Реакційну суміш вливають в 1800 мл води і перемішування проводять протягом 30 хвилин; твердий матеріал потім відфільтровують, промивають водою і висушують у вакуумі, щоб одержати бажаний продукт. Стадія 4: 3-(2-Бром-5-метокси-4-метилфеніл)пропаннітрил 14 UA 100003 C2 5 10 15 20 25 30 35 40 45 50 55 60 При температурі навколишнього середовища, 46 г (182,5 ммоль) попередньої сполуки і 27,7 г (730 ммоль/4 екв.) боргідриду натрію змішують в 380 мл ізопропанолу, і потім нагрівання зі зворотним холодильником проводять протягом 2 днів (додають 1 екв. боргідриду натрію через 1 день). Суміші дають охолонути і потім концентрують. Залишок додають в 630 мл суміші води і льоду і потім окислюють до рН 1 шляхом обережного додавання 90 мл концентрованої хлористоводневої кислоти. Цю водну фазу екстрагують двічі етилацетатом. Об'єднані органічні фази промивають насиченим водним розчином хлориду натрію і потім висушують над сульфатом магнію. Після концентрування залишок перекристалізовують з 100 мл гептану для одержання бажаного продукту. Стадія 5: 3-Метокси-4-метилбіцикло[4.2.0]окта-1,3,5-триєн-7-карбонітрил Проводять таку ж Методику, як і на Стадії 2 Приготування 29, для одержання очікуваного продукту. Стадія 6: [(3-Метокси-4-метилбіцикло[4.2.0]окта-1,3,5-триєн-7-іл)метил]амін Проводять таку ж Методику, як і на Стадії 3 Приготування 29, для одержання очікуваного продукту. Приклад 1: N-[(3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл)метил]-3-(7,8-диметокси1,2,4,5-тетрагідро-3Н-3-бензазепін-3-іл)-N-метил-3-оксопропан-1-аміну гідрохлорид Стадія 1: 7,8-Диметокси-1,3,4,5-тетрагідро-2Н-3-бензазепін-2-он При температурі навколишнього середовища, 35 г (159,6 ммоль) 7,8-диметокси-1,3-дигідро2Н-3-бензазепін-2-ону розчиняють в суміші 525 мл етанолу і 175 мл етилацетату. Потім додають 7 г (20 % за вагою) паладію-на-вуглеці 10 % і гідрогенізацію проводять при 65 °C і 3,5 бар протягом 22 годин. Каталізатор відфільтровують над целітом; проводять промивання сумішшю етанол/етилацетат і випаровування досуха для одержання бажаного продукту. Стадія 2: 7,8-Диметокси-2,3,4,5-тетрагідро-1Н-3-бензазепіну гідрохлорид 22,13 г (100 ммоль) продукту, одержаного на Стадії 1, суспендованого в 250 мл THF, охолоджують до 0 °C. Потім додають, краплями, протягом 15 хвилин, 250 мл боран/THF (1М в THF) і нагрівання проводять при 80 °C протягом 24 годин. Проводять охолодження і потім додають, краплями, 250 мл етанолу, і потім 2,6N етанольної HCl. Нагрівання зі зворотним холодильником проводять протягом 40 хвилин; деякий світлий нерозчинний матеріал відфільтровують і проводять випаровування досуха. Залишок, який таким чином одержують, перекристалізовують з суміші 150 мл ізопропанолу і 20 мл води, для одержання бажаного продукту. Стадія 3: 3-Акрилоїл-7,8-диметокси-2,3,4,5-тетрагідро-1Н-3-бензазепін При температурі навколишнього середовища, 70 г (287,2 ммоль) продукту, одержаного на Стадії 2, розчиняють в 1200 мл дихлорметану, і потім додають одразу 100 мл (718 ммоль/2,5 екв.) триетиламіну. Суміш доводять до 0 °C і розчин 25,8 мл (315,9 ммоль/1,1 екв.) акрилоїлхлориду в 270 мл дихлорметану вливають краплями, підтримуючи температуру при близько 0 °C. Через 2 години при 0 °C, суміш перемішують при температурі навколишнього середовища протягом ночі. Проводять промивання з 750 мл води, 750 мл 1N хлористоводневої кислоти і 750 мл води і потім висушування над сульфатом магнію. Після фільтрування і випаровування, залишок хроматографують над 3,2 кг кремнезему (елюент: дихлорметан/етанол 95/5), з наступною перекристалізацією з ізопропанолу. Після фільтрування над фритою і висушування у вакуумі при 50 °C одержують бажаний продукт. Стадія 4: N-[(3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл)метил]-3-(7,8-диметокси1,2,4,5-тетрагідро-3Н-3-бензазепін-3-іл)-N-метил-3-оксопропан-1-аміну гідрохлорид 1,05 г (4,0 ммоль) продукту, який одержують на Стадії 3, і 0,82 г (4,0 ммоль) {[(7R, S)-3,4диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл]метил}метиламіну розчиняють в 5 мл THF. Нагрівання зі зворотним холодильником (масляна баня при 90 °C) проводять протягом ночі під потоком азоту так, щоб розчинник поступово випаровувався. Залишок, який одержують, хроматографують негайно над кремнеземом (елюент: дихлорметан/етанол/аміак 95/5/0,5). Після розчинення в ізопропанолі, проводять обробку з 1,1 екв. ефірної HCl і перемішування продовжують доти, доки не випаде осад. Після висушування, одержану тверду речовину роблять більш твердою в суміші етилацетату (10 мл) і ацетонітрилу (20 мл), щоб одержати, після фільтрування і висушування, очікуваний продукт. Точка плавлення (М.К.): 176-179 °C. Приклад 2: N-{[(7R)-3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл]метил}-3-(7,8диметокси-1,2,4,5-тетрагідро-3Н-3-бензазепін-3-іл)-N-метил-3-оксопропан-1-аміну гідрохлорид Одержують таким же чином, як і продукт Прикладу 1, але із заміною рацемічного [(3,4диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл)метил]метиламіну на Стадії4 на {[(7R)-3,4диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл]метил}метиламін. 15 UA 100003 C2 5 10 15 Точка плавлення (М.К.): 155-158 °C. 3 Оптичне обертання: розчинник: DMSO, С=0,01 г/см , Т=20 °C, L=589 нм, D=-1,46. Приклад 3а: N-{[(7S)-3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл]метил}-3-(7,8диметокси-1,2,4,5-тетрагідро-3Н-3-бензазепін-3-іл)-N-метил-3-оксопропан-1-аміну гідрохлорид Одержують таким же чином, як і продукт Прикладу 1, але із заміною рацемічного [(3,4диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл)метил]метиламіну на Стадії 4 на {[(7S)-3,4диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл]метил}метиламін. Точка плавлення (М.К.): 157-160 °C. 3 Оптичне обертання: розчинник: DMSO, 0=0,01 г/см , Т=20 °C, L=589 нм, D=+1,6. -1 + ІЧ (см ): 2438 (NH ), 1625 (С=О), 1234-1203-1179 (С-О-С), 865-846 (СН-Аr). Приклад 3b: N-{[(7S)-3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл]метил}-3-(7,8диметокси-1,2,4,5-тетрагідро-3Н-3-бензазепін-3-іл)-N-метил-3-оксопропан-1-аміну фумарат Очікуваний продукт одержують за допомогою перетворення N-{[(7S)-3,4диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл]метил}-3-(7,8-диметокси-1,2,4,5-тетрагідро-3Н-3бензазепін-3-іл)-N-метил-3-оксопропан-1-аміну, одержаного за допомогою повернення гідрохлориду, який одержують у Прикладі 3а, до основи, до солі, використовуючи фумарову кислоту. Елементний мікроаналіз: Підраховано Знайдено %С 63,68 63,40 %Н 6,90 6,88 %N 4,79 4,90 20 25 Приклад 3с: N-{[(7S)-3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл)метил}-3-(7,8диметокси-1,2,4,5-тетрагідро-3Н-3-бензазепін-3-іл)-N-метил-3-оксопропан-1-аміну геміпамоат Очікуваний продукт одержують за допомогою перетворення N-{[(7S)-3,4диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл]метил}-3-(7,8-диметокси-1,2,4,5-тетрагідро-3Н-3бензазепін-3-іл)-N-метил-3-оксопропан-1-аміну, який одержують за допомогою повернення гідрохлориду, який одержують у Прикладі 3а, до основи, до солі, використовуючи памову кислоту. Елементний мікроаналіз: Підраховано Знайдено %С 69,77 69,38 %Н 6,69 6,56 %N 4,23 3,91 30 35 Приклад 3d: N-{[(7S)-3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл]метил}-3-(7,8диметокси-1,2,4,5-тетрагідро-3Н-3-бензазепін-3-іл)-N-метил-3-оксопропан-1-аміну гемінападизилат Очікуваний продукт одержують за допомогою перетворення N-{[(7S)-3,4диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл]метил}-3-(7,8-диметокси-1,2,4,5-тетрагідро-3Н-3бензазепін-3-іл)-N-метил-3-оксопропан-1-аміну, який одержують за допомогою повернення гідрохлориду, який одержують у Прикладі 3а, до основи, до солі, використовуючи 1,5нафталендисульфонову кислоту. 1 ЯМР Н: 40 (аа) δ=10,77 ррm (1Н; шир) (а) δ=6,74 ppm (1Н; с) (b) δ=6,70 ppm (1Н; с) (с) δ=6,68 ppm (1Н; с) (d) δ=6,65 ppm (1Н; с) (е) δ=3,874 ppm (3Н; с) (f) δ=3,871 ppm (3H; c) (g) δ=3,858 ppm (3H; c) (h) δ=3,851 ppm (3H; c) (i) δ=3,73 ppm (2H; м) (j) δ=3,60 ppm (2H; м) (k) δ=3,59 ppm (1H; м) (1,1') δ=3,29 і 2,77 ppm (2Н; дд) J1,1'=13,4 Hz; J1k=4,7 Hz; J1'k=1,9 Hz (m) δ=2,87 ppm (2H; м) (n) δ=2,86 ppm (2H; м) (о) δ=2,85 ppm (2H; м) (р) δ=2,81 ppm (1Н; дд) Jрp'=12,5 Гц; Jрk=5,9 Гц (р') δ=2,63 ppm (1Н; м) (q) δ=2,65 ppm (2H; м) (r) δ=2,40 ppm (3Н; с) (х) δ=2,40 ppm (1Н; д) Jxz=8,7 Hz (у) δ=2,40 ppm (1Н; д) Jyz=7,2 Hz (z) δ=2,40 ppm (1H; дд) 16 UA 100003 C2 5 10 15 20 25 30 35 40 45 50 55 60 Приклад 4: N-{[(7S)-3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл]метил}-3-(7,8диметокси-1,2,4,5-тетрагідро-3Н-3-бензазепін-3-іл)-3-оксопропан-1-аміну гідрохлорид Одержують таким же чином, як і продукт Прикладу 1, але із заміною рацемічного [(3,4диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл)метил]метиламіну на Стадії 4 на {[(7S)-3,4диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл]метил}амін і THF на діоксан. Точка плавлення (М.К.): 177-180 °C. 3 Оптичне обертання: розчинник: МеОН, С=0,011 г/см , Т=20 °C, L=589 нм, D=-4,15. -1 + ІЧ (см ): 2723 (NH ), 1645 (С=О). Приклад 5: N-[(4,5-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл)метил]-3-(7,8-диметокси1,2,4,5-тетрагідро-3Н-3-бензазепін-3-іл)-3-оксопропан-1-аміну гідрохлорид Одержують таким же чином, як і продукт Прикладу 1, але із заміною [(3,4диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл)метил]метиламіну на Стадії 4 на продукт Приготування 1 і THF на діоксан. Точка плавлення (М.К.): 199-201 °C. -1 + ІЧ (см ): 1645 (CO), від 3000 до 2400 (NH2 ). Приклад 6: N-[2-(5,6-диметокси-2,3-дигідро-1Н-інден-2-іл)етил]-3-(7,8-диметокси-1,2,4,5reтpагiдpo-3Н-3-бeнзазeпiн-3-iл)-N-мeтил-S-oкcoпpoпан-1-аміну гідрохлорид Одержують таким же чином, як і продукт Прикладу 1, але із заміною [(3,4диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл)метил]метиламіну на Стадії 4 на [2-(5,6-диметокси2,3-дигідро-1Н-інден-2-іл)етил]метиламін. Точка плавлення (М.К.): 193-199 °C. Приклад 7: Метил-N-[(5,6-диметокси-23-дигідро-1Н-інден-2-іл)]-3-(7,8-диметокси-1,2,4,5тетрагідро-3Н-3-бензазепін-3-іл)-N-метил-3-оксопропан-1-аміну гідрохлорид Одержують таким же чином, як і продукт Прикладу 1, але із заміною [(3,4диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл)метил]метиламіну на Стадії 4 на (5,6-диметокси2,3-дигідро-1Н-інден-2-іл)[метил]метиламін. Точка плавлення (М.К.): 194-197 °C. Приклад 8: N-[(2,3-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл)метил]-3-(7,8-диметокси1,2,4,5-тетрагідро-3Н-3-бензазепін-3-іл)-3-оксопропан-1-аміну гідрохлорид Одержують таким же чином, як і продукт Прикладу 1, але із заміною [(3,4диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл)метил]метиламіну на Стадії 4 на продукт Приготування 10. Точка плавлення (М.К.): 220-222 °C. Приклад 9: N-[(23,4-триметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл)метил]-3-(7,8-диметокси1,2,4,5-тетрагідро-3Н-3-бензазепін-3-іл)-3-оксопропан-1-аміну геміфумарат Одержують таким же чином, як і продукт Прикладу 1, але із заміною [(3,4диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл)метил]метиламіну на Стадії 4 на продукт Приготування 11. Перетворення на сіль проводять у присутності фумарової кислоти. Точка плавлення (М.К.): 155-157 °C. Приклад 10: 3-(7,8-Димeтoкcи-1,2,4,5)-тeтpaгiдpo-3Н-3-бeнзaзeпiн-3-iл)-N-[(5метоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл)метил]-3-оксопропан-1-аміну гідрохлорид Одержують таким же чином, як і продукт Прикладу 1, але із заміною [(3,4диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл)метил]метиламіну на Стадії 4 на продукт Приготування 9 і THF на діоксан. Точка плавлення (М.К.): 185-187 °C. Приклад 11: N-{[(7S)-3,4-диметоксибіцикло[4.2.0]oкта-1,3,5-триєн-7-іл]метил}-3-(7-метокси1,2,4,5-тетрагідро-3Н-3-бензазепін-3-іл)-3-оксопропан-1-аміну гідрохлорид Одержують таким же чином, як і продукт Прикладу 1, але із заміною, на Стадії 1, 7,8диметокси-1,3-дигідро-2Н-3-бензазепін-2-ону на 8-метокси-1,3-дигідро-2Н-3-бензазепін-2-он і, на Стадії 4, рацемічного (3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл)метил]метиламіну на {[(7S)-3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл]метил}амін і THF на діоксан. Точка плавлення (М.К.): 171-173 °C. -1 + ІЧ (см ): 1636 (С=О), від 3000 до 2400 (NH2 ). Приклад 12: N-[2-(5,6-диметокси-2,3-дигідро-1Н-інден-2-іл)метил]-3-(7,8-диметокси-1,2,4,5тетрагідро-3Н-3-бензазепін-3-іл)-3-оксопропан-1-аміну гідрохлорид Стадія 1: N-бензил-3-(7,8-диметокси-1,2,4,5-тетрагідро-3Н-3-бензазепін-3-іл)-3-оксопропан1-амін Методика є такою ж, як і на Стадії 4 Прикладу 1, але із заміною [(3,4диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл)метил]метиламіну бензиламіном. 17 UA 100003 C2 5 10 15 20 25 30 35 40 45 50 55 60 Точка плавлення (М.К.): 100-102 °C. Стадія 2: Метил-N-бензил-N-[(5,6-диметокси-2,3-дигідро-1Н-інден-2-іл)]-3-(7,8-диметокси1,2,4,5-тетрагідро-3Н-3-бензазепін-3-іл)-3-оксопропан-1-амін 1,7 г (4,6 ммоль) продукту Стадії 1 і 1,25 г (1 еквівалент) продукту Приготування 24 розчиняють в 20 мл ацетонітрилу. Додають 5,1 г (8 еквівалентів) K2СО3 і нагрівання зі зворотним холодильником проводять протягом 24 годин. Суміш охолоджують і фільтрують і фільтрат випаровують. Одержують залишок, який очищують хроматографією над кремнеземом (елюент: СН2Сl2/етанол 95/5) для одержання очікуваного продукту у формі олії. Стадія 3: N-[2-(5,6-диметокси-2,3-дигідро-1Н-інден-2-іл)метил]-3-(7,8-диметокси-1,2,4,5тетрагідро-3Н-3-бензазепін-3-іл)-3-оксопропан-1-аміну гідрохлорид 2,3 г (4,1 ммоль) продукту, одержаного на Стадії 2, розчиняють в 46 мл етанолу. Додають 230 мг Pd/C 5 %, і гідрогенізацію проводять під тиском 1 бар і при температурі навколишнього середовища протягом 24 годин. Суміш фільтрують над целітом, промивають етанолом, і фільтрат випаровують досуха. Одержують 1,95 г залишку, який розчиняють в 15 мл етанолу. Додають 2,5 мл (2М) розчину Et2O-HCl. Продукт викристалізовується, його відфільтровують і висушують. Очікуваний продукт одержують у формі твердої речовини білого кольору. Точка плавлення (М.К.): 198-204 °C. Приклад 13: 3-(7,8-Диметокси-1,2,4,5-тетрагідро-3Н-3-бензазепін-3-іл)-N-[(2метоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл)метил]-3-оксопропан-1-аміну гідрохлорид При температурі навколишнього середовища, 0,93 г (3,6 ммоль/1 екв.) продукту Стадії 3 Прикладу 1, 0,58 г (3,6 ммоль) продукту Приготування 2 і 0,11 г (0,18 ммоль/0,05 екв.) трифлату ітербію вмішують в 10 мл толуолу. Нагрівання проводять при 100 °C доти, доки реакція не закінчиться (оцінюють за допомогою ТШХ), і потім проводять випаровування досуха. Залишок, який одержують, хроматографують негайно над кремнеземом (елюент: дихлорметан/етанол/аміак 95/5/0,5) для одержання очікуваного продукту у формі основи. Після розчинення в 10 мл ацетонітрилу, проводять обробку 0,56 мл (1,1 екв.) 3,5N етанольною HCl, щоб одержати, після фільтрування і висушування, очікуваний продукт. Точка плавлення (М.К.): 202-204 °C. -1 + ІЧ (см ): 1641 (С=О), від 3000 до 2500 (NH2 ). Приклад 14: 3-(7,8-Диметокси-1,2,4,5-тетрагідро-3Н-3-бензазепін-3-іл)-N-[(3етоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл)метил]-3-оксопропан-1-аміну гідрохлорид Одержують таким же чином, як і продукт Прикладу 13, але із заміною продукту Приготування 2 на продукт Приготування 5. Точка плавлення (М.К.): 221-225 °C. Приклад 15: N-[(3-трет-бутоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл)метил]-3-(7,8-диметокси1,2,4,5-тетрагідро-3Н-3-бензазепін-3-іл)-3-оксопропан-1-аміну геміфумарат Одержують таким же чином, як і продукт Прикладу 13, але із заміною продукту Приготування 2 на продукт Приготування 6 і використовуючи фумарову кислоту замість хлористоводневої кислоти як солеутворювальний агент. Точка плавлення (М.К.): 189-191 °C. Приклад 16: N-(5,6-дигідроциклобута[f][1,3]бензодіоксол-5-ілметил)-3-(7,8-диметокси-1,2,4,5тетрагідро-3Н-3-бензазепін-3-іл)-N-метил-3-оксопропан-і-аміну гідрохлорид Одержують таким же чином, як і продукт Прикладу 13, але із заміною продукту Приготування 2 на продукт Приготування 7. Точка плавлення (М.К.): 180-184 °C. Приклад 17: N-(5,6-дигідроциклобута[f][1,3]бензодіоксол-5-ілметил)-3-(7,8-диметокси-1,2,4,5тетрагідро-3Н-3-бензазепін-3-іл)-3-оксопропан-1-аміну гідрохлорид Одержують таким же чином, як і продукт Прикладу 13, але із заміною продукту Приготування 2 на (5,6-дигідроциклобута[4,5]бензо[1,2-d][1,3]діоксол-5-ілметил)амін. Точка плавлення (М.К.): 201-207 °C. Приклад 18: N-[2-(5,6-диметокси-2,3-дигідро-1Н-інден-2-іл)етил]-3-(7,8-диметокси-1,2,4,5тетрагідро-3Н-3-бензазепін-3-іл)-3-оксопропан-1-аміну гідрохлорид Одержують таким же чином, як і продукт Прикладу 13, але із заміною продукту Приготування 2 на продукт Приготування 8. Точка плавлення (М.К.): 186-189 °C. Приклад 19: 7-({[3-(7,8-Диметокси-1,2,4,5-тетрагідро-3Н-3-бензазепін-3-іл)-3оксопропіл]аміно}метил)біцикло[4.2.0]окта-1,3,5-триєн-3-ілу трифторметансульфонат гідрохлорид Одержують таким же чином, як і продукт Прикладу 13, але із заміною продукту Приготування 2 на продукт Приготування 21. 18 UA 100003 C2 5 10 15 20 25 30 35 40 45 50 55 Точка плавлення (М.К.): 162-168 °C. Приклад 20: 7-({[3-(7,8-Диметокси-1,2,4,5-тетрагідро-3Н-3-бензазепін-3-іл)-3оксопропіл]аміно}метил)біцикло[4.2.0]окта-1,3,5-триєн-3-ілу диметилсульфамат гідрохлорид Одержують таким же чином, як і продукт Прикладу 13, але із заміною продукту Приготування 2 на продукт Приготування 22. Точка плавлення (М.К.): 228-235 °C. Приклад 21: N-(5,6-дигідроциклобута[f][1]бензофуран-6-ілметил)-3-(7,8-диметокси-1,2,4,5тетрагідро-3Н-3-бензазепін-3-іл)-3-оксопропан-1-аміну гідрохлорид Одержують таким же чином, як і продукт Прикладу 13, але із заміною продукту Приготування 2 на продукт Приготування 23. Точка плавлення (М.К.): 245-255 °C. Приклад 22: N-(циклопропілметил)-N-{[(7S)-3,4-диметоксибіцикло-[4.2.0]окта-1,3,5-триєн-7іл]метил}-347,8-диметокси-1,2,4,5-тетрагідро-3Н-3-бензазепін-3-іл)-3-оксопропан-1-аміну гідрохлорид Одержують таким же чином, як і продукт Прикладу 13, але із заміною продукту Приготування 2 на продукт Приготування 12 і толуолу на діоксан. Точка плавлення (М.К.): 88-92 °C. 3 Оптичне обертання: розчинник: МеОН, С=0,01 г/см , Т=20 °C, L=589 нм, D=-13,25. -1 + ІЧ (см ): 1632 (CO), 3420 (Н2О), від 3000 до 2200 (NH ). Приклад 23: N-аліл-N-([(7S)-3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл]метил)-3-(7,8диметокси-1,2,4,5-тетрагідро-3Н-3-бензазепін-3-іл)-3-оксопропан-1-аміну гідрохлорид Одержують таким же чином, як і продукт Прикладу 13, але із заміною продукту Приготування 2 на продукт Приготування 18 і толуолу на діоксан. Точка плавлення (М.К.): 74-80 °C. 3 Оптичне обертання: розчинник: МеОН, С=0,01 г/см , T=20 °C, L=589 нм, D=-4,6. -1 + ІЧ(см ): 1631 (С=0), 3400 (Н2О), від 3000 до 2000 (NH ). Приклад 24: N-{[(7S)-3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл]метил}-3-(7,8диметокси-1,2,4,5-тетрагідро-3Н-3-бензазепін-3-іл)-N-етил-3-оксопропан-1-аміну геміфумарат Одержують таким же чином, як і продукт Прикладу 13, але із заміною продукту Приготування 2 на продукт Приготування 13 і толуолу на діоксан. Утворюють сіль, використовуючи фумарову кислоту. Точка плавлення (М.К.): 71-73 °C. 3 Оптичне обертання: розчинник: МеОН, С=0,01 г/см , Т=20 °C, L-589 нм, D=-6,67. -1 + ІЧ (см ): від 2200 до 2700 (NH /OH), 1701-1631 (CO), 1276-1203 (С-О-С). Приклад 25: N-{[(7S)-3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл]метил}-3-(7,8диметокси-1,2,4,5-тетрагідро-3Н-3-бензазепін-3-іл)-N-(2,2,2-трифторетил)-3-оксопропан-1-аміну гідрохлорид Одержують таким же чином, як і продукт Прикладу 13, але із заміною продукту Приготування 2 на продукт Приготування 17 і толуолу на діоксан. Точка плавлення (М.К.): 68-70 °C. 3 Оптичне обертання: розчинник: МеОН, С=0,01 г/см , T=20 °C, L=589 нм, D=-8,04. 1 + ІЧ (см ): 1633 (С-О), від 2800 до 1900 (-NH ), від 1107 до 1206 (-CF3). Приклад 26: N-бензил-N-{[(7S)-3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл]метил}-3(7,8-диметокси-1,2,4,5-тетрагідро-3Н-3-бензазепін-3-іл)-3-оксопропан-1-аміну фумарат Одержують таким же чином, як і продукт Прикладу 13, але із заміною продукту Приготування 2 на продукт Приготування 14 і толуолу на діоксан. Утворюють сіль, використовуючи фумарову кислоту. Точка плавлення (М.К.): 146-148 °C. 3 Оптичне обертання: розчинник: МеОН, С=0,011 г/см , Т=20 °C, L=589 нм. D=+2,07. -1 ІЧ(см ): 1708 і 1646 (CO), від 3000 до 2500 (-ОН). Приклад 27: N-циклопентил-N-{[(7S)-3,4-диметоксибіцикло[4.2.0]-окта-1,3,5-триєн-7іл]метил}-3-(7,8-диметокси-1,2,4,5-тетрагідро-3Н-3-бензазепін-3-іл)-3-оксопропан-1-аміну фумарат. Одержують таким же чином, як і продукт Прикладу 13, але із заміною продукту Приготування 2 на продукт Приготування 19 і толуолу на діоксан. Точка плавлення (М.К.): 79-82 °C. 3 Оптичне обертання: розчинник: МеОН, С=0,01 г/см , Т=20 °C, L=589 нм, D=-10,54. -1 ІЧ(см ): 1701 і 1635 (CO), від 3000 до 2500 (-ОН). 19 UA 100003 C2 5 10 15 20 25 30 35 40 45 50 55 60 Приклад 28: N-(циклопентилметил)-N-{[(7S)-3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7іл]метил}-3-(7,8-диметокси-1,2,4,5-тетрагідро-3Н-3-бензазепін-3-іл)-3-оксопропан-1-аміну гідрохлорид Одержують таким же чином, як і продукт Прикладу 13, але із заміною продукту Приготування 2 на продукт Приготування 15 і толуолу на діоксан. Точка плавлення (М.К.): 87-90 °C. 3 Оптичне обертання: розчинник: МеОН, С=0,008 г/см , Т=20 °C, L=589 нм, D=-19,07. -1 + ІЧ (см ): 2454 (-NH ), 1633 (CO), 1279-1205 (С-О-С). Приклад 29: N-(циклобутилметил)-N-{[(7S)-3,4-диметоксибіцикло-[4.2.0]окта-1,3,5-триєн-7іл]метил}-3-(7,8-диметокси-1,2,4,5-тетрагідро-3Н-3-бензазепін-3-іл)-3-оксопропан-1-аміну фумарат Одержують таким же чином, як і продукт Прикладу 13, але із заміною продукту Приготування 2 на продукт Приготування 16 і толуолу на діоксан. Утворення солі проводять у присутності фумарової кислоти. Точка плавлення (М.К.): 68-71 °C. 3 Оптичне обертання: розчинник: МеОН, С=0,01 г/см , T=20 °C, L=589 нм, D=-12,04. -1 ІЧ (см ): 1703 і 1634 (CO), 1279-1072 (С-О-С). Приклад 30: N-(циклобутил)-N-{[(7S)-3,4-диметоксибіцикло-[4.2.0]окта-1,3,5-триєн-7іл]метил}-3-(7,8-диметокси-1,2,4,5-тетрагідро-3Н-3-бензазепін-3-іл)-3-оксопропан-1-аміну гідрохлорид При температурі навколишнього середовища, 1 г (2,2 ммоль) N-{[(7S)-3,4диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл]метил}-3-(7,8-диметокси-1,2,4,5-тетрагідро-3Н-3бензазепін-3-іл)-3-оксопропан-1-аміну (одержаного за допомогою повернення сполуки Прикладу 4 до вільної основи) і 0,17 мл (2,2 ммоль/1 екв.) циклобутанону змішують в 7 мл дихлорметану. Потім додають 0,7 г (3,3 ммоль/1,5 екв.) триацетоксиборгідриду натрію і потім 0,13 мл (2,2 ммоль/1 екв.) оцтової кислоти, і перемішування проводять при температурі навколишнього середовища протягом 5 годин. Якщо реакція не завершена, надалі додають 0,08 мл (0,5 екв.) циклобутанону і 350 мг (0,75 екв.) триацетоксиборгідриду натрію і перемішування проводять при температурі навколишнього середовища протягом ще 1 години 45 хвилин. Потім додають 1N водний розчин гідроксиду натрію і потім проводять двічі екстрагування з 15 мл ефіру. Об'єднані органічні фази промивають 10 мл води і потім 10 мл насиченого водного розчину хлориду натрію і потім висушують над сульфатом магнію. Після фільтрування і концентрування залишок (1 г) хроматографують над колонкою 50 г кремнезему (елюент: дихлорметан/етанол/аміак 98/2/0,2) для одержання бажаного продукту у формі основи. Останнє розчиняють в 9 мл етилацетату і 12 мл ефіру і перетворюють на сіль, використовуючи 0,63 мл 2N ефірної HCl, для одержання очікуваного продукту. Точка плавлення (М.К.): 93-95 °C. 3 Оптичне обертання: розчинник: МеОН, С=0,01 г/см , Т=20 °C, L=589 нм, D=-5,63. -1 + ІЧ (см ): 2424 (-NH ), 1633 (CO), 1205-1107 (C-O-C). Приклад 31: N-{[(7R)-3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл]метил}-N-метил-3(6,7,8-триметокси-1,2,4,5-тетрагідро-3Н-3-бензазепін-3-іл)-3-оксопропан-1-аміну гідрохлорид Одержують таким же чином, як і продукт Прикладу 13, але із заміною продукту Стадії 3 Прикладу 1 на 3-акрилоїл-6,7,8-триметокси-2,3,4,5-тетрагідро-1Н-3-бензазепін, і продукту Приготування 2 на {[(7R)-3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл]метил}метиламін, і толуолу на THF. Точка плавлення (М.К.): 83-86 °C. Приклад 32: N-{[(7S)-3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл]метил}-N-метил-3(6,7,8-триметокси-1,2,4,5-тетрагідро-3Н-3-бензазепін-3-іл)-3-оксопропан-1-аміну гідрохлорид Одержують таким же чином, як і продукт Прикладу 13, але із заміною продукту Стадії 3 Прикладу 1 на 3-акрилоїл-6,7,8-триметокси-2,3,4,5-тетрагідро-1Н-3-бензазепін, і продукту Приготування 2 на {[(7S)-3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл]метил}метиламін, і толуолу на THF. Точка плавлення (М.К.): 83-87 °C. 3 Оптичне обертання: розчинник: МеОН, С=0,01 г/cм , T=20 °C, L=589 нм, αD=-3,00. -1 + ІЧ (см ): 1633 (CO), від 3100 до 2000 (-NH ), від 3600 до 3100 (-ОН). Приклад 33: N-{[(7R)-3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл]метил}-3-(7-метокси1,2,4,5-тетрагідро-3Н-3-бензазепін-3-іл)-N-метил-3-оксопропан-1-аміну гідрохлорид Одержують таким же чином, як і продукт Прикладу 13, але із заміною продукту Стадії 3 Прикладу 1 на 3-акрилоїл-7-метокси-2,3,4,5-тетрагідро-1Н-3-бензазепін, продукту Приготування 2 на {[(7R)-3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл]метил}метиламін, і толуолу на THF. 20 UA 100003 C2 5 10 15 20 25 30 35 40 45 50 55 Точка плавлення (М.К.): 126-129 °C. 3 Оптичне обертання: розчинник: МеОН, С=0,0126 г/см , Т=20 °C, L=589 нм, D=+2,67. Приклад 34: N-{[(7S)-3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл]метил}-3-(7-метокси1,2,4,5-тетрагідро-3Н-3-бензазепін-3-іл)-N-метил-3-оксопропан-1-аміну гідрохлорид Одержують таким же чином, як і продукт Прикладу 13, але із заміною продукту Стадії 3 Прикладу 1 на 3-акрилоїл-7-метокси-2,3,4,5-тетрагідро-1Н-3-бензазепін, продукту Приготування 2 на {[(7S)-3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл]метил}метиламін, і толуолу на THF. Точка плавлення (М.К.): 127-129 °C. 3 Оптичне обертання: розчинник: МеОН, С=0,01 г/см , Т=20 °C, L=589 нм, D=-2,7. -1 + ІЧ (см ): 1629 (C=О), від 3000 до 1800 (-NH ), 3500 (-ОН) (слабкий). Приклад 35: 7-({[3-(7,8-Диметокси-1,2,4,5-тетрагідро-3Н-3-бензазепін-3-іл)-3оксопропіл)аміно}метил)біцикло[4.2.0]окта-1,3,5-триєн-3-олу гідрохлорид 10 г (38,3 ммоль/0,95 екв.) продукту Стадії 3 Прикладу 1,6 г (40,2 ммоль) продукту Приготування 3 і 42 мг (0,2 ммоль/0.05 екв.) трихлориду рутенію розчиняють в 19 г PEG 300. Розчин нагрівають при 40 °C протягом 4 годин. Реакційну суміш додають в 600 мл дихлорметану і промивають двічі 500 мл і потім двічі 800 мл води. Органічну фазу висушують над сульфатом магнію. Після концентрування, залишок хроматографують над 500 г кремнезему (елюент: дихлорметан/етанол/аміак 95/5/0,5) для одержання очікуваного продукту у формі основи. 1 г чистої основи роблять більш твердим в 9 мл етанолу і потім перетворюють у сіль, використовуючи 1,1 екв. 2N ефірної HCl в 9 мл ацетонітрилу і потім остаточно перекристалізовують з суміші етанолу (27 мл) і води (4 мл). для одержання, після фільтрування і висушування, очікуваного продукту у формі гідрохлориду. Точка плавлення (М.К.): 212-215 °C. -1 + ІЧ (см ): 1633 (С=О), від 3400 до 2400 (-NH2 /OH). Приклад 36: 8-({[3-(7,8-Диметокси-1,2,4,5-тетрагідро-3Н-3-бензазепін-3-іл)-3оксопропіл]аміно}іметил)біцикло[4.2.0]окта-1,3,5-триєн-3-ол Одержують таким же чином, як і продукт Прикладу 35, але із заміною продукту Приготування 3 на продукт Приготування 4. Точка плавлення (М.К.): 193-195 °C. -1 + ІЧ (см ): 1627 (С=О), від 3700 до 2200 (-NH2 /OH). Приклад 37: N-[(біцикло[4.2.0]окта-1,3,5-триєн-7-іл)метил]3-(7,8-диметокси-1,2,4,5тетрагідро-3Н-3-бензазепін-3-іл)-3-оксопропан-1-аміну гідрохлорид Одержують таким же чином, як і продукт Прикладу 35, але із заміною продукту Приготування 3 на (біцикло[4.2.0]окта-1,3,5-триєн-7-іл-метил)амін. Точка плавлення (М.К.): 189-193 °C. Приклад 38: 3-(7,8-Диметокси-1,2,4,5-тетрагідро-3Н-3-бензазепін-3-іл)-N-{(4-метокси-3метилбіцикло[4.2.0]окта-1,3,5-триєн-7-іл)метил}-3-оксопропан-1-аміну гідрохлорид Одержують таким же чином, як і продукт Прикладу 35, але із заміною продукту Приготування 3 на продукт Приготування 29. Точка плавлення (М.К.): 166-168 °C. Приклад 39: 3-(7,8-Диметокси-1,2,4,5-тетрагідро-3Н-3-бензазепін-3-іл)-N-{[3-метокси-4метилбіцикло[4.2.0]окта-1,3,5-триєн-7-іл]іметил}-3-оксопропан-1-аміну гідрохлорид Одержують таким же чином, як і продукт Прикладу 35, але із заміною продукту Приготування 3 на продукт Приготування 30. Точка плавлення (М.К.): 211-214 °C. Приклад 40: N-{[(7S)-3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл]метил}-3-(7,8димeтoкcи-1,2,4,5-тeтpaгiдpo-3Н-3-бeнзaзeпiн-3-iл)-N-мeтил-4-оксобутан-1-аміну гідрохлорид Стадія 1: 4-(7,8-Диметокси-1,2,4,5-теіпрагідро-3Н-3-бензазепін-3-іл)-4-оксобутан-1-ол До 6,0 г (29 ммоль) 7,8-диметокси-2,3,4,5-тетрагідро-1Н-3-бензазепіну в 30 мл THF, при 0 °C, додають, краплями, протягом 15 хвилин, 11,6 мл (29 ммоль/1 екв.) 2,6 М розчину n-бутиллітію в гексані. Суміш потім охолоджують до близько -78 °C і вливають краплями, протягом 10 хвилин, у розчин 2,7 мл (34,8 ммоль/1,2 екв.) гамма-бутиролактону в 15 мл THF. Перемішування проводять при -78 °C протягом 30 хвилин і температуру потім доводять до -30 °C і підгримують протягом 1 години; температурі потім дають повернутись до температури навколишнього середовища, де перемішування проводять протягом 48 годин. Суміш вливають в 75 мл насиченого водного розчину хлориду амонію і потім екстрагують двічі з 120 мл етилацетату. Об'єднані органічні фази промивають 150 мл насиченого водного розчину хлориду натрію, висушують над сульфатом магнію і концентрують. Залишок додають в 300 мл етилацетату і промивають двічі 75 мл 1М водного розчину хлористоводневої кислоти. Об'єднані водні кислотні 21 UA 100003 C2 5 10 15 20 25 30 35 40 45 50 55 фази повторно екстрагують двічі з 100 мл дихлорметану. Органічні фази об'єднують, висушують над сульфатом магнію і концентрують, для одержання бажаного продукту. Стадія 2: 4-(7,8-Диметокси-1,2,4,5-тетрагідро-3Н-3-бензазепініл)-4-оксобутаналь 3,3 мл (46 ммоль/6 екв.) DMSO додають краплями до 2,0 мл (23 ммоль/3 екв.) оксалілхлориду в 45 мл дихлорметану, при -60 °C. Суміш доводять до близько -25 °C і додають краплями розчин 2,25 г (7,7 ммоль) сполуки Стадії 1 в 22 мл дихлорметану. Перемішування проводять при -25 °C протягом 15 хвилин; потім додають краплями 6,5 мл (46 ммоль/6 екв.) триетиламіну і суміші обережно дають повернутись до температури навколишнього середовища. Потім додають 75 мл дихлорметану і 75 мл води; проводять перемішування, відокремлення фаз і промивання органічної фази послідовно 75 мл 1N водного розчину хлористоводневої кислоти, 75 мл води, 75 мл 1 водного розчину гідроксиду натрію і 75 мл води. Після висушування над сульфатом магнію і концентрування збирають бажаний продукт. Стадія 3: N-{[(7S)-3,4-дметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл]метил}-3-(7,8-диметокси1,2,4,5-тетрагідро-3Н-3-бензазепін-3-іл)-N-метил-4-оксобутан-1-аміну гідрохлорид При температурі навколишнього середовища, 2,53 г (12,2 ммоль) {[(7S)-3,4диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл]метил}метиламіну і 3,95 г (12,2 ммоль/1 екв.) сполуки Стадії 2 змішують в 90 мл дихлорметану. Потім додають 3,88 г (18,3 ммоль/1,5 екв.) триацетоксиборгідриду натрію і перемішування проводять при температурі навколишнього середовища протягом 4 годин. Потім додають 60 мл 1N водного розчину гідроксиду натрію, з наступним екстрагуванням двічі з 150 мл етилацетату. Об'єднані органічні фази промивають 100 мл води і потім 100 мл насиченого водного розчину хлориду натрію і потім висушують над сульфатом магнію. Після фільтрування і концентрування, залишок хроматографують над 300 г кремнезему (елюент: дихлорметан/етанол/аміак 97/3/0,3) для одержання бажаного продукту у формі основи. Останнє розчиняють в 13 мл ізопропанолу, перетворюють в сіль, використовуючи 0,67 мл 4,8N етанольної HCl, і потім перекристалізовують з 25 мл етилацетату, для одержання очікуваного продукту. Точка плавлення (М.К.): 132-136 °C. 3 Оптичне обертання: розчинник: МеОН, С=0,012 г/см , Т=20 °C, L=578 нм, D=+4,28. -1 + ІЧ (см ): 3500 (ОН), 2441 (NH ), 1610 (С=О), 1278-1234-1204 (С-О-С), 865-845 (СН-Аr). Приклад 41: N-{[(7R)-3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-iл]метил}-3-(7,8димeтoкcи-1,2,4,5-тeтpагiдpo-3Н-3-бeнзазeпiн-3-iл)-N-мeтил-4-оксобутан-1-аміну гідрохлорид Одержують таким же чином, як і продукт Прикладу 40, але із заміною, на Стадії 3, {[(7S)-3,4диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл]метил}метиламіну на {[(7R)-3,4диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл]метил}метиламін (2 еквіваленти). Точка плавлення (М.К.): 106-137 °C. Приклад 42: N-{[(7S)-3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл]метил}-3-(7,8диметокси-1,2,4,5-тетрагідро-3Н-3-бензазепін-3-іл)-4-оксобутан-1-аміну гідрохлорид Одержують таким же чином, як і продукт Прикладу 40, але із заміною, на Стадії 3, {[(7S)-3,4диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл]метил}метиламіну на {[(7S)-3,4диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл]метил}амін. Точка плавлення (М.К.): 169-171 °C. 3 Оптичне обертання: розчинник: МеОН, С=0,009 г/см , Т=20 °C, L=589 нм, D=-0,9. -1 + ІЧ (см ): 2719 (NH2 ), 1630 (С=О), 1276-1202-1177 (С-О-С), 862-832-781 (СН-Аr). Приклад 43: 7-({[3-(7,8-Диметокси-1,2,4,5-тетрагідро-3Н-3-бензазепін-3-іл)-3оксопропіл](метил)аміно}метил)біцикло[4.2.0]окта-1,3,5-триєн-3-ол При температурі навколишнього середовища, 3,2 г (7,8 ммоль) продукту Прикладу 35, 6,4 мл (78 ммоль/10 екв.) 37 % водного розчину формальдегіду і 0,98 г (15,6 ммоль) ціаноборгідриду натрію вмішують в 145 мл ацетонітрилу. Перемішування проводять протягом 1 години 40 хвилин при температурі навколишнього середовища, з наступним випаровуванням досуха. Залишок додають в 250 мл води і водну фазу екстрагують двічі з 150 мл дихлорметану. Об'єднані органічні фази промивають водою і висушують над сульфатом магнію. Після фільтрування, концентрування і хроматографування над 200 г кремнезему (елюент: етанол/аміак/дихлорметан 95/5/0,5), очікуваний продукт одержують у формі основи. В результаті перетворення основи, розчиненої в ацетонітрилі, в сіль, використовуючи ефірну HCl, одержують гідрохлорид очікуваного продукту. Точка плавлення (М.К.): =167-170 °C. -1 + ІЧ (см ): від 3600 до 2000 (OH/NH ), 1616 (С=О). Приклад 44: 7-{[[3-(7,8-Диметокси-1,2,4,5-тетрагідро-3Н-3-бензазепін-3-іл)-3оксопропіл](метил)аміно]метил}біцикло[4.2.0]окта-1,3,5-триєн-3-іл метилкарбамату гідрохлорид 22 UA 100003 C2 5 10 15 20 25 30 35 40 45 50 55 До 0,7 г (1,65 ммоль) сполуки Прикладу 43 в 30 мл толуолу, при температурі навколишнього середовища, в автоклаві, додають 0,2 мл (3,3 ммоль/2 екв.) метилізоціанату і нагрівання проводять при 90 °C протягом 48 годин. Після концентрування, залишок хроматографують над 130 г кремнезему (елюент: дихлорметан/етанол/аміак 95/5/0,5) для одержання очікуваного продукту у формі основи. Останнє розчиняють в 6 мл етанолу і обробляють 0,5 мл 3N етанольної HCl, для одержання очікуваного продукту. Точка плавлення (М.К.): 185-188 °C. Приклад 45: 8-({[3-(7,8-Диметокси-1,2,4,5-тетрагідро-3Н-3-бензазепін-3-іл)-3оксопропіл](метил)аміно}метил)біцикло[4.2.0]окта-1,3,5-триєн-3-ол Одержують таким же чином, як і продукт Прикладу 43, але із заміною продукту Прикладу 35 на продукт Прикладу 36. Точка плавлення (М.К.): 201-205 °C. -1 + ІЧ (см ): 3071 (ОН), 2672 (NH ), 1634 (С=О), 1250-1228-1196 (С-О-С), 885-749-741 (СН-Аr). Приклад 46: 8-{[[3-(7,8-Диметокси-1,2,4,5-тетрагідро-3Н-3-бензазепін-3-іл)-3оксопропіл](метил)аміно]метил}біцикло[4.2.0]окта-1,3,5-триєн-3-іл метилкарбамату гідрохлорид Одержують таким же чином, як і сполуку Прикладу 44, але використовуючи сполуку Прикладу 45 замість сполуки Прикладу 43. Точка плавлення (М.К.): 107-110 °C. Приклад 47: 7-{[[3-(7,8-Диметокси-1,2,4,5-тетрагідро-3Н-3-бензазепін-3-іл)-3оксопропіл](метил)аміно]метил}біцикло[4.2.0]окта-1,3,5-триєн-3-іл диметилкарбамату гідрохлорид При температурі навколишнього середовища, до 0,7 г (1,65 ммоль) сполуки Прикладу 43 в 5 мл піридину, додають, одразу, 0,3 мл (2,06 ммоль/1,25 екв.) триетиламіну і потім, краплями, 0,2 мл (2,06 ммоль/1,25 екв.) хлориду диметилкарбамоїлу. Перемішування проводять при температурі навколишнього середовища протягом ночі і суміш потім концентрують. Залишок хроматографують над 130 г кремнезему (елюент: дихлорметан/етанол/аміак 95/5/0,5) для одержання очікуваного продукту у формі основи. Його розчиняють в 7 мл етанолу і обробляють 0,5 мл 3N етанольної HCl, щоб одержати гідрохлорид. Точка плавлення (М.К.): 176-180 °C. Приклад 48: (-)-енантіомер 7-{[[3-(7,8-диметокси-1,2,4,5-тетрагідро-3Н-3-бензазепін-3-іл)-3оксопропіл](метил)аміно]метил}біцикло[4.2.0]окта-1,3,5-триєн-3-іл диметилкарбамату гідрохлорид 1,9 г сполуки Прикладу 47 розділяють хроматографією на хіральній фазі; рухома фаза: MeOH/DEA 1000/1. Перший продукт, елюйований, відповідає очікуваному продукту, який перетворюють у сіль, використовуючи 3N етанольну HCl. Точка плавлення (М.К.): 132-137 °C. 3 Оптичне обертання: розчинник: МеОН, С=0,012 г/см , Т=20 °C, L=589 нм, D=-6,72. Приклад 49: (+)-енантіомер 7-{[[3-(7,8-диметокси-1,2,4,5-тетрагідро-3Н-3-бензазепін-3-іл)-3оксопропіл](метил)аміно]метил}біцикло[4.2.0]окта-1,3,5-триєн-3-іл диметилкарбамату гідрохлорид Другий продукт, елюйований, у Прикладі 48 відповідає очікуваному продукту, який перетворюють у сіль в тих же умовах, що і продукт Прикладу 48. Точка плавлення (М.К.): 164-167 °C. 3 Оптичне обертання: розчинник: МеОН, С=0,01 г/см , Т=20 °C, L=589 нм, D=+7,15. Приклад 50: 8-{[[3-(7,8-Диметокси-1,2,4,5-тетрагідро-3Н-3-бензазепін-3-іл)-3оксопропіл](метил)аміно]метил}біцикло[4.2.0]окта-1,3,5-триєн-3-іл диметилкарбамату гідрохлорид Одержують таким же чином, що і сполуку Прикладу 47, але використовуючи сполуку Прикладу 45 замість сполуки Прикладу 43. Точка плавлення (М.К.): 108-112 °C. Приклад 51: 7-{[[3-(7,8-Диметокси-1,2,4,5-тетрагідро-3Н-3-бензазепін-3-іл)-3оксопропіл](метил)аміно]метил}біцикло[4.2.0]окта-1,3,5-триєн-3-іл етилкарбонату гідрохлорид До 0,95 г (2,24 ммоль) сполуки Прикладу 43 в 20 мл дихлорметану, при температурі навколишнього середовища, додають, одразу, 0,33 мл (2,35 ммоль/1,05 екв.) триетиламіну. Суміш доводять до близько 0 °C і вливають краплями 0,23 мл (2,46 ммоль/1,1 екв.) етилхлорформіату. Перемішування проводять при 0 °C протягом 1 години 30 хвилин і температурі потім дають повернутись до температури навколишнього середовища. Органічну фазу промивають двічі 20 мл води і висушують над сульфатом магнію. Після концентрування, залишок (0,96 г) хроматографують над 130 г кремнезему (елюент: дихлорметан/етанол/аміак 23 UA 100003 C2 5 10 15 20 25 30 35 40 45 50 55 95/5/0,5) для одержання очікуваного продукту у формі основи, який, коли розчинений в 9 мл етанолу і оброблений 0,65 мл 3N етанольної HCl, дає гідрохлорид. Точка плавлення (М.К.): 149-152 °C. Приклад 52: 8-{[[3-(7,8-Диметокси-1,2,4,5-тетрагідро-3Н-3-бензазепін-3-іл)-3оксопропіл]аміно]метил}біцикло[4.2.0]окта-1,3,5-триєн-3-іл метилкарбамату гідрохлорид Стадія 1: Трет-бутил-[3-(7,8-диметокси-1,2,4,5-тетрагідро-3Н-3-бензазепін-3-іл)-3оксопропіл]-[(4-гідроксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл)метил]карбамат При температурі навколишнього середовища, 1,93 г (4,7 ммоль) продукт Прикладу 36 і 1,03 г (4,7 ммоль/ 1 екв.) ди-трет-бутилдикарбонату вмішують в 20 мл дихлорметану. Після перемішування протягом 2 годин при температурі навколишнього середовища, додають 50 мл дихлорметану; проводять промивання двічі 40 мл води і висушування над сульфатом магнію. Після концентрування, збирають очікуваний продукт. Точка плавлення (М.К.): 150-154 °C. Стадія 2: 8-({(Трет-бутоксикарбоніл-[3-(7,8-диметокси-1,2,4,5-тетрагідро-3Н-3-бензазепін-3іл)-3-оксопропіл]аміно)метил}біцикло[4.2.0]окта-1,3,5-триєн-3-іл)метилкарбамат Методика є такою ж, як і у Прикладі 44, але із заміною продукту Прикладу 43 на продукт Стадії 1 вище. Стадія 3: 8-{[[3-(7,8-Диметокси-1,2,4,5-тетрагідро-3Н-3-бензазепін-3-іл)-3оксопропіл]аміно]метил}біцикло[4.2.0]окта-1,3,5-триєн-3-іл метилкарбамату гідрохлорид 2,8 мл (8,4 ммоль/10 екв.) 3N HCl в етилацетаті додають до 0,48 г (0,84 ммоль) сполуки Стадії 2 вище, розчиненої в 8 мл етилацетату. Перемішування проводять при температурі навколишнього середовища протягом ночі; утворену тверду речовину потім відфільтровують, промивають етилацетатом і висушують у вакуумі, щоб одержати очікуваний продукт. Точка плавлення (М.К.): 150-154 °C. Приклад 53: 8-{[[3-(7,8-Диметокси-1,2,4,5-тетрагідро-3Н-3-бензазепін-3-іл)-3оксопропіл]аміно]метил}біцикло[4.2.0]окта-1,3,5-триєн-3-іл диметилкарбамату гідрохлорид Стадія 1: 8-({(Трет-бутоксикарбоніл-[3-(7,8-диметокси-1,2,4,5-тетрагідро-3Н-3-бензазепін-3іл)-3-оксопропіл]аміно)метил}біцикло[4.2.0]окта-1,3,5-триєн-3-іл)диметилкарбамат Застосовують ту ж методику, що і для одержання сполуки Прикладу 47, але із заміною продукту Прикладу 43 на продукт Стадії 1 Прикладу 52. Стадія 2: 8-([[3-(7,8-Диметокси-1,2,4,5-тетрагідро-3H-3-бензазепін-3-іл)-3оксопропіл]аміно]метил}біцикло[4.2.0]окта-1,3,5-триєн-3-іл диметилкарбамату гідрохлорид До 0,93 г (1,6 ммоль) сполуки Стадії 1, розчиненої в 9 мл етанолу, додають 2,4 мл (7,2 ммоль/4,5 екв.) 3N етанольної HCl. Перемішування проводять при температурі навколишнього середовища протягом ночі; утворену тверду речовину потім відфільтровують і висушують у вакуумі, щоб одержати очікуваний продукт. Точка плавлення (М.К.): 220-222 °C. Приклад 54: 7-{[[3-(7,8-Диметокси-1,2,4,5-тетрагідро-3Н-3-бензазепін-3-іл)-3оксопропіл]аміно]метил}біцикло[4.2.0]окта-1,3,5-триєн-3-іл диметилкарбамату гідрохлорид Стадія 1: 7-({(Трет-бутоксикарбоніл-[3-(7,8-диметокси-1,2,4,5-тетрагідро-3Н-3-бензазепін-3іл)-3-оксопропіл]аміно)метил}біцикло[4.2.0]окта-1,3,5-триєн-3-іл)диметилкарбамат 3,6 г (8,8 ммоль) трет-бутил-[3-(7,8-диметокси-1,2,4,5-тетрагідро-3Н-3-бензазепін-3-іл)-3оксопропіл][(3-гідроксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл)метил]карбамату розчиняють в 50 мл дихлорметану. При 0 °C додають 2,1 г (1,1 еквівалента) N, N-диметилкарбамоїлхлориду. Перемішування проводять при 25 °C протягом 3 днів. Суміш виливають у воду, екстрагують дихлорметаном, відокремлюють, висушують над MgSO4, фільтрують і випаровують досуха. Одержаний залишок очищують флеш-хроматографією над 70 г кремнезему (елюент: СН2Сl2/етанол від 98/2 до 90/10), щоб одержати очікуваний продукт. Стадія 2: 7-{[[3-(7,8-Диметокси-1,2,4,5-тетрагідро-3Н-3-бензазепін-3-іл)-3оксопропіл]аміно]метил}біцикло[4.2.0]окта-1,3,5-триєн-3-іл диметилкарбамату гідрохлорид 0,8 г (1,37 ммоль) продукту, який одержують на Стадії 1, розчиняють в 4 мл етанолу і додають 2 мл 3,2N етанольної HCl. Нагрівання проводять при 60 °C протягом 2 годин. Суміші дають охолонути до температури навколишнього середовища і перемішування проводять протягом 2 годин. Тверду речовину відфільтровують, перекристалізовують з 6 мл етанолу при кип'ятінні зі зворотним холодильником. Суміші дають кристалізуватися при 25 °C, фільтрують і висушують. Очікуваний продукт одержують у формі твердої білої речовини. Точка плавлення (М.К.): 217-230 °C. Приклад 55: 7-{[[3-(7,8-Диметокси-1,2,4,5-тетрагідро-3Н-3-бензазепін-3-іл)-3оксопропіл]аміно]метил}біцикло[4.2.0]окта-1,3,5-триєн-3-іл 4-морфолінкарбоксилату гідрохлорид 24 UA 100003 C2 5 10 15 20 25 30 35 40 45 50 55 Застосовують ту ж методику, що і для одержання сполуки Прикладу 54, але із заміною, на Стадії 1, N, N-диметилкарбамоїлхлориду на морфолініл-4-карбонілхлорид. Точка плавлення (М.К.): 217-220 °C. Приклад 56: 7-{[[3-(7,8-Диметокси-1,2,4,5-тетрагідро-3Н-3-бензазепін-3-іл)-3оксопропіл]аміно]метил}біцикло[4.2.0]окта-1,3,5-триєн-3-іл діетилкарбамату гідрохлорид Застосовують ту ж методику, що і для одержання сполуки Прикладу 54, але із заміною, на Стадії 1, N, N-диметилкарбамоїлхлориду на N, N-діетилкарбамоїлхлорид. Точка плавлення (М.К.): 197-200 °C. Приклад 57: 7-{[[3-(7,8-Диметокси-1,2,4,5-тетрагідро-3Н-3-бензазепін-3-іл)-3оксопропіл]аміно]метил}біцикло[4.2.0]окта-1,3,5-триєн-3-іл 1-піролідинкарбоксилату гідрохлорид Застосовують ту ж методику, що і для одержання сполуки Прикладу 54, але із заміною, на Стадії 1, N, N-диметилкарбамоїлхлориду на піролідиніл-1-карбонілхлорид. Точка плавлення (М.К.): 220-222 °C. Приклад 58: 8-{[[3-(7,8-Диметокси-1,2,4,5-тетрагідро-3Н-3-бензазепін-3-іл)-3оксопропіл]аміно]метил}біцикло[4.2.0]окта-1,3,5-триєн-3-іл етилкарбонату гідрохлорид Стадія 1: 8-({(Трет-бутоксикарбоніл-[3-(7,8-диметокси-1,2,4,5-тетрагідро-3Н-3-бензазепін-3іл)-3-оксопропіл]аміно)метил}біцикло[4.2.0]окта-1,3,5-триєн-3-іл)етилкарбонат Одержують як для синтезу Прикладу 51, але із заміною продукту Прикладу 43 на трет-бутил[3-(7,8-диметокси-1,2,4,5-тетрагідро-3Н-3-бензазепін-3-іл)-3-оксопропіл][(4гідроксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл)метил]карбамат, який одержують на Стадії 1 Прикладу 52. Стадія 2: 8-{[[3-(7,8-Диметокси-1,2,4,5-тетрагідро-3Н-3-бензазепін-3-іл)-3оксопропіл]аміно]метил}біцикло[4.2.0]окта-1,3,5-триєн-3-іл етилкарбонату гідрохлорид До 2,55 г (4,4 ммоль) сполуки Стадії 1, розчиненої в 50 мл етилацетату, додають 14,5 мл (44 ммоль/10 екв.) 3N HCl в етилацетаті. Перемішування проводять при температурі навколишнього середовища протягом 4 днів; утворену тверду речовину потім відфільтровують, промивають етилацетатом і висушують у вакуумі, щоб одержати 2,15 г залишку, який очищують над кремнеземом (елюент: етанол/дихлорметан/аміак 95/5/0,5). Після перетворення в сіль, використовуючи етанольну HCl в етанолі, одержують очікуваний продукт. Точка плавлення (М.К.): 164-167 °C. Приклад 59: 7-{[[3-(7,8-Диметокси-1,2,4,5-тетрагідро-3Н-3-бензазепін-3-іл)-3оксопропіл]аміно]метил}біцикло[4.2.0]окта-1,3,5-триєн-3-іл етилкарбонату гідрохлорид Одержують таким же чином, як і продукт Прикладу 58, але із заміною, на Стадії 1, продукту Стадії 1 Прикладу 52 на трет-бутил-[3-(7,8-диметокси-1,2,4,5-тетрагідро-3Н-3-бензазепін-3-іл)-3оксопропіл][(3-гідроксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл)метил]карбамат Точка плавлення (М.К.): 208-212 °C. Приклад 60: 8-{[[3-(7,8-Диметокси-1,2,4,5-тетрагідро-3Н-3-бензазепін-3-іл)-3оксопропіл]аміно]метил}біцикло[4.2.0]окта-1,3,5-триєн-3-іл ацетату гідрохлорид Стадія 1: 8-({(Трет-бутоксикарбоніл-[3-(7,8-диметокси-1,2,4,5-тетрагідро-3Н-3-бензазепін-3іл)-3-оксопропіл]аміно)метил}біцикло[4.2.0]окта-1,3,5-триєн-3-іл)ацетат До 3,25 г (6,4 ммоль) трет-бутил-[3-(7,8-диметокси-1,2,4,5-тетрагідро-3Н-3-бензазепін-3-іл)3-оксопропіл][(4-гідроксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл)метил]карбамату, який одержують на Стадії 1 Прикладу 52 в 20 мл дихлорметану, при температурі навколишнього середовища, додають, одразу, 0,33 мл (6,7 ммоль/1,05 екв.) триетиламіну. Суміш доводять до близько 0 °C і вливають краплями 0,45 мл (6,4 ммоль/1 екв.) ацетилхлориду. Перемішування проводять при 0 °C протягом 1 години, і суміші дають повернутись до температури навколишнього середовища. Органічну фазу промивають двічі 20 мл води і висушують над сульфатом магнію. Після концентрування, залишок хроматографують над 200 г кремнезему (елюент: ацетат дихлорметан/етилу: 97/3) для одержання бажаного продукту. Стадія 2: 8-{[[3-(7,8-Диметокси-1,2,4,5-тетрагідро-3Н-3-бензазепін-3-іл)-3оксопропіл]аміно]метил}біцикло[4.2.0]окта-1,3,5-триєн-3-іл ацетату гідрохлорид До 2,2 г (4,0 ммоль) сполуки, одержаної на Стадії 1, розчиненої в 45 мл етилацетату, додають 13,5 мл (40 ммоль/10 екв.) 3N HCl в етилацетаті. Перемішування проводять при температурі навколишнього середовища протягом 4 днів і реакційну суміш вливають в 300 мл ефіру; утворену тверду речовину потім відфільтровують, промивають ефіром і висушують у вакуумі, щоб одержати залишок, який хроматографують над кремнеземом (елюент: дихлорметан/етанол/аміак 95/5/0,5). Після перетворення в сіль, використовуючи етанольну HCl в етанолі, очікуваний продукт одержують у формі гідрохлориду. Точка плавлення (М.К.): 176-179 °C. 25 UA 100003 C2 5 10 15 20 25 30 35 40 45 50 55 60 Приклад 61: 7-({[3-(7,8-Диметокси-1,2,4,5-тетрагідро-3Н-3-бензазепін-3-іл)-3оксопропіл]аміно}метил)біцикло[4.2.0]окта-1,3,5-триєн-3-іл гексагідроциклопента[с]пірол-2(1Н)карбоксилат (цис-сполука) Стадія 1: 7-({(Трет-бутоксикарбоніл)-[3-(7,8-диметокси-1,2,4,5-тетрагідро-3Н-3-бензазепін-3іл)3-оксопропіл]аміно}метил)біцикло[4.2.0]окта-1,3,5-триєн-3-іл гексагідроциклопента[с]пірол2(1Н)-карбоксилат 1,5 г (2,94 ммоль) трет-бутил-[3-(7,8-диметокси-1,2,4,5-тетрагідро-3Н-3-бензазепін-3-іл)-3оксопропіл][(3-гідроксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл)метил]карбамату, 4,1 мл триетиламіну і 2,37 г (11,74 ммоль) 4-нітрофенілхлорйодкарбонату розчиняють в 210 мл THF. Перемішування проводять при температурі навколишнього середовища протягом 1 години і потім додають 0,65 г (5,87 ммоль) октагідропента[с]піролу і 2,9 мл триетиламіну. Через 2 години при температурі навколишнього середовища знову додають 0,65 г октагідропента[с]піролу і суміші дають постояти при температурі навколишнього середовища протягом 1 години. Реакційну суміш розбавляють 700 мл етилацетату і потім промивають водою, відокремлюють, висушують над MgSO4 і випаровують. Залишок хроматографують над кремнеземом (елюент: СН2Сl2/етанол/NН4ОН 99/1/0,1) для одержання очікуваного продукту. Стадія 2: 7-({[3-(7,8-Диметокси-1,2,4,5-тетрагідро-3Н-3-бензазепін-3-іл)-3оксопропіл]аміно}метил)біцикло[4.2.0]окта-1,3,5-триєн-3-іл гексагідроциклопента[с]пірол-2(1Н)карбоксилат (цис-сполука) Продукт, який одержують на Стадії 1, розчиняють в 10 об'ємах етанолу і 10 об'ємах 3N етанольного HCl розчину. Перемішування проводять при температурі навколишнього середовища протягом 24 годин і одержаний осад, який відповідає очікуваному продукту, відфільтровують. Точка плавлення (М.К.): 214-217 °C. Приклад 62: 7-({[3-(7,8-Диметокси-1,2,4,5-тетрагідро-3Н-3-бензазепін-3-іл)-3оксопропіл]аміно}метил)біцикло[4.2.0]окта-1,3,5-триєн-3-іл 4,4-дифтор-1-піперидинкарбоксилат Одержують як і у Прикладі 61, але використовуючи, на Стадії 1, 4,4-дифторпіперидин замість октагідропента[с]піролу. Точка плавлення (М.К.): 212-216 °C. Приклад 63: 3-(7,8-Диметокси-1,2,4,5-тетрагідро-3H-3-бензазепін-3-іл)-N-[(3ізопропоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл)метил]-3-оксопропан-1-аміну геміфумарат Стадія 1: Трет-бутил-[3-(7,8-диметокси-1,2,4,5-тетрагідро-3Н-3-бензазепін-3-іл)-3оксопропіл][(3-гідроксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл)метил]карбамат 3,6 г (8,8 ммоль) продукту Прикладу 35 розчиняють в 60 мл дихлорметану. Потім додають 2,1 г (1,1 еквівалента) ди-трет-бутилдикарбонату і перемішування проводять при температурі навколишнього середовища протягом 3 годин (доки не припинить виділятися газ). Дихлорметан випаровують, проводять висушування у лопатевому вакуум-насосі і одержують очікуваний продукт. Стадія 2: Трет-бутил-[3-(7,8-диметокси-1,2,4,5-тетрагідро-3H-3-бензазепін-3-іл)-3оксопропіл][(3-ізопропоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл)метил]карбамат 1,4 г (2,7 ммоль) продукту Стадії 1 розчиняють в 15 мл DMF. Потім додають 740 мг (2 еквіваленти) карбонату калію, 160 мг (0,18 еквівалента) карбонату цезію і 0,54 мл (2 еквіваленти) ізопропілйодиду. Нагрівання потім проводять при 40 °C протягом 24 годин. DMF випаровують, використовуючи роторний випарник. Залишок, який одержують, потім розбавляють водою і екстрагують СН2Сl2. Органічну фазу потім висушують над MgSO4, фільтрують і випаровують досуха. Одержують олію, яку очищують флеш-хроматографією над 100 г кремнезему (елюент: СН2Сl2/етилацетат 80/20) для одержання очікуваного продукту у формі в'язкої меренги. Стадія 3: 3-(7,8-Диметокси-1,2,4,5-тетрагідро-3Н-3-бензазепін-3-іл)-N-[(3ізопропоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл)метил]-3-оксопропан-1-аміну геміфумарат 1,1 г (1,99 ммоль) продукту Стадії 2 розчиняють в 10 мл етанолу. Потім додають 14 мл (18 еквівалентів) розчину етанольної HCl (2,6N). Перемішування проводять при температурі навколишнього середовища протягом ночі. Викристалізовується продукт, який відфільтровують і висушують, щоб одержати 800 мг продукту. Цей твердий матеріал розчиняють у воді; додають NaOH (1N), щоб довести рН до 9; проводять екстрагування СН2Сl2, висушування над MgSO4, фільтрування і випаровування досуха, щоб одержати 650 мг олії. Останню очищують флешхроматографією над 100 г кремнезему (елюент: СН2Сl2/етанол/NН4ОН 95/5/0,5). Очікуваний продукт одержують у формі основи, яку розчиняють в 10 мл етанолу. Додають 8,1 мл (1 еквівалент) 2 % розчину фумарової кислоти в етанолі (М=0,172). Перемішування проводять при температурі навколишнього середовища протягом 30 хвилин, і тоді проводять випаровування 26 UA 100003 C2 5 10 15 20 25 30 35 40 45 50 55 досуха. Залишок, який одержують, кристалізується з ацетонітрилу при 25 °C. Кристали відфільтровують; одержують 314 мг твердого матеріалу, який перекристалізовують при кип'ятінні зі зворотним холодильником з ацетонітрилу. Проводять фільтрування в гарячому стані і потім дають кристалізації мати місце протягом однієї години при температурі навколишнього середовища. Твердий матеріал відфільтровують і висушують, щоб одержати очікуваний продукт у формі білих кристалів. Точка плавлення (М.К.): 208-211 °C. Приклад 64: 2-{[((7S)-3,4-Диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл)метил](метил)аміно}етил 7,8-диметокси-1,2,4,5-тетрагідро-3Н-3-бензазепін-3-карбоксилату гідрохлорид Стадія 1: 7,8-Диметокси-1,2,4,5-тетрагідро-3Н-3-бензазепін-3-карбонілу хлорид До 1,2 мл (10 ммоль/1 екв.) дифосгену в 20 мл дихлорметану, при близько 0 °C, додають, краплями, розчин 3,55 г (20 ммоль) 7,8-диметокси-2,3,4,5-тетрагідро-1Н-3-бензазепіну в 22 мл дихлорметані, і потім 4,2 мл (30 ммоль/1,5 екв.) триетиламіну. Перемішування протягом ночі при температурі навколишнього середовища і потім проводять концентрування. Залишок додають в дихлорметан, промивають водою і висушують над сульфатом магнію, щоб одержати, після концентрування, бажаний продукт. Стадія 2: 2-{[(3,4-Диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл)метил]-(метил)аміно}етил 7,8диметокси-1,2,4,5-тетрагідро-3Н-3-бензазепін-3-карбоксилат При температурі навколишнього середовища, 0,23 г (5,7 ммоль/1,25 екв.) гідриду натрію (60 %) очищують пентаном і потім додають 7 мл THF. Потім додають, краплями, розчин 1,14 г (4,5 ммоль/1 екв.) сполуки Приготування 25 у 1 мл THF; перемішування проводять протягом 1 години; порціями додають 1,02 г (3,8 ммоль/0,85 екв.) сполуки Стадії 1 вище, і перемішування проводять протягом ночі при температурі навколишнього середовища. Реакційну суміш вливають в 50 мл 1N водного розчину хлористоводневої кислоти. Проводять екстрагування дихлорметаном, і потім об'єднані органічні фази промивають 1N розчином гідроксиду натрію і висушують над сульфатом магнію. Після фільтрування і концентрування, залишок хроматографують над 150 г кремнезему (елюент: дихлорметан/етанол/аміак 98/2/0,2). Основу, яку таким чином одержують, розчиняють в ізопропанолі і перетворюють в сіль, використовуючи етанольну HCl, для одержання очікуваного продукту. Точка плавлення (М.К.): 147-150 °C. 3 Оптичне обертання: розчинник: МеОН, С=0,01 г/см , Т=20 °C, L=589 нм, D=+7,1. Приклад 65: 2-{[((7R)-3,4-Диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7іл)метил](метил)аміно}етил 7,8-диметокси-1,2,4,5-тетрагідро-3Н-3-бензазепін-3-карбоксилату гідрохлорид Одержують таким же чином, що і Приклад 64, але використовуючи, на Стадії 2, продукт Приготування 26 замість продукту Приготування 25. Точка плавлення (М.К.): 144-147 °C. 3 Оптичне обертання: розчинник: МеОН, С=0,01 г/см , T=20 °C, L=589 нм, D=-6,94. Приклад 66: N-{2-[{[(7S)-3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7іл]метил}(метил)аміно]етил}-7,8-диметокси-1,2,4,5-тетрагідро-3Н-3-бензазепін-3-карбоксаміду метансульфонат При температурі навколишнього середовища, до 1,06 г (4,5 ммоль) сполуки Приготування 27, розчиненої в 40 мл дихлорметану, додають, одразу, 2,34 мл (13,4 ммоль/3 екв.) діізопропілетиламіну і потім, порціями, 1,02 г (3,8 ммоль/0,85 екв.) сполуки Стадії 1 Прикладу 64, і перемішування проводять протягом ночі при температурі навколишнього середовища. Реакційну суміш промивають водою і концентрують. Залишок хроматографують над 140 г кремнезему (елюент: дихлорметан/етанол/аміак 95/5/0,5). Очищений продукт перетворюють на сіль, використовуючи метансульфонову кислоту в етилацетаті, і, після випаровування, роблять більш твердим з ефіру, для одержання очікуваного продукту. Точка плавлення (М.К.): 65-85 °C. Приклад 67: N-{2-[{[(7R)-3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7іл]метил}(метил)аміно]етил}-7,8-диметокси-1,2,4,5-тетрагідро-3Н-3-бензазепін-3-карбоксаміду метансульфонат Одержують таким же чином, що і Приклад 66, але використовуючи продукт Приготування 28 замість продукту Приготування 27. Точка плавлення (М.К.): 65-85 °C. Приклад 68: N-[(2,3-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл)метил]-3-(7,8-диметокси1,2,4,5-тетрагідро-3Н-3-бензазепін-3-іл)-N-метил-3-оксопропан-1-аміну гідрохлорид 27 UA 100003 C2 5 10 15 20 25 30 35 40 45 50 55 60 Одержують таким же чином, як і продукт Прикладу 43, але із заміною продукту Прикладу 35 на продукт Прикладу 8. Точка плавлення (М.К.): 185-186 °C. Приклад 69: N-[(2,3,4-триметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл)метил]-3-(7,8-диметокси1,2,4,5-тетрагідро-3Н-3-бензазепін-3-іл)-N-метил-3-оксопропан-1-аміну фумарат Одержують таким же чином, як і продукт Прикладу 43, але із заміною продукту Прикладу 35 на продукт Прикладу 9. Перетворення в сіль проводять, використовуючи фумарову кислоту. Точка плавлення (М.К.): 158-160 °C. Приклад 70: 3-(7,8-Диметокси-1,2,4,5-тетрагідро-3Н-3-бензазепін-3-іл)-N-(5метоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл)метил-N-метил-3-оксопропан-1-аміну гідрохлорид Одержують таким же чином, як і продукт Прикладу 43, але із заміною продукту Прикладу 35 на продукт Прикладу 10. Точка плавлення (М.К.): 130-132 °C. Приклад 71: 7-{[[3-(7,8-Диметокси-1,24,5-тетрагідро-3Н-3-бензазепін-3-іл)-3оксопропіл](метил)аміно]метил}біцикло[4.2.0]окта-1,3,5-триєн-3-іл діетилкарбамату гідрохлорид Одержують таким же чином, як і продукт Прикладу 43, але із заміною продукту Прикладу 35 па продукт Прикладу 56. Точка плавлення (М.К.): 175-178 °C. Приклад 72: 7-{[[3-(7,8-Диметокси-1,2,4,5-тетрагідро-3Н-3-бензазепін-3-іл)-3оксопропіл](метил)аміно]метил}біцикло[4.2.0]окта-1,3,5-триєн-3-іл 4-морфолінкарбоксилату гідрохлорид Одержують таким же чином, як і продукт Прикладу 43, але із заміною продукту Прикладу 35 на продукт Прикладу 55. Точка плавлення (M.К.): 196-198C°. Приклад 73: 7-{[[3-(7,8-Диметокси-1,2,4,5-тетрагідро-3Н-3-бензазепін-3-іл)-3оксопропіл](метил)аміно]метил}біцикло[4.2.0]окта-1,3,5-триєн-3-іл 1-піролідинкарбоксилату гідрохлорид Одержують таким же чином, як і продукт Прикладу 43, але замінюючи продукт Прикладу 35 на продукт Прикладу 57. Точка плавлення (М.К.): 174-177 °C. Приклад 74: 3-(7,8-Диметокси-1,2,4,5-тетрагідро-3Н-3-бензазепін-3-іл)-N-{[3-метокси-4метилбіцикло[4.2.0]окта-1,3,5-триєн-7-іл]метил}-N-метил-3-оксопропан-1-аміну гідрохлорид Одержують таким же чином, як і продукт Прикладу 43, але із заміною продукту Прикладу 35 на продукт Прикладу 39. Точка плавлення (М.К.): 172-175 °C. Приклад 75: 8-{[[3-(7,8-Диметокси-1,2,4,5-тетрагідро-3Н-3-бензазепін-3-іл)-3оксопропіл](метил)аміно]метил}біцикло[4.2.0]окта-1,3,5-триєн-3-іл етилкарбонату гідрохлорид Одержують таким же чином, як і продукт Прикладу 43, але із заміною продукту Прикладу 35 на продукт Прикладу 58. Точка плавлення (М.К.): 156-159 °C. Приклад 76: 3-(7,8-Диметокси-1,2,4,5-тетрагідро-3Н-3-бензазепін-3-іл)-N-{[4-метокси-3метилбіцикло[4.2.0]окта-1,3,5-триєн-7-іл]метил}-N-метил-3-оксопропан-1-аміну гідрохлорид Одержують таким же чином, як і продукт Прикладу 43, але із заміною продукту Прикладу 35 на продукт Прикладу 38. Точка плавлення (М.К.): 191-193 °C. Приклад 77: N-[(біцикло[4.2.0]окта-1,3,5-триєн-7-іл)метил]-3-(7,8-диметокси-1,2,4,5тетрагідро-3Н-3-бензазепін-3-іл)-N-метил-3-оксопропан-1-аміну гідрохлорид Одержують таким же чином, як і продукт Прикладу 43, але із заміною продукту Прикладу 35 на продукт Прикладу 37. Точка плавлення (М.К.): 110-113 °C. Приклад 78: 7-({[3-(7,8-Диметокси-1,2,4,5-тетрагідро-3Н-3-бензазепін-3-іл)-3оксопропіл](метил)аміно}метил)біцикло[4.2.0]окта-1,3,5-триєн-3-іл гексагідроциклопента[с]пірол2(1Н)-карбоксилат (цис-сполука) Одержують таким же чином, як і продукт Прикладу 43, але із заміною продукту Прикладу 35 на продукт Прикладу 61. Точка плавлення (М.К.): 110-113 °C. Приклад 79: 2-({[(7S)-3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл]метил}[3-(7,8диметокси-1,2,4,5-тетрагідро-3Н-3-бензазепін-3-іл)][3-оксопропіл]аміно)етанолу гідрохлорид 1 г (2,2 ммоль) (7S)-N-[(3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл)метил]-3-(7,8диметокси-1,2,4,5-тетрагідро-3Н-3-бензазепін-3-іл)-3-оксопропан-1-аміну (одержують за 28
ДивитисяДодаткова інформація
Назва патенту англійською1,2,4,5-tetrahydro-3h-benzazepine compounds, a process for their preparation and pharmaceutical compositions containing them
Автори англійськоюPeglion Jean-Louis, Goument Bertrand, Dessinges Aimee, GAIGNARD Pascal, THOLLON Catherine, VILLENEUVE Nicole, CHIMENTI Stefano
Назва патенту російськоюСоединения 1,2,4,5-тетрагидро-3н-бензазепина, способ их получения и фармацевтическая композиция, которая их содержит
Автори російськоюПеглион Жан-Луи, Гуман Бертран, Десенж Эме, Кеньяр Паскаль, Толлон Катрин, Вильньов Николь, Шиманти Стефано
МПК / Мітки
МПК: A61K 31/55, C07D 223/16, A61P 9/00
Мітки: сполуки, композиція, спосіб, 1,2,4,5-тетрагідро-3н-бензазепіну, одержання, яка, містить, фармацевтична
Код посилання
<a href="https://ua.patents.su/38-100003-spoluki-1245-tetragidro-3n-benzazepinu-sposib-kh-oderzhannya-i-farmacevtichna-kompoziciya-yaka-kh-mistit.html" target="_blank" rel="follow" title="База патентів України">Сполуки 1,2,4,5-тетрагідро-3н-бензазепіну, спосіб їх одержання і фармацевтична композиція, яка їх містить</a>
Попередній патент: Піридопіримідинові інгібітори pi3ka
Наступний патент: Спосіб оптимізації енергоживлення буксирувальної лінійної передавальної антени для передачі у ненаправленому режимі
Випадковий патент: Спосіб виробництва кисломолочного сиру "домашній овочевий"