1н-індол-3-гліоксиламіди як інгібітори spla2 та фармацевтична композиція на їх основі
Номер патенту: 47387
Опубліковано: 15.07.2002
Автори: Драхейм Сюзан Елізабет, Діллард Роберт Ділейн, Бах Ніколас Джеймс
Формула / Реферат
1. 1Н-индол-3-глиоксиламид, представленный формулой (I), или его фармацевтически приемлемая соль, сольват или пролекарство:
в которой
каждый Χ независимо является кислородом или серой;
R1 выбирают из групп (а), (b) или (с), где:
(a) - С7-С20 алкил, С7-С20 алкенил, С7-С20 алкинил, карбоциклические радикалы или гетероциклические радикалы;
(b) - член группы (а), замещенный одним или несколькими независимо выбранными неинтерферирующими заместителями;
(c) - группа -(L)-R80; где -(L)- является двухвалентной связывающей группой, состоящей из 1-12 атомов, выбранных из углерода, водорода, кислорода, азота и серы; где комбинацию атомов в -(L)- выбирают из группы, состоящей (і) только из углерода и водорода; (іі) только из серы (ііі) только из кислорода; (iv) только из азота и водорода; (v) только из углерода, водорода и серы, и (vi) только из углерода, водорода и кислорода; и где R80 является группой, выбранной из (а) или (b);
R2 - водород, галоген, С1-С3 алкил, С3-С4 циклоалкил, С3-С4 циклоалкенил, -O-(С1-C2 алкил), -S-(C1-C2 алкил) или неинтерферирующий заместитель, содержащий от 1 до 3 атомов, отличных от водорода;
R4 и R5 независимо выбирают из водорода, неинтерферирующего заместителя или группы -(Lа)-(кислотная группа); где -(La)- – кислотный мостик, имеющий длину от 1 до 4 атомов для R4 и от 3 до 8 атомов – для R5; при условии, что как минимум один из R4 или R5 должен являться группой -(La)-(кислотная группа);
R6 и R7 каждый независимо выбирают из водорода, неинтерферирующих заместителей, карбоциклических радикалов, карбоциклических радикалов, замещенных неинтерферирующими заместителями, гетероциклических радикалов и гетероциклических радикалов, замещенных неинтерферирующими заместителями.
2. Соединения по пункту 1, в которых
(і) оба Χ являются кислородом;
(ii) R2 выбирают из группы, включающей галоген, циклопропил, метил, этил и пропил;
(iii) связывающая группа -(L)- в R1 является алкиленовой цепью из 1 или 2 атомов углерода и R80 является замещенной или незамещенной группой, выбранной из группы, состоящей из циклоалкила, циклоалкенила, фенила, нафтила, норборнанила, бициклогептадиенила, толулила, ксиленила, инденила, стильбенила, терфенилила, дифенилэтиленила, фенилциклогексенила, аценафтиленила и антраценила, дифенила, дибензилила и гомологов дибензилила, представленных формулой (bb):
,
где n принимает целочисленные значения от 1 до 8; заместители для R80 независимо выбирают из группы, состоящей из галогена, С1-С10 алкила, С1-С10 алкокси, -S-( С1-С10 алкила) и С1-С10 галогеналкила;
(iv) (кислотную группу) в группе -(La)-(кислотная группа) в R4 или R5 выбирают из:
-5-тетразолила,
-SO3Н,
где n принимает значения от 1 до 8, R89 - металл или С1-С10 алкил, R99 - водород или С1-С10 алкил;
(v) когда R4 является группой -(Lа)-(кислотная группа), R4 является заместителем, имеющим кислотный мостик длиной 2 или 3 атома, и кислотная мостиковая группа, -(La)-, для R4 представлена формулой
,
где Q выбирают из группы, включающей -(СН2)-, -О-, -NH- и -S-, и R84 и R85 каждый независимо выбирают из водорода, С1-С10 алкила, арила, С1-С10 алкарила, С1-С10 аралкила, карбокси, карбалкокси и галогена;
(vi) когда R5 является группой -(La)-(кислотная группа), R5 является заместителем, имеющим кислотный мостик длиной от 3 до 8 атомов, и кислотную мостиковую группу -(La)- для R5 выбирают из:
где r принимает значения от 1 до 7, s принимает значения 0 или 1, и Q выбирают из группы, включающей -(СН2)-, -О-, -NH- и -S-, и R84 и R85 каждый независимо выбирают из водорода, С1-С10 алкила, арила, С1-С10 алкарила, С1-С10 аралкила, карбокси, карбалкокси и галогена; и
(vii) R6 и R7 каждый независимо выбирают из водорода и неинтерферирующих заместителей, причем неинтерферирующие заместители выбирают из группы, состоящей из С1-С6 алкила, С2-С6 алкенила, С2-С6 алкинила, С7-С12 аралкила, С7-С12 алкарила, С3-C8 циклоалкила, С3-C8 циклоалкенила, фенила, толулила, ксиленила, дифенила, C1-C6 алкокси, С2-С6 алкенилокси, С2-С6 алкинилокси, С2-С12 алкоксиалкила, С2-С12 алкоксиалкилокси, С2-С12 алкилкарбонила, С2-С12 алкилкарбониламино, С2-С12 алкоксиамино, С2-С12 алкоксиаминокарбонила, С1-С12 алкиламино, С1-С6 алкилтио, С2-С12 алкилтиокарбонила, С1-С6 алкилсульфинила, C1-C6 алкилсульфонила, С2-С6 галогеналкокси, C1-C6 галогеналкилсульфонила, С2-С6 галогеналкила, C1-C6 гидроксиалкила, -C(O)O(C1-C6 алкила), -(СН2)n-O-(С1-С6 алкила), бензилокси, фенокси, фенилтио, -(CONHSO2R), -СНО, амино, амидино, брома, карбамила, карбоксила, карбалкокси, -(СН2)n-СO2Н, хлора, циано, цианогуанидинила, фтора, гуанидино, гидразида, гвдразино, гидразидо, гидрокси, гидроксиамино, йода, нитро, фосфоно, -SО3Н, тиоацеталя, тиокарбонила и C1-C6 карбонила; где R является водородом или С1-С10 алкил и n принимает значения от 1 до 8.
3. 1Н-индол-3-глиоксиламид, представленный формулой (II) или его фармацевтически приемлемая соль, сольват или пролекарство:
в которой:
каждый Χ независимо является кислородом или серой;
R11 выбирают из групп (а), (b) или (с), где
(а) - С7-С20 алкил, С7-С20 алкенил, С7-С20 алкинил; или карбоциклический радикал, выбранный из группы, состоящей из циклоалкила, циклоалкенила, фенила, нафтила, норборнанила, бициклогептадиенила, толулила, ксиленила, инденила, стильбенила, терфенилила, дифенилэтиленила, фенилциклогексенила, аценафтиленила и антраценила, дифенила, дибензилила и гомологов дибензилила представленных формулой (bb)
где n принимает значения от 1 до 8; или
(b) является членом группы (а), замещенным одним или несколькими независимо выбранными неинтерферирующими заместителями, выбранными из группы, состоящей из С1-С6 алкила, С2-С6 алкенила, С2-С6 алкинила, C7-C12 аралкила, С7-С12 алкарила, С3-C8 циклоалкила, С3-C8 циклоалкенила, фенила, толулила, ксиленила, дифенила, С1-C6 алкокси, С2-С6 алкенилокси, С2-С6 алкинилокси, С2-С12 алкоксиалкила, С2-С12 алкоксиалкилокси, С2-С12 алкилкарбонила, С2-С12 алкилкарбониламино, С2-С12 алкоксиамино, С2-С12 алкоксиаминокарбонила, С1-С12 алкиламино, С1-С6 алкилтио, С2-С12 алкилтиокарбонила, С1-С6 алкилсульфинила, С1-С6 алкилсульфонила, С2-С6 галогеналкокси, С1-С6 галогеналкилсульфонила, С2-С6 галогеналкила, С1-С6 гидроксиалкила, -С(O)O(С1-С6 алкила), -(СН2)n-О-(С1-С6 алкила), бензилокси, фенокси, фенилтио, (-CONHSO2R), -СНО, амино, амидино, брома, карбамила, карбоксила, карбалкокси, -(СН2)n-СО2Н, хлора, циано, цианогуанидинила, фтора, гуанидино, гидразида, гидразино, гидразидо, гидрокси, гидроксиамино, йода, нитро, фосфоно, -SO3Н, тиоацеталя, тиокарбонила и С1-С6 карбонила; где R является водородом или С1-С10 алкилом и n принимает значения от 1 до 8;
(c) является группой -(L1)-R81; где -(L1)- - двухвалентная мостиковая группа формулы:
где
R84 и R85 каждый независимо выбирают из водорода, С1-С10 алкила, карбоксила, карбалкокси или галогена;
p принимает значения от 1 до 5;
Ζ - связь, -(СН2)-, -О-, -N(C1-C10 алкил)-, -NH- или -S-; и
где R81 является группой, выбранной из (а) или (b);
R12 - водород, галоген, С1-С3 алкил, С3-С4 циклоалкил, С3-С4 циклоалкенил, -O-(C1-C2 алкил) или -S-(C1-C2 алкил);
R14 и R15 независимо выбирают из водорода, неинтерферирующего заместителя или группы -(La)-(кислотная группа), при условии, что по крайней мере один из R14 или R15 должен являться группой -(La)-(кислотная группа); и далее при условии, что
когда R14 является группой -(La)-(кислотная группа), R14 является заместителем, имеющим кислотный мостик длиной 2 или 3 атома, и кислотная мостиковая группа, -(La)-, для R14 представлена формулой:
где Q выбирают из группы, включающей -(СН2)-; -О-, -NH- и -S-, и R84 и R85 каждый независимо выбирают из водорода, С1-С10 алкила, арила, С1-С10 алкарила, C1-С10 аралкила, гидрокси и галогена; и
когда R15 является группой -(La)-(кислотная группа), R15 является заместителем, имеющим кислотный мостик длиной от 3 до 8 атомов, и кислотную мостиковую группу -(La)- для R15 выбирают из:
,
где r принимает целые значения от 1 до 7, s принимает значения 0 или 1, Q выбирают из группы, включающей -(СН2)-, -О-, -NH- и -S-, и R84 и R85 каждый независимо выбирают из водорода, C1-С10 алкила, арила, C1-С10 алкарила, C1-С10 аралкила, карбокси, карбалкокси и галогена; и
R16 и R17 каждый независимо выбирают из водорода, неинтерферирующих заместителей, выбранных из группы, включающей C1-С6 алкил, С2-С6 алкенил, С2-С6 алкинил, С7-С12 аралкил, С7-С12 алкарил, С3-C8 циклоалкил, С3-C8 циклоалкенил, фенил, толулил, ксиленил, дифенил, С1-C6 алкокси, С2-С6 алкенилокси, С2-С6 алкинилокси, С2-С12 алкоксиалкил, С2-С12 алкоксиалкилокси, С2-С12 алкилкарбонил, С2-С12 алкилкарбониламино, С2-С12 алкоксиамино, С2-С12 алкоксиаминокарбонил, С1-С12 алкиламино, C1-C6 алкилтио, С2-С12 алкилтиокарбонил, С1-С6 алкилсульфинил, C1-C6 алкилсульфонил, С2-С6 галогеналкокси, C1-C6 галогеналкилсульфонил, С2-С6 галогеналкил, С1-С6 гидроксиалкил, -С(O)O(С1-С6 алкил), -(СН2)n-O-(С1-С6 алкил), бензилокси, фенокси, фенилтио, -(CONHSO2R), -СНО, амино, амидино, бромо, карбамил, карбоксил, карбалкокси, -(СН2)n-СO2Н, хлоро, циано, цианогуанидинил, фтор, гуанидино, гидразид, гидразино, гидразидо, гидрокси, гидроксиамино, йодо, нитро, фосфоно,-SO3Н, тиоацеталь, тиокарбонил и С1-С6 карбонил; где R является водородом или С1-С10 алкилом и n принимает значения от 1 до 8.
4. 1Н-индол-3-глиоксиламид, представленный формулой (I), либо его фармацевтически приемлемая соль, либо эфирное производное, используемое в качестве пролекарства:
,
где:
оба Χ - кислород, R1 выбирают из группы, в состав которой входят:
,
где R10 - радикал, независимо выбираемый из галогена, С1-С10 алкила, C1-C10 алкокси, -S-(C1-C10 алкила) и С1-С10 галогеналкила и t - целое число от 0 до 5;
R2 выбирают из следующей группы: галоген, циклопропил, метил, этил и пропил;
R4 и R5 независимо выбирают из водорода, неинтерферирующего заместителя либо группы -(La)-(кислотная группа); где -(Lа)-кислотный мостик; при условии, что кислотную мостиковую группу, -(La)-, для R4 выбирают из группы, включающей:
и
;
и при условии, что кислотный мостик -(La)- для R5 выбирают из группы, включающей:
и
,
где каждый из R84 и R85 независимо выбирают из водорода, C1-С10 алкила, арила, С1-С10 алкарила, С1-С10 аралкила, карбокси, карбалкокси и галогена; и
при условии, что по крайней мере один из R4 и R5 должен быть группой -(Lа)-(кислотная группа) и где (кислотная группа) в группе -(La)-(кислотная группа) для R4 или R5 выбирается из -СО2Н, -SO3Н либо -Р(O)(ОН)2;
каждый из R6 и R7 независимо выбирают из водорода и неинтерферирующих заместителей, причем неинтерферирующие заместители выбирают из группы, включающей C1-C6 алкил, С2-С6 алкенил, С2-С6 алкинил, С7-С12 аралкил, С7-С12 алкарил, С3-C8 циклоалкил, С3-C8 циклоалкенил, фенил, толулил, ксиленил, дифенил, С1-С6 алкокси, С2-С6 алкенилокси, С2-С6 алкинилокси, С2-С12 алкоксиалкил, С2-С12 алкоксиалкилокси, С2-С12 алкилкарбонил, С2-С12 алкилкарбониламино, С2-С12 алкоксиамино, С2-С12 алкоксиаминокарбонил, С1-С12 алкиламино, С1-С6 алкилтио, С2-С12 алкилтиокарбонил, С1-С6 алкилсульфинил, С1-С6 алкилсульфонил, С2-С6 галогеналкокси, С1-С6 галогеналкилсульфонил, С2-С6 галогеналкил, С1-С6 гидроксиалкил, -С(O)O(С1-С6 алкил), -(СН2)n-O-(С1-С6 алкил), бензилокси, фенокси, фенилтио, -(CONHSO2R), -СНО, амино, амидино, бромо, карбамил, карбоксил, карбалкокси, -(СН2)n-СО2Н, хлоро, циано, цианогуанидинил, фтор гуанидино, гидразид, гидразино, гидразидо, гидрокси, гидроксиамино, йодо, нитро, фосфоно, -SO3Н, тиоацеталь, тиокарбонил и С1-С6 карбонил; где R является водородом или C1-С10 алкилом и где n принимает значения от 1 до 8.
5. Соединения по п. 4, где в формуле (I) только один из R4 или R5 является группой -(La)-(кислотная группа), R6 и R7 являются водородом, и кислотная группа является карбоксильной группой.
6. 1Н-индол-3-глиоксиламид или его фармацевтически приемлемая соль, сольват или пролекарство, выбранные из группы, состоящей из соединений (А)-(Р):
(A) [[3-(2-амино-1,2-диоксоэтил)-2-метил-1-(фенилметил)-1Н-индол-4-ил]окси]уксусная кислота,
(B) dl-2[[3-(2-амино-1,2-диоксоэтил)-2-метил-1-(фенилметил)-1Н-индол-4-ил]окси]пропановая кислота,
(C) [[3-(2-амино-1,2-диоксоэтил)-1-([1,1'-дифенил]-2-илметил)-2-метил-1Н-индол-4-ил]-окси]уксусная кислота,
(D) [[3-(2-амино-1,2-диоксоэтил)-1-([1,1'-дифенил]-3-илметил)-2-метил-1Н-индол-4-ил]окси]уксусная кислота,
(Е) [[3-(2-амино-1,2-диоксоэтил)-1-([1,1'-дифенил]-4-илметил)-2-метил-1Н-индол-4-ил]окси]уксусная кислота,
(F) [[3-(2-амино-1,2-диоксоэтил)-1-[(2,6-дихлорфенил)метил]-2-метил-1Н-индол-4-ил]окси]уксусная кислота,
(G) [[3-(2-амино-1,2-диоксоэтил)-1-[4-(фторфенил)метил]-2-метил-1Н-индол-4-ил]окси]уксусная кислота,
(Н) [[3-(2-амино-1,2-диоксоэтил)-2-метил-1-[(1-нафталенил)метил]-1Н-индол-4-ил]окси]уксусная кислота,
(I) [[3-(2-амино-1,2-диоксоэтил)-2-этил-1-(фенилметил)-1Н-индол-4-ил]окси]уксусная кислота,
(J) [[3-(2-амино-1,2-диоксоэтил)-1-[(3-хлорфенил)метил]-2-этил-1Н-индол-4-ил]окси]уксусная кислота,
(К) [[3-(2-амино-1,2-диоксоэтил)-1-([1,1'-дифенил]-2-илметил)-2-этил-1Н-индол-4-ил]окси]уксусная кислота,
(L) [[3-(2-амино-1,2-диоксоэтил)-1-([1,1'-дифенил]-2-илметил)-2-пропил-1Н-индол-4-ил]окси]уксусная кислота,
(М) [[3-(2-амино-1,2-диоксоэтил)-2-циклопропил-1-(фенилметил)-1Н-индол-4-ил]окси]уксусная кислота,
(N) [[3-(2-амино-1,2-диоксоэтил)-1-([1,1'-дифенил]-2-илметил)-2-циклопропил-1Н-индол-4-ил]окси]уксусная кислота,
(О) 4-[[3-(2-амино-1,2-диоксоэтил)-2-этил-1-(фенилметил)-1Н-индол-5-ил]окси]бутановая кислота и
(Р) смеси соединений от (А) до (О).
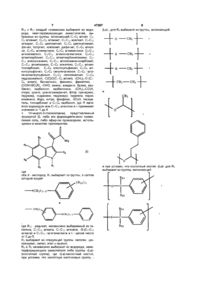
7. 1Н-индол-3-глиоксиламид, выбранный из формул:
или
или его производные, используемые в качестве пролекарств.
8. Фармацевтическая композиция, содержащая активный ингредиент в сочетании с одним или несколькими фармацевтически приемлемыми носителями или разбавителями, отличающийся тем, что в качестве упомянутого активного ингредиента она содержит 1Н-индол-3-глиоксиламид по любому из пунктов 1-7.
9. 1Н-индол-3-глиоксиламид по любому из пунктов 1-7 для применения в качестве фармацевтического средства для ингибирования sPLA2-опосредованного выделения жирной кислоты.
10. 1Н-индол-3-глиоксиламид по любому из пунктов 1-7 для применения в качестве фармацевтического средства для лечения млекопитающих, включая человека, для облегчения патологических эффектов септического шока, респираторного дистресс-синдрома у взрослых, панкреатита, травмы, бронхиальной астмы, аллергического ринита и ревматоидного полиартрита.
11. Соединение метиловый эфир [[3-(2-амино-1,2-диоксоэтил)-2-этил-1-(фенилметил)-1Н-индол-4-ил]окси]уксусной кислоты.
12. Соединение, выбираемое из группы, в состав которой входят [[3-(2-амино-1,2-диоксоэтил)-2-метил-1-(фенилметил)-1Н-индол-4-ил]окси]уксусная кислота; натриевая соль упомянутой кислоты; метиловый эфир упомянутой кислоты.
13. Соединение, выбираемое из группы, в состав которой входят [[3-(2-амино-1,2-диоксоэтил)-1-([1,1'-дифенил]-3-илметил)-2-метил-1Н-индол-4-ил]окси]уксусная кислота; натриевая соль упомянутой кислоты; метиловый эфир упомянутой кислоты.
Текст
1 1Н-индол-3-глиоксиламид, представленный формулой (І), или его фармацевтически приемлемая соль, сольват или пролекарство X X. NH2 (D в которой каждый X независимо является кислородом или серой, Ri выбирают из групп (а), (Ь) или (с), где (a) - С7-С20 алкил, С7-С20 алкенил, С7-С20 алкинил, карбоциклические радикалы или гетероциклические радикалы, (b) - член группы (а), замещенный одним или несколькими независимо выбранными неинтерферирующими заместителями, (c) - группа -(L)-Rso, где -(L)- является двухвалентной связывающей группой, состоящей из 1-12 атомов, выбранных из углерода, водорода, кислорода, азота и серы, где комбинацию атомов в -(L)выбирают из группы, состоящей (і) только из углерода и водорода, (и) только из серы (ш) только из кислорода, (iv) только из азота и водорода, (v) только из углерода, водорода и серы, и (vi) только из углерода, водорода и кислорода, и где Rso является группой, выбранной из (а) или (Ь), КОМПОЗИЦІЯ НА IX R2 - водород, галоген, С-і-Сз алкил, С3-С4 циклоалкил, С3-С4 циклоалкенил, -О-(С-і-С2 алкил), -S-(Cr С2 алкил) или неинтерферирующий заместитель, содержащий от 1 до 3 атомов, отличных от водорода, R4 и Rs независимо выбирают из водорода, неинтерферирующего заместителя или группы -(La)(кислотная группа), где -(La)- - кислотный мостик, имеющий длину от 1 до 4 атомов для R4 и от 3 до 8 атомов - для Rs, при условии, что как минимум один из R4 или Rs должен являться группой -(La)(кислотная группа), R6 и R7 каждый независимо выбирают из водорода, неинтерферирующих заместителей, карбоциклических радикалов, карбоциклических радикалов, замещенных неинтерферирующими заместителями, гетероциклических радикалов и гетероциклических радикалов, замещенных неинтерферирующими заместителями 2 Соединения по пункту 1, в которых (і) оба X являются кислородом, (м) R2 выбирают из группы, включающей галоген, циклопропил, метил, этил и пропил, (ш) связывающая группа -(L)- в Ri является алкиленовой цепью из 1 или 2 атомов углерода и Rso является замещенной или незамещенной группой, выбранной из группы, состоящей из циклоалкила, циклоалкенила, фенила, нафтила, норборнанила, бициклогептадиенила, толулила, ксиленила, инденила, стильбенила, терфенилила, дифенилэтиленила, фенилциклогексенила, аценафтиленила и антраценила, дифенила, дибензилила и гомологов дибензилила, представленных формулой (bb) (ЬЬ) где п принимает целочисленные значения от 1 до 8, заместители для Rso независимо выбирают из группы, состоящей из галогена, С-і-С-ю алкила, d Сю алкокси, -S-( С-і-С-ю алкила) и С-і-С-ю галогеналкила, (iv) (кислотную группу) в группе -(І_а)-(кислотная группа) в R4 или Rs выбирают из -5-тетразолила, О 1 00 го 47387 -SO3H, ная мостиковая группа, -(La)-, для R4 представлена формулой о P ОН ORas Q R85 где Q выбирают из группы, включающей -( О-, -NH- и -S-, и Rs4 и Rs5 каждый независимо выбирают из водорода, С-і-С-іо алкила, арила, С-і-С-ю алкарила, Сі-Сю аралкила, карбокси, карбалкокси и галогена, (vi) когда Rs является группой -(La)-(кислотная группа), Rs является заместителем, имеющим кислотный мостик длиной от 3 до 8 атомов, и кислотную мостиковую группу -(La)- для Rs выбирают из О •p он он о t •о—Р— он Q • 2 , или их производных, которыми являются соль и пролекарство (например, эфир) Другим предпочтительным подклассом соединений формулы (I) являются соединения, в которых Rs является заместителем, имеющим кислотный мостик длиной от 3 атомов до 8 атомов, и кислотную мостиковую группу -(La)- для RS выбирают из Q' (CH2) { фенилен !І R85 где г принимает значения от 1 до 7, s принимает значения 0 или 1, и Q выбирают из группы -(СЬЬ)-, -О-, -NH- и -S-, и Rs4 и Rs5 каждый независимо вы {CH2)i С R85 \ J 25 H 47387 ^84 I I (С) 2-4 н 26 Предпочтительными соединениями данного изобретения являются соединения, имеющие общую формулу R85 ын2 (И) (С) 2-4 Н R85 Н j—ttW 1*84 - L, \к.) Н R85 Н Н2С 2-4 ^84 С (С) 2-4 н R5 8 в которых Rs4 и Rs5 каждый независимо выбирают из водорода, C-1-C-io алкила, арила, Сі-Сю алкарила, Сі-Сю аралкила, карбокси, карбалкокси и галогена Другим предпочтительным подклассом соединений формулы (I) являются соединения, в которых F 6 и R7 каждый независимо выбирают из во? дорода и неинтерферирующих заместителей, причем неинтерферирующие заместители выбирают из группа, состоящей из С-і-Сє алкила, С-і-Сє алкенила, С-і-Сє алкинила, С7-С12 аралкила, С7-С12 алкарила, Сз-Cs циклоалкила, Сз-Cs циклоалкенила, фенила, толулила, ксиленила, дифенила, d Сб алкокси, Сі-Сб алкенилокси, С-і-Сє алкинилокси, С2-С12 алкоксиалкила, C2-Q2 алкоксиалкилокси, Сг-С]2 алкилкарбонила, С2-С12 алкилкарбониламино, С2-С12 алкоксиамино, С2-С12 алкоксиаминокарбонила, С-І-С-І2 алкиламино, С-і-Сє алкилтио, С2-С12 алкилтиокарбонила, С-і-Сє алкилсульфинила, d Сб алкилсульфонила, Сг-Сє галогеналкокси, С-і-Сє галогеналкилсульфонила, Сг-Сє галогеналкила, Сі-Сб гидроксиалкила, -С(О)О(Сі-Сє алкила), -(СН2)п-О-(Сі-Сб алкила), бензилокси, фенокси, фенилтио, -(CONHSO2R), -СНО, амино, амидино, брома, карбамила, карбоксила, карбалкокси, -(СНгЭп-ССЬН, хлора, циано, цианогуанидинила, фтора, гуанидино, гидразида, гуанидино, гидразидо, гидрокси, гидроксиамино, йода, нитро, фосфоно, -SO3H, тиоацеталя, тиокарбонила и С-і-Сє карбонила, где R является водородом или Сі-Сю алкил и п принимает значения от 1 до 8 в которой каждый X независимо является кислородом или серой, Rn выбирают из групп (а), (Ь) и (с), где (а) - С7-С20 алкил, С7-С20 алкенил, С7-С20 алкинил, или карбоциклический радикал, выбранный из группы, состоящей из циклоалкила, циклоалкенила, фенила, нафтила, норборнанила, бициклогептадиенила, толулила, ксиленила, инденила, стильбенила, терфенилила, дифенилэтиленила, фенилциклогексенила, аценафтиленила и антраценила, дифенила, дибензилила и родственных гомологов дибензилила, представленных формулой (bb) V •(CHai (bfo! где n принимает значения от 1 до 8, или (Ь) является группой (а), замещенной одним или несколькими независимо выбранными неинтерферирующими заместителями, выбранными из группы, состоящей из С-і-Сб алкила, Сі-Сє алкенила, С-і-Сє алкинила, С7-С12 аралкила, С7-С12 алкарила, Сз-Cs циклоалкила, Сз-Cs циклоалкенила, фенила, толулила, ксиленила, дифенила, С-і-Сє алкокси, Сі-Сє алкенилокси, Сі-Сє алкинилокси, С2-С12 алкоксиалкила, С2-С12 алкоксиалкилокси, С2-С12 алкилкарбонила, С2-С12 алкилкарбониламино, С2-С12 алкоксиамино, С2-С12 алкоксиаминокарбонила, С2-С12 алкиламино, Сі-Сб алкилтио, С2-С12 алкилтиокарбонила, Сі-Сб алкилсульфинила, С-і-Сє алкилсульфонила, Сг-Сє галогеналкокси, Сі-Сє галогеналкилсульфонила, Сг-Сє галогеналкила, Сі-Сб гидроксиалкила, -С(О)О(Сі-Сє алкила), (СН2)п-О-(Сі-Сб алкила), бензилокси, фенокси, фенилтио, (-CONHSO2R), -СНО, амино, амидино, брома, карбамила, карбоксила, карбалкокси, (СЬЬЭп-СОгН, хлора, циано, цианогуанидинила, фторо, гуанидино, гидразида, гидразино, гидразидо, гидрокси, гидроксиамино, йода, нитро, фосфоно, -SO3H, тиоацеталя, тиокарбонила, и С-і-Сє карбонила, где R является водородом или C-i-C-ю алкил и п принимает значения от 1 до 8, или (с) является группой -(I_i)-Rsi, где -(1-і)- является двухвалентной мостиковой группой, имеющей формулу 47387 27 28 RM выбирают из водорода, неинтерферирующего заместителя или группы "-^а)-(кислотная группа)", в которой кислотный мостик -(La)- имеет длину от 2 до 3 атомов и представлен формулой где Rs4 и Rs5 каждый независимо выбирают из водорода, C-1-C-io алкила, арила, С-і-С-ю алкарила, d Сю аралкила, карбокси, карбалкокси и галогена, р принимает значения от 1 до 5, Z - связь, -(СН2)-, -О-, -N(d-Cio алкил)-, -NHили -S-, и где Rsi является группой, выбранной из (а) или (Ь), R12 - водород, галоген, С-і-Сз алкил, С3-С4 циклоалкил, С3-С4 циклоалкенил, -О-(Сі-С2 алкил) или -S-(C-i-C2 алкил), где Q выбирают из группы -(СЬЬ)-, -О-, -NH- и -S-, Rs4 и Rs5 каждый независимо выбирают из водорода, C-i-C-io алкила, арила, СгСю алкарила, d С-іо аралкила, гидрокси и галогена, и кислотную группу выбирают из -5-тетразолила, -SO 3 H, •О О Р О t OEgg НО •о—р—он он О t 1 1 он (СН 2 )п-— N R99 где п принимает значения от 1 до 8, Rs9 — металл или СгСю алкил и R99 - водород или СгСю алкил, R-I5 выбирают из водорода, неинтерферирующего заместителя или группы "-(І_а)-(кислотная группа)", в которой кислотный мостик -(La)- имеет длину от 3 атомов до 8 атомов и кислотный мостик -(La)-является группой 1 RgS Q (СН2 £ фенилен ), где г принимает значения от 1 до 7, s принимает значение 0 или 1, Q выбирают из группы -(СЬЬ)-, О-, -NH-, и -S-, и Rs4 и Rs5 каждый независимо вы 29 47387 бирают из водорода, С-і-С-ю алкила, арила, С-і-С-ю алкарила, Сі-Сю аралкила, карбокси, карбалкокси и галогена, и кислотную группу выбирают из 30 N -5-тетразолила, \ НО О -P ОН ОН где п принимает значения от 1 до 8, Rs9 - металл или Сі-Сю алкил, Rgg - водород или Сі-Сю алкил, при условии, что по меньшей мере один из Ни кислотная или Ri5 должен являться группой " - ( Ь а ) - ( группа)", R-іб и Ru каждый независимо выбирают из водорода, неинтерферирующих заместителей, выбранных из группы, состоящей из С-і-Сб алкила, С-і-Сб алкенила, С-і-Сє алкинила, С7-С12 аралкила, С7-С12 алкарила, Сз-Cs циклоалкила, Сз-Cs циклоалкенила, фенила, толулила, ксиленила, дифенила, Сі-Сб алкокси, С-і-Сє алкенилокси, С-і-Сє алкинилокси, С2-С12 алкоксиалкила, С2-С12 алкоксиалкилокси, С2-С12 алкилкарбонила, С2-С12 алкилкарбониламино, С2-С12 алкоксиамино, С2-С12 алкоксиаминокарбонила, С1-С12 алкиламино, d СС2-С12 6 алкилтио, С2-С12 алкилтиокарбонила, Сі-Сб алкилсульфинила, С-і-Сє алкилсульфонила, Сг-Сб галогеналкокси, С-і-Сє галогеналкилсульфонила, Сг-Сб галогеналкила,С-і-Сє гидроксиалкила, -С(О)О(Сі-С6 алкила), -(СН2)п-О-(Сі-С6 алкила), бензилокси, фенокси, фенилтио, (CONHSO2R), -СНО, амино, амидино, брома, карбамила, карбоксила, карбалкокси, -(СЬ^п-СОгН, хлора, циано, цианогуанидинила, фтора, гуанидино, гидразида, гидразино, гидразидо, гидрокси, гидроксиамино, йода, нитро, фосфоно, -SO3H, тиоацеталя, тиокарбонила и С-і-Сє карбонила, где R является водородом или Сі-Сю алкил и п принимает значения от 1 до 8 Предпочтительным классом соединений, соответствующих данному изобретению, являются соединения, представленные формулой (II), где оба X - кислород Другим предпочтительным классом соединений, соответствующих данному изобретению, являются соединения, представленные формулой (II), где кислотный мостик, -(La)-, для RIS выбирают из групп •с—-он 47387 31 32 {C} 2 -4 •S H2C C н R84 «85 |CH2)X R5 8 в которых Rs4 и Rs5 каждый независимо выбирают из водорода С-і-С-іо алкила, арила, Сі-Сю алкарила, Сі-Сю аралкила, карбокси, карбалкокси и галогена Предпочтительными соединениями данного изобретения являются также соединения, имеющие общую формулу (III) о С R22 H R 84 (С) 2 в которой R21 ЯВЛЯеТСЯ ГРУППОЙ -(I_2)-R21 ГДЄ -(L2) — двухвалентная мостиковая группа формулы н Н ^84 ( C b2-4 р принимает значения от 1 до 5, и Rsi является группой, выбранной из (а) или (Ь), где (а) выбирают из группы, состоящей из где R-іо - радикал, независимо выбранный из галогена, Сі-Сю алкила, С-і-С-ю алкокси, -S-(Ci-Cio алкила) и Сі-Сю галогеналкила, и t принимает зна 33 47387 чения от 0 до 5, и (Ь) - является группой (а), замещенной одним или несколькими независимо выбранными неинтерферирующими заместителями, выбранными из группы, состоящей из Сі-Сб алкила, С-і-Сє алкокси, Сг-Сб галогеналкокси, Сг-Сб галогеналкила, брома, хлора, фтора и йода, R22 - является водородом, галогеном, С-і-Сз алкилом, С3-С4 циклоалкилом, С3-С4 циклоалкенилом, -O-(Ci-C2 алкилом) или -S-(C-i-C2 алкилом), R24 выбирают из водорода, С-і-Сє алкила, d Сб алкокси, Сг-Сб галогеналкокси, Сг-Сб галогеналкила, брома, хлора, фтора или йода или группы "-(La)-(кислотная группа)", в которой кислотный мостик -(La)- имеет длину 2 или 3 атома и представлен формулой где Q выбирают из группы -(СНг)-, -О-, -NH- и -S-, R24 и R25 каждый независимо выбирают из водорода, C-i-C-io алкила, арила, С-і-С-ю алкарила, С-і-Сб аралкила, гидрокси и галогена, и кислотную группу выбирают из со2н SO3H Р (онон) 2 R25 выбирают из водорода, С-і-Сє алкила, d Сб алкокси, Сг-Сб галогеналкокси, Сг-Сб галогеналкила, брома, хлора, фтора или йода или группы "-^а)-(кислотная группа), где кислотный мостик -(La)- имеет длину от 3 атомов до 8 атомов и кислотный мостик -^-является группой С феНИЛеН где г принимает значения от 1 до 7, s принимает значения 0 или 1, Q выбирают из группы -(СНг)-, О-, -NH-, и -S-, и Rs4 и Rs5 каждый независимо выбирают из водорода, С-і-Сю алкила, арила, С-і-С-ю алкарила, С-і-С-ю аралкила, карбокси, карбалкокси и галогена, и кислотную группу выбирают из 34 СО2Н Р(О) 2 при условии, что по меньшей мере один из R24 или R25 должен являться группой "-(La)-(кислотная группа)", R26 и R27 каждый независимо выбирают из водорода или С-і-Сб алкила, С-і-Сє алкокси, Сг-Сб галогеналкокси, Сг-Сб галогеналкила, брома, хлора, фтора или йода Самыми предпочтительными являются соединения формулы III, в которых ТОЛЬКО ОДИН ИЗ R24 ИЛИ R25 ЯВЛЯЄТСЯ ГРУППОЙ -(L a ) (кислотная группа), R26 и/или R27 являются водородом и кислотная группа является карбоксилом Конкретные предпочтительные соединения и все их фармацевтически приемлемые соли, сольваты и пролекарства, которые являются наглядными примерами соединений данного изобретения, включают следующие (A) [[3-(2-амино-1,2-диоксоэтил)-2-метил-1 (фенил метил)-1 Н-индол-4-ил]окси]уксусная кислота, (B) с11-2[[3-(2-амино-1,2-диоксоэтил)-2-метил-1 -(фенил метил)- 1Н-индол-4-ил]окси] пропановая кислота, (C) [[3-(2-амино-1,2-диоксоэтил)-1 -([1,1 і дифенил]-2-илметил)-2-метил-1 Н-индол-4-ил]окси]уксусная кислота, (D) [[3-(2-амино-1,2-диоксоэтил)-1-([1,Гдифенил]-3-илметил)-2-метил-1 Н-индол-4ил]окси]уксусная кислота, (E) [[3-(2-амино-1,2-диоксоэтил)-1 -([1,1'дифенил]-4-илметил)-2-метил-1 Н-индол-4ил]окси]уксусная кислота, (F) [[3-(2-амино-1,2-диоксоэтил)-1-[(2,6дихлорфенил)метил]-2-метил-1 Н-индол-4ил]окси]уксусная кислота, (G) [[3-(2-амино-1,2-диоксоэтил)-1[4(фторфенил)метил]-2-метил-1Н-индол-4ил]окси]уксусная кислота, (Н) [[3-(2-амино-1,2-диоксоэтил)-2-метил-1 -[(1нафталенил)метил]-1Н-индол-4-ил]окси]уксусная кислота, (I) [[3-(2-амино-1,2-диоксоэтил)-2-этил-1 (фенилметил)-1 Н-индол-4-ил]окси]уксусная кислота, (J) [[3-(2-амино-1,2-диоксоэтил)-1 -[(3хлорфенил)метил]-2-этил-1Н-индол-4ил]окси]уксусная кислота, (К) [[3-(2-амино-1,2-диоксоэтил)-1 -([1,1 і дифенил]-2-илметил)-2-этил-1Н-индол-4ил]окси]уксусная кислота, (L) [[3-(2-амино-1,2-диоксоэтил)-1 -([1,1'дифенил]-2-илметил)-2-пропил-1 Н-4ил]окси]уксусная кислота, (М) [[3-(2-амино-1,2-диоксоэтил)-2циклопропил-1 -(фенил метил)-1Н-индол-4ил]окси]уксусная кислота, (N) [[3-(2-амино-1,2-диоксоэтил)-1 -(1,1'дифенил]-2-илметил)-2-циклопропил-1 Н-индол-4ил]окси]уксусная кислота, 35 47387 (О) 4-[[3-(2-амино-1,2-диоксоэил)-2-этил-1 (фенил метил)-1Н-индол-5-ил]окси]бутановая кислота и (Р) смеси соединений от (А) до (О) в любом сочетании Наиболее предпочтительными являются 1Ниндол-3-глиоксиламиды, представленные формулами О. \ или Соли вышеуказанных 1 Н-индол-3глиоксиламид-производных, представленных формулами (I) или (II) и обозначенных буквами от (А) до (Р) являются дополнительным объектом данного изобретения В тех примерах, где соединения данного изобретения обладают кислотными или основными функциональными группами, могут быть получены различные соли, которые являются более водорастворимыми и приемлемыми с физиологической точки зрения, чем исходное соединение, от которого данная соль образована Примеры фармацевтически приемлемых солей включают, но не ограничиваются только ими, соли щелочных и щелочноземельных металлов, таких как литий, натрий, калий, кальций, магний, алюминий и т п Соли обычно получают из свободной кислоты действием на кислоту в растворе основанием или выдерживанием кислоты на ионообменной смоле В определение фармацевтически приемлемых 36 солеи включают относительно нетоксичные неорганические и органические соли соединений данного изобретения, полученные добавлением основания, например, катионы аммония, четвертичного аммония и амина, полученные из азотсодержащих оснований, достаточно основных для образования солей с соединениями данного изобретения (см , например, S М Berge et al , "Pharmaceutical Salts", J Phar Sci, 66 1 - 19 (1977)) Кроме того, основная(ые) группа(ы) соединений данного изобретения могут реагировать с подходящими органическими или неорганическими кислотами для получения солей, таких как ацетат, бензолсульфонат, бензоат, бикарбонат, бисульфат, битартрат, борат, бромид, камзилат, карбонат, хлорид, клавуланат, цитрат, хлорид, эдетат, эдисилат, эстолат, эзилат, фторид, фумарат, глюцептат, глюконат, глютамат, гликолиларсанилат, гексилрезорцинат, бромид, хлорид, гидроксинафтоат, йодид, изотионат, лактат, лактобионат, лаурат, малат, мальзеат, манделат, мезилат, метилбромид, метилнитрат, метилсульфат, мукат, напзилат, нитрат, олеат, оксалат, пальмитат, пантотенат, фосфат, полигалактуронат, салицилат, стеарат, субацетат, сукцинат, таннат, тартрат, тозилат, трифторацетат, трифторметансульфонат и валерат Некоторые соединения данного изобретения могут содержать один или более хиральных центров и могут, таким образом, существовать в оптически активных формах Аналогично, когда соединения содержат алкенильную или алкениленовую группу, существует возможность наличия цис- и трансизомерных форм этих соединений R- и S-изомеры и их смеси, включая рацемические смеси, а также смеси цис- и трансизомеров, тоже включаются в объем данного изобретения Дополнительные асимметричные атомы могут присутствовать в замещающей группе, такой как алкильная группа Все эти изомеры, а также их смеси включаются в данное изобретение Если необходим отдельный стереоизомер, он может быть получен хорошо известными способами, например, стереоспецифическими реакциями из исходных материалов, которые содержат асимметрические центры и являются уже разделенными, или способами, которые приводят к получению смесей стереоизомеров с последующим разделением их известными способами Пролекарства являются производными соединений данного изобретения, которые имеют химически или метаболически расщепляемые группы и становятся под действием сольволиза или при определенных физиологических условиях соединениями данного изобретения, которые фармацевтически активны in vivo Производные соединений данного изобретения имеют активность как в их кислотной, так и в основной производных формах, но кислотная форма часто имеет лучшую растворимость, тканевую совместимость или медленное разложение в организме млекопитающих (см Burgard Н , Design of Prodrags, pp 7 - 9, 21 24, Elsevier, Amsterdam, 1985) Пролекарства включают кислотные производные, хорошо известные специалистам в этой области, такие как, например, эфиры, полученные реакцией исходно 37 47387 го кислотного соединения с подходящим спиртом, или амиды, полученные реакцией исходного кислотного соединения с подходящим амином Простые алифатические или ароматические эфиры, полученные из кислотных групп соединений данного изобретения, являются предпочтительными пролекарствами В некоторых случаях требуется получить Пролекарства двойного эфирного типа, такие как (ацилокси)алкильные или ((алкоксикарбонил)окси)алкильные эфиры Синтез 1Н-индол-3-глиоксиламидов данного изобретения (например, формулы I) может осуществляться хорошо известными способами, приведенными в химической литературе Эти методики, применимые для синтеза соединений данного изобретения, приводятся далее в схемах реакций 1 -6 Схема 1 ОСНз 38 батывают затем подходящим замещенным Nметокси-Ы-метилалканамидом Продукт 4 можно очистить кристаллизацией из гексана или сразу использовать в реакции с трифторуксуснои кислотой в хлористом метилене с получением 1,3незамещенного индола 5 1,3-незамещенный индол 5 взаимодействует с гидридом натрия в диметилформамиде при комнатной температуре (20 25°С) в течение 0,5-1 ч Образующуюся натриевую соль 5 обрабатывают эквивалентным количеством арилметилгалогенида, и смесь перемешивают при температуре в пределах 0 - 100°С, обычно при комнатной температуре, в течение 4 - 36 ч для получения 1-арилметилиндола 6 Этот индол 6 подвергают реакции О-деметилирования при перемешивании с трибромидом бора в хлористом метилене в течение приблизительно 5ч (см статью Tsung-Ymg Shem and Charles A Winter, Adv Drug Res , 1977, 12, 176, которая включена сюда в качестве ссылки) 4-гидроксииндол 7 алкилируют эфиром альфа-бромалкановой кислоты в диметилформамиде (ДМФА), используя в качестве основания гидрид натрия, в условиях, аналогичных описанным для конверсии 5 в 6 Эфир 8 альфа[(индол-4-ил)окси]алкановой кислоты взаимодействует с оксалилхлоридом в хлористом метилене с получением 9, который без очистки непосредственно используется в реакции с аммиаком, в результате которой получают глиоксамид 10 Этот продукт подвергают гидролизу с использованием IN гидроксида натрия в МеОН Конечный глиоксиламид 11 выделяют либо в виде свободной карбоновой кислоты, либо в виде его натриевой соли, либо в обеих формах СХЕМА 2 Для получения глиоксиламидов, замещенных в 4-ом положении кислотной группой, присоединенной через атом кислорода, используют реакции, представленные на схеме 1 (для превращений 1 - 5см статью Robin D Clark, Joseph M Muchowski, Lawrence E Fisher, Lee A Fhppm, David В Repke, Michel Souchet, Synthesis, 1991, 871 878, которая включена сюда в качестве ссылки) Орто-нитротолуол 1 легко восстанавливают до 2метиланилина, 2, используя в качестве катализатора Pd/C Восстановление может быть проведено в этаноле или тетрагидрофуране (ТГФ) или в их смеси при использовании водорода низкого давления Анилин 2 при нагревании с ди-третбутилдикарбонатом в ТГФ до температуры перегонки превращается с хорошим выходом в N-третбутилкарбонил-производное 3 Двулитиевую соль дианиона 3 получают при температуре от -40°С до -20°С в ТГФ, используя втор-бутиллитий, и обра 18 Для синтеза глиоксиламидов, замещенных на индольном кольце в 5-ом положении оксибутановой кислотой и во 2-ом положении алкильной группой, используется последовательность реакций, представленная на схеме 2 1,3незамещенные индолы 12 получают способом, аналогичным описанному на Схеме 1 для получения соединения 5 Затем 12 в смеси ДМФА и ТГФ обрабатывают сначала смесью NaH/минерального масла, а затем арилметилгалогенидом, получая с хорошим выходом 1-арилметилиндол 13 Индол 39 47387 13 в хлористом метилене реагирует с оксалилхлоридом, и образующуюся смесь добавляют непосредственно в ТГФ, насыщенный аммиаком, в результате чего получают 5-метоксиглиоксамид 15 5-метокси-производное О-деметилируют до 5гидрокси-соединения 16 при перемешивании с трибромидом бора в хлористом метилене Этот продукт подвергают реакции с NaH в минеральном масле и трет-бутиловым эфиром гаммаброммасляной кислоты, как описано выше, с получением промежуточного продукта 17, который при перемешивании с трифторуксуснои кислотой в хлористом метилене легко может быть превращен в карбоксильное производное 18 СХЕМА 3 СН 3 О. 2 3 Для получения глиоксиламидов, замещенных в 5-ом положении оксибутановои кислотой и во 2ом положении водородом, коммерчески доступный индол 19 превращают через последовательность реакций, представленных на схеме 3, в глиоксиламид 24, используя условия реакций, аналогичные описанным для реакций схемы 1 40 НОСО 35 Для получения глиоксиламидов, замещенных в 4-ом положении кислотной функциональной группой через атом кислорода и во 2-ом положении хлором, метоксильной или метилтиогруппой, могут быть использованы реакции, представленные на схеме 4 2-оксииндол 25 может быть превращен в 4-оксиэфир 27 способами, описанными на схеме 1 В результате обработки этого промежуточного продукта сначала оксалилхлоридом, а затем аммиаком получают глиоксамид 29 Алкилирование бензилбромидом и гидридом натрия с последующим гидролизом приводит к получению 2-хлор-замещенного кислотного производного 31 При использовании промежуточного продукта 30 2-хлорзаместитель может быть заменен метилмеркаптаном или метанолом для получения 2 метилтио- и 2-метокси-производных 34 и 35 CXtMA5 СХЕМА 4 сек-, он 40 4 J Для получения глиоксиламидов, в которых карбоксильная группа в четвертом положении присоединяется через атом азота, может быть использована последовательность реакций, приведенная на схеме 5 Нитроиндол (36) (полученный по методике, приведенной в публикации Tetrahedron 46 (17) 6085-6112 (1990) авторов Jan Bergman и Peter Sand, которая приведена здесь в качестве ссылки), может подвергаться реакции алкилирования с арилметилбромидом при использовании NaH в качестве основания с получением (37) Обработка (37) сначала оксалилхлоридом, а затем аммиаком дает глиоксиламид (38) Восстановление нитрогруппы (38) водородом при использовании в качестве катализатора Pt/BaSO4 и последующее алкилирование 2-6 ром ацетатом с использованием ЫаНСОз в качестве основания дает продукт (40) Щелочной гидролиз с использованием разбавленного гидроксида натрия приво 41 дит к получению продукта (41) 47387 СХЕМА 6 COjR, НЯ2 СНЭСН3 Для получения глиоксиламидов, в которых карбоксильная группа в четвертом положении связана через всю углеродную цепь, могут использоваться реакции, изображенные на схеме 6 Бензойная кислота 53 реагирует с тионилхлоридом с образованием соответствующего бензоилхлорида, который далее взаимодействует сначала с 2-амино-2-метил-1-пропанолом, а затем с тионилхлоридом, а результате чего получают защищенную кислоту 54 Нитрогруппу оксазолина восстанавливают водородом, используя в качестве катализатора Pd/C, и анилин 55 нагревают с дитрет-бутилдикарбонатом, в результате чего получают N-трет-бутоксикарбонильное производное 56 Этот продукт превращают в индол 57 способом, представленным на схеме 1, индол алкилируют бензилбромидом, используя NaH и основание, с получением продукта 58 Оксазолиновую группу превращают в альдегид обработкой метилйодидом, восстанавливая боргидридом натрия и гидролизуя кислотой Обработка этого альдегида (карбэтоксиметилен)трифенилфосфораном 42 приводит к образованию производного 60 акриловой кислоты Это соединение реагирует с оксалилхлоридом и аммиаком, как описано ранее, а затем полученный продукт восстанавливают, используя Pd/C, с получением глиоксиламида 62 Этот эфир гидролизуют до производного 63 карбоновой кислоты Используя аналогичную последовательность химических превращений, можно получить производное карбоновой кислоты 64, содержащее на один углеродный атом больше, чем соединение 63 Полагают, что 1Н-индол-3-глиоксиламиды, описанные в данном изобретении, обладают хорошим терапевтическим действием, главным образом, за счет прямого ингибирования SPLA2 у млекопитающих (включая человека), а не действием в качестве антагонистов для арахидоновой кислоты или других активных агентов ниже арахидоновой кислоты в каскаде арахидоновой кислоты, таких как 5-липоксигеназы, циклооксигеназы и тд Способ ингибирования SPLA2 опосредованного выделения жирных кислот, соответствующий данному изобретению, включает соприкосновение SPLA2 млекопитающего с терапевтически эффективным количеством 1Н-индол3-глиоксиламида, замещенного в положении 4 или 5 кислотной группой, его солью или его пролекарством Предпочтительный способ изобретения включает соприкосновение SPLA2 с терапевтически эффективным количеством 1 Н-индол-3глиоксиламида, представленного формулами (I), (II), (III), или соединений (А)-(О), представленных выше Предпочтительный способ данного изобретения включает также контакт sPLA 2 человека с терапевтически эффективным количеством 1Ниндол-3-глиоксиламида, представленного формулой (III), где указанный глиоксиламид замещен в 4-ом положении кислотной группой, (или его солями или пролекарствами) Другим предметом данного изобретения является способ лечения септического шока, респираторного дистресссиндрома взрослых, панкреатита, травмы, бронхиальной астмы, аллергического ринита, ревматоидного полиартрита и родственных заболеваний, который включает введение млекопитающему (включая человека) терапевтически эффективной дозы 1Н-индол-3-глиоксиламидов данного изобретения (см формулы I, II или III, или соединения от (А) до (О), представленные ранее) или его фармацевтически приемлемой соли или пролекарства Наиболее предпочтительным способом лечения септического шока у человека является введение терапевтическиэффективной дозы 1Ниндол-3-глиоксиламидов, выбранных из формул 43 47387 или или их фармацевтически приемлемой соли, сольвата или пролекарства Как отмечалось ранее, соединения данного изобретения полезны для ингибирования sPLA 2 опосредованного выделения жирных кислот, таких как арахидоновая кислота Под термином "ингибирование" понимают предотвращение иди терапевтически значимое уменьшение высвобождения жирных кислот, инициированного SPLA2, соединениями данного изобретения Термин "фармацевтически приемлемый" означает, что носитель, разбавитель или наполнитель должен быть совместимым с другими ингредиентами композиции и не вредным для реципиента Определенная доза соединения, вводимого согласно данному изобретению для получения терапевтического иди профилактического эффектов, будет, конечно, определяться конкретными особенностями каждого случая, включая, например, вводимое соединение, способ введения и состояние, подвергаемое лечению Обычные ежедневные дозы будут содержать нетоксичное количество активного соединения данного изобретения, равное от приблизительно 0,01 мг до приблизительно 60мг на килограмм веса тела Предпочтительно, фармацевтическая композиция представляет собой лекарственную форму, 44 содержащую стандартную дозу Форма, содержащая стандартную дозу, может сама быть капсулой или таблеткой или подходящим количеством капсул или таблеток Количество активного ингредиента в стандартной дозе композиции может изменяться и достигать от приблизительно 0,1мг до приблизительно 1000мг или более, в соответствии с особенностями лечения Это может быть необходимо для изменения дозировки в зависимости от возраста и состояния пациента Доза будет зависеть также от способа введения Соединение может вводиться различными способами, включая пероральный, аэрозольный, ректальный, трансдермальный, подкожный, внутривенный, внутримышечный и интраназальный Фармацевтические композиции изобретения получают соединением (например, смешением) терапевтически эффективного количества 1Ниндол-3-глиоксиламидов изобретения с фармацевтически приемлемым носителем или наполнителем Данные фармацевтические композиции получают известными способами, используя хорошо известные и легко доступные ингредиенты При изготовлении композиций данного изобретения активный ингредиент будет обычно смешиваться с носителем, разбавляться носителем или заключаться в носитель, который может быть в форме капсулы, саше, бумажного или другой контейнера Когда носитель служит разбавителем, он может быть твердым, полутвердым или жидким материалом, который действует как растворитель, или может быть в форме таблеток, пилюль, порошков, лепешек, эликсиров, суспензий, эмульсий, растворов, сиропов, аэрозолей (как твердое вещество или в жидкой среде) или в форме мази, содержащей, например, до 10% от веса активного ингредиента Соединения данного изобретения предпочтительно формируются в виде композиции до введения Для фармацевтических композиций могут использоваться любые известные носители В такой композиции носитель может быть твердым веществом, жидкостью или смесью твердого вещества и жидкости Например, для внутреннего введения соединения данного изобретения могут растворяться до концентрации 2мг/мл в водном растворе 4% декстрозы/0,3% цитрата натрия Композиции в твердой форме включают порошки, таблетки и капсулы Твердым носителем может быть одно вещество или несколько веществ, которые могут также действовать как агенты, улучшающие вкус, смазывающие агенты, солюбилизаторы, суспендирующие агенты, связывающие агенты, разрыхляющие агенты и включающие агенты Таблетки для перорального введения могут содержать подходящие наполнители, такие как карбонат кальция, карбонат натрия, лактоза, фосфат кальция, вместе с дезинтегрирующими агентами такими, как маис, крахмал или альгиновая кислота, и/или связывающими агентами, например, желатином или аравийской камедью, а также смазывающими агентами, такими как стеарат магния, стеариновая кислота или тальк В порошках носителем является тонко размолотое твердое вещество, которое находится в смеси с тонко размолотым активным ингредиен 45 47387 том В таблетках активный ингредиент смешивается с носителем, обладающим необходимыми связывающими свойствами, в подходящих пропорциях и спрессовывается до необходимой формы и размера Порошки и таблетки предпочтительно содержат от приблизительно 1% до приблизительно 99% (мае), активного ингредиента, который является новым соединением данного изобретения Подходящими твердыми носителями являются карбонат магния, стеарат магния, тальк, молочный сахар, пектин, декстрин, крахмал, желатин, трагакант, метил целлюлоза, натрийкарбоксиметилцеллюлоза, низкоплавкие воска и кокосовое масло Стерильные жидкие лекарственные формы включают суспензии, эмульсии, сиропы и эликсиры Активный ингредиент может быть растворен или суспендирован в фармацевтически приемлемом носителе, таком как стерильная вода, стерильный органический растворитель или их смесь Активный ингредиент часто может быть растворен в подходящем органическом растворителе, например, водном растворе пропиленгликоля Другие композиции могут быть изготовлены диспергированием тонко размолотого активного ингредиента в водном растворе крахмала или натрий-карбоксиметилцеллюлозы или в подходящем масле Фармацевтические композиции 1-8, помещенные ниже, приводятся только в качестве примеров, а не для ограничения объема данного изобретения каким бы то ни было образом Термин "активный ингредиент" относится к соединению, соответствующему формуле (I) или его фармацевтически приемлемой соли, его сольвату или пролекарству Композиция 1 Твердые желатиновые капсулы готовят, используя следующие ингредиенты Активный ингредиент Крахмал высушенный Стеарат магния Всего Количество (мг/капсулу) 250 200 10 460мг Композиция 2 Таблетку получают при использовании следующих ингредиентов Активный ингредиент Целлюлоза микрокристаллическая Диоксид кремния, следовые количества Стеариновая кислота Всего Количество (мг^аблетку) 250 400 10 5 665 мг Компоненты смешивают и спрессовывают в таблетки массой 665 мг каждая Композиция 3 46 Раствор для аэрозольного применения получают из следующих компонентов Активный ингредиент Этанол Пропеллент 22 (хлордифторметан) Всего Масса 0,25 25,75 74,00 100,00 Активный ингредиент смешивают с этанолом и смесь добавляют к части пропеллента 22, охлажденного до температуры -30°С, и переносят в загружающее устройство Необходимое количество затем подают в контейнер из нержавеющей стали и разбавляют оставшимся пропеллентом После этого к контейнеру прилаживают клапанные устройства Композиция 4 Таблетки, каждая из которых содержит 60 мг активного ингредиента, изготавливают следующим образом Активный ингредиент 60мг Крахмал 48мг Микрокристаллическая целлюлоза 35мг Поливинилпирролидон (в виде 10%-ногораствора в воде) 4мг Натрийкарбоксиметилированный крахмал 0,5мг Стеарат магния 0,5мг Тальк 1мг Всего 150мг Активный ингредиент, крахмал и целлюлозу пропускают через сито № 45 меш (США) (0,353мм) и тщательно смешивают Водный раствор, содержащий Поливинилпирролидон, смешивают с полученным порошком, и смесь пропускают через сито № 14 меш (США) (1,41мм) Полученные таким образам гранулы сушат при температуре 50°С и пропускают через сито № 18 меш (США) (1,00мм) Натрий-карбоксиметилированный крахмал, стеарат магния и тальк, предварительно пропущенные через сито № 60 меш (США) (0,248мм), добавляют к гранулам, которые после смешивания спрессовывают на таблеточной машине, в результате чего получают таблетки массой по 150мг каждая Композиция 5 Капсулы, каждая из которых содержит по 80 мг активного ингредиента, изготавливают следующим образом Активный ингредиент 80мг Крахмал 59мг Микрокристаллическая целлюлоза 59мг Стеарат магния 2мг Всего 200мг Активный ингредиент, целлюлозу, крахмал и стеарат магния смешивают, пропускают через сито № 45 меш (США) (0,353мм) и вносят полученную смесь в твердые желатиновые капсулы по 200мг в каждую Композиция 6 Суппозитории, содержащие по 225мг активного ингредиента, наготавливают следующим образом 47 47387 АІСГИВНЬІЙ ингредиент 225мг Глицериды насыщенных жирных кислот Всего 2000 мг 2225 мг Активный ингредиент пропускают через сито № бОмеш (0,248мм) и суспендируют в глицеридах насыщенных жирных кислот, предварительно расплавленных с использованием минимального подогрева Затем смесь заливают в форму для получения суппозиториев номинальным объемом 2г и выдерживают до охлаждения Композиция 7 Суспензии, содержащие по 50мг активного ингредиента, в 5мл, получают следующим образом Активный ингредиент 50мг Натрийкарбоксиметил целлюлоза 50мг Сироп 1,25мл Раствор бензойной кислоты 0,10мл Корригент го Краситель го Дистиллированная вода до общего количества 5мл Всего 150мг Активный ингредиент пропускают через сито № 45меш (США) и сманивают с натрийкарбоксиметилцеллюлозой и сиропом с образованием однородной пасты Раствор бензойной кислоты, корригент и краситель разбавляют порцией воды и добавляют с перемешиванием Затем доливаютнеобходимое количество воды для получения требуемого объема Композиция 8 Композицию для внутривенного введения приготавливают следующим образом Активный ингредиент 100мг Изотонический физраствор 1000мл Раствор указанных ингредиентов обычно вводят внутривенно пациенту со скоростью 1 мл/мин Все продукты описанных ниже Примеров, а также промежуточные продукты, использованные в методиках, приведенных ниже, имеют спектры ядерного магнитного резонанса и инфракрасные спектры, соответствующие указанному строению Они имеют также точные масс-спектральные величины Пример 1 Получение [[3-(2-амино-1,2-диоксоэтил)-2метил-1-(фенилметил)-1Н-индол-4ил]окси]уксусной кислоты, соединения, представленного формулой О "О О NH2 48 Часть А Получение N-трет-бутоксикарбонилЗ-метокси-2-метиланилина Раствор 44,4г (344ммоль) З-метокси-2метиланилина и 75г (344ммоль) ди-третбутилдикарбоната в 400мл ТГФ кипятят в колбе с обратным холодильником в течение 4ч После выпаривания под вакуумом остаток обрабатывают этилацетатом, промывают IN лимонной кислотой, водой и сушат (MgSC^) После отгонки растворителя под вакуумом остаток кристаллизуют из гексана с получением 64,5г (выход 84%) N-третбутоксикарбонил-З-метокси-2-метиланилина, т пл 56 -57°С Анализ для С13Н19НО3 Вычислено С 65,80, Н 8,07, N 5,90, Найдено С 63,32, Н 7,83, N 5,56 Часть В Получение 4-метокси-2-метил-1Ниндола Раствор 280мл (О.Збмоль) 1 ,ЗМ вторбутиллития в циклогексане медленно добавляют к г\|-трет-бутоксикарбонил-3-метокси-2метиланилину (43г, 0,18моль) в 300мл ТГФ, поддерживая температуру ниже -40°С с помощью бани сухой лед-этанол Баню удаляют, давая температуре подняться до -20°С Затем реакционную массу снова охлаждают с помощью бани до температуры -60°С и по каплям добавляют 18,5г (0,18моль) г\І-метокси-І\І-метилглиоксиламида в равном объеме ТГФ Реакционную смесь перемешивают 1ч, охлаждающую баню удаляют и перемешивают еще 1ч Полученную смесь выливают в смесь 600мл эфира и 600мл IN HCI Органическую фракцию отделяют, промывают водой, сушат MgSO4 и выпаривают под вакуумом, в результате получают 39,5г смеси 1-[2-(третбутоксикарбониламино)-6-метоксифенил]-2пропанона и исходного анилида Смесь растворяют в 100мл хлористого метилена и 40мл трифторуксусной кислоты и перемешивают, чтобы общее время перемешивания составило 26 ч Смесь промывают водой, сушат (MgSO4) и выпаривают под вакуумом Остаток хроматографируют на силикагеле, элюируя 20%-ным раствором этилацетата в гексане, получая после кристаллизации из смеси хлористого метилена с гексаном 13,9 г 4метокси-2-метил-1 Н-индола, т пл 80 - 86°С Анализ для CioHnNO Вычислено С 74,51, Н 6,88, N 8,69, Найдено С 74,41, Н 7,08, N 8,47 Часть С Получение 4-метокси-2-метил-1(фенилметил)-1 Н-индола 4-метокси-2-метил-1 Н-индол (1 г, 6,2ммоль) добавляют к 248мг (6, ммоль) 60% гидрида натрия в минеральном масле (промытого гексаном перед добавлением ДМФА) в 15мл ДМФА и после перемешивания в течение 0,5ч добавляют 0,74мл (6,2ммоль) бензилбромида Смесь перемешивают при комнатной температуре в течение 18ч, разбавляют водой и экстрагируют этилацетатом Раствор в этилацетате промывают рассолом, сушат (MgSO4) и после выпаривания под вакуумом остаток хроматографируют на силикагеле, (элюент 20%-ный раствор этилацетата в гексане), в результате чего получают 1,3г (выход 84%) 4метокси-2-метил-1-(фенилметил)-1 Н-индола, т пл 96-116°С 49 47387 Анализ для C17H17NO Вычислено С 81,24, Н 6,82, N 5,57, Найдено С 81,33, Н 6,74, N 5,29 Часть D Получение 4-гидрокси-2-метил-1(фенилметил)-1 Н-индола Раствор 1,25г (5ммоль) 4-метокси-2-метил-1(фенилметил)-1 Н-индола и 20мл 1М ВВГ3/СН2СІ2 в 50мл хлористого метилена перемешивают при комнатной температуре в течение 5ч и упаривают под вакуумом Остаток растворяют в етилацетате, промывают рассолом и сушат (MgSO4) После упаривания под вакуумом остаток хроматографируют на силикагеле (элюент 20% этилацетат в гексане), в результате чего получают 577мг (выход 49%) 4-гидрокси-2-метил-1-(фенилметил)-1Ниндола, т пл 125-127°С Анализ для CI16H15NO Вычислено С 80,98, Н 6,37, N 5,90, Найдено С 80,76, Н 6,26, N 5,80 Часть Е Получение метилового эфира [[2метил-1-(фенилметил)-1Н-индол-4ил]окси]уксусной кислоты 4-гидрокси-2-метил-1 -(фенилметил)-1 Н-индол (530мг, 2,2ммоль) добавляют к 88мг (2,2ммоль) 60%-ного гидрида натрия в минеральном масле в 20мл ДМФА и смесь перемешивают в течение 0,67 ч После этого к полученной смеси добавляют 0,21мл (2,2ммоль) метил б ром ацетата и продолжают перемешивание в течение 17ч Смесь разбавляют водой и экстрагируют этилацетатом Этилацетатную фракцию промывают рассолом, сушат (MgSO4) и упаривают под вакуумом Остаток хроматографируют на силикагеле (элюент 20%-ный раствор этилацетата в гексане), в результате получают 597мг (выход 88%) метилового эфира [[2-метил-1-(фенилметил)-1Н-индол-4ил]окси]уксусной кислоты, т пл 140 - 143°С Анализ для C19H19NO3 Вычислено С 73,77, Н 6,19, N 4,53 Найдено С 74,01, Н 6,23, N 4,32 Часть F Получение метилового эфира [[3-(2амино-1,2-диоксоэтил)-2-метил-1 -(фенил метил)-1 Н-индол-4-ил]окси]уксусной кислоты К 582мг (1,9ммоль) метилового эфира [[2метил-1 -(фенилметил)1 Н-индол-4ил]окси]уксусной кислоты в 10мл метиленхлорида добавляют оксалилхлорид (0,16мл, 1,9ммоль) и смесь перемешивают в течение 1,5ч Смесь упаривают под вакуумом и остаток растворяют в 10мл метиленхлорида Безводный аммиак барботируют в полученную смесь в течение 0,25ч, смесь перемешивают 1,8ч и упаривают под вакуумом Остаток смешивают с 20мл этилацетата и смесь фильтруют Фильтрат упаривают, в результате чего получают 672мг смеси метилового эфира [[3-(2-амино-1,2-диоксоэтил)-2-метил-1 (фенилметил)- 1Н-индол-4-ил]окси]уксусной кислоты и хлорида аммония, т пл 202 - 215°С Часть G Получение [[3-(2-амино-1,2диоксоэтил)-2-метил-1-(фенилметил)-І Н-индол-4ил]окси]уксусной кислоты Смесь 660мг (1,7ммоль) метилового эфира [[3-(2-амино-1,2-диоксоэтил)-2-метил-1 (фенил метил)-1 Н-индол-4-ил]окси]уксусной кислоты и 10 мл IN NaOH в 30мл метанола кипятят в колбе с обратным холодильником в течение 1ч, 50 затем охлаждают до комнатной температуры и перемешивают еще ЗОмин Смесь упаривают под вакуумом и остаток обрабатывают смесью этилацетата с водой Водную фракцию отделяют, подкисляют до рН 2-3 IN HCI и экстрагируют этилацетатом Из упаренной фракции этилацетата кристаллизуется 431мг (выход 69%) [[3-(2-амино1,2-диоксоэтил)-2-метил-1-(фенилметил)-1Ниндол-4-ил]окси]уксусной кислоты, т пл 218 220°С Анализ для C20H18N2O5 Вычислено С 65,57, Н 4,95, N 7,65 Найдено С 63,31, Н 4,79, N 6,91 Пример 2 Получение сіІ-2-[[3-(2-амино-1,2-диоксоэтил)-2метил-1-(фенилметил)-1Н-индол-4ил]окси]пропионовой кислоты, соединения, представленного формулой Часть А Получение метилового эфира с11-2[[2-метил-1-фенил метил)-1 Н-индол-4ил]окси]пропионовой кислоты 4-гидрокси-2-метил-1 -(фенилметил)-1 Н-индол (483мг, 2,0ммоль) взаимодействует с 82мг (2,0ммоль) 60% гидрида натрия в минеральном масле в 20мл ДМФА, а затем с 0,22мл (2,0ммоль) метил-2-бромпропионата, по методике, описанной в примере 1 (часть Е), в результате чего после хроматографии на силикагеле (элюент 20%-ный раствор этилацетата в гексане) получают 480мг (выход 74%) метилового эфира сЛ-2-[[2-метил-1(фенилметил)-1Н-индол-4-ил]окси]уксусной кислоты Часть В Получение метилового эфира dl-2-[[3(2-амино-1,2-диоксоэтил)-2-метил-1(фенилметил)-1Н-индол-4-ил]окси]пропионовой кислоты Оксалилхлорид (0,16мл, 1,9ммоль) взаимодействует с 480мг (1,5ммоль) метилового эфира ди-2-[[2-метил-1 -(фенилметил)-1 Н-индол-4ил]окси]пропионовой кислоты, а затем с безводным аммиаком, в соответствии с методикой, описанной в примере 1 (часть F), продукт реакции растворяют в этилацетате, промывают водой, сушат (MgS04) и упаривают Остаток хроматографируют на силикагеле (элюент этилацетат), в результате чего получают 531мг (выход 90%) метилового эфира (сЛ-2-[[3-(2-амино-1,2диоксоэтил)-2-метил-1-(фенилметил)-1Н-индол-4ил]окси]пропионовой кислоты, т пл приблизи 51 52 47387 тельно 175°С Анализ для C22H22N2O5 Вычислено С 66,99, Н 5,62, N 7,10, Найдено С 67,28, Н 5,59, N 7,03 Часть С Получение с11-2-[[3-(2-амино-1,2диоксоэтил)-2-метил-1-(фенилметил)-1Н-индол-4ил]окси]пропионовой кислоты Смесь 521 г (1,3ммоль) метилового эфира dl-2[[3-(2-амино-1,2-диоксоэтил)-2-метил-1(фенилметил)-1Н-индол-4-ил]пропионовой кислоты и 10мл IN NaOH в 30мл метанола кипятят в колбе с обратным холодильником в течение 0,17ч, охлаждают до комнатной температуры и перемешивают еще ЗОмин Полученную смесь упаривает под вакуумом и остаток обрабатывают раствором этилацетата в воде Водную фракцию отделяют, подкисляют 1N соляной кислотой до рН 2-3 и экстрагируют этилацетатом Раствор продукта в этилацетате упаривают под вакуумом и остаток обрабатывают смесью этилацетата-диэтилового эфира Нерастворимый продукт фильтруют, в результате чего получают 246мг (выход 50%) dl-2[[3-(2-амино-1,2-диоксоэтил)-2-метил-1 -(фенил метил)-1 Н-индол-4-ил]окси]пропионовой кислоты, т пл 201 - 204°С Анализ для C21H20N2O5 Вычислено С 66,31, Н 5,30, N 7,36, Найдено С 65,63, Н 5,61, N 7,03 Пример 3 Получение [[3-(2-амино-1,2-диоксоэтил)-1([1, Г-дифенил]-2-илметил)-2-метил-1 Н-индол-4ил]окси]уксусной кислоты, соединения формулы но. Часть А Получение 1 -([1, Г-дифенил]-2илметил)-4-метокси-2-метил-1Н-индола 1 г (6,2ммоль) 4-метокси-2-метил-1 Н-индола взаимодействует с 248мг (6,2ммоль) 60%-ного гидрида натрия в минеральном масле, а затем с 1,1мл (6,2ммоль) 2-(бромметил)дифенила по методике, описанной в примере 1 (часть С), после хроматографии на силикагеле (элюент 17%-ный раствор этилацетата в гексане) получают 1,63г (выход 80%) 1-([1,Г-дифенил]-2-илметил)-4метокси-2-метил-1 Н-индола в виде масла Анализ для C23H21NO Вычислено С 84,37, Н 6,46, N 4,28, Найдено С 84,11, Н 5,66, N3,83 Часть В Получение 1 -([1, Г-дифенил]-2илметил)-4-гидрокси-2-метил-1 Н-индола По методике, приведенной в примере 1 (часть D), 1,6г (4,9ммоль) 1-([1,1'-дифенил]-2-илметил)-4метокси-2-метил-1 Н-индола О-деметилируют взаимодействием с 20мл 1М ВВГ3/СН2СІ2 Технический продукт хроматографируют на силикагеле (элюент 20% раствор этилацетата в гексане), в результате получают 841мг (выход 55%) 1-([1,1'дифенил]-2-илметил)-4-гидрокси-2-метил-1Ниндола Анализ для C22H19NO Вычислено С 84,32, Н 6,11, N4,47, Найдено С 84,59, Н 6,33, N 4,75 Часть С Получение метилового эфира [[1([1,1'-дифенил]-2-илметил)-2-метил-1Н-индол-4ил]окси]уксусной кислоты 1-([1,1'-дифенил]-2-илметил)-4-гидрокси-2МЄТИЛ-1Н-ИНДОЛ (767мг, 2,45ммоль) алкилируют обработкой 0,23мл (2,45ммоль) метил б ром ацетата и 98мг (2,45ммоль) 60%-ного гидрида натрия в минеральном масле в ДМФА, как описано в примере 1 (часть Е) Продукт хроматографируют на силикагеле (элюент 20% раствор этилацетата в гексане), в результате получают 730мг (выход 77%) метилового эфира [[1-(1,1'-дифенил]-2илметил)-2-метил-1Н-индол-4-ил]окси]уксусной кислоты, т пл 99-101°С Анализ для C25H23NO3 Вычислено С 77,90, Н 6,01, N 3,63, Найдено С 78,11, Н6.17, N3,74 Часть D Получение метилового эфира [[3-(2амино-1,2-диоксоэтил)-1 -([1,1 '-дифенил]-2илметил]-2-метил-1Н-индол-4-ил]окси]уксусной кислоты 715мг (1,9ммоль) метилового эфира [[1-([1,1'дифенил]-2-илметил)-2-метил-1Н-индол-4ил]окси]уксусной кислоты сначала взаимодействует с 0,16мл (1,9ммоль) оксалилхлорида, а затем с избытком аммиака в соответствии с методикой, описанной в примере 1 (часть F), в результате получают твердое белое вещество Этот продукт смешивают с этил ацетатом, нерастворимый осадок фильтруют и сушат, таким образом получают 660 мг смеси метилового эфира [[3-(2-амино-1,2диоксоэтил)-1-([1,1'-дифенил]-2-илметил)-2-метил1Н-индол-4-ил]окси]уксусной кислоты и хлорида аммония Данная смесь плавится при 144 - 148°С Часть Е Получение [[3-(2-амино-1,2диоксоэтил)-1-([1,1'-дифенил]-2-илметил)-2-метил1 Н-индол-4-ил]окси]уксусной кислоты Смесь 648мг (1,4ммоль) метилового эфира [[3-(2-амино-1,2-диоксоэтил)-1 -([1,1 '-дифенил]-2илметил)-2-метил-1Н-индол-4-ил]-окси]уксусной кислоты в 10 мл IN NaOH и 20мл МеОН кипятят в колбе с обратным холодильником в течение 1ч, охлаждают до комнатной температуры и перемешивают еще 0,5ч Смесь упаривают, остаток смешивают со смесью эти л ацетат/вод а, твердый нерастворимый осадок фильтруют и сушат, в результате получают 227мг (выход 35%) натриевой соли [[3-(2-амино-1,2-диоксоэтил)-1 -([1,1'дифенил] -2-илметил)-2-метил-1Н-индол-4ил]окси]уксусной кислоты, т пл >265°С Анализ для С г є Н г і ^ С ^ а Вычислено С 67,24, Н 4,56, N 6,03 53 47387 54 Найдено С 69,38, Н 4,88, N 5,42 ют 1,0г (выход 79%) метилового эфира [[1-([1,1'Часть F Водную фракцию отделяют от вышедифенил]-3-илметил)-2-метил-1Н-индол-4упомянутого фильтрата и подкисляют до рН 2-3 ил]окси]уксусной кислоты, т пл 99 - 102°С при помощи IN HCI Осадок экстрагируют этилацеАнализ для С25Н23НО3 татом и после упаривания этилацетата в осадке Вычислено С 77,90, Н 6,01, N 3,63 получают 128мг (20% выход) [[3-(2-амино-1,2Найдено С 77,61, Н 6,09, N 3,62 диоксоэтил)-1-(1,1'-дифенил]-2-илметил)-2-метилЧасть D Получение метилового эфира [[3-(21Н-индол-4-ил]окси]уксусной кислоты, т пл 228 амино-1,2-диоксоэтил)-1 -([1, Г-дифенил]-3231 °С илметил)-2-метил-1Н-индол-4-ил]окси]уксусной кислоты Анализ для C26H22N2O5 Вычислено С 70,58, Н 5,01, N 6,33 Оксалилхлорид (0,23мл, 2,6ммоль) добавляют Найдено С 73,12, Н 5,37, N 5,81 к 1,0г (2,6ммоль) метилового эфира [[1 -([1,1'дифенил] -3-илметил)-2-метил-1Н-индол-4Пример 4 Получение [[3-(2-амино-1,2-диоксоэтил)-1ил]окси]уксусной кислоты в 15мл метиленхлорида ([1,1'-дифенил]-3-илметил)-2-метил-1Н-индол-4и смесь перемешивают 1,3ч, упаривают под ваил]окси]уксусной кислоты, соединения формулы куумом, остаток снова растворяют в 15мл метиленхлорида, в полученный раствор в течение 0,25ч барботируют газообразный аммиак, после чего его перемешивают еще 0,25ч и упаривают Остаток смешивают со смесью эти л ацетат/вод а, нерастворимый осадок фильтруют, в результате получают 300мг метилового эфира [[3-(2-амино1,2-диоксоэтил)-1 -([1,1 '-дифенил]-3-илметил)-2метил1Н-индол-4-ил]окси]уксусной кислоты Этилацетатную фракцию выделяют из фильтрата, промывают рассолом, сушат (MgSO4) и упаривают Остаток хроматографируют на силикагеле (элюент этилацетат), в результате получают дополнительные 671мг метилового эфира [[3-(2амино-1,2-диоксоэтил)-1 -([1,1 '-дифенил]-3илметил)-2-метил-1Н-индол-4-ил]окси]уксусной кислоты, т пл 175-179°С Общий выход продукта Часть А Получение 1 -(1,1 '-дифенил]-3составляет 82% илметил)-4-метокси-2-метил-1Н-индола 805мг (5ммоль) 4-метокси-2-метил-1Н-индола сначала взаимодействует с 200мг (5ммоль) 60%ного гидрида натрия в минеральном масле, а затем с 1,0г (5ммоль) (З-хлорметил)дифенила в ДМФА в соответствии с методикой, приведенной в примере 1 (часть С), в результате после хроматографии на силикагеле (элюент 20%-ный раствор этилацетата в гексане) получают 1,25г (выход 76%) 1-([1,1'-дифенил]-3-илметил)-4-метокси-2метил-1Н-индола, т пл 127-131 °С Анализ для C23H21NO Вычислено С 84,37, Н 6,46, N 4,27 Найдено С 83,30, Н 6,55, N 4,07 Часть В Получение 1 -([1,1 '-дифенил]-3илметил)-4-гидрокси-2-метил-1Н-индола По методике, приведенной в примере 1 (часть D), 1,25г (3,8ммоль) 1-([1,1'-дифенил]-3-илметил)4-метокси-2-метил-1Н-индола О-деметилируют обработкой его 15,2мл 1М ВВГ3/СН2СІ2, в результате чего получают 1,03г (выход 87%) технического11-([1,1'-дифенил]-3-илметил)-4-гидрокси-2метил-1Н-индола Часть С Получение метилового эфира [[1([1,1'-дифенил]-илметил)-2-метил-1Н-индол-4ил]окси]уксусной кислоты 1-([1,1'-дифенил]-3-илметил)-4-гидрокси-2метил-1Н-индол(1,03г, З.Зммоль) алкилируют обработкой 0,31мл (З.Зммоль) метил б ром ацетата и 132мг (З.Зммоль) 60%-ного гидрида натрия в минеральном масле в ДМФА, по методике, описанной в примере 1 (часть Е) Продукт хроматографируют на силикагеле (элюент 20%-ный раствор этилацетата в гексане), в результате чего получа Анализ для C27H24N2O5 Вычислено С 71,04, Н 5,30, N6,14 Найдено С 71,30, Н 5,41, N 6,35 Часть Е Получение [[3-(2-амино-1,2диоксоэтил)-1-([1,1'-дифенил]-3-илметил)-2-метил1 Н-индол-4-ил]окси]уксусной кислоты Используя методику, описанную в примере 2 (часть Е), 956мг (2,1ммоль) метилового эфира [[3(2-амино-1,2-диоксоэтил)-1 -([1,1 '-дифенил]-3илметил)-2-метил-1Н-индол-4-ил]окси]уксусной кислоты гидролизуют в 10мл NaOH и 20мл МеОН, в результате получают 403мг (выход 41%) натриевой соли [[3-(2-амино-1,2-диоксоэтил)-1 -([1,1'дифенил]-3-илметил)-2-метил-1Н-индол-4ил]окси]уксусной кислоты, т пл > 265°С Анализ для C26H2iN2OsNa Вычислено С 67,24, Н 4,56, N 6,03 Найдено С 67,20, Н 4,58, N 6,03 Также получают 346мг (выход 37%) [[3-(2амино-1,2-диоксоэтил)-1 -([1,1 '-дифенил]-3илметил)-2-метил-1Н-индол-4-ил]окси]уксусной кислоты, т пл 236 - 238°С Анализ для C26H22N2O5 Вычислено С 70,58, Н 5,01, N 6,33 Найдено С 70,58, Н 5,25, N 6,11 Пример 5 Получение [[3-(2-амино-1,2-диоксоэтил)-1([1,1'-дифенил]-4-илметил)-2-метил-1Н-индол-4ил]окси]уксусной кислоты, соединения, представленного формулой 55 47387 56 ремешивают еще 0,25ч и упаривают Остаток смешивают с раствором этилацетата в воде и нерастворимый продукт фильтруют, в результате получают 818мг (выход 94%) метилового эфира [[3-(2-амино-1,2-диоксоэтил)-1 -([1,1 '-дифенил]-4илметил)-2-метил-1Н-индол-4-ил]окси]уксусной кислоты, т п л 215-217°С Анализ для C27H24N2O5 Часть А Получение 1 -([1,1 '-дифенил]-4илметил)-4-метокси-2-метил-1Н-индола Взаимодействие 805мг (5ммоль) 4-метокси-2метил-1Н-индола с 200мг (5ммоль) 60%-ного гидрида натрия в минеральном масле, а затем с 1,0г (5ммоль) 4-(хлорметил)дифенила в ДМФА осуществляют по методике, приведенной в примере 1 (часть С), в результате после хроматографии на силикагеле (элюент 20%-ный раствор этилацетата в гексане) получают 1,3г (выход 80%) 1-([1,1'дифенил]-4-илметил)-4-метокси-2-метил-1Ниндола, тпл 118- 123°С Анализ для C23H21NO Вычислено С 84,37, Н 6,46, N 4,27 Найдено С 84,66, Н 6,62, N 4,00 Часть В Получение 1 -([1,1 '-дифенил]-4илметил)-4-гидрокси-2-метил-1Н-индола По методике, приведенной в примере 1 (часть D), 1,3г (4,0ммоль) 1-([1,1'-дифенил]-4-илметил)-4метокси-2-метил-1Н-индола О-деметилируют обработкой его 16мл 1М ВВГ3/СН2СІ2, в результате чего получают 970мг (выход 77%) технического 1([1,1'-дифенил]-4-илметил)-4-гидрокси-2-метил-1Ниндола Часть С Метиловый эфир [[1-([1,1'-дифенил]4-илметил)-2-метил-1Н-индол-4-ил]окси]уксусной кислоты По методике, приведенной в примере 1 (часть Е),11-([1,1'-дифенил]-3-илметил)-4-гидрокси-2метил-1Н-индол (970мг, 3,1ммоль) обрабатывают 124мг (3,1ммоль) 60%-ного гидрида натрия в минеральном масле, а затем 0,29мл (3,1ммоль) мети л б ром ацетата Продукт хроматографируют на силикагеле (элюент 20%-ный раствор этилацетата в гексане), в результате получают 747мг (выход 63%) метилового эфира [[1-([1,1'-дифенил]-4илметил)-2-метил-1Н-индол-4-ил]окси]уксусной кислоты, т п л 164-167°С Анализ для C25H23NO3 Вычислено С 77,90, Н 6,01, N 3,63 Найдено С 78,83, Н 6,10, N 3,56 Часть D Получение метилового эфира [[3-(2амино-1,2-диоксоэтил)-1 -([1,1 '-дифенил]-4илметил)-2-метил-1Н-индол-4-ил]окси]уксусной кислоты К 747мг (2,6ммоль) метилового эфира [[1([1,1'-дифенил]-4-илметил)-2-метил-1Н-индол-4ил]окси]уксусной кислоты в 15мл метиленхлорида добавляют оксалилхлорид (0,17мл, 1,9ммоль), полученную смесь перемешивают в течение 1,3ч Смесь упаривают под вакуумом, остаток повторно растворяют в 15мл метиленхлорида, через полученный раствор барботируют газообразный аммиак в течение 0,25ч, а затем полученную смесь пе Вычислено С 71,04, Н 5,30, N6,14 Найдено С 71,32, Н 5,43, N 6,33 Часть Е Получение [[3-(2-амино-1,2диоксоэтил)-1-[(1,1'-дифенил]-4-илметил)-2-метил1 Н-индол-4-ил]окси]уксусной кислоты Используя методику, описанную в примере 2 (часть Е), 803мг (1,8ммоль) метилового эфира [[3(2-амино-1,2-диоксоэтил)-1 -([1,1 '-дифенил]-4илметил)-2-метил-1Н-индол-4-ил]окси]уксусной кислоты гидролизуют в 10мл IN NaOH и 20мл МеОН, в результате получают 614мг (выход 74%) натриевой соли [[3-(2-амино-1,2-диоксоэтил)-1([1,1'-дифенил]-4-илметил)-2-метил-1Н-индол-4ил]окси]уксусной кислоты, т пл > 265°С Анализ для С г є Н г і ^ С ^ а Вычислено С 67,24, Н 4,56, N 6,03 Найдено С 67,48, Н 4,62, N 6,14 Также получают 35мг (выход 4%) [[3-(2-амино1,2-диоксоэтил)-1 -([1,1 '-дифенил-4-илметил)-2метил-1 Н-индол-4-ил]окси]уксусной кислоты, т пл 228 - 232°С Анализ для C26H22N2O5 Вычислено С 70,58, Н 5,01, N 6,33 Найдено С 70,54, Н 5,08, N 6,14 Пример 6 Получение [[3-(2-амино-1,2-диоксоэтил)-1-[(2,6дихлорфенил)метил)-2-метил-1Н-индол-4ил]окси]уксусной кислоты, соединения, представленного формулой Часть А Получение 1-[(2,6дихлорфенил)метил]-4-метокси-2-метил-1Ниндола 4-метокси-2-метил-1Н-индол (805мг, 5ммоль) добавляют к смеси 160мг (4ммоль) 60%-ного гидрида натрия в минеральном масле (промытого гексаном перед добавлением ДМФА) в 10мл ДМФА и после перемешивания в течение 0,67ч к полученной смеси добавляют 782мг (4ммоль) альфа,2,6-трихлортолуола Смесь перемешивают при комнатной температуре в течение 5ч, разбав 57 47387 ляют водой и экстрагируют етилацетатом Раствор этилацетата промывают рассолом, сушат (MgSO4), упаривают под вакуумом, остаток хроматографируют на силикагеле (элюент 20%-ный раствор этилацетата в гексане), получают 1,08г (выход 84%) 1-[(2,6-дихлорфенил)метил]-4метокси-2-метил-1 Н-индола, т пл 154 -157°С Анализ для C17H15CI2NO Вычислено С 63,77, Н 4,72, N 4,37 Найдено С 67,16, Н 5,14, N 4,19 Часть В Получение 1-[(2,6дихлорфенил)метил]-4-гидрокси-2-метил-1Ниндола По методике, описанной в примере 1 (часть D), 1,08г (3,38ммоль) 1-[[2,6-дихлорфенил)метил]4-метокси-2-метил-1 Н-индола О-деметилируют обработкой его 13,5мл 1М ВВГ3/СН2СІ2, в результате получают после хроматографирования на силикагеле (элюент 20%-ный раствор этилацетата в гексане) 862 мг (выход 83%) 1-[(2,6дихлорфенил)метил]-4-гидрокси-2-метил-1Ниндола Анализ для C16H13CI2NO Вычислено С 62,76, Н 4,28, N 4,57 Найдено С 63,03, Н 4,45, N 4,56 Часть С Получение метилового эфира [[1[(2,6-дихлорфенил)метил]-2-метил-1 Н-индол-4ил]окси]уксусной кислоты Используя методику, описанную в примере 1 (часть Е), 862мг (2,8 ммоль)1-[[2,6дихлорфенил)метил]-4-гидрокси-2-метил-1Ниндола обрабатывают 112мг (2,8ммоль) 60%-ного гидрида натрия в минеральном масле, а затем 0,27мл (2,8ммоль) метил б ром ацетата После хроматографирования продукта на силикагеле (элюент 20%-ный раствор этилацетата в гексане) получают 411мг (выход 39%) метилового эфира [[1[[2,6-дихлорфенил)метил]-2-метил-1Н-индол-4ил]-окси]уксусной кислоты, т пл 168 - 169°С Анализ для C19H17CI2NO3 Вычислено С 60,33, Н 4,53, N 3,70 Найдено С 60,55, Н 4,70, N 3,75 Часть D Получение метилового эфира [[3-(2амино-1,2-диоксоетил)-1-[(2,6дихлорфенил)метил]-2-метил-1Н-индол-4ил]окси]-уксусной кислоты К 405 мг(1,07ммоль) метилового эфира [[1[(2,6-дихлорфенил)метил]-2-метил-1Н-индол-4ил]окси]уксусной кислоты в 10мл метиленхлорида добавляют оксалилхлорид (0,09мл, 1,07ммоль) и смесь перемешивают в течение Зч После этого смесь упаривают под вакуумом, остаток повторно растворяют в 15мл метиленхлорида, через полученный раствор в течение 0,25ч барботируют газообразный аммиак, затем смесь перемешивают еще 0,25ч и упаривают Остаток смешивается со смесью этилацетата с водой Этилацетатную фракцию отделяют, промывают рассолом, сушат (MgSO4) и упаривают После хроматографирования остатка на силикагеле (элюент этилацетат) получают 426 мг (выход 88%) метилового эфира [[3-(2-амино-1,2-диоксоэтил)-1-[[2,6дихлорфенил)метил]-2-метил-1Н-индол-4ил]окси]уксусной кислоты, т пл 200 - 202°С Анализ для C21H18CI2N2O5 Вычислено С 56,14, Н 4,04, N 6,24 58 Найдено С 56,39, Н 4,15, N 6,45 Часть Е Получение [[3-(2-амино-1,2диоксоэтил)-1-[[2,6-дихлорфенил)метил] -2-метил1 Н-индол-4-ил]окси]уксусной кислоты Смесь 420мг (0,94ммоль) метилового эфира [[3-(2-амино-1,2-диоксоэтил)-1-[(2,6дихлорфен ил) метил ] -2-МЄТИЛ-1Н-ИНДОЛ-4ил]окси]уксусной кислоты, 5мл IN NaOH и 15мл МеОН кипятят в колбе с обратным холодильником в течение 0,17ч, охлаждают до комнатной температуры и перемешивают еще 0,5ч К реакционной смеси добавляют этилацетат и воду, водную фракцию отделяют, подкисляют до рН 2-3 IN HCI, смесь дважды экстрагируют этилацетатам Нерастворимый продукт выделяют фильтрованием Фильтрат сушат сульфатом магния и упаривают Образующееся твердое вещество промывают небольшим количеством смеси эфир/метиленхлорид, нерастворимый осадок фильтруют и соединяют с осадком, полученным ранее, в результате получают 351мг (выход 86%) [[3-(2-амино-1,2-диоксоэтил)-1-[(2,6дихлорфенил)метил]-2-метил-1Н-индол-4ил]окси]уксусной кислоты, т пл 236 - 239°С Анализ для C20H16CI2N2O5 Вычислено С 55,19, Н 3,70, N 6,44 Найдено С 55,34, Н 3,72, N 6,35 Пример 7 Получение [[3-(2-амино-1,2-диоксоэтил)-1[(4-фторфенил)метил]-2-метил-1Н-индол-4ил]окси]уксусной кислоты, соединения, представленного формулой НО. ^ Qv _NH2 Часть А Получение 1-[[4-фторфенил)метил]4-метокси-2-метил-1 Н-индола К смеси 200мг (5ммоль) 60%-ного гидрида натрия в минеральном масле (промытого гексаном перед добавлением ДМФА) и 10мл ДМФА добавляют 805мг (5ммоль) 4-метокси-2-метил-1Ниндола, и после перемешивания полученной смеси в течение 0,5ч в реакционную смесь добавляют 0,6мл (5ммоль) 4-фторбензилхлорида Смесь перемешивают при комнатной температуре в течение 18ч, разбавляют водой и экстрагируют этилацетатом Фракцию этилацетата промывают рассолом, сушат сульфатом магния и после упаривания под вакуумом и хроматографирования остатка на силикагеле (элюент 20%-ный раствор этилацетата в гексане) получают 1,1 г (выход 84%) 1-[(4-фторфенил)метил]-4-метокси-2-метил-1Ниндола, т пл 104-108°С 59 Анализ для C19H18FNO3 Вычислено С 69,71, Н 5,54, N 4,28 Найдено С 70,83, Н 6,00, N 4,08 Часть D Получение метилового эфира [[3-(2амино-1,2-диоксоэтил)-1-[[4-фторфенил)метил]-2метил-1 Н-индол-4-ил]окси]уксусной кислоты К 914мг (2,8ммоль) метилового эфира [[1-[(4фторфенил)метил]-2-метил-1Н-индол-4ил]окси]уксусной кислоты в 15мл метиленхлорида добавляют 0,24мл (2,6ммоль) оксалилхлорида, смесь перемешивают в течение 1,3ч Смесь упаривают под вакуумом, остаток повторно растворяют в 15мл метиленхлорида и через полученную смесь в течение 0,25ч барботируют газообразный аммиак Реакционную массу перемешивают еще 0,25ч и упаривают Остаток обрабатывают смесью этилацетата с водой и образующийся осадок фильтруют, в результате получают 25мг (выход 4%) метилового эфира [[3-(2-амино-1,2диоксоэтил)-1-[(4-фторфенил)метил]-2-метил-1Ниндол-4-ил]окси]уксусной кислоты Этилацетатную фракцию выделяют из фильтрата, промывают рассолом, сушат сульфатом магния и упаривают Остаток хроматографируют на силикагеле (элюент этилацетат), дополнительно получают 757мг метилового эфира [[3-(2-амино-1,2-диоксоэтил)-1[[4-фторфенил)метил]-2-метил-1Н-индол-4ил]уксусной кислоты, т пл 178 - 180°С Общий выход продукта составляет 70% Анализ для C21H19FN2O5 Вычислено С 63,31, Н 4,81, N 7,03 Найдено С 62,31, Н 4,78, N 6,85 Часть Е Получение [[3-(2-амино-1,2диоксоэтил)-1-[(4-фторфенил]метил]-2-метил-1Ниндол-4-ил]окси]уксусной кислоты Смесь 767мг (1,9ммоль) метилового эфира [[3-(2-амино-1,2-диоксоэтил)-1 -[(4фторфенил)метил]-2-метил-1Н-индол-4ил]окси]уксусной кислоты, 10мл IN NaOH и 30мл МеОН кипятят в колбе с обратным холодильником 60 в течение 0,67ч, охлаждают до комнатной температуры и перемешивают в течение 1ч К полученной массе добавляют этилацетат и воду, водную фракцию отделяют, подкисляют до рН 2-3 добавлением IN HCI и дважды экстрагируют этилацетатом Соединенные фракции этилацетата сушат сульфатом магния и упаривают Твердый остаток промывают небольшим количеством этилацетата, после чего получают 593мг (выход 81%) [[3-(2амино-1,2-диоксоэтил)-1-[(4-фторфенил)метил]-2метил-1Н-индол-4-ил]окси]уксусной кислоты, т пл 244 - 247°С 47387 Анализ для C17H16FNO Вычислено С 75,82, Н 5,99, N 5,20 Найдено С 73,82, Н 5,95 N5,01 Часть В Получение 1-[[4-фторфенил)метил]4-гидрокси-2-метил-1 Н-индола Используя методику, описанную в примере 1 (часть D), 1,1г (4,1ммоль) 1 - [(4-фторфенил)метил ] -4-метокси-2-метил-1 Н-индола О-деметилируют обработкой 16,4мл 1М ВВГ3/СН2СІ2 с получением 881мг (выход 84%) технического 1-[(4фторфенил)метил]-4-гидрокси-2-метил-1Ниндола Часть С Получение метилового эфира [[1-[(4фторфенил)метил]-2-метил-1Н-индол-4ил]окси]уксусной кислоты Используя методику, описанную в примере 1 (часть Е), 881мг (3,45ммоль)1-[(4фторфенил)метил]-4-гидрокси-2-метил-1 Н-индола обрабатывают 138 мг (3,45ммоль) 60%-ного гидрида натрия в минеральном масле, а затем 0,33мл (3,45ммоль) метил б ром ацетата Продукт хроматографируют на силикагеле (элюент 20%ный раствор этилацетата в гексане), в результате чего получают 914мг (выход 81%) метилового эфира [[1-[(4-фторфенил)метил]-2-метил-1Ниндол-4-ил]окси]уксусной кислоты, т пл 9 - 98°С Анализ для C20H17FN2O5 Вычислено С 62,50, Н 4,46, N 7,29 Найдено С 62,40, Н 4,57, N 7,00 Пример 8 Получение [[3-(2-амино-1,2-диоксоэтил)-2метил-1-[(1-нафталенил)метил]-1 Н-индол-4ил]окси]уксусной кислоты, соединения, представленного формулой NH2 Часть А Получение 4-метокси-2-метил-1-[(1нафталенил)метил]-1 Н-индола 4-мєтокси-2-мєтил-1Н-индол (644мг, 4ммоль) растворяют в 10мл ДМФА и к полученному раствору добавляют 160мг (4ммоль) 60%-ного гидрида натрия в минеральном масле Спустя 0,67ч к реакционной массе добавляют 707мг (4ммоль) 1(хлорметил)нафталина Через 5ч смесь разбавляют водой и дважды экстрагируют этилацетатом Соединенные фракции этил ацетата промывают рассолом, сушат сульфатом магния и упаривают под вакуумом Остаток хроматографируют на силикагеле (элюент 20%-ный раствор этилацетата в гексане), в результате получают 1,17г (выход 97%) 4-метокси-2-метил-Н(1 -нафталенил)метил]-1 Ниндола Анализ для C21H19NO Вычислено С 83,69, Н 6,35, N 4,65 Найдено С 83,71, Н 6,45, N 4,41 Часть В Получение 4-гидрокси-2-метил-1-[(1нафталенил)метил]-1 Н-индола Используя методику, описанную в примере 1 (часть D), 1,17г (3,9 ммоль) 4-метокси-2метил-1-[(1-нафталенил)метил]-1 Н-индола Одеметилируют обработкой его 15,6мл ІМ ВВГ3/СН2СІ2, в результате чего получают продукт,
ДивитисяДодаткова інформація
Назва патенту англійською1h-indole-3-glyoxylamides as inhibitors of spla2 and pharmaceutical composition on their basis
Автори англійськоюBach Nicolas James, Dillard Robert Dilane, Draheim Suzanne Elizabeth
Назва патенту російською1н-индол-3-глиоксиламиды в качестве ингибиторов spla2 и фармацевтическая композиция на их основе
Автори російськоюБах Николас Джеймс, Диллард Роберт Дилейн, Драхейм Сюзан Элизабет
МПК / Мітки
МПК: C07D 209/22, C07D 209/12, C07D 403/12, A61K 31/405
Мітки: основі, інгібітори, spla2, 1н-індол-3-гліоксиламіди, фармацевтична, композиція
Код посилання
<a href="https://ua.patents.su/41-47387-1n-indol-3-glioksilamidi-yak-ingibitori-spla2-ta-farmacevtichna-kompoziciya-na-kh-osnovi.html" target="_blank" rel="follow" title="База патентів України">1н-індол-3-гліоксиламіди як інгібітори spla2 та фармацевтична композиція на їх основі</a>
Попередній патент: Спосіб керамопластики кісткових кіст
Наступний патент: Пестицидний засіб з оболонкою, спосіб його одержання (варіанти) та пестицидна композиція у формі змочуваного порошку
Випадковий патент: Засіб для лікування шлунково-кишкових захворювань "орнізим-д"