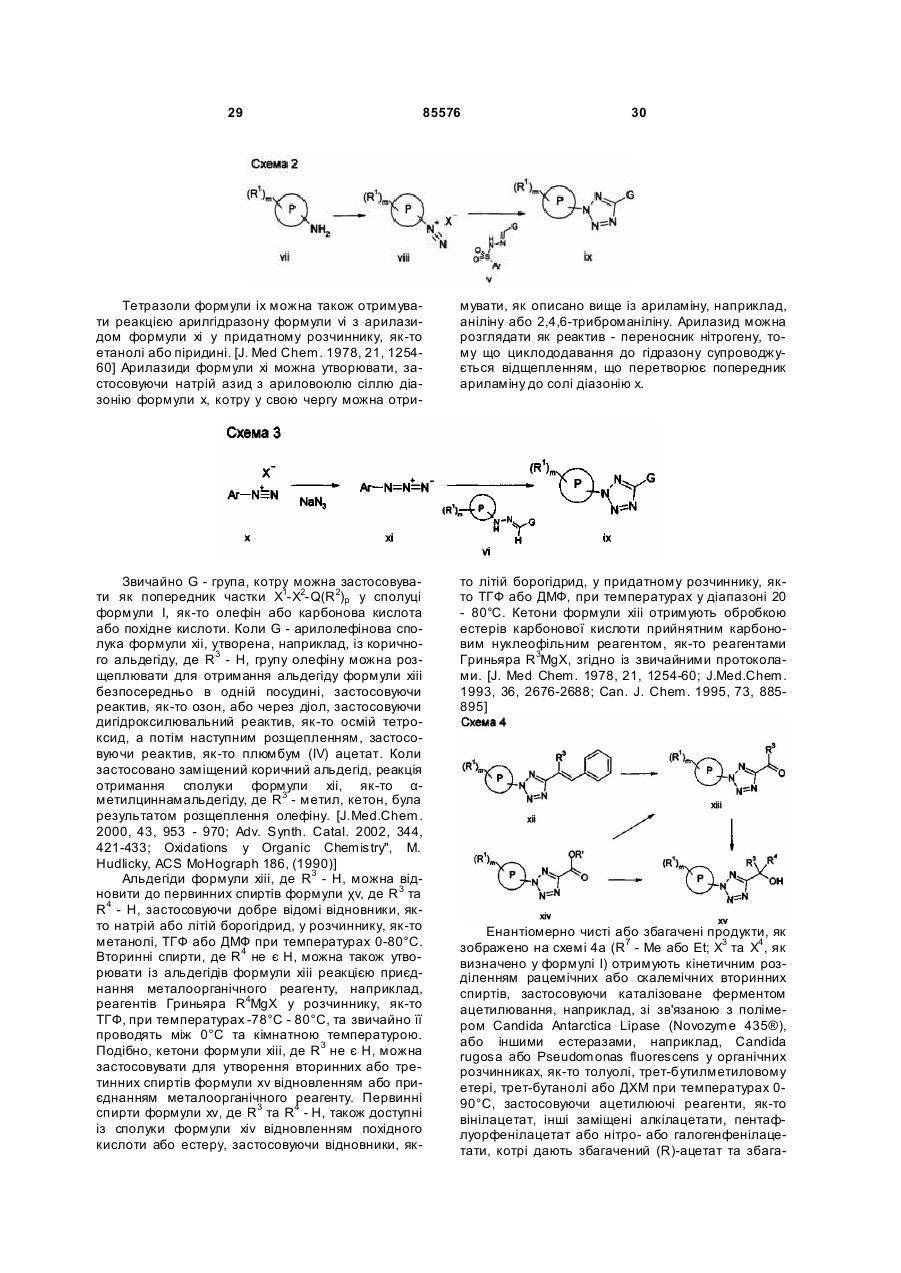
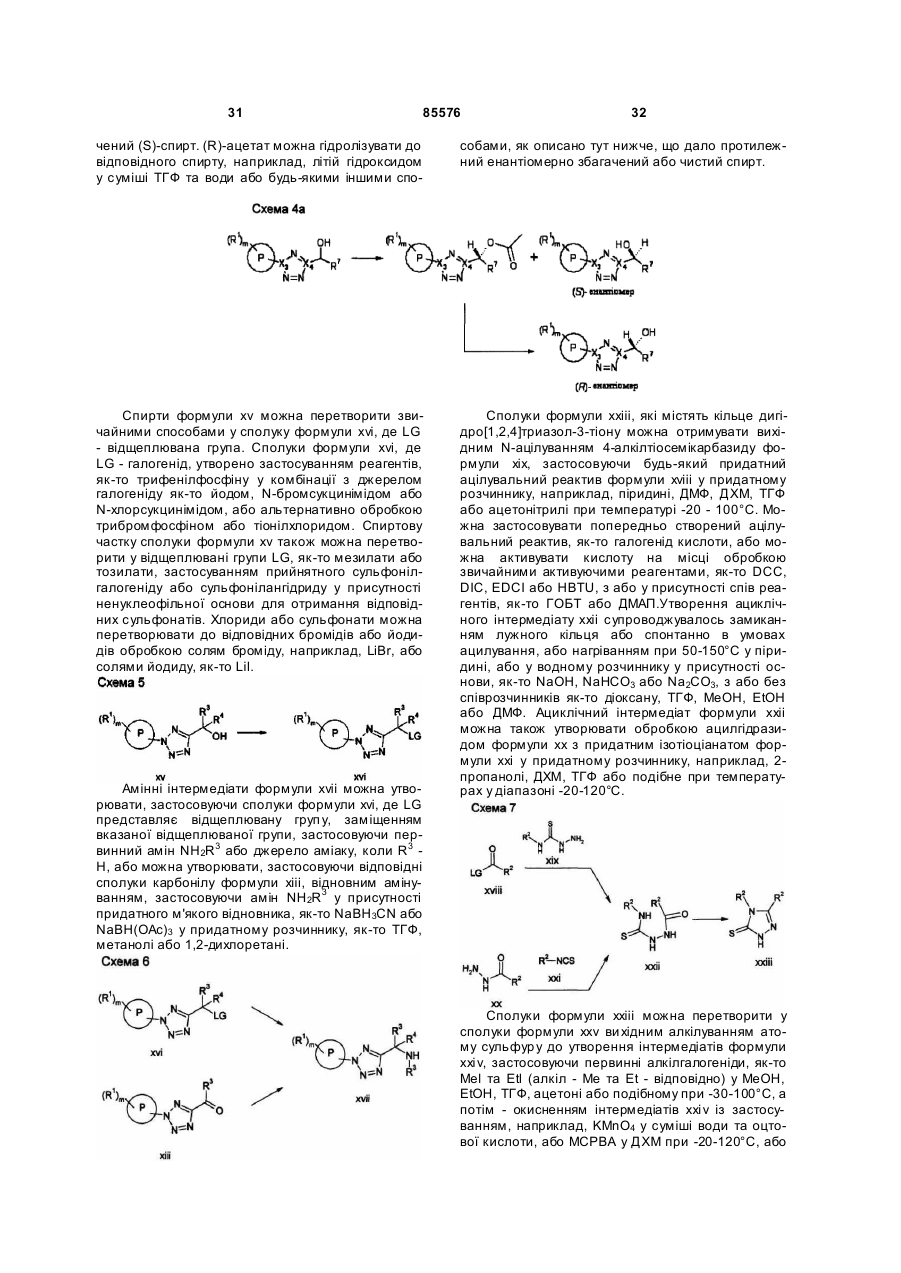
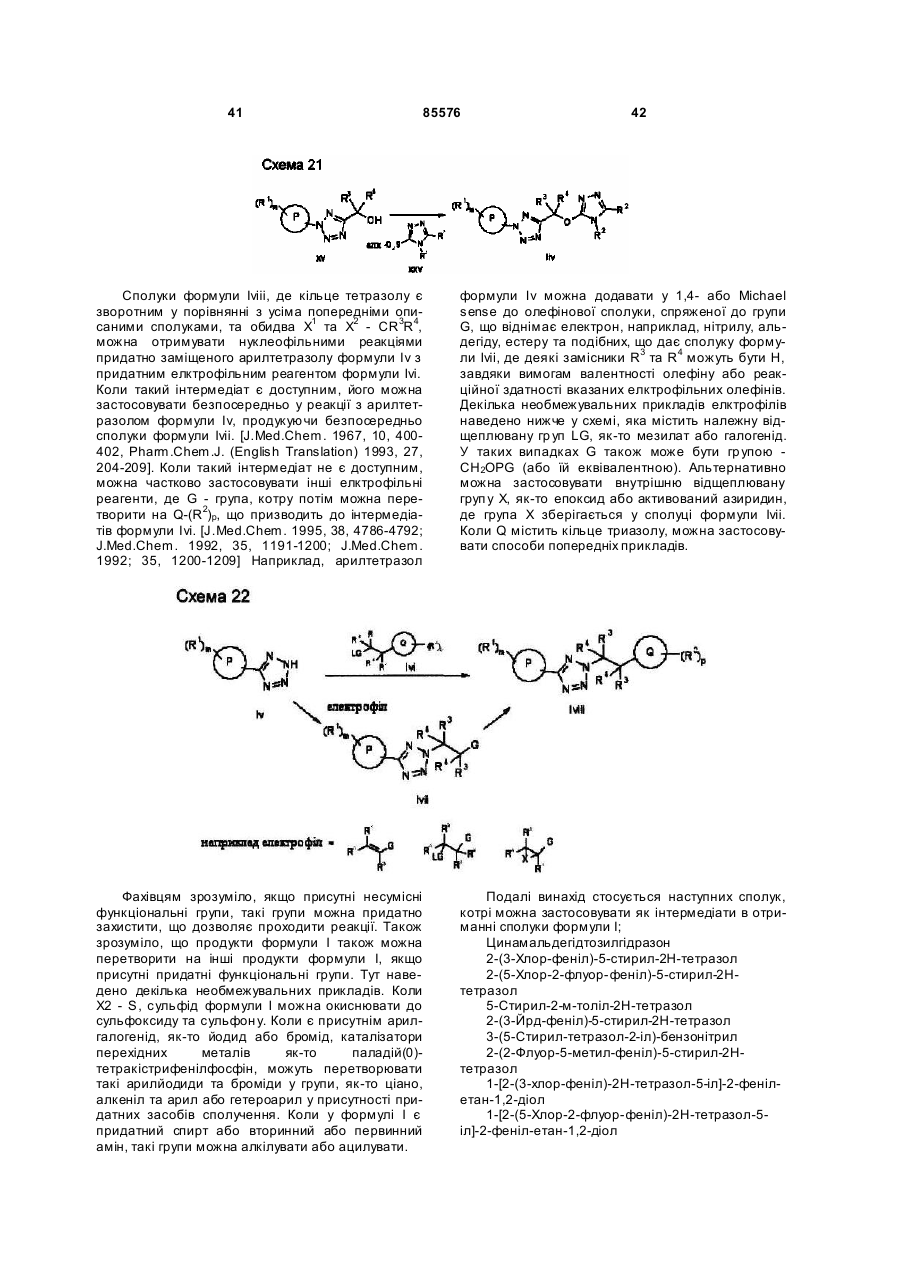
Тетразольні сполуки та їх застосування як метаботропічних антагоністів рецепторів глутамату
Номер патенту: 85576
Опубліковано: 10.02.2009
Автори: Сінь Тао, Мінідіс Александер, Маклеод Доналд, Едвардс Луіз, Стааф Карін, Айзек Метвін, Йохансон Мартін, Слессі Абделмалік, Венсбо Дейвід, О'Браен Енн
Формула / Реферат
1. Сполука формули І
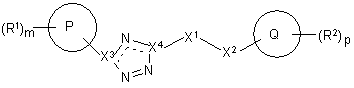 ,
,
де
Х3 та Х4 вибрано з N та С таким чином, що коли X3 - N, X4 – С, а коли X3 - С, X4 - N ;
Р вибрано з арилу та гетероарилу;
якщо m = 1, тоді R1 приєднано до Р через атом карбону на кільці Р у мета-позиції кільця Р відносно місця приєднання Р до X3, а якщо m = 2, тоді R1 приєднано до Р через атом карбону на кільці Р у 2- та 5-позиціях кільця Р;
R1 вибрано із групи: гідроксил, галоген, С1-6алкіл, С0-6алкілС3-6циклоалкіл, ціано, (CO)R5; С1-6алкілОR5, С0-6алкілціано, ОС0-6алкілNR5R6;
X1 вибрано із групи: С2-3алкіл, С2-3алкеніл, NR3, S, CR3R4, SO;
X2 вибрано із групи: зв'язок, CR3R4, О, S, NR3, SO;
R3 та R4 незалежно вибрано із групи: гідроген, гідроксил, С1-6алкіл, ОС1-4алкіл, С1-4алкілОR5;
Q або вибрано з триазолу, піперазину та імідазолу, або Q - будь-яке інше 5- або 6-членне гетероциклічне кільце, яке містить один або більше N атомів, та є конденсованим з триазольним кільцем;
R2 вибрано із групи: гідроксил, =NR5, С1-6алкіл, С3-6циклоалкіл, С0-6алкіларил, С0-6алкілгетероарил, (СО)OС1-4алкіл, С0-4алкілNR5R6 та 5- або 6-членне кільце, яке містить один або більше N атомів, це кільце може бути необов'язково конденсованим з 5- або 6-членним кільцем, яке містить один або більше N атомів, причому вказане кільце та вказане конденсоване кільце можуть бути заміщеними одним або більше А; а будь-який С1-6алкіл, арил або гетероарил, позначений R1, R2 та R3, може бути заміщеним одним або більше А; і
А вибрано із групи: гідроген, гідроксил, галоген, С0-6алкілціано, -ОС1-6алкіл, С0-4алкілС3-6циклоалкіл, С1-6алкіл,
R5 та R6 незалежно вибрано з групи: Н, С1-6алкіл,
m вибрано з 1 або 2,
р вибрано з 0, 1, 2 або 3; та
її солі та гідрати.
2. Сполука за п. 1, де X3 - N, а X4 - С.
3. Сполука за п. 1, де Р - арил.
4. Сполука за п. 3, де Р - феніл.
5. Сполука за п. 1, де R1 вибрано з групи: галоген, С1-6алкіл, С0-6алкілціано.
6. Сполука за п. 5, де R1 вибрано з групи: Сl, F, ціано та метил.
7. Сполука за п. 1, де X1 - CR3R4.
8. Сполука за п. 7, де X2 вибрано з групи: CR3R4, О, S та NR3.
9. Сполука за п. 1, де Q або вибрано з триазолу та піперазину, або Q - будь-яке інше 5- або 6-членне гетероциклічне кільце, яке містить один або більше N атомів, та є конденсованим з триазольним кільцем.
10. Сполука за п. 1, де Q -триазол.
11. Сполука за п. 1, де X2 - зв'язок.
12. Сполука за п. 1, де Q - піперазин.
13. Сполука за п. 1, де Q - 5- або 6-членне гетероциклічне кільце, що не є триазолом або піперазином та конденсоване з триазольним кільцем.
14. Сполука за п. 1, де R2 вибрано з групи: С1-6алкіл, С3-6циклоалкіл, С0-6алкіларил, С0-6алкілгетероарил, (СО)ОС1-4алкіл.
15. Сполука за п. 1, де R2 - 5- або 6-членне кільце, яке містить один або більше N атомів, це кільце може бути необов'язково конденсованим з 5- або 6-членним кільцем, яке містить один або більше N атомів, причому вказане кільце та вказане конденсоване кільце можуть бути заміщеними одним або більше А.
16. Сполука за п. 1, де А вибрано з групи: галоген, -ОС1-6алкіл.
17. Сполука за п. 1 вибрана із групи:
етил 4-{[2-(3-хлорфеніл)-2Н-тетразол-5-іл]метил}піперазин-1-карбоксилат,
4-[2-(5-хлор-2-флуорфеніл)-2Н-тетразол-5-ілметил]-піперазин-1-карбонової кислоти етиловий естер,
4-(2-мета-толіл-2Н-тетразол-5-ілметил)-піперазин-1-карбонової кислоти етиловий естер,
4-[2-(3-йодфеніл)-2Н-тетразол-5-ілметил]-піперазин-1-карбонової кислоти етиловий естер,
4-[2-(3-ціанофеніл)-2Н-тетразол-5-ілметил]-піперазин-1-карбонової кислоти етиловий естер,
4-[2-(2-флуор-5-метилфеніл)-2Н-тетразол-5-ілметил]-піперазин-1-карбонової кислоти етиловий естер,
4-[5-({[2-(3-хлорфеніл)-2Н-тетразол-5-іл]метил}тіо)-4-циклопропіл-4Н-1,2,4-триазол-3-іл]піридин,
4-[5-({1-[2-(3-хлорфеніл)-2Н-тетразол-5-іл]етил}тіо)-4-циклопропіл-4Н-1,2,4-триазол-3-іл]піридин,
етил 4-{1-[2-(3-хлорфеніл)-2Н-тетразол-5-іл]етил}піперазин-1-карбоксилат,
4-{5-[2-(5-хлор-2-флуорфеніл)-2Н-тетразол-5-ілметилсульфаніл]-4-метил-4Н-[1,2,4]триазол-3-іл}-піридин,
4-{5-[2-(5-хлор-2-флуорфеніл)-2Н-тетразол-5-ілметилсульфаніл]-4-циклопропіл-4Н-[1,2,4]триазол-3-іл}-піридин,
4-(5-{1-[2-(5-хлор-2-флуорфеніл)-2Н-тетразол-5-іл]-етилсульфаніл}-4-метил-4Н-[1,2,4]триазол-3-іл)-піридин,
4-(5-{1-[2-(5-хлор-2-флуорфеніл)-2Н-тетразол-5-іл]-етилсульфаніл}-4-циклопропіл-4Н-[1,2,4]триазол-3-іл)-піридин,
4-{1-[2-(5-хлор-2-флуорфеніл)-2Н-тетразол-5-іл]-етил}-піперазин-1-карбонової кислоти етиловий естер,
4-[4-циклопропіл-5-(2-мета-толіл-2Н-тетразол-5-ілметилсульфаніл)-4Н-[1,2,4]триазол-3-іл]-піридин,
4-{4-циклопропіл-5-[1-(2-мета-толіл-2Н-тетразол-5-іл)-етилсульфаніл]-4Н-[1,2,4]триазол-3-іл}-піридин,
4-{4-метил-5-[1-(2-мета-толіл-2Н-тетразол-5-іл)-етилсульфаніл]-4Н-[1,2,4]триазол-3-іл}-піридин,
3-[5-(4-циклопропіл-5-піридин-4-іл-4Н-[1,2,4]триазол-3-ілсульфанілметил)-тетразол-2-іл]-бензонітрил,
3-{5-[1-(4-циклопропіл-5-піридин-4-іл-4Н-[1,2,4]триазол-3-ілсульфаніл)-етил]-тетразол-2-іл}-бензонітрил,
3-{5-[1-(4-метил-5-піридин-4-іл-4Н-[1,2,4]триазол-3-ілсульфаніл)-етил]-тетразол-2-іл}-бензонітрил,
4-{4-циклопропіл-5-[2-(2-флуор-5-метилфеніл)-2Н-тетразол-5-ілметилсульфаніл]-4Н-[1,2,4]триазол-3-іл}-піридин,
4-(4-циклопропіл-5-{1-[2-(2-флуор-5-метилфеніл)-2Н-тетразол-5-іл]-етилсульфаніл}-4Н-[1,2,4]триазол-3-іл)-піридин,
4-(5-{1-[2-(2-флуор-5-метилфеніл)-2Н-тетразол-5-іл]-етилсульфаніл}-4-метил-4Н-[1,2,4]триазол-3-іл)-піридин,
метил-(4-метил-5-піридин-4-іл-4Н-[1,2,4]триазол-3-іл)-(2-мета-толіл-2Н-тетразол-5-ілметил)-амін,
метил-(4-метил-5-піридин-4-іл-4Н-[1,2,4]триазол-3-іл)-[1-(2-мета-толіл-2Н-тетразол-5-іл)-етил]-амін,
[2-(3-хлорфеніл)-2Н-тетразол-5-ілметил]-метил-(4-метил-5-піридин-4-іл-4Н-[1,2,4]триазол-3-іл)-амін,
{1-[2-(3-хлорфеніл)-2Н-тетразол-5-іл]-етил}-метил-(4-метил-5-піридин-4-іл-4Н-[1,2,4]триазол-3-іл)-амін,
[2-(2-флуор-5-метилфеніл)-2Н-тетразол-5-ілметил]-метил-(4-метил-5-піридин-4-іл-4Н-[1,2,4]триазол-3-іл)-амін,
{1-[2-(2-флуор-5-метилфеніл)-2Н-тетразол-5-іл]-етил}-метил-(4-метил-5-піридин-4-іл-4Н-[1,2,4]триазол-3-іл)-амін,
[2-(3-йодфеніл)-2Н-тетразол-5-ілметил]-метил-(4-метил-5-піридин-4-іл-4Н-[1,2,4]триазол-3-іл)-амін,
{1-[2-(3-йодфеніл)-2Н-тетразол-5-іл]-етил}-метил-(4-метил-5-піридин-4-іл-4Н-[1,2,4]триазол-3-іл)-амін,
метил-(4-метил-5-піридин-4-іл-4Н-[1,2,4]триазол-3-іл)-(2-мета-толіл-2Н-тетразол-5-ілметил)-амін,
метил-(4-метил-5-піридин-4-іл-4Н-[1,2,4]триазол-3-іл)-[1-(2-мета-толіл-2Н-тетразол-5-іл)-етил]-амін,
[2-(3-хлорфеніл)-2Н-тетразол-5-ілметил]-метил-(4-метил-5-піридин-4-іл-4Н-[1,2,4]триазол-3-іл)-амін,
{1-[2-(3-хлорфеніл)-2Н-тетразол-5-іл]-етил}-метил-(4-метил-5-піридин-4-іл-4Н-[1,2,4]триазол-3-іл)-амін,
[2-(2-флуор-5-метилфеніл)-2Н-тетразол-5-ілметил]-метил-(4-метил-5-піридин-4-іл-4Н-[1,2,4]триазол-3-іл)-амін,
{1-[2-(2-флуор-5-метилфеніл)-2Н-тетразол-5-іл]-етил}-метил-(4-метил-5-піридин-4-іл-4Н-[1,2,4]триазол-3-іл)-амін,
8-[2-(3-йодфеніл)-2Н-тетразол-5-ілметил]-3-піридин-4-іл-5,6,7,8-тетрагідро-[1,2,4]триазоло[4,3-а]піримідин,
8-{1-[2-(3-йодфеніл)-2Н-тетразол-5-іл]-етил}-3-піридин-4-іл-5,6,7,8-тетрагідро-[1,2,4]триазоло[4,3-а]піримідин,
3-піридин-4-іл-8-(2-мета-толіл-2Н-тетразол-5-ілметил)-5,6,7,8-тетрагідро-4Н-1,2,3а,8-тетраазаазулен,
3-піридин-4-іл-8-[1-(2-мета-толіл-2Н-тетразол-5-іл)-етил]-5,6,7,8-тетрагідро-4Н-1,2,3а,8-тетраазаазулен,
8-[2-(3-хлорфеніл)-2Н-тетразол-5-ілметил]-3-піридин-4-іл-5,6,7,8-тетрагідро-4Н-1,2,3а,8-тетраазаазулен,
8-{1-[2-(3-хлорфеніл)-2Н-тетразол-5-іл]-етил}-3-піридин-4-іл-5,6,7,8-тетрагідро-4Н-1,2,3а,8-тетраазаазулен,
8-[2-(2-флуор-5-метилфеніл)-2Н-тетразол-5-ілметил]-3-піридин-4-іл-5,6,7,8-тетрагідро-4Н-1,2,За,8-тетраазаазулен,
8-{1-[2-(2-флуор-5-метилфеніл)-2Н-тетразол-5-іл]-етил}-3-піридин-4-іл-5,6,7,8-тетрагідро-4Н-1,2,3а,8-тетраазаазулен,
8-[2-(3-йодфеніл)-2Н-тетразол-5-ілметил]-3-піридин-4-іл-5,6,7,8-тетрагідро-4Н-1,2,3а,8-тетраазаазулен,
8-{1-[2-(3-йодфеніл)-2Н-тетразол-5-іл]-етил}-3-піридин-4-іл-5,6,7,8-тетрагідро-4Н-1,2,3а,8-тетраазаазулен,
4-(5-{[2-(3-хлорфеніл)-2Н-тетразол-5-іл]метокси}-4-метил-4Н-1,2,4-триазол-3-іл)піридин,
4-(5-{1-[2-(3-хлорфеніл)-2Н-тетразол-5-іл]етокси}-4-метил-4Н-1,2,4-триазол-3-іл)піридин,
4-[4-метил-5-(2-мета-толіл-2Н-тетразол-5-ілметокси)-4Н-[1,2,4]триазол-3-іл]-піридин,
4-{4-метил-5-[1-(2-мета-толіл-2Н-тетразол-5-іл)-етокси]-4Н-[1,2,4]триазол-3-іл}-піридин,
4-{5-[2-(2-флуор-5-метилфеніл)-2Н-тетразол-5-ілметокси]-4-метил-4Н-[1,2,4]триазол-3-іл}-піридин,
4-(5-{1-[2-(2-флуор-5-метилфеніл)-2Н-тетразол-5-іл]-етокси}-4-метил-4Н-[1,2,4]триазол-3-іл)-піридин,
4-{5-[2-(3-хлорфеніл)-2Н-тетразол-5-ілметокси]-4-циклопропіл-4Н-[1,2,4]триазол-3-іл}-піридин,
4-(5-{1-[2-(3-хлорфеніл)-2Н-тетразол-5-іл]-етокси}-4-циклопропіл-4Н-[1,2,4]триазол-3-іл)-піридин,
4-[4-циклопропіл-5-(2-мета-толіл-2Н-тетразол-5-ілметокси)-4Н-[1,2,4]триазол-3-іл]-піридин,
4-{4-циклопропіл-5-[1-(2-мета-толіл-2Н-тетразол-5-іл)-етокси]-4Н-[1,2,4]триазол-3-іл}-піридин,
4-{4-циклопропіл-5-[2-(2-флуор-5-метилфеніл)-2Н-тетразол-5-ілметокси]-4Н-[1,2,4]триазол-3-іл}-піридин,
4-(4-циклопропіл-5-{1-[2-(2-флуор-5-метилфеніл)-2Н-тетразол-5-іл]-етокси}-4Н-[1,2,4]триазол-3-іл)-піридин,
4-{5-[2-(3-йодфеніл)-2Н-тетразол-5-ілметокси]-4-метил-4Н-[1,2,4]триазол-3-іл}-піридин,
4-(5-{1-[2-(3-йодфеніл)-2Н-тетразол-5-іл]-етокси}-4-метил-4Н-[1,2,4]триазол-3-іл)-піридин,
4-{4-циклопропіл-5-[2-(3-йодфеніл)-2Н-тетразол-5-ілметокси]-4Н-[1,2,4]триазол-3-іл}-піридин,
4-(4-циклопропіл-5-{1-[2-(3-йодфеніл)-2Н-тетразол-5-іл]-етокси}-4Н-[1,2,4]триазол-3-іл)-піридин,
3-[5-(4-метил-5-піридин-4-іл-4Н-[1,2,4]триазол-3-ілоксиметил)-тетразол-2-іл]-бензонітрил,
3-{5-[1-(4-метил-5-піридин-4-іл-4Н-[1,2,4]триазол-3-ілоксі)-етил]-тетразол-2-іл}-бензонітрил,
3-[5-(4-циклопропіл-5-піридин-4-іл-4Н-[1,2,4]триазол-3-ілоксиметил)-тетразол-2-іл]-бензонітрил,
3-{5-[1-(4-циклопропіл-5-піридин-4-іл-4Н-[1,2,4]триазол-3-ілоксі)-етил]-тетразол-2-іл}-бензонітрил,
3-(5-{[метил-(4-метил-5-піридин-4-іл-4Н-[1,2,4]триазол-3-іл)-аміно]-метил}-тетразол-2-іл)-бензонітрил,
3-(5-{1-[метил-(4-метил-5-піридин-4-іл-4Н-[1,2,4]триазол-3-іл)-аміно]-етил}-тетразол-2-іл)-бензонітрил,
3-[5-(3-піридин-4-іл-6,7-дигідро-5Н-[1,2,4]триазоло[4,3-а]піримідин-8-ілметил)-тетразол-2-іл]-бензонітрил,
3-{5-[1-(3-піридин-4-іл-6,7-дигідро-5Н-[1,2,4]триазоло[4,3-а]піримідин-8-іл)-етил]-тетразол-2-іл}-бензонітрил,
3-[5-(3-піридин-4-іл-4,5,6,7-тетрагідро-1,2,3а,8-тетраазаазулен-8-ілметил)-тетразол-2-іл]-бензонітрил,
3-{5-[1-(3-піридин-4-іл-4,5,6,7-тетрагідро-1,2,3а,8-тетраазаазулен-8-іл)-етил]-тетразол-2-іл}-бензонітрил,
(R)- та (S)-4-(5-{1-[2-(3-хлорфеніл)-2Н-тетразол-5-іл]етокси}-4-метил-4Н-1,2,4-триазол-3-іл)піридин,
2-(3-хлорфеніл)-5-[(трифеніл-![]() -фосфаніл)-метил]-2Н-тетразол гідробромід,
-фосфаніл)-метил]-2Н-тетразол гідробромід,
4-(5-{2-[2-(3-хлорфеніл)-2Н-тетразол-5-іл]-вініл}-4-етил-4Н-[1,2,4]триазол-3-іл)-піридин,
4-(5-{2-[2-(3-хлорфеніл)-2Н-тетразол-5-іл]-вініл}-4-етил-4Н-[1,2,4]триазол-3-іл)-піридин,
1-[2-(3-хлорфеніл)-2Н-тетразол-5-іл]-2-(4-циклопропіл-5-піридин-4-іл-4Н-[1,2,4]триазол-3-іл)-етанол,
2-[2-(3-хлорфеніл)-2Н-тетразол-5-іл]-1-(4-циклопропіл-5-піридин-4-іл-4Н-[1,2,4]триазол-3-іл)-етанол,
4-(5-{2-[2-(3-хлорфеніл)-2Н-тетразол-5-іл]-вініл}-4-етил-4Н-[1,2,4]триазол-3-іл)-піридин,
3-[4-метил-5-({[2-(3-метилфеніл)-2Н-тетразол-5-іл]метил}тіо)-4Н-1,2,4-триазол-3-іл]бензонітрил,
5-({[5-(3,5-дифлуорфеніл)-4-етил-4Н-1,2,4-триазол-3-іл]тіо}метил)-2-(3-метилфеніл)-2Н-тетразол,
3-[4-метил-5-({1-[2-(3-метилфеніл)-2Н-тетразол-5-іл]етил}тіо)-4Н-1,2,4-триазол-3-іл]бензонітрил,
5-(1-{[5-(3,5-дифлуорфеніл)-4-етил-4Н-1,2,4-триазол-3-іл]тіо}етил)-2-(3-метилфеніл)-2Н-тетразол,
6-(4-{1-[2-(3-хлорфеніл)-2Н-тетразол-5-іл]етил}піперазин-1-іл)нікотинонітрил,
3-(4-{1-[2-(3-хлорфеніл)-2Н-тетразол-5-іл]етил}піперазин-1-іл)піразин-2-карбонітрил,
2-(4-{1-[2-(3-хлорфеніл)-2Н-тетразол-5-іл]етил}піперазин-1-іл)нікотинонітрил,
1-{1-[2-(3-хлорфеніл)-2Н-тетразол-5-іл]етил}-4-(3-нітропіридин-2-іл)піперазин,
8-{1-[2-(3-хлорфеніл)-2Н-тетразол-5-іл]етил}-3-(3,5-дифлуорфеніл)-5,6,7,8-тетрагідро[1,2,4]триазоло[4,3-а]піримідин,
8-{1-[2-(3-хлорфеніл)-2Н-тетразол-5-іл]етил}-3-(4-метоксифеніл)-5,6,7,8-тетрагідро[1,2,4]триазоло[4,3-а]піримідин,
3-(2-хлор-6-метоксипіридин-4-іл)-8-{1-[2-(3-хлорфеніл)-2Н-тетразол-5-іл]етил}-5,6,7,8-тетрагідро[1,2,4]триазоло[4,3-а]піримідин,
8-{1-[2-(3-хлорфеніл)-2Н-тетразол-5-іл]етил}-3-(2-метоксипіридин-4-іл)-5,6,7,8-тетрагідро[1,2,4]триазоло[4,3-а]піримідин,
8-{[2-(3-хлорфеніл)-2Н-тетразол-5-іл]метил}-3-(2-метоксипіридин-4-іл)-5,6,7,8-тетрагідро[1,2,4]триазоло[4,3-а]піримідин,
3-(5-{[3-(2-метоксипіридин-4-іл)-6,7-дигідро[1,2,4]триазоло[4,3-а]піримідин-8(5Н)-іл]метил}-2Н-тетразол-2-іл)бензонітрил,
3-(2-метоксипіридин-4-іл)-8-{1-[2-(3-йодфеніл)-2Н-тетразол-5-іл]етил}-5,6,7,8-тетрагідро[1,2,4]триазоло[4,3-а]піримідин,
3-(5-{1-[3-(2-метоксипіридин-4-іл)-6,7-дигідро[1,2,4]триазоло[4,3-а]піримідин-8(5Н)-іл]етил}-2Н-тетразол-2-іл)бензонітрил,
3-(5-{[3-(2-метоксипіридин-4-іл)-5,6,7,8-тетрагідро-9Н-[1,2,4]триазоло[4,3-а][1,3]діазепін-9-іл]метил}-2Н-тетразол-2-іл)бензонітрил,
3-(5-{[3-(2,6-диметоксипіримідин-4-іл)-6,7-дигідро[1,2,4]триазоло[4,3-а]піримідин-8(5Н)-іл]метил}-2Н-тетразол-2-іл)бензонітрил,
(R)-3-(5-{1-[3-(2-метоксипіридин-4-іл)-6,7-дигідро[1,2,4]триазоло[4,3-а]піримідин-8(5Н)-іл]етил}-2Н-тетразол-2-іл)бензонітрил,
(S)-3-(5-{1-[3-(2-метоксипіридин-4-іл)-6,7-дигідро[1,2,4]триазоло[4,3-а]піримідин-8(5Н)-іл]етил}-2Н-тетразол-2-іл)бензонітрил,
(R)-етил 4-{1-[2-(3-хлорфеніл)-2Н-тетразол-5-іл]етил}піперазин-1-карбоксилат,
(S)-етил 4-{1-[2-(3-хлорфеніл)-2Н-тетразол-5-іл]етил}піперазин-1-карбоксилат,
(R)-етил 4-{1-[2-(5-хлор-2-флуорфеніл)-2Н-тетразол-5-іл]етил}піперазин-1-карбоксилат,
(S)-етил 4-{1-[2-(5-хлор-2-флуорфеніл)-2Н-тетразол-5-іл]етил}піперазин-1-карбоксилат,
(R)-6-(4-{1-[2-(3-хлорфеніл)-2Н-тетразол-5-іл]етил}піперазин-1-іл)нікотинонітрил,
(S)-6-(4-{1-[2-(3-хлорфеніл)-2Н-тетразол-5-іл]етил}піперазин-1-іл)нікотинонітрил,
(R)-3-(4-{1-[2-(3-хлорфеніл)-2Н-тетразол-5-іл]етил}піперазин-1-іл)піразин-2-карбонітрил,
(S)-3-(4-{1-[2-(3-хлорфеніл)-2Н-тетразол-5-іл]етил}піперазин-1-іл)піразин-2-карбонітрил,
4-(5-{(S)-1-[2-(3-хлорфеніл)-2Н-тетразол-5-іл]-етокси}-4-метил-4Н-[1,2,4]триазол-3-іл)-піридин,
2-(3-хлорфеніл)-5-{(R)-1-[5-(3,5-дифлуорфеніл)-4-метил-4Н-[1,2,4]триазол-3-ілоксі]-етил}-2Н-тетразол,
3-(5-{(R)-1-[2-(3-хлорфеніл)-2Н-тетразол-5-іл]-етокси}-4-метил-4Н-[1,2,4]триазол-3-іл)-піридин,
4-(5-{2-[5-(3-хлорфеніл)-2Н-тетразол-2-іл]пропіл}-4-метил-4Н-1,2,4-триазол-3-іл)піридин,
4-(5-{(R)-1-[2-(3-хлорфеніл)-2Н-тетразол-5-іл]-етокси}-4-метил-4Н-[1,2,4]триазол-3-іл)-піридин,
2-(3-хлорфеніл)-5-[1-метил-2-фенілвініл]-2Н-тетразол та
2-({1-[2-(3-хлорфеніл)-2Н-тетразол-5-іл]етил}тіо)-імідазо[4,5-b]піридин.
18. Фармацевтична композиція, яка містить як активний інгредієнт терапевтично ефективну кількість сполуки за будь-яким з пп. 1-17 в асоціації з одним або більше фармацевтично прийнятними розріджувачами, наповнювачами та/або інертними носіями.
19. Фармацевтична композиція за п. 18 для застосування у лікуванні розладів, опосередкованих mGluR5.
20. Сполука за будь-яким з пп. 1-17 для застосування у терапії.
21. Сполука за будь-яким з пп. 1-17 для застосування в лікуванні розладів, опосередкованих mGluR5.
22. Застосування сполуки за будь-яким з пп. 1-17 у виробництві медикаменту для лікування розладів, опосередкованих mGluR5.
23. Спосіб лікування розладів, опосередкованих mGluR5, в якому вводять ссавцю, включаючи людину, що потребує такого лікування, терапевтично ефективну кількість сполуки за будь-яким з пп. 1-17.
24. Спосіб за п. 23 для застосування у лікуванні неврологічних розладів.
25. Спосіб за п. 23 для застосування у лікуванні психіатричних розладів.
26. Спосіб за п. 23 для застосування у лікуванні хронічних та гострих больових розладів.
27. Спосіб за п. 23 для застосування у лікуванні шлунково-кишкових розладів.
28. Спосіб інгібування активації рецепторів mGluR5, в якому діють на клітини, які містять вказаний рецептор, ефективною кількістю сполуки за пп. 1-17.
Текст
1. Сполука формули І C2 2 (19) 1 3 85576 6. Сполука за п.5, де R1 вибрано з групи: Сl, F, ціано та метил. 7. Сполука за п.1, де X1 - CR 3R4 . 8. Сполука за п.7, де X2 вибрано з групи: CR3R4, О, S та NR3. 9. Сполука за п.1, де Q або вибрано з триазолу та піперазину, або Q - будь-яке інше 5- або 6-членне гетероциклічне кільце, яке містить один або більше N атомів, та є конденсованим з триазольним кільцем. 10. Сполука за п.1, де Q -триазол. 11. Сполука за п.1, де X2 - зв'язок. 12. Сполука за п.1, де Q - піперазин. 13. Сполука за п.1, де Q - 5- або 6-членне гетероциклічне кільце, що не є триазолом або піперазином та конденсоване з триазольним кільцем. 14. Сполука за п.1, де R2 вибрано з групи: С1С3-6циклоалкіл, С0-6алкіларил, С06алкіл, 6алкілгетероарил, (СО)ОС 1-4алкіл. 2 15. Сполука за п.1, де R - 5- або 6-членне кільце, яке містить один або більше N атомів, це кільце може бути необов'язково конденсованим з 5- або 6-членним кільцем, яке містить один або більше N атомів, причому вказане кільце та вказане конденсоване кільце можуть бути заміщеними одним або більше А. 16. Сполука за п.1, де А вибрано з групи: галоген, ОС1-6алкіл. 17. Сполука за п.1 вибрана із групи: етил 4-{[2-(3-хлорфеніл)-2Н-тетразол-5іл]метил}піперазин-1-карбоксилат, 4-[2-(5-хлор-2-флуор феніл)-2Н-тетразол-5ілметил]-піперазин-1-карбонової кислоти етиловий естер, 4-(2-мета-толіл-2Н-тетразол-5-ілметил)-піперазин1-карбонової кислоти етиловий естер, 4-[2-(3-йодфеніл)-2Н-тетразол-5-ілметил]піперазин-1-карбонової кислоти етиловий естер, 4-[2-(3-ціанофеніл)-2Н-тетразол-5-ілметил]піперазин-1-карбонової кислоти етиловий естер, 4-[2-(2-флуор-5-метилфеніл)-2Н-тетразол-5ілметил]-піперазин-1-карбонової кислоти етиловий естер, 4-[5-({[2-(3-хлорфеніл)-2Н-тетразол-5-іл]метил}тіо)4-циклопропіл-4Н-1,2,4-триазол-3-іл]піридин, 4-[5-({1-[2-(3-хлорфеніл)-2Н-тетразол-5іл]етил}тіо)-4-циклопропіл-4Н-1,2,4-триазол-3іл]піридин, етил 4-{1-[2-(3-хлорфеніл)-2Н-тетразол-5іл]етил}піперазин-1-карбоксилат, 4-{5-[2-(5-хлор-2-флуорфеніл)-2Н-тетразол-5ілметилсульфаніл]-4-метил-4Н-[1,2,4]триазол-3іл}-піридин, 4-{5-[2-(5-хлор-2-флуорфеніл)-2Н-тетразол-5ілметилсульфаніл]-4-циклопропіл-4Н[1,2,4]триазол-3-іл}-піридин, 4-(5-{1-[2-(5-хлор-2-флуорфеніл)-2Н-тетразол-5іл]-етилсульфаніл}-4-метил-4Н-[1,2,4]триазол-3іл)-піридин, 4-(5-{1-[2-(5-хлор-2-флуорфеніл)-2Н-тетразол-5іл]-етилсульфаніл}-4-циклопропіл-4Н[1,2,4]триазол-3-іл)-піридин, 4-{1-[2-(5-хлор-2-флуорфеніл)-2Н-тетразол-5-іл]етил}-піперазин-1-карбонової кислоти етиловий естер, 4 4-[4-циклопропіл-5-(2-мета-толіл-2Н-тетразол-5ілметилсульфаніл)-4Н-[1,2,4]триазол-3-іл]-піридин, 4-{4-циклопропіл-5-[1-(2-мета-толіл-2Н-тетразол-5іл)-етилсульфаніл]-4Н-[1,2,4]триазол-3-іл}-піридин, 4-{4-метил-5-[1-(2-мета-толіл-2Н-тетразол-5-іл)етилсульфаніл]-4Н-[1,2,4]триазол-3-іл}-піридин, 3-[5-(4-циклопропіл-5-піридин-4-іл-4Н[1,2,4]триазол-3-ілсульфанілметил)-тетразол-2-іл]бензонітрил, 3-{5-[1-(4-циклопропіл-5-піридин-4-іл-4Н[1,2,4]триазол-3-ілсульфаніл)-етил]-тетразол-2-іл}бензонітрил, 3-{5-[1-(4-метил-5-піридин-4-іл-4Н-[1,2,4]триазол-3ілсульфаніл)-етил]-тетразол-2-іл}-бензонітрил, 4-{4-циклопропіл-5-[2-(2-флуор-5-метилфеніл)-2Нтетразол-5-ілметилсульфаніл]-4Н-[1,2,4]триазол-3іл}-піридин, 4-(4-циклопропіл-5-{1-[2-(2-флуор-5-метилфеніл)2Н-тетразол-5-іл]-етилсульфаніл}-4Н[1,2,4]триазол-3-іл)-піридин, 4-(5-{1-[2-(2-флуор-5-метилфеніл)-2Н-тетразол-5іл]-етилсульфаніл}-4-метил-4Н-[1,2,4]триазол-3іл)-піридин, метил-(4-метил-5-піридин-4-іл-4Н-[1,2,4]триазол-3іл)-(2-мета-толіл-2Н-тетразол-5-ілметил)-амін, метил-(4-метил-5-піридин-4-іл-4Н-[1,2,4]триазол-3іл)-[1-(2-мета-толіл-2Н-тетразол-5-іл)-етил]-амін, [2-(3-хлорфеніл)-2Н-тетразол-5-ілметил]-метил-(4метил-5-піридин-4-іл-4Н-[1,2,4]триазол-3-іл)-амін, {1-[2-(3-хлорфеніл)-2Н-тетразол-5-іл]-етил}-метил(4-метил-5-піридин-4-іл-4Н-[1,2,4]триазол-3-іл)амін, [2-(2-флуор-5-метилфеніл)-2Н-тетразол-5ілметил]-метил-(4-метил-5-піридин-4-іл-4Н[1,2,4]триазол-3-іл)-амін, {1-[2-(2-флуор-5-метилфеніл)-2Н-тетразол-5-іл]етил}-метил-(4-метил-5-піридин-4-іл-4Н[1,2,4]триазол-3-іл)-амін, [2-(3-йодфеніл)-2Н-тетразол-5-ілметил]-метил-(4метил-5-піридин-4-іл-4Н-[1,2,4]триазол-3-іл)-амін, {1-[2-(3-йодфеніл)-2Н-тетразол-5-іл]-етил}-метил(4-метил-5-піридин-4-іл-4Н-[1,2,4]триазол-3-іл)амін, метил-(4-метил-5-піридин-4-іл-4Н-[1,2,4]триазол-3іл)-(2-мета-толіл-2Н-тетразол-5-ілметил)-амін, метил-(4-метил-5-піридин-4-іл-4Н-[1,2,4]триазол-3іл)-[1-(2-мета-толіл-2Н-тетразол-5-іл)-етил]-амін, [2-(3-хлорфеніл)-2Н-тетразол-5-ілметил]-метил-(4метил-5-піридин-4-іл-4Н-[1,2,4]триазол-3-іл)-амін, {1-[2-(3-хлорфеніл)-2Н-тетразол-5-іл]-етил}-метил(4-метил-5-піридин-4-іл-4Н-[1,2,4]триазол-3-іл)амін, [2-(2-флуор-5-метилфеніл)-2Н-тетразол-5ілметил]-метил-(4-метил-5-піридин-4-іл-4Н[1,2,4]триазол-3-іл)-амін, {1-[2-(2-флуор-5-метилфеніл)-2Н-тетразол-5-іл]етил}-метил-(4-метил-5-піридин-4-іл-4Н[1,2,4]триазол-3-іл)-амін, 8-[2-(3-йодфеніл)-2Н-тетразол-5-ілметил]-3піридин-4-іл-5,6,7,8-тетрагідро-[1,2,4]триазоло[4,3а]піримідин, 8-{1-[2-(3-йодфеніл)-2Н-тетразол-5-іл]-етил}-3піридин-4-іл-5,6,7,8-тетрагідро-[1,2,4]триазоло[4,3а]піримідин, 5 85576 3-піридин-4-іл-8-(2-мета-толіл-2Н-тетразол-5ілметил)-5,6,7,8-тетрагідро-4Н-1,2,3а,8тетраазаазулен, 3-піридин-4-іл-8-[1-(2-мета-толіл-2Н-тетразол-5-іл)етил]-5,6,7,8-тетрагідро-4Н-1,2,3а,8тетраазаазулен, 8-[2-(3-хлорфеніл)-2Н-тетразол-5-ілметил]-3піридин-4-іл-5,6,7,8-тетрагідро-4Н-1,2,3а,8тетраазаазулен, 8-{1-[2-(3-хлорфеніл)-2Н-тетразол-5-іл]-етил}-3піридин-4-іл-5,6,7,8-тетрагідро-4Н-1,2,3а,8тетраазаазулен, 8-[2-(2-флуор-5-метилфеніл)-2Н-тетразол-5ілметил]-3-піридин-4-іл-5,6,7,8-тетрагідро-4Н1,2,За,8-тетраазаазулен, 8-{1-[2-(2-флуор-5-метилфеніл)-2Н-тетразол-5-іл]етил}-3-піридин-4-іл-5,6,7,8-тетрагідро-4Н-1,2,3а,8тетраазаазулен, 8-[2-(3-йодфеніл)-2Н-тетразол-5-ілметил]-3піридин-4-іл-5,6,7,8-тетрагідро-4Н-1,2,3а,8тетраазаазулен, 8-{1-[2-(3-йодфеніл)-2Н-тетразол-5-іл]-етил}-3піридин-4-іл-5,6,7,8-тетрагідро-4Н-1,2,3а,8тетраазаазулен, 4-(5-{[2-(3-хлорфеніл)-2Н-тетразол-5-іл]метокси}-4метил-4Н-1,2,4-триазол-3-іл)піридин, 4-(5-{1-[2-(3-хлорфеніл)-2Н-тетразол-5-іл]етокси}4-метил-4Н-1,2,4-триазол-3-іл)піридин, 4-[4-метил-5-(2-мета-толіл-2Н-тетразол-5ілметокси)-4Н-[1,2,4]триазол-3-іл]-піридин, 4-{4-метил-5-[1-(2-мета-толіл-2Н-тетразол-5-іл)етокси]-4Н-[1,2,4]триазол-3-іл}-піридин, 4-{5-[2-(2-флуор-5-метилфеніл)-2Н-тетразол-5ілметокси]-4-метил-4Н-[1,2,4]триазол-3-іл}-піридин, 4-(5-{1-[2-(2-флуор-5-метилфеніл)-2Н-тетразол-5іл]-етокси}-4-метил-4Н-[1,2,4]триазол-3-іл)-піридин, 4-{5-[2-(3-хлорфеніл)-2Н-тетразол-5-ілметокси]-4циклопропіл-4Н-[1,2,4]триазол-3-іл}-піридин, 4-(5-{1-[2-(3-хлорфеніл)-2Н-тетразол-5-іл]-етокси}4-циклопропіл-4Н-[1,2,4]триазол-3-іл)-піридин, 4-[4-циклопропіл-5-(2-мета-толіл-2Н-тетразол-5ілметокси)-4Н-[1,2,4]триазол-3-іл]-піридин, 4-{4-циклопропіл-5-[1-(2-мета-толіл-2Н-тетразол-5іл)-етокси]-4Н-[1,2,4]триазол-3-іл}-піридин, 4-{4-циклопропіл-5-[2-(2-флуор-5-метилфеніл)-2Нтетразол-5-ілметокси]-4Н-[1,2,4]триазол-3-іл}піридин, 4-(4-циклопропіл-5-{1-[2-(2-флуор-5-метилфеніл)2Н-тетразол-5-іл]-етокси}-4Н-[1,2,4]триазол-3-іл)піридин, 4-{5-[2-(3-йодфеніл)-2Н-тетразол-5-ілметокси]-4метил-4Н-[1,2,4]триазол-3-іл}-піридин, 4-(5-{1-[2-(3-йодфеніл)-2Н-тетразол-5-іл]-етокси}-4метил-4Н-[1,2,4]триазол-3-іл)-піридин, 4-{4-циклопропіл-5-[2-(3-йодфеніл)-2Н-тетразол-5ілметокси]-4Н-[1,2,4]триазол-3-іл}-піридин, 4-(4-циклопропіл-5-{1-[2-(3-йодфеніл)-2Н-тетразол5-іл]-етокси}-4Н-[1,2,4]триазол-3-іл)-піридин, 3-[5-(4-метил-5-піридин-4-іл-4Н-[1,2,4]триазол-3ілоксиметил)-тетразол-2-іл]-бензонітрил, 3-{5-[1-(4-метил-5-піридин-4-іл-4Н-[1,2,4]триазол-3ілоксі)-етил]-тетразол-2-іл}-бензонітрил, 3-[5-(4-циклопропіл-5-піридин-4-іл-4Н[1,2,4]триазол-3-ілоксиметил)-тетразол-2-іл]бензонітрил, 6 3-{5-[1-(4-циклопропіл-5-піридин-4-іл-4Н[1,2,4]триазол-3-ілоксі)-етил]-тетразол-2-іл}бензонітрил, 3-(5-{[метил-(4-метил-5-піридин-4-іл-4Н[1,2,4]триазол-3-іл)-аміно]-метил}-тетразол-2-іл)бензонітрил, 3-(5-{1-[метил-(4-метил-5-піридин-4-іл-4Н[1,2,4]триазол-3-іл)-аміно]-етил}-тетразол-2-іл)бензонітрил, 3-[5-(3-піридин-4-іл-6,7-дигідро-5Н[1,2,4]триазоло[4,3-а]піримідин-8-ілметил)тетразол-2-іл]-бензонітрил, 3-{5-[1-(3-піридин-4-іл-6,7-дигідро-5Н[1,2,4]триазоло[4,3-а]піримідин-8-іл)-етил]тетразол-2-іл}-бензонітрил, 3-[5-(3-піридин-4-іл-4,5,6,7-тетрагідро-1,2,3а,8тетраазаазулен-8-ілметил)-тетразол-2-іл]бензонітрил, 3-{5-[1-(3-піридин-4-іл-4,5,6,7-тетрагідро-1,2,3а,8тетраазаазулен-8-іл)-етил]-тетразол-2-іл}бензонітрил, (R)- та (S)-4-(5-{1-[2-(3-хлорфеніл)-2Н-тетразол-5іл]етокси}-4-метил-4Н-1,2,4-триазол-3-іл)піридин, 2-(3-хлорфеніл)-5-[(трифеніл- l 5 -фосфаніл)метил]-2Н-тетразол гідробромід, 4-(5-{2-[2-(3-хлорфеніл)-2Н-тетразол-5-іл]-вініл}-4етил-4Н-[1,2,4]триазол-3-іл)-піридин, 4-(5-{2-[2-(3-хлорфеніл)-2Н-тетразол-5-іл]-вініл}-4етил-4Н-[1,2,4]триазол-3-іл)-піридин, 1-[2-(3-хлорфеніл)-2Н-тетразол-5-іл]-2-(4циклопропіл-5-піридин-4-іл-4Н-[1,2,4]триазол-3-іл)етанол, 2-[2-(3-хлорфеніл)-2Н-тетразол-5-іл]-1-(4циклопропіл-5-піридин-4-іл-4Н-[1,2,4]триазол-3-іл)етанол, 4-(5-{2-[2-(3-хлорфеніл)-2Н-тетразол-5-іл]-вініл}-4етил-4Н-[1,2,4]триазол-3-іл)-піридин, 3-[4-метил-5-({[2-(3-метилфеніл)-2Н-тетразол-5іл]метил}тіо)-4Н-1,2,4-триазол-3-іл]бензонітрил, 5-({[5-(3,5-дифлуорфеніл)-4-етил-4Н-1,2,4триазол-3-іл]тіо}метил)-2-(3-метилфеніл)-2Нтетразол, 3-[4-метил-5-({1-[2-(3-метилфеніл)-2Н-тетразол-5іл]етил}тіо)-4Н-1,2,4-триазол-3-іл]бензонітрил, 5-(1-{[5-(3,5-дифлуорфеніл)-4-етил-4Н-1,2,4триазол-3-іл]тіо}етил)-2-(3-метилфеніл)-2Нтетразол, 6-(4-{1-[2-(3-хлорфеніл)-2Н-тетразол-5іл]етил}піперазин-1-іл)нікотинонітрил, 3-(4-{1-[2-(3-хлорфеніл)-2Н-тетразол-5іл]етил}піперазин-1-іл)піразин-2-карбонітрил, 2-(4-{1-[2-(3-хлорфеніл)-2Н-тетразол-5іл]етил}піперазин-1-іл)нікотинонітрил, 1-{1-[2-(3-хлорфеніл)-2Н-тетразол-5-іл]етил}-4-(3нітропіридин-2-іл)піперазин, 8-{1-[2-(3-хлорфеніл)-2Н-тетразол-5-іл]етил}-3(3,5-дифлуор феніл)-5,6,7,8тетрагідро[1,2,4]триазоло[4,3-а]піримідин, 8-{1-[2-(3-хлорфеніл)-2Н-тетразол-5-іл]етил}-3-(4метоксифеніл)-5,6,7,8тетрагідро[1,2,4]триазоло[4,3-а]піримідин, 3-(2-хлор-6-метоксипіридин-4-іл)-8-{1-[2-(3хлорфеніл)-2Н-тетразол-5-іл]етил}-5,6,7,8тетрагідро[1,2,4]триазоло[4,3-а]піримідин, 7 85576 8 8-{1-[2-(3-хлорфеніл)-2Н-тетразол-5-іл]етил}-3-(2метоксипіридин-4-іл)-5,6,7,8тетрагідро[1,2,4]триазоло[4,3-а]піримідин, 8-{[2-(3-хлорфеніл)-2Н-тетразол-5-іл]метил}-3-(2метоксипіридин-4-іл)-5,6,7,8тетрагідро[1,2,4]триазоло[4,3-а]піримідин, 3-(5-{[3-(2-метоксипіридин-4-іл)-6,7дигідро[1,2,4]триазоло[4,3-а]піримідин-8(5Н)іл]метил}-2Н-тетразол-2-іл)бензонітрил, 3-(2-метоксипіридин-4-іл)-8-{1-[2-(3-йодфеніл)-2Нтетразол-5-іл]етил}-5,6,7,8тетрагідро[1,2,4]триазоло[4,3-а]піримідин, 3-(5-{1-[3-(2-метоксипіридин-4-іл)-6,7дигідро[1,2,4]триазоло[4,3-а]піримідин-8(5Н)іл]етил}-2Н-тетразол-2-іл)бензонітрил, 3-(5-{[3-(2-метоксипіридин-4-іл)-5,6,7,8-тетрагідро9Н-[1,2,4]триазоло[4,3-а][1,3]діазепін-9-іл]метил}2Н-тетразол-2-іл)бензонітрил, 3-(5-{[3-(2,6-диметоксипіримідин-4-іл)-6,7дигідро[1,2,4]триазоло[4,3-а]піримідин-8(5Н)іл]метил}-2Н-тетразол-2-іл)бензонітрил, (R)-3-(5-{1-[3-(2-метоксипіридин-4-іл)-6,7дигідро[1,2,4]триазоло[4,3-а]піримідин-8(5Н)іл]етил}-2Н-тетразол-2-іл)бензонітрил, (S)-3-(5-{1-[3-(2-метоксипіридин-4-іл)-6,7дигідро[1,2,4]триазоло[4,3-а]піримідин-8(5Н)іл]етил}-2Н-тетразол-2-іл)бензонітрил, (R)-етил 4-{1-[2-(3-хлорфеніл)-2Н-тетразол-5іл]етил}піперазин-1-карбоксилат, (S)-етил 4-{1-[2-(3-хлорфеніл)-2Н-тетразол-5іл]етил}піперазин-1-карбоксилат, (R)-етил 4-{1-[2-(5-хлор-2-флуорфеніл)-2Нтетразол-5-іл]етил}піперазин-1-карбоксилат, (S)-етил 4-{1-[2-(5-хлор-2-флуорфеніл)-2Нтетразол-5-іл]етил}піперазин-1-карбоксилат, (R)-6-(4-{1-[2-(3-хлорфеніл)-2Н-тетразол-5іл]етил}піперазин-1-іл)нікотинонітрил, (S)-6-(4-{1-[2-(3-хлорфеніл)-2Н-тетразол-5іл]етил}піперазин-1-іл)нікотинонітрил, (R)-3-(4-{1-[2-(3-хлорфеніл)-2Н-тетразол-5іл]етил}піперазин-1-іл)піразин-2-карбонітрил, (S)-3-(4-{1-[2-(3-хлорфеніл)-2Н-тетразол-5іл]етил}піперазин-1-іл)піразин-2-карбонітрил, 4-(5-{(S)-1-[2-(3-хлорфеніл)-2Н-тетразол-5-іл]етокси}-4-метил-4Н-[1,2,4]триазол-3-іл)-піридин, 2-(3-хлорфеніл)-5-{(R)-1-[5-(3,5-дифлуорфеніл)-4метил-4Н-[1,2,4]триазол-3-ілоксі]-етил}-2Нтетразол, 3-(5-{(R)-1-[2-(3-хлорфеніл)-2Н-тетразол-5-іл]етокси}-4-метил-4Н-[1,2,4]триазол-3-іл)-піридин, 4-(5-{2-[5-(3-хлорфеніл)-2Н-тетразол-2-іл]пропіл}4-метил-4Н-1,2,4-триазол-3-іл)піридин, 4-(5-{(R)-1-[2-(3-хлорфеніл)-2Н-тетразол-5-іл]етокси}-4-метил-4Н-[1,2,4]триазол-3-іл)-піридин, 2-(3-хлорфеніл)-5-[1-метил-2-фенілвініл]-2Нтетразол та 2-({1-[2-(3-хлорфеніл)-2Н-тетразол-5-іл]етил}тіо)імідазо[4,5-b]піридин. 18. Фармацевтична композиція, яка містить як активний інгредієнт терапевтично ефективну кількість сполуки за будь-яким з пп.1-17 в асоціації з одним або більше фармацевтично прийнятними розріджувачами, наповнювачами та/або інертними носіями. 19. Фармацевтична композиція за п.18 для застосування у лікуванні розладів, опосередкованих mGluR5. 20. Сполука за будь-яким з пп.1-17 для застосування у терапії. 21. Сполука за будь-яким з пп.1-17 для застосування в лікуванні розладів, опосередкованих mGluR5. 22. Застосування сполуки за будь-яким з пп.1-17 у виробництві медикаменту для лікування розладів, опосередкованих mGluR5. 23. Спосіб лікування розладів, опосередкованих mGluR5, в якому вводять ссавцю, включаючи людину, що потребує такого лікування, терапевтично ефективну кількість сполуки за будь-яким з пп.117. 24. Спосіб за п.23 для застосування у лікуванні неврологічних розладів. 25. Спосіб за п.23 для застосування у лікуванні психіатричних розладів. 26. Спосіб за п.23 для застосування у лікуванні хронічних та гострих больових розладів. 27. Спосіб за п.23 для застосування у лікуванні шлунково-кишкових розладів. 28. Спосіб інгібування активації рецепторів mGluR5, в якому діють на клітини, які містять вказаний рецептор, ефективною кількістю сполуки за пп.1-17. Заявлений винахід стосується нового класу сполук, фармацевтичних композицій, що містять указані сполуки, та застосування вказаних сполук у терапії. Заявлений винахід, крім того, стосується способу отримання вказаних сполук та нових інтермедіатів, отриманих при цьому. Глутамат є головним збуджувальним нейротрансмітером у центральній нервовій системі (ЦНС) ссавців. Глутамат діє на центральні нейрони зв'язуванням із рецепторами поверхні клітин та їх активуванням. На основі структурних особливостей рецепторних білків, засобів, котрими рецептори перетворюють сигнали в клітині, та фармакологічних профілів ці рецептори поділено на два голо вних класи - іонотропічні та метаботропічні рецептори глутамату, Метаботропні рецептори глютамату (mGluR) є сполученими з білком G рецепторами, що активують кілька внутрішньоклітинних вторинних месенджерних систем після зв'язування глютамату. Активація mGluR в інтактних нейронах тварин викликає один або більше наступних відгуків: активацію фосфоліпази С; зростання гідролізу фосфоінозитиду (РІ); вивільнення внутрішньоклітинного кальцію; активацію фосфоліпази D; активацію або інгібування аденілциклази; підвищення або зменшення утворення циклічного аденозинмонофосфа ту (цАМФ); активацію гуанілілциклази; підвищення утворення циклічного гуанозинонофос 9 85576 фату (цГМФ); активацію фосфоліпази А2; підвищення вивільнення арахідонової кислоти; та підвищення або зменшення активності керованих потенціалом та лігандами іонних каналів. [Schoepp et al., Trends Pharmacol. Sci. 14: 13 (1993), Schoepp, Neurochem. Int. 24:439 (1994), Pin et al., Neuropharmacology 34:1 (1995), Bordi та Ugolini, Prog. Neurobiol. 59:55 (1999)]. Вісім різних підтипів mGluR, позначених mGluR1 - mGluR8, ідентифіковано молекулярним клонуванням. [Nakanishi, Neuron 13: 1031 (1994), Pin et al., Neuropharmacology 34: 1 (1995), Knopfel et al., J. Med. Chem. 38: 1417 (1995)]. Подалі диверсифікація рецептору відбувається через експресію альтернативно сплайсованих форм деяких підтипів mGluR, [Pin et al., PNAS 89: 10331 (1992), Minakami et al., BBRC 199: 1136 (1994), Joly et al., J. Neurosci. 15: 3970 (1995)]. Підтипи метаботропного рецептору глютамату можна підрозділяти на три групи, Групу І, Групу II та Групу III mGluR, на основі гомологїі амінокислотних послідовностей, вторинних месенджерних систем, використовуваних рецепторами, та їх фармакологічних характеристик. Група І mGluR охоплює mGluR1, mGluR5 та їх альтернативно сплайсовані різновиди. Зв'язування агоністів цими рецепторами призводить до активації фосфоліпази С та подальшій мобілізації внутрішньоклітинного кальцію. Неврологічні, психіатричні та больові розлади. Спроби пояснити фізіологічну роль групи І mGluR підказують, що активація цих рецепторів викликає нейронне збудження. Різні дослідження показують, що агоністи Групи І mGluR можуть створювати постсинаптичне збудження після застосування до нейронів у гіпокампі, корі головного мозку, мозочку та зоровому бугрі, а також інших ділянках ЦНС. Дані показують, що це збудження утворюється завдяки прямій активації постсинаптичних mGluR, але також припущено, що виникає активація пресинаптичних mGluR, яка призводить до підвищення вивільнення нейротрансміттеру. [Baskys, Trends Pharmacol. Sci. 15: 92 (1992), Schoepp, Neurochem. Int. 24: 439 (1994), Pin et al., Neuropharmacology 34: 1(1995), Watkins et al., Trends Pharmacol. Sci. 15 :33 (1994)]. Метаботропні рецептори глютамату залучені у ряд нормальних процесів у ЦНС ссавців. Активація mGluR, як показано, є необхідною для індукції гіпокампального довготермінового потенціювання та довготермінової мозочкової депресії. [Bashir et al., Nature 363: 347 (1993), Bortolotto et al., Nature 368: 740 (1994), Aiba et al., Cell 79: 365 (1994), Aiba et al., Cell 79: 377 (1994)]. Також показано роль активації mGluR у ноцицепції та аналгезії. [Meller et al., Neuroreport 4: 879 (1993), Bordi та Ugolini, Brain Res. 871: 223 (1999)]. На додаток, припускають, що активація mGluR грає модуляторну роль у різних інших нормальних процесах, охоплюючи синаптичну передачу, розвиток нейронів, апоптозну загибель нейронів, синаптичну пластичність, просторове навчання, нюхальну пам'ять, центральний контроль серцевої активності, пробудження, моторний контроль та контроль вестибулярноокулярного рефлексу. [Nakanishi, Neuron 13: 1031 10 (1994), Pin et al., Neuropharmacology 34: 1, Knopfel et al., J. Med. Chem. 38: 1417 (1995)]. Подалі припускають, що метаботропні рецептори глютамату Гр упи І грають роль у різних гострих та хронічних патофізіологічних процесах та розладах, які впливають на ЦНС. Вони охоплюють інсульт, травму голови, аноксичне та ішемічне ушкодження, гіпоглікемію, епілепсію, нейродегенеративні розлади, як-то хворобу Альцгеймера, психіатричні розлади та біль. [Schoepp et al., Trends Pharmacol. Sci. 14: 13 (1993), Cunningham et al., Life Sci. 54: 135 (1994), Hollman et al., Ann. Rev. Neurosci. 17: 31 (1994), Pin et al., Neuropharmacology 34: 1 (1995), Knopfel et al., J. Med. Chem. 38: 1417 (1995), Spooren et al., Trends Pharmacol. Sci. 22: 331 (2001), Gasparini et al. Curr. Opin. Pharmacol. 2:43 (2002), Neugebauer Pain 98: 1 (2002)]. Вважають, що багато патології у цих умовах у значній мірі спостерігається завдяки надлишковому індукованому глютаматом збудженню нейронів ЦНС. Тому що Група І mGluR підвищує опосередковане глютаматом збудження нейронів через постсинаптичні механізми та підсилює пресинаптичне вивільнення глютамату, її активація можливо сприяє патології. Відповідно, селективні антагоністи рецепторів групи І mGluR можуть бути терапевтично корисними в усіх умовах надлишкового індукованого глютаматом збудження нейронів ЦНС, особливо як нейропротекторні засоби, анальгетики або протисудомні засоби. Недавні досягнення у з'ясуванні нейрофізіологічної ролі метаботропних рецепторів глютамату взагалі та Групи І конкретно визначають ці рецептори як багатообіцяючі ліки у терапії гострих та хронічних неврологічних та психіатричних розладів та хронічних та гостри х больових розладів. Шлунково-кишкові розлади Нижчий стравохідний сфінктер (LES) схильний до періодичної релаксації. Як наслідок, рідина із шлунку може переходити у стравохід, оскільки механічний бар'єр є тимчасово відсутнім у цей час, це явище тут далі позначено як "рефлюкс". Хвороба шлунково-стравохідний рефлюкс (GERD) є найбільш переважною серед хвороб шлунково-кишкового тракту. Сучасна фармакотерапія спрямована на зменшення секреції шлункової кислоти, або на нейтралізацію кислоти у стравоході. Як вважають, головний механізм, що стоїть за рефлкжсом, залежить від гіпотонічного нижчого стравохідного сфінктера. Однак, показано, наприклад, [Holloway & Dent (1990) Gastroenterol. Clin. N. Amer. 19, pp.517-535], що найбільше випадків рефлюксу відбувається протягом минущи х релаксацій нижчого стравохідного сфінктера (TLESR), тобто релаксацій, не ініційованих ковтаннями. Також показано, що шлункова секреція кислоти звичайно є нормальною у пацієнтів з GERD. Припускається, що нові сполуки згідно із заявленим винаходом є корисними для інгібування минущих релаксацій нижчого стравохідного сфінктера (TLESR) та, таким чином, для лікування розладів шлунково-стравохідного рефлюксу (GERD). Термін "TLESR", минуща релаксація нижчого стравохідного сфінктера, тут визначено у відповідності з [Mittal, R.K., Holloway, R.H., Penagini, R., 11 85576 Blackshaw, L.A., Dent, J., 1995; Transient lower esophageal sphincter relaxation. Gastroenterology 109, pp.601-610]. Формулювання "рефлюкс" тут визначено як таке, коли рідина із шлунку може переходити у стравохід, тому що механічний бар'єр є тимчасово відсутнім у цей час. Формулювання "GERD", хвороби шлунковостравохідний рефлекс, тут визначено у відповідності з [van Heerwarden, M.A., Smout A.J.P.M., 2000; Diagnosis of reflux disease. Bailliere's Clin. Gastroenterol. 14, pp.759-774]. Внаслідок фізіологічної та патофізіологічної важливості є потреба у нових сильнодіючих агоністах та антагоністах mGluR, що виявляють високу селективність щодо підтипів mGluR, особливо підтипу рецепторів Групи І. Згідно з одним аспектом винаходу запропоновано сполуку формули І де Х3 та X4 вибрано з N та С таким чином, що коли Х3 - N, X4 - С, а коли Х3 - С, X4 -N; Ρ - арил та гетероарил R1 приєднано до Ρ через атом карбону на кільці Ρ та вибрано з групи: гідрокси, галоген, нітро, С1-6алкілгалоген, ОС1-6алкілгалоген, С1-6алкіл, ОС16алкіл, С 2-6алкеніл, ОС 2-6алкеніл, С 2-6алкуніл, ОС 2С0-6алкілС 3-6циклоалкіл, ОС0-6алкілС 36алкуніл, 6циклоалкіл, С 0-6алкіларил, ОС 0-6алкіларил, СНО, 5 (CO)R , O(CO)R 5, O(CO)OR 5 , O(CNR5)OR5, С15 5 5 6алкілOR , OC 2-6алкілOR , С 1-6алкіл(СО)R , OС 15 5 5 6aлкіл(CO)R , C 0-6алкілCO2R , OС 1-6алкілCO2R , С 0алкілціано, ОС2-6алкілціано, C0-6aлкiлNR5R6, OC26 5 6 C1-6алкіл(CO)NR5R6, OC16aлкiлNR R , 5 6 C0-6алкілNR5(CO)R6, OC26алкіл(CO)NR R , 5 6 С0-6алкілNR5(СО)NR5R6, C06алкілNR (CO)R , 5 5 5 6aлкiлSR , OC 2-6алкілSR , C 0-6алкіл(SO)R , OC 25 5 5 6алкіл(SO)R , С 0-6алкілSО2R , OC 2-6aлкiлSO2R , C 05 6 5 6 OC2-6aлкiл(SO2)NR R , C06алкіл(SO2)NR R , 5 6 OC2-6алкілNR5(SO2)R6, C06aлкiлNR (SO2)R , 5 5 6 OC2-6aлкiлNR5(SO2)NR5R6, 6aлкiлNR (SO2)NR R , (CO)NR5R6, O(CO)NR 5R6, NR5OR6, C0алкілNR5(CO)OR 6, OC2-6aлкiлNR5(CO)OR 6, SO3R5 6 та 5- або 6-членне кільце, яке містить один або більше атомів, незалежну вибраних з: С, Ν, Ο та S; X1 вибрано з групи: С2-3алкіл, С2-3алкеніл, NR3, О, S, CR 3R4, SO, SO2 X2 вибрано з групи: зв'язок, CR3R4, О, S, NR3, SO, SO 2 R3 та R4 незалежно вибрано з групи: гідроген, гідрокси, С1-6аліл, С0-6алкілціано, оксо, =NR5, =NOR 5, С1-4алкілгалоген, галоген, С1-4алкілС 3С3-7циклоалкіл, О(СО)С1-4алкіл, 7циклоалкіл, (СО)С1-4алкіл, С1-4алкіл(SО)С0-4алкіл, С14алкіл(SО2)С 0-4алкіл, (SO)C 0-4алкіл, (SO2)C 0-4алкіл, ОС1-4алкіл, C1-4aлкiлOR5 та C0-4алкілNR5R6; Q - 4-, 5-, 6-, або 7-членне кільце, яке містить один або більше гетероатомів, вибраних з Ν, Ο та S, котре, як варіант, конденсовано з 5-, 6-, або 7 12 членним кільцем, яке містить один або більше гетероатомів, вибраних з Ν, Ο та S; R2 вибрано з групи: гідрокси, С0-6алкілціано, =NR5, =O, =NOR 5, С1-4алкілгалоген, галоген, С1С3-6циклоалкіл, С0-6алкіларил, С06алкіл, C0-6алкілциклоалкіл, С06алкілгетероарил, ОС1-4алкіл, ОС06алкілгетероциклоалкіл, 6алкіларил, О(СО)С 1-4алкіл, (СО)ОС 1-4алкіл, С 0С1-4алкіл(SО)С0-4алкіл, С14алкіл(S)С 0-4алкіл, 4алкіл(SО2)С 0-4алкіл, (SО)С 0-4алкіл, (SО2)С 0-4алкіл, С1-4алкілOR5, C0-4алкілNR5R6 та 5- або 6-членне кільце, яке містить один або більше атомів, незалежно вибраних з С, Ν, Ο та S, це кільце може, як варіант, бути конденсованим з 5- або 6-членним кільцем, яке містить один або більше атомів, незалежно вибраних з групи: С, N та О, та, де вказане кільце та вказане конденсоване кільце можуть бути заміщеними одним або більше А; та будьякий С 1-6алкіл, арил, або гетероарил, позначений R1, R2 та R3, може бути заміщеним одною або більше А; та А вибрано з групи: гідроген, гідрокси, галоген, нітро, оксо, С0-6алкілціано, С0-4алкілС 3-6циклоалкіл, С1-6алкіл, -ОС1-6алкіл, С1-6алкілгалоген, ОС1С2-6алкеніл, С0-Залкіларил, C06алкілгалоген, 5 OC2-6алкілOR5, C1-6aлкiлSRs, OC26алкілOR , 5 5 5 6алкілSR , (CO)R , O(CO)R , ОС 2-6алкілціано, OС 1алкілCO2R5, O(CO)OR 5, OС1-6алкіл(CO)R5, С16 5 NR5ORe, C0-6NR5R6, OC26aлкiл(CO)R , aлкiлNR5R6, С0-6алкіл(СО)NR5Rв, O С16 5 6 OC2-6алкілNR5(CO)R6, C06алкіл(CO)NR R , 5 6 С0-6алкілNR5(CO)NRsR6, 6алкілNR (CO)R , O(CO)NR5R6, С0-6алкіл(SO2)NR5R6, OС25 6 C0-6алкілNR5(SO2)R6, ОC26алкіл(SO2)NR R , 5 6 5 5 5 6 6алкілNR (SO2)R , SO 3R , С 1-6алкілNR (SO)NR R , 5 5 OC2-6алкіл(SO2)R , C0-6алкіл(SO2)R , C05 5 6алкіл(SO)R , OC 2-6aлкiл(SO)R тa 5- або 6-членне кільце, яке містить один або більше атомів, незалежно вибраних з: С, Ν, Ο та S; R5 та R6 незалежно вибрано з групи: Н, С16алкіл, С 3-7циклоалкілта арил та солі, та їх гідрати m дорівнює 0,1, 2, 3 або 4 p дорівнює 0, 1, 2, 3 або 4 або сіль або її гідрат. за умови, що сполукою не є: 1-[гідроксил(2-феніл-2Н-тетразол-5іл)метил]піперидин; 1-(2-феніл-2Н-тетразол-5ілметил)-піридин; 1-(2-феніл-2Н-тетразол-5ілметил)-піперидин; 1-(2-бензотіазоліл)-4-[[5-(5-метил-2-фураніл)2Н-тетразол-2-іл]ацетил-піперазин; 1-(4-ацетилфеніл)-4-[[5-(5-метил-2чрураніл)2Н-тетразол-2-іл]ацетил]-піперазин, або 5-(5-метил-2-фураніл)-N-(2-феніл-2Нбензотриазол-5-іл)-2Н-тетразол-2-ацетамід. Згідно з наступним аспектом винаходу запропоновано фармацевтичні композиції, які містять терапевтично ефективну кількість сполуки формули І та фармацевтично прийнятний розріджувач, наповнювачі та/або інертний носій. Згідно з ще одним аспектом винаходу запропоновано фармацевтичну композицію, яка містить сполуку формули І для застосування у лікуванні розладів, опосередкованих рецептором mGluR5 та 13 85576 для застосування у лікуванні неврологічних розладів, психіатричних розладів, шлунково-кишкових розладів та больових розладів. Згідно з ще одним аспектом винаходу запропоновано сполуку формули І для застосування у терапії, особливо для лікування розладів, опосередкованих рецептором mGluR5, та для лікування неврологічних розладів, психіатричних розладів, шлунково-кишкових розладів та больових розладів. Згідно з ще одним аспектом винаходу запропоновано способи отримання сполук формули І, інтермедіатів, застосовуваних у їх отриманні. Ці та інші аспекти заявленого винаходу більш детально описано нижче. Предметом заявленого винаходу є отримання сполук, які виявляють активність щодо метаботропних рецепторів глютамату (mGluR), особливо рецепторів mGluR5. Наведене нижче представляє різні терміни, застосовані в описі та формулі винаходу для опису заявленого винаходу. Щоб уникнути невизначеності, зрозуміло, що там, де у цьому описі групу визначено як 'вище визначено', 'визначено вище' або 'визначено раніше', названа група охоплює перше, що попалося, та найширше визначення, а також кожне та усі інші визначення цієї групи. Щоб уникнути невизначеності, зрозуміло, що у цьому описі "С1-6" означає карбонову груп у, яка має 1, 2, 3, 4, 5 атомів карбону. Подібно "С1-6" означає карбонову груп у, яка має 1, 2 або 3 атоми карбону. У випадку, де індекс дорівнює 0 (нуль), група, котрої індекс стосується, означає, що група відсутня. У цьому описі, якщо не визначене інше, термін "гетероатом" стосується атому, котрий не є карбоном або гідрогеном. Приклади гетероатомів охоплюють (але без обмеження) нітроген, оксиген, та сульфур. У цьому описі, якщо не визначене інше, термін "алкіл" охоплює алкіли з лінійним та розгалуженим ланцюгом та можуть представляти (але без обмеження) метил, етил, н-пропіл, і-пропіл, н-бутил, ібутил, втор-бутил, трет-бутил, н-пентил, і-пентил, трет-пентил, неопентил, н-гексил або і-гексил, трет-гексил. Термін С1-3алкіл має 1-3 атоми карбону та можуть представляти метил, етил, н-пропіл або і-пропіл. У цьому описі, якщо не визначене інше, термін "алкеніл" охоплює алкеніли з лінійним та розгалуженим ланцюгом. Термін "С2-6алкеніл" стосується алкеніли, що має 2-6 атомів карбону та один або два подвійні зв'язки, та може представляти (але без обмеження) вініл, аліл, пропеніл, і-пропеніл, бутеніл, і-бутеніл, кротил, пентеніл, і-пентеніл та гексеніл. У цьому описі, якщо не визначене інше, термін "алкініл" охоплює алкініли з лінійним та розгалуженим ланцюгом. Термін С2-6алкініл, що має 2-6 атомів карбону та один або два потрійних зв'язки, та може представляти (але без обмеження) етиніл, пропаргіл, бутиніл, і-бутиніл, пентиніл, іпентиніл та гексиніл. 14 У цьому описі, якщо не визначене інше, термін "циклоалкіл" стосується, як варіант, заміщеної насиченої циклічної вуглеводневої кільцевої системи. Термін "С3-6циклоалкіл" може представляти циклопропіл, циклобутил, циклопентил, циклогексил або циклогептил. У цьому описі, якщо не визначене інше, термін "гетероциклоалкіл" стосується, як варіант, заміщеної насиченої циклічної вуглеводневої кільцевої системи, де один або більше атомів карбону заміщено гетероатомом. Термін "гетероциклоалкіл" охоплює (але без обмеження) піролідин, тетрагідрофуран, тетрагідротіофен, піперидин, піперазин, морфолін, тіоморфолін, тетрагідропіран, тетрагідротіопіран. У цьому описі, якщо не визначене інше, термін "алкокси" охоплює обидві пряму або розгалужену алкокси-групи. С1-3алкокси може представляти (але без обмеження) метокси, етокси, н-пропокси або і-пропокси. У цьому описі, якщо не визначене інше, термін "галоген" та "галоген" може представлять флуор, хлор, бром або йод. У цьому описі, якщо не визначене інше, термін "алкілгалоген" означає алкіл, як визначено вище, котра є заміщеною галогеном, як описано вище. Термін "С1-6алкілгалоген" може охоплювати (але без обмеження) флуорметил, дифлуорметил, трифлуорметил, флуоретил, дифлуоретил або бромпропіл. Термін "ОС1-6алкілгалоген" може охоплювати (але без обмеження) флуорметокси, дифлуорметокси, трифлуорметокси, флуоретокси або дифлуоретокси. У цьому описі, якщо не визначене інше, термін "арил" стосується, як варіант, заміщеної моноциклічної або біциклічної вуглеводневої кільцевої системи, яка містить, принаймні, одне ненасичене ароматичне кільце. Приклади та придатні значення терміну "арил" представляють феніл, нафтил, 1,2,3,4-тетрагідронафтил, індил та інденіл. У цьому описі, якщо не визначене інше, термін "гетероарил" стосується , як варіант, заміщеної моноциклічної або біциклічної ненасиченої ароматичної кільцевої системи, яка містить, принаймні, один гетероатом, вибраний незалежно із Ν, Ο або S. Прикладами "гетероарилу" можуть бути, (але без обмеження) тіофен, тієніл, піридил, тіазоліл, фурил, піроліл, триазоліл, імідазоліл, оксадіазоліл, оксазоліл, ізоксазоліл, піразоліл, імідазолоніл, оксазолоніл, тіазолоніл, тетразоліл та тіадіазоліл, бензоімідазоліл, бензооксазоліл, тетрагідротриазолопіридил, тетрагідротриазолопіримідиніл, бензофурил, індоліл, ізоіндоліл, піридоніл, піридазиніл, піримідиніл, імідазопіридил, оксазолопіридил, тіазолопіридил, піридил, імідазопіридазиніл, оксазолопіридазиніл, тіазолопіридазиніл та пуриніл. У цьому описі, якщо не визначене інше, терміни "алкіларил", "алкілгетероарил", "алкілциклоалкіл" та "алкілгетероциклоалкіл" стосуються замісника, який приєднано через алкіл до арилу, гетероарилу, циклоалкілу та гетероциклоалкілу. У цьому описі, якщо не визначене інше, термін "5- або б-членне кільце, яке містить атоми, незалежно вибрані з С, Ν, Ο або S", охоплює аромати 15 85576 чні та гетероароматичні кільця а також карбоциклічні та гетероциклічні кільця, котрі можуть бути насиченими, частково насиченими або ненасиченими. Прикладами таких кілець можуть бути (але без обмеження) фурил, ізоксазоліл, ізотіазоліл, оксазоліл, піразиніл, піразоліл, піридазиніл, піридил, піримідил, піроліл, тіазоліл, тієніл, імідазоліл, імідазолідиніл, імідазолініл, триазоліл, морфолініл, піперазиніл, піперидил, піперидоніл, піразолідиніл, піразолініл, піролідиніл, піролініл, тетрагідропіраніл, тіоморфолініл, феніл, циклогексил, циклопентил та циклогексеніл. У цьому описі, якщо не визначене інше, термін "4-, 5-, б-, або 7-членне кільце, яке містить один або більше гетероатомів, вибраних з Ν, Ο та S, це кільце, як варіант, конденсовано з 5-, 6-, або 7членним кільцем, яке містить один або більше гетероатомів, вибраних з Ν, Ο та S", стосується гетероциклічного або гетероароматичного кільця, котре може бути насиченим, частково ненасиченим або ароматичним кільцем. Приклади таких кілець охоплюють (але без обмеження) морфолініл, тіоморфолініл, піперазиніл, піперидиніл, піперидоніл, піразолідиніл, піразолініл, піролідиініл, піролініл, тіоморфолініл фураніл, тіофеніл, піридиніл, піразиніл, піридазиніл, піраніл, оксазоліл, тіазоліл, імідазоліл, триазоліл, тетразоліл, азетидиніл, окситаніл, азепаніл, оксазепаніл, оксепаніл, діазепаніл, тіазепаніл, та азепін та їх частково або повністю ненасичений варіант, наприклад, тетрагідропіраніл, дигідропіразоліл та подібне. Це кільце , як варіант, може бути конденсовано з другим 5-, 6або 7-членним кільцем, котре може бути гетероциклічним або гетероароматичним та насиченим, частково ненасиченим або ароматичним. Друге або конденсоване кільце може бути незалежно вибраним з таких прикладів, як-то морфолініл, тіоморфолініл, піперазиніл, піперидиніл, піперидоніл, піразолідиніл, піразолініл, піролідиініл, піролініл, тіоморфолініл фураніл, тіофеніл, піридиніл, піразиніл, піридазиніл, піраніл, оксазоліл, тіазоліл, імідазоліл, триазоліл, тетразоліл, азетидиніл, окситаніл, азепаніл, оксазепаніл, оксепаніл, діазепаніл, тіазепаніл, та азепін та їх ненасичені варіації, як-то тетрагідропіраніл, дигідропіразоліл та подібне. Приклади конденсованих кільцевих систем, які можна утворювати, о хоплюють (але без обмеження) ізохінолін, хінолін, хіназолін, хіноксалін, індол, індазол, індолін, бензімідазол, бензоксазоліл, бензофурил, імідазопіридил, оксазолопіридил, тіазолопіридил, імідазопіридазиніл, оксалопіридазиніл, тіазолопіридазиніл, пуриніл, тетрагідротриазолопіридил, тетрагідротриазолопіримідиніл, дигідротриазолотіазин, тетрагідротриазолопіразин, тетрагідротетрааза-азулен, дигідропіролотриазол. Термін "конденсовані", як вказано вище, стосується кілець, котрі мають два спільні атоми. У цьому описі, якщо не визначене інше, термін "зв'язок" може означати насичений або ненасичений зв'язок. У цьому описі, якщо не визначене інше, термін "=NR5" та "=NOR5" охоплює іміно- та оксимо-групи, які несуть R5-замісник та можуть бути або є групами, які охоплюють (але без обмеження) іміноалкіл, 16 іміногідрокси, іміноалкокси, амідин, гідроксиамідин та алкоксиамідин. У випадку, де індекс дорівнює 0 (нуль), є відсутньою група, котрої стосується індекс, тобто є прямий зв'язок між групами. У цьому описі, якщо не визначене інше, термін "місток" означає фрагмент молекули, який містить один або більше атомів, або зв'язок, котрий поєднує два віддалені атоми у кільці, утворюючи, таким чином, або бі-, або трициклічні системи. В одному втіленні винаходу запропоновано сполуки формули І Формула І, де Х3 та Х4 вибрано з N та С таким чином, що коли Х3-N, Х4-С, а коли Х3-С, Х4-N; Ρ - арил та гетероарил R1 приєднано до Ρ через атом карбону на кільці Ρ та вибрано з групи: гідроксил, галоген, нітро, С1-6алкілгалоген, ОС1-6алкілгалоген, С1-6алкіл, ОС1-6алкіл, С2-6алкеніл, ОС2-6алкеніл, С2-6алкініл, ОС2-6алкініл, С0-6алкілС 3-6циклоалкіл, ОС0-6алкілС 36циклоалкіл, C 0-6алкіларил, ОС 0-6алкіларил, СНО, (CO)R5, O(CO)R 5, O(CO)OR 5 , O(CNR5)OR5, С15 5 5 6алкілOR , OС 2-6алкілOR , С 1-6алкіл(СО)R , С 15 5 5 6алкіл(CO)R , С 0-6алкілСО2R , С 1-6aлкiлCO2R , С 05 6 6алкілціано, ОС 2-6алкілціано, C 0-6алкілNR R , ОС 25 6 С1-6алкіл(CO)NR5R6, OС16алкілNR R , 5 6 C0-6алкілNR5(CO)R6, OC26алкіл(CO)NR R , 5 6 C0-6aлкiлNR5(CO)NR5R6, C06алкілNR (CO)R , 5 5 5 6алкілSR , OC 2-6aлкiлSR , С 0-6алкіл(SO)R , OC 25 5 5 6алкіл(SO)R , C 0-6алкілSO2R , OC 2-6алкілSO2R , С 05 6 5 6 OC2-6алкіл(SО2)NR R , C06алкіл(SO2)NR R , 5 6 OC2-6алкілNR5(SO2)R6, C06алкілNR (SO2)R , 5 5 6 OC2-6алкілNR5(SO2)NR5R6, 6алкілNR (SO2)NR R , (CO)NR5R6, O(CO)NR 5R6, NR5OR6, C0алкілNR5(CO)OR 6, OC2-6алкілNR5(CO)OR 6, SO3R5 6 та 5- або 6-членне кільце, яке містить один або більше атомів, незалежно вибраних з: С, Ν, Ο та S; X1 вибрано з групи: С1-3алкіл, С2-3алкеніл, NR3, О, S, CR 3R4, SO, SO2 X2 вибрано з групи: зв'язок, CR3R4, О, S, NR3, SO, SO 2 R3 та R4 незалежно вибрано з групи: гідроген, гідроксил, С1-6аліл, С0-6алкілціано, оксо, =NR5, =NOR 5, С1-4алкілгалоген, галоген, С1-4алкіл, С3О(СО)С 1-4алкіл, (СО)С1-4алкіл, С17циклоалкіл С1-4алкіл(SО2)С0-4алкіл, 4алкіл(SО)С 0-4алкіл, (SО)С0-4алкіл, (SO2)C0-4алкіл, ОС1-4алкіл, С15 5 6 4aлкiлOR та С 0-4алкілNR R ; Q - 4-, 5-, 6-, або 7-членне кільце, яке містить один або більше гетероатомів, вибраних з N, О та S, це кільце, як варіант, конденсовано з 5-, 6-, або 7-членним кільцем, яке містить один або більше гетероатомів, вибраних з Ν, Ο та S; R2 вибрано з групи: гідроген, гідроксил, С05 5 6алкілціано, =NR , =O, =NOR , С 1-4алкілгалоген, галоген, С1-6алкіл, С3-6циклоалкіл, С0-6алкіларил, С0-6алкілгетероарил, C0-6алкілциклоалкіл, C0ОС1-4алкіл, ОC06алкілгетероциклоалкіл, 17 6алкіларил, 85576 О(СО)С1-4алкіл, (СО)OС1-4алкіл, С0С1-4алкіл(SO)С0-4алкіл, С14алкіл(S)С 0-4алкіл, 4алкіл(SО2)С 0-4алкіл, (SО)С 0-4алкіл, (S0 2)С 0-4алкіл, С1-4алкілOR5, C0-4алкілNR5R6 та 5- або 6-членне кільце, яке містить один або більше атомів, незалежно вибраних з С, Ν, Ο та S, це кільце може, як варіант, бути конденсованим з 5- або 6-членним кільцем, яке містить один або більше атомів, незалежно вибраних з групи: С, N та О та, де вказане кільце та вказане конденсоване кільце, може бути заміщеним одним або більше А; та будь-який С1-6алкіл, арил, або гетероарил, позначений R1, R2 та R 3, може бути заміщеним одним або більше А та А вибрано з групи: гідроген, гідроксил, галоген, нітро, оксо, С0-6алкілціано, С0-4алкілС 3-6циклоалкіл, С1-6алкіл, -ОС1-6алкіл, С1-6алкілгалоген, ОС1С2-6алкеніл, С0-3алкіларил, С06алкілгалоген, 5 ОС2-6алкілOR5, C1-6алкілSR5, OC26алкілOR , 5 5 5 6алкілSR , (CO)R , O(CO)R , ОС 2-6алкілціано, ОС 15 5 O(CO)OR , ОС1-6алкіл(СО)R5, C16алкілСO2R , 5 NR5OR6, C0-6NR5R6, OC26алкіл(CO)R , алкілNR5R6, C0-6алкіл(CO)NR5R6, OC16 5 6 OC2-6алкілNR5(CO)R6, C06aлкiл(CO)NR R , 5 6 C0-6алкілNR5(CO)NR5R6, 6aлкiлNR (CO)R , O(CO)NR5R6, C0-6алкіл(SO2)NR5R6, OC25 6 C0^алкілNR5(SO2)R6, OC26алкіл(SO2)NR R , 5 6 5 5 5 6 6алкілNR (SO2)R , SO 3R , C 1-6алкілNR (SO2)NR R , 5 5 OC2-6алкіл(SO2)R , C0-6алкіл(SO2)R , С05 5 6алкіл(SО)R , OC 2-6алкіл(SO)R тa 5- або 6-членне кільце, яке містить один або більше атомів, незалежно вибраних з: С, Ν, Ο та S; R5 та R6 незалежно вибрано з групи: Н, С16алкіл, С 3-7циклоалкіл та арил та солі, та їх гідрати m дорівнює 0, 1, 2, 3 або 4 p дорівнює 0, 1, 2, 3 або 4 або сіль або її гідрат. за умови, що сполукою не є: 1-[гідроксил-(2-феніл-2Н-тетразол-5іл)метил]піперидин; 1-(2-феніл-2Н-тетразол-5ілметил)-піридин; та 1-(2-феніл-2Н-тетразол-5ілметил)-піперидин. Цей винахід стосується сполук тетразолу, визначених у формулі 1. Сполуки формули 1 охоплюють такі, де Ρ - арил або гетероарилу. Конкретні втілення винаходу о хоплюють такі сполуки, де Ρ феніл або піридил. Ρ може бути заміщеним 0-4 замісниками R1. Переважною є наявність одного або двох R1 замісників на Р. Зокрема, якщо є один замісник R1, то переважним є наявність замісника у мета-положенні кільця Ρ відносно місця приєднання Ρ в X3, та якщо є два замісники, - на 2-, та 5позиції кільця Р. Втілення винаходу охоплюють сполуки, де R1 визначено у формул 1. Зокрема, втілення R1 вибрано з групи: галоген, С1-6алкіл, ОС1-6алкіл та С0-6алкілціано. Конкретніше - R1 вибрано з групи: СІ, F, ціано та метил. Формула 1 описує сполуки, що мають 5членне кільце, яке містить 4 атоми нітрогену та один карбону (тетразол). Причому карбон може бути у X3 позиції, або X4 позиції. Конкретні втілення винаходу о хоплюють сполуки, де карбон - у X4 позиції. 18 Формула 1 описує змінні X1 та X2, котрі утворюють зв'язок між 5-членним кільцем тетразолу та кільцем Q. У втіленні винаходу X1 - CR3R4. У переважному втілення R3 та R4 незалежно вибрано з Η та С1-6алкілу, та більш особливо - із Η або метилу. В одному втіленні винаходу X2 - зв'язок. У ще одному втіленні винаходу X2 вибрано з CR3R4, О, S та NR3. Коли X2 - CR3R4 або NR3, R3 та R4 - такі, як описано вище. Q визначено як 4-, 5-, 6- або 7-членне кільце, де один або більше членів кільця -гетероатом, вибраний з Ν, Ο та S. Крім того, кільце може бути конденсованим з другим 5- або 6-членним кільцем, що має складові, які містять один або більше гетероатомів, які утворюють конденсовану біциклічну груп у. В одному втіленні винаходу Q - 5- або 6членне кільце, не конденсоване з другим кільцем. У більш конкретному втіленні Q - 5- або 6-членне кільце гетероциклоалкілу. Навіть конкретніше Q 6-членне кільце, а більш конкретно - кільце піперазину. У ще одному втіленні винаходу Q - 5- або 6членне гетероароматичне кільце. У більш конкретному втіленні, Q - 5-членне гетероароматичне кільце, навіть ще конкретніше Q - кільце триазолу. У ще одному втіленні винаходу Q - 5-, 6- або 7членне кільце, конденсоване з 5-або 6-членним кільцем. У конкретному втіленні Q - 5-, 6-, або 7членне гетероциклічне кільце, конденсоване з 5або 6-членним кільцем гетероарилу. У переважному втіленні Q - 5-, 6-, або 7-членне гетероциклічне кільце, конденсоване з кільцем триазолу. В особливому втіленні винаходу сформоване конденсоване біциклічне кільце системи вибрано з групи: тетрагідротриазолопіридил, тетрагідротриазолопіримідиніл, дигідротриазолотіазин, тетрагідротриазолопіразин, тетрагідротетрааза-азулен, дигідропіролотриазол. У наступному втіленні винаходу коли Q - конденсоване з другим кільцем, як описано вище, X2 зв'язок та X1 - CR 3R4. У ще одному втіленні, коли Q - триазол, який не є конденсованим, тоді X1 - CR3R4, а X2 - CR3R4, О, S та NR3, а коли Q - піперазин, X1 - CR3R4, а Х2 є зв'язком. Згідно з ще одним аспектом винаходу кільце Q (одне з двох, або обидва з 4, 5, 6, або 7-членного кільця та конденсованого 5, 6, або 7-членного кільця) подалі може бути заміщеним 0-4 замісниками R2. В одному втіленні R2 вибрано з групи: С1С1-6алкілгалоген, С3-7циклоалкіл, С06алкіл, 6алкіларил, С 0-6алкілгетероарил, (СО)ОС 1-4алкіл. В окремому втіленні, коли Q - піперазин, R2 (СО)ОС 1-4алкіл. У ще одному конкретному втіленні коли Q - триазол, R2 - С1-6алкіл, С3-7циклоалкіл, С06алкіларил, C 0-6алкілгетероарил. У наступному втіленні може бути два замісники R2, де один вибрано з групи: С0-6алкіларил, С0-6алкілгетероарил, а другий вибрано з групи: С1-6алкіл, С3-7циклоалкіл. Більш конкретно, один замісник можна вибирати з фенілу та піридилу, а другий можна вибирати з метилу або циклопропілу. 19 85576 У ще одному конкретному втіленні, коли Q має конденсоване друге кільце, друге кільце заміщено R2, вибраним з С 0-6алкіларилу, С06алкілгетероарилу. Більш конкретно, коли конденсоване кільце - триазол, кільце триазолу заміщено фенілом або піридилом. У ще одному втіленні винаходу, коли R2 - 5або 6-членне кільце, R2 може бути заміщеним одним або більше замісниками А. Крім того, будьякий С1-6алкіл, арил або гетероарил, позначений R1, R2 та R3, подалі може бути заміщеним одною або більше групами А. В окремому втіленні винаходу А вибрано з групи: галоген, С1-6алкіл, -ОС1-6алкіл та С06алкілціано. Винахід також стосується наступних сполук; Етил 4-{[2-(3-хлорфеніл)-2Н-тетразол-5іл]метил}піперазин-1-карбоксилат 4-[2-(5-Хлор-2-флуор-феніл)-2Н-тетразол-5ілметил]-піперазин-1-карбонової кислоти етиловий естер 4-(2-м-Толіл-2Н-тетразол-5-ілметил)піперазин-1-карбонової кислоти етиловий естер 4-[2-(3-Йод-феніл)-2Н-тетразол-5-ілметил]піперазин-1-карбонової кислоти етиловий естер 4-[2-(3-Ціано-феніл)-2Н-тетразол-5-ілметил]піперазин-1-карбонової кислоти етиловий естер 4-[2-(2-Флуор-5-метил-феніл)-2Н-тетразол-5ілметил]-піперазин-1-карбонової кислоти етиловий естер 4-[5-({[2-(3-хлорфеніл)-2Н-тетразол-5іл]метил}тіо)-4-циклопропіл-4Н-1,2,4-триазол-3-іл] піридин 4-[5-({1-[2-(3-хлорфеніл)-2Н-тетразол-5іл]етил}тіо)-4-циклопропіл-4Н-1,2,4-триазол-3іл]піридин Етил 4-{1 -[2-(3-хлорфеніл)-2Н-тетразол-5іл]етил}піперазин-1-карбоксилат 4-{5-[2-(5-Хлор-2-флуор-феніл)-2Н-тетразол-5ілметилсульфаніл]-4-метил-4Н-[1,2,4]триазол-3іл}-піридин 4-{5-[2-(5-Хлор-2-флуор-феніл)-2Н-тетразол-5ілметилсульфаніл]-4-циклопропіл-4Н[1,2,4]триазол-3-іл}-піридин 4-(5-{1-[2-(5-Хлор-2-флуор-феніл)-2Нтетразол-5-іл]-етилсульфаніл}-4-метил-4Н[1,2,4]триазол-3-іл)-піридин 4-(5-{1-[2-(5-Хлор-2-флуор-феніл)-2Нтетразол-5-іл]-етилсульфаніл}-4-циклопропіл-4Н[1,2,4]триазол-3-іл)-піридин 4-{1-[2-(5-Хлор-2-флуор-феніл)-2Н-тетразол-5іл]-етил}-піперазин-1-карбонової кислоти етиловий естер 4-[4-Циклопропіл-5-(2-м-толіл-2Н-тетразол-5ілметилсульфаніл)-4Н-[1,2,4]триазол-3-іл]-піридин 4-{4-Циклопропіл-5-[1-(2-м-толіл-2Н-тетразол5-іл)-етилсульфаніл]-4Н-[1,2,4]триазол-3-іл}піридин 4-{4-метил-5-[1-(2-м-толіл-2Н-тетразол-5-іл)етилсульфаніл]-4Н-[1,2,4]триазол-3-іл}-піридин 3-[5-(4-Циклопропіл-5-піридин-4-іл-4Н[1,2,4]триазол-3-ілсульфанілметил)-тетразол-2-іл]бензонітрил 20 3-{5-[1-(4-Циклопропіл-5-піридин-4-іл-4Н[1,2,4]триазол-3-ілсульфаніл)-етил]-тетразол-2-іл}бензонітрил 3-{5-[1-(4-метил-5-піридин-4-іл-4Н[1,2,4]триазол-3-ілсульфаніл)-етил]-тетразол-2-іл}бензонітрил 4-{4-Циклопропіл-5-[2-(2-флуор-5-метилфеніл)-2Н-тетразол-5-ілметилсульфаніл]-4Н[1,2,4]триазол-3-іл}-піридин 4-(4-Циклопропіл-5-{1-[2-(2чрлуор-5-метилфеніл)-2Н-тетразол-5-іл]-етилсульфаніл}-4Н[1,2,4]триазол-3-іл)-піридин 4-(5-{1-[2-(2-Флуор-5-метил-феніл)-2Нтетразол-5-іл]-етилсульфаніл}-4-метил-4Н[1,2,4]триазол-3-іл)-піридин Метил-(4-метил-5-піридин-4-іл-4Н[1,2,4]триазол-3-іл)-(2-м-тоіліл-2Н-тетразол-5ілметил)-амін Метил-(4-метил-5-піридин-4-іл-4Н[1,2,4]триазол-3-іл)-[1-(2-м-тоіліл-2Н-тетразол-5іл)-етил]-амін [2-(3-Хлорчреніл)-2Н-тетразол-5-ілметил]метил-(4-метил-5-піридин-4-іл-4Н-[1,2,4]триазол-3іл)-амін {1-[2-(3-Хлор-феніл)-2Н-тетразол-5-іл]-етил}метил-(4-метил-5-піридин-4-іл-4Н-[1,2,4]триазол-3іл)-амін [2-(2-Флуор-5-метил-феніл)-2Н-тетразол-5ілметил]-метил-(4-метил-5-піридин-4-іл-4Н[1,2,4]триазол-3-іл)-амін {1-[2-(2-Флуор-5-мегил-феніл)-2Н-тетразол-5іл]-етил}-метил-(4-метил-5-піридин-4-іл-4Н[1,2,4]триазол-3-іл)-амін [2-(3-Йрд-феніл)-2Н-тетразол-5-ілметил]метил-(4-метил-5-піридин-4-іл-4Н-[1,2,4]триазол-3іл)-амін {1-[2-(3-Йод-феніл)-2Н-тетразол-5-іл]-етил}метил-(4-метил-5-піридин-4-іл-4Н-[1,2,4]триазол-3іл)-амін Метил-(4-метил-5-піридин-4-іл-4Н[1,2,4]триазол-3-іл)-(2-м-топіл-2Н-тетразол-5ілметил)-амін Метил-(4-метил-5-піридин-4-іл-4Н[1,2,4]триазол-3-іл)-[1-(2-м-толіл-2Н-тетразол-5-іл)етил]-амін [2-(3-Хлор-феніл)-2Н-тетразол-5-ілметил]метил-(4-метил-5-піридин-4-іл-4Н-[1,2,4]триазол-3іл)-амін {1-[2-(3-Хлор-феніл)-2Н-тетразол-5-іл]-етил}метил-(4-метил-5-піридин-4-іл-4Н-[1,2,4]триазол-3іл)-амін [2-(2-Флуор-5-метил-феніл)-2Н-тепгразол-5ілметил]-метил-(4-метил-5-піридин-4-іл-4Н[1,2,4]триазол-3-іл)-амін {1-[2-(2-Флуор-5-метил-феніл)-2Н-тетразол-5іл]-етил}-метил-(4-метил-5-піридин-4-іл-4Н[1,2,4]триазол-3-іл)-амін 8-[2-(3-Йод-феніл)-2Н-тетразол-5-ілметил]-3піридин-4-іл-5,6,7,8-тетрагідро-[1,2,4]триазоло[4,3а]піримідин 8-{1-[2-(3-Йод-феніл)-2Н-тетразол-5-іл]-етил}3-піридин-4-іл-5,6,7,8-тетрагідро[1,2,4]триазоло[4,3-а]піримідин 21 3-Піридин-4-іл-8-(2-м-толіл-2Н-тетразол-5ілметил)-5,6,7,8-тетрагідро-4Н-1,2,3а,8-тетраазаазулен 3-Піридин-4-іл-8-[1-(2-м-толіл-2Н-тетразол-5іл)-етил]-5,6,7,8-тетрагідро-4Н-1,2,3а,8-тетраазаазулен 8-[2-(3-Хлор-феніл)-2Н-тетразол-5-ілметил]-3піридин-4-іл-5,б,7,8-тетрагідро-4Н-1,2,3а,8тетрааза-азулен 8-{1-[2-(3-Хлор-феніл)-2Н-тетразол-5-іл]-етил}3-піридин-4-іл-5,6,7,8-тетрагідро-4Н-1,2,3а,8тетрааза-азулен 8-[2-(2-Флуор-5-метил-феніл)-2Н-тетразол-5ілметил]-3-піридин-4-іл-5,6,7,8-тетрагідро-4Н1,2,3а,8-тетрааза-азулен 8-{1-[2-(2-Флуор-5-метил-феніл)-2Н-тетразол5-іл]-етил}-3-піридин-4-іл-5,6,7,8-тетрагідро-4Н1,2,3а,8-тетрааза-азулен 8-[2-(3-Йод-феніл)-2Н-тетразол-5-ілметил}-3піридин-4-іл-5,6,7,8-тетрагідро-4Н-1,2,3а,8тетрааза-азулен 8-{1-[2-(3-Йод-феніл)-2Н-тетразол-5-іл]етил}-3піридин-4-іл-5,6,7,8-тетрагідро-4Н-1,2,3а,8тетрааза-азулен 4-(5-{[2-(3-хлорфеніл)-2Н-тетразол-5іл]метокси}-4-метил-4Н-1,2,4-триазол-3-іл)піридин 4-(5-{1-[2-(3-хлорфеніл)-2Н-тетразол-5іл]етокси}-4-метил-4Н-1,2,4-триазол-3-іл)піридин 4-[4-метил-5-(2-м-толіл-2Н-тетразол-5ілметокси)-4Н-[1,2,4]триазол-3-іл]-піридин 4-{4-метил-5-[1-(2-м-толіл-2Н-тетразоп-5-іл)етокси]-4Н-[1,2,4]триазол-3-іл}-піридин 4-{5-[2-(2-Флуор-5-метил-феніл)-2Н-тетразол5-ілметокси]-4-метил-4Н-[1,2,4]триазол-3-іл}піридин 4-(5-{1-[2-(2-Флуор-5-метил-феніл)-2Нтетразол-5-іл]-етокси}-4-метил-4Н-[1,2,4]триазол3-іл)-піридин 4-{5-[2-(3-Хлор-феніл)-2Н-тетразол-5ілметокси]-4-циклопропіл-4Н-[1,2,4]триазол-3-іл}піридин 4-(5-{1-[2-(3-Хлор-феніл)-2Н-тетразол-5-іл]етокси}-4-циклопропіл-4Н-[1,2,4]триазол-3-іл)піридин 4-[4-Циклопропіл-5-(2-м-толіл-2Н-тетразол-5ілметокси)-4Н-[1,2,4]триазол-3-іл]-піридин 4-{4-Циклопропіл-5-[1-(2-м-толіл-2Н-тетразол5-іл)-етокси]-4Н-[1,2,4]триазол-3-іл}-піридин 4-{4-Циклопропіл-5-[2-(2-флуор-5-метилфеніл)-2Н-тетразол-5-ілметокси]-4Н[1,2,4]триазол-3-іл}-піридин 4-(4-Циклопропіл-5-{1-[2-(2-флуор-5-метилфеніл)-2Н-тетразол-5-іл]-етокси}-4Н[1,2,4]триазол-3-іл)-піридин 4-{5-[2-(3-Йод-феніл)-2Н-тетразол-5ілметокси]-4-метил-4Н-[1,2,4]триазол-3-іл}-піридин 4-(5-{1-[2-(3-Йод-феніл)-2Н-тетразол-5-іл]етокси}-4-метил-4Н-[1,2,4]триазол-3-іл)-піридин 4-{4-Циклопропіл-5-[2-(3-йод-феніл)-2Нтетразол-5-ілметокси]-4Н-[1,2,4]триазол-3-іл}піридин 4-(4-Циклопропіл-5-{1-[2-(3-йодчреніл)-2Нтетразол-5-іл]-етокси}-4Н-[1,2,4]триазол-3-іл)піридин 85576 22 3-[5-(4-метил-5-піридин-4-іл-4Н-[1,2,4]триазол3-ілоксиметил)-тетразол-2-іл]-бензонітрил 3-{5-[1-(4-метил-5-піридин-4-іл-4Н[1,2,4]триазол-3-ілокси)-етил]-тетразол-2-іл}бензонітрил 3-[5-(4-Циклопропіл-5-піридин-4-іл-4Н[1,2,4]триазол-3-ілоксиметил)-тетразол-2-іл]бензонітрил 3-{5-[1-(4-Циклопропіл-5-піридин-4-іл-4Н[1,2,4]триазол-3-ілокси)-етил]-тетразол-2-іл}бензонітрил 3-(5-{[Метил-(4-метил-5-піридин-4-іл-4Н[1,2,4]триазол-3-іл)-аміно]-метил}-тетразол-2-іл)бензонітрил 3-(5-{1-[Метил-(4-метил-5-піридин-4-іл-4Н[1,2,4]триазол-3-іл)-аміно]-етил}-тетразол-2-іл)бензонітрил 3-[5-(3-Піридин-4-іл-6,7-дигідро-5Н[1,2,4]триазоло[4,3-а]піримідин-8-ілметил)тетразол-2-іл]-бензонітрил 3-{5-[1-(3-Піридин-4-іл-6,7-дигідро-5Н[1,2,4]триазоло[4,3-а]піримідин-8-іл)-етил]тетразол-2-іл}-бензонітрил 3-[5-(3-Піридин-4-іл-4,5,6,7-тетрагідро-1,2,3а,8тeтpaaaa-aayлен-8-ілметил)-тетразол-2-іл]бензонітрил 3-{5-[1-(3-Піридин-4-іл-4,5,6,7-тетрагідро1,2,3а,8-тeтpaaaa-aayлен-8-іл)-етил]-тетразол-2іл}-бензонітрил (R)&(S)-4-(5-{1-[2-(3-хлорфеніл)-2Н-тетразол5-іл]етокси}-4-метил-4Н-1,2,4-триазол-3-іл)піридин 2-(3-хлор-феніл)-5-[(трифеніл-l5-фосфаніл)метил]-2Н-тетразол гідробромід 4-(5-{2-[2-(3-хлорчреніл)-2Н-тетразол-5-іл]вініл}-4-етил-4Н-[1,2,4]триазол-3-іл)-піридин 4-(5-{2-[2-(3-хлор-феніл)-2Н-тетразол-5-іл]вініл}-4-етил-4Н-[1,2,4]триазол-3-іл)-піридин 1-[2-(3-Хлор-феніл)-2Н-тетразол-5-іл]-2-(4циклопропіл-5-піридин-4-іл-4Н-[1,2,4]триазол-3-іл)етанол 2-[2-(3-Хлор-феніл)-2Н-тефазол-5-іл]-1-(4циклопропіл-5-піридин-4-іл-4Н-[1,2,4]триазол-3-іл)етанол 4-(5-{2-[2-(3-хлор-феніл)-2Н-тетразол-5-іл]вініл}-4-етил-4Н-[1,2,4]триазол-3-іл)-піридин 3-[4-метил-5-({[2-(3-метилфеніл)-2Н-тетразол5-іл]метил}тіо)-4Н-1,2,4-триазол-3-іл]бензонітрил, 5-({[5-(3,5-Дифлуорфеніл)-4-етил-4Н-1,2,4триазол-3-іл]тіо}метил)-2-(3-метилфеніл)-2Нтетразол, 3-[4-метил-5-({1-[2-(3-метилфеніл)-2Нтетразол-5-іл]етил)тіо)-4Н-1,2,4-триазол-3іл]бензонітрил, 5-(Н[5-(3,5-Дифлуорфеніл)-4-етил-4Н-1,2,4триазол-3-іл]тіо}етил)-2-(3-метилфеніл)-2Нтетразол, 6-(4-{1-[2-(3-Хлорфеніл)-2Н-тетразол-5іл]етил}піперазин-1-іл)нікотинонітрил, 3-(4-{1-[2-(3-Хлорфеніл)-2Н-тетразол-5іл]етил}піперазин-1-іл)піразин-2-карбонітрил, 2-(4-{1-[2-(3-Хлорфеніл)-2Н-тетразол-5іл]етил}піперазин-1-іл)нікотинонітрил, 1-{1-[2-(3-Хлорфеніл)-2Н-тетразол-5-іл]етил}4-(3-нітропіридин-2-іл)піперазин, 23 85576 8-{1-[2-(3-Хлорфеніл)-2Н-тетразол-5-іл]етил}3-(3,5-дифлуорфеніл)-5,6,7,8тетрагідро[1,2,4]триазоло[4,3-а]піримідин, 8-{1-[2-(3-Хлорфеніл)-2Н-тетразол-5-іл]етил}3-(4-метоксифеніл)-5,6,7,8тетрагідро[1,2,4]триазоло[4,3-а]піримідин, 3-(2-Хлор-6-метоксипіридин-4-іл)-8-{1-[2-(3хлорфеніл)-2Н-тетразол-5-іл]етил}-5,6,7,8тетрагідро[1,2,4]триазоло[4,3-а]піримідин, 8-{1-[2-(3-Хлорфеніл)-2Н-тетразол-5-іл]етил}3-(2-метоксипіридин-4-іл)-5,6,7,8тетрагідро[1,2,4]триазоло[4,3-а]піримідин, 8-{[2-(3-Хлорфеніл)-2Н-тетразол-5-іл]метил}-3(2-метоксипіридин-4-іл)-5,6,7,8тетрагідро[1,2,4]триазоло[4,3-а]піримідин, 3-(5-{[3-(2-Метоксипіридин-4-іл)-6,7дигідро[1,2,4]триазоло[4,3-а]піримідин-8(5Н)іл]метил}-2Н-тетразол-2-іл)бензонітрил, 3-(2-Метоксипіридин-4-іл)-8-{1-[2-(3-йодфеніл)2Н-тетразол-5-іл]етил}-5,6,7,8тетрагідро[1,2,4]триазоло[4,3-а]піримідин, 3-(5-{1-[3-(2-Метоксипіридин-4-іл)-6,7дигідро[1,2,4]триазоло[4,3-а]піримідин-8(5Н)іл]етил}-2Н-тетразол-2-іл)бензонітрил, 3-(5-{[3-(2-Метоксипіридин-4-іл)-5,6,7,8тетрагідро-9Н-[1,2,4]триазоло[4,3-а][1,3]діазепін-9іл]метил}-2Н-тетразол-2-іл)бензонітрил, 3-(5-{[3-(2,6-Диметоксипіримідин-4-іл)-6,7дигідро[1,2,4]триазоло[4,3-а]піримідин-8(5Н)іл]етил}-2Н-тетразол-2-іл)бензонітрил, (R) 3-(5-{1-[3-(2-Метоксипіридин-4-іл)-6,7дигідро[1,2,4]триазоло[4,3-а]піримідин-8(5Н)іл]етил}-2Н-тетразол-2-іл)бензонітрил, (S) 3-(5-{1-[3-(2-Метоксипіридин-4-іл)-6,7дигідро[1,2,4]триазоло[4,3-а]піримідин-8(5Н)іл]етил}-2Н-тетразол-2-іл)бензонітрил, (R) Етил 4-{1-[2-(3-хлорфеніл)-2Н-тетразол-5іл]етил}піпвразин-1-карбоксилат, (S) Етил 4-{1-[2-(3-хлорфеніл)-2Н-тетразол-5іл]етил}піперазин-1-карбоксилат, (R) Етил 4-{1-[2-(5-хлор-2-флуорфеніл)-2Нтетразол-5-іл]етил}піперазин-1-карбоксилат, (S) Етил 4-{1-[2-(5-хлор-2-флуорфеніл)-2Нтетразол-5-іл]етил}піперазин-1-карбоксилат, (R) 6-(4-{1-[2-(3-Хлорфеніл)-2Н-тетразол-5іл]етил}піперазин-1-іл)нікотинонітрил, (S) 6-(4-{1-[2-(3-Хлорфеніл)-2Н-тетразол-5іл]етил}піперазин-1-іл)нікотинонітрил, (R) 3-(4-{1-[2-(3-Хлорфеніл)-2Н-тетразол-5іл]етил}піперазин-1-іл)піразин-2-карбонітрил, (S) 3-(4-{1-[2-(3-Хлорфеніл)-2Н-тетразол-5іл]етил}піперазин-1-іл)піразин-2-карбонітрил, 4-(5-{(S)-1-[2-(3-Хлор-феніл)-2Н-тетразол-5-іл]етокси}-4-метил-4Н-[1,2,4]триазол-3-іл)-піридин, 2-(3-Хлор-феніл)-5-{(R)-1-[5-(3,5-дифлуорфеніл)-4-метил-4Н-[1,2,4]триазол-3-ілокси]-етил}2Н-тетразол, 3-(5-{(R)-1-[2-(3-Хлор-феніл)-2Н-тетразол-5-іл]етокси}-4-метил-4Н-[1,2,4]триазол-3-іл)-піридин, 4-(5-{2-[5-(3-Хлорфеніл)-2Н-тетразол-2іл]пропіл}-4-метил-4Н-1,2,4-триазол-3-іл)піридин, 4-(5-{(R)-1-[2-(3-Хлор-феніл)-2Н-тетразол-5-іл]етокси}-4-метил-4Н-[1,2,4]триазол-3-іл)-піридин, 2-(3-хлорфеніл)-5-[1-метил-2-фенілвініл]-2Нтетразол та 24 2-({1-[2-(3-хлорфеніл)-2Н-тетразол-5іл]етил}тіо)-імідазо[4,5-b]піридин; Втілення винаходу охоплюють солі сполук формули І. Солі для застосування у фармацевтичній композиції повинні бути фармацевтично прийнятними солями, але інші солі можуть бути корисними у виготовленні сполук формули І. Придатною фармацевтично прийнятною сіллю сполук винаходу є, наприклад, кислотно-адитивна сіль, наприклад, неорганічної або органічної кислоти. На додаток, придатною фармацевтично прийнятною сіллю сполук винаходу є сіль лужного металу, сіль лужноземельного металу або сіль з органічною основою. Інші фармацевтично прийнятні солі та способи отримання цих солей можна знайти, наприклад, у Remington's Pharmaceutical Sciences (18 th Edition, Mack Publishing Co.) 1990. Деякі сполуки формули І можуть мати хіральні центри та/або центри геометричної ізомерії (Е- та Z- ізомери), та зрозуміло, що винахід охоплює усі такі оптичні, діастереоізомерні та геометричні ізомери. Винахід також стосується будь-яких та усіх таутомерних форм сполук формули І. Винахід також стосується будь-яких та усі х форм сольватів та гідратів сполук формули 1. Фармацевтична композиція Згідно з одним аспектом заявленого винаходу запропоновано фармацевтичну композицію, яка містить як активний інгредієнт терапевтично ефективну кількість сполуки формули І, або її солі, сольвати або сольватовані солі у асоціації з одним або більше фармацевтично прийнятним розріджувачем, наповнювачами та/або інертним носієм. Композиція може бути у формі, придатній для перорального застосування, наприклад, як таблетка, пілюля, сироп, порошок, гранула або капсула, для парентеральної ін'єкції (охоплюючи внутрішньовенну, підшкірну, внутрішньом'язову, вн утрішньосудинну або інфузію) як стерильний розчин, суспензію або емульсію, для місцевого застосування, наприклад, як мазь, бляшку або крем, або для ректального застосування, наприклад, як супорзиторій. Взагалі, вищезгадані композиції можна отримувати звичайним способом, застосовуючи один або більше звичайних наповнювачів, фармацевтичних прийнятних розріджувачів та/або інертних носіїв. Придатними добовими дозами сполук формули І у лікуванні ссавця, охоплюючи людину, є приблизно 0,01-250мг/кг маси тіла при пероральному застосуванні та приблизно 0,001-250мг/кг маси тіла при парентеральному застосуванні. Типові добові дози активних інгредієнтів змінюються у широкому діапазоні та повинні залежати від різних факторів, як-то доречності показання, тяжкості лікованої хвороби, шляху застосування, віку, маси та ста ті пацієнта та конкретної застосованої сполуки, та може бути визначною спеціалістом. Медичне застосування Знайдено, що сполуки згідно із заявленим винаходом, або її солі, сольвати або сольватовані 25 85576 солі, показують високий ступінь активності та селективності відносно окремих підтипів метаботропного рецептору глютамату (mGluR). Відповідно, сполуки заявленого винаходу, як очікують, будуть корисними у лікуванні станів, асоційованих зі збуджуючою активацією mGluR5, та для інгібування нейронального порушення, викликаного збуджуючою активацією mGluR5. Сполуки можна застосовувати для отримання інгібіторної дії на mGluR5 у ссавців, охоплюючи людину. Рецептор Групи І mGluR, охоплюючи mGluR5, є високо експресованими у центральну та периферійну нервову систему та у інші тканини. Таким чином, очікують, що сполуки винаходу є добре придатними для лікування mGluR5опосередкованих розладів, як-то гострих та хронічних неврологічних та психіатричних розладів, шлунково-кишкових розладів, та хронічних та гострих больових розладів Винахід стосується сполуки формули І, яку визначено вище, для застосування у терапії. Винахід стосується сполуки формули І, яку визначено вище, для застосування у лікуванні mGluR5-опосередкованиї розладів. Винахід стосується сполуки формули І, яку визначено вище, для застосування у лікуванні хвороби Альцгеймера - старечого слабоумства, СНІДіндукованого слабоумства, хвороби Паркінсона, бічного латерального склерозу, хореї Гентінгтона, мігрені, епілепсії, шизофренії, депресії, занепокоєння, гострого занепокоєння, офтальмологічних розладів, як-то ретинопатій, діабетичних ретинопатій, глаукоми, слухови х невропатичних розладів, як-то дзенькіту у вухах, невропатій, індукованих хемотерапією, пост-герпетичної невралгії, витривалості, залежності, слабкості X, аутизму, затримки психічного розвитку, шизофренії та синдрому Дауна. Винахід стосується сполуки формули І, як визначено вище, для застосування у лікуванні болю, пов'язаного з мігренню, запалювального болю, невропатичних больових розладів, як-то діабетичних невропатій, артритів та ревматоїдних хвороб, поперекового болю, післяопераційного болю та болю, асоційованого з різними станами, охоплюючи ангіну, ниркову або печінкову кольку, менструацію, мігрень та подагру. Винахід стосується сполуки формули І, як визначено вище, для застосування у лікуванні інсульту, травми голови, аноксичних та ішемічних травм, гіпоглікемії, серцево-судинної хвороби та епілепсії. Заявлений винахід також стосується застосування сполуки формули І, як визначено вище, у виробництві медикаменту для лікування рецепторопосередкованих розладів Групи І mGluR та будьяких розладів, наведених ви ще. Одне втілення винаходу стосується застосування сполуки формули І у лікуванні шлунковокишкових розладів. Ще одне втілення винаходу стосується застосування сполуки формули І, для виробництва медикаменту для інгібування минущих релаксацій нижчого стравохідного сфінктера, для лікування GERD, для попередження рефлюксу, для лікуван 26 ня регургітації, лікування астми, лікування ларингіту, лікування хвороб легенів та для терапії недостатності ваги. Подальшим аспектом винаходу є застосування сполуки формули І для виробництва медикаменту для лікування або попередження функціональних шлунково-кишкових розладів, як-то функціональної диспепсії (FD). Ще одним аспектом винаходу є застосування сполуки формули І для виробництва медикаменту для лікування або попередження синдрому подразнення кишки (IBS), як-то домінування запору IBS, діареї IBS або домінування альтернуючого випорожнення IBS. Винахід також стосується способу лікування mGluR5-опосередкованих розладів та будь-якого наведеного вище розладу, у пацієнта, який потерпає або при ризику названих станів, спосіб полягає у застосуванні пацієнту ефективної кількості сполуки формули І, як вище визначено. Необхідну для терапевтичного або превентивного лікування конкретного розладу дозу слід обов'язково змінювати залежно від лікованого організму, шляху застосування та тяжкості хвороби, яку лікують. У контексті даного опису, термін "терапія" та "лікування" охоплює попередження або профілактику, якщо не визначене інше. Терміни "терапевтичне" та "терапевтично" пояснюється відповідно. У цьому описі, якщо не визначене інше, термін "антагоніст" та "інгібітор" означатиме сполуку, яка частково або повністю будь-якими способами блокує шля х трансдукції, що призводить до продукування лігандом відгуку. Термін "розлад", якщо не визначене інше, означає будь-який стан та хворобу, асоційовану з активністю метаботропного рецептора глютамату. Немедичне застосування На додаток до їх застосування у терапевтичній медицині, сполуки формули І, їх солі, сольвати або сольватовані солі, також є корисними як фармакологічне оснащення у розвитку та стандартизації систем тестів in vitro та in vivo для оцінки дій інгібіторів mGluR, пов'язаних з активністю у лабораторних тварин, як-то котів, собак, кролів, мавп, щурів та мишей, як частина пошуку нових терапевтичних засобів. Способи отримання Ще один аспект заявленого винаходу стосується способів отримання сполук формули І, або її солей, сольватів або сольватованих солей. Способи отримання сполук у заявленому винаході описано тут. Зрозуміло, що весь наступний опис таких способів, де прийнятні, придатні захисні групи додаватимуть до, та потім видалятимуть із різних реагентів та інтермедіатів способом, легко зрозумілий фа хівцям з органічного синтезу. Звичайні способи застосування таких захисних гр уп а також приклади придатних захисних груп описано, наприклад, у ["Protective Groups in Organic Synthesis", T.W. Green, P.GM. Wuts, Wiley-Interscience, New York, (1999)]. Також зрозуміло, що перетворення групи або замісника у ще одну групу або замісник хімічним способом можна проводити на будь-якому інтермедіаті або кінцевому продукті на шляху син 27 85576 28 тезу до кінцевого продукту, можливий тип перетворення котрого обмежено тільки несумісністю інших функціональностей, які несе молекула на стадії станів, або реагентів, застосованих у перетворенні. Такі властиві несумісності та шляхи їх обійти проведенням прийнятних перетворень, та етапи синтезу у придатному належному порядку легко зрозумілі фахівцям з органічного синтезу. Приклади перетворень наведено нижче, та зрозуміло, що описані перетворення не обмежено тільки загальними групами або замісниками, для котрих наведено приклади перетворення. Посилання та описи на інші придатні перетворення наведено у ["Comprehensive Organic Transformations - A Guide to Functional Group Preparations" R. С Larock, VHC Publishers, Inc. (1989)]. Посилання та описи інших придатних реакцій описано у посібниках по органічній хімії, наприклад, ["Ad vanced Organic Chemistry". March, 4th ed. McGraw Hill (1992) або, "Organic Synthesis", Smith, McGraw Hill, (1994)]. Способи очищення інтермедіатів та кінцевих продуктів охоплюють, наприклад, пряму та реверснофазову хроматографію на колонці або обертальний планшет, перекристалізацію, дистиляцію та рідинну-рідинну або тверду-рідинну екстракцію, котрі легко зрозумілі фахівцям. Визначення замісників та гр уп відповідає формулі І за винятком того, де визначено інакше. Термін "кімнатна темпе ратура" та "зовнішня температура" означатиме, якщо не визначено інше, температуру 16-25°С. Термін "нагрівання із зворотним холодильником" означатиме, якщо не визначено інше, застосування температури у відповідності до застосованого розчинника при або вище точки кипіння названого розчинника. Способи отримання сполуки Формули і Наведені нижче необмежувальні шляхи синтезів є корисними для подальшого отримання інтермедіатів та сполук формули І. Інші вихідні матеріали, застосовані для отримання сполук формули І, є або комерційно доступними або їх можна отримувати способами, описаними у літературі. Сполуки формули ν отримують конденсацією альдегідів формули іі, наприклад, коричного альдегіду або гліоксалевої кислоти з арилсульфонілгідразинами ііі, як-то 4толуолсульфонілгідразином, у придатному розчиннику, наприклад, метанолі, етанолі, ДМФ або діалкілетерах при температурі 0-100°С, альтернативно без розчинника у мікрохвильовому опроміненні. Подібно, арилгідразони формули vi можна утворювати реакцією арилгідразину iv з альдегідами формули іі. [J. Med. Chem,1980, 23, 631-634; Monatshefte fuer Chemie 2001, 403-406; J.Med.Chem. 2000, 43, 953 - 970; J. Med Chem. 1978, 21, 1254-60] Солі діазонію формули viii є доступними із придатно заміщеного аміну арилу або гетероарилу формули vii, застосовуючи добре відомі способи через діазотування, застосовуючи джерело нітриту, як-то натрій нітрит або ізоамілнітрит, у присутності придатного джерела кислоти, як-то гідрохлоридної кислоти або тетрафлуорборної кислоти у розчиннику, як-то воді, при температурі -10-0°С. У випадку, де застосовано менш розчинну сполуку з протиіоном X-, як-то тетрафлуорборат, таким чином отриману сіль діазонію можна збирати осадженням та застосовувати у наступній реакції у неводних умовах. Розчинні солі діазонію, отримані, застосовуючи інші джерела кислоти, можна осаджувати додаванням придатного реагенту, як то тетра флуорборної кислоти або натрій тетрафлуорборату [Angew. Chem. Int. Ed. Engl. 2004, 43, 897-900]. Тетразоли формули іх, де G - електрофіл, якто олефін, карбоніл або арил, який можна отримувати 1,3-диполярним циклододаванням солі діазонію до арилсульфонілгідразону а потім відщепленням арилсульфінової кислоти, що створює кільце тетразолу, у протоновмісних розчинниках, як-то воді та спирті або їх суміші, в основних апротонних розчинниках, як-то піридині, або суміші цих розчинників з застосованими протоновмісними розчинниками, що дає сіль діазонію. [J.Med.Chem. 2000, 43, 953 - 970] 29 85576 30 Тетразоли формули іх можна також отримувати реакцією арилгідразону формули vi з арилазидом формули хі у придатному розчиннику, як-то етанолі або піридині. [J. Med Chem. 1978, 21, 125460] Арилазиди формули хі можна утворювати, застосовуючи натрій азид з ариловоюлю сіллю діазонію формули х, котру у свою чергу можна отри мувати, як описано вище із ариламіну, наприклад, аніліну або 2,4,6-триброманіліну. Арилазид можна розглядати як реактив - переносник нітрогену, тому що циклододавання до гідразону супроводжується відщепленням, що перетворює попередник ариламіну до солі діазонію х. Звичайно G - група, котру можна застосовувати як попередник частки X1-X2-Q(R2)p у сполуці формули І, як-то олефін або карбонова кислота або похідне кислоти. Коли G - арилолефінова сполука формули хіі, утворена, наприклад, із коричного альдегіду, де R3 - Н, групу олефіну можна розщеплювати для отримання альдегіду формули хііі безпосередньо в одній посудині, застосовуючи реактив, як-то озон, або через діол, застосовуючи дигідроксилювальний реактив, як-то осмій тетроксид, а потім наступним розщепленням, застосовуючи реактив, як-то плюмбум (IV) ацетат. Коли застосовано заміщений коричний альдегід, реакція отримання сполуки формули хіі, як-то αметилциннамальдегіду, де R3 - метил, кетон, була результатом розщеплення олефіну. [J.Med.Chem. 2000, 43, 953 - 970; Adv. Synth. Catal. 2002, 344, 421-433; Oxidations у Organic Chemistry", M. Hudlicky, ACS MoHograph 186, (1990)] Альдегіди формули хііі, де R3 - Η, можна відновити до первинних спиртів формули χν, де R 3 та R4 - Н, застосовуючи добре відомі відновники, якто натрій або літій борогідрид, у розчиннику, як-то метанолі, ТГФ або ДМФ при температурах 0-80°С. Вторинні спирти, де R4 не є Н, можна також утворювати із альдегідів формули хііі реакцією приєднання металоорганічного реагенту, наприклад, реагентів Гриньяра R4MgX у розчиннику, як-то ТГФ, при температурах -78°С - 80°С, та звичайно її проводять між 0°С та кімнатною температурою. Подібно, кетони формули хііі, де R3 не є Н, можна застосовувати для утворення вторинних або третинних спиртів формули xv відновленням або приєднанням металоорганічного реагенту. Первинні спирти формули xv, де R3 та R4 - Н, також доступні із сполуки формули xiv відновленням похідного кислоти або естеру, застосовуючи відновники, як то літій борогідрид, у придатному розчиннику, якто ТГФ або ДМФ, при температурах у діапазоні 20 - 80°С. Кетони формули хііі отримують обробкою естерів карбонової кислоти прийнятним карбоновим нуклеофільним реагентом, як-то реагентами Гриньяра R3MgX, згідно із звичайними протоколами. [J. Med Chem. 1978, 21, 1254-60; J.Med.Chem. 1993, 36, 2676-2688; Can. J. Chem. 1995, 73, 885895] Енантіомерно чисті або збагачені продукти, як зображено на схемі 4а (R7 - Me або Et; X3 та X4 , як визначено у формулі І) отримують кінетичним розділенням рацемічних або скалемічних вторинних спиртів, застосовуючи каталізоване ферментом ацетилювання, наприклад, зі зв'язаною з полімером Candida Antarctica Lipase (Novozyme 435®), або іншими естеразами, наприклад, Candida rugosa або Pseudomonas fluorescens у органічних розчинниках, як-то толуолі, трет-бутилметиловому етері, трет-бутанолі або ДХМ при температурах 090°С, застосовуючи ацетилюючі реагенти, як-то вінілацетат, інші заміщені алкілацетати, пентафлуорфенілацетат або нітро- або галогенфенілацетати, котрі дають збагачений (R)-ацетат та збага 31 85576 32 чений (S)-спирт. (R)-ацетат можна гідролізувати до відповідного спирту, наприклад, літій гідроксидом у суміші ТГФ та води або будь-якими іншими спо собами, як описано тут нижче, що дало протилежний енантіомерно збагачений або чистий спирт. Спирти формули xv можна перетворити звичайними способами у сполуку формули xvi, де LG - відщеплювана група. Сполуки формули xvi, де LG - галогенід, утворено застосуванням реагентів, як-то трифенілфосфіну у комбінації з джерелом галогеніду як-то йодом, N-бромсукцинімідом або N-хлорсукцинімідом, або альтернативно обробкою трибромфосфіном або тіонілхлоридом. Спиртову частку сполуки формули xv також можна перетворити у відщеплювані групи LG, як-то мезилати або тозилати, застосуванням прийнятного сульфонілгалогеніду або сульфонілангідриду у присутності ненуклеофільної основи для отримання відповідних сульфонатів. Хлориди або сульфонати можна перетворювати до відповідних бромідів або йодидів обробкою солям броміду, наприклад, LiBr, або солями йодиду, як-то Lil. Сполуки формули ххііі, які містять кільце дигідро[1,2,4]триазол-3-тіону можна отримувати вихідним N-ацілуванням 4-алкілтіосемікарбазиду формули хіх, застосовуючи будь-який придатний ацілувальний реактив формули xviii у придатному розчиннику, наприклад, піридині, ДМФ, ДХМ, ТГФ або ацетонітрилі при температурі -20 - 100°С. Можна застосовувати попередньо створений ацілувальний реактив, як-то галогенід кислоти, або можна активувати кислоту на місці обробкою звичайними активуючими реагентами, як-то DCC, DIC, EDCI або HBTU, з або у присутності спів реагентів, як-то ГОБТ або ДМАП.Утворення ациклічного інтермедіату ххіі супроводжувалось замиканням лужного кільця або спонтанно в умовах ацилування, або нагріванням при 50-150°С у піридині, або у водному розчиннику у присутності основи, як-то NaOH, NaHCO3 або Na2CO3, з або без співрозчинників як-то діоксану, ТГФ, МеОН, ЕtOН або ДМФ. Ациклічний інтермедіат формули ххіі можна також утворювати обробкою ацилгідразидом формули хх з придатним ізотіоціанатом формули ххі у придатному розчиннику, наприклад, 2пропанолі, ДХМ, ТГФ або подібне при температурах у діапазоні -20-120°С. Амінні інтермедіати формули xvii можна утворювати, застосовуючи сполуки формули xvi, де LG представляє відщеплювану груп у, заміщенням вказаної відщеплюваної групи, застосовуючи первинний амін NH2R3 або джерело аміаку, коли R3 Н, або можна утворювати, застосовуючи відповідні сполуки карбонілу формули хііі, відновним амінуванням, застосовуючи амін NH2R3 у присутності придатного м'якого відновника, як-то NaBH3CN або NaBH(OAc)3 у придатному розчиннику, як-то ТГФ, метанолі або 1,2-дихлоретані. Сполуки формули ххііі можна перетворити у сполуки формули xxv ви хідним алкілуванням атому сульфур у до утворення інтермедіатів формули xxi ν, застосовуючи первинні алкілгалогеніди, як-то Mel та Etl (алкіл - Me та Et - відповідно) у МеОН, ЕtOН, ТГФ, ацетоні або подібному при -30-100°С, а потім - окисненням інтермедіатів xxi v із застосуванням, наприклад, KMnО4 у суміші води та оцтової кислоти, або МСРВА у ДХМ при -20-120°С, або 33 85576 34 із застосуванням будь-якого іншого придатного окисника. Сполуки 3-аміно[1,2,4]триазолу формули ххіх, де групи Rx' та Rx еквівалентні R2 та R3 у сполуках формули І, де Q - моноциклічне кільце триазолу, або можуть разом утворювати кільце, що призводить до сполуки формули І, де гр упа Q - біциклічна система, яка містить конденсоване триазолокільце, можна отримувати обробкою ізотіосечовиною формули xxvi або ацилгідразидом формули xxvii, або поетапно обробкою гідразином, а потім ацілувальним реагентом формули xviii. Інтермедіати формули xxviii можуть утворювати кільце триазолу нагріванням при 50-200°С у придатному розчиннику, як-то піридині або ДМФ. Завдяки можливості циклізації обох NHRx груп у сполуки формули xxviii ця реакція найкраще працює, коли застосовують симетричні тіосечовини, щоб уникнути суміші ізомерів, що може відбутися, коли групи Rx не є ідентичними. Коли застосовують асиметричні тіосечовини, ізомери можна розділяти хроматографічною очисткою. пропанолі, ТГФ або подібних при температурах між -20-180°С. Процеси ацилування у два етапи можна провести у придатному розчиннику, як-то ТГФ, піридині або ДМФ при -20-100°С. Як описано вище, відщеплювана група LG в ацілувальному агенті xviii може охоплювати хлор або будь-яку іншу придатну відщеплювану груп у, як-то таку, що генеровано обробкою на місці відповідної кислоти звичайними активуючими реагентами. Ізотіосечовини формули xxvi можна отримувати Sалкілуванням відповідних тіосечовин алкілгалогенщом, наприклад, Mel або Etl у придатному розчиннику, як-то ацетоні, ЕtOН, ТГФ, ДХМ або подібних при температурах між -100-100°С. Карбон-заміщені триазоли формули хххііі можна отримувати подібним способом, застосуванням аміду формули ххх. Груп у аміду можна активувати, застосовуючи реактив, як-то РОСІ3 або Me3OBF4 , що генерує сполуки формули хххі, як-то хлорімідати (LG=CI) або метоксиімідати (LG=OMe). Подібні до вищезгаданих ізотіосечовин формули xxvi сполуки формули хххі можуть реагувати з ацилгідразидом або гідразином, а потім з ацілувальним агентом, що генерує інтермедіат хххіі, котрий може бути приєднаним до триазолу спонтанно або нагріванням. Конденсовані [1,2,4]триазоли, де групи Rx та Rx разом утворюють 5-7 - членне кільце, можна отримувати застосуванням придатного циклічного лактаму замість ациклічного аміду. Такі імідати лактаму є доступними обробкою відповідних їх лактамів Me3 OBF4 або диметилсульфатом. [Org.Prep.Proced.lnt; 24,1992, pp.147-158 або Tetrahedron Lett. 42, 2001, pp.173-1776] Реакцію ізотіосечовин формули xxvi, у котрих S-алкіл (наприклад, S-Me або S-Et) частково діє як відщеплювана група після обробки гідразином або нуклеофільним ацилгідразидом, можна провести у розчинниках, як-то піридині, метанолі, етанолі, 2 Сполуки формули ххііі можна перетворити на сполуки формули xxxiv відновленням частки тіону, застосовуючи придатний відновник, як-то нікель Ренея, у придатному розчиннику, як-то етанолі, при температурі 50-100°С, що звичайно виконують при 65°С. Сполуки формули xxxv є доступними із сполук формули xxxi v обробкою альдегідом, наприклад, формальдегідом, у придатному розчиннику, як-то воді, при температурі між кімнатною температурою та 100°С, та її звичайно виконують при 37°С, коли застосовують водний формалін як джерело формальдегіду. Отримані спирти формули xxxv можна окиснювати для отримання альдегідів або кетонів формули xxxvi, застосовуючи добре відомі фахівцям способи окиснення, як-то застосуванням МnО2 як окисника або окисненням Свема. Альтернативно, сполуки формули xxxvii, де відщеплювану гр упу, як-то галогенід, можна отримувати із сполуки формули xxxv, як описано вище для спиртів формули xv. 35 85576 Приклади сполук формули І, де Q містить моноциклічну групу, що охоплює біс-аміни, як-то піперазин та гомопіперазин, які приєднано до X1 або X2 одним атомом N у кільці Q. Біс-аміни, як-то Nмоно-заміщені піперазини або піперазини, котрі містять частку R2, можуть бути комерційно доступними або їх можна отримувати, застосовуючи способи відомі фахівцям. Такі комерційно недоступні сполуки можна отримувати із амінокислот через інтермедіати, як-то дикетопіперазини, котрі можна відновити до амінів, як-то піперазинів. У деяких відомих фахівцям реакціях захист біс-аміну в Q не є необхідним, і вільну аміносполуку можна застосовува ти безпосередньо, наприклад, у заміщенні відщеплюваної групи в сполуках формули xvi. У таких випадках, або у випадках, коли видаляють захисну гр уп у, можна застосовувати вільний амін для уведення замісника R2 у сполуки формули xxxviii, оскільки такі аміни можна застосовувати як нуклеофілльні речовини у реакції з багатьма типами елктрофілів, як-то алкілгалогенідами, хлоридами або ангідридами кислот, хлороформіатами, карбамоїлхлоридами, сульфонілихлоридами, ізоціанатами, ізотіоціанатами та подібними. Сполуки формули xxxviii можна також отримувати із сполук карбонілу формули хііі, застосовуючи описані вище умови відновного амінування для утворення сполук формули xvii. Коли Q у формул I - циклічний діамін, як-то піперазин, та R3 - арил або гетероарил, необхідні нуклеофільні реагенти (W=H або захисні групи) можна отримувати сполученням арилгалогеніду з нуклеофільним циклічним діаміном, як показано у Схемі 12а. Коли арил містить активуючу гр упу, наприклад, присутній суміжний N, як-то у 2піридині (X=N, інше=СR), 2-піримідині (X=X5=N або X=X3=N) або 2-піразині (X=X4=N), реакція полегшується та може відбуватися при нагріванні без 36 додаткового каталізатора. У присутності додаткової активуючої гр упи, що відтягає електрон, як-то орто або пара NO2 або CN, реакція може відбуватися при нижчій температурі. Ароматичне нуклеофільне заміщення менш реактивними галогенідами фенілу може супроводжуватися додаванням придатної системи каталізатор/ліганд [Urgaonkar, S.; Xu, J.-H.; Verkade, J.G J. Org. Chem. 2003, 68, 8416; Urgaonkar, S.; Nagarajan, N.; Verkade, J.G. Org. Lett. 2003, 5, 815]. Кільце Q можна створити з сполуки формули xvii, яка містить частку первинного аміну, будьяким сумісним способом. Один такий спосіб, де кільце Q є моноциклічним біс-аміном, як-то піперазином, охоплює створення кільця заміщенням із сполуки двох відщеплюваних груп, як показано у формулі хххіх [Bioorg. Med. Chem. Lett. 2002,12,791 -794; Bioorg. Med. Chem. Lett. 2002, 12, 3195-3198; Synthesis 1990, 10, 925-930; J. Org. Chem. 1990, 55,1684-1687]. Сполуки формули xvii, які містять вторинний амін, є ідеально прийнятними для створення 3аіиіно-[1,2,4]триазолів, асиметрично заміщених на 3-аміно заміснику та 4-N кільця триазолу. Аміни формули xvii можна перетворити до широкого розмаїття тіосечовин формули ххххі реакцією з придатним ізотіоціанатом у придатному розчиннику, як-то метанолі, етанолі та подібних, при температурі між кімнатною температурою та 100°С, та звичайно виконується при 60°С. Тіосечовини формули ххххі можна перетворити у сполуку формули ххххіі конверсією до ізотіосечовини а потім - реакцією з ацилгідразином та циклізацією до амінотриазолу, як описано вище для ххі х. У цьому випадку, оскільки необхідна група (R1)m-P-CR3R4 із формули І вже є у аміні, та амін є вторинним, циклізація 37 85576 38 триазолу має тільки один варіант реагувати через частину NHR2, утворюючи сполуки формули ххххіі та не ізомерний триазол. Сполуки формули ххххіі (де X2, як зображено у формулі І, - NR3) можна також отримувати заміщенням відщеплюваної групи із сполуки формули xvi, застосовуючи придатний 3-аміно[1,2,4]триазол формули ххіх, охоплюючи такі моноциклічні триазоли, де групи Rx стають R3 та R2, та такі конденсовані триазоли, де обидві групи Rx разом утворюють кільце з сильною основою, як-то натрій гідридом, у розчиннику, як-то ДМФ, при температурах між кімнатною температурою та 100°С, та реакцію звичайно проводять при 60-80°С. Сполуки формул xxxxv та xxxxvi (де X2, як зображено у формулі І - CR3R4) також можна отримувати заміщенням відщеплюваної групи в сполуках формули xvi або додаванням до частки карбонілу у сполуках формули хііі, застосовуючи придатний карбоновий нуклеофіл, як-то, що міститься у сполуці формули xxxxi v, M-CR 3R4-Q-(R 2)p, де Μ - металовмісна частина, як-то Li або МgВr. Карбаніон можна отримувати депротонуванням, коли Q здатна стабілізувати вказаний карбаніон, як-то, коли Q -ароматичний гетеро цикл, як-то триазол, застосовуючи сильнішу основу, як-то нбутиллітій або трет-бутиллітій, або уведенням металу у зв'язок карбон-галоген, як то відбувається, коли реактив Грин'яра створено із сполуки формули xvi (LG=Br). Карбаніони можна отримувати та застосовувати у е терних розчинниках, як-то ТГФ та тільки діетиловий етер, або як суміш з алканами, як-то пентаном або гексаном, при температурах у діапазоні -78°С - 80°С, та реакцію звичайно ініціюють при -78°С та поступово нагрівають до кімнатної температури після додавання сполуки формули xvi. Реакцію карбаніону з відщеплюваною групою мезилату або галогеніду бензилу можна поліпшувати додаванням солі купруму, що генерує металокупрат, тоді як реактив Грин'яра сприяє 1,2-додаванню до карбонілу, навіть коли є можливими інші варіанти. Подібно можна отримувати спирти формули ххххіх додаванням реактиву Грин'я ра формули xxxxvii, доступного із сполуки формули xvi (LG=Br), до карбонілу сполуки формули xxxxviii, котрий, наприклад, є еквівалентним сполукам формули xxxvi, коли Q - триазол. Подібно, сполуки формули ххххііі (де X2, як зображено у формул І є S) можна також отримувати заміщенням відщеплюваної групи у сполуці формули xvi, застосовуючи придатні нуклеофільні реагенти, як-то дигідро-[1,2,4]триазол-3-тіони, котрі реагують через їх таутомерну форму [1,2,4]триазол-3-тіолу у присутності основи, як-то калій карбонату або триетиламіну, у придатному розчиннику, як-то ацетонітрилі або ДМФ, при температурах від кімнатної температури до 100°С, та реакцію звичайно проводять при кімнатній температурі. 39 85576 40 Сполуки формули І, де X1 - С2-алкеніл та X2 зв'язок, можна отримувати із реагентів Вітіга, генерованих обробкою сполуки формули xvi (LG=Br) фосфорними реагентами, як-то PPh3, у розчиннику, як-то толуолі, при температурі 50-100°С, звичайно при 80°С, а потім обробкою отриманої солі фосфоній броміду карбоніловими сполуками формули xxxxviii, наприклад, коли Q - триазольна спо лука формули xxxvi, у присутності основи, як-то DBU, у розчиннику, як-то ДМФ, при температурі 50-100°С, звичайно при 80°С. подібно до вищезгаданих реакцій Грин'яра та альдегіду для отримання xxxxvi та ххххіх, учасників можна змінювати, що у цьому випадку призводить до той же сполуки І, завдяки симетрії реакції утворення зв'язку. Олефінові сполуки формули І можна відновити застосуванням водню у присутності металевого каталізатору, як-то паладію на вугіллі, у придатному розчиннику, як-то етилацетаті або етанолі. Альтернативно такі олефінові сполуки можна відновити додаванням до олефіну придатного реагенту, як-то діалкілборанів R2BH або триалкілсиліланів R3SiH, а потім відновним розщепленням знов утворених зв'язків. Такі iнтермедіати також можна застосовувати у інших реакціях, як-то окиснення, які генерують спирти формули xxxxvi або ххххі х. Аналогічні сполуки формули Ііі та Іііі також можуть бути доступними відновленням спиртової частки у сполуках формули xxxxvi та ххххі х, застосовуючи придатний відновник, наприклад, триалкіл- або триарил-силан у присутності кислоти, як то трифлуороцтової кислоти, або чистої, або у придатному розчиннику, як-то дихлорметані або бензолі, при температурі між кімнатною температурою та 80°С, переважно при 40°С. Сполуки формули Ην (де X2 - О, як зображено у формул І, та R3=Me або Et та R4=H) можна отримувати утворенням зв'язку через нуклеофільне заміщення відщеплюваної групи, як-то алк-SО2, із сполуки формули xxv, де Q - триазол, нуклеофільним спиртом або алкоксидом в основних умовах. Застосована основа може охоплювати сильні гідридні основи, наприклад, NaH або м'які основи, як-то Cs 2CO3, при температурах 0-80°С у полярних апротонних розчинниках, як-то ДМФ або ацетонітрилі, тоді як для енантіомерно збагаченої або чистої сполуки xv (R4=H) переважною основою Cs 2CO3 для того, щоб безпосередньо отримати енантіомерно чисті продукти liv. Інші придатні відщеплювані групи можуть охоплювати галогени, якто хлор або бром. 41 85576 42 Сполуки формули Iviii, де кільце тетразолу є зворотним у порівнянні з усіма попередніми описаними сполуками, та обидва X1 та X2 - CR3R4, можна отримувати нуклеофільними реакціями придатно заміщеного арилтетразолу формули Iv з придатним елктрофільним реагентом формули Ivi. Коли такий інтермедіат є доступним, його можна застосовувати безпосередньо у реакції з арилтетразолом формули Iv, продукуючи безпосередньо сполуки формули Ivii. [J.Med.Chem. 1967, 10, 400402, Pharm.Chem.J. (English Translation) 1993, 27, 204-209]. Коли такий інтермедіат не є доступним, можна частково застосовувати інші елктрофільні реагенти, де G - група, котру потім можна перетворити на Q-(R2)p, що призводить до інтермедіатів формули Ivi. [J.Med.Chem. 1995, 38, 4786-4792; J.Med.Chem. 1992, 35, 1191-1200; J.Med.Chem. 1992; 35, 1200-1209] Наприклад, арилтетразол формули Iv можна додавати у 1,4- або Michael sense до олефінової сполуки, спряженої до групи G, що віднімає електрон, наприклад, нітрилу, альдегіду, естеру та подібних, що дає сполуку формули Ivii, де деякі замісники R3 та R4 можуть бути Н, завдяки вимогам валентності олефіну або реакційної здатності вказаних елктрофільних олефінів. Декілька необмежувальних прикладів елктрофілів наведено нижче у схемі, яка містить належну відщеплювану гр уп LG, як-то мезилат або галогенід. У таких випадках G також може бути гр упою CH2OPG (або їй еквівалентною). Альтернативно можна застосовувати внутрішню відщеплювану груп у X, як-то епоксид або активований азиридин, де група X зберігається у сполуці формули Ivii. Коли Q містить кільце триазолу, можна застосовувати способи попередніх прикладів. Фахівцям зрозуміло, якщо присутні несумісні функціональні групи, такі групи можна придатно захистити, що дозволяє проходити реакції. Також зрозуміло, що продукти формули І також можна перетворити на інші продукти формули І, якщо присутні придатні функціональні групи. Тут наведено декілька необмежувальних прикладів. Коли Х2 - S, сульфід формули І можна окиснювати до сульфоксиду та сульфон у. Коли є присутнім арилгалогенід, як-то йодид або бромід, каталізатори перехідних металів як-то паладій(0)тетракістрифенілфосфін, можуть перетворювати такі арилйодиди та броміди у групи, як-то ціано, алкеніл та арил або гетероарил у присутності придатних засобів сполучення. Коли у формулі І є придатний спирт або вторинний або первинний амін, такі групи можна алкілувати або ацилувати. Подалі винахід стосується наступних сполук, котрі можна застосовувати як інтермедіати в отриманні сполуки формули І; Цинамальдегідтозилгідразон 2-(3-Хлор-феніл)-5-стирил-2Н-тетразол 2-(5-Хлор-2-флуор-феніл)-5-стирил-2Нтетразол 5-Стирил-2-м-толіл-2Н-тетразол 2-(3-Йрд-феніл)-5-стирил-2Н-тетразол 3-(5-Стирил-тетразол-2-іл)-бензонітрил 2-(2-Флуор-5-метил-феніл)-5-стирил-2Нтетразол 1-[2-(3-хлор-феніл)-2Н-тетразол-5-іл]-2-фенілетан-1,2-діол 1-[2-(5-Хлор-2-флуор-феніл)-2Н-тетразол-5іл]-2-феніл-етан-1,2-діол 43 85576 1-Феніл-2-(2-м-толіл-2Н-тетразол-5-іл)-етан1,2-діол 1-[2-(3-Йод-феніл)-2Н-тетразол-5-іл]-2-фенілетан-1,2-діол 3-[5-(1,2-Дигідрокси-2-феніл-етил)-тетразол-2іл]-бензонітрил 1-[2-(2-Флуор-5-метилч|зеніл)-2Н-тетразол-5іл]-2-феніл-етан-1,2-діол 2-(3-Хлор-феніл)-2Н-тетразол-5-карбальдегід 2-(5-Хлор-2-флуор-феніл)-2Н-тетразол-5карбальдегід 2-м-Толіл-2Н-тетразол-5-карбальдегід 2-(3-Йод-феніл)-2Н-тетразол-5-карбальдегід 3-(5-Форміл-тетразол-2-іл)-бензонітрил 2-(2-Флуор-5-метил-феніл)-2Н-тетразол-5карбальдегід [2-(3-Хлор-феніл)-2Н-тетразол-5-іл]-метанол [2-(5-Хлор-2-флуор-феніл)-2Н-тетразол-5-іл]метанол (2-м-Толіл-2Н-тетразол-5-іл)-метанол [2-(3-Йод-феніл)-2Н-тетразол-5-іл]-метанол 3-(5-Гідроксиметил-тетразол-2-іл)-бензонітрил [2-(2-Флуор-5-метил-феніл)-2Н-тетразол-5-іл]метанол 1-[2-(3-хлор-феніл)-2Н-тетразол-5-іл-етанол 1-[2-(5-Хлор-2-флуор-феніл)-2Н-тетразол-5іл]-етанол 1-(2-м-Толіл-2Н-тетразол-5-іл)-етанол 1-[2-(3-Йод-феніл)-2Н-тетразол-5-іл]-етанол 3-[5-(1-Гідроксил-етил)-тетразол-2-іл]бензонітрил 1-[2-(2-Флуор-5-метил-феніл)-2Н-тетразол-5іл]-етанол 5-Бромметил-2-(3-хлор-феніл)-2Н-тетразол Метансуль фонової кислоти 1-[2-(3-хлорфеніл)2Н-тетразол-5-іл]-етиловий естер Метансуль фонової кислоти 2-(5-хлор-2-флуорфеніл)-2Н-тетразол-5-ілметиловий естер Метансуль фонової кислоти 1-[2-(5-хлор-2флуор-феніл)-2Н-тетразол-5-іл]-етиловий естер Метансуль фонової кислоти 2-м-толіл-2Нтетразол-5-ілметиловий естер Метансуль фонової кислоти 1-(2-м-толіл-2Нтетразол-5-іл)-етиловий естер Метансуль фонової кислоти 2-(3-ціано-феніл)2Н-тетразол-5-ілметиловий естер Метансуль фонової кислоти 1-[2-(3-ціанофеніл)-2Н-тетразол-5-іл]-етиловий естер Метансуль фонової кислоти 2-(2-флуор-5метил-феніл)-2Н-тетразол-5-ілметиловий естер Метансуль фонової кислоти 1-[2-(2-флуор-5метил-феніл)-2Н-тетразол-5-іл]-етиловий естер Метансуль фонової кислоти 2-(3-йод-феніл)2Н-тетразол-5-ілметиловий естер Метансуль фонової кислоти 1-[2-(3-йод-феніл)2Н-тетразол-5-іл]-етиловий естер 4-метил-5-піридин-4-іл-2,4-дигідро[1,2,4]триазол-3-тіон 4-Етил-5-піридин-4-іл-2,4-дигідро[1,2,4]триазол-3-тіон 4-Циклопропіл-5-піридин-4-іл-2,4-дигідро[1,2,4]триазол-3-тіон 4-(4-метил-5-метилсульфаніл-4Н[1,2,4]триазол-3-іл)-піридин 44 4-(4-Циклопропіл-5-метилсульфаніл-4Н[1,2,4]триазол-3-іл)-піридин 4-(5-Метансульфоніл-4-метил-4Н[1,2,4]триазол-3-іл)-піридин 4-(4-Циклопропіл-5-метансульфоніл-4Н[1,2,4]триазол-3-іл)-піридин Метил-(4-метил-5-піридин-4-іл-4Н[1,2,4]триазол-3-іл)-амін 3-Піридин-4-іл-5,6,7,8-тетрагідро[1,2,4]триазоло[4,3-а]піримідин 2-(метилтіо)-4,5,6,7-тетрагідро-1Н-1,3-діазепін 1,3-діазепан-2-онгідразонгідройодид 3-піридин-4-іл-6,7,8,9-тетрагідро-5Н[1,2,4]триазоло[4,3-a][1,3]діазепін 4-(4-Етил-4Н-[1,2,4]триазол-3-іл)-піридин (4-Етил-5-піридин-4-іл-4Н-[1,2,4]триазол-3-іл)метанол 4-Етил-5-піридин-4-іл-4Н-[1,2,4]триазол-3карбальдегід Тепер винахід слід ілюструвати наступними необмежувальними прикладами. Загальні способи Усі вихідні матеріали є комерційно доступними або раніше описаними у літературі. Спектр 1Н та 13 С ЯМР записували або на Brucker 400 або Varian 400 при 400МГц та 100МГц, відповідно. Масспектр записували, застосовуючи техніку іонізації електророзпилюванням (РХ-МС; РХ: Waters 2790, колонка ХТегга МС С 8 2,5мкмоль 2,1´30мм, градієнт буферу Η2Ο+0,1%ΤΦΟΚ:ΟΗ 3ΟΝ+0,04%ΤΦΟΚ, МС: мікромас ZMD). Приклад 1 a) Цинамідтозилгідразон Коричний альдегід (8,80г, 66,59ммоль) додавали до п-толуолсульфонаміду (12,44г, 66,79ммоль) в етанолі (70мл). Реакція відразу тверділа, і знов додавали, етанол (20мл) Реакційну суміш перемішували при кімнатній температурі протягом одної години і тоді фільтрували. Тверду речовину промивали метанолом та сушили при зниженому тиску, отримуючи заголовну сполуку, як білу тверду речовину (17,5г, 87%). 1Н ЯМР (CDCI3) δ. (млн.1): 8,23 (s, 1H), 7,88 (d, 2H), 7,60 (d, 1H), 7,34 (m, 6H), 6,83 (m, 2H), 2,43 (s, 3Н). b) α-метил-цинамідтозилгідразон Заголовну сполуку (32,2г, 61%, біла тверда) отримували додаванням α-метилциннамальдегіду (15г, 102,6ммоль) до п-толуолсульфонаміду (19,2г, 102,9ммоль) в етанолі (100мл), а потім видаленням розчиннику у вакуумі, що допомагало осадженню, та тверду речовину збирали фільтруванням і отриману тверду речовину сушили під зменшеним тиском. 1Н ЯМР (CDCI3) δ (млн.-1): 7,90 (s, 2H), 7,87 (s, 1H), 7,55 (s, 1H), 7,34 (m, 7H), 6,65 (s, 1H), 2,45 (s, 3Н), 2,08 (s, 3Н). Приклад 2 а) 2-(3-Хлор-феніл)-5-стирил-2Н-тетразол Водний (5мл) розчин натрій нітриту (540,9мг, 7,839ммоль) додавали крапельною лійкою до розчину 3-хлораніліну у воді (7мл), концентрованої гідрохлоридної кислоти (3мл) та етанолу (7мл). Реакційну суміш перемішували при 0°С протягом десяти хвилин. Цей розчин виливали у крапельну лійку та додавали льоду. Це додавали краплями до розчину цинамідтозилгідразону (2,3г, 45 85576 7,682ммоль) у піридині (20мл). Це перемішували протягом ночі. Водний шар екстрагували дихлорметаном три рази. Комбіновані шари промивали розсолом, сушили над натрій сульфатом, фільтрували та концентрували. Сирий продукт очищали колонковою хроматографією (20% ЕtOАс/гексани), отримуючи заголовну сполуку як світлу пурпурову тверду речовину (433,6мг, 19%). 1Н ЯМР (CDCI3) δ (млн.-1): 8,21 (m, 1H), 8,09 (dt, 1H), 7,89 (d, 1H), 7,61 (m, 2H), 7,49 (m, 5H), 7,24 (d, 1H). Приклади 2b-2g отримували як описано, наприклад, в 2а. b) 2-(5-Хлор-2-фпуор-феніл)-5-стирил-2Нтетразол Заголовну сполуку (200мг, 16%, темну коричневу тверду речовину) отримували додаванням солі діазонію, отриманого із 5хлор-2-флуор-аніліну (0,46мл, 4,07ммоль) з водним натрій нітритом (286мг, 4,1ммоль у 3мл води), гідрохлоридною кислотою (5,5мл, 17,8ммоль) в етанолі (4мл), до розчину цинамідтозилгідразону (1,202г, 4,0ммоль) у піридині (30мл). Сирий продукт частково очищали колонковою хроматографією (5% ЕtOАс/гексани) та застосовували у наступному етапі без додаткової очистки. с) 5-Стирил-2-м-толіл-2Н-тетразол Заголовну сполук у (320мг, 30%, темно-жовту тверду речовину) отримували додаванням солі діазонію, отриманої із м-толіламіну (0,44мл, 4,1ммоль) з водним натрій нітритом (286мг, 4,1ммоль у 3мл води), гідрохлоридною кислотою (5,5мл, 17,8ммоль) в етанолі (4мл), до розчину цинамідтозилгідразону (1,207г, 4,1ммоль) у піридині (30мл). Сирий продукт очищали колонковою хроматографією (3-6% ЕtOАс/гексани). 1Н ЯМР (CDCI3) δ (млн.-1): 8,00 (s, 1H), 7,98 (d, 1H), 7,88(d, 1H), 7,63 (m, 2H), 7,38-7,47 (m, 4H), 7,33 (d, 1H), 7,26 (d, 1H), 2,55 (s, 3Н). d) 2-(3-Йод-феніл)-5-стирил-2Н-тетразол Заголовну сполуку отримано додаванням солі діазонію, отриманої із 3-йод-феніламіну (1ммоль) з водним натрій нітритом (1ммоль у 0,75мл вод), гідрохлоридною кислотою (4,3ммоль у 1,3мл вод) в етанолі (1мл), до розчину цинамідтозилгідразону (1ммоль) у піридині (7,5мл). е) 3-(5-Стирил-тетразол-2-іл)-бензонітрил Заголовну сполуку отримано додаванням солі діазонію, отриманої із 3-амінобензонітрилу (1ммоль) з водним натрій нітритом (1ммоль у 0,75мл води), гідрохлоридною кислотою (4,3ммоль у 1,3мл води) в етанолі (1мл), до розчину цинамідтозилгідразону (1ммоль) у піридині (7,5мл). f) 2-(2-Флуор-5-метил-феніл)-5-стирил-2Нтетразол Заголовну сполуку отримано додаванням солі діазонію, отриманої із 2-флуор-5-метилфеніламіну (1ммоль) з водним натрій нітритом (1ммоль у 0,75мл вод), гідрохлоридною кислотою (4,3ммоль у 1,3мл вод) в етанолі (1мл), до розчину цинамідтозилгідразону (1ммоль) у піридині (7,5мл). r) 2-(3-хлорфеніл)-5-[1-метил-2-фенілвініл]-2Нтетразол Заголовну сполуку (3,82г, 37%, оранжеву тверду речовину) о тримували додаванням солі діазо 46 нію, отриманої із 3-хлор-аніліну (4,15мл, 39,2ммоль) з водним натрій нітритом (2,7г, 39,2ммоль у 25мл вод), гідрохлоридною кислотою (45мл, 180ммоль) в етанолі (35мл), до розчину цинамідтозилгідразону (10,77г, 34,25ммоль) у піридині (50мл). Сирий продукт частково очищали колонковою хроматографією (15% ЕtOАс/гексани) та застосовували у наступному етапі без додаткової очистки. 1Н ЯМР (CDCI3) δ (млн-1): 8,22 (m, 1Н), 8,11 (dt, 1Н), 7,94 (br s, 1Н), 7,50 (m, 6Н), 7,31 (m, 1Н), 2,50 (s, 3Н). Приклад 3 a) 1-[2-(3-хлор-феніл)-2Н-тетразол-5-іл]-2феніл-етан-1,2-діол 2-(3-Хлор-феніл)-5-стирил-2Н-тетразол (127,0мг, 0,446ммоль) зважували в пробірці та додавали лимонну кислоту (171,35мг, 0,892ммоль), а потім - суміш 1:1 трет-бутанолу та води (3мл). Додавали калій осматоксид гідрат (0,3мг), а потім 4-метилморфолін N-оксид (у 1,5мл води), та реакційну суміш перемішували протягом ночі. Реакцію фільтрували та промивали водою і 1М гідрохлоридною кислотою, отримуючи заголовну сполуку як бежеву тверду речовину (95,4мг, 68%). 1Н ЯМР (MeOD) δ (млн.-1): 8,086 (s, 1Н); 8,012 (d від t, 1Η); 7,584 (m, 2H); 7,252 (m, 5H); 5,148 (s, 2H). Приклади 3b-3f отримували як описано, наприклад, в 3а. b) 1-[2-(5-Хлор-2-флуор-феніл)-2Н-тетразол-5іл]-2-феніл-етан-1,2-діол Заголовну сполуку (застосовано сиру, ви хід визначено після наступного етапу) отримували з 2(5-хлор-2-флуор-феніл)-5-стирил-2Н-тетразолу (637мг, 2,1ммоль), застосовуючи лимонну кислоту (796мг, 4,1ммоль), калій осматоксид гідрат (малу ложечку), 4-метил морфолін N-оксид (275мг, 2,3ммоль) у суміші 1:1 трет-бутанолу та води (20мл). Сирий продукт від екстракції подалі не очищали. c) 1-Феніл-2-(2-мета-толіл-2Н-тетразол-5-іл)етан-1,2-діол Заголовну сполуку (2,26г, застосовано сиру, вихід визначено після наступного етапу) отримували з 5-стирил-2-мета-толіл-2Н-тетразолу (1,44г, 5,5ммоль), застосовуючи лимонну кислоту (2,1г, 10,9ммоль), калій осматоксид гідрат (малу ложечку), 4-метил морфолін N-оксид (710мг, 6,1ммоль) у суміші 1:1 трет-бутанолу та води (52мл). Сирий продукт від екстракції подалі не очищали. d) 1-[2-(3-Йод-феніл)-2Н-тетразол-5-іл]-2феніл-етан-1,2-діол Заголовну сполуку отримано із 2-(3-йодфеніл)-5-стирил-2Н-тетразолу (1ммоль), застосовуючи лимонну кислоту (2ммоль), калій осматоксид гідрат (малу ложечку), 4-метил морфолін Nоксид (1,1ммоль) у суміші 1:1 трет-бутанолу та води (10мл). Сирий продукт від екстракції подалі не очищали. e) 3-[5-(1,2-Дигідрокси-2-феніл-етил)-тетразол2-іл]-бензонітрил Заголовну сполуку отримано з 3-(5-стирилтетразол-2-іл)-бензонітрилу (1ммоль), застосовуючи лимонну кислоту (2ммоль), калій осматоксид гідрат (малу ложечку), 4-метилморфолін N-оксид 47 85576 (1,1ммоль) у суміші 1:1 трет-бутанолу та води (10мл). Сирий продукт від екстракції подалі не очищали. f) 1-[2-(2-Флуор-5-метил-феніл)-2Н-тетразол-5іл]-2-феніл-етан-1,2-діол Заголовну сполуку отримано з 2-(2-флуор-5метил-феніл)-5-стирил-2Н-тетразолу (1ммоль), застосовуючи лимонну кислоту (2ммоль), калій осматоксид гідрат (малу ложечку), 4метилморфолін N-оксид (1,1ммоль) у суміші 1:1 трет-бутанолу та води (10мл). Сирий продукт від екстракції подалі не очищали. Приклад 4 а) 2-(3-Хлор-феніл)-2Н-тетразол-5карбальдегід 1-[2-(3-хлор-феніл)-2Н-тетразол-5-іл]-2-фенілетан-1,2-діол (50,0мг, 0,158ммоль) зважували в пробірці та додавали толуол (3мл). Додавали з перемішуванням калій карбонат (47,0мг, 0,340ммоль) та плюмбум (IV) ацетат (70,0мг, 0,158ммоль). Реакційну суміш перемішували протягом 2,5 годин. Реакційну суміш фільтрували та до фільтрату додавали етилацетат і робили водну суміш. Органічні шари промивали розсолом, сушили над натрій сульфатом, фільтрували та концентрували. Сирий продукт очищали колонковою хроматографією (40% ЕtOАс/Гексани), що дало чистий продукт як білу тверду речовину (22,3мг, 68%). 1Н ЯМР (CDCI3) δ (млн -1): 10,34 (s, 1H); 8,27 (s, 1H); 8,14 (m, 1H); 7,575 (d, 2H). Приклади 4b-4f отримували як описано, наприклад, в 4а. b) 2-(5-Хлор-2-флуор-феніл)-2Н-тетразол-5карбальдегід Заголовну сполуку (286мг, 60% через 2 етапи) отримували з 1-[2-(5-хлор-2-флуор-феніл)-2Нтетразол-5-іл]-2-феніл-етан-1,2-діолу (сирий, з 2,1ммоль вищезазначеної реакції), застосовуючи калій карбонат (1,0г, 7ммоль) та плюмбум (IV) ацетат (980мг, 2,2ммоль) у толуолі (14мл). Сирий продукт очищали колонковою хроматографією (1020% ЕtOАс/гексани). с) 2-мета-Толіл-2Н-тетразол-5-карбальдегід Заголовну сполуку (870мг, 84% через 2 етапи) отримували з 1-феніл-2-(2-мета-толіл-2Нтетразол-5-іл)-етан-1,2-діолу (сирий, із 5,5ммоль вищезазначеної реакції), застосовуючи калій карбонат (2,02г, 14,6ммоль) та плюмбум (IV) ацетат (2,52г, 5,7ммоль) у толуолі (35мл) та дихлорметані (20мл). Сирий продукт очищали колонковою хроматографією (10% ЕtOАс/гексани). 1Н ЯМР (CDCI3) δ (млн -1): 10,34 (s, 1Н), 8,06 (s, 1Н), 8,03 (d, 1Н), 7,50 (t, 1Н), 7,40 (d, 1Н), 2,50 (s, 3Н). d) 2-(3-Йод-феніл)-2Н-тетразол-5-карбальдегід Заголовну сполуку о тримано з 1-[2-(3-йодфеніл)-2Н-тетразол-5-іл]-2-феніл-етан-1,2-діолу (1ммоль), застосовуючи калій карбонат (~3ммоль) та плюмбум (IV) ацетат (1,05ммоль) у толуолі (7мл). е) 3-(5-Форміл-тетразол-2-іл)-бензонітрил Заголовну сполуку отримано з 3-[5-(1,2дигідрокси-2-феніл-етил)-тетразол-2-іл]бензонітрилу (1ммоль), застосовуючи калій карбонат (~3ммоль) та плюмбум (IV) ацетат (1,05ммоль) у толуолі (7мл). 48 f) 2-(2-Флуор-5-метил-феніл)-2Н-тетразол-5карбальдегід Заголовну сполук у отримано з 1-[2-(2-флуор-5метил-феніл)-2Н-тетразол-5-іл]-2-феніл-етан-1,2діолу (1ммоль), застосовуючи калій карбонат (~3ммоль) та плюмбум (IV) ацетат (1,05ммоль) у толуолі (7мл). Приклад 5 а) [2-(3-Хлор-феніл)-2Н-тетразол-5-іл]-метанол 2-(3-Хлор-феніл)-2Н-тетразол-5-карбальдегід (70,8мг, 0,339ммоль) розчиняли у ТГФ (5мл) та додавали літій борогідрид (25,9мг, 1,187ммоль). Реакцію три години гріли при кипінні під зворотним холодильником під аргоном і тоді перемішували протягом ночі при кімнатній температурі. Реакцію гасили 1М гідрохлоридною кислотою та водну суміш піддавали екстракції етилацетатом три рази. Поєднані органічні шари промивали розсолом, сушили над натрій сульфатом, фільтрували та концентрували, отримуючи заголовну сполуку як білу тверду речовину (75,8мг, 106%). 1Н ЯМР (CDCI3) δ (мл-1): 8,190 (s, 1Н), 8,070 (m, 1Н), 7,507 (m, 2Н), 5,082 (s, 2H). Приклади 5b до 5f отримували як описано, наприклад, в 5а. b) [2-(5-Хлор-2-флуор-феніл)-2Н-тетразол-5іл]-метанол Заголовну сполуку (59,8мг, 75%) отримували з 2-(5-хлор-2-флуор-феніл)-2Н-тетразол-5карбальдегіду (78,9мг, 0,35ммоль), застосовуючи літій борогідрид (1,0мл, 2ммоль) у ТГФ (5мл). Сирий продукт очищали колонковою хроматографією (25-30% ЕtOАс/гексани). 1Н ЯМР (CDCI3) δ (млн.-1): 7,92 (dd, 1H), 7,52 (ddd, 1H), 7,33 (t, 1H), 5,11 (d, 2H), 2,41 (t, 1H). с) (2-мета-Толіл-2Н-тетразол-5-іл)-метанол Заголовну сполук у (221мг, 96%, бежеву тверду речовину) отримували з 2-мета-толіл-2Н-тетразол5-карбальдегіду (229мг, 1,22ммоль), застосовуючи літій борогідрид (3,5мл, 7ммоль) у ТГФ (10мл). Сирий продукт очищали колонковою хроматографією (20-30% ЕtOАс/гексани). 1Н ЯМР (CDCI3) δ (млн -1): 7,97 (s, 1H), 7,94 (d, 1H), 7,46 (t, 1H), 7,33 (d, 1Н), 5,08 (d, 2Н), 2,50 (s, 3Н), 2,40 (t, 1H). d) [2-(3-Йод-феніл)-2Н-тетразол-5-іл]-метанол Заголовну сполук у отримано з 2-(3-йод-феніл)2Н-тетразол-5-карбальдегіду (1ммоль), застосовуючи літій борогідрид (3-6ммоль) у ТГФ (8-10мл). е) 3-(5-Гідроксиметил-тетразол-2-іл)бензонітрил Заголовну сполук у отримано з 3-(5-формілтетразол-2-іл)-бензонітрилу (1ммоль), застосовуючи літій борогідрид (3-6ммоль) у ТГФ (8-10мл). f) [2-(2-Флуор-5-метил-феніл)-2Н-тетразол-5іл]-метанол Заголовну сполуку отримано з 2-(2-флуор-5метил-феніл)-2Н-тетразол-5-карбальдегіду (1ммоль), застосовуючи літій борогідрид (36ммоль) у ТГФ (8-10мл). Приклад 6 a) 1-[2-(3-хлор-феніл)-2Н-тетразол-5-іл-етанол 2-(3-Хлор-феніл)-2Н-тетразол-5-карбальдегід (75,6мг, 0,362ммоль) розчиняли у ТГФ (2мл) під аргоном та колбу занурювали у льоді. Поки реакцію охолоджували у льоді додавали краплями ме 49 85576 тил магній бромід (1М розчин/бутиловий етер 0,51мл, 0,507ммоль). Після п'ятнадцяти хвилин при 0°С льодяну баню видаляли та реакційну суміш перемішували при кімнатній температурі протягом двох годин. Для гасіння реакції 1М додавали гідрохлоридну кислоту та водну суміш піддавали екстракції етилацетатом три рази. Поєднані органічні шари промивали розсолом, сушили над натрій сульфатом, фільтрували та концентрували. Сирий продукт очищали колонковою хроматографією (3% МеОН/СН2СІ2), о тримуючи заголовну сполуку як чисте масло (62,4мг, 77%). 1Н ЯМР (CDCI3) δ (млн.-1): 8,18 (s, 1H), 8,06 (m, 1H), 7,50 (m, 2H), 5,32 (m, 1H), 2,69 (d, 1H), 1,76 (d, 3Н). Приклади 6b до 6f отримували як описано, наприклад, в 6а. b) 1-[2-(5-Хлор-2-флуор-феніл)-2Н-тетразол-5іл]-етанол Заголовну сполуку (143,7мг, 77%, розраховано ~90% чистоту, перенесено до наступних етапів) отримували з 2-(5-хлор-2-флуор-феніл)-2Нтетразол-5-карбальдегіду (174мг, 0,77ммоль), застосовуючи метил магній бромід (2,0мл, 2ммоль) у ТГФ (5мл). Сирий продукт очищали колонковою хроматографією (25-30% ЕtOАс/гексани). 1Н ЯМР (CDCI3) δ (млн.-1): 7,90 (dd, 1H), 7,51 (ddd, 1H), 7,33 (t, 1H), 5,34 (q, 1H), 1,87 (t, 1H), 1,77 (d, 3H). c) 1-(2-мета-Тол іл-2Н-тетразол-5-іл)-етанол Заголовну сполук у (221мг, 96%, бежеву тверду речовину) отримували з 2-мета-толіл-2Н-тетразол5-карбальдегіду (229мг, 1,22ммоль), застосовуючи метил магній бромід (3,5мл, 7ммоль) у ТГФ (10мл). Сирий продукт очищали колонковою хроматографією (20-30% ЕtOАс/гексани). 1Н ЯМР (CDCI3) δ (млн.-1): 7,94 (s, 1H), 7,92 (d, 1Н), 7,43 (t, 1Н), 7,31 (d, 1Н), 5,31 (m, 1Н), 2,48 (s, 3Н), 1,77 (d, 3Н). d) 1-[2-(3-Йод-феніл)-2Н-тетразол-5-іл]-етанол Заголовну сполук у отримано з 2-(3-йод-феніл)2Н-тетразол-5-карбальдегіду (1ммоль), застосовуючи метил магній бромід (1,4ммоль) у ТГФ (5мл). е) 3-[5-(1-Гідроксил-етил)-тетразол-2-іл]бензонітрил Заголовну сполук у отримано з 3-(5-формілтетразол-2-іл)-бензонітрилу (1ммоль), застосовуючи метил магній бромід (1ммоль) у ТГФ (5мл). f) 1-[2-(2-Флуор-5-метил-феніл)-2Н-тетразол-5іл]-етанол Заголовну сполуку отримано з 2-(2-флуор-5метил-феніл)-2Н-тетразол-5-карбальдегіду (1ммоль), застосовуючи метил магній бромід (1,4ммоль) у ТГФ (5мл). Приклад 7 a) 5-Бромметил-2-(3-хлор-феніл)-2Н-тетразол Дихлорметан (5мл) додавали до 2-(3-хлорфеніл)-2Н-тетразол-5-іл]-метанолу(49,5мг, 0,235ммоль), а потім - трифенілфосфін (92,6мг, 0,353ммоль). Реакцію занурювали у баню -40°С та додавали N-BCI (62,8мг, 0,353ммоль) у дихлорметані (2мл). Реакційну суміш перемішували під аргоном протягом двох годин. Додавали насичений натрій гідрокарбонат та холодну баню видаляли. Водну суміш піддавали екстракції дихлорметаном три рази. Поєднані органічні шари промивали розсолом, сушили над натрій сульфатом, фільтрува 50 ли та концентрували. Сирий продукт очищали колонковою хроматографією (2%МеОН/СН2СІ2), отримуючи заголовну сполуку як білу тверду речовину (45,9мг, 71%). 1Н ЯМР (CDCI3) δ (млн -1): 8,179 (g, 1H), .8,050 (m, 1H), 7,518 (m, 2Н), 4,730 (s,2H). b) 5-(1-Бром-етил)-2-(3-хлор-феніл)-2Нтетразол Заголовну сполуку отримано згідно з способом для 5-броіиметил-2-(3-хлор-феніл)-2Н-тетразолу (приклад 7а), застосовуючи 1-[2-(3-хлор-феніл)2Н-тетразол-5-іл-етанол як вихідний матеріал. Приклад 8 a) МетансульФонової кислоти 1-[2-(3хлорфеніл)-2Н-тетразол-5-іл]-етиловий естер 1-[2-(3-хлор-феніл)-2Н-тетразол-5-іл-етанол (55,3мг, 0,246ммоль) розчиняли у дихлорметані під аргоном та додавали триетиламін (41,1мкл, 0,295ммоль), а потім - метилсульфонілхлорид (22,8мкл, 0,295ммоль). Реакційну суміш перемішували при кімнатній температурі протягом ночі. Додавали натрій гідрокарбонат (насичен.) та водну суміш піддавали екстракції етилацетатом три рази. Поєднані органічні шари промивали розсолом, сушили над натрій сульфатом, фільтрували та концентрували. Сирий продукт очищали SPE tube (5% МеОН/СН2СІ2), отримуючи заголовну сполуку як жовте масло (27,7мг, 37%). 1Н ЯМР (CDCI3) δ (млн-1): 8,18 (s, 1Н), 8,07 (m, 1Н), 7,533 (m, 2Н), 6,15 (q, 1Н), 3,157 (s, 3Н), 1,99 (d, 3Н). Приклади 8b до 8k отримували як описано, наприклад, у 8а. b) Метансуль фонової кислоти 2-(5-хлор-2флуор-феніл)-2Н-тетразол-5-ілметиловий естер Заголовну сполук у отримували з [2-(5-хлор-2флуор-феніл)-2Н-тетразол-5-іл]-метанолу(39мг, 0,17ммоль), застосовуючи метан сульфоніл хлорид (0,02мл, 0,26ммоль) та триетиламін (0,05мл, 0,36ммоль) у дихлорметані (5мл). Сирий продукт екстракції розподіляли на два зразки та переносили далі до наступної реакції без наступної очистки. c) Метансульфонової кислоти 1-[2-(5-хлор-2флуор-феніл)-2Н-тетразол-5-іл]-етиловий естер Заголовну сполук у отримували з 1-[2-(5-хлор2-флуор-феніл)-2Н-тетразол-5-іл]-етанолу (103мг, 65% чистота, 0,28ммоль), застосовуючи метансульфонілхлорид (0,05мл, 0,65ммоль) та триетиламін (0,15мл, 1,1ммоль) у дихлорметані (5мл). Сирий продукт екстракції розподіляли на три зразки та переносили далі до наступної реакції без наступної очистки. d) Метансульфонової кислоти 2-мета-толіл2Н-тетразол-5-ілметиловий естер Заголовну сполук у отримано з (2-мета-толіл2Н-тетразол-5-іл)-метанолу (1ммоль), застосовуючи метансульфонілхлорид (1,5ммоль) та триетиламін (2ммоль) у дихлорметані (15мл). е) МетансульФонової кислоти 1-(2-мета-толіл2Н-тетразол-5-ілметиловий естер Заголовну сполуку отримували з 1-(2-метатоліл-2Н-тетразол-5-іл)-етанолу (1ммоль), застосовуючи метансульфонілхлорид (1,5ммоль) та триетиламін (2ммоль) у ди хлорметані (15мл). f) Метансульфонової кислоти 2-(3-ціанофеніл)-2Н-тетразол-5-ілметиловий естер 51 85576 Заголовну сполуку отримано з 3-(5гідроксиметил-тетразол-2-іл)-бензонітрилу (1ммоль), застосовуючи метансульфонілхлорид (1,5ммоль) та триетиламін (2ммоль) у дихлорметані (5мл). g) Метансульфонової кислоти 1-[2-(3-ціанофеніл)-2Н-тетразол-5-іл]-етиловий естер Заголовну сполуку отримано з 3-[5-(1гідроксил-етил)-тетразол-2-іл]-бензонітрилу (1ммоль), застосовуючи метансульфонілхлорид (1,5ммоль) та триетиламін (2ммоль) у дихлорметані (15мл). h) Метансульфонової кислоти 2-(2-флуор-5метил-феніл)-2Н-тетразол-5-ілметиловий естер Заголовну сполуку о тримано з [2-(2-флуор-5метил-феніл)-2Н-тетразол-5-іл]-метанолу (1ммоль), застосовуючи метансульфонілхлорид (1,5ммоль) та триетиламін (2ммоль) у дихлорметані (5мл). і) Метансульфонової кислоти 1-[2-(2-флуор-5метил-феніл)-2Н-тетразол-5-іл]-етиловий естер Заголовну сполук у отримано з 1-[2-(2-флуор-5метил-феніл)-2Н-тетразол-5-іл]-етанолу (1ммоль), застосовуючи метансульфонілхлорид (1,5ммоль) та триетиламін (2ммоль) у дихлорметані (5мл). і) МетансульФонової кислоти 2-(3-йод-Феніл)2Н-тетразол-5-ілметиловий естер Заголовну сполуку отримано з [2-(3-йодфеніл)-2Н-тетразол-5-іл]-метанолу (1ммоль), застосовуючи метансульфонілхлорид (1,5ммоль) та триетиламін (2ммоль) у ди хлорметані (15мл). k) Ме тансульфонової кислоти 1-[2-(3-йодфеніл)-2Н-тетразол-5-іл]-етиловий естер Заголовну сполуку отримували з 1-[2-(3-йодфеніл)-2Н-тетразол-5-іл]-етанолу (1ммоль), застосовуючи метансульфонілхлорид (1,5ммоль) та триетиламін (2ммоль) у ди хлорметані (15мл). Приклад 9 а) 4-метил-5-піридин-4-іл-2,4-дигідро[1,2,4]триазол-3-тіон Ізонікотиноїл хлорид гідрохлорид (27,5г, 154,5ммоль) та 4-метил-3-тіосемікарбазид (16,4г, 155,9ммоль) перемішували у піридині (200мл) під аргоном при зовнішній температурі протягом ночі. Після випарювання до сухого стану додавали водний натрій гідроксид (250мл, 2М, 500ммоль) та отриманий розчин гріли при 60°С протягом 16 годин. Після охолодження до кімнатної температури, розчин нейтралізували 6 н гідрохлоридною кислотою. Утворений осад збирали фільтруванням, отримуючи заголовну сполуку (бліду жовту тверду речовину, 16,4г, 55%). 1Н ЯМР (ДМСО-d6), δ (млн1 ): 8,78 (dd, 2Н), 7,75 (dd, 2Н), 3,59 (s, 3Н). Приклад 10 Отримано способом аналогічним вищезазначеному: а) 4-Етил-5-піридин-4-іл-2,4-дигідро[1,2,4]триазол-3-тіон Заголовну сполуку (бліду жовту тверду речовину, 16,7г, 58%) отримували з ізонікотиноїлхлорид гідрохлориду (25,1г, 140,8ммоль) та 4-етил-3тіосемікарбазиду (16,87г, 141,5ммоль) у піридині (185мл) з натрій гідроксидом (220мл, 2М, 440ммоль), доданим до інтермедіату, утвореного для здійснення циклізації. 1Н ЯМР (ДМСО-d6) δ 52 (млн.-1): 8,80 (dd, 2H), 7,72 (dd, 2H), 4,11 (q, 2H), 3,59 (t, 3Н). Приклад 11 4-Циклопропіл-5-піридин-4-іл-2,4-дигідро[1,2,4]триазол-3-тіон Розчин ізонікотиноїлгідразиду (2,62г, 19,1ммоль) та циклопропілізотіоціанату (1,55мл, 16,7ммоль) у метанолі (15мл) гріли при 60°С протягом 1 години. Суміш охолоджували до кімнатної температури та розчинник видаляли. Додавали водний натрій гідроксид (9мл, 2М, 18ммоль) і отриманий розчин гріли при 60°С протягом 20 годин. Після охолодження до кімнатної температури розчин нейтралізували 3 н гідрохлоридною кислотою. Утворений осад збирали фільтруванням, отримуючи заголовну сполуку (бліду жовту тверду речовину, 3,58г, 98%). 1Н Я МР (ДMCO-d 6) δ (млн -1): 8,76 (dd, 2Н), 7,80 (dd, 2Н), 1,00 (m, 2Н), 0,61 (m, 2Н) (один сигнал циклопропілу-N блоковано сигналом розчинника при 3,32млн -1). Приклад 12 4-(4-метил-5-метилсульфаніл-4Н[1,2,4]триазол-3-іл)-піридин До розчину 4-метил-5-піридин-4-іл-2,4-дигідро[1,2,4]триазол-3-тіону (1000мг, 5,20ммоль) у 1М натрій гідроксиді (10мл) додавали розчин йодметану (0,52мл, 8,32ммоль) в етанолі (3мл). Перемішували при к.т. протягом ночі. Екстрагували 200мл дихлорметану та промивали розсолом (50мл). Сушили над безводним натрій сульфатом, фільтрували та концентрували у вакуумі, отримуючи заголовну сполуку (1,00г, 94% виходу). 1Н-ЯМР (CDCI3) δ (млн.-1): 8,81 (d, 2H), 7,62 (d, 2H), 3,68 (s, 3Н), 2,82 (s, 3Н). Приклад 13 4-(4-Циклопропіл-5-метилсульфаніл-4Н[1,2,4]триазол-3-іл)-піридин Розчин йодметану (0,457мл, 7,33ммоль) в етанолі (3мл) додавали до розчину 4-циклопропіл5-піридин-4-іл-4Н-[1,2,4]триазол-3-тіолу (1г, 4,58ммоль) у 1М натрій гідроксиді (10мл) при кімнатній температурі. Після перемішування протягом ночі реакційну суміш екстрагували дихлорметаном і тоді органічний шар промивали розсолом, сушили над безводним натрій сульфатом, фільтр ували та концентрували, що дало заголовну сполуку (729,1мг, 69%, бежеву тверду речовину). 1Н ЯМР (CDCI3) δ (млн -1): 8,77 (d, 2Н), 7,75 (m, 2Н), 3,23 (m, 1Н), 2,82 (s, 3Н), 1,17 (m, 2H), 0,80 (m, 2H). Приклад 14 a) 4-(5-Метансульфоніл-4-метил-4Н[1,2,4]триазол-3-іл)-піридин До розчину 4-(4-метил-5-метилсульфаніл-4Н[1,2,4]триазол-3-іл)-піридину (1000мг, 4,85ммоль) у оцтовій кислоті, додавали поступово краплями розчин KМnО4 (1,15г, 7,28ммоль) у Н2O (50мл). Перемішували при к.т. протягом 3 годин. Додавали натрій гідросульфіт до знебарвлення пупрпурової барви. Екстрагували хлороформом (3´100мл). Органічний шар промивали насиченим натрій гідрокарбонатом (50мл). Сушили над безводним натрій сульфатом, фільтрували та концентрували у вакуумі, отримуючи заголовну сполуку (1,01г, 87% виходу). 1Н-ЯМР (CDCI3) δ (млн.-1): 8,89 (d, 2H), 7,64 (d, 2H), 4,05 (s, 3Н), 3,64 (s, 3Н). 53 85576 b) 3-(5-Метансульфоніл-4-метил-4Н[1,2,4]триазол-3-іл)-піридин Заголовну сполуку отримували аналогічно послідовності, описаній у прикладі 9, 12, та 14, застосовуючи нікотиноїлхлорид гідрохлорид як вихідний матеріал. 1Н ЯМР (CDCI3) δ (млн.-1): 3,59 (s, 3Н) 3,99 (s, 3Н) 7,52 (m, 1H) 8,02 (dt, 1H) 8,83 (dd, 1H) 8,91 (m, 1H). с) 3-(3,5-Дифлуор-феніл)-5-метансульфоніл-4метил-4Н-[1,2,4]триазол Заголовну сполуку отримували аналогічно послідовності, описаній у прикладі 9, 12, та 14, застосовуючи 3,5-ди флуор-бензоїл хлорид як вихідний матеріал. 1Н ЯМР (ДМСО-d6) δ (млн.-1): 3,60 (s, 3Η) 3,89 (s, 3Η) 7,56 (s, 3Η). Приклад 15 4-(4-Циклопропіл-5-метансульфоніл-4Н[1,2,4]триазол-3-іл)-піридин Розчин калій перманганату (525мг, 3,3ммоль) у воді (22,0мл) додавали поступово краплями до розчину 4-(4-циклопропіл-5-метилсульфаніл-4Н[1,2,4]триазол-3-іл)-піридину (514мг, 2,2ммоль) у оцтовій кислоті (11мл) при кімнатній температурі. Після перемішування протягом 3 годин натрій гідросульфіт додавали до знебарвлення пурпурової барви. Реакційну суміш екстрагували хлороформом і тоді органічний шар промивали насиченим натрій гідрокарбонатом, сушили над безводним натрій сульфатом, фільтрували та концентрували, що дало заголовну сполуку (546,7мг, 94%, білу тверду речовину). 1Н ЯМР (CDCI3) δ (млн.-1): 8,86 (d, 2H), 7,77 (d, 2H), 3,64 (m, 1H), 3,63 (s, 3Н), 1,25 (m, 2H), 1,01 (m, 2H). Приклад 16 a) Метил-(4-метил-5-піридин-4-іл-4Н[1,2,4]триазол-3-іл)-амін Суміш 1000мг (4,35ммоль) N-амiно-N',N"диметил-гуанідин гідройодиду [Henry; Smith; J.Amer.Chem.Soc; 73; 1951; 1858] та 774мг (4,35ммоль) ізонікотиноїлхлорид гідрохлориду у 3мл піридину гріли мікрохвильовим опроміненням протягом 5 хвилин при 160°С. Додавали K2СО3(насичен.) та суміш екстрагували 4 рази СНСІ3. Органічну фазу сушили та концентрували. Перекристалізація із етанолу, води та EtOAc дала 216мг (26%) жовто-білої твердої речовини. 1Н ЯМР (ДМСО), d (млн.-1): 2,85 (d, 3Η) 3,45 (s, 3Η) 6,25 (d, 1Η) 7,65 (m, 2Η) 8,67 (m, 2Η). b) [5-(3,5-Дифлуор-феніл)-4-метил-4Н[1,2,4]триазол-3-іл]-метил-амін Заголовну сполуку отримували згідно з способом для метил-(4-метил-5-піридин-4-іл-4Н[1,2,4]триазол-3-іл)-аміну (приклад 16а) із 3,5дифлуор-бензоїлхлориду. 1Н Я МР (ДМСО-d6) d (млн.-1): 2,83 (d, 3Η) 3,41 (s, 3Η) 6,20 (d, 1Η) 7,35 (m, 3Η), c) Метил-(4-метил-5-піридин-3-іл-4Н[1,2,4]триазол-3-іл)-амін Заголовну сполуку отримано згідно з способом для метил-(4-метил-5-піридин-4-іл-4Н[1,2,4]триазол-3-іл)-аміну (приклад 16а) із нікотиноїлхлорид гідрохлориду. Приклад 17 а) 3-Піридин-4-іл-5,6,7,8-тетрагідро[1,2,4]триазоло[4,3-а]піримідин 54 Розчин 750мг (3,1ммоль) (1,4,5,6-тетрагідропіримідин-2-іл)-гідразин гідройодиду [ref. Krezel, Izabella; Pharmazie; EN; 49; 1; 1994; 27-31] та 552мг (3,1ммоль) ізонікотиноїлхлорид гідрохлориду у 3мл піридину гріли при 120°С протягом ночі. Реакційну суміш охолоджували та розбавляли K2СО3 (насичен.) та екстрагували 3x10мл хлороформу. Поєднані органічні екстракти сушили та концентрували. Флеш-хроматографія (СН2СІ2/МеOН 10:1) дала 83мг (18%) білої твердої речовини. 1Н ЯМР (CDCI3) d (млн.-1): 1,91 (m, 2Η) 3,24 (m, 2Η) 4,13 (m, 2Η) 7,67 (m, 2Η) 8,65 (m, 2Η). b) 3-Піридин-3-іл-5,6,7,8-тетрагідро[1,2,4]триазоло[4,3-а]піримідин Заголовну сполуку отримано згідно з способом для 3-піридин-4-іл-5,6,7,8-тетрагідро[1,2,4]триазоло[4,3-а]піримідину (приклад 17а) із нікотиноїлхлорид гідрохлориду. с) 3-(3,5-Дифлуор-феніл)-5,6,7,8-тетрагідро[1,2,4]триазоло[4,3-а]піримідин Заголовну сполуку отримано згідно з способом для 3-піридин-4-іл-5,6,7,8-тетрагідро[1,2,4]триазоло[4,3-а]піримідину (приклад 17а) із 3,5-дифлуор-бензоїлхлориду. Приклад 18 2-(метилтіо)-4,5,6,7-тетрагідро-1Н-1,3-діазепін Метилйодид (0,55мл, 1,15ммоль) додавали до розчину 1,3-діазепан-2-тіону (1,00г, 7,68ммоль) у ацетоні (8мл). Реакційну суміш гріли при кипінні під зворотним холодильником протягом 15 хвилин. До гарячого розчину додавали EtOH для розчинення твердого продукту. Після охолодження до к.т. додавали гексан та осад збирали фільтруванням, промивали гексаном та сушили для отримання 1,79г (86%) сирої заголовної сполуки, котру застосовували безпосередньо у наступному етапі. Приклад 19 1,3-діазепан-2-он гідразон гідройодид Гідразин гідрат (0,44мл, 7,23ммоль) додавали до розчину 2-(метилтіо)-4,5,6,7-тетрагідро-1Н-1,3діазепін гідройодиду (1,79 d, 6,58ммоль) у ЕtOН (12мл). Реакційну суміш гріли при кипінні під зворотним холодильником протягом 5 годин та охолоджували до к.т. Додавали Et2O та продукт збирали фільтруванням, промивали Et2O та сушили у вакуумі для отримання 1,46г (100%) сирої заголовної сполуки, котру застосовували безпосередньо у наступному етапі. Приклад 20 а) 3-піридин-4-іл-6,7,8,9-тетрагідро-5Н[1,2,4]триазоло[4,3-а][1,3]діазепін Суміш 1,3-діазепан-2-он гідразон гідройодиду (1,00г, 3,9ммоль) та ізонікотиноїлхлорид гідрохлориду (695мг, 3,9ммоль) гріли у мікрохвильовому реакторі при 160°С протягом 10 хвилин. Реакційну суміш виливали в насичений розчин Na 2CO3 та екстрагували ДХМ. Органічну фаз у сушили та концентрували. Флеш-хроматографія (ДХМ/МеОН 20:1) дала 1,74г сирої заголовної сполуки, котру застосовували безпосередньо у наступному етапі. 1 Н ЯМР: 1,89 (s, 4Η) 3,15 (m, 2Η) 3,86 (m, 2Η) 7,44 (d, 2Η) 8,66 (d, 2Η). b) 3-Піридин-3-іл-5,6,7,8-тетрагідро-4Н1,2,3а,8-тетрааза-азулен 55 85576 Заголовну сполуку отримано з нікотиноїлхлорид гідрохлориду згідно з способом, описаним для 3-піридин-4-іл-6,7,8,9-тетрагідро-5Н[1,2,4]триазоло[4,3-а][1,3]діазепіну (приклад 20а). с) 3-(3,5-Дифлуор-феніл)-5,6,7,8-тетрагідро4Н-1,2,3а,8-тетрааза-азулен Заголовну сполук у отримано з 3,5-дифлуорбензоїлхлориду згідно з способом, описаним для 3-піридин-4-іл-6,7,8,9-тетрагідро-5Н[1,2,4]триазоло[4,3-а][1,3]діазепіну (приклад 20а). Приклад 21 4-(4-Етил-4Н-[1,2,4]триазол-3-іл)-піридин 4-Етил-5-піридин-4-іл-2,4-дигідро[1,2,4]триазол-3-тіон (4,2г, 20,4ммоль) повільно додавали до нікелю Ренея (~40г, промивали три рази 25мл порціями етанолу) в етанолі (50мл). Стриману суміш перемішували при 65°С протягом приблизно 28 годин. Розчин суміші обережно відфільтровували та концентрували у вакуумі, отримуючи заголовну сполуку (2,88г, 81,3%). 1Н ЯМР (CDCI3) δ (млн.-1): 8,81 (d, 2H), 8,33 (s, 1H), 7,62 (d, 2H), 8,18 (q, 2H), 1,51 (t, 3H). Приклад 22 (4-Етил-5-піридин-4-іл-4Н-[1,2,4]триазол-3-іл)метанол Розчин 4-(4-етил-4Н-[1,2,4]триазол-3-іл)піридину (2,55г, 14,6ммоль) у 37% формальдегіді (~12мл) перемішували при 37°С протягом 16 годин. Флеш-хроматографія (10% метанольний аміак у дихлорметані) дала продукт заголовної сполуки (2,55г, 85%, застосований без наступної очистки для видалення залишкового пара-формальдегіду). 1 Н ЯМР (CDCI3) δ (млн-1): 8,81 (d, 2H), 7,72 (d, 2H), 5,74 (t, 1H), 4,73 (d, 2Н), 4,26 (q, 2Н), 1,27 (t, 3Н). Приклад 23 а) 4-Етил-5-піридин-4-іл-4Н-[1,2,4]триазол-3карбальдегід Дихлорметан (4мл) додавали до сосуду, який містить (4-етил-5-піридин-4-іл-4Н-[1,2,4]триазол-3іл)-метанол (56,7мг, 0,279ммоль), та додавали манган діоксид (364,3мг, 4,19ммоль). Сосуд герметизували та реакційну суміш перемішували протягом двох годин. Реакційний продукт фільтрували через целіт та концентрували, отримуючи заголовну сполук у. 1Н ЯМР (CDCI3) δ (млн 1-): 10,21 (s, 1H), 8,88 (d, 2H), 7,63 (d, 2H), 4,45 (q, 2H), 1,48 (t, 3H). b) 4-метил-5-піридин-3-іл-4Н-[1,2,4]триазол-3карбальдегід Заголовну сполуку о тримано аналогічно послідовності, описаної для 4-(4-етил-4Н-[1,2,4]триазол3-іл)-піридину (приклад 21), (4-етил-5-піридин-4-іл4Н-[1,2,4]триазол-3-іл)-метанолу (приклад 22) та 4етил-5-піридин-4-іл-4Н-[1,2,4]триазол-3карбальдегіду (приклад 23а), застосовуючи 4метил-5-піридин-3-іл-2,4-дигідро-[1,2,4]триазол-3тіон як вихідний матеріал. c) 5-(3,5-Дифлуор-феніл)-4-метил-4Н[1,2,4]триазол-3-карбапьдегід Заголовну сполуку о тримано аналогічно послідовності, описаної для 4-(4-етил-4Н-[1,2,4]триазол3-іл)-піридину (приклад 21), (4-етил-5-піридин-4-іл4Н-[1,2,4]триазол-3-іл)-метанолу (приклад 22) та 4етил-5-піридин-4-іл-4Н-[1,2,4]триазол-3карбальдегіду (приклад 23а), застосовуючи 5-(3,5 56 Дифлуор-феніл)-4-метил-2,4-дигідро[1,2,4]триазол-3-тіон як вихідний матеріал. Приклад 24 а) Етил 4-{[2-(3-хлорфеніл)-2Н-тетразол-5іл]метил}піперазин-1-карбоксилат 2-(3-Хлор-феніл)-2Н-тетразол-5-карбальдегід (22,3мг, 0,107ммоль) розчиняли у 1,2-дихлоретані під аргоном та додавали етил-1-піперазин карбоксилат (16,4мкл, 0,112ммоль), а потім - натрій триацетоксиборогідрид (31,8мг, 0,150ммоль). Реакційну суміш перемішували протягом ночі. Додавали етилацетат та розчин промивали натрій гідрокарбонатом (насичен.), розсолом, сушили над натрій сульфатом, фільтрували та концентрували. Сирий продукт очищали колонковою хроматографією, застосовуючи 45% ЕtOАс/Гексани та 100% EtOAc, отримуючи заголовну сполуку як білу тверду речовину (17,4мг, 46%). 1Н Я МР (CDCI3) δ (млн.1 ): 8,190 (s, 1H); 8,070 (m, 1H); 7,469 (m, 2H); 4,139 (q, 2H); 3,983 (s, 2H); 3,541 (m, 4H); 2,604 (m, 4H); 1,263 (t, 3Н). Приклади 24b-24f отримували як описано, наприклад, в 24а. b) 4-[2-(5-Хлор-2-флуор-феніл)-2Н-тетразол-5ілметил]-піперазин-1-карбонової кислоти етиловий естер Заголовну сполуку (28мг, 79%, жовте масло) отримували з 2-(5-хлор-2-флуор-феніл)-2Нтетразол-5-карбальдегіду (21,8мг, 0,1ммоль), застосовуючи етил-1-піперазин карбоксилат (0,03мкл, 0,2ммоль) та натрій триацетоксиборогідрид (50мг, 0,24ммоль) у 1,2-дихлоретані (1,3мл). Сирий продукт очищали колонковою хроматографією (35-40% ЕtOАс/гексани). 1Н ЯМР (CDCI3) δ (млн -1): 7,93 (dd, 1H), 7,51 (ddd, 1H), 7,34 (t, 1H), 4,14 (q, 2Н), 4,02 (s, 2Н), 3,55 (m, 4Н), 2,61 (m, 4Н), 1,27 (t, 3Н). c) 4-(2-мета-Толіл-2Н-тетразол-5-ілметил)піперазин-1-карбонової кислоти етиловий естер Заголовну сполуку (36мг, 57%, жовте масло) отримували з 2-мета-толіл-2Н-тетразол-5карбальдегіду (36,1мг, 0,19ммоль), застосовуючи етил-1-піперазин карбоксилат (0,04мкл, 0,27ммоль) та натрій триацетоксиборогідрид (75мг, 0,35ммоль) у 1,2-дихлоретані (2,5мл). Сирий продукт очищали колонковою хроматографією (20-35% ЕtOАс/гексани). 1Н ЯМР (CDCI3) δ (млн -1): 7,97 (s, 1H), 7,94 (d, 1H), 7,45 (t, 1H), 7,32 (d, 1Н), 4,14 (q, 2Н), 4,00 (s, 2Н), 3,55 (m, 4Н), 2,61 (m, 4Н), 2,49 (s, 3Н), 1,27 (t, 3Н). d) 4-[2-(3-Йод-феніл)-2Н-тетразол-5-ілметил]піперазин-1-карбонової кислоти етиловий естер Заголовну сполук у отримано з 2-(3-йод-феніл)2Н-тетразол-5-карбальдегіду (1ммоль), застосовуючи етил-1-піперазин карбоксилат (1,1-2ммоль) та натрій триацетоксиборогідрид (1,5-2ммоль) у 1,2-дихлоретані (10-15мл). e) 4-[2-(3-Ціано-феніл)-2Н-тетразол-5-іл метил]-піперазин-1-карбонової кислоти етиловий естер Заголовну сполук у отримано з 3-(5-формілтетразол-2-іл)-бензонітрилу (1ммоль), застосовуючи етил-1-піперазин карбоксилат (1,1-2ммоль) та натрій триацетоксиборогідрид (1,5-2ммоль) у 1,2дихлоретані (10-15мл). 57 85576 f) 4-[2-(2-Флуор-5-метил-феніл)-2Н-тетразол-5ілметил]-піперазин-1-карбонової кислоти етиловий естер Заголовну сполуку отримано з 2-(2-флуор-5метил-феніл)-2Н-тетразол-5-карбальдегід (1ммоль), застосовуючи етил-1-піперазин карбоксилат (1,1-2ммоль) та натрій триацетоксиборогідрид (1,5-2ммоль) у 1,2-дихлоретані (10-15мл). Приклад 25 а) 4-[5-({[2-(3-хлорфеніл)-2Н-тетразол-5іл]метил}тіо)-4-циклопропіл-4Н-1,2,4-триазол-3-іл] піридин 5-Бромметил-2-(3-хлор-феніл)-2Н-тетразол (18,7мг, 0,068ммоль) зважували в пробірці та додавали калій карбонат (10,4мг, 0,075ммоль), 4циклопропіл-5-піридин-4-іл-2,4-дигідро[1,2,4]триазол-3-тіон (14,8мг, 0,068ммоль) та ацетонітрил (3мл). Сосуд герметизували та реакційну суміш перемішували при кімнатній температурі протягом ночі. Реакційну суміш пропускали через колонку SPE (10% метанол у ди хлорметані), отримуючи заголовну сполуку як білу тверду речовину (18,3мг, 66%). 1Н ЯМР δ (млн-1): 8,78 (d, 2H), 8,16 (s, 1H), 8,04 (m, 1H), 7,76 (d, 2H), 7,49 (m, 2H), 4,97 (s, 2H), 3,29 (m, 1H), 1,19 (m, 2H), 0,84 (m, 2H). Приклади 25b-25y можна отримувати як описано, наприклад, в 25а. b) 4-[5-({1-[2-(3-хлорфеніл)-2Н-тетразол-5іл]етил}тіо)-4-циклопропіл-4Н-1,2,4-триазол-3іл]піридин Заголовну сполук у (25,2мг, 68%, білу тверду речовину) отримували з метансульфонової кислоти 1-[2-(3-хлорфеніл)-2Н-тетразол-5-іл]-етилового естеру (26,4мг, 0,087ммоль), застосовуючи калій карбонат (13,3мг, 0,096ммоль) та 4-циклопропіл-5піридин-4-іл-2,4-дигідро-[1,2,4]триазол-3-тіон (19,0мг, 0,087ммоль) у ацетонітрилі (3мл) при кімнатній температурі протягом ночі. Реакційну суміш очищали хроматографією, застосовуючи колонку SPE з діоксидом силіцію (2% метанол у дихлорметані). 1Н ЯМР (CDCI3) δ (млн.-1): 8,78 (d, 2H), 8,16 (s, 1H), 8,04 (m, 1H), 7,75 (d, 2H), 7,49 (m, 2H), 5,67 (q, 1Н), 3,24 (m, 1Н), 2,08 (d, 3Н), 1,16 (m, 2H), 0,82 (m, 2H). c) Етил 4-{1-[2-(3-хлорфеніл)-2Н-тетразол-5іл]етил}піперазин-1-карбоксилат Заголовну сполуку (12,3мг, 37%, жовте масло) отримували з метилсульфонової кислоти 1-[2-(3хлорфеніл)-2Н-тетразол-5-іл]-етилового естеру (27,7мг, 0,091ммоль), застосовуючи калій карбонат (13,8мг, 0,100ммоль) та 1-етоксикарбонілпіперазин (13,3мкл, 0,091ммоль) у ацетонітрилі (4мл), при 80°С протягом ночі. Продукт очищали хроматографією, застосовуючи колонку SPE з діоксидом силіцію (10% МеОН/СН2СІ2), а потім другу хроматографією із застосування силікагелевої SPE tube (5% МеОН/СН2СІ2). 1Н ЯМР (CDCI3) δ (млн.-1): 8,17 (s, 1H), 8,07 (dt, 1H), 7,50 (m, 2H), 4,29 (q, 1H), 4,10 (q, 2H), 3,52 (m, 4Н), 2,56 (m, 4Н), 1,64 (d, 3Н), 1,24 (t, 3Н). d) 4-{5-[2-(5-Хлор-2-флуор-феніл)-2Нтетразол-5-ілметилсульфаніл]-4-метил-4Н[1,2,4]триазол-3-іл}-піридин Заголовну сполук у (32,1мг, 94%, білу тверду речовину) отримували з метансульфонової кисло 58 ти 2-(5-хлор-2-флуор-феніл)-2Н-тетразол-5ілметилового естеру (~26мг, 0,085ммоль), застосовуючи калій карбонат (38мг, 0,27ммоль) та 4метил-5-піридин-4-іл-2,4-дигідро-[1,2,4]триазол-3тіон (20мг, 0,10ммоль) у ацетонітрилі (1,5мл), при кімнатній температурі протягом ночі. Реакційну суміш очищали хроматографією, застосовуючи колонку SPE з діоксидом силіцію (2-3% метанол у дихлорметані). 1Н ЯМР (CDCI3) δ (млн.-1): 8,80 (br.s, 2H), 7,87 (dd, 1H), 7,62 (d, 2H), 7,49 (m, 1Н), 7,31 (t, 1Н), 4,84 (s, 2Н), 3,71 (s, 3Н). e) 4-{5-[2-(5-Хлор-2-флуор-феніл)-2Нтетразол-5-ілметилсульфаніл]-4-циклопропіл-4Н[1,2,4]триазол-3-іл}-піридин Заголовну сполук у (30,7мг, 84%, білу плівчасту тверду речовину) отримували з метансульфонової кислоти 2-(5-хлор-2-флуор-феніл)-2Н-тетразол-5ілметилового естеру (~26мг, 0,085ммоль), застосовуючи калій карбонат (38мг, 0,27ммоль) та 4циклопропіл-5-піридин-4-іл-2,4-дигідро[1,2,4]триазол-3-тіон (22мг, 0,10ммоль) у ацетонітрилі (1,5мл), при кімнатній температурі протягом ночі. Реакційну суміш очи щали хроматографією, застосовуючи колонку SPE з діоксидом силіцію (23% метанол у ди хлорметані). 1Н ЯМР (CDCI3) δ (млн.-1): 8,76 (br.s, 2H), 7,88 (dd, 1H), 7,75 (d, 2H), 7,49 (m, 1H), 7,32 (dd, 1H), 4,96 (s, 2H), 3,30 (септет, 1Η), 1,18 (m, 2H), 0,83 (m, 2H). f) 4-(5-{1-[2-(5-Хлор-2-флуор-феніл)-2Нтетразол-5-іл]-етилсульфаніл}-4-метил-4Н[1,2,4]триазол-3-іл)-піридин Заголовну сполук у (12,3мг, 32%, білу піну ) отримували з метансульфонової кислоти 1-[2-(5хлор-2-флуор-феніл)-2Н-тетразол-5-іл]-етилового естеру (~29,5мг, 0,09ммоль), застосовуючи калій карбонат (38мг, 0,27ммоль) та 4-метил-5-піридин4-іл-2,4-дигідро-[1,2,4]триазол-3-тіон (22мг, 0,11ммоль) у ацетонітрилі (1,5мл), при кімнатній температурі протягом ночі. Реакційну суміш очищали хроматографією, застосовуючи колонку SPE з діоксидом силіцію (2-3% метанол у дихлорметані). 1Н ЯМР (CDCI3) δ (млн.-1): 8,80 (br.s, 2H), 7,85 (dd, 1H), 7,62 (d, 2H), 7,50 (m, 1H), 7,31 (t, 1H), 5,30 (q, 1H), 3,66 (s, 3Н), 2,05 (d, 3Н). g) 4-(5-{1-[2-(5-Хлор-2-флуор-феніл)-2Нтетразол-5-іл]-етилсульфаніл}-4-циклопропіл-4Н[1,2,4]триазол-3-іл)-піридин Заголовну сполуку (34,1мг, 84%, білу піну) отримували з метансульфонової кислоти 1-[2-(5хлор-2-флуор-феніл)-2Н-тетразол-5-іл]-етилового естеру (~29,5мг, 0,09ммоль), застосовуючи калій карбонат (38мг, 0,27ммоль) та 4-циклопропіл-5піридин-4-іл-2,4-дигідро-[1,2,4]триазол-3-тіон (23мг, 0,10ммоль) у ацетонітрилі (1,5мл), при кімнатній температурі протягом ночі. Реакційну суміш очищали хроматографією, застосовуючи колонку SPE з діоксидом силіцію (2-2,5% метанол у дихлорметані). 1Н ЯМР (CDCI3) δ (млн-1): 8,78 (d, 2H), 7,90 (dd, 1H), 7,75 (d, 2H), 7,49 (m, 1H), 7,32 (t, 1H), 5,67 (q, 1Н), 3,26 (септет, 1Н), 2,07 (d, 3Н), 1,17 (m, 2Н), 0,81 (m, 2Н). h) 4-{1-[2-(5-Хлор-2-флуор-феніл)-2Нтетразол-5-іл]-етил}-піперазин-1-карбонової кислоти етиловий естер 59 85576 Заголовну сполуку (25,2мг, 72%, жовте масло, ~90% чистота) отримували з метансульфонової кислоти 1-[2-(5-хлор-2-флуор-феніл)-2Н-тетразол5-іл]-етилового естеру (~29,5мг, 0,09ммоль), застосовуючи калій карбонат (38мг, 0,27ммоль) та 1етоксикарбоніл піперазин (20мкл, 0,14ммоль) у ацетонітрилі (1,5мл), при 80°С протягом ночі. Продукт очи щали хроматографією, застосовуючи колонку SPE з діоксидом силіцію (25-35% етилацетат у гексані). 1Н ЯМР (CDCI3) δ (млн.-1): 7,91 (dd, 1Н), 7,51 (ddd, 1H), 7,33 (t, 1H), 4,32 (q, 1H), 4,11 (q, 2H), 3,52 (m, 4H), 2,61 (m, 2H), 2,51 (m,2H), 1,65 (d,3H), 1,24 (t, 3Н). і) 4-[4-Циклопропіл-5-(2-мета-толіл-2Нтетразол-5-ілметилсульфаніл)-4Н-[1,2,4]триазол-3іл]-піридин Заголовну сполуку (29%, не зовсім білу тверду речовину) отримували з метансульфонової кислоти 2-мета-толіл-2Н-тетразол-5-ілметилового естеру (1ммоль), застосовуючи калій карбонат (3ммоль) та 4-циклопропіл-5-піридин-4-іл-2,4дигідро-[1,2,4]триазол-3-тіон (1ммоль) у ацетонітрилі (15мл), при кімнатній температурі протягом ночі. 1Н ЯМР (CDCI3) δ (млн -1): 8,77 (d, 2H), 7,93 (s, 1H), 7,91 (d, 1H), 7,75 (d, 2Н), 7,42 (t, 1Н), 7,31 (d, 1Н), 4,96 (s, 2Н), 3,28 (m, 1Н), 2,46 (s, 3Н), 1,18 (m, 2H), 0,84 (m, 2Н). j) 4-{4-Циклопропіл-5-[1-(2-мета-толіл-2Нтетразол-5-іл)-етилсульфаніл]-4Н-[1,2,4]триазол-3іл}-піридин Заголовну сполуку (31%, не зовсім білу тверду речовину) отримували з метансульфонової кислоти 1-(2-мета-толіл-2Н-тетразол-5-іл)-етилового естеру (1ммоль), застосовуючи калій карбонат (3ммоль) та 4-циклопропіл-5-піридин-4-іл-2,4дигідро-[1,2,4]триазол-3-тіон (1ммоль) у ацетонітрилі (15мл), при кімнатній температурі протягом ночі. 1Н ЯМР у CDCI3: 8,76 (d, 2H), 7,93 (s, 1H), 7,91 (d, 1H), 7,74 (d, 2H), 7,43 (t, 1Н), 7,30 (d, 1Н), 5,65 (q, 1Н), 3,22 (m, 1Н), 2,46 (s, 3Н), 2,08 (d, 3Н), 1,16 (m, 2Н), 0,79 (m, 2Н). k) 4-{4-метил-5-[1-(2-мета-толіл-2Н-тетразол-5іл)-етилсульфаніл]-4Н-[1,2,4]триазол-3-іл}-піридин Заголовну сполуку о тримано з метансульфонової кислоти 1-(2-мета-толіл-2Н-тетразол-5-іл)етилового естеру (1ммоль), застосовуючи калій карбонат (3ммоль) та 4-циклопропіл-5-піридин-4іл-2,4-дигідро-[1,2,4]триазол-3-тіон (1ммоль) у ацетонітрилі (15мл), при кімнатній температурі протягом ночі. І) 3-[5-(4-Циклопропіл-5-піридин-4-іл-4Н[1,2,4]триазол-3-ілсульфанілметил)-тетразол-2-іл]бензонітрил Заголовну сполуку о тримано з метансульфонової кислоти 2-(3-ціано-феніл)-2Н-тетразол-5ілметилового естеру (1ммоль), застосовуючи калій карбонат (3ммоль) та 4-циклопропіл-5-піридин-4іл-2,4-дигідро-[1,2,4]триазол-3-тіон (1ммоль) у ацетонітрилі (15мл), при кімнатній температурі протягом ночі. m) 3-{5-[1-(4-Циклопропіл-5-піридин-4-іл-4Н[1,2,4]триазол-3-ілсульфаніл)-етил]-тетразол-2-іл}бензонітрил Заголовну сполуку о тримано з метансульфонової кислоти 1-[2-(3-ціано-феніл)-2Н-тетразол-5 60 іл]-етилового естеру (1ммоль), застосовуючи калій карбонат (3ммоль) та 4-циклопропіл-5-піридин-4іл-2,4-дигідро-[1,2,4]триазол-3-тіон (1ммоль) у ацетонітрилі (15мл), при кімнатній температурі протягом ночі. n) 3-{5-[1-(4-метил-5-піридин-4-іл-4Н[1,2,4]триазол-3-ілсульфаніл)-етил]-тетразол-2іл}бензонітрил Заголовну сполуку о тримано з метансульфонової кислоти 1-[2-(3-ціано-феніл)-2Н-тетразол-5іл]-етилового естеру (1ммоль), застосовуючи калій карбонат (3ммоль) та 4-циклопропіл-5-піридин-4іл-2,4-дигідро-[1,2,4]триазол-3-тіон (1ммоль) у ацетонітрилі (15мл), при кімнатній температурі протягом ночі. о) 4-{4-Циклопропіл-5-[2-(2-флуор-5-метилфеніл)-2Н-тетразол-5-ілметилсульфаніл]-4Н[1,2,4]триазол-3-іл}-піридин Заголовну сполуку о тримано з метансульфонової кислоти 2-(2-флуор-5-метил-феніл)-2Нтетразол-5-ілметилового естеру (1ммоль), застосовуючи калій карбонат (3ммоль) та 4циклопропіл-5-піридин-4-іл-2,4-дигідро[1,2,4]триазол-3-тіон (1ммоль) у ацетонітрилі (15мл), при кімнатній температурі протягом ночі. р) 4-(4-Циклопропіл-5-{1-[2-(2-флуор-5-метилфеніл)-2Н-тетразол-5-іл]-етилсульфаніл}-4Н[1,2,4]триазол-3-іл)-піридин Заголовну сполуку о тримано з метансульфонової кислоти 1-[2-(2-флуор-5-метил-феніл)-2Нтетразол-5-іл]-етилового естеру (1ммоль), застосовуючи калій карбонат (3ммоль) та 4циклопропіл-5-піридин-4-іл-2,4-дигідро[1,2,4]триазол-3-тіон (1ммоль) у ацетонітрилі (15мл), при кімнатній температурі протягом ночі. q) 4-(5-{1-[2-(2-Флуор-5-метил-феніл)-2Нтетразол-5-іл]-етилсульфаніл}-4-метил-4Н[1,2,4]триазол-3-іл)-піридин Заголовну сполуку о тримано з метансульфонової кислоти 1-[2-(2-флуор-5-метил-феніл)-2Нтетразол-5-іл]-етилового естеру (1ммоль), застосовуючи калій карбонат (3ммоль) та 4циклопропіл-5-піридин-4-іл-2,4-дигідро[1,2,4]триазол-3-тіон (1ммоль) у ацетонітрилі (15мл), при кімнатній температурі протягом ночі. Подібним способом отримували наступні сполуки: r) 3-[4-метил-5-({[2-(3-метилфеніл)-2Нтетразол-5-іл]метил}тіо)-4Н-1,2,4-триазол-3іл]бензонітрил; вихід 7,1мг, 23%, чисте масло; 1Н ЯМР CDCI3: 7,93 (m, 4H), 7,82 (d від t, 1Н), 7,67 (t, 1Н), 7,44 (t, 1Н), 7,28 (d, 1Н), 4,82 (s, 2Н), 3,64 (s, 3Н), 2,47 (s, 3Н). s) 5-({[5-(3,5-дифлуорфеніл)-4-етил-4Н-1,2,4триазол-3-іл]тіо}метил)-2-(3-метилфеніл)-2Нтетразол; вихід 23,7мг, 77%, чисте масло; 1Н ЯМР CDCI3: 7,89 (m, 2H), 7,43 (t, 1H), 7,33 (d, 1H), 7,17 (d від d, 2H), 6,99 (t від t, 1H), 4,87 (s, 2Η), 4,03 (q, 2H), 2,47 (s, 3H), 1,33 (t, 3H). t) 3-[4-метил-5-({1-[2-(3-метилфеніл)-2Нтетразол-5-іл]етил)тіо)-4Н-1,2,4-триазол-3іл]бензонітрил; вихід 39,1мг, 81%, чисте масло; 1Н ЯМР CDCI3: 7,89 (m, 4H), 7,79 (d від t, 1Н), 7,66 (t, 1Н), 7,41 (t, 1Н), 7,33 (d, 1Н), 5,24 (q, 1Н), 3,55 (s, 3Н), 2,46 (s, 3Н), 2,04 (d, 3Н).
ДивитисяДодаткова інформація
Назва патенту англійськоюTetrazole compounds and their use as metabotropic glutamate receptor antagonits
Автори англійськоюJohansson Martin, Minidis Alexander, Staaf Karin, Wensbo David, Mcleod Donald, Edwards Louise, ISAAC METHVIN, O'brien Anne, Slassi Abdelmalik, Xin Tao
Назва патенту російськоюТетразольные соединения и их применение в качестве метаботропических антагонистов рецепторов глутамата
Автори російськоюЙохансон Мартин, Минидис Александер, Стааф Карин, Венсбо Дейвид, Маклеод Доналд, Эдвардс Луиз, Айзек Метвин, О'Браен Энн, Слесси Абдельмалик, Синь Тао
МПК / Мітки
МПК: C07D 401/12, C07D 401/14, A61K 31/4439, A61K 31/41, C07D 403/06, A61K 31/497, A61K 31/496, C07D 487/04, A61P 25/00, C07D 403/12, C07D 257/00
Мітки: метаботропічних, сполуки, тетразольні, антагоністів, рецепторів, застосування, глутамату
Код посилання
<a href="https://ua.patents.su/42-85576-tetrazolni-spoluki-ta-kh-zastosuvannya-yak-metabotropichnikh-antagonistiv-receptoriv-glutamatu.html" target="_blank" rel="follow" title="База патентів України">Тетразольні сполуки та їх застосування як метаботропічних антагоністів рецепторів глутамату</a>
Попередній патент: 4-арилпіперидини
Наступний патент: Спосіб прямого перетворення теплоти в електроенергію
Випадковий патент: Спосіб біліарної декомпресії