Спосіб ідентифікації протипухлинних цільових ензимів
Номер патенту: 77718
Опубліковано: 15.01.2007
Автори: Окабе Хісафумі, Ішицука Хідео, Умеда Ісао, Цукуда Такуо, Шимма Нобуо
Формула / Реферат
1. Спосіб ідентифікації ензиму для використання в побудові протиракових сполук, які селективно перетворюються на активні речовини у пухлинних тканинах або клітинах, при цьому згаданий спосіб включає етапи: порівняння рівнів експресії генів або білків у здоровій тканині або клітинах людини з рівнями експресії генів або білків у людській тканині або клітинах пухлинного походження та вибір ензиму, рівні експресії якого у клітинах або тканині пухлинного походження більш ніж удвічі перебільшують рівні у здорових клітинах або тканині.
2. Спосіб за п. 1, де ензим ідентифікують шляхом аналізу рангованих мікрорядів ДНК, полімеразно-ланцюгової реакції, нозерн-блотингу та гібридизації in situ, диференціальних проявів, аналізу захисту від рибонуклеази, рядів білків, вестерн-блотингу, двомірного гель-електрофорезу або твердофазного імуноферментного аналізу.
3. Спосіб за п. 2, де ензим ідентифікують шляхом аналізу рангованих мікрорядів ДНК або полімеразно-ланцюгової реакції.
4. Спосіб за п. 1, де здорові клітини або тканину беруть від здорових зростаючих клітин.
5. Спосіб за п. 1, де тканини або клітини пухлинного походження вибирають з групи, що складається з головного мозку, легенів, стравоходу, грудей, шлунку, підшлункової залози, печінки, товстої кишки, прямої кишки, нирки, яєчника, матки, сечового міхура, простати, шкіри та крові.
6. Спосіб за п. 1, де здорові клітини беруть з кровотворних клітин-попередників, кишки або шкіри.
7. Спосіб за п. 1, де здорові клітини беруть з кишки або шкіри.
8. Спосіб за п. 6, де кровотворні клітини-попередники походять з кісткового мозку або крові пуповини.
9. Спосіб за п. 4, де рівні експресії ензиму у клітинах або тканині пухлинного походження більш ніж удвічі перебільшують рівні у здорових клітин з кровотворних клітин-попередників, а також зі здорових клітин або тканини печінки.
10. Застосування ензимів, ідентифікованих за способом, згідно з будь-яким з пп. 1-9, для одержання, ідентифікації та/або побудови протиракових сполук, які можуть перетворюватися на активні речовини селективно у пухлинах.
11. Застосування за п. 10, де згадані ензими являють собою мікросомну дипептидазу, арилсульфатазу А, піролін-5'-карбоксиредуктазу, дегідродіолдегідрогеназу, карбонілредуктазу, лізилгідроксилазу, пролідазу, дигідропіримідиназу, глютамін:фруктоза-6-фосфатамідотрансферазу, UDP-галактоза-церамідгалактозилтрансферазу, лізилоксидазу, енолазу, глюкоза-6-фосфатдегідрогеназу, стеароїл-коензим А десатуразу, епоксидгідролазу або альдолазу С.
12. Застосування за п. 11, де згадані ензими являють собою мікросомну дипептидазу, дегідродіолдегідрогеназу, піролін-5’-карбоксиредуктазу, карбонілредуктазу та лізилгідроксилазу, переважно мікросомну дипептидазу.
13. Спосіб ідентифікації протиракових сполук, які можна перетворити на активні речовини селективно у пухлинах, який включає етапи:
а) генерування клітин, які експресують ензим, рівні білка якого у пухлинній тканині більш ніж удвічі перебільшують рівні у здорових клітинах або тканині, та
б) визначення інгібіторної активності згаданих протиракових сполук стосовно росту.
14. Спосіб за п. 13, де згаданий ензим являє собою ензим за пп. 10-13.
15. Протиракові сполуки формули (І)
X-Y-Q, (І)
де Х являє собою про-складову, побудовану для генерування активної протиракової речовини (Q-Y-H) селективно у пухлинах за допомогою ензимів згідно з будь-яким з пп. 10-13; Q-Y- являє собою радикал, що походить з активної протиракової речовини (Q-Y-Н), де Y являє собою -O-, -S- або -N-,
та їх фармацевтично прийнятні солі.
16. Сполука за п. 15, де радикал (Q-Y-) активної протиракової речовини (Q-Y-H) являє собою таксани, камптотецини, протиракові нуклеозиди, доластатини, антрацикліни, інгібітори фарнезилтрансферази або інгібітори тирозинкінази рецептора епідермального фактора росту.
17. Сполука за п. 16, де активна протиракова речовина (Q-Y-H) являє собою таксан, що вибирається з групи, яка складається з
a) таксолу
[2аR-[2а![]() ,4
,4![]() ,4а
,4а![]() ,6
,6![]() ,9
,9![]() (
(![]() R*,
R*,![]() S*),11
S*),11![]() ,12
,12![]() ,12а
,12а![]() ,12b
,12b![]() ]]-
]]-![]() -(бензоїламіно)-
-(бензоїламіно)-![]() -гідроксибензолпропанової кислоти 6,12b-біс(ацетилокси)-12-(бензоїлокси)-2а,3,4,4а,5,6,9,10,11,12,12а,12b-додекагідро-4,11-дигідрокси-4а,8,13,13-тетраметил-5-оксо-7,11-метано-1Н-циклодека-[3,4]бенз[1,2-b]оксет-9-иловий естер,
-гідроксибензолпропанової кислоти 6,12b-біс(ацетилокси)-12-(бензоїлокси)-2а,3,4,4а,5,6,9,10,11,12,12а,12b-додекагідро-4,11-дигідрокси-4а,8,13,13-тетраметил-5-оксо-7,11-метано-1Н-циклодека-[3,4]бенз[1,2-b]оксет-9-иловий естер,
b) таксотеру
[2aR-[2a![]() ,4
,4![]() ,4a
,4a![]() ,6
,6![]() ,9
,9![]() (
(![]() R*,
R*,![]() S*,11
S*,11![]() ,12
,12![]() ,12a
,12a![]() ,12b
,12b![]() )]]-
)]]-![]() -[[(1,1-диметилетокси)карбоніл]аміно]-
-[[(1,1-диметилетокси)карбоніл]аміно]-![]() -гідроксибензолпропанової кислоти 12b-(ацетилокси)-12-(бензоїлокси)-2а,3,4,4а,5,6,9,10,11,12,12а,12b-додекагідро-4,6,11-тригідрокси-
-гідроксибензолпропанової кислоти 12b-(ацетилокси)-12-(бензоїлокси)-2а,3,4,4а,5,6,9,10,11,12,12а,12b-додекагідро-4,6,11-тригідрокси-
4a,8,13,13-тетраметил-5-оксо-7,11-метано-1Н-циклодека-[3,4]бенз[1,2-b]оксет-9-иловий естер,
c) IDN 5109
(2R,3S)-3-[[(1,1-диметилетокси)карбоніл]аміно]-2-гідрокси-5-метил-4-гексенової кислоти (3aS,4R,7R,8aS,9S,10aR,12aS,12bR,13S,13aS)-7,12а-біс(ацетилокси)-13-(бензилокси)-3а,4,7,8,8а,9,10,10а,12,12а,12b,13-додекагідро-9-гідрокси-5,8а,14,14-тетраметил-2,8-діоксо-6,13а-метано-13аН-оксето[2",3":5',6']бенз[1',2':4,5]-циклодека-[1,2-d]-1,3-діоксол-4-іловий естер,
d) BMS 188797
(2R,3S)-![]() -(бензоїламіно)-
-(бензоїламіно)-![]() -гідроксибензолпропанової кислоти (2aR,4S,4aS,6R,9S,11S, 12S,12aR,12bS)-6-(ацетилокси)-12-(бензоїлокси)-2a,3,4,4a,5,6,9,10,11,12,12а,12b-додекагідро-4,11-дигідрокси-12b-[(метоксикарбоніл)окси]-4а,8,13,13-тетраметил-5-оксо-7,11-метано-1Н-циклодека[3,4]бенз[1,2-b]оксет-9-иловий естер, та
-гідроксибензолпропанової кислоти (2aR,4S,4aS,6R,9S,11S, 12S,12aR,12bS)-6-(ацетилокси)-12-(бензоїлокси)-2a,3,4,4a,5,6,9,10,11,12,12а,12b-додекагідро-4,11-дигідрокси-12b-[(метоксикарбоніл)окси]-4а,8,13,13-тетраметил-5-оксо-7,11-метано-1Н-циклодека[3,4]бенз[1,2-b]оксет-9-иловий естер, та
e) BMS 184476
(2R,3S)-![]() -(бензоїламіно)-
-(бензоїламіно)-![]() -гідроксибензолпропанової кислоти
-гідроксибензолпропанової кислоти
(2aR,4S,4aS,6R,9S,11S,12S,12aR,12bS)-6,12b-біс(ацетилокси)-12-(бензоїлокси)-2а,3,4,4а,5,6,9,10,11,12,12а,12b-додекагідро-11-гідрокси-4а,8,13,13-тетраметил-4-[(метилтіо)метокси]-5-оксо-7,11-метано-1Н-циклодека[3,4]бенз[1,2-b]оксет-9-иловий естер.
18. Сполука за п. 16, де активна протиракова речовина (Q-Y-H) являє собою камптотецин, що вибирається з групи, яка складається з
a) камптотецину:
4(S)-етил-4-гідрокси-1Н-пірано [3',4': 6,7]індолізино[1,2-b]хінолін-3,14(4Н,12Н)-діон,
b) топотекану
4(S)-10-[(диметиламіно)метил]-4-етил-4,9-дигідрокси-1Н-пірано[3',4':6,7]індолізино[1,2-b]хінолін-3,14(4Н,12Н)-діонумоногідрохлорид,
c) DX-8951f
(1S,9S)-1-аміно-9-етил-5-фтор-9-гідрокси-4-метил-2,3,9,10,13,15-гексагідро-1Н,12Н-бенз[де]пірано[3',4' :6,7]індолізино[1,2-b]хінолін-10,13-діон,
d) BN-80915
5(R)-етил-9,10-дифтор-1,4,5,13-тетрагідро-5-гідрокси-3Н,15Н-оксепіно[3',4':6,7]індолізино[1,2-b]хінолін-3,15-діон,
e) 9-амінокамптотецину
(S)-10-аміно-4-етил-4-гідрокси-1Н-пірано[3',4':6,7]індолізино[1,2-b]хінолін-3,14(4Н,12Н)-діон,
f) 9-нітрокамптотецину
4(S)-етил-4-гідрокси-10-нітро-1Н-пірано[3',4':6,7]індолізино[1,2-b]хінолін-3,14(4Н,12Н)-діон,
g) (9S)-9-етил-9-гідрокси-1-пентил-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-де]хіназолін-10,13(9Н,15Н)-діону,
h) (9S)-9-етил-9-гідрокси-2-метил-1-пентил-1Н,12Н-пірано[3",4":6',7']індолізино[1',2',:6,5]піридо[4,3,2-де]хіназолін-10,13(9Н,15Н)-діону та
і) (9S)-9-етил-9-гідрокси-2-гідроксиметил-1-пентил-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]тридо[4,3,2-де]хіназолін-10,13(9Н,15Н)-діону.
19. Сполука за п. 16, де активна протиракова речовина (Q-Y-H) являє собою протираковий нуклеозид, що вибирається з групи, яка складається з
a) DFDC
2' -дезокси-2',2' -дифтороцитидин,
b) DMDC
2'-дезокси-2'-метиліденцитидин,
c) FMDC
(Е)-2' -дезокси-2' -(фторометилен)цитидин,
d) Ara-C
1-(![]() -D-арабінофуранозил)цитозин,
-D-арабінофуранозил)цитозин,
e) децитабіну 4-аміно-1-(2-дезокси-(![]() -D-еритропентофуранозил)-1,3,5-триазин-2(1Н)-он,
-D-еритропентофуранозил)-1,3,5-триазин-2(1Н)-он,
f) троксацитабіну 4-аміно-1-[(2S,4S)-2-(гідроксиметил)-1,3-діоксолан-4-іл]-2(1Н)-піримідинон,
g) флударабіну
2-фторо-9-(5-O-фосфоно-![]() -D-арабінофуранозил)-9Н-пурин-6-амін та
-D-арабінофуранозил)-9Н-пурин-6-амін та
h) кладрибіну 2-хлоро-2'-дезоксіаденозин.
20. Сполука за п. 16, де активна протиракова речовина (Q-Y-H) являє собою доластатин, що вибирається з групи, яка складається з
а) доластатину 10
N,N-диметил-L-валіл-N-[(1S,2R)-2-метокси-4-[(2S)-2-[(1R,2R)-1-метокси-2-метил-3-
оксо-3-[[(1S)-2-феніл-1-(2-тіазоліл)етил]аміно]пропіл]-1-піролідиніл]-1-[(1S)-1-метилпропіл]-4-оксобутил]-N-метил-L-валінамід,
b) доластатину 14
цикло[N-метилаланіл-(2Е,4Е,10Е)-15-гідрокси-7-метокси-2-метил-2,4,10-гексадекатриєноїл-L-валіл-N-метил-L-фенілаланіл-N-метил-L-валіл-N-метил-L-валіл-L-пропіл-N2-метиласпарагініл],
c) доластатину 15
(1S)-1-[[(2S)-2,5-дигідро-3-метоксі-5-оксо-2-(фенілметил)-1Н-пірол-1-іл]карбоніл]-2-метилпропіловий естер N,N-диметил-L-валіл-L-валіл-N-метил-L-валіл-L-пропіл-L-проліну,
d) TZT 1027
N,N-диметил-L-валіл-N-[(1S,2R)-2-метокси-4-[(2S)-2-[(1R,2R)-1-метокси-2-метил-3-оксо-3-[(2-фенілетил)аміно]пропіл]-1-піролідиніл]-1-[(1S)-1-метилпропіл]-4-оксобутил]-N-метил-L-вілінамід та
e) цемадотину
N,N-диметил-L-валіл-L-валіл-N-метил-L-валіл-L-пропіл-N-(фенілметил)-L-пролінамід.
21. Сполука за п. 16, де активна протиракова речовина (Q-Y-H) являє собою антрациклін, що вибирається з групи, яка складається з
a) адріаміцину
(8S,10S)-10-[(3-аміно-2,3,6-тридезокси-L-ліксогексопіранозил)окси]-7,8,9,10-тетрагідро-6,8,11-тригідрокси-8-(гідроксіацетил)-1-метоксинафтацен-5,12-діон, гідрохлорид,
b) дауноміцину
8-ацетил-10-[(3-аміно-2,3,6-тридезокси-L-ліксогексопіранозил)окси]-7,8,9,10-тетрагідро-6,8,11-тригідрокси-1-метоксинафтацен-5,12-діон, гідрохлорид та
c) ідарубіцину
(7S,9S)-9-ацетил-7-[(3-аміно-2,3,6-тридезокси-L-ліксогексопіранозил)окси]-7,8,9,10-тетрагідро-6,9,11-тригідрокси-нафтацен-5,12-діон.
22. Сполука за п. 16, де активна протиракова речовина (Q-Y-H) являє собою інгібітор тирозинкінази рецептора епідермального фактора росту або інгібітор фарнезилтрансферази.
23. Сполука за п. 22, де активна протиракова речовина (Q-Y-H) являє собою інгібітор тирозинкінази рецептора епідермального фактора росту, що вибирається з групи, яка складається з
a) ZD 1839
N-(3-xлopo-4-фтopoфeнiл)-7-мeтoкcи-6-[3-(4-мopфoлiнiл)пpoпoкcи]-4-xiнaзoлiнaмiн,
b) CP 358774
N-(3-етинілфеніл)-6,7-біс(2-метоксіетокси)-4-хіназолінамін,
c) PD 158780
N4-(3-бpoмфeнiл)-N6-мeтилпipидo[3,4-d]пipимiдин-4,6-дiaмiн та
d) GW 2016
Н-(3-хлоро-4-((3-фторобензил)окси)феніл)-6-(5-(((2-метилсульфоніл)етил)аміно)метил)-2-фурил)-4-хіназолінамін.
24. Сполука за п. 22, де активна протиракова речовина (Q-Y-H) являє собою інгібітор фарнезилтрансферази R 115777 формули 6-[1-аміно-1-(4-хлорфеніл)-1-(1-метилімідазол-5-іл)метил]-4-(3-хлорфеніл)-1-метилхінолін-2(1Н)-он.
25. Сполуки за п. 15, які представлено формулою (II)
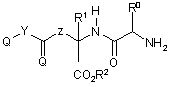 , (II)
, (II)
де Q та Y є такими, як визначено у п. 15,
R0 являє собою бічний ланцюг природної або неприродної амінокислоти,
Z являє собою (С1-С3) алкілен або -O-CH(R3)-, де R3 являє собою водень або прямий (С1-С4) алкіл,
R1 являє собою водень або метил, та
R2 являє собою водень, розгалужений (С3-С10) алкіл або (С3-С8) циклоалкіл,
або їх фармацевтично прийнятні солі.
26. Сполуки за п. 25, де (Q-Y-H) являє собою таксол або таксотер, які представлено формулою (III)
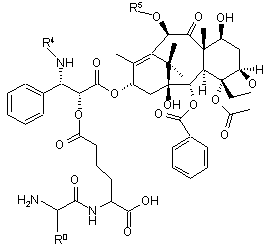 , (III)
, (III)
де R0 є таким, як визначено у п. 25,
R4 являє собою бензоїл або трет-бутоксикарбоніл, та
R5 являє собою водень або ацетил,
або їх фармацевтично прийнятні солі.
27. Сполука за п. 26, де R0 являє собою метил, бензил або 2-метилпропіл.
28. Сполука за п. 26 або 27, що вибирається з групи, яка складається з
a) 13-((2R,3S)-2-{(5S)-[5-((2S)-2-аміно-4-метилпентаноїламіно)-5-гідроксикарбоніл]пентаноїлокси}-3-бензоїламіно-3-фенілпропіонілокси)-2![]() -бензилокси-4
-бензилокси-4![]() ,10
,10![]() -діацетокси-1
-діацетокси-1![]() ,7
,7![]() -дигідроксі-5
-дигідроксі-5![]() ,20-епокситакс-11-ен-9-ону,
,20-епокситакс-11-ен-9-ону,
b) 13![]() -((2R,3S)-2-{(5S)-[5-((2S)-2-амінопропіноїламіно)-5-гідроксикарбоніл]пентаноїлокси}-3-бензоїламіно-3-фенілпропіонілокси)-2
-((2R,3S)-2-{(5S)-[5-((2S)-2-амінопропіноїламіно)-5-гідроксикарбоніл]пентаноїлокси}-3-бензоїламіно-3-фенілпропіонілокси)-2![]() -бензилокси-4
-бензилокси-4![]() , 10
, 10![]() -діацетокси-1
-діацетокси-1![]() ,7
,7![]() -дигідроксі-5
-дигідроксі-5![]() ,20-епокситакс-11-ен-9-ону та
,20-епокситакс-11-ен-9-ону та
c) 13-((2R,3S)-2-{(5S)-[5-((2S)-2-аміно-3-фенілпропіноїламіно)-5-гідроксикарбоніл]пентаноїлокси}-3-бензоїламіно-3-фенілпропіонілокси)-2![]() -бензилокси-4
-бензилокси-4![]() , 10
, 10![]() -діацетокси-1
-діацетокси-1![]() ,7
,7![]() -дигідроксі-5
-дигідроксі-5![]() ,20-епокситакс-11-ен-9-ону, та
,20-епокситакс-11-ен-9-ону, та
їх фармацевтично прийнятних солей.
29. Сполуки за п. 25, де (Q-Y-H) являє собою протираковий нуклеозид, які представлено формулою (IV)
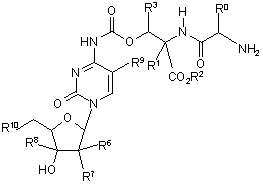 , (IV)
, (IV)
де
R0, R1, R2 та R3 є такими, як визначено у п. 25,
R6 являє собою водень, фтор, гідроксил або ціано,
R7 являє собою водень, фтор або гідрокси,
або R6 та R7 разом утворюють метиліден або фторметиліден,
R8 являє собою водень або етиніл,
R9 являє собою водень, фтор, вініл або етиніл, та
R10 являє собою водень або гідрокси, та їх фармацевтично прийнятні солі.
30. Сполука за п. 29, де
R6 являє собою водень, фтор, гідроксил,
R7 являє собою фтор або гідрокси,
або R6 та R7 разом утворюють метиліден або фторметиліден.
31. Сполука за п. 29 або 30, де
R0 являє собою 2-метилпропіл, циклогексилметил, 2-нафтилметил, 4-фенілбензил, (4-циклогексилциклогексил)метил, алкілтіометил, циклогексилтіометил або 4-алкоксибензил, та
R3 являє собою водень або метил.
32. Сполука за будь-яким з пп. 29-31, що вибирається з групи, яка складається з
a) (2R)-((2S)-аміно-3-циклогексилпропіоніламіно)-(3S)-[1-((4S)-гідрокси-(5R)-гідроксиметил-3-метилентетрагідрофуран-(2R)-іл)-2-оксо-1,2-дигідропіримідин-4-ілкарбамоїлокси]-масляної кислоти,
b) (2R)-((2S)-аміно-4-метилпентаноїламіно)-(3S)-[1-((4S)-гідрокси-(5R)-гідроксиметил-3-метилентетрагідрофуран-(2R)-іл)-2-оксо-1,2-дигідропіримідин-4-ілкарбамоїлокси]-масляної кислоти,
c) (2R)-((2S)-аміно-3-біфеніл-4-ілпропіоніламіно)-(3S)-[1-((4S)-гідрокси-(5R)-гідроксиметил-3-метилентетрагідрофуран-(2R)-іл)-2-оксо-1,2-дигідропіримідин-4-ілкарбамоїлокси]-масляної кислоти,
d) (2R)-[(2S)-аміно-3-біфеніл-4-ілпропіоніламіно)-3-{1-[(4S)-гідрокси-(5R)-гідроксиметил-3 -метилентетрагідрофуран-(2R)-іл]-2-оксо-1,2-дигідропіримідин-4-ілкарбамоїлокси]-пропіонової кислоти,
e) (2R)-((2S)-аміно-3-нафтален-2-ілпропіоніламіно)-(3S)-[1-((4S)-гідрокси-(5R)-гідроксиметил-3-метилентетрагідрофуран-(2R)-іл]-2-оксо-1,2-дигідропіримідин-4-ілкарбамоїлокси]-масляної кислоти,
f) (2R)-{(2S)-аміно-3-[4-(4-гідроксифенокси)-феніл]-пропіоніламіно}-3-[1-((4S)-гідрокси-(5R)-гідроксиметил-3-метилентетрагідрофуран-2-іл)-2-оксо-1,2-дигідропіримідин-4-ілкарбамоїлокси]-масляної кислоти,
g) (2R)-[(2S)-аміно-3-(4-метоксифеніл)-пропіоніламіно]-(3S)-[1-[(4S)-гідрокси-(5R)-гідроксиметил-3-метилентетрагідрофуран-2-іл]-2-оксо-1,2-дигідропіримідин-4-ілкарбамоїлокси]-масляної кислоти,
h) (2R)-[(2S)-аміно-4-етилсульфанілбутириламіно]-(3S)-[1-[(4S)-гідрокси-(5R)-гідроксиметил-3-метилентетрагідрофуран-(2R)-іл]-2-оксо-1,2-дигідропіримідин-4-ілкарбамоїл]-масляної кислоти,
і) (2R)-((2S)-аміно-3-циклогексилпропіоніламіно)-(3S)-[1-(3,3-дифторо-(4R)-гідрокси-(5R)-гідроксиметилтетрагідрофуран-2-іл)-2-оксо-1,2-дигідропіримідин-4-ілкарбамоїлокси]-масляної кислоти,
j) 2(S)-[2(S)-аміно-3-циклогексилпропіоніламіно)-3[1-(3,3-дифтор-(4R)-гідрокси-(5R)-гідроксиметилтетрагідрофуран-2(R)-іл)-2-оксо-1,2-дигідропіримідин-4-ілкарбамоїлокси]-2(S)-метилпропіонової кислоти,
k) 2(R)-[2(S)-аміно-3-циклогексилпропіоніламіно]-3-{1-[3,3-дифтор-(4R)-гідрокси-(5R)-гідроксиметилтетрагідрофуран-2(R)-іл]-2-оксо-1,2-дигідропіримідин-4-ілкарбамоїлокси]-2(R)-метилпропіонової кислоти,
l) (2S, 3S)-2-(2-аміно-3-циклогексилпропіоніламіно)-3-[1-{(4R,5R)-3,3-дифтор-4-гідрокси-5-гідроксиметилтетрагідрофуран-2-іл}-2-оксо-1,2-дигідропіридин-4-ілкарбамоїлокси]-2-метилмасляної кислоти,
m) (2R, 3R)-2-(2-аміно-3-циклогексилпропіоніламіно)-3-[1-{(4R,5R)-3,3-дифтор-4-гідрокси-5 -гідроксиметилтетрагідрофуран-2-іл}-2-оксо-1,2-дигідропіридин-4-ілкарбамоїлокси]-2-метилмасляної кислоти та
n) (2R)-[(2S)-аміно-3-циклогексилпропіоніламіно)-3(S)-[1-[(4S)-гідрокси-(5R)-гідроксиметил-3-метилентетрагідрофуран-(2R)-іл]-2-оксо-1,2-дигідропіримідин-4-ілкарбамоїлокси]-масляної кислоти ізопропілового естеру, та
їх фармfцевтично прийнятних солей.
33. Сполуки за п. 25, де (Q-Y-H) являє собою протираковий нуклеозид, які представлено формулою (V)
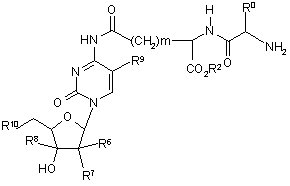 , (V)
, (V)
де m являє собою ціле число 2 або 3, та
R0, R2, R6, R7, R8, R9 та R10 є такими, як визначено у п. 29,
та їх фармацевтично прийнятні солі.
34. Сполука за п. 33, де
R6 являє собою водень, фтор або гідроксил,
R7 являє собою фтор або гідрокси,
або R6 та R7 разом утворюють метиліден або фторметиліден.
35. Сполука за пп. 33 або 34, де R0 являє собою циклогексилметил, 2-нафтилметил, 4-фенілбензил, бензил, індол-3-ілметил або 4-алкоксибензил.
36. Сполука за будь-яким з пп. 33-35, що вибрана з групи, яка складається з
a) (2R)-[(2S)-аміно-3-(1Н-індол-3-іл)пропіоніламіно]-4-[1-((4S)-гідрокси-(5R)-гідроксиметил-3-метилентетрагідрофуран-2-іл]-2-оксо-1,2-дигідропіримідин-4-ілкарбамоїл]-масляної кислоти,
b) (2R)-((2S)-аміно-3-циклогексилпропіоніламіно)-4-[1-((4S)-гідрокси-(5R)-гідроксиметил-3-метилентетрагідрофуран-2-іл)-2-оксо-1,2-дигідропіримідин-4-ілкарбамоїл]-масляної кислоти,
c) (2R)-((2S)-аміно-3-біфеніл-4-ілпропіоніламіно)-4-[1-((4S)-гідрокси-(5R)-гідроксиметил-3-метилентетрагідрофуран-2-іл)-2-оксо-1,2-дигідропіримідин-4-ілкарбамоїл]-масляної кислоти та
d) (2R)-((2S)-аміно-3-нафтален-2-ілпропіоніламіно)-4-[1-((4S)-гідрокси-(5R)-гідроксиметил-3-метилентетрагідрофуран-2-іл)-2-оксо-1,2-дигідропіримідин-4-ілкарбамоїл]-масляної кислоти, та
їх фармацевтично прийнятних солей.
37. Сполуки за п. 25, де (Q-Y-H) являє собою камптотецин або його похідні, які представлено формулою (VI)
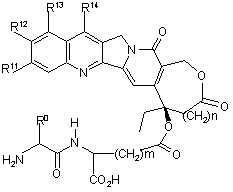 , (VI)
, (VI)
де m являє собою ціле число від 1 до 3,
n являє собою ціле число від 0 до 1,
R0 є таким, як визначено у п. 26,
R11 являє собою водень або фтор,
R12 являє собою водень, фтор, метил або гідрокси,
R13 являє собою водень, аміно, нітро або (диметиламіно)метил,
R14 являє собою водень, (С1-С4) алкіл, (4-метилпіперазиніл)метил або (трет-бутоксііміно)метил,
або R13 та R14, або R11 та R12 разом утворюють 5- або 6-членне кільце, яке необов'язково містить один або два гетероатоми, та яке необов'язково заміщене 1-3 замісниками, які вибрані з групи, що складається з (С1-С8) алкілу, аміно, (С1-С8) алкіламіно та/або ді-(С1-С4) алкіламіно, та їх фармацевтично прийнятні солі.
38. Сполука за п. 37, де R11 являє собою водень, R12 являє собою водень або гідрокси, R13 являє собою водень або (диметиламіно)метил та R14 являє собою водень або етил.
39. Сполука за п. 37 або 38, де R0 являє собою 2-метилпропіл, циклогексилметил, бензил, індол-3-ілметил, 4-амінобутил або 4-амінопропіл.
40. Сполука за будь-яким з пп. 37-39, що вибрана з групи, яка складається з
a) 20-O-[(S)-триптофіл-![]() -(S)-глутаміл]-20-(S)-камптотецину,
-(S)-глутаміл]-20-(S)-камптотецину,
b) 20-O-[(S)-валіл-![]() -(S)-глутаміл]-20(S)-камптотецину,
-(S)-глутаміл]-20(S)-камптотецину,
c) 20-O-[(S)-фенілаланіл-![]() -(S)-глутаміл]-20(S)-камптотецину,
-(S)-глутаміл]-20(S)-камптотецину,
d) 20-O-[(S)-лейцил-![]() -(S)-глутаміл]-20(S)-камптотецину,
-(S)-глутаміл]-20(S)-камптотецину,
е) 20-O-[(R)-лейцил-![]() -(S)-глутаміл]-20(S)-камптотецину,
-(S)-глутаміл]-20(S)-камптотецину,
f) 20-O-[(R)-фенілаланіл-![]() -(S)-глутаміл]-20(S)-камптотецину,
-(S)-глутаміл]-20(S)-камптотецину,
g) 20-O-[(S)-триптофіл-![]() -(R)-глутаміл]-20(S)-камптотецину,
-(R)-глутаміл]-20(S)-камптотецину,
h) 20-O-[(R)-триптофіл-![]() -(R)-глутаміл]-20(S)-камптотецину,
-(R)-глутаміл]-20(S)-камптотецину,
і) 20-O-[(S)-фенілаланіл-![]() -(R)-глутаміл]-20(S)-камптотецину,
-(R)-глутаміл]-20(S)-камптотецину,
j) 20-O-[(S)-лейцил-![]() -(R)-глутаміл]-20(S)-камптотецину,
-(R)-глутаміл]-20(S)-камптотецину,
k) 20-O-[(R)-триптофіл-![]() -(S)-глутаміл]-20(S)-камптотецину,
-(S)-глутаміл]-20(S)-камптотецину,
l) 20-O-[(R)-фенілаланіл-![]() -(R)-глутаміл]-20(S)-камптотецину,
-(R)-глутаміл]-20(S)-камптотецину,
m) 20-O-[(R)-лейцил-![]() -(R)-глутаміл]-20(S)-камптотецину,
-(R)-глутаміл]-20(S)-камптотецину,
n) 7-етил-10-гідрокси-20-O-[(R)-триптофіл-(R)-гомоглутаміл] -20(S)-камптотецину,
о) 7-етил-10-гідрокси-20-O-[(R)-триптофіл-![]() -(R)-глутаміл]-20(S)-камптотецину,
-(R)-глутаміл]-20(S)-камптотецину,
р) 7-етил-10-гідрокси-20-O-[(S)-фенілаланіл-![]() -(R)-глутаміл]-20(S)-камптотецину,
-(R)-глутаміл]-20(S)-камптотецину,
q) 7-етил-10-гідрокси-20-O-[(S)-фенілаланіл-![]() -(S)-аспартил]-20(S)-камптотецину,
-(S)-аспартил]-20(S)-камптотецину,
r) 7-етил-10-гідрокси-20-O-[(S)-лейцил-![]() -(S)-аспартил]-20(S)-камптотецину,
-(S)-аспартил]-20(S)-камптотецину,
s) 20-O-[(S)-триптофіл-![]() -(R)-аспартил]-20(S)-камптотецину,
-(R)-аспартил]-20(S)-камптотецину,
t) 20-O-[(S)-фенілаланіл-![]() -(R)-аспартил]-20(S)-камптотецину,
-(R)-аспартил]-20(S)-камптотецину,
u) 20-O-[(R)-фенілаланіл-![]() -(R)-аспартил]-20(S)-камптотецину,
-(R)-аспартил]-20(S)-камптотецину,
v) 20-O-[(S)-фенілаланіл-![]() -(S)-аспартил]-20(S)-камптотецину,
-(S)-аспартил]-20(S)-камптотецину,
w) 20-O-[(S)-лейцил-![]() -(R)-acпартил]-20(S)- камптотецину,
-(R)-acпартил]-20(S)- камптотецину,
х) 20-O-[(S)-валіл-![]() -(R)-аспартил]-20(S)-камптотецину,
-(R)-аспартил]-20(S)-камптотецину,
у) 7-етил-10-гідрокси-20-O-[(S)-циклогексилаланіл-(R)-глутаміл] -20(S)-камптотецину,
z) 7-етил-10-гідрокси-20-O-[(S)-циклогексилаланіл-(S)-глутаміл]-20(S)-камптотецину,
аа) 20-O-[(S)-лізил-![]() -(S)-глутаміл]-20(S)-камптотецину,
-(S)-глутаміл]-20(S)-камптотецину,
bb) 20-O-[(S)-орнітил-![]() -(S)-глутаміл]-20(S)-камптотецину,
-(S)-глутаміл]-20(S)-камптотецину,
сс) (9S)-9-етил-9-[(L)-триптофіл-(L)-![]() -глутамілокси]-1-пентил-1Н,12Н-пірано[3",4":6',7']індолізино[1,2':6,5]піридо[4,3,2-де]хіназолін-10,13(9Н,15Н)-діону гідрохлориду,
-глутамілокси]-1-пентил-1Н,12Н-пірано[3",4":6',7']індолізино[1,2':6,5]піридо[4,3,2-де]хіназолін-10,13(9Н,15Н)-діону гідрохлориду,
dd) (9S)-9-етил-9-[(L)-циклогексилаланіл-(D)-![]() -глутамілокси]-1-пентил-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-де]хіназолін-10,13(9Н,15Н)-діону гідрохлориду,
-глутамілокси]-1-пентил-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-де]хіназолін-10,13(9Н,15Н)-діону гідрохлориду,
ее) (9S)-9-етил-9-[(L)-фенілаланіл-(D)-![]() -глутамілокси]-1-пентил-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-де]хіназолін-10,13(9Н,15Н)-діону гідрохлориду,
-глутамілокси]-1-пентил-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-де]хіназолін-10,13(9Н,15Н)-діону гідрохлориду,
ff) (9S)-9-етил-9-[(L)-лейцил-(D)-![]() -глутамілокси]-1-пентил-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-де]хіназолін-10,13(9Н,15Н)-діону гідрохлориду,
-глутамілокси]-1-пентил-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-де]хіназолін-10,13(9Н,15Н)-діону гідрохлориду,
gg) (9S)-9-етил-9-[(L)-лізил-(L)-![]() -глутамілокси]-1-пентил-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-де]хіназолін-10,13(9Н,15Н)-діону дигідрохлориду,
-глутамілокси]-1-пентил-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-де]хіназолін-10,13(9Н,15Н)-діону дигідрохлориду,
hh) (9S)-9-етил-9-[(L)-валіл-(D)-![]() -глугамілокси]-1-пентил-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-де]хіназолін-10,13(9Н,15Н)-діону гідрохлориду,
-глугамілокси]-1-пентил-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-де]хіназолін-10,13(9Н,15Н)-діону гідрохлориду,
іі) (9S)-9-етил-9-[(L)-орнітил-(L)-![]() -глутамілокси]-1-пентил-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-де]хіназолін-10,13(9Н,15Н)-діону дигідрохлориду,
-глутамілокси]-1-пентил-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-де]хіназолін-10,13(9Н,15Н)-діону дигідрохлориду,
jj) солі (9S)-9-етил-9-[(L)-лейцил-(D)-![]() -глутамілокси]-1-пентил-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-де]хіназолін-10,13(9Н,15Н)-діону метансульфонової кислоти,
-глутамілокси]-1-пентил-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-де]хіназолін-10,13(9Н,15Н)-діону метансульфонової кислоти,
kk) (9S)-9-етил-9-[(D)-лізил-(L)-![]() -глутамілокси]-1-пентил-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-де]хіназолін-10,13(9Н,15Н)-діону
-глутамілокси]-1-пентил-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-де]хіназолін-10,13(9Н,15Н)-діону
дигідрохлориду,
ll) (9S)-9-етил-9-[(L)-фенілаланіл-(L)-![]() -аспартилокси]-1-пентил-1Н,12Н-
-аспартилокси]-1-пентил-1Н,12Н-
пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-де]хіназолін-10,13(9Н,15Н)-діону гідрохлориду,
mm) (9S)-9-етил-9-[(L)-циклогексилаланіл-(D)-![]() -аспартилокси]-1-пентил-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-де]хіназолін-10,13(9Н,15Н)-діону гідрохлориду,
-аспартилокси]-1-пентил-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-де]хіназолін-10,13(9Н,15Н)-діону гідрохлориду,
nn) (9S)-9-етил-9-[(L)-циклогексилаланіл-(L)-![]() -аспартилокси]-1-пентил-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-де]хіназолін-10,13(9Н,15Н)-діону гідрохлориду,
-аспартилокси]-1-пентил-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-де]хіназолін-10,13(9Н,15Н)-діону гідрохлориду,
оо) (9S)-9-етил-9-[(L)-триптофіл-(L)-![]() -аспартилокси]-1-пентил-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-де]хіназолін-10,13(9Н,15Н)-діону гідрохлориду,
-аспартилокси]-1-пентил-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-де]хіназолін-10,13(9Н,15Н)-діону гідрохлориду,
рр) (9S)-9-етил-9-[(L)-орнітил-(D)-![]() -глутамілокси]-1-пентил-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-де]хіназолін-10,13(9Н,15Н)-діону дигідрохлориду,
-глутамілокси]-1-пентил-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-де]хіназолін-10,13(9Н,15Н)-діону дигідрохлориду,
qq) (9S)-9-етил-9-[(L)-лейцил-(D)-![]() -аспартилокси]-1-пентил-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-де]хіназолін-10,13(9Н,15Н)-діону гідрохлориду,
-аспартилокси]-1-пентил-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-де]хіназолін-10,13(9Н,15Н)-діону гідрохлориду,
rr) (9S)-9-етил-9-[(L)-валіл-(D)-![]() -аспартилокси]-1-пентил-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-де]хіназолін-10,13(9Н,15Н)-діону гідрохлориду,
-аспартилокси]-1-пентил-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-де]хіназолін-10,13(9Н,15Н)-діону гідрохлориду,
ss) (9S)-9-етил-9-[(L)-лейцил-(L)-![]() -аспартилокси]-1-пентил-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-де]хіназолін-10,13(9Н,15Н)-діону гідрохлориду,
-аспартилокси]-1-пентил-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-де]хіназолін-10,13(9Н,15Н)-діону гідрохлориду,
tt) (9S)-9-етил-9-[(L)-циклогексилгліцил-(L)-![]() -глутамілокси]-1-пентил-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-де]хіназолін-10,13(9Н,15Н)-діонугідрохлориду,
-глутамілокси]-1-пентил-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-де]хіназолін-10,13(9Н,15Н)-діонугідрохлориду,
uu) (9S)-9-етил-9-[(D)-циклогексилаланіл-(L)-![]() -глутамілокси]-1-пентил-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-де]хіназолін-10,13(9Н,15Н)-діону гідрохлориду,
-глутамілокси]-1-пентил-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-де]хіназолін-10,13(9Н,15Н)-діону гідрохлориду,
vv) (9S)-9-етил-9-[(L)-лізил-(D)-![]() -глутамілокси]-1-пентил-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-де]хіназолін-10,13(9Н,15Н)-діону
-глутамілокси]-1-пентил-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-де]хіназолін-10,13(9Н,15Н)-діону
дигідрохлориду,
ww) (9S)-9-етил-9-[(L)-триптофіл-(D)-![]() -глутамілокси]-1-пентил-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-де]хіназолін-10,13(9Н,15Н)-діону
-глутамілокси]-1-пентил-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-де]хіназолін-10,13(9Н,15Н)-діону
гідрохлориду,
хх) (9S)-9-етил-9-[(L)-лейцил-(L)-![]() -глутамілокси]-1-пентил-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-де]хіназолін-10,13(9Н,15Н)-діону гідрохлориду,
-глутамілокси]-1-пентил-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-де]хіназолін-10,13(9Н,15Н)-діону гідрохлориду,
уу) (9S)-9-етил-9-[гліцил-(D)-![]() -глутамілокси]-1-пентил-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-де]хіназолін-10,13(9Н,15Н)-діону гідрохлориду,
-глутамілокси]-1-пентил-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-де]хіназолін-10,13(9Н,15Н)-діону гідрохлориду,
zz) (9S)-9-етил-9-[(L)-аланіл-(D)-![]() -глутамілокси]-1-пентил-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-де]хіназолін-10,13(9Н,15Н)-діону гідрохлориду,
-глутамілокси]-1-пентил-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-де]хіназолін-10,13(9Н,15Н)-діону гідрохлориду,
ааа) (9S)-9-етил-9-[(L)-фенілаланіл-(D)-![]() -аспартилокси]-1-пентил-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-де]хіназолін-10,13(9Н,15Н)-діону гідрохлориду,
-аспартилокси]-1-пентил-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-де]хіназолін-10,13(9Н,15Н)-діону гідрохлориду,
та їх безсольових сполук та інших фармацевтично прийнятних солей.
41. Сполука за пп. 37 або 38, яка являє собою (9S)-9-етил-9-[(L)-лізил-(L)-![]() -глутамілокси]-1-пентил-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-де]хіназолін-10,13(9Н,15Н)-діону дигідрохлорид, її безсольові сполуки та інші фармацевтично прийнятні солі.
-глутамілокси]-1-пентил-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-де]хіназолін-10,13(9Н,15Н)-діону дигідрохлорид, її безсольові сполуки та інші фармацевтично прийнятні солі.
42. Спосіб одержання сполук формули (І) згідно з будь-яким з пп. 15-41, де сполуку Q-Y-H конденсують з реакційноздатним похідним X.
43. Фармацевтична композиція, яка містить сполуку за будь-яким з пп. 15-41.
44. Фармацевтична композиція за п. 43, яка є придатною для перорального або парентерального введення.
45. Застосування протиракової сполуки згідно з будь-яким з пп. 15-41 для приготування лікарських засобів.
46. Застосування за п. 45 для приготування лікарських засобів для лікування розладів, пов'язаних з проліферацією клітин.
47. Застосування за пп. 45 або 46 для приготування лікарських засобів для лікування раку.
48. Застосування за будь-яким з пп. 45-47 для приготування лікарських засобів для лікування раку прямої кишки, раку легенів, раку грудей, раку шлунку, раку шийки матки або раку сечового міхура.
49. Застосування за пп. 46 або 47, де рак є твердою пухлиною.
50. Спосіб лікування розладів, пов'язаних з проліферацією клітин, який включає введення пацієнтові, якому це необхідно, терапевтично ефективної кількості протиракової сполуки за будь-яким з пп. 15-41.
51. Спосіб за п. 50, де розладом, пов'язаним з проліферацією клітин, є рак.
52. Спосіб за пп. 50 або 51, де рак являє собою тверду пухлину.
53. Спосіб за будь-яким з пп. 50-52, де рак являє собою рак прямої кишки, рак легенів, рак грудей, рак шлунку, рак шийки матки та рак сечового міхура.
54. Сполука за будь-яким з пп. 15-41 для застосування у терапії.
Текст
1. Спосіб ідентифікації ензиму для використання в побудові протиракових сполук, які селективно перетворюються на активні речовини у пухлинних тканинах або клітинах, при цьому згаданий спосіб включає етапи: порівняння рівнів експресії генів або білків у здоровій тканині або клітинах людини з рівнями експресії генів або білків у людській тканині або клітинах пухлинного походження 2 (19) 1 3 77718 4 9. Спосіб за п. 4, де рівні експресії ензиму у кліти[2aRнах або тканині пухлинного походження більш ніж [2a a ,4 b ,4a a ,6 b ,9 a ( a R*, b S*,11 a ,12 a ,12a a , удвічі перебільшують рівні у здорових клітин з кро12b a )]]- b -[[(1,1-диметилетокси)карбоніл]аміно]вотворних клітин-попередників, а також зі здороa -гідроксибензолпропанової кислоти 12bвих клітин або тканини печінки. (ацетилокси)-12-(бензоїлокси)10. Застосування ензимів, ідентифікованих за спо2а,3,4,4а,5,6,9,10,11,12,12а,12b-додекагідрособом, згідно з будь-яким з пп. 1-9, для одержан4,6,11-тригідроксиня, ідентифікації та/або побудови протиракових 4a,8,13,13-тетраметил-5-оксо-7,11-метано-1Нсполук, які можуть перетворюватися на активні циклодека-[3,4]бенз[1,2-b]оксет-9-иловий естер, речовини селективно у пухлинах. c) IDN 5109 11. Застосування за п. 10, де згадані ензими яв(2R,3S)-3-[[(1,1-диметилетокси)карбоніл]аміно]-2ляють собою мікросомну дипептидазу, арилсульгідрокси-5-метил-4-гексенової кислоти фатазу А, піролін-5'-карбоксиредуктазу, дегідроді(3aS,4R,7R,8aS,9S,10aR,12aS,12bR,13S,13aS)олдегідрогеназу, карбонілредуктазу, 7,12а-біс(ацетилокси)-13-(бензилокси)лізилгідроксилазу, пролідазу, дигідропіримідиназу, 3а,4,7,8,8а,9,10,10а,12,12а,12b,13-додекагідро-9глютамін:фруктоза-6-фосфатамідотрансферазу, гідрокси-5,8а,14,14-тетраметил-2,8-діоксо-6,13аUDP-галактоза-церамідгалактозилтрансферазу, метано-13аН-оксето[2",3":5',6']бенз[1',2':4,5]лізилоксидазу, енолазу, глюкоза-6циклодека-[1,2-d]-1,3-діоксол-4-іловий естер, фосфа тдегідрогеназу, стеароїл-коензим А десатуd) BMS 188797 разу, епоксидгідролазу або альдолазу С. (2R,3S)- b -(бензоїламіно)- a 12. Застосування за п. 11, де згадані ензими явгідроксибензолпропанової кислоти ляють собою мікросомну дипептидазу, дегідродіо(2aR,4S,4aS,6R,9S,11S, 12S,12aR,12bS)-6лдегідрогеназу, піролін-5’-карбоксиредуктазу, кар(ацетилокси)-12-(бензоїлокси)бонілредуктазу та лізилгідроксилазу, переважно 2a,3,4,4a,5,6,9,10,11,12,12а,12b-додекагідро-4,11мікросомну дипептидазу. дигідрокси-12b-[(метоксикарбоніл)окси]-4а,8,13,1313. Спосіб ідентифікації протиракових сполук, які тетраметил-5-оксо-7,11-метано-1Нможна перетворити на активні речовини селективциклодека[3,4]бенз[1,2-b]оксет-9-иловий естер, та но у пухлина х, який включає етапи: e) BMS 184476 а) генерування клітин, які експресують ензим, рівні (2R,3S)- b -(бензоїламіно)- a білка якого у пухлинній тканині більш ніж удвічі перебільшують рівні у здорових клітинах або ткагідроксибензолпропанової кислоти нині, та (2aR,4S,4aS,6R,9S,11S,12S,12aR,12bS)-6,12bб) визначення інгібіторної активності згаданих пробіс(ацетилокси)-12-(бензоїлокси)тиракових сполук стосовно росту. 2а,3,4,4а,5,6,9,10,11,12,12а,12b-додекагідро-1114. Спосіб за п. 13, де згаданий ензим являє согідрокси-4а,8,13,13-тетраметил-4бою ензим за пп. 10-13. [(метилтіо)метокси]-5-оксо-7,11-метано-1Н15. Протиракові сполуки формули (І) циклодека[3,4]бенз[1,2-b]оксет-9-иловий естер. X-Y-Q, (І) 18. Сполука за п. 16, де активна протиракова реде Х являє собою про-складову, побудовану для човина (Q-Y-H) являє собою камптотецин, що вигенерування активної протиракової речовини (Q-Yбирається з групи, яка складається з H) селективно у пухлинах за допомогою ензимів a) камптотецину: згідно з будь-яким з пп. 10-13; Q-Y- являє собою 4(S)-етил-4-гідрокси-1Н-пірано [3',4': радикал, що походить з активної протиракової 6,7]індолізино[1,2-b]хінолін-3,14(4Н,12Н)-діон, речовини (Q-Y-Н), де Y являє собою -O-, -S- або b) топотекану N-, 4(S)-10-[(диметиламіно)метил]-4-етил-4,9та їх фармацевтично прийнятні солі. дигідрокси-1Н-пірано[3',4':6,7]індолізино[1,216. Сполука за п. 15, де радикал (Q-Y-) активної b]хінолін-3,14(4Н,12Н)-діонумоногідрохлорид, протиракової речовини (Q-Y-H) являє собою такc) DX-8951f сани, камптотецини, протиракові нуклеозиди, до(1S,9S)-1-аміно-9-етил-5-фтор-9-гідрокси-4-метилластатини, антрацикліни, інгібітори фарнезилтран2,3,9,10,13,15-гексагідро-1Н,12Нсферази або інгібітори тирозинкінази рецептора бенз[де]пірано[3',4' :6,7]індолізино[1,2-b]хінолінепідермального фактора росту. 10,13-діон, 17. Сполука за п. 16, де активна протиракова реd) BN-80915 човина (Q-Y-H) являє собою таксан, що вибира5(R)-етил-9,10-дифтор-1,4,5,13-тетрагідро-5ється з групи, яка складається з гідрокси-3Н,15Н-оксепіно[3',4':6,7]індолізино[1,2a) таксолу b]хінолін-3,15-діон, [2аRe) 9-амінокамптотецину (S)-10-аміно-4-етил-4-гідрокси-1Н[2а a ,4 b ,4а b ,6 b ,9 a ( a R*, b S*),11 a ,12 a ,12а a , пірано[3',4':6,7]індолізино[1,2-b]хінолін12b a ]]- b -(бензоїламіно)- a 3,14(4Н,12Н)-діон, гідроксибензолпропанової кислоти 6,12bf) 9-нітрокамптотецину біс(ацетилокси)-12-(бензоїлокси)4(S)-етил-4-гідрокси-10-нітро-1Н2а,3,4,4а,5,6,9,10,11,12,12а,12b-додекагідро-4,11пірано[3',4':6,7]індолізино[1,2-b]хіноліндигідрокси-4а,8,13,13-тетраметил-5-оксо-7,113,14(4Н,12Н)-діон, метано-1Н-циклодека-[3,4]бенз[1,2-b]оксет-9иловий естер, b) таксотеру 5 77718 6 g) (9S)-9-етил-9-гідрокси-1-пентил-1Н,12Нa) адріаміцину пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2(8S,10S)-10-[(3-аміно-2,3,6-тридезокси-Lде]хіназолін-10,13(9Н,15Н)-діону, ліксогексопіранозил)окси]-7,8,9,10-тетрагідроh) (9S)-9-етил-9-гідрокси-2-метил-1-пентил6,8,11-тригідрокси-8-(гідроксіацетил)-11Н,12Нметоксинафтацен-5,12-діон, гідрохлорид, пірано[3",4":6',7']індолізино[1',2',:6,5]піридо[4,3,2b) дауноміцину де]хіназолін-10,13(9Н,15Н)-діону та 8-ацетил-10-[(3-аміно-2,3,6-тридезокси-Lі) (9S)-9-етил-9-гідрокси-2-гідроксиметил-1-пентилліксогексопіранозил)окси]-7,8,9,10-тетрагідро1Н,12Н6,8,11-тригідрокси-1-метоксинафтацен-5,12-діон, пірано[3",4":6',7']індолізино[1',2':6,5]тридо[4,3,2гідрохлорид та де]хіназолін-10,13(9Н,15Н)-діону. c) ідарубіцину 19. Сполука за п. 16, де активна протиракова ре(7S,9S)-9-ацетил-7-[(3-аміно-2,3,6-тридезокси-Lчовина (Q-Y-H) являє собою протираковий нуклеоліксогексопіранозил)окси]-7,8,9,10-тетрагідрозид, що вибирається з групи, яка складається з 6,9,11-тригідрокси-нафтацен-5,12-діон. a) DFDC 22. Сполука за п. 16, де активна протиракова ре2' -дезокси-2',2' -дифтороцитидин, човина (Q-Y-H) являє собою інгібітор тирозинкінаb) DMDC зи рецептора епідермального фактора росту або 2'-дезокси-2'-метиліденцитидин, інгібітор фарнезилтрансферази. c) FMDC 23. Сполука за п. 22, де активна протиракова ре(Е)-2' -дезокси-2' -(фторометилен)цитидин, човина (Q-Y-H) являє собою інгібітор тирозинкінаd) Ara-C зи рецептора епідермального фактора росту, що вибирається з групи, яка складається з 1-( b -D-арабінофуранозил)цитозин, a) ZD 1839 e) децитабіну 4-аміно-1-(2-дезокси-( b -DN-(3-xлopo-4-фтopoфeнiл)-7-мeтoкcи-6-[3-(4еритропентофуранозил)-1,3,5-триазин-2(1Н)-он, мopфoлiнiл)пpoпoкcи]-4-xiнaзoлiнaмiн, f) троксацитабіну 4-аміно-1-[(2S,4S)-2b) CP 358774 (гідроксиметил)-1,3-діоксолан-4-іл]-2(1Н)N-(3-етинілфеніл)-6,7-біс(2-метоксіетокси)-4піримідинон, хіназолінамін, g) флударабіну c) PD 158780 2-фторо-9-(5-O-фосфоно- b -D-арабінофуранозил)N4-(3-бpoмфeнiл)-N6-мeтилпipидo[3,4-d]пipимiдин9Н-пурин-6-амін та 4,6-дiaмiн та h) кладрибіну 2-хлоро-2'-дезоксіаденозин. d) GW 2016 20. Сполука за п. 16, де активна протиракова реН-(3-хлоро-4-((3-фторобензил)окси)феніл)-6-(5човина (Q-Y-H) являє собою доластатин, що виби(((2-метилсульфоніл)етил)аміно)метил)-2-фурил)рається з групи, яка складається з 4-хіназолінамін. а) доластатину 10 24. Сполука за п. 22, де активна протиракова реN,N-диметил-L-валіл-N-[(1S,2R)-2-метокси-4-[(2S)човина (Q-Y-H) являє собою інгібітор фарнезилт2-[(1R,2R)-1-метокси-2-метил-3рансферази R 115777 формули 6-[1-аміно-1-(4оксо-3-[[(1S)-2-феніл-1-(2хлорфеніл)-1-(1-метилімідазол-5-іл)метил]-4-(3тіазоліл)етил]аміно]пропіл]-1-піролідиніл]-1-[(1S)-1хлорфеніл)-1-метилхінолін-2(1Н)-он. метилпропіл]-4-оксобутил]-N-метил-L-валінамід, 25. Сполуки за п. 15, які представлено формуb) доластатину 14 лою (II) цикло[N-метилаланіл-(2Е,4Е,10Е)-15-гідрокси-7R0 H метокси-2-метил-2,4,10-гексадекатриєноїл-L-валілR1 N-метил-L-фенілаланіл-N-метил-L-валіл-N-метилY z N Q NH 2 L-валіл-L-пропіл-N2-метиласпарагініл], (II) c) доластатину 15 Q O (1S)-1-[[(2S)-2,5-дигідро-3-метоксі-5-оксо-2CO2R2 , (фенілметил)-1Н-пірол-1-іл]карбоніл]-2де Q та Y є такими, як визначено у п. 15, метилпропіловий естер N,N-диметил-L-валіл-LR0 являє собою бічний ланцюг природної або неваліл-N-метил-L-валіл-L-пропіл-L-проліну, природної амінокислоти, d) TZT 1027 Z являє собою (С1-С3) алкілен або -O-CH(R3)-, де N,N-диметил-L-валіл-N-[(1S,2R)-2-метокси-4-[(2S)R3 являє собою водень або прямий (С1-С4) алкіл, 2-[(1R,2R)-1-метокси-2-метил-3-оксо-3-[(2R1 являє собою водень або метил, та фенілетил)аміно]пропіл]-1-піролідиніл]-1-[(1S)-1R2 являє собою водень, розгалужений (С3-С10) метилпропіл]-4-оксобутил]-N-метил-L-вілінамід та алкіл або (С3-С8) циклоалкіл, e) цемадотину або їх фармацевтично прийнятні солі. N,N-диметил-L-валіл-L-валіл-N-метил-L-валіл-L26. Сполуки за п. 25, де (Q-Y-H) являє собою такпропіл-N-(фенілметил)-L-пролінамід. сол або таксотер, які представлено формулою (III) 21. Сполука за п. 16, де активна протиракова речовина (Q-Y-H) являє собою антрациклін, що вибирається з групи, яка складається з 7 77718 8 R6 являє собою водень, фтор, гідроксил, O O OH R7 являє собою фтор або гідрокси, R4 або R6 та R7 разом утворюють метиліден або фтоNH O H рметиліден. O H O 31. Сполука за п. 29 або 30, де O OH O O O R0 являє собою 2-метилпропіл, циклогексилметил, (III) O 2-нафтилметил, 4-фенілбензил, (4O циклогексилциклогексил)метил, алкілтіометил, циклогексилтіометил або 4-алкоксибензил, та O R3 являє собою водень або метил. H2N OH N 32. Сполука за будь-яким з пп. 29-31, що вибираH O ється з групи, яка складається з R0 , a) (2R)-((2S)-аміно-3-циклогексилпропіоніламіно)де R0 є таким, як визначено у п. 25, (3S)-[1-((4S)-гідрокси-(5R)-гідроксиметил-34 R являє собою бензоїл або трет-бутоксикарбоніл, метилентетрагідрофуран-(2R)-іл)-2-оксо-1,2та 5 дигідропіримідин-4-ілкарбамоїлокси]-масляної киR являє собою водень або ацетил, слоти, або їх фармацевтично прийнятні солі. b) (2R)-((2S)-аміно-4-метилпентаноїламіно)-(3S)-[127. Сполука за п. 26, де R0 являє собою метил, ((4S)-гідрокси-(5R)-гідроксиметил-3бензил або 2-метилпропіл. метилентетрагідрофуран-(2R)-іл)-2-оксо-1,228. Сполука за п. 26 або 27, що вибирається з грудигідропіримідин-4-ілкарбамоїлокси]-масляної кипи, яка складається з слоти, a) 13-((2R,3S)-2-{(5S)-[5-((2S)-2-аміно-4c) (2R)-((2S)-аміно-3-біфеніл-4-ілпропіоніламіно)метилпентаноїламіно)-5(3S)-[1-((4S)-гідрокси-(5R)-гідроксиметил-3гідроксикарбоніл]пентаноїлокси}-3-бензоїламіно-3метилентетрагідрофуран-(2R)-іл)-2-оксо-1,2фенілпропіонілокси)-2 a -бензилокси-4 a ,10 b дигідропіримідин-4-ілкарбамоїлокси]-масляної кидіацетокси-1 b ,7 b -дигідроксі-5 b ,20-епокситакс-11слоти, ен-9-ону, d) (2R)-[(2S)-аміно-3-біфеніл-4-ілпропіоніламіно)-3b) 13 a -((2R,3S)-2-{(5S)-[5-((2S)-2{1-[(4S)-гідрокси-(5R)-гідроксиметил-3 амінопропіноїламіно)-5метилентетрагідрофуран-(2R)-іл]-2-оксо-1,2гідроксикарбоніл]пентаноїлокси}-3-бензоїламіно-3дигідропіримідин-4-ілкарбамоїлокси]-пропіонової кислоти, фенілпропіонілокси)-2 a -бензилокси-4 a , 10 b e) (2R)-((2S)-аміно-3-нафтален-2діацетокси-1 b ,7 b -дигідроксі-5 b ,20-епокситакс-11ілпропіоніламіно)-(3S)-[1-((4S)-гідрокси-(5R)ен-9-ону та гідроксиметил-3-метилентетрагідрофуран-(2R)-іл]c) 13-((2R,3S)-2-{(5S)-[5-((2S)-2-аміно-32-оксо-1,2-дигідропіримідин-4-ілкарбамоїлокси]фенілпропіноїламіно)-5масляної кислоти, гідроксикарбоніл]пентаноїлокси}-3-бензоїламіно-3f) (2R)-{(2S)-аміно-3-[4-(4-гідроксифенокси)-феніл]фенілпропіонілокси)-2 a -бензилокси-4 a , 10 b пропіоніламіно}-3-[1-((4S)-гідрокси-(5R)діацетокси-1 b ,7 b -дигідроксі-5 b ,20-епокситакс-11гідроксиметил-3-метилентетрагідрофуран-2-іл)-2ен-9-ону, та оксо-1,2-дигідропіримідин-4-ілкарбамоїлокси]їх фармацевтично прийнятних солей. масляної кислоти, 29. Сполуки за п. 25, де (Q-Y-H) являє собою проg) (2R)-[(2S)-аміно-3-(4-метоксифеніл)тираковий нуклеозид, які представлено формупропіоніламіно]-(3S)-[1-[(4S)-гідрокси-(5R)лою (IV) гідроксиметил-3-метилентетрагідрофуран-2-іл]-2R3 R0 O H оксо-1,2-дигідропіримідин-4-ілкарбамоїлокси]N масляної кислоти, HN O NH 2 h) (2R)-[(2S)-аміно-4-етилсульфанілбутириламіно]R9 R1 O (3S)-[1-[(4S)-гідрокси-(5R)-гідроксиметил-3N CO 2R2 метилентетрагідрофуран-(2R)-іл]-2-оксо-1,2(IV) O N дигідропіримідин-4-ілкарбамоїл]-масляної кислоти, O R10 і) (2R)-((2S)-аміно-3-циклогексилпропіоніламіно)R8 R6 (3S)-[1-(3,3-дифторо-(4R)-гідрокси-(5R)гідроксиметилтетрагідрофуран-2-іл)-2-оксо-1,2HO R7 , дигідропіримідин-4-ілкарбамоїлокси]-масляної киде слоти, 0 1 2 3 R , R , R та R є такими, як визначено у п. 25, j) 2(S)-[2(S)-аміно-3-циклогексилпропіоніламіно)6 R являє собою водень, фтор, гідроксил або ціано, 3[1-(3,3-дифтор-(4R)-гідрокси-(5R)R7 являє собою водень, фтор або гідрокси, гідроксиметилтетрагідрофуран-2(R)-іл)-2-оксо-1,2або R6 та R7 разом утворюють метиліден або фтодигідропіримідин-4-ілкарбамоїлокси]-2(S)рметиліден, метилпропіонової кислоти, 8 R являє собою водень або етиніл, k) 2(R)-[2(S)-аміно-3-циклогексилпропіоніламіно]-3R9 являє собою водень, фтор, вініл або етиніл, та {1-[3,3-дифтор-(4R)-гідрокси-(5R)R10 являє собою водень або гідрокси, та їх фармагідроксиметилтетрагідрофуран-2(R)-іл]-2-оксо-1,2цевтично прийнятні солі. дигідропіримідин-4-ілкарбамоїлокси]-2(R)30. Сполука за п. 29, де метилпропіонової кислоти, R5 9 77718 10 l) (2S, 3S)-2-(2-аміно-3їх фармацевтично прийнятних солей. циклогексилпропіоніламіно)-3-[1-{(4R,5R)-3,337. Сполуки за п. 25, де (Q-Y-H) являє собою камдифтор-4-гідрокси-5птотецин або його похідні, які представлено форгідроксиметилтетрагідрофуран-2-іл}-2-оксо-1,2мулою (VI) R13 R1 4 дигідропіридин-4-ілкарбамоїлокси]-2R12 метилмасляної кислоти, O N m) (2R, 3R)-2-(2-аміно-3R11 циклогексилпропіоніламіно)-3-[1-{(4R,5R)-3,3N O дифтор-4-гідрокси-5 (VI) O гідроксиметилтетрагідрофуран-2-іл}-2-оксо-1,2(C H2)n R0 H O дигідропіридин-4-ілкарбамоїлокси]-2N метилмасляної кислоти та (C H2)m O H2 N n) (2R)-[(2S)-аміно-3-циклогексилпропіоніламіно)O CO 2H 3(S)-[1-[(4S)-гідрокси-(5R)-гідроксиметил-3, метилентетрагідрофуран-(2R)-іл]-2-оксо-1,2де m являє собою ціле число від 1 до 3, дигідропіримідин-4-ілкарбамоїлокси]-масляної киn являє собою ціле число від 0 до 1, слоти ізопропілового естеру, та R0 є таким, як визначено у п. 26, їх фармацевтично прийнятних солей. R11 являє собою водень або фтор, 33. Сполуки за п. 25, де (Q-Y-H) являє собою проR12 являє собою водень, фтор, метил або гідрокси, тираковий нуклеозид, які представлено формуR13 являє собою водень, аміно, нітро або (диметилою (V) ламіно)метил, R0 O H R14 являє собою водень, (С1-С4) алкіл, (4метилпіперазиніл)метил або (третN HN (CH2 )m бутоксііміно)метил, NH2 R9 O або R13 та R14, або R11 та R12 разом утворюють 5CO2 R2 N або 6-членне кільце, яке необов'язково містить (V) один або два гетероатоми, та яке необов'язково O N заміщене 1-3 замісниками, які вибрані з групи, що O 10 R складається з (С1-С8) алкілу, аміно, (С1-С8) алкіR8 R6 ламіно та/або ді-(С1-С4) алкіламіно, та їх фармацевтично прийнятні солі. HO R7 , 38. Сполука за п. 37, де R11 являє собою водень, де m являє собою ціле число 2 або 3, та R12 являє собою водень або гідрокси, R13 являє R0, R2, R6, R7 , R8, R9 та R10 є такими, як визначено собою водень або (диметиламіно)метил та R14 у п. 29, являє собою водень або етил. та їх фармацевтично прийнятні солі. 39. Сполука за п. 37 або 38, де R 0 являє собою 234. Сполука за п. 33, де метилпропіл, циклогексилметил, бензил, індол-3R6 являє собою водень, фтор або гідроксил, ілметил, 4-амінобутил або 4-амінопропіл. 7 R являє собою фтор або гідрокси, 40. Сполука за будь-яким з пп. 37-39, що вибрана з 6 7 або R та R разом утворюють метиліден або фтогрупи, яка складається з рметиліден. a) 20-O-[(S)-триптофіл- g -(S)-глутаміл]-20-(S)35. Сполука за пп. 33 або 34, де R0 являє собою камптотецину, циклогексилметил, 2-нафтилметил, 4b) 20-O-[(S)-валіл- g -(S)-глутаміл]-20(S)фенілбензил, бензил, індол-3-ілметил або 4камптотецину, алкоксибензил. c) 20-O-[(S)-фенілаланіл- g -(S)-глутаміл]-20(S)36. Сполука за будь-яким з пп. 33-35, що вибрана з камптотецину, групи, яка складається з d) 20-O-[(S)-лейцил- g -(S)-глутаміл]-20(S)a) (2R)-[(2S)-аміно-3-(1Н-індол-3іл)пропіоніламіно]-4-[1-((4S)-гідрокси-(5R)камптотецину, гідроксиметил-3-метилентетрагідрофуран-2-іл]-2е) 20-O-[(R)-лейцил- g -(S)-глутаміл]-20(S)оксо-1,2-дигідропіримідин-4-ілкарбамоїл]-масляної камптотецину, кислоти, f) 20-O-[(R)-фенілаланіл- g -(S)-глутаміл]-20(S)b) (2R)-((2S)-аміно-3-циклогексилпропіоніламіно)камптотецину, 4-[1-((4S)-гідрокси-(5R)-гідроксиметил-3g) 20-O-[(S)-триптофіл- g -(R)-глутаміл]-20(S)метилентетрагідрофуран-2-іл)-2-оксо-1,2камптотецину, дигідропіримідин-4-ілкарбамоїл]масляної кислоти, h) 20-O-[(R)-триптофіл- g -(R)-глутаміл]-20(S)c) (2R)-((2S)-аміно-3-біфеніл-4-ілпропіоніламіно)-4камптотецину, [1-((4S)-гідрокси-(5R)-гідроксиметил-3і) 20-O-[(S)-фенілаланіл- g -(R)-глутаміл]-20(S)метилентетрагідрофуран-2-іл)-2-оксо-1,2дигідропіримідин-4-ілкарбамоїл]-масляної кислоти камптотецину, та j) 20-O-[(S)-лейцил- g -(R)-глутаміл]-20(S)d) (2R)-((2S)-аміно-3-нафтален-2камптотецину, ілпропіоніламіно)-4-[1-((4S)-гідрокси-(5R)k) 20-O-[(R)-триптофіл- g -(S)-глутаміл]-20(S)гідроксиметил-3-метилентетрагідрофуран-2-іл)-2камптотецину, оксо-1,2-дигідропіримідин-4-ілкарбамоїл]-масляної кислоти, та 11 77718 12 l) 20-O-[(R)-фенілаланіл- g -(R)-глутаміл]-20(S)jj) солі (9S)-9-етил-9-[(L)-лейцил-(D)- g камптотецину, глутамілокси]-1-пентил-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2m) 20-O-[(R)-лейцил- g -(R)-глутаміл]-20(S)де]хіназолін-10,13(9Н,15Н)-діону метансульфонокамптотецину, вої кислоти, n) 7-етил-10-гідрокси-20-O-[(R)-триптофіл-(R)kk) (9S)-9-етил-9-[(D)-лізил-(L)- g -глутамілокси]-1гомоглутаміл] -20(S)-камптотецину, пентил-1Н,12Но) 7-етил-10-гідрокси-20-O-[(R)-триптофіл- g -(R)пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2глутаміл]-20(S)-камптотецину, де]хіназолін-10,13(9Н,15Н)-діону р) 7-етил-10-гідрокси-20-O-[(S)-фенілаланіл- g -(R)дигідрохлориду, глутаміл]-20(S)-камптотецину, ll) (9S)-9-етил-9-[(L)-фенілаланіл-(L)- b q) 7-етил-10-гідрокси-20-O-[(S)-фенілаланіл- g -(S)аспартилокси]-1-пентил-1Н,12Наспартил]-20(S)-камптотецину, пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2r) 7-етил-10-гідрокси-20-O-[(S)-лейцил- g -(S)де]хіназолін-10,13(9Н,15Н)-діону гідрохлориду, аспартил]-20(S)-камптотецину, mm) (9S)-9-етил-9-[(L)-циклогексилаланіл-(D)- b s) 20-O-[(S)-триптофіл- b -(R)-аспартил]-20(S)аспартилокси]-1-пентил-1Н,12Нкамптотецину, пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2t) 20-O-[(S)-фенілаланіл- b -(R)-аспартил]-20(S)де]хіназолін-10,13(9Н,15Н)-діону гідрохлориду, камптотецину, nn) (9S)-9-етил-9-[(L)-циклогексилаланіл-(L)- b u) 20-O-[(R)-фенілаланіл- b -(R)-аспартил]-20(S)аспартилокси]-1-пентил-1Н,12Нкамптотецину, пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2v) 20-O-[(S)-фенілаланіл- b -(S)-аспартил]-20(S)де]хіназолін-10,13(9Н,15Н)-діону гідрохлориду, камптотецину, оо) (9S)-9-етил-9-[(L)-триптофіл-(L)- b w) 20-O-[(S)-лейцил- b -(R)-acпартил]-20(S)- кампаспартилокси]-1-пентил-1Н,12Нтотецину, пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2де]хіназолін-10,13(9Н,15Н)-діону гідрохлориду, х) 20-O-[(S)-валіл- b -(R)-аспартил]-20(S)рр) (9S)-9-етил-9-[(L)-орнітил-(D)- g -глутамілокси]камптотецину, 1-пентил-1Н,12Ну) 7-етил-10-гідрокси-20-O-[(S)-циклогексилаланілпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2(R)-глутаміл] -20(S)-камптотецину, де]хіназолін-10,13(9Н,15Н)-діону дигідрохлориду, z) 7-етил-10-гідрокси-20-O-[(S)-циклогексилаланіл(S)-глутаміл]-20(S)-камптотецину, qq) (9S)-9-етил-9-[(L)-лейцил-(D)- b -аспартилокси]аа) 20-O-[(S)-лізил- g -(S)-глутаміл]-20(S)1-пентил-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2камптотецину, де]хіназолін-10,13(9Н,15Н)-діону гідрохлориду, bb) 20-O-[(S)-орнітил- g -(S)-глутаміл]-20(S)rr) (9S)-9-етил-9-[(L)-валіл-(D)- b -аспартилокси]-1камптотецину, пентил-1Н,12Нсс) (9S)-9-етил-9-[(L)-триптофіл-(L)- g пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2глутамілокси]-1-пентил-1Н,12Нде]хіназолін-10,13(9Н,15Н)-діону гідрохлориду, пірано[3",4":6',7']індолізино[1,2':6,5]піридо[4,3,2ss) (9S)-9-етил-9-[(L)-лейцил-(L)- b -аспартилокси]де]хіназолін-10,13(9Н,15Н)-діону гідрохлориду, 1-пентил-1Н,12Нdd) (9S)-9-етил-9-[(L)-циклогексилаланіл-(D)- g пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2глутамілокси]-1-пентил-1Н,12Нде]хіназолін-10,13(9Н,15Н)-діону гідрохлориду, пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2tt) (9S)-9-етил-9-[(L)-циклогексилгліцил-(L)- g де]хіназолін-10,13(9Н,15Н)-діону гідрохлориду, глутамілокси]-1-пентил-1Н,12Нее) (9S)-9-етил-9-[(L)-фенілаланіл-(D)- g пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2глутамілокси]-1-пентил-1Н,12Нде]хіназолін-10,13(9Н,15Н)-діону гідрохлориду, пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2uu) (9S)-9-етил-9-[(D)-циклогексилаланіл-(L)- g де]хіназолін-10,13(9Н,15Н)-діону гідрохлориду, глутамілокси]-1-пентил-1Н,12Нff) (9S)-9-етил-9-[(L)-лейцил-(D)- g -глутамілокси]-1пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2пентил-1Н,12Нде]хіназолін-10,13(9Н,15Н)-діону гідрохлориду, пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2vv) (9S)-9-етил-9-[(L)-лізил-(D)- g -глутамілокси]-1де]хіназолін-10,13(9Н,15Н)-діону гідрохлориду, пентил-1Н,12Нgg) (9S)-9-етил-9-[(L)-лізил-(L)- g -глутамілокси]-1пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2пентил-1Н,12Нде]хіназолін-10,13(9Н,15Н)-діону пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2дигідрохлориду, де]хіназолін-10,13(9Н,15Н)-діону дигідрохлориду, ww) (9S)-9-етил-9-[(L)-триптофіл-(D)- g hh) (9S)-9-етил-9-[(L)-валіл-(D)- g -глугамілокси]-1глутамілокси]-1-пентил-1Н,12Нпентил-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2де]хіназолін-10,13(9Н,15Н)-діону де]хіназолін-10,13(9Н,15Н)-діону гідрохлориду, гідрохлориду, іі) (9S)-9-етил-9-[(L)-орнітил-(L)- g -глутамілокси]-1хх) (9S)-9-етил-9-[(L)-лейцил-(L)- g -глутамілокси]пентил-1Н,12Н1-пентил-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2де]хіназолін-10,13(9Н,15Н)-діону дигідрохлориду, 13 77718 14 пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,245. Застосування протиракової сполуки згідно з де]хіназолін-10,13(9Н,15Н)-діону гідрохлориду, будь-яким з пп. 15-41 для приготування лікарських засобів. уу) (9S)-9-етил-9-[гліцил-(D)- g -глутамілокси]-146. Застосування за п. 45 для приготування лікарпентил-1Н,12Нських засобів для лікування розладів, пов'язаних з пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2проліферацією клітин. де]хіназолін-10,13(9Н,15Н)-діону гідрохлориду, 47. Застосування за пп. 45 або 46 для приготуванzz) (9S)-9-етил-9-[(L)-аланіл-(D)- g -глутамілокси]-1ня лікарських засобів для лікування раку. пентил-1Н,12Н48. Застосування за будь-яким з пп. 45-47 для припірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2готування лікарських засобів для лікування раку де]хіназолін-10,13(9Н,15Н)-діону гідрохлориду, прямої кишки, раку легенів, раку грудей, раку шлуааа) (9S)-9-етил-9-[(L)-фенілаланіл-(D)- b нку, раку шийки матки або раку сечового міхура. аспартилокси]-1-пентил-1Н,12Н49. Застосування за пп. 46 або 47, де рак є тверпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2дою пухлиною. де]хіназолін-10,13(9Н,15Н)-діону гідрохлориду, 50. Спосіб лікування розладів, пов'язаних з проліта їх безсольових сполук та інших фармацевтично ферацією клітин, який включає введення пацієнтоприйнятних солей. ві, якому це необхідно, терапевтично ефективної 41. Сполука за пп. 37 або 38, яка являє собою кількості протиракової сполуки за будь-яким з пп. (9S)-9-етил-9-[(L)-лізил-(L)- g -глутамілокси]-115-41. пентил-1Н,12Н51. Спосіб за п. 50, де розладом, пов'язаним з пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2проліферацією клітин, є рак. де]хіназолін-10,13(9Н,15Н)-діону дигідрохлорид, її 52. Спосіб за пп. 50 або 51, де рак являє собою безсольові сполуки та інші фармацевтично прийнтверду пухлину. ятні солі. 53. Спосіб за будь-яким з пп. 50-52, де рак являє 42. Спосіб одержання сполук формули (І) згідно з собою рак прямої кишки, рак легенів, рак грудей, будь-яким з пп. 15-41, де сполуку Q-Y-H конденсурак шлунку, рак шийки матки та рак сечового ють з реакційноздатним похідним X. міхура. 43. Фармацевтична композиція, яка містить сполу54. Сполука за будь-яким з пп. 15-41 для застосуку за будь-яким з пп. 15-41. вання у терапії. 44. Фармацевтична композиція за п. 43, яка є придатною для перорального або парентерального введення. Цей винахід стосується способу ідентифікації ензимів, які експресуються переважно у певній пухлинній тканині порівняно з швидко зростаючими нормальними клітинами або тканиною, застосування згаданих ензимів для побудови сполуки, яка б генерувала активну протиракову речовину селективно у пухлинній тканині, сполук, сконструйованих на основі згаданих ензимів, їхніх фармацевтично прийнятних солей, а також їхніх фармацевтичних композицій. Однією з найбільш серйозних та найважливіших проблем при застосуванні ліків є побічний ефект. Побічні ефекти ліків здебільшого є наслідком неспецифічної дії ліків: ліки взаємодіють з та впливають не тільки на молекули-мішені ліків, але також й на інші молекули, які відіграють важливу роль у підтримці нормальних фізіологічних процесів. Інша головна причина побічних ефектів є наслідком необмеженого розповсюдження ліків у багатьох тканинах, ліки поглинаються не тільки тканиною, на яку слід впливати, але також й іншою тканиною, на яку для зберігання її нормальні фізіологічні функції не слід впливати. Молекули-мішені більшості протиракових ліків широко експресуються у багатьох тканинах, та вони є неспецифічними для певної тканини. З іншого боку, хвороба звичайно є наслідком неправильної регуляції певних молекул у певній тканині. Отже, для того, щоб уникнути побічних ефектів, необхідно розробити спо соби, при яких ліки впливали б на певні молекули тільки у певній тканині, які є причиною хвороб, та надати ліки, розроблені для таких способів. Серед багатьох хвороб побічні ефекти ліків слід особливо враховувати при лікуванні ракових пацієнтів. Цитотоксичні ліки широко застосовувалися для лікування раку, та їх будуть продовжувати регулярно застосовувати для хіміотерапії раку принаймні протягом наступного десятиріччя. Проте, застосування цитотоксичних ліків є обмеженим внаслідок їхньої недостатньої ефективності та суворих побічних ефектів. У пухлинній тканині багато цитотоксичних ліків, включаючи 5-FU, 2'дезоксицитидини, метотрексат, камптотецини та таксани, впливають на пухлинні клітини у S- або М-фазі клітинного циклу, тобто у той час, коли виникає синтез ДНК або мітоз. Проте, зростаючі пухлинні клітини у пухлинній тканині знаходяться на різних стадіях клітинних циклів, і тільки невелика частина пухлинних клітин знаходиться у S- або Мфазі. Отже, ідеальний час дії ліків повинен бути принаймні тривалішим, ніж це необхідно для завершення одного клітинного циклу (у діапазоні від 20 до 40 годин), та ідеальна схема прийому цитотоксичних ліків являє собою послідовне щоденне або тривале лікування, спрямоване на уражання усіх ракових клітин, присутніх у пухлинній тканині. Проте, лікування цитотоксичними ліками за такими схемами прийому ліків спричиняє сувору токсич 15 77718 16 ність для швидко зростаючих здорових клітин, ксинів. Внаслідок застосування цих сполук, отже, особливо для кровотворних клітин-попередників можна знизити тривалість госпіталізації, яка є нета клітин кишкової крипти. Мієлосупресія, яка є обхідною через побічні ефекти, та їх можна з безнаслідком токсичного впливу на кровотворні клітипекою призначати для амбулаторних пацієнтів. ни-попередники, є найчастішою серед різних типів Інші переваги цитотоксинів, що улучають у пухлипобічних ефектів цитотоксичних ліків та часто стає ну, включають те, що вони дозволять нам дотрипричиною ослаблення імунних реакцій хазяїна та муватися індивідуалізованої терапії (пристосовафетальних інфекцій. У випадку, коли виникає мієної терапії) шляхом вимірювання рівнів експресії їх лосупресія, взагалі потребується 2-3 тижні для ензимів активації (ензимів активації цитотоксинів, того, щоб позбавитися мієлотоксичності, і це є що улучають у пухлин у). Окремі пухлини, що ексголовною причиною того, чому багато цитотоксичпресують високі рівні ферментів активації цитотокних ліків приймають один раз кожні 3-4 тижні. Просинів, що улучають у пухлин у, будуть ефективно те, ця переривчаста схема прийому ліків стає пригенерувати активні ліки з цитотоксинів, що улучачиною недостатньої ефективності більшості ють у пухлину, та, отже, певно є дуже сприйнятлиіснуючих цитотоксичних ліків. вими до цитотоксинів, що улучають у пухлин у. Зараз розробляється декілька новітніх протиПредметом цього винаходу є способи ідентипухлинних агентів з новими способами дії. Однак, фікації ензимів для побудови протиракових споїм також притаманні декілька проблем, пов'язаних лук, які перетворюються на активні речовини сез небезпекою, які є наслідком недостатньої селеклективно у пухлинах, які включають вимірювання тивності пухлин. Насправді, головними наслідками рівнів експресії генів та/або білків у тканині та/або токсичності інгібіторів фарнезилтрансферази та клітинах людини здорового та пухлинного похоінгібіторів тирозинкінази рецепторів епідермальнодження, порівняння виміряних рівнів експресії та го фактору росту стають мієлотоксичність та привибір ензимів, рівні мРНК та/або білків яких у пухплив крові до шкіри, відповідно. Це, ймовірно, є линній тканині більш ніж удвічі перебільшують рівнаслідком того, що ензим-мішень або білок-мішень ні у здорових зростаючих кровотворних клітинахнадмірно експресуються не тільки у пухлинній ткапопередниках, кишкових клітинах та/або клітинах нині, але також й у іншій здоровій тканині, такій як шкіри. кістковий мозок або шкіра. Іншим предметом цього винаходу є способи З іншого боку, капецитабін (фторпіримідин для ідентифікації протиракових сполук, які можна пеперорального прийому) являє собою цитотоксичні ретворити на активні речовини селективно у пухліки, що потім перетворюються на активні ліки 5линах, що включають етапи генерування клітин, FU ензимами, які більше експресуються в печінці які експресують ензим, рівні білка якого у пухлинта пухлині, а не у зростаючих клітинах кісткового ній тканині більш ніж удвічі перебільшують рівні у мозку [Miwa. Μ. et al. Design of oral fluoropyrimidine здорових клітинах або тканині, та визначення інгіcarbamate, capecitabine, which generates 5біторної активності згаданих протиракових сполук furuolouracil selectively in tumors by enzymes стосовно росту. concentrated in human liver and cancer tissue. Eur. J. Іншим предметом цього винаходу є протираCancer 34,1274-1281 (1998)]. Як наслідок, це сприкові сполуки за формулою (І), чиняє високу концентрацію 5-FU селективно у пухлинній тканині, та спостерігають кращу е фективність порівняно з звичайно прийнятими 5-FU. Крім того, це спричиняє незначну мієлотоксичність. Ці де характеристики роблять ліки придатними для щоX являє собою προ-складову, побудовану для денного лікування за великими дозами навіть прогенерування активної протиракової речовини (Q-Yтягом тривалого часу. Їх зараз призначають для H) селективно у пухлинах за допомогою ензимів лікування раку грудей, раку прямої кишки та інших згідно з цим винаходом, видів раку. Проте, досі важко ідентифікувати проQ-Y являє собою радикал, що походить з актиракові ліки, що мають більш високу ефективність тивної протиракової речовини (Q-Y-H), де Υ являє та більш широкі границі безпеки, як капецитабін, собою -Ο-,-S- або -N-, тому досі не розроблено способу того, як точно та їхні фармацевтично прийнятні солі. визначити ензими та/або білки серед кола тих, що Іншим предметом цього винаходу є протираекспресуються у різних тканинах. кові сполуки, представлені формулою (ll) Цей винахід стосується способів ідентифікації ензимів для побудови сполук, які можна перетворити на активні речовини селективно у пухлинах, а не у здорових зростаючих клітинах (далі позначаються як цитотоксини, що улучають у п ухлину (ТТС)), зокрема у попередниках гранулоцитів, які здебільшого є присутніми у кістковому мозку. Цитотоксини, що улучають у пухлин у, будуть демонде Q та Υ є такими, як визначено вище, струвати дію, спрямовану селективно на пухлину, R0 являє собою бічний ланцюг природної або наслідком якої буде незначна мієлотоксичність. неприродної амінокислоти, Такі сполуки можна безпечно уводити у високих Ζ являє собою (С1-С3) алкілен або -O-CH(R3)-, дозах протягом тривалих періодів, та вони будуть де R3 являє собою водень або прямий (С1-С4) демонструвати поліпшені профілі безпеки та ефеалкіл, ктивності порівняно з профілями існуючих цитотоR1 являє собою водень або метил, та 17 77718 18 R2 являє собою водень, розгалужений (С3Іншим предметом цього винаходу є протираС10) алкіл або (С3-С8) циклоалкіл, кові сполуки, представлені формулою (VI) та їхні фармацевтично прийнятні солі. Іншим предметом цього винаходу є протиракові сполуки, представлені формулою (III) де R0 є таким, як визначено вище, R4 являє собою бензоїл або третбутоксикарбоніл, R5 являє собою водень або ацетил, та їхні фармацевтично прийнятні солі. Іншим предметом цього винаходу є протиракові сполуки, представлені формулою (IV) де R0, R1, R2 та R3 є такими, як визначено вище, R6 являє собою водень, фтор, гідроксил або ціано, R7 являє собою водень, фтор або гідрокси, або R6 та R7 разом утворюють метиліден або фторметиліден, R8 являє собою водень або етиніл, R9 являє собою водень, фтор, вініл або етиніл, та R10 являє собою водень або гідрокси та їхні фармацевтично прийнятні солі. Іншим предметом цього винаходу є протиракові сполуки, представлені формулою (V) де m являє собою ціле число 2 або 3, R0, R2, R6, R7 , R8, R9 та R10 є такими, як визначено вище, та їхні фармацевтично прийнятні солі. де m являє собою ціле число від 1 до 3, n являє собою ціле число від 0 до 1, R0 є таким, як визначено вище, R11 являє собою водень або фтор, R12 являє собою водень, фтор, метил або гідрокси, R13 являє собою водень, аміно, нітро або (диметиламіно)метил, R14 являє собою водень, (С1-С4) алкіл, 4метилпіперазинілметил, трет-бутоксиімінометил, або R13 та R14, або R11 та R12 , разом утворюють 5- або 6-членне кільце, яке необов'язково містить один або два гетероатоми та яке необов'язково заміщене (С1-С8) алкілом, аміно, (С1-С8) алкіламіно та/або дй-(С1-С4) алкіламіно, та їхні фармацевтично прийнятні солі. У цьому винаході термін "(С1-С3) алкілен" позначає бірадикальний розгалужений або нерозгалужений вуглеводневий ланцюг, що містить 1-3 атоми вуглецю, такий як метилен, етилен, пропілен та триметилен, найбільш переважно етилен. У цьому винаході термін "-O-CH(R3)-" позначає -О-СН2-, -О-СН(СН3)-, -О-СН(СН2СН3)-,-ОСН(СН2СН2СН3)-, -О-СН(СН2СН2СН2СН3)-; переважно -О-СН2-, -O-СН(СН 3)-, та найбільш переважно -О-СН(СН3)-. Термін "ацетил" позначає СН3СО-. Термін "циклоалкіл" позначає насичену циклічну вуглеводневу гр упу з 3-7 атомами вуглецю, переважно з 4-7 атомами вуглецю, найбільш переважно з 4-6 атомами вуглецю, тобто циклопропіл, циклобутан, циклопентил та циклогексил та їм подібні. Термін "гетероатом" позначає кисень, азот та сірку. Термін "моно- та ді-алкіламіно" позначає аміно, заміщений алкілом або ді-алкілом, як визначено вище, тобто алкіл-NH- та ді-алкіл-N-. "(С1-С8) алкіламіно" позначає метиламіно, етиламіно, пропіламіно, ізо-пропіламіно, бутиламіно, третбутиламіно, пентиламіно, гексиламіно, гептиламіно та октиламіно, переважно бутиламіно та пентиламіно. Термін "ди-(С1-С4)алкіламіно)" позначає диметиламіно, ді-етиламіно, ди-пропіламіно, дибутиламіно, переважно ди-метиламіно та діетиламіно. У визначені R0 формули (II) термін "бічний ланцюг природної амінокислоти" переважно позначає бічний ланцюг природних амінокислот, такий як метил, ізопропіл, 2-метилпропіл, 1-метилпропіл, бензил, індол-3-ілметил, 2-(метилтіо)етил та 4 19 77718 20 амонобутил, 3-амінопропіл, більш переважно поці солі можна одержати шляхом додавання неорзначає бічний ланцюг природних ліпофільних аміганічного лугу або органічного лугу до вільної киснокислот, такий як метил, 2-метилпропіл, бензил лоти. Солі, що походять з неорганічного лугу, та індол-3-ілметил. включають, проте не обмежуються лише ними, Термін "бічний ланцюг неприродної амінокиссолі натрію, калію, літію, амонію, кальцію, магнію лоти" переважно позначає (С5-С12) алкіл, циклоата їм подібні. Солі, що походять з органічних лугів, лкілметил, заміщений або незаміщений арилмевключають, проте не обмежуються лише ними, тил, (циклоалкілтіо)метил, алкілтіо-(СН2)r-, де r солі первинних, вторинних та третинних амінів, являє собою ціле число 1 або 2, та їм подібні. заміщених амінів, включаючи природно виникаючі Вищевказаний термін "(С5-С12) алкіл" позназаміщені аміни, циклічних амінів та лужних іонітів, чає прямий або розгалужений алкільний ланцюг, таких як ізопропіламін, триметиламін, діетиламін, що містить 5-12 атомів вуглецю, більш переважно триетиламін, трипропіламін, етаноламін, лізин, прямий (С8-С12) алкільний ланцюг, такий як nаргінін, N-етилпіперидин, піперидин, полімін та їм октил, ноніл, децил, ундецил та додецил. подібні. Переважними солями є гідрохлориди. Термін "алкілтіо-(СН2)r-" позначає алкілтіомеБезсольові сполуки можна приготувати за спосотил або алкілтіоетил, що має прямий, розгалужебами, відомими у галузі. ний алкільний ланцюг, який містить 2-10 атомів У цьому винаході "про-складова (Х)" являє совуглецю, такий як етилтіометил, етилтіоетил, nбою відчіпну груп у, що вилучається у пухлинах пропілтіометил, n-бутилтіометил, nензимом, описаним вище, після введення сполуки пентилтіометил, n-октилтіометил, n-нонілтіометил, за формулою (І) або (II), наприклад, (X) являє соn-децилтіометил, трет-бутилтіометил та їм подібні, бою групу за формулою більш переважно етилтіоетил, n-пропілтіометил та n-бутилтіометил. Термін "заміщений або незаміщений арилметил" переважно позначає 4-фенілбензил, нафт-2ілметил, [4-(4-гідроксифенокси)феніл)]метил та (4нижчий-алкоксифеніл)метил, де термін "нижчийалкокси" позначає прямий або розгалужений алкіУ цьому винаході термін "таксани" позначає льний ланцюг, що містить 1-6 атомів вуглецю, петаксол [Front. Biotechnol.Pharm. (2000), 1, 336-348], реважно метокси, етокси, пропокси, бутоксил та таксотер [J. Med. Aromat. Plant Sci. (2001), 22/4Aізопропокси. Найбільш переважними варіантами 23/1A 4-5], IDN 5109 [Chirality, (2000), 12 (5/6), 431здійснення "заміщеного або незаміщеного арил441], BMS 188797 [Clinical Cancer Research. 5 метилу" є 4-фенілбензил, нафт-2-ілметил, (4(suppl.), 3859, Nov 1999], BMS 184476 [J. Clinical метоксифеніл)метил та [4-(4Oncologyl9: 2493-2503, 1 Ma y 2001]. гідроксифенокси)феніл]метил. 2 Термін "Камптотецини" [(A) Cancer У визначенні R формули (II) термін "розгалуChemotherapy and Biotherapy: Principle and жений (С3-С10) алкіл" позначає розгалужений алPractice, 2nd Ed., Lippincott-Ravenmeans, page 463кільний ланцюг, що містить 3-6 атомів вуглецю, та 484, (b) Biochim. Biophys. Acta (1998), 1400 (1-3), переважно позначає ізопропіл, 2-бутил, 3-пентил, 107-119] позначає будь-які сполуки, що мають канеопентил та їм подібні, більш переважно ізопромптотециновий скелет, такі як камптотецин, топопіл та 3-пентил. Термін "(С3-С8) циклоалкіл" потекан, SN-38, 9-амінокамптотецин, 9значає вуглецеве кільце, що складається з 3-8 нітрокамптотецин, луртотекан [Вг. J. Cancer (1998), атомів вуглецю, таке як циклопропіл, циклобутил, 78 (10), 1329-1336], DX-8951F [ANN. Ν. Υ. Acad. циклопентил, циклогексил та їм подібні, більш пеSci. (2000), 922 (Camptotecins), 260-273], BN-80915 реважно циклопентил та циклогексил. 3 [Anti-cancer Drugs (2001), 12 (1), 9-19] та їм подібні. У визначенні R формули (II) термін "прямий Термін "протиракові нуклеозиди" позначає по(С1-С4) алкіл" позначає прямий алкільний ланцюг, хідні цитидину [Cancer Chemotherapy and що містить 1-4 атоми вуглецю, та переважно поBiotherapy: Principle and Practice, 2nd Ed., значає метил, етил та n-пропіл. Lippincott-Ravenmeans, page 213-233], такі як Термін "фармацевтично прийнятна сіль" поDFDC (гемцитабін), DMDC [Clin. Cancer Res. значає ті солі, що зберігають біологічну ефектив(2000), 6 (6), 2288-2294], FMDC [Curr. Opin. Invest. ність та властивості вільних лугів або вільних кисDrugs (PharmaPress Ltd.) (2000), 1 (1), 135-140], лот, але при цьому вони не є небажаними з Ara-C, децитабін [IDrugs (2000), 3 (12), 1525-1533], біологічної або іншої точки зору. Солі утворюються троксацитабін [Clin. Cancer Res. (2000), 6 (4), 1574з неорганічними кислотами, такими як соляна кис1588], 2'-ціано-2'-дезоксицитидин (CNDAC), 3'лота, бромводнева кислота, сірчана кислота, азоетинілцитидин (TAS106) [JPN.J. Cancer Res. тна кислота, фосфорна кислота та їм подібні, та (2001), 92 (3), 343-351], 5-фтор-5'-дезоксицитидин органічними кислотами, такими як оцтова кислота, [Bioorg. Med. Che. Lett, (2000), 8, 1697-1706], 5-вініпропіонова кислота, гліколева кислота, піровиног5'-дезоксицитидин, або похідні аденозину [Cancer радна кислота, оксилова кислота, малеїнова кисChemotherapy and Biotherapy: Principle and лота, малонова кислота, бурштинова кислота, фуPractice, 2nd Ed., Lippincott-Ravenmeans, page 235марова кислота, винна кислота, лимонна кислота, 252], таку як флударабін, кладрибін та їм подібні. бензойна кислота, корична кислота, мигдальна Термін "доластатини" позначає доластатин 10 кислота, метансульфонова кислота, етансульфо[Curr. Pharm. Des. (1999), 5 (3), 139-162], доластанова кислота, р-толуолсульфонова кислота, салітин 14, TZT1027 [Drugs Future (1999), 24 (4), 404цилова кислота, N-ацетилцистеїн тощо. Крім того, 21 77718 22 409], цемадотин та їм подібні. пірано[3',4':6,7]індолізино[1,2-b]хінолінТермін "антрацикліни" [Cancer Chemotherapy 3,14(4Н,12Н)-діон, and Biotherapy: Principle and Practice, 2nd Ed., g) топотекан позначає Lippincott-Ravenmeans, page 409-434] позначає 4(S)-10-[(диметиламіно)метил]-4-етил-4,9адріаміцин, дауноміцин, ідарубіцин та їм подібні. дигідрокси-1Н-пірано[3',4':6,7]індолізино[1,2Термін "інгібітори фарнезилтрансферази" поb]хінолін-3,14(4Н,12Н)-діону моногідрохл ори д, значає R115777 [Cancer Res. (2001), 61 (1), 131h)DX-8951f позначає 137] та їм подібні. (1S,9S)-1-аміно-9-етил-5-фтор-9-гідрокси-4Термін "інгібітори тирозинкінази рецепторів метил-2,3,9,10,13,15-гексагідро-1Н,12Непідермального фактору росту (EGF)" позначає бензо[де]пірано[3',4':6,7}індолізино[1,2-b]хінолінZD1839 [Drugs (2000), 60 (Suppl. 1), 33-40], CP 10,13-діон, 358774 (OSI-774) [J. Pharmacol. Exp. Thr. (1999), і) BN-80915 позначає 291 (2), 739-748], PD 158780 [J. Med. Chem. (2001), 5(R)-етил-9,10-дифтор-1,4,5,13-тетрагідро-544 (3), 429-440], GW2016 та їм подібні. гідрокси-3Н,15Н-оксепіно[3',4':6,7}індолізино[1,2У цьому описі винаходу наступні символи або b]хінолін-3,15-діон, абревіатури позначають наступні відповідні споj) 9-амінокамптотецин позначає луки. (S)-10-аміно-4-етил-4-гідрокси-1Нa) таксол позначає пірано[3',4':6,7]індолізино[1,2-b]хінолін[2aR3,14(4Н,12Н)-діон, k) 9-нітрокамптотецин позначає [2aa,4b,4ab,6b,9a(aR*,bS*),11a,12a,12аa,12ba]]-b4(S)-етил-4-гідрокси-10-нітро-1Н(бензоїламіно)-a-гідроксибензолпропанової кислопірано[3',4':6,7]індолізино[1,2-b]хінолінти 6,12b-біс(ацетилокси)-12-(бензоїлокси)3,14(4Н,12Н)-діон, 2а,3,4,4а,5,6,9,10,11,12,12а,12b-додекагідро-4,111) DFDC позначає дигідрокси-4а,8,13,13 -тетраметил-5-оксо-7,112'-дезокси-2',2'-дифтороцитидин, метано-1Н-циклодека-[3,4]бенз[1,2-b]оксет-9m) DMDC позначає іловий естер, 2'-дезокси-2'-метиліденцитидин, b) таксотер позначає n) FMDC позначає [2aR(Е)-2'-дезокси-2'-(фторометилен)цитидин, [2aa,4b,4aa,6b,9a(aR*,bS*,11a,12a,12aa,12ba)]-bо) Ara-С позначає [[(1,1-диметилетокси)карбоніл]аміно]-a1-(b-D-арабінофуранозил)цитозин, гідроксибензолпропанової кислоти 12bр) децитабін позначає (ацетилокси)-12-(бензоїлокси)4-аміно-1-(2-дезокси-b-D2а,3,4,4а,5,6,9,10,11,12,12а,12b-додекагідроеритропентофуранозил)-1,3,5-триазин-2(1Н)-он, 4,6,11-тригідрокси-4а,8,13,13-тетраметил-5-оксоq) троксацитабін позначає 7,11-метано-1Н-циклодека-[3,4]бенз[1,2-b]оксет-94-аміно-1-[(2S,4S)-2-(гідроксиметил)-1,3іловий естер, діоксолан-4-іл]-2(1Н)-піримідинон, c) IDN 5109 позначає r) флударабін позначає (2R,3S)-3-[[(1,12-фторо-9-(5-О-фосфоно-b-Dдиметилетокси)карбоніл]аміно]-2-гідрокси-5арабінофуранозил)-9Н-пурин-6-амін та метил-4-гексенової кислоти s) кладрибін позначає (3аS,4R,7R,8аS,9S,10аR,12аS,12bR,13S,13аS)2-хлоро-2'-дезоксиаденозин. 7,12а-біс(ацетилокси)-13-(бензилокси)t) доластатин 10 позначає 3а,4,7,8,8а,9,10,10а,12,12а,12b,13-додекагідро-9N,N-диметил-L-валіл-N-[(1S,2R)-2-метокси-4гідрокси-5,8а,14,14-тетраметил-2,8-діоксо-6,13а[(2S)-2-[(1R,2R)-1-метокси-2-метил-3-оксо-3-[[(1S)метано-13аН-оксето[2",3":5',6']бензо[1',2':4,5]2-феніл-1-(2-тіазоліл)етил]аміно]пропіл]-1циклодека-[1,2-d]-1,3-діоксол-4-іловий естер, піролідиніл]-1-[(1S)-1-метилпротл]-4-оксобутил]-Nd) BMS 188797 позначає метил-L-валінамід, (2R,3S)-b-(бензоїламіно)-a-гідрокси бензолпu) доластатин 14 позначає ропанової кислоти цикло[N-метилаланіл-(2Е,4Е,10Е)-15-гідрокси(2aR,4S,4aS,6R,9S,11S,12S,12aR,12bS)-67-метокси-2-метил-2,4,10-гексадекатриеноїл-L(ацетилокси)-12-(бензоїлокси)валіл-N-метил-L-фенілаланіл-N-метил-L-валіл-N2а,3,4,4а,5,6,9,10,11,12,12а,12b-додекагідро-4,11метил-L-валіл-L-пропіл-N2-метиласпарагініл], дигідрокси-12b-[(метоксикарбоніл)окси]-4а,8,13,13ν) доластатин 15 позначає тетраметил-5-оксо-7,11-метано-1Н(1S)-1-[[(2S)-2,5,-дигідро-3-метокси-5-оксо-2циклодека[3,4]бенз[1,2-b]оксет-9-іловий естер, та (фенілметил)-1Н-пірол-1-іл]карбоніл]-2e) BMS 184476 позначає метилпропіловий естер N,N-диметил-L-валіл-L(2R,3S)-b-(бензоїламіно)-a-гідрокси бензолпваліл-N-метил-L-валіл-L-пропіл-L-проліну, ропанової кислоти w) TZT 1027 позначає (2aR,4S,4aS,6R,9S,11S,12S,12aR,12bS)-6,12bN,N-диметил-L-валіл-N-[(1S,2R)-2-метокси-4біс(ацетилокси)-12-(бензоїлокси)[(2S)-2-[(1R,2R)-1-метокси-2-метил-3-оксо-3-[(22а,3,4,4а,5,6,9,10,11,12,12а,12b-додекагідро-11фенілетил)аміно]пропіл]-1-піролідиніл]-1-[(1S)-1гідрокси-4а,8,13,13-тетраметил-4метилпропіл]-4-оксобутил]-N-метил-L-валінамід та [(метилтіо)метокси]-5-оксо-7,11-метано-1Нх) цемадотин позначає циклодека[3,4]бенз[1,2-b]оксет-9-іловий естер. N,N-диметил-L-валіл-L-валіл-N-метил-L-валілf) камптотецин позначає L-пропiл-N-(фенiлметил)-L-пролінамід. 4(S)-етил-4-гідрокси-1Н 23 77718 24 у) адріаміцин позначає Biotechniques 29, 530-536 (2000), Leethanakul C, et (8S,10S)-10-[(3-аміно-2,3,6-тридезокси-Lal., Gene expression profiles in squamous cell ліксогексопіранозил)окси]-7,8,9,10-тетрагідроcarcinomas of the oral cavity: use of laser capture 6,8,11 -тригідрокси-8-(гідроксиацетил)-1-метоксиmicrodissection for the construction and analysis of нафтацен-5,12-діону гідрохлорид, stage-specific CDNA libraries. Oral Oncol 36,474-83 z) да уноміцин позначає (2000)]. Для мікрургії заморожені зрізи товщиною 8-ацетил-10-[(3-аміно-2,3,6-тридезокси-L6-10 мікрометрів фіксуються 70% етанолом, забаліксогексопіранозил)окси]-7,8,9,10-тетрагідрорвленим гематоксиліном Mayer, а потім зневод6,8,11-тригідрокси-1-метоксинафтацен-5,12-діону нюються градієнтом етанолу та ксиленом. Мікрохігідрохлорид та рургію пухлинних клітин здійснюють за допомогою аа) ідарубіцин позначає мікрургічного пристрою лазерного захоплення (7S,9S)-9-ацетил-7-[(3-аміно-2,3,6-тридезокси[Olympus, Tokyo, Japan, Model LM200] та РНК у L-ліксо-гексопіранозил)окси]-7,8,9,10-тетрагідропухлинних клітинах екстрагують, застосовуючи 6,9,11-тригідроксинафтацен-5,12-діон, комерційно доступний набір [Micro RNA Isolation bb) ZD 1839 позначає Kit, Stratagene, La Jolla, CA, USA]. N-(3-хлоро-4-фторофеніл)-7-метокси-6-[3-(4Попередники гранулоцитів людини, які є найморфолініл)пропокси]-4-хіназолінамін, більш сприйнятливими до цитотоксичних ліків, сс) СР 358774 позначає готують шляхом експансії СD34-позитивних моноN-(3-етинілфеніл)-6,7-біс-(2-метоксиетокси)-4нуклеарів на стромальних клітинах мишей у прихіназолінамін, сутності декількох цитокінів, включаючи FLT3dd) PD 158780 позначає ліганд, фактор стовбурових клітин (SCF) та тромN4-(3-бромфеніл)-N6-метилпіридо[3,4бопоетин (ТРО). СD34-позитивні мононуклеари у d]піримідин-4,6-діамінта крові пуповини або у кістковому мозку інкубують з ее) GW 2016 позначає та зв'язують з анти-СD34 антитілом, яке є кон'югоN-(3-хлоро-4-((3-фторобензил)окси)феніл)-6ваним з магнітними кульками, та очищують шля(5-(((2-метилсульфоніл)етил)аміно)метил)-2хом магнітного сортування клітин (MACS) [Miltenyi, фурил)-4-хіназолінамін et. al. In: Hematopoietic stem cells: The mulhouse ff) R 115777 позначає mannual, 201-213, Med press, Dayton (1994)]. Очи6-[1-аміно-1-(4-хлорфеніл)-1-(1-метилімідазолщені СD34-позитивні мононуклеари, що підтвер5-іл)метил]-4-(3-хлорфеніл)-1-метилхінолін-2(1Н)джують спроможність диференціювати у різні типи он. кровотворних клітин, вирощують у чашках з кульУ цьому винаході ензими, що переважно екстурою, та відсоткове відношення попередників пресуються у пухлинній тканині, тим самим селекгранулоцитів у к ультурі визначають шляхом дослітивно активуючи сполуки, ідентифікуються шлядження експресії CD34 після забарвлення клітин хом аналізу рівнів мРНК та/або білків тканини флуоресцентним кон'югованим анти-СD34 антитілюдини. Сполуки потім будують з відомих та/або лом. Звичайно більше ніж 90% клітин у культурі новітніх цитотоксичних ліків шляхом додавання стають СD34-позитивними попередниками гранускладових, які маскують біологічну активність цилоцитів після вирощування. Спроможність цих тотоксичних ліків, але розпізнаються та видаляпопередників гранулоцитів диференціюватися у ються згаданими ензимами селективно при улумієлобласти, а потім у мієлоцити та гранулоцити чанні у пухлинну тканину. визначають шляхом обробки їх колонієстимулююЗдорові та пухлинні тканини людини, які зачим фактором гранулоцитів (Г-КСФ) або інтерлейстосовуються для аналізів, включають тканини кіном-3 (IL3) у комбінації з колонієстимулюючим головного мозку, стравоходу, серця, легенів, груфактором гранулоцитів-макрофагів (ГМ-КСФ) та дей, шлунка, печінки, підшлункової залози, жовчколонієстимулюючим фактором гранулоцитів (Гного міхура, тонкої кишки, товстої кишки, прямої КСФ). Послідовність клітинних поколінь та стадій кишки, нирки, сечового міхура, яєчника, матки, диференціації підтверджується шляхом моніториняєчка, простати, шкіри, кісток, кісткового мозку та гу клітинних поверхневих антигенів (антигенів CD), крові. Переважно, у якості здорових клітин застотаких як CD11, CD13 та CD15, шляхом флуорессовуються гранулоцити-попередники для порівцентного сортування клітин з FACSCalibur [Becton няння рівнів експресії генів та/або білків між пухDickinson, Franklin Lakes, New Jersey, USA] та/або линною та здоровою тканиною та для вибору генів за допомогою мікроскопії після забарвлення клітин та/або білків, які переважно експресуються у пухбарвником Giemsa (Diff-Quick) [Midori-Juji. Co. линній тканині. Після того, як тканину людини виріOsaka, Japan, Catalog No. 16920] або барвником зують під час хірургічної операції, бажано її одразу Leishman [Merck, Darmstadt, Germany, Catalog No. заморозити у зрідженому азоті або ацетоні, що 1.05387. 0500]. Дані флуоресцентного сортування містить сухий лід, заливши її або ні, зі сполукою клітин аналізували за допомогою програмного заО.С.Т. [Sakura-Seiki, Tokyo, Japan, Catalog No. безпечення FACSCalibur CELLQuest згідно з ін4583] та зберігати при температурі нижче -70°С струкцією FACSCalibur FACStation ver. 1.1 [Bectonабо -80°С до застосування. Dickinson, Franklin Lakes, New Jersey, USA]. Якщо пухлинна тканина містить велику частиПошук ензимів та білків, що експресуються у ну здорових клітин, пухлинні клітини вилучаються певній пухлинній тканині, здійснюють шляхом виз тканини, залитої проліками ОСТ, шляхом мікрурмірювання рівнів їхніх мРНК та/або білків у тканині гії лазерного захоплення [Ohyama Η, et al. Laser або клітинах людини. Рівні експресії мРНК визнаcapture microdissection-generated target sample for чають за відомими способами, такими як ранговаhigh-density oligonucleotide array hybridization. ний мікроряд ДНК [Schena, M. et al.Quantitative 25 77718 26 monitoring of gene expression patterns with a Застосовуючи кДНК як матрицю, кРНК синтеcomplementary DNA microarray. Science 270, 467зують, застосовуючи полімеразу Т7, аденозинт470 (1995), та Lipshutz, R. J. et al. High density рифосфат (АТФ), гуанозинтрифосфат (ГТФ), цитиsynthetic oligonucleotide arrays. Nature Genetics 21, динтрифосфат (ЦТФ), уридинтрифосфа т (УТФ), 20-24 (1999)], полімеразна ланцюгова реакція зі Біо-11-ЦТФ та Біо-16-УТФ [ENZO Diagnostics, зворотною транскриптазою (далі позначається як Farmingdale, USA, Catalog No. 42818 та 42814, ПЛР зі зворотною транскриптазою (RT-PCR)) відповідно] при 37°С протягом 6 годин. Отриману [Weis, J. Η. et al. Detection of rare mRNAs via кРНК відокремлюють від нуклеотидів шляхом гельquantitative RT-PCR, Trends Genetics 8, 263-264 хроматографії на колонці. Кількість кРНК визнача(1992), та Bustin, S. A. Absolute quantification of ють з довжини кРНК після електрофорезу в агароmRNA using real-time reverse transcription зному гелі та забарвлення кРНК бромідом етидію. polymerase chain reaction assays, J. МоI. Endocrinol. Аналіз рангованих мікрорядів ДНК здійснюють 25, 169-193 (2000)], нозерн-блотинг та гібридизація відламками олігонуклеотидів високої щільності in situ [Parker, R. M. & Barnes, N. M. mRNA: [(HuGeneFL array, Affymetrix, Santa Clara, USA, detection in situ and northern hybridization, Methods Catalog No. 510137) (Lipshutz, R. L. et al. Nature МоI. Biol. 106, 247-283 (1999)], аналіз захисту від Genet. 21,20-24 (1999)] згідно з інструкцією виробрибонуклеази [Hod, Y.A. Simplified ribonuclease ника. Фрагментацію кРНК при 95°С, гібридизацію protection assay, Biotechniques 13, 852-854 (1992), та промивання виконують згідно з інструкцією виSaccomanno, С F. et al. A faster ribonuclease робника. Кожен піксель-рівень збирається лазерprotection assay, Biotechniques 13, 846-850 (1992)], ним сканером [Affymetrix, Santa Clara, USA] та рівні вестерн-блотинг [Towbin, H. et al. Electrophoretic експресії кожної кДНК та надійність (сигнал присуtransfer of proteins from polyacrylamide gels to тності/відсутності) розраховуються за допомогою nitrocellulose sheets, Proc. Natl. Acad. Sci. U S A програмного забезпечення Affymetrix GeneChip 76,4350-4354 (1979), Burnette, W. N. Western ver. 3.3 та Affymetrix Microarray Suite ver. 4.0. blotting: Electrophoretic transfer of proteins form Окрім аналізу рангованих мікрорядів ДНК, інші sodium dodecyl sulfate-polyacrylamide gels to способи, включаючи ПЛР зі зворотною транскрипunmodified nitrocellulose and radioiodinated protein тазою [Weis, J. Η. et al. Detection of rare mRNAs via A, Anal. Biochem. 112, 195-203 (1981)], аналіз quantitative RT-PCR. Trends in Genetics, 8, 263-264 ELISA (твердофазний імуноферментний аналіз) (1992), та Bustin, S. A. Absolute quantification of [Engvall, Ε. & Perlman, P.Enzyme-linked mRNA using real-time reverse transcription immunosorbent assay (ELISA): Quantitative assay of polymerase chain reaction assays. J. Molecular immunoglobulin G, Immunochemisty 8: 871-879 Endocrinology 25, 169-193 (2000)], нозерн-блотинг (1971)], та ранговані ряди білків [Merchant, Μ. & та гібридизацію in situ [Parker, R. M. and Barnes, N. Weinberger, S. R. Review: Recent advancements in M. mRNA: detection in situ and northern surface-enhanced laser desorption/ionization-time of hybridization. Methods in Molecular Biology, 106, flight-mass spectrometry, Electrophoresis 21, 1164247-283 (1999)], диференціальні прояви [Zhu, W. 1177 (2000), Paweletz, С. Р. et al. Rapid protein and Liang, P. Detection and isolation of differentially display profiling of cancer progression directly from expressed genes by differential display. Methods МоI. human tissue using a protein biochip, Drug Biol. 68, 211-20 (1997), Liang P. and Pardee A. B. Development Research 49, 34-42 (2000)]. Більш Differential display of eukaryotic messenger RNA by переважно, ранговані мікроряди ДНК та ПЛР зі means of the polymerase chain reaction. Science. зворотною транскриптазою застосовуються для 257, 967-971 (1992)], аналіз захисту від рибонуканалізу витраченого матеріалу та кількісного аналеази [Hod, Y. A simplified ribonuclease protection лізу експресії мРНК, відповідно. assay. Biotechniques 13, 852-854 (1992), Для того, щоб виконати аналіз рангованих мікSaccomanno, С. F. et al. A faster ribonuclease рорядів ДНК, РНК екстрагують з дрібних шматочків protection assay. Biotechniques 13, 846-850 (1992)], тканини та/або клітин, які швидко заморожують у аналіз рангованих рядів білків [Merchant, M. and зрідженому азоті або ацетоні у присутності сухого Weinberger, S. R. Review: Recent advancements in льоду та зберігають при температурі нижче -70°С surface-enhanced laser desorption/ionization-time of або -80°С до застосування. Тканину та клітини flight-mass spectrometry. Electrophoresis 21: 1164гомогенізують та РНК з клітинних та тканинних 1177 (2000), Paweletz, C. P. et al. Rapid protein гомогенатів екстрагують хлороформом та осаджуdisplay profiling of cancer progression directly from ють ізопропіловим спиртом. ДНК, забруднена у human tissue using a protein biochip. Drug препараті РНК, перетравлюється дезоксирибонукDevelopment Research 49: 34-42 (2000)], вестернлеазою І, та РНК далі очищують шля хом гельблотинг [Towbin, H. et al. Electrophoretic transfer of хроматографії на колонці. Кількість усієї РНК виproteins from polyacrylamide gels to nitrocellulose значають з відношення рибосомної РНК 28S та sheets. Proc.Natl. Acad. Sci. USA 76: 4350-4354 18S після електрофорезу в агарозному гелі та за(1979), Bumette, W. N. Western blotting: барвлення РНК бромідом етидію. Electrophoretic transfer of proteins form sodium Застосовуючи загальну РНК як матрицю, кДНК dodecyl sulfate-polyacrylamide. gels to unmodified синтезують праймером оліго-dT [Sawady nitrocellulose and radioiodinated protein A. Anal. Technology, Tokyo, Japan], що містить послідовноBiochem. 112: 195-203 (1981)], двомірний електсті для промотора Т7 та ревертази. Отриману рофорез у гелі [O'Farrell, P. H. High-resolution twoкДНК екстрагують сумішшю фенолу та хлорофорdimentional electrophoresis of proteins. J. Biol. Chem. му та відокремлюють від коротких олігонуклеоти250: 4007-4021 (1975)], аналіз ELISA [Engvall, E. дів шля хом гель-хроматографії на колонці. and Perlman, P. Enzyme-linked immunosorbent 27 77718 28 assay (ELISA): Quantitative assay of immunoglobulin винний або вторинна аміногрупа, гідрокси-група G. Immunochemistry 8: 871-879 (1971)] також заабо сульфгідрильна група у стр уктурі (Q-Y-H), тастосовуються для визначення рівнів мРНК та/або ким чином, що вона може спонтанно виділяти акбілків. тивну протиракову речовину завдяки дії ензиму(Ензими та/або білки, що переважно експресуів), знайдених за способами цього винаходу. Більш ються у певних пухлинах, а не у попередниках переважно (Q-Y-H) являє собою цитотоксичний гранулоцитів та іншій здоровій тканині, ідентифіагент, такий як таксан, камптотецин, протиракові кують шляхом порівняння рівнів мРНК та білків у нуклеозиди, доластатин та антрациклін та інгібітор пухлинній тканині з рівнями у здоровій тканині. фарнезилтрансферази, інгібітор тирозинкінази Гени та/або білки, рівні експресії яких відрізняютьрецептору епідермального фактору росту та їм ся більше ніж у два рази у певних пухлинах та поподібні. передниках гранулоцитів, відбираються як гениПереважними є сполуки, де активна протиракандидати для ензимів та/або білків, придатних кова речовина (Q-Y-H) являє собою таксан, який для активації цитотоксину, що улучає в п ухлину. обирається з групи, що складається з Більш переважними є гени та/або білки, які демона) таксолу струють більшу різницю у рівнях експресії між пев[2aRними пухлинами та попередниками гранулоцитів. [2aa,4b,4ab,6b,9a(aR*,bS*),11a,12a,12аa,12ba]]-bДалі рівні мРНК, що значно експресуються у пев(бензоїламіно)-a-гідроксибензолпропанової кислоних пухлинних тканинах, а не у попередниках грати 6,12b-біс(ацетилокси)-12-(бензоїлокси)нулоцитів, порівнюються з рівнями в іншій здоро2а,3,4,4а,5,6,9,10,11,12,12а,12b-додекагідро-4,11вій тканині, зокрема з рівнями у здоровій печінці, дигідрокси-4а,8,13,13 -тетраметил-5-оксо-7,11тому що печінка - це головний орган, який метабометано-1Н-циклодека-[3,4]бенз[1,2-b]оксет-9лізує більшість ліків. Вибирається та мРНК, рівні іловий естер, якої у певній пухлинній тканині перебільшують b) таксотеру рівні у кровотворних попередниках та іншій здоро[2aRвій тканині, зокрема у печінці. [2aa,4b,4aa,6b,9a(aR*,bS*,11a,12a,12aa,12ba)]-bСеред ензимів та/або білків, які вибирають згі[[(1,1-диметилетокси)карбоніл]аміно]-aдно з різницями у рівнях експресії між певною пухгідроксибензолпропанової кислоти 12bлинною тканиною та попередниками гранулоцитів (ацетилокси)-12-(бензоїлокси)та іншої здорової тканини, такої як печінка, далі 2а,3,4,4а,5,6,9,10,11,12,12а,12b-додекагідрообираються такі, що мають відносно широку суб4,6,11-тригідрокси-4а,8,13,13-тетраметил-5-оксостратну специфічність та механізм ферментатив7,11-метано-1Н-циклодека-[3,4]бенз[1,2-b]оксет-9ної реакції, придатний для побудови сполуки. іловий естер, Такі ензими включають фосфоліпазу С, мікроc)IDN5109 сомну дипептидазу, арилсульфатазу А, DT(2R,3S)-3-[[(1,1діафоразу, піролін-5'-карбоксиредуктазу, дегідродиметилетокси)карбоніл]аміно]-2-гідрокси-5діолдегідрогеназу, карбонілредуктазу, лізилгідрокметил-4-гексенової кислоти силазу, пролідазу, дигідропіримідиназу, глюта(3аS,4R,7R,8аS,9S,10аR,12аS,12bR,13S,13аS)мін:фруктоза-6-фасфатамідотрансферазу, UDP7,12а-біс(ацетилокси)-13-(бензилокси)галактоза-церамідгалактозилтрансферазу, лізило3а,4,7,8,8а,9,10,10а,12,12а,12b,13-додекагідро-9ксидазу, енолазу, глюкоза-6-фосфатдегідрогеназу, гідрокси-5,8а,14,14-тетраметил-2,8-діоксо-6,13астеароїл-коензим А десатуразу, епоксидгідролазу метано-13аН-оксето[2",3":5',6']бензо[1',2':4,5]та альдолазу С циклодека-[1,2-d]-1,3-діоксол-4-іловий естер, Більш переважними ензимами для побудови d)BMS 188797 цитотоксинів, що улучають у п ухлину, є мікросом(2R,3S)-b-(бензоїламіно)-a-гідрокси бензолпна дипептидаза, фосфоліпаза С, DT-діафораза, ропанової кислоти дигідродіолдегідрогеназа, піролін-5'(2aR,4S,4aS,6R,9S,11S,12S,12aR,12bS)-6карбоксиредуктаза, карбонілредуктаза, лізилгідро(ацетилокси)-12-(бензоїлокси)ксилаза або матричні метал опротеїнази. 2а,3,4,4а,5,6,9,10,11,12,12а,12b-додекагідро-4,11Ці ензими можна застосовувати для побудови дигідрокси-12b-[(метоксикарбоніл)окси]-4а,8,13,13протиракових сполук за формулою (І), тетраметил-5-оксо-7,11-метано-1Нциклодека[3,4]бенз[1,2-b]оксет-9-іловий естер, та X-Y-Q (I) e) BMS 184476 (2R,3S)-b-(бензоїламіно)-a-гідрокси бензолпде Х являє собою προ-складову, побудовану з ропанової кислоти метою генерування активної протиракової речови(2aR,4S,4aS,6R,9S,11S,12S,12aR,12bS)-6,12bни (Q-Y-H) селективно у пухлинах за допомогою біс(ацетилокси)-12-(бензоїлокси)ензимів, знайдених за способом цього винаходу, 2а,3,4,4а,5,6,9,10,11,12,12а,12b-додекагідро-11(Q-Y-) являє собою радикал, що походить з активгідрокси-4а,8,13,13-тетраметил-4ної протиракової речовини (Q-Y-H), де Υ являє [(метилтіо)метокси]-5-оксо-7,11-метано-1Нсобою -Ο-,-S- або -N-. циклодека[3,4]бенз[1,2-b]оксет-9-іловий естер. Сполуки за формулою (І) можна описати більш Переважними також є сполуки, де активна докладно наступним чином. Активна протиракова протиракова речовина (Q-Y-H) являє собою кампречовина (Q-Y-H) може бути будь-яким протипухтотецин, що обирається з групи, яка складається з линним агентом. Вони можуть бути з'єднаними з a) камптотецину: προ-складовою Χ через груп у -Y-H, таку як пер4(S)-етил-4-гідрокси-1Н-пірано[3',4 29 77718 30 :6,7]індолізино[1,2-b]хінолін-3,14(4Н,12Н)-діон, 7-метокси-2-метил-2,4,10-гексадекатриеноїл-Lb) топотекану 4(S)-10-[(диметиламіно)метил]валіл-N-метил-L-фенілаланіл-N-метил-L-валіл-N4-етил-4,9-дигідрокси-1Нметил-L-валіл-L-пропіл-N2-метиласпарагініл], пірано[3',4':6,7]індолізино[1,2-Ь]хінолінc) доластатину 15 (1S)-1-[[(2S)-2,5-дигідро-33,14(4Н,12Н)-діонумоногідрохлорид, метокси-5-оксо-2-(фенілметил)-1Н-пірол-1c)DX-8951f іл]карбоніл]-2-метилпропіловий естер N,N(1S,9S)-1-аміно-9-етил-5-фтор-9-гідрокси-4диметил-L-валіл-L-валіл-N-метил-L-валіл-L-пропілметил-2,3,9,10,13,15-гексагідро-1Н,12НL-проліну, бензо[де]пірано[3',4':6,7}індолізино[1,2-b]хінолінd)TZT1027 10,13-діон, N,N-диметил-L-валіл-N-[(1S,2R)-2-метокси-4d)BN-80915 [(2S)-2-[(1R,2R)-1-метокси-2-метил-3-оксо-3-[(25(R)-етил-9,10-дифтор-1,4,5,13-тетрагідро-5фенілетил)аміно]пропіл]-1-піролідиніл]-1-[(1S)-1гідрокси-3Н,15Н-оксепіно[3',4':6,7}індолізино[1,2метилпропіл]-4-оксобутил]-N-метил-L-валінамід та b]хінолін-3,15-діон, e) цемадотину e) 9-амінокамптотецину N,N-диметил-L-валіл-L-валіл-N-метил-L-валіл(S)-10-аміно-4-етил-4-гідрокси-1НL-пропіл-N-(фенілметил)-L-пролінамід. пірано[3',4':6,7]індолізино[1,2-b]хінолінТакож переважною є сполука, де активна про3,14(4Н,12Н)-діон, тиракова речовина (Q-Y-H) являє собою антрациf) 9-нітрокамптотецину клін, що обирається з групи, яка складається з 4(S)-етил-4-гідрокси-10-нітро-1Нa) адріаміцину пірано[3',4':6,7] індолізино[1,2-b]хінолін(8S,10S)-10-[(3-аміно-2,3,6-тридезокси-L3,14(4Н,12Н)-діон, ліксогексопіранозил)окси]-7,8,9,10-тетрагідроg) (9S)-9-етил-9-гідрокси-1-пентил-1Н,12Н6,8,11 -тригідрокси-8-(гідроксиацетил)-1-метоксипірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2нафтацен-5,12-діону гідрохлорид, де]хіназолін-10,13(9Н,15Н)-діону, b) дауноміцину h) (98)-9-етил-9-гідрокси-2-метил-1-пентил8-ацетил-10-[(3-аміно-2,3,6-тридезокси-L1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4 ліксогексопіранозил)окси]-7,8,9,10-тетрагідро,3,2-де]хіназолін-10,13(9Н,15Н)-діону, та 6,8,11-тригідрокси-1-метоксинафтацен-5,12-діону і) (9S)-9-етил-9-гідрокси-2-гідроксиметил-1гідрохлорид та пентил-1Н,12Нc) ідарубіцину (7S,9S)-9-ацетил-7-[(3-амінопірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,22,3,6-тридезокси-L-ліксогексопіранозил)окси]де]хіназолін-10,13(9Н,15Н)-діону. 7,8,9,10-тетрагідро-6,9,11-тригідрокси-нафтаценТакож переважними є сполуки, де активна 5,12-діон. протиракова речовина (Q-Y-H) являє собою проТакож переважною є сполука, де активна протираковий нуклеозид, що обирається з групи, яка тиракова речовина (Q-Y-H) являє собою інгібітор складається з тирозинкінази рецептору епідермального фактору a) DFDC росту або інгібітор фарнезилтрансферази. 2'-дезокси-2',2'-дифтороцитидин, Також переважною є сполука, де активна прос) DMDC тиракова речовина (Q-Y-H) являє собою інгібітор 2'-дезокси-2'-метиліденцитидин, тирозинкінази рецептору епідермального фактору c) FMDC росту, який обирається з групи, яка складається з: (Е)-2'-дезокси-2'-(фторометилен)цитидин, a) ZD1839 d) Ara-C N-(3-хлоро-4-фторофеніл)-7-метокси-6-[3-(4морфолініл)пропокси]-4-хіназолінамін, 1-(b-В-арабінофуранозил)цитозин, b) CP 358774 e) децитабіну N-(3-етинілфеніл)-6,7-біс-(2-метоксиетокси)-44-аміно-1-(2-дезокси-b-Dхіназолінамін, еритропентофуранозил)-1,3,5-триазин-2(1Н)-он, c) PD 158780 f) троксацитабіну N4-(3-бромфеніл)-N6-метилпіридо [3,4-d] піри4-аміно-1-[(2S,4S)-2-(гідроксиметил)-1,3мідин-4,6-діамін та діоксолан-4-іл]-2(1Н)-піримідинон, d) GW2016 g) флударабіну N-(3-хлоро-4-((3-фторобензил)окси)феніл)-62-фторо-9-(5-О-фосфоно-b-D(5-(((2-метилсульфоніл)етил)аміно)метил)-2арабінофуранозил)-9Н-пурин-6-амін та фурил)-4-хіназолінамін. h)кладрибіну Також переважною є сполука, де активна про2-хлоро-2'-дезоксиаденозин. тиракова речовина (Q-Y-H) являє собою інгібітор Також переважною є сполука, де активна профарнезилтрансферази R 115777 за формулою 6тиракова речовина (Q-Y-H) являє собою доласта[1-аміно-1-(4-хлорфеніл)-1-(1-метилімідазол-5тин, що обирається з групи, яка складається з іл)метил]-4-(3-хлорфеніл)-1-метилхінолін-2(1Н)-он. a) доластатину 10 Як сполуки, побудовані із застосуванням енN,N-диметил-L-валіл-N-[(1S,2R)-2-метокси-4зиму, знайденого за способами, описаними вище, [(2S)-2-[(1R,2R)-1-метокси-2-метил-3-оксо-3-[[(1S)наведені нижче приклади сполук цього винаходу 2-феніл-1-(2-тіазоліл)етил]аміно]пропіл]-1за формулою (II), що улучають у пухлину, тролідиніл]-1-[(1S)-1-метилпропіл]-4-оксобутил]-Nметил-L-валінамід, b) доластатину 14 цикло[N-метилаланіл-(2Е,4Е,10Е)-15,-гідрокси 31 77718 32 ен-9-он та та їхні фармацевтично прийнятні солі. Селективна активація у пухлині сполук за формулою (III) за допомогою мікротомної дипептидази проілюстрована на Фіг. Другий приклад сполук, які улучають у пухлин у де Q та Υ є такими, як визначено вище, R0 явта які сконструйовані з нуклеозидного похідного як ляє собою бічний ланцюг природної або неприроактивного протиракового засобу та мікросомної дної амінокислоти, Ζ являє собою (С1-С3) алкілен дипептидази як ензиму активації, відображується 3 3 або -O-CH(R )-, де R являє собою водень або формулою (IV) 1 прямий (С1-С4) алкіл, R являє собою водень або 2 метил, a R являє собою водень, розгалужений (С3-С10) алкіл або (С3-С8) циклоалкіл, які генерують протиракові речовини селективно у пухлині завдяки дії мікросомної дипептидази. Проте, ми не наполягаємо обмежувати ними обсяг винаходу. Сполуки за формулою (II) також включають їхні фармацевтично прийнятні солі. У цьому винаході перший приклад сполук, які улучають у п ухлину та які сконструйовані з таксанів як активних протиракових ліків та мікросомної дипептидази як ензиму активації, відображується загальною формулою (III) де R0, R1, R2 та R3 є такими, як визначено у формулі (II), R 6 являє собою водень, фтор, гідроксил або ціано, R7 являє собою водень, фтор або гідрокси, або R6 та R7 разом утворюють метиліден або фторметиліден, R8 являє собою водень або етиніл, R9 являє собою водень, фтор, вініл або етиніл, та R10 являє собою водень або гідрокси, та фармацевтично прийнятні солі згаданих сполук також охоплюються цим винаходом. Переважний варіант здійснення винаходу стосується сполук за формулою (IV), як визначено вище, де R6 являє собою водень, фтор, гідроксил, R7 являє собою фтор або гідрокси, або R6 та R7 разом утворюють груп у метилідену або фторметилідену. Інший переважний варіант здійснення винаходу стосується 0 4 де R є таким, як описано вище, R являє совищезазначеної сполуки за формулою (IV), де R 0 5 бою бензоїл або трет-бутоксикарбоніл, a R являє являє собою 2-метилпропіл, циклогексилметил, 2собою водень або ацетил, та фармацевтично принафтилметил, 4-фенілбензил, (4йнятні солі згаданих сполук також охоплюються циклогексилциклогексил)метил, алкілтіометил, цим винаходом. циклогексилтіометил або 4-алкоксибензил, та R3 Переважними варіантами здійснення R0 у фоявляє собою водень або метил. рмулі (III) є метил, ізопропіл, 2-метилпропіл, 1Переважним варіантом активних нуклеозидів, метилпропіл, бензил, індол-3-ілметил та 2що охоплюються формулою (IV), є DFDC, D MDC, (метилтіо)етил, більш переважно метил, бензил та FMDC, Ara-С, децитабін, троксацитабін, 2'-ціано-2'2-метилпропіл. дезоксицитидин, 3'-етинілцитидин, 5-фтор-5'Переважними сполуками за формулою (III) згідезоксицитидин, 5-віні-5'-дезоксицитидин та їм дно з цим винаходом є наступні: подібні, більш переважно DFDC, DMDC та FMDC. а) 13-((2R,3S)-2-{(5S)-[5-((2S)-2-аміно-4Переважним варіантом R0 у формулі (IV) є заметилпентаноїламіно)-5лишок ліпофільної природної амінокислоти, (С8гідроксикарбоніл]пентаноїлокси} -3 -бензоїламіноС12) алкіл, (С3-С8) циклоалкілметил, заміщений 3-фенілпропіонілокси)-2a-бензилокси-4a,10bабо незаміщений бензил або нафтилметил, (С8діацетокси-1b,7b-дигідрокси-5b,20-епокси-такс-11С12) алкілтіометил, (С3-С8) циклоалкілтіометил, ен-9-он, більш переважно 2-метилпропіл, циклогексилмеб) 13a-((2R,3S)-2-{(5S)-[5-((2S)-2тил, бензил, нафт-2-ілметил, 4-фенілбензил, меaмінопропаноїламіно)-5тилтіоетил, циклогексилтіометил та їм подібні. гідроксикарбоніл]пентаноїлокси}-3-бензоіламіно-3Переважні сполуки за формулою (IV) згідно з фенілпропіонілокси)-2a-бензилокси-4a,10bцим винаходом можуть обиратися з групи, що діацетокси-1b,7b-дигідрокси-5b,20-епокси-такс-11складається з: ен-9-он та a) (2R)-((2S)-aмiнo-3в) 13-((2R,3S)-2-{(5S)-[5-((2S)-2-аміно-3циклoгeкcилпpoпioнiлaмiнo)-(3S)-[1-((4S)-гiдpoкcифенілпропіноїламіно)-5(5R)-гідроксиметил-3-метилентетрагідрофурангідроксикарбоніл]пентаноїлокси}-3-бензоїламіно-3(2R)-іл)-2-оксо-1,2-дигідропіримідин-4ілкарбамоїлокси]-масляної кислоти, фенілпропіонілокси)-2a-бензилокси-4a,10bб) (2R)-((2S)-aмiнo-4-метилпентаноїламіно)діацетокси-1b,7b-дигідрокси-5b,20-епокси-такс-11 33 77718 34 (3S)-[1-((4S)-гiдpoкcи-(5R)-гідроксиметил-3їхні х фармацевтично прийнятних солей. метилентетрагідрофуран-(2R)-іл)-2-оксо-1,2Третій приклад сполук, які улучають у пухлин у дигідропіримідин-4-ілкарбамоїлокси]-масляної кита які сконструйовані з нуклеозидів як активних слоти, протиракових ліків та мікросомноі дипептидази як в) (2R)-((2S)-aмiнo-3-біфеніл-4-ілензиму активації, відображається формулою (V) пропіоніламіно)-(3S)-[1-((4S)-гідрокси-(5R)гiдpoкcимeтил-3-мeтилeнтeтpaгiдpoфypaн-(2R)-iл)2-oкco-l,2-дигiдpoпipимiдин-4-ілкарбамоїлокси]масляної кислоти, г) (2R)-[(2S)-аміно-3-біфеніл-4-ілпрошоніламіно)-3-{1-[(4S)-гідрокси-(5R)гідроксиметил-3-метилентетрагідрофуран-(2R)-іл]2-оксо-1,2-дигідропіримідин-4-ілкарбамоїлокси]пропіонової кислоти, д) (2R)-((2S)-aмiнo-3-нaфтaлeн-2-iлпpoпioнiлaмiнo)-(3S)-[1-((4S)-гiдpoкcи-(5R)гідроксиметил-3-метилентетрагідрофуран-(2R)-іл]де m являє собою ціле число 2 або 3, та R0, 2 2-оксо-1,2-дигідропіримідин-4-ілкарбамоїлокси]R , R6, R7, R 8, R9 та R10 є такими, як визначено масляної кислоти, вище. е) (2R)-{(2S)-аміно-3-[4-(4-гідроксифенокси)Переважним варіантом активних аналогів цифеніл]-пропіоніламіно}-3-[1-((4S)-гідрокси-(5R)тидину за формулою (V) є DFDC, DMDC, FMDC, гідроксиметил-3-метилентетрагідрофуран-2-іл]-2Ara-С, децитабін, троксацитабін, 2'-ціано-2'оксо-1,2-дигідропіримідин-4-ілкарбамоїлокси]дезоксицитидин, 3'-етинілцитидин, 5-фтор-5'масляної кислоти, дезоксицитидин, 5-віні-5'-дезоксицитидин та їм є) (2R)-[(2S)-аміно-3-(4-метоксифеніл)подібні, більш переважно DFDC, DMDCTaFMDC. пропіоніламіно]-(3S)-[1-[(4S)-гідрокси-(5R)Переважним варіантом R0 у формулі (V) є цигідроксиметил-3-метилентетрагідрофуран-2-іл]-2клогексилметил, нафт-2-ілметил, 4-фенілбензил, оксо-1,2-дигідропіримідин-4-ілкарбамоїлокси]бензил, індол-3-ілметил або 4-алкоксибензил, намасляної кислоти, приклад, (4-нижчий-алкоксифеніл)метил, такий як ж) (2R)-[(2S)-аміно-44-метоксибензил, 4-етоксибензил та їм подібні. етилсульфанілбутириламіно]-(3S)-[1-[(4S)Переважні сполуки за формулою (V) згідно з гідрокси-(5R)-гідроксиметил-3цим винаходом є наступними: метилентетрагідрофуран-(2R)-іл]-2-оксо-1,2а) (2R)-[(2S)-aмiнo-3-(1Н-iндoл-3дигідропіримідин-4-ілкарбамоїл]-масляної кислоти, iл)пpoпioнiлaмiнo]-4-[1-((4S)-riдpoкcи-(5R)з) (2R)-((2S)-аміно-3гідроксиметил-3-метилентетрагідрофуран-2-іл]-2циклогексилпропіоніламіно)-(3S)-[1-(3,3-дифторооксо-1,2-дигідропіримідин-4-ілкарбамоїл]-масляна (4R)-гідрокси-(5R)-гідроксиметилтетрагідрофуранкислота, 2-іл)-2-оксо-1,2-дигідропіримідин-4б) (2R)-((2S)-aмiнo-3ілкарбамоїлокси]масляної кислоти, циклогексилпропіоніламіно)-4-[1-((4S)-riдpoкcии) 2(S)-[2(S)-аміно-3(5R)-гідроксиметил-3-метилентетрагідрофуран-2циклогексилпропіоніламіно)-3-[1-(3,3-дифтор-(4R)іл)-2-оксо-1,2-дигідропіримідин-4гідрокси-(5R)-гідроксиметилтетрагідрофуран-2(R)ілкарбамоїл]масляна кислота, іл)-2-оксо-1,2-дигідропіримідин-4-ілкарбамоїлокси]в) (2R)-((2S)-aмiнo-3-бiфeнiл-42(S)-метилпропіонової кислоти, iлпpoпioнiлaмiнo)-4-[1-((4S)-riдpoкcи-(5R)і) 2(R)-[2(S)-аміно-3гiдpoкcимeтил-3-метилентетрагідрофуран-2-іл)-2циклогексилпропіоніламіно]-3-{1-[3,3-дифтор-(4R)оксо-1,2-дигідропіримідин-4-ілкарбамоїл]масляна гідрокси-(5R)-гідроксиметилтетрагідрофуран-2(R)кислота та іл]-2-оксо-1,2-дигідропіримідин-4-ілкарбамоїлокси]г) (2R)-((2S)-aмiнo-3-нaфтaлeн-22(R)-метилпропіонової кислоти, iлпpoпioнiлaмiнo)-4-[1-((4S)-гiдpoкcи-(5R)ϊ) (2S,3S)-2-(2-аміно-3гідроксиметил-3-метилентетрагідрофуран-2-іл)-2циклогексилпропіоніламіно)-3-[1-{(4R,5R)-3,3оксо-1,2-дигідропіримідин-4-ілкарбамоїл]масляна дифтор-4-гідрокси-5кислота, та гідроксиметилтетрагідрофуран-2-іл}-2-оксо-1,2та їхні фармацевтично прийнятні солі. дигідропіридин-4-ілкарбамоїлокси]-2Четвертий приклад сполук, які улучають у п ухметилмасляної кислоти, лину та які сконструйовані з камптотецинів як акк) (2R,3R)-2-(2-аміно-3тивних протиракових ліків та мікросомної дипептициклогексилпропіоніламіно)-3-[1-{(4R,5R)-3,3дази як ензиму активації, відображуються дифтор-4-гідрокси-5формулою (VI) гідроксиметилтетрагідрофуран-2-іл}-2-оксо-1,2дигідропіридин-4-ілкарбамоїлокси]-2-метилмасляної кислоти та л) (2R)-[(2S)-аміно-3-циклогексилпропіоніламіно)-3(S)-[1-[(4S)-гідрокси-(5R)гідроксиметил-3-метилентетрагідрофуран-(2R)-іл]2-оксо-1,2-дигідропіримідин-4-ілкарбамоїлокси]масляної кислоти ізопропілового естеру та 35 77718 36 камптотецин, f) 20-О-[(R)-фенілаланіл-g-(S)-глутаміл]-20(S)камптотецин, g) 20-О-[(S)-триптофіл-g-(R)-глутаміл]-20(S)камптотецин, h) 20-О-[(R)-триптофіл-g-(R)-глутаміл]-20(S)камптотецин, і) 20-О-[(S)-фенілаланіл-g-(R)-глутаміл]-20(S)камптотецин, j) 20-O-[(S)-лeйцил-g-(R)-глyтaмiл]-20(S)кaмптoтeцин, k) 20-О-[(R)-триптофіл-g-(S)-глутаміл]-20(S)де m являє собою ціле число від 1 до 3, т явкамптотецин, ляє собою ціле число від 0 до 1, R° є таким, як I) 20-О-[(R)-фенілаланіл-g-(R)-глутаміл]-20(S)визначено у формулі (II), R11 являє собою водень камптотецин, або фтор, R12 являє собою водень, фтор, метил m) 20-О-[(R)-лейцил-g-(R)-глутаміл]-20(S)або гідрокси, R13 являє собою водень, аміно, нітро камптотецин, або (диметиламіно)метил, R14 являє собою водень, (С1-С4) алкіл, (4-метилпіперазиніл)метил, n) 7-етил-10-гідрокси-20-О-[(R)-триптофіл-g(R)-гомоглутаміл]-20(S)-камптотецин, (трет-бутоксиіміно)метил або R13 та R14, або R11 та R12, разом утворюють 5- або 6-членне кільце, яке о) 7-етил-10-гідрокси-20-О-[(R)-триптофіл-gможе необов'язково містити один або два гетеро(R)-глутаміл]-20(S)-камптотецин, атоми, та яке може необов'язково заміщува тися 1р) 7-етил-10-гідрокси-20-О-[(S)-фенілаланіл-g3 замісниками, які обираються з групи, що склада(R)-глутаміл]-20(S)-камптотецин, ється з (С1-С8) алкілу, аміно, (С1-С8) алкіламіно q) 7-етил-10-гідрокси-20-О-[(S)-фенілаланіл-gта/або ди-(С1-С4)алкіламіно, та фармацевтично (S)-аспартил]-20(S)-камптотецин, прийнятні солі згаданих сполук також охоплюютьr) 7-етил-10-гідрокси-20-О-[(S)-лейцил-g-(S)ся цим винаходом. Більш переважно сполуки за аспартил]-20(S)-камптотецин, формулою (VI) характеризуються тим, що R11 явs) 20-О-[(S)-триптофіл-b-(R)-аспартил]-20(S)ляє собою водень, R12 являє собою водень або камптотецин, гідрокси, R13 являє собою водень або (диметилаt) 20-О-[(S)-фенілаланіл-b--(R)-аспартил]міно)метил та R14 являє собою водень або етил. 20(S)-камптотецин, 0 Переважним варіантом R у формулі (VI) є 2u) 20-О-[(R)-фенілаланіл-b--(R)-аспартил]метилпропіл, циклогексилметил, бензил, індол-320(S)-камптотецин, ілметил або 4-амінобутил, 4-амінопропіл, більш v) 20-О-[(S)-фенілаланіл-b--(S)-аспартил]переважно 2-метилпропіл, циклогексилметил, бен20(S)-камптотецин, зил та індол-3-ілметил. w) 20-О-[(S)-лейцил-)-b--(R)-аспартил]-20(S)Переважними варіантами активного аналога камптотецин, камптотецину, що охоплюються формулою (VI), є х) 20-О-[(S)-валіл-)-b--(R)-аспартил]-20(S)камптотецин, топотекан, SN-38, луртотекан, 9камптотецин, амінокаптотецин, 9-нітрокамптотецин, DX-8951f, у) 7-етил-10-гідрокси-20-О-[(S)BN-80915, (9S)-9-етил-9-гідрокси-1-пентил-1Н,12Нциклогексилаланіл-(R)-глутаміл]-20(S)пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2камптотецин, де]хіназолін-10,13(9Н,15Н)-діон, (9S)-9-етил-9z) 7-етил-10-гідрокси-20-О-[(S)гідрокси-2-метил-1-пентил-1Н,12Нциклогексилаланіл-(S)-глутаміл]-20(S)пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2камптотецин, де]хіназолін-10,13(9Н,15Н)-діон та (9S)-9-етил-9аа) 20-О-[(S)-лізил-g-(S)-глутаміл]-20(S)гідрокси-2-гідроксиметил-1-пентил-1Н,12Н-піранокамптотецин, та [3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2bb) 20-О-[(S)-орнітил-g-(S)-глутаміл]-20(S)де]хіназолін-10,13(9Н,15Н)-діон та їм подібні. 0 камптотецин, Переважним варіантом R у формулі (VI) є 2сс) (9S)-9-етил-9-[(L)-триптофіл-(L)-gметилпропіл, циклогексилметил, бензил, індол-3глутамілокси]-1-пентил-1Н,12Нілметил, 4-амінобутил, 4-амінопропіл, більш перепірано[3",4":6',7']індолізино[1',2':6,5] піридо[4,3,2важно 2-метилпропіл, циклогексилметил, бензил де]хіназолін-10,13(9Н,15Н)-діону гідрохлорид, та індол-3-ілметил. dd) (9S)-9-етил-9-[(L)-циклогексилаланіл-(D)-gПереважними сполуками за формулою (VI) глутамілокси]-1-пентил-1Н,12Нзгідно з цим винаходом є наступні: пірано[3",4":6',7']індолізино[1',2':6,5] піридо[4,3,2а) 20-О-[(S)-триптофіл-g-(S)-глутаміл]-20-(S)де]хіназолін-10,13(9Н,15Н)-діону гідрохлорид, камптотецин, ее) (9S)-9-етил-9-[(L)-фенілаланіл-(D)-gb) 20-О-[(S)-валіл-g-(S)-глутаміл]-20(S)глутамілокси]-1-пентил-1Η,12Нкамптотецин, пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2с) 20-О-[(S)-фенілаланіл-g-(S)-глутаміл]-20(S)де]хіназолін-10,13(9Н,15Н)-діону гідрохлорид, камптотецин, ff) (9S)-9-етил-9-[(L)-лейцил-(D)-gd) 20-О-[(S)-лейцил-g-(S)-глутаміл]-20(S)глутамілокси]-1-пентил-1Η,12Нкамптотецин, пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2е) 20-О-[(R)-лейцил-g-(S)-глутаміл]-20(S) 37 77718 38 де]хіназолін-10,13(9Н,15Н)-діону гідрохлорид, де]хіназолін-10,13(9Н,15Н)-діону дигідрохлорид, gg) (9S)-9-етил-9-[(L)-лізил-(L)-g-глутамілокси]ww) (9S)-9-етил-9-[(L)-триптофіл-(D)-g1-пентил-1Н,12Нглутамілокси]-1-пентил-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2де]хіназолін-10,13(9Н,15Н)-діону дигідрохлорид, де]хіназолін-10,13(9Н,15Н)-діону гідрохлорид, хх) (9S)-9-етил-9-[(L)-лейцил-(L)-уhh) (9S)-9-етил-9-[(L)-валіл-(D)-g-глутамілокси]глутамілокси]-1-пентил-1Н,12Н1-пентил-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2де]хіназолін-10,13(9Н,15Н)-діону гідрохлорид, де]хіназолін-10,13(9Н,15Н)-діону гідрохлорид, уу) (9S)-9-етил-9-[гліцил-(D)-g-глутамілокси]-1іі) (9S)-9-етил-9-[(L)-орнітил-(L)-gпентил-1Н,12Нглутамілокси]-1-пентил-1Н, 12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2трано[3",4":6',7']індолізино[1',2':6,5]пірйдо[4,3,2де]хіназолін-10,13(9Н,15Н)-діону гідрохлорид, де]хіназолін-10,13(9Н,15Н)-діону дигідрохлорид, zz) (9S)-9-етил-9-[(L)-аланіл-(D)-gjj) (9S)-9-етил-9-[(L)-лейцил-(D)-gглутамілокси]-1-пентил-1Н,12Нглутамілокси]-1-пентил-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2шрано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2де]хіназолін-10,13(9Н,15Н)-діону гідрохлорид, де]хіназолін-10,13(9Н,15Н)-діонна сіль метансуааа) (9S)-9-етил-9-[(L)-фенілаланіл-(D)-|3льфонової кислоти, аспартилокси]-1-пентил-1Η,12Нkk) (9S)-9-етил-9-[(D)-лізил-(L)-g-глутамілокси]пірано[3",4":6',7']індолізино[1',2':6,5]тридо[4,3,21-пентил-1Н,12Нде]хіназолін-10,13(9Н,15Н)-діону гідрохлорид, пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2їхні безсольові сполуки та їхні інші фармацевде]хіназолін-10,13(9Н,15Н)-діону дигідрохлорид, тично прийнятні солі. II) (9S)-9-етил-9-[(L)-фенілаланіл-(L)-bБільш переважними варіантами сполук за фоаспартилокси]-1-пентил-1Н,12Нрмулою (VI) є наступні: пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2а) 20-О-[(S)-триптофіл-g-(S)-глутаміл]-20-(S)де]хіназолін-10,13(9Н,15Н)-діону гідрохлорид, камптотецин, mm) (9S)-9-етил-9-[(L)-циклогексилаланіл-(D)b) 20-О-[(S)-лейцил-g-(S)-глутаміл]-20(S)b-аспартилокси]-1-пентил-1Н,12Нкамптотецин, пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2де]хіназолін-10,13(9Н,15Н)-діону гідрохлорид, c) 20-О-[(S)-триптофіл-g-(R)-глутаміл]-20(S)камптотецин, nn) (9S)-9-етил-9-[(L)-циклогексилаланіл-(L)-bd) 20-О-[(S)-лейцил-g-(R)-глутаміл]-20(S)аспартилокси]-1-пентил-1Н,12Нкамптотецин, пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2де]хіназолін-10,13(9Н,15Н)-діону гідрохлорид, e) 7-етил-10-гідрокси-20-О-[(S)-фенілаланіл-b(R)-глутаміл]-20(S)-камптотецин, оо) (9S)-9-етил-9-[(L)-триптофіл-(L)-bаспартилокси]-1-пентил-1Н,12Нf) 7-етил-10-гідрокси-20-О-[(S)-фенілаланіл-bпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2(S)-аспартил]-20(S)-камптотецин, де]хіназолін-10,13(9Н,15Н)-діону гідрохлорид, g) 20-O-[(S)-фeнiлaлaнiл-b-(S)-acпapтил]-20(S)рр) (9S)-9-етил-9-[(L)-орнітил-(D)-gкaмптoтeцин, глутамілокси]-1-пентил-1Н,12Нh) 7-етил-10-гідрокси-20-О-[(S)пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2циклогексилаланіл-(R)-глутаміл]-20(S)де]хіназолін-10,13(9Н,15Н)-діону дигідрохлорид, камптотецин, і) 7-етил-10-гідрокси-20-О-[(S)qq) (9S)-9-етил-9-[(L)-лейцил-(О)-bциклогексилаланіл-(S)-глутаміл]-20(S)аспартилокси]-1-пентил-1Н,12Нкамптотецин, пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2де]хіназолін-10,13(9Н,15Н)-діону гідрохлорид, j) (9S)-9-етил-9-[(L)-триптофіл-(L)-gглутамілокси]-1-пентил-1Н,12Нrr) (9S)-9-етил-9-[(L)-валіл-(D)-b-аспартилокси]пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,21-пентил-1Н,12Нде]хіназолін-10,13(9Н,15Н)-діону гідрохлорид, пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2де]хіназолін-10,13(9Н,15Н)-діону гідрохлорид, k) (9S)-9-етил-9-[(L)-циклогексилаланіл-(D)-gглутамілокси]-1-пентил-1Н, 12Нss) (9S)-9-етил-9-[(L)-лейцил-(L)-bаспартилокси]-1-пентил-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2де]хіназолін-10,13(9Н,15Н)-діону гідрохлорид, пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2де]хіназолін-10,13(9Н,15Н)-діону гідрохлорид, I) (9S)-9-етил-9-[(L)-фенілаланіл-(D)-gглутамілокси]-1-пентил-1Н,12Нtt) (9S)-9-етил-9-[(L)-циклогексилгліцил-(L)-gпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2глутамілокси]-1-пентил-1Н,12Нде]хіназолін-10,13(9Н,15Н)-діону гідрохлорид, пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2де]хіназолін-10,13(9Н,15Н)-діону гідрохлорид, m) (9S)-9-етил-9-[(L)-лейцил-(D)-gглутамілокси]-1-пентил-1Н,12Нuu) (9S)-9-етил-9-[(D)-циклогексилаланіл-(L)-gпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2глутамілокси]-1-пентил-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2де]хіназолін-10,13(9Н,15Н)-діону гідрохлорид, де]хіназолін-10,13(9Н,15Н)-діону гідрохлорид, n) (9S)-9-етил-9-[(L)-лізил-(L)-g-глутамілокси]-1vv) (9S)-9-етил-9-[(L)-лізил-(D)-у-глутамілокси]пентил-1Н,12Н1-пентил-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2де]хіназолін-10,13(9Н,15Н)-діону дигідрохлорид, 39 77718 40 ее) (9S)-9-етал-9-[(L)-лейцил-(L)-уо) (9S)-9-етил-9-[(L)-валіл-(D)-g-глутамілокси]глутамілокси]-1-пентил-1Н, 12Н1-пентил-1Н,12Нтрано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2де]хіназолін-10,13(9Н,15Н)-діону гідрохлорид, де]хіназолін-10,13(9Н,15Н)-діону гідрохлорид, ff) (9S)-9-етил-9-[гліцил-(D)-g-глутамілокси]-1р) (9S)-9-етил-9-[(L)-орнітил-(L)-gпентил-1Н,12Нглутамілокси]-1-пентил-1Н, 12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2трано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2де]хіназолін-10,13(9Н,15Н)-діону гідрохлорид, де]хіназолін-10,13(9Н,15Н)-діону дигідрохлорид, gg) (9S)-9-етил-9-[(L)-аланіл-(D)-gq) (9S)-9-етил-9-[(L)-лейцил-(D)-gглутамілокси]-1-пентил-1Н,12Нглутамілокси]-1-пентил-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2шрано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2де]хіназолін-10,13(9Н,15Н)-діонну сіль метансульде]хіназолін-10,13(9Н,15Н)-діону гідрохлорид, фонової кислоти, hh) (9S)-9-етил-9-[(L)-фенілаланіл-(D)-bаспартилокси]-1-пентил-1Н,12Нr) (9S)-9-етил-9-[(D)-лізил-(L)-g-глутамілокси]-1пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2пентил-1Н,12Нде]хіназолін-10,13(9Н,15Н)-діону гідрохлорид, пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2їхні безсольові сполуки та їхні інші фармацевде]хіназолін-10,13(9Н,15Н)-діону дигідрохлорид, тично придатні солі. s) (9S)-9-етил-9-[(L)-фенілаланіл-(L)-bНайбільш переважним варіантом сполук за аспартилокси]-1-пентил-1Н,12Нформулою (VI) є (9S)-9-етил-9-[(L)-лізил-(L)-gпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2де]хіназолін-10,13(9Н,15Н)-діону гідрохлорид, глутамілокси]-1-пентил-1H,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2t) (9S)-9-етил-9-[(L)-циклогексилаланіл-(D)-bде]хіназолін-10,13(9Н,15Н)-діону дигідрохлорид, аспартилокси]-1-пентил-1Н,12Нбезсольова сполука та її інші фармацевтично припірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2йнятні солі. де]хіназолін-10,13(9Н,15Н)-діону гідрохлорид, Сполуку за формулою (І) можна одержати u) (9S)-9-етил-9-[(L)-циклогексилаланіл-(L)-)3шляхом конденсації сполуки Q-Y-H з реакційнозаспартилокси]-1-пентил-1Н,12Ндатним похідним X. Ці реакції є відомими у галузі: пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2наприклад, сполуку за формулою (II), (III), (V) та де]хіназолін-10,13(9Н,15Н)-діону гідрохлорид, (VI) можна одержати шляхом реакції конденсації ν) (9S)-9-етил-9-[(L)-триптофіл-(L)-bсполуки за формулою (VII), а сполуку за формуаспартилокси]-1-пентил-1Н,12Нлою (IV) можна одержати шляхом реакції конденпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2сації сполуки за формулою (VIII), як описується де]хіназолін-10,13(9Н,15Н)-діону гідрохлорид, нижче. w) (9S)-9-етил-9-[(L)-орнітил-(D)-gСполуку за формулою (II), (III), (V) та (VI) можглутамілокси]-1-пентил-1Н,12Нна одержати шляхом реакції конденсації сполуки пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2за формулою (VII) де]хіназолін-10,13(9Н,15Н)-діону дигідрохлорид, х) (9S)-9-етил-9-[(L)-лейцил-(D)-bаспартилокси]-1-пентил-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2де]хіназолін-10,13(9Н,15Н)-діону гідрохлорид, у) (9S)-9-етил-9-[(S)-валіл-(D)-b-аспартилокси]1-пентил-1Н,12НП1рано[3",4":6',7']індолізино[1',2':6,5 піридо[4,3,2де]хіназолін-10,13(9Н,15Н)-дioну гідрохлорид, де Р1 та Р2 є захисними групами аміно та карz) (9S)-9-етил-9-[(L)-лейцил-(L)-bбокси, відповідно, R0 та m є такими, як визначено аспартилокси]-1-пентил-1Н,12Нвище, та відповідним чином захищеної протиракопірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2вої речовини, такої як паклітаксел, похідні цитидиде]хіназолін-10,13(9Н,15Н)-діону гідрохлорид, ну або камптотецини, конденсувальним агентом, аа) (9S)-9-етил-9-[(L)-циклогексилгліцил-(L)-gтаким як дициклогексилкарбодіімід, BOP, HBTU, глугамілокси]-1-пентил-1Н,12НTNTU, PyBroPÔ , PyBOPÔ , TBTU, TSTU, HOBt [копірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2мерційно доступні зв'язувальні реагенти: cf. The де]хіназолін-10,13(9Н,15Н)-діону гідрохлорид, Combinatorial Chemistry Catalog, Feb., 1997, bb) (9S)-9-етил-9-[(D)-циклогексилаланіл-(L)Novabiochem] та їм подібні, з наступним вилученgглутамілокси]-1-пентил-1Η,12Нням захисних груп. пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2У вищезгаданому захисні групи Р1 та Р2 аміно де]хіназолін-10,13(9Н,15Н)-дioну гідрохлорид, та карбокси, а також реакція конденсації по суті є сс) (9S)-9-етил-9-[(L)-лізил-(D)-g-глутамілокси]відомими для фахівців у галузі, [cf. The practice of 1-пентил-1Н,12НPeptide Synthesis, M. Bodansky and A. Bodansky/ пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,22nd ed., 1994 (Spring-Verlag)]. де]хіназолін-10,13(9Н,15Н)-діону дигідрохлорид, Сполуку за формулою (IV) можна одержати dd) (9S)-9-етил-9-[(L)-триптофіл-(D)-gшляхом реакції конденсації сполуки за формулою глутамілокси]-1-пентил-1Н,12Н(VIII) пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2де]хіназолін-10,13(9Н,15Н)-діону гідрохлорид, 41 77718 42 чають у пухлин у, також генеруються шляхом трансфекції плазміди , у якій кДНК для ензиму, що активує цитотоксини, що улучають у пухлин у, клонується за сильним конструктивним промотором, який включає промотор цитомегаловірусу (CMV) [Foecking, Μ. K. and Hofstetter, Η. Powerful and versatile enhance-promoter unit for mammalian де P1, P2, R0, R1 та R3 є такими, як визначено expression vectors. Gene. 45, 101-105 (1986)]. Отже, транскрипція ензимів, що активують цитотоквище, та відповідним чином захищеного похідного цитидину конденсувальним агентом, таким як 4сини, що улучають у п ухлину, у трансфектантах нітрофенілхлорформіат та трифосген, з наступним здійснюється під контролем сильного конструктиввилученням захисних груп. ного промотора. Активацію цитотоксинів, що улуРеакцію можна здійснювати у розчиннику, тачають у пухлину, досліджують шля хом інкубації цитотоксинів, що улучають у пухлину, з рекомбінакому як метилендихлорид, піридин, Ν,Νдиметилформамід, N-метилпіролідон, ацетонітрил нтними ензимами, що активують цитотоксини, що та їм подібні, у присутності або відсутності основи, улучають у пухлину, та/або клітинними екстрактатакої як триетиламін, діізопропілетиламін, піридин, ми, які експресують або не експресують ензим, що Ν,Ν-диметиламінопіридин та їм подібні, при темактивує цитотоксини, що улучають у пухлин у, та шляхом вимірювання кількості цитотоксинів, що пературі від -20°С до +50°С, переважно від 0°С до +25°С. улучають у п ухлину, та активних ліків, застосовуюВилучення амінозахисної групи, коли застосочи високоефективну рідинну хроматографію вується аміно- та/або карбокси-захищений дипепта/або РХ-МС. тид для реакції конденсації, можна виконувати за Окрім клітин, що несуть додаткові копії кДНК для ензимів, що активують цитотоксини, що улуспособом, відомим для фахівців у галузі, наприклад, шляхом обробки трифтороцтовою кислотою чають у пухлин у, екстракти різних тканин людини для групи Вос, піперидином для групи Fmoc або та тварин також застосовуються для підтверджентетрабутиламонійфторидом для групи 2ня пухлина-специфічної активації цитотоксинів, що (триметилсиліл)етоксикарбонілу (Теос), триметилулучають у пухлину. Пухлинні та здорові тканини, що застосовуються для аналізу, включають тканисилілетилу та тер-бутилдиметилсилілу, та шляхом каталітичного гідрогенолізу для групи Cbz. ни з головного мозку, серця, легенів, шлунку, кишАмінокислотні похідні, що застосовуються для ки, товстої кишки, печінки, нирки, крові та кістковоодержання дипептидних похідних у формулі (VII) го мозку, взятих у мишей, щурів, мавп та людей. та (VIII), є або комерційно доступними, або їх можСелективна дія цитотоксинів, що улучають у пухлину, далі підтверджується шляхом порівняння на одержати за відомими способами, які описані в літературі [наприклад, J. Am. Chem. Soc. 2000, уповільнення росту клітин цитотоксинами, що улу122, 762-766; J. Org. Chem. 1998 5240; Tetrahedron чають у пухлину, між клітинами, що експресують Asymmetry 1995,1741; Tetrahedron Asymmetry високі рівні ензимів, які активують цитотоксини, що 1998, 4249]. Похідні S-алкіл-цистеїну одержали улучають у пухлин у, та клітинами, які експресують дуже низькі рівні ензиму, що активує цитотоксини, або шляхом S-алкілування аміно/карбоксизахищених похідних цистеїн у алкілувальним агенщо улучають у пухлину. Інгібування росту клітин том, або шляхом заміщення гідроксигрупи амівизначають шляхом підрахування кількості живих но/карбокси-захищених похідних серину атомом клітин після культивації клітин у присутності або брому з наступною реакцією заміщення похідним відсутності цитотоксинів, що улучають у пухлин у. тіолу. Похідні О-алкіл-тирозину одержали шляхом Сполуку, активація якої опосередкована мікроО-алкілування аміно/карбокси-захищених похідних сомною дипептидазою, визначають через інгібітотирозину алкілувальним агентом. Ці дипептидні рну активність сполук проти росту клітин, що експохідні можна одержати шляхом традиційних спопресують низькі рівні мікросомної дипептидази, та собів хімії пептидів, відомими для фахівців у галузі клітин, що експресують високий рівень мікросом[cf. The practice of Peptide Synthesis, M. Bodansky ної дипетидази, та попередників гранулоцитів, які and A. Bodansky2nd ed., 1994 (Springer-Verlag)]. розповсюджені ex vivo. Клітинні лінії раку товстої Цитотоксини, що улучають у п ухлину, потім кишки людини, НСТ116 (Американська колекція тестують на їхню селективну активацію певним типових культур №CCL-247), та попередників граензимом, застосовуючи рекомбінантні ензими нулоцитів застосовують як клітини, що експресута/або екстракти клітин, які експресують або не ють лише низький рівень мікросомної дипептидаекспресують високі рівні ензимів, які активують зи. Стійкий трансфектант, НСТ116/S5, у який цитотоксини, що улучають у пухлину. Кровотворні трансфектували кДНК мікросомної дипептидази клітини-попередники людини також застосовуютьлюдини (далі позначається мікросомна дипептися як клітини, які не експресують або лише за нидаза (MDP)), з'єднану з промотором цитомегаловізькими рівнями експресують ензими, які активують русу, застосовується як клітини, що експресують цитотоксини, що улучають у пухлину. Рекомбінанвисокий рівень мікросомної дипептидази. кДНК тні білки для ензимів, які активують цитотоксини, дипетидази [Satoh et al. Biotechnol. Prog. 10(2), що улучають у пухлин у, можна генерувати шляхом 134-140 (1994) та інші посилання] та процедури експресії кДНК для ензимів у бактеріях або у інших клонування, які згадувалися, є відомими у галузі. клітинах, включаючи клітини комах та клітини ссаНСТ116, НСТ116/S5 та попередників гранулоцитів вців. Клітинні лінії, які суттєво експресують високі культивують у присутності та відсутності ліків, та рівні ензимів, що активують цитотоксини, що улузначення IC50, яке являє собою концентрацію ліків, 43 77718 44 необхідну для 50%-го інігбування росту порівняно ру, наприклад, застосовуючи мазі, креми, гелі або з клітинами, що культивуються без ліків, визначарозчини, або парентерально, наприклад, застосоють та порівнюють серед НСТ116, НСТ116/S5 та вуючи розчини для ін'єкцій. Для виробництва фапопередників гранулоцитів. Незважаючи на те, що рмацевтичних препаратів (таблеток, таблеток з тривалість впливу ліків на клітини різниться залепокриттям, драже або твердих желатинових капжно від клітин та ліків, вона може становити 24 сул) ці сполуки можна змішати з терапевтично години, 96 годин або 168 годин. Коли клітини кульінертними, органічними або неорганічними носіятивуються у присутності ліків протягом 24 годин, ми. Лактозу, кукурудзяний крохмаль або їхні похідліки видаляють з культурального середовища ні, тальк, стеаринову кислоту або її сіль можна шляхом заміни середовища, та клітини далі інкузастосовувати як носії для таблеток, таблеток з бують протягом 72 годин перед вимірюванням покриттям, драже та твердих желатинових капсул. значення IC50 ліків. Придатними носіями для м'яких желатинових капсул є рослинні олії, віск, жири, напівтверді або рідкі Біологічні дані сполук з прикладів 4, 16, 17, 31, 39, поліоли. Проте, залежно від природи активної ре49-1, 49-2, 49-3, 49-4 та 49-11 Цитотоксичність човини, жодного носія взагалі не потребується у (ІС50 у нМ) [тривалість впливу ліків, 24 години] випадку м'яких желатинових капсул. Придатними носіями для виробництва розчинів та сиропів є вода, поліоли, цукроза, інвертний цукор та глюкоСполука НСТП 6 HCT116/S5 CFU-GM за. Придатними носіями для розчинів для ін'єкцій є Паклітаксел 2,5 2,4 16 вода, спирти, поліоли, гліцерин та рослинні олії. Приклад 4 51 5,1 54 Придатними носіями для супозиторіїв є природні Камптотецин 19 5,6 6,1 або затвердлі олії, віск, жири або напіврідкі поліоПриклад 31 300 18 170 ли. Фармацевтичні препарати також можуть містиSN38 3,7 2,2 1,8 ти консерванти, солюбілізувальні агенти, стабіліПриклад 39 23 2,8 20 затори, зволожувачі, емульгатори, підсолоджувачі, Приклад 49-1 33 3,3 61 барвники, ароматизатори, солі для зміни осмотичПриклад 49-2 18 2,6 31 ного тиску, буфери, агенти для покриття або антиПриклад 49-4 15 2,1 54 оксиданти. Вони можуть також містити іще інші Приклад 49-3 >50 2,9 250 терапевтично цінні речовини. Приклад 49-11 >50 13 120 Доза може змінюватися у широкому діапазоні, Цитотоксичність (ІС50 у н М) [тривалість впливу ліків, 96 годин] [тривалість впливу ліків, 168 годин] Сполука DMDC Приклад 16 Приклад 17 НСТ116 0,2 1,7 0,99 HCT116/S5 0,3 0,23 0,098 CFU-GM 0,07 2,8 1,1 НСТ116: клітинна лінія раку товстої кишки людини, НСТ116/S5: НСТ116, трансфектована кДНК мікросомної дипептидази людини, CFU-GM: кровотворні клітини-попередники людини. Отже, суттєво поліпшені профілі ефективності та безпеки, особливо у мієлотоксичності, цитотоксинів, що улучають у пухлину, порівняно з такими профілями існуючих цитотоксинів, прогнозуються у клінічних ситуаціях. Наступний варіант здійснення цього винаходу стосується фармацевтичних композицій, що містять сполуку, описану вище. Переважно, щоб ці композиції були придатними для перорального або парентерального введення. Як згадувалося вище, лікарські засоби, що містять сполуку за формулою І, є також предметом цього винаходу, як і спосіб одержання таких лікарських засобів, при цьому спосіб включає поєднання однієї або більше сполук за формулою І та, якщо бажано, однієї або більше терапевтично цінних речовин у галенову форму для введення. Фармацевтичні склади можна вводити перорально, наприклад, у формі таблеток, таблеток з покриттям, драже, твердих або м'яких желатинових капсул, розчинів, емульсій або суспензій. Введення можна також здійснювати ректально, наприклад, застосовуючи супозиторії, місцево або через шкі та її, звичайно, слід пристосовувати до індивідуальних вимог у кожному певному випадку. Взагалі, у випадку перорального або парентерального способу введення дорослій людині, доречною буде щоденна доза від приблизно 5мг/м 2 до приблизно 500мг/м 2. Верхню границю можна розширити, якщо це вважається доречним. Щоденну дозу можна вводити як єдину дозу або розділеними дозами, або, у випадку перорального або парентерального введення, її можна вводити як тривалу інфузію. Інший варіант здійснення цього винаходу спрямований на застосування протиракової сполуки, які описано вище, для одержання лікарських засобів, переважно для лікування розладів, пов'язаних з проліферацією клітин, наприклад, для лікування раку, наприклад, раку кишечнику, раку легенів, раку грудей, раку шлунку, раку шийки матки та раку сечового міхура. Цей винахід також стосується способу лікування розладів, пов'язаних з проліферацією клітин, наприклад, раку, наприклад, твердої пухлини або раку кишечнику, раку легенів, раку грудей, раку шлунку, раку шийки матки та раку сечового міхура, при цьому спосіб включає введення пацієнту у випадку необхідності терапевтично ефективної кількості протиракової сполуки, яку описано вище. Винахід також стосується вищезазначених сполук для застосування під час терапії. Наступні приклади тільки ілюструють переважні способи ідентифікації ензимів та/або білків, придатних для активації сполук згаданими ензимами, та способи одержання сполук цього винаходу, при цьому приклади не слід тлумачити як такі, що обмежують обсяг винаходу. Приклади 45 77718 46 Приклад 1: No. 42818 та 42814, відповідно] при 37°С протягом Вимірювання різних рівнів мРНК у пухлинній 6 годин. Мононуклеотиди та короткі олігонуклеота здоровій тканині людини шляхом аналізу ранготиди вилучили шля хом хроматографії на колонці ваних олігонуклеотидних мікрорядів та ПЛР зі звоCHROMA SPIN + STE-100 [CLONTECH, Palo Alto, ротною транскриптазою. USA, Catalog No. Kl 302-2], та кРНК в елюатах 1-1. Екстракція РНК з тканини осадили шляхом додавання етанолу. Коли 0,1мкг Дрібні шматочки 41 пухлини прямої кишки люкРНК відокремили шляхом електрофорезу на агадини, ЗО шлункових пухлин, 41 недрібноклітиннорозному гелі та забарвили бромідом етидію, довго раку легенів, 24 пухлин гр удей, 15 пухлин яєчжина кРНК становила ряд від 300 пар нуклеотидів ника, 53 печінково-клітинного раку та 15 не до 3 тисяч пар нуклеотидів. Очищену кРНК зберіпухлинної печінкової тканини (приблизно 125мм гали при температурі нижче -80°С у 70% розчині кожен) та 10 клітин-попередників гранулоцитів, які етанолу до застосування. експансували ex vivo, швидко заморозили у зрід1-3. Аналіз генної експресії пухлинної та здоженому азоті. Для того, щоб екстрагувати РНК з рової тканини тканини та клітин, їх суспендували у TRIZOL [Life Структури генної експресії первинних пухлин Technologies, Gaithersburg, USA, Catalog No. людини від пацієнтів з раком печінки досліджували 15596-018] або Sepasol-RNAI [Nacalai tesque, шляхом застосування рангованих мікрорядів оліKyoto, Japan, Catalog No. 306-55] та гомогенізувагонуклеотидів високої щільності [(HuGeneFL array, ли двічі за допомогою Polytron [Kinematica, Littau, Afrymetrix, Santa Clara, USA, Catalog No. 510137) Switzerland] (5 секунд з максимальною швидкістю). (Lipshutz, R. L. et al. Nature Genet. 21, 20-24 Після додавання хлороформу тканинні гомогенати (1999)]. Для гібридизації з олігонуклеотидами на центрифугували при 15000xg протягом 10 хвилин чіпсах, кРНК розділяли на фрагменти при 95°С та зібрали водні фази, які містили РНК. Усю кліпротягом 35 хвилин у буфері, що містив 40мМ Tris тинну РНК осадили ізопропіловим спиртом, про[Sigma, St. Louis, USA, Catalog Νο.Τ1503]-оцтової мили один раз 70% етанолом та суспендували у кислоти [Wako, Osaka, Japan, Catalog No. 017воді, обробленій DEPC [Life Technologies, 00256] (pH 8,1), 100мМ ацетату калію [Wako, Gaithersburg, USA, Catalog No. 10813-012]. Після Osaka, Japan, Catalog No. 160-03175] та 30мМ того, як РНК обробили 1,5 одиницями ДНКази І ацетату магнію [Wako, Osaka, Japan, Catalog No. [Life Technologies, Gaithersburg, USA, Catalog No. 130-00095]. Гібридизацію здійснювали у 200мкл 18068-015], РНК знов екстрагували буферу, що містив 0,1Μ 2-(ΝTRIZOL/хлороформом, осадили етанолом та розМорфоліно)етансульфонової кислоти (MES) чинили у воді, обробленій DEPC. Після цього нук[Sigma, St. Louis, USA, Catalog No. M-3885], (pH леозиди з невеликою молекулярною масою вилу6,7), 1Μ NaCl [Nacalai tescque, Tokyo, Japan, чили із застосуванням RNeasy Mini Kit [QIAGEN, Catalog No. 313-20], 0,01% поліоксилен(10) октилHilden, Germany, Catalog No. 74104] згідно з інструфеніловий етер [Wako, Osaka, Japan, Catalog No. кцією виробника. Коли очищена РНК зазнала еле168-11805], 20мкг ДНК сперми оселедця [Promega, ктрофорезу на агарозному гелі та коли її забарвиMadison, USA, Catalog No. D181B], 100мкг ацетилли бромідом етидію, рибосомні РНК 28S та 18S ьованого альбуміну бичачої сироватки [Sigma, St. було легко розпізнати, та флюоресценція зв'язку Louis, USA, Catalog No. B-8894], 10мкг фрагментоброміду етидію з РНК 28S перебільшувала флюованої кРНК, та оброблені біотином контрольні оліресценцію з РНК 18S. Очищену суцільну РНК збегонуклеотиди, біотин -5'рігали при -80°С у 70% етаноловому розчині до CTGAACGGTAGC ATCTTGAC-3' [Sawady застосування для синтезу кДНК. technology, Tokyo, Japan] при 45°С протягом 12 1-2. Синтез кДНК та мічені зонди кРНК годин. Після промивання чіпсів буфером, що міскДНК синтезували, застосовуючи зворотну тив 0,01Μ MES (pH 6,7), 0,1 Μ NaCl, 0,001% поліоSuperscript Choice System [Life Technologies, ксилен(10) октифеніловий етер, чіпси інкубували з Gaithersburg, USA, Catalog No. 18090-019] згідно з антитілом анти-стрептавідину, обробленим біотиінструкцією виробника. 5 мікрограмів очищеної ном [Funakoshi, Tokyo, Japan, Catalog No. BA0500] загальної РНК гібридизували з праймером оліго-dT та забарвили стрептавідиновим R-фікоеритрином [Sawady Technology, Tokyo, Japan], що містив по[Molecular Probes, Eugene, USA, Catalog No. S-866] слідовності для промотора Т7 та 200 одиниць редля підсилення сигналів гібридизації, як описано в вертази SuperScriptll, та інкубували при 42°С проінструкції виробника [Affymetrix, Santa Clara, USA]. тягом 1 години. Одержану кДНК екстрагували Кожен піксел-рівень збирали за допомогою лазерфенолом/хлороформом та очистили за допомогою ного сканера Affymetrix, Santa Clara, USA та рівні експресії кожної кДНК та надійність (сигнал присуPhase Lock GELÔ Light [Eppendorf, Hamburg, тності/відсутності) розраховували за допомогою Germany, Catalog No. 0032 005. 101]. програмного забезпечення Affymetrix GeneChip кРНК також синтезували, застосовуючи набір MEGAscript T7 [Ambion, Austin, USA, Catalog No. ver. 3.3 та Affymetrix Microarray Suite ver. 4.0. У цих експериментах визначили експресію приблизно 1334] та кДНК як матриці згідно з інструкцією ви6000 генів у 41 пухлині прямої кишки людини, 30 робника. Приблизно 5мкг кДНК інкубували з 2мкг шлункових пухлинах, 41 недрібноклітинному раку суміші ензимів, що містила полімеразу Т7, по легенів, 24 пухлинах грудей, 15 пухлинах яєчників, 7,5мМ (кожного) аденозинтрифосфату (АТФ) та гуанозинтрифосфату (ГТФ), по 5,625мМ (кожного) 53 зразках печінково-клітинному раку та у 15 непухлинних печінкових тканинах та 10 груп незалежно цитидинтрифосфату (ЦТФ) та уридинтрифосфату культивованих клітин-попередників гранулоцитів (УТФ), по 1,875мМ (кожного) Біо-11-ЦТФ та Біо-16(107 клітин для кожної групи). УТФ [ENZO Diagnostics, Farmingdale, USA, Catalog 47 77718 48 Приклад 2: Вибір ензимів, що експресуються більш ніж 50% пацієнтів. Серед таких кДНК вибрапереважно у пухлинах, а не у попередниках гранули більш ніж 150 кДНК, що кодують білки, які малоцитів та не у печінці ють відому каталітичну активність. Такі ензими 2-1. Експансія попередників гранулоцитів Ex включають фосфоліпазу С, мікросомну дипептиVi vo дазу, арилсульфазу A, DT-діафоразу, піролін 5'СD34-позитивні мононуклеари, що походять з карбоксиредуктазу, дегідродіолдегідрогеназу, каркрові пуповини людини та кісткового мозку, купубонілредуктазу, лізилгідроксилазу, пролідазу, дигівали у VERITAS [Veritas Co, Tokyo, Japan, Catalog дропіримідиназу, гама-глютмілтранспептидазу, No. CB009F, ABM019F] та культивували на зливглютамін:фруктоза-6-фосфатамідотрансферазу, ному моношарі MS5 [Itoh, K., et Al. Reproducible UDP-галактозо церамід галактозилтрансферазу, establishment of hematopoietic supportive stromal лізилоксидазу, енолазу, глюкоза-6cells from murine bone marrow. Exp. Hematol. 17, фосфа тдегідрогеназу, уридинфосфорилазу, стеа145-153 (1989)]. У лінії мишачих стромальних кліроїл-коензимдесатуразу, епоксидгідролазу, алдотин у середовищі альфа MEM [Life Technologies, лазуС. Gaithersburg, USA, Catalog No. 12571-0063] додали 2-3. Аналіз за кінетичною ПЛР зі зворотною 10%-ву (об'єм/об'єм) конячу сироватку (HS) [Stem транскриптазою Cell Technologies, Vancouver, Canada, Catalog No. Рівні мРНК для кДНК ензимів, що активують 06750], 10%-ву (об'єм/об'єм) фетальну телячу сицитотоксини, що улучають у п ухлину, також визнароватку (FBS) [Stem Cell Technologies, Vancouver, чали шляхом кінетичної ПЛР зі зворотною трансCanada, Catalog No. 06450], 50нг/мл ліганду Flt3 криптазою. Кінетичну ПЛР зі зворотною транскрип[PeproTec EC, London, UK., Catalog No. 300-19], тазою виконували за допомогою системи 100нг/мл SCF [PeproTech EC, London, UK., Catalog флуоресцентної ПЛР реального часу. АмпліфікаNo. 300-07] та 50нг/мл ТРО [PeproTech EC, цію ПЛР із застосуванням системи LightCycler London, England, Catalog No. 300-18] при 37°С у [Roche Diagnostics, Mannheim, Germany, Catalog присутності 5% СО2 у зволоженому повітрі. ПлаNo. 2011468] здійснювали у 20мкл реакційної суваючі кровотворні клітини зібрали та забарвили міші, що складалася з головної суміші, яка містила моноклональними антитілами проти РеrСР-антиДНК-полімеразу Taq, буфер реакції, суміш dNTP СD34 [BD pharMingen, SanDiego, USA, Catalog No. та барвник SYBR Green I [LightCycler-DNA Master 340430], РЕ-анти-CD13 [BD pharMingen, SanDiego, SYBR Green I, Roche Diagnostics, Mannheim, USA, Catalog No. 30525X] та FITC-aHTH-15 [BD Germany, Catalog No. 2158817], 4мМ хлориду магpharMingen, SanDiego, USA, Catalog No. нію [Nacalai tescque, Tokyo, Japan, Catalog No. PM30525X]. 5 мікролітрів кожного антитіла дода7791-18-6], 10пМ праймерів ПЛР [Sawady вали у 50 мкл клітинної суспензії та інкубували при Technology, Tokyo, Japan] та 2мкл матричної кДНК 4°С протягом 25 хвилин. Після промивання фізіоу капілярі LightCycler [Roche Diagnostics, логічним розчином з фосфатним буфером, що Mannheim, Germany, Catalog No. 1909339]. Послімістив 10% (об'єм/об'єм) FCS, експресію антигенів довності праймерів для ампліфікації кДНК мікроCD визначили шляхом застосування інструкції сомної дипептидази людини являли собою FACSCalibur Traing [FACStation ver 1.1. Becton ATCGACTTGGCTC ACGTGTCTGTGG та Dickinson, Franklin Lakes, New Jersey, USA]. Аналіз TGTGATCCAGATGGTCGGCCACTTG. FACS показав, що більш ніж 90% мононуклеарів Ампліфікацію виконували у LightCycler з 40 циекспресували маркер попередника CD34 після клами інкубації при 95°С протягом 0 секунд для їхньої експансії за вищезазначеними умовами. денатурації, при 57-60°С протягом 3-10 секунд для Коли ці СD34-позитивні клітини обробили 50нг/мл відпалу та при 72°С протягом 10 секунд для поG-CSF [Sou za, L. Μ., et al. Recombinant human довження, при цьому температурний нахил станоgranulocyte colony-stimulating factor: effects on вив 20°С/секунду. Моніторинг ПЛР у реальному normal and leukemic myeloid cells. Science 232, 61часі здійснювали шляхом вимірювання сигналів 65 (1986). Pepro Tech EC, London, UK. Catalog No. флюоресценції наприкінці фази відпалу у кожному 300-23], більш ніж 80% клітин перетворилися на циклі ампліфікації. кДНК здорових легенів, серця, СD34-негативні, CD13- та СD15-позитивні мієлобпечінки, нирки, кишки, товстої кишки, шкіри та голасти та мієлоцити протягом 7 днів, а потім на ловного мозку синтезували з РНК, яку купували у нейтрофіли протягом 14 днів після додавання GStrategene [Strategene, La Jolla, USA, Catalog. No. CSF. D6030-01 для головного мозку , D6050-01 для тов2-2. кДНК. що переважно експресуються у пустої кишки, D6064-01 для серця, D6065-01 для хлинах, а не у попередниках гранулоцитів та інших тонкої кишки, D6070-01 для нирки, D6080-01 для непухлинних тканинах печінки, D6115-01 для шкіри]. Для того, щоб виВнаслідок експериментів з чіпсами ДНК одерзначити якість цілісності виділеної РНК та нормажали декілька сот кДНК, мРНК яких вважали відсулізувати кількість копій послідовностей-мішеней, тньою (що визначалося сигналом відсутності), або аналіз кінетичної ПЛР зі зворотною транскриптавважали, що вона експресується на дуже низьких зою для гліцеральдегід-3-фосфатдегідрогенази рівнях (що визначалося середньою різницею ниж(GAPDH) також виконували, застосовуючи зонди че 50), у попередниках гранулоцитів та печінці, гібридизації. Зовнішні стандарти для мРНК-мішені проте вона експресувалася (згідно з сигналом та мРНК-GAPDH одержали шляхом десятикратноприсутності) за певними рівнями (визначалося го серійного розведення (103-108) плазмідної ДНК. згідно з середньою різницею, що перебільшувала Кількісний аналіз мРНК у кожному зразку викону200), у пухлинах грудей, печінки, ободочної та вали автоматично, звертаючись до стандартної прямої кишки, підшлункової залози або яєчника у кривої, побудованої у кожній часовій точці згідно, з 49 77718 50 програмний забезпеченням LightCycler [LightCycler метилпентаноїламіно)-5software version 3, Roche Diagnostics, Mannheim, бензилоксикарбоніл]пентаноїлокси}-3Germany]. Послідовності праймерів для ампліфібензоїламіно-3-фенілпропіонілокси)-2aкації кДНК GAPDH були наступними: бензилокси-4a,10b-діацетокси-1b,7b-дигідроксиTCTCCAGAAC ATC ATCCCTGCCTCTAC та 5b,20-епокси-такс-11-ен-9-ону (31,3мг), 10% Pd/C TGCTGTAGCCAAATTCGTTGTC ATACC. (7,1мг) та мурашиної кислоти (0,42мл) у метанолі Незважаючи на те, що мРНК мікросомної ди(6,0мл) перемішували у присутності Н 2 при кімнатпептидази визначили у нирці та тонкій кишці, її не ній температурі протягом 6,5 годин. Суміш фільтвиявили у легенях, серці, шлунку, товстій кишці та рували, а фільтрат концентрували в умовах вакупечінці. Однак, рівні мРНК мікросомної дипептидауму, внаслідок чого одержали сіль 13a-((2R,3S)-2зи, які досліджували у 12 пухлинах прямої кишки, {(5S)-[5-((2S)-2-аміно-4-метилпентаноїламіно)-5були суттєво вищими, ніж у нирці та тонкій кишці. гідроксикарбоніл]пентаноїлокси}-3-бензоїламіно-3фенілпропіонілокси)-2a-бензилокси-4a,10bРівні мРНК мікросомної дипептидази у тканині людiацетокси-1b,7b-дигідрокси-5b,20-епокси-такс-11дини ен-9-ону мурашиної кислоти у вигляді блідо-жовтої Рівень мРНК (відношення до мРНК GAPDH) твердої речовини (23,6мг, 91%). 1 H-ЯМР (CDCI3): d 0,8~0,9 (6Н, м), 0,98 (3Н, с), мРНК мікросомної дипепти1,20 (3Н, с), 1,48 (3Н, с), 1,2~1,6 (2Н, м), 1,55-1,8 Тканина дази /мРНК GAPDH (7Н, м), 1,75 (3Н, с), 2,16 (3Н, с), 2,3~2,5 (6Н, м), Пухлини прямої киш2,25 (3Н, с), 3,50 (1Н, шир), 3,80 (1Н, м), 3,95 (2Н, 2,6 ки м), 4,08 (1Н, м), 4,7-4,9 (3Н, м), 5,32 (1Н, д, Попередники грануJ=11Гц), 5,39 (1Н, д, J=8Гц), 5,50 (1Н, т, J=9Гц), 0,02 лоцитів 5,78 (1Н, шир.т, J=8,8Гц), 6,29 (1Н, с), 7,17 (1Н, м), Товста кишка 0,06 7,4-7,8 (11Н, м), 7,87 (2Η, м), 7,98 (2Η, м), 9,28 (1Н, Шкіра
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for identification of enzymes that are expressed in certain tumor tissue
Автори англійськоюShimma Nobuo, Tsukuda Takuo, Umeda Isao
Назва патенту російськоюСпособ обнаружения ферментов, выраженных в определенной опухолевой ткани
Автори російськоюШимма Нобуо, Цукуда Такуо, Умеда Исао
МПК / Мітки
МПК: A61K 31/4745, A61K 31/704, C12Q 1/32, A61P 35/00, C12Q 1/37, A61P 43/00, A61K 38/00, C12Q 1/02, G01N 33/50, G01N 33/573, C07K 7/06, A61K 31/517, A61K 31/53, A61K 31/4725, A61K 31/519, A61K 31/7076, G01N 33/574, A61K 31/506, C12Q 1/48, G01N 33/15, A61K 31/426, C12Q 1/68, A61K 31/5377, A61K 31/337, C12Q 1/26, A61K 31/401, G01N 37/00, A61K 47/48, C12N 15/09, A61K 31/7068, C07K 5/06
Мітки: ідентифікації, цільових, протипухлинних, ензимів, спосіб
Код посилання
<a href="https://ua.patents.su/43-77718-sposib-identifikaci-protipukhlinnikh-cilovikh-enzimiv.html" target="_blank" rel="follow" title="База патентів України">Спосіб ідентифікації протипухлинних цільових ензимів</a>
Попередній патент: Інструмент для лиття під тиском, спосіб лиття під тиском відкривального пристрою та пакувальна тара, яка має виконаний литтям під тиском відкривальний пристрій
Наступний патент: Спосіб одержання листів, смуг і стрічок з металевих порошків і гранул
Випадковий патент: Пристрій для використання у реагуванні газових компонентів та спосіб одержання водного розчину пероксиду водню















































