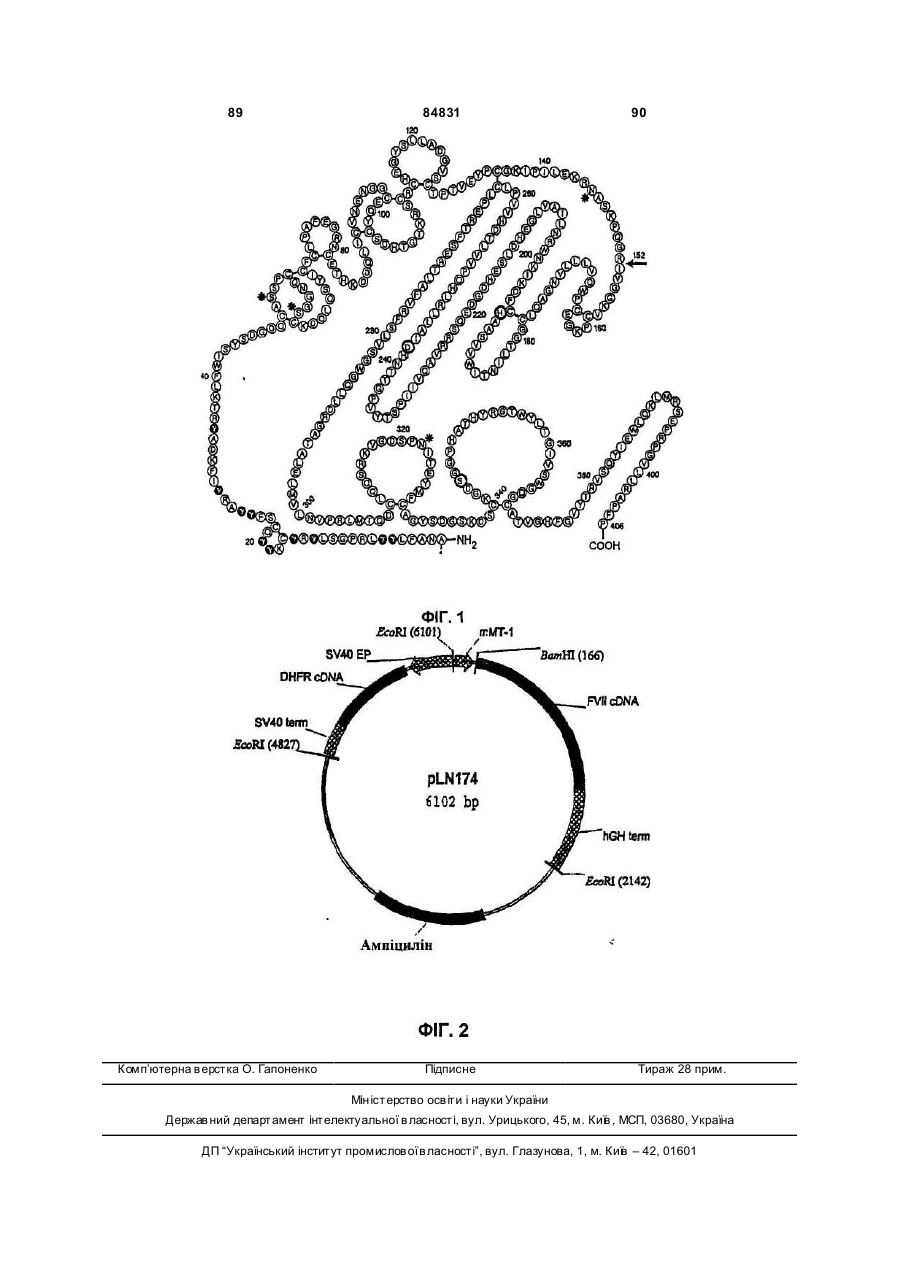
Похідні фактора коагуляції vii
Формула / Реферат
1. Поліпептид фактора VII, що включає амінокислотну послідовність SEQ ID NO: 1 або її варіант, де амінокислота, що відповідає амінокислоті в положенні, вибраному з Q250, R396 або Р406 SEQ ID NO: 1, була заміщена на цистеїн, або де цистеїн був доданий до С-кінця SEQ ID NO: 1.
2. Поліпептид фактора VII за п. 1, у якому амінокислота, що відповідає R396 SEQ ID NO: 1, була заміщена на цистеїн.
3. Поліпептид фактора VII за будь-яким з пп. 1-2, у якому амінокислота, що відповідає Q250 SEQ ID NO: 1, була заміщена на цистеїн.
4. Поліпептид фактора VII за будь-яким з пп. 1-3, у якому амінокислота, що відповідає Р406 SEQ ID NO: 1, була заміщена на цистеїн.
5. Похідна фактора VII, що включає поліпептид фактора VII, який має амінокислотну послідовність SEQ ID NO: 1 або її варіант, де амінокислота, що відповідає амінокислоті в положенні, вибраному з Q250, R396 або Р406 SEQ ID NO: 1, була заміщена на цистеїн, або де цистеїн був доданий до С-кінця SEQ ID NO: 1, причому зазначений цистеїн кон'югований з хімічною групою, що збільшує справжню молекулярну масу зазначеного поліпептиду фактора VII на приблизно 300 дальтон - приблизно 100000 дальтон, і де зазначена похідна фактора VII має майже таку саму активність або підвищену активність порівняно з рекомбінантним фактором VIIа дикого типу людини.
6. Похідна фактора VII за п. 5, у якій поліпептид фактора VII відповідає будь-якому з пп. 1-4.
7. Похідна фактора VII за будь-яким з пп. 5-6, у якій хімічна група є головним чином нейтральною.
8. Похідна фактора VII за будь-яким з пп. 5-7, у якій хімічна група збільшує справжню молекулярну масу похідної фактора VII на приблизно 1000 дальтон приблизно 80000 дальтон.
9. Похідна фактора VII за будь-яким з пп. 5-8, у якій хімічна група збільшує справжню молекулярну масу похідної фактора VII на приблизно 5000 дальтон -приблизно 60000 дальтон.
10. Похідна фактора VII за будь-яким з пп. 5-9, у якій хімічна група підвищує справжню молекулярну масу похідної фактора VII на приблизно 10000 дальтон -приблизно 40000 дальтон.
![]()
![]() 11. Похідна фактора VII за будь-яким з пп. 5-10, у якій хімічна група є поліетиленгліколем.
11. Похідна фактора VII за будь-яким з пп. 5-10, у якій хімічна група є поліетиленгліколем.
12. Похідна фактора VII за будь-яким з пп. 5-11, у якій хімічна група вибрана з 1-6 молекул поліетиленгліколю.
13. Похідна фактора VII за п. 12, у якій хімічна група являє собою одну молекулу поліетиленгліколю.
14. Похідна фактора VII за будь-яким з пп. 5-13, де хімічна група кон'югована з вільною сульфгідрильною групою, присутньою в амінокислоті, заміщеній на амінокислоту, вставлену в або додану до поліпептиду.
15. Похідна фактора VII за будь-яким з пп. 5-14, у якій хімічна група кон'югована з цистеїном.
16. Молекула виділеної або рекомбінантної нуклеїнової кислоти, що кодує поліпептид фактора VII за будь-яким з пп. 1-4.
17. Вектор експресії еукаріотичних клітин, що включає молекулу за п. 16.
18. Еукаріотична клітина-хазяїн експресії поліпептиду фактора VII за будь-яким з пп. 1-4, де зазначена клітина-хазяїн включає молекулу виділеної або рекомбінантної нуклеїнової кислоти, що кодує поліпептид фактора VII.
19. Еукаріотична клітина-хазяїн за п. 18, яка має походження від ссавців.
20. Еукаріотична клітина-хазяїн за п. 19, де зазначена клітина вибрана з групи, що складається з клітин СНО, клітин ВНК або клітин НЕК.
21. Спосіб одержання поліпептиду фактора VII за будь-яким з пп. 1-4, який включає культивування еукаріотичної клітини-хазяїна за будь-яким з пп. 18-20 в прийнятному середовищі для росту, за умов, що дозволяють синтез білка з зазначеного полінуклеотидного конструкту та виділення поліпептиду фактора VII з культурального середовища.
22. Спосіб одержання похідної фактора VII, що складається з етапів:
a) продукування поліпептиду фактора VII відповідно до способу за п. 21;
b) кон'югації поліпептиду фактора VII з хімічною групою;
с) введення похідної фактора VII в катіонобмінну хроматографічну колонку або гельфільтраційну колонку; і
d) елюювання похідної фактора VII.
Текст
1. Поліпептид фактора VII, що включає амінокислотну послідовність SEQ ID N O: 1 або її варіан т, де амінокислота , що ві дповіда є амінокислоті в положенні, вибраному з Q250, R396 або Р406 SEQ ID NO: 1, була заміщена на цистеїн, або де цистеїн був доданий до С-кінця SEQ ID NO: 1. 2. Поліпептид фактора VII за п. 1, у якому амінокислота, що відповідає R396 SEQ ID NO: 1, була заміщена на цистеїн. 3. Поліпептид фактора VII за будь-яким з пп. 1-2, у якому амінокислота, що відповідає Q250 SEQ ID NO: 1 , була заміщена на цистеїн. 4. Поліпептид фактора VII за будь-яким з пп. 1-3, у якому амінокислота, що відповідає Р406 SEQ ID NO: 1 , була заміщена на цистеїн. 5 . По хі дн а фактора VII, що вк люча є п оліпе пти д фактора VII, як ий м а є амінокислотну послідовність SEQ ID NO: 1 або її варіант, де амінокислота, що ві дп о ві да є а м і н о ки сло ті в п о л о же н н і , ви бр а н о м у з Q2 5 0 , R 3 9 6 а бо Р4 0 6 SEQ ID NO: 1, була заміщена на цистеїн, або де цистеїн був доданий до С-кінця SEQ ID NO: 1, причому зазначений цистеїн кон'югований з хімічною групою, що збільшує справжню молекулярну 2 (19) 1 3 84831 4 1 5 . П о хі дн а фактора VII з а будь -яким з пп . 521. Спосіб о держання поліпептиду фактора VII 1 4 , у я кій хі мі чна гр уп а кон'югована з цистеїном. за будь-яким з пп. 1-4 , який включає к ульти ву16 . Мо лек ула виді лено ї або рекомбінан тно ї вання еукаріоти чної клі тини-хазяїна за будьн ук ле їно вої ки сло ти, що ко дує поліпептид факяким з пп. 18-20 в прийня тном у сере до ви щі для тора VII за будь-яким з пп. 1-4. росту, за умов, що доз во ляють син тез бі лка з 17. Вектор експресії еукаріотичних клітин, що вклюзазначеного полінуклеотидного конструкту та вичає молекулу за п. 16. ділення поліпептиду фактора VII з культурального 18. Еукаріо ти чна клі тина-хазя їн експре сі ї полісередовища. пептиду фактора VII за будь-яким з пп. 1-4, де 22. Спосіб одержання похідної фактора VII, що зазначена клітина-хазяїн включає молекулу вискладається з етапів: діленої або рекомбінантної нуклеїнової кислоти, a) продукування поліпептиду фактора VII відповідщо кодує поліпептид фактора VII. но до способу за п. 21; 19. Еукаріотична клітина-хазяїн за п. 18, яка має b) кон'югації поліпептиду фактора VII з хімічною походження від ссавців. групою; 20. Еукаріотична клітина-хазяїн за п. 19, де зазнас) введення похідної фактора VII в катіонобмінну чена клітина вибрана з групи, що складається з хроматогра фічн у колонку або гельфільтраційну клітин СНО, клітин ВНК або клітин НЕК. колонку; і d) елюювання похідної фактора VII. Цей винахід стосується нових похідних фактора коагуляції VII людини, поліпептидів фактора VII, а також полінуклеотидних конструктів, що кодують такі поліпептиди, векторів та клітин-хазяїв, що містять та експресують полінуклеотид, фармацевтичних композицій, що містять похідні фактора VII, використання та методів лікування. Коагуляція крові - це процес, що складається зі складної взаємодії різних компонентів крові (або факторів), що зрештою викликає утворення фібринового згустку. Загалом, компоненти крові, які беруть участь у процесі, що має назву "каскад" коагуляції, є ферментативно неактивними білками (проферментами або зимогенами), що перетворюються на протеолітичні ферменти під дією активатора (який сам по собі є активованим фактором згортання). Фактори коагуляції, що зазнали такого перетворення, мають назву "активні фактори" та позначаються додаванням літери "а" до назви фактора коагуляції (наприклад, Фактор Vlla). Початок гемостатичного процесу здійснюється формуванням комплексу між тканинним фактором, вивільненим внаслідок пошкодження стінки судини, і фактором VIIa. Цей комплекс потім перетворює фактори IX та X на їхні активні форми. Фактор Xa перетворює обмежену кількість протромбіну на тромбін на клітині, що несе тканинний фактор. Тромбін активує тромбоцити та фактори V та VIII на фактори Va та VIIIa, обидва кофактори в подальшому процесі, що приводить до повного вивільнення тромбіну. Цей процес включає утворення фактора Xa фактором IXa (в комплексі з фактором VIIIa) та відбувається на поверхні активованих тромбоцитів. Тромбін зрештою перетворює фібриноген на фібрин, що приводить до утворення фібринового згустку. Фактор VII - це глікопротеїн плазми в слідовій кількості, що циркулює в крові як одноланцюговий зимоген. Зимогени є каталітично неактивними. Одноланцюговий фактор VII може бути перетворений на дволанцюговий фактор VIIa фактором Xa, фактором XIIa, фактором IXa, фактором VIIa або тромбіном in vitro. Фактор Xa вважається го ловним фізіологічним активатором фактора VII. Перетворення зимогену фактора VII на активовану дволанцюгову молекулу відбувається розщепленням внутрішнього Аrg152-llе153 пептидного зв'язку. Часто бажано стимулювати або селективно блокувати коагуляційний каскад пацієнта. Фактор VIIa використовували для лікування хвороб згортання крові, що мають кілька причин, такі як дефіцит фактора згортання (наприклад, гемофілія А та В або дефіцит факторів коагуляції Xl або VII) або інгібітори фактора згортання. Фактор VIIa також використовували для лікування надлишкових кровотеч, що мають місце в пацієнтів з нормально функціонуючим каскадом згортання крові (відсутній дефіцит фактора згортання або інгібіторів відносно будь-яких факторів коагуляції). Такі кровотечі можуть, наприклад, бути викликані дефектним функціонуванням тромбоцитів, тромбоцитопенією або псевдогемофілією. Кровотечі є також головною проблемою у зв'язку з операцією та іншими формами ушкодження тканини. [Європейський патент №200421] (Зимогенетика) стосується нуклеотидної послідовності, що кодує фактор VII людини, і рекомбінантної експресії фактора VII в клітинах ссавців. [Dickinson et al. (Proc. Natl. Acad. Sci. USA 93, 14379-14384, 1996] описує поліпептиди фактора VII, де L ys157, Val158, Glu296, Met298, Asp334, Ser336 або Lys337 були поодинці заміщені на Ala. Iwanaga et al. [Thromb. Haemost. (додаток, серпень 1999), 466, реферат 1474] описує варіанти фактора VIIa , де залишки 316-320 видалені, або залишки 311-322 заміщені на відповідні залишки трипсину. Антикоагулянти, такі як гепарин, кумарин, похідні кумарину, похідні індандіону або інші агенти, можуть бути використані для селективного блокування коагуляційного каскаду в пацієнта, наприклад, під час діалізу нирки, або для лікування глибоких тромбозів вен, розсіяної внутрішньосудинної коагуляції (PBК) та багатьох інши х захворювань. Наприклад, лікування гепарином або зовнішнє застосування іону цитрату [патент США 5 84831 6 №4500309] можуть бути використані в діалізі для [Міжнародна заявка №WO 96/12800] стосуєтьзапобігання коагуляції під час курсу лікування. Геся способу лікування гострих закупорок коронарної парин також використовується для запобігання артерії, а також окремої композиції, яка складаєтьглибоких тромбозів вен в пацієнтів під час операся з інактивованого фактора VIIa разом з тканинції. ним активатором плазміногену або стрептокінаЛікування гепарином та іншими антикоагулянзою. тами може, проте, мати небажані побічні ефекти. Більшість білків, що потрапляють у кровообіг, Наявні антикоагулянти загалом діють по всьому видаляються швидко зі ссавців з допомогою нирок. організмі, а не специфічно в якомусь місці. ГепаЦя проблема може бути частково вирішена вверин, наприклад, може викликати важкі кровотечі. денням більшої кількості білка або через повторне Крім того, з напівжиттям приблизно 80 хвилин, введення. Проте, вищі дози білка можуть викликагепарин швидко видаляється з крові, що потребує ти антитіла, які можуть зв'язувати та інактивува ти частого введення. Оскільки гепарин діє як кофакбілок та/або полегшувати видалення білка з оргатор для антитромбіну III (AT III), a AT III швидко нізму пацієнта. Повторне введення терапевтичнозменшується за лікування РВК, часто важко підго білка є значно неефективним та може бути нетримувати належне дозування гепарину, що побезпечним, оскільки воно може викликати требує безперервного спостереження за вмістом алергічну реакцію. AT III та гепарину. Гепарин є також неефективним, До різних спроб вирішити проблеми, пов'язані якщо AT III істотно знижується. Крім того, тривале з білковими терапіями, належать мікроенкапсулявикористання гепарину може також підвищува ти ція, системи доставки ліпосом, введення складеагрегацію тромбоцитів та зменшувати кількість них білків, а також хімічна модифікація. Найперстромбоцитів, а також брати участь у розвитку оспективнішими з них є модифікація терапевтичного теопорозу. Похідні індандіону можуть також мати білка ковалентним приєднанням полімерів поліалтоксичні побічні ефекти. кіленоксиду, зокрема поліетиленгліколю (ПЕГ). Окрім антикоагулянтів, що були коротко опиНаприклад, [патент США №4179337] описує викосані вище, були знайдені ще кілька природних білристання ПЕГ або поліпропіленгліколю, зв'язаного ків, що мають антикоагулянтну активність. Наприз білками для утворення фізіологічно активної неклад, Reutelingsperger [патент США №4736018] імуногенної водорозчинної поліпептидної композивиділив антикоагулянті білки з аорти бика та артеції. [Nucci et al.] описують кілька білків, що були рій пуповини людини. Maki et al. [патент США модифіковані додаванням ПЕГ, включаючи адено№4732891] описує виділені з плаценти людини зиндезамідазу, L-аспарагіназу, інтерферон альфа антикоагулянтні білки. Крім того, AT III був запро2b (IFN-a2b), супероксиддисмутазу, стрептокіназу, понований як терапевтичний антикоагулянт тканинний активатор плазміногену (тАП), урокіна[Schipper et al., Lancet 1 (8069): 854-856 (1978); зу, уриказу, гемоглобін, інтерлейкіни, інтерферони, Jordan, патент США №4386025; Bock et al., патент TGF-бета, EGF та інші фактори росту [Nucci et al., США №4517294]. 1991, Adv. Drug Delivery Rev. 4:133-151]. Ці спроби У приблизно 30% або більше пацієнтів, яких привели до подовження напівжиття білків та змелікували ангіопластією, ендартеректомією або ншення імуногенності білка. обхідними трансплантатами, тромбоз та/або проЗазвичай, ПЕГіляція білків включає активацію ліферація клітин гладеньких м'язів у вн утрішньому ПЕГ функціональною групою, яка реагуватиме із шарі судин викликає перетискання судини і, як залишками лізину на поверхні білка. Якщо модифінаслідок, зводить нанівець реконструктивну опекація білка відбувається до кінця, активність білка рацію. Це закриття судини як наслідок операції зазвичай втрачається. Модифікація процедури, відоме як рестеноз. Вважається, що рестеноз є яка дозволяє частково ПЕГілювати білок, зазвичай результатом комплексної взаємодії біологічних приводить до лише приблизно 50% втрати активпроцесів, включаючи відкладання тромбоцитів та ності та значно підвищує напівжиття в сироватці утворення тромбу, вивільнення хемотаксичних та так, що загальна ефективна доза білка є нижчою. мітогенних факторів, міграцію та проліферацію В останніх досягненнях у способах ПЕГіляції клітин гладеньких м'язів судин у внутрішній шар білка використовують активовані ПЕГ-реагенти, які судин розширеного артеріального сегменту. реагують з тіоловими групами білка, що приводить Інгібування накопичення тромбоцитів на місдо ковалентного приєднання ПЕГ до цистеїну, зацях механічного ушкодження може обмежувати лишку, що вставляють замість лізину білка. Shaw швидкість рестенозу людини. Тоді як накопичення et al. [патент США №5166322] описують специфічтромбоцитів відбувається на місцях гострих суні варіанти ІЛ-3, який містить цистеїн, вставлений динних ушкоджень, утворення тромбіну на цих в специфічні сайти природної послідовності аміномісцях може відповідати за активацію тромбоцитів кислот. Сульфгідрил-реактивні сполуки (наприта їх відповідне накопичення. клад, активований поліетиленгліколь) потім при[Міжнародна заявка №WO 92/15686] стосуєтьєднують до цих цистеїнових залишків реакцією з ся інактивованого фактора VIIa, полінуклеїнової ІЛ-3 варіантом. Katre et al. [патент США кислоти та клітинних ліній ссавців для утворення №5206344] описують специфічні ІЛ-2 варіанти, які інактивованого фактора VIIa та композицій, що містять цистеїн, вставлений в специфічній сайт у містять інактивований фактор VIIa для інгібування межах природної послідовності амінокислот. ІЛ-2 згортання крові. варіант потім реагує з активованим поліетиленглі[Міжнародна заявка №WO 94/27631] стосуєтьколем для приєднання цієї складової до цистеїну. ся способів інгібування рестенозу судин, активносНезважаючи на це, існує потреба в покращенні ті тканинного фактора та відкладання тромбоцитів. поліпептидів фактора VII, що мав би тривалу про 7 84831 8 коагулянтну або антикоагулянтну активність. Зокбез істотного зменшення активності поліпептиду рема, існує потреба в поліпептидах фактора VII, фактора VII. які мали би подовжене напівжиття в сироватці без У третьому аспекті винахід стосується поліпенебажаних побічних ефектів, таких як системна птиду фактора VII, що містить послідовність аміноактивація згортання крові та кровотеч, пов'язаних кислот послідовності №1 або її варіанта, де аміноіз загальноприйнятою терапією, і які можуть бути кислота, що відповідає амінокислоті, вибраній з введені за відносно низьких доз для уникнення R396, Q250 або Р406 послідовності №1, була заповторного введення більшої кількості білка. міщена на іншу амінокислоту. Зрозуміло, що перЦей винахід стосується нових поліпептидів ша літера R396, Q250 та Р406 представляє амінофактора коагуляції VII з такою самою або підвикислоту, що природно присутня в зазначеному щеною активністю порівняно з фактором VIIa дикоположенні послідовності №1. го типу та похідних фактора VII, що мають подовУ подальшому аспекті винахід стосується пожене напівжиття в сироватках. ліпептиду фактора VII, що містить послідовність Були визначені зони в молекулі фактора VIIa, амінокислот послідовності №1 або її варіанта, де де можливі зміни первинної структури, а також інші амінокислоти, здатні до кон'югації з хімічною грумодифікації без впливу або зменшення біологічної пою, були вставлені в межах послідовності №1 активності фактора VIIa. До зон у межах структури або її варіанта, у положення, де поліпептид факфактора VIIa, які були визначені як такі, що не бетора VII має майже таку саму активність або підруть участі у зв'язуванні з тканинним фактором вищену активність порівняно з рекомбінантним або фактором X, належать положення амінокислот фактором VIIa дикого типу людини. Зрозуміло, що з 247-260 та 393-406 послідовності №1. Зокрема амінокислота може бути вставлена в межах посліамінокислоти в положенні Q250, R396, та Р406 довності №1 без заміщення будь-якої амінокислопослідовності №1 були аналізовані на введення ти. Вставка амінокислоти може бути в тому самоцистеїнових залишків (Cys). Введення залишків му положенні в межах послідовності №1, де Cys супроводжувалось наступною кон'югацією з амінокислота зазнає подальшого заміщення. Тахімічною групою, наприклад, поліетиленгліколем ким чином, у першому втіленні вставка амінокис(ПЕГ), для того, щоб подовжити напівжиття похідлоти супроводжується наступним заміщенням аміного фактора VII в кровообігові. Цистеїн також нокислоти або навпаки. уводили в C-кінцеву послідовність послідовності У подальшому аспекті винахід стосується по№1 (означену як 407C), що супроводжувалось ліпептиду фактора VII, що містить послідовність подальшою кон'югацією з ПЕГ. Також це додаванамінокислот послідовності №1 або її варіанта, де ня цистеїну в С-кінцеву послідовність послідовносамінокислоти, здатні до кон'югації з хімічною груті №1 відбувається без зменшення протеолітичної пою, були додані до N- або C-кінцевої послідовноактивності поліпептидів фактора VIIa. Ці похідні сті №1 або її варіанта. фактора VII, наприклад, поліпептид фактора VII, Термін "амінокислота", що використовується в кон'югований з молекулою ПЕГ, є терапевтично цьому винаході, означає одну або кілька амінокискорисним за ситуацій, де пролонгований ефект лот. Зрозуміло, що амінокислота, яка заміщує аміполіпептидів фактора VII є бажаним, наприклад, за нокислоту або вставлена в, або додана до поліпеситуацій, де повторне введення або введення біптиду фактора VII, здатна до кон'югації з будьльшої кількості поліпептиду фактора VII є незручякою хімічною групою, що підвищуватиме справжним або проблематичним. Крім того, поліпептиди ню молекулярну масу поліпептиду фактора VII. До фактора VIIa цього винаходу з уведеними амінокицієї кон'югації з хімічною групою належить, окрім слотами (наприклад, залишком Cys), здатними до іншого, ковалентне приєднання поліетиленгліколю кон'югації з хімічною групою в певних положеннях (ПЕГ), монометоксиполіетиленгліколю, декстрану, у молекулі фактора VIIa , які не впливають на прополі-(N-вінілпіролідону) поліетиленгліколю, гомотеолітичну активність, можуть бути використані полімерів пропіленгліколю, кополімерів поліпропідля введення будь-якої функціональної групи леноксид/етиленоксиду, поліпропіленгліколю, покон'югата фактора VII. ліоксіетильованих поліолів (наприклад, гліцеролу) У першому аспекті цей винахід стосується пота полівінілового спирту, коломінових кислот або ліпептиду фактора VII, що містить послідовність інших полімерів, основаних на вуглеводах, поліамінокислот послідовності №1 або її варіанта, де мерів амінокислот та похідних біотину. амінокислота була заміщена на іншу амінокислоту, Краще, якщо хімічна група є біосумісним, неде інша амінокислота здатна до кон'югації з хімічтоксичним, неімуногенним та водорозчинним поною групою, і де поліпептид фактора VII має майлімером. Краще, якщо хімічна група є водорозчинже таку саму активність або підвищену активність ною в усі х пропорціях. порівняно з рекомбінантним фактором VIIa дикого Це заміщення амінокислоти, вставка або дотипу людини. давання та кон'югація з хімічною групою відбуваУ другому аспекті винахід стосується поліпепється без істотного зменшення прокоагулянтної тиду фактора VII, що містить послідовність аміноактивності активованої форми похідної фактора VII кислот послідовності №1 або її варіанта, де амінопорівняно з рекомбінантним фактором VIIa дикого кислота, що відповідає амінокислоті в положенні, типу людини. вибраного з 247-260, 393-405 або 406 послідовноТермін "поліпептид фактора VII", що викориссті №1, була заміщена на іншу амінокислоту. Зротовується в цьому винаході, означає будь-який зуміло, що будь-яка амінокислота в положенні, білок, що містить послідовність амінокислот 1-406 вибраному з 247-260, 393-405 або 406 послідовноприродного фактора VII людини (послідовність сті №1, може бути заміщена на іншу амінокислоту №1) або його варіанти. Сюди належить, окрім ін 9 84831 10 шого, фактор VII людини, фактор VIIa людини та кон'юговану з амінокислотою поліпептиду фактора його варіанти. VIIa людини. Терміни "фактор VII", або "FVII", що викорисТермін "цистеїн-ПЕГільований фактор VIIa товуються в цьому винаході, означають продукт, людини" означає фактор VIIa, що містить молекущо є неактивованою формою (фактор VII). Термін лу ПЕГ, кон'юговану з сульфгідрильною групою "фактор VIIa", або "FVIIa", що використовується в цистеїну, введену у фактор VIIa людини. цьому винаході, означає продукт, що є активоваТермін "інша амінокислота", що використовуною формою (фактор VIIa). До них належать білки, ється в цьому винаході, означає одну або кілька що мають послідовності амінокислот 1-406 прироамінокислот, що відрізняються від тієї амінокислодного фактора VII людини або фактора VIIa. До ти, що природно присутня в цій позиції. До таких них також належать білки з трохи модифікованою належать, окрім іншого, амінокислоти, що можуть послідовністю амінокислот, наприклад, модифікобути кодовані полінуклеотидом. Краще, якщо інша ваний N-кінець, включаючи N-кінцеві видалення амінокислота є в природній L-формі та може бути або додавання амінокислот настільки, наскільки кодована полінуклеотидом. Особливим прикладом такі білки істотно зберігають активність фактора є L-цистеїн (Cys). VIIa. До "фактора VII" або "фактора VIIa", у межах Термін "активність", що використовується в означеного вище, також належать природні алецьому винаході, означає здатність поліпептиду льні варіації, що можуть існувати та відбуватися в фактора VII перетворювати його субстрат - фактор різних суб'єктах. Також, ступінь та розташування X на активний фактор Xa. Активність поліпептиду глікозилювання або інших посттрансляційних мофактора VII може бути виміряна з допомогою дифікацій може змінюватись залежно від обраних "Протеолізу In Vitro" (див. Приклад 6). клітин-хазяїв та природи внутрішньоклітинного Термін "поліетиленгліколь" або "ПЕГ" означає середовища. сполуку поліетиленгліколь або її похідну з або без Терміни "варіант" або "варіанти", як викорисзв'язуючих агентів, зв'язуючих або активаційних тано в цьому винаході, означає фактор VII людискладових (наприклад, з тіолом, трифлатом, трени, що має послідовність послідовності №1, де зилатом, азирдином, оксираном або краще, якщо з одна або кілька амінокислот вихідного білка були малеїмідом). Сполуки, такі як малеїмідмонометокзаміщені на інші амінокислоти та/або, де одна або си-ПЕГ є прикладом активованих ПЕГ-сполук викілька амінокислот вихідного білка були видалені находу. та/або, де одна або кілька амінокислот були встаУ подальшому аспекті винахід стосується повлені в білок та/або, де одна або кілька амінокисхідної фактора VII, що є поліпептидом фактора VII, лот були додані до вихідного білка. Такі додавання що має послідовність амінокислот послідовності можуть також мати місце або на N-кінці або на С№1 або її варіанта, де амінокислота була заміщекінці вихідного білка або на обох. на на іншу амінокислоту, де інша амінокислота Термін "істотно така сама активність або підкон'югована з хімічною групою, що збільшує справищена активність порівняно з рекомбінантним вжню молекулярну масу поліпептиду фактора VII з фактором VIIa дикого типу людини", як використаприблизно 300 дальтон до приблизно 100000 дано в цьому винаході, означає активність більш, ніж льтон, і де похідна фактора VII має майже таку 70% активності рекомбінантного фактора VIIa дисаму активність або підвищену активність порівнякого типу людини. У першому втіленні активність є но з рекомбінантним фактором VIIa дикого типу більш, ніж 80% активності рекомбінантного фактолюдини. ра VIIa дикого типу людини. В іншому втіленні акТермін "хімічна група", що використовується в тивність є більш, ніж 90% активності рекомбінантцьому винаході, означає одну або кілька хімічних ного фактора VIIa дикого типу людини. У груп. подальшому втіленні активність є більш, ніж 100% У подальшому аспекті винахід стосується поактивності рекомбінантного фактора VIIa дикого хідної фактора VII, що є поліпептидом фактора VII, типу людини. У подальшому втіленні активність є що складається з послідовності амінокислот побільш, ніж 120% активності рекомбінантного факслідовності №1 або її варіанта, де амінокислота, тора VIIa дикого типу людини. У подальшому втіщо відповідає амінокислоті в положенні, вибраноленні активність є більш, ніж 200% активності рему з 247-260, 393-405 або 406 послідовності №1, комбінантного фактора VIIa дикого типу людини. У була заміщена на іншу амінокислоту, де інша аміподальшому втіленні активність є більш, ніж 400% нокислота кон'югована з хімічною групою, що збіактивності рекомбінантного фактора VIIa дикого льшує справжню молекулярну масу поліпептиду типу людини. фактора VII з приблизно 300 дальтон до приблизТермін "похідна фактора VII", що використовуно 100000 дальтон, і де похідна фактора VII має ється в цьому винаході, означає поліпептид факмайже таку саму активність або підвищену активтора VII, що має послідовність послідовності №1 ність порівняно з рекомбінантним фактором VIIa або її варіанта, у котрій одна або кілька амінокисдикого типу людини. лот вихідного пептиду були хімічно модифіковані, У подальшому аспекті винахід стосується понаприклад, алкілуванням, ПЕГілюванням, ацилюхідної фактора VII, що є поліпептидом фактора VII, ванням, естерифікацією або амідуванням тощо. До що складається з послідовності амінокислот поцього належить, окрім іншого, ПЕГільований факслідовності №1 або її варіанта, де амінокислота, тор VIIa людини, цистеїн-ПЕГільований фактор що відповідає амінокислоті, вибраній з R396, Q250 VIIa людини та його варіанти. або Р406 послідовності №1, була заміщена на Термін "ПЕГільований фактор VIIa людини" іншу амінокислоту, де інша амінокислота кон'югоозначає фактор VIIa, що містить молекулу ПЕГ, вана з хімічною групою, що збільшує справжню 11 84831 12 молекулярну масу поліпептиду фактора VII з примає майже таку саму активність або підвищену близно 300 дальтон до приблизно 100000 дальтон, активність порівняно з рекомбінантним фактором і де похідна фактора VII має майже таку саму акVIIa дикого типу людини. тивність або підвищену активність порівняно з реУ подальшому аспекті винахід стосується комкомбінантним фактором VIIa дикого типу людини. позиції, що містить похідну фактора VII, що є поліУ подальшому аспекті винахід стосується попептидом фактора VII, що складається з послідовхідної фактора VII, що є поліпептидом фактора VII, ності амінокислот послідовності №1 або її що складається з послідовності амінокислот поваріанта, де амінокислота була вставлена в межах слідовності №1 або її варіанта, де амінокислота послідовності №1 або її варіанта, і де амінокислобула вставлена в межах послідовності №1 або її та кон'югована з хімічною групою, що збільшує варіанта, і де амінокислота кон'югована з хімічною справжню молекулярну масу поліпептиду фактора групою, що збільшує справжню молекулярну масу VII з приблизно 300 дальтон до приблизно 100000 поліпептиду фактора VII з приблизно 300 дальтон дальтон, і де похідна фактора VII має майже таку до приблизно 100000 дальтон, і де похідна фактосаму активність або підвищену активність порівняра VII має майже таку саму активність або підвино з рекомбінантним фактором VIIa дикого типу щену активність порівняно з рекомбінантним факлюдини. тором VIIa дикого типу людини. У подальшому аспекті винахід стосується комУ подальшому аспекті винахід стосується попозиції, що містить похідну фактора VII, що є поліхідної фактора VII, що є поліпептидом фактора VII, пептидом фактора VII, що складається з послідовщо складається з послідовності амінокислот поності амінокислот послідовності №1 або її слідовності №1 або її варіанта, де амінокислоти варіанта, де амінокислоти були додані до N- або були додані до N- або C-кінцевої послідовності №1 С-кінцевої послідовності №1 або її варіанта, і де або її варіанта, і де амінокислота кон'югована з амінокислота кон'югована з хімічною групою, що хімічною групою, що збільшує справжню молекузбільшує справжню молекулярну масу поліпептиду лярну масу поліпептиду фактора VIl з приблизно фактора VII з приблизно 300 дальтон до приблиз300 дальтон до приблизно 100000 дальтон, і де но 100000 дальтон, і де похідна фактора VII має похідна фактора VII має майже таку саму активмайже таку саму активність або підвищену активність або підвищену активність порівняно з рекомність порівняно з рекомбінантним фактором VIIa бінантним фактором VIIa дикого типу людини. дикого типу людини. У подальшому аспекті винахід стосується комУ подальшому аспекті винахід стосується фапозиції, що містить похідну фактора VII, що є полірмацевтичної композиції, що містить похідну факпептидом фактора VII, що складається з послідовтора VII, що є поліпептидом фактора VII, що скланості амінокислот послідовності №1 або її дається з послідовності амінокислот послідовності варіанта, де амінокислота була заміщена на іншу №1 або її варіанта, де амінокислота була заміщеамінокислоту, де інша амінокислота кон'югована з на на іншу амінокислоту, де інша амінокислота хімічною групою, що збільшує справжню молекукон'югована з хімічною групою, що збільшує спралярну масу поліпептиду фактора VII з приблизно вжню молекулярну масу поліпептиду фактора VII з 300 дальтон до приблизно 100000 дальтон, і де приблизно 300 дальтон до приблизно 100000 дапохідна фактора VII має майже таку саму активльтон, і де похідна фактора VII має майже таку ність або підвищену активність порівняно з рекомсаму активність або підвищену активність порівнябінантним фактором VIIa дикого типу людини. но з рекомбінантним фактором VIIa дикого типу У подальшому аспекті винахід стосується комлюдини; та, за бажанням, фармацевтично прийняпозиції, що містить похідну фактора VII, що є політний носій. пептидом фактора VII, що складається з послідовУ подальшому аспекті винахід стосується фаності амінокислот послідовності №1 або її рмацевтичної композиції, що містить похідну факваріанта, де амінокислота, що відповідає амінокитора VII, що є поліпептидом фактора VII, що скласлоті в положенні, вибраного з 247-260, 393-405 дається з послідовності амінокислот послідовності або 406 послідовності №1, була заміщена на іншу №1 або її варіанта, де амінокислота, що відповіамінокислоту, де інша амінокислота кон'югована з дає амінокислоті в положенні, вибраного з 247хімічною групою, що збільшує справжню молеку260, 393-405 або 406 послідовності №1, була залярну масу поліпептиду фактора VII з приблизно міщена на іншу амінокислоту, де інша амінокисло300 дальтон до приблизно 100000 дальтон, і де та кон'югована з хімічною групою, що збільшує похідна фактора VII має майже таку саму активсправжню молекулярну масу поліпептиду фактора ність або підвищену активність порівняно з рекомVII з приблизно 300 дальтон до приблизно 100000 бінантним фактором VIIa дикого типу людини. дальтон, і де похідна фактора VII має майже таку У подальшому аспекті винахід стосується комсаму активність або підвищену активність порівняпозиції, що містить похідну фактора VII, що є поліно з рекомбінантним фактором VIIa дикого типу пептидом фактора VII, що складається з послідовлюдини; та, за бажанням, фармацевтично прийняності амінокислот послідовності №1 або її тний носій. варіанта, де амінокислота, що відповідає амінокиУ подальшому аспекті винахід стосується фаслоті, вибраної з R396, Q250 або Р406 послідоврмацевтичної композиції, що містить похідну факності №1, була заміщена на іншу амінокислоту, де тора VII, що є поліпептидом фактора VII, що склаінша амінокислота кон'югована з хімічною групою, дається з послідовності амінокислот послідовності що збільшує справжню молекулярну масу поліпеп№1 або її варіанта, де амінокислота, що відповітиду фактора VII з приблизно 300 дальтон до придає амінокислоті, вибраної з R396, Q250 або Р406 близно 100000 дальтон, і де похідна фактора VII послідовності №1, була заміщена на іншу аміноки 13 84831 14 слоту, де інша амінокислота кон'югована з хіміччає поліпептид фактора VII, що не здатен активуною групою, що збільшує справжню молекулярну вати фактор X або IX плазми. масу поліпептиду фактора VII з приблизно 300 У подальшому аспекті винахід стосується інакдальтон до приблизно 100000 дальтон, і де похідтивованої похідної фактора VII, де інактивований на фактора VII має майже таку саму активність поліпептид фактора VII, що складається з послідоабо підвищену активність порівняно з рекомбінанвності амінокислот послідовності №1 або її варіантним фактором VIIa дикого типу людини; та, за та, і що містить модифікацію в її каталітичному бажанням, фармацевтично прийнятний носій. центрі, де модифікація інгібує здатність поліпептиУ подальшому аспекті винахід стосується фаду фактора VII активувати фактор X або IX плазрмацевтичної композиції, що містить похідну факми, надалі кон'югований з хімічною групою, що тора VII, що є поліпептидом фактора VII, що склазбільшує справжню молекулярну масу інактивовадається з послідовності амінокислот послідовності ного поліпептиду фактора VII з приблизно 300 да№1 або її варіанта, де амінокислота була вставлельтон до приблизно 100000 дальтон. на в межах послідовності №1 або її варіанта, і де У подальшому аспекті винахід стосується інакамінокислота кон'югована з хімічною групою, що тивованої похідної фактора VII, де інактивований збільшує справжню молекулярну масу поліпептиду поліпептид фактора VII, що складається з послідофактора VII з приблизно 300 дальтон до приблизвності амінокислот послідовності №1 або її варіанно 100000 дальтон, і де похідна фактора VII має та, де амінокислота була заміщена на іншу аміномайже таку саму активність або підвищену активкислоту, де інша амінокислота здатна до кон'югації ність порівняно з рекомбінантним фактором VIIa з хімічною групою, і де поліпептид фактора VII має дикого типу людини; та, за бажанням, фармацевмайже таку саму активність або підвищену активтично прийнятний носій. ність порівняно з рекомбінантним фактором VIIa У подальшому аспекті винахід стосується фадикого типу людини, і що містить модифікацію в її рмацевтичної композиції, що містить похідну факкаталітичному центрі, де модифікація інгібує здаттора VII, що є поліпептидом фактора VII, що скланість поліпептиду фактора VII активувати фактор X дається з послідовності амінокислот послідовності або IX плазми, надалі кон'югований з хімічною гру№1 або її варіанта, де амінокислоти були додані пою, що збільшує справжню молекулярну масу до N- або С-кінцевої послідовності №1 або її варіінактивованого поліпептиду фактора VII з приблианта, і де амінокислота кон'югована з хімічною зно 300 дальтон до приблизно 100000 дальтон. групою, що збільшує справжню молекулярну масу У подальшому аспекті винахід стосується інакполіпептиду фактора VII з приблизно 300 дальтон тивованої похідної фактора VII, де інактивований до приблизно 100000 дальтон, і де похідна фактополіпептид фактора VII, що складається з послідора VII має майже таку саму активність або підвивності амінокислот послідовності №1 або її варіанщену активність порівняно з рекомбінантним факта, де амінокислота, що відповідає амінокислоті у тором VIIa дикого типу людини; та, за бажанням, положенні, вибраного з 247-260, 393-405 або 406 фармацевтично прийнятний носій. послідовності №1, була заміщена на іншу амінокиУ подальшому аспекті винахід стосується інакслоту, і що містить модифікацію в її каталітичному тивованого поліпептиду фактора VII, де поліпепцентрі, де модифікація інгібує здатність поліпептитид фактора VlI зазнає подальшої модифікації у ду фактора VII активувати фактор X або IX плазсвоєму каталітичному центрі, де модифікація інгіми, надалі кон'югований з хімічною групою, що бує здатність поліпептиду фактора VII активува ти збільшує справжню молекулярну масу інактивовафактор X або IX плазми. У першому втіленні інакного поліпептиду фактора VII з приблизно 300 дативований поліпептид фактора VII зазнає модифільтон до приблизно 100000 дальтон. кації в своєм у каталітичному центрі інгібітором У подальшому аспекті винахід стосується інаксеринової протеази. У подальшому втіленні інактивованої похідної фактора VII, де інактивований тивований поліпептид фактора VII зазнає модифіполіпептид фактора VII, що складається з послідокації у своєму каталітичному центрі пептидгаломевності амінокислот послідовності №1 або її варіантилкетоном, вибраним з групи, що складається з: та, де амінокислота, що відповідає амінокислоті, Phe-Phe-Arg хлорметилкетону, Phe-Phe-Arg хлорвибраної з R396, Q250 або Р406 послідовності метилкетону, D-Phe-Phe-Arg хлорметилкетону, D№1, була заміщена на іншу амінокислоту, і що Phe-Phe-Arg хлорметилкетону, Phe-Pro-Arg хлормістить модифікацію в її каталітичному центрі, де метилкетону, D-Phe-Pro-Arg хлорметилкетону, модифікація інгібує здатність фактора VII поліпепPhe-Pro-Arg хлорметилкетону, D-Phe-Pro-Arg хлотид активувати фактор X або IX плазми, надалі рметилкетону, L-Glu-Gly-Arg хлорметилкетону та кон'югований з хімічною групою, що збільшує D-Glu-Gly-Arg хлорметилкетону, Dansyl-Phe-Pheсправжню молекулярну масу інактивованого поліArg хлорметилкетону, Dansyl-Phe-Phe-Arg хлормепептиду фактора VII з приблизно 300 дальтон до тилкетону, Dansyl-D-Phe-Phe-Arg хлорметилкетоприблизно 100000 дальтон. ну, Dansyl-D-Phe-Phe-Arg хлорметилкетону, У подальшому аспекті винахід стосується інакDansyl-Phe-Pro-Arg хлорметилкетону, Dansyl-Dтивованої похідної фактора VII, де інактивований Phe-Pro-Arg хлорметилкетону, Dansyl-Phe-Pro-Arg поліпептид фактора VII, що складається з послідохлорметилкетону, Dansyl-D-Phe-Pro-Arg хлормевності амінокислот послідовності №1 або її варіантилкетону, Dansyl-L-Glu-Gly-Arg хлорметилкетону та, де амінокислота, здатна до кон'югації з хімічта Dansyl-D-Glu-Gly-Arg хлорметилкетону. ною групою, була вставлена в межах Термін "інактивований поліпептид фактора послідовності №1 або її варіанта в положенні, де VII", що використовується в цьому винаході, ознаполіпептид фактора VII має майже таку саму активність або підвищену активність порівняно з реко 15 84831 16 мбінантним фактором VIIa дикого типу людини, і У подальшому аспекті винахід стосується комщо містить модифікацію в її каталітичному центрі, позиції, що містить інактивовану похідну фактора де модифікація інгібує здатність поліпептиду факVII, де інактивований поліпептид фактора VII, що тора VII активувати фактор X або IX плазми, надаскладається з послідовності амінокислот послідолі кон'югований з хімічною групою, що збільшує вності №1 або її варіанта, де амінокислота, що справжню молекулярну масу інактивованого полівідповідає амінокислоті, вибраної з R396, Q250 пептиду фактора VII з приблизно 300 дальтон до або Р406 послідовності №1, була заміщена на приблизно 100000 дальтон. іншу амінокислоту, і що містить модифікацію в її У подальшому аспекті винахід стосується інаккаталітичному центрі, де модифікація інгібує здаттивованої похідної фактора VII, де інактивований ність поліпептиду фактора VII активувати фактор X поліпептид фактора VII, що складається з послідоабо IX плазми, надалі кон'югований з хімічною грувності амінокислот послідовності №1 або її варіанпою, що збільшує справжню молекулярну масу та, де амінокислота, здатна до кон'югації з хімічінактивованого поліпептиду фактора VII з приблиною групою, була додана до N- або С-кінцевої зно 300 дальтон до приблизно 100000 дальтон. послідовності №1 або її варіанта, і що містить моУ подальшому аспекті винахід стосується комдифікацію в її каталітичному центрі, де модифікапозиції, що містить інактивовану похідну фактора ція інгібує здатність поліпептиду фактора VII актиVII, де інактивований поліпептид фактора VII, що вувати фактор X або IX плазми, надалі складається з послідовності амінокислот послідокон'югований з хімічною групою, що збільшує вності №1 або її варіанта, де амінокислота, здатна справжню молекулярну масу інактивованого полідо кон'югації з хімічною групою, була вставлена в пептиду фактора VII з приблизно 300 дальтон до межах послідовності №1 або її варіанта в полоприблизно 100000 дальтон. женні, де поліпептид фактора VII має майже таку У подальшому аспекті винахід стосується комсаму активність або підвищену активність порівняпозиції, що містить інактивовану похідну фактора но з рекомбінантним фактором VIIa дикого типу VII, де інактивований поліпептид фактора VII, що людини, і що містить модифікацію в її каталітичскладається з послідовності амінокислот послідоному центрі, де модифікація інгібує здатність полівності №1 або її варіанта, і що містить модифікапептиду фактора VII активувати фактор X або IX цію в її каталітичному центрі, де модифікація інгіплазми, надалі кон'югований з хімічною групою, бує здатність поліпептиду фактора VII активува ти що збільшує справжню молекулярну масу інактифактор X або IX плазми, надалі кон'югований з вованого поліпептиду фактора VII з приблизно 300 хімічною групою, що збільшує справжню молекудальтон до приблизно 100000 дальтон. лярну масу інактивованого поліпептиду фактора У подальшому аспекті винахід стосується комVII з приблизно 300 дальтон до приблизно 100000 позиції, що містить інактивовану похідну фактора дальтон. VII, де інактивований поліпептид фактора VII, що У подальшому аспекті винахід стосується комскладається з послідовності амінокислот послідопозиції, що містить інактивовану похідну фактора вності №1 або її варіанта, де амінокислота, здатна VII, де інактивований поліпептид фактора VII, що до кон'югації з хімічною групою, була додана до Nскладається з послідовності амінокислот послідоабо C-кінцевої послідовності №1 або її варіанта, і вності №1 або її варіанта, де амінокислота була що містить модифікацію в її каталітичному центрі, заміщена на іншу амінокислоту, де інша амінокисде модифікація інгібує здатність поліпептиду факлота здатна до кон'югації з хімічною групою, і де тора VII активувати фактор X або IX плазми, надаполіпептид фактора VII має майже таку саму актилі кон'югований з хімічною групою, що збільшує вність або підвищену активність порівняно з рекосправжню молекулярну масу інактивованого полімбінантним фактором VIIa дикого типу людини, і пептиду фактора VII з приблизно 300 дальтон до що містить модифікацію в її каталітичному центрі, приблизно 100000 дальтон. де модифікація інгібує здатність поліпептиду факУ подальшому аспекті винахід стосується фатора VII активувати фактор X або IX плазми, надармацевтичної композиції, що містить інактивовану лі кон'югований з хімічною групою, що збільшує похідну фактора VII, де інактивований поліпептид справжню молекулярну масу інактивованого поліфактора VII, що складається з послідовності аміпептиду фактора VII з приблизно 300 дальтон до нокислот послідовності №1 або її варіанта, і що приблизно 100000 дальтон. містить модифікацію в її каталітичному центрі, де У подальшому аспекті винахід стосується коммодифікація інгібує здатність поліпептиду фактора позиції, що містить інактивовану похідну фактора VII активувати фактор X або IX плазми, надалі VII, де інактивований поліпептид фактора VII, що кон'югований з хімічною групою, що збільшує складається з послідовності амінокислот послідосправжню молекулярну масу інактивованого полівності №1 або її варіанта, де амінокислота, що пептиду фактора VII з приблизно 300 дальтон до відповідає амінокислоті в положенні, вибраного з приблизно 100000 дальтон; та, за бажанням, фар247-260, 393-405 або 406 послідовності №1, була мацевтично прийнятний носій. заміщена на іншу амінокислоту, і що містить моУ подальшому аспекті винахід стосується фадифікацію в її каталітичному центрі, де модифікармацевтичної композиції, що містить інактивовану ція інгібує здатність поліпептиду фактора VII актипохідну фактора VII, де інактивований поліпептид вувати фактор X або IX плазми, надалі фактора VII, що складається з послідовності амікон'югований з хімічною групою, що збільшує нокислот послідовності №1 або її варіанта, де амісправжню молекулярну масу інактивованого полінокислота була заміщена на іншу амінокислоту, де пептиду фактора VII з приблизно 300 дальтон до інша амінокислота здатна до кон'югації з хімічною приблизно 100000 дальтон. групою, і де поліпептид фактора VII має майже 17 84831 18 таку саму активність або підвищену активність нокислота, здатна до кон'югації з хімічною групою, порівняно з рекомбінантним фактором VIIa дикого була додана до N- або С-кінцевої послідовності типу людини, і що містить модифікацію в її каталі№1 або її варіанта, і що містить модифікацію в її тичному центрі, де модифікація інгібує здатність каталітичному центрі, де модифікація інгібує здатполіпептиду фактора VII активувати фактор X або ність поліпептиду фактора VII активувати фактор X IX плазми, надалі кон'югований з хімічною групою, або IX плазми, надалі кон'югований з хімічною грущо збільшує справжню молекулярну масу інактипою, що збільшує справжню молекулярну масу вованого поліпептиду фактора VII з приблизно 300 інактивованого поліпептиду фактора VII з приблидальтон до приблизно 100000 дальтон; та, за базно 300 дальтон до приблизно 100000 дальтон; та, жанням, фармацевтично прийнятний носій. за бажанням, фармацевтично прийнятний носій. У подальшому аспекті винахід стосується фаУ подальшому аспекті винахід стосується пормацевтичної композиції, що містить інактивовану лінуклеотидного конструкту, що кодує поліпептид похідну фактора VII, де інактивований поліпептид фактора VII, що складається з послідовності аміфактора VII, що складається з послідовності амінокислот послідовності №1 або її варіанта, де амінокислот послідовності №1 або її варіанта, де амінокислота була заміщена на іншу амінокислоту, де нокислота, що відповідає амінокислоті в положенінша амінокислота здатна до кон'югації з хімічною ні, вибраного з 247-260, 393-405 або 406 групою, і де поліпептид фактора VII має майже послідовності №1, була заміщена на іншу амінокитаку саму активність або підвищену активність слоту, і що містить модифікацію в її каталітичному порівняно з рекомбінантним фактором VIIa дикого центрі, де модифікація інгібує здатність поліпептитипу людини. ду фактора VII активувати фактор X або IX плазУ подальшому аспекті винахід стосується поми, надалі кон'югований з хімічною групою, що лінуклеотидного конструкту, що кодує поліпептид збільшує справжню молекулярну масу інактивовафактора VII, що складається з послідовності аміного поліпептиду фактора VII з приблизно 300 данокислот послідовності №1 або її варіанта, де амільтон до приблизно 100000 дальтон; та, за бажаннокислота, що відповідає амінокислоті в положенням, фармацевтично прийнятний носій. ні, вибраного з 247-260, 393-405 або 406 У подальшому аспекті винахід стосується фапослідовності №1, була заміщена на іншу амінокирмацевтичної композиції, що містить інактивовану слоту. похідну фактора VII, де інактивований поліпептид У подальшому аспекті винахід стосується пофактора VII, що складається з послідовності амілінуклеотидного конструкту, що кодує поліпептид нокислот послідовності №1 або її варіанта, де аміфактора VII, що складається з послідовності амінокислота, що відповідає амінокислоті, вибраної з нокислот послідовності №1 або її варіанта, де аміR396, Q250 або Р406 послідовності №1, була занокислота, що відповідає амінокислоті, вибраної з міщена на іншу амінокислоту, і що містить модифіR396, Q250 або Р406 послідовності №1, була закацію в її .каталітичному центрі, де модифікація міщена на іншу амінокислоту. інгібує здатність поліпептиду фактора VII активуУ подальшому аспекті винахід стосується повати фактор X або IX плазми, надалі кон'югований лінуклеотидного конструкту, що кодує поліпептид з хімічною групою, що збільшує справжню молекуфактора VII, що складається з послідовності амілярну масу інактивованого поліпептиду фактора нокислот послідовності №1 або її варіанта, де аміVII з приблизно 300 дальтон до приблизно 100000 нокислота, здатна до кон'югації з хімічною групою, дальтон; та, за бажанням, фармацевтично прийнбула вставлена в межах послідовності №1 або її ятний носій. варіанта в положенні, де поліпептид фактора VII У подальшому аспекті винахід стосується фамає майже таку саму активність або підвищену рмацевтичної композиції, що містить інактивовану активність порівняно з рекомбінантним фактором похідну фактора VII, де інактивований поліпептид VIIa дикого типу людини. фактора VII, що складається з послідовності аміУ подальшому аспекті винахід стосується понокислот послідовності №1 або її варіанта, де амілінуклеотидного конструкту, що кодує поліпептид нокислота, здатна до кон'югації з хімічною групою, фактора VII, що складається з послідовності амібула вставлена в межах послідовності №1 або її нокислот послідовності №1 або її варіанта, де аміваріанта в положенні, де поліпептид фактора VII нокислота, здатна до кон'югації з хімічною групою, має майже таку саму активність або підвищену була додана до N- або С-кінцевої послідовності активність порівняно з рекомбінантним фактором №1 або її варіанта. VIIa дикого типу людини, і що містить модифікацію У першому втіленні полінуклеотидний консв її каталітичному центрі, де модифікація інгібує трукт є вектором. здатність поліпептиду фактора VII активувати факТермін "полінуклеотид" означає одно- або тор X або IX плазми, надалі кон'югований з хімічдволанцюговий полімер дезоксирибонуклеотидних ною групою, що збільшує справжню молекулярну або рибонуклеотидних основ, що читаються з 5' до масу інактивованога поліпептиду фактора VII з 3' кінця. До полінуклеотидів належать РНК та ДНК, приблизно 300 дальтон до приблизно 100000 дащо можуть бути виділені з природних джерел, синльтон; та, за бажанням, фармацевтично прийняттезовані in vitro або одержані з комбінації природний носій. них та синтетични х молекул. Довжина полінуклеоУ подальшому аспекті винахід стосується фатидної молекули наведена в цьому винаході в рмацевтичної композиції, що містить інактивовану термінах нуклеотидів (скорочено "нт") або пар оспохідну фактора VII, де інактивований поліпептид нов (скорочено "п.о."). Термін "нуклеотиди" викофактора VII, що складається з послідовності аміристовується для одно- та дволанцюгових моленокислот послідовності №1 або її варіанта, де амікул, де дозволяє контекст. Коли термін 19 84831 20 застосовується до дволанцюгової молекули, він тид фактора VII має майже таку саму активність використовується для означення загальної довжиабо підвищену активність порівняно з рекомбінанни та відповідає терміну "пара основ". Фахівцю в тним фактором VIIa дикого типу людини. галузі буде зрозуміло, що два ланцюги дволанцюУ подальшому аспекті винахід стосується еугового полінуклеотиду можуть відрізнятись трохи в каріотичної клітини-хазяя, що містить полінуклеодовжині, і що їх кінці можуть бути зміщені внаслітидний конструкт, що містить послідовність, що док ферментативного розщеплення; таким чином кодує поліпептид фактора VII, що складається з усі нуклеотиди в межах дволанцюгової молекули послідовності амінокислот послідовності №1 або її полінуклеотиду можуть бути непаровані. Такі неваріанта, де амінокислота, здатна до кон'югації з паровані кінці загалом не перебільшува тимуть хімічною групою, була додана до N- або С-кінцевої 20нт в довжині. послідовності №1 або її варіанта. Термін "вектор", як використано в цьому винаТермін "еукаріотична клітина-хазяїн", як викоході, означає будь-яку нуклеїнову кислоти, здатну ристано в цьому винаході, означає будь-яку клітидо ампліфікації в клітині-хазяї. Таким чином, векну, включаючи гібридні клітини, у котрій чужорідна тор може бути автономним реплікаційним вектоДНК може бути експресована. До типових клітинром, тобто вектором, який існує як екстрахромохазяїв належать, окрім іншого, клітини комах, клісомний об'єкт, реплікація котрого незалежна від тини дріжджів, клітини ссавців, включаючи клітини реплікації хромосоми, наприклад, плазміда. Як людини, такі як BHK, CHO, HEK та COS. У втіленні альтернатива, вектор може бути вектором, котрий цього винаходу краще, якщо клітини-хазяї, що підза введення в клітину-хазяя інтегрується в геном даються культивуванню, це клітини ссавців, ще клітини-хазяя та реплікується разом з хромосокраще, якщо усталена клітинна лінія ссавців, мою(мами), у котру він інтегрувався. Вибір вектора включаючи, окрім іншого, клітинні лінії CHO (начасто залежить від клітини-хазяя, у котру він має приклад, ATCC CCL 61), COS-1 (наприклад, ATCC бути введений. До векторів належать, окрім іншоCRL 1650), клітини нирок молодих ховрахів (BHK) го, плазмідні вектори, фагові вектори, віруси або та НЕК293 (наприклад, ATCC CRL 1573; Graham et космідні вектори. Вектори зазвичай містять почаal., J. Gen. Viral. 36:59-72, 1977). ток реплікації та щонайменше один селективний Кращою клітинною лінією BHK є клітинна лінія ген, тобто, ген, який кодує продукт, котрий легко tk- ts13 BHK (Waechter та Baserga, Proc. Natl. Acad. визначається або присутність котрого є необхідSci. USA 79:1106-1110,1982), у цьому винаході ною для росту клітин. надалі означена як клітини BHK 570. Клітинна лінія У подальшому аспекті винахід стосується еуBHK 570 знаходиться в American Type Culture каріотичної клітини-хазяя, що містить полінуклеоCollection, 12301 Parklawn Dr., Rockville, MD 20852, тидний конструкт, що містить послідовність, що під ATCC номером доступу CRL 10314. Клітинна кодує поліпептид фактора VII, що складається з лінія tk- ts13 BHK також знаходиться під ATCC нопослідовності амінокислот послідовності №1 або її мером доступу CRL 1632. варіанта, де амінокислота була заміщена на іншу До інших придатних клітинних ліній належать, амінокислоту, де інша амінокислота здатна до окрім іншого, Rat Hep I (гепатома щура; ATCC CRL кон'югації з хімічною групою, і де поліпептид фак1600), Rat Hep Il (гепатома щура; ATCC CRL 1548), тора VII має майже таку саму активність або підTCMK (ATCC CCL 139), Human lung (ATCC HB вищену активність порівняно з рекомбінантним 8065), NCTC 1469 (ATCC CCL 9.1) та клітини фактором VIIa дикого типу людини. DUKX (Urlaub та Chasin, Proc. Natl. Acad. Sci. USA У подальшому аспекті винахід стосується еу77:4216-4220, 1980). Також корисними є 3Т3 клітикаріотичної клітини-хазяя, що містить полінуклеони, клітини Namalwa, мієломи та злиття мієлом з тидний конструкт, що містить послідовність, що іншими клітинами. У першому втіленні еукаріотичні кодує полівептид фактора VII, що складається з клітини-хазяї походять з клітин ссавців. У подальпослідовності амінокислот послідовності №1 або її шому втіленні еукаріотична клітина-хазяїн вибрана варіанта, де амінокислота, що відповідає амінокиз групи, що складається з клітин CHO, клітин BHK слоті в положенні, вибраного з 247-260, 393-405 або клітин HEK. або 406 послідовності №1, була заміщена на іншу У подальшому аспекті винахід стосується амінокислоту. трансгенної тварини, що експресує полінуклеотидУ подальшому аспекті винахід стосується еуний конструкт, що кодує поліпептид фактора VII, каріотичної клітини-хазяя, що містить полінуклеощо складається з послідовності амінокислот потидний конструкт, що містить послідовність, що слідовності №1 або її варіанта, де амінокислота кодує поліпептид фактора VII, що складається з була заміщена на іншу амінокислоту, де інша аміпослідовності амінокислот послідовності №1 або її нокислота здатна до кон'югації з хімічною групою, і варіанта, де амінокислота, що відповідає амінокиде поліпептид фактора VII має майже таку саму слоті, вибраної з R396, Q250 або Р406 послідовактивність або підвищену активність порівняно з ності №1, була заміщена на іншу амінокислоту. рекомбінантним фактором VIIa дикого типу людиУ подальшому аспекті винахід стосується еуни. каріотичної клітини-хазяя, що містить полінуклеоУ подальшому аспекті винахід стосується тидний конструкт, що містить послідовність, що трансгенної тварини, що експресує полінуклеотидкодує поліпептид фактора VII, що складається з ний конструкт, що кодує поліпептид фактора VII, послідовності амінокислот послідовності №1 або її що складається з послідовності амінокислот поваріанта, де амінокислота, здатна до кон'югації з слідовності №1 або її варіанта, де амінокислота, хімічною групою, була вставлена в межах послідощо відповідає амінокислоті в положенні, вибраного вності №1 або її варіанта в положенні, де поліпеп 21 84831 22 з 247-260, 393-405 або 406 послідовності №1, була но з рекомбінантним фактором VIIa дикого типу заміщена на іншу амінокислоту. людини. У подальшому аспекті винахід стосується У подальшому аспекті винахід стосується трансгенної тварини, що експресує полінуклеотидтрансгенної рослини, що експресує полінуклеотиний конструкт, що кодує поліпептид фактора VII, дний конструкт, що кодує поліпептид фактора VII, що складається з послідовності амінокислот пощо складається з послідовності амінокислот послідовності №1 або її варіанта, де амінокислота, слідовності №1 або її варіанта, де амінокислота, що відповідає амінокислоті, вибраної з R396, Q250 здатна до кон'югації з хімічною групою, була додаабо Р406 послідовності №1, була заміщена на на до N- або C-кінцевої послідовності №1 або її іншу амінокислоту. варіанта. У подальшому аспекті винахід стосується У подальшому аспекті винахід стосується спотрансгенної тварини, що експресує полінуклеотидсобу одержання поліпептиду фактора VII, спосіб, ний конструкт, що кодує поліпептид фактора VII, що складається з культивування в придатному що складається з послідовності амінокислот попоживному середовищі еукаріотичної клітинислідовності №1 або її варіанта, де амінокислота, хазяя, що містить полінуклеотидний конструкт, що здатна до кон'югації з хімічною групою, була встакодує поліпептид фактора VII, що складається з влена в межах послідовності №1 або її варіанта в послідовності амінокислот послідовності №1 або її положенні, де поліпептид фактора VII має майже варіанта, де амінокислота була заміщена на іншу таку саму активність або підвищену активність амінокислоту, де інша амінокислота здатна до порівняно з рекомбінантним фактором VIIa дикого кон'югації з хімічною групою, і де поліпептид фактипу людини. тора VII має майже таку саму активність або підУ подальшому аспекті винахід стосується вищену активність порівняно з рекомбінантним трансгенної тварини, що експресує полінуклеотидфактором VIIa дикого типу людини за умов, що ний конструкт, що кодує поліпептид фактора VII, дозволяють синтез білка з полінуклеотидного що складається з послідовності амінокислот поконструкту та виділення поліпептиду фактора VII з слідовності №1 або її варіанта, де амінокислота, культурального середовища. здатна до кон'югації з хімічною групою, була додаУ подальшому аспекті винахід стосується спона до N- або C-кінцевої послідовності №1 або її собу одержання поліпептиду фактора VII, спосіб, варіанта. що складається з культивування в придатному У подальшому аспекті винахід стосується поживному середовищі еукаріотичної клітинитрансгенної рослини, що експресує полінуклеотихазяя, що містить полінуклеотидний конструкт, що дний конструкт, що кодує поліпептид фактора VII, кодує поліпептид фактора VII, що складається з що складається з послідовності амінокислот попослідовності амінокислот послідовності №1 або її слідовності №1 або її варіанта, де амінокислота варіанта, де амінокислота, що відповідає амінокибула заміщена на іншу амінокислоту, де інша аміслоті в положенні, вибраного з 247-260, 393-405 нокислота здатна до кон'югації з хімічною групою, і або 406 послідовності №1, була заміщена на іншу де поліпептид фактора VII має майже таку саму амінокислоту за умов, що дозволяють синтез білка активність або підвищену активність порівняно з з полінуклеотидного конструкту та виділення полірекомбінантним фактором VIIa дикого типу людипептиду фактора VII з культурального середовини. ща. У подальшому аспекті винахід стосується У подальшому аспекті винахід стосується спотрансгенної рослини, що експресує полінуклеотид собу одержання поліпептиду фактора VII, спосіб, конструкт, що кодує поліпептид фактора VII, що що складається з культивування в придатному складається з послідовності амінокислот послідопоживному середовищі еукаріотичної клітинивності №1 або її варіанта, де амінокислота, що хазяя, що містить полінуклеотидний конструкт, що відповідає амінокислоті в положенні, вибраного з кодує поліпептид фактора VII, що складається з 247-260, 393-405 або 406 послідовності №1, була послідовності амінокислот послідовності №1 або її заміщена на іншу амінокислоту. варіанта, де амінокислота, що відповідає амінокиУ подальшому аспекті винахід стосується слоті, вибраної з R396, Q250 або Р406 послідовтрансгенної рослини, що експресує полінуклеотиності №1, була заміщена на іншу амінокислоту за дний конструкт, що кодує поліпептид фактора VII, умов, що дозволяють синтез білка з полінуклеотищо складається з послідовності амінокислот подного конструкту та виділення поліпептиду фактослідовності №1 або її варіанта, де амінокислота, ра VII з культурального середовища. що відповідає амінокислоті, вибраної з R396, Q250 У подальшому аспекті винахід стосується споабо Р406 послідовності №1, була заміщена на собу одержання поліпептиду фактора VII, спосіб, іншу амінокислоту. що складається з культивування в придатному У подальшому аспекті винахід стосується поживному середовищі еукаріотичної клітинитрансгенної рослини, що експресує полінуклеотихазяя, що містить полінуклеотидний конструкт, що дний конструкт, що кодує поліпептид фактора VII, кодує поліпептид фактора VII, що складається з що містить послідовність амінокислот послідовнопослідовності амінокислот послідовності №1 або її сті №1 або її варіанта, де амінокислота, здатна до варіанта, де амінокислота, здатна до кон'югації з кон'югації з хімічною групою, була вставлена в хімічною групою, була вставлена в межах послідомежах послідовності №1 або її варіанта в половності №1 або її варіанта в положенні, де поліпепженні, де поліпептид фактора VII має майже таку тид фактора VII має майже таку саму активність саму активність або підвищену активність порівняабо підвищену активність порівняно з рекомбінантним фактором VIIa дикого типу людини за умов, 23 84831 24 що дозволяють синтез білка з полінуклеотидного VII з молока, утвореного трансгенною твариною, конструкту та виділення поліпептиду фактора VII з що експресує полінуклеотидний конструкт, що кокультурального середовища. дує поліпептид фактора VII, що складається з поУ подальшому аспекті винахід стосується спослідовності амінокислот послідовності №1 або її собу одержання поліпептиду фактора VII, спосіб, варіанта, де амінокислота, здатна до кон'югації з що складається з культивування в придатному хімічною групою, була додана до N- або С-кінцевої поживному середовищі еукаріотичної клітинипослідовності №1 або її варіанта. хазяя, що містить полінуклеотидний конструкт, що У подальшому аспекті винахід стосується спокодує поліпептид фактора VII, що складається з собу одержання поліпептиду фактора VII, спосіб, послідовності амінокислот послідовності №1 або її що складається з культивування клітини трансгенваріанта, де амінокислота, здатна до кон'югації з ної рослини, що експресує полінуклеотидний консхімічною групою, була додана до N- або С-кінцевої трукт, що кодує поліпептид фактора VII, що міспослідовності №1 або її варіанта за умов, що дотить послідовність амінокислот послідовності №1 зволяють синтез білка з полінуклеотидного консабо її варіанта, де амінокислота була заміщена на трукту та виділення поліпептиду фактора VII з іншу амінокислоту, де інша амінокислота здатна культурального середовища. до кон'югації з хімічною групою, і де поліпептид У подальшому аспекті винахід стосується спофактор VII має майже таку саму активність або собу одержання поліпептиду фактора VII, спосіб, підвищену активність порівняно з рекомбінантним що складається з виділення поліпептиду фактора фактором VIIa дикого типу людини, та виділення VII з молока, утвореного трансгенною твариною, поліпептиду фактора VII з трансгенної рослини. що експресує полінуклеотидний конструкт, що коУ подальшому аспекті винахід стосується сподує поліпептид фактора VII, що складається з пособу одержання поліпептиду фактора VII, спосіб, слідовності амінокислот послідовності №1 або її що складається з культивування клітини трансгенваріанта, де амінокислота була заміщена на іншу ної рослини, що експресує полінуклеотидний консамінокислоту, де інша амінокислота здатна до трукт, що кодує поліпептид фактора VII, що склакон'югації з хімічною групою, і де поліпептид факдається з послідовності амінокислот послідовності тора VII має майже таку саму активність або під№1 або її варіанта, де амінокислота, що відповівищену активність порівняно з рекомбінантним дає амінокислоті в положенні, вибраного з 247фактором VIIa дикого типу людини. 260, 393-405 або 406 послідовності №1, була заУ подальшому аспекті винахід стосується споміщена на іншу амінокислоту, та виділення поліпесобу одержання поліпептиду фактора VII, спосіб, птиду фактора VII з трансгенної рослини. що складається з виділення поліпептиду фактора У подальшому аспекті винахід стосується споVII з молока, утвореного трансгенною твариною, собу одержання поліпептиду фактора VII, спосіб, що експресує полінуклеотидний конструкт, що кощо складається з культивування клітини трансгендує поліпептид фактора VII, що складається з поної рослини, що експресує полінуклеотидний консслідовності амінокислот послідовності №1 або її трукт, що кодує поліпептид фактора VII, що склаваріанта, де амінокислота, що відповідає амінокидається з послідовності амінокислот послідовності слоті в положенні, вибраного з 247-260, 393-405 №1 або її варіанта, де амінокислота, що відповіабо 406 послідовності №1, була заміщена на іншу дає амінокислоті, вибраної з R396, Q250 або Р406 амінокислоту. послідовності №1, була заміщена на іншу амінокиУ подальшому аспекті винахід стосується спослоту, та виділення поліпептиду фактора VII з собу одержання поліпептиду фактора VII, спосіб, трансгенної рослини. що складається з виділення поліпептиду фактора У подальшому аспекті винахід стосується споVII з молока, утвореного трансгенною твариною, собу одержання поліпептиду фактора VII, спосіб, що експресує полінуклеотидний конструкт, що кощо складається з культивування клітини трансгендує поліпептид фактора VII, що складається з поної рослини, що експресує полінуклеотидний консслідовності амінокислот послідовності №1 або її трукт, що кодує поліпептид фактора VII, що склаваріанта, де амінокислота, що відповідає амінокидається з послідовності амінокислот послідовності слоті, вибраної з R396, Q250 або Р406 послідов№1 або її варіанта, де амінокислота, здатна до ності №1, була заміщена на іншу амінокислоту. кон'югації з хімічною групою, була вставлена в У подальшому аспекті винахід стосується спомежах послідовності №1 або її варіанта в полособу одержання поліпептиду фактора VII, спосіб, женні, де поліпептид фактора VII має майже таку що складається з виділення поліпептиду фактора саму активність або підвищену активність порівняVII з молока, утвореного трансгенною твариною, но з рекомбінантним фактором VIIa дикого типу що експресує полінуклеотидний конструкт, що колюдини, та виділення поліпептиду фактора VII з дує поліпептид фактора VII, що складається з потрансгенної рослини. слідовності амінокислот послідовності №1 або її У подальшому аспекті винахід стосується споваріанта, де амінокислота, здатна до кон'югації з собу одержання поліпептиду фактора VII, спосіб, хімічною групою, була вставлена в межах послідощо складається з культивування клітини трансгенвності №1 або її варіанта в положенні, де поліпепної рослини, що експресує полінуклеотидний констид фактора VII має майже таку саму активність трукт, що кодує поліпептид фактора VII, що склаабо підвищену активність порівняно з рекомбінандається з послідовності амінокислот послідовності тним фактором VIIa дикого типу людини. №1 або її варіанта, де амінокислота, здатна до У подальшому аспекті винахід стосується спокон'югації з хімічною групою, була додана до Nсобу одержання поліпептиду фактора VII, спосіб, або С-кінцевої послідовності №1 або її варіанта, та що складається з виділення поліпептиду фактора 25 84831 26 виділення поліпептиду фактора VII з трансгенної та виділення поліпептиду фактора VII з культурарослини. льного середовища. У подальшому аспекті винахід стосується споУ подальшому втіленні винаходу спосіб одерсобу одержання похідної фактора VII, що складажання поліпептиду фактора VII складається з ється з етапів: культивування в придатному поживному середоа) створення поліпептиду фактора VII; вищі еукаріотичної клітини-хазяя, що містить поліб) кон'югації поліпептиду фактора VII з хімічнуклеотидний конструкт, що кодує поліпептид фаною групою; ктора VII, що складається з послідовності в) очищення похідної фактора VII з допомогою амінокислот послідовності №1 або її варіанта, де катіонобмінної хроматографії або гельфільтрації; і амінокислота, здатна до кон'югації з хімічною груг) елюювання похідної фактора VII. пою, була вставлена в межах послідовності №1 У подальшому аспекті винахід стосується споабо її варіанта в положенні, де поліпептид фактособу одержання інактивованої похідної фактора ра VII має майже таку саму активність або підвиVII, що складається з етапів: щену активність порівняно з рекомбінантним фака) створення поліпептиду фактора VII; тором VIIa дикого типу людини за умов, що б) модифікації поліпептиду фактора VII в її кадозволяють синтез білка з полінуклеотидного талітичному центрі інгібітором серинової протеази. конструкту та виділення поліпептиду фактора VII з в) кон'югації інактивованого поліпептиду факкультурального середовища. тора VII з хімічною групою; У подальшому втіленні винаходу спосіб одерг) очищення інактивованої похідної фактора жання поліпептиду фактора VII складається з VII з допомогою катіонобмінної хроматографії або культивування в придатному поживному середогельфільтрації; і вищі еукаріотичної клітини-хазяя, що містить полід) елюювання інактивованої похідної фактора нуклеотидний конструкт, що кодує поліпептид фаVII. ктора VII, що складається з послідовності У першому втіленні винаходу спосіб одержанамінокислот послідовності №1 або її варіанта, де ня поліпептиду фактора VII складається з культиамінокислота, здатна до кон'югації з хімічною грувування в придатному поживному середовищі еупою, була додана до N- або С-кінцевої послідовкаріотичної клітини-хазяя, що містить ності №1 або її варіанта за умов, що дозволяють полінуклеотидний конструкт, що кодує поліпептид синтез білка з полінуклеотидного конструкту та фактора VII, що складається з послідовності амівиділення поліпептиду фактора VII з культуральнокислот послідовності №1 або її варіанта, де аміного середовища. нокислота була заміщена на іншу амінокислоту, де У подальшому втіленні винаходу спосіб одерінша амінокислота здатна до кон'югації з хімічною жання поліпептиду фактора VII складається з вигрупою, і де поліпептид фактора VII має майже ділення поліпептиду фактора VII з молока, утворетаку саму активність або підвищену активність ного трансгенною твариною, що експресує порівняно з рекомбінантним фактором VIIa дикого полінуклеотидний конструкт, що кодує поліпептид типу людини за умов, що дозволяють синтез білка фактора VII, що складається з послідовності аміз полінуклеотидного конструкту та виділення полінокислот послідовності №1 або її варіанта, де аміпептиду фактора VII з культурального середовинокислота була заміщена на іншу амінокислоту, де ща. інша амінокислота здатна до кон'югації з хімічною У подальшому втіленні винаходу спосіб одергрупою, і де поліпептид фактора VII має майже жання поліпептиду фактора VII складається з таку саму активність або підвищену активність культивування в придатному поживному середопорівняно з рекомбінантним фактором VIIa дикого вищі еукаріотичної клітини-хазяя, що містить політипу людини. нуклеотидний конструкт, що кодує поліпептид фаУ подальшому втіленні винаходу спосіб одерктора VII, що складається з послідовності жання поліпептиду фактора VII складається з виамінокислот послідовності №1 або її варіанта, де ділення поліпептиду фактора VII з молока, утвореамінокислота, що відповідає амінокислоті в полоного трансгенною твариною, що експресує женні, вибраного з 247-260, 393-405 або 406 пополінуклеотидний конструкт, що кодує поліпептид слідовності №1, була заміщена на іншу амінокисфактора VII, що складається з послідовності амілоту за умов, що дозволяють синтез білка з нокислот послідовності №1 або її варіанта, де аміполінуклеотидного конструкту та виділення полінокислота, що відповідає амінокислоті в положенпептиду фактора VII з культурального середовині, вибраного з 247-260, 393-405 або 406 ща. послідовності №1, була заміщена на іншу амінокиУ подальшому втіленні винаходу спосіб одерслоту. жання поліпептиду фактора VII складається з У подальшому втіленні винаходу спосіб одеркультивування в придатному поживному середожання поліпептиду фактора VII складається з вивищі еукаріотичної клітини-хазяя, що містить поліділення поліпептиду фактора VII з молока, утворенуклеотидний конструкт, що кодує поліпептид фаного трансгенною твариною, що експресує ктора VII, що складається з послідовності полінуклеотидний конструкт, що кодує поліпептид амінокислот послідовності №1 або її варіанта, де фактора VII, що складається з послідовності аміамінокислота, що відповідає амінокислоті, вибранокислот послідовності №1 або її варіанта, де аміної з R396, Q250 або Р4С6 послідовності №1, була нокислота, що відповідає амінокислоті, вибраної з заміщена на іншу амінокислоту за умов, що дозвоR396, Q250 або Р406 послідовності №1, була заляють синтез білка з полінуклеотидного конструкту міщена на іншу амінокислоту. 27 84831 28 У подальшому втіленні винаходу спосіб одерпослідовності №1 або її варіанта в положенні, де жання поліпептиду фактора VII складається з виполіпептид фактора VII має майже таку саму актиділення поліпептиду фактора VII з молока, утворевність або підвищену активність порівняно з реконого трансгенною твариною, що експресує мбінантним фактором VIIa дикого типу людини, та полінуклеотидний конструкт, що кодує поліпептид виділення поліпептиду фактора VII з трансгенної фактора VII, що складається з послідовності амірослини. нокислот послідовності №1 або її варіанта, де аміУ подальшому втіленні винаходу спосіб одернокислота, здатна до кон'югації з хімічною групою, жання поліпептиду фактора VII складається з була вставлена в межах послідовності №1 або її культивування клітини трансгенної рослини, що варіанта в положенні, де поліпептид фактора VII експресує полінуклеотидний конструкт, що кодує має майже таку саму активність або підвищену поліпептид фактора VII, що складається з послідоактивність порівняно з рекомбінантним фактором вності амінокислот послідовності №1 або її варіанVIIa дикого типу людини. та, де амінокислота, здатна до кон'югації з хімічУ подальшому втіленні винаходу спосіб одерною групою, була додана до N- або С-кінцевої жання поліпептиду фактора VII складається з випослідовності №1 або її варіанта, та виділення ділення поліпептиду фактора VII з молока, утвореполіпептиду фактора VII з трансгенної рослини. ного трансгенною твариною, що експресує У подальшому аспекті винахід стосується виполінуклеотидний конструкт, що кодує поліпептид користання похідної фактора VII, що є поліпептифактора VII, що складається з послідовності амідом фактора VII, що складається з послідовності нокислот послідовності №1 або її варіанта, де аміамінокислот послідовності №1 або її варіанта, де нокислота, здатна до кон'югації з хімічною групою, амінокислота була заміщена на іншу амінокислоту, була додана до N- або С-кінцевої послідовності де інша амінокислота кон'югована з хімічною гру№1 або її варіанта. пою, що збільшує справжню молекулярну масу У подальшому втіленні винаходу спосіб одерполіпептиду фактора VII з приблизно 300 дальтон жання поліпептиду фактора VII складається з до приблизно 100000 дальтон, і де похідна фактокультивування клітини трансгенної рослини, що ра VII має майже таку саму активність або підвиекспресує полінуклеотидний конструкт, що кодує щену активність порівняно з рекомбінантним факполіпептид фактора VII, що складається з послідотором VIIa дикого типу людини для одержання вності амінокислот послідовності №1 або її варіанліків для лікування кровотеч або для підсилення та, де амінокислота була заміщена на іншу амінонормальної гемостатичної системи. кислоту, де інша амінокислота здатна до кон'югації Термін "лікування", як використано в цьому з хімічною групою, і де поліпептид фактора VII має винаході, означає введення ефективної кількості майже таку саму активність або підвищену активтерапевтично активної сполуки винаходу з метою ність порівняно з рекомбінантним фактором VIIa запобігання будь-яких симптомів або захворювандикого типу людини, та виділення поліпептиду ня, що тільки починаються, з метою лікування або фактора VII з трансгенної рослини. полегшення таких симптомів, або захворювання, У подальшому втіленні винаходу спосіб одерщо вже розвинулись. Термін "лікування" таким жання поліпептиду фактора VII складається з чином означає профілактичне лікування. культивування клітини трансгенної рослини, що Термін "підсилення нормальної гемостатичної експресує полінуклеотидний конструкт, що кодує системи" означає підсилення здатності утворюваполіпептид фактора VII, що складається з послідоти тромбін. вності амінокислот послідовності №1 або її варіанЯк використовується в цьому винаході, термін та, де амінокислота, що відповідає амінокислоті в "хвороби згортання крові" означає будь-який деположенні, вибраного з 247-260, 393-405 або 406 фект, успадкований, набутий або викликаний, що є послідовності №1, була заміщена на іншу амінокиклітинного або молекулярного походження, що слоту, та виділення поліпептиду фактора VII з виявляється в кровотечах. До прикладів належать: трансгенної рослини. дефіцит фактора згортання (наприклад, гемофілія У подальшому втіленні винаходу спосіб одерА і В або дефіцит факторів коагуляції Xl або VII), жання поліпептиду фактора VII складається з інгібітори фактора згортання, порушене функціокультивування клітини трансгенної рослини, що нування тромбоцитів, тромбоцитопенія або псевекспресує полінуклеотидний конструкт, що кодує догемофілія. поліпептид фактора VII, що складається з послідоТермін "кровотеча" означає неконтрольовану й вності амінокислот послідовності №1 або її варіаннадлишкову кровотечу, яка є головною проблемою та, де амінокислота, що відповідає амінокислоті, у зв'язку з операцією та іншими формами ушковибраної з R396, Q250 або Р406 послідовності дження тканини. Неконтрольована й надлишкова №1, була заміщена на іншу амінокислоту, та видікровотеча може відбуватися у пацієнтів, що мають лення поліпептиду фактора VII з трансгенної роснормальну систему коагуляції та пацієнтів, що лини. мають хвороби коагуляції або згортання крові. У подальшому втіленні винаходу спосіб одерДефіцит фактора згортання (гемофілія А і В, дефіжання поліпептиду фактора VII складається з цит факторів коагуляції Xl або VII) або інгібітори культивування клітини трансгенної рослини, що фактора згортання можуть бути причиною хвороб експресує полінуклеотидний конструкт, що кодує згортання крові. Надлишкові кровотечі також відполіпептид фактора VII, що складається з послідобуваються у пацієнтів з нормальним функціонуювності амінокислот послідовності №1 або її варіанчим каскадом згортання крові (відсутній дефіцит та, де амінокислота, здатна до кон'югації з хімічфактора згортання або інгібітори будь-яких фактоною групою, була вставлена в межах рів коагуляції) і можуть бути викликані порушеним 29 84831 30 функціонуванням тромбоцитів, тромбоцитопенією У подальшому аспекті винахід стосується виабо псевдогемофілією. За таких випадків, кровокористання похідної фактора VII, що є поліпептитечі можуть бути такими самими, як і кровотечі, дом фактора VII, що складається з послідовності викликані гемофілією, оскільки в гемостатичній амінокислот послідовності №1 або її варіанта, де системі, як і в гемофілії, не вистачає або існує амінокислота, що відповідає амінокислоті, вибранадлишок необхідних "сполук" згортання (таких як ної з R396, Q250 або Р406 послідовності №1, була тромбоцити або білковий фактор Фон Віллебранзаміщена на іншу амінокислоту, де інша амінокисда), що викликає більшість кровотеч. У пацієнтів, лота кон'югована з хімічною групою, що збільшує хто зазнав значного ушкодження тканини, пов'язасправжню молекулярну масу поліпептиду фактора ного з операцією або великою травмою, нормальVII з приблизно 300 дальтон до приблизно 100000 ний гемостатичний механізм може бути пригнічедальтон, і де похідна фактора VII має майже таку ний потребою негайного гомеостазу й може саму активність або підвищену активність порівняпочатися кровотеча, незважаючи на нормальний но з рекомбінантним фактором VIIa дикого типу гемостатичний механізм. Досягнення задовільного людини для одержання ліків для лікування кровогомеостазу є також проблемою, коли кровотечі теч або для підсилення нормальної гемостатичної відбуваються в органах, таких як мозок, внутрішнє системи. вухо та очі з обмеженою можливістю хірургічного У подальшому аспекті винахід стосується вигемостазу. Така сама проблема може виникнути в користання похідної фактора VII, що є поліпептипроцесі відібрання біопсій з різних органів (печінка, дом фактора VII, що складається з послідовності легені, тканина пухлин, шлунково-кишковий тракт), амінокислот послідовності №1 або її варіанта, де а також за лапароскопічної операції. Спільним для амінокислота була вставлена в межах послідовновсіх цих ситуацій є труднощі створення гомеостазу сті №1 або її варіанта, і де амінокислота кон'югохірургічними способами (шви, затискувачі тощо), вана з хімічною групою, що збільшує справжню що також має місце, коли кровотечі є дифузними молекулярну масу поліпептиду фактора VII з при(геморагічний гастрит та надмірні маточні кровотеблизно 300 дальтон до приблизно 100000 дальтон, чі). Гострі та надмірні кровотечі можуть також віді де похідна фактора VII має майже таку саму акбуватися у пацієнтів за антикоагулянтної терапії, в тивність або підвищену активність порівняно з реяких порушений гомеостаз був викликаний застокомбінантним фактором VIIa дикого типу людини сованою терапією. Такі пацієнти можуть потребудля одержання ліків для лікування кровотеч або вати хір ургічного втр учання у випадку, коли антидля підсилення нормальної гемостатичної систекоагулянтному ефектові потрібно швидко ми. протидіяти. Радикальну ретролобкову простатоекУ подальшому аспекті винахід стосується витомію зазвичай виконують для пацієнтів з місцекористання похідної фактора VII, що є поліпептивим раком простати. Операція часто ускладнюєтьдом фактора VII, що складається з послідовності ся значними та іноді великими втратами крові. амінокислот послідовності №1 або її варіанта, де Значні втрати крові під час простатоектомії голоамінокислоти були додані до N- або C-кінцевої вним чином стосуються ускладненої анатомічної послідовності №1 або її варіанта, і де амінокислоситуації з різноманітними щільно судинізованими та кон'югована з хімічною групою, що збільшує сайтами, до яких немає легкого доступу для хір урсправжню молекулярну масу поліпептиду фактора гічного гомеостазу, і який може призводить до диVII з приблизно 300 дальтон до приблизно 100000 фузної кровотечі з великою площею. До інших сидальтон, і де похідна фактора VII має майже таку туацій, що можуть викликати проблеми у випадку саму активність або підвищену активність порівнянезадовільного гомеостазу, належать такі, коли но з рекомбінантним фактором VIIa дикого типу пацієнтам з нормальним гемостатичним механізлюдини для одержання ліків для лікування кровомом призначають антикоагулянтну терапію для теч або для підсилення нормальної гемостатичної запобігання тромбоемболії. До таких терапій може системи. належати уведення гепарину, інши х форм протеоУ першому втіленні винаходу кровотечі пов'ягліканів, варфарину або інших форм антагоністів зані з гемофілією А або В. В іншому втіленні кровітаміну K, а також аспірину та інших інгібіторів вотечі пов'язані з гемофілією з набутими інгібітоагрегації тромбоцитів. рами. В іншому втіленні кровотечі пов'язані з У подальшому аспекті винахід стосується витромбоцитопенією. В іншому втіленні кровотечі користання похідної фактора VII, що є поліпептипов'язані з псевдогемофілією. В іншому втіленні дом фактора VII, що складається з послідовності кровотечі пов'язані з сильними ушкодженнями ткаамінокислот послідовності №1 або її варіанта, де нин. В іншому втіленні кровотечі пов'язані з сильамінокислота, що відповідає амінокислоті в полоними травмами. В іншому втіленні кровотечі пов'яженні, вибраного з 247-260, 393-405 або 406 позані з операцією. В іншому втіленні кровотечі слідовності №1, була заміщена на іншу амінокиспов'язані з лапароскопічною операцією. В іншому лоту, де інша амінокислота кон'югована з хімічною втіленні кровотечі пов'язані з геморагічним гастригрупою, що збільшує справжню молекулярну масу том. В іншому втіленні кровотечі є надмірними поліпептиду фактора VII з приблизно 300 дальтон маточними кровотечами. В іншому втіленні кроводо приблизно 100000 дальтон, і де похідна фактотечі відбуваються в органах з обмеженою можлира VII має майже таку саму активність або підвивістю для механічного гомеостазу. В іншому втіщену активність порівняно з рекомбінантним факленні кровотечі відбуваються в мозку, тором VIIa дикого типу людини для одержання внутрішньому вухо ві або очах. В іншому втіленні ліків для лікування кровотеч або для підсилення кровотечі пов'язані з процесом відібрання біопсій. нормальної гемостатичної системи. 31 84831 32 В іншому втіленні кровотечі пов'язані з антикоагудля підсилення нормальної гемостатичної систелянтною терапією. ми. Термін "суб'єкт", що використовується в цьому У подальшому аспекті винахід стосується вивинаході, означає будь-яку тварину, зокрема ссавкористання похідної фактора VII, що є поліпептиців, таких як людина, і може, де прийнятно, викодом фактора VII, що складається з послідовності ристовуватись рівнозначно з терміном "пацієнт". амінокислот послідовності №1 або її варіанта, де У подальшому аспекті винахід стосується виамінокислоти були додані до N- або C-кінцевої користання похідної фактора VII, що є поліпептипослідовності №1 або її варіанта, і де амінокислодом фактора VII, що складається з послідовності та кон'югована з хімічною групою, що збільшує амінокислот послідовності №1 або її варіанта, де справжню молекулярну масу поліпептиду фактора амінокислота була заміщена на іншу амінокислоту, VII з приблизно 300 дальтон до приблизно 100000 де інша амінокислота кон'югована з хімічною грудальтон, і де похідна фактора VII має майже таку пою, що збільшує справжню молекулярну масу саму активність або підвищену активність порівняполіпептиду фактора VII з приблизно 300 дальтон но з рекомбінантним фактором VIIa дикого типу до приблизно 100000 дальтон, і де похідна фактолюдини для одержання ліків для лікування кровора VII має майже таку саму активність або підвитеч або для підсилення нормальної гемостатичної щену активність порівняно з рекомбінантним факсистеми. тором VIIa дикого типу людини для одержання У подальшому аспекті винахід стосується споліків для лікування кровотеч або для підсилення собу лікування кровотеч, хвороб згортання крові нормальної гемостатичної системи. пацієнта або для підсилення нормальної гемостаУ подальшому аспекті винахід стосується витичної системи, спосіб, що складається з уведення користання похідної фактора VII, що є поліпептисуб'єктові за потреби терапевтично або профілакдом фактора VII, що складається з послідовності тично ефективної кількості похідної фактора VII, амінокислот послідовності №1 або її варіанта, де що є поліпептидом фактора VII, що складається з амінокислота, що відповідає амінокислоті в полопослідовності амінокислот послідовності №1 або її женні, вибраного з 247-260, 393-405 або 406 поваріанта, де амінокислота була заміщена на іншу слідовності №1, була заміщена на іншу амінокисамінокислоту, де інша амінокислота кон'югована з лоту, де інша амінокислота кон'югована з хімічною хімічною групою, що збільшує справжню молекугрупою, що збільшує справжню молекулярну масу лярну масу поліпептиду фактора VII з приблизно поліпептиду фактора VII з приблизно 300 дальтон 300 дальтон до приблизно 100000 дальтон, і де до приблизно 100000 дальтон, і де похідна фактопохідна фактора VII має майже таку саму активра VII має майже таку саму активність або підвиність або підвищену активність порівняно з рекомщену активність порівняно з рекомбінантним факбінантним фактором VIIa дикого типу людини. тором VIIa дикого типу людини для одержання У подальшому аспекті винахід стосується споліків для лікування кровотеч або для підсилення собу лікування кровотеч, хвороб згортання крові нормальної гемостатичної системи. пацієнта або для підсиленнянормальної гемостаУ подальшому аспекті винахід стосується витичної системи, спосіб, що складається з уведення користання похідної фактора VII, що є поліпептисуб'єктові за потреби терапевтично або профілакдом фактора VII, що складається з послідовності тично ефективної кількості похідної фактора VII, амінокислот послідовності №1 або її варіанта, де що є поліпептидом фактора VII, що складається з амінокислота, що відповідає амінокислоті, вибрапослідовності амінокислот послідовності №1 або її ної з R396, Q250 або Р406 послідовності №1, була варіанта, де амінокислота, що відповідає амінокизаміщена на іншу амінокислоту, де інша амінокисслоті в положенні, вибраного з 247-260, 393-405 лота кон'югована з хімічною групою, що збільшує або 406 послідовності №1, була заміщена на іншу справжню молекулярну масу поліпептиду фактора амінокислоту, де інша амінокислота кон'югована з VII з приблизно 300 дальтон до приблизно 100000 хімічною групою, що збільшує справжню молекудальтон, і де похідна фактора VII має майже таку лярну масу поліпептиду фактора VII з приблизно саму активність або підвищену активність порівня300 дальтон до приблизно 100000 дальтон, і де но з рекомбінантним фактором VIIa дикого типу похідна фактора VII має майже таку саму активлюдини для одержання ліків для лікування кровоність або підвищену активність порівняно з рекомтеч або для підсилення нормальної гемостатичної бінантним фактором VIIa дикого типу людини. системи. У подальшому аспекті винахід стосується споУ подальшому аспекті винахід стосується висобу лікування кровотеч, хвороб згортання крові користання похідної фактора VII, що є поліпептипацієнта або для підсилення нормальної гемостадом фактора VII, що складається з послідовності тичної системи, спосіб, що складається з уведення амінокислот послідовності №1 або її варіанта, де суб'єктові за потреби терапевтично або профілакамінокислота була вставлена в межах послідовнотично ефективної кількості похідної фактора VII, сті №1 або її варіанта, і де амінокислота кон'югощо є поліпептидом фактора VII, що складається з вана з хімічною групою, що збільшує справжню послідовності амінокислот послідовності №1 або її молекулярну масу поліпептиду фактора VII з приваріанта, де амінокислота, що відповідає амінокиблизно 300 дальтон до приблизно 100000 дальтон, слоті, вибраної з R396, Q250 або Р406 послідові де похідна фактора VII має майже таку саму акності №1, була заміщена на іншу амінокислоту, де тивність або підвищену активність порівняно з реінша амінокислота кон'югована з хімічною групою, комбінантним фактором VIIa дикого типу людини що збільшує справжню молекулярну масу поліпепдля одержання ліків для лікування кровотеч або тиду фактора VII з приблизно 300 дальтон до приблизно 100000 дальтон, і де похідна фактора VII 33 84831 34 має майже таку саму активність або підвищену но 100000 дальтон для одержання ліків для інгібуактивність порівняно з рекомбінантним фактором вання утворення тромбу в пацієнта. VIIa дикого типу людини. У подальшому аспекті винахід стосується виУ подальшому аспекті винахід стосується спокористання інактивованої похідної фактора VII, де собу лікування кровотеч, хвороб згортання крові інактивований поліпептид фактора VII, що складапацієнта або для підсилення нормальної гемостається з послідовності амінокислот послідовності тичної системи, спосіб, що складається з уведення №1 або її варіанта, де амінокислота, що відповісуб'єктові за потреби терапевтично або профілакдає амінокислоті в положенні, вибраного з 247тично ефективної кількості похідної фактора VII, 260, 393-405 або 406 послідовності №1, була защо є поліпептидом фактора VII, що складається з міщена на іншу амінокислоту, і що містить модифіпослідовності амінокислот послідовності №1 або її кацію в її каталітичному центрі, де модифікація варіанта, де амінокислота була вставлена в межах інгібує здатність поліпептиду фактора VII активупослідовності №1 або її варіанта, і де амінокисловати фактор X або IX плазми, надалі кон'югований та кон'югована з хімічною групою, що збільшує з хімічною групою, що збільшує справжню молекусправжню молекулярну масу поліпептиду фактора лярну масу інактивованого поліпептиду фактора VII з приблизно 300 дальтон до приблизно 100000 VII з приблизно 300 дальтон до приблизно 100000 дальтон, і де похідна фактора VII має майже таку дальтон для одержання ліків для інгібування утвосаму активність або підвищену активність порівнярення тромбу в пацієнта. но з рекомбінантним фактором VIIa дикого типу У подальшому аспекті винахід стосується вилюдини. користання інактивованої похідної фактора VII, де У подальшому аспекті винахід стосується споінактивований поліпептид фактора VII, що складасобу лікування кровотеч, хвороб згортання крові ється з послідовності амінокислот послідовності пацієнта або для підсилення нормальної гемоста№1 або її варіанта, де амінокислота, що відповітичної системи, спосіб, що складається з уведення дає амінокислоті, вибраної з R396, Q250 або Р406 суб'єктові за потреби терапевтично або профілакпослідовності №1, була заміщена на іншу амінокитично ефективної кількості похідної фактора VII, слоту, і що містить модифікацію в її каталітичному що є поліпептидом фактора VII, що складається з центрі, де модифікація інгібує здатність поліпептипослідовності амінокислот послідовності №1 або її ду фактора VII активувати фактор X або IX плазваріанта, де амінокислоти були додані до N- або ми, надалі кон'югований з хімічною групою, що C-кінцевої послідовності №1 або її варіанта, і де збільшує справжню молекулярну масу інактивоваамінокислота кон'югована з хімічною групою, що ного поліпептиду фактора VII з приблизно 300 дазбільшує справжню молекулярну масу поліпептиду льтон до приблизно 100000 дальтон для одержанфактора VII з приблизно 300 дальтон до приблизня ліків для інгібування утворення тромбу в но 100000 дальтон, і де похідна фактора VII має пацієнта. майже таку саму активність або підвищену активУ подальшому аспекті винахід стосується виність порівняно з рекомбінантним фактором VIIa користання інактивованої похідної фактора VII, де дикого типу людини. інактивований поліпептид фактора VII, що складаУ подальшому аспекті винахід стосується виється з послідовності амінокислот послідовності користання інактивованої похідної фактора VII, де №1 або її варіанта, де амінокислота, здатна до інактивований поліпептид фактора VII, що складакон'югації з хімічною групою, була вставлена в ється з послідовності амінокислот послідовності межах послідовності №1 або її варіанта в поло№1 або її варіанта, і що містить модифікацію в її женні, де поліпептид фактора VII має майже таку каталітичному центрі, де модифікація інгібує здатсаму активність або підвищену активність порівняність поліпептиду фактора VII активувати фактор X но з рекомбінантним фактором VIIa дикого типу або IX плазми, надалі кон'югований з хімічною грулюдини, і що містить модифікацію в її каталітичпою, що збільшує справжню молекулярну масу ному центрі, де модифікація інгібує здатність поліінактивованого поліпептиду фактора VII з приблипептиду фактора VII активувати фактор X або IX зно 300 дальтон до приблизно 100000 дальтон для плазми, надалі кон'югований з хімічною групою, одержання ліків для інгібування утворення тромбу що збільшує справжню молекулярну масу інактив пацієнта. вованого поліпептиду фактора VII з приблизно 300 У подальшому аспекті винахід стосується видальтон до приблизно 100000 дальтон для одеркористання інактивованої похідної фактора VII, де жання ліків для інгібування утворення тромбу в інактивований поліпептид фактора VII, що містить пацієнта. послідовність амінокислот послідовності №1 або її У подальшому аспекті винахід стосується виваріанта, де амінокислота була заміщена на іншу користання інактивованої похідної фактора VII, де амінокислоту, де інша амінокислота здатна до інактивований поліпептид фактора VII, що складакон'югації з хімічною групою, і де поліпептид факється з послідовності амінокислот послідовності тора VII має майже таку саму активність або під№1 або її варіанта, де амінокислота, здатна до вищену активність порівняно з рекомбінантним кон'югації з хімічною групою, була додана до Nфактором VIIa дикого типу людини, і що містить або С-кінцевої послідовності №1 або її варіанта, і модифікацію в її каталітичному центрі, де модифіщо містить модифікацію в її каталітичному центрі, кація інгібує здатність поліпептиду фактора VII де модифікація інгібує здатність поліпептиду факактивувати фактор X або IX плазми, надалі кон'ютора VII активувати фактор X або IX плазми, надагований з хімічною групою, що збільшує справжню лі кон'югований з хімічною групою, що збільшує молекулярну масу інактивованого поліпептиду справжню молекулярну масу інактивованого поліфактора VII з приблизно 300 дальтон до приблизпептиду фактора VII з приблизно 300 дальтон до 35 84831 36 приблизно 100000 дальтон для одержання ліків дає амінокислоті, вибраної з R396, Q250 або Р406 для інгібування утворення тромбу в пацієнта. послідовності №1, була заміщена на іншу амінокиУ подальшому аспекті винахід стосується спослоту, і що містить модифікацію в її каталітичному собу інгібування утворення тромбу в пацієнта, що центрі, де модифікація інгібує здатність поліпептискладається із застосування місцево на частину ду фактора VII активувати фактор X або IX плазсудини, сприйнятливої до утворення тромбу в пами, надалі кон'югований з хімічною групою, що цієнта, терапевтично ефективної дози композиції, збільшує справжню молекулярну масу інактивоващо містить інактивовану похідну фактора VII, де ного поліпептиду фактора VII з приблизно 300 даінактивований поліпептид фактора VII, що складальтон до приблизно 100000 дальтон. ється з послідовності амінокислот послідовності У подальшому аспекті винахід стосується спо№1 або її варіанта, і що містить модифікацію в її собу інгібування утворення тромбу в пацієнта, що каталітичному центрі, де модифікація інгібує здатскладається із застосування місцево на частину ність поліпептиду фактора VII активувати фактор X судини, сприйнятливої до утворення тромбу в паабо IX плазми, надалі кон'югований з хімічною груцієнта, терапевтично ефективної дози композиції, пою, що збільшує справжню молекулярну масу що містить інактивовану похідну фактора VII, де інактивованого поліпептиду фактора VII з приблиінактивований поліпептид фактора VII, що складазно 300 дальтон до приблизно 100000 дальтон. ється з послідовності амінокислот послідовності У подальшому аспекті винахід стосується спо№1 або її варіанта, де амінокислота, здатна до собу інгібування утворення тромбу в пацієнта, що кон'югації з хімічною групою, була вставлена в складається із застосування місцево на частину межах послідовності №1 або її варіанта в полосудини, сприйнятливої до утворення тромбу в паженні, де поліпептид фактора VII має майже таку цієнта, терапевтично ефективної дози композиції, саму активність або підвищену активність порівнящо містить інактивовану похідну фактора VII, де но з рекомбінантним фактором VIIa дикого типу інактивований поліпептид фактора VII, що складалюдини, і що містить модифікацію в її каталітичється з послідовності амінокислот послідовності ному центрі, де модифікація інгібує здатність полі№1 або її варіанта, де амінокислота була заміщепептиду фактора VII активувати фактор X або IX на на іншу амінокислоту, де інша амінокислота плазми, надалі кон'югований з хімічною групою, здатна до кон'югації з хімічною групою, і де поліпещо збільшує справжню молекулярну масу інактиптид фактора VII має майже таку саму активність вованого поліпептиду фактора VII з приблизно 300 або підвищену активність порівняно з рекомбінандальтон до приблизно 100000 дальтон. тним фактором VIIa дикого типу людини, і що місУ подальшому аспекті винахід стосується спотить модифікацію в її каталітичному центрі, де собу інгібування утворення тромбу в пацієнта, що модифікація інгібує здатність поліпептиду фактора складається із застосування місцево на частину VII активувати фактор X або IX плазми, надалі судини, сприйнятливої до утворення тромбу в пакон'югований з хімічною групою, що збільшує цієнта, терапевтично ефективної дози композиції, справжню молекулярну масу інактивованого поліщо містить інактивовану похідну фактора VII, де пептиду фактора VII з приблизно 300 дальтон до інактивований поліпептид фактора VII, що складаприблизно 100000 дальтон. ється з послідовності амінокислот послідовності У подальшому аспекті винахід стосується спо№1 або її варіанта, де амінокислота, здатна до собу інгібування утворення тромбу в пацієнта, що кон'югації з хімічною групою, була додана до Nскладається із застосування місцево на частину або С-кінцевої послідовності №1 або її варіанта, і судини, сприйнятливої до утворення тромбу в пащо містить модифікацію в її каталітичному центрі, цієнта, терапевтично ефективної дози композиції, де модифікація інгібує здатність поліпептиду факщо містить інактивовану похідну фактора VII, де тора VII активувати фактор X або IX плазми, надаінактивований поліпептид фактора VII, що складалі кон'югований з хімічною групою, що збільшує ється з послідовності амінокислот послідовності справжню молекулярну масу інактивованого полі№1 або її варіанта, де амінокислота, що відповіпептиду фактора VII з приблизно 300 дальтон до дає амінокислоті в положенні, вибраного з 247приблизно 100000 дальтон. 260, 393-405 або 406 послідовності №1, була заУ першому втіленні винаходу хімічна група є міщена на іншу амінокислоту, і що містить модифіобов'язково нейтральною. кацію в її каталітичному центрі, де модифікація Термін "нейтральний", що використовується в інгібує здатність поліпептиду фактора VII активуцьому винаході, стосується хімічної групи, що є вати фактор X або IX плазми, надалі кон'югований біосумісною, що означає, що вона є нетоксичною, з хімічною групою, що збільшує справжню молекунеімуногенною та водорозчинною. До хімічних лярну масу інактивованого поліпептиду фактора груп, що є обов'язково нейтральними, належать, VII з приблизно 300 дальтон до приблизно 100000 окрім іншого, поліетиленгліколь (ПЕГ), монометокдальтон. сиполіетиленгліколь, декстран, полi-(NУ подальшому аспекті винахід стосується сповінілпіролідон) поліетиленгліколь, гомополімери собу інгібування утворення тромбу в пацієнта, що пропіленгліколю, кополімери поліпропіленоксискладається із застосування місцево на частину ду/е тиленоксиду, поліпропіленгліколь, поліоксіетисудини, сприйнятливої до утворення тромбу в пальовані поліоли (наприклад, гліцерол) та полівініцієнта, терапевтично ефективної дози композиції, ловий спирт, коломінова кислота або інші що містить інактивовану похідну фактора VII, де полімери, основані на вуглеводах, полімери аміноінактивований поліпептид фактора VII, що складакислот та похідні біотину. ється з послідовності амінокислот послідовності У подальшому втіленні винаходу хімічна група №1 або її варіанта, де амінокислота, що відповіє водорозчинною. 37 84831 38 У подальшому втіленні винаходу хімічна група У подальшому втіленні винаходу заміщена, має молекулярну масу від приблизно 1000 дальвставлена або додана амінокислота - це сульфгідтон до приблизно 80000 дальтон. рилвмісна амінокислота, така як цистеїн. У подальшому втіленні винаходу хімічна група У подальшому втіленні поліпептиду фактора має молекулярну масу від приблизно 5000 дальVII амінокислота була вставлена в положення, тон до приблизно 60000 дальтон. вибране з 247-260, 393-405 або 406 послідовності У подальшому втіленні винаходу хімічна група №1. має молекулярну масу від приблизно 10000 дальУ подальшому втіленні поліпептиду фактора тон до приблизно 40000 дальтон. VII, амінокислота, що відповідає R396 послідовноУ подальшому втіленні винаходу хімічна група сті №1, була заміщена на іншу амінокислоту. має молекулярну масу від приблизно 500 дальтон У подальшому втіленні поліпептиду фактора до приблизно 20000 дальтон. VII, амінокислота, що відповідає Q250 послідовноУ подальшому втіленні винаходу хімічна група сті №1, була заміщена на іншу амінокислоту. має молекулярну масу від приблизно 500 дальтон У подальшому втіленні поліпептиду фактора до приблизно 5000 дальтон. VII, амінокислота, що відповідає Р406 послідовноУ подальшому втіленні винаходу хімічна група сті №1, була заміщена на іншу амінокислоту. має молекулярну масу від приблизно 750 дальтон У подальшому втіленні поліпептиду фактора до приблизно 5000 дальтон. VII додаткова амінокислота, здатна до кон'югації з У подальшому втіленні винаходу хімічна група хімічною групою, була вставлена в межах послідо- це поліетиленгліколь. вності №1 або її варіанта в положенні, де поліпепУ подальшому втіленні винаходу хімічна група тид фактора VII має майже таку саму активність вибрана з 1-6 молекул поліетиленгліколю. або підвищену активність порівняно з рекомбінанУ кращому втіленні винаходу хімічна група - це тним фактором VIIa дикого типу людини. одна молекула поліетиленгліколю. У подальшому втіленні поліпептиду фактора У подальшому втіленні винаходу хімічна група VII наступна амінокислота, здатна до кон'югації з - це монометоксиполіетиленгліколь. хімічною групою, була додана до N- або С-кінцевої У подальшому втіленні винаходу хімічна група послідовності №1 або її варіанта. - це декстран. У подальшому втіленні поліпептиду фактора У подальшому втіленні винаходу хімічна група VII амінокислоти були додані до С-кінцевої послі- це полі-(N-вінілпіролідон) поліетиленгліколь. довності №1. У подальшому втіленні винаходу хімічна група У подальшому втіленні поліпептиду фактора - це гомополімери пропіленгліколю. VlI амінокислоти були додані до N-кінцевої посліУ подальшому втіленні винаходу хімічна група довності №1. - це поліпропіленоксид. У подальшому втіленні поліпептиду фактора У подальшому втіленні винаходу хімічна група VII був доданий цистеїн. - це поліпропіленгліколь. У подальшому втіленні поліпептиду фактора У подальшому втіленні винаходу хімічна група VII був вставлений цистеїн. - це поліоксіетильований поліол. У подальшому втіленні поліпептиду фактора У подальшому втіленні винаходу хімічна група VII амінокислота, вибрана з групи, що складається - це полівініловий спирт. з K157, V158, Е296, М298, L305, D334, S336, K337 У подальшому втіленні винаходу хімічна група та F374 послідовності №1, була заміщена на іншу - це коломінова кислота. амінокислоту, яка підвищує активність порівняно з У подальшому втіленні винаходу хімічна група рекомбінантним фактором VIIa дикого типу люди- це полімер, оснований на вуглеводі. ни. У подальшому втіленні винаходу хімічна група У подальшому втіленні поліпептиду фактора - це полімер амінокислоти. VII амінокислота, що відповідає K157 послідовносУ подальшому втіленні винаходу хімічна група ті №1, була заміщена на амінокислоту, незалежно - це похідна біотину. вибрану з G, V, S, T, N , Q, D та E. У подальшому втіленні винаходу хімічна група У подальшому втіленні поліпептиду фактора кон'югована з вільною сульфгідрильною групою, VII амінокислота, що відповідає V158 послідовносприсутньою в амінокислоті, заміщеній на амінокиті №1, була заміщена на амінокислоту, незалежно слоту в поліпептиді, вставленій в або доданій до вибрану з S, T, N, Q, D та E. поліпептиду. У подальшому втіленні поліпептиду фактора У подальшому втіленні винаходу хімічна група VII амінокислота, що відповідає V158 послідовноскон'югована з цистеїном. ті №1, була заміщена на амінокислоту, незалежно У першому втіленні винаходу, заміщена, вставибрану з T та D. влена або додана амінокислота здатна до кон'юУ подальшому втіленні поліпептиду фактора гації з хімічною групою. VII амінокислота, що відповідає Е296 послідовносУ подальшому втіленні винаходу амінокислоті №1, була заміщена на амінокислоту, незалежно та, здатна до кон'югації з хімічною групою, - це вибрану з R, K та V. амінокислота з вільною сульфгідрильною групою. У подальшому втіленні поліпептиду фактора У подальшому втіленні винаходу амінокислоVII амінокислота, що відповідає Е296 послідовноста, здатна до кон'югації з хімічною групою, - це ті №1, була заміщена на V. цистеїн. У подальшому втіленні поліпептиду фактора VII амінокислота, що відповідає М298 послідовно 39 84831 40 сті №1, була заміщена на амінокислоту, незалежГістидин His H но вибрану з R, K, Q та N. Лізин Lys K У подальшому втіленні поліпептиду фактора Аргінін Arg R VII амінокислота, що відповідає М298 послідовноГлутамін Gin Q сті №1, була заміщена на Q. Аспарагін Asn N У подальшому втіленні поліпептиду фактора Глутамінова GIu E VII амінокислота, що відповідає L305 послідовності кислота №1, була заміщена на амінокислоту, незалежно Аспарагінова вибрану з A, V, L, І, M, F, W, P, G, S, T, C, Y, N, E, Asp D кислота K, R, H, D та Q. Серин Ser S У подальшому втіленні поліпептиду фактора Треонін Thr T VII амінокислота, що відповідає L305 послідовності №1, була заміщена на V. Винахід також стосується способу одержання У подальшому втіленні поліпептиду фактора поліпептидів фактора VII людини, як було згадано VII амінокислота, що відповідає D334 послідовносвище. Краще, якщо поліпептиди фактора VII люті №1, була заміщена на E. дини одержують способами рекомбінантної ДНК. У У подальшому втіленні поліпептиду фактора такому разі послідовності ДНК, що кодують фактор VII амінокислота, що відповідає S336 послідовносVII людини, можуть бути виділені одержанням геті №1, була заміщена на G. номної або кДНК бібліотеки та скринінгом послідоУ подальшому втіленні поліпептиду фактора вності ДНК, що кодує усю або частину білка, гібриVII амінокислота, що відповідає K337 послідовносдизацією, використовуючи синтетичні ті №1, була заміщена на амінокислоту, незалежно олігонуклеотидні зонди згідно зі стандартними вибрану з A, G, V, S, T, N, Q, D та E. способами [див. Sambrook et al., Molecular Cloning: У подальшому втіленні поліпептиду фактора Laboratory Manual, Cold Spring Harbor Laboratory, VII амінокислота, що відповідає K337 послідовносCold Spring Harbor, New York, 1989]. У цьому винаті №1, була заміщена на А. ході послідовність ДНК, що кодує білок, краще, У подальшому втіленні поліпептиду фактора якщо людського походження, тобто походить з VII амінокислота, що відповідає F374 послідовносгеномної ДНК людини або бібліотеки кДНК. ті №1, була заміщена на амінокислоту, незалежно Послідовності ДНК, що кодують поліпептиди вибрану з A, V, L, І, M, F, W, P, G, S, T, C, Y, N, E, фактора VII людини, можуть також бути одержані K, R, H, D та Q. синтетично з допомогою стандартних способів, У подальшому втіленні поліпептиду фактора наприклад, у фосфоамідитний спосіб, описаний VII амінокислота, що відповідає F374 послідовнос[Beaucage та Caruthers, Tetrahedron Letters 22 ті №1, була заміщена на P. (1981), 1859-1869], або у спосіб, описаний [Matthes У подальшому втіленні винаходу поліпептид et al., EMBO Journal 3 (1984), 801-805]. Згідно з фактора VII - це фактор VII людини. фосфоамідитним способом синтезуються олігонуУ подальшому втіленні винаходу поліпептид клеотиди, наприклад, в автоматичному ДНК синфактора VII - це фактор VIIa людини. тезаторі, очищені, гібридизовані, ліговані та клоУ цьому описі амінокислоти наведено з виконовані в придатні вектори. ристанням абревіатур, які наведені в таблиці, ухПослідовності ДНК може також бути одержані валеній IUPAC-IUB Комісією з біохімічної номенкполімеразною ланцюговою реакцією, використолатури (CBN). Амінокислоти та подібні сполуки, що вуючи специфічні праймери, наприклад, як описамають ізомери, представлені на ім'я або наступно в [патенті США 4683202, Saiki et al., Science 239 ною абревіатурою, знаходяться в природній L(1988), 487-491, або Sambrook et al., згаданий виформі, якщо тільки не вказано іншим чином. Крім ще]. того, ліві та праві кінці послідовності амінокислот Послідовності ДНК, що кодують поліпептиди пептиду є, відповідно, N- та С-кінцями, якщо тільки фактора VII людини, зазвичай вставлені в рекомне вказано інакше. бінантний вектор, який може бути будь-яким вектором, який може загальноприйнято бути підданий Таблиця процедурам рекомбінантної ДНК, де вибір вектора часто залежатиме від клітини-хазяя, в котру він Абревіатури амінокислот був уведений. Таким чином, вектор може бути автономним реплікаційним вектором, тобто вектоАмінокислота Трилітерний код Однолітерний код ром, який існує як екстрахромосомне утворення, Гліцин GIy G реплікація котрого незалежна від реплікації хромоПролін Pro P соми, наприклад, плазміда. Як альтернатива, векАланін AIa A тор може бути таким, щоб, коли був уведений в Валін VaI V клітину-хазяя, інтегрувався в геном клітини-хазяя Лейцин Leu L та реплікувався разом з хромосомою(мами), у котІзолейцин lIe I ру він інтегр увався. Метіонін Met M Краще, якщо вектором є експресійний вектор, Цистеїн Cys C у якому послідовність ДНК, що кодує поліпептиди Фенілаланін Phe F фактора VII людини, функціонально з'єднана з додатковими сегментами, потрібними для трансТирозин Туr Y крипції ДНК. Загалом, експресійний вектор одерТриптофан Тrр W 41 84831 42 жують з плазмідної або вірусної ДНК, або він може 1982, pp. 419-434] або ADH3 [McKnight et al., містити елементи обох. Термін, "функціонально EMBO J. 4, 1985, pp. 2093-2099] термінаторами. з'єднаний" означає, що сегменти розташовані так, Вектор може також містити набір сайтів сплайсинщо вони функціонують разом з однією метою, нагу РНК, розташованих нижче від промотору та виприклад, транскрипція починається в промоторі та ще від сайту вставки для самої послідовності факпродовжується через ДНК послідовність, що кодує тора VII. Кра щі сайти сплайсингу РНК можуть бути поліпептид. одержані з аденовірусу. та/або генів імуноглобуліПромотором може бути будь-яка послідовність нів. Також в експресійних векторах знаходиться ДНК, яка виявляє транскрипційну активність у вибсигнал поліаденілювання, розташований нижче від раній клітині-хазяїні та може походити з генів, що сайту вставки. Зокрема до кращих сигналів полікодують свої білки або чужорідні білки стосовно аденілювання належать ранні або пізні сигнали клітини-хазяя. поліаденілювання з SV40 [Kaufman та Sharp, там До прикладів придатних промоторів для спрясамо], сигнал поліаденілювання з ділянки EIb адемування транскрипції ДНК, що кодує поліпептид новірусу 5, термінатори гена гормону росту людифактора VII людини в клітинах ссавців, належить ни [DeNoto et al. Nuc. Acid Res. 9:3719-3730, 1981] SV40 промотор [Subramani et al., Mol. Cell Biol. 1 або сигнал поліаденілювання з гена фактора VII (1981), 854-864], МТ-1 (ген металотіонеїну) промолюдини або гена фактора VII бика. До експресійтор [Palmiter et al., Science 222 (1983), 809-814], них векторів може також належати некодуюча ліCMV промотор [Boshart et al., Cell 41:521-530, дерна послідовність вірусів, така як потрійна ліде1985] або головний пізній промотор аденовірусу 2 рна послідовність аденовірусу 2, розташована між [Kaufman та Sharp, Mol. Cell. Biol, 2:1304-1319, промотором і сайтами сплайсингу РНК; та енхан1982]. серні послідовності, такі як SV40 енхансер. До прикладів придатних промоторів для викоРекомбінантний вектор може, крім того, містиристання в клітинах комах належать полігедринові ти послідовність ДНК, що дозволяє вектору репліпромотори [патент США 4745051; Vasuvedan et al., куватися в клітині-хазяїні. Прикладом такої посліFEBS Lett. 311, (1992)7-11], Р10 промотор [J.M. довності (коли клітина-хазяїн є клітиною ссавців) є Vlak et al., J. Gen. Virology 69, 1988, pp. 765-776], початок реплікації SV40. промотор основного білка вірусу полігідрозу Коли клітиною-хазяїном є клітина дріжджів, Autographa californica [Європейський патент придатними послідовностями, що дозволяють век397485], промотор раннього гена 1 бакуловірусу торові реплікуватися, є гени реплікації REP 1-3 [патент США 5155037; патент США 5162222] або плазміди 2m дріжджів та початок реплікації. промотор раннього гена, що експресується із заВектор може також містити селективний мартримкою, бакуловірусу 39K [патент США 5155037; кер, наприклад, ген, продукт котрого доповнює патент США 5162222]. дефект у клітині-хазяї, такий як ген, що кодує дегіДо прикладів придатних промоторів для викодрофолатредуктазу (DHFR), ген TPI ристання в клітинах дріжджів-хазяїв належать Schizosaccharomyces pombe [описаний P.R. промотори з генів гліколізу дріжджів [Hitzeman et Russell, Gene 40, 1985, pp. 125-130] або ген, що al., J. Biol. Chem. 255 (1980), 12073-12080; Alber та надає резистентності до ліків, наприклад, ампіциKawasaki, J. Mol. Appl. Gen. 1 (1982), 419-434] або лін, канаміцин, тетрациклін, хлорамфенікол, неогени алкогольдегідрогенази [Young et al., in Genetic міцин, гігроміцин або метотрексат Для ниткоподібEngineering of Microorganisms for Chemicals них грибів, селективними маркерами є amdS, pyrG, (Hollaender et al., eds.), Plenum Press, New York, argB, niaD або sC. 1982)], ТРI1 [патент США 4599311] або ADH2-4c Для того, щоб спрямувати поліпептиди факто[Russell et al., Nature 304 (1983), 652-654] промотора VII людини цього винаходу на секреторний ри. шлях клітини-хазяя, секреторна сигнальна посліДо прикладів придатних промоторів для викодовність (також відома як лідерна послідовність, ристання в ниткоподібних грибах клітин-хазяїв препропослідовність або препослідовність) може належать, наприклад, ADH3 промотор [McKnight et бути введена в рекомбінантний вектор. Секреторal., EMBO J. 4 (1985), 2093-2099] або tpiA промона сигнальна послідовність приєднується до потор. До прикладів інших корисних промоторів наслідовностей ДНК, що кодують поліпептиди факлежать ті, що по ходять з гена, що кодує A. oryzae тора VII людини у вірній рамці зчитування. TAKA амілазу, Rhizomucor miehei аспартатпротеїСекреторні сигнальні послідовності зазвичай розташовані 5' до послідовності ДНК, що кодує пепназу, А. niger нейтральну a-амілазу, А. niger кислотид. Секреторна сигнальна послідовність може тостійку a-амілазу, А. niger або A. awamon глюкобути від цього ж білка або може бути з гена, що амілазу (gluA), Rhizomucor miehei ліпазу, A. oryzae кодує іншій секретований білок. лужну протеазу, A. oryzae тріозофосфатізомеразу Для секреції з клітин дріжджів секреторна сигабо А. nidulans ацетамідазу. Кращими є промотори нальна послідовність може кодувати будь-який ТАKА-амілази та gluA. Придатні промотори навесигнальний пептид, який забезпечує е фективне дені в, наприклад, [Європейському патенті 238023 спрямування експресованих поліпептидів фактора та Європейському патенті 383779]. VII людини на секреторний шлях клітини. СигнальПослідовності ДНК, що кодують поліпептиди ний пептид може бути природнім сигнальним пепфактора VII людини можуть також, за необхідності, тидом або його функціональною частиною, або це бути функціонально з'єднаними з придатними теможе бути синтетичний пептид. Придатними сигрмінаторами, такими як термінатори гормону росту людини [Palmiter еt al., Science 222, 1983, pp. 809нальними пептидами є a-фактор сигнальний пеп814], ТРl1 [Alber та Kawasaki, J. Mol. Appl. Gen. 1, тид [див. патент США 4870008], сигнальний пептид 43 84831 44 амілази слинних залоз миші [див. O. Hagenbuchle Genetics 7 (1981), 603, Graham та van der Eb, et al., Nature 289, 1981, pp. 643-646], модифіковаVirology 52 (1973), 456; та Neumann et al., EMBO ний сигнальний пептид карбоксипептидази [див. J.1(1982), 841-845]. L.A. Vails et al., Cell 48, 1987, pp. 887-897], сигнаСелективні маркери можуть бути введені в клільний пептид BAR1 дріжджів [див. WO 87/02670] тину в окремій плазміді одночасно з потрібним або сигнальний пептид аспарагінової протеази 3 геном або вони можуть бути введені в одну плаз(YAP3) дріжджів [див. M. Egel-Mitani et al., Vesi 6, міду. Якщо в одній плазміді, селективний маркер 1990, pp. 127-137]. та потрібний ген можуть бути під контролем різних Для ефективної секреції в дріжджах послідовпромоторів або одного промотору, останнє розтаність, що кодує лідерний пептид, може також бути шування веде до утворення дицистронної матриці. вставлена нижче від сигнальної послідовності та Конструкти цього типу відомі в галузі [наприклад, вище від послідовності ДНК, що кодує поліпептиди Levinson та Simonsen, патент США №4713339]. фактора VII людини. Функціонування лідерного Додавання додаткової ДНК може також бути перепептиду складається в тому, що експресований вагою, відомою як "ДНК-носій," до суміші, що ввопептид спрямовується з ендоплазматичного ретидиться в клітини. кулум у до апарату Гольджі та, крім того, до секреПісля того, як клітини прийняли ДНК, вони виторних везикул для секреції в культуральне серерощуються в прийнятному середовищі для зросдовище (тобто експорту поліпептидів фактора VII тання, типово 1-2 дні, для початку експресії потрілюдини через клітинну стінку або щонайменше бного гена. Як використано в цьому винаході, через клітинну мембрану у периплазматичний термін "прийнятне середовищі для зростання" простір дріжджової клітини). Лідерний пептид може означає середовище, що містить поживні речовибути лідерною послідовністю альфа-фактора дріни та інші компоненти, потрібні для росту клітин та жджів [використання якого описано, наприклад, в експресії потрібних поліпептидів фактора VII люпатенті США 4546082, патенті США 4870008, Євдини. Середовища загалом містять джерело вугропейському патенті 16201, Європейському патенлецю, джерело азоту, незамінні амінокислоти, неті 123294, Європейському патенті 123544 та Єврозамінні цукри, вітаміни, солі, фосфоліпіди, білки та пейському патенті 163529]. Як альтернатива, фактори росту. Для утворення g-карбоксильованих лідерним пептидом може бути синтетичний лідербілків краще, якщо середовище містить вітамін K ний пептид, який є лідерним пептидом, котрого не за концентрації від приблизно 0,1мкг/мл до приіснує в природі. Синтетичні лідерні пептиди моблизно 5мкг/мл. Селекцію з допомогою ліків потім жуть, наприклад, бути створені, як описано в [WO застосовують для селекції на ріст клітин, що по89/02463 або WO 92/11378]. стійно експресують селективний маркер. Для кліДля використання в ниткоподібних грибах сигтин, що були трансфіковані селективним маркенальний пептид може загальноприйнято бути одером, здатним до ампліфікації, концентрація ліків ржаним з гена, що кодує амілазу або глюкоамілазу може бути підвищена для селекції на збільшену Aspergillus sp., гена, що кодує ліпазу або протеазу кількість копій клонованих послідовностей, таким Rhizomucor miehei або ліпазу Humicola lanuginosa. чином підвищуючи рівень експресії. Клони стабіКраще, якщо сигнальний пептид походить з гена, льно трансфікованих клітин потім піддають скриніщо кодує TAKA амілазу A. oryzae, нейтральну aнгові на експресію потрібного поліпептиду фактора амілазу А. niger, кислотостійку амілазу А. niger або VII людини. глюкоамілазу А. niger. Придатні сигнальні пептиди Клітина-хазяїн, в котру вводять послідовності описані в, наприклад, [Європейському патенті ДНК, що кодують поліпептиди фактора VII людини, 238023 та Європейському патенті 215594]. може бути будь-якою клітиною, яка здатна до Для використання в клітинах комах, сигнальутворення посттрансляційно модифікованих поліний пептид може загальноприйнято бути одержапептидів фактора VII людини, і включає дріжджі, ним з гена комахи [див. WO 90/05783], такого як гриби та вищі е укаріотичної клітини. попередник сигнального пептиду адипокінетичного До прикладів клітинних ліній ссавців для викогормону лускокрилого Manduca sexta [див. патент ристання в цьому винаході належать: COS-1 США 5023328]. (ATCC CRL 1650), клітини нирок молодих ховрахів Процедури, що використовуються для з'єд(BHK) та 293 (ATCC CRL 1573; [Graham et al., J. нання послідовностей ДНК, що кодують поліпепGen. Virol. 36:59-72, 1977]). Кращою BHK клітинтиди фактора VII людини, з промотором та за баною лінією є tk- ts13 BHK [Waechter та Baserga, жанням термінаторами та/або секреторною Proc. Natl. Acad. Sci. USA 79:1106-1110, 1982, сигнальною послідовністю, відповідно, і для вставключений в цей винахід шляхом посилання], влення їх у придатні вектори, що містять інформаозначена надалі у цьому винаході як BHK 570 кліцію, необхідну для реплікації, є добре відомими тини. BHK 570 клітинна лінія була депонована в фа хівцям у галузі [див., наприклад, Sambrook et Американському типовому зібранні культур, 12301 al., Molecular Cloning: Laboratory Manual, Cold Parklawn Dr., Rockville, Md. 20852, під ATCC номеSpring Harbor, New York, 1989]. ром доступу CRL 10314. Клітинна лінія tk- ts13 BHK Способи трансфекції клітин ссавців та експреє також доступною під ATCC номером доступу сії послідовностей ДНК, введених у клітини, опиCRL 1632. Крім того, кілька інших клітинних ліній сані в, наприклад, [Kaufman та Sharp, J. Mol. Biol. можуть бути використані в межах цього винаходу, 159 (1982), 601-621; Southern та Berg, J. Mol. Appl. включаючи Rat Hep І (гепатома щура; ATCC CRL Genet. 1 (1982), 327-341; Loyter et al., Proc. Natl. 1600), Rat Hep Il (гепатома щура; ATCC CRL 1548), Acad. Sci. USA 79 (1982), 422-426; Wigler et al., Cell TCMK (ATCC CCL 139), легенів людини (ATCC HB 14 (1978), 725; Corsaro та Pearson, Somatic Cell 8065), NCTC 1469 (ATCC CCL 9.1), CHO (ATCC 45 84831 46 CCL 61) та клітини DUKX [Urlaub та Chasin, Proc. Трансформовані або трансфіковані клітиниNatl. Acad. Sci. USA 77:4216-4220, 1980]. хазяї, описані вище, потім культивують у придатДо прикладів придатних клітин дріжджів наленому поживному середовищі за умов, що дозвожать клітини Saccharomyces spp. або ляють експресію поліпептиду фактора VII людини, Schizosaccharomyces spp., зокрема штами після чого усі або частина пептиду, що утворився, Saccharomyces cerevisiae або Saccharomyces може бути виділена з культури. Середовище, що kluyveri. Способи трансформації клітин дріжджів використовується для культивування клітин, може чужорідною ДНК та одержання чужорідних поліпебути будь-яким загальноприйнятим середовищем, птидів описані, наприклад, у [патенті США придатним для вирощування клітин-хазяїв, таким 4599311, патенті США 4931373, патенті США як мінімальні або комплексні середовища, що міс4870008, 5037743, та патенті США 4845075, усі тять прийнятні додатки. Придатні середовища, включені сюди шляхом посилання]. Трансформодоступні від комерційних постачальників, можуть вані клітини вибираються по фенотипу, що визнабути одержані згідно з опублікованими рецептами чається по селективному маркеру, зазвичай рези(наприклад, у каталогах Американського типового стентністю до ліків або здатністю рости за зібрання культур). Поліпептид фактора VII людини, відсутності певної поживної речовини, наприклад, утворений клітинами, може потім бути одержаний лейцину. Кращим вектором для використання в з культурального середовища загальноприйнятидріжджах є вектор РОТ1, описаний в [патенті США ми процедурами, включаючи виділення клітин4931373]. Послідовностям ДНК, що кодують поліхазяїв з середовища центрифугуванням або фільпептиди фактора VII людини, можуть передувати труванням, осадженням білково-водних компоненсигнальна послідовність та, за бажанням, лідерна тів супернатанту або фільтрату з допомогою солі, послідовність, наприклад, як описано вище. Крім наприклад, сульфату амонію, очищення чисельтого, до прикладів придатних клітини дріжджів наними хроматографічними процедурами, наприлежать штами Kluyveromyces, такі як K. lactis, клад, іонообмінною хроматографією, гельфільтраHansenula, наприклад, H. polymorpha або Pichia, цією, хроматографією за спорідненістю тощо, наприклад, P. pastoris [див. Gleeson et al., J. Gen. залежно від типу поліпептиду, що потрібно виділяMicrobiol. 1321986, pp. 3459-3465; патент США ти. 4882279]. Для одержання рекомбінантних поліпептидів До прикладів інших клітин грибів належать кліфактора VII людини використовується клонована тини ниткоподібних грибів, наприклад, Aspergillus послідовність ДНК фактора VII дикого типу. Ця spp., Neunospora spp., Fusarium spp. або послідовність може бути модифікована так, щоб Trichoderma spp., зокрема штами A. oryzae, A. кодувати бажаний варіант фактора VII. Повні нукnidulans або А. niger. Використання Aspergillus spp. леотидні та послідовності амінокислот фактора VII для експресії білків описане в, наприклад, [Євролюдини є відомими. Дивіться [патент США пейському патенті 272277, Європейському патенті №4784950, який включений в цей винахід шляхом 238023, Європейському патенті 184438]. Трансфопосилання], де описано клонування та експресія рмація F. oxysporum може, наприклад, бути викорекомбінантного фактора VII людини. Послідовнана, як описано в [Malardier et al., 1989, Gene ність фактора VII бика, описана в [Takeya et al., J. 78:147-156]. Трансформація Trichoderma spp. моBiol. Chem, 263:14868-14372 (1988), який включеже бути виконана, наприклад, як описано в [Євроний в цей винахід шляхом посилання]. пейському патенті 244234]. Зміни послідовностей амінокислот можуть буКоли ниткоподібні гриби використовуються як ти досягнуті чисельними способами. Модифікація клітини-хазяї, вони можуть бути трансформовані послідовності ДНК може бути здійснена сайтконструктом ДНК винаходу загальноприйнятою специфічним мутагенезом. Способи сайтінтеграцією конструкту ДНК в хромосому хазяїна, специфічного мутагенезу є добре відомими в галущоб одержати рекомбінантну клітину-хазяя. Ця зі та описані, наприклад, в Zoller та Smith [DNA інтеграція загалом вважається переважною, оскі3:479-488,1984]. Таким чином, використовуючи льки більш імовірно, що послідовність ДНК стабінуклеотидні та амінокислотні послідовності фактольно підтримується в клітині. Інтеграція конструкра VII, можна впроваджувати будь-які зміни. тів ДНК в хромосому-хазяїна може бути виконана Послідовності ДНК для використання в межах згідно із загальноприйнятими способами, наприцього винаходу типово кодують пре-про пептид на клад, гомологічною або гетерологічною рекомбінааміно-кінці білкового фактора VII, щоб одержати цією. належний посттрансляційний процесинг (наприТрансформація клітин комах та одержання клад, g-карбоксилювання залишків глутамінової чужорідних поліпептидів у цьому винаході може кислоти) та секрецію з клітини-хазяя. Пре-про пепбути виконана, як описано в [патенті США тид може бути фактором VII або іншим вітамін K4745051; патенті США 4879236; патенті США залежним білком плазми, таким як фактор IX, фак5155037; 5162222; Європейському патенті 397485, тор X, протромбін, білок C або білок S. Як буде включені в цей винахід шляхом посилання]. Кліоцінено фахівцем у галузі, додаткові модифікації тинна лінія комах, що використовуються як хазяїн, можуть бути зроблені в послідовності амінокислот може бути клітинна лінія Lepidoptera, така як клітифактора VII, де ці модифікації незначно порушуни Spodoptere frugiperda або Trichoplusia nі [див. ють здатність білка діяти, як фактор коагуляції. патент США 5077214]. Умови культивування моНаприклад, фактор VII в каталітичній тріаді може жуть бути, як описано в, наприклад, [WO 89/01029 також бути модифікований в активаційному сайті або WO 89/01028, або в будь-яких з вищезгаданих розщеплення для інгібування перетворення зимопосилань]. гену фактора VII на його активовану дволанцюгову 47 84831 48 форму, що загалом описано в [патенті США ном, окрім іншого, є кращим включення щонайме№5288629, включеному в цей винахід шляхом нше кількох інтронів з, наприклад, гена bпосилання]. лактоглобуліну. Однією такою ділянкою є сегмент У межах цього винаходу трансгенна тваринна ДНК, який передбачає сплайсинг інтронів та політехнологія може бути використана для одержання аденілювання PHK з 3'- некодуючої ділянки гена bполіпептиду фактора VII людини. Краще, якщо лактоглобуліну вівці. Цей сегмент b-лактоглобуліну одержувати білки в молочних залозах самиці ссавівці, коли заміщений на природну 3'-некодуючу вця. Експресія в молочній залозі та наступна секпослідовність гена, може як підсилювати, так і стареція потрібного білка в молоко дозволяє подолабілізувати експресію потрібного білка або поліпепти багато складнощів, з котрими стикаються за тиду. У межах інших втілень ділянка, що оточує виділення білка з інших джерел. Молоко легко початок ATG-послідовності, що кодує поліпептид збирати, доступне у великий кількості та добре фактора VII людини, заміщена на відповідні посліописано біохімічно. Крім того, головні білки молока довності з молокоспецифічного гена білка. Таке присутні в молоці за високих концентрацій (типово заміщення сприяє тканиноспецифічним умовам з приблизно 1 до 15г/л). З комерційної точки зору ініціації для підсилення експресії. Є зручним заміабсолютно краще використовува ти як' хазяї види, щувати повністю пре-про послідовність поліпептищо мають великий вихід молока. У той час, як меду фактора VII людини та 5'-некодуючі послідовнші тварини, такі як миші та щури, можуть викориності на такі, як наприклад, з гена BLG, хоча стовуватись (і є кращими, як принциповий доказ) у можуть бути заміщені й менші ділянки. межах цього винаходу, краще використовувати Для експресії поліпептиду фактора VII людини стадних ссавців, включаючи, окрім іншого, свиней, в трансгенних тваринах сегмент ДНК, що кодує кіз, овець та крупний рогатий скот. Вівці є, зокреполіпептид фактора VII людини, є функціонально ма, кращими завдяки таким факторам, як поперез'єднаним з додатковими сегментами ДНК, потрібдня історія трансгенезу цих видів, вихід молока, ними для його експресії для одержання експресійвартість та наявність обладнання для збирання них одиниць. Такі додаткові сегменти містять вимолока. Дивіться [WIPO п ублікацію WO 88/00239] щезгаданий промотор, а також послідовності, які для порівняння факторів, що впливають на вибір передбачають термінацію транскрипції та поліадевиду хазяїна. Загалом бажано вибирати породу нілювання мРНК. Експресійні одиниці, крім того, тварини-хазяїна, що була виведена для молочного містять сегмент ДНК, що кодує секреторну сигнавикористання, така як вівці East Fnesland, або для льну послідовність, функціонально з'єднану з сегстворення молочного стада виведенням трансгенментом, що кодує поліпептид фактора VII людини. ної лінії пізніше. У будь-якому разі мають викорисСекреторна сигнальна послідовність може бути товуватись тварини, відомі гарним здоров'ям. природною секреторною сигнальною послідовнісЩоб одержати експресію в молочній залозі, тю поліпептиду фактора VII людини або може бути використовується транскрипція промотору з гена від іншого білка, такого як білок молока. Дивіться, білка молока. Гени білка молока містять ті гени, наприклад, [von Heinje, Nuc. Acid Res. 14: 4683що кодують казеїни [дивіться патент США 4690 (1986); та Meade et al., патент США №5304489, включений в цей винахід шляхом по№4873316, який включений в цей винахід шляхом силання], b-лактоглобулін, a-лактальбумін та сипосилання]. роватковий кислотний білок. Промотор bСтворення експресійних одиниць для викорислактоглобуліну (BLG) є кращим. У випадку гена bтання в трансгенних тваринах загальноприйнято лактоглобуліну вівці загалом використовується виконується вставленням послідовності, що кодує проксимальна ділянка щонайменше 406п.о. 5'поліпептид фактора VII людини, у плазміду або граничної послідовності гена, хоча більші ділянки фаговий вектор, що містять додаткові сегменти 5'-граничної послідовності до приблизно 5т.п.о. є ДНК, хоча експресійна одиниця може бути створекращими, такі як приблизно 4,25т.п.о. сегмент на зі з'єднань головним чином будь-яких послідовДНК, що вміщує 5'-граничний промотор та некодуностей. Зокрема є зручним створення вектора, що містить сегмент ДНК, що кодує білок молока, та ючу ділянку гена b-лактоглобуліну. Дивіться заміщува ти кодуючу послідовність білка молока на [Whitelaw et al., Biochem J. 286: 31-39 (1992)]. Є поліпептид фактора VII людини, таким чином також придатними подібні фрагменти промотору створюючи складений ген, що включає експресійні ДНК з інших видів. контрольні послідовності гена білка молока. У Інші ділянки гена b-лактоглобуліну можуть табудь-якому разі клонування експресійних одиниць кож бути включені в конструкти, як і геномні ділянв плазміди або інші вектори полегшує ампліфікаки гена, що має бути експресованим. Загалом у цію поліпептиду фактора VII людини. Ампліфікація галузі прийнято, що конструкти, яким бракує інтрозагальноприйнято виконується в бактеріальній нів, наприклад, експресуються погано порівняно з (наприклад, E. coli) клітині-хазяї, таким чином вектими, що містять такі послідовності ДНК [дивіться тори типово містять початок реплікації та селектиBrinster et al., Ргос. Natl. Acad. Sci. USA 85: 836-840 вний маркер, функціональний в бактеріальній клі(1988); Palmiter et al., Proc. Natl. Acad. Sci. USA тині-хазяї. 88:478-482 (1991); Whitelaw et al., Transgene Res. Експресійну одиницю потім уводять у заплід1:3-13 (1991); WO 89/01343; та WO 91/02318, кожнені яйця (включаючи ембріони на ранніх стадіях) ний з котрих включений в цей винахід шляхом пообраного виду хазяїна. Уведення чужорідної ДНК силання]. У цьому разі, загалом краще, де можлиможе бути досягнуте одним з кількох шляхів, во, використовува ти геномні послідовності, що включаючи мікроін'єкцію [наприклад, патент США містять усі або кілька природних інтронів гена, що №4873191], ретровірусну інфекцію [Jaenisch, кодує потрібний білок або поліпептид, таким чи 49 84831 50 Science 240:1468-1474 (1988)] або сайтScopes, R. Protein Purification. Springer-Verlag, N.Y., спрямовану інтеграцію, використовуючи ембріонні 1982]. Краще, якщо фактор VII має щонайменше стволові клітини (ES) [в огляді Bradley et al., приблизно 90-95% гомогенності, та 98-99% або Bio/Technology 10: 534-539 (1992)]. Яйця потім імбільше гомогенності ще краще для фармацевтичплантують в яйцеводи або матку псевдовагітних них використань. Після того, як фактор VII, очи щесамиць та залишають для дозрівання. Нащадки, ний частково або до гомогенності, що бажано, мощо несуть уведену ДНК в їх зародкові клітини, може потім використовуватись терапевтично. жуть передавати ДНК своїм нащадкам нормальПеретворення одноланцюгового фактора VII ним чином, за Менделем, що дозволяє розвиток на активний дволанцюговий фактор VIIa може бутрансгенних стад. ти досягнуте, використовуючи фактор XIIa, як опиЗагальні процедури одержання трансгенних сано Hednerand Kisiel [1983, J. Clin. Invest. 71:1836тварин відомі в галузі. Дивіться, наприклад, [Hogan 1841], або інші протеази, що мають трипсинподібet al., Manipulating Mouse Embryo: Laboratory ну специфічність [Kisiel та Fujikawa, Behring lnst. Manual, Cold Spring Harbor Laboratory, 1986; Mitt. 73: 29-42, 1983]. Як альтернатива, фактор VII Simons et al., Bio/Technology 6.179-183 (1988); Wall може бути автоактивований пропусканням його et al., Biol. Reprod. 32: 645-651 (1985); Buhler et al., через іонообмінну хроматографічну колонку, таку Bio/Technology 8:140-143 (1990); Ebert et al., як моно Q.RTM. (Pharmacia Fire Chemicals) або Bio/Technology 9: 835-838 (1991); Krimpenfort et al., подібну [Bjoern et al., 1986, Research Disclosures Bio/Technology 9: 844-847 (1991); Wall et al., J. Cell. 269:564-565]. Молекула фактора VII цього винахоBiochem. 49:113-120 (1992); патенти США ду та їх фармацевтична композиція є зокрема ко№4873191 та 4873316; WIPO публікації WO рисною для введення людині для лікування різно88/00239, WO 90/05188, WO 92/11757; та GB манітних станів, включаючи внутрішньосудинну 87/00458, які включені в цей винахід шляхом посикоагуляцію. лання]. Способи уведення чужорідної послідовноУ винаході також запропоновано придатні спості ДНК у сса вців та їх зародкові клітини були розсоби селекції кращих поліпептидів фактора VIIa та роблені спочатку в миші. Дивіться, наприклад, похідних фактора VIIa згідно з винаходом. Ці спо[Gordon et al., Proc. Natl. Acad. Sci. USA 77: 7380соби можуть бути виконані як простий попередній 7384 (1980); Gordon та Ruddle, Science 214:1244тест in vitro. 1246 (1981); Palmiter та Brinster, Cell 41: 343-345 Таким чином, у Прикладі 5 цього винаходу (1985); та Brinster et al., Proc. Natl. Acad. Sci. USA описано простий тест (названий "Гідроліз in vitro") 82: 4438-4442 (1985)]. Ці способи потім пристосуна активність поліпептидів фактора VIIa винаходу. вали для використання в більших тварин, включаЗгідно з тестом поліпептиди фактора VIIa, які ючи стадні види [дивіться, наприклад, WIPO публіскладають певний інтерес, це такі поліпептиди, де кації WO 88/00239, WO 90/05188, та WO 92/11757; відношення між активністю варіанта та активністю та Simons et al., Bio/Technology 6: 179-183 (1988)]. природного фактора VII людини, показаного в У підсумок, у більшості е фективних шляхів, що Фіг.1, є приблизно 1,0 або вище, коли здійснено за використовуються сьогодні в створенні трансген"Гідроліз in vitro", описаний в цьому винаході. них мишей або стадних тварин, кілька сотень ліАктивність поліпептидів може також бути вимінійних молекул ДНК потрібно ввести в одне з проряна, використовуючи фізіологічний субстрат, таядер заплідненого яйця згідно зі встановленими кий як фактор X ("Протеоліз in vitro") (див. Приклад способами. Ін'єкція ДНК у цитоплазму зиготи може 6), придатний за концентрації 100-1000нМ, де також бути використана. Одержання трансгенних утворений фактор Xa визначається після додарослин може також бути використане. Експресія вання придатного хромогенного субстрату (наприможе бути загальна або спрямована в певний орклад, S-2765). Крім того, аналіз на активність може ган, такий як бульба. Дивіться, [Hiatt, Nature бути виконаний за фізіологічної температури. 344:469-479 (1990); Edelbaum et al., J. lnterferon Прокоагулянтна здатність поліпептидів фактоRes. 12:449-453 (1992); Sijmons et al., ра VIIa утворювати тромбін може також бути виміBio/Technology 8:217-221 (1990); та Європейський ряна в тесті, що містить усі відповідні фактори коапатент 255378]. гуляції та інгібітори за фізіологічних концентрацій Фактор VII, одержаний згідно з цим винаходом, (мінус фактор VIII за умов відтворення стану геможе бути очищений хроматографією за споріднемофілії), а також активовані тромбоцити [як описаністю на колонці з анти-Фактор VII антитілом. Крано на стор. 543 в Monroe et al. (1997) Brit J. ще, якщо імуноадсорбційна колонка містить висоHaematol. 99, 542-547, включений сюди шляхом коспецифічне моноклональне антитіло. посилання]. Використання кальційзалежного моноклонального Прокоагулянтні похідні фактора VII згідно з антитіла, як описано [Wakabayashi et al., J. Biol. цим винаходом можуть бути використані для лікуChem, 261:11097-11108, (1986) та Thim et al. вання хвороб згортання крові, які мають кілька Biochem. 27: 7785-7793, (1988), включені у цей причин, такі як дефіцит фактора згортання (напривинахід шляхом посилання], є особливо кращим. клад, гемофілія А та В або дефіцит факторів коаДодаткове очищення може бути досягнуте засогуляції Xl або VII) або інгібітори фактора згортання, бами загальноприйнятого хімічного очищення, або вони можуть бути використані для лікування такого як рідинна хроматографія високої роздільнадлишкових кровотеч, що відбуваються у пацієнної здатності. Інші способи очищення, включаючи тів з нормальним функціонуючим каскадом згоробробку цитратом барію, відомі в галузі та можуть тання крові (немає дефіциту фактора згортання бути застосовані для очищення фактора VII, опиабо інгібіторів будь-якого з факторів коагуляції). саного в цьому винаході [дивіться, загалом, Кровотечі можуть бути викликані дефектним фун 51 84831 52 кціонуванням тромбоцитів, тромбоцитопенією або Краще, якщо фармацевтична композиція вводитьпсевдогемофілією. Вони можуть також спостерігася парентерально, тобто, внутрішньовенно, підтися в пацієнтів, у котрих підвищена фібринолітичшкірно або внутрішньом'язово, або вона може буна активність була викликана різними стимулами. ти введена як безперервна або ударна інфузія. У пацієнтів, які зазнали значного ушкодження Композиції для парентерального введення містять тканин, пов'язаного з операцією або загальною похідну фактора VII винаходу в комбінації з краще, травмою, гемостатичний механізм може бути приякщо розчиненим фармацевтично прийнятним гнічений потребою в швидкому гомеостазі й у них носієм, краще, якщо водному носії. Можуть бути можуть виникнути кровотечі, незважаючи на норвикористані чисельні водні носії такі, як вода, бумальний гемостатичний механізм. Досягнення заферна вода, 0,4% сольовий розчин, 0,3% гліцин довільного гомеостазу є також проблемою, коли тощо. Похідні фактора VII винаходу можуть також кровотечі відбуваються в органах, таких як мозок, бути складені на ліпосомних препаратах для довнутрішнє вухо та очі й може також бути проблеставки або спрямування до сайтів ушкодження. мою у випадках дифузних кровотеч (геморагічний Ліпосомні препарати загалом описані в, напригастрит та надмірні маточні кровотечі), коли склаклад, [патентах США 4837028, 4501728 та дно визначити джерело. Така сама проблема мо4975282]. Композиції можуть бути стерилізовані же виникнути в процесі відібрання біопсій з різних загальноприйнятими, добре відомими способами органів (печінка, легені, пухлина тканин, шлунковостерилізації. Водні розчини можуть бути спаковані кишковий тракт), а також у лапароскопічній операдля використання або фільтровані за асептичних ції. Спільним за цих ситуацій є труднощі забезпеумов та ліофілізовані, ліофілізований препарат чення гомеостазу хір ургічними способами (шви, з'єднують зі стерильним водним розчином перед затискачі тощо). Гострі та надмірні кровотечі моуведенням. Композиції можуть містити фармацевжуть також відбуватися у пацієнтів за антикоагутично прийнятні додаткові речовини, потрібні для лянтної терапії, у котрих порушений гомеостаз був відтворення фізіологічних умов, таких як нормалівикликаний впровадженою терапією. Такі пацієнти зуючі рН та буферуючі агенти, агенти, що модуможуть потребувати хірургічного втручання у вилюють тонус, тощо, наприклад, ацетат натрію, падку, якщо антикоагулянтному ефектові потрібно лактат натрію, хлорид натрію, хлорид калію, хлошвидко протидіяти. До інших ситуацій, коли морид кальцію тощо. жуть викликати проблеми у випадку незадовільноКонцентрація похідної фактора VII в цих комго гомеостазу, належать такі, коли пацієнтам з позиціях може змінюватись у широких межах, тобнормальним гемостатичним механізмом назначато, з менш, ніж приблизно 0,5% за масою, зазвиють антикоагулянтну терапію для запобігання чай або щонайменше приблизно 1% за масою до тромбоемболічних захворювань. До таких терапій 15 або 20% за масою та вибиратиметься в першу належать гепарин, інші форми протеогліканів, вачергу за об'ємом рідини, в'язкістю тощо, згідно з рфарин або інші форми вітамін K-антагоністів, а певним обраним шляхом уведення. також аспірин та інші інгібітори агрегації тромбоциТаким чином, типова фармацевтична компотів. зиція для внутрішньовенної інфузії може бути Системна активація каскаду коагуляції може складена так, щоб містити 250мл стерильного розприводити до розсіяної внутрішньосудинної коагучину Рингера та 10мг поліпептиду фактора VII. ляції (РВК). Проте, такі ускладнення не спостеріСправжні способи одержання парентеральної галися в пацієнтів, яким уводили високі дози рекокомпозиції відомі або очевидні фахівцям у галузі мбінантного фактора VIIa, завдяки локалізованому та описані більш детально в, наприклад, гемостатичному процесові, викликаному комплек[Remington's Pharmaceutical Sciences, 18th ed., сом, утвореним між фактором VIIa та TF на місці Mack Publishing Company, Easton, PA (1990)]. ушкодження стінки судини. Прокоагулянтні похідні Композиції, що містять похідні фактора VII фактора VII згідно з винаходом можуть, таким чицього винаходу, можуть бути введені для профіланом, також використовуватись в їх активованій ктичного та/або терапевтичного лікування. За теформі для лікування таких надлишкових кровотеч, рапевтичного застосування композиція вводиться пов'язаних з нормальним гемостатичним механізпацієнтові, що вже страждає на захворювання, як мом. описано вище, у кількості, достатній для лікування, Для лікування у зв'язку зі заздалегідь планополегшення або часткової зупинки захворювання ваними втручаннями прокоагулянтні похідні факта його ускладнення. Кількість, достатня для здійтора VII винаходу типово вводять у межах приблиснення цієї мети, описана як "терапевтично ефекзно 24 години перед виконанням втручання та тивна кількість". Як буде зрозуміло фахівцю у гапротягом 7 днів або більше після того. Уведення, лузі, кількість, ефективна для цієї мети, як коагулянта, може бути виконано багатьма шлязалежатиме від важкості захворювання або ушкохами, як описано в цьому винаході. дження, а також маси та загального стану пацієнДоза похідних фактора VII становить у межах та. Загалом, проте, ефективна кількість становивід приблизно 0,05мг до 500мг/день краще, якщо з тиме від приблизно 0,05мг до приблизно 500мг приблизно 1мг до 200мг/день, та ще краще, якщо з похідної фактора VII на день для 70кг пацієнта, де приблизно 10мг до приблизно 175мг/день на 70кг більше за все використовуються дози від приблизпацієнта як перша та підтримуюча доза залежно но 1,0мг до приблизно 200мг похідної фактора VII від складності стану. на день. Фармацевтична композиція у першу чергу приПотрібно враховува ти, що матеріали цього визначена для парентерального введення для пронаходу можуть загалом використовува тися за серфілактичного та/або терапевтичного лікування. йозних захворювань або ушкоджень, що загрожу 53 84831 54 ють життю або є потенційно такими. За таких виприклад, інгібування згортання крові, тромбозу або падків з метою зменшення чужорідних речовин та відкладання тромбоцитів. загального браку імуногенності похідних фактора Інактивовані похідні фактора VII можуть бути VII людини є можливим та може бути бажаним зокрема корисними за лікування гіперплазії внутуведення спеціалізованим лікарем істотного надрішнього шару судин, рестенозу завдяки гострим лишку ци х композицій фактора VII. ушкодженням судин, глибокого тромбозу вен, арЗа профілактичного застосування композиції, теріального тромбозу, постхірургічного тромбозу, що містять похідну фактора VII винаходу, вводятьобхідного трансплантату коронарних артерій ся пацієнтові, схильному або піддатному до ризику (CABG), крізьшкірної коронарної ангіопластії захворювання або ушкодження, для підсилення (PTCA), інсульту, раку, метастазу пухлин, ангіогевласної коагулятивної спроможності пацієнта. Така незу, ішемії/реперфузії, ревматоїдного артриту, кількість описана як "профілактично ефективна тромболізу, артеріосклерозу та рестенозу після доза". За профілактичного застосування точна ангіопластії, гострим та хронічним показанням, кількість знову ж таки залежить від стану здоров'я таким як запалення, септичний шок, септицемія, пацієнта та маси, але доза загалом у межах від гіпотонія, синдром дихального виснаження доросприблизно 0,05мг до приблизно 500мг на день для лих (ARDS), розсіяна внутрішньосудинна коагуло70-кілограмового пацієнта, більше звичайно від патія (РВК), легеневий емболія, відкладання тромприблизно 1,0мг до приблизно 200мг на день для боцитів, інфаркт міокарду або профілактичне 70-кілограмового пацієнта. лікування ссавців з атеросклеротичними судинаОдиночне або чисельне введення композиції ми, що мають ризик тромбозу. Гострі судинні можуть виконуватися за доз та схем, обраних спеушкодження є ті, що відбуваються швидко (тобто ціалізованим лікарем. Для амбулаторних пацієнтів, від днів до місяців), на відміну від хронічних сущо потребують підтримання дози цілу добу, похіддинних ушкоджень (наприклад, атеросклероз), які ні фактора VII можуть бути введені безперервною з'являються протягом життя. Гострі судинні ушкоінфузією, використовуючи, наприклад, портативну дження часто виникають після хірургічних втрусистему подачі. чань, таких як судинні перетворення, де викорисЛокальне доставляння похідної фактора VII товують способи ангіопластії, ендартеректомії, цього винаходу, таке як, наприклад, місцеве заатеректомії, вставлення судинного трансплантату стосування, може виконуватися, наприклад, з дотощо. Гіперплазія може також відбуватися як упопомогою спрею, перфузії, подвійних балонних кавільнена реакція на, наприклад, вставлення тетерів, стентів, вставлених у судинні трансплантату або трансплантацію органів. Оскітрансплантати або стенти, гідрогелі, що викорисльки інактивовані похідні фактора VII є більше сетовуються для покриття балонних катетерів, або лективними, ніж гепарин, що зазвичай зв'язує лиінші загальноприйняті способи. У будь-якому разі ше тканинний фактор на місцях ушкодження, і фармацевтична композиція має нести кількість оскільки інактивовані похідні фактора VII не руйпохідної фактора VII, достатньої для ефективного нують інші коагуляційні білки, вони є більш ефеклікування пацієнта. тивними та менш імовірно, що вони можуть виклиІнактивовані поліпептиди фактора VII цього кати ускладнення в кровотечах, ніж гепарин, коли винаходу здатні зв'язуватись з тканинним фактовикористовуються профілактично для запобігання ром на поверхні клітини. Наприклад, DEGR-Фактор глибоких тромбозів вен. VIIa зв'язує тканинний фактор на поверхні клітині з Інактивовані похідні фактора VII, які утримують еквівалентною або вищою спорідненістю, ніж фактканинний фактор зв'язаним інгібують накопичення тор VIIa дикого типу. DEGR-Фактор VIIa немає фетромбоцитів на місцях ушкодження судин, блокуюрментативної активності, проте, він зв'язує тканинчи утворення тромбіну та наступне відкладання ний фактор та діє як конкурентний антагоніст для фібрину. фактора VIIa дикого типу, таким чином інгібуючі Завдяки здатності DEGR-Фактора VII блокуванаступні шляхи в зовнішньому шляху коагуляції, ти утворення тромбіну та обмежувати відкладання що приводить до утворення тромбіну. тромбоцитів на місцях гострих ушкоджень судин, Інактивовані похідні фактора VII є зокрема коінактивовані похідні фактора VII, які утримують рисними для введення людині для лікування різтканинний фактор зв'язаним, але не мають ферноманітних станів, включаючи внутрішньосудинну ментативної активності фактора VIIa, можуть бути коагуляцію. Наприклад, хоча глибокий тромбоз вен використані для інгібування рестенозу судин. та легенева емболія можуть лікуватися загальноКомпозиції, що містять інактивовані похідні прийнятими антикоагулянтами, інактивовані похідфактора VII є зокрема корисними в способах лікуні фактора VII, описані в цьому винаході, можуть вання пацієнтів, коли складені у фармацевтичну бути використані для запобігання тромбоемболічкомпозицію, де вони можуть вводитись пацієнтам, них ускладнень у пацієнтів з визначеним високим що страждають на різноманітні захворювання для ризиком, таких як ті, що зазнали операції або з лікування коагупяція-споріднених станів. Такі інакзастійною серцевою недостатністю. Крім того, інтивовані похідні фактора VII, здатні до зв'язування активовані похідні фактора VII можуть діяти як тканинного фактора, але з істотним зменшенням антагоністи для опосередкованої тканинним факздатності каталізувати активацію іншого фактора в тором індукції коагуляції, таким чином блокуючі каскаді згортання крові, можуть мати довше напівутворення тромбіну та наступне відкладання фібжиття в плазмі та, таким чином, відповідно довший рину. Таким чином, інактивовані похідні фактора період антикоагулятивної активності порівняно з VII можуть бути корисними для інгібування активіншими антикоагулянтами. Серед медичних поканості тканинного фактора, що призводить до, назань для пацієнтів є такі, котрим потрібно уводити 55 84831 56 антикоагулянти, такі як, наприклад, глибокий тротромбів та присутність тромбоцитів може потім мбоз вен, легенева емболія, інсульт, розсіяна внувикликати утворення та вивільнення чисельних трішньосудинна коагуляція (DIG), відкладання фібіоактивних факторів, включаючи ті, що утворюбрину в легенях та нирках, пов'язане з ються в шляха х коагуляції, таких як тромбін та грамнегативною ендотоксемією, та інфаркт міокафактор X, а також факторів, що вивільнюються з рду. Композиція може використовуватись для інгіактивованих тромбоцитів. У свою чергу ці фактори бування рестенозу судин, який відбувається після можуть викликати утворення додаткових факторів механічного ушкодження судин, такого як ушкоз ендотеліальних клітин, клітин гладеньких м'язів дження, викликані балонною ангіопластією, ендарабо з моноцитів, таких як TNF-a та ІЛ-1. Ці фактотеректомією, редуктивною атеректомією, встановри, у свою чергу, можуть потім активувати ендотелення стенту, лазерною терапією або ліальні клітини, що приводить до збільшення синротабляцією, або такі, що є вторинними до транстезу різних адгезивних молекул, пов'язаних зі плантатів судин, стентів, обхідних трансплантатів зв'язуванням моноцитів та нейтрофілів. Зв'язуванабо трансплантатів органів. Композиція може, таня та міграція моноцитів та нейтрофілів, вивільким чином, використовуватись для інгібування нення біоактивних сполук цими клітинами, вклювідкладання тромбоцитів та пов'язаних захворючаючи утворення реактивних кисневих радикалів, вань. Таким чином, спосіб інгібування коагуляції, можуть загострювати активацію та ушкодження рестенозу судин або відкладання тромбоцитів, ендотеліальних клітин. Зрештою, якщо каскад наприклад, складається з уведення пацієнтові процесів стає неконтрольованим, це може привокомпозиції, що містить інактивовані похідні фактодити до системних ускладнень та потенційно стира VII, такі, які мають щонайменше одне заміщенмулювати недостатність багатьох органів. Блокуня амінокислоти в каталітичній тріаді Ser344, вання тканинного фактора згідно з цим винаходом Asp242 та His193, у кількості, достатній для ефекуведенням специфічного інгібітору для тканинного тивного інгібування коагуляції, рестенозу судин фактора/зв'язування фактора VII (наприклад, FFRабо відкладання тромбоцитів. Способи також маFVIIa), і таким чином, блокуючи початок зовнішють використання в лікуванні гострого закриття нього шляху коагуляції, початку каскаду процесів коронарної артерії в пацієнта (наприклад, гострий можна запобігти, таким чином уникаючи або мініінфаркт міокарду), який складається з введення мізуючи шкідливі процеси, пов'язані з ішеміінактивованих похідних фактора VII, які включають єю/реперфузією. DEGR-Фактор VII та FFR-Фактор VII, разом з ткаДоза інактивованих похідних фактора VII для нинним активатором плазміногену або стрептокізапобігання глибоких тромбозів вен становить від назою, та можуть підвищувати тАП викликаний приблизно 50мкг до 500мг/день, більш типово від тромболіз. Інактивовані похідні фактора VII дають1мг до 200мг/день, і ще краще, якщо від 10 до ся перед, разом з, або незадовго після введення приблизно 175мг/день для 70кг пацієнта, де вветромболітичного агента, такого як тканинний актидення має початись за щонайменше приблизно 6 ватор плазміногену. години перед операцією та тривати щонайменше Композиція інактивованих похідних фактора доки пацієнт не стане амбулаторним. Доза інактиVII також матиме значне використання в запобівованих похідних фактора VII за лікування рестеганні кардіогенної емболії та в лікуванні тромботинозу змінюватиметься з кожним пацієнтом але чних інсультів. Завдяки його низькому потенціалу загалом становитиме дози, запропоновані вище. для викликання ускладнення за кровотеч та його Композиції, що містять інактивовані похідні селективність, похідні фактора VII можуть бути фактора VII типово уводять у межах приблизно 24 назначені жертвам інсульту та можуть запобігати годин перед виконанням втручання, і протягом 7 поширенню тромбу артерій. Кількість уведених днів або більше після того. Уведення може здійспохідних фактора VII змінюватиметься з кожним нюватися багатьма шляхами, які далі описано в пацієнтом залежно від природи та важкості інсульцьому винаході. Композиції, що містять інактивоту, але дози загалом знаходитимуться в діапазоні, вані похідні фактора VII, можуть також бути введещо наведено нижче. ними системно або місцево для вставлення суІнактивовані похідні фактора VII та їх композидинних трансплантатів (наприклад, покриттям ція можуть також використовуватись для інгібусинтетичних або модифікованих природних артевання шкідливих процесів, пов'язаних з ішемічною ріальних судинних трансплантатів) на місцях анасреперфузією. Сильна ішемія тканин, органів або томозу, хірургічної ендартеректомії (типово ендаркінцівки може відбуватися завдяки зменшенню теректомії сонної артерії), обхідних трансплантатів потоку крові та може бути пов'язана з травмою, тощо. хірургічною операцією або зниженим тиском крові. У лікуванні розвинутих глибоких тромбозів вен Одним з ускладнень, пов'язаним з сильною ішеміта/або легеневої емболії, доза похідних фактора єю є збільшення синтезу тканинного фактора в VII в межах від приблизно 50мкг до 500мг/день, артеріальній системі. Це підвищення експресії більш типово від 1мг до 200мг/день, та ще краще, тканинного фактора вважається, що стимулює якщо від 10мг до приблизно 175мг/день для 70кг прокоагулянтну реакцію, у першу чергу в капілярпацієнта як перша та підтримуюча дози залежно ному руслі. З наступною реперфузією ішемічної від маси пацієнта та складності стану. Завдяки тканини може утворюватися тромб, який може або нижчій імовірності ускладнення за кровотеч від закупорювати, або не закупорювати судини. Утвоінфузій інактивованих похідних фактора VII, інакрення тромбів в артеріальному руслі та відклативовані похідні фактора VII можуть замінити або дання тромбоцитів вздовж тромбу призводить до знизити дозу гепарину під час або після операції у вторинного утворення - ішемії тканин. Утворення випадку тромбоектомій або емболектомій. 57 84831 58 За випадків гострої бактеріемії, ендотоксемії Приклад 1 або РВК, пацієнту дають першу дозу похідної факСтворення ДНК, що кодує FVII-(R396C), FVIIтора VII щонайменше від приблизно 50мкг до (Q250C), FVII-(P406C), FVII-(407C), FVII-(VI 500мг/день, більш типово від 1мг до 200мг/день, і 58T/M298Q), FVII-(L305V/M306D/D309S), FVIIще краще, якщо від 10мг до приблизно 175мг/день (K337A), FVII-(L305V) та FVII-(F374P): для 70кг пацієнта, з підтримуючою дозою після ДНК конструкти, що кодують FVII-(R396C), того в діапазоні від 50мкг до 500мг/день, типово FVII-(Q250C), FVII-(P406C), FVII-(407C) (один довід 1мг до 200мг/день для 70кг пацієнта. датковий С-кінцевий Cys), FVII-(M298Q), FVIIКраще, якщо похідна фактора VII має напів(L305V/M306D/D309S), FVII-(K337A), FVII-(L305V) життя (t1/2), яке збільшено відносно напівжиття та FVII-(F374P), одержували сайт-спрямованим некон'югованого фактора VII з котрого він похомутагенезом, використовуючи суперспіралізовадить. Краще, якщо напівжиття похідної фактора VII ний дволанцюговий ДНК вектор зі вставкою FVII збільшено на щонайменше 1,5-2 рази, ще краще, людини (pLN174) та два синтетичні праймери, що якщо на приблизно 2-3 рази, навіть ще краще, якмістять бажану мутацію. Використовували наступні що на приблизно 5-10 разів, оптимально приблизпраймери: Для FVII-(R396C): но на 100 разів, зазвичай приблизно на 6 разів 5'-GCG CTC AGA GCC ATG CCC AGG AGT відносно напівжиття немодифікованого вихідного CCT СС-3' (послідовність №3) фактора VII. 5'-GGA GGA CTC CTG GGC ATG GCT CTG Загальні способи приєднання поліетиленглікоAGC GC-3' (послідовність №4) лю білків описані в [патенті США №4179337, видаДля FVII-(Q250C): ного 18 грудня, 1979 (включений в цей винахід 5'-GCT CCG CCT GCA CTG TCC CGT GGT шляхом посилання для описання способів приєдCCT CAC TGA СС-3' (послідовність №5) нання поліетиленгліколю до білків)]. Крім того, інші 5'-GGT C AG TGA GGA CCA CGG GAC AGT способи приєднання поліетиленгліколю описані в GCA GGC GGA GC-3' (послідовність №6) [патенті США №5122614, виданому 16 червня, Для FVII-(P406C): 1992, що також включений в цей винахід шляхом 5'-GCG AGC CCC ATT TTG СТА GAC TAG посилання для описання способів приєднання поAGG АТС TGG G-3' (послідовність №7) ліетиленгліколю до білків]. Малеїмід-ПЕГ є можли5'-CCC AGA TCC TCT AGT СТА GC A AAA TGG во більш корисним реагентом для цистеїнGGC TCG С-3' (послідовність №8) ПЕГіляції, але інші реактиви також доступні для Для FVIl-(407C): специфічної модифікації цистеїну. 5'-CCT GCG AGC CCC ATT TCC CTG TTA Цей винахід надалі описано в прикладах з поGAC TAG AGG АТС TGG G-3' (послідовність №9) силанням на графічні матеріали, що додаються, 5'-CCC AGA TCC TCT AGT СТА АС А GGG AAA де: TGG GGC TCG CAG G-3' (послідовність №10) Фіг.1 Структура процесованого належним чиДля FVII-(M298Q): ном фактора коагуляції VII людини, амінокислоти 5'-GCC CTG GAG CTC CAG GTC CTC AAC GTG ССС-3' (послідовність №11) 1-406, з g-карбоксильованим GIu-залишком (g) та глікозилюванням (*). Стрілка на залишкові аміно5'-GGG C AC GTT GAG GAC CTG GAG CTC CAG GGC-3' (послідовність №12) кислоти 152 показує на сайт, де одноланцюговий Для FVII-(L305V): фактор VII розщеплюється для перетворення на 5'-CGT GCC CCG GGT GAT GAC CCA GGA Сактивований дволанцюговий фактор VII (FVIIa). 3' (послідовність №13) Фіг.2 Створення плазмід для експресії полі пептидів рекомбінантного фактора VII людини. Пла5'-GTC CTG GGT CAT CAC CCG GGG C AC G3' (послідовність №14) зміда pLN174 експресує фактор VII людини з приДля FVII-(M306D/D309S): єднаним пропептидом, природно пов'язаним з 5'-TCT AGA TAC CCA GTC TTG CCT GCA GC A фактором VII. GTC ACG GAA-3' (послідовність №15) Цей винахід окрім іншого проілюстрований наступними прикладами, які, проте, наведені як такі, 5'-TTC CGT GAC TGC TGC AGG C AA GAC TGG GTA TCT AGA-3' (послідовність №16) що не обмежують об'єм захисту. Деталі, описані в Для FVII-(K337A): наступному описові та прикладах можуть бути 5'-CGG ATG GC A GCG CGG ACT CCT GC A окремо й в будь-якій їх комбінації матеріалом для AGG G-3' (послідовність №17) втілення винаходу в його різноманітних форм. Приклади 5'-CCC TTG .CAG GAG TCC GCG CTG CC A TCC G-3' (послідовність №18) Термінологія для заміщень амінокислот, що Для FVII-(F374P): використовується в наступних прикладах, така: 5'-CCG TGG GCC ACC CTG GGG TGT АС А перша літера представляє амінокислоту, що приСС-3' (послідовність №19) родно присутня в положенні послідовності №1; наступне число представляє положення в послі5'-GGT GTA C AC CCC AGG GTG GCC CAC GG-3' (послідовність №20) довності №1; друга літера представляє іншу аміОлігонуклеотидні праймери, кожний компленокислоту, що заміщує природну амінокислоту, ментарний протилежному ланцюгові вставки векнаприклад, R396C, де аргінін у положенні 396 потора, нарощувались під час температурних циклів слідовності №1 заміщений на цистеїн. В іншому прикладі, V158T/M298Q, валін в положенні 158 з допомогою Pfu ДНК-полімерази. Після вставлення праймерів, створювали мутовану плазміду, що послідовності №1 заміщений на треонін, а метіонін містить зміщені "ніки". Після температурних циклів, в положенні 298 послідовності №1 заміщений на продукт обробляли Dpni, який є специфічним для глутамін в тому самому поліпептиді фактора VII. 59 84831 60 метильованої та геміметильованої ДНК, для роззв'язаний матеріал елюювали врівноваженим бущеплення вихідної ДНК матриці та для селекції на фером, що містить 10мМ EDTA замість СаСІ2. Пемутацієвмісну синтезовану ДНК. ред використанням або зберіганням, додавали Процедури одержання ДНК конструкту, виконадлишок СаСІ2 над EDTA або FVII-(R396C) переристовуючи полімеразну ланцюгову реакцію зі носили до Са 2+-вмісного буфера. Ви хід кожного специфічними праймерами, є добре відомими фаетапу супроводжувався визначеннями фактора VII хівцям у галузі [див. PCR Protocols, 1990, Academic ELISA та очищений білок аналізували з допомогою ress, San Diego, California, USA]. SDS-PAGE. Приклад 2 Приклад 4 Одержання FVII-(R396C). Одержання FVII-(L305V/M306D/D309S). BHK клітини трансфікували головним чином, BHK клітини трансфікували головним чином, як попередньо описано [Thim et al. (1988) як попередньо описано [Thim et al. (1988) Biochemistry 27, 7785-7793; Persson та Nielsen Biochemistry 27, 7785-7793; Persson та Nielsen (1996) FEBS Lett. 385. 241-243], щоб одержати (1996) FEBS Lett. 385, 241-243], щоб одержати експресію варіанта FVII-(R396C). Поліпептид факекспресію варіанта FVII-(L305V/M306D/D309S). тора VII очищували наступним чином: Поліпептид фактора VII очи щували наступним Досліджуване середовище завантажували на чином: 25-мл колонку з Q Sepharose Fast Flow (Pharmacia Досліджуване середовище завантажували на Biotech) після додавання 5мМ EDTA, 0,1% Triton Х25-мл колонку з Q Sepharose Fast Flow (Pharmacia 100 та 10мМ Tris, доведення рН до 8,0 та довеBiotech) після додавання 5мМ EDTA, 0,1% Triton Хдення провідності до 10-11мСм/см додаванням 100 та 10мМ Tris, доведення рН до 8,0 та довеводи. Елюції білка досягали градієнтом з 10мМ дення провідності до 10-11мСм/см додаванням Tris, 50мМ NaCI, 0,1% Triton Х-100, рН 8,0; до води. Елюції білка досягали градієнтом з 10мМ 10мМ Tris, 50мМ NaCI, 25мМ CaCI2, 0,1% Triton ХTris, 50мМ NaCI, 0,1% Triton Х-100, рН 8,0; до 100, рН 7,5. Фракції, що містили FVII-(R396C), зби10мМ Tris, 50мМ NaCI, 25мМ CaCI2, 0,1% Triton Храли та застосовували на 25-мл колонку, що міс100, рН 7,5. Фракції, що містили FVII-(R396C), збитить моноклональне антитіло F1A2 (Novo Nordisk, рали та застосовували на 25-мл колонку, що місBagsvaerd, Denmark), зв'язане з CNBrтить моноклональне антитіло F1A2 (Novo Nordisk, активованою Sepharose 4B (Pharmacia Biotech). Bagsvaerd, Denmark), зв'язане з CNBrКолонку врівноважували 50мМ Hepes, pH 7,5, що активованою Sepharose 4B (Pharmacia Biotech). містить 10мМ CaCI2,100мМ NaCI та 0,02% Triton XКолонку врівноважували 50мМ Hepes, рН 7,5, що 100. Після промивання з врівноваженим буфером містить 10мМ CaCI2, 100мМ NaCI та 0,02% Triton та врівноваженим буфером, що містить 2M NaCI, Х-100. Після промивання з врівноваженим буфезв'язаний матеріал елюювали врівноваженим буром та врівноваженим буфером, що містить 2M фером, що містить 10мМ EDTA замість CaCI2. ПеNaCI, зв'язаний матеріал елюювали врівноважеред використанням або зберіганням, додавали ним буфером, що містить 10мМ EDTA замість надлишок CaCI2 над EDTA або FVII-(R396C) переCaCI2. Перед використанням або зберіганням, доносили до Са 2+-вмісного буфера. Ви хід кожного давали надлишок СаСІ2 над EDTA або FVIIетапу супроводжувався визначеннями фактора VII (R396C) переносили до Са2+-вмісного буфера. ELISA та очищений білок аналізували з допомогою Вихід кожного етапу супроводжувався визначенSDS-PAGE. нями фактора VII ELISA та очищений білок аналіПриклад 3 зували з допомогою SDS-PAGE. Одержання FVII-(M298Q). Приклад 5 BHK клітини трансфікували головним чином, Гідроліз in vitro як попередньо описано [Thim et al. (1988) Природні (дикого типу) варіанти фактора VIIa Biochemistry 27, 7785-7793; Persson та Nielsen та фактора VIIa (обидва означені як "Фактор VIIa") (1996) FEBS Lett. 385, 241-243], щоб одержати перевіряли паралельно для прямого порівняння їх експресію варіанта FVII-(VI 58T/M298Q). Поліпепспецифічної активності. Тест виконували в мікротид фактора VII очи щували наступним чином: титрувальному планшеті (Ma xisorp, Nunc, Досліджуване середовище завантажували на Denmark). Хромогенний субстрат D-lle-Pro-Arg-р25-мл колонку з Q Sepharose Fast Flow (Pharmacia нітроанілід (S-2288, Chromogenix, Sweden), кінцева Biotech) після додавання 5мМ EDTA, 0,1% Triton Хконцентрація 1mМ, додавали до фактора VIIa (кін100 та 10мМ Tris, доведення рН до 8,0 та довецева концентрація 100нМ) в 50мМ Hepes, рН 7,4, дення провідності до 10-11мСм/см додаванням що містить 0,1M NaCI, 5мМ СаСІ2 та 1мг/мл альводи. Елюції білка досягали градієнтом з 10мМ буміну сироватки бика. Поглинання за 405нМ виTris, 50мМ NaCI, 0,1% Triton Х-100, рН 8,0; до значалося безперервно в SpectraMaxÔ 340 план10мМ Tris, 50мМ NaCI, 25мМ CaCI2, 0,1% Triton Хшетному зчитувачеві (Molecular Devices, USA). 100, рН 7,5. Фракції, що містили FVII-(R396C), збиПоглинання, розвинуте протягом 20-хвилинної рали та застосовували на 25-мл колонку, що місінкубації після вирахування поглинання в пустій тить моноклональне антитіло F1A2 (Novo Nordisk, лунці, що не містить ферменту, використовували Bagsvaerd, Denmark), зв'язане з CNBrдля підрахування відношення між активністю варіактивованою Sepharose 4B (Pharmacia Biotech). анта та фактора VIIa дикого типу: Колонку врівноважували 50мМ Hepes, рН 7,5, що Відношення = (A405 нМ варіанта фактора містить 10мМ CaCI2,100мМ NaCI та 0,02% Triton ХVIIa)\(A405 нМ фактора VIIa дикого типу). 100. Після промивання з врівноваженим буфером Приклад 6 та врівноваженим буфером, що містить 2M NaCI, Протеоліз in vitro
ДивитисяДодаткова інформація
Назва патенту англійськоюCoagulation factor vii derivatives
Автори англійськоюPersson Egon
Назва патенту російськоюПроизводные фактора коагуляции vii
Автори російськоюПерссон Эгон
МПК / Мітки
МПК: A61P 7/04, C07K 14/745, A61K 38/43, C12P 21/02, C12N 5/10, C12N 15/09, A61P 7/02, A61K 38/48, A01K 67/027, A61K 38/22, A01H 5/00
Мітки: фактора, коагуляції, похідні
Код посилання
<a href="https://ua.patents.su/45-84831-pokhidni-faktora-koagulyaci-vii.html" target="_blank" rel="follow" title="База патентів України">Похідні фактора коагуляції vii</a>
Попередній патент: Розчинний рецептор інтерлейкіну-20
Наступний патент: Остеопротегерин, його застосування для виготовлення фармацевтичної композиції та отримання харчового продукту та корму для тварин
Випадковий патент: Пептидоміметичний інгібітор протеаз