Сполуки, корисні для пригнічення снк1
Номер патенту: 92164
Опубліковано: 11.10.2010
Автори: Діаз Френк, Кесіцкій Едвард А., Годіно Джон Джосеф, Фішер Кімба Л., Оой Хуа Че, Хоулком Райан, Стейппенбек Френк, Рудолф Александер, Кук Адам Уейд, Фароуз Франсін С.
Формула / Реферат
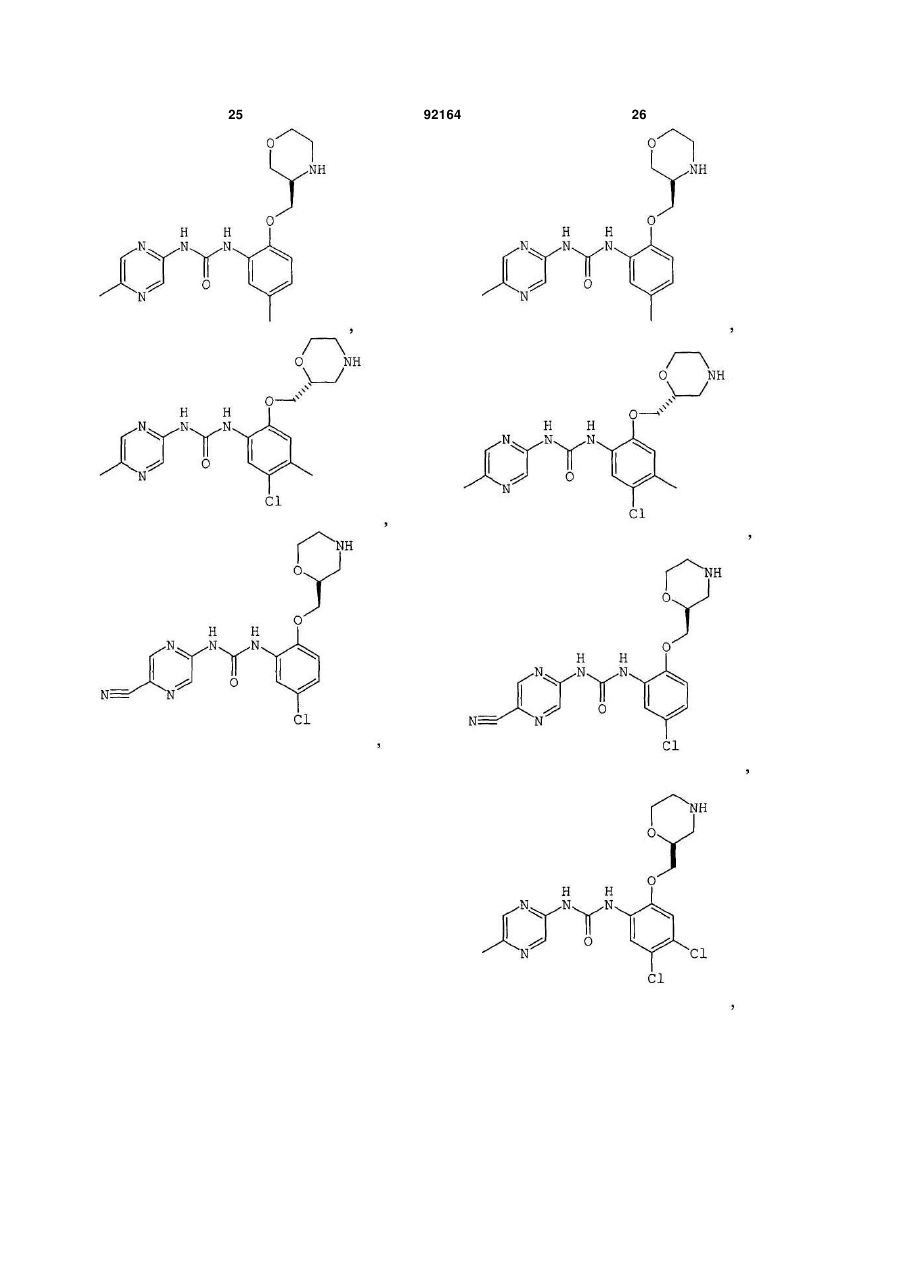
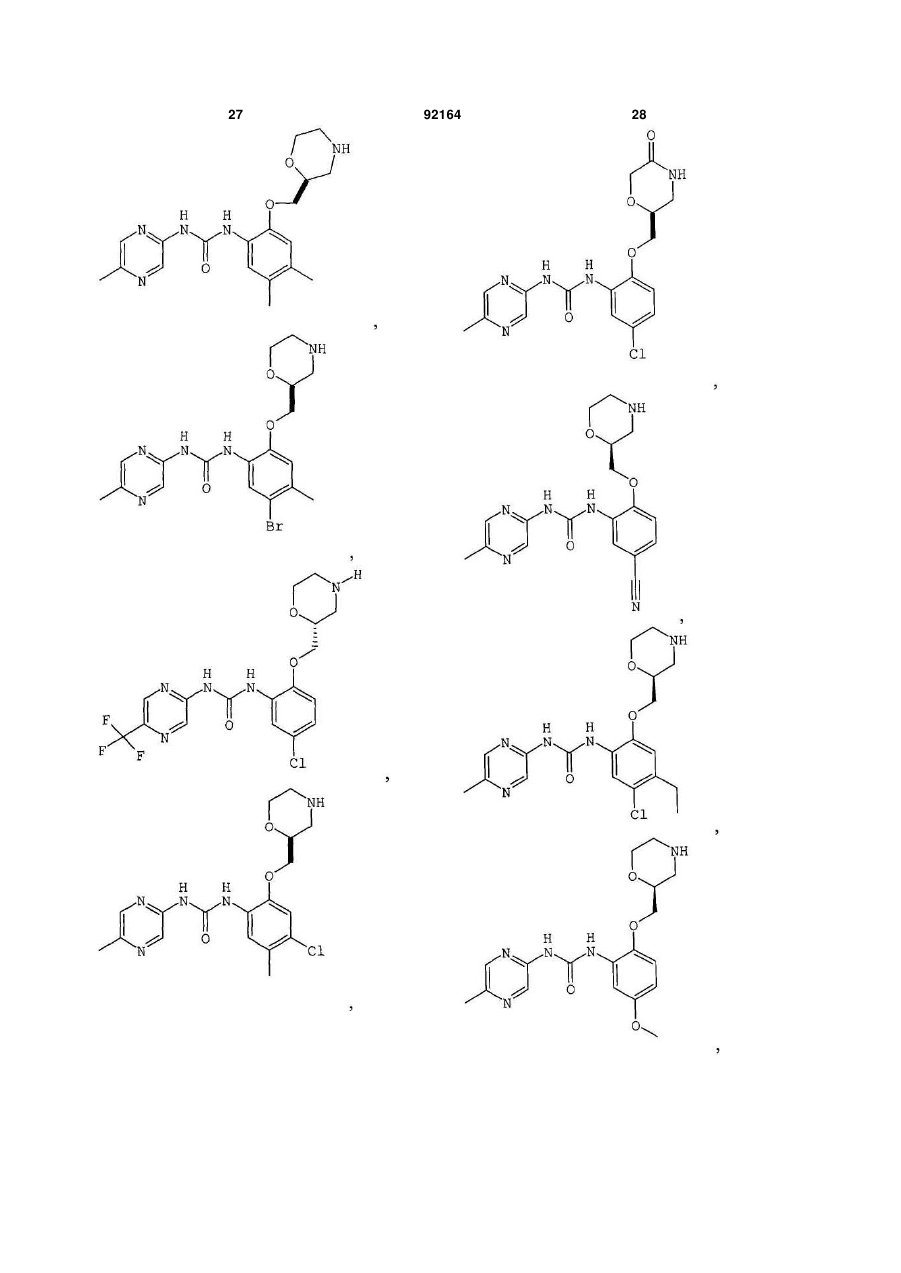
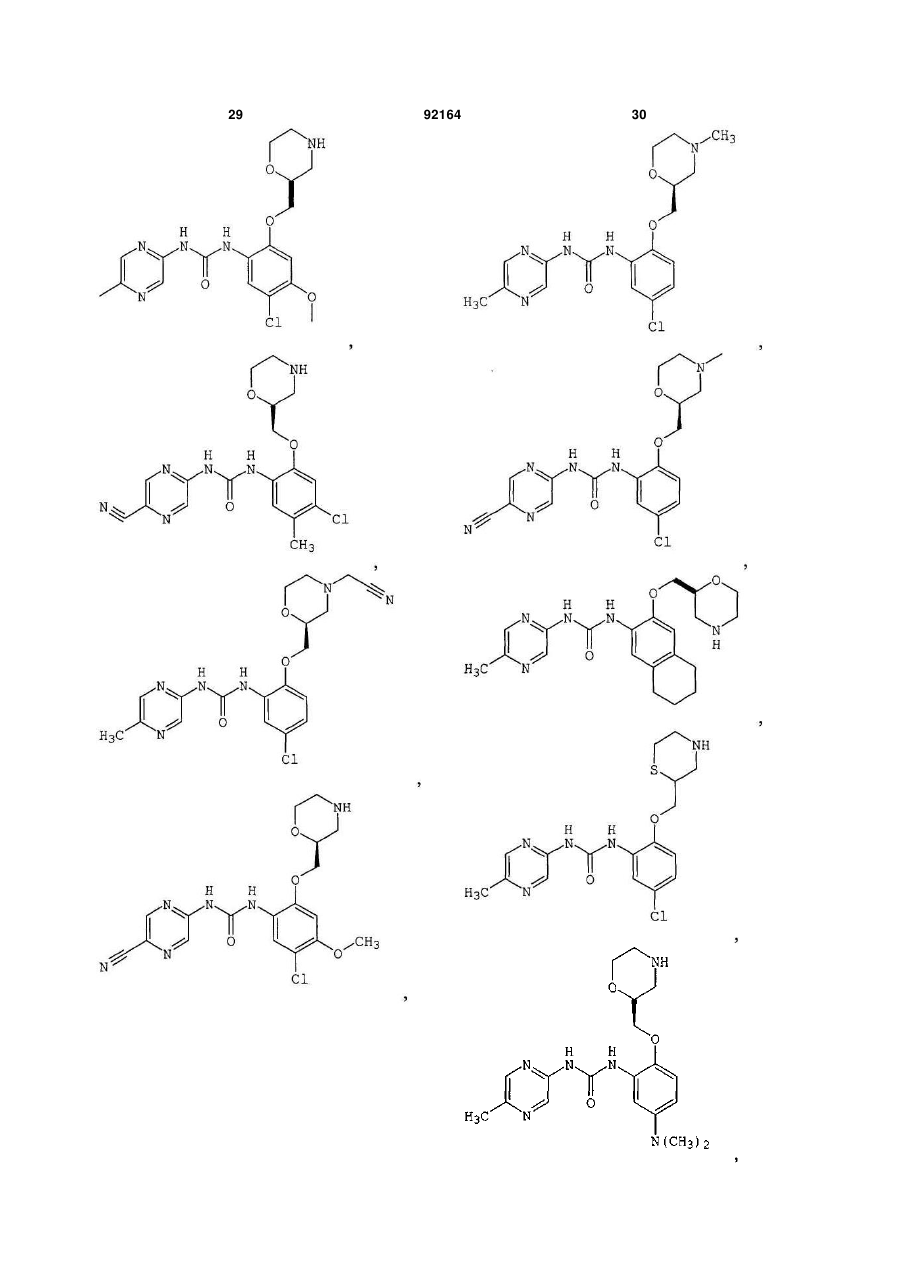
1. Сполука, вибрана з групи, яка включає:
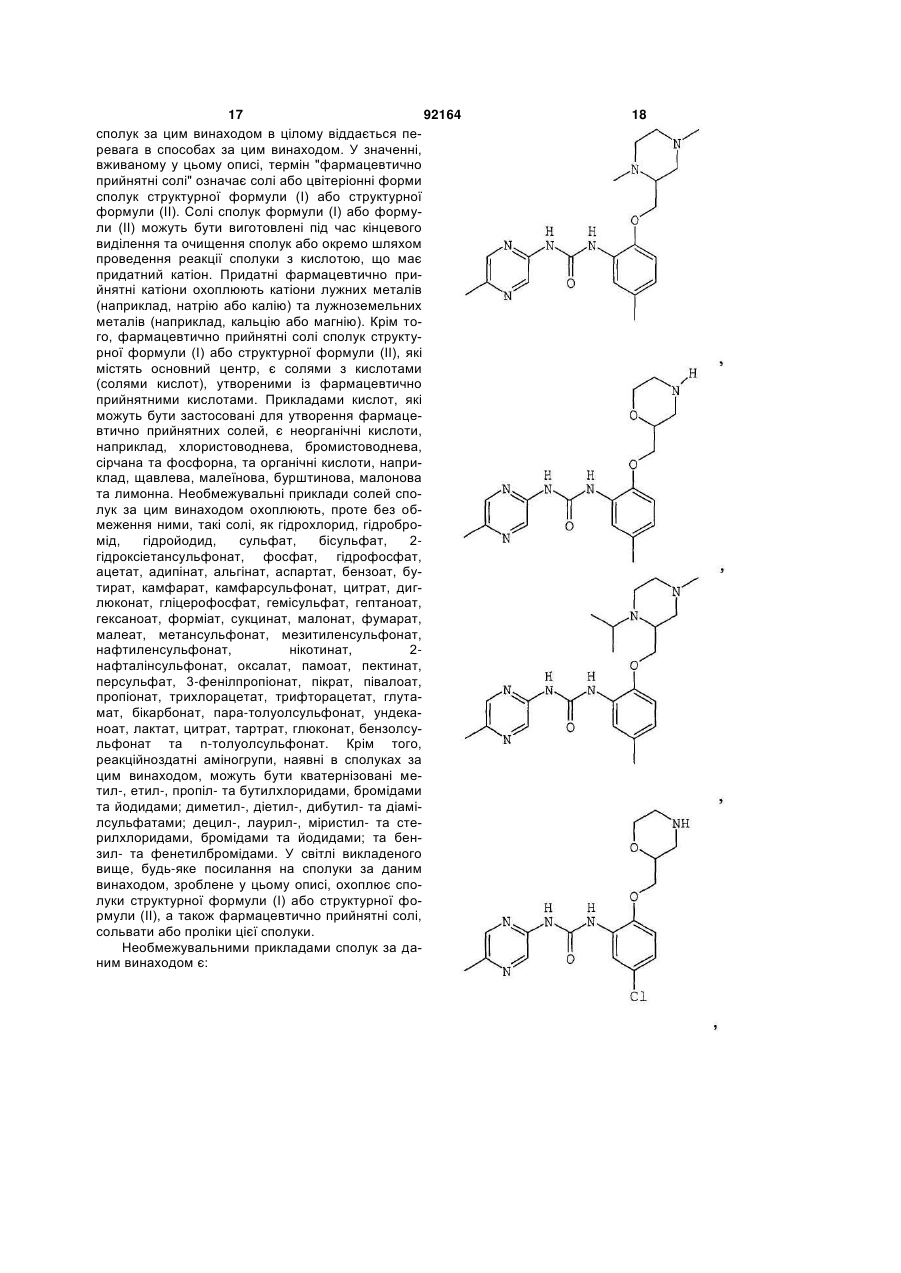
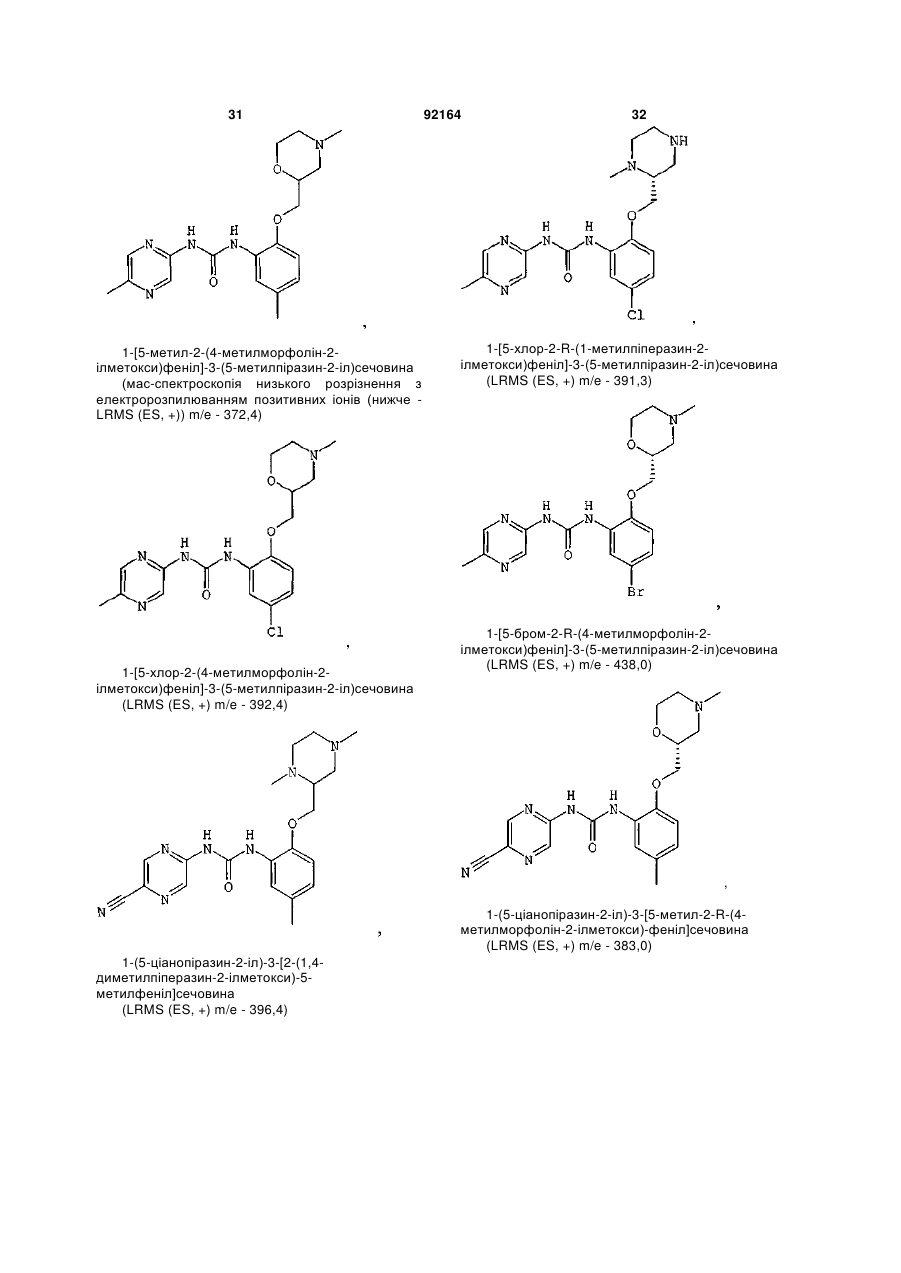
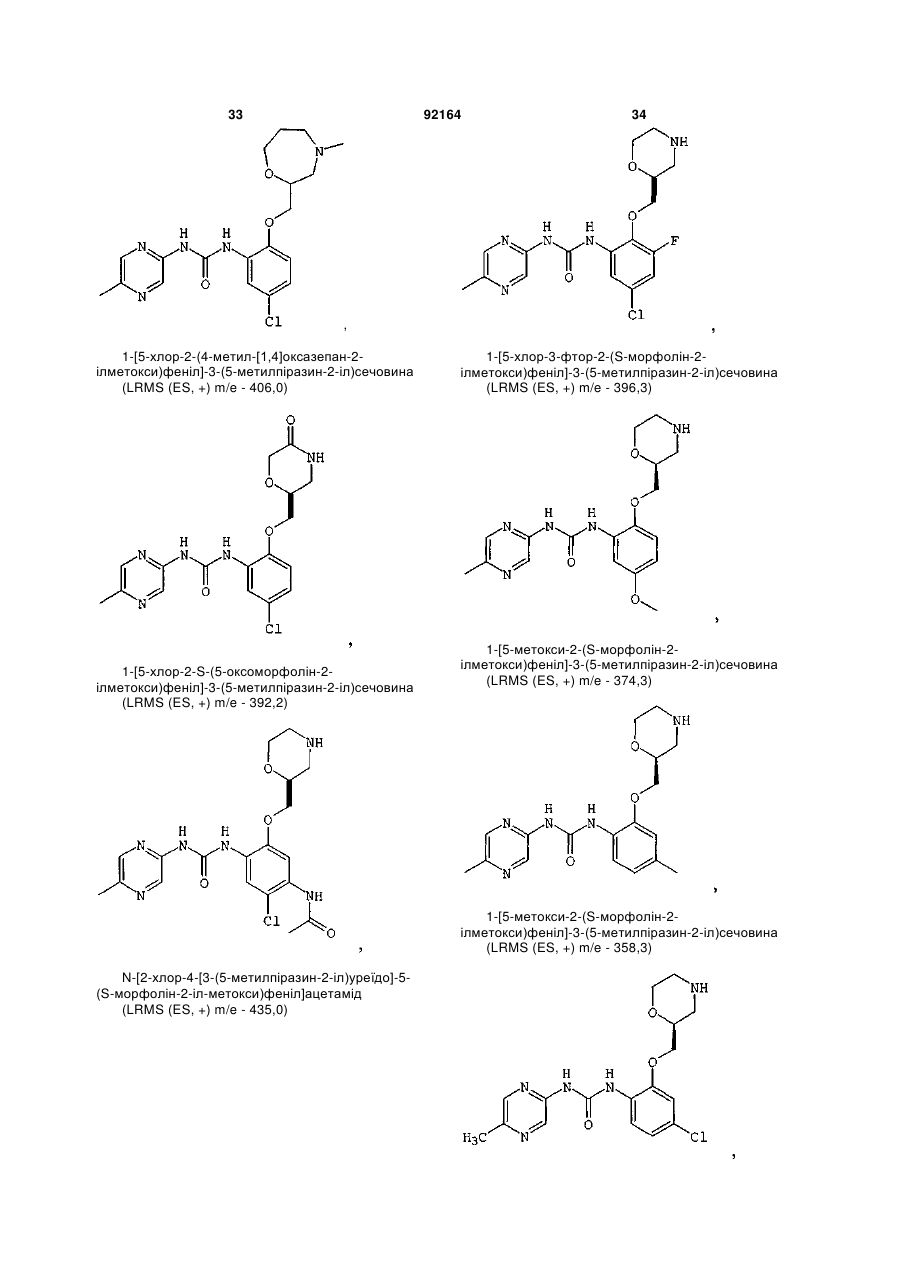
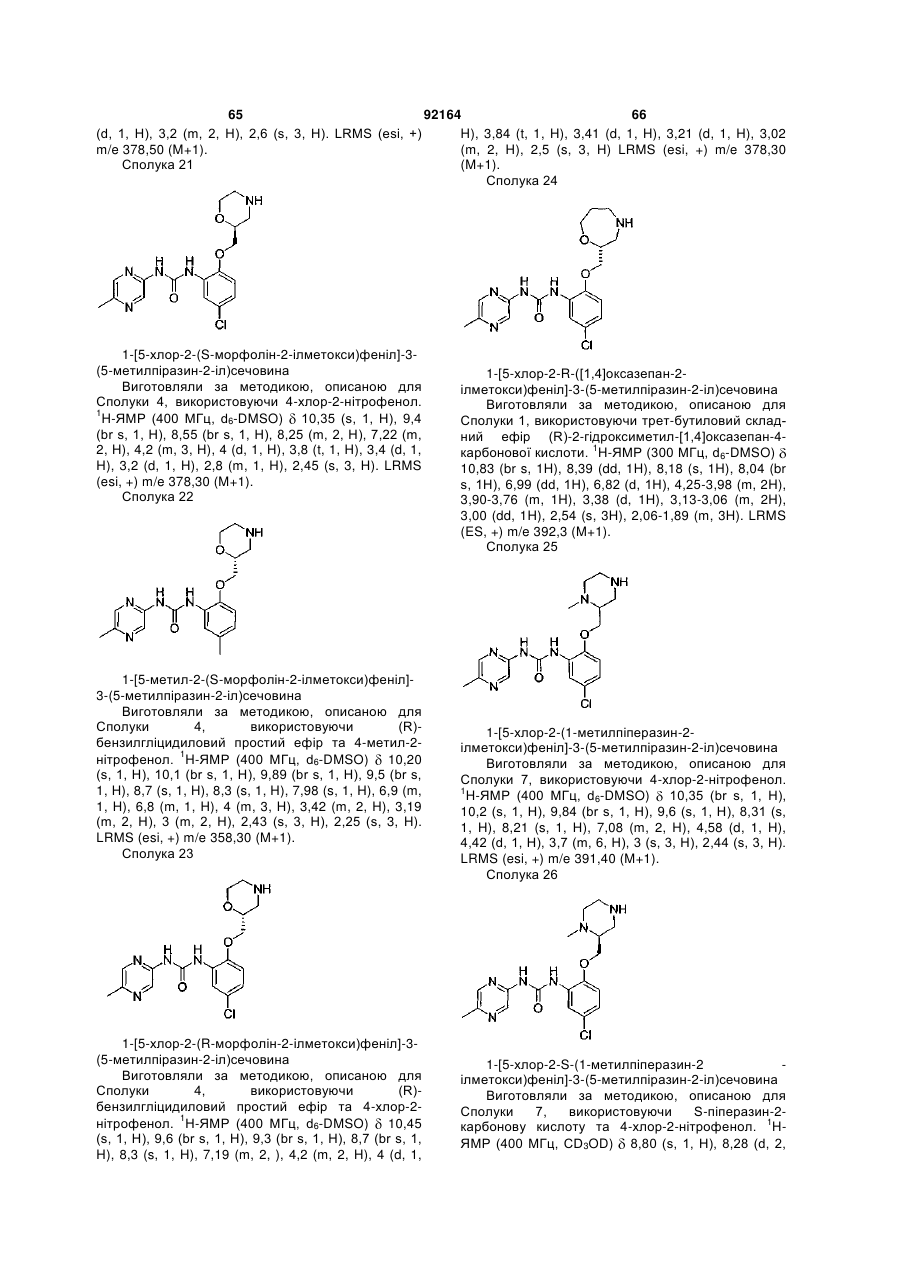
1-[5-хлор-2-S-([1,4]оксазепан-2-ілметокси)феніл]-3-(5-метилпіразин-2-іл)сечовину,
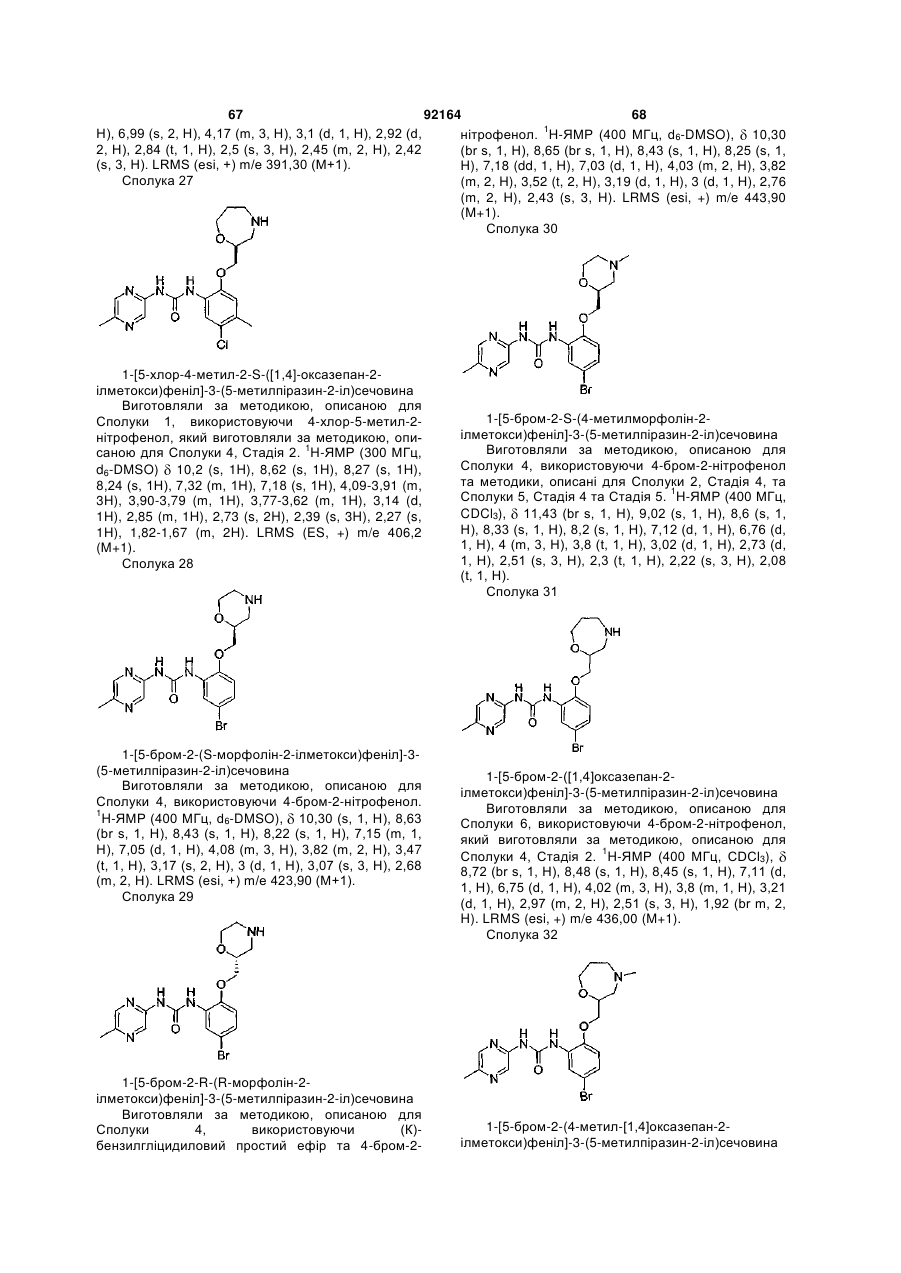
1-[5-хлор-2-([1,4]оксазепан-2-ілметокси)феніл]-3-(5-метилпіразин-2-іл)сечовину,
1-[5-хлор-2-R-([1,4]оксазепан-2-ілметокси)феніл]-3-(5-метилпіразин-2-іл)сечовину,
1-[5-хлор-4-метил-2-S-([1,4]-оксазепан-2-ілметокси)феніл]-3-(5-метилпіразин-2-іл)сечовину,
1-[5-бром-2-([1,4]оксазепан-2-ілметокси)феніл]-3-(5-метилпіразин-2-іл)сечовину,
1-[5-бром-2-(4-метил-[1,4]оксазепан-2-ілметокси)феніл]-3-(5-метилпіразин-2-іл)сечовину,
або фармацевтично прийнятна сіль цієї сполуки.
2. Сполука, вибрана з групи, яка включає:
1-[2-(1,4-диметилпіперазин-2-ілметокси)-5-метилфеніл]-3-(5-метилпіразин-2-іл)сечовину,
1-[5-метил-2-(1-метилпіперазин-2-ілметокси)феніл]-3-(5-метилпіразин-2-іл)сечовину,
1-[5-хлор-2-(1-метилпіперазин-2-ілметокси)феніл]-3-(5-метилпіразин-2-іл)сечовину,
1-[5-хлор-2-S-(1-метилпіперазин-2-ілметокси)феніл]-3-(5-метилпіразин-2-іл)сечовину,
або фармацевтично прийнятна сіль цієї сполуки.
3. Сполука, вибрана з групи, яка включає:
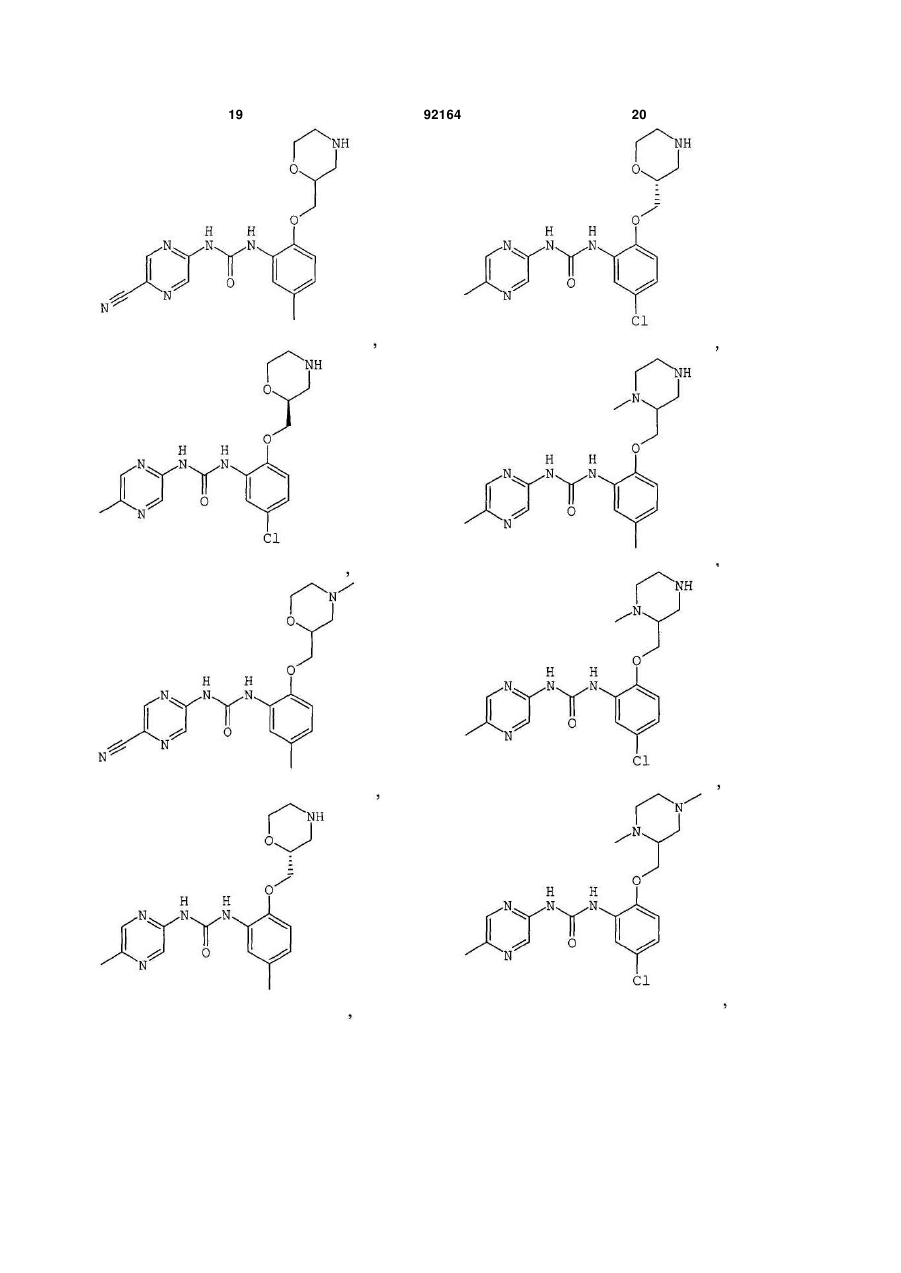
1-(5-ціанопіразин-2-іл)-3-[5-метил-2-(4-метилморфолін-2-ілметокси)феніл]сечовину,
1-[5-бром-2-S-(4-метилморфолін-2-ілметокси)феніл]-3-(5-метилпіразин-2-іл)сечовину,
1-[5-хлор-2-S-(4-ціанометилморфолін-2-ілметокси)феніл]-3-(5-метилпіразин-2-іл)сечовину,
1-[5-хлор-2-S-(4-метилморфолін-2-ілметокси)феніл]-3-(5-ціанопіразин-2-іл)сечовину,
1-[5-хлор-2-(S-4-метилморфолін-2-ілметокси)феніл]-3-(5-метилпіразин-2-іл)сечовину,
або фармацевтично прийнятна сіль цієї сполуки.
4. Сполука, вибрана з групи, яка включає:
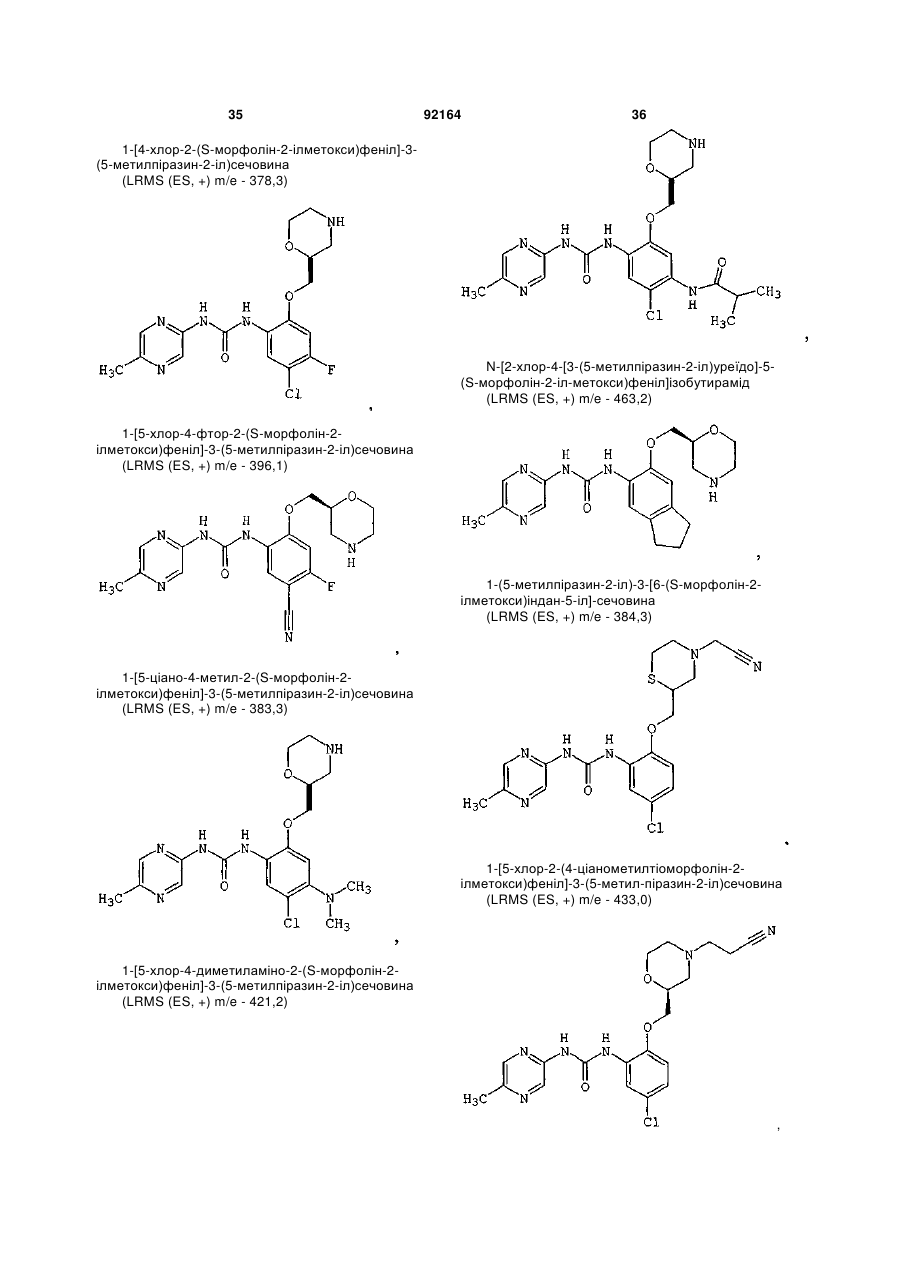
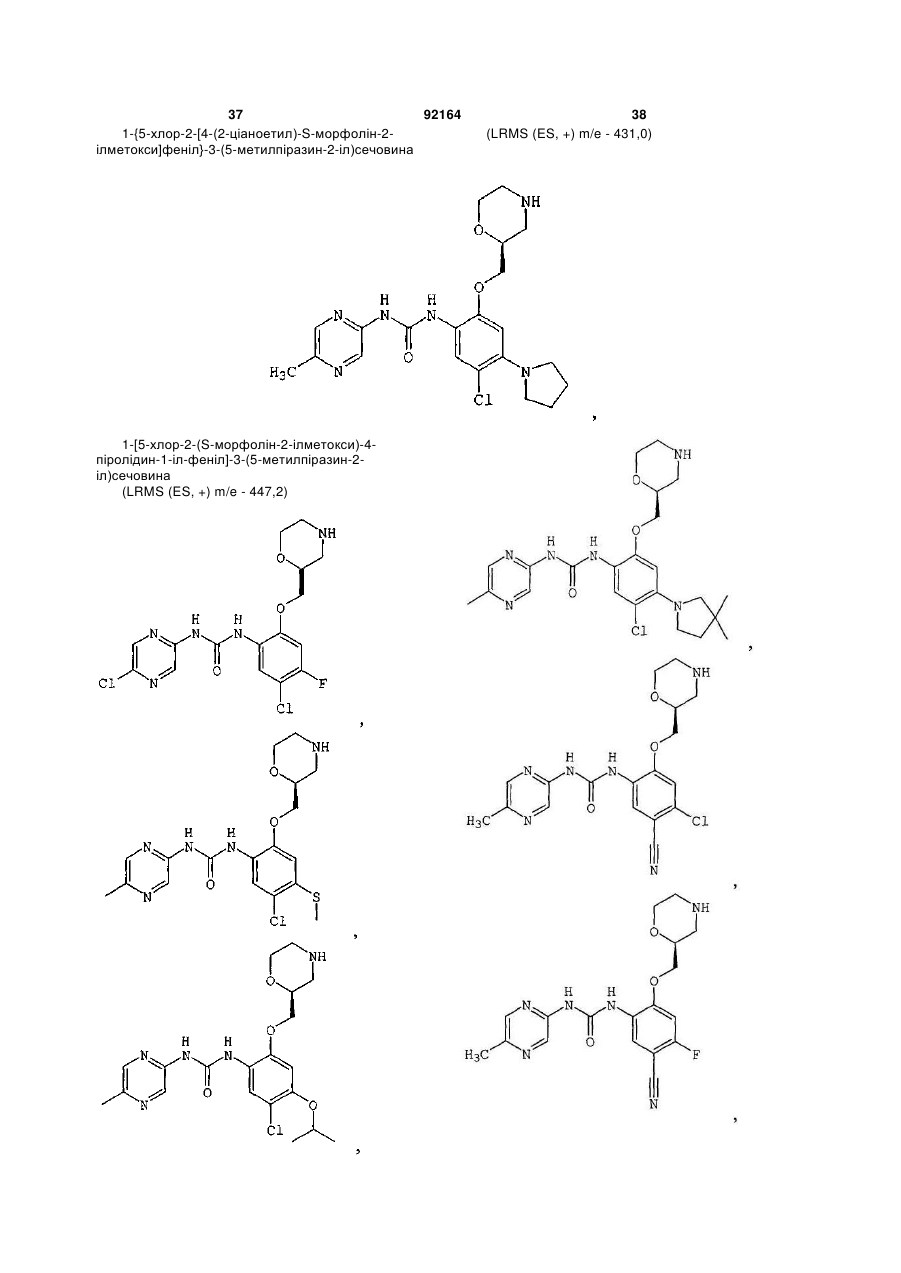
1-[5-хлор-2-(R-морфолін-3-ілметокси)феніл]-3-(5-метилпіразин-2-іл)сечовину,
1-[4,5-дихлор-2-(S-морфолін-2-ілметокси)феніл]-3-(5-метилпіразин-2-іл)сечовину,
1-(5-ціанопіразин-2-іл)-3-[5-метил-2-(морфолін-2-ілметокси)феніл]сечовину,
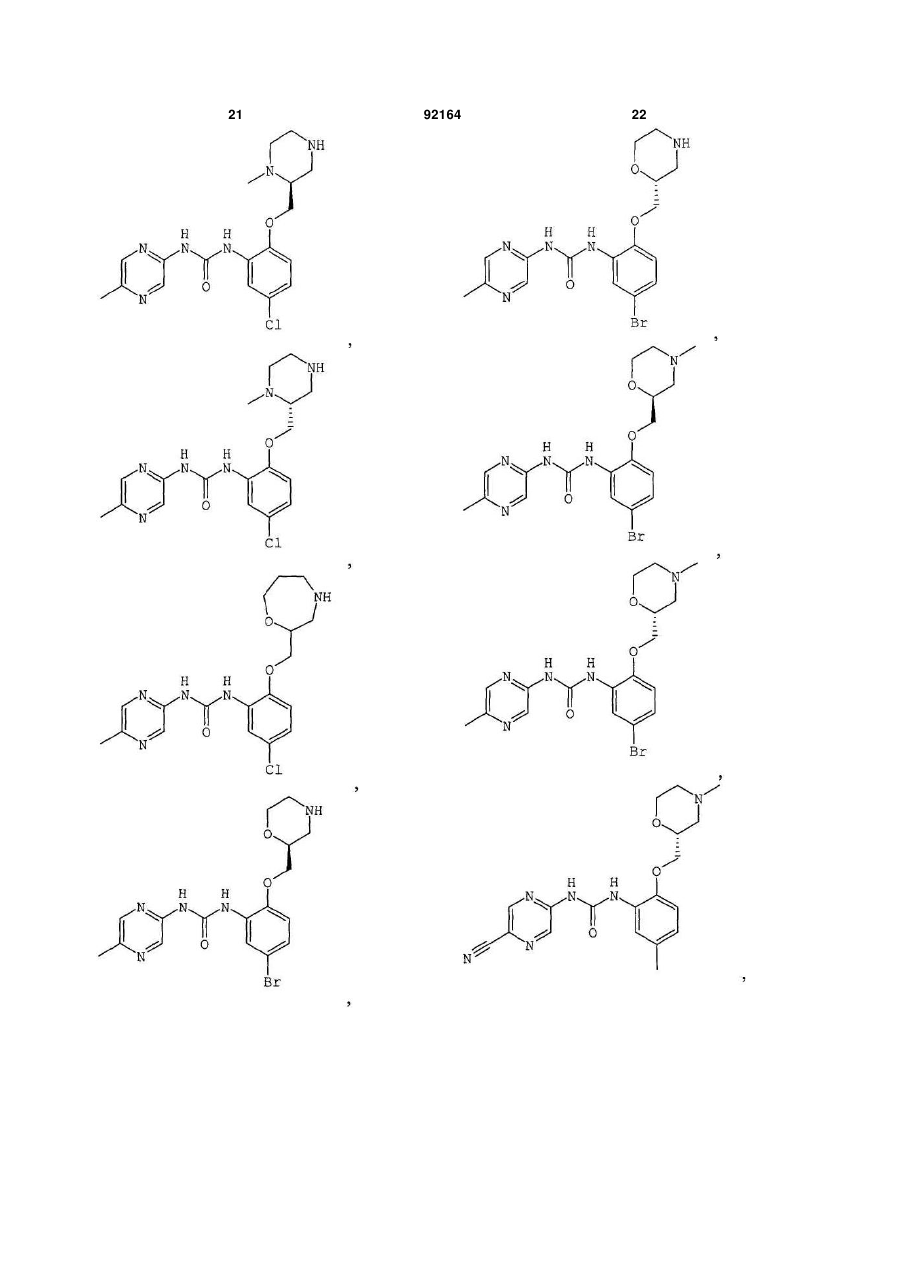
1-[5-хлор-4-метил-2-(S-морфолін-2-ілметокси)феніл]-3-(5-метилпіразин-2-іл)сечовину,
1-[5-хлор-4-метил-2-(R-морфолін-2-ілметокси)феніл]-3-(5-метилпіразин-2-іл)сечовину,
1-[4,5-дихлор-2-(R-морфолін-2-ілметокси)феніл]-3-(5-метилпіразин-2-іл)сечовину,
1-[4,5-диметил-2-(морфолін-2-ілметокси)феніл]-3-(5-метилпіразин-2-іл)сечовину,
1-[4-хлор-5-метил-2-(S-морфолін-2-ілметокси)феніл]-3-(5-метилпіразин-2-іл)сечовину,
1-[5-ціано-2-(S-морфолін-2-ілметокси)феніл]-3-(5-метилпіразин-2-іл)сечовину,
1-[5-хлор-4-етил-2-(S-морфолін-2-ілметокси)феніл]-3-(5-метилпіразин-2-іл)сечовину,
1-[5-хлор-4-метокси-2-(S-морфолін-2-ілметокси)феніл]-3-(5-метилпіразин-2-іл)сечовину,
1-[5-диметиламіно-2-(S-морфолін-2-ілметокси)феніл]-3-(5-метилпіразин-2-іл)сечовину,
1-[5-метил-2-(морфолін-2-ілметокси)феніл]-3-(5-метилпіразин-2-іл)сечовину,
1-[5-хлор-2-(морфолін-2-ілметокси)феніл]-3-(5-метилпіразин-2-іл)сечовину,
1-[5-хлор-2-(S-морфолін-2-ілметокси)феніл]-3-(5-метилпіразин-2-іл)сечовину,
1-[5-метил-2-(S-морфолін-2-ілметокси)феніл]-3-(5-метилпіразин-2-іл)сечовину,
1-[5-хлор-2-(R-морфолін-2-ілметокси)феніл]-3-(5-метилпіразин-2-іл)сечовину,
1-[5-бром-2-(S-морфолін-2-ілметокси)феніл]-3-(5-метилпіразин-2-іл)сечовину,
1-[5-бром-2-R-(R-морфолін-2-ілметокси)феніл]-3-(5-метилпіразин-2-іл)сечовину,
1-(5-метилпіразин-2-іл)-3-[3-S-(морфолін-2-ілметокси)-5,6,7,8-тетрагідронафталін-2-іл]сечовину,
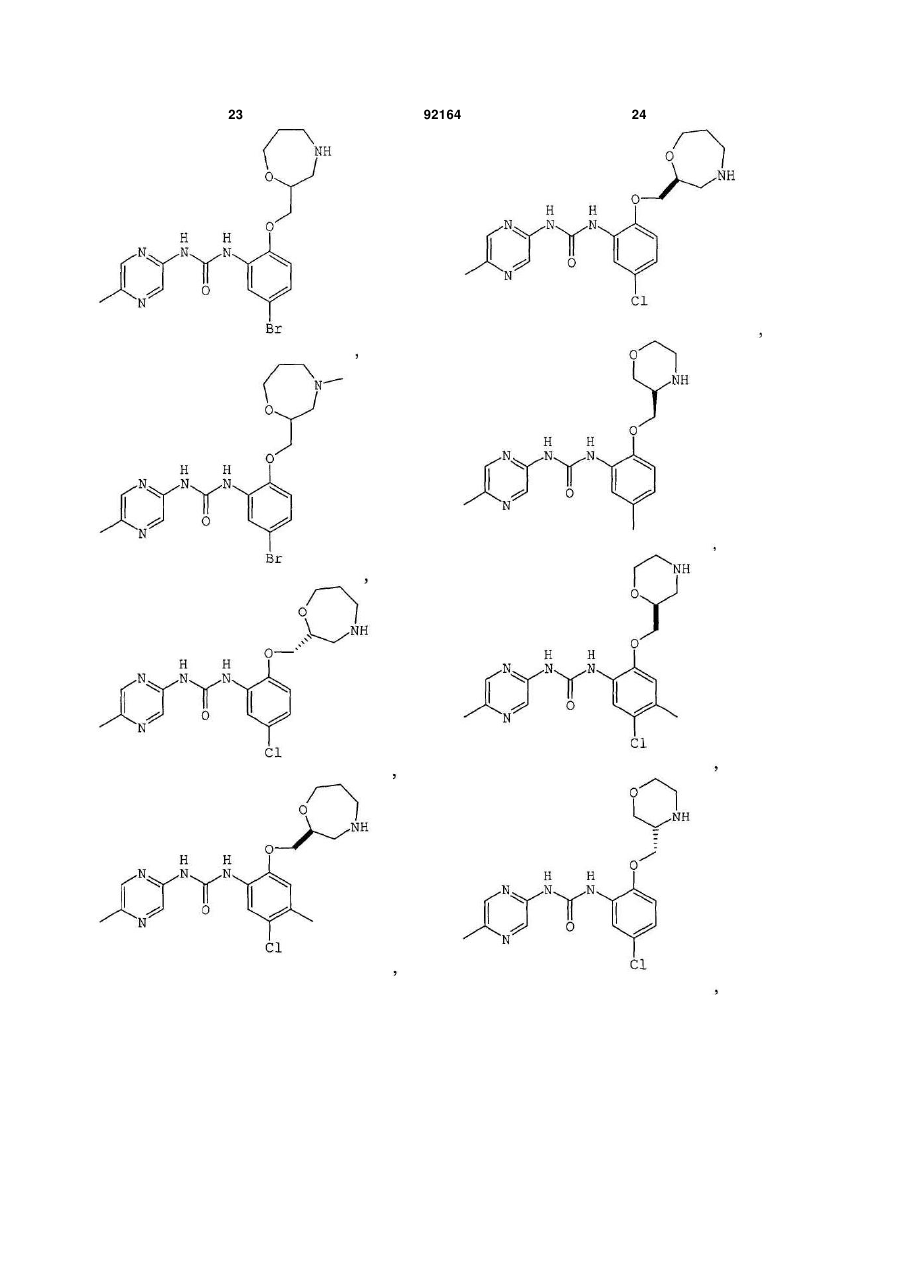
1-[5-хлор-2-S-(морфолін-3-ілметокси)феніл]-3-(5-метилпіразин-2-іл)сечовину,
1-[5-метил-2-R-(морфолін-3-ілметокси)феніл]-3-(5-метилпіразин-2-іл)сечовину,
1-[5-хлор-2-S-(морфолін-2-ілметокси)феніл]-3-(5-трифторметилпіразин-2-іл)сечовину,
1-[4-хлор-5-метил-2-S-(морфолін-2-ілметокси)феніл]-3-(5-ціанопіразин-2-іл)сечовину,
1-[5-хлор-4-метокси-2-(S-морфолін-2-ілметокси)феніл]-3-(5-ціанопіразин-2-іл)сечовину,
1-[5-хлор-2-S-(морфолін-2-ілметокси)феніл]-3-(5-ціанопіразин-2-іл)сечовину,
або фармацевтично прийнятна сіль цієї сполуки.
5. Сполука, яка являє собою:
1-[5-бром-4-метил-2-S-(морфолін-2-ілметокси)феніл]-3-(5-метилпіразин-2-іл)сечовину,
або фармацевтично прийнятна сіль цієї сполуки.
6. Сполука, яка являє собою:
1-[5-хлор-2-(тіоморфолін-2-ілметокси)феніл]-3-(5-метилпіразин-2-іл)сечовину,
або фармацевтично прийнятна сіль цієї сполуки.
7. Фармацевтична композиція, яка містить сполуку за будь-яким із пп. 1-6 або фармацевтично прийнятну сіль цієї сполуки та фармацевтично прийнятний розріджувач або носій.
8. Сполука за будь-яким із пп. 1-6 або фармацевтично прийнятна сіль цієї сполуки для застосування у терапії.
9. Сполука за будь-яким із пп. 1-6 або фармацевтично прийнятна сіль цієї сполуки для застосування у лікуванні раку ободової та прямої кишки, раку голови та шиї, раку підшлункової залози, раку молочної залози, раку шлунка, раку сечового міхура, раку вульви, лейкозу, лімфоми, меланоми, гіпернефроїдного раку, раку яєчника, раку мозку, остеосаркоми або раку легень.
Текст
1. Сполука, вибрана з групи, яка включає: 1-[5-хлор-2-S-([1,4]оксазепан-2-ілметокси)феніл]-3(5-метилпіразин-2-іл)сечовину, 1-[5-хлор-2-([1,4]оксазепан-2-ілметокси)феніл]-3(5-метилпіразин-2-іл)сечовину, 1-[5-хлор-2-R-([1,4]оксазепан-2-ілметокси)феніл]-3(5-метилпіразин-2-іл)сечовину, 1-[5-хлор-4-метил-2-S-([1,4]-оксазепан-2ілметокси)феніл]-3-(5-метилпіразин-2-іл)сечовину, 1-[5-бром-2-([1,4]оксазепан-2-ілметокси)феніл]-3(5-метилпіразин-2-іл)сечовину, 1-[5-бром-2-(4-метил-[1,4]оксазепан-2ілметокси)феніл]-3-(5-метилпіразин-2-іл)сечовину, або фармацевтично прийнятна сіль цієї сполуки. 2. Сполука, вибрана з групи, яка включає: 1-[2-(1,4-диметилпіперазин-2-ілметокси)-5метилфеніл]-3-(5-метилпіразин-2-іл)сечовину, 1-[5-метил-2-(1-метилпіперазин-2ілметокси)феніл]-3-(5-метилпіразин-2-іл)сечовину, 1-[5-хлор-2-(1-метилпіперазин-2-ілметокси)феніл]3-(5-метилпіразин-2-іл)сечовину, 2 (19) 1 3 92164 4 1-[5-метил-2-(морфолін-2-ілметокси)феніл]-3-(51-[5-хлор-2-S-(морфолін-2-ілметокси)феніл]-3-(5метилпіразин-2-іл)сечовину, ціанопіразин-2-іл)сечовину, 1-[5-хлор-2-(морфолін-2-ілметокси)феніл]-3-(5або фармацевтично прийнятна сіль цієї сполуки. метилпіразин-2-іл)сечовину, 5. Сполука, яка являє собою: 1-[5-хлор-2-(S-морфолін-2-ілметокси)феніл]-3-(51-[5-бром-4-метил-2-S-(морфолін-2метилпіразин-2-іл)сечовину, ілметокси)феніл]-3-(5-метилпіразин-2-іл)сечовину, 1-[5-метил-2-(S-морфолін-2-ілметокси)феніл]-3-(5або фармацевтично прийнятна сіль цієї сполуки. метилпіразин-2-іл)сечовину, 6. Сполука, яка являє собою: 1-[5-хлор-2-(R-морфолін-2-ілметокси)феніл]-3-(51-[5-хлор-2-(тіоморфолін-2-ілметокси)феніл]-3-(5метилпіразин-2-іл)сечовину, метилпіразин-2-іл)сечовину, 1-[5-бром-2-(S-морфолін-2-ілметокси)феніл]-3-(5або фармацевтично прийнятна сіль цієї сполуки. метилпіразин-2-іл)сечовину, 7. Фармацевтична композиція, яка містить сполуку 1-[5-бром-2-R-(R-морфолін-2-ілметокси)феніл]-3за будь-яким із пп. 1-6 або фармацевтично прийн(5-метилпіразин-2-іл)сечовину, ятну сіль цієї сполуки та фармацевтично прийнят1-(5-метилпіразин-2-іл)-3-[3-S-(морфолін-2ний розріджувач або носій. ілметокси)-5,6,7,8-тетрагідронафталін-28. Сполука за будь-яким із пп. 1-6 або фармацевіл]сечовину, тично прийнятна сіль цієї сполуки для застосуван1-[5-хлор-2-S-(морфолін-3-ілметокси)феніл]-3-(5ня у терапії. метилпіразин-2-іл)сечовину, 9. Сполука за будь-яким із пп. 1-6 або фармацев1-[5-метил-2-R-(морфолін-3-ілметокси)феніл]-3-(5тично прийнятна сіль цієї сполуки для застосуванметилпіразин-2-іл)сечовину, ня у лікуванні раку ободової та прямої кишки, раку 1-[5-хлор-2-S-(морфолін-2-ілметокси)феніл]-3-(5голови та шиї, раку підшлункової залози, раку мотрифторметилпіразин-2-іл)сечовину, лочної залози, раку шлунка, раку сечового міхура, 1-[4-хлор-5-метил-2-S-(морфолін-2раку вульви, лейкозу, лімфоми, меланоми, гіперілметокси)феніл]-3-(5-ціанопіразин-2-іл)сечовину, нефроїдного раку, раку яєчника, раку мозку, осте1-[5-хлор-4-метокси-2-(S-морфолін-2осаркоми або раку легень. ілметокси)феніл]-3-(5-ціанопіразин-2-іл)сечовину, Галузь винаходу Цей винахід стосується сполук, корисних для пригнічення ферментів, які підтримують та відновлюють цілісність генетичного матеріалу. Більш конкретно, цей винахід стосується низки арил- та гетероарил-заміщених сечовин, способів виготовлення цих сполук та їх застосування як терапевтичних засобів, наприклад, у лікуванні раку та інших захворювань, які характеризуються дефектами реплікації дезоксирибонуклеїнової кислоти (ДНК), сегрегації хромосом або клітинного поділу. Рівень техніки Різноманітні захворювання, хворобливі стани та розлади (нижче "показання") характеризуються як такі, що в них беруть участь аберантно проліферуючі клітини. У значенні, вживаному у цьому описі, термін "аберантно проліферуючі клітини" (або "аберантна проліферація клітин") означає проліферацію клітин, яка відхиляється від нормального, природного або очікуваного перебігу. Наприклад, аберантна проліферація клітин охоплює невідповідну проліферацію клітин, в яких ДНК або інші елементи клітини зазнають пошкоджень або стають дефектними. Аберантна проліферація клітин також характеризується клінічними показаннями, які спричиняються, опосередковуються або є наслідками неприйнятно високих рівнів клітинного поділу, неприйнятно високих рівнів загибелі клітин (наприклад, апоптозу) або того й іншого. Такі симптоми можуть характеризуватися, наприклад, одиночною або численними місцевими анормальними проліфераціями клітин, груп клітин або тканини (тканин), та охоплюють ракові (доброякісні або злоякісні) та неракові показання. За визначенням, всі види раку (доброякісні та злоякісні) включають деякі форми аберантної проліферації клітин. Деякі неракові показання також включають аберантну проліферацію клітин. Приклади неракових показань, що включають аберантну проліферацію клітин, охоплюють ревматоїдний артрит, псоріаз, вітиліго, гранулематоз Вегенера (Wegener) та системний червоний вовчак. Один із підходів до лікування показань, у яких беруть участь аберантно проліферуючі клітини, включає застосування засобів, що пошкоджують ДНК. Ці сполуки створені для вбивання аберантно проліферуючих клітин шляхом порушення життєвих клітинних процесів, наприклад, метаболізму ДНК, синтезу ДНК, транскрипції ДНК та утворення мікротрубочок веретена. Вони можуть також діяти, наприклад, шляхом введення пошкоджень у ДНК, що порушує цілісність хромосомної структури. Засоби, що пошкоджують ДНК, призначаються та вводяться шляхами, які спрямовані на спричинення максимальних пошкоджень та викликають загибель аберантно проліферуючих клітин із мінімальним пошкодженням нормальних, здорових клітин. На сьогодні вже розроблені та знаходяться в стадії розробки численні й різноманітні засоби, що пошкоджують ДНК, в тому числі хіміотерапевтичні засоби та радіотерапія. На жаль, ефективність засобів, що пошкоджують ДНК, у лікуванні станів, що включають аберантну проліферацію клітин, нижча, ніж бажано, особливо у лікуванні раку. Селективність таких сполук для аберантно проліферуючих клітин у порівнянні зі здоровими клітинами (яку іноді називають терапевтичним індексом) часто є мінімальною. 5 92164 6 Крім того, всі клітини мають сенсорні та віднофази S (синтезу), фази G2 (проміжної) та фази Μ влювальні механізми, які можуть працювати, пе(мітозу). Фази G1, S та G2 звуться у сукупності решкоджаючи цілям засобів, що пошкоджують фазою інтеркінезу циклу поділу клітин. Під час ДНК. Такі сенсорні механізми, які називають точфази G1 біосинтетична діяльність клітини розвиками контролю клітинного циклу, допомагають вається з високою швидкістю. Фаза S починається, підтримувати порядок різноманітних стадій репліколи починається синтез ДНК, та закінчується, кації клітин та гарантувати, що кожна стадія здійсколи вміст ДНК у ядрі клітини відновлюється, та нюється з високою точністю (Hartwell et al., утворюються дві ідентичні сукупності хромосом. Science, 246:629-634 (1989); Weinert et al., Genes Потім клітина переходить у фазу G2, яка проDev., 8:652 (1994)). Коли клітини виявляють пошдовжується до початку мітозу. У процесі мітозу кодження ДНК, в тому числі пошкодження, навмихромосоми подвоюються та розділяються, утвосно спричинені засобами, що пошкоджують ДНК, рюються два нових ядра та протікає цитокінез, при певні шляхи передавання сигналів активують точякому клітина розщеплюється на дві дочірні клітики контролю клітинного циклу, і цикл реплікації ни, кожна з яких отримує одне ядро, що містить клітин тимчасово припиняється ("зупиняється"). Ця один або два набори хромосом. Цитокінез заверзупинка надає клітинам час для відновлення їхньої шує фазу Μ та позначає початок проміжної фази ДНК, часто на період, достатній для надання їм наступного циклу поділу клітин. Послідовність проможливості для продовження існування та пролітікання подій у циклі поділу клітин жорстко регуферації. У випадку аберантно проліферуючих клілюється, отже, початок однієї фази циклу поділу тин, це відновлення є небажаним, оскільки воно клітин залежить від завершення попередньої фази може підірвати зусилля, спрямовані на спричиненциклу поділу клітин. Це забезпечує точність відтня пошкоджень ДНК, достатніх для вбивання таких ворення подвоєння та розділення генетичного маклітин. теріалу при переході від одного покоління соматиНаприклад, хіміотерапевтичний засіб, що чних клітин до наступного. зветься GEMZAR (гемцитабін, або 2',2'-дифтор-2'Виявлено, що точки контролю клітинного цикдеоксицитидин) пошкоджує ДНК шляхом включенлу включають щонайменше три різних класи поліня у ДНК під час синтезу. Невідновлена, пошкопептидів, які діють послідовано у відповідь на сигджена ДНК в цілому стає нездатною підтримувати нали циклу поділу клітин або на дефекти життя. Однак у багатьох уражених клітинах, точки хромосомних механізмів (Саrr, Science, 271:314контролю клітинного циклу детектують невідповід315, 1996). Першим класом є група протеїнів, які но синтезовану (або іншим чином пошкоджену) детектують або відчувають пошкодження ДНК або ДНК. Активовані точки контролю клітинного циклу аномалії у циклі поділу клітин. До цих сенсорів спричиняють призупинення циклу поділу клітин належать мутований протеїн атаксіїпротягом часу, достатнього для забезпечення відтелеангіетаксії (Ataxia-telangiectasia Mutated новлення пошкодженої ДНК. Таке явище є одним protein, Atm) та пов'язаний з опроміненням протеїн зі шляхів, якими аберантно проліферуючі клітини, атаксії-телеангіетаксії (Atr). Другий клас поліпепзгідно з теорією, протидіють руйнувальному ефектидів посилює та передає сигнал, що генерується ту сполук, що пошкоджують ДНК, наприклад, хіміодетектором; прикладами таких чинників є Rad53 терапевтичних, радіотерапевничних та інших за(Alen et al. Genes Dev. 8:2416-2488, 1994) та Chk1. собів. Третій клас поліпептидів охоплює ефектори циклу Інші сполуки, що пошкоджують ДНК, спричиподілу клітин, наприклад, р53, які опосередковуняють призупинення розвитку пухлинних клітин у ють клітинну реакцію, наприклад, призупинення S-фазі. Спостерігалися явища опору пухлинних мітозу та апоптоз. клітин впливу деяких хіміотерапевтичних засобів Значну частину сучасної інформації про функшляхом простого призупинення розвитку в S-фазі ції точок контролю клітинного циклу одержано при під час введення хіміотерапевтичного засобу. Подослідженнях ліній пухлинних клітин. У багатьох тім, після виведення лікарського засобу, пошковипадках пухлинні клітини втрачають головні точки дження ДНК відновлюються, призупинення циклу контролю циклу поділу клітин (Hartwell et al., поділу клітин зникає, і клітини розвиваються згідно Science 266:1821-28, 1994). Є відомості, що клюз програмою залишку циклу поділу клітин (Shi et човою стадією у розвитку неопластичного стану al., Cancer Res. (57:1065-1072, 2001). Інші терапеклітин є виникнення мутацій, які інактивують шлявтичні засоби спричиняють призупинення циклу хи передавання сигналів точок контролю циклу поділу клітин в інших контрольних точках, в тому поділу клітин, наприклад, шляхи, які включають числі G1 та G2. Тому очікується, що інгібування р53 (Weinberg, Cell 817:323-330, 1995; Levine, Cell різних контрольних точок пошкодження ДНК має 88.3234-331, 1997). Наслідком втрати цих точок сприяти запобіганню відновлення терапевтично контролю клітинного циклу є реплікація пухлинних спричинених пошкоджень ДНК та сенсибілізації клітин, незважаючи на пошкодження ДНК. клітин-мішеней до засобів, що пошкоджують ДНК. Неракова тканина, яка містить інтактні точки Очікується, що така сенсибілізація, у свою чергу, контролю клітинного циклу, як правило, є ізольосприятиме підвищенню терапевтичного індексу ваною від тимчасового розриву шляху передачі цих лікарських засобів. сигналу, який включає одну точку контролю. ПухЦикл поділу клітин є структурно та функціоналинні клітини, однак, мають дефекти у шляхах, що льно однаковим із точки зору основного процесу контролюють розвиток циклу поділу клітин і, таким та способу регуляції у всіх еукаріотних видів живих чином, збурення додаткових точок контролю надає істот. Мітотичний (соматичний) цикл поділу клітин їм особливої чутливості до засобів, що пошкоджускладається з чотирьох фаз: фази G1 (проміжної), ють ДНК. Наприклад, пухлинні клітини, які містять 7 92164 8 мутантний р53, є дефектними як стосовно до точки фазу мітозу у присутності пошкодженої ДНК або контролю G1 пошкодження ДНК, так і стосовно до нереплікованої ДНК. здатності зберігати точку контролю G2 пошкоДодаткові класи інгібіторів точок контролю цидження ДНК (Bunz et al., Science, 282:1497-501, клу поділу клітин діють у фазі G1 або G2/M. UCN1998). Очікується, що інгібітори точок контролю, які 01, або 7-гідроксистауроспорин, спочатку був виспрямовані на ініціювання точки контролю G2 або ділений як неспецифічний інгібітор кінази, який точки контролю фази S, будуть додатково пошковпливає, головним чином, на протеїнкіназу С, але джувати здатність цих пухлинних клітин до відновостаннім часом виявлено, що він пригнічує активлення пошкодженої ДНК і, таким чином, сприяти ність Chk1 та відключає точку контролю G2 циклу підвищенню терапевтичного індексу як радіотераподілу клітин (Shi et al., supra). Отже, оскільки пії, так і системної хіміотерапії (Gesner, Abstract at UCN-01 є неселективним інгібітором Chk1, у велиSRI Conference: Protein Phosphorylation and Drug ких дозах він є токсичним для клітин. У малих доDiscovery World Summit, March 2003). зах він неспецифічно пригнічує численні клітинні У присутності пошкодження ДНК або будь-якої кінази, а також пригнічує точку контролю G1 перешкоди реплікації ДНК, протеїни точок контро(Tenzer et al., Сип. Мей Chem. AntiCancer Сполуки, лю Atm та Atr ініціюють шлях передачі сигналу, 3:35-46, 2003). який призводить до призупинення циклу поділу UCN-01 використовувався у поєднанні з тераклітин. Показано, що Atm відіграє певну роль у пією раку, наприклад, радіотерапією, протиракоточці контролю пошкодження ДНК під впливом вими засобами камптотецином (Tenzer et al., іонізуючого проміння (IR). Atr стимулюється сполуsupra), та гемцитабіном (Shi etal., supra) з обмеками, які викликають порушення двоспіральної женим успіхом. Крім того, UCN-01 використовувавДНК, односпіральної ДНК та сполуками, які блокуся для підсилення ефекту відновлення спричинеють ДНК під впливом випромінення. них темозоломідом (TMZ) порушень ДНК (MMR) у Chk1 є протеїнкіназою, яка включається у клітинах гліобластоми (Hirose et al., Cancer Res., шлях передачі сигналу точки контролю пошко61:5843-5849, 2001). У клінічних умовах UCN-01 не дження ДНК за Atm та/або Atr (Sanchez et al., виправдав очікувань як ефективний хіміотерапевScience, 277:1497-1501, 1997; Патент США No. тичний засіб, можливо, внаслідок порушення ре6,218,109). У клітинах ссавців фосфорилування жиму лікування та недостатньої ідентифікації конChk1 відбувається як реакція на фактори, що кретних молекулярних мішеней (Grant et al., Drug спричиняють пошкодження ДНК, в тому числі на Resistance Updates, 6:15-26, 2003). Так, Мак та ін. іонізуюче проміння (IR), ультрафіолетове (UV) сповіщають про залежний від циклу поділу клітин світло та гідроксисечовини (Sanchez et al., supra; ефект підсилення цисплатину UCN-01 у культурі Lui et al., Genes Dev., 14:1448-1459, 2000). Це фолінії клітин недрібноклітинної карциноми легенів, сфорилування, яке активує Chk1 у клітинах ссавале не ідентифікують конкретно точки контролю ців, залежить від Atm (Chen et al., Oncogene, циклу поділу клітин, які є мішенями для UCN-01. 18:249-256, 1999) та Atr (Lui et al., supra). Крім того, (Mack et al., Cancer Chemother. Pharmacol., показано, що Chk1 фосфорилює як Weel 51(4):337-348, 2003). (O'Connell et al., EMBO J., 16:545-554, 1997), так і Існує кілька інших підходів до сенсибілізування Pdsl (Sanchez et al., Science, 286:1166-1171, 1999) пухлинних клітин для лікування хіміотерапевтич- генні продукти, важливі для контролю циклу поними засобами, які впливають на цикл поділу кліділу клітин. тин. Наприклад, введення 2-амінопурину пригнічує Ці дослідження показують, що Chk1 ссавців численні механізми дії точок контролю циклу подівідіграє певну роль у точках контролю пошкодженлу клітин, наприклад, спричиненого мімозином ня ДНК, залежних від Atm, які спричиняють призупризупинення фази G1 або спричиненого гідроксипинення фази S. Останнім часом з'ясовано роль сечовиною призупинення фази S, що дозволяє Chk1 у фазі S клітин ссавців (Feijoo et al., J. Cell клітинам переходити у фазу мітозу та проходити Biol., 154:913-923, 2001; Zhao et al., PNAS U.S.A, цю фазу (Andreassen et al., Proc NatlAcad Sci 99:14795-800, 2002; Xiao et al., J Biol Chem., U.S.A., 86:2272-2276, 1992). Для підвищення цито278(24):21767-21773, 2003; Sorensen et al., Cancer токсичності засобів, що пошкоджують ДНК, наприCell, 3(3):247-58, 2003); ці дослідження висвітлюклад, цисплатину та іонізуючого випромінення, ють роль Chk1 у контролі цілісності синтезу ДНК. застосовували також кофеїн - метилксантин, який Chk1 спричиняє призупинення S-фази шляхом опосередковує проходження через точку контролю фосфорилування Cdc25A, який регулює активність G2 і, таким чином, спричиняє загибель клітини циклінА/сdk2 (Xiao et al., supra та Sorensen et al., (Bracey et al., Clin. Cancer Res., 3:1371-1381, 1997). supra). Chk1 також спричиняє призупинення G2 Однак доза кофеїну, використовувана для порушляхом фосфорилування та інактивації Cdc25C шення циклу поділу клітин, перевищує клінічно фосфорилази подвійної специфічності, яка за ноприйнятні рівні, тому цей засіб не є практично прирмальних умов дефосфорилює циклін-В/сdс2 (тайнятним варіантом терапії. Крім того, для підсикож відомий під назвою Cdk1) при переході клітини лення чутливості до інгібітора топоізомерази від фази G2 до мітозу (Fernery et al., Science, BNP1350 використовувалися нуклеотиди, які де277:1495-7, 1997; Sanchez et al., supra; Matsuoka et сенсибілізують Chk1 кіназу, (Yin et al., Biochem. al., Science, 282:1893-1897, 1998; та Blasina et al., Biophys. Res. Commun., 295:435-44, 2002), однак Curr. Biol, 9:1-10, 1999). В обох випадках регуляція при цьому виникають ускладнення, типові для анактивності Cdk спричиняє призупинення циклу тисенсорної терапії та генної терапії. поділу клітин для запобігання переходу клітин у Розкрито інгібітори Chk1, в тому числі арил- та гетероарил-заміщені сечовини, описані у заявці на 9 92164 10 патент США № 10/087,715 та попередніх заявках на патент США №№ 60/583,080, 60/585,292, та 60/602,968; діарилсечовини, описані у патентній публікації США № 2004/0014765, патентній публікації США № US2003/199511, патентній публікації США № 2004/0014765, та WO 03/101444; метилксантини та аналогічні сполуки, описані у публікації Fan et al., Cancer Res. 55:1649-54. 1995; уреїдотіофени, описані у WO 03/029241 та WO 03/028731; де R1 - галоген, С1-3-алкіл, CN або CF3; карбоксаміди N-піролопіридинілу, описані у WO R2 - водень, С1-3-алкіл, CN, ОС1-3-алкіл, гало03/028724; антисенсорні до Chk1 олігонуклеотиди, ген або N(Rb)2, де Rb, незалежно від інших замісописані у WO 01/57206 та патенті США № ників, є водень або С1-3-алкіл; 6,211,164; антагоністи рецептора Chk1, описані у R3 - 6- або 7-членний насичений гетероцикл, WO 00/16781; похідні гетероароматичних карбокщо містить в циклі одну групу N-Ra та/або другу самідів, описані у WO 2003/037886; амінотіофени, групу N-Ra, або кисень, або сірку, де Ra, незалежно описані у WO 2003/029242; (індазоліл)від інших замісників, є водень, С1-3-алкіл, CH2CN бензимідазоли, описані у WO 2003/004488; бензиабо CH2CH2CN та де R3 факультативно заміщений мідазол-хінолінони, описані у патентній публікації оксогрупою (=O); США № 2004/0092535 ,та WO 2004/018419; гетеR4 - водень, С1-3-алкіл, ОС1-3-алкіл, SС1-3-алкіл, роциклічні гідроксиімінофлуорени, описані у WO b N(R )2, NRbC(=O)С1-3-алкіл, або 5- або 6-членний 2002/16326; похідні сцитонеману, наприклад, сцинасичений гетероцикл, що містить одну групу N-Ra тонемін, описані у патенті США No 6,495,586; гета факультативно цикл, заміщений одною-трьома тероарилбензаміди, описані у WO 01/53274; індаС1-3-алкільними групами; золи, описані у WO 01/53268; індолкарбазоли, або R2 та R4 спільно з атомами вуглецю, до описані у роботі Tenzer et al., supra; похідні хромаяких вони приєднані, утворюють 5-, 6- або 7ну, описані у WO 2002/070515; пауллони, описані у членний насичений карбоцикл; роботі Schultz et al., J. Med. Chem., Vol:2909-2919, та R5 - водень або галоген, 1999; інденопіразоли, описані у WO 99/17769; за умови, що щонайменше один із R2 та R4 не флавони, описані у роботі Sedlacek et al., Int J. є воднем, та що у разі якщо R5 є галоген, то R2 або Oncol., 9:1143-1168, 1996; пептиди - похідні пептиR4 є водень, дного контуру серин-треонінкіназ, описані у WO або фармацевтично прийнятні солі, проліки 98/53050; оксіндоли, описані у WO 2003/051838; або сольвати цієї сполуки. діазепініндолони, описані у WO 2004/063198; піриЗа іншим аспектом цього винаходу, запропомідини, описані у WO 2004/048343; сечовини, опиновані сполуки структурної формули (II), які, серед сані у WO 2004/014876; та піролкарбазоли, бенінших застосувань, можуть бути застосовані у спозофуроізоіндоли та азациклопентафлуорени, собах пригнічення Chk1, описані у WO 2003/091255. Однак у галузі постійно існує потреба в ефективних та селективних інгібіторах Chk1. Цей винахід спрямовано на задоволення цієї та інших потреб. Суть винаходу Цей винахід стосується ефективних та селективних інгібіторів кінази Chk1, які виявляють несподівані властивості у біохімічних та/або клітинних дослідженнях. Ці інгібітори Chk1 корисні у лікуванні показань, що включають аберантну проде R1 - галоген, С1-3-алкіл, CN або CF3; ліферацію клітин, та як хіміосенсибілізатори та R2 - водень, С1-3-алкіл, CN, ОС1-3-алкіл, галорадіосенсибілізатори у лікуванні показань, пов'яген або N(Rb)2, де Rb, заних із пошкодженнями ДНК або порушеннями незалежно від інших замісників, є водень або реплікації ДНК. С1-3-алкіл; Отже, за першим аспектом цього винаходу, R3 - 6- або 7-членний насичений гетероцикл, запропоновано сполуки структурної формули (І). що містить у циклі одну групу N-Ra та/або другу Поряд з іншими застосуваннями, ці сполуки корисгрупу N-Ra, або кисень або сірку, де Ra, незалежно ні у способах інгібування Chk1, які включають ставід інших замісників, є водень, С1-3-алкіл або дію введення ефективної кількості сполуки струкCH2CN, та де R3 факультативно заміщений оксогтурної формули (І) в організм пацієнта, який рупою (=O); потребує цього. R4 - водень, С1-3-алкіл, ОС1-3-алкіл або галоген; Сполуки формули (І) мають структурну форабо R2 та R4 спільно з атомами вуглецю, до мулу: яких вони приєднані, утворюють 5-, 6- або 7членний насичений карбоцикл, за умови, що щонайменше один із R2 та R4 не є воднем, або фармацевтично прийнятні солі, проліки, або сольвати цієї сполуки. 11 92164 12 За іншим аспектом цього винаходу, запропоновані фармацевтичні композиції, що містять одну де R1 - галоген, С1-3-алкіл, CN або CF3; або декілька сполук структурної формули (І) або R2 - водень, С1-3-алкіл, CN, ОС1-3-алкіл, галоструктурної формули (II), та застосування цих комген або N(Rb)2, де Rb, незалежно від інших заміспозицій у терапевтичному лікуванні показань, де ників, є водень або С1-3-алкіл; 3 пригнічення Chk1, in vivo або ex vivo, надає тераR - 6- або 7-членний насичений гетероцикл, певтичні переваги або становить дослідницький що містить в циклі одну групу N-Ra та/або другу або діагностичний інтерес. групу N-Ra, або кисень або сірку, де Ra, незалежно За ще одним аспектом цього винаходу, запровід інших замісників, є водень, С1-3-алкіл, CH2CN поновано спосіб сенсибілізування клітин у пацієнабо CH2CH2CN та де R3 факультативно заміщений та, якого піддають хіміотерапевтичному або радіооксогрупою (=О); терапевтичному лікуванню показань, який включає R4 - водень, С1-3-алкіл, ОС1-3-алкіл, SС1-3-алкіл, введення в організм пацієнта сполуки структурної N(Rb)2, NRbC(=O)С1-3-aлкiл, або 5- або 6-членний формули (І) або структурної формули (II) у комбінасичений гетероцикл, що містить одну групу N-Ra нації з хіміотерапевтичним засобом, радіотерапевта факультативно цикл, заміщений одною-трьома тичним засобом або тим і іншим. НеобмежувальС1-3-алкільними групами; ним показанням для лікування за цим способом є або R2 та R4 спільно з атомами вуглецю, до рак. яких вони приєднані, утворюють 5-, 6- або 7За іншим аспектом цього винаходу, запропочленний насичений карбоцикл; новано спосіб пригнічення або попередження абета R5 є водень або галоген, рантної проліферації клітин. За одним варіантом за умови, що щонайменше один із R2 та R4 не здійснення, цей спосіб включає введення в контакт є воднем, та що у разі якщо R5 - галоген, то R2 або популяції клітин, що містить аберантно проліфеR4 є водень, руючі клітини, із щонайменше одним активатором або фармацевтично прийнятні солі, проліки Chk1 у кількості та протягом часу, достатніх для або сольвати цієї сполуки. істотного синхронізування призупинення циклу За одним із варіантів здійснення, якому віддаподілу клітин серед аберантно проліферуючих ється перевага, сполуки мають структурну формуклітин. Після досягнення істотної синхронізації лу (II): затримання циклу поділу клітин у популяції клітин, згадану популяцію клітин вводять у контакт із щонайменше одним інгібітором Chk1 у кількості та протягом часу, достатніх для практичного припинення згаданого призупинення циклу поділу клітин. Інший аспект цього винаходу пропонує виріб, призначений для фармацевтичних цілей, що включає в себе: (а) фармацевтичну композицію, що містить сполуку структурної формули (І) або структурної де R1 - галоген, С1-3-алкіл, CN або CF3; формули (II); R2 - водень, С1-3-алкіл, CN, ОС1-3-алкіл, гало(b) вкладиш, який повідомляє, що композиція ген або N(Rb)2, де Rb, незалежно від інших заміскорисна у лікуванні показань, що включають абеників, є водень або С1-3-алкіл; рантну проліферацію клітин; та R3 - 6- або 7-членний насичений гетероцикл, (c) упаковку. що містить у циклі одну групу N-Ra та/або другу За іншим аспектом, цей винахід пропонує: групу N-Ra, або кисень або сірку, де Ra, незалежно (a) фармацевтичну композицію, що містить від інших замісників, є водень, С1-3-алкіл або сполуку структурної формули (І) або структурної CH2CN, та де R3 факультативно заміщений оксогформули (II); рупою (=O); (b) вкладиш, який повідомляє, що композиція R4 - водень, С1-3-алкіл, ОС1-3-алкіл або галоген; корисна як хіміосенсибілізатор або радіосенсибіліабо R2 та R4 спільно з атомами вуглецю, до затор у лікуванні показань, пов'язаних з пошкояких вони приєднані, утворюють 5-, 6- або 7дженням ДНК або порушенням реплікації ДНК; членний насичений карбоцикл, (c) упаковку. за умови, що щонайменше один із R2 та R4 не Ці та інші аспекти даного винаходу будуть є воднем, очевидними з подальшого детального опису. або фармацевтично прийнятні солі, проліки, Детальний опис винаходу або сольвати цієї сполуки. Сполуки за даним винаходом мають структурЗа одним із варіантів здійснення сполук форну формулу (І): мули (І) та формули (II), якому віддається перевага, R1 - хлор, метил, CN або CF3. За іншим варіантом здійснення, якому віддається перевага, R2 є водень, метил, етил, хлор, бром, диметиламіно-, ціано- або метоксигрупа. За іншими варіантами здійснення, яким віддається перевага, R2 не є воднем. За іншими варіантами здійснення сполук формули (І) та формули (II), яким віддається перевага, 13 92164 14 R4 - метил, хлор, фтор, метокси-, ізопропокси-, диметиламіногрупа, -SCH3, -NHC(=O)CH(CH3)2, NHC(=O)CH3, піролідиніл або 3,3диметилпіролідиніл. За іншими варіантами здійснення, яким віддається перевага, R4 - метил, хлор або метоксигрупа. За ще одним варіантом здійснення, якому віддається перевага, R2 та R4 спільно з атомами вуглецю, до яких вони приєднані, утворюють п'ятичленний або шестичленний насичений карбоцикл. За ще одним варіантом здійснення, перевага віддається сполукам формули (І) та формули (II), де R5 - галоген, R4 - водень. За варіантом здійснення, якому віддається перевага, R5 - фтор. За іншими варіантами здійснення, яким віддається перевага, R5 - водень. За одним варіантом здійснення сполук формули (І) та формули (II), R1 - ціаногрупа, R2 - водень, a R4 за варіантом, якому віддається перевага, є хлор або метил. За іншим варіантом здійснення, R5 - фтор, R4 - водень, a R2 У значенні, вживаному у цьому описі, термін " - метил, хлор або бром. С1-3-алкіл" охоплює нерозгалужені та розгалужені Приклади груп R3 у формулі (І) та формулі (II), алкільні групи, що містять від одного атому до яким віддається перевага, охоплюють, проте без трьох атомів вуглецю, а саме метил, етил, нобмеження ними, пропіл та ізопропіл. Термін "галоген" у цьому описі означає фтор, хлор, бром та йод. Термін "ціано[група]" означає -CN. Термін "трифторметил" означає -CF3. Скорочення "Me" означає метил, тобто -СН3-. Засоби, що пошкоджують ДНК, які активують точки контролю клітинного циклу, в цілому позначені у цьому описі як "активатори точок контролю". Засоби, що пошкоджують ДНК, які активують точку контролю, позначену "Chk1" позначені у цьому описі як "активатори Chk1". Аналогічно, інгібітори таких точок контролю позначені у цьому описі відповідно як "інгібітори точок контролю" та "інгібітори Chk1". У значенні, вживаному у цьому описі, інгібіторами Chk1 є сполуки, здатні принаймні частково інгібувати активність щонайменше однієї точки контролю циклу поділу клітин протешу Chk1. Інгібування точки контролю циклу поділу клітин досягається, коли механізм клітинної точки контролю пригнічується достатньою мірою для уможливлення переходу клітини від фази циклу поділу, на якій він призупинений, до наступної фази циклу поділу або уможливлення переходу клітини безпосередньо до фази загибелі клітини. Інгібування точки контролю циклу поділу клітини уможливлює перенесення клітиною пошкодженого або дефектного генетичного матеріалу до наступних фаз циклу поділу клітин, тим самим спричиняючи загибель клітини або сприяючи їй. Загибель клітини може бути викликана будь-яким механізмом, в тому числі апоптозом та мітотичною катастрофою. Сполуки за цим винаходом є інгібіторами Chk1. Термін "активатор Chk1" охоплює будь-які відомі сполуки або сполуки, що будуть відкриті згодом, які мають здатність до активування дії кінази Chk1 і таким чином спричинють принаймні часткове призупинення циклу поділу клітин. Активатори Chk1 охоплюють сполуки, здатні призупиняти цикл поділу клітин на будь-якій фазі циклу, причому такі 15 92164 16 фази можуть згадуватися в цьому описі під назвою промінення, що має довжину хвилі у діапазоні від "фаз-мішеней" для цього активатора. Фази-мішені 10-20 м до 100 м. включають будь-які фази циклу поділу клітин, за Термін "упаковка" означає будь-яку тару та винятком мітозу, а саме будь-яку із фаз G1, S та кришку до неї, придатні для зберігання, перевеG2. Активатори Chk1, придатні для цього винахозення, дозування фармацевтичного продукту ду, охоплюють засоби, що пошкоджують ДНК, ната/або поводження з ним. приклад, хіміотерапевтичні засоби та/або випроміТермін "вкладиш" означає інформацію, що сунення. До радіаційних активаторів Chk1 належить, проводжує продукт, яка включає вказівки щодо проте без обмеження ним, іонізуюче випромінензастосування продукту спільно з даними про його ня. Іонізуюче випромінення охоплює електромагнібезпечність та ефективність, необхідні лікареві, тне або частинкове випромінення, здатне створюфармацевту та пацієнтові для прийняття обгрунвати іонні пари шляхом взаємодії з речовиною. тованого рішення щодо застосування продукту. Іонізуюче випромінення охоплює рентгенівські та Вкладиш в цілому розглядається як "характерисгамма-промені, альфа- та бета-частинки, нейтрони тика" фармацевтичного продукту. та заряджені ядра. Випромінення охоплює ультЦей винахід охоплює всі можливі стереоізомерафіолетове випромінення, випромінення у видири та геометричні ізомери сполук структурної фомій частині спектра, інфрачервоне випромінення, рмули (І) або структурної формули (II). Цей винанадвисокочастотне випромінення, та суміші цих хід охоплює не тільки рацемічні сполуки, але й випромінень. Для визначення ефективності того чи оптично активні ізомери. Якщо сполука структурної іншого засобу як активатора Chk1 можна застософормули (І) або структурної формули (II) необхідвувати випробування, наприклад, описані у Прикна у вигляді одиничного енантіомера, вона може ладі 8. бути одержана як шляхом розділення кінцевого Вираз "пригнічення аберантної проліферації продукту, так і шляхом стереоспецифічного синтеклітин" означає зменшення швидкості проліферації зу з будь-яких ізомерно чистих вихідних продуктів аберантно проліферуючих клітин або повне приабо із застосуванням хоральних допоміжних реапинення такої проліферації. Це пригнічення може гентів, наприклад, дивись Ма та інші (Z. Ma et al., бути наслідком зниження швидкості проліферації, Tetrahedron: Asymmetry, 8(6), 883-888 (1997)). Розпідвищення швидкості відмирання клітин або обох ділення кінцевого продукту, проміжної сполуки, цих чинників. Відмирання клітин може відбуватися або вихідного матеріалу може бути досягнуте за будь-яким механізмом, в тому числі шляхом будь-яким придатним способом, відомим у галузі. апоптозу та мітотичної катастрофи. Крім того, у ситуаціях, коли можлива таутомерія Вислів "попередження аберантної проліферасполук структурної формули (І) або структурної ції клітин" означає пригнічення аберантної проліформули (II), цей винахід передбачає охоплення ферації клітин до її початку або пригнічення її ревсіх таутомерних форм сполук. Як показано нижче, цидиву. конкретні стереоізомери можуть виявляти надзвиТермін "in vivo" означає всередині живого орчайну здатність до пригнічення Cnk1 у комбінації з ганізму, наприклад, всередині тварини або людихіміотерапевтичним або радіотерапевтичним лікуни. У цьому контексті, сполуки можуть бути застованням. совані терапевтично in vivo для уповільнення або Проліки сполук структурної формули (І) або припинення проліферації клітин, що аберантно структурної формули (II) також можуть бути застореплікуються. Ці сполуки також можуть бути засовані як сполуки у способі за цим винаходом. стосовані in vivo як профілактичний засіб для поНадійно встановлено, що для тимчасової (наприпередження аберантної проліферації клітин або клад, біореверсивної) зміни фізико-хімічних власвиявлення симптомів, пов'язаних із нею. тивостей сполук можна успішно застосувати принТермін "ex vivo" означає зовні живого організцип проліків, згідно з яким сполуку переводять у му. Приклади ex vivo клітинних популяцій включаформу, придатну для виготовлення фармацевтичють клітинні культури та біологічні зразки, наприних препаратів та/або введення в організм, з поклад, зразки рідин або тканин людини або тварин. дальшим вивільненням лікарського засобу in vivo Такі зразки можуть бути одержані способами, доб(дивись Бундгаард (редактор), «Розроблення проре відомими у галузі. Приклади зразків біологічних ліків» - Bundgaard, Ed., "Design of Prodrags", рідин охоплюють кров, спинномозкову рідину, сеElsevier, Amsterdam, (1985); Сілвермен, «Органіччу, слину. Приклади зразків тканин охоплюють на хімія розроблення ліків та дія ліків» - R.B. пухлини та біопсії. У цьому контексті, сполуки за Silverman, "The Organic Chemistry of Drug Design цим винаходом можуть мати численні застосуванand Drug Action", Academic Press, San Diego, ня, як терапевтичні, так і експериментальні. chapter 8, (1992); K.M.Hillgren et al., Med. Res. Rev., Термін "радіосенсибілізатор" у значенні, вжи15, 83 (1995)). ваному у цьому описі, означає сполуку, яку ввоСполуки за цим винаходом містять одну або дять в організм людини або іншої тварини у терадекілька функціональних груп. Функціональні групевтично ефективній кількості для підсилення пи, у разі бажання або потреби, можуть бути мочутливості клітин до електромагнітного випромідифіковані для одержання проліків. Придатні пронення та/або для сприяння лікуванню захворюліки охоплюють, наприклад, похідні кислот, вань, що піддаються вилікуванню електромагнітнаприклад, аміди та складні ефіри. Для фахівця в ним випроміненням. галузі також зрозуміло, що як проліки можуть бути Термін "випромінення" у значенні, вживаному застосовані N-оксиди. у цьому описі охоплює, але без обмеження, виСполуки за цим винаходом можуть існувати у вигляді солей. Фармацевтично прийнятним солям 17 92164 сполук за цим винаходом в цілому віддається перевага в способах за цим винаходом. У значенні, вживаному у цьому описі, термін "фармацевтично прийнятні солі" означає солі або цвітеріонні форми сполук структурної формули (І) або структурної формули (II). Солі сполук формули (І) або формули (II) можуть бути виготовлені під час кінцевого виділення та очищення сполук або окремо шляхом проведення реакції сполуки з кислотою, що має придатний катіон. Придатні фармацевтично прийнятні катіони охоплюють катіони лужних металів (наприклад, натрію або калію) та лужноземельних металів (наприклад, кальцію або магнію). Крім того, фармацевтично прийнятні солі сполук структурної формули (І) або структурної формули (II), які містять основний центр, є солями з кислотами (солями кислот), утвореними із фармацевтично прийнятними кислотами. Прикладами кислот, які можуть бути застосовані для утворення фармацевтично прийнятних солей, є неорганічні кислоти, наприклад, хлористоводнева, бромистоводнева, сірчана та фосфорна, та органічні кислоти, наприклад, щавлева, малеїнова, бурштинова, малонова та лимонна. Необмежувальні приклади солей сполук за цим винаходом охоплюють, проте без обмеження ними, такі солі, як гідрохлорид, гідробромід, гідройодид, сульфат, бісульфат, 2гідроксіетансульфонат, фосфат, гідрофосфат, ацетат, адипінат, альгінат, аспартат, бензоат, бутират, камфарат, камфарсульфонат, цитрат, диглюконат, гліцерофосфат, гемісульфат, гептаноат, гексаноат, форміат, сукцинат, малонат, фумарат, малеат, метансульфонат, мезитиленсульфонат, нафтиленсульфонат, нікотинат, 2нафталінсульфонат, оксалат, памоат, пектинат, персульфат, 3-фенілпропіонат, пікрат, півалоат, пропіонат, трихлорацетат, трифторацетат, глутамат, бікарбонат, пара-толуолсульфонат, ундеканоат, лактат, цитрат, тартрат, глюконат, бензолсульфонат та n-толуолсульфонат. Крім того, реакційноздатні аміногрупи, наявні в сполуках за цим винаходом, можуть бути кватернізовані метил-, етил-, пропіл- та бутилхлоридами, бромідами та йодидами; диметил-, діетил-, дибутил- та діамілсульфатами; децил-, лаурил-, міристил- та стерилхлоридами, бромідами та йодидами; та бензил- та фенетилбромідами. У світлі викладеного вище, будь-яке посилання на сполуки за даним винаходом, зроблене у цьому описі, охоплює сполуки структурної формули (І) або структурної формули (II), а також фармацевтично прийнятні солі, сольвати або проліки цієї сполуки. Необмежувальними прикладами сполук за даним винаходом є: 18 19 92164 20 21 92164 22 23 92164 24 25 92164 26 27 92164 28 29 92164 30 31 1-[5-метил-2-(4-метилморфолін-2ілметокси)феніл]-3-(5-метилпіразин-2-іл)сечовина (мас-спектроскопія низького розрізнення з електророзпилюванням позитивних іонів (нижче LRMS (ES, +)) m/e - 372,4) 1-[5-хлор-2-(4-метилморфолін-2ілметокси)феніл]-3-(5-метилпіразин-2-іл)сечовина (LRMS (ES, +) m/e - 392,4) 92164 32 1-[5-хлор-2-R-(1-метилпіперазин-2ілметокси)феніл]-3-(5-метилпіразин-2-іл)сечовина (LRMS (ES, +) m/e - 391,3) 1-[5-бром-2-R-(4-метилморфолін-2ілметокси)феніл]-3-(5-метилпіразин-2-іл)сечовина (LRMS (ES, +) m/e - 438,0) , 1-(5-ціанопіразин-2-іл)-3-[5-метил-2-R-(4метилморфолін-2-ілметокси)-феніл]сечовина (LRMS (ES, +) m/e - 383,0) 1-(5-ціанопіразин-2-іл)-3-[2-(1,4диметилпіперазин-2-ілметокси)-5метилфеніл]сечовина (LRMS (ES, +) m/e - 396,4) 33 92164 34 , 1-[5-хлор-2-(4-метил-[1,4]оксазепан-2ілметокси)феніл]-3-(5-метилпіразин-2-іл)сечовина (LRMS (ES, +) m/e - 406,0) 1-[5-хлор-2-S-(5-оксоморфолін-2ілметокси)феніл]-3-(5-метилпіразин-2-іл)сечовина (LRMS (ES, +) m/e - 392,2) 1-[5-хлор-3-фтор-2-(S-морфолін-2ілметокси)феніл]-3-(5-метилпіразин-2-іл)сечовина (LRMS (ES, +) m/e - 396,3) 1-[5-метокси-2-(S-морфолін-2ілметокси)феніл]-3-(5-метилпіразин-2-іл)сечовина (LRMS (ES, +) m/e - 374,3) 1-[5-метокси-2-(S-морфолін-2ілметокси)феніл]-3-(5-метилпіразин-2-іл)сечовина (LRMS (ES, +) m/e - 358,3) N-[2-хлор-4-[3-(5-метилпіразин-2-іл)уреїдо]-5(S-морфолін-2-іл-метокси)феніл]ацетамід (LRMS (ES, +) m/e - 435,0) 35 92164 36 1-[4-хлор-2-(S-морфолін-2-ілметокси)феніл]-3(5-метилпіразин-2-іл)сечовина (LRMS (ES, +) m/e - 378,3) N-[2-хлор-4-[3-(5-метилпіразин-2-іл)уреїдо]-5(S-морфолін-2-іл-метокси)феніл]ізобутирамід (LRMS (ES, +) m/e - 463,2) 1-[5-хлор-4-фтор-2-(S-морфолін-2ілметокси)феніл]-3-(5-метилпіразин-2-іл)сечовина (LRMS (ES, +) m/e - 396,1) 1-(5-метилпіразин-2-іл)-3-[6-(S-морфолін-2ілметокси)індан-5-іл]-сечовина (LRMS (ES, +) m/e - 384,3) 1-[5-ціано-4-метил-2-(S-морфолін-2ілметокси)феніл]-3-(5-метилпіразин-2-іл)сечовина (LRMS (ES, +) m/e - 383,3) 1-[5-хлор-2-(4-ціанометилтіоморфолін-2ілметокси)феніл]-3-(5-метил-піразин-2-іл)сечовина (LRMS (ES, +) m/e - 433,0) 1-[5-хлор-4-диметиламіно-2-(S-морфолін-2ілметокси)феніл]-3-(5-метилпіразин-2-іл)сечовина (LRMS (ES, +) m/e - 421,2) , 37 92164 1-{5-хлор-2-[4-(2-ціаноетил)-S-морфолін-2ілметокси]феніл}-3-(5-метилпіразин-2-іл)сечовина 1-[5-хлор-2-(S-морфолін-2-ілметокси)-4піролідин-1-іл-феніл]-3-(5-метилпіразин-2іл)сечовина (LRMS (ES, +) m/e - 447,2) 38 (LRMS (ES, +) m/e - 431,0) 39 92164 40 факультативно, іншими терапевтичними та/або профілактичними інгредієнтами. Згадані носії є "прийнятними" у сенсі сумісності з іншими інгредієнтами композиції та нешкідливості для рецепієнта цієї композиції. Сполуки за цим винаходом виявляють несподівано високу ефективність. Ефективність у типових випадках характеризують як концентрацію сполуки, необхідну для досягнення певного результату. Що вищою є ефективність, то менша кількість сполуки є необхідною для виконання призначеної їй функції. Ефективність in vitro у типових випадках характеризують значенням ІС50 та вимірюють, використовуючи залежність доза-реакція. Значення ІС50 можна вимірювати шляхом введення чутливої випробувальної системи в контакт із досліджуваною сполукою у певному діапазоні концентрацій, в тому числі у концентрації, при якій ефект не спостерігається або є мінімальним, далі у вищих концентраціях, при яких спостерігається частковий ефект, включно у концентрації насичення, при якій спостерігається максимальний ефект. Теоретично результати таких випробувань залежності доза-реакція для інгібувальних сполук можна описати побудованою в логарифмічному масштабі S-подібною кривою, яка характеризує ступінь інгібування як функцію концентрації. Така крива, також теоретично, проходить через точку, в якій концентрація є достатньою для пригнічення активності ферменту точки контролю на 50% різниці між мінімальною та максимальною активностями ферменту, що спостерігаються при випробуванні. Цю концентрацію називають концентрацією 50% пригнічення, або ІС50. Значення ІС50 можна визначати, використовуючи звичайні біохімічні (позаклітинні) способи випробування або способи випробування у клітинних системах, добре відомі пересічному фахівцеві у галузі. Приклад такого випробування подано нижче у Прикладі 1. За варіантом, якому віддається перевага, значення ІС50 одержують шляхом виконання відповідних випробувань щонайменше двічі, при цьому значення ІС50 встановлюється як середнє (середнє арифметичне, або «середнє») значення одержаних індивідуальних значень. За варіантом, якому або солі, сольвати (наприклад, гідрати) або віддається більша перевага, випробування повтопроліки цих сполук. рюють від 3 разів до 10 (або більше) разів, при Сполуки за даним винаходом можуть бути зацьому значення ІС50 встановлюється як середнє стосовані у терапевтичних цілях у хімічно чистому значення для всіх одержаних значень. За варіанвигляді, але перевага віддається введенню сполук том, якому віддається найбільша перевага, випроу вигляді фармацевтичної композиції або препарабування виконують таку кількість разів, яка є досту. Таким чином, цей винахід пропонує фармацевтатньою для визначення статистично надійного тичну композицію, що містить сполуку формули (І) середнього значення ІС50 з використанням статисабо формули (II) спільно із фармацевтично прийнтичних методів, відомих пересічному фахівцеві у ятними розріджувачем або носієм. Також запропогалузі. новано спосіб виготовлення фармацевтичної комСполуки за цим винаходом виявляють неспопозиції, який включає змішування сполуки дівано низькі значення ІС50, які відповідають неформули (І) або формули (II) із фармацевтично сподівано високій ефективності in vitro. Сполуки за прийнятним розріджувачем або носієм. цим винаходом при випробуваннях за методикою, Таким чином, цей винахід додатково пропонує описаною нижче у Прикладі 1, виявляють значенфармацевтичні композиції, що містять сполуку ня ІС50 нижче від приблизно 200 нМ, у деяких варіструктурної формули (І) або структурної формули антах нижче від приблизно 150 нМ, в інших варіан(II), або фармацевтично прийнятні сіль, проліки тах нижче від приблизно 100 нМ, в інших - нижче або сольват цієї сполуки, спільно з одним або девід приблизно 50 нМ, ще в інших - нижче від прибкількома фармацевтично прийнятними носіями та, лизно 10 нМ, а в деяких - нижче від приблизно 5 41 92164 42 нМ. В інших варіантах сполуки за цим винаходом самої сполуки, яка пригнічує ріст 50% клітин) для виявляють значення ІС50 від приблизно 0,1 нМ до сполуки-інгібітора Chk1. Згадані дві величини, приблизно 5нМ. ECTFS та кратність сенсибілізації при LD50, уможСполуки за цим винаходом виявляють селекливлюють безпосереднє ранжування як ефективтивність для пригнічення Chk1 стосовно до інших ності, так і токсичності інгібітора Chk1s відносно протеїнкіназ. Селективність може бути перевагою одна одної. з точки зору послаблення негативних побічних Приклад випробування, корисного для виміефектів та/або підвищення терапевтичного індекрювання ECTFS, описано нижче у Прикладі 3. У су. загальних рисах, при цьому випробуванні викорис"Селективність" у цьому описі характеризуєтьтовують клітини людського раку товстої кишки ся як "кратна селективність". Загалом, кратна сеНТ29 як популяцію аберантно проліферуючих клілективність у значенні, вживаному у цьому описі, тин, гемцитабін як засіб для пошкодження являє собою ІС50 випробовуваної сполуки стосовДНК/активатор Chk1, та сполуку за цим винаходом но до ферменту порівняння, поділену на ІС50 стояк інгібітор Chk1. Популяцію аберантно проліфесовно до компараторного ферменту. Зокрема, краруючих клітин висівають та культивують у відповітна селективність для інгібітора Chk1 у значенні, дному ростовому середовищі. Потім клітини підвживаному у цьому описі, являє собою ІС50 інгібідають впливу засобу пошкодження ДНК у певному тора Chk1 (випробовуваної сполуки) стосовно до діапазоні концентрацій. Після збігання заздалегідь Chk1 (ферменту порівняння), поділену на ІС50 стовизначеного періоду часу засіб пошкодження ДНК совно до компараторного ферменту. Компараторні видаляють, і клітини піддають дії інгібітора Chk1 у ферменти, відносно яких можуть бути випробувані певному діапазоні концентрацій та протягом засполуки за цим винаходом, включають принаймні здалегідь визначеного періоду часу. Потім культутакі протеїнкінази: Cdc2, Chk2, СТАK, EphAl, ри клітин збирають із ростових планшетів і підраEphA2, Erkl, FGFR1, FGFR4, IR, JNK1, c-Kit, ховують відносну кількість живих клітин. Одержані р38альфа, p38beta, p38delta, Ros, Rse, Rsk2, TrkA, дані нормалізують відносно результатів, одержаTrkB, протеїнкіназа А, протеїнкіназа С, pp60v-src, них із застосуванням тільки інгібітора Chk1 як конпротеїнкіназа B/Akt-1, p38MapK, p70S6K, кальційтролю, після чого графічно відображають у покальмодулін-залежна кіназа II та тирозинкіназа двійній логарифмічній шкалі залежність між ab1. концентрацією засобу пошкодження ДНК та відноВипробування для визначення значень ІС50 сною кількістю клітин, що вижили (100% відповідає для випробовуваних сполук стосовно до компара1,0). Кратність сенсибілізації обчислюють на осноторних ферментів описані у Прикладі 2 та добре ві різниці між кількістю засобу пошкодження ДНК, відомі пересічному фахівцеві у галузі. Сполуки за необхідною для досягнення 90% пригнічення росту цим винаходом виявляють щонайменше приблизу присутності та за відсутності інгібітора Chk1 для но 20-кратну селективність відносно вищезгаданих кожної концентрації використовуваного інгібітора протеїнкіназ. У деяких варіантах інгібітори Chk1 за Chk1. Потім на основі цих даних графічно відоцим винаходом виявляють щонайменше приблизбражають залежність між концентрацією інгібітора но 50-кратну селективність, в інших варіантах Chk1 та кратністю сенсибізізації, з якої обчислющонайменше приблизно 75-кратну селективність, ють ECTFS. в інших варіантах - щонайменше приблизно 100За варіантом, якому віддається перевага, знакратну селективність інгібування Chk1 відносно чення ECTFS визначають при проведенні випробувищезгаданих протеїнкіназ. вання щонайменше двічі, при цьому значення Сполуки за цим винаходом виявляють неспоECTFS визначають як середнє з одержаних індивідівано високу ефективність при випробуванні у дуальних значень. За варіантом, якому віддається клітинній системі. Для вимірювання ефективності більша перевага, випробування повторюють від 3 інгібіторів Chk1 у клітинній системі розроблено разів до 10 (або більше) разів, при цьому значення методику, яка дозволяє вимірювати концентрацію ECTFS визначають як середнє з одержаних індивіінгібітора Chk1, необхідну для підсилення ефектів дуальних значень. За варіантом, якому віддається пригнічення росту засобом пошкодження ДНК у найбільша перевага, випробування виконують таку моделі клітинної системи, яка включає аберантно кількість разів, яка є достатньою для визначення проліферуючі клітини. Цю величину ефективності статистично надійного середнього значення ECTFS на клітинній основі характеризують у цьому описі із використанням статистичних методів, відомих значенням "ECTFS", де "ECTFS" означає ефективну пересічному фахівцеві у галузі. концентрацію інгібітора Chk1, яка спричиняє двокУсі сполуки виявляють при випробуванні для ратну сенсибілізацію популяції аберантно пролівизначення ECTFS значення ECTFS нижче від прибферуючих клітин до ефектів пригнічення росту під лизно 1000 нМ. Навпаки, відомі до цього часу сповпливом засобу пошкодження ДНК. Значення луки аналогічної структури виявляють значення ECTFS обчислюють як концентрацію інгібітора ECTFS приблизно 11000 нМ. У деяких варіантах Chk1, яка зменшує вдвічі кількість засобу пошкосполуки за даним винаходом виявляють значення дження ДНК, необхідну для 90% пригнічення росту ECTFS нижче від приблизно 500 нМ, в інших - нижклітин. Заявниками з'ясовано, що сполуки за цим че від приблизно 300 нМ, ще в інших - нижче від винаходом виявляють несподівано низькі значенприблизно 200 нМ, ще в інших - нижче від приблиня ECTFS, Що відповідає несподівано високій ефекзно 150 нМ, в інших - нижче від приблизно 100 нМ, тивності у клітинній системі. ще в інших - нижче від приблизно 50 нМ, в інших Іншим параметром, який може бути виміряний, нижче від приблизно 30 нМ, та ще в інших - нижче є кратність сенсибілізації, досягнута при LD50 (дозі від приблизно 20 нМ або нижче від приблизно 10 43 92164 44 нМ, або в інших варіантах - нижче від приблизно 5 плаценти 2, тромбоцитопохідний фактор росту нМ. ендотеліальних клітин, тромбоцитопохідний факСполуки та фармацевтичні композиції, придатор росту, ланцюг тромбоцитопохідного факторa тні для застосування за цим винаходом, охоплюросту А, тромбоцитопохідний фактор росту АА, ють препарати, в яких активний інгредієнт вводять тромбоцитопохідний фактор росту АВ, ланцюг в ефективній кількості для досягнення його мети. тромбоцитопохідного фактора росту В, тромбоциБільш конкретно, "терапевтично ефективна кільто-похідний фактор росту ВВ, рецептор тромбоцикість" означає кількість, достатню для вилікування топохідного фактора росту, рецептор тромбоцитосуб'єкта, що виявляє ознаки відповідного показанпохідного фактора росту, фактор стимуляції росту ня, або для полегшення наявних симптомів такого попередників клітин В, фактор стовбурових клітин, показання. Визначення терапевтично ефективної рецептор фактора стовбурових клітин, трансфоркількості знаходиться у межах можливостей фахімувальний фактор росту (TGF), TGF, TGF 1, TGF вця у галузі, особливо з урахуванням детального 1,2, TGF 2, TGF 3, TGF 5, латентний TGF 1, TGFопису винаходу. зв'язувальний білок І, TGF-зв'язувальний білок II, На додаток до інгібітора Chk1, фармацевтичні TGF-зв'язувальний білок III, рецептор типу І факкомпозиції за цим винаходом можуть містити біотора некрозу пухлин, рецептор типу II фактора логічно активні сполуки, наприклад, цитокіни, лімнекрозу пухлин, рецептор активатора плазміногефокіни, фактори росту, інші гематопоетичні факну типу урокінази, фактор росту судинного ендотори, або суміші цих сполук, для зменшення телію та химеричні білки та біологічно або імунонесприятливих побічних ефектів, які можуть бути логічно активні фрагменти цих сполук. спричинені введенням самої фармацевтичної комСполуки структурної формули (І) та структурпозиції або бути пов'язані з ним. Альтернативно, ної формули (II) також можуть бути сполучені з такі біологічно активні сполуки можуть бути вклюдопоміжними речовинами або прищеплені до дочені у фармацевтичну композицію за цим винахопоміжних речовин, які посилюють сприятливі власдом для сприяння бажаному терапевтичному ефетивості (або послаблюють несприятливі властивокту. Допоміжні біологічно активні сполуки, корисні у сті) сполук у способах терапевтичного фармацевтичних композиціях за цим винаходом, застосування. Такі комбінації здатні покращити охоплюють, проте без обмеження ними, M-CSF, постачання сполук у конкретний анатомічний пункт GM-CSF, TNF, IL-1, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, або область, що становлять інтерес (наприклад, у IL-8, IL-9, IL-10, IL-11, IL-12, IL-13, IL-14, IL-15, ILпухлину), уможливлювати тривале підтримання 16, IL-17, IL-18, IFN, TNF, G-CSF, Meg-CSF, GMтерапевтичної концентрації сполук у клітинахCSF, тромбопоетин, стовбурово-клітинний фактор, мішенях, модифікувати фармакокінетичні та фареритропоетин, ангіопоетини, в тому числі Ang-1, макодинамічні властивості сполук та/або покращуAng-2, Ang-4, Ang-Y, та/або людський ангіопоетивати терапевтичний індекс або профіль безпечноноподібний поліпептид, судинно-ендотеліальний сті сполук. До придатних допоміжних речовин фактор росту (VEGF), ангіогенін, морфогенний належать, наприклад, амінокислоти, олігопептиди білок кістки-1 (ВМР-1), ВМР-2, ВМР-3, ВМР-4, або поліпептиди, наприклад, антитіла, наприклад, ВМР-5, ВМР-6, ВМР-7, ВМР-8, ВМР-9, BMP-10, моноклонні антитіла та інші штучні антитіла; та ВМР-11, ВМР-12, ВМР-13, ВМР-14, ВМР-15, рецеприродні або синтетичні ліганди до рецепторів у птор BMP ΙΑ, рецептор BMP IB, нейротрофний клітинних або тканинних мішенях. До інших придафактор головного мозку, циліарний нейтрофільний тних допоміжних речовин належать жирні кислоти фактор, рецептор циліарного нейтрофільного факабо ліпідні речовини, які сприяють біорозподілу тору, фактор 1 хемотаксису нейтрофілів цитокінта/або споживанню сполук клітинами-мішенями ного походження, фактор 2 хемотаксису нейтрофі(дивись, наприклад, Bradley et al., Clin. Cancer Res. лів цитокінного походження, фактор 2 хемотаксису 7:3229, 2001). нейтрофілів цитокінного походження, фактор росЛікарські форми за цим винаходом можна ту ендотеліальних клітин, ендотелій 1, епідермавводити в організм стандартними способами, зальний фактор росту, атрактант нейтрофілів епітестосовуваними при лікуванні згаданих захворюліального походження, фактор росту фібробластів вань, наприклад, перорально, парентерально, (FGF) 4, FGF 5, FGF 6, FGF 7, FGF 8, FGF 8b, FGF через слизові оболонки (наприклад, при сублінг8c, FGF 9, FGF 10, кислотний FGF, основний FGF, вальному або букальному введенні), місцевим рецептор 1 нейтрофільного фактора, що вивільспособом, черезшкірним, ректальним, інгаляційнюється лінією гліальних клітин, рецептор 2 нейтним способами (наприклад, назальною або глиборофільного фактора, що вивільнюється лінією глікою ленегевою інгаляцією). Парентеральні спосоальних клітин, ростовий протеїн, ростовий протеїн, би введення охоплюють, але без обмеження ними, ростовий протеїн, ростовий протеїн, епідермальвнутрішньовенний, внутрішньоартеріальний, внутний фактор росту, що зв'язує гепарин, фактор росрішньоочеревинний, підшкірний, внутрішньом'язоту гепатоцитів, рецептор фактора росту гепатоцивий, внутрішньооболонковий та внутрішньосуглобтів, інсуліноподібний фактор росту І, рецептор ний способи. Парентеральне введення можна інсуліноподібного фактора росту, інсуліноподібний також виконувати, використовуючи способи та фактор росту II, зв'язувальний білок інсуліноподібпристрої високого тиску, наприклад, ногофактора росту, фактор росту кератиноцитів, POWDERJECT (Powderject Pharmaceuticals, Ріс, інгібувальний фактор лейкемії, рецептор інгібуваOxford, England). льного фактора лейкемії, фактор росту нерва, реДля перорального та букального введення цептор фактора росту нерва, нейротропін-3, нейкомпозиція може мати форму таблетки або пастиротропін-4, фактор росту плаценти, фактор росту лки, виготовленої звичайним способом. Напри 45 92164 46 клад, таблетки та капсули можуть містити звичайні або тривалої інфузії. Лікарські форми для ін'єкцій допоміжні речовини, наприклад, в'яжучі сполуки можуть мати вигляд суспензії, розчину або емуль(наприклад, сироп, гуміарабік, желатин, сорбіт, сії у масляному або водному носії та можуть містрагакант, клейку речовину крохмалю або полівінітити допоміжні сполуки, наприклад, суспензатори, лпіролідон), наповнювачі (наприклад, лактозу, цустабілізатори та/або диспергатори. Альтернативкор, мікрокристалічну целюлозу, кукурудзяний кроно, активний інгредієнт може бути у порошкоподіхмаль, фосфат кальцію або сорбіт), лабриканти бній формі, призначеній для поєднання перед за(наприклад, стеарат магнію, стеаринову кислоту, стосуванням із відповідним носієм (наприклад, тальк, поліетиленгліколь або діоксид кремнію), стерильною апірогенною водою). розпушувальні речовини (наприклад, картопляний Композиції за цим винаходом також можна викрохмаль або гліколят натрієвого крохмалю) або готовляти у формі препаратів-депо. Такі лікарські змочувальні сполуки (наприклад, лаурилсульфати форми тривалої дії можна вводити в організм натрію). Таблетки можуть бути вкриті оболонкою шляхом імплантації (наприклад, підшкірної або за способами, добре відомими у галузі. внутрішньом'язової) або внутрішньом'язової ін'єкАльтернативно, сполуки за даним винаходом ції. Для такої мети сполуки за цим винаходом моможуть бути введені в пероральні рідкі лікарські жна поєднувати з відповідними полімерними маформи, такі як, наприклад, водні або масляні сутеріалами (наприклад, із водорозчинними полімеспензії, розчини, емульсії, сиропи або еліксири. рами), гідрофобними матеріалами (наприклад, Крім того, лікарські форми, що містять ці сполуки, виготовляти емульсії у прийнятній олії), іонообмінможуть бути представлені у вигляді сухого продукними смолами або використовувати у формі слату для поєднання з водою або іншим придатним борозчинних похідних (наприклад, слаборозчинних носієм перед застосуванням. Такі рідкі препарати солей). можуть містити звичайні домішки, наприклад, суДля застосування у ветеринарії сполуку форспензаторні сполуки, наприклад, сорбітовий сироп, мули (І) або формули (II), або фармацевтично метилцелюлозу, глюкозовий/цукровий сироп, жеприйнятну сіль, проліки або сольват цієї сполуки, латин, гідроксіетилцелюлозу, гідроксипропілвводять у формі відповідної прийнятної композиції метилцелюлозу, карбоксиметилцелюлозу, гель згідно з нормальною ветеринарною практикою. стеарату алюмінію та гідрогенізовані їстівні жири; Ветеринар може без утруднень визначити режим емульгувальні сполуки, наприклад, лецитин, модозування та шлях введення, найбільш придатні ноолеат сорбіту або гуміарабік; неводні носії (які для конкретної тварини. До тварин, що піддаються можуть включати їстівні масла та олії), наприклад, лікуванню сполуками та способами за цим винамигдалеву олію, фракціоновану кокосову олію, ходом, належать, проте без обмеження ними, хатмасляні складні ефіри, пропіленгліколь та етилоні тварини, свійські тварини, декоративні тварини вий спирт; та консерванти, наприклад, метил- або та експонати зоопарків. пропіл- n-гідроксибензоат та сорбінову кислоту. Методи синтезу Композиції також можна виготовляти у формі Сполуки за даним винаходом можуть бути висупозиторіїв, що містять, наприклад, звичайні осготовлені за поданими нижче схемами синтезу. нови для супозиторіїв, наприклад, какаову олію Передусім слід зазначити, що алкоксіариламіни, або інші гліцериди. Композиції для інгаляції можна, використовувані для одержання інгібіторів Chk1, як правило, виготовляти у формі розчину, суспенописаних у цьому документі, можуть бути виготовзії або емульсії, яку можна застосовувати у вигляді лені за різними загальними схемами синтезу. Набезводного порошку або аерозолю з використанприклад, Загальна схема 1 коротко ілюструє реакням звичайного пропелента, наприклад, дихлорцію нітрофенолу з активованою формою спирту, дифторметану або трихлорфторметану. утворюваною in situ або виготовленою та ізольоЛікарські форми місцевого застосування та ваною на незалежній стадії; в результаті цієї реакчерезшкірного введення містять звичайні водні ції одержують простий ефір нітрофенілу. Відновабо неводні носії; до таких форм належать, наприленням цього простого ефіру у стандартних клад, очні краплі, креми, мазі, лосьйони та пасти умовах одержують ариламін, який використовують або медичні пластирі, серветки або мембрани. для одержання сполуки за цим винаходом. Крім того, композиції за цим винаходом можуть бути призначені для введення шляхом ін'єкції За альтернативним способом, в результаті реакції галогенованого нітробензолу зі спиртом у присутності сильної основи, наприклад, гідриду натрію або біс(триметилсиліл)аміду калію, також одержують простий ефір нітроарилу, як показано на Загальній схемі 2. Потім одержаний простий ефір відновлюють, як показано на Загальній схемі 1. 47 92164 48 Перетворення ариламіну у сечовину можна здійснювати за однією з кількох загальних схем синтезу. Наприклад, ариламін можна вводити в реакцію з піразинкарбаматом, одержуючи сечовину, як показано на Загальній схемі 3. Альтернативно, як показано на Загальній схемі 4, в результаті розкладу ацилазиду під впливом тепла одержують реакційноздатний арилізоціанат, який потім вводять у реакцію з ариламіном, одержуючи бажану сечовину. Згідно з іншим принципом, ілюстрованим Загальною схемою 5, для сполучення двох ариламі нів та одержання сечовини застосовують фосген або еквівалент фосгену. Скорочення, використовувані у синтезах, описаних нижче, мають такі значення: години (год), хвилини (хв), фунт на квадратний дюйм (psi), вода (Н2О), деіонізований (DI), ізопропіловий спирт (iPrOH), платина на вугіллі (Pt/C), азот (N2), водень (Н2), паладій на вугіллі (Pd/C), оксид платини (Pt2O), сульфат магнію (MgSO4), хлористоводнева кислота (HCl), діізопропіл азодикарбоксилат (DIAD), метиленхлорид (СН2Сl2), хлороформ (СHCl3), метанол (МеОН), гідроксид амонію (NH4OH), тетрагідрофуран (THF), Nметилпіролідон (NMP), оцтова кислота (АсОН), гідроксид натрію (NaOH), етилацетат (EtOAc), етанол (EtOH), диметилсульфоксид (DMSO), дейтерований диметилсульфоксид (d6-DMSO), карбонат натрію (Nа2СО3), дейтерований хлороформ (CDCI3), бікарбонат натрію (NaНСО3), гідрид натрію (NaH), триетиламін (TEA), карбонат цезію (CSSCO3), діоксид вуглецю (СО2), гідроксид паладію (Pd(OH)2), сірчана кислота (H2SO4), азотна кислота (HNO3), хлорид натрію (NaCl), сульфат натрію (Na2SO4) та диметилформамід (DMF). Виготовлення сполук Перелічені нижче сполуки за даним винаходом були виготовлені із застосуванням загальних схем, описаних вище. Додаткові сполуки за цим винаходом можуть бути виготовлені із застосуванням описаних вище загальних схем та наведених нижче конкретних синтезів, шляхом відповідного вибору вихідних матеріалів. Сполука 1 1-[5-хлор-2-S-([1,4]оксазепан-2ілметокси)феніл]-3-(5-метилпіразин-2-іл)сечовина Стадія 1: 2-аміно-5-метилпіразин. Паратолуолсульфонат аміномалононітрилу (20,0 г, 79 ммоль) та 1-оксим піровиноградного альдегіду (6,88 г, 79 ммоль) змішували у колбі. Додавали iPrOH (140 мл), та одержану жовту суспензію витримували при перемішуванні при кімнатній температурі протягом 18 год, при цьому нагромаджувався жовтий осад. Суміш фільтрували, та одержаний осад промивали iPrOH (2 50 мл) та DI 49 92164 50 Н2О (20 мл), після чого ліофілізували, одержуючи та перемішували 6 год. Реакційну суміш обережно N-оксид 2-аміно-3-ціано-5-метилпіразину (10,7 г). гасили, додаючи 50 мл води, та екстрагували тричі Одержаний N-оксид піразину суспендували у порціями по 50 мл EtOAc. Об'єднані органічні шари МеОН (22 мл) та АсОН (5 мл). До цієї суспензії сушили над Na2SO4 та концентрували у вакуумі. обережно додавали 5% Pt/C (1,6 г) та Darco KB-B Неочищений продукт розчиняли у EtOH та заван(8 г). Суміші дозволяли поглинати водень під тистажували у гідрувальний апарат Парра. До одерком 60 фунтів на кв. дюйм (413,7 кПа) протягом 18 жаного розчину також додавали 10% (мас.) Pd/C год. Реакцію гасили, додаючи 25% розчин NaOH (0,426 г, 0,30 ммоль) та 2М розчин HCl (2,1 мл). (34 мл), та продували суміш азотом протягом 30 Гідрування виконували під тиском 50 фунтів на кв. хв. Суміш фільтрували через шар вологого целіту дюйм (344,7 кПа) протягом 2 діб, після чого реакцію вважали закінченою за даними LCMS аналізу та промивали МеОН (4 100 мл). Одержаний філь(рідинна хроматографія з мас-спектроскопічним трат концентрували у вакуумі до чверті початководетектуванням). Одержаний розчин нейтралізуваго об'єму. Одержаний фільтрат розводили EtOAc ли насиченим водним розчином NaНСО3 та екст(150 мл) та промивали 5% розчином NaOH (30 мл) рагували, використовуючи суміш СНСІ3:iPrOH та піддавали зворотній екстракції EtOAc (2 70 мл). (3:1). Об'єднані органічні шари концентрували у Одержані органічні шари об'єднували та промивавакуумі, і неочищений продукт застосовували на ли насиченим розчином NaCl (20 мл), фільтруванаступній стадії. ли, та концентрували у вакуумі, одержуючи оранНеочищений аміноспирт розчиняли у 100 мл жеву клейку тверду речовину (5,16 г). безводного СН2Сl2. До цього розчину додавали Стадія 2: феніловий складний ефір (5TEA (1,59 мл, 11,5 ммоль) та ди-третметилпіразин-2-іл)карбамінової кислоти. 2-аміно-5бутилдикарбонат (5,74 г, 5,74 ммоль). Одержаний метилпіразин (5,16 г, 47 ммоль) розчиняли у розчин перемішували при кімнатній температурі СН2Сl2 (52 мл), перемішували та охолоджували до протягом 18 год, після чого гасили насиченим вод0°С у атмосфері азоту. До цієї суміші додавали ним розчином NaHCO3 та екстрагували тричі, випіридин (4,8 мл, 59 ммоль), потім краплями протякористовуючи 50 мл порції СН2Сl2. Об'єднані оргагом 15 хв додавали фенілхлорформіат (6,2 мл, 59 нічні шари сушили над Na2SO4 та концентрували у ммоль), при цьому утворювався осад. Суміш певакуумі. Продукт очищали хроматографією на коремішували при 0°С протягом 1 год. Потім реакцію лонці, використовуючи градієнт 25-50% гасили, додаючи 0,25 Μ розчин HCl (40 мл) та безEtOAc/гексан. Вихід 0,240 г оксазепанового спирту водний діетиловий ефір (50 мл), та перемішували у вигляді жовтого масла. при 0°С, протягом 30 хв. Одержаний осад відділяСтадія 4: трет-бутиловий складний ефір (S)-2ли шляхом фільтрування, промивали DI Н2О (20 (4-хлор-2-нітрофеноксиметил)-[1,4]оксазепан-4мл) та діетиловим ефіром (2 25 мл), та сушили у карбонової кислоти. У круглодонну колбу місткістю вакуумі, одержуючи продукт (7,4 г) у вигляді білого 50 мл завантажували оксазепановий спирт (0,240 пухнастого порошку. г, 1,03 ммоль), TEA (0,21 мл, 1,545 ммоль) та 10 Стадія 3: трет-бутиловий складний ефір (S)-2мл безводного СН2Сl2. Одержаний розчин охологідроксиметил-[1,4]оксазепан-4-карбонової кислоджували до 0°С, та додавали краплями метансути. У круглодонну колбу місткістю 250 мл завантальфонілхлорид (0,10 мл). Суміш перемішували жували (S)-(+)-бензилгліцидиловий простий ефір протягом 1,5 год при 0°С, після чого гасили, в охо(1,31 г, 7,9 ммоль), 3-бензиламінопропан-1-ол (1,3 лодженому стані, водою. Одержані шари розділяг, 7,9 ммоль) та 10 мл EtOH. Суміш нагрівали при ли, а водний шар екстрагували один раз 20 мл 40°С протягом 15 год. Реакційну суміш охолоджуСН2Сl2. Об'єднані органічні шари сушили над вали та концентрували у вакуумі, і одержаний маNa2SO4 та концентрували у вакуумі. Потім неочислянистий продукт використовували без додаткощений мезилат розчиняли у 5 мл безводного DMF. вого очищення. Діол завантажували у круглодонну До цього розчину додавали Cs2CO3 (0,671 г, 2,06 колбу місткістю 250 мл та розчиняли у 75 мл безммоль) та 4-хлор-2-нітрофенол (0,215 г, 1,24 водного піридину. Одержаний розчин охолоджуваммоль). Потім цей яскраво-жовтий розчин нагрівали до 0°С, та однією порцією додавали толуолсули при 100°С протягом ночі. Реакційну суміш охольфонілхлорид (5,27 г, 27,7 ммоль). Суміш лоджували до кімнатної температури, гасили 50 перемішували протягом 6 год, ретельно підтримумл води, та екстрагували тричі порціями по 50 мл ючи температуру реакційної суміші при 0°С. ХолоEtOAc. Продукт очищали флеш-хроматографією, дну реакційну суміш гасили, додаючи 50 мл насивикористовуючи градієнт 10-35% EtOAc/гексан. ченого водного розчину NaHCO3. Додавали ще 20 Вихід після цієї послідовності стадій становив мл води, та суміш екстрагували тричі порціями по 0,120 г нітрофенілоксазепану у вигляді яскраво100 мл EtOAc. Об'єднані органічні шари сушили жовтого масла. над Na2SO4 та концентрували у вакуумі. Потім Стадія 5: 1-[5-хлор-2-([1,4]оксазепан-2-(S)одержаний спирт очищали хроматографією на ілметокси)феніл]-3-(5-метилпіразин-2-іл)сечовина. колонці, використовуючи градієнт 25-50% EtOAc у У круглодонну колбу місткістю 25 мл завантажувагексані як елюент. Вихід 1,39 г тозилового спирту у ли нітрофенілоксазепан (0,120 г, 0,31 ммоль) та вигляді жовтого масла. Pt2O (0,007 г, 0,03 ммоль) у 5 мл МеОН. ПриєднуОдержаний спирт розчиняли у 50 мл DMF та вали еластичну камеру з гелієм, колбу вакуумуваохолоджували до 0°С. До цієї холодної суміші при ли, використовуючи водоструменевий насос, та перемішуванні обережно додавали 95% (мас.) заповнювали воднем тричі, після чого витримуваNaH (0,29 г, 11,5 ммоль). Реакційну суміш переміли при перемішуванні у атмосфері водню протяшували при 0°С протягом 15 хв, після чого дозвогом 2 год. Реакційну суміш фільтрували через целяли повільно нагрітися до кімнатної температури 51 92164 52 літ, промивали шар целіту двічі 20 мл порціями рагували СН2Сl2 (3 20 мл), і об'єднані органічні МеОН. Одержаний розчин концентрували у вакуушари сушили (MgSO4), та фільтрували. Відфільтмі. Неочищений анілін розчиняли у 5 мл безводнорований розчин концентрували до одержання білої го DMF. До цього розчину додавали TEA (0,005 мл, твердої речовини (0,46 г). 0,34 ммоль) та феніловий складний ефір (5Стадія 2: трет-бутиловий складний ефір 3-(4метилпіразин-2-іл)карбамінової кислоти (0,07 г, хлор-2-нітрофеноксиметил)-R-морфолін-40,31 ммоль). Цю суміш перемішували 18 год при карбонової кислоти. До охолодженого (-78°С у кімнатній температурі. Розчинник видаляли у вабані) розчину трет-бутилового складного ефіру 3куумі, а одержаний залишок вдруге розчиняли у 10 гідроксиметил-S-морфолін-4-карбонової кислоти мл EtOAc та промивали насиченим водним розчи(0,13 г, 0,60 ммоль) та 5-хлор-2-фторнітробензолу ном NaНСО3. Органічні шари сушили над Na2SO4 (0,11 г, 0,66 ммоль) у безводному THF (40 мл) при та концентрували під зниженим тиском. Одержаперемішуванні додавали краплями ний сіро-коричневий залишок змішували з 3 мл біс(триметилсиліл)амід калію (2,4 мл 0,5М розчину СН2Сl2, та додавали до цієї суміші 1 мл конценту THF, 1,2 ммоль) протягом 15 хв у атмосфері азорованої трифтороцтової кислоти. При додаванні ту. Після перемішування протягом додаткових 15 кислоти всі тверді речовини розчинялись. Реакційхв додавали водний насичений розчин хлориду ну суміш перемішували при кімнатній температурі амонію (10 мл), і баню відстороняли, дозволяючи протягом 4 год, в той самий час додаючи насичерозчину нагрітися до температури навколишнього ний водний розчин NaHCO3 до досягнення рН 8. середовища. Після перемішування протягом 1 год Суміш екстрагували тричі порціями по 10 мл сумідодавали воду (15 мл) та СН2Сl2 (10 мл), переміші (3:1) СHCl3:iPrOH. Об'єднані органічні шари шували протягом 5 хв, і одержані шари розділяли. після цього сушили над Na2SO4 та концентрували Водний шар екстрагували СН2Сl2 (2 10 мл), а у вакуумі. Потім одержану злегка забарвлену реоб'єднані органічні шари сушили (MgSO4), та фільчовину розтирали у EtOAc та фільтрували через трували. Відфільтрований розчин концентрували фільтр зі скляною фритою, промиваючи 50 мл до одержання жовтого масла (0,26 г), яке очищали EtOAc. Одержану білу тверду речовину ретельно хроматографією на колонці, елююючи сумішшю сушили у вакуумі. Вихід становив 0,020 г бажаної гексан/EtOAc (1:1), і одержували світло-жовте масечовини у вигляді тонкого білого порошку. 1Hсло (0,195 г). ЯМР (300 МГц, d6-DMSO) 10,83 (br s, 1H), 8,39 Стадія 3: трет-бутиловий складний ефір 3-(2(dd, 1H), 8,18 (s, 1H) 8,04 (br s, 1H), 6,99 (dd, 1H), аміно-4-хлорфеноксиметил)-R-морфолін-46,82 (d, 1H), 4,25-3,98 (m, 2H), 3,90-3,76 (m, 1H), карбонової кислоти. До розчину трет-бутилового 3,38 (d, 1Н), 3,13-3,06 (m, 2H), 3,00 (dd, 1H), 2,54 складного ефіру 3-(4-хлор-2-нітрофеноксиметил)(s, 3H), 2,06-1,89 (m, 3H). LCMS (ES, +) m/e 392,3 R-морфолін-4-карбонової кислоти (0,17 г, 0,46 (M+1). ммоль) у МеОН (4 мл) при перемішуванні додаваСполука 2 ли Pt2O (0,020 г, 0,088 ммоль). Колбу вакуумували, після чого заповнювали воднем (повторюючи процедуру тричі). Після перемішування протягом 4 год розчин фільтрували через шар целіту, а одержаний фільтрат концентрували, одержуючи продукт у вигляді жовтого масла. Стадія 4: трет-бутиловий складний ефір 3-{4хлор-2-[3-(5-метилпіразин-2-іл)уреїдо]феноксиметил}-R-морфолін-4-карбонової кислоти. Приготовляли розчин одержаного жовтого масла та фенілового складного ефіру (5-метилпіразин-2іл)-карбамінової кислоти (0,13 г, 0,57 ммоль) у безводному DMF (2 мл) та додавали TEA (0,074 1-[5-хлор-2-(R-морфолін-3-ілметокси)феніл]-3мл, 0,53 ммоль). Після перемішування протягом 24 (5-метилпіразин-2-іл)сечовина год реакційну суміш концентрували під зниженим Стадія 1: трет-бутиловий складний ефір 3тиском, після чого вдруге розчиняли у воді (10 мл) гідроксиметил-S-морфолін-4-карбонової кислоти. та EtOAc (10 мл). Після перемішування протягом До охолодженого (0°С у бані) розчину 4-трет15 хв, одержані шари розділяли, водний шар екстбутилового складного ефіру морфолін-3-R-4рагували EtOAc (2 10 мл), а об'єднані органічні дикарбонової кислоти (1,00 г, 4,32 ммоль) у безвошари промивали розсолом (10 мл), після чого судному THF (40 мл) додавали краплями боран (4,76 шили (Na2SO4) та фільтрували. Відфільтрований мл 1M розчину у THF, 4,76 ммоль) протягом 15 хв розчин концентрували, після чого очищали хромау атмосфері азоту. Після перемішування протягом тографією на колонці, елююючи сумішшю 1 год, баню відстороняли, і перемішування продоEtOAc/СН2Сl2 (1:1), і одержували жовте масло (0,8 вжували протягом додаткових 3 год при темпераг). турі навколишнього середовища. Потім додавали Стадія 5: 1-[5-хлор-2-(R-морфолін-3оцтову кислоту (14,3 мл 1M водного розчину, 14,3 ілметокси)феніл]-3-(5-метилпіразин-2-іл)сечовина. ммоль). Після перемішування протягом 1 год, одеДо розчину трет-бутилового складного ефіру 3-{4ржаний розчин нейтралізували шляхом додавання хлор-2-[3-(5-метилпіразин-2-іл)уреці;о]надлишку насиченого водного розчину бікарбонату феноксиметил}-R-морфолін-4-карбонової кислоти натрію. Додавали дихлорметан (20 мл), і одержа(0,8 г) у СН2Сl2 (6 мл) при перемішуванні додавали ний розчин перемішували протягом 15 хв, після трифтороцтову кислоту (3 мл). Після перемішучого одержані шари розділяли. Водний шар екст 53 92164 54 вання протягом 5 год одержаний розчин обробля(691 мг, 5 ммоль) перемішували у толуолі (15 мл) ли водним розчином карбонату калію (1M) до дота обробляли TEA (765 мл, 5,5 ммоль), а потім сягнення основної реакції, після чого перемішувадифенілфосфорилазидом (1,0 мл, 5,0 ммоль). ли протягом 30 хв. Одержані шари розділяли, і Одержаний розчин перемішували протягом 30 хв, після чого одразу ж використовували. водний шар екстрагували СН2Сl2 (3 10 мл). Об'єдРозчин 5-метилпіразин-2-карбонілазиду (1,0 нані органічні шари сушили (MgSO4) та фільтруваммоль) у толуолі нагрівали при 90°С протягом 10 ли. Відфільтрований розчин концентрували, після хв. Реакційну колбу видаляли з нагрівальної бані, і чого очищали хроматографією на колонці, елююодержаний коричневий розчин обробляли 2-(1,4ючи сумішшю МеОН/СН2Сl2 (1:9), і одержували диметилпіперазин-2-ілметокси)-5блідо-жовту тверду речовину (0,0523 г). 1H-ЯМР метилфеніламіном (0,25 г, 1,0 ммоль). Колбу по(300 МГц, d6-DMSO) 10,22 (s, 1H), 9,96 (br s, 1Н), вертали у нагрівальну баню та нагрівали при 40°С 8,74 (s, 1H), 8,28 (d, 1H), 8,18 (s, 1H), 7,04 (dd, 2H), протягом 4 год. Суміш витримували для охоло3.,94 (m, 3H), 3,71 (br d, 1H), 3,43 (m, 1H), 3,23 (m, дження, після чого фільтрували, одержуючи про2H), 3,34 (br m, 2H), 2,66 (br m, 1H), 2,43 (s, 3H). дукт у вигляді жовто-коричневого порошку. 1HLRMS (es, +) m/e 378,3 (M+1). ЯМР (400 МГц, CDCl3) 10,90 (s, 1, Η), 8,4 (s, 1, Η), Сполука3 8,2 (m, 3, Η), 6,8 (m, 2, Η), 4,2 (dd, 1, Η), 3,9 (t, 1, Η), 3,1 (d, 1, Η), 2,8 (br d, 1, Η), 2,6 (m, 2, Η), 2,5 (s, 3, Η), 2,4 (m, 1, Η), 2,4 (s, 3, Η), 2,3 (s, 3, Η), 2,25 (m, 1, Η), 2,2 (s, 3, Η), 2,1 (m, 1, Η). LRMS (esi, +) m/e 385,30 (M+1). Сполука 4 1-[2-(1,4-диметилпіперазин-2-ілметокси)-5метилфеніл]-3-(5-метилпіразин-2-іл)сечовина Стадія 1: 1,4-диметил-2-(4-метил-2нітрофеноксиметил)-піперазин. 4-метил-2нітрофенол (0,95 г, 6,20 ммоль), (1,4диметилпіперазин-2-іл)-МеОН (0,98 г, 6,82 ммоль) та трифенілфосфін (1,79 г, 6,82 ммоль) змішували у THF, перемішували протягом 5 хв, після чого обробляли DIAD (1,38 г, 6,82 ммоль). Реакційну суміш витримували при перемішуванні протягом ночі. Після концентрування у вакуумі одержали оранжеве масло, яке розчиняли у EtOAc та екстрагували 2М водним розчином HCl. Водні змиви об'єднували, промивали EtOAc, та обробляли твердим NaOH до досягнення основної реакції. Одержану водну суміш екстрагували EtOAc, а об'єднані органічні екстракти сушили над Na2SO4, фільтрували та концентрували у вакуумі, одержуючи коричневе масло. Після флеш-хроматографії (1% МеОН у СН2Сl2) одержали 1,0 г бажаного арилового простого ефіру. Стадія 2: 2-(1,4-диметилпіперазин-2ілметокси)-5-метилфеніламін. 1,4-диметил-2-(4метил-2-нітрофеноксиметил)-піперазин (1,02 г, 3,65 ммоль) розчиняли у МеОН (75 мл) та обробляли насиченим водним розчином хлориду амонію до помутніння суміші. Додавали цинк (0,24 г, 3,65 ммоль). Одержану теплу реакційну суміш витримували при перемішуванні ще 30 хв, після чого LCMS показувала витрачання вихідного матеріалу. Реакційну суміш розводили EtOAc та водним розчином NaНСО3, і одержані шари розділяли. Органічний шар промивали насиченим розчином NaCl та сушили над твердим безводним Na2SO4. Суміш фільтрували та концентрували у вакуумі, і одержували бажаний анілін. Стадія 3: 1-[2-(1,4-диметилпіперазин-2ілметокси)-5-метилфеніл]-3-(5-метилпіразин-2іл)сечовина. 5-метилпіразин-2-карбонову кислоту 1-[4,5-дихлор-2-(S-морфолін-2ілметокси)феніл]-3-(5-метилпіразин-2-іл)сечовина Стадія 1: трет-бутиловий складний ефір (S)-2гідроксиметилморфолін-4-карбонової кислоти. У колбу місткістю 500 мл завантажували (S)бензилгліцидиловий простий ефір (15 г, 91,4 ммоль), МеОН (10 мл) та 50% (мас.) розчин NaOH (30 мл, 365 ммоль). До цієї суміші додавали порціями 2-аміноетилсульфат (25,8 г, 183 ммоль). Одержану гетерогенну суміш нагрівали до 40°С, після чого одержаний розчин ставав гомогенним. Температуру підтримували при 40°С протягом 4 год. Реакційну суміш злегка охолоджували, та додавали додаткову кількість твердого NaOH (14,6 г, 365 ммоль) спільно з 50 мл толуолу. Потім двофазовий розчин нагрівали до 65°С протягом 12 год. Реакційну суміш охолоджували до кімнатної температури, одержані шари розділяли, та водний шар екстрагували один раз 75 мл толуолу. Об'єднані органічні шари промивали тричі порціями по 75 мл 1M розчину HCl. рН об'єднаних водних шарів доводили до 12 шляхом додавання водного розчину NaOH, та екстрагували чотири рази порціями по 70 мл EtOAc. Об'єднані органічні шари сушили над Na2SO4 та концентрували у вакуумі, одержуючи 10,084 г бажаного морфоліну у вигляді непрозорого масла. Неочищений морфоліновий продукт розчиняли у СН2Сl2 (100 мл) та TEA (12,1 мл, 87,5 ммоль), та додавали ди-трет-бутилдикарбонат (15,9 г, 73 ммоль), що супроводжувалося утворенням газоподібного СО2. Реакційну суміш перемішували при кімнатній температурі протягом 18 год, після чого 55 92164 56 гасили 35 мл насиченого водного розчину нагрітися до кімнатної температури. Одержану NaHCO3. Додавали ще 50 мл води, та одержані реакційну суміш перемішували протягом ночі, пісшари розділяли. Органічний шар сушили над безля чого розводили додатковою кількістю СН2Сl2 водним Na2SO4, концентрували у вакуумі та очи(200 мл) та промивали 10% водним розчином щали флеш-хроматографією (20% EtOAc/гексан), Nа2СО3. Одержані шари розділяли, і органічний одержуючи бажаний N-Вос-О-бензилморфолін у шар промивали насиченим водним розчином NaCl, вигляді блідо-жовтого масла (5,536 г). після чого сушили над безводною MgSO4, фільтОчищений двозахищений морфолін розчиняли рували, та концентрували під зниженим тиском. у 50 мл абсолютного EtOH та додавали Pd(OH)2 Одержаний залишок розчиняли у EtOAc (50 мл), а (1,26 г, 20% (мас), 1,8 ммоль). Приєднували еласпродукт осаджували шляхом додавання гексану тичну камеру з воднем, вакуумували колбу, вико(300 мл). Осад сушили у вакуумі, одержуючи 5,57 г ристовуючи водоструменевий насос, та заповнюжовто-коричневої твердої речовини. вали воднем (повторюючи цю операцію тричі). Стадія 2: 5-аміно-піразин-2-карбонітрил. 5Реакційну суміш перемішували у атмосфері водню бром-піразин-2-іламін змішували з йодидом міді(І) протягом 30 год. Суміш фільтрували через целіт, (1,3 г, 6,9 ммоль), ціанідом калію (0,44 г, 6,8 ретельно ополіскуючи шар целіту EtOH. Відфільтммоль), тетракіс(трифенілфосфін)паладієм(0) рований розчин концентрували у вакуумі, одержу(0,95 г, 0,83 ммоль) та 18-краун-6 (0,058 г, 0,22 ючи бажаний N-Boc-морфоліновий спирт у вигляді ммоль) у DMF (15 мл). Одержану суміш перемішузлегка забарвленої твердої речовини (3,918 г). вали протягом 40 хв, після чого нагрівали зі звороСтадія 2: 4,5-дихлор-2-нітрофенол. Круглотним холодильником (155°С) протягом 2 год. Реадонну колбу місткістю 250 мл, що містила 3,4кційну суміш охолоджували до кімнатної дихлорфенол (3,053 г, 18,7 ммоль) у 50 мл СН2Сl2, температури, після чого залишали стояти протяохолоджували до 0°С на льодяній бані. До розчину гом ночі. Одержаний осад відділяли шляхом фільпри перемішуванні додавали концентровану трування, а фільтрат концентрували досуха у ваH2SO4 (1,56 мл, 28,1 ммоль). Розчин ставав калакуумі. Одержаний оранжево-забарвлений осад мутним. До цієї суміші краплями додавали конценрозчиняли у EtOAc та гексані, і утворений початкотровану HNO3 (1,2 мл, 18,7 ммоль), та ретельно вий осад потім відділяли шляхом фільтрування. підтримували температуру нижче 5°С. Реакційну Після відстоювання у маточному розчині утворюсуміш перемішували протягом 30 хв при 0°С, після вався додатковий осад, який збирали шляхом фічого охолоджували на льодяній бані та гасили 150 льтрування. Ці тверді речовини об'єднували, одемл Н2О. Одержані шари розділяли, та водний шар ржуючи 0,10 г яскраво-оранжевої твердої екстрагували один раз 35 мл СН2Сl2. Об'єднані речовини. органічні шари сушили над безводним Na2SO4, Стадія 3: трет-бутиловий складний ефір 2-{2концентрували у вакуумі та очищали флеш[3-(5-ціанопіразин-2-іл)уреїдо]-4хроматографією (10% EtOAc/гексан як елюент), метилфеноксиметил}-морфолін-4-карбонової кисодержуючи бажаний нітрофенол у вигляді яскралоти. Трет-бутиловий складний ефір 2-(2-аміно-4во-жовтої твердої речовини (1,793 г). метилфеноксиметил)-морфолін-4-карбонової кисСтадія 3: 1-[4,5-дихлор-2-(S-морфолін-2лоти (0,087 г, 0,270 ммоль) виготовляли з 2-аміноілметокси)феніл]-3-(5-метилпіразин-2-іл)сечовина. 4-метилфенолу за способом, описаним для СпоВиготовляли за методикою, описаною для Сполулуки 3, Стадія 1 та Стадія 2, використовуючи третки 1, Стадія 4 та Стадія 5, використовуючи 4,5бутиловий складний ефір 2дихлор-2-нітрофенол та трет-бутиловий складний гідроксиметилморфолін-4-карбонової кислоти (виефір (S)-2-бензилоксиметилморфолін-4готовлений за методикою, описаною для Сполуки 2, Стадія 1, з використанням відповідної кислоти) карбонової кислоти. 1H-ЯМР (300 МГц, d6-DMSO) та 4-метил-2-нітрофенол. Цю суміш об'єднували з 10,42 (s, 1Н), 10,29 (s, 1Н), 8,93 (s, 1H), 8,42 (s, трифосгеном (0,029 г, 0,10 ммоль), толуолом (2 1H), 8,21 (s, 1Н), 7,32 (s, 1H), 4,18-3,41 (m, 5H), мл) та основою Хуніга (Hunig) (0,15 мл, 0,86 3,03-2,66 (m, 4H), 2,38 (s, 3H) LRMS (ES, +) m/e ммоль), та перемішували при кімнатній темпера412,2 (M+1). турі протягом 25 хв. Потім одержану суспензію Сполука 5 переносили за допомогою канюлі у холодний розчин (-78°С), що містив 5-аміно-піразин-2карбонітрил (0,032 г, 0,27 ммоль) та біс(триметилсиліл)амід літію (0,27 ммоль) у THF (1 мл), який перемішували при -78°С протягом 30 хв. Реакційну суміш залишали для нагрівання, після чого перемішували протягом 16 год при кімнатній температурі. Утворений осад збирали шляхом фільтрування, одержуючи бажаний продукт (0,043 г). Стадія 4: 1-(5-ціанопіразин-2-іл)-3-[5-метил-21-(5-ціанопіразин-2-іл)-3-[5-метил-2-(4(морфолін-2-ілметокси)-феніл]сечовина. Суспенметилморфолін-2-ілметокси)феніл]-сечовина зію трет-бутилового складного ефіру 2-{2-[3-(5Стадія 1: 5-бром-піразин-2-іламін. Розчин піраціанопіразин-2-іл)уреїдо]-4-метилфеноксиметил}зин-2-іламіну (6,66 г, 70 ммоль) у СН2Сl2 (200 мл) морфолін-4-карбонової кислоти (0,043 г, 0,0918 охолоджували до 0°С, обробляли Nммоль) у THF (2 мл) обробляли HCl у діоксані (4М, бромсукцинимідом (12,5 г, 70 ммоль) та дозволяли 0,11 мл) та перемішували протягом 20 год. Дода 57 92164 58 вали додаткову кількість HCl у діоксані (4М, 0,25 60°С протягом 12 год, після чого залишали для мл), та реакційну суміш нагрівали при 50°С протяохолодження до кімнатної температури та розвогом 18 год. Реакційну суміш охолоджували та кондили EtOAc (200 мл) та 10% водним розчином центрували. Одержану тверду речовину суспендуNa2CO3 (200 мл). Одержані шари розділяли, а орвали у діетиловому ефірі, суспензію фільтрували ганічний шар промивали розсолом, сушили над та сушили на відкритому повітрі, і одержували бабезводним MgSO4 та концентрували у вакуумі. жаний продукт у формі гідрохлориду (0,042 г). Неочищений продукт очищали флешСтадія 5: 1-(5-ціанопіразин-2-іл)-3-[5-метил-2хроматографією (70:30 гексан/EtOAc), одержуючи (4-метилморфолін-2-ілметокси)феніл]сечовина. 480 мг світло-оранжевого масла. Розчин гідрохлориду 1-(5-ціанопіразин-2-іл)-3-[5Це масло розчиняли у СН2Сl2 (5 мл) та охолометил-2-(морфолін-2-ілметокси)феніл]сечовини джували на льодяній бані. Додавали альфа(0,0104 г, 0,129 ммоль) у МеОН (1 мл) охолоджухлоретилхлорформіат (0,18 мл, 1,65 ммоль). Реавали до 0°С та обробляли водним розчином форкційну суміш перемішували протягом 2 год, після мальдегіду (0,12 ммоль), а потім триацетоксиборчого додавали 2-н. водний розчин HCl. Перемішугідридом натрію (0,06 г, 0,292 ммоль). Реакційну вання продовжували протягом 10 хв, після чого суміш перемішували протягом 12 год, після чого суміш концентрували досуха. Одержаний залишок концентрували у вакуумі. Одержаний залишок розчиняли у МеОН та нагрівали зі зворотним хохроматографували на силікагелі (2% МеОН у лодильником протягом 2 год. Реакційну суміш конСН2Сl2), одержуючи продукт у вигляді білої твердої центрували під зниженим тиском, а одержаний залишок розчиняли у 2-н. водному розчині HCl (75 речовини (0,014 г). 1H-ЯМР (400 МГц, d6-DMSO) 10,90 (s, 1, Η), 10 (br s, 1, Η), 8,9 (s, 1, Η), 8,8 (s, 1, мл) та промивали EtOAc (2 50 мл). рН водного Η), 8 (s, 1, Η), 6,9 (m, 1, Η), 6,8 (m, 1, Η), 3,9 (m, 4, шару доводили до 11 шляхом додавання твердого Η), 3,6 (t, 1, Η), 2,9 (d, 1, Η), 2,7 (d, 1, Η), 2,2 (s, 3, NaOH. Одержаний основний розчин екстрагували Η), 2,1 (s, 3, Η), 2 (t, 1, Η), 1,8 (t, 1, Η). LRMS (esi, +) EtOAc (2 50 мл), а об'єднані органічні шари проm/e 383,40 (M+1). мивали розсолом та сушили над MgSO4. Після Сполука 6 фільтрування та концентрування у вакуумі одержали 240 мг продукту у вигляді світло-жовтого масла. Це масло розчиняли у СН2Сl2 (3 мл), після чого обробляли TEA (0,116 мл, 0,831 ммоль) та дитрет-бутилдикарбонатом (0,181 г, 0,831 ммоль). Реакційну суміш витримували при перемішуванні при кімнатній температурі протягом 1 год, після чого розводили додатковою кількістю СН2Сl2 (100 мл) та промивали 10% водним розчином Na2CO3 (100 мл). Органічний шар сушили над MgSO4, фільтрували та концентрували під зниженим тиском. Очищення виконували, використовуючи флеш1-[5-хлор-2-([1,4]оксазепан-2-ілметокси)феніл]хроматографію (7:3 гексан/EtOAc), одержуючи 252 3-(5-метилпіразин-2-іл)сечовина мг продукту у вигляді білої піни. Стадія 1: 3-бензил-2-хлорметилСтадія 3: трет-бутиловий складний ефір 2-(2[1,3]оксазепан. Розчин 3-бензиламіно-пропан-1аміно-4-хлорфеноксиметил)-[1,3]оксазепан-3олу (14 г, 88,0 ммоль) в епіхлоргідрині (81,4 г, 880 карбонової кислоти. Виготовляли з третммоль) нагрівали при 40°С. Після перемішування бутилового складного ефіру 2-(4-хлор-2протягом 3 год реакційну суміш охолоджували, та нітрофеноксиметил)-[1,3]оксазепан-3-карбонової надлишок епіхлоргідрину видаляли випарюванням кислоти (0,252 г, 0,65 ммоль) за методикою, опиу вакуумі. Повільно додавали сірчану кислоту (10 саною для Сполуки 3, Стадія 2, одержуючи 150 мг мл), після чого реакційну колбу уміщували у запродукту у вигляді прозорого масла. здалегідь нагріту масляну баню при 150°С. ПереСтадія 4: 1-[5-хлор-2-([1,4]оксазепан-2мішування продовжували протягом 1 год, після ілметокси)феніл]-3-(5-метилпіразин-2-іл)сечовина. чого реакційну суміш витримували для охолоВиготовляли з трет-бутилового складного ефіру 2дження до кімнатної температури та гасили дода(2-аміно-4-бромфеноксиметил)-[1,3]оксазепан-3ванням льоду. Суміш доводили до основного рН карбонової кислоти, використовуючи методики, 10% водним розчином Nа2СО3 та екстрагували описані для Сполуки 2, Стадія 4, та Сполуки 5, EtOAc (3 300 мл). Об'єднані органічні шари сушиСтадія 4, і одержували 0,175 г продукту. 1H-ЯМР ли над безводним MgSO4, фільтрували, та сушили (400 МГц, CDCl3), 8,65 (br s, 1, Η), 8,3 (s, 1, Η), під зниженим тиском. Одержаний залишок очища8,25 (s, 1, Η), 6,98 (dd, 1, Η), 6,8 (d, 1, Η), 4,08 (m, 3, ли флеш-хроматографією (70:28:2 гекΗ), 3,8 (m, 1, Η), 3,35 (s, 1, Η), 3,25 (d, 1, Η), 3 (m, 3, сан/СН2Сl2/2М водний розчин NH4OH), і одержуваΗ), 2,5 (s, 3, Η), 1,98 (m, 2, Η). LRMS (esi, +) m/e ли 5 г світло-жовтого масла. 391,90 (M+1). Стадія 2: трет-бутиловий складний ефір 2-(4Сполука 7 хлор-2-нітрофеноксиметил)-[1,3]оксазепан-3карбонової кислоти. До розчину 4-бром-2нітрофенолу (1,39 г, 8,0 ммоль) у DMSO (30 мл) при перемішуванні додавали карбонат калію (2,76 г, 20,0 ммоль), а потім 3-бензил-2-хлорметил[1,3]оксазепан. Реакційну суміш перемішували при 59 1-[5-метил-2-(1-метилпіперазин-2ілметокси)феніл]-3-(5-метилпіразин-2-іл)сечовина Стадія 1: трет-бутиловий складний ефір 3гідроксиметил-4-метилпіперазин-1-карбонової кислоти. Піперазин-2-карбонову кислоту (20 г, 154 ммоль) у суспензії з 200 мл суміші 1:1 H2О/діоксан охолоджували на льодяній бані та обробляли твердим NaOH (11 г), а потім додавали краплями розчин ди-трет-бутилдикарбонату (21,6 г, 99 ммоль) у діоксані із завантажувальної лійки. рН реакційної суміші під час проведення реакції доводили за потребою до рН>10. Одержану суміш витримували при перемішуванні протягом 3 год, після чого розводили водою до однорідності та підкислювали концентрованим водним розчином HCl до рН у межах від 2 до 3. Одержаний розчин промивали діетиловим ефіром, після чого, додаючи NaOH, рН доводили до значення від 6,5 до 7. Розчин залишали стояти декілька днів, і одержаний осад збирали шляхом фільтрування, одержуючи 1-третбутиловий складний ефір піперазин-1,3дикарбонової кислоти у вигляді білої твердої речовини (9,7 г). Суспензію 1-трет-бутилового складного ефіру піперазин-1,3-дикарбонової кислоти (4,62 г, 20,0 ммоль) у СН3ОН (100 мл) обробляли водним розчином формальдегіду (40 ммоль) та мурашиною кислотою (70 ммоль), після чого нагрівали при 65°С протягом декількох годин. Після завершення реакції за даними РХВЕ, реакційну суміш витримували для охолодження та концентрували у вакуумі. Одержаний залишок розчиняли у THF та охолоджували на льодяній бані, після чого обробляли розчином алюмогідриду літію у THF (19,0 ммоль). Через 1 год реакційній суміші дозволяли нагрітися до кімнатної температури та перемішували протягом додаткових 30 хв. Потім реакційну суміш охолоджували на льодяній бані та гасили H2О (0,75 мл) та 15% водним розчином NaOH (0,75 мл) та знову Н2О (3 0,75 мл). Солі видаляли шляхом фільтрування, а одержаний фільтрат концентрували у вакуумі, одержуючи неочищений продукт. Після хроматографування на силікагелі (2,5% МеОН у СН2Сl2) одержували продукт у вигляді жовтого масла (0,70 г). Стадія 2: 1-[5-метил-2-(1-метилпіперазин-2ілметокси)феніл]-3-(5-метилпіразин-2-іл)сечовина. Виготовляли за методикою, описаною для Сполуки 3, використовуючи трет-бутиловий складний ефір 3-гідроксиметил-4-метилпіперазин-1карбонової кислоти, та методику, описану для Сполуки 5, Стадія 4. 1H-ЯМР (400 МГц, d6-DMSO) 10,24 (br s, 1, Η), 10,1 (s, 1, Η), 9,7 (br s, 1, H), 9,42 (s, 1, H), 9,12 (s, 1, H), 8,2 (s, 1, H), 8,08 (s, 1, H), 6,91 (d, 1, H), 6,82 (d, 1, H), 4,6 (d, 1, H), 4,4 (m, 1, 92164 60 H), 4,1 (m, 1, H), 3,6 (m, 6, H), 3 (s, 3, H), 2,4 (s, 3, H), 2,2 (s, 3, H). LRMS (esi, +) m/e 371,40 (M+1). Сполука 8 1-(5-ціанопіразин-2-іл)-3-[5-метил-2-(морфолін2-ілметокси)феніл]сечовина Виготовляли за методикою, описаною для Сполуки 5, Стадії з 1 по 4, використовуючи 4метил-2-нітрофенол. 1H-ЯМР (400 МГц, CD3OD), 8,80 (s, 1, Η), 8,7 (s, 1, Η), 7,9 (s, 1, Η), 6,8 (m, 2, Η), 4,2 (m, 4, Η), 3,8 (m, 1, Η), 3,6 (m, 1, Η), 3,5 (m, 1, Η), 3,2 (m, 2, Η), 2,3 (s, 3, Η). LRMS (esi, +) m/e 369,30 (M+1). Сполука 9 1-[5-хлор-4-метил-2-(S-морфолін-2ілметокси)феніл]-3-(5-метилпіразин-2-іл)сечовина Виготовляли за методикою, описаною для Сполуки 1, Стадія 4 та Стадія 5, використовуючи трет-бутиловий складний ефір 2-гідроксиметил-Sморфолін-4-карбонової кислоти, виготовлений за методикою, описаною для Сполуки 4, Стадія 1, та 4-хлор-5-метил-2-нітрофенол, виготовлений за методикою, описаною для Сполуки 4, Стадія 2. 1HЯМР (300 МГц, d6-DMSO) 10,32 (s, 1Н), 10,21 (s, 1Н), 8,75 (s, 1H), 8,29-8,10 (m, 2H), 7,06 (d, 1H), 7,18 (d, 1H), 4,12-3,42 (m, 5H), 3,29-2,63 (m, 4H), 2,48 (s, 3H), 2,25 (s, 3H). LRMS (ES, +) m/e 392,2 (M+1). Сполука 10 1-[5-хлор-4-метил-2-(R-морфолін-2ілметокси)феніл]-3-(5-метилпіразин-2-іл)сечовина Виготовляли за методикою, описаною для Сполуки 1, Стадія 4 та Стадія 5, використовуючи 2-гідроксиметил-R-морфолін-4-карбонову кислоту,
ДивитисяДодаткова інформація
Назва патенту англійськоюHeteroaryl urea derivatives useful for inhibiting chkl
Автори англійськоюDiaz Frank, Farouz Francine S., Holcomb Ryan, Kesicki Edward A., Ooi Hua Chee, Rudolph Alexander, Stappenbeck Frank, Gaudino John Joseph, Fischer Kimba L., Cook Adam Wade
Назва патенту російськоюСоединения, пригодные для угнетения снк1
Автори російськоюДиаз Френк, Фароуз Франсин С., Хоулком Райан, Кесицкий Эдвард А., Оой Хуа Че, Рудолф Александер, Стейппенбек Френк, Годино Джон Джосеф, Фишер Кимба Л., Кук Адам Уейд
МПК / Мітки
МПК: C07D 417/12, A61K 31/497, A61K 31/5355, A61K 31/541, A61P 35/00, C07D 413/12, C07D 403/12
Мітки: корисні, пригнічення, снк1, сполуки
Код посилання
<a href="https://ua.patents.su/47-92164-spoluki-korisni-dlya-prignichennya-snk1.html" target="_blank" rel="follow" title="База патентів України">Сполуки, корисні для пригнічення снк1</a>
Попередній патент: Ливарна одноразова модель і спосіб її збирання
Наступний патент: Спосіб виготовлення кроквяних балок с хвилеподібною стінкою
Випадковий патент: Спосіб одержання галію з відходів виробництва алюмінію