Спосіб одержання етил 6-арил-5-гідрокси-1-r-2-метиліндол-3-карбоксилатів
Номер патенту: 71671
Опубліковано: 25.07.2012
Автори: Матійчук Василь Степанович, Мартяк Роман Львович, Обушак Микола Дмитрович
Формула / Реферат
Спосіб одержання етил 6-арил-5-гідрокси-1-К-2-метиліндол-3-карбоксилатів, що включає взаємодію хінонів з єнамінами, який відрізняється тим, що як хінони використовують 2-арил-1,4-бензохінони, як єнаміни - етил 3-(R-аміно)-2-бутеноати, де R = алкіл, аліл, бензил, гетарил-СН2-, причому реакцію здійснюють у середовищі органічного розчинника -1,2-дихлоретану чи нітрометану при температурі кипіння упродовж 1-1,5 год. і одержують індоли загальної формули
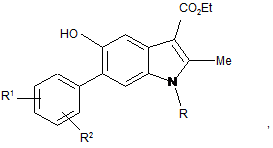
де R1, R2 = Н, Alk, OAlk, Hal, CF3, NO2, NHCOCH3, R1R2C6H3 = 2-C10H7;
R = алкіл, аліл, бензил, гетарил-СН2- .
Текст
Реферат: UA 71671 U UA 71671 U 5 10 15 20 25 30 35 40 Корисна модель належить до органічної хімії, а саме способів одержання практично корисних органічних сполук, які можуть бути використані у фармакології як лікарські препарати, що застосовуються при лікуванні низки захворювань, таких як ревматоїдні артрити, артеріальна гіпертензія, подагра, алергії. Відомий спосіб одержання заміщених індолів - синтез Фішера [Robinson В. The Fischer indole synthesis // Chem. Rev. 1963. Vol. 63. № 4. P. 373-401; Przheval'skii N.M., Kostromina L.Yu., Grandberg I.I. New data on the mechanism of the Fischer indole synthesis // Chem. Heterocycl. Compd. 1988. Vol. 24. P. 709-721], який полягає у перегрупуванні арилгідразонів альдегідів чи кетонів при нагріванні за присутності кислотних каталізаторів. Недоліком цього способу є те, що застосування мета-заміщених фенілгідразонів, а також арилгідразонів, отриманих із несиметричних кетонів, приводить до утворення ізомерних похідних індолу. Відомий спосіб одержання заміщених індолів - синтез Маделунга [Джилкрист Т. Химия гетероциклических соединений. Μ.: Мир, 1996], який полягає у високотемпературній конденсації орто-алкіланілідів карбонових кислот під дією основ. Недолік цього способу - жорсткі умови реакції, через що отримувати можна лише термічно стійкі індоли. Відомий спосіб одержання заміщених індолів - синтез Біпілера [Общая органическая химия / Под. ред. Д. Бартона, У.Д.Оллиса. М.: Химия, 1985. - Т. 8], який полягає у циклізації ариламінокарбонільних сполук при нагріванні за присутності кислотних каталізаторів. Недоліком цього способу є те, що практично завжди утворюється суміш ізомерних індолів. Відомий спосіб одержання заміщених індолів - синтез Рейсерта [Общая органическая химия / Под. ред. Д. Бартона, У.Д. Оллиса. М.: Химия, 1985. - Т. 8.], який полягає у циклізації естерів орто-нітрофеніл-піровиноградної кислоти за присутності відновників. Недоліком цього способу є те, що отримання похідних індолу обмежене колом заміщених орто-нітротолуолів. Найближчим за технічною суттю прототипом є спосіб одержання заміщених 5гідроксиіндолів за реакцією Неніцеску [Patrick J.B., Saunders Е.К. Studies on the Nenitzescu synthesis of 5-hydroxyindoles // Tetrahedron Lett. 1979. № 42. P. 4009-4012; Грант ВТ., Любчанская В.Μ., Муханова Т.Н. Реакция Неницеску //Хим.-фарм. журн., 1993. № 6. - С. 37-55], який полягає у взаємодії заміщених 1,4-бензохінонів з єнамінами у середовищі органічного розчинника. Реакція відбувається при кімнатній температурі або при температурі кипіння розчинника. Недоліком способу є невисокі виходи заміщених індолів при застосуванні низки хінонів та єнамінів, а також можливість утворення ізомерів. В основу корисної моделі поставлено задачу удосконалити спосіб одержання естерів 5гідроксиіндол-3-карбонових кислот шляхом використання взаємодії легкодоступних 2-арил-1,4бензохінонів в реакції з єнамінами, що дасть змогу значно розширити межі цієї реакції. Поставлена задача вирішується тим, що у способі одержання заміщених 5-гідроксиіндолів, який включає взаємодію хінонів з єнамінами, як хінони використовують 2-арил-1,4-бензохінони, як єнаміни - етил 3-(R-aміно)-2-бутеноати, де R = алкіл, аліл, бензил, гетарил-СН2-, причому реакцію проводять у середовищі 1,2-дихлоретану чи нітрометану при температурі кипіння розчинника упродовж 1-1,5 год. і одержують індоли загальної формули CO2Et HO Me N R1 R , R2 45 50 1 2 1 2 де R , R = Η, Alk, OAlk, Hal, CF3, NO2, NHCOCH3, R R C6H3 = 2-C10H7; R = алкіл, аліл, бензил, гетарил-СН2-. Автори вперше запропонували використати в реакції Неніцеску ряд нових 2-арил-1,4бензохінонів. Вони реагують з етил 3-(R-aміно)-2-бутеноатами з утворенням продуктів приєднання - гідрохінон-адуктів. В умовах реакції гідрохінон-аддукти легко окиснюються у заміщені хінони, в яких відбувається внутрішньо-молекулярна взаємодія аміногрупи з карбонільною групою хінону, що призводить у свою чергу до формування індольної системи утворюються етил 6-арил-5-гідрокси-1-R-2-метиліндол-3-карбоксилати. 1 UA 71671 U 5 Спосіб можна проілюструвати прикладами, результати яких зведено у таблиці, де 1 2 розшифровка замісників R, R і R , виходи та температури плавлення сполук наведені після перекристалізації з диметилформаміду чи суміші етанол-диметилформамід. Дані спектроскопії 1 ЯМР Н та елементного аналізу підтверджують будову цих сполук. Одержання сполук 1-30 здійснюють за реакцією: O CO2Et CO2Et (CH2Cl)2 + O R1 HN HO Me або MeNO2 Me N R1 R R2 R , R2 1 2 1 2 де R , R = Н, Alk, OAlk, Hal, CF3, NO2, NHCOCH3, R R C6H3 = 2-С10Н7; R = алкіл, аліл, бензил, гетарил-СН2-. Таблиця Виходи та температури плавлення етил 6-арил-5-гідрокси-1 -R-2-метиліндол-3-карбоксилатів Номер сполуки 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 R Me Me Me Me Me Me Me Me Me Me Me Me Me Me Me аліл аліл аліл аліл аліл аліл аліл бензил 2-фурилметил 2-фурилметил 2-фурилметил 2-фурилметил 2-фурилметил 2-фурилметил 2-фурилметил R 1 R 2 Η Η 3-Ме Η 4-Ме Η 4-Et Η 4-ОМе Η 3-CF3 Η 4-F Η 3-Сl Η 4-Вr Η 3-NO2 Η 4-NHCOMe Η 3-Ме 4-Ме 2-Сl 5-Сl 3-Сl 4-Сl 1 2 R R С6Н3 = 2-С10Н7 Η Η 3-Ме Η 4-Ме Η 3-Сl Η 4-Вr Η 3-ΝΟ2 Η 4-ΝΟ2 Η 4-Ме Η Η Η 4-Ме Η 4-ОМе Η 3-CF3 Η 4-Сl Η 3-NO2 Η 3-Ме 4-Ме Т. пл., °C 221-222 185-186 223-224 218-219 233-234 225-226 235-236 217-218 250-251 265-266 246-247 231-232 225-226 244-245 254-255 169 167 208-209 199-200 219-220 220-221 231-232 204-205 201-202 189-190 199-200 211-212 210 220-221 221-222 Вихід, % 26 24 23 25 23 20 27 25 22 21 19 21 27 24 23 24 22 23 20 25 23 24 22 25 23 21 23 24 22 25 10 15 Приклад 1. Розчин 1,84 г (0,01 моля) 2-феніл-1,4-бензохінону і 2,1 г (0,01 моля) етил 3-(2фурилметил)аміно-2-бутеноату у 40 мл 1,2-дихлоретану кип'ятять упродовж 1 год. з одночасною відгонкою розчинника (25-30 мл дистиляту відбирають). Реакційну суміш залишають при кімнатній температурі на 48 год. Твердий залишок відфільтровують, промивають холодним етанолом і перекристалізовують із суміші етанол-диметилформамід. 2 UA 71671 U 5 10 15 Етил 5-гідрокси-2-метил-6-феніл-1-(2-фурилметил)індол-3-карбоксилат "24". Вихід 25 %; т. 1 пл. 201-202 °C (ЕtOН-ДМФА, 2:1). ЯМР H, : 1,45 т (3Н, СН3), 2,81 с (3Н, СН3С=), 4,33 к (2Н, ОСН2), 5,36 с (2Н, CH2N), 6,29 ш.с (2Н, фурил), 7,23 м (1Н, С6Н5), 7,36 м (3Н, С6Н5+1Н, фурил), 7,40 с (1Н, 4-Н), 7,56 с (1Н, 7-Н), 7,59 д (2Н, С6Н5), 8,73 с (1Н, ОН). Знайдено, %: С 73,42; Η 5,55; Ν 3,65; C23H21NO4. Обчислено, %: С 73,58; Η 5,64; Ν 3,73. Приклад 2. Розчин 2,3 г (0,01 моль) 2-(3-нітрофеніл)-1,4-бензохінону і 1,43 г (0,01 моль) етил 3-метиламіно-2-бутеноату у 15 мл сухого нітрометану кип'ятять 1,5 год. Після цього реакційну суміш охолоджують до кімнатної температури і залишають на 48 год. до утворення кристалічної маси. Твердий залишок відфільтровують, промивають холодним етанолом і перекристалізовують із суміші етанол-диметилформамід. Етил 5-гідрокси-1,2-диметил-6-(3-нітрофеніл)індол-3-карбоксилат "10". Вихід 21 %; т. пл. 1 265-266 °C (ЕtOН-ДМФА, 1:1). ЯМР Н, : 1,45 т (3Н, СО2СН2СН3), 2,74 с (3Н, СН3С=), 3,75 с (3Н, CH3N), 4,33 к (2Н, СО2СН2СН3), 7,34 с (1Н, 4-Н), 7,60 с (1Н, 7-Н), 7,62 т (1Н, С6Н4), 8,06 д (1Н, С6Н4), 8,10 д (1Н, С6Н4), 8,51 с (1Н, С6Н4), 9,09 с (1Н, ОН). Знайдено, %: С 64,31; Η 5,09; Ν 8,06; C19H18N2O5. Обчислено, %: С 64,40; Η 5,12; Ν 7,91. Запропонований спосіб дає змогу легко одержувати етил 6-арил-5-гідрокси-1-R-2метиліндол-3-карбоксилати за одну стадію, використовуючи дешеві та доступні вихідні реагенти ФОРМУЛА КОРИСНОЇ МОДЕЛІ 20 25 Спосіб одержання етил 6-арил-5-гідрокси-1-R-2-метиліндол-3-карбоксилатів, що включає взаємодію хінонів з єнамінами, який відрізняється тим, що як хінони використовують 2-арил1,4-бензохінони, як єнаміни - етил 3-(R-аміно)-2-бутеноати, де R = алкіл, аліл, бензил, гетарилСН2-, причому реакцію здійснюють у середовищі органічного розчинника -1,2-дихлоретану чи нітрометану при температурі кипіння упродовж 1-1,5 год. і одержують індоли загальної формули CO2Et HO Me N R1 R , R2 1 2 1 2 де R , R = Н, Alk, OAlk, Hal, CF3, NO2, NHCOCH3, R R C6H3 = 2-C10H7; R = алкіл, аліл, бензил, гетарил-СН2-. Комп’ютерна верстка Л.Литвиненко Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 3
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for the preparation of ethyl 6-aryl-5-hydroxy-1-r-2-methylindole-3-carboxylates
Автори англійськоюMartiak Roman Lvovych, Obushak Mykola Dmytrovych, Matiichuk Vasyl Stepanovych
Назва патенту російськоюСпособ получения этил 6-арил-5-гидрокси-1-r-2-метилиндол-3-карбоксилатов
Автори російськоюМартяк Роман Львович, Обушак Николай Дмитриевич, Матийчук Василий Степанович
МПК / Мітки
МПК: C07D 209/04
Мітки: спосіб, одержання, 6-арил-5-гідрокси-1-r-2-метиліндол-3-карбоксилатів, етил
Код посилання
<a href="https://ua.patents.su/5-71671-sposib-oderzhannya-etil-6-aril-5-gidroksi-1-r-2-metilindol-3-karboksilativ.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання етил 6-арил-5-гідрокси-1-r-2-метиліндол-3-карбоксилатів</a>
Попередній патент: Теплоутилізаційна енергетична установка
Наступний патент: Спосіб л.о.валігури відновлення і підтримки активної діяльності людини
Випадковий патент: Стенд для дослідження гичковідділяючих робочих органів збиральних машин









