Заміщені 1-фенілпіразол-3-карбоксаміди, спосіб їх одержання та проміжні сполуки, фармацевтична композиція, що має спорідненість до рецепторів нейротензину
Номер патенту: 66750
Опубліковано: 15.06.2004
Автори: Жиллі Даніель, Молімар Жан-Шарль, Жанжан Френсі, Лабеу Бернар, Буажгрен Робер
Формула / Реферат
1. Заміщений 1-фенілпіразол-3-карбоксамід загальної формули
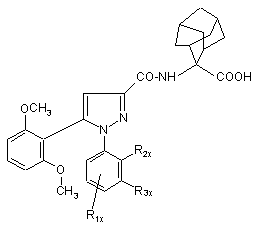 , (Ia)
, (Ia)
де
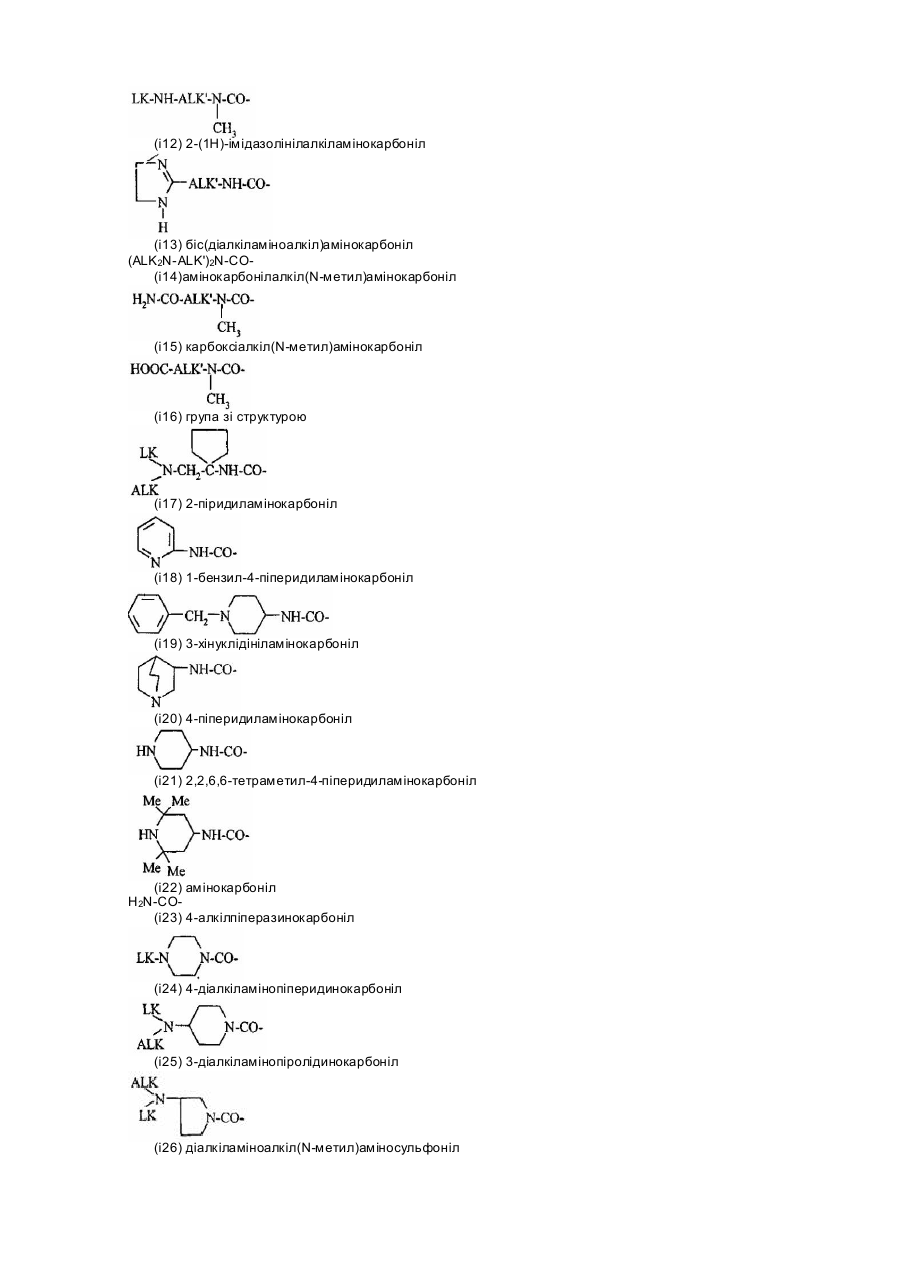
R1x знаходиться у положенні 4 або5 і означає групу -T-CONRaRb, в якій Т - прямий зв’язок або С1-7алкілен;
NRaRb означає групу, вибрану з: –NR9(CH2)sCR7R8(CH2)tNR5R6,
 ,
, 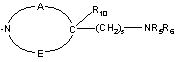 ;
;
R5 та R6 кожний незалежно означає водень, С1-6алкіл, С3-8алкеніл; або
R5 і R6 разом з атомом азоту, з яким вони зв’язані, утворюють гетероцикл, вибраний з: піролідину, піперидину, морфоліну, піперазину, заміщеного R9 у положенні 4;
R7 означає водень, С1-4алкіл або бензил;
R8 означає водень, С1-4алкіл; або
R7 і R8 разом з атомом вуглецю, з яким вони зв’язані, утворюють С3-5циклоалкан;
R9 означає водень, С1-4алкіл, бензил або групу -X-NR'5R'6;
R'5 і R'6 кожний незалежно означає С1-6алкіл;
R10 означає водень, С1-4алкіл;
Х означає С2-7алкілен;
s - від 0 до 3;
t - від 0 до 3, за умови, що (s + t) в тій самій групі більше або дорівнює 1;
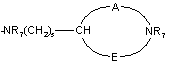
двовалентні радикали А і Е разом з атомом вуглецю і атомом азоту, з якими вони зв’язані, утворюють насичений гетероцикл, що містить від 4 до 7 ланок, і, крім того, може бути заміщений одним або більше С1-4алкілом;
R2x і R3x кожний незалежно означає водень, С1-6алкіл, С3-8циклоалкіл, С3-8циклоалкілметил,
за умови, що R2x і R3х не означають одночасно водень; або
R2x і R3х разом утворюють тетраметиленову групу;
та його фармацевтичнo прийнятні солі.
2. Заміщений 1-фенілпіразол-3-карбоксамід за п. 1, який відрізняється тим, що Т означає прямий зв’язок; NRaRb означає
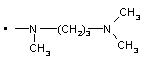 ,
, ![]() ,
, 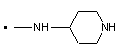 ,
, 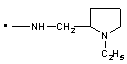 ,
, 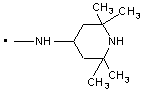 ,
, 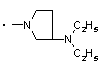 ,
, 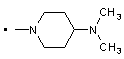 .
.
3. Заміщений 1-фенілпіразол-3-карбоксамід за п. 1, який відрізняється тим, що являє собою 2-[5-(2,6-диметоксифеніл)-1-[4-[N-метил-N-(3-диметиламінопропіл)карбамоїл]-2-ізопропілфеніл]піразол-3-ілкарбоніламіно]адамантан-2-карбонову кислоту, її внутрішню сіль та її фармацевтичнo прийнятні солі.
4. Оксазолон формули
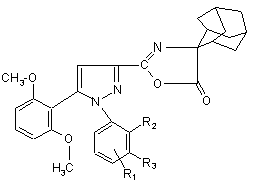 , (Ic)
, (Ic)
де
R1 знаходиться в положенні 4 або 5 і означає групу -T-CONRaRb, в якій Т - прямий зв’язок або С1-7алкілен;
NRaRb означає групу -NR9(CH2)sCR7R8(CH)tNR5R6;
R2 означає С1-6алкіл;
R3 означає водень;
R5 і R6 означають С1-6алкіл;
R7 і R8 означають водень;
s = від 0 до 3;
t = від 0 до 3, за умови, що сума (s +1) більша або дорівнює 1.
5. Спосіб одержання заміщених 1-фенілпіразол-3-карбоксамідів за будь-яким з пп. 1-3 та їх солей, який відрізняється тим, що
1) функціональну похідну 1-фенілпіразол-3-карбонової кислоти формули (II) або (ІI')
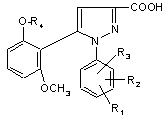 (II),
(II), 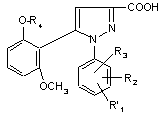 ,(ІI')
,(ІI')
де
R1, R2 і R3 мають значення, які відповідають значенням R1x, R2x і R3х, вказаним для сполуки формули (Іа) у п. 1; та
R'1 означає попередник R1, вибираний з: карбокси, С1-4алкоксикарбонілу, бензилоксикарбонілу,
піддають обробленню амінокислотою, необов’язково захищеною захисними групами, які зазвичай застосовуються у пептидному синтезі, формули
H-HN-AA(OH), (III)
де -NН-АА(ОН) означає групу формули
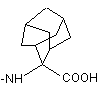 ;
;
2) потім, при необхідності, одержану таким чином функціональну похідну кислоти формули (I')
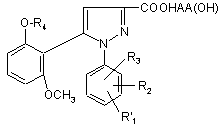 , (I')
, (I')
піддають відповідному обробленню для перетворення замісника R'1, який є попередником R1, в замісник R1;
3) при необхідності, сполуку, одержану таким чином на етапі 1) або 2), піддають депротекційному обробленню з одержанням відповідної вільної кислоти формули (І);
4) при необхідності, одержують сіль одержаної таким чином сполуки (І).
6. 1-фенілпіразол-3-карбонова кислота формули (II) або (ІI')
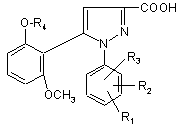 (II),
(II), 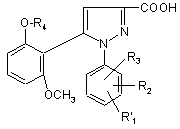 , (ІI')
, (ІI')
де
R1, R2 і R3 мають значення, що відповідають значенням R1x, R2x і R3х, вказаним для сполуки формули (Іа) у п. 1; та
R'1 означає попередник R1, вибираний з: карбокси, С1-4алкоксикарбонілу, бензилоксикарбонілу,
та її функціональні похідні, вибрані з хлорангідриду і складного С1-4алкілового ефіру.
7. Похідна фенілгідразину формули (3')
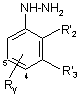 , (3')
, (3')
де
R'2 і R'3 кожний незалежно означає водень, С1-6алкіл, С3-8циклоалкіл; або
R'2 і R'3 разом утворюють тетраметиленову групу;
Ry знаходиться у положенні 4 або 5 і означає групу, вибрану з: карбокси, С1-4алкоксикарбонілу, бензилоксикарбонілу;
за умови, що R'2 і R'3 не означають одночасно водень, і за умови, що R'2 не означає етил, коли R'3 означає водень, а Ry означає метоксикарбонільну групу в положенні 4;
і її солі.
8. Фармацевтична композиція, що має спорідненість до рецепторів нейротензину людини, яка відрізняється тим, що містить як активний компонент сполуку за будь-яким з пп. 1-3 або одну з її фармацевтичнo прийнятних солей, в сполученні з фармацевтичнo прийнятним носієм.
Текст
Винахід стосується нових заміщених 1-фенілпіразол-3-карбоксамідів, які мають високу спорідненість до рецепторів нейротензину людини. Винахід стосується також способу одержання цих сполук і фармацевтичних композицій, які їх містять у якості активних компонентів. Вперше синтетичні непептидні вироби медичного спрямування, спроможні зв'язуватися з рецепторами нейротензину, були описані в ЕР 0477049. Це були аміди піразол-3-карбонової кислоти, у різних ступенях заміщені амінокислотами, які при дозах менше ніж 1мкмоль заміщують йодований нейротензин з його рецептора на оболонках мозку морської свинки. Пошуки у цьому ряді привели до розробки сполуки 2-[(1-(7хлор-4-хіноліл)-5-(2,6-диметоксифеніл)піразол-3-іл)карбоніламіно]-2-адамантанкарбонової кислоти (SR 48692), наділеної потужною і селективною нейротензин-антагоністичною активністю (D. Gully et al., Proc. Natl. Acad. Sci. USA, 1993, 90, 65-69). Характерною особливістю для ряду виробів, описаних в ЕР 0477049, є наявність у положенні 1 піразолевого циклу, зокрема, заміщеної або незаміщеної фенільної, нафтильної або 4-хінолільної групи. Більш конкретно, SR 48692 має 7-хлор-4-хінолільну груп у у положенні 1 піразолу. Описані у даному документі продукти, які мають групу 1-нафтилу або 4-хлор-1-нафтилу у положенні 1 піразолевого циклу, володіють вкрай підвищеною спогрідненостю до рецептора нейротензину морської свинки, оскільки їхній ІС 50 є порядку 1-10нМ, тоді як їхня спорідненість до рецептора людини є нижчою, оскільки їхній IС50 становить від 10 до 100нМ. Було знайдено, що при заміщенні фенільної групи в 1-фенілпіразол-З-кабоксамідних сполуках певними іншими групами зростає спорідненість до рецепторів нейротензину і, зокрема, до рецепторів нейротензину людини. Крім того, сполуки за винаходом демонструють in vitro більш широкий спектр активності, ніж сполуки, описані в ЕР 0477049, як антагоністи рецепторів нейротензину. Таким чином, даний винахід стосується згідно з одним з його аспектів, нових заміщених 1-фенілпіразол-3карбоксамідів за формулою де: - R1 означає групу, вибрану з: -T-CN; -C(NH2)=NOH; -C(=NOH)NH(CH2)rNR5R6; -T-C(NR12R13)=NR14; -C(NH2)=NO(CH 2)rNR5R6; -T-CONRaRb; -T-CONR7RC; -Y-CO2R 7; -ORd; -T-NR5R6, за умови, що R5 і R 6 не є одночасно воднем, коли Τ означає прямий зв'язок; -T-N(R7)COR e; -SO2NRaRb; -T-N(R7)SO2R'7 ; -T-NR27R28; -NRaRb означає групу, вибрану з: -NR5R6; -NR 9(CH2)sCR7R8(CH2),NR5Re; - Rc означає групу, вибрану з: -X-OR7 ; -CHR20CO 2R7; -(CH2) 4CH(NH2)CO2R7; - Rd означає групу, вибрану з: -X-NR5R6; -Y-CONR 5R6; -Y-CO 2R7; -Y-SO2NR5R6; - Re означає групу, вибрану з: - R2 і R3 кожний незалежно означає водень, (С1-С6)алкіл, (С3-С8)циклоалкілметил, (С3-С8)циклоалкіл, галоген, нітро, трифторметил, груп у - OR4, гр упу - NR 5R6, 1-піроліл, ціано, карбамоїл; - або R2 і R3 разом утворюють триметиленову, тетраметиленову або пентаметиленову гр упу; - R4 означає водень, (С1-С6)алкіл, (С3-С4)алкеніл, (С3-С8)циклоалкіл, (С3-С8)циклоалкілметил, (С1С4)алкоксі(С 1-С4)алкілен, бензил; - R5 і R6 кожний незалежно означає водень, (С1-С6)алкіл, (С3-С8)алкеніл, (С3-С8)циклоалкілметил, бензил, або R5 і R6 разом з атомом азоту, з яким вони зв'язані, являють собою гетероцикл, вибраний з:піролідину, піперидину, морфоліну, тіоморфоліну, піперазину, заміщеного R9 у положенні 4, азирідину, азетидину і пергідроазепіну; - R'5 і R'6 кожний незалежно означає водень або (С1-С6)алкіл; або краще R'5 і R'6 разом з атомом азоту, з яким вони зв'язані, являють собою гетероцикл, вибраний з:піролідину, піперидину, морфоліну, тіоморфоліну або піперазину, незаміщеного або заміщеного (С1-С6)алкілом у положенні 4; - R'7 означає (С1-С4)алкіл; феніл, незаміщений або однократно чи багатократно заміщений (С1-С4)алкілом; груп у -X-NR 5R6; - R7 означає водень, (С1-С4)алкіл або бензил; - R8 означає водень, (С1-С4)алкіл, гідрокси, або R7 і R8 разом з атомом вуглецю, з яким вони зв'язані, утворюють (С3-С5)циклоалкан; - R9 означає водень, (С1-С4)алкіл, бензил, групу -Х-ОН або груп у -X-NR'5R' 6, (C 3-С8)алкеніл; - R10 означає водень, (С1-С4)алкіл, бензил, карбамоїл, ціано; - R11 означає водень, (С1-С4)алкіл, групу -Х-ОН, гр упу -X-NR' 5R'6; - R12 і R13 кожний незалежно означає водень або (С1-С4)алкіл; - R14 означає водень, R14, крім того, може являти собою (С1-С4)алкіл, коли R12 означає водень і R13 означає (С1-С4)алкіл; - або R13 і R14 разом являють собою групу Z; - R15 означає водень, (С1-С4)алкіл, групу -(CH2)sNR5R6; - R16 означає водень, (С1-С8)алкіл, (С3-С8)циклоалкіл, феніл, 2-піперидил, 3-піперидил, 4-піперидил; - R17 означає (СгС6)алкіл, феніл, бензил, гідроксi(С1-С4)алкіл, аміно(С 1-С4)алкіл; - R18 і R19 кожний незалежно означає водень, (С1-С4)алкіл; R18, крім того, може являти собою групу -(CH 2)q NR5R6; - або R18 і R19 разом з атомом азоту, з яким вони зв'язані, являють собою гетероцикл, вибраний з:піролідину, піперидину, морфоліну, тіоморфоліну, піперазину, заміщеного R9 у положенні 4; - R20 означає водень, (С1-С4)алкіл, бензил, гідроксифенілметил, краще 4-гідроксифенілметил, гідроксі(С 1С4)алкіл, меркапто(С 1-С4)алкіл; груп у -(CH2)3-NH-C(=NH)NH2, груп у -(CH2)4NH2, гр упу -CH2-lm, де Im означає імідазол-4-іл; - R21 означає (С1-С4)алкіл, аліл або бензил; - R22 і R23 кожний незалежно означає (С1-С6)алкіл; або краще R22 і R23 разом з атомом азоту, з яким вони зв'язані, являють собою гетероцикл, вибраний з:піролідину, піперидину, морфоліну або пергідроазепіну; - R24 означає (С1-С4)алкіл, бензил, аліл, гідроксі(С 1-С4)алкіл, (С1-С4)алкоксі(С 1-С6)алкіл; -Qq означає аніон; - R25 означає водень або (С1-С6)алкіл; - R26 означає (С1-С4)алкоксикарбоніл, бензилоксикарбоніл; (С1-С4)алкілкарбоніл; - R27 означає водень; (С1-С4)алкіл; (С1-С4)алкілкарбоніл; групу -СО-(СН2)r-ОН; гр уп у -SO 2R’7; - R28 означає груп у -X-NR 5R6; - s = від 0 до 3; - 1 = від 0 до 3, за умови, що (s+t) в тій самій групі є ви ще або дорівнює 1; - r = від 2 до 5; - q = від 1 до 5; - Τ означає прямий зв'язок або (С1-С7)алкілен; - X означає (С2-С7)алкілен; - Υ означає (С1-С7)алкілен; - Ζ означає (С2-С6)алкілен; - двовалентні радикали А і Ε разом з атомом вуглецю і атомом азоту, з якими вони зв'язані, утворюють насичений гетероцикл, що містить від 4 до 7 членів, і, крім того, може бути заміщений одним або більше (С1С4)алкілами; - двовалентні радикали G і L разом з атомами азоту, з якими вони зв'язані, утворюють піперазинове або імідазолідинове або імідазолінове кільця, які можуть бути необов'язково заміщені на атомах вуглецю одним або більше (С1-С4)алкілами; - група -NH-AA(OH) означає амінокислотний залишок: де Ха є водень і Х'а є водень, (С1-С5)алкіл або неароматичний С3-С15карбоциклічний радикал, або краще Ха і Х' а разом з атомом вуглецю, з яким вони зв'язані, утворюють неароматичний С 3-С15карбоцикл; їхні солі, їхні солі четвертинного амонію, утворені з ациклічних або циклічних третинних амінів, і їхні сольвати. Якщо сполука за винаходом містить один або кілька асиметричних атомів вуглецю, то кожний з оптичних ізомерів, як і рацемічна форма, становлять частину винаходу. Якщо сполука за винаходом має кілька таутомерних форм, то кожна з них становить частину винаходу. Особливо це стосується тих випадків, коли заміщуючий R1 містить заміщену амідинову груп у C(NR12R13)=NR14. Якщо група -NH(AA)OH являє собою залишок циклоаліфатичної амінокислоти, то амінні або амінометилові групи можуть знаходитися в ендо- або екзо-положенні відносно циклічної системи; у двох останніх випадках сполуки за формулою (І) становлять частину винаходу; Згідно з винаходом, під алкілом або алкіленом мають на увазі лінійний бо розгалужений алкіл або алкілен, який кваліфікується за кількістю атомів вуглецю, які він містить. Під галогеном мають на увазі атом хлору, брому, фтору або йоду. Неароматичні карбоциклічні радикали з 3-15 атомами вуглецю включають у себе насичені або ненасичені, конденсовані або місткові моно- або поліциклічні радикали, можливо терпени. Ці радикали можуть бути моноабо полізаміщені (С1-С4)алкілом. Моноциклічні радикали включають у себе циклоалкіли, наприклад, циклопропіл, циклопентил, циклогексил, циклогептил, циклооктил, циклододецил. Якщо у згаданому вище амінокислотному залишку Ха і Х'а разом з атомом вуглецю, з яким вони зв'язані, утворюють неароматичний карбоцикл з 3-15 атомами вуглецю, то цей карбоцикл є таким, як визначено вище для відповідних радикалів. Серед поліциклічних неароматичних карбоциклів кращими є адамантан, біцикло[3.3.1]нонан і норборнан. Радикалом, відповідним адамантану, може бути 1-адамантил, коли Ха є воднем, або 2-адамантиліден, коли Ха і Х' а разом з атомом вуглецю, з яким вони зв'язані, утворюють карбоцикл. Серед моноциклічних неароматичних карбоциклів особлива перевага віддається циклопентану і циклогексану. Солями сполук за винаходом можуть бути вн утрішні солі або солі з лужними металами, краще з натрієм або калієм, і з лужноземельними металами, краще кальцієм, і з органічними основами, такими як діетиламін, трометамін, меглумін (N-метил-D-глукамін), лізин, аргінін, гістидин, холін або діетаноламін, або з оптично чистими органічними основами, такими як a-метилбензиламін. Згідно з винаходом, солі сполук за формулою (І) включають у себе також такі солі з неорганічними або органічними кислотами, які дозволяють відповідне відділення або кристалізацію сполук за формулою (І), такими як пікринова кислота, щавлева кислота або оптичноактивна кислота, наприклад, мигдальна кислота або камфосульфокислота, і краще з такими, які утворюють фармацевтично прийнятні солі, такі як гідрохлорид, ацетат, гідросульфат, ди гідрофосфат, метансульфонат, малеат, фумарат, 2-нафталінсульфонат, ізетіонат, бензолсульфонат, паратолуолсульфонат, тартрат, цитрат і едісилат. Четвертинні солі амонію з ациклічними або циклічними третинними амінами утворюються шляхом заміщення аміну (С1-С4)алкілом, бензилом, алілом, гідроксі(С 1-С4)алкілом або (С1-С4)алкоксi(С1-С4)алкіленом, де у якості аніону за краще вважається фармацевтично прийнятний аніон. Одним з корисних аспектів винаходу є те, що він стосується сполук за формулою (Ір) де: - R1p означає груп у, вибрану з: - T-CN; - C(NH2) = NOH; - C(=NOH)NH(CH 2)rNR5R6; - T-C(NR12R13)=NR14 ; - C(NH2)=NO(CH 2)rNR5R6; - T-CONRaRb; - T-CONR7RC; - Y-CO 2R7; - ORd; - T-NR5R6, за умови, що R5 і R6 не є одночасно воднем, коли Τ означає прямий зв'язок; - T-N(R7)COR e; - SO2NRaRb; - T-N(R7)SO2R' 7; - NRaRb означає групу, вибрану з: - NR7(CH2)q CN; -NR7(CH2)q C(NR 12R13) = NR 14; - Rc означає групу, вибрану з: - X-OR 7; -CHR20CO 2R7; -(CH2)4CH(NH2)CO2R7; - Rd означає групу, вибрану з: - X-NR5R6 ; -Y-CONR 5R6; -Y-CO2R7; -Y-SO 2NR5R6; - Re означає групу, вибрану з: - R16; -Y-NR 5R6; -Y-NHCOR 16; -CH(R 17)NR5R6; - R2P i R3P кожний незалежно означає водень, (С1-С6)алкіл, (С3-С8)циклоалкілметил, (С3-С8)циклоалкіл, галоген, нітро, трифторметил, груп у -OR4, груп у-NR5R6, 1-піроліл, ціано, карбамоїл; - або R2p і R3P разом утворюють триметиленову, тетраметиленову або пентаметиленову груп у; - R4p означає водень, (С1-С6)алкіл, (С3-С4)алкеніл, (С3-С8)циклоалкіл, (С3-С8)циклоалкілметил, (С1С4)алкоксі(С 1-С4)алкіл, бензил; - R5 і R6 кожний незалежно означає водень, (С1-С6)алкіл; або R5 і R6 разом з атомом азоту, з яким вони зв'язані, являють собою гетероцикл, вибраний з:піролідину, піперидину, морфоліну, тіоморфоліну, піперазину, заміщеного R9 y положенні 4; - R'7 означає (С1-С4)алкіл; - R7 означає водень, (С1-С4)алкіл або бензил; - R8 означає водень, (С1-С4)алкіл, гідрокси, або R7 і R8 разом з атомом вуглецю, з яким вони зв'язані, утворюють (С3-С5)циклоалкан; - R9 означає водень, метил, групу -Х-ОН або гр упу -X-NR 5R6 ; - R10 означає водень, (С1-С4)алкіл, бензил, карбамоїл, ціано; - R11 означає водень, (С1-С4)алкіл, групу -Х-ОН, гр упу -X-NR 5R6 ; - R12 і R13 кожний незалежно означає водень або (С1-С4)алкіл; - R14 означає водень, R14, крім того, може являти собою (С1-С4)алкіл, коли R12 означає водень, і R13 означає (С1-С4)алкіл; - або R13 і R14 разом являють собою групу Z; - R15 означає водень, (С1-С4)алкіл, групу -(CH2)sNR5R6; - R16 означає водень, (С1-С8)алкіл, (С3-С8)циклоалкіл, феніл, 2-піперидил, 3-піперидил, 4-піперидил; - R17 означає (С1-С6)алкіл, феніл, бензил, гідроксі(С 1-С4)алкіл, аміно(С 1-С4)алкіл; - R18 і R19 кожний незалежно означає водень, (С1-С4)алкіл; R18, крім того, може являти собою групу -(CH 2)q NR5R6; - або R18 і R19 разом з атомом азоту, з яким вони зв'язані, являють собою гетероцикл, вибраний з:піролідину, піперидину, морфоліну, тіоморфоліну, піперазину, заміщеного R9 у положенні 4; R20 означає водень, (С1-С4)алкіл, бензил, гідроксифенілметил, гідроксі(С 1-С4)алкіл, меркапто(С1-С4)алкіл; груп у -(CH2)3-NH-C(=NH)NH2, груп у -(CH 2)4NH2, гр упу -CH 2-lm, де Im означає 4-їмідазоліл; - s = від 0 до 3; - t = від 0 до 3, за умови, що (s+t) є вище або дорівнює 1; - r = від 2 до 5; - q = від 1 до 5; - Τ означає прямий зв'язок або (С1-С7)алкілен; - X означає (С2-С7)алкілен; - Υ означає (С1-С7)алкілен; - Ζ означає (С2-С6)алкілен; - двовалентні радикали А і Ε разом з атомом вуглецю і атомом азоту, з якими вони зв'язані, утворюють насичений гетероцикл, який містить від 5 до 7 членів і, крім того, може бути заміщений одним або більше (С1С4)алкілами; - двовалентні радикали G і L разом з атомами азоту, з якими вони зв'язані, утворюють піперазинове, або імідазолідинове, або імідазолінове кільця, які можуть бути необов'язково заміщені на атомах вуглецю одним або більше (С1-С4)алкілами; - група -ΝΗ-ΑΑp(ΟΗ) означає амінокислотний залишок: де Ха означає водень, і Х'а означає водень, (С1-С5)алкіл або неароматичний С 3-С15карбоциклічний радикал; або краще Ха і Х' а разом з атомом вуглецю, з яким вони зв'язані, утворюють неароматичний С3 С15карбоцикл, та їхні солі. Кращі сполуки за винаходом відповідають формулі де: - R"4 означає водень, метил або циклопропілметил; - АА"(ОН) означає групу 2-карбоксі-2-адамантил, групу a-карбоксициклогексилметил або групу 9карбоксибіцикло[3.3.1]нонан-9-іл; - серед замісників w2, w3, w4 і w5 принаймні один є воднем і принаймні один інший не є воднем, таким чином, що: або (і). w5 є водень; . w3 є водень або метил; . w2 є (С1-С4)алкіл, (С3-С6)циклоалкіл, (С1-С4)алкокси, хлор або трифторметил, або w2 і w3 разом утворюють 1,4-бутиленову гр упу; . w4 вибирають з наступних гр уп: (i1) діалкіламіноалкіламінокарбоніл (і2) діалкіламіноалкіл(N-метил)амінокарбоніл (i3) діалкіламіноалкіл(N-етил)амінокарбоніл (i4) ціаноалкіл(N-метил)амінокарбоніл (i5) аміноалкіламінокарбоніл H2N-ALK'-NH-CO(і6) аміноалкіл(N-метил)амінокарбоніл (i7) (N'-метил)-(N'-алкоксикарбонт)амiноалкіл(N-метил)карбоніл (i8) амідиноалкіламінокарбоніл (i9) піролідиноалкіламінокарбоніл (i10) морфоліноалкіламінокарбоніл (i11) алктамiноалкiл(N-метил)амiнокарбоніл (i12) 2-(1Н)-імідазолінілалкіламінокарбоніл (i13) біс(діалкіламіноалкіл)амінокарбоніл (ALK2N-ALK')2N-CO(і14)амінокарбонілалкіл(N-метил)амінокарбоніл (і15) карбоксіалкіл(N-метил)амінокарбоніл (i16) група зі структурою (i17) 2-піридиламінокарбоніл (і18) 1-бензил-4-піперидиламінокарбоніл (i19) 3-хінуклідініламінокарбоніл (i20) 4-піперидиламінокарбоніл (і21) 2,2,6,6-тетраметил-4-піперидиламінокарбоніл (i22) амінокарбоніл H2N-CO(i23) 4-алкілпіперазинокарбоніл (і24) 4-діалкіламінопіперидинокарбоніл (i25) 3-діалкіламінопіролідинокарбоніл (i26) діалкіламіноалкіл(N-метил)аміносульфоніл (i27) діалкіламіноалкіл(N-бензил)аміносульфоніл (i28) 1-алкіл-2-піролідинілметиламінокарбоніл (i29) аліламінокарбоніл CH2=CH-CH 2-NH-CO(i30) діалкіламіноалкіл(N-ацетил)аміно (i31) діалкіламіноалкіламіно (i32) діалкіламіноалкілкарбоксамідо або w4 вибирають з наступних гр уп: (і33) піперидиноалкілкарбоксамідо (i34) гліцинамідо H2N-CH2-CO-NH(i35) тозиламідо (i36) аміноалкілсульфонамідо H2N-ALK'-SO 2NH- або H2N-CH2-SO2NH(i37) сіль триалкіламонійалкіл(N-метил)амінокарбонілу де ALK означає (С1-С4)алкіл і ALK' означає (С2-С5)алкілен; або (іі) w2 і w5 є водень; w3 є хлор; w4 є ціано або амінокарбоніл; або (ііі) w2 і w5 є водень, w3 є ізопропіл і w4 є діалкіламіноалкіламінокарбоніл ALK і ALK' є такі, як визначено вище; або (iv) w2 і w 5 є водень, w3 є діалкіламіноалкіл(N-метил)амінокарбоніл і w4 є хлор; ALK і ALK’ є такі, як визначено вище; або (v) w3 і w4 є водень; w2 є хлор, (С1-С4)алкокси або (С1-С4)алкіл; w5 є (v1) діалкіламіноалкіл(N-метил)амінокарбоніл (v2) діалкіламіноалкілкарбоніламіно ALK і ALK' є такі, як визначено вище; їхні вн утрішні солі і їхні фармацевтично прийнятні солі, їхні солі четвертинного амонію і їхні сольвати. Краща група сполук за винаходом складається зі сполук, визначених формулою де: - R1, R2 , R3 є такі, як визначено вище для формули (І); - R4y означає водень, груп у (С1-С4)алкіл, аліл або циклопропілметил; і - група -NH-AAy-(OH) означає залишок, що вибирається з залишків 2-аміноадамантан-2-карбонової кислоти, або (S)-a-аміноциклогексаноцтової кислоти, або 9-амінобіцикло[3.3.1]нонан-9-карбонової кислоти, або залишку 2-амінонорборнан-2-карбонової кислоти, їхніх солей, їхніх солей четвертинного амонію, утворених з ациклічних або циклічних третинних амінів, та їхніх сольватів. Серед сполук за формулою (Іу) перевага віддається таким, в яких: - R1 є такий, як визначено для формули (І), і знаходиться у положенні 4 або 5; - R2 знаходиться у положенні 2 і означає групу, вибрану з:водню, (С1-С6)алкілу, (С3-С8)циклоалкілу, (С3С8)циклоалкілметилу, (С1-С6)алкокси, (С3-С8)циклоалкiлокси, хлору, трифторметилу; - R3 знаходиться в положенні 3 і означає водень, (С1-С6)алкіл, (С3-С8)циклоалкіл, (С3-С8)циклоалкілметил; - або R2 і R3 разом утворюють триметилен, тетраметилен або пентаметилен; їхнім солям і їхнім солям четвертинного амонію, утвореним з ациклічних або циклічних третинних амінів, та їхнім сольватам. Особлива перевага віддається сполукам за формулою де: - R1, R2 , R3 означають відповідно R1p, R2p, R3p, як визначено вище для формули (Ір); - R'4y означає груп у (С1-С4)алкіл або циклопропілметил; і - група -NH-AA' y-(OH) означає залишок 2-аміноадамантан-2-карбонової кислоти, або (S)-aаміноциклогексаноцтової кислоти, або 9-амінонорборнан-2-карбонової кислоти. Серед сполук за формулою (Іу’) перевага віддається таким, в яких: - R1 означає R1p, як визначено для формули (І), і знаходиться у положенні 4 або 5; - R2 знаходиться у положенні 2 і означає групу, вибрану з:водню, (С1-С6)алкілу, (С3-С8)циклоалкілу, (С1С6)алкокси, хлору, трифторметилу; - R3 знаходиться в положенні 3 і означає водень або (С1-С6)алкіл; - або R2 і R3 разом утворюють триметилен, тетраметилен або пентаметилен; і їхнім солям. Найбільша перевага віддається сполукам за формулою де: - R4y і NH-AAy(OH) є такі, як визначено вище для формули (Іу); - R1x знаходиться у положенні 4 або 5 і означає групу, вибрану з:-T-CONRaRb, -SO2NRaRb, -T-NR5R6 , N(R7)COR e, -ORd, -N(R7)SO2R’7, -T-NR27R28; групи -Τ-, R a, R b, Rd , Re, R5, R6, R7 , R’7, R27 et R28 , є такі, як визначено вище для формули (І); - R2X i R3X кожний незалежно означає водень, (С1-С6)алкіл, (С3-С8)циклоалкіл, (С3-С8)циклоалкілметил, за умови, що R2X і R 3x не є одночасно воднем, - або R2x і R3x разом утворюють тетраметиленову груп у; їхнім солям і їхнім солям четвертинного амонію, утвореним з ациклічних або циклічних третинних амінів, та їхнім сольватам. Серед сполук, що виражаються формулою (Iх), перевага віддається таким, що визначаються формулою (I’х): де: - R'4y означає (С1-С6)алкілову або циклопропілметилову груп у і NH-AA' y(OH) є така, як визначено вище для формули (Іу’); - R'1x означає груп у, вибрану з:-T-CONR aRb, -SO2NRaRb, -Y-NR 5R6, -N(R7)COR e, -OR d ; групи -Τ-, NR aRb, Rd , Re, R5, R6, R7 є такі, як визначено вище для формули (Ір); - R'2x означає (С1-С6)алкіл, (С3-С8)циклоалкіл; - R'3x означає водень або (С1-С6)алкіл; - або R'2x і R'3x разом утворюють те траметиленову гр упу; і їхнім солям. Серед сполук за формулою (Іу) краща група складається зі сполук, які виражаються формулою де R4y, R1x і NH-AAy(OH) є такими, як визначено вище, і в кращому варіанті означають R'4y, R1p і NHAA' y(OH), визначені для формули (Іу’); їхні х солей, їхніх солей четвертинного амонію, утворених з ациклічних або циклічних третинних амінів, та їхні х сольватів. Особлива перевага віддається сполукам, які виражаються наступною формулою де: - R1X, R2X і R3X є такими, як визначено для формули (Iх), і краще, якщо є такими як R’1X, R’2X і R’3X, визначені для формули (Iх’), де краще, якщо R'1x знаходиться у пара-положенні; їхнім солям, їхнім солям четвертинного амонію, утвореним з ациклічних або циклічних третинних амінів, та їхнім сольватам. Винахід стосується переважно 2-[5-(2,6-диметоксифент}-1-[4-[N-метил-N-(3диметиламінопропіл)карбамоїл]-2-ізопропілфеніл]піразол-3-ілкарбоніламіно]-2-адамантанкарбонової кислоти, її вн утрішньої солі, її солей, бажано фармацевтично прийнятних, і її сольватів. Винахід стосується також способу одержання заміщених 1-фенілпіразол-3-карбоксамідів за формулою (І) і їхні х солей, який відрізняється тим, що 1) функціональну похідну 1-фенілпіразол-3-карбонової кислоти за формулою або де R1 R2, R 3 і R4 є такі, як визначено для сполуки за формулою (І), і R'1 є попередник R1 який вибирається з таких груп:нітро, аміно, фталімідо, галогено, гідрокси, сульфо, гідрокси(С1-С7)алкілен 1 ціано, карбокси, (С1С4)алкоксикарбоніл і бензилоксикарбоніл, піддають обробці амінокислотою, необов'язково захищеною захисними групами, які зазвичай застосовуються у пептидному синтезі, за формулою (III) H-HN-AA(OH) (III), де -NH-AA(OH) є такою, як визначено вище для сполуки за формулою (І); 2) при необхідності, одержану таким чином функціональну кислотну похідну формули піддають наступній відповідній обробці для перетворення замісника R’1, який є попередником R1 у замісник R1; 3) при можливості, сполуку, одержану таким чином на етапі 1) або на етапі 2) піддають депротекційній обробці з одержанням відповідної вільної кислоти за формулою (I); 4) при необхідності, виготовляють сіль одержаної таким чином сполуки (І) або її сіль четвертинного амонію. У якості функціональної похідної заміщеної 1-фенілпіразол-3-карбонової кислоти за формулою (II) або (II’) можна використовувати хлорид цієї кислоти, її ангідрид, змішаний ангідрид, С1-С4 алкіловий естер, активований естер, наприклад, р-нітрофеніловий естер, або вільну кислоту, активовану відповідним чином, наприклад, N,Nдициклогексилкарбодіімідом чи бензотріазол-1-ілокси-тріс-(диметиламіно)фосфонійгексафторфосфатом (БОФ). Амінокислоти за формулою (III) можна використовувати як в їхньому первинному стані, так і після попередньої захисної обробки карбоксильної групи захисними групами, які зазвичай застосовуються у пептидному синтезі, як описано, наприклад, в (Protective Groups in Organic Chemistry, Ed. J.F.W. McOmie, Plenum Press, 1973, page 183) або в (Protective Groups in Organic Chemistry, II Ed. J.F.W. Greene and P.G.M. Wuts, John Wiley & Sons, 1991, page 224). Для цього захисту карбоксильна група амінокислоти (III) може бути доволі просто естерифікована, наприклад, у форму метилового, бензилового або mpem-бутилового естеру з наступним видаленням естерифікуючої групи шляхом кислотного або основного гідролізу або гідрогенолізу. Захист шляхом естерифікації може бути використаний тільки, якщо група R1 або R'1 також сама по собі не містить ні естерної групи, яка повинна бути захищена, як, наприклад, тоді, коли R1 повинен означати групу O-Y-COOR7 або -Y COOR7 або -T-CONR7CHR20COOR7 або -T-CONR7(CH2)4CH(NH2)CO2R7, де R7 = алкіл, ні ніяким чином групи, яка може бути задіяна під час розблокування естерної групи. Захист карбоксильної групи амінокислоти (III) може бути виконаний також силіціюванням, наприклад, біс(триметилсиліл)ацетамідом, що може бути здійснено in situ. Після цього силіловий естер сполуки (I) може бути легко видалений під час відділення кінцевого продукту простою ацидифікацією, гідролізом або обміну зі спиртом. Таким чином, на етапі 1) процесу хлорангідрид 1-фенілпіразол-3-карбонової кислоти, одержаний шляхом реакції хлориду тіонілу з кислотою, яка виражається формулою (II) або (II’), може бути підданий реакції з амінокислотою за формулою (III) у розчиннику, такому як ацетонітрил, тетрагідрофуран, диметилформамід або дихлорметан в інертній атмосфері при кімнатній температурі на протязі часу від кількох годин до кількох днів, при наявності основи, такої як піридин, гідроксид натрію або триетиламін. Один із варіантів етапу 1) полягає у тому, що готують хлорангідрид або змішаний ангідрид 1-фенілпіразол3-карбонової кислоти шляхом реакції хлорформіату ізобутилу або етилу з кислотою за формулою (II) або (II’) при наявності основи, такої як триетиламін, і одержаний продукт піддають реакції з Ν,Ο-бістриметилсиліловою похідною амінокислоти за формулою (III), одержаною шляхом реакції біс(триметилсиліл)ацетаміду, або 1.3біс(триметилсиліл)сечовини, або біс(трифторметилсиліл)ацетаміду з амінокислотою за формулою (III) у розчиннику, такому як ацетонітрил і дихлометан, в інертній атмосфері на протязі часу від 1 години до кількох днів при температурі від кімнатної до температури дефлегмації розчинника. Інший варіант процесу на етапі 1) полягає у тому, що піддають реакції змішаний ангідрид 1-фенілпіразол3-карбонової кислоти за формулою (II) або (ІI’) з амінокислотою за формулою (III) у розчиннику, такому як дихлорметан, в інертній атмосфері при кімнатній температурі на протязі часу від 1 дня до кількох днів при наявності основи, такої як триетиламін. Якщо сполука за формулою (І) володіє основною функцією і одержується у формі вільної основи, то солеутворення здійснюється шляхом обробки вибраною кислотою в органічному або водному розчиннику. Внаслідок обробки вільної основи, розчиненої, наприклад, у спирті, такому як ізопропанол, розчином відповідної кислоти у тому ж самому розчиннику, одержують відповідну сіль, яку відділяють стандартними методами. Таким шляхом одержують, наприклад, гідрохлорид, гідробромід, сульфат, гідросульфа т, дигідрофосфат, метансульфонат, метилсульфат, оксалат, малеат, фумарат, 2-нафталінсульфонат. Якщо сполука за формулою (І) володіє основною функцією і відділяється у формі однієї з її солей, наприклад, у формі гідрохлориду або оксалату, то вільна основа може бути одержана шляхом нейтралізації цієї солі неорганічною або органічною основою, такою як гідроксид натрію, або триетиламін, або карбонатом чи бікарбонатом лужного металу, таким як карбонат чи бікарбонат натрію або калію. Якщо продукт за формулою (І) одержують у формі кислоти, то його можна перетворити стандартним способом на сіль металу і, зокрема, на сіль лужного металу, таку як сіль натрію або сіль лужноземельного металу, таку як сіль кальцію. Сполуки за формулою (І) або (I’) можуть бути піддані дегідратації при наявності ангідриду, наприклад, оцтового ангідриду з утворенням похідної оксазолону за формулою або де R1, R'1 R2, R3, R4, Ха і Х' а є такі, як визначено вище для формули (І), a R’1 є попередником R1, як визначено вище. Ці сполуки є новими і становлять ще один об'єкт винаходу. Серед сполук за формулами (Іс) і (I’c) перевага віддається тим, в яких Ха і Х'а разом з атомом вуглецю, з яким вони зв'язані, утворюють адамантановий цикл або біцикло[3.3,1]нонан, або в яких Ха означає водень, а Х' а означає циклогексан. Із сполуки за формулою (I’c) або (Іс) сполуку за формулою (І) або (I’) одержують також шляхом гідролізу в кислотному або основному середовищі, наприклад, при наявності солі лужного металу, такi, як mpem-бутилат калію. Проміжне одержання сполуки за формулою (Іс) може бути корисним тим, що дозволяє здійснювати очищення сполуки за формулою (І). Крім того, проміжне одержання сполуки за формулою (Ге) може бути корисним тим, що дозволяє перетворювати замісник R'1 на інший замісник R’1 або R1 причому кислотна функція групи NHAA(OH) зостається захищеною в оксазолоновій групі. Заміщені 1-фенілпіразол-3-карбонові кислоти за формулою або де R1 R2, R3 і R4 є такі, як визначено вище для сполук за формулою (І), a R’1 є попередником R1, який вибирають з таких груп:галогено, нітро, зміно, фталіміде гідрокси, пдрокси(С1-С7)алкілену, сульфо, ціано, карбокси, (С1-С4)алкоксикарбонілу і бензилоксикарбонілу, а також їхні функціональні похідні кислотної функції є ключовими проміжними продуктами у одержанні сполук за формулою (І). Якщо R’1 не є карбокси або галогено, то сполуки за формулами (II) і (ІI’) є новими і становлять подальший об'єкт даного винаходу. Щодо проміжних продуктів, особливу перевагу віддають кислотам за формулами (II) і (ІI’), хлорангідридам кислот за формулами (II) і (ІI’), (С1-С4)алкіловим естерам кислот за формулами (II) і (ІI’), які також можуть бути попередниками даних кислот (зокрема, метиловий, етиловий і mpem-бутиловий естери), і змішаним ангідридам кислот за формулами (II) і (ІI’) з хлорформіатом ізобутилу або етилу. Спосіб виготовлення сполук за формулами (II) або (ІI’) з проміжними естерами (IIа) або (ІI’а) представлений наступною схемою: На першому етапі а) сильна основа, така, як алкоголят металу, реагує з кетоном за формулою 1, де R4 такий самий, як визначено вище, а далі (етап b) еквімолярна кількість етилоксалату у спирті, такому, як, наприклад, метанол або етанол, реагує згідно з [L.CIaisen, Веr., 1909, 42, 59]. Після преципітації в етері, наприклад, етиловому або ізопропіловому, відділяють шляхом фільтрації еноляти 2. Можливо також виготовляти енолят літію згідно з [W.V.Murray et al., J. Heterocyclic Chem., 1989, 26, 1389]. Одержаний таким чином енолят 2 металу і похідну 3 фенілгідразину або його сіль піддають далі нагріву до дефлегмації оцтової кислоти (етап с), внаслідок чого утворюються естери IIа або ІI’а. Після омилювання естерів IIа або ІI’а дією лужного агенту, такого, як гідроксид калію, гидроксид натрію або гідроксид літію з наступним підкисленням, одержують кислоти II або II" (етап d). Деякі зі сполук за формулою 3 є новими і становлять ще один об'єкт даного винаходу. Таким чином, сполуки, що виражаються формулою де: - R'2 і R'3 кожний незалежно означає водень, (С1-С6)алкіл, (С3-С8)циклоалкіл, (С3-С8)циклоалкілметил; - або R'2 і R'3 разом утворюють триметиленову, те траметиленову або пентаметиленову груп у; - Ry знаходиться у положенні 4 або 5 і означає групу, яка вибирається з:ціано, карбокси, (С1С4)алкоксикарбонілу, бензилоксикарбонілу, сульфо, (С1-С4)алкілcульфоніламіно, (С1С4)алкілфенілсульфоніламіно, карбамоїлу, (С 1-С4)алкілкарбоксамідо; за умови, що R'2 і R'3 водночас не означають водень, і за умови, що R'2 не є метилом, коли Ry є сульфогр упою; і їхні солі є новими і становлять подальший об'єкт даного винаходу. Похідні феніл гідразину (3) можна виготовити згідно з [Houben-Weyl, 1967, Х-2, 169]. Наприклад, можна провести діазотування відповідного феніламіну при наявності нітриту натрію з наступним відновленням солі діазонію, наприклад, дією хлориду свинцю. Якщо феніл містить електроноакцепторний замісник, такий як ціано- або нітрогрупа, то похідна фторфенілу також може бути заміщена гідратом гідразину з одержанням відповідної гідразинфенілової похідної. Заміщені феніламіни, як і способи їх виготовлення, відомі для фахівців у даній галузі. Наприклад, аміносульфокислоти виготовляють способами, описаними в [Houben-Weil, Methoden der Organischen Chemie. Verlag, 1955, vol. IX, 450]. Похідні фенілгідразину, заміщені групою R1=YCO2R7, виготовляють із відповідних похідних аніліну або нітрофенілу. Перетворення однієї зі сполук за формулою I’ або, відповідно, за формулою ІI’, або ІI’а, де фенільна група заміщена R’1, у сполуку за формулою І, або відповідно за формулою II, або за формулою IIа, де фенільна група заміщується R1, здійснюється стандартними способами, добре відомими фахівцям у даній галузі. Сполуки за формулами IIа або ІI’а, де R1 або R’1 означають групу карбокси або карбокси(С 1-С7)алкілен, дозволяють одержувати сполуки за формулою IIа, де R1 означає групу –TCONRaRb, шляхом реакції аміну HNRaRb з хлорангідридом кислоти, одержаним на проміжній стадії, або з будь якою іншою активованою похідною цієї кислоти, такою, як змішаний ангідрид, активований естер або похідні, одержані з використанням 1,3-діциклогексилкарбодііміду. Таким самим шляхом сполуки за формулою I’, де R’1 означає групу -ТСООН, дозволяють одержувати сполуки за формулою І, де R1 означає групу - TCONRaRb; при цьому на проміжній стадії повинна бути захищена карбокислотна функція амінокислотного залишку NHAA(OH), наприклад, естерною групою, такою, як mpem-бутиловий естер, або утворенням оксазолонової похідної за формулою (Іс). Із сполуки за формулою І або відповідно Іс, або відповідно з естеру за формулою IIа, або відповідно із лужної солі кислоти за формулою II, де у цих сполуках замісник R 1 означає групу TCONH(CH2)sCR7R8(CH2)tNR5R6, можна дією йодидом за формулою R9I виготовляти сполуку за формулою І або, відповідно, за формулою Іс, або, відповідно, за формулою На, або, відповідно, лужну сіль кислоти за формулою II, де у ци х сполуках замісник R1 означає груп у -TCONHR 9(CH2)sCR7R8(CH2)tNR5R6. Сполуки за формулою IIа або відповідно за формулою II, або відповідно за формулою Іс, де R1 означає карбокси(С 1-С7)алкіленову груп у, дозволяють одержувати сполуки за формулою На або відповідно за формулою II, або відповідно за формулою І, де R1 означає групу -TCONR7RC шляхом реакції одержаного на проміжній стадії хлорангідриду кислоти зі сполукою NHR7RC, тобто зі сполукою за формулою NHR7XOR7 , або сполукою за формулою HNR7CHR20CO2R7, або зі сполукою за формулою HNR7(CH2)4CH(NHPro)CO2R7, де Pro означає групу захисту амінової функції, наприклад, mpem-бутоксикарбоніл або бензилоксикарбоніл, яка зазвичай використовується у галузі хімії пептидів. Шляхом реакції сполук за формулою І, де R1 представляє груп у -CH2CONH2, з пероксидом натрію одержують сполуки за формулою І, де R1 представляє карбоксиметилову гр упу. Шля хом відновлення сполук за формулою І, де R1 представляє групу CH2CN, наприклад, шляхом гідрогенізації при наявності каталізатора, такого як нікель Ренея (RaneyÒ), одержують сполуки за формулою І, де R1 представляє гр упу - CH2CH2NH2. Останні з цих сполук дозволяють одержувати сполуки за формулою I, де R1 представляє груп у -CH2CH2NR5R6, груп у -CH2CH2N(R7)COR e або гр упу -CH2CH2N(R7)SO2R'7 за допомогою способів, добре відомих фа хівцям у даній галузі. Подібним чином, сполуки за формулою (І), де R1 представляє групу –T’-CN, де T’ - прямий зв'язок або (С1С6)алкілен, дозволяють одержувати сполуки за формулою І, де R1 представляє групу -T'-CH 2NH2, і далі сполуки за формулою І, де R1 означає групу –Т’-CH2NR6R6, гр уп у -T'-CH2N(R7)COR e або гр упу –T’CH2N(R7)SO2R7. Каталітичне відновлення може здійснюватися згідно з [Catalytic Hydrogenation, R.L.Augustine, Marcel Dekker, 1967, 96-97]. Його можна застосовувати до сполук за формулою І, де R 2 і R3 не є нітро- або ціаногрупою, a R4 не є (С3-С4)алкенілом. Заміщення аміногрупи може здійснюватися за різними методами, описаними, наприклад, в [Catalytic Hydrogenation, R.L.Augustine, Marcel Dekker, 1965, 102-113] і [Catalytic Hydrogenation over Platinum Metals, P.N.Rylander. -Academic Press, 1967, 291]. Таким чином, наприклад, добавлення альдегіду за формулою RvCHO до аміногрупи дає іміногрупу, яка після каталітичної гідрогенізації перетворюється на вторинний амін -NHCH2Rv, де Rv означає водень або (С1-С3)алкіл. Добавка кетону за формулою RCOR' дає амін -NHCHRR', де –CHRR’ представляє групу R5, a R6 означає водень. Добавлення (С1-С4)алкілгалогеніду також дозволяє одержувати аміногрупу, заміщену одним або двома (С1-С4)алкілами. Добавлення відповідного дигалогеніду дозволяє одержати сполуки, в яких R5 і R6 разом з атомом азоту, з яким вони зв'язані, утворюють гетероцикл, який вибирають з піролідину, піперидину, морфоліну, тіоморфоліну і піперазину, заміщенного R9 у положенні 4, азиридіну, азетидіну або пергідроазепіну. Сполуки за формулою IIа, де R1 представляє групу -T-NHSO2R'7 дозволяють одержувати сполуки за формулою ІI’а, де R1 представляє групу -T-N(XNR 5R6)SO 2R’7, Дією галогеніду за формулою HalXNR5R6. Далі у кислому середовищі можна одержати сполуки за формулою II, де R 1 є гр упою -TNHXNR5R6, яка представляє TNHR28. Для одержання сполук за формулою І, де R1 представляє гр упу -TNHR27R28, відомими способами проводиться заміщення азоту у сполуках за формулою II або у сполуках за формулою І. Сполуки за формулою ІI’а або відповідно за формулою ІI’, або за формулою I’, де R'1 представляє нітрогрупу, можуть бути трансформовані у сполуки за формулою ІI’а, або відповідно за формулою ІI’, або за формулою I’, де R'1 представляє аміногрупу. Далі відомими способами одержують сполуки за формулою IIа, або відповідно за формулою II, або за формулою І, де R 1 представляє груп у -N(R7)COR e aбо NR5R6. Сполуки за формулою ІI’а або відповідно за формулою ІI’, або за формулою I’, де R'1 представляє аміногрупу, дозволяють також одержувати сполуки за формулою ІI’а, або відповідно за формулою ІI’, або за формулою I’, де R'1 представляє гідроксильну груп у. Далі відомими способами одержують сполуки за формулою IIа, або відповідно за формулою II, або за формулою І, де R1 представляє гр упу -ORd . Зі сполук за формулою ІI’а, де R'1 означає групу -Y-OH, дією на них соляної кислоти або тіонілхлориду можна одержувати сполуки за формулою ІI’а, де R1 означає групу -Y-CI. Використовуючи дію по хідної сульфокислоти на ці самі сполуки, що несуть замісник -Y-OH, можуть бути одержані сполуки за формулою ІI’а, де R'1 означає групу -Y-OSO 2W, де W представляє метил, трифторметил або толіл. Використовуючи дію аміну NHR5R6 на сполуки за формулою ІI’а, заміщені групою -Y-CI або гр упою -Y-OSO2 W, можна одержувати сполуки за формулою IIа, де R1 представляє групу -Y-NHR 5R6. Якщо R2 означає нітро- або ціаногрупу, і R3 - водень, то дією сполуки RdOH в основному середовищі на сполуку за формулою ІI’а або відповідно за формулою ІI’, або відповідно за формулою I’, де R'1 означає галоген в орто- або пара-положенні відносно R2, можна одержувати сполуки за формулою IIа, або відповідно за формулою II, або відповідно за формулою І, де R1 є гр упою -ORd. Якщо R2 і R3 не є атомом галогену, то реакцією сполуки за формулою ІI’а, або відповідно за формулою ІI’, або відповідно за формулою I’ з ціанідною похідною, наприклад, з ціанідом міді, можна одержувати також сполуку за формулою IIа, або відповідно за формулою II, або відповідно за формулою І, де R1 є ціаногрупою. Сполуки за формулою І, де R1 означає ціаногрупу, дозволяють одержувати сполуки за формулою І, де R 1 означає карбамоїльну груп у, шля хом реакції з пероксидом водню при наявності основи, такої як гідрокарбонат натрію. Так само одержують сполуки за формулою II, де R1 означає карбамоїльну груп у, зі сполук за формулою IIа, де R1 означає ціаногрупу.Сполуки за формулою І, де R1 означає ціаногрупу, також можна одержувати, реакцією сполук за формулою І, де R1 представляє груп у -C(NH2)=NOH або груп у -C(NH2)=NO(CH 2)rNR5R6, з гідроксиламіном, який у разі необхідності може бути О-заміщений на -(CH2)q NR5R6, при наявності основи, такої, як карбонат калію. Із сполук за формулою На або відповідно за формулою II, або відповідно за формулою І, де R 1 представляє групу -C(NH2)=NOH, згідно з [Chem. Ber., 1970, 103, 2330-2335] одержують сполуки за формулою На, або відповідно за формулою II, або відповідно за формулою І, де Ri представляє груп у C(=NOH)NH(CH2)rNR5R6. Шляхом відновлення сполук за формулою IIа, або відповідно за формулою II, або за формулою І, де R 1 означає ціаногрупу, шля хом, наприклад, гідрогенізації при наявності каталізатора, такого, як оксид платини, і наступної реакції з хлорангідридом кислоти або відповідним ангідридом, або хлоридом сульфонілу, одержують сполуки за формулою II або відповідно за формулою II, або за формулою І, де R1 представляє груп у -CH2NHCOR16 або відповідно -CH2NHSO2R'7. Подібним чином, шляхом реакції алкілювання на аміді, що одержується на проміжному етапі, одержують сполуки за формулою На або відповідно за формулою II, або за формулою І, де R1 представляє груп у -CH2N(R7)COR 16 або груп у -CH 2N(R7)SO 2R'7, де R7 не означає водень. Якщо гідрогенізація сполуки за формулою ІI’а або відповідно за формулою ІI’, або відповідно за формулою I’, де R1 означає ціаногрупу, здійснюється при наявності аміну NHR5R6, то одержують сполуку за формулою І або відповідно за формулою II, або відповідно за формулою IIа, де R' 1 представляє гр упу CH2NR5R6. Реакція сполук за формулою І, де R 1 представляє групу -TCN або -Т-CON(R7)(CH2)qCN, або групу -TN(R7)CO(CH2)q CN, або групу -SO2N(R7)(CH2)q CN, з соляною кислотою у спиртовому розчині AlkOH дозволяє одержувати на проміжній стадії відповідні імідати за формулами; -T-C(=NH)OAIk, -T-CONR 7(CH2)q C(=NH)OAlk, -T-N(R7)CO(CH2)q C(-NH)OAIk або -SO 2-N(R7)(CH2)q C(=NH)OAIk, де АІк є (С1-С4)алкілом. Якщо імідат піддають реакції з еквімолярною кількістю аміну NHR12R13, то одержують сполуки за формулою І, де R1 представляє: груп у -TC(NR12R13)=NR14; груп у -TCON(R7)(CH2)q C(NR12R13)=NR14 або груп у -TN(R7)CO(CH2)q C(NR12R13)=NR14 або груп у -SO 2N(R7)(CH2)q C(NR12R13)=NR14. де R14 = Η. Якщо імідат піддають реакції з надлишком аміну NH2R13, де R13 не є воднем, то одержують сполуки за формулою І, де R1 представляє: груп у -TC(NHR13)=NR13; груп у -TCON(R7)(CH2)q C(NHR13)=N-R13 або груп у -TN(R7)CO(CH2)q C(NHR13)=NR13 або груп у -SO 2N(R7)(CH2)q C(NHR13)=NR13. Якщо імідат піддають реакції з діаміном за формулою H2N-Z-NHR12, то одержують сполуки за формулою І, де R1 представляє: груп у -TC(NR12R13)=NR14; груп у -TCON(R7)(CH2)q C(NR12R13)=N-R14 або груп у -TN(R7)CO(CH2)q C(NR12R13)=NR14 або груп у -SO 2N(R7)(CH2)q C(NR12R13)=NR14, де R13 і R14 разом утворюють груп у (С2-С6)алкілену, a R12 означає водень або (С1-С4)алкіл. Сполука за формулою (І), де R1 містить радикал амідіно, може бути також одержана за способами, описаними в [The Chemistry of amidines and imidates, Saul Patai, 1975, John Wiley and Sons]. Із сполук за формулою І або відповідно за формулою II або IIа, де R 1 представляє групу TCONR7(CH2)q CN, одержують за допомогою відомих реакцій сполуки за формулою І або відповідно II або IIа, де R1 представляє групу -TCONR7(CH2)qCONH2, або груп у -TCONR 7(CH2)q CO2R7. Якщо R'1=SO3H, то одержують сполуку за формулою ІI’а, де R'1 = SO2CI, яка далі під дією відповідного аміну HNRaRb перетворюється на іншу сполуку IIа, де R1 означає можливо заміщену аміносульфонільну груп у. Сполуки за формулою І, які містять групу четвертинного амонію, одержують із відповідних аміносполук реакцією зі сполукою за формулою QR24 , де Q є аніон, наприклад, йодид. Амінокислоти за формулою III включають, наприклад, гліцин, аланін, лейцин, норлейцин, ізолейцин, валін, 1-адамантилгліцин, 2-адамантилгліцин, циклопропілгліцин, циклопентилгліцин, циклогексилгліцин, циклогептилгліцин, 1-аміноциклопропанкарбонову кислоту, 1-аміноциклобутанкарбонову кислоту, 1аміноциклопентанкарбонову кислоту, 1-аміноциклогексанкарбонову кислоту, 1-аміноциклогептанкарбонову кислоту, 1-аміно-4-метилциклогесанкарбонову кислоту, 2-аміноадамантан-2-карбонову кислоту, 2амінобіцикло[3.2.1]октан-2-карбонову кислоту, 9-амінобіцикло[3.3.1]нонан-9-карбонову кислоту і 2амінобіцикло[2.2.1]гептан-2-карбонову кислоту або 2-аміно-2-норборнанкарбонову кислоту. Амінокислоти за формулою III є комерційними продуктами або можуть бути легко виготовлені за стандартними способами. Щодо некомерційних амінокислот (III), то їх одержують синтезом способами, описаними в [Strecker, Ann., 1850, 75, 27] або в [Н.Т. Bucherer et al., J. Pract. Chem., 1934, 141, 5], з наступним гідролізом. Наприклад, 2-аміноадамантан-2-карбонову кислоту і 9-амінобіцикло[3.3.1]нонан-9-карбонову кислоту одержують способом [Н.Т. Nagasawa et al., J. Med. Chem., 1973, 16 (7), 823]. a-Аміно-1-адамантилоцтову кислоту і а-аміно-2-адамантилоцтову кислоту одержують способом, описаним в [В. Gaspert et al., Croatica Chemica Acta, 1976, 48 (2), 169-178]. 2-Аміно-2-норборнанкарбонову кислоту одержують способом, описаним в [H.S. Tager et al., J. Am. Chem. Soc, 1972, 94, 968]. a-Аміноциклоалкілкарбонові кислоти одержують способом, описаним в [J.W. Tsang et al., J. Med. Chem., 1984, 27, 1663]. R- і S-циклопентилгліцини одержують способом, описаним у заявці на європейський патент ЕР 477049. R- і S-циклогексилгліцини одержують способом, описаним в [Rudman et al., J. Am. Chem. Soc, 1952,74,551]. R- і S-циклогексилгліцини можна одержувати також шляхом каталітичної гідрогенізації R- і S-фенілгліцинів. a-Аміноциклоалкілкарбонові кислоти R- або S-конфігурації можна одержувати також стереоспецифічним ферментативним гідролізом відповідних рацемічних N-ацетилових похідних згідно з [J. Hill et a!., J. Org, Chem., 1965, 1321]. Сполуки за формулою (І) і їхні солі проявляють дуже велику спорідненість до рецепторів нейротензину людини в дослідах, описаних в [D. Gully et al. in Proc. Natl. Acad. Sci. USA, 1993, 90, 65-69]. Сполуки за формулою (І) і їхні солі були досліджені in vivo. Методика, описана в [М. Poncelet et al. in Naunyn Schmiedberg's Arch. Pharmacol., 1994, 60, 349-351], дозволяє спостерігати, що сполуки, запропоновані даним винаходом, при їх вн утрішньому введенні запобігають контралатеральному обертанню у мишей, яке викликається односторонньою інтрастріатальною ін'єкцією нейротензину. Крім того, досліди на морських свинках, проведені за методикою, описаною в [D. Nisato et al. in Life Sciences, 1994, 54, 7, 95-100], показали, що сполука за винаходом, введена внутрішньовенно, гальмує ріст кров'яного тиску, викликаний внутрішньовенною ін'єкцією нейротензину в ци х тваринах. Сполуки, описані в патенті ЕР 0477049, виказують в цих дослідах меншу активність проти сполук, запропонованих даним винаходом. Сполуки за винаходом мають низьку токсичність; зокрема їхня гостра токсичність узгоджується з використанням їх у якості медичного продукту. Для такого використання при лікуванні нейротензин-залежних патологій ссавцям вводять ефективну кількість сполуки за формулою І або однієї з її фармацевтичне прийнятних солей. Таким чином, запропоновані сполуки можна використовувати для лікування нейропсихіатричних розладів і, зокрема, таких, які пов'язані з порушенням функції допамінергічних систем, тобто психозів і, зокрема, шизофренії, і захворювань на рух, таких, як хвороба Паркінсона [D.R. Handrich et al., Brain Research, 1982, 231, 216-221; СВ. Nemeroff, Biological Psychiatry, 1980, 15 (2), 283-302]. Ці сполуки можна застосовувати в діагностиці і/або лікуванні ракових неопластичних хвороб, наприклад, менінгіом людини, які є недоступні для хірургії [P. Mailleux, Peptides, 1990, 11, 1245-1253], раку простати [І. Sehgal et al., Proc. Nat. Acad. Sci., 1994, 91, 4673-4677] і дрібноклітинного раку легенів [Т. Sethi et al., Cancer Res., 1991, 51, 36213623]. їх можна застосовувати для лікування моторних, секреторних, виразкових і/або пухлинних гастроінтестинальних розладів [огляд в A. Schulkes in «Gut Peptides:Biochemistry and Physiology, Ed. J. Waish and G.J. Dockray, 1994»]. Таким чином, сполуки І за винаходом можуть бути корисними при лікуванні таких захворювань, як подразнювальний синдром шлунку, діарея, коліт, виразки, пухлини гастроінтестинального тракту, диспепсія, панкреатит і езофагіт. Вони можуть також звертати на себе увагу як модулятори прийому страви [В. Beck, Metabolism, 1995, 44, 972-975]. Запропоновані винаходом сполуки можна призначати у якості діуретичних препаратів, а також у випадках серцево-судинних розладів, як і патологій, пов'язаних з вивільненням гістаміну, наприклад, при запальних процесах [D.E, Cochrane et al., Faseb J., 1994, 8, 7, 1195]. Ці сполуки можна застосовувати також при лікуванні певних розладів, викликаних стресом, таких як мігрені, неврогенний свербіж і інтерстиціальний цистит [Т.С. Theoharides et al., Endocrinol., 1995, 136, 5745-5750]. Сполуки за винаходом можна застосовувати також для аналгезії, де вони справляють дію морфію [М.О. Urban, J. Pharm. Exp. Then, 1993, 265, 2, 580-586]. Таким чином, об'єктом даного винаходу, відповідно до одного з інших його аспектів, є фармацевтичні композиції, які у якості активних компонентів містять сполуки за формулою І або їхні фармацевтично прийнятні солі. У фармацевтичних композиціях за винаходом для перорального, під'язикового, підшкірного, внутрішньом'язового, внутрішньовенного, трансдермального і ректального введення активні компоненти можуть вводитися тваринам і людям у формі одиниць лікарських препаратів як суміші або разом зі стандартними фармацевтичними носіями. Відповідні форми одиниць вживання включають у себе форми для перорального введення, такі як таблетки, желатинові капсули, порошки, гранули і оральні розчини або суспензії, форми для інгаляційного введення, форми для під'язикового і букального введення, форми для підшкірного, трансдермального, внутрішньом'язового або внутрішньовенного введення і форми для ректального введення. Доза активного компоненту, яка є потрібною для досягнення бажаного ефекту, може змінюватися у межах від 0,5 до 1000мг на день і краще у межах від 2 до 500мг. Кожна одинична доза може містити від 0,5 до 250мг активного компоненту і краще від 1 до 125мг його у комбінації з фармацевтичним носієм. Цю одиничну можна приймати від 1 до 4 раз на день. Якщо тверду композицію приготовляють у формі таблеток, то активний компонент змішують з фармацевтичним носієм, таким як желатин, крохмаль, лактоза, стеарат магнію, тальк, гуміарабік і под. Таблетки можна покривати цукрозою або іншими відповідними речовинами або піддавати їх обробці для підтримання або гальмування активності і безперервного вивільнення заданої кількості активного компоненту. Препарати у желатинових капсулах приготовляють шля хом змішування активного компоненту з розчинником і вливання одержаної суміші до м'яких або жорстких желатинових капсул. В препаратах у формі сиропу або еліксиру активний компонент може знаходитися разом з підсолоджуючою речовиною, бажано безколірною, метилпарабеном і пропілпарабеном у якості антисептика, а також смаковими коректорами і відповідними барвниками. Порошки або гранули, що диспергуються у воді, можуть містити активний компонент, змішаний з диспергуючими, зволожуючими, суспендуючими агентами, такими, як полівінілпіролідон і под., а також підсолоджуючими речовинами або смаковими коректорами. Для ректального введення вживають супозиторії, які приготовляють зі зв'язуючими агентами, що розтоплюються при ректальній температурі, наприклад, масло-какао або поліетиленгліколями. Для парентерального введення застосовують водні суспензії, Ізотонічні фармакологічні солеві розчини, а також стерильні і ін'єкційні розчини, які містять фармакологічно сумісні, диспергуючі і/або зволожуючі агенти, такі, наприклад, як пропиленгліколь або бутиленгліколь. Активний компонент можна приготовляти також у формі мікрокапсул, якщо потрібно, з одним і більше носіями або добавками. Для покращення розчинності продуктів за винаходом сполуки за формулою І або їхні фармацевтичне прийнятні солі можуть знаходитися також у формі комплексів з циклодекстринами. У поданому опису винаходу і прикладах застосовані наступні скорочення: МеОН:метанол EtOH:етанол Ефір:етиловий ефір Ізоефір:ізопропіловий ефір Солянокислий ефір:насичений розчин соляної кислоти в ефірі Солянокислий етанол:насичений розчин соляної кислоти в етанолі AcOEt:етилацетат у MeCN:ацетонітрил DCM:дихлорметан DMF:диметилформамід DMSO:диметилсульфоксид THF:тетрагідрофуран НСІ:соляна кислота H2SO4:сірчана кислота АсОН:оцтова кислота TFA:трифтороцтова кислота NaOH:гідроксид натрію КОН:гідроксид калію LiOH:гідроксид літію NH4OH:гідроксид амонію Na2SO4:сульфат натрію NaHCO3:гідрокарбонат натрію NaHSO3:гідросульфіт натрію Na2CO3:карбонат натрію К2СО3:карбонат калію Р2О5 :пентоксид фосфору NBS:N-бромсукцинімід РОСІ3:оксихлорид фосфору NaNO2:нітрит натрію SOCI2:хлорид тіонілу SnCI2:хлорид олова CuCN:ціанід міді Me, MeO:метил, метокси Et:етил ІРr:ізопропіл ІВu:ізобутил n-Bu:n-бутил t-Bu:mpem-бутил Bz:бензил т. пл.:температура плавлення КТ:кімнатна температура Силікагель Η:Силікагель 60 Η виробництва MERCK (Дармштадт) ЯМР:ядерний магнітний резонанс Якщо не зазначено іншого, спектри ЯМР знімали на частоті 200МГц у деитерованому диметилсульфоксиді DMSO-d6. Величини хімічного зсуву s виражено в мільйонних частках (м. ч.) відносно тетраметилсилану як внутрішнього еталону. s:синглет bs:розширений синглет ss:розщеплений синглет d:дублет dd:подвійний дублет t:триплет qr:квадруплет qt:квінтуплет sp:септуплет u.c.:нерозв'язаний комплекс mt:мультиплет Препарат 1.1 Натрієва сіль метил-4-(2,6-диметоксифеніл)-4-оксидо-2-оксобут-3-еноату (сполука А) Розчин 100г 2,6-диметоксіацетофенону і 7,5мл етилоксалату в 520мл безводного МеОН додали помалу до розчину метилату натрію, приготовленого із 12,7г натрію і 285мл безводного МеОН. Реакційну суміш гріли у стані дефлегмації на протязі 7 годин і залишили на ніч при КТ. Далі реакційну суміш влили до 2л ізопропілового ефіру і перемішали на протязі 15 хвилин. Після фільтрації, промивання ізопропіловим ефіром і просушування у вакуумі одержали продукт масою 120г з т. пл. = 178°С. Калійна сіль етил-4-(2,6-диметоксифеніл)-4-оксидо-2-оксобут-3-еноату (сполука Α1) Розчин 13,4г 95%-го mpem-бутилату калію в 72мл етанолу на протязі 6 хвилин додали до перемішаного і нагрітого до 50°С розчину 18г 2,6-диметоксіацетофенону у 54мл етанолу. С уміш гріли у стані дефлегмації, додали до неї на протязі 9 хвилин 16,3мл етилоксалату і піддали безперервній дефлегмації на протязі 1 години. Далі було дистильовано 40мл етанолу, а суміш залишили охолоджуватися на протязі двох з половиною годин. Потім суміш відфільтрували, а преципітат промили у 40мл етанолу і просушили у вакуумі при 60°С на протязі 17 годин. У результаті одержали 31г цільового продукту. ЯМР:1,2:t:3Н; 3,6:s:6Н; 4:mt:2Н; 5,5:s:1Н; 6,55:d:2Н; 7,1:t:1Н. Препарат 1.2 Натрієва сіль етил-4-[2-(циклопропілметилокси)-6-метоксифеніл]-4-оксидо-2-оксобут-3-еноату А) 2-(циклопропілметилокси)-6-метоксіацетофенон До розчину 26г 2-гідрокси-6-метоксіацетофенону у 400мл 2-пропанолу додали при кімнатній температурі 32,7мл 50% розчину гідроксиду цезію у воді, і суміш перемішували 15 хвилин при КТ. Далі її піддали концентрації у вакуумі, залишок вилучили 2-пропанолом, суміш концентрували у вакуумі, додали до неї толуол і знову піддали концентраційній обробці у вакуумі. Після цього залишок розчинили у 200мл DMF, додали 25,3г циклопропілметилброміду і утворену таким чином суміш витримали 2 години 30 хвилин при температурі 80°С. Далі її концентрували у вакуумі, залишок вилучили водою, суміш екстрагували AcOEt, органічну фазу промили насиченим розчином NaCI і просушили над Na2SO4 , і розчинник випарили у вакуумі. У результаті було одержано 32,7г цільового продукту. В) Натрієва сіль етил-4-[2-(циклопропілметилокси)-6-метоксифеніл]-4-оксидо-2-оксобут-3-еноату Розчин 32,6г сполуки, одержаної на попередньому етапі, і 20,1мл діетилоксалату у 100мл ЕtOН помалу додали до розчину етилату натрію, приготовленого із 3,4г натрію і 60мл ЕtOН. Суміш витримали на протязі ночі при температурі 60°С, залишили охолоджуватися до КТ і піддали концентрації у вакуумі. Залишок вилучили пентаном, а утворений преципітат декантували, промили пентаном й просушили у вакуумі. У результаті одержали 41,2г цільового продукту. ПРИГОТУВАННЯ ГІДРАЗИНІВ ЗА ФОРМУЛОЮ 3 Препарат 2.1 Гідрохлорид 3-ізопропіл-4-гідразинбензойної кислоти A) 2-ізопропілацетанілід Ця сполука описана в [Bull. Soc. Chim. France, 1949,144]. Суміш із 300мл толуолу і 31мл 2-ізопропіланіліну охолодили на льоду і до неї помалу додали 22мл оцтового ангідриду. Через 40 хвилин перемішування при КТ реакційну суміш випарили і залишок вилучили петролейним ефіром. Утворений преципітат декантували. Після кристалізації у петролейному ефірі було одержано 35,9г цільового продукту з т. пл. = 81°С. B) 4-бром-2-ізопропілацетанілід Ця сполука описана в [J. Med. Chem., 1974, 17 (2), 221]. Кілька крапель розчину 10,1мл брому у 180мл оцтової кислоти помалу додали до суміші, яка містила 34,8г одержаної на попередньому етапі сполуки у 250мл оцтової кислоти, і суміш нагріли до 50°С. Після охолодження знову додали кілька крапель розчину і суміш нагріли до 50°С. і так до кінця процесу додавання. Реакційне середовище поступово нагрівали до стану дефлегмації і далі залишили охолоджуватися на протязі ночі при КТ. Утворений преципітат відфільтрували і додали до розрідженого розчину NaHSO3. Далі продукт знову відфільтрували, промили водою і просушили над Р2О5. У результаті було одержано 27,4г цільового продукту з т. пл. = 134°С. Сполуку етапу В) можна також одержати наступним способом. В') 4-Бром-2-ізопропилацетанілід Приготували суміш із 117,6г 2-ізопропілацетаніліду і 330мл DMF. До цієї суміші на протязі 25 хвилин додали 117,6г NBS у 330мл DMF. Утворену суміш перемішували при КТ на протязі 5 годин і потім влили до 1,5л води при охолодженні реакційного середовища льодом. Преципітат, що утворився, відфільтрували, промили водою і просушили при 50°С у вакуумі. Фільтрат екстрагували (двічі) дихлорметаном, промили водою і просушили над Na2SO4. У результаті одержали другу фракцію цільового продукту. Очи щені фракції об'єднали одна з одною і у результаті одержали 158г цільового продукту з т. пл. = 134°С. C) 4-Ціано-2-ізопропілацетанілід Суміш із 26,48г продукту, одержаного на попередньому етапі, 60мл DMF, 1мл води і 10,25г ціаніду міді перемішали в умовах дефлегмації на протязі 10 годин. Після охолодження суміш влили до розчину із 50г ціаніду натрію у 150мл води при 40°С. Утворений преципітат відфільтрували і кілька раз промили водою. У результаті було одержано 16,7г цільового продукту з т.пл. = 134°С. D) Гідрохлорид 4-ціано-2-ізопропіланіліну 16,13г сполуки, одержаної на попередньому етапі, змішали з 65мл 100%-го етанолу і 40мл 1N соляної кислоти, і суміш перемішували в умовах де флегмації на протязі 19 годин. Далі суміш витримали на протязі однієї ночі при КТ і додали до неї 10%-й NaOH до отримання рН 10. Реакційне середовище дворазово екстрагували дихлорметаном, органічну фазу просушили над Na2SO4 і піддали концентрації у вакуумі. Залишок розрідили в ефірі і додали до нього солянокислий ефір. Утворений преципітат відфільтрували і промили ефіром. Було одержано 15,32г цільового продукту. Продукт кристалізувався у суміші Et2 O/HCI і мав т. пл. = 188°С. E) Гідрохлорид 4-аміно-3-ізопропілбензойної кислоти Ця сполука описана в [J. Med. Chem., 1974,17 (2), 221]. Суміш із 1г сполуки, одержаної на попередньому етапі, 2,86г роздрібненого гідроксиду калію, 6мл води і 0,5мл диметоксиметану гріли до стану дефлегмації на протязі 12 годин. Після охолодження до неї добавляли концентровану соляну кислоту до рН 1, і потім суміш двократно екстрагували дихлорметаном; органічну фазу просушили над Na2SO4 і концентрували. Було одержано 0,96г цільового продукту з т. пл. = 128°С. F) Гідрохлорид 3-ізопропіл-4-гідразинбензойної кислоти Суміш із 0,96г продукту, одержаного на попередньому етапі, 22мл концентрованої соляної кислоти і 20мл оцтової кислоти, охолодили до -5°С, додали до неї розчин 0,36г NaNO2 в 4мл води, і потім суміш перемішували при 0°С на протязі 1 години 15 хвилин. Далі суміш охолодили до -10°С і додали до неї 3,73г дигідрату хлориду олова у 4мл концентрованої соляної кислоти. Потім дали температурі зрости до 18°С, і утворений преципітат відфільтрували і промили 1мл розрідженої соляної кислоти. Після просушування над Р2О5 було одержано 0,96г цільового продукту. Препарат 2.1а Гідрохлорид 3-ізопропіл-4-гідразинбензойної кислоти можна одержати також способом, описаним нижче. A) 4-бром-2-ізопропілацетанілід 200мл оцтового ангідриду додали на протязі 10 хвилин до 300мл 2-ізопропіланіліну, підтримуючи при цьому температур у на рівні нижче 60°С. Через 45 хвилин перемішування при КТ до суміші додали розчин одного еквіваленту N-бромсукциніміду у 720мл DMF. Через 2 години перемішування суміш влили до 5,7л суміші води з AcOEt у співвідношенні 2:1 (об.), зцідили, і відділили органічну фазу, яку просушили над Na2SO4 і випарили у вакуумі. Залишок піддали затвердінню в ізопропіловому ефірі і відфільтрували, одержавши 367г цільового продукту. B) 4-ціано-2-ізопропілацетанілід 10,25г продукту, одержаного на етапі А), і 1,2 еквівалента ціаніду міді у 20мл DMF піддали нагрівали до стану дефле гмації на протязі 6 годин. Суміш охолодили до 20°С і влили до суміші із 200мл AcOEt і 200мл 20%-го гідроксиду амонію. Органічну фазу знову промили 50мл 20%-го гідроксиду амонію і потім дворазово промили насиченим розчином хлориду натрію. Після просушування над Na2SO4 суміш випарували у вакуумі, залишок піддали обробці ізопропіловим ефіром, відфільтрували і просушили при 40°С у вакуумі, отримавши у результаті 6,15г цільового продукту. Сполуку, одержану на етапі В), можна одержати також наступним способом. В’) При перемішуванні суміш із 22,16г продукту етапу А) і 0,6 еквіваленту ціаніду цинку в 67мл безводного DMF барботували аргоном. Суміш нагріли до 80°С і під захистом від світла додали до неї 2г тетракіс(трифенілфосфїн)паладію(0). Через 3 години перемішування при 80°С суміші дали охолонути до КТ і додали до неї 120мл 4%-го гідроксиду амонію і 200мл AcOEt. Комбіновані органічні фази знову промили 4%-м гідроксидом амонію. Далі їх просушили над Na2SO4, випарили у вакуумі, а залишок піддали обробці ізопропіловим ефіром, потім відфільтрували і просушили у вакуумі, отримавши 15г цільового нітрилу, C) Гідрохлорид 4-аміно-3-ізопропілбензойної кислоти Суміш із 100г продукту етапу В), 500мл концентрованої соляної кислоти і 500мл АсОН витримали у нагрітому до дефлегмації стані на протязі 10 годин. Далі її концентрували у вакуумі, а преципітат відфільтрували і просушили у вакуумі, отримавши у результаті 103,8г цільового продукту. D) Гідрохлорид 3-ізопропіл-4-гідразинбензойної кислоти Розчин 27,7г NaNO2 у 250мл води помалу додали до охолодженої до -5°С суміші 59г продукту етапу С) з 1050мл АсОН і 1420мл концентрованої соляної кислоти. Після 1 години 20 хвилин перемішування при 0°С суміш охолодили до -10°С і додали до неї розчин 236г SnCI2x2H2O у 250мл концентрованої НСІ. Температурі дали зрости до кімнатної, преципітат відфільтрували, промили концентрованою соляною кислотою і просушили у вакуумі, отримавши у результаті 56,36г цільового продукту. Препарат 2.2 Гідрохлорид 3-ізопропіл-4-гідразинбензолсульфокислоти А) 4-Аміно-3-ізопропілбензолсульфокислота 5,7мл H2SO4 додали до 10мл води, суміш нагріли до 80°С і додали до неї 13,5г 2-ізопропіланіліну. Воду випарили нагрівом у вакуумі, після чого температуру на протязі півтори години поступово підняли до 260°С. Через 3 години реакційному середовищу при перемішуванні у вакуумі дали повернутися до КТ і атмосферного тиску. Після цього з метою розрідження його гріли на протязі 30 хвилин у 15мл NaOH і 100мл води. Нерозчинну речовину відфільтрували, і суміш охолодили до 5°С і підкислили до рН 1 добавкою концентрованої H2SO4. Утворений преципітат відфільтрували, промили 5мл холодної води і просушили, отримавши 20г цільового продукту. ЯМР:1,1:d:6Н; 2,95:mt:1Н; 6,85:d:1Н; 7,45:dd:1Н; 7,6:d:1Н. В) Гідрохлорид 3-ізопропіл-4-гідразинбензолсульфокислоти До розчину 10г продукту, одержаного на попередньому етапі, в 10мл 30%-го NaOH і 20мл води додали 10мл льоду і 3,2г NaNO2. Розчин помалу влили до розчину із 30мл концентрованої соляної кислоти у 20мл води при температурі у межах від -5°С до -15°С. Суміш піддали перемішуванню на протязі 1 години при цій самій температурі, після чого до неї при температурі у межах від 0°С до -5°С додали 26г дигідрату хлориду олова у 20мл концентрованої соляної кислоти. Через дві з половиною години перемішування при КТ одержаний продукт відфільтрували і просушили у вакуумі при наявності Р2О5. У результаті було одержано 9,7г цільового продукту. ЯМР; 1,2:d:6Н; 3,15:mt:1Н; 6,8:d:1Н; 7,45:d:1Н; 7,55:s:1Н; 7,9:bs:1Н; 10:bs:3H. Препарат 2.3 Гідрохлорид 4-гідразино-5,6,7,8-тетрагідро-1-нафталінкарбонової кислоти A) 4-Аміно-5,6,7,8-тетрагідро-1-нафталінкарбонова кислота 4-Нітро-5,6,7,8-тетрагідро-1-нафталінкарбонова кислота описана в [Chem. Pharm. Bull., 1984, 32, 3968]. Була проведена гідрогенізація 1,48г цієї нітропохідної у метанолі при наявності нікелю РенеюÒ. Через 4 години перемішування каталізатор був відфільтрований, і суміш випарили до сухого стану, а залишок вилучили е фіром і відфільтрували, отримавши 1г цільового продукту з т. пл. = 180°С (розклад). B) Гідрохлорид 4-гідразино-5,6,7,8-тетрагідро-1-нафталінкарбонової кислоти Розчин 0,26г NaNO2 в 1мл води додали до охолодженого до -5°С розчину 0,73г 4-аміно-5,6,7,8-тетрагідро1-нафталінкарбонової кислоти у 10мл концентрованої соляної кислоти. Через півтори години перемішування при -5°С при цій температурі додали розчин із 3,4г SnCI2x2H2O у 34мл концентрованої соляної кислоти. Суміш перемішали на протязі 1 години при КТ і відфільтрували. Продукт промили концентрованою соляною кислотою і просушили у стр умі сухого азоту, отримавши у результаті 0,67г цільового гідразину. Препарат 2.4 Гідрохлорид4-гідразино-5,6,7,8-тетрагідро-1-нафталінсульфокислоти A) 4-Аміно-5,6,7,8-тетрагідро-1-нафталінсульфокислота Гарячу суспензію 20г сульфамінової кислоти у 40мл N-метилліролідону додали до розчину 10г 5,6,7,8тетрагідро-1-нафталаміну у 100мл 1,2-дихлорбензолу. С уміш перемішували під нагрівом до 150°С на протязі 7 годин. Продукт відфільтрували і промили дихлорбензолом, а потім толуолом. Преципітату повторно надали форму суспензії у 70мл води і нейтралізували до рН 7 добавкою 5,5мл 30%-го гідроксиду натрію. Нерозчинну частину відфільтрували, а водну фазу екстрагували ефіром. Далі кислотність водної фази скоректували до рН 5 добавкою НСІ при 5°С. Суміш відфільтрували, а залишок промили водою і просушили, одержавши 7,5г цільового продукту. B) Гідрохлорид 4-гідразино-5,6,7,8-тетрагідро-1-нафталінсульфокислоти 1г NaNO2 додали до розчину 3г одержаної на етапі А) кислоти у 10мл води і 2мл 3%-го гідроксиду натрію. Розчин на протязі 1 години влили до 10мл концентрованої соляної кислоти, охолодженої до 5°С. Після перемішування на протязі 3 годин при 5°С розчин 7,5г SnCI2x2H2O помалу додали до 15мл концентрованої соляної кислоти, підтримуючи температуру на рівні 5°С. Далі суміш перемішали на протязі 1,5 години при КТ і відфільтрували, а залишок просушили у вакуумі, одержавши 2,86г цільового продукту. ЯМР (D2O - NaOD):1,6:mt:4Н; 2,25:mt:2Н; 2,9:mt:2Н; 6,75:d; 1Н; 7,6:d:1Н. Препарат 2.5 Гідрохлорид 4-гідразино-3-метилбензаміду A) 4-Аміно-3-метилбензамід Цей продукт з т. пл. = 124°С приготували шля хом каталітичної гідрогенізації 3-метил-4-нітробензаміду. B) Гідрохлорид 4-гідразино-3-метилбензаміду 0,5г сполуки етапу А) розчинили у 10мл 1N соляної кислоти і 5мл концентрованої соляної кислоти. Суміш охолодили до 0°С і до неї додали розчин 230 мг NaNO2 у 30мл води. Через 15 хвилин витримання при -10°С додали розчин 1,5г SnCI2x2H2O у 5мл концентрованої соляної кислоти. Через 1 годину преципітат відфільтрували і просушили у вакуумі над Р2О5 , одержавши 390 мг цільового продукту. Препарат 2.6 Гідрохлорид 2,3-диметил-4-гідразинбензойної кислоти Розчин 1,87г NaNO2 у 7мл води помалу додали до охолодженого до -5°С розчину 4,5г 4-аміно-2,3діметилбензойної кислоти у 135мл концентрованої НСІ. Через 2 години перемішування при -5°С додали розчин 25г SnCI2x2H2O у 250мл концентрованої НСІ при -10°С, і суміш перемішали на протязі 30 хвилин при 5°С і потім 2 години при КТ. Суміш відфільтрували, а преципітат промили 5мл концентрованої НСІ і просушили під струмом сухого азоту і потім у вакуумі, одержавши 5,5г цільового продукту. ЯМР:2,1:s:3Н; 2,4:s:3Н; 6,8:d:2Н; 7,6:d:2Н; 8,2:s:1Н; 10:bs:2Н. Препарат 2.7 Гідрохлорид 4-гідразино-3-метоксибензойноїкислоти Розчин 2,17 r NaNO2 у 40мл води помалу додали до охолодженого до 0°С розчину 5г 4-аміно-3метоксибензойної кислоти у 50мл концентрованої НСІ. Через 1 годину 15 хвилин перемішування при 0°С суміш охолодили до -10°С і на протязі 30 хвилин додали до неї розчин 23,6г SnCI2x2H2O у 20мл концентрованої соляної кислоти і 20мл води. Через півтори години перемішування при -10°С суміш відфільтрували, а преципітат промили 50мл пентану, одержавши після просушування 6г цільового продукту. ЯМР:3,8:s:3Н; 7:d:1Н; 7,4:s:1Н; 7,5:dd:1Н; 8:bs:1Н; 1,6:bs:2Н. Препарат 2.8 Гідрохлорид 2-хлор-4-гідразинбензонітрилу 5г 4-аміно-2-хлорбензонітрилу і 40мл концентрованої соляної кислоти в 30мл тетрагідрофурану перемішали при -5°С. До суміші додали 2,26г NaNO2 у 30мл води і піддали її перемішуванню на протязі 2 годин, після чого додали 30г SnCI2x2H2O у 30мл концентрованої соляної кислоти і перемішували на протязі 30 хвилин, підтримуючи температуру на рівні -5°С. Після повернення до КТ нерозчинну речовину відфільтрували, додали NaCl і суміш знову перемішали. Цільовий продукт кристалізувався з NaCl. Його вилучили етанолом, у той час як NaCl відфільтрували. Після випарювання розчинників було одержано 4,25г цільового продукту. Препарат 2,9 Гідрохлорид 3-циклопропіл-4-гідразинбензойної кислоти А) 4-Ацетамідо-3-циклопропілбензонітрил 1,67 r CuCN додали до розчину 4,3г 4-бром-2-циклопропілацетаніліду (одержаного згідно з [J. Am. Chem. Soc, 1968, 90, 3404]) у 100мл диметилформаміду, і суміш піддали нагріву до стану дефлегмації на протязі 24 годин. Далі її влили до 30мл води, утворену суміш відфільтрували, а преципітат промили водою і потім перемішували на протязі 30 хвилин у суміші 59мл води і 25мл етилендіаміну. Після екстракції 100мл AcOEt, просушування над Na2SO4 і випарювання у вакуумі було одержано 2,39г цільового продукту. ЯМР:0,6:u.с.:2Н; 0,9:u.с.:2Н; 1,9 :u.с.:1Н; 2,1:s:3Н; 7,3:d:1Н; 7,5:dd:1H; 7,8:d:1H; 9,5:bs:1H. B) Гідрохлорид 4-аміно-3-циклопропілбензонітрилу Суміш із 2,39г продукту етапу А), розчиненого у 45мл етанолу з 36мл води і 5мл концентрованої соляної кислоти піддали перемішуванню на протязі 12 годин у стані дефлегмації. Етанол випарили у вакуумі, а преципітат відфільтрували, промили 1мл води і просушили у вакуумі, одержавши 1,5г цільового продукту. ЯМР:0,5:u.с.:2Н; 0,9:u.с.:2Н; 1,6 :u.с.:1Н; 6,7:d:1Н; 7,1-7,3:mt:2Н; 8:bs:2Н. C) Гідрохлорид 4-аміно-3-циклопропілбензойної кислоти 1,3г продукту етапу В) у 21мл 50%-го КОН перемішували на протязі 29 годин у стані дефлегмації. Після підкислення до рН 1 концентрованою соляною кислотою суміш відфільтр ували і залишок просушили у вакуумі, одержавши 0,96г цільового продукту. ЯМР:0,5:u.с.:2Н; 0,9:u.с.:2Н; 1,7 :u.с.:1Н; 5,9:bs:2Н; 6,6:d:1Н; 7,4:s:1H; 7,5:mt:1H; 12:bs:1H. D) Гідрохлорид 3-циклопропіл-4-гідразинбензойної кислоти Розчин 0,38г NaNO2 у 4,5мл води помалу додали до охолодженого до -5°С розчину 0,95г продукту, одержаного на етапі С), у 22мл концентрованої соляної кислоти і 21мл АсОН, і утворену суміш перемішували на протязі 1 години 15 хвилин при 0°С. Далі її охолодили до -10°С і помалу додали до неї розчин 3,76г SnCI2x2H2O у 8мл концентрованої соляної кислоти. Через 4 години перемішування при КТ суміш відфільтрували, а залишок промили 2мл концентрованої соляної кислоти і просушили у вакуумі, одержавши 1г цільового продукту. ЯМР:0,6:u.с.:2Н; 1:u.с.:2Н; 1,9:u .с.:1Н; 7,1:d:1Н; 7,6:s:1Н; 7,8:d:1Н; 8,4:s:1H; 10,7:bs:2Н. Препарат 2.10 Гідрохлорид 5-гідразино-2-хлорбензойної кислоти Розчин 2,11г NaNO2 у 40мл води на протязі 30 хвилин додали до охолодженої до -2°С суспензії 5г 5-аміно2-хлорбензойної кислоти у 50мл концентрованої НСІ. Розчин перемішували на протязі 2 годин при -3°С і охолодили до -20°С, після чого до нього на протязі 30 хвилин додали розчин 23г SnCI2x2H2O у 20мл концентрованої соляної кислоти і 20мл води. Суміш перемішували на протязі 1,5 години при 0°С і після цього відфільтрували. Преципітат просушили, одержавши 4г цільового продукту. ЯМР:7,6:bs:23Н; 7,7: bs:1Н; 8,4:bs:1Н; 11,0:bs:3Н. Препарат 2.11 Гідрохлорид 3-гідразино-4-метилбензойної кислоти Розчин 2,74г NaNO2 у 28мл води на протязі 30 хвилин додали до охолодженого до -5°С розчину 5г 3аміно-4-метилбензойної кислоти у 120мл концентрованої НСІ і 40мл АсОН. Суміш перемішували на протязі 1 години 20 хвилин при 0°С. Після охолодження до -10°С до неї помалу додали розчин 27,6г SnCI2x2H2O у 28мл концентрованої соляної кислоти. Після перемішування на протязі 1 години при КТ, фільтрації, промивання преципітату у 5мл 1N НСІ i просушування над Р2О5 у вакуумі було одержано 6,15г цільового продукту. За описаними вище методиками з правильно заміщених анілінових похідних у якості сировини були одержані гідразини, вказані у Табл.1. ЯМР: Препарат 2.12:2:s:3Н; 2,4:s:3Н; 6,5:d:1Н; 7,5:d:1Н; 9,9:bs:3Н. Препарат 2.13:7,6:bs:2Н; 7,7:bs:1Н; 8,4:bs:1Н; 11,0:bs:3Н. Препарат 2.14:7,3:u.c.:2Н; 7,4:u.c.:1Н; 8,4:bs:1Н; 10,8:bs:3Н. Препарат 2.17:3,8:s:3Н; 4,4:bs:1Н; 7,0:d:1Н; 3,6:d:1Н; 10,0:bs:3Н. Препарат 2.18 Оксалат N-(4-гідразино-3-ізопропілфеніл)-4-метилбензолсульфонаміду A) N-(2-Бром-5-ізопропіл-4-нітрофеніл)-4-метилбензолсульфонамід Розчин 23,47г N-(4-нітрофеніл)-4-метилбензолсульфонаміду у 230мл тетрагідрофурану о холодили до 30сС, додали до нього 100мл 2М розчину хлориду ізопропілмагнію в ефірі і суміш залишили на 30 хвилин перемішува тися при -30°С. Потім до неї при температурі -30°С додали 10,3мл брому, перемішали все це 15 мін при цій самій температурі, після чого дали суміші нагрітися природним шляхом до 20°С. Потім до неї додали 55мл триетиламіну і перемішували на протязі 1 години при КТ. Далі додали воду, суміш підкислили до рН 3-4 добавкою 10%-го розчину соляної кислоти, органічну фазу після осадження відділили, водну фазу екстрагували ефіром, органічні фази об'єднали і просушили над Na2SO4. Органічну фазу перемішали при наявності тваринного вугілля, відфільтрували і концентрували у вакуумі. Залишок вилучили за допомогою EtOH і утворений кристалізований продукт декантували. У результаті було одержано 11,6г цільового продукту з т. пл.=132°С. ЯМР:1,0:d:6Н; 2,32:s:3Н; 3,12:s:1Н; 7,14:s:1Н; 7,36:d:2Н; 7,65:d:2Н; 8,08:s:1H; 10,25:bs:1Н. B) N-(4-аміно-3-ізопропілфеніл)-4-метилбензолсульфонамід Суміш із 11,5г сполуки, одержаної на попередньому етапі, і 1г паладію на вугіллі (5% паладію) у 200мл МеОН і 30мл DMF піддали гідрогенізації на протязі 7 годин при ТК і тиску 1бар. Каталізатор відфільтрували і фільтрат концентрували у вакуумі. Залишок вилучили водою, суміш нейтралізували до рН 7 добавкою 10%-го розчину NaOH і екстрагували за допомогою AcOEt. Органічну фазу просушили над Na2SO4, а розчинник випарили у вакуумі. У результаті було одержано 8г цільового продукту. ЯМР:1,1:d:6Н;2,4:s:3Н; 2,89:mt:1Н; 4,91:bs:2Н; 6,42-6,68:u.c.:3Н; 7,35 :d:2H; 7,56:d:2Н; 9,38:s:1H. C) Оксалат N-(4-гідразино-3-ізопропілфеніл)-4-метилбензолсульфонаміду Суміш із 6,68г сполуки, одержаної на попередньому етапі, і 70 мл концентрованого розчину соляної кислоти перемішали при 0°С, додали до неї розчин 1,48г NaNO2 у 5мл води і поставили на перемішування на 1 годину при 0°С. Потім до неї додали розчин 11,35г дитіоніту натрію у 60мл води і продовжили перемішування ще на 1 годину при 0°С. Далі додали 120г порошкового ацетату натрію і 30мл води, і реакційну суміш поставили на 30 хвилин перемішування при 0°С. Після цього суміш екстрагували за допомогою AcOEt, органічну фазу просушили над Na2SO4 і відфільтрували. До фільтрату додали розчин 1,98г щавлевої кислоти у мінімальній кількості ЕtOН, і суміш піддали концентрації у вакуумі. Залишок вилучили ізопропіловим ефіром, а суміш перемішували далі на протязі 12 годин, після чого утворений преципітат осушили. У результаті було одержано 4,84г цільового продукту, готового до вживання без подальшої обробки. Препарат 2.19 Гідрофторид 1-гідразино-2-метил-4-нітробензолу Суміш із 4,6г 1-фтор-2-метил-4-нітробензолу і 3мл гідрату гідразину у 45мл 2-пропанолу утримували у нагрітому до дефлегмації стані на протязі 2 годин. Далі до неї додали 3мл гідрату гідразину і продовжили дефлегмацію ще 2 години, після чого суміш поставили на ніч на перемішування при КТ. Утворений преципітат осушили. У результаті одержали 3,53г цільового продукту з т. пл.=182°С. Препарат 2.20 Гідробромід N-(4-гідразино-3-ізобутилфеніл)-4-метилбензолсульфонаміду A) N-(2-бром-5-ізобутил-4-нітрофеніл)-4-метилбензолсульфонамід Цю сполуку одержали способом, описаним у розділі Препарат 2.18, етап А), із 10г N-(4-нітрофеніл)-4метилбензолсульфонаміду у 100мл тетрагідрофурану і 42,6мл 2М розчину хлориду ізобутилмагнію в ефірі, і далі із 4,4мл брому і 23,4мл триетиламіну. Було одержано 5,9г цільового продукту з т. пл.=170°С. ЯМР:0,8:d:6Н; 1,7:mt:1Н; 2,35:s:3Н; 2,6:d:2Н; 7,2:s:1Н; 7,3:d:2Н; 7,4:d:2H; 8,2:s:1H; 10,25:s:1H. B) N-(4-аміно-3-ізобутилфеніл)-4-метилбензолсульфонамід Ця сполука була одержана способом, описаним у розділі Препарат 2.18, етап В), із 4,7г сполуки, одержаної на попередньому етапі. У результаті було одержано 2,8г цільового продукту. ЯМР: 0,8:d; 6Н; 1,75:mt:1Н; 2,2:d:2Н; 2,4:s:3Н; 4,8:s:2Н; 6,45:d:1Н; 6,5:d:1Н; 6,65:dd:1Н; 7,35:d:2Н; 7,55:d:2Н; 9,4:s:1Н. C) Гідробромід N-(4-пдразино-3-ізобутилфеніл)-4-метилбензолсульфонаміду Ця сполука була одержана способом, описаним у розділі Препарат 2,18, етап С), із 2,5г сполуки, одержаної на попередньому етапі, 35мл концентрованої соляної кислоти, 50мл оцтової кислоти і 0,53г NaNO2, і далі із 4,78г дитіоніту натрію у 50мл води, 140г ацетату натрію і 70мл води. Через 30 хвилин перемішування при 0°С додали бромисто-водневу кислоту при 0°С, і кристалізований продукт піддали декантації і просушуванню. У результаті було одержано 1,9г цільового продукту. ЯМР:0,65:d:6Н; 1,6:mt:1Н; 2,05:d:2Н; 2,2:s:3Н; 6,05:bs:1Н; 6,4:bs:1Н; 6,6-6,8:u.c.:2H; 7,2:d:2H; 7,4:d:2H. Препарат 2.21 Оксалат N-(4-гідразино-3-циклопентиллфеніл)-4-метилбензолсульфонаміду A) N-(2-бром-5-циклопентил-4-нітрофеніл)-4-метилбензолсульфонамід Цю сполуку одержали способом, описаним у розділі Препарат 2.18, етап А), із 15г N-(4-нітрофеніл)-4метилбензолсульфонаміду у 100мл тетрагідрофурану і 64мл 2М розчину хлориду циклопентилмагнію в ефірі, і далі із 6,8мл брому і 35мл триетиламіну. Було одержано 6,1г цільового продукту з т. пл.=122°С. ЯМР (DMSO+TFA):1,25:mt:2Н; 1,5-1,7:u.c.:4Н; 1,95:mt:2Н; 2,36:s:3Н; 3,2:qt:1Н; 7,12:s:2Н; 7,4:d:2Н; 7,7:d:2Н; 8,08:s:1Н. B) N-(4-аміно-3-циклопентилфеніл)-4-метилбензолсульфонамід Ця сполука була одержана способом, описаним у розділі Препарат 2.18, етап В), із 6г сполуки, одержаної на попередньому етапі. У результаті було отримано 4,25г цільового продукту з т. пл.=128°С. ЯМР (DMSO+TFA):1,25:mt:2Н; 1,5-1,75:u.c.:4Н; 1,95:mt:2Н; 2,3:s:3Н; 3,0:qt:1Н; 7,0:dd:1Н; 7,12:d:1Н; 7,2:d:1Н; 7,34:t:2Н; 7,65:d:2Н. C) Оксалат N-(4-гідразино-3-циклопентиллфент)-4-метилбензол сульфонаміду Ця сполука була одержана способом, описаним у розділі Препарат 2,18, етап С), із 3,35г сполуки, одержаної на попередньому етапі, 20мл сірчаної кислоти, 50мл оцтової кислоти, 10мл води і 0,69г NaNO2, і далі із 5,5г дитіоніту натрію у 50мл води і 200г ацетату натрію і 300мл води. Було одержано 2,42г цільового продукту. Препарат 2.22 Гідрохлорид 4-гидразино-2-ізопропілбензойної кислоти А) 4-Йодо-3-ізопропілацетанілід Цю сполуку одержали способом, описаним в [Bull. Soc. Chim. Jap., 1989, 62,1349]. 5,7г хлориду цинку і 10,8г дихлорйодату бензилтриметиламонію при КТ було добавлено до розчину 5г 3ізопропілацетаніліду у 150мл оцтової кислоті, і суміш поставили на перемішування на протязі 2 днів. Далі вона була піддана концентрації у вакуумі, залишок вилучили за допомогою 100мл 5%-го розчину гідросульфіту натрію, кислотність суміші добавленням 10%-го розчину Na 2СО3 доведено до рН 5-6, проведено чотириразове екстрагування за допомогою 200мл хлороформу, і органічну фазу просушено над Na2SO4. Після фільтрації отриманий фільтрат піддано хроматографії на 100г оксиду алюмінію з елююванням хлороформом. У результаті було одержано 5,2г цільового продукту. ЯМР:1,1:d:6Н; 2,0:s:3Н; 3,06:u.c:1Н; 7,28:dd:1Н; 7,5:d:1Н; 7,72:d:1Н; 10,0:bs:1H. B) 4-Йодо-3-ізопропіланілін Суміш із 5,1г сполуки, одержаної на попередньому етапі, у 40мл 96%-го ЕtOН і 25мл концентрованого NaOH гріли до стану дефлегмації на протязі 6 годин. Потім її піддали концентрації у вакуумі і екстрагуванню ефіром. Органічну фазу просушили над Na2SO4, а розчинник випарили у вакуумі. У результаті було одержано 5г цільового продукту у формі олії. ЯМР:1,16:d:6Н; 2,94:u.с.:1Н; 5,2:bs:2Н; 6,2:dd:1Н; 6,6:d:1Н; 7,4; d:1Н. C) 4-Аміно-2-ізопропілбензойна кислота До розчину 5г одержаної на попередньому етапі сполуки у 60мл диметилформаміду додали 40мл води і 10г К2СО3. Розчин піддали дегазації барботуванням азотом на протязі 10 хвилин. Далі до утвореної таким чином суміші додали 0,5г ацетату паладію(ІІ) і піддали її дегазації барботуванням азотом на протязі 10 хвилин. Потім реакційну суміш перемішували 10 годин у середовищі оксиду вуглецю під тиском 1 бар. Після цього розчин відфільтрували, фільтр 4 рази промили 20мл води, а фільтрат піддали концентрації у вакуумі. Залишок було вилучено за допомогою 50мл води і 10мл насиченого розчину NaCI. Водну фаз у промили ефіром і підкислили до рН 3,5-4 добавкою концентрованої соляної кислоти і екстрагували за допомогою AcOEt. Органічну фазу промили насиченим розчином NaCI і просушили над Na2SO4. Розчинник випарили у вакуумі. Було одержано 2г сирого продукту, який вилучили за допомогою 20мл насиченого розчину газоподібного хлороводню у метанолі, і суміш ви тримали у нагрітому до дефлегмації стані на протязі ночі. Потім її піддали концентрації у вакуумі, залишок вилучили водою у кількості 20 мл, а суміш обробили добавкою концентрованого NaOH до рН 8 і екстрагували за допомогою 30мл дихлорметану. До органічної фази додали 0,8мл оцтового ангідриду, NaHCO3 і Na2SO4; після цього суміш перемішали. Після фільтрації фільтрат концентрували у вакуумі, а залишок хроматографували на оксиді кремнію з елююванням сумішшю дихлорметану з ефіром у співвідношенні 50:50 (об.). Було одержано 0,8г метилового ефіру 4-ацетамідо-2ізопропілбензойної кислоти у формі олії. Суміш із 0,8г отриманого продукту і 3г КОН у 10мл води і 2мл 1,2диметоксіетану витримали у нагрітому до дефлегмації стані на протязі ночі. Після охолодження до КТ реакційну суміш промили ефіром, водну фазу підкислили до рН 3-4 добавкою концентрованої НСІ і екстрагували за допомогою AcOEt. Далі органічну фазу просушили над Na2SO4, а розчинник випарили у вакуумі. У результаті було одержано 0,6г цільового продукту. ЯМР:1,17:d:6Н; 4,0:sp:1Н; 5,7:bs:2Н; 6,36:dd:1Н; 6,80:d:1Н; 7,6:d:1Н; 11,80:bs:1Н. D) Гідрохлорид 4-гидразино-2-ізопропілбензойної кислоти Суміш із 0,5г сполуки, одержаної на попередньому етапі, у7мл концентрованої соляної кислоти охолодили до 0°С і додали до неї розчин 0,23г NaNO2 у 4мл води і все це поставили на перемішування на 1 годину 30 хвилин при 0°С. Далі суміш охолодили до -10°С і додали до неї розчин 2,6г SnCI2x2H2O у 5мл концентрованої соляної кислоти і 3мл води. Потім суміш піддали перемішуванню на протязі 2 годин при 0°С. Утворений преципітат осушили, промили концентрованою НСІ і просушили при 50°С у вакуумі. У результаті було одержано 0,36г цільового продукту. ЯМР:1,15:d:6Н; 3,98:u.с.:1Н; 6,7:dd:1Н; 6,96:d:1Н; 7,8:d:1Н; 8,2:bs:1Н; 13:bs:4H. Препарат 2.23 Гідрохлорид 1-гидразино-4-нітро-5,6,7,8-тетрагідронафталіну A) 1-Ацетамідо-5,6,7,8-тетрагідронафталін Суміш із 24,39г 1-аміно-5,6,7,8-тетрагідронафталіну і 18,6мл оцтового ангідриду у 230мл дихлорметану перемішали на протязі 1 години при КТ. Далі її піддали концентрації у вакуумі, залишок вилучили ефіром, а утворений преципітат осушили. У результаті було одержано 26,8г цільового продукту з т. пл.=158°С. B) 1-Аміно-4-нітро-5,6,7,8-тетрагідронафталін Суміш із 13г одержаної на попередньому етапі сполуки у 72мл концентрованої сірчаної кислоти охолодили до 0°С і додали до неї суміш із 4,55мл азотної кислоти (питомою вагою 1,4) і 22мл концентрованої сірчаної кислоти. Суміш перемішували на протязі 45 хвилин при 0°С. Далі реакційну суміш вилили на лід і утворений преципітат осушили. Преципітат вилучили за допомогою 145мл ЕtOН, 30мл концентрованії НСІ і 30мл води, і суміш витримали у нагрітому до дефлегмації стані на протязі 1 години 30 хвилин. 70мл реакційної суміші випарили, а до розчину, що залишився, додали 220мл води. Добавкою концентрованого розчину гідроксиду амонію рН суміші була доведена до 7, а преципітат, що утворився, був декантований і просушений. Преципітат вилучили за допомогою 210мл нітробензолу, суміш о холодили до 0°С і барботували стр умом газоподібного хлороводню на протязі 50 хвилин. Утворений преципітат осушили і промили ефіром. Далі його вилучили метанолом, суміш нейтралізували добавкою концентрованого розчину гідроксиду амонію, додали до неї воду, і преципітат осушили. Після осушування одержали 5,15г цільового продукту з т. пл.=114°С. C) Гідрохлорид 1-гідразино-4-нітро-5,6,7,8-тетрагідронафталіну Суміш із 3,8г одержаної на попередньому етапі сполуки у 70мл концентрованої соляної кислоти охолодили до 3°С, додали до неї розчин 1,34г NaNO2 у 2мл води і утворену суміш поставили на перемішування на 2 години при 3°С. Потім до неї додали розчин 18,2г SnCI2x2H2O у 90мл концентрованої соляної кислоти і поставили на перемішування на 30 хвилин при 3°С, після чого дали їй прогрітися природним шляхом до КТ. Утворений преципітат піддали декантації і просушуванню. У результаті було одержано 6,3г цільового продукту, змішаного з солями олова. ЯМР (D MSO+TFA):1,7:mt:4Н; 2,55:mt:2Н; 2,85:mt:2Н; 6,88:d:1Н; 7,85:d:1Н. Препарат 2.24 3-Діетиламіно-N-(4-ізопропіл-3-гідразинфеніл)пропіонамід A) Оксалат 3-діетиламіно-N-(4-ізопропіл-3-нітрофеніл)пропіонаміду 4г 4-ізопропіл-3-нітроаніліну (одержаного згідно з [J. Org. Chem., N 1954,19,1067]) нагрівали до стану дефлегмації на протязі 1 години з 8,14мл біс(триметилсиліл)ацетаміду у 20мл ацетонітрилу і сюди ж додали хлорангідрид кислоти, одержаний із 4г гідрохлориду 3-(N,N-диетиламіно)пропанової кислоти в дихлорметані і потім 8,9мл триетиламіну. Через 1 годину перемішування при КТ суміш випарили до сухого стану, залишок екстрагували дихлорметаном і суміш промили водою, а потім 5%-м NaOH. Після просушування над Na2SO4 суміш випарили у вакуумі, отриману олію повторно розчинили у мінімальній кількості етанолу і додали 1,2г оцтової кислоти. Через 2 години перемішування суміш відфільтрували, одержавши 4,5г цільового оксалату з т. пл.=165°С. B) Оксалат 3-діетиламіно-N-(4-ізопропіл-3-амінофеніл)пропіонаміду Розчин 4,5г одержаної на попередньому етапі нітропохідної у 100мл МеОН і 10мл диметилформаміду піддали гідрогенізації на протязі 5 годин з нікелем РенеюÒ. Після того, як каталізатор був відфільтрований, суміш концентрували у вакуумі, провели преципітацію добавкою ізопропілового ефіру, і суміш перемішали на протязі 1 години при КТ. Після фільтрування отримали 3г цільового оксалату аніліну з т. пл.=127°С. С) 3Діетиламіно-N-(4-ізопропіл-3-гідразинфеніл)пропіонамід До охолодженої до 0°С суміші 2,7г одержаного на попередньому етапі аміну і 30мл концентрованої соляної кислоти додали 0,67г NaNO2, розчиненої у мінімальній кількості води. Суміш перемішали при 0°С на протязі 1 години. Після цього до суміші додали 5г дитіоніту натрію, розчиненого у мінімальній кількості води, і піддали її подальшому перемішуванню на протязі 30 хвилин при 0°С. Потім до суміші додали 50г порошкового ацетату натрію і перемішували її ще 30 хвилин при 0°С. Далі додали 50г води і за допомогою AcOEt були екстраговані деякі забруднення. Водну фазу наситили NaCI, кислотність підняли до рН 9 20%-м NH4OH, екстрагували дихлорметаном, просушили над Na2SO4 і випарили у вакуумі. Залишок лишили кристалізуватися у пентані на протязі ночі і відфільтрували його, одержавши 3,26г цільового гідразину з т. пл.=77-80°C. ПРИКЛАДИ ОДЕРЖАННЯ ЕФІРІВ IIа, ІІ'а Препарат 3.1 Метиловий ефір 1-(4-карбокси-2-ізопропілфеніл)-5-(2,6-диметоксифеніл)-3-піразолкарбонової кислоти (ІІ'а: R' 1=4-СО2Н; R2=2-iPr; R3=Η ; R4=СН3) Суміш із 0,96г продукту, одержаного у розділі Препарат 2.1, і 1,2г сполуки А, одержаної в розділі Препарат 1.1, у 15мл оцтової кислоти піддали дефлегмаційній обробці на протязі 5 годин. Після 3 днів витримання при КТ суміш влили до води з льодом. Утворений преципітат відфільтрували, промили водою і просушили над Р2О5 . У результаті було одержано 1,34г цільового продукту з т. пл.=228-230°С. ЯМР; 0,85:d:6Н; 2,55; sp:1Н; 3,5:s:6Н; 3,75:s:3Н; 6,5:d:2Н; 6,75:s:1Н; 7,05-7,3:u.с.:2Н; 7,7:d:1Н; 13,05:bs:1Н. Препарат 3.1а Етиловий ефір 1-(4-карбокси-2-ізолропілфеніл)-5-(2,6-диметоксифеніл)-3-піразолкарбонової кислоти Шляхом реакції продукту, одержаного в розділі Препарат 2.1 або 2.1а, зі сполукою А1 згідно зі способом, описаним у розділі Препарат 3.1, і наступної рекристалізації в AcOEt одержали цільовий етиловий ефір з т.пл.=231°С. Препарат 3.2 Метиловий ефір 1-[4-[N-метил-(3-(N',N'-диметиламіно)пропіл)карбамоїл]-2-ізопропілфеніл]-5-(2,6диметоксифеніл)-3-піразолкарбонової кислоти (IIа: R1=4-CON(CH3)(CH2)3NMe2 ; R2=2-iPr; R3=Η; R4= CH3) A) Метиловий ефір 1-(4-хлорформіл-2-ізопропілфеніл)-5-(2,6-диметоксифеніл)-3-піразолкарбонової кислоти Приготували суміш із 26г продукту, одержаного в розділі Препарат 3.1, і 170мл хлориду тіонілу. С уміш перемішували на протязі 1 дня при КТ. Далі її випарили у вакуумі, залишок вилучили ди хлорметаном, суміш піддали випарюванню, і процес цей повторили три рази. B) Метиловий ефір 1-[4-[N-метил-(3-(N',N'-диметиламіно)пропіл)карбамоїл]-2-ізопропілфеніл]-5-(2,6диметоксифеніл)-3-піразолкарбонової кислоти 9,3мл триетиламіну і 9,9мл N,N,N’-триметил-1,3-пропандіаміну додали до 50мл дихлорметану. Продукт, одержаний на попередньому етапі, додали до 280мл дихлорметану в атмосфері азоту, і суміш поставили на перемішування при КТ на 3,5 години. Після промивання водою (дворазово) суміш просушили над МgSО 4 і випарили у вакуумі. Залишок вилучили ефіром. Нерозчинну речовину відфільтрували, а суміш піддали випарюванню, залишок піддали хроматографії на кремнії з елююванням сумішшю DCM/MeOH/H2 O у співвідношенні 95:5:0,5 - 88:12:0,8 (об.). У результаті було одержано 24,5г цільового продукту. ЯМР: 0,95:d:6Н; 1,7:u.с.:2Н; 1,9-2,4:u.с.:8Н; 2,95:ss:3Н; 3,5:u.с.:2Н; 3,7:s:6Н; 3,9; s:9Н; 6,7:d:2Н; 6,9:s:1Н; 7,17,5:u.с.:4Н. Препарат 3.2а Етиловий ефір 1-[4-[N-метил-(3-N',N'-диметиламінопропіл)карбамоїл]-2-ізопропілфеніл]-5-(2,6диметоксифеніл)-3-піразолкарбонової кислоти A) Етиловий ефір 1-(4-хлорформіл-2-ізопропілфеніл)-5-(2,6-диметоксифеніл)-3-піразолкарбонової кислоти 26г продукту, одержаного в розділі Препарат 3.1 або 3.1а, додали до 50мл SOCI2, охолодженого до 5°С, і суміш перемішали на протязі 5 годин при КТ і барботуванні її сухим азотом. Після випарювання у вакуумі залишок видалили дихлорметаном і випарили у вакуумі; цю операцію повторили двічі. Хлористий ангідрид кислоти можна приготувати способом, описаним нижче у А'). А') 2,5мл SOCI2 додали до розчину 5г продукту з розділу Препарат 3.1 або 3.1а в 50мл дихлорметану, суміш витримали у нагрітому до дефлегмації стані на протязі 3 годин і випарили у вакуумі. Залишок вилучили дихлорметаном, а суміш випарили у вакуумі. Процес цей провели дворазово. B) Етиловий ефір 1-[4-[N-метил-(3-N’,N'-диметиламінопропіл)карбамоїл]-2-ізопропілфеніл]-5-(2,6диметоксифеніл)-3-піразолкарбонової кислоти Розчин одержаного на етапі А) хлориду кислоти у 220мл дихлорметану в атмосфері сухого азоту додали до розчину 9мл триетиламіну і 9,5мл Ν,Ν,Ν'-триметил-13-пропандіаміну у 50мл дихлорметану, і суміш перемішували на протязі ночі. Потім її два рази промили водою і водну фазу дворазово вилучили дихлорметаном. Комбіновані органічні фази просушили над MgSO4 і випарили у вакуумі. Залишок перемішали з 300мл ефіру, нерозчинену речовину відфільтрували, а фільтрат обезбарвили на тваринному вугіллі і випарили, одержавши 28,8г цільового продукту у формі олії. ЯМР (DMSO+TFA):1:d:6Н; 1,3:t:3Н; 1,8-2,1:u.с.:2Н; 2,65:qt:1Н; 2,7-3,0,5:u.с.:9Н; 3,15:mt:2Н; 3,5:mt:2Н; 3,65:s:6Н; 4,35:qr:2Н; 6,6:d:2Н; 6,85:s:1Н; 7,2-7,4:u.с.:4Н. Продукт етапу В) можна одержати також способом, описаним нижче. В') Розчин одержаного на етапі А') хлористого ангідриду кислоти у 37,5мл дихлорметану додали до розчину 1,32г N,N,N’-триметил-1,3-пропандiамiну у 37,5мл 3N гідроксиду натрію. Через 1 годину перемішування до суміші додали 25мл хлороформу і 25мл води, дали їй відстоятися і відділили органічну фазу, яку просушили над Na2SO4 і випарили у вакуумі, одержавши 6,1г цільового продукту. Препарат 3.3 Метиловий ефір 1-[4-|N(2-ціаноетил)карбамоїл]-2-ізопропілфеніл]-5-(2,6-диметоксифеніл)-3піразолкарбонової кислоти (IIа:R1=4-CONHCH2CH2CN; R2=2-iPr; R3=Η; R4=CH3) 0,935г напівфумарату 3-амінопропіонітрилу змішали з 3,7мл 1,3N NaOH. Суміш екстрагували дихлорметаном, органічну фазу просушили над Na2SO4, а розчинник випарили у вакуумі. Залишок вилучили за допомогою 6мл дихлорметану, додали 0,96мл триетиламіну і потім помалу додали розчину 2,45г сполуки, одержаної на етапі А) розділу Препарат 3.2, у 30мл дихлорметану. С уміш перемішували на протязі ночі при КТ в атмосфері азоту. Нерозчинну речовину відфільтрували, фільтрат промили водою, насиченим розчином NaHCO3 і водою і просушили над Na2SO4, а розчинник випарили у вакуумі. У результаті одержали 2,24г цільового продукту з т. пл.=114-116°С (розклад). ЯМР:1:d:6Н; 2,7:mt:1Н; 2,8:t:2Н; 3,5:q:2Н; 3,65:s:6Н; 3,9:s:3Н; 6,7:d:2Н; 6,9:s:1Н; 7,9-7,4:u.с.:2Н; 7,75:d:1Н; 7,9:s; 1Н; 9:t:1Н. Шляхом піддання реакції відповідного первинного аміну зі сполукою, одержаною в розділі Препарат 3.2 на етапі А), і здійснення процесу, описаного у розділі Препарат 3.2, етап В), були приготовлені ефіри, описані в Табл.2. ЯМР: Препарат 3.4:1:d:6Н; 1,65:mt:2Н; 2,1:s:6Н; 2,25:t:2Н; 2,6:mt:1Н; 3,25:u.c.:2Н; 3,6:s:6Н; 3,85:s:3Н; 6,6:d:2Н; 6,85:s:1Н; 7,2-7,3:u.с.:2Н; 7,6:dd:1Н; 7,8:d:1 H;8,6:t:1H. Препарат 3.5 (DMSO+TFA):1:d:6Н; 2,6:mt:2Н; 2,8:s:6Н; 3,25:mt:2Н; 3,6:u.c.+s:8Н; 3,85:s:3Н; 6,6:d:2Н; 6,8:s:1Н; 7,2-7,4:u.с.:2Н; 7,7:d:1Н; 7,8:d:1Н. Препарат 3.6 (DMSO+TFA):0,9:d:6Н; 1,15:t:6Н; 1,8-2:u.с.:2Н; 2,6:mt:1Н; 3,1:mt:4Н; 3,3:t:2Н; 3,55:u.c.+s:8Н; 3,8:s:3Н; 6,5:d:2Н; 6,8:s:1Н; 7,15-7,3:u.с.:2H;7,6:dd; 1Н; 7,8:bs:1Н. Препарат 3.7:1,05:d:6Н; 1,7:mt:4Н; 2,45-2,75:u.с.:7Н; 3,4:mt:2Н; 3,7:s:6Н; 3,9:s:3Н; 6,65:d:2Н; 6,9:s:1Н; 7,37,4:u.с.:2Н; 7,7-7,9. u.с:2Н; 8,6:t:1Н. Препарат 3.8:1,05:d:6Н; 2,7:mt:1Н; 3,7:s:6Н; 3,9:s:3Н; 6,7:d:2H; 6,9:s:1Н; 7,2-7,4:u.с.:3Н; 7,85-8,5:u.с.:5Н; 11:s:1Н. Препарат 3.9:0,9:s:6Н; 1,05:d:6Н; 2,25:s:2Н; 2,3:s:6Н; 2,7:mt:1Н; 3,2:d 2Н; 3,7:s:6Н, 3,9:s:ЗН, 6,65:d :2Н; 6,09:bs:1Н; 7,3-7,4:u.с.:2Н; 7,6-7,8:u.с.:2Н:8,7:t:1Н. Препарат 3.10:1:d:6Н; 1,4-1,9:u.c.:4Н; 2:t:2Н; 2,6:mt:1Н; 2,8:d:2Н; 3,5:s:2Н; 3,6:s:6Н; 3,6-3,85:u.c.:1Н; 3,85:s:3Н; 6,6:d:2Н; 6,85:s:1Н; 7,1-7,4:u.c.:5Н; 7,65:d:1H;7,8:s:1H;8,3:d:1H. Препарат 3.11 (DMSO+TFA):1,05:d:6H; 1,6-2,3:u.c.:5H;-2,7:mt:1H; 3,2-3,4:u.c.:5H; 3,5-3,8:u.c.+s:7H; 3,9:s:3H; 4,344:u.c.:1H; 6,65:d:2H; 6,9:s:1H; 7,3-7,4:mt:2H;7,8:d:1H;7,9:s:1H. Препарат 3.12 Метиловий ефір 5-(2,6-диметоксифеніл)-1-(2-ізопропіл-4-сульфофеніл)-3-піразолкарбонової кислоти (ll'a:R'1=4-SO3H; R2-2-iPr; R 3=Η; R 4=CH3) Суміш із 0,82г 3-ізопропіл-4-гідразинбензолсульфокислоти, одержаної в розділі Препарат 2.2, і 1,26г сполуки А, одержаної в розділі Препарат 1.1, у 15мл оцтової кислоти витримали у нагрітому до дефлегмації стані на протязі 5 годин. Після випарювання залишок розчинили у дихлорметані, розчин промили 1N НСІ і обезбарвили на активованому вугіллі. Далі його просушили і випарили, залишок перемішували при дефлегмації в ізопропіловому ефірі, а суміш відфільтрували у гарячому стані. У результаті одержали 1,28г цільового продукту. ЯМР: 1:d:6Н; 2,6:mt:1Н; 3,6:s:6Н; 3,8:s:3Н; 6,6:d:2Н; 6,8:s:1Н; 7,15:d:1Н; 7,3:t:1H;7,4:d:1H;7,5:s:1H. Препарат 3.13 Метиловий ефір 5-(2,6-диметоксифеніл)-1-[2-iзопропіл-4-N-метилN-(3-N'N’диметиламінопропіл)аміносульфоніл)феніл]-3-піразолкарбонової кислоти (lla:R'1=4-SO3NMe(CH2)3N Me2; R2=2-iPr; R 3=Η; R4=CH3) A) Метиловий ефір 5-(2,6-диметоксифеніл)-1-(4-хлорсульфоніл-2-ізопропілфеніл)-3-піразолкарбонової кислоти 1,08г продукту, одержаного в розділі Препарат 3.12, і 4мл РОСІ3 перемішали при КТ на протязі 24 годин і потім при температурі 70°С ще 24 години. Реакційну суміш двічі випарили толуолом і одержали 1,6г цільового продукту. B) Метиловий ефір 5-(2,6-диметоксифеніл)-1-[2-ізопропіл-4-(N-метил-N-(3-N',N'диметиламінопропіл)аміносульфоніл)феніл]-3-піразол карбонової кислоти 1,8мл Ν,Ν,Ν'-триметил-1,3-пропандіаміну і потім 2мл триетиламіну додали до суспензії 1,6г одержаного на попередньому етапі продукту у 10мл толуолу і 5мл дихлорметану. Суміш перемішували 3 години при КТ, а потім 1,5 години при 50°С. Після фільтрації і випарювання до сухого стану залишок екстрагували ефіром і потім AcOEt. Органічну фазу промили водою, просушили над Na2SO4 і випарили у вакуумі. У результаті було одержано 1,13г цільового продукту. ЯМР:0,85:d:6Н; 1,45:mt:2Н; 2:s:6Н; 2,4:s+mt:4Н; 2,85:t:2Н; 3,5:s:6Н; 3,8:s:3Н; 6,5:d:2Н; 6,8:s:1Н; 7,2:1:1Н; 7,4:d:1Н; 7,5-7,6:u.с.:2Н. Препарат 3.14 Метиловий ефір 5-(2,6-диметоксифеніл)-1-(4-карбокси-5,6,7,8-тетрагідро-1-нафтил)-3-піразолкарбонової кислоти (ІI’а: R'1=4-СО3Н; R2, R 3=-(СН2)4- і R4=CH3) Суміш із 0,67г гідразину, одержаного в розділі Препарат 2,3, і 0,83г сполуки А у 6мл АсОН перемішали у стані дефлегмації на протязі 2 годин. Далі її екстрагували дихлорметаном, і органічну фазу промили водою, просушили над MgSO4 і випарили у вакуумі. Залишок піддали хроматографічному очищенню на оксиді кремнію, елюювали сумішшю DCM/MeOH у співвідношенні 100:2 (об.) і одержали 0,7г цільового продукту. ЯМР:1,4-2:u.с.:4Н; 2,3-3,1:u.с,:4Н; 3,4-4:u.с.:9Н; 6,6:d:2Н; 6,8-7,6:u.с.:4Н; 12,95 :bs:1Н. Препарат 3.15 Метиловий ефір 5-(2,6-диметоксифеніл)-1-{4-|N-(3-N’,N'-диметиламінопропіл-карбамоїл]-5,6,7,8тетрагідро-1-нафтил}-3-піразолкарбонової кислоти (II’а: R’1-4-CONH(CH2)3NMe2; R2 , R3=-(СН2)4-; N4=СН3) Розчин 0,7г продукту, одержаного в розділі Препарат 3.14, у 6мл SOCI2 і 30мл дихлорметану витримали у нагрітому до 40°С стані на протязі 1,5 години. Розчин випарили у вакуумі, хлористий ангідрид повторно розчинили у 5мл дихлорметану, суміш охолодили до 5°С і додали до неї 0,225мл N.N-диметилпропілендіаміну і 0,225мл триетиламіну. Після 2 годин перемішування при КТ суміш випарили у вакуумі, залишок знову розчинили у дихлорметані, а суміш промили водою, просушили над MgSO4 і випарили у вакуумі, одержавши 0,79г цільового продукту. Препарат 3.16 Метиловий ефір 5-(2,6-диметоксифеніл)-1-(4-сульфо-5,6,7,8-тетрагідро-1-нафтил)-3-піразолкарбонової кислоти (ІI’а: R'1=4-SO 3H; R2, R3=-(СН2)4-; R 4=СН3) Суміш із 0,5г гідразину, одержаного в розділі Препарат 2,4, і 0,62г сполуки А у 4мл АсОН витримали у нагрітому до дефлегмації стані на протязі 4,5 годин. Суміш випарили у вакуумі, залишок знову розчинили у дихлорметані і суміш двічі промили 1N НСІ, просушили над MgSO4 і випарили, одержавши 1г цільового продукту. ЯМР: 1,7:bs:4Н; 2,5:u.с.:2Н; 3,2:u.с.:2Н; 3,7:s:6Н; 3,95:s:3Н; 6,7:d:2Н; 6,8-6,9:u.c.:2H; 7,35:t:1H; 7,55:d:1H. Препарат 3.17 Метиловий ефір 5-(2,6-диметоксифент)-1-{4-N-метил-N-(2-N',N'-диметиламіноетил)аміносульфоніл]5,6,7,8-тетрагідро-1-нафтил}-3-піразолкарбонової кислоти (IIа: R1=4-SO 2NMe(CH2)2N Me2; R2, R 3=(СН2)4; R4=СН3) Суміш із 1г кислоти, одержаної в розділі Препарат 3,16, і 3мл РОСІ3 перемішували на протязі 5 годин при КТ і потім ще 3,5 години при 70°С. Далі її випарили у вакуумі, додали толуолу і двічі випарили у вакуумі. Одержаний таким чином розчин хлориду сульфонілу у 10мл дихлорметану додали до розчину 1,5мл Ν,Ν,Ν'триметилетилендіаміну і 1,5мл триетиламіну у 10мл дихлорметану при 5°С. Суміш перемішували на протязі 4 днів при 10°С, відфільтрували і випарили у вакуумі. Після повторного розчинення у дихлорметані, промивання водою і екстрагування водної фази дихлорметаном органічну фазу просушили над MgSO4 і випарили у вакуумі, одержавши 1,07г цільового сульфонаміду з т. пл.=90°С. ЯМР: 1,6-1,8:u.c.:4Н; 2,1:s:6Н; 2,35:t:2Н; 2,4-2,6:u.c.:2Н; 2,9:s:3Н; 3,1:mt:2Н; 3,2:t:2Н; 3,6:s:6Н; 3,9:s:3Н; 6,7:d:2Н; 6,9:s:1Н; 7,1:d:1Н; 7,4:t:1Н; 7,7:d:1H. Препарат 3.18 Метиловий ефір 5-(2,6-диметоксифеніл)-1-(4-карбамоїл-2-метилфеніл)-3-піразолкарбонової кислоти (lla: R 1=4-CONH2; R2=2-CH3; R3=H; R 4=CH3) у Суспензію 0,39г гідразину, одержаного в розділі Препарат 2.5, і 450 мг сполуки А у 5мл АсОН витримали у нагрітому до дефлегмації стані на протязі 8 годин. Потім до реакційного середовища додали 100мл води; утворений преципітат відфільтрували, помістили до 10мл ізопропілового ефіру, витримали у стані дефлегмації на протязі 30 хвилин і відфільтрували. Було одержано 300 мг цільового продукту з т. пл.=219°С. Через 24 години водну фаз у відфільтрували і одержали ще 70 мг цільового продукту у голчастій формі. ЯМР: 2,05:s:3Н; 3,5:s:6Н; 3,8:s:3Н; 6,6:d:2Н; 6,8:s:1Н; 7:d:6Н; 7,2:t:1Н; 7,4:bs:1Н; 7,6:d:1Н; 7,7:s:1Н; 7,9:bs:1Н. Препарат 3.19 Метиловий ефір 5-(2,6-диметоксифеніл)-1-(4-карбокси-2,3-диметилфеніл)-3-піразолкарбонової кислоти (ІІ'а: R' 1=4-CO2H; R2=2-CH3; R 3=3-CH3; R4=CH3) Суміш із 4,5г продукту, одержаного в розділі Препарат 2.6, і 12г сполуки А у 50мл АсОН витримали у нагрітому до дефлегмації стані при перемішуванні на протязі З годин. Преципітацію викликали вливанням суміші до 300мл води з льодом, преципітат відфільтрували і промили 50мл води. Після перемішування у 50мл ефіру, фільтрації і просушування у вакуумі над Р2О5 було одержано 5г цільового продукту з т. пл.=240°С. Препарат 3.20 Метиловий ефір 5-(2,6-диметоксифеніл}-1-{2,3-диметил-4-[N-(2-N'N'-диметиламіноетил)карбамоїл]-феніл}3-піразолкарбонової кислоти (IIа: R1=4-CONH(CH2)2NMe2 ; R2=2-СН3; R3=3-СН3; R 4=СН3) Розчин 2г продукту із розділу Препарат 3.19 у 10мл SOCI2 і 40мл дихлорметану витримали при температурі 40°С на протязі 1,5 години. Далі його випарили у вакуумі, хлористий ангідрид повторно розчинили у 10мл дихлорметану і суміш влили до розчину 0,54мл Ν,Ν-диметиламіноетилендіаміну у 10мл дихлорметану. До одержаної суміші додали 0,68мл триетиламіну і все це перемішали на протязі 2 годин при КТ. Після випарювання у вакуумі, екстрагування за допомогою 100мл дихлорметану, промивання водою, просушування над MgSO4 і випарювання у вакуумі було одержано 1,8г цільового продукту. ЯМР: 1,9:s:3Н; 2,2:s+s:9Н; 2,4:t:2Н; 3,4:u.с.:2Н; 3,6:s:6Н; 3,8:s:3Н; 6,6:d:2Н; 6,8:s:1Н; 6,9-7,1:dd:2Н; 7,3:t:1Н; 8,2:t:1Н. Препарат 3.21 Метиловий ефір 5-(2,6-диметоксифеніл)-1-(4-карбокси-2-метоксифеніл)-3-піразолкарбонової кислоти (Il'a: R'1=4-СО2Н; R2=2-ОСН3; R3=Η; R4=СН3) Суміш із 4,8г продукту, одержаного в розділі Препарат 2.7, і 5,6г сполуки А у 60мл АсОН піддали перемішуванню на протязі 6 годин у стані дефлегмації. Після преципітації 300мл води з льодом, 30 хвилин перемішування, фільтрації, промивання водою і потім пентаном і просушування було одержано 6г цільового продукту з т. пл.=210°С. Препарат 3.22 Метиловий ефір 5-(2,6-диметоксифент)-1-{4-[N-метил-N-(2-N'N'-диметиламіноетил)карбамоїл]-2метоксифеніл}-3-піразолкарбонової кислоти (IIа: R1=4-CON Me(CH 2)2NEt2; R2=2-ОСН3; R3=Η; R4=CH3) Розчин 2,5г продукту з розділу Препарат 3.21 у 5мл SOCI2 і 30мл дихлорметану витримали при температурі дефлегмації на протязі 3,5 години. Після випарювання у вакуумі з наступними двома азеотропними випарюваннями 20мл дихлорметану утворений хлористий ангідрид повторно розчинили у 40мл дихлорметану і одержану суміш влили до розчину 1,1мл Ν,Ν-диметил-N'-метилетилендіаміну 11мл триетиламіну у 40мл дихлорметану і поставили все це на 15 годин перемішування при КТ. Після випарювання у вакуумі залишок хроматографували на оксиді кремнію, елюювали з градієнтом розчинника у діапазоні від суміші DCM/MeOH у співвідношенні 90:10 (об.) до суміші DCM/MeOH/H2O у співвідношенні 80:20:0,7 (об.). У результаті було одержано 1,73г цільового продукту. ЯМР: 0,7-1,1:mt:6Н; 2,2-3,7:mt:20Н; 3,85:s:3Н; 6,55:d:2Н; 6,8:s:1Н; 6,95:mt:2Н; 7,3:mt:2Н. Препарат 3.23 Етиловий ефір 1-(4-карбокси-2-хлорфеніл)-5-(2,6-диметоксифеніл)-3-піразол карбонової кислоти (ll'a: R'1=4-СО2Н; R2=2-СІ; R3=Η; R4=CH3) 3-Хлор-4-гідразинбензойна кислота описана у патенті США 3959309. 5,6г цієї кислоти і 8,75г сполуки Α1 у 100мл АсОН нагрівали до стану дефлегмації на протязі 6 годин. Цю реакційну суміш влили до 500мл води з льодом, і утворений преципітат відфільтрували, а потім промили водою, пентаном і ізопропіловим ефіром. Після просушування у вакуумі було одержано 2г цільової сполуки. Препарат 3.24 Етиловий ефір 5-(2,6-димзтоксифеніл)-1-{4-[N-метил-N-(2-(N',N'-диметиламіноетил)карбамоїл]-2хлорфеніл}-3-піразолкарбонової кислоти (IIа: R1=4-CON Me(CH 2)2NEt2; R2=2-СІ; R3=Η; R4=CH3) Розчин 2,63г продукту з розділу Препарат 3.23 у 4,5мл SOCl2 і 30мл дихлорметану витримали при температурі дефлегмації на протязі 4 годин. Після випарювання у вакуумі з наступними двома азеотропними випарюваннями 20мл дихлорметану утворений хлористий ангідрид повторно розчинили у 40мл дихлорметану, і одержану суміш влили до розчину 1,1мл Ν,Ν-діетил-N'-метилетилендіаміну і 1мл триетиламіну у 4мл толуолу і поставили все це на 15 годин перемішування при КТ. Після випарювання у вакуумі, екстрагування залишку за допомогою 100мл дихлорметану, дворазового промивання водою, просушування над Na2SO4 і випарювання у вакуумі залишок хроматографували на силікагелі Η з елююванням сумішшю DCM/MeOH у співвідношенні 90:10 (об.) і потім DCM/MeOH/H 2O у співвідношенні 90:10:0,5 (об.). У результаті було одержано 2,6г цільового продукту. ЯМР (D MSO Η-TFA): 2,8:s:3Н; 3-3,7:u.c.:17Н; 6,6:d:2H; 6,8:s:1H; 7,05:u.c.:2H; 7,3:u.c.:2H. Препарат 3.25 Етиловий ефір 5-(2,6-диметоксифеніл)-1-[4-N-(2-морфоліноетил)карбамоїл)-2-хлорфеніл]-3піразолкарбонової кислоти Розчин 2,63г продукту з розділу Препарат 3.23 у 4,5мл SOCI2 і 30мл дихлорметану перемішували у стані дефлегмації на протязі 4 годин. Після випарювання у вакуумі з наступними двома азеотропними випарюваннями толуолом 30мл утвореного хлористого ангідриду кислоти повторно розчинили у 40мл дихлорметану, і суміш додали до розчину 0,9мл 4-(2-аміноетил)морфоліну і 1мл триетиламіну у 4мл толуолу. Після 15 годин перемішування при КТ, випарювання у вакуумі, повторного розчинення залишку у 200мл дихлорметану, промивання 100мл насиченого розчину NaCI, просушування над Na2SO4 і випарювання у вакуумі було одержано 3г цільового продукту. ЯМР: 1,3:t:3Н; 2,3-2,6:mt:6Н; 3,3:mt:2Н; 3,5:mt:10Н; 4,3:qr:2Н; 6,55:d:2Н; 6,8; s:1Н; 7,1-7,4:mt:3Н; 6,75:dd:1Н; 6,9:dd:1Н; 8,6:d:1Н. Препарат 3.26 Метиловий ефір 5-(2,6-диметоксифеніл)-1-(3-хлор-4-ціанофеніл)-3-піразолкарбонової кислоти (IIа: R1=4-CN; R 2=3-СІ; R3=Η; R4=CH3) Суміш із 4,2г сполуки, одержаної в розділі Препарат 2.8, і 6г сполуки А у 10мл АсОН нагрівали на водяній бані на протязі 2 годин. Суміш влили до води з льодом, утворений преципітат відфільтрували, просушили і у результаті одержали 3,78г цільового продукту. Препарат 3.27 Метиловий ефір 5-(2,6-диметоксифеніл)-1-(4-карбокси-2-циклопропілфеніл)-3-піразолкарбонової кислоти (ll'a: R'1=4-СО2Н; R2=2-циклопропіл; R3=Η; R4=CH3) Суміш із 1,28г сполуки А і 1г продукту розділу Препарат 2.9 у 12мл АсОН перемішували у стані дефлегмації на протязі 7 годин. Преципітацію викликали 120мл води з льодом, преципітат відфільтрували, промили водою і просушили у вакуумі над Р2О5, одержавши 1,27г цільового продукту. ЯМР: 0,5:u.c.:2Н; 0,8:u.c.:2Н; 1,3:t:ЗН; 1,5:u.c.:1Н; 3,6:s:6Н; 4,3:qr:2H; 6,6:d:2H; 6,9:s:1H; 7,3:u.c.:ЗН; 7,7:d:1H; 13:bs:1H. Препарат 3.28 Метиловий ефір 5-(2,6-диметоксифент)-1-{4-[N-метил-N-(2-(N',N'-диетиламіноетил)карбамоїл]-2циклопропілфеніл}-3-піразолкарбонової кислоти (IIа: R1=4-CON(Me)(CH 2)2NEt2; R2=2-циклопропіл; R3=Η; R4=CH3) Розчин 1,27г продукту розділу Препарат 3.27 у 28мл толуолу і 2мл SOCI2 витримали на протязі 5 годин при 100°С. Після випарювання у вакуумі з наступними двома азеотропними випарюваннями толуолом 30мл одержаного хлористого ангідриду повторно розчинили у 19мл дихлорметану, і суміш помалу влили до розчину 0,53мл Ν,Ν-діетил-N’-метилетилендіаміну і 0,61мл триетиламіну у 1,9мл толуолу. Після 12 годин перемішування при КТ, випарювання у вакуумі, екстрагування 100мл дихлорметаном, промивання водою, просушування над Na2SO4 і випарювання у вакуумі було одержано 1,29г цільового продукту. ЯМР: 0,4-1:u.c.:10Н; 1,2:t:3Н; 1,4:mt:1Н; 2,1-3:u.c.:9Н; 3,5:u.c.:8Н; 4,3:qr:2Н; 6,5:d:2Н; 6,6:s:1Н; 6,8:s:1Н; 6,97,2:mt:3Н. Препарат 3.29 Метиловий ефір 5-(2,6-диметоксифеніл)-1-(3-карбокси-4-хлорфеніл)-3-піразолкарбонової кислоти (ll'a: R 1=3-СО2Н; R2=4-СІ; R3=Η; R4=СН3) Суміш із 4г продукту розділу Препарат 2.10 і 4,6г сполуки А у 60мл АсОН перемішували у стані дефлегмації на протязі 5 годин. Преципітацію викликали 100мл води з льодом, преципітат відфільтрували і промили водою 5мл і потім ефіром 20 мл. Далі його просушили у вакуумі і одержали 3г цільового продукту з т. пл.=206°С. ЯМР: 3,55:s:6Н; 3,85:s:3Н; 6,7:d:2Н; 6,9:s:1Н; 7,35:dd:1Н; 7,4:t:1Н; 7,55:d:1H;7,7:d:1H. Препарат 3.30 Метиловий ефір 5-(2,6-диметоксифент)-1-{3-[N-метил-N-(2-N',N-диметиламіноетил)карбамоїл]-2хлорфеніл}-3-піразолкарбонової кислоти (IIа: R1=4-CON(Me)(CH 2)2NMe2 ; R2=4-СІ; R3 =Η; R4=CH3) Розчин 1,5г продукту розділу Препарат 3.29 у 2,6мл SOCI2 і 20мл дихлорметану нагрівали при перемішуванні на протязі 3,5 годин при 60°С. Після випарювання у вакуумі, хлористий ангідрид повторно розчинили у 30мл дихлорметану і одержану суміш влили до розчину 0,5мл Ν,Ν,Ν'-триметилетилендіаміну і 0,6мл триетиламіну у 2,5мл толуолу і потім поставили на 15 годин перемішування при КТ. Після випарювання у вакуумі, повторного розчину залишку у 100мл дихлорметану, промивання 100мл води, просушування над Na2SO4 і випарювання у вакуумі було одержано 0,8г цільового продукту. Препарат 3.31 Метиловий ефір 5-(2,6-диметоксифеніл)-1-(5-карбокси-2-метилфеніл)-3-піразолкарбонової кислоти (ll'a: R 1=5-СО2Н; R2=2-СН3; R3=Η; R4= CH3) Суміш із 6,15г продукту, одержаного в розділі Препарат 2.11, і 7,76г сполуки А у 100мл АсОН перемішували на протязі 1,5 годин у стані дефлегмації. Після концентрації у вакуумі до 5 мл, преципітації у 20мл охолодженої льодом води, фільтрації, промивання преципітату 5мл води і просушування над Р2О5 у вакуумі при 80°С було одержано 9,55г цільового продукту з т. пл.=189°С. ЯМР: 1,20:t:3Н; 3,55:s:6Н; 4,26:qr:2Н; 6,58:d:2Н; 6,80:s:1Н; 7,20:t:1Н; 7,60:d:1Н; 7,70:d :1Н; 7,80:dd :1Н. Препарат 3.32 Метиловий ефір 5-(2,6-диметоксифеніл)-1-{5-[N-метил-N-(3-(N',N'-диетиламінопропіл)карбамоїл]-2метилфеніл}-3-піразолкарбонової кислоти (IIа: R1=5-CON(Me)(CH 2)3NMe2 ; R2= 2-СН3; R 3=Η; R4=CH3) Розчин 2г продукту розділу Препарат 3.31 у 10мл SOCI2 перемішували на протязі 5 годин при КТ. Після випарювання у вакуумі з наступними трьома азеотропними перегонками 30мл дихлорметану утворений хлористий ангідрид повторно розчинили у 25мл дихлорметану, суміш влили до розчину 0,81мл N,N,N'триметил-1,3-пропандіаміну і 0,77мл триетиламіну у 5мл дихлорметану і ставили на 12 годин перемішування при КТ. Після дворазового промивання 20мл води і двох екстрагувань водної фази 50мл дихлорметану фази дихлорметану дворазово промивали 20мл 5%-го NaHCO3 і потім 20мл води, після чого просушували над MgSO4 і випарювали у вакуумі. У результаті було одержано 2,3г цільового продукту (олії). ЯМР: 1,9:u.с.:2Н; 2,1:s:3Н; 2,6:s:3Н; 2,8:s:6Н; 2,9-3,2:u.с.:2Н; 3,45:u.с.:2Н; 3,6:s:6Н; 3,8:s:3Н; 6,6:d:2Н; 6,85:s:1Н; 7,05:bs:1Н; 7,2-7,4:u.с.:3Н. За описаними вище способами були одержані ефіри за формулою IIа, указані в Табл.3. При цьому використовували або ефір за формулою ІІ'а, заміщений R'1 або дію відповідного гідразину на сполуку А або сполуку А1 ТАБЛИЦЯ 3 ЯМР Препарат 3.33:2-3,8:mt:1Н; 3,9:s:3Н; 6,6:d:2Н; 6,85:s:1Н; 6,9-7,4:u.c.:4Н. Препарат 3.36 (DMSO+TFA):1,9:u.c.+s:5Н; 2,5:s:3Н; 2,8:s:9Н; 3-3,5:u.c.:2Н; 3,25:t:2Н; 3,6:s:6Н; 3,85:s:3Н; 6,6:d:2Н; 6,9:s:1Н; 7,05-7,15:u.c.:1Н; 7,3:і:1Н; 7,6:d:1Н. Препарат 3.37:1,2:t:3Н; 3,5:s:6Н; 4,3:qr:2Н; 6,5:d:2Н; 6,8:s:1Н; 7,2:t:1Нг7,6:d:1Н; 7,7:s:1Н; 7,85:d:1Н. Препарат 3,38:1,4:t:3Н; 1,8-3,3:u.c.:13Н; 3,65:s:6Η; 4,4:qr:2Н; 6,6:d:2Н; 6,95:s:1Н; 7,2-7,4:u.c.:4Н; 7,7:d:1Н. Препарат 3.40:0,6-1:u.c.:6Н; 1,3:t:ЗН; 2,2:u.c:2Н; 2,4-3,4:u.c.:7Н; 3,6:s:6Н; 4,1:u.c.:2Н; 4,3:qr:2Н; 6,6:d:2Н; 6,8:s:1Н; 7,15:ас. :2Н; 7,6:d:1Н; 7,8:bs:1Н. Препарат 3.41:1,4:t:3Н; 3,6:s:9Н; 4,4:qr:2Н; 6,62:d:2Н; 6,81:s:1Н; 7,2:d:1Н; 7,36:t:1Н; 7,8:d:1Н; 8,0:dd:1Н; 12,6:bs:1Н. Препарат 3.42:1,4:t:3Н; 1,8-2,4:bs:8Н; 2,8:bs:3Н; 3,2-3,8:bs:2Н; 3,6:s:9Н; 4,4:qr:2Н; 6,6:d:2Н; 6,8:s:1Н; 7,07,5:u.c.:4Н. Препарат 3.43:1,0-1,1:u.c.:18Н; 2,4-2,75:2mt:3Н; 2,9-3,1:mt:2Н; 3,1-3,35:mt:2Н; 3,65:s:6Н; 3,9:s:3Н; 6,65:d:2Н; 6,9:s:1Н; 7,3-7,4:mt:2Н; 7,7:d:1Н; 7,8:s:1H;8,55:t:1H. Препарат 3.45:0,75:t:6Н; 0,9:d:6Н; 1,05-1,15:u.c.:8Н; 1,5:t:2Н; 2,5-2,4:u.c.:6H; 2,55:sp:1H; 3,15:mt:2H; 3,55:s:6H; 4,2:s:3Н; 6,5:d:2H; 6,72:s:1H; 7,2-7,25:u.c.:2H; 7,55:dd:1H; 7,65:d:1H; 8,45:t:1H. Препарат 3.46:0,8-1,1:u.c.:12Н; 1,25:t:3Н; 2,4-2,8:u.c.:6Н; 3,1-3,4:u.c.:3Н; 3,5:s:6НГ4.2:qt:2H; 6,5:d:2H; 7,2:u.c.:2H; 7,6:d:1H; 7,8:bs:1H; 8,6:bs:1H. Препарат 3.49:0,9-1,15:2mt:9Н; 1,5-1,9:u.c.:4Н; 2,1-2,45:2mt:2Н; 2,65:mt:1Н; 2,75-3:mt:1Н; 3-3,2:u.c.:2Н; 3,23,55:u.c.:2Н; 3,65:s:6Н; 3,9:s:3Н; 6,65:d:2Н; 6,9:s:1Н; 7,25-7,4:mt:2Н; 7,7:d:1Н; 7,85:s:1Н; 8,6:t:1Н. Препарат 3.50:1,05:d:6Н; 1,1-1,6:2s+m:14Н; 1,8:dd:2Н; 2,65:mt:1Н; 3,7:s:6Н; 3,9:s:3Н; 4,2-4,5:u.c.:1Н; 6,65:d:2Н; 6,9:s:1Н; 7,25-7,4:mt:2Н; 7,7:d:1Н; 7,85:s:1H;8,3:d:1H. Препарат 3.51 (DMSO+TFA):1,0:d:6Н; 1,1-1,4:u.c.:6Н; 2,0-2,5:u.c.:2Н; 2,7:2u.с.:1Н; 3,0-4,2:Su.c.+s:18Н;6,7:d:2Н; 6 9:s:1Н; 7,3-7,55:u.c.:4Н. Препарат 3.52 (DMSO+TFA):0,95:d:6Н; 1,5-1,8:u.c.:2Н; 1,8-2,2:u.c.:2Н; 2,6; mt:1Н; 2,75:s:6Н; 2,9 3,8:2u.c.+s:10Н; 3,85:s:3Н; 4,5-4,7:u.c.:1Н; 6,6:d:2Н; 6,85:s:1H; 7,2-7,35:mt :4Н. Препарат 3.53 (DMSO+TFA):0,98:d:6Н; 2,6:mt:1Н; 2,7-3,8:u.c.:13Н; 3,82:s:3Н; 6,58:d:2Н; 6,85:s:1Н; 7,157,37:u.c.:4Н. Препарат 3.54 (DMSO+TFA):1,05:d:6H; 2,7:mt:1H; 3,7:s:6H; 3,85-4,0:s+mt:5H; 5,1-5,3:u.c.:2H; 5,8-6,1:u.c.:1H; 6,55:d:2H; 6,9:s:1H; 7,3-7,4:u.c.:2H; 7,75:d:1H;7,9:s:1H; 8,8:t:1H. Препарат 3.55 (DMSO+TFA):1,05:d:6H; 2:s:6H; 2,15:t:2H; 2,75:qt:1H; 3,2:t:2H; 3,7:s:6H; 3,9:s:3H; 4,45:s:2H; 6,1:d:2H; 7:s:1H; 7,3-7,5:u.c.:6H; 7,55:d:1H; 7,7-7,9:u.c.2H. Препарат 3.57 Метиловий ефір 5-(2,6-диметоксифеніл)-1-[4-N-метил-N-[3-N'-метил-N’-(mpemбутоксикарбоніл)аміно]пропіл]карбамоїл]-2-ізопропілфеніл]-3-піразолкарбонової кислоти (IIа: R1=4-CON Me(CH 2)3NMeCOOt-Bu; R 2=2-iPr; R3=Η; R 4=CH3) A) Tpem-бутиловий ефір N-метил-N-(3-метиламінопропіл)карбамінової кислоти Розчин 4,19г N,N'-диметил-1,3-пропандiамiну у 80мл тетрагідрофурану охолодили до 0°С, додали до нього розчин 2,68г ди-трет-бутилдикарбонату у 25мл тетрагідрофурану, і одержану суміш поставили на 72 години перемішування при КТ. Нерозчинну речовину відфільтрували, і фільтрат концентрували у вакуумі. Залишок екстрагували дихлорметаном, органічну фазу тричі промили водою і просушили над MgSO4 , а розчинник випарили у вакуумі. У результаті було одержано 1,6г цільового продукту у формі олії жовтого кольору. B) Метиловий ефір 5-(2,6-диметоксифеніл)-1-[4-[N-метил-N-[3-[N’-метил-N'-(третбутоксикарбоніл)аміно]пропіл]карбамоїл]-2-ізопропілфеніл]-3-піразолкарбонової кислоти Розчин 2,6г сполуки, одержаної на етапі А) розділу Препарат 3.2, додали при КТ в атмосфері азоту до розчину 1,31г сполуки, одержаної на попередньому етапі, і 0,9мл триетиламіну у 4мл дихлорметану, і реакційну суміш поставили на перемішування на ніч при КТ. Реакційну суміш двічі промили водою, органічну фазу просушили над MgSO4, і розчинник випарили у вакуумі. Залишок хроматографували на силікагелі, елюювали сумішшю толуол/AcOEt у співвідношенні від 65:35 до 65:40 (об.). У результаті було одержано 2,85г цільового продукту. ЯМР (D MSO+TFA):1,0:d:6Н; 1,4:d . 9Н; 1,6-1,9:u.с.:2Н; 2,7:mt:1Н; 2,7-3,55:d+bs+u.c.:10Н; 3,65:s:6Н; 3,9:s:3Н; 6,65:d:2Н; 6,9:s:1Н; 7,3-7,45:u.с.:4Н. Препарат 3.58 Етиловий ефір 5-(2,6-диметоксифеніл)-1-[4-(4-метил-фенілсульфоніламіно)-2-ізопропілфеніл]-3піразолкарбонової кислоти Суміш із 3,44г сполуки, одержаної в розділі Препарат 2.18, і 2,6г сполуки А1 у 50мл оцтової кислоти нагрівали на протязі 1 години при 70°С. Реакційну суміш влили до води, суміш, яка утворилася, екстрагували за допомогою AcOEt, органічну фазу просушили над Na2SO4 і розчинник випарили у вакуумі. Залишок піддали хроматографічному очищенню на силікагелі, елюювали сумішшю DCM/MeOH у співвідношенні 100:0,5 (об.) і в результаті одержали цільовий продукт у кількості 1,26 г. ЯМР: 0,7:d:6Н; 1,22:t:3Н; 2,2-2,5:u.с.:4Н; 3,45:s:6Н; 4,2:t:2Н; 4,46:d:2Н; 6,69:s:1Н; 6,75-6,9:u.с.:2Н; 7,0:d:1Н; 7,15-7,3:u.с.:3Н; 7,5:d:2Н; 10,2:s:1Н. Препарат 3.59 Етиловий ефір 5-(2,6-диметоксифеніл)-1-[4-[4-метилфенілсульфоніл-N-(3-диетиламінопропіл)аміно]-2ізопропілфеніл]-3-піразолкарбонової кислоти Суміш із 0,65г сполуки, одержаної в розділі Препарат 3.58, 0,338г (3-хлорпропіл)діетиламіну і 0,65г К2СО 3 у 5мл диметилформаміду нагрівали протягом 2 годин при температурі 80°С. Реакційну суміш влили до води, суміш, яка утворилася, екстрагували AcOEt, просушили над Na2SO4, а розчинник випарили у вакуумі. Залишок піддали хроматографічному очищенню на силікагелі Н, елюювали сумішшю DC M/MeOH у співвідношенні 100:5 (об.) і в результаті одержали цільовий продукт у кількості 0,57 г. ЯМР: 0,8:bs:6Н; 1,95:t:6Н; 1,4:t:3Н; 1,5:qt:2Н; 2,3-2,65:u.с.:10Н; 3,5-3,8:u.с.:8Н; 4,35:qr:2Н; 6,7:d:2Н; 6,75:d:1Н; 6,9:s:1Н; 7,05:dd:1Н; 7,2-7,6:u.с.:6Н. Препарат 3.60 Етиловий ефір 5-[2-(циклопропілметилокси)-6-метоксифеніл]-1-(4-карбокси-2-ізопропілфеніл)-3піразолкарбонової кислоти Суміш із 5,26г сполуки, одержаної в розділі Препарат 1.2, і 3,9г сполуки, одержаної в розділі Препарат 2.1, у 50мл оцтової кислоти нагрівали при температурі 80°С на протязі 8 годин. Реакційну суміш влили до воднольодяної суміші, і преципітат, що утворився, осушили і промили водою, а потім пентаном. Преципітат вилучили толуолом, а розчинник випарили у вакуумі. У результаті одержали 5,2г цільового продукту. Препарат 3.61 Етиловий ефір 5-[2(циклопроптметокси)-6-метоксифен1л]-1-[4-[N-метил-N-(3-диметиламінопропіл)карбамоїл]-2-ізопропілфеніл]-3-піразолкарбонової кислоти Цю сполуку одержують за способами, описаними у розділі Препарат 3.2, етапи А) і В), із 5,2г сполуки, одержаної в розділі Препарат 3.60, і 2,4мл SOCI2 з наступними 1,39г N,N,N'-триметил-1,3-пропандіаміну i 1,5мл триетиламіну у 10мл толуолу. Продукт очищали хроматографією на силікагелі, елюювали дихлорметаном і потім сумішшю DCM/MeOH у співвідношенні 88:2 (об.). У результаті було одержано 3,8г цільового продукту.
ДивитисяДодаткова інформація
Назва патенту англійськоюSubstituted 1-phenylpirazole 3-carboxamides, a method for the preparation thereof and intermediary compounds, pharmaceutical composition having affinity to neurotensin receptors
Автори англійськоюMolimar Jean-Charles
Назва патенту російськоюЗамещенные 1-фенилпиразол-3-карбоксамиды, способ их получения и промежуточные соединения, фармацевтическая композиция, имеющая родственность к рецепторам нейротензина
Автори російськоюМолимар Жан-Шарль
МПК / Мітки
МПК: A61K 31/44, A61K 31/496, A61K 31/42, A61K 31/439, C07C 243/00, C07D 231/14, C07D 403/12, A61K 31/5377, C07C 309/00, C07D 401/12, A61K 31/4439, C07D 413/04, A61K 31/445, A61K 31/495, C07C 255/66, A61K 31/415, C07D 403/10, A61K 31/454, C07D 453/00, A61P 25/00, A61K 31/535, C07C 311/21, A61P 43/00, A61P 35/00, A61K 31/435, A61K 31/4427, C07D 401/10
Мітки: 1-фенілпіразол-3-карбоксаміди, спорідненість, рецепторів, заміщені, сполуки, проміжні, нейротензину, композиція, спосіб, фармацевтична, одержання, має
Код посилання
<a href="https://ua.patents.su/55-66750-zamishheni-1-fenilpirazol-3-karboksamidi-sposib-kh-oderzhannya-ta-promizhni-spoluki-farmacevtichna-kompoziciya-shho-maeh-sporidnenist-do-receptoriv-nejjrotenzinu.html" target="_blank" rel="follow" title="База патентів України">Заміщені 1-фенілпіразол-3-карбоксаміди, спосіб їх одержання та проміжні сполуки, фармацевтична композиція, що має спорідненість до рецепторів нейротензину</a>