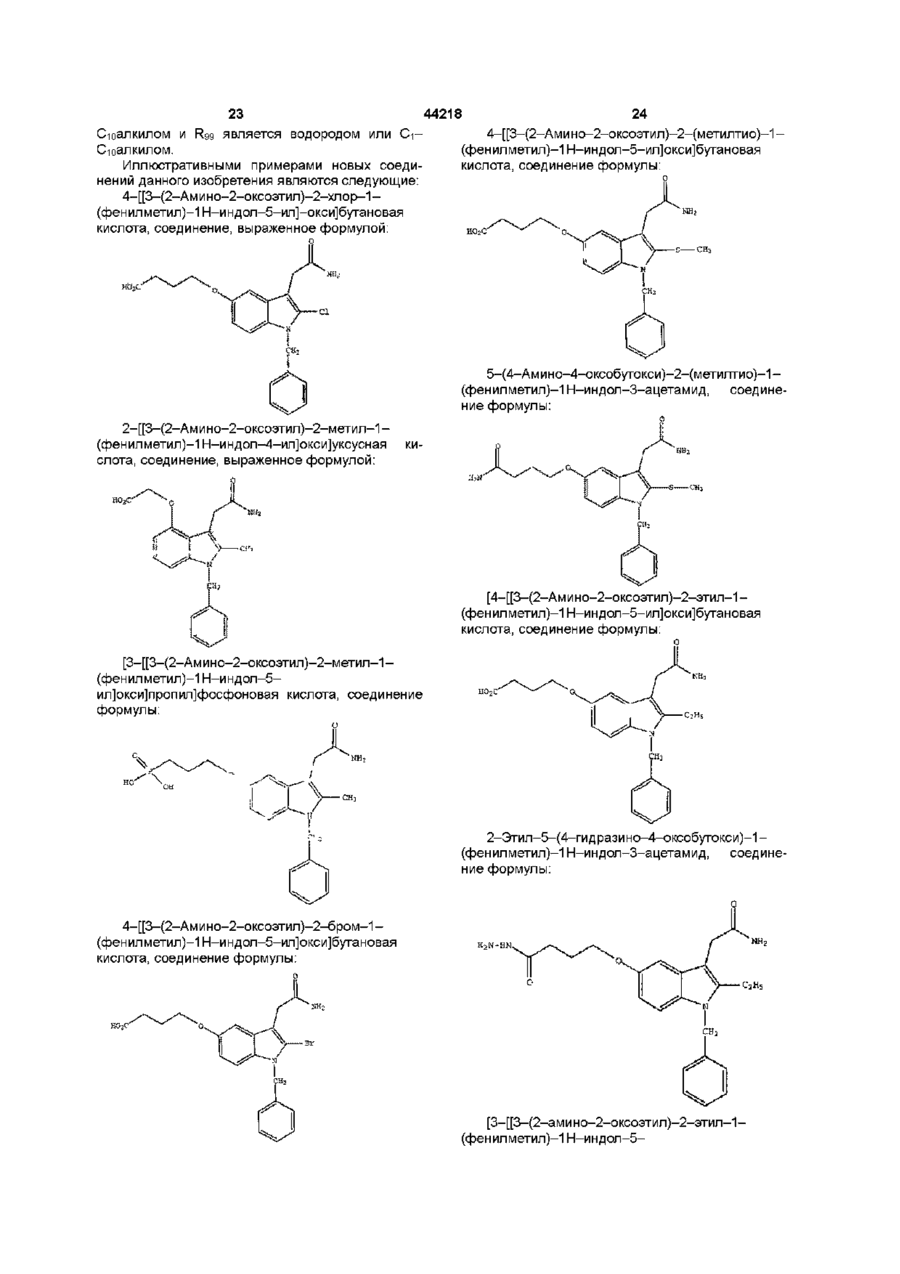
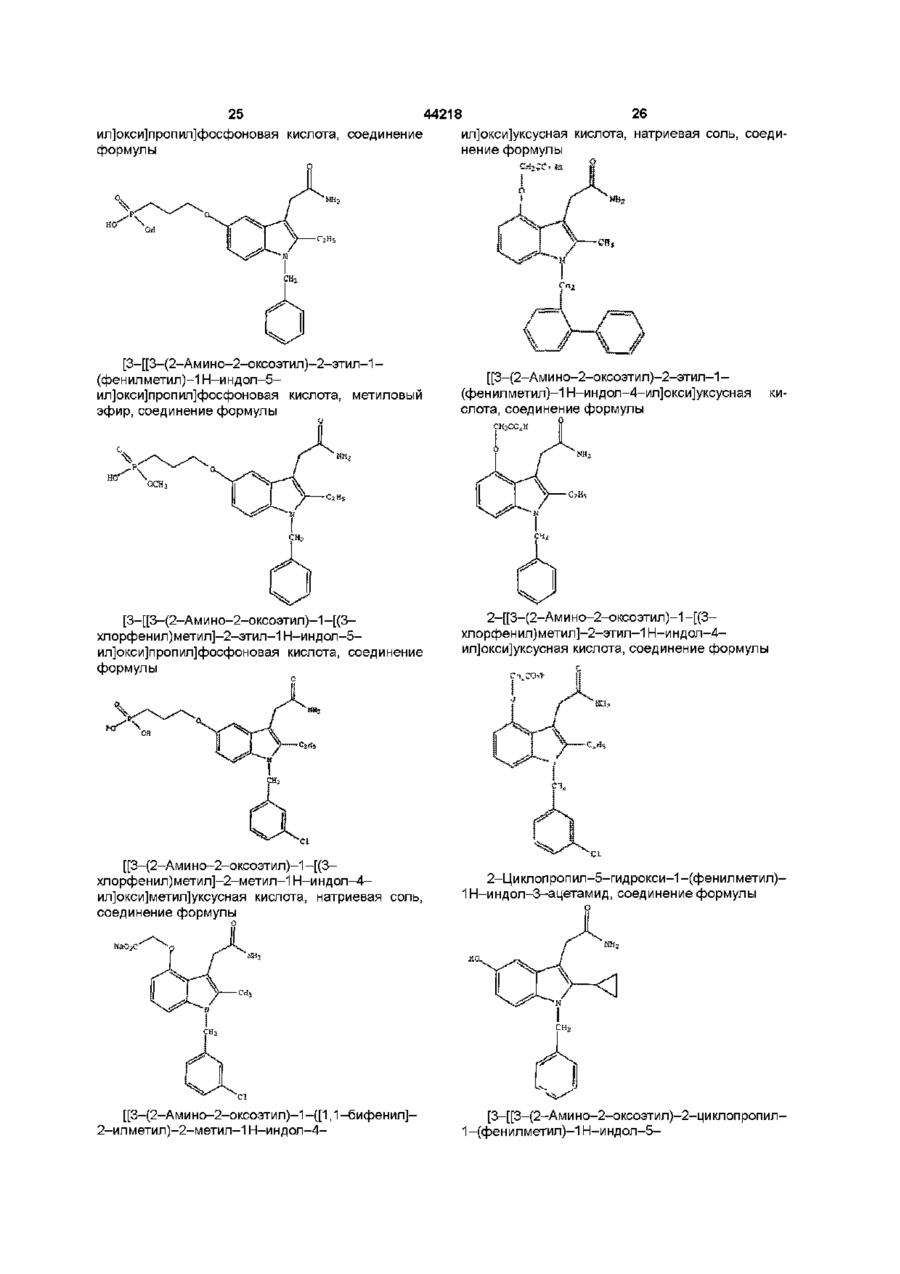
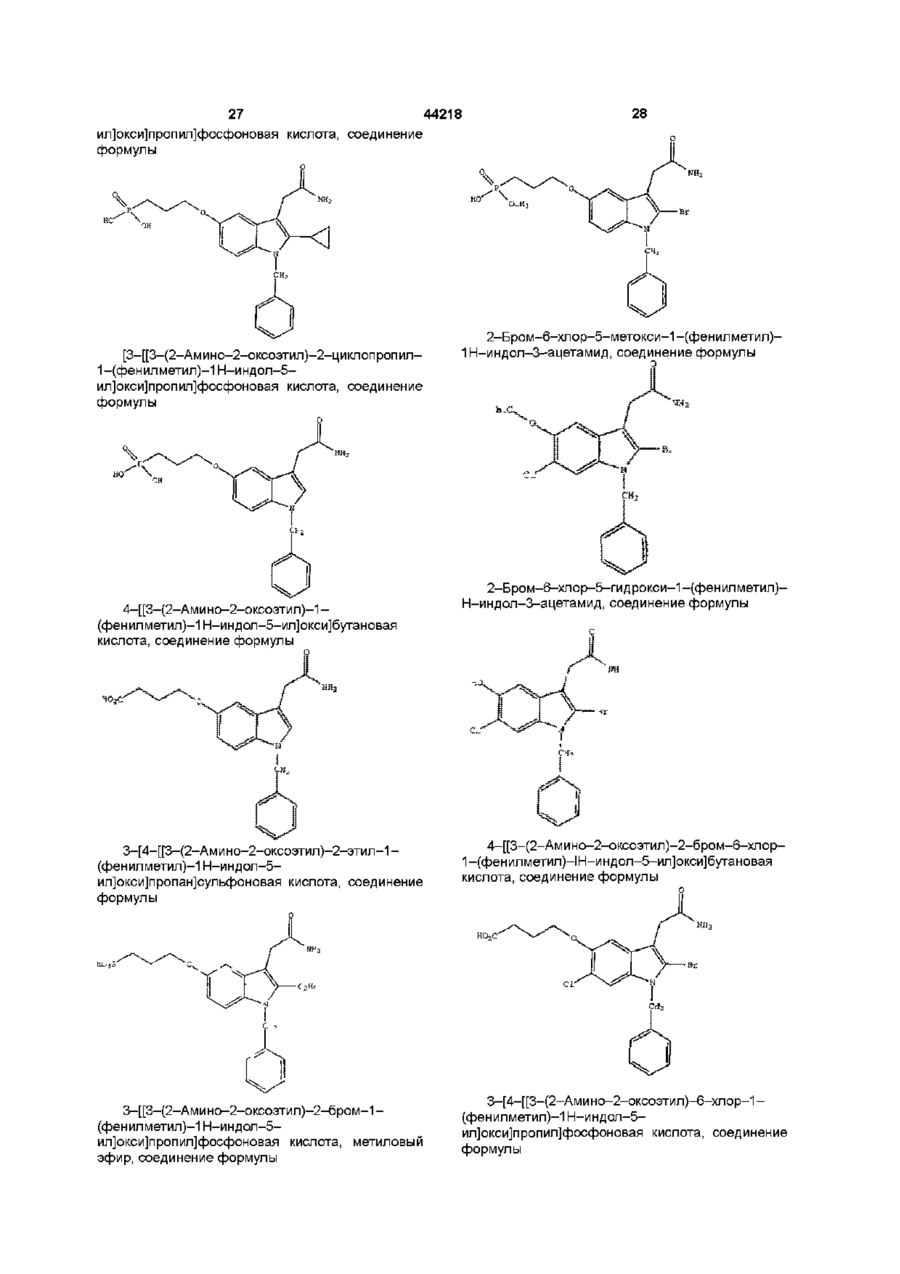
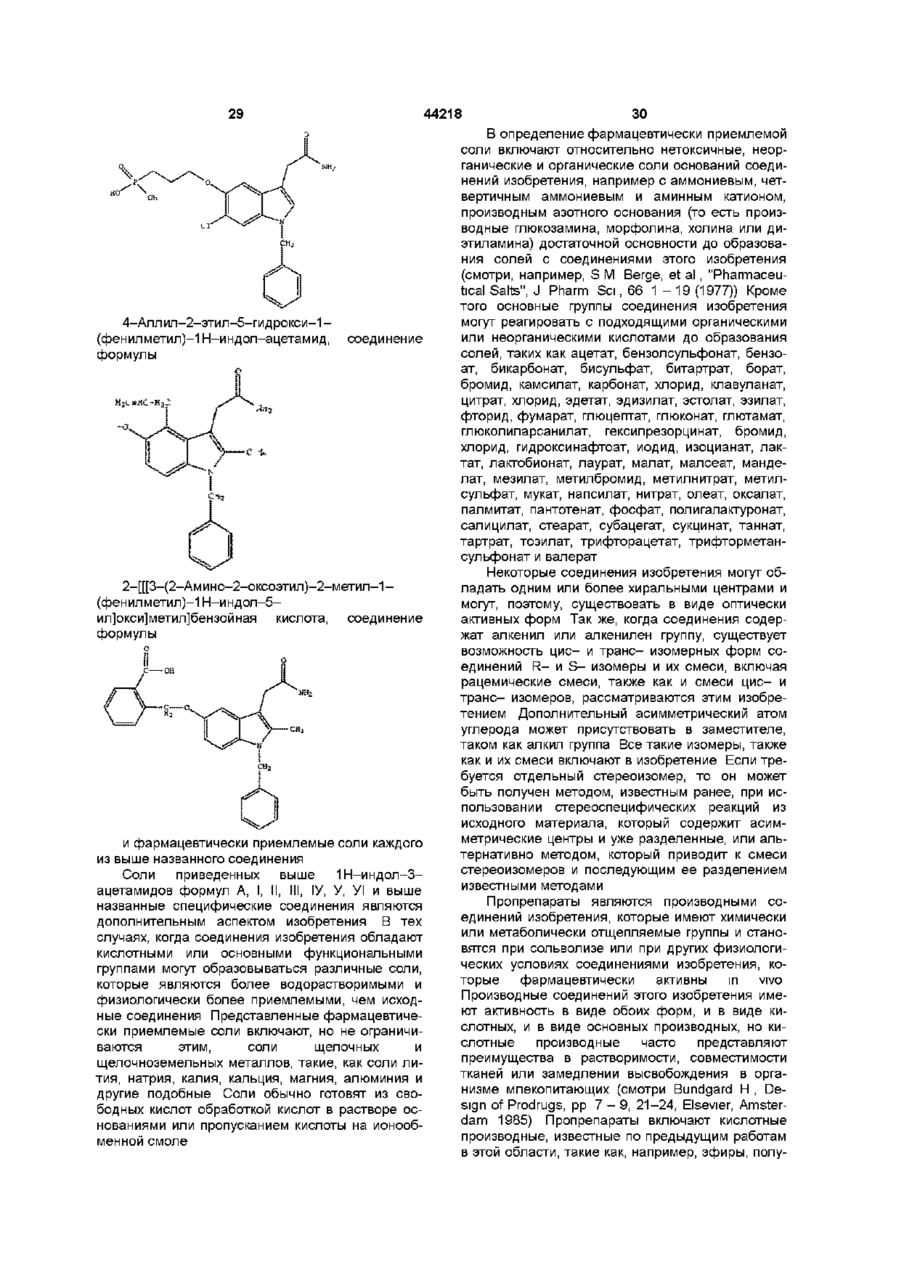
1н-індол-3-ацетаміди та фармацевтична композиція
Номер патенту: 44218
Опубліковано: 15.02.2002
Автори: Діллард Роберт Ділейн, Драхейм Сюзан Елізабет, Германн Роберт Белл, Шевіц Ричард Вальтер, Бах Ніколас Джеймс
Формула / Реферат
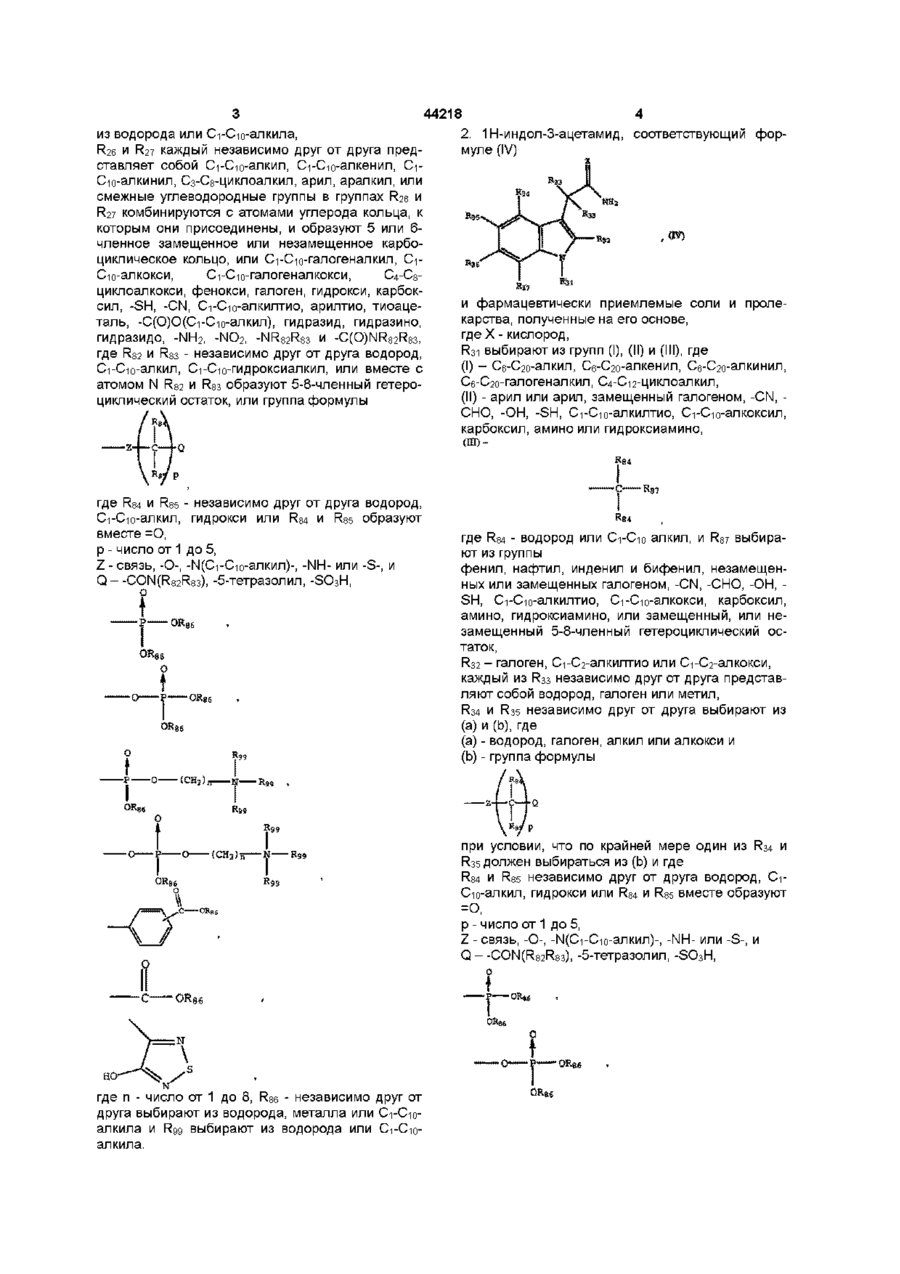
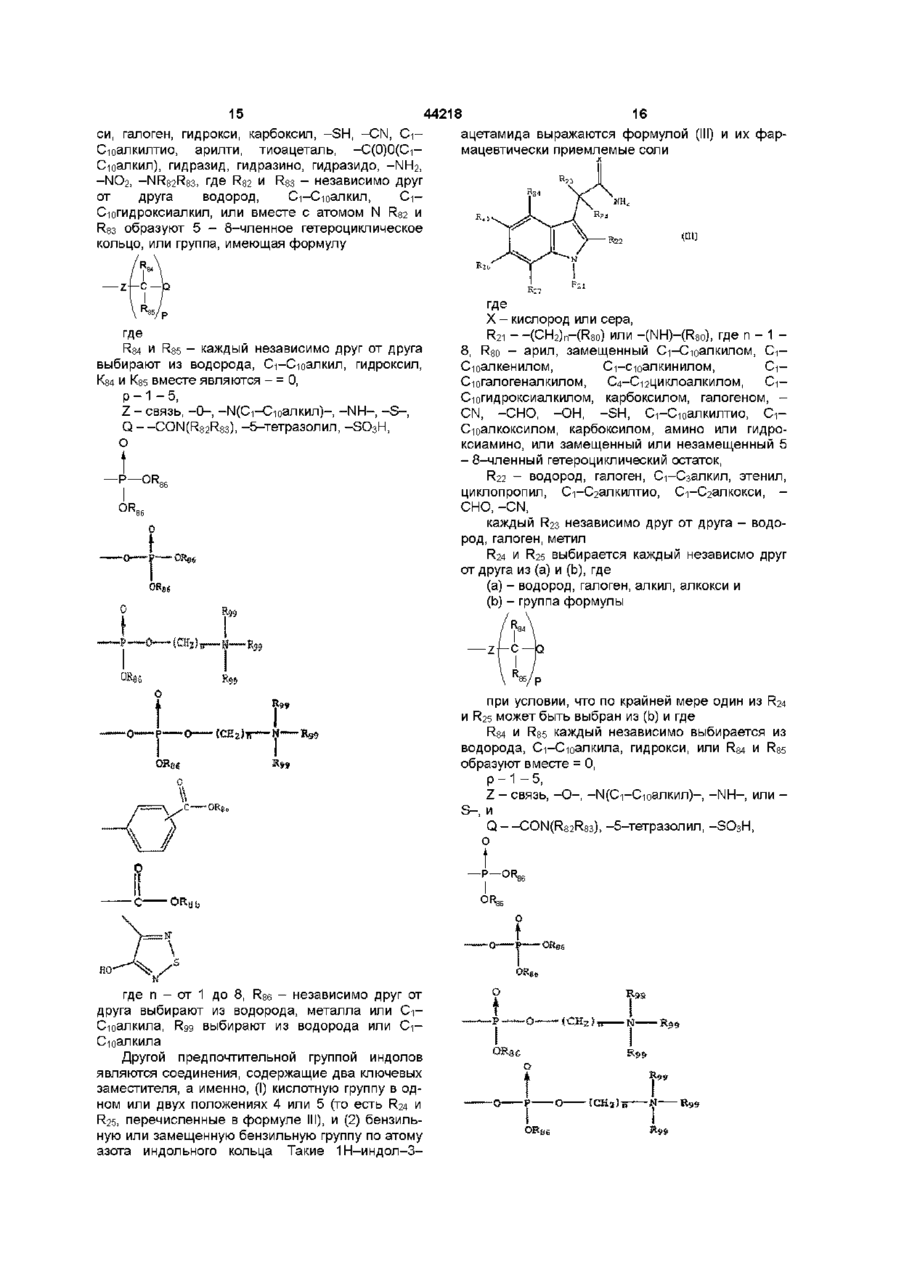
1. 1Н-индол-3-ацетамид, соответствующий формуле (III)
и фармацевтически приемлемые соли и пролекарства, полученные на его основе,
где Х - кислород,
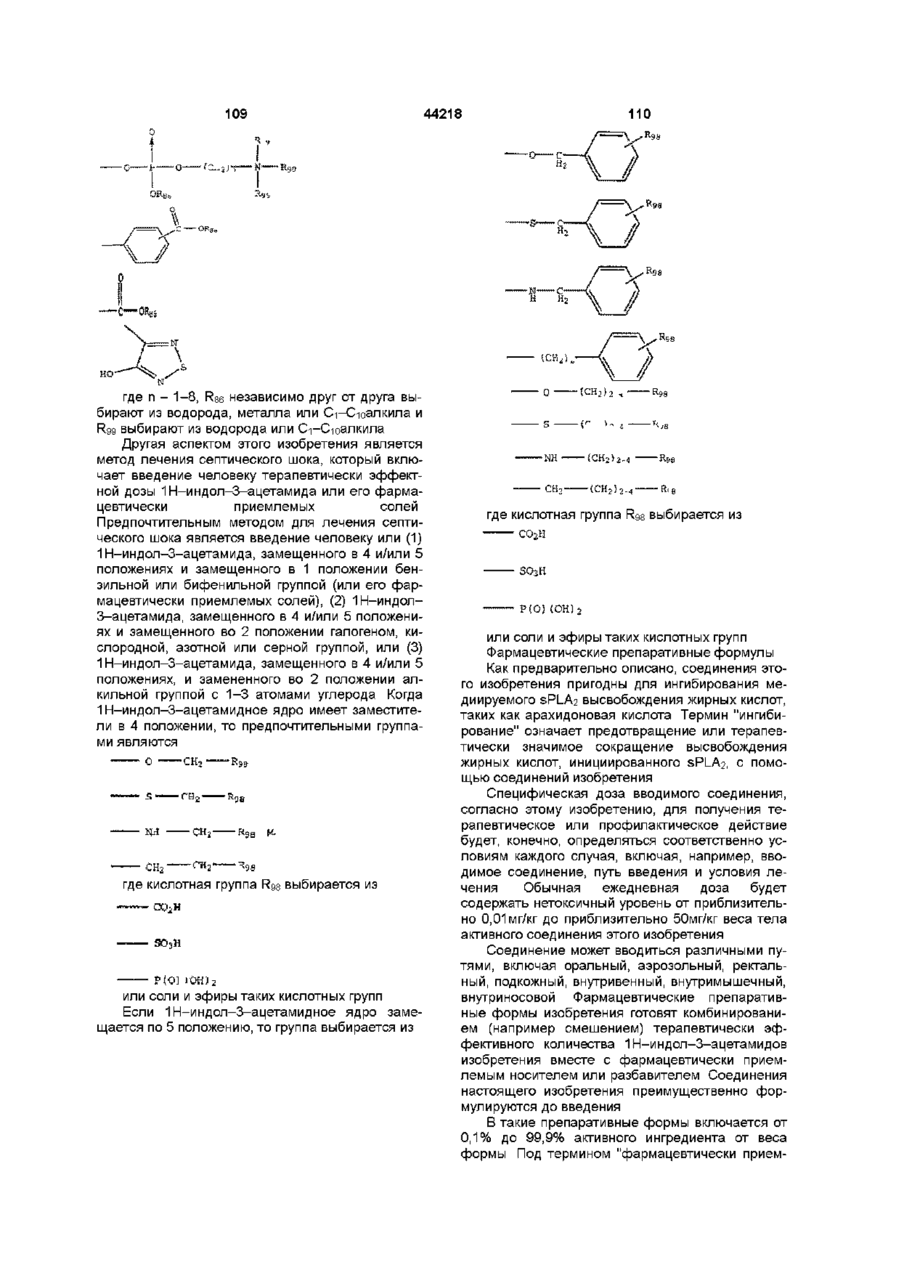
R21 – -(CH2)n-(R80) или -(NH)-(R80), где n - число от 1 до 8 и R80 - арил, арил, замещенный C1-C10-алкил, C2-C10-алкенил, C2-C10-алкинил, C1-C10-галогеналкил, C4-C12-циклоалкил, C1-C10-гидроксиалкил, карбоксил, галоген, -CN, -СНО, -ОН, -SH, C1-C10-алкилтио, C1-C10-алкоксил, карбоксил, амино или гидроксиамино или замещенный или незамещенный 5-8-членный гетероциклический остаток,
R22 - водород, галоген, C1-C3-алкил, этенил, циклопропил, C1-C2-алкилтио, C1-C2-алкокси, -СНО, -CN,
каждый R23 - независимо друг от друга водород, галоген или метил,
R24 и R25 независимо друг от друга выбирают из (а) и (b), где
(a) - водород, галоген, алкил или алкокси и
(b) - группа формулы
при условии, что по крайней мере один из R24 и R25 должен быть выбран из (b) и где
R84 и R85 независимо друг от друга выбираются из водорода, C1-C10-алкил, гидрокси или R84 и R85 вместе образуют =О,
р – число от 0 до 5,
Z - связь, -О-, -N(C1-C10-алкил)-, -NH- или -S-, и
Q - -СON((R82R83), -5-тетразолил, -SО3H,
где n - число от 1 до 8,
R86 - независимо друг от друга выбирают из водорода, металла или C1-C10-алкила и R99 выбирают из водорода или C1-C10-алкила,
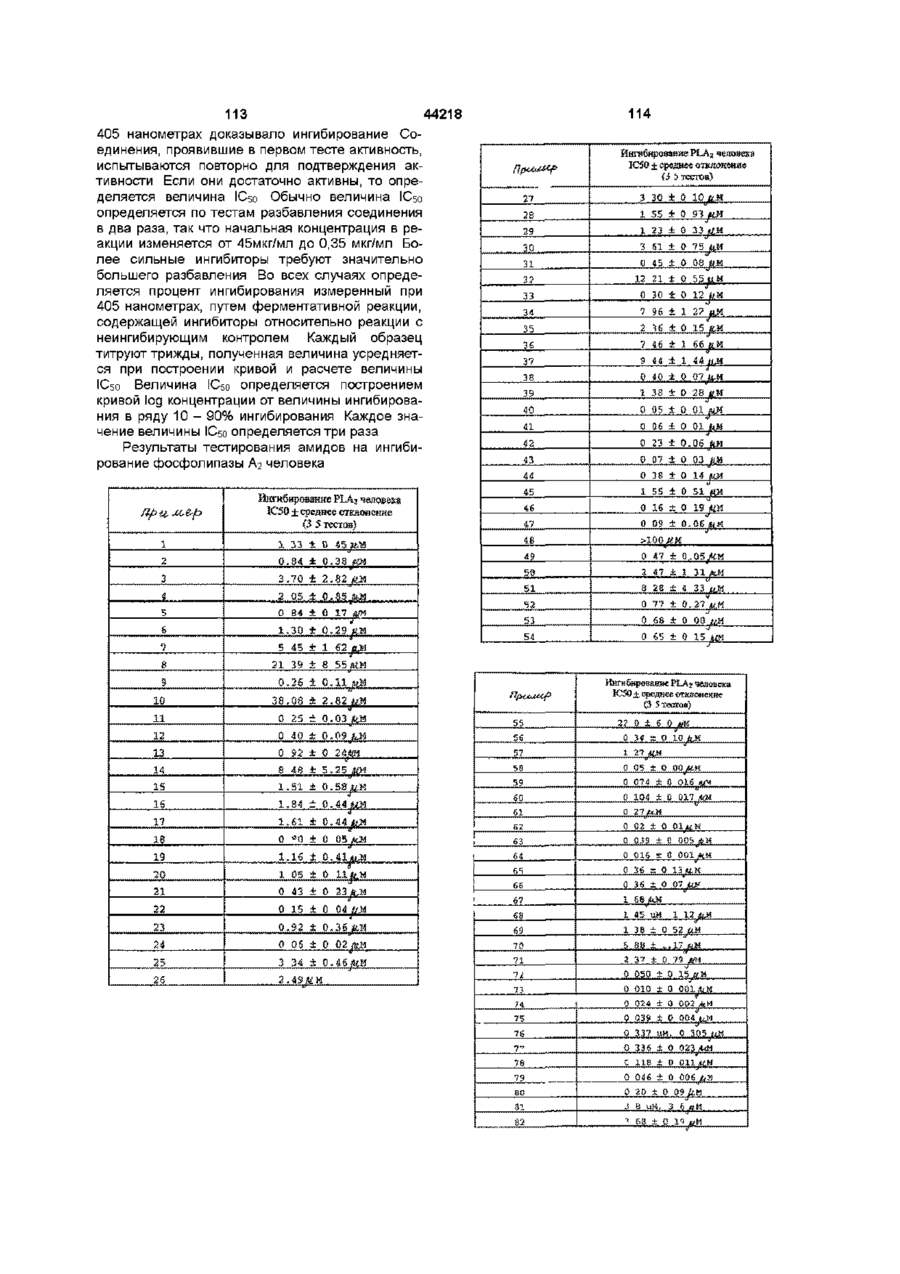
R26 и R27 каждый независимо друг от друга представляет собой C1-C10-алкил, C1-C10-алкенил, C1-C10-алкинил, C3-C8-циклоалкил, арил, аралкил, или смежные углеводородные группы в группах R26 и R27 комбинируются с атомами углерода кольца, к которым они присоединены, и образуют 5 или 6-членное замещенное или незамещенное карбоциклическое кольцо, или C1-C10-галогеналкил, C1-C10-алкокси, C1-C10-галогеналкокси, C4-C8-циклоалкокси, фенокси, галоген, гидрокси, карбоксил, -SH, -CN, C1-C10-алкилтио, арилтио, тиоацеталь, -С(О)О(C1-C10-алкил), гидразид, гидразино, гидразидо, -NH2, -NО2, -NR82R83 и -C(О)NR82R83, где R82 и R83 - независимо друг от друга водород, C1-C10-алкил, C1-C10-гидроксиалкил, или вместе с атомом N R82 и R83 образуют 5-8-членный гетероциклический остаток, или группа формулы
где R84 и R85 - независимо друг от друга водород, C1-C10-алкил, гидрокси или R84 и R85 образуют вместе =О,
р - число от 1 до 5,
Z - связь, -О-, -N(C1-C10-алкил)-, -NH- или -S-, и
Q – -CON(R82R83), -5-тетразолил, -SO3Н,
где n - число от 1 до 8, R86 - независимо друг от друга выбирают из водорода, металла или C1-C10-алкила и R99 выбирают из водорода или C1-C10-алкила.
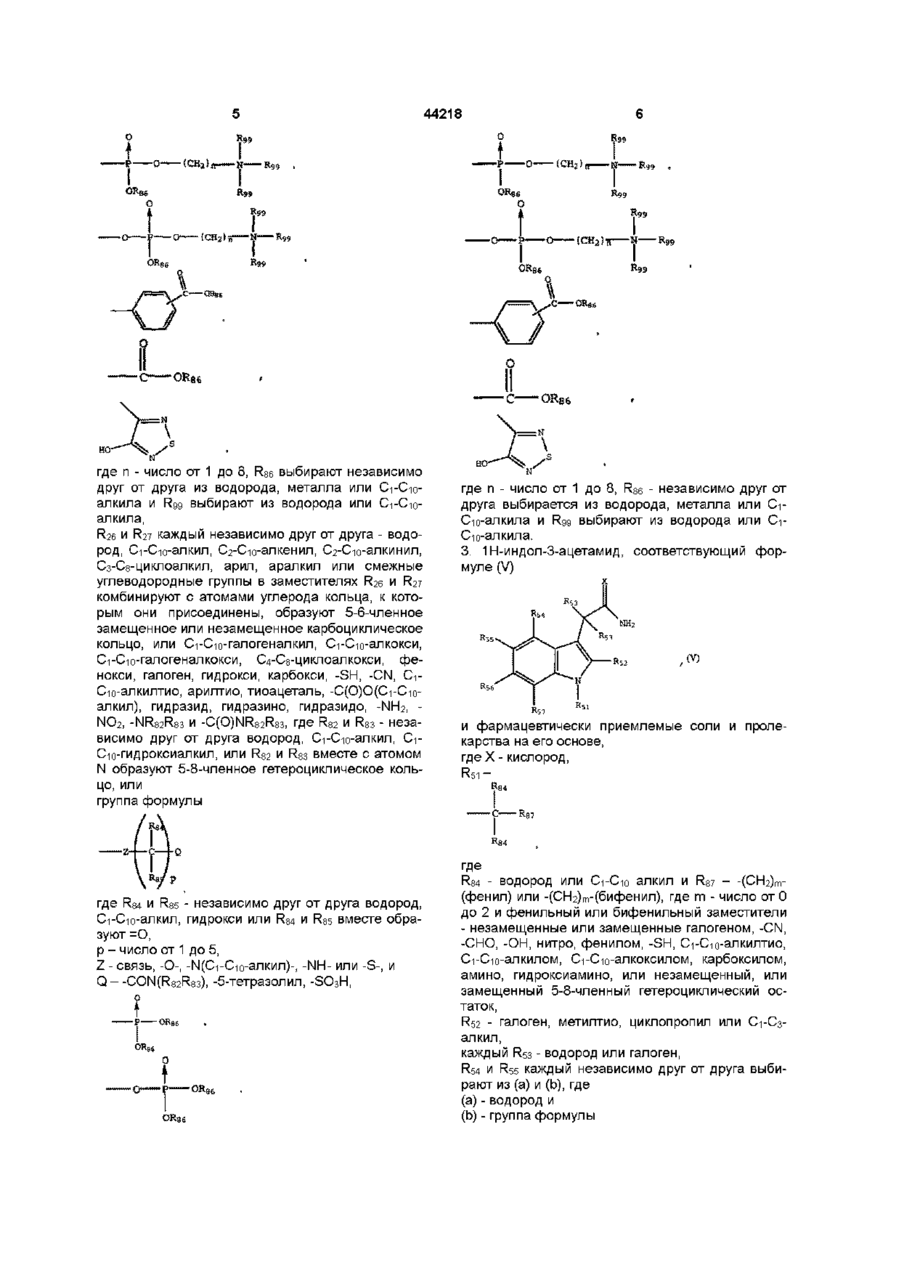
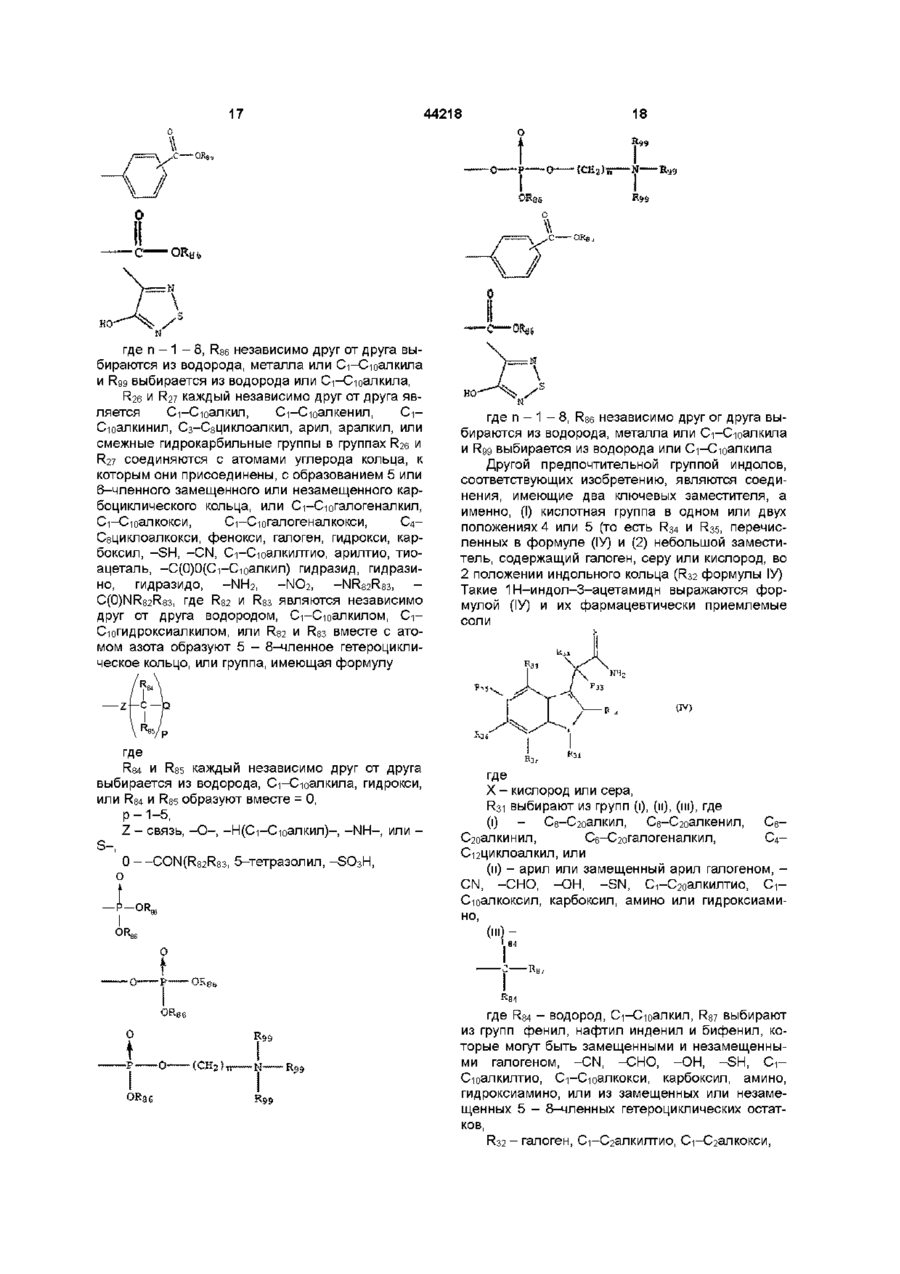
2. 1Н-индол-3-ацетамид, соответствующий формуле (IV)
и фармацевтически приемлемые соли и пролекарства, полученные на его основе,
где Х - кислород,
R31 выбирают из групп (I), (II) и (III), где
(I) – C6-C20-алкил, C6-C20-алкенил, C6-C20-алкинил, C6-C20-галогеналкил, C4-C12-циклоалкил,
(II) - арил или арил, замещенный галогеном, -CN, -СНО, -ОН, -SH, C1-C10-алкилтио, C1-C10-алкоксил, карбоксил, амино или гидроксиамино,
где R84 - водород или C1-C10 алкил, и R87 выбирают из группы
фенил, нафтил, инденил и бифенил, незамещенных или замещенных галогеном, -CN, -СНО, -ОН, -SH, C1-C10-алкилтио, C1-C10-алкокси, карбоксил, амино, гидроксиамино, или замещенный, или незамещенный 5-8-членный гетероциклический остаток,
R32 – галоген, C1-C2-алкилтио или C1-C2-алкокси,
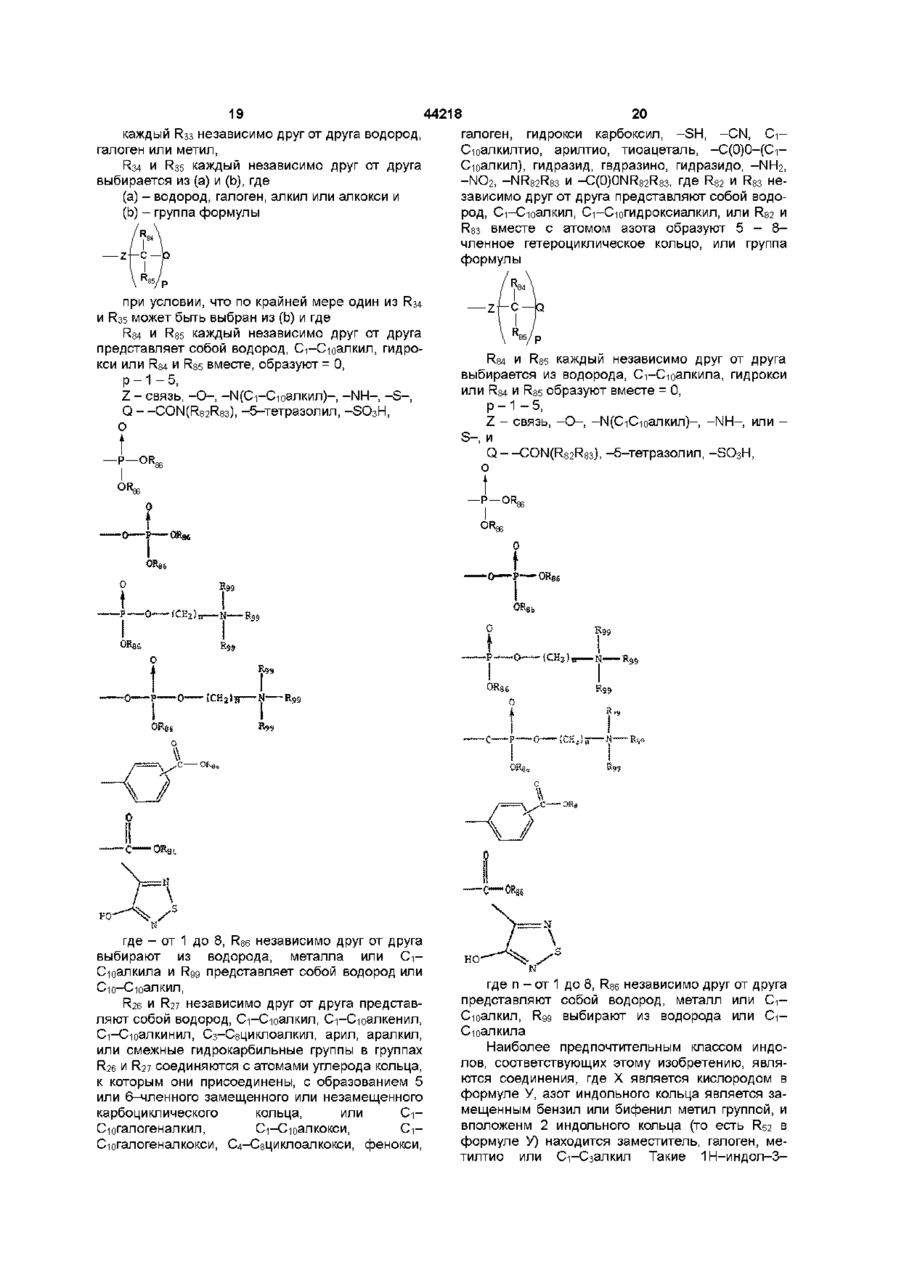
каждый из R33 независимо друг от друга представляют собой водород, галоген или метил,
R34 и R35 независимо друг от друга выбирают из (а) и (b), где
(a) - водород, галоген, алкил или алкокси и
(b) - группа формулы
при условии, что по крайней мере один из R34 и R35 должен выбираться из (b) и где
R84 и R85 независимо друг от друга водород, C1-C10-алкил, гидрокси или R84 и R85 вместе образуют =O,
р - число от 1 до 5,
Z - связь, -О-, -N(C1-C10-алкил)-, -NH- или -S-, и
Q – -CON(R82R83), -5-тетразолил, -SО3Н,
где n - число от 1 до 8, R86 выбирают независимо друг от друга из водорода, металла или C1-C10-алкила и R99 выбирают из водорода или C1-C10-алкила,
R26 и R27 каждый независимо друг от друга - водород, C1-C10-алкил, C2-C10-алкенил, C2-C10-алкинил, C3-C8-циклоалкил, арил, аралкил или смежные углеводородные группы в заместителях R26 и R27 комбинируют с атомами углерода кольца, к которым они присоединены, образуют 5-6-членное замещенное или незамещенное карбоциклическое кольцо, или C1-C10-галогеналкил, C1-C10-алкокси, C1-C10-галогеналкокси, C4-C8-циклоалкокси, фенокси, галоген, гидрокси, карбокси, -SH, -CN, C1-C10-алкилтио, арилтио, тиоацеталь, -С(О)О(C1-C10-алкил), гидразид, гидразино, гидразидо, -NH2, -NO2, -NR82R83 и -C(О)NR82R83, где R82 и R83 - независимо друг от друга водород, C1-C10-алкил, C1-C10-гидроксиалкил, или R82 и R83 вместе с атомом N образуют 5-8-членное гетероциклическое кольцо, или
группа формулы
где R84 и R85 - независимо друг от друга водород, C1-C10-алкил, гидрокси или R84 и R85 вместе образуют =О,
р – число от 1 до 5,
Z - связь, -О-, -N(C1-C10-алкил)-, -NH- или -S-, и
Q – -CON(R82R83), -5-тетразолил, -SO3H,
где n - число от 1 до 8, R86 - независимо друг от друга выбирается из водорода, металла или C1-C10-алкила и R99 выбирают из водорода или C1-C10-алкила.
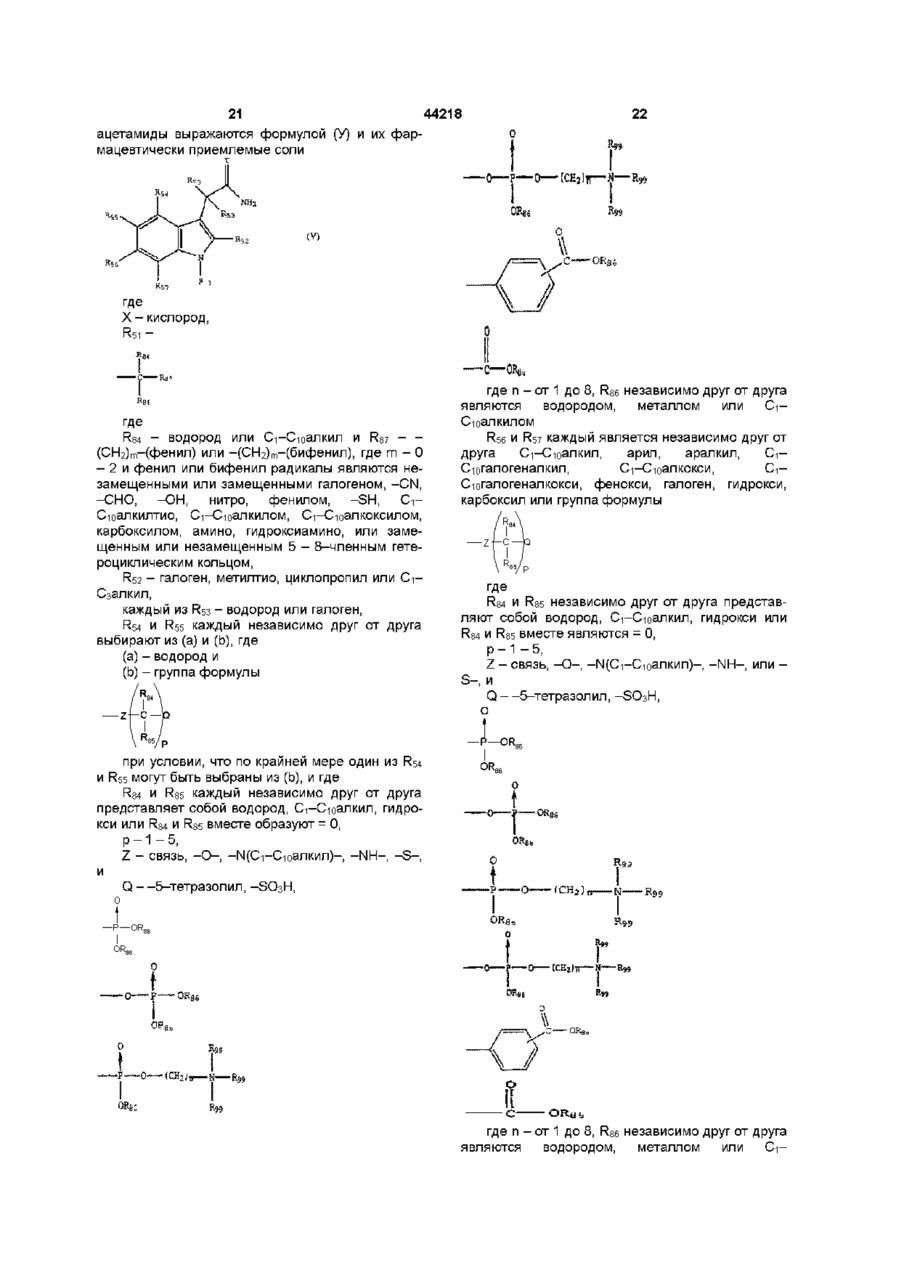
3. 1Н-индол-3-ацетамид, соответствующий формуле (V)
и фармацевтически приемлемые соли и пролекарства на его основе,
где Х - кислород,
R51 –
где
R84 - водород или C1-C10 алкил и R87 – -(СН2)m-(фенил) или -(СН2)m-(бифенил), где m - число от 0 до 2 и фенильный или бифенильный заместители - незамещенные или замещенные галогеном, -CN, -СНО, -ОН, нитро, фенилом, -SH, C1-C10-алкилтио, C1-C10-алкилом, C1-C10-алкоксилом, карбоксилом, амино, гидроксиамино, или незамещенный, или замещенный 5-8-членный гетероциклический остаток,
R52 - галоген, метилтио, циклопропил или C1-C3-алкил,
каждый R53 - водород или галоген,
R54 и R55 каждый независимо друг от друга выбирают из (а) и (b), где
(a) - водород и
(b) - группа формулы
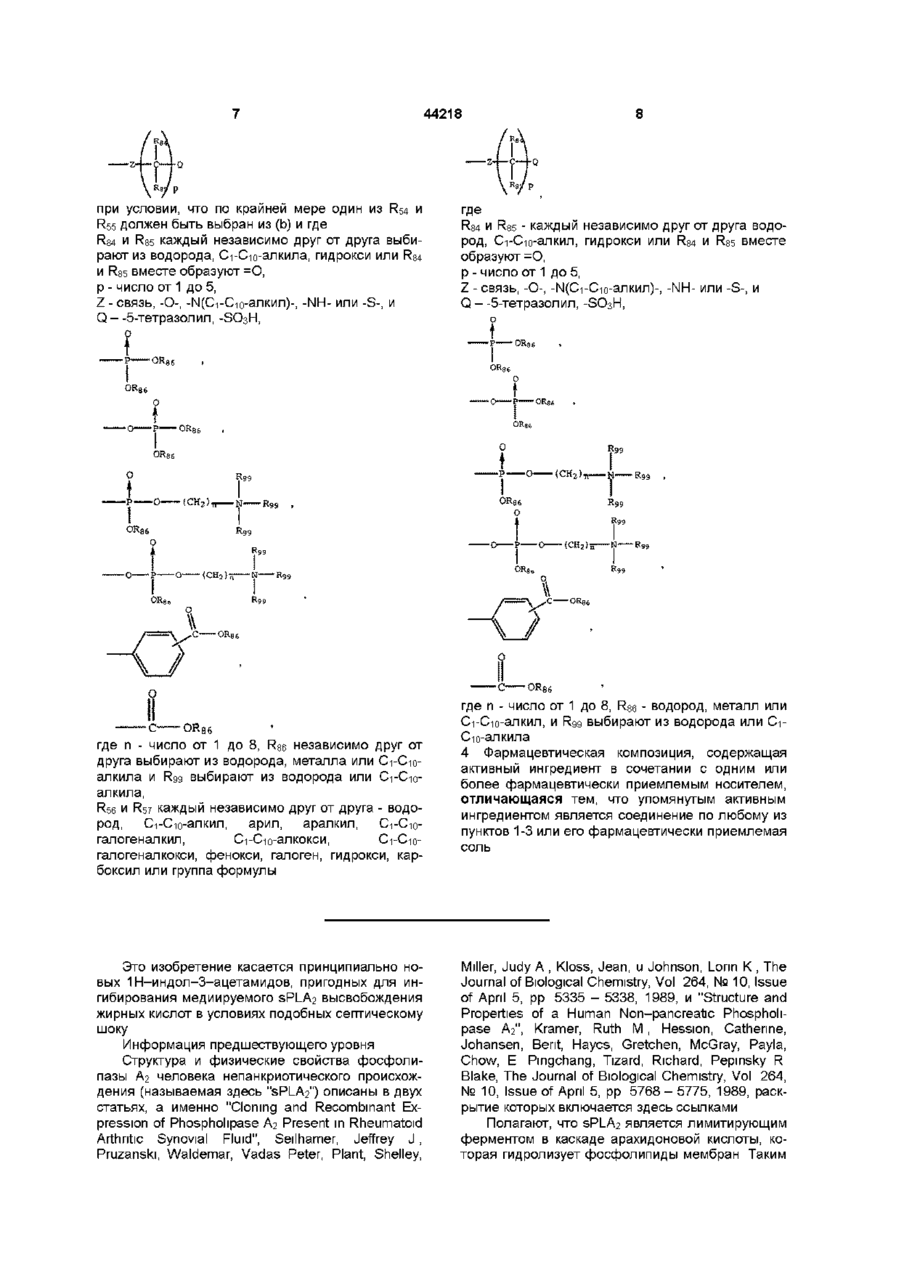
при условии, что по крайней мере один из R54 и R55 должен быть выбран из (b) и где
R84 и R85 каждый независимо друг от друга выбирают из водорода, C1-C10-алкила, гидрокси или R84 и R85 вместе образуют =О,
р - число от 1 до 5,
Z - связь, -О-, -N(C1-C10-алкил)-, -NH- или -S-, и
Q – -5-тетразолил, -SO3H,
где n - число от 1 до 8, R86 независимо друг от друга выбирают из водорода, металла или C1-C10-алкила и R99 выбирают из водорода или C1-C10-алкила,
R56 и R57 каждый независимо друг от друга - водород, C1-C10-алкил, арил, аралкил, C1-C10-галогеналкил, C1-C10-алкокси, C1-C10-галогеналкокси, фенокси, галоген, гидрокси, карбоксил или группа формулы
где
R84 и R85 - каждый независимо друг от друга водород, C1-C10-алкил, гидрокси или R84 и R85 вместе образуют =O,
р - число от 1 до 5,
Z - связь, -О-, -N(C1-C10-алкил)-, -NH- или -S-, и
Q – -5-тетразолил, -SO3Н,
где n - число от 1 до 8, R86 - водород, металл или C1-C10-алкил, и R99 выбирают из водорода или C1-C10-алкила.
4. Фармацевтическая композиция, содержащая активный ингредиент в сочетании с одним или более фармацевтически приемлемым носителем, отличающаяся тем, что упомянутым активным ингредиентом является соединение по любому из пунктов 1-3 или его фармацевтически приемлемая соль.
Текст
1 1Н-индол-3-ацетамид, формуле (III) при условии, что по крайней мере один из R24 и R25 должен быть выбран из (Ь) и где Rs4 и Rs5 независимо друг от друга выбираются из водорода, Сі-Сю-алкил, гидрокси или Rs4 и Rss вместе образуют =0, р - число от 0 до 5, Z - связь, -О-, -NfCi-Cio-алкил)-, -NH- или -S-, и Q - -CON((R82R83), -5-тетразолил, -SO3H, соответствующий •о—і О (Ш) и фармацевтически приемлемые соли и пролекарства, полученные на его основе, где X - кислород, R21 - -(CH2)n-(R8o) или -(NH)-(Rso), где п - число от 1 до 8 и Rso - арил, арил, замещенный С-і-С-юалкил, Сг-Сю-алкенил, Сг-Сю-алкинил, С-і-С-югалогеналкил, С4-Сі2-циклоалкил, С-і-С-югидроксиалкил, карбоксил, галоген, -CN, -СНО, ОН, -SH, Сі-Сю-алкилтио, Сі-Сю-алкоксил, карбоксил, амино или гидроксиамино или замещенный или незамещенный 5-8-членный гетероциклический остаток, R22 - водород, галоген, СгСз-алкил, этенил, циклопропил, Сі-Сг-алкилтио, С-і-Сг-алкокси, -СНО, CN, каждый R23 - независимо друг от друга водород, галоген или метил, R24 и R25 независимо друг от друга выбирают из (а) и (Ь), где (a) - водород, галоген, алкил или алкокси и (b) - группа формулы 00 ORg6 -О—-р——о—— •C OR 8 6 где п - число от 1 до 8, Rs6 - независимо друг от друга выбирают из водорода, металла или С-і-С-ю-алкила и R99 выбирают из водорода или С-і-С-ю-алкила, F 2 и R27 каждый независимо друг от друга пред?6 ставляет собой Сі-Сю-алкил, С-і-С-ю-алкенил, C r Сю-алкинил, Сз-Св-циклоалкил, арил, аралкил, или 44218 2. 1Н-индол-3-ацетамид, соответствующий формуле (IV) СМеЖНЫе уГЛеВОДОрОДНЫе ГруППЫ В Г р у п п а х F?26 И R27 комбинируются с атомами углерода кольца, к которым они присоединены, и образуют 5 или 6членное замещенное или незамещенное карбоциклическое кольцо, или С-і-С-ю-галогеналкил, С г Сю-алкокси, Сі-Сю-галогеналкокси, d-Csциклоалкокси, фенокси, галоген, гидрокси, карбоксил, -SH, -CN, Ci-Сю-алкилтио, арилтио, тиоацеталь, -С(О)О(Сі-Сю-алкил), гидразид, гидразино, гидразидо, -NH2, -NO2, -NR82Rs3 и -C(O)NR82Rs3, где Rs2 и Rs3 - независимо друг от друга водород, Сі-Сю-алкил, С-і-С-ю-гидроксиалкил, или вместе с атомом N Rs2 и Rs3 образуют 5-8-членный гетероциклический остаток, или группа формулы и фармацевтически приемлемые соли и пролекарства, полученные на его основе, где X - кислород, R31 выбирают из групп (I), (II) и (III), где (I) - Сб-Сго-алкил, Сб-Сго-алкенил, Сб-Сго-алкинил, Сб-Сго-галогеналкил, С4-Сі2-циклоалкил, (II) - арил или арил, замещенный галогеном, -CN, СНО, -ОН, -SH, СгСю-алкилтио, d-Сю-алкоксил, карбоксил, амино или гидроксиамино, (Ш) где Rs4 и Rs5 - независимо друг от друга водород, Сі-Сю-алкил, гидрокси или Rs4 и Rss образуют вместе =0, р - число от 1 до 5, Z - связь, -0-, -NfCi-Cio-алкил)-, -NH- или -S-, и Q--CON(R82R83), -5-тетразолил, -SO3H, о •О -Р -О Р О (СН 3 ) Я к (CH 3 )s R s 9 N где Rs4 - водород или Сі-Сю алкил, и Rs7 выбирают из группы фенил, нафтил, инденил и бифенил, незамещенных или замещенных галогеном, -CN, -СНО, -ОН, SH, Ci-Сю-алкилтио, Сі-Сю-алкокси, карбоксил, амино, гидроксиамино, или замещенный, или незамещенный 5-8-членный гетероциклический остаток, R32 - галоген, СгСг-алкилтио или СгСг-алкокси, каждый из R33 независимо друг от друга представляют собой водород, галоген или метил, R34 и R35 независимо друг от друга выбирают из (а) и (Ь), где (a) - водород, галоген, алкил или алкокси и (b) - группа формулы , R99 При УСЛОВИИ, ЧТО ПО К р а й н е й о - Qn где п - число от 1 до 8, Rs6 - независимо друг от друга выбирают из водорода, металла или С-і-С-юалкила и R99 выбирают из водорода или С-і-С-юалкила. М е р е ОДИН ИЗ R34 И R35 должен выбираться из (Ь) и где Rs4 и Rs5 независимо друг от друга водород, СіСю-алкил, гидрокси или Rs4 и Rs5 вместе образуют =0, р - число от 1 до 5, Z - связь, -0-, -І\І(Сі-Сю-алкил)-, -NH- или -S-, и Q--CON(R82R83), -5-тетразолил, -SO3H, 44218 -Р .Q О (СН 3 )я р о У •С Н (СНа)ц R39 'М ORss •0Rg6 где п - число от 1 до 8, Rs6 выбирают независимо друг от друга из водорода, металла или С-і-С-юалкила и R99 выбирают из водорода или С-і-С-юалкила, R26 и R27 каждый независимо друг от друга - водород, Сі-Сю-алкил, Сг-С-ю-алкенил, Сг-С-ю-алкинил, Сз-Св-циклоалкил, арил, аралкил или смежные где п - число от 1 до 8, Rs6 - независимо друг от друга выбирается из водорода, металла или d С-ю-алкила и R99 выбирают из водорода или d Сю-алкила. 3. 1Н-индол-3-ацетамид, соответствующий формуле (V) х уГЛеВОДОрОДНЫе ГруППЫ В Заместителях R26 И R27 комбинируют с атомами углерода кольца, к которым они присоединены, образуют 5-6-членное замещенное или незамещенное карбоциклическое кольцо, или Сі-Сю-галогеналкил, Сі-Сю-алкокси, Сі-Сю-галогеналкокси, С4-С8-циклоалкокси, фенокси, галоген, гидрокси, карбокси, -SH, -CN, d Сю-алкилтио, арилтио, тиоацеталь, -С(О)О(Сі-Сюалкил), гидразид, гидразино, гидразидо, -NH2, NO2, -NR82R83 и -C(O)NR82R83, где R82 и R83 - независимо друг от друга водород, С-і-С-ю-алкил, С г Сю-гидроксиалкил, или Rs2 и Rs3 вместе с атомом N образуют 5-8-членное гетероциклическое кольцо, или группа формулы где Rs4 и Rs5 - независимо друг от друга водород, Сі-Сю-алкил, гидрокси или Rs4 и Rss вместе образуют =0, р - число от 1 до 5, Z - связь, -0-, -NfCi-Cio-алкил)-, -NH- или -S-, и Q--CON(R82R83), -5-тетразолил, -SO3H, -^к -1^ г (V) и фармацевтически приемлемые соли и пролекарства на его основе, где X - кислород, R51 где Rs4 - водород или C-i-C-io алкил и Rs7 —(CH2) m (фенил) или -(СН2)т-(бифенил), где гп - число от О до 2 и фенильныи или бифенильныи заместители - незамещенные или замещенные галогеном, -CN, -СНО, -ОН, нитро, фенилом, -SH, С-і-Сю-алкилтио, С-і-С-іо-алкилом, Сі-Сю-алкоксилом, карбоксилом, амино, гидроксиамино, или незамещенный, или замещенный 5-8-членный гетероциклический остаток, R52 - галоген, метилтио, циклопропил или С-і-Сзалкил, каждый R53 - водород или галоген, R54 и R55 каждый независимо друг от друга выбирают из (а) и (Ь), где (a) - водород и (b) - группа формулы 44218 При УСЛОВИИ, ЧТО ПО К р а й н е й М е р е ОДИН ИЗ R54 И R55 должен быть выбран из (Ь) и где Rs4 и Rs5 каждый независимо друг от друга выбирают из водорода, Сі-Сю-алкила, гидрокси или Rs4 и Rs5 вместе образуют =0, р - число от 1 до 5, Z - связь, -0-, -NfCi-Cio-алкил)-, -NH- или -S-, и Q - -5-тетразолил, -SO3H, о где Rs4 и Rs5 - каждый независимо друг от друга водород, Сі-Сю-алкил, гидрокси или Rs4 и Rss вместе образуют =0, р - число от 1 до 5, Z - связь, -0-, -І\І(Сі-Сю-алкил)-, -NH- или -S-, и Q - -5-тетразолил, -SO3H, о — P-OR. ORS$ о t О Р ОКДЙ ОЕай Р О (CHj In О _ L о_Р ORgt. о_(СН2Ііі 1 И """™ R.99 • Л , R99 R9S Q 4 / где п - число от 1 до 8, Rs6 независимо друг от друга выбирают из водорода, металла или С-і-С-юалкила и R99 выбирают из водорода или С-і-С-юалкила, R56 и R57 каждый независимо друг от друга - водород, Сі-Сю-алкил, арил, аралкил, С-і-С-югалогеналкил, Сі-Сю-алкокси, С-і-С-югалогеналкокси, фенокси, галоген, гидрокси, карбоксил или группа формулы Это изобретение касается принципиально новых 1Н-индол-3-ацетамидов, пригодных для ингибирования медиируемого SPLA2 высвобождения жирных кислот в условиях подобных септическому шоку Информация предшествующего уровня Структура и физические свойства фосфолипазы Аг человека непанкриотического происхождения (называемая здесь 'SPLA2") описаны в двух статьях, а именно "Cloning and Recombmant Expression of Phosphohpase A2 Present in Rheumatoid Arthritic Synovial Fluid", Seilhamer, Jeffrey J , Pruzanski, Waldemar, Vadas Peter, Plant, Shelley, где n - число от 1 до 8, Rs6 - водород, металл или Сі-Сю-алкил, и R99 выбирают из водорода или d Сю-алкила 4 Фармацевтическая композиция, содержащая активный ингредиент в сочетании с одним или более фармацевтически приемлемым носителем, отличающаяся тем, что упомянутым активным ингредиентом является соединение по любому из пунктов 1-3 или его фармацевтически приемлемая соль Miller, Judy A , Kloss, Jean, u Johnson, Lorm К , The Journal of Biological Chemistry, Vol 264, № 10, Issue of April 5, pp 5335 - 5338, 1989, и "Structure and Properties of a Human Non-pan create Phosphohpase A2", Kramer, Ruth M , Hession, Catherine, Johansen, Bent, Hayes, Gretchen, McGray, Payla, Chow, E Pmgchang, Tizard, Richard, Pepmsky R Blake, The Journal of Biological Chemistry, Vol 264, № 10, Issue of April 5, pp 5768 - 5775, 1989, раскрытие которых включается здесь ссылками Полагают, что SPLA2 является лимитирующим ферментом в каскаде арахидоновой кислоты, которая гидролизует фосфолипиды мембран Таким 44218 10 образом, важно получить соединения, которые 3-ацетамиды, для ингибирования медиируемого ингибируют медиируемое SPLA2 высвобождение SPLA2 человека высвобождения жирных кислот жирных кислот (например арахидоновои кислоты) Это изобретение представляет также новый Такие соединения были бы ценны при общем лекласс 1Н-индол-3-ацетамидов, обладающих чении для индуцирования и/или поддержания высильным и избирательным действием в качестве сокого уровня SPLA2 таких случаев, как септичеингибиторов SPLA2 человека ский шок, синдрома расстройства дыхания у Это изобретение дает также фармацевтичесвзрослых, панкреатит, травма, бронхиальная асткие составы, содержащие 1 Н-индол-3ма, аллергический ринит, ревматический артрит и ацетамиды изобретения тд Это изобретение предлагает также метод предупреждения и лечения септического шока с Индолил-3 замещенные соединения, содериспользованием 1Н-индол-3-ацетамидов изожащие глиоксиамидную группу описаны в пат бретения США 2825734 Этот патент касается способа получения глиоксиамидов 3-(2-амино-1Определения гидроксиэтил)индолов 1Н-индол-3-ацетамиды изобретения употПат США № 3271416 описывает индолинребляют некоторые определяющие понятия, наалифатические кислоты в качестве конечных пример следующие агентов и промежуточных продуктов Эти кислоты Понятие "алкил" само по себе или как часть могут быть -NH2 замещенными (смотри опредедругого заместителя означает, если особо не укаление М в пункте 1) и требуют замещения в 5- или зано, прямую или разветвленную цепочку монова6-положениях азот- или серосодержащими груплентного углеводородного радикала, например, пами метил, этил, пропил, изопропил, н-бутил, третичный бутил, изобутил, втор-бутил, н-пентил и hiПат США № 2890223 и статья "The Synthesis re кс ил of Tryptammes Related to Serotonin", Elliot Shaw, J Am Chem Soc , Vol 77, 1955, (pp 4319 - 4324) Понятие "алкенил", употребляемое одно или в описывают различные производные амидов 3 комбинации с другими понятиями означает пряиндолуксусной кислоты Эти соединения примемую цепочку или разветвленную моновалентную няются для получения 5-(низший алкокуглеводородную группу, имеющую установленное си)триптаминов и, как установлено, являются поколичество атомов углерода, примерами являютлезными в плане их влияния на функцию мозга, ся такие группы, как винил, пропенил, кротоноил, медиируемую серотонином Кроме того, статья изопентенил и различные изомеры бутенила "Recherches en senc mdohque VI sur tryptammes Термин "галоген" означает фтор, хлор, бром substituees", Marc Julia, Jean Igolen and Hanne Igoили йод len, Bull Soc Chim France, 1962, pp 1060 - 1068 Термин "гетероциклический радикал" относитописывает некоторые индол-3-ацетамиды и их ся к радикалам моноциклических или полициклипревращение в производные триптамина ческих, насыщенных или ненасыщенных, замещенных или незамещенных гетероциклических Отдельные соединения типа индолиламидов колец, имеющих 5 - 1 4 атомов и содержащих от 1 описаны в литературе пригодными для лечения до 3 гетероатомов, выбранных из азота, кислороартрита Так, пат США № 3196162, 3242162, да или серы Типичными гетероциклическими ра3242163 и 3242193 (смотри кол 3, строки 55 - 60, дикалами являются пирролил, фуранил, тиофепример 56) описывают индолил алифатические нил, пиразолил, имидазолил, фенилимидазолил, кислоты, их соли, эфиры и амиды Эти соединения триазолил, изоксазолил, оксазолил, тиазолил, тесно связаны с соединениями типа индометацитиадиазолил, индолил, карбазолил, норхарманил, на, имеют замещенную бензильную группу в 1 азаиндолил, бензофуранил, дибензофуранил, положении и вероятно обладают их благотворным тианафтенеил, дибензотиофенил, индазолил, действием ингибиторов циклооксигепазы имидазо(1 2-А)пиридинил, бензотриазолил, анСтатья "Some Analogs of 1-p-Chlorobenzyl-5транилил, 1,2-бенизоксазолил, бензоксазолил, methylmdole-3-acetic Acid", E Walton, et al , J Med бензотиазолил, пуринил, пиридинил, дипиридиChem Vol 11, 1968, pp 1252 - 1255 описывает лил, фенилпиридинил, бензилпиридинил, пиримиполучение изомерного метилового эфира 3-(1-пдинил, фенил пиримидинил, пиразинил, 1,3,5хлорбензил-5-метокси-3-метилиндол-2)триазинил, хинолинил, фталазинил, хиназолинил, пропионовой кислоты хиноксалинил Статья "2-Aryl-3-lndoleacetamides (FG-IN-1) A New Class of Potent and Specific Ligands for the Термин "карбоциклический радикал" относитMitochondrial DB] Receptor (MDR)", E Romeo, et al ся к радикалам насыщенных или ненасыщенных, The Journal of Pharmacology and Experimental замещенных или незамещенных 5 - 1 4 членных Therapeutics Vol 262, № 3, (pp 971 - 978) описыорганических колец, которые состоят исключивает 2-арил-З-индолацетамиды, имеющие истельно из атомов углерода Типичными карбоцикследовательское применение на центральной лическими радикалами являются циклоалкил цикнервной системе млекопитающих лоалкенил, фенил, нафтил, норборнанил, бициклогептадиенил, толуил, ксиленил, бифенил, Рассмотрено получение новых соединений и инденил, аценафтиленил и антраценил применение их для лечения болезней, индуцируемых SPLA2 Понятие "немешающий заместитель" относитЭто изобретение является новым использовася к заместителям, пригодным для замещения по нием класса соединений известных как 1Н-индолположениям 4, 5, 6 и/или 7 индольного кольца (как представлено ниже в формуле 1) и к радикал(ам), 44218 11 12 О пригодным для замещения по гетероциклическому или карбоциклическому радикалам, которые покаС—ОН заны выше Примерами таких радикалов являются С-і-Сб алкил, С-і-Сб алкенил, С-і-Сє алкинил, С7С^аралкил, С7-С12 алкарил, Сз-Свциклоалкил, Сз-Свциклоалкенил, фенил, толуил, ксиленил, бифенил, Сі-Сєалкокси, Сі-Сєалкенилокси, С і Сєалкинилокси, Сг-Сігалкоксиалкил, Czгде п-1-8, Rs9 - металл или С-і-С-ю-алкил и Сігалкоксиалкилокси, Сг-С^алкилокарбонил, CzR99 - водород или Сі-Сю-алкил С^алкилкарбониламино, Сг-С^алкоксиамино, CzСоединения изобретения, обладающие споС^алкоксиаминокарбонил, Сг-С^алкиламино, С-ісобностью ингибировать SPLA2 человека посредСєалкилтио, Сг-С^алкилтиокарбонил, С-іством высвобождения жирных кислот, выбираютСєалкилсульфинил, Сі-Сєалкилсульфонил, С-іся из "1Н-индол-3-ацетамидов", имеющих общую Сєгалогеналкоксил, Сі-Сбгалогеналкилсульфонил, формулу (А) Сі-Сєгидроксиалил, -С(0)0(Сі-Сєалкил), -(СН2)ППН; О-(Сі-Сєалкил), бензилокси, фенокси, фенилтио, (-CONHSO2R), -СНО, амино, амидино, бром, карбамил, карбоксил, -(СНгЭп-СОгН, хлор, циано, цианогуанидинил, фтор, гуанидино, гидразид, гидразино, гидразидо, гидрокси, гидроксиамино, йод, нитро, фосфоно, -SO3H, тиоацегаль, тиокарбонил, трифторметил и Сі-Сбкарбонил, где п - от 1 до 8 где Z - бивалентный органический радикал, Термин "амин" включает первичные, вторичпредставляющий собой . О S ные и третичные амины, Термин "гидрокарбил" означает органическую группу, содержащую только углерод и водород Понятие "кислотная группа" означает органиили і ческую группу, которая присоединяется к индольи незамещенные положения индольного кольному кольцу через соединительный атом, дейстца могут включать независимо водород или невует как донор протонов, способный связывать мешающий заместитель Индольный атом азота водород Примерами кислотных групп являются формулы (А) предпочтительно замещается 5-тетразолил, (СЬІ2)і-8-(карбоциклический радикал)лом или -SOjH, (СЬІ2)і-8-(гетероциклический радикал) о Предпочтительным классом соединений согласно этому изобретению являются соединения, •он имеющие в качестве заместителя у индольного атома азота арил, алкил, галогеналкил, алкенил или алкинил группы и в положении 2 индольного кольца (примыкающем к индольному азоту) отно—о—р—он сительно короткую группу (вплоть до приблизительно 3 атомов углерода или аналогичную) Такие 1Н-индол-3-ацетамиды выражаются формулой (I) и их фармацевтически приемлемые —р—он соли он о — О — р — ОН он о Р—О—(CH 2 ) n —N ОН О -О— Р—О—(CH2)n—N—Rg 0R BS п R 99 где Х - кислород или сера, Ri выбирается из групп (і), (іі) и (їм), где (і) - Сє-Сго-алкил, Сє-Сго-алкенил, Сє-Сгоалкинил, Сб-Сго-галогеналкил, С4-С12циклоалкил, (м) - выбирается из групп фенил, нафтил, инденил, бифенил, каждая из групп является замещенной или незамещенной заместителями галогеном, -CN, -СНО, -ОН, нитро, -SH, C-iСюалкоксил, ,Сі-Сюалкил, карбоксил, амино или гидроксиамино, (MI) --(CH 2 ) n -(R8o), или -(NH)-(R 81 ), где n - 1 8 и Rso является группой, значения которой пере 13 44218 числены в (і), И RSI выбирается из групп, перечисленных в (і) или (м), R2 - водород, галоген, Сі-Сзалкил, этенил, циклопропил, Сі-С 2 алкилтио, Сі-Сгалкокси, СНО, и л и - C N , каждый R3 независимо друг от друга является водородом, галогеном или метилом, F?4, R5, Re и R7 каждый независимо друг от друга является водородом, С-і-С-юалкилом, С-іСюалкенилом, Сі-Сюалкинилом, СзСвциклоалкилом, арилом, аралкилом или любые две смежные гидрокарбильные группы в серии F?4, Rs, R6 и R7 соединяются с атомами углеводорода кольца, к которым они присоединены, с образованием 5 или 6-членного и замещенного или незамещенного углеводородного кольца, или это - С-1Сюгалогеналкил, С-і-С-юалкокси, С-іСюгалогеналкокси, С4-С8Циклоалкокси, фенокси, галоген, гидроксил, карбоксил, - Н , - О Н , С-іСюалкилтио, арилтио, тиоацеталь, - С ( 0 ) 0 ( С і С-юалкил), гидразил, гидразино, гидразидо, -NH2, NO 2 , - N R 8 2 R 8 3 и -C(0)NR 8 2 R 8 3 , где R 82 и R 83 - независимо друг от друга водород, С-і-С-юалкил, С-іСюгидроксиалкил или R 82 и R83 вместе с атомом N образуют 5 - или - 8-членное гетероциклическое кольцо, или это - группа формулы 14 где п - 1 - 8, R86 - независимо друг от друга выбираются из группы водород, металл или C-iСюалкил, R99 - водород или С-і-С-юалкил Другим предпочтительным классом индолов, соответствующих этому изобретению, являются соединения, содержащие алкил, арил или бензил группы или их производные в положении азота индольного кольца Такие 1 Н-индол-3ацетамиды выражаются формулой (II) и их фармацевтически приемлемые соли Rja V») О -ORC где R84 и R85 - каждый независимо друг от друга выбираются из водорода, С-і-С-юалкила, гидроксила, или R84 и R85 вместе являются группой = О, р — 1 — 5, Z - связь, - 0 - , -І\І(Сі-Сюалкил)-, - N H - , или SQ - -CON(R 8 R 83 ), -5-тетразил, - S O 3 H , О P—— 0 — " ( d i g ) , , й« R5& О *~ (СНз) ЇГ""""" где Х - кислород или сера, Rn выбирают из групп (і), (іі), (їм) и (iv), где (і) Сб-С2оал кил, Сб-С2оал кен и л, СєС2оалкинил, Сє-С2огалогеналкил, С4Сі2циклоалкил или (м) - арил, замещенный арил заместителями галоген, нитро, -CN, -СНО, -ОН, -SH, С і С-юалкил, Сі-Сюалкилтио, Сі-Сюалкоксил, карбоксил, амино, гидроксиамино, или (їм) - -(CH 2 ) n -(R 80 ), -(NH)-(R 81 ), где n - 1 - 8, Rso - группы, перечисленные в (і) ИЛИ (ІІ), (IV) где R87 - водород, Сі-Сюалкил и R88 выбирают из групп фенил, нафтил, инденил и бифенил, замещенных или незамещенных галогеном, -CN, -СНО, -ОН, -SH, Сі-Сюалкилтио, СіСюалкоксилом, фенилом, нитро, С-і-С-юалкилом, Сі-Сюгалогеналкилом, карбоксилом, амино, гидроксиамино, или замещенный или незамещенный 5 - 8-членный гетероциклический остаток, R-I2 - галоген, Сі-С2алкилтио, Сі-С 2 алкокси, каждый из R13 независимо друг от друга водород, галоген, метил, R-I4, Ri5, R16, и Ru - каждый независимо друг от друга водород, С-і-С-юалкил, Сі-Сюалкенил, Сі-Сюалкинил, Сз-С8циклоалкил, арил, аралкил или любые две смежные гидрокарбильные группы в серии R-I4, R-I5, Ri6, и Ru, соединяются с атомами углеводорода кольца, к которым они присоединены, с образованием 5 или 6-членного замещенного или незамещенного карбоциклического кольца, или Сі-Сюгалогеналкил, С-і-С-юалкокси, Сі-Сюгалогеналкокси, С4-С8циклоалкокси, фенок 15 си, галоген, гидрокси, карбоксил, -SH, -CN, C-iСюалкилтио, арилти, тиоацеталь, -С(0)0(СіСюалкил), гидразид, гидразино, гидразидо, -NH2, -NO2, -NRs2R83, где Rs2 и Rs3 - независимо друг от друга водород, С-і-С-юалкил, С-іСюгидроксиалкил, или вместе с атомом N Rs2 и Rs3 образуют 5 - 8-членное гетероциклическое кольцо, или группа, имеющая формулу где Rs4 и Rs5 - каждый независимо друг от друга выбирают из водорода, С-і-С-юалкил, гидроксил, «84 И «85 ВМеСТе ЯВЛЯЮТСЯ - = О, р — 1 — 5, Z - связь, -0-, -М(Сі-Сюалкил)-, -NH-, - S Q - -CON(R82R83), -5-тетразолил, -SO 3 H, О P-OR B 0Roe -о——-р 44218 16 ацетамида выражаются формулой мацевтически приемлемые соли Й2Э и их фар (Ш) где Х - кислород или сера, R2i - -(CH2)n-(Rso) или -(NH)-(Rso), где n - 1 8 , Rso - арил, замещенный С-і-С-юалкилом, С-іС-юалкенилом, Сі-Сюалкинилом, С-іСюгалогеналкилом, С4-Сі2Циклоалкилом, С-іСюгидроксиалкилом, карбоксилом, галогеном, CN, -СНО, -ОН, -SH, Сі-Сюалкилтио, С і Сюалкоксилом, карбоксилом, амино или гидроксиамино, или замещенный или незамещенный 5 -8-членный гетероциклический остаток, R22 - водород, галоген, Сі-Сзалкил, этенил, циклопропил, Сі-Сгалкилтио, Сі-Сгалкокси, СНО, -CN, каждый R23 независимо друг от друга - водород, галоген, метил R24 и R25 выбирается каждый независмо друг от друга из (а) и (Ь), где (a) - водород, галоген, алкил, алкокси и (b) - группа формулы при условии, что по крайней мере один из R24 и R25 может быть выбран из (Ь) и где Rs4 и Rs5 каждый независимо выбирается из водорода, Сі-Сюалкила, гидрокси, или Rs4 и Rss образуют вместе = О, р — 1 — 5, Z - связь, - 0 - , -NfCi-Сіоалкил)-, -NH-, или S-, и Q - -CON(R82R83), -5-тетразолил, -SO 3 H, о где п - от 1 до 8, Rs6 - независимо друг от друга выбирают из водорода, металла или C-iС-юалкила, R99 выбирают из водорода или С-іСюалкила Другой предпочтительной группой индолов являются соединения, содержащие два ключевых заместителя, а именно, (I) кислотную группу в одном или двух положениях 4 или 5 (то есть R24 и R25, перечисленные в формуле III), и (2) бензильную или замещенную бензильную группу по атому азота индольного кольца Такие 1Н-индол-3 0 (сНа)к 44218 17 С 18 0Е е „ где n - 1 - 8, Rs6 независимо друг от друга выбираются из водорода, металла или С-і-С-юалкила и R99 выбирается из водорода или С-і-С-юалкила, R26 и R27 каждый независимо друг от друга является Сі-Сюалкил, Сі-Сюалкенил, С-іСюалкинил, Сз-Свциклоалкил, арил, аралкил, или смежные гидрокарбильные группы в группах R26 и R27 соединяются с атомами углерода кольца, к которым они присоединены, с образованием 5 или 6-членного замещенного или незамещенного карбоциклического кольца, или С-і-С-югалогеналкил, Сі-Сюалкокси, Сі-Сюгалогеналкокси, С4Свциклоалкокси, фенокси, галоген, гидрокси, карбоксил, -SH, -CN, Сі-Сюалкилтио, арилтио, тиоацеталь, -С(0)0(Сі-Сюалкил) гидразид, гидразино, гидразидо, -ISIH2, -NO2, -NRs2Rs3, C(0)NRs2R83, где Rs2 и Rs3 являются независимо друг от друга водородом, С-і-С-юалкилом, С-іСюгидроксиалкилом, или Rs2 и Rs3 вместе с атомом азота образуют 5 - 8-членное гетероциклическое кольцо, или группа, имеющая формулу где Rs4 и Rs5 каждый независимо друг от друга выбирается из водорода, С-і-С-юалкила, гидрокси, или Rs4 и Rs5 образуют вместе = О, р — 1—5, Z - связь, -О-, -Н(Сі-Сюалкил)-, -NH-, или S 0--CON(R 82 R83, 5-тетразолил, -SO 3 H, о -P-OR8I OROC R99 • М где п - 1 - 8, Rs6 независимо друг ог друга выбираются из водорода, металла или С-і-С-юалкила и R99 выбирается из водорода или С-і-С-юалкила Другой предпочтительной группой индолов, соответствующих изобретению, являются соединения, имеющие два ключевых заместителя, а именно, (I) кислотная группа в одном или двух положениях 4 или 5 (то есть R34 и R35, перечисленных в формуле (ІУ) и (2) небольшой заместитель, содержащий галоген, серу или кислород, во 2 положении индольного кольца (R32 формулы ІУ) Такие 1Н-индол-3-ацетамидн выражаются формулой (ІУ) и их фармацевтически приемлемые соли где Х - кислород или сера, R31 выбирают из групп (і), (іі), (їм), где (і) Сб-Сгоал кил, Сб-Сгоал кен и л, Сгоал кинил, Сє-Сгогалогеналкил, С4Сі2Циклоалкил, или (м) - арил или замещенный арил галогеном, CN, -СНО, -ОН, -SN, Сі-С20алкилтио, С і С-юалкоксил, карбоксил, амино или гидроксиамино, (їм) где Rs4 - водород, Сі-Сюалкил, Rs7 выбирают из групп фенил, нафтил инденил и бифенил, которые могут быть замещенными и незамещенными галогеном, -CN, -СНО, -ОН, -SH, C i С-юалкилтио, С-і-С-юалкокси, карбоксил, амино, гидроксиамино, или из замещенных или незамещенных 5 - 8-членных гетероциклических остатков, R32 - галоген, Сі-Сгалкилтио, С і 19 44218 20 каждый R33 независимо друг от друга водород, галоген, гидрокси карбоксил, -SH, -CN, C-iгалоген или метил, Сюалкилтио, арилтио, тиоацеталь, -С(0)0-(СіС-юалкил), гидразид, гвдразино, гидразидо, -NH2, R34 и R35 каждый независимо друг от друга -NO 2 , -NR 82 R 83 и -C(0)0NR 82 R 83 , где R82 и R83 невыбирается из (а) и (Ь), где зависимо друг от друга представляют собой водо(a) - водород, галоген, алкил или алкокси и род, Сі-Сюалкил, С-і-С-югидроксиалкил, или R82 и (b) - группа формулы R83 вместе с атомом азота образуют 5 - 8 членное гетероциклическое кольцо, или группа формулы При УСЛОВИИ, ЧТО ПО К р а й н е й М е р е ОДИН ИЗ R34 и R35 может быть выбран из (Ь) и где Rs4 и Rs5 каждый независимо друг от друга представляет собой водород, С-і-С-юалкил, гидрокси или Rs4 и Rs5 вместе, образуют = 0, р — 1 — 5, Z - связь, - О - -М(Сі-Сюалкил)-, -NH-, - S Q - -CON(R 82 R 83 ), -5-тетразолил, -SO 3 H, о —р—ORDC -О—р R84 и R85 каждый независимо друг от друга выбирается из водорода, С-і-С-юалкила, гидрокси или R84 и R85 образуют вместе = 0, р — 1 — 5, Z - связь, -О-, -І\І(СіСюалкил)-, -NH-, или S-, и Q - -CON(R 82 R 83 ), -5-тетразолил, -SO 3 H, о (Вт -О где - от 1 до 8, R86 независимо друг от друга выбирают из водорода, металла или C-iСюалкила и R99 представляет собой водород или С-ю-С-юалкил, R26 и R27 независимо друг от друга представляют собой водород, Сі-Сюалкил, Сі-Сюалкенил, Сі-Сюалкинил, Сз-С8циклоалкил, арил, аралкил, или смежные гидрокарбильные группы в группах R26 и R27 соединяются с атомами углерода кольца, к которым они присоединены, с образованием 5 или 6-членного замещенного или незамещенного карбоциклического кольца, или C-iСюгалогеналкил, Сі-Сюалкокси, С-іСюгалогеналкокси, С4-С8циклоалкокси, фенокси, Р где п - от 1 до 8, R86 независимо друг от друга представляют собой водород, металл или С і Сюалкил, R99 выбирают из водорода или C-iСюалкила Наиболее предпочтительным классом индолов, соответствующих этому изобретению, являются соединения, где X является кислородом в формуле У, азот индольного кольца является замещенным бензил или бифенил метил группой, и вположенм 2 индольного кольца (то есть Rs2 в формуле У) находится заместитель, галоген, метилтио или Сі-Сзалкил Такие 1 Н-индол-3 21 44218 ацетамиды выражаются формулой (У) и их фармацевтически приемлемые соли 22 —О—Р—0 (CEj)ir (V) где Х - кислород, R51 где Rs4 - водород или Сі-Сюалкил и Rs7 (СН2) т -(фЄНИЛ) ИЛИ -(СЬІ2)т-(бифЄНИЛ), ГДЄ ГП - О - 2 и фенил или бифенил радикалы являются незамещенными или замещенными галогеном, -CN, -СНО, -ОН, нитро, фенилом, -SH, C-iСюалкилтио, Сі-Сюалкилом, Сі-Сюалкоксилом, карбоксилом, амино, гидроксиамино, или замещенным или незамещенным 5 - 8-членным гетероциклическим кольцом, R52 - галоген, метилтио, циклопропил или С-1Сзалкил, каждый из R53 - водород или галоген, R54 и R55 каждый независимо друг от друга выбирают из (а) и (Ь), где (a) - водород и (b) - группа формулы где п - от 1 до 8, Rsi независимо друг от друга являются водородом, металлом или C-iС-юал килом R56 и R57 каждый является независимо друг от друга Сі-Сюалкил, арил, аралкил, С-іСюгалогеналкил, Сі-Сюалкокси, С-іСюгалогеналкокси, фенокси, галоген, гидрокси, карбоксил или группа формулы где Rs4 и Rs5 независимо друг от друга представляют собой водород, Сі-Сюалкил, гидрокси или Rs4 и Rs5 вместе являются = О, р — 1 — 5, Z - связь, -О-, -І\І(Сі-Сюалкил)-, -NH-, или S-, и Q —5-тетразолил, -SO3H, о —р—OROC При УСЛОВИИ, ЧТО ПО К р а й н е й М е р е ОДИН ИЗ R54 и R55 могут быть выбраны из (Ь), и где Rs4 и Rs5 каждый независимо друг от друга представляет собой водород, С-і-С-юалкил, гидрокси или Rs4 и Rs5 вместе образуют = О, р — 1 — 5, Z - связь, - О - -М(Сі-Сюалкил)-, -NH-, -S-, и Q —5-тетразолил, -SO3H, о о— В-93 -P-OR8 ORaB -О О р Р R99 Сл2 J j I где п - от 1 до 8, Rs6 независимо друг от друга являются водородом, металлом или С-| 23 44218 24 С-юалкилом и R99 является водородом или С-і4-[[3-(2-Амино-2-оксоэтил)-2-(метилтио)-1Сюал килом. (фенил метил)-1Н-индол-5-ил]окси]бутановая Иллюстративными примерами новых соедикислота, соединение формулы: нений данного изобретения являются следующие: 4-[[3-(2-Амино-2-оксоэтил)-2-хлор-1(фенилметил)-1Н-индол-5-ил]-окси]бутановая кислота, соединение, выраженное формулой: 5-(4-Амино-4-оксобутокси)-2-(метилтио)-1(фенилметил)-1Н-индол-3-ацетамид, соединение формулы: 2-[[3-(2-Амино-2-оксоэтил)-2-метил-1(фенилметил)-1Н-индол-4-ил]окси]уксусная слота, соединение, выраженное формулой: ки [4-[[3-(2-Амино-2-оксоэтил)-2-этил-1(фенилметил)-1Н-индол-5-ил]окси]бутановая кислота, соединение формулы: о [3-[[3-(2-Амино-2-оксоэтил)-2-метил-1(фенилметил)-1 Н-индол-5ил]окси]пропил]фосфоновая кислота, соединение формулы: 2-Этил-5-(4-гидразино-4-оксобутокси)-1(фенилметил)-1Н-индол-3-ацетамид, соединение формулы: 4-[[3-(2-Амино-2-оксоэтил)-2-бром-1(фенилметил)-1Н-индол-5-ил]окси]бутановая кислота, соединение формулы: Н2М-НЫ. [3-[[3-(2-амино-2-оксоэтил)-2-этил-1(фенилметил)-1 Н-индол-5 25 44218 26 ил]окси]пропил]фосфоновая кислота, соединение ил]окси]уксусная кислота, натриевая соль, соедиформулы нение формулы [3-[[3-(2-Амино-2-оксоэтил)-2-этил-1(фенилметил)-1 Н-индол-5ил]окси]пропил]фосфоновая кислота, метиловый эфир, соединение формулы [3-[[3-(2-Амино-2-оксоэтил)-1-[(3хлорфенил)метил]-2-этил-1Н-индол-5ил]окси]пропил]фосфоновая кислота, соединение формулы [[3-(2-Амино-2-оксоэтил)-2-этил-1(фенилметил)-1Н-индол-4-ил]окси]уксусная слота, соединение формулы ки 2-[[3-(2-Амино-2-оксоэтил)-1-[(3хлорфенил)метил]-2-этил-1Н-индол-4ил]окси]уксусная кислота, соединение формулы [[3-(2-Амино-2-оксоэтил)-1-[(3хлорфенил)метил]-2-метил-1Н-индол-4ил]окси]метил]уксусная кислота, натриевая соль, соединение формулы 2-Циклопропил-5-гидрокси-1-(фенил метил)1 Н-индол-3-ацетамид, соединение формулы [[3-(2-Амино-2-оксоэтил)-1-([1,1-бифенил] 2-илметил)-2-метил-1 Н-индол-4 [3-[[3-(2-Амино-2-оксоэтил)-2-циклопропил1-(фенилметил)-1Н-индол-5 27 44218 ил]окси]пропил]фосфоновая кислота, соединение формулы [3-[[3-(2-Амино-2-оксоэтил)-2-циклопропил1-(фенилметил)-1Н-индол-5ил]окси]пропил]фосфоновая кислота, соединение формулы 4-[[3-(2-Амино-2-оксоэтил)-1(фенилметил)-1Н-индол-5-ил]окси]бутановая кислота, соединение формулы 3-[4-[[3-(2-Амино-2-оксоэтил)-2-этил-1(фенилметил)-1 Н-индол-5ил]окси]пропан]сульфоновая кислота, соединение формулы 3-[[3-(2-Амино-2-оксоэтил)-2-бром-1(фенилметил)-1 Н-индол-5ил]окси]пропил]фосфоновая кислота, метиловый эфир, соединение формулы 28 2-Бром-6-хлор-5-метокси-1-(фенил метил)1 Н-индол-3-ацетамид, соединение формулы 2-Бром-6-хлор-5-гидрокси-1-(фенил метил)Н-индол-3-ацетамид, соединение формулы 4-[[3-(2-Амино-2-оксоэтил)-2-бром-6-хлор1-(фенил метил)-ІН-индол-5-ил]окси]бутановая кислота, соединение формулы 3-[4-[[3-(2-Амино-2-оксоэтил)-6-хлор-1(фенилметил)-1 Н-индол-5ил]окси]пропил]фосфоновая кислота, соединение формулы 29 4-Аллил-2-этил-5-гидрокси-1(фенилметил)-ІН-индол-ацетамид, формулы 44218 соединение 2-[[[3-(2-Амино-2-оксоэтил)-2-метил-1(фенилметил)-і Н-индол-5ил]окси]метил]бензойная кислота, соединение формулы и фармацевтически приемлемые соли каждого из выше названного соединения Соли приведенных выше 1 Н-индол-3ацетамидов формул А, I, II, III, ІУ, У, УІ и выше названные специфические соединения являются дополнительным аспектом изобретения В тех случаях, когда соединения изобретения обладают кислотными или основными функциональными группами могут образовываться различные соли, которые являются более водорастворимыми и физиологически более приемлемыми, чем исходные соединения Представленные фармацевтически приемлемые соли включают, но не ограничиваются этим, соли щелочных и щелочноземельных металлов, такие, как соли лития, натрия, калия, кальция, магния, алюминия и другие подобные Соли обычно готовят из свободных кислот обработкой кислот в растворе основаниями или пропусканием кислоты на ионообменной смоле ЗО В определение фармацевтически приемлемой соли включают относительно нетоксичные, неорганические и органические соли оснований соединений изобретения, например с аммониевым, четвертичным аммониевым и аминным катионом, производным азотного основания (то есть производные глюкозамина, морфолина, холина или диэтиламина) достаточной основности до образования солей с соединениями этого изобретения (смотри, например, S М Berge, et al , "Pharmaceutical Salts", J Pharm Sci, 66 1-19(1977)) Кроме того основные группы соединения изобретения могут реагировать с подходящими органическими или неорганическими кислотами до образования солей, таких как ацетат, бензолсульфонат, бензоат, бикарбонат, бисульфат, битартрат, борат, бромид, камсилат, карбонат, хлорид, клавуланат, цитрат, хлорид, эдетат, эдизилат, эстолат, эзилат, фторид, фумарат, глюцептат, глюконат, глютамат, глюколиларсанилат, гексил резорцинат, бромид, хлорид, гидроксинафтоат, йодид, изоцианат, лактат, лактобионат, лаурат, малат, малсеат, манделат, мезилат, метилбромид, метилнитрат, метилсульфат, мукат, напсилат, нитрат, олеат, оксалат, палмитат, пантотенат, фосфат, полигалактуронат, салицилат, стеарат, субацегат, сукцинат, таннат, тартрат, тозилат, трифторацетат, трифторметансульфонат и валерат Некоторые соединения изобретения могут обладать одним или более хиральными центрами и могут, поэтому, существовать в виде оптически активных форм Так же, когда соединения содержат алкенил или алкенилен группу, существует возможность цис- и транс- изомерных форм соединений R- и S- изомеры и их смеси, включая рацемические смеси, также как и смеси цис- и транс- изомеров, рассматриваются этим изобретением Дополнительный асимметрический атом углерода может присутствовать в заместителе, таком как алкил группа Все такие изомеры, также как и их смеси включают в изобретение Если требуется отдельный стереоизомер, то он может быть получен методом, известным ранее, при использовании стереоспецифических реакций из исходного материала, который содержит асимметрические центры и уже разделенные, или альтернативно методом, который приводит к смеси стереоизомеров и последующим ее разделением известными методами Пропрепараты являются производными соединений изобретения, которые имеют химически или метаболически отщепляемые группы и становятся при сольволизе или при других физиологических условиях соединениями изобретения, которые фармацевтически активны in vivo Производные соединений этого изобретения имеют активность в виде обоих форм, и в виде кислотных, и в виде основных производных, но кислотные производные часто представляют преимущества в растворимости, совместимости тканей или замедлении высвобождения в организме млекопитающих (смотри Bundgard H , Design of Prodrugs, pp 7 - 9 , 21-24, Elsevier, Amsterdam 1985) Пропрепараты включают кислотные производные, известные по предыдущим работам в этой области, такие как, например, эфиры, полу 31 44218 ченные реакцией исходных кислотных соединений с подходящими спиртами, или амины, полученные реакцией исходных кислотных соединений с подходящими аминами Простые алифатические или ароматические эфиры являются производными от кислотных групп в соединениях изобретения представляют собой пропрепараты В некоторых случаях требуется получить пропрепараты типа двойных эфиров, такие как (ацилокси)алкил эфиры или ((алкоксикарбонил) окси)алкил эфиры 32 Методы синтеза Синтез структуры 1Н-индол-3-ацетамидов может выполняться известными методами Методики, пригодные для синтеза соединений этого изобретения описываются следующими схемами реакций По первой схеме эфиры ІН-индол-3-уксусной кислоты II могут Схема I Р. О •= ГІ mcth a легко алкилироваться галогеналкилами или галогенарилалкилами в растворителе, таком как 11,11-диметилформамид (ДМФА), в присутствии основания (метод а) с образованием промежуточного продукта, эфира 1-алкил-1Н-индол-3уксусной кислоты III Пригодны в качестве основания трет-бутилат калия и гидрид натрия Целесообразно проводить реакцию индола II с основанием для первонального образования соли II и затем прибавлять алкилирующий агент При обработке эфиров 1-алкил-1Н-индол-3-уксусной кислоты II гидразином или гидразин гидратом в этаноле (метод Ь) получают требуемые гидразиды 1-алкил1Н-индол-3-уксусной кислоты ІУ Такая конден сация с образованием ІУ может выполняться при температуре кипения растворителя в течение 1 24 часов Гидразиды уксусной кислоты 1У гидрируют с получением ацетамидов I с помощью нагревания с никелем Ренея в этаноле (метод с) Промежуточные эфиры уксусной кислоты III могут быть сначала гидролизаваны до производных уксусной кислоты У (метод d), которые после обработки алкилхлорформиатом и последующей обработкой безводным аммиаком образуют также амиды I ( метод е) Промужеточные эфиры 1Н-индол-3-уксусной кислоты II могут быть получены различными синтетическими путями, как показано на схеме 2 33 44218 34 Схема 2 0R= 1Н-Индол-3-уксусные кислоты ІУ легко этерифицируются в спирте, например в метаноле, в присутствии сильной кислоты, такой как серная кислота (метод f) до образования II Замещенные фенилгидразины УП могут реагировать с производными левулиновой кислоты УМІ по известному синтезу индолов по Фишеру (метод д) прямо с образованием индолов II (смотри ссылку В Carlm и Е Е Fisher, J Am Chem Soc , 1948, 70, 3421) В большинстве случаев используются этанол в качестве растворителя, температура кипения растворителя и хлористый водород в качестве кислотного катализатора Индолы, незамещенные в 3 положении IX, могут алкилироваться с помощью первоначального получения цинковой соли IX, а затем обработки этой соли ал кил 2 бромалканоатом (смотри ссылку loshihiko Ito, Hideaki Sato, Masahiro Murakami, J Org Chem, 1991, 56, 4864 - 4867) no (методу ) до получения II Цинковую соль IX могут получать реакцией индолов IX вначале с н-бутиллитием в тетрагидрофуране в качестве растворителя и затем с хлоридом цинка в эфире Растворитель для этой реакции обычно изменяют после образования цинковой соли на толуол с помощью удаления эфира и растворителя ТГФ при уменьшенном давлении и добавлением толуола Для дополнительных замещенных производных IX используют реакции по схеме 3 (смотри ссылку Robin D Clark, Joseph M Muchowski, Lawrence E Fisher, Lee A Fhppm, David В Repke, Michel Souchet, Synthesys, 1991, 871 - 878) Сіїч TILEth І XI meth к MHCO3-t-£u XII Орто-метиланилины X обрабатывают д и трет-бутилдикарбонатом в ТГФ при температуре кипения (метод і) с образованием N-третбутоксикарбониланилинов XI Дианион XI образу ется в ТГФ при обработке двумя эквивалентами втор-бутиллития и реагирует с одним эквивалентом амида г\І-метокси-г\І-метилалкановой кислоты с получением по (методу j) арил кетона XII При 35 44218 36 обработке этих кетонов трифтор-уксусной кислонатрия к соответствующему индолу, предваритой (метод к) идет циклизация и снятие защитной тельно растворенному в серной кислоте (метод I) группы на атоме азота с образованием индолов (смотри ссылку Wayland E Noland, Lowell R Smith, IX Индолы типа IX, замещенные нитро-группой в Donald С Johnson, J Org Chem , 1963, 28, 2 2 6 2 5 положении, получают при добавлении нитрата 2266) Схема 4 meth 1 Для того, чтобы получить производные І, в которых заместитель Ri представляет собой гидрокси или алкокси, кроме метокси, используют методы, описанные на схеме 5 5-Метокси-индол-Зуксусные кислоты быстро деметилируются (метод т ) обработкой с ВВгз (смотри ссылку Tsung-lmg Shen and Charles A , Winter, Adv Drug Res , 1977, 12, 176) с образованием 5-гидрокси-индола У, который превращают с помощью методов, описанных выше, в I, в котором Ri - гидрокси Скегла 5 , ft СНЭО, «•ill ET 1Н-индол-3-ацетамиды, в которых Ri является 4-, или 5-, или 6-метокси, могут также прямо метилироваться до I (Ri = гидрокси) методом m Эти соединения могут затем алкилироваться с 38 37 44218 получением соединений струїсгурьі XIII При исЛитиевое производное обрабатывают бензолпользовании алкилакрилатов получают производсульфонилхлоридом и получают ХУІ, который поные XIII, в которых х равняется 2 Бромацетаты и сле обработки водным HCI теряет диметиламин4-бромбутираты дают эфиры структуры XIII, в ную группу и образует 2-хлор-5-метокси-1 Нкоторых х - 1 и 3, соответственно Все соединеиндол Реакции этого индола с использованием ния, в которых R7 содержат эфирную группу, могут методик, описанных ранее, дают 2-хлор зфиры III превращаться в их соответствующие карбоновые Эти эфиры могут превращаться в 2-хлор амиды I кислоты ХУІ с использованием реагента (СНзЬАІІЧНг (метод q) Полученные соединения могут 02-Хлор-1Н-индол-3-ацетамиды лучше всего получают реакциями, представленными на схеме деметилироваться и образующийся промежуточ6 Для прямого введения лития во второе положеный фенольным продукт повторно алкилироватьние с помощью втор-бутиллития используют 1 ся, как описано в схеме 5, с получением соединедиметиламино-замещенные производные ХУ ния структуры XIII, в которой R3 - хлор Промежуточные эфиры ІН-индол-3-уксусной кислоты III, где F 3 - бром, получают реакцией ? эфира, в котором R3 - водород, с Nрп R l I. бромсукцинимидом (метод s) Подобным образом реакцией с метансульфенилхлоридом получают 3-метилтиоиндол III, где R3 = СНз О R \1г в "v л З " I OR4 39 40 44218 Соединения структуры I, где Ri - фенил, получают с помощью введения фенильной группы в промежуточный продукт, где Ri - Вг (метод t) (смотри ссылку II Miyaura, T Yamag, A Suzuk Snyth Commun, 1981, II, р 5 1 3 - 5 1 9 ) Такое введение фенильной группы может выпол Схема 7 Е; 9. III няться на любых соответствующе замещенных бромом промежуточных продуктах 1Н-Индол-3ацетамид I, в котором Ri является аминокарбони лом могут быть получены через соответствующие диэфиры ХУП, которые превращаются по описанным ранее методам в конечные диамиды I Да ЕГ020" R Й Амиды І, в которых заместители Ri содержат азот, так же как и соединения, где заместители по амино группе включают остатки эфира или карболовой кислоты, такие как XXI и XXII, могут быть получены с помощью методик, представленных на схеме 8 2-Метил-5-нитро-1Н-индол вначале бензилируют и получают N-замещенное производное ХУІІІ При обработке этого индола оксалилхлоридом (метод и) с последующим добавлением газообразного аммиака получают оксамид XIX, проводят ступенчатое восстановление этого соединения Амид гликолевой кислоты XX получают реакцией ХУІІІ с ІЧаВЬЦ (методу v) Восстановление этого промежуточного продукта с триэтилсиланом (метод w) в трифторуксусной кислоте приводит к образованию ацетамида I (Ri = O2N) Нитро группа может быть восстановлена каталитически (метод х) до получения 5-амино амида (I, Ri = NH2) При обработке этого амино производного метил а крил атом получают эфироамид XXI (по этой реакции также получают некоторые N.N-дизамещенные производные) Этот эфир может быть гидролизован гидроокисью натрия с получением амида карболовой кислоты XXII Тот же промежуточный эфир XXI реагирует с гидразином с образованием гидразинокарбонильного производного XXIII б-Метокси-2-метил-ІН-индол превращают в 6-метокси-2-метил-1Н-индол-3-ацетамиды с помощью последовательности реакций, представленых на первых 4 ступенях схемы 8 41 44218 Ниже описаны примеры настоящего изобретения, которые предлагаются только для иллюстративных целей Они не ограничивают область настоящего изобретения, во всяком случае как многочисленные воплощения внутри области пунктов будут очевидны Примеры Пример 1 Получение 2,6-Диметил-1-(фенилметил)1 Н-3-ацетамида А г\|-трет-Бутоксикарбонил-2,5диметиланилин Раствор 2,5-диметиланилина (2402г, 0,2моля) и 50,0г (0,299молей) ди-третбутилдикарбоната в 200мл тетрагидрофурана медленно нагревают до кипения и непрерывно кипятят 2 часа, охпаждают, реакционную смесь упаривают при уменьшенном давлении, остаток растворяют в ЕЮАс Раствор в этилацетате промывают IN лимонной кислотой, сушат над Na2SO4, упаривают при уменьшенном давлении Остаток 42 перекристаллизовывают из гексана и получают 24,Ог (54% выход) г\І-трет-бутоксикарбонил-2,5диметиланилина с т пл 103 - 104°С Анализ для C13H19NO2 Вычислено С 70,56 Н 8,65 N 6,32 Найдено С 70,28 Н 8,51 N6,60 В 2,6-Диметил-1Н-индол К 11,05г (0,05молям) N-TpeT-6yroKCHKap6oHHn-4-3TOKH-2метиланилина в 150мл ТГФ при температуре ниже -40°С, сохраняемой с помощью бани сухой ледэтанол, медленно прибавляют раствор 1,ЗМ вторбутиллития/циклогексан (81,0мл, 0,105молей), через 0,25 часа вносят по каплям 7,21 г (0,07молей) N-мeтoкcи-N-мeтилaцeтaмидa в равном объеме ТГФ, реакционную смесь перемешивают 1 час, охлаждающую баню удаляют, дополнительно перемешивают 1 час и выливают в смесь 500мл эфира и 500мл IN HCI Органический слой отделяют, промывают водой, сушат над Na2SO4, упаривают растворитель и получают 12,5г 43 44218 44 сырого 1-(2-трет-бутоксикарбониламино-4д иметил-1-(фенил метил)-1Н-индол-3-уксусной кислоты, т пл 179-180°С метилфенил)-2-пропанона, к которому добавляют 15г трифторуксуснои кислоты в 250мл CH2CI2, пеЭлементный анализ для C19H19NO2 ремешивают при комнатной температуре 16 чаВычислено С 77 79 Н 6 53 N 4 77 сов Смесь промывают дважды водой, насыщенНайдено С 78 01 Н 6 60 N 4 80 ным ЫагСОз раствором, сушат над Na2SO4, F 2,6-Диметил-1-(фенилметил)-1Н-индолупаривают растворитель Остаток хроматографи3-ацетамид К раствору 0 48г (1 64ммолей) 2,6руют на силикагеле при элюировании толуолом и д иметил-1-(фенил метил)-1Н-индол-3-уксусной получают 3,2г (44% выход) 2,6-д иметил-1 Нкислоты в 25мг тетрагидрофурана (ТГФ) при охиндоластпл 74 - 76°С лаждении баней лед-вода прибавляют 0 45мл триэтиламина, затем 0 13мл (1 7ммолей) метилЭлементный анализ для С-юНцЫ хлорформиата, через 0 5 часа в реакционную Вычислено С 82,72 Н 7,64 N 9,65 смесь в течение 0 5 часа пропускают газообразНайдено С 82,47 Н 7,34 N9,92 ный NH3, охлаждающую баню удаляют, перемеС 2,6-Диметил-1 Н-индол-3-уксусная кислошивают дополнительно 2 часа, выливают в воду и та, метиловый эфир К охлажденному раствору экстрагируют ЕЮАс Этилацетатныи раствор про2,9г (0,02молей) 2,6-диметил-1Н-индола в 40мл мывают раствором Na2CO3, сушат (Na2SO4), упаТГФ прибавляют при температуре ниже 10°С при ривают при уменьшенном давлении Остаток криохлаждении на бане сухой лед-этанол 12,5мл сталлизуют из МеОН/вода и получают 019г (0,02молей) 1,6М раствора н-бутиллития в гекса(выход 39%) 2,6-д иметил-1-(фенил метил)-1Нне, через 0,25 часа добавляют 20,0мл индол-3-ацетамида, т пл 160-163°С (0,0277молей) 1М раствора ZnCb в эфире, охлаждающую баню удаляют, смесь перемешивают 2 Элементный анализ для C19H20N2O часа, упаривают при уменьшенном давлении до Вычислено С 78 05 Н 6 89 N 9 58 воско-образного остатка, который растворяют в Найдено С 78 31 Н 6 97 N 9 31 40мл толуола К этому раствору прибавляют Пример 2 1,89мл (0,02молей) метил 2-6 ром ацетата, переПолучение 5-гидрокси-2-метил-1мешивают 24 часа и выливают в 100мл IN HCI и (фенилметил)-1Н-индол-3-ацетамида 100мл ЕЮАс Органический слой промывают А Метиловый эфир 5-метокси-2-метил-1 Ндвадцы водой, сушат над Na2SO4 и упаривают при индол-3-уксусной кислоты Раствор 12 2г уменьшенном давлении Остаток хроматографи(0 0557молей) 5-метокси-2-метил-1 Н-индол-3руют на силикагеле при элюировании 10% уксусной кислоты в 150мл МеОН и 1мл серной ЕЮДс^олуолом до получения 3,17г (73%) метикислоты кипятят 15 часов, охлаждают, разбавляют лового эфира 2,6-диметил-1Н-индол-3-уксусной раствором бикарбоната натрия, экстрагируют кислоты в виде масла ЕЮАс Этилацетатныи слой промывают насыщенным раствором КаСІ, сушат над Na2O4, расЭлементный анализ для C13H15NO2 творитель упаривают при уменьшенном давлении Вычислено С 71,87 Н 6,96 N6,45 и получают 13г сырого метилового эфира 5Найдено С 71,61 Н6.95 N6,30 метокси-2-метил-1 Н-индол-уксусной кислоты Д Метиловый эфир 2,6-д иметил-1 (фенилметил)-1Н-индол-3-уксусной кислоты К В 5-Метокси-2-метил-1-(фенил метил)-1Н1,89г (0,0087молей) метилового эфира 2,6индол-3-уксусная кислота Сырой метиловый диметил-1Н-индол-3-уксусной кислоты в 25мл эфир 5-метокси-2-метил-1Н-индол-3-уксусной ДМФА прибавляют трет-бутилат калия (0,975г, кислоты из А (56ммолей растворяют в 250мл 0,0087молей), перемешивают 0,25 часа, вносят ДМФА и приблизительно 10мл ТГФ, вносят 2 5г 1,0мл бензилхлорида, перемешивают 72 часа, (62ммолей) 60% NaH/минеральное масло, выдерразбавляют водой и экстрагируют ЕЮАс Этилживают 0 5 часа, добавляют 8мл (67ммолей) бенацетатный раствор промывают четыре раза возилбромида, перемешивают 0 75 часа, разбавлядой, сушат над Na2SO4, растворитель упаривают ют водой и экстрагируют ЕЮАс Продукт при уменьшенном давлении, остаток хроматограхроматографируют на силикагеле (20% фируют на силикагеле при элюировании толуолом эфир/гексан -^50% эфир/гексан) и получают 10 1 г и получают 1,76г (66% выход) метилового эфира смеси метилового и этилового эфиров 5-метокси2,6-д иметил-1-(фенил метил)-1Н-индол-32-метил-1-(фенил метил)-1Н-индол-3-уксусной уксусной кислоты в виде масла кислоты Эту смесь растворяют в 200мл ЕЮН и 20мл 5 N NaOH, кипятят 20 75 часа, охлаждают, Элементный анализ дал C20H21NO2 подкисляют 5 N HCI и экстрагируют ЕЮАс ЭтилВычислено С 78 15 Н 6 89 N 4 56 ацетатный слой промывают NaCI, сушат над Найдено С 7818 Н 7 10 N 4 53 Na2SO4, упаривают при уменьшенном давлении и Е 2,6-Диметил-1-(фенил метил)-1 Н-индолполучают 7 9г (выход 46%) сырой 5-метокси-23-уксусная кислота Раствор 1 7г (0 0055 молей) метил-1-(фенил метил)-1Н-индол-3-уксусной метилового эфира 2,6-диметил-1-(фенилметил)кислоты 1Н-индол-3-уксусной кислоты и 2мл 5 N NaOH в 50мл МеОН нагревают при температуре кипения 3 часа, разбавляют водой, подкисляют 5 N HCI раствором и экстрагируют ЕЮАс этилацетатныи раствор сушат над Na2SO4, упаривают при уменьшенном давлении, остаток кристаллизуют из толуола и получают 0 85г (выход 58%) 2,6 С Метиловый эфир 5-гидрокси-2-метил-1(фенилметил)-1Н-индол-3-уксусной кислоты К 31г (Юммолей) 5-метокси-2-метил-1(фенилметил)-1Н-индол-3-уксусной кислоты в 250мл CH2CI2 прибавляют 3 мл (ЗОммолей) ВВгз, перемешивают 17 часов, обрабатывают 1 N HCI, добавляют некоторое количество ЕЮН Органи 45 44218 46 ческий слой отделяют, промывают насыщенным Элементный анализ для C18H19N3O2 раствором NaCI, сушат, упаривают при уменьшенВычислено С 69 88 Н 6 19 N 13 58 ном давлении и получают 2,95г (выход 100%) сыНайдено С 69 91 Н 6 19 N13 37 рой 5-гид рокси-2-метил-1-(фенил метил)-1НД 5-Метокси-1-(фенил метил)-1Н-индол-3индол-3-уксусной кислоты, 1 7г которой раствоацетамид К 790мг (2 4ммолей) гидразида 5ряют в метаноле, раствор обрабатывают серной метокси-1-(фенил метил)-1Н-индол-3-уксусной кислотой, как описано в части А и получают после кислоты в 120мл ЕЮН прибавляют 1г никеля Рехроматографирования на силикагеле (30% нея, кипятят 2 часа, катализатор отфильтровываэфир/гексан -> 60% эфир/гексан) 1,5г метилового ют, фильтрат упаривают при уменьшенном давэфира 5-гидрокси-2-метил-1-(фенилметил)-1Нлении, остаток обрабатывают эфиром и получают индол-3-уксусной кислоты 675мг (выход 89%) 5-метокси-1-(фенилметил)1Н-индол-3-ацетамида, т пл 156 - 158°С Д 5-Гидрокси-2-метил-1-(фенилметил)-1НЭлементный анализ для C18H18N2O2 индол-3-ацетамид Раствор 750мг (2 4ммолей) Вычислено С 73 45 Н 6 16 N 9 52 метилового эфира 5-гид рокси-2-метил-1(фенил метил)-1Н-индол-3-уксусной кислоты и Найдено С 7018 Н 5 96 N 8 93 2мл гидразина в 75мл этанола кипятят 72 часа, Пример 4 охлаждают вносят 2г никеля Ренея осторожно, Получение 1-циклогексилметил-5-метоксикипятят 4 часа, охлаждают, растворитель декан2-метил-1 Н-индол-3-ацетамида тируют и твердое вещество промывают ЕЮАс с А Этиловый эфир 5-метокси-2-метил-1 Нпомощью декантирования Растворители объедииндол-3-уксусной кислоты Сухой хлористый воняют, фильтруют через целит, упаривают при дород пропускают в течение 0,5 часа при охлажуменьшенном давлений Остаток кристаллизуют дении на бане лед-вода через раствор 27 95г из ЕЮН и получают 570мг (выход 80%) 5(016молей ) гидрохлорида 4-метоксигид рокси-2-метил-1-(фенил метил)-1Н-индол-3фенилгидразина и 19 72г (0 17молей) левулиноацетамида, т пл 185-187°С вой кислоты в 500мл этанола, затем баню удаляют, реакционную смесь медленно нагревают до Элементный анализ для C18H18N2O2 кипения, кипятят 20 часов, охлаждают, выливают Вычислено С 73 45 Н 6 16 N 9 52 в воду и экстрагируют ЕЮАс Этилацетатный эксНайдено С 73 23 Н 6 32 N 9 69 тракт промывают раствором бикарбоната натрия, Пример 3 сушат над Na2SO4, упаривают растворитель при Получение 5-метокси-1-(фенил метил)-1Нуменьшенном давлении, остаток хроматографииндол-3-ацетамида руют на силикагеле при элюировании 5% А Этиловый эфир 5-метокси-1 Н-индол-3ЕЮДс^олуолом и получают 14 2г (36% выход) уксусной кислоты Как описано в примере 1 части этилового эфира 5-метокси-2-метил-1Н-индолС, 29 44г (0 02молей) 25-метокси-1Н-индола об3-уксусной кислоты, т пл 38 - 40°С рабатывают 125мл (0 2молей) 1 6М н-бутиллития Элементный анализ для C14H17NO3 в гексане, 200мл (0 2молей) 1М ZnCb в эфире и Вычислено С 67 99 Н 6 93 N 5 66 22 2мл (0 2молей) этил 2-6 ром ацетата, хроматографируют на силикагеле при элюировании 5% Найдено С 68 24 Н 6 88 N 5 75 ЕЮДс^олуолом и получают 20г (выход 43%) этиВ ЭТИЛОВЫЙ Эфир 1-ЦИКЛОГЄКСИЛМЄТИЛ-5лового эфира 5-метокси-1Н-индол-3-уксусной метокси-2-метил-1 Н-индол-3-уксусной кислоты кислоты в виде масла По методике, описанной в части Д примера 1, 4 7г (019молей) этилового эфира 5-метокси-1 НВ Этиловый эфир 5-метокси-1индол-3-уксусной кислоты взаимодействуют с (фенилметил)-1Н-индол-3-уксусной кислоты С 2 13г (0 019молей) трет-бутилата калия и 2 65мл использованием методики, описанной в части Д (0 019молей) циклогексилметилбромида и после примера 1, 3 15г (0 0135молей) этилового эфира хроматографирования на силкагеле (градиент, 5-метокси-1Н-индол-3-уксусной кислоты реагитолуол -Ї 5% ЕЮДс^олуол) и получают 3 16г (вырует с 1 51 г (0 0135молей) трет-бутилата калия и ход 48%) этилового эфира 1-циклогексилметил1 55мл (0 0135молей) бензилхлорида, и после 5-метокси-2-метил-1 Н-индол-3-уксусной кислохроматографирования на силикагеле (при элюиты в виде масла ровании толуолом -Ї 5% ЕЮДс^олуолом) получают этиловый эфир 5-метокси-1-(фенилметил)Элементный анализ для C21H29NO3 1Н-индол-3-уксусной кислоты в виде масла, 3 6г Вычислено С 73 44 Н 8 51 N 4 08 (83%) Найдено С 73 68 Н 8 64 N 414 С 1-Циклогексилметил-5-метокси-2-метилЭлементный анализ для C20H21NO3 1Н-индол-3-уксусная кислота По методике, опиВычислено С 74 28 Н 6 55 N 4 33 санной в части Е примера 1, 3 1 г (9 Оммолей) этиНайдено С 75 53 Н 6 67 N 4 08 лового эфира 1-циклогексилметил-5-метокси-2С Гидразид 5-метокси-1-(фенилметил)-1Нметил-1 Н-индол-3-уксусной кислоты и 5мл NaOH индол-3-уксусной кислоты Раствор 1 4г реагируют в 50мл ЕЮН с образованием 2 1 г (вы(4 ЗЗмолей) этилового эфира 5-метокси-1ход 74%) 1-циклогексил-5-метокси-1Н-индол-3(фенилметил)-1Н-индол-3-уксусной кислоты и уксусной кислоты с т пл 173 - 175°С после кри10мл гидразина в 75мл ЕЮН кипятят 16 часов, сталлизации из толуола охлаждают, образовавшийся осадок фильтруют и получают 1 ЗЗг (выход 93%) гидразида 5-метоксиЭлементный анализ для C19H25NO3 1-(фенил метил)-1Н-индол-3-уксусной кислоты, Вычислено С 72 35 Н 7 99 N 4 44 т п л 143-144°С Найдено С 72 64 Н 8 00 N 4 52 47 44218 48 Д 1-Циклогексиметил-5-метокси-2-метилвают гексаном, добавляют 8мл ДМФА, охлаждают на бане со льдом, добавляют 494мг (2ммоля) эти1 Н-индол-3-ацетамид Раствор 0 63г (2 Оммолей) лового эфира 5-метокси-2-метил-1 Н-индол-31-ЦИКЛОГЄКСИЛМЄТИЛ-5-МЄТОКСИ-2-МЄТИЛ-1Нуксусной кислоты, затем вносят 391мг (2ммоля) индол-3-уксусной кислоты и 0 56мл (4ммолей) альфа,2,6-трихлортолуола, перемешивают 1 5 триэтиламина в 25мл тетрагидрофурана ЛТФ) часа, разбавляют водой, экстрагируют ЕЮАс реагирует с 0 162мл (2 1 молей) метилхлорфорЭтилацетатный экстракт промывают водой/NaCI, миата, затем обрабатывают газообразным ІЧНз, сушат над MgSO4, упаривают растворитель при как описано в части Г примера 1, и получают 0 Зг уменьшенном давлении, остаток хроматографи(выход 48%) 1-циклогексилметил-5-метокси-2руют на двуокиси кремния элюируют с 25% метил-1Н-индол-3-ацетамида, т пл 125 - 126°С ЕЮАс/гексаном и получают 556мг (выход 68%) Элементный анализ для C19H26N2O2 этилового эфира 1-(2,6-дихлорфенилметил)-5Вычислено С 72 58 Н 8 33 N 8 91 метокси-2-метил-1 Н-индол-3-уксусной кислоты, Найдено С 72 57 Н 8 35 N 8 81 который кристаллизуется при стоянии, т п л 131 Пример 5 133°С Получение 5-метокси-2-метил-1(фенилметил)-і Н-индол-3-ацетамид А Этиловый эфир 5-метокси-2-метил-1(фенилметил)-і Н-индол-3-уксусной кислоты По методике, описанной в части Д примера 1, 4,07г (0 0165молей) этилового эфира 5-метокси-2метил-1 Н-индол-3-уксусной кислоты (часть А примера 4) реагируют с 1 85г (0 0165молей) третбутилата калия и 196мл (0 0165молей) бензилхлорида и образуют 3 78г (выход 68%) этилового эфира 5-метокси-2-метил-1-(фенилметил)-1Ниндол-3-уксусной кислоты, который очищают хроматографически на силикагеле при элюировании толуол -> 10% ЕЮАс/голуол, т пл 63 - 64°С Элементный анализ для C21H23NO3 Вычислено С 74 75 Н 6 87 N 4 15 Найдено С 74 76 Н 6 89 N 4 28 В Гидразид 5-метокси-2-метил-1(фенилметил)-і Н-индол-3-уксусной кислоты 1 Ог (2 Эбммолей) Этилового эфира 5-метокси-2метил-1-(фенил метил)-1 Н-индол-3-уксусной кислоты и 5мл гидразина в 50мл МеОН взаимодействуют по методике, описанной в части С примера 3, и получают при затирании в эфире 920мг (96% выход) гидразида 5-метокси-2-метил-1(фенилметил)-1Н-индол-уксусной кислоты, т пл 161 -162°С Элементный анализ для C19H21N3O2 Вычислено С 70 53 Н 6 54 N 12 99 Найдено С 70 41 Н 6 58 N 12 93 С 5-Метокси-2-метил-1-(фенил метил)-1Ниндол-3-ацетамид По методике, описанной в части Д примера 3, 945мг (2 Эммолей) гидразида 5-метокси-2-метил-1-(фенил метил)-1 Н-индол3-уксусной кислоты гидрируют в 50мл ЕЮН в присутствии 1 5г никеля Ренея После окончания реакции выделяют сырой продукт, который фильтруют через двуокись кремния с использованием ЕЮАс и перекристаллизовывают из СНгСЬ/МеОН, и получают 225мг (выход 25%) 5-метокси-2метил-1-(фенил метил)-1Н-индол-3-ацетамида, т п л 128-130°С Элементный анализ для C19H20N2O2 Вычислено С 74 00 Н 6 54 N 9 08 Найдено С 74 00 Н 6 51 N 9 05 Пример 6 Получение 1-(2,6-дихлорфенилметил)-5метокси-2-метил-1Н-индол-3-ацетамида А Этиловый эфир 1-(2,6дихлорфенилметил)-5-метокси-2-метил-1Ниндол-3-уксусной кислоты Суспензию 80мг (2ммолей) 60%, NaH/минеральное масло промы Элементный анализ для C21H21CI2NO3 Вычислено С 62 08 Н 5 21 N 3 45 Найдено С 61 79 Н 5 23 N 3 51 В Гидразид 1-(2,6-дихлорфенилметил)-5метокси-2-метил-1 Н-индол-3-уксусной кислоты К 533мг (1 Зммолей) этилового эфира 1-(2,6дихлорфенилметил)-5-метокси-2-метил-1Ниндол-3-уксусной кислоты в 10мл ЕЮН прибавляют гидразин (1 Змл), кипятят 6 часов, охлаждают смесь разбавленной водой, экстрагируют ЕЮАс Этилацетатный экстракт промывают раствором хлористого натрия, сушат над MgSO4, растворитель упаривают при уменьшенном давлении, остаток кристаллизуют из МеОН и получают 250мг (выход 61%) гидразида 1-(2,6дихлорфенилметил)-5-метокси-2-метил-1Ниндол-3-уксусной кислоты, т пл 194 - 196°С Элементный анализ для C19H19CI2N3O2 Вычислено С 58 17 Н 4 88 N 10 71 Найдено С 58 65 Н 4 98 N 10 68 С 1-(2,6-Дихлорфенилметил)-5-метокси-2метил-1 Н-индол-3-ацетамид К 168мг (0 43ммолей) гидразида 1-(2,6дихлорфенилметил)-5-метокси-2-метил-1Нидол-3-уксусной кислоты в 10мл ЕЮН прибавляют никель Ренея, кипятят 3,5 часа, охлаждают, растворитель декантируют от твердого вещества, твердый осадок промывают несколько раз ЕЮАс, растворители объединяют и упаривают при уменьшенном давлении Остаток фильтруют через двуокись кремния с ЕЮАс и затем кристаллизуют из МеОН, и получают 24мг (выход 15%) 1 (2,6-дихлорфенилметил)-5-метокси-2-метил1Н-индол-3-ацетамида, т пл 203 - 205°С Элементный анализ для CI9HI8CI2N2O2 Вычислено С 60 49 Н 4 81 N 7 42 Найдено С 60 75 Н 4 89 N 7 65 Пример 7 Получение 1-[(4-бензилоксифенил)метил]-5метокси-2-метил-1 Н-индол-3-ацетамид А 1-[(4-Бензилоксифенилметил-5-метокси]2-метил-1Н-индол-3-уксусная кислота По методике, описанной в примере 6, часть А, 2 Ог (812ммолей) этилового эфира 5-метокси-2метил-1 Н-индол-3-уксусной кислоты, 0 325г (8 12ммолей) 60% NaH/минералыюе масло и 1 88г (8 12ммолей) 4-бензилокси-1-хпорметилбензола реагируют с образованием 800 мг сырого этилового эфира 1-[(4-бензилоксифенил)метил]-5метокси-2-метил-1 Н-индол-3-уксусной кислоты Сырой эфир в 50мл МеОН и 15мл 1 N NaOH кипя 49 44218 50 тят 3 часа, выдерживают 16 часов, разбавляют Элементный анализ для C18H19N3O2 водой, смесь подкисляют 1 N НСІ и экстрагируют Вычислено С 69 88 Н 6 19 N 13 58 ЕЮАс Этилацетатный экстракт сушат над Найдено С 70 04 Н 6 32 N 13 85 Na2SO4, упаривают, остаток кристаллизуют из Пример 9 МеОН и получают 280мг (выход 32%) 1-[(4Получение 2-этил-5-метокси-1бензилоксифенил)метил]-5-метокси-2-метил(фенилметил)-1 Н-индол-ацетамида 1Н-индол-3-уксусной кислоты, т пл 175-179°С А г\І-трет-Бутоксикарбонил-4-метокси-2метиланилин По методике, описанной в части А Элементный анализ для C26H25NO4 примера 1, 13 7г (01 молей) 4-метокси-2Вычислено С 75 16 Н 6 06 N 3 37 метиланалина реагируют с 25мг (0 1145 молей) Найдено С 75 05 Н 6 07 N 3 47 ди-трет-бутилдикарбоната и после кристаллизаВ 1-[(4-Безилоксифенил)метил]-5-метоксиции из гексана получают 17 25г (выход 73%) N2-метил-1Н-индол-3-ацетамид По методике, трет-бутоксикарбонил-4-метокси-2описанной в части Г примера 1, 170мг метиланилина, т пл 80 - 82°С (0 41ммолей) 1-[(4-бензилоксифенил)метил]-5метокси-2-метил-1 Н-индол-3-уксусной кислоты, Элементный анализ для C13H19NO3 0 1мл этилхлорформиата и избыток ІЧНз реагируВычислено С 65 80 Н 8 07 N 5 90 ют с образованием 60мг (выход 35%) 1-[(4Найдено С 65 86 Н8 15 N5 61 бенизилоксифенил)метил]-5-метокси-2-метилВ 1-[2-(трет-Бутоксикарбониламино)-51Н-индол-3-ацетамида, который красталлизуют метоксифенил]-2-бутанон К 11 85г (0 05молей) изМеОН.тпл 155-157°С г\|-трет-бутоксикарбонил-4-метокси-2метиланилина в 80мл ТГФ при температуре ниже Элементный анализ для C26H26N2O3 -40°С при охлаждении на бане сухой лед-этанол Вычислено С 75 34 Н 6 32 N 6 76 прибавляют раствор 1 ЗМ вторНайдено С 75 09 Н 6 35 N 6 64 бутиллития/циклогексана (81мл, 0 105молей), баПример 8 ню удаляют, температура смеси поднимается до Получение 5-метокси-2-метил-1-[(220°С, затем баню заменяют Реакционную массу пиридил)метил]-1Н-индол-3-ацетамид охлаждают до -60°С, вносят по каплям 61г А Этиловый эфир 5-метокси-2-метил-1-[(2(0 052молей) ІЧ-метокси-ІЧ-метилпропанамида в пиридил)метил]-1 Н-индол-3-уксусной кислоты равном объеме ТГФ, перемешивают 1 час, охлажПо методике, описанной в части А примера 6, дающую баню удаляют, дополнительно переме494мг (2ммоля) этилового эфира 5-метокси-2шивают 1 час, выливают в смесь 200мл эфира и метил-1 Н-индол-3-уксусной кислоты реагируют с 200мл 1 N НСІ Органический слой отделяют, про160мг (4ммолей) 60% NaH/минерального масла и мывают водой, сушат над Na2SO4, упаривают при 328мг (2ммоля) гидрохлорида 2-пиколилхлорида уменьшенном давлении и получают 10 9г (выход и после хроматографии на двуокиси кремния (при 74%) 1-(2-(трет-бутоксикарбониламино)-5элюировании с 50% ЕЮАс/гексаном) получают 510мг (выход 75%) этилового эфира 5-метокси-2метоксифенил)-2-бутанона, т пл 80 - 81 °С после метил-1-[(2-пиридил)метил]-1Н-индол-3хроматографии на двуокиси кремния при элюироуксусной кислоты в виде масла вании 5% EtOAcfronyonoM Элементный анализ для C16H23NO4 Элементный анализ для C20H22N2O3 Вычислено С 65 51 Н 7 90 N 4 77 Вычислено С 70 99 Н 6 55 N 8 28 Найдено С 65 69 Н 7 89 N 4 90 Найдено С 71 28 Н 6 84 N 8 44 С 2-Этил-5-метокси-1Н-индол Смесь 1-[2В Гидразид 5-метокси-2-метил-1-[(2(трет-бутоксикарбониламино)-5-метоксифенил]пиридил)метил]-1 Н-индол-3-уксусной кислоты 2-бутанона (7 ЗЗг, 0 025молей) в 120мл CH2CI2 и По методике, описанной в части В примера 6, 20мл трифторуксуснои кислоты перемешивают 20 480мг (1 4ммолей) этилового зфира 5-метокси-2часов, промывают водой, раствором ЫаСОз, хрометил-1-[(2-пиридил)метил]-1Н-индол-3матографируют на двуокиси кремния (при элюиуксусной кислоты реагируют с 1 4мл гидразина и ровании % ЕЮАс/гексаном) и получают 2,54г (вывыделяют после кристаллизации из МеОН 304мг ход 58%) 2-этил-5-метокси-1Н-индола, в виде (выход 67%) гидразида 5-метокси-2-метил-1белого твердрго вещества, т пл 49 - 50°С [(2-пиридил)метил]-1 Н-индол-3-уксусной кислоты, т п л 147-148°С Элементный анализ для СЦНЗІЧО Вычислено С 75 40 Н 7 48 N 7 99 Элементный анализ для C18H20N4O2 Найдено С 75 64 Н 7 61 N 8 04 Вычислено С 66 65 Н 6 22 N 17 27 Д Метиловый эфир 2-этил-5-метокси-1 ННайдено С 66 40 Н 6 21 N 17 34 индол-3-уксусной кислоты По методике, описанС 5-Метокси-2-метил-1 - [ ( 2 ном в части С примера 1, 3 5г (0 02молей) 5пиридил)метил]-1 Н-индол-3-ацетамид По метометокси-2-этил-1Н-индола обрабатывают 12 5мл дике, описанной в части С примера 6, 200мг (0 02молей) 1 6М раствором н-бутиллития в гек(0,62ммолей) гидразида 5-метокси-2-метил-1сане, 20мл (0 02молей) 1М раствора ZnCb в эфи[(2-пиридил)метил]-1 Н-индол-3-уксусной кислоре и 1 89мл (0 02молей) метилового эфира 2ты и приблизительно 1г никеля Ренея в 10мл бромуксусной кислоты, хроматографируют на ЕЮН реагируют и после хроматографии на двудвуокиси кремния (толуол -Ї 10% Е ОАс^олуол) и окиси кремния при элюировании ЕЮАс -> 5% получают метиловый эфир 2-этил-5-метоксиМеОН/ЕЮАс выделяют 54мг (выход 28%) 51 Н-индол-3-уксусной кислоты в виде масла метокси-2-метил-1-[(2-пиридил)метил]-1НЭлементный анализ для C14H17NO3 индол-3-ацетамида в виде полукристаллического Вычислено С 67 99 Н 6 93 N 5 66 продукта 52 51 44218 Найдено С 67 73 Н 6 94 N 5 39 Найдено С 66 42 Н 8 09 N 4 71 Е Метиловый эфир 2-этил-5-метокси-1В 5-Метокси-2-пропил-1 Н-индол 1-[2(фенилметил)-1Н-индол-3-уксусной кислоты (трет-Бутоксикарбониламино)-5-метоксифенил]Раствор 2 47г (0 01 молей) метилового эфира 22-пентанон (14 27г, 0 0465молей) обрабатывают этил-5-метокси-1Н-индол-3-уксусной кислоты в 20мл трифторуксусной кислоты, как описано в 25мл ДМФА обрабатывают 1 12г (0 01 молей) части С примера 9, образующийся продукт критрет-бутилата калия, перемешивают 0 5 часа, сталлизуют из гексана и получают 5 5г (выход добавляют 1 15мл (0 01 молей) бензилхлорида, 58%) 5-метокси-2-пропил-1Н-индола в виде бевыдерживают 72 часа, разбавляют водой и экстлого кристаллического продукта, т пл 49 - 50°С рагируют ЕЮАс Этилацетатный экстракт промыЭлементный анализ для C12H15NO вают четыре раза водой, сушат над Na2SO4, упаВычислено С 76 16 Н 7 99 N 7 40 ривают при уменьшенном давлении, остаток Найдено С 76 36 Н 8 07 N 7 52 хроматографируют на двуокиси кремния при С Метиловый эфир 5-метокси-2-пропил-1Нэлюировании с градиентом толуол -> 10% индол-3-уксусной кислоты По методике, описанЕЮДс^олуолом и получают 1 5г (выход 44%) меной в Примере 1, часть С, 5 125г (0 0271 молей) 5тилового эфира 2-этил-5-метокси-1метокси-2-пропил-1Н-индола обрабатывают (фенилметил)-1Н-индол-3-уксусной кислоты в 16 9мл (0 0271 молей) 1 6М раствора нвиде масла бутиллития в гексане, 27 1мл (0 0271 молей) 1М раствора ZnCb в эфире и 2 7мл (0 0271 молей) Элементный анализ для C21H23NO3 метилового эфира 2-бромуксусной кислоты, хроВычислено С 74 75 Н 6 87 N 4 15 матографируют на двуокси кремния (20% Найдено С 75 00 Н 6 99 N 4 28 ЕЮАс/гексаном) и получают 4 65г (66%) метилоР Гидразид 2-этил-5-метокси-1 вого эфира 5-метокси-2-пропил-1Н-индол-3(фенилметил)-і Н-индол-3-уксусной кислоты По уксусной кислоты в виде масла методике, описанной в части С примера 3, 748мг Элементный анализ для C15H19NO3 (2 2ммолей) метилового эфира 2-этил-5Вычислено С 68 94 Н 7 33 N 5 36 метокси-1-(фенил метил)-1 Н-индол-3-уксусной кислоты реагируют с 2 2мл гидразина с образоваНайдено С 68 69 Н 7 36 N 5 63 нием 552мг (выход 72%) гидразида 2-этил-5Д Метиловый эфир 5-метокси-1метокси-1-(фенил метил)-1 Н-индол-3-уксусной (фенилметил)-2-пропил-1 Н-индол-3-уксусной кислоты, который кристаллизуют при охлаждении кислоты По методике, описанной в части Д приреакционной смеси, т пл 138-140°С мера 1, 522мг (2ммоля) метилового эфира 5метокси-2-пропил-1 Н-индол-3-уксусной кислоты Элементный анализ для C20H23N3O2 реагируют с 80мг (2ммоля) 60% NaH в минеральВычислено С 71 19 Н 6 87 N 12 45 ном масле и 0 24мл (2ммоля) бензилбромида и Найдено С 71 13 Н 6 86 N12 33 после хроматографирования на двуокиси кремния С 2-Этил-5-метокси-1-(фенил метил)-1Н(25% ЕЮАс/гексаном) получают 501мг (71%) меиндол-3-ацетамид Раствор 225мг (0 67ммолей) тилового эфира 5-метокси-1-(фенил метил)-2гидразида 2-этил-5-метокси-1-(фенил метил)пропил-1 Н-индол-3-уксусной кислоты в виде 1 Н-индол-3-уксусной кислоты в этаноле обрабамасла тывают приблизительно 1 5г никеля Ренея, как описано в части С примера 6, образовавшийся Е Гидразид 5-метокси-1-(фенил метил)-2сырой продукт хроматографируют на двуокиси пропил-1 Н-индол-3-уксусной кислоты По метокремния при элюировании 50% ЕЮАс/гексаком, дике, описанной в части С примера 3, 480мг ЕЮАс и затем 5% МеОН/ЕЮАс и получают после (1 37ммолей) метилового эфира 5-метокси-1кристаллизации из МеОН 46мг (выход 21%) 2(фенилметил)-2-пропил-1 Н-индол-3-уксусной этил-5-метокси-1-(фенил метил)-1Н-индол-3кислоты регируют с 1 4мл гидразина и после криацетамида, т пл 161-166°С сталлизации из МеОН получают 56мг (выход 74%) гидразида 5-метокси-1-(фенилметил)-2-пропилЭлементный анализ для C20H22N2O2 1 Н-индол-3-уксусной кислоты, т пл 140-141 °С Вычислено С 74 51 Н 6 88 N 8 69 Элементный анализ для C21H25N3O2 Найдено С 74 77 Н 6 94 N 8 81 Вычислено С 71 77 Н 7 17 N1196 Пример 10 Найдено С 71 98 Н 7 12 N1198 Получение 5-метокси-1-(фенил метил)-2F 5-Метокси-1-(фенилметил)-2-пропил-1Нпропил-1 Н-индол-3-ацетамида индол-3-ацетамид Раствор в спирте 160мг А 1-[2-(трет-Бутоксикарбониламино)-5(0 46ммолей) гидразида 5-метокси-1метоксифенил]-2-пентанон По методике, опи(фенилметил)-2-пропил-1 Н-индол-3-уксусной санной в части В примера 9, 15 17г (0 064 мол ей) кислоты обрабатывают приблизительно 1 Ог никег\|-трет-бутоксикарбонил-4-метокси-2ля Ренея, как описано в части С примера 6, и пометиланилина (пример 9, часть А) обрабатывают сле кристаллизации из МеОН получают 55мг (вы1 ЗМ втор-бутиллитием/цеклогексаном (100мл, ход 36%) 5-метокси-1-(фенилметил)-2-пропил0 13молей) и 8 4г (0 064молей) г\І-метокси-І\І1 Н-индол-3-ацетамида, т пл 154 - 156°С метилбутанамида и после хроматографирования на двуокиси кремния при элюировании с 5% Элементный анализ для C21H24N2O2 ЕЮДс^олуолом получают 14 31 г (выход 73%) 1 Вычислено С 74 97 Н 7 19 N 8 33 (трет-бутоксикарбониламино-5-метоксифенил)Найдено С 75 05 Н 7 21 N 8 29 2-пентанона, т пл 77 - 78°С Пример 11 Получение 2-хлор-5-метокси-1Элементный анализ для C17H25NO4 (фенилметил)-і Н-индол-3-ацетамида Вычислено С 66 43 Н 8 20 N 4 56 53 44218 54 А 1-Диметиламинометил-5-метокси-1Нсырой промежуточный продукт, метиловый эфир индол К Юг (0 068молелей) 5-метокси-1 Н2-хлор-5-метокси-1-(фенил метил)-1Н-индол-3индола и 17мл (0 176молей) 40%-ого водного диуксусной кислоты (710мг, выход 79%) Один ммоль метиламина в 100мл тетрагидрофурана прибавэтого продукта (344мг) растворяют в 20мл бензоляют по каплям 37%-ный водный раствор форла, добавляют 5мл 0 67М (СНзЬАІІЧНг в бензоле, мальдегида (11 г, 0 176молей), кипятят 3 часа, кипятят 2 часа, вносят дополнительное количестохлаждают водой и экстрагируют ЕЮАс Экстракт во алюминиевого реагента, нагревают непрерывэтилацетата промывают дважды водой, сушат но 1 5 часа, охлаждают на бане со льдом, смесь (Na2SO4), упаривают при уменьшенном давлении, обрабатывают 1 N НСІ, экстрагируют ЕЮАс Эксостаток хроматографируют на двуокиси кремния с тракт этилацетата промывают насыщенным NaCI, градиентом CH2CI2 -> 2%МеОН/СЬІ2СІ2 и получают сушат над Na2SO4, упаривают при уменьшенном 6 26г (выход 45%) 1-диметиламинометил-5давлении, остаток хроматографируют на двуокиси метокси-1Н-индола в виде масла кремния (при элюировании с CH2CI2 -> 2% МеOH/CH2CI2) и получают 50мг исходного материала Элементный анализ для C12H16N2O (эфира) и 165мг (выход 50%) 2-хлор-5-метоксиВычислено С 70 56 Н 70 56 N 13 71 1-(фенилметил)-1Н-индол-3-ацетамида, т пл Найдено С 70 79 Н 7 92 N 13 64 166-168°С В Метиловый эфир 2-хлор-5-метокси-1 Ниндол-3-уксусной кислоты К 5 1г (0 025молей) 1 Элементный анализ для C18H17CIN2O2 диметиламинометил-5-метокси-1Н-индола в Вычислено С 66 07 Н 5 38 CI 10 76 N 8 48 100мл ТГФ при температуре ниже -50°С при охНайдено С 65 75 Н 5 21 CI 10 78 N 8 52 лаждении на бане сухой лед-этанол прибавляют Пример 12 20мл (0 026молей) 1 ЗМ втор-бутиллития в циклоПолучение 5-метокси-2-(метилтио)-1гексане, удаляют охлаждающую баню, температу(фенилметил)-1Н-индол-3-ацетамида ра при этом поднимается до 0°С, затем баню возК раствору 1 0мл диметилдисульфида в 25мл вращают и при температуре -60°С прибавляют метиленхлорида при охлаждении на бане со 3 32мл (0 026молей) бензолсульфонилхлорида в льдом прибавляют сульфурилхлорид (0 8мл, 10мл ТГФ, перемешивают 0 3 часа, баню удаляют, Юммолей), охлаждающую баню удаляют, смесь выдерживают 1 час, температура при этом поднипостепенно нагревают до комнатной температуры мается до 20°С К этой смеси добавляют 100мл 1 и Змл этого раствора (содержащего метансульN НСІ и 50мл ЕЮАс, перемешивают 20 часов, фенилхлорид) прибавляют к 320мг (1 Іммолей) 5подщелачивают 5 N NaOH Этилацетатный слой метокси-1-(фенил метил)-1Н-индол-3отделяют, сушат (ЫагЗОД упаривают при уменьацетамида (пример 3) в 100мл метиленхлорида, шенном давлении, остаток хроматографируют на перемешивают 0 33 часа, добавляют насыщенный двуокиси кремния при элюировании толуолом и раствор ЫаНСОз, встряхивают сосуд, раствор меполучают 1 37г (выход 29%) сырого 2-хлор-5тиленхлорида отделяют, промывают насыщенным метокси-1 Н-индола К этому продукту раствором NaCI, сушат над Na2SO4, упаривают (7 55ммолей) в 30мл ТГФ прибавляют при темпепри уменьшенном давлении, остаток хроматограратуре ниже 10°С при охлаждении на бане этафируют на двуокиси кремния при элюировании с нол-лед 4 7мл (7 55ммолей) 1 6М раствора н40% ЕЮАс/гексаном -» 100% ЕЮАс и получают бутиллития в гексане, выдерживают 0 25 часа, 115мг (выход 31%) 5-метокси-2-(метилтио)-1вносят 7 55мл (7 55ммолей) 1М ZnCb в эфире, (фенилметил)-ІН-индол-З-ацетамида, т пл 195 перемешивают 2 часа, упаривают при уменьшен-197°С ном давлении, вносят 40мл толуола, затем 0 72мл Элементный анализ для C19H20N2O2S (7 55ммолей) метилового эфира 2-бромуксусной Вычислено С 67 03 Н 5 92 N 8 22 S 9 42 кислоты, перемешивают 16 часов, нагревают 4 Найдено С 66 57 Н 5 93 N 7 93 S 9 88 часа при 76°С, обрабатывают 50мл 1 N HCI и 40мл Пример 13 ЕЮАс Через 0 5 часа органический слой отделяПолучение 5-бензилокси-2-метил-1ют, сушат над Na2SO4, упаривают при уменьшен(фенилметил)-1Н-индол-3-ацетамида ном давлении, остаток хроматографируют на дву5-Гид рокси-2-метил-1-(фенил метил)-1Нокиси кремния при элюировании с градиентом индол-3-ацетамид (400мг, 1 4ммолей) растворярастворителей (толуол -> 20% Е ОАсл^луол) и ют в 50мл ДМСО, добавляют 40мг (1 Оммолей) получают 0 79г (выход 41%) метилового эфира 260% NaH в минеральном масле, перемешивают хлор-5-метокси-1Н-индол-3-уксусной кислоты в приблизительно 0 5 часа, прибавляют 0 2мл бровиде масла мистого бензила, перемешивают 2 5 часа, смесь разбавляют водой, экстрагируют ЕЮАс Экстракт Элементный анализ для C12H12CINO3 ЕЮАс промывают водой, насыщенным раствором Вычислено С 56 82 Н 4 77 N 5 52 NaCI, сушат над Na2SO4, упаривают при уменьНайдено С 56 47 Н 519 N 4 99 шенном давлении, остаток хроматографируют на С 2-Хлор-5-метокси-1-(фенил метил)-1Ндвуокиси кремния (при элюировании с градиениндол-3-ацетамид Метод, приведенный в части том, СН2СІ2 -» 2% MeOH/CH2CI2), кристаллизуют В примера 2, используется для реакции 660мг из СН2СІ2/Ме0Н и получают 440мг (выход 82%) 5(2 бммолей) метилового эфира 2-хлор-5бензилокси-2-метил-1-(фенилметил)-1Н-индолметокси-1Н-индол-3-уксусной кислоты, 140мг 3-ацетамида, т пл 118-120°С (3 5ммолей) 60% NaH в минеральном масле и 0 5мл бромистого бензила и получают после хроЭлементный анализ для C25H24N2O2 матографирования на двуокиси кремния (при Вычислено С 78 10 Н 6 29 N 7 29 элюировании 5% эфир/гексан -> 15% эфир/гексан) Найдено С 77 56 Н 6 33 N 716 55 44218 56 Пример 14 этилового эфира 5-этоксикарбонил-2-метил-1Ниндол-3-уксусной кислоты, т пл 74 - 76°С Получение 1-Децил-5-метокси-2-метил-1 Ниндол-3-ацетамида Элементный анализ для C16H19NO4 А Этиловый эфир 1-децил-5-метокси-2Вычислено С 66 42 Н 6 62 N 4 84 метил-1Н-индол-3-уксусной кислоты По методиНайдено С 66 54 Н 5 00 N 10 39 ке, приведенной в части Д примера 1, 2 47г В Этиловый эфир 5-этоксикарбонил-2(10 Оммолей) этилового эфира 5-метокси-2метил-1-(фенил метил)-1 Н-индол-3-уксусной метил-1Н-индол-3-уксусной кислоты реагируют с кислоты По методике, описанной в примере 2, 1 12г (10 Оммолей) трет-бутилата калия и 2 07мл часть В, 2 18г (7 5ммолей) этилового эфира 5(10 Оммолей) бромистого децила и после хромаэтоксикарбонил-2-метил-1 Н-индол-3-уксусной тографии на двуокиси кремния (при элюировании кислоты реагируют с 320мг (8ммолей) 60% NaH в с 5% ЕЮДс^олуолом) получают 2 16г (выход 56%) минеральном масле и 1 0мл (8 4ммолей) бромиэтилового эфира 1-децил-5-метокси-2-метилстого бензила и после хроматографии на двуокиси 1Н-индол-3-уксусной кислоты кремния (25% эфир/гексан -> 50% эфир/гексан) получают 1 6г (56%) этилового эфира 5Элементный анализ для C24H37NO3 этоксикарбонил-2-метил-1-(фенил метил)-1НВычислено С 74 38 Н 9 62 N 3 61 индол-3-уксусной кислоты Найдено С 74 53 Н 9 38 N 3 57 В Гидразид 1-децил-5-метокси-2-метилС Этиловый эфир 5-карбокси-2-метил-11 Н-индол-3-уксусной кислоты Раствор 2 1 г (фенилметил)-і Н-индол-3-уксусной кислоты (5 4ммолей) этилового эфира 1-децил-5Раствор 1 6г (4 2ммолей) этилового эфира 5метокси-2-метил-1 Н-индол-3-уксусной кислоты этоксикарбонил-2-метил-1-(фенил метил)-1Ни 5мл гидразина в 40мл ЕЮН кипятят 5 часов, индол-3-уксусной кислоты и 4 2мл 1 N NaOH в выдерживают 16 часов, выпавший осадок от75мл ЕЮН перемешивают 2 25 часов, добавляют фильтровывают, кристаллизовывают из МеОН и 10мл 1 N NaOH, перемешивают дополнительно получают 0 65г (выход 32%) гидразида 1-децил18 5 часов, подкисляют 1 N HCI, экстрагируют 5-метокси-2-метил-1 Н-индол-3-уксусной кислоЕЮАс Экстракт ЕЮАс промывают насыщенным ты, т пл 129-131 °С раствором NaCI, сушат (ЫагЗСч), упаривают при уменьшенном давлении, остаток в 150мл EtOH Элементный анализ для C22H35N3O2 нагревают 4 5 часа, выдерживают 96 часов при Вычислено С 70 74 Н 9 44 N 11 25 комнатной температуре, упаривают при уменьНайдено С 70 79 Н 9 60 N1113 шенном давлении, остаток хроматографируют на С 1-Децил-5-метокси-2-метил-1Н-индолдвуокиси кремния (25% эфир/гексан -> 50% 3-ацетамид К 1 5г (4 Оммолей) гидразида 1 эфир/гексан) и получают 110мг (7 5% выход) этидецил-5-метокси-2-метил-1 Н-индол-3-уксусной лового эфира 5-карбокси-2-метил-1кислоты в 250мл ЕЮН прибавляют приблизитель(фенилметил)-і Н-индол-3-уксусной кислоты но 1 5г никеля Ренея, кипятят 3 часа, охлаждают, фильтруют, фильтрат упаривают при уменьшенД Гидразид 5-гидразинокарбонил-2-метилном давлении, остаток кристаллизуют из 1-(фенилметил)-1 Н-индол-3-уксусной кислоты ЕЮАс/гексана и получают 0 987г (выход 69%) 1 По методике, описанной в части С примера 3 децил-5-метокси-2-метил-1Н-индол-3110мг (0 31ммолей) этилового эфира 5-карбоксиацетамида, т пл 110-111 °С 2-метил-1-(фенил метил)-1 Н-индол-3-уксусной Элементный анализ для C22H34N2O2 кислоты реагирует с Змл гидразина (общее время Вычислено С 73 70 Н 9 56 N 7 81 кипячения 78 часов), затем при охлаждении реакНайдено С 76 80 Н 9 36 N 7 95 ционной смеси выделяют 40мг (выход 38%) гидраПример 15 зида 5-гидразинокарбонил-2-метил-1(фенилметил)-і Н-индол-3-уксусной кислоты, Получение 5-аминокарбонил-2-метил-1т п л 255°С (фенилметил)-1Н-индол-3-ацетамида А Этиловый эфир 5-этоксикарбонил-2Элементный анализ для G19H21N5O2 метил-1 Н-индол-3-уксусной кислоты Сухой хлоВычислено С 64 94 Н 6 02 N 19 93 ристый водород пропускают через раствор 25г Найдено С 6515 Н 6 14 N19 82 (0 1643молей) 4-гидразинобензойной кислоты, и Е 5-Аминокарбонил-2-метил-120 5мл (0 2молей) левулиновои кислоты в течение (фенилметил)-1Н-индол-3-ацетамид 0 5 часов, кипятят 20 часов, охлаждают, упариваПо методике, описанной в примере 3, часть Д, ют при уменьшенном давлении, добавляют воду, 40мг (0,11 ммолей) гидразида 5экстрагируют ЕЮАс/эфиром, экстракт сушат гид разинокарбонил-2-метил-1-(фенил метил)(Na2SO4), раствор упаривают, остаток хромато1 Н-индол-3-уксусной кислоты гидрогенолизуют графируют на двуокиси кремния с градиентом при использовании приблизительно 1г никеля Рерастворителей (толуол -> 20% ЕЮАс/голуол) и в нея в 50мл ЕЮН и после хроматографии на двупоследней фракции собирают 12г смеси этилового окиси кремния (градиент, CH2CI2 -> 8% эфира 5-этоксикарбонил-2-метил-1Н-индол-3MeOH/CH2CI2) получают 17мг (выход 50%) 5уксусной кислоты и промежуточный гидразон Эту аминокарбонил-2-метил-1-(фенил метил)-1Нсмесь обрабатывают сухим HCI в 250мл ЕЮН, индол-3-ацетамида кипятят 16 часов, охлаждают, смесь выливают в Элементный анализ для C19H19N3O2 воду и экстрагируют ЕЮАс Экстракт ЕЮАс проВычислено С 71,02 Н 5,96 N13,07 мывают раствором ЫагСОз, сушат (МагЄСч), хроНайдено С 67,21 Н 5,76 N12,66 матографируют на двуокиси кремния (толуол -> Пример 16 20% ЕЮАсл-олуол) и получают 3 6г (выход 7 6%) 58 57 44218 Получение 2-метил-5-нитро-1Элементный анализ для C18H17N3O4 Вычислено С 63,71 Н5.05 N12,38 (фенилметил)-ІН-индол-З-ацетамида А 2-Метил-5-нитро-1Н-индол Найдено С 64,88 Н 5,38 N12,17 К 26,9г (0,205молей) 2-метил-1Н-индола в Е 2-Метил-5-нитро-1-(фенил метил)-1Н150мл серной кислоты при температуре от 2 - 10° индол-3-ацетамид до 0°С при охлаждении на бане этанол-вода приРаствор 0,927г (2,7ммолей) амида 2-метилбавляют по каплям 17,0г (0,2молей) нитрата на5-н итро-1-(фенил метил)-1Н-индол-3трия в 150мл серной кислоты, через 0,25 часа гликолевой кислоты в 15мл трифторуксусной кисмесь выливают на лед, экстрагируют ЕЮАс Эксслоты обрабатывают 1,0мл (б.Оммолей) триэтилтракт ЕЮАс промывают водой, раствором ЫагСОз, силана, смесь перемешивают 1 час, упаривают сушат (Na2SO4), упаривают при уменьшенном при уменьшенном давлении, остаток хроматоградавлении, остаток кристаллизуют из ЕЮН и полуфируют на двуокиси кремния (при элюировании чают 20,86г (выход 59%) 2-метил-5-нитро-1НЕЮАс), кристаллизуют из МеОН/СНгСЬ и получаиндола, т пл 163-165°С ют 455мг (52% выход) 2-метил-5-нитро-1(фенилметил)-ІН-индол-З-ацетамида, т пл 189 Элементный анализ для C9H8N2O2 -192°С Вычислено С 61,36 Н 4,58 N15,90 Найдено С 61,36 Н4.61 N16,17 Элементный анализ для C18H17N3O3 Вычислено С 66,86 Н 5,80 N12,99 В 2-Метил-5-нитро-1-(фенил метил)-1Ниндол Найдено С 66,99 Н 5,26 N12,95 80мг (2,0ммоля) 60% NaH в минеральном Пример 17 масле промывают гексаном, добавляют 6мл Получение 5-амино-2-метил-1ДМФА, затем 352мг (2,0ммолей) 2-метил-5(фенилметил)-1Н-индол-3-ацетамида нитро-1Н-индола, через 0,33 часа вносят 0,24мл Раствор 205мг (0,634ммолей) 2-метил-5(2,0ммолей) бромистого бензила, перемешивают нитро-1-(фенилметил)-1Н-индол-3-ацетамида в 0,5 часов, разбавляют водой, экстрагируют ЕЮАс 30мл ТГФ/ЕЮН (2 1) гидрируют при 60 Экстракт ЕЮАс промывают насыщенным раствофунт/дюйм2 (4218 г/см2) водородом в течение 4 ром NaCI, сушат (MgSO4), упаривают при уменьчасов при использовании в качестве катализатора шенном давлении Образующиеся кристаллы 0,1 г Pd/C Катализатор отфильтровывают, фильтпромывают МеОН и получают 400мг (выход 75%) рат упаривают при уменьшенном давлении, оста2-метил-5-н итро-1-(фенил метил)-1Н-индола, ток хроматографируют на двуокиси кремния при т п л 150-152°С элюировании ЕЮАс и затем 5% МеОН/ЕЮАс и получают 52мг (выход 28%) 5-амино-2-метил-1Элементный анализ для C16H14N2O2 (фенилметил)-1Н-индол-3-ацетамида, 175 Вычислено С 72,17 Н 5,30 N10,54 178°С Найдено С 72,37 Н 5,24 N10,53 С Амид 2-метил-5-нитро-1-(фенилметил)Элементный анализ для C18H19N3O 1Н-индол-3-глиоксалевой кислоты Вычислено С 73,69 Н 6,53 N14,32 К раствору 380мг (1,4ммолей) 2-метил-5Найдено С 73,90 Н 6,57 N14,25 нитро-1-(фенилметил)-1Н-индола в 10мл хлориПример 18 стого метила прибавляют 0,12мл оксалилхлорида, Получение этилового эфира 2-[[3-(2-аминоохлаждающую баню удаляют, реакционную смесь 2-оксоэтил)-2-метил-1-(фенил метил)-1Нперемешивают 3 часа, упаривают при уменьшениндол-5-ил]окси]уксусной кислоты ном давлении до твердого осадка, который расА 5-(Карбэтоксиметокси)-2-метил-1творяют в 10мл метиленхлорида и приблизитель(фенилметил)-1 Н-индол-уксусная кислота но в течение 5 минут пропускают безводный Раствор 590мг (2,0ммоля) 5-гидрокси-2аммиак, упаривают при уменьшенном давлении, метил-1-(фенил метил)-1Н-индол-3-уксуной киостаток обрабатывают ЕЮАс, промывают водой, слоты (пример 2, часть С) в 30мл ТГФ и 10мл раствором NaCI, сушат (MgSC^), упаривают, остаДМСО обрабатывают 180мг (4,5ммолей) 60% NaH ток кристаллизуют из МеОН и получают 315мг в минеральном масле и через 10 минут вносят (выход 67%) амида 2-метил-5-нитро-10,25мл (2,25ммолей) этилового эфира 2(фенилметил)-1Н-индол-3-глиоксалевой кислобромуксусной кислоты, перемешивают 0,5 часа, ты, т пл 204-206°С подкисляют 1 N HCI, экстрагируют ЕЮАс Экстракт ЕЮАс промывают водой, насыщенным раствором Элементный анализ для C18H15N3O4 NaCI, сушат (Na2SO4), упаривают при уменьшенВычислено С 64,09 Н 4,48 N12,46 ном давлении, хроматографируют на двуокиси Найдено С 64,32 Н 4,38 N12,44 кремния (при элюировании с градиентом СНгСІд -> Д Амид 2-метил-5-нитро-13% МеОН/СН2СІ2) и получают 590мг (выход 77%) (фенилметил)-1 Н-индол-3-гликолевой кислоты 5-(карбэтоксиметокси)-2-метил-1К смеси 1,04г (3,1ммолей) амида 2-метил-5(фенилметил)-і Н-индол-3-уксусной кислоты нитро-1-(фенил метил)-1Н-индол-3глиоксалевой кислоты в 30мл ЕЮН прибавляют В Этиловый эфир 2[[3-(2-амино-2148мг (3,9ммолей) NaBH4, смесь перемешивают 1 оксоэтил)-2-метил-1-(фенилметил)-1Н-индолчас, упаривают при уменьшенном давлении Ос5-ил]окси]уксусной кислоты таток обрабатывают водой и ЕЮАс, нерастворивК 630мг (1,6ммолей) 5-(карбэтоксиметокси)шийся осадок отфильтровывают и получают 2-метил-1-(фенил метил)-1 Н-индол-3-уксусной 1,05мг (выход 100%) амида 2-метил-5-нитро-1кислоты и 0,3мл (2,2ммолей) триэтиламина в 30мл (фенилметил)-і Н-индол-3-гликолевой кислоты, СН2СІ2 прибавляют при охлаждении при -5°С т п л 120-124°С 0 16мл (2 Іммолей) метилхлорформиата, пере 59 44218 60 мешивают 10 минут, в реакционную массу в течелэтилкетона реагируют с образованием 130мг ние 0 5 часов пропускают безводный аммиак, бензилового эфира 3-[[3-(2-амино-2-оксоэтил)смесь промывают водой, насыщенным раствором 2-метил-1-(фенил метил)-1Н-индол-5NaCI, сушат (Na2SO4), упаривают при уменьшенил]окси]пропановой кислоты (хроматографируют ном давлении, остаток хроматографируют на двуна двуокиси кремния при элюировании с СН2СІ2 -> окиси кремния при элюировании с градиентом 7% МеОН/СН2СІ2) (CH2CI2 -» 3% MeOH/CH2CI2), кристаллизуют из В 3-[[3-(2-Амино-2-оксоэтил)-2-метил-1эфира и получают 270г (выход 44%) этилового (фенилметил)-1Н-индол-5-ил]окси]пропановая эфира 2-[[3-(2-амино-2-оксоэтил)-2-метил-1кислота (фенилметил)-1Н-индол-5-ил]окси]уксусной киСмесь 130мг (0,29ммолей) бензилового эфира слоты,тпл 160-161 °С 3-[[3-(2-амино-2-оксоэтил)-2-метил-1(фенилметил)-1Н-индол-5-ил]окси]пропановой Элементный анализ для C22H24N2O4 кислоты и 0,2г 10% Pd/C гидрируют при 40 Вычислено С 69,46 Н 6,36 N 7,36 фунт/дюйм2 (2812 г/см2) водорода в течение 4,5 Найдено С 69,69 Н 6,38 N7,18 часов, смесь фильтруют, упаривают до кристалПример 19 лического остатка, промывают эфиром и получают Получение 2-[[3-(2-амино-2-оксоэтил)-280мг (выход 75%) 3-[[3-(2-амино-2-оксоэтил)-2метил-1-(фенил метил)-1Н-индол-5метил-1-(фенил метил)-1Н-индол-5ил]окси]уксусной кислоты ил]окси]пропановой кислоты, т пл 201 - 203°С Раствор 190мг (0,5ммолей) этилового эфира 2-[[3-(2-амино-2-оксоэтил)-2-метил-1Элементный анализ для C2iH22N2O4 (фенилметил)-1Н-индол-5-ил]окси]уксусной киВычислено С 68,84 Н 6,05 N 7,65 слоты и 2мл 5 N NaOH в 30мл ЕЮН и 10мл ТГФ Найдено С 65,88 Н 6,32 N6,68 перемешивают 15 часов, подкисляют 5 N HCI и Пример 22 экстрагируют ЕЮАс Экстракт ЕЮА промывают 4-[[3-(2-Амино-2-оксоэтил)-2-метил-1насыщенным раствором NaCI, сушат над Na2SO4, (фенилметил)-1Н-индол-5-ил]окси]бутановая упаривают при уменьшенном давлении, остаток кислота промывают эфиром и получают 155мг (выход Раствор 430мг (1,5ммолей) 5-гидрокси-290%) 2-[[3-(2-амино-2-оксоэтил)-2-метил-1метил-1-(фенил метил)-1 Н-индол-3-ацетамида (фенилметил)-1Н-индол-5-ил]окси]уксусной ки(пример 2, часть Д) в 50мл ДМСО обрабатывают слоты, т п л 196-198°С 60мг (1,5ммолей) 60% NaH в минеральном масле, затем 0,26мл (1,8ммолей) бромистого бензила, Элементный анализ для C2oH2oN204 перемешивают 1,5 часа при комнатной темпераВычислено С 68,17 Н 5,72 N7,95 туре, 1,5 часа при 85°С, 16 часов при комнатной Найдено С 68,35 Н 5,73 N7,73 температуре, разбавляют водой и экстрагируют Пример 20 ЕЮАс, экстракт ЕЮАс промывают водой, насыПолучение метилового эфира 3-[[3-(2-аминощенным раствором NaCI, сушат над Na2SO4, упа2-оксоэтил)-2-метил-1-(фенил метил)-1Нривают при уменьшенном давлении, остаток хроиндол-5-ил]окси]-пропановой кислоты матографируют на двуокиси кремния (CH2CI2 -> Смесь 5-гидрокси-2-метил-1-(фенилметил)3% MeOH/CH2CI2) и получают 315мг (выход 51%) 1 Н-индол-3-ацетамида (550мг, 1,8ммолей), этилового эфира 4-[[3-(2-амино-2-оксоэтил)-2550мг (4ммолей) К2СОз и 0,2мл метилакрилата в метил-1-(фенил метил)-1Н-индол-540мл ацетона кипятят 100 часов (в течение этого ил]окси]бутановой кислоты Этот продукт перемевремени добавляют дополнительное количество шивают 20 часов с 1мл 5 N NaOH в 15мл ЕЮН, метилакрилата), охлаждают, разбавляют водой и подкисляют 5 N HCI, экстрагируют ЕЮАс, экстракт экстрагируют ЕЮАс Экстракт ЕЮАс промывают ЕЮАс промывают насыщенным раствором NaCI насыщенным NaCI раствором, сушат над Na2SO4, сушат над Na2SO4, упаривают, собирают образоупаривают, остаток хроматографируют на двуокивавшийся твердый осадок и получают 245мг (выси кремния (при элюировании с CH2CI2 -> 1% ход 38%) 4-[[3-(2-амино-2-оксоэтил)-2-метилMeOH/CH2CI2), кристаллизуют из СН2С12/эфира и 1-(фенил метил)-1Н-индол-5-ил]окси]бутановой получают 375мг (выход 55%) метилового эфира кислоты, т п л 218-221 °С 3-[[3-(2-амино-2-оксоэтил)-2-метил-1(фенилметил)-1Н-индол-5-ил]окси]пропановой Элементный анализ для C22H24N2O4 кислоты, т пл, 1 1 3 - 115°С Вычислено С 69,46 Н 6,36 N 7,36 Элементный анализ для C22H24N2O4 Вычислено С 69,46 Н 6,36 N 7,36 Найдено С 69,52 Н 6,38 N7,33 Пимер 21 3-[[3-(2-Амино-2-оксоэтил)-2-метил-1(фенилметил)-1Н-индол-5-ил]окси]пропановая кислота А Бензиловый эфир 3-[[3-(2-амино-2оксоэтил)-2-метил-1-(фенилметил)-1Н-индол5-ил]окси]пропановой кислоты По методике, приведенной в примере 20, 270мг (0,92ммолей) 5-гидрокси-2-метил-1(фенилметил)-і Н-индол-3-ацетамида, 0,5г карбоната калия и 1мл бензилакрилата в 30мл мети Найдено С 68,35 Н 6,36 N7,00 Пример 23 Получение 5-[[3-(2-амино-2-оксоэтил)-2метил-1-(фенил метил)-1Н-индол-5ил]окси]пентановой кислоты Как описано в примере 22, 125мг (0,43ммолей) 5-гид рокси-2-метил-1-(фенил метил)-1 Н-индол3-ацетамида (пример 2), 30мг 60% NaH в минеральном масле и 0,1мл метилового эфира 5бромпентановой кислоты в 15мл ДМСО реагируют с образованием 80мг метилового эфира 5-[[3-(2амино-2-оксоэтил)-2-метил-1-(фенил метил)1Н-индол-5-ил]окси]пентановой кислоты после хроматографии на двуокиси кремния (при элюи
ДивитисяДодаткова інформація
Автори англійськоюBach Nicolas James, Dillard Robert Dilane, Draheim Suzanne Elizabeth, Hermann Robert Bell, Shevits Richard Walter
Автори російськоюБах Николас Джеймс, Диллард Роберт Дилейн, Драхейм Сюзан Элизабет, Германн Роберт Белл, Шевиц Ричард Вальтер
МПК / Мітки
МПК: A61P 3/02, A61K 31/40, A61P 1/00, A61P 17/00, A61P 31/04, C07D 209/14, C07D 401/06, A61K 31/404, C07D 209/30, C07D 209/22, C07D 209/18, A61P 43/00, C07D 403/12, A61P 11/00, A61P 11/16, C07F 9/572, C07D 209/24, C07D 209/42, A61P 11/08, C07D 417/12, A61K 31/675, C07D 209/34, A61K 31/403
Мітки: композиція, 1н-індол-3-ацетаміди, фармацевтична
Код посилання
<a href="https://ua.patents.su/59-44218-1n-indol-3-acetamidi-ta-farmacevtichna-kompoziciya.html" target="_blank" rel="follow" title="База патентів України">1н-індол-3-ацетаміди та фармацевтична композиція</a>
Наступний патент: Оптично активні похідні 2-імідазолін-5-онів, спосіб їх одержання, проміжні сполуки, фунгіцидна композиція та спосіб обробки культур
Випадковий патент: Клиновий патрон