Похідні сульфонаміду, спосіб їх одержання та фармацевтична композиція на їх основі
Номер патенту: 71892
Опубліковано: 17.01.2005
Автори: Мацумото Кен, Циммерман Денніс Майкл, Арнольд Маклін Брайян, Блікман Давід, Блейш Томас Джон, Кантрелл Баді Юджін, Бейкер Стівен Річард, Орнстейн Пол Леслі, Маккенон Трайсі Елейн, Тіззано Джозеф Патрік, Сміт Едвард К.Р., Саймон Річард Лі, Заррінмег Хамідех, Ескрібано Ана Марія
Формула / Реферат
1. Похідні сульфонаміду формули
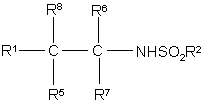 , Іа
, Іа
де R1 являє собою нафтил або феніл, фурил, тієніл чи піридил, незаміщений або заміщений одним або двома замісниками, вибраними незалежно один від одного з групи, яка включає галоїд; нітрогрупу; ціан; гідроксііміногрупу; С1-С10-алкіл; С2-С10-алкеніл; С2-С10-алкініл; С3-C8-циклоалкіл; гідрокси-С3-С8-циклоалкіл; оксо-С3-С8-циклоалкіл; галоїдний С1-С10-алкіл; групу (CH2)yX1R9, де у - нуль або ціле число від 1 до 4, X1 - О, S, NR10, CO, COO, ОСО, CONR11, NR12CO, NR12COCOO, OCONR13, R9 - водень, С1-С10-алкіл, С3-С10-алкеніл, С3-С10-алкініл, піролідиніл, тетрагідрофурил, морфолінова група або С3-С8-циклоалкіл, а кожний з R10, R11, R12 і R13 незалежно від інших являє собою водень чи С1-С10-алкіл, або ж R9 і R10, R11, R12 чи R13 разом з атомом азоту, до якого вони приєднані, утворюють азетидиніл, піролідиніл, піперидиніл або морфолінову групу; N-C1-С4-алкілпіперазиніл; N-феніл-С1-С4-алкілпіперазиніл; тієніл; фурил; оксазоліл; ізоксазоліл; піразоліл; імідазоліл; тіазоліл; піридил; піридазиніл; піримідиніл; дигідротієніл; дигідрофурил; дигідротіопіраніл; дигідропіраніл; дигідротіазоліл; С1-С4-алкоксикарбонілдигідротіазоліл; С1-С4-алкоксикарбонілдиметилдигідротіазоліл; тетрагідротієніл; тетрагідрофурил; тетрагідротіопіраніл; тетрагідропіраніл; індоліл; бензофурил; бензотієніл; бензімідазоліл; і групу формули R14-(La)n-X2-(Lb)m, де X2 є зв'язком, О, NH, S, SO, SO2, CO, CH(OH), CONH, NHCO, NHCONH, NHCOO, COCONH, ОСН2СОNН або СН=СН, кожна з груп La і Lb є С1-С4-алкіленом, одне з чисел m і n є 0 або 1, а друге - 0, а R14 - феніл або гетероароматична група, незаміщена або заміщена одним або двома замісниками з перелічених нижче: галоїд, нітрогрупа, ціан, гідроксііміногрупа, С1-С10-алкіл, С2-С10-алкеніл, С2-С10-алкініл, С3-С8-циклоалкіл, 4-(1,1-діоксотетрагідро-1,2-тіазиніл), галоїдний С1-С10-алкіл, ціано-С2-С10-алкеніл, феніл і група (СН2)zХ3R15, в якій z - нуль або ціле число від 1 до 4, X3 - О, S, NR16, CO, СН(ОН), СОО, ОСО, CONR17, NR18CO, NHSO2, NHSO2NR17, NHCONH, OCONR19, NR19CO, R15 - водень, С1-С10-алкіл, феніл-С1-С4-алкіл, галоїдний С1-С10-алкіл, С1-С4-алкоксикарбоніл-С1-С4-алкіл, С1-С4-алкілсульфоніламіно-С1-С4-алкіл, (N-C1-С4-алкоксикарбоніл)-С1-С4-алкілсульфоніламіно-С1-С4-алкіл, С3-С10-алкеніл, С3-С10-алкініл, С3-С8-циклоалкіл, камфорил чи ароматична або гетероароматична група, незаміщена або заміщена одним або двома такими замісниками: галоїд, С1-С4-алкіл або С1-С4-алкоксигрупа, а кожний з R16, R17, R18 і R19 незалежно від інших являє собою водень чи С1-С10-алкіл, або ж R15 і R16, R17, R18 чи R19 разом з атомом азоту, до якого вони приєднані, утворюють азетидиніл, піролідиніл, піперидиніл або морфолінову групу;
R2 являє собою С1-С6-алкіл, С3-С6-циклоалкіл, С1-С6-фторалкіл, C1-C6-хлоралкіл, С2-С6-алкеніл, С1-С4-алкоксі-С1-С4-алкіл або групу формули R3R4N, де кожний з R3 і R4 незалежно від іншого являє собою С1-С4-алкіл або разом з атомом азоту, до якого вони приєднані, утворюють азетидиніл, піролідиніл, піперидиніл, морфолінову групу, піперазиніл, гексагідроазепініл або октагідроазоциніл; і
або один з R5 і R8 являє собою С1-С4-алкіл, або ж разом з атомом вуглецю, до якого вони приєднані, утворюють С3-С8-карбоциклічну групу, а інші з R5, R6, R7 і R8 є атомами водню;
або фармацевтично прийнятна сіль такої сполуки.
2. Сполуки за п. 1, де
R1 являє собою нафтил або феніл, незаміщений або заміщений одним або двома замісниками, вибраними незалежно один від одного із групи, яка включає галоїд; нітрогрупу; ціан; С1-С10-алкіл; С2-С10-алкеніл; С2-С10-алкініл; С3-С8-циклоалкіл; галоїдний С1-С10-алкіл; групу (CH2)yX1R9, де у - нуль або ціле число від 1 до 4, X1 - О, S, NR10, CO, COO, ОСО, CONR11, NR12CO, OCONR13, R9 - водень, С1-С10-алкіл, С3-С10-алкеніл, С3-С10-алкініл або С3-С8-циклоалкіл, а кожний з R10, R11, R12 і R13 незалежно від інших являє собою водень чи С1-С10-алкіл, або ж R9 і R10, R11, R12 чи R13 разом з атомом азоту, до якого вони приєднані, утворюють азетидиніл, піролідиніл, піперидиніл або морфолінову групу; тієніл; фурил; оксазоліл; ізоксазоліл; піразоліл; імідазоліл; тіазоліл; піридил; піридазиніл; піримідиніл; дигідротієніл; дигідрофурил; дигідротіопіраніл; дигідропіраніл; тетрагідротієніл; тетрагідрофурил; тетрагідротіопіраніл; тетрагідропіраніл; індоліл; бензофурил; бензотієніл; бензимідазоліл; і групу формули R14-(La)n-X2-(Lb)m, де X2 є зв'язком, О, NH, S, SO, SO2, CO, CONH або NНCO, кожна з груп La і Lb є С1-С4-алкіленом, одне з чисел m і n є 0 або 1, а друге - 0, a R14 - феніл, незаміщений або заміщений одним або двома замісниками з перелічених нижче: галоїд, нітрогрупа, ціан, С1-С10-алкіл, С2-С10-алкеніл, С2-С10-алкініл, С3-С8-циклоалкіл, галоїдний С1-С10-алкіл і група (CH2)zX3R15, в якій z - нуль або ціле число від 1 до 4, X3 - О, S, NR16, CO, COO, ОСО, CONR17, NR18CO, OCONR19, R15 - водень, С1-С10-алкіл, С3-С10-алкеніл, С3-С10-алкініл або С3-С8-циклоалкіл, а кожний з R16, R17, R18 і R19 незалежно від інших являє собою водень чи С1-С10-алкіл, або ж R15 і R16, R17, R18 чи R19 разом з атомом азоту, до якого вони приєднані, утворюють азетидиніл, піролідиніл, піперидиніл або морфолінову групу; а
R2 являє собою С1-С6-алкіл, С1-С6-фторалкіл, С2-С6-алкеніл або групу формули R3R4N, де кожний з R3 і R4 незалежно від інших являє собою С1-C4-алкіл або разом з атомом азоту, до якого вони приєднані, утворюють азетидиніл, піролідиніл, піперидиніл, морфолінову групу, піперазиніл, гексагідроазепініл або октагідроазоциніл.
3. Сполуки за п. 1 або п. 2, де R8 являє собою метил або етил, або ж R5 і R8 разом з атомом вуглецю, до якого вони приєднані, утворюють циклопропільну групу.
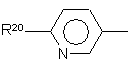
4. Сполуки за будь-яким із пп. 1-3, де R1 являє собою 2-нафтил або групу формули
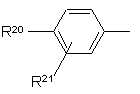 ,
,
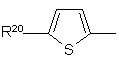 ,
,
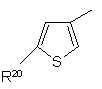 ,
,
 ,
,
де R20 являє собою галоїд; нітрогрупу; ціан; гідроксііміногрупу; С1-С10-алкіл; С2-С10-алкеніл; С2-С10-алкініл; С3-С8-циклоалкіл; гідрокси-С3-C8-циклоалкіл; оксо-С3-С8-циклоалкіл; галоїдний С1-С10-алкіл; групу (CH2)yX1R9, де у - нуль або ціле число від 1 до 4, X1 - О, S, NR10, CO, COO, ОСО, CONR11, NR12CO, NR12COCOO, OCONR13, R9 - водень, С1-С10-алкіл, С3-С10-алкеніл, С3-С10-алкініл, піролідиніл, тетрагідрофурил, морфолінова група або С3-С8-циклоалкіл, а кожний з R10, R11, R12 і R13 незалежно від інших являє собою водень чи С1-С10-алкіл, або ж R9 і R10, R11, R12 чи R13 разом з атомом азоту, до якого вони приєднані, утворюють азетидиніл, піролідиніл, піперидиніл або морфолінову групу; N-С1-С4-алкілпіперазиніл; N-феніл-С1-С4-алкілпіперазиніл; тієніл; фурил; оксазоліл; ізоксазоліл; піразоліл; імідазоліл; тіазоліл; піридил; піридазиніл; піримідиніл; дигідротієніл; дигідрофурил; дигідротіопіраніл; дигідропіраніл; дигідротіазоліл; С1-С4-алкоксикарбонілдигідротіазоліл; С1-C4-алкоксикарбонілдиметилдигідротіазоліл; тетрагідротієніл; тетрагідрофурил; тетрагідротіопіраніл; тетрагідропіраніл; індоліл; бензофурил; бензотієніл; бензимідазоліл; і групу формули R14-(La)n-X2-(Lb)m, де X2 є зв'язком, О, NH, S, SO, SO2, CO, CONH, NHCO, NHCONH, NHCOO, COCONH, ОСН2СОNН або СН=СН, кожна з груп La і Lb є С1-С4-алкіленом, одне з чисел m і n є 0 або 1, а друге - 0, a R14 - феніл або гетероароматична група, незаміщена або заміщена одним або двома замісниками з перелічених нижче: галоїд, нітрогрупа, ціан, гідроксііміногрупа; С1-С10-алкіл, С2-С10-алкеніл, С2-С10-алкініл, С3-С8-циклоалкіл, 4-(1,1-діоксотетрагідро-1,2-тіазиніл), галоїдний С1-С10-алкіл, ціано-С2-С10-алкеніл, феніл і група (СН2)zХ3R15, в якій z - нуль або ціле число від 1 до 4, X3 - О, S, NR16, CO, СН(ОН), СОО, ОСО, CONR17, NR18CO, NHSO2, NHSO2NR17, NHCONH, OCONR19 або NR19COО, R15 - водень, С1-С10-алкіл, феніл-С1-С4-алкіл, галоїдний С1-С10-алкіл, С1-С4-алкоксикарбоніл-С1-С4-алкіл, С1-С4-алкілсульфоніламіно-С1-С4-алкіл, (N-C1-С4-алкоксикарбоніл)-С1-С4-алкілсульфоніламіно-С1-С4-алкіл, С3-С10-алкеніл, С3-С10-алкініл, С3-С8-циклоалкіл, камфорил чи ароматична або гетероароматична група, незаміщенаабо заміщена одним або двома такими замісниками: галоїд, С1-С4-алкіл або С1-С4-алкоксигрупа, а кожний з R16, R17, R18 і R19 незалежно від інших являє собою водень чи С1-С10-алкіл, або ж R15 і R16, R17, R18 чи R19 разом з атомом азоту, до якого вони приєднані, утворюють азетидиніл, піролідиніл, піперидиніл або морфолінову групу; а
R21 являє собою водень, галоїд, С1-С4-алкіл або С1-С4-алкоксигрупу.
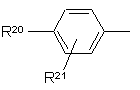
5. Сполуки за будь-яким із пп. 1-3, де R1 являє собою 2-нафтил або групу формули
 ,
,
в якій
R20 являє собою галоїд; нітрогрупу; ціан; С1-С10-алкіл; С2-С10-алкеніл; С2-С10-алкініл; С3-С8-циклоалкіл; галоїдний С1-С10-алкіл; групу (CH2)yX1R9, де у - нуль або ціле число від 1 до 4, X1 - О, S, NR10, CO, COO, ОСО, CONR11, NR12CO або OCONR13, R9 - водень, С1-С10-алкіл, С3-С10-алкеніл, С3-С10-алкініл або С3-С8-циклоалкіл, а кожний з R10, R11, R12 і R13 незалежно від інших являє собою водень чи С1-С10-алкіл, або ж R9 і R10, R11, R12 чи R13 разом з атомом азоту, до якого вони приєднані, утворюють азетидиніл, піролідиніл, піперидиніл або морфолінову групу; тієніл; фурил; оксазоліл; ізоксазоліл; піразоліл; імідазоліл; тіазоліл; піридил; піридазиніл; піримідиніл; дигідротієніл; дигідрофурил; дигідротіопіраніл; дигідропіраніл; тетрагідротієніл; тетрагідрофурил; тетрагідротіопіраніл; тетрагідропіраніл; індоліл; бензофурил; бензотієніл; бензимідазоліл і групу формули R14-(La)n-X2-(Lb)m, де X2 є зв'язком, О, NH, S, SO, SO2, CO, CONH або NHCO, кожна з груп La і Lb є С1-С4-алкіленом, одне з чисел m і n є 0 або 1, а друге - 0, а R14 - феніл, незаміщений або заміщений одним або двома замісниками з перелічених нижче: галоїд, нітрогрупа, ціан, С1-С10-алкіл, С2-С10-алкеніл, С2-С10-алкініл, С3-С8-циклоалкіл, галоїдний С1-С10-алкіл і група (СН2)zХ3R15, в якій z - нуль або ціле число від 1 до 4, X3 - О, S, NR16, CO, СОО, ОСО, CONR17, NR18CO, OCONR19, R15 - водень, С1-С10-алкіл, С3-С10-алкеніл, С3-С10-алкініл або С3-С8-циклоалкіл, а кожний з R16, R17, R18 і R19 незалежно від інших являє собою водень чи С1-С10-алкіл, або ж R15 і R16, R17, R18 чи R19 разом з атомом азоту, до якого вони приєднані, утворюють азетидиніл, піролідиніл, піперидиніл або морфолінову групу; а
R21 являє собою водень, галоїд, С1-С4-алкіл або С1-С4-алкоксигрупу.
6. Сполуки за п. 5, де R1 являє собою 2-нафтил, 4-бромфеніл, 4-бензамідофеніл, 4-метилфеніл, 4-ізопропілфеніл, 4-ізобутилфеніл, 4-трет-бутилфеніл, 4-метоксифеніл, 4-ізопропоксифеніл, 4-циклопентилфеніл, 4-циклогексилфеніл, 4-(4-(гідроксиметил)феніл)феніл, 4-(2-(гідроксиметил)феніл)феніл, 4-(2-фурил)феніл, 4-(3-фурил)феніл, 4-(2-тієніл)феніл, 4-(3-тієніл)феніл, 4-(піролідин-1-іл)феніл, 4-(піперидин-1-іл)феніл, 3-хлор-4-піперидин-1-ілфеніл, 4-бензилоксифеніл, 4-(2-фторфеніл)феніл, 4-(3-фторфеніл)феніл, 4-(2-формілфеніл)феніл, 4-(3-формілфеніл)феніл, 4-(4-формілфеніл)феніл, 4-(4-метилфеніл)феніл або 4-(2-метоксифеніл)феніл.
7. Сполуки за будь-яким із пп. 1-6, де R2 являє собою метил, етил, пропіл, 2-пропіл, 2-метилпропіл, циклогексил, трифторметил, 2,2,2-трифторетил, хлорметил, етеніл, проп-2-еніл, метоксіетил або диметиламіногрупу.
8. Сполуки за п. 7, де R2 являє собою етил, 2-пропіл або диметиламіногрупу.
9. Сполука за п. 1, вибрана з такого переліку:
N-2-(4-(3-тієніл)феніл)пропіл-2-пропансульфамід;
N-2-(4-(3-тієніл)феніл)пропілдиметилсульфамід;
N-2-(4-циклопентилфеніл)пропіл-2-пропансульфамід;
N-2-(4-(4-(2-метансульфамідетил)феніл)феніл)пропіл-2-пропансульфамід;
N-2-(4-(5-бром-[1,2,4]оксадіазол-3-іл)феніл)пропіл-2-пропансульфамід;
N-2-(4-(5-(2-мeтил)тeтpaзoлiл)фeнiл)пpoпiл-2-пpoпaнcyльфaмiд;
N-2-(4-(4-aмiнoфeнiл)фeнiл)пpoпiл-2-пpoпaнcyльфaмiд;
N-2-(4-(3-(5-(2-гідрокси)етил)ізоксазоліл)феніл)пропіл-2-пропансульфамід;
N-2-(4-(5-(3-бром)ізоксазоліл)феніл)пропіл-2-пропансульфамід;
N-2-(4-(2-піридил)феніл)пропіл-2-пропансульфамід;
N-2-(4-(4-(2-ацетамідоетил)феніл)феніл)пропіл-2-пропансульфамід;
N-2-(4-N-(бeнзaмiдo)фeнiл)пpoпiл-2-пpoпaнcyльфaмiд;
N-2-(4-N-(4-eтилбeнзaмiдo)фeнiл)пpoпiл-2-пpoпaнcyльфaмiд;
N-2-(4-N-(циклобутилкарбоксамідо)феніл)пропіл-2-пропансульфамід;
N-2-(4-N-(5-ізоксазолілкарбоксамідо)феніл)пропіл-2-пропансульфамід;
N-2-(4-N-(6-хлорнікотинілкарбамідо)феніл)пропіл-2-пропансульфамід;
N-2-(4-N-(піколіноїлкарбамідо)феніл)пропіл-2-пропансульфамід;
N-2-(4-N-(бeнзaмiдo)фeнiл)пpoпiл-2-димeтилcyльфaмiд;
N-2-(2-тієн-3-iл-5-тієніл)пропіл-2-пропансульфамід;
(+)-N-(2R-4-(3-тієніл)феніл)пропіл-2-пропансульфамід;
і фармацевтично прийнятні солі цих сполук.
10. Фармацевтична композиція, що містить сполуку за будь-яким із пп. 1-9 і фармацевтично прийнятний розріджувач або наповнювач.
11. Спосіб одержання сполуки за будь-яким із пп. 1-9, який включає проведення реакції сполуки формули
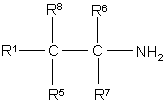 II
II
зі сполукою формули
R2SO2X, III
де Х - атом або група, що відщеплюється, з подальшим утворенням фармацевтично прийнятної солі в разі необхідності та/або за бажанням.
12. Сполука, що являє собою N-2-(4-(4-(2-метансульфамідоетил)феніл)феніл)пропіл-2-пропансульфамід або фармацевтично прийнятну його сіль.
13. Сполука, що являє собою N-2-(4-(4-(2-метансульфамідоетил)феніл)феніл)пропіл-2-пропансульфамід.
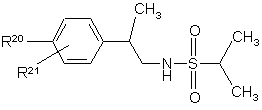
14. Похідні сульфонаміду формули
 ,
,
де R20 являє собою галоїд; нітрогрупу; ціан; С1-С10-алкіл; С2-С10-алкеніл; С2-С10-алкініл; С3-С8-циклоалкіл; галоїдний С1-С10-алкіл; групу (CH2)yX1R9, де у - нуль або ціле число від 1 до 4, X1 - О, S, NR10, CO, COO, ОСО, CONR11, NR12CO або OCONR13, R9 - водень, С1-С10-алкіл, С3-С10-алкеніл, С3-С10-алкініл або С3-С8-циклоалкіл, а кожний з R10, R11, R12 і R13 незалежно від інших являє собою водень чи С1-С10-алкіл, або ж R9 і R10, R11, R12 чи R13 разом з атомом азоту, до якого вони приєднані, утворюють азетидиніл, піролідиніл, піперидиніл або морфолінову групу; тієніл; фурил; оксазоліл; ізоксазоліл; піразоліл; імідазоліл; тіазоліл; піридил; піридазиніл; піримідиніл; дигідротієніл; дигідрофурил; дигідротіопіраніл; дигідропіраніл; тетрагідротієніл; тетрагідрофурил; тетрагідротіопіраніл; тетрагідропіраніл; індоліл; бензофурил; бензотієніл; бензимідазоліл і групу формули R14-(La)n-X2-(Lb)m, де X2 є зв'язком, О, NH, S, SO, SO2, CO, CONH або NHCO, кожна з груп La і Lb є С1-С4-алкіленом, одне з чисел m і n є 0 або 1, а друге - 0, a R14 - феніл, незаміщений або заміщений одним або двома замісниками з перелічених нижче: галоїд, нітрогрупа, ціан, С1-С10-алкіл, С2-С10-алкеніл, С2-С10-алкініл, С3-С8-циклоалкіл, галоїдний С1-С10-алкіл і група (СН2)zХ3R15, в якій z - нуль або ціле число від 1 до 4, X3 - О, S, NR16, CO, СОО, ОСО, CONR17, NR18CO, OCONR19, R15 - водень, С1-С10-алкіл, С3-С10-алкеніл, С3-С10-алкініл або С3-С8-циклоалкіл, а кожний з R16, R17, R18 і R19 незалежно від інших являє собою водень чи С1-С10-алкіл, або ж R15 і R16, R17, R18 чи R19 разом з атомом азоту, до якого вони приєднані, утворюють азетидиніл, піролідиніл, піперидиніл або морфолінову групу; а
R21 являє собою водень, галоїд, С1-С4-алкіл або С1-С4-алкоксигрупу;
або їх фармацевтично прийнятна сіль.
15. Сполуки за п. 14, де R21 являє собою водень.
16. Сполуки за п. 15, де R20 являє собою групу R14-(La)n-X2-(Lb)m.
17. Похідні сульфонаміду формули
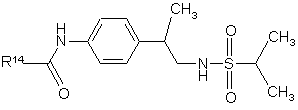 ,
,
де R14 - феніл незаміщений або заміщений одним або двома замісниками з перелічених нижче: галоїд, нітрогрупа, ціан, С1-С10-алкіл, С2-С10-алкеніл, С2-С10-алкініл, С3-С8-циклоалкіл, галоїдний С1-С10-алкіл, група (CH2)zX3R15, в якій z - нуль або ціле число від 1 до 4, X3 - О, S, NR16, CO, COO, ОСО, CONR17, NR18CO або OCONR19, R15 - водень, С1-С10-алкіл, С3-С10-алкеніл, С3-С10-алкініл або С3-С8-циклоалкіл, а кожний з R16, R17, R18 і R19 незалежно від інших являє собою водень чи С1-С10-алкіл, або ж R15 і R16, R17, R18 чи R19 разом з атомом азоту, до якого вони приєднані, утворюють азетидиніл, піролідиніл, піперидиніл або морфолінову групу; або фармацевтично прийнятна сіль таких сполук.
18. Сполуки за п. 17, в яких R14 являє собою феніл, заміщений одним або двома галоїдами.
19. Похідні сульфонаміду формули
 ,
,
де R14 являє собою феніл, заміщений двома галоїдами, або фармацевтично прийнятна сіль таких сполук.
20. Похідні сульфонаміду формули
 ,
,
де R14 являє собою феніл, заміщений двома галоїдами.
21. Активний інгредієнт для лікарського засобу для посилення функції рецепторів глутамату, який відрізняється тим, що являє собою сполуку за п. 1.
Текст
Цей винахід стосується посилення функції рецепторів глутамату з використанням певних похідних сульфаміду. Він стосується також нових похідних сульфаміду, способів їх приготування та фармацевтичних композицій, що містять такі похідні. У центральній нервовій системі (ЦНС) ссавців передача нервових імпульсів регулюється взаємодією між нейротрансміттером, що його виділяє нейрон-передавач, і поверхневим рецептором нейронаприймача, який спричиняє збудження цього нейрона-приймача. L-Глутамат, який є найбільш поширеним нейротрансміттером у ЦНС, є посередником у головному процесі передачі збудження у ссавців і називається збуджувальною амінокислотою (ЗАК). Рецептори, які відповідають за дію глутамату, називають рецепторами збуджувальної амінокислоти (рецепторами ЗАК). Див. Уоткінс і Еванс (Watkins and Evans, Ann. Rev. Pharmacol. Toxicol. 21, 165 (1981)); Монеган, Бріджес і Котмен (Monaghan, Bridges and Cotman, Ann. Rev. Pharmacol Toxicol. 29, 365 (1989)); Уоткінс, Крогсгард і Оноре (Watkins, Crogsgaard-Larsen and Honore, Trans. Pharm. Sci. 11, 25 (1990)). Збуджувальні амінокислоти мають велике фізіологічне значення, відіграють певну роль у різноманітних фізіологічних процесах, наприклад, у довготривалому посиленні функцій (навчання та пам'ять), розвитку синаптичної пластичності, керуванні рухами, диханні, сердечносудинній регуляції та в сенсорному сприйманні. Рецептори збуджувальних амінокислот розділяють на два основні типи. Рецептори, які безпосередньо сполучені з відкриттям катіонних каналів у клітинній мембрані, називають "іонотропними". Цей тип рецепторів підрозділяють, щонайменше, на три підтипи, які визначаються деполяризаційною дією селективних агоністів N-метил-D-аспартату (NMD A), альфа-аміно-3-гідрокси-5-метилізоксазол-4пропіонової кислоти (АМРА) та каїнової кислоти (КА). Другий основний тип рецепторів збуджувальних амінокислот складають "метаботропні" рецептори, з'єднані з G-протеїном або з вторинним месенджером. Цей другий тип сполучений з численними системами вторинних месенджерів, які забезпечують підвищення інтенсивності гідролізу фосфоінозитидів, активацію фосфолідази D, збільшення або зменшення утворення с-АМР та зміни в функції іонних каналів. Див. Шеп і Кон (Schoepp and Conn, Trends in Pharmacol. Sci. 14, 13 (1993)). Обидва типи рецепторів не тільки є посередниками у нормальних синаптичних процесах передачі збудження, але й беруть участь у модифікації синаптичних зв'язків у процесі розвитку та протягом усього життя. Див. Шеп, Бокерт і Сладечек (Schoepp, Bockaert and Sladeczek, Trends in Pharmacol Sci 11, 508 (1990)); Макдональд і Джонсон (McDonald and Johnson, Brain Research Reviews 15, 41 (1990)). Рецептори підтипу АМРА складаються з чотирьох протеїнових фрагментів, відомих як GluR1-GluR4, в той час як рецептори типу каїнової кислоти складаються з фрагментів, що позначаються як GluR5-GluR7 та КА-1 і КА-2. Див. Вон і Майєр (Wong and Mayer, Molecular Pharmacology 44:505-510, 1993). Досі невідомо, яким чином ці фрагменти з'єднані у природному стані. Проте структури деяких варіантів кожного фрагменту, притаманних організму людини, з'ясовано, і клоновані лінії клітин, відповідні кожному з варіантів цих фрагментів, вбудо вано в тест-системи, розроблені для ідентифікації сполук, що зв'язуються або взаємодіють з ними і, таким чином, здатні модифікувати їхні функції. Так, у європейському патенті (публікація № ЕР-А2-0574257) описані притаманні людському організму варіанти фрагментів GluR1B, GluR2B, GluR3A і GluR3B. У заявці на європейський патент, публікація № ЕР-А1-0583917, описано людський варіант фрагменту GluR4B. Відмітною властивістю рецепторів АМРА та каїнової кислоти є їхня швидка дезактивація та десенсибілізація до глутамату. Див. Ямада і Тан (Yamada and Tang, The Journal of Neuroscience, September 1993, 13(9): 3904-3915) і Кетрін М. Партінт (Kathryn М. Partin, J. Neuroscience, November 1, 1996, 16(21):6634-6647). Фізіологічне значення швидкої десенсибілізації та дезактивації невідоме. Відомо, що швидку десенсибілізацію та дезактивацію рецепторів АМРА та/або каїнової кислоти до глутамату можна відвернути, вживаючи певні сполуки. Таку дію цих сполук часто називають інакше "посиленням" ("потенціюванням") рецепторів. Одною з таких сполук, які селективно посилюють функцію рецепторів АМРА, є циклотіазид. Див. Партін та ін. (Partin et al., Neuron, Vol. 11, 1069-1082, 1993). Сполуки, що посилюють рецептори АМРА, подібно до циклотіазиду, часто називають ампакінами. У заявці на міжнародний патент, публікація № WO 9625926, описана група і фенілтіоалкілсульфамідів, S-оксидів та гомологів, які, як стверджується, підсилюють мембранні струми, індуковані каїновою кислотою та АМРА. В описі до патенту США №3143549 вказано певні фенілалкілсульфаміди, в тому числі 1-метил-2фенілетил-диметилсульфамід. Стверджується, що ці сполуки впливають на центральну нервову систему, зокрема, мають властивості транквілізаторів. В описі до патенту США №3,267,139 наведено деякі N'-триметилацетил-N-фенілалкілсульфаміди та N’триметилацетил-N-фенілциклопропілсульфаміди, що впливають на центральну нервову систему та мають протисудомну активність. Стверджується також, що ці сполуки викликають у піддослідних тварин симптоми, подібні до виявлень хвороби Паркінсона. В описі до патенту США №3,860,723 розкрито спосіб підвищення споживання їжі здоровими тваринами шляхом використання деяких феніл алкілсульфамідів. Фуайє та ін. (Fo ye et al., J. Pharm. Sci. (1971), 60(7), 1095-6) описують деякі фенілалкілметилсульфаміди, в тому числі N-1-метил-2-фенілетил-метансульфамід, що мають гіпотензивні властивості. У британському патенті №1059360 розкрито деякі фенілалкілсульфаміди, що мають седативні, наркотичні та протисудомні властивості, серед них згадано 1-(1-метил-2фенілетиламіносульфоніл)піперидин. У патенті США №4,210,749 описано N-1-метил-2-феніл-3-метоксиетилбутансульфамід. Гуальтієрі та ін. (Gualtieri et al., J. Pharm. Sci. (1973), 62(5), 849-851) описують N-1-метил-2фенілетилбутансуль фамід та оцінюють його ефективність як репеленту проти москітів. Фуайє та ін. (Fo ye et al., J. Pharm. Sci. (1979), 68(5), 591-5) описують Ν-1-метил-2-(4хлорфеніл)етилметансульфамід. Фуайє і Сейн (Foye and Sane, J. Pharm. Sci. (1977), 66(7), 923-6) описують N-метансульфонільні та Nтрифторметансульфонільні похідні амфетамінів та деякі 4-заміщені аналоги цих сполук і оцінюють їх з точки зору впливу на центральну нервову систему та е фектів анорексії. У заявці на європейський патент, публікація № ЕР-А1-0657442, розкрито деякі похідні нафтилоксиоцтової кислоти як агоністи й антагоністи PEG2. N-(2,2-дифенілетил)метансульфамід згаданий як проміжний продукт на стор.53, рядок 38. Патент США №3,629,332 характеризує деякі N-арил- і N-гетероарил-алкілфторалкансульфаміди як сполуки, що впливають на зростання рослин, в тому числі згадано N-(альфа-метилфенілетил)трифторметансульфамід, -ди-фторметансульфамід і -фторметансульфамід. Стверджується, що деякі з цих сполук є також біологічно активними в інших відношеннях, в тому числі вони виявляють інсектицидну, акаріцидну, нематоцидну, анальгетичну та протизапалювальну активність. У різноманітних експериментах на тваринах показано, що ампакіни поліпшують пам'ять. Див. Штаублі та ін. (Staubli et al., Proc. Natl. Acad. Sci. Vol.91, pp.777-781, 1994, Neurobiology) і Араї та ін. (Arai et al., The Journal of Pharmacology and Experimental Therapeutics, 278:627-638, 1996). На цей час з'ясовано, що циклотіазид і деякі похідні сульфаміду посилюють індуковану агоністами збуджуваність людського рецептора GluR4B у клітинах лінії НЕК 293. Оскільки відомо, що циклотіазид посилює функцію рецепторів глутамату in vivo, вважається, що цей факт свідчить, що похідні сульфаміду також будуть посилювати функцію рецепторів глутамату in vi vo, і, отже, що ці сполуки будуть спричиняти дію, подібну до дії ампакінів. Відповідно, цей винахід забезпечує спосіб посилення функції рецепторів глутамату у ссавців, що потребують такого лікування, який включає прийом в ефективній кількості сполуки формули R1-L-NHSО2R2 I в якій R1 являє собою незаміщену або заміщену ароматичну або гетероароматичну груп у; R2 являє собою С 1-С6 алкіл, С3-С6 циклоалкіл, С1-С6 фторалкіл, С1-С6 хлоралкіл, C2-С6 алкеніл, С1-С4алкокси-С 1-С4 алкіл, феніл, незаміщений або заміщений галоїдом, С1-С4 алкілом або С1-С4 алкоксилом, або груп у R3R4N, в якій кожна з груп R3 і R4 незалежно від другої являє собою С 1-С4 алкіл або разом з атомом азоту, до якого обидві ці групи приєднані, вони утворюють азетидинільну, піролідинільну, піперидинільну, морфолінову, піперазинільну, гексагідроазепінільну або октагідроазоцинільну груп у; і L являє собою С2-С4 алкіленовий ланцюжок, незаміщений або заміщений одним або двома замісниками, вибраними незалежно один від одного з групи, що включає С1-С6 алкіл, арил-(С1-С6) алкіл, С2С6 алкеніл, арил-(С2-С6) алкеніл та арил, або двома замісниками, які разом з атомом або атомами вуглецю, до якого або до яких вони приєднані, утворюють С3-C8 карбоциклічне кільце; або фармацевтично прийнятної солі такої сполуки. Згідно з іншим аспектом, цей винахід забезпечує використання сполуки формули І або її фармацевтично прийнятної солі, визначеної вище, для виробництва медикаменту для посилення функції рецепторів глутамату. Згідно зі ще одним аспектом, цей винахід забезпечує використання сполуки формули І або її фармацевтично прийнятної солі, визначеної вище, для посилення функції рецепторів глутамату. В цьому описі термін "посилення функції рецепторів глутамату" стосується будь-якого посилення відгук у рецепторів глутамату, наприклад, рецепторів АМРА, на глутамат або агоніст, і охоплює інгібування швидкої десенсибілізації або дезактивації рецепторів АМРА до глутамату, але не обмежується цим аспектом. Сполуки формули І та їх фармацевтично прийнятні солі можуть бути використані для лікування або профілактики багатьох різноманітних хворобливих станів завдяки дії цих сполук як посилювачів функції рецепторів глутамату. Такі хворобливі стани включають ті, що пов'язані з гіпофункцією глутамату, в тому числі психіатричні та неврологічні розлади, наприклад, розлади свідомості; нейродегенеративні розлади, наприклад, хворобу Альцгеймера; вікові недоумства; вікові погіршення пам'яті; розлади руху, наприклад, уповільнена дискінезія, хорея Хантінгтона, міоклонус і хворобу Паркінсона; залишкові явища станів наркотичного сп'яніння (наприклад, від кокаїну, амфетамінів, алкоголю); депресії; розлади, що викликають послаблення уваги; послаблення уваги, пов'язане з гіперактивністю; психози; розлади свідомості, пов'язані з психозами; і психози наркотичного походження. Сполуки формули І можуть бути корисними також для поліпшення пам'яті (як короткочасної, так і довгочасної) і здатності до навчання. Цей винахід передбачає використання сполук формули І для лікування кожного з вищезгаданих станів. Мається на увазі, що сполуки формули І можуть містити один або кілька асиметричних атомів вуглецю і, отже, можуть існувати та бути використані у вигляді індивідуальних енантіомерів. Цей винахід охоплює індивідуальні енантіомери сполук формули І. В уживаному тут значенні термін "ароматична група" означає те ж саме, що й арил, і о хоплює феніл і поліциклічні ароматичні карбоциклічні групи, наприклад, нафтил. Термін "гетероароматична група" охоплює ароматичні 5- або 6-членні цикли, що містять від одного до чотирьох гетероатомів, вибраних із групи, яка включає кисень, сірку й азот, і біциклічні групи, що складаються з 5-6-членного циклу, що містить від одного до чотирьох гетероатомів, вибраних із групи, яка включає кисень, сірку й азот, конденсованого з бензольним циклом або іншим 5-6-членним циклом, що містить від одного до чотирьох гетероатомів, вибраних із групи, яка включає кисень, сірку й азот. Прикладами гетероароматичних груп є тієніл, фурил, оксазоліл, ізоксазоліл, оксадіазоліл, піразоліл, тіазоліл, тіадіазоліл, ізотіазоліл, імідазоліл, триазоліл, тетразоліл, піридил, піридазінил, піримідил, бензофурил, бензотієніл, бензімідазоліл, бензоксазоліл, бензотіазоліл, індоліл і хіноліл. Термін "заміщений" у складі терміну "заміщена ароматична або гетероароматична група" в даному описі означає наявність одного або кількох (наприклад, одного або двох) замісників, причому ці замісники вибрані з-поміж атомів та груп, які, в разі їх присутності у сполуці формули І, не заважають дії сполуки формули І як посилювача функції рецепторів глутамату. Приклади замісників, які можуть бути присутні в заміщеній ароматичній або гетероароматичній групі, включають галоїди; нітрогрупу; ціан; гідроксиіміногрупу; С1-С10 алкіл; С2-С10 алкеніл; С2-С10 алкініл; С3-С8 циклоалкіл; гідрокси-С 3-С8 циклоалкіл; оксо-С3-C8 циклоалкіл; галоїдний С1-С10 алкіл; (CH2)yX1R9, де у - нуль або ціле число від 1 до 4, X1 являє собою О, S, NR10, CO, COO, ОСО, CONR 11, NR12CO, NR12COCOO, OCONR13, R9 - водень, С1-С10 алкіл, С3-С10 алкеніл, С3-С10 алкініл, піролідиніл, тетрагідрофурил, морфолінова група або С 3-C8 циклоалкіл, а кожна з груп R10, R11, R12 і R13, незалежно від інших, являє собою водень або С1-С10 алкіл, або ж R9 і R10, R11, R 12 чи R13 разом з атомом азоту, до якого вони приєднані, утворюють азетидинільну, гііролідинільну, піперидинільну чи морфолінову гр уп у; N-(С1-С4) алкілпіперазиніл; N-феніл-(С1-С4) алкілпіперазиніл; тієніл; фурил; оксазоліл; ізоксазоліл; піразоліл; імідазоліл; тіазоліл; піридил; піридазиніл; піримідиніл; дигідротієніл; дигідрофурил; дигідротіопіраніл; дигідропіраніл; дигідротіазоліл; (С1-С4) алкоксикарбонілдигідротіазоліл; (С1-С4) алкоксикарбонілдиметилдигідротіазоліл; тетрагідротієніл; тетрагідрофурил; тетрагідротіопіраніл; тетрагідропіраніл; індоліл; бензофурил, бензотієніл, бензімідазоліл; і групу формули R 14-(La) n-X2-(Lb) m, в якій X2 - зв'язок, О, NH, S, SO, SO2, CO, СН(ОН), CONH, NHCO, NHCONH, NHCOO, COCONH, OCH2CONH або CH=CH, кожна з груп La і Lb - С1-С4 алкілен, одне з чисел m і n - 0 або 1, а друге - 0, a R14 - феніл або гетероароматична група, незаміщена або заміщена одним або двома галоїдами; нітрогрупа; ціан; С1-С10 алкіл; С2-С10 алкеніл; С2-С10 алкініл; С3-C8 циклоалкіл; 4-(1,1-діоксотетрагідро-1,2-тіазиніл); галоїдний С1-С10 алкіл; ціано-С2-С10 алкеніл; феніл; (CH2)zX3R15, де z - н уль або ціле число від 1 до 4, X3 являє собою О, S, NR16, CO, СН(ОН), СОО, ОСО, CONR17 , NR18CO, NHSO2, NHSO 2NR17, OCONR 19 NR19COO, R 15 - водень, С1-С10 алкіл, феніл-С 1-С4 алкіл, галоїдний С 1-С10 алкіл, С1-С4 алкоксикарбоніл-С 1-С4 алкіл, С1-С4 алкілсульфоніламіно-С 1-С4 алкіл, N(С1-С4 алкоксикарбоніл)-С1-С4 алкілсульфоніламіно-С 1-С4 алкіл, С3-С10 алкеніл, С3-С10 алкініл, С3-С8 циклоалкіл, камфорил або ароматична чи гетероароматична група, незаміщена або заміщена одним або двома галоїдами, С1-С4 алкілами, галоїдними С 1-С4 алкілами, ди(С1-С4 алкіл) аміногрупами і С1-С4 алкоксигрупами, а кожна з груп R16, R17, R 18 і R 19, незалежно від інших, являє собою водень або С 1-С10 алкіл, або ж R15 і R16 , R17, R 18 чи R19 разом з атомом азоту, до якого вони приєднані, утворюють азетидинільну, піролідинільну, піперидинільну чи морфолінову гр упу. Термін "С1-С10 алкіл" включає С 1-С8 алкіл, С1-С6 алкіл і С1-С4 алкіл. Конкретними значеннями його є метил, етил, пропіл, ізопропіл, бутил, ізобутил, трет-б утил, пентил, гексил, гептил, октил, ноніл і децил. Термін "С2-С10 алкеніл" включає С 3-С10 алкеніл, С1-С8 алкеніл, С1-С6 алкеніл і С1-С4 алкеніл. До конкретних його значень належать вініл і 2-пропеніл. Термін "С2-С10 алкініл" включає С 3-С10 алкініл, С1-С8 алкініл, С1-С6 алкініл і С 3-С4 алкініл. До конкретних його значень належить 2-пропініл. Термін "С3-С8 циклоалкіл", вжитий самостійно або у складі терміну "С3-С8 циклоалкілокси...", включає моноциклічні та поліциклічні групи. Конкретними значеннями його є циклопропіл, циклобутил, циклопентил, циклогексил та біцикло[2.2.2]октан. Термін включає С 3-С6 циклоалкіли: циклопропіл, циклобутил, циклопентил та циклогексил. Термін "гідрокси-С 3-C8 циклоалкіл" включає гідроксициклопентил, наприклад, 3-гідроксициклопентил. Термін "оксо-С3-С8 циклоалкіл" включає оксоциклопентил, наприклад, 3-оксоциклопентил. Термін "галоїд" ("галоген") охоплює фтор, хлор, бром і йод. Термін "галоїдний С1-С10 алкіл" включає фтор(С 1-С10 алкіл), наприклад, трифторметил і 2,2,2трифторетил, і хлор(С1-С10 алкіл), наприклад, хлорметил. Термін "ціано(С2-С10 алкеніл)" включає 2-ціаноетеніл. Термін "С2-С4 алкілен" включає етилен, пропілен та бутилен. Значенням, якому віддається перевага, є етилен. Термін "тієніл" охоплює тієн-2-іл і тієн-3-іл. Термін "фурил" охоплює фур-2-ил і фур-3-ил. Термін "оксазоліл" охоплює оксазол-2-іл, оксазол-4-іл і оксазол-5-іл. Термін "ізоксазоліл" охоплює ізоксазол-3-іл, ізоксазол-4-іл і ізоксазол-5-іл. Термін "оксадіазоліл" охоплює [1,2,4]оксадіазол-3-іл і [1,2,4]оксадіазол-5-іл. Термін "піразоліл" охоплює піразол-3-іл, піразол-4-іл і піразол-5-іл. Термін "тіазоліл" охоплює тіазол-2-іл, тіазол-4-іл і тіазол-5-іл. Термін "тіадіазоліл" охоплює [1,2,4]тіадіазол-3-іл і [1,2,4]тіадіазол-5-іл. Термін "ізотіазоліл" охоплює ізотіазол-3-іл, ізотіазол-4-іл і ізотіазол-5-іл. Термін "імідазоліл" охоплює імідазол-2-іл, імідазол-4-іл і імідазол-5-іл. Термін "триазоліл" охоплює [1,2,4]триазол-3-іл і [1,2,4]триазол-5-іл. Термін "тетразоліл" охоплює тетразол-5-іл. Термін "піридил" охоплює пірид-2-іл, пірид-3-іл і пірид-4-іл. Термін "піридазиніл" охоплює піридазин-3-іл, піридазин-4-іл, піридазин-5-іл і піридазин-6-іл. Термін "піримідиніл" охоплює піримідин-2-іл, піримідин-4-іл, піримідин-5-іл і піримідин-6-іл. Термін "бензофурил" о хоплює бензофур-2-ил і бензофур-3-ил. Термін "бензотієніл" охоплює бензотієн-2-іл і бензотієн-3-іл. Термін "бензімідазоліл" охоплює бензімідазол-2-іл. Термін "бензоксазоліл" охоплює бензоксазол-2-іл. Термін "бензотіазоліл" охоплює бензотіазол-2-іл. Термін "індоліл" охоплює індол-2-іл та індол-3-іл. Термін "хіноліл" охоплює хінол-2-іл. Термін "дигідротіазоліл" охоплює 4,5-дигідротіазол-2-іл, а термін "(С1-С4 алкоксикарбоніл)дигідротіазоліл" охоплює 4-метоксикарбоніл-4,5-дигідротіазол-2-іл. У сполуках формули І L у варіантах, яким віддається перевага, являє собою групу формули в якій дві з груп R5, R6, R7 і R8 є атомами водню, а дві інші, незалежно одна від одної, являють собою водень, С1-С6 алкіл, арил-С1-С6 алкіл, C2-C6 алкеніл, арил-С2-С6 алкеніл або арил, або ж разом з атомом чи атомами вуглецю, до яких вони приєднані, утворюють С 3-C8 карбоциклічну гр упу. У варіантах, яким віддається перевага, одна або дві з груп R 5, R6, R7 і R8 являють собою С 1-С6 алкіл, арил-С 1-С6 алкіл, С2-С6 алкеніл, арил-С2-С6 алкеніл або арил, або ж дві з груп R 5, R6 , R7 і R8 разом з атомом чи атомами вуглецю, до яких вони приєднані, утворюють С 3-C8 карбоциклічну групу, а інші з груп R5, R6, R7 і R8 є атомами водню. Прикладами С 1-С6 алкілів, що їх являють собою групи R5, R6, R7 і R8, є метил, етил і пропіл. Прикладом арил-С 1-С6 алкілу є бензил. Прикладом С2-С6 алкенілу є проп-2-еніл. Прикладом С3-C8 карбоциклічної групи є циклопропіл. У варіантах, яким віддається більша перевага, R6 і R7 є атомами водню. У варіантах, яким віддається перевага, кожна з груп R5 і R8, незалежно від другої, являє собою атом водню або С1-С4 алкіл або ж ці групи разом з атомом вуглецю, до якого вони приєднані, утворюють C 3-C8 карбоциклічну групу. У варіантах, яким віддається більша перевага, R8 являє собою метил або етил, або ж R5 і R8 разом з атомом вуглецю, до якого вони приєднані, утворюють циклопропільну групу. Якщо R8 являє собою метил або етил, то краще, коли R5 являє собою водень або метил. Найбільша перевага віддається сполукам, в котрих R8 являє собою метил, а R5, R6 і R7 - атоми водню. Кожна з груп R3 і R4 у варіантах, яким віддається перевага, являє собою метил. Прикладами групи R2 є метил, етил, пропіл, 2-пропіл, бутил, 2-метил пропіл, циклогексил, трифторметил, 2,2,2-трифторетил, хлорметил, етеніл, проп-2-еніл, метоксиетил, феніл, 4-фторфеніл або диметиламіногрупа. У варіантах, яким віддається перевага, R2 являє собою етил, 2-пропіл або диметиламіногрупу. Прикладами групи R9 є водень, метил, етил, пропіл, ізопропіл, трет-бутил, етеніл, циклопропіл, · циклобутил, циклопентил, циклогексил, 2-піролідиніл, морфолінова група або 2-тетрагідрофурил. Прикладами групи R15 є водень, метил, етил, пропіл, ізопропіл, бутил, трет-бутил, бензил, 2,2,2трифторетил, 2-метоксикарбонілетил, циклогексил, 10-камфорил, феніл, 2-фторфеніл, 3-фторфеніл, 2трифторметилфеніл, 4-трифторметилфеніл, 2-метоксифеніл, 3-метоксифеніл, 4-метоксифеніл, 1-(5-диметиламіно)нафтил і 2-тієніл. X1 у варіантах, яким віддається перевага, являє собою О, CO, CONH або NHCO. У варіантах, що їм віддається перевага, z=0. R9 у варіантах, яким віддається перевага, являє собою С1-С4 алкіл, С2-С4 алкеніл, С3-С6 циклоалкіл, піролідиніл, морфолінову гр упу або тетрагідрофурил. Конкретні приклади груп (СН2)уХ1R 9 і (CH2)z X3R15 включають С 1-С10 алкоксигрупи, в тому числі С 1-С6 алкоксигрупи і С 1-С4 алкоксигрупи, наприклад, метокси-, етокси-, пропокси-, ізопропокси- та ізобутоксигрупи; С3-С10 алкенілоксигрупи, в тому числі С3-С6 алкенілоксигрупи, наприклад, проп-2-енілоксигрупу; С3-С 10 алкінілоксигрупи, в тому числі С 3-C6 алкінілоксигрупи, наприклад, проп-2-інілоксигрупу; і С 1-С6 алканоїли, наприклад, форміл та етаноїл. Прикладами конкретних значень у є 0 та 1. Прикладами конкретних значень z є 0, 1, 2 і 3. Кожна з груп La і Lb, незалежно від іншої, у варіантах, яким віддається перевага, являє собою групу СН 2. X2 у варіантах, яким віддається перевага, являє собою зв'язок, О, NH, CO, СН(ОН), CONH, NHCONH або OCH2CONH. Група (СН2)уХ1R9 у варіантах, яким віддається перевага, являє собою СНО; СОСН3; ОСН3; ОСН(СН3)2; NHCOR9, де R9 - метил, етил, ізопропіл, трет-бутил, етеніл, циклопропіл, циклобутил, циклопентил, циклогексил, 2-піролідиніл або морфолінова група; CONHR9, де R9 - циклопропіл або циклопентил; NHCOCOOCH3; або 2-тетрагідрофурилметоксигрупа. Група ((CH2)zX3R15 у варіантах, яким віддається перевага, являє собою NH2; CH2NH2; (CH2)2NH2; (CH2)3NH2; CONH2; CONHCH3; CON(CH3)2; N(C2H5) 2; CH2OH; CH(OH)CH3; CH(OH)CH2CH2; CHO; COCH3; COOH; COOCH 3; CH2NHCOOC(CH3)3; (СН2)2ННСООС(СН3)3; NHSO 2CH(CH3)2; гр упу формули (CH2)2NHSO2R15, де R15 - CH3, CH2CH3, СН(СН3)2, (СН2) 2СН3, (СН3)3СН3, бензил, CH2CF3, 2метоксикарбонілетил, циклогексил, 10-камфорил, феніл, 2-фтор феніл, 4-фтор феніл, 2-трифторметилфеніл, 4-трифторметилфеніл, 4-метоксифеніл, 1-(2-диметиламіно)нафтил або 2-тієніл; CH(OH)CH2NHSO2CH3; (CH2)3NHSO2CH(CH3)2; COCH2N(OCOC(CH3)2SO2CH3; COCH2NHSO2CH3; (CH2)2NHCOR15 , де R15 - СН3, СН(СН3)2, СН2СН(СН3)2, феніл, 3-фторфеніл, 4-фторфеніл, бензил, 2-метоксифеніл, 4-метоксифеніл, 2тієніл, СН=СН, CH=CHCN, OCH3 або О(СН 2)3СН3. Прикладами групи (La)n-X2-(Lb) m є зв'язок, О, NH, S, SO, SO2, CO, CH 2, СОСН2, COCONH, CH(OH)CH2, CONH, NHCO, NHCONH, СН2О, ОСН2, OCH2CONH, CH2NH, NHCH2 і СН2СН2. R14 у варіантах, яким віддається перевага, являє собою заміщений або незаміщений феніл, нафтил, фурил, тієніл, ізоксазоліл, тіазоліл, тетразоліл, піридил, піримідил, бензотієніл або бензотіазоліл. Конкретними прикладами групи R14 є феніл, 2-фторфеніл, 3-фторфеніл, 4-фторфеніл, 2-хлорфеніл, 3хлорфеніл, 4-хлорфеніл, 2-бромфеніл, 3-бромфеніл, 4-бромфеніл, 4-йодфеніл, 2,3-дифторфеніл, 2,4дифторфеніл, 3,4-дихлорфеніл, 3,5-дихлор феніл, 4-ціанофеніл, 3-нітрофеніл, 4-гідроксиімінофеніл, 2метилфеніл, 4-метилфеніл, 4-етилфеніл, 3-пропілфеніл, 4-трет-бутилфеніл, 2-проп-2-енілфеніл, 4-(4-(1,1діоксотетрагідро-1,2-тіазиніл)-феніл, 2-трифторметилфеніл, 3-трифторметилфеніл, 4-трифторметилфеніл, 2-бромметилфеніл, 2-фтор-4-трифторметилфеніл, 4-(2-ціаноетеніл)-феніл, 4-феніл, 2-формілфеніл, 3формілфеніл, 4-формілфеніл, 2-ацетилфеніл, 3-ацетилфеніл, 4-ацетилфеніл, 2-пропаноїлфеніл, 2-(2метилпропаноїл)феніл, 2-метоксифеніл, 3-метоксифеніл, 4-метоксифеніл, 4-бутоксифеніл, 2гідроксиметилфеніл, 4-гідроксиметилфеніл, 2-(1-гідроксиетил)феніл, 3-(1-гідроксиетил)-феніл, 4-(1гідроксиетил)феніл, 2-(1-гідроксипропіл)феніл, 4-(1-гідрокси-пропіл)феніл, 2-(1-гідрокси-2,2диметилпропіл)феніл, 4-трифторметоксифеніл, 2-амінофеніл, 4-амінофеніл, 4-N,N-діетиламінофеніл, 4амінометилфеніл, 4-(2-аміноетил)феніл, 4-(3-амінопропіл)феніл, 4-карбоксифеніл, 4-карбамоїлфеніл, 4-Nметилкарбамоїлфеніл, 4-Ν,Ν-диметилкарбамоїлфеніл, 2-ізопропіламінометилфеніл, 4-третбутоксикарбоніламінометилфеніл, 4-(2-ізопропоксикарбоксамідо)етилфеніл, 4-(2-третбутоксикарбоксамідо)етилфеніл, 4-ізопропілсульфоніламінофеніл, 4-(2-метан-сульфоніламіно)етилфеніл, 4-(2-етилсульфоніламіно)етилфеніл, 4-(3-ізопропілсульфоніламіно)пропілфеніл, 4-(1-(2пропан)сульфоніламіно)пропілфеніл, 4-(2-пропілсульфоніламіно)етилфеніл, 4-(2 ізопропілсульфоніламіно)етилфеніл, 4-(2-бутилсульфоніламіно)етилфеніл, 4-(1ізопропілсульфоніламінометил)етилфеніл, 4-(1-гідрокси-2-метансульфоніламіно)етилфеніл, 4-(2-(2,2,2трифторетил)-сульфоніламіноетил)феніл, 4-(2-циклогексйлсульфоніламіно)-етилфеніл, 4-(2-(2,2,2трифторетил)сульфоніламіно)-етилфеніл, 4-(2-N,N-диметиламіносульфоніламіно)-етилфеніл, 4-(2фенілсульфоніламіноетил)феніл, 4-(2-(2-фторфеніл)сульфоніламіноетил)феніл, 4-(2-(4-фторфеніл)сульфоніламіноетил)феніл, 4-(2-(2-трифторметилфеніл)сульфоніламіноетил)феніл, 4-(2-(4трифторметилфеніл)сульфоніламіноетил)феніл, 4-(2-(4-метоксифеніл)сульфоніламіноетил)феніл, 4-(2-(1(5-диметиламіно)нафталінсульфоніламіно)етил)феніл, 4-(2-(2-тієніл)сульфоніламіно)етил)феніл, 4-(2бензамідоетил)феніл, 4-(2-(4-фторбензамідо)етил)феніл, 4-(2-(3-метоксибензамідо)етил)феніл, 4-(2-(3фторбензамідо)етил)феніл, 4-(2-(4-метоксибензамідо)етил)феніл, 4-(2-(2-метокси-бензамідо)етил)феніл, 4(1-(2-(2-метоксикарбонілетансульфоніламіно)етил)феніл, 4-(1-(2-(10-камфорсульфоніламіно)етил)феніл, 4(1-(2-бензилсульфоніламіно)-етил)феніл, 4-(2-фенілацетамідо)етил)феніл, 4метансульфоніламідоетаноїлфеніл, 4-(N-(трет-бутоксикарбоніл)метансульфоніламідоетаноїл)феніл, 4-(2(2-тієнілкарбоксамідо)етил)феніл, тієн-2-іл, 5-гідроксиметилтієн-2-іл, 5-формілтієн-2-іл, тієн-3-іл, 5гідроксиметилтієн-3-іл, 5-формілтієн-3-іл, 2-бромтієн-3-іл, фур-2-ил, 5-нітрофур-2-ил, фур-3-ил, ізоксазол-5іл, 3-бромізоксазол-5-іл, ізоксазол-3-іл, 5-триметилсилілізоксазол-3-іл, 5-метилізоксазол-3-іл, 5гідроксиметилізоксазол-3-іл, 5-метил-3-фенілізоксазол-4-іл, 5-(2-гідроксиетил)ізоксазол-3-іл, 5ацетилізоксазол-3-іл, 5-карбоксиізоксазол-3-іл, 5-N-метилкарбамоїлізоксазол-3-іл, 5метоксикарбонілізоксазол-3-іл, 3-бром[1,2,4]оксадіазол-5-іл, піразол-1-іл, тіазол-2-іл, 4-гідроксиметилтіазол2-іл, 4-метоксикарбонілтіазол-2-іл, 4-карбокситіазол-2-іл, імідазол-1-іл, 2-сульфгідрилімідазол-1-іл, [1,2,4]триазол-1-іл, тетразол-5-іл, 2-метилтетразол-5-іл, 2-етилтетразол-5-іл, 2-ізопропілтетразол-5-іл, 2-(2пропеніл)тетразол-5-іл, 2-бензилтетразол-5-іл, пірид-2-ил, 5-етоксикарбонілпірид-2-ил, пірид-3-ил, 6хлорпірид-3-ил, пірид-4-ил, 5-трифторметилпірид-2-ил, 6-хлорпіридазин-3-іл, 6-метилпіридазин-3-іл, 6метоксипіразин-3-іл, піримідин-5-іл, бензотієн-2-іл, бензотіазол-2-іл і хінол-2-іл. Прикладами незаміщеної або заміщеної ароматичної або гетероароматичної групи, позначеної R 1, є незаміщені або заміщені феніл, фурил, тієніл (наприклад, 3-тієніл) і піридил (наприклад, 3-піридил). У варіантах, яким віддається перевага, R1 являє собою нафтил або феніл, фурил, тієніл чи піридил, незаміщені або заміщені одним або двома замісниками, вибраними незалежно один від одного із групи, яка включає галоїд; нітрогрупу; ціан; гідроксиіміногрупу; С1-С 10 алкіл; С2-С10 алкеніл; С2-С10 алкініл; С3-C8 циклоалкіл; гідрокси-С 3-C8 циклоалкіл; оксо-С3-C8 циклоалкіл; галоїдний С 1-С10 алкіл; групу (CH2) yX1R9, де у - нуль або ціле число від 1 до 4, X1 - О, S, NR10, CO, COO, ОСО, CONR 11, NR12CO, NR12COCOO, OCONR 13, R9 - водень, С1-С10 алкіл, С3-С10 алкеніл, С3-С10 алкініл, піролідиніл, тетрагідрофурил, морфолінова група або C3-C8 циклоалкіл, а кожна з груп R10, R 11, R12 і R13 незалежно від інших являє собою водень чи С1-С10 алкіл, або ж R9 і R10, R11, R12 чи R13 разом з атомом азоту, до якого вони приєднані, утворюють азетидиніл, піролідиніл, піперидиніл або морфолінову груп у; N-(С1-С4 алкіл)піперазиніл; N-феніл(С 1-С4 алкіл)піперазиніл; тієніл; фурил; оксазоліл; ізоксазоліл; піразоліл; імідазоліл; тіазоліл; піридил; піридазиніл; піримідиніл; дигідротієніл; дигідрофурил; дигідротіопіраніл; дигідропіраніл; дигідротіазоліл; С1-С4алкоксикарбонілдигідротіазоліл; С1-С4-алкоксикарбонідциметилдигідротіазоліл; тетрагідротієніл; тетрагідрофурил; тетрагідротіопіраніл; тетрагідропіраніл; індоліл; бензофурил; бензотієніл; бензімідазоліл; і груп у формули R14-(La)n-X2-(Lb) m, де X2 є зв'язок, О, ΝΗ, S, SO, SO2, CO, CH(OH), CONH, NHCONH, NHCO, NHCOO, COCONH, OCH2CONH або CH=CH, кожна-з груп La і Lb є С1-С4 алкілен, одне з чисел m і n є 1 а друге - 0, a R14 - феніл або гетероароматична група, незаміщена або заміщена одним або двома замісниками з перелічених нижче: галоїд, нітрогрупа, ціан, гідроксиімшогрупа, С1-С10 алкіл, С2-С10 алкеніл, С2-С10 алкініл, С3-С8 циклоалкіл, 4-(1,1-діоксотетрагідро-1,2-тіазиніл), галоїдний С 1-С10 алкіл, ціано-С2-С10 алкеніл, феніл і група (CH2)zX3R15 , в якій z - нуль або ціле число від 1 до 4, Χ3 - О, S, NR16, CO, СН(ОН), СОО, ОСО, CONR 17 , NR18CO, NHSO2, NHSO2NR17, NHCONH, OCONR19 NR19COO, R 15 - водень, С1-С10 алкіл, феніл-С 1-С4 алкіл, галоїдний С 1-С10 алкіл, С1-С4 алкокси-С 1-С4 алкіл, (С1-С4-алкиісульфоніламіно)-С1-С4 алкіл, N-(С1-С4-алкоксикарбоніл)(С1-С4-алкілсульфоніламіно)С 1-С4 алкіл, С3-С10 алкеніл, С3-С10 алкініл, С3С8 циклоалкіл, камфорил чи ароматична або гетероароматична група, незаміщена або заміщена одним або двома такими замісниками: галоїд, С1-С4 алкіл, галоїдний С 1-С4 алкіл, ди(С1-С4 алкіл) аміно або С1-С4 алкоксигрупа, а кожна з груп R16, R17, R18 і R19 незалежно від інших являє собою водень чи С1-С10 алкіл, або ж R15 і R16, R17 , R18 чи R19 разом з атомом азоту, до якого вони приєднані, утворюють азетидиніл, піролідиніл, піперидиніл або морфолінову груп у. У варіантах, яким віддається більша перевага, R1 являє собою 2-нафтил або групу формули в якій R20 являє собою галоїд; нітрогрупу; ціан; гідроксиіміногрупу; С1-С10 алкіл; С2-С10 алкеніл; С2-С10 алкініл; С3-С8 циклоалкіл; гідрокси-С 3-C8 циклоалкіл; оксо-С3-С8 циклоалкіл; галоїдний С1-С10 алкіл; групу (СН2)уХ1R9 , де у - н уль або ціле число від 1 до 4, X1 - О, S, NR10, CO, COO, ОСО, CONR 11, NR12CO, NR12COCOO, OCONR 13 , R9 - водень, С1-С10 алкіл, С3-С10 алкеніл, С3-С10 алкініл, піролідиніл, тетрагідрофурил, морфолінова група або С 3-C8 циклоалкіл, а кожна з груп R 10, R11, R12 і R13 незалежно від інших являє собою водень чи С1-С10 алкіл, або ж R9 і R10, R11, R12 чи R13 разом з атомом азоту, до якого вони приєднані, утворюють азетидиніл, піролідиніл, піперидиніл або морфолінову гр упу; N-(С1-С4 алкіл) піперазиніл; N-феніл(С 1-С4 алкіл) піперазиніл; тієніл; фурил; оксазоліл; ізоксазоліл; піразоліл; імідазоліп; тіазоліл; тетразоліл; піридил; піридазиніл; піримідиніл; дигідротієніл; дигідрофурил; дигідротіопіраніл; дигідропіраніл; дигідротіазоліл; С1-С4-алкоксикарбонілдигідротіазоліл; С1-С4алкоксикарбонілдиметилдигідротіазоліл; тетрагідротієніл; тетрагідрофурил; тетрагідротіопіраніл; тетрагідропіраніл; індоліл; бензофурил; бензотієніл; бензімідазоліл; бензотіазоліл; і групу формули R14-(L a)nX2-(L b)m, де X2 є зв'язок, О, NH, S, SO, SO2 , CO, CH(OH), CONH, NHCONH, NHCOO, COCONH, OCH2CONH або СН =СН, кожна з груп La і Lb є С1-С4 алкілен, одне з чисел m і n є 1, а друге - 0, a R14 - феніл або гетероароматична група, незаміщена або заміщена одним або двома замісниками з перелічених нижче: галоїд, нітрогрупа, ціан, С1-С10 алкіл, С2-С10 алкеніл, С2-С10 алкініл, С3-C8 циклоалкіл, 4-(1,1діоксотетрагідро-1,2-тіазиніл), галоїдний С1-С10 алкіл, ціано-С 2-С10 алкеніл, феніл і група (CH2)zX3R 15, в якій z - нуль або ціле число від 1 до 4, X3 - О, S, NR16, CO, СН(ОН), СОО, ОСО, CONR 17, NR18CO, NHSO2, NHSO2NR17, NHCONH, OCONR19, NR19COO, R 15 - водень, С1-С10 алкіл, феніл-С 1-С4 алкіл, галоїдний С 1-С10 алкіл, С1-С4-алкоксикарбоніл-С1-С4 алкіл, (С1-С4-алкілсульфоніламіно)-С1-С4 алкіл, N-(С1-С4алкоксикарбоніл)(С1-С4-алкілсульфоніламіно)-С1-С4 алкіл, С3-С10 алкеніл, С3-С10 алкініл, С3-C8 циклоалкіл, камфорил чи ароматична або гетероароматична група, незаміщена або заміщена одним або двома такими замісниками: галоїд, С1-С4 алкіл, галоїдний С1-С4 алкіл, ди(С1-С4 алкіл) аміно або С 1-С4 алкоксигрупа, а кожна з груп R16, R17, R18 і R19 незалежно від інших являє собою водень чи С1-С10 алкіл, або ж R15 і R16, R17, R18 чи R19 разом з атомом азоту, до якого вони приєднані, утворюють азетидиніл, піролідиніл, піперидиніл або морфолінову груп у; а R21 являє собою водень, галоїд, С1-С4 алкіл або С 1-С4-алкоксигрупу. Конкретними прикладами групи R20 є групи: фтор, хлор, бром, ціано, гідроксиіміно, метил, етил, пропіл, 2-пропіл, бутил, 2-метилпропіл, 1,1-диметилетил, циклопентил, циклогексил, 3-гідроксициклопентил, 3оксоциклопентил, метокси, етокси, пропокси, 2-пропокеи, ацетил, ацетиламіно, етилкарбоксамідо, пропілкарбоксамідо, 1-бутаноїламідо, трет-бутилкарбоксамідо, акрилоїламідо, 2-піролідинілкарбоксамідо, 2тетрагідрофурилметокси, морфолінокарбоксамідо, метилоксаліламідо, циклопропілкарбоксамідо, циклобутилкарбоксамідо, циклопентилкарбоксамідо, циклогексилкарбоксамідо, циклопропілкарбамоїл, циклопентилкарбамоїл, піролідин-1-іл, морфолін, піперидин-1-іл, N-метил-піперазиніл, N-бензилпіперазиніл, 2-тієніл, 3-тієніл, 2-фурил, 3-фурил, ізоксазол-3-іл, тіазол-2-іл, тетразол-5-іл, пірид-2-іл, пірид-3-іл, пірид-4іл, піримідин-5-іл, 4,5-дигідротіазол-2-іл, 4,5-дигідро-4-метоксикарбонілтіазол-2-іл, 4,5-дигідро-4метоксикарбоніл-5,5-диметилтіазол-2-іл, бензотієн-2-іл, бензотіазол-2-іл, феніл, 2-фторфеніл, 3-фторфеніл, 2,3-дифторфеніл, 4-хлор феніл, 3,4-дихлорфеніл, 3,5-дихлорфеніл, 3-нітрофеніл, 4-ціанофеніл, 2метилфеніл, 4-метилфеніл, 4-(4-(1,1-діоксотетрагідро-1,2-тіазиніл)феніл, 3-трифторметилфеніл, 4трифторметилфеніл, 4-(2-ціаноетеніл)феніл, 2-формілфеніл, 3-формілфеніл, 4-формілфеніл, 3ацетилфеніл, 4-ацетилфеніл, 4-карбоксифеніл, 2-метоксифеніл, 4-метоксифеніл, 2-гідроксиметилфеніл, 4гідроксиметилфеніл, 3-(1-гідрокси-етил)феніл, 4-(1-гідроксиетил)феніл, 4-(1-гідроксипропіл)феніл, 2амінофеніл, 4-амінофеніл, 4-N,N-діетиламінофеніл, 4-амінометилфеніл, 4-(2-аміноетил)феніл, 4-(3амінопропіл)феніл, 4-(2-ацетиламіноетил)феніл, 4-трет-бутокси-карбоксиламіноетилфеніл, 4-(2-третбутоксикарбоксиламіноетил)феніл, бензилсульфоніламіно, 4-ізопропілсульфоніламінофеніл, 4-(2метансульфоніламіно-етил)феніл, 4-(2-етилсульфоніламіноетил)феніл, 4-(2пропілсульфоніламіноетил)феніл, 4-(2-бутилсульфоніламіноетил)феніл, 4-(2ізопропілсульфоніламіноетил)феніл, 4-(1-гідрокси-2-метансульфоніламіноетил)феніл, 4-(2-диметиламіносульфоніламіноетил)феніл, 4-(1-(2-(2-пропіл)сульфоніламінопропіл)феніл, 4-(2-(2,2,2трифторетил)сульфоніламіноетил)феніл, 4-(2-циклогексилсульфоніламіноетил)феніл, 4-(2фенілсульфоніламіноетил)феніл, 4-(2-(2-фторфеніл)сульфоніламіноетал)феніл, 4-(2-(4фтор феніл)сульфоніламіноетил)феніл, 4-(2-(2-трифторметилфеніл)сульфоніламіноетил)феніл, 4-(2-(4трифторметилфеніл)сульфоніламіноетил)феніл, 4-(2-(4-метоксифеніл)сульфоніламіноетил)феніл, 4-(2-(1(5-диметиламіно)нафталінсульфоніламіно)етил)феніл, 4-(2-(2-ттієніл)сульфоніламіно)етил)феніл, 4-(2бензамідоетил)феніл, 4-(2-(4-фтор-бензамідо)етил)феніл, 4-(2-(3-метоксибензамідо)етил)феніл, 4-(2-(3фторбензамідо)етил)феніл, 4-(2-(4-метоксибензамідо)етил)феніл, 4-(2-(2-метоксибензамідо)етил)феніл, 4(2-(2-тієнілкарбоксамідо)етил)феніл, 4-карбамоїлфеніл, 4-метилкарбамоїлфеніл, 4диметилкарбамоїлфеніл, 4-(2-(2-метилпропанамідо)етил)феніл, 4-(2-(3-метилбутанамідо)етил)феніл, бензоїлметил, бензамідо, 2-фторбензамідо, 3-фторбензамідо, 4-фторбензамідо, 2,4-дифторбензамідо, 3хлорбензамідо, 4-хлорбензамідо, 4-бромбензамідо, 4-йодбензамідо, 4-ціанбензамідо, 3-метилбензамідо, 4метилбензамідо, 4-етилбензамідо, 4-пропілбензамідо, 4-трет-бутилбензамідо, 4-вінілбензамідо, 2трифторметилбензамідо, 3-трифторметилбензамідо, 4-трифторметилбензамідо, 2-фтор-4трифторметилбензамідо, 2-метоксибензамідо, 3-метоксибензамідо, 4-метоксибензамідо, 4бутоксибензамідо, 4-фенілфенілкарбоксамідо, 4-бензилкарбоксамідо, 4-феноксиметилкарбоксамідо, 2фторбензиламіно, бензилокси, 2-фторбензилокси, 2-гідрокси-2-фенілетил, 2-фторфенілкарбамоїл, 4-(1-(2(2-метоксикарбонілетансульфоніламіно)етил)феніл, 4-(1-(2-(10-камфорасульфоніламіно)етил)феніл, 4-(1(2-бензилсульфоніламідо)етил)феніл, 4-(2-фенілацетамідо)етил)феніл, 4(метансульфоніламіноетаноїл)феніл, 4-(Ν-трет-бутоксикарбоніл)метансульфоніламіноетаноїл)феніл, 2тіенілкарбоксамідо, 2-фурилкарбоксамідо, 3-(5-метилізоксазоліл)карбоксамідо, 5-ізоксазолілкарбоксамідо, 2-бензотієнілкарбоксамідо, 4-(5-метил-3-фенілізоксазоліл)-карбоксамідо, 4-піридилкарбоксамідо, 2-(5нітрофурил)-карбоксамідо, 2-піридилкарбоксамідо, 6-хлор-2-піридилкарбоксамідо, 2-тієнілсульфонамідо, 2тієнілметиламіно, 3-тієнілметиламіно, 2-фурилметиламіно, 3-фурилметиламіно, 3-ацетилуреїцо і 2-(2тієніл)етилуреїдо. Конкретними прикладами групи R21 є водень і хлор. У варіантах, яким віддається перевага, група R21 займає орто-положення відносно групи R20. Конкретними прикладами групи R1 є 2-нафтил, 4-бромфеніл, 4-ціанфеніл, 4-бензамідофеніл, 4метилфеніл, 4-ізопропілфеніл, 4-ізобутилфеніл, 4-трет-бутилфеніл, 4-метоксифеніл, 4-ізопропоксифеніл, 4циклопентилфеніл, 4-циклогексилфеніл, 4-(2-гідроксиметилфеніл)феніл, 4-(4-гідроксиметилфеніл)феніл, 4(2-фурил)феніл, 4-(3-фурил)феніл, 4-(2-тієніл)феніл, 4-(3-тієніл)феніл, 4-(піро-лідин-1-іл)феніл, 4-(піперідин1-іл)феніл, 3-хлор-4-піперідин-1-ілфеніл, 4-бензилоксифеніл, 4-(2-фторфеніл)феніл, 4-(3-фторфеніл) феніл, 4-(2-формілфеніл)-феніл, 4-(3-формілфеніл)феніл, 4-(4-формілфеніл)феніл, 4-(4-метилфеніл)-феніл і 4-(2метоксифеніл)феніл. Деякі сполуки формули І вважаються новими і являють собою ще один аспект цього винаходу. Ці сполуки можуть бути представлені формулою в якій R1 являє собою нафтил або феніл, фурил, тієніл чи піридил, незаміщений або заміщений одним або двома замісниками, вибраними незалежно один від одного з групи, яка включає галоїд; нітрогрупу; ціан; гідроксиіміногрупу; С 1-С10 алкіл; С2-С10 алкеніл; С2-С10 алкініл; С3-С8 циклоалкіл; гідрокси-С 3-С8 циклоалкіл; оксо-С3-С8 циклоалкіл; галоїдний С 1-С10 алкіл; групу (СН2)уХ1R9, де у - нуль або ціле число від 1 до 4, X1 - О, S, NR10, CO, COO, ОСО, CONR 11, NR12CO, NR12COCOO, OCONR 13, R9 - водень, С1-С10 алкіл, С3-С10 алкеніл, С3-С10 алкініл, піролідиніл, тетрагідрофурил, морфолінова група або С 3-С8 циклоалкіл, а кожна з груп R10, R11, R12 і R13 незалежно від інших являє собою водень чи С1-С10 алкіл, або ж R9 і R10, R11, R12 чи R13 разом з атомом азоту, до якого вони приєднані, утворюють азетидиніл, піролідиніл, піперидиніл або морфолінову груп у; N-(С1-С4 алкіл)-піперазиніл; N-феніл(С1-С4 алкіл)-піперазиніл; тієніл; фурил; оксазоліл; ізокеазоліл; піразоліл; імідазоліл; тіазоліл; піридил; піридазиніл; піримідиніл; дигідротієніл; дигідрофурил; дигідротіопіраніл; дигідропіраніл; дигідротіазоліл; С1-С4-алкоксикарбонілдигідротіазоліл; С1-С4алкоксикарбонілдиметилдигідротіазоліл; тетрагідротієніл; тетрагідрофурил; тетрагідротіопіраніл; тетрагідропіраніл; індоліл; бензофурил; бензотієніл; бензімідазоліл; і групу формули R14-(La)n-X2-(Lb) m, де X2 є зв'язок, О, NH, S, SO, SO2, CO, CH(OH), CONH, NHCO, NHCONH, NHCOO, COCONH, OCH 2CONH або СН=СН , кожна з груп Lа і Lb є С1-С4 алкілен, одне з чисел m і n є 1 а друге - 0, a R14 - феніл або гетероароматична група, незаміщена або заміщена одним або двома замісниками з перелічених нижче: галоїд, нітрогрупа, ціан, С1-С10 алкіл, С2-С10 алкеніл, С2-С10 алкініл, C3-C8 циклоалкіл, 4-(1,1діоксотетрагідро-1,2-тіазиніл), галоїдний С1-С10 алкіл, ціано-С 2-С10 алкеніл, феніл і група (CH2)zX3R 15, в якій z - нуль або ціле число від 1 до 4, X3 - О, S, NR16, CO, СН(ОН), СОО, ОСО, CONR 17, NR18CO, NHSO2, NHSO2NR17, NHCONH, OCONR19 або NR19COO, R15 - водень, С1-С10 алкіл, феніл-С 1-С4 алкіл, галоїдний С 1С10 алкіл, С1-С4-алкоксикарбоніл-С1-С4 алкіл, (С1-С4-алкілсульфоніламіно)-С1-С4 алкіл, N-(С1-С4алкоксикарбоніл)(С1-С4-алкілсульфоніламіно)-С1-С4 алкіл, С3-С10 алкеніл, С3-С10 алкініл, С3-C8 циклоалкіл, камфорил чи ароматична або гетероароматична група, незаміщена або заміщена одним або двома такими замісниками: галоїд, С1-С4 алкіл, галоїдний С 1-С4 алкіл, ди(С1-С4 алкіл)аміно або С 1-С4 алкоксигрупа, а кожна з груп R16, R17, R18 і R19 незалежно від інших являє собою водень чи С1-С10 алкіл, або ж R15 і R16, R17, R18 чи R19 разом з атомом азоту, до якого вони приєднані, утворюють азетидиніл, піролідиніл, піперидиніл або морфолінову груп у; R2 являє собою С 1-С6 алкіл, С3-С6 циклоалкіл, С1-С6 фторалкіл, С1-С6 хлоралкіл, C2-C6 алкеніл, (С1-С4 алкокси)-С1-С4 алкіл, феніл, незаміщений або заміщений галоїдом, С1-С4 алкілом або С1-С4 алкоксигрупою, або група формули R3R4N, де кожна з груп R3 і R4 незалежно від другої являє собою С 1-С4 алкіл або ці групи разом з атомом азоту, до. якого вони приєднані, утворюють піролідиніл, піперідиніл, піперазиніл або морфолінову гр упу; і одна або дві з груп R5, R6, R7 і R8 являють собою С 1-С6 алкіл, арил-С 1-С6 алкіл, C2-C6 алкеніл, арил-С2С6 алкеніл або арил, або ж дві з груп R 5, R6, R7 і R8 разом з атомом чи атомами вуглецю, до яких вони приєднані, утворюють С3-С8 карбоциклічну групу, а інші з груп R 5, R6, R7 і R8 є атомами водню; або фармацевтично прийнятні солі таких сполук, але за винятком N-(2,2-дифенілетил)метансульфонаміду і тих сполук формули І, в яких R7 - метил, R5, R6 і R8 є атомами водню і (a) R1 - феніл, a R2 - метил, бутил, фторметил, дифторметил, трифторметил, диметиламіно або піперидиніл; або (b) R1 - 4-хлор феніл, 4-нітрофеніл або 3-метоксифеніл, a R2 - метил; або (c) R1 - 4-нітрофеніл, a R2 - трифторметил. Сполуки формули 1 можуть бути одержані шляхом реакції сполуки формули R1-L-NH2 II зі сполукою формули R2SO2 X III де Χ - р ухомий атом або група, з наступним утворенням фармацевтично прийнятної солі в разі необхідності та/або за бажанням. Рухомий атом або група, позначений X, може являти собою, наприклад, атом галогену, як-от хлору або брому. Реакцію доцільно проводити за присутності основи, наприклад, гідроксиду лужного металу, як-от гідроксиду натрію, карбонату лужного металу, наприклад, карбонату калію, третинного аміну, наприклад, триетиламіну або 1,8-діазабіцикло-[5.4.0]ундец-7-ену. До придатних розчинників належать галогеновані вуглеводні, наприклад, дихлорметан. Реакцію доцільно проводити при температурі в межах від -20°С до 100°С, краще від -5°С до 50°С. Сполуки формули І, в яких R1 являє собою 4-бромфеніл, можуть бути легко перетворені в інші сполуки формули І, в яких R1 являє собою іншу фенільну гр упу, заміщену в положенні 4, шляхом реакції з відповідною похідною борної кислоти, наприклад, похідною бензолборної кислоти. Цю реакцію доцільно проводити за присутності каталізатора на основі тетракіс-(триарилфосфін)паладію (0), наприклад, тетракіс(трифенілфосфін)паладію (0), і основи, наприклад, карбонату калію. До зручних для проведення цієї реакції розчинників належать ароматичні вуглеводні, наприклад, толуол. Доцільно, щоб температура, при якій проводять реакцію, була в межах від 0°С до 150°С, краще від 75°С до 120°С. Біс-ароматичні проміжні продукти, корисні для приготування сполук формули І, можуть бути одержані шляхом реакції бромароматичної або бромгетероароматичної сполуки з ароматичною або гетероароматичною похідною борної кислоти аналогічним способом. Похідна борної кислоти, що використовується як вихідний матеріал, може бути одержана шляхом реакції триалкілборату, наприклад, триізопропілборату, з відповідною літійорганічною сполукою при низькій температурі. Наприклад, 2-фторбензолборна кислота може бути одержана шляхом реакції 2фторбромбензолу з бутиллітієм в тетрагідрофурані при температурі приблизно мінус 78°С, що призводить до утворення 2-фторфеніллітію, і подальшої реакції цієї літійорганічної сполуки з триізопропілборатом. Згідно з альтернативним варіантом, сполуки формули І, в яких R1 являє собою 4-бромфеніл, можуть бути перетворені в сполуки, які містять 4-(триметилстаніл)фенільну групу або 4-(три-nбутилстаніл)фенільну груп у, шля хом оброблення відповідного броміду паладієвим каталізатором, наприклад, тетракіс(трифенілфосфін)паладієм (0) і гексаалківдистананом, де алкільна група являє собою метил або n-бутил, в апротонному розчиннику, наприклад, в толуолі, за присутності основи третинного аміну, наприклад, триетиламіну, при температурах в межах від 80°С до 140°С, переважно від 90°С до 110°С. Сполуки формули І, в яких R1 являє собою 4-(три-n-бутилстаніл)фенільну груп у, можуть потім бути введені в реакцію з арил- або гетероарилбромідом, наприклад, з 2-бромтіофен-5-карбоксальдегідом, за присутності каталізатора на основі паладію (0), наприклад, тетракіс(трифенілфосфін)паладію (0), або на основі паладію (II), наприклад, біс(трифенілфосфін)паладій(ІІ)дихлориду, в апротонному розчиннику, наприклад, в діоксані, при температурах в межах від 80°С до 140°С, переважно від 90°С до 110°С, з одержанням сполуки, що містить відповідний 4-арилфеніл або 4-гетероарилфеніл як замісник. Сполуки формули І, в яких R1 являє собою 4-бромфеніл, можуть бути перетворені в інші сполуки формули І, в яких R1 являє собою фенільну групу, заміщену алкілом або циклоалкілом в положенні 4, наприклад, 4-циклопентилфеніл, шляхом оброблення відповідного броміду придатним для цього алкіл- або циклоалкілвмісним реагентом Гріньяра, наприклад, циклопентилмагнійбромідом, за присутності каталізатора на основі паладію (II), наприклад, [1,1’-біс(дифенілфосфін)-фероцен]-дихлорпаладію(ІІ) (PdCl 2(dppf)), в апротонному розчиннику, наприклад, в діетиловому ефірі, при температурах в межах від 78°С до 25°С. Сполуки формули І, в яких R1 являє собою 4-бромфеніл, можуть бути перетворені в сполуки, в яких R1 являє собою фенільну групу, заміщену в положенні 4 карбоксальдегідом (формілфенільну групу), шляхом реакції відповідного броміду з газоподібним моноксидом вуглецю, який вводять в реакційну суміш під атмосферним тиском способом барботування за присутності каталізатора на основі паладію (II), наприклад, біс(трифенілфосфін) паладій (II)-дихлориду, і форміатом натрію в апротонному розчиннику, наприклад, в диметилформаміді, при температурах в межах від 70°С до 110°С, переважно при 90°С. Сполуки формули І, в яких R1 являє собою 4-гідроксифеніл, можуть бути перетворені в інші сполуки формули І, в яких R1 являє собою алкоксильну групу, шляхом оброблення відповідної гідроксифенільної групи придатним для цього галоїдним алкілом, наприклад, бензилбромідом, за присутності гідриду натрію в апротонному розчиннику, наприклад, в диметилформаміді, при температурах в межах від 25°С до 100°С, переважно від 50°С до 90°С. Сполуки формули ІІ відомі або можуть бути одержані відомими способами, наприклад, відновленням відповідного аміду або нітрилу з застосуванням бороводню. Деякі аміди або нітрили, що використовуються як вихідні матеріали, можуть бути одержані шляхом оброблення ацетонітрилу формули R1CH2CN, наприклад, заміщеного фенілацетонітрилу, як-от 4метоксифенілацетонітрилу, або ацетату формули R1CH2COOR (де R - наприклад, алкіл), наприклад, фенілацетату, як-от метил-4-трет-бутилфенілацетату, сильною основою - амідом, наприклад, біс(триметилсиліл)амідом літію або натрію, і галоїдним алкілом, наприклад, метилйодидом, в апротонному розчиннику, наприклад, тетрагідрофурані, при температурах в межах від -78°С до 25°С. Складні ефіри перетворюють в аміди шляхом гідролізу (водою, спиртом і гідроксидом натрію або калію) до кислоти, конвертування кислоти в хлорангідрид (SОСІ2 або (СОСI)2 плюс ДМФ (1 крапля)) і наступного перетворення хлорангідриду в амід дією водного аміаку за присутності допоміжного розчинника, наприклад, тетрагідрофурану або діоксану. Деякі нітрили, що використовуються для одержання сполук формули II, можуть бути легко одержані шляхом реакції відповідного кетону, наприклад, сполуки формули R 1COR8, як-от (2-ацетил-5-тієніл-3іл)тіофену, з тозилметилізоціанідом і трет-бутоксидом калію в диметиловому ефірі. Здатність сполук формули І посилювати функцію рецепторів глутамату можна продемонструвати, використовуючи тест за методикою, описаною нижче. Було підготовлено 96 пластин з виїмками, які містили моношари клітин лінії НЕК, що стабільно показували активність людського рецептора GluR4B (одержаного за методикою, описаною в заявці на європейський патент ЕР-А1-583917). Потім живильне середовище культури тканини видаляли з виїмок, а кожну виїмку промивали один раз 200мкл буферу 5NaCa (глюкоза - 10ммоль, хлорид натрію - 138ммоль, хлорид магнію - 1ммоль, хлорид калію - 5ммоль, хлорид кальцію - 5ммоль, N-[2-гідроксиетил]піперазнн-N[2-етансульфокислота] (ГЕПЕС) - 10ммоль, до рН від 7,1 до 7,3). Потім пластини інкубували в темряві протягом 60 хвилин з 20ммоль барвника Флюо3-АМ (Fluo3-AM) (одержано від фірми Molecular Probes Inc., Eugene, Oregon) в буфері 5NaCa у кожній виїмці. Після інкубації кожну виїмку промивали один раз 100мкл буферу 5NaCa, додавали 200мкл буферу 5NaCa, і пластини інкубували протягом 30 хвилин. Розчини, використовувані в тесті, виготовляли, як описано нижче. Із розчину досліджуваної сполуки в диметилсульфоксіді (ДМСО) концентрації 10ммоль готували розведенням розчини концентрацій 30мкмоль, 10мкмоль, 3мкмоль і 1мкмоль з використанням буферу 5NaCa. Розчин циклотіазиду готували додаванням 3мкл розчину циклотіазиду концентрації 100ммоль до 3мл буферу 5NaCa. Контрольний буферний розчин готували додаванням 1,5мкл ДМСО до 498,5мкл буферу 5NaCa. Кожний тест виконували, як описано нижче. 200мкл буферу 5NaCa видаляли з кожної виїмки і заміняли 45мкл буферу 5NaCa. Потім виконували перше вимірювання, використовуючи флуориметр FLUOROSKAN II (Labsystems, Needham Heights, MA, USA, a Division of Life Sciences International Ріс). Потім буфер видаляли з виїмок, додавали 45мкл буферу 5NaCa у зовнішні виїмки і 45мкл розчину досліджуваної сполуки у внутрішні виїмки. Виконували друге вимірювання на флуориметрі. Пластину залишали у флуориметрі на 5 хвилин і провадили третє вимірювання. Потім у кожну виїмку додавали 15мкл розчину глутамату концентрації 400мкмоль (кінцева концентрація глутамату 100мкмоль) і виконували четверте вимірювання. Приблизно через три хвилини виконували п'яте вимірювання. Активність досліджуваних речовин, контрольного розчину та розчину циклотіазиду визначали шляхом віднімання результату третього вимірювання від результату четвертого (флуоресценція, обумовлена глутаматом). Значення активності досліджуваних сполук виражали відносно активності розчину циклотіазиду концентрації 100мкмоль. У другому тесті клітини лінії НЕК293, що стабільно показували активність людського рецептора GluR4 (одержаного за методикою, описаною в заявці на європейський патент ЕР-А1-0583917), використовували для електрофізіологічної характеризації посилювачів рецепторів АМРА. Розчин для позаклітинної реєстрації містив (у ммоль): хлорид натрію 140, хлорид калію 5, ГЕПЕС 10, хлорид магнію 1, хлорид кальцію 2, глюкоза 10, рН доведено до 7,4 за допомогою гідроксиду натрію, 295мОсм кг-1. Розчин для внутріклітинної реєстрації містив (у ммоль) хлорид цезію 140, хлорид магнію 1, ГЕПЕС (N-[2гідроксиетил]піперазин-N1-[2-етансульфокислота]) 10, ЕГТА (e тилен-біс(оксиетиленнітрил)тетраоцтова кислота) 10, рН=7,2 за допомогою гідроксиду цезію, 295мОсм кг-1. За умови застосування цих розчинів піпетки для реєстрації мали опір 2-3МОм. На клітини був поданий потенціал 60мВ з застосуванням способу підключення цілої клітини і збуджений контрольний відгук на 100мкмоль глутамату. Після встановлення стабільної базової лінії відгуку на цей агоніст у позаклітинний розчин, що омивав клітини, був доданий посилювач у найнижчій концентрації і виміряний відгук на 100мкмоль глутамату за присутності цієї концентрації посилювача. Концентрацію посилювача як в розчині, що омивав клітини, так і в сумісному розчині з агоністом збільшували таким чином, що інкремент її логарифму щоразу збільшувався на 0,5, до досягнення максимального ступеня посилення. Дані, зібрані таким чином, підставляли в рівняння Хілла (Hill), одержуючи значення ЕС 50, які характеризують активність посилювача. Потім посилювач вимивали як з контрольного розчину, так і з розчину, що містив агоніст, для дослідження його видалення. Після відновлення контрольного значення відгуку на агоніст визначали посилення цього відгуку під впливом 100мкмоль циклотіазиду шляхом додавання цієї речовини як до розчину, що омивав клітини, так і до розчину, який містив агоніст. Таким чином визначали ефективність посилювача відносно ефективності циклотіазиду. Сполуки, подані в прикладах, наведених у цьому описі, показували у ви щезгаданому тесті значення ЕС50, принаймні, 30мкмоль. Наприклад, сполука прикладу 28 мала ЕС50 230±59нмоль. Згідно зі ще одним аспектом винаходу, він забезпечує фармацевтичну композицію, що містить сполуку формули Іа або фармацевтично прийнятну сіль її згідно з вищенаведеним визначенням і фармацевтично прийнятний розріджувач або наповнювач. Фармацевтичні композиції готують відомими способами з використанням добре відомих і легко доступних інгредієнтів. При приготуванні композицій згідно з цим винаходом активний інгредієнт звичайно змішують з наповнювачем або розводять наповнювачем, або ж вміщують у наповнювач, і він може мати форму капсули, саше, облатки або іншу. Якщо наповнювач грає роль розріджувача, то він може являти собою твердий, напівтвердий або рідкий матеріал, що діє як носій, наповнювач або середовище для активного інгредієнта. Композиції можуть мати форму таблеток, пілюль, порошків, облаток, саше, крохмальних капсул, еліксирів, суспензій, емульсій, розчинів, сиропів, аерозолів, мазей, які містять, наприклад, до 10% (мас.) активної сполуки, м'яких або твердих желатинових капсул, свічок, стерильних розчинів для ін'єкцій і стерильно упакованих порошків. Деякі приклади придатних для цього наповнювачів, розріджувачів та носіїв включають лактозу, декстрозу, са харозу, сорбіт, маніт, різні види крохмалю, каучук, гуміарабік, фосфат кальцію, альгінати, трагант, желатин, силікат кальцію, мікрокристалічну целюлозу, полівінілпіролідон, целюлозу, водні сиропи, метилцелюлозу, метил- і пропілгідроксибензоати, тальк, стеарат магнію і мінеральне масло. Рецептури можуть додатково містити змащувальні агенти, змочувальні агенти, емульгатори та суспензатори, консерванти, підсолоджувальні агенти і ароматизатори. Композиції згідно з цим винаходом можуть бути виготовлені у таких лікарських формах, що забезпечують швидке, уповільнене або затримане виділення активного інгредієнта після вживання пацієнтом, для чого використовуються способи, добре відомі в галузі. У варіантах, яким віддається перевага, композиції виготовляють у дозованих формах, причому кожна одиниця дозування містить від 1мг до приблизно 500мг, краще від приблизно 5мг до приблизно 300мг (наприклад, 25мг) активного інгредієнта. Термін "одиниця дозування" означає фізично дискретну одиницю, придатну для одноразового дозування активного інгредієнта людині або іншим ссавцям, причому кожна така одиниця містить певну кількість активного матеріалу, визначену в розрахунку на бажаний терапевтичний ефект, в комбінації з придатним фармацевтичним носієм, розріджувачем або наповнювачем. Приклади лікарських форм, наведені нижче, мають лише ілюстративне значення і ніяким чином не обмежують об'єм винаходу. Лікарська форма 1 Виготовляють тверді желатинові капсули з використанням таких інгредієнтів: Кількість (мг на капсулу) Активний інгредієнт 250 Крохмаль, висушений 200 Стеарат магнію 10 Разом 460мг Вищенаведені інгредієнти змішують і вводять у тверді желатинові капсули по 460мг у кожну. Лікарська форма 2 Таблетки з вмістом активного інгредієнта по 60мг у кожній виготовляють таким способом: Активний інгредієнт 60мг Крохмаль 45мг Мікрокристалічна целюлоза 35мг Полівінілпіролідон 4мг метилкарбоксилований крохмаль натрію 4,5мг Стеарат магнію 0,5мг Тальк 1мг Разом 150мг Активний інгредієнт, крохмаль і целюлозу пропускають через сито 45меш за стандартом США (розмір отвору 0,35мм) і ретельно перемішують. З одержаним порошком змішують розчин полівінілпіролідону, і одержану суміш пропускають через сито 14меш за стандартом США (розмір отвору 1,4мм). Одержані гранули висушують при 50°С і пропускають через сито 18меш за стандартом США (розмір отвору 1,0мм). Потім до гранул додають метилкарбоксилований крохмаль натрію, стеарат магнію і тальк, які попередньо пропущені через сито 60меш за стандартом США (розмір отвору 0,25мм), і після перемішування пресують на таблет-пресі, одержуючи таблетки масою 150мг кожна. Конкретна доза прийому сполук згідно з цим винаходом, безумовно, визначається з урахуванням реальних обставин, в тому числі виду активної речовини, шляху прийому, конкретного стану, що підлягає лікуванню, та іншіх подібних міркувань. Сполуки можна вводити в організм різноманітними шляхами, в тому числі оральним, ректальним, через шкіру, підшкірно, внутрішньовенно, внутрішньом'язово, через ніс. В альтернативному варіанті можливе також введення шляхом безперервної інфузії. Типова денна доза складає від приблизно 0,01мг/кг до приблизно 100мг/кг активної сполуки згідно зцим винаходом. У варіантах, яким віддається перевага, денні дози складають від приблизно 0,05мг/кг до приблизно 50мг/кг, краще від приблизно 0,1мг/кг до приблизно 25мг/кг. Винахід ілюструється нижченаведеними прикладами приготування проміжних продуктів та прикладами. Проміжний продукт 1 2-(4-бромфеніл)пропіонітрил Розчин 50,0г (225,0ммоль) 4-бромфенілацетонітрилу і 1,8г (12,8ммоль) карбонату калію нагрівали при 180°С в закритій посудині протягом 16 годин. Потім розчин охолоджували, розбавляли 200мл етилацетату і промивали один раз 100мл води, один раз 100мл 10-процентного водного розчину бісульфату натрію і один раз 100мл розсолу. Органічний шар сушили (сульфат магнію), фільтрували та концентрували у вакуумі. Залишок переганяли під вакуумом в апараті для молекулярної дистиляції. Одержано 40,3г (85%) сполуки, названої у заголовку. Проміжний продукт 2 2-(4-бромфеніл)пропіламін гідрохлорид До розчину 35,2г (167,6ммоль) проміжного продукту 1 у 35мл тетрагідрофурану при кипінні зі зворотним холодильником додавали поступово, за допомогою шприца, 18,4мл (184,3ммоль) 10М бороводнюдиметилсульфіду. Після завершення додавання суміш нагрівали зі зворотним холодильником ще протягом 1 години. Потім розчин охолоджували до температури приміщення і повільно додавали насичений розчин хлороводню в метанолі до рН 2. Одержану суспензію концентрували у вакуумі. Залишок розчиняли в метанолі і концентрували у вакуумі. Цю операцію повторювали двічі. Одержану тверду речовину суспендували в діетиловому ефірі, фільтрували, промивали діетиловим ефіром і сушили в вакуумі. Одержано 31,2г (74%) сполуки, названої у заголовку. Проміжний продукт 3 2-фторбензолборна кислота Розчин 50г (285,6ммоль) 2-фторбромбензолу в 400мл тетрагідрофурану о холоджували до -78°С і додавали через голку для шприца 200мл (320,0ммоль) 1,6М розчину n-бутиллітію. С уміш розмішували при 78°С протягом 60 хвилин, потім додавали через голку для шприца 98,9мл (428,4ммоль) триізопропілборату і продовжували розмішувати ще протягом 60 хвилин. Усували о холоджуючу баню і перемішували суміш при температурі приміщення протягом 1,5 години, потім додавали 150мл 6-нормальної хлористоводневої кислоти і продовжували розмішування ще протягом 1,5 години. Додавали до суміші 150мл розсолу, відділяли органічний шар, а водний шар тричі екстрагували ефіром порціями по 30мл кожна. Об'єднані органічні екстракти сушили (сульфат магнію), фільтрували і концентрували в вакуумі. Залишок перекристалізовували з води. Одержано 25,2г (63%) сполуки, названої у заголовку. Проміжний продукт 4 2-(4-бромфеніл)-N-(тpет-бутоксикарбоніл)пропіламін До розчину 11,8г (55,0ммоль) проміжного продукту 2 у 100мл хлороформу і 100мл насиченого розчину бікарбонату натрію додавали 12,0г (55,0ммоль) ди-трет-бутилдикарбонату. Розчин перемішували при температурі приміщення протягом години. Органічний шар відділяли, а водний шар тричі екстрагували хлороформом порціями по 30мл кожна. Об'єднані органічні екстракти сушили (сульфа т магнію), фільтрували і концентрували в вакуумі. Одержано 16,5г (95%) сполуки, названої у заголовку. Проміжний продукт 5 2-(4-(2-фторфеніл)феніл)-N-(трет-бутоксикарбоніл)пропіламін До знегаженого розчину 12,5г (39,8ммоль) проміжного продукту 4, 6,7г (47,7ммоль) проміжного продукту 3 у 100мл хлороформу і 8,2г (59,7ммоль) бікарбонату калію в 140мл толуолу додавали 2,3г (1,9ммоль) тетракіс(трифенілфосфін)паладію (0). Суміш нагрівали при 90°С протягом 18 годин. Потім суміш охолоджували до температури приміщення, додавали 300мл води і 150мл ефіру. Органічний шар відділяли, а водний шар тричі екстрагували етилацетатом порціями по 50мл кожна. Об'єднані органічні екстракти сушили (сульфат магнію), фільтрували і концентрували в вакуумі. Після хроматографічного очищення (500г силікагелю, 10% етилацетату в гексані) одержано 9,3г (71%) сполуки, названої у заголовку. Проміжний продукт 6 2-(4-(2-фторфеніл)феніл)пропіламін Розчин 9,3г проміжного продукту 5 в 100мл 20-процентного розчину трифтороцтової кислоти в дихлорметані перемішували при температурі приміщення протягом 2 годин. Суміш концентрували у вакуумі; одержано 11,7г матеріалу. Цю речовину розчиняли в 100мл ефіру і двічі промивали 1-нормальним розчином гідроксиду натрію порціями по 50мл кожна. Органічний шар концентрували у вакуумі. Одержано 5,48г (85%) сполуки, названої у заголовку. Проміжний продукт 7 2-(4-ізопропілфеніл)пропіонітрил В колбі місткістю 250мл розчиняли 8,00г (50,2ммоль) 4-ізопропілфенілацетонітрилу в тетрагідрофурані (150мл) в атмосфері азоту. Розчин охолоджували до -78°С і додавали біс(триметилсиліл)амід літію (1M в тетрагідрофурані, 52,8мл, 52,8ммоль). Одержану суміш розмішували при -78°С протягом години. Додавали до реакційної суміші йодметан (3,29мл, 52,8ммоль) Суміші давали повільно нагріватися до температури приміщення на протязі 16 годин, потім реакцію припиняли додаванням 0,2М хлористоводневої кислоти і суміш двічі екстрагували діетиловим ефіром. Об'єднані органічні екстракти сушили (суль фат магнію), фільтрували і концентрували в вакуумі. Після хроматографічного очищення (SiO2, 20% етилацетату вгексані) одержано 6,32г (73%) сполуки, названої у заголовку. Мас-спектр з польовою десорбцією: М=173. Аналіз для C12H15N: Теоретичний розрахунок С, 83,19; Н, 8,73; N, 8,08. Фактично знайдено С, 82,93; Н, 8,57; N, 8,02. Проміжний продукт 8 2-(4-ізопропілфеніл)пропіламін гідрохлорид В колбі місткістю 100мл, обладнаній конденсатором, розчиняли 2-(4-ізопропілфеніл)пропіонітрил (1,90г, 11,0ммоль) в тетрагідрофурані (70мл) в атмосфері азоту. Додавали до розчину бороводневометилеульфідний комплекс (10,0-10,2М в тетрагідрофурані, 1,20мл, 12,1ммоль) і суміш нагрівали зі зворотним холодильником протягом 3 годин. Охолоджували до температури приміщення і повільно додавали насичений розчин хлористоводневої кислоти в метанолі до утворення білого осаду. Розчинник видаляли у вакуумі, а одержану білу тверду речовину розтирали в порошок (х4) з діетиловим ефіром. Після висушування у вакуумі одержано 1,76г (73%) сполуки, названої у заголовку. Проміжний продукт 9 2-(4-метоксифеніл)пропіонітрил За методикою синтезу проміжного продукту 7, але з використанням 4-метоксифенілацетонітрилу (5,00г, 34,0ммоль), одержано 6,32г сполуки, названої у заголовку. Мас-спектр з польовою десорбцією: М=161. Аналіз для C10H11NO: Теоретичний розрахунок С, 74,51; Н, 6,88; N, 8,69. Фактично знайдено С, 74,34; Н, 6,67; N, 8,93. Проміжний продукт 10 2-(4-метоксифеніл)пропіламін гідрохлорид За методикою синтезу проміжного продукту 8, але з використанням проміжного продукту 9 (2,75г, 17,1ммоль), одержано 2,77г (81%) сполуки, названої у заголовку. Аналіз для C10H16ClNO: Теоретичний розрахунок С, 59,55; Н, 8,00; N, 6,94. Фактично знайдено С, 59,33; Н, 7,89; N, 6,71. Проміжний продукт 11 Метил-2-(4-трет-бутилфеніл)пропаноат 23,2мл біс(триметилсиліл)аміду літію (1М, 23ммоль) по краплях додавали до 4,75г (23ммоль) метил-4трет-бутилфенілацетату в 100мл сухого тетрагідрофурану при -78°С при перемішуванні в атмосфері азоту. Суміш розмішували при цій температурі протягом 45 хвилин, потім додавали по краплях 1,5мл (24ммоль) метилйодиду, і розчин розмішували при -78°С ще протягом години. Виливали суміш у 200мл води, і цільовий продукт екстрагували 500мл діетилового ефіру. Органічний шар обробляли методом зворотної промивки один раз 500мл води, сушили над карбонатом калію і концентрували під зниженим тиском; одержано 5,12г темного масла. Це масло очищали хроматографуванням через шар силікагелю з градієнтним елююванням (склад елюенту змінювали від чистого гексану до суміші гексан:етилацетат 19:1). Фракції, що містили цільовий продукт, об'єднували і концентрували під зниженим тиском. Одержано 2,65г (53%) сполуки, названої у заголовку. Мас-спектр: М=220. Проміжний продукт 12 Метил-2-(4-трет-бутилфеніл)бутаноат 4г (19ммоль) метил-4-трет-бутилфенілацетату, 19,5мл біс(триметил-силіл)аміду літію (1М, 19ммоль) і 3,12г (20ммоль) метилйодиду вводили в реакцію за методикою, описаною для синтезу проміжного продукту 11; одержано 5,13г темного масла. Після хроматографічного очищення з градієнтним елююванням (гексан гексан:етилацетат 19:1) одержано 2,35г (53%) сполуки, названої у заголовку. Мас-спектр: М=234. Проміжний продукт 13 Метил-2-(4-трет-бутилфеніл)-2-метилпропаноат 4,75г (23ммоль) метил-4-трет-бутилфенілацетату, 46,6мл біс(триметил-силіл)аміду літію (1М, 46ммоль) і 6,80г (48ммоль) метилйодиду вводили в реакцію за методикою, описаною для синтезу проміжного продукту 11; одержано 4,73г сирового масла. Після хроматографічного очищення з градієнтним елююванням (гексан - гексан:етилацетат 19:1) одержано 2,0г (37%) сполуки, названої у заголовку. Мас-спектр: М=234. Проміжний продукт 14 Етил-2-(2-нафтил)пропаноат 5г (23ммоль) етил-2-нафтилацетату, 23,3мл біс(триметил-силіл)аміду літію (1М, 23ммоль) і 1,5мл (24ммоль) метилйодиду вводили в реакцію за методикою, описаною для синтезу проміжного продукту 11; одержано 5,51г темного масла. Після хроматографічного очищення з градієнтним елююванням (гексан гексан:етилацетат 19:1) одержано 2,85г (54%) сполуки, названої у заголовку. Мас-спектр: М=228. Проміжний продукт 15 2-(4-трет-бутилфеніл)пропіонова кислота 2,60г (12ммоль) проміжного продукту 11 і 1,75г (42ммоль) гідроксиду літію додавали до суміші трьох розчинників: тетрагідрофурану (189мл), метанолу (63мл) і води (63мл) і розмішували при температурі приміщення протягом 16 годин. Потім суміш концентрували під зниженим тиском, і одержаний твердий білий продукт змішували з 200мл 1-нормального розчину хлористоводневої кислоти. Цільовий продукт екстрагували 250мл етилацетату. Органічний шар концентрували під зниженим тиском; одержано 1,21г (49%) сполуки, названої у заголовку. Мас-спектр: М=206. Проміжний продукт 16 2-(4-третя-бутилфеніл)масляна кислота Сполуку, вказану у заголовку, в кількості 2,14г було одержано за методикою синтезу проміжного продукту 15 із проміжного продукту 12 і перекристалізовано з гексану. Мас-спектр: М=220. Проміжний продукт 17 2-(4-трет-бутилфеніл)-2-метилпропіонова кислота Сполуку, вказану у заголовку, в кількості 1,75г було одержано за методикою синтезу проміжного, продукту 15 із проміжного продукту 13 і перекристалізовано з гексану. Мас-спектр: М=220. Проміжний продукт 18 2-(2-нафтил)пропіонова кислота Сполуку, вказану у заголовку, в кількості 3,81г було одержано за методикою синтезу проміжного продукту 15 із проміжного продукту 14 і перекристалізовано з суміші гексану з етилацетатом (9:1). Мас-спектр: М=214. Проміжний продукт 19 2-(4-трет-бутилфеніл)пропіонамід 900мг (4,4ммоль) проміжного продукту 15 додавали порціями до оксалілхлориду (10мл) при температурі приміщення в атмосфері азоту, а потім додавали дихлорметан (10мл). Реакцію ініціювали додаванням одної краплі диметилформаміду. Після початку виділення газу реакційну суміш перемішували протягом 2 годин при температурі приміщення. Концентруючи реакційну суміш під зниженим тиском, одержували масло. Додавали діоксан (10мл) для розчинення і при розмішуванні додавали при температурі приміщення 28-процентний гідроксид амонію (10мл), після чого перемішували при тій же температурі протягом 16 годин. Потім суміш концентрували під зниженим тиском, одержуючи білий твердий продукт. Цей останній змішували з 50мл етилацетату, обробляли методом зворотної промивки 50мл води, сушили над карбонатом калію і концентрували під зниженим тиском; одержано 770мг твердого продукту. Після перекристалізації з суміші гексану з етилацетатом (1:1) одержано 555мг (61%) сполуки, названої у заголовку. Мас-спектр: М=205. Проміжний продукт 20 2-(4-трет-бутилфеніл)бутанамід Сполуку, вказану в заголовку, одержано за методикою синтезу проміжного продукту 19 із проміжного продукту 16. Очищення здійснювали хроматографуванням на силікагелі (прилад "Хроматотрон", Chromatotron-2000 micron rotor), як елюент застосовували суміш гексану з етилацетатом (1:1). Вихід 471мг (60%). Мас-спектр: М=219. Проміжний продукт 21 2-(4-трет-бутилфеніл)2-метилпропіонамід Сполуку, вказану в заголовку, одержано за методикою синтезу проміжного продукту 19 із проміжного продукту 17. Сировий продукт розтирали з сумішшю гексану з етилацетатом (19:1) протягом півгодини і фільтрували; одержано 1,16г білої твердої речовини. Після перекристалізації з суміші етилацетату з етанолом (1:1) одержано 80% вихід продукту у вигляді пластинчастих кристалів. Мас-спектр: М=219. Проміжний продукт 22 2-(2-нафтил)пропіонамід Сполуку, вказану в заголовку, одержано за методикою синтезу проміжного продукту 19, із проміжного продукту 18. Після перекристалізації з суміші гексану з етилацетатом (1:1) одержано 1,65г (90%) продукту. Мас-спектр: М=199. Проміжний продукт 23 2-(4-трет-бутилфеніл)пропіламін 25мл комплексу бороводню з тетрагідрофураном (1,0М, 0,025моль) додавали за допомогою шприца до 1,10г (5,4ммоль) проміжного продукту 19 (60мл) при температурі приміщення в атмосфері азоту. Потім суміш нагрівали при 60-65°С протягом 16 годин. Додавали при температурі приміщення за допомогою шприца 5мл насиченого розчину хлороводню в метанолі, що спричиняло сильне спінення реакційної маси, і концентрували масу під зниженим тиском. Одержану білу тверду речовину розмішували зі 100мл 1N розчину гідроксиду натрію, і виділений вільний амін екстрагували один раз 200мл діетилового ефіру. Органічний шар піддавали зворотній промивці 200мл води, сушили над карбонатом калію і концентрували під зниженим тиском; одержано 1,21г коричневого масла. Хроматографічне очищення ("Хроматотрон") з градієнтним елююванням (зміна складу елюенту від суміші етилацетат:метанол 9:1 до метанолу) дало 856мг (83%) продукту. Мас-спектр: М=191. Проміжний продукт 24 2-(4-трет-бутилфеніл)бутиламін Сполуку, вказану в заголовку (540мг) у ви гляді масла одержано за методикою синтезу проміжного продукту 23 із проміжного продукту 20. Мас-спектр: М=205. Проміжний продукт 25 2-(4-трет-бутилфеніл)-2-метилпропіламін Сполуку, вказану в заголовку (428мг, 42%) одержано за методикою синтезу проміжного продукту 23 із проміжного продукту 21 з використанням метанолу як хроматографічного елюенту. Мас-спектр: М=205. Проміжний продукт 26 2-(2-нафтил)пропіламін Сполуку, вказану в заголовку (450мг, 44%) у вигляді масла одержано за методикою синтезу проміжного продукту 23 із проміжного продукту 22 з використанням метанолу як хроматографічного елюенту. Мас-спектр: М=185. Проміжний продукт 27 Метил-1-(4-трет-бутилфеніл)циклопропан карбоксилат 4г (19,4ммоль) метил-4-трет-бутилфенілацетату, 39мл біс(триметил-силіл)аміду літію (1М, 2 еквіваленти) і 3г (2 еквіваленти) 1-бром-2-хлоретану у 100мл сухого тетрагідрофурану вводили в реакцію за методикою, описаною для синтезу проміжного продукту 11, з тим винятком, що суміш перед подальшою обробкою витримували при розмішуванні при температурі приміщення протягом години. Одержано 4,21г коричневого масла. Цей матеріал очищали хроматографуванням через шар силікагелю з градієнтним елююванням (склад елюенту змінювали від чистого гексану до суміші гексан:етилацетат 19:1). Одержано 1,57г (35%) сполуки, названої у заголовку, у вигляді блідожовтої твердої речовини з температурою плавлення 58-60°С. Вирахувано для С15Н20О 2: Теоретичний розрахунок С, 77,37; Н, 8,81. Фактично знайдено С, 77,54; Н, 8,68. Проміжний продукт 28 1-(4-трет-бутилфеніл)циклопропанкарбонова кислота 1г (4,3ммоль) проміжного продукту 27 і 650мг (15,5ммоль) гідроксиду літію додавали до суміші трьох розчинників: тетрагідрофурану (66мл), метанолу (22мл) і води (22мл) і проводили реакцію за методикою синтезу проміжного продукту 15; одержано 840мг твердого продукту. Цей матеріал очищали хроматографуванням через шар силікагелю з використанням суміші гексан:етилацетат (1:1) як елюенту, одержано 600мг (64%) сполуки, названої у заголовку, у вигляді білої твердої речовини з температурою плавлення (з розкладом) вище 150°С. Вирахувано для С14Н18О2: Теоретичний розрахунок С, 77,03; Н, 8,31. Фактично знайдено С, 77,08; Н, 8,02. Проміжний продукт 29 1-(4-трет-бутилфеніл)циклопропанкарбоксамід 580мг (2,7ммоль) проміжного продукту 27, оксалілхлорид (10мл), дихлорметан (10мл) і одну краплю диметилформаміду вводили в реакцію, як описано в методиці синтезу проміжного продукту 19. Одержано 573мг сирового хлорангідриду кислоти. Конверсію в амід було виконано з використанням 28%-ного гідроксиду амонію (10мл) і діоксану (10мл), як описано для проміжного продукту 27; одержано 590мг твердого продукту. Після розтирання з сумішшю гексану з етилацетатом (19:1) і фільтрації одержано 510мг (87%) сполуки, вказаної у заголовку, у вигляді твердої білої речовини з температурою плавлення 178180°С. Вирахувано для C14H19NO: Теоретичний розрахунок С, 77,38; Н, 8,81; N, 6,45. Фактично знайдено С, 77,53; Н, 8,77; N, 6,39. Проміжний продукт 30 1-(4-трет-бутилфеніл)циклопропілметиламін 7мл комплексу бороводню з тетрагідрофураном (1,0М, 7ммоль) і 500мг (2,3ммоль) проміжного продукту 29 у тетрагідрофурані (50мл) вводили в реакцію за методикою синтезу проміжного продукту 23; одержано 510мг продукту реакції у вигляді масла. Очищення здійснювали хроматографуванням на силікагелі з градієнтним елююванням, змінюючи склад елюенту від суміші етилацетату з метанолом (9:1) до чистого метанолу. Одержано 222мг (47%) продукту у вигляді твердої речовини з температурою плавлення 39-41°С. Вирахувано для С14H21N: Теоретичний розрахунок С, 82,70; Н, 10,41; N, 6,89. Фактично знайдено С, 81,36; Н, 10,13; N, 7,24. Проміжний продукт 31 2-(4-бромфеніл)пропіламін гідрохлорид До охолодженого до -15°С розчину 50,0г (251,2ммоль) 4-бромацетофенону і 49,0г (251,2ммоль) тозилметилізоціаніду у 800мл сухого диметоксіетану додавали по краплях гарячий розчин 50,7г (452,2ммоль) трет-бутилату калію в 230мл трет-бутилового спирту; швидкість додавання добирали так, щоб температура суміші весь час була нижче 0°С. Після завершення додавання реакційну суміш перемішували при -5°С ще 45 хвилин. Усували охолоджувальну баню і розмішували реакційну суміш ще протягом 2 годин. Суміш концентрували у вакуумі до об'єму 200мл і розбавляли 500мл води. Водну суміш екстрагували 4 рази діетиловим ефіром, і об'єднані органічні екстракти сушили над сульфатом магнію, фільтрували і концентрували у вакуумі. Залишок розчиняли в 55мл тетрагідрофурану і нагрівали зі зворотним холодильником. До киплячого розчину повільно, по краплях, додавали 27,6мл (276,3ммоль) 10,0М комплексу бороводню з диметилсульфідом. Продовжували нагрівання зі зворотним холодильником ще протягом 20 хвилин після завершення додавання комплексу. Охолоджували суміш до температури приміщення і дуже повільно додавали метанол, насичений хлороводнем, до досягнення рН 2. Суміш концентрували у вакуумі, залишок розчиняли в метанолі і знов концентрували .у вакуумі. Твердий залишок суспендували у 125мл етанолу, фільтрували, промивали етанолом, а потім діетиловим ефіром. Білий твердий продукт сушили у вакуумі. Одержано 25,4г (40%) сполуки, вказаної у заголовку. Фільтрат концентрували у вакуумі й суспендували в діетиловому ефірі. Твердий залишок фільтрували, промивали діетиловим ефіром і сушили в вакуумі; таким чином одержано додатково 15,6г (25%) сполуки, вказаної у заголовку. Проміжний продукт 32 2-(4-метилфеніл)пропіонітрил Сполуку, вказану в заголовку, одержано із 4-метилфенілацетонітрилу за методикою синтезу проміжного продукту 7. Аналіз для C10H11N: Теоретичний розрахунок С, 82,72; Н, 7,64; N, 9,65. Фактично знайдено С, 82,75; Н, 7,42; N, 9,94. Проміжний продукт 33 2-(4-метилфеніл)пропіламін гідрохлорид Сполуку, вказану в заголовку, одержано із проміжного продукту 32 за методикою синтезу проміжного продукту 8. Мас-спектр з польовою десорбцією: М=150 (М-НСІ). Проміжний продукт 34 2-(4-бензилоксифеніл)пропіонітрил 4-гідроксифенілацетонітрил (15,3г, 114,9ммоль) розчиняли в диметилформаміді (120мл) і додавали карбонат калію (23,78г, 172,4ммоль), бензилбромід (20,64г, 120,6ммоль) і йодид калію (3,81г, 30,0ммоль). Суміш розмішували при температурі приміщення протягом 6 годин, після чого додавали воду. Із розчину випадав 4-бензилоксифенілацетонітрил. Суспензію фільтрували і тричі промивали осад водою. Вихід продукту 24,8г (97%) у вигляді жовтих кристалів. Сполуку, вказану в заголовку, одержано із 4-бензилоксифенілацетонітрилу за методикою синтезу проміжного продукту 7. Вихід 76%. Мас-спектр з польовою десорбцією: М=237,2. Аналіз для C16H15NO: Теоретичний розрахунок С, 80,98; Н, 6,37; N, 5,90. Фактично знайдено С, 80,93; Н, 6,46; N,6,11. Проміжний продукт 35 2-(4-бензилоксифеніл)пропіламін гідрохлорид Сполуку, вказану в заголовку, одержано із проміжного продукту 34 за методикою синтезу проміжного продукту 2. Аналіз для С 16Н20ClNO: Теоретичний розрахунок С, 59,55; Н, 8,00; N, 6,94. Фактично знайдено С, 59,33; Н, 7,89; N, 6,71. Проміжний продукт 36 N-трет-бутоксикарбоніл-N-(2-(4-гідроксифеніл)пропіл)2-пропансульфамід Продукт, одержаний за Прикладом 40 (7,6г, 23,8ммоль), розчиняли в дихлорметані (100мл) і додавали до цього розчину ди-трет-бутилкарбонат (5,71г, 26,2ммоль) і 4-диметиламінопіридин (1,45г, 11,9ммоль). Реакційну суміш розмішували при температурі приміщення протягом години. Потім суміш промивали насиченим водним розчином бісульфату натрію та розсолом. Органічний шар сушили над сульфатом магнію і концентрували у вакуумі. Захи щений сульфамід (9,00г, 21,0ммоль) розчиняли в суміші води з етилацетатом (1:5) і додавали форміат амонію (2,0г, 31,5ммоль). Додавали до реакційної суміші паладій на вугіллі (10%) (0,9г) і розмішували при температурі приміщення протягом 6 годин. Суспензію фільтрували через целіт, і очищений розчин концентрували у вакуумі. Одержано 5,51г (78%) сполуки, вказаної у заголовку. Мас-спектр з польовою десорбцією: М=329,1. Аналіз для С 15H23NO5S: Теоретичний розрахунок С, 54,69; Н, 7,04; N, 4,25. Фактично знайдено С, 53,70; Н, 7,72; N, 4,04. Проміжний продукт 37 2-(4-бромфеніл)-1-нітро-1-метилетилен Розчин 30,0г (162ммоль) 4-бромбензальдегіду, 116мл (1,6моль) нітроетану і 37,5г (486ммоль) ацетату амонію в 200мл толуолу нагрівали з насадкою Діна і Старка протягом 18 годин. Потім суміш охолоджували до 80°С, додавали 1мл концентрованої сірчаної кислоти і перемішували про 80°С протягом 2 годин. Потім суміш охолоджували до температури приміщення і промивали 200мл розсолу. Органічний шар відділяли і тричі екстрагували 60мл діетилового ефіру. Об'єднані екстракти сушили над сульфатом магнію, фільтрували та концентрували у вакуумі. Залишок перекристалізували з метанолу. Одержано 18,7г (47%) сполуки, вказаної у заголовку. Проміжний продукт 38 2-(4-бромфеніл)-1-нітро-1-метилетан Суспензію 1,3г (33,9ммоль) літійалюмінійгідриду в 55мл тетрагідрофурану (ТГФ) о холоджували до 0°С. По краплях додавали розчин 4,1г (16,9ммоль) проміжного продукту 37 у 5мл ТГФ. Додавали до суміші 1,3мл води, 1,3мл 1М розчину гідроксиду натрію і 4,0мл води в порядку переліку. Суміш фільтрували через целіт і промивали дихлорметаном. Органічний шар концентрували у вакуумі. Одержано 3,0г (83%) сполуки, вказаної у заголовку. Проміжний продукт 39 N-2-(4-бромфеніл)пропіл-2-пропансульфамід Розчин 15,0г (59,9ммоль) проміжного продукту 31 і 18,4мл (131,8ммоль) триетиламіну в 150мл дихлорметану перемішували протягом 20 хвилин при температурі приміщення, потім охолоджували до 0°С і по краплях додавали протягом 5 хвилин 8,1мл (71,9ммоль) 2-пропілсульфонілхлориду в 10мл дихлорметану. Після перемішування протягом ночі при температурі приміщення реакційну суміш промивали один раз 200мл 10%-ного водного розчину бісульфату натрію, розділяли шари і екстрагували водний шар двома порціями дихлорметану по 100мл кожна. Об'єднані органічні екстракти сушили над сульфатом магнію, фільтрували й концентрували у вакуумі. Залишок очищали хроматографуванням через силікагель (500г, елюент - 30% етилацетату в гексані). Одержано 11,0г (57%) сполуки, вказаної у заголовку. Проміжний продукт 40 N-2-(4-три-n-бутилстанілфеніл)пропіл-2-пропансульфамід До знегаженого розчину 4,8г (15,1ммоль) проміжного продукту 39, 2,1г (15,1ммоль) триетиламіну і 8,0мл (15,9ммоль) гексабутилдіолова в 35мл толуолу додавали 0,9г (0,8ммоль) тетракіс(трифенілфосфін)паладію (0). Суміш нагрівали при 100°С протягом 16 годин, охолоджували до температури приміщення і розбавляли 35мл етилацетату. Промивали суміш 50мл 10%-ного водного розчину бісульфа ту натрію, відділяли органічний шар, а водний шар екстрагували двома порціями етилацетату по 50мл кожна. Об'єднані органічні розчини сушили над сульфатом магнію, фільтрували й концентрували у вакуумі. Залишок очищали хроматографуванням через силікагель (350г, елюент - 20% етилацетату в гексані). Одержано 3,5г (44%) сполуки, вказаної у заголовку, у вигляді прозорого безбарвного масла. Аналітично вирахувано для C24H45NO 2SSn: %С, 54,35; %Н, 8,55; %N, 2,64. Фактично знайдено %С, 54,41; %Н, 8,16; %N, 2,74. Мас-спектр: М=530. Проміжний продукт 41 2-(4-бромфеніл)-N-(трет-бутоксикарбоніл)етиламін До розчину 10,0г (50,0ммоль) 4-бромфенетиламіну і 11,0г (50,0ммоль) ди-трет-бутилдикарбонату в 100мл хлороформу додавали при температурі приміщення 100мл насиченого водного розчину бікарбонату натрію. Суміш розмішували при температурі приміщення протягом 1,5 години і розбавляли 100мл води. Органічний шар відділяли, а водний шар екстрагували двома порціями хлороформу по 100мл кожна. Об'єднані органічні розчини промивали один раз 100мл 10%-ного водного розчину бісульфату натрію, сушили над сульфатом натрію, фільтрували й концентрували у вакуумі. Одержано 14,6г (97%) сполуки, вказаної у заголовку. Мас-спектр: М+1=301. Проміжний продукт 42 4-ціанфенілборна кислота Розчин 10,0г (54,9ммоль) 4-бромбензонітрилу в 100мл тетрагідрофурану о холоджували до -85°С і додавали 36,0мл (57,6ммоль) 1,6Μ розчину n-бутиллітію в гексані. Суміш перемішували протягом 5 хвилин і додавали 19,0мл (82,4ммоль) триізопропілборату. С уміш перемішували при -85°С протягом півгодини, потім підігрівали до температури приміщення протягом години. Додавали до суміші 35мл 5Ν хлористоводневої кислоти і продовжували розмішувати ще протягом 2,5 годин. Розбавляли суміш 100мл насиченого водного розчину хлориду натрію і екстрагували трьома порціями етилового ефіру по 100мл кожна. Об'єднані органічні розчини сушили над сульфатом магнію, фільтрували й концентрували у вакуумі. Залишок перекристалізували з води і фільтрували. Одержано 2,0г (25%) сполуки, вказаної у заголовку. Проміжний продукт 43 N-2-(4-формілфеніл)пропіл-2-пропансульфамід Розчин 4,6г (14,5ммоль) проміжного продукту 39 в 100мл тетрагідрофурану о холоджували до -85°С і додавали за допомогою шприца 19мл (30,5ммоль) 1,6Μ розчину n-бутиллітію. Суміш перемішували при 85°С протягом 30 хвилин, потім додавали (шприцем) 2,2мл (29,0ммоль) Ν,Ν-диметилформамІду і продовжували перемішування ще протягом 30 хвилин. Суміш перемішували 30 хвилин при 0°С, після чого додавали 100мл розсолу і 50мл ефіру. Відділяли органічний шар, а водний шар екстрагували трьома порціями ефіру по 20мл кожна. Об'єднані органічні екстракти сушили над сульфатом магнію, фільтрували й концентрували у вакуумі. Залишок очищали хроматографуванням через силікагель (200 г, елюент — 40% етилацетату в гексані). Одержано 2,2г (56%) сполуки, вказаної у заголовку. Проміжний продукт 44 N-2-(4-(4-(1-гідрокси-2-(N-трет-бутоксикарбоніл)-метилсульфамідо)етил)феніл)феніл)пропіл-2пропансульфамід A. N-(трет-бутоксикарбоніл)метансульфамід. До розчину 15,0г (157,7ммоль) метансульфаміду, 17,6г (173,5ммоль) триетиламіну і 1,9г (15,8ммоль) диметиламінопіридину в 200мл дихлорметану додавали 37,9г (173,5ммоль) ди-трет-бутилдикарбонату в 200мл дихлорметану протягом 10 хвилин. Суміш перемішували при температурі приміщення протягом 2,25 годин і концентрували у вакуумі. Залишок розчиняли в 250мл етилацетату і промивали один раз 200мл 1N хлористоводневої кислоти, один раз 100мл води і один раз 100мл насиченого водного розчину хлориду натрію. Органічний шар сушили над сульфатом магнію, фільтрували й концентрували у вакуумі. Одержано 26,1г (85%) вищевказаної сполуки. Аналітично вирахувано для C7H13NO4S: %C, 36,91; %Н, 6,71; %N, 7,17. Фактично знайдено %С, 36,97; %Н, 6,79; %N, 7,04. Мас-спектр: М+1=196. B. N-(4-бромфеніл)карбонілметил-N-трет-бутоксикарбонілметансульфамід. Розчин 1,0г (5,1ммоль) продукту зі стадії А, 1,4г (5,1ммоль) 2,4'-дибромацетофенону і 0,8г (5,6ммоль) карбонату калію в 25мл ацетонітрилу перемішували при температурі приміщення протягом двох годин. Суміш розбавляли 25мл етилацетату і промивали один раз 15мл води. Відділяли органічний шар, а водний шар екстрагували трьома порціями етилацетату по 10мл кожна. Об'єднані органічні екстракти сушили над сульфатом магнію, фільтрували й концентрували у вакуумі. Залишок очищали хроматографуванням через силікагель (50г, елюент - 20% етилацетату в гексані). Одержано 1,5г (76%) вищевказаної сполуки. Аналітично вирахувано для C14H17NBrO 5S: %C, 42,87; %Н, 4,63; %N, 3,57. Фактично знайдено %С, 43,11; %Н, 4,66; %N, 3,37. Мас-спектр: N-1=391. C. N-[2-(4-бромфеніл)-2-гідроксиетил-N-(трет-бутоксикарбоніл)метансульфамід. До розчину 2,6г (6,7ммоль) продукту зі стадії В в 25мл етанолу додавали 0,3г (6,7ммоль) боргідриду натрію і перемішували при температурі приміщення протягом 16 годин. Суміш концентрували у вакуумі, а залишок перерозподіляли між 25мл етилацетату і 25мл води. Відділяли органічний шар, а водний шар екстрагували трьома порціями етилацетату по 10мл кожна. Об'єднані органічні екстракти сушили над сульфатом магнію, фільтрували й концентрували у вакуумі. Одержано 2,6г (98%) вищевказаної сполуки. Аналітично вирахувано для C14H19NBrO 5S: %С, 42,65; %Н,-5,11; %N, 3,55. Фактично знайдено %С, 42,60; %Н, 5,08; %N, 3,46. Мас-спектр: М=394. D. До знегаженого розчину 0,6г (1,5ммоль) продукту зі стадії С і 0,8г (1,5ммоль) проміжного продукту 40 в 5мл толуолу додавали 0,08г (0,07ммоль) тетракіс(трифенілфосфін)паладію (0). Суміш нагрівали зі зворотним холодильником протягом 16 годин, потім охолоджували до температури приміщення і розбавляли 10мл етилацетату. Суміш промивали один раз 8мл насиченого водного розчину фториду калію, відділяли органічний шар, а водний шар екстрагували чотирма порціями етилацетату по 5мл кожна. Об'єднані органічні екстракти сушили над сульфатом магнію, фільтрували й концентрували у вакуумі. Після хроматографічного очищення (50г силікагелю, елюент - 50% етилацетату в гексані) одержано 0,3г (32%) вищевказаної сполуки. Аналітично вирахувано для С26Н38N2 О7S 20,05 СНСI3: %С, 55,80; %Н, 6,84; %N, 5,00. Фактично знайдено %С, 55,47; %Н, 6,93; %N, 4,72. Мас-спектр: М=554. Проміжний продукт 45 Дибромформальдоксим Розчин 150г (1,6моль) гліоксилової кислоти і 142г (2,0моль) гідрохлориду гідроксиламіну в 1200мл води перемішували при температурі приміщення протягом двох діб. До суміші повільно додавали 342г (4,1моль) бікарбонату натрію і 1000мл дихлорметану. Суміш охолоджували до 0°С і по краплях додавали розчин 147мл (2,8моль) брому в 700мл дихлорметану. Суміш перемішували при температурі, приміщення протягом 18 годин. Відділяли органічний шар, а водний шар екстрагували трьома порціями дихлорметану по 300мл кожна. Об'єднані органічні екстракти сушили над суль фатом магнію, фільтрували й концентрували у вакуумі. Одержано 93,1г (28%) сполуки, вказаної в заголовку. Проміжний продукт 46 2-триметилстанілтіазол А. До охолодженого до -78°С розчину 5,0г (58,7ммоль) тіазолу в 120мл тетрагідрофурану додавали 36,7мл (58,7ммоль) 1,6М розчину n-бутиллітію в гексані. Суміш перемішували протягом 20 хвилин, після чого по краплях додавали протягом 15 хвилин 11,7г (58,7ммоль) в 15мл тетрагідрофурану. Усували охолоджувальну баню і перемішували суміш протягом двох годин. Розбавляли суміш 100мл води і екстрагували трьома порціями етилового ефіру по 100мл кожна. Об'єднані органічні екстракти сушили над сульфатом магнію, фільтрували й концентрували у вакуумі. Залишок розчиняли в 50мл етилового ефіру, фільтрували через силікагель і концентрували у вакуумі. Одержано 3,6г (24%) сполуки, вказаної в заголовку. Проміжний продукт 47 N-2-(4-бромфеніл)етил-2-пропансульфамід До розчину 10,0г (50ммоль) 4-бромфенетиламіну і 7,6г (55ммоль) триетиламіну в 150мл дихлорметану додавали по краплях розчин 6,2мл (55ммоль) ізопропілсульфонілхлориду в 40мл дихлорметану. Суміш розмішували при температурі приміщення протягом 18 годин. Реакційну суміш промивали 100мл 1N водного розчину хлористоводневої кислоти, відділяли органічний шар, а водний шар екстрагували один раз 100мл дихлорметану. Об'єднані органічні розчини сушили над сульфатом магнію, фільтрували й концентрували у вакуумі. Одержано 6,7г (44%) сполуки, вказаної в заголовку. Проміжний продукт 48 N-2-(4-(три-n-бутилстаніл)феніл)етил-2-пропансульфамід До розчину 5,0г (16,3ммоль) проміжного продукту 47, 9,9г (17ммоль) біс-три-n-бутилстанату і 2,3г (16,3ммоль) триетиламіну в 55мл толуолу додавали 0,9г (0,8ммоль) тетракіс(трифенілфосфін)паладію (0). Суміш нагрівали при 100°С протягом 18 годин, потім охолоджували до температури приміщення і додавали 55мл 10%-ного водного розчину бісульфату натрію. Відділяли органічний шар, а водний шар екстрагували двічі порціями ефіру по 100мл кожна. Об'єднані органічні розчини сушили над сульфа том магнію, фільтрували й концентрували у вакуумі. Після хроматографічного очищення (400г силікагелю, елюент - 25% етилацетату в гексані) одержано 3,5г (42%) сполуки, вказаної в заголовку. Проміжний продукт 49 4-(4-бромфеніл)-1,1-діоксотетрагідро-1,2-тіазин A. Етил-4-бромфенілацетат. Розчин 25,0г (116,3ммоль) 4-бромфеніл-оцтової кислоти, 24,1г (174,4ммоль) карбонату калію і 10,2г (127,9ммоль) йодетану в 250мл ацетонітрилу нагрівали при 70°С протягом 16 годин. Охолоджували суміш до температури приміщення, розбавляли 200мл етилацетату і промивали один раз 200мл насиченого водного розчину бікарбонату натрію. Відділяли органічний шар, а водний шар екстрагували двічі порціями етилацетату по 100мл кожна. Об'єднані органічні розчини сушили над сульфатом магнію, фільтрували й концентрували у вакуумі. Одержано 16,2г (57%) вищевказаної сполуки. B. Феніл-3-карбетокси-3-(4-бромфеніл)пропілсульфонат. Розчин 16,2г (66,6ммоль) продукту зі стадії А, 4,6г (33,3ммоль) карбонату калію і 4,4г (16,7ммоль) 18-краун-6 в 130мл толуолу нагрівали до 90°С і додавали по краплях 6,1г (33,3ммоль) фенілвінілсульфонату в 35мл толуолу протягом години. Суміш нагрівали протягом 16 годин, охолоджували до температури приміщення, розбавляли 100мл етилацетату і промивали один раз 100мл напівнасиченого розсолу. Відділяли органічний шар, а водний шар екстрагували один раз 100мл етилацетату. Об'єднані органічні розчини сушили над сульфатом магнію, фільтрували й концентрували у вакуумі. Після хроматографічного очищення (Waters 2000, елюент - 15% етилацетату в гексані) одержано 4,8г (77%) вищевказаної сполуки. Аналітично вирахувано для C18H19 O5SBr: %C, 50,59; %Н, 4,48. Фактично знайдено %С, 50,61; %Н, 4,47. Мас-спектр: М+1=428. C. Феніл-3-карбокси-3-(4-бромфеніл)пропілсульфонат. До розчину 4,8г (11,3ммоль) продукту зі стадії В в 40мл метанолу додавали 6,8мл 2Ν водного розчину гідроксиду натрію. Суміш перемішували при температурі приміщення протягом 5 годин і концентрували у вакуумі. Залишок розчиняли в 50мл води і екстрагували тричі порціями етилового ефіру по 20мл кожна. Водний шар підкислювали до рН 2 10%-ним водним розчином бісульфату натрію і екстрагували чотири рази порціями етилацетату по 20мл кожна. Об'єднані етилацетатні екстракти сушили над сульфатом магнію, фільтрували й концентрували у вакуумі. Одержано 4,1г (91%) вищевказаної сполуки. Аналітично вирахувано для C16H15 O5SBr: %C, 48,13; %Н, 3,79. Фактично знайдено %С, 48,17; %Н, 3,53. Мас-спектр: М=399. D. Феніл-3-карбоксамідо-3-(4-бромфеніл)пропілсульфонат. До розчину 4,1г (10,2ммоль) продукту зі стадії С і 2,0мл (14,3ммоль) триетиламіну в 23мл тетрагідрофурану додавали при температурі 0°С 1,9мл (14,3ммоль) ізобутилхлор форміату. Суміш розмішували при 0°С протягом 25 хвилин, після чого додавали 11,2мл (22,4ммоль) розчину аміаку в метанолі. Усували охолодокувальну баню і розмішували реакційну масу протягом 16 годин. Розбавляли суміш 50мл етилацетату і промивали один раз 50мл води. Відділяли органічний шар, а водний шар екстрагували тричі порціями етилацетату по 100мл кожна. Об'єднані органічні розчини сушили над сульфатом магнію, фільтрували й концентрували у вакуумі. Після хроматографічного очищення (250г силікагелю, елюент - 35% ацетону в гексані) одержано 1,7г (44%) вищевказаної сполуки. Мас-спектр: М=398. Ε. 4-(4-бромфеніл)-1,1,3-триоксотетрагідро-1,2-тіазин. До охолодженого до 0°С розчину 9,0мл (9,0ммоль) трет-бутилату калію (1,0М в тетрагідрофурані) по краплях додавали протягом 30 хвилин розчин 1,7г (4,5ммоль) продукту зі стадії D в 14мл тетрагідрофурану. Після розмішування протягом двох годин при 0°С усували охолоджувальну баню і продовжували розмішування ще 30 хвилин. Розбавляли суміш 50мл етилацетату і екстрагували двічі порціями етилового ефіру по 10мл кожна. Водний шар підкислювали до рН 2 10%-ним водним розчином бісульфату натрію і екстрагували чотири рази порціями етилацетату по 20мл кожна. Об'єднані етилацетатні екстракти сушили над сульфа том магнію, фільтрували й концентрували у вакуумі. Після хроматографічного очищення (75г силікагелю, елюент - 0,25% оцтової кислоти/40% ацетону в гексані) одержано 0,2г (17%) вищевказаної сполуки. Аналітично вирахувано для, C10H10NO3SBr: %C, 39,49; %Н, 3,31; %N, 4,61. Фактично знайдено %С, 39,74; %Н, 3,23; %N, 4,42. Мас-спектр: М=304. F. До суспензії 0,13г (0,4ммоль) продукту зі стадії Ε і 0,2г (4,9ммоль) боргідриду натрію в 3мл діоксану повільно додавали за допомогою шприца 0,4мл (4,9ммоль) трифтороцтової кислоти. Після перемішування протягом 30 хвилин при температурі приміщення суміш нагрівали зі зворотним холодильником протягом 5 годин, потім охолоджували до температури приміщення, додавали 3мл метанолу і розмішували протягом 16 годин. Видаляли суміш і продовжували перемішування ще 30 хвилин. Суміш концентрували у вакуумі, розчиняли в 10мл етилацетату і двічі промивали порціями 1N хлористоводневої кислоти по 5мл кожна, а потім один раз 5мл насиченого розчину бікарбонату натрію в розсолі. Органічні розчини сушили над сульфатом магнію, фільтрували й концентрували у вакуумі. Одержано 0,2г (17%) сполуки, вказаної в заголовку. Аналітично вирахувано для C10H12NO 3SBr: %C, 41,39; %Н, 4,17; %N, 4,83. Фактично знайдено %С, 41,10; %Н, 4,34, %N, 4,76. Мас-спектр: М-1=289. Проміжний продукт 50 D,L-пеніциламін метиловий ефір, гідрохлорид Через суспензію 10,0г (67,0ммоль) D,L-пеніциламіну в 200мл метанолу барботували хлористий водень протягом 5 хвилин. Суміш нагрівали зі зворотним холодильником протягом 16 годин, охолоджували до температури приміщення і концентрували у вакуумі. Залишок суспендували в етиловому е фірі, фільтрували й сушили. Одержано 12,6г (94%) сполуки, вказаної в заголовку. Мас-спектр: М=163. Проміжний продукт 51 N-(трет-бутоксикарбоніл)-4-трибутилстаніланілін А. N-(трет-бутоксикарбоніл)-4-броманілін. До розчину 6,0г (39,4ммоль) 4-броманіліну в 30мл тетрагідрофурану додавали 69,8мл (69,8ммоль) 1,0М розчину біс(триметилсиліл)аміду натрію в тетрагідрофурані. До цієї суміші додавали 7,6г (34,9ммоль) ди-трет-бутилдикарбонату в 10мл тетрагідрофурану. Перемішували масу при температурі приміщення протягом години і концентрували у вакуумі. Залишок розчиняли в 50мл етилацетату і промивали один раз 50мл 10%-ного водного розчину бісульфату натрію. Відділяли органічний шар, а водний шар екстрагували двічі порціями етилацетату по 25мл кожна. Об'єднані органічні розчини сушили над сульфатом магнію, фільтрували й концентрували у вакуумі. Після хроматографічного очищення (250г силікагелю, елюент - 10% етилацетату в гексані) одержано 5,0г (53%) вищевказаної сполуки. Аналітично вирахувано для C11H14NО 2Br: %C, 48,55; %Н, 5,19; %N, 5,15. Фактично знайдено %С, 48,81; %Н, 5,29, %N, 4,95. Мас-спектр: М-1=271. В. Знегажений розчин 4,9г (18,0ммоль) продукту зі стадії А, 2,6мл (18,9ммоль) триетиламіну, 9,6мл (18,9ммоль) біс(трибутилолова) і 1,0г (0,ммоль) тетракіс(трифенілфосфін)паладію (0) в 45мл толуолу нагрівали при 100°С протягом 5 годин. Реакційну масу охолоджували до температури приміщення і розбавляли 40мл етилацетату. Промивали суміш один раз 50мл 10%-иого водного розчину бісульфату натрію, відділяли органічний шар, а водні й шар екстрагували тричі порціями етилацетату по 20мл кожна. Об'єднані органічні розчини сушили над сульфатом магнію, фільтрували й концентрували у вакуумі. Після хроматографічного очищення (400г силікагелю, елюент - 5% етилацетату в гексані) одержано 1,4г (16%) сполуки, вказаної в заголовку. Мас-спектр: М+1=483. Проміжний продукт 52 N-2-(три-n-бутилстанілфеніл)пропілметансульфамід Сполуку, вказану в заголовку (3,6г), одержано за методикою синтезу проміжного продукту 40 із продукту, одержаного за методикою Прикладу 1. Проміжний продукт 53 N-2-(4-(3-тієнил)феніл)пропіламін А. 2-(3-тієніл)феніл-N-(трет-бутоксикарбоніл)пропіламін. До розчину 0,7г (2,2ммоль) проміжного продукту 4, 0,3г (2,4ммоль) тіофен-3-борної кислоти і 0,46г (3,3ммоль) карбонату натрію в 5мл діоксану і 1мл води додавали 0,025г (0,11ммоль) паладій(ІІ)ацетату і 0,058г (0,22ммоль) трифенілфосфіну. Масу нагрівали при 100°С протягом 18 годин, потім охолоджували до температури приміщення і додавали 5мл розсолу. Органічний шар відділяли, сушили над сульфатом магнію, фільтрували й концентрували у вакуумі. Після хроматографічного очищення (25г силікагелю, елюент - 25% етилацетату в гексані) одержано 0,44г (60%) вищевказаної сполуки. В. Розчин 0,4г (1,3ммоль) продукту стадії А в 4мл дихлорметану і 1мл трифтороцтової кислоти перемішували при температурі приміщення протягом 3 годин. Суміш концентрували у вакуумі і розчиняли залишок у 5мл етилацетату і 5мл насиченого розчину бікарбонату натрію. Відділяли органічний шар, а водний шар екстрагували тричі порціями етилацетату по 5мл кожна. Об'єднані органічні розчини сушили над сульфатом магнію, фільтрували й концентрували у вакуумі. Одержано 0,21г (74%) сполуки, вказаної в заголовку. Проміжний продукт 54А 4-(N,N-дибензиламіно)фенілацетонітрил Розчин 4-амінофенлацетонітрилу (20г, 151,3ммоль) в сухому диметилформаміді (150мл) обробляли карбонатом калію (50,1г, 363,1ммоль), бензилбромідом (54,4г, 318ммоль) і йодидом калію (5г, 0,2 30,3ммоль). Реакційну масу перемішували при температурі приміщення протягом 12 годин. Додавали до суміші воду (100мл) і екстрагували органічний шар ефіром (3 порції по 200мл). Об'єднані органічні розчини промивали розсолом (200мл), сушили над сульфатом магнію, фільтрували й концентрували. Сировий продукт очищали флеш-хроматографічним методом (хроматографією з прискореним елююванням під тиском газу) (SiO2, елюент - 20% етилацетату в гексані). Одержано 36,2г (76%) чистого продукту. ЯМР спектр підтвердив структуру сполуки, названої в заголовку. Мас-спектр: М+=312. Проміжний продукт 54В 1-хлорпроп-2-ілсульфонілхлорид До охолодженого до 0°С насиченого розчину хлору в 100мл води додавали по краплях 15,7мл (200ммоль) пропіленсульфіду при одночасному барботуванні хлору через реакційну суміш. Перемішували масу після завершення додавання протягом години при 0°С. Масло, що утворилося, відділяли, а водний шар екстрагували двічі порціями дихлорметану по 20мл кожна. Об'єднані органічні розчини сушили над хлоридом кальцію, фільтрували й концентрували у вакуумі. Після вакуумної дистиляції одержано 10,8г (30%) сполуки, вказаної в заголовку. Мас-спектр з польовою десорбцією: М-1=176. Проміжний продукт 55 2-(4-(N,N-дибензиламіно)феніл)пропіонітрил Розчин проміжного продукту 54А (22,8г, 73ммоль) в сухому тетрагідрофурані (70мл) обробляли біс(триметилсиліл)амідом літію (1М у тетрагідрофурані, 76,6мл, 76,6ммоль) при температурі -78°С. Реакційну суміш перемішували при цій температурі протягом години, а потім дозволяли поступово нагріватися до температури приміщення протягом 12 годин. Додавали хлористоводневу кислоту (0,2 М, 100мл) і екстрагували органічний шар ефіром (3 порції по 200мл). Об'єднані органічні розчини промивали водою (3 порції по 200мл), розсолом (200мл), сушили над сульфатом натрію, фільтрували й концентрували. Сировий продукт очищали флеш-хроматографічним методом (SіO2, елюент - 20% етилацетату в гексані). Одержано 22,6г (95%) чистого продукту. Я МР спектр підтвердив структур у сполуки, названої в заголовку. Мас-спектр з польовою десорбцією: М+=326. Проміжний продукт 56 2-(4-(Ν,N-дибензиламіно)феніл)пропіламін гідрохлорид Розчин проміжного продукту 55 (23,6г, 72,3ммоль) в сухому тетрагідрофурані (100мл) обробляли метил сульфідним комплексом бороводню (10Μ у тетрагідрофурані, 8мл, 80ммоль) при температурі 0°С. Реакційну суміш перемішували при нагріванні зі зворотним холодильником протягом 3 годин, охолоджували до температури приміщення і обробляли насиченим розчином хлороводню в метанолі до утворення білого осаду. Розчинник видаляли під вакуумом і розтирали твердий білий залишок з ефіром (4 порції по 100мл). Цільовий продукт - гідрохлорид аміну - сушили у вакуумі; одержано 28,2г (97%) чистого продукту, який був використаний у наступному синтезі без додаткового очищення. ЯМР спектр підтвердив структур у сполуки, названої в заголовку. Проміжний продукт 57 N-2-(4-(N',N'-дибензиламіно)феніл)пропіл-2-пропансульфамід Суспензію проміжного продукту 56 (15,2г, 37,7ммоль) у дихлорметані (125мл) обробляли при 0°С триетиламіном (11,4г, 113ммоль), а потім 2-проділсульфонілхлоридом (9,2г, 56,5ммоль). Реакційну масу перемішували при 0°С протягом години, а потім при температурі приміщення протягом 6 годин. Реакцію припиняли додаванням води (100мл) і екстрагували органічний шар дихлорметаном (3 порції по 200мл). Об'єднані органічні розчини промивали хлористоводневою кислотою (0,2М, 100мл), водою (3 порції по 200мл), розсолом (100мл), сушили над сульфатом натрію, фільтрували й концентрували у вакуумі. Сировий продукт очищали флеш-хроматографічним методом (SіO2, елюент - 30% етилацетату в гексані). Одержано 10,32г (63%) чистого продукту. Я МР спектр підтвердив структуру сполуки, названої в заголовку. Мас-спектр з польовою десорбцією: М+=436. Проміжний продукт 58 N-2-(4-амінофеніл)пропіл-2-пропансульфамід Розчин проміжного продукту 57 (2,5г, 5,72ммоль) в етанолі (30мл) обробляли форміатом амонію (0,4г, 6,3ммоль) і паладієм на вугіллі (0,25г, 10моль-%). Реакційну масу перемішували при температурі приміщення протягом 6 годин. Суміш фільтрували через шар целіту, і фільтрат концентрували у вакуумі. Одержано 1,36г (93%) чистого продукту. Я МР спектр підтвердив структур у сполуки, названої в заголовку. Мас-спектр з польовою десорбцією: М+=257. Проміжний продукт 59 N-трет-бутилоксикарбоніл-2-(4-(N',N'-дибензиламіно)феніл)пропіл-2-пропансульфамід Розчин проміжного продукту 57 (2,5г, 5,72ммоль) в сухому ди хлорметані (25мл) обробляли ди-третбутилдикарбонатом (1,47г, 6,3ммоль) і 4-диметиламінопіридином (0,37г, 2,8ммоль). Реакційну масу перемішували при температурі приміщення протягом 1 години. Реакцію припиняли додаванням води (20мл) і екстрагували органічний шар ефіром (3 порції по 30мл). Об'єднані органічні розчини промивали 20%-ним розчином бісульфату натрію (2 порції по 30мл), водою (3 порції по 100мл), розсолом (30мл), сушили над сульфатом натрію, фільтрували й концентрували у вакуумі. Сировий продукт очищали флешхроматографічним методом (SiO2, елюент - 30% етилацетату в гексані). Одержано 3,07г (100%) чистого продукту. Я МР спектр підтвердив структур у сполуки, названої в заголовку. Мас-спектр з польовою десорбцією: М+=ХХХ. Проміжний продукт 60 N-трет-бутилоксикарбоніл-N-2-(4-амінофеніл)пропіл-2-пропансульфамід Розчин проміжного продукту 59 (3,07г, 5,72ммоль) в етанолі (30мл) обробляли форміатом амонію (0,54г, 8,6ммоль) і паладієм на вугіллі (0,3г, 10моль-%). Реакційну масу перемішували при температурі приміщення протягом 6 годин. Суміш фільтрували через шар целіту, і фільтрат концентрували у вакуумі. Одержано 1,9г (93%) чистого продукту. ЯМР спектр підтвердив структур у сполуки, названої в заголовку. Мас-спектр з польовою десорбцією: М+=257. Проміжний продукт 61 2-(4-нітрофеніл)пропіонітрил До охолодженого до -15°С розчину 4-нітроацетофенону (16,5г, 100ммоль) і тозилметилізоціаніду (29,3г, 150ммоль) в метоксиетиловому ефірі (400мл) повільно додавали розчин трет-бутилату калію (28г, 250ммоль) в трет-бутанолі (200мл), який мав температуру приміщення. Реакційну суміш перемішували при -15°С протягом години і потім дозволяли нагріватися до температури приміщення протягом ночі. Додавали до суміші воду (100мл) і екстрагували органічний шар ефіром (3 порції по 200мл). Об'єднані органічні розчини промивали водою (3 порції по 100мл), розсолом (100мл), сушили над сульфатом натрію, фільтрували й концентрували у вакуумі. Сировий продукт очищали флеш-хроматографічним методом (SіO2, елюент - 30% етилацетату в гексані). Одержано 13,6г (77%) чистого продукту. Я МР спектр підтвердив структур у сполуки, названої в заголовку. Мас-спектр з польовою десорбцією: М+=225. Проміжний продукт 62 2-(4-нітрофеніл)пропіламін Розчин проміжного продукту 61 (11,8г, 67ммоль) в сухому тетрагідрофурані (ТГФ) (200мл) обробляли при температурі 0°С бороводневим комплексом з тетрагідрофураном (1M в ТГФ, 72мл, 72ммоль). Реакційну суміш перемішували при температурі приміщення протягом 16 годин. Додавали до реакційної маси порціями розчин ТГФ:метанол (1:1, 10мл) і гідроксиду натрію (5-н., 40мл) і нагрівали суміш зі зворотним холодильником протягом 5 годин. Охолоджували масу до температури приміщення і екстрагували органічний шар дихлорметаном (3 порції по 100мл). Об'єднані органічні розчини промивали водою (3 порції по 200мл), розсолом (100мл), сушили над карбонатом калію, фільтрували й концентрували у вакуумі. Сировий продукт очищали фле ш-хроматографічним методом (SiO2, елюент - 5% метанолу в ди хлорметані). Одержано 8,5г (71%) чистого продукту. ЯМР спектр підтвердив структур у сполуки, названої в заголовку. Мас-спектр з польовою десорбцією: М+=181. Проміжний продукт 63 N-2-(4-нітрофенш)пропіл-2-пропансульфамід Суспензію проміжного продукту 62 (8,2г, 45,3ммоль) в дихлорметані (200мл) обробляли при 0°С 1,8діазабіцикло[5.4.0]ундеценом (7,6г, 49,8ммоль), а потім 2-пропілсульфонілхлоридом (12г, 49,8ммоль). Реакційну суміш перемішували при 0°С протягом години, а потім при температурі приміщення ще 12 годин. Припиняли реакцію додаванням води (100мл). Екстрагували органічний шар дихлорметаном (3 порції по 100мл). Об'єднані органічні розчини промивали водою (3 порції по 200мл), розсолом (100мл), сушили над карбонатом калію, фільтрували й концентрували у вакуумі. Сировий продукт очищали флешхроматографічним методом (SіO2, елюент - 30% етилацетату в гексані). Одержано 8,9г (68%) чистого продукту. Я МР спектр підтвердив структур у сполуки, названої в заголовку. Мас-спектр з польовою десорбцією: М+=287. Проміжний продукт 64 N-2-(4-амінофеніл)пропіл-2-пропансульфамід Знегажений розчин проміжного продукту 63 (8,75г, 31ммоль) в етилацетаті (200мл) обробляли паладієм на вугіллі (4г, 50моль-%). Суміш перемішували стр ушуванням протягом 2 годин під тиском газоподібного водню 60 фунтів на кв. дюйм (4,2кг/см 2). Фільтрували реакційну масу через шар целіту і концентрували фільтрат у вакуумі. Одержано 7,44г (94%) чистого продукту. Я МР спектр підтвердив структур у сполуки, названої в заголовку. Мас-спектр з польовою десорбцією: М+=257. Проміжний продукт 65 N-2-(4-(бензиламіно)феніл)пропіл-2-пропансульфамід Знегажений розчин броміду (проміжного продукту 39) (3г, 9,7ммоль) у безводному толуолі (40мл) обробляли в апараті для проведення реакцій під тиском бензиламіном (1,27мл, 11,6ммоль), трис(дибензиліденацетон)дипаладієм (0) (170мг, 0,19ммоль), S(-)BINAP (360мг, 0,58ммоль) і трет-бутилатом натрію (1,95мг, 20,3ммоль). Реакційну суміш розмішували при 80°С протягом 16 годин. Потім суміш охолоджували до температури приміщення. Додавали воду (5мл). Екстрагували органічний шар ефіром (3 порції по 5мл). Об'єднані органічні розчини промивали водою (2 порції по 5мл), розсолом (5мл), сушили над сульфатом натрію, фільтрували й концентрували у вакуумі. Сировий продукт очищали флеш-хроматографічним методом (SiO2, елюент - 20% етилацетату в гексані). Одержано 1,9г (58%) речовини у вигляді жовтого масла. ЯМР спектр підтвердив структур у сполуки, названої в заголовку. Проміжний продукт 66 2-(4-(амінофеніл)пропіл-2-пропансульфамід Розчин проміжного продукту 65 (1,5г, 4,33ммоль) в етилацетаті (30мл) обробляли форміатом амонію (0,41г, 6,5ммоль) і паладієм на вугіллі (0,15г, 10моль-%). Реакційну масу перемішували при температурі приміщення протягом 3 годин. Суміш фільтрували через шар целіту, і фільтрат концентрували у вакуумі. Одержано 1,1г (98%) речовини, названої в заголовку. Стр уктуру сполуки підтверджено ЯМР спектром. Мас-спектр з польовою десорбцією: М+=257. Проміжний продукт 67 N-2-(4-(карбокси)феніл)пропіл-2-пропансульфамід Розчин проміжного продукту 39 (220мг, 0,65ммоль) в сухому тетрагідрофурані (2мл) обробляли при температурі -85°С розчином n-бутиллітію (0,87мл, 1,37ммоль, 1,6Μ розчин). Реакційну масу перемішували протягом 10 хвилин при -85°С, після чого продували діоксидом вуглецю протягом однієї хвилини. Залишали масу для нагрівання до температури приміщення. Додавали воду (5мл) і концентровану хлористоводневу кислоту (3мл) і екстрагували органічний шар ефіром (3 порції по 10мл). Об'єднані органічні розчини промивали водою (2 порції по 10мл), розсолом (5мл), сушили над сульфатом натрію, фільтрували й концентрували у вакуумі. Одержано 210мг (98%) чистого продукту, який був використаний у наступному синтезі без додаткового очищення. Проміжний продукт 68 N-трет-бутилоксикарбоніл-4-піперазиноацетофенон Розчин 4-піперазиноацетофенону (10г, 49ммоль) у суміші тетрагідрофурану з водою (1:1, 200мл) обробляли карбонатом калію (8,43г, 58ммоль) і ди-трет-бутилдикарбонатом (13,1г, 53,9ммоль). Реакційну масу перемішували при температурі приміщення протягом 3 годин. Додавали воду (300мл) і екстрагували органічний шар етилацетатом (3 порції по 100мл). Об'єднані органічні розчини промивали водою (2 порції по 200мл), розсолом (100мл), сушили над суль фатом натрію, фільтрували й концентрували у вакуумі. Одержано 17,41г продукту у вигляді жовтуватої твердої речовини. Сировий продукт очищали хроматографічним методом (Prep LC 2000, елюент - 30% етилацетату в гексані). Одержано 10,9г (73%) продукту, вказаного в заголовку, у вигляді білої твердої речовини. Мас-спектр з польовою десорбцією: М+=305. Проміжний продукт 69 2-(N-трет-бутилоксикарбоніл-4-піперазинофеніл)пропіонітрил Сполуку, вказану в заголовку, в кількості 1,8г (16%) одержано у вигляді твердої речовини за методикою синтезу проміжного продукту 61 із проміжного продукту 68 з застосуванням тозилметилізоціаніду. Стр уктур у продукту підтверджено ЯМР спектром. Мас-спектр з польовою десорбцією: М+=316. Проміжний продукт 70 2-(N-трет-бутилоксикарбоніл-4-піперазинофеніл)пропіламін Сполуку, вказану в заголовку, в кількості 1,78г (100%) одержано у вигляді твердої речовини за методикою синтезу проміжного продукту 62 із проміжного продукту 69 з застосуванням бороводневометилсульфідного комплексу. Стр уктуру продукту підтверджено ЯМР спектром. Мас-спектр з польовою десорбцією: М+=319. Проміжний продукт 71 N-2-(N-трет-бутоксикарбоніл-4-піперазинофеніл)пропіл 2-пропансульфамід Сполуку, вказану в заголовку, в кількості 676мг (61%) одержано у вигляді твердої речовини за методикою синтезу проміжного продукту 63 із проміжного продукту 70 з застосуванням бороводневометилсульфідного комплексу. Стр уктуру продукту підтверджено ЯМР спектром. Мас-спектр з польовою десорбцією: М+=319. Проміжний продукт 72 N-2-(-4-піперазинофеніл)пропіл 2-пропансульфамід Розчин проміжного продукту 71 (800мг, 1,88ммоль) в дихлорметані (10мл) обробляли трифтороцтовою кислотою (5мл). Реакційну масу перемішували при температурі приміщення протягом 3 годин. Додавали до суміші 1N розчин гідроксиду натрію (10мл) і екстрагували органічний шар дихлорметаном (3 порції по 20мл). Об'єднані органічні розчини промивали водою (2 порції по 20мл), розсолом (20мл), сушили над карбонатом калію, фільтрували й концентрували у вакуумі. Одержано 560мг (91%) чистого продукту. Стр уктура продукту підтверджена ЯМР спектром. Мас-спектр з польовою десорбцією: М+=319. Проміжний продукт 73 N-2-(-N-бензоїл-4-піперазинофеніл)пропіл 2-пропансульфамід Розчин проміжного продукту 72 (80мг, 0,25ммоль) в дихлорметані (10мл) обробляли при 0°С триетиламіном (28мг, 0,27ммоль) і бензойним ангідридом (61мг, 0,27ммоль). Реакційну масу перемішували при 0°С протягом 30 хвилин. Додавали до суміші воду (5мл) і екстрагували органічний шар дихлорметаном (3 порції по 5мл). Об'єднані органічні розчини промивали водою (2 порції по 5мл), розсолом (5мл), сушили над карбонатом калію, фільтрували й концентрували у вакуумі. Одержано 94мг (87%) сполуки, вказаної в заголовку. Структура продукту підтверджена ЯМР спектром. Мас-спектр з польовою десорбцією: М+=430,2. Проміжний продукт 74 3-трибутилолово-2-циклопентен-1-он Розчин гексабутилдіолова (4,6г, 7,9ммоль) в сухому тетрагідрофурані (15мл) обробляли при температурі -20°С n-бутиллітієм (4,9мл, 7,9ммоль, 1,6Μ розчин в гексані). Реакційну масу перемішували при -20°С протягом 30 хвилин, а потім охолоджували до -78°С. Обробляли суміш 3-етокси-2-циклопентен-1оном (1,0г, 7,9ммоль) і розмішували реакційну масу при -78°С протягом 30 хвилин. Додавали насичений водний розчин хлористого амонію (2мл), потім воду (30мл) і екстрагували органічний шар гексаном (2 порції по 30мл). Об'єднані органічні розчини промивали розсолом (20мл), сушили над сульфатом магнію, фільтрували й концентрували у вакуумі. Одержано 2,7г (93%) сирового продукту, який був використаний без додаткового очищення. Структур у продукту підтверджено ЯМР спектром. Проміжний продукт 75 N-2-(4-(1-(3-оксо)циклопентеніл)феніл)пропіл 2-пропансульфамід Розчин проміжного продукту 39 (1,0г, 3,22ммоль) в сухому знегаженому тетрагідрофурані (15мл) обробляли проміжним продуктом 74 (1,8г, 4,83ммоль) і дихлорбіс(трифенілфосфін)паладієм (II) (45мг, 0,06ммоль). Реакційну суміш нагрівали зі зворотним холодильником протягом 48 годин. Потім суміш охолоджували і перерозподіляли між ацетонітрилом і гексаном. Ацетонітрильний шар промивали гексаном (3 порції по 20мл) і концентрували у вакуумі. Сировий продукт очищали флеш-хроматографічним методом (SіO2, елюент - 70% етилацетату в гексані). Одержано 0,71г (68%) чистого продукту, вказаного в заголовку. Структуру продукту підтверджено ЯМР спектром. Мас-спектр з польовою десорбцією: М+=321,1. Проміжний продукт 76 1-(4-бромфеніл)-2,5-диметилпірол 4-броманілін (56,0г, 0,33моль)2,5-гександіон (37,6г, 0,33моль) і оцтову кислоту (5мл) розчиняли в толуолі (500мл) і нагрівали зі зворотним холодильником протягом 8 годин, використовуючи насадку ДінаСтарка для видалення води з реакційної маси. Охолоджували масу до температури приміщення і концентрували під зниженим тиском. Одержане масло розчиняли в етилацетаті, промивали послідовно по одному разу 2N хлористоводневою кислотою, 2N гідроксидом натрію і водою і концентрували під зниженим тиском; одержано коричневу тверду речовину. Матеріал очищали флеш-хроматографуванням на силікагелі з використанням гексану як елюенту. Після концентрування відповідних фракцій одержано 55,0г злегка жовтуватої твердої речовини (68%). Структуру продукту підтверджено ЯМР спектром. Температура плавлення 71-73°С. Мас-спектр з польовою десорбцією: М+=249. Проміжний продукт 77 1-(4-ацетилфеніл)-2,5-диметилпірол Розчин проміжного продукту 76 (25,0г, 0,1моль) в сухому е фірі (500мл) обробляли при температурі 30°С n-бутиллітієм (70мл 1,6Μ розчину, 0,12моль) і розмішували протягом години при -30°С. Додавали Ν,Νдиметилацетамід (9,7г, 0,12моль) і продовжували реакцію при тій же температурі ще 4 години. Потім давали суміші нагрітися до температури приміщення і перемішували при цій температурі протягом ночі. Після цього розбавляли етилацетатом, об'єднані органічні розчини промивали послідовно по одному разу 2N хлористоводневою кислотою і водою, сушили над сульфа том магнію, фільтрували і концентрували під зниженим тиском; одержано білу тверду речовину. Цей матеріал розтирали в гексані і фільтрували. Одержано 12,8г білого твердого продукту (60%), температура плавлення 106-108°С. Структур у продукту підтверджено ЯМР спектром. Мас-спектр з польовою десорбцією: М+=214. Проміжний продукт 78 1-(4-(1-ціано)етилфеніл)-2,5-диметилпірол Проводили реакцію кетону - проміжного продукту 77 (44,3г, 0,21моль), тозилчетилізоціаніду (40,6г, 0,21.моль), трет-бутилату калію (39,2г, 0,35моль) і трет-бутилового спирту (250мл) у диметиловому ефірі етиленгліколю (500мл) згідно з методикою синтезу проміжного продукту 61. Одержано твердий продукт жовтого кольору. Очищення флеш-хроматографуванням на силікагелі з елююванням сумішшю гексану з етилацетатом (4:1) дало 32,3г (68%) жовтої кристалічної речовини з температурою плавлення 79-80°С. Мас-спектр з польовою десорбцією: М+=225. Проміжний продукт 79 1-(4-2-(2-ціано)пропіл)феніл)-2,5-диметилпірол Розчин проміжного продукту 78 (7,0г, 32ммоль) в сухому тетрагідрофурані (100мл) обробляли при температурі -78°С біс(триметилсиліл)амідом літію (40мл 1,0Μ розчину, 1,3 еквіваленту). Після перемішування протягом 30 хвилин при вищезгаданій температурі додавали по краплях метилйодид (2,6мл, 1,3 еквіваленту) і давали реакційній суміші нагрітися до температури приміщення. Розбавляли масу ефіром і промивали органічний шар один раз водою, сушили над карбонатом калію і концентрували у вакуумі. Одержано 7,61г твердої речовини жовтого кольору. Очи щення хроматографуванням на силікагелі з елююванням сумішшю гексану з етилацетатом (9:1) дало 6,30г (83%) жовтої твердої речовини з температурою плавлення 135-137°С. Мас-спектр з польовою десорбцією; М++1=239. Проміжний продукт 80 1-(4-(2-(3-аміно-2-метил)пропіл)феніл)-2,5-диметилпірол Нітрил - проміжний продукт 79 (6,23г, 26,2ммоль) в тетрагідрофурані (250мл) обробляли комплексом бороводню з тетрагідрофураном (17,1мл, 1,0М), як описано в методиці синтезу проміжного продукту 62; одержано 6,37г спіненого продукту реакції. Цей матеріал очищали хроматографічним методом на силікагелі з градієнтним елююванням (зміна складу елюенту від чистого дихлорметану до суміші дихлорметан/метанол (9:1)). Одержано 4,08г білої твердої речовини (65%) з температурою плавлення 9597°С. Структур у продукту підтверджено ЯМР спектром. Мас-спектр з польовою десорбцією: М+=243. Проміжний продукт 81 N-2-(4-(2,5-диметилпірол)феніл)-2-метилпропіл-2-пропансульфамід Амін - проміжний продукт 80 (4,0г, 16,6ммоль) обробляли 1,8-діазабіцикло[5.4.0]ундеценом (3,28г, 1,3екв.) та 2-пропілсульфонілхлоридом (3,2мл, 1,3екв.) (стр.72) в дихлорметані (80мл) згідно з методикою синтезу проміжного продукту 63; одержано 6,1г жовтого масла. Цей матеріал очищали хроматографічним методом на силікагелі з ізократичним елююванням сумішшю гексану з етилацетатом (4:1). Одержано 4,3г білої твердої речовини (62%) з температурою плавлення 110-112°С. Структур у продукту підтверджено ЯМР спектром. Мас-спектр з польовою десорбцією: М+=349. Проміжний продукт 82 N-2-(4-амінофеніл)-2-метилпропіл-2-пропансульфамід Сульфамід - проміжний продукт 81 (2,17г, 6,3ммоль) обробляли гідроксиламіном-гідрохлоридом (2,0г, 13,8ммоль) і гідроксидом калію (0,96г, 20,0ммоль) в абсолютному етанолі (16мл) і воді (6мл). Цю суміш нагрівали зі зворотним холодильником протягом 24 годин. Потім реакційну масу охолоджували до температури приміщення, виливали у воду і екстрагували цільовий продукт ефіром. Органічний шар промивали один раз водою, сушили над карбонатом калію і концентрували під зниженим тиском. Одержано 1,57г продукту у вигляді масла. Очищення хроматографуванням на силікагелі з ізократичним елююванням сумішшю гексану з етилацетатом (1:1) дало 1,41г (84%) білої твердої речовини з температурою плавлення 87-88°С. Структура сполуки підтверджується ЯМР спектром. Мас-спектр з польовою десорбцією: М+=271. Проміжний продукт 83 N-2-(4-нітрофеніл)пропіл-N,N-диметилсульфамід Нітроамін - проміжний продукт 62 (1,8г, 0,01моль) обробляли діазабіцикло[5.4.0]ундеценом (1,70г, 1,1екв.) і Ν,Ν-диметилсульфамоїлхлоридом (2,1мл, 1,1екв.) в дихлорметані (40мл), як описано в методиці синтезу проміжного продукту 63. Одержано 3,60г коричневого масла. Цей матеріал очищали хроматографічним методом на силікагелі з градієнтним елююванням (зміна складу елюенту від суміші гексан/етилацетат (9:1) до суміші гексан/етилацетат (7:3)). Одержано 1,0г білої твердої речовини (50%) з температурою плавлення 79-81°С. Мас-спектр з польовою десорбцією: М+=288. Проміжний продукт 84 N-2-(4-амінофеніл)пропіл Ν,Ν-диметилсульфамід Нітросульфамід - проміжний продукт 83 (1,0г, 3,5ммоль) обробляли 5%-ним паладієм на вугіллі (2,0мл, надлишок) і воднем в етилацетаті (100мл), як описано в методиці синтезу проміжного продукту 64. Одержано 820мг білої твердої речовини (91%) з температурою плавлення 101,5-103°С. Мас-спектр: М+=258. Проміжний продукт 85 4-бромфенілацетилхлорид Розчин 50,0г (232ммоль) 4-бромфенілоцтової кислоти в 150мл тіоніл хлориду перемішували при температурі приміщення протягом 18 годин. Суміш концентрували у вакуумі. Одержано 54г (100%) сполуки, названої в заголовку. Проміжний продукт 86 (R)-(-)-4-бензил-3-(4-бромфенілацетил)-2-оксазолідинон Розчин 20,0г (117ммоль) (R-(+)-4-бензил-2-оксазолідинону в 300мл тетрагідрофурану о холоджували до -78°С і по краплях додавали 73,0мл (117ммоль) 1,6М розчину n-бутиллітію. Розмішували масу протягом 30 хвилин, після чого повільно додавали її через голку для шприца до розчину 25г (107кмоль) проміжного продукту 85 в 150мл тетрагідрофурану при -78°С. Масу перемішували протягом години і після цього додавали 300мл 10%-ного водного розчину бісульфату натрію. Відділяли органічний шар, а водний шар екстрагували трьома порціями ефіру по 100мл кожна. Об'єднані органічні екстракти сушили над сульфатом магнію, фільтрували й концентрували у вакуумі. Залишок очищали хроматографуванням (750г силікагелю, елюент - 25% етилацетату в гексані). Одержано 27,4г (68%) сполуки, названої в заголовку. Аналітично вирахувано для C18H16BrNO 3: %C, 57,77; %Н, 4,31; %N, 3,74. Фактично знайдено %С, 57,62; %Н, 4,21, %N, 3,74. Мас-спектр з польовою десорбцією: М=374. [a]D20=-59,83 (c=1,04, СНСІ3). Проміжний продукт 87 (-)-4R-бензил-3-(2R-(4-бромфеніл)пропіоніл)-2-оксазолідинон Розчин 48г (128ммоль) проміжного продукту 86 в 200мл тетрагідрофурану о холоджували до -78°С і по краплях додавали 141мл (141ммоль) 1М розчину біс(триметилсиліл)аміду. Розмішували масу протягом 60 хвилин, після чого повільно додавали розчин 20г (141ммоль) метилйодиду в 20мл тетрагідрофурану. Масу перемішували протягом години при -78°С і після цього давала нагрітися до температури приміщення протягом години. До реакційної маси додавали 10%-ний водний розчин бісульфату натрію. Відділяли органічний шар, а водний шар екстрагували трьома порціями ефіру по 100мл кожна. Об'єднані органічні екстракти сушили над сульфатом магнію, фільтрували й концентрували у вакуумі. Залишок очищали хроматографуванням (500г силікагелю, елюент - 25% етилацетату в гексані). Одержано 28,7г (58%) сполуки, названої в заголовку. Аналітично вирахувано для C19H18BrNO 3: %C, 58,78; %Н, 4,67; %N, 3,61. Фактично знайдено %С, 58,81; %Н, 4,63, %N, 3,54. Мас-спектр з польовою десорбцією: М=388. [[a]D20=-110,4(c=0,96, СНСІ3). Проміжний продукт 88 (R)-(+)-2-(4-бромфеніл)пропанол Розчин 28,7г (74ммоль) проміжного продукту 87 в 250мл ефіру охолоджували до 0°С і по краплях додавали 74мл (148ммоль) 2,0М розчину боргідриду літію в те трагідрофурані. Розмішували масу протягом 2 годин, після чого додавали 1N розчин гідроксиду натрію і продовжували перемішування, доки обидва шари (органічний і водний) ставали прозорими. Відділяли органічний шар, а водний шар екстрагували трьома порціями етилацетату по 10мл кожна. Об'єднані органічні екстракти сушили над сульфатом магнію, фільтрували й концентрували у вакуумі. Залишок очищали хроматографуванням (800г силікагелю, елюент 25% етилацетату в гексані). Одержано 12,3г (79%) сполуки, названої в заголовку. Аналітично вирахувано для С9Н11ВrO: %С, 50,26; %Н, 5,15. Фактично знайдено %С, 48,96; %Н, 4,91. Мас-спектр з польовою десорбцією: М+1=216. [a]D20=+13,79 (c=1,06, СНСІ3). Проміжний продукт 89 (R)-2-(4-бромфеніл)пропілметансульфонат Розчин 12,2г (56,7ммоль) проміжного продукту 88 і 8,7мл (62,4ммоль) триетиламіну в 180мл дихлорметану охолоджували до 0°С і по краплях додавали розчин 4,8мл (62,4ммоль) метансульфохлориду в 10мл дихлорметану. Усували льодову баню і розмішували масу при температурі приміщення протягом 2 годин. Промивали суміш 200мл 10%-ного водного розчину бісульфату натрію, відділяли органічний шар, а водний шар екстрагували трьома порціями ефіру по 60мл кожна. Об'єднані органічні розчини сушили над сульфатом магнію, фільтрували й концентрували у вакуумі. Одержано 15,9г (96%) сполуки, названої в заголовку. Проміжний продукт 90 (R)-2-(4-бромфеніл)пропілазид Розчин 15,8г (54ммоль) проміжного продукту 89 у 180мл Ν,Ν-диметилформаміду і 7,0г (62,4ммоль) азиду натрію нагрівали при 80°С протягом 15 годин. Суміш охолоджували й перерозподіляли між 100мл води і 100мл ефіру. Відділяли органічний шар, а водний шар екстрагували трьома порціями ефіру по 30мл кожна. Об'єднані органічні розчини сушили над сульфатом магнію, фільтрували й концентрували у вакуумі. Одержано 12,13г (94%) сполуки, названої в заголовку. Проміжний продукт 91 (R)-(+)-2-(4-бромфеніл)пропіламін гідрохлорид Розчин 12,2г (50,4ммоль) проміжного продукту 90 в 168мл тетрагідрофурану і 3,6мл води розмішували при температурі приміщення протягом 18 годин, після чого масу розбавляли 100мл ефіру і додавали 50мл розсолу. Органічний шар сушили над сульфатом магнію, фільтрували й концентрували у вакуумі. Залишок розчиняли в 100мл ефіру і додавали 200мл ефіру, насиченого хлороводнем. Після фільтрування осаду одержано 11,9г (94%) сполуки, вказаної в заголовку. Аналітично вирахувано для C9H13BrClN: %C, 43,14; %Н, 5,23; %N, 5,59. Фактично знайдено %С, 43,44; %Н, 5,23; %N, 5,56. Мас-спектр з польовою десорбцією: М-НСІ=214. [a]D20=+24,06 (с=1,00, Н2О). Проміжний продукт 92 (R)-2-(4-бромфеніл)-N-(трет-бутоксикарбоніл)пропіламін До розчину 5,0г (20,0ммоль) проміжного продукту 91 в 30мл хлороформу і 30мл насиченого бікарбонату натрію додавали 4,3г (20,0ммоль) ди-трет-бутилдикарбонату. С уміш розмішували при температурі приміщення протягом 18 годин. Відділяли органічний шар, а водний шар екстрагували трьома порціями хлороформу по 10мл кожна. Об'єднані органічні розчини сушили над сульфатом магнію, фільтрували й концентрували у вакуумі. Одержано 6,2г (100%) сполуки, названої в заголовку. Проміжний продукт 93 (S)-(+)-4-бензил-3-(4-бромфенілацетил)-2-оксазолідинон За методикою синтезу проміжного продукту 86 з використанням (S)-(-)-4-бензил-2-оксазолідинону замість (R)-(+)-4-бензил-2-оксазолідинону одержано 25,3г (63%) сполуки, названої в заголовку. Аналітично вирахувано для C18H16BrNO 3: %С, 57,77; %Н, 4,31; %N, 3,74. Фактично знайдено %С, 57,69; %Н, 4,18; %N, 3,82. Мас-спектр з польовою десорбцією: М=374. [a]D20=+59,35 (c=1,04, СНСІ3). Проміжний продукт 94 (+)-4S-бензил-3-(2S-(4-бромфеніл)пропіоніл)-2-оксазолідинон За методикою синтезу проміжного продукту 87 з використанням проміжного продукту 93 замість проміжного продукту 86 одержано 28,9г (51%) сполуки, названої в заголовку. Аналітично вирахувано для C19H18BrNO 3: %C, 58,78; %Н, 4,67; %N, 3,61. Фактично знайдено %С, 59,40; %Н, 4,61; %N, 3,64. Мас-спектр з польовою десорбцією: М=388. [a]D20=+114,8 (с=1,01, СНСІ3). Проміжний продукт 95 (S)-(-)-2-(4-бромфеніл)пропанол За методикою синтезу проміжного продукту 88 з використанням проміжного продукту 94 замість проміжного продукту 87 одержано 12,3г (79%) сполуки, названої в заголовку. Аналітично вирахувано для С9Н11ВrО: %С, 50,26; %Н, 5,15. Фактично знайдено %С, 50,38; %Н, 5,08. Мас-спектр з польовою десорбцією: М+1=216. [a]D20=-13,25 (с=1,06, СНСІ3). Проміжний продукт 96 (S)-2-(4-бромфеніл)пропілметансульфонат За методикою синтезу проміжного продукту 89 з використанням проміжного продукту 95 замість проміжного продукту 88 одержано 16,9г (100%) сполуки, названої в заголовку. Проміжний продукт 97 (S)-2-(4-бромфеніл)пропілазид За методикою синтезу проміжного продукту 90 з використанням проміжного продукту 96 замість проміжного продукту 89 одержано 13,0г (94%) сполуки, названої в заголовку. Проміжний продукт 98 (S)-(-)-2-(4-бромфеніл)пропіламін гідрохлорид За методикою синтезу проміжного продукту 91 з використанням проміжного продукту 97 замість проміжного продукту 90 одержано 11,6г (86%) сполуки, названої в заголовку. Аналітично вирахувано для C9H13BrClN: %C, 43,14; %Н, 5,23; %N, 5,59. Фактично знайдено %С, 43,36; %Н, 5,39; %N, 5,64. Мас-спектр з польовою десорбцією: [М-НСІ]=214. [a]D20=-25,3 (с=1,02, Н2О). Проміжний продукт 99 (S)-2-(4-бромфеніл)-N-трет-бутоксикарбоніл)пропіламін За методикою синтезу проміжного продукту 92 з використанням проміжного продукту 98 замість проміжного продукту 91 одержано 5,9г (94%) сполуки, названої в заголовку. Проміжний продукт 100 (R)-2-(4-(3-тієніл)феніл)-N-трет-бутоксикарбоніл)пропіламін До розчину 2,0г (6,4ммоль) проміжного продукту 92, 0,9г (7,0ммоль) тіофєн-3-борної кислоти і 1,3г (9,6ммоль) карбонату калію в 20мл діоксану і 5мл води додавали 0,4г (0,32ммоль) тетракіс(трифенілфосфін)паладію (0). Суміш нагрівали при 100°С протягом 18 годин. Охолоджували суміш до температури приміщення і додавали 20мл ефіру. Відділяли органічний шар, а водний шар екстрагували трьома порціями ефіру по 10мл кожна. Об'єднані органічні розчини сушили над сульфатом магнію, фільтрували й концентрували у вакуумі. Після хроматографічного очищення (150г силікагелю, елюент - 15% етилацетету в гексані) одержано 1,4г (70%) сполуки, названої в заголовку. Проміжний продукт 101 (S)-2-(4-(3-тієніл)феніл)-N-трет-бутоксикарбоніл)пропіламін За методикою синтезу проміжного продукту 100 з використанням проміжного продукту 99 замість проміжного продукту 92 одержано 5,9г (94%) сполуки, названої в заголовку. Проміжний продукт 102 2R-(4-(3-тієніл)феніл)пропіламін Розчин 1,4г проміжного продукту 100 в 15мл 25%-ної трифтороцтової кислоти в дихлорметані перемішували при температурі приміщення протягом 3 годин. Суміш концентрували у вакуумі, залишок розчиняли в 20мл 1N гідроксиду натрію і 20мл етилацетату. Відділяли органічний шар, а водний шар екстрагували чотирма порціями етилацетату по 10мл кожна. Об'єднані органічні розчини сушили над сульфатом магнію, фільтрували й концентрували у вакуумі. Одержано 0,85г (89%) сполуки, названої в заголовку. Проміжний продукт 103 2S-(4-(3-тієнІл)феніл)пропіламін За методикою синтезу проміжного продукту 102 з використанням проміжного продукту 101 замість, проміжного продукту 100 одержано 0,9г (94%) сполуки, названої в заголовку. Приклад 1 N-2-(4-бромфеніл)пропілметансульфамід До розчину 2,8г (11,3ммоль) проміжного продукту 2 в 30мл дихлорметану і 30мл 10%-ного водного розчину гідроксиду натрію додавали при температурі приміщення 1,1мл (13,6ммоль) метансульфонілхлориду. За годину додавали ще 1,1мл (13,6ммоль) метансульфонілхлориду і продовжували перемішування ще півтори години. Відділяли органічний шар, а водний шар екстрагували двома порціями дихлорметану по 25мл кожна. Об'єднані органічні розчини промивали один раз 25мл 10%ного водного бісульфату натрію, сушили над сульфатом натрію, фільтрували й концентрували у вакуумі. Одержано 2,7г (81%) сполуки, вказаної в заголовку. Аналітично вирахувано для C10H14NBrO 2S: %С, 41,11; %Н, 4,83; %N, 4,79. Фактично знайдено %С, 40,92; %Н, 4,78; %N, 4,85. Мас-спектр з польовою десорбцією: М-1=291. Приклад 2 N-2-(4-(3-фторфеніл)феніл)пропілметансульфамід До знегаженого розчину 1,5г (5,1ммоль) продукту Прикладу 1, 1,1г (7,7ммоль) 3-фторбензолборної кислоти і 1,1г (7,7ммоль) карбонату калію в 30мл толуолу додавали 0,2г (0,3ммоль) біс(трифенілфосфін)паладію (II) дихлорид. С уміш нагрівали при 100°С протягом 16 годин,охолоджували до температури приміщення і розбавляли 20мл етилацетату. Промивали масу один раз 25мл води і відділяли органічний шар. Водний шар тричі екстрагували етилацетатом. Об'єднані органічні розчини сушили над сульфатом магнію, фільтрували й концентрували у вакуумі. Одержано 2,7г (81%) сполуки, вказаної в заголовку. Після очищення хроматографічним методом (75г силікагелю, елюент - 20% етилацетату в толуолі), перекристалізації з етилового ефіру, фільтрації і висушування у вакуумі при 60°С одержано 0,15г (9%) сполуки, вказаної в заголовку. Аналітично вирахувано для C16H18NFO2S0,25H2O: %C, 61,62; %Н, 5,98; %N, 4,49. Фактично знайдено %С, 61,67; %Е, 5,83; %N, 4,64. Мас-спектр з польовою десорбцією: М=307 Приклад 3 N-2-(4-(3-формілфеніл)феніл)пропілметансульфамід До знегаженого розчину 1,5г (5,1ммоль) продукту Прикладу 1, 1,2г (8,1ммоль) 3-формілбензолборної кислоти і 1,1г (8,1ммоль) карбонату калію в 30мл толуолу додавали 0,3г (0,3ммоль) тетракіс(трифенідфосфін)паладію (0). Суміш нагрівали при 100°С протягом 16 годин, потім додавали 5мл води і продовжували нагрівання ще протягом години. Охолоджували масу до температури приміщення і додавали 10мл води. Відділяли органічний шар. Водний шар двічі екстрагували етилацетатом. Об'єднані органічні розчини сушили над сульфатом магнію, фільтрували й концентрували у вакуумі. Після очищення хроматографічним методом (50г силікагелю, елюент - 40% етилацетату в гексані) одержано 0,7г (41%) сполуки, вказаної в заголовку. Аналітично вирахувано для C17H19NO 3S: %C, 64,33; %Н, 6,03; %N, 4,41. Фактично знайдено %С, 64,33; %Н, 6,06; %N, 4,01. Мас-спектр з польовою десорбцією: М=317. Приклад 4 N-2-(4-(4-формілфеніл)феніл)пропілметансульфамід До знегаженого розчину 1,5г (5,1ммоль) продукту Прикладу 1, 1,2г (8,1ммоль) 4-формілбензолборної кислоти і 1,1г (8,1ммоль) карбонату калію в 30мл толуолу додавали 0,3г (0,3ммоль) тетракіс(трифенілфосфін)паладію (0). Суміш нагрівали при 100°С протягом 4 годин, потім додавали 0,3г (2,0ммоль) 4-формілбензолборної кислоти і 0,1г (0,09ммоль) тетракіс(трифенілфосфін)паладію (0) і продовжували нагрівання ще протягом 16 годин. Додавали 5мл води і нагрівали ще годину. Охолоджували масу до температури приміщення і додавали 10мл води. Відділяли органічний шар. Водний шар двічі екстрагували етилацетатом, Об'єднані органічні розчини сушили над сульфатом магнію, фільтрували й концентрували у вакуумі. Після очищення залишку хроматографічним методом (50г силікагелю, елюент 50% етилацетату в гексані), перекристалізації з суміші бутилброміду з етилацетатом, фільтрування й висушування у вакуумі одержано 0,5г (32%) сполуки, вказаної в заголовку. Аналітично вирахувано для C17H19NO 3S: %С, 64,33; %Н, 6,03; %N, 4,41. Фактично знайдено %С, 64,62; %Н, 5,97; %N, 4,36. Мас-спектр з польовою десорбцією: М=317. Приклад 5 N-2-(4-(3-тієніл)феніл)пропілметансульфамід До знегаженого розчину 1,5г (5,1ммоль) продукту Прикладу 1, 1,0г (7,7ммоль) тіофен-3-борної кислоти і 1,1г (7,7ммоль) карбонату калію в 30мл толуолу додавали 0,3г (0,3ммоль) тетракіс(трифенілфосфін)паладію (0). Суміш нагрівали при 100°С протягом 4 годин, після чого охолоджували до температури приміщення і розбавляли 20мл етилацетату. Промивали масу один раз водою і відділяли органічний шар. Водний шар двічі екстрагували етилацетатом. Об'єднані органічні розчини сушили над сульфатом магнію, фільтрували й концентрували у вакуумі. Після очищення залишку хроматографічним методом (50г силікагелю, елюент - 35% етилацетату в гексані), перекристалізації з бутилброміду, фільтрування й висушування у вакуумі при 60°С одержано 0,4г (27%) сполуки, вказаної в заголовку. Аналітично вирахувано для C14H17NО 2S2: %С, 56,92; %Н, 5,80; %Ν, 4,74. Фактично знайдено %С, 57,00; %Н, 5,92; %Ν, 4,78. Мас-спектр з польовою десорбцією: М=295. Приклад 6 N-2-(4-(2-метоксифеніл)феніл)пропілметансульфамід До знегаженого розчину 1,0г (3,4ммоль) продукту Прикладу 1, 0,8г (5,1ммоль) 2-метоксибензолборної кислоти і 0,7г (5,1ммоль) карбонату калію в 15мл діоксану і 5мл води додавали 0,2г (0,2ммоль) тетраіас(трифенілфосфін)паладію (0). Суміш нагрівали при 100°С протягом 16 годин. Охолоджували масу до температури приміщення і додавали 10мл води і тричі екстрагували етилацетатом. Об'єднані органічні розчини сушили над сульфатом магнію, фільтрували й концентрували у вакуумі. Після очищення залишку хроматографічним методом (50г силікагелю, елюент - 35% етилацетату в гексані) одержано 1,0г (90%) сполуки, вказаної в заголовку, у вигляді в'язкого масла. Аналітично вирахувано для C17H21NO 3S: %C, 63,92; %Н, 6,62; %N, 4,39. Фактично знайдено %С, 63,68; %Н, 6,78; %N, 4,23, Мас-спектр з польовою десорбцією: М=319. ПРИКЛАД 7 N-2-(4-(2-фторфеніл)феніл)етил)2-пропансульфамід A. (2-(4-бромфеніл)-N-трет-бутоксикарбоніл)етиламін: До розчину 10,0г (50,0ммоль) бромфенетиламіну в 100мл хлороформу і 100мл насиченого бікарбонату натрію додавали 11,0г (50,0ммоль) ди- третбутилдикарбонату. Розмішували масу протягом години при температурі приміщення. Відділяли органічний шар, а водний шар екстрагували трьома порціями хлороформу по 30мл кожна. Об'єднані органічні екстракти сушили над суль фатом магнію, фільтрували й концентрували у вакуумі. Одержано 15г (100%) вищезазначеної сполуки. B. 2-(4-(2-фторфеніл)феніл)-N-трет-бутоксикарбоніл)-фенілетиламін: До знегаженого розчину 7,9г (26,2ммоль) продукту зі стадії А, 5,5г (39,3ммоль) проміжного продукту 3 і 5,4г (39,3ммоль) карбонату калію в 90мл толуолу додавали 1,5г (1,3ммоль) тетракіс(трифенілфосфін)паладію (0). Суміш нагрівали при 90°С протягом 3 годин. Охолоджували масу до температури приміщення і додавали 90мл води. Відділяли органічний шар, а водний шар екстрагували трьома порціями етилацетату по 30мл кожна, Об'єднані органічні екстракти сушили над сульфатом магнію, фільтрували й концентрували у вакуумі. Залишок очищали хроматографічним методом (400г силікагелю, елюент - 15% етилацетату в гексані). Одержано 7,1г продукту, який після розтирання з гексаном дав 3,5г (42%) вищезазначеної сполуки. С. 2-(4'-(2-фторбіфеніл)етиламін: Розчин 3,5г продукту зі стадії В в 40мл 20%-ного розчину трифтороцтової кислоти в дихлорметані перемішували протягом години при температурі приміщення. Суміш концентрували у вакуумі. Одержано 3,9г (100%) вищезазначеної сполуки. D. Розчин 1,0г (3,0ммоль) продукту зі стадії С і 1мл (7,6ммоль) триетиламіну в 10мл дихлорметану охолоджували до 0°С. Додавали по краплях розчин 0,33мл (3,0ммоль) ізопропілсульфонілхлориду в 5мл дихлорметану. Усували льодову баню і перемішували масу при температурі приміщення протягом години. Розбавляли масу 10мл ефіру і промивали 20мл 10%-ного водного розчину бісульфату натрію. Відділяли органічний шар, а водний шар екстрагували трьома порціями ефіру по 10мл кожна. Об'єднані органічні екстракти сушили над сульфатом магнію, фільтрували й концентрували у вакуумі. Одержано 0,5г (52%) сполуки, вказаної в заголовку. Аналітично вирахувано для C17H20 FNО2S0,25H2О: %C, 62,65; %Н, 6,34; %N, 4,30. Фактично знайдено %С, 62,62; %Н, 6,15; %N, 4,49. Мас-спектр з польовою десорбцією: М=321. Приклад 8 N-2-(4-(2-фторфеніл)феніл)пропіл-етенсульфамід Розчин 1,0г (4,4ммоль) проміжного продукту 6 і 0,67мл (4,8ммоль) триетиламіну в 15мл дихлорметану охолоджували до 0°С. Додавали по краплях розчин 0,46мл (4,4ммоль) 2-хлор-1-етансульфонілхлориду в 2мл дихлорметану. Усували льодову баню і перемішували масу при температурі приміщення протягом години. Розбавляли масу 15мл ефіру і промивали 15мл 10%-ного водного розчину бісульфату натрію. Відділяли органічний шар, а водний шар екстрагували трьома порціями ефіру по 5мл кожна. Об'єднані органічні екстракти сушили над сульфатом магнію, фільтрували й концентрували у вакуумі. Залишок очищали хроматографічним методом (25г силікагелю, елюент - 30% етилацетату в гексані). Одержано 0,6г (43%) сполуки, вказаної в заголовку. Аналітично вирахувано для C17H18 FNO2S: %C, 63,93; %Н, 5,68; %N, 4,39. Фактично знайдено %С, 63,98; %Н, 5,58; %N, 4,42. Мас-спектр з польовою десорбцією: М=319. Приклад 9 N-2-(4-(2-фторфеніл)феніл)пропіл-етансульфамід Розчин 0,2г (0,80ммоль) проміжного продукту 6 і 0,13мл (0,95ммоль) триетиламіну в 5мл дихлорметану охолоджували до 0°С. Додавали по краплях розчин 0,076 мл (0,80 ммоль) етансульфонілхлориду в 1 мл дихлорметану. Усували льодову баню і перемішували масу при температурі приміщення протягом 16 годин. Промивали масу 5мл 10%-ного водного розчину бісульфату натрію. Відділяли органічний шар, а водний шар екстрагували один раз 5мл дихлорметану. Об'єднані органічні екстракти сушили над сульфатом магнію, фільтрували й концентрували у вакуумі. Залишок очищали хроматографічним методом (25г силікагелю, елюент - 35% етилацетату в гексані). Одержано 0,20г (78%) сполуки, вказаної в заголовку. Аналітично вирахувано для C17H20 FNО2S: %C, 63,53; %Н, 6,27; %Ν, 4,36. Фактично знайдено %С, 63,24; %Н, 6,27; %N, 4,39. Мас-спектр з польовою десорбцією: М=321. Приклад 10 N-2-(4-(2-фторфеніл)феніл)пропіл-2-пропансульфамід Розчин 0,2г (0,80ммоль) проміжного продукту 6 і 0,13мл (0,95ммоль) триетиламіну в 5мл дихлорметану охолоджували до 0°С. Додавали по краплях розчин 0,090мл (0,80ммоль) ізопропілсульфонілхлориду в 1мл дихлорметану. Усували льодову баню і перемішували масу при температурі приміщення протягом 16 годин. Промивали масу 5мл 10%-ного водного розчину бісульфату натрію. Відділяли органічний шар, а водний шар екстрагували один раз 5мл дихлорметану. Об'єднані органічні екстракти сушили над сульфатом магнію, фільтрували й концентрували у вакуумі. Залишок очищали хроматографічним методом (25г силікагелю, елюент - 35% етилацетату в гексані). Одержано 0,40г (15%) сполуки, вказаної в заголовку. Аналітично вирахувано для C18H22 FNO2S: %C, 64,45; %Н, 6,61; %N, 4,81. Фактично знайдено %С, 64,2; %Н, 6,51; %N, 4,02. Мас-спектр з польовою десорбцією: М=335. Приклад 11 N-2-(4-(2-фторфеніл)феніл)пропіл Ν',Ν'-диметилсульфамід Розчин 0,2г (0,80ммоль) проміжного продукту 6 і 0,13мл (0,95ммоль) триетиламіну в 5мл дихлорметану охолоджували до 0°С. Додавали по краплях розчин 0,086мл (0,80ммоль) диметилсульфамоїлхлориду в 1мл дихлорметану. Усували льодову баню і перемішували масу при температурі приміщення протягом 16 годин. Промивали масу 5мл 10%-ного водного розчину бісульфату натрію. Відділяли органічний шар, а водний шар екстрагували один раз 5мл дихлорметану. Об'єднані органічні екстракти сушили над сульфатом магнію, фільтрували й концентрували у вакуумі. Залишок очищали хроматографічним методом (25г силікагелю, елюент - 35% етилацетату в гексані). Одержано 0,20г (74%) сполуки, вказаної в заголовку. Аналітично вирахувано для C17H21 FN2О2S: %C, 60,69; %Н, 6,29; %N, 8,33. Фактично знайдено %С, 60,42; %Н, 6,23; %N, 8,06. Мас-спектр з польовою десорбцією: М=336. Приклад 12 N-2-(4-ізопропіл)феніл)пропіл-трифторметансульфамід Суспензію 0,30г (1,40ммоль) проміжного продукту 8 в 20мл дихлорметану охолоджували до 0°С. Додавали до суспензії 0,59мл (4,21ммоль) триетиламіну, а потім 0,16мл (1,54ммоль) трифторметансульфонілхлориду. Перемішували масу при 0°С протягом півгодини, а потім нагрівали до температури приміщення. Процес реакції контролювали хроматографією в тонкому шарі. По закінченні конверсії вихідного матеріалу реакційну суміш перерозподіляли між водою й дихлорметаном, Органічний шар промивали 0,2М хлористоводневою кислотою, розсолом, сушили над сульфатом магнію, фільтрували й концентрували у вакуумі. Залишок очищали хроматографічним методом (силікагель, елюент - 30% етилацетату в гексані). Одержано 0,35г (81%) сполуки, вказаної в заголовку. Мас-спектр з польовою десорбцією: М=309. Аналіз для C13H18F 3NO3S: Теоретичний розрахунок С, 50,48; Н, 5,86; N, 4,53. Фактично знайдено С, 50,40; Н, 5,78; N, 4,74. Приклад 13 N-2-(4-ізопропілфеніл)пропіл-2-пропансульфамід Суспензію 0,30г (1,40ммоль) проміжного продукту 8 в 20мл дихлорметану охолоджували до 0°С. Додавали до суспензії 0,59мл (4,21ммоль) триетиламіну, а потім 0,16мл (1,54ммоль) ізопропілсульфонілхлориду. Перемішували масу при 0°С протягом півгодини, а потім нагрівали до температури приміщення. Процес реакції контролювали хроматографією в тонкому шарі. По закінченні конверсії вихідного матеріалу реакційну суміш перерозподіляли між водою й дихлорметаном. Органічний шар промивали 0,2М хлористоводневою кислотою, розсолом, сушили над сульфатом магнію, фільтрували й концентрували у вакуумі. Залишок очищали хроматографічним методом (силікагель, елюент - 30% етилацетату в гексані). Одержано 0,35г (81%) сполуки, вказаної в заголовку. Мас-спектр з польовою десорбцією: М=283. Аналіз для C13H18F 3NO3S: Теоретичний розрахунок С, 63,57; Н, 8,89; N, 4,94, Фактично знайдено С, 63,63; Н, 8,90; N, 5,18. Приклад 14 N-2-(4-метоксифеціл)пропіл трифторметансульфамід Суспензію 1,00г (4,96ммоль) проміжного продукту 10 в 50мл дихлорметану охолоджували до 0°С. Додавали до суспензії 2,09мл (14,9ммоль) триетиламіну, а потім 0,58мл (5,45ммоль) трифторметансудьфонілхлориду. Перемішували масу при 0°С протягом півгодини, а потім нагрівали до температури приміщення. Процес реакції контролювали хроматографією в тонкому шарі. По закінченні конверсії вихідного матеріалу реакційну суміш перерозподіляли між водою й дихлорметаном. Органічний шар промивали 0,2М хлористоводневою кислотою, розсолом, сушили над сульфатом магнію, фільтрували й концентрували у вакуумі. Залишок очищали хроматографічним методом (силікагель, елюент - 30% етилацетату в гексані). Одержано 1,07г (73%) сполуки, вказаної в заголовку. Мас-спектр з польовою десорбцією: М=297. Аналіз для C11H14F 3NO3S: Теоретичний розрахунок С, 44,44; Η, 4,75; Ν, 4,77. Фактично знайдено С, 44,54; Η, 4,55; Ν, 4,80. Приклад 15 N-2-(4-циклопентилфеніл)пропіл метансульфамід Режим 1: 0,50г (1,71ммоль) продукту Прикладу 1 розчиняли в безводному тетрагідрофурані (5мл) в атмосфері азоту. До розчину додавали 0,099г (0,086ммоль) тетракіс(трифенілфосфін)паладію (0), а потім циклопентилмагній-бромід (2М в діетиловому ефірі, 2,14мл, 4,28ммоль). Масу нагрівали зі зворотним холодильником протягом 16 годин, Після охолодження реакційну суміш перерозподіляли між водою й діетиловим ефіром. Водний шар екстрагували двічі діетиловим ефіром. Об'єднані органічні розчини промивали розсолом, сушили над сульфатом магнію, фільтрували й концентрували у вакуумі. Залишок очищали хроматографічним методом (силікагель, елюент - 30% етилацетату в гексані). Одержано 0,06г (13%) сполуки, вказаної в заголовку. Аналіз для С 15H23F 3NO2S: Теоретичний розрахунок С, 64,02; Н, 8,24; Ν, 4,98, Фактично знайдено С, 64,30; Н, 8,35; Ν, 4,84, Режим 2: Пізніше було з'ясовано, що оптимальним способом проведення вищевказаної реакції є такий: бромід розчиняли в діетиловому ефірі і о холоджували до -78°С. Додавали [1,1'біс(дифенілфосфіно)фероцен]-дихлорпаладій (II) (PdCl2(dppf)), а потім відповідний магнійорганічний реагент. Розчин переміщували протягом години, а потім давали нагрітися до температури приміщення протягом 2 годин. Обробляли масу, як описано вище (режим 1). Приклад 16 N-2-(4-трет-бутилфеніл)пропіл метансульфамід 65мг (0,57ммоль) метансульфонілхлориду в дихлорметані (5мл) додавали по краплях до розчину 100мг (0,52ммоль) проміжного продуту 23 і 60мг (0,59ммоль) триетиламіну в ди хлорметані (15мл) при температурі приміщення в атмосфері азоту. Реакційну масу перемішували протягом 16 годин при температурі приміщення. Потім суміш концентрували під зниженим тиском і одержану пасту розчиняли в 25мл етилацетату, промивали один раз 25мл води, сушили над карбонатом калію і концентрували під зниженим тиском. Після перекристалізації із суміші гексану з етилацетатом (9:1) одержано 65мг (46%) сполуки, вказаної в заголовку, у вигляді білих кристалів. Аналітично вирахувано для C14H23NO 2S: %С, 62,42; %Н, 8,61; %N, 5,20. Фактично знайдено %С, 62,64; %Н, 8,41; %N, 5,19. Мас-спектр: М=269. Приклад 17 N-2-(4-трет-бутилфеніл)пропіл-трифторметансульфамід Сполуку, вказану в заголовку, в кількості 70мг (29%) одержано у вигляді масла за методикою Прикладу 16 з використанням проміжного продукту 23 і трифторметансульфонілхлориду. Аналітично вирахувано для C14H20NО 2SF3 : %C, 52,00; %Н, 6,23; %N, 4,33. Фактично знайдено %С, 51,79; %Н, 6,20; %N, 4,27. Мас-спектр: М=323. Приклад 18 N-2-(4-трет-бутилфеніл)бутил-метансульфамід Сполуку, вказану в заголовку, в кількості 140мг (67%) одержано у вигляді масла за методикою Прикладу 16 з використанням проміжного продукту 24. Продукт очищали хроматографічним методом на силікагелі (Chromatotron 1000 micron rotor), елюент - суміш гексану з етилацетатом (3:1). Аналітично вирахувано для C15H25NO 2S: %C, 63,57; %Н, 8,89; %N, 4,94. Фактично знайдено %С, 63,63; %Н, 8,49; %N, 4,93. Мас-спектр: М=283. Приклад 19 N-2-(4-трет-бутилфеніл)-2-метилпропіл-трифторметансульфамід Сполуку, вказану в заголовку, в кількості 131мг (40%) одержано у вигляді кристалічної твердої речовини (після кристалізації з суміші гексан-етилацетат, 19:1) за методикою Прикладу 16 з використанням проміжного продукту 25 і трифторметансульфонілхлориду. Аналітично вирахувано для C15H22NO 2SF3 : %С, 53,40; %Н, 6,57; %N, 4,15. Фактично знайдено %С, 53,75; %Н, 6,40; %N, 4,02. Мас-спектр: М=337. Приклад 20 N-2-(2-нафтил)пропіл-трифторметансульфамід Сполуку, вказану в заголовку, одержано за методикою Прикладу 16 з використанням проміжного продукту 26. Продукт очищали хроматографічним методом на силікагелі (Chromatotron 1000 micron rotor), елюент - суміш гексану з етилацетатом (19:1). Одержано 140мг (44%) продукту у вигляді твердої речовини. Аналітично вирахувано для C14H14NO 2SF3 : %C, 52,99; %Н, 4,45; %N, 4,41. Фактично знайдено %С, 52,90; %Н, 4,42; %N, 4,32, Мас-спектр: М=317. Приклад 21 N-2-(4-трет-бутилфеніл)бутил-трифторметансульфамід Сполуку, вказану в заголовку, одержано за методикою Прикладу 16 з використанням проміжного продукту 24 і трифторметансульфонілхлориду. Продукт очищали хроматографічним методом на силікагелі (Chromatotron 2000 micron rotor), елюент - суміш гексану з етилацетатом (19:1). Одержано 187мг (57%) продукту у вигляді масла. Аналітично вирахувано для C15H22NO 2SF3 : %С, 53,56; %Н, 6,31; %N, 4,12. Фактично знайдено %С, 53,40; %Н, 6,57; %N, 4,15. Мас-спектр: М=337. Приклад 22 N-2-(4-трет-бутилфеніл)бутил-2-пропансульфамід Сполуку, вказану в заголовку, одержано за методикою Прикладу 16 з використанням проміжного продукту 24 і ізопропілсульфонілхлориду. Продукт очи щали хроматографічним методом на силікагелі (Chromatotron 2000 micron rotor), з градієнтним елююванням (склад елюенту змінювали від гексану до суміші гексану з етилацетатом (4:1). Одержано 73мг (32%) продукту у вигляді масла. Аналітично вирахувано для C17H29NO 2S: %C, 65,55; %Н, 9,38; %N, 4,50. Фактично знайдено %С, 64,65; %Н, 8,96; %N, 4,60. Мас-спектр: М=311. Приклад 23 N-2-(4-трет-6утилфеніл)пропіл-2-пропансульфамід Сполуку, вказану в заголовку, одержано за методикою Прикладу 16 з використанням проміжного продукту 23 і ізопропілсульфонілхлориду. Продукт очи щали хроматографічним методом на силікагелі (Chromatotron 2000 micron rotor), елюент - суміш гексану з етилацетатом (4:1). Одержано 111мг (29%) продукту. Аналітично вирахувано для C16H27NO 2S: %C, 64,61; %Н, 9,15; %N, 4,71. Фактично знайдено %С, 64,53; %Н, 8,99; %N, 4,92. Мас-спектр: М=297. Приклад 24 N-1-(4-трет-бутилфеніл)циклопропілметил-трифторметансульфамід 165мг (0,98ммоль) трифторметилсульфонілхлориду, 100мг (0,49ммоль) проміжного продукту 30 і 100мг (0,98ммоль) триетиламіну змішували в ди хлорметані (15мл) і обробляли згідно з методикою Прикладу 16; одержано 164мг масла. Продукт очищали хроматографічним методом на силікагелі з градієнтним елююванням (склад елюенту змінювали від гексану до суміші гексану з етилацетатом (9:1). Одержано 100мг (61%) сполуки, вказаної в заголовку, у вигляді масла, яке повільно кристалізувалося; температура плавлення продукту 82-84°С. Вирахувано для C15H20NO2SF3: Теоретичний розрахунок С, 53,72; Н, 6,01; N, 4,18. Фактично знайдено С, 53,97; Н, 6,12; N, 4,10. Мас-спектр: М=335. Приклад 25 N-1-(4-трет-бутилфеніл)циклопропілметил-2-пропансульфамід 140мг (0,98ммоль) ізопропілсульфонілхлориду, 100мг (0,49ммоль) проміжного продукту 30 і 100мг (0,98ммоль) триетиламіну змішували в ди хлорметані (15мл) і обробляли згідно з методикою Прикладу 16; одержано 147мг масла. Продукт очищали хроматографічним методом на силікагелі з градієнтним елююванням (склад елюенту змінювали від суміші гексану з етилацетатом (19:1) до суміші гексану з етилацетатом (1:1). Одержано 33мг (22%) сполуки, вказаної в заголовку, у вигляді масла, яке повільно кристалізувалося; температура плавлення продукту 87-89,5°С. Вирахувано для C17H27NO2S: Теоретичний розрахунок С, 65,98; Н, 8,79; N, 4,53. Фактично знайдено С, 65,78; Н, 9,01; N, 4,35. Приклад 26 N-2-(4-(4-метилфеніл)феніл)пропілметансульфамід До знегаженого розчину 1,4г (4,7ммоль) продукту Прикладу 1, 1,0г (7,1ммоль) 4-метилбензолборної кислоти, 1,0г (7,1ммоль) карбонату калію в 30мл толуолу і 10мл води додавали 0,3г (0,2ммоль) тетракіс(трифенілфосфін)-паладію (0). Суміш нагрівали при 100°С протягом 2 годин, охолоджували до температури приміщення і відділяли органічний шар. Водний шар екстрагували тричі етилацетатом. Об'єднані органічні розчини сушили над сульфатом магнію, фільтрували й концентрували у вакуумі. Залишок очищали хроматографічним методом (силікагель, елюент - 30% етилацетату в гексані). Одержано злегка забарвлену тверду речовину. Цей продукт суспендували в діетиловому ефірі, фільтрували й сушили у вакуумі. Одержано 0,6г (43%) сполуки, вказаної в заголовку. Аналітично вирахувано для C17H21NO 2S: %С, 67,29; %Н, 6,98; %N, 4,62. Фактично знайдено %С, 66,98; %Н, 6,96; %N, 4,36. Мас-спектр з польовою десорбцією: М=307. Приклад 27 N-2-(4-бромфеніл)пропіл-2-пропілсульфамід До суспензії 0,5г (2,0ммоль) проміжного продукту 31 в 5мл дихлорметану додавали 0,6мл (4,0ммоль) триетиламіну. Охолоджували суміш до 0°С і додавали 0,2мл (2,0ммоль) ізопропілсульфонілхлорвду. Після розмішування при 0°С протягом 20 хвилин суміш промивали один раз 10%-ним водним розчином бісульфату натрію і відділяли органічний шар. Водний шар екстрагували тричі дихлорметаном. Об'єднані органічні розчини сушили над сульфатом магнію, фільтрували й концентрували у вакуумі. Залишок очищали хроматографічним методом (50г силікагелю, елюент - 35% етилацетату в гексані). Одержано 0,2г (25%) сполуки, вказаної в заголовку. Аналітично вирахувано для C12H18NO 2SBr: %C, 45,01; %Н, 5,67; %N, 4,37. Фактично знайдено %С, 45,30; %Н, 5,92; %N, 4,43. Мас-спектр з польовою десорбцією: М+1=321. Приклад 28 N-2-(4-(3-тієніл)фенілпропіл-2-пропансульфамід A. N-2-(4-(3-тієніл)феніл)-N-трет-бутоксикарбонілпроліламін: До знегаженого розчину 8,2г (26,0ммоль) проміжного продукту 4, 4,0г (31,2ммоль) тіофен-3-борної кислоти і 5,3г (39,0ммоль) карбонату калію в 75мл діоксану і 25мл води додавали 1,5г (1,3ммоль) тетракіс(трифенілфосфін)паладію (0). Суміш нагрівали при 90°С протягом 18 годин. Охолоджували масу до температури приміщення і додавали до неї 20мл води і 100мл ефіру. Відділяли органічний шар. Водний шар екстрагували трьома порціями ефіру по 60мл кожна. Об'єднані органічні екстракти сушили над сульфатом магнію, фільтрували й концентрували у вакуумі. Залишок очищали хроматографічним методом (500г силікагелю, елюент - 10% етилацетату в гексані). Одержано 7,8г (94%) вищезазначеної сполуки. B. 2-(4-(3-тієніл)феніл)пропіламін, сіль з трифтороцтовою кислотою: Розчин 7,8г (24,6ммоль) продукту стадії А в 80мл 20%-ного розчину трифтороцтової кислоти в дихлорметані перемішували при температурі приміщення протягом 5 годин. Суміш концентрували у вакуумі. Одержано 8,1г (100%) вищезазначеної сполуки. С. Розчин 0,5г (1,5ммоль) продукту стадії В і 0,52мл (3,7ммоль) триетиламіну в 10мл дихлорметану охолоджували до 0°С. Додавали по краплях розчин 0,17мл (1,5ммоль) ізопропілсульфонілхлориду в 1мл дихлорметану. Усували льодову баню і перемішували масу при температурі приміщення протягом 5 годин. Промивали суміш 10мл 10%-ного водного розчину бісульфату натрію. Відділяли органічний шар. Водний шар екстрагували трьома порціями дихлорметану по 5мл кожна. Об'єднані органічні розчини сушили над сульфатом магнію, фільтрували й концентрували у вакуумі. Залишок очищали хроматографічним методом (25г силікагелю, елюент - 35% етилацетату в гексані). Одержано 0,100г (21%) сполуки, вказаної в заголовку. Аналітично вирахувано для. C16H21NO2S2 : %C, 59,41; %Н, 6,54; %N, 4,33. Фактично знайдено %CS 59,34; %Н, 6,34; %N, 4,29. Мас-спектр з польовою десорбцією: М=323. Приклад 29 N-2-(4-(3-тієніл)фенілпропіл-диметилсульфамід А. Розчин 0,5г (1,5ммоль) продукту, одержаного на стадії Б Прикладу 28, і 0,52мл (3,7ммоль) триетиламіну в 10мл дихлорметану охолоджували до 0°С. Додавали по краплях розчин 0,16мл (1,5ммоль) диметилсульфамоїлхлориду в 1мл дихлорметану. Усували льодову баню і перемішували масу при температурі приміщення протягом 5 годин. Промивали суміш 10мл 10%-ного водного розчину бісульфату натрію. Відділяли органічний шар. Водний шар екстрагували трьома порціями дихлорметану по 5мл кожна, Об'єднані органічні розчини сушили над сульфатом магнію, фільтрували й концентрували у вакуумі. Залишок суспендували в суміші ефіру з гексаном (50:50) і фільтрували. Одержано 0,22г (46%) сполуки, вказаної в заголовку. Аналітично вирахувано для С15H20N2 O2S 2: %С, 55,53; %Н, 6,21; %N, 8,63. Фактично знайдено %С, 55,51; %Н, 6,21; %N, 8,39. Мас-спектр з польовою десорбцією: М=324. Приклад 30 N-2-(4-метоксифеніл)пропіл-2-пропансульфамід Сполуку, названу в заголовку, одержано з проміжного продукту 10 за методикою Прикладу 13. Мас-спектр з польовою десорбцією: М=271,4. Аналіз для C13H21NO3S: Теоретичний розрахунок С, 56,71; Н, 8,16; N, 4,86. Фактично знайдено С, 57,54; Н, 7,80; N, 5,16. Приклад 31 N-2-(4-метилфеніл)пропіл-2-пропансульфамід Сполуку, названу в заголовку, одержано з проміжного продукту 33 за методикою Прикладу 13. Мас-спектр з польовою десорбцією: М=255,2. Аналіз для C13H21NO2S: Теоретичний розрахунок С, 61,14; Н, 8,29; N, 5,48. Фактично знайдено С, 61,23; Н, 8,35; N, 5,30. Приклад 32 N-2-(4-ізопропілфеніл)пропіл-етансульфамід Сполуку, названу в заголовку, одержано з проміжного продукту 8 за методикою, описаною в Прикладі 13, з тим винятком, що замість ізопропілсульфонілхлориду був використаний етансульфонілхлорид. Мас-спектр з польовою десорбцією: М=269,1. Аналіз для С 14H23NO2S: Теоретичний розрахунок С, 62,42; Н, 8,61; N, 5,20. Фактично знайдено С, 62,68; Н, 8,34; N, 5,11. Приклад 33 N-2-(4-ізопропілфеніл)пропіл-диметилсульфамід Сполуку, названу в заголовку, одержано з проміжного продукту 8 за методикою, описаною в Прикладі 13, з тим винятком, що замість ізопропілсульфонілхлориду був використаний диметилсульфамоїлхлорид. Мас-спектр з польовою десорбцією: М=349,1. Аналіз для C14H23F 3NO2S: Теоретичний розрахунок С, 55,00; Н, 6,35; N, 4,01. Фактично знайдено С, 54,70; Н, 6,12; N, 3,82. Приклад 34 N-2-(4-ізобутилфеніл)пропіл-2-пропансульфамід Сполуку, названу в заголовку, одержано з 2-(4-ізобутилфеніл)пропіламіну гидрохлориду за методикою, описаною в Прикладі 13. Мас-спектр з польовою десорбцією: М=297,2. Аналіз для C16H27NO2S: Теоретичний розрахунок С, 64,61; Н, 9,15; N, 4,71. Фактично знайдено С, 64,84; Н, 9,10; N, 4,74. Приклад 35 N-2-(4-циклопентилфеніл)пропіл-2-пропансульфамід Сполуку, названу в заголовку, одержано з ((4-бром)2-метилфенетил)2-пропансульфаміду за методикою, описаною в Прикладі 15, режим 2. Мас-спектр з польовою десорбцією: М=309,3. Аналіз для С 17H27NO2S: Теоретичний розрахунок С, 65,98; Н, 8,79; N, 4,53. Фактично знайдено С, 66,21; Н, 9,04; N, 4,54. Приклад 36 N-2-(4-циклогексилфеніл)пропіл-2-пропансульфамід Сполуку, названу в заголовку, одержано з продукту, одержаного за Прикладом 27, за методикою, описаною в Прикладі 15, режим 2, з тим винятком, що замість циклопентилмагнійброміду був використаний циклогексилмагнійхлорид. Мас-спектр з польовою десорбцією; М=323,3. Аналіз для C18H29F 3NO2S; Теоретичний розрахунок С, 66,83; Н, 9,04; N, 4,33. Фактично знайдено С, 67,00; Н, 9,18; N, 4,09. Приклад 37 N-2-(3-хлор-4-піперидинілфеніл)пропіл-2-пропансульфамід Сполуку, названу в заголовку, одержано з 2-(3-хлор-4-піперидинілфеніл)пропіламіну гідрохлориду за методикою, описаною в Прикладі 13. Мас-спектр з польовою десорбцією: М=358,2. Аналіз для C17H27CIN2O 2S: Теоретичний розрахунок С, 56,89; Н, 7,58; N, 7,80. Фактично знайдено С, 57,19; Н, 7,68; N, 8,02. Приклад 38 N-2-(-)-(4-піперидинілфеніл)пропіл-2-пропансульфамід Сполуку, названу в заголовку, одержано з (-)-2-(4-піперидинілфеніл) пропіламіну гідрохлориду за методикою, описаною в Прикладі 13. Мас-спектр з польовою десорбцією: М=324,2. Аналіз для С 17H28F 3N2O 2S: Теоретичний розрахунок С, 62,93; Н, 8,70; N, 8,63. Фактично знайдено С, 63,22; Н, 8,51; N, 8,49. Приклад 39 N-2-(+)-(4-піперидинілфеніл)пропіл-2-пропансульфамід Сполуку, названу в заголовку, одержано з (+)-2-(4-піперидинілфеніл)пропіламіну гідрохлориду (Synthesis 6, 447, 1991) за методикою, описаною в Прикладі 13. Мас-спектр з польовою десорбцією: М=324,2. Аналіз для C17H28F 3N2O 2S: Теоретичний розрахунок С, 62,93; Н, 8,70; N, 8,63. Фактично знайдено С, 62,68; Н, 8,45; N, 8,72. Приклад 40 N-2-(4-бензилоксифеніл)пропіл-2-пропансульфамід Сполуку, названу в заголовку, одержано з проміжного продукту 35 за методикою, описаною в Прикладі 13. Мас-спектр з польовою десорбцією: М=347,2. Аналіз для C19H25NО3S: Теоретичний розрахунок С, 65,68; Н, 7,25; N, 4,03. Фактично знайдено С, 65,63; Н, 7,31; N, 4,07. Приклад 41 N-2-(4-ізопропоксифеніл)пропіл-2-пропансульфамід Проміжний продукт 36 (0,14г, 0,40ммоль) розчиняли в диметилформаміді і додавали гідрид натрію (0,018г, 0,44ммоль). Через 10 хвилин додавали 2-бромпропан (0,054г, 0,44ммоль) і перемішували реакційну масу при температурі приміщення протягом 2 годин. Перерозподіляли реакційну суміш між діетиловим ефіром і водою. Органічний шар промивали розсолом, сушили над сульфатом магнію і концентрували у вакуумі. Залишок очищали хроматографічним методом (SіO2, елюент - 20% етилацетату в гексані). Одержано 0,11г (70%) алкілованого продукту. Цей продукт розчиняли в дихлорметані і обробляли трифтороцтовою кислотою при температурі приміщення. Реакційну масу промивали водою, розсолом, сушили над сульфатом магнію і концентрували у вакуумі. Одержано 0,083г сполуки, названої в заголовку. Мас-спектр з польовою десорбцією: М=299,0. Аналіз для C15H25NO3S: Теоретичний розрахунок С, 60,17; Н, 8,42; N, 4,68. Фактично знайдено C, 58,57; Η, 8,40; Ν, 4,31. Приклад 42 N-2-(4-(2-фторфеніл)феніл)пропіл-2-метансульфамід Розчин 1,6г (6,5ммоль) проміжного продукту 6 і 1,2мл (7,1ммоль) Ν,Ν-діізопропілметиламіну в 20мл дихлорметану охолоджували до 0°С. Додавали по краплях розчин 0,51мл (6,5ммоль) метансульфонілхлориду в 1мл дихлорметану. Усували льодову баню і перемішували масу при температурі приміщення протягом години. Промивали масу 20мл 10%-ного водного розчину бісульфату натрію,
ДивитисяДодаткова інформація
Назва патенту англійськоюSulfonamide derivatives
Автори англійськоюEscribano Ana Maria, Smith Edward C. R.
Назва патенту російськоюПроизводные сульфамида
Автори російськоюБлейш Томас Джон, Эскрибано Ана Мария, Смит Эдвард К.Р.
МПК / Мітки
МПК: A61K 31/4406, C07D 277/66, C07D 307/12, C07C 311/04, C07C 311/18, C07D 333/22, A61K 31/455, C07D 261/10, C07D 333/58, C07D 277/24, A61K 31/41, C07D 213/42, A61K 31/42, C07C 311/53, A61K 31/54, A61K 31/426, C07C 311/14, C07D 207/16, C07C 311/39, A61K 31/4245, C07D 207/277, C07C 307/00, C07D 213/76, C07D 239/26, A61K 31/4465, C07D 271/06, C07D 333/16, A61K 31/695, C07D 277/10, C07C 311/05, C07C 311/13, C07D 277/56, C07D 213/82, C07D 261/18, A61K 31/5375, C07D 277/28, C07D 333/20, C07C 311/06, C07D 333/40, C07C 311/09, C07D 409/04, A61K 31/4402, A61K 31/451, A61K 31/341, C07D 333/38, A61K 31/4439, C07D 277/26, C07C 311/16, A61K 31/428, A61K 31/4409, A61K 31/505, C07C 311/08, C07D 307/52, A61K 31/4418, C07C 311/03, C07D 307/68, C07C 311/29, C07D 213/81, C07D 333/68, C07D 295/20, C07D 295/12, A61K 31/40, A61K 31/381, C07D 307/71, C07D 211/28, C07D 277/20, C07D 261/08, C07D 333/28, C07D 211/18, C07D 279/00, C07D 333/34, C07D 257/00, A61K 31/18, C07C 311/24, C07D 211/26, A61K 31/495, C07C 311/11
Мітки: похідні, фармацевтична, спосіб, основі, композиція, одержання, сульфонаміду
Код посилання
<a href="https://ua.patents.su/64-71892-pokhidni-sulfonamidu-sposib-kh-oderzhannya-ta-farmacevtichna-kompoziciya-na-kh-osnovi.html" target="_blank" rel="follow" title="База патентів України">Похідні сульфонаміду, спосіб їх одержання та фармацевтична композиція на їх основі</a>
Попередній патент: Спосіб обробки неоднорідних по проникності продуктивних пластів
Наступний патент: Спосіб з’єднання елементів складених деталей
Випадковий патент: Спосіб розконсервації тимчасово неробочих бортів кар'єрів












