Похідні нітрокатехолу як комт-інгібітори
Номер патенту: 94054
Опубліковано: 11.04.2011
Автори: Кісс Ласло Ерно, Дос Сантос Феррейра Умберто, Ліл Палма Педро Нуно, Лєрмонт Дейвід Александер, Араужо Соарес Да Сілва Патрісіо Мануель Віейра
Формула / Реферат
1. Сполука формули (І):
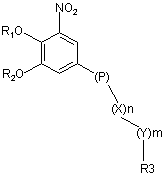 , (I)
, (I)
де R1 і R2 є незалежно одна від одної воднем або групою, що здатна гідролізуватись при фізіологічних умовах, необов'язково заміщеними нижчим алканоїлом або ароїлом;
Х представляє метиленову групу;
Y представляє атом кисню, нітрогену або сульфуру;
n представляє число 0, 1, 2 або 3, a
m представляє число 0 або 1;
R3 представляє групу піридин N-оксиду згідно з формулою А, В або С, яка сполучена як позначено невідміченим зв'язком:
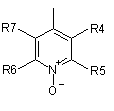 ,
, 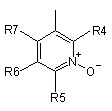 ,
, 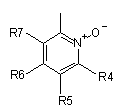 ,
,
А В С
де R4, R5, R6 і R7 незалежно одна від одної представляють водень, С1-С6-алкіл, С1-С6-тіоалкіл, С1-С6-алкокси, С6-С12-арилокси або С6-С12-тіоарилову групу, С1-С6-алканоїл або С7-С13-ароїлову групу, аміно, С1-С6-алкіламіно, С1-С6-діалкіламіно, С3-С12-циклоалкіламіно або С3-С12-гетероциклоалкіламіно, С1-С6-алкілсульфоніл або С6-С12-арилсульфоніл, галоген, С1-С6-галоалкіл, трифторметил, ціано, нітро або гетероарильну групу;
або де два або більше залишків R4, R5, R6 і R7 взяті разом, представляють аліфатичні або гетероаліфатичні кільця або ароматичні або гетероароматичні кільця, і де Р представляє центральний блок, переважно вибраний з регіоізомерів 1,3,4-оксадіазол-2,5-діїлу, 1,2,4-оксадіазол-3,5-діїлу, 4-метил-4Н-1,2,4-триазол-3,5-діїлу, 1,3,5-триазин-2,4-діїлу, 1,2,4-триазин-3,5-діїлу, 2Н-тетразол-2,5-діїлу, 1,2,3-тіадіазол-4,5-діїлу, 1-алкіл-3-(алкоксикарбоніл)-1Н-пірол-2,5-діїлу, де алкіл представлений метилом, етилом, n-пропілом і n-бутилом, і де алкокси представлений метокси, етокси, n-пропокси і ізопропокси, 1-алкіл-1Н-пірол-2,5-діїлом, де алкіл представлений метилом, етилом, n-пропілом і n-бутилом, тіазол-2,4-діїлом, 1-Н-піразол-1,5-діїлом, піримідин-2,4-діїлом, оксазол-2,4-діїлом, карбонілом, 1Н-імідазол-1,5-діїлом, ізоксазол-3,5-діїлом, фуран-2,4-діїлом, 3-алкоксикарбонілфуран-2,4-діїлом, де алкокси представлений метокси, етокси, n-пропокси і ізопропокси, бензол-1,3-діїлом і (Z)-1-ціаноетен-1,2-діїлом, і де регіоізомери центрального блока включають обидва регіоізомери, отримані обміном частини нітрокатехолу і частини -(Х)n-(Y)m-R3.
2. Сполука за п. 1, вибрана з групи, що включає
5-[3-(3,5-дихлор-1-оксипіридин-4-іл)-[1,2,4]оксадіазол-5-іл]-3-нітробензол-1,2-діол,
5-[3-(2-хлор-1-оксипіридин-4-іл)-[1,2,4]оксадіазол-5-іл]-3-нітробензол-1,2-діол,
5-[3-(2-морфолін-4-іл-1-оксипіридин-4-іл)-[1,2,4]оксадіазол-5-іл]-3-нітробензол-1,2-діол,
3-нітро-5-[3-(1-окси-4-трифторметилпіридин-3-іл)-[1,2,4]оксадіазол-5-іл]-бензол-1,2-діол,
5-[3-(4-бром-1-оксипіридин-3-іл)-[1,2,4]оксадіазол-5-іл]-3-нітробензол-1,2-діол,
5-[3-(2-хлор-6-метил-1-оксипіридин-3-іл)-[1,2,4]оксадіазол-5-іл]-3-нітробензол-1,2-діол,
5-[3-(2-морфолін-4-іл-1-оксипіридин-3-іл)-[1,2,4]оксадіазол-5-іл]-3-нітробензол-1,2-діол,
3-нітро-5-[3-(1-окси-6-трифторметилпіридин-3-іл)-[1,2,4]оксадіазол-5-іл]-бензол-1,2-діол,
5-[3-(2-метил-1-окси-6-трифторметилпіридин-3-іл)-[1,2,4]оксадіазол-5-іл]-3-нітробензол-1,2-діол,
5-[3-(6-метил-1-окси-4-трифторметилпіридин-3-іл)-[1,2,4]оксадіазол-5-іл]-3-нітробензол-1,2-діол,
5-[3-(2,6-диметил-1-окси-4-трифторметилпіридин-3-іл)-[1,2,4]оксадіазол-5-іл]-3-нітробензол-1,2-діол,
5-[3-(2-метил-1-окси-6-феніл-4-трифторметилпіридин-3-іл)-[1,2,4]оксадіазол-5-іл]-3-нітробензол-1,2-діол,
5-[3-(6-метил-1-окси-2-феніл-4-трифторметилпіридин-3-іл)-[1,2,4]оксадіазол-5-іл]-3-нітробензол-1,2-діол,
5-[3-(2-бром-6-метил-1-оксипіридин-3-іл)-[1,2,4]оксадіазол-5-іл]-3-нітробензол-1,2-діол,
5-[3-(2-хлор-4,6-диметил-1-оксипіридин-3-іл)-[1,2,4]оксадіазол-5-іл]-3-нітробензол-1,2-діол,
5-[3-(2-бром-4,6-диметил-1-оксипіридин-3-іл)-[1,2,4]оксадіазол-5-іл]-3-нітробензол-1,2-діол,
5-[3-(2-бром-4,5,6-триметил-1-оксипіридин-3-іл)-[1,2,4]оксадіазол-5-іл]-3-нітробензол-1,2-діол,
5-[3-(2-хлор-4,5,6-триметил-1-оксипіридин-3-іл)-[1,2,4]оксадіазол-5-іл]-3-нітробензол-1,2-діол,
5-[3-(2,5-дихлор-4,6-диметил-1-оксипіридин-3-іл)-[1,2,4]оксадіазол-5-іл]-3-нітробензол-1,2-діол,
5-[3-(2-бром-5-хлор-4,6-диметил-1-оксипіридин-3-іл)-[1,2,4]оксадіазол-5-іл]-3-нітробензол-1,2-діол і
3-нітро-5-[3-(1-окси-2-трифторметилпіридин-3-іл)-[1,2,4]оксадіазол-5-іл]-бензол-1,2-діол.
3. Фармацевтична композиція, що містить терапевтично ефективну кількість сполуки за п. 1 або п. 2 у комбінації з фармацевтично прийнятним носієм.
4. Спосіб лікування суб'єкта, ураженого порушеннями центральної або периферичної нервової системи, причому при зазначеному способі суб'єкту вводять ефективну кількість сполуки за п. 1 або п. 2 або фармацевтичної композиції за п. 3.
5. Спосіб за п. 4, де порушення вибрано з порушень настрою, хвороби Паркінсона і паркінсонівських порушень, синдрому втомлених ніг, шлунково-кишкових розладів, станів, що супроводжуються утворенням едеми, і гіпертензії.
6. Сполука за п. 1 або п. 2 для виготовлення лікарського засобу для застосування як КОМТ (катехол-О-метилтрансфераза) інгібітора.
7. Спосіб отримання сполук згідно з формулою І, що включає етапи, де сполуку формули IIА або ІІВ, або ІІС
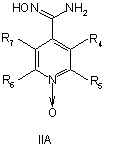 ,
,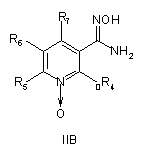 ,
,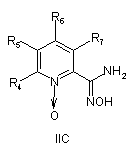 ,
,
де R4, R5, R6 і R7 визначені, як у загальній формулі І за п. 1,
піддають циклізації зі сполукою формули III
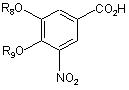 , (III)
, (III)
де R8 і R9 незалежно одна від одної представляють водень або придатні захисні групи для ароматичних гідроксильних груп,
при умовах, придатних для отримання похідних оксадіазолу формули IVA, IVB або IVC
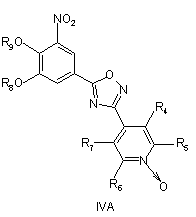 ,
,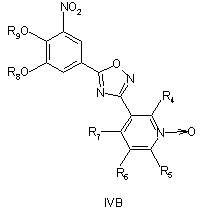 ,
,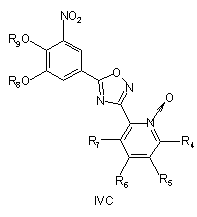 ,
,
необов'язково з наступним видаленням захисних груп R8 і/або R9.
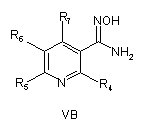
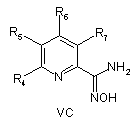
8. Спосіб отримання сполук згідно з формулою І, що включає етапи, де сполуку формули VA абоVB, або VC
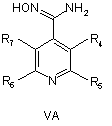 ,
, ,
, ,
,
де R4, R5, R6 і R7 визначені, як у загальній формулі І за п. 1,
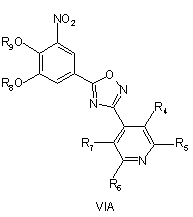
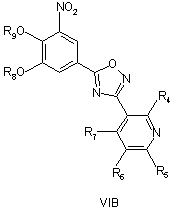
піддають циклізації зі сполукою формули III при умовах, придатних для отримання похідних оксадіазолу формули VIA, VIB або VIC
 ,
, ,
,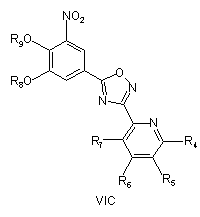 ,
,
з наступним окисленням атома нітрогену піридилу для отримання сполуки згідно з формулою IVA або IVB, або IVC, необов'язково з наступним видаленням захисних груп R8 і/або R9.
9. Спосіб за п. 7 або п. 8, де сполуку формули III активують реакцією з тіонілхлоридом або 1,1-карбонілдіімідазолом.
10. Спосіб за будь-яким з пп. 7-9, де етап циклізації, що складається з конденсації і дегідратації, проводять послідовно в однореакторній реакції.
11. Спосіб за будь-яким з пп. 7-10, де етап циклізації виконують у присутності придатної органічної основи.
12. Спосіб за п. 11, де етап циклізації виконують у присутності піридину.
13. Спосіб за будь-яким з пп. 7-11, де групи R8 і R9 незалежно одну від одної або разом видаляють і заміщають воднем або групою, що здатна гідролізуватись при фізіологічних умовах.
14. Спосіб за будь-яким з пп. 7-13, де R8 і R9 сполуки формули III незалежно одна від одної представляють метил або водень.
15. Спосіб за п. 14, де метильну групу видаляють реакцією з хлоридом алюмінію і піридином у N-метилпіролідиноні.
16. Спосіб за будь-яким з пп. 7-15, де конденсацію і дегідратацію здійснюють у диполярному апротонному розчиннику.
17. Спосіб за п. 16, де конденсацію і дегідратацію здійснюють у диметилацетаміді, N-метилпіролідиноні або диметилсульфоксиді.
18. Спосіб за будь-яким з пп. 8-17, де атом нітрогену піридилу сполуки оксадіазолілу формули VIA або VIB, або VIC окислюють пероксидом водню, надоцтовою кислотою, трифторнадоцтовою кислотою або комплексом перекису водню з сечовиною і трифтороцтовим ангідридом.
19. Спосіб за будь-яким з пп. 7 і 9-17, де сполуку формули IIА або ІІВ, або ІІС отримують реакцією сполуки VIIA абоVIIB, або VIIC, відповідно,
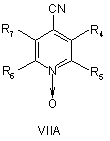 ,
,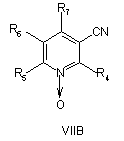 ,
,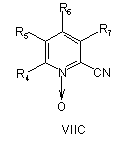 ,
,
де R4, R5, R6 і R7 визначені, як у загальній формулі І за п. 1,
з гідроксиламіном у присутності хелатного агента при умовах, придатних для отримання похідних амідоксиму.
20. Спосіб за будь-яким з пп. 8-17, де сполуку формули VA, VB або VC отримують реакцією сполуки VIIIA абоVIIIB, або VIIIC, відповідно,
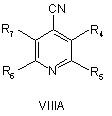 ,
,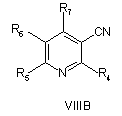 ,
,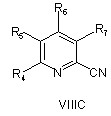 ,
,
де R4, R5, R6 і R7 визначені як у загальній формулі І за п. 1, з гідроксиламіном у присутності хелатного агента при умовах, придатних для отримання похідних амідоксиму.
21. Спосіб за п. 17 або 18, де хелатний агент вибирають з групи, що складається з 8-гідроксихіноліну, орто-фенантроліну і їх гідратів або похідних.
22. Спосіб отримання сполук за формулою І, при якому виконують окислення відповідної сполуки піридину до сполуки піридин N-оксиду.
Текст
1. Сполука формули (І): (P) (X)n (Y)m R3 , (I) де R1 і R2 є незалежно одна від одної воднем або групою, що здатна гідролізуватись при фізіологічних умовах, необов'язково заміщеними нижчим алканоїлом або ароїлом; Х представляє метиленову групу; Y представляє атом кисню, нітрогену або сульфуру; n представляє число 0, 1, 2 або 3, a m представляє число 0 або 1; R3 представляє групу піридин N-оксиду згідно з формулою А, В або С, яка сполучена як позначено невідміченим зв'язком: (11) R2O UA R1O 94054 (13) NO2 (19) (21) a200802153 (22) 26.07.2006 (24) 11.04.2011 (86) PCT/PT2006/000020, 26.07.2006 (31) 0515327.5 (32) 26.07.2005 (33) GB (31) 06008203.9 (32) 20.04.2006 (33) EP (31) 06011073.1 (32) 30.05.2006 (33) EP (46) 11.04.2011, Бюл.№ 7, 2011 р. (72) ЛЄРМОНТ ДЕЙВІД АЛЕКСАНДЕР, PT, КІСС ЛАСЛО ЕРНО, PT, ЛІЛ ПАЛМА ПЕДРО НУНО, PT, ДОС САНТОС ФЕРРЕЙРА УМБЕРТО, PT, АРАУЖО СОАРЕС ДА СІЛВА ПАТРІСІО МАНУЕЛЬ ВІЕЙРА, PT (73) ПОРТЕЛА ЕНД КА. С.А., PT (56) EP 1167342 A TERVO, ANU J. et al: " A str4ucture-activsty relationship study of catechol-0-methyltransferase inhibitors combining molecular docking and 3D QSAR methods" JOURNAL OF COMPUTER-AIDED MOLECULAR DESIGN, VOLUM DATE 2003, 17(12), 797-810 CODEN: JCADEQ; ISSN: 0920-654x, 2004, XP002402314 page 799; table 1 LEARMONTH, DAVID A. et al: "Chemical Synthesis and Characterization of Conjugates of a Novel Catechol-0-methyltransferase Inhibitor" 2 C2 1 3 R7 R7 R7 R6 R6 R6 R4 R4R4 + + + NN R7 R7 R7 R5 R5R5 R6 R6 R6 94054 R4 R7 R4 R4 R7 R7 + OO , + + N N N O O O R5 R5 R5 R6 R6 R6 + O+ O + O NN N R4 R4 R4 R5 R5 R5 , , АВС де R4, R5, R6 і R7 незалежно одна від одної представляють водень, С1-С6-алкіл, С1-С6-тіоалкіл, С1С6-алкокси, С6-С12-арилокси або С6-С12-тіоарилову групу, С1-С6-алканоїл або С7-С13-ароїлову групу, аміно, С1-С6-алкіламіно, С1-С6-діалкіламіно, С3-С12циклоалкіламіно або С3-С12гетероциклоалкіламіно, С1-С6-алкілсульфоніл або С6-С12-арилсульфоніл, галоген, С1-С6-галоалкіл, трифторметил, ціано, нітро або гетероарильну групу; або де два або більше залишків R4, R5, R6 і R7 взяті разом, представляють аліфатичні або гетероаліфатичні кільця або ароматичні або гетероароматичні кільця, і де Р представляє центральний блок, переважно вибраний з регіоізомерів 1,3,4оксадіазол-2,5-діїлу, 1,2,4-оксадіазол-3,5-діїлу, 4метил-4Н-1,2,4-триазол-3,5-діїлу, 1,3,5-триазин2,4-діїлу, 1,2,4-триазин-3,5-діїлу, 2Н-тетразол-2,5діїлу, 1,2,3-тіадіазол-4,5-діїлу, 1-алкіл-3(алкоксикарбоніл)-1Н-пірол-2,5-діїлу, де алкіл представлений метилом, етилом, n-пропілом і nбутилом, і де алкокси представлений метокси, етокси, n-пропокси і ізопропокси, 1-алкіл-1Н-пірол2,5-діїлом, де алкіл представлений метилом, етилом, n-пропілом і n-бутилом, тіазол-2,4-діїлом, 1Н-піразол-1,5-діїлом, піримідин-2,4-діїлом, оксазол-2,4-діїлом, карбонілом, 1Н-імідазол-1,5-діїлом, ізоксазол-3,5-діїлом, фуран-2,4-діїлом, 3алкоксикарбонілфуран-2,4-діїлом, де алкокси представлений метокси, етокси, n-пропокси і ізопропокси, бензол-1,3-діїлом і (Z)-1-ціаноетен-1,2діїлом, і де регіоізомери центрального блока включають обидва регіоізомери, отримані обміном частини нітрокатехолу і частини -(Х)n-(Y)m-R3. 2. Сполука за п.1, вибрана з групи, що включає 5-[3-(3,5-дихлор-1-оксипіридин-4-іл)[1,2,4]оксадіазол-5-іл]-3-нітробензол-1,2-діол, 5-[3-(2-хлор-1-оксипіридин-4-іл)-[1,2,4]оксадіазол5-іл]-3-нітробензол-1,2-діол, 5-[3-(2-морфолін-4-іл-1-оксипіридин-4-іл)[1,2,4]оксадіазол-5-іл]-3-нітробензол-1,2-діол, 3-нітро-5-[3-(1-окси-4-трифторметилпіридин-3-іл)[1,2,4]оксадіазол-5-іл]-бензол-1,2-діол, 5-[3-(4-бром-1-оксипіридин-3-іл)-[1,2,4]оксадіазол5-іл]-3-нітробензол-1,2-діол, 5-[3-(2-хлор-6-метил-1-оксипіридин-3-іл)[1,2,4]оксадіазол-5-іл]-3-нітробензол-1,2-діол, 5-[3-(2-морфолін-4-іл-1-оксипіридин-3-іл)[1,2,4]оксадіазол-5-іл]-3-нітробензол-1,2-діол, 3-нітро-5-[3-(1-окси-6-трифторметилпіридин-3-іл)[1,2,4]оксадіазол-5-іл]-бензол-1,2-діол, 5-[3-(2-метил-1-окси-6-трифторметилпіридин-3-іл)[1,2,4]оксадіазол-5-іл]-3-нітробензол-1,2-діол, 5-[3-(6-метил-1-окси-4-трифторметилпіридин-3-іл)[1,2,4]оксадіазол-5-іл]-3-нітробензол-1,2-діол, 5-[3-(2,6-диметил-1-окси-4-трифторметилпіридин3-іл)-[1,2,4]оксадіазол-5-іл]-3-нітробензол-1,2-діол, 4 5-[3-(2-метил-1-окси-6-феніл-4трифторметилпіридин-3-іл)-[1,2,4]оксадіазол-5-іл]3-нітробензол-1,2-діол, 5-[3-(6-метил-1-окси-2-феніл-4трифторметилпіридин-3-іл)-[1,2,4]оксадіазол-5-іл]3-нітробензол-1,2-діол, 5-[3-(2-бром-6-метил-1-оксипіридин-3-іл)[1,2,4]оксадіазол-5-іл]-3-нітробензол-1,2-діол, 5-[3-(2-хлор-4,6-диметил-1-оксипіридин-3-іл)[1,2,4]оксадіазол-5-іл]-3-нітробензол-1,2-діол, 5-[3-(2-бром-4,6-диметил-1-оксипіридин-3-іл)[1,2,4]оксадіазол-5-іл]-3-нітробензол-1,2-діол, 5-[3-(2-бром-4,5,6-триметил-1-оксипіридин-3-іл)[1,2,4]оксадіазол-5-іл]-3-нітробензол-1,2-діол, 5-[3-(2-хлор-4,5,6-триметил-1-оксипіридин-3-іл)[1,2,4]оксадіазол-5-іл]-3-нітробензол-1,2-діол, 5-[3-(2,5-дихлор-4,6-диметил-1-оксипіридин-3-іл)[1,2,4]оксадіазол-5-іл]-3-нітробензол-1,2-діол, 5-[3-(2-бром-5-хлор-4,6-диметил-1-оксипіридин-3іл)-[1,2,4]оксадіазол-5-іл]-3-нітробензол-1,2-діол і 3-нітро-5-[3-(1-окси-2-трифторметилпіридин-3-іл)[1,2,4]оксадіазол-5-іл]-бензол-1,2-діол. 3. Фармацевтична композиція, що містить терапевтично ефективну кількість сполуки за п.1 або п.2 у комбінації з фармацевтично прийнятним носієм. 4. Спосіб лікування суб'єкта, ураженого порушеннями центральної або периферичної нервової системи, причому при зазначеному способі суб'єкту вводять ефективну кількість сполуки за п.1 або п.2 або фармацевтичної композиції за п.3. 5. Спосіб за п.4, де порушення вибрано з порушень настрою, хвороби Паркінсона і паркінсонівських порушень, синдрому втомлених ніг, шлунково-кишкових розладів, станів, що супроводжуються утворенням едеми, і гіпертензії. 6. Сполука за п.1 або п.2 для виготовлення лікарського засобу для застосування як КОМТ (катехолО-метилтрансфераза) інгібітора. 7. Спосіб отримання сполук згідно з формулою І, що включає етапи, де сполуку формули IIА або ІІВ, або ІІС HON HON NH2NH2 HON R7 R7 NOH NOH NH2 R7 R7 R4 R4 R6 R6 R7 R4 N R6 R6 R6 N R5 R5 N R5 R7 R5 R5 NH2NH2R5 R6 O O O R6 N OO O 0R4 0R4 R 0 4 R R4 NN N R44 R7 R7 R7 NH2 R5 R5 N N R5 R6 R6 NOH NH2 2 NH NH2 NOH NOH NOH OO O IIC IIC IIC IIA IIA IIB IIB IIA IIB , , , де R4, R5, R6 і R7 визначені, як у загальній формулі І за п.1, піддають циклізації зі сполукою формули III R8O CO2H R9O NO2 , (III) де R8 і R9 незалежно одна від одної представляють водень або придатні захисні групи для ароматичних гідроксильних груп, при умовах, придатних для отримання похідних оксадіазолу формули IVA, IVB або IVC 5 94054 NO2 NO2 NO2 R9 O R9 O R9O R9O O O R8 O R8 O O O N N NN R8 O R8 O IVA IVA OO NN R R6 6 O O RO 8 R8O R R4 4 R R77 R5 R5 N N RR6 6 N N N N R4 R4 RR 7 7 2 NO2 R9 O R9 O RR5 5 IVB IVB , NO2 R9O O N N R7 N R6 O R8O R4 N O N N O R7 R4 R5 R5 R6 IVC IVB , , необов'язково з наступним видаленням захисних груп R8 і/або R9. 8. Спосіб отримання сполук згідно з формулою І, що включає етапи, де сполуку формули VA абоVB, або VC HON HON NH2 NH2 R R77 NH2 R7 R 7 NOH 6 4 R R NOH NOH R7 R R66 R R4 R4R R666 R NH NH22 NH R5 R5 5 R R R7 7 7 2 R6 R6 N N N R5 R5R5 N N N R R55 5 R VC VC VC VB VB VB VA VAVA NH NH NH2 2 2 N NN R R4 R4 4 R4 R44 R NOH NOH NOH , , , де R4, R5, R6 і R7 визначені, як у загальній формулі І за п.1, піддають циклізації зі сполукою формули III при умовах, придатних для отримання похідних оксадіазолу формули VIA, VIB або VIC R9 O R9 O R8 O R8 O NO2 NO2 R9 O R9 O O R8 O R8 O O N N N N R4R 7 R9O O R7 N R6 VIB O R8O O R O OO N N N N R5 R5 , R7 R4 6 R6 VIC , CN R7 R4 R R4 7 RR R6 6 R5 OO O VIIB VIIB VIIB CN CN R7 CN R4 4 R4 NN NCN CN R OO O NN RR7 R7 7 R5 5 R5 R VIIC VIIC VIIC , R , , R4 4 де R5, R6 і R7 визначені, як у загальній формулі І за п.1, R5R5 R R6 6 з гідроксиламіном у присутності хелатного агента VIC VIC при умовах, придатних для отримання похідних амідоксиму. 20. Спосіб за будь-яким з пп.8-17, де сполуку формули VA, VB або VC отримують реакцією сполуки VIIIA або VIIIB, або VIIIC, відповідно, RR7 R7 , 4 R7 R N R5 N N VIIA VIIA VIIA N N R6 6 R6 R CN CN CN R6 R6R6 N N N R5R5R5 R5R5 R5 N N N R4 4 R4 R O RO R88 O 4 R4 VIB VIB , NO2 R4 N N N N R6 R6 VIA VIA N O O R7R7 R7 R4R4R4 R6R6 R6 2 RO R99 O 5 NN R6 R6 N NO R7 R7 R7NO 2 R7 R7 R5 R з наступним окисленням атома нітрогену піридилу NO2 NO2 для отримання сполуки згідно з формулою IVA або IVB, або IVC, необов'язково з наступним видаленням захисних груп R8 і/або R9. O O 9. Спосіб N п.7 або п.8, де сполуку формули III за N O O N N активують реакцією з тіонілхлоридом або 1,1карбонілдіімідазолом. N N R 4 R4 10. R7 R7 Спосіб за будь-яким з пп.7-9, де етап циклізації, що складається з конденсації і дегідратації, R5 R5 R6 R проводять6 послідовно в однореакторній реакції. IVC IVC 11. Спосіб за будь-яким з пп.7-10, де етап циклізації виконують у присутності придатної органічної основи. 12. Спосіб за п.11, де етап циклізації виконують у присутності піридину. 13. Спосіб за будь-яким з пп.7-11, де групи R8 і R9 незалежно одну від одної або разом видаляють і заміщають воднем або групою, що здатна гідролізуватись при фізіологічних умовах. 14. Спосіб за будь-яким з пп.7-13, де R8 і R9 сполуки формули III незалежно одна від одної представляють метил або водень. 15. Спосіб за п.14, де метильну групу видаляють реакцією з хлоридом алюмінію і піридином у Nметилпіролідиноні. 16. Спосіб за будь-яким з пп.7-15, де конденсацію і дегідратацію здійснюють у диполярному апротонному розчиннику. 17. Спосіб за п.16, де конденсацію і дегідратацію здійснюють у диметилацетаміді, Nметилпіролідиноні або диметилсульфоксиді. 18. Спосіб за будь-яким з пп.8-17, де атом нітрогену піридилу сполуки оксадіазолілу формули VIA або VIB, або VIC окислюють пероксидом водню, надоцтовою кислотою, трифторнадоцтовою кислотою або комплексом перекису водню з сечовиною і трифтороцтовим ангідридом. 19. Спосіб за будь-яким з пп.7 і 9-17, де сполуку формули IIА або ІІВ, або ІІС отримують реакцією сполуки VIIA абоVIIB, або VIIC, відповідно, CN CN CN NO2 NO2 4 R7 R 6 NN N 4 RR R55 5 RR 6 R6 R7 R7 CNCN 6 RRR5 5 5 R 6 R6 R6 N NN R R5 R55 R4 R4 R4 R R4 R44 N CN R R7 R7 7 N CN N CN CN VIIIC VIIIC VIIIC VIIIA VIIIB VIIIA VIIIB VIIIA VIIIB , , , де R4, R5, R6 і R7 визначені як у загальній формулі І за п.1, з гідроксиламіном у присутності хелатного 7 94054 8 агента при умовах, придатних для отримання похідних амідоксиму. 21. Спосіб за п.17 або 18, де хелатний агент вибирають з групи, що складається з 8 гідроксихіноліну, орто-фенантроліну і їх гідратів або похідних. 22. Спосіб отримання сполук за формулою І, при якому виконують окислення відповідної сполуки піридину до сполуки піридин N-оксиду. Даний винахід відноситься до нових заміщених нітрокатехолів, їх застосування при лікування деяких порушень центральної і периферичної нервової системи і фармацевтичних композицій, що містять їх. Незважаючи на застосування у клінічній практиці протягом декількох десятиліть, леводопа (LDOPA) продовжує бути лікарським засобом золотого стандарту для симптоматичного лікування Хвороби Паркінсона. Це допомогло підтримувати підвищений інтерес до розвитку інгібіротів ферменту катехол-О-метилтрансферази (КОМТ), основаного на гіпотезі, що інгібування цього ферменту може забезпечити клінічні покращення у пацієнтів, що страждають на Хворобу Паркінсона, що піддаються лікуванню L-DOPA і периферичним інгібітором амінокислотної декарбоксилази (AADC). Головна причина застосування КОМТ інгібіторів у якості добавки до терапії L-DOPA/AADC основана на їх здатності знижувати метаболічне (9-метилування L-DOPA до 3-0-метил-L-DOPA (3-OMD). Тривалість викликаного L-DOPA клінічного покращення є короткою у результаті короткого часу напівжиття LDOPA in vivo, на відміну від довгого часу напівжиття 3-OMD. Крім того, 3-OMD конкурує з L-DOPA для переносу через гематоенцефалічний бар'єр (ГЕБ), що означає, що тільки дуже обмежена кількість дози L-DOPA, що вводиться перорально, фактично досягає місця прикладення дії, тобто мозку. Звичайно, протягом тільки декількох років після початку терапії L-DOPA зі звичайним дозованим режимом, L-DOPA спричинила зниження клінічного покращення наприкінці циклу кожної дози, викликаючи так називаний зразок вичерпання дози ефекту моторних флуктуацій. Був описаний тісний взаємозв'язок між феноменом вичерпання дози ефекту і накопиченням 3-OMD (Tohgi, Η., et al., Neurosci. Letters, 132:19-22, 1992). Вважалось, що це може випливати з ослабленого проникнення до мозку L-DOPA протягом конкурування для переносу системи через ГЕБ з 3-OMD (Reches, A. et al., Neurology, 32:887-888, 1982) або простіше, що існує менше доступної L-DOPA для досягнення мозку (Nutt, J.G., Fellman, J.H., Clin. Neuropharmacol., 7:35-49, 1984). По суті, КОМТ інгібування захищає L-DOPA від метаболічного розщеплення у периферії через О-метилування, так, що з повторними дозами L-DOPA, середнє значення концентрації L-DOPA у плазмі підвищене. В доповнення до зниженого конкурування для переносу у мозок, значно більший процент дози LDOPA, що перорально вводять, здатний досягти місця прикладення дії. Таким чином, КОМТ інгібування служить для підвищення біологічної доступності L-DOPA і тривалість антипаркінсонської дії продовжили єдиними дозами L-DOPA (Nutt, J.G., Lancet, 351:1221-1222, 1998). Найсильнішими КОМТ інгібіторами, відомими на цей час, є 3,4-дигідрокси-4'-метил-5нітробензофенон (Толкапон, патент Австралии AU-B-69764/87), (Е)-2-циано-N,N-діетил-3-(3,4дигідрокси-5-нітрофеніл)акриламід (Ентакапон, патент Германии 3740383 Al) і ΒΘΑ 3-202 (патент США 6512136), які всі мають константи інгібування у нижній частині наномолярного діапазону. Маючи, по суті, фактично однаковий фармакофор, толкапон відрізняється від етакапону і ΒΘΑ 3-202 тим, що він легко потрапляє до центральної нервової системи (ЦНС), і здатний інгібувати церебральну КОМТ так само, як і периферичну КОМТ. Вважають, що центральне інгібування може бути менш важливим, якщо більш значна дія інгібування КОМТ попереджує порушення L-DOPA у периферії. Насправді, застосування КОМТ інгібіторів, які не проникли до мозку в клінічно релевантних дозах, може уникнути потенційно небажаних побічних ефектів цих агентів у ЦНС. Інша серйозна проблема, що з'явилась тоді, коли КОМТ інгібітори ввели у клінічну практику, відноситься до потенціалу цих ксенобіотиків, основаних на нітрокатехолі, викликати серйозне пошкодження печінки (гепатотоксичність). Насправді, незабаром після його введення, толкапон вилучили з ринку після повідомлення про декілька випадків гепатотоксичністі, включаючи три несподівані смерті від фатального швидкоплинного гепатиту. Зараз толкапон може тільки застосовуватись для хворих паркінсонізмом, які не сприймають інші лікування, і строго тільки з регулярним моніторингом функції печінки, який дорогий і незручний для пацієнта. Хоча актуальні механістичні причини печінкової токсичності, що пов'язані з толкапоном, не є повністю зрозумілими, дослідження in vitro показали, що толкапон може бути метаболічно зниженим до реакційно здатних інтермедіатів і розглядалось, що це може утворити ковалентні адукти з білками печінки, призводячи до гепатоцелюлярних ушкоджень (Smith, K.S. et al, Chem. Res. Toxicol., 16:123-128, 2003). Ентакапон, з іншого боку, хоча і має той самий фармакофор нітрокатехолу, що і толкапон, не пов'язаний з печінковою токсичністю і взагалі оцінюється як безпечний лікарський засіб. Нажаль при цьому, ентакапон є значно менш сильним КОМТ інгібітором, ніж толкапон, і має набагато коротший період напіввиведення in vivo. Це означає, що ентакапон має дуже обмежену тривалість ефекту і, у результаті, лікарський засіб потрібно вводити у дуже високих дозах з кожною дозою L-DOPA пацієнту. По суті, клінічна ефективність ентакапону була під сумнівом, нещодавнє дослідження (Parashos, S.A. et al., Clin. Neuropharmacol., 27(3): 119-123, 2004) показало, що основна причина для переривання лікування ентакапоном пацієнтів з 9 хворобою Паркінсона була відмічена недостатня ефективність. Таким чином, все ще залишається чітка клінічна вимога безпеки і ефективності КОМТ інгібітору для додаткової терапії при лікуванні симптомів хвороби Паркінсона. Переважно, КОМТ інгібітор повинен бути наділений більшою силою і тривалістю КОМТ інгібування, ніж ентакапон, що приведе до більшої клінічної ефективності. Більш переважно, КОМТ інгібітор повинен, на відміну від толкапону, мати обмежений доступ до ЦНС, тобто, він повинен, переважно, інгібувати периферичний КОМТ замість центрального КОМТ. Навіть більш переважно, КОМТ інгібітор повинен об'єднувати вищезгадані ознаки і, крім того, не повинен бути наділений силою викликати печінкову токсичність, як спостерігається з толкапоном. З'ясували, що певні нітрокатехоли дуже сильні КОМТ інгібітори, які також позбавлені, або мають значно знижений ризик токсичності. Більш того, несподівано виявили, що це є хімічною функціональністю замісника, що не є катехолом, який сполучений з гетероциклічним кільцем, що визначає відсутність токсичних ефектів сполук. На сьогоднішній день існує тільки один опублікований приклад [1,2,4]-оксадіазолу нітрокатехолу у відомому рівні техніки (Приклад 75 патенту Австралії AU-B-69764/87), це 5-(3-метил-1,2,4оксадіазол-5-іл)-3-нітропірокатехол 1, який має хімічну структуру, показану нижче, Цією речовиною є 3,5-дизаміщений-[1,2,4]оксадіазол з метильною групою, що має положення С-3 гетероциклічного кільця оксадіазолілу, а фармакофор нітрокатехолу приєднаний до С-5. Вивчали сполука оксадіазолілу 1, згадана вище, і з'ясували, що вона помірно активна у аналізі КОМТ інгібування (59% контролю, див. експериментальний розділ). Нажаль, незважаючи на це, сполука 1 представляє значний ризик токсичності (55% життєздатність клітини, див. експериментальний розділ). По суті, ця окрема сполука 1 не може розглядатись як та, що представляє адекватний розв'язок даної проблеми забезпечення сили і клінічної безпеки КОМТ інгібітору. З'ясували, що коли центральне кільце заміщене піридильним кільцем у окисленій формі (наприклад, піридин N-оксид), це призводить до того, що сполуки піридину N-оксиду проявляють значно знижену токсичність, або навіть позбавлені ризику токсичності, у той час, як все ще зберігається можливість підтримувати КОМТ інгібування краще, ніж ентакапон. Якщо положення фармакофору нітрокатехолу 'переходить' з С-5 у С-3 положення оксадіазольного кільця, то отримані сполуки звичайно менш активні у відношенні КОМТ інгібування. Регіоізомерні 1,3,4-оксадіазоли, де фармакофор нітрокатехолу приєднаний до С-2 центрального кільця оксадіазолілу, також звичай 94054 10 но менше активні у відношенні КОМТ інгібування. Наприклад, розглядають регіоізомери 2 і 3 попереднього рівня техніки оксадіазолу 1, які також синтезували і оцінили in vivo, Хоча кожен 2 і 3 представляють знижений ризик токсичності відносно 1, у відношенні КОМТ інгібування сполука 2 проявляє тільки 79% контролю, а сполука 3 тільки не набагато краще - до 64%. Таким чином, можна зробити висновок, що це є несподівано критичною комбінацією правильно позиційного угрупування гетероатомів у центральному оксадіазольному кільці і включення функціональності піридин N-оксиду для отримання синергізму між високою активністю КОМТ інгібітору і безпекою для даного типу КОМТ-інгібітора. Відповідно, даний винахід відноситься до КОМТ інгібіторів нітрокатехолу, які позбавлені, або мають дуже знижений, ризик токсичності. Більш того, несподівано з'ясувалось, що це досягається введенням гетероциклічної групи на основі нітрогену у N-окисленій формі, такий як, наприклад, піридин N-оксид, що визначає відсутність токсичних ефектів сполук нітрокатехолу. Крім того, було з'ясовано, що сполуки загальної формули І є КОМТ інгібіторами, які забезпечені збалансованими властивостями біоактивності, біологічної доступності і, особливо, безпеки: де R1 і R2 являють собою незалежно одна від одної водень або групу, здатну гідролізуватися при фізіологічних умовах, необов'язково заміщену нижчим алканоїлом або ароїлом; X представляє метиленову групу; Υ представляє атом кисню, нітроген або сульфур; n представляє число 0, 1, 2 або 3, і m представляє число 0 або 1; R3 представляє групу піридин N-оксиду згідно з формулою А, В або С, яка сполучена як позначено невідміченим зв'язком: де R4, R5, R6 і R7 незалежно одна від одної представляють водень, С1-C6-алкіл, С1-C6-тіоалкіл, С1-C6-алкокси, С6-С12-арилокси або С6-С12 11 тіоарилову групу, С1-C6-алканоїл або С7-С13ароїлову групу, аміно, С1-C6-алкіламіно, С1-C6діалкіламіно, С3-С12-циклоалкіламіно, С3-С12гетероциклоалкіламіно, С1-C6-алкілсульфоніл, С6С12-арилсульфоніл, галоген, С1-C6-галоалкіл, трифторметил, циано, нітро або гетероарильну групу; або два або більше залишків R4, R5, R6 і R7, що взяли разом, представляють аліфатичні або гетероаліфатичні кільця або ароматичні або гетероароматичні кільця, і де Ρ представляє центральний блок, який переважно є планарною одиницею, і який навіть більш переважно вибраний з регіоізомерів 1,3,4-оксадіазол-2,5-діілу, 1,2,4-оксадіазол3,5-діілу, 4-метил-4Н-1,2,4-триазол-3,5-діілу, 1,3,5триазин-2,4-діілу, 1,2,4-триазин-3,5-дііл, 2Нтетразол-2,5-діілу, 1,2,3-тіадіазол-4,5-діілу, 1алкіл-3-(алкоксикарбоніл)-1Н-пірол-2,5-діілу, де алкіл представлений метилом, етилом, n-пропілом і n-бутилом, і де алкокси представлений метокси, етокси, n-пропокси і ізопропокси, 1-алкіл-1Н-пірол2,5-діілом, де алкіл представлений метилом, етилом, n-пропілом і n-бутилом, тіазол-2,4-дііл, 1-Нпіразол-1,5-діілом, піримідин-2,4-діілом, оксазол2,4-діілом, карбонілом, Ш-імідазол-1,5-діілом, ізоксазол-3,5-діілом, фуран-2,4-діілом, 3алкоксикарбонілфуран-2,4-діілом, де алкокси представлений метокси, етокси, n-пропокси та ізопропокси, бензол-1,3-діілом і (Ζ)-1-цианоетен1,2-діілом. У вищезгаданому визначенні, регіоізомери центрального блоку включають обидва регіоізомери, що здійсненні обміном частини нітрокатехолу і частини -(X)n-(Y)m-R3. Переважно, залишки С1-C6-алкілу представляють метил, етил, n-пропіл, ізопропіл, n-бутил, сек-бутил, терт-бутил, пентил або гексил. Переважно, залишки С1-C6-тіоалкілу представляють тіометил, тіоетил, тіо-n-пропіл, тіо-ізопропіл, тіо-nбутил, тіо-n-пентил і тіо-n-гексил. Переважно, залишки С1-C6-алкокси представляють метокси, етокси, n-пропокси, ізопропокси, n-бутокси, секбутокси і терт-бутокси. Переважно, залишки С6С12-арилокси представляють фенокси або нафтокси, які необов'язково можуть бути заміщеними. Переважно, залишки С6-С12-тіоарилу представляють тіофеніл і тіонафтил, які необов'язково можуть бути заміщеними. Переважно, залишки С1-C6алканоїлу представляють метаноїл, етаноїл, пропаноїл або бутаноїл. Переважно, залишки С7-С13ароїлу представляють бензоїл і нафтоїл. Переважно, залишки С1-C6-алкіламіно представляють метиламіно, етиламіно, n-пропіламіно, ізопропіламіно і n-бутиламіно. Переважно, залишки С1-C6діалкіламіно представляють диметиламіно, діетиламіно, ди-n-пропіламіно, ди-n-бутиламіно, діізопропіламіно, метил етил аміно, метилпропіламіно і етилпропіламіно. Переважно, залишки С3-С12циклоалкіламіно представляють пропілідино, піперидино, циклогексиламіно і дициклогексиламіно. Переважно, залишки С3-С12гетероциклоалкіламіно представляють морфоліно, 2,6-диметилморфоліно, 3,5-диметилморфоліно, піперазино, N-метилпіперазино і Nетилпіперазино. Переважно, залишки С1-C6алкілсульфонілу або С6-С12-арилсульфонілу пред 94054 12 ставляють метилсульфоніл, етилсульфоніл, фенілсульфоніл і толілсульфоніл. Переважно, залишки галогену представляють хлор, бром, йод і фтор. Переважно, С1-C6-галоалкіл представляє хлорметил, фторметил, дихлорметил, дифторметил, трихлорметил і трифторметил. Переважно, залишки гетероарилу представляють піридил, піримідил, ізоксазоліл, оксазоліл, ізоксадіазоліл, оксадіазоліл, триазоліл і тетразоліл. У випадку, де два або більше залишків R4, R5, R6 і R7, взяті разом, представляють аліфатичні або гетероаліфатичні кільця або ароматичні або гетероароматичні кільця, переважними скомбінованими залишками є індолізиніл, ізоіндоліл, індоліл, індазоліл, пуриніл, хінолізиніл, нафтиридиніл, ізохіноліл і хіноліл. Переважно, центральний блок вибраний з гетероароматичного π'ятичленного кільця, яке включає 1-4 гетероатоми Ν, Ο і S. Більш переважно, центральний блок Ρ вибраний з регіоізомерів 1,3,4-оксадіазол-2,5-діілу, 1,2,4-оксадіазол-3,5діілу, 4-метил-4Н-1,2,4-триазол-3,5-діілу, 1,3,5триазин-2,4-діілу, 1,2,4-триазин-3,5-діілу, 2Нтетразол-2,5-діілу, 1,2,3-тіадіазол-4,5-діілу, 1алкіл-3-(алкоксикарбоніл)-1H-пірол-2,5-діілу, де алкіл представлений метилом, етилом, n-пропілом і n-бутилом, і де алкокси представлений метокси, етокси, n-пропокси і ізопропокси, 1-алкіл-1Н-пірол2,5-діілом, де алкіл представлений метилом, етилом, n-пропілом і n-бутилом, тіазол-2,4-діілом, 1-Нпіразол-1,5-діілом, оксазол-2,4-діілом, карбонілом, 1Н-імідазол-1,5-діілом, ізоксазол-3,5-діілом, фуран-2,4-діілом, 3-алкоксикарбонілфуран-2,4-діілом, де алкокси представлений метокси, етокси, nпропокси і ізопропокси. Найбільш переважно, центральний блок Ρ вибраний з 1,3,4-оксадіазол-2,5-діілу і 1,2,4оксадіазол-3,5-діілу. Переважні сполуки вищезгаданої загальної формули (І), що мають 1,2,4-оксадіазол-3,5-дііл як центральний блок, включають 5-[3-(3,5-дихлор-1окси-піридин-4-іл)-[1,2,4]оксадіазол-5-іл]-3-нітробензол-1,2-діол, 5-[3-(2-хлор-1-окси-піридин-4-іл)[1,2,4]оксадіазол-5-іл]-3-нітро-бензол-1,2-діол, 5-[3(2-морфолін-4-іл-1-окси-піридин-4-іл)[1,2,4]оксадіазол-5-іл]-3-нітро-бензол-1,2-діол, 3нітро-5-[3-(1-окси-4-трифторметил-піридин-3-іл)[1,2,4]оксадіазол-5-іл]-бензол-1,2-діол, 5-[3-(4бром-1-окси-піридин-3-іл)-[1,2,4]оксадіазол-5-іл]-3нітро-бензол-1,2-діол, 5-[3-(2-хлор-6-метил-1-оксипіридин-3-іл)-[1,2,4]оксадіазол-5-іл]-3-нітро-бензол1,2-діол, 5-[3-(2-морфолін-4-іл-1-окси-піридин-3іл)-[1,2,4]оксадіазол-5-іл]-3-нітро-бензол-1,2-діол, 3-нітро-5-[3-(1-окси-6-трифторметил-піридин-3-іл)[1,2,4]оксадіазол-5-іл]-бензол-1,2-діол, 5-[3-(2метил-1-окси-6-трифторметил-піридин-3-іл)[1,2,4]оксадіазол-5-іл]-3-нітро-бензол-1,2-діол, 5-[3(6-метил-1-окси-4-трифторметил-піридин-3-іл)[1,2,4]оксадіазол-5-іл]-3-нітро-бензол-1,2-діол, 5-[3(2,6-диметил-1-окси-4-трифторметил-піридин-3іл)-[1,2,4]оксадіазол-5-іл]-3-нітро-бензол-1,2-діол, 5-[3-(2-метил-1-окси-6-феніл-4-трифторметилпіридин-3-іл)-[1,2,4]оксадіазол-5-іл]-3-нітро-бензол1,2-діол, 5-[3-(6-метил-1-окси-2-феніл-4трифторметил-піридин-3-іл)-[1,2,4]оксадіазол-5-іл]3-нітро-бензол-1,2-діол, 5-[3-(2-бром-6-метил-1 13 окси-піридин-3-іл)-[1,2,4]оксадіазол-5-іл]-3-нітробензол-1,2-діол, 5-[3-(2-хлор-4,6-диметил-1-оксипіридин-3-іл)-[1,2,4]оксадіазол-5-іл]-3-нітро-бензол1,2-діол, 5-[3-(2-бром-4,6-диметил-1-окси-піридин3-іл)-[1,2,4]оксадіазол-5-іл]-3-нітро-бензол-1,2-діол, 5-[3-(2-бром-4,5,6-триметил-1-окси-піридин-3-іл)[1,2,4]оксадіазол-5-іл]-3-нітробензол-1,2-діол, 5-[3(2-хлор-4,5,6-триметил-1-окси-піридин-3-іл)[1,2,4]оксадіазол-5-іл]-3-нітробензол-1,2-діол, 5-[3(2,5-дихлор-4,6-диметил-1-окси-піридин-3-іл)[1,2,4]оксадіазол-5-іл]-3-нітробензол-1,2-діол, 5-[3(2-бром-5-хлор-4,6-диметил-1-окси-піридин-3-іл)[1,2,4]оксадіазол-5-іл]-3-нітробензол-1,2-діол, та 3нітро-5-[3-(1-окси-2-трифторметил-піридин-3-іл)[1,2,4]оксадіазол-5-іл]-бензол-1,2-діол, 3-(3-(3,4дигідрокси-5-нітрофеніл)-1,2,4-оксадіазол-5-іл)-4(трифторметил)піридин 1-оксид, 2-хлор-3-(3-(3,4дигідрокси-5-нітрофеніл)-1,2,4-оксадіазол-5-іл)-4,6диметилпіридин 1-оксид, 3-(3-(3,4-дигідрокси-5нітрофеніл)-1,2,4-оксадіазол-5-іл)-2-метил-6(трифторметил)піридин 1-оксид, 5-(3-(3,4дигідрокси-5-нітрофеніл)-1,2,4-оксадіазол-5-іл)-2(трифторметил)піридин 1-оксид, 5-(3-(3,4дигідрокси-5-нітрофеніл)-1,2,4-оксадіазол-5-іл)-2метил-4-(трифторметил)піридин 1-оксид, 3-(3-(3,4дигідрокси-5-нітрофеніл)-1,2,4-оксадіазол-5-іл)-2,6диметил-4-(трифторметил)піридин 1-оксид, 3,5дихлор-4-(3-(3,4-дигідрокси-5-нітрофеніл)-1,2,4оксадіазол-5-іл)піридин 1-оксид, 3-(3-(3,4дигідрокси-5-нітрофеніл)-1,2,4-оксадіазол-5-іл)-6метил-2-феніл-4-(трифторметил)піридин 1-оксид, 2-бром-3-(3-(3,4-дигідрокси-5-нітрофеніл)-1,2,4оксадіазол-5-іл)-4,5,6-триметилпіридин 1-оксид, 2хлор-3-(3-(3,4-дигідрокси-5-нітрофеніл)-1,2,4оксадіазол-5-іл)-4,5,6-триметилпіридин 1-оксид, 3(3-(3,4-дигідрокси-5-нітрофеніл)-1,2,4-оксадіазол5-іл)-2-(трифторметил)піридин 1-оксид, 2,5дихлор-3-(3-(3,4-дигідрокси-5-нітрофеніл)-1,2,4оксадіазол-5-іл)-4,6-диметилпіридин 1-оксид, 3-(3(3,4-дигідрокси-5-нітрофеніл)-1,2,4-оксадіазол-5іл)-5-(трифторметил)піридин 1-оксид, 3-(3-(3,4дигідрокси-5-нітрофеніл)-1,2,4-оксадіазол-5-іл)-2фторпіридин 1-оксид, 4-(3-(3,4-дигідрокси-5нітрофеніл)-1,2,4-оксадіазол-5-іл)-2-фторпіридин 1-оксид, 2-(3-(3,4-дигідрокси-5-нітрофеніл)-1,2,4оксадіазол-5-іл)-6-фторпіридин 1-оксид, 2-хлор-3(3-(3,4-дигідрокси-5-нітрофеніл)-1,2,4-оксадіазол5-іл)-6-метилпіридин 1-оксид, 2-бром-3-(3-(3,4дигідрокси-5-нітрофеніл)-1,2,4-оксадіазол-5-іл)-6метилпіридин 1-оксид і 2-бром-5-хлор-3-(3-(3,4дигідрокси-5-нітрофеніл)-1,2,4-оксадіазол-5-іл)-4,6диметилпіридин 1-оксид. Переважні сполуки вищезгаданої загальної формули (І), що мають 1,3,4-оксадіазол-2,5-дііл як центральний блок, включають 3-(5-(3,4-дигідрокси5-нітрофеніл)-1,3,4-оксадіазол-2-іл)-4(трифторметил)піридин 1-оксид, 2-хлор-3-(5-(3,4дигідрокси-5-нітрофеніл)-1,3,4-оксадіазол-2-іл)-4,6диметилпіридин 1-оксид, 3-(5-(3,4-дигідрокси-5нітрофеніл)-1,3,4-оксадіазол-2-іл)-2-метил-6(трифторметил)піридин 1-оксид, 5-(5-(3,4дигідрокси-5-нітрофеніл)-1,3,4-оксадіазол-2-іл)-2(трифторметил)піридин 1-оксид, 5-(5-(3,4дигідрокси-5-нітрофеніл)-1,3,4-оксадіазол-2-іл)-2метил-4-(трифторметил)піридин 1-оксид, 3-(5-(3,4 94054 14 дигідрокси-5-нітрофеніл)-1,3,4-оксадіазол-2-іл)-2,6диметил-4-(трифторметил)піридин 1-оксид, 3,5дихлор-4-(5-(3,4-дигідрокси-5-нітрофеніл)-1,3,4оксадіазол-2-іл)піридин 1-оксид, 3-(5-(3,4дигідрокси-5-нітрофеніл)-1,3,4-оксадіазол-2-іл)-6метил-2-феніл-4-(трифторметил)піридин 1-оксид, 2-бром-3-(5-(3,4-дигідрокси-5-нітрофеніл)-1,3,4оксадіазол-2-іл)-4,5,6-триметилпіридин 1-оксид, 2хлор-3-(5-(3,4-дигідрокси-5-нітрофеніл)-1,3,4оксадіазол-2-іл)-4,5,6-триметилпіридин 1-оксид, 3(5-(3,4-дигідрокси-5-нітрофеніл)-1,3,4-оксадіазол2-іл)-2-(трифторметил)піридин 1-оксид, 2,5дихлор-3-(5-(3,4-дигідрокси-5-нітрофеніл)-1,3,4оксадіазол-2-іл)-4,6-диметилпіридин 1-оксид, 3-(5(3,4-дигідрокси-5-нітрофеніл)-1,3,4-оксадіазол-2іл)-5-(трифторметил)піридин 1-оксид, 3-(5-(3,4дигідрокси-5-нітрофеніл)-1,3,4-оксадіазол-2-іл)-2фторпіридин 1-оксид, 4-(5-(3,4-дигідрокси-5нпрофеніл)-1,3,4-оксадіазол-2-іл)-2-фторпіридин 1оксид, 2-(5-(3,4-дигідрокси-5-нітрофеніл)-1,3,4оксадіазол-2-іл)-6-фторпіридин 1-оксид, 2-хлор-3(5-(3,4-дигідрокси-5-нітрофеніл)-1,3,4-оксадіазол2-іл)-6-метилпіридин 1-оксид, 2-бром-3-(5-(3,4дигідрокси-5-нітрофеніл)-1,3,4-оксадіазол-2-іл)-6метилпіридин 1-оксид і 2-бром-5-хлор-3-(5-(3,4дигідрокси-5-нітрофеніл)-1,3,4-оксадіазол-2-іл)-4,6диметилпіридин 1-оксид. Переважні сполуки вищезгаданої загальної формули (І), що мають 4-метил-4Н-1,2,4-триазол3,5-дііл як центральний блок, включають 3-(5-(3,4дигідрокси-5-нітрофеніл)-4-метил-4Н-1,2,4триазол-3-іл)-4-(трифторметил)піридин 1-оксид, 2хлор-3-(5-(3,4-дигідрокси-5-нітрофеніл)-4-метил4Н-1,2,4-триазол-3-іл)-4,6-диметилпіридин 1оксид, 3-(5-(3,4-дигідрокси-5-нітрофеніл)-4-метил4Н-1,2,4-триазол-3-іл)-2-метил-6(трифторметил)піридин 1-оксид, 5-(5-(3,4дигідрокси-5-нітрофеніл)-4-метил-4Н-1,2,4триазол-3-іл)-2-(трифторметил)піридин 1-оксид, 5(5-(3,4-дигідрокси-5-нітрофеніл)-4-метил-4Н-1,2,4триазол-3-іл)-2-метил-4-(трифторметил)піридин 1оксид, 3-(5-(3,4-дигідрокси-5-нітрофеніл)-4-метил4Н-1,2,4-триазол-3-іл)-2,6-диметил-4(трифторметил)піридин 1-оксид, 3,5-дихлор-4-(5(3,4-дигідрокси-5-нітрофеніл)-4-метил-4Н-1,2,4триазол-3-іл)піридин 1-оксид, 3-(5-(3,4-дигідрокси5-нітрофеніл)-4-метил-4Н-1,2,4-триазол-3-іл)-6метил-2-феніл-4-(трифторметил)піридин 1-оксид, 2-бром-3-(5-(3,4-дигідрокси-5-нітрофеніл)-4-метил4Н-1,2,4-триазол-3-іл)-4,5,6-триметилпіридин 1оксид, 2-хлор-3-(5-(3,4-дигідрокси-5-нітрофеніл)-4метил-4Н-1,2,4-триазол-3-іл)-4,5,6триметилпіридин 1-оксид, 3-(5-(3,4-дигідрокси-5нітрофеніл)-4-метил-4Н-1,2,4-триазол-3-іл)-2(трифторметил)піридин 1-оксид, 2,5-дихлор-3-(5(3,4-дигідрокси-5-нітрофеніл)-4-метил-4Н-1,2,4триазол-3-іл)-4,6-диметилпіридин 1-оксид, 3-(5(3,4-дигідрокси-5-нітрофеніл)-4-метил-4Н-1,2,4триазол-3-іл)-5-(трифторметил)піридин 1-оксид, 3(5-(3,4-дигідрокси-5-нітрофеніл)-4-метил-4Н-1,2,4триазол-3-іл)-2-фторпіридин 1-оксид, 4-(5-(3,4дигідрокси-5-нітрофеніл)-4-метил-4Н-1,2,4триазол-3-іл)-2-фторпіридин 1-оксид, 2-(5-(3,4дигідрокси-5-нітрофеніл)-4-метил-4Н-1,2,4триазол-3-іл)-6-фторпіридин 1-оксид, 2-хлор-3-(5 15 (3,4-дигідрокси-5-нітрофеніл)-4-метил-4Н-1,2,4триазол-3-іл)-6-метилпіридин 1-оксид, 2-бром-3-(5(3,4-дигідрокси-5-нітрофеніл)-4-метил-4Н-1,2,4триазол-3-іл)-6-метилпіридин 1-оксид і 2-бром-5хлор-3-(5-(3,4-дигідрокси-5-нітрофеніл)-4-метил4Н-1,2,4-триазол-3-іл)-4,6-диметилпіридин 1оксид. Переважні сполуки вищезгаданої загальної формули (І), що мають 1,3,5-триазин-2,4-дііл як центральний блок, включають 3-(4-(3,4-дигідрокси5-нітрофеніл)-1,3,5-триазин-2-іл)-4(трифторметил)піридин 1-оксид, 3-(4-(3,4дигідрокси-5-нітрофеніл)-1,3,5-триазин-2-іл)-2метил-6-(трифторметил)піридин 1-оксид, 5-(4-(3,4дигідрокси-5-нітрофеніл)-1,3,5-триазин-2-іл)-2(трифторметил)піридин 1-оксид, 5-(4-(3,4дигідрокси-5-нітрофеніл)-1,3,5-триазин-2-іл)-2метил-4-(трифторметил)піридин 1-оксид, 3-(4-(3,4дигідрокси-5-нітрофеніл)-1,3,5-триазин-2-іл)-2,6диметил-4-(трифторметил)піридин 1-оксид, 3-(4(3,4-дигідрокси-5-нітрофеніл)-1,3,5-триазин-2-іл)-6метил-2-феніл-4-(трифторметил)піридин 1-оксид, 3-(4-(3,4-дигідрокси-5-нітрофеніл)-1,3,5-триазин-2іл)-2-(трифторметил)піридин 1-оксид і 3-(4-(3,4дигідрокси-5-нітрофеніл)-1,3,5-триазин-2-іл)-5(трифторметил)піридин 1-оксид. Переважні сполуки вищезгаданої загальної формули (І), що мають 1,2,4-триазин-3,5-дііл як центральний блок, включають 3-(5-(3,4-дигідрокси5-нітрофеніл)-1,2,4-триазин-3-іл)-4(трифторметил)піридин 1-оксид, 3-(5-(3,4дигідрокси-5-нітрофеніл)-1,2,4-триазин-3-іл)-2метил-6-(трифторметил)піридин 1-оксид, 5-(5-(3,4дигідрокси-5-нітрофеніл)-1,2,4-триазин-3-іл)-2(трифторметил)піридин 1-оксид, 5-(5-(3,4дигідрокси-5-нітрофеніл)-1,2,4-триазин-3-іл)-2метил-4-(трифторметил)піридин 1-оксид, 3-(5-(3,4дигідрокси-5-нітрофеніл)-1,2,4-триазин-3-іл)-2,6диметил-4-(трифторметил)піридин 1-оксид, 3-(5(3,4-дигідрокси-5-нітрофеніл)-1,2,4-триазин-3-іл)-6метил-2-феніл-4-(трифторметил)піридин 1-оксид, 3-(5-(3,4-дигідрокси-5-нітрофеніл)-1,2,4-триазин-3іл)-2-(трифторметил)піридин 1-оксид, 3-(5-(3,4дигідрокси-5-нітрофеніл)-1,2,4-триазин-3-іл)-5(трифторметил)піридин 1-оксид, 4-(5-(3,4дигідрокси-5-нітрофеніл)-1,2,4-триазин-3-іл)-2фторпіридин 1-оксид і 2-(5-(3,4-дигідрокси-5нітрофеніл)-1,2,4-триазин-3-іл)-6-фторпіридин 1оксид. Переважні сполуки вищезгаданої загальної формули (І), що мають частину (Z)-1-цианоетен1,2-діілу як центральний блок, включають (Ζ)-3-(1циано-2-(3,4-дигідрокси-5-нітрофеніл)вініл)-4(трифторметил)піридин 1-оксид, (Z)-2-хлор-3-(1циано-2-(3,4-дигідрокси-5-нітрофеніл)вініл)-4,6диметилпіридин 1-оксид, (Z)-3-(1-циано-2-(3,4дигідрокси-5-нітрофеніл)вініл)-2-метил-6(трифторметил)піридин 1-оксид, (Z)-5-(1-циано-2(3,4-дигідрокси-5-нітрофеніл)вініл)-2(трифторметил)піридин 1-оксид, (Z)-5-(1-циано-2(3,4-дигідрокси-5-нітрофеніл)вініл)-2-метил-4(трифторметил)піридин 1-оксид, (Z)-3-(1-циано-2(3,4-дигідрокси-5-нітрофеніл)вініл)-2,6-диметил-4(трифторметил)піридин 1-оксид, (Z)-3,5-дихлор-4(1-циано-2-(3,4-дигідрокси-5 94054 16 нітрофеніл)вініл)піридин 1-оксид, (Z)-3-(1-циано-2(3,4-дигідрокси-5-нітрофеніл)вініл)-6-метил-2феніл-4-(трифторметил)піридин 1-оксид, (Z)-2бром-3-(1-циано-2-(3,4-дигідрокси-5нітрофеніл)вініл)-4,5,6-триметилпіридин 1-оксид, (Z)-2-хлор-3-(1-циано-2-(3,4-дигідрокси-5нітрофеніл)вініл)-4,5,6-триметилпіридин 1-оксид, (Z)-3-(1-циано-2-(3,4-дигідрокси-5нітрофеніл)вініл)-2-(трифторметил)піридин 1оксид, (Z)-2,5-дихлор-3-(1-циано-2-(3,4-дигідрокси5-нітрофеніл)вініл)-4,6-диметилпіридин 1-оксид, (Z)-3-(1-циано-2-(3,4-дигідрокси-5нітрофеніл)вініл)-5-(трифторметил)піридин 1оксид, (Z)-3-(1-циано-2-(3,4-дигідрокси-5нітрофеніл)вініл)-2-фтор піридин 1-оксид, (Z)-4-(1циано-2-(3,4-дигідрокси-5-нітрофеніл)вініл)-2фторпіридин 1-оксид, (Z)-2-(1-циано-2-(3,4дигідрокси-5-нітрофеніл)вініл)-6-фторпіридин 1оксид, (Z)-2-xлop-3-(1-циано-2-(3,4-дигідрокси-5нітрофеніл)вініл)-6-метилпіридин 1-оксид, (Z)-2бром-3-(1-циано-2-(3,4-дигідрокси-5нітрофеніл)вініл)-6-метилпіридин 1-оксид і (Z)-2бpoм-5-xлop-3-(1-циaнo-2-(3,4-дигiдpoкcи-5нiтpoфeнiл)вiнiл)-4,6-диметилпіридин 1-оксид. Переважні сполуки вищезгаданої загальної формули (І), що мають як центральний блок частину фуран-2,4-діілу або 3-алкоксикарбонілфуран2,4-діілу, де алкокси представлений метокси, етокси, n-пропокси і ізопропокси, включають 3-(4-(3,4дигідрокси-5-нітрофеніл)-3-(етоксикарбоніл)фуран2-іл)-4-(трифторметил)піридин 1-оксид, 2-хлор-3(4-(3,4-дигідрокси-5-нітрофеніл)-3(етоксикарбоніл)фуран-2-іл)-4,6-диметилпіридин 1оксид, 3-(4-(3,4-дигідрокси-5-нітрофеніл)-3(етоксикарбоніл)фуран-2-іл)-2-метил-6(трифторметил)піридин 1-оксид, 5-(4-(3,4дигідрокси-5-нітрофеніл)-3-(етоксикарбоніл)фуран2-іл)-2-(трифторметил)піридин 1-оксид, 5-(4-(3,4дигідрокси-5-нітрофеніл)-3-(етоксикарбоніл)фуран2-іл)-2-метил-4-(трифторметил)піридин 1-оксид, 3(4-(3,4-дигідрокси-5-нітрофеніл)-3(етоксикарбоніл)фуран-2-іл)-2,6-диметил-4(трифторметил)піридин 1-оксид, 3,5-дихлор-4-(4(3,4-дигідрокси-5-нітрофеніл)-3(етоксикарбоніл)фуран-2-іл)піридин 1-оксид, 3-(4(3,4-дигідрокси-5-нітрофеніл)фуран-2-іл)-6-метил2-феніл-4-(трифторметил)піридин 1-оксид, 2-бром3-(4-(3,4-дигідрокси-5-нітрофеніл)фуран-2-іл)4,5,6-триметилпіридин 1-оксид, 2-хлор-3-(4-(3,4дигідрокси-5-нітрофеніл)фуран-2-іл)-4,5,6триметилпіридин 1-оксид, 3-(4-(3,4-дигідрокси-5нітрофеніл)фуран-2-іл)-2-(трифторметил)піридин 1-оксид, 2,5-дихлор-3-(4-(3,4-дигідрокси-5нітрофеніл)фуран-2-іл)-4,6-диметилпіридин 1оксид, 3-(4-(3,4-дигідрокси-5-нітрофеніл)фуран-2іл)-5-(трифторметил)піридин 1-оксид, 3-(4-(3,4дигідрокси-5-нітрофеніл)-3-(етоксикарбоніл)фуран2-іл)-2-фторпіридин 1-оксид, 4-(4-(3,4-дигідрокси-5нітрофеніл)-3-(етоксикарбоніл)фуран-2-іл)-2фторпіридин 1-оксид, 2-(4-(3,4-дигідрокси-5нітрофеніл)-3-(етоксикарбоніл)фуран-2-іл)-6фторпіридин 1-оксид, 2-хлор-3-(4-(3,4-дигідрокси5-нітрофеніл)-3-(етоксикарбоніл)фуран-2-іл)-6метилпіридин 1-оксид, 2-бром-3-(4-(3,4-дигідрокси5-нітрофеніл)-3-(етоксикарбоніл)фуран-2-іл)-6 17 метилпіридин 1-оксид і 2-бром-5-хлор-3-(4-(3,4дигідрокси-5-нітрофеніл)-3-(етоксикарбоніл)фуран2-іл)-4,6-диметилпіридин 1-оксид. Переважні сполуки вищезгаданої загальної формули (І), що мають як центральний блок частину 1Н-імідазол-1,5-діілу, включають 3-(5-(3,4дигідрокси-5-нітрофеніл)-1Н-імідазол-1-іл)-4(трифторметил)піридин 1-оксид, 2-хлор-3-(5-(3,4дигідрокси-5-нітрофеніл)-1Н-імідазол-1-іл)-4,6диметилпіридин 1-оксид, 3-(5-(3,4-дигідрокси-5нітрофеніл)-1Н-імідазол-1-іл)-2-метил-6(трифторметил)піридин 1-оксид, 5-(5-(3,4дигідрокси-5-нітрофеніл)-1Н-імідазол-1-іл)-2(трифторметил)піридин 1-оксид, 3,5-дихлор-4-(5(3,4-дигідрокси-5-нітрофеніл)-1Н-імідазол-1іл)піридин 1-оксид, 3-(5-(3,4-дигідрокси-5нітрофеніл)-1Н-імідазол-1-іл)-2(трифторметил)піридин 1-оксид, 3-(5-(3,4дигідрокси-5-нітрофеніл)-1Н-імідазол-1-іл)-5(трифторметил)піридин 1-оксид, 3-(5-(3,4дигідрокси-5-нітрофеніл)-1Н-імідазол-1-іл)-2фторпіридин 1-оксид, 2-(5-(3,4-дигідрокси-5нітрофеніл)-1H-імідазол-1-іл)-6-фторпіридин 1оксид, 2-хлор-3-(5-(3,4-дигідрокси-5-нітрофеніл)1Н-імідазол-1-іл)-6-метилпіридин 1-оксид і 2-бром3-(5-(3,4-дигідрокси-5-нітрофеніл)-1Н-імідазол-1іл)-6-метилпіридин 1-оксид. Переважні сполуки вищезгаданої загальної формули (І), що мають як центральний блок частину ізоксазол-3,5-діілу, включають 3-(3-(3,4дигідрокси-5-нітрофеніл)ізоксазол-5-іл)-4(трифторметил)піридин 1-оксид, 2-хлор-3-(3-(3,4дигідрокси-5-нітрофеніл)ізоксазол-5-іл)-4,6диметилпіридин 1-оксид, 3-(3-(3,4-дигідрокси-5нітрофеніл)ізоксазол-5-іл)-2-метил-6(трифторметил)піридин 1-оксид, 5-(3-(3,4дигідрокси-5-нітрофеніл)ізоксазол-5-іл)-2(трифторметил)піридин 1-оксид, 5-(З-(3,4дигідрокси-5-нітрофеніл)ізоксазол-5-іл)-2-метил-4(трифторметил)піридин 1-оксид, 3-(3-(3,4дигідрокси-5-нітрофеніл)ізоксазол-5-іл)-2,6диметил-4-(трифторметил)піридин 1-оксид, 3,5дихлор-4-(3-(3,4-дигідрокси-5нітрофеніл)ізоксазол-5-іл)піридин 1-оксид, 3-(3(3,4-дигідрокси-5-нітрофеніл)ізоксазол-5-іл)-6метил-2-феніл-4-(трифторметил)піридин 1-оксид, 2-бром-3-(3-(3,4-дигідрокси-5нітрофеніл)ізоксазол-5-іл)-4,5,6-триметилпіридин 1-оксид, 2-хлор-3-(3-(3,4-дигідрокси-5нітрофеніл)ізоксазол-5-іл)-4,5,6-триметилпіридин 1-оксид, З -(З -(3,4-дигідрокси-5нітрофеніл)ізоксазол-5-іл)-2(трифторметил)піридин 1-оксид, 2,5-дихлор-3-(3(3,4-дигідрокси-5-нітрофеніл)ізоксазол-5-іл)-4,6диметилпіридин 1-оксид, 3-(3-(3,4-дигідрокси-5нітрофеніл)ізоксазол-5-іл)-5(трифторметил)піридин 1-оксид, 3-(3-(3,4дигідрокси-5-нітрофеніл)ізоксазол-5-іл)-2фторпіридин 1-оксид, 4-(3-(3,4-дигідрокси-5нітрофеніл)ізоксазол-5-іл)-2-фторпіридин 1-оксид, 2-(3-(3,4-дигідрокси-5-нітрофеніл)ізоксазол-5-іл)-6фторпіридин 1-оксид, 2-хлор-3-(3-(3,4-дигідрокси5-нітрофеніл)ізоксазол-5-іл)-6-метилпіридин 1оксид, 2-бром-3-(3-(3,4-дигідрокси-5нітрофеніл)ізоксазол-5-іл)-6-метилпіридин 1-оксид 94054 18 і 2-бром-5-хлор-3-(3-(3,4-дигідрокси-5нітрофеніл)ізоксазол-5-іл)-4,6-диметилпіридин 1оксид. Переважні сполуки вищезгаданої загальної формули (І), що мають як центральний блок частину карбонілу, включають 3-(3,4-дигідрокси-5нітробензоїл)-4-(трифторметил)піридин 1-оксид, 2хлор-3-(3,4-дигідрокси-5-нітробензоїл)-4,6диметилпіридин 1-оксид, 3-(3,4-дигідрокси-5нітробензоїл)-2-метил-6-(трифторметил)піридин 1оксид, 5-(3,4-дигідрокси-5-нітробензоїл)-2(трифторметил)піридин 1-оксид, 5-(3,4-дигідрокси5-нітробензоїл)-2-метил-4-(трифторметил)піридин 1-оксид, 3-(3,4-дигідрокси-5-нітробензоїл)-2,6диметил-4-(трифторметил)піридин 1-оксид, 3,5дихлор-4-(3,4-дигідрокси-5-нітробензоїл)піридин 1оксид, 3-(3,4-дигідрокси-5-нітробензоїл)-6-метил-2феніл-4-(трифторметил)піридин 1-оксид, 2-бром-3(3,4-дигідрокси-5-нітробензоїл)-4,5,6триметилпіридин 1-оксид, 2-хлор-3-(3,4дигідрокси-5-нітробензоїл)-4,5,6-триметилпіридин 1-оксид, 3-(3,4-дигідрокси-5-нітробензоїл)-2(трифторметил)піридин 1-оксид, 2,5-дихлор-3-(3,4дигідрокси-5-нітробензоїл)-4,6-диметилпіридин 1оксид, 3-(3,4-дигідрокси-5-нітробензоїл)-5(трифторметил)піридин 1-оксид, 3-(3,4-дигідрокси5-нітробензоїл)-2-фторпіридин 1-оксид, 4-(3,4дигідрокси-5-нітробензоїл)-2-фторпіридин 1-оксид, 2-(3,4-дигідрокси-5-нітробензоїл)-6-фторпіридин 1оксид, 2-хлор-3-(3,4-дигідрокси-5-нітробензоїл)-6метилпіридин 1-оксид, 2-бром-3-(3,4-дигідрокси-5нітробензоїл)-6-метилпіридин 1-оксид і 2-бром-5хлор-3-(3,4-дигідрокси-5-нітробензоїл)-4,6диметилпіридин 1-оксид. Переважні сполуки вищезгаданої загальної формули (І), що мають як центральний блок частину оксазол-2,4-діілу, включають 3-(4-(3,4дигідрокси-5-нітрофеніл)оксазол-2-іл)-4(трифторметил)піридин 1-оксид, 2-хлор-3-(4-(3,4дигідрокси-5-нітрофеніл)оксазол-2-іл)-4,6диметилпіридин 1-оксид, 3-(4-(3,4-дигідрокси-5нітрофеніл)оксазол-2-іл)-2-метил-6(трифторметил)піридин 1-оксид, 5-(4-(3,4дигідрокси-5-нітрофеніл)оксазол-2-іл)-2(трифторметил)піридин 1-оксид, 5-(4-(3,4дигідрокси-5-нітрофеніл)оксазол-2-іл)-2-метил-4(трифторметил)піридин 1-оксид, 3-(4-(3,4дигідрокси-5-нітрофеніл)оксазол-2-іл)-2,6диметил-4-(трифторметил)піридин 1-оксид, 3,5дихлор-4-(4-(3,4-дигідрокси-5-нітрофеніл)оксазол2-іл)піридин 1-оксид, 3-(4-(3,4-дигідрокси-5нітрофеніл)оксазол-2-іл)-6-метил-2-феніл-4(трифторметил)піридин 1-оксид, 2-бром-3-(4-(3,4дигідрокси-5-нітрофеніл)оксазол-2-іл)-4,5,6триметилпіридин 1-оксид, 2-хлор-3-(4-(3,4дигідрокси-5-нітрофеніл)оксазол-2-іл)-4,5,6триметилпіридин 1-оксид, 3-(4-(3,4-дигідрокси-5нітрофеніл)оксазол-2-іл)-2-(трифторметил)піридин 1-оксид, 2,5-дихлор-3-(4-(3,4-дигідрокси-5нітрофеніл)оксазол-2-іл)-4,6-диметилпіридин 1оксид, 3-(4-(3,4-дигідрокси-5-нітрофеніл)оксазол-2іл)-5-(трифторметил)піридин 1-оксид, 3-(4-(3,4дигідрокси-5-нітрофеніл)оксазол-2-іл)-2фторпіридин 1-оксид, 4-(4-(3,4-дигідрокси-5нітрофеніл)оксазол-2-іл)-2-фторпіридин 1-оксид, 2 19 (4-(3,4-дигідрокси-5-нітрофеніл)оксазол-2-іл)-6фторпіридин 1-оксид, 2-хлор-3-(4-(3,4-дигідрокси5-нітрофеніл)оксазол-2-іл)-6-метилпіридин 1оксид, 2-бром-3-(4-(3,4-дигідрокси-5нітрофеніл)оксазол-2-іл)-6-метилпіридин 1-оксид і 2-бром-5-хлор-3-(4-(3,4-дигідрокси-5нітрофеніл)оксазол-2-іл)-4,6-диметилпіридин 1оксид. Переважні сполуки вищезгаданої загальної формули (І), що мають як центральний блок частину бензол-1,3-діілу, включають 3-(3',4'дигідрокси-5'-нітробіфеніл-3-іл)-4(трифторметил)піридин 1-оксид, 5-(3',4'дигідрокси-5'-нітробіфеніл-3-іл)-2(трифторметил)піридин 1-оксид, 3,5-дихлор-4(3',4'-дигідрокси-5'-нітробіфеніл-3-іл)піридин 1оксид, 3-(3',4'-дигідрокси-5'-нітробіфеніл-3-іл)-2(трифторметил)піридин 1-оксид і 3-(3',4'дигідрокси-5'-нітробіфеніл-3-іл)-5(трифторметил)піридин 1-оксид. Переважні сполуки вищезгаданої загальної формули (І), що має як центральний блок частину 1-Н-піразол-1,5-діілу, включають 3-(5-(3,4дигідрокси-5-нітрофеніл)-1Н-піразол-1-іл)-4(трифторметил)піридин 1-оксид, 5-(5-(3,4дигідрокси-5-нітрофеніл)-1Н-піразол-1-іл)-2(трифторметил)піридин 1-оксид, 3,5-дихлор-4-(5(3,4-дигідрокси-5-нітрофеніл)-1Н-тразол-1іл)піридин 1-оксид, 3-(5-(3,4-дигідрокси-5нітрофеніл)-1Н-піразол-1-іл)-2(трифторметил)піридин 1-оксид, 3-(5-(3,4дигідрокси-5-нітрофеніл)-1Н-піразол-1-іл)-5(трифторметил)піридин 1-оксид і 4-(5-(3,4дигідрокси-5-нітрофеніл)-1H-піразол-1-іл)-2фторпіридин 1-оксид. Переважні сполуки вищезгаданої загальної формули (І), що мають як центральний блок частину піримідин-2,4-діілу, включають 3-(4-(3,4дигідрокси-5-нітрофеніл)піримідин-2-іл)-4(трифторметил)піридин 1-оксид, 2-хлор-3-(4-(3,4дигідрокси-5-нітрофеніл)піримідин-2-іл)-4,6диметилпіридин 1-оксид, 3-(4-(3,4-дигідрокси-5нітрофеніл)піримідин-2-іл)-2-метил-6(трифторметил)піридин 1-оксид, 5-(4-(3,4дигідрокси-5-нітрофеніл)піримідин-2-іл)-2(трифторметил)піридин 1-оксид, 5-(4-(3,4дигідрокси-5-нітрофеніл)піримідин-2-іл)-2-метил-4(трифторметил)піридин 1-оксид, 3-(4-(3,4дигідрокси-5-нітрофеніл)піримідин-2-іл)-2,6диметил-4-(трифторметил)піридин 1-оксид, 3,5дихлор-4-(4-(3,4-дигідрокси-5нітрофеніл)піримідин-2-іл)піридин 1-оксид, 3-(4(3,4-дигідрокси-5-нітрофеніл)піримідин-2-іл)-6метил-2-феніл-4-(трифторметил)піридин 1-оксид, 2-бром-3-(4-(3,4-дигідрокси-5нітрофеніл)піримідин-2-іл)-4,5,6-триметилпіридин 1-оксид, 2-хлор-3-(4-(3,4-дигідрокси-5нітрофеніл)піримідин-2-іл)-4,5,6-триметилпіридин 1-оксид, 3-(4-(3,4-дигідрокси-5нітрофеніл)піримідин-2-іл)-2(трифторметил)піридин 1-оксид, 2,5-дихлор-3-(4(3,4-дигідрокси-5-нітрофеніл)піримідин-2-іл)-4,6диметилпіридин 1-оксид і 3-(4-(3,4-дигідрокси-5нітрофеніл)піримідин-2-іл)-5(трифторметил)піридин 1-оксид. 94054 20 Переважні сполуки вищезгаданої загальної формули (І), що мають як центральний блок частину 1Н-пірол-2,5-діілу, включають 3-(5-(3,4дигідрокси-5-нітрофеніл)-1-метил-3(етоксикарбоніл)-1H-пірол-2-іл)-4(трифторметил)піридин 1-оксид, 2-хлор-3-(5-(3,4дигідрокси-5-нітрофеніл)-3-(етоксикарбоніл)-1метил-1Н-пірол-2-іл)-4,6-диметилпіридин 1-оксид, 3-(5-(3,4-дигідрокси-5-нітрофеніл)-1-метил-1Hпірол-2-іл)-2-метил-6-(трифторметил)піридин 1оксид, 5-(5-(3,4-дигідрокси-5-нітрофеніл)-1-етил-3(етоксикарбоніл)-1H-пірол-2-іл)-2(трифторметил)піридин 1-оксид, 5-(5-(3,4дигідрокси-5-нітрофеніл)-1-метил-1Н-пірол-2-іл)-2метил-4-(трифторметил)піридин 1-оксид, 3-(5-(3,4дигідрокси-5-нітрофеніл)-1-метил-1Н-пірол-2-іл)2,6-диметил-4-(трифторметил)піридин 1-оксид, 3,5-дихлор-4-(5-(3,4-дигідрокси-5-нітрофеніл)-1метил-1Н-пірол-2-іл)піридин 1-оксид, 3-(5-(3,4дигідрокси-5-нітрофеніл)-1-метил-1Н-пірол-2-іл)-6метил-2-феніл-4-(трифторметил)піридин 1-оксид, 2-бром-3-(5-(3,4-дигідрокси-5-нітрофеніл)-1-метил1H-пірол-2-іл)-4,5,6-триметилпіридин 1-оксид, 2хлор-3-(5-(3,4-дигідрокси-5-нітрофеніл)-1-метил1H-пірол-2-іл)-4,5,6-триметилпіридин 1-оксид, 3-(5(3,4-дигідрокси-5-нітрофеніл)-1-метил-1H-пірол-2іл)-2-(трифторметил)піридин 1-оксид, 2,5-дихлор3-(5-(3,4-дигідрокси-5-нітрофеніл)-1-метил-1Нпірол-2-іл)-4,6-диметилпіридин 1-оксид, 3-(5-(3,4дигідрокси-5-нітрофеніл)-1-метил-1H-пірол-2-іл)-5(трифторметил)піридин 1-оксид, 3-(5-(3,4дигідрокси-5-нітрофеніл)-1-метил-1Н-пірол-2-іл)-2фторпіридин 1-оксид, 4-(5-(3,4-дигідрокси-5нітрофеніл)-1-метил-1Н-пірол-2-іл)-2-фторпіридин 1-оксид, 2-(5-(3,4-дигідрокси-5-нітрофеніл)-3(етоксикарбоніл)-1-метил-1H-пірол-2-іл)-6фторпіридин 1-оксид, 2-хлор-3-(5-(3,4-дигідрокси5-нітрофеніл)-1-метил-1Н-пірол-2-іл)-6метилпіридин 1-оксид, 2-бром-3-(5-(3,4-дигідрокси5-нітрофеніл)-1-метил-1Н-пірол-2-іл)-6метилпіридин 1-оксид і 2-бром-5-хлор-3-(5-(3,4дигідрокси-5-нітрофеніл)-1-метил-1H-пірол-2-іл)4,6-диметилпіридин 1-оксид. Переважні сполуки вищезгаданої загальної формули (І), що має як центральний блок частину 2Н-тетразол-2,5-діілу, включають 3-(5-(3,4дигідрокси-5-нітрофеніл)-2Н-тетразол-2-іл)-4(трифторметил)піридин 1-оксид, 5-(5-(3,4дигідрокси-5-нітрофеніл)-2Н-тетразол-2-іл)-2(трифторметил)піридин 1-оксид, 3,5-дихлор-4-(5(3,4-дигідрокси-5-нітрофеніл)-2Н-тетразол-2іл)піридин 1-оксид, 3-(5-(3,4-дигідрокси-5нітрофеніл)-2Н-тетразол-2-іл)-2(трифторметил)піридин 1-оксид і 3-(5-(3,4дигідрокси-5-нітрофеніл)-2Н-тетразол-2-іл)-5(трифторметил)піридин 1-оксид. Переважні сполуки вищезгаданої загальної формули (І), що мають як центральний блок частину 1,2,3-тіадіазол-4,5-діілу, включають 3-(4-(3,4дигідрокси-5-нітрофеніл)-1,2,3-тіадіазол-5-іл)-4(трифторметил)піридин 1-оксид, 2-хлор-3-(4-(3,4дигідрокси-5-нітрофеніл)-1,2,3-тіадіазол-5-іл)-4,6диметилпіридин 1-оксид, 3-(4-(3,4-дигідрокси-5нітрофеніл)-1,2,3-тіадіазол-5-іл)-2-метил-6(трифторметил)піридин 1-оксид, 5-(4-(3,4 21 дигідрокси-5-нітрофеніл)-1,2,3-тіадіазол-5-іл)-2(трифторметил)піридин 1-оксид, 5-(4-(3,4дигідрокси-5-нітрофеніл)-1,2,3-тіадіазол-5-іл)-2метил-4-(трифторметил)піридин 1-оксид, 3-(4-(3,4дигідрокси-5-нітрофеніл)-1,2,3-тіадіазол-5-іл)-2,6диметил-4-(трифторметил)піридин 1-оксид, 3,5дихлор-4-(4-(3,4-дигідрокси-5-нітрофеніл)-1,2,3тіадіазол-5-іл)піридин 1-оксид, 3-(4-(3,4-дигідрокси5-нітрофеніл)-1,2,3-тіадіазол-5-іл)-6-метил-2феніл-4-(трифторметил)піридин 1-оксид, 2-бром-3(4-(3,4-дигідрокси-5-нітрофеніл)-1,2,3-тіадіазол-5іл)-4,5,6-триметилпіридин 1-оксид, 2-хлор-3-(4(3,4-дигідрокси-5-нітрофеніл)-1,2,3-тіадіазол-5-іл)4,5,6-триметилпіридин 1-оксид, 3-(4-(3,4дигідрокси-5-нітрофеніл)-1,2,3-тіадіазол-5-іл)-2(трифторметил)піридин 1-оксид, 2,5-дихлор-3-(4(3,4-дигідрокси-5-нітрофеніл)-1,2,3-тіадіазол-5-іл)4,6-диметилпіридин 1-оксид, 3-(4-(3,4-дигідрокси5-нітрофеніл)-1,2,3-тіадіазол-5-іл)-5(трифторметил)піридин 1-оксид, 3-(4-(3,4дигідрокси-5-нітрофеніл)-1,2,3-тіадіазол-5-іл)-2фторпіридин 1-оксид, 4-(4-(3,4-дигідрокси-5нітрофеніл)-1,2,3-тіадіазол-5-іл)-2-фторпіридин 1оксид, 2-(4-(3,4-дигідрокси-5-нітрофеніл)-1,2,3тіадіазол-5-іл)-6-фторпіридин 1-оксид, 2-хлор-3-(4(3,4-дигідрокси-5-нітрофеніл)-1,2,3-тіадіазол-5-іл)6-метилпіридин 1-оксид, 2-бром-3-(4-(3,4дигідрокси-5-нітрофеніл)-1,2,3-тіадіазол-5-іл)-6метилпіридин 1-оксид і 2-бром-5-хлор-3-(4-(3,4дигідрокси-5-нітрофеніл)-1,2,3-тіадіазол-5-іл)-4,6диметилпіридин 1-оксид. Переважні сполуки вищезгаданої загальної формули (І), що мають як центральний блок частину тіазол-2,4-діілу, включають 3-(4-(3,4дигідрокси-5-нітрофеніл)тіазол-2-іл)-4(трифторметил)піридин 1-оксид, 2-хлор-3-(4-(3,4дигідрокси-5-нітрофеніл)тіазол-2-іл)-4,6диметилпіридин 1-оксид, 3-(4-(3,4-дигідрокси-5нітрофеніл)тіазол-2-іл)-2-метил-6(трифторметил)піридин-1-оксид, 5-(4-(3,4дигідрокси-5-нітрофеніл)тіазол-2-іл)-2(трифторметил)піридин 1-оксид, 5-(4-(3,4дигідрокси-5-нітрофеніл)тіазол-2-іл)-2-метил-4(трифторметил)піридин 1-оксид, 3-(4-(3,4дигідрокси-5-нітрофеніл)тіазол-2-іл)-2,6-диметил4-(трифторметил)піридин 1-оксид, 3,5-дихлор-4-(4(3,4-дигідрокси-5-нітрофеніл)тіазол-2-іл)піридин 1оксид, 3-(4-(3,4-дигідрокси-5-нітрофеніл)тіазол-2 94054 22 іл)-6-метил-2-феніл-4-(трифторметил)піридин 1оксид, 2-бром-3-(4-(3,4-дигідрокси-5нітрофеніл)тіазол-2-іл)-4,5,6-триметилпіридин 1оксид, 2-хлор-3-(4-(3,4-дигідрокси-5нітрофеніл)тіазол-2-іл)-4,5,6-триметилпіридин 1оксид, 3-(4-(3,4-дигідрокси-5-нітрофеніл)тіазол-2іл)-2-(трифторметил)піридин 1-оксид, 2,5-дихлор3-(4-(3,4-дигідрокси-5-нітрофеніл)тіазол-2-іл)-4,6диметилпіридин 1-оксид, 3-(4-(3,4-дигідрокси-5нітрофеніл)тіазол-2-іл)-5-(трифторметил)піридин 1-оксид, 3-(4-(3,4-дигідрокси-5-нітрофеніл)тіазол-2іл)-2-фторпіридин 1-оксид, 4-(4-(3,4-дигідрокси-5нітрофеніл)тіазол-2-іл)-2-фторпіридин 1-оксид, 2(4-(3,4-дигідрокси-5-нітрофеніл)тіазол-2-іл)-6фторпіридин 1-оксид, 2-хлор-3-(4-(3,4-дигідрокси5-нітрофеніл)тіазол-2-іл)-6-метилпіридин 1-оксид, 2-бром-3-(4-(3,4-дигідрокси-5-нітрофеніл)тіазол-2іл)-6-метилпіридин 1-оксид і 2-бром-5-хлор-3-(4(3,4-дигідрокси-5-нітрофеніл)тіазол-2-іл)-4,6диметилпіридин 1-оксид. У одному варіанті здійснення, сполуки загальної формули І, де центральний блок складається з частини 1,2,4-оксадіазо-3,5-дііл, можуть бути отримані способом, де сполука загальної формули ІІА, ІІВ або ІІС, де R4, R-5, R6 і R7 визначені як у загальній формулі І, піддали реакції циклізації, що включає конденсацію і дегідратацію зі сполукою загальної формули III, де R8 і R9 незалежно одна від одної представляють водень або відповідні захисні групи для ароматичних гідроксильних групи, при умовах, придатних для отримання похідних оксадіазолу формули IVA, IVB або IVC, 23 З наступним видаленням гідроксильних захисних груп для забезпечення сполук загальної формули І, де центральний блок складається з частини 1,2,4-оксадіазо-3,5-діілу. У іншому варіанті здійснення, сполуки загальної формули І, де центральний блок складається з частини 1,2,4-оксадіазо-3,5-діілу, можуть бути отримані способом, де сполука загальної формули VA, VB або VC, з наступним окисленням атому нітрогену піридилу для отримання сполуки, згідно з формулою IVA, IVB або IVC як показано вище, і нарешті, у разі необхідності, видалили гідроксильні захисні групи для забезпечення сполук загальної формули І, де центральний блок складається з частини 1,2,4-оксадіазо-3,5-діілу. Відповідні захисні групи для ароматичних гідроксильних груп добре відомі у техніці. Приклади придатних захисних груп для ароматичних гідроксильних груп включають метил, етил, ізопропіл, бензил, 4-метоксибензил, метоксиметил, бензилоксиметил, метоксиетоксиметил, тетрагідропіраніл, фенацил, аліл, триметилсиліл, тертбутилдиметилсиліл, бензилоксикарбоніл, тертбутоксикарбоніл, ефір, сульфонат, карбамат, фосфінат, ацеталь і кеталь похідні. У переважному варіанті здійснення, одна з груп R8 і R9 є воднем, а інша є метилом. У окремому переважному варіанті здійснення, R8 представляє метил, а R9 представляє водень. У альтернативному переважному варіанті здійснення, захисні групи R8 і R9 заміщені воднем або групою, здатною гідролізуватись при фізіологічних умовах. Захисні групи R8 і R9 можуть бути видаленими незалежно одна від одної на різних етапах реакції або вони можуть бути видаленими на тому ж етапі реакції. Подібно, введення групи, здатної гідролізуватись при фізіологічних умовах, може мати місце на тому ж або на наступному етапі реакції. У даному винаході, умови, придатні для отримання похідних оксадіазолу, включають умови, які надають похідну оксадіазолу з високим виходом і чистотою. Переважно, вихід бажаного похідного оксадіазолу складає, щонайменше, 70%, більш переважно 75-99%, навіть більш переважно 80 94054 24 де R4, R5, R6 і R7 визначені як у загальній формулі І, піддали реакції циклізації, що включає конденсацію і дегідратацію зі сполукою загальної формули III при умовах, придатних для отримання похідних оксадіазолу формули VIA, VIB або VIC, 97%, і найбільш переважно 85-95%. Переважно, чистота бажаної похідної оксадіазолу складає, щонайменше, 90%, більш переважно, щонайменше, 95%, навіть більш переважно, щонайменше, 99%, і найбільш переважно, щонайменше, 99,5%. Виходячи з вивчення даного винаходу спеціаліст може регулярно досліджувати більш придатні реакційні умови для оптимізації виходу і чистоти оксадіазолу. Параметри, які взяті до уваги спеціалістом, включають, але не обмежуються, реагенти, що забезпечують агенти конденсації і дегідратації, вибір захисних груп R8 і R9, системи розчинника, температури реакції і часу реакції і розчинності реагентів. Сполука загальної формули III вимагає активації перед конденсацією зі сполукою формули ІІАІІС або VA-VC. Придатні агенти для активації сполуки формули III включають 1,1карбонілдиімідазол, тіонілхлорид, сульфонілхлорид, Ν,Ν'-дициклогексилкарбодиімід, 1гідроксибензотриазол і N-(3-диметиламінопропіл)N'-етилкарбодиімід, фосген, РСI3, РОСI3, РСI5, ангідриди, трихлортриазин і хлордиметокситриазин і подібне. Зокрема переважними є 1,1карбонілдиімідазол і тіонілхлорид. У деяких випадках, однакові реагенти можуть застосовувати для виконання етапу циклізації, який складається з конденсації і дегідратації. Альтернативні реагенти для виконання конденсації і/або дегідратації включають піридин і тетрабутиламоній фторид. Переважно дегідратація може виконуватись тепловим нагріванням реакційної суміші у поєднанні з вищезгаданими реагентами. Сполука загальної формули III може бути активована надлишком реагенту, таким як тіонілхлорид у придатному розчиннику або без потреби додаткового розчинника. Якщо переважно, над 25 лишок реагенту потім видаляють, наприклад, дистиляцією, і заміняють розчинником або іншим реагентом, таким як піридин для виконання етапів конденсації і дегідратації. Переважними системами розчинника для активації сполуки загальної формули III, і циклізації зі сполуками загальних формул llА-llС або VA-VC є диполярні апротонні розчинники, що включають диметилформамід, диметилсульфоксид, диметилацетамід і Nметилпіролідинон. Зокрема переважними є диметилсульфоксид і диметилацетамід. Придатні температури реакції і часи реакції залежать від реакційності застосованих реагентів для виконання конденсації і дегідратації. Переважно, температура реакції знаходиться у межах від 0°С до точки кипіння застосованої системи розчинника, більш переважно у межах 20-150°С і найбільш переважно у межах 25-120°С. Переважно, час реакції знаходиться у межах 30 хвилин-24 годин, більш переважно у межах 1 година - 18 годин і найбільш переважно у межах 2-6 годин. У альтернативному переважному варіанті здійснення, реакцію конденсації і дегідратації проводять у присутності органічної і неорганічної основи. Придатні переважні основи включають триетиламін, трибутиламін, 2,6-лутидин, Nметилморфолін, піридин, імідазол, Nметилімідазол і 4-диметиламінопіридин. Окремі переважні основи включають піридин, Nметилімідазол і 4-диметиламінопіридин. У переважному варіанті здійснення даного винаходу, конденсацію і дегідратацію провели у два різних етапи реакції. У даному окремому варіанті здійснення, можуть застосовувати різні агенти конденсації і дегідратації і системи розчинника для оптимізації виходу і чистоти отриманого продукту. У альтернативному переважному варіанті здійснення даного винаходу, конденсацію і дегідратацію провели послідовно у тій самій ємності без ізоляції є О-ацетильованих інтермедіатів. У даному окремому варіанті здійснення реагенти, що виконують конденсацію і дегідратацію, можуть бути однаковими або різними, але переважно ідентичними. Кількість реагентів, що виконують конденсацію і дегідратацію, не є критичною. Типові кількості реагентів, що виконують конденсацію і дегідратацію, включають, щонайменше, кількість 1моль, переважно 2,1моль-5моль, більш переважно 2,24моль і найбільш переважно 2,3моль-3моль на моль похідної піридину. У випадках, коли реагенти, що проводять конденсацію і дегідратацію, також служать розчинником або допоміжним розчинником, надлишкова кількість може бути набагато вищою. Як згадувалось вище, у переважних варіантах здійснення, винахід включає етап на якому атом нітрогену частини піридилу VIA, VIB або VIC окисляють при придатних умовах до відповідної похідної піридил-N-оксиду IVA, IVB або IVC після реакції циклізації. У даному винаході придатні окисні умови для отримання піридил-И-оксиду включають умови, які надають похідна піридил-N-оксиду з високим виходом і чистотою. Переважно вихід бажаної похід 94054 26 ної піридил-N-оксиду складає, щонайменше, 90%, більш переважно 92-99%, навіть більш переважно 94-98%, і найбільш переважно 95-97%. Переважно, чистота бажаної похідної піридил-N-оксиду складає, щонайменше, 90%, більш переважно, щонайменше, 95%, навіть більш переважно, щонайменше, 99%, і найбільш переважно, щонайменше, 99,5%. Виходячи з вивчення даного винаходу спеціаліст може регулярно досліджувати більш придатні реакційні умови для оптимізації виходу і чистоти піридил-N-оксиду. Параметри, які взяті до уваги спеціалістом, включають, але не обмежуються, агент, що окислює, кількість агента, що окислює, вибір захисних груп, систему розчинника, температуру реакції і час реакції і розчинність реагентів. Переважні агенти, що окислюють, включають пероксид водню, МnО2, надоцтову кислоту, трифторнадоцтову кислоту, t-бутилгідропероксид, тхлорпероксибензойну кислоту, надсірчану кислоту, Охоnе®, комплекс пероксиду водню з сечовиною і трифтороцтовий ангідрид, піридиній хлорхромат і іони перманганату. Зокрема переважним є комплекс пероксиду водню з сечовиною і трифтороцтовий ангідрид. Переважна кількість агенту, що окислює, знаходиться у межах еквімолярних кількостей до 20тикратного надлишку до похідної піридину. Переважно, кількість агентів, що окислюють, знаходиться у межах 1,2-кратного - 10-кратного надлишку, більш переважно 1,5-кратного - 8-кратного надлишку і найбільш переважно 2-кратного - 5кратного надлишку. Переважними системами розчинника для проведення окислення є розчинники, які інертні до агентів, що окислюють. Зокрема, переважними є галогеновані розчинники, такі як дихлорметан, хлороформ, хлорбензол і вуглецю тетрахлорид, ароматичні розчинники, такі як бензол і толуол, алкани, такі як циклогексан і гексан, і ефіри, такі як THF (тетрагiдрофуран), 1,4-діоксан і тертбутилметилефір. Придатні температури реакції і часи реакції залежать від реакційності застосованих агентів, що окислюють. Переважно температура реакції знаходиться у межах від 0°С до точки кипіння застосованої системи розчинника, більш переважно у межах 20-100°С, і найбільш переважно у межах 40-80°С. Переважно, час реакції знаходиться у межах 30 хвилин - 24 години, більш переважно у межах 1 годна - 18 годин і найбільш переважно 2-6 годин. Окислення атому нітрогену піридилу може проводитись на будь-якому етапі способу отримання сполук за загальною формулою І. Переважно, окислення проводять перед утворенням сполук формул ІІА-llС, або альтернативно після утворення оксадіазольного кільця як у сполук формул VIAVIC. У іншому аспекті винаходу, сполуки формули llА, llВ або llС отримані реакцією сполук загальної формули VIIA, VIIB або VIIC, 27 з гідроксиламіном у присутності хелатного агенту при придатних умовах реакції. У іншому аспекті винаходу, сполуки формули VA, VB або VC отримані реакцією сполук загальної формули VIIIA, VIIIB або VIIIC, з гідроксиламіном у присутності хелатного агенту при придатних умовах реакції. У даному винаході, придатні умови реакції вищезгаданих реакцій включають умови, при яких отримують похідну амідоксиму з високим виходом і чистотою. Переважно, вихід бажаної похідної амідоксиму складає, щонайменше, 70%, більш переважно 72-95%, навіть більш переважно 7590%, і найбільш переважно 78-85%. Переважно, чистота бажаного амідоксиму складає, щонайменше, 90%, більш переважно, щонайменше, 95%, навіть більш переважно, щонайменше, 96% і найбільш переважно, щонайменше, 97%. Виходячи з даного винаходу спеціаліст може регулярно досліджувати більш придатні реакційні умови для оптимізації виходу і чистоти амідоксиму. Параметри, які взяті до уваги спеціалістом, включають, але не обмежуються, кількість гідроксиламіну, вибір каталізатора, природу замісників R4-R.7, систему розчинника, температуру реакції, час реакції і розчинність реагентів. Переважна кількість гідроксиламіну знаходиться у межах еквімолярних кількостей до 50кратного надлишку до похідної піридину. Переважно, кількість гідроксиламіну знаходиться у межах 1,2-кратного - 20-кратного надлишку, більш переважно 1,5-кратного - 10-кратного надлишку і найбільш переважно 3-кратного - 5-кратного надлишку. Переважні хелатні агенти включають 8гідроксихінолін, орто-фенантролін і гідрати і їх похідні. Переважна кількість хелатного агента знаходиться у межах 0,1-10мол.%, більш переважно 0,55мол.%, більш переважно 0,75-3мол.% і найбільш переважно 1-1,5мол.%. Система розчинника частково не обмежена і включає воду, спирти, такі як метанол, етанол або ізопропанол, ефіри, такі як THF або 1,4-діоксан, і диполярні апротонні розчинники, такі як диметилсульфоксид і подібне, або суміші даних розчинників. Переважно температура реакції знаходиться у межах від 0°С то точки кипіння застосованої системи розчинника, більш переважно у межах 20100°С, і найбільш переважно у межах 40-80°С. Переважно, час реакції знаходиться у межах 30 хвилин - 24 години, більш переважно у межах 1 години - 18 годин і найбільш переважно 2-8 годин. 94054 28 Для отримання фармацевтичної композиції загальної формули (І), інертні фармацевтично прийнятні носії змішали з активними сполуками. Фармацевтично прийнятні носії можуть бути або твердими, або рідкими. Препарати у твердій формі включають порошки, таблетки, дисперсні гранули і капсули. Твердим носієм може бути одна або більше речовин, які також можуть діяти як розріджувачі, запашники, солюбілізатори, змащувачі, суспендуючі агенти, зв'язувачі або агенти, що дезінтегрують таблетки; він також може бути інкапсульованим матеріалом. Переважно фармацевтичний препарат є одиницею дозованої форми, наприклад, запакованим препаратом, упаковкою, що містить дискретні кількості препарату, такого як запаковані таблетки, капсули і порошки у пробірках або ампулах. Дозування можуть варіювати в залежності від потреби пацієнта, важкості захворювання і застосування окремої сполуки. Для зручності, всю денну дозу можна розділити і вводити порціями протягом дня. Дослідження належного дозування для окремої ситуації знаходиться у межах кваліфікації спеціалістів медичної галузі. Матеріали і способи Аналіз КОМТ активності миші В усіх експериментах застосовують зразки печінки мишей лінії NMRI віком від 60 днів, вагою 2030г (Harlan-Interfauna Iberica, Barcelona, Spain), що тримають по десять на клітку при регульованих умовах навколишнього середовища (12 годинний цикл світло/темрява і кімнатна температура 24°С). У експериментах застосовують тканини, перфузовані сольовим розчином, відібрані у мишей, анестезованих пентобарбітоном (60мг/кг). Тканини відразу видаляють і гомогенізують у 5мМ фосфатному буфері, рН7,8, і зберігають при -80°С. КОМТ активність оцінюють за здатністю метилювати адреналін до метанефрину, як попередньо описано (Vieira-Coelho, M.A., Soares-da-Silva, P., Brain Res, 1999, 821, 69-78). Аліквоти по 0,5мл печінкового гомогенату попередньо інкубують протягом 20 хвилин за допомогою 0,4мл фосфатного буферу (5мМ); згодом реакційну суміш інкубують протягом 10 хвилин за допомогою адреналіну (500мкМ; 0,1мл) у присутності S-аденозил-Lметіоніну з насиченою концентрацією, донору метилу (250мкМ). Інкубаційне середовище також містить паргілін (100мкМ), MgCl2 (100мкМ) і EGTA (етиленгліколь тетраоцтову кислоту) (1мМ). Попередню інкубацію і інкубацію проводять при 37°С при умовах захисту від світла з безперервним струшуванням і без окислення. Наприкінці періоду інкубації пробірки помістили на лід, а реакцію зупинили додаванням 200мкл 2Μ надхлорної кислоти. Потім зразки центрифугують (200×g, 4 хвилини, 4°С), і застосовують 500мкл аліквот супернатанту, відфільтрованого у пробірки з фільтрувальною вставкою з розміром пор 0,22мкм Spin-X (Costar), і піддають аналізу метанефрину з використанням високоефективної рідинної хроматографії з електрохімічним визначенням. У експериментах, спланованих для оцінювання ефектів дослідних сполук на КОМТ печінки, дослідні сполуки (у 5% карбоксиметилцелюлозі) 29 подають через шлунковий зонд мишам, що голодували протягом ночі. Потім при певних інтервалах печінки видаляють і застосовують для дослідження активності КОМТ, як описано вище. Аналіз КОМТ активності щурів В усіх експериментах застосовують печінки самців щурів лінії Wistar віком 60 днів вагою 240260г (Harlan-Interfauna Iberica, Barcelona, Spain), яких тримають по два на клітку при регульованих умовах навколишнього середовища (12 годинний цикл світло/темрява і кімнатна температура 24°С). Після декапітації органи відразу видаляють і гомогенізують у5мМ фосфатного буфера при рН7,8. Активність КОМТ оцінюють за здатністю метилювати адреналін до метанефрину. Аліквоти по 0,5мл печінкових гомогенатів попередньо інкубують протягом 20 хвилин з 0,4мл фосфатного буферу (5мМ); згодом реакційну суміш інкубують протягом 5 хвилин з епінефрином (1000мкМ; 0,1мл) у присутності S-аденозил-Ь-метіоніну (500мкМ) з насиченою концентрацією, донору метилу; інкубаційне середовище також містить паргілін (100мкМ), MgCl2 (100мкМ) і EGTA (1мМ). Попередню інкубацію і інкубацію проводять при 37°С при умовах захисту від світла з безперервним струшуванням і без окислення. У експериментах, спланованих для оцінювання пероральної біологічної активності дослідних речовин, сполуки подають через шлунковий зонд щурам, що голодували протягом ночі. Потім при певних інтервалах тварин забивають декапітацією, а печінки видаляють і використовують для дослідження активності КОМТ, як описано вище. Наприкінці періоду інкубації (5 хвилин) пробірки поміщають на лід, а реакцію зупиняють додаванням 200мкл 2Μ надхлорної кислоти. Потім зразки центрифугують (200×g, 4 хвилин, 4°С), і застосовують 500 мкл аліквот супернатанту, відфільтрованого у пробірки з фільтрувальною вставкою з розміром пор 0,22мкм Spin-X (Costar) для аналізу метанефрину. Аналіз метанефрину виконують за допомогою високоефективної рідинної хроматографії з електрохімічним визначенням. Нижчі межі визначення метанефрину коливаються від 350 до 500фмоль (0,5-1,0пмоль/мг білок/година). Рівні L-DOPA і 3-О-метил-L-DOPA у плазмі Щурам, що голодували протягом ночі, перорально вводять толкапон, ентакапон і сполуки загальної формули І (усе при 3мг/кг) або наповнювач (0,5% карбоксиметилцелюлоза, 4мл/кг). Після 1, 6 або 23 години щурам перорально вводять L-DOPA (12мг/кг) плюс бензеразид (3мг/кг) або наповнювач (0,5% карбоксиметилцелюлоза, 4мл/кг). Через одну годину щурів анестезують пентобарбітоном натрію (60мг/кг, інтраперитонально), кров відбирають через порожнисту вену і швидко видаляють весь мозок. Зразки крові центрифугують протягом 15 хвилин при 3000g (4°C), зразки плазми зберігають при -80°С до аналізу L-DOPA і 3-О-метил-LDOPA. Усі експерименти на тваринах виконували згідно з Європейською Директивою №86/609 і правилами "Guide for the Care and Use of Laboratory Animals", 7th edition, 1996, Institute for Laboratory Animal Research (ILAR), Washington, DC. Аналіз L-DOPA і похідних катехолу 94054 30 L-DOPA і 3-О-метил-L-DOPA у зразках крові аналізують за допомогою ВЕРХ (високоефективна рідинна хроматографія) з електрохімічним визначенням, як попередньо описано (Soares-da-Silva et al., Brain Res. 2000;863:293-297). Коротко, аліквоти 20 мкл вводять до хроматографа. Хроматографічна система складається з насосу (Gilson 307) і 5мкм колонки ODS2 з нержавіючої сталі (Biophase; Bioanalytical Systems, West Lafayette, IN) довжиною 25см і діаметром 4,6мм; зразки вводять за допомогою автоматичного дозатору зразків (Gilson 231), що приєднаний до ділютора Gilson (Gilson 401). Рухлива фаза є дегазованим розчином лимонної кислоти 0,1мМ; октилсульфату натрію 0,5мМ; ацетату натрію 0,1М; Na2EDTA 0,17мМ; дибутиламіну 1мМ і метанолу (10% об'єм/об'єм), рН регулюють до 3,5 за допомогою PCА 2Μ і перекачують при швидкості 1,0мл хвилина-1. Визначення виконують електрохімічно зі скловуглеводневим електродом, дослідним електродом Ag/AgCl і амперметричним детектором (Gilson 142); комірка детектора керується при 0,75В. Отриманий потік регулюють, застосовуючи програмне забезпечення Gilson Unipoint HPLC. Клітинна токсичність Спосіб, за яким визначають клітинну токсичність дослідної речовини виконують, як описано у Pedrosa та Soares-da-Silva (Br. J. Pharmacol., 137, 1 1305-1313, 2002). Коротко, клітини мишачої нейробластоми Neuro 2A висівають на 96-лункові планшети на культуральне середовище по 200мкл на лунку для зв'язування клітини (СМА) при зволоженій атмосфері СО2/повітря (5%/95%) при 37°С. Регулювання дослідної системи перед інкубаціями полягає у морфологічному контролі (світлова мікроскопія) культуральних клітин: зв'язування, розширення і щільність. Через п'ять днів після висівання (через 24 години клітини зливаються) культуральні клітини інкубують протягом 24 годин з дослідними сполуками. Культури без дослідного зразка або етанолу запускають паралельно як негативні і позитивні контролі. Усі інкубації містять однаковий відсоток розчинника, потрібного для дослідної сполуки. Життєздатність клітини вимірюють, застосовуючи кальцеїн-АМ (Molecular Probes, Eugene, OR, USA). Кальцеїн-АМ, що проникає через мембрану, нефлуоресцентний барвник, взяли і перетворили внутрішньоклітинними естеразами на кальцеїн, що не проникає через мембрану, який випромінює зелену флуоресценцію. Після обробки дослідним зразком або носієм протягом 24 годин клітини двічі промивають середовищем Хенкса (композиція середовища, у мМ: NaCl, 137; KСI, 5; MgSO4, 0,8; Na2HPO4, 0,33; KН2РО4, 0,44; СаСI2, 0,25; MgCl2, 1,0; Tris HCl, 0,15 і бутират натрію, 1,0, рН=7,4) і насичують 2мкМ кальцеїном-АМ у середовище Хенкса при кімнатній температурі протягом 30 хвилин. Флуоресценцію вимірюють у діапазоні 485нм при збудженні і в діапазоні 530нм при емісії довжини хвиль на багапланшетному зчитувач. Щоб визначити мінімальне забарвлення для кальцеїну-АМ (кальцеїнmn), вісім лунок обробляють етанолом за 30 хвилин перед додаванням кальце 31 їну-АМ. Процент життєздатності потім розраховують як [(кальцеїнзразок-кальцеїнmin)/ (кальцеїнконтроль-кальцеїнmin)]×100. Результати Таблиця 1 показує ефекти стандартних КОМТ інгібіторів, толкапону і ентакапону, і сполук загаль 94054 32 ної формули І на КОМТ активність у печінці миші через 3 години після перорального введення (3мг/кг). У таблиці 1 також показано життєздатність клітин через 24 години після введення толкапону, ентакапону і сполук загальної формули І (усі при 30мкМ) у клітини Neuro 2А. 33 94054 34 35 94054 36 37 94054 38 39 94054 40 Примітка: * представляє точку приєднання замісника піридин N-оксиду до молекули. Також з'ясували, що сполуки загальної формули І також є сильними інгібіторами КОМТ у печінці щура, максимальний інгібіторний ефект досягається за 1 годину - 3 години після їх перорального введення (Таблиця 2). Максимальний інгібіторний ефект ентакапона (Ent) і толкапона (Тоlс) досліджують у межах 1 години після введення (Таблиця 2). Через дев'ять годин після введення ентакапон втрачає ефекти КОМТ інгібітору, а толкапон проявляє мінімальні інгібіторні ефекти (~16% інгібування), тоді як сполуки загальної формули І продовжують інгібувати КОМТ активність на 22%-90% від контрольних рівнів (Таблиця 2). Таблиця 2 КОМТ активність у печінці щура (% контролю) після 3мг/кг (перорального) введення перелічених сполук Сполука Ентакапон Толкапон 18 29 1 32,0 18,3 5,2 1,2 Час (година) 3 6 74,5 95,2 28,6 56,8 19,9 43,0 18,5 39,7 9 100,0 83,9 57,4 56,4 41 30 41 42 43 45 47 6,3 21,2 3,6 16,1 1,1 10,6 94054 34,8 9,3 6Д 30,6 1,2 4,0 41,2 18,8 12,3 64,3 3,8 3,8 54,5 39,7 30,9 77,9 8,9 8,2 Таблиця 3 показує відсоткові зміни рівнів у плазмі L-DOPA і 3-О-метил-L-DOPA (3-OMD) щурів, яких обробили L-DOPA плюс бензеразид через 2 години після введення ентакапону, толкапону і сполук загальної формули І (3мг/кг). L-DOPA плюс бензеразид вводять за 1 годину перед відбиранням зразків плазми. Даний момент часу вибрали, тому що він представляє tmax для L-DOPA. Як спостерігають, сполуки загальної формули І утворюють значні підвищення L-DOPA у плазмі, що супроводжується відміченим зниженням у плазмі 3-(9-метил-L-DOPA. Таблиця 3 Ефект перелічених сполук, (3мг/кг; пероральне введення) на зміни (% контролю) рівнів у плазмі LDOPA і 3-О-метил-L-DOPA (3-OMD) щурів, оброблених L-DOPA плюс бензеразид L-DOPA 3-OMD L-Dopa/ % підвищення % зниження 3-OMD Ентакапон 68,5 -55,6 3,8 Толкапон 202,4 -89,0 27,6 18 61,4 -63,9 4,5 29 105,1 -80,7 10,6 30 103,5 -75,0 8Д 41 95,2 -72,3 7,1 42 30,7 -43,4 2,3 43 74,9 -48,3 3,4 45 100,8 -54,3 4,4 47 102,9 -58,5 4,9 Сполука Висновок Сполуки загальної формули І є дуже сильними інгібіторами катехол-О-метилтрансферази (КОМТ) при значно зниженій токсичності. Сполуки загальної формули І мають потенційно корисні фармацевтичні властивості у лікуванні деяких порушень центральної і периферичної нервової системи, де інгібування (9-метилювання катехоламінів може бути терапевтично вигідним, таких як порушення настрою, хвороба Паркінсона і паркінсонівські порушення, синдром втомлених ніг, шлунковокишкові захворювання, захворювання, що супроводжуються утворенням едеми, і гіпертензія. Можливість застосування сильного, довго діючого інгібітору з покращеним показниками безпеки відкриває нові перспективи у лікуванні хвороби Паркінсона і паркінсонівських порушень, шлунково-кишкових захворювань, захворювань, що супроводжуються утворенням едеми, і гіпертензії шляхом покращення безпеки КОМТ інгібіторів нітрокатехолу у процесі покращення або підтримки тривалості і селективності КОМТ інгібування. Це, зокрема, є важливим для лікування пацієнтів, що страждають на хворобу Паркінсона, які приймають 42 L-DOPA плюс периферійний AADC інгібітор, внаслідок того, що це довготривале лікування. Даний винахід описується наступними прикладами отримання, які не можна розглядати, як обмежуючі об'єм розкриття. Альтернативні шляхи і аналогічні структури можуть бути очевидними для спеціалістів даної галузі. Приклад 1 3-Нітро-5-[3-(1-окси-піридин-4-іл)[1,2,4]оксадіазол-5-іл]-бензол-1,2-діол (сполука 4, Таблиця 1) a) До перемішаного розчину 3,4-дибензилокси5-нітробензойної кислоти (0,5г, 1,32ммоль) у диметилформаміді (5мл) при кімнатній температурі додали одну порцію 1,1-карбонілдиімідазолу (0,246г, 1,52ммоль). Після перемішування протягом однієї години, додали одну порцію N'гідроксипіридин-4-карбоксімідаміду (0,208г, 1,52ммоль) і отриману суміш перемішували протягом ночі при кімнатній температурі. Потім суміш перемішували при 110°С протягом трьох годин і потім дозволили охолонути до кімнатної температури. Суміш вилили у льодяну воду (100мл) і екстрагували 20% ізопропанолом/дихлорметаном. Органічні екстракти промили водою і розсолом, потім висушили (Na2SO4), відфільтрували і випарили, щоб залишився твердий залишок, який перекристалізували з етанолу. 4-[5-(3,4-Біс-бензилокси-5нітро-феніл)-[1,2,4]оксадіазол-3-іл]-піридин отримали як бежеву тверду речовину (0,395г, 62%). b) Перемішаний розчин вищезгаданої сполуки піридину (0,331г, 0,689ммоль) у дихлорметані (15мл) охолодили у бані з льодяною водою і порціями додали т-хлорпероксибензойну кислоту (0,179г, 1,03ммоль). Отриману суміш перемішували на холоді протягом тридцяти хвилин і потім при кімнатній температурі протягом тридцяти хвилин, після чого її знову охолодили у бані з льодяною водою. Крім того, додали m-хлорпероксибензойну кислоту (0,17г, 1,03ммоль) і потім суміші знову дозволили перемішуватись при кімнатній температурі протягом півтори години. Додали воду (20мл) і органічну фазу відділили і промили насиченим водним розчином бікарбонату натрію, водою і розсолом, потім висушили (Na2SO4), відфільтрували і випарили, щоб залишилось жовте масло. Добавкою діетилового ефіру спричинили утворення осаду, який відфільтрували і перекристалізували з суміші дихлорметан/ізопропанол. 4-[5-(3,4-Бісбензилокси-5-нітро-феніл)-[1,2,4]оксадіазол-3-іл]піридин 1-оксид отримали як білі кристали (0,239г, 70%). с) Розчин вищезгаданого дибензилового ефіру (0,232г, 0,468ммоль) у дихлорметані (5мл) охолодили до -78°С з перемішуванням під аргоном і обробили краплями триброміду бору (0,586г, 2,34ммоль). Отриманій темнопурпурній суспензії потім дозволили перемішуватись при кімнатній температурі протягом однієї години перед повторним охолодженням до -78°С. Реакцію у суміші погасили обережним додаванням метанолу. Після перемішування при кімнатній температурі протягом однієї години, леткі компоненти випарили і залишок обробили етанолом/толуолом і повторно випарили. Жовтий залишок перетерли у порошок з 43 киплячим етанолом і відфільтрували, поки він залишався теплим, для отримання зазначеного продукту як жовтої твердої речовини (0,102г, 69%) з т.пл. 280-282°С. Приклад 2 3-Нітро-5-[3-(1-окси-піридин-3-іл)[1,2,4]оксадіазол-5-іл]-бензол-1,2-діол (сполука 5, Таблиця 1) а) До перемішаного розчину 3,4-диметокси-5нітробензойної кислоти (0,232г, 1,022ммоль) у диметилформаміді (5мл) при кімнатній температурі додали одну порцію 1,1-карбонілдиімідазолу (0,174г, 1,073ммоль). Отриману суміш перемішували протягом дев'яноста хвилин, після чого додали одну порцію N'-гідроксипіридин-3карбоксімідамід 1-оксиду (0,156г, 1,022ммоль). Отриману суміш перемішували при кімнатній температурі протягом двох годин, потім при 75°С протягом ночі. Після охолодження до кімнатної температури, суміш вилили у воду (100мл) і осад відфільтрували, промили водою, потім висушили на повітрі і перекристалізували з діетилового ефіру. 3-[5-(3,4-диметокси-5-нітро-феніл[1,2,4]оксадіазол-3-іл]-піридин 1-оксид отримали як білу тверду речовину (0,162г, 46%). b) До перемішаного розчину диметилового ефіру з вищеописаного (0,153г, 0,445ммоль) у дихлорметані (10мл) при -78°С під аргоном додали по краплям трибромід бору (0,445г, 1,779ммоль). Реакційній суміші дозволили нагрітись до кімнатної температури і перемішували дев'яносто хвилин перед обережним виливанням у воду (100мл). Після перемішування протягом двадцяти хвилин, суміш екстрагували етилацетатом. Органічні екстракти промили водою і розсолом, висушили (Na2SO4), відфільтрували і випарили. 2-метокси-3нітро-5-[3-(1-окси-піридин-3-іл)-[1,2,4]оксадіазол-5іл]-фенол отримали як жовту тверду речовину (0,12г, 82%). c) Перемішану суспензію вищеописаного метилового ефіру (0,108г, 0,327ммоль) у 1,2дихлоретані (10мл) при кімнатній температурі під аргоном обробили хлоридом алюмінію (0,087г, 0,654ммоль), з наступним додаванням по краплям піридину (0,207г, 2,62ммоль). Потім суміш кип'ятили протягом семи годин, після чого додатково додали хлорид алюмінію (0,087г, 0,654ммоль) і піридин (0,207г, 2,62ммоль) і суміш перемішували при кипінні протягом додаткових семи годин. Потім суміші дозволили охолонути до кімнатної температури, і вилили у холодну 1N соляну кислоту (30мл). Отриманий осад відфільтрували, промили водою і висушили при 50°С під вакуумом. Необхідний продукт отримали як оранжеву тверду речовину, (0,075г, 72%) з т.пл. 278-280°С. Приклад 3 3-Нітро-5-[3-(1-оксипіридин-2-іл)[1,2,4]оксадіазол-5-іл]-бензол-1,2-діол (сполука 6, Таблиця 1) a) До перемішаного розчину 3,4-диметокси-5нітробензойної кислоти (1,0г, 4,40ммоль) у диметилформаміді (10мл) при кімнатній температурі додали 1 порцію 1,1-карбонілдиімідазолу (0,821г, 5,06ммоль). Отриманій жовтій суміші дозволили перемішуватись протягом дев'яноста хвилин, після 94054 44 чого додали одну порцію]Ч'-гідроксипіридин-2карбоксімідамід 1-оксиду (0,775г, 5,06ммоль). Отриману суміш перемішували при кімнатній температурі протягом ночі і потім вилили у воду (100мл). Отриманий осад відфільтрували, промили водою і потім помістили у дихлорметан (30мл). Органічний шар промили водою і розсолом, висушили (Na2SO4), відфільтрували і випарили, щоб видалити білу тверду речовину (1,37г, 86%). b) До перемішаної суспензії твердої речовини, отриманої вище, (1,365г, 3,77ммоль) у тетрагідрофурані (14мл) при кімнатній температурі під аргоном додали 1N розчин тетрабутиламоній фториду у тетрагідрофурані (3,8мл, 3,8ммоль). Отриманому прозорому жовтому розчину дозволили перемішуватись при кімнатній температурі протягом семи годин, під час чого утворився осад. Суміш відфільтрували і тверду речовину промили декількома порціями холодного тетрагідрофурану. 2-[5-(3,4диметокси-5-нітро-феніл)-[1,2,4]оксадіазол-3-іл]піридин 1-оксид отримали як білу тверду речовину (0,97г, 75%). c) До перемішаної суспензії диметилового ефіру, отриманого вище (0,961г, 2,79ммоль), у дихлорметані (15мл) при -78°С під аргоном додали по краплям трибромід бору (3,5г, 13,97ммоль). Отриманій пурпурній суспензії потім дозволили перемішуватись при кімнатній температурі протягом семи годин перед охолодженням у льодяній/водяній бані. Реакцію у суміші погасли обережним додаванням метанолу. Отриманій жовтій суміші дозволили перемішуватись при кімнатній температурі одну годину перед тим, як осад відфільтрували і промили метанолом. Тверду речовину перетерли у порошок з киплячим етанолом і відфільтрували, доки вона тепла. Після сушки, необхідну сполуку отримали як оранжеву тверду речовину (0,712г, 81%) з т.пл. 168°С. Приклад 4 5-(5-Метил-[1,2,4]оксадіазол-3-іл)-3-нітробензол-1,2-діол (сполука 2, Таблиця 1) a) До перемішаного розчину 3,4-бісбензилокси-N'-гідрокси-5-нітро-бензамідину (1,0г, 2,54ммоль) у диметилформаміді (5мл) при кімнатній температурі додали одну порцію 1,1карбонілдиімідазолу (0,494г, 3,048ммоль) і суміш перемішували при кімнатній температурі дев'яносто хвилин. Потім додали по краплям оцтову кислоту (0,184г, 3,067ммоль) і суміші дозволили перемішуватись дві години при кімнатній температурі, потім при 155°С три години. Суміші дозволили охолонути до кімнатної температури, і вилили у льодяну воду (100мл). Додали сольовий розчин (10мл) і отриманий осад видалили фільтрацією, промили водою і висушили на повітрі. Потім тверду речовину розчинили у дихлорметані (20мл) і на кінчику шпателю додали активоване вугілля. Після перемішування протягом двадцяти хвилин, суспензію відфільтрували через целіт і фільтрат випарили, щоб залишити жовте масло, яке затверділо при стоянні. Після перекристалізації з дихлорметан/петролейний ефір, 3-(3,4-бісбензилокси-5-нітрофеніл)-5-метил[1,2,4]оксадіазол отримали як блідо-жовту тверду речовину (0,537г, 51%). 45 b) До перемішаного розчину твердої речовини, отриманої вище (0,128г, 0,307ммоль) у дихлорметані (15мл) при -78°С під аргоном додали по краплям трибромід бору (0,318г, 1,269ммоль). Отриманій пурпурній суспензії дозволили перемішуватись при кімнатній температурі протягом однієї години, потім знову охолодили до -78°С. Суміш у реакції погасили обережним додаванням метанолу, і після перемішування при кімнатній температурі одну годину, розчинники випарили. Жовтий залишок перетерли у порошок з діетиловим ефіром, відфільтрували і висушили. Необхідну сполука отримали як жовту тверду речовину (0,070г, 96%) з т.пл. 169,8-172°С. Приклад 5 5-(5-Метил-[1,3,4]оксадіазол-2-іл)-3-нітробензол-1,2-діол (сполука 3, Таблиця 1) a) До перемішаного розчину 3,4-диметокси-5нітробензойної кислоти (0,438г, 1,93ммоль) у тетрагідрофурані (10мл) при кімнатній температурі додали одну порцію 1,1-карбонілдиімідазолу (0,343г, 2,12ммоль) і суміш перемішували при кімнатній температурі одну годину, потім при 70°С протягом двох годин, після чого додали гідразид оцтової кислоти (0,157г, 2,12ммоль). Отримане перемішували при кімнатній температурі тридцять хвилин, потім при 70°С протягом двох годин. Після охолодження до кімнатної температури, суміш вилили у льодяну воду (100мл) і осад відфільтрували і промили водою. 3,4-Диметокси-5-нітробензойну кислоту N'-ацетилгідразид отримали як білу тверду речовину (0,296г, 54%). b) Суспензію твердої речовини, отриманої вище, (0,288г, 1,017ммоль) у фосфорному оксихлориді (7мл) перемішували при 120°С дві години, потім дозволили охолонути до кімнатної температури. Потім розчин вилили у льодяну воду (200мл), чим викликали утворення білого осаду. Екстрагували дихлорметаном, і органічні екстракти промили водою і розсолом, потім висушили, відфільтрували і випарили, щоб залишити білу тверду речовину. Перекристалізація з дихлорметан/петролейного ефіру дала 2-(3,4-диметокси-5нітро-феніл)-5-метил-[1,3,4]оксадіазол як білі кристали (0,151г, 56%). c) До перемішаного розчину твердої речовини, отриманої вище, (0,145г, 0,547ммоль) у дихлорметані (10мл) при -78°С під аргоном додали по краплям трибромід бору (0,685г, 2,74ммоль). Отриманій пурпурній суспензії дозволили перемішуватись при кімнатній температурі протягом ночі, потім охолодили знову до -78°С. Суміш у реакції погасили додаванням метанолу, і після перемішування при кімнатній температурі одну годину, леткі компоненти випарили. До залишку додали толуол (20мл) і повторно випарили. Залишок перетерли у порошок з киплячим етанолом і відфільтрували, доки він теплий, щоб отримати необхідний продукт як оранжеву тверду речовину (0,107г, 82%) з т.пл. 245-246°С. Приклад 6 5-[3-(3,5-Дихлор-1-окси-піридин-4-іл)[1,2,4]оксадіазол-5-іл]-3-нітро-бензол-1,2-діол (сполука 7, Таблиця 1) 94054 46 a) До перемішаного розчину 3,4-дибензилокси5-нітробензойної кислоти (0,50г, 1,32ммоль) у диметилформаміді (5мл) при кімнатній температурі додали одну порцію 1,1-карбонілдиімідазолу (0,246г, 1,52ммоль), і суміш перемішували дев'яносто хвилин, після чого додали одну порцію 3,5дихлор-]чР-гідрокси-1-оксиізонікотинамідибн (0,337г, 1,52ммоль). Отриману суміш перемішували при кімнатній температурі протягом ночі і потім вилили у льодяну воду (100мл). Додали розеол (10мл) і осад відфільтрували, промили водою і розчинили у 30% ізопропанолі/дихлорметані. Потім дихлорметан відігнали і отриману суспензію ізопропанолу зберігали при 0°С одну годину. Тверду речовину потім відфільтрували, промили холодним ізопропанолом і висушили, щоб залишити білу тверду речовину (0,756г, 98%). b) Порцію даної твердої речовини (0,664г, 1,14ммоль) і 1,1-карбонілдиімідазол (0,185г, 1,14ммоль) розчинили у диметилформаміді (10мл), потім перемішували при 100°С дев'ять годин при кімнатній температурі протягом ночі. Отриману суміш вилили у льодяну воду (100мл) і потім підкислили до рН 1-2 додаванням по краплям 2N соляної кислоти. Жовтий осад, що утворився, відфільтрували, промили водою і розчинили у 10% ізопропанолі/дихлорметані (50мл). Органічну фазу висушили, відфільтрували і випарили до сухості. Залишок хроматогрували на силікагелі, застосовуючи суміш розчинників етилацетат/петролейний ефір (1:1. Гомогенні фракції об'єднали і випарили, і залишок перекристалізували з дихлорметану/ізопропанолу для отримання 2бензилокси-4-[3-(3,5-дихлор-1-окси-піридин-4-іл)[1,2,4]оксадіазол-5-іл]-6-нітро-фенолу як жовту тверду речовину (0,263г, 49%). с) До перемішаної суспензії твердої речовини, отриманої вище, (0,24г, 0,505ммоль) у дихлорметані (5мл) при -78°С під аргоном додали по краплям трибромід бору (0,371г, 1,5ммоль). Отриманій пурпурній суспензії дозволили перемішуватись при кімнатній температурі одну годину, потім зносу охолодили до -78°С і погасили додаванням метанолу. Після перемішування при кімнатній температурі протягом однієї години, розчинники видалили випарюванням. Отриману жовту піну перекристалізували з дихлорметану/ізопропанолу для отримання необхідного продукту як жовту тверду речовину (0,153г, 79%) з т.пл. 252-253°С. Приклад 7 5-[3-(2-Хлор-1-окси-піридин-4-іл)[1,2,4]оксадіазол-5-іл]-3-нітро-бензол-1,2-діол (сполука 8, Таблиця 1) a) До перемішаного розчину 3,4-дибензилокси5-нітробензойної кислоти (0,50г, 1,32ммоль) у диметилформаміді (5мл) при кімнатній температурі додали одну порцію 1,1-карбонілдиімідазолу (0,246г, 1,52ммоль) і суміш перемішували одну годину, після чого додали одну порцію 2-хлор-N'гідрокси-1-окси-ізонікотинамідину (0,284г, 1,52ммоль). Отриману суміш перемішували при кімнатній температурі тридцять хвилин, потім при 140°С чотири години. Після охолодження до кімнатної температури, суміш вилили у воду (100мл) і підкислили до рН1-2 додаванням по краплям 2N 47 соляної кислоти. Суміш екстрагували етилацетатом, і органічні екстракти промили водою і розсолом, потім висушили, відфільтрували і випарили, щоб залишити оранжеву тверду речовину, яку перекристалізували з дихлорметану/ізопропанолу для отримання 4-[5-(3,4-біс-бензилокси-5-нітрофеніл)-[1,2,4]оксадіазол-3-іл]-2-хлор-піридин 1оксиду як світло-оранжевих кристалів (0,265г, 38%). b) До перемішаного розчину твердої речовини, отриманої вище, (0,25г, 0,471ммоль) у дихлорметані (5мл) при -78°С під аргоном додали по краплям трибромід бору (0,59г, 2,36ммоль). Отриманій темно-пурпурній суспензії дозволили перемішуватись при кімнатній температурі одну годину, потім знову охолодили до -78°С. Суміш у реакції погасили додаванням метанолу, і після перемішування при кімнатній температурі протягом однієї години, розчинники видалили випарюванням. Додали етанол (5мл) і толуол (20мл) до залишку і повторно випарили. Залишок перетерли у порошок з киплячим етанолом і фільтрували, доки він теплий, щоб отримати необхідний продукт як жовті кристали (0,12г, 72%), які розпадались вище 300°С. Приклад 8 2,5-Дихлор-3-(5-(3,4-дигідрокси-2-нітрофеніл)1,2,4-оксадіазол-3-іл)-4,6-диметилпіридин-1-оксид a) До перемішаної суспензії 3-гідрокси-4метокси-2-нітробензойної кислоти (0,900г, 4,22ммоль) у N,N-диметилацетаміді (10,35мл) при кімнатній температурі додали по краплям 1,1карбонілдиімідазол (1,540г, 9,506ммоль) у 7,65мл N,N-диметилацетаміду. Після перемішування протягом трьох годин, додали одну порцію (Z-2,5дихлор-N'-гідрокси-4,6-диметилнікотинімідамід (1,19г, 5,107ммоль) у 2,7мл N,N-диметилацетаміді. Отриману суміш перемішували одну годину і сорок п'ять хвилин, потім нагрівали при 135°С одну годину. Реакційну суміш вилили у суміш лід/2N НСI. Осад відфільтрували, промили водою і висушили під вакуумом для отримання жовтої твердої речовини. Перекристалізація з дихлорметану/ізопропанолу дала 3-(3-(2,5-дихлор-4,6диметилпіридин-3-іл)-1,2,4-оксадіазол-5-іл)-6метокси-2-нітрофенол як жовту тверду речовину (0,317г, 18%). b) До перемішаної суспензії твердої речовини, отриманої вище, (0,315г, 0,766ммоль) у дихлорметані (4,3мл) при кімнатній температурі додали додатково комплекс пероксиду водню з сечовиною (0,231г, 2,451ммоль). Отриману суспензію охолодили до 0°С і додали по краплям трифтороцтовий ангідрид (0,483г, 2,30ммоль). Суміші дозволили перемішуватись при кімнатній температурі двадцять чотири години, потім додали воду і перемішували одну годину. Осад відфільтрували, промили водою і висушили. Неочищений продукт хроматографували у суміші дихлорметану/метанолу (99:1). Випарювання прозорих фракцій дало 2,5-дихлор-3-(5-(3-гідрокси-4-метокси-2нітрофеніл)-1,2,4-оксадіазол-3-іл)-4,6диметилпіридин 1-оксид як жовті кристали (0,195г, 59%). с) До перемішаної суспензії твердої речовини, отриманої вище, (0,143г, 0,335ммоль) у N 94054 48 Метилпіролідоні (2,5мл) при 0°С під аргоном додали одну порцію хлориду алюмінію (0,056г, 0,42ммоль) з наступним додаванням піридину (0,106г, 1,34ммоль). Отриманий розчин нагрівали при 60°С двадцять п'ять хвилин, потім знову охолодили до кімнатної температури і вилили у суміш лід/2N НСI. Після перемішування при кімнатній температурі сорок п'ять хвилин, осад відфільтрували, промили водою і висушили під вакуумом. Неочищений продукт перекристалізували з суміші дихлорметан/ізопропанол. Після сушіння, необхідну сполуку отримали як жовті кристали (0,101г, 73%) з т.пл. 230°С (град.) Приклади 9-17 Шляхом застосування вищеописаних методик і супутніх процедур, відомих спеціалістам даної області техніки, і застосовуючи відповідні Nгідрокси-1-окси-ізонікотинамідини, були отримані наступні сполуки: 3-Нітро-5-[3-(1-окси-2-феніл-піридин-4-іл)[1,2,4]оксадіазол-5-іл]-бензол-1,2-діол, з т.пл. 264264,8°С (сполука 9, Таблиця 1) 5-[3-(2-Фуран-3-іл-1-окси-піридин-4-іл)[1,2,4]оксадіазол-5-іл]-3-нітро-бензол-1,2-діол, з т.пл. 304-305°С (сполука 10, Таблиця 1) 5-[3-(2-Морфолін-4-іл-1-окси-піридин-4-іл)[1,2,4]оксадіазол-5-іл]-3-нітро-бензол-1,2-діол, з т.пл. 277-280°С (сполука 11, Таблиця 1) 3-Нітро-5-[3-(1-окси-2-тіоморфолін-4-ілпіридин-4-іл)-[1,2,4]оксадіазол-5-іл]-бензол-1,2діол, з т.пл. 260-262°С (сполука 12, Таблиця 1) 3-Нітро-5-[3-(1-окси-2-фенілсульфанілпіридин-4-іл)-[1,2,4]оксадіазол-5-іл]-бензол-1,2діол, з т.пл. 299-301°С (сполука 13, Таблиця 1) 3-Нітро-5-[3-(1-окси-2-фенокси-піридин-4-іл)[1,2,4]оксадіазол-5-іл]-бензол-1,2-діол, з т.пл. 245246°С (сполука 14, Таблиця 1) 5-[3-(2,6-Диметил-1-окси-піридин-4-іл)[1,2,4]оксадіазол-5-іл]-3-нітро-бензол-1,2-діол з т.пл. 280-282°С (сполука 15, Таблиця 1) 5-[3-(2-Метансульфоніл-1-окси-піридин-4-іл)[1,2,4]оксадіазол-5-іл]-3-нітро-бензол-1,2-діол з т.пл. 282-285°С (сполука 16, Таблиця 1) 5-[3-(2-Метилсульфаніл-1-окси-піридин-4-іл)[1,2,4]оксадіазол-5-іл]-3-нітро-бензол-1,2-діол з т.пл. 239-240°С (сполука 17, Таблиця 1) Приклад 18 3-Нітро-5-[3-(1-окси-4-трифторметил-піридин3-іл)-[1,2,4]оксадіазол-5-іл]-бензол-1,2-діол (сполука 18, Таблиця 1) a) До перемішаного розчину 3,4-дибензилокси5-нітробензойної кислоти (0,291г, 0,769ммоль) у диметилформаміді (5мл) при кімнатній температурі додали одну порцію 1,1-карбонілдиімідазолу (0,131г, 0,808ммоль). Після перемішування протягом дев'яноста хвилин, додали одну порцію N'гідрокси-1-окси-4-трифторметил-нікотинамідину (0,17г, 0,769ммоль). Отриману суміш перемішували дві години і потім вилили у льодяну воду (100мл). Осад відфільтрували, промили водою і висушили на повітрі для отримання білої твердої речовини (0,192г, 43%). b) До перемішаного розчину твердої речовини, отриманої вище, (0,192г, 0,33ммоль) у тетрагідрофурані (10мл) при кімнатній температурі під арго 49 ном, додали по краплям 1N розчин тетрабутиламоній фториду у тетрагідрофурані (1,2мл, 1,2ммоль). Після перемішування при кімнатній температурі протягом ночі, суміш вилили у воду (100мл) і екстрагували дихлорметаном. Органічні екстракти промили водою і розсолом, висушили (Na2SO4), відфільтрували і випарили. Залишок хроматографували над силікагелем, застосовуючи суміш розчинників дихлорметан/метанол (99:1) як елюент. Гомогенні фракції об'єднали і випарили, і залишок потім перекристалізували з дихлорметану/ізопропанолу. 3-[5-(3,4-Біс-бензилокси-5-нітрофеніл)-[1,2,4]оксадіазол-3-іл]-4-трифторметилпіридин 1-оксид отримали як білу тверду речовину (0,092г, 49%). с) До перемішаного розчину твердої речовини, отриманої вище (0,09г, 0,16ммоль), у дихлорметані (5мл) при -78°С під аргоном додали по краплям трибромід бору (0,16г, 0,64ммоль). Отриманій пурпурній суспензії дозволили перемішуватись при кімнатній температурі одну годину, потім знову охолодили до -78°С і обережно погасили додаванням води. Після перемішування при кімнатній температурі протягом однієї години, осад відфільтрували, промили водою і висушили при 50°С під вакуумом для отримання необхідної сполуки як жовтих кристалів (0,048г, 79%) з т.пл. 239-240°С. Приклади 19-35 Шляхом застосування вищеописаних методик і супутніх процедур, відомих спеціалістам даної області техніки, і застосовуючи відповідні Nгідрокси-1-окси-ізонікотинамідини, були отримані наступні сполуки: 5-[3-(5-Бром-1-окси-піридин-3-іл)[1,2,4]оксадіазол-5-іл]-3-нітро-бензол-1,2-діол, з т.пл. 258-260°С (сполука 19, Таблиця 1) 5-[3-(6-Метил-1-окси-піридин-3-іл)[1,2,4]оксадіазол~5-іл]-3-нітро-бензол-1,2-діол, з т.пл. 325-326°С (сполука 20, Таблиця 1) 5-[3-(4-Метил-1-окси-піридин-3-іл)[1,2,4]оксадіазол-5-іл]-3-нітро-бензол-1,2-діол, з т.пл. 297°С (сполука 21, Таблиця 1) 3-Нітро-5-[3-(1-окси-5-феніл-піридин-3-іл)[1,2,4]оксадіазол-5-іл]-бензол-1,2-діол, з т.пл. 288289°С (сполука 22, Таблиця 1) 5-[3-(6-Хлор-1-окси-піридин-3-іл)[1,2,4]оксадіазол-5-іл]-3-нітро-бензол-1,2-діол, з т.пл. 268-270°С (сполука 23, Таблиця 1) 5-[3-(2-Хлор-1-окси-піридин-3-іл)[1,2,4]оксадіазол-5-іл]-3-нітро-бензол-1,2-діол, з т.пл. 265-267°С (сполука 24, Таблиця 1) 5-[3-(2-Хлор-6-метил-1-окси-піридин-3-іл)[1,2,4]оксадіазол-5-іл]-3-нітро-бензол-1,2-діол, з т.пл. 218-220°С (сполука 25, Таблиця 1) 5-[3-(2-Морфолін-4-іл-1-окси-піридин-3-іл)[1,2,4]оксадіазол-5-іл]-3-нітро-бензол-1,2-діол, з т.пл. 175-177°С (сполука 26, Таблиця 1) 5-[3-(6-Метилсульфаніл-1-окси-піридин-3-іл)[1,2,4]оксадіазол-5-іл]-3-нітро-бензол-1,2-діол, з т.пл. 264-266°С (сполука 27, Таблиця 1) 3-Нітро-5-[3-(1-окси-6-трифторметил-піридин3-іл)-[1,2,4]оксадіазол-5-іл]-бензол-1,2-діол, з т.пл. 269.5-271,3°С (сполука 28, Таблиця 1) 94054 50 5-[3-(2-Метил-1-окси-6-трифторметил-піридин3-іл)-[1,2,4]оксадіазол-5-іл]-3-нітро-бензол-1,2-діол, з т.пл. 240-242°С (сполука 29, Таблиця 1) 5-[3-(6-Метил-1-окси-4-трифторметил-піридин3-іл)-[1,2,4]оксадіазол-5-іл]-3-нітро-бензол-1,2-діол, з т.пл. 250-252,5°С (сполука 30, Таблиця 1) 5-[3-(2,6-Диметил-1-окси-4-трифторметилпіридин-3-іл)-[1,2,4]оксадіазол-5-іл]-3-нітро-бензол1,2-діол, з т.пл. 252-253°С (сполука 31, Таблиця 1) 5-[3-(2-Метил-1-окси-6-феніл-4-трифторметилпіридин-3-іл)-[1,2,4]оксадіазол-5-іл]-3-нітро-бензол1,2-діол, з т.пл. 256-256,5°С (сполука 32, Таблиця 1) 5-[3-(6-Метил-1-окси-2-феніл-4-трифторметилпіридин-3-іл)-[1,2,4]оксадіазол-5-іл]-3-нітро-бензол1,2-діол, з т.пл. 237-239°С (сполука 33, Таблиця 1) 3-Нітро-5-[3-(1-окси-хінолін-4-іл)[1,2,4]оксадіазол-5-іл]-бензол-1,2-діол, з т.пл. 306307°С (сполука 34, Таблиця 1) 3-Нітро-5-[3-(1-окси-хінолін-3-іл)[1,2,4]оксадіазол-5-іл]-бензол-1,2-діол, з т.пл. 276277°С (сполука 35, Таблиця 1) 3-Нітро-5-[3-(1-окси-2-трифторметил-піридин3-іл)-[1,2,4]оксадіазол-5-іл]-бензол-1,2-діол, з т.пл. 253-254°С (сполука 42, Таблиця 1) Приклад 36 5-[3-(2-Бром-6-метил-1-окси-піридин-3-іл)[1,2,4]оксадіазол-5-іл]-3-нітро-бензол-1,2-діол (сполука 36, Таблиця 1) a) До перемішаного розчину 3,4-дибензилокси5-нітробензойної кислоти (1,355г, 3,576ммоль) у диметилформаміді (10мл) при кімнатній температурі додали одну порцію 1,1-карбонілдиімідазолу (0,667г, 4,113ммоль). Після перемішування протягом дев'яноста хвилин додали 2-бром-N'-гідрокси6-метилнікотинамідин (0,946г, 4,113ммоль) і суміш перемішували протягом ночі, потім вилили у воду (100мл). Додали розеол (10мл) і осад відфільтрували, промили водою і розчинили у дихлорметані (50мл). Органічний шар промили водою і розсолом, потім висушили (Na2SO4), відфільтрували і випарили, щоб залишилась біла піна (1,91г, 90%). b) До розчину твердої речовини, отриманої вище (1,91г, 3,23ммоль), у диметилформаміді (30мл) додали 1,1-карбонілдиімідазол (0,576г, 3,55ммоль) і отриману суміш перемішували при 120°С три години, потім дозволили охолонути до кімнатної температури. Вилили у льодяну воду (150мл) і підкислили до рН1-2 додаванням по краплям 2N соляної кислоти. Суміш екстрагували дихлорметаном і органічні екстракти промили водою і розсолом, потім висушили (Na2SO4), відфільтрували і випарили, щоб залишити оранжеву тверду речовину. Перекристалізація з дихлорметану/етанолу дала 3-[5-(3,4-біс-бензилокси-5-нітрофеніл)-[1,2,4]оксадіазол-3-іл]-2-бром-6-метилпіридин як оранжеву тверду речовину (0,702г, 38%). c) До перемішаного розчину твердої речовини, отриманої вище (0,609г, 1,063ммоль), у дихлорметані (15мл) при кімнатній температурі додали додатково комплекс пероксиду водню з сечовиною (0,525г, 5,579ммоль). Отриману суспензію охолодили до 0°С і по краплям додали трифтороцтовий ангідрид (1,12г, 5,314ммоль). Суміші дозволили 51 перемішуватись при кімнатній температурі протягом п'яти годин, потім нерозчинний матеріал відфільтрували і промили невеликим об'ємом дихлорметану. Комбінований фільтрат перемішували з 10% водним розчином метабісульфіту натрію (10мл) протягом п'ятнадцяти хвилин, щоб знищити надлишок пероксидів, потім фази розділили. Органічну фазу промили водою, насиченим водним розчином бікарбонату натрію, знову водою і розсолом, потім висушили (Na2SO4), відфільтрували і випарили, щоб залишити білу тверду речовину. Перекристалізація двічі з дихлорметаном/етанолом дала 3-[5-(3,4-біс-бензилокси-5нітро-феніл)-[1,2,4]оксадіазол-3-іл]-2-бром-6метил-піридин 1-оксид як білі кристали (0,344г, 55%). d) До перемішаного розчину твердої речовини, отриманої вище (0,337г, 0,572ммоль), у дихлорметані (10мл) при -78°С під аргоном додали по краплям трибромід бору (0,717г, 2,86ммоль). Отриману пурпурну суспензію перемішували при кімнатній температурі одну годину, потім знову охолодили до -78°С і погасили додаванням метанолу. Після перемішування при кімнатній температурі протягом однієї години, розчинники випарили. Додали до залишку етанол (5мл) і толуол (20мл) і повторно випарили. Залишок перемішували у киплячому етанолі і фільтрували, доки він ще теплий. Після сушіння, необхідну сполуку отримали як оранжеві кристали (0,187г, 80%) з т.пл. 246-247°С. Приклади 37-41 Шляхом застосування вищеописаних методик і супутніх процедур, відомих спеціалістам даної області техніки, і застосовуючи відповідні N'гідрокси-нікотинамідини, були отримані наступні сполуки: 5-[3-(2-Хлор-4,6-диметил-1-окси-піридин-3-іл)[1,2,4]оксадіазол-5-іл]-3-нітро-бензол-1,2-діол, з т.пл. 234-235°С (сполука 37, Таблиця 1) 5-[3-(2-Бром-4,6-диметил-1-окси-піридин-3-іл)[1,2,4]оксадіазол-5-іл]-3-нітро-бензол-1,2-діол, з т.пл. 205-207°С (сполука 38, Таблиця 1) 3-Нітро-5-[3-(1'-окси-піридин-3-ілметил)[1,2,4]оксадіазол-5-іл]-бензолдіол, з т.пл. 232°С (сполука 39, Таблиця 1) 3-Нітро-5-[3-(1'-окси-6-трифторметил-піридин3-ілметил)-[1,2,4]оксадіазол-5-іл]-бензол-1,2-діол, з т.пл. 195,2°С (сполука 43, Таблиця 1) 3-Нітро-5-[3-(1'-окси-5-трифторметил-піридин2-ілоксиметил)-[1,2,4]оксадіазол-5-іл]-бензол-1,2діол, з т.пл. 222°С (сполука 44, Таблиця 1) Приклад 42 5-[3-(2-Бром-4,5,6-триметил-1-окси-піридин-3іл)-[1,2,4]оксадіазол-5-іл]-3-нітробензол-1,2-діол (сполука 40, Таблиця 1) a) До перемішаного розчину 3,4-дибензилокси5-нітробензойної кислоти (0,945г, 2,49ммоль) у диметилформаміді (10мл) при кімнатній температурі додали одну порцію 1,1-карбонілдиімідазолу (0,465г, 2,87ммоль), і отриману суміш перемішували дві години, після чого додали одну порцію 2бром-N'-гідрокси-4,5,6-триметил-нікотинамідину (0,74г, 2,87ммоль). Отриманій суміші дозволили перемішуватись при кімнатній температурі протягом ночі, і потім вилили у воду (150мл). Додали 94054 52 розеол (10мл) і отриманий осад відфільтрували і промили водою. Потім тверду речовину розчинили у дихлорметані (50мл) і органічну фазу промили водою і розсолом, потім висушили, відфільтрували і випарили, щоб залишити не зовсім білу тверду речовину (1,40г, 91%). b) До перемішаного розчину твердої речовини, отриманої вище (1,39г, 2,245ммоль), у тетрагідрофурані (20мл) при кімнатній температурі під аргоном додали 1N розчин тетрабутиламоній фториду у тетрагідрофурані (2,47мл, 2,47ммоль). Після перемішування при кімнатній температурі протягом ночі, майже чорну реакційну суміш вилили у воду (150мл) і екстрагували дихлорметаном. Органічні екстракти промили водою і розсолом, потім висушили, відфільтрували і випарили, щоб залишити коричневе масло. Додавання дихлорметану (4мл) і діетилового ефіру (4мл) спричинило утворення осаду, який відфільтрували і перекристалізували з ізопропанолу. 3-[5-(3,4-біс-бензилокси-5нітро-феніл)-[1,2,4]оксадіазол-3-іл]-2-бром-4,5,6триметил-піридин отримали як бежеву тверду речовину (0,879г, 65%). c) До перемішаного розчину піридину, отриманого вище (0,621г, 1,033ммоль), у дихлорметані (20мл) при кімнатній температурі додали одну порцію комплексу пероксиду водню з сечовиною(1,018г, 10,82ммоль). Отриману суспензію охолодили у бані з льодяною водою і додали по краплям трифтороцтовий ангідрид (2,23г, 10,62ммоль). Отриману суспензію перемішували у холоді п'ятнадцять хвилин і потім дозволили перемішуватись при кімнатній температурі протягом ночі. Нерозчинний матеріал потім відфільтрували і промили невеликою кількістю дихлорметану. Комбінований фільтрат перемішували з 10% водним розчином метабісульфіту натрію п'ятнадцять хвилин і потім фази розділили. Органічну фазу промили водою, насиченим водним розчином бікарбонату натрію, знову водою і розсолом, потім висушили, відфільтрували і випарили, щоб залишити пінисту світлооранжеву тверду речовину. Цю тверду речовину хроматографували над силікагелем, застосовуючи суміш петролейного ефіру/етилацетату (1:1) як елюент. Гомогенний продукт, що містить фракції, об'єднали і випарили. 3-[5-(3,4-Бiс-бензилокси-5нітро-феніл)-[1,2,4]оксадіазол-3-іл]-2-бром-4,5,6триметил-піридин 1-оксид отримали як пінисту світло-жовту тверду речовину (0,342г, 54%). d) До перемішаного розчину твердої речовини, отриманої вище (0,325г, 0,527ммоль), у дихлорметані (10мл) при -78°С під аргоном додали по краплям трибромід бору (0,66г, 2,633ммоль). Отриманій темно-пурпурній суспензії дозволили перемішуватись при кімнатній температурі одну годину, потім знову охолодили до - 78°С і обережно погасили додаванням по краплям метанолу. Після перемішування при кімнатній температурі протягом однієї години, розчинники видалили випарюванням. Додали до залишку толуол (20мл) і етанол (5мл) і повторно випарили. Отриману жовту тверду речовину перетерли у порошок з киплячим етанолом (15мл) і фільтрували, доки вона тепла. Необхідний продукт отримали як жовту тверду речовину (0,172г, 75%) з т.пл. 242-243°С. 53 Приклади 43-46 Шляхом застосування вищеописаних методик і супутніх процедур, відомих спеціалістам даної області техніки, і застосовуючи відповідний N'гідрокси-нікотинамідин, були отримані наступні сполуки: 5-[3-(2-Хлор-4,5,6-триметил-1-окси-піридин-3іл)-[1,2,4]оксадіазол-5-іл]-3-нітробензол-1,2-діол, т.пл. 246-247,3°С (сполука 41, Таблиця 1) 5-[3-(2,5-Дихлор-4,6-диметил-1-окси-піридин-3іл)-[1,2,4]оксадіазол-5-іл]-3-нітробензол-1,2-діол, т.пл. 237-240°С (сполука 45, Таблиця 1) 3-Нітро-5-[3-(4,5,6-триметил-1-окси-піридин-3іл)-[1,2,4]оксадіазол-5-іл]-бензол-1,2-діол, т.пл. 255-256°С (сполука 46, Таблиця 1) 5-[3-(2-Бром-5-хлор-4,6-диметил-1-оксипіридин-3-іл)-[1,2,4]оксадіазол-5-іл]-3-нітробензол1,2-діол, т.пл. 227-228°С (сполука 47, Таблиця 1) Приклад 47 Як приклад сполуки загальної формули (І), що має частину 2Н-піразол-1,5-діілу як центральний блок, 3-нітро-5-[2-(1-окси-2-трифторметил-піридин3-іл)-2Н-піразол-3-іл]-бензол-1,2-діол отримали наступним способом: а) До перемішаного розчину 1-(3,4-диметокси5-нітро-феніл)-3-диметиламіно-проп-2-ен-1-ону (0,5г, 1,79ммоль) і (2-трифторметил-піридин-3-іл)гідразину (0,33г, 1,87ммоль) у етанолі (10мл) додали 10 крапель концентрованої соляної кислоти і суміш кип'ятили протягом двох годин. Суміші дозволили охолонути до кімнатної температури і отриманий осад відфільтрували, промили етанолом і висушили, щоб отримати 3-[5-(3,4диметокси-5-нітро-феніл)-піразол-1-іл]-2трифторметил-піридин, 0,58г (82%). b) До розчину 3-[5-(3,4-диметокси-5-нітрофеніл)-піразол-1-іл]-2-трифторметил-піридину (0,50г, 1,27ммоль) у дихлорметані (10мл), що охолоджений у бані з льодяною водою, додали одну порцію комплексу перекису водню з сечовиною (0,26г, 2,76ммоль), а потім по краплям трифтороцтовий ангідрид (0,53г, 2,52ммоль). Отриманій суміші дозволили перемішуватись при кімнатній температурі протягом ночі і потім нерозчинний матеріал відфільтрували. Фільтрат промили водою і розсолом, потім висушили безводним сульфатом натрію, відфільтрували і випарили, щоб залишити не зовсім білу тверду речовину. Перекристалізацією з етанолу отримали 3-[5-(3,4-диметокси-5нітро-феніл)-піразол-1-іл]-2-трифторметил-піридин 1-оксид, 0,34г (65%). c) Суспензію 3-[5-(3,4-диметокси-5-нітрофеніл)-піразол-1-іл]-2-трифторметил-піридин 1оксиду (0,3г, 0,73ммоль) у 48% безводній гідробромній кислоті (10мл) перемішували при 140°С одну годину і потім дозволили охолонути до кімнатної температури. Потім суміш вилили у льодяну воду (100мл) і отриманий жовтий осад відфільтрували, промили водою і висушили для отримання 3нітро-5-[2-(1-окси-2-трифторметил-піридин-3-іл)2Н-піразол-3-іл]-бензол-1,2-діолу, 0,16г (57%). Приклад 48 Як приклад сполуки загальної формули (І), що має частину 1,3,4-оксадіазол-2,5-діілу як центральний блок, 3-нітро-5-[5-(1-окси-2-трифторметил 94054 54 піридин-3-іл)-[1,3,4]оксадіазол-2-іл]-бензол-1,2діол отримали наступним способом: а) Суміш 3,4-диметокси-5-нітробензойної кислоти (0,53г, 2,34ммоль) і 1,1-карбонілдиімідазолу (0,42г, 2,59ммоль) нагрівали у тетрагідрофурані (10мл) при кипінні три години і потім охолодили до кімнатної температури. Додали одну порцію гідразиду 2-трифторметил-нікотинової кислоти (0,53г, 2,57ммоль) і жовтувату суміш перемішували при кип'ятінні протягом ночі і потім дозволили охолонути до кімнатної температури. Суміш вилили у холодну воду (100мл) і густий осад відфільтрували, промили водою і висушили, щоб отримати 2трифторметил-нікотинову кислоту №-(3,4диметокси-5-нітро-бензоїл)-гідразиду, 0,71г (73%). b) Суспензію 2-трифторметил-нікотинової кислоти]Ч'-(3,4-диметокси-5-нітро-бензоїл)-гідразиду (0,60г, 1,44ммоль) у оксихлориді фосфору (10мл) перемішували при 130°С три години, що вона ставала світло-жовтим розчином. Суміші дозволили охолонути до кімнатної температури і потім вилили у льодяну воду (200мл). Білий осад відфільтрували, промили водою і висушили для отримання 3[5-(3,4-диметокси-5-нітро-феніл)-[1,3,4]оксадіазол2-іл]-2-трифторметил-піридину, 0,48г (84%). c) До перемішаного розчину 3-[5-(3,4диметокси-5-нітро-феніл)-[1,3,4]оксадіазол-2-іл]-2трифторметил-піридину (0,45г, 1,13ммоль) у дихлорметані (10мл), охолодженому у бані з льодяною водою, додали одну порцію комплексу пероксиду водню з сечовиною (0,23г, 2,45ммоль), а потім по краплям трифтороцтовий ангідрид (0,47г, 2,24ммоль). Отриманій суміші дозволили перемішуватись при кімнатній температурі протягом ночі і потім нерозчинний матеріал відфільтрували. Фільтрат промили водою і розсолом, потім висушили безводним сульфатом натрію, відфільтрували і випарили, щоб залишити не зовсім білу тверду речовину. Перекристалізацією з етанолу отримали 3-[5-(3,4-диметокси-5-нітро-феніл)[1,3,4]оксадіазол-2-іл]-2-трифторметил-піридин 1оксид, 0,39г (83%). d) Суспензію 3-[5-(3,4-диметокси-5-нітрофеніл)-[1,3,4]оксадіазол-2-іл]-2-трифторметилпіридин 1-оксиду (0,30г, 0,73ммоль) у суміші 48% гідробромної кислоти (5мл) і 30% броміду водню у оцтовій кислоті (5мл) нагрівали при 140°С протягом ночі, і потім дозволили охолонути до кімнатної температури. Після випарювання насухо під зниженим тиском, додали до залишку толуол (10мл) і повторно випарили під зниженим тиском. Отриману тверду речовину перекристалізували ізопропанолу для отримання 3-нітро-5-[5-(1-окси-2трифторметил-піридин-3-іл)-[1,3,4]оксадіазол-2-іл]бензол-1,2-діол як жовту тверду речовину, 0,19г, (68%). Приклад 49 Як приклад сполуки загальної формули (І), що має частину піримідин-2,4-діілу як центральний блок, 3-нітро-5-[2-(1-окси-2-трифторметил-піридин3-іл)-піримідин-4-іл]-бензол-1,2-діол отримали наступним способом: a) Перемішану суспензію 1-(3,4-диметокси-5нітро-феніл)-3-диметиламіно-проп-2-ен-1-ону (0,28г, 1,0ммоль), і-окси-2-трифторметил 55 нікотинамідину (0,31г, 1,5ммоль) і терт-бутоксид калію (0,17г, 1,5ммоль) у абсолютному етанолі (5мл) нагрівали до 80°С у запаяній трубці одну годину і потім дозволили охолонути до кімнатної температури. Суміш вилили у холодну воду (100мл) і отриманий осад відфільтрували, промили водою і висушили для отримання 4-(3,4диметокси-5-нітро-феніл)-2-(1-окси-2трифторметил-піридин-3-іл)-піримідину, 0,31г (73%). b) Суспензію 4-(3,4-диметокси-5-нітро-феніл)2-(1-окси-2-трифторметил-піридин-3-іл)-піримідину (0,25г, 0,59ммоль) у 48% гідробромідній кислоті (5мл) перемішували при 140°С чотири години і потім дозволили охолонути до кімнатної температури. Суміш вилили у льодяну воду (100мл) і отриманий фільтрат відфільтрували, промили водою і висушили для отримання 3-нітро-5-[2-(1окси-2-трифторметил-піридин-3-іл)-піримідин-4-іл]бензол-1,2-діолу, 0,21г (90%). Приклад 50 Як приклад сполуки загальної формули (І), що має частину бензол-1,3-діілу як центральний блок, 5-нітро-З'-(1-окси-6-трифторметил-піридин-2-іл)біфеніл-3,4-діол отримали наступним способом: а) До перемішаного розчину 4-бензилокси-3метоксифенілборної кислоти (1,0г, 3,87ммоль) і 2(3-бром-феніл)-6-трифторметил-піридин 1-оксиду (1,12г, 3,52ммоль) у толуолі (10мл) і етанолі (1мл) при кімнатній температурі під аргоном додали 2N водний розчин карбонату натрію (5,41мл, 10,82ммоль), а потім тетракіс(трифенілфосфін)палладій (0,22г, 0,19ммоль). Отриману суміш перемішували при 90°С дві години і потім дозволили охолонути до кімнатної температури. Фази розділили і водну фазу екстрагували толуолом (5мл). Комбіновані органічні фази промили водою і розсолом, потім висушили безводним сульфатом натрію і відфільтрували. Після випарювання розчинника залишилось коричневе масло, яке хроматогрували на силікагелі (петролейний ефір/етилацетат, 9:1) для отримання 2-(4'бензилокси-3'-метоксибіфеніл-3-іл)-6трифторметил-піридин 1-оксиду як прозорого масла, 1,11г (70%). b) До розчину 2-(4'-бензилокси-3'метоксибіфеніл-3-іл)-6-трифторметил-піридин 1оксиду (1,10г, 2,44ммоль) у дихлорметані (20мл), охолодженому у бані з льодяною водою, додали по краплям 30% розчину броміду водню у оцтовій кислоті (4мл, 20ммоль). Отриманому розчину дозволили перемішуватись при кімнатній температурі шість годин, потім вилили у льодяну воду (100мл). Фази розділили і водну фазу екстрагували дихлорметаном (10мл). Комбіновані органічні шари промили водою і розсолом, потім висушили безводним сульфатом натрію і відфільтрували. Після випарювання розчинника залишилась коричневе масло, яке хроматогрували на силікагелі (петролейний ефір/етилацетат, 4:1), щоб отримати 3-метокси-3'-(1-окси-6-трифторметил-піридин-2іл)-біфеніл-4-ол як прозоре масло, 0,57г (65%). c) До розчину 3-метокси-3'-(1-окси-6трифторметил-піридин-2-іл)-біфеніл-4-олу (0,50г, 1,38ммоль) у оцтовій кислоті (10мл) при кімнатній 94054 56 температурі додали по краплям 60% азотну кислоту (0,12мл, 1,52ммоль). Отриманій суміші дозволили перемішуватись тридцять хвилин, потім вилили у льодяну воду (100мл) і отриманий осад відфільтрували, промили водою і висушили. Після хроматографії на силікагелі (петролейний ефір/етилацетат, 2:1), 5-метокси-3-нітро-3'-(1-окси6-трифторметил-піридин-2-іл)-біфеніл-4-ол отримали як жовту тверду речовину, 0,34г (60%). d) До перемішаного розчину 5-метокси-3-нітро3'-(1-окси-6-трифторметил-піридин-2-іл)-біфеніл-4олу (0,30г, 0,738ммоль) у 1,2-дихлоретані (10мл), охолодженому у бані з льодяною водою, додали одну порцію хлориду алюмінію (0,123г, 0,922ммоль), а потім по краплям піридин (0,233г, 2,95ммоль). Отриману червону суспензію перемішували при 80°С дві години, потім охолодили до кімнатної температури і вилили у холодну 2N водну соляну кислоту (100мл). Осад відфільтрували, промили водою і висушили для отримання 5-нітро3'-(1-окси-6-трифторметил-піридин-2-іл)-біфеніл3,4-діолу, 0,17г, (59%). Приклад 51 Як приклад сполуки загальної формули (І), що має частину карбонілу як центральний блок, (3,4дигідрокси-5-нітро-феніл)-(1-окси-2-трифторметилпіридин-3-іл)-метанон отримали наступним способом: a) До розчину 4-бензилокси-3-метоксибромбензолу (2,0г, 6,82ммоль) у тетрагідрофурані (50мл) при -78°С під аргоном додали по краплям 2N розчин бутиллітію у гексані (3,75мл, 7,5ммоль). Отриманій суміші дозволили перемішуватись одну годину, після чого розчин 1Ч-метокси-]Ч-метил-2трифторметил-нікотинаміду (1,76г, 7,5ммоль) у тетрагідрофурані (20мл) додали по краплям. Суміші дозволили досягти кімнатної температури протягом двох годин, потім вилили у холодну 2N водну соляну кислоту (150мл). Суміш екстрагували діетилефіром, і комбіновані органічні шари промили водою і розсолом, висушили безводним сульфатом натрію і відфільтрували. Після випарювання розчинника залишилась коричневе масло, яке хроматогрували на силікагелі (петролейний ефір/етилацетат, 2: 1) для отримання (4бензилокси-3-метокси-феніл)-(2-трифторметилпіридин-3-іл)-метанону, 1,72г (65%). b) До перемішаного розчину (4-бензилокси-3метокси-феніл)-(2-трифторметил-піридин-3-іл)метанону (1,60г, 4,13ммоль) у дихлорметані (20мл), охолодженому у бані з льодяною водою, додали одну порцію комплексу пероксиду водню з сечовиною (0,85г, 9,08ммоль), а потім по краплям трифтороцтовий ангідрид (1,73г, 8,26ммоль). Отриманій суміші потім дозволили перемішуватись при кімнатній температурі протягом ночі, після чого нерозчинний матеріал відфільтрували і промили дихлорметаном (5мл). Комбінований фільтрат промили водою і розсолом, потім висушили безводним сульфатом натрію і відфільтрували. Після випарювання розчинника залишилась оранжева тверда речовина, яку перекристалізували з етанолу для отримання (4-бензилокси-3-метоксифеніл)-(1-окси-2-трифторметил-піридин-3-іл)метанону, 1,01г (60%). 57 c) До перемішаного розчину (4-бензилокси-3метокси-феніл)-(1-окси-2-трифторметил-піридин-3іл)-метанону (0,95г, 2,36ммоль) у дихлорметані, охолодженому у бані з льодяною водою, додали по краплям 30% розчин броміду водню у оцтовій кислоті (3,54мл, 17,7ммоль). Отриманому розчину дозволили перемішуватись при кімнатній температурі протягом ночі, потім вилили у льодяну воду (100мл). Фази розділили і водну фазу екстрагували дихлорметаном (10мл). Комбіновані органічні шари промили водою і розсолом, потім висушили безводним сульфатом натрію і відфільтрували. Після випарювання розчинника залишилось коричневе масло, яке хроматогрували на силікагелі (петролейний ефір/етилацетат, 1:1) для отримання (4-гідрокси-3-метокси-феніл)-(1-окси-2трифторметил-піридин-3-іл)-метанону як безбарвну тверду речовину, 0,59г (80%). d) До розчину (4-гідрокси-3-метокси-феніл)-(1окси-2-трифторметил-піридин-3-іл)-метанону (0,50г, 1,59ммоль) у оцтовій кислоті (10мл) при кімнатній температурі додали по краплям 60% азотну кислоту (0,14мл, 1,75ммоль). Отриманій суміші дозволили перемішуватись тридцять хвилин, потім вилили у льодяну воду (100мл) і отриманий осад відфільтрували, промили водою і висушили. Перекристалізація з етанолу забезпечила (4-гідрокси-3-метокси-5-нітро-феніл)-(1-окси-2трифторметил-піридин-3-іл)-метанон як жовту тверду речовину, 0,33г (58%). е) До перемішаного розчину (4-гідрокси-3метокси-5-нітро-феніл)-(1-окси-2-трифторметилпіридин-3-іл)-метанону (0,30г, 0,84ммоль) у 1,2дихлоретані (10мл), охолодженому у бані з льодяною водою, додали одну порцію хлориду алюмінію (0,14г, 1,05ммоль), а потім по краплям піридин (0,26г, 3,35ммоль). Отриману червону суспензію перемішували при 80°С дві години, потім охолодили до кімнатної температури і вилили у холодну 2N водну соляну кислоту (100мл). Осад відфільтрували, промили водою і висушили для отримання (3,4-дигідрокси-5-нітро-феніл)-(1-окси-2трифторметил-піридин-3-іл)-метанону, 0,19г, (66%). Приклад 52 Як приклад сполуки загальної формули (І), що має частину (Z)-1-цианоетен-1,2-діілу як центральний блок, 3-(3,4-дигідрокси-5-нітро-феніл)-2-(1окси-6-трифторметил-піридин-3-іл)-акрилонітрил отримали наступним способом: a) Суспензію ваніліну (1,0г, 6,57ммоль), (1окси-6-трифторметил-піридин-3-іл)-ацетонітрилу (1,33г, 6,57ммоль) і піперидину (0,71мл, 7,23ммоль) у абсолютному етанолі (10мл) перемішували при кипінні сорок вісім годин і потім дозволили охолонути до кімнатної температури. Отриманий осад відфільтрували, промили водою і висушили. Перекристалізація з ізопропанолу забезпечила 3-(4-гідрокси-3-метокси-феніл)-2-(1окси-6-трифторметил-піридин-3-іл)-акрилонітрил як білі кристали, 0,95г (43%). b) До розчину 3-(4-гідрокси-3-метокси-феніл)2-(1-окси-6-трифторметил-піридин-3-іл)акрилонітрилу (0,90г, 2,68ммоль) у оцтовій кислоті (20мл) додали по краплям 60% азотну кислоту 94054 58 (0,23мл, 2,95ммоль). Отриманій суміші дозволили перемішуватись при кімнатній температурі тридцять хвилин, потім вилили у льодяну воду (100мл). Жовтий осад відфільтрували, промили водою і висушили. Перекристалізація з ізопропанолу забезпечила 3-(4-гідрокси-3-метокси-5-нітрофеніл)-2-(1-окси-6-трифторметил-піридин-3-іл)акрилонітрил як жовту тверду речовину, 0,63г, (62%). c) До перемішаного розчину 3-(4-гідрокси-3метокси-5-нітро-феніл)-2-(1-окси-6-трифторметилпіридин-3-іл)-акрилонітрилу (0,55г, 1,44ммоль) у 1,2-дихлоретані (10мл), охолодженому у бані з льодяною водою, додали одну порцію хлориду алюмінію (0,24г, 1,80ммоль), а потім по краплям піридин (0,46г, 5,77ммоль). Отриману червону суспензію перемішували при 80°С дві години, потім охолодили до кімнатної температури і вилили у холодну 2N водну соляну кислоту (100мл). Осад відфільтрували, промили водою і висушили для отримання 3-(3,4-дигідрокси-5-нітро-феніл)-2-(1окси-6-трифторметил-піридин-3-іл)-акрилонітрилу, 0,32г (60%). Приклад 53 Як приклад сполуки загальної формули (І), що має частину 1Н-імідазол-1,5-діілу як центральний блок, 2-(5-(3,4-дигідрокси-5-нітрофеніл)-1Hімідазол-1-іл)-5-(трифторметил)піридин 1-оксид отримали наступним способом: a) До перемішаного розчину 2-аміно-5(трифторметил)піридин 1-оксиду (0,445г, 2,5ммоль) у суміші етанолу (12,5мл) і оцтової кислоти (0,25мл) при кімнатній температурі додали 3,4-диметокси-5-нітробензальдегід (0,53г, 2,5ммоль). Реакцію нагрівали при температурі кипіння дві години, потім етанол випарили. Залишки масла розчинили у суміші метанолу (17мл) і 1,2диметоксиетану (7,5мл), після чого додали одну порцію 1-(ізоцианометилсульфоніл)-4метилбензолу (TOSMIC) (0,73г, 3,75ммоль) і карбонату калію (0,69г, 5ммоль). Отриману суміш перемішували при температурі кипіння протягом 3 годин. Реакцію випарили насухо, і помістили у дихлорметан (50мл). Органічну фазу промили водою (50мл) і потім висушили безводним сульфатом магнію, відфільтрували і випарили, щоб лишилось коричневе масло. Колонковою хроматографією на силікагелі (петролейний ефір-етилацетат 9:1) отримали 2-(5-(3,4-диметокси-5-нітрофеніл)-1Німідазол-1-іл)-5-(трифторметил)піридин 1-оксид, 0,56г (55%). b) 2-(5-(3,4-Диметокси-5-нітрофеніл)-1Hімідазол-1-іл)-5-(трифторметил)піридин 1-оксид (0,41г, 1ммоль) нагрівали при 140°С у 48% водному броміді водню (6мл) протягом 2,5 годин. Темний гомогенний розчин охолодили до кімнатної температури і леткі компоненти видалили випарюванням, щоб залишити кристалічну тверду речовину, яку висушили Р2О5 під вакуумом. Перетиранням у порошок отриманої твердої речовини з діетиловим ефіром отримали 2-(5-(3,4-дигідрокси5-нітрофеніл)-1Н-імідазол-1-іл)-5(трифторметил)піридин 1-оксид як жовту кристалічну тверду речовину, 0,27г (71%). Приклад 54 59 Як приклад сполуки загальної формули (І), що має частину ізоксазо-3,5-діілу як центральний блок, 3-(3-(3,4-дигідрокси-5-нітрофеніл)ізоксазол5-іл)-2-(трифторметил)піридин 1-оксид отримали наступним способом: a) До перемішаної суспензії (Е)-3-(3-(3,4диметокси-5-нітрофеніл)акрилоїл)-2(трифторметил)піридин 1-оксиду (1,19г, 3ммоль) у етанолі (15мл) додали 50% водного розчину гідроксиламіну (0,74мл, 4,5ммоль) і суміш нагрівали до 80°С. Після перемішування протягом 1 години, дрібний осад почав відділятись від реакційної суміші. Після охолодження до кімнатної температури жовтий осад відфільтрували, промили етанолом і висушили під вакуумом для отримання 3-(3-(3,4диметокси-5-нітрофеніл)-5-гідрокси-4,5дигідроізоксазол-5-іл)-2-(трифторметил)піридин 1оксиду, 0,94г (73%). b) 3-(3-(3,4-диметокси-5-нітрофеніл)-5гідрокси-4,5-дигідроізоксазол-5-іл)-2(трифторметил)піридин 1-оксид (2,14г, 5ммоль) нагрівали у 20мл етилацетату до 70°С. До отриманої зависі додали по краплям трифтороцтову кислоту (0,74г, 6,5ммоль). Через 10 хвилин реакцію випарили насухо і залишок перекристалізували з ізопропанолу для отримання 3-(3-(3,4-диметокси5-нітрофеніл)ізоксазол-5-іл)-2(трифторметил)піридин 1-оксиду, 1,27г (62%). c) 3-(3-(3,4-диметокси-5-нітрофеніл)ізоксазол5-іл)-2-(трифторметил) піридин 1-оксид (0,81г, 2ммоль) помістили у дихлорметан (15мл) і жовтувату суспензію охолодили до -78°С під аргоном, після чого додали по краплям трибромід бору (4,5г, 18ммоль). Червонуватій реакційній суміші дозволили нагрітись до кімнатної температури і перемішували протягом 18 годин, потім обережно вилили у льодяну воду (100мл) і дозволили перемішуватись протягом 1 години. Жовтий осад відфільтрували, промили водою і висушили Р2О5 під вакуумом. Перетирання у порошок з киплячим етанолом дало 3-(3-(3,4-дигідрокси-5нітрофеніл)ізоксазол-5-іл)-2(трифторметил)піридин 1-оксид як жовту тверду речовину, 0,49г (64%). Приклад 55 Як приклад сполуки загальної формули (І), що має частину фуран-2,4-діілу як центральний блок, 3-(4-(3,4-дигідрокси-5-нітрофеніл)-3(етоксикарбоніл)фуран-2-іл)-2(трифторметил)піридин-1-оксид отримали наступним способом: a) До перемішаного розчину 3-(3-етокси-3оксопропаноїл)-2-(трифторметил)піридин-1-оксиду (1,39г, 5ммоль) у піридині (25мл) додали 2-бром-1(3,4-диметокси-5-нітрофеніл)етанон (1,67г, 5,5ммоль). Реакційну суміш нагрівали до 70°С і перемішували протягом 5 годин, потім охолодили до кімнатної температури і вилили у 6N водну НСI (100мл). Осад відфільтрували, промили водою і висушили Р2О5 під вакуумом. Тверду речовину перекристалізували з дихлорметану/ізопропанолу, щоб отримати неочищений 3-(4-(3,4-диметокси-5нітрофеніл)-3-(етоксикарбоніл)фуран-2-іл)-2(трифторметил)піридин 1-оксид, 1,05г (43%). 94054 60 b) 3-(4-(3,4-Диметокси-5-нітрофеніл)-3(етоксикарбоніл)фуран-2-іл)-2(трифторметил)піридин-1-оксид (482 мг, 1ммоль) помістили у дихлорметан (8мл). Жовтувату суспензію охолодили до -78°С під аргоном і додали по краплям трибромід бору (0,85мл, 9ммоль). Червонуватій реакційній суміші дозволили нагрітись до кімнатної температури і перемішували протягом 18 годин і потім обережно вилили у льодяну воду (100мл) і перемішували 1 годину. Жовтий осад відфільтрували, промили водою і висушили Р2О5 під вакуумом. Перекристалізація твердої речовини з етанолу дала 3-(4-(3,4-дигідрокси-5нітрофеніл)-3-(етоксикарбоніл)фуран-2-іл)-2(трифторметил)піридин 1-оксид як жовту тверду речовину, 0,31г (68%). Приклад 56 Як приклад сполуки загальної формули (І), що має частину оксазол-2,4-діілу як центральний блок, 3-(4-(3,4-дигідрокси-5-нітрофеніл)оксазол-2іл)-2-(трифторметил)піридин 1-оксид отримали наступним способом: a) До розчину 2-(3,4-диметокси-5-нітрофеніл)2-охоетилацетату (4,24г, 15ммоль) у ксилолі (30мл) додали 3-карбамоїл-2(трифторметил)піридин 1-оксид (3,40г, 16,5ммоль) і ефірат фтористого бору(0,18мл, 15ммоль). Отриманий жовтий розчин нагрівали до кипіння протягом 18 годин і потім охолодили до кімнатної температури. Після випарювання розчинника, залишок розділили між етилацетатом і насиченим водним бікарбонатом натрію. Органічну фазу відділили, промили розсолом і висушили безводним сульфатом магнію, відфільтрували і випарили. Чистий 3-(4-(3,4-диметокси-5-нітрофеніл)оксазол2-іл)-2-(трифторметил) піридин 1-оксид отримали колонковою хроматографією на силікагелі (петролейний ефір/етилацетат 2:1) як блідо-жовту тверду речовину, 2,58г (42%). b) 3-(4-(3,4-Диметокси-5-нітрофеніл)оксазол-2іл)-2-(трифторметил)піридин 1-оксид (1,23г, 3ммоль) помістили у дихлорметан (25мл). Жовтувату суспензію охолодили до -78°С під аргоном і по краплям додали трибромід бору (2,55мл, 27ммоль). Червоній реакційній суміші дозволили нагрітись до кімнатної температури і перемішували протягом 18 годин. Потім обережно вилили у льодяну воду (100мл) і перемішували 1 годину. Отриманий жовтий осад відфільтрували, промили водою і висушили Р2О5 під вакуумом. Тверду речовину перекристалізували з етанолу для отримання 3-(4-(3,4-дигідрокси-5-нітрофеніл)оксазол-2іл)-2-(трифторметил)піридин 1-оксиду як жовтої твердої речовини, 0,65г, (57%). Приклад 57 Як приклад сполуки загальної формули (І), що має частину 1,2,4-триазин-3,5-діілу як центральний блок, 3-(5-(3,4-дигідрокси-5-нітрофеніл)-1,2,4триазин-3-іл)-2-(трифторметил)піридин 1-оксид отримали наступним способом: a) До перемішаного розчину (Z)-3карбамогідразоноїл-2-(трифторметил) піридин 1оксиду (1,10г, 5ммоль) у етанолі (30мл) додали 2(3,4-диметокси-5-нітрофеніл)-2-оксоацетальдегід (1,19г, 5ммоль). Реакційну суміш нагрівали до ки
ДивитисяДодаткова інформація
Назва патенту англійськоюNitrocatechol derivatives as comt inhibitors
Автори англійськоюLearmonth David Alexander, Kiss Laszlo Erno, Leal Palma Pedro Nuno, Dos Santos Ferreira Humberto, Ara Jo Soares Da Silva Patricio Manuel Vieira
Назва патенту російськоюПроизводные нитрокатехола в качестве комт-ингибиторов
Автори російськоюЛермонт Дейвид Александер, Кисс Ласло Эрно, Лил Палма Педро Нуно, Дос Сантос Феррейра Умберто, Араужо Соарес Да Силва Патрисио Мануэль Виэйра
МПК / Мітки
МПК: C07D 417/14, C07D 271/06, C07D 213/89, A61K 31/4439, C07D 413/04, C07D 413/06, A61P 25/00, A61K 31/421, C07D 413/14, C07D 401/04, A61K 31/506, C07D 271/10, A61K 31/4425, C07D 407/04
Мітки: похідні, нітрокатехолу, комт-інгібітори
Код посилання
<a href="https://ua.patents.su/34-94054-pokhidni-nitrokatekholu-yak-komt-ingibitori.html" target="_blank" rel="follow" title="База патентів України">Похідні нітрокатехолу як комт-інгібітори</a>
Попередній патент: Заміщені похідні 3-сульфоніліндазолу як ліганди 5-гідрокситриптаміну-6
Наступний патент: Заміщені бензімідазоли як інгібітори кіназ
Випадковий патент: Пристрій для візуального виявлення електричного пробою електроустаткування ліній електропередачі












