Ароїламіно- та гетероароїламінозаміщені піперидини як інгібітори glyt-1
Номер патенту: 104611
Опубліковано: 25.02.2014
Автори: Колчевскі Сабіне, Пінар Еммануель, Штальдер Генрі
Формула / Реферат
1. Сполука загальної формули
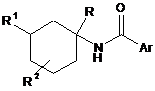 , I
, I
де
R1 являє собою атом водню, нижчий алкіл, CD3, -(CH2)n-CHO, -(СН2)n-О-нижчий алкіл, -(СН2)n-ОН, -(СН2)n-циклоалкіл або являє собою гетероциклоалкіл;
R2 являє собою атом водню, атом галогену, гідрокси, нижчий алкіл, динижчий алкіл, -ОСН2-О-нижчий алкіл або нижчий алкокси; або піперидинове кільце разом з R2 утворює спірокільце, вибране з 4-азаспіро[2,5]окт-6-илу;
Аr являє собою арил або гетероарил, які можливо мають один, два або три замісники, вибрані з атома галогену, нижчого алкілу, нижчого алкілу, що має як замісники атом галогену, нижчого алкокси, що має як замісники атом галогену, циклоалкілу, нижчого алкокси, S-нижчого алкілу, гетероарилу, гетероциклоалкілу, або можливо мають як замісники феніл, можливо такий, що має як замісники R', і
R' являє собою атом галогену, нижчий алкіл, нижчий алкокси або нижчий алкокси, що має як замісники атом галогену, або являє собою гетероарил;
R являє собою нижчий алкіл, циклоалкіл, гетероциклоалкіл, арил або гетероарил, де арил і гетероарил можливо мають як замісники один або два R';
n має значення 0, 1, 2 або 3;
або її фармацевтично прийнятна адитивна кислотна сіль, рацемічна суміш або відповідний енантіомер і/або оптичний ізомер.
2. Сполука формули І за п. 1, де R1 являє собою нижчий алкіл.
3. Сполука формули І за п. 2, де кожний з Аr і R являє собою феніл.
4. Сполука формули І за п. 3, де фенільна група Аr має як замісники щонайменше дві групи CF3.
5. Сполука формули І за п. 4, де сполука вибрана з групи, яка включає
рац-2-фтор-N-(1-метил-3-фенілпіперидин-3-іл)-4,6-біс(трифторметил)бензамід,
рац-2-метокси-N-(1-метил-3-фенілпіперидин-3-іл)-4,6-біс(трифторметил)бензамід,
рац-2-етил-N-(1-метил-3-фенілпіперидин-3-іл)-4,6-біс(трифторметил)бензамід,
рац-N-[3-(4-фторфеніл)-1-метилпіперидин-3-іл]-2-метокси-4,6-біс(трифторметил)бензамід або
2-метокси-N-((R)-1-метил-3-фенілпіперидин-3-іл)-4,6-біс(трифторметил)бензамід.
6. Сполука формули І за п. 3, де фенільна група Аr має як замісники щонайменше одну групу CF3.
7. Сполука формули І за п. 6, де сполука вибрана з групи, яка включає
рац-2-етил-N-(1-метил-3-фенілпіперидин-3-іл)-4-трифторметилбензамід;
рац-2-бром-6-метокси-N-(1-метил-3-фенілпіперидин-3-іл)-4-трифторметилбензамід;
рац-N-(1,2-диметил-3-фенілпіперидин-3-іл)-2-метокси-6-метилсульфаніл-4-трифторметилбензамід;
рац-2-циклопропіл-N-(1-метил-3-фенілпіперидин-3-іл)-4-трифторметилбензамід;
рац-2-метокси-N-(1-метил-3-фенілпіперидин-3-іл)-6-метилсульфаніл-4-трифторметилбензамід;
рац-N-(1-метил-3-фенілпіперидин-3-іл)-2-метилсульфаніл-4-трифторметилбензамід;
рац-N-[3-(4-фторфеніл)-1-метилпіперидин-3-іл]-2-метокси-6-метилсульфаніл-4-трифторметилбензамід;
рац-N-[3-(4-хлорфеніл)-1-метилпіперидин-3-іл]-2-метокси-6-метилсульфаніл-4-трифторметилбензамід;
2-метокси-N-((S)-1-метил-3-фенілпіперидин-3-іл)-6-метилсульфаніл-4-трифторметилбензамід;
2-метокси-N-((R)-1-метил-3-фенілпіперидин-3-іл)-6-метилсульфаніл-4-трифторметил-бензамід;
рац-2-дифторметокси-N-(1-метил-3-фенілпіперидин-3-іл)-4-трифторметилбензамід;
рац-N-[3-(3-хлорфеніл)-1-метилпіперидин-3-іл]-2-метокси-6-метилсульфаніл-4-трифторметилбензамід;
рац-2-метокси-N-[3-(4-метоксифеніл)-1-метилпіперидин-3-іл]-6-метилсульфаніл-4-трифторметилбензамід;
рац-N-(5-фтор-1-метил-3-фенілпіперидин-3-іл)-2-метокси-6-метилсульфаніл-4-трифторметилбензамід;
рац-N-(1-ізопропіл-3-фенілпіперидин-3-іл)-2-метокси-6-метилсульфаніл-4-трифторметилбензамід;
2-циклопропіл-N-((S)-1-метил-3-фенілпіперидин-3-іл)-4-трифторметилбензамід;
2-циклопропіл-N-((R)-1-метил-3-фенілпіперидин-3-іл)-4-трифторметилбензамід;
рац-2-циклобутил-N-(1-метил-3-фенілпіперидин-3-іл)-4-трифторметилбензамід;
рац-N-[3-(2,4-дифторфеніл)-1-метилпіперидин-3-іл]-2-метокси-6-метилсульфаніл-4-трифторметилбензамід;
рац-N-[3-(2-фторфеніл)-1-метилпіперидин-3-іл]-2-метокси-6-метилсульфаніл-4-трифторметилбензамід;
рац-N-[3-(2,5-дифторфеніл)-1-метилпіперидин-3-іл]-2-метокси-6-метилсульфаніл-4-трифторметилбензамід;
рац-2-ізопропіл-N-(1-метил-3-фенілпіперидин-3-іл)-4-трифторметилбензамід;
рац-2-метокси-6-метилсульфаніл-N-(1-метил-1,4,5,6-тетрагідро-2Н-[3,4']біпіридиніл-3-іл)-4-трифторметилбензамід;
рац-2-етил-N-(1-метил-1,4,5,6-тетрагідро-2Н-[3,4']біпіридиніл-3-іл)-4-трифторметилбензамід;
рац-2-метокси-6-метилсульфаніл-N-(1-метил-1,4,5,6-тетрагідро-2H-[3,3']біпіридиніл-3-іл)-4-трифторметилбензамід;
рац-2-етил-N-(1-метил-1,4,5,6-тетрагідро-2H-[3,3']біпіридиніл-3-іл)-4-трифторметилбензаміду гідрохлорид;
2-метокси-N-((3RS,5SR)-5-метокси-1-метил-3-фенілпіперидин-3-іл)-6-метилсульфаніл-4-трифторметилбензамід;
2-циклопропіл-N-((3RS,5SR)-5-метокси-1-метил-3-фенілпіперидин-3-іл)-4-трифторметилбензамід;
2-етил-N-((3RS,5SR)-5-метокси-1-метил-3-фенілпіперидин-3-іл)-4-трифторметилбензамід;
рац-2,6-диметокси-N-(1-метил-3-фенілпіперидин-3-іл)-4-трифторметилбензамід;
2-циклопропіл-N-((3RS,5SR)-1,5-диметил-3-фенілпіперидин-3-іл)-4-трифторметилбензамід;
рац-2-циклопропіл-4-трифторметил-N-(1,5,5-триметил-3-фенілпіперидин-3-іл)-бензамід;
рац-2-метокси-6-метилсульфаніл-4-трифторметил-N-(1,6,6-триметил-3-фенілпіперидин-3-іл)бензамід;
N-((3RS,5SR)-1,5-диметил-3-фенілпіперидин-3-іл)-2-метокси-6-метилсульфаніл-4-трифторметилбензамід;
2-метокси-N-((3RS,5SR)-5-метоксиметокси-1-метил-3-фенілпіперидин-3-іл)-6-метилсульфаніл-4-трифторметилбензамід;
рац-N-[3-(3-бромфеніл)-1-метилпіперидин-3-іл]-2-метокси-6-метилсульфаніл-4-трифторметилбензамід;
рац-N-[3-(2-хлор-4-фторфеніл)-1-метилпіперидин-3-іл]-2-метокси-6-метилсульфаніл-4-трифторметилбензамід;
рац-2-метокси-6-метилсульфаніл-N-[1-метил-3-(3-трифторметилфеніл)піперидин-3-іл]-4-трифторметилбензамід;
рац-2-метокси-N-[3-(3-метоксифеніл)-1-метилпіперидин-3-іл]-6-метилсульфаніл-4-трифторметилбензамід;
рац-N-[3-(3-фторфеніл)-1-метилпіперидин-3-іл]-2-метокси-6-метилсульфаніл-4-трифторметилбензамід;
рац-N-[3-(3-хлор-4-фторфеніл)-1-метилпіперидин-3-іл]-2-метокси-6-метилсульфаніл-4-трифторметилбензамід;
рац-N-[3-(3,4-дифторфеніл)-1-метилпіперидин-3-іл]-2-метокси-6-метилсульфаніл-4-трифторметилбензамід;
рац-2-метокси-6-метилсульфаніл-N-(1-метил-3-метатолілпіперидин-3-іл)-4-трифторметилбензамід;
рац-N-[3-(4-фтор-3-метилфеніл)-1-метилпіперидин-3-іл]-2-метокси-6-метилсульфаніл-4-трифторметилбензамід;
рац-N-[3-(3,5-дифторфеніл)-1-метилпіперидин-3-іл]-2-метокси-6-метилсульфаніл-4-трифторметилбензамід;
рац-2-метокси-6-метилсульфаніл-4-трифторметил-N-(1,5,5-триметил-3-фенілпіперидин-3-іл)бензамід;
рац-2-етил-3-метил-N-(1-метил-3-фенілпіперидин-3-іл)-4-трифторметилбензамід;
рац-N-(1-трет-бутил-3-фенілпіперидин-3-іл)-2-метокси-6-метилсульфаніл-4-трифторметилбензамід;
рац-2-метокси-N-(4-метил-6-феніл-4-азаспіро[2,5]окт-6-ил)-6-метилсульфаніл-4-трифторметилбензамід;
N-((3R,5S) або (3S,5R)-5-гідрокси-1-метил-3-фенілпіперидин-3-іл)-2-метокси-6-метилсульфаніл-4-трифторметилбензамід;
2-метокси-N-((3R,5S) або (3S,5R)-5-метокси-1-метил-3-фенілпіперидин-3-іл)-6-метилсульфаніл-4-трифторметилбензамід;
2-метокси-N-((3S,5R) або (3R,5S)-5-метокси-1-метил-3-фенілпіперидин-3-іл)-6-метилсульфаніл-4-трифторметилбензамід;
N-[(R або S)-3-(2-фторфеніл)-1-метилпіперидин-3-іл-2-метокси-6-метилсульфаніл-4-трифторметилбензамід;
N-[(R або S)-3-(2,5-дифторфеніл)-1-метилпіперидин-3-іл]-2-метокси-6-метилсульфаніл-4-трифторметилбензамід;
2-етил-N-((R або S)-1-метил-3-фенілпіперидин-3-іл)-4-трифторметилбензамід;
2-метокси-6-метилсульфаніл-4-трифторметил-N-((S або R)-1,5,5-триметил-3-фенілпіперидин-3-іл)-бензамід;
N-((3S,6S) або (3R,6R)-1,6-диметил-3-фенілпіперидин-3-іл)-2-метокси-6-метилсульфаніл-4-трифторметилбензамід;
N-((3R,6R) або (3S,6S)-1,6-диметил-3-фенілпіперидин-3-іл)-2-метокси-6-метилсульфаніл-4-трифторметилбензамід;
N-((3R,6S) або (3S,6R)-1,6-диметил-3-фенілпіперидин-3-іл)-2-метокси-6-метилсульфаніл-4-трифторметилбензамід;
N-((3S,5R) або (3R,5S)-1,5-диметил-3-фенілпіперидин-3-іл)-2-метокси-6-метилсульфаніл-4-трифторметилбензамід;
N-((3R,5S) або (3S,5R)-1,5-диметил-3-фенілпіперидин-3-іл)-2-етил-4-трифторметилбензамід;
2-етил-N-((3R,5S) або (3S,5R)-5-метокси-1-метил-3-фенілпіперидин-3-іл)-4-трифторметилбензамід;
2-циклопропіл-N-((3R,5S) або (3S,5R)-5-метокси-1-метил-3-фенілпіперидин-3-іл)-4-трифторметилбензамід або
2,6-диметокси-N-((R або S)-1-метил-3-фенілпіперидин-3-іл)-4-трифторметилбензамід.
8. Сполука формули І за п. 1, де R1 являє собою циклоалкіл або гетероциклоалкіл і кожний з Аr і R являє собою феніл.
9. Сполука формули І за п. 8, де сполука вибрана з групи, яка включає
рац-N-(1-циклопентил-3-фенілпіперидин-3-іл)-2-метокси-4,6-біс(трифторметил)бензамід,
рац-N-(1-циклопропілметил-3-фенілпіперидин-3-іл)-2-метокси-4,6-біс(трифторметил)бензамід або
рац-2-метокси-N-[3-феніл-1-(тетрагідропіран-4-іл)-піперидин-3-іл]-4,6-біс(трифторметил)бензамід.
10. Сполука формули І за п. 1, де R1 являє собою нижчий алкіл, Аr являє собою феніл і R являє собою гетероарил.
11. Сполука Формули І за п. 10, де сполука вибрана з групи, яка включає
рац-N-(5-фтор-1'-метил-1',4',5',6'-тетрагідро-2'Н-[2,3']біпіридиніл-3'-іл)-2-метокси-6-метилсульфаніл-4-трифторметилбензамід,
paц-2-мeтoкcи-6-мeтилcyльфaнiл-N-(1-мeтил-1,4,5,6-тeтpaгiдpo-2H-[3,4']бiпipидинiл-3-іл)-4-трифторметилбензамід,
рац-2-етил-N-(1-метил-1,4,5,6-тетрагідро-2Н-[3,4']біпіридиніл-3-іл)-4-трифторметилбензаміду гідрохлорид,
рац-2-метокси-6-метилсульфаніл-N-(1-метил-1,4,5,6-тетрагідро-2Н-[3,3']біпіридиніл-3-іл)-4-трифторметилбензамід або
рац-2-етил-N-(1-метил-1,4,5,6-тетрагідро-2Н-[3,3']біпіридиніл-3-іл)-4-трифторметилбензамід.
12. Сполука формули І за п. 1, де R1 являє собою атом водню і Аr і R являють собою феніл.
13. Сполука формули І за п. 12, де сполука являє собою
рац-2-циклопропіл-N-(3-фенілпіперидин-3-іл)-4-трифторметилбензамід.
14. Сполука формули І за п. 1, де R2 являє собою гідрокси.
15. Сполука формули І за п. 14, де сполука вибрана з групи, яка включає
рац-N-(5-гідрокси-1-метил-3-фенілпіперидин-3-іл)-2-метокси-6-метилсульфаніл-4-трифторметилбензамід або
N-((3R,5S) або (3S,5R)-5-гідрокси-1-метил-3-фенілпіперидин-3-іл)-2-метокси-6-метилсульфаніл-4-трифторметилбензамід.
16. Сполука формули І за п. 3, де R2 являє собою атом галогену.
17. Сполука формули І за п. 16, де сполука являє собою
рац-N-(5-фтор-1-метил-3-фенілпіперидин-3-іл)-2-метокси-6-метилсульфаніл-4-трифторметилбензамід.
18. Сполука формули І за п. 1, де R1 являє собою CD3.
19. Сполука формули І за п. 18, де сполука являє собою
[2Н-метил]-2-метокси-N-((R або S)-1-метил-3-фенілпіперидин-3-іл)-6-метилсульфаніл-4-трифторметилбензаміду гідрохлорид.
20. Лікарський засіб, який містить одну або більше ніж одну сполуку за будь-яким з п. 1-19 і фармацевтично прийнятні ексципієнти.
21. Лікарський засіб за п. 20 для лікування захворювань на основі інгібітора зворотного захоплення гліцину.
22. Лікарський засіб за п. 21, де захворювання являють собою психози, біль, дисфункцію пам'яті і навчання, дефіцит уваги, шизофренію, деменціальні розлади або хворобу Альцгеймера.
Текст
Реферат: Даний винахід стосується сполуки загальної формули І R R 1 N H R O Ar 2 ,I де 1 R являє собою атом водню, нижчий алкіл, CD3, -(CH2)n-CHO, -(СН2)n-О-нижчий алкіл, -(СН2)nОН, -(СН2)n-циклоалкіл або являє собою гетероциклоалкіл; UA 104611 C2 (12) UA 104611 C2 2 R являє собою атом водню, атом галогену, гідрокси, нижчий алкіл, динижчий алкіл, -ОСН2-О2 нижчий алкіл або нижчий алкокси; або піперидинове кільце разом з R утворює спірокільце, вибране з 4-азаспіро[2,5]окт-6-илу; Аr являє собою арил або гетероарил, які можливо мають один, два або три замісники, вибрані з атома галогену, нижчого алкілу, нижчого алкілу, що має як замісники атом галогену, нижчого алкокси, що має як замісники атом галогену, циклоалкілу, нижчого алкокси, S-нижчого алкілу, гетероарилу, гетероциклоалкілу, або можливо мають як замісники феніл, можливо такий, що має як замісники R', і R' являє собою атом галогену, нижчий алкіл, нижчий алкокси або нижчий алкокси, що має як замісники атом галогену, або являє собою гетероарил; R являє собою нижчий алкіл, циклоалкіл, гетероциклоалкіл, арил або гетероарил, де арил і гетероарил можливо мають як замісники один або два R'; n має значення 0, 1, 2 або 3; або фармацевтично прийнятної солі приєднання кислоти, рацемічної суміші або відповідного енантіомера і/або оптичного ізомеру даної сполуки. Крім того, даний винахід стосується фармацевтичних композицій, що містять сполуки Формули І, і їх застосування в лікуванні неврологічних і психоневрологічних розладів. R O R 1 N R 2 N H Ar UA 104611 C2 Даний винахід належить до сполуки загальної Формули I R N R 5 10 15 20 25 30 35 40 45 50 55 O R 1 N H Ar 2 I, де 1 R являє собою атом водню, нижчий алкіл, CD 3, -(CH2)n-CHO, -(CH2)n-O-нижчий алкіл, -(CH2)n-OH, -(CH2)n-циклоалкіл або являє собою гетероциклоалкіл; 2 R являє собою атом водню, атом галогену, гідрокси, нижчий алкіл, ди-нижчий алкіл, 2 -OCH2-O-нижчий алкіл або нижчий алкокси; або піперидинове кільце разом з R утворює спірокільце, вибране з 4-аза-спіро[2,5]окт-6-илу; Ar являє собою арил або гетероарил, які можливо мають один, два або три замісника, вибрані з атома галогену, нижчого алкілу, нижчого алкілу, що має в якості замісників атом галогену, нижчого алкокси, що має в якості замісників атом галогену, циклоалкілу, нижчого алкокси, S-нижчого алкілу, гетероарилу, гетероциклоалкілу, або можливо мають в якості замісників феніл, що можливо має в якості замісників R', і R' являє собою атом галогену, нижчий алкіл, нижчий алкокси або нижчий алкокси, що має в якості замісників атом галогену, або являє собою гетероарил; R являє собою нижчий алкіл, циклоалкіл, гетероциклоалкіл, арил або гетероарил, де арил і гетероарил можливо мають в якості замісників один або два R'; n має значення 0, 1, 2 або 3; або до фармацевтично прийнятної солі приєднання кислоти, до рацемічної суміші або до відповідного енантіомеру і/або оптичному ізомеру даної сполуки. Крім того, даний винахід належить до фармацевтичних композицій, що містять сполуки Формули I, і до їх застосування в лікуванні неврологічних і психоневрологічних розладів. Неочікувано було знайдено, що сполуки загальної Формули I є хорошими інгібіторами гліцинового переносника 1 (GlyT-1) і що вони мають гарну селективність відносно інгібіторів гліцинового переносника 2 (GlyT-2). Шизофренія являє собою прогресуюче і виснажливе неврологічне захворювання, яке характеризується епізодичними позитивними симптомами, такими як марення, галюцинації, розлади мислення і психоз, і стійкими негативними симптомами, такими як притуплений афект, порушення уваги і соціальна самоізоляція, і когнітивними порушеннями (Lewis DA and Lieberman JA, Neuron, 2000, 28:325-33). Протягом декількох десятиліть дослідження були сконцентровані на гіпотезі "дофамінергічній гіперактивності”, що призвело до терапевтичних втручаннь, що включають блокаду дофамінергічної системи (Vandenberg RJ and Aubrey KR., Exp. Opin. Ther. Targets, 2001, 5(4): 507-518; Nakazato A and Okuyama S, et al., 2000, Exp. Opin. Ther. Patents, 10(1): 75-98). Цей фармакологічний підхід погано відповідає лікуванню негативних і когнітивних симптомів, які являються кращими показниками функціонального результату (Sharma T., Br.J. Psychiatry, 1999, 174 (suppl. 28): 44-51). У середині 1960-их років була запропонована додаткова модель шизофренії, заснована на психотоміметичній дії, що викликається блокадою глутаматною системи сполуками, подібними фенциклідину (PCP) і спорідненим агентам (кетаміну), які являються неконкурентними антагоністами NMDA-рецептора. Цікаво, що у здорових волонтерів PCP-індуковане психотоміметична дія включає позитивні і негативні симптоми, а також когнітивну дисфункцію і, таким чином, сильно нагадує шизофренію у пацієнтів (Javitt DC et al., 1999, Biol. Psychiatry, 45: 668-679 і посилання в даному описі). Крім того, трансгенні миші, експресуючі знижчені рівні NMDAR1-субодиниці, проявляють аномалії в поведінці, подібні тим, які спостерігають в фармакологічно індукованих моделях шизофренії, що підтверджує модель, в якій зменшення активності NMDA-рецептора приводить до шизофренічної поведінки (Mohn AR et al., 1999, Cell, 98: 427-236). Глутаматна нейротрансмісія, зокрема активність NMDA-рецептора, відіграє ключову роль в синаптичній пластичності, навчанні і пам'яті, а саме NMDA-рецептори, очевидно, служать в якості диференційованого перемикача для синхронізації порогового значення синаптичної пластичності і формування пам'яті (Hebb DO, 1949, The organization of behavior, Wiley, NY; Bliss TV і Collingridge GL, 1993, Nature, 361: 31-39). Трансгенні миші, сверхекспресуючі NR2Bсубодиницю NMDA, проявляють підвищену синаптичну пластичність, мають кращі здібності до навчання і кращу пам'ять (Tang JP et al., 1999, Nature: 401: 63-69). 1 UA 104611 C2 5 10 15 20 25 30 35 40 45 50 55 Таким чином, якщо патофізіологія шизофренії включає дефіцит глутамата, можна очікувати, що збільшення глутаматної трансмісії, зокрема за допомогою активації NMDA-рецептора, буде викликати як антипсихотичні ефекти, так і ефекти підвищення когнітивної функції. Відомо, що в ЦНС амінокислота гліцин має щонайменше дві важливі функції. Зв'язуючись зі стрихнін-чутливими гліциновими рецепторами, вона діє як гальмівна амінокислота, а, діючи в якості основного коагоніста глутамата на функцію рецептора N-метил-D-аспартата (NMDA), ця амінокислота виявляє вплив також на збуджувальну активність. В той час як глутамат вивільняється із синаптичних закінчень в залежності від активности, гліцин є присутнім можливо на більш постійному рівні і, очевидно, модулює/контролює рецептор для його відповіді на глутамат. Один із найбільш ефективних шляхів контролю синаптичних концентрацій нейромедіатора полягає у тому, щоб впливати на його зворотний захват в синапсах. Шляхом видалення нейромедіаторів з позаклітинного простору переносники нейромедіаторів можуть контролювати їх позаклітинний час життя і тим самим модулювати параметри синаптичної передачі (Gainetdinov RR et al, 2002, Trends в Pharm. Sci., 23(8): 367-373). Гліцинові переносники, які належать натрій- і хлорид-залежному сімейству переносників нейромедіаторів, відіграють важливу роль в термінації постсинаптичних гліцинергічних впливів і підтримці низької позаклітинної концентрації гліцина шляхом зворотного захвату гліцина в пресинаптичних нервових закінченнях і в прилеглих тонких гліальних відростках. Із головного мозку ссавців були клоновані два різних гена гліцинових переносників (GlyT-1 і GlyT-2), які дають початок двом переносникам приблизно з 50% гомологією амінокислотної послідовності. GlyT-1 представлений чотирма ізоформами, які є результатом альтернативного сплайсінгу і альтернативного використання промоторів (1a, 1b, 1c і 1d). Тільки дві із цих ізоформ були знайдені в головному мозку гризунів (GlyT-1a і GlyT-1b). GlyT-2 також показує деяку ступінь гетерогенності. В головному мозку гризунів були ідентифіковані дві ізоформи GlyT-2 (2a і 2b). Відомо, що GlyT-1 локалізується в ЦНС і в периферичних тканинах, тоді як GlyT-2 є специфічним для ЦНС. GlyT-1 має переважно гліальний розподіл, і його знаходять не тільки в областях, відповідних стрихнін-чутливому гліциновому рецептору, але також за межами цих областей, де, як передбачається, він бере участь в модуляції функції NMDA-рецептора (LopezCorcuera B et al., 2001, Mol. Mem. Biol., 18: 13-20). Відповідно, один із способів підвищення активності NMDA-рецептора полягає в збільшенні концентрації гліцину в локальному мікрооточенні синаптичних NMDA-рецепторов шляхом інгібування GlyT-1-переносника (Bergereon R. et al., 1998, Proc. Natl. Acad. Sci. USA, 95: 15730-15734; Chen L et al., 2003, J. Neurophysiol., 89 (2): 691-703). Інгібітори гліцинових переносників підходять для лікування неврологічних і психоневрологічних розладів. Більшість пов'язаних з ними хворобливих станів являють собою психози, шизофренію (Armer RE and Miller DJ, 2001, Exp. Opin. Ther. Patents, 11 (4): 563-572), психотичні розлади настрою, такі як великий депресивний розлад важкого типу, розлади настрою, пов'язані із психотичними розладами, такими як гострий маніакальний синдром або депресія, пов'язана з біполярними розладами, і розлади настрою, пов'язані із шизофренією (Pralong ET et al., 2002, Prog. Neurobiol., 67: 173-202), аутистичні розлади (Carlsson ML, 1998, J. Neural Transm. 105: 525-535), когнітивні розлади, такі як деменції, включаючи вікову деменцію і сенільну деменцію Алцгеймеровського типу, порушення пам'яті у ссавців, включаючи людину, синдроми дефіциту уваги, і біль (Armer RE and Miller DJ, 2001, Exp. Opin. Ther. Patents, 11 (4): 563-572). Відповідно, збільшення активації NMDA-рецепторів за допомогою інгібування GlyT-1 може привести до агентів, які лікують психоз, шизофренію, деменцію й інші захворювання, при яких порушені когнітивні процеси, такі як синдроми дефіциту уваги або хвороба Альцгеймера. Предметами даного винаходу є сполуки Формули I per se, застосування сполук Формули I і їх фармацевтично прийнятних солей у виготовленні ліків для лікування захворювань, на які можна впливати шляхом активації NMDA-рецепторів за допогою інгібування GlyT-1, одержання зазначених сполук, ліки на основі сполуки згідно з винаходом і їх виготовлення, а також застосування сполук Формули I у лікуванні або попередженні таких захворювань, як психози, дисфункция пам'яті й навчання, шизофренія, деменція й інші захворювання, при яких порушені когнітивні процеси, такі як синдроми дефіциту уваги або хвороба Альцгеймера. Бажаними показаннями для застосування сполук за даним винаходом є шизофренія, когнітивне порушення і хвороба Альцгеймера. Крім того, винахід включає всі рацемічні суміші, усі відповідні енантіомери і/або оптичні ізомери. 2 UA 104611 C2 5 10 15 20 25 30 35 40 45 50 55 60 У контексті даного опису термін "нижчий алкіл" означає групу з насиченим нормальним або розгалуженим ланцюгом, що містить від 1 до 7 атомів вуглецю, наприклад метил, етил, пропіл, ізопропіл, н-бутил, ізо-бутил, 2-бутил, трет-бутил і тому подібне. Бажаними алкільними групами є групи, що містять від 1 до 4 атомів вуглецю. У контексті даного опису термін "нижчий алкокси" означає нижчу алкільну групу, таку, як визначено вище, яка зв'язана з атомом O. Термін "циклоалкіл" означає насичене або частково ненасичене кільце, що містить від 3 до 7 атомів вуглецю, наприклад циклопропіл, циклобутил, циклопентил, циклопентеніл, циклогексил, циклогексеніл, циклогептил або циклогептеніл. Бажаними циклоалкільними кільцями є циклопропіл і циклопентил. Термін "гетероциклоалкіл" означає насичене або частково ненасичене кільце, що містить від 3 до 6 атомів вуглецю, де щонайменше один атом вуглецю замінений гетероатомом, вибраним з N, S або O, наприклад піперазиніл, пірролідиніл, оксетаніл, морфолініл, піперидиніл або тетрагідропіраніл. Термін "галоген" означає атом хлору, атом йоду, атом фтору і атом брому. Термін "арил" означає одновалентний циклічний ароматичний вуглеводневий радикал, який складається із одного кільця або декількох конденсованих кілець, у якого щонайменше одне кільце є ароматичним за природою, наприклад феніл або нафтил. Термін "нижчий алкіл, що має в якості замісників атом галогену", означає нижчу алкільну групу, таку, як визначено вище, де щонайменше один атом водню замінений атомом галогену, наприклад наступні групи: CF3, CHF2, CH2F, CH2CF3, CH2CHF2, CH2CH2F, CH2CH2CF3, CH2CH2CH2CF3, CH2CH2Cl, CH2CF2CF3, CH2CF2CHF2, CF2CHFCF3, C(CH3)2CF3, CH(CH3)CF3 або CH(CH2F)CH2F. Термін "нижчий алкокси, що має в якості замісників атом галогену", означає алкокси-групу, таку, як визначено вище, де щонайменше один атом водню замінений атомом галогену. Термін "гетероарил" означає циклічний ароматичний вуглеводневий радикал, що складається з одного кільця або декількох конденсованих кілець, що містить від 5 до 14 кільцевих атомів, що бажано містить від 5 до 10 кільцевих атомів, у якого щонайменше одне кільце є ароматичним за природою і який містить щонайменше один гетероатом, вибраний з N, O або S, наприклад хіноксалініл, дигідроізохінолініл, піразиніл, піридазиніл, піразоліл, піридиніл, піридил, піримідиніл, оксадіазоліл, тріазоліл, тетразоліл, тіазоліл, тіадіазоліл, тіеніл, фурил, імидазоліл, бензофураніл, дигідробензофураніл і бензо[1,3]діоксол. Бажана гетероарильна група являє собою піридиніл. Термін "фармацевтично прийнятні солі приєднання кислот" включає солі з неорганічними і органічними кислотами, такими як соляна кислота, азотна кислота, сірчана кислота, фосфорна кислота, лимонна кислота, мурашина кислота, фумарова кислота, малеїновая кислота, оцтова кислота, бурштинова кислота, винна кислота, метан-сульфонова кислота, паратолуолсульфонова кислота і тому подібне. 1 Бажаними сполуками Формули I є сполуки, у яких R являє собою нижчий алкіл і Ar і R представляють собою феніл. Особливо бажаними є сполуки, у яких фенільна група Ar має в якості замісників щонайменше дві групи CF3, наприклад наступні сполуки: рац-2-фтор-N-(1-метил-3-феніл-піперидин-3-іл)-4,6-біс-трифторметил-бензамід; рац-2-метокси-N-(1-метил-3-феніл-піперидин-3-іл)-4,6-біс-трифторметил-бензамід; рац-2-етил-N-(1-метил-3-феніл-піперидин-3-іл)-4,6-біс-трифторметил-бензамід; рац-N-[3-(4-фтор-феніл)-1-метил-піперидин-3-іл]-2-метокси-4,6-біс-трифторметил-бензамід або 2-метокси-N-((R)-1-метил-3-феніл-піперидин-3-іл)-4,6-біс-трифторметил-бензамід. Іншими бажаними сполуками є сполуки, у яких фенільна група Ar має в якості замісників щонайменше одну групу CF3, наприклад наступні сполуки: рац-2-етил-N-(1-метил-3-феніл-піперидин-3-іл)-4-трифторметил-бензамід; рац-2-бром-6-метокси-N-(1-метил-3-феніл-піперидин-3-іл)-4-трифторметил-бензамід; рац-N-(1,2-диметил-3-феніл-піперидин-3-іл)-2-метокси-6-метилсульфаніл-4-трифторметилбензамід; рац-2-циклопропіл-N-(1-метил-3-феніл-піперидин-3-іл)-4-трифторметил-бензамід; рац-2-метокси-N-(1-метил-3-феніл-піперидин-3-іл)-6-метилсульфаніл-4-трифторметилбензамід; рац-N-(1-метил-3-феніл-піперидин-3-іл)-2-метилсульфаніл-4-трифторметил-бензамід; рац-N-[3-(4-фтор-феніл)-1-метил-піперидин-3-іл]-2-метокси-6-метилсульфаніл-4трифторметил-бензамід; 3 UA 104611 C2 5 10 15 20 25 30 35 40 45 50 55 рац-N-[3-(4-хлор-феніл)-1-метил-піперидин-3-іл]-2-метокси-6-метилсульфаніл-4трифторметил-бензамід; 2-метокси-N-((S)-1-метил-3-феніл-піперидин-3-іл)-6-метилсульфаніл-4-трифторметилбензамід; 2-метокси-N-((R)-1-метил-3-феніл-піперидин-3-іл)-6-метилсульфаніл-4-трифторметилбензамід; рац-2-дифторметокси-N-(1-метил-3-феніл-піперидин-3-іл)-4-трифторметил-бензамід; рац-N-[3-(3-хлор-феніл)-1-метил-піперидин-3-іл]-2-метокси-6-метилсульфаніл-4трифторметил-бензамід; рац-2-метокси-N-[3-(4-метокси-феніл)-1-метил-піперидин-3-іл]-6-метилсульфаніл-4трифторметил-бензамід; рац-N-(5-фтор-1-метил-3-феніл-піперидин-3-іл)-2-метокси-6-метилсульфаніл-4трифторметил-бензамід; рац-N-(1-ізопропіл-3-феніл-піперидин-3-іл)-2-метокси-6-метилсульфаніл-4-трифторметилбензамід; 2-циклопропіл-N-((S)-1-метил-3-феніл-піперидин-3-іл)-4-трифторметил-бензамід; 2-циклопропіл-N-((R)-1-метил-3-феніл-піперидин-3-іл)-4-трифторметил-бензамід; рац-2-циклобутил-N-(1-метил-3-феніл-піперидин-3-іл)-4-трифторметил-бензамід; рац-N-[3-(2,4-дифтор-феніл)-1-метил-піперидин-3-іл]-2-метокси-6-метилсульфаніл-4трифторметил-бензамід; рац-N-[3-(2-фтор-феніл)-1-метил-піперидин-3-іл]-2-метокси-6-метилсульфаніл-4трифторметил-бензамід; рац-N-[3-(2,5-дифтор-феніл)-1-метил-піперидин-3-іл]-2-метокси-6-метилсульфаніл-4трифторметил-бензамід; рац-2-ізопропіл-N-(1-метил-3-феніл-піперидин-3-іл)-4-трифторметил-бензамід; рац-2-метокси-6-метилсульфаніл-N-(1-метил-1,4,5,6-тетрагідро-2H-[3,4']біпіридиніл-3-іл)-4трифторметил-бензамід; рац-2-етил-N-(1-метил-1,4,5,6-тетрагідро-2H-[3,4']біпіридиніл-3-іл)-4-трифторметилбензамід; рац-2-метокси-6-метилсульфаніл-N-(1-метил-1,4,5,6-тетрагідро-2H-[3,3']біпіридиніл-3-іл)-4трифторметил-бензамід; рац-2-етил-N-(1-метил-1,4,5,6-тетрагідро-2H-[3,3']біпіридиніл-3-іл)-4-трифторметилбензаміду гідрохлорид; 2-метокси-N-((3RS,5SR)-5-метокси-1-метил-3-феніл-піперидин-3-іл)-6-метилсульфаніл-4трифторметил-бензамід; 2-циклопропіл-N-((3RS,5SR)-5-метокси-1-метил-3-феніл-піперидин-3-іл)-4-трифторметилбензамід; 2-етил-N-((3RS,5SR)-5-метокси-1-метил-3-феніл-піперидин-3-іл)-4-трифторметил-бензамід; рац-2,6-диметокси-N-(1-метил-3-феніл-піперидин-3-іл)-4-трифторметил-бензамід; 2-циклопропіл-N-((3RS,5SR)-1,5-диметил-3-феніл-піперидин-3-іл)-4-трифторметил-бензамід; рац-2-циклопропіл-4-трифторметил-N-(1,5,5-триметил-3-феніл-піперидин-3-іл)-бензамід; рац-2-метокси-6-метилсульфаніл-4-трифторметил-N-(1,6,6-триметил-3-феніл-піперидин-3іл)-бензамід; N-((3RS,5SR)-1,5-диметил-3-феніл-піперидин-3-іл)-2-метокси-6-метилсульфаніл-4трифторметил-бензамід; 2-метокси-N-((3RS,5SR)-5-метоксиметокси-1-метил-3-феніл-піперидин-3-іл)-6метилсульфаніл-4-трифторметил-бензамід; рац-N-[3-(3-бром-феніл)-1-метил-піперидин-3-ил]-2-метокси-6-метилсульфаніл-4трифторметил-бензамід; рац-N-[3-(2-хлор-4-фтор-феніл)-1-метил-піперидин-3-іл]-2-метокси-6-метилсульфаніл-4трифторметил-бензамід; рац-2-метокси-6-метилсульфаніл-N-[1-метил-3-(3-трифторметил-феніл)-піперидин-3-іл]-4трифторметил-бензамід; рац-2-метокси-N-[3-(3-метокси-феніл)-1-метил-піперидин-3-іл]-6-метилсульфаніл-4трифторметил-бензамід; рац-N-[3-(3-фтор-феніл)-1-метил-піперидин-3-іл]-2-метокси-6-метилсульфаніл-4трифторметил-бензамід; рац-N-[3-(3-хлор-4-фтор-феніл)-1-метил-піперидин-3-іл]-2-метокси-6-метилсульфаніл-4трифторметил-бензамід; 4 UA 104611 C2 5 10 15 20 25 30 35 40 45 50 55 60 рац-N-[3-(3,4-дифтор-феніл)-1-метил-піперидин-3-іл]-2-метокси-6-метилсульфаніл-4трифторметил-бензамід; рац-2-метокси-6-метилсульфаніл-N-(1-метил-3-мета-толіл-піперидин-3-іл)-4-трифторметилбензамід; рац-N-[3-(4-фтор-3-метил-феніл)-1-метил-піперидин-3-іл]-2-метокси-6-метилсульфаніл-4трифторметил-бензамід; рац-N-[3-(3,5-дифтор-феніл)-1-метил-піперидин-3-ил]-2-метокси-6-метилсульфаніл-4трифторметил-бензамід; рац-2-метокси-6-метилсульфаніл-4-трифторметил-N-(1,5,5-триметил-3-феніл-піперидин-3іл)-бензамід; рац-2-етил-3-метил-N-(1-метил-3-феніл-піперидин-3-іл)-4-трифторметил-бензамід; рац-N-(1-трет-бутил-3-феніл-піперидин-3-іл)-2-метокси-6-метилсульфаніл-4-трифторметилбензамід; рац-2-метокси-N-(4-метил-6-феніл-4-аза-спіро[2,5]окт-6-іл)-6-метилсульфаніл-4трифторметил-бензамід; N-((3R,5S) або (3S,5R)-5-гідрокси-1-метил-3-феніл-піперидин-3-іл)-2-метокси-6метилсульфаніл-4-трифторметил-бензамід; 2-метокси-N-((3R,5S) або (3S,5R)-5-метокси-1-метил-3-феніл-піперидин-3-іл)-6метилсульфаніл-4-трифторметил-бензамід; 2-метокси-N-((3S,5R) або (3R,5S)-5-метокси-1-метил-3-феніл-піперидин-3-іл)-6метилсульфаніл-4-трифторметил-бензамід; N-[(R або S)-3-(2-фтор-феніл)-1-метил-піперидин-3-іл]-2-метокси-6-метилсульфаніл-4трифторметил-бензамід; N-[(R або S)-3-(2,5-дифтор-феніл)-1-метил-піперидин-3-іл]-2-метокси-6-метилсульфаніл-4трифторметил-бензамід; 2-етил-N-((R або S)-1-метил-3-феніл-піперидин-3-іл)-4-трифторметил-бензамід; 2-метокси-6-метилсульфаніл-4-трифторметил-N-((S або R)-1,5,5-триметил-3-фенілпіперидин-3-іл)-бензамід; N-((3S,6S) або (3R,6R)-1,6-диметил-3-феніл-піперидин-3-іл)-2-метокси-6-метилсульфаніл-4трифторметил-бензамід; N-((3R,6R)або (3S,6S)-1,6-диметил-3-феніл-піперидин-3-іл)-2-метокси-6-метилсульфаніл-4трифторметил-бензамід; N-((3R,6S) або (3S,6R)-1,6-диметил-3-феніл-піперидин-3-іл)-2-метокси-6-метилсульфаніл-4трифторметил-бензамід; N-((3S,5R) або (3R,5S)-1,5-диметил-3-феніл-піперидин-3-іл)-2-метокси-6-метилсульфаніл-4трифторметил-бензамід; N-((3R,5S) або (3S,5R)-1,5-диметил-3-феніл-піперидин-3-іл)-2-етил-4-трифторметилбензамід; 2-етил-N-((3R,5S) або (3S,5R)-5-метокси-1-метил-3-феніл-піперидин-3-іл)-4-трифторметилбензамід; 2-циклопропіл-N-((3R,5S) або (3S,5R)-5-метокси-1-метил-3-феніл-піперидин-3-іл)-4трифторметил-бензамід або 2,6-диметокси-N-(R або (S)-1-метил-3-феніл-піперидин-3-іл)-4-трифторметил-бензамід. 1 Бажаними сполуками Формули I є сполуки, у яких R являє собою циклоалкіл або гетероциклоалкіл і Ar і R представляють собою феніл, наприклад рац-N-(1-циклопентил-3-феніл-піперидин-3-іл)-2-метокси-4,6-біс-трифторметил-бензамід, рац-N-(1-циклопропилметил-3-феніл-піперидин-3-іл)-2-метокси-4,6-біс-трифторметилбензамід або рац-2-метокси-N-[3-феніл-1-(тетрагідро-піран-4-іл)-піперидин-3-іл]-4,6-біс-трифторметилбензамід. 1 Бажаними сполуками Формули I є сполуки, у яких R являє собою нижчий алкіл, Ar являє собою феніл і R являє собою гетероарил, наприклад рац-N-(5-фтор-1'-метил-1',4',5',6'-тетрагідро-2`H-[2,3']біпіридиніл-3'-іл)-2-метокси-6метилсульфаніл-4-трифторметил-бензамід, рац-2-метокси-6-метилсульфаніл-N-(1-метил-1,4,5,6-тетрагідро-2H-[3,4']біпіридиніл-3-іл)-4трифторметил-бензамід, рац-2-етил-N-(1-метил-1,4,5,6-тетрагідро-2H-[3,4']біпіридиніл-3-іл)-4-трифторметилбензаміду гідрохлорид, рац-2-метокси-6-метилсульфаніл-N-(1-метил-1,4,5,6-тетрагідро-2H-[3,3']біпіридиніл-3-іл)-4трифторметил-бензамід або 5 UA 104611 C2 5 10 15 20 рац-2-етил-N-(1-метил-1,4,5,6-тетрагідро-2H-[3,3']біпіридиніл-3-іл)-4-трифторметилбензамід. 1 Бажаними сполуками Формули I є сполуки, у яких R являє собою атом водню і Ar і R представляють собою феніл, наприклад рац-2-циклопропіл-N-(3-феніл-піперидин-3-іл)-4-трифторметил-бензамід. 2 Бажаними сполуками Формули I є сполуки, у яких R являє собою гідрокси, наприклад рац-N-(5-гідрокси-1-метил-3-феніл-піперидин-3-іл)-2-метокси-6-метилсульфаніл-4трифторметил-бензамід або N-((3R,5S) або (3S,5R)-5-гідрокси-1-метил-3-феніл-піперидин-3-іл)-2-метокси-6метилсульфаніл-4-трифторметил-бензамід. 2 Бажаними сполуками Формули I є сполуки, у яких R являє собою атом галогену, наприклад рац-N-(5-фтор-1-метил-3-феніл-піперидин-3-іл)-2-метокси-6-метилсульфаніл-4трифторметил-бензамід. 1 Бажаними сполуками Формули I є сполуки, у яких R являє собою CD3, наприклад наступні сполуки: [2H-метил]-2-метокси-N-(R) або (S)-1-метил-3-феніл-піперидин-3-іл)-6-метилсульфаніл-4трифторметил-бензаміду гідрохлорид. Сполуки за даним винаходом Формули I і їх фармацевтично прийнятні солі можуть бути отримані за допомогою методик, відомих в даній галузі техніки, наприклад за допомогою методик, описаних нижче, які включають a) взаємодію сполуки Формули R 1 R N NH2 2 R 25 II зі сполукою Формули O Ar HO 30 За наявності активуючого агента, такого як HATU (орто-(7-азабензотріазол-1-іл)-1,1,3,3тетраметилуронію гексафторфосфат) або тіонилхлорид, з одержанням сполуки Формули R R 1 N R 35 O Ar N H 2 I, де замісники є такими, як визначено вище, або b) взаємодію сполуки Формули H O R N R 40 III N Ar H 2 IV зі сполукою Формули 1 RX за наявності основи, такої як N-етилдіізопропіламін, з одержанням сполуки Формули 6 UA 104611 C2 R N R 5 2 I, N Ar N H 2 IV 4 5 з карбонільним реагентом Формули R -C(O)-R за наявності відновлюючого агента, такого як ціаноборгідрид натрію, з одержанням сполуки Формули R O R 1 N R 20 O R R 15 Ar N H де X являє собою атом галогену та інші замісники є такими, як визначено вище, або c) взаємодію сполуки Формули H 10 O R 1 Ar N H 2 I, 4 5 де замісники є такими, як визначено вище, R і R представляють собою нижчий алкіл або разом з атомом вуглецю, до якого вони приєднані, утворюють циклоалкільну або гетероциклоалкільну групу, і при бажанні, перетворення отриманих сполук в фармацевтично прийнятні солі приєднання кислот. Сполуки Формули I можуть бути отримані з використанням однієї з методик a), b) або c) у відповідності з приведеними нижче Схемами 1-12. Вихідні речовини або є у продажі, або можуть бути отримані у відповідності до відомих методик. Схема 1 25 30 Сполуки загальної Формули I можуть бути отримані в результаті взаємодії піперидинових похідних Формули II з кислотою Формули III за наявності активуючого агента, такого як HATU (орто-(7-азабензотрізол-1-іл)-1,1,3,3-тетраметилуронію гексафторфосфат) або тіонілхлорид. Піперидинові похідні Формули II можуть бути отримані в результаті взаємодії піперидонового 7 UA 104611 C2 похідного VI з металоорганічним реагентом, таким як реагент Грін’яра, наступної обробки отриманого спирту VII азидом натрію за наявності кислоти, такої як ТФУ, і перетворення отриманого азидного похідного VIII в сполуку II за наявності відновлюючого агента, такого як алюмогідрид літію. 5 Схема 2 2 10 15 20 Альтернативно піперидинові похідні Формули II, де R являє собою атом водню, можуть бути отримані із нітро-піперидонових похідних XII в результаті відновлення нітро-групи відновлюючим агентом, наприклад нікелем Ренея в атмосфері водню або цинком за наявності кислоти, такої як соляна кислота, і наступного відновлення отриманих аміно-піперидонових похідних XIII до сполуки II, яке може бути виконано за наявності відновлюючого агента, такого як алюмогідрид літію. Нітро-піперидонові похідні XII можуть бути отримані із нітро-похідних XI з 1 використанням внутрішньомолекулярної реакції Манніха, виконуваної за наявності аміну R NH2 і альдегіду, такого як формальдегід. Сполуки XI можуть бути отримані шляхом приєднання нітрометил-арильних похідних IX до метилакрилату за наявності основи, такої як Amberlyst A21 або Триton B, з використанням реакції Міхаеля або в результаті взаємодії арилгалогенідних похідних X з метил 4-нітробутиратом за наявності паладієвого каталізатора, такого як Pd 2dba3, ліганду, такого як 2-(ди-трет-бутилфосфіно)-2`-метилбифеніл, і основи, такої як карбонат цезію, у відповідності з методикою, описаною Buchwald et al. в J. Org. Chem. 2002, 106. 8 UA 104611 C2 Схема 3 5 10 Альтернативно піперидинові похідні Формули II, де R являє собою алкільну групу, можуть бути одержані з кислоти XVI з використанням перегрупування Курціуса за наявності такого реагенту, як DPPA (дифенілфосфоразідат), і наступного гідролізу отриманого ізоціанату XVII за наявності основи, такої як гідроксид натрію, до захищеного піперидину XVIII, який відновлюють до сполуки II за наявності відновлюючого агента, такого як алюмогідрид літію. Кислота XVI може бути одержана з ефіру XIV в результаті обробки основою, такою як діізопропіламід літію, і алкілуючим агентом R-X і наступного омилення отриманої проміжної сполуки, ефіру XV, до сполуки XVI за наявності основи, такої як гідроксид літію. Схема 4 15 9 UA 104611 C2 4 5 10 5 Замісники є такими, як описано вище, R і R представляють собою нижчий алкіл або разом з атомом вуглецю, до якого вони приєднані, утворюють циклоалкільну або гетероциклоалкільну групу. Альтернативно сполуки загальної Формули I можуть бути одержані в результаті взаємодії 1 піперидинового похідного IV або з алкілуючим агентом R X за наявності основи, такої як Nетилдіізопропіламін, або з карбонільним реагентом V за наявності відновлюючого агента, такого як ціаноборгідрид натрію. Піперидинове похідне IV може бути отримане в результаті відновлення азиду VIII таким реагентом, як боргідрид натрію, з одержанням амінного похідного XIX, яке потім може бути піддане взаємодії з кислотою III за наявності активуючого агента, такого як HATU або тіонілхлорид, і наступного перетворення отриманого амідного похідного XX в сполуку IV шляхом видалення N-захисної групи. Схема 5 15 20 2 Альтернативно піперидинові похідні Формули II, де R являє собою атом фтору, можуть бути одержані із фторованого нітро-піперидону XXI шляхом двох послідовних відновлень, спочатку з використанням такого агента, як нікель Ренея, і потім з використанням такого агента, як алюмогідрид літію. Сполука XXI може бути отримана в результаті взаємодії нітро-піперидину XII з основою, такою як діізопропіламін літію, і наступної обробки електрофільним фторуючим агентом, таким як N-фторбензолсульфонімід. 10 UA 104611 C2 Схема 6 5 10 2 Альтернативно піперидинові похідні Формули II, де R являє собою алкіл, можуть бути одержані з алкіліруваного нітро-піперидону XXIII шляхом двох послідовних відновлень, спочатку з використанням такого агента, як нікель Ренея, і потім з використанням такого агента, як алюмогідрид літію. Сполука XXIII може бути отримана в результаті взаємодії нітро-піперидину XII з основою, такою як діізопропіламін літію, і наступної обробки електрофільним алкілуючим 2 агентом, таким як R X, де X являє собою атом галогену. Схема 7 15 20 Альтернативно піперидинові похідні Формули II, які містить дві гемінальних алкільних групи 2 R , можуть бути одержані із біс-алкілованого нітро-піперидону XXV шляхом двох послідовних відновлень, спочатку з використанням такого агента, як нікель Ренея, і потім з використанням такого агента, як алюмогідрид літію. Сполука XXV може бути отримана в результаті взаємодії моно-алкілованого нітро-піперидину XXIII з основою, такою як діізопропіламін літію, за наявності TMEDA (тетраметилетилендіаміну) і наступної обробки електрофільним алкілуючим агентом, 2 таким як R X, де X являє собою атом галогену. 11 UA 104611 C2 Схема 8 2 5 10 15 20 6 Альтернативно піперидинові похідні Формули II, де R являє собою гідроксил (R = H) або 6 алкокси-групу (R = Алкіл), можуть бути одержані з гідрокси нітро-піперидону XXVII або алкокси нітро-піперидону XXVIII шляхом двох послідовних відновлень, спочатку з використанням такого агента, як нікель Ренея, і потім з використанням такого агента, як алюмогідрид літію. Сполука XXVIII може бути отримана із сполуки XXVII в результаті взаємодії з основою, такою як гідрид 6 натрію, і електрофільним алкілуючим агентом, таким як R X, де X являє собою атом галогену. Сполука XXVII може бути отримана в результаті взаємодії нітро-піперидину XII з основою, такою як діізопропіламін літію, і наступної обробки електрофільним гідроксиліруючим агентом, таким як (оксодиперокси(піридин) (1,3-диметил-3,4,5,6-тетрагідро-2(1H)-піримідон)молібден(IV)) або біс(триметилсиліл)пероксид. Схема 9 Альтернативно піперидинові похідні Формули II, де R являє собою гетероарильну групу, таку як піридин, можуть бути одержані із нітро-піперидинтіону XXX шляхом двох послідовних відновлень, спочатку з використанням такого агента, як боргідрид натрію, і потім з використанням такого агента, як нікель Ренея. Сполука XXX може бути отримана із нітропіперидинону XXII в результаті взаємодії з реагентом Лавессона. 12 UA 104611 C2 Схема 10 5 Альтернативно піперидинові похідні Формули II, які містить дві гемінальні метильні групи, можуть бути одержані із Boc-захищеного аміно-піперидинону XXXII в результаті взаємодії з бромідом метилмагнію і хлоридом цирконію (IV) і наступного видалення Boc-групи в кислих умовах. Сполука XXXII може бути отримана в результаті взаємодії аміно-піперидону XIII з дитрет-бутил дикарбонатом. 10 Схема 11 15 Альтернативно піперидинові похідні Формули II, які містять циклопропіл, можуть бути одержані із Boc-захищеного аміно-піперидинону XXXII в результаті взаємодії з бромідом етилмагнію та ізопропоксидом титану і наступного видалення Boc-групи в кислих умовах. 13 UA 104611 C2 Схема 12 5 10 15 20 25 2 Альтернативно піперидинові похідні Формули II, де R являє собою алкільну групу, можуть бути одержані із нітро-похідного XXXIX з використанням внутрішньомолекулярної реакції Манніха, виконуваній за наявності альдегіду, такого як формальдегід, і наступної обробки отриманого нітро-піперидину XXXX відновлюючим агентом, таким як нікель Ренея. Сполука XXXIX може бути отримана шляхом деблокування Boc-захищеного нітро-похідного XXXVIII, яке може бути отримане в результаті взаємодії нітро-похідного XXXXI з галогенованою сполукою XXXVII за наявності основи, такої як н-бутиллітій. Сполука XXXVII може бути отримана в результаті введення захисної групи в аміноспирт XXXV і наступного галогенування. Рацемічні суміші хіральних сполук I можуть бути розділені з використанням хіральної РХВД. Солі приєднання кислот основних сполук Формули I можуть бути перетворені в відповідні вільні основи шляхом обробки щонайменше стехіометричним еквівалентом підходящої основи, такої як гідроксид натрію або калію, карбонат калі., бікарбонат натрію, аміак і тому подібне. Експериментальна частина Абревіатури HATU O-(7-азабензотріазол-1-іл)-1,1,3,3-тетраметилуронію гексафторфосфат ДМФА Диметилформамід ДМСО Диметилсульфоксид ТГФ Тетрагідрофуран TMEDA Тетраметилетилендіамін Одержання проміжних сполук Приклад A.1 Одержання рац-1-Метил-3-феніл-піперидин-3-іламіну H2N N 30 a) Стадія 1: рац-3-Гідрокси-3-феніл-піперидин-1-карбонової кислоти бензиловий ефір 14 UA 104611 C2 HO N O O 5 10 До розчину 9 мл (9 ммоль) броміду фенілмагнію (1 М розчин в ТГФ) в ТГФ (13 мл) додавали протягом 15 хв розчин 1,5 г (6,00 ммоль) 3-оксо-піперидин-1-карбонової кислоти бензилового ефіру (є у продажі) в ТГФ (5 мл) при кімнатній температурі. Дану суміш перемішували протягом 30 хв і потім гасили 20% розчином хлориду амонію (4 мл), використовуючи охолодження в крижаній бані. Органічний шар декантували, і залишок один раз екстрагували етилацетатом. Об'єднані органічні шари сушили над сульфатом натрію, фільтрували і концентрували під вакуумом. Отриману неочищену олію очищали на силікагелі (елюент: гептан/етилацетат 0-50%) з виходом вказаної в заголовку сполуки (0,55 г, 30%) у вигляді білої твердої речовини. Мас+ спектр (m/z): 312,0 (M+H ). b) Стадія 2: рац-3-Азидо-3-феніл-піперидин-1-карбонової кислоти бензиловий ефір N + N N N O O 15 20 25 30 35 1,0 г (3,212 ммоль) 3-гідрокси-3-феніл-піперидин-1-карбонової кислоти бензилового ефіру розчиняли в холодній суміші (10°C) трифтороцтової кислоти (12,3 мл) і води (2,0 мл). Даний розчин охолоджували до 0°C? і додавали порціями азид натрію (1,46 г, 22,48 ммоль). Температура піднімалася до 10°C. Крижану баню видаляли, і суміш перемішували протягом 3 г при кімнатній температурі. Потім суміш охолоджували в крижаній бані і підлужували, додаючи по краплям 25% розчин гідроксиду амонію (13,0 мл), підтримуючи температуру нижче 20°C. Суміш розбавляли водою (45 мл) і 3 раза екстрагували дихлорметаном. Об’єднані екстракти один раз промивали сольовим розчином, сушили над сульфатом натрію, фільтрували і концентрували під вакуумом з одержанням вказаної в заголовку сполуки у вигляді світло-жовтої олії, яку використовували на наступній стадії без додаткової очистки. c) Стадія 3: рац-1-Метил-3-феніл-піперидин-3-іламін До суспензії 126 мг (3,15 ммоль) LiAlH4 в ТГФ (2,7 мл) при температурі нижче 10°C додавали по краплям розчин 530 мг (1,576 ммоль) рац-3-азидо-3-феніл-піперидин-1-карбонової кислоти бензилового ефіру в ТГФ (5,3 мл). Крижану баню видаляли. Температура піднімалася до 35°C. Потім суміш нагрівали протягом 1 г при 65°C в масляній бані. Потім суміш охолоджували до 0°C. Додавали по краплям воду (125 мкл), 5 н. NaOH (125 мкл) і знову воду (0,375 мл), підтримуючи температуру нижче 10°C. Суміш розбавляли етилацетатом. Додавали сульфат натрію. Дану суміш фільтрували, і фільтрат концентрували під вакуумом. Отриману неочищену олію очищали на силікагелі (елюент: гептан/етилацетат 0-100%) з виходом вказаної в заголовку сполуки (0,14 + г, 47%) у вигляді жовтої олії. Мас-спектр (m/z): 191,5 (M+H ). Приклад A.2 Одержання рац-3-(4-Фтор-феніл)-1-метил-піперидин-3-іламину F H2N N 15 UA 104611 C2 5 Вказану в заголовку сполуку одержували з 3-оксо-піперидин-1-карбонової кислоти бензилового ефіру (є у продажі) і броміду 4-фтор-фенілмагнію з використанням методики, аналогичній методиці синтезу, описаної в Прикладі A.1 (стадії 1-3). Мас-спектр (m/z): 209,2 + (M+H ). Приклад A.3 Одержання рац-3-(4-Хлор-феніл)-1-метил-піперидин-3-іламіну Cl H2N N 10 15 Вказану в заголовку сполуку одержували з 3-оксо-піперидин-1-карбонової кислоти бензилового ефіру (є в продажі) і броміду 4-хлор-фенілмагнію з використанням методики, аналогічній методиці синтезу, описаної в Прикладі A.1 (стадії 1-3). Мас-спектр (m/z): 225,3 + (M+H ). Приклад A.4 Одержання рац-1-Метил-3-пара-толіл-піперидин-3-іламіну H2N N 20 25 Вказану в заголовку сполуку одержували з 3-оксо-піперидин-1-карбонової кислоти бензилового ефіру (є в продаже) і броміду 4-метил-фенілмагнію з використанням методики, аналогічній методиці синтезу, описаної в Прикладі A.1 (стадії 1-3). Мас-спектр (m/z): 205,3 + (M+H ). Приклад A.5 Одержання рац-1,2-Диметил-3-феніл-піперидин-3-іламіну H2N N a) Стадія 1: 3-Гідрокси-2-метил-піперидин-1-карбонової кислоти бензиловий ефір 30 O O N OH До розчину 1,4 г (9,232 ммоль) 2-метил-піперидин-3-ола (CAS: 4766-56-7) в 9,8 мл дихлорметану в атмосфері аргону при кімнатній температурі додавали 2,57 мл (18,46 ммоль) 16 UA 104611 C2 5 триетиламіну. Дану суміш перемішували протягом 15 хв і потім охолоджували до 0°C. Додавали по краплям 1,37 мл (9,232 ммоль) хлормурашиної кислоти бензиловий ефір. Дану реакційну суміш залишали нагріватися до кімнатної температури, і перемішування продовжували протягом ночі. Потім суміш три рази екстрагували водою, і об’єднані екстракти сушили над сульфатом натрію, фільтрували і концентрували під вакуумом. Отриманий неочищений продукт очищали шляхом колоночної флеш-хроматографії на силікагелі (елюент: гептан/етилацетат 030) з виходом вказаної в заголовку сполуки (800 мг, 34,8%) у вигляді безбарвної олії. Мас-спектр + (m/z): 272,4 (M+Na ). b) Стадія 2: рац-2-Метил-3-оксо-піперидин-1-карбонової кислоти бензиловий ефір 10 O O 15 20 25 30 O N До розчину, що перемішується 309,5 мкл (3,530 ммоль) оксалілхлориду в 3 мл дихлорметану при температурі від -50°C до -60°C додавали розчин 873 мкл ДМСО в 2 мл дихлорметану. Дану реакційну суміш перемішували протягом 10 хв, потім протягом 10 хв додавали розчин 800 мг (3,209 ммоль) 3-гідрокси-2-метил-піперидин-1-карбонової кислоти бензилового ефіру в 3 мл дихлорметану. Перемішування продовжували додатково протягом 30 хв. Потім до суміші додавали 2,24 мл (16,05 ммоль) триетиламіну. Дану реакційну суміш перемішували протягом 15 хв, потім залишали нагріватися до кімнатної температури, суспендували у воді, шари розділяли, і водний шар екстрагували дихлорметаном. Об’єднані органічні шари двічі промивали водою, сушили над сульфатом натрію, фільтрували і концентрували під вакуумом. Отриманий неочищений продукт очищали шляхом колонкової флеш-хроматографії на силікагелі (елюент: гептан/етилацетат 0-40) з виходом вказаної в + заголовку сполуки (600 мг, 76%) у вигляді світло-жовтої олії. Мас-спектр (m/z): 270,2 (M+Na ). c) Стадія 3: рац-1,2-Диметил-3-феніл-піперидин-3-іламін Вказану в заголовку сполуку одержували з рац-2-метил-3-оксо-піперидин-1-карбонової кислоти бензилового ефіру і броміду фенілмагнію з використанням методики, аналогічній + методиці синтезу, описаної в Прикладі A.1 (стадії 1-3). Мас-спектр (m/z): 205,2 (M+H ). Приклад A.6 Одержання рац-3-(3-Хлор-феніл)-1-метил-піперидин-3-іламіну Cl N NH2 a) Стадія 1: рац-4-(3-Хлор-феніл)-4-нітро-масляної кислоти метиловий ефір 35 Cl O + N O 40 O O До розчину 1 г (5,828 ммоль) 1-хлор-3-нітрометил-бензолу (CAS: 38362-91-3) при 0°C в 2 мл діоксану додавали 0,512 г (5,828 ммоль) метилакрилата і потім 3,3 г Amberlyst A-21. Дану реакційну суміш перемішували протягом ночі при кімнатній температурі, фільтрували, і фільтрат сушили над сульфатом натрію і концентрували під вакуумом. Отриманий неочищений продукт очищали шляхом колонкової флеш-хроматографії на силікагелі (елюент: гептан/етилацетат 010%) з одержанням вказаної в заголовку сполуки (980 мг, 65%) у вигляді безбарвної олії. b) Стадія 2: рац-5-(3-Хлор-феніл)-1-метил-5-нітро-піперидин-2-он 17 UA 104611 C2 Cl N + N O 5 10 15 O O До розчину, який перемішується при кімнатній температурі 164 мкл (1,940 ммоль) метиламіну (41% розчин у воді) в 1 мл діоксану додавали по краплям 141 мкл (1,940 ммоль) формальдегіду (37% розчин у воді) (екзотермічна реакція). Дану суміш перемішували протягом 5 хв, і потім додавали за один прийом розчин 0,5 г (1,940 ммоль) рац-4-(3-хлор-феніл)-4-нітромасляної кислоти метилового ефіру в 1,5 мл діоксану Дану суміш перемішували протягом 6 г при 65°C. Потім суміш охолоджували до кімнатної температури, додавали етилацетат і насичений розчин NaCl. Водну фазу екстрагували 2 рази етилацетатом. Об’єднані органічні фази промивали насиченим розчином NaCl, сушили над сульфатом натрію і концентрували під вакуумом. Одержаний неочищений продукт очищали шляхом колонкової флеш-хроматографії на силікагелі (елюент: гептан/етилацетат 0-100%) з виходом вказаної в заголовку сполуки (395 + мг, 76%) у вигляді безбарвної олії. Мас-спектр (m/z): 269,2 (MH ). c) Стадія 3: рац-5-Аміно-5-(3-хлор-феніл)-1-метил-піперидин-2-он Cl N NH2 O 20 25 30 35 До розчину 115 мг (0,428 ммоль) 5-(3-хлор-феніл)-1-метил-5-нітро-піперидин-2-она в 0,5 мл діоксану додавали 2 мл 3 н. HCl і 280 мг (4,28 ммоль) цинкового пилу. Дану суміш перемішували протягом 30 хв при кімнатній температурі. Потім суміш фільтрували, і одержаний фільтрат підлужували 5 н. розчином NaOH. Додавали етилацетат. Суміш фільтрували через подушку дикаліту. Органічний шар відокремлювали, і водний шар двічі екстрагували етилацетатом. Об’єднані екстракти сушили над сульфатом натрію, фільтрували і концентрували під вакуумом з одержанням вказаної в заголовку сполуки (88 мг, 86%) у вигляді світло-жовтої олії. Мас-спектр + (m/z): 239,0 (MH ). d) Стадія 4: рац-3-(3-Хлор-феніл)-1-метил-піперидин-3-іламін До суспензії 20 мг (0,494 ммоль) LiAlH4 в 0,5 мл ТГФ додавали по краплям розчин 59 мг (0,247 ммоль) рац-5-аміно-5-(3-хлор-феніл)-1-метил-піперидин-2-она в 0,6 мл ТГФ при кімнатній температурі. Дану суміш піддавали дефлегмації протягом 30 хв. Потім суміш охолоджували в крижаній бані і обережно гасили шляхом додавання 20 мкл води, 20 мкл 5 н. NaOH і потім 60 мкл води. Додавали етилацетат. Суміш фільтрували, і фільтрат концентрували під вакуумом з одержанням вказаної в заголовку сполуки (48 мг, 86%) у вигляді безбарвної олії. Мас-спектр + (m/z): 225,2 (MH ). Приклад A.7 Одержання рац-3-(4-Метокси-феніл)-1-метил-піперидин-3-іламіну O N 40 NH2 a) Стадія 1: рац-4-(4-Метокси-феніл)-4-нітро-масляної кислоти метиловий ефір 18 UA 104611 C2 O O + N O 5 10 15 20 O O У відповідності з методикою, описаною Buchwald et al. (J. Org. Chem. 2002, 106), в реакційну колбу додавали послідовно 187 мг (0,198 ммоль) Pd2dba3, 247 мг (0,791 ммоль) 2-(ди-третбутилфосфіно)-2`-метилбіфеніла і 1,555 г (4,747 ммоль) карбонату цезію. Дану суміш поміщали в атмосферу аргону, і додавали послідовно 740 мг (3,956 ммоль) 4-броманізолу, 15 мл ДМЕ (диметилетану) і потім 600 мг (3,956 ммоль) метил 4-нітробутирату. Дану суміш інтенсивно перемішували протягом 1 хв при кімнатній температурі, потім колбу поміщали в попередньо нагріту до 50°C масляну баню і перемішували при цій же температурі протягом ночі. Реакційну суміш охолоджували до кімнатної температури, і додавали насичений розчин NH4Cl і етилацетат. Водну фазу екстрагували 3 раза етилацетатом, і об’єднані органічні фази промивали сольовим розчином і концентрували під вакуумом. Одержаний неочищений продукт очищали шляхом колонкової флеш-хроматографії на силікагелі (елюент: гептан/етилацетат 020%) з виходом вказаної в заголовку сполуки (897 мг, 90%) у вигляді помаранчевої олії. b) Стадія 2: рац-3-(4-Метокси-феніл)-1-метил-піперидин-3-іламін Вказану в заголовку сполуку одержували з рац-4-(4-метокси-феніл)-4-нітро-масляної кислоти метилового ефіру з використанням методики, аналогічній методиці синтезу, описаної в + Прикладу A.6 (стадії: 2-4). Мас-спектр (m/z): 221,2 (MH ). Приклад A.8 Одержання рац-5-Фтор-1'-метил-1',4',5',6'-тетрагідро-2H-[2,3']бупуридинул-3'-іламіну F N N 25 NH2 Вказану в заголовку сполуку одержували з метил 4-нітробутирату і 2-бром-5-фторпіридину з використанням методики, аналогічній методиці синтезу, описаної в Прикладі A.7 (стадії: 1-2). + Мас-спектр (m/z): 210,2 (MH ). Приклад A.9 Одержання рац-5-Фтор-1-метил-3-феніл-піперидин-3-іламіну 30 N NH2 F a) Стадія 1: рац-1-Метил-5-нітро-5-феніл-піперидин-2-он 19 UA 104611 C2 N + N O O 5 O Вказану в заголовку сполуку одержували з нітрометил-бензолу (CAS: 622-42-4) з використанням методики, аналогічній методиці синтезу, описаної в Прикладі A.6 (стадії 1-2). + Мас-спектр (m/z): 235,2 (MH ). b) Стадія 2: рац-3-Фтор-1-метил-5-нітро-5-феніл-піперидин-2-он N + N O O O F 10 15 20 До розчину 78,4 мкл (0,555 ммоль) діізопропіламіну в 2 мл ТГФ додавали 347 мкл (0,555 ммоль) 1,6 М розчину н-BuLi в гексані при температурі -5°C. Даний розчин перемішували протягом 15 хв при 0°C і потім охолоджували до -70°C. Додавали по краплям розчин 100 мг (0,427 ммоль) рац-1-метил-5-нітро-5-феніл-піперидин-2-она в 1 мл ТГФ. Одержаний коричневий розчин перемішували при -70°C протягом 45 хв. Додавали по краплям розчин 180 мг (0,555 ммоль) N-фторбензолсульфоніміду в 1 мл ТГФ. Дану суміш перемішували протягом 1,5 г при -70°C, гасили шляхом додавання 2 мл 20% розчину NH 4Cl і залишали нагріватися до кімнатної температури. Додавали воду і етилацетат. Водний шар двічі екстрагували етилацетатом. Об’єднані органічні шари сушили над сульфатом натрію, фільтрували і концентрували під вакуумом. Отриману неочищену олію очищали на силікагелі (елюент: гептан/етилацетат 0100%) з виходом вказаної в заголовку сполуки (58 мг, 54%) у вигляді світло-жовтої твердої речовини. Мас-спектр (m/z): 253,2 (M+H). c) Стадія 3: рац-5-Аміно-3-фтор-1-метил-5-феніл-піперидин-2-он N NH2 O F 25 30 35 До розчину 55 мг (0,218 ммоль) рац-3-фтор-1-метил-5-нітро-5-феніл-піперидин-2-она в 1,5 мл ТГФ при 0°C додавали 100 мкл нікеля Ренея (50% у воді). Дану суміш перемішували в атмосфері водню протягом 2 г при 0°C. Потім суміш фільтрували, і катализатор промивали, використовуючи ТГФ. Фільтрат концентрували під вакуумом з одержанням вказаної в заголовку сполуки (48 мг, 99%) у вигляді світло-жовтої твердої речовини. Мас-спектр (m/z): 223,3 (M+H). d) Стадія 4: рац-5-Фтор-1-метил-3-феніл-піперидин-3-іламін Вказану в заголовку сполуку одержували з рац-5-аміно-3-фтор-1-метил-5-феніл-піперидин2-она з використанням методики, аналогічній методиці синтезу, описаної в Прикладі A.6 (стадія 4). Мас-спектр (m/z): 192,3 (M-NH2). Приклад A.10 Одержання рац-5-Метоксиметокси-1-метил-3-феніл-піперидин-3-іламіну 20 UA 104611 C2 N NH2 O O a) Стадія 1: рац-3-Гідрокси-1-метил-5-нітро-5-феніл-піперидин-2-он N + N O O OH 5 10 15 20 O До розчину 118 мкл (0,833 ммоль) діізопропіламіну в 3 мл ТГФ додавали 520 мкл (0,833 ммоль) 1,6 М розчину н-BuLi в гексані при температурі -5°C. Даний розчин перемішували протягом 15 хв при 0°C і потім охолоджували до -70°C. Додавали по краплям розчин 150 мг (0,641 ммоль) рац-1-метил-5-нітро-5-феніл-піперидин-2-она (Приклад A.9, стадія 1) в 1,5 мл ТГФ. Одержаний коричневий розчин перемішували протягом 45 хв при -70°C. При -70°C додавали порціями 517 мг (1,282 ммоль) (оксодиперокси(піридин)(1,3-диметил-3,4,5,6тетрагідро-2(1H)-піримідон)молібдену (IV)). Дану суміш перемішували протягом 1 г при -70°C і потім залишали нагріватися до 0°C. Суміш витримували протягом 1 г при 0°C і потім гасили шляхом додавання 2,5 мл насиченого розчину сульфіта натрію. Додавали воду і етилацетат. Водний шар один раз екстрагували етилацетатом. Об’єднані органічні шари сушили над сульфатом натрію, фільтрували і концентрували під вакуумом. Отриману неочищену олію очищали на силікагелі (елюент: гептан/етилацетат 0-100%) з виходом вказаної в заголовку + сполуки (82 мг, 51%) у вигляді світло-коричневої олії. Мас-спектр (m/z): 251,1 (MH ). b) Стадія 2: рац-3-Метоксиметокси-1-метил-5-нітро-5-феніл-піперидин-2-он N + N O O O O O 25 30 До розчину 50 мг (0,2 ммоль) рац-3-гідрокси-1-метил-5-нітро-5-феніл-піперидин-2-она і 52 мкл (0,3 ммоль) N-етил діізопропіламіну в 1,2-диметоксиетані додавали 23 мкл (0,3 ммоль) хлорметилметилового ефіру при кімнатній температурі. Через 1 г розчин нагрівали в масляній бані при 60°C протягом 20 г. Потім суміш охолоджували до кімнатної температури. Додавали 52 мкл (0,3 ммоль) N-етил діізопропіламіну і 23 мкл (0,3 ммоль) хлорметилметилового ефіру. Дану суміш нагрівали в масляній бані при 60°C протягом 4 г. Розчинник видаляли під вакуумом. Залишок переносили в етилацетат. Дану суміш один раз промивали водою. Водний шар один раз екстрагували етилацетатом. Об’єднані екстракти сушили над сульфатом натрію, фільтрували і концентрували під вакуумом. Отриману неочищену олію очищали на силікагелі (елюент: гептан/етилацетат 0-100%) з виходом вказаної в заголовку сполуки (30 мг, 51%) у + вигляді жовтої олії. Мас-спектр (m/z): 295,2 (MH ). c) Стадія 3: рац-5-Аміно-3-метоксиметокси-1-метил-5-феніл-піперидин-2-он 35 21 UA 104611 C2 N NH2 O O O 5 10 Вказану в заголовку сполуку одержували з рац-3-метоксиметокси-1-метил-5-нітро-5-фенілпіперидин-2-она з використанням методики, аналогічній методиці синтезу, описаної в Прикладі + A.9 (стадія 3). Мас-спектр (m/z): 265,1 (MH ). d) Стадія 4: рац-5-Метоксиметокси-1-метил-3-феніл-піперидин-3-іламін Вказану в заголовку сполуку одержували з рац-5-аміно-3-метоксиметокси-1-метил-5-фенілпіперидин-2-она з використанням методики, аналогічній методиці синтезу, описаної в Прикладі + A.6 (стадія 4). Мас-спектр (m/z): 251,2 (MH ). Приклад A.11 Одержання рац-3-Циклогексил-1-метил-піперидин-3-іламіну N 15 NH2 a) Стадія 1: рац-4-Циклогексил-4-нітро-масляної кислоти метиловий ефір O + N O O O 20 25 До розчину 3,18 г (22,2 ммоль) нітрометил-циклогексану (CAS: 2625-30-1) в 1 мл третбутанола і 0,12 мл 35% гідроксиду бензилтриметиламонію в метанолі, нагрітому до 40°C, додавали 1,99 мл (22,2 ммоль) метилакрилата. Отриману жовту суміш перемішували протягом 2 г при 40°C, потім розбавляли водою і екстрагували етилацетатом. Об’єднані екстракти промивали сольовим розчином, сушили над сульфатом натрію, фільтрували і упарювали. •+ Вказану в заголовку сполуку одержували у вигляді жовтуватої олії: Мас-спектр (EI): 198 (M •+ •+ MeO), 183 (M -NO2), 151 (M-(MeO+NO2+H)) (100%). b) Стадія 2: рац-5-Циклогексил-1-метил-5-нітро-піперидин-2-он O + N N O O 30 До 4,25 г (18,5 ммоль) рац-4-циклогексил-4-нітро-масляної кислоти метилового ефіру додавали 4,56 мл (32,5 ммоль) 1,3,5-триметилгексагідро-1,3,5-тріазину, і дану суміш нагрівали до 100°C протягом 4 г. Потім реакційну суміш охолоджували до температури навколишнього середовища і адсорбували на силікагелі, який наносили на колонку силікагеля. В результаті очистки шляхом флеш-хроматографії з використанням градієнта 10-75% етилацетата в гептані 22 UA 104611 C2 одержували 2,55 г вказаної в заголовку сполуки у вигляді безбарвної олії. Мас-спектр (m/z): 240 + (MH ). c) Стадія 3: рац-5-Аміно-5-циклогексил-1-метил-піперидин-2-он N 5 10 15 20 NH2 O До розчину 500 мг (2,08 ммоль) рац-5-циклогексил-1-метил-5-нітро-піперидин-2-она в 5 мл метанола додавали 500 мг вологого нікеля Ренея, і дану суміш перемішували в атмосфері водню при нормальному тиску і температурі навколишнього середовища протягом 22 г. Потім реакційну суміш фільтрували через подушку дикаліту, осад промивали метанолом, і фільтрат упарювали з одержанням 452 мг вказаної в заголовку сполуки у вигляді безбарвної олії, яку використовували без очистки на наступній стадії. d) Стадія 4: рац- 3-Циклогексил-1-метил-піперидин-3-іл-амін До 2,06 мл 2,5 М розчину алюмогідриду літію в тетрагідрофурані, охолодженого до 0°C, додавали по краплям розчин 452 мг (2,15 ммоль) рац-5-аміно-5-циклогексил-1-метил-піперидин2-она в 6 мл тетрагідрофурана. Потім даний розчин нагрівали до 65°C протягом 1 г. Отриману мутну реакційну суміш охолоджували за допомогою крижаної бані до температури нижче 12°C, і додавали по краплям 0,13 мл води, 0,32 мл 2 н. NaOH і потім 0,19 мл води. Дану суспензію розбавляли трет-бутилметиловим ефіром, сушили над сульфатом натрію, фільтрували і упарювали з одержанням 368 мг вказаної в заголовку сполуки у вигляді безбарвної олії, яку використовували без очистки на наступній стадії. Приклад A.12 Одержання рац-1-Метил-3-(тетрагідро-піран-4-ил)-піперидин-3-іламіну O N NH2 25 a) Стадія 1: 4-Нітрометил-тетрагідро-піран O O + N O 30 35 40 До охолодженої до 0°C суспензії, що перемішується 1,81 г (11,8 ммоль) нітрату срібла в 6 мл ацетонітрилу, поміщеної в реакційну колбу, загорнену в алюмінієву фольгу, по краплям протягом 5 хв додавали 1,60 г (8,93 ммоль) 4-бромметил-тетрагідро-пірану. Перемішування продовжували протягом 93 г при температурі навколишнього середовища. Потім реакційну суміш фільтрували і ретельно промивали діетиловим ефіром. Одержаний фільтрат змішували з силікагелем і упарювали. Залишок наносили на колонку силікагелю і очищали шляхом флешхроматографії на силікагелі (елюент: гептан/етилацетат 9:1) з одержанням вказаної в заголовку сполуки (441 мг) у вигляді безбарвної олії. b) Стадія 2: рац-1-Метил-3-(тетрагідро-піран-4-ил)-піперидин-3-іламін Вказану в заголовку сполуку одержували з 4-нітрометил-тетрагідро-пірану з використанням методики, аналогічній методиці синтезу, описаної в Прикладі A.11 (стадії 1-4). 23 UA 104611 C2 Приклад A.13 Одержання рац-1,3-Диметил-піперидин-3-іламіну дигідрохлориду NH2 N 2HCl 5 a) Стадія 1: рац-3-Ізоціанато-3-метил-піперидин-1-карбонової кислоти трет-бутиловий ефір O O 10 15 O N N До суспензії 727 мг (3,0 ммоль) рац-3-метил-піперидин-1,3-дикарбонової кислоти 1-третбутилового ефіру (CAS: 534602-47-6) в 8 мл толуола додавали при температурі навколишнього середовища 0,42 мл (3,0 ммоль) триетиламіну. до отриманого розчину додавали при перемішуванні 0,72 мл (3,3 ммоль) дифенілфосфорилазиду, і дану суміш нагрівали до 90°C (виділення газу) протягом 90 хв. Потім реакційну суміш виливали на суміш крига/вода і 3 рази екстрагували трет-бутилметиловим ефіром. Об’єднані екстракти промивали сольовим розчином, сушили над сульфатом натрію, фільтрували і упарювали. Вказану в заголовку сполуку одержували у вигляді жовтуватої олії, яку використовували на наступній стадії без очистки. Мас-спектр (m/z): 240 (M). b) Стадія 2: рац-3-Аміно-3-метил-піперидин-1-карбонової кислоти трет-бутиловий ефір 20 O O 25 30 35 40 N NH2 До розчину 812 мг (3,38 ммоль) рац-3-ізоціанато-3-метил-піперидин-1-карбонової кислоти трет-бутилового ефіру в 17 мл ТГФ додавали 16,9 мл 2 н. NaOH, і отриману емульсію інтенсивно перемішували протягом 20 г при температурі навколишнього середовища. Потім емульсію розбавляли трет-бутилметиловим ефіром і три рази екстрагували. Об’єднані екстракти промивали сольовим розчином до одержання нейтрального pH, сушили над сульфатом натрію, фільтрували і упарювали. Одержаний неочищений продукт очищали шляхом колонкової хроматографії на силікагелі з використанням градієнта 10-100% етилацетату в гептані, потім суміші етилацетат /MeOH з виходом 232 мг вказаної в заголовку сполуки у вигляді безбарвної олії, яка кристалізувалася при температурі навколишнього середовища. Мас-спектр (m/z): 215,2 (M+H). c) Стадія 3: рац-1,3-Диметил-піперидин-3-іламіну дигідрохлорид До 3,15 мл 1 М алюмогідриду літію в ТГФ додавали по краплям при 5-10°C розчин 225 мг (1,05 ммоль) рац-3-амуно-3-метил-піперидин-1-карбонової кислоти трет-бутилового ефіру в 4 мл сухого ТГФ. Дану реакційну суміш нагрівали до 65°C протягом 1 г. Отриману мутну реакційну суміш охолоджували за допомогою крижаної бані до температури нижче 12°C, додавали по краплям 0,13 мл води, 0,32 мл 2 н. NaOH і потім ще 0,19 мл води. Дану суспензію розбавляли трет-бутилметиловим ефіром, сушили над сульфатом натрію, фільтрували і підкисляли шляхом додавання 2 н. HCl в діетиловому ефірі. В результаті випарювання одержували 210 мг вказаної в заголовку сполуки у вигляді безбарвної напівтвердої речовини. Мас-спектр (m/z): 129,3 (M+H). Приклад A.14 Одержання рац-3-(2,4-Дифторфеніл)-1-метил-піперидин-3-іламіну 24 UA 104611 C2 F F N 5 NH2 Вказану в заголовку сполуку одержували з 2,4-дифтор-1-нітрометил-бензолу використанням методики, аналогічній методиці синтезу, описаної в Прикладі A.6 (стадії 1-4). Приклад A.15 Одержання рац-3-(2-Фтор-феніл)-1-метил-піперидин-3-іламіну з F N 10 NH2 Вказану в заголовку сполуку одержували з 1-фтор-2-нітрометил-бензолу з використанням методики, аналогічній методиці синтезу, описаної в Прикладі A.6 (стадії 1-4). Приклад A.16 Одержання рац-3-(2,5-Дифтор-феніл)-1-метил-піперидин-3-іламіну F F N NH2 15 20 Вказану в заголовку сполуку одержували з 1,4-дифтор-2-нітрометил-бензолу використанням методики, аналогічній методиці синтезу, описаної в Прикладі A.6 (стадії 1-4). Приклад A.17 Одержання рац-1-Метил-1,4,5,6-тетрагідро-2H-[3,4']біпіридиніл-3-іламіну з N N NH2 a) Стадія 1: рац-1-Метил-3-нітро-2,3,4,5-тетрагідро-1H-[3,4']біпіридиніл-6-он 25 N N NO2 O Вказану в заголовку сполуку одержували з 4-нітрометил-піридину (CAS: 22918-06-5) з використанням методики, аналогічній методиці синтезу, описаної в Прикладі A.6 (стадії 1-2). 25 UA 104611 C2 b) Стадія 2: рац-1-Метил-3-нітро-2,3,4,5-тетрагідро-1H-[3,4']біпіридиніл-6-тіон N N NO2 S 5 10 До розчину 125 мг (0,531 ммоль) рац-1-метил-3-нітро-2,3,4,5-тетрагідро-1H-[3,4']біпіридиніл6-она в 2,5 мл толуола додавали 240 мг (0,584 ммоль) реагенту Лавессона. Отриману суспензію нагрівали при 80°C в масляній бані протягом 30 хв. Потім суміш концентрували під вакуумом. Отриману неочищену олію очищали на силікагелі (елюент: гептан/етилацетат 0-100%) з виходом вказаної в заголовку сполуки (105 мг, 79%) у вигляді світло-жовтої твердої речовини. Мас-спектр (m/z): 252,1 (M+H). c) Стадія 3: рац-1-Метил-3-нітро-1,2,3,4,5,6-гексагідро-[3,4']біпіридиніл N N 15 20 25 30 NO2 До розчину 105 мг (0,418 ммоль) рац-1-метил-3-нітро-2,3,4,5-тетрагідро-1H-[3,4']біпіридиніл6-тіона в 2,1 мл метанолу додавали 144 мг (3,8 ммоль) NaBH4. Дану суміш перемішували протягом 20 хв при кімнатній температурі. Додавали воду (1,0 мл). Суміш перемішували протягом 1 г. Метанол видаляли під вакуумом. Залишок розбавляли водою і 3 рази екстрагували дихлорметаном. Об’єднані екстракти сушили над сульфатом натрію, фільтрували і концентрували під вакуумом. Отриману неочищену олію очищали на силікагелі (елюент: гептан/етилацетат 0-100%) з виходом вказаної в заголовку сполуки (53 мг, 57%) у вигляді жовтої олії. Мас-спектр (m/z): 222,3 (M+H). d) Стадія 4: рац-1-Метил-1,4,5,6-тетрагідро-2H-[3,4']біпіридиніл-3-іламін До охолодженого до 0°C розчину 52 мг (0,235 ммоль) рац-1-метил-3-нітро-1,2,3,4,5,6гексагідро-[3,4']біпіридиніла в 2,0 мл ТГФ додавали 150 мкл нікеля Ренея (50% у воді). Дану суміш перемішували при 0°C в атмосфері водню протягом 7 г. Каталізатор відфільтровували, і фільтрат концентрували під вакуумом з одержанням вказаної в заголовку сполуки (45 мг, 88%) у вигляді світло-жовтої олії. Мас-спектр (m/z): 192,4 (M+H). Приклад A.18 Одержання рац- 1-Метил-1,4,5,6-тетрагідро-2H-[3,3']біпіридиніл-3-іламіну N N NH2 a) Стадія 1: рац-1-Метил-3-нітро-2,3,4,5-тетрагідро-1H-[3,3']біпіридиніл-6-он 35 N N NO2 O 26 UA 104611 C2 5 Вказану в заголовку сполуку одержували з 3-нітрометил-піридину (CAS: 69966-29-6) з використанням методики, аналогічній методиці синтезу, описаної в Прикладі A.7 (стадії 1-2). b) Стадія 2: рац- 1-Метил-1,4,5,6-тетрагідро-2H-[3,3']біпіридиніл-3-іламін Вказану в заголовку сполуку одержували з рац-1-метил-3-нітро-2,3,4,5-тетрагідро-1H[3,3']біпіридиніл-6-она з використанням методики, аналогічній методиці синтезу, описаної в Прикладі A.17 (стадії 2-4). Приклад A.19 Одержання (3RS,5SR)-5-Метокси-1-метил-3-феніл-піперидин-3-іламіну 10 N NH2 O a) Стадія 1: (3SR,5RS)-3-Метокси-1-метил-5-нітро-5-феніл-піперидин-2-он N NO2 O O 15 20 25 Розчин 1,15 г (4,595 ммоль) рац-3-гідрокси-1-метил-5-нітро-5-феніл-піперидин-2-она (Приклад A.10, стадія 1) в 11,5 мл ДМФА охолоджували до 0°C. Додавали 220 мг (5,514 ммоль) NaH (60% в олії). Температура піднімалася до 3°C. Суміш перемішували протягом 15 хв при 0°C. Додавали 430 мкл (6,893 ммоль) йодметану, і дану суміш перемішували протягом 30 хв при 0°C. Додавали 6,5 мл води, і розчинник видаляли під вакуумом. Залишок переносили в етилацетат. Одержаний розчин двічі промивали водою. Водні шари, отримані після промивання, повторно екстрагували один раз етилацетатом. Об’єднані екстракти сушили над сульфатом натрію, фільтрували і концентрували під вакуумом. Отриману неочищену олію очищали на силікагелі (елюент: гептан/етилацетат 0-100%) з виходом вказаної в заголовку сполуки (500 мг, 42%) у вигляді світло-коричневої твердої речовини. Мас-спектр (m/z): 265,1 (M+H). b) Стадія 2: (3SR,5RS)-5-Аміно-3-метокси-1-метил-5-феніл-піперидин-2-он N NH2 O O 30 35 Вказану в заголовку сполуку одержували з (3SR,5RS)-3-метокси-1-метил-5-нітро-5-фенілпіперидин-2-она з використанням методики, аналогічній методиці синтезу, описаної в Прикладі A.17 (стадія 4). c) Стадія 3: (3RS,5SR)-5-Метокси-1-метил-3-феніл-піперидин-3-іламін Вказану в заголовку сполуку одержували з (3SR,5RS)-5-аміно-3-метокси-1-метил-5-фенілпіперидин-2-она з використанням методики, аналогічній методиці синтезу, описаної в Прикладі A.6 (стадія 4). 27 UA 104611 C2 Приклад A.20 Одержання (3RS,5SR)-1,5-Диметил-3-феніл-піперидин-3-іламіну N NH2 5 a) Стадія 1: (3SR,5RS)-1,3-Диметил-5-нітро-5-феніл-піперидин-2-он N NO2 O 10 15 20 До розчину 1,6 мл (11,1 ммоль) діізопропіламіну в 40 мл ТГФ додавали 7 мл (11,1 ммоль) 1,6 М розчину н-BuLi в гексані при -5°C. Даний розчин перемішували протягом 15 хв при 0°C і потім охолоджували до -70°C. Додавали по краплям розчин 2 г (8,538 ммоль) рац-1-метил-5-нітро-5феніл-піперидин-2-она (Приклад A9, стадія 1) в 20 мл ТГФ. Одержаний коричневий розчин перемішували протягом 45 хв при -70°C. Додавали по краплям при -70°C 639 мкл (10,25 ммоль) метилйодиду в ТГФ (8 мл). Дану суміш перемішували протягом 1 г при -70°C і потім залишали нагріватися до 0°C. Суміш витримували протягом 30 хв при 0°C і потім гасили шляхом додавання 30 мл 20% розчину NH4Cl. Додавали воду і етилацетат. Водний шар один раз екстрагували етилацетатом. Об’єднані органічні фази сушили над сульфатом натрію, фільтрували і концентрували під вакуумом. Одержаний неочищений продукт очищали на силікагелі (елюент: гептан/етилацетат 0-100%) з виходом вказаної в заголовку сполуки (1,72 г, 81%) у вигляді жовтої олії. Мас-спектр (m/z): 249,2 (M+H) b) Стадія 2: (3SR,5RS)-5-Аміно-1,3-диметил-5-феніл-піперидин-2-он N NH2 O 25 30 Вказану в заголовку сполуку одержували з (3SR,5RS)-1,3-диметил-5-нітро-5-фенілпіперидин-2-она з використанням методики, аналогічній методиці синтезу, описаної в Прикладі A.17, (стадія 4,). Мас-спектр (m/z): 202,2 (M-NH2) c) Стадія 3: (3RS,5SR)-1,5-Диметил-3-феніл-піперидин-3-іламін Вказану в заголовку сполуку одержували з (3SR,5RS)-5-аміно-1,3-диметил-5-фенілпіперидин-2-она з використанням методики, аналогічній методиці синтезу, описаної в Прикладі A.6, (стадія 4). Мас-спектр (m/z): 205,3 (M+H). Приклад A.21 Одержання рац-1,5,5-Триметил-3-феніл-піперидин-3-іламіну 35 28
ДивитисяДодаткова інформація
Назва патенту англійськоюAroylamino- and heteroaroylamino-substituted piperidines as glyt-1 inhibitors
Автори англійськоюPinard, Emmanuel, Stalder, Henri
Автори російськоюПинар Эммануель
МПК / Мітки
МПК: C07D 401/12, A61K 31/4535, C07D 401/04, C07D 417/10, A61K 31/4525, C07D 211/56, A61K 31/4545, C07D 405/04, A61K 31/445
Мітки: піперидини, інгібітори, гетероароїламінозаміщені, ароїламіно, glyt-1
Код посилання
<a href="https://ua.patents.su/80-104611-arolamino-ta-geteroarolaminozamishheni-piperidini-yak-ingibitori-glyt-1.html" target="_blank" rel="follow" title="База патентів України">Ароїламіно- та гетероароїламінозаміщені піперидини як інгібітори glyt-1</a>
Попередній патент: Спосіб зберігання продукту
Наступний патент: Спосіб дражирування насіння
Випадковий патент: Зубчато-важільно-кулачкова коробка передач