Низькомолекулярні органічні атф-конкурентні інгібітори серин/треонінової протеїнкінази ск2 на основі 4-аміно-тієно[2,3-d]піримідинового гетероциклу
Номер патенту: 86041
Опубліковано: 10.12.2013
Автори: Котей Ігор Михайлович, Кухаренко Олександр Петрович, Бджола Володимир Григорович, Баланда Анатолій Олексійович, Остринська Ольга Василівна, Ярмолюк Сергій Миколайович
Формула / Реферат
Низькомолекулярні органічні АТФ-конкурентні інгібітори серин/треонінової протеїнкінази СК2 на основі 4-аміно-тієно[2,3-d]піримідинового гетероциклу, отримані шляхом взаємодії 4-хлоро-тієно[2,3-d]піримідину із амінокислотами, загальної формули:
 ,
,
де R1 - водень; метил; R1=R2 - бутилен; R1=R2 - бутилен, заміщений -СН3; феніл; феніл, заміщений -СН3; феніл, заміщений -Сl; феніл, заміщений -F; феніл, заміщений діоксиметилом;
R2 - водень; метил; етил; карбоксил; етилкарбоксил; феніл; R1=R2 - бутилен; R1=R2 - бутилен, заміщений -СН3;
R3 - водень; метил;
R4 - оцтова кислота; пропанова кислота; бутанова кислота; феніл, заміщений 1-2 залишками карбоксилу; феніл, одночасно заміщений карбоксильною та гідроксильною групами; 2-заміщена 3-гідроксипропанова кислота; 2-моноамід бурштинової кислоти; 2-карбоксил-С4-алкіл; 3- або 4-карбоксил-С5-алкіл; С5-алкіл.
Текст
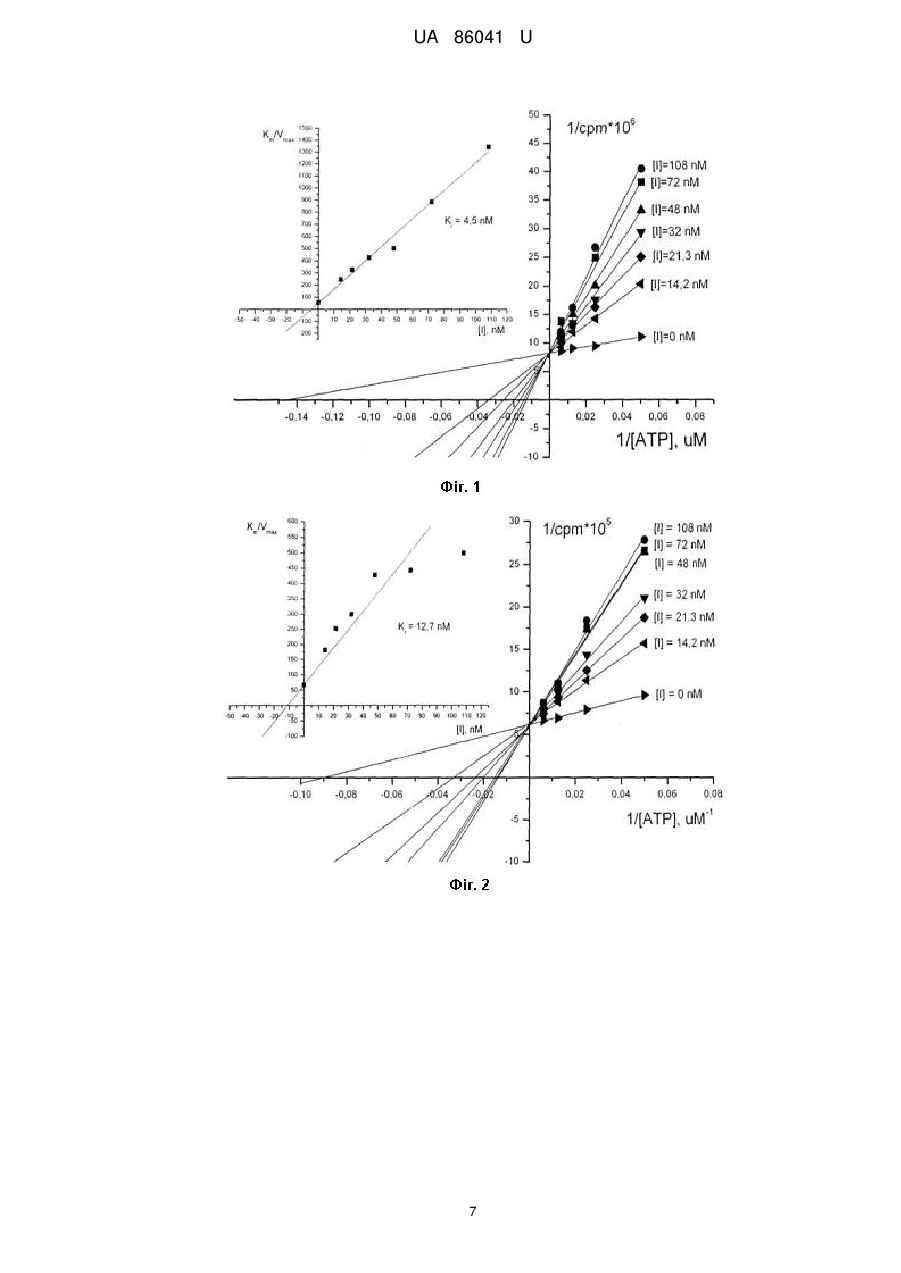
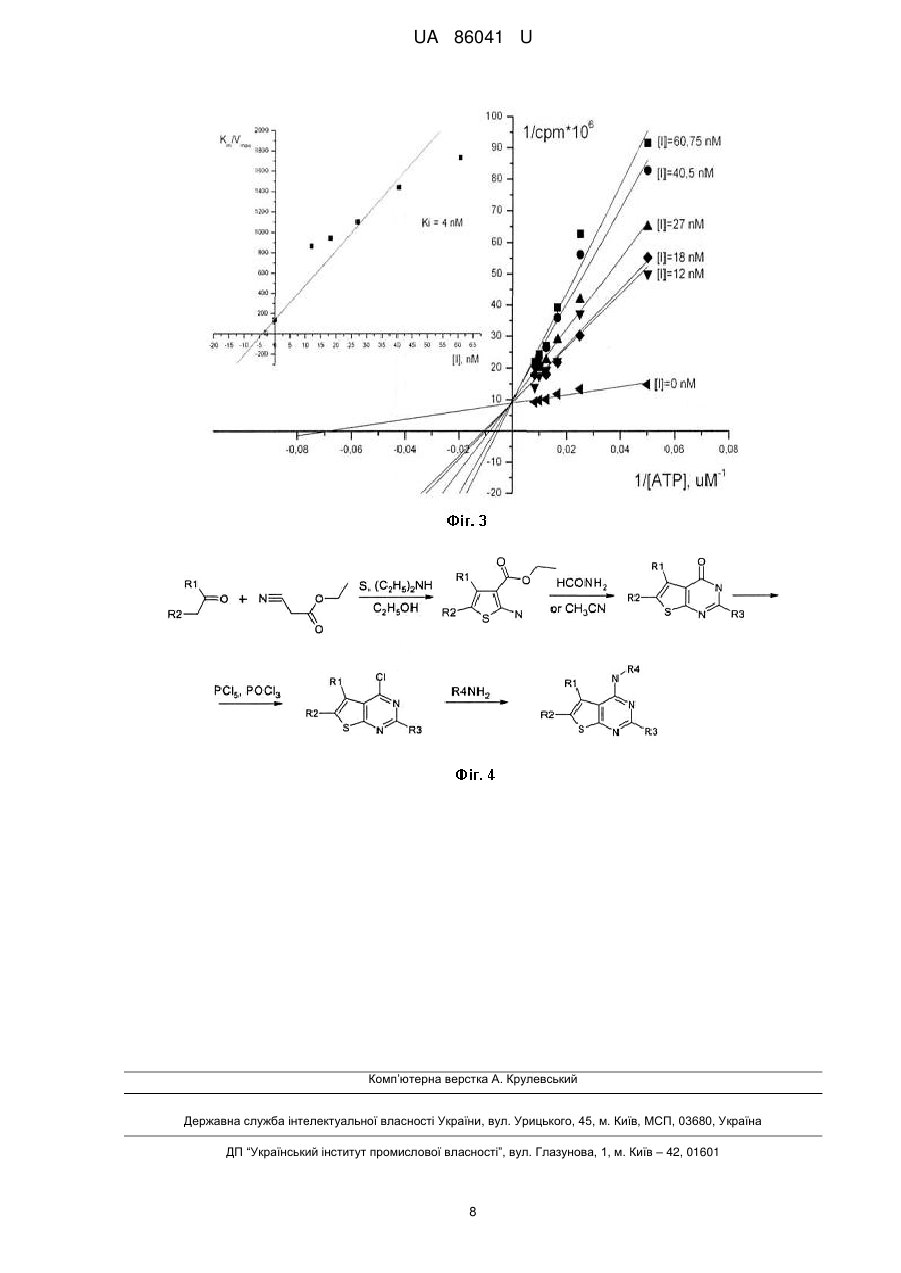
Реферат: Низькомолекулярні органічні АТФ-конкурентні інгібітори серин/треонінової протеїнкінази СК2 на основі 4-аміно-тієно[2,3-d]піримідинового гетероциклу, отримані шляхом взаємодії 4-хлоротієно[2,3-d]піримідину із амінокислотами, загальної формули: R1 N R4 N R2 S N R3 . UA 86041 U (12) UA 86041 U UA 86041 U 5 10 15 20 25 30 35 40 45 50 Пропонована корисна модель належить до інгібіторів протеїнкіназ, які призначені для використання в наукових цілях та фармацевтиці, у моно- або комбінованій терапії для лікування, профілактики або пригнічення захворювань і станів у ссавців та рослин, виникнення яких пов'язане із функціонуванням протеїнкінази СК2, а більш конкретно до низькомолекулярних органічних АТФ-конкурентних інгібіторів серин/треонінової протеїнкінази СК2 на основі 4-аміно-тієно[2,3-d]піримідинового гетероциклу. Відомі високоактивні інгібітори протеїнкінази СК2 серед похідних флавону. Серед них кверцетин (IC50=0,55 М), апігенін (IC50=0,80 М), фізетин (ІС50=0,35 М), лютеолін (Ki=0,50 М) та інші (Lolli G, Cozza G, Mazzorana M, Tibaldi E, Cesaro L, Donella-Deana A, Meggio F, Venerando A, Franchin C, Samo S, Battistutta R, Pinna LA. Inhibition of protein kinase CK2 by flavonoids and tyrphostins. A structural insight. Biochemistry, 2012, 51(31), 6097-6107.). Недоліком даних інгібіторів є їх здатність інгібувати широке коло інших протеїнкіназ та білків. Інші відомі високоактивні інгібітори протеїнкінази СК2 належать до класу антрахінонів (Meggio, F.; Pagano, M.A.; Моrо, S.; Zagotto, G.; Ruzzene, M.; Sarno, S.; Cozza, G.; Bain, J.; Elliott, M.; Donella-Deana, A.; Brunati, A.M.; Pinna, L.A. Inhibition of protein kinase CK2 by condensed polyphenolic derivatives. An in vitroand in vivostudy. Biochemistry, 2004, 43, 12931-12936). Першим дослідженим інгібітором з даного класу сполук є Емодин (Emodin) із константою інгібування Ki=1,25 М. З метою покращити активність Емодину було зроблено ряд модифікацій його скафолду та отримано інгібітори із субмікромолярними величинами ІС 50. Серед них MNA (Ki=0,78 М), MNX (Ki=0,80 M), Хіналізарин (Quinalizarin) (Ki=0,055 М) тощо. Зокрема MNA був успішно використаний для залучення СК2 в резистентність до ліків на СЕМ клітинах. Хіналізарин - 1,2,5,8-тетрагідрокси-антрахінон пригнічував ендогенну активність СК2 в НЕК293Т клітинах та індукував апоптоз в клітинах Юрката. Недоліком даних сполук є невисока селективність по відношенню до протеїнкінази СК2. Зокрема Емодин є доволі специфічним інгібітором деяких рецептор-тирозинових протеїнкіназ. Найбільш успішним низькомолекулярним високоактивним інгібітором протеїнкінази СК2 є 5(3-хлор-феніламіно)-бензо[с][2,6]нафтіридин-8-карбоксильна кислота (СХ-4945). Він має активність Кі=0,38 nМ та є селективним і АТФ-конкурентним інгібітором обох ізоформ каталітичної субодиниці СК2 (СК2 і СК2‘) з величиною ІС50 1 nМ. СХ-4945 пригнічує здатність до виживання та ангіогенний сигналінг в лініях ракових клітин, а також проявляє протипухлинну активність на мишачих ксенотрансплантантах. Протипухлинний механізм дії інгібітору пов'язаний з пригніченням внутрішньо і зовнішньо-клітинних СК2-залежних процесів, які необхідні для підтримування фенотипу ракових клітин. СХ-4945 є єдиним оральним біодоступним низькомолекулярним інгібітором протеїнкінази СК2, який перебуває на першій стадії клінічних випробувань і використовується для лікування прогресуючих солідних пухлин, захворювання Кастельмана та множинної мієломи. (СХ-4945, an Orally Bioavailable Selective Inhibitor of Protein Kinase CK2, Inhibits Prosurvival and Angiogenic Signaling and Exhibits Antitumor Efficacy). Недоліком даного інгібітору є недостатня вивченість його побічних ефектів на організм людини. Жоден з відомих інгібіторів протеїнкінази СК2 не вийшов на фармацевтичний ринок, окрім того, створені на їх основі препарати можуть мати негативну побічну дію. Тому, пошук нових низькомолекулярних селективних інгібіторів даного ензиму залишається актуальним. В основу корисної моделі поставлена задача винайти нові низькомолекулярні органічні АТФконкурентні інгібітори серин/треонінової протеїнкінази СК2 на основі 4-аміно-тієно[2,3d]піримідинового гетероциклу, які б були низькомолекулярними високоактивними органічними АТФ-конкурентними інгібіторами серин/треонінової протеїнкінази СК2 та мали б більшу активність та селективність по відношенню до протеїнкінази СК2. Поставлена задача вирішується пропонованими низькомолекулярними органічними АТФконкурентними інгібіторами серин/треонінової протеїнкінази СК2 на основі 4-аміно-тієно[2,3d]піримідинового гетероциклу, що отримані шляхом взаємодії 4-хлоро-тієно[2,3-d]піримідину з амінокислотами: R1 N R4 N R2 S 1 N R3 1 2 1 2 де R - водень, метил, R =R - бутилен, R =R - бутилен, заміщений -СН3, феніл, феніл, заміщений -СН3, феніл, заміщений -Сl, феніл, заміщений -F, феніл, заміщений диоксиметилом; 1 UA 86041 U 2 5 10 15 20 25 30 35 40 45 50 55 60 1 2 1 2 R - водень, метил, етил, карбоксил, етил-карбоксил, феніл, R =R - бутилен, R =R бутилен, заміщений -СН3; 3 R - водень, метил; 4 R - оцтова кислота; пропанова кислота; бутанова кислота; феніл, заміщений 1-2 залишками карбоксилу; феніл, одночасно заміщений карбоксильною та гідроксильною групами; 2-заміщена 3-гідроксипропанова кислота; 2-моноамід бурштинової кислоти; 2-карбоксил-С4-алкіл; 3- або 4карбоксил-С5-алкіл; С5-алкіл. Суть корисної моделі пояснюється за допомогою схематичних креслень, де: - на фіг. 1 показано графік Лайнуївера-Берка, який зображує пригнічення активності СК2 інгібітором NHTP23. Константа інгібування дорівнює 0,0045 nМ; - на фіг. 2 показано графік Лайнуївера-Берка, який зображує пригнічення активності СК2 інгібітором NHTP25. Константа інгібування дорівнює 0,03 nМ; - на фіг. 3 показано графік Лайнуївера-Берка, який зображує пригнічення активності СК2 інгібітором NHTP33. Константа інгібування дорівнює 0,005 nМ; - на фіг. 4 показано схему синтеза похідних тієно[2,3-d]піримідин-4-аміну. Запропоновані низькомолекулярні органічні АТФ-конкурентні інгібітори серин/треонінової протеїнкінази СК2 на основі 4-аміно-тієно[2,3-d]піримідинового гетероциклу одержували шляхом синтезу з відповідних карбонільних сполук. Спочатку отримували заміщені 2-аміно-3карбетокситіофени за реакцією Гевальда (у випадку ацетофенонів синтез проводили у дві стадії: спочатку конденсували ціаноцтовий ефір з відповідним ацетофенолом, а далі одержаний продукт циклізували з сіркою). Далі шляхом конденсації з формамідом чи ацетонітрилом було отримано тієнопіримідинони, взаємодією яких з п'ятихлористим фосфором було синтезовано низку 4-хлоро-тієно[2,3-d]піримідинів, що слугували синтонами для подальшого формування комбінаторних рядів. Кінцеві сполуки отримували заміщенням хлору на аміногрупу відповідної амінокислоти. Контроль за протіканням реакції і чистотою одержаних низькомолекулярних органічних АТФконкурентних інгібіторів серин/треонінової протеїнкінази СК2 проводили за допомогою методу ТШХ на пластинах "Kieselgel 60 F 254" (Merck). Структуру синтезованих речовин встановлювали 1 за допомогою спектрів Н-ЯМР, записаних у ДМСО-D6 на приладі "Varian MercuryVRX-400" з робочою частотою 400 МГц і внутрішнім стандартом - ТМС. Одержані результати свідчать про відповідність синтезованих низькомолекулярних органічних АТФ-конкурентних інгібіторів серин/треонінової протеїнкінази СК2 заявленим. Визначення інгібувальної активності низькомолекулярних органічних АТФ-конкурентних інгібіторів серин/треонінової протеїнкінази СК2 Здатність похідних аміно-тієно[2,3-d]піримідину пригнічувати активність протеїнкінази СК2 була досліджена in vitro методом із використанням радіоактивно міченого фосфору (Golub AG, Bdzhola VG, Briukhovetska NV, Balanda АО, Kukharenko OP, Kotey IM, Ostrynska OV, Yarmoluk SM. Synthesis and biological evaluation of substituted (thieno[2,3-d]pyrimidin-4-ylthio)carboxylic acids as inhibitors of human protein kinase CK2. Eur. J. Med. Chem. 46 (2011) 870-876). Для початку було проведено прескринінг низькомолекулярних органічних інгібіторів на холоензимі СК2 із використанням лише однієї концентрації інгібітору (33 мкМ). Кожен тест проводився у подвійному повторі. Об'єм реакційної суміші на одну пробу становив 20 мкл і включав: 3 мкл буфера для СК2 (20 мМ Tris-HCl, рН 7,5; 50 мМ КСl; 10 мМ MgCl2); 3 мкл (6 мкг) пептидного субстрату RRRDDDSDDD (New England Biolabs); 0,02 мкл (10 одиниць) рекомбінантної протеїнкінази СК2 (New England Biolabs); 14,5 мкл дистильованої води. Аліквоту реакційної суміші 19 мкл/пробу поміщали в епендорф об'ємом 1,5 ml. До кожної проби додавали 1 мкл розчину інгібітору попередньо розчиненого в DMSO у необхідній концентрації. Для ініціації 2+ реакції до кожного зразка додавали 10 мкл суміші Mg /ATP (150 мкМ АТР, 10 мМ MgCl2, 15 мМ 32 MOPS; рН 7,2) з додаванням АТР, міченого ізотопом фосфору Р, розведеного до активності 100 мкСі/мкМ. Кінцева концентрація АТР у реакційній суміші становила 50 мкМ. Час інкубації становив 25 хв. при 30 °C. Реакцію зупиняли додаючи 8 мкл 5 % розчину ортофосфорної кислоти, після чого реакційна суміш наносилась на 20 мм диск фосфоцелюлозного паперу (Whatman). Диски відмивались тричі з використанням 0,75 % розчину ортофосфорної кислоти та просушувались при кімнатній температурі. Рівень радіоактивного сигналу вимірювали по методиці Черенкова, використовуючи сцинтиляційний лічильник (Rack Beta, Pharmacia). Як негативний контроль, замість розчину інгібітору додавали DMSO в об'ємі, що дорівнював об'єму розчину інгібітору в DMSO (3,8 %). Ступінь інгібування СК2 визначали за співвідношенням 32 включення Р при додаванні інгібітору та за його відсутності. Для інгібіторів, які пригнічували активність СК2 більше ніж на 50 % проводили визначення ІС50 за різних концентрацій інгібіторів. Діапазон концентрації сполуки для встановлення ІС50 вибирали залежно від залишкової 2 UA 86041 U 5 активності ензиму. Інгібітор перевіряли при 10 концентраціях, отриманих шляхом двократного розведення. Визначали показники лічильника для кожної концентрації інгібітору та будували залежність в координатах десяткового логарифму концентрації інгібітору (lg[I]) та cps (counts per second). Для середнього значення cps знаходили обернений логарифм концентрації, який дорівнював ІС50. Хімічні структури замісників та активність низькомолекулярних органічних АТФ-конкурентних інгібіторів серин/треонінової протеїнкінази СК2 наведено в таблиці 1. Таблиця 1 Хімічні структури замісників 4-аміно-тієно[2,3-d]піримідину їх IC50 (М) N R1 N R2 S № NHTP1 NHTP2 NHTP3 NHTP4 NHTP5 NHTP6 NHTP7 NHTP8 NHTP9 NHTP10 NHTP11 NHTP12 NHTP13 NHTP14 NHTP15 NHTP16 NHTP17 NHTP18 NHTP19 NHTP20 NHTP21 NHTP22 NHTP23 NHTP24 NHTP25 NHTP26 NHTP27 NHTP28 NHTP29 NHTP30 NHTP31 NHTP32 NHTP33 NHTP34 NHTP35 NHTP36 NHTP37 NHTP38 NHTP39 NHTP40 R4 N R1 R2 -CH2-CH2-CH2-CH2-CH2-CH2-CH2-CH2СН3 СН3 -CH2-CH2-CH(CH3)-CH2-CH2-CH2-CH(CH3)-CH2СН3 СН3 4-СН3С6H46 Н Ph Н СН3 СОО-СН2-СН3 4-FC6H4 H 3,4-(СН3)С6Н3 H 3,4-(СН3)С6Н3 H Н СН3 Н Ph H Ph H СН2-СН3 4,5-(О-СН3)С6Н3 Н Н Ph -СН2-СН2-СН(СН3)-СН2СН3 СН3 Н Ph 4-СН3С6Н4 Н 4-СН3С6Н4 H Ph H Ph H 4-СlС6Н4 H Н Ph Н Ph СН3 COO-CH2-СН3 Ph СН3 Н СН3 4-СН3С6Н4 Н Ph СН3 Ph СН3 Н Ph Н Ph Н Ph H Ph СН3 СООН СН3 СООН R3 Н H H H H H H H H H H H H H H H H СН3 H H H H H H H H СН3 СН3 H H H H H H H СН3 СН3 СН3 СН3 Н 3 R3 R4 СН2СООН СН2-СН2СООН СН2СООН СН2СООН СН2-СН2СООН СН2-СН2СООН СН2-СН2СООН СН2-СН2СООН СН2СООН СН2-СН2СООН СН2СООН (СН2)2-СН2СООН СН2СООН СН-(СН2ОН)(СООН) СН-(CH2ONH2)(COOH) СН2СООН СН2-СН2СООН CH-(CH2NO)(COOH) C6H4COOH-р С6Н4СООН-m C6H4COOH-m С6Н4СООН-р C6H4COOH-m С6Н4СООН-р C6H4COOH-m С6Н4СООН-р С6Н4СООН-р С6Н4СООН-m С6Н4СООН-m С6Н4СООН-р 3,5-(СООН)С6Н3 C6H4COOH-m С6Н4СООН-m 3-СООН-4-ОН-С6Н3 -СН2-СН2-СН2-СН(СООН)-СН2-СН2-СН2-СН(СООН)-СН2-СН(СООН)-СН2-СН2-СН2-СН2-СН2-СН(СООН)-СН2-СН2-СН2-СН2-СН2-СН2- СН2С6Н4СООН-m ІС50, (М) >33 9,5 >33 >33 16 >33 >33 >33 >33 >33 >33 >33 >33 >33 >33 >33 >33 >33 >33 3,8 0,26 0,65 0,01 1,1 0,065 0,83 >33 1,5 6,5 1,5 >33 0,02 0,008 0,31 >33 >33 >33 >33 >33 >33 UA 86041 U 5 10 15 20 25 30 35 40 45 50 55 Вивчення кінетичних характеристик низькомолекулярних органічних АТФ-конкурентних інгібіторів серин/треонінової протеїнкінази СК2 Для трьох низькомолекулярних органічних АТФ-конкурентних інгібіторів серин/треонінової протеїнкінази СК2, що виявили найбільшу інгібувальну активність по відношенню до протеїнкінази СК2 визначали константу інгібування Ki. Спочатку за допомогою графічного методу подвійних обернених величин Лайнуївера-Берка знаходили максимальну швидкість 5 реакції (vmax) і константу Міхаеліса (КM). Графік залежності будувався в координатах 1/срm*10 (приймали за 1/v0) від 1/[АТР] (1/S). Точки перетину ліній із віссю абсцис відповідали 1/Кm, а на 4 осі ординат - vmax. Будували графік залежності величини Km/vmax*10 від концентрації інгібітора [І]. Екстраполюючи графік на вісь абсцис, визначали точку перетину з віссю, що чисельно дорівнювала Ki (Фіг. 1 а, б, в). Встановлено, що інгібітори NHTP23, NHTP25 та NHTP33 є АТФ-конкурентними інгібіторами протеїнкінази СК2. Константи інгібування дорівнюють 0,0045 nМ, 0,03 nМ та 0,005 nМ, відповідно. Визначення селективності низькомолекулярних органічних АТФ-конкурентних інгібіторів по відношенню до протеїнкінази СК2. Селективність низькомолекулярних органічних АТФ-конкурентних інгібіторів по відношенню до протеїнкінази СК2 було перевірено на чотирьох серин/треонінових (ASK1, JNK3, Aurora А та Rock 1) і трьох тирозинових протеїнкіназах (FGFR1, Met і Тіе2). Процедура встановлення величини ІС50 інгібіторів на інших протеїнкіназах проводилась аналогічно до методики визначення концентрації інгібування для протеїнкінази СК2 in vitro. Відмінним для усіх кіназ був склад суміші для проведення реакції та час інкубації проб. Склад суміші та час інкубації проб для визначення ефективності інгібіторів на протеїнкіназі ASK1. Об'єм реакційної суміші на одну пробу становив 20 мкл і включав: 6 мкл 5Х-кратного реакційного буферу (25 мМ MOPS; pH 7,2, 2,5 мМ EGTA, 2,5 мМ EDTA, 0,5 мМ DTT, 0,25 мг/мл BSA, 20 мМ -гліцерофосфат), 3 мкл розчину пептидного субстрату МВР (концентрація 5 мг/мл), 0,3 мкл розчину протеїнкінази (концентрація 0,1 мкг/мл), 10,3 мкл дистильованої води. Для 2+ ініціації реакції до кожного зразка додавали 10 мкл суміші Mg /ATP (150 мкМ АТР, 10 мМ MgCl2, 32 15 мМ MOPS; pH 7,2) з додаванням АТР, міченого ізотопом фосфору Р розведеного до активності 100 мкСі/мкМ. Час інкубації становив 25 хв. при 30 °C. Склад суміші та час інкубації проб для визначення ефективності інгібіторів на протеїнкіназі JNK3. Об'єм реакційної суміші на одну пробу становив 20 мкл і включав: 2,5 мкл 10Х-кратного реакційного буферу (500 мМ Tris-HCl; pH 7,5, 1 мМ EGTA, 1 % -меркаптоетанол), 2,5 мкл розчину пептидного субстрату (ATF2, амінокислотні залишки 19-96) (концентрація 5 мг/мл), 2,5 мкл розчину протеїнкінази (UpstateXMillipore) (концентрація 10-60 нг/мл), 7,5 мкл дистильованої 2+ води. Для ініціації реакції до кожного зразка додавали 10 мкл суміші Mg /ATP (50 мкМ АТР, 75 мМ MgCl2, 20 мМ MOPS; pH 7,2, 1 мМ DTT, 25 мМ -гліцерофосфат, 1 мМ Na3VO4) з 32 додаванням АТР, міченого ізотопом фосфору Р розведеного до активності 100 мкСі/мкМ. Час інкубації становив 10 хв. при 30 °C. Склад суміші та час інкубації проб для визначення ефективності інгібіторів на протеїнкіназі Aurora A. Об'єм реакційної суміші на одну пробу становив 20 мкл і включав: 6 мкл 5Х-кратного реакційного буферу (75 мМ MOPS; pH 7,1, 1,25 мМ EDTA, 0,5 мг/мл BSA, 0,05 % меркаптоетанол, 0,015 % Brij 35), 3 мкл розчину пептидного субстрату Kemptide (концентрація 1,4 мг/мл), 0,02 мкл розчину протеїнкінази (Upstate/Millipore) (концентрація 0,2 мкг/мл), 10 мкл 2+ дистильованої води. Для ініціації реакції до кожного зразка додавали 10 мкл суміші Mg /ATP (150 мкМ АТР, 50 мМ MgCl2, 10 мМ MOPS; pH 7,2, 3 мМ EGTA, 0,6 мМ DTT, 0,6 мМ Na3VO4) 15 32 мМ -гліцерофосфат) з додаванням АТР, міченого ізотопом фосфору Р, розведеного до активності 100 мкСі/мкМ. Час інкубації становив 20 хв. при 30 °C. Склад суміші та час інкубації проб для визначення ефективності інгібіторів на протеїнкіназі ROCK1. Об'єм реакційної суміші на одну пробу становив 20 мкл і включав: 5 мкл 5Х-кратного реакційного буферу (40 мМ MOPS; pH 7,0, 1 мМ EDTA), 2,5 мкл розчину пептидного субстрату Long S6 Kinase substrate (концентрація 1,96 мг/мл), 0,3 мкл розчину протеїнкінази (концентрація 1 мкг/мл), 12,2 мкл дистильованої води. Для ініціації реакції до кожного зразка додавали 10 мкл 2+ 32 суміші Mg /ATP (1:1) з додаванням АТР, міченого ізотопом фосфору Р розведеного до активності 100 мкСі/мкМ. Час інкубації становив 30 хв. при 30 °C. 4 UA 86041 U 5 10 15 20 25 30 Склад суміші та час інкубації проб для визначення ефективності інгібіторів на протеїнкіназі FGFR1. Об'єм реакційної суміші на одну пробу становив 20 мкл і включав: 6 мкл 5Х-кратного реакційного буферу (50 мМ MOPS; pH 7,1, 1 мМ EDTA, 1 мг/мл BSA, 0,1 % -меркаптоетанол, 0,01 % Brij 35, 0,5 мМ Na3VO4), 2,5 мкл розчину пептидного субстрату IGR-IRtide (концентрація 4 мг/мл), 0,01 мкл розчину протеїнкінази (UpstateXMiUipore) (концентрація 0,2 мкг/мл), 10,5 мкл 2+ дистильованої води. Для ініціації реакції до кожного зразка додавали 10 мкл суміші Mg /ATP (150 мкМ АТР, 35 мМ Mg(CH3COO)2, 1,5 мМ HEPES; рН 7,5) з додаванням АТР, міченого 32 ізотопом фосфору Р розведеного до активності 100 мкСі/мкМ. Час інкубації становив 25 хв. при 30 °C. Склад суміші та час інкубації проб для визначення ефективності інгібіторів на протеїнкіназі с-МЕТ. Об'єм реакційної суміші на одну пробу становив 20 мкл і включав: 6 мкл 5Х-кратного реакційного буферу (50 мМ MOPS; pH 7,1, 0,6 мМ EDTA, 0,5 мг/мл BSA, 1 мМ Na3VO4, 25 мМ гліцерофосфат, 0,05 % -меркаптоетанол), 3 мкл розчину пептидного субстрату KKKSPGEYVNIEFG (концентрація 4 мг/мл), 0,3 мкл розчину протеїнкінази (Upstate\Millipore) (концентрація 1 мкг/мл), 9,8 мкл дистильованої води. Для ініціації реакції до кожного зразка 2+ додавали 10 мкл суміші Mg /ATP (150 мкМ АТР, 40 мМ MgCl2, 10 мМ MOPS; pH 7,2, 3 мМ 32 EGTA, 0,5 мМ DTT) з додаванням АТР, міченого ізотопом фосфору Р розведеного до активності 100 мкСі/мкМ. Час інкубації становив 30 хв. при 30 °C. Склад суміші та час інкубації проб для визначення ефективності інгібіторів на протеїнкіназі Тіе2. Об'єм реакційної суміші на одну пробу становив 20 мкл і включав: 5 мкл 5Х-кратного реакційного буферу (50 мМ MOPS/NaOH; pH 7,0, 1 мМ EDTA), 2.5 мкл розчину пептидного субстрату Poly(Glu4-Tyr) (Upstate\Millipore) (концентрація 1 мг/мл), 1,25 мкл 10 мМ МnСl2, 2,5 мкл розчину протеїнкінази (концентрація 35,8-71,5 нг), 3,75 мкл дистильованої води. Для ініціації 2+ реакції до кожного зразка додавали 10 мкл суміші Mg /ATP (150 мкМ АТР, 10 мМ Mg(CH3COO)2) 32 з додаванням АТР, міченого ізотопом фосфору Р, розведеного до активності 100 мкСі/мкМ. Час інкубації становив 10 хв. при 30 °C. Результати тестів показали, що пропоновані низькомолекулярні органічні АТФ-конкурентні інгібітори серин/треонінової протеїнкінази СК2 на основі 4-аміно-тієно[2,3-d]піримідинового гетероциклу при концентрації 10 М незначно пригнічують активність кіназ (табл. 2). Найбільшу інгібувальну активність виявлено проти Aurora A. Проте у порівнянні із ступенем пригнічення активності СК2 нею можна знехтувати. 35 Таблиця 2 Залишкова активність протеїнкіназ (%) при додаванні інгібітору в концентрації 10 М № NHTP23 NHTP25 NHTP33 40 45 50 СК2 1,14 1,51 0,91 ASK1 122 122 112 Jnk3 85,7 89,5 70,3 FGFR 80,5 78,9 73,9 Met 53,7 71,5 87,2 Aurora A 36,2 38,9 15,3 Tie 2 109 119,7 84,2 Rock 1 105,8 88,6 101,5 Таким чином, похідні 4-аміно-тієно[2,3-d]піримідину проявляють високу інгібувальну активність по відношенню до протеїнкінази СК2 та є її АТФ-конкурентними і селективними інгібіторами. Це дозволяє використовувати винайдені низькомолекулярні органічні АТФконкурентні інгібітори серин/треонінової протеїнкінази СК2 на основі 4-аміно-тієно[2,3d]піримідинового гетероциклу, а також композиції, що містять їх, в наукових цілях та фармацевтиці, а саме: для встановлення ролі протеїнкінази СК2 в сигнальних шляхах клітини, для визначення впливу на активність інших серин/протеїнових та тирозинових протеїнкіназ, для пригнічення активності протеїнкінази СК2 в експериментах на клітинних лініях, а також як фармацевтичний препарат у моно- та комбінованій терапії для лікування, профілактики або пригнічення захворювань і станів у ссавців та рослин, виникнення яких пов'язане із функціонуванням протеїнкінази СК2. Детальні методики одержання низькомолекулярних органічних АТФ-конкурентних інгібіторів серин/треонінової протеїнкінази СК2. Всі похідні тієно[2,3-d]пірімідинів синтезували з відповідних карбонільних сполук згідно з Схемою 1 (Фіг. 2). Спочатку отримували заміщені 2-аміно-3-карбетокситіофени за реакцією Гевальда (у випадку ацетофенонів синтез проводили у дві стадії: спочатку конденсували 5 UA 86041 U 5 10 15 20 25 30 35 ціаноцтовий ефір з відповідним ацетофеноном, а далі одержаний продукт циклізували з сіркою) (методика 1). Далі шляхом конденсації з формамідом чи ацетонітрилом було отримано тієнопіримідинони (методики 2, 3), взаємодією яких з п'ятихлористим фосфором було синтезовано низку 4-хлоро-тієно[2,3-d]піримідинів (методика 4), що слугували синтонами для подальшого формування комбінаторних рядів. Кінцеві сполуки отримували заміщенням хлору на аміногрупу відповідної амінокислоти (Методики 5, 6). Методика 1. Суміш 107 л (1 моль) етилового естеру ціаноцтової кислоти, 32 г (1 моль) елементарної сірки та 1 моля відповідного кетону у 200 мл етилового спирту перемішували при кімнатній температурі та протягом 12 годин додавали 80 мл діетиламіну. Реакційну суміш залишали на ніч, утворений осад відфільтровували, промивали водним спиртом (1:1) та сушили на повітрі. Вихід 50-88 %. Методика 2. До 1 моля отриманого амінотіофену приливали еквімолярну кількість формаміду і витримували отриманий розчин 24 год. при температурі 160-170 °C. Контроль за протіканням реакції вели за допомогою тонкошарової хроматографії (рухома фаза - хлороформ - метиловий спирт (9:1)). По закінченні конденсації гарячий розчин реакційної суміші розбавляли ізопропіловим спиртом, охолоджували, отримані кристали відфільтровували, промивали ізопропанолом, водою та висушували в шафі-термостаті (60 °C). Вихід 85-90 %. Методика 3. До 0,01 моля відповідного амінотіофену приливали 30 мл діоксану, 0,85 мл ацетонітрилу та 30 мл діоксану насиченого хлороводнем. Отриману суміш перемішували 12 год. при кімнатній температурі та нейтралізовували розчином аміаку. Отримані кристали відфільтровували, промивали ізопропанолом та водою. Вихід 85-90 %. Методика 4. До 0,01 моля отриманого тієнопіримідинону додають 11 мл оксихлориду фосфору і 1,5 г п'ятихлористого фосфору, суміш швидко доводять до кипіння і кип'ятять 5-6 год. Розчинник ретельно випаровують до сухого залишку, який розчиняють в хлористому метилені і вливають в охолоджений розчин 0,5н лугу. Суміш розділяють, органічний шар обезводнюють і випаровують розчинник. Залишок за необхідності перекристалізовують з ізопропілового спирту. Вихід 70-80 % від теоретичного. Методика 5. До 0,011 моля амінокислоти, розчиненої у мінімальній кількості води, додають 15 мл етанолу, 0,5 мл триетиламіну та 0,01 моля вихідної сполуки, отриману суміш нагрівають при кипінні 24 год., розчинник випаровують, залишок послідовно перекристалізовують з етилового спирту та води. Вихід 30-80 %. Методика 6. Суміш 0,01 моля 4-хлоро-тієно[2,3-d]піримідину, 0,011 моля амінобензойної кислоти та 2 мл ДМФА кип'ятять 6 годин. Осад, що утворюється після охолодження фільтрували та промивали ацетоном. Для отримання речовин у вигляді основ виділений гідрохлорид розчиняли у спирті та додавали триетиламін. Вихід 60-80 %. ФОРМУЛА КОРИСНОЇ МОДЕЛІ 40 Низькомолекулярні органічні АТФ-конкурентні інгібітори серин/треонінової протеїнкінази СК2 на основі 4-аміно-тієно[2,3-d]піримідинового гетероциклу, отримані шляхом взаємодії 4-хлоротієно[2,3-d]піримідину із амінокислотами, загальної формули: R1 N N R2 S 1 45 50 R4 N R3 , 1 2 1 2 де R - водень; метил; R =R - бутилен; R =R - бутилен, заміщений -СН3; феніл; феніл, заміщений -СН3; феніл, заміщений -Сl; феніл, заміщений -F; феніл, заміщений діоксиметилом; 2 1 2 1 2 R - водень; метил; етил; карбоксил; етилкарбоксил; феніл; R =R - бутилен; R =R - бутилен, заміщений -СН3; 3 R - водень; метил; 4 R - оцтова кислота; пропанова кислота; бутанова кислота; феніл, заміщений 1-2 залишками карбоксилу; феніл, одночасно заміщений карбоксильною та гідроксильною групами; 2-заміщена 3-гідроксипропанова кислота; 2-моноамідбурштинової кислоти; 2-карбоксил-С4-алкіл; 3- або 4карбоксил-С5-алкіл; С5-алкіл. 6 UA 86041 U 7 UA 86041 U Комп’ютерна верстка А. Крулевський Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 8
ДивитисяДодаткова інформація
МПК / Мітки
МПК: C07D 215/00, A61P 35/00
Мітки: гетероциклу, протеїнкінази, низькомолекулярні, атф-конкурентні, ск2, інгібітори, органічні, 4-аміно-тієно[2,3-d]піримідинового, основі
Код посилання
<a href="https://ua.patents.su/10-86041-nizkomolekulyarni-organichni-atf-konkurentni-ingibitori-serin-treoninovo-protenkinazi-sk2-na-osnovi-4-amino-tiehno23-dpirimidinovogo-geterociklu.html" target="_blank" rel="follow" title="База патентів України">Низькомолекулярні органічні атф-конкурентні інгібітори серин/треонінової протеїнкінази ск2 на основі 4-аміно-тієно[2,3-d]піримідинового гетероциклу</a>
Попередній патент: Спосіб догляду за шкірою
Наступний патент: Спосіб пиляння матеріалів
Випадковий патент: Багатоцільовий верстат