Протибактеріальні індолоноксазолідинони, проміжні сполуки для їх одержання і фармацевтична композиція, що їх містять
Формула / Реферат
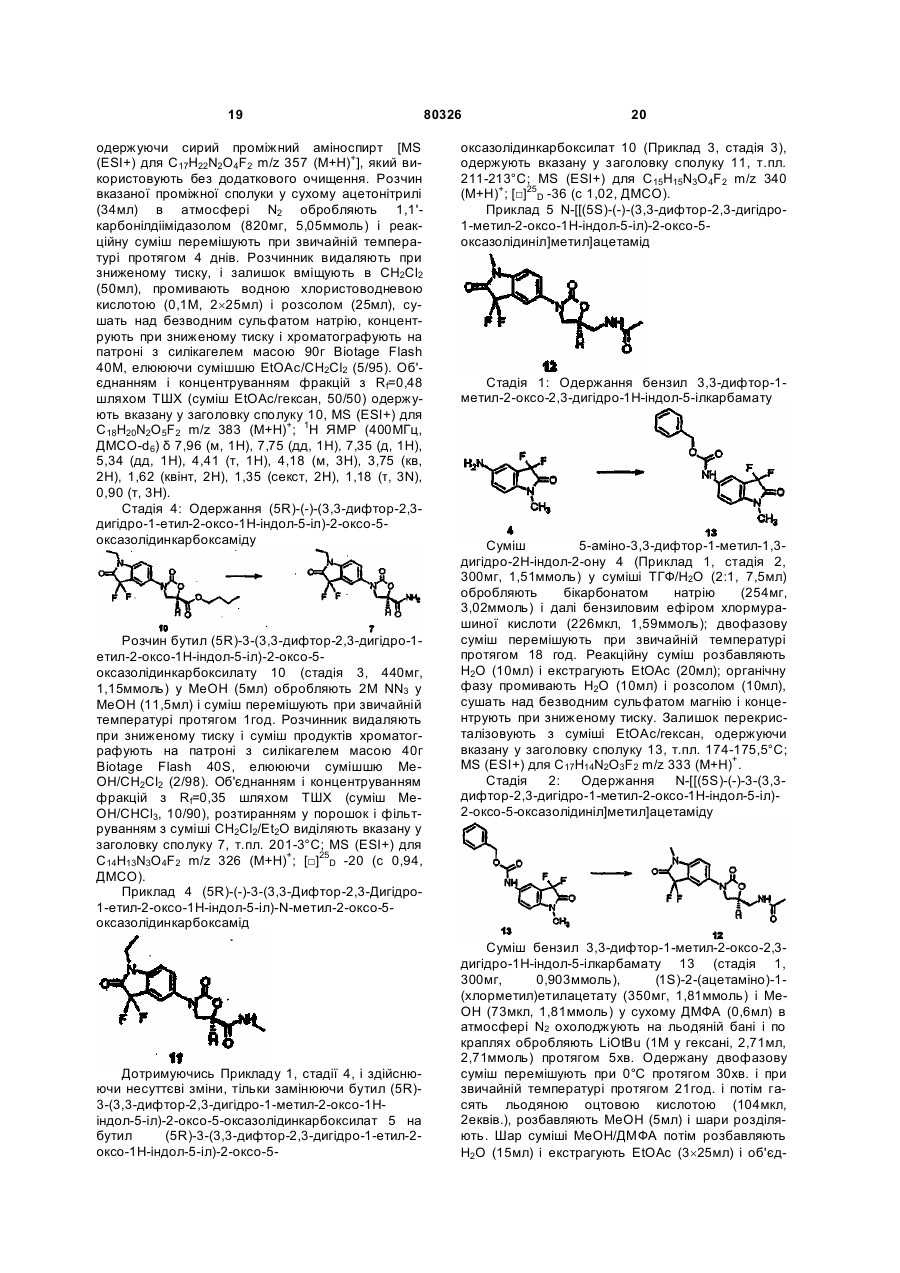
1. Сполуки формули І
Формула І
або їх фармацевтично прийнятні солі, де А являє собою залишки і, іі, ііі або iv;
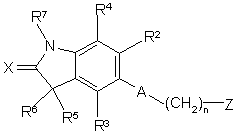
 і,
і, іі,
іі, 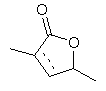 ііі,
ііі, 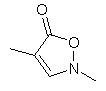 iv,
iv,
де штрих-пунктирна лінія у формулі ііі означає можливий подвійний зв'язок;
n дорівнює 0 або 1;
Х являє собою О, S, NH, N-алкіл, NOH і NO-алкіл;
Z являє собою NHC(=O)R1, NHC(=S)R1, C(=O)NHR1, C(=O)N(H)OH, NHC(=NCN)R1, NH-het1, O-het1, S-het1 або het2;
R1 являє собою Н, NH2, NH-C1-4-алкіл, C1-4-алкіл, С2-4-алкеніл, -(CH2)mC(=O)-C1-4-алкіл, ОC1-4-алкіл, SC1-4-алкіл, (СН2)mС3-6-циклоалкіл, СН=СН-арил, СН=СН-het1, СН2С(=O)-арил або CH2C(=O)-het1; алкіл, арил або het можуть являти собою заміщений алкіл, заміщений арил або заміщений het, відповідно;
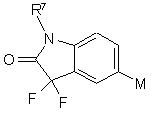
R2 і R3 незалежно один від одного являють собою Н або F;
R4 являє собою Н, Сl, F, СН3, СF3, NH2, NO2 або CN;
R5 і R6 незалежно один від одного являють собою Н, алкіл, заміщений алкіл, -S-алкіл, -O-алкіл, алкеніл, заміщений алкеніл, гідроксигрупу, арил або галоген;
R7 являє собою Н, алкіл, заміщений алкіл, циклоалкіл, С(=O)-алкіл, С(=O)-заміщений алкіл, арил, алкеніл, заміщений алкеніл, het, заміщений het або заміщений арил;
het1 являє собою С-зв'язане п'яти(5)- або шести(6)-членне гетероциклічне кільце, яке містить від 1 до 4 гетероатомів, вибраних з кисню, сірки і азоту;
het2 являє собою N- або С-зв'язане п'яти(5)- або шести(6)-членне гетероциклічне кільце, яке містить від 1 до 4 гетероатомів, вибраних з кисню, сірки і азоту;
кожний m незалежно один від одного дорівнює 0, 1 або 2.
2. Сполука за п. 1, де А являє собою
 i.
i.
3. Сполука за п. 1, де R7 являє собою алкіл або заміщений алкіл.
4. Сполука за п. 1, де R5 являє собою галоген.
5. Сполука за п. 4, де R6 являє собою галоген.
6. Сполука за п. 1, вибрана з групи:
a) (5R)-(-)-3-(3,3-дифтор-2,3-дигідро-1-метил-2-оксо-1Н-індол-5-іл)-N-метил-2-оксо-5-оксазолідинкарбоксамід;
b) (5R)-(-)-3-(3,3-дифтор-2,3-дигідро-1-метил-2-оксо-1Н-індол-5-іл)-2-оксо-5-оксазолідинкарбоксамід;
c) (5R)-(-)-3-(3,3-дифтор-2,3-дигідро-1-етил-2-оксо-1Н-індол-5-іл)-2-оксо-5-оксазолідинкарбоксамід;
d) (5R)-(-)-3-(3,3-дифтор-2,3-дигідро-1-етил-2-оксо-1Н-індол-5-іл)-N-метил-2-оксо-5-оксазолідинкарбоксамід;
e) N-[[(5S)-(-)-3-(3,3-дифтор-2,3-дигідро-1-метил-2-оксо-1Н-індол-5-іл)-2-оксо-5-оксазолідиніл]метил]ацетамід; і
f) N-[[(5S)-(-)-3-(3,3-дифтор-2,3-дигідро-1-етил-2-оксо-1Н-індол-5-іл)-2-оксо-5-оксазолідиніл]метил]ацетамід.
7. Сполука формули II
 , II
, II
де:
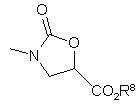
R7 являє собою алкіл, що містить від 1 до 4 атомів вуглецю;
М вибраний з групи, що складається з NO2, NH2, NHC(O)OR8 або залишку і
 , I
, I
де R8 являє собою алкіл, що містить від 1 до 4 атомів вуглецю, або бензил.
8. Сполука за п. 7, де R7 являє собою алкіл або заміщений алкіл.
9. Сполука за п. 7, вибрана з групи:
a) бутил (5R)-3-(3,3-дифтор-1-метил-2-оксо-2,3-дигідро-1H-індол-5-іл)-2-оксо-5-оксазолідинкарбоксилат;
b) бензил 1-етил-3,3-дифтор-2-оксо-2,3-дигідро-1Н-індол-5-ілкарбамат;
c) 5-аміно-1-етил-3,3-дифтор-1,3-дигідро-2Н-індол-2-он;
d) 1-етил-3,3-дифтор-5-нітро-1,3-дигідро-2Н-індол-2-он;
e) бензил 3,3-дифтор-1-метил-2-оксо-2,3-дигідро-1Н-індол-5-ілкарбамат;
f) 5-аміно-3,3-дифтор-1-метил-1,3-дигідро-2Н-індол-2-он;
g) 3,3-дифтор-1-метил-5-нітро-1,3-дигідро-2Н-індол-2-он і
h) бутил (5R)-3-(3,3-дифтор-1-етил-2-оксо-2,3-дигідро-1Н-індол-5-іл)-2-оксо-5-оксазолідинкарбоксилат.
10. Застосування сполуки за п. 1 або 7 для одержання лікарського препарату для лікування мікробних інфекцій у ссавців.
11. Застосування за п. 10, в якому лікарський препарат приготований для орального, парентерального, трансдермального або місцевого введення.
12. Застосування за п. 10, в якому лікарський препарат містить від приблизно 0,1 до приблизно 1000 мг сполуки за п. 1 або 7.
13. Застосування за п. 10, в якому лікарський препарат містить від приблизно 0,1 до приблизно 500 мг сполуки за п. 1 або 7.
14. Фармацевтична композиція, що містить сполуку за п. 1 або 7 і фармацевтично прийнятний носій.
Текст
1. Сполуки формули І R4 R7 R2 N X C2 2 (19) 1 3 80326 6. Сполука за п. 1, вибрана з групи: a) (5R)-(-)-3-(3,3-дифтор-2,3-дигідро-1-метил-2оксо-1Н-індол-5-іл)-N-метил-2-оксо-5оксазолідинкарбоксамід; b) (5R)-(-)-3-(3,3-дифтор-2,3-дигідро-1-метил-2оксо-1Н-індол-5-іл)-2-оксо-5оксазолідинкарбоксамід; c) (5R)-(-)-3-(3,3-дифтор-2,3-дигідро-1-етил-2-оксо1Н-індол-5-іл)-2-оксо-5-оксазолідинкарбоксамід; d) (5R)-(-)-3-(3,3-дифтор-2,3-дигідро-1-етил-2-оксо1Н-індол-5-іл)-N-метил-2-оксо-5оксазолідинкарбоксамід; e) N-[[(5S)-(-)-3-(3,3-дифтор-2,3-дигідро-1-метил-2оксо-1Н-індол-5-іл)-2-оксо-5оксазолідиніл]метил]ацетамід; і f) N-[[(5S)-(-)-3-(3,3-дифтор-2,3-дигідро-1-етил-2оксо-1Н-індол-5-іл)-2-оксо-5оксазолідиніл]метил]ацетамід. 7. Сполука формули II R7 N II O F M F , де: R7 являє собою алкіл, що містить від 1 до 4 атомів вуглецю; М вибраний з групи, що складається з NO2, NH2, NHC(O)OR8 або залишку і O N O I CO2R8 , Даний винахід відноситься до нових 2оксііндоліл (або індол-2-он)оксазолідинонів, їх похідних, проміжних сполук та їх одержання. Оксазолідинонові протибактеріальні агенти є новим синтетичним класом протимікробних засобів з сильною активністю проти ряду патогенних мікроорганізмів людини і тварин (ветеринарія), включаючи грам-позитивні аеробні бактерії, такі як багато-резистентні стафілококи і стептококи, анаеробні організми, такі як бактероїди і види клостридій, і стійкі до кислот організми, такі як Mycobacterium tuberculosis і Mycobacterium avium. В одному аспекті винахід стосується сполук формули І 4 де R8 являє собою алкіл, що містить від 1 до 4 атомів вуглецю, або бензил. 8. Сполука за п. 7, де R7 являє собою алкіл або заміщений алкіл. 9. Сполука за п. 7, вибрана з групи: a) бутил (5R)-3-(3,3-дифтор-1-метил-2-оксо-2,3дигідро-1H-індол-5-іл)-2-оксо-5оксазолідинкарбоксилат; b) бензил 1-етил-3,3-дифтор-2-оксо-2,3-дигідро1Н-індол-5-ілкарбамат; c) 5-аміно-1-етил-3,3-дифтор-1,3-дигідро-2Н-індол2-он; d) 1-етил-3,3-дифтор-5-нітро-1,3-дигідро-2Н-індол2-он; e) бензил 3,3-дифтор-1-метил-2-оксо-2,3-дигідро1Н-індол-5-ілкарбамат; f) 5-аміно-3,3-дифтор-1-метил-1,3-дигідро-2Ніндол-2-он; g) 3,3-дифтор-1-метил-5-нітро-1,3-дигідро-2Ніндол-2-он і h) бутил (5R)-3-(3,3-дифтор-1-етил-2-оксо-2,3дигідро-1Н-індол-5-іл)-2-оксо-5оксазолідинкарбоксилат. 10. Застосування сполуки за п. 1 або 7 для одержання лікарського препарату для лікування мікробних інфекцій у ссавців. 11. Застосування за п. 10, в якому лікарський препарат приготований для орального, парентерального, трансдермального або місцевого введення. 12. Застосування за п. 10, в якому лікарський препарат містить від приблизно 0,1 до приблизно 1000 мг сполуки за п. 1 або 7. 13. Застосування за п. 10, в якому лікарський препарат містить від приблизно 0,1 до приблизно 500 мг сполуки за п. 1 або 7. 14. Фармацевтична композиція, що містить сполуку за п. 1 або 7 і фармацевтично прийнятний носій. або їх фармацевтично прийнятних солей, де А являє собою залишки і, іі, ііі або iv де штрих-пунктирна лінія у формулі ііі являє собою можливий подвійний зв'язок; n дорівнює 0 або 1; X являє собою О, S, ΝN, N-алкіл, ΝΟN і NOалкіл; Ζ являє собою NHC(=O)R1, NHC(=S)R1, C(=O)NHR1, C(=O)N(H)OH, NHC(=NCN)R1, NH-het1, O-het1, S-het1 або het2; R1 являє собою N, ΝN2, NHС1-4-алкіл, С1-4алкіл, С2-4-алкеніл, -(CH2)mC(=O)С1-4-алкіл, ОС1-4алкіл, SС1-4-алкіл, (СН2)mС3-6-циклоалкіл, СН=СН арил, CH=CH-het1, СН2С(=О)-арил або CH2C(=:O)het1, (причому) алкіл, арил або het, можливо явля 5 ють собою заміщений алкіл, заміщений арил або заміщений het, відповідно; R2 і R3 незалежно один від одного являють собою N або F; R4 являє собою Н, СІ, F, CH3, CF3, NH2, NO2 або CN; R5 і R6 незалежно один від одного являють собою Н, алкіл, заміщений алкіл, -S-алкіл, -О-алкіл, алкеніл, заміщений алкеніл, гідроксигрупу, арил або галоген; R7 являє собою Н, алкіл, заміщений алкіл, циклоалкіл, С(=О)-алкіл, С(=О)-заміщений алкіл, арил, алкеніл, заміщений алкеніл, het, заміщений het або заміщений арил; het1 являє собою С-зв'язане п'яти(5)- або шести(6)-членне гетероциклічне кільце, яке містить від 1 до 4 гетероатомів, вибраних з кисню, сірки і азоту; het2 являє собою N- або С-зв'язане п'яти(5)або шести(6)-членне гетероциклічне кільце, яке містить від 1 до 4 гетероатомів, вибраних з кисню, сірки і азоту; кожний m незалежно один від одного дорівнює 0, 1 або 2. В іншому аспекті винахід представляє сполуку формули II де: R7 являє собою алкіл, що містить від 1 до 4 атомів вуглецю; Μ вибраний з групи, що складається з NO2, NH2, NHC(O)OR8 або залишку і де R8 являє собою алкіл, що містить від 1 до 4 атомів вуглецю, або бензил. У ще іншому аспекті винахід стосується застосування сполуки формули І для виготовлення лікарського препарату для лікування мікробних інфекцій у ссавців. Лікарський препарат готують для перорального, парентерального, трансдермального або місцевого введення. Лікарський препарат може містити сполуку формули І у кількості від приблизно 0,1 до приблизно 100мг/кг маси тіла/день, більш переважно, у кількості від приблизно 1 до приблизно 50мг/кг маси тіла/день. Наприклад, лікарський препарат може містити від приблизно 0,1 до приблизно 1000мг, наприклад, від приблизно 0,1 до приблизно 500мг сполуки формули І. 80326 6 Ще в іншому аспекті у винаході запропонована фармацевтична композиція, яка містить сполуку формули І і фармацевтично прийнятний носій. Переважно сполуки даного винаходу виявляють сильну протибактеріальну активність. Використані наступні визначення, якщо не вказано інакше. Вміст атомів вуглецю у різних вуглеводовмісних групах вказаний префіксом, що визначає мінімальне і максимальне число атомів вуглецю у групі, тобто префікс Ci-j означає групу з числом атомів вуглецю від "і" до "j", включно. Так, наприклад, С17-алкіл відноситься до алкілу, що містить від одного до семи атомів вуглецю включно. Термін "галоген" відноситься до атома галогену, вибраного з СІ, Вr, І та F. Термін "алкіл" відноситься до груп як з лінійним, так і з розгалуженим ланцюгом. Якщо не вказано спеціально, алкільні групи містять від 1 до 6 атомів вуглецю. Термін "алкеніл" відноситься до груп як з лінійним, так і з розгалуженим ланцюгом, які містить щонайменше одну групу -С=С -. Якщо не вказано спеціально, алкенільні групи містять від 1 до 6 атомів вуглецю. Термін "алкініл" відноситься до груп як з лінійним, так і з розгалуженим ланцюгом, які містить щонайменше одну групу -СºС-. Якщо не вказано спеціально, алкініл ьні групи містять від 1 до 6 атомів вуглецю. Термін "алкокси" відноситься до -О-алкільних груп. Термін "циклоалкіл" відноситься до циклічної алкільної групи. Якщо не вказано спеціально, циклоалкільні групи можуть містити від 3 до 7 атомів вуглецю. Термін "циклоалкеніл" відноситься до циклічної алкенільної групи. Якщо не вказано спеціально, циклоалкенільні групи можуть містити від 3 до 7 атомів вуглецю і щонайменше одну групу -С=Свсередині кільця. Термін "аміногрупа" відноситься до -ΝN2. Термін "арил" відноситься до фенілу або нафтилу. Термін "net" відноситься до моно- або біциклічної кільцевої системи, яка містить щонайменше один гетероатом, вибраний з О, S і N. Кожне моноциклічне кільце може бути ароматичним, насиченим або частково ненасиченим. Біциклічна кільцева система може містити моноциклічне кільце, яке містить щонайменше один гетероатом, сконденсований з циклоалкільною або арильною групою. Біциклічна кільцева система може також містити моноциклічну кільцеву систему, яка містить щонайменше один гетероатом, сконденсовану з іншою het, моноциклічною кільцевою системою. Термін het охоплює терміни het1, het2 і гетероциклоалкіл, визначений у даному описі. Прикладами "het" є, але цим не обмежуються, піридин, тіофен, фуран, піразолін, піримідин, 2піридил, 3-піридил, 4-піридил, 2-піримідиніл, 4піримідиніл, 5-піримідиніл, 3-піридазиніл, 4піридазиніл, 3-піразиніл, 4-оксо-2-імідазоліл, 2імідазоліл, 4-імідазоліл, 3-ізоксазоліл, 4ізоксазоліл, 5-ізоксазоліл, 3-піразоліл, 4-піразоліл, 7 5-піразоліл, 2-оксазоліл, 4-оксазоліл, 4-оксо-2оксазоліл, 5-оксазоліл, 1,2,3-оксатіазол, 1,2,3оксадіазол, 1,2,4-оксадіазол, 1,2,5-оксадіазол, 1,3,4-оксадіазол, 2-тіазоліл, 4-тіазоліл, 5-тіазоліл, 3-ізотіазол, 4-ізотіазол, 5-ізотіазол, 2-фураніл, 3фураніл, 2-тієніл, 3-тієніл, 2-піроліл, 3-піроліл, 3ізопіроліл, 4-ізопіроліл, 5-ізопіроліл, 1,2,3оксатіазол-1 -оксид, 1,2,4-оксадіазол-3-іл, 1,2,4оксадіазол- 5-іл, 5-оксо-1,2,4-оксадіазол-3-іл, 1,2,4тіадіазол-3-іл, 1,2,4-тіадіазол-5-іл, 1,2,5-тіадіазол3-іл, 3-оксо-1,2,4-тіадіазол-5-іл, 1,3,4-тіадіазол-5-іл, 2-оксо-1,3,4-тіадіазол-5-іл, 1,2,3-триазол-1-іл, 1,2,4-триазол-3-іл, 1,2,4-триазол-5-іл, 1,2,3,4тетразол-5-іл, 5-оксазоліл, 3-ізотіазоліл, 4ізотіазоліл, 5-ізотіазоліл, 1,3,4-оксадіазол, 4-оксо2-тіазолініл, 5-метил-1,3,4-тіадіазол-2-іл, тіазолдіон, 1,2,3,4-тіатриазол, 1,2,4-дитіазолон, фталімід, хінолініл, морфолініл, бензоксазоїл, діазиніл, триазиніл, хінолініл, хіноксалініл, нафтиридиніл, азетидиніл, піролідиніл, гідантоїніл, оксатіоланіл, діоксоланіл, імідазолініл і азабіцикло[2.2.1]гептил. Термін "гетероарил" відноситься до ароматичного het, прикладами яких є, але цим не обмежуються, піридин і тіофен. Термін "заміщений алкіл" відноситься до алкільної групи, що містить від 1 до 4 замісників, вибраних з галогену, het, циклоалкілу, циклоалкенілу, арилу, -OQ10, -SQ10, -S(O)2Q10, -S(O)Q10, OS(O)2Q10, -C(=NQ10)Q10, -C(=NOQ10)Q10, SC(O)Q10, -NQ10Q10, -C(O)Q10, -C(S)Q10, -C(O)OQ10, -OC(O)Q10, -C(O)NQ10Q10, C(O)C(Q16)2OC(O)Q10, CN, =O, =S, -NQ10C(O)Q10, -NQ10C(O)NQ10Q10, S(O)2NQ10Q10, -NQ10S(O)2Q10, -NQ10S(O)Q10, NQ10SQ10, -NO2 і -SNQ10Q10. Кожний het, циклоалкіл, циклоалкеніл і арил можуть бути заміщені 1-4 замісниками, незалежно один від одного вибраними з галогену і Q15. Термін "заміщений арил" відноситься до арильної групи, що містить від 1 до 3 замісників, вибраних з –OQ10, -SQ10, -S(O)2Q10, -S(O)Q10, OS(O)2Q10, -C(=NQ10)Q10, -SC(O)Q10, -NQ10Q10, C(O)Q10, -C(S)Q10, -C(O)OQ10, -OC(O)Q10, C(O)NQ10Q10, -C(O)C(Q16)2OC(O)Q10, -CN, NQ10C(O)Q10, -NQ10C(O)NQ10Q10, -S(O)2NQ10Q10, NQ10S(O)2Q10, -NQ10S(O)Q10, -NQ10SQ10, -NO2, SNQ10Q10, алкілу, заміщеного алкілу, het, галогену, циклоалкілу, циклоалкенілу і арилу. Het, циклоалкіл, циклоалкеніл і арил можуть бути заміщені 1-3 замісниками, вибраними з галогену і Q15. Термін "заміщений het" відноситься до гетероциклічної групи, що містить від 1 до 4 замісників, вибраних з –OQ10, -SQ10, -S(O)2Q10, -S(O)Q10, OS(O)2Q10, -C(=NQ10)Q10, -C(=NOQ10)Q10, SC(O)Q10, -NQ10Q10, -C(O)Q10, -C(S)Q10, -C(O)OQ10, -OC(O)Q10, -C(O)NQ10Q10, -C(O)C(Q16)2OC(O)Q10, CN, -NQ10C(O)Q10, -NQ10C(O)NQ10Q10, S(O)2NQ10Q10, -NQ10S(O)2Q10, -NQ10S(O)Q10, NQ10SQ10, -NO2, -SNQ10Q10, алкілу, заміщеного алкілу, het, галогену, циклоалкілу, циклоалкенілу і арилу. Замісник het також може бути заміщений одним або більше замісниками =О або =S, причому О або S приєднані до атома циклу, здатного містити подвійний зв'язок між атомом циклу і О або S. Het, циклоалкіл, циклоалкеніл і арил можуть 80326 8 бути заміщені 1-3 замісниками, вибраними з галогену і Q15. Термін "заміщений алкеніл" відноситься до алкенільної групи, що містить від 1 до 3 замісників OQ10, -SQ10, -S(O)2Q10, -S(O)Q10; -OS(O)2Q10, C(=NQ10)Q10, -C(=NOQ10)Q10, -SC(O)Q10, -NQ.oQio, -C(O)Q10, -C(S)Q10, -C(O)OQ10, -OC(O)Q10, C(0)NQ10Q10, -C(O)C(Q16)2OC(O)Q10, -CN, =O, =S, NQ10C(O)Q10, -NQ10C(O)NQ10Q10, -S(O)2NQ10Q10, NQ10S(O)2Q10, -NQ10S(O)Q10, -NQ10SQ10, -NO2, SNQ10Q10, алкілу, заміщеного алкілу, het, галогену, циклоалкілу, циклоалкенілу і арилу. Het, циклоалкіл, циклоалкеніл і арил можуть бути заміщені 1-3 замісниками, вибраними з галогену і Q15. Термін "заміщена алкоксигрупа" відноситься до алкоксильної групи, що містить від 1 до 3 замісників -OQ10, -SQ10, -S(O)2Q10, -S(O)Q10, -OS(O)2Q10, -C(=NQ10)Q10, -SC(O)Q10, -NQ10Q10, -C(O)Q10, C(S)Q10, -C(O)OQ10, -OC(O)Q10, -C(O)NQ10Q10, C(O)C(Q16)2OC(O)Q10, -CN, =O, =S, -NQ10C(O)Q10, NQ10C(O)NQ10Q10, -S(O)2NQ10Q10, -NQ10S(O)2Q10, NQ10S(O)Q10, -NQ10SQ10, -NO2 -SNQ10Q10, алкілу, заміщеного алкілу, het, галогену, циклоалкілу, циклоалкенілу і арилу. Het, циклоалкіл, циклоалкеніл і арил можуть бути заміщені 1-3 замісниками, вибраними з галогену і Q15. Термін "заміщений циклоалкеніл" відноситься до циклоалкенільної групи, що містить від 1 до 3 замісників -OQ10, -SQ10, -S(O)2Q10) -S(O)Q10, OS(O)2Q10, -C(=NQ,o)Qio, -SC(O)Q10, -NQ10Q10, C(O)Q10, -C(S)Q10, -C(O)OQ10, -OC(O)Q10, C(O)NQ10Q10, -C(O)C(Q16)2OC(O)Q10, -CN, =0, =S, NQ10C(O)Q10, -NQ10C(O)NQI0Q10, -S(O)2NQ10Q10, NQ10S(O)2Q10, -NQ10S(O)Q10, -NQ10SQ10, -N02, SNQloQio, алкілу, заміщеного алкілу, het, галогену, циклоалкілу, циклоалкенілу і арилу. Het, циклоалкіл, циклоалкеніл і арил можуть бути заміщені 1-3 замісниками, вибраними з галогену і Q15. Термін "заміщена аміногрупа" означає аміногрупу, в якій один або обидві водні аміногрупи замінені групою, вибраною з -OQ10, -SQ10, -S(O)2Q10, -S(O)Q10, -OS(O)2Q10, -C(O)Q10, -C(S)Q10, C(O)OQ10, -OC(O)Q10, -C(O)NQ10Q10, C(O)C(Q16)2OC(O)Q10, -CN, алкілу, заміщеного алкілу, het, галогену, циклоалкілу, циклоалкенілу і арилу. Het, циклоалкіл, циклоалкеніл і арил можуть бути заміщені 1-3 замісниками, вибраними з галогену і Q15. Кожний з Q10 незалежно один від одного вибраний з -Н, алкілу, циклоалкілу, het, циклоалкенілу і арилу. Het, циклоалкіл, циклоалкеніл і арил можуть бути заміщені 1-3 замісниками, вибраними з галогену і Q13. Кожний з Q11 незалежно один від одного вибраний з -Н, галогену, алкілу, арилу, циклоалкілу і het. Алкіл, циклоалкіл і het можуть бути заміщені 13 замісниками, незалежно один від одного вибраними з галогену, -NO2, -CN, =S, =O і Q14. Арил може бути заміщений 1-3 замісниками, незалежно один від одного вибраними з галогену, -NO2, -CN і Q14. Кожний з Q13 незалежно один від одного вибраний з Q11, -OQ11, -SQ11,-S(O)2Q11, -S(O)Q11, OS(O)2Q11, -C(=NQ11)Q11, -SC(O)Q11, -NQ11Q11, C(O)Q11, -C(S)Q11, -C(O)OQ11, -OC(O)Q11, 9 C(O)NQ11Q11, -C(O)C(Q16)2OC(O)Q10, -CN, =O, =S, NQ11C(O)Q11, -NQ11C(O)NQ11Q11, -S(O)2NQ11Q11, NQ11S(O)2Q11, -NQ11S(O)Q11, -NQ11SQ11, -NO2 і SNQ11Q11, причому Q13 не означає =O або =S, якщо Q10 означає арил або het, які не містять атому, здатного утворювати подвійний зв'язок з О або S. Кожний з Q14 означає -Н або замісник, вибраний з алкілу, циклоалкілу, циклоалкенілу, фенілу або нафтилу, кожний з яких може бути заміщений 1-4 замісниками, незалежно один від одного вибраними з -F, -СІ, -Br, -I, -OQ16, -SQ16, -S(O)2Q16, S(O)Q16, -OS(O)2Q16, -NQ16Q16, -C(O)Q16, -C(S)Q16, C(O)OQ16, -NO2, -C(O)NQ16Q16, -CN, -NQ16C(O)Q16, -NQ16C(O)NQ16Q16, -S(O)2NQ16Q16 і -NQ16S(O)2Q16. Алкіл, циклоалкіл і циклоалкеніл можуть бути додатково заміщені =O або =S. Кожний з Q15 означає алкіл, циклоалкіл, циклоалкеніл, het, феніл або нафтил, кожний можливо заміщений 1-4 замісниками, незалежно один від одного вибраними з -F, -СІ, Br, -I, -OQ16, -SQ16, S(O)2Q16, -S(O)Q16, -OS(O)2Q16, -C(=NQ16)Q16, SC(O)Q16, -NQ16Q16, -C(O)Q16, -C(S)Q16, -C(O)OQ16, -OC(O)Q16, -C(O)NQ16Q16, -C(O)C(Q16)2OC(O)Q16, CN, -NQ16C(O)Q16, -NQ16C(O)NQ16Q16, S(O)2NQ16Q16, -NQ16S(O)2Q16, -NQ16S(O)Q16, NQ16SQ16, -NO2 і -SNQ16Q16. Алкіл, циклоалкіл і циклоалкеніл можуть бути додатково заміщені =O або =S. Кожний з Q16 незалежно один від одного вибраний з -Н, алкілу і циклоалкілу. Алкіл і циклоалкіл можуть додатково містити від 1 до 3 (атомів) галогену. Термін "ссавець" відноситься до людини або тварин. Сполуки даного винаходу звичайно називають відповідно до системи номенклатури IUPAC або СAS. Можуть бути використані скорочення, добре відомі звичайному фахівцеві у даній галузі (наприклад, "Ph" для фенілу, "Me" для метилу, "Et" для етилу, "О" для атома кисню, "S" для атома сірки, "N" для атома азоту, "год." для години або годин і "КТ" для кімнатної температури). Сполуки даного винаходу можуть бути перетворені в їх солі, де це доцільно, звичайними способами. Термін "фармацевтично прийнятні солі" відноситься до кислотно-адитивних солей, застосовних для введення сполук даного винаходу, і включають гідрохлориди, гідроброміди, гідройодиди, сульфати, фосфати, ацетати, пропіонати, лактати, мезилати, малеати, малати, сукцинати, тартрати, цитрати, 2-гідроксіетилсульфонати, фумарати і подібні. Вказані солі можуть бути у гідратованій формі. Сполуки формули І даного винаходу містять хіральний центр, а саме біля С-5 оксазолідинонового циклу, і як такі вони знаходяться як у формі двох енантіомерів, так і їх рацемічної суміші. Винахід відноситься як до обох енантіомерів, які володіють описаними тут властивостями, так і до сумішей, що містять обидва ізомери. Додатково, в залежності від замісників, у сполуках формули І можуть бути присутніми додаткові хіральні центри та інші ізомерні форми, і даний винахід включає всі можливі стереоізомери і геометричні форми. 80326 10 Сполуки даного винаходу застосовні для лікування мікробних інфекцій у людини та інших теплокровних тварин, шляхом як парентерального, так і орального введення. Фармацевтичні композиції даного винаходу можуть бути виготовлені шляхом комбінування сполук даного винаходу з твердим або рідким фармацевтично прийнятним носієм і, можливо, з фармацевтично прийнятними допоміжними речовинами і наповнювачами із застосуванням стандартних і загальноприйнятих методик. Композиціями у твердій формі є порошки, таблетки, гранули, що диспергуються, капсули, крохмальні капсули і супозиторії. Твердим носієм може бути щонайменше одна речовина, яка також може виконувати функцію розріджувача, віддушки, солюбілізатора, лубриканта, суспендуючого агента, зв'язуючого, дезінтегруючого агента та інкапсулюючого агента. Інертними твердими носіями є карбонат магнію, стеарат магнію, тальк, цукор, лактоза, пектин, декстрин, крохмаль, желатин, целюлозні матеріали, низькоплавкий віск, масло какао і подібні. Композиціями у рідкій формі є розчини, суспензії та емульсії. Наприклад, можуть бути приготовані розчини сполук даного винаходу, розчинені у воді та у системах водапропіленгліколь, що можливо містять придатні загальноприйняті барвники, віддушки, стабілізатори і загусники. Переважно фармацевтичну композицію готують з використанням загальноприйнятої методики в одиничній дозованій формі, що містить ефективні або доцільні кількості активного компонента, тобто сполуки відповідно до даного винаходу. Кількість активного компонента, який є сполукою відповідно до даного винаходу, у фармацевтичній композиції і його одиничній дозованій формі може варіюватися або пристосовуватися в залежності від конкретного застосування, сили дії конкретної сполуки і бажаної концентрації. Звичайно кількість активного компонента знаходиться в інтервалі від 0,5% до 90% від маси композиції. При терапевтичному застосуванні для лікування або боротьби з бактеріальними інфекціями у теплокровних тварин сполуки або їх фармацевтичні композиції можуть вводитися перорально, парентерально і/або місцево у дозах для одержання і підтримки концентрації, тобто протибактеріально ефективної кількості або рівня активного компонента у крові у тварини, яка піддається лікуванню. Звичайно така протибактеріально ефективна кількість дози активного компонента знаходиться в інтервалі від приблизно 0,1 до приблизно 100, більш переважно, від приблизно 3,0 до приблизно 50мг/кг маси тіла/день. Потрібно розуміти, що дози можуть сильно залежати від потреб пацієнта, тяжкості бактеріальної інфекції, що лікується, і конкретної використовуваної сполуки. Крім того, потрібно розуміти, що початкова доза, яка вводиться, може бути збільшена за межі вказаного вище рівня для швидкого досягнення бажаного рівня у крові або початкова доза може бути меншою оптимальної і щоденна доза може бути прогресивно збільшена під час курсу лікування в залежності від конкретної ситуації. За бажанням 11 денна доза може також бути розбита на множину доз для введення, наприклад, від 2 до 4 разів на день. Сполуки відповідно до даного винаходу можуть бути введені парентерально, наприклад, шляхом внутрішньовенного вливання або іншого парентерального шляху введення. Фармацевтичні композиції для парентерального введення звичайно містять фармацевтично прийнятну кількість розчинної солі (кислотно-адитивної солі або солі основи), розчиненої у фармацевтично прийнятному рідкому носії, такому як, наприклад, вода для ін'єкцій і буферний розчин, для одержання відповідного буферного ізотонічного розчину, який, наприклад, має рН приблизно від 3,5 до 6. Придатними буферними агентами є, наприклад, тринатрійортофосфат, бікарбонат натрію, цитрат натрію, N-метилглюкамін, L(+)-лізин і L(+)-аргінін, що являють собою тільки декілька буферних агентів. Сполуки даного винаходу звичайно розчиняють у носії у кількості, достатній для забезпечення фармацевтично прийнятної для ін'єкцій концентрації в інтервалі від приблизно 1мг/мл до приблизно 400мг/мл розчину. Одержану рідку фармацевтичну композицію потрібно вводити таким чином, щоб одержати згадану вище протибактеріально ефективну кількість дози. Сполуки відповідно до даного винаходу переважно вводять перорально у вигляді твердих або рідких дозованих форм. При місцевому лікуванні ефективну кількість сполуки формули І змішують з фармацевтично прийнятним наповнювачем у вигляді гелю або крему, які можуть бути нанесені на шкіру пацієнтів у ділянці лікування. Приготування вказаних кремів і гелів добре відоме з рівня техніки і може передбачати включення засобів, які поліпшують пенетрацію. Оксазолідинонові протибактеріальні засоби даного винаходу володіють застосовною активністю проти різних організмів. Активність in vitro сполук даного винаходу може бути оцінена стандартними тестовими процедурами, такими як визначення мінімальної інгібуючої концентрації (МІС) шляхом розбавлення агаром, [як описано в "Approved Standard Methods for Dilution Antimicrobial Susceptibility Test for Bacteria That Grow Aerobically", 3-є вид., опубліковане у 1993 National Committee for Clinical Laboratory Standards, Villanova, Pennsylvania, США]. Сполуки формули І можуть бути одержані способами, відомими фахівцям у даній галузі. Наприклад, сполуки формули І можуть бути синтезовані за схемою І, як показано нижче. 80326 12 Відповідно до схеми І, функціоналізований нітрооксиндол А (X=О) алкілують алкілгалогенідом або складним ефіром сульфонатом у присутності основи, такої як 1,8-діазобіцикло[5.4.0]ундец-7-ен (DBU) або карбонату калію з утворенням оксиндолу В. Шляхом відновлення нітрогрупи В, використовуючи, наприклад, каталітичне гідрування над паладієвим або платиновим каталізатором, одержують амінооксиндол С. Перетворення амінооксиндолу С у сполуки даного винаходу може бути досягнуто відомими способами або як описано у схемах нижче. Наприклад, як описано у схемі II, амінооксиндол С може бути оброблений алкілхлорформіатом у присутності відповідної основи, такої як бікарбонат натрію, з утворенням проміжного карбамату D. Подальша обробка 2(S)ацетиламіно-1-(хлорметил)етилацетатом [Tet. Lett, 1996, 37 (44), 7937-7940] у присутності основи, такої як трет-бутилат літію, у розчиннику, такому як диметилфорамід, при температурі від приблизно 0°С до 25°С дає 5(ацетиламінометил)оксазолідинон-оксиндол Ε (W=О, R1=метил). Більш загальний синтез вказаних 5(ациламінометил)оксазолідинон-оксиндолів, виходячи з карбамату D, показаний також на схемі II. Обробка літієвою основою, такою як н-бутиллітій або гексаметилдисилазид літію, у розчиннику, такому як тетрагідрофуран, при температурі звичайно в інтервалі від -78°С до -40°С дає літійоване похідне, яке відразу обробляють (R)гліцидилбутиратом і нагрівають до кімнатної температури, одержуючи 5(гідроксиметил)оксазолідинон-оксиндол F. Гідроксигрупу потім перетворюють у відповідну відхідну групу (Lg), таку як алкіл- або арилсульфонат, використовуючи реагенти алкіл- або арилсульфонілхлорид, у присутності аміну, що зв'язує кислоту, такого як триетиламін, у розчиннику, такому як дихлорметан або тетрагідрофуран. Відхідну групу потім витісняють сіллю азиду (наприклад, азидом натрію) у розчиннику, такому як ацетон або диметилсульфоксид, при температурі звичайно в інтервалі приблизно від 25°С до 75°С і одержаний алкілазид потім відновлюють, одержуючи проміжний 5-(амінометил)оксазолідинон Н. Останній може бути підданий, наприклад, каталітичному гідруванню або шляхом реакції азиду з трифенілфосфіном у розчиннику, такому як тетрагідрофуран, перетворений в імінофосфоран, який потім гідролізують до аміну при температурах приблизно від 20°С до 60°С при додаванні води. Амін потім ацилюють (W=О) або тіоацилюють (W=S), використовуючи способи, відомі фахівцеві у даній галузі, одержуючи цільову структуру Е. 13 80326 14 Структура G може просто реагувати з het2-H у формі вільної основи або у формі аніону het2-, утвореного з вільної основи, і утворювати цільову структуру J. Альтернативний спосіб для 1,2,3триазолів (наприклад, структури L) передбачає перетворення структури G в азид K (як описано у схемі II) з подальшим циклоприєднанням норборнадієну. [Див. також International Publications WO 99/64417 і WO 00/21960, WO 01/81350] для додаткових шляхів синтезу структури J. На схемі III нижче наведені загальні способи одержання сполук формули І, в яких А= оксазолідинону, n=1 і Ζ=NHhet1, Ohet1 або Shet1. Вихідними речовинами для вказаної процедури є гідроксиметилпохідні F (описані у попередній схемі), а перетворення вказаних проміжних продуктів у кінцеві сполуки І відомі у техніці [див. Gravestock, M.B., International Publications WO 99/64417 і WO 00/21960]. Спочатку гідроксигрупу перетворюють у групу (Lg), що витісняється, таку як алкіл- або арисульфонат, бромід або йодид. Вказане активування може бути здійснене відповідно до способів, відомих фахівцям у даній галузі і як описано на схемі II. Потім активоване гідроксипохідне вводять у реакцію зі сполукою формули HN(Pg)het1, HOhet1, HShet1 або з відповідними солями алкоголятів металів M-N(Pg)het1, M-Ohet1, M-Shet1, де Μ являє собою лужний метал або інший метал, відомий як промотор О-алкілування (наприклад, срібло) і "Pg" являє собою відповідну захисну групу. У вигляді альтернативи вихідна речовина може бути введена у реакцію зі сполукою формули HN(Pg)het', HOhet1, HShet1 при активуванні типу Міцунобу у присутності, наприклад, вільного або зв'язаного з полімером трифенілфосфіну і діетил(або діізопропіл)азоди-карбоксилату. Як кінцеву стадію проводять видалення захисної групи, використовуючи відомі способи. Схема IV нижче описує вибрані способи одержання сполук формули І, в яких А= оксазолідинону, n=1 і Ζ=her2. Одержання вказаних аналогів з активованих гідроксиметилоксазолідинонів G відоме у техніці [див. Gravestock, M.B., Betts, M.J., і Griffin, D.A., International Publications WO 01/81350]. Схема V ілюструє загальний спосіб одержання сполук формули І, де А= оксазолідинону, n=1 і Ζ=C(=O)NHR1. Аніліни С (див. схему І) можуть бути перетворені в алкілові ефіри оксазолідинон-5карбонової кислоти Μ двостадійним способом. Спочатку обробка aлкiл-(2R)-eпoкcипpoпaнoaтoм (або гліцидатом) і трифлатом літію у прийнятному розчиннику, такому як ацетонітрил, при прийнятній температурі, звичайно в інтервалі від 20°С до 110°С в залежності від розчинника, дає проміжний аміноспирт внаслідок приєднання азоту аніліну до кінцевого вуглецю епоксидного циклу. Подальша обробка 1,1'-карбонілдіімідазолом у розчиннику, такому як ацетонітрил або ТГФ, при відповідній температурі, звичайно в інтервалі від 20°С до 60°С, або фосгеном у розчиннику, такому як толуол або метиленхлорид або їх суміші, у присутності основи, такої як триетиламін, при відповідній температурі, звичайно в інтервалі від -10°С до 25°С, приводить потім до одержання проміжного оксазолідинону Μ (R8=C1-4-алкіл). Вказана структура може бути перетворена у цільову структуру Ν, використовуючи способи, добре відомі фахівцеві у даній галузі, наприклад, взаємодією з амінами або похідними амінів (R1NH2) у прийнятному розчиннику, такому як метанол. Прийнятні проміжні продукти, застосовні при одержанні сполук формули І, і додаткові способи синтезу для використання в одержанні сполук формули І можуть бути знайдені, наприклад, у насту 15 пних публікаціях, кожна з яких наведена тут як посилання. [Патент США No.5164510; заявка РСТ і публікації WO 95/07271, WO 00/21960, WO 99/40094, WO 99/64417, WO 99/64416, WO 00/21960 і WO 01/81350; Європейський патент No.ЕР 738726 і патент Німеччини No.DE 19802239.] Прикладами сполук винаходу є, але цим не обмежуються: (5R)-(-)-3-(3,3-дифтop-2,3-дигiдpo-1-мeтил-2oкco-1H-індoл-5-iл)-N-мeтил-2-оксо-5оксазолідинкарбоксамід; (5R)-(-)-3-(3,3-дифтop-2,3-дигiдpo-1-мeтил-2oкco-1H-iндoл-5-iл)-2-oкco-5оксазолідинкарбоксамід; (5R)-(-)-3-(3,3-дифтор-2,3-дигідро-1-етил-2оксо-1Н-індол-5-іл)-2-оксо-5оксазолідинкарбоксамід; (5R)-(-)-3-(3,3-дифтop-2,3-дигiдpo-1-eтил-2oкco-1H-iндoл-5-iл)-N-мeтил-2-оксо-5оксазолідинкарбоксамід; N-[[(5S)-(-)-3-(3,3-дифтор-2,3-дигідро-1-метил2-оксо-1H-індол-5-іл)-2-оксо-5оксазолідиніл]метил]ацетамід; і N-[[(5S)-(-)-3-(3,3-дифтор-2,3-дигідро-1-етил-2оксо-1Н-індол-5-іл)-2-оксо-5-оксазолідиніл] метил] ацетамід. У деяких варіантах виконання протибактеріальні сполуки є проліками сполук формули І. Вираз "проліки" означає похідне відомого безпосередньо діючого лікарського засобу, який перетворюється в активний лікарський засіб у результаті ферментативного або хімічного процесу. Проліки сполук формули І одержують модифікуванням функціональних груп, присутніх у сполуці, таким чином, щоб модифікації розщеплювалися або при звичайній маніпуляції, або in vivo до вихідної сполуки. Проліками є, але цим не обмежуються, сполуки будови (І), в яких гідроксильна, аміно- або сульфгідрильна групи зв'язані з будь-якою групою таким чином, щоб при введенні тварині вона розщеплювалася з утворенням вільного гідроксилу, аміно- або сульфгідрильної групи, відповідно. Зразковими прикладами проліків є, але цим не обмежуються, ацетатні, форміатні і бензоатні похідні спиртових або амінних функціональних груп. [Див. Notari, R.E., "Theory and Practice of Prodrug Kinetics", Methods in Enzymology, 112: 309-323 (1985); Bodor, N., "Novel Approaches in Prodrug Design", Drugs of Future, 6(3): 165-182 (1981); і Bundgaard, H., "Design of Prodrugs: Bioreversible-Derivaties for Various Functional Groups and Chemical Entities", in Designes of Prodrugs (H. Bundgaard, вид.), Eisevier, N. Y. (1985).] Приклади Вважають, що без додаткових досліджень фахівець у даній галузі, використовуючи попередні описи, може у повній мірі здійснити даний винахід. Наступні докладні приклади описують, яким чином одержують різні сполуки і/або здійснюють різні способи винаходу, і є тільки ілюстративними і жодним чином не обмежують винахід. Фахівець у даній галузі зможе розпізнати відповідні варіанти як відносно реагентів, так і відносно умов реакцій і обладнання. 80326 16 Приклад 1 (5R)-(-)-3-(3,3-дифтор-2,3-дигідро-1метил-2-оксо-1Н-індол-5-іл)-N-метил-2-оксо-5оксазолідинкарбоксамід Стадія 1: Одержання 3,3-дифтор-1-метил-5нітро-1,3-дигідро-2Н-індол-2-ону Розчин 3,3-дифтор-5-нітро-1,3-дигідро-2Ніндол-2-ону 2 (Tetrahedron, 1999, 55, 1881-92, 7,05г, 32,9ммоль) у безводному Ν,Νдиметилформаміді (66мл) в атмосфері N2 по краплях обробляють 1,8-діазабіцикло[5.4.0]ундец-2еном (6,40мл, 42,8ммоль) і потім йодометаном (2,46мл, 39,5ммоль). Реагуючу слабо екзотермічно реакційну суміш перемішують при звичайній температурі протягом 18 год., розбавляють водою з льодом (100мл) і фільтрують, одержуючи вказану у заголовку сполуку 3, т.пл. 131,5-134,5°С Стадія 2: Одержання 5-аміно-3,3-дифтор-1метил-1,3-дигідро-2Н-індол-2-ону Суміш 3,3-дифтор-1-метил-5-нітро-1,3-дигідро2Н-індол-2-ону 3 (стадія 1, 3,80г, 16,6ммоль) і оксиду платини (188мг, 0,828ммоль, 5мол.%) у суміші 1:1 ТГФ/МеОН (100мл) струшують на апараті Parr під тиском водню 20фунт/кв. дюйм протягом 1,5год. Каталізатор потім видаляють фільтруванням через подушку целіту і фільтрат концентрують при зниженому тиску, одержуючи вказану у заголовку сполуку 4, MS (ESI+) для C9H8N2OF2 m/z 199 (М+Н)+, яка може бути використана без додаткового очищення. Очищенням хроматографією на силікагелі (елюент 40%-на суміш EtOAc/гептан) одержують зразок для аналізу, т.пл. 186-9°С. Стадія 3: Одержання бутил (5R)-3-(3,3дифтop-2,3-дигiдpo-1-мeтил-2-oкco-1Н-індол-5-іл)2-оксо-5-оксазолідинкарбоксилату Суміш 5-аміно-3,3-дифтор-1-метил-1,3дигідро-2Н-індол-2-ону 4 (стадія 2, 4,50г, 22,7ммоль) і бутил(2R)-гліцидату (3,60г, 25,0ммоль) у сухому ацетонітрилі (11,4мл) в атмосфері N2 нагрівають до 70°С при енергійному перемішуванні і відразу обробляють трифторметан 17 сульфонатом літію (3,89г, 25,0ммоль). Одержану суміш нагрівають до слабкого кипіння, кип'ятять зі зворотним холодильником протягом 1,5 год. і потім концентрують при зниженому тиску. Суміш продуктів виливають у 10%-ну суміш МеОН/СН2СІ 2 (150мл), промивають водою (100мл) і розсолом (50мл), сушать над безводним сульфатом натрію і концентрують при зниженому тиску, одержуючи сирий проміжний аміноспирт [MS (ESI+) для C16H20N2O4F2 m/z 343 (М+Н)+], який використовують без додаткового очищення. Розчин вказаної проміжної сполуки у сухому ацетонітрилі (113мл) в атмосфері N2 обробляють 1,1'карбонілдіімідазолом (5,52г, 34,1ммоль) і реакційну суміш перемішують при звичайній температурі протягом 24год. Розчинник видаляють при зниженому тиску і залишок вносять у СН2С12 (125мл), промивають водною хлористоводневою кислотою (0,2М, 3´50мл) і розсолом (50мл), сушать над безводним сульфатом натрію, концентрують при зниженому тиску і хроматографують на двох патронах з силікагелем масою 90г Biotage Flash 40M, елююючи сумішшю EtOAc/CH2Cl2 (3/97). Об'єднанням і концентруванням фракцій з Ff=0,40 шляхом ТШХ (суміш EtOAc/гексан, 50/50) одержують вказану у заголовку сполуку 5 MS (ESI+) для C17H18N2O5F2 m/z 369 (М+Н)+; 1НЯМР (400МГц, ДМСО-d6) δ 7,96 (м, 1H), 7,76 (дд, 1Н), 7,28 (д, 1H), 5,34 (дд, 1Н), 4,41 (т, 1Н), 4,18 (м, 3Н), 3,19 (с, 3Н), 1,62 (квінт, 2Н), 1,35 (секст, 2Н), 0,90 (т, 3Н). Стадія 4: Одержання (5R)-(-)-3-(3,3-дифтop2,3-дигiдpo-1-мeтил-2-oкco-1H-індол-5-іл)-N-метил2-оксо-5-оксазолідинкарбоксаміду Бутил (5R)-3-(3,3-дифтор-2,3-дигідро-1-метил2-оксо-1Н-індол-5-іл)-2-оксо-5оксазолідинкарбоксилат 5 (стадія 3, 5,55г, 15,1ммоль) обробляють 2М MeNH2 у МеОН (151мл) при енергійному перемішуванні. Одержану суспензію перемішують при звичайній температурі протягом 1год. і осаджений продукт відділяють фільтруванням, одержуючи вказану у заголовку сполуку 1, т.пл. 242,5-245°С; MS (ESI+) для C14H13N3O4F2 m/z 326 (М+Н)+; [□]25D -39 (с 0,95, ДМСО). Приклад 2 (5R)-(-)-3-(3,3-дифтор-2,3-дигідро-1метил-2-оксо-1H-індол-5-іл)-2-оксо-5оксазолідинкарбоксамід Бутил (5R)-3-(3,3-дифтop-2,3-дигiдpo-1-мeтил2-oкco-1H-iндoл-5-iл)-2-oкco-5оксазолідинкарбоксилат 5 (Приклад 1, стадія 4, 340мг,0,923ммоль) при енергійному перемішуван 80326 18 ні обробляють 7н NH3 у МеОН (9,2мл). Одержану суспензію перемішують при звичайній температурі протягом 1год., розбавляють простим діетиловим ефіром (5мл) і осаджений продукт виділяють фільтруванням, одержуючи вказану у заголовку сполуку 6, т.пл. 274-7°С (розкл.); MS (ESI-) для C13H11N3O4F2 m/z 310 (М-Н) -; [□]25D -22 (с 0,95, ДМСО). Приклад 3 (5R)-(-)-3-(3,3-дифтор-2,3-дигідро-1етил-2-оксо-1Н-індол-5-іл)-2-оксо-5оксазолідинкарбоксамід Стадія 1: Одержання 3,3-дифтор-1-етил-5нітро-1,3-дигідро-2Н-індол-2-ону Дотримуючись Прикладу 1, стадії 1, і здійснюючи несуттєві зміни, тільки замінюючи йодметан на йодетан, одержують вказану у заголовку сполуку 8, т.пл. 111-2°С. Стадія 2: Одержання 5-аміно-3,3-дифтор-1етил-1,3-дигідро-2Н-індол-2-ону Дотримуючись Прикладу 1, стадії 2, і здійснюючи несуттєві зміни, тільки замінюючи 3,3-дифтор1-метил-5-нітро-1,3-дигідро-2Н-індол-2-он 3 на 3,3дифтор-1-етил-5-нітро-1,3-дигідро-2Н-індол-2-он 8, одержують вказану у заголовку сполуку 9, т.пл. 124-7°С; MS (ESI+) для C10H10N2OF2 m/z 213 (М+Н)+. Стадія 3: Одержання бутил (5R)-3-(3,3дифтop-2,3-дигiдpo-1-eтил-2-oкco-1H-індол-5-іл)-2оксо-5-оксазолідинкарбоксилату Суміш 5-аміно-3,3-дифтор-1-етил-1,3-дигідро2Н-індол-2-ону 9 (стадія 2, 2,715мг, 3,37ммоль) і бутил-(2R)-гліцидату (729мг, 5,05ммоль) у сухому ацетонітрилі (13,5мл) в атмосфері N2 обробляють трифторметансульфонатом літію (788мг, 5,05ммоль). Одержану суміш нагрівають до 75°С, перемішують при вказаній температурі протягом 20год. і потім концентрують при зниженому тиску. Суміш продуктів вміщують у 10%-ну суміш МеОН/СН2Сl2 (40мл), промивають водою (20мл) і розсолом (20мл), сушать над безводним сульфатом натрію і концентрують при зниженому тиску, 19 одержуючи сирий проміжний аміноспирт [MS (ESI+) для C17H22N2O4F2 m/z 357 (М+Н)+], який використовують без додаткового очищення. Розчин вказаної проміжної сполуки у сухому ацетонітрилі (34мл) в атмосфері N2 обробляють 1,1'карбонілдіімідазолом (820мг, 5,05ммоль) і реакційну суміш перемішують при звичайній температурі протягом 4 днів. Розчинник видаляють при зниженому тиску, і залишок вміщують в СН2Сl2 (50мл), промивають водною хлористоводневою кислотою (0,1М, 2´25мл) і розсолом (25мл), сушать над безводним сульфатом натрію, концентрують при зниженому тиску і хроматографують на патроні з силікагелем масою 90г Biotage Flash 40M, елююючи сумішшю EtOAc/CH2Cl2 (5/95). Об'єднанням і концентруванням фракцій з Rf=0,48 шляхом ТШХ (суміш EtOAc/гексан, 50/50) одержують вказану у заголовку сполуку 10, MS (ESI+) для C18H20N2O5F2 m/z 383 (М+Н)+; 1Н ЯМP (400МГц, ДМСО-d6) δ 7,96 (м, 1Н), 7,75 (дд, 1H), 7,35 (д, 1Н), 5,34 (дд, 1Н), 4,41 (т, 1H), 4,18 (м, 3Н), 3,75 (кв, 2Н), 1,62 (квінт, 2Н), 1,35 (секст, 2Н), 1,18 (τ, 3N), 0,90 (т, 3Н). Стадія 4: Одержання (5R)-(-)-(3,3-дифтop-2,3дигiдpo-1-eтил-2-oкco-1H-iндoл-5-іл)-2-оксо-5оксазолідинкарбоксаміду Розчин бутил (5R)-3-(3,3-дифтop-2,3-дигiдpo-1eтил-2-oкco-1H-iндoл-5-iл)-2-оксо-5оксазолідинкарбоксилату 10 (стадія 3, 440мг, 1,15ммоль) у МеОН (5мл) обробляють 2М ΝN3 у МеОН (11,5мл) і суміш перемішують при звичайній температурі протягом 1год. Розчинник видаляють при зниженому тиску і суміш продуктів хроматографують на патроні з силікагелем масою 40г Biotage Flash 40S, елююючи сумішшю МеОН/СН2Сl2 (2/98). Об'єднанням і концентруванням фракцій з Rf=0,35 шляхом ТШХ (суміш МеОН/СНСl3, 10/90), розтиранням у порошок і фільтруванням з суміші CH2Cl2/Et2O виділяють вказану у заголовку сполуку 7, т.пл. 201-3°С; MS (ESI+) для C14H13N3O4F2 m/z 326 (М+Н)+; [□]25D -20 (с 0,94, ДМСО). Приклад 4 (5R)-(-)-3-(3,3-Дифтор-2,3-Дигідро1-етил-2-оксо-1Н-індол-5-іл)-N-метил-2-оксо-5оксазолідинкарбоксамід Дотримуючись Прикладу 1, стадії 4, і здійснюючи несуттєві зміни, тільки замінюючи бутил (5R)3-(3,3-дифтор-2,3-дигідро-1-метил-2-оксо-1Ніндол-5-іл)-2-оксо-5-оксазолідинкарбоксилат 5 на бутил (5R)-3-(3,3-дифтор-2,3-дигідро-1-етил-2оксо-1Н-індол-5-іл)-2-оксо-5 80326 20 оксазолідинкарбоксилат 10 (Приклад 3, стадія 3), одержують вказану у заголовку сполуку 11, т.пл. 211-213°С; MS (ESI+) для C15H15N3O4F2 m/z 340 (М+Н)+; [□]25D -36 (с 1,02, ДМСО). Приклад 5 N-[[(5S)-(-)-(3,3-дифтор-2,3-дигідро1-метил-2-оксо-1H-індол-5-іл)-2-оксо-5оксазолідиніл]метил]ацетамід Стадія 1: Одержання бензил 3,3-дифтор-1метил-2-оксо-2,3-дигідро-1H-індол-5-ілкарбамату Суміш 5-аміно-3,3-дифтор-1-метил-1,3дигідро-2Н-індол-2-ону 4 (Приклад 1, стадія 2, 300мг, 1,51ммоль) у суміші ТГФ/Н2О (2:1, 7,5мл) обробляють бікарбонатом натрію (254мг, 3,02ммоль) і далі бензиловим ефіром хлормурашиної кислоти (226мкл, 1,59ммоль); двофазову суміш перемішують при звичайній температурі протягом 18 год. Реакційну суміш розбавляють Н2О (10мл) і екстрагують ЕtOАс (20мл); органічну фазу промивають Н2О (10мл) і розсолом (10мл), сушать над безводним сульфатом магнію і концентрують при зниженому тиску. Залишок перекристалізовують з суміші ЕtOАс/гексан, одержуючи вказану у заголовку сполуку 13, т.пл. 174-175,5°С; MS (ESI+) для C17H14N2O3F2 m/z 333 (М+Н)+. Стадія 2: Одержання N-[[(5S)-(-)-3-(3,3дифтор-2,3-дигідро-1-метил-2-оксо-1H-індол-5-іл)2-оксо-5-оксазолідиніл]метил]ацетаміду Суміш бензил 3,3-дифтор-1-метил-2-оксо-2,3дигідро-1H-індол-5-ілкарбамату 13 (стадія 1, 300мг, 0,903ммоль), (1S)-2-(ацетаміно)-1(хлорметил)етилацетату (350мг, 1,81ммоль) і МеОН (73мкл, 1,81ммоль) у сухому ДМФА (0,6мл) в атмосфері N2 охолоджують на льодяній бані і по краплях обробляють LiOtBu (1Μ у гексані, 2,71мл, 2,71ммоль) протягом 5хв. Одержану двофазову суміш перемішують при 0°С протягом 30хв. і при звичайній температурі протягом 21год. і потім гасять льодяною оцтовою кислотою (104мкл, 2еквів.), розбавляють МеОН (5мл) і шари розділяють. Шар суміші МеОН/ДМФА потім розбавляють Н2О (15мл) і екстрагують ЕtOАс (3´25мл) і об'єд 21 80326 наний EtOAc-шар промивають Н2О (2´20мл) і розсолом (20мл), сушать над безводним сульфатом магнію і концентрують при зниженому тиску. Залишок хроматографують з силікагелем масою 40г Flash 40S, елююючи сумішшю МеОН/СН2Сl2 з перепадом (2/98-4/96), і фракції з Rf=0,20 шляхом ТШХ (суміш МеОН/СНСl3, 5/95) об'єднують і концентрують, одержуючи вказану у заголовку сполуку 12, т.пл. 125-127°С; MS (ESI+) для C15H15N3O4F2 m/z 340 (М+Н)+. Приклад 6 N-[[(5S)-(-)-3-(3,3-дифтор-2,3дигідро-1-етил-2-оксо-1Н-індол-5-іл)-2-оксо-5оксазолідиніл] метил] ацетамід Стадія 1: Одержання бензил 3,3-дифтор-1етил-2-оксо-2,3-дигідро-1Н-індол-5-ілкарбамату Дотримуючись Прикладу 5, стадії 1, і здійснюючи несуттєві зміни, тільки замінюючи 5-аміно-3,3дифтор-1-метил-1,3-дигідро-2Н-індол-2-он 4 на 5аміно-3,3-дифтор-1-етил-1,3-дигідро-2Н-індол-2-он 9 (Приклад 3, стадія 2), одержують вказану у заголовку сполуку 15, т.пл. 152-154°С; MS (ESI-) для C18H16N20O3F2 m/z 345 (М-Н) -. Стадія 2: Одержання N-[[(5S)-(-)-3-(3,3дифтор-2,3-дигідро-1-етил-2-оксо-1Н-індол-5-іл)-2оксо-5-оксазолідиніл]метил]ацетаміду 22 CH2Cl2/Et2O з подальшим хроматографуванням, одержують вказану у заголовку сполуку 14, т.пл. 139-141°С; MS (ESI+) для C16H17N3O4F2 m/z 354 (М+Н)+; [□]25D -22 (с 0,98, ДМСО). Протибактеріальна активність: Спосіб визначення мінімальної інгібуючої активності МІС МІС in vitro випробовуваних сполук визначали стандартним методом розбавлення в агаровому гелі. Готували розчин вихідної лікарської речовини кожного аналога у переважному розчиннику, звичайно у суміші ДМСО:Н2О (1:3). Серійні 2-разові розбавлення кожного зразка здійснювали, використовуючи 1,0мл аліквоти стерильної дистильованої води. До кожної 1,0мл аліквоти лікарської речовини додавали 9мл рідкого агарового середовища Mueller Hinton. Завантажений лікарською речовиною агар перемішували, виливали у 15´100мм чашку Петрі і залишали для твердіння і висихання перед інокуляцією. Пробірки кожного з випробовуваних організмів витримували замороженими у паровій фазі морозильника з рідким азотом. Випробовувані культури залишали на ніч при 35°С на середовищі відповідного організму. Колонії збирали стерильним тампоном і клітинну суспензію готували у бульйоні соєвої триптикази (TSB) до каламутності 0,5 стандарту McFarland. Розбавлення кожної суспензії 1:20 проводили у TSB. Чашки Петрі, що містять завантажений лікарською речовиною агар, інокулювали 0,001мл краплею клітинної суспензії, використовуючи реплікатор Steers, даючи приблизно від 104 до 105 клітин на пляму. Чашки Петрі інкубували протягом ночі при 35°С. У процесі інкубації були зареєстровані і відмічені наступні мінімальні інгібуючі концентрації (МІС мкг/мл), найменші концентрації лікарської речовини, які інгібують видимий ріст організму. Дані наведені у таблиці. Таблиця Приклад No. 1 2 3 4 5 6 Дотримуючись Прикладу 5, стадії 2, і здійснюючи несуттєві зміни, тільки замінюючи бензил 3,3дифтор-1-метил-2-оксо-2,3-дигідро-1Н-індол-5ілкарбамат 13 на бензил 3,3-дифтор-1-етил-2оксо-2,3-дигідро-1Н-індол-5-ілкарбамат 15 (стадія 1), і перекристалізовуючи продукт з суміші Комп’ютерна верстка Т. Чепелева а b Сполука No. 1 6 7 11 12 14 SAUR 9213а SPNE 9912b МІС МІС 2 2 2 1-2 8 4 8 4 2 1 8 2 S. aureus S. pneumonias Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюAntibacterial indolone oxazolidinones, intermediates for their preparation and pharmaceutical compositions containing them
Автори англійськоюPoel Toni-Jo
Назва патенту російськоюПротивобактериальные индолоноксазолидиноны, промежуточные соединения для их получения и фармацевтическая композиция, которая их содержит
Автори російськоюПоел Тони-Джо
МПК / Мітки
МПК: A61P 31/04, C07D 405/04, C07D 413/04, C07D 209/32
Мітки: одержання, композиція, проміжні, містять, протибактеріальні, індолоноксазолідинони, фармацевтична, сполуки
Код посилання
<a href="https://ua.patents.su/11-80326-protibakterialni-indolonoksazolidinoni-promizhni-spoluki-dlya-kh-oderzhannya-i-farmacevtichna-kompoziciya-shho-kh-mistyat.html" target="_blank" rel="follow" title="База патентів України">Протибактеріальні індолоноксазолідинони, проміжні сполуки для їх одержання і фармацевтична композиція, що їх містять</a>
Попередній патент: Аналізатор опору двопровідних електричних мереж до 1000 в
Наступний патент: Спосіб відтирки сипкого матеріалу та установка для його здійснення
Випадковий патент: Конічний ежекційний скрубер з рухомою насадкою