Похідні піперидин-4-ілпіридазин-3-іламіну як швидко дисоціюючі антагоністи рецептора дофаміну 2
Номер патенту: 94058
Опубліковано: 11.04.2011
Автори: Кенніс Лудо Едмонд Джозефін, Де Браян Марсель Франс Леопольд, МакДональд Грегор Джеймс, Ланглуіс Ксав'єр Джін Майкл, ван Роосброеск Явес Еміль Марія, ван ден Кейбус Франс Альфонс Марія
Формула / Реферат
1. Сполука формули (І)
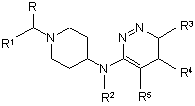 (I)
(I)
або її фармацевтично прийнятна сіль, гідрат або сольват або її стереоізомерна форма, в якій
R являє собою водень або С1-6алкіл;
R1 являє собою феніл, заміщений 1, 2 або 3 замісниками, кожний з яких незалежно вибраний з групи, що включає водень, галоген, ціано, С1-4алкіл, С1-4алкілокси, перфторС1-4алкіл, діС1-4алкіламіно; тієніл, заміщений 1 або 2 замісниками, вибраними з групи, що включає галоген та С1-4алкіл; С3-8циклоалкіл або С5-7циклоалкеніл;
R2 являє собою водень або С1-6алкіл;
R3 являє собою галоген, С1-4алкіл або перфторС1-4алкіл, та
R4 та R5 кожний незалежно являє собою водень або галоген.
2. Сполука за п. 1, в якій R3 являє собою трифторметил, a R, R4 та R5 являють собою водень.
3. Сполука за п. 1, в якій R2 являє собою водень або метил.
4. Сполука за п. 1, в якій R1 являє собою 4-фторфеніл або 3,4-дифторфеніл.
5. Сполука за п. 1, де сполука являє собою N-[1-(4-фторбензил)піперидин-4-іл]-6-(трифторметил)піридазин-3-амін.
6. Сполука за п. 1, де сполука являє собою N-[1-(3,4-дифторбензил)піперидин-4-іл]-6-(трифторметил)піридазин-3-амін.
7. Фармацевтична композиція, що містить терапевтично ефективну кількість сполуки за п. 1.
8. Сполука за п. 1, призначена для застосування як лікарський засіб.
9. Сполука за п. 8, призначена для застосування як антипсихотичний засіб.
10. Сполука за п. 8, призначена для застосування як лікарський засіб для лікування або попередження шизофренії, шизофреноподібного розладу, шизоафективного розладу, маревного розладу, короткого психотичного розладу, загального психотичного розладу, психотичного розладу внаслідок загального медичного стану хворого, психотичного розладу, викликаного речовинами, психотичного розладу без додаткових уточнень, психозу, пов'язаного з деменцією, великого депресивного розладу, дистимічного розладу, передменструального дисфоричного розладу, депресивного розладу без додаткових уточнень, біполярного розладу І, біполярного розладу II, циклотимічного розладу, біполярного розладу без додаткових уточнень, розладу настрою внаслідок загального медичного стану хворого, розладу настрою, викликаного речовинами, розладу настрою без додаткових уточнень, генералізованого тривожного розладу, обсесивно-компульсивного розладу, панічного розладу, гострого стресового розладу, посттравматичного стресового розладу, розумової відсталості, загальних розладів психічного розвитку, розладу дефіциту уваги, розладу дефіциту уваги/гіперактивності, розладів з агресивною повною, розладів особистості параноїдного типу, розладів особистості шизоїдного типу, розладів особистості шизотипового типу, розладів, що супроводжуються тиками, синдрому Турета, залежності від ліків, зловживання алкоголем або наркотиками, синдрому відміни ліків, трихотиломанії.
11. Спосіб одержання сполуки формули (І)
 , (I)
, (I)
в якій R, R1-R5 є такими, як визначено в п. 1, згідно з яким проводять
(a) взаємодію проміжної сполуки формули (II)
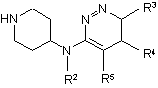 , (II)
, (II)
де R2-R3 є такими, як визначено в п. 1, з проміжною сполукою формули R1-C(=O)-R, де R та R1 визначені в п. 1, у присутності відновника та кислотного каталізатора в реакційно-інертному розчиннику.
12. Спосіб одержання сполуки формули (І)
 , (I)
, (I)
в якій R, R1-R5є такими, як визначено в п. 1,
згідно з яким проводять
взаємодію проміжного продукту формули (V)
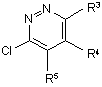 , (V)
, (V)
де R3-R5 є такими, як визначено в п. 1,
з проміжною сполукою формули (VII)
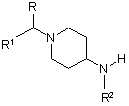 , (VII)
, (VII)
де R, R1 та R2 є такими, як визначено в п. 1,
в присутності основи в реакційно-інертному розчиннику.
Текст
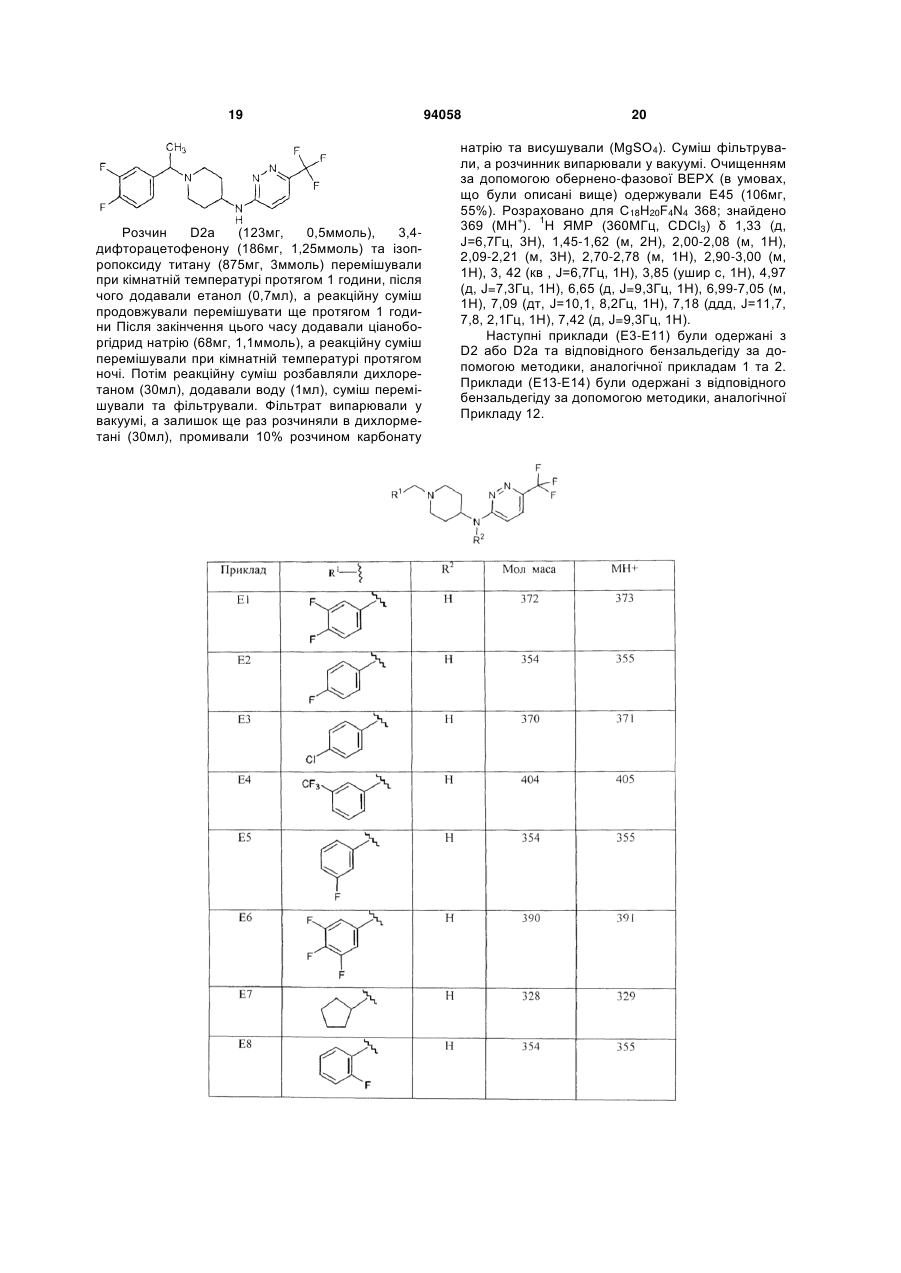
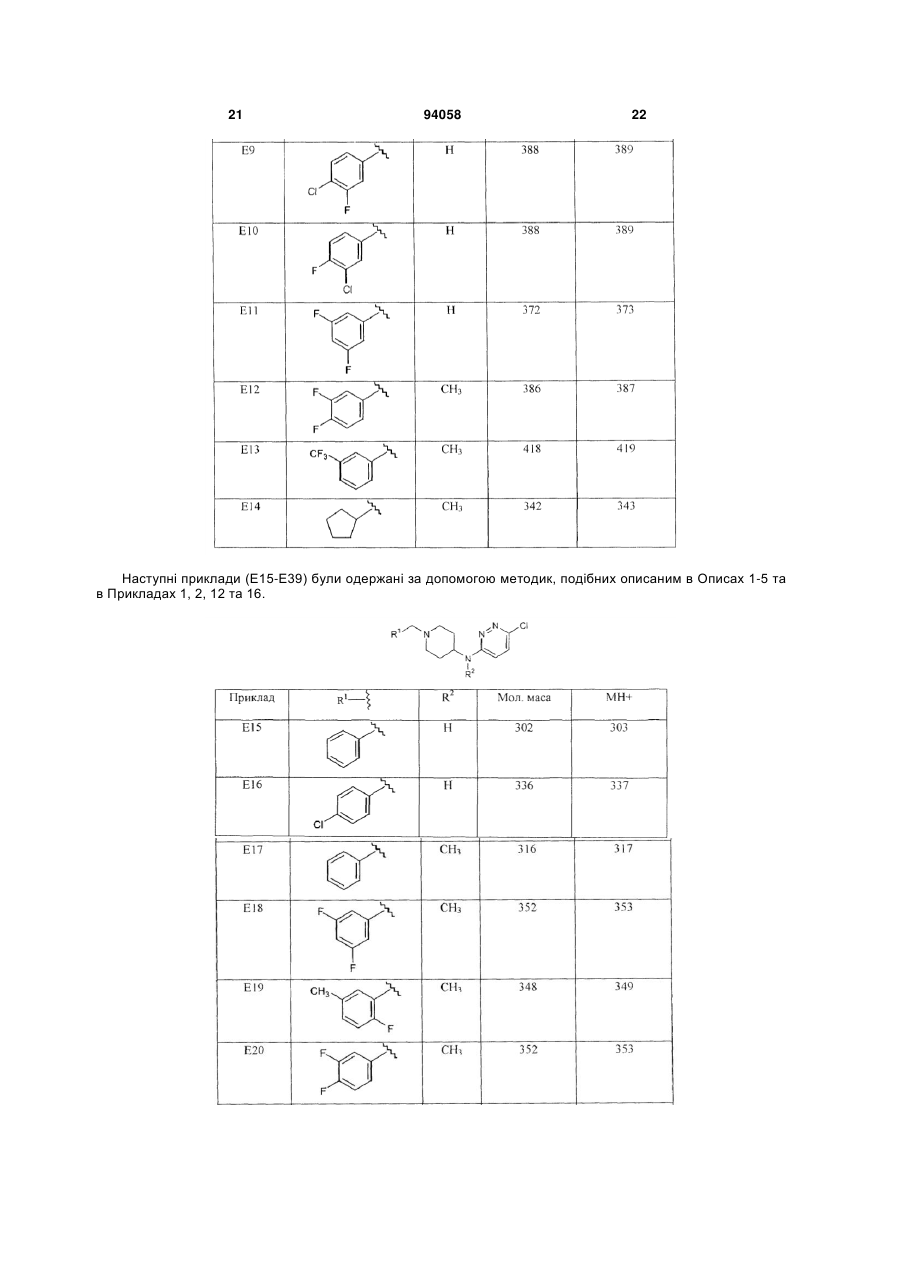
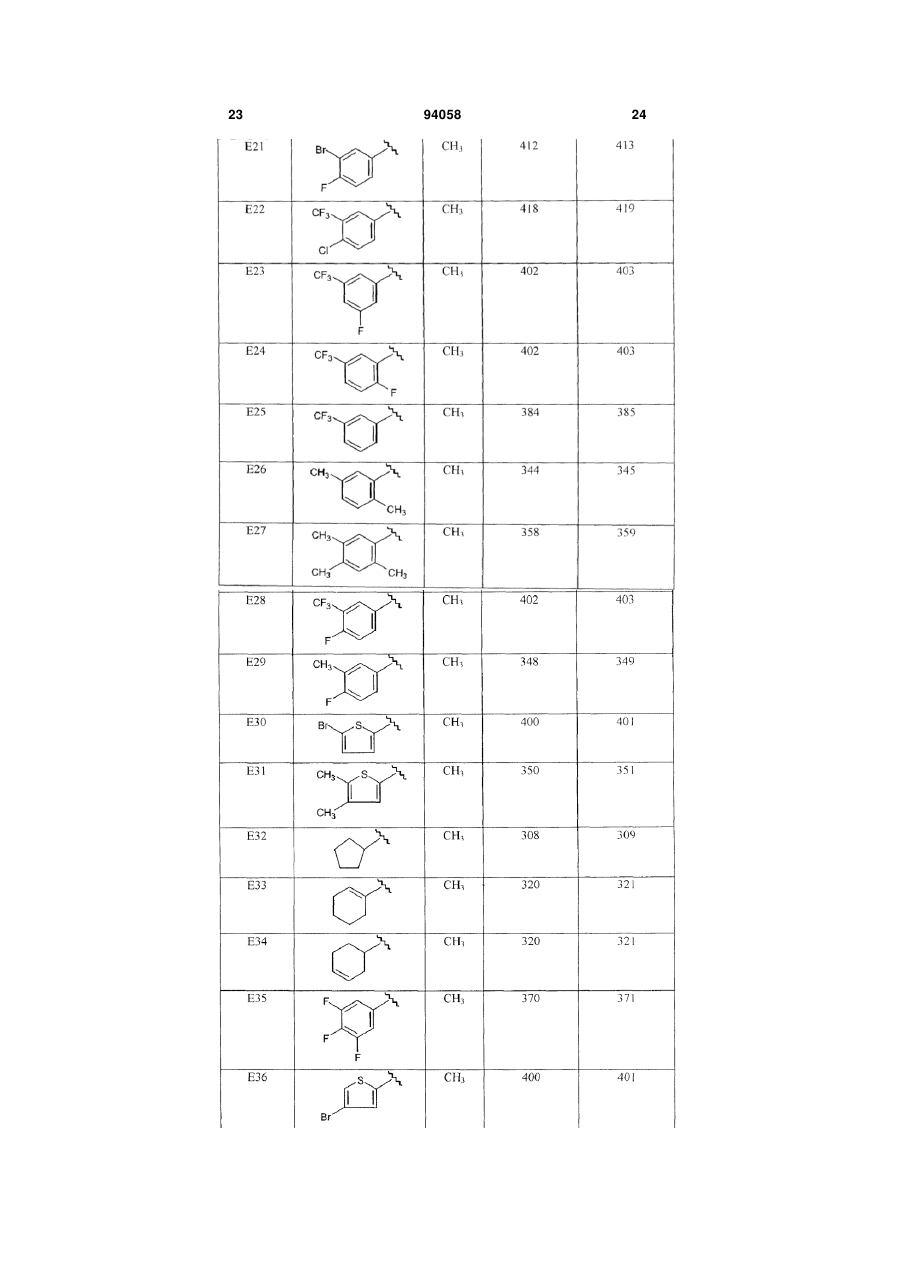
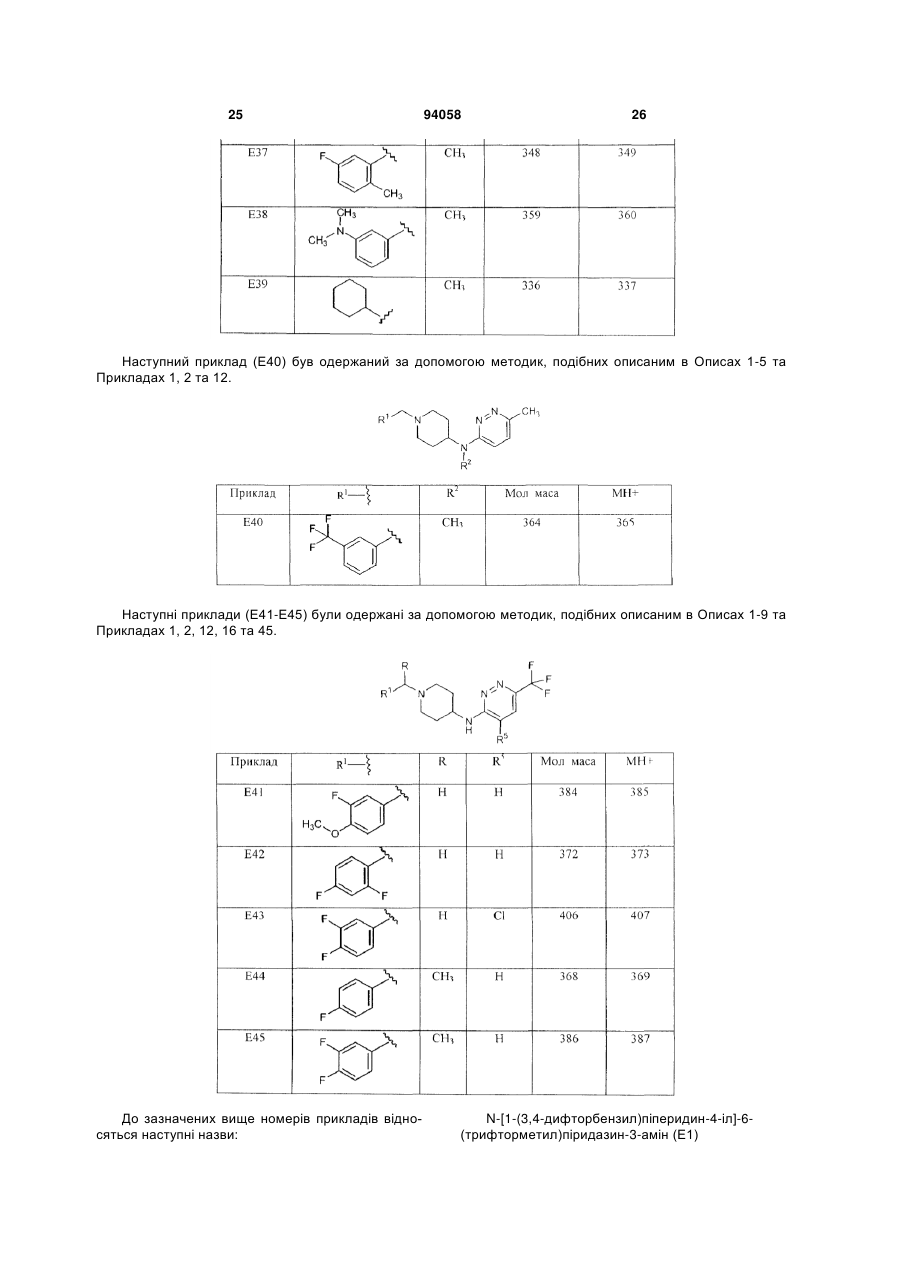
1. Сполука формули (І) 2 (19) 1 3 94058 панічного розладу, гострого стресового розладу, посттравматичного стресового розладу, розумової відсталості, загальних розладів психічного розвитку, розладу дефіциту уваги, розладу дефіциту уваги/гіперактивності, розладів з агресивною повною, розладів особистості параноїдного типу, розладів особистості шизоїдного типу, розладів особистості шизотипового типу, розладів, що супроводжуються тиками, синдрому Турета, залежності від ліків, зловживання алкоголем або наркотиками, синдрому відміни ліків, трихотиломанії. 11. Спосіб одержання сполуки формули (І) R R1 N N N 4 чені в п.1, у присутності відновника та кислотного каталізатора в реакційно-інертному розчиннику. 12. Спосіб одержання сполуки формули (І) R N R1 R2 R5 , (I) в якій R, R1-R5 є такими, як визначено в п.1, згідно з яким проводять (a) взаємодію проміжної сполуки формули (II) HN N N R3 R4 R5 , (I) в якій R, R -R є такими, як визначено в п.1, згідно з яким проводять взаємодію проміжного продукту формули (V) N N 5 R3 R4 R5 , (V) де R3-R5 є такими, як визначено в п.1, з проміжною сполукою формули (VII) R R1 N N N R3 R4 R2 1 R3 R4 N N Cl N N H , (II) де R2-R3 є такими, як визначено в п.1, з проміжною сполукою формули R1-C(=O)-R, де R та R1 визна R2 , (VII) де R, R1 та R2 є такими, як визначено в п.1, в присутності основи в реакційно-інертному розчиннику. Даний винахід відноситься до сполук, що є швидко дисоціюючими антагоністами рецепторів дофаміну 2, до способів одержання цих сполук та до фармацевтичних композицій, що містять ці сполуки як активний інгредієнт. Дані сполуки знаходять застосування як лікарські засоби для лікування або попередження захворювань центральної нервової системи, наприклад, шизофренії, виявляючи ангипсихотичний ефект без побічних моторних ефектів. Публікація в J. Med. Chem. (1999), 42(4), 730741 розкриває 6-феніл-N-[1-(фенілметил)-4піперидиніл]-3-піридазинамін та аналогічні сполуки як інгібітори ацетилхолінестерази. Публікація Farmaco, Vol. 35, no.11, 1980, pages 951-964 розкриває заміщені N-[4-піперидиніл]-2амінопіримідини, що мають дофамінергічну активність, тобто більшість розкритих сполук, є агоністами рецептора дофаміну D2. Оскільки жодна зі сполук при тестуванні не виявляла антагонізму до стереотипного поводження, викликаного наступною дозою апоморфіну, їх також можна розглядати як речовини, позбавлені властивості блокувати дофаміновий рецептор. Сполуки, розглянуті в даному винаході, відрізняються присутністю піридазину замість піримідину та несподіваною наявністю антагоністичної дії у відношенні рецептора дофаміну D2. Шизофренія - це важке та хронічне психічне захворювання, на яке страждає приблизно 1% населення. Клінічні симптоми очевидні у відносно ранньому віці та звичайно виявляються у підлітків або молодих людей. Симптоми шизофренії прийнято підрозділяти на так називані позитивні, вклю чаючи галюцинації, марення та дезорганізоване мислення, та так називані негативні, включаючи соціальну самоізоляцію, включаючи зниження емоціональних реакцій, убогість мови та нездатність до насолоди. Крім того, хворі на шизофренію страждають когнітивними порушеннями, такими як розлад уваги та пам'яті. Етіологія цього захворювання дотепер невідома, однак існує припущення про те, що в основі симптомів шизофренії лежать порушення дії нейротрансмітерів. Одна з найбільш обґрунтованих та часто розглянутих дофамінергічна гіпотеза побудована на тому припущенні, що за позитивні симптоми, що спостерігаються у хворих на шизофренію, відповідає перенос дофаміну. В основі цієї гіпотези лежать спостереження про те, що ліки та наркотики, що підсилюють дію дофаміну, наприклад, амфетамін або кокаїн, можуть індукувати психоз, та існуюча кореляція між клінічними дозами антипсихотичних засобів та їх потужністю в блокуванні рецепторів дофаміну D2. Терапевтична ефективність усіх випущених на фармацевтичний ринок антипсихотичних засобів проти позитивних симптомів шизофренії опосередкована блокуванням рецептора дофаміну D2. При виході за межі клінічної ефективності виявляється, що основні побічні ефекти антипсихотичних засобів, наприклад, екстрапірамідальні симптоми (EPS) та пізня дискінезія, також пов'язані з антагонізмом до дофаміну. Ці послаблюючі побічні ефекти найчастіше виявляються при використанні типових антипсихотичних засобів першого покоління, наприклад, галоперидолу. Вони виражені в меншому ступені при використанні атипових антипсихотичних засобів другого покоління, наприклад, R2 R5 5 рисперидону, оланзапіну, та навіть практично відсутні при лікуванні клозапіном, який прийнято вважати прототипом атипових антипсихотичних засобів. Серед різних теорій, запропонованих для пояснення зниженої частоти EPS при лікуванні атиповими антипсихотичними засобами, треба виділити мультирецепторну гіпотезу, що в останні п'ятнадцять років викликає до себе величезну увагу. Вона випливає з результатів досліджень рецепторного зв'язування, в яких було показано, що багато атипових антипсихотичних засобів, на додаток до рецепторів дофаміну D2, взаємодіють з іншими рецепторами нейротрансмітерів, особливо з рецепторами серотоніну 5-НТ2, тоді як типові антппсихотичні засоби, подібні до галоперидолу, більш вибірково зв'язуються з рецепторами D2. В останні роки ця теорія поставлена під сумнів, оскільки всі основні атипові антппсихотичні засоби в клінічно прийнятних дозах повністю захоплюють рецептори серотоніну 5-НТ2, але все ж відрізняються один від одного індукуванням побічних моторних ефектів. Як альтернатива мультирецепторній гіпотезі в статті Kapur та Seeman ("Does fast dissociation from the dopamine D2 receptor explain the action of atypical antipsychotics?: A new hypothesis", Am. J. Psychiatry 2001, 158:3 p.360369) було висунуте припущення про те, що атипові антипсихотичні засоби можуть відрізнятися від типових антипсихотичних засобів за швидкістю, з якою вони від'єднуються від рецепторів дофаміну D2. Швидка дисоціація з рецептором D2 робить антипсихотичні засоби більш пристосованими до фізіологічного переносу дофаміну, тобто створює потенціал для реалізації антипсихотпчного ефекту без побічних моторних ефектів. Ця гіпотеза виглядає особливо переконливо при розгляді клозапіну та кветіапіну. Для цих двох лікарських засобів характерна найвища швидкість дисоціації з рецепторами дофаміну D2, та вони сполучені з найнижчим ризиком індукування EPS у людини. І навпаки, типові антипсихотичні засоби, що виявляють статистичну асоціацію з високою частотою EPS, є найбільш повільно дисоціюючими антагоністами рецептора дофаміну D2. Отже, ідентифікація нових лікарських засобів, заснована на швидкості їх дисоціації з рецептором D2, представляється надійною перспективною стратегією для створення нових атипових антипсихотичних засобів. Додаткова мета пошуку полягає в комбінуванні властивостей швидкої дисоціації з вибірковістю до рецепторів D2. Вважається, що багаторецепторнип профіль сучасних атипових антипсихотичних засобів є причиною інших побічних ефектів, наприклад, збільшення ваги та розвитку цукрового діабету. Пошук селективних антагоністів D2 якийсь час ігнорувався як підхід, але автори винаходу переконані в тому, що застосування в клініці більш селективних (до цих рецепторів) сполук допоможе знизити частоту метаболічних розладів, пов'язаних із сучасними атиповими антипспхотичними лікарськими засобами. Задачею даного винаходу є забезпечення нових сполук, що являють собою швидко дисоціюючі антагоністи рецептора дофаміну D2, для яких характерний сприятливий фармакологічний профіль, 94058 6 як пояснено вище, зокрема знижений рівень побічних моторних ефектів та помірні або незначні взаємодії с іншими рецепторами, що приводить до низького ризику розвитку метаболічних розладів. Поставлена задача вирішується представленими в даній заявці новими сполуками, що відповідають формулі (l): (I) їх фармацевтично прийнятними солями, гідратами та сольватами, а також їх стереоізомерними формами, де R являє собою водень або С1-6алкіл; R1 являє собою феніл; феніл, заміщений 1, 2 або 3 замісниками, кожний з яких незалежно вибраний з групи, що включає водень, галоген, ціано, С1-4алкіл, С1-4алкилокси, перфторС1-4алкіл, діС14алкіламіно; тієніл, заміщений 1 або 2 замісниками, вибраними з групи, що включає галоген та С14алкіл; С3-8циклоалкіл або С5-7циклоалкеніл; R2 являє собою водень або С1-6алкіл; R3 являє собою галоген, С1-4алкіл або перфторС1-4алкіл, а R4 та R5 кожний незалежно являє собою водень або галоген. Відповідно до винаходу зазначені сполуки є швидко дисоціюючими антагоністами рецептора D2, активність яких не приписується жодним похідним 6-феніл-N-[4-піперидиніл]-3-піридазинаміну, описаним у J. Med. Chem. (1999), 42 (4), 730-741, жодним заміщеним N-[4-піперидиніл]-2амінопіримідинам, описаним у Farmaco, Vol.35, no.11, 1980, pages 951-964. Відповідно до винаходу ця властивість робить зазначені сполуки особливо придатними для медичного застосування з метою лікування або профілактики шизофренії, шизофреноподібного розладу, шизоафективного розладу, маревного розладу, короткого психотичного розладу, загального психотичного розладу, психотичного розладу внаслідок загального медичного стану хворого, психотичного розладу, викликаного речовинами, психотичного розладу без додаткових уточнень, психозу, пов'язаного з деменцією, великого депресивного розладу, дистимічного розладу, предменструального дисфоричного розладу, депресивного розладу без додаткових уточнень, біполярного розладу І, біполярного розладу II, циклотимічного розладу, біполярного розладу без додаткових уточнень, розладу настрою внаслідок загального медичного стану хворого, розладу настрою, викликаного речовинами, розладу настрою без додаткових уточнень, генералізованого тривожного розладу, обсесивно-компульсивного розладу, панічного розладу, гострого стресового розладу, посттравматичного стресового розладу, розумової відсталості, загальних розладів психічного розвитку, розладів дефіциту уваги, розладу дефіциту уваги/гіперактивності, розладів з агресивним поводженням, розладів особистості параноїдного типу, розладів особистості шизоїдного типу, роз 7 ладів особистості шизотипового типу, розладів, що супроводжуються тиками, синдрому Турета, залежності від ліків, зловживання алкоголем або наркотиками, синдрому відміни ліків, трихотиломанії. Фахівець в даній галузі техніки може здійснити вибір сполук, ґрунтуючись на експериментальних даних, що представлені нижче в експериментальній частині. Будь-який вибір сполук здійснюється в межах понять, охоплених даним винаходом. Наприклад, винахід особливо відноситься до сполук формули (І), в яких R3 являє собою трифторметил, та R, R4 та R5 являють собою водень. Інші сполуки, що представляють інтерес, описані формулою (І), є сполуками, в яких радикал R2 являє собою водень або метил. Особливий інтерес представляють сполуки, описані формулою (I), в яких R1 являє собою 4фторфеніл або 3,4-дифторфеніл. Серед сполук, описаних формулою (І), найбільший інтерес представляють N-[1-(4фторбензил)піперидин-4-іл]-6(трифторметил)піридазин-3-амін та N-[1-(3,4дифторбензил)піперидин-4-іл]-6(трифторметил)піридазин-3-амін. В даній заявці термін "С1-4алкіл", коли він використовується окремо та в сполученнях, таких як "С1-4алкілокси", "перфторС1-4алкіл", "діС14алкіламіно", включає, наприклад, метил, етил, пропіл, бутил, 1-метилпропіл, 1,1-диметилетил; термін "С1-6алкіл" включає метил, етил, пропіл, бутил, 1-метилпропіл, 1,1-диметилетил, пентил та гексил; термін "перфторС1-4алкіл" включає, наприклад, трифторметил, пентафторетил, гептафторпропіл та нонафторбутил; термін "С3-8циклоалкіл" включає циклопропіл, циклобутил, циклопентил, циклогексил, циклогептил та циклооктил; термін "С5-7циклоалкеніл" включає циклопентеніл, циклогексеніл та циклогептеніл. Фармацевтично прийнятні солі визначені, як такі, що включають терапевтично активні та нетоксичні кислотно-адитивні сольові форми, які здатні утворювати сполуки, описані формулою (I). Зазначені солі можна одержати обробкою основної форми сполук, описаних формулою (І), прийнятними кислотами, наприклад, неорганічними кислотами, наприклад, галогенводневою кислотою, зокрема соляною кислотою, бромистоводневою кислотою, сірчаною кислотою, азотною кислотою та фосфорною кислотою, а також органічними кислотами, наприклад, оцтовою кислотою, гідроксіоцтовою кислотою, пропіоновою кислотою, молочною кислотою, піровиноградною кислотою, щавлевою кислотою, малоновою кислотою, бурштиновою кислотою, малеїновою кислотою, мигдальною кислотою, фумаровою кислотою, яблучною кислотою, винною кислотою, лимонною кислотою, метансульфоновою кислотою, етансульфоновою кислотою, бензолсульфоновою кислотою, nтолуолсульфоновою кислотою, цикламовою кислотою, саліциловою кислотою, nаміносаліциловою кислотою, памовою кислотою та мигдальною кислотою. 1 навпаки, зазначені сольові форми можна перетворити на вільні форми обробкою відповідною основою. 94058 8 Термін сольвати відноситься до гідратів та алкоголятів, які можуть утворювати сполуки, описані формулою (I). Термін "стереохімічні ізомерні форми" при використанні в даній заявці означає всі можливі ізомерні форми сполук, описаних формулою (І). Якщо не зазначено або не вказано інше, то хімічна назва сполук включає суміш всіх можливих стереохімічно ізомерних форм, причому такі суміші містять всі діастереомери та енантіомери основної молекулярної структури. Переважно, стереогенні центри можуть мати R- або S-конфігурацію; замісники на двовалентних циклічних (частково) насичених радикалів можуть мати цис- або транс-конфігурацію. Сполуки, що містять подвійні зв'язки, можуть мати Е- або Z-стереохімію при зазначеному подвійному зв'язку. У межі даного винаходу включені всі стереохімічно ізомерні форми сполук формули (I). Сполуки формули (І), які отримують в описаних нижче процесах, можуть бути синтезовані у вигляді рацемічних сумішей або енантіомерів, які можна відокремити один від одного за допомогою відомих у даній галузі техніки способів розділення. Рацемічні сполуки формули (І) можуть бути перетворені на відповідні діастереомерні сольові форми за допомогою реакції з відповідною хіральною кислотою. Зазначені діастереомерні сольові форми потім розділяють, наприклад, селективною або фракційною кристалізацією, а енантіомери вивільнюють з них за допомогою лугу. Альтернативний спосіб розділення енантіомерних форм сполук формули (І) включає рідинну хроматографію із застосуванням хіральної стаціонарної фази. Зазначені чисті стереохімічно ізомерні форми можна також одержувати з відповідних чистих стереохімічно ізомерних форм підходящих вихідних речовин за умови, що реакція протікає стереоспецифічно. Переважно, якщо бажаним є конкретний стереоізомер, то зазначена сполука буде синтезована, використовуючи стереоспецифічні способи одержання. В цих способах переважно використовують енантіомерно чисті вихідні речовини. Фармакологія Для того щоб виявити антипсихотичні сполуки, які активні проти позитивних симптомів шизофренії та які мають поліпшений профіль безпеки (низьку частоту EPS та відсутність метаболічних розладів), автори винаходу провели скринінг у групі сполук, що вибірково взаємодіють з рецептором дофаміну D2 та швидко від'єднуються від цього рецептора. Сполуки були, насамперед, піддані скринінгу на їх афінність до D2 в аналізі зв'язування з використанням [3Н]спіперону та рецепторів клітинних мембран людини D2L. Сполуки, що демонструють ІС50 менше 1мкМ, для оцінки швидкості їх дисоціації були досліджені в непрямому аналізі, адаптованому, виходячи з методики, описаної в публікації Josee E. Leysen and Walter Gommeren, Journal of Receptor Research, 1984, 4(7), 817-845. Далі тестові сполуки піддавали скринінгу в панелі, що складалася з більш ніж 50 розповсюджених рецепторів, що зв'язуються з G-протеїном (CEREP), та було знайдено, що вони мають рівний профіль з низькою афінністю до цих рецепторів. 9 Деякі сполуки були додатково досліджені в моделях in vivo, наприклад, у "тесті на собаках з індукованою апоморфіном блювотою", у "тесті з апоморфіном на пацюках", та було знайдено, що вони є перорально біодоступними. З вищезазначених фармакологічних властивостей сполук формули (I) випливає, що вони придатні для застосування як лікарські засоби, особливо для застосування як антипсихотичні засоби. Більш особливо, зазначені сполуки придатні для застосування як лікарський засіб для лікування або попередження шизофренії, шизофреноподібного розладу, шизоафективного розладу, маревного розладу, короткого психотичного розладу, загального психотичного розладу, психотичного розладу внаслідок загального медичного стану хворого, психотичного розладу, викликаного речовинами, недиференційованого психотичного розладу, психозу, пов'язаного з деменцією, великого депресивного розладу, дистимічного розладу, предменструального дисфоричного розладу, депресивного розладу без додаткових уточнень, біполярного розладу І, біполярного розладу II, циклотимічного розладу, біполярного розладу без додаткових уточнень, розладу настрою внаслідок загального медичного стану хворого, розладу настрою, викликаного речовинами, розладу настрою без додаткових уточнень, генералізованого тривожного розладу, обсесивно-компульсивного розладу, панічного розладу, гострого стресового розладу, посттравматичного стресового розладу, розумової відсталості, загальних розладів психічного розвитку, розладу дефіциту уваги, розладу дефіциту уваги/гіперактивності, розладів з агресивним поводженням, розладів особистості параноїдного типу, розладів особистості шизоїдного типу, розладів особистості шизотипового типу, розладів, що супроводжуються тиками, синдрому Турета, залежності від ліків, зловживання алкоголем або наркотиками, синдрому відміни ліків, трихотиломанії. Для оптимізації лікування хворих, що страждають на зазначені в попередньому абзаці захворювання, сполуки формули (І) можна вводити разом з іншими психотропними сполуками. Таким чином, стосовно до шизофренії, лікування можна направити також на негативні та когнітивні симптоми. Даний винахід також пропонує спосіб лікування теплокровних тварин, що страждають на такі захворювання, причому зазначений спосіб включає системне введення терапевтичної кількості сполуки формули (I), ефективної для лікування вищеописаних захворювань. Даний винахід також відноситься до застосування сполук формули (І), які описані вище, для одержання лікарських засобів, особливо антипсихотичних лікарських засобів, більш особливо лікарських засобів для лікування або попередження шизофренії, шизофреноподібного розладу, шизоафективного розладу, маревного розладу, короткого психотичного розладу, загального психотичного розладу, психотичного розладу внаслідок загального медичного стану хворого, психотичного розладу, викликаного речовинами, психотичного розладу без додаткових уточнень, психозу, пов'я 94058 10 заного з деменцією, великого депресивного розладу, дистимічного розладу, предменструального дисфоричного розладу, депресивного розладу без додаткових уточнень, біполярного розладу 1, біполярного розладу II, циклотимічного розладу, біполярного розладу без додаткових уточнень, розладу настрою внаслідок загального медичного стану хворого, розладу настрою, викликаного речовинами, розладу настрою без додаткових уточнень, генералізованого тривожного розладу, обсесивнокомпульсивного розладу, панічного розладу, гострого стресового розладу, посттравматичного стресового розладу, розумової відсталості, загальних розладів психічного розвитку, розладу дефіциту уваги, розладу дефіциту уваги/гіперактивності, розладів з агресивним поводженням, розладів особистості параноїдного типу, розладів особистості шизоїдного типу, розладів особистості шизотипового типу, розладів, що супроводжуються тиками, синдрому Турета, залежності від ліків, зловживання алкоголем або наркотиками, синдрому відміни ліків, трихотиломанії. Фахівці в галузі лікування зазначених захворювань можуть визначити щоденну терапевтично ефективну кількість таких ліків, спираючись на результати описаних нижче досліджень. Щоденна терапевтично ефективна кількість звичайно складає від приблизно 0,01мг/кг до приблизно 10мг/кг ваги тіла, більш переважно, від приблизно 0,05мг/кг до приблизно 1мг/кг ваги тіла. Винахід також відноситься до фармацевтичних композицій, що містять фармацевтично прийнятний носій, а також як активний інгредієнт терапевтично ефективну кількість сполуки, що відповідає формулі (І). Для легкості введення сполуки за даним винаходом можуть бути виготовлені в різних фармацевтичних формах з метою введення. Сполуки за даним винаходом, особливо сполуки формули (І), їх фармацевтично прийнятні кислотно- або основно-адитивні солі, їх стереохімічно ізомерні форми, їх N-оксидні форми та їх проліки або їх будь-яка підгрупа або комбінація можуть бути представлені в різних фармацевтичних формах з метою введення. Як підходящі композиції можуть бути названі всі композиції, що звичайно застосовують для системного введення ліків. Для одержання фармацевтичних композицій за даним винаходом, ефективну кількість конкретної сполуки, необов'язково у формі адитивної солі, як активний інгредієнт поєднують з фармацевтично прийнятним носієм, причому такий носій може приймати широку різноманітність форм, в залежності від форми препарату, бажаної для введення. Бажано, щоб ці фармацевтичні композиції були доступні в стандартних дозованих формах, зокрема для перорального, ректального, крізьшкірного введення, введення за допомогою парентеральної ін'єкції або за допомогою інгаляції. Наприклад, при одержанні композицій у пероральній дозованій формі можна використовувати будь-яке звичайне фармацевтичне середовище, таке як, наприклад, вода, гліколі, олії, спирти та т.п., у випадку рідких препаратів, наприклад, суспензій, сиропів, еліксирів, емульсій та розчинів; або тверді носії, наприклад, крохмалі, 11 цукри, каолін, розріджувачі, змазувальні речовини, зв'язувальні речовини, агенти дезинтеграції та т.п., у випадку порошків, пігулок, капсул та таблеток. Завдяки легкості введення таблетки та капсули є найбільш переважними стандартними дозованими формами для перорального застосування, в випадку яких очевидно застосовують тверді фармацевтичні носії. Носій для парентеральних композицій звичайно містить стерильну воду, що складає, щонайменше, більшу його частину, хоча можуть бути включені й інші інгредієнти, наприклад, для підсилення розчинності. Наприклад, можуть бути одержані розчини для ін'єкцій, в яких носій містить фізіологічний розчин, розчин глюкози або суміш фізіологічного розчину та розчину глюкози. Розчини для ін'єкцій, що містять сполуки формули (І), можуть бути виготовлені в масляній формі для пролонгованої дії. Підходящими маслами для цієї мети є, наприклад, арахісова олія, кунжутна олія, бавовняна олія, кукурудзяна олія, соєва олія, синтетичні гліцеринові ефіри довголанцюгових жирних кислот, їх суміші, а також інші масла. Також можуть бути одержані суспензії для ін'єкцій, в яких використовують підходящі рідкі носії, суспендувальні агенти та подібні речовини. Також включені препарати у твердій формі, що призначені для перетворення на рідкі препарати безпосередньо перед застосуванням. У композиціях, придатних для крізьшкірного введення, носій необов'язково містить засіб, що підсилює проникнення ліків, та/або підходящий змочувальний агент, необов'язково об'єднаний з підходящими добавками будьякого походження, що використовуються в невеликій кількості, які не здійснюють істотного шкідливого впливу на шкіру. Зазначені добавки можуть полегшувати введення лікарського засобу через шкіру та/або можуть бути корисними при одержання бажаних композицій. Такі композиції можна вводити різними способами, наприклад, за допомогою трансдермального пластиру, крапкового нанесення або мазі. Кислотно- або основноадитивні солі сполук формули (І) завдяки їх підвищеній розчинності у воді в порівнянні з вихідною кислотною або основною формою є більш придатними для одержання водних композицій. Особливо корисним є виготовлення вищезазначених фармацевтичних композицій в стандартній дозованій формі для простоти введення та однаковості доз. Стандартна дозована форма при використанні в даній заявці означає фізично дискретні одиниці, прийнятні як стандартне дозування, кожна одиниця препарату містить заздалегідь визначену кількість активного інгредієнта, розраховану таким чином, щоб забезпечити бажаний терапевтичний ефект, у сполученні з необхідним фармацевтичним носієм. Прикладами таких стандартних дозованих форм є таблетки (включаючи таблетки з надсічками або оболонкою), капсули, пігулки, пакетики з порошками, облатки, супозиторії, розчини або суспензії для ін'єкцій та т.п., а також їх різні різновиди. Оскільки сполуки за винаходом є сполуками, що виявляють сильний ефект при пероральному введенні, особливо корисними є фармацевтичні 94058 12 композиції, що містять зазначені сполуки, що призначені саме для перорального введення. Для того щоб підсилити розчинність та/або стабільність сполук формули (І) у фармацевтичних композиціях корисно використовувати α-, β- або циклодекстрини або їх похідні, особливо гідроксіалкілзаміщені циклодекстрини, наприклад, 2гідроксипропіл-β-циклодекстрин. Крім того, розчинність та/або стабільність сполук за винаходом у фармацевтичних композиціях може бути покращена за допомогою співрозчинників, таких як спирти. Одержання Сполуки формули (І) (I) де R, R1, R2, R3, R4 та R5, визначені вище, були отримані взаємодією проміжної сполуки формули (II) (II) де R2, R3, R4 та R5 мають значення, зазначені для формули (І), із проміжною сполукою формули R1-C(=O)-R, де R та R1 є такими, як визначено вище, у присутності підходящого відновника, такого як триацетоксиборгідрид натрію, підходящого кислотного каталізатора, такої як оцтова кислота, у підходящому реакційно-інертному розчиннику, такому як 1,2-дихлоретан. Проміжні продукти формули (II) були отримані в результаті реакції захищеного похідного піперидину формулі (IV) (IV) де P являє собою підходящу захисну групу, таку як трет-бутилоксикарбоніл, з 3хлорпіридазином формули (V) (V) у присутності підходящого каталізатора, такого як йодид калію, у підходящим умовах реакції, таких як реакція в розплавленому стані, з депротектуванням захисної групи в проміжній сполуці (VI) (VI) у підходящих умовах, як наприклад у соляній кислоті з метанолом для третбутилоксикарбонільної групи. Проміжні продукти формули (V) можуть бути комерційно доступними або можуть бути одержані за допомогою методик, аналогічних описаним у 13 94058 хімічній літературі (для R3=CF3, див. Tetrahedron, 1999, 55 (52), 15067-15070). Сполуки формули (І) також можуть бути одержані за допомогою взаємодії 3-хлорпіридазину формули V з похідним піперидину формули VII (VII) у присутності підходящої основи, такої як діізопропіламін, у підходящому розчиннику, такому як алканол (зокрема, 1-бутанол), при підвищеній температурі. Проміжні сполуки формули (VII) були отримані в результаті реакції 4,4-етилендіоксипіперидину (VIII) із проміжним продуктом формули R1-C(=O)-R у присутності підходящого відновника, такого як триацетоксиборгідрид натрію, підходящого кислотного каталізатора, такого як оцтова кислота, у підходящому реакційно-інертному розчиннику, такому як 1,2-дихлоретан. Отриманий проміжний продукт формули (IX) 14 Кінцеве очищення сполук Прикладів (Е1-Е45) проводили або за допомогою колоночної хроматографії на силікагелі з використанням описаного елюента або за допомогою обернено-фазової препаративної ВЕРХ на колонці Hyperprep RP 18 BDS (Shandon) (8мкм, 200мм, 250г). Три мобільні фази (мобільна фаза А: 90% 0,5% ацетату амонію +10% ацетонітрилу; мобільна фаза В метанол; мобільна фаза С ацетонітрил) використовували для здійснення градієнтного методу, починаючи з 75% А та 25% В зі швидкістю потоку 40мл/хв., із затримкою на 0,5 хвилини в тих же умовах, наступним збільшенням швидкості потоку до 80мл/хв. протягом 0,01 хвилини, до 50% В та 50% С протягом 41 хвилини, до 100% С протягом 20 хвилин із затримкою цих умов на 4 хвилини. Спектри 1Η були зняті на спектрометрі Bruker DPX 360. Хімічні зсуви виражені в м.ч. відносно тетраметилсилану. Опис 1 трет-Бутил 4-{[6-(трифторметил)піридазин-3іл)аміно}піперидин-1-карбоксилат (D1) (IX) депротектують за допомогою обробки кислотою, такою як соляна кислота, з одержанням проміжного продукту формули (X) (X) який потім піддають реакції з аміном формули R2-NH2 (XI), у присутності підходящого відновника, такого як водень, підходящого каталізатора, такого як паладій на вугіллі, у підходящому реакційноінертному розчиннику, такому як етанол. Проміжні продукти формули (ll), в якій R5 означає хлор, були отримані в результаті реакції піперидину формули XII (XII) Суміш 3-хлор-6-трифторметил-піридазину (4,4г, 24,1ммоль) (одержаного за допомогою методики, аналогічної описаній в Tetrahedron, 1999, 55 (52), 15067-15070), 4-аміно-1-третбутилоксикарбонілпіперидину (9,63г, 48,1ммоль) та йодиду калію (кат.) нагрівали в розплавленому стані при 150°С протягом 30 хвилин. Після закінчення цього часу реакційну суміш розбавляли водою та екстрагували дихлорметаном. Органічний шар відокремлювали та висушували, випарюючи розчинник у вакуумі. Неочищений продукт очищали за допомогою хроматографії (силікагель; 1%4% аміаку в метанолі (7М)/дихлорметан), одержуючи D1 (7,06г, 85%). Розраховано для C15H21F3N4O2 346; знайдено 347 (МН+). Опис 2 N-Піперидин-4-іл-6-(трифторметил)піридазин3-амін (D2) де L являє собою групу, що відходить, таку як тозил, з піридазином формули XIII (XIII) 3 де радикал R є таким, як визначено вище, в присутності підходящої основи, такої як гідрид натрію, в апротонному розчиннику, такому як диметилформамід, з наступним депротектуванням захисної групи в проміжному продукті формули VI в підходящих умовах, наприклад як у соляній кислоті з метанолом для трет-бутилоксикарбонільної групи. Проміжні продукти формули XIII можуть бути одержані з піридазинів формули V за допомогою амінування та наступного галогенування. Експериментальна частина Хімія Розчин D1 (7,06г, 20,4ммоль) та соляної кислоти/ізопропанолу (6н, 100мл) у метанолі (100мл) перемішували при кімнатній температурі протягом 2 годин. Після закінчення цього часу розчинники випарювали у вакуумі, а залишок розтирали в порошок з ацетонітрилом. Твердий продукт відфільтровували та висушували, одержуючи D2 у вигляді дигідрохлоридної солі (6,05г, 95%). Розраховано для C10H13F3N4 246; знайдено 247 (МН+). Дигідрохлоридну сіль (D2) або безпосередньо використовували при наступному одержанні сполук, або альтернативно перетворювали на вільну основу перед застосуванням. Вільну основу одержували, розчиняючи дигидрохлоридну сіль у воді, 15 підлужували карбонатом натрію та екстрагували дихлорметаном. Після висушування (MgSO4) розчинники випарювали у вакуумі, одержуючи вільну основу (D2a). Опис 3 8-(3,4-Дифторбензил)-1,4-діокса-8азаспіро[4.5]декан (D3) Розчин 3,4-дифторбєнзальдегіду (4,40г, 30,9ммоль), 4,4-етилендіоксипіперидину (4,40г, 30,9ммоль), триацетоксиборогідриду натрію (6,40г, 30,2ммоль) та оцтової кислоти (1,8г, 30,0ммоль) у дихлоретані (200мл) перемішували при кімнатній температурі протягом 18 годин. Після закінчення цього часу реакційну суміш промивали 1н гідроксидом натрію. Органічний шар відокремлювали, висушували (MgSO4), а розчинники випарювали у вакуумі, одержуючи D3 (7,9г, 98%). Розраховано для C14H17F2NO2 269; знайдено 270 (MH+). Опис 4 1-(3,4-Дифторбензил)піперидин-4-он (D4) Розчин D3 (7,9г, 29,4ммоль) у соляній кислоті (5н, 150мл) нагрівали при 50°С протягом 2 годин. Після закінчення цього часу реакційну суміш промивали діізопропіловим ефіром (100мл), а потім насиченим розчином бікарбонату натрію (100мл). Потім суміш екстрагували дихлорметаном, екстракти висушували (MgSO4), а розчинники випарювали у вакуумі, одержуючи D4 (5,4г, 82%). Розраховано для C15H13F2NO 225; знайдено 226 (МH+). Опис 5 1-(3,4-Дифторбензил)-N-метилпіперидин-4амін (D5) Суспензію D4 (5,4г, 24ммоль), розчин тіофену (4% у діізопропіловому ефірі, 2мл), розчин метиламіну (40% у воді, 10мл) та 10% паладію на вугіллі (2г) у метанолі (150мл) гідрогенізували при атмосферному тиску та температурі навколишнього середовища до поглинання 1екв. (~600мл) водню. Після закінчення цього часу реакційну суміш фільтрували, а фільтрат випарювали у вакуумі. Неочищений продукт очищали за допомогою колоночної хроматографії (силікагель; 5%-10% аміаку в метанолі/дихлорметані), одержуючи D5 (4,7г, 81%). Розраховано для C13H18F2N2 240; знайдено 241 (МН+). Опис 6 6-Трифторметил-3-піридазинямін (D6) 94058 16 Суміш 3-хлор-6-трифторметил-піридазину (1,6г, 8,8ммоль) (одержаного за допомогою методики, аналогічної описаній в Tetrahedron, 1999, 55 (52), 15067-15070) та гідроксиду амонію (30мл) у ТГФ (10мл) нагрівали при 100°С у мікрохвильовому реакторі (Emrys Optimizer, 0-9бар) протягом 1 години. Після закінчення цього часу реакційну суміш випарювали, а залишок екстрагували дихлорметаном. Об'єднані екстракти висушували (MgSO4), фільтрували, а розчинники випарювали у вакуумі, одержуючи D6 (1,3г, 93%). Розраховано для C5H4F3N3 163; знайдено 164 (MH+). Опис 7 4-Хлор-6-трифторметил-3-піридазинамін (D7) Суміш D6 (4,0г, 24,5ммоль) та Nхлорсукциніміду (3,3г, 24,5ммоль) в ацетонітрилі (160мл) нагрівали при 70°С протягом 18 годин. Після закінчення цього часу реакційну суміш охолоджували до кімнатної температури, а розчинники випарювали у вакуумі. Неочищений залишок очищали за допомогою колоночної хроматографії (силікагель; 3%-5% метанолу/дихлорметану), одержуючи D7 (1,6г, 33%). Розраховано для C5H3CI3N3 197; знайдено 198 (МН+). Опис 8 трет-Еутил 4-{[4-хлор-6(трифторметил)піридазин-3-іл]аміно}піперидин-1карбоксилат (D8) До перемішаного розчину D7 (1,6г, 8,1ммоль) у диметилформаміді (50мл) при 0°С під азотом порціями додавали NaH (60% в маслі, 390мг, 8,1ммоль). Реакційну суміш перемішували протягом 1 години, після чого по краплях додавали третбутиловий ефір 4-(толуол-4-сульфонілокси)піперидин-1-карбонової кислоти (2,9г, 8,1ммоль), розчинений у диметилформаміді (10мл). Потім реакційну суміш нагрівали в діапазоні температур 80-90°С протягом 6 годин. Після охолодження до кімнатної температури розчинники випарювали у вакуумі. Залишок розчиняли в дихлорметані та промивали водою. Органічний шар висушували (MgSО4), фільтрували, а розчинники випарювали у вакуумі. Неочищений продукт очищали за допомогою колоночної хроматографії (силікагель; 3% метанолу в дихлорметані), одержуючи D8 (1,1г, 37%). Розраховано для C15H20CI3N4O2 380; знайдено 381 (МН+). Опис 9 4-Хлор-N-піперидин-4-іл-6(трифторметил)піридазин-3-амін (D9) 17 Розчин D8 (1,1г, 2,9ммоль) та соляної кислоти/ізопропанолу (6н, 20мл) у метанолі (100мл) перемішували при кімнатній температурі протягом 18 годин. Після закінчення цього часу реакційну суміш випарювали у вакуумі, залишок повторно розчиняли в метанолі, та розчин підлужували метанольним аміаком. Реакційну суміш концентрували у вакуумі, а залишок очищали за допомогою колоночної хроматографії (силікагель; 5%-15% метанольного аміаку в дихлорметані), одержуючи D9 (70мг, 9%). Розраховано для C10H12CI3N4 280; знайдено 281 (МН+). Приклад 1 N-[1-(3,4-Дифторбензил)піперидин-4-іл]-6(трифторметил)піридазин-3-амін (Е1) До перемішаного розчину D2a (2,61г, 10,6ммоль) та оцтової кислоти (0,64г, 10,6ммоль) у дихлоретані (200мл) додавали 3,4дифторбензальдегід (1,52г, 10,6ммоль) та триацетоксиборгідрид натрію (2,24г, 10,6ммоль) при кімнатній температурі. Після перемішування протягом 18 годин реакційну суміш гасили 1н гідроксидом натрію, органічний шар видаляли, висушували, а розчинники випарювали у вакуумі. Неочищений продукт очищали за допомогою хроматографії (силікагель, 2%-5% аміаку в метанолі (7М)/дихлорметані, одержуючи Е1 (2,39г, 61%). Розраховано для C17H17F5N4 372; знайдено 373 (МН+); т.пл.: 167,7-168,9°С. 1H ЯМР (DMSO-D6) δ 1,50 (кв.д, J=11,5, 3,7Гц, 1H), 1,96 (ушир, д, J=12,4Гц, 2Н), 2,12 (тд, J=11,4, 2,6Гц, 2Н), 2,78 (ушир, д, J=11,3Гц, 2Н), 3,48 (с, 2Н), 3,90 (ушир, с, 1Н), 6,94 (д, J=9,4Гц, 1Н), 7,13-7,19(м, 1Н), 7,327,42 (м, 2Н), 7,53 (ушир, д, J=7,3Гц, 1Н), 7,63 (д, J=9,4Гц, 1H). Приклад 2 N-[1-(4-Фторбензил)піперидин-4-іл]-6(трифторметил)піридазин-3-амін (Е2) Суспензію D2 (1,7г, 5,32ммоль), 4фторбензальдегіду (0,66г, 5,32ммоль), діізопропілетиламіну (1,37г, 10,6ммоль) та триацетоксиборгідриду на смолі (Argonaut Technologies, 2,2ммоль/г; 3екв.) у дихлоретані (10мл) перемішували при кімнатній температурі протягом 18 годин. Після закінчення цього часу реакційну суміш фільтрували, а розчинники випарювали y вакуумі. Неочищений продукт очищали за допомогою хроматографії (силікагель, 2%-6% аміаку в метанолі (7М)/дихлорметані, одержуючи Е2 (0,79г, 42%). Розраховано для C17H18F4N4 354; знайдено 355 (МН+); т.пл.: 163,3-165,3°С. 1H ЯМР (DMSO-D6) δ 1,48 (кв., J=10,8Гц, 2Н), 1,95 (ушир, д, J=12,5Гц, 2Н), 2,09 (т, J=11,1Гц, 2Н), 2,78 (ушир, д, J=11,3Гц, 2Н), 3,47 (с, 2Н), 3,89 (ушир, с, 1Н), 6,94 (д, J=9,4Гц, 1Н), 7,15 (т, J=8,8Гц, 2Н), 7,34 (дд, J=8,3, 94058 18 5,7Гц, 2Н), 7,53 (ушир, д, J=7,3Гц, 1Н), 7,63 (д, J=9,4Гц, 1Н). Приклад 12 N-[1-(3,4-Дифторбензил)піперидин-4-іл]-Nметил-6-(трифторметил)піридазин-3-амін (Е12) Розчин D5 (480мг, 2ммоль), 3-хлор-6трифторметилпіридазину (182мг, 1ммоль) та діізопропілетиламіну (260мг, 2ммоль) у н-бутанолі (4мл) нагрівали при 190°С у мікрохвильовому реакторі (Emrys Optimizer, 0-9бар) протягом 2 годин. Після закінчення цього часу реакційну суміш випарювали у вакуумі, а залишок екстрагували дихлорметаном. Органічний шар відмивали насиченим розчином бікарбонату натрію, висушували (MgSO4), a розчинники випарювали у вакуумі. Очищенням за допомогою обернено-фазової ВЕРХ (в умовах, що були описані вище) одержували Е12 (210мг, 54%). Розраховано для C18H19F5N4 386; знайдено 387 (ΜΗ+). 1H ЯМР (CDCl3) δ 1,74 (ушир, д, J=12,0Гц, 2Н), 1,88 (кв.д, J=12,0, 3,9Гц, 2Н), 2,17 (тд, J=11,8, 2,5Гц, 2Н), 2,96 (ушир.д, J=11,6Гц, 2Н), 3,00 (с, 3Н), 3,47 (с, 2Н), 4,85 (т, J=12,1Гц, 1Н), 6,78 (д, J=9,6Гц, 1Η), 6,997,05 (м, 1Η), 7,10 (дт, J=10,2, 8,1Гц, 1Н), 7,20 (ддд, J=11,4, 7,8, 2,1Гц, 1Н), 7,46 (д, J=9,6Гц, 1Η). Приклад 16 N-[1-(4-Хлорбензил)піперидин-4-іл]-6хлорпіридазин-3-амін (E16) Розчин 1-(4-хлорбензил)-піперидин-4-іламіну (1г, 4,45ммоль) (одержаного за допомогою методики, подібної описаній в WO 2001098273), 3,6дихлорпіридазину (670мг, 4,45ммоль) та карбонату натрію (940мг, 8,90ммоль) у диметилацетаміді (5мл) нагрівали при 120°С у мікрохвильовому реакторі (Emrys Optimizer; 0-9бар) протягом 40 хвилин Після закінчення цього часу реакційну суміш розбавляли водою та екстрагували дихлорметаном. Органічний шар висушували (MgSO4), фільтрували, а розчинники випарювали у вакуумі. Очищенням за допомогою обернено-фазової ВЕРХ (в умовах, що були описані вище) одержували Е16 (228мг, 15%). Розраховано для C16H18Cl2N4 336; знайдено 337 (ΜΗ+) 1H ЯМР (360МГц, CDCl3) δ 1,52 (кв.д, J=11,5, 3,5Гц, 2Н), 2,08 (д, J=12,5Гц, 2Н), 2,16 (т, J=11,3Гц, 2Н), 2,82 (д, J=11,5Гц, 2Н), 3,48 (с, 2Н), 3,77-3,87 (м, 1Н), 4,55 (д, J=7,8Гц, 1Н), 6,59 (д, J=9,3Гц, 1Н), 7,14 (д, J=9,3Гц, 1Н), 7,25 (д, J=7,7Гц, 2Н), 7,29 (д, J=7,7Гц, 2Н). Приклад 45 (R,S)-N-[1-(3,4-дифтор-αметилбензил)піперидин-4-іл]-6(трифторметил)піридазин-3-амін (Е45) 19 Розчин D2a (123мг, 0,5ммоль), 3,4дифторацетофенону (186мг, 1,25ммоль) та ізопропоксиду титану (875мг, 3ммоль) перемішували при кімнатній температурі протягом 1 години, після чого додавали етанол (0,7мл), а реакційну суміш продовжували перемішувати ще протягом 1 години Після закінчення цього часу додавали ціаноборгідрид натрію (68мг, 1,1ммоль), а реакційну суміш перемішували при кімнатній температурі протягом ночі. Потім реакційну суміш розбавляли дихлоретаном (30мл), додавали воду (1мл), суміш перемішували та фільтрували. Фільтрат випарювали y вакуумі, а залишок ще раз розчиняли в дихлорметані (30мл), промивали 10% розчином карбонату 94058 20 натрію та висушували (MgSO4). Суміш фільтрували, а розчинник випарювали у вакуумі. Очищенням за допомогою обернено-фазової ВЕРХ (в умовах, що були описані вище) одержували Е45 (106мг, 55%). Розраховано для C18H20F4N4 368; знайдено 369 (ΜΗ+). 1H ЯМР (360МГц, CDCl3) δ 1,33 (д, J=6,7Гц, 3Н), 1,45-1,62 (м, 2Н), 2,00-2,08 (м, 1H), 2,09-2,21 (м, 3Н), 2,70-2,78 (м, 1Н), 2,90-3,00 (м, 1Н), 3, 42 (кв , J=6,7Гц, 1Н), 3,85 (ушир с, 1Н), 4,97 (д, J=7,3Гц, 1H), 6,65 (д, J=9,3Гц, 1H), 6,99-7,05 (м, 1Н), 7,09 (дт, J=10,1, 8,2Гц, 1Н), 7,18 (ддд, J=11,7, 7,8, 2,1Гц, 1Н), 7,42 (д, J=9,3Гц, 1Н). Наступні приклади (Е3-E11) були одержані з D2 або D2а та відповідного бензальдегіду за допомогою методики, аналогічної прикладам 1 та 2. Приклади (Е13-Е14) були одержані з відповідного бензальдегіду за допомогою методики, аналогічної Прикладу 12. 21 94058 22 Наступні приклади (Е15-Е39) були одержані за допомогою методик, подібних описаним в Описах 1-5 та в Прикладах 1, 2, 12 та 16. 23 94058 24 25 94058 26 Наступний приклад (Е40) був одержаний за допомогою методик, подібних описаним в Описах 1-5 та Прикладах 1, 2 та 12. Наступні приклади (Е41-Е45) були одержані за допомогою методик, подібних описаним в Описах 1-9 та Прикладах 1, 2, 12, 16 та 45. До зазначених вище номерів прикладів відносяться наступні назви: N-[1-(3,4-дифторбензил)піперидин-4-іл]-6(трифторметил)піридазин-3-амін (E1) 27 N-[1-(4-фторбензил)піперидин-4-іл]-6(трифторметил)піридазин-3-амін (Е2) N-[1-(4-хлорбензил)піперидин-4-іл]-6(трифторметил)піридазин-3-амін (Е3) N-[1-(3-тpифтopмeтилбeнзил)пiпepидин-4-iл]6-(тpифтopмeтил)пipидaзин-3-aмiн (Е4) N-[1-(3-фтopбeнзил)пiпepидин-4-iл]-6(тpифтopмeтил)пipндaзин-3-амін (Е5) N-[1-(3,4,5-трифторбензил)піперидин-4-іл]-6(трифторметил)піридазин-3-амін (Е6) N-[1-(циклопентилметил)піперидин-4-іл]-6(трифторметил)піридазин-3-амін (Е7) N-[1-(2-фторбензил)піперидин-4-іл]-6(трифторметил)піридазин-3-амін (Е8) N-[1-(4-хлор-3-фторбензил)піперидин-4-іл]-6(трифторметил)піридазин-3-амін (Е9) N-[1-(3-хлор-4-фторбензил)піперидин-4-іл]-6(трифторметил)піридазин-3-амін (Е10) N-[1-(3,5-дифторбензил)піперидин-4-іл]-6(трифторметил)піридазин-3-амін (Е11) N-[1-(3,4-днфторбензил)піперидин-4-іл]-Nметил-6-(трифторметил)піридазин-3-амін (Е12) N-[1-(3-трифторметилбензил)піперидин-4-іл]N-метил-6-(трифторметил)пiридазин-3-амін (Е13) N-[1-(циклoпeнтилмeтил)пiпepидин-4-iл]-Nмeтил-6-(тpифтopмeтил)пipидaзин-3-aмiн (Е14) N-[1-(4-хлорбензил)піперидин-4-іл]-6хлорпіридазин-3-амін (Е16) N-(1-бензилпіперидин-4-іл)-N-метил-6хлорпіридазин-3-амін (Ε17) N-[1-(3,5-дифторбензил)піперидин-4-іл]-Nметил-6-хлорпіридазин-3-амін (Е18) N-[1-(2-фтор-5-метилбензил)піперидин-4-іл]-Nметил-6-хлорпіридазин-3-амін (Ε19) Ν-[1-(3,4-дифторбензил)піперидин-4-іл]-Nметил-6-хлорпіридазин-3-амін (Е20) N-[1-(3-бром-4-фторбензил)піперидин-4-іл]-Nметил-6-хлорпіридазин-3-амін (Е21) N-[1-(4-хлор-3трифторметилбензил)піперидин-4-іл]-N-метил-6хлорпіридазин-3-амін (Е22) N-[1-(3-фтор-5трифторметилбензил)піперидин-4-іл]-N-метил-6хлорпіридазин-3-амін (Е23) N-[1-(2-фтор-5трифторметилбензил)піперидин-4-іл]-N-метил-6хлорпіридазин-3-амін (Е24) N-[1-(3-трифторметилбензил)піперидин-4-іл]N-метил-6-хлорпіридазин-3-амін (Е25) N-[1-(2,5-диметилбензил)піперндин-4-іл]-Nмегил-6-хлорпіридазин-3-амін (Е26) N-[1-(2,4,5-триметилбензил)піперидин-4-іл]-Nметил-6-хлорпіридазин-3-амін (Е27) N-[1-(4-фтор-3трифторметилбензил)піперидин-4-іл]-N-метил-6хлорпіридазин-3-амін (Е28) N-[1-(4-фтор-3-метилбензил)піперидин-4-іл]-Nметил-6-хлорпіридазин-3-амін (Е29) N-[1-(5-бромтіофен-2-ілметил)піперидин-4-іл]N-метил-6-хлорпіридазин-3-амін (Е30) N-[1-(4,5-диметилтіофен-2-ілметил)піперидин4-іл]-N-метил-6-хлорпіридазин-3-амін (Е31) N-[1-(циклопентилметил)піперидин-4-іл]-Nметил-6-хлорпіридазин-3-амін (Е32) 94058 28 N-[1-(1-циклогекс-1-ен-ілметил)піперидин-4-іл]N-метил-6-хлорпіридазин-3-амін (Е33) N-[1-(1-циклогекс-3-ен-ілметил)піперидин-4-іл]N-метил-6-хлорпіридазин-3-амін (Е34) N-[1-(3,4,5-трифторбензил)піперидин-4-іл]-Nметил-6-хлорпіридазин-3-амін (Е35) N-[1-(4-бромтіофен-2-ілметил)піперидин-4-іл]N-метил-6-хлорпіридазин-3-амін (Е36) N-[1-(3-фтор-6-метилбензил)піперидин-4-іл]-Nметил-6-хлорпіридазин-3-амін (Е37) N-[1-(3-диметиламіно-бензил)піперидин-4-іл]N-метил-6-хлорпіридазин-3-амін (Е38) N-[1-(циклогексилметил)піперидин-4-іл]-Nметил-6-хлорпіридазин-3-амін (Е39) N-[1-(3-трифторметилбензил)піперидин-4-іл]N-метил-6-метилпіридазин-3-амін (Е40) N-[1-(3-фторбензил-4метоксибензил)піперидин-4-іл]-6(трифторметил)піридазин-3-амін (Е41) N-[1-(2,4-дифторбензил)піперидин-4-іл]-6(трифторметил)піридазин-3-амін (Е42) N-[1-(3,4-дифторбензил)піперидин-4-іл]-6(трифторметил)-4-хлор-піридазин-3-амін (Е43) N-[1-(4-фтор-α-метилбензил)піперидин-4-іл]-6(трифторметил)піридазин-3-амін (Е44) N-[1-(3,4-дифтор-α-метилбензил)піперидин-4іл]-6-(трифторметил)піридазин-3-амін (Е45) Фармакологія Афінність зв'язування з рецепторами D2L людини in vitro Заморожені мембрани клітин СНО, трансфікованих дофаміновими рецепторами D2L людини, розморожували, нетривало гомогенізували в гомогенізаторі Ultra-Turrax T25 та розбавляли аналітичним буфером Трис-НСІ, що містив NaCl, СаСl2, MgCl2, KCl (50, 120, 2, 1 та 5ммоль, відповідно, з доведенням рН до 7,7 за допомогою НСl) для одержання погрібної концентрації білків, оптимізованої для специфічного та неспецифічного зв'язування. Радіоліганд [3Н]спіперон (NEN, специфічна активність ~70Кюрі/ммоль) розбавляли в аналітичному буфері до концентрації 2нмоль/л. Потім одержаний радіоліганд (50мкл) разом з 50мкл або контрольного розчину 10% ДМСО, бутакламолу (кінцева концентрація 10-6моль/л), або тестової сполуки інкубували (30хв., 37°С) з 400мкл одержаного розчину мембран. Зв'язані мембрани відфільтровували з використанням пристрою Packard Filtermate у планшети GF/B Unifilter та промивали охолодженим на льоді буфером Трис-НСІ (50ммоль, рН7,7, 6×0,5мл). Фільтрам давали висохнути перед додаванням сцинтиляційної рідини та проведенням підрахунку в сцинтиляційному лічильнику Topcount. Процентний показник специфічною зв'язування та криві конкурентного зв'язування розраховували за допомогою комп'ютерної програми S-Plus (Insightful). Усі сполуки мали показник рІС50>6,0 за винятком Е8, Е25, Е41, Е42, Е44 та Е45 (рІС50>5,2). Швидка дисоціація Сполуки, що демонструють ІС50 вище 1мкм, для оцінки швидкості їх дисоціації були досліджені з використанням методики, описаної в публікації Josee E. Leysen and Walter Gommeren, Journal of Receptor Research, 1984, 4(7), 817-845. Сполуки, 29 94058 концентрація яких у 4 рази перевершувала їх ІС50, спочатку інкубували протягом однієї години з клітинними мембранами, що містять рецептор D2L людини, в об'ємі 2мл при температурі 25°С, потім фільтрували через скловолокнистий фільтр під відсмоктуванням, використовуючи 40-лунковий фільтраційний апарат multividor. Відразу ж після фільтрації вакуум знімали. Потім на фільтр додавали 0,4мл попередньо підігрітого до 25°С буфера, що містить 1нмоль [3Н]спіперону, протягом 5 хвилин. Інкубацію зупиняли, ініціюючи вакуум, та негайно матеріал промивали 2×5мл охолодженого на льоді буфером. Зв'язану з фільтром радіоактивність вимірювали в рідинному сцинтиляційному спектрометрі. Принцип аналізу базується на припущенні про те, що, чим швидше сполука від'єднується від рецептора D2, тим швидше [3Н]спіперон Комп’ютерна верстка Т. Чепелева 30 зв'язується з цим рецептором. Наприклад, якщо рецептори D2 інкубують з клозапіном у концентрації 1850нмоль (4×ІС50), зв'язування [3Н]спіперону еквівалентне 60-70% його загальної здатності зв'язування (виміряної за відсутності ліків) після 5хвилинної інкубації на фільтрі. При інкубації з іншими антипсихотичними засобами зв'язування [3Н]спіперону змінюється в діапазоні від 20 до 50%. Оскільки клозапін включали в кожен сеанс фільтрування, тестові сполуки розцінювали як швидко дисоціюючі антагоністи рецептора D2 у тому випадку, якщо вони дисоціювали так само швидко, як клозапін або ще швидше. Усі досліджені сполуки демонстрували швидкість дисоціації вище, ніж у клозапіну, тобто перевершували клозапін за цим параметром більше, ніж на 50%. Підписне Тираж 23 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюPiperidin-4-yl-pyridazin-3-ylamine derivatives as fast dissociating dopamine 2 receptor antagonists
Автори англійськоюDe Bruyn Marcel Frans Leopold, Macdonald Gregor James, Kennis Ludo Edmond Josephine, Langlois Xavier Jean Michel, Van Den Keybus Frans Alfons Ma, Van Roosbroeck Yves Emiel Mari
Назва патенту російськоюПроизводные пиперидин-4-илпиридазин-3-иламина в качестве быстро диссоциирующих антагонистов рецептора дофамина 2
Автори російськоюДе Браян Марсель Франс Леопольд, МакДональд Грегор Джеймс, Кеннис Лудо Эдмонд Джозефин, Ланглуис Ксавьер Джин Майкл, ван ден Кейбус Франс Альфонс Мария, ван Роосброеск Явес Эмиль Мария
МПК / Мітки
МПК: A61K 31/501, C07D 409/14, A61P 25/00, C07D 401/12
Мітки: дофаміну, антагоністи, дисоціюючі, піперидин-4-ілпіридазин-3-іламіну, швидкої, похідні, рецептора
Код посилання
<a href="https://ua.patents.su/15-94058-pokhidni-piperidin-4-ilpiridazin-3-ilaminu-yak-shvidko-disociyuyuchi-antagonisti-receptora-dofaminu-2.html" target="_blank" rel="follow" title="База патентів України">Похідні піперидин-4-ілпіридазин-3-іламіну як швидко дисоціюючі антагоністи рецептора дофаміну 2</a>
Попередній патент: Поршневий насос з пневморозподільником, упором і тарілчастими клапанами
Наступний патент: Змінні інтервали часу передачі для системи радіозв’язку
Випадковий патент: Спосіб одержання композиційних покриттів на основі нікеля