Двозаміщені фталазини – антагоністи провідного шляху hedgehog
Номер патенту: 106755
Опубліковано: 10.10.2014
Автори: Уілсон Такако, Хіпскінд Філіп Артур, Пейтел Барвін Кумар
Формула / Реферат
1. Сполука, яка описується формулою
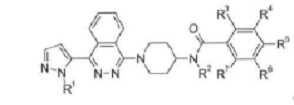
де:
R1 - водень або метил;
R2 - водень або метил; та
R3, R4, R5, R6 або R7 незалежно один від одного являють собою водень, фтор, хлор, ціаногрупу, трифторометил, трифторометоксигрупу, дифторометоксигрупу, метилсульфоніл або трифторометилсульфоніл, за умови, що щонайменше три з R3, R4, R5, R6 та R7 являють собою водень;
або фармацевтично прийнятна сіль цієї сполуки.
2. Сполука за п. 1, яка відрізняється тим, що R1 - метил, або її фармацевтично прийнятна сіль.
3. Сполука за п. 1 або п. 2, яка відрізняється тим, що R2 - метил, або її фармацевтично прийнятна сіль.
4. Сполука за будь-яким із пп. 1-3, яка відрізняється тим, що R3, R4, R5, R6 та R7 незалежно один від одного являють собою водень, фтор, хлор, трифторометил або метилсульфоніл, або її фармацевтично прийнятна сіль.
5. Сполука за будь-яким із пп. 1-4, яка відрізняється тим, що R3, R4, R5, R6 та R7 незалежно один від одного являють собою водень, фтор або трифторометил, або її фармацевтично прийнятна сіль.
6. Сполука за будь-яким із пп. 1-5, яка відрізняється тим, що R4, R6 та R7 є атомами водню, або її фармацевтично прийнятна сіль.
7. Сполука за будь-яким із пп. 1-6, яка являє собою 4-фторо-N-метил-N-(1-(4-(1-метил-1H-піразол-5-іл)фталазин-1-іл)піперидин-4-іл)-2-(трифторометил)бензамід, або її фармацевтично прийнятна сіль.
8. Сполука за будь-яким із пп. 1-7, яка являє собою гідрохлорид 4-фтор-N-метил-N-(1-(4-(1-метил-1H-піразол-5-іл)фталазин-1-іл)піперидин-4-іл)-2-(трифторометил)бензаміду.
9. Фармацевтична композиція, яка містить сполуку за будь-яким із пп. 1-8 або її фармацевтично прийнятну сіль разом із фармацевтично прийнятним носієм, розріджувачем або наповнювачем.
10. Сполука за будь-яким із пп. 1-8 або її фармацевтично прийнятна сіль для застосування у терапії.
11. Сполука за будь-яким із пп. 1-8 або її фармацевтично прийнятна сіль для застосування у лікуванні раку.
Текст
Реферат: Цей винахід пропонує нові 1,4-двозаміщені фталазини формули (І) які є інгібіторами провідного шляху hedgehog і корисні у лікуванні онкологічних захворювань. UA 106755 C2 (12) UA 106755 C2 UA 106755 C2 5 10 15 20 25 30 35 40 45 50 Цей винахід стосується антагоністів провідного шляху hedgehog і, більш конкретно, нових 1,4-двозаміщених фталазинів та їх терапевтичного застосування. Сигнальний провідний шлях Hedgehog (Hh) відіграє значну роль у формуванні ембріональної системи та підтриманні стану тканини у дорослих шляхом спрямування диференціації та проліферації клітин. Групу hedgehog-(Hh)-протеїнів, до якої входять Sonic Hedgehog (Shh), Indian Hedgehog (Ihh) та Desert Hedgehog (Dhh), складають секретовані глікопротеїни, які зазнають посттрансляційних модифікацій, в тому числі автокаталітичного розщеплення та приєднання холестерину до амінотермінального пептиду з утворенням фрагмента, який має сигнальну активність. Hh зв’язується з 12-прохідним трансмембранним протеїном Ptch (Ptch1 та Ptch2), тим самим полегшуючи опосередковане Ptch пригнічення агента Smoothened (Smo). Активація Smo запускає послідовність внутрішньоклітинних процесів, які завершуються стабілізацією факторів транскрипції Gli (Gli1, Gli2 та Gli3) та експресії Gli-залежних генів, відповідальних за проліферацію клітин, виживання клітин, ангіогенез та інвазію. Передача сигналів за участю Hh останнім часом викликає значний інтерес у зв’язку з виявленням факту, що аберантна активація передачі сигналу за участю Shh призводить до виникнення різноманітних пухлин, наприклад, раку підшлункової залози, медулобластоми, базально-клітинного раку, дрібноклітинного раку легенів та раку простати. У WO2005/033288 розкриті деякі 1,4-двозаміщені фталазини, вказані як антагоністи hedgehog. Так само, у WO2008/110611 розкриті певні 1,4-двозаміщені фталазини, які мають відношення до діагностики і лікування патологій, зв’язаних з провідним шляхом hedgehog. У WO2009/002469 розкриті певні 1,4-двозаміщені фталазини, які запропоновані, як факультативний засіб для лікування всіх видів злоякісних пухлин, розвиток яких пов’язаний із хибним функціонуванням сигнальної системи hedgehog. Втім, існує потреба у сильнодіючих інгібіторах провідного шляху hedgehog – особливо таких, що мають бажаний токсикологічний профіль. Цей винахід пропонує нові 1,4-двозаміщені фталазини як сильнодіючі антагоністи цього провідного шляху. Конкретні сполуки за цим винаходом забезпечують бажану взаємодію лікарських препаратів між собою, та відповідні профілі безпечності за умов оборотного та/або необоротного інгібування CYP3A4. Цей винахід пропонує сполуку формули I 4 3 R R O 5 R N N 2 7 6 N N N N R R R 1 R , Формула I 1 2 3 4 5 6 7 де R означає водень або метил; R означає водень або метил; R , R , R , R або R незалежно один від одного означають водень, фтор, хлор, ціаногрупу, трифторометил, трифторометокси, дифторометокси, метилсульфоніл або трифторометилсульфоніл, за умови, 3 4 5 6 7 що принаймні три з R , R , R , R та R являють собою водень; або фармацевтично прийнятну сіль цієї сполуки. Цей винахід пропонує також фармацевтичну композицію, яка містить сполуку Формули I або її фармацевтично прийнятну сіль разом із фармацевтично прийнятним наповнювачем, носієм або розріджувачем. Цей винахід пропонує метод лікування раку, обраного з групи, яка складається з раку мозку, базально-клітинного раку, раку стравоходу, раку шлунка, раку шлунково-кишкового тракту, раку підшлункової залози, раку жовчних шляхів, раку простати, раку молочної залози, дрібноклітинного раку легенів, недрібноклітинного раку легенів, лімфоми B-клітин, множинної мієломи, раку яєчників, колоректального раку, раку печінки, раку нирки, меланоми, злоякісних новоутворень голови і шиї, мезотеліоми, саркоми м’яких тканин, саркоми кісток, лейкемії та раку яєчка у ссавців, який включає введення до організму ссавця ефективної кількості сполуки формули I або її фармацевтично прийнятної солі. Крім того, цей винахід пропонує сполуку формули I або її фармацевтично прийнятну сіль для застосування у терапії. Також цей винахід пропонує сполуку формули I або її фармацевтично прийнятну сіль для застосування у лікуванні раку. Зокрема, згаданий рак обраний з групи, яка складається з раку мозку, базально-клітинного раку, раку стравоходу, раку шлунка, раку шлунково-кишкового тракту, раку підшлункової залози, раку жовчних шляхів, раку простати, раку молочної залози, дрібноклітинного раку легенів, недрібноклітинного раку легенів, 1 UA 106755 C2 5 10 15 20 25 30 35 40 45 50 55 60 лімфоми B-клітин, множинної мієломи, раку яєчників, колоректального раку, раку печінки, раку нирки, меланоми, злоякісних новоутворень голови і шиї, мезотеліоми, саркоми м’яких тканин, саркоми кісток, лейкемії та раку яєчка. Цей винахід також пропонує застосування в терапії сполуки формули I або її фармацевтично прийнятної солі. Крім того, цей винахід пропонує застосування сполуки формули I або її фармацевтично прийнятної солі для виготовлення лікарського засобу для лікування раків. Зокрема, згаданий рак обраний з групи, яка складається з раку мозку, базальноклітинного раку, раку стравоходу, раку шлунка, раку шлунково-кишкового тракту, раку підшлункової залози, раку жовчних шляхів, раку простати, раку молочної залози, дрібноклітинного раку легенів, недрібноклітинного раку легенів, лімфоми B-клітин, множинної мієломи, раку яєчників, колоректального раку, раку печінки, раку нирки, меланоми, злоякісних новоутворень голови і шиї, мезотеліоми, саркоми м’яких тканин, саркоми кісток, лейкемії, та раку яєчка. Крім того, цей винахід пропонує фармацевтичну композицію, яка містить сполуку формули I або її фармацевтично прийнятну сіль як активний інгредієнт для лікування раку, обраного з групи, яка складається з раку мозку, базально-клітинного раку, раку стравоходу, раку шлунка, раку шлунково-кишкового тракту, раку підшлункової залози, раку жовчних шляхів, раку простати, раку молочної залози, дрібноклітинного раку легенів, недрібноклітинного раку легенів, лімфоми B-клітин, множинної мієломи, раку яєчників, колоректального раку, раку печінки, раку нирки, меланоми, злоякісних новоутворень голови і шиї, мезотеліоми, саркоми м’яких тканин, саркоми кісток, лейкемії та раку яєчка. До конкретних сполук, що описуються формулою I, або їх фармацевтично прийнятних солей належать сполуки, у складі яких: (a) R1 означає метил; (b) R2 означає метил; (c) R3, R4, R5, R6 або R7 незалежно одне від одного означають водень, фтор, хлор, трифторометил або метилсульфоніл; (d) R3, R4, R5, R6 або R7 незалежно один від одного означають водень, фтор або трифторометил; (e) щонайменше двоє з таких замісників, як R3, R4, R5, R6 та R7, незалежно один від одного означають фтор, хлор, трифторометил або метилсульфоніл, за умови, що R3 та R7 не є одночасно атомами водню; (f) щонайменше двоє з таких замісників, як R3, R4, R5, R6 та R7, незалежно один від одного означають фтор або трифторометил, за умови, що R3 та R7 не є одночасно атомами водню; (g) R4, R6 та R7 означають водень; (h) R3 та R5 незалежно один від одного означають фтор, хлор, трифторометил або метилсульфоніл, а R4, R6 та R7 означають водень; (i) R3 та R5 незалежно один від одного означають фтор або трифторометил, а R4, R6 та R7 означають водень; (j) R1 є метилом та R2 є метилом; (k) R1 означає метил, R2 означає метил, а R3, R4, R5, R6 або R7 незалежно один від одного означають водень, фтор, хлор, трифтрометил або метилсульфоніл; (l) R1 означає метил, R2 означає метил, а R3, R4, R5, R6 або R7 незалежно один від одного означають водень, фтор або трифторометил; (m) R1 означає метил, R2 означає метил, а щонайменше двоє з таких замісників як R3, R4, R5, R6 та R7, незалежно один від одного означають фтор, хлор, трифторометил або метилсульфоніл, за умови, що R3 та R7 не є одночасно атомами водню; (n) R1 означає метил, R2 означає метил, а щонайменше двоє з таких замісників як R3, R4, R5, R6 та R7, незалежно один від одного означають фтор або трифторометил, за умови, що R3 та R7 не є одночасно атомами водню; (o) R1 означає метил, R2 означає метил, а R4, R6 та R7 означають водень; (p) R1 означає метил, R2 означає метил, R3 та R5 незалежно один від одного означають фтор, хлор, трифторометил або метилсульфоніл, а R4, R6 та R7 означають водень; (q) R1 означає метил, R2 означає метил, R3 та R5 незалежно один від одного означають фтор або трифторометил, а R4, R6 та R7 означають водень. Терміни і визначення як застосовані вище, так і на протязі всього опису цього винаходу, якщо не зазначено інше, слід розуміти як такі, що мають наведені нижче значення. Терміном "фармацевтично прийнятний носій, розріджувач або наповнювач" позначають середовище, яке вважається загальновизнаним у цій галузі засобом введення біологічно активних речовин до організму ссавців, наприклад людини. 2 UA 106755 C2 5 10 15 20 25 30 35 40 45 50 55 Термін "фармацевтично прийнятні солі" стосується відносно нетоксичних неорганічних та органічних солей сполук за цим винаходом. "Терапевтично ефективна кількість" або "ефективна кількість" означає кількість сполуки формули I або її фармацевтично прийнятної солі за цим винаходом, або фармацевтичну композицію, яка містить сполуку формули I або її фармацевтично прийнятну сіль за цим винаходом, яка здатна викликати певну біологічну або медичну реакцію або бажаний терапевтичний вплив на тканини, органу або організму тварини, ссавця або людини, що його передбачив дослідник, ветеринар, лікар або інший медичний працівник. Терміни "курс лікування", "лікувати", "процес лікування" тощо, у цьому описі означають сповільнення або обернення розвитку (прогресування) хвороби. Ці терміни також передбачають полегшення, поліпшення, послаблення, часткове або повне зняття одного або більше симптомів захворювання або хворобливого стану навіть у випадку, коли хворобу або хворобливий стан фактично не усунено, і навіть якщо прогресування хвороби або хворобливого стану як таких не сповільнено і не обернено. Відповідно до стандартних правил номенклатури, вживаних у цьому описі, передусім описують кінцеву частину бокового ланцюга із подальшим описом суміжної частини у напрямку до точки приєднання ланцюга. Наприклад, замісник метилсульфоніл є еквівалентом фрагмента CH3-SO2-. Сполуки за цим винаходом здатні вступати у реакцію, наприклад, із численними неорганічними або органічними кислотами з утворенням фармацевтично прийнятних солей – продуктів приєднання кислот. Такі фармацевтично прийнятні солі і способи їхнього приготування добре відомі фахівцям у відповідній галузі (див., наприклад, P. Stahl, et al., HANDBOOK OF PHARMACEUTICAL SALTS: PROPERTIES, SELECTION AND USE (СОЛІ У ФАРМАЦІЇ – ВЛАСТИВОСТІ, АСОРТИМЕНТ, КРИТЕРІЇ ВІДБОРУ І ЗАСТОСУВАННЯ: ДОВІДНИК), (VCHA/Wiley-VCH, 2002); S.M. Berge, et al., “Pharmaceutical Salts“ ("Солі у фармації"), Journal of Pharmaceutical Sciences, Vol 66, No. 1, January 1977). Сполуки за цим винаходом переважно включають до складу фармацевтичних композицій із застосуванням фармацевтично прийнятного носія, розріджувача або наповнювача і вводять до організму різноманітими шляхами. Переважно, такі композиції призначені для для перорального або внутрішньовенного введення. Такі фармацевтичні композиції та способи їх виготовлення добре відомі у відповідній галузі (див., наприклад, REMINGTON: THE SCIENCE AND PRACTICE th OF PHARMACY (ТЕОРЕТИЧНІ ЗАСАДИ І ПРАКТИКА ФАРМАЦІЇ) (A. Gennaro, et al., eds., 19 ed., Mack Publishing Co., 1995)). Практична форма застосування сполуки визначатиметься лікарем-терапевтом залежно від обставин, в тому числі стану, який належить лікувати, обраного шляху введення, фактичної природи сполуки, яку вводитимуть, віку, ваги тіла та індивідуальної чутливості (реакції) конкретного пацієнта, а також тяжкості симптомів захворювання. Добова доза зазвичай становить від приблизно 0,1 мг/кг до приблизно 10 мг/кг ваги тіла. У деяких випадках більш ніж достатньою може виявитися доза, нижча за нижчу межу зазначеного діапазону, натомість у інших випадках цілком припустимим є застосування ще більших доз. Сполуки Формули I або їх солі можуть бути виготовлені різноманітними методами, відомими у галузі, а також способами, показаними на Схемах, розкритими в описах Підготовчих синтезів та у Прикладах, наведених нижче. Для одержання сполук Формули I або їх солей конкретні стадії синтезів для кожного з описаних методів можна комбінувати різними способами або пов’язувати зі стадіями, показаними на різних схемах. Якщо не вказано інше, замісники відповідають наведеним вище визначенням. Реагенти та вихідні матеріали, як правило, є легко доступними для фахівця у галузі. Інші реагенти та вихідні матеріали можуть бути одержані стандартними методами хімії органічних та гетероциклічних сполук, методами, аналогічними способам синтезу відомих структурно аналогічних сполук, та методами, розкритими нижче в описах Препаративних методик та у Прикладах, в тому числі будь-якими новими методами. Пойменування наступних препаративних методик і прикладів здійснювали за допомогою функції Struct=Name у складі прикладного пакету ChemDraw Ultra 10.0. В контексті цього опису наведені нижче терміни застосовані у вказаних значеннях: "Et 2O" – діетиловий ефір, "DMF" – диметилформамід, "DMSO" – диметилсульфоксид,"DMAC" – N,Nдиметилацетамід, "NMP" – N-метилпіролідін, "MeOH" – метанол, “boc” або “t-boc” – третбутоксикарбоніл; “IC50” – концентрація засобу, яка спричиняє 50% максимальної інгібувальної реакції, можливої для цього засобу. 3 UA 106755 C2 Схема 5 10 15 20 25 30 35 Сполуку формули I можна одержати за реакціями, які подані на схемі. На стадії 1 дигалогенопохідне фталазину (1) (X=Cl або Br) вводять у реакцію нуклеофільного ароматичного заміщення (SNAr) із піперидином, захищеним групою 4-аміно-boc (2), із одержанням галогенопохідного піперидилфталазину формули (3). Реакція відбувається у середовищі диполярного апротонного розчинника, такого як DMF, DMAC або NMP, у присутності органічної або неорганічної основи. За варіантом, якому надається перевага, реакція відбувається у середовищі NMP у присутності карбонату калію, при температурі 50140C. На стадії 2 галогенопохідне піперидилфталазину формули (3) зазнає реакції кроссполучення Сузукі зі складним ефіром піразолборонової кислоти або вільною кислотою (4). Наприклад, галогенопохідне піперидилфталазину формули (3) сполучають із пінаколовим складним ефіром 1-метил-1H-піразол-5-боронової кислоти у присутності паладієвого каталізатора, такого як тетракіс(трифенілфосфін)паладію, і неорганічної основи, такої як бікарбонат натрію. Реакція відбувається у змішаному розчиннику толуол:етанол:вода із утворенням піразолілфталазину формули (5). Стадія 3 полягає просто у знятті захисту групою boc, яке здійснюють у умовах кислого середовища, такого як розчин HCl в діетиловому ефірі або діоксані, одержуючи амінопіперидинілфталазин формули (6). Методи введення і зняття захисту азот- та кисеньвміщуючих захисних груп добре відомі у галузі (див., наприклад, Greene and Wuts, Protective rd Groups in Organic Synthesis (Захисні групи в органічному синтезі), 3 Ed., John Wiley and Sons, New York, (1999)). На стадії 4 амінопіперидинілфталазин формули (6) ацилюють, одержуючи піперидиніламід формули I. За одним із методів амін вводять у реакцію із відповідним чином заміщеним бензоїлхлоридом у середовищі інертного розчинника, такого як дихлорметан, у присутності органічної основи, такої як триетиламін або діізопропілетиламін. У альтернативному варіанті амід одержують, виходячи з відповідним чином заміщеної бензойної кислоти. Складний ефір, що виступає в ролі ацилюючого реагента, одержують із пентафторофенілдифенілфосфінату, і потім вводять у реакцію з аміном. Реакція відбувається у змішаному розчиннику DMF:DMSO при помірній температурі (приблизно від 10C до 100C) у присутності органічної основи, такої як триетиламін або діізопропілетиламін. Препаративна методика 1 трет-бутил-1-(4-хлорофталазин-1-іл)піперидин-4-іл(метил)карбамат 4 UA 106755 C2 O O Cl N N N N 5 10 Суміш карбонату калію (21,23 г, 153,6 ммоль), 1,4-дихлорофталазину (26 г, 128 ммоль) і трет-бутилового складного ефіру метилпіперидин-4-іл-карбамінової кислоти (30,01 г, 134,4 ммоль) у вигляді розчину в N-метилпіролідині (200 мл) гріють протягом ночі при 80C. Реакційну суміш виливають у воду, екстрагують дихлорометаном, висушують над Na2SO4, і згущують під зниженим тиском. Додають діетиловий ефір, і відділяють фільтруванням твердий осад (4-хлорофеталазін-1-ол, зі сторонніх домішок у вихідному матеріалі). Фільтрат згущують. Залишок, що утворився, очищують флеш-хроматографією на силікагелі (елюент – гексан:етилацетат=2:1), одержуючи сполуку, вказану у заголовку, у вигляді білої твердої речовини (17,66 г, 37%). Мас-спектр 37 (ES/MS (Мас-спектроскопія з електророзпиленням)): m/z ( Cl) 377,0 (M+1). Препаративна методика 2 трет-бутил-1-(4-хлорофталазін-1-іл)піперидин-4-іл-карбамат O O N Cl N H N N 15 20 Сполуку, вказану у заголовку, одержують із дотриманням препаративної методики 1, але виходячи з трет-бутилового складного ефіру піперидин-4-іл-карбамінової кислоти. Реакційну суміш охолоджують і виливають у воду (500 мл). Екстрагують етилацетатом, промивають екстракт водою, висушують над Na2SO4, і випаровують розчинник у вакуумі, одержуючи сполуку, вказану у заголовку, у вигляді жовтої твердої речовини (36 г, 97%). Мас-спектр (ES/MS): m/z 363,0 (M+1). Препаративна методика 3 трет-бутилметил(1-(4-(1-метил-1H-піразол-5-іл)фталазин-1-іл)піперидин-4-іл)карбамат O O N N 25 30 35 N N N N У колбу, що містить суміш толуолу (50 мл), етанолу (17 мл) і води (17 мл), вносять карбонат натрію (3,82 г, 36,09 ммоль), трет-бутил-1-(4-хлорофталазин-1-іл)піперидин-4іл(метил)карбамат (6,8 г, 18,04 ммоль) та пінаколовий складний ефір 1-метил-1H-піразол-5боронової кислоти (5,3 г, 27,1 ммоль). Суміш знекиснюють, витісняючи повітря азотом протягом 10 хв. Додають тетракіс(трифенілфосфін)паладій (0,4 г, 0,35 ммоль), і нагрівають суміш протягом ночі при 74C. Охолоджують реакційну суміш до температури навколишнього середовища, і розводять діхлорометаном. Шар органічних продуктів промивають ропою, висушують над Na2SO4, і згущують під зниженим тиском. Залишок, що утворився, очищують флеш-хроматографією на силікагелі (елюент – гексан:етилацетат:2 М розчин NH3 у MeOH=20:5:1), одержуючи сполуку, вказану у заголовку, у вигляді жовтої піни (5,33 г, 70%). Масспектр (ES/MS): m/z 423,2 (M+1). Альтернативний спосіб синтезу трет-бутилметил(1-(4-(1-метил-1H-піразол-5-іл)фталазин-1іл)піперидин-4-іл)карбамату: Препаративні методики 4–6 Препаративна методика 4 1,4-Дибромофталазин Br 40 Br N N У товстостінну пробірку-реактор для роботи під тиском вносять пентабромід фосфору 5 UA 106755 C2 5 (24,5 г, 54,1 ммоль) і 2,3-дігідро-фталазин-1,4-діон (5,00 г, 30,8 ммоль). Пробірку заварюють, і нагрівають при 140C протягом 6-7 год, після чого залишають до ранку для охолодження. Обережно відкривають пробірку (можливий підвищений тиск або вакуум!). Тверду речовину виймають зсередини і вносять у крижану воду. Розмішуючи, дають продукту розійтися у крижаній воді, і відділяють тверду речовину, що утворилася, фільтруванням у вакуумі. Висушують у вакуумній сушильній шафі, одержуючи кінцевий продукт (8,31 г, 93%). Мас-спектр 79 81 (ES/MS): m/z ( Br, Br) 288,8 (M+). Джерело: Can. J. Chem. 1965, 43, 2708. Препаративна методика 5 трет-бутил-1-(4-бромофталазин-1-іл)піперидин-4-іл(метил)карбамат O O N Br 10 15 N N N Готують суміш 1,4-дибромофталазину (0,70 г, 2,38 ммоль), N-метилпіролідону (7,0 мл), карбонату калію (395 мг, 2,86 ммоль) і трет-бутилового складного ефіру метилпіперидин-4-іл-карбамінової кислоти (532 мг, 2,38 ммоль), і гріють її протягом ночі при 80C. Реакційну суміш охолоджують і виливають у воду. Відділяють осад твердої речовини, і висушують протягом ночі у вакуумній сушильній шафі при температурі навколишнього 81 середовища, одержуючи кінцевий продукт (0,96 г, 95%). Мас-спектр (ES/MS): m/z ( Br) 421,0 (M+1). Препаративна методика 6 трет-бутилметил(1-(4-(1-метил-1H-піразол-5-іл)фталазин-1-іл)піперидин-4-іл)карбамат O O N N 20 25 30 N N N N У товстостінну пробірку-реактор вносять трет-бутил-1-(4-бромофталазин-1-іл)піперидин-4іл(метил)карбамат (500 мг, 1,2 ммоль), пінаколовий складний ефір 1-метил-1H-піразол-5боронової кислоти (370 мг, 1,8 ммоль), карбонат натрію (252 мг, 2,4 ммоль), толуол (3,75 мл), етанол (1,25 мл) і воду (1,25 мл). Суміш знекиснюють, витісняючи повітря азотом протягом 10 хв. Додають тетракіс(трифенілфосфін)паладій (137,1 мг, 118,7 мкмоль). Барботують азот крізь реакційну суміш ще 10 хв. Реактор закорковують і нагрівають протягом ночі при 90C. Потому реакційну суміш охолоджують і фільтрують крізь шар силікагелю із наступним елююванням CH2Cl2, що містить 5% MeOH. Фракції продукту згущують у вакуумі. Залишок, що утворився, очищують хроматографією на силікагелі (елюент – 2% 2 М розчину NH3 у MeOH:CH2Cl2), одержуючи кінцевий продукт (345,6 мг, 69%). Мас-спектр (ES/MS): m/z 423,2 (M+1). Препаративна методика 7 трет-бутил-1-(4-(1H-піразол-5-іл)фталазин-1-іл)піперидин-4-іл(метил)карбамат O O 35 40 N N N N N N H Сполуку, вказану у заголовку, одержують із дотриманням препаративної методики 3, але виходячи з трет-бутил-1-(4-хлорофталазин-1-іл)піперидин-4-іл(метил)карбамату та пінакольного складного ефіру 1H-піразол-3-боронової кислоти. Вихід 580 мг (67%). Мас-спектр (ES/MS): m/z 409,2 (M+1). Препаративна методика 8 трет-бутил-1-(4-(1-метил-1H-піразол-5-іл)фталазин-1-іл)піперидин-4-іл-карбамат 6 UA 106755 C2 O O N N N 5 Сполуку, вказану у заголовку, одержують із дотриманням препаративної методики 3, але виходячи з трет-бутил-1-(4-хлорофталазин-1-іл)піперидин-4-ілкарбамату. Вихід 5,92 г (94%). + Мас-спектр (ES/MS): m/z 308,8 (M ). Препаративна методика 9 N-метил-1-(4-(1-метил-1H-піразол-5-іл)фталазин-1-іл)піперидин-4-амін N 10 15 N H N N N N N N Розчиняють у діхлорометані (100 мл) трет-бутилметил (1-(4-(1-метил-1H-піразол-5іл)фталазин-1-іл)піперидин-4-іл)карбамат (7,77 г, 18,39 ммоль). До розчину додають із надлишком 1 M розчин хлороводню у діетиловому ефірі (20 мл, 80 ммоль), і перемішують протягом 2 год при кімнатній температурі. Реакційну суміш згущують у вакуумі. Залишок, що утворився, очищують флеш-хроматографією на силікагелі (елюент – діхлорометан:2 М NH3 у MeOH=10:1), одержуючи сполуку, вказану у заголовку, у вигляді жовтої піни (5,83 г, 98%). Масспектр (ES/MS): m/z 323,2 (M+1). Проміжні сполуки, подані нижче у таблиці, одержують із дотриманням препаративної методики 9, за винятком того, що захисну групу із відповідного аміну, захищеного t-Boc, знімають за допомогою 4 M розчину HCl у діоксані. Преп. методики № Хімічна назва 10 1-(4-(1H-піразол-5-іл)фталазин1-іл)-N-метилпіперидин-4-амін 11 25 ES/MS, m/z Будова N N H 20 H N 1-(4-(1-метил-1H- піразол-5yl)фталазин-1-іл)піперидин-4амін N N N H N 309,2 (M+) NH2 408,8 + (M ) N N N N N Приклад 1 4-фтор-N-метил-N-(1-(4-(1-метил-1H-піразол-5-іл)фталазин-1-іл)піперидин-4-іл)-2(трифторометил)бензамід F F F O F N N N N N N До розчину N-метил-1-(4-(1-метил-1H-піразол-5-іл)фталазин-1-іл)піперидин-4-аміну (2,8 г, 8,68 ммоль) і триетиламіну (3,36 мл, 26,1 ммоль) у CH2Cl2 (30 мл) додають 4-фторо-2 7 UA 106755 C2 5 10 15 20 (трифторометил)бензоїлхлорид (2,14 мл, 10,42 ммоль). Перемішують 3 години при температурі навколишнього середовища. Реакційну суміш згущують під зниженим тиском. Залишок, що утворився, очищують флеш-хроматографією на силікагелі (елюент – гексан:етилацетат:2 М NH3 у MeOH=20:5:1), одержуючи основу цільової сполуки у вигляді жовтої піни (3,83 г, 86%). Масспектр (ES/MS): m/z 513,0 (M+1). Приклад 1a 4-фторо-N-метил-N-(1-(4-(1-метил-1H-піразол-5-іл)фталазин-1-іл)піперидин-4-іл)-2(трифторометил)бензаміду гідрохлорид Розчиняють у діхлорометані (100 мл) 4-фторо-N-метил-N-(1-(4-(1-метил-1H-піразол-5іл)фталазин-1-іл)піперидин-4-іл)-2-(трифторометил)бензамід (7,13 г, 13,91 ммоль), і до розчину додають із надлишком 1н розчин хлороводню у діетиловому ефірі (30 мл, 30 ммоль). Розчинник випаровують під зниженим тиском, одержуючи сполуку, вказану у заголовку (7,05 г, 92%). Масспектр (ES/MS): m/z 513,0 (M+1). Спектри ЯМР свідчать про співіснування суміші ротамерів 1 аміду у пропорції 2:1. Для головного ротамера H ЯМР (400 МГц, DMSO-d6): 8,34 (m, 1H), 8,26 (m, 2H), 7,95 (m, 1H), 7,75 (m, 1H), 7,64 (m, 2H), 7,55 (m, 1H), 6,72 (d, 1H, J=2 Гц), 5,15 (br, 1H), 4,71 (m, 1H), 4,22 (m, 2H), 3,84 (s, 3H), 3,48 (m, 2H), 2,65 (s, 3H), 2,19 (m, 2H), 1,89 ( m, 2H). Для 1 другорядного ротамера H ЯМР (400 МГц, DMSO-d6): 8,27 (m, 1H), 8,24 (m, 2H), 7,94 (m, 1H), 7,73 (m, 1H), 7,63 (m, 3H), 6,70 (d, 1H, J=2 Гц), 5,15 (br, 1H), 4,71 (m, 1H), 4,07 (m, 2H), 3,81 (s, 3H), 3,16 (m, 2H), 2,92 (s, 3H), 1,90 (m, 2H), 1,62 (m 2H). Аміди, подані нижче у таблиці, одержують із дотриманням препаративної методики, наведеної у Прикладі 1 та Прикладі 1a, виходячи з відповідного піперидинілфталазину і заміщеного бензоїлхлориду. № прикладу Хімічна назва 2 2-фторо-N-метил-N-(1-(4-(1метил-1H-піразол-5-іл)фталазин1-іл)піперидин-4-іл)-3(трифторометил)бензаміду гідрохлорид 3 ESIMS, m/z Будова F F HCl F F O N N-метил-N-(1-(4-(1-метил-1Hпіразол-5-іл)фталазин-1іл)піперидин-4-іл)-4(трифторометокси)бензаміду гідрохлорид N N 513,0 (M+1) N N N F F HCl O F O N N N N 511,0 (M+1) N N F F 4 F N-метил-N-(1-(4-(1-метил-1Hпіразол-5-іл)фталазин-1іл)піперидин-4-іл)-2(трифлтрометокси)бензаміду гідрохлорид O HCl 511,0 (M+1) O N N N N N N F F 5 6 5-фторо-N-метил-N-(1-(4-(1метил-1H-піразол-5-іл)фталазин1-іл)піперидин-4-іл)-2(трифторометил)бензаміду гідрохлорид F HCl O N N N N N N F Cl HCl 3,5-дихлоро-N-метил-N-(1-(4-(1метил-1H-піразол-5-іл)фталазин1-іл)піперидин-4-іл)бензаміду гідрохлорид 513,0 (M+1) 35 O N N 8 N N N N Cl ( Cl) 495,0 (M+1) UA 106755 C2 № прикладу Хімічна назва 7 4-ціано-N-метил-N-(1-(4-(1-метил1H-піразол-5-іл)фталазин-1іл)піперидин-4-іл)бензаміду гідрохлорид 8 9 ESIMS, m/z Будова HCl O N F N N N 526,2 (M +1) 499,0 (M+1) N N N F F N-(1-(4-(1H-піразол-5yl)фталазин-1-іл)піперидин-4-іл)4-фторо-N-метил-2(трифторометил)бензаміду гідрохлорид F HCl O N N N H N N N F F HCl N-(1-(4-(1-метил-1H-піразол-5іл)фталазин-1-іл)піперидин-4-іл)4-(трифторометокси)бензаміду гідрохлорид O F O N N N N H N N 497,0 (M+1) F F F 10 N-(1-(4-(1-метил-1H-піразол-5іл)фталазин-1-іл)піперидин-4-іл)2-( трифторометокси)бензаміду гідрохлорид O HCl 497,0 (M+1) O N N N N H N N F F 11 12 13 5-фторо-N-(1-(4-(1-метил-1Hпіразол-5-іл)фталазин-1іл)піперидин-4-іл)-2(трифторометил)бензаміду гідрохлорид F HCl 499,0 (M+1) O N N N N H N N F F F 4-фторо-N-(1-(4-(1-метил-1Hпіразол-5-іл)фталазин-1іл)піперидин-4-іл)-2(трифторометил)бензаміду гідрохлорид HCl F O F N N N 499,0 (M+1) N H N N HCl 4-ціано-N-(1-(4-(1-метил-1Hпіразол-5-іл)фталазин-1іл)піперидин-4-іл)бензаміду гідрохлорид O N N N N N H N N 438,0 (M+1) Приклад 14 4-хлоро-N-метил-N-(1-(4-(1-метил-1H-піразол-5-іл)фталазин-1-іл)піперидин-4-іл)-2(метилсульфоніл)бензаміду гідрохлорид HCl O O S O Cl N N 5 N N N N При температурі 60C готують розчин N-метил-1-(4-(1-метил-1H-піразол-5-іл)фталазин-1іл)піперидин-4-аміну (100 мг, 0,31 ммоль), 4-хлоро-2-(метилсульфоніл)бензенкарбонової 9 UA 106755 C2 5 10 кислоти (87 мг, 0,37 ммоль) і діізопропілетиламіну (0,26 мл, 1,5 ммоль) у суміші DMF:DMSO=4:1(2 мл). Охолоджують розчин до 0C, і додають пентафторофенілдифенілфосфінат (250 мг, 0,65 ммоль) у суміші DMF:DMSO =1:1 (1 мл). Перемішують протягом ночі при 60C. Охолоджують реакційну масу до температури навколишнього середовища, розводять CH2Cl2, промивають ропою, висушують над Na 2SO4 і згущують у вакуумі. Залишок, що утворився, очищують флеш-хроматографією на силікагелі (елюент – гексан:етилацетат:2 М NH3 у MeOH=20:5:1), одержуючи цільовий продукт. До виділеного продукту додають із надлишком 1н розчин хлороводню у діетиловому ефірі (1 мл, 10 ммоль), і видаляють розчинник, одержуючи сполуку, вказану у заголовку (150 мг, 84%). Масспектр (ES/MS): m/z 539,0 (M+1). Аміди, подані нижче у таблиці, одержують із дотриманням препаративної методики, наведеної у Прикладі 14, виходячи з відповідного піперидинілфталазину і заміщеної бензенкарбонової кислоти. No прикладу 15 16 17 18 Хімічна назва ES/MS m/z Будова N-метил-N-(1-(4-(1-метил-1H-піразол5-іл)фталазин-1-іл)піперидин-4-іл)-2(метилсульфоніл)бензаміду гідрохлорид O O S HCl O 505,0 (M+1) N N N-метил-N-(1-(4-(1-метил-1H-піразол5-іл)фталазин-1-іл)піперидин-4-іл)-2(трифторометилсульфоніл)бензаміду гідрохлорид 2-хлоро-4-фторо-N-метил-N-(1-(4-(1метил-1H-піразол-5-іл)фталазин-1іл)піперидин-4-іл)бензаміду гідрохлорид N N HCl 5-фторо-N-метил-N-(1-(4-(1-метил1H-піразол-5-іл)фталазин-1іл)піперидин-4-іл)-2(метилсульфоніл)бензаміду гідрохлорид N N O O S O N N N N F N N O O S O HCl N N N 476,0 (M+1) F F F 559,0 (M+1) N N N Cl HCl 35 O F N N N N N N ( Cl) 479,0 (M+1) N 19 20 2-ціано-N-метил-N-(1-(4-(1-метил-1Hпіразол-5-іл)фталазин-1іл)піперидин-4-іл)бензаміду гідрохлорид 4-(дифторометокси)-N-метил-N-(1-(4(1-метил-1H-піразол-5-іл)фталазин1-іл)піперидин-4-іл)бензаміду гідрохлорид 10 HCl O N N N 452,0 (M+1) N N N F HCl F O O N N N N N N 493,0 (M+1) UA 106755 C2 No прикладу 21 22 Хімічна назва ES/MS m/z Будова N-(1-(4-(1-метил-1H-піразол-5іл)фталазин-1-іл)піперидин-4-іл)-2(метилсульфоніл)бензаміду гідрохлорид O O S O HCl 4-хлоро-N-(1-(4-(1-метил-1H-піразол5-іл)фталазин-1-іл)піперидин-4-іл)-2(метилсульфоніл)бензаміду гідрохлорид N N N H HCl N 491,0 (M+1) O O S O N N 35 Cl N N N N H N N ( Cl) 525,0 (M+1) F F 23 24 5 10 15 20 25 30 N-(1-(4-(1-метил-1H-піразол-5іл)фталазин-1-іл)піперидин-4-іл)-2(трифторометилсульфоніл)бензаміду гідрохлорид O N N N 545,0 (M+1) N H N N Cl HCl 2-хлоро-4-фторо-N-(1-(4-(1-метил1H-піразол-5-іл)фталазин-1іл)піперидин-4-іл)бензаміду гідрохлорид F O S O HCl 35 O F N N N N N N H ( Cl) 465,0 (M+1) Провідний шлях Hedgehog бере участь як фактор виживання у розвитку таких раків як базально-клітинний рак; раки верхнього відділу шлунково-кишкового тракту (стравоходу, шлунка, підшлункової залози та жовчних шляхів); рак простати; рак молочної залози; дрібноклітинний рак легенів; недрібноклітинний рак легенів; лімфома B-клітин; множинна мієлома; рак шлунка; рак яєчників; рак ободової та прямої кишки; рак печінки; меланома; злоякісні новоутворення голови і шиї, мезотеліома, саркоми м’яких тканин, саркоми кісток, лейкемія, рак яєчка, рак нирки, а також рак мозку. З’ясовано, що елементи провідного шляху hedgehog є потенціальними мішенями для фармацевтичних засобів лікування раку. Знайдена у медулобластомних пухлинах (АТСС, НТВ186) клітинна лінія Daoy реагує на ліганди Hh. При обробленні цих клітин введеним екзогенно Shh-кондиціонованим середовищем активується провідний шлях Hh, що призводить до посиленої експресії Gli1. Циклопамін – алкалоїд, виділений з чемериці каліфорнійської Veratrum californicum, є слабким антагоністом hedgehog, і було показано, що він пригнічує експресію Gli1 як реакцію на стимуляцію Shh. Дослідження останнього часу свідчать, що циклопамін інгібує ріст культивованих клітин та аллотрансплантантів медулобластоми. Застосовуючи цю модель клітин Daoy, можна розпізнати ефективні інгібітори провідних шляхів hedgehog. Оскільки сполуки за цим винаходом є антагоністами hedgehog, вони є придатними для лікування вищезазначених типів пухлин. Визначення біологічної активності IC50: Функціональний тест із одержанням кількісної оцінки інгібування Gli1 у клітинах лінії Daoy Наведені нижче загальна схема і результати проведення тесту свідчать про доцільність і ефективність використання сполук і методів, що є об’єктами цього винаходу. Функціональні проби підтверджують, що сполуки за цим винаходом виявляють здатність до інгібування провідного шляху Shh. Усі ліганди, розчинники та реагенти, використовувані в описаних нижче випробуваннях, є наявними на ринку або можуть бути без утруднень виготовлені фахівцем у цій галузі. Біологічну активність визначали, застосовуючи функціональну пробу з використанням нейронних ракових клітин Daoy та вимірювання рівнів рибонуклеїнової кислоти Gli1 з використанням системи випробування на bDNA (розгалужену деоксирибонуклеїнову кислоту) (Panomics, Inc., Fremont, CA). Gli1 був раніше відкритий у лінії клітин гліобластоми, і він кодує протеїн zinc finger, який активується провідним шляхом Shh. Максимальний відгук одержують 11 UA 106755 C2 5 10 15 20 25 30 35 40 45 50 55 60 шляхом індукування транскрипції Gli1 у клітинах Daoy за допомогою кондиціонованого середовища (мезонефросу людини, або клітин НЕК-293, які стабільно експресують рекомбінантний Shh) протягом 24 год з подальшим визначенням кількості стимульованого транскрипту Gli1. Мінімальним відгуком є кількість транскрипту Gli1, інгібованого досліджуваною сполукою у клітинах Daoy, які були стимульовані кондиціонованим середовищем (мезонефросу людини, або клітин НЕК-293, які стабільно експресують рекомбінантний Shh) протягом 24 год. У системі випробування на bDNA застосовується технологія з використанням розгалуженої ДНК для забезпечення ампліфікації рибонуклеїнової кислоти-мішені (транскрипту). У цій технології використовуються три типи синтетичних гібридних Gli1-специфічних зондів сDNA, які визначають специфічність транскрипту-мішені (розширювачів захоплення (СЕs), розширювачів мічення (LЕs) та блокаторів (BLs), які у формі комплекса гібридизуються з транскриптамимішенями з метою підсилення сигналу гібридизації. Додання хемілюміногенного субстрату на стадії ампліфікації дозволяє для детектування використовувати люмінесценцію. Клітини Daoy вирощують до злиття у склянках для тканинних культур типу Т225 у середовищі для вирощування Daoy, яке містить мінімальне базове середовище (МЕМ) плюс 10% сироватки крові плоду корови (FBS) з 0,1 нМ замінних амінокислот та 1 мМ пірувату натрію. Клітини видаляють із склянок Т225 з застосуванням трипсину та етилендіамінтетраоцтової кислоти (EDTA), центрифугують, знов суспендують у середовищі та підраховують. Потім клітини Daoy висівають у кількості 50000 клітин на лунку у ростовому середовищі у 96лункові прозорі планшети Costar для культивування тканин та піддають інкубуванню протягом ночі при 37С в атмосфері 5% діоксиду вуглецю (СО 2). Промивають клітини один раз сольовим розчином з фосфатним буфером (PBS), після чого додають 100 мкл кондиціонованого середовища Shh (Shh-СМ) для стимулювання рівнів експресії Gli1. Розводять Shh-СМ для досягнення максимальної стимуляції, застосовуючи стандартне ростове середовище – 0,1% FBS/DMEM (модифіковане за Дюльбекко середовище Eagle). Потім клітини Daoy, оброблені Shh-СМ, обробляють різними концентраціями інгібіторів hedgehog у діапазоні концентрацій від приблизно 1 мкМ до 0,1 нМ. Суміші з досліджуваними сполуками інкубують протягом 24 год при 37С в атмосфері 5% СО2 Визначення кількості транскрипту Gli1 виконують, застосовуючи пробу на Gli1 типу Quantigene 2.0 згідно з описом виробника (Panomics, Inc.). Виготовляють розведений буфер лізисної суміші (DLM), який містить протеїназу-К. Після інкубування протягом 24 год з досліджуваною сполукою клітини промивають один раз PBS, та додають до клітин 180 мкл DLM. Планшет з клітинами, який містить лізисний буфер, закривають та витримують при 55С протягом 30-45 хв. Одержані лізати клітин потім розтирають 5 разів. Робочий набір зондів, який містить зонди Gli1, виготовляють шляхом розведення зондів у DLM згідно з інструкціями виробника, після чого додають у планшети для проби на bDNA 20 мкл робочого набору зондів разом з 80 мкл лізатів Daoy. Планшети закривають та інкубують при 55С протягом ночі. Потім обробляють планшети для bDNA згідно з інструкціями виробника. Сигнал кількісно вимірюють шляхом сканування планшетів на приладі Perkin Elmer Envision reader, який реєструє люмінесценцію. Величина люмінісцентного сигнала є прямо пропорційною кількості транскрипту-мішені, присутнього у пробі. Дані про сигнал люмінесценції, одержані при функціональній пробі, застосовують для обчислення ІС50 при випробуванні in vitro. Ці дані обчислюють на основі максимальних контрольних значень (для клітин Daoy, оброблених Shh-СМ) та мінімального контрольного значення (для клітин Daoy, оброблених Shh-СМ та інгібувальною концентрацією контрольної сполуки – 1 мкМ N-(3-(1Н-бензо[d]імідазол-2-іл)-4-хлорфеніл)3,5-диметоксибензаміду). Для отримання значень ІС50 застосовують чотирьохпараметрову логістичну криву з використанням програм ActivityBase, версія 5.3, рівняння 205 (див. Assay Guidance Manual Version 5.0 (Практичний посібник з виконання біотестів, редакція5.0), 2008, Eli Lilly and Company and NIH Chemical Genomics Center (компанія "Eli Lilly & Co" у співпраці з Центром біохімічної генетики Національного інституту охорони здоров’я США)). При випробуванні за вищезазначеною методикою сполуки, взяті за приклади, виявили ІС50
ДивитисяДодаткова інформація
Назва патенту англійськоюDisubstituted phthalazine hedgehog pathway antagonists
Автори англійськоюHipskind, Philip, Arthur, Patel, Bharvin, Kumar, Wilson, Takako
Автори російськоюХипскинд Филип Артур, Пейтел Барвин Кумар, Уилсон Такако
МПК / Мітки
МПК: A61K 31/502, C07D 401/14, A61P 35/00
Мітки: шляху, антагоністи, двозаміщені, hedgehog, провідного, фталазини
Код посилання
<a href="https://ua.patents.su/17-106755-dvozamishheni-ftalazini-antagonisti-providnogo-shlyakhu-hedgehog.html" target="_blank" rel="follow" title="База патентів України">Двозаміщені фталазини – антагоністи провідного шляху hedgehog</a>
Попередній патент: Пристрій, призначений для лікування гнійних ран, спосіб лікування гнійних ран та застосування пристрою для лікування гнійних ран
Наступний патент: Генетичні маркери, асоційовані з відповіддю на інтерферон-альфа
Випадковий патент: Композиція інгредієнтів для бальзаму "золотий крим"












