Двозаміщені фталазини – антагоністи провідного шляху hedgehog
Номер патенту: 102115
Опубліковано: 10.06.2013
Автори: Хіпскінд Філіп Артур, Бастіан Джолі Ен, Селл Даніель Джон, Уілсон Такако
Формула / Реферат
1. Сполука вказаної нижче формули:
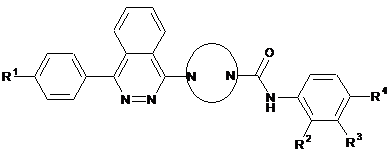 ,
,
де
R1 - водень, фтор, ціаногрупа, трифторметил або метоксигрупа;
R2 - водень, фтор або трифторметил;
R3 - водень або хлор, за умови, що принаймні один замісник з R2 та R3 - водень;
R4 - хлор, фтор, ціаногрупа, трифторметил, дифторметил, метокси- або трифторметоксигрупа;
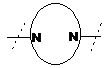 - заміщений піперазин-1,4-діїл, вибраний з групи, яку складають
- заміщений піперазин-1,4-діїл, вибраний з групи, яку складають
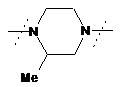 ,
, 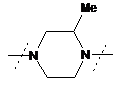 ,
,  ,
, 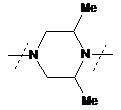 ,
, 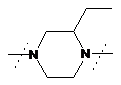 ,
, 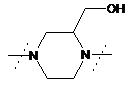 ;
;
або фармацевтично прийнятна сіль такої сполуки.
2. Сполука за п. 1, де R1 - водень, фтор або ціаногрупа, або фармацевтично прийнятна сіль такої сполуки.
3. Сполука за п. 1 або п. 2, де R1 - фтор, або фармацевтично прийнятна сіль такої сполуки.
4. Сполука за будь-яким із пп. 1-3, де R2 - водень або фтор, або фармацевтично прийнятна сіль такої сполуки.
5. Сполука за будь-яким із пп. 1-4, де R2 - водень, або фармацевтично прийнятна сіль такої сполуки.
6. Сполука за будь-яким із пп. 1-5, де R3 - водень, або фармацевтично прийнятна сіль такої сполуки.
7. Сполука за будь-яким із пп. 1-6, де R4 - фтор, хлор, ціаногрупа, трифторметоксигрупа, трифторметил або дифторметил, або фармацевтично прийнятна сіль такої сполуки.
8. Сполука за будь-яким із пп. 1-7, де R4 - фтор або ціаногрупа, або фармацевтично прийнятна сіль такої сполуки.
9. Сполука за будь-яким із пп. 1-8, де 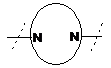 являє собою
являє собою 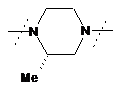 або
або 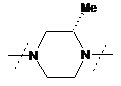 , або фармацевтично прийнятна сіль такої сполуки.
, або фармацевтично прийнятна сіль такої сполуки.
10. Сполука за будь-яким із пп. 1-9, яка являє собою (S)-N-(4-фторфеніл)-4-(4-(4-фторфеніл)фталазин-1-іл)-2-метилпіперазин-1-карбоксамід або фармацевтично прийнятну сіль такої сполуки.
11. Сполука за п. 10, яка являє собою гідрохлорид (S)-N-(4-фторфеніл)-4-(4-(4-фторфеніл)фталазин-1-іл)-2-метилпіперазин-1-карбоксаміду.
12. Фармацевтична композиція, яка містить сполуку за будь-яким із пп. 1-11 або фармацевтично прийнятну сіль такої сполуки у комбінації з фармацевтично прийнятним носієм, розріджувачем або наповнювачем.
13. Сполука за будь-яким із пп. 1-11 або фармацевтично прийнятна сіль такої сполуки для застосування як лікарський засіб.
14. Сполука за будь-яким із пп. 1-11 або фармацевтично прийнятна сіль такої сполуки для застосування при лікуванні раку.
15. Сполука за п. 14 або її фармацевтично прийнятна сіль, де рак вибраний з групи, яку складають рак головного мозку, базальноклітинна карцинома, рак стравоходу, рак шлунка, рак підшлункової залози, рак жовчних шляхів, рак простати, рак молочної залози, дрібноклітинний рак легенів, недрібноклітинний рак легенів, лімфома В-клітин, множинна мієлома, рак яєчників, рак ободової та прямої кишки, рак печінки, рак нирок та меланома.
Текст
Реферат: Цей винахід пропонує нові 1,4-двозаміщені фталазинові антагоністи провідного шляху hedgehog, корисні при лікуванні раку. UA 102115 C2 (12) UA 102115 C2 UA 102115 C2 5 10 15 20 25 Цей винахід стосується антагоністів провідного шляху hedgehog і, більш конкретно, нових 1,4-двозаміщених фталазинів та їх терапевтичного застосування. Провідний шлях Hedgehog (Hh) відіграє значну роль у формуванні ембріональної системи та підтриманні стану тканини у дорослих шляхом спрямування диференціації та проліферації клітин. Групу hedgehog-(Hh)протеїнів, до якої входять Sonic Hedgehog (Shh), Indian Hedgehog (Ihh) та Desert Hedgehog (Dhh), складають секретовані глікопротеїни, які зазнають посттрансляційних модифікацій, в тому числі автокаталітичного розщеплення та приєднання холестерину до амінотермінального пептиду з утворенням фрагмента, який має сигнальну активність. Hh зв'язується з 12-прохідним трансмембранним протеїном Ptch (Ptch1 та Ptch2), тим самим полегшуючи опосередковане Ptch пригнічення агента Smoothened (Smo). Активація Smo запускає послідовність внутрішньоклітинних процесів, кульмінацією яких є стабілізація факторів транскрипції Gli (Gli1, Gli2 та Gli3) та експресія Gli-залежних генів, відповідальних за проліферацію клітин, виживання клітин, ангіогенез та інвазію. Передавання сигналів за участю Hh останнім часом викликає значний інтерес у зв'язку з виявленням факту, що аберантна активація передавання сигналу за участю Shh призводить до виникнення різноманітних пухлин, наприклад, раку підшлункової залози, медулобластоми, базально-клітинного раку, дрібноклітинного раку легенів та раку простати. Відомі декілька антагоністів Hh, такі як IР-609 (похідне стероїдного алкалоїду); CUR61414 (похідне амінопроліну) та JK18 (похідне 2,4-двозаміщеного тіазолу). У WO2005/033288 описані деякі 1,4двозаміщені фталазини, вказані як антагоністи hedgehog. Аналогічно, WO2008/110611 розкриває конкретні 1,4-двозаміщені фталазини, які пов'язані з діагностикою та лікуванням патологій, які мають відношення до провідного шляху hedgehog. Існує постійна потреба в ефективних інгібіторах провідного шляху hedgehog, зокрема, у таких, які мають бажані фармакодинамічні, фармакокінетичні та токсикологічні профілі. Цей винахід пропонує нові 1,4-двозаміщені фталазини, які є ефективними антагоністами згаданого провідного шляху. Цей винахід пропонує сполуку Формули I: O 1 R N N N N 4 R N H 2 R 3 R , Формула I: 30 35 де 1 R – водень, фтор, ціаногрупа, трифторметил або метоксигрупа; 2 R – водень, фтор або трифторметил; 3 2 3 R – водень або хлор, за умови, що щонайменше один замісник із R та R – водень, 4 R – хлор, фтор, ціаногрупа, трифторметил, метокси-, дифторметокситрифторметоксигрупа; N або N – заміщений піперазин-1,4-діїл, вибраний з групи, яку складають: 40 45 або фармацевтично прийнятну сіль такої сполуки. Стосовно до вищевказаних піперазинових циклічних структур мається на думці, що зображений піперазиновий цикл з лівого боку зв'язаний з біциклічним фталазином, а з правого боку – з карбонілом. Для фахівця у галузі зрозуміло, що сполуки за цим винаходом містять третинну аміногрупу та здатні реагувати із численними неорганічними та органічними кислотами, утворюючи фармацевтично прийнятні солі з кислотами. Такі фармацевтично прийнятні солі з кислотами та загальна методологія їх одержання добре відомі в галузі. Дивись, наприклад, P. Stahl et al., HANDBOOK OF PHARMACEUTICAL SALTS: PROPERTIES, SELECTION, AND USE, (VCHA/Wiley-VCH, 2002); S.M. Berge et al., Pharmaceutical Salts, Journal of Pharmaceutical Sciences, Vol. 66, No. 1, January 1977. 1 UA 102115 C2 5 10 Конкретні варіанти здійснення цього винаходу охоплюють сполуки Формули I або їх фармацевтично прийнятні солі, де: 1 (a) R – водень, фтор та ціаногрупа; 1 (b) R – фтор; 2 (c) R – водень або фтор; 2 (d) R – водень; 3 (e) R – водень; 4 (f) R – фтор, хлор, ціано-, трифторметокси-, дифторметоксигрупа або трифторметил; 4 (g) R – фтор або ціаногрупа; 4 (h) R – фтор; N Me N N N N є Me (і) N або N ; N N N є Me (j) ; Me N N 15 20 25 30 35 N N (k) є ; 1 2 (l) R – водень, фтор та ціаногрупа; та R – водень або фтор; 1 2 (m) R – водень, фтор та ціаногрупа; та R – водень; 1 2 (n) R – фтор; та R – водень або фтор; 1 2 (o) R – фтор; та R – водень; 1 2 4 (p) R – водень, фтор та ціаногрупа; та R – водень або фтор; та R – фтор, хлор, ціаногрупа, трифторметокси-, дифторметоксигрупа або трифторметил; 1 2 4 (q) R – водень, фтор та ціаногрупа; R – водень; та R – фтор, хлор, ціаногрупа, трифторметокси-, дифторметоксигрупа або трифторметил; 1 2 4 (r) R – фтор; R – водень або фтор; та R – фтор, хлор, ціаногрупа, трифторметокси-, дифторметоксигрупа або трифторметил; 1 2 4 (s) R – фтор; R – водень; та R – фтор, хлор, ціано-, трифторметокси-, дифторметоксигрупа або трифторметил; 1 2 3 (t) R – водень, фтор та ціаногрупа; R – водень або фтор; R – водень; 4 та R – фтор, хлор, ціано-, трифторметокси-, дифторметоксигрупа або трифторметил; 1 2 3 4 (u) R – водень, фтор та ціаногрупа; R – водень; R – водень; та R – фтор, хлор, ціано-, трифторметокси-, дифторметоксигрупа або трифторметил; 1 2 3 4 (v) R – фтор; R – водень або фтор; R – водень; та R – фтор, хлор, ціаногрупа, трифторметокси-, дифторметоксигрупа або трифторметил; та 1 2 3 4 (w) R – фтор; R – водень; R – водень; та R – фтор, хлор, ціаногрупа, трифторметокси-, дифторметоксигрупа або трифторметил; 1 2 3 4 (x) R – фтор; R – водень; R – водень; та R – фтор; 1 2 (y) R – водень, фтор або ціаногрупа; R – водень або фтор; та N Me N N N N є Me N або ; N 1 2 (z) R – водень, фтор або ціаногрупа; R – водень; та N Me N N Me N або ; N N 1 2 (z) R –фтор; R – водень або фтор; та N 40 Me є Me N N або N ; 2 N є UA 102115 C2 1 2 3 4 (aa) R – водень, фтор або ціаногрупа; R – водень або фтор; R – водень; R – фтор, хлор, N N ціано-, трифторметокси-, дифторметоксигрупа або трифторметил; та N N є Me Me N або N ; 1 2 3 4 (bb) R – водень, фтор або ціаногрупа; R – водень; R – водень; R – фтор або ціаногрупа; N N 5 10 15 20 25 30 35 40 45 50 N Me N N N є Me або . Цей винахід пропонує також фармацевтичну композицію, яка містить сполуку Формули I або її фармацевтично прийнятну сіль у сполученні із фармацевтично прийнятним наповнювачем, носієм або розріджувачем. Перевага віддається включенню сполук за цим винаходом до складу фармацевтичних композицій, які вводяться в організм різноманітними шляхами. За варіантами, яким віддається перевага, такі композиції призначені для перорального або внутрішньовенного введення. Такі фармацевтичні композиції та способи їх виготовлення добре відомі в галузі. Дивись, наприклад, th REMINGTON: THE SCIENCE AND PRACTICE OF PHARMACY, (А. Gennaro et al., eds. 19 ed., Mack Publishing Co., 1995). Цей винахід пропонує також спосіб лікування раку головного мозку, базально-клітинного раку, раку стравоходу, раку шлунка, раку підшлункової залози, раку жовчних шляхів, раку простати, раку молочної залози, дрібноклітинного раку легенів, недрібноклітинного раку легенів, В-клітинної лімфоми, множинної мієломи, раку яєчників, раку ободової та прямої кишки, раку печінки, раку нирки або меланоми у пацієнта, який включає введення в організм пацієнта, який потребує такого лікування, ефективної кількості сполуки Формули I або фармацевтично прийнятної солі такої сполуки. Мається на увазі, що реально застосовувана кількість сполуки визначається лікарем з урахуванням відповідних обставин, в тому числі патологічного стану, який підлягає лікуванню, обраного шляху введення, конкретної застосовуваної сполуки або сполук, віку, маси тіла та індивідуальної реакції пацієнта та тяжкості симптомів, які спостерігаються у пацієнта. Добові дози у звичайних випадках становлять від приблизно 0,1 мг/кг до приблизно 5 мг/кг маси тіла. За деяких обставин повністю відповідними можуть бути дози, нижчі від нижчої межі вищезгаданого діапазону, тоді як в інших випадках можуть застосовуватися ще більші дози. Отже, вищезгаданий діапазон дозування не призначений для обмеження будь-яким чином обсягу винаходу. Цей винахід пропонує також сполуку Формули I або фармацевтично прийнятну сіль такої сполуки для застосування як лікарський засіб. Крім того, цей винахід пропонує застосування сполуки Формули I або фармацевтично прийнятної солі такої сполуки при виготовленні лікарського засобу для лікування раку. Зокрема, рак, який піддають лікуванню, вибраний з групи, яку складають рак головного мозку, базальноклітинний рак, рак стравоходу, рак шлунка, рак підшлункової залози, рак жовчних шляхів, рак простати, рак молочної залози, дрібноклітинний рак легенів, недрібноклітинний рак легенів, Вклітинна лімфома, множинна мієлома, рак яєчників, рак ободової та прямої кишки, рак печінки, рак нирки та меланома. Крім того, цей винахід пропонує фармацевтичну композицію, яка містить як активний інгредієнт сполуку Формули I або її фармацевтично прийнятну сіль, для лікування раку головного мозку, базально-клітинного раку, раку стравоходу, раку шлунка, раку підшлункової залози, раку жовчних шляхів, раку простати, раку молочної залози, дрібноклітинного раку легенів, недрібноклітинного раку легенів, В-клітинної лімфоми, множинної мієломи, раку яєчників, раку ободової та прямої кишки, раку печінки, раку нирки або меланоми. Сполуки Формули I або їх солі можуть бути виготовлені різноманітними методами, відомими у галузі, а також способами, показаними на Схемах, розкритими в описах Підготовчих синтезів та у Прикладах, наведених нижче. Для одержання сполук Формули I або їх солей конкретні стадії синтезів для кожного з описаних методів можна комбінувати різними способами або пов'язувати зі стадіями, показаними на різних схемах. Якщо не вказано інше, замісники відповідають наведеним вище визначенням. Реагенти та вихідні матеріали, як правило, є легко доступними для фахівця у галузі. Інші реагенти та вихідні матеріали можуть бути одержані стандартними методами хімії органічних та гетероциклічних сполук, методами, аналогічними способам синтезу відомих структурно аналогічних сполук, та та 3 UA 102115 C2 5 методами, розкритими нижче в описах Підготовчих синтезів та у Прикладах, в тому числі будьякими новими методами. При вживанні в цьому описі нижчезазначені терміни мають вказані відповідні значення: „"Et2O" – діетиловий ефір; "DMF" – диметилформамід; "DMSO" – диметилсульфоксид; "EtOAc" – етилацетат; "THF" – тетрагідрофуран; "MeOH" – метанол; "MTBE" – метил-трет-бутиловий ефір; "boc" або "t-boc" – трет-бутоксикарбоніл; "SCX" – сильний катіонообмінник; та "IC50" – концентрація засобу, яка спричиняє 50 % максимальної інгібувальної реакції, можливої для цього засобу. 10 15 20 25 30 35 40 45 Сполуку Формули I (6b) можна одержати згідно з реакціями, показаними на Схемі 1. Як показано на Схемі 1, стадія 1, 1,4-дихлорфталазин (2) можна ввести в реакцію нуклеофільного ароматичного заміщення (SNAr) із заміщеним піперазином (3a) або (3b), і одержати піперазинілфталазин формули (4a) або формули (4b). Реакція відбувається в диполярному апротонному розчиннику, такому як DMSO або DMF, у присутності прийнятної основи, такої як триетиламін, діізопропілетиламін або карбонат калію. Реакційну суміш нагрівають приблизно при 70-150C. Для фахівця у галузі зрозуміло, що за деяких умов доцільно використовувати у піперазині формули (3a) групу захисту, таку як t-boc група, для забезпечення захисту атома азоту з меншим ступенем стеричного утруднення, наприклад, у (S)трет-бутил-3-метилпіперазин-1-карбоксилаті. І навпаки, якщо реакція проходить при атомі азоту з меншим ступенем стеричного утруднення, можливо застосовувати незахищені піперазини, такі як цис-2,6-диметилпіперазин або піперазин-2-ілметанол. Захист непотрібний також при використанні 2,5-диметилпіперазину. На стадії 2 фталазинілхлорид формули (4) вводять у реакцію з фенілборною кислотою в умовах перехресного сполучення за Судзукі (Suzuki). Для фахівця у галузі зрозуміло, що існують різноманітні умови, корисні для полегшення таких реакцій перехресного сполучення. Умови реакції включають використання прийнятного розчинника, такого як діоксан або суміш діоксану з водою. Реакцію проводять у присутності основи, такої як карбонат цезію або фторид цезію. Реакція відбувається у присутності паладієвого каталізатора, такого як біс(ди-третбутил(4-диметиламінофеніл)фосфін)дихлорпаладій(II), (1,1’біс(дифенілфосфіно)фероцен)паладій(II)-хлорид або (SP-4-1)-біс[біс(1,1-диметилетил)(4метоксифеніл)фосфін-P]дихлорпаладій (одержаного за способом синтезу каталізатора D, описаним у J. Org. Chem. 2007, 72, 5104-5112) в інертній атмосфері при температурі приблизно 80-110C, з утворенням фенілпіперазинілфталазину формули (6a) або (6b). За альтернативним варіантом на стадії 3 фенілфталазинілхлорид формули (5) вводять в реакцію нуклеофільного ароматичного заміщення (SNAr) з піперазином формули (3a) або формули (3b), аналогічну описаній вище для стадії 1. Згідно зі Схемою 1, стадія 4, від амінної функціональної групи, такої як група, присутня у фенілпіперазинілфталазині формули (6a), можна відщепити групу захисту з одержанням сполуки (6b) та піддати цю сполуку подальшим перетворенням для одержання сполук за цим винаходом. Способи відщеплення груп захисту добре відомі в галузі (Гріні та Вутс, "Групи захисту в органічному синтезі" – дивись, наприклад, Greene and Wuts, Protective Groups in rd Organic Synthesis, 3 Ed., John Wiley and Sons, New York, (1999)). Наприклад, відщеплення групи boc від фенілпіперазинілфталазину формули (6) можна виконувати у кислотному 4 UA 102115 C2 5 10 15 20 середовищі, наприклад, із застосуванням хлороводню. Одержану хлороводневу сіль можна перетворити у вільний амін із застосуванням колонки SCX або неорганічної основи, такої як бікарбонат натрію. Для фахівця у цій галузі зрозуміло, що сполуки формули (5) за Схемою 1 є наявними на ринку або можуть бути без утруднень одержані способами, аналогічними розкритим у цьому описі або із застосуванням відомих у галузі методик. Наприклад, 2-фенілкарбонілбензойну кислоту, одержану шляхом реакції Гріньяра (Grignard) з фенілмагнійброміду та фталевого ангідриду, можна циклізувати гідразином, одержуючи 4-феніл-2Н-фталазин-1-он. Подальше оброблення оксихлоридом фосфору дає 1-хлор-4-фенілфталазин формули (5). Альтернативно можна провести реакцію перехресного сполучення за Судзукі (Suzuki) між 1,4дихлорфталазином та фенілборною кислотою, та одержати прийнятний 1-хлор-4фенілфталазин формули (5). Схема 2 Згідно зі Схемою 2, після відщеплення групи захисту піперазиніл формули (6b) можна ацилювати з застосуванням заміщеного фенілізоціанату в інертному розчиннику, наприклад, у дихлорметані, одержуючи сечовину Формули (I). Наведені нижче описи підготовчих синтезів та прикладів запропоновані з метою подальшого більш детального ілюстрування винаходу і стосуються типових синтезів сполук Формули I. Назви сполук за цим винаходом, як правило, утворені із застосуванням програми ChemDraw Ultra 10.0. Підготовчий синтез 1 (S)-трет-бутил-4-(4-(4-фторфеніл)фталазин-1-іл)-2-метилпіперазин-1-карбоксилат O N F N N 25 30 35 40 45 N O Нагрівають суміш 1-хлор-4-(4-фторфеніл)фталазину (5,0 г, 19,3 ммоль), (S)-трет-бутил-2метилпіперазин-1-карбоксилату (5,03 г, 25,1 ммоль) та триетиламіну (8,1 мл, 59,0 ммоль) у DMSO (97 мл), і витримують при 115C протягом 3 діб. Виливають реакційну суміш у воду, ополіскуючи посудину CH2Cl2. Екстрагують Et2O. Промивають органічний шар водою (2), потім сушать Na2SO4, та концентрують під зниженим тиском. Очищають одержаний залишок флешхроматографією на силікагелі (градієнт від 0 % до 20 % EtOAc в CH2Cl2), і одержують вказану в заголовку сполуку у вигляді блідо-жовтої піни (7,05 г, 84 %). Мас-спектроспопія з електророзпиленням (ES/MS) m/z 423,2 (M+1). Альтернативна методика Додають (S)-трет-бутил-2-метилпіперазин-1-карбоксилат (276 г, 1,38 моль) до суспензії 1хлор-4-(4-фторфеніл)фталазину (275 г, 1,06 моль) та діізопропілетиламіну (346 мл, 1,99 моль) у DMSO (2,56 л) при 25C. Нагрівають суміш до 102C і витримують протягом 9 год. Охолоджують реакційну суміш до 25C і перемішують протягом 48 год. Додають суміш до EtOAc (2,5 л) та води (3,5 л). Екстрагують водну фазу етилацетатом (22,0 л). Об'єднують органічні шари, промивають водою (2,5 л), і концентрують, одержуючи коричневу піну. Розчиняють цю піну в ацетонітрилі (1,0 л), охолоджують до 1C і витримують протягом 30 хв. Відфільтровують осад, одержуючи жовтувато-коричневу тверду речовину. Концентрують маточний розчин, і суспендують залишок в ацетонітрилі (500 мл) протягом 30 хв. Фільтрують суміш, одержуючи жовтувато-коричневу тверду речовину. Об'єднують тверді осади, і сушать у вакуумній шафі (14 мм рт.ст., 25C) протягом 25 год., одержуючи вказану в заголовку сполуку у вигляді жовтувато-коричневої твердої речовини (435 г, 96 %). ES/MS m/z 423,0 (M+1). Піперазинілфталазини, перелічені у наведеній нижче таблиці, одержують по суті за загальною методикою, описаною у Підготовчому синтезі 1, з використанням 1,5 екв. прийнятного заміщеного піперазину та 3-5 екв. триетиламіну при температурі від 115C до 150C з витримуванням від 3 до 6 діб. 50 5 UA 102115 C2 Підг. синт. № 2 3 4* 5 6 Хімічна назва РХ-ES/MS m/z Структура (S)-трет-бутил-4-(4-(4фторфеніл)фталазин-1-іл)-3метилпіперазин-1-карбоксилат O N F O N N (R)-трет-бутил-4-(4-(4фторфеніл)фталазин-1-іл)-2метилпіперазин-1-карбоксилат 423,2 (M+1) N O N F O N N (R)-трет-бутил-4-(4-(4фторфеніл)фталазин-1-іл)-3метилпіперазин-1-карбоксилат 423,2 (M+1) N O N F O N N трет-бутил-4-(4-(4фторфеніл)фталазин-1-іл)-2метилпіперазин-1-карбоксилат 423,2 (M+1) N O N F O N N трет-бутил-4-(4-(4фторфеніл)фталазин-1-іл)-3метилпіперазин-1-карбоксилат 423,0 (M+1) N O N F 423,0 (M+1) N O N N *Із застосуванням DMF як розчинника. 5 10 Альтернативна методика для Підготовчого синтезу 2 Додають 1-хлор-4-(4-фторфеніл)фталазин (200 г, 773 ммоль) до розчину (S)-трет-бутил-3метилпіперазин-1-карбоксилату (232 г, 1,16 моль), діізопропілетиламіну (674 мл, 28,1 моль) та DMSO (2,0 л). Нагрівають суміш до 120C і витримують протягом 60 год. Охолоджують суміш до 25C, виливають у льодяну воду (3,0 л), та фільтрують. Збирають тверду речовину, розчиняють її у CH2Cl2 (2,0 л), та екстрагують водою (2,0 л). Концентрують органічну фазу, і додають до шару силікагелю (3,0 кг силікагелю), елююючи 3 % THF у CH2Cl2, та одержують вказану в заголовку сполуку у вигляді жовтої піни (126 г, 38 %). ES/MS m/z 423,0 (M+1). Підготовчий синтез 7 (S)-трет-бутил-2-етил-4-(4-(4-фторфеніл)фталазин-1-іл)піперазин-1-карбоксилат O N F N N N 15 20 O Нагрівають суміш 1-хлор-4-(4-фторфеніл)фталазину (5,02 г, 19,4 ммоль), (S)-трет-бутил-2етилпіперазин-1-карбоксилату (5,00 г, 23,3 ммоль) та K2CO3 (5,38 г, 38,9 ммоль) у DMSO (75 мл) і витримують при 120C протягом 1 доби. Виливають реакційну суміш у воду, ополіскуючи посудину EtOAc. Екстрагують EtOAc. Промивають органічний шар водою (2), потім – розсолом, сушать Na2SO4, та концентрують під зниженим тиском. Очищають одержаний залишок флешхроматографією на силікагелі (градієнт від 20 % до 80 % EtOAc у гексані), і одержують вказану в заголовку сполуку (5,11 г, 60 %). ES/MS m/z 437,2 (M+1). Піперазинілфталазин, вказаний у наведеній нижче таблиці, одержують за загальною методикою, описаною у Підготовчому синтезі 7, використовуючи цис-2,6-диметилпіперазин. Підг. синт. № 8 Хімічна назва Структура 1-(цис-3,5-диметилпіперазин-1-іл)-4-(4фторфеніл)фталазин N F N N 25 Підготовчий синтез 9 6 ES/MS m/z NH 337,2 (M+1) UA 102115 C2 (R)-(4-(4-(4-фторфеніл)фталазин-1-іл)піперазин-2-іл)метанол OH F N NH N N 5 10 Розчиняють 1-хлор-4-(4-фторфеніл)фталазин (0,1 г, 0,39 ммоль), (R)-піперазин-2-ілметанол (0,07 г, 0,58 ммоль) та діізопропілетиламін (0,34 мл, 1,93 ммоль) у DMSO (1 мл). Перемішують реакційну суміш при 120C протягом 64 год. Очищають реакційну суміш флеш-хроматографією на силікагелі (0-10 % 2 M метанольного розчину аміаку в CH2Cl2), і одержують вказану в заголовку сполуку у вигляді коричневої твердої речовини (0,11 г, 84 %). ES/MS m/z 339,0 (M+1). Піперазинілфталазини, перелічені у наведеній нижче таблиці, одержують по суті за загальною методикою, описаною у Підготовчому синтезі 9, з використанням прийнятного заміщеного піперазину. Підг. синт. № Хімічна назва Структура (S)-(4-(4-(4-фторфеніл)фталазин-1іл)піперазин-2-іл)метанол 10 ES/MS m/z OH F N NH 339,0 (M+1) N N 1-((2S, 5S)-2,5-диметилпіперазин-1-іл)4-(4-фторфеніл)фталазин 11 F N NH N 337,0 (M+1) NH N N F N N 1-(цис-2,5-диметилпіперазин-1-іл)-4-(4фторфеніл)фталазин (рацемічна суміш) 12 + F 337,0 (M+1) N NH N N F N NH N N 1-(транс-2,5-диметилпіперазин-1-іл)-4(4-фторфеніл)фталазин (рацемічна суміш) 13 + F 337,0 (M+1) N NH N N Підготовчий синтез 14 (S)-трет-бутил-4-(4-хлорфталазин-1-іл)-3-метилпіперазин-1-карбоксилат O N Cl N N 15 20 N O Нагрівають суміш 1,4-дихлорфталазину (10,0 г, 50,2 ммоль), (S)-трет-бутил-3метилпіперазин-1-карбоксилату (15,1 г, 75,4 ммоль) та триетиламіну (21,0 мл, 150,7 ммоль) у DMSO (200 мл) і витримують при 120C протягом 2 діб. Виливають реакційну суміш у воду, ополіскуючи посудину CH2Cl2. Екстрагують Et2O. Промивають органічний шар водою (2), сушать Na2SO4, та концентрують під зниженим тиском. Очищають одержаний залишок флешхроматографією на силікагелі (градієнт від 0 % до 20 % EtOAc в CH2Cl2), і одержують вказану в 7 UA 102115 C2 35 заголовку сполуку у вигляді блідо-жовтої твердої речовини. (6,0 г, 33 %). ES/MS m/z ( Cl) 363,0 (M+1). Підготовчий синтез 15 (S)-трет-бутил-4-(4-хлорфталазин-1-іл)-2-метилпіперазин-1-карбоксилат O N Cl N O N N 5 10 Нагрівають суміш 1,4-дихлорфталазину (7,80 г, 39,2 ммоль), (S)-трет-бутил-2метилпіперазин-1-карбоксилату (4,98 г, 24,9 ммоль) та триетиламіну (10,3 мл, 73,9 ммоль) в DMSO (110 мл) і витримують при 80C протягом 18 год. Виливають реакційну суміш у воду, ополіскуючи посудину EtOAc. Екстрагують EtOAc. Промивають органічний шар водою (2) та розсолом, сушать Na2SO4, та концентрують під зниженим тиском Очищають одержаний залишок флеш-хроматографією на силікагелі (градієнт від 20 % до 80 % EtOAc у гексані), і 35 одержують вказану в заголовку сполуку (4,13 г, 46 %). ES/MS m/z ( Cl) 363,0 (M+1). Підготовчий синтез 16 (S)-трет-бутил-4-(4-(4-ціанофеніл)фталазин-1-іл)-3-метилпіперазин-1-карбоксилат O N N N N 15 20 25 N O Нагрівають суміш (S)-трет-бутил-4-(4-хлорфталазин-1-іл)-3-метилпіперазин-1-карбоксилату (4,0 г, 11,0 ммоль), 4-ціанофенілборної кислоти (2,43 г, 16,5 ммоль), карбонату цезію (14,4 г, 44,1 ммоль), та (SP-4-1)-біс[біс(1,1-диметилетил)(4-метоксифеніл)фосфін-P]дихлорпаладію (J. Org. Chem. 2007, 72, 5104-5112) (75,4 мг, 0,11 ммоль) в 1,4-діоксані (80 мл) та воді (20 мл) і витримують при 90C протягом ночі. Розподіляють реакційну суміш між водою та CH 2Cl2. Екстрагують водний шар CH2Cl2. Сушать об'єднані органічні шари Na2SO4, і концентрують під зниженим тиском. Очищають одержаний залишок флеш-хроматографією на силікагелі (градієнт від 0 % до 20 % EtOAc в CH2Cl2), і одержують вказану в заголовку сполуку у вигляді світлооранжевої піни (4,46 г, 94 %). ES/MS m/z 430,2 (M+1). Піперазинілфталазини, перелічені у наведеній нижче таблиці, одержують по суті за загальною методикою, описаною у Підготовчому синтезі 16, з використанням прийнятних 4хлорфталазину та борної кислоти. Знегажують речовини з Підготовчих синтезів 19-20, після чого додають біс(ди-трет-бутил(4-диметиламінофеніл)фосфін)дихлорпаладій(II) як каталізатор, нагрівають одержані суміші до 90C і витримують протягом 72 год. 30 Підг. синт. № Хімічна назва 17 (S)-трет-бутил-3-метил-4-(4фенілфталазин-1-іл)-піперазин-1карбоксилат 18 19 20 Структура LC-ES/MS m/z O O N N (S)-трет-бутил-4-(4-(4ціанофеніл)фталазин-1-іл)-2метилпіперазин-1-карбоксилат 405,2 (M+1) N N O N N N O N N (S)-трет-бутил-2-метил-4-(4фенілфталазин-1-іл)-піперазин-1карбоксилат 430,2 (M+1) O O N N (S)-трет-бутил-2-метил-4-(4-(4(трифторметил)-феніл)фталазин1-іл)-піперазин-1-карбоксилат O F F F 8 405,2 (M+1) N N N N N N O 473,2 (M+1) UA 102115 C2 Підготовчий синтез 21 (S)-трет-бутил-4-(4-(4-метоксифеніл)фталазин-1-іл)-2-метилпіперазин-1-карбоксилат O N O N O N N 5 10 Обробляють (1,1’-біс(дифенілфосфіно)фероцен)паладій(II)-хлоридом (0,27 г, 0,33 ммоль) знегажену суміш (S)-трет-бутил-4-(4-хлорфталазин-1-іл)-2-метилпіперазин-1-карбоксилату (0,81 г, 2,23 ммоль), 4-метоксифенілборної кислоти (1,07 г, 7,05 ммоль) та фториду цезію (1,05 г, 6,94 ммоль) в 1,4-діоксані (30 мл). Нагрівають одержану суміш до 95C і витримують протягом ночі. Розподіляють реакційну суміш між водою та EtOAc. Екстрагують водний шар EtOAc. Промивають органічну фазу водою та розсолом, сушать Na 2SO4, і концентрують під зниженим тиском. Очищають одержаний залишок флеш-хроматографією на силікагелі (градієнт від 15 % до 70 % EtOAc у гексані), і одержують вказану в заголовку сполуку (0,94 г, 96 %). ES/MS m/z 435,2 (M+1). Підготовчий синтез 22 (S)-1-(4-фторфеніл)-4-(3-метилпіперазин-1-іл)фталазин N F 15 20 25 30 35 NH N N Обробляють розчин (S)-трет-бутил-4-(4-(4-фторфеніл)фталазин-1-іл)-2-метилпіперазин-1карбоксилату (7,05 г, 16,2 ммоль) в 1,4-діоксані (50 мл) 4 M розчином HCl в 1,4-діоксані (25 мл). Додають MeOH для розчинення одержаного осаду, і перемішують протягом 2 год. при температурі навколишнього середовища. Концентрують реакційну суміш під зниженим тиском. ® Розчиняють залишок у MeOH, і завантажують у колонку з 50 г сорбенту Varian SCX. Ополіскують MeOH та CH2Cl2, після чого елююють продукт сумішшю CH2Cl2 з 2 M розчином аміаку в MeOH (1:1). Концентрують елюат під зниженим тиском, і одержують вказану в заголовку сполуку у вигляді блідо-жовтої піни (4,83 г, 93 %). ES/MS m/z 323,2 (M+1). Альтернативна методика для Підготовчого синтезу 22: Охолоджують метанол (2,82 л) до 0C за допомогою ацетоно-водної (1:1) бані з сухим льодом, і додають краплями ацетилхлорид (142 мл, 2,0 моль) протягом 30 хв, підтримуючи температуру під час додавання нижче ніж 15C. Перемішують суміш протягом 15 хв. Додають (S)-трет-бутил-4-(4-(4-фторфеніл)фталазин-1-іл)-2-метилпіперазин-1-карбоксилат (282 г, 667 ммоль). Перемішують суміш протягом 12 год. при 25C. Концентрують, і розчиняють залишок у воді (3,0 л). Додають твердий NaHCO3 до досягнення pH 7. Екстрагують продукт CH2Cl2 (22,0 л), об'єднують органічні шари, і концентрують, одержуючи вказану в заголовку сполуку у вигляді коричневої крихкої піни з кількісним виходом (236 г, >100 %). ES/MS m/z 323,0 (M+1). Піперазинілфталазини, перелічені у наведеній нижче таблиці, одержують по суті за загальною методикою, описаною у Підготовчому синтезі 22, з використанням прийнятних піперазинілфталазинів, захищених групою boc, при тривалості реакції від 2 год. до 16 год. У Підготовчих синтезах 30-34 як розчинник застосовують MeOH. 9 UA 102115 C2 Підг. синт. № Хімічна назва 23 (S)-1-(4-фторфеніл)-4-(2-метилпіперазин1-іл)фталазин F (R)-1-(4-фторфеніл)-4-(3-метилпіперазин1-іл)фталазин F 24 Структура LC-ES/MS m/z 323,2 (M+1) N NH N NH N NH 323,2 (M+1) N NH 323,0 (M+1) N NH 323,0 (M+1) N N 323,2 (M+1) N N (R)-1-(4-фторфеніл)-4-(2-метилпіперазин1-іл)фталазин 26 F (±)-1-(4-фторфеніл)-4-(3-метилпіперазин1-іл)фталазин 25 F N N N N (±)-1-(4-фторфеніл)-4-(2-метилпіперазин1-іл)фталазин 27 F N N (S)-1-(2-метилпіперазин-1-іл)-4фенілфталазин 28 (S)-4-(4-(2-метилпіперазин-1-іл)фталазин1-іл)бензонітрил 29 (S)-1-(3-етилпіперазин-1-іл)-4-(4фторфеніл)фталазин 30 305,2 (M+1) NH N N N NH N N 330,2 (M+1) N N NH N F 337,2 (M+1) N N (S)-1-(3-метилпіперазин-1-іл)-4фенілфталазин 31 NH N 305,2 (M+1) N N (S)-1-(3-метилпіперазин-1-іл)-4-(4(трифторметил)феніл)фталазин 32 F F (S)-4-(4-(3-метилпіперазин-1-іл)фталазин1-іл)бензонітрил 33 NH N F N NH N NH 373,2 (M+1) N N N 330,2 (M+1) N N (S)-1-(4-метоксифеніл)-4-(3метилпіперазин-1-іл)фталазин 34 O 335,2 (M+1) N N Підготовчий синтез 35 3-фтор-4-ізоціанатобензонітрил F O 5 N N Охолоджують розчин трифосгену (1,09 г, 3,67 ммоль) у толуолі (20 мл) на льодо-водяній бані. Додають краплями розчин 4-аміно-3-фторбензонітрилу (1,36 г, 10,0 ммоль) та 10 UA 102115 C2 5 триетиламіну (2,8 мл, 20,0 ммоль) у толуолі (30 мл). Нагрівають одержану суміш до 70C і витримують протягом 5 год. Охолоджують реакційну суміш до температури навколишнього середовища, і відфільтровують тверду речовину. Концентрують фільтрат під зниженим тиском, і одержують білу тверду речовину (1,44 г, 84 %), яку використовують без додаткового очищення. + GC/MS m/z 162 (M ). Виготовляють відомий ізоціанат, вказаний у наведеній нижче таблиці, з прийнятного аніліну по суті за загальною методикою, описаною у Підготовчому синтезі 35. Підг. синт. № Хімічна назва Структура GC/MS m/z F 36 10 2-фтор-1-ізоціанато-4(трифторметил)бензол Приклад 1 Гідрохлорид карбоксаміду N F F 205 + (M ) (S)-N-(4-фторфеніл)-4-(4-(4-фторфеніл)фталазин-1-іл)-2-метилпіперазин-1 H N F F O N F N N N O HCl 15 20 25 30 35 Обробляють розчин (S)-1-(4-фторфеніл)-4-(3-метилпіперазин-1-іл)фталазину (1,0 г, 3,1 ммоль) в CH2Cl2 (31 мл) 1-фтор-4-ізоціанатобензолом (0,42 мл, 3,72 ммоль). Перемішують протягом 3 діб при температурі навколишнього середовища. Концентрують реакційну суміш під зниженим тиском. Розтирають залишок з Et2O, і фільтрують. Ополіскують тверду речовину пентаном, після чого сушать у вакуумній шафі при 45C. Розчиняють твердий продукт у суміші CH2Cl2 та MeOH, і обробляють 3 екв. 1 M HCl в Et2O. Перемішують одержану суміш, концентрують під зниженим тиском, і сушать у вакуумній шафі при 45C, одержуючи вказаний у заголовку гідрохлорид у вигляді жовтої піни (1,5 г, 98 %). ES/MS m/z 460,0 (M+1). Альтернативна методика для Прикладу 1: 1-фтор-4-ізоціанатобензол (105 мл, 930 ммоль) додають краплями протягом 1 год. до розчину (S)-1-(4-фторфеніл)-4-(3-метилпіперазин-1-іл)фталазину (300 г, 930 ммоль) у CH2Cl2 (4,5 л) при 25C. Перемішують одержану суміш протягом 25 хв, і концентрують, одержуючи піну. Суспендують цю піну в MTBE (3,0 л), фільтрують, і промивають вологий осад на фільтрі MTBE (500 мл). Концентрують маточний розчин, одержуючи масло. Суспендують це масло в етилацетаті (2,0 л), одержуючи тверду речовину, яку відділяють фільтруванням. Об'єднують тверді фази, і сушать, одержуючи вказану в заголовку сполуку у вигляді жовто-коричневої твердої речовини (344 г, 80 %). Суспендують цю речовину (327 г, 711 ммоль) в ізопропанолі (3,27 л) при 42C, і обробляють 4 M розчином HCl в 1,4-діоксані (177 мл, 711 ммоль). Нагрівають одержану суміш до 60C і витримують 30 хв. Повільно охолоджують до 25C протягом 2 год. Фільтрують, і промивають вологий осад на фільтрі ізопропанолом (200 мл) та гептаном (200 мл). Сушать осад на фільтрі у вакуумній шафі (12 мм.рт.ст., 35C, 2 год.), і одержують вказану в заголовку сполуку у вигляді блідо-жовтої твердої речовини (308 г, 87 %). ES/MS m/z 460,0 (M+1). Приклад 2 Гідрохлорид (S)-N-(4-фторфеніл)-4-(4-(4-фторфеніл)фталазин-1-іл)-3-метилпіперазин-1карбоксаміду HCl H N F N N N 40 45 F N O Обробляють розчин (S)-1-(4-фторфеніл)-4-(2-метилпіперазин-1-іл)фталазину (0,5 г, 1,55 ммоль) в CH2Cl2 (15,5 мл) 1-фтор-4-ізоціанатобензолом (0,194 мл, 1,71 ммоль). Перемішують протягом ночі при температурі навколишнього середовища. Очищають реакційну суміш флеш-хроматографією на силікагелі (градієнт від 0 % до 3 % 2 M аміаку в MeOH у CH2Cl2). Розчиняють очищену вільну основу у суміші CH2Cl2 та MeOH, і обробляють 3 екв. 1 M розчину HCl в Et2O. Перемішують одержану суміш, концентрують під зниженим тиском, і сушать 11 UA 102115 C2 5 10 15 20 у вакуумній шафі при 45C, одержуючи вказаний у заголовку гідрохлорид у вигляді жовтої піни (0,72 г, 94 %). ES/MS m/z 460,0 (M+1). Альтернативна методика для Прикладу 2: 1-фтор-4-ізоціанатобензол (27,9 мл, 245 ммоль) додають краплями протягом 1 год. до розчину (S)-1-(4-фторфеніл)-4-(2-метилпіперазин-1-іл)фталазину (72 г, 223 ммоль) у CH2Cl2 (500 мл) при 25C. Перемішують одержану суміш протягом 25 хв, і концентрують, одержуючи піну. Додають ацетилхлорид (16,5 мл, 231 ммоль) до метанолу при 0C, і перемішують 5 хв. Додають до цього метанольного розчину піну, і перемішують протягом 1 год. Концентрують одержаний розчин, одержуючи піну. Суспендують цю піну в ацетонітрилі (200 мл) та CH2Cl2 (30 мл), фільтрують, і одержують вказану в заголовку сполуку у вигляді жовтої твердої речовини (91 г, 86 %). ES/MS m/z 460,0 (M+1). Вказані у наведеній нижче таблиці сечовини одержують по суті за загальною методикою, описаною у Прикладі 1 або у Прикладі 2, використовуючи прийнятні піперазинілфталазини та незначний надлишок прийнятного ізоціанату. Тривалість реакції варіює від 0,5 год. до 3 діб. Одержані сполуки очищають розтиранням (з Et2O або сумішшю 1:1 CH2Cl2 з гексаном) або флеш-хроматографією на силікагелі. Продукти за Прикладами 57-60 та Прикладами 66-69 очищають хроматографією з оберненою фазою з детектуванням за масою (колонка Waters XBridge C18 ODB MS HPLC, 3075 мм, розмір зерна сорбенту 5 мкм, градієнт від 20 % до 70 % ацетонітрилу у воді, яка містить 0,01 M бікарбонат амонію, швидкість потоку 85 мл/хв протягом 8 хв). Для Прикладів 75-82 застосовують неочищені ізоціанати (Підготовчі синтези 35-36) в 1,52-кратному надлишку. Для Прикладу 18, Прикладу 29 та Прикладу 38 застосування MeOH при одержанні гідрохлориду виключається. Прикл. №. Хімічна назва 3 гідрохлорид (±)-N-(4-фторфеніл)-4(4-(4-фторфеніл)фталазин-1-іл)-2метилпіперазин-1-карбоксаміду 4 5 6 7 HCl H N F 460,0 (M+1) O F H N F F N N HCl N O 526,0 (M+1) F F N N N O HCl H N F N N N N F O F F 526,0 (M+1) N N N O H N F N N 460,0 (M+1) O H N F F N HCl гідрохлорид (±)-4-(4-(4фторфеніл)фталазин-1-іл)-3метил-N-(4-(трифторметокси)феніл)-піперазин-1-карбоксаміду гідрохлорид (R)-N-(4-фторфеніл)4-(4-(4-фторфеніл)фталазин-1-іл)2-метилпіперазин-1-карбоксаміду N N гідрохлорид (±)-4-(4-(4фторфеніл)фталазин-1-іл)-2метил-N-(4-(трифторметокси)феніл)піперазин-1-карбоксаміду гідрохлорид (±)-N-(4-фторфеніл)-4(4-(4-фторфеніл)фталазин-1-іл)-3метилпіперазин-1-карбоксаміду ES/MS m/z Структура F N N O 460,2 (M+1) HCl 8 9 F гідрохлорид (R)-4-(4-(4фторфеніл)фталазин-1-іл)-2метил-N-(4-(трифторметокси)феніл)-піперазин-1-карбоксаміду гідрохлорид (R)-N-(4-ціанофеніл)4-(4-(4-фторфеніл)фталазин-1-іл)2-метилпіперазин-1-карбоксаміду H N F N O F F 526,2 (M+1) N N N O HCl H N F N N N O HCl 12 N N 467,2 (M+1) UA 102115 C2 10 гідрохлорид (R)-N-(2,4дифторфеніл)-4-(4-(4фторфеніл)фталазин-1-іл)-2метилпіперазин-1-карбоксаміду F H N F N N 478,2 (M+1) F N N O HCl HCl 11 12 гідрохлорид (R)-N-(4-фторфеніл)4-(4-(4-фторфеніл)фталазин-1-іл)3-метилпіперазин-1-карбоксаміду H N F N N гідрохлорид (R)-4-(4-(4фторфеніл)фталазин-1-іл)-3метил-N-(4(трифторметокси)феніл) піперазин-1-карбоксаміду 460,2 (M+1) F N N O HCl F H N F N F F O 526,2 (M+1) N N N O HCl 13 14 15 16 гідрохлорид (R)-N-(4-ціанофеніл)4-(4-(4-фторфеніл)фталазин-1-іл)3-метилпіперазин-1-карбоксаміду гідрохлорид (R)-N-(2,4дифторфеніл)-4-(4-(4фторфеніл)фталазин-1-іл)-3метилпіперазин-1-карбоксаміду H N F N N N F 478,2 (M+1) O F H N F N N 467,2 (M+1) N HCl N N O F гідрохлорид (S)-4-(4-(4фторфеніл)фталазин-1-іл)-2метил-N-(4-(трифторметокси)феніл)піперазин-1-карбоксаміду гідрохлорид (S)-N-(4-ціанофеніл)4-(4-(4-фторфеніл)фталазин-1-іл)2-метилпіперазин-1-карбоксаміду N H N F N F F O 526,2 (M+1) N N N O HCl H N F N N 467,2 (M+1) N N N O HCl F 17 гідрохлорид (S)-N-(2,4дифторфеніл)-4-(4-(4фторфеніл)фталазин-1-іл)-2метилпіперазин-1-карбоксаміду H N F N N F 478,2 (M+1) F 528,0 (M+1) N N O HCl F F 18 гідрохлорид (S)-N-(4-фтор-2(трифторметил)-феніл)-4-(4-(4фторфеніл)фталазин-1-іл)-2метилпіперазин-1-карбоксаміду F H N F N N N N O HCl 19 20 гідрохлорид (S)-N-(3-хлор-4фторфеніл)-4-(4-(4фторфеніл)фталазин-1-іл)-2метилпіперазин-1-карбоксаміду H N F N F N N N O Cl 35 Cl 494,0 (M+1) HCl H N гідрохлорид (S)-N-(4-хлорфеніл)-4(4-(4-фторфеніл)фталазин-1-іл)-2метилпіперазин-1-карбоксаміду N N F O N N HCl 13 Cl 35 Cl 476,0 (M+1) UA 102115 C2 21 22 23 24 гідрохлорид (S)-4-(4-(4фторфеніл)фталазин-1-іл)-2метил-N-(4-(трифторметил)феніл) піперазин-1-карбоксаміду гідрохлорид (S)-N-(4(дифторметокси)феніл)-4-(4-(4фторфеніл)-фталазин-1-іл)-2метилпіперазин-1-карбоксаміду F N F 510,0 (M+1) F N N N O HCl H N N O O F F 508,0 (M+1) F N N N HCl гідрохлорид (S)-4-(4-(4фторфеніл)фталазин-1-іл)-N-(4метоксифеніл)-2-метилпіперазин1-карбоксаміду гідрохлорид (S)-N-(4-ціанофеніл)4-(4-(4-ціанофеніл)фталазин-1-іл)2-метилпіперазин-1-карбоксаміду F H N H N F N O 472,0 (M+1) N O N N HCl H N N N N 474,2 (M+1) N N N O HCl 25 гідрохлорид (S)-4-(4-(4ціанофеніл)фталазин-1-іл)-N-(4фторфеніл)-2-метилпіперазин-1карбоксаміду H N N N F 467,2 (M+1) F 485,0 (M+1) N N N O HCl 26 27 28 F гідрохлорид (S)-4-(4-(4ціанофеніл)фталазин-1-іл)-N-(2,4дифторфеніл)-2-метилпіперазин-1карбоксаміду N гідрохлорид (S)-N-(3-хлор-4фторфеніл)-4-(4-(4ціанофеніл)фталазин-1-іл)-2метилпіперазин-1-карбоксаміду N гідрохлорид (S)-N-(4-хлорфеніл)-4(4-(4-ціанофеніл)фталазин-1-іл)-2метилпіперазин-1-карбоксаміду N H N N N N N O HCl H N N F 35 Cl 35 Cl 500,8 (M+1) N O N N Cl HCl N N Cl 483,0 (M+1) N N N O HCl F 29 гідрохлорид (S)-4-(4-(4ціанофеніл)фталазин-1-іл)-N-(4фтор-2-(трифторметил)феніл)-2метилпіперазин-1-карбоксаміду F F H N N N 535,0 (M+1) F N N N O HCl 30 31 гідрохлорид (S)-4-(4-(4ціанофеніл)фталазин-1-іл)-2метил-N-(4-(трифторметил)феніл) піперазин-1-карбоксаміду гідрохлорид (S)-4-(4-(4ціанофеніл)фталазин-1-іл)-2метил-N-(4-(трифторметокси)феніл)піперазин-1-карбоксаміду F H N N N N N F F N O 517,0 (M+1) HCl F F H N N N HCl 14 N O N N F O 533,0 (M+1) UA 102115 C2 32 33 гідрохлорид (S)-4-(4-(4ціанофеніл)фталазин-1-іл)-N-(4(дифторметокси)феніл)-2метилпіперазин-1-карбоксаміду F F H N N N O 515,0 (M+1) F 442,2 (M+1) F 460,2 (M+1) N O N N HCl H N гідрохлорид (S)-N-(4-фторфеніл)2-метил-4-(4-фенілфталазин-1-іл)піперазин-1-карбоксаміду N N N N O HCl 34 35 F гідрохлорид (S)-N-(2,4дифторфеніл)-2-метил-4-(4фенілфталазин-1-іл)-піперазин-1карбоксаміду H N N N N N O HCl H N гідрохлорид (S)-N-(4-ціанофеніл)2-метил-4-(4-фенілфталазин-1-іл)піперазин-1-карбоксаміду N N 449,2 (M+1) N O N N HCl 36 37 гідрохлорид (S)-N-(3-хлор-4фторфеніл)-2-метил-4-(4фенілфталазин-1-іл)-піперазин-1карбоксаміду H N N F 35 Cl 35 Cl 476,0 (M+1) N Cl O N N HCl H N гідрохлорид (S)-N-(4-хлорфеніл)-2метил-4-(4-фенілфталазин-1-іл)піперазин-1-карбоксаміду Cl 458,0 (M+1) N N O N N HCl F 38 гідрохлорид (S)-N-(4-фтор-2(трифторметил)-феніл)-2-метил-4(4-фенілфталазин-1-іл)піперазин1-карбоксаміду F F H N N 510,0 (M+1) F N N N O HCl 39 40 41 42 гідрохлорид (S)-2-метил-4-(4фенілфталазин-1-іл)-N-(4(трифторметил)-феніл)піперазин1-карбоксаміду F H N F 492,0 (M+1) F N N N N O HCl F F гідрохлорид (S)-2-метил-4-(4фенілфталазин-1-іл)-N-(4(трифторметокси)феніл)піперазин-1-карбоксаміду F H N N O 508,0 (M+1) N O N N HCl F гідрохлорид (S)-N-(4(дифторметокси)-феніл)-2-метил4-(4-фенілфталазин-1-іл)піперазин-1-карбоксаміду F H N N O 490,0 (M+1) N O N N HCl гідрохлорид (S)-N-(4-ціанофеніл)4-(4-(4-метоксифеніл)фталазин-1іл)-2-метилпіперазин-1карбоксаміду H N N O O N N HCl 15 N N 478,8 (M+1) UA 102115 C2 43 44 45 46 гідрохлорид (S)-N-(4-фторфеніл)4-(4-(4-метоксифеніл)фталазин-1іл)-2-метилпіперазин-1карбоксаміду H N N O F 472,2 (M+1) F 490,2 (M+1) N O N N HCl F гідрохлорид (S)-N-(2,4дифторфеніл)-4-(4-(4метоксифеніл)фталазин-1-іл)-2метилпіперазин-1-карбоксаміду H N N O N N N O HCl гідрохлорид (S)-N-(4-фторфеніл)2-метил-4-(4-(4-(трифторметил)феніл)фталазин-1-іл)піперазин-1карбоксаміду H N F F F N F 510,2 (M+1) N N N O HCl гідрохлорид (S)-N-(4-ціанофеніл)2-метил-4-(4-(4-(трифторметил)феніл)фталазин-1-іл)піперазин-1карбоксаміду H N F F F N N 517,2 (M+1) N N N O HCl F 47 гідрохлорид (S)-N-(2,4дифторфеніл)-2-метил-4-(4-(4(трифторметил)-феніл)фталазин1-іл)піперазин-1-карбоксаміду H N F F F N F 528,0 (M+1) N N N O HCl 48 гідрохлорид (S)-4-(4-(4фторфеніл)фталазин-1-іл)-3метил-N-(4-(трифторметокси)феніл)піперазин-1-карбоксаміду F HCl H N F N O F F 526,2 (M+1) N N N O HCl 49 50 гідрохлорид (S)-N-(4-ціанофеніл)4-(4-(4-фторфеніл)фталазин-1-іл)3-метилпіперазин-1-карбоксаміду гідрохлорид (S)-N-(2,4дифторфеніл)-4-(4-(4фторфеніл)фталазин-1-іл)-3метилпіперазин-1-карбоксаміду H N F N N 467,2 (M+1) N N N O F HCl H N F N 478,2 (M+1) F N N N O F 51 52 53 гідрохлорид (S)-N-(4-фтор-2(трифторметил)-феніл)-4-(4-(4фторфеніл)фталазин-1-іл)-3метилпіперазин-1-карбоксаміду F HCl F H N F N N 528,0 (M+1) F N N O HCl гідрохлорид (S)-4-(4-(4фторфеніл)фталазин-1-іл)-N-(4метоксифеніл)-3-метилпіперазин1-карбоксаміду H N F N 472,0 (M+1) O N N N O HCl гідрохлорид (S)-N-(3-хлор-4фторфеніл)-4-(4-(4фторфеніл)фталазин-1-іл)-3метилпіперазин-1-карбоксаміду H N F N F N N N O Cl 35 Cl 494,0 (M+1) HCl 54 гідрохлорид (S)-N-(4-хлорфеніл)-4(4-(4-фторфеніл)фталазин-1-іл)-3метилпіперазин-1-карбоксаміду H N F N N N 16 N O Cl 35 Cl 476,0 (M+1 UA 102115 C2 55 56 57 58 59 60 61 ідро хлорид (S)-4-(4-(4фторфеніл)фталазин-1-іл)-3метил-N-(4-(трифторметил)феніл)піперазин-1-карбоксаміду HCl F ідро хлорид(S)-N-(4-ціанофеніл)4-(4-(4-ціанофеніл)фталазин-1-іл)3-метилпіперазин-1-карбоксаміду ідро хлорид (S)-4-(4-(4ціанофеніл)фталазин-1-іл)-N-(2,4дифторфеніл)-3-метилпіперазин-1карбоксаміду N 510,0 (M+1) F F N N N ідро хлорид (S)-N-(4(дифторметокси)-феніл)-4-(4-(4фторфеніл)-фталазин-1-іл)-3метилпіперазин-1-карбоксаміду ідро хлорид (S)-4-(4-(4ціанофеніл)фталазин-1-іл)-N-(4фторфеніл)-3-метилпіперазин-1карбоксаміду F H N O HCl H N F N 508,0 (M+1) O N F N N O F HCl H N N N N 467,0 (M+1) F N N O HCl H N N N N 474,0 (M+1) F 485,2 (M+1) N N N O HCl F H N N N N N N ідро хлорид (S)-4-(4-(4ціанофеніл)фталазин-1-іл)-N-(4фтор-2-(трифторметил)феніл)-3метилпіперазин-1-карбоксаміду O F HCl F F H N N N 535,0 (M+1) F N N N O HCl ідро хлорид (S)-N-(3-хлор-4фторфеніл)-4-(4-(4ціанофеніл)фталазин-1-іл)-3метилпіперазин-1-карбоксаміду H N 35 Cl 501,0 (M+1) F N N N O N N Cl HCl 62 63 64 65 ідро хлорид (S)-N-(4-хлорфеніл)4-(4-(4-ціанофеніл)фталазин-1-іл)3-метилпіперазин-1-карбоксаміду H N ідро хлорид (S)-4-(4-(4ціанофеніл)фталазин-1-іл)-3метил-N-(4-(трифторметокси)феніл)піперазин-1-карбоксаміду ідро хлорид (S)-4-(4-(4ціанофеніл)фталазин-1-іл)-N-(4(дифторметокси)феніл)-3метилпіперазин-1-карбоксаміду O N N ідро хлорид (S)-4-(4-(4ціанофеніл)фталазин-1-іл)-3метил-N-(4-(трифторметил)феніл) піперазин-1-карбоксаміду HCl F H N N N N Cl 483,0 (M+1) N N N 35 Cl 517,0 (M+1) F F O N N HCl H N O N N N O F H N N N F F O 533,0 (M+1) HCl N N N F O N N F 515,0 (M+1) HCl 66 ідро хлорид (S)-N-(4-фторфеніл)3-метил-4-(4-фенілфталазин-1-іл)піперазин-1-карбоксаміду H N N N 17 N N O F 442,2 (M+1) UA 102115 C2 HCl 67 68 гідрохлорид (S)-N-(4-ціанофеніл)3-метил-4-(4-фенілфталазин-1-іл)піперазин-1-карбоксаміду H N N N N O F HCl гідрохлорид (S)-N-(2,4дифторфеніл)-3-метил-4-(4фенілфталазин-1-іл)-піперазин-1карбоксаміду H N N N 449,2 (M+1) N N F 460,0 (M+1) F 510,0 (M+1) N N O F 69 70 гідрохлорид (S)-N-(4-фтор-2(трифторметил)-феніл)-3-метил-4(4-фенілфталазин-1-іл)-піперазин1-карбоксаміду F F HCl H N N N N N O HCl гідрохлорид (S)-N-(3-хлор-4фторфеніл)-3-метил-4-(4фенілфталазин-1-іл)-піперазин-1карбоксаміду H N 35 Cl 476,0 (M+1) F N N Cl O N N HCl 71 72 73 74 75 76 77 78 гідрохлорид (S)-N-(4-хлорфеніл)-3метил-4-(4-фенілфталазин-1-іл)піперазин-1-карбоксаміду H N O N N HCl F H N N N 492,0 (M+1) F F O N N HCl гідрохлорид (S)-3-метил-4-(4фенілфталазин-1-іл)-N-(4(трифторметокси)-феніл)піперазин-1-карбоксаміду H N O F H N N N 508,0 (M+1) O N N F F O HCl гідрохлорид (S)-N-(4(дифторметокси)феніл)-3-метил-4(4-фенілфталазин-1-іл)-піперазин1-карбоксаміду N N 490,0 (M+1) F F O N N F гідрохлорид (S)-N-(4-ціано-2фторфеніл)-4-(4-(4фторфеніл)фталазин-1-іл)-2метилпіперазин-1-карбоксаміду H N F N N 484,8 (M+1) F 528,0 (M+1) N N N O HCl F гідрохлорид (S)-N-(2-фтор-4(трифторметил)-феніл)-4-(4-(4фторфеніл)фталазин-1-іл)-2метилпіперазин-1-карбоксаміду гідрохлорид (S)-N-(4-ціано-2фторфеніл)-4-(4-(4ціанофеніл)фталазин-1-іл)-2метилпіперазин-1-карбоксаміду Cl 458,0 (M+1) N N гідрохлорид (S)-3-метил-4-(4фенілфталазин-1-іл)-N-(4(трифторметил)-феніл)-піперазин1-карбоксаміду 35 Cl F H N F N N F N N O HCl F H N N N N N N N O 492,0 (M+1) HCl F гідрохлорид (S)-N-(4-ціано-2фторфеніл)-2-метил-4-(4фенілфталазин-1-іл)-піперазин-1карбоксаміду H N N N N O HCl 18 N N 467,0 (M+1) UA 102115 C2 79 80 81 82 83 84 85 86 87 88 89 HCl гідрохлорид (S)-N-(4-ціано-2фторфеніл)-4-(4-(4фторфеніл)фталазин-1-іл)-3метилпіперазин-1-карбоксаміду F N O HCl F F H N F N F O HCl F H N N N N N N N F H N N N N N N O N N N H N N HCl N N N N H N N HCl 481,2 (M+1) 474,2 (M+1) O F гідрохлорид (S)-N-(4-ціанофеніл)2-етил-4-(4-(4фторфеніл)фталазин-1іл)піперазин-1-карбоксаміду 467,0 (M+1) O F гідрохлорид N-(4-фторфеніл)-4-(4(4-фторфеніл)фталазин-1-іл)-цис2,6-диметилпіперазин-1карбоксаміду 492,0 (M+1) O HCl гідрохлорид N-(4-ціанофеніл)-4-(4(4-фторфеніл)фталазин-1-іл)-цис2,6-диметилпіперазин-1карбоксаміду 528,0 (M+1) F N N N гідрохлорид (S)-N-(4-ціано-2фторфеніл)-3-метил-4-(4фенілфталазин-1-іл)-піперазин-1карбоксаміду 484,8 (M+1) N N N N гідрохлорид (S)-N-(2-фтор-4(трифторметил)-феніл)-4-(4-(4фторфеніл)-фталазин-1-іл)-3метилпіперазин-1-карбоксаміду гідрохлорид (S)-N-(4-ціано-2фторфеніл)-4-(4-(4ціанофеніл)фталазин-1-іл)-3метилпіперазин-1-карбоксаміду F H N F HCl O F N N N N гідрохлорид (S)-N-(2,4дифторфеніл)-2-етил-4-(4-(4фторфеніл)-фталазин-1іл)піперазин-1-карбоксаміду N N O F N N N N N H HCl гідрохлорид (S)-2-етил-N-(4-фтор2-(трифторметил)феніл)-4-(4-(4фторфеніл)-фталазин-1іл)піперазин-1-карбоксаміду F 481,2 (M+1) 492,2 (M+1) F O F N N N N HCl N H F гідрохлорид (S)-2-етил-N-(4фторфеніл)-4-(4-(4фторфеніл)фталазин-1іл)піперазин-1-карбоксаміду F гідрохлорид (2S, 5S)-N-(4ціанофеніл)-4-(4-(4фторфеніл)фталазин-1-іл)-2,5диметилпіперазин-1-карбоксаміду F F F F O N F 474,2 (M+1) CN 481,0 (M+1) N N N N H 542,2 (M+1) HCl O N N N N N H HCl 5 Приклад 90 Гідрохлорид (R)-N-(4-фторфеніл)-4-(4-(4-фторфеніл)фталазин-1-іл)-2(гідроксиметил)піперазин-1-карбоксаміду 19 UA 102115 C2 HO O F N N N N N H F HCl 5 10 Обробляють розчин (R)-(4-(4-(4-фторфеніл)фталазин-1-іл)піперазин-2-іл)метанолу (0,15 г, 0,44 ммоль) у CH2Cl2 (3 мл) 1-фтор-4-ізоціанатобензолом (0,04 г, 0,31 ммоль). Перемішують реакційну суміш при температурі навколишнього середовища протягом 30 хв, після чого концентрують. Очищають одержаний залишок флеш-хроматографією на силікагелі (градієнт 050 % EtOAc у гексані, потім перехід на 3 % MeOH у CH2Cl2), одержуючи тверду речовину. Розчиняють цю речовину в MeOH (1 мл), і обробляють 1-н. водним розчином HCl (0,13 мл, 0,13 ммоль). Концентрують одержаний розчин, і одержують вказану в заголовку сполуку у вигляді твердої речовини (0,065 г, 29 %). ES/MS m/z 476,0 (M+1). Піперазинілфталазин сечовини, вказані в наведеній нижче таблиці, одержують по суті за загальною методикою, описаною у Прикладі 90, з використанням прийнятних піперазинілфталазинів та ізоціанатів. Прикл. №. Хімічна назва Структура ES/MS m/z HO 91 92 93 гідрохлорид (R)-N-(4-фторфеніл)4-(4-(4-фторфеніл)фталазин-1іл)-2-(гідроксиметил)-піперазин-1карбоксаміду O F N N H N N 476,0 (M+1) F HCl HO гідрохлорид (S)-N-(4-фторфеніл)4-(4-(4-фторфеніл)фталазин-1іл)-2-(гідроксиметил)-піперазин-1карбоксаміду гідрохлорид (R)-N-(4-ціанофеніл)4-(4-(4-фторфеніл)фталазин-1іл)-2-(гідроксиметил)-піперазин-1карбоксаміду N O F N 476,0 (M+1) N N H N N F HCl HO O F N N N N N H N 483,0 (M+1) HCl 15 20 25 30 Приклад 94 та Приклад 95 Гідрохлорид N-(4-фторфеніл)-4-(4-(4-фторфеніл)фталазин-1-іл)-транс-2,5диметилпіперазин-1-карбоксаміду, ізомер 1 та ізомер 2 Обробляють розчин 1-(транс-2,5-диметилпіперазин-1-іл)-4-(4-фторфеніл)фталазину (0,3 г, 0,89 ммоль) у CH2Cl2 (5 мл) 1-фтор-4-ізоціанатобензолом (0,17 г, 1,25 ммоль). Перемішують реакційну суміш при температурі навколишнього середовища протягом 1 год. Очищають реакційну суміш флеш-хроматографією на силікагелі (градієнт 0-50 % EtOAc у гексані). Збирають та концентрують відповідні фракції. Розчиняють суміш ізомерів N-(4-фторфеніл)-4-(4(4-фторфеніл)фталазин-1-іл)-транс-2,5-диметилпіперазин-1-карбоксаміду (0,3 г, 0,59 ммоль) у MeOH (2 мл). Розділяють суміш транс-ізомерів за допомогою хіральної хроматографії (колонка Chiralcel OJ-H, швидкість потоку 30 мл/хв, детектування на довжині хвилі 225 нм, рухома фаза MeOH:ацетонітрил, 6:4). Пік, що елююється першим, збирають як ізомер 1, а пік, що елююється другим, – як ізомер 2. Збирають та концентрують відповідні фракції. Розчиняють розділені ізомери у MeOH (1 мл), і обробляють кожний розчин 1 екв. 1-н. водного розчину HCl. Концентрують, і одержують гідрохлориди ізомеру 1 (0,131 г, 44 %) та ізомеру 2 (0,129 г, 43 %). Iзомер 1: ES/MS m/z 474,2 (M+1), енантіомерний надлишок (ее) 99 %. Ізомер 2: ES/MS m/z 474,2 (M+1), ee 99 %. Приклад 96 та Приклад 97 20 UA 102115 C2 Гідрохлорид N-(4-фторфеніл)-4-(4-(4-фторфеніл)фталазин-1-іл)-цис-2,5-диметилпіперазин1-карбоксаміду, ізомер 1 та ізомер 2 5 10 15 20 25 30 35 40 45 50 Продукти за Прикладами 96 та 97 одержують за методикою, аналогічною описаній для Прикладів 94 та 95, використовуючи суміш цис-диметилпіперазинів із Підготовчого синтезу 12. Розділяють суміш цис-ізомерів за допомогою хіральної хроматографії, та одержують гідрохлориди ізомеру 1 (0,21 г, 34 %) та ізомеру 2 (0,20 г, 33 %). Ізомер 1: ES/MS m/z 474,2 (M+1), ee 95 %. Ізомер 2: ES/MS m/z 474,2 (M+1), ee 92 %. Біологія Провідний шлях Hedgehog бере участь як фактор виживання у розвитку таких раків як базальноклітинна карцинома; раки верхнього відділу шлунково-кишкового тракту (стравоходу, шлунка, підшлункової залози та жовчних шляхів); рак простати; рак молочної залози; дрібноклітинний рак легенів; недрібноклітинний рак легенів; лімфома B-клітин; множинна мієлома; рак шлунка; рак яєчників; рак ободової та прямої кишки; рак печінки; меланома; рак нирок; та рак головного мозку. З'ясовано, що елементи провідного шляху hedgehog є потенціальними мішенями для фармацевтичних засобів лікування раку. Знайдена у медулобластомних пухлинах (АТСС, НТВ186) клітинна лінія Daoy реагує на ліганди Hh. При обробленні цих клітин введеним екзогенно Shh-кондиціонованим середовищем активується провідний шлях Hh, що призводить до посиленої експресії Gli1. Циклопамін – алкалоїд, виділений з чемериці каліфорнійської Veratrum californicum, є слабким антагоністом hedgehog, і було показано, що він пригнічує експресію Gli1 як реакцію на стимуляцію Shh. Дослідження останнього часу свідчать, що циклопамін інгібує ріст культивованих клітин та алотрансплантатів медулобластоми. Застосовуючи цю модель клітин Shh, можна ідентифікувати ефективні інгібітори провідних шляхів hedgehog. Оскільки сполуки за цим винаходом є антагоністами hedgehog, вони є прийнятними для лікування вищезазначених типів пухлин. Визначення IС50 біологічної активності Описані нижче методика випробувань та їх результати демонструють корисність та ефективність сполук та способів їх використання за цим винаходом. Функціональні проби підтверджують, що сполуки за цим винаходом виявляють здатність до інгібування провідного шляху Shh. Усі ліганди, розчинники та реагенти, використовувані в описаних нижче випробуваннях, є наявними на ринку або можуть бути без утруднень виготовлені фахівцем у цій галузі. Біологічну активність визначали, застосовуючи функціональну пробу з використанням нейронних ракових клітин Daoy та вимірювання рівнів рибонуклеїнової кислоти Gli1 з використанням системи випробування на bDNA (розгалужену деоксирибонуклеїнову кислоту) (Panomics, Inc., Fremont, CA). Gli1 був раніше відкритий у лінії клітин гліобластоми, і він кодує протеїн zinc finger, який активується провідним шляхом Shh. Максимальний відгук одержують шляхом індукування транскрипції Gli1 у клітинах Daoy за допомогою кондиціонованого середовища (клітин нирки людського ембріона (НЕК-293), які стабільно експресують рекомбінантний Shh) протягом 24 год. з подальшим визначенням кількості стимульованого транскрипту Gli1. Мінімальним відгуком є кількість транскрипту Gli1, інгібованого досліджуваною сполукою у клітинах Daoy, які були стимульовані кондиціонованим середовищем (клітинами нирки людського ембріона (НЕК-293), які стабільно експресують рекомбінантний Shh) протягом 24 год. Функціональна проба для визначення інгібування Gli1 у клітинах Daoy У системі випробування на bDNA застосовується технологія з використанням ДНК з розгалуженим ланцюгом для забезпечення ампліфікації рибонуклеїнової кислоти-мішені (транскрипту). У цій технології використовуються три типи синтетичних гібридних коротких Gli1специфічних зондів сDNA, які визначають специфічність транскрипту-мішені [розширювачів захоплення (СЕ), розширювачів мічення (LЕ) та блокаторів (BL)], які у формі комплекса гібридизуються з транскриптами-мішенями з метою підсилення сигналу гібридизації. Додання хемілюміногенного субстрату на стадії ампліфікації дозволяє використовувати для детектування люмінесценцію. 21 UA 102115 C2 5 10 15 20 25 30 35 40 45 50 55 Фізіологічно прийнятна пухлинна лінія клітин Daoy, одержана з Американської колекції типових культур (АТСС), являє собою лінію клітин людської нейронної пухлини, які реагують на Shh, і була виділена у 1985 р. з десмопластичної мозочкової медулобластомної пухлини. Ендогенні рівні транскриптів Gli1 у клітинах Daoy є низькими, але можуть стимулюватися шляхом застосування кондиціонованого середовища, взятого з клітин, які стабільно надлишково експресують людський Shh (клітин НЕК-293, стабільно трансфікованих hShh). Клітини Daoy вирощують до злиття у склянках для тканинних культур типу Т225 у середовищі для вирощування Daoy, яке містить мінімальне базове середовище (МЕМ) плюс 10 % сироватки крові плоду корови (FBS) з 0,1 нМ замінних амінокислот та 1 мМ пірувату натрію. Клітини видаляють зі склянок Т225 із застосуванням трипсину та етилендіамінтетраоцтової кислоти (EDTA), центрифугують, знов суспендують у середовищі, та підраховують. Потім клітини Daoy висівають у кількості 50000 клітин на лунку у ростовому середовищі у 96лункові прозорі планшети Costar для культивування тканин, та піддають інкубуванню протягом ночі при 37С в атмосфері 5 % діоксиду вуглецю (СО2). Промивають клітини один раз сольовим розчином із фосфатним буфером (PBS), після чого додають 100 мкл кондиціонованого середовища Shh (Shh-СМ) для стимулювання рівнів експресії Gli1. Розводять Shh-СМ для досягнення максимальної стимуляції, застосовуючи стандартне ростове середовище – 0,1 % FBS/DMEM (модифіковане за Дюльбекко (Dulbeccos) середовище Eagle). Потім клітини Daoy, оброблені Shh-СМ, обробляють різними концентраціями інгібіторів hedgehog у діапазоні концентрацій від приблизно 1 мкМ до 0,1 нМ. Суміші з досліджуваними сполуками інкубують протягом 24 год. при 37С в атмосфері 5 % СО2. Визначення кількості транскрипту Gli1 виконують, застосовуючи пробу на Gli1 типу Quantigene 2.0 згідно з описом виробника (Panomics, Inc.) Виготовляють розведений буфер лізисної суміші (DLM), який містить протеїназу-К. Після інкубування протягом 24 год. із досліджуваною сполукою клітини промивають один раз PBS, та додають до клітин 180 мкл DLM. Планшет із клітинами, який містить лізисний буфер, закривають та витримують при 55С протягом 30-45 хв. Одержані лізати клітин потім розтирають 5 разів. Робочий набір зондів, який містить зонди Gli1, виготовляють шляхом розведення зондів у DLM згідно з інструкціями виробника, після чого додають у планшети для проби на bDNA 20 мкл робочого набору зондів разом із 80 мкл лізатів Daoy. Планшети закривають та інкубують при 55С протягом ночі. Потім обробляють планшети для bDNA згідно з інструкціями виробника. Сигнал кількісно вимірюють шляхом сканування планшетів на приладі Perkin Elmer Envision reader, який детектує люмінесценцію. Сигнал люмінесценції є прямо пропорційним кількості транскрипту-мішені, присутнього у пробі. Дані про сигнал люмінесценції, одержані при функціональній пробі, застосовують для обчислення IС50 при випробуванні in vitro. Ці дані обчислюють на основі максимальних контрольних значень (для клітин Daoy, оброблених Shh-СМ) та мінімального контрольного значення (для клітин Daoy, оброблених Shh-СМ та контрольною сполукою, яка має інгібувальну концентрацію, -1 мкМ розчином N-(3-(1Н-бензо[d]імідазол-2-іл)-4-хлорфеніл)3,5диметоксибензаміду). Чотирипараметрова логістична крива застосовується для отримання значень IС50 з використанням програм ActivityBase, версія 5.3, рівняння 205 (за Assay Guidance Manual Version 5.0, 2008, Eli Lilly and Company and NIH Chemical Genomics Center). При випробуванні за вищезазначеною методикою сполуки, взяті за приклади, виявили IС50
ДивитисяДодаткова інформація
Назва патенту англійськоюDisubstituted phthalazine hedgehog pathway antagonists
Автори англійськоюBastian, Jolie, Anne, Hipskind, Philip, Arthur, Sall, Daniel, Jon, Wilson, Takako
Назва патенту російськоюДизамещенные фталазиновые антагонисты сигнального пути hedgehog
Автори російськоюБастиан Джоли Эн, Хипскинд Филип Артур, Селл Даниэль Джон, Уилсон Такако
МПК / Мітки
МПК: C07D 403/04, A61P 35/00, A61K 31/502
Мітки: hedgehog, фталазини, двозаміщені, провідного, шляху, антагоністи
Код посилання
<a href="https://ua.patents.su/26-102115-dvozamishheni-ftalazini-antagonisti-providnogo-shlyakhu-hedgehog.html" target="_blank" rel="follow" title="База патентів України">Двозаміщені фталазини – антагоністи провідного шляху hedgehog</a>
Попередній патент: Спосіб гіроскопічного вимірювання вібраційним гіроскопом
Наступний патент: Двосекційна упаковка пенального типу з висувною частиною
Випадковий патент: Спосіб прогнозування типу вуглеводнів у покладі сейсморозвідкою












