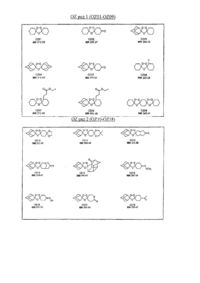
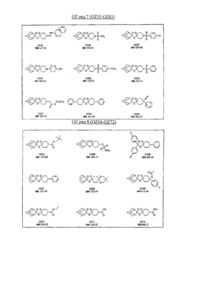
Протималярійні сполуки спіро- і диспіро- 1,2,4-триоксолану, спосіб їх одержання, фармацевтична композиція на їх основі, спосіб її одержання
Номер патенту: 78709
Опубліковано: 25.04.2007
Автори: Чарман Уільям Н., Матіль Юг, Падманілаям Маніян, Джіан Чанд Ядав, Веннерстром Джонатан Л., Ятендра Кумар, Дун Юйсян, Шоллє Жак, Тан Юаньцін
Формула / Реферат
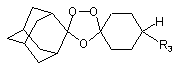
1. Спіро- або диспіро-1,2,4-триоксолан, що має наступну структуру:
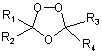 ,
,
де R1 і R2, взяті разом, являють собою спіроадамантил, 3,3,5,5-тетраметилспіроциклогексил, спіроциклододеканіл;
R3 і R4 є однаковими або різними й вибрані з заміщеної або незаміщеної ароматичної або піридильної групи, де жодний з R3 і R4 не може являти собою водень; і, крім того, R3 і R4, взяті разом, можуть утворювати заміщену або незаміщену аліциклічну групу, що необов'язково переривається одним атомом кисню, сірки або азоту.
2. Диспіро-1,2,4-триоксолан, що має наступну структуру:
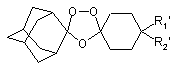 ,
,
де R1' і R2' є однаковими або різними і вибрані з групи, що складається з водню, заміщених або незаміщених лінійних або розгалужених алкільних, арильних і алкарильних груп, гідроксигрупи, галогену і заміщених або незаміщених аліциклічних груп, заміщених або незаміщених гетероароматичних груп і заміщених або незаміщених гетероциклічних груп, де дані гетероароматичні і гетероциклічні групи містять у циклі один або два атоми, вибрані з кисню, сірки або азоту, і далі, за умови, що спіроциклогексильне кільце, до якого приєднані R1' і R2', необов'язково переривається одним атомом кисню, сірки або азоту, за умови, що R1' і R2' одночасно не є воднем.
3. Диспіро-1,2,4-триоксолан за п. 2, де вказаний 1,2,4-триоксолан вибирають з групи, що складається з наступних сполук:
адамантан-2-спіро-3'-8'-оксо-1',2',4'-триоксаспіро[4.5]декан;
адамантан-2-спіро-3'-11',11'-диметил-1',2',4',9',13'-пентаоксадиспіро[4.2.5.2]пентадекан;
адамантан-2-спіро-3'-8'-пропіл-1',2',4'-триоксаспіро[4.5]декан;
адамантан-2-спіро-3'-8'-феніл-1',2',4'-триоксаспіро[4.5]декан;
адамантан-2-спіро-3'-8'-етоксикарбонілметил-1',2',4'-триоксаспіро[4.5]декан;
цис-адамантан-2-спіро-3'-8'-карбокси-1',2',4'-триоксаспіро[4.5]декан;
aдaмaнтaн-2-спіро-3'-8'-кapбoкcимeтил-1',2',4'-тpиoкcacпipo[4.5]дeкaн;
транс-адамантан-2-спіро-3'-8'-[(гідроксіаміно)карбоніл]-1',2',4'-триоксаспіро[4.5]декан;
цис-адамантан-2-спіро-3'-8'-(1'Н-імідазол-1'-ілметил)-1',2',4'-триоксаспіро[4.5]декан;
цис-адамантан-2-спіро-3'-8'-бензил-1',2',4'-триоксаспіро[4.5]декан;
цис-адамантан-2-спіро-3'-8'-(амінометил)-1',2',4'-триоксаспіро[4.5]декан гідрохлорид;
цис-адамантан-2-спіро-3'-8'-(2'-гідроксіаміно-2'-оксоетил)-1',2',4'-триоксаспіро[4.5]декан;
цис-адамантан-2-спіро-3'-8'-(1'Н-1',2',4'-триазол-1-ілметил)-1',2',4-триоксаспіро[4.5]декан;
цис-адамантан-2-спіро-3'-8'-(1'Н-імідазол-1-ілметил)-1',2',4'-триоксаспіро[4.5]декан гідрохлорид;
цис-адамантан-2-спіро-3'-8'-(амінометил)-1',2',4'-триоксаспіро[4.5]декан цитрат;
цис-адамантан-2-спіро-3'-8'-[2'-(4'-морфолініл)-2'-оксоетил]-1',2',4'-триоксаспіро[4.5]декан;
цис-адамантан-2-спіро-3'-8'-(2'-гідрокси-2'-метилпропіл)-1',2',4'-триоксаспіро[4.5]декан;
цис-адамантан-2-спіро-3'-8'-(амінометил)-1',2',4'-триоксаспіро[4.5]декан п-тозилат;
цис-aдaмaнтaн-2-cпipo-3'-8'-(aмiнoмeтил)-1',2',4'-тpиoкcacпipo[4.5]дeкaн мезилат;
цис-адамантан-2-спіро-3'-8'-[(фенілсульфоніл)метил]-1',2',4'-триокса-8'-азаспіро[4.5]декан;
цис-адамантан-2-спіро-3'-8'-(1'Н-імідазол-1-ілетил)-1',2',4'-триоксаспіро[4.5]декан;
цис-адамантан-2-спіро-3'-8'-[[4'-метил-1'-піперазиніл)карбоніл]метил]-1',2',4'-триоксаспіро[4.5]декан;
цис-адамантан-2-спіро-3'-8'-(аміноетил)-1',2',4'-триоксаспіро[4.5]декан гідрохлорид;
цис-адамантан-2-спіро-3'-8'-(1'Н-1',2',4'-триазол-1'-ілметил)-1',2',4'-триоксаспіро[4.5]декан мезилат;
цис-адамантан-2-спіро-3'-8'-[[(4'-піридинілкарбоніл)аміно]метил]-1',2',4'-триоксаспіро[4.5] декан;
цис-адамантан-2-спіро-3'-8'-[[(2'-аміно-2'-оксоетил)аміно]метил]-1',2',4'-триоксаспіро[4.5]декан;
цис-адамантан-2-спіро-3'-8'-[[(метансульфоніл)аміно]метил]-1',2',4'-триоксаспіро[4.5]декан;
цис-адамантан-2-спіро-3'-8'-[[[(1'Н-імідазол-4'-іл)карбоніл]аміно]метил]-1',2',4'-триоксаспіро[4.5]декан мезилат;
цис-адамантан-2-спіро-3'-8'-[[[(1'-оксидо-4'-піридиніл)карбоніл]аміно]метил]-1',2',4'-триоксаспіро[4.5]декан;
цис-адамантан-2-спіро-3'-8'-[[(амінокарбоніл)аміно]метил]-1',2',4'-триоксаспіро[4.5]декан;
цис-адамантан-2-спіро-3'-8'-[[[(диметиламіно)карбоніл]аміно]метил]-1',2',4'-триоксаспіро[4.5]декан;
цис-адамантан-2-спіро-3'-8'-[[[(4'-метил-1'-піперазиніл)карбоніл]аміно]метил]-1',2',4'-триоксаспіро[4.5]декан;
N-(цис-адамантан-2-спіро-3'-1',2',4'-триоксаспіро[4.5]декан-8'-метил)оксамід;
транс-адамантан-2-спіро-3'-8'-(амінометил)-1',2',4'-триоксаспіро[4.5]декан мезилат;
цис-адамантан-2-спіро-3'-8'-[[[(1'-оксидо-2'-піридиніл)карбоніл]аміно]метил]-1',2',4'-триоксаспіро[4.5]декан;
цис-адамантан-2-спіро-3'-8'-[[[(2'-аміно-2'-метилпропіл)аміно]карбоніл]метил]-1',2',4'-триоксаспіро[4.5]декан;
N-(цис-адамантан-2-спіро-3'-1',2',4'-триоксаспіро[4.5]декан-8'-метил)-N'-(транс-4-аміноциклогексил)оксамід п-тозилат;
N-(цис-адамантан-2-спіро-3'-1',2',4'-триоксаспіро[4.5]декан-8'-метил)-N'(2-аміно-2-метилпропіл)транс-4-аміноциклогексил)оксамід мезилат;
цис-адамантан-2-спіро-3'-8'-[2'-[[(2'-аміно-2'-метилпропіл)аміно]карбоніл]етил-1',2',4'-триоксаспіро[4.5]декан п-тозилат;
N-(цис-адамантан-2-спіро-3'-1',2',4'-триоксаспіро[4.5]декан-8'-метил)-Н'-(4-піперидиніл)оксамід мезилат;
цис-адамантан-2-спіро-3'-8'-[[[[(1'-аміноциклопропіл)метил]аміно]карбоніл]метил]-1',2',4'-триоксаспіро[4.5]декан п-тозилат і
цис-адамантан-2-спіро-3'-8'-(1-піперазинілкарбоніл)-1',2',4'-триоксаспіро[4.5]декан п-тозилат.
4. Фармацевтична композиція для профілактики і лікування малярії, що містить ефективну для профілактики або лікування малярії кількість спіро- або диспіро-1,2,4-триоксолану за пп. 1 або 2, його проліків і оптичних ізомерів і фармацевтично прийнятний носій.
5. Композиція за п. 4, де вказаний спіро- або диспіро-1,2,4-триоксолан є сполукою за п. 1.
6. Композиція за п. 5, де R3 і R4, взяті разом, являють собою моно- або дизаміщену С5-С12-спіроциклічну групу, що необов'язково переривається одним атомом кисню або азоту, причому вказаний атом азоту необов'язково є заміщеним.
7. Композиція за п. 6, де R1 і R2, взяті разом, і/або R3 і R4, взяті разом, являють собою спіроадамантан.
8. Композиція за п. 7, де R1 і R2, взяті разом, являють собою спіроадамантан, a R3 і R4 являють собою заміщені або незаміщені фенільне або піридильне кільця.
9. Композиція за п. 7, де R1 і R2, взяті разом, являють собою спіроадамантан, а R3 і R4, взяті разом, являють собою спіроциклогексильний цикл, що заміщений або функціоналізований по 4-положенню.
10. Композиція за п. 9, де спіроциклогексильний цикл переривається одним атомом кисню або азоту.
11. Композиція за п. 10, де спіроциклогексильний цикл замінений N-заміщеним піперидилом.
12. Композиція за п. 9, де спіроциклогексильний цикл функціоналізований заміщеним або незаміщеним замісником, вибраним з групи, що складається з лінійних або розгалужених алкілу, кетону, кислоти, спирту, аміну, аміду, сульфонаміду, гуанідину, простого ефіру, складного ефіру, оксиму, сечовини, оксимного (простого) ефіру, сульфону, лактону, карбамату, семикарбазону, фенілу, гетероциклу або аліциклічної групи.
13. Композиція за п. 4, де вказаний диспіро-1,2,4-триоксолан є сполукою за п. 2.
14. Композиція за п. 13, де спіроциклогексильний цикл переривається одним атомом кисню, сірки або азоту.
15. Композиція за п. 14, де спіроциклогексильний цикл замінений N-заміщеним піперидилом.
16. Композиція за п. 4, де згаданий триоксолан включає сіль, вибрану з групи, що складається з ацетату, адипату, альгінату, цитрату, аспартату, бензоату, бензолсульфонату, бісульфату, бутирату, камфорату, камфорсульфонату, диглюконату, гліцерофосфату, гемісульфату, гептаноату, гексаноату, фумарату, гідрохлориду, гідроброміду, гідройодиду, ізотіонату, лактату, малеату, метансульфонату, нікотинату, 2-нафталінсульфонату, оксалату, пальмітоату, пектинату, персульфату, 3-фенілпропіонату, пікрату, півалату, пропіонату, сукцинату, тартрату, тіоціанату, фосфату, глутамату, бікарбонату, п-толуолсульфонату й ундеканоату.
17. Композиція за п. 16, де триоксолан вибирають із групи, що складається з п-тозилату цис-адамантан-2-спіро-3'-8'-[[[(2'-аміно-2'-метилпропіл)аміно]карбоніл]метил]-1',2',4'-триоксаспіро[4.5]декану; гідромалеату цис-адамантан-2-спіро-3'-8'-[[[(2'-аміно-2'-метилпропіл)аміно]карбоніл]метил]-1',2',4'-триоксаспіро[4.5]декану; гідрохлориду цис-адамантан-2-спіро-3'-8'-[[[(2'-аміно-2'-метилпропіл)аміно]карбоніл]метил]-1',2',4'-триоксаспіро[4.5]декану; гідротартрату цис-адамантан-2-спіро-3'-8'-[[[(2'-аміно-2'-метилпропіл)аміно]карбоніл]метил]-1',2',4'-триоксаспіро[4.5]декану; і гідросукцинату цис-адамантан-2-спіро-3'-8'-[[[(2'-аміно-2'-метилпропіл)аміно]карбоніл]метил]-1',2',4'-триоксаспіро[4.5]декану.
18. Спосіб профілактики або лікування малярії, що включає введення ефективної для профілактики або лікування малярії кількості спіро- або диспіро-1,2,4-триоксолану за пп. 1 або 2 у фармацевтично прийнятному носії.
19. Спосіб виробництва композиції для профілактики і лікування малярії, що включає змішування ефективної для профілактики або лікування малярії кількості спіро- або диспіро-1,2,4-триоксолану з фармацевтично прийнятним носієм, причому вказаний триоксолан є триоксоланом за пп. 1 або 2.
20. Спосіб лікування раку, що включає введення ефективної для лікування раку кількості спіро- або диспіро-1,2,4-триоксолану за пп. 1 або 2 у фармацевтично прийнятному носії.
21. Спосіб профілактики або лікування шистосомозу, що включає введення ефективної для профілактики або лікування шистосомозу кількості спіро- або диспіро-1,2,4-триоксолану за пп. 1 або 2 у фармацевтично прийнятному носії.
22. Спосіб синтезу диспіро-1,2,4-триоксолану за пп. 1 або 2, що включає обробку триоксолану, що має наступну структуру:
 ,
,
де R3 вибраний із групи, що складається з кетону, альдегіду, складного ефіру і фталіміду, окисником.
Текст
Даний винахід відноситься до композицій і способів для лікування малярії. Особливо, даний винахід відноситься до фармацевтичних композицій, що включають спіро- і диспіротриоксолани, способів їх застосування і виробництва. Малярія являє собою гостре, а часто і хронічне інфекційне захворювання, зумовлене присутністю паразитів, що відносяться до найпростіших, в червоних кров'яних клітинах. Малярія, що викликається одноклітинними паразитами роду Plasmodium, переноситься від суб'єкта до суб'єкта через укус самиці комара. Хоча раніше малярія була широко поширена в Північній Америці і інших частинах світу з помірним кліматом, сьогодні вона в основному зустрічається в тропічних і субтропічних країнах. Кожний рік від 400 до 600 мільйонів людей заражаються даною хворобою і від 1,5 до 2,7 мільйонів вмирають від неї. Загалом, за малярію відповідальні чотири види найпростіших паразитів Plasmodium, включаючи Plasmodium vivax, Plasmodium falciparum, Plasmodium malariae і Plasmodium ovale. З чотирьох найбільш небезпечним є Plasmodium falciparum, що є причиною половини всіх клінічних випадків малярії і 90% смертей від даної хвороби. Передача малярії починається, коли самиця комара кусає людину, вже інфіковану малярійним паразитом. Якщо інфікований комар кусає іншу людину, спорозоїти зі слиною комара переносяться в кров, яка потім попадає в печінку. У печінці спорозоїти швидко діляться, потім надходять до кровотоку, де вони вкорінюються в червоні кров'яні клітини. Всередині вказаних кров'яних клітин мерозоїти швидко діляться доти, доки вони не спричинять руйнування червоних кров'яних клітин з вивільненням в кровотік нового покоління мерозоїтів, які потім інфікують інші червоні кров'яні клітини. Пов'язані з малярією симптоми, як правило, зумовлені руйнуванням червоних кров'яних клітин. Внаслідок руйнування червоних кров'яних клітин відбувається викид в кров забруднюючих речовин, токсину і інших продуктів руйн ування. Це в свою чергу викликає сильний жар, який робить інфікованого суб'єкта виснаженим і знесиленим. Більш важкі симптоми, пов'язані з повторюваними інфекціями і/або інфекцією Plasmodium falciparum, включають анемію, важкі головні болі, судоми, деліріозний синдром і, в деяких випадках, смерть. Лікування малярії є особливо складним через здатність малярійних паразитів розвивати стійкість до лікарських засобів. Хінін - протималярійна сполука, яку екстрагують з кори південноамериканського хінного дерева, - є одним з найбільш старих і найбільш ефективних з існуючих фармацевтичних препаратів. Недоліком хініну є короткочасність дії і нездатність запобігти рецидиву захворювання. Крім того, хінін володіє побічними ефектами, що варіюють від запаморочення до глухоти. Хлорохін є синтетичним хімічним препаратом, подібним до хініну. Він став препаратом, вибраним для лікування малярії, коли був розроблений в 1940-х роках завдяки його ефективності, простоті одержання і, як правило, відсутності побічних ефектів. Однак протягом декількох останніх десятиріч малярійні паразити в багатьох частинах світу стали стійкими до хлорохіну. Ме флохін є іншим синтетичним аналогом хініну, що застосовувався для лікування малярії. Однак у малярійних паразитів також розвинулася стійкість і до мефлохіну. Крім того, в деяких випадках мефлохін також має небажані побічні ефекти, пов'язані з центральною нервовою системою, включаючи галюцинації і образні нічні кошмари. Анти фолатні лікарські засоби діють проти малярійних паразитів, інгібуючи їх репродуктивні функції. Хоч у паразитів розвивається стійкість і до антифолатних лікарських засобів, дані лікарські засоби ще можна ефективно використовувати в поєднанні з іншими типами протималярійних препаратів. Однак застосування поєднувальних терапій для лікування малярії має недоліки, а саме, воно є незручним і дорогим. Розробки, що здійснюються останнім часом в області лікування малярії, включають застосування пероксидної функціональної групи, присутньої, наприклад, в лікарському засобі артемізиніні, який містить унікальний 1,2,4-триоксановий гетероциклічний фармакофор. Протималярійна активність артемізиніну зумовлена його здатністю взаємодіяти із залізом молекул вільного гема малярійного паразита з утворенням вільних радикалів, що приводять до руйнування клітини. Відкриття артемізиніну (хінгхаосу (qinghaosu)), що з устрічається в природі ендопероксидного сесквітерпенового лактону [Meshnick et al., 1996; Vroman et al. 1999; Dhingra et al. 2000], поклало початок інтенсивним спробам з'ясувати молекулярний механізм його дії [Jefford, 1997; Gumming et al., 1997] і ідентифікувати нові протималярійні пероксиди [Dong and Vennerstrom, 2001. Були одержані численні синтетичні 1,2,4-триоксани, 1,2,4,5-тетраоксани і інші ендопероксиди. Хоча застосовні в клініці напівсинтетичні похідні артемізиніну є швидкодіючими і сильними протималярійними засобами, вони мають декілька недоліків, включаючи, відновлюваність захворювання, нейротоксичність [Wesche et al., 1994] і метаболічну нестабільність [White, 1994]. Значна кількість даних сполук є вельми активним in vitro, але більшість з них володіє низькою активністю при пероральному застосуванні [White, 1994; van Agtmael et al., 1999]. Хоча пізніше були одержані численні протималярійні 1,2,4-триоксани [Gumming et al., 1996; Jefford, 1997], в даній області існує потреба в ідентифікації нових пероксидних протималярійних агентів, особливо таких, які можна легко синтезувати, які не є нейротоксичними, і, які володіють поліпшеними фармакокінетичними властивостями, наприклад, поліпшеною стабільністю, абсорбцією при пероральному застосуванні і інш. Відповідно, першою метою даного винаходу є надання композицій і способів, призначених для профілактики і лікування малярії з використанням спіро- і диспіро-1,2,4-триоксоланів. Іншою метою даного винаходу є надання композиції і способу, призначених для профілактики і лікування малярії з використанням нетоксичних спіро- і диспіро-1,2,4-триоксоланів. Наступною метою даного винаходу є надання композиції і способу, призначених для профілактики і лікування малярії з використанням метаболічно стабільних і активних при пероральному застосуванні спіроі диспіро-1,2,4-триоксоланів. Черговою метою даного винаходу є надання композиції і способу, призначених для профілактики і економічно вигідного лікування малярії з використанням спіро- і диспіро-1,2,4-триоксоланів, які не зв'язані з режимом лікування тривалістю більше ніж 3 дні. Наступною метою даного винаходу є надання композицій і способів, призначених для профілактики і лікування малярії з використанням спіро- і диспіро-1,2,4-триоксоланів, які можна використати або як самостійні лікарські засоби, або в поєднанні з іншими агентами. Ще однією метою даного винаходу є надання нових проміжних сполук для синтезу композицій, призначених для профілактики і лікування малярії. Спосіб і засоби здійснення кожної із згаданих вище цілей, також як і іншої, стануть очевидні з наведеного нижче докладного опису винаходу. Винахід описує спосіб і композицію для лікування малярії за допомогою спіро- і диспіро-1,2,4триоксоланів, їх проліків і аналогів. Триоксолани даного винаходу є стерично утр удненими з одного боку триоксоланового гетероциклу для забезпечення хімічної і метаболічної стабільності триоксоланового циклу для кращої активності in vivo. В одному втіленні спіро- і диспіротриоксолани стерично утрудняють за допомогою незаміщеної, моно-, ди- або полізаміщеної С 5-С12-спіроциклоалкільної групи, яка може бути спіроадамантаном. У даному втіленні спіро- і диспіротриоксолани можуть включати спіроциклогексил, який функціоналізований або заміщений по 4-положенню або спіропіперидильне кільце, яке функціоналізоване або заміщене по атому азоту. Ще в одному втіленні триоксолани даного винаходу включають алкільний місток від 4-положення спіроциклогексильного циклу, що зв'язує замісник, який, найбільш переважно, являє собою слабку основу. Винахід охоплює ахіральні діастереомери, рацемічні суміші, а також енантіомерні форми сполук. Триоксолани даного винаходу володіють чудо вою активністю і ефективністю проти паразитів Plasmodium і низькою мірою нейротоксичності. Додатково, деякі триоксолани є придатними як для перорального, так і неперорального введення. Крім того, в порівнянні з напівсинтетичними похідними артемізиніну сполуки даного винаходу є простими в структурному відношенні, їх легко і економічно синтезувати, і вони можуть ефективно застосовуватися окремо або в поєднанні з іншими протималярійними засобами. Даний винахід відноситься до розробки спіро- і диспіро-1,2,4-триоксоланів для застосування в профілактиці і лікуванні малярії. Даний винахід оснований на несподіваному відкритті, що триоксолани, які є відносно стерично ускладненими, щонайменше, по одній стороні триоксоланового гетероциклу, забезпечують метаболічну і хімічну стабільність триоксоланового циклу, таким чином, забезпечуючи кращу активність in vivo, особливо, по відношенню до перорального введення. Як він використаний в даному описі, термін "профілактично ефективна кількість" відноситься до концентрації сполуки даного винаходу, яка ефективна при інгібуванні або профілактиці інфекції і подальшого захворювання, викликаного малярійними паразитами. Аналогічно, термін "лікувальноефективна кількість" відноситься до концентрації сполуки, яка ефективна при лікуванні малярії з точки зору запобігання збільшенню концентрації малярійних паразитів, зменшення концентрації малярійних паразитів і/або "лікування" малярійної інфекції, тобто забезпечення виживання протягом 30 днів після інфікування. Чотиризаміщені триоксолани є відносно стабільними пероксидними сполуками, виходячи з попередньої літератури [Griesbaum et al., 1997a; 1997b]. Даний ефект може бути частково зумовлений недоліком aводневих атомів. Автори даного винаходу синтезували нові сполуки в класі триоксоланів, що володіють як чудовою протималярійною активністю, так і ефективністю при пероральному введенні. Крім того, сполуки даного винаходу мають низьку токсичність, і періоди напіврозпаду, придатні для лікування малярії, які, як вважають, дозволяють здійснювати нетривалі режими лікування, що є сприятливим чинником при порівнянні з іншими ліками, подібними до артемізиніну. Дані сполуки можна також застосовувати для профілактики малярії. У попередній заявці автори даного винаходу розкрили деякі нові чотиризаміщені триоксолани, які мають наступну структурн у формулу: де R1, R2, R3 і R4 являють собою комбінації циклічних систем, ациклічних систем і функціональних груп, які забезпечують достатнє стеричне ускладнення навколо триоксоланового циклу для придання циклу хімічної і метаболічної стабільності. R1, R2, R3 і R4 можуть бути однаковими або різними і можуть являти собою лінійну або розгалужену алкільну, арильну і алкарильну групу, яка необов'язково є заміщеною. Альтернативно, R1 і R2, взяті разом, і/або R3 і R4, взяті разом, можуть утворювати аліциклічну групу, яка необов'язково уривається одним або декількома атомами кисню, сірки або азоту і є необов'язково заміщеною. Ні в якому разі будь-який з R1, R2, R3 або R4 не може являти собою водень. В одному втіленні сполуки включають такі сполуки, де R1 і R2, взяті разом, і/або R3 і R4, взяті разом, являють собою моно- або дизаміщену С 5-С12-спіроциклоалкільну групу, яка необов'язково уривається одним або декількома атомами кисню, сірки або азоту і є необов'язково заміщеною. В іншому втіленні R 1 і R2, взяті разом, або R3 і R4 являють собою спіроадамантан. Даний винахід розкриває нове втілення триоксоланових сполук, що мають наступну стр уктуру: Спіроциклогексильний цикл може необов'язково уриватися одним або декількома атомами кисню, сірки або азоту. В цьому випадку R1 і R2 можуть бути однаковими або різними і можуть являти собою водень, заміщені або незаміщені лінійні або розгалужені алкільну, арильну і алкарильну групи і заміщені або незаміщені аліциклічні групи, які можуть уриватися одним або декількома атомами кисню, сірки або азоту, заміщені або незаміщені ароматичні або гетероциклічні групи, які можуть уриватися одним або декількома атомами кисню, сірки або азоту, гідроксильну гр упу або галоген. В одному втіленні R 1 і R2 являють собою функціональну гр упу, що є амідом. Автори несподівано виявили, що амідвмісні замісники по 4-положенню забезпечують протималярійним сполукам хорошу абсорбцію при пероральному введенні, хорошу протималярійну активність і хорошу фармакокінетику, тобто міри абсорбції, метаболізму і виведення, які є відповідними і корисними для профілактики і лікування малярії. Ще в одному втіленні сполуки даного винаходу мають наступну стр уктурну формулу: де R3 являє собою (CH2)n-Y. В даній формулі Υ являє собою функціональну груп у, яка в одному втіленні є некислотною, а в ще одному втіленні є слабкою основою. Функціональна група Υ може являти собою алкіл, кетон, кислоту, спирт, амін, амід, сульфонамід, гуанідин, простий ефір, складний ефір, оксим, сечовину, оксимний ефір, сульфон, лактон, карбамат, семікарбазон, феніл або гетероцикл. В одному втіленні n=1. Було виявлено, що алкільна "місткова" група поліпшує метаболічну стабільність (тобто пероральну активність і фармакокінетику) протималярійних сполук згідно з даним винаходом. У ще одному втіленні даного винаходу такі триоксоланові сполуки являють собою слабкі основи, які надають ідеальне поєднання високої характеристичної активності і хорошої пероральної активності. Два перспективних структурних підтипи триоксолану являють собою слабкоосновні аміди, що утворюються аміном триоксолану ΟΖ209 і триоксолановою кислотою ΟΖ78. Дані сполуки мають одну з наступних двох структурних формул: Можливі також інші замісники по 4-положенню спіроциклогексильного циклу, які попадають в об'єм даного винаходу. Спіроциклогексильний цикл може також бути заміщений по інших положеннях, крім 4положення. Наприклад, автори синтезували декілька сполук, заміщених по 2-положенню спіроциклогексильного циклу, які виявляють чудову протималярійну активність. У ще одному втіленні переважні сполуки даного винаходу включають алкільну гр упу, що зв'язує замісник по 4-положенню зі спіроциклогексильним циклом. У одному втіленні алкільна група являє собою метил або етил. Ще в одному втіленні алкільна група з метилом являє собою переважний варіант. Алкільна "місткова" група, також безпосередньо приєднана до 4-положення, поліпшує метаболічну стабільність (тобто пероральну активність і фармакокінетику) спіроциклогексильного циклу протималярійних сполук даного винаходу. Автори даного винаходу ідентифікували два активних при пероральному введенні ведучих диспіро1,2,4-триоксолани, OZ03 і OZ05: Дані триоксолани мають значення IC50S проти P. Falciparum in vitro між 1 і 5нг/мл і, мабуть, володіють хорошими терапевтичними показниками при тому, що не спостерігали очевидної токсичності для сполук як на клітинній лінії нейробластоми, так і при однократних дозах 640мг/кг на мишах в тесті Рейну. Дані результати суперечать опублікованим даним [de Almeida Barbosa et al., 1992; 1996], що розкривають слабку протималярійну активність in vitro для декількох трициклічних триоксоланів, кращий з яких мав значення ІС50 проти P. Falciparum in vitro, що дорівнювало 2000нг/мл. Відмітною ознакою даних триоксоланів в порівнянні з напівсинтетичними похідними артемізиніну є їх структурна простота. Можливою перевагою триоксоланів перед як триоксанами [Jefford, 1997; Gumming et al., 1997], так і тетраоксанами [Vennerstrom et al., 2000] є більш зручний доступ до структурно різноманітних, несиметричних і, в багатьох випадках, а хіральних сполук. Нижче приведені деякі диспіро-1,2,4-триоксолани, синтезовані відповідно до вказівок даного винаходу. "OZ" є вн утрішнім позначенням для даних сполук, яке буде використане у всій іншій частині заявки для зручності. Прототипними триоксоланами даного винаходу є OZ03 і OZ05. Переважні сполуки, ідентифіковані до цього часу включають OZ03, OZ05, OZ11, OZ25, OZ27, OZ61, OZ71, OZ78, OZ127, OZ145, OZ156, OZ163, OZ175, OZ177, OZ179, OZ181, OZ189, OZ205, OZ207, OZ209, OZ210, OZ219, OZ227, OZ229, OZ235, OZ255, OZ256, OZ257, OZ263, OZ264, OZ265, OZ266, OZ267, OZ268, OZ269, OZ270, OZ271, OZ277, OZ279, OZ281, OZ288, OZ289, OZ290, OZ296, OZ297, OZ298, OZ301, OZ305, OZ309, OZ315, OZ317, OZ319, OZ320, OZ323, OZ329, OZ333, OZ335, OZ336, OZ337, OZ338, OZ339, OZ343, OZ349, OZ351, OZ353, OZ354, OZ357, OZ358, OZ359, OZ365 і OZ368. Найбільш переважними сполуками є OZ78, OZ163, OZ181, OZ207, OZ209, OZ255, OZ256, OZ257, OZ263, OZ264, OZ267, OZ271, OZ277, OZ279, OZ301, OZ305, OZ315, OZ317, OZ319, OZ323, OZ329, OZ338, OZ339, OZ349, OZ351, OZ354, OZ357, OZ359 і OZ368, причому найкращими з даних сполук, ідентифікованих таким чином, є OZ277 і OZ279. У загальному випадку, найбільшу активність in vitro проти малярійних паразитів одержують для триоксоланів, функціоналізованих або заміщених по 4-положенню спіроциклогексильного циклу. Як правило, також переважними є несиметричні, ахіральні триоксолани. Відмітними ознаками даних спіро- і диспіро-1,2,4-триоксоланів в порівнянні з напівсинтетичними похідними артемізиніну є їх структурна простота і легкість синтезу. Наприклад, диспіротриоксолани можуть бути легко синтезовані за допомогою співозонолізу О-метилоксимів циклоалканонів в присутності необхідних похідних циклоалканону у відповідності до способу Griesbaum et al. (1997а; 1997b) як проілюстровано нижче для симетричного диспіроциклогексилтриоксолану: Якщо в даній реакції співозонолізу виходи є низькими, то їх можна значно збільшити, коли Ометилоксим і кетон "обертаються". Нова методика забезпечує виключно зручний спосіб для синтезу спіро- і диспіротриоксоланів. Переваги оксим-ефірного шляху перед алкеновим підходом включають зручний синтез початкових речовин (оксимних простих ефірів в порівнянні з чотиризаміщеними алкенами), більш високі вихід і селективність цільових триоксоланів за рахунок цілеспрямованого вибору парних реакційних субстратів. Триоксолани можна очищати кристалізацією або колонковою флеш-хроматографією. їхні структури і чистоту можна підтвердити аналітичною ВЕРХ, 1Н- і 13С-Я МР, ІЧ, температурою плавлення і елементним аналізом. Нещодавно Griesbaum et al. (1997b) виявили, що чотиризаміщені 1,2,4-триоксолани зручно одержувати озонолізом О-алкілоксимов кетону в присутності карбонільних сполук. Передбачають, що утворення триоксолану з оксимного простого ефіру і кетону є тристадійним процесом. Послідовність починається електрофільним приєднанням озону до подвійного зв'язку оксиму з утворенням первинного озоніду. На другому етапі дуже нестабільний первинний адукт фрагментується до реакційноздатного оксиду карбонілу, що частково супроводжується попутним виділенням відносно стабільного метилнітриту. На третьому етапі оксид карбонілу зазнає [3+2]циклоприєднання з кетоном з утворенням вторинного озоніду або 1,2,4-триоксолану. Залишається визначити, чи є даний рекомбінаційний процес постадійним або таким, що протікає одночасно. Як продемонстровано вище синтезом OZ03, найбільша частина нових диспіротриоксоланів містить спіроадамантан і може бути синтезована співозонолізом О-метилоксиму адамантанону в присутності необхідного похідного циклоалканону. Переважними реакційними розчинниками для реакцій співозонолізу є вуглеводневі розчинники, такі як пентан або циклогексан; більш полярні розчинники мають тенденцію зменшувати ви хід реакції. Коли кетони не є легко розчинними в пентані або циклогексані, можна застосовувати змішаний розчинник (пентан/метиленхлорид) або один метиленхлорид. Декілька чинників визначають відношення оксимного простого ефіру до кетону. У деяких реакціях, щоб уникнути утворення дипероксиду (1,2,4,5-тетраоксану), запобігти утворенню діозоніду з дикетонів і активізувати реакцію з кетонами, легко розчинними в пентані, застосовують надлишок кетону (2:1). У самому загальному випадку, на стадії дослідницького синтезу і особливо у випадках, коли кетони не є легко розчинними в пентані, є дорогими або такими, що складно видалити, при обробці реакційної суміші можна використати відношення кетону до оксимного простого ефіру 1:1. При великомасштабних триоксоланових синтезах, можна використати 1,5-кратний надлишок оксимного простого ефіру для досягнення більш високих мір конверсії кетону в цільові триоксоланові продукти, не створюючи проблем з очищенням. Існує декілька прикладів, де застосовують перетворення після озонолізу для одержання цільових триоксоланових сполук, які важко або в деяких випадках неможливо одержувати безпосередньо [Kashima et al., 1987] способом співозонолізу. Триоксоланові третинні спирти OZ90 і OZ108 можуть бути одержані обробкою метиллітієм триоксоланового кетону OZ05 і триоксоланового складного ефіру OZ70, відповідно. В інших реакціях триоксолановий лактон OZ17 і триоксолановий спирт OZ32 одержують обробкою OZ05 м-СРВА (метахлопербензойна кислота) і боргідридом натрію, відповідно. Крім того, різні оксимні прості ефіри, гідразони, кеталі і аміни (відновне амінування з триацетоксиборгідридом натрію) також одержують з триоксоланового кетону OZ05 з хорошими і відмінними виходами. У прикладах, відмічених ви ще, є очевидним, що триоксолановий кетон OZ05 являє собою ключовий інтермедіат, оскільки його кетонова функціональна група надає зручний засіб для трансформації функціональної групи. Подальше очевидне свідчення стійкості даних триоксоланів до відновлювальних агентів продемонстроване відновленням складних триоксоланових ефірів OZ70 і OZ61 в їх відповідні триоксоланові спирти OZ119 і OZ89 сумішшю боргідриду літію і триетилборгідриду літію і гідразинолізом триоксоланових фталімідів OZ136 і OZ146 в їх відповідні аміни OZ137 і OZ209. Як показано нижче в прикладах, триоксоланові складні ефіри можна зручним чином перетворити в їх відповідні триоксоланові кислоти. У доповнення до триоксоланового кетону OZ05, триоксоланового аміну мезилату OZ209, триоксоланового складного ефіру OZ61 і триоксоланової кислоти OZ78, триоксоланові спирти OZ119 і OZ89 повинні і будуть являтися ключовими інтермедіатами для синтетичних перетворень після озонолізу. Недавнім прикладом є синтез триоксоланового триазолу OZ177 в реакції між мезилатним похідним OZ119 і натрієвою сіллю 1,2,4-триазолу. Було виявлено, що спосіб співозонолізу з використанням ефіру метилоксиму надає швидкий, гнучкий і передбачуваний доступ до структурно різноманітних триоксоланів. Фактично, деякі ключові триоксолани, які служили важливими білдінг-блоками, були одержані у великому масштабі, включаючи OZ05 (100ммоль), OZ61 (100ммоль), OZ146 (60ммоль), без зменшення реакційних виходів в порівнянні із звичайним масштабом 5-10ммоль. Крім того, як OZ61, так і OZ146 можуть бути зручним чином виділені у вигляді білих твердих речовин додаванням етанолу до неочищених реакційних сумішей. Експерименти з диференціальною скануючою калориметрією (ДСК) (Cammenga, and Epple, 1995) демонструють, що дані сполуки володіють хорошою термічною стабільністю, порівнянною з артемізиніном. Середня т.пл. з розкладанням становить 160±15°С в порівнянні з т.пл. з розкладанням 181°С для артемізиніну. Передбачають, що термічне розкладання даних триоксоланів ініціюється утворенням 1,5дирадикалу, що утворюється гомолітичним розщеплення пероксидного зв'язку триоксоланового циклу. Оскільки велика частина цільових триоксоланів містить симетричний спіроадамантановий структурний каркас, їх стереохімія значною мірою є функцією структури кетону початкової речовини або реагентів, що застосовуються для реакцій після озонолізу. Для OZ27 і інших аналогічних 1,4-заміщених триоксоланів можлива наявність двох ахіральних діастереомерів. Однак як продемонстровано прикладом з OZ27, велику частину даних триоксоланів виділяють у вигляді єдиних ахіральних діастереомерів в більшій мірі, ніж у вигляді сумішей двох ахіральних діастереомерів. Наприклад, для OZ27 хіральність відсутня, оскільки триоксолановий цикл і фенільний замісник знаходяться у 1,4-взаєморозташуванні в шестичленному циклі. Такі сполуки мають площину симетрії. Як визначають методом рентгенівської кристалографії, OZ78, OZ209 і їх похідні мають цисконфігурацію в ти х випадках, коли пероксидні кисні знаходяться в аксіальному положенні. Початкова речовина 2-адамантанон може бути одержаний від Aldrich Chemical Co. або від TCI American Organic Chemicals або може також бути синтезована. Фахівці в даній області можуть легко запропонувати інші відповідні засоби для синтезу початкових речовин і сполук відповідно до даного винаходу. Спіро- і диспіротриоксоланові композиції даного винаходу в основному можуть бути використані для профілактики і лікування малярії. Триоксоланові композиції даного винаходу вводять разом з фармацевтично прийнятним носієм. Як правило, для даної мети можна використати будь-який фармацевтично прийнятний носій, за умови, що носій не надає значного несприятливого впливу на стабільність або біодоступність триоксоланових сполук даного винаходу. Триоксолани даного винаходу можна вводити теплокровним тваринам, включаючи людину і інших тварин, в будь-якій ефективній фармацевтично прийнятній формі, наприклад, у вигляді лікарських форм для місцевого введення, промивання, перорального введення, парентерального введення, у вигляді свічок або у вигляді лікарських форм для інфузії, таких як засоби для місцевого, щічного, під'язичного введення або назальний спрей, або будь-яким іншим способом, що забезпечує ефективну доставку ци х засобів. Переважно спосіб введення повинен забезпечувати оптимізацію доставки і/або локалізацію засобів в напрямі клітин-мішеней. На додаток до активних сполук, тобто триоксоланів, фармацевтичні композиції даного винаходу можуть містити відповідні середовища для ліків і допоміжні засоби, що полегшують одержання препаратів на основі активних сполук, які можуть використовуватися як фармацевтичні препарати. Лікарські форми для перорального введення включають таблетки, капсули і гранули. Препарати, які можуть бути введені ректально, включають свічки. Інші лікарські форми включають розчини, відповідні для парентерального або перорального введення, а також композиції, які можуть бути введені щічним або під'язичним способом. Фармацевтичні композиції даного винаходу одержують таким шляхом, який сам по собі добре відомий в даній області. Наприклад, фармацевтичні композиції можуть бути одержані за допомогою традиційних способів змішування, гранулювання, одержання драже, розчинення, ліофілізації. У кінцевому результаті, спосіб вибирають в залежності від фізичних властивостей активного інгредієнта, що використовується. Відповідними середовищами для ліків є, зокрема, наповнювачі, такі як цукри, наприклад, лактоза або сахароза, маніт або сорбіт, целюлозні препарати і/або фосфати кальцію, наприклад, трикальцію фосфат або гідрофосфат кальцію, а також зв'язуючі засоби, такі як крохмаль, паста, одержана, наприклад, з використанням кукурудзяного крохмалю, пшеничного крохмалю, рисового крохмалю, картопляного крохмалю, желатину, трагакантової камеді, метилцелюлози, гідроксипропілметилцелюлози, натрій карбоксиметилцелюлози і/або полівінілпіролідону. За бажанням можуть бути додані дезінтегруючі засоби, такі як вищезазначений крохмаль, а також карбоксиметилкрохмаль, поперечно зшитий полівінілпіролідон, агар або альгінова кислота або її сіль, наприклад, альгінат натрію. Допоміжними засобами є засоби, регулюючі текучість, а також змащувальні засоби, наприклад, такі як діоксид кремнію, тальк, стеаринова кислота або її солі, наприклад, стеарат магнію або стеарат кальцію, і/або поліетиленгліколь. Лікарські форми для перорального введення можуть бути забезпечені відповідними покриттями, які за бажанням можуть бути стійкими до шлункових соків. Для даної мети можна використати концентровані розчини цукрів, які необов'язково можуть містити гуміарабік, тальк, полівінілпіролідон, поліетиленгліколь і/або діоксид титану, лакові розчини і відповідні органічні розчинники або суміші розчинників. Для одержання покриттів, стійких до шлункового соку, до покриттів таблеток можуть бути додані розчини відповідних целюлозних препаратів, таких як фталат ацетилцелюлози або фталат гідроксипропілметилцелюлози, фарбувальні засоби і пігменти, наприклад, для ідентифікації, або для характеристики різних поєднань доз сполук. Інші фармацевтичні композиції, які можуть використовуватися для перорального введення, включають щільно набиті капсули з желатину, м'які, герметично запечатані капсули з желатину, а також пластифікатор, такий як гліцерин або сорбіт. Щільно набиті капсули можуть містити активні сполуки у вигляді гранул, які можуть бути змішані з наповнювачами, такими як лактоза, зв'язуючими засобами, такими як крохмаль, і/або змащувальними засобами, такими як тальк або стеарат магнію, і, необов'язково, зі стабілізаторами. У м'яких капсулах активні сполуки переважно розчинені або суспендовані у відповідних рідинах, таких як жирні масла, рідкий парафін або рідкі поліетиленгліколі. Крім того, можуть бути додані стабілізатори. Можливі фармацевтичні препарати, які можуть застосовуватися шляхом ректального введення, включають, наприклад, свічки, які складаються з поєднання активних сполук і основи свічок. Відповідними основами для свічок є, наприклад, природні або синтетичні тригліцериди, парафінові вуглеводні, поліетиленгліколі або вищі алканоли. Крім того, можна також використати желатинові ректальні капсули, які складаються з поєднання активних сполук і основи. Можливі речовини для основи включають, наприклад, рідкі тригліцериди, поліетиленгліколі або парафінові вуглеводні. Відповідні композиції для парентерального введення включають водні розчини активних сполук у водорозчинній або вододиспергованій формі. Крім того, можуть бути введені суспензії активних сполук у вигляді відповідних масляних суспензій, призначених для ін'єкцій. Відповідні ліпофільні розчинники або середовища включають жирні олії, наприклад, кунжутну олію, або синтетичні ефіри жирних кислот, наприклад, етилолеат або тригліцериди. Водні суспензії для ін'єкцій можуть містити речовини, які збільшують в'язкість суспензії, що включають, наприклад, натрійкарбоксиметилцелюлозу, сорбіт і/або декстран. Такі композиції можуть також включати допоміжні засоби, такі як такі, що консервують, зволожують, емульгують і диспергують. їх також можна стерилізувати, наприклад, фільтрацією через фільтр, затримуючий бактерії, або шляхом включення в композицію стерилізуючих засобів. Вони можуть бути також одержані у вигляді стерильних твердих композицій, які перед введенням можна розчинити або суспендувати в стерильній воді, фізіологічному розчині або в іншому середовищі для ін'єкцій. На додаток до введення з традиційними носіями активні інгредієнти можуть бути введені за допомогою ряду спеціалізованих способів доставки лікарських засобів, відомих фахівцям в даній області, таких як спосіб з використанням портативних інфузійних насосів. Триоксоланові композиції даного винаходу вводять разом з фармацевтично прийнятним носієм в кількості, достатній для запобігання малярійній інфекції і/або лікування активної інфекції. Триоксоланові сполуки даного винаходу навіть у високих дозах володіють гранично низькою токсичністю і низькою мірою побічних ефектів. Дозувальний інтервал для триоксоланових композицій залежить від ряду чинників, таких як мета їх застосування, а саме, профілактика або лікування активної інфекції, спосіб введення, дозувальний режим і інш. Як правило, терапевтична доза триоксолану може варіювати в інтервалі приблизно 0,1-1000мг/кг/день, переважно, приблизно 1-100мг/кг/день. Вищезгадані дози можна вводити у вигляді однократної дози, або вони можуть бути розділені для введення в декількох дозах. Триоксоланові композиції можна вводити від одного до декількох разів на день. Для профілактики малярії звичайний дозувальний режим може включати, наприклад, 2,0-1000мг/кг на тиждень, починаючи за 1-2 тижні до контакту з джерелом зараження і аж до 1-2 тижнів після контакту. Спіро- і диспіротриоксолани даного винаходу можуть бути введені у вигляді будь-якої фармацевтично ефективної сольової форми. Такі солі добре відомі в даній області і включають, не обмежуючись ними, солі ацетату, адипату, альгінату, цитрату, аспартату, бензоату, бензолсульфонату, бісульфату, бутирату, камфорату, камфорсульфонату, диглюконату, гліцерофосфату, гемісульфату, гептаноату, гексаноату, фумарату, гідрохлориду, гідроброміду, гідройодиду, 2-гідроксіетансульфонату (ізотіонату), лактату, малеату, метансульфонату, нікотинату, 2-нафталінсульфонату, оксалату, пальмітоату, пектинату, персульфату, 3-фенілпропіонату, пікрату, півалату, пропіонату, сукцинату, тартрату, тіоціанату, фосфату, глутамату, бікарбонату, п-толуолсульфонату і ундеканоату. Переважними солями є солі, що збільшують біодоступність триоксоланових сполук. Це буде залежати від ряду чинників, що включають хімічну стр уктур у триоксолану, носій, в який він включений, шлях введення і т.д. Було виявлено, що спіро- і диспіротриоксолани даного винаходу є ефективними при лікуванні шистосомозу. Шистосомоз займає друге місце після малярії по значущості в соціоекономічній сфері і в сфері охорони здоров'я в тропічних і субтропічних районах. Дане захворювання є ендемічним в 74 країнах, що розвиваються, вражаючи більше 200 мільйонів чоловік в сільських землеробських і примикаючих до міст районах. За оцінками, 500-600 мільйонів чоловік у всьому світі мають ризик заразитися даною хворобою. Основні види людського шистосомозу викликаються п'ятьма видами плоского черв'яка, що передаються через воду, або кров'яними глистами, які називають шистосомами. Одним із згаданих видів є Schistosoma mansoni, яка була виявлена в 53 країнах Африки, в Східному районі Середземного моря, в районі Карибського моря і в Південній Америці. Паразити проникають в організм при контакті з поверхнею інфікованої води в основному людей, зайнятих в сільському господарстві і рибальстві. Паразити звичайно інфікують хазяїна в формі церкарій, або на стадії личинки. Знаходячись всередині хазяїна, церкарія розвивається у дорослі особні, або шистосоми. У цей час лікування шистосомозу в основному сфокусоване на профілактиці, тобто запобіганні інфікуванню хазяїна церкаріями. Зараз лікарським засобом, що найбільш широко використовується для лікування шистосомозу є празиквантел. Хоч артеметер виявляє активність при профілактиці шистосомозу, не було показано, що він володіє активністю проти дорослих S. mansoni. Несподівано було виявлено, що спіро- і диспіротриоксолани даного винаходу є активними як проти церкарій, так і проти дорослих S. mansoni і S. japonicum при введенні відповідно до доз і способів, описаних вище в зв'язку з лікуванням малярії. Також вважають, що триоксолани даного винаходу є активними проти S. haematobium. Переважні сполуки, визначені для застосування для лікування шистосомозу включають OZ05, OZ11, OZ23, OZ25, OZ28, OZ32, OZ71, OZ78, OZ89, OZ90, OZ119, OZ145, OZ163, OZ179, OZ205, OZ207, OZ209, OZ219, OZ227 і OZ229. Найбільш переважними сполуками є OZ78, OZ163, OZ207 і OZ209. Переважні дозувальні рівні спіро- і диспіротриоксоланів при пероральному введенні становлять приблизно 100-200мг/кг/день. Дослідними зразками триоксоланів даного винаходу є OZ03 і OZ05. Спіро- і диспіротриоксолани даного винаходу також можуть бути е фективними при лікуванні раку. Як показано, сполуки, що включають ендопероксидний фрагмент, здатний взаємодіяти з гемом і залізом, володіють здатністю вбивати ракові клітини [див., наприклад, патент США №5578637, розкриття якого включене в даний опис як посилання]. Як відмічено в зв'язку з артемізиніном, механізм дії триоксоланів проти малярійних паразитів оснований на здатності триоксоланових сполук взаємодіяти із залізом вільних молекул гема малярійних паразитів з утворенням вільних радикалів, що приводять до руйнування клітини. Аналогічно, триоксолани володіють виборчою активністю проти ракових клітин внаслідок підвищеної концентрації рецепторів трансферту на мембранах ракових клітин, які поглинають залізо в більш високій мірі, ніж нормальні клітини. У присутності триоксоланів даного винаходу ракові клітини нагромаджують вільних радикалів у високих концентраціях, що приводить до загибелі клітини. Для лікування раку триоксолани даного винаходу можуть бути введені відповідно до доз і способів, описаних вище. У носій також можуть бути включені інші лікарські засоби, крім триоксолану, сумісні з інгредієнтами носія. Рядовий фахівець в даній області може легко визначити такі лікарські засоби і може включити, наприклад, антибіотики, інші протималярійні засоби, протизапальні засоби і інш. Потрібно розуміти, що даний винахід передбачає застосування не тільки самих вищезгаданих триоксоланових сполук, але і їх проліків, які внаслідок метаболізму перетворюються в дані сполуки, їх аналоги і біологічно активні сольові форми, а також оптичних ізомерів, що володіють такою ж фармацевтичною активністю. Нижченаведені приклади служать для ілюстрації, але не для обмеження винаходу. Таким чином, вони представлені з розумінням того, що можуть бути здійснені різні модифікації складу і способу доставки, які також будуть відповідати суті винаходу. Приклад 1 Загальна методика одержання 1,2,4-триоксоланів Синтез О-метилоксиму 2-адамантанону (типова методика). До розчину 2-адамантанону (4,51г, 30ммоль) в метанолі (30мл) додають піридин (4,5мл) і гідрохлорид метоксиламіну (3,76г, 45,0ммоль). Реакційну суміш перемішують при кімнатній температурі протягом 48 годин, концентрують у вакуумі і розбавляють СН 2Сl2 (50мл) і водою (50мл). Органічний шар відділяють і водний шар екстрагують СН 2Сl2 (30мл). Об'єднані органічні екстракти промивають 1М HCl (30мл´2) і насиченим водним розчином NaCl (30мл) і сушать над MgSO4. Упарюванням у вакуумі одержують О-метилоксим 2-адамантанону (4,77г, 89%) у вигляді безбарвної твердої речовини. Т.пл. 70-71°С; 1Н ЯМР (300МГц, CDCl3) d 1,60-2,10 (м, 12Н), 2,54 (с, Ш), 3,47 (с, Ш), 3,82 (с, 3Н). [Посилання: Corey, E.J.; Niimura, К.; Konishi, Y.; Hashimoto, S.; Hamada, Υ. Α New Synthetic Route to Prostaglandins. Tetrahedron Lett. 1986, 27, 2199-2202]. О-метилоксим циклогексанону. Вихід, 76%; безбарвне масло; 1Н ЯМР (300МГц, CDCl3) d 1,40-1,80 (м, 6Η), 2,20 (т, J=6,0Гц, 2H), 2,45 (т, J=6,1Гц, 2Н), 3,81 (с, 3Н). О-метилоксим циклододеканону. Вихід, 98%; безбарвне масло; 1Н ЯМР (500МГц, CDCl3) d 1,20-1,49 (м, 14Н), 1,50-1,60 (м, 2Н), 1,61-1,70 (м, 2Н), 2,22 (т, J=6,8Гц, 2Н), 2,35 (т, J=6,6Гц, 2Н), 3,81 (с, 3Н). О-метилоксим 3,3,5,5-тетраметилциклогексанону. Вихід, 91%; безбарвне масло; 1Н ЯМР (500МГц, CDCl3) d 0,96 (с, 6Н), 0,97 (с, 6Н), 1,33 (с, 2Н), 1,95 (с, 2Н), 2,20 (с, 2Н), 3,80 (с, 3Н). О-метилоксим 4-фенілциклогексанону. Вихід, 92%; безбарвна тверда речовина. Т.пл. 45-47°С; 1Н ЯМР (500МГц, CDCl3) d 1,57-1,76 (м, 2Н), 1,82-1,92 (м, 1Н), 1,99-2,13 (м, 2Н), 2,19-2,30 (м, 1Н), 2,47-2,56 (м, 1Н), 2,72-2,81 (м, 1Н), 3,32-3,42 (м, 1Н), 3,85 (с, 3Н), 7,17-7,34 (м, 5Н). О-метилоксим біцикло[3.3.1]нонан-9-ону. Вихід, 96%; безбарвне масло; 1Н ЯМР (500МГц, CDCl3) d 1,461,62 (м, 2Н), 1,72-2,11 (м, 10Н), 2,47 (уш.с, 1Н), 3,40 (уш.с, 1Н), 3,82 (с, 3Н). 1-(п-толуолсульфоніл)-4-піперидон. До розчину гідрохлориду моногідрату 4-піперидону (7,68г, 50ммоль) в метиленхлориді (50мл) додають послідовно п-толуолсульфонілхлорид (10,50г, 55,07ммоль) і триетиламін (21мл). Суміш перемішують при кімнатній температурі протягом 16 годин перед гасінням водою (100мл). Органічний шар промивають 1Μ НСl (100мл) і насиченим розчином солі (100мл) і сушать над сульфатом натрію. Упарюванням розчинника одержують цільовий кетон (8,60г, 68%) у вигляді безбарвної твердої речовини. Т.пл. 130-132°С; 1Н ЯМР (500МГц, CDCl3) d 2,40 (с, 3Н), 2,58 (т, J=6,4Гц, 4Н), 3,38 (т, J=6,4Гц, 4Н), 7,35 (д, J=7,8Гц, 2Н), 7,68 (д, J=8,3Гц, 2Н). 1-[3-(етоксикарбоніл)пропіоніл]-4-піперидон. До розчину гідрохлориду моногідрату 4-піперидону (7,68г, 50ммоль) і триетиламіну (21мл) в метиленхлориді (100мл) додають 3-(етоксикарбоніл)пропіонілхлорид (9,87г, 60ммоль) при 0°С протягом періоду, що дорівнює 10хв. Суміш перемішують при кімнатній температурі протягом 16 годин перед гасінням водою (100мл). Органічний шар відділяють і водний шар екстрагують метиленхлоридом (100мл). Об'єднані органічні шари промивають 1Μ НСl (100мл), насиченим водним розчином бікарбонату натрію (100мл) і насиченим розчином солі (100мл), сушать над сульфатом натрію і концентрують. Очищенням флеш-хроматографією (силікагель, 30% ефір в гексанах) одержують цільовий кетон (3,80г, 33%) у вигляді ясно-жовтого масла. 1Н ЯМР (500МГц, CDCl3) d 1,27 (т, J=7,3Гц, 3Н), 2,48 (т, J=6,4Гц, 2Н), 2,53 (т, J=6,4Гц, 2Н), 2,68 (с, 4Н), 3,82 (т, J=6,3Гц, 2Н), 3,82 (т, J=6,3Гц, 2Н), 4,16 (кв, J=7,3Гц, 2Н). 1,1-діоксотетрагідротіопіран-4-он. До розчину тетрагідротіопіран-4-ону (400мг, 3,45ммоль) в ацетонітрилі (5мл) додають водний розчин Na2EDTA (3мл, 0,0004Μ). Суміш оксону (6,30г, 10,30ммоль) і бікарбонату натрію (2,70г, 32ммоль) додають невеликими порціями до вищезгаданого розчину протягом періоду, що дорівнює 20хв. Суспензію перемішують протягом іншої 1 години перед гасінням метиленхлоридом. Органічний розчинник декантують і твердий залишок розтирають в етилацетаті (3´25мл). Об'єднані органічні шари сушать над сульфатом натрію і концентрують з одержанням цільового кетону (0,37г, 73%) у вигляді безбарвної твердої речовини. Т.пл. 170-172°С (літ. 168-170°С); 1Н ЯМР (500МГц, CDCl3) d 2,99 (т, J=6,8Гц, 4Н), 3,39 (т, J=6,8Гц, 4Н). [Посилання: Yang, D.; Yip, Y.-C; Jiao, G.-S.; Wong, M.-K. Design of Efficient Ketone Catalysts for Epoxidation by Using the Field Effect. J. Org. Chem, 1998, 63, 8952-8956]. Синтез 1-бензолсульфоніл-4-піперидону (типова методика). До розчину гідрохлориду моногідрату 4піперидону (4,59г, 30ммоль), триетиламіну (12,5мл, 90ммоль) в СН2Сl2 (50мл) додають бензолсульфонілхлорид (5,30г, 30ммоль). Суміш перемішують при 25°С протягом 16 годин. Після упарювання розчинників залишок розтирають у воді (100мл), фільтрують і далі очищають перекристалізацією з суміші гексани/СН 2Сl2 (3:1) з одержанням цільового кетону (5,97г, 83%) у вигляді безбарвної твердої речовини. Т.пл. 116-118°С; 1Н ЯМР (500МГц, CDCl3) d 2,54 (т, J=6,4Гц, 4Н), 3,41 (т, J=6,4Гц, 4Н), 7,58 (д, J=7,8Гц, 2Н), 7,63 (т, J=7,0Гц, 1Н), 7,81 (д, J=7,8Гц, 2Н). 1-(4-метоксибензолсульфоніл)-4-піперидон. Вихід, 77%; безбарвна тверда речовина. Т.пл. 130-132°С; 1 Н ЯМР (500МГц, CDCl3) d 2,56 (т, J=6,4Гц, 4Н), 3,38 (т, J=6,3Гц, 4Н), 3,95 (с, 3Н), 7,00 (д, J=8,2Гц, 2Н), 7,75 (д, J=8,2Гц, 2Н). 1-(4-хлорбензолсульфоніл)-4-піперидон. Вихід, 73%; безбарвна тверда речовина. Т.пл. 166-168°С; 1Н ЯМР (500МГц, CDCl3) d 2,55 (т, J=6,4Гц, 4Н), 3,41 (т, J=6,4Гц, 4H), 7,54 (д, J=8 ,3Гц, 2Н), 7,81 (д, J=8,4Гц, 2Н). 1-метансульфоніл-4-піперидон. До суспензії гідрохлориду моногідрату 4-піперидону (2,0г, 13ммоль) і К2СО3 (9,0г, 65,2ммоль) в ацетоні (40мл) додають метансульфонілхлорид (5,96г, 52,1ммоль) при 0-5°С. Суміш перемішують при 25°С протягом 24 годин. Тверду речовину видаляють фільтрацією і фільтрат концентрують досуха. Залишок очищають флеш-хроматографією (силікагель, 80% ефір в гексанах) з одержанням цільового кетону (1,20г, 52%) у вигляді безбарвної твердої речовини. Т.пл. 102-104°С; 1Н ЯМР (500МГц, CDCl3) d 2,58 (т, J=6,4Гц, 4Н), 2,90 (с, 3Н), 3,60 (т, J=6,4Гц, 4Н). Трифенілфосфоран етоксикарбонілметилену. До розчину трифенілфосфіну (26,20г, 100ммоль) в бензолі (150мл) додають етилбромацетат (16,70г, 100 ммоль) при 0-5°С. Суміш витримують при кімнатній температурі протягом 16 годин. Одержану фосфонієву сіль фільтр ують, промивають бензолом (100мл) і сушать. До розчину твердої речовини у воді (200мл) додають бензол (200мл) з подальшим доданням 10% розчину NaOH (100мл). Органічний шар відділяють і водний шар екстрагують бензолом (200мл). Об'єднані органічні шари промивають водою (100мл) і насиченим розчином солі (100мл), концентрують до 50мл у вакуумі і виливають в гексан (200мл). Преципітат фільтрують і сушать з одержанням цільового фосфорану (28,00г, 80%) у вигляді безбарвної твердої речовини. Т.пл. 128-130°С. Етиловий ефір 4-оксоциклогексиліденоцтової кислоти. До розчину 1,4-циклогександіону (5,00г, 44,64ммоль) в бензолі (100мл) додають ілід (15,55г, 44,68моль). Суміш нагрівають при кип'ятінні із зворотним холодильником протягом 12 годин. Після видалення розчинника упарюванням залишок очищають флеш-хроматографією (силікагель, 5% етилацетату в гексанах) з одержанням складного ефіру кетону (5,80г, 71%) у вигляді безбарвного масла. 1Н ЯМР (500МГц, CDCl3) d 1,26 (т, J=6,4Гц, 3Н), 2,42-2,50 (м, 4Н), 2,60-2,66 (м, 2Н), 3,12-3,20 (м, 2Н), 4,16 (кв, J=6,4Гц, 2Н), 5,86 (с, 1Н). Етиловий ефір 4-оксоциклогексаноцтової кислоти. До розчину ненасиченого складного ефіру (2,50г, 13,74ммоль) в етанолі (25мл) додають нікель Ренея (1,0г). Суміш перемішують при кімнатній температурі в атмосфері Н2 (балон) протягом 24 годин. Після видалення каталізатора фільтруванням фільтрат концентрують з одержанням складного ефіру спирту, який застосовують для окислення за Джонсом без подальшого очищення. До розчину вищезгаданого залишку в ацетоні (20мл) при 0°С додають реагент Джонса (6мл), одержаний розчиненням СrО3 (27,20г) в концентрованій сірчаній кислоті (25мл) і подальшим розбавленням розчину до 100мл водою. Реакційну суміш перемішують при 0°С протягом 2 годин перед гасінням ізопропанолом (3мл). Органічний розчинник видаляють у вакуумі і залишок розбавляють ефіром (100мл) і промивають водою (50мл) і насиченим розчином солі (50мл). Органічний шар сушать над MgSO4 і концентрують з одержанням складного ефіру кетону (1,80г, 71%) у вигляді безбарвного масла. 1Н ЯМР (500МГц, CDCl3) d 1,26 (т, J=6,4Гц, 3Н), 1,44-1,48 (м, 3Н), 2,08-2,10 (м, 2Н), 2,29-2,31 (д, J=8,3Гц, 2Н), 2,392,40 (м, 4Н), 4,18 (кв, J=6,4Гц, 2Н). 4-оксоциклогексанкарбонова кислота. Суміш етил-4-оксоциклогексанкарбоксилату (1,74г, 10ммоль), метанолу (25мл) і 17% водного КОН (5мл) нагрівають при 50°С протягом 1,5 годин. Після охолоджування до кімнатної температури реакційну суміш підкисляють до рН 3 концентрованою НСl, концентрують до 10мл при зниженому тиску і екстрагують хлороформом (3´15мл). Об'єднані органічні шари сушать над MgSO4, фільтрують і концентрують з одержанням цільової кетокислоти (1,30г, 91%) у вигляді безбарвної твердої речовини. Т.пл. 62-64°С; 1Н ЯМР (500МГц, CDCl3) d 2,05-2,10 (м, 2Н), 2,23-2,27 (м, 2Н), 2,35-2,41 (м, 2Н), 2,49-2,54 (м, 2Н), 2,80-2,84 (м, 1Н). Неопентил-4-оксоциклогексанкарбоксилат. До розчину 4-оксоциклогексанкарбонової кислоти (852мг, 6ммоль), трифенілфосфіну (1,59г, 6ммоль) і неопентилового спирту (635мг, 7,2ммоль) в сухому ТГФ (18мл) при 0°С по краплях додають розчин діетилазодикарбоксилату (0,96мл, 6мл) в сухому ТГФ (7,5мл). Реакційну суміш перемішують при кімнатній температурі протягом ночі перед гасінням за допомогою додання насиченого водного розчину NaHCO3 (50мл). Водну фазу відділяють і екстрагують СН 2Сl2 (2´30мл). Органічні екстракти об'єднують, сушать над MgSO4 і концентрують у вакуумі. Залишок розбавляють ефіром (10мл) і петролейним ефіром (20мл) і фільтрують для видалення оксиду трифенілфосфіну. Розчинник видаляють у вакуумі і залишок очищають хроматографією (20% ефір в петролейному ефірі) з одержанням цільового складного ефіру кетону (820мг, 65%) у вигляді безбарвного масла. 1Н ЯМР (500МГц, CDCl3) d 0,96 (с, 9Н), 2,04-2,07 (м, 2Н), 2,22-2,25 (м, 2Н), 2,34-2,40 (м, 2Н), 2,46-2,50 (м, 2Н), 2,80 (м, 1Н), 3,82 (с, 2Н). Кеталь 4-гідрокси-4-(4-фторфеніл)циклогексанонетилену. В круглодонну колбу об'ємом 500мл, забезпечену механічною мішалкою, холодильником і лійкою для додавання додають магнієві стружки (3,50г, 140ммоль) і достатньо ТГФ для покриття Mg. Розчин 1-бром-4-фторбензолу (12,45г, 70,43ммоль) в ТГФ (90мл) додають по краплях з такою швидкістю, щоб в реакційній суміші підтримувалося слабке кип'ятіння із зворотним холодильником з подальшою ініціацією реакції (ініціація може супроводжуватися нагріванням колби). Після кип'ятіння суміші із зворотним холодильником протягом додаткових 2,5 годин по краплях додають розчин кеталю 1,4-циклогександіонмоноетилену (10,00г, 64,03ммоль) в ТГФ (75мл). Суміш підтримують в стані кип'ятіння із зворотним холодильником в протягом додаткових 2 годин перед гасінням насиченим розчином хлориду амонію (7мл). Після видалення солей магнію фільтрацією фільтрат концентрують досуха. Осад розчиняють в СНСl3 і промивають водою й насиченим розчином солі. Органічний шар відділяють, сушать над MgSO4 і концентрують. Залишок очищають флеш-хроматографією (30% ефір в петролейному ефірі) з одержанням цільового спирту (13,50г, 87%) у вигляді безбарвної твердої речовини. Т.пл. 133-134°С. 1Н ЯМР (500МГц, CDCl3) d 1,69 (д, J=11,7Гц, 2Н), 1,79 (д, J=12,2Гц, 2Н), 2,052,18 (м, 4Н), 3,98 (м, 4Н), 7,02 (т, J=8,3, 2Н), 7,47-7,50 (м, 2Н). 4-гідрокси-4-(4-фторфеніл)циклогексанон. Суміш кеталю 4-гідрокси-4-(4фтор феніл)циклогексанонетилену (7,20г, 28,6ммоль), ТГФ (125мл) і 5% водної НСl (65мл) кип'ятять із зворотним холодильником протягом 14 годин. Реакційну суміш охолоджують до кімнатної температури, концентрують до 60 мл і екстрагують СН 2Сl2 (3´60мл). Об'єднані органічні шари сушать над MgSO4 і концентрують у вакуумі. Залишок очищають кристалізацією з гексанів з одержанням цільового спиртового кетону (5,30г, 89%) у вигляді безбарвної твердої речовини. Т.пл. 111-114°С (літ. 115-117°С). 1Н ЯМР (500МГц, CDCl3) d 2,17-2,20 (м, 2Н), 2,23-2,29 (м, 2Η), 2,32-2,37 (м, 2Н), 2,87-2,94 (м, 2Н), 7,04-7,07 (м, 2Н), 7,48-7,51 (м,2Н). 4-ацетокси-4-(4-фторфеніл)циклогексанон. До розчину 4-гідрокси-4-(4-фторфеніл)циклогексанону (520мг, 2,5ммоль), піридину (2мл) і 4-диметиламінопіридину (46мг) в СН2Сl2 (25мл) при 0°С по краплях додають розчин оцтового ангідриду (1мл) в СН2Сl2 (5мл). Суміш нагрівають до кімнатної температури і перемішують протягом 28 годин перед гасінням водою (30мл). Органічну фазу промивають 1М НСl (2´30мл) і насиченим розчином солі (30мл), сушать над MgSO4 і концентрують у вакуумі. Залишок очищають флешхроматографією (25% ефір в петролейному ефірі) з одержанням цільового кетону (510мг, 82%) у вигляді безбарвної твердої речовини. Т.пл. 113-115°С. 1Н ЯМР (500МГц, CDCl3) d 2,11 (с, 3Н), 2,20 (м, 2Н), 2,43 (м, 2Н), 2,68 (м, 2Н), 2,86 (м, 2Н), 7,05 (т, J=8,3, 2Н), 7,35-7,38 (м, 2Н).
ДивитисяДодаткова інформація
Назва патенту англійськоюSpiro or dispiro-1,2,4-trioxolane as antimalarial agents, pharmaceutical composition, method of production
Назва патенту російськоюПротивомалярийные соединения спиро- или диспиро-1,2,4-триоксолана, способ их получения, фармацевтическая композиция на их основе, способ ее получения
Автори російськоюVennerstrom, Jonathan, L., Dong, Yuxiang, Matile, Hugues, Charman, William, N.
МПК / Мітки
МПК: A61K 31/438, A61K 31/4196, A61P 33/06, C07D 493/10, A61K 31/5377, A61K 31/382, A61P 35/00, A61K 31/444, A61K 31/496, A61K 31/422, C07D 405/12, C07D 417/06, A61K 31/357, A61K 31/497, C07D 491/113, A61K 31/4035, A61P 33/12, C07D 323/00, C07D 417/12, C07D 405/14, A61K 31/427, C07D 413/10, C07D 495/10, A61K 31/4178, A61K 31/335, C07D 491/10, C07D 417/04, A61K 31/4709, C07D 405/06
Мітки: одержання, сполуки, фармацевтична, диспіро, спіро, 1,2,4-триоксолану, спосіб, основі, протималярійні, композиція
Код посилання
<a href="https://ua.patents.su/90-78709-protimalyarijjni-spoluki-spiro-i-dispiro-124-trioksolanu-sposib-kh-oderzhannya-farmacevtichna-kompoziciya-na-kh-osnovi-sposib-oderzhannya.html" target="_blank" rel="follow" title="База патентів України">Протималярійні сполуки спіро- і диспіро- 1,2,4-триоксолану, спосіб їх одержання, фармацевтична композиція на їх основі, спосіб її одержання</a>
Попередній патент: Заміщені нафтиліндольні похідні як інгібітори активатора плазміногена типу 1 (pai-1)
Наступний патент: Спосіб лікування пароксизмальної форми тріпотіння передсердь
Випадковий патент: Пристрій для вібраційної обробки деталей