Інгібітори гістон дезацетилази
Номер патенту: 77263
Опубліковано: 15.11.2006
Автори: ван Емелен Крістоф, Меерпоель Лівен, Дяткін Олексій Борисович, Вердонк Марк Густааф Селін, Анжибо Патрік Рене, ван Брандт Свен Францискус Анна
Формула / Реферат
1. Сполука формули (І),
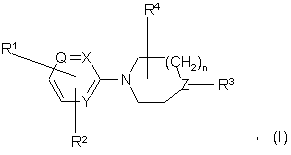
її N-оксидні форми, фармацевтичнo прийнятні солі приєднання та стереохімічно ізомерні форми, де
n дорівнює 0,1,2 або 3, і коли n дорівнює 0, тоді мають на увазі прямий зв'язок;
кожна Q являє собою азот або 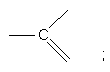
або кожна Х являє собою азот або 
кожна Y являє собою азот або 
кожна Z являє собою азот або 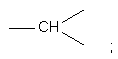
R1 являє собою –C(O)NR5R6, -N(H)C(O)R7, -С(O)-С1-6алкандіїлSR7, -NR8С(O)N(ОH)R7, -NR8C(O)С1-6aлкaндiiлSR7, -NR8C(O)C=N(OH)R7 або іншу Zn-хелатуючу групу, де R5 та R6, кожна незалежно, вибирається із водню, гідрокси, С1-6алкілу, гідроксіС1-6алкілу, аміноС1-6алкілу або аміноарилу;
R7 вибирається, незалежно, із водню, С1-6алкілу, С1-6алкілкарбонілу, арилС1-6алкілу, С1-6алкілпіразинілу, піридинону, піролідинону або метилімідазолілу;
R8 вибирається, незалежно, із водню або С1-6алкілу;
R2 являє собою водень, гало, гідрокси, аміно, нітро, С1-6алкіл, С1-6алкілокси, трифторометил, ді(С1-6алкіл)аміно, гідроксіаміно або нафталінілсульфонілпіразиніл;
R3 являє собою водень, С1-6алкіл, арилС1-6алкендіїл, фуранілкарбоніл, нафталінілкарбоніл, -С(O)фенілR9, С1-6алкіламінокарбоніл, аміносульфоніл, ариламіносульфоніл, аміносульфоніламіно, ді(С1-6алкіл)аміносульфоніламіно, ариламіносульфоніламіно,
аміносульфоніламіноС1-6алкіл, ді(С1-6алкіл)аміносульфоніламіноС1-6алкіл, ариламіносульфоніламіноС1-6алкіл, ді(С1-6алкіл)аміноС1-6алкіл, С1-12алкілсульфопіл, ді(С1-6алкіл)аміносульфоніл, тригалоС1-6алкілсульфоніл, ди(арил)С1-6алкілкарбоніл, тіофенілС1-6алкілкарбоніл, піридинілкарбоніл або арилС1-6алкілкарбоніл, де кожна R9 вибирається, незалежно, із фенілу; фенілу, заміщеного одним, двома або трьома замісниками, котрі вибираються, незалежно, із гало, аміно, С1-6алкілу, С1-6алкілокси, гідроксіС1-4алкілу, гідроксіС1-4алкілокси, аміноС1-4алкілокси, ді(С1-4алкіл)аміноС1-4алкілокси, ді(С1-6алкіл)аміноС1-6алкілу, ді(С1-6алкіл)аміноС1-6алкіл(С1-6алкіл)аміноС1-6алкілу, гідрокси С1-4алкілпіперазинілС1-4алкілу, С1-4алкілоксипіперидинілС1-4алкілу, гідроксіС1-4алкілоксиС1-4алкілпіперазинілу, С1-4алкілпіперазинілС1-4алкілу, ди(гідроксіС1-4алкіл)аміноС1-4алкілу, піролідинілС1-4алкілокси, морфолінілС1-4алкілокси, або морфолінілС1-4алкілу; тіофенілу або тіофенілу, заміщеного ді(С1-4алкіл)аміноС1-4алкілокси, ді(С1-6алкіл)аміноС1-6алкілом, ді(С1-6алкіл)аміноС1-6алкіл(С1-6алкіл)аміноС1-6алкілом, піролідинілС1-4алкілокси, С1-4алкілпіперазинілС1-4алкілом, ди(гідроксіС1-4алкіл)аміноС1-4алкілом або морфолінілС1-4алкілокси.
R4 являє собою водень, гідрокси, аміно, гідроксіС1-6алкіл, С1-6алкіл, С1-6алкілокси, арилС1-6алкіл, амінокарбоніл, гідроксикарбоніл, аміноС1-6алкіл, амінокарбонілС1-6алкіл, гідроксикарбонілС1-6алкіл, гідроксиамінокарбоніл, С1-6алкілоксикарбоніл, С1-6алкіламіноС1-6алкіл або ді(С1-6алкіл)аміноС1-6алкіл;
коли R3 та R4 присутні на тому самому вуглецевому атомі, R3 та R4 можуть утворювати, разом, бівалентний радикал формули
-C(O)-NH-CH2-NR10- (а-1),
де R10 являє собою водень або арил;
коли R3 та R4 присутні на суміжних вуглецевих атомах, R3 та R4 можуть утворювати, разом, бівалентний радикал формули
=СН-СН-СН-СН= (b-1);
вищезазначений арил являє собою феніл або феніл, заміщений одним або більшою кількістю замісників, кожен із яких вибирається, незалежно, із гало, С1-6алкілу, С1-6алкілокси, трифторометилу, ціано або гідроксикарбонілу.
2. Сполука за п. 1, яка відрізняється тим, що
R1 являє собою –С(O)NR5R6, -С(O)-С1-6алкандіїлSR7, -NR8С(O)N(ОH)R7, -NR8C(O)С1-6алкандіїлSR7, -NR8C(O)C=N(OH)R7 або іншу Zn-хелатуючу групу, де R5 та R6 кожна, незалежно, вибирається із водню, гідрокси, гідроксіС1-6алкілу або аміноС1-6алкілу;
R2 являє собою водень, гало, гідрокси, аміно, нітро, С1-6алкіл, С1-6алкілокси, трифторометил або ді(С1-6алкіл)аміно;
R3 являє собою водень, С1-6алкіл, арилС2-6алкендіїл, фуранілкарбоніл, нафталінілкарбоніл, -С(O)фенілR9, С1-6алкіламінокарбоніл, аміносульфоніл, ариламіносульфоніл, аміносульфоніламіно, ді(С1-6алкіл)аміносульфоніламіно, ді(С1-6алкіл)аміноС1-6алкіл, С1-12алкілсульфоніл, ді(С1-6алкіл)аміносульфоніл або піридинілкарбоніл, де кожна R9 вибирається, незалежно, із фенілу; фенілу, заміщеного одним, двома або трьома замісниками, котрі вибираються, незалежно, із гало, С1-6алкілу, С1-6алкілокси; або тіофенілу; та R4 являє собою водень, гідрокси, аміно, гідроксіС1-6алкіл, С1-6алкіл, С1-6алкілокси, арилС1-6алкіл, амінокарбоніл, аміноС1-6алкіл, С1-6алкіламіноС1-6алкіл або ді(С1-6алкіл)С1-6алкіл.
3. Сполука за п. 1, яка відрізняється тим, що n дорівнює 0 або 1; кожна Q є 
R1 являє собою -C(O)NH(OH) або -NНС(O)С1-6алкандіїлSH; R2 являє собою водень або нітро; R3 являє собою С1-6алкіл, арилС2-6алкендіїл, фуранілкарбоніл, нафталінілкарбоніл, С1-6алкіламінокарбоніл, аміносульфоніл, ді(С1-6алкіл)аміносульфоніламіноС1-6алкіл, ді(С1-6алкіл)аміноС1-6алкіл, С1-12алкілсульфоніл, ді(С1-6алкіл)аміносульфоніл, тригалоС1-6алкілсульфоніл, ди(арил)С1-6алкілкарбоніл, тіофенілС1-6алкілкарбоніл, піридинілкарбоніл або арилС1-6алкілкарбоніл; R4 являє собою водень; коли R3 та R4 присутні на тому самому вуглецевому атомі, R3 та R4 можуть утворювати, разом, бівалентний радикал формули (а-1), де R10 являє собою арил; або коли R3 та R4 присутні на суміжних вуглецевих атомах, R3 та R4 можуть утворювати, разом, бівалентний радикал формули (b-1).
4. Сполука за пп. 1 та 3, яка відрізняється тим, що n дорівнює 1; кожна Q є ; кожна Z являє собою азот; R1 являє собою -C(O)NH(OH); R являє собою водень; R являє собою нафталінілкарбоніл, С1-12алкілсульфоніл або ди(арил)С1-6алкілкарбоніл; та R4 являє собою водень.
; кожна Z являє собою азот; R1 являє собою -C(O)NH(OH); R являє собою водень; R являє собою нафталінілкарбоніл, С1-12алкілсульфоніл або ди(арил)С1-6алкілкарбоніл; та R4 являє собою водень.
5. Сполука за пп.1, 3 та 4, яка відрізняється тим, що вибирається із сполук за № 18, № 5 та № 24.
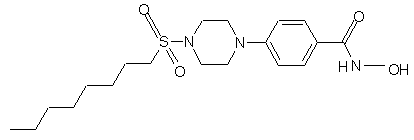
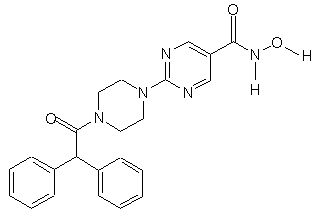
Сполука № 18
Сполука №5
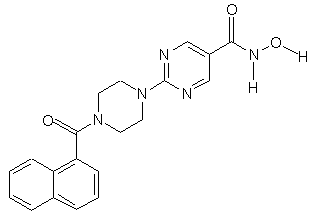
Сполука № 24
6. Фармацевтична композиція, що містить фармацевтично прийнятні носії та як активний інгредієнт терапевтично ефективну кількість сполуки за пп. 1-5.
7. Спосіб одержання фармацевтичної композиції за п.6, де фармацевтично прийнятні носії та сполуку за пп. 1-5 ретельно змішують.
8. Сполука за будь-яким із пп. 1-5 для застосування як ліків.
9. Застосування сполуки за будь-яким із пп. 1-5 для виробництва медикаментів для лікування проліферативних хвороб.
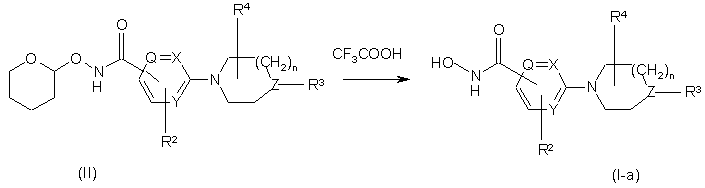
10. Спосіб одержання сполуки за п. 1, який відрізняється тим, що проміжну сполуку формули (II) піддають реакції з відповідною кислотою, такою як, наприклад, трифторооцтова кислота, з одержанням гідроксамової кислоти формули (1-а), де R1 являє собою -C(О)NH(OH)
11. Спосіб виявлення або ідентифікації HDAC у біологічній пробі, що включає виявлення або визначення утворення комплексу між міченою сполукою за п. 1 та HDAC.
12. Комбінація протиракового агента та інгібітора HDAC за будь-яким із пп. 1-5.
Текст
1. Сполука формули (І), ді(С1-6алкіл)аміноС1-6алкіл(С16алкілом, R4 піролідинілС1-4алкілокси, 6алкіл)аміноС1-6алкілом, С1-4алкілпіперазинілС1-4алкілом, ди(гідроксіС1R1 Q X (CH2)n або морфолінілС14алкіл)аміноС1-4алкілом N R3 Z 4алкілокси. Y R4 являє собою водень, гідрокси, аміно, гідроксіС1, (I) R2 6алкіл, С1-6алкіл, С1-6алкілокси, арилС1-6алкіл, амінокарбоніл, гідроксикарбоніл, аміноС1-6алкіл, аміїї N-оксидні форми, фармацевтичнo прийнятні солі нокарбонілС1-6алкіл, гідроксикарбонілС1-6алкіл, приєднання та стереохімічно ізомерні форми, де гідроксиамінокарбоніл, С1-6алкілоксикарбоніл, С1n дорівнює 0,1,2 або 3, і коли n дорівнює 0, тоді або ді(С1-6алкіл)аміноС1мають на увазі прямий зв'язок; 6алкіламіноС1-6алкіл 6алкіл; C кожна Q являє собою азот або коли R3 та R4 присутні на тому самому вуглецево; му атомі, R3 та R4 можуть утворювати, разом, бівалентний радикал формули C або кожна Х являє собою азот або ; -C(O)-NH-CH2-NR10- (а-1), де R10 являє собою водень або арил; C коли R3 та R4 присутні на суміжних вуглецевих кожна Y являє собою азот або ; атомах, R3 та R4 можуть утворювати, разом, бівалентний радикал формули CH кожна Z являє собою азот або =СН-СН-СН-СН= (b-1); ; вищезазначений арил являє собою феніл або феR1 являє собою –C(O)NR5R6, -N(H)C(O)R7, -С(O)7 8 7 8 ніл, заміщений одним або більшою кількістю заміС1-6алкандіїлSR , -NR С(O)N(ОH)R , -NR C(O)С1сників, кожен із яких вибирається, незалежно, із aлкaндiiлSR7, -NR8C(O)C=N(OH)R7 або іншу Zn6 гало, С1-6алкілу, С1-6алкілокси, трифторометилу, хелатуючу групу, де R5 та R6, кожна незалежно, ціано або гідроксикарбонілу. вибирається із водню, гідрокси, С1-6алкілу, гідрок2. Сполука за п. 1, яка відрізняється тим, що сіС1-6алкілу, аміноС1-6алкілу або аміноарилу; 7 R1 являє собою –С(O)NR5R6, -С(O)-С1R вибирається, незалежно, із водню, С1-6алкілу, 7 8 -NR С(O)N(ОH)R7, -NR8C(O)С16алкандіїлSR , С1-6алкілкарбонілу, арилС1-6алкілу, С17 8 7 6алкандіїлSR , -NR C(O)C=N(OH)R або іншу Znпіридинону, піролідинону або 6алкілпіразинілу, 5 6 хелатуючу групу, де R та R кожна, незалежно, метилімідазолілу; вибирається із водню, гідрокси, гідроксіС1-6алкілу R8 вибирається, незалежно, із водню або С1або аміноС1-6алкілу; 6алкілу; R2 являє собою водень, гало, гідрокси, аміно, нітR2 являє собою водень, гало, гідрокси, аміно, нітро, С1-6алкіл, С1-6алкілокси, трифторометил або ро, С1-6алкіл, С1-6алкілокси, трифторометил, ді(С1ді(С1-6алкіл)аміно; алкіл)аміно, гідроксіаміно або нафталінілсульфо6 R3 являє собою водень, С1-6алкіл, арилС2нілпіразиніл; 3 6алкендіїл, фуранілкарбоніл, нафталінілкарбоніл, R являє собою водень, С1-6алкіл, арилС1С(O)фенілR9, С1-6алкіламінокарбоніл, аміносуль6алкендіїл, фуранілкарбоніл, нафталінілкарбоніл, фоніл, ариламіносульфоніл, аміносульфоніламіно, С(O)фенілR9, С1-6алкіламінокарбоніл, аміносульді(С1-6алкіл)аміносульфоніламіно, ді(С1фоніл, ариламіносульфоніл, аміносульфоніламіно, 6алкіл)аміноС1-6алкіл, С1-12алкілсульфоніл, ді(С1ді(С1-6алкіл)аміносульфоніламіно, ариламіносуль6алкіл)аміносульфоніл або піридинілкарбоніл, де фоніламіно, кожна R9 вибирається, незалежно, із фенілу; феніаміносульфоніламіноС1-6алкіл, ді(С1лу, заміщеного одним, двома або трьома замісниариламіно6алкіл)аміносульфоніламіноС1-6алкіл, ками, котрі вибираються, незалежно, із гало, С1сульфоніламіноС1-6алкіл, ді(С1-6алкіл)аміноС14 6алкілу, С1-6алкілокси; або тіофенілу; та R являє С1-12алкілсульфопіл, ді(С16алкіл, собою водень, гідрокси, аміно, гідроксіС1-6алкіл, С16алкіл)аміносульфоніл, тригалоС1-6алкілсульфоніл, 6алкіл, С1-6алкілокси, арилС1-6алкіл, амінокарбоніл, ди(арил)С1-6алкілкарбоніл, тіофенілС1аміноС1-6алкіл, С1-6алкіламіноС1-6алкіл або ді(С1піридинілкарбоніл або арилС16алкілкарбоніл, 9 6алкіл)С1-6алкіл. 6алкілкарбоніл, де кожна R вибирається, незале3. Сполука за п. 1, яка відрізняється тим, що n жно, із фенілу; фенілу, заміщеного одним, двома або трьома замісниками, котрі вибираються, незаC дорівнює 0 або 1; кожна Q є лежно, із гало, аміно, С1-6алкілу, С1-6алкілокси, ; гідроксіС1-4алкілу, гідроксіС1-4алкілокси, аміноС1R1 являє собою -C(O)NH(OH) або -NНС(O)С14алкілокси, ді(С1-4алкіл)аміноС1-4алкілокси, ді(С12 3 6алкандіїлSH; R являє собою водень або нітро; R ді(С1-6алкіл)аміноС16алкіл)аміноС1-6алкілу, являє собою С1-6алкіл, арилС2-6алкендіїл, фуранігідрокси С16алкіл(С1-6алкіл)аміноС1-6алкілу, 5 77263 6 O лкарбоніл, нафталінілкарбоніл, С1O аміносульфоніл, ді(С16алкіламінокарбоніл, N N H ді(С16алкіл)аміносульфоніламіноС1-6алкіл, H N N 6алкіл)аміноС1-6алкіл, С1-12алкілсульфоніл, ді(С1N O 6алкіл)аміносульфоніл, тригалоС1-6алкілсульфоніл, ди(арил)С1-6алкілкарбоніл, тіофенілС1піридинілкарбоніл або арилС16алкілкарбоніл, 4 3 6алкілкарбоніл; R являє собою водень; коли R та 4 Сполука № 24 R присутні на тому самому вуглецевому атомі, R3 та R4 можуть утворювати, разом, бівалентний ра6. Фармацевтична композиція, що містить фармадикал формули (а-1), де R10 являє собою арил; цевтично прийнятні носії та як активний інгредієнт або коли R3 та R4 присутні на суміжних вуглецевих терапевтично ефективну кількість сполуки за пп. 1атомах, R3 та R4 можуть утворювати, разом, біва5. лентний радикал формули (b-1). 7. Спосіб одержання фармацевтичної композиції 4. Сполука за пп. 1 та 3, яка відрізняється тим, за п.6, де фармацевтично прийнятні носії та сполуку за пп. 1-5 ретельно змішують. C 8. Сполука за будь-яким із пп. 1-5 для застосуванщо n дорівнює 1; кожна Q є ; кожна Z ; ня як ліків. являє собою азот; R1 являє собою -C(O)NH(OH); R 9. Застосування сполуки за будь-яким із пп. 1-5 являє собою водень; R являє собою нафталінілкадля виробництва медикаментів для лікування прорбоніл, С1-12алкілсульфоніл або ди(арил)С1ліферативних хвороб. 4 6алкілкарбоніл; та R являє собою водень. 10. Спосіб одержання сполуки за п. 1, який відріз5. Сполука за пп.1, 3 та 4, яка відрізняється тим, няється тим, що проміжну сполуку формули (II) що вибирається із сполук за № 18, № 5 та № 24. піддають реакції з відповідною кислотою, такою як, O O наприклад, трифторооцтова кислота, з одержанS N N ням гідроксамової кислоти формули (1-а), де R1 HN OH O являє собою -C(О)NH(OH) R4 O O Сполука № 18 O N X N H N O R2 H (II) CF3COOH (CH2)n N Y O R4 O Q Z R3 HO N H Q X (CH2)n N Z R3 Y R2 (I-a) Сполука №5 11. Спосіб виявлення або ідентифікації HDAC у біологічній пробі, що включає виявлення або визначення утворення комплексу між міченою сполукою за п. 1 та HDAC. 12. Комбінація протиракового агента та інгібітора HDAC за будь-яким із пп. 1-5. Даний винахід стосується сполук, що мають) ферментну активність, інгібуючу пістон дезацетилазну (HDAC). Крім того, він стосується способів одержання цих сполук, композицій, що містять ці сполуки, так само як і їх застосування, як in vitro, так і in vivo, для інгібування HDAC та як ліків, наприклад, як ліків для інгібування проліферативних станів, таких як рак та псоріаз. В усіх еукаріотних клітинах геномна ДНК у хроматині зв'язується з гістонами з утворенням нуклеосом. Кожна нуклеосома складається із білкового октамеру, що утворений з двох копій кожного гістону Н2А, Н2В, Н3 та Н4. ДНК, обвивається навколо цього білкового ядра, і основні амінокислоти зазначених гістонів взаємодіють з негативно зарядженими фосфатними групами даної ДНК. Найбільш загальною посттрансляційною модифікацією цих ядерних гістонів є оборотне адетилювання ε-аміногруп консервативних, високоосновних Ν-термінальних лізинових залишків. Стаціонарний стан гістонного ацетилювання встановлюється шляхом досягнення динамічної рівно ваги між конкуруючими гістон ацетилтрансферазою (ами) та гістон дезацетилазою (ами), на яку у даному тексті робиться посилання як на "HDAC". Гістонне ацетилювання та дезацетилювання давно пов'язується з транскрипційним контролем. Нещодавнє клонування генів, що кодують різні гістон ацетилтрансферази та гістон дезацетилази дало можливе пояснення щодо зв'язку між гістонним ацетилюванням та транскрипційним контролем. Зазначене оборотне ацетилювання гістонів може спричинити хроматинове ремоделювання, і як таке воно діє як контрольний механізм для транскрипції генів. Загалом, гіперацетилювання гістонів полегшує експресію генів, тоді як гістонне дезацетилювання корелює з транскрипційною репресією. Було показано, що гістон ацетилтрансферази діють як транскрипційні коактиватори, тоді як гістон дезацетилази, як було встановлено, пов'язані зі шляхами транскрипційної репресії. Динамічна рівновага між гістонним ацетилюванням та дезацетилювадням є суттєвою для нормального росту клітин. Інгібування гістон дезаце N O N H N 7 77263 8 тилази призводить до затримки клітинного циклу, форм, де клітинної диференціації, апоптозу та зміни трансn дорівнює 0, 1, 2 або 3, і коли n дорівнює 0, формованого фенотипу. Тому інгібітори HDAC тоді мається на думці прямий зв'язок; можуть мати високий терапевтичний потенціал у кожна Q являє собою азот або лікуванні хвороб або станів, пов'язаних з проліферацією клітин [Marks et al., Nature Reviews: Cancer кожна X являє собою азот або 1: 194-202, 2001]. Дослідження інгібіторів гістон дезацетилаз (HDAC) вказує, що ці ферменти дійсно відіграють кожна Υ являє собою азот або важливу роль у проліферації та диференціації клітин. Інгібітор трихостатин A (Trichostatin A) кожна Ζ являє собою азот або (TSA) зумовлює затримку клітинного циклу як у G1, R1 являє собою -C(O)NR5R6, -N(H)C(O)R7, так і у G2 фазах, змінює трансформований феноC(O)-C1-6aлкaндiiлSR7, -NR8C(O)N(OH)R7, тип різних клітинних ліній, індукує диференціацію 8 7 NR C(O)C1-6aлкaндiiлSR , -NR8C(O)ON(OH)R7 або лейкозних клітин Френда (Friend) та інших. Як поіншу Zn-хелатуючу групу, де R5 та R6 кожна, незавідомлялось, ТSA (та субсроїланілід і гідроксимова лежно, вибирається із водню, гідрокси, С1-6алкілу, кислота SAНA) інгібують ріст клітин, індукують тегідрокси C1-6алкілу, аміно C1-6алкілу або амінормінальну диференціацію та запобігають утворенарилу; ню пухлин у мишей [Finnin et al., Nature, 401: 188R7 вибирається, незалежно, із водню, C1193, 1999]. алкілу, C1-6алкілкарбонілу, арилC1-6алкілу, C16 Трихостатин А, як також повідомлялось, є копіридинону, піролідинону або 6алкілпіразинілу, рисним у лікуванні фіброзу, наприклад, фіброзу метилімідазолілу; печінки, та цирозу печінки [Geerts et al., European R8 вибирається, незалежно, із водню або C1Patent Application EP 0827742, published 11 March, 6алкілу; 1998]. R2 являє собою водень, гало, гідрокси, аміно, [Патентна заявка WO 01/383222 від 31 травня нітро, C1-6алкіл, C1-6алкілокси, трифторометил, 2001 року] розкриває, окрім іншого, інгібітори гісди(C1-6алкіл)аміно, гідроксиаміно або нафталінілтон дезацетилази загальної формули Cy-L1-Ar-Y1сульфонілпіразиніл; C(O)-NH-Z, композиції та способи лікування хвоR3 являє собою водень, C1-6алкіл, арилC1роб та станів, пов'язаних з проліферацією клітин. алкендііл, фуранілкарбоніл, нафталінілкарбоніл, 6 [Патентна заявка WO 01/70675 від 27 вересня C(O)фeнiлR9, C1-6алкіламінокарбоніл, аміносуль2001 року] розкриває інгібітори гістон дезацетила1 3 фоніл, ариламіносульфоніл, аміносульфоніламіно, зи формул Cy-X-Y -W та Cy-S(O)2-NH-Y -W і зади(C1-6алкіл)аміносульфоніламіно, ариламіносупроваджує також композиції та способи лікування льфоніламіно, аміносульфоніламіноC1-6алкіл, хвороб та станів, пов'язаних з проліферацією кліди(C1-6алкіл)аміносульфоніламіноC1-6алкіл, аритин. ламіносуліфоніламіно C1-6алкіл, ди(C1Проблема, яка має бути розв'язана, полягає у 6алкіл)амігоC1-6алкіл, C1-12алкілсульфоніл, ди(C1тому, щоб запровадити інгібітори гістон дезацети6алкіл)аміносульфоніл, тригалоC1-6алкілсульфоніл, лази з високою ферментною активністю, котрі види(арил)C1-6алкілкарбоніл, тіофенілC1являють поліпшені властивості, такі як клітинна піридинілкарбоніл або арилС16алкілкарбоніл, активність та підвищена біодоступність, краще, 9 6алкілкарбоніл, де кожна R вибирається, незалеоральна біодоступність, та мають незначні або жно, із фенілу; фенілу, заміщеного одним, двома зовсім не мають побічних ефектів. або трьома замісниками, котрі вибираються, незаНові сполуки даного винаходу розв'язують вилежно, із гало, аміно, С1-6алкілу, С1-6алкілокси, щезазначені проблеми. Ці сполуки відрізняються гідроксиС1-4алкілу, гідроксиС1-4алкілокси, аміноС1від сполук попереднього доробку за своєю струк4алкілокси, ди(С1-4алкіл)аміноС1-4алкілокси, ди(С1турою. ди(С1-6алкіл)аміноС16алкіл)аміноС1-6алкілу, Сполуки даного винаходу виявляють чудову in гідроксиС16алкіл(С1-6алкіл)аміноС1-6алкілу, vitro гістон дезацетилазну інгібуючу ферментну С14алкілпіперазинілС1-4алкілу, активність. Зазначені сполуки мають поліпшені гідроксиС14алкілоксипіперидинілС1-4алкілу, властивості щодо клітинної активності та специфіС14алкілоксиС1-4алкілпіперазинілу, чні властивості щодо інгібування розвитку клітинди(гідроксиС14алкілпіперазинілС1-4алкілу, ного циклу як у G1, так і G2 контрольних точках піролідинілС1-4алкілокси, 4алкіл)аміноС1-4алкілу, (р21 індукційна здатність). Сполуки даного винаморфолінілС1-4алкілокси, або морфолінілС1ходу виявляють добру метаболічну стійкість та 4алкілу; тіофенілу; або тіофенілу, заміщеного високу біодоступність, і більш конкретно, вони види(С1-6алкіл)аміноС1-4алкілокси, ди(С1являють оральну біодоступність. ди(С1-6алкіл)аміноС16алкіл)аміноС1-6алкілом, Даний винахід стосується сполук формули (l) піролідинілС16алкіл(С1-6алкіл)аміноС1-6алкілом, С1-4алкілтперазинілС1-4алкілом, 4алкілокси, ди(гідроксиС1-4алкіл)аміноС1-4алкілом або морфо(I) лінілС1-4алкілокси. R4 являє собою водень, гідрокси, аміно, гідроксиС1-6алкіл, С1-6алкіл, С1-6алкілокси, арилС16алкіл, амінокарбоніл, гідроксикарбоніл, аміноС1Їх N-оксидних форм, фармацевтично прийнят6алкіл, амінокарбонілС1-6алкіл, гідроксикарбонілС1них солей приєднання та стереохімічно ізомерних 9 77263 10 алкіл, гідроксиамінокарбоніл, С1солі приєднання. Фармацевтично прийнятні кислі 6 С1-6алкіламіноС1-6алкіл або солі приєднання, як згадувались вище, включають, 6алкілоксикарбоніл, ди(С1-6алкіл)аміноС1-6алкіл; як мається на думці, терапевтично активні нетокколи R3 та R4 присутні на тому самому вуглесичні кислі форми солей приєднання, котрі здатні цевому атомі, R3 та R4 можуть утворювати, разом, утворювати сполуки формули (І). Сполуки формубівалентний радикал формули ли (І), котрі мають основні властивості, можуть -C(O)-NH-CH2-NR10- (а-1), перетворюватись у свої фармацевтично прийнятніде R10 являє собою водень або арил; кислі солі приєднання обробкою зазначеної основколи R3 та R4 присутні на суміжних вуглецевих ної форми відповідною кислотою. Відповідні кисатомах, R3 та R4 можуть утворювати, разом, бівалоти включають, наприклад, неорганічні кислоти, лентний радикал формули такі як галоїдоводневі кислоти, наприклад, хлорис=СН-СН=СН-СН= (b-1); товоднева або бромистоводнева кислота; сірчана; вищезазначений арил являє собою феніл, або азотна; фосфорна і подібні кислоти; або органічні феніл, заміщений одним або більшою кількістю кислоти, такі як, наприклад, оцтова, трифторооцзамісників, кожен із яких вибирається, незалежно, това, пропанова, гідроксиоцтова, молочна, піровиіз гало, С1-6алкілу, С1-6алкілокси, трифторометилу, ноградна, щавлева, малонова, бурштинова (тобто ціано або гідроксикарбонілу. бутандикислота), малеїнова, фумарова, яблучна, Вираз "гістон дезацетилазний інгібітор" або "інвинна, лимонна, метансульфонова, етансульфогібітор гістон дезацетилази" застосовується для нова, бензолсульфонова, р-толуолсульфонова, ідентифікації сполуки, котра здатна взаємодіяти з цикламінова, " саліцилова, р-аміносаліцилова, гістон дезацетилазою та інгібувати її активність, памова і подібні кислоти. більш конкретно, її ферментну активність. ІнгібуСполуки формули (І), щo мають кислотні власвання ферментної активності гістон дезацетилази тивості, можуть перетворюватись у свої фармацеозначає зниження здатності гістон дезацетилази втично прийнятні основні солі приєднання обробвилучати ацетильну групу із гістону. Краще, коли кою зазначеної кислотної форми придатною таке інгібування є специфічним, тобто інгібітор органічною або неорганічною основами. Відповідні гістон дезацетилази знижує здатність гістон дезаосновні сольові форми включають, наприклад, цетилази вилучати ацетильну групу із гістону при амонієві солі, солі лужних та лужноземельних меконцентрації, що є нижчою, ніж концентрація інгібіталів, наприклад, солі літію, натрію, калію, магнію, тора, котра потрібна для продукування деякого кальцію і таке подібне, солі з органічними основаіншого, неспорідненого біологічного ефекту. ми, наприклад, бензатинові, N-метил-DЯк застосовується у попередніх визначеннях глюкамінові, гідрабамінові солі та солі з амінокистак і у подальшому, вираз гало є родовим до фтолотами, такими як, наприклад, аргінін, лізин і таке ро, хлоро, бромо та йодо; С1-4алкіл визначає насиподібне. чені вуглеводневі радикали з прямими або розгаВираз "кисла або основна сіль приєднання" луженими ланцюгами, що мають від 1 до 4 включає також гідратні та сольватні форми приєдвуглецевих атомів, такі як, наприклад, метил, етил, нання, котрі здатні утворювати сполуки формули пропіл, бутил, 1-метилетил, 2-метилпропіл і таке (І). Прикладами таких форм є, наприклад, гідрати, подібне; С1-6алкілвключає С1-4алкіл та його вищі алкоголяти і таке подібне. гомологи, що мають від 5 до 6 вуглецевих атомів, Вираз "стереохімічно ізомерні форми сполук такі як, наприклад, пентил, 2-метилбутил, гексил, формули (І)", як застосовується у даному тексті, 2-метилпентил і такс подібне; С1-6алкандііл визнавизначає всі можливі сполуки, що складаються із чає бівалентні насичені вуглеводневі радикали з однакових атомів, котрі зв'язані тією самою посліпрямими та розгалуженими ланцюгами, що мають довністю зв'язків, але мають відмінні тривимірні від 1 до 6 вуглецевих атомів, такі як, наприклад, структури, що не є рівнозначними, які можуть мати метилен, 1,2-етандііл, 1,3-пропандііл, 1,4сполуки формули (І). Якщо окремо не зазначено бутандііл, 1,5-пентандііл, 1,6-гександііл, та їх розабо не вказано, хімічне позначення сполук відповігалужені ізомери, такі як 2-мгилпентандііл, 3дає суміші всіх можливих стереохімічно ізомерних метилпентандііл, 2,2-диметилбутандііл, 2,3форм, які можуть мати зазначені сполуки. Зазнадиметилбутандііл і таке подібне; тригалоС1-6алкіл чена суміш може містити усі діастереомери та/або визначає С1-6алкіл, що містить три ідентичних або енантіомери базової молекулярної структури зарізних гало замісників, наприклад, трифторометил; значеної сполуки. Як мається на думці, всі стереоС2-6алкендііл визначає бівалентні вуглеводневі хімічно ізомерні форми сполук формули (І), як у радикали з прямими та розгалуженими ланцюгачистій формі, так і у суміші одна з одною, входять ми, що містять один подвійний зв'язок та мають від до обсягу даного винаходу. 2 до 6 вуглецевих атомів, такі як, наприклад, етенN-оксидні форми сполук формули (І), як мадііл, 2-пропендііл, 3-бутендііл, 2-пентендііл, 3ється на думці, включають ті сполуки формули (І), пентендііл, 3-метил-2-бутендііл і таке подібне; і де один або кілька атомів азоту є окисненими до аміноарил визначає арил, заміщений аміно. так званого N-оксиду, зокрема, ті N-оксиди, де Вираз "інша Zn-хелатуюча група" стосується один або більше піперидинових, піперазинових групи, котра здатна взаємодіяти з Zn-іоном, що або піридазинілових азотів є N-окисненими. може бути присутнім на ферментному зв'язувальДеякі зі сполук формули (І) можуть також існуному сайті. вати у своїй таутомерій формі. Хоча такі форми й Фармацевтично прийнятні солі приєднання не вказані у явному вигляді у вищенаведених фоохоплюють фармацевтично прийнятні кислі солі рмулах, вони також включені, як мається на думці, приєднання та фармацевтично прийнятні основні в обсяг даного винаходу. 11 77263 12 Як мається на думці, вираз "сполуки формули тих сполук формули (І), щодо яких застосовуються (І)" при його застосуванні у подальшому викладі одне або більше із наступних обмежень: включає всі фармацевтично прийнятні солі приєдa) R1 являє собою -C(O)NR5R6, -С(О)нання та всі стереоізомерні форми. Сі.6алкандіілSR7, -NR8C(O)N(OH)R7, -NRsC(O)C17 8 7 Як застосовується у даному тексті, вирази "гіс6aлкaндiiлSR , -NR C(O)C=N(OH)R або іншу Zn5 6 тон дезацетилаза" та "HDAC", як мається на думці, хелатуючу групу, де R та R кожна, незалежно, стосуються будь-якого представника сімейства вибирається із водню, гідрокси, гідроксиС1-6алкілу ферментів, котрий вилучає ацетильні групи із εабо аміноС1-6алкілу; аміногруп лізинових залишків у N-кінці гістону. Якb) R2 являє собою водень, гало, гідрокси, аміщо окремо не зазначено у контексті, вираз "гістон", но, нітро, С1-6алкіл, С1-6алкілокси, трифторометил як мається на думці, стосується будь-якого гістонабо ди(С1-6алкіл)аміно; ного білка, включаючи НІ, Н2А, Н2В, Н3, Н4 та Н5, c) R3 являє собою водень, С1-6алкіл, арилС2від будь-якого виду. HDAC білки людини або генні алкендііл, фуранілкарбоніл, нафталінілкарбоніл, 6 продукти включають, проте не обмежуючись цим, С(О)фенілR9, С1-6алкіламінокарбоніл, аміносульHDAC-1, HDAC-2, HDAC-3, HDAC-4, HDAC-5, фоніл, ариламіносульфоніл, аміносульфоніламіно, HDAC-6, HDAC-7, HDAC-8, HDAC-9 та HDAC-10. ди(С1-6алкіл)аміносульфоніламіно, ди(С1Гістон дезацетилаза може бути також одержана із 6алкіл)аміноС1-6алкіл, С1-6алкілсульфоніл, ди(С1протозойного або грибкового джерел. 6алкіл)аміносульфоніл або піридинілкарбоніл, де Перша група інтересних сполук складається із кожна R9 вибирається, незалежно, із фенілу; фенітих сполук формули (І), щодо яких застосовуються лу, заміщеного одним, двома або трьома замісниодне або більше із наступних обмежень: ками, котрі вибираються, незалежно, із гало, С1a) n дорівнює 0 або 1; 6алкілу, С1-6алкілокси; або тіофенілу; d) R4 являє собою водень, гідрокси, аміно, гідb) кожна Q являє собою роксиС1-6алкіл, С1-6алкіл, С1-6алкілокси, арилС1амінокарбоніл, аміноС1-6алкіл, С16алкіл, c) R1 являє собою -C(O)NH(OH) або або ди(С1-6алкіл)аміноС16алкіламіноС1-6алкіл NHС(О)С1-6алкандіілSH; 6алкіл. d) R2 являє собою водень або нітро; Група сполук, яким віддається перевага, склаe) R3 являє собою С1-6алкіл, арилС2-6алкендііл, дається із тих сполук формули (І), де -R1 являє фуранілкарбоніл, нафталінілкарбоніл, С1собою -C(O)NR5R6, -С(О)-С1-6алкандіілSR7, аміносульфоніл, ди(С16алкіламінокарбоніл, NR8C(O)N(OH)R7, -NR8C(O)C1-6алкандіілSR7, ди(С16алкіл)аміносульфоніламіноС1-6алкіл, 8 7 NR C(O)C=N(OH)R або іншу Zn-хелатуючу групу, алкіл)аміноС1-6алкіл, С1-12алкілсульфоніл, ди(С16 5 6 де R та R кожна, незалежно, вибирається із вод6алкіл)аміносульфоніл, тригалоС1-6алкілсульфоніл, ню, гідрокси, гідроксиС1-6алкілу або аміноС1ди(арил)С1-6алкілкарбоніл, тіофенілС16алкілу; піридинілкарбоніл або арилС16алкілкарбоніл, R2 являє собою водень, гало, гідрокси, аміно, 6алкілкарбоніл; 4 нітро, С1-6алкіл, С1-6алкілокси, трифторометил або f) R являє собою водень; ди(С1-6алкіл)аміно; g) коли R3 та R4 присутні на тому самому вугR3 являє собою водень, С1-6алкіл, арилС1лецевому атомі, R3 та R4 можуть утворювати, ра10 алкендііл, фуранілкарбоніл, нафталінілкарбоніл, 6 зом, бівалентний радикал формули (а-1), де R C(O)фенілR9, С1-6алкіламінокарбоніл, аміносульявляє собою арил; 3 4 фоніл, ариламіносульфоніл, аміносульфоніламіно, h) коли R та R присутні на суміжних вуглеце3 4 ди(С1-6алкіл)аміносульфоніламіно, ди(С1вих атомах, R та R можуть утворювати, разом, 6алкіл)аміноС1-6алкіл, С1-6алкілсульфоніл, ди(С1бівалентний радикал формули (b-1). 6алкіл)аміносульфоніл або піридинілкарбоніл, де Друга група інтересних сполук складається із кожна R9 вибирається, незалежно, із фенілу; фенітих сполук формули (І), щодо яких застосовуються лу, заміщеного одним, двома або трьома замісниодне або більше із наступних обмежень: ками, котрі вибираються, незалежно, із гало, С1a) n дорівнює 1; 6алкілу, С1-6алкілокси; або тіофенілу; та b) кожна Q являє собою R4 являє собою водень, гідрокси, аміно, гідроксиС1-6алкіл, С1-6алкіл, С1-6алкілокси, арилС1c) кожна Ζ являє собою азот; амінокарбоніл, аміноС1-6алкіл, С11 6алкіл, d) R являє собою -C(O)NH(OH); або ди(С1-6алкіл)аміноС12 6алкіламіноС1-6алкіл e) R являє собою водень; 6алкіл. f) R3 являє собою нафталінілкарбоніл, С1Ще одна група сполук, яким віддається пере12 алкілсульфоніл або ди(арил)С1-6алкілкарбоніл; вага, складається із тих сполук формули (І), де n g) R являє собою водень. Третя група інтересних сполук складається із дорівнює 0 або 1; кожна Q є R1 являє сотих сполук формули (І), де R2 являє собою водень. бою -C(O)NH(OH) або -NHC(O)C1-6алкандіілSН; R2 Четверта група інтересних сполук складається 3 1 являє собою водень або нітро; R являє собою С1із тих сполук формули (І), де R являє собою алкіл, арилС1-6алкендііл, фуранілкарбоніл, наф6 C(O)NH(OH). талінілкарбоніл, С1-6алкіламінокарбоніл, аміносуП'ята група інтересних сполук складається із льфоніл, ди(С1-6алкіл)аміносульфоніламіноС1тих сполук формули (І), де R2 являє собою водень, 1 ди(С1-6алкіл)аміноС1-6алкіл, С16алкіл, і R являє собою -C(O)NH(OH). ди(С1-6алкіл)аміносульфоніл, 12алкілсульфоніл, Шоста група інтересних сполук складається із тригалоС1-6алкілсульфоніл, ди(арил)С1 13 77263 14 алкілкарбоиіл, тіофенілС1-6алкілкарбоніл, піридигідрокси-1H-бензотріазол (НОВТ). Дана реакція 6 нілкарбоніл або арилС1-6балкілкарбоніл; R4 являє може проводитись у придатному розчиннику, тасобою водень; коли R3 та R4 присутні на тому сакому як суміш DCM та THF. мому вуглецевому атомі, R3 та R4 можуть утворювати, разом, бівалентний радикал формули (а-1), 10 3 4 де R являє собою арил; або коли R та R прису3 тні на суміжних вуглецевих атомах, R та R4 можуть утворювати, разом, бівалентний радикал формули (b-1). Група сполук, яким віддається більша перевага, складається із тих сполук формули (І), де n c) проміжні сполуки формули (III) можуть бути дорівнює 1; кожна Q є кожна Ζ являє собою одержані шляхом реакції проміжної сполуки формули (V) з відповідною основою, такою як NaOH, у азот; R1 являє собою -C(O)NH(OH); R2 являє соприсутності придатного розчинника, такого як етабою водень; R3 являє собою нафталінілкарбоніл, нол. С1-12алкілсульфоніл або ди(арил)С1алкілкарбоніл; та R4 являє собою водень. 6 Сполуки, яким віддається найбільша перевага, є сполуками за номерами №18, №5 та №24. O O S N N HN O OH Сполука № 18 O N N O N O H H N N Сполука №5 O N N O N N O H H N Сполука № 24 Сполуки формули (І) та їх фармацевтично прийнятні солі і N-оксиди, та їх стереохімічно ізомерні форми можуть бути одержані у звичайний спосіб. Загальна схема синтезу охоплює, наприклад: а) Гідроксамові кислоти формули (І), де R1 являє собою C(О)NH(ОН), на зазначені сполуки робиться посилання як на сполуки формули (1-а), можуть бути одержані шляхом реакції проміжної сполуки формули (II) з відповідною кислотою, такою як, наприклад, трифторооцтова кислота. Зазначена реакція проводиться у відповідному розчиннику, такому як, наприклад, метанол. b) проміжні сполуки формули (II) можуть бути одержані шляхом реакції проміжної сполуки формули (III) з проміжною сполукою формули (IV) у присутності відповідних реагентів, таких як N’(етилкарбонімідоїл)-N,N-диметил-1,3пропандіамін, моногідрохлорид (EDC) та 1 Сполуки формули (І) можуть бути також зручно одержані з використанням способу твердофазового синтезу. Загалом, твердофазовий синтез включає реакцію проміжної сполуки у сполученні з полімерним носієм. Ця проміжна сполука на полімерному носії може потім використовуватись у ряді стадій синтезу. Після кожної стадії багаторазове фільтрування смоли та її промивання з використанням різних розчинників очищає її від забруднень та домішок. На кожній стадії дану смолу можна розділяти для проведення реакцій з різними проміжними сполуками на наступній стадії, що дозволяє синтезувати велику кількість сполук. Після останньої стадії даної процедури зазначену смолу обробляють реактивом для відщеплення від зразка. Більш детальне пояснення способів, що застосовуються у твердофазовій хімії, подане у таких працях як, наприклад, "The Combinatprial Index" (В. Bunin, Academic Press) та Novabiochem's 1999 Catalogue & Peptide Synthesis Handbook (Novabiochem AG, Switzerland), на які у даному тексті робиться посилання. Сполуки формули (І) та деякі проміжні сполуки можуть мати принаймні один стереогенний центр у своїй структурі. Цей стереогенний центр може бути присутній у R або S конфігурації. Сполуки формули (І), що отримані у процесах, описаних вище, являють собою, загалом, рацемічні суміші енантіомерів, котрі можуть бути відділені один від одного за допомогою відомих у даній галузі процедур розділення. Рацемічні сполуки формули (І) можуть бути перетворені у відповідні діастереомерні сольові форми шляхом реакції з придатною хіральною кислотою. Зазначені діастереомерні сольові форми потім розділяють, наприклад, за допомогою селективної або фракційної кристалізації, і енантіомери вивільнюють звідти лугом. Альтернативний метод розділення енантіомерних форм сполук формули (І) включає рідинну хроматографію з використанням хіральної стаціонарної фази. Зазначені чисті стереохімічно ізомерні форми можуть бути також одержані із відповідних чистих стереохімічно ізомерних форм відповідних вихідних матеріалів за умови, що дана реакція носить стереоспецифічний характер. Якщо потрібен специфічний стереоізомер, то зазначена 15 77263 16 сполука може бути синтезована за допомогою станів, таких як виразковий коліт, хвороба Крона, стереоспецифічних способів одержання, чому відалергічний риніт, реакція "трансплантат проти хадається перевага. У цих методах вигідно викорисзяїна", кон'юнктивіт, астма, респіраторний дистрестовувати енантіомерно чисті вихідні матеріали. синдром у дорослих (ARDS), хвороба Бехчета, Сполуки формули (І), їх фармацевтично привідторгнення трансплантата, кропив'янка, алергічйнятні кислі солі приєднання та стереоізомерні ний дерматит, гніздова алопеція, склеродермія, форми мають цінні фармакологічні властивості, екзантема, екзема, дерматоміозит, акне, діабет, котрі полягають у тому, що вони мають інгібіторсистемний червоний вовчак, хвороба Кавасакі, ний ефект щодо гістон дезацетилази (HDAC). множинний склероз, емфізема, кістозний фіброз та Даний винахід запроваджує спосіб інгібування хронічний бронхіт; аномального росту клітин, включаючи трансфоре) лікування сидометріозу, фіброми матки, димовані клітини, шляхом застосування ефективної сфункціональної маткової кровотечі та ендометрікількості сполуки даного винаходу. Аномальний альної гіперплазії; ріст клітин стосується росту клітин, незалежного f) лікування очної васкуляризації, включаючи від нормальних регуляторних механізмів (наприваскулопатію, що вражає ретинальні та хоріодаклад, втрата контактного інгібування). Це включає льні судини; інгібування росту пухлин як прямим шляхом, шляg) лікування серцевої дисфункції; хом зупинки росту, термінальної диференціації h) інгібування імуносупресивних станів, таких та/або апоптозу ракових клітин, так і непрямим як лікування ВІЛ інфекцій; шляхом, інгібуванням реваскуляризації пухлин. і) лікування ниркової дисфункції; Даний винахід також запроваджує спосіб інгіj) приглушення ендокринних розладів; бування росту пухлин шляхом призначення ефекk) інгібування дисфункції глюконеогенезу; тивної кількості сполуки даного винаходу суб'єкту, l) лікування невропатології, наприклад, хворонаприклад, ссавцю (і більш конкретно, людині), що би Паркінсона або невропатології, що призводить потребує такого лікування. Зокрема, даний винахід до розладу пізнавальної системи, наприклад, хвозапроваджує спосіб інгібування росту пухлин шляроби Альцгеймера, або нейронних хвороб, пов'яхом застосування ефективної кількості сполук дазаних з поліглютаміном; ного винаходу. Приклади пухлин, що можуть бути m) інгібування нервово-м'язових патологій, напіддані інгібуванню, включають, але не обмежуприклад, бічного аміотрофічного склерозу; ються цим, рак легень (наприклад, аденокарциноn) лікування спінальної м'язової атрофії; ма та недрібноклітинний рак легень), панкреатичні о) лікування інших патологічних станів, що форми раку (наприклад, карцинома підшлункової піддаються лікуванню шляхом підсилення експрезалози, така як, наприклад, екзокринна панкреатисії гена; чна карцинома), рак товстої кишки (наприклад, р) підсилення генної терапії. колоректальні карциноми, такі як, наприклад, адеТаким чином, даний винахід розкриває сполунокарцинома товстої кишки та аденома товстої ки формули (І) для застосування як ліків, так само кишки), рак передміхурової залози, включаючи як і застосування даних сполук для виробництва застарілу хворобу, ісмопостичні пухлини лімфоїдліків для лікування одного або більшої кількості із ного походження (наприклад, гострий лімфоцитаперелічених вище станів та захворювань. рний лейкоз, В-клітинна лімфома, лімфома БеркіСполуки формули (І), їх фармацевтично прита), мієлоїдні лейкози (наприклад, гострий йнятні кислі солі приєднання та стереоізомери і мієлобластний лейкоз (AML)), тиреоїдноформи можуть мати цінні діагностичні властивості, фолікулярний рак, мієлодиспластичний синдром які полягають у тому, що вони можуть використо(MDS), пухлини мезенхімального походження (навуватись для виявлення або ідентифікації HDAC у приклад, фібросаркоми та рабдоміосаркоми), мебіологічній пробі, що включає виявлення або виміланоми, тератокарциноми, нейробластоми, гліоми, рювання утворення комплексу між міченою сполудоброякісні пухлини шкіри (наприклад, кератоакакою та HDAC. нтоми), карцинома молочної залози (наприклад, У способах виявлення або ідентифікації мозадавнений рак молочної залози), рак нирок, рак жуть використовуватись сполуки, котрі мічені агеняєчника, рак січового міхура та епідермоїдний рак. тами мічення, такими як радіоактивні ізотопи, феСполука згідно з даним винаходом може викорменти, флюоресцентні речовини, світні речовини ристовуватись для інших терапевтичних цілей, і т.д. Приклади радіоактивних ізотопів включають 125 наприклад: І, 131І, 3Η та 14С. Ферменти звичайно роблять a) сенсибілізація пухлин щодо променевої тевиявлюваними шляхом спряження з відповідним рапії шляхом застосування сполуки згідно з даним носієм, котрий, у свою чергу, каталізує виявлювану винаходом до, підчас або після опромінення даної реакцію. Прикладами таких ферментів є бетапухлини для лікування раку; галактозидаза, бета-глюкозидаза, лужна фосфаb) лікування артропатій та остеопатологічних таза, пероксидаза та малатдегідрогеназа, краще, станів, таких як ревматоїдний артрит, остеоартрит, пероксидаза хрону. Світні речовини включають, ювенільний артрит, подагра, поліартрит, псоріатинаприклад, люмінол, похідні люмінолу, люцифечний артрит, анкілозивний спондиліт та системний рин, екворин та люциферазу. червоний вовчак; Біологічні проби можуть вивчатись як тілесні c) інгібування проліферації клітин гладкої мустканини або тілесні води. Прикладами вод органікулатури, включаючи васкулярні проліферативні зму є цереброспінальна рідина, кров, плазма, сирозлади, атеросклероз та рестеноз; роватка, сеча, слина і таке подібне. d) лікування запальних станів та дермальних Завдяки своїм корисним фармаколологічним 17 77263 18 властивостям, розглядувані сполуки можуть бути таке подібне, та кратні їм сегреговані порції. використані для складання різних фармацевтичФахівці у даній галузі можуть легко визначити них форм, призначених для уживання. ефективну кількість за результатами тестів, що Для приготування фармацевтичних композицій подані в тексті. Загалом, вважають, що ефективна даного винаходу ефективну кількість даної сполукількість складає від 0,05мг/кг до 100мг/кг ваги ки у формі основної або кислої солі приєднання, як тіла, і зокрема, від 0,05мг/кг до 10мг/кг ваги тіла. У активний інгредієнт, поєднують у вигляді тонкої деяких випадках доцільно потрібну дозу розділяти суміші з фармацевтично прийнятним носієм, котна дві, три, чотири або більше субдоз і вживати рий може приймати широкий різновид форм, у через відповідні інтервали часу протягом доби. залежності від форми препарату, потрібної для Зазначені субдози можуть бути складені як стануживання. Ці фармацевтичні композиції бажано дартні дозові форми, що містять, наприклад, від 5 мати в унітарній дозовій формі, що придатна, крадо 500мг, і, зокрема, від 10 до 500мг активного ще, для перорального, ректального, черезшкірного інгредієнта на стандартну дозову форму. застосування або у вигляді парентеральних ін'єкЯк інший аспект даного винаходу, передбачацій. Наприклад, при приготуванні композицій у фоється комбінація HDAC-інгібітора з іншим протирармі пероральних доз може використовуватись ковим агентом, особливо для використання як лібудь-яке зі звичайних фармацевтичних середоків, зокрема, для лікування раку або споріднених вищ, таких як, наприклад, вода, гліколі, олії, спирхвороб. ти і таке подібне, у випадку пероральних рідких Для лікування вищезазначених станів сполуки препаратів, таких як суспензії, сиропи, еліксири та даного винаходу можуть бути з вигодою застосорозчини; або тверді носії, такі як крохмалі, цукри, вані у комбінації з одним або більшою кількістю каолін, мастила, зв'язувальні речовини, дезінтегінших медичних препаратів, більш конкретно, з ратори і таке подібне у випадку порошків, пілюль, іншими протираковими агентами. Прикладами капсул та таблеток. протиракових.агентів є: Завдяки легкості уживання, таблетки та капсу- координаційні сполуки платини, наприклад, ли являють собою найбільш придатні стандартні цисплатин, карбоплатин або оксаліплатин; таксадозові форми для перорального застосування, і в нові сполуки, наприклад, паклітаксел або доцетакцьому випадку використовуються, очевидно, тверсел; ді фармацевтичні носії. Для парентеральних ком- топоізомеразні інгібітори (топоізомерази І), позицій носій звичайно включає стерильну воду, такі як камптотекінові сполуки, наприклад, ірінотепринаймні, у більшій своїй частині, хоча можуть кан або топотекан; бути включені й інші інгредієнти, наприклад, для - топоізомеразні інгібітори (топоізомерази II), поліпшення розчинності. Для ін'єкцій можуть бути, такі як протипухлинні подофілотоксинові похідні, наприклад, виготовлені розчини, в яких носій наприклад, етопозид або тенипозид; включає сольовий розчин, розчин глюкози або - протипухлинні барвінкові алкалоїди, наприсуміш сольового розчину та розчину глюкози. Моклад, вінбластин, вінкристин або вінорелбін; жуть бути також виготовлені суспензії для ін'єкцій, і - протипухлинні нуклеозидні похідні, наприв цьому разі можуть використовуватись відповідні клад, 5-флюороурацил, гемцитабін або капецитарідкі носії, агенти для суспендування і таке подіббін; не. У композиціях, що придатні для черезшкірного - азотно-гірчичні або нітрозосечовинні алкілууведення, носій включає, при потребі, агент, котвальні агенти, наприклад, циклофосфамід, хлорарий сприяє проникненню, та/або придатний змочумбуцил, кармустин або ломустин; вальний агент, що можуть бути, при потребі, ском- протипухлинні антрациклінові похідні, наприбіновані з придатними добавками будь-якої клад, даунорубіцин, доксорубіцин, ідарубіцин або природи у незначних пропорціях, добавками, котрі мітоксантрон; не чинять значної шкідливої дії на шкіру. Зазначені - HER2 антитіла, наприклад, трастузумаб; добавки можуть полегшувати нанесення на шкіру - антагоністи естрогенних рецепторів або сета/або можуть бути корисними при виготовленні лективні модулятори естрогенних рецепторів, напотрібних композицій. Ці композиції можуть застоприклад, тамоксифен, тореміфен, дролоксифен, совуватись у різні способи, наприклад, як трансфаслодекс або ралоксифен; дермальні петчі, як бляшки або як мазь. - інгібітори ароматази, такі як екземестан, анаОсоблива перевага віддається складанню вистрозол, летразол та ворозол; щезазначених фармацевтичних композицій у ста- агенти диференціювання, такі як ретиноїди, ндартній дозовій формі для легкості уживання та вітамін D та агенти, що блокують метаболізм реоднорідності дозування. Стандартна дозова фортиноєвої кислоти (RAMBA), наприклад, акутан; ма в даній специфікації та формулі винаходу сто- інгібітори ДНК метилтрансферази, наприсується фізично дискретних одиниці, як уніфіковаклад, азацитидін; них дозових форм, кожна одиниця містить - інгібітори кінази, наприклад, флавоперидол, попередньо визначену кількість активного інгредііматиніб мезилат або гефитиніб; єнта, що розрахована на отримання бажаного те- інгібітори фарнезилтрансферази; або рапевтичного ефекту, сумісно з потрібним фарма- інші HDAC інгібітори. цевтичним носієм. Прикладами таких стандартних Вираз "координаційна сполука платини" застодозових форм слугують таблетки (включаючи шосовується у даному тексті для позначення будьрсткі таблетки або таблетки з покриттям), капсули, якої координаційної сполуки платини, що інгібує пілюлі, порошкові упаковки, облатки, розчини або ріст пухлинних клітин, котра постачає платину у суспензії для ін'єкцій, чайні ложки, столові ложки і формі іонів. 19 77263 20 Вираз "таксанові сполуки" вказує на клас спопозаклітинним доменом HER 2 рецептора. лук, що мають систему таксанового кільця і стосуБагато видів раку молочної залози мають естються або одержані із екстрактів деревини дерев рогенні рецептори, і ріст цих пухлин може стимувиду тисових (Taxus). люватись естрогеном. Вирази "антагоністи естроВираз "топоізомеразні інгібітори" використовугенних рецепторів" та "селективні модулятори ється для позначення ферментів, що здатні змінюестрогенних рецепторів" використовуються для вати топологію ДНК в еукаріотних клітинах. Вони визначення конкуруючих інгібіторів зв'язування мають критичне значення для важливих клітинних естрадіолу з естрогенним рецептором (ER). Селефункцій та проліферації клітин. Є два класи топоіктивні - модулятори естрогенних рецепторів, коли зомераз в еукаріотних клітинах, а саме, типу І та вони зв'язані з даним ER, індукують зміни у тривитипу II. Топоізомераза І являє собою мономерний мірній конфігурації даного рецептора, що інгібує фермент з приблизною молекулярною вагою його зв'язування з чутливим до естрогену елемен100000. Даний фермент зв'язується з ДНК і запротом (ERE) на ДНК. ваджує тимчасовий розрив одиничної нитки, розкУ жінок у постклімактеричному періоді головручує подвійну спіраль (або дозволяє розкрутити ним джерелом циркулюючого естрогену є перетїї) і потім знову замикає даний розрив перед віддіворення наднирковозалозних та оваріальних андленням від нитки ДНК. Топоізомераза II має схорогенів (андростендіону та тестостерону) в жий механізм дії, котрий включає індукування розестрогени (естрон та естрадіол) ароматазним феривів ниток ДНК або утворення вільних радикалів. рментом у периферичних тканинах. Депривація Вираз "камптотекінові сполуки" використовуестрогену через інгібування або інактивацію ароється для позначення сполук, що стосуються або матази є ефективним та селективним лікуванням одержані із материнської камптотекінової сполуки, для деяких постклімактеричних пацієнтів із залежкотра являє собою нерозчинний у воді алкалоїд, ним від гормону раком молочної залози. одержаний із деревини китайського дерева Вираз "антиестрогенний агент" використовуCamptothecin acuminata або деревини індійського ється у даному тексті для позначення не лише дерева Nothapodytes foetida. антагоністів естрогенних рецепторів та селективВираз "подофілотоксинові сполуки" викорисних модуляторів естрогенних рецепторів, а й для товується для позначення сполук, що стосуються позначення інгібіторів ароматази, як це розглянуто або одержані із материнського подофілотоксину, вище. котрий екстрагують із мандрагори. Вираз "агенти диференціювання" охоплює Вираз "протипухлинні барвінкові алкалоїди" сполуки, що можуть, різними шляхами, інгібувати використовується для позначення сполук, що стопроліферацію клітин та індукувати диференціацію. суються або одержані із екстрактів барвінку (Vinca Відомо, що вітамін D та ретиноїди відіграють голоrosea). вну роль у регулюванні росту та диференціації Вираз "алкілувальні агенти" охоплює різні груширокого різновиду нормальних та злоякісних типи хімічних речовин, загальною рисою яких є те, пів клітин. Агенти, що блокують метаболізм ретищо вони мають здатність вносити, за фізіологічних ноєвої кислоти (RAMBA's), підвищують рівні ендоумов, алкільні групи у біологічно життєві макромогенних ретиноєвих кислот шляхом інгібування лекули, такі як ДНК. У випадку більшості найбільш опосередкованого цитохромом Р450 катаболізму важливих агентів, таких як азотні гірчиці та нітроретиноєвих кислот. зосечовини, активні алкілувальні частинки генеруЗміни у ДНК метилуванні є одними із самих ються in vivo після складних розщеплювальних звичайних аномалій у неоплазії у людини. Гіперреакцій, деякі з яких є ферментними. Найбільш метилування у промоторах вибраних генів звичайважливими фармакологічними діями зазначених но асоціюється з інактивацією залучених генів. алкілувальних агентів є такі, що порушують фунВираз "інгібітори ДНК метилтрансферази" застодаментальні механізми, котрі стосуються проліфесовується для позначення сполук, що діють через рації клітин, зокрема синтезу ДНК, та поділу кліфармакологічне інгібування ДНК метилтрансфератин. Здатність алкілувальних агентів порушувати зи та реактивацію експресії генів пухлинного супфункцію та цілісність ДНК у швидко проліферуюресора. чих тканинах запроваджує основу для їх терапевВираз "інгібітори кінази" включає активні інгібітичного застосування та їх багатьох токсичних тори кіназ, що задіяні у. розвитку клітинного циклу властивостей. та запрограмованому некрозі клітин (апоптозі). Вираз "протипухлинні антрациклінові похідні" Вираз "інгібітори фарнезилтрансферази" виковключає антибіотики, що одержані із грибка Strep. ристовується для позначення сполук, що були Peuticus var. caesius, та їх похідні, котрі характерирозроблені для запобігання фарнезилації Ras та зуються наявністю тетрациклінової кільцевої струінших внутрішньоклітинних білків. Було показано, ктури з незвичайним цукром, донозаміном, що що вони впливають на проліферацію та виживанприєднаний глікозидним зв'язком. ня злоякісних пухлин. Ампліфікація білка рецептора 2 фактору епіВираз "інші HDAC інгібітори" включає, але не дермального росту людини (HER 2) при первинних обмежується цим, наступні сполуки: карциномах молочної залози корелює, як було - жирні кислоти з короткими ланцюгами, напоказано, з несприятливим клінічним прогнозом приклад, бутират, 4-фенілбутират або валпроєва для деяких пацієнтів. Трастузумаб є олюдненим кислота; моноклональним IgG1 капа антитілом високої очи- гідроксамові кислоти, наприклад, субероїластки, одержаним із рекомбінантної ДНК, що зв'язунілід гідроксамова кислота (SAHA), біарилгідрокється з високою спорідненістю та специфічністю з самат А-161906, біциклічні арил-N 21 77263 22 гідроксикарбоксаміди, піроксамід, CG-1521, PXDрема, паклітаксел у дозі приблизно 175-250мг/м2 і 101, сульфонамідгідроксамова кислота, LAQ-824, доцетаксел у дозі приблизно 75-150мг/м2 на курс трихостатин A (TSA), оксамфлатин, скриптед, mлікування. карбоксицинамова кислота, бісгідроксамова кисКампотекінова сполука використовується, пелота або аналог трапоксин-гідроксамової кислоти; реважно, у дозі 0,1-400мг на квадратний метр 2 2 - циклічні тетрапептиди, наприклад, трапоксин, (мг/м ) площі поверхні тіла, наприклад, 1-300мг/м , апідицин або депсипептид; зокрема, ірінотекан у дозі приблизно 100-350мг/м2 - бензаміди, наприклад, MS-275 або СІ-994, і топотекан у дозі приблизно 1-2мг/м2 на курс лікуабо вання. - депудецин. Протипухлинна подофілотоксинова похідна Для лікування раку сполуки згідно з даним вивикористовується, переважно, у дозі 30-300мг на находом можуть бути призначені пацієнту, як виквадратний метр (мг/м2) площі поверхні тіла, назначено вище, у сполученні з опромінюванням. приклад, 50-250мг/м2, зокрема, етопозид у дозі Опромінення означає застосування іонізуючого приблизно 35-100мг/м2 і тенипозид у дозі приблизвипромінювання, і зокрема, гаммано 50-250мг/м2 на курс лікування. випромінювання, особливо того, що емітується Протипухлинний барвінковий алкалоїд виколінійними прискорювачами або радіоізотопами, ристовується, переважно, у дозі 2-30мг на квадракотрі звичайно використовуються у теперішній час. тний метр (мг/м2) площі поверхні тіла, зокрема, Опромінення пухлини радіоізотопами може бути вінбластин у дозі приблизно 3-12мг/м2, вінкристин зовнішнім або внутрішнім. у дозі приблизно 1-2мг/м2 і вінорелбін у дозі прибДаний винахід також стосується комбінації згілизно 10-30мг/м2 на курс лікування. дно з даним винаходом протиракового агента та Протипухлинна нуклеозидна похідна викорисінгібітора HDAC згідно з даним винаходом. товується, переважно, у дозі 200-2500мг на квадДаний винахід також стосується комбінації згіратний метр (мг/м2) площі поверхні тіла, напридно з даним винаходом для застосування у фарклад, 700-1500мг/м2, зокрема, 5-FU у дозі 200макотерапії, наприклад, для інгібування росту пух500мг/м2, гемцитабін у дозі приблизно 800линних клітин. 1200мг/м2 і капецитабін у дозі приблизної000Даний винахід також стосується способу інгі2500мг/м2 на курс лікування. бування росту пухлинних клітин у людського суАлкілувальні агенти, такі як азотно-гірчичні або б'єкта, котрий включає призначення даному сунітрозосечовинні, використовуються, переважно, у б'єкту ефективної кількості комбінації згідно з дозі 100-500мг на квадратний метр (мг/м2) площі даним винаходом. поверхні тіла, наприклад, 120-200мг/м2, зокрема, 2 Даний винахід також запроваджує спосіб інгіциклофосфамід у дозі приблизно 100-500мг/м , бування аномального росту клітин, включаючи хлорамбуцил у дозі приблизно 0,1-0,2мг/кг, кармутрансформовані клітини, шляхом застосування стин у дозі приблизно 150-200мг/м2 і ломустин у ефективної кількості комбінації згідно з даним дозі приблизно 100-150мг/м2 на курс лікування. .винаходом. Протипухлинні антрациклінові похідні викорисІнший лікарський засіб та інгібітор HDAC мотовуються, переважно, у дозі 10-75мг на квадратжуть застосовуватись одночасно (наприклад, в ний метр (мг/м2) площі поверхні тіла, наприклад, окремих або єдиних композиціях) або послідовно у 15-60мг/м2, зокрема, доксорубіцин у дозі приблизбудь-якому порядку. В останньому випадку зазнано 40-75мг/м2, даунорубіцин у дозі приблизно 25чені дві сполуки будуть застосовуватись протягом 45мг/м2 і ідарубіцин у дозі приблизно 10-15мг/м2 на такого періоду і у такій кількості, та у такий спосіб, курс лікування. котрі достатні для гарантії того, що досягається Трастузумаб використовується, переважно, у сприятливий або синергічний ефект. Зрозуміло, дозі 1-5мг на квадратний метр (мг/м2) площі повещо спосіб, якому віддається перевага, порядок рхні тіла, зокрема, 2-4мг/м2 на курс лікування. застосування, відповідні дозові кількості та схеми Антиестрогенний агент застосовується, передля кожного компонента даної комбінації будуть важно, у дозі приблизно 1-100мг на добу, у залежзалежати від конкретного іншого лікарського засоності від конкретного агента та стану, що піддаєтьбу та інгібітора HDAC, що застосовуються, способу ся лікуванню. Тамоксифен використовується, їх застосування, виду пухлини, котра піддається переважно, перорально у дозі 5-50мг, краще, 10лікуванню, та конкретного хазяїна, що проходить 20мг два рази на добу, терапію продовжують прокурс лікування. Оптимальний спосіб та порядок тягом достатнього часу для досягнення та підтризастосування, дозові кількості та схема можуть мки терапевтичного ефекту. Тореміфен застособути легко визначені фахівцями у даній галузі з вується, переважно, перорально у дозі приблизно використанням звичайних способів і з урахуванням 60мг один раз на добу, терапію продовжують проподаної в даному тексті інформації. тягом достатнього часу для досягнення та підтриКоординаційна сполука платини застосовуєтьмки терапевтичного ефекту. Анастрозол застосося, переважно, у дозі 1-500мг на квадратний метр вується, переважно, перорально у дозі приблизно 2 (мг/м ) площі поверхні тіла, наприклад, 501мг один раз на добу. Дролоксифен застосовуєть400мг/м2, зокрема, цисплатин у дозі приблизно ся, переважно, перорально у дозі приблизно 2075мг/м2 і карбоплатин у дозі приблизно 300мг/м2 100мг один раз на добу. Ралоксифен застосовуна курс лікування. ється, переважно, перорально у дозі приблизно Таксанова сполука використовується, перева60мг один раз на добу. Екземестан використовужно, у дозі 50-400мг на квадратний метр (мг/м2) ється, переважно, перорально у дозі приблизно площі поверхні тіла, наприклад, 75-250мг/м2, зок25мг один раз на добу. 23 77263 24 Зазначені дози можуть призначатись, наприклад, одноразово, двічі або більше разів на курс лікування, котрий може повторюватись, наприклад, кожні 7, 14, 21 або 28 діб. З урахуванням своїх корисних фармакологічних властивостей компоненти комбінацій згідно з даним винаходом, тобто інший лікарський засіб та інгібітор HDAC, можуть використовуватись для складання різних фармацевтичних форм, признаРозчин 1-(фенілметил)-піперазину (0,068моль) чених для уживання. Зазначені компоненти мов ацетонітрилі аналітичної чистоти (135мл) додажуть застосовуватись окремо в індивідуальних вали поступово до розчину карбонату калію фармацевтичних композиціях або в унітарній ' фа(0,18моль) та 2-(метилсульфоніл)-5рмацевтичній композиції, котра містить обидва піримідинкарбонової кислоти, етилового ефіру зазначені компоненти. (0,082моль), в ацетонітрилі аналітичної чистоти Тому даний винахід також стосується фарма(135мл), і дану реакційну суміш перемішували цевтичної композиції, що включає інший лікарсьпротягом 45 хвилин при кімнатній температурі. кий засіб та інгібітор HDAC сумісно з одним або Потім дану реакційну суміш витримували протягом більшою кількістю фармацевтичних носіїв. ночі. Додавали DCM (400мл), Додавали воду Даний винахід також стосується комбінації згі(300мл), і органічний шар відокремлювали, осушудно з даним винаходом у формі фармацевтичної вали (MgSO4), фільтрували, і розчинник випарюкомпозиції, що містить протираковий агент та інгівали. Залишок (28г) очищали методом колонкової бітор HDAC згідно з даним винаходом сумісно з хроматографії на силікагелі (елюент: DCM/MeOH одним або більшою кількістю фармацевтичних 95/5). Чисті фракції збирали, і розчинник випарюносіїв. вали. Залишок піддавали кристалізації із ацетонітДаний винахід також стосується використання рилу, відфільтровували та висушували у вакуумі, з комбінації згідно з даним винаходом у виробництві виходом 15,1г проміжної сполуки 1. фармацевтичної композиції для інгібування росту b) Одержання пухлинних-клітин. Даний винахід також стосується продукту, що містить як перший активний інгредієнт інгібітор HDAC згідно з даним винаходом і як другий активний інгредієнт протираковий агент, як комбінований препарат для одночасного, окремого або послідовного використання при лікуванні пацієнтів, що Суміш проміжної сполуки 1 (0,03моль) в ЕtOН потерпають від раку. (250мл) піддавали гідруванню при 50°С з викорисЕкспериментальна частина танням Pd/C 10% (2г) як каталізатора. Після погНаступні приклади запроваджені для ілюлинання H2 (1 еквівал.) даний каталізатор відфільстрації. тровували, і фільтрат випарювали. Залишок Під "BSA" мається на думці бичачий сироваточищали методом колонкової хроматографії на ковий альбумін, під "DCM" мається на думці дихсилікагелі (елюент: DCM/MeOH/NH3 90/10). Дані лорометан, під "DIEA" мається на думці діізопропіпродуктові фракції збирали, і розчинник випарюлетиламін, під "DMSO" мається на думці вали, з виходом 6,8г (>96%) проміжної сполуки 2. диметилсульфокcид, під "EtOAс" мається на думці c) Одержання етилацетат, під "Fmoc" мається на думці флуоренілметоксикарбоніл, під "Hepes" мається на думці 4-(-2-гідроксиетил)-1-піперазин-етансульфонова кислота, під "НОВТ" мається на думці 1-гідрокси1Н-бензотріазол, під "МеОН" мається на думці метанол, під "РуВор" мається на думці бензотріазол-1-іл-окси-тріс-піролідино-фосфоній гексафторофосфат, під "РуВrOP" мається на думці бромоРозчин диметил-сульфамоїлхлориду тріс-піролідино-фосфоній гесафторофосфат, під (0,0015моль) у DCM (1мл) додавали при 5°С до "TEA" мається на думці триетиламін, під "TFA" суміші проміжної сполуки 2 (0,0012моль) та TEA мається на думці трифторооцтова кислота, під (0,0017моль) у DCM (1мл) під струменем N2. Дану "THF" мається на думці тетрагідрофуран, суміш перемішували при кімнатній температурі Extrelut™ є продуктом Merck KgaA, Darmstadt, протягом 18 годин. Додавали 10% карбонат калію. Germany, і являє собою коротку колонку, що місДану суміш екстрагували DCM. Органічний шар тить діатомову землю. відокремлювали, осушували (MgSO4), фільтруваА. Одержання проміжних сполук ли, і розчинник випарювали до сухого стану. ЗаПриклад А1 лишок (0,69г) розчиняли у діетиловому ефірі. Осад а) Одержання відфільтровували та висушували, з виходом 0,64г (73%) проміжної сполуки 3, Тпл. 193°С. 25 77263 26 Приклад А2 Одержання Розчин 2-(метилсульфоніл)-5тримідинкарбонової кислоти, етилового ефіру (0,0434моль), в ацетонітрилі (100мл) додавали но краплях при 10°С до розчину 4піперидинметанаміну (0,0868моль) та карбонату калію (0,0434моль) в ацетонітрилі (200мл) під струменем N2. Дану суміш перемішували при кімнатній температурі протягом 2 годин, виливали у льодяну воду та екстрагували DCM. Органічний шар відокремлювали, осушували (MgSО4), фільтрували, і розчинник випарювали. Залишок (14,18г) очищали методом колонкової хроматографії на силікагелі (20-45мкм) (елюент: DCM/MeOH/NH4OH від 90/10/1 до 80/20/2). Чисті фракції збирали, і розчинник випарювали, з виходом 3.7г (32%) проміжної сполуки 4. Приклад A3 А) Одержання Суміш проміжної сполуки 2 (0,0002моль), феніл-бензолацетілхлориду (0,0003моль) та морфолінометил-РS-поглинача (постачальник Novabiochem cat No 01-64-0171: Morpholinomethyl polystyrene HL (200-400меш), 2% дівінілбензолу) (0,150г) у DCM (5мл) перемішували при кімнатній температурі протягом 20 годин, потім додавали тріс(2-аміноетил)амін-РS-поглинач (постачальник Novabiochem cat No 01-64-0170: Tris-(2амінометил)-амін полістирол НЦ200-400 меш), 1% дивинілбензолу) (0,150г), і дану реакційну суміш перемішували ще протягом 4 годин. Зазначені поглиначі відфільтровували, промивали DCM, і розчинник випарювали, з виходом проміжної сполуки 5. b) Одержання Суміш проміжної сполуки 5 (0,0003моль) у гідроксиді натрію 1N (1,5мл), THF (4мл) та МеОН (1мл) перемішували при кімнатній температурі протягом 3 днів, потім дану реакційну суміш нейтралізували НСІ (1,5мл, 1N) Диму суміш відфільтровували через Extrelut™ NT (постачальник: Merck) та висушували під струменем N2, з виходом проміжної сполуки 6. с) Одержання Суміш проміжної сполуки 6 (0,0003моль), НОВТ-6-карбоксамідометил-РS-поглинача (0,200г; Novabiochem Cat. No. 01-64-0425) та Ν,Ν-диметил4-піридинаміну (0,00015моль) у DCM/DMF (5мл) перемішували при кімнатній температурі протягом 15 хвилин, потім додавали Ν,Ν'-метантетраїлбіс-2пропанамін (0,070мл), і дану реакційну суміш струшували протягом 4 годин. Дану смолу промивали тричі DCM, тричі DMF і знову три рази DCM, і три рази DMF, і нарешті шість разів DCM. Додавали розчин О-(тетрагідро-2Н-піран-2-іл)гідроксиламіну (0,00026моль) у DCM (5мл), і дану реакційну суміш струшували протягом 20 годин, потім додавали PS-зв'язаний метилізоціанат (постачальник Novabiochem cat No 01-64-0289: Methylisothiocyanate polystyrene HL (200-400 меш), 2% дивініл бензолу) (0,150г), і дану суміш струшували протягом 4 годин. Зазначені поглиначі відфільтровували, промивали два рази DCM, і використовували даний фільтрат, з виходом проміжної сполуки 7. В. Одержання кінцевих сполук Приклад В1 N-Fmoc-гідроксиламін 2-хлоротритілову смолу (Novabiochem, 01-64-0165) піддавали депротектуванню 50% піперидином у DMF (кімнатна темп., 24 години). Дану смолу промивали кілька разів DCM та DMF і розчиняли у DMF. Два еквіваленти кислоти1, РуВrОР та 4 еквіваленти DIEA додавали однією порцією. Дану суміш струшували протягом 24 годин, рідину зливали, і дану смолу промивали кілька разів DCM та DMF. Смолу розчиняли у DMF, що містив 2 еквіваленти аміну, струшували протягом 24 годин при кімнатній температурі, дану рідину зливали, і смолу промивали DСМ та DMF. До смоли, що була розчинена у DMF з 4 еквівалентами ТЕА, додавали арилсульфонілхлорид (2 еквіваленти). Реакційну суміш перемішували протягом ночі, рідину зливали, і дану смолу промивали DCM та DMF. Кінцевий продукт розщеплювали 5% ТЕА у DCM, аналізували методом високоефективної рідинної хроматографії та мас-спектроскопії і випарювали у попередньо зважених пробірках. 1 Виходячи із наповнення даної смоли. З метою ілюстрації нижче наводиться схема. 27 77263 28 Приклад В2 N-Fmoc-гідроксиламін 2-хлоротритілову смолу (Novabiochem, 01-64-0165) піддавали депротектуванню 50% піперидином у DMF (кімнатна темп., 24 години)1. Дану смолу промивали2 кілька разів DCM та DMF і розчиняли у DMF. Два еквіваленти кислоти3, РуВrОР та 4 еквіваленти DIEA додавали одніN'-(етилкарбонімідоїл)-N,N-диметил-1,3єю порцією. Дану суміш струшували протягом 24 пропандіамін, моногідрохлорид (0,0021моль), догодин, рідину зливали, і дану смолу промивали давали порціями до суміші проміжної сполуки 8, кілька разів DCM та DMF. Смолу розчиняли у DMF, Na (0,0016моль), О-(тетрагідро-2Н-піран-2-іл)що містив 2 еквіваленти аміну, струшували протягідроксиламіну (0,0021моль) та 1-гідрокси-1Нгом 24 годин при кімнатній температурі, дану рідибензотріазолу (0,0021моль) у DCM/THF (10мл) під ну зливали, і смолу промивали DCM та DMF. Кінструменем N2. Дану суміш перемішували при кімцевий продукт розщеплювали 5% ТЕА у DCM, натній температурі протягом уікенду. Додавали аналізували методом високоефективної рідинної 10% карбонат калію. Дану суміш екстрагували хроматографії та мас-спектроскопії і випарювали у DCM. Органічний шар відокремлювали, осушували попередньо зважених пробірках. (MgSO4), фільтрували, і розчинник випарювали до 1 В одному прикладі використовувалась сполусухого стану. Залишок (0,94г) очищали методом ка 1 карбоксиметантіол 4-метокситритілова смола колонкової хроматографії на кромасилі (елю(Novabiochem, 01-64-0238). ент:DCM/MeOH/NH4OH 97/3/0,1; 15-40мкм). Чисті 2 В одному випадку у різних процедурах профракції збирали, і розчинник випарювали. Залимивання сполуки 1 використовували також МеОН. шок (0,45г, 65%) розчиняли в діетиловому ефірі. 3 Виходячи із наповнення даної смоли. Осад відфільтровували та висушували, з виходом 4 В одному випадку замість РуВrОР використо0,422г (61%) проміжної сполуки 9, Тпл. 183°С. вувався РуВОР. c) Одержання Приклад В3 N-Fmoc-гідроксиламін 2-хлоротритілову смолу (Novabiochem, 01-64-0165) піддавали депротектуванню 50% піперидином у DMF (кімнатна темп., 24 години)1. Дану смолу промивали2 кілька разів DCM та DMF і розчиняли у DMF. Два еквіваленти кислоти3, РуВrОР4 та 4 еквіваленти DIEA додавали однією порцією. Дану суміш струшували протягом 24 Трифторооцтову кислоту (0,5мл) додавали до годин, рідину зливали, і дану смолу промивали суміші проміжної сполуки 9 (0,0009моль) у МеОН кілька разів DCM та DMF. Смолу розчиняли у DMF, (10мл). Дану суміш перемішували при кімнатній що містив 2 еквіваленти аміну, струшували протятемпературі протягом 18 годин. Осад відфільтрогом 24 годин при кімнатній температурі, дану рідивували, промивали DCM та висушували, з вихону зливали, і смолу промивали DCM та DMF. Три дом 0,176г (59%) сполуки 2, Тпл. >260°С. еквіваленти кислоти, DIC та DIEA струшували зі Приклад В5 смолою протягом ночі при кімнатній температурі. Одержання Рідину зливали, і смолу промивали DCM та DMF. Кінцевий продукт розщеплювали 5% TFA у DCM, аналізували методом високоефективної рідинної хроматографії та мас-спектроскопії і випарювали у попередньо зважених пробірках. Приклад В4 а) Одержання Суміш проміжної сполуки 2 (0,0019моль) та сульфаміду (0,0021моль) у 1,2-диметокси-етані (5мл) перемішували та нагрівали зі зворотним холодильником протягом 4 днів. Додавали воду. Суміш відфільтровували та висушували, з винаходом 0,51г (83%) проміжної сполуки 10, Тпл. 192°С. Проміжну сполуку 10 обробляли аналогічно до того як описано у прикладі [B4] з одержанням Суміш проміжної сполуки 3 (0,0016моль) та гі0,034г (13%) сполуки 3, Тпл. 212°С. дроксиду натрію (0,0033моль) у EtOH (6мл) перемішували та нагрівали зі зворотним холодильником протягом 2 годин, потім охолоджували до кімнатної температури. Осад відфільтровували, промивали ЕtOН та висушували, з виходом 0,59г (>100%) проміжної сполуки 8, Na. b) Одержання 29 Приклад В6 Одержання Розчин диметил-сульфамоїлхлориду (0,007моль) у DCM (5мл) додавали при 10°С до розчину проміжної сполуки 4 (0,0057моль) та TEA (0,0085моль) у DCM (5мл) під струменем азоту. .Дану суміш перемішували протягом ночі, виливали у льодяну воду та екстрагували DCM. Органічний шар відокремлювали, осушували (MgSО4), фільтрували, і розчинник випарювали. Залишок кристалізували із суміші СН3СN/діетиловий ефір. Осад відфільтровували та висушували, з виходом 0,492г (24%) проміжної сполуки 11, Тпл. 142°С. Проміжну сполуку 11 обробляли аналогічно до того як описано у прикладі [В4] з одержанням 0,7г (85%) сполуки 4, Тпл. 182°С. Приклад В7 Одержання Суміш проміжної сполуки 7 (0,0003моль) в оцтовій кислоті, трифторооцтовій кислоті (5мл, 5% у МеОН) перемішували при кімнатній температурі протягом 20 годин, потім дану реакційну суміш висушували продуванням, з виходом сполуки 5. Приклад В8 Одержання Суміш проміжної сполуки 2 (0,0025моль), 2нафталінкарбонілхлориду (0,003моль) та карбонату калію (0,005моль) в ацетонітрилі (20мл) перемішували та нагрівали зі зворотним холодильником протягом ночі, потім охолоджували до кімнатної температури, виливали у льодяну воду та екстрагували DCM. Органічний шар відокремлювали, осушували (MgSO4), фільтрували, і розчинник випарювали. Залишок кристалізували із діетилового ефіру. Осад відфільтровували та висушували, з виходом 0,97г (100%) проміжної сполуки 12, Тпл. 140°С. Проміжну сполуку 12 обробляли аналогічно до 77263 30 того як описано у прикладі [В4] з одержанням 0,338г (86%) сполуки 6, Тпл. 130°С. У Таблиці F-1 подано перелік сполук, що були одержані згідно з одним із вищерозглянутих Прикладів. У даних таблицях використано наступні скорочення. Co.No. означає № сполуки, Ех. [Вn°] стосується того самого способу, що описаний у Вn° прикладах, C2HF3O2 означає трифтороацетатну сіль. Деякі сполуки характеризуються через точку плавлення (mр), інші сполуки характеризуються через мас-спектроскопічні дані [МН+] (ms). Таблиця F-1 31 77263 32 оптимальній довжині хвилі у межах 290-500нм. Метаболізм ліків означає, що розчинна у ліпідах ксенобіотична або ендобіотична сполука трансформується ферментативним шляхом у полярний(ні), водорозчинний(ні) та здатний(ні) до екскреції метаболіт(и). Основним органом, де здійснюються метаболічні перетворення ліків, є печінка. Метаболічні продукти є часто менш активними, ніж вихідні ліки, або є інактивними. Проте, деякі метаболіти можуть мати підвищену активність або токсичні ефекти. Тому метаболізм ліків може включати процеси як "детоксикації", так і "токсикації". Одна із головних ферментних систем, що визначає здатність даного організму взаємодіяти з ліками та хімічними речовинами, репрезентується цитохром Р450 монооксигеназами, котрі є НАДФ (NADPH)-залежними ферментами. Метаболічна стійкість сполук може визначатись in vitro з використанням субклітинної тканини людини (дивись приклад С.5). У даному тексті метаболічна стійкість сполук виражається як % ліків, що піддались метаболічному перетворенню після 15 хвилинного інкубування цих сполук з мікросомами. С. Фармакологічний приклад: Кількісні дані щодо сполук даного винаходу були У in vitro пробі на інгібування гістон дезацетиодержані з використанням LC-MS (рідиннолази (дивись приклад С.1) вимірюється інгібування хроматографічного та мас-спектроскопічного) анаHDAC ферментної активності, що досягається з лізу. допомогою сполук формули (І). Протипухлинний супресор р53 транскрипційКлітинну активність сполук формули (І) визнаним шляхом активує ряд генів, включаючи чали на клітинах пухлини А2780 з використанням WAF1/CIP1 ген, як реакція на ушкодження ДНК. колориметричної проби на токсичність або вижи21kDa продукт гена WAF1 знайдений у комплексі, вання клітин [Mosmann Tim, Journal of що включає цикліни, циклін-залежні кінази (CDK) Immunological Methods 65: 55-63, 1983] (дивись та проліферувальний клітинний ядерний антиген приклад С.2). (PCNA), у нормальних, але нетрансформованих Кінетична розчинність у водних середовищах клітинах, і, як ввижається, є універсальним інгібівимірює здатність сполуки залишатись у водному тором активності CDK. Одним із наслідків зв'язурозчині при розведенні (дивись приклад С.3). вання p21WAF1з CDK та інгібування останнього є Маточні DMSO розчини розводять простим запобігання залежному від CDK фосфорилуванню водним буферним розчинником у три послідовні та наступній інактивації Rb білка, що суттєво для стадії. Для кожного розведення за допомогою нерозвитку клітинного циклу. Тому індукція p21WAFI фелометра вимірюють каламутність. як реакція на клітинний контакт з інгібітором HDAC Проникність ліків виражає їх здатність до трає ефективним та специфічним індикатором інгібунспортування із одного середовища в інше або вання розвитку клітинного циклу як у G1, так і G2 через інше середовище, Більш конкретно, їх здатконтрольних точках. ність проникати через інтестинальну мембрану у Здатність даних сполук індукувати p21WAF1 кровотік та/або із кровотоку у дану мішень. Пронивизначали з використанням твердо фазового імукність можна вимірювати (дивись приклад С.4) ноферментного p21WAF1 аналізу (WAF1 ELISA of шляхом формування іммобілізованого на фільтрі Oncogene). Зазначений p21WAFl аналіз являє соштучного мембранного фосфоліпідного бішару. У бою "сандвічевий" імуноферментний аналіз із запробі з використанням зазначеної штучної мемстосуванням як моноклонального антитіла миші, брани з іммобілізацією на фільтрі "сандвіч" утвотак і поліклонального антитіла кроля. Поліклонарюється з допомогою 96-коміркового титраційного льне антитіло кроля, що є специфічним щодо планшету та 96-коміркового фільтраційного планлюдського білка WAF1, іммобілізували на поверхні шету у такий спосіб, що кожна складена комірка пластикових комірок, запроваджених у наборі. поділена на дві камери з донорним розчином на Будь-який p21WAF1, присутній у пробі, що має дні і акцепторним розчином у верхній частині, розаналізуватись, зв'яжеться з іммобілізованим антиділені 125 мкм мікро-фільтраційним диском (пори тілом. Біотинильоване детекторне моноклональне 0,45мкм), покритим 2% (вага/об'єм) додекановим антитіло також розпізнає p21WAF1 білок людини і розчином діолеоїлфосфатидил-холіну, за умов, зв'язується з будь-яким p21WAF1, що утримується що мультиламелярні бішари утворюються усерезазначеним іммобілізованим антитілом. Дане дедині фільтраційних каналів, коли дана система текторне антитіло, у свою чергу, зв'язується пероконтактує з водним буферним розчином. Проникксидаза-кон'югованим стрептавідином. Дана пероність сполук через цю штучну мембрану вимірюксидаза хрону каталізує перетворення ється у см/с. Метою є вивчення проникності даних хромогенного субстратного тетра-метилбензидину ліків через паралельну штучну мембрану при 2 із безбарвного розчину у блакитний розчин (або різних величинах рH: 4,0 та 7,4. Виявлення сполужовтий після додавання інгібітора), інтенсивність ки проводиться методом УФ-спектрометрії при 33 77263 34 якого пропорційна кількості p21WAF1 білка, зв'яму середовищі. У пробах на проліферацію клітин заного з цією поверхнею. Зазначений забарвлений кінцеві концентрації DMSO не перевищували 0,1% реакційний продукт аналізують кількісно з допомо(об'єм/об'єм). Контрольні зразки містили клітини гою спектрофотометра. Кількісні дані одержують А2780 та DMSO, і не містили сполуку, і зразки для шляхом побудови еталонної кривої з використансліпих досліджень містили DMSO, але не містили ням відомих концентрацій p21WAF1 (за умови ліклітин. МТТ розчиняли при 5мг/мл у PBS (фізіолоофілізації) (дивись приклад С.6). гічний розчин із фосфатним буфером). Готували Приклад C.1 гліциновий буфер, що містив 0,1Μ гліцину та 0,1Μ In vitro проба на інгібування гістон дезацеNaCl, величина рН якого встановлювалась нарівні тилази: 10,5 з допомогою NaOH (1N) (усі реактиви були від HeLa ядерні екстракти (постачальник: Biomol) фірми Мерк). Ракові клітини яєчника людини А2780 (люб'язінкубували при 60мкг/мл з 2 10-8Μ міченим радіоано надані д-ром Т.К.Гамильтоном (Fox Chase ктивним ізотопом пептидним субстратом. Як субCancer Centre, Pennsylvania, USA)) культивували у страт для визначення активності HDAC використосередовищі RPMI 1649 з додатком 2мМ Lвували синтетичний пептид, тобто амінокислоти глутаміну, 50мкг/мл гентаміцину та 10% сироватки 14-21 гістону Н4. Даний субстрат був підданий плода корови. Клітини, як належить, витримували біотинилюванню у NH2-кінцевій частині 6як моношарові культури при 37°С у зволоженій аміногексаново-кислотним спейсером та захищеатмосфері з 5% вмістом СО2. Раз на тиждень кліний у СООН-кiнцевій частині амідною групою, і тини пасирували з використанням розчину трипспецифічно [3Н]ацетильований по лізину 16. Даний син/EDTA при відношенні розщеплення 1:40. Усі субстрат, біотин-(6-аміногексановий)Glу-Аlа-([3Н]середовища та додаткові препарати були одержаацетил-Lуs-Аrg-Нis-Аrg-Lys-Val-NH2), додавали у ні від фірми Life Technologies. Клітини не містили буфері, що містив 25мМ Hepes, 1М цукрози, мікоплазмових забруднень, як було визначено з 0,1мг/мл BSA (альбумін бичачої сироватки) та використанням набору Gen-Probe Mycoplasma 0,01% Triton Х-100 при рН7,4. За 30 хвилин реакція Tissue Culture (постачальник: ВіоМегІеих). Клітини деацетилювання була припинена шляхом додависівали у 96-коміркові культуральні планшети вання НСl та оцтової кислоти (кінцева концентраNUNC™ (постачальник: Life Technologies) та доція складала, відповідно, 0,035мМ та 3,8мМ). Після зволяли їм прилипнути до пластика протягом ночі. припинення даної реакції вільний Н-ацетат екстраЩільності посіву складали 1500 клітин на комірку у гували етилацетатом. Після перемішування та загальному об'ємі середовища 200мкл. Після прицентрифугування радіоактивність в аліквотній кілипання клітин середовище змінювали, і до кінцелькості верхньої (органічної) фази вимірювали з вого об'єму 200мкл додавали ліки та/або розчиндопомогою -лічильника. ники. Після інкубації протягом чотирьох днів Для кожного експерименту паралельно провосередовище було замінено 200мкл свіжого середили контрольні досліди (використовували контдовища, і щільність клітин та їх життєздатність рольні зразки, що містили HeLa ядерний екстракт оцінювали з використанням аналізу на основі МТТ. та DMSO без сполуки), сліпу інкубацію (з DMSO, До кожної комірки додавали 25мкл розчину МІГ, і але без HeLa ядерного екстракту або сполуки) та дані клітини піддавались додатковому інкубуванню дослідження випробуваних зразків (що містили протягом 2 годин при 37°С. Потім дане середовисполуку, розчинену у DMSO, та HeLa ядерний ексще ретельно відсмоктували, і блакитний МТТтракт). У першому прикладі сполуки випробували формазановий продукт був солюбілізований шляпри концентрації 10-5М. Коли дані сполуки виявляхом додавання 25мкл гліцинового буфера з настули активність при 10-5М, була побудована крива пним додаванням 100мкл DMSO. Дані планшети концентрація-реакція, де сполуки випробувались струшували протягом 10 хвилин на планшетному при концентраціях у межах 10-5-10-12М. У кожному шейкері, і оптичну густину на хвилі 540нм вимірютесті значення для сліпого досліду віднімали як від вали за допомогою 96-коміркового спектрофотоконтрольного значення, так і значення для випрометра Макс (Еmах) (постачальник: фірма буваних зразків. Контрольний зразок репрезентуSopachem). У межах даного експерименту резульвав 100% дезацетилювання субстрату. Для кожнотати для кожної експериментальної умови є серего випробуваного зразка радіоактивність виражали дніми із 3 ідентичних комірок. З метою первинного як відсоток від середнього значення для контрольскринінгу сполуки випробувались при одній фіксоних зразків. Відповідні IС50-значення (концентрація ваній концентрації 10-6М. Для активних сполук дані ліків, що потрібна для зниження кількості метабоексперименти повторювались i мстою одержання літів на 50% відносно контрольних зразків) обчисповних кривих концсіпрація-рсакція. Для кожного лювали з використанням пробіт-аналізу для ранексперименту паралельно проводились контрольні жованих даних. У даному тексті ефекти досліди (в яких ліки були відсутні) та сліпе інкубувипробуваних сполук виражені як pIC50 (від'ємний вання (при якому були відсутні клітини або ліки). логарифм значення ІС50). Усі випробувані сполуки Значення для сліпого досліду віднімали від усіх виявили ферментну активність при тестовій кон-5 контрольних значень і значень для випробуваних центрації 10 М, і 21 сполука мала значення зразків. Для кожного випробуваного зразка середplC50 5 (дивись Таблицю F-2). нє значення щодо росту клітин (в одиницях оптичПриклад С.2 ної густини) виражали як відсоток від середнього Визначення антипроліферативної активності значення для росту клітин контрольних зразків. на клітинах A2780 Відповідні ІС50-значення (концентрація ліків, що Усі випробувані сполуки розчинялись у DMSO, потрібна для зниження росту клітин на 50% відноі додаткові розведення робились у культурально 35 77263 36 сно контрольних зразків) обчислювали з викорисрий містив 0,1% 2,6-ді-трет-бутил-4-метилфенолу, танням пробіт-аналiзу для ранжованих даних. та помішували на верхню частину донорного [Finney, D.J., Probit Analyses, 2nd Ed. Chapter 10, планшета 1 з утворенням "сандвіча". Буфер Graded Responses, Cambridge University Press, (200мкл) виливали в акцепторні комірки у верхній Cambridge 1962]. У даному тексті ефекти випробучастині. Даний сандвіч накривали кришкою та збеваних сполук виражені як pIC50 (від'ємний логарігали протягом 18 годин при кімнатній температурифм значення ІС50). Більшість випробуваних спорі у темряві. лук виявили клітинну активність при тестовій Сліпе вимірювання акцепторного планшета 2 концентрації 10-6М, і 9 сполук мали значення проводилось шляхом додавання 150мкл буфера до комірок з наступним проведенням УФpIC50 5 (дивись Таблицю F-2). вимірювань. Після проведення сліпого вимірюванПриклад С.3 ня акцепторного планшета 2 даний буфер зливаКінетична розчинність у водних середовищах ли, і 150мкл акцепторного розчину переносили із На першій стадії розведення 10мкл концентзазначеного акцепторного фільтраційного планрованого вихідного розчину даної активної сполушета 1 до акцепторного планшета 2. Потім зазнаки, солюбілізованого у DMSO (5мМ), додавали до чений акцепторний фільтраційний планшет 1 ви100мкл фосфатно-цитратного буфера рН7,4 та лучали із даного сандвіча. Після проведення перемішували. На другій стадії розведення аліквосліпого вимірювання донорного планшета 2 (дитну кількість (20мкл) розчину першої стадії розвевись вище) 150мкл донорного розчину переносили дення додатково вливали у 100мкл фосфатноіз донорного планшета 1 у донорний планшет 2. цитратного буфера рН7,4 та перемішували. НаУФ спектри комірок донорного планшета 2, акцепрешті, на третій стадії розведення проба (20мкл) торного планшета 2 та еталонного планшета скадругої стадії розведення додатково розводилась у нували (з допомогою приладу SpectraMAX 190). 100мкл фосфатно-цитратного буфера рН7,4 та Усі спектри піддавали комп'ютерній обробці для перемішувалась. Усі розведення проводились у обчислення проникності за допомогою програмно96-коміркових планшетах. Зразу ж після останньої го забезпечення PSR4p Command Software. Вимістадії розведення каламутність зазначених трьох рювання для всіх сполук проводили трикратно. Як послідовних стадій розведення визначали з допоеталони у кожному експерименті використовували могою нефелометра. З метою виключення випадкарбамазепін, грізеофулвін, ациклогуанізин, атекових похибок для кожної сполуки робили по три нолол, фуросемід та хлоротіазид. Сполуки ранжурозведення. Виходячи із вимірювань каламутності, вали на 3 категорії, як такі, що мають низьку пропроведено ранжування даних сполук на три категорії, Сполуки з високою розчинністю отримали 3 никність (середній ефект середній -6 прозорий розчин. Сполуки з середньою розчиннісефект 0,5 10 см/с; категорія 2) та високу прониктю отримали 2 категорію. Для цих сполук перше ність ( 0,5 10-6см/с; категорія 3). Дві сполуки вирозведення дає каламутний розчин, і друге розвеявили категорію 1 при одному з виміряних рН. дення дає-прозорий розчин. Сполуки з низькою Приклад С.5 розчинністю отримали 1 категорію, і для цих споМетаболічна стійкість лук як перше, так і друге розведення дає каламутСубклітинні тканинні препарати виготовляли ний розчин. Була виміряна розчинність 9 сполук. Із згідно з Gorrod et al. (Xenobiotica 5: 453-462, 1975) зазначених сполук 7 виявили 3 категорію, і дві шляхом центрифугального розділення після мехасполуки продемонстрували 1 категорію (див. Табнічної гомогенізації тканини. Тканину печінки пролицю F-2). мивали у льодяному буфері 0,1Μ Tpic(Tris)-HCl Приклад С.4 (рН7,4) для вимивання надлишків крові. Потім ткаАналіз проникності із застосуванням параленину промокали до сухого стану, зважували та льної штучної мембрани грубо розрізали з використанням хірургічних ножиВихідні проби (аліквоти по 10мкл вихідного роців. Шматки тканини гомогенізували у 3 об'ємах зчину 5мМ у 100% DMSO) розводили у глибокій льодяного 0,1Μ фосфатного буфера (рН7,4) з викомірці планшета попереднього змішування, що користанням гомогенізатора або марки Potter-S містить 2мл водної буферної системи рН4 або (фірма Braun, Italy), обладнаного тефлоновим товрН7,4 (PSR4 System Solution Concentrate (pION). качиком, або Sorvall Omni-Mix протягом 7 10с. В Перед уведенням проб в еталонний планшет обох випадках посудину підчас процесу гомогеніДо комірок додавали 150мкл буфера і проводили зації тримали у/на льоді. сліпе УФ-вимірювання. Після цього даний буфер Тканинні гомогенати піддавали центрифугузливали, і даний планшет використовували як ванню при 9000 g протягом 20 хвилин при 4°С з еталонний. Усі вимірювання проводились у стійких використанням центрифуги марки Sorvall або ульдо УФ випромінювання планшетах (постачальник: трацентрифуги марки Beckman. Утворений в рефірми Costar або Greiner). зультаті супернатант зберігали при -80°С і познаПісля проведення сліпого вимірювання етачали як 'S9'. лонного планшета 150мкл розведених проб додаФракцію S9 можна додатково центрифугувати вали до еталонного планшета і 200мкл розведепри 100000 g протягом 60 хвилин (4°С) з викорисних проб додавали до донорного планшета 1. танням ультрацентрифуги Beckman. Утворений в Акцепторний фільтраційний планшет 1 (постачарезультаті супернатант ретельно відсмоктували, льник; Millipore, тип: МАІР N45) покривали 4мкл поділяли на аліквотні кількості та позначали як розчину, що утворює штучну мембрану (1,2'цитозоль'. Дану таблетку піддавали повторному діолеоїл-sn-гліцер-3-фосфохолін у додекані), котсуспендуванню в 0,1Μ фосфатному буфері (рН7,4) 37 77263 38 у кінцевому об'ємі 1мл на 0,5г ваги оригінальної кість. Коли проводився скринінг метаболічної стійтканини і позначали як 'мікросоми'. кості, завжди включали три еталонних сполуки. Усі субклітинні фракції були поділені на алікВерапаміл включали як сполуку з низькою метавотні кількості, миттєво заморожені у рідкому азоті болічною стійкістю (% метаболізму =73%). Цисапта поміщені на зберігання при -80°С до викорисрид включали як сполуку з помірною метаболічтання. ною стійкістю (% метаболізму =45%), і пропанол Для випробуваних зразків інкубаційна суміш був включений як сполука з проміжною -високою містила PBS (0,1М), сполуку (5мкМ), мікросоми метаболічною стійкістю (25% метаболізму). Зазна(1мг/мл) та NADPH-генеруючу систему (0,8мМ чені еталонні сполуки використовувались для підглюкоза-6-фосфату, 0,8мМ хлориду магнію та 0,8 твердження достовірності аналізу метаболічної одиниць глюкоза-6-фосфат дегідрогенази). Контстійкості. Була випробувана одна сполука, яка вирольні зразки містили той самий матеріал, але явила метаболізм менше 20%. мікросоми були замінені на інактивовані теплом Приклад С.6 (10 хвилин при 95°С) мікросоми. Відновлення споЗдатність до індукування р21 лук у контрольних зразках у всіх випадках складаНаступний протокол застосований для визнало 100%. Дані суміші піддавали попередній інкучення рівня експресії білка р21 у ракових клітинах бації протягом 5 хвилин при 37°С. Дана реакція яєчника людини А2780. Клітини А2780 (20000 клірозпочиналась у нульовий момент часу (t=0) шлятин/180мкл) висівали у 96-мікрокоміркових планхом додавання 0,8мМ NADP, і зразки інкубували шетах у середовищі RPMI 1640, до якого додавали протягом 15 хвилин (t=15). Реакцію завершали 2мМ L-глутаміну, 50мкг/мл гентаміцину та 10% шляхом додавання 2 об'ємів DMSO. Потім дані сироватки плода корови. 24 години перед лізисом зразки піддавали центрифугуванню протягом 10 даних клітин додавали сполуки при кінцевих концентраціях 10-5, 10-6, 10-7 та 10-8М. Усі випробувані хвилин при 900 g, і супернатанти зберігали при сполуки розчиняли у DMSO, і подальші розведенкімнатній температурі не більше 24 годин перед ня були зроблені у культуральному середовищі. За проведенням аналізу. Усі інкубації проводили по 24 години після додання даної сполуки супернатадва рази. Аналіз супернатантів проводився з виконти відокремлювались від даних клітин. Клітини ристанням LC-MS аналізу. Елюювання зразків ропромивали 200мкл льодяного PRS. Комірки відсбили на колонці типу Xterra MS CIS (50 4,6мм, моктували, і додавали 30мкл лізиспого буфера 5мкм, Waters, US). Застосовували систему високо(50мМ Tris.HCl (рН7,6), 150мМ NaCl, 1% Nonidet ефективної рідинної хроматографії типу Aliance p40 та 10% гліцерину). Планшети інкубували про2790 (постачальник: фірма Waters, US). Елюювантягом ночі при -70°С. ня проводили буфером А (25мМ амонійацетату Відповідна кількість комірок мікротитрувально(рН5,2) в Н2О/ацетонітрил (95/5)), розчинником В го планшета була вилучена із фольгового пакета і був ацетонітрил, і розчинником С метанол при поміщена у пустий тримач комірок. Був зроблений швидкості потоку 2,4мл/хвилину. Використовувавробочий розчин (1х) промивного буфера (20х прося градієнт, що підвищував концентрацію органічмивний планшетиий концентрат: 100мл 20-кратно ної фази від 0% до 50% В та 50% С протягом 5 концентрованого розчину PBS та поверхневохвилин і до 100% В протягом 1 хвилини - у лінійактивної сполуки. Містить 2% хлороацетаміду). ний спосіб, і концентрацію органічної фази підтриЛіофілізований еталон p21WAF . був відновлений мували на стаціонарному рівні протягом ще 1,5 дистильованою водою і додатково розведений хвилини. Загальний інжекційний об'єм зразків зразковим розріджувачем (що запроваджений у складав 25мкл. Як детектор застосовувався потнаборі). рійно-квадрупольний мас-спектрометр Quattro (поЗразки готували шляхом їх розведення 1:4 у стачальник: фірма Micromass, Manchester, UK) з зразковому розріджувачі. Зразки (100мкл) та етаджерелом ESI. Температури джерела та десольлони p21WAF1 (100мкл) піпетували у відповідні ватації встановлювались на рівні, відповідно, 120 комірки та інкубували при кімнатній температурі та 350°С, і як розпилювальний та осушувальний протягом 2 годин. Комірки промивали 3 рази 1 газ використовувався азот. Збирання даних пропромивним буфером, і потім 100мкл реактиву деводилось способом позитивного сканування (реатекторного антитіла (розчин біотинильовапого мокція однозарядного іона). Конусна напруга встаноноклонального антитіла p21WAF1) піпетували у влювалась на рівні 10В, і час перебування складав кожну комірку. Дані комірки інкубували при кімнат1с. ній температурі протягом 1 години і потім промиМетаболічна стійкість виражалась як % метавали тричі 1 промивним буфером. 400 кон'югат болізму даної сполуки після 15 хвилин інкубування у присутності активних мікросом (Е(акт)) (% мета(пероксидаза стрептавідиновий кон'югат: 400болізму =100% кратний концентрований розчин) розводили, і до даних комірок додавали 100мкл їх розчину. Дані Загальний іонний струм (ЗІС ) Е(акт ) при t 15 (( ) 100). комірки піддавали інкубуванню при кімнатній тем(ЗІС ) Е(акт ) при t 0 пературі протягом 30 хвилин і потім промивали Сполуки, котрі мали відсоток метаболізму менше три рази 1 промивним буфером та 1 раз дисти20%, визначались як такі, що мають високу метальованою водою. До комірок додавали субстратболічну стійкість. Сполуки, котрі мали метаболізм ний розчин (хромогенний субстрат) (100мкл), і дані у межах 20-70%, визначались як такі, що мають комірки Інкубували протягом 30 хвилин у темряві проміжну метаболічну стійкість, і сполуки, котрі при кімнатній температурі. Інгібуючий розчин довиявляли відсоток метаболізму вище 70, визначадавали до кожної комірки у такому самому порядку лись як такі, що мають низьку метаболічну стійяк і попередньо доданий субстратний розчин. Оп 39 77263 40 19 5,536 5 дихлорометану та 2,5мл 1,2,3-пропантріолу. 10г 11 >5 поліетиленгліколю розплавляють і розчиняють у 12 >5 75мл дихлорометану. Останній розчин додають до 1
ДивитисяДодаткова інформація
Назва патенту англійськоюHistone deacetylase inhibitors
Автори англійськоюVan Emelen Kristof, Verdonck Marc Gustaaf Celine, van Brandt Sven Franciscus Anna, Meerpoel Lieven
Назва патенту російськоюИнгибиторы гистон дезацетилазы
Автори російськоюван Эмелен Кристоф, Вердонк Марк Густааф Селин, ван Брандт Свен Францискус Анна, Меерпоель Ливен
МПК / Мітки
МПК: A61P 9/10, A61P 17/00, A61P 17/16, C07D 211/58, A61P 19/06, C07D 401/12, A61K 45/00, A61K 31/496, A61P 5/00, A61P 9/00, A61P 13/10, C07D 213/74, C07D 295/155, C07D 403/04, A61P 29/00, A61P 25/16, A61P 11/00, C07D 207/09, A61P 21/04, A61P 13/08, A61P 25/28, A61P 35/02, C12Q 1/48, C07D 207/14, C07D 409/12, C07D 413/04, A61P 17/06, A61K 31/517, A61K 31/4545, A61P 37/06, A61K 31/495, A61K 31/5377, C07D 249/12, C07D 213/78, C07D 307/68, A61P 27/06, A61P 35/00, A61P 37/04, A61K 31/506, A61K 31/445, A61P 15/00, A61K 31/4427, C07D 239/42, A61P 17/14, A61K 31/472, C07D 241/04, A61K 31/55, C07D 413/12, C07D 295/14, A61P 37/08, C07D 211/26, A61P 43/00, C07D 401/14, A61P 11/06, C07D 401/06, A61P 9/02, C07D 295/20, A61P 1/04, A61K 31/551, C07D 403/12, A61K 31/438, A61P 11/02, C07D 295/26, A61P 13/12, A61K 31/40, A61P 9/08, C07D 405/14, A61P 25/00, C07D 471/10, A61P 3/10, C07D 401/04, C07D 217/02, A61P 31/18, A61P 27/02, A61P 17/04, A61P 37/02, A61P 19/02, C07D 405/12, C07D 295/22, C07D 217/04, C07D 317/58, A61P 17/10
Мітки: інгібітори, дезацетилази, гістон
Код посилання
<a href="https://ua.patents.su/20-77263-ingibitori-giston-dezacetilazi.html" target="_blank" rel="follow" title="База патентів України">Інгібітори гістон дезацетилази</a>
Попередній патент: Універсальний автоматичний захватний пристрій для контейнерів
Наступний патент: Піперазинілові, піперидинілові та морфолінілові похідні як інгібітори гістон дезацетилази
Випадковий патент: Поліпептид для блокування індукованої колагеном адгезії тромбоцитів












