Сполуки n-{‘4-заміщений піперазин-1-сульфонілметилалкіл}-n-гідроксиформаміду як інгібітори металопротеїнази, фармацевтична композиція на їх основі, спосіб їх одержання, проміжна сполука (варіанти)
Формула / Реферат
1. Сполука формули (І):
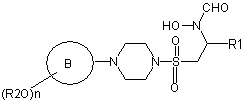 (I)
(I)
або її фармацевтично прийнятна сіль, пролікарська форма або сольват,
в якій кільце В являє собою моноциклічне арильне кільце, що має шість кільцевих атомів, або моноциклічне гетероарильне кільце, що включає до шести кільцевих атомів, яке містить один або більше кільцевих гетероатомів, де кожний з вказаних гетероатомів являє собою азот;
R2 являє собою групу, вибрану з С1-6 алкілу або арилу, де вказана група є заміщеною однією або більше групами фтору;
n дорівнює 1, 2 або 3;
R1 являє собою необов'язково заміщену групу, вибрану з С1-6 алкілу, С5-7 циклоалкілу, гетероциклоалкілу, арилу, гетероарилу, С1-6 алкіларилу, С1-6 алкілгетероарилу, С1-6 алкілциклоалкілу або С1-6 алкілгетероциклоалкілу.
2. Сполука згідно з пунктом 1, в якій В являє собою моноциклічне арильне кільце, що включає шість кільцевих атомів, або моноциклічне гетероарильне кільце, що включає до шести кільцевих атомів, яке містить від одного до чотирьох кільцевих атомів азоту.
3. Сполука згідно з пунктом 1 або пунктом 2, в якій кільце В являє собою феніл, піридиніл або піримідиніл.
4. Сполука згідно з будь-яким попереднім пунктом, в якій R2 являє собою С1-6 алкільну групу, заміщену 1-5 групами фтору.
5. Сполука згідно з будь-яким попереднім пунктом, в якій R2 є заміщеним трьома або чотирма групами фтору.
6. Сполука згідно з пунктом 5, в якій R2 являє собою групу -CF2CHCF2.
7. Сполука згідно з пунктом 5, в якій R2 являє собою групу - CH2CF3.
8. Сполука згідно з будь-яким попереднім пунктом, в якій n дорівнює 1.
9. Сполука згідно з будь-яким попереднім пунктом, в якій R1 являє собою необов'язково заміщену групу, вибрану з С1-4 алкілу, арилу, що включає шість кільцевих атомів, п'яти-шестичленного гетероциклоалкільного кільця, яке містить один або два кільцевих гетероатоми, які можуть бути однаковими або різними та вибрані з N, О та S, або С1-4 алкілгетероарильної групи, в якій гетероарил має до шести кільцевих атомів та включає один або два кільцевих гетероатоми, вибрані з N, О та S.
10. Сполука згідно з пунктом 9, в якій R1 являє собою необов'язково заміщене п'яти-шестичленне гетероциклоалкільне кільце, яке включає один або два кільцеві гетероатоми, які можуть бути однаковими або різними та вибрані з N, О та S, або С1-4 алкілгетероарильну групу, яка включає до шести кільцевих атомів та містить один або більше гетероатомів, які можуть бути однаковими або різними та вибрані з N, О та S, необов'язково заміщені на гетероарильному кільці.
11. Сполука згідно з пунктом 9 або 10, в якій R1 є незаміщеним.
12. Сполука згідно з пунктом 9 або 10, в якій R1 є заміщеним одним або двома замісниками, які можуть бути однаковими або різними та вибрані з С1-4 алкілу, галогену, CF3 та CN.
13. Сполука згідно з пунктом 12, в якій R1 є заміщеним фтором.
14. Сполука згідно з пунктом 11 або пунктом 13, в якій R1 являє собою тетрагідропіраніл, 2-піримідиніл-СН2СН2-, 2-піримідиніл-СН2СН2СН2-або 5-F-2-піримідиніл-СН2СН2-.
15. Сполука згідно з пунктом 1, в якій R2 являє собою С1-6 алкіл, заміщений від однієї до п'яти групами фтору; n дорівнює 1; кільце В являє собою феніл, піридиніл або піримідиніл, а R1 являє собою необов'язково заміщене п'яти-шестичленне гетероциклоалкільне кільце, яке включає один або два кільцеві гетероатоми, які можуть бути однаковими або різними та вибрані з N, О та S, або С1-4 алкілгетероарильну групу, що включає до шести кільцевих атомів та містить один або більше гетероатомів, які можуть бути однаковими або різними та вибрані з N, О та S, необов'язково заміщені на гетероарильному кільці.
16. Фармацевтична композиція, яка містить сполуку формули (І) або її фармацевтично прийнятну сіль, пролікарську форму або сольват, як заявлено в будь-якому з пунктів 1-15, у комбінації з фармацевтично прийнятною допоміжною речовиною, розріджувачем або носієм.
17. Спосіб одержання фармацевтичної композиції, яку заявлено в пункті 16, який включає змішування сполуки формули (І) або її фармацевтично прийнятної солі, пролікарської форми або сольвату, як визначено в будь-якому з пунктів 1-15, з фармацевтично прийнятною допоміжною речовиною, розріджувачем або носієм.
18. Сполука формули (І) або її фармацевтично прийнятна сіль, пролікарська форма або сольват, за будь-яким з пунктів 1-15, для застосування у терапії.
19. Застосування сполуки формули (І) або її фармацевтично прийнятної солі, пролікарської форми або сольвату, як визначено в будь-якому з пунктів 1-15, при виробництві лікарського засобу для застосування при лікуванні хворобливого стану, опосередкованого одним або більше ферментами металопротеїназ.
20. Застосування сполуки формули (І) або її фармацевтично прийнятної солі, пролікарської форми або сольвату, як визначено в будь-якому з пунктів 1-15, при виробництві лікарського засобу для застосування при лікуванні хворобливого стану, опосередкованого колагеназою 3.
21. Застосування сполуки формули (І) або її фармацевтично прийнятної солі, пролікарської форми або сольвату, як визначено в будь-якому з пунктів 1-15, при виробництві лікарського засобу для застосування при лікуванні обструктивного захворювання дихальних шляхів.
22. Застосування згідно з пунктом 21, в якому обструктивне захворювання дихальних шляхів являє собою астму або хронічне обструктивне легеневе захворювання.
23. Застосування сполуки формули (І) або її фармацевтично прийнятної солі, пролікарської форми або сольвату, як визначено в будь-якому з пунктів 1-15, при виробництві лікарського засобу для застосування при лікуванні остеоартриту.
24. Застосування сполуки формули (І) або її фармацевтично прийнятної солі, пролікарської форми або сольвату, як визначено в будь-якому з пунктів 1-15, при виробництві лікарського засобу для застосування при лікуванні атеросклерозу.
25. Спосіб лікування хворобливого стану, опосередкованого металопротеїназою, що включає введення пацієнтові терапевтично ефективної кількості сполуки формули (І) або її фармацевтично прийнятної солі, пролікарської форми або сольвату, як визначено в будь-якому з пунктів 1-15.
26. Спосіб лікування ревматоїдного артриту або остеоартриту, який включає введення пацієнтові терапевтично ефективної кількості сполуки формули (І) або її фармацевтично прийнятної солі, пролікарської форми або сольвату, як визначено в будь-якому з пунктів 1-15.
27. Спосіб лікування обструктивного захворювання дихальних шляхів, який включає введення пацієнтові терапевтично ефективної кількості сполуки формули (І) або її фармацевтично прийнятної солі, пролікарської форми або сольвату, як визначено в будь-якому з пунктів 1-15.
28. Спосіб одержання сполуки формули (І) або її фармацевтично прийнятної солі, пролікарської форми або сольвату, який включає:
перетворення прийнятної сполуки гідроксіаміно формули (IV)
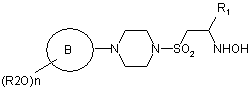 (IV)
(IV)
(в якій R2, n, кільце В та R1 є такими, як визначено у формулі (І))
у сполуку формули (І) шляхом формілування з прийнятним змішаним ангідридом;
після чого, у разі необхідності, здійснюють один або більше наступних етапів:
перетворення одержаної сполуки у сполуку згідно з винаходом та/або утворення фармацевтично прийнятної солі, пролікарської форми або сольвату сполуки.
29. Сполука формули (II)
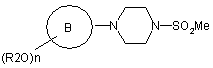 , (II)
, (II)
в якій R2, n та кільце В є такими, як визначено у формулі (І) в пункті 1.
30. Сполука формули (III)
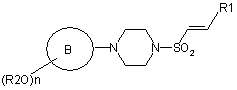 , (III)
, (III)
в якій R2, n, В та R1 є такими, як визначено у формулі (І) у пункті 1.
31. Сполука формули (IV)
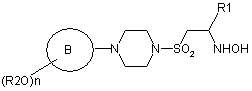 , (IV)
, (IV)
в якій R2, n, кільце В та R1 є такими, як визначено у формулі (І) у пункті 1.
Текст
1. Сполука формули (І): CHO C2 2 (19) 1 3 два кільцеві гетероатоми, які можуть бути однаковими або різними та вибрані з N, О та S, або С1-4 алкілгетероарильну групу, яка включає до шести кільцевих атомів та містить один або більше гетероатомів, які можуть бути однаковими або різними та вибрані з N, О та S, необов'язково заміщені на гетероарильному кільці. 11. Сполука згідно з пунктом 9 або 10, в якій R1 є незаміщеним. 12. Сполука згідно з пунктом 9 або 10, в якій R1 є заміщеним одним або двома замісниками, які можуть бути однаковими або різними та вибрані з С1-4 алкілу, галогену, CF3 та CN. 13. Сполука згідно з пунктом 12, в якій R1 є заміщеним фтором. 14. Сполука згідно з пунктом 11 або пунктом 13, в якій R1 являє собою тетрагідропіраніл, 2піримідиніл-СН2СН2-, 2-піримідиніл-СН2СН2СН2або 5-F-2-піримідиніл-СН2СН2-. 15. Сполука згідно з пунктом 1, в якій R2 являє собою С1-6 алкіл, заміщений від однієї до п'яти групами фтору; n дорівнює 1; кільце В являє собою феніл, піридиніл або піримідиніл, а R1 являє собою необов'язково заміщене п'ятишестичленне гетероциклоалкільне кільце, яке включає один або два кільцеві гетероатоми, які можуть бути однаковими або різними та вибрані з N, О та S, або С1-4 алкілгетероарильну групу, що включає до шести кільцевих атомів та містить один або більше гетероатомів, які можуть бути однаковими або різними та вибрані з N, О та S, необов'язково заміщені на гетероарильному кільці. 16. Фармацевтична композиція, яка містить сполуку формули (І) або її фармацевтично прийнятну сіль, пролікарську форму або сольват, як заявлено в будь-якому з пунктів 1-15, у комбінації з фармацевтично прийнятною допоміжною речовиною, розріджувачем або носієм. 17. Спосіб одержання фармацевтичної композиції, яку заявлено в пункті 16, який включає змішування сполуки формули (І) або її фармацевтично прийнятної солі, пролікарської форми або сольвату, як визначено в будь-якому з пунктів 115, з фармацевтично прийнятною допоміжною речовиною, розріджувачем або носієм. 18. Сполука формули (І) або її фармацевтично прийнятна сіль, пролікарська форма або сольват, за будь-яким з пунктів 1-15, для застосування у терапії. 19. Застосування сполуки формули (І) або її фармацевтично прийнятної солі, пролікарської форми або сольвату, як визначено в будь-якому з пунктів 1-15, при виробництві лікарського засобу для застосування при лікуванні хворобливого стану, опосередкованого одним або більше ферментами металопротеїназ. 20. Застосування сполуки формули (І) або її фармацевтично прийнятної солі, пролікарської форми або сольвату, як визначено в будь-якому з пунктів 1-15, при виробництві лікарського засобу для застосування при лікуванні хворобливого стану, опосередкованого колагеназою 3. 21. Застосування сполуки формули (І) або її фармацевтично прийнятної солі, пролікарської 81491 4 форми або сольвату, як визначено в будь-якому з пунктів 1-15, при виробництві лікарського засобу для застосування при лікуванні обструктивного захворювання дихальних шляхів. 22. Застосування згідно з пунктом 21, в якому обструктивне захворювання дихальних шляхів являє собою астму або хронічне обструктивне легеневе захворювання. 23. Застосування сполуки формули (І) або її фармацевтично прийнятної солі, пролікарської форми або сольвату, як визначено в будь-якому з пунктів 1-15, при виробництві лікарського засобу для застосування при лікуванні остеоартриту. 24. Застосування сполуки формули (І) або її фармацевтично прийнятної солі, пролікарської форми або сольвату, як визначено в будь-якому з пунктів 1-15, при виробництві лікарського засобу для застосування при лікуванні атеросклерозу. 25. Спосіб лікування хворобливого стану, опосередкованого металопротеїназою, що включає введення пацієнтові терапевтично ефективної кількості сполуки формули (І) або її фармацевтично прийнятної солі, пролікарської форми або сольвату, як визначено в будь-якому з пунктів 1-15. 26. Спосіб лікування ревматоїдного артриту або остеоартриту, який включає введення пацієнтові терапевтично ефективної кількості сполуки формули (І) або її фармацевтично прийнятної солі, пролікарської форми або сольвату, як визначено в будь-якому з пунктів 1-15. 27. Спосіб лікування обструктивного захворювання дихальних шляхів, який включає введення пацієнтові терапевтично ефективної кількості сполуки формули (І) або її фармацевтично прийнятної солі, пролікарської форми або сольвату, як визначено в будь-якому з пунктів 115. 28. Спосіб одержання сполуки формули (І) або її фармацевтично прийнятної солі, пролікарської форми або сольвату, який включає: перетворення прийнятної сполуки гідроксіаміно формули (IV) R1 B N N SO2 NHOH (R2O)n (IV) (в якій R2, n, кільце В та R1 є такими, як визначено у формулі (І)) у сполуку формули (І) шляхом формілування з прийнятним змішаним ангідридом; після чого, у разі необхідності, здійснюють один або більше наступних етапів: перетворення одержаної сполуки у сполуку згідно з винаходом та/або утворення фармацевтично прийнятної солі, пролікарської форми або сольвату сполуки. 29. Сполука формули (II) 5 B N 81491 N в якій R2, n, В та R1 є такими, як визначено у формулі (І) у пункті 1. 31. Сполука формули (IV) R1 SO2Me (R2O)n , (II) в якій R2, n та кільце В є такими, як визначено у формулі (І) в пункті 1. 30. Сполука формули (III) R1 B (R2O)n N N 6 SO2 B N N SO2 NHOH (R2O)n , (IV) в якій R2, n, кільце В та R1 є такими, як визначено у формулі (І) у пункті 1. , (III) Даний винахід відноситься до деяких похідних N-гідроксиформаміду, корисних для інгібування металопротеїназ, способів їх одержання, фармацевтичних композицій, що їх містять, та до їх застосування у терапії. Сполуки згідно з даним винаходом є інгібіторами одного або більше металопротеїназних ферментів. Металопротеїнази представляють собою надродину протеїназ (ферментів), кількість відомих членів якої значно збільшилася за останній час. Базуючись на структурному та функціональному аналізі, ці ферменти були згруповані у родини та підродини так, як описано у [N. Μ Hooper (1994) EEBS Letters 354: 1-6]. Приклади металопротеїназ включають матриксні металопротеїнази (ММР), такі, як колагенази (ММР1, ММР8, ММР13), желатинази (ММР2, ММР9), стромелізини (ММР3, ММР10, ММР11), матрилізин (ММР7), металоеластазу (ММР12), енамелізин (ММР19), МТ-ММР (ММР14, ММР15, ММР16, ММР17); репролізин або адамалізин, або родину MDC, що включає секретази та шеддази, такі, як, ферменти, які перетворюють TNF (ADAM10 та ТАСЕ); родину астацину, що включає ферменти, такі, як протеїназа, яка перетворює проколаген (РСР); та інші металопротеїнази, такі, як агреканази, родина ферментів, що перетворюють ендотелій, та родина ферментів, що перетворюють ангіотензин. Металопротеїнази, як передбачається, є важливими при багатьох фізіологічних процесах, що втягують трансформацію тканин, таку, як ембріональний розвиток, утворення кісток та перебудова матки під час менструації. Це явище базується на здатності металопротеїназ розщеплювати широкий спектр матриксних субстратів, таких, як колаген, протеоглікан та фібронектин. Металопротеїнази, як передбачають, також є важливими при процесінгу або виділенні біологічно важливих клітинних медіаторів, таких, як фактор некрозу пухлин (TNF); та під час посттрансляційного протеолітичного процесінгу або при виділенні біологічно активних мембранних білків, таких, як рецептор CD23 з низькою спорідненістю до ІgЕ (для більш повного списку [див. N. М. Hooper та ін. (1997) Biochem J. 321; 265-279]). Металопротеїнази були асоційовані з багатьма хворобливими станами. Інгібування активності однієї або більше металопротеїназ може бути дуже корисним при таких хворобливих станах, як, наприклад: різноманітні запальні та алергічні захворювання, такі, як запалення суглоба (зокрема, ревматоїдний артрит, остеоартрит та подагра), запалення шлунково-кишкового тракту (зокрема, запальне захворювання кишечника, виразковий коліт та гастрит), запалення шкіри (зокрема, псоріаз, екзема, дерматит); при пухлинних метастазах або інвазії; при захворюванні, асоційованому з неконтрольованою деградацією екстрацелюлярного матриксу, такому, як остеоартрит; при резорбтивному захворюванні кісток (такому, як остеопороз та захворювання Педжета); при захворюваннях, асоційованих з аберантним ангіогенезом; при прискореній трансформації колагену, асоційованій з діабетом, при захворюваннях періодонту (таких, як гінгівіт), при корнеальній виразці, виразках шкіри, при післяоперативних станах (таких, як анастомоз товстого кишечника) та заживленні шкірних ран; при демієлінізуючих захворюваннях центральної та периферичної нервових систем (таких, як розсіяний склероз); хвороби Альцгеймера; екстрацелюлярный реконструкція матриксу, що спостерігається при серцево-судинних захворюваннях, таких, як рестеноз та атеросклероз, та при хронічних обструктивних легеневих захворюваннях, COPD (в які втягнений ММР12). Відомий ряд інгібіторів металопротеїназ; різноманітні класи сполук можуть мати різні ступені ефективності та селективності стосовно інгібування різноманітних металопротеїназ. Винахідниками згідно з даним винаходом було виявлено новий клас сполук, що є інгібіторами металопротеїназ та які представляють особливий інтерес стосовно інгібування колагенази 3 (що також відома як ММР-13). Сполуки згідно з даним винаходом мають корисну ефективність та/або фармакокінетичні властивості. 7 Колагеназу 3 (ММР13) спочатку було клоновано з бібліотеки кДНК, що походить від пухлини молочної залози [J. М. P. Freije та ін. (1994) Journal of Biological Chemistry 269 (24): 16766-16773]. ПЛР аналіз РНК, виділеної з широкого спектру тканин, показав, що експресія колагенази 3 (ММР13) обмежується карциномами молочної залози, оскільки її не було виявлено у фіброаденомах молочної залози, у нормальних молочних залозах або у молочних залозах, що перебувають у стадії відпочинку, у плаценті, печінці, яєчнику, матці, передміхуровій або навколовушній залозі, у ракових клітинних лініях молочної залози (T47-D, MCF-7 та ZR75-1). Після цього спостереження колагеназа 3 (MMΡ13) була виявлена у трансформованих епідермальних кератиноцитах [N. Johansson та ін., (1997) Cell Growth Differ. 8 (2): 243-250], карциномах лускатих клітин [N. Johansson та ін. (1997) Am. J. Pathol. 151 (2): 499-508] та епідермальних пухлинах [K. Airola та ін. (1997) J. Invest. Dermatol. 109 (2): 225-231]. Ці результати дають змогу зробити припущення, що колагеназа 3 (ММР13) секретується трансформованими епітеліальними клітинами та може бути втягнена у деградацію ексрацелюлярного матриксу та у взаємодію клітина-матрикс, що асоційована з метастазом, зокрема, як це спостерігається при інвазивних ракових пошкодженнях молочної залози та при злоякісному рості епітелію при карциногенезі шкіри. Опубліковані нещодавно дані передбачають, що колагеназа 3 (ММР13) грає певну роль у перетворенні інших сполучних тканин. Наприклад, на основі співпадаючої з колагеназою 3 (ММР13) субстратної специфічності та переважності для колагену деградуючого типу II [P. G. Mitchell та ін., (1996) J. Clin. Invest. 97 (3): 761-768; V. Knauper та ін., (1996) The Biochemical Journal 271: 154415501], була висунута гіпотеза, що колагеназа 3 (ММР13) виконує певну роль під час процесу утворення кісток та при реконструкції скелету [М. Stahle-Backdahl та ін., (1997) Lab. Invest. 76 (5): 717-728: N. Johansson та ін., (1997) Dev. Dyn. 208 (3): 387-397], при деструктивних захворюваннях суглобів, таких, як ревматоїдний артрит та остеоартрит [D. Wernicke та ін., (1996) J. Rheumatol. 23: 590-595; P. G. Mitchell та ін. (1996) J. Clin. Invest. 97 (3): 761-768; O. Lindy та ін., (1997) Arthritis Rheum. 40 (8): 1391-1399]; та під час асептичного розшатування стегнового протезу [S. Imai та ін., (1998) J. Bone Joint Surg. Br. 80 (4): 701710]. Колагеназа 3 (ММР13) також була втягнена у хронічний періодонтит дорослих, який був локалізований у епітелії хронічно запаленої слизової оболонки гінгівальної тканини людини [V. J. Uitto та ін., (1998) Am. J. Pathol 152 (6): 14891499] та у процес реконструкції колагенового матриксу при хронічних ранах [М. Vaalamo та ін., (1997) J. Invest. Dermatol. 109 (1): 96-101].Сполуки, які інгібують дію металопротеїназ, зокрема, колагенази 3 (ММР 13) описані в [WO 00/12478, WO 00/75108 та WO 01/62742]. Ці зазначені інгібітори включають арил/гетероарилпіперазинсульфонілметил 81491 8 заміщені N-гідроксиформамідні сполуки, в яких арильне кільце заміщене рядом можливих замісників, включаючи серед інших алкокси та арилокси. Немає ніякої вказівки на те, що замісник алкокси або арилокси у такій сполуці може бути сам заміщеним. Заміщений алкокси або арилокси арил/гетероарилпіперазинсульфонілметил заміщені N-гідроксиформамідні сполуки як інгібітори матриксних металопротеїназ охоплюються загальним розкриттям згідно з [WO 99/38843]. Серед багаточисленних наведених можливих замісників для групи алкокси вказаний також галоген. Проте не розкрито жодної такої алкоксизаміщеної сполуки, і тільки однією специфічно розкритою N-гідроксиформамідною сполукою є N-{1S-[4-(4-хлорфеніл)піперазин-1сульфонілметил]-2-метилпропіл}-Nгідроксиформамід. Винахідники згідно з даним винаходом виявили, що заміщений арил або гетероарилпіперазинсульфонілметил заміщені Nгідроксиформамідні сполуки, в яких замісник представляє собою групу алкокси, яка сама є заміщеною однією або більше групами фтору, є особливо бажаними інгібіторами металопротеїназ, зокрема, колагенази 3 (ММР13), та мають бажані профілі активності. Даний винахід у першому аспекті забезпечує сполуку формули (І): або її фармацевтично прийнятну сіль, пролікарську форму або сольват, в якій кільце В представляє собою арильне кільце, що містить шість кільцевих атомів, або моноциклічне гетероарильне кільце, що містить до шести кільцевих атомів, яке включає один або більше кільцевих гетероатомів, де кожний з вказаних гетероатомів представляє собою азот; R2 представляє собою групу, вибрану з С1-6 алкілу або арилу, де вказана група є заміщеною однією або більше групами фтору; n дорівнює 1, 2 або 3; R1 представляє собою необов'язково заміщену групу, вибрану з С1-6 алкілу, С5-7 циклоалкілу, гетероциклоалкілу, арилу, гетероарилу, С1-6 алкіларилу, С1-6 алкілгетероарилу, С1-6 алкілциклоалкілу або С1-6 алкілгетероциклоалкілу. Як такий, що використовується у контексті даної заявки, термін «арил» означає ароматичний карбоциклічний радикал з одним або двома кільцями, який включає до десяти кільцевих атомів, такий як феніл або нафтил. Коли мають на увазі один кільцевий ароматичний карбоциклічний радикал, то він зазначається як «моноциклічний арильний радикал». Коли мають на увазі, що 9 арильне кільце має шість кільцевих атомів, то це зазначається. «Гетероарил» відноситься до ароматичної кільцевої системи, яка містить до десяти атомів, зокрема, до шести кільцевих атомів, та включає один або більше кільцевих гетероатомів, які можуть бути однаковими або різними та які вибирають з N, О та S. Приклади включають піроліл, фураніл, тіофеніл, імідазоліл, тіазоліл, піридиніл, піримідиніл та піразиніл. Гетероатоми азота можуть бути заміщеними у разі необхідності та можуть бути також у формі N-оксидів. Атоми сірки можуть бути у формі S, S(O) або S(O2). Коли мають на увазі гетероароматичну кільцеву систему, що включає одне кільце, то це означає «моноциклічне гетероарильне кільце», коли вказується, що гетероарильне кільце має максимальну кількість кільцевих атомів, що є меншою, ніж десять, то це зазначається. Якщо мають на увазі, що кільцевий гетероатом представляє собою, зокрема, один з N, S або О, або що гетероарильне кільце включає більше, ніж один кільцевий гетероатом, у специфічній комбінації, наприклад, коли кожний з них є таким самим, то це зазначається. Термін «галоген» включає фтор, хлор, бром та йод, та, зокрема, представляє собою фтор. Якщо не зазначено інше, то термін «С1-6 алкіл», коли використовується сам або у комбінації, відноситься до алкільного залишку з нерозгалуженим або розгалуженим ланцюгом, що містить від одного до шести атомів вуглецю, включаючи метил, етил, пропіл, ізопропіл, бутил, трет-бутил, пентил, гексил, тощо. Відповідно до цього буде зрозуміло, що «С1-4 алкіл» означає алкільний залишок з нерозгалуженим або розгалуженим ланцюгом, що включає від одного до чотирьох атомів вуглецю. Термін «циклоалкіл» відноситься до насиченого аліциклічного залишку, що містить п'ять, шість або сім атомів вуглецю та включає, наприклад, циклопентил та циклогексил. Гетероциклоалкільне кільце відноситься до насиченого п'яти-, шести- або семичленного кільця, що включає один або більше гетероатомів, які можуть бути однаковими або різними та вибраними з Ν, Ο та S, та включає, наприклад, піперидиніл, піролідиніл, тетрагідрофураніл, тетрагідропіраніл. «Необов'язково заміщений» використовується в даній заявці для позначення необов'язкового заміщення вказаною групою або вказаними групами у будь-якому наявному прийнятному положенні. Є прийнятним, коли кільце В представляє собою моноциклічне арильне кільце, що містить шість кільцевих атомів, таке, як фенільне або моноциклічне гетероарильне кільце, яке включає до шести кільцевих атомів та містить від одного до чотирьох кільцевих атомів азоту, таке, як піридиніл або піримідиніл, триазиніл або тетразиніл. Коли кільце В представляє собою гетероарильне кільце, то воно переважно є шестичленним кільцем, що містить від одного до 81491 10 чотирьох кільцевих атомів азоту таке, як піридиніл або піримідиніл. В одному переважному втіленні кільце В представляє собою фенільне кільце. В іншому бажаному втіленні кільце є шестичленним гетероарильним кільцем, що включає один або два кільцевих атомів азоту. Одним з бажаних значень для кільця В є піридиніл, зокрема, 2-піридиніл. Особливо бажаним значенням для кільця В є піримідиніл, зокрема, 2-піримідиніл. R2 може бути арильною групою, що включає до десяти кільцевих атомів, зокрема, моноциклічною арильною групою, що включає шість кільцевих атомів (такою, як феніл), заміщених однією або більше групами фтору, але бажано представляє собою С1-6 алкіл, зокрема, С1-4 алкіл, групу (таку, як метил та зокрема, етил), заміщену однією або більше групами фтору. Бажано, коли R2 є заміщеним 1-5 групами фтору, зокрема, 3-4 групами фтору. В одному переважному втіленні R2 представляє собою С1-6 алкіл, зокрема, С1-4 алкіл, заміщений 3-4 групами фтору. Одне переважне значення для R2 представляє собою CF2CHF2. В іншому особливо бажаному втіленні R2 представляє собою CH2CF3. Є прийнятним, коли n дорівнює 1 або 2, та бажаним значенням є 1. Бажано, коли замісник R2O- на кільці В знаходиться у пара-положенні стосовно з'єднання кільця. R1 представляє собою прийнятну необов'язково заміщену групу, вибрану з С1-4 алкілу (такого, як метил або етил), арилу, що включає шість кільцевих атомів (такого, як феніл), п'яти- - шестичленного гетероциклоалкільного кільця, що включає один або два кільцевих гетероатомів, які можуть бути однаковими або різними та вибрані з N, О та S (такого, як піперидиніл або тетрагідропіраніл), або С1-4 алкілгетероарилу, в якому гетероарил має до шести кільцевих атомів та включає один або два кільцевих гетероатоми, вибрані з Ν, Ο та S (такого, як алкілпіримідиніл або алкілпіридиніл). Бажано, коли R1 представляє собою необов'язково заміщене п'яти- - шестичленне гетероциклоалкільне кільце, яке включає один або два кільцевих гетероатоми, які можуть бути однаковими або різними та є вибраними з Ν, Ο та S, або С1-4 алкілгетероарильну групу, що містить до шести кільцевих атомів та включає один або більше гетероатоми, які можуть бути однаковими або різними та є вибраними з Ν, Ο та S, необов'язково заміщених на гетероарильному кільці. В одному переважному втіленні R1 є незаміщеним. В одному переважному втіленні R1 представляє собою тетрагідропіранільну групу, зокрема, 4-тетрагідропіраніл. В іншому бажаному втіленні R1 представляє собою С2-3 алкілпіримідинільну групу, необов'язково заміщену на піримідинільному кільці. 11 Одне бажане значення для R1 представляє собою 2-піримідиніл-СН2СН2-. Інше особливо бажане значення для R1 представляє собою 2піримідиніл-СН2СН2СН2-. Прийнятні необов'язкові замісники для R1 включають одну або більше груп, незалежно вибраних з NO2, CF3, CN, галогену, С1-4 алкілу, карбокси(С1-4)алкілу, циклоалкілу, -OR4, -SR4, С1-4 алкілу, заміщеного -OR4, SR4 (та їх окиснених аналогів), NR4, N-Y-R4 або С1-4 алкілY-NR4, де R4 представляє собою водень, С1-6 алкілу, арилу, гетероарилу або С1-6 алкіларилу, кожний з яких є необов'язково заміщеним галогеном, NO2, CN, CF3, С1-6 алкілом, -S-C1-6 алкілом, -SO-C1-6 алкілом, -SO2-C1-6 алкілом або С1-6 алкокси; при цьому Υ є вибраним з -SO2- та СO-. Якщо R1 у сполуках формули (І) є заміщеним, то він є заміщеним одним або двома замісниками, які можуть бути однаковими або різними та є вибраними з С1-4 алкілу, галогену, CF3 та CN. Бажаний замісник представляє собою галоген, зокрема, фтор. Коли R1 є заміщеним, то він бажано є монозаміщеним. Одне бажане значення для R1 у сполуках формули (І), якщо R1 є заміщеним, представляє собою 5-Р-2-піримідинілСН2СН2-. Слід враховувати, що кількість та природу замісників на кільцях, утворених R1 та/або R2 у сполуках згідно з винаходом, слід вибирати так, щоб уникнути просторово небажаних комбінацій. В одній бажаній групі сполук згідно з винаходом R2 представляє собою С1-6 алкіл, заміщений 1-5 групами фтору, n дорівнює 1; кільце В представляє собою феніл, піридиніл або піримідиніл, a R1 є необов'язково заміщеним п'яти- шестичленним гетероциклоалкільним кільцем, що включає один або два кільцевих гетероатоми, які можуть бути однаковими або різними та є вибраними з Ν, О та S, або С1-4 алкілгетероарильну групу, що включає до шести кільцевих атомів, а також включає один або більше гетероатомів, які можуть бути однаковими або різними та є вибраними з Ν, Ο та S, необов'язково заміщених на гетероарильному кільці. Особливо бажаними сполуками згідно з винаходом у межах цієї групи є ті, в яких R1 є незаміщеним або є заміщеним галогеном, зокрема, фтором. Специфічні сполуки включають 81491 12 13 81491 14 15 81491 16 вище, а найбільш активний енантіомер може бути потім ідентифікований за допомогою прийнятного аналізу без необхідності визначення абсолютних конфігурацій. Сполуки згідно з винаходом можуть забезпечуватися у вигляді фармацевтично прийнятних солей. Прийнятні фармацевтичні солі включають основні солі, такі, як сіль лужного металу, наприклад, натрію, сіль лужноземельного металу, наприклад, кальцію або магнію, органічну сіль аміну, наприклад, триетиламіну, морфоліну, N-метипіперидину, N-етилпіперидину, прокаїну, дибензиламіну, Ν,Ν-дибензилетиламіну або амінокислот, наприклад, лізину. В іншому аспекті, коли сполука є в достатній мірі основною, прийнятні солі включають солі приєднання кислоти, такі, як метансульфонат, фумарат, гідрохлорид, гідробромід, цитрат, малеат, та солі, утворені з фосфорною та сірчаною кислотами. Прийнятні пролікарські форми сполук згідно з формулою (І) представляють собою сполуки, які є гідролізованими in vivo з утворенням сполуки формули (І). Вони можуть бути одержані за допомогою традиційних способів. Даний винахід також забезпечує спосіб для одержання сполуки формули (І), як описано вище, або її фармацевтично прийнятної солі, пролікарської форми або сольвату, що включає: перетворення прийнятної сполуки гідроксиаміно формули (IV) Коли сполуки згідно з винаходом містять один або більше асиметрично заміщених атомів вуглецю, то винахід включає усі стереоізомери, включаючи енантіомери та діастереомери, та суміші, включаючи їх рацемічні суміші. Таутомери та їх суміші також включаються. Рацемати можуть бути розділені на індивідуальні енантіомери при використанні відомих способів [див. Advanced Organic Chemistry: 3-е видання: автор J March, стор.104107]. Прийнятний спосіб передбачає утворення діастереомерних похідних за допомогою реакції рацемічного матеріалу з хіральним допоміжним агентом, після чого здійснюють відокремлення, наприклад, шляхом хроматографії, діастереомерів, а потім проводять відщеплення допоміжних сполук. Не бажаючи обмежуватися початковими визначеннями, передбачається, що у даному випадку активний енантіомер має S стереохімію. Це базується на порівнянні його зі спорідненими сполуками, для яких була підтверджена абсолютна конфігурація. Згідно з цим S-структура показана у формулах, що приведені у прикладах, представлених нижче. Проте слід мати на увазі, що рацемат будь-якої сполуки згідно з винаходом може бути розділений на індивідуальні енантіомери за допомогою способу, описаного (в якій R2, n, кільце В та R1 є такими, як визначено у формулі (І)) у сполуку формули (І) шляхом формілування з прийнятним змішаним ангідридом; після чого, у разі необхідності: перетворення одержаної сполуки у сполуку згідно з винаходом та/або утворення фармацевтично прийнятної солі, пролікарської форми або сольвату сполуки. Процес формілування може бути прийнятним чином здійснений шляхом реакції сполуки формули (IV) зі змішаним ангідридом, одержаним в результаті реакції мурашиної кислоти та оцтового ангідриду. Реакцію традиційно проводять у присутності органічної кислоти, такої, як мурашина кислота. Є бажаним, коли реакцію проводять в прийнятному інертному розчиннику або розріджувачі, такому, як дихлорметан (DCM) або тетрагідрофуран та при температурі у межах, наприклад, від 0° до 50°С Сполуки формули (IV) можуть бути одержані з відповідного алкену формули (III) 17 (в якій R2, n, В та R1 є такими, як визначено у формулі (І)), які можуть самі по собі бути одержані з відповідної сполуки формули (II) (в якій R2, n та кільце В є такими, як визначено у формулі (І)) за допомогою реакції з прийнятною сполукою формули R1CHO (де R1 є таким, як визначено у формулі (І)) або за допомогою реакції з прийнятним естером з одержанням кетону, після чого здійснюють відновлення до відповідного спирту та дегідратацію. При цьому зрозуміло, що сполука формули (III) може бути у формі Е- або Zізомеру, або у вигляді суміші обох. Структура, яка представлена формулою (III), не призначена для обмеження будь-яким певним геометричним ізомеризмом стосовно подвійного зв'язку. Сполуки формул (III) та (IV) можуть бути одержані при використанні відомих методів за допомогою способів, аналогічних тим, що описані в [WO 00/12478, WO 00/75108 та WO 01/62742], які зазначені вище. Приклади способів одержання для деяких з цих сполук наведені нижче у прикладах. Сполуки формул (II), (III) та (IV) є новими та утворюють додатковий аспект даного винаходу. Специфічні сполуки формули (II) включають: Приклади способів одержання для цих сполук наведені нижче у прикладах. Сполуки формули (І) можуть бути перетворені за допомогою подальших способів у сполуки формули (І) при використанні стандартних способів, що є традиційними в області техніки. При цьому зрозуміло, що одержання сполук формули (І) може передбачати на різних стадіях приєднання та видалення однієї або більше захисних груп. Захист та зняття захисту функціональних груп описане в [«Захисні групи в органічній хімії» під ред. J.W.F. McOmie, Plenum Press (1973) та «Захисні групи в органічному синтезі», 2-е видання, T.W. Greene та P.G.M. Wuts, Wiley-Interscience (1991)]. Сполуки згідно з винаходом представляють собою інгібітори металопротеїназ, зокрема, вони представляють собою інгібітори колагенази 3 (ММР13) та, таким чином, призначаються при 81491 18 лікуванні захворювань та станів, опосередкованих ферментами металопротеїназами, включаючи артрит (такий, як остеоартрит), атеросклероз та хронічне обструктивне легеневе захворювання (COPD), як було згадано вище. Зокрема, сполуки згідно з винаходом призначаються при лікуванні захворювань або станів, опосередкованих колагеназою 3 (ММР13). Специфічна перевага інгібіторів колагенази 3 згідно з винаходом полягає у тому, що вони мають підвищену селективність у порівнянні з іншими металопротеїназами. Таким чином, згідно з додатковим аспектом даний винахід забезпечує сполуку формули (І) або її фармацевтично прийнятну сіль, пролікарську форму або сольват, як визначено вище, для використання у терапії при лікуванні організму людини або тварини. Винахід також забезпечує застосування сполуки формули (І) або її фармацевтично прийнятної солі, пролікарської форми або сольвату, як визначено вище, при виробництві лікарського засобу для використання у терапії. Необхідно зазначити, що термін «терапія» також включає «профілактику», якщо не вказано інше. Терміни «терапевтичний» та «терапевтично» розуміються відповідно до цього. Ще в одному аспекті даний винахід забезпечує спосіб лікування хворобливого стану, опосередкованого металопротеїназою, що включає введення теплокровній тварині терапевтично ефективної кількості сполуки формули (І) або її фармацевтично прийнятної солі, пролікарської форми або сольвату. При цьому необхідно розуміти, що доза, яка вводиться, буде варіювати в залежності від використовуваної сполуки, способу введення, бажаного способу лікування та вказаного захворювання. Типово, коли одержувана добова доза складає від 0,5 до 75мг/кг ваги тіла (та бажано від 0,5 до 30мг/кг ваги тіла). Ця добова доза при необхідності може вводитися у вигляді розділених доз, при цьому точна кількість одержуваної сполуки та спосіб введення залежать від ваги тіла та статі пацієнта, якого піддають лікуванню, та від конкретного хворобливого стану, який піддають лікуванню, у відповідності з принципами, відомими в цій галузі. Сполуки формули (І) та їх фармацевтично прийнятні солі, пролікарські форми та сольвати можуть використовуватися самі по собі, але в загальному випадку вони будуть вводитися в формі фармацевтичної композиції у поєднанні з фармацевтично прийнятною допоміжною речовиною, розріджувачем або носієм. Таким чином, даний винахід також забезпечує фармацевтичну композицію, яка включає сполуку формули (І) або її фармацевтично прийнятну сіль, пролікарську форму або сольват у поєднанні з фармацевтично прийнятною допоміжною речовиною, розріджувачем або носієм. Фармацевтичні композиції згідно з винаходом можуть вводитися стандартним для хворобливого стану способом, що є бажаним для лікування, наприклад, пероральним, парентеральним, букальним, назальним, вагінальним або 19 ректальним способом або шляхом інгаляції. З цією метою сполуки згідно з даним винаходом можуть бути рецептовані за допомогою способів, відомих у даній галузі техніки, у формі, наприклад, таблеток, капсул, водних або масляних розчинів, суспензій, емульсій, кремів, мазей, гелів, назальних аерозолей, супозиторіїв, тонко подрібнених порошків або аерозолей для інгаляції, та для парентерального застосування (включаючи внутрішньовенне, внутрішньом'язове або інфузію) стерильних водних або масляних розчинів або емульсій, суспензій або стерильних емульсій. У доповнення до сполук згідно з даним винаходом фармацевтична композиція згідно з даним винаходом може також містити або може сумісно вводитися (одночасно або послідовно) з одним або більше фармакологічними агентами, які є цінними при лікуванні одного або більше хворобливих станів, що були згадані вище. Типово, коли одинична дозована форма буде містити від приблизно 1мг до 500мг сполуки згідно з даним винаходом. Активність та селективність сполук згідно з даним винаходом може бути визначена при використанні прийнятного аналізу ферментативного інгібування так, як описано в [WO 00/12478, WO 00/75108 та WO 01/62742]. Інгібіторна активність колагенази 3 (ММР13) може бути оцінена, наприклад, при використанні способу, що представлений нижче: Рекомбінантний людський рrоММР13 може бути експресований та очищений так, як описано Knauper та ін. [V. Knauper та ін., (1996) The Biochemical Journal 271: 1544-1550 (1996)]. Очищений фермент може бути використаний для моніторінгу інгібіторів активності, як представлено нижче: очищений рrоММР13 активували при використанні 1мМ амінофеніл ртутної кислоти (АРМА), протягом 20 годин при температурі 21°С; активовану ММР13 (11,25нг на аналіз) інкубували протягом 4-5 годин при температурі 35°С у буфері для аналізу (0,1Μ Трис-НСІ, рН 7,5, що містить 0,1Μ NaCI, 20мМ СаСІ2, 0,02мМ ZnCI та 0,05% (мас/об.) Brij 35 при використанні синтетичного субстрату 7-метоксикумарин-4-іл)ацетил. Pro.Leu.Gly.Leu.N-3-(2,4-динітрофеніл)-L-2,3діамінопропіоніл.АІа.Аrg.NН2 у присутності або при відсутності інгібіторів. Активність визначали шляхом вимірювання флуоресценції при lекс 328нм та lем 393нм. Шляхом вимірювання активності в інтервалі концентрацій одержували криву зв'язування, з якої можна визначити значення ІС50, це значення є концентрацією інгібітора, при якій активність ферменту знижується на 50%. При цьому слід враховувати, що фармакологічні властивості сполук згідно з даним винаходом будуть варіювати в залежності від їх структури, але у загальному випадку сполуки згідно з винаходом демонструють інгібіторну активність стосовно колагенази 3, як визначено за допомогою описаного вище аналізу при ІС50 концентраціях в інтервалі від 0,01 до 1000нМ. Приведена нижче таблиця показує значення ІС50 для характерного відбору сполук згідно з 81491 20 винаходом при дослідженні їх за допомогою описаного вище аналізу. Сполука згідно з формулою І може використовуватися у комбінації з іншими лікарськими засобами та терапіями, що застосовуються для лікування хворобливих станів, які полегшуються шляхом інгібування метапопротеїназ, зокрема, колагенази 3 (ММР13). Наприклад, сполука згідно з формулою І може використовуватися у комбінації з лікарськими засобами та терапіями, які використовуються при лікуванні ревматоїдного артриту, астми, запального захворювання кишечника, розсіяного склерозу, AIDS, септичного шоку, застійної серцевої недостатності, ішемічної хвороби серця, псоріазу та інших хворобливих станів, що згадані раніше у цьому описі. Наприклад, завдяки її здатності інгібувати металопротеїнази сполука формули І є цінною при лікуванні певних запальних та незапальних захворювань, які зараз лікуються за допомогою лікарських засобів на основі нестероїдних протизапальних інгібіторів циклооксигенази (NSAID), таких, як індометацин, кеторолак, ацетилсаліцилова кислота, ібупрофен, суліндак, толметин та піроксикам. Сумісне ведення сполуки згідно з формулою І згідно з даним винаходом з NSAID може приводити до зменшення кількості останнього агенту, що необхідний для забезпечення терапевтичного ефекту. Таким чином, ймовірність шкідливих побічних ефектів, NSAID, таких, як шлунково-кишкові ефекти, знижується. Таким чином, згідно з додатковою характеристикою даного винаходу забезпечується фармацевтична композиція, яка включає сполуку згідно з формулою І або її фармацевтично прийнятну сіль у поєднанні з нестероїдним протизапальним агентом, що має інгібіторну активність стосовно циклооксигенази, та фармацевтично прийнятний розріджувач або носій. Сполука формули І може також використовуватися разом з протизапальними агентами, такими, як інгібітор ферменту 5ліпооксигенази. Сполука формули І може також використовуватися при лікуванні станів, таких, як ревматоїдний артрит, у поєднанні з антиартричними агентами, такими, як золото, метотрексат, стероїди та пеніцилінамін, а також 21 станів, таких, як остеоартрит, у комбінації зі стероїдами. Сполука формули І може також вводитися при захворюваннях, пов'язаних з деградацією, наприклад, при остеоартриті, разом з хондропротективними, антидеградативними та/або репаративними агентами, такими, як діацереїн, композиції гіалуронової кислоти, такі, як гіалан, румалон, артепарон та солі глюкозаміну, такі, як антрил. Сполука формули І може використовуватися при лікуванні астми у комбінації з протиастматичними агентами, такими, як стероїди, бронходилятори та антагоністи лейкотрієну. Зокрема, для лікування запальних захворювань, таких, як ревматоїдний артрит, остеоартрит, псоріаз, запальне захворювання кишечника, хронічне обструктивне легеневе захворювання, астма та алергічний риніт, сполука згідно з даним винаходом може бути поєднана з агентами, такими, як інгібітори TNF-a, такі, як антиTNF моноклональні антитіла (такі, як ремікад, CDP-870 та D.sub2.E.sub7.) та імуноглобуліновими молекулами рецепторів TNF (такими, як Enbrel.reg.), неселективними інгібіторами СОХ1/СОХ-2 (такими, як піроксикам, диклофенак, пропіонові кислоти, такі, як напроксен, флубіпрофен, фенопрофен, кетопрофен та ібупрофен, фенамати, такі, як мефенамінова кислота, індометацин, суліндак, апазон, піразолони, такі, як фенілбутазон, саліцилати, такі, як аспірин), інгібіторами СОХ-2 (такими, як мелоксикам, целекоксиб, рофекоксиб, валдекоксиб та еторикоксиб), низькими дозами метотрексату, лефуноміду; циклезоніду; гідроксихлороквіну, d-пенілиламіну, ауронофіну або парентеральним чи оральним золотом. Даний винахід також додатково відноситься до комбінації сполуки формули І разом з інгібітором біосинтезу лейкотріенів, інгібітором 5ліпоксигенази (5-LO) або антагоністом білка, що активує 5-ліпоксигеназу (FLAP), таким, як зілейтон; АВТ-761; фенлейтоном; тепоксаліном; Абботт79175; Абботт-85761; N-(5-заміщені)-тіофен-2алкілсульфонамідами; 2,6-ди-третбутилфенолгідразонами; метокситетрагідропіранами, такими, як Зенека ZD2138; сполукою SB-210661; піридинілзаміщеними сполуками 2-ціанонафталену, такими, як L739,010; сполуками 2-ціанохіноліну, такими, як L746,530; сполуками індолу та хіноліну, такими, як МК-591, МК-886 та BAY x 1005. Даний винахід також відноситься до комбінації сполуки формули І разом з антагоністом рецептора для лейкотрієнів LTB.sub4., LTC.sub4., LTD.suM. та LTE.sub4., вибраним з групи, яка складається з фенотіазин-3-онів, таких, як L651,392; сполук амідино, таких, як CGS-25019c; бензоксаламінів, таких, як онтазоласт; бензолкарбоксімідамідів, таких, як BEL 284/260; та сполук таких, як зафірлукаст, аблукаст, монтелукаст, пранлукаст, верлукаст (МK-679), RG12525, Ro-245913, іралукаст (CGP 45715А) та BAY x 7195. 81491 22 Даний винахід також відноситься до комбінації сполуки формули І разом з інгібітором PDE4, включаючи інгібітори ізоформи PDE4D. Даний винахід також відноситься до комбінації сполуки формули І разом з антагоністами антигістамінового рецептора H.subl., такими, як цетиризин, лоратадин, дезлоратидин, фексофенадин, астемізол, азеластин та хлорфенірамін. Даний винахід також відноситься до комбінації сполуки формули І разом з рецептором гастропротективного рецептора H.sub2. Даний винахід також відноситься до комбінації сполуки формули І разом з вазоконстрикторам симпатоміметичним агентом агоністом адреноцептора a.sub1. та a.sub2., таким, як пропілгекседрин, фенілефрин, фенілпропаноламін, псевдоефедрин, гідрохлорид нафазоліну, гідрохлорид оксиметазоліну, гідрохлорид тетрагідрозоліну, гідрохлорид ксилометазоліну та гідрохлорид етилнорепінефрину. Даний винахід також відноситься до комбінації сполуки формули І разом з антихолінергічними агентами, такими, як бромід іпратропію; бромід тіотропію; бромід окситропію; пірензепін та телензепін. Даний винахід також відноситься до комбінації сполуки формули І разом з агоністами адреноцептора від b.sub1 до b.sub4., такими, як метапротеренол, ізопротеренол, ізопреналін, альбутерол, сальбутанол, формотерол, сальметерол, тербутапін, орципреналін, мезилат бітолтеролу та пірбутерол; або метилксантаніни, включаючи теофілін та амінофілін; кромоглікат або антагоніст мускаринового рецептора (М1, М2 та М3). Даний винахід також відноситься до комбінації сполуки формули І разом з міметиком інсуліноподібного фактора росту типу І (IGF-1). Даний винахід також відноситься до комбінації сполуки формули І разом з глюкортикоїдом зі зниженими систематичними побічними ефектами, який вводиться шляхом інгаляції, таким, як преднізон, преднізолон, флунізолід, триамцинолон ацетонід, беклометазон дипропіонат, будезонід, флутіказон пропіонат та мометазон фуроат. Даний винахід також відноситься до комбінації сполуки формули І разом з іншими модуляторами функції хемокінового рецептора, такими, як CCR1, CCR2, CCR2A, CCR2B, CCR3, CCR4, CCR5, CCR6, CCR7, CCR8, CCR9, CCR10 та CCR11 (для родини С-С); CXCR1, CXCR3, CXCR4 та CXCR5 (для родини С-Х-С) та CX3CRI для родини С-Х3-С. Даний винахід також відноситься до комбінації сполуки формули І разом з антивірусними агентами, такими, як вірацепт, AZT, ацикловір та фамцикловір, та сполуками проти сепсису, такими, як валант. Даний винахід також відноситься до комбінації сполуки формули І разом з серцево-судинними агентами, такими, як блокатор кальцієвих каналів, агентами, які знижують вміст ліпідів, такими, як статини, фібрати, бета-блокатори, інгібітори Асе, 23 антагоністи рецептора ангіотензина-2 та інгібітори агрегації тромбоцитів. Даний винахід також відноситься до комбінації сполуки формули І разом з агентами ЦНС, такими, як антидепресанти (такі, як сертралін), антипаркінсонічними лікарськими засобами (такими, як депреніл, L-допа, реквіп, мірапекс, інгібіторами МАОВ, такими, як селегін та разагілін, інігібіторами соmР, такими, як тасмар, інгібіторами А-2, інгібіторами зворотного поглинання допаміну, антагоністами NMDA, агоністами нікотину, допаміновими агоністами та інгібіторами нейронної синтази оксиду азоту) та лікарськими засобами проти хвороби Альцгеймера, такими, як донепезіл, такрин, інгібітори СОХ-2, пропентофілін або метрифонат. Даний винахід також відноситься до комбінації сполуки формули І разом з (і) інгібіторами триптази; (іі) антагоністами фактора, що активує тромбоцити (PAF); (ііі) інгібіторами ферменту, що перетворює інтерлейкін (ICE); (iv) інгібіторами IMPDH; (ν) інгібіторами молекули адгезії, включаючи антагоністи VLA-4; (vi) катепсинами, (vii) інгібіторами МАР кінази; (viii) інгібіторами глюкоза-6 фосфат дегідрогенази; (іх) антагоністами рецепторів кініну B.sub1. та B.sub2.; (x) антилодагричними агентами, наприклад, колхіцином; (хі) інгібіторами ксантиноксидази, наприклад, алопуринолом; (хіі) урикозурічними агентами, наприклад, пробенецидом, сульфінпіразоном та бензбромароном (хііі) агентами, що стимулюють виділення ростового гормону; (xiv) трансформуючим фактором росту (TGFb); (xv) ростовим фактором тромбоцитів (PDGF); (xvi) ростовим фактором фібробластів, наприклад, основним фактором росту фібробластів (bFGF); (xvii) фактором стимуляції росту фанулоцитів-макрофагів (GM-CSF); (xviii) капсаїциновим кремом; (хіх) антагоністом рецептора ташикініну NK.sub1. та NK.sub3., вибраним з групи, яка складається з NKP-608C; SB-233412 (талнетант); та D-4418; (хх) інгібіторами еластази, вибраними з групи, яка складається з UT-77 та ZD-0892; (ххі) інгібіторами ферменту, що перетворює TNFa (TACE); (ххіі) інгібіторами синтази, що активується оксидом азоту (iNOS) або (ххііі) хемоатрактантною молекулою, що гомологічна рецептору, яка експресується на клітинах ТН2, (антагоністи CRTH2). Сполука формули І може також використовуватися у комбінації з агентами проти остеопорозу, такими, як ролоксифен, дролоксифен, лазофоксифен або фозомакс, та імуносупресивними агентами, такими, як FK-506, рапаміцин, циклоспорин, азатіоприн та метотрексат. Сполука формули І може також використовуватися у комбінації з існуючими терапевтичними агентами для лікування остеоартриту. Прийнятні агенти, що використовуйся у комбінації, включають стандартні нестероїдні протизапальні агенти (що далі називаються NSAID), такі, як піроксикам, диклофенак, пропіонові кислоти, такі, як напроксен, флубіпрофен, фенопрофен, 81491 24 кетопрофен та ібупрофен, фенамати, такі, як мефенамінова кислота, індометацин, суліндак, апазон, піразолони такі, як фенілбутазон, саліцилати, такі, як аспірин, інгібітори СОХ-2, такі, як целекоксиб, валдекоксиб, рофекоксиб та еторикоксиб, анальгетики та внутрішньосублобовими терапіями, такими, як кортикостероїди та гіапуронові кислоти, такі, як гіалан та синвіск, та антагоністами рецептора Р2Х7. Сполука формули І також може використовуватися у комбінації з існуючими терапевтичними агентами для лікування раку. Прийнятні агенти, які використовуються у комбінації, включають: (і) антипроліферативні/антинеопластичні лікарські засоби та їх комбінації, як це використовується у медичній онкології, такі, як алкілувальні агенти (наприклад, цисплатин, карбоплатин, циклофосфамід, гірчичний газ, мелфалан, хлорамбуцил, бузулпан та нітрозосечовини); антиметаболіти (наприклад, антифолати, такі, як фторпіримідини, подібні 5фторурацилу та тегафуру, ралтитрексед, метотрексат, цитоцин арабінозид, гідроксисечовина, гемцитабін та паклітаксел (ТаксолÒ); протипухлинні антибіотики (наприклад, антрацикліни, подібні до адріаміцину, блеоміцину, доксорубіцину, даунорубіцину, епірубіцину, мітоміцину-С, дактиноміцину та нітраміцину); антимітотичні агенти (наприклад, алкалоїди барвінка, подібні вінкристину, вінбластину, віндезину та вінорелбіну, та таксоїди, подібні таксолу та таксотере); інгібітори топоізомерази (наприклад, епіподофілотоксини, подібні етопозиду та теніпозиду, амсакрину, топотекану та камптотецину); (іі) цитостатичні агенти, такі, як антиестрогени (наприклад, тамоксифен, тореміфен, ралоксифен, дролоксифен та йодоксифен), знижуючі регулятори естрогенового рецептора (наприклад, фулвестрант), антиандрогени (наприклад, бікалутамід, фултамід, нілутамід та ципротерон ацетат), антагоністи LHRH або агоністи LHRH (наприклад, гозерелін, лейпрорелін та бузерелін), прогестогени (наприклад, мегестрол ацетат), інгібітори ароматази (наприклад, такі, як анастразол, лейтрозол, воразол та екземестан) та інгібітори 5a-редуктази, такі, як фінастерид; (ііі) агенти, які інгібують інвазію ракових клітин (наприклад, інгібітори металопротеїнази, подібні марімастату та інгібіторам функції активатора рецептора урокіназного плазміногену); (iv) інгібітори функції фактора росту, такі інгібітори включають, наприклад, антитіла до фактора росту, антитіла до рецептора фактора росту (наприклад, анти-еrbb2 антитіло трастузумаб [ГерцептинÔ] та анти-еrbb2 антитіло цетуксимаб [С225]), інгібітори фарнезилтрансферази, інгібітори тирозинкінази та інгібітори серин/треонін кінази, наприклад інгібітори родини епідермального фактора росту (наприклад, родина EGFR інгібіторів тирозинкінази, такі, як N-(3-хлор-4-фторфеніл)-7метокси-6-(3-морфолінпропокси)хіназолін-4-амін 25 (гефітініб, A2D1839), N-(3-етенілфеніл)-6,7-біс(2метоксиетокси)хінозалолін-4-амін (ерлотініб, OSI774) та 6-акриламідо-N-(3-хлор-4-фторфеніл)-7-(3морфолінопропокси)хінозалолін-4-амін (СІ 1033)), наприклад, інгібітори родини фактора росту тромбоцитів, та інгібітори родини фактора росту гепатоцитів; (ν) антиангіогенні агенти, такі, як ті, що інгібують ефекти фактора росту судинного ендотелію (наприклад, антитіло до фактора росту судинного ендотелію бевацизумаб [авастинÔ], сполуки такі, як ті, що описані в міжнародних заявках [WO 97/22596, WO 97/30035, WO 97/32856 та WO 98/13354]) та сполуки, що діють у відповідності з іншими механізмами (наприклад, ліномід, інгібітори функції anb інтегрину та ангіостатин); (vi) агенти, що пошкоджують судини, такі, як комбретастатин А4 та сполуки, розкриті в міжнародних заявках [WO 99/02166, WO00/40529, WO 00/41669, WO01/92224, WO02/04434 та WO02/08213]; (vii) антисмислові терапії, наприклад, ті, які направлені на мішені, приведені нижче, такі, як ISIS 2503, анти-ras антисмислова терапія; (viii) підходи генної терапії, включаючи, наприклад, підходи, що мають на меті заміну аберантних генів, таких, як аберантний р53 або аберантний BRCA1 або BRCA2, GDERT (геннаправлена ферментативна пролікарська терапія) підходи, такі, як ті, що використовують цитозиндезаміназу, тимідинкіназу або бактеріальний нітроредуктазний фермент, та підходи для підвищення толерантності пацієнта до хіміотерапії або радіотерапії, такі, як генна терапія резистентності на різноманітні лікарські засоби; та (іх) імунотерапевтичні підходи, включаючи, наприклад, підходи, ex-vivo та in-vivo для підвищення імуногенності пухлинних клітин пацієнта, такі, як трансфекція цитокінами, такими, як інтерлейкін 2, інтерлейкін 4 або фактор стимуляції гранулоцитів-макрофагів, підходи для зниження Т-клітинної анергії, підходи при використанні трансфікованих імунних клітин, таких, як цитокін-трансфіковані дендритні клітини, підходи при використанні цитокін-трансфікованих ліній пухлинних клітин та підходи при використанні анти-ідіотипічних антитіл. При рецептуванні у вигляді фіксованої дози таких комбінаційних продуктів використовують сполуку формули І у межах дозового інтервалу, що описаний у даній заявці, та інший фармацевтично активний агент у межах схваленого дозового інтервалу. Послідовне використання застосовують у випадку, коли комбінаційна композиція є неприйнятною. Незважаючи на те, що сполука формули І перш за все є цінним терапевтичним агентом для застосування у теплокровних тварин (включаючи людину), вона також є корисною кожного разу, коли необхідно інгібувати ефекти металопротеїнази. Таким чином, вона також є корисною як фармакологічний стандарт для використання при розробці нових біологічних 81491 26 аналізів та при пошуку нових фармакологічних агентів. Винахід далі ілюструється наступними необмежуючими прикладами. Відповідні вихідні матеріали є комерціно доступними або можуть бути одержані за допомогою будь-якого традиційного способу, як описано у літературі, або як відомо спеціалісту у галузі хімії, або як описано у Прикладах, що приведені у даній заявці. Крім того, наступна таблиця показує деталі проміжних сполук та їх відповідні реєстраційні номери у Chemical Abstracts. Реєстраційний номер згідно з Chemical Abstracts 5-йод-2-[4(метилсульфоніл)піперазин -1-іл]піримідин 497915-65-8 етил 4-піримідин-2ілбутаноат 459818-75-8 4-піримідин-2-ілбутаналь 260441-10-9 етил 3-піримідин-2ілпропаноат 459818-76-9 У прикладах спектри ядерного магнітного резонансу (ЯМР) були виміряні при кімнатній температурі на спектрометрі BRUKER DPX, що працює при силовому полі 400МГц, якщо не вказано інше. Для спектрів базовим було внутрішнє блокування дейтерію. Спектри масспектроскопії (МС) вимірювали на спектрометрі Micromass MZD (електророзпилення) Використовувалися наступні абревіатури: ДХМ дихлорметан ТГФ тетрагідрофуран лгмдс гексаметилдисилазид літію ДМСО диметилсульфоксид ТФО трифтороцтовакислота Приклад 1 Гідрокси{(1S)4-піримідин-2-іл-1-[({4-[5-(2,2,2трифторетокси)піримідин-2-іл]піперазин-1іл}сульфоніл)метил]бутил}формамід До мурашиної кислоти (114мл, 3,03моля) при 0°С додавали оцтовий ангідрид (28,6мл, 0,303моля) та суміш перемішували при кімнатній температурі протягом 10 хвилин. Реакційну суміш потім охолоджували до температури 0°С та додавали до розчину 2-(4-{[2-(гідроксіаміно)-5піримідин-2-ілпентил]сульфоніл}піперазин-1-іл)-5(2,2,2-трифторетокси)піримідин (30,6г, 60,5ммоля) та мурашину кислоту (114мл, 3,03моля) в ТГФ (600мл). Реакційну суміш витримували при кімнатній температурі та перемішували протягом однієї години. Леткі речовини видаляли у вакуумі, а залишок азеотропно відганяли з толуолом (2x300мл). Потім залишок розчиняли у метанолі (300мл) та нагрівали до температури 40°С 27 протягом однієї години. Потім розчин охолоджували до кімнатної температури та концентрували у вакуумі. Після цього залишок очищали за допомогою флеш-хроматографії (силікагель, 10% МеОН в EtOAc) з одержанням рацемічної сполуки у вигляді світлооранжевої піни (22,94г, 43ммоля, 71%). Рацемічну суміш розділяли за допомогою хіральної ВЕРХ, використовуючи умови, представлені нижче: Колонка 20мкм Chiralpak AD, Merck 100мм Елюент MeCN/MeOH 90/10 (7хв., ізократично) MeCN/MeOH 90/10 (етап) MeCN/MeOH 85/15 (10хв., ізократично) MeCN/MeOH 85/15 (градієнт, 1хв.) MeCN/EtOH 85/15 (ізократично, 37хв.). Витікання 120мл/хв. Єдиний енантіомер може бути одержаний у кристалічній формі при використанні наступної процедури. 40г вказаної у назві сполуки перемішували з етанолом (50мл) при кімнатній температурі протягом 30 хвилин. Розчинник видаляли у вакуумі. Одержану тверду речовину перемішували в ацетоні (20мл) при кімнатній температурі протягом 24 годин. Розчинник видаляли потоком аргону, а потім у вакуумі. 1 Н ЯМР (ДMCO-D6, 373К): 9,39 (шс, 1Н), 8,67 (д, 2Н), 8,32 (с, 2Н), 8,15 (шс,1Н), 7,28 (т, 1Η), 4,70 (к, 2Η), 4,39 (шс,1Н), 3,79 (м, 4Н), 3,47 (дд, 1Н), 3,29 (м, 4Н), 3,17 (дд, 1Н), 2,91 (м, 2Н), 1,75 (м, 4Η); MS (ESI): 534,01 (ΜΗ+); Т. п. 129-133°С. Вихідний матеріал готували так, як описано нижче: До перемішаної суспензії 5-йод-2-[4(метилсульфоніл)піперазин-1-іл]піримідину (25,0г, 67,9ммоля), бензилового спирту (125мл), 1,10фенантроліну (2,45г, 20моля%) та карбонату цезію додавали йодид міді (І) (12,9г, 67,9ммоля), та реакційну суміш нагрівали до температури 110°С протягом 90 хвилин, а потім охолоджували до кімнатної температури. Потім додавали ДХМ (250мл), та нерозчинні сполуки відфільтровували через целітову прокладку. Прокладку промивали за допомогою ДХМ (250мл) та фільтрати ДХМ промивали водою. Після цього водну фазу повторно екстрагували з більшою кількістю ДХМ (500мл), поєднані екстракти ДХМ промивали за допомогою насиченого сольового розчину (500мл), висушували (MgSO4), фільтрували та концентрували у вакуумі з одержанням темнокоричневого осаду. Цей осад потім очищали за допомогою флеш-хроматографії (силікагель, 50% EtOAc/гексани) з одержанням 5-(бензилокси)2-[4-(метилсульфоніл)піперазин-1-іл]піримідин у вигляді не зовсім білої твердої речовини (14,2г, 40,7ммоля, 60%). 1 Н ЯМР (CDCI3): 8,20 (с, 2Н), 7,49 (м, 5Н), 5,05 (с, 2Н), 3,88 (м, 4Н), 3,30 (м, 4Н), 2,79 (с, 3Н); MS (ESI): 349,08 (MH+). 5-(бензилокси)-2-[4(метилсульфоніл)піперазин-1-іл]піримідин (57,9г, 0,17моля) розчиняли в ТГФ (600мл) та реакційну суміш нагрівали до температури кипіння при 81491 28 перемішуванні протягом 7 годин, а потім охолоджували до кімнатної температури.ТГФ видаляли у вакуумі, а залишок азеотропно відганяли з толуолом (2x300мл). Одержану тверду речовину розтирали з ДХМ, відфільтровували, промивали за допомогою етеру та висушували з одержанням 2-[4-(метилсульфоніл)піперазин-1іл]піримідин-5-олу у вигляді світложовтої твердої речовини (54,4г, 0,15моля, 88%, сіль ТГФ). 1 Н ЯМР (ДMCO-D6): 8,02 (с, 2Н), 3,68 (м, 4Н), 3,12 (м, 4Н), 2,86 (с, 3Η). До перемішаної суспензії 2-[4(метилсульфоніл)піперазин-1-іл]піримідин-5-олу (53,5г, 0,145моля), K2СО3 (100,1г, 0,725моля) в ацетоні (1л) додавали 2,2,2трифторетилнонафторбутансульфонат (78г, 0,203моля) та реакційну суміш нагрівали до температури 60°С протягом 6 годин, потім охолоджували до кімнатної температури. Після цього реакційну суміш фільтрували та фільтрат випарювали до осушення. Залишок розділяли між ДХМ (500мл) та водою (500мл), екстрагували за допомогою ДХМ (500мл), поєднані органічні фази промивали за допомогою насиченого сольового розчину (500мл), висушували (MgSO4), фільтрували та концентрували у вакуумі з одержанням 2-[4-(метилсульфоніл)піперазин-1-іл]5-(2,2,2-трифторетокси)піримідину у вигляді білуватої твердої речовини (45,3г, 0,133моля, 92%). 1 Н ЯМР (CDCI3): 8,15 (с, 2Н), 4,32 (м, 2Н), 3,90 (м, 4Н), 3,30 (м, 4Н), 2,78 (с, 3Η); MS (ESI): 341,08 (MH+). Спосіб 1 До перемішаної суспензії 2-[4(метилсульфоніл)піперазин-1-іл]-5-(2,2,2трифторетокси)піримідину (8,05г, 23,6ммоля) в ТГФ (175мл) при температурі -78°С додавали ЛГМДС (47,2мл, 47,2ммоля) по краплях та реакційну суміш перемішували протягом 15 хвилин. Потім додавали розчин етил 4-піримідин2-ілбутаноату (5,5г, 28,3ммоля) в ТГФ (50мл) при температурі -78°С, підігрівали до -20°С та перемішували протягом 2 годин. Потім зупиняли реакцію шляхом додання насиченого розчину NH4CI (250мл), двічі екстрагували за допомогою EtOAc (2x250мл), промивали поєднані органічні фази за допомогою насиченого сольового розчину (250мл), висушували (MgSO4), фільтрували та концентрували у вакуумі з одержанням а жовтої твердої речовини. Цю речовину очищали за допомогою флеш-хроматографії (силікагель, 50% EtOAc/гексани) з одержанням 5-піримідин-2-іл-1({4-[5-(2,2,2-трифторетокси)піримідин-2іл]піперазин-1-іл}сульфоніл)пентан-2-ону у вигляді білуватої твердої речовини (9,47г, 19,4ммоля, 82%). 1 Н ЯМР (CDCI3): 8,66 (д, 2Н), 8,16 (с, 2Н), 7,12 (т, 1Н), 4,30 (м, 2Н), 4,00 (с, 2Н), 3,82 (м, 4Н), 3,34 (м, 4Н), 2,98 (т, 2Н), 2,85 (т, 2Н), 2,16 (м, 2Н); MS (ESI): 489,02 (MH+). До перемішаного розчину 5-піримідин-2-іл-1({4-[5-(2,2,2-трифторетокси)піримідин-2іл]піперазин-1-іл}сульфоніл)пентан-2-ону (9,47г, 19,4ммоля) в ДХМ/МеОН (100мл/100мл) додавали 29 NaBH4 (807мг, 21,3ммоля) порціями та реакційну суміш перемішували при кімнатній температурі. Реакцію зупиняли шляхом додання насиченого розчину NH4CI (250мл) та органічну фазу видаляли у вакуумі. Водний залишок потім екстрагували за допомогою EtOAc (2х250мл), поєднані органічні фази промивали за допомогою насиченого сольового розчину (250мл), висушували (MgSO4), фільтрували та концентрували у вакуумі з одержанням 5піримідин-2-іл-1-({4-[5-(2,2,2трифторетокси)піримідин-2-іл]піперазин-1іл}сульфоніл)пентан-2-олу у вигляді білої твердої речовини (9,10г, 18,6ммоля, 96%). MS (ESI): 491,13 (МН+). До перемішаного розчину 5-піримідин-2-іл-1({4-[5-(2,2,2-трифторетокси)піримідин-2іл]піперазин-1-іл}сульфоніл)пентан-2-олу (9,10г, 18,6ммоля), триетиламіну (13мл, 93,0ммоля) в ДХМ (200мл) при температурі 0°С додавали метансульфонілхлорид (2,16мл, 27,9ммоля). Реакційну суміш перемішували при 0°С протягом 15 хвилин, підігрівали до кімнатної температури та перемішували протягом 16 годин. Після цього реакційну суміш промивали водою (200мл) та водну фазу повторно екстрагували за допомогою ДХМ (200мл). Поєднані екстракти ДХМ промивали за допомогою насиченого сольового розчину (250мл), висушували (MgSO4), фільтрували та концентрували у вакуумі з одержанням 2-(4-{[(1Е)5-піримідин-2-ілпент-1-ен-1іл]сульфоніл}піперазин-1-іл)-5-(2,2,2трифторетокси)піримідину у вигляді оранжевої твердої речовини (8,79г, 18,6ммоля, 100%). MS (ESI): 472,49 (МН+). До перемішаного розчину 2-(4-{[(1Е)-5піримідин-2-ілпент-1-ен-1-іл]сульфоніл}піперазин1-іл)-5-(2,2,2-трифторетокси)піримідину (8,79г, 18,6ммоля) в ТГФ (90мл) додавали 50% водного розчину гідроксиламіну (18мл) та реакційну суміш перемішували при кімнатній температурі протягом 2 годин. Після цього додавали насичений розчин NH4CI (200мл), а потім одержаний розчин двічі екстрагували з екстрагованим за допомогою EtOAc (2х250мл), поєднані органічні фази промивали за допомогою насиченого сольового розчину (250мл), висушували (MgSO4), фільтрували та концентрували у вакуумі з одержанням 2-(4-{[2(гідроксиаміно)-5-піримідин-2ілпентил]сульфоніл}піперазин-1-іл)-5-(2,2,2трифторетокси)піримідину у вигляді світложовтої твердої речовини (8,96г, 17,7ммоля, 95%). MS (ESI): 506,05 (МН+). Спосіб 2 До перемішаної суспензії 2-[4(метилсульфоніл)піперазин-1-іл]-5-(2,2,2трифторетокси)піримідину (850мг, 2,50ммоля) в ТГФ (25мл) при температурі -78°С додавали ЛГМДС (5,5мл, 5,5ммоля) по краплях та реакційну суміш перемішували протягом 15 хвилин. Потім додавали діетилхлорфосфат (0,4мл, 2,75ммоля) та перемішували протягом 15 хвилин. Потім до розчину по краплях додавали розчин 4-піримідин2-ілбутаналю (413мг, 2,75ммоля) в ТГФ (5мл), залишали нагріватися до температури -20°С та 81491 30 перемішували протягом 1 години. Реакцію зупиняли шляхом додання насиченого розчину NH4CI (100мл), двічі екстрагували за допомогою EtOAc (2х100мл), поєднані органічні фази промивали за допомогою насиченого сольового розчину (100мл), висушували (MgSO4), фільтрували та концентрували у вакуумі з одержанням а жовтого масла. Це масло потім очищали за допомогою флеш-хроматографії (силікагель, 50% EtOAc/гексани) з одержанням 2(4-{[(1Е)-5-піримідин-2-ілпент-1-ен-1іл]сульфоніл}піперазин-1-іл)-5-(2,2,2трифторетокси)піримідину у вигляді жовтої твердої речовини (1,13г, 2,39ммоля, 96%). MS (ESI): 472,49 (МН+). Одержаний матеріал перетворювали до 2-(4{[2-(гідроксиаміно)-5-піримідин-2ілпентил]сульфоніл}піперазин-1-іл)-5-(2,2,2трифторетокси)піримідину та далі до гідрокси{(1S)4-піримідин-2-іл-1-[({4-[5-(2,2,2трифторетокси)піримідин-2-іл]піперазин-1іл}сульфоніл)метил]бутил}формаміду шляхом такої самої процедури, як описано у Способі 1. Приклад 2 Також одержували наступні сполуки. Приклад 3 Гідрокси{(1S)-3-піримідин-2-іл-1-[({4-[5-(2,2,2трифторетокси)піридин-2-іл]піперазин-1іл}сульфоніл)метил]пропіл}формамід До мурашиної кислоти (54мл, 1,4моля) при температурі 8°С додавали оцтовий ангідрид (11мл, 100ммоля) та суміш перемішували при кімнатній температурі протягом 10 хвилин. Змішаний ангідрид потім охолоджували до температури 8°С та додавали до попердньо охолодженого до температури 0°С розчину, що містить 2-[3-(гідроксиаміно)-4-({4-[5-(2,2,2трифторетокси)піридин-2-іл]піперазин-1іл}сульфоніл)бутил]піримідин (16,32г, 33,3ммоля) в ДХМ (170мл) та мурашину кислоту (65мл, 1,7моля). Реакційну суміш витримували при кімнатній температурі та перемішували протягом 31 однієї години. Леткі речовини видаляли у вакуумі та залишок азеотропно відганяли з толуолом (2x50мл). Залишок потім розчиняли в МеОН/ДХМ (1:1, 250мл) та перемішували протягом ночі при кімнатній температурі. Після цього розчин концентрували у вакуумі та розділяли на частини між ДХМ (250мл) та насиченим NаНСО3 (250мл). Шар ДХМ потім фільтрували через силікагель (20г), промивали за допомогою 5% МеОН/ДХМ та видаляли леткі речовини у вакуумі з одержанням рацемічної сполуки, вказаної у назві, у вигляді світложовтої піни (15,68г, 302ммоля, 91%). Рацемічну суміш розділяли (86,5г) на енантіомери за допомогою хіральної ВЕРХ при використанні наступних умов: Колонка 20мкм Chiralpak AD, Merck 100ммЕлюєнт MeCN/MeOH 90/10(17хв., ізократичний) МеСN/МеОН 90/10 (етап) MeCN/EtOH 90/10 (8хв., ізократичний) MeCN/EtOH 90/10 (градієнт, 1хв.) MeCN/EtOH 85/15 (ізократичний, 39хв.). Витікання 120мл/хв. Концентрували у вакуумі з одержанням піни. Викристалізовували з гарячого етанолу (430мл), фільтрували та промивали за допомогою етанолу та етеру. Висушували з одержанням вказаної у назві сполуки у вигляді білої кристалічної твердої речовини (28г, 54ммоля). 1 Н ЯМР (ДМСО, 373К): 9,41 (с, 1Н), 8,66 (д, 2Н), 8,07 (с, 1Н), 7,99 (д, 1Н), 7,38 (дд, 1Н), 7,26 (т, 1Н), 6,83 (д, 1Н), 4,61 (к, 2Н), 4,45 (В, 1Н), 3,51 (т, 4Н), 3,47 (д, 1Н), 3,27 (т, 4Н), 3,24 (д, 1Н), 2,91 (т, 2Н), 2,17 (м, 2Н); MS(ESI):519(MH+); Т.п. 149-151°С. Вихідний матеріал одержували так, як описано нижче: Ретельно перемішували суспензію 1-(5бромпіридин-2-іл)піперазину (номер CAS 7340697-0, 116г, 479ммоля), 1,10-фенантроліну (17,3г, 96ммоля), карбонату цезію (312г, 960ммоля) та йодиду міді (І) (91г, 480ммоля) у бензиловому спирті (960мл). Перемішування здійснювали при температурі 120°С в інертній атмосфері протягом 24 годин, потім додавали аліквоти йодиду міді (І) (5x91г) кожну годину. Охолоджували до температури 40°С та розводили за допомогою ДХМ (1л) при перемішуванні при кімнатній температурі протягом 30 хвилин. Фільтрували через целіт, ретельно промивали за допомогою ДХМ (500мл). Фракції промивали за допомогою NaOH (2M, 300мл), поєднували та екстрагували за допомогою НСІ (2М, 5x1л). Поєднані кислотні екстракти промивали за допомогою ДХМ (500мл), Охолоджували до температури 0°С та екстрагували в ДХМ (1л), повільно підлужуючи за допомогою NaOH (~46ваг.%) до рН10. Водний шар додатково екстрагували за допомогою ДХМ (2x500мл та видаляли . леткі речовини у вакуумі з одержанням 1-[5-(бензилокси)піридин-2іл]піперазину у вигляді чорної рідини (104г, 278ммоля, 72ваг.%, 58%). 81491 32 1 Н ЯМР (CDCI3): 8,0 (д, 1Н), 7,2 (дд, 1Н), 6,3 (д, 1Н), 5,0 (с, 2Н), 3,50 (с, 8Н), 1,48 (с, 9Н), 3,4 (В, 5Н), 3,0 (В, 4Η); MS (ESI): 270 (MH+). Перемішаний розчин 1-[5(бензилокси)піридин-2-іл]піперазину (104г, 278ммоля) в СН2СІ2 (1,1л) при 0°С послідовно обробляли за допомогою триетиламіну (94мл, 672ммоля) та метансульфонілхлориду (31мл, 400ммоля). Реакційну суміш витримували при кімнатній температурі та перемішували протягом 3 годин. Реакційну суміш потім розводили за допомогою ДХМ (3л) та промивали водою (1л), НСІ (0,5М, 2x800мл) та насиченого NaHCO3 (800мл), повторно екстрагували за допомогою ДХМ (500мл). Поєднані органічні екстракти потім висушували (MgSO4), фільтрували та концентрували у вакуумі з одержанням 1-[5(бензилокси)піридин-2-іл]-4(метилсульфоніл)піперазину у вигляді чорної рідини (120г, 278ммоля, 81ваг.%, 100%). 1 Н ЯМР (CDCI3): 8,0 (д, 1Н), 7,35 (м, 5Н), 7,2, (дд, 1Н), 6,65 (д, 1Н), 5,05 (с, 2Н), 3,55 (т, 4Н), 3,3 (т, 4Н), 2,8 (с, 3Н); MS (ESI): 348 (МН+). 1-[5-(бензилокси)піридин-2-іл]-4(метилсульфоніл)піперазин (120г, 278ммоля) розчиняли в ТГФ (1,3л) та реакційну суміш нагрівали до температури кипіння при перемішуванні протягом 3 годин, а потім охолоджували до кімнатної температури. Потім видаляли ТГФ у вакуумі та залишок азеотропно відганяли з толуолом (2x300мл). Одержану рідину розводили за допомогою ДХМ (100мл) та повільно нейтралізували до значення рН 8 за допомогою насиченого розчину NaНСО3 (700мл). Суспензію фільтрували, промивали водою з мінімальною кількістю ДХМ та етеру та висушували з одержанням 6-[4-(метилсульфоніл)піперазин-1іл]піридин-3-олу у вигляді бежевої твердої речовини (69г, 270 моля, 97%). 1 Н ЯМР (ДMCO-D6): 7,7 (д, 1Н), 7,1 (дд, 1Н), 6,75 (д, 1Н), 3,45 (т, 4Н), 3,2 (т, 4Н), 2,85 (с, 3Н); MS (ESI): 257 (МН+). До перемішаної суспензії 6-[4(метилсульфоніл)піперазин-1-іл]піридин-3-олу (69г, 270ммоля), K2СО3 (112г, 810ммоля) в ацетоні (1,8л) додавали 2,2,2-трифторетил нонафторбутансульфонат та/або 2,2,2трифторетил трифторметансульфонат (загальна кількість 324ммоля) та реакційну суміш перемішували протягом 18 годин при кімнатній температурі. Потім реакційну суміш фільтрували та фільтрат випарювали до осушення. Залишок екстрагували між ДХМ (2,5л, 500мл) та водою (1,5л, 300мл), екстрагували за допомогою ДХМ (500мл), висушували (MgSO4) та фільтрували. Концентрували у вакуумі, розводили за допомогою ETOH до мінімального об'єму, фільтрували та висушували з одержанням 1-(метилсульфоніл)-4[5-(2,2,2-трифторетокси)піридин-2-іл]піперазину у вигляді білуватої твердої речовини (62г, 183ммоля, 68%). 33 1 Н ЯМР (CDCI3): 8,0 (д, 1Н), 7,25 (дд, 1Н), 6,65 (д, 1Н), 4,3 (к, 2Н), 3,6 (т, 4Н), 3,35 (т, 4Н), 2,8 (с, 3Н); MS (ESI): 340 (ΜΗ+). До перемішаної суспензії 1-(метилсульфоніл)4-[5-(2,2,2-трифторетокси)піридин-2-іл]піперазину (13,3г, 39,2ммоля) в ТГФ (200мл) при температурі 70°С додавали ЛГМДС (75мл, 75ммоля) по краплях та реакційну суміш перемішували протягом 20 хвилин. Потім додавали розчин етил 3-піримідин-2-ілпропаноату (9,2г, 51ммоля) в ТГФ (55мл) при температурі -70°С, підігрівали до -20°С та перемішували протягом 2 годин. Реакцію зупиняли шляхом додання насиченого розчину NH4CI (250мл), двічі екстрагували за допомогою EtOAc (3x250мл), поєднані органічні фази промивали за допомогою насиченого сольового розчину (250мл), висушували (MgSO4), фільтрували та концентрували у вакуумі з одержанням жовтої твердої речовини. Тверду речовину перемішували протягом 20 хвилин у 20% суміші ізогексан/етер (100мл), фільтрували та промивали за допомогою ізогексану та висушували з одержанням 4-піримідин-2-іл-1-({4[5-(2,2,2-трифторетокси)піридин-2-іл]піперазин-1іл}сульфоніл)бутан-2-ону у вигляді білуватої твердої речовини (15,2г, 32,2ммоля, 82%). 1 Н ЯМР (CDCI3): 8,6 (д, 2Н), 7,95 (д, 1Н), 7,2 (дд, 1Н), 7,1 (т, 1Н), 6,6 (д, 1Н), 4,30 (к, 2Н), 4,15 (с, 2Н), 3,55 (т, 4Н), 3,4 (т, 4Н), 3,35 (т, 2Н), 3,3 (т, 2Н); MS (ESI): 472 (МН+). До перемішаного розчину 4-піримідин-2-іл-1({4-[5-(2,2,2-трифторетокси)піридин-2-іл]піперазин1-іл}сульфоніл)бутан-2-ону (15г, 31,6ммоля) в 10% МеОН/ДХМ (300мл) додавали NaBH4 (0,52г, 15,8ммоля) по краплях та реакційну суміш перемішували при кімнатній температурі протягом 45 хвилин. Реакцію зупиняли шляхом додання насиченого розчину NH4CI (100мл), розводили за допомогою води (150мл) та екстрагували за допомогою ДХМ (3x200мл), поєднані органічні фази висушували (насичений сольовий розчин, MgSO4), фільтрували та концентрували у вакуумі. Після цього розтирали з етером, фільтрували та висушували з одержанням 4-піримідин-2-іл-1-({4[5-(2,2,2-трифторетокси)піримідин-2-іл]піперазин1-іл}сульфоніл)бутан-2-олу у вигляді твердої речовини світложовтого кольору (13,8г, 29,0ммоля, 92%). MS (ESI): 476 (МН+). До перемішаного розчину 4-піримідин-2-іл-1({4-[5-(2,2,2-трифторетокси)піридин-2-іл]піперазин1-іл}сульфоніл)бутан-2-олу (13,7г, 28,8ммоля) в ДХМ (250мл) при 0°С додавали метансульфонілхлорид (2,68мл, 34,6ммоля). Реакційну суміш перемішували при 0°С протягом 20 хвилин перед доданням по краплях триетиламіну (18,1мл, 129ммоля). Підігрівали до кімнатної температури та перемішували протягом 16 годин. Потім реакційну суміш розводили за допомогою ДХМ (1л), промивали водою (150мл) та висушували (насичений сольовий розчин, MgSO4), фільтрували та концентрували у вакуумі. Після цього залишок очищали за допомогою флешхроматографії (кремнезем, 0-5% МеОН в ДХМ) з 81491 34 одержанням 2-[(3Е)-4-({4-[5-(2,2,2трифторетокси)піридин-2-іл]піперазин-1-іл} сульфоніл)бут-3-ен-1-іл]піримідину у вигляді жовтої твердої речовини (11,9г, 18,6ммоля, 90%). MS (ESI): 458 (ΜΗ*). До перемішаного розчину 2-[(3Е)-4-({4-[5(2,2,2-трифторетокси)піридин-2-іл]піперазин-1іл}сульфоніл)бут-3-ен-1-іл]піримідину (10,9г, 23,7ммоля) в ТГФ (200мл) додавали 50% водного розчину гідроксиламіну (11мл) та реакційну суміш перемішували при кімнатній температурі протягом 2 годин. Потім додавали воду (100мл), а після цього екстрагували за допомогою EtOAc (3x100мл) та висушували (насичений сольовий розчин, MgSO4), фільтрували та концентрували у вакуумі з одержанням 2-[3-(гідроксиаміно)-4-({4-[5-(2,2,2трифторетокси)піридин-2-іл]піперазин-1іл}сульфоніл)бутил]піримідину у вигляді світложовтої твердої речовини (11,1г, 22,6ммоля, 96%). MS (ESI): 491 (МН+). Альтернативно вихідний матеріал одержували так, як описано нижче: До перемішаної суспензії 1-(метилсульфоніл)4-[5-(2,2,2-трифторетокси)піридин-2-іл]піперазину (23г, 67,8ммоля, яка одержано так, як описано вище) в ТГФ (450мл) при температурі -65°С, додавали по краплях розчин ЛГМДС в ТГФ (149мл, 1,0Μ розчин, 149ммоля), суміш перемішували протягом 30 хвилин. Після цього додавали діетилхлорфосфат (11,3мл, 78ммоля) та перемішували протягом 1 години. Цей розчином оброблювали шляхом додання по краплях розчину 3-(2-піридиніл)пропальдегіду (12г, 88,1ммоля) в ТГФ (290мл), а потім залишали його нагріватися до температури 0°С протягом 3 годин перед тим, як зупинити реакцію шляхом додання розчину гідроксиламіну (41мл, 50% водний розчин у воді, 680ммоля). Реаційну суміш перемішували протягом 16 годин при кімнатній температурі. Реакційну суміш промивали за допомогою насиченого розчину NH4CI (250мл), повторно екстрагували за допомогою етилацетату (250мл). Потім висушували поєднані органічні екстракти (насичений сольовий розчин та MgSO4), фільтрували та концентрували у вакуумі. Потім залишок обробляли при використанні етеру протягом 1 години, фільтрували та висушували з одержанням 2-[3-(гідроксиаміно)-4-({4-[5-(2,2,2трифторетокси)піридин-2-іл]піперазин-1іл}сульфоніл)бутил]піримідину (31,5г, 64,3ммоля, 95 %). 1 Н ЯМР (CDCI3): 8,65 (д, 2Н), 8,0 (д, 1Н), 7,25 (дд, 1Н), 7,15 (т, 1Н), 6,65 (д, 1Н), 4,3 (к, 2Н), 3,55 (м, 6Н), 3,4 (т, 4Н), 3,2 (т, 2Н), 2,9 (д, 1Н), 2,25 (м, 1Н), 2,1 (м, 1Н); MS (ESI): 491 (МН+). Приклад 4 Гідрокси[(1S)-2-({4-[4-(1,1,2,2тетрафторетокси)феніл]піперазин-1-іл}сульфоніл)1-(тетрагідро-2H-піран-4-іл)етил]формамід До охолодженого льодом розчину 1-{[(2S)-2(гідроксиаміно)-2-(тетрагідро-2H-піран-4іл)етил]сульфоніл}-4-[4-(1,1,2,2тетрафторетокси)феніл]піперазину (52,9г, 35 0,1моля) у змішаній системі розчинників, яка складалася з ТГФ/мурашиної кислоти (1л/20мл) додавали попередньо одержану суміш мурашиної кислоти (19мл) та оцтового ангідриду (65мл). Суміш перемішували при кімнатній температурі протягом ночі. Розчинники потім випарювали до мінімального об'єму та залишок розділяли між дихлорметаном (500мл) та насиченим розчином гідрокарбонату натрію. Відокремлювали органічний шар, висушували (MgSO4), фільтрували та концентрували з одержанням масла. Це масло потім перемішували протягом ночі у метанолі (500мл), а потім концентрували з одержанням моноформільованого продукту у вигляді білої твердої речовини. Тверду речовину, що має незначне забруднення, перемішували у діетиловому етері протягом 4 годин перед фільтруванням та висушували з одержанням гідрокси[(1S)-2-({4-[4-(1,1,2,2тетрафторетокси)феніл]піперазин-1-іл}сульфоніл)1-(тетрагідро-2Н-піран-4-іл)етил]формаміду (51,41г, 92%). Гідрокси[(1S)-2-({4-[4-(1,1,2,2тетрафторетокси)феніл]піперазин-1-іл}сульфоніл)1-(тетрагідро-2Н-піран-4-іл)етил]формамід (51,4г) розчиняли в гарячому метанолі (80мл), а потім залишали для повільного нагрівання протягом ночі до кімнатної температури. Білу тверду речовину фільтрували та висушували. Тверду речовину потім перемішували в ізопропанолі (190мл) протягом 24 годин перед фільтруванням та висушували при температурі 50°С протягом ночі. Кристалічний білий матеріал промивали за допомогою діетилового етеру та повторно висушували протягом 2 днів. 1 Н ЯМР (ДМСО-D6): 9,95 та 9,60 (1Н, с), 8,30 та 8,00 (1Н, с), 7,15 (2Н, д), 7,05 (2Н, д), 6,75 (1Н, тт), 4,45 та 3,85 (1Н, т), 3,85 (2Н, м), 3,40 (2Н, м), 3,25 (10Н, м), 1,75 (2Н, м), 1,50 (1Н, м), 1,25 (2Н, м); MS(ES) 514 (MH+); Т. п. 175-176°С. Вихідний матеріал одержували так, як описано нижче: 1-бром-4-тетрафторетоксибензол (Номер CAS 68835-05-9, 12г, 0,044М) розчиняли в толуолі (250мл) в атмосфері аргону. Додавали N-Bocпіперазин (Номер CAS 57260-71-6, 9,79г, 0,053М), трет-бутоксид натрію (5,93г, 0,062М), BINAP (96мг) та дипалладійтрибензиліден ацетон (96мг). Суміш перемішували при температурі 80°С протягом 4 годин, охолоджували та відфільтровували нерозчинний матеріал (промивання за допомогою толуолу). Фільтрат випарювали до осушення з одержанням сирового трет-бутил 4-[4-(1,1,2,2тетрафторетокси)феніл]піперазин-1-карбоксилату. Вихід 15,36г (92%). 1 Н ЯМР (CDCL3): d 7,10 (д, 2Н), 6,90 (д, 2Н), 5,90 (тт, 1Н), 3,60 (м, 4Н), 3,15 (м, 4Н), 1,50 (с, 9Н); MS (ES): 323,0 (МН-трет-бутил). Додавали сировий трет-бутил4-[4-(1,1,2,2тетрафторетокси)феніл]піперазин-1-карбоксилат (15,30г, 0,04Μ), розчиняли в ДХМ (150мл) та ТГФ (30мл). Суміш перемішували при кімнатній температурі протягом ночі, випарювали до 81491 36 осушення та азеотропно відганяли з толуолом. Одержаний залишок розділяли між етилацетатом та насиченим розчином бікарбонату натрію та збирали органічну фазу, висушували над MgSO4, фільтрували та випарювали до осушення з одержанням 1-[4-(1,1,2,2тетрафторетокси)феніл]піперазину у вигляді твердої речовини (10,97г, 98%). 1 Н ЯМР (CDCI3): d 7,15 (д, 2Н), 6,90 (д, 2Н), 5,90 (т, 1Н), 3,35 (м, 8Η); MS (ES): 279,0. 1-[4-(1,1,2,2-тетрафторетокси)феніл]піперазин (10,95г, 0,04) розчиняли в ДХМ (500мл) та додавали триетламін (18,5мл, 0,13моля). Суміш охолоджували до температури 0°С та додавали метансульфонілхлорид (7,4мл, 0,048моля). Залишали для поступового нагрівання до кімнатної температури та перемішували протягом ночі. Реакційну суміш промивали водою та збирали органічну фазу, висушували над MgSO4, фільтрували та випарювали до осушення. Тверду речовину, що залишилася, кристалізували з етанолу з одержанням 1-(метилсульфоніл)-4-[4(1,1,2,2-тетрафторетокси)феніл]піперазину у вигляді білої твердої речовини. Вихід 12,3г (78,5%). 1 Н ЯМР (CDCI3): d 7,15 (д, 2Н), 6,95 (д, 2Н), 5,9 (тт, 1Н), 3,35 (м, 4Н), 3,3 (м, 4Н), 2,8 (с, 3Η); MS (ES): 357,26 (MH+). 1-(метилсульфоніл)-4-[4-(1,1,2,2тетрафторетокси)феніл]піперазин (2,85г, 0,008моля) розчиняли в безводному ТГФ (200мл) та охолоджували до температури -10°С в атмосфері аргону. Додавали 1,0Μ розчин біс(триметилсиліл)аміду літію в ТГФ (17,6мл, 0,0176моля) при охолодженні до температури 30°С та до суміші додавали розчин метил тетрагідро-2Н-піран-4-карбоксилату (Номер CAS 110238-91-0) в ТГФ (2мл). Цей розчин залишали нагріватися до кімнатної температури та перемішували протягом 2 годин. Реакцію зупиняли шляхом додання розчину NH4CI та розводили за допомогою Н2О та етилацетату. Збирали органічну фазу, висушували над MgSO4, фільтрували та випарювали до осушення з одержанням сирового 2-({4-[4-(1,1,2,2-тетрафторетокси)феніл]піперазин1-іл}сульфоніл)-1-(тетрагідро-2Н-піран-4іл)етанону (3,64г, 97%). 1 Н ЯМР (CDCI3): d 7,15 (д, 2Н), 6,95 (д, 2Н), 5,90 (тт, 1Н), 4,05 (с, 2Н), 4,00 (м, 2 Η) 3,50 (м, 6Н), 3,25 (м, 4Н), 2,95 (м, 1Н), 1,85 (м, 2Н), 1,70 (м, 2 Η); MS (ES): 469,08 (ΜΗ+). Сировий 2-({4-[4-(1,1,2,2тетрафторетокси)феніл]піперазин-1-іл}сульфоніл)1-(тетрагідро-2Н-піран-4-іл)етанон (3,60г, 0,008Μ) розчиняли в ДХМ (120мл) та метанолі (40мл) при кімнатній температурі та додавали борогідрид натрію (334мг, 0,0088моля). Перемішували протягом 2 годин, додавали Н2О (250мл) та екстрагували за допомогою ДХМ. Збирали органічну фазу, висушували над MgSO4, фільтрували та випарювали до осушення з одержанням 2-({4-[4-(1,1,2,2тетрафторетокси)феніл]піперазин-1-іл}сульфоніл)1-(тетрагідро-2H-піран-4-іл)етанолу (3,6г, 95 %). 37 1 Н ЯМР (CDCI3): d 7,15 (д, 2Н), 6,90 (д, 2Н), 5,90 (тт, 1Н), 4,00 (м, 2Н), 4,00 (м, 1Н), 3,45 (м, 4Н), 3,40 (м, 2Н), 3,25 (м, 4Н), 3,10 (м, 2Н), 3,05 (м, 1Н), 1,75 (м, 2Н), 1,50 (м, 3Н); MS (ES): 471,08 (МН+). 2-({4-[4-(1,1,2,2тетрафторетокси)феніл]піперазин-1-іл}сульфоніл)1-(тетрагідро-2Н-піран-4-іл)етанол (3,6г, 0,008М) розчиняли в ДХМ (100мл) та додавали триетиламін (5,58мл, 0,04моля). Суміш охолоджували до температури 0°С та при перемішуванні додавали метансульфонілхлорид (0,94мл, 0,012 М) при кімнатній температурі протягом ночі . Додавали воду та відокремлювали органічну фазу, висушували над MgSO4) фільтрували та випарювали до осушення з одержанням 1-[4-(1,1,2,2-тетрафторетокси)феніл]4-{[(Е)-2-(тетрагідро-2Н-піран-4іл)вініл]сульфоніл}піперазину. Вихід (3,15г, 86,6%). 1 Н ЯМР (CDCI3): d 7,1 (д, 2Н), 6,9 (д, 2Н), 6,75 (дд, 1Н), 6,1 (д, 1Н), 5,85 (тт, 1Н), 4,0 (м, 2Н), 3,4 (м, 2Н), 3,25 (м, 8Н), 2,5 (м, 1Н), 1,7 (м, 2Н), 1,55 (м, 2Н); MS (ES): 452,88 (ΜΗ+). 1-[4-(1,1,2,2-тетрафторетокси)феніл]-4-{[(E)-2(тетрагідро-2Н-піран-4іл)вініл]сульфоніл}піперазин (3,13г, 0,007моля) розчиняли в ТГФ (50мл) та додавали 50% гідроксиламін в Н2О (12мл). Перемішували при кімнатній температурі протягом ночі, зупиняли реакцію при використанні насиченого розчину NH4CI та екстрагували за допомогою етилацетату. Органічну фазу висушували над MgSO4, фільтрували та випарювали до осушення з одержанням рацемічного 1-{[2-(гідроксиаміно)-2(тетрагідро-2Н-піран-4-іл)етил]сульфоніл}-4-[4(1,1,2,2-тетрафторетокси)феніл]піперазину. Одержану речовину розділяли на енантіомери при використанні колонки AD Chiralpak для хіральної препаративної ВЕРХ та елюювали за допомогою 20% суміші метанол/ацетонітрил. Друга сполука, відокремлена на колонці, забезпечувала одержання 1-{[(2S)-2-(гідроксиаміно)-2-(тетрагідро2Н-піран-4-іл)етил]сульфоніл}-4-[4-(1,1,2,2тетрафторетокси)феніл]піперазину. 1 Н ЯМР (CDCI3): d 7,2 (д, 2Н), 6,9 (д, 2Н), 5,9 (тт, 1Н), 3,85 (м, 2Н), 3,5-3,1 (м, 11Н), 3,05 (м, 2Н), 1,951,8 (дд, 2Н), 1,6 (д, 2Н), 1,35 (м, 2Н); MS (ES): 485,92 (МН+). Приклад 5 Гідрокси[1-феніл-2-({4-[4-(1,1,2,2тетрафторетокси)феніл]піперазин-1іл}сульфоніл)етил]формамід 81491 38 Цю сполуку одержували при використанні способу, приведеного у Прикладі 4. 1 Н ЯМР (CDCI3): 8,45 та 8,2 (д, 1Н), 7,4 (м, 5Н), 7,15 (д, 2Н), 6,85 (д, 2Н), 5,9 (тт, 1Н), 5,5 (д, 1Н), 3,4 (шс, 4Н), 3,3 (с, 2Н), 3,15 (ш, 4Н). Проміжну сполуку 1-[(-2-фенілвініл)сульфоніл]4-[4-(1,1,2,2-тетрафторетокси)феніл]піперазин одержували так, як описано нижче: 1-[4-(1,1,2,2-тетрафторетокси)феніл]піперазин (1,39г, 0,005моля) розчиняли в ДХМ (250мл) та додавали триетиламін (2,1мл, 0,015моля). Одержану речовину охолоджували до температури 0°С та додавали стиренсульфонілхлорид (Номер CAS Number 52147-97-4, 1,11г, 0,0055моля). Залишали для нагрівання до кімнатної температури та перемішували протягом ночі. Промивали за допомогою Н2О та відокремлювали органічну фазу. Висушували над MgSO4, фільтрували та випарювали до осушення з одержанням масла, яке очищали за допомогою флеш-колонкової хроматографії (Merck 9385 кремнезем), елюювали за допомогою 80% ізогексан/етилацетату з одержанням 1-[(-2-фенілвініл)сульфоніл]-4-[4(1,1,2,2-тетрафторетокси)феніл]піперазину у вигляді жовтої твердої речовини. Вихід 650мг (25%). 1 Н ЯМР (CDCI3): d 7,5 (м, 3Н), 7,4 (м, 3Н), 7,15 (д, 2Н), 6,9 (д, 2Н), 6,7 (д, 1Н), 5,85 (тт, 1Н), 3,4 (м, 4Н), 3,25 (м, 4Н); MS (ES): 445,27 (МН+). Приклад 6 Гідрокси{4-піримідин-2-іл-1-[({4-[4-(1,1,2,2тетрафторетокси)феніл]піперазин-1іл}сульфоніл)метил]бутил}формамід Цю сполуку одержували при використанні способу, приведеного у Прикладі 4 MS (ES): 550,03 (МН+). Проміжну сполуку 2-[5-({4-[4-(1,1,2,2тетрафторетокси)феніл]піперазин-1іл}сульфоніл)пент-4-ен-1-іл]піримідин одержували так, як описано нижче: 1-(метилсульфоніл)-4-[4-(1,1,2,2тетрафторетокси)феніл]піперазин (356мг, 0,001моля) розчиняли в безводному ТГФ (100мл) та охолоджували до температури -10°С в атмосфері аргону. 1,0 моля розчину біс(триметилсиліл)аміду літію в ТГФ (2,2мл, 0,0022моля) додавали та перемішували при температурі -10°С протягом 30 хвилин, після цього додавали діетилхлорфосфат (0,15мл, 0,001моля) при перемішуванні та при температурі -10°С протягом подальших 30 хвилин. Додавали розчин 2-піримідиніл-4-бутиральдегіду в безводному ТГФ 39 (5мл), суміш перемішували при температурі -10°С протягом 60 хвилин та поки, він залишався холодним зупиняли реакцію за допомогою насиченого розчину NH4CI. Після розведення Н2О та етилацетатом органічну фазу збирали, висушували над MgSO4, фільтрували та випарювали до осушення з одерженням масла. Очищали за допомогою флеш-колонкової хроматографії (Меrсk9385 кремнезем), елюювали за допомогою етилацетату з одержанням 2-[5-({4[4-(1,1,2,2-тетрафторетокси)феніл]піперазин-1іл}сульфоніл)пент-4-ен-1-іл]піримідину. Вихід 230мг (47%). 1 Н ЯМР (CDCI3): 8,8 (д, 2Н), 7,2 (с, 1Н), 7,1 (д, 2Н), 6,85 (д, 2Н), 6,2 (д, 2Н), 5,8 (тт, 1Н), 4,05 (ш, 1Н), 3,25 (ш, 8Н), 3,05 (м, 2Н), 2,3 (м, 1Н), 2,05 (м, 2Н), 1,4 (м, 2Н); MS (ESI): 489 (МН+). Приклад 7 Були синтезовані наступні сполуки: 81491 40 / Chiralpak AD, елюювання за допомогою 10% МеОН, MeCN // Відокремлений на колонці Chiralpak AD, елюювання за до МеОН, MeCN /// Відокремлений на колонці Chiralpak AD, елюювання за до МеОН, MeCN Вихідний матеріал для синтезу одержували так, як описано нижче: 1-(метилсульфоніл)-4-[4(2,2,2-трифторетокси)феніл]піперазин Карбонат калію (22,89г, 166ммоля) та 2,2,2трифторетил трифторметансульфонат (16,0г, 69ммоля) додавали до розчину 4-бромфенолу (9,57г, 55ммоля) в ацетоні (200мл). Реакційну суміш перемішували при кімнатній температурі / енантіомер, відокремлений за допомогою OJ протягом ночі, а потом фільтрували та хіральної препаративної колонкової ВЕРХ, елюювання при використанні метанолу концентрували при 300мбар та 30°С для // енантіомер, відокремлений за допомогою AD видалення ацетону. Це забезпечувало одержання хіральної препаративної колонкової ВЕРХ, елюювання при використанні 20% суміші 1-бром-4-(2,2,2-трифторетокси)бензолу у вигляді метанол/ацетонітрил воскоподібної твердої речовини (>100% вихід, оскільки присутня деяка кількість ацетону). 1 Приклад 8 Н ЯМР (ДМСО-D6), d: 7,50 (2Η, д), 7,05 (2Η, д), Наступні сполуки були одержані так, як 4,75 (2Η, κ). описано у попередніх прикладах. 1-бром-4-(2,2,2-трифторетокси)бензол (14,5г, 57ммоля) розчиняли у толуолі (250мл) в атмосфері аргону. Додавали трет-бутилпіперазин1-карбоксилат (12,7г, 68ммоля), mpem-бутоксид натрію (7,6г, 79,5ммоля) rас-2,2'біс(дифенілфосфіно)-1,1'-бінафтил (200мг, 0,32ммоля) та трис(дибензиліденацетон)дипалладій (0) (200мг, 0,2ммоля) та реакційну суміш нагрівали до 80°С протягом 4 годин. Потім суміш охолоджували та фільтрували через целіт з одержанням сирового трет-бутил 4-[4-(2,2,2трифторетокси)феніл]піперазин-1-карбоксилату (32,47г). 1 Н ЯМР (400МГц, CDCI3): d 6,90 (4Η, с), 4,30 (2Η, к), 3,60 (4Η, м), 3,05 (4Η, м), 1,45 (9Η, с); m/z (ЕS) 305 (МН+-tВu). 41 Сировий трет-бутил 4-[4-(2,2,2трифторетокси)феніл]піперазин-1-карбоксилат (32,47г, приблизно 57ммоля) розчиняли в ДХМ (300мл) та додавали ТГФ (69мл). Реакційну суміш перемішували при кімнатній температурі протягом ночі, а потім випарювали до осушення, азеотропно відганяючи з толуолом. Одержаний залишок розділяли між ДХМ та насиченим розчином бікарбонату натрію. Відокремлювали органічну фазу, висушували (MgSO4), фільтрували та концентрували з одержанням 1-[4-(2,2,2трифторетокси)феніл]піперазину у вигляді твердої речовини (13,48г, 91%). 1 Н ЯМР (400МГц, CDCI3): d 6,90 (4Η, с), 4,30 (2Η, к), 3,30 (8Η, м); MS (ES) 261 MH+. 1-[4-(2,2,2-трифторетокси)феніл]піперазин (13,48г, 50ммоля) розчиняли в ДХМ (500мл) та охолоджували до температури 0°С. Додавали триетиламін (29мл, 0,2моля), після цього по краплях додавали метансульфонілхлорид (4,2мл, 55ммоля). Реакційну суміш залишали нагріватися до кімнатної температури при перемішуванні протягом ночі перед тим, як зупинити реакцію шляхом додання води. Розділяли шари та органічну фазу висушували (MgSO4), фільтрували та концентрували. Залишок перекристалізовували з гарячого етанолу з одержанням чистого 1(метилсульфоніл)-4-[4-(2,2,2трифторетокси)феніл]піперазину (3,3г, 18%). 1 Н ЯМР (CDCI3): d 6,90 (4Η, с), 4,30 (2Η, к), 3,40 (4Η, м), 3,20 (4Η, м), 2,85 (3Н, с); m/z (ES) 339 MH+. 81491 42
ДивитисяДодаткова інформація
Назва патенту англійськоюN-{'4-substituted piperazine-1-sulfonylmethyl]alkyl}-n-hydroxyformamide compounds as metalloproteinase inhibitors, pharmaceutical composition based thereon, process for the preparation thereof, intermediate (variants)
Автори англійськоюWaterson David
Назва патенту російськоюСоединения n-{'4-замещенный пиперазин-1-сульфонилметилалкил}- n-гидроксиформамида как ингибиторы металопротеиназы, фармацевтическая композиция на их основе, способ их получения, промежуточное соединение (варианты)
Автори російськоюВотерсон Дейвид
МПК / Мітки
МПК: C07D 309/04, A61P 11/00, C07D 401/12, A61P 19/02, C07D 295/26, C07D 405/12, C07D 239/46
Мітки: композиція, сполуки, n-{'4-заміщений, інгібітори, спосіб, проміжна, варіанти, сполука, металопротеїнази, фармацевтична, піперазин-1-сульфонілметилалкіл}-n-гідроксиформаміду, основі, одержання
Код посилання
<a href="https://ua.patents.su/21-81491-spoluki-n-4-zamishhenijj-piperazin-1-sulfonilmetilalkil-n-gidroksiformamidu-yak-ingibitori-metaloprotenazi-farmacevtichna-kompoziciya-na-kh-osnovi-sposib-kh-oderzhannya-promizhna-s.html" target="_blank" rel="follow" title="База патентів України">Сполуки n-{‘4-заміщений піперазин-1-сульфонілметилалкіл}-n-гідроксиформаміду як інгібітори металопротеїнази, фармацевтична композиція на їх основі, спосіб їх одержання, проміжна сполука (варіанти)</a>
Попередній патент: Склад для виготовлення магнезіальновуглецевого вогнетриву
Наступний патент: Спосіб прогнозування граничної пошкодженості деформованого пластичного матеріалу
Випадковий патент: Спосіб одержання чорного залізоокисного пігменту