Бета-амінотетрагідроімідазо-(1,2-а)-піразини і тетрагідротриазоло-(4,3-а)-піразини як інгібітори дипептидилпептидази для лікування або запобігання діабету
Номер патенту: 74912
Опубліковано: 15.02.2006
Автори: Вебер Енн Е., Фішер Майкл Г., Ксу Дзінйоу, Пармі Емма Р., Едмондсон Скотт Д., Маккосс Малкольм, Кім Доосеоп
Формула / Реферат
1. Сполука формули І:
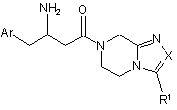 ,
,
де:
Аr являє собою феніл, незаміщений або заміщений 1-5 R3, де R3 незалежно вибраний з групи, що складається з:
(1) галогену,
(2) С1-6-алкілу з лінійним або розгалуженим ланцюгом, незаміщеного або заміщеного 1-5 атомами галогенів,
(3) ОС1-6-алкілу з лінійним або розгалуженим ланцюгом, незаміщеного або заміщеного 1-5 атомами галогену, і
(4) CN;
Х вибраний з групи, що складається з:
(1) N i
(2) CR2;
R1 і R2 незалежно вибрані з групи, що складається з:
(1) водню,
(2) CN,
(3) C1-10-алкілу з лінійним або розгалуженим ланцюгом, незаміщеного або заміщеного 1-5 атомами галогенів або фенілом, незаміщеного або заміщеного 1-5 замісниками, незалежно вибраними з галогену, CN, OH, R4, OR4, NHSO2R4, SO2R4, CO2H і СО2С1-6-алкілу, де СО2С1-6-алкіл являє собою алкіл з лінійним або розгалуженим ланцюгом,
(4) фенілу, незаміщеного або заміщеного 1-5 замісниками, незалежно вибраними з галогену, CN, OH, R4, OR4, NHSO2R4, SO2R4, CO2H і СО2С1-6-алкілу, де СО2С1-6-алкіл являє собою алкіл з лінійним або розгалуженим ланцюгом, і
(6) 5- або 6-членного гетероциклу, який може бути насиченим або ненасиченим, який містить 1-4 гетероатоми, незалежно вибраних з N, S і О, гетероцикл незаміщений або заміщений 1-3 замісниками, незалежно вибраними з оксо, ОН, галогену, С1-6-алкілу і ОС1-6-алкілу, де С1-6-алкіл і ОС1-6-алкіл являють собою алкіли з лінійним або розгалуженим ланцюгом і необов'язково заміщені 1-5 атомами галогенів;
R4 являє собою С1-6-алкіл з лінійним або розгалуженим ланцюгом, незаміщений або заміщений 1-5 групами, незалежно вибраними з галогену, CO2H і СО2С1-6-алкілу, де СО2С1-6-алкіл являє собою алкіл з лінійним або розгалуженим ланцюгом;
фармацевтично прийнятні солі вказаної сполуки і її індивідуальні діастереомери.
2. Сполука за п. 1 формули Іа:
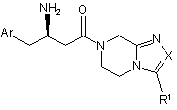 ,Ia
,Ia
де X, Аr і R1 визначені в п. 1;
і її фармацевтично прийнятні солі та індивідуальні діастереомери.
3. Сполука за п. 1 формули Іb:
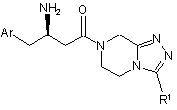 , Іb
, Іb
де Аr і R1 визначені в п. 1;
і її фармацевтично прийнятні солі та індивідуальні діастереомери.
4. Сполука за п.1 формули Іс:
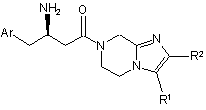 ,Ic
,Ic
де Аr, R1 і R2 визначені в п. 1;
і її фармацевтично прийнятні солі та індивідуальні діастереомери.
5. Сполука за п. 1, де Аr являє собою феніл, незаміщений або заміщений 1-5 замісниками, які незалежно вибрані з групи, що складається з:
(1) фтору,
(2) брому і
(3) СF3.
6. Сполука за п. 1, де Аr вибраний з групи, що складається з:
(1) фенілу,
(2) 2-фторфенілу,
(3) 3,4-дифторфенілу,
(4) 2,5-дифторфенілу,
(5) 2,4,5-трифторфенілу,
(6) 2-фтор-4-(трифторметил)фенілу і
(7) 4-бром-2,5-дифторфенілу.
7. Сполука за п. 1, де R1 вибраний з групи, що складається з:
(1) водню і
(2) С1-6-алкілу з лінійним або розгалуженим ланцюгом, незаміщеним або заміщеним фенілом або 1-5 атомами фтору.
8. Сполука за п. 1, де R1 вибраний з групи, що складається з:
(1) водню,
(2) метилу,
(3) етилу,
(4) СF3,
(5) СН2СF3,
(5) СF2СF3,
(6) фенілу і
(7) бензилу.
9. Сполука за п. 1, де R1 вибраний з групи, що складається з:
(1) водню,
(2) метилу,
(3) етилу,
(4) СF3 і
(5) СН2СF3.
10. Сполука за п. 1, де R1 являє собою водень або СF3.
11. Сполука за п. 1, де R2 вибраний з:
(1) водню,
(2) С1-6-алкілу з лінійним або розгалуженим ланцюгом, незаміщеного або заміщеного 1-5 атомами фтору,
(3) фенілу, незаміщеного або заміщеного 1-3 замісниками, незалежно вибраними з фтору, ОСН3 і ОСF3.
12. Сполука за п. 1, де R2 вибраний з групи, що складається з
(1) водню,
(2) метилу,
(3) етилу,
(4) СF3,
(5) СН2СF3,
(5) СF2СF3
(6) фенілу,
(7) (4-метокси)фенілу,
(8) (4-трифторметокси)фенілу,
(9) 4-фторфенілу і
(10) 3,4-дифторфенілу.
13. Сполука за п. 1, де R2 являє собою СF3 або СF2СF3.
14. Сполука за п.1, де R3 являє собою F, Вr або СF3.
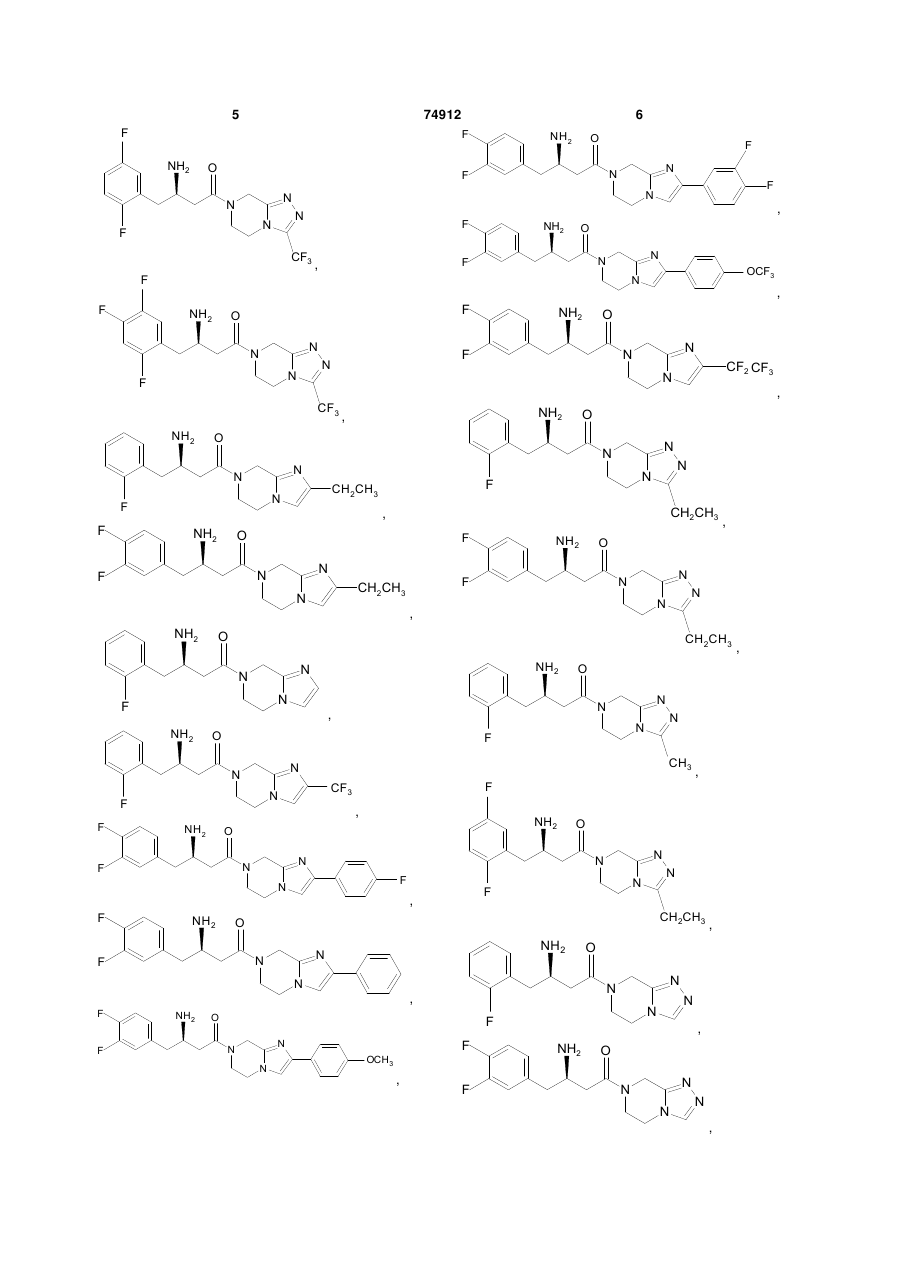
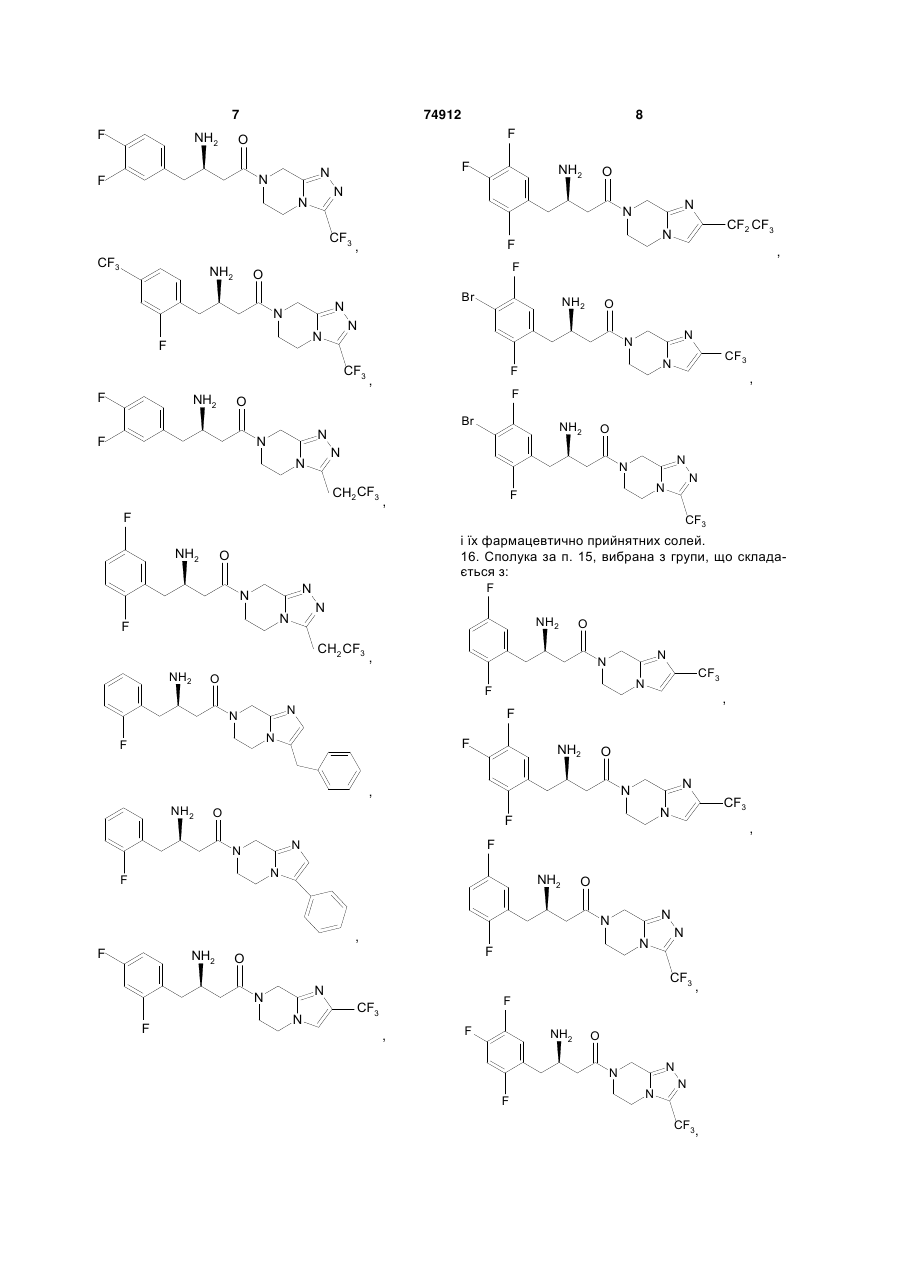
15. Сполука, вибрана з групи, що складається з:
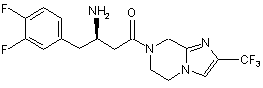 ,
,
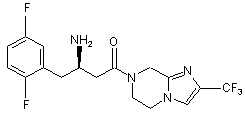 ,
,
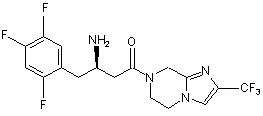 ,
,
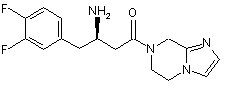 ,
,
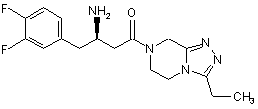 ,
,
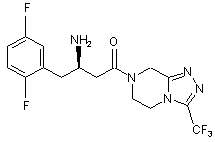 ,
,
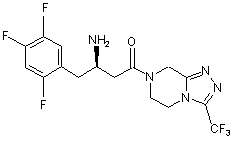 ,
,
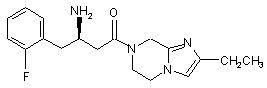 ,
,
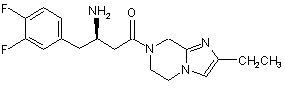 ,
,
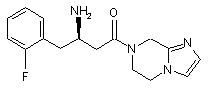 ,
,
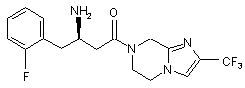 ,
,
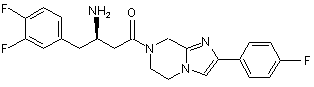 ,
,
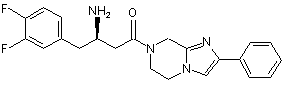 ,
,
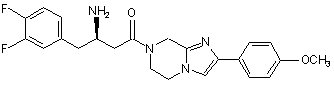 ,
,
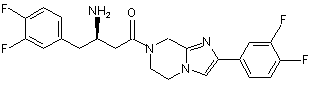 ,
,
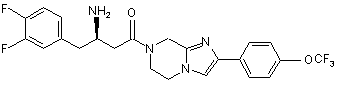 ,
,
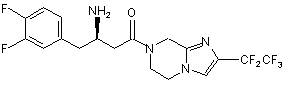 ,
,
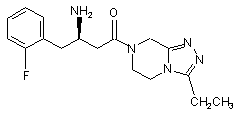 ,
,
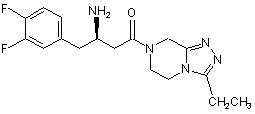 ,
,
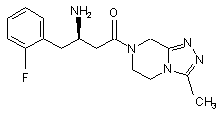 ,
,
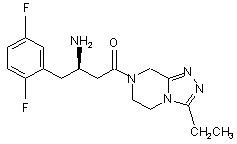 ,
,
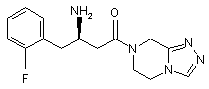 ,
,
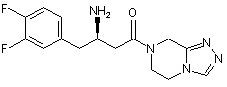 ,
,
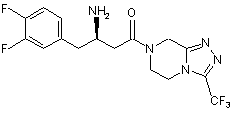 ,
,
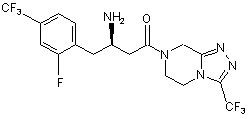 ,
,
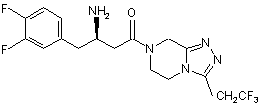 ,
,
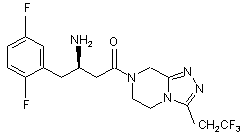 ,
,
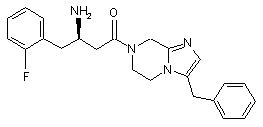 ,
,
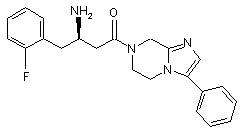 ,
,
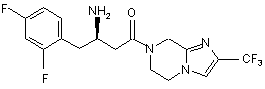 ,
,
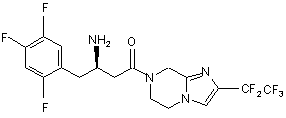 ,
,
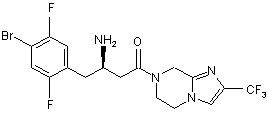 ,
,
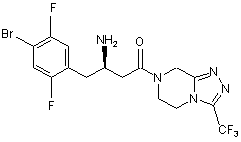
і їх фармацевтично прийнятних солей.
16. Сполука за п. 15, вибрана з групи, що складається з:
 ,
,
 ,
,
 ,
,
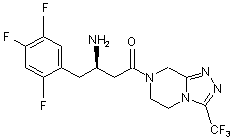 ,
,
 ,
,
або її фармацевтично прийнятна сіль.
17. Сполука за п. 16, яка являє собою
 ,
,
або її фармацевтично прийнятна сіль.
18. Сполука за п. 16, яка являє собою
 ,
,
або її фармацевтично прийнятна сіль.
19. Сполука за п. 16, яка являє собою
 ,
,
або її фармацевтично прийнятна сіль.
20. Фармацевтична композиція, що містить інертний носій і сполуку за п. 1.
21. Застосування сполуки за п. 1 для виготовлення лікарського засобу для лікування стану, вибраного з групи: гіперглікемія, діабет типу 2, ожиріння, і ліпідні розлади у ссавців.
22. Застосування за п. 21, де вказаний розлад ліпідного обміну вибраний з групи, що складається з дисліпідемії, гіперліпідемії, гіпертригліцеридемії, гіперхолестеринемії.
Текст
1. Сполука формули І: NH2 O C2 2 (19) 1 3 74912 4 (2) С1-6-алкілу з лінійним або розгалуженим ланцюO гом, незаміщеного або заміщеного 1-5 атомами Ar фтору, N N (3) фенілу, незаміщеного або заміщеного 1-3 заміN N сниками, незалежно вибраними з фтору, ОСН3 і ОСF3. 12. Сполука за п. 1, де R2 вибраний з групи, що 1 R , Іb складається з де Аr і R1 визначені в п. 1; (1) водню, і її фармацевтично прийнятні солі та індивідуальні (2) метилу, діастереомери. (3) етилу, 4. Сполука за п.1 формули Іс: (4) СF3, NH2 O (5) СН2СF3, (5) СF2СF3 Ar N (6) фенілу, N R2 (7) (4-метокси)фенілу, N (8) (4-трифторметокси)фенілу, (9) 4-фторфенілу і R1 (10) 3,4-дифторфенілу. ,Ic 1 2 13. Сполука за п. 1, де R2 являє собою СF3 або де Аr, R і R визначені в п. 1; СF2СF3. і її фармацевтично прийнятні солі та індивідуальні 14. Сполука за п.1, де R3 являє собою F, Вr або діастереомери. СF3. 5. Сполука за п. 1, де Аr являє собою феніл, неза15. Сполука, вибрана з групи, що складається з: міщений або заміщений 1-5 замісниками, які незаF NH2 O лежно вибрані з групи, що складається з: (1) фтору, (2) брому і N N F (3) СF3. CF3 6. Сполука за п. 1, де Аr вибраний з групи, що N складається з: , F (1) фенілу, (2) 2-фторфенілу, (3) 3,4-дифторфенілу, NH2 O (4) 2,5-дифторфенілу, (5) 2,4,5-трифторфенілу, N N (6) 2-фтор-4-(трифторметил)фенілу і CF3 (7) 4-бром-2,5-дифторфенілу. N 1 F 7. Сполука за п. 1, де R вибраний з групи, що , складається з: F (1) водню і F (2) С1-6-алкілу з лінійним або розгалуженим ланцюNH2 O гом, незаміщеним або заміщеним фенілом або 1-5 атомами фтору. N N 8. Сполука за п. 1, де R1 вибраний з групи, що CF3 складається з: N F (1) водню, , (2) метилу, F NH2 O (3) етилу, (4) СF3, N (5) СН2СF3, N F (5) СF2СF3, N (6) фенілу і , (7) бензилу. F NH2 O 9. Сполука за п. 1, де R1 вибраний з групи, що складається з: (1) водню, N N F (2) метилу, N N (3) етилу, (4) СF3 і CH3 (5) СН2СF3. , 1 10. Сполука за п. 1, де R являє собою водень або СF3. 11. Сполука за п. 1, де R2 вибраний з: (1) водню, NH2 5 74912 F 6 F NH2 O NH2 O F N N F F , N N F N N N F CF3 NH2 O N N F , F OCF3 N , F NH2 F O N N O N N F N N F NH2 , CF3 NH2 NH2 , O O N N N N CH2CH3 , NH2 O F N N F NH2 N N O CH2CH3 NH2 N N O CH3 N , NH2 O F CH2CH3 O NH2 N N F N F O N N N F OCH3 , F N N F N , O N , NH2 N N F , F N N N NH2 O N N , F CF3 N F N N F F NH2 N N , N F O N F NH2 N N , NH2 , O F CH2CH3 N F N N F CH2CH3 N F F CF2 CF3 N , NH2 O N N N N , , 7 F NH2 74912 O F N N F , Br N NH2 , CF3 N F , F O Br N NH2 O N N N N CF3 N O N N F CF2 CF3 N F , O F NH2 N F N F O N CF3 NH2 NH2 N N CF3 8 F N N CH2 CF3 , N N F F CF3 NH2 і їх фармацевтично прийнятних солей. 16. Сполука за п. 15, вибрана з групи, що складається з: O F N N N N F NH2 CH2 CF3 NH2 O , N N O N N , F N F F NH2 O N N , NH2 CF3 N F O N F , F N N NH2 O N N , F NH2 F N CF3 N N N F O N CF3 N F , F CF3 , F NH2 O N N F N N CF3 , 9 74912 10 19. Сполука за п. 16, яка являє собою F F F NH2 O NH2 N CF2 CF3 N F , NH2 O N N CF2 CF3 N F , або її фармацевтично прийнятна сіль. 18. Сполука за п. 16, яка являє собою F F NH2 F N CF3 , або її фармацевтично прийнятна сіль. 20. Фармацевтична композиція, що містить інертний носій і сполуку за п. 1. 21. Застосування сполуки за п. 1 для виготовлення лікарського засобу для лікування стану, вибраного з групи: гіперглікемія, діабет типу 2, ожиріння, і ліпідні розлади у ссавців. 22. Застосування за п. 21, де вказаний розлад ліпідного обміну вибраний з групи, що складається з дисліпідемії, гіперліпідемії, гіпертригліцеридемії, гіперхолестеринемії. O N N F N N або її фармацевтично прийнятна сіль. 17. Сполука за п. 16, яка являє собою F F O N N N CF3 , або її фармацевтично прийнятна сіль. Діабет відноситься до захворювання, що викликається великою кількістю факторів, і характеризується підвищеними рівнями глюкози у плазмі або гіперглікемією, що спостерігається у стані натщесерце або після введення глюкози під час проведення проби на толерантність до глюкози. Стійка або неконтрольована гіперглікемія пов'язана з підвищеною і передчасною захворюваністю і смертністю. Часто аномальний гомеостаз глюкози пов'язаний як прямо, так і непрямо з альтераціями ліпідного, ліпопротеїнового і аполіпопротеїнового обміну та іншим метаболічним і гемодинамічним захворюванням. Отже, пацієнти з цукровим діабетом типу 2 схильні до особливо високого ризику ускладнень, пов'язаних з великими і дрібними кровоносними судинами, включаючи коронарну хворобу серця, «удар», захворювання периферійних судин, гіпертонію, нефропатію, невропатію і ретинопатію. Тому для клінічної терапії і лікування цукрового діабету надто необхідний терапевтичний контроль гомеостазу глюкози, ліпідного обміну і гіпертонії. Існує дві загальновизнані форми діабету. При діабеті типу 1, або інсулінзалежному цукровому діабеті (IDDM), у пацієнтів виробляється мало інсуліну або в загальному випадку інсулін, гормон, який регулює утилізацію глюкози, не виробляється. При діабеті типу 2, або інсуліннезалежному цукровому діабеті (NIDDM), рівні інсуліну в плазмі пацієнтів у порівнянні з суб'єктами, які не страждають діабетом, часто такі ж або навіть вище; однак у таких пацієнтів розвивається резистентність до інсуліну, що володіє стимулюючим впливом на метаболізм глюкози і ліпідів в основних, сприйнятливих до інсуліну тканинах, які являють собою м'язову, печінкову і жирову тканини, а рівні інсуліну в плазмі, незважаючи на те, що вони підвищені, недостатні для подолання явно вираженої резистентності до інсуліну. Резистентність до інсуліну зумовлена, насамперед, не зменшенням числа інсулінових рецепторів, а дефектом, пов'язаним з інсуліновим рецептором після його зв'язування з інсуліном, який ще не пояснений. Така резистентність до сприйнятливості інсуліну приводить до недостатньої інсулінової активації поглинання, окислення і відкладення глюкози у м'язах і неадекватного інсулінового придушення ліполізу в жировій тканині і вироблення глюкози, а також секреції в печінці. Застосовні в наш час способи лікування діабету типу 2, які за багато років істотно не змінились, мають відомі обмеження. Незважаючи на те, що фізичне навантаження і зменшення споживаних з їжею калорій разюче поліпшують стан хворих діабетом, мало хто згодний з таким лікуванням через добре укорінений сидячий спосіб життя і надмірне споживання харчових продуктів, особливо продуктів, що містять високі кількості насичених жирів. 11 74912 12 Підвищення рівня інсуліну в плазмі шляхом ввеа це, в свою чергу, приводить до підвищення ефедення похідних сульфонілсечовини (наприклад, ктивності інкретинів при стимулюванні продукутолбутаміду і гліпізиду) або меглитиніду, які стивання інсуліну підшлунковою залозою. Тому інгібування DP-IV приводить до підвищення рівня мулюють -клітини підшлункової залози до видісироваткового інсуліну. Оскільки інкретини вироблення більшої кількості інсуліну, і/або шляхом ін'єляються в організмі переважно тільки після вжикції інсуліну, коли похідні сульфонілсечовини або вання їжі, інгібування DP-IV, як очікується, в промеглитинід стають неефективними, може привоміжки часу між прийманням їжі не буде дити до концентрацій інсуліну, досить високим для збільшувати рівень інсуліну, який може приводити стимулювання тих самих резистентних до інсуліну до понадміру низького цукру в крові (гіпоглікемії). тканин. Однак внаслідок введення інсуліну або Інгібування DP-IV, як очікується, буде підвищувати стимуляторів секреції інсуліну (похідні сульфонілінсулін без збільшення ризику гіпоглікемії, яка є сечовини або меглитинід) рівні глюкози в плазмі небезпечним побічним ефектом, пов'язаним із заможуть стати небезпечно низькими, а через рівностосуванням стимуляторів секреції інсуліну. мірне підвищення рівнів інсуліну в плазмі рівень У інгібіторів DP-IV також є інші терапевтичні резистентності до інсуліну може підвищуватись. застосування, які обговорюються тут. До цього Бігуаніди підвищують сприйнятливість до інсуліну, часу інгібітори DP-IV широко не вивчались, зокреприводячи до деякої корекції гіперглікемії. Однак ма, відносно інших захворювань, які відрізняються два бігуаніди, фенформін і метформін, можуть від діабету. Для того, щоб знайти поліпшені інгібівикликати молочний ацидоз і нудоту/діарею. Меттори DP-IV для лікування діабету і потенційно інформін має менше побічних ефектів, ніж фенфорших захворювань і станів, необхідні нові сполуки. мін, і часто прописується для лікування діабету Даний винахід відноситься до сполук, що є інтипу 2. гібіторами ферменту дипептидилпептидази-IV («інГлітазони (наприклад, 5-бензилтіазолідин-2,4гібітори DP-IV») і застосовними для лікування або діони) відносяться до раніше описаного класу спопрофілактики захворювань, в які залучений ферлук, потенційно здатних поліпшувати багато які мент дипептидилпептидаза-IV, таких як діабет і, симптоми діабету типу 2. У деяких моделях діабезокрема, діабет типу 2. Винахід також відноситься ту типу 2 у тварин такі агенти істотно підвищують до фармацевтичних композицій, що містять такі сприйнятливість м'язової, печінкової і жирової ткасполуки, і застосування таких сполук і композицій нини до інсуліну, приводячи до часткової або повдля профілактики або лікування таких захворюної корекції підвищених рівнів глюкози в плазмі без вань, в які залучений фермент дипептидилпептипояви гіпоглікемії. Наявні у наш час у продажу глідаза-IV. тазони є агоністами рецептора, активованого пеДаний винахід відноситься до сполук формули роксисомним проліфератором (PPAR), передусім І: підтипу гамма-PPAR. Як вважають, гамма-агонізм PPAR відповідає за поліпшену сприйнятливість доінсуліну, яка спостерігається з глітазонами. Більш нові агоністи PPAR, які випробовуються для лікування діабету типу II, є агоністами підтипу альфа, гамма або дельта або їх комбінацією, і в багатьох випадках хімічно відрізняються від глітазонів (тобто, вони не є тіазолідиндіонами). Деякі з глітазонів, такі як троглітазон, володіють серйозними побічними ефектами (наприклад, викликають інтоксикаде: цію печінки). Аr являє собою феніл, незаміщений або заміУ цей час вивчаються додаткові способи лікущений 1-5 R3, де R3 незалежно вибраний з групи, вання захворювання. Введені нещодавно або всі що складається з: нові біохімічні підходи, які ще розвиваються, вклю(1) галогену, чають лікування інгібіторами альфа-глюкозидази (2) С1-6-алкілу з лінійним або розгалуженим (наприклад, акарбозою) та інгібіторами (протеїнланцюгом, незаміщеного або заміщеного 1-5 атотирозин) фосфатази-IB (РТР-1В). мами галогенів, Як лікарські засоби досліджуються сполуки, (3) С1-6-алкілу з лінійним або розгалуженим що є інгібіторами ферменту дипептидилпептидазиланцюгом, незаміщеного або заміщеного 1-5 атоIV («DP-IV» або «DPP-IV»), які також можна застомами галогену, і совувати для лікування діабету, і зокрема, діабету (4) CN; типу 2. Див., наприклад наступні публікації: [заявки X вибраний з групи, що складається з: WO 97/40832, WO 98/19998, патент США № (1) N i 5939560; Bioorg. Med. Chem. Lett., 6(10), 1163-1166 (2) CR2; (1996); і Bioorg. Med. Chem. Lett., 6(22), 2745-2748 R1 і R2 незалежно вибрані з групи, що склада(1996)]. Застосування інгібіторів DP-IV для лікується з: вання діабету типу 2 основане на тому факті, що (1) водню, DP-IV in vivo легко інактивує глюкагон, подібний (2) CN, пептиду-1 (GLP-1) і поліпептиду, який пригнічує (3) С1-10-алкілу з лінійним або розгалуженим секрецію шлунка (GIP). GLP-1 і GIP є інкретинами і ланцюгом, незаміщеного або заміщеного 1-5 атовиробляються після споживання їжі. Інкретини мами галогенів або фенілом, незаміщеного або стимулюють вироблення інсуліну. Інгібування DPзаміщеного 1-5 замісниками, незалежно вибраниIV приводить до зменшення інактивації інкретинів, 13 74912 14 ми з галогену, CN, OH, R4, OR4, NHSO2R4, SO2R4 групи, що складається з: СО2Н і СО2С1-6-алкілу, де СО2С1-6-алкіл являє со(1) фтору, бою алкіл з лінійним або розгалуженим ланцюгом, (2) брому, і (4) фенілу, незаміщеного або заміщеного 1-5 (3) CF3. замісниками, незалежно вибраними з галогену, У даному винаході Аr більш переважно виби4 4 4 4 CN, OH, R , OR , NHSO2R , SO2R СО2Н і СО2С1-6рають з групи, що складається з: алкілу, де СО2С1-6-алкіл являє собою алкіл з ліній(1) фенілу, ним або розгалуженим ланцюгом, і (2) 2-фторфенілу, (6) 5- або б-членного гетероциклу, який може (3) 3,4-дифторфенілу, бути насиченим або ненасиченим, який містить 1-4 (4) 2,5-дифторфенілу, гетероатомів, незалежно вибраних з N, S і О, гете(5) 2,4,5-трифторфенілу, роцикл незаміщений або заміщений 1-3 замісни(6) 2-фтор-4-(трифторметил)фенілу, і ками, незалежно вибраними з оксо, ОН, галогену, (7) 4-бром-2,5-дифторфенілу. С1-6-алкілу і С1-6-алкілу, де С1-6-алкіл і ОС1-6-алкіл У даному винаході R1 переважно вибирають з являють собою алкіли з лінійним або розгалужегрупи, що складається з: ним ланцюгом і необов'язково заміщені 1-5 атома(1) водню і ми галогенів; (2) С1-6-алкілу з лінійним або розгалуженим R4 являє собою С1-6-алкіл з лінійним або розланцюгом, незаміщеного або заміщеного фенілом галуженим ланцюгом, незаміщений або заміщений або 1-5 атомами фтору. 1-5 групами, незалежно вибраними з галогену, У даному винаході R1 більш переважно вибиСО2Н і СО2С1-6-алкілу, де СО2С1-6-алкіл являє сорають з групи, що складається з: бою алкіл з лінійним або розгалуженим ланцюгом; (1) водню, фармацевтично прийнятних солей вказаних (2) метилу, сполук і їх індивідуальних діастереомерів. (3) етилу, Втілення даного винаходу включає сполуки (4) CF3, формули Іа: (5) CH2CF3, (5) CF2CF3, (6) фенілу і (7) бензилу. У даному винаході R1 більш переважно вибирають з групи, що складається з: (1) водню, (2) метилу, (3) етилу, (4) CF3 і де X, Аr і R1 визначені тут; (5) CH2CF3. їх фармацевтично прийнятні солі та індивідуаУ даному винаході R1 найбільш переважно явльні діастереомери. ляє собою водень або CF3. Ще одне втілення даного винаходу включає У даному винаході R2 переважно вибирають з: сполуки формули Іb: (1) водню, (2) С1-6-алкілу з лінійним або розгалуженим ланцюгом, незаміщеного або заміщеного 1-5 атомами фтору, (3) фенілу, незаміщеного або заміщеного 1-3 замісниками, незалежно вибраними з фтору, ОСН3 і OCF3. У даному винаході R2 більш переважно вибирають з групи, що складається з: де Ar і R1 визначені тут; (1) водню, їх фармацевтично прийнятні солі та індивідуа(2) метилу, льні діастереомери. (3) етилу, Інше втілення даного винаходу включає спо(4) CF3, луки формули Іс: (5) CH2CF3, (6) фенілу, (7) (4-метокси)фенілу, (8) (4-трифторметокси)фенілу, (9) 4-фторфенілу і (10) 3,4-дифторфенілу. У даному винаході R2 найбільш переважно являє собою CF3 або CF2CF3. У даному винаході R3 переважно являє собою 1 2 де Ar, R і R визначені тут; F, Вr або CF3. їх фармацевтично прийнятні солі та індивідуаСполуки даного винаходу можуть містити один льні діастереомери. У даному винаході Аг переваабо більше асиметричних центрів і, отже, можуть жно являє собою феніл, незаміщений або заміщеіснувати у вигляді рацематів і рацемічних сумішей, ний 1-5 замісниками, які незалежно вибрані з окремих енантіомерів, сумішей діастереомерів та 15 74912 16 індивідуальних діастереомерів. Сполуки даного чні або органічні кислоти. Солі, що одержуються з винаходу мають один асиметричний центр на атонеорганічних основ, включають солі алюмінію, мі вуглецю в бета-положенні. В залежності від амонію, кальцію, міді, тривалентного заліза, двоприроди різних замісників в молекулі можуть бути валентного заліза, літію, магнію, тривалентного присутніми додаткові асиметричні центри. Кожний марганцю, двовалентного марганцю, калію, натакий асиметричний центр незалежно продукує трію, цинку і т. п. Особливо переважні солі амонію, два оптичних ізомери, при цьому мається на увазі, кальцію, магнію, калію і натрію. У твердій формі що всі можливі оптичні ізомери і діастереомери в солі можуть існувати у вигляді більше ніж однієї сумішах, у вигляді чистих або частково очищених кристалічної структури, а також можуть бути у фосполук включені в об'єм даного винаходу. Мається рмі гідратів. Солі, одержані з фармацевтично прина увазі, що даний винахід включає в себе всі ізойнятних, органічних нетоксичних основ, включають мерні форми таких сполук. солі первинних, вторинних і третинних амінів, заДеякі з описаних тут сполук містять олефінові міщених амінів, включаючи існуючі в природі заподвійні зв'язки, і якщо не визначено інакше, маміщені аміни, циклічні аміни і основні іонообмінні ється на увазі, що в об'єм винаходу включені як Е, полімери, такі як аргінін, бетаїн, кофеїн, холін, Ν, так і Ζ геометричні ізомери. Ν'-дибензилетилендіамін, діетиламін, 2Деякі з описаних тут сполук можуть існувати у діетиламіноетанол, 2-диметиламіноетанол, етановигляді таутомерів, які відрізняються приєднанням ламін, етилендіамін, N-етилморфолін, Nводню до різних атомів, яке супроводжується одетилпіперидин, глюкамін, глюкозамін, гістидин, ним або більше зсувом подвійних зв'язків. Напригідрабамін, ізопропіламін, лізин, метилглюкамін, клад, кетон і його енольна форма є кетоморфолін, піперазин, піперидин, поліамінні смоли, енольними таутомерами. Індивідуальні таутомери прокаїн, пурини, теобромін, триетиламін, триметитакож як їх суміші включені в об'єм даного винахоламін, трипропіламін, трометамін і т. п. ду. Коли сполука даного винаходу є основною, Формула І ілюструє структуру класу сполук без солі можна одержати з фармацевтично прийнятврахування переважної стереохімії. Формула Іа них нетоксичних кислот, включаючи неорганічні і ілюструє переважну стереохімію на атомі вуглецю, органічні кислоти. Такі кислоти включають оцтову, пов'язаному з аміногрупою бета-амінокислоти, з бензолсульфонову, бензойну, камфорсульфонову, якої одержують дані сполуки. лимонну, етансульфонову, фумарову, глюконову, Як відомо в даній області, можна провести неглутамінову, бромистоводневу, соляну, ізетіонову, залежний синтез таких діастереомерів або можна молочну, малеїнову, яблучну, мигдалеву, метандосягнути їх розділення хроматографічно при відсульфонову, слизову, азотну, памову, пантотеноповідній модифікації методики, що розкривається ву, фосфорну, янтарну, сірчану, винну, птут. їх абсолютну стереохімію можна визначити толуолсульфокислоту і т. п. Особливо переважні шляхом рентгенокристалографічного дослідження лимонна, бромистоводнева, соляна, малеїнова, кристалічних продуктів або кристалічних проміжфосфорна, сірчана, фумарова і винна кислоти. них продуктів, які одержують у разі необхідності з Зрозуміло, що посилання, які застосовуються реактивом, що містить асиметричний центр з вітут, на сполуки формули І передбачають також домою абсолютною конфігурацією. включення фармацевтично прийнятних солей. У разі необхідності рацемічні суміші сполук Як очевидно фахівцеві, термін галоген, що заможна розділити, щоб виділити індивідуальні енастосовується тут, має на увазі включення фтору, нтіомери. Розділення можна проводити за допомохлору, брому і йоду. Точно так само позначення гою способів, відомих в даній області, таких як С1-8 в С1-8-алкілі означає групу, що містить 1, 2, 3, поєднання сполук рацемічної суміші з енантіомер4, 5, 6, 7 або 8 атомів вуглецю, з лінійним або розно чистою сполукою для утворення суміші діастегалуженим розташуванням атомів, так що С1-8реомерів з подальшим розділенням індивідуальалкіл, зокрема, включає метил, етил, н-пропіл, них діастереомерів стандартними способами, ізопропіл, н-бутил, ізобутил, трет-бутил, пентил, такими як фракційна кристалізація або хроматоггексил, гептил і октил. Аналогічно позначення С0 в рафія. Реакція поєднання часто являє собою C0-алкілі означає присутність прямого ковалентноутворення солей із застосуванням енантіомерно го зв'язку. Група, що позначається як незалежно чистої кислоти або основи. Похідні діастереомерів заміщена замісниками, може бути незалежно заможна потім перетворити до чистих енантіомерів міщена великим числом таких замісників. Термін шляхом відщеплення доданого хірального залиш«гетероцикл», що застосовується тут, включає ку. Рацемічну суміш сполук можна також розділити системи з 5- або б-членних кілець, які представлепрямими хроматографічними способами із застоні в наступному списку: бензімідазоліл, бензодіоксуванням хіральних стаціонарних фаз, способами, саніл, бензофураніл, бензопіразоліл, бензотіадіаякі відомі в даній області. золіл, бензотриазоліл, бензотіофеніл, З іншого боку, будь-який енантіомер сполуки бензоксадіазоліл, бензоксазоліл, карбазоліл, карможна одержати шляхом стереоселективного синболініл, хроманіл, цинолініл, фураніл, імідазоліл, тезу, застосовуючи оптично чисті вихідні матеріаіндолініл, індоліл, індолазиніл, індазоліл, ізобенли або реактиви відомої конфігурації за допомогою зофураніл, ізоіндоліл, ізохіноліл, ізотіазоліл, ізокспособів, добре відомих в даній області. сазоліл, нафтиридиніл, оксадіазоліл, оксазоліл, Термін «фармацевтично прийнятні солі» відпіразиніл, піразоліл, піридопіридиніл, піридазиніл, носиться до солей, одержаних з фармацевтично піридил, піримідил, піроліл, хіназолініл, хінолініл, прийнятних нетоксичних основ або кислот, вклюхіноксалініл, тетразоліл, тіадіазоліл, тіазолідиніл, чаючи неорганічні або органічні основи і неорганітіазоліл, тієніл, триазоліл, азетидиніл, 1,4 17 74912 18 діоксаніл, гексагідроазепініл, піперазиніл, піпериповідно фармацевтичні композиції даного винаходиніл, піролідиніл, морфолініл, тіоморфолініл, диду включають будь-яку композицію, виготовлену гідробензімідазоліл, дигідробензофураніл, дигідшляхом змішування сполуки даного винаходу і робензотіофеніл, дигідробензоксазоліл, фармацевтично прийнятного носія. Під «фармадигідрофураніл, дигідроімідазоліл, дигідроіндоліл, цевтично прийнятним» розуміється носій, розрідигідроізооксазоліл, дигідроізотіазоліл, дигідроокджувач або наповнювач, який сумісний з іншими садіазоліл, дигідрооксазоліл, дигідропіразиніл, інгредієнтами композиції і не завдає шкоди реципідигідропіразоліл, дигідропіридиніл, дигідропіримієнту. диніл, дигідропіроліл, дигідрохінолініл, дигідротетПід термінами «введення» і/або «прийом» разоліл, дигідротіадіазоліл, дигідротіазоліл, дигідсполуки потрібно розуміти забезпечення індивідуротієніл, дигідротриазоліл, дигідроазетидиніл, ума у випадку необхідності лікування сполукою, метилендіоксибензоїл, тетрагідрофураніл, тетрагівідповідною винаходу, або проліками, відповіднидроімідазоліл, тетрагідроізохінолініл і тетрагідротіми сполуці винаходу. єніл. Застосовність сполук, відповідних даному виІлюстрацією винаходу є застосування описанаходу, як інгібіторів активності ферменту дипепних тут і у прикладах сполук. тидилпептидази-IV можна продемонструвати за Визначені сполуки, відповідні даному винаходопомогою відомої в даній області методики. Конду, включають сполуку, вибрану з групи, що скластанти інгібування визначають таким чином. Задається зі сполук, описаних в наступних прикластосовують безперервний флуорометричний анадах, їх фармацевтично прийнятних солей та їх ліз, використовуючи як субстрат Gly-Pro-AMC, який індивідуальних діастереомерів. розщеплюється під дією DP-IV з вивільненням Представлені сполуки застосовні для способу флуоресцентної відхідної групи АМС. Така реакція інгібування ферменту дипептидилпептидази-IV, описується наступними кінетичними параметрами: що включає введення ефективної кількості сполуКm=50мкМ; kкат=75с-1; kкат/Km=1, 5x106 М-1с-1. Типоки пацієнту, такому як ссавець, який потребує тава реакційна суміш містить приблизно 50пМ феркого інгібування. Даний винахід направлений на менту, 50мкМ Gly-Pro-AMC і буфер (100мМ застосування сполук, описаних тут як інгібітори HEPES, pH 7, 5, 0,1мг/мл BSA) в загальному реакактивності ферменту дипептидилпептидази-IV. ційному об'ємі 100мкл. Вивільнення АМС безпереКрім приматів, таких як людина, спосіб, відпорвно контролюється в 96-ямковому планшеті, вмівідний даному винаходу, можна застосовувати для щеному у флуорометр, при довжині хвилі лікування ряду інших ссавців. Наприклад, можна збудження 360нм і довжині хвилі випромінювання застосовувати для лікування ссавців, включаючи, 460нм. При таких умовах протягом 30 хвилин при але цим не обмежуючись, корів, овець, кіз, коней, 25°С продукується приблизно 0,8мкМ АМС. Ферсобак, кішок, морських свинок, щурів або інших мент, що застосовується у таких дослідженнях, є представників цих видів. Спосіб можна також зарозчинним (з виключеними транс-мембранним стосовувати для представників інших видів, таких доменом і цитоплазматичною ділянкою) людським як види птахів (наприклад, курчата). протеїном, продукованим в системі бакуловірусної Даний винахід також відноситься до способу експресії (Bac-To-Bac, Gibco BRL). Знайдені кіневиготовлення лікарського засобу для інгібування тичні константи гідролізу Gly-Pro-AMC і GLP-1 відактивності ферменту дипептидилпептидази-IV у повідають літературним значенням для нативного людини і тварин, що включає об'єднання сполуки ферменту. При вимірюванні констант дисоціації даного винаходу з фармацевтичним носієм або сполук розчини інгібітора в ДМСО додають до реарозріджувачем. кційної суміші, що містить фермент і субстрат (кінДані способи лікування призначені для ссавця, цева концентрація ДМСО дорівнює 1%). Всі експепереважно людини, чоловіка або жінки, який потрименти проводять при кімнатній температурі при ребує інгібування активності ферменту дипептиописаних вище стандартних умовах реакції. При дилпептидази-IV. Термін «терапевтично ефективвизначенні констант дисоціації (Ki) швидкості реана кількість» означає кількість сполуки, що кції відповідають нелінійній регресії для рівняння обговорюється, при якій буде встановлена біологіМіхаеліса-Ментена для конкурентного інгібування. чна або терапевтична реакція тканини, системи, Погрішності при відтворенні констант дисоціації тварини або людини, і яка визначається досліднизвичайно не перевищують двох разів. ком, ветеринаром, лікарем або іншим клініцистом. Зокрема, сполуки, що розглядаються у настуТермін «композиція», що застосовується, пних прикладах, при згаданих вище випробуванвключає продукт, який містить певні інгредієнти в нях звичайно мають інгібуючу активність, яка хапевних кількостях, також як будь-який продукт, рактеризується значенням ІС50, по відношенню до який одержується, прямо або непрямо, при поєдферменту дипептидилпептидазі-IV приблизно менанні певних інгредієнтів у певних кількостях. Танше 1мкМ. Такий результат вказує на властиву кий термін, що відноситься до фармацевтичної сполукам активність у випадку застосування їх як композиції, включає продукт, який містить активінгібіторів активності ферменту дипептидилпептиний інгредієнт(и) та інертний інгредієнт(и), що є дази-IV. носієм, також як будь-який продукт, який одержуФермент дипептидилпептидаза-IV (DP-IV) є ється, прямо або непрямо, при поєднанні, утвопротеїном клітинної поверхні, який залучений до ренні комплексів або агрегації будь-яких двох або біологічних функцій широкого діапазону. Він широбільше інгредієнтів, або при дисоціації одного або ко розподілений в тканинах (кишечник, нирки, пебільше інгредієнтів, або при інших видах реакцій чінка, підшлункова залоза, плацента, тимус, селеабо взаємодій одного або більше інгредієнтів. Відзінка, епітеліоцити, васкулярний ендотелій, 19 74912 20 лімфоїдні і мієлоїдні клітини, сироватка) і має різні гічно з GLP-1 ймовірно, що GLP-2 також регулюрівні експресії в тканинах і клітинах різних типів. ється DP-IV. ICV-введення GLP-2 також інгібує DP-IV ідентична маркеру CD26 активації Т-клітин і всмоктування їжі, аналогічно ефектам, що спостеможе розщеплювати ряд імунорегуляторних, енрігаються для GLP-1 (Nature Medicine б, 802-807, докринних і неврологічних пептидів in vitro. Можна 2000). передбачити потенційну участь такої пептидази у Дефіцит гормону росту: інгібування DP-IV мопротіканні ряду захворювань людини або інших жна застосовувати для лікування дефіциту гормовидів. ну росту, виходячи з гіпотези, що рилізинг-фактор Відповідно сполуки, що обговорюються, застогормону росту (GRF), пептид, стимулюючий вивісовні для способу профілактики або лікування нальнення гормону росту з передньої долі гіпофізу, ступних захворювань, розладів і станів.розщеплюється ферментом DP-TV in vivo (WO Діабет типу 2 і споріднені розлади: Добре ві00/56297). Наступні дані свідчать, що GRF є ендодомо, що інкретини GLP-1 і GIP швидко інактивугенним субстратом: (1) GRF ефективно розщепються DP-IV in vivo. Вивчення мишей, дефіцитних люється in vitro з утворенням неактивного продукза DP-lV(-/-), і попередні клінічні випробування вкату GRF[3-44] (BBA 1122, 147-153 (1992)); (2) GRF зують, що інгібування DP-IV підвищує стійкі концешвидко розкладається в плазмі до GRF[3-44]; вкантрації GLP-1 і GIP, приводячи до поліпшення пезаним явищам можна запобігати впливом інгібітореносимості глюкози. Аналогічно з GLP-1 і GIP, ра DP-IV дипротину А; і (3) GRF[3-44] виявляють в ймовірно, що інші пептиди сімейства глюкагону, плазмі трансгенних свиней з людським GRF (J. включені в регуляцію глюкози, також інактивуютьClin. Invest. 83, 1533-1540 (1989)). Отже, інгібітори ся DP-IV (наприклад, РАСАР, глюкагон). ІнактиваDP-IV можна застосовувати для того ж спектра ція таких пептидів DP-IV може також відігравати симптомів, які обговорюються для стимуляторів роль в гомеостазі глюкози. секреції гормону росту. Тому інгібітори DP-IV даного винаходу застоПошкодження кишечнику: потенційне застосусовуються для лікування діабету типу II і лікування вання інгібіторів DP-IV для лікування пошкодження і запобігання численним станам, якими діабет типу кишечнику підказане результатами досліджень, які II часто супроводжується, включаючи метаболічвказують, що глюкагоноподібний пептид-2 (GLP-2), ний синдром X, реактивну гіпоглікемію і діабетичну вірогідний ендогенний субстрат для DP-IV, може дисліпідемію. Ожиріння, що обговорюється нижче, викликати трофічний вплив на кишковий епітелій є іншим станом, яке часто виявляється при діабеті (Regulatory Peptides 90, 27-32 (2000)). Введення типу II, що може давати реакцію на лікування споGLP-2 приводить до збільшення маси тонкої кишки луками даного винаходу. у гризунів і пом'якшує пошкодження кишечнику в Наступні захворювання, розлади і стани пов'ямоделях коліту і ентериту у гризунів. зані з діабетом типу 2 і, отже, при лікуванні за доІмунодепресія: інгібування DP-IV можна застопомогою сполук даного винаходу їх можна лікувасовувати для модуляції імунної реакції, основуюти, контролювати або в деяких випадках чись на дослідженнях причетності ферменту DP-IV попереджати: (1) гіперглікемія, (2) низька перенодо активації Т-клітин і до процесингу хемокінів, і на симість глюкози, (3) резистентність до інсуліну, (4) ефективності інгібіторів DP-IV в моделях захворюожиріння, (5) розлади ліпідного обміну, (6) дисліпівання in vivo. Встановлено, що DP-IV ідентичний демія, (7) гіперліпідемія, (8) гіпертригліцеридемія, CD26, маркеру клітинної поверхні активованих (9) гіперхолестеринемія, (10) низькі рівні HDL, (11) імунних клітин. Експресія CD26 регулюється дивисокі рівні LDL, (12) атеросклероз і його наслідки, ференціюванням і активованим статусом імунних (13) васкулярний рестеноз, (14) синдром подразклітин. Загальноприйнято, що CD26 функціонує як неної товстої кишки, (15) запальні захворювання ко-стимулююча молекула в моделях активації Ткишечнику, включаючи хворобу Крона і неспециклітин in vitro. Ряд хемокінів містить пролін в перефічний виразковий коліт, (16) інші запальні стани, достанньому положенні, можливо для захисту їх (17) панкреатит, (18) ожиріння черевної порожнивід деградації під дією неспецифічних амінопептини, (19) нейродегенеративне захворювання, (20) даз. Встановлено, що багато які з них піддаються ретинопатія, (21) нефропатія, (22) невропатія, (23) процесингу in vitro під дією DP-IV. У деяких випадсиндром X, (24) оваріальний гіперандрогенізм (сиках (RANTES, бетa-LD78, MDC, еотаксин, альфандром полікістозу яєчників) та інші розлади, де SDF-l) розщеплення приводить до зміни активності складовим компонентом є резистентність до інсупри хемотаксисі і передачі сигналу. У деяких випаліну. дках (RANTES), мабуть, змінюється також селекОжиріння: інгібітори DP-IV можна застосовувативність рецептора. У системах культивування ти для лікування ожиріння. Таке лікування основаклітин in vitro ідентифіковані численні укорочені з не на інгібуючому впливі GLP-1 і GLP-2, що споN-кінця форми ряду хемокінів, включаючи передстерігається, на всмоктування їжі і випорожнення бачені продукти гідролізу DP-IV. шлунка. Екзогенне введення GLP-1 істотно зменНа моделях трансплантації і артриту у тварин шує всмоктування їжі і уповільнює випорожнення встановлено, що інгібітори DP-IV є ефективними шлунка у людини (Am. J. Physiol. 277, R910-R916, імунодепресантами. Було показано, що безпово1999). ICV-введення GLP-1 щурам і мишам також ротний інгібітор DP-IV продипін (Pro-Proзначно впливає на всмоктування їжі (Nature дифенілфосфонат) подвоює тривалість функціоMedicine 2, 1254-1258 (1996)). У мишей GLP-1R(-/-) нування серцевого алотрансплантанту щурів з 7 такого інгібування всмоктування спожитої їжі не до 14 днів (Transplantation 63, 1495-1500 (1997)). спостерігається, що вказує на те, що дані ефекти Інгібітори DP-IV досліджували на моделі артриту, опосередковані рецепторами GLP-1 мозку. Аналоіндукованого колагеном і алкілдіаміном у щурів, і 21 74912 22 дослідження показали статистично значне змензміни рухливості сперматозоїдів і для контрацепції шення пухлини задньої кінцівки в такій моделі (Int. чоловіка, оскільки у сім'яній рідини важливі для J. Immunopharmacology 19, 15-24 (1997), рухливості сперматозоїду простатосоми, органели, Immunopharmacology 40, 21-26 (1998)). Рівень DPщо виробляються простатою, володіють надвисоIV підвищується при ряді аутоімунних захворюкими рівнями активності DP-IV (Eur. J. Clin. Chem. вань, включаючи ревматоїдний артрит, розсіяний Clin. Biochem 30, 333-338 (1992)). склероз, хворобу Грейвса і тиреоїдит Хасімото Гінгівіт: інгібування DP-IV можна застосовува(Immunology Today 20, 367, 375 (1999)). ти для лікування гінгівіту, оскільки в деяких досліВІЛ-інфекція: інгібування DP-IV можна застодженнях, що встановлюють зв'язок з тяжкістю песовувати для лікування або запобігання ВІЛріодонтального захворювання, виявлена інфекції або СНІДу, тому що ряд хемокінів, які інгіактивність DP-IV у десневій рідині, що знаходиться бують проникнення ВІЛ-клітин, є потенційними в десневій борозні (Arch. Oral Biol. 37, 167-173 субстрат для DP-IV (Immunology Today 20, 367-375 (1992)). (1999)). У випадку альфа-SDF-l розщеплення змеОстеопороз: інгібування DP-IV можна застосоншує противірусну активність (PNAS 95, 6331-6 вувати для лікування або профілактики остеопо(1998)). Таким чином, при інгібуванні DP-IV можна розу, оскільки в остеобластах присутні GIPчекати стабілізації альфа-SDF-l для зменшення рецептори. інвазивної здатності ВІЛ. Сполуки даного винаходу можна застосовуваГемопоез: інгібування DP-IV можна застосовути для лікування або попередження одного або вати для лікування або запобігання гемопоезу, більше наступних станів або захворювань: (1) гітому що DP-IV може бути залучений в гемопоез. перглікемія, (2) низька переносимість глюкози, (3) Інгібітор DP-IV, Val-Boro-Pro, стимулював гемопоез резистентність до інсуліну, (4) ожиріння, (5) розлав моделі нейтропенії мишей, індукованій циклофоди ліпідного обміну, (6) дисліпідемія, (7) гіперліпісфамідом (WO 99/56753). демія, (8) гіпертригліцеридемія, (9) гіперхолестеНейронні розлади: інгібування DP-IV можна ринемія, (10) низькі рівні HDL, (11) високі рівні LDL, застосовувати для лікування або запобігання різ(12) атеросклероз і його наслідки, (13) васкулярним нейронним або психіатричним розладам, тому ний рестеноз, (14) синдром подразненої товстої що ряд пептидів, залучених до різних нейронних кишки, (15) запалення кишечнику, включаючи хвопроцесів, розщеплюється DP-IV in vitro. Отже, інгіробу Крона і неспецифічний виразковий коліт, (16) бітор DP-IV може володіти терапевтичною переваінші запальні стани, (17) панкреатит, (18) ожиріння гою при лікуванні нейронних розладів. Встановлечеревної порожнини, (19) нейродегенеративне но, що ендоморфін-2, бета-казоморфін і речовина захворювання, (20) ретинопатія, (21) нефропатія, Р, всі є in vitro субстратами для DP-IV. У всіх випа(22) невропатія, (23) синдром X, (24) оваріальний дках розщеплення in vitro високоефективне, відгіперандрогінізм (синдром полікістозу яєчників), (25) діабет типу 2, (26) дефіцит гормону росту, (27) ношення kcat/Km 106 Μ-1с-1 або більше. У моделі нейтропенія, (28) нейронні розлади, (29) метастаанальгезії в тесті підстрибування під дією електризуюча пухлина, (30) доброякісна гіпертрофія печного струму щурів інгібітор DP-IV показав значний редміхурової залози, (32) гінгівіт, (33) гіпертонія, ефект, який не залежав від присутності екзогенно(34) остеопороз та інші стани, які можна лікувати го ендоморфіну-2 (Brain Research 815,278-286 або попереджати шляхом інгібування DP-IV. (1999)). Сполуки, що обговорюються, також застосоІнвазія (проростання) пухлини і метастазів: інвують для попередження або лікування вищезагібування DP-IV можна застосовувати для лікуванзначених захворювань, розладів і станів в поєдня або запобігання інвазії пухлини і метастазів, нанні з іншими агентами. тому що під час трансформації нормальних клітин Сполуки даного винаходу можна застосовувау злоякісний фенотип спостерігається збільшення ти в поєднанні з одним або більше інших лікарсьабо зменшення експресії деяких ектопептидаз, ких засобів для лікування, попередження, придувключаючи DP-IV (J. Exp. Med. 190, 301-305 шення або зменшення інтенсивності симптомів (1999)). Підвищення і зниження рівня таких протеїзахворювань або станів, для яких застосовуються нів, мабуть, є специфічним відносно різних типів сполуки формули І або інші лікарські засоби, коли тканин і клітин. Наприклад, спостерігається підвикомбінація лікарських засобів більш надійна або щена експресія CD26/DP-IV при Т-клітинній лімбільш ефективна, ніж будь-який з лікарських засофомі, Т-клітинному гострому лімфобластному лейбів окремо. Інший такий лікарський засіб (засоби) козі, при карциномах щитовидної залози можна вводити відповідно до способу застосуванклітинного походження, базально-клітинних карциня і в кількості, в якій він звичайно застосовується, номах і карциномах молочної залози. Таким чиодночасно або послідовно зі сполукою формули І. ном, інгібітори DP-IV можна застосовувати у лікуКоли сполуку формули І застосовують одночасно з ванні таких карцином. одним або більше іншим лікарським засобом, пеДоброякісна гіпертрофія передміхурової залореважна фармацевтична композиція у вигляді дози (ВРН): інгібування DP-IV можна застосовувати зованої лікарської форми, що містить такі інші лідля лікування доброякісної гіпертрофії передміхукарські засоби і сполуку формули І. Однак рової залози, оскільки у пацієнтів з ВРН відмічакомбінована терапія може також включати терапії, ється підвищена активність DP-IV у тканині проспри яких сполука формули І і один або більше інтати (Eur. J. Clin. Chem. Clin. Biochem 30, 333-338 ших лікарських засобів вводяться за різними схе(1992)). мами прийому, що перекриваються. Також розгляРухливість сперматозоїдів/контрацепція чолодається випадок, коли сполуки даного винаходу, віка: інгібування DP-IV можна застосовувати для 23 74912 24 що застосовуються в поєднанні з одним або більстероїдні протизапальні лікарські засоби, глюкокоше іншими активними інгредієнтами, та інші активртикоїди, азулфідин і селективні інгібітори циклооні інгредієнти можна застосовувати в більш низьксигенази-2. ких дозах, ніж коли кожний з них застосовується Згадані вище комбінації включають комбінації окремо. Відповідно, фармацевтичні композиції сполуки даного винаходу не тільки з однією з інданого винаходу включають композиції, які крім ших активних сполук, але також і з двома або бісполуки формули І містять один або більше інших льше іншими активними сполуками. Необмежуваактивних інгредієнтів. льні приклади включають комбінацію сполук Приклади інших активних інгредієнтів, які можформули І з двома або більше активними сполуна вводити в поєднанні зі сполукою формули 1, ками, вибраними з бігуанідів, сульфонілсечовин, причому їх можна вводити або окремо, або в склаінгібіторів HMG-CoA-редуктази, агоністів PPAR, ді тієї ж самої фармацевтичної композиції, вклюінгібіторів РТР-1В, інших інгібіторів DP-IV і сполук, чають, але цим не обмежуються: призначених проти ожиріння. (а) інші інгібітори дипептидилпептидази IV (DPАналогічно сполуки даного винаходу можна IV); застосовувати в поєднанні з іншими лікарськими (b) сенсибілізатори інсуліну, включаючи (і) засобами, що застосовуються для лікування/профілактики/придушення або зменшення інтеагоністи PPAR, такі як глітазони (наприклад, трогнсивності симптомів захворювань або станів, для літазон, піоглітазон, енглітазон, МСС-555, розигліяких застосовуються сполуки даного винаходу. тазон і т. п.) та інші PPAR-ліганди, включаючи поІнші такі лікарські засоби можна вводити згідно зі двійні агоністи / PPAR, такі як KRP-297, і агоністи способом застосування і в кількості, в якій вони PPAR, такі як похідні фенофібрової кислоти (гезвичайно застосовуються, одночасно або послідомфіброзил, клофібрат, фенофібрат і безафібрат), вно зі сполукою даного винаходу. Коли сполуку (іі) бігуаніди, такі як метформін і фенформін, та (ііі) даного винаходу застосовують одночасно з одним інгібітори (протеїн-тирозин)фосфатази-ІВ (РТРабо більше інших лікарських засобів, переважна 1В); фармацевтична композиція, що містить крім спо(c) інсулін або інсуліноміметики; луки даного винаходу інші такі лікарські засоби. (d) сульфонілсечовини та інші стимулятори Відповідно, фармацевтичні композиції даного висекреції інсуліну, такі як толбутамід і гліпізид, мегнаходу включають композиції, які крім сполуки літинід і споріднені матеріали; даного винаходу містять один або більше інших (e) інгібітори альфа-глюкозидази (такі як акарактивних інгредієнтів. боза); Вагове співвідношення сполуки даного вина(f) антагоністи глюкагонових рецепторів, такі як ходу і другого активного інгредієнта може варіюваописані в заявках WO 98/04528, WO 99/01423, WO тись і буде залежати від ефективної дози кожного 00/39088 і WO 00/69810; інгредієнта. У загальному випадку застосовують (g) GLP-1, міметики GLP-1 і агоністи GLP-1ефективну дозу кожного з них. Таким чином, коли рецепторів, такі як описані в заявках WO 00/42026 сполука даного винаходу об'єднана, наприклад, з і WO 00/59887; іншим агентом, вагове співвідношення сполуки (h) GIP і міметики GIP, такі як описані в заявці даного винаходу та іншого агента в загальному WO 00/58360, і агоністи GIP-рецепторів; випадку складає приблизно від 1000:1 до 1:1000, (і) РАСАР, міметики РАСАР і агоністи рецеппереважно складає приблизно від 200:1 до 1:200. тора-3 РАСАР, такі як описані в заявці WO Комбінації сполуки даного винаходу з іншими ак01/23420; тивними інгредієнтами в загальному випадку також (j) агенти, які знижують холестерин, такі як (і) знаходяться в межах вищезазначеного діапазону, інгібітори HMG-CoA-редуктази (ловастатин, симоднак в кожному випадку потрібно застосовувати вастатин, правастатин, флувастатин, аторвастаефективну дозу кожного активного інгредієнта. тин, ривастатин, ітавастатин, розувастатин та інші У таких комбінаціях сполуку даного винаходу статини), (іі) агенти, що посилюють екскрецію (хота інші активні агенти можна вводити окремо або лестирамін, холестипол і діалкіламіноалкільні поразом. Крім того, введення одного з елементів хідні поперечно-зшитого декстрану), (ііі) нікотиніможна здійснити до, в той же самий час або посліловий спирт, нікотинова кислота або її солі, (iv) довно після введення іншого агента(ів). агоністи PPAR, такі як похідні фенофібрової кисСполуки даного винаходу можна вводити пелоти (гемфіброзил, клофібрат, фенофібрат і безрорально, парентерально (наприклад, внутрішафібрат), (ν) подвійні агоністи / PPAR, такі як ньом'язово, внутрішньоочеревинно, внутрішньоKRP-297, (vi) інгібітори абсорбції холестерину, такі венно, ICV, внутрішньопорожнинною ін'єкцією або як бета-ситостерол і езетиміб, (vii) інгібітори СоАвливанням, підшкірною ін'єкцією або у вигляді імацил:холестеролацилтрансферази, такі як авасиплантату), спреєм для інгаляції, назальним, вагіміб, і (viii) антиоксиданти, такі як пробукол; нальним, ректальним, під'язиковим або локальним (k) агоністи 5PPAR, такі як описані в заявці WO способом введення, можна приготувати з однієї 97/28149; речовини або з речовин, взятих разом, відповідну (l) сполуки проти ожиріння, такі як фенфлурадозовану лікарську форму, що містить загальнопмін, дексфенфлурамін, фентермин, сибутрамін, рийняті нетоксичні фармацевтично прийнятні носії, орлистат, інгібітори У5-нейропептиду і агоністи рздопоміжні речовини і зв'язувальні, відповідні кожадренергічних рецепторів; ному способу введення. Крім лікування теплокро(m) інгібітор транспортера жовчної кислоти в вних тварин, таких як миші, щури, коні, худоба, клубову кишку; і вівці, собаки, кішки, мавпи і т. д., сполуки винаходу (п) протизапальні агенти, такі як аспірин, не 25 74912 26 ефективні для лікування людини. капсул, де активний інгредієнт змішаний з водою Фармацевтичні композиції для введення споабо масляним середовищем, наприклад, арахісолук даного винаходу можна представляти в загавою олією, вазеліновим маслом або оливковою льноприйнятій стандартній лікарській формі і одеолією. ржати будь-яким з відомих у фармацевтиці Водні суспензії містять активні матеріали в суспособів. Всі способи включають стадію об'єднанміші з наповнювачами, відповідними для виготовня активного інгредієнта з носієм, який складаєтьлення водних суспензій. Такі наповнювачі являють ся з одного або більше допоміжних інгредієнтів. У собою суспендуючі агенти, наприклад, натрійкарзагальному випадку фармацевтичні композиції боксиметилцелюлозу, метилцелюлозу, гідроксиподержують шляхом уніфікованого і однорідного ропілметилцелюлозу, альгінат натрію, полівінілпіоб'єднання активного інгредієнта з рідким або тонролідон, трагакантову камедь і аравійську камедь; коподрібненим твердим носієм, або з тим та індиспергуючі або змочувальні агенти можуть бути шим, і потім, у разі необхідності, придання продукпредставлені фосфатидом, що зустрічається в ту форми необхідного складу. Активну цільову природі, наприклад, лецитином, або продуктами сполуку включають у фармацевтичну композицію в конденсації алкіленоксиду з жирними кислотами, кількості, достатній, щоб надати необхідну дію на наприклад, поліоксіетиленстеаратом, або продукпроцес захворювання або стан, пов'язаний із затами конденсації етиленоксиду з аліфатичними хворюванням. Термін «композиція», що застосовуспиртами з довгим ланцюгом, наприклад, гептадеється тут, означає продукт, що містить певні інгрекаетиленоксицетанолом, або продуктами кондендієнти в певних кількостях, також як будь-який сації етиленоксиду з частковими складними ефіпродукт, який виходить прямо або непрямо від рами, що одержуються з жирних кислот і гекситу, комбінації певних інгредієнтів, взятих у певних таких як поліоксіетиленсорбітмоноолеат, або прокількостях. дуктами конденсації етиленоксиду з частковими Фармацевтичні композиції, що містять активскладними ефірами, що одержуються з жирних ний інгредієнт, можна одержувати у формі, відпокислот і ангідридів гекситу, наприклад, поліетилевідній для перорального застосування, наприклад, нсорбітанмоноолеат. Водні суспензії можуть також таблетки, пастилки, коржики, водні або масляні містити один консервант або більше, наприклад, суспензії, дисперсії порошків або гранул, емульсії, етил- або н-пропіл-п-гідроксибензоат, один барвтверді або м'які капсули, сиропи або еліксири. ник або більше, один коригент або більше і один Композиції, призначені для перорального застосупідсолоджувач або більше, такий як сахароза або вання, можна приготувати згідно з будь-яким спосахарин. собом, відомим в даній області для виготовлення Масляні суспензії можна одержати шляхом суфармацевтичних композицій, і такі композиції моспендування активного інгредієнта в олії, наприжуть містити один або більше агентів, вибраних з клад арахісовій олії, оливковій олії, кунжутній олії групи, що складається з підсолоджувачів, коригенабо кокосовій олії, або в мінеральному маслі, татів, барвників і консервантів, щоб забезпечити дукому як вазелінове масло. Масляні суспензії може хороші фармацевтичні і апетитні на смак прежуть містити загусник, наприклад бджолиний віск, парати. Таблетки містять активний інгредієнт в твердий парафін або цетиловий спирт. Можна суміші з нетоксичними фармацевтично прийнятдодавати підсолоджувачі, такі як згадані вище, і ними наповнювачами, відповідними для виготовкоригенти, щоб забезпечити прийнятний препарат лення таблеток. Такими наповнювачами можуть для перорального прийому. Такі композиції можна бути, наприклад, інертні розріджувачі, такі як карзберігати при додаванні антиоксиданту, такого як бонат кальцію, карбонат натрію, лактоза, фосфат аскорбінова кислота. кальцію або фосфат натрію; гранулюючі і дезінтеУ дисперсних порошках і гранулах, відповідних груючі агенти, наприклад, кукурудзяний крохмаль для одержання водної суспензії при додаванні до або альгінова кислота; зв'язувальні агенти, наприних води, активний інгредієнт змішують з дисперклад крохмаль, желатин або акація, і змащувальні гатором або змочувальним агентом, суспендуюагенти, наприклад, стеарат магнію, стеаринова чим агентом і одним або більше консервантом. кислота або тальк. Таблетки можуть бути без покВідповідні диспергуючі або змочувальні агенти і риття, або їх можна покрити відомими способами, суспендуючі агенти вже перераховані вище. Мощоб сповільнити дезінтеграцію і абсорбцію у шлужуть також бути присутніми додаткові наповнюванково-кишковому тракті і таким чином підтримувачі, наприклад, підсолоджувачі, коригенти і барвнити їх дію більш тривалий період. Наприклад, для ки. збільшення періоду дезінтеграції і абсорбції можна Фармацевтичні композиції винаходу можна тазастосовувати такі матеріали, як гліцерилмоностекож одержувати у вигляді емульсій «масло у воді». арат або гліцерилдистеарат. Відповідно до метоМасляною фазою може бути олія, наприклад, олидик, описаних в патентах США 4256108; 4166452 і вкова або арахісова олія, або мінеральне масло, 4265874, можна також одержати осмотичні теранаприклад, вазелінове масло, або їх суміші. Відпопевтичні таблетки з покриттям для контрольовановідними емульгаторами можуть стати наприклад го вивільнення. аравійська камедь, камеді, що зустрічаються в Препаративні форми для перорального застоприроді, або трагакантова камедь, фосфатиди, що сування можна також представити у вигляді тверзустрічаються в природі, наприклад, фосфатиди дих желатинових капсул, де активний інгредієнт сої, лецитин і складні ефіри або часткові складні змішаний з інертним твердим розріджувачем, наефіри, що одержуються з жирних кислот і ангідриприклад, карбонатом кальцію, фосфатом кальцію дів гекситу, наприклад сорбітанмоноолеат, і проабо каоліном, або у вигляді м'яких желатинових дукти конденсації згаданих часткових складних 27 74912 28 ефірів з етиленоксидом, наприклад, поліоксіети1,0, 5,0, 10,0, 15,0, 20,0, 25,0, 50,0, 75,0, 100,0, ленсорбітанмоноолеат. Емульсії можуть також 150,0, 200,0, 250,0, 300,0, 400,0, 500,0, 600,0, містити підсолоджувачі і коригенти. 750,0, 800,0, 900,0 і 1000,0 міліграмів активного Сиропи і еліксири можна виготовляти з підсоінгредієнта для симптоматичної корекції дозування лоджувачами, наприклад, гліцерином, пропіленглідля пацієнта, що піддається лікуванню. Сполуки колем, сорбітом або сахарозою. Такі препаративні можна вводити в режимі від 1 до 4 разів на день, форми можуть також містити засіб, що зменшує переважно один раз або двічі на день. подразнення, консервант, коригенти і барвники. При лікуванні або профілактиці цукрового діаФармацевтичні композиції можна одержувати бету і/або гіперглікемії або гіпертригліцеридемії у формі стерильної водної або маслянистої суабо інших захворювань, для яких призначені споспензії для ін'єкції. Таку суспензію можна приготулуки даного винаходу, задовільні результати звивати згідно з відомими способами, застосовуючи чайно одержують, коли сполуки даного винаходу відповідні диспергатори або змочувальні агенти і вводять щодня при дозі приблизно від 0,1 до 100 суспендуючі агенти, згадані вище. Стерильний міліграм/кілограм маси тварини, препарат перевапрепарат для ін'єкцій може також являти собою жно дають у вигляді разової добової дози або у стерильний розчин для ін'єкції або суспензію в вигляді дози, розділеної на два-шість прийомів на нетоксичному парентерально прийнятному розрідень, або у формі пролонгованого вивільнення джувачі або розчиннику, наприклад, розчин в 1,3лікарського засобу. Для найбільших ссавців загабутандіолі. Серед прийнятних зв'язувальних і розльна добова доза складає приблизно від 1,0 до чинників, які можна застосовувати, знаходиться 1000 міліграмів, переважно приблизно від 1 до 50 вода, розчин Рінгера та ізотонічний розчин хлориміліграмів. Для дорослої людини масою 70кг загаду натрію. Крім того, як розчинник або суспензійне льна добова доза звичайно складає приблизно від середовище традиційно застосовують стерильні 7 до 350 міліграмів. Для одержання оптимальної нелеткі масла. Для такої мети можна застосовуватерапевтичної реакції вказаний режим прийому ти будь-яке рідке нелетке масло, включаючи синможна відкоригувати. тетичні моно- або дигліцериди. Крім того, для одеОднак зрозуміло, що для будь-якого з конкрержання препаратів для ін'єкцій застосовують жирні тних пацієнтів певний рівень доз і частоту прийому кислоти, такі як олеїнова кислота. можна варіювати, вони будуть залежати від ряду Сполуки даного винаходу можна також вводифакторів, включаючи активність конкретної сполути у вигляді супозиторіїв для ректального введенки, що застосовується, метаболічну стабільність і ня лікарського засобу. Такі композиції можна одетривалість дії такої сполуки, вік, масу тіла, загальржати шляхом змішування лікарського засобу з ний стан здоров'я, стать, дієту, режим і час ввевідповідним неподразнюючим наповнювачем, який дення, швидкість виділення, комбінацію лікарських є твердим при звичайних температурах, але рідзасобів, серйозність конкретного стану і суб'єкта, ким при ректальній температурі і, отже, розплащо зазнає терапії. виться у прямій кишці для вивільнення лікарського На наступних схемах і прикладах проілюстрозасобу. Такими матеріалами є масло какао і поліевані деякі способи одержання сполук даного винатиленгліколі. ходу. Вихідні матеріали одержували згідно з метоДля місцевого застосування використовуються диками, відомими в даній області або як показано креми, мазі, желе, розчини або суспензії і т. д., що в описі. містять сполуки даного винаходу. (З метою такого Сполуки даного винаходу можна одержати з застосування місцеве застосування повинно вклюпроміжних сполук ß-амінокислот, таких як сполуки чати рідини для полоскання рота і горла.) формули П, і заміщених гетероциклічних проміжФармацевтична композиція і спосіб згідно з них сполук, таких як сполуки формули III, при стаданим винаходом можуть також включати інші ндартних умовах реакції зв'язування пептидів, з терапевтично активні сполуки, як тут відмічалось, подальшим зняттям захисту. Одержання таких які звичайно застосовуються при лікуванні згадапроміжних сполук описане на наступних схемах. них вище патологічних станів. Для лікування або запобігання станам, при яких потрібно інгібування активності ферменту дипептидилпептидази-IV, відповідний рівень дозування звичайно складає приблизно від 0,01 до 500мг/кг маси пацієнта на день, при цьому препарат можна вводити у вигляді разових або багатоде Аr, X і R1 визначені вище, а Р являє собою разових доз. Переважний рівень дозування склавідповідну захисну групу для азоту, таку як третдає приблизно від 0,1 до 250мг/кг на день; більш бутоксикарбоніл, бензилоксикарбоніл або 9переважний - приблизно від 0,5 до приблизно флуоренілметоксикарбоніл. 100мг/кг на день. Відповідний рівень дозування може складати приблизно від 0,01 до 250мг/кг на день, приблизно від 0,05 до 100мг/кг на день, або приблизно від 0,1 до 50мг/кг на день. В межах такого діапазону дозування може складати від 0,05 до 0,5, від 0,5 до 5 або від 5 до 50мг/кг на день. Для перорального прийому композиції одержують переважно у формі таблеток, що містять від 1,0 до Сполуки формули II є в продажу, описані в лі1000 міліграмів активного інгредієнта, зокрема, 29 74912 30 тературі або їх можна одержати за допомогою ряду відповідних способів, відомих в даній області. Один з таких способів проілюстрований на схемі 1. Кислоту 1, яка може бути в продажу-або легко одержується з відповідної амінокислоти із застосуванням захисної групи, наприклад, ди-третбутилдикарбонату (Р=Вос), карбобензилоксихлориду (P=Cbz) або N-(9флуоренілметоксикарбонілокси)сукциніміду Відповідний спосіб одержання проміжної спо(P=Fmoc) обробляють ізобутилхлорформіатом і луки 2b, де X являє собою N, проілюстрований на основою, такою як триетиламін або діізопропілесхемі 4. Для одержання гідразинопіразину 7 хлортиламін, і потім діазометаном. Для одержання бепіразин 6 обробляють гідразином. Сполуку 2b мота-амінокислоти II одержаний діазокетон потім жна одержати конденсацією сполуки 7 або зі склаобробляють бензоатом срібла в розчиннику, такодним ортоефіром, таким як складний триетиловий му як метанол або водний розчин діоксану, його ефір ортокислоти 8, або з карбоновою кислотою 9 також можна піддати обробці ультразвуком, слів поліфосфорній кислоті при підвищених темперадуючи методиці, описаній Sewald та інш., Sinthesis, турах. 837 (1997). Як зрозуміло фахівцеві, для одержання енантіомерно чистих бета-амінокислот II можна застосовувати енантіомерно чисті альфаамінокислоти 1. Опис альтернативних способів одержання таких сполук можна знайти в наступних оглядах: [Е. Juaristi, Enantioselective Synthesis of J3-Amino Acids, Ed., Wiley-VCH, New York: 1997, Juaristi та інш., Aidrichimica Acta, 27, 3 (1994), Cole та інш., Tetrahedron, 32, 9517 (1994)]. Сполуки III є в продажу, описані в літературі або їх можна одержати за допомогою ряду відповідних способів, відомих в даній області. Один з відповідних способів проілюстрований на схемі 2. Для одержання сполуки III ненасичене похідне 2 відновлюють, наприклад, обробкою газоподібним воднем в присутності каталізатора, такого як паладій на вуглеці або оксид платини в розчиннику, такому як метанол або етанол. Проміжний продукт 2 на схемі 2 сам по собі є в продажу, описаний в літературі або його можна одержати за допомогою ряду відповідних способів, відомих в даній області. Один з таких способів, коли X являє собою CR2, проілюстрований на схемі 3. Для одержання проміжної сполуки 2а амінопіразин З обробляють 2-галогенкетоном, таким як 2бромкетон 4 в розчиннику, такому як метанол або етанол. З іншого боку, для одержання проміжної сполуки 2а, де R2 являє собою Н, замість проміжної сполуки 4 можна застосовувати 2бромдиметилацеталь 5 і каталітичну кількість кислоти, такої як соляна кислота. Альтернативний спосіб одержання сполуки IIIb, де X являє собою N, проілюстрований на схемі 5. Сполуку 12 одержують згідно зі способом, описаним вище, застосовуючи замість хлорпіразину 6 дихлорпіразин 10. Потім для одержання сполуки IIIb у вигляді її монохлористоводневої солі сполуки 12 піддають каталітичному гідруванню, застосовуючи каталізатор, такий як оксид платини. Для одержання проміжної сполуки 13 проміжні сполуки II і III зв'язують при стандартних умовах реакції зв'язування пептидів, наприклад, застосовуючи 1-етил-3-(3-диметиламінопропіл)карбодіімід (EDC), 1-гідроксибензотриазол (HOBT), і основу, звичайно діізопропілетиламін, в розчиннику, такому як Ν,Ν-диметилформамід (DMF) або дихлорметан, протягом від 3 до 48 годин при температурі навколишнього середовища, як показано на схемі 6. Потім видаляють захисну групу, наприклад, при взаємодії з трифтороцтовою кислотою або з розчином хлористого водню в метанолі у випадку В ос, щоб одержати необхідний амін І. У випадку 31 74912 32 необхідності продукт очищають від небажаних зометану гасять, додаючи краплями оцтову кислопобічних продуктів рекристалізацією, розтиранням, ту, розбавляють реакційну суміш етилацетатом і препаративною тонкошаровою хроматографією, промивають послідовно 5%-ним розчином соляної флеш-хроматографією на силікагелі, як описано в кислоти, насиченим водним розчином бікарбонату публікації W. С. Still, J. Org. Chem. 43, 2923 (1978) натрію і соляним розчином, сушать над сульфатом або ВЕРХ. Сполуки, які очищені шляхом ВЕРХ, магнію і концентрують у вакуумі. Після очищення можна виділити у вигляді відповідних солей. Очифлеш-хроматографією (силікагель, гекщення проміжних продуктів проводять таким же сан:етилацетат у відношенні 4:1) одержують 1,5г чином. діазокетону. ЯМР 1H (500МГц, CDCl3) 7,03-6,95 У деяких випадках проміжний продукт 13, оде(м, 1Н), 6,95-6,88 (м, 2Н), 5,43 (уш. с, 1Н), 5,18 (уш. ржаний внаслідок реакції зв'язування, описаної на с, 1Н), 4,45 (уш. с, 1Н), 3,19-3,12 (м, 1Н), 2,97-2,80 схемі 6, можна далі модифікувати перед видален(м, 1Н), 1,38 (с, 9Н). ням захисної групи, наприклад, шляхом обробки Стадія С. (3R)-3-[(1,1-диметилетоксикарбоніл замісників на X або R1. Така обробка може вклю)аміно]-4-(2,5-дифторфеніл)бутанова кислота чати, однак цим не обмежується, реакції відновДо розчину 2,14г (6,58ммоль) (R,S)-3-[(1,1лення, окислення, алкілування, ацилювання і гіддиметилетоксикарбоніл)аміно]-1-діазо-4-(2,5ролізу, які звичайно відомі фахівцеві в даній дифторфеніл)бутан-2-ону, розчиненого в 100мл області. метанолу, при -30°С додають послідовно 3,3мл У деяких випадках порядок виконання згада(19ммоль) діізопропілетиламіну і 302мг них вище на схемах реакцій можна варіювати, щоб (1,32ммоль) бензоату срібла. Реакційну суміш пеполегшити протікання реакції або уникнути небаремішують протягом 90 хвилин перед розбавленжаних продуктів реакції. Наступні приклади навеням етилацетатом і промиванням послідовно 2н дені для того, щоб можна було більш повно зрозурозчином соляної кислоти, насиченим водним роміти винахід. Дані приклади наведені тільки для зчином бікарбонату натрію і соляним розчином. ілюстрації і не повинні тлумачитись як такі, що Органічну фазу сушать над сульфатом магнію, обмежують винахід яким-небудь чином. концентрують у вакуумі і розділяють енантіомери Проміжний продукт 1 препаративною хіральною ВЕРХ (на колонці, Chiralpak AD, 5% розчин етанолу в гексані), одержуючи при цьому 550мг необхідного (R)енантіомера, який елююється першим. Одержану речовину розчиняють в 50мл суміші тетрагідрофуран:метанол:1н водний розчин гідроксиду літію (3:1:1) і перемішують при 50°С протягом 4 годин. Реакційну суміш охолоджують, підкисляють 5% розбавленою соляною кислотою і екстрагують етилацетатом. Об'єднані органічні фази промива(3R)-3-[(1,1-диметилетоксикарбоніл)аміно]-4ють соляним розчином, сушать над сульфатом (2,5-дифторфеніл)бутанова кислота магнію і концентрують у вакуумі, одержуючи при Стадія A. (R,S)-N-(1,1цьому 360мг вказаної в заголовку сполуки у виглядиметилетоксикарбоніл)-2,5-дифторфенілаланін ді білої, спіненої твердої речовини. ЯМР 1H До розчину 0,5г (2,49ммоль) 2,5-дифтор-DL(500МГц, CDCl3) 7,21 (м, 1Η), 6,98 (м, 2H), 6, 10 фенілаланіну в 5мл трет-бутанолу додають послі(уш. с, 1Н), 5,05 (м, 1Н), 4,21 (м, 1Н), 2,98 (м, 2Н), довно 1,5мл 2н водного розчину гідроксиду натрію 2,60 (м, 2Н), 1,38 (с, 9Н). і 543мг ди-трет-бутилдикарбонату. Реакційну суПроміжний продукт 2 міш перемішують при температурі навколишнього середовища протягом 16 годин і розбавляють етилацетатом. Органічну фазу промивають послідовно 1н розчином соляної кислоти і соляним розчином, сушать над сульфатом магнію і концентрують у вакуумі. Неочищений продукт очищають флешхроматографією (силікагель, дихлорметан:метанол:оцтова кислота у відношенні 97:2:1), одержуючи при цьому 671мг вказаної в заголовку сполуки. MS 302 (М+1) (3R)-3-[(1,1-диметилетоксикарбоніл)аміно1-4Стадія В. (R,S)-3-[(1,1[(2-фтор-4-(трифторметил)феніл)бутанова кислота диметилетоксикарбоніл)аміно1-1-діазо-4-(2,5Стадія А. (2R,5S)-2,5-дигідро-3,6-диметокси-2дифтор-феніл)бутан-2-он (2'-фтор-4'-(трифторметил)бензил)-5До розчину 2,23г (7,4ммоль) (R,S)-N-(1,1ізопропілпіразин диметилетоксикарбоніл)-2,5-дифторфенілаланіну До розчину 3,32г (18ммоль) комерційно достув 100мл простого діетилового ефіру при 0°С допного (2S)-2,5-дигідро-3,б-диметокси-2дають послідовно 1,37мл (8,1ммоль) триетиламіну ізопропілпіразину в 100мл тетрагідрофурану при і 0,931мл (7,5ммоль) ізобутилхлорформіату, реак70°С додають 12мл (19ммоль) 1,6Μ розчину буційну суміш перемішують при вказаній температурі тиллітію в гексані. Після перемішування при вкапротягом 15 хвилин. Додають охолоджений ефірзаній температурі протягом 20 хвилин додають 5г ний розчин діазометану до одержання стійкого (19,5ммоль) 2-фтор-4жовтого забарвлення і продовжують подальше трифторметилбензилброміду в 20мл тетрагідроперемішування протягом 16 годин. Надлишок діа 33 74912 34 фурану і продовжують перемішування протягом 3 зометану гасять, додаючи краплями оцтову кислогодин перед тим, як нагріти реакційну суміш до ту, розбавляють реакційну суміш етилацетатом і температури навколишнього середовища. Реакпромивають послідовно 5%-ним розчином соляної ційну суміш гасять водою, концентрують у вакуумі і кислоти, насиченим водним розчином бікарбонату екстрагують етилацетатом. Об'єднану органічну натрію і соляним розчином, сушать над сульфатом фазу промивають соляним розчином, сушать і магнію і концентрують у вакуумі. Після очищення концентрують у вакуумі. Після очищення флешфлеш-хроматографією (на силікагелі, гекхроматографією (на силікагелі, 0-5% етилацетату сан:етилацетат у відношенні 9:1) одержують 0,5г в гексані) одержують 5,5г вказаної в заголовку діазокетону. До розчину 0,5г (1,33ммоль) діазокетону, розчиненого в 100мл метанолу при 0°С досполуки. ЯМР 1H (500МГц, CDCl3) 7,33-7,25 (м, дають послідовно 0,7мл (4ммоль) діізопропілети3Н), 4,35-4,31 (м, 1Н), 3,75 (с, 3Н), 3,65 (с, 3Н), 3,60 ламіну і 32мг (0,13ммоль) бензоату срібла. (т, 1Н, J=3,4Гц), 3,33 (дд, 1Н, J=4,6, 13,5Гц), 3,03 Реакційну суміш перемішують протягом 2 годин (дд, 1Н, J=7, 13,5Гц), 2,25-2,15 (м, 1Н), 1,0 (д, 3Н, раніше, ніж розбавити етилацетатом і промити J=7Гц), 0,66 (д, 3Н, J=7Гц). послідовно 2н розчином соляної кислоти, насичеСтадія В. Складний метиловий ефір (R)-N-(1,1ним водним розчином бікарбонату натрію і солядиметилетоксикарбоніл)-2-фтор-4ним розчином. Органічну фазу сушать над сультрифторметил)феніл аланіну фатом магнію, концентрують у вакуумі і До розчину 5,5г (15ммоль) (2R,5S)-2,5-дигідророзчиняють в 50мл суміші тетрагідрофу3,6-диметокси-2-(2'-фтор-4'ран:метанол:1н водний розчин гідроксиду літію (трифторметил)бензил)-5-ізопропілпіразину в (3:1:1) і перемішують при 50°С протягом 3 годин. 50мл суміші ацетонітрил:дихлорметан (10:1) доРеакційну суміш охолоджують, підкисляють 5% дають 80мл 1н водного розчину трифтороцтової розбавленою соляною кислотою і екстрагують кислоти. Реакційну суміш перемішують протягом б етилацетатом. Об'єднані органічні фази промивагодин і видаляють органічні розчинники у вакуумі. ють соляним розчином, сушать над сульфатом Додають карбонат натрію доти, доки розчин не магнію і концентрують у вакуумі, одержуючи при стане основним (>рН 8), потім реакційну суміш цьому 410мг вказаної в заголовку сполуки у виглярозбавляють 100мл тетрагідрофурану і додають ді білої спіненої твердої речовини. ЯМР 1H 10г (46ммоль) ди-трет-бутилдикарбонату. Одержану суспензію перемішують протягом 16 годин, (500МГц, CD3OD) 7,47-7,33 (м, 3Н), 4,88 (уш. с, концентрують у вакуумі і екстрагують етилацета1Н), 4,26-3,98 (м, 1Н), 3,06-3,01 (м, 1Н), 2,83-2,77 том. Об'єднану органічну фазу промивають соля(м, 1Н), 2,58-2,50 (м, 2Н), 1,29 (с, 9Н). ним розчином, сушать і концентрують у вакуумі. Проміжна сполука 3 Після очищення флеш-хроматографією (силікагель, 20% розчин етилацетату в гексані) одержують 5,1г вказаної в заголовку сполуки. ЯМР 1H (500МГц, CDCl3) 7,38-7,28 (м, 3Н), 5,10 (уш. д, 1Н), 4,65-3,98 (м, 1Н), 3,76 (с, 3Н), 3,32-3,25 (м, 1Н), 3,13-3,05 (м, 1Н), 1,40 (с, 9Н). Стадія С. (R)-N-(1,1-диметилетоксикарбоніл)2-фтор-4-трифторметил)феніл-аланін Розчин 5,1г (14ммоль) складного метилового (3R)-3-[(1,1-диметилетоксикарбоніл)аміно]-4ефіру (R,S)-N-(1,1-диметилетоксикарбоніл)-2(2,4,5-трифторфеніл)бутанова кислота фтор-4-трифторметил)фенілаланіну в 350мл суСтадія A. (2S,5R)-2,5-дигідро-3,6-диметоксі-2міші тетрагідрофуран:метанол:1н гідроксид літію ізопропіл-5-(2',4',5'-трифторбензил)піразин (3:1:1) перемішують при 50°С протягом 4 годин. Вказану в заголовку сполуку (3,81г) одержують Реакційну суміш охолоджують, підкисляють 5% з 3,42г (18,5ммоль) (2S)-2,5-дигідро-3,6-диметоксірозбавленою соляною кислотою і екстрагують 2-ізопропілпіразину згідно з методикою, описаною етилацетатом. Об'єднані органічні фази промивадля одержання проміжної сполуки 2, стадія А. ють соляним розчином, сушать над сульфатом ЯМР 1H (500МГц, CD3OD) 7,01 (м, 1Н), 6,85 (м, магнію і концентрують у вакуумі, одержуючи при 1Η), 4,22 (м, 1Н), 3,78 (м, 3Н), 3,64 (м, 3Н), 3,61 (м, цьому 4,8г вказаної в заголовку сполуки. ЯМР 1H 1Н), 3,20 (м, 1Н), 2,98 (м, 1Н), 2,20 (м, 1Н), 0,99 (д, (500МГц, CD3OD) 7,45-7,38 (м, 3Н), 4,44-4,40 (м, 3Н, J=8Гц), 0,62 (д, 3Н, J=8Гц). 1Н), 3,38-3,33 (м, 1Н), 2,98 (дд, 1Н, J=9,6, 13,5Гц), Стадія В. Складний метиловий ефір (R)-N-(1,11,44 (с, 9Н). диметилетоксикарбоніл)-2,4,5Стадія D. (3R)-3-[(1,1трифторфенілаланіну диметилетоксикарбоніл)аміно]-4-[2-фтор-4До розчину 3,81г (11,6ммоль) (2S,5R)-2,5(трифтор-метил)феніл]бутанова кислота дигідро-3,6-диметоксі-2-ізопропіл-5-(2',4',5'До розчину 3,4г (9,7ммоль) продукту зі стадії С трифторбензил)піразину в 20мл ацетонітрилу дов 60мл тетрагідрофурану при 0°С додають послідають 20мл 2н соляної кислоти. Реакційну суміш довно 2,3мл (13ммоль) діізопропілетиламіну і перемішують протягом 72 годин і концентрують у 1,7мл (13ммоль) ізобутилхлорформіату і перемівакуумі. Залишок розчиняють в 30мл дихлорметашують реакційну суміш при вказаній температурі ну і додають 10мл (72ммоль) триетиламіну і 9,68г протягом 30 хвилин. Потім додають охолоджений (44,8ммоль) ди-трет-бутилдикарбонату. Реакційну ефірний розчин діазометану до одержання стійкосуміш перемішують протягом 16 годин, розбавляго жовтого забарвлення і продовжують подальше ють етилацетатом і послідовно промивають 1н перемішування протягом 16 годин. Надлишок діа 35 74912 36 соляною кислотою і соляним розчином. Органічну тодикою, описаною в публікації Ishikawa та ін., фазу сушать над сульфатом натрію, концентрують Kogyo Kagaku Zasshi, стор. 972-979, 1970) в 20мл у вакуумі і очищають флеш-хроматографією (на тетрагідрофурану додають 40мл 1М розчину комсилікагелі, гексан:етилацетат у відношенні 9:1), плексу борану з тетрагідрофураном. Розчин кип'яодержуючи при цьому 2,41г вказаної в заголовку тять зі зворотним холодильником протягом 64 го1 дин, охолоджують до кімнатної температури і сполуки. ЯМР H (500МГц, CDCl3) 6,99 (м, 1Н), додають 100мл метанолу. Реакційну суміш нагрі6,94 (м, 1Н), 5,08 (м, 1Н), 4,58 (м, 1Н), 3,78 (м, 3Н), вають протягом наступних 2 годин, охолоджують і 3,19 (м, 1Н), 3,01 (м, 1Н), 1,41 (с, 9Н). концентрують у вакуумі. Після очищення флешСтадія С (R)-N-(1,1-диметилетоксикарбоніл)хроматографією (на силікагелі, гексан:етилацетат 2.4,5-трифторфенілаланін у відношенні 9:1) одержують 1,6г 4-бром-2,5Вказану в заголовку сполуку (2,01г) одержують дифторбензилового спирту. До розчину 1,3г з 2,41г (7,5ммоль) складного метилового ефіру (5,6ммоль) 4-бром-2,5-дифторбензилового спирту (R)-N-(1,1-диметилетоксикарбоніл)-2,4,5в 20мл дихлорметану при 0°С додають 2,27г трифторфенілаланіну згідно з методикою, описа(6,7ммоль) тетраброміду вуглецю і 1,8г (6,7ммоль) ною для одержання проміжної сполуки 2, стадія С трифенілфосфіну. Реакційну суміш перемішують MS (M+1)-BOC 220,9. протягом 2 годин при вказаній температурі, розСтадія D. (3R)-3-[(1,1чинник видаляють у вакуумі і залишок змішують з диметилетоксикарбоніл)аміно]-4-[2,4,5100мл простого діетилового ефіру. Розчин фільттрифторфеніл) бутанова кислота рують, концентрують у вакуумі і очищають флешДо розчину 0,37г (1,16ммоль) (R)-N-(1,1хроматографією (на силікагелі, гексан:етилацетат диметилетоксикарбоніл)-2,4,5у відношенні 9:1), одержуючи при цьому 1,5г вкатрифторфенілаланіну в 10мл простого діетилового заної в заголовку сполуки. ефіру при -20°С додають послідовно 0,193мл Стадія В. (2S,5R)-2.5-дигідро-3,6-диметоксі-2(1,3ммоль) триетиламіну і 0,18мл (1,3ммоль) ізоізопропіл-5-(4'-бром-2',5'-дифторбензил)піразин бутилхлорформіату і перемішують реакційну суВказану в заголовку сполуку (1,61г) одержують міш при вказаній температурі протягом 15 хвилин. з 0,865г (4,7ммоль) (2S)-2,5-дигідро-3,6-диметоксіПотім додають охолоджений ефірний розчин діа2-ізопропілпіразину і 1,5г (5,2ммоль) 4-бром-2,5зометану до одержання стійкого жовтого забарвдифторбензилброміду згідно з методикою, описалення і продовжують подальше перемішування ною для проміжної сполуки 2, стадія А. ЯМР 1H протягом 1 години. Надлишок діазометану гасять, додаючи краплями оцтову кислоту, розбавляють (400МГц, CDCl3) 7,21 (м, 1Н), 6,97 (м, 1Н), 4,25 суміш етилацетатом і промивають послідовно на(м, 1Н), 3,78 (с, 3Н), 3,70-3,64 (м, 4Н), 3,25-3,18 (м, сиченим водним розчином бікарбонату натрію і 1Н), 2,96-2,90 (м, 1Н), 2,25-2,16 (м, 1Н), 1,01 (д, 3Н, соляним розчином, сушать над сульфатом магнію J=8Гц), 0,65 (д, 3Н, J=8Гц). і концентрують у вакуумі. Після очищення флешСтадія С. Складний метиловий ефір (R)-Nхроматографією (силікагель, гексан:етилацетат у (1,1-диметилетоксикарбоніл)-4-бром-2,5відношенні 3:1) одержують 0,36г діазокетону. До дифторфенілаланіну розчину 0,35г (1,15ммоль) діазокетону, розчиненоДо розчину 1,61г (4,14ммоль) (2S,5R)-2,5го в 12мл суміші 1,4-діоксан:вода (5:1), додають дигідро-3,6-диметоксі-2-ізопропіл-5-(4'-бром-2',5'26мг (0,113ммоль) бензоату срібла. Одержаний дифторбензил)піразину в 10мл ацетонітрилу дорозчин протягом 2 годин обробляють ультразвудають 10мл 2н соляної кислоти. Реакційну суміш ком, після чого розчиняють в етилацетаті і посліперемішують протягом 16 годин і концентрують у довно промивають 1н розчином соляної кислоти і вакуумі. Залишок розчиняють в 30мл дихлорметасоляним розчином, сушать над сульфатом магнію ну і додають 5,6мл (40ммоль) триетиламіну і 2,2г і концентрують у вакуумі. Після очищення флеш(10ммоль) ди-трет-бутилдикарбонату. Реакційну хроматографією (на силікагелі, дихлормесуміш перемішують протягом 16 годин, розбавлятан:метанол:оцтова кислота у відношенні 97:2:1) ють етилацетатом і промивають послідовно насиодержують 401мг вказаної в заголовку сполуки. ченим водним розчином бікарбонату натрію і соляним розчином. Органічну фазу сушать над ЯМР 1H (500МГц, CDCl3) 7,06 (м, 1Н), 6,95 (м, сульфатом магнію, концентрують у вакуумі і очи1Н), 5,06 (уш. с, 1Н), 4,18 (м, 1Н), 2,98 (м, щають флеш-хроматографією (на силікагелі, гек2Н),2,61(м, 2Н), 1,39(с, 9Н). сан:етилацетат у відношенні 9:1), одержуючи при Проміжна сполука 4 цьому 1,22г вказаної в заголовку сполуки. ЯМР 1H (400МГц, CDCl3) 7,27-7,15 (м, 1Н), 6,98-6,93 (м, 1Н), 5,08 (уш. с, 1Н), 4,61-4,55 (м, 1Н), 3,78 (с, 3Н), 3,23-3,18 (м, 1Н), 3,05-2,95 (м, 1Н), 1,41 (с, 9Н). Стадія D. (R)-N-(1,1-диметилетоксикарбоніл)4-бром-2,5-дифторфенілаланін Вказану в заголовку сполуки (1,34г) одержують з 1,4г (3,5ммоль) складного метилового ефіру (R)N-(1,1-диметилетоксикарбоніл)-4-бром-2,5(3R)-3-[(1,1-диметилетоксикарбоніл)аміно]-4дифторфенілаланіну згідно з методикою, описа[4-бром-2,5-дифторфеніл)бутанова кислота ною для одержання проміжної сполуки 2, стадія С Стадія А. 4-бром-2,5-дифторбензилбромід MS (M+l) 380,3 і 382,3. До розчину 2г (8,44ммоль) 4-бром-2,5Стадія Е. (3R)-3-[(1,1дифторбензойної кислоти (одержаної згідно з медиметилетоксикарбоніл)аміно]-4-[4'-бром-2',5' 37 74912 38 дифтор-феніл)бутанова кислота дають EDC (96,6мг, 0,50ммоль). Після видалення Вказану в заголовку сполуки (0,36г) одержують бані з льодом реакційну суміш перемішують при з 0,6г (1,57ммоль) (R)-N-(1,1температурі навколишнього середовища протягом диметилетоксикарбоніл)-4-бром-2,514 годин. Суміш концентрують і очищають ВЕРХ дифторфенілаланіну згідно з методикою, описа(Gilson; колонка YMC-Pack Pro С18, 100x20мм I. ною для одержання проміжної сполуки 3, стадія D. D.; градієнт розчинників від суміші: 10% ацетонітMS (M+1) 394,1 і 396,1. рилу, 90% води і 0,1% трифтороцтової кислоти до ПРИКЛАД 1 суміші: 90% ацетонітрилу, 10% води і 0,1% трифтороцтової кислоти), одержуючи при цьому 115мг вказаної в заголовку сполуки у вигляді спіненої твердої речовини. ЯМР 1H (500МГц, CDCl3) 1,36 (с, 9Н), 2,62 (м, 2Н), 2,86 (м, 2Н), 3,34 (уш. с, 1Н), 3,86 (м, 1Н), 4,05 (м, 4Н), 4,85 (м, 1Н), 5,305,38 (м, 1Н), 6,97 (м, 3Н), 7,28 (м, 1Н). LC/MS 489 (М+1). Дигідрохлорид 7-[(3R)-3-аміно-4-(3,4Стадія Р. Дигідрохлорид 7-[(3R)-3-аміно-4-(3,4дифторфеніл)бутаноїл1-2-(трифтор-метил)дифторфеніл)бутаноїл]-2-(трифторметил)-5,6,7,85,6,7,8-тетрагідроімідазо[1,2-а]піразину тетрагідроімідазо[1,2-а]піразину Стадія А. 2-(трифторметил)імідазо[1,2До 7-[(3R)-3-[(1,1а]піразин диметилетоксикарбоніл)аміно]-4-(3,4До розчину 2-амінопіразину (5,25г, 55,2ммоль) дифторфеніл)бутаноїл]-2-(трифторметил)-5,6,7,8в етанолі (120мл) додають 1-бром-3,3,3тетрагідроімідазо[1,2-а]піразину (110,8мг, трифторацетон (5,73мл, 55,2ммоль). Реакційну 0,226ммоль, зі стадії С) додають 2мл метанолу, суміш кип'ятять із зворотним холодильником при насиченого хлористим воднем. Реакційну суміш перемішуванні протягом 20 годин. Після випаровуперемішують при температурі навколишнього севання розчинника залишок розподіляють між етиредовища протягом 1 години. Після концентруванлацетатом і насиченим водним розчином бікарбоня одержують 89,5мг вказаної в заголовку сполуки нату натрію. Водний шар екстрагують у вигляді спіненої твердої речовини. ЯМР 1H етилацетатом (х3). Об'єднану органічну фазу про(500МГц, CD3OD) 2,97-3,10 (м, 4Н), 3,91-4,34 (м, мивають соляним розчином, сушать над сульфа5Н), 4,90-5,04 (м, 2Н), 7,16-7,33 (м, 2Н), 8,01-8,08 том магнію і концентрують. Залишок очищають (м, 1Н). ESI-MS 389 (М+1). флеш-хроматографією (на силікагелі, етилацетатПРИКЛАД 2 тексан у відношенні 1:1, потім 100% етилацетат), одержуючи при цьому 2,35г вказаної в заголовку сполуки у вигляді твердої речовини. ЯМР 1H (500МГц, CDCl3) 8,02 (м, 2Н), 8,13 (м, 1H), 9,22 (с, 1Н) ESI-MS 188 (М+1). Стадія В. 2-(трифторметил)-5,6,7,8тетрагідроімідазо[1,2-а]піразин До розчину 2-(трифторметил)імідазо[1,2а]піразину (2,0г, 10,46ммоль, зі стадії А) в метанолі (100мл) додають 10% паладію на вуглеці (400мг). Суміш перемішують в атмосфері водню при температурі навколишнього середовища протягом 14 годин. Суміш фільтрують через целіт (Celite) і промивають метанолом (х3). Фільтрат концентрують і очищають флеш-хроматографією (на силікагелі, 10% метанолу в етилацетаті, потім 15% метанолу в хлороформі з 1% водного розчину гідроксиду амонію), одержуючи при цьому 1,33г вказаної в заголовку сполуки у вигляді твердої речовини. ЯМР 1H (500МГц, CDCl3) 1,93 (уш. с, 1Н), 3,26 (т, 2H, J=5,5Гц), 3,99 (т, 2Н, J=5,5Гц), 4,10 (с, 1Н), 7,16 (с, 1Н). ESI-MS 192 (М+1). Стадія С. 7-[(3R)-3-[(1,1диметилетоксикарбоніл)аміно]-4-(3,4дифторфеніл)бутаноїл]-2-(трифторметил)-5,6,7,8тетрагідроімідазо[1,2-а]піразин До розчину 2-(трифторметил)-5,6,7,8тетрагідроімідазо[1,2-а]піразину (64,3мг, 0,34ммоль, зі стадії В) і (3К)-3-[(1,1диметилетоксикарбоніл)аміно]-4-[3,4дифторфеніл)бутанової кислоти (105,9мг, 0,34ммоль) в дихлорметані (5мл) додають HOBT (54,5мг, 0,42ммоль) при 0°С. Реакційну суміш перемішують при 0°С протягом 10 хвилин, потім до Дигідрохлорид 7-[(3R)-3-аміно-4-(2.5дифторфеніл)бутаноїл1-2-(трифтор-метил)5,6,7,8-тетрагідроімідазо[1,2-а]піразину Стадія A. 7-[(3R)-3-[(1,1диметилетоксикарбоніл)аміно]-4-(2,5дифторфеніл)-бутаноїл]-5,6,7,8тетрагідроімідазо[1,2-а]піразин Вказану в заголовку сполуку одержують з 2(трифторметил)-5,6,7,8-тетрагідроімідазо[1,2а]піразину (277мг, 1,45ммоль, за прикладом 1, стадія В), (3R)-3-[(1,1диметилетоксикарбоніл)аміно]-4-(2,5дифторфеніл)бутанової кислоти (проміжний продукт 1,416мг, 1,32ммоль), DIPEA (226мг, 1,58 моль), HOBT (216мг, 1,98 моль) і HATU (753мг, 1,98 моль) в ДМФ (6мл) за методикою, аналогічною описаній у прикладі 1 для стадії С, виключаючи спосіб очищення. Сполуку очищають препаративною ТШХ (на силікагелі, 20% розчин гексану в етилацетаті, потім 10% розчин метанолу в дихлорметані), одержуючи при цьому 360мг вказаної в заголовку сполуки у вигляді спіненої твердої речовини. ЯМР 1H (500МГц, CDCl3) 1,35 (с, 9Н), 2,62 (м, 2Н), 2,88 (м, 2Н), 3,88-4,16 (м, 5Н), 4,73 (с, 1Н), 4,85 (м, 1Н), 5,26-5,39 (м, 1Н), 6,90 (уш. с, 1Н), 7,06 (м, 2Н), 7,24 (м, 1Н). ESI-MS 489 (М+1). Стадія В. Дигідрохлорид 7-[(3R)-3-аміно-4-(2,5 39 74912 40 дифторфеніл)бутаноїл]-5,6,7,8тетрагідроімідазо[1,2-а]піразину Вказану в заголовку сполуку одержують з 7[(3R)-3-[(1,1-диметилетоксикарбоніл)аміно]-4-(2,5дифторфеніл)бутаноїл]-5,6,7,8тетрагідроімідазо[1,2-а]піразину (349,8мг, 0,72 Дигідрохлорид 7-[(3R)-3-аміно-4-(3,4моль, зі стадії А) в 1,5мл метанолу, насиченого дифторфеніл)бутаноїл]-5,6,7,8-тетрахлористим воднем, за методикою, аналогічною гідроімідазо[1,2-а]піразину описаній у прикладі 1 для стадії D. Після випароСтадія А. Імідазо[1,2-а]піразин вування розчинника одержують 299мг вказаної в До розчину 2-амінопіразину (2,0г, 21,03ммоль) заголовку сполуки у вигляді спіненої твердої речов етанолі (40мл) додають 2-бром-1,11 вини. ЯМР H (500МГц, CD3OD) 3,10-3,17 (м, 2Н), диметоксіетан (2,5мл, 21,03ммоль), потім 5 кра2,89-2,99 (м, 2Н), 3,94-4,22 (м, 4Н), 4,33 (м, 1Н), пель концентрованої соляної кислоти. Після кип'я4,91-5,48 (м, 2Н), 7,07-7,23 (м, 3Н), 8,05 (м, 1Н). тіння зі зворотним холодильником протягом 14 ESI-MS 389 (М+1). годин розчинник випаровують. Залишок розподіПРИКЛАД 3 ляють між етилацетатом і насиченим водним розчином бікарбонату натрію. Водний шар екстрагують етилацетатом (х3). Об'єднану органічну фазу промивають соляним розчином, сушать над сульфатом магнію і концентрують. Залишок очищають флеш-хроматографією (100% етилацетат, 10% розчин метанолу в етилацетаті, потім 10% розчин метанолу в дихлорметані), одержуючи при цьому Дигідрохлорид 7-[(3R)-3-аміно-4-(2,4,5536мг вказаної в заголовку сполуки у вигляді твертрифторфеніл)бутаноїл1-2-(трифтор-метил)дої речовини. ЯМР 1H (500МГц, CDCl3) 7,70 (уш. 5,6,7,8-тетрагідроімідазо[ 1,2-а]піразину с, 1Н), 7,82 (уш. с, 1Н), 7,89 (д, 1Н, J=4,4Гц), 8,10 Стадія А. 7-[(3R)-3-[(1,1(д, 1H, J=4,6Гц), 9,12 (с, 1Н). диметилетоксикарбоніл)аміно]-4-(2,4,5-трифторСтадія В. 5,6,7,8-тетрагідроімідазо[1,2феніл)бутаноїл]-5А7,8-тетрагідроімідазо[1,2а]піразин а]піразин Вказану в заголовку сполуку одержують з іміВказану в заголовку сполуку одержують з 2дазо[1,2-а]піразину (500мг, 4,20ммоль, зі стадії А) і (трифторметил)-5,6,7,8-тетрагідроімідазо[1,2оксиду платини (250мг) в метанолі (50мл) за метоа]піразину (31,7мг, 0,166ммоль, за прикладом 1, дикою, аналогічною описаній у прикладі 1 для стастадія В), (3R)-3-[(1,1дії В. Після концентрування одержують вказану в диметилетоксикарбоніл)аміно]-4-(2,4,5заголовку сполуку (512мг) у вигляді в'язкої маслятрифторфеніл)бутанової кислоти (проміжна сполунистої речовини. ЯМР 1H (500МГц, CD3OD) 3,37 ка 3,57мг, 0,166ммоль), HOBT (26,9мг, (т, 1Η, J=5,5Гц), 4,18 (т, 2Η, J=5,6Гц), 4,88 (с, 1Н), 0,199ммоль) і EDC (47,8мг, 0,249ммоль) в 4мл 7,27 (д, J=1,6Гц, 1Н), 7,33 (д, 1Н). дихлорметану за методикою, аналогічною описаСтадія С. 7-[(3R)-3-[(1,1ній у прикладі 1 для стадії С. Після очищення предиметилетоксикарбоніл)аміно]-4-(3,4-дифторпаративною ТШХ (на силікагелі, 100% етилацетат, феніл)бутаноїл]-5,6,7,8-тетрагідроімідазо[1,2потім 10% розчин метанолу в дихлорметані) одеа]піразин ржують 40мг вказаної в заголовку сполуки у вигляВказану в заголовку сполуку одержують з 1 ді спіненої твердої речовини. ЯМР H (500МГц, 5,6,7,8-тетрагідроімідазо[1,2-а]піразину (31,3мг, CDCl3) 1,35 (с, 9Η), 3,00 (м, 2Н), 3,30 (м, 2Н), 3,93 0,254ммоль, зі стадії В), (3R)-3-[(1,1(м, 1Н), 4,04-4,24 (м, 2Н), 4,23 (с, 1Н), 4,35 (м, 1Н), диметилетоксикарбоніл)аміно]-4-(3,44,97-5,48 (м, 2Н), 7,22 (м, 1Н), 7,44 (м, 1Н), 8,04 (м, дифторфеніл)бутанової кислоти (80мг,ммоль), 1Н). ESI-MS 507 (М+1). DIPEA (32,8мг, 0,254ммоль), HOBT (41,2мг, Стадія В. Дигідрохлорид 7-[(3R)-3-аміно-40,305ммоль) і EDC (73мг, 0,381ммоль) в 5мл дих(2,4,5-трифторфеніл)бутаноїл]-5,6,7,8лорметану за методикою, аналогічною описаній у тетрагідроімідазо[1,2-а1піразину прикладі 1 для стадії С Після очищення ВЕРХ Вказану в заголовку сполуку одержують з 7(Gilson; колонка YMC-Pack Pro С18, 100x20мм I. [(3R)-3-[(1,1-диметилетоксикарбоніл)аміно]-4D.; система розчинників з градієнтом від суміші: (2,4,5-трифторфеніл)бутаноїл]-5,6,7,810% ацетонітрилу, 90% води і 0,1% трифтороцтотетрагідроімідазо[1,2-а]піразину (38мг, вої кислоти до суміші: 90% ацетонітрилу, 10% во0,075ммоль, зі стадії А) в 1,5мл метанолу, насичеди і 0,1% трифтороцтової кислоти) одержують ного хлористим воднем, за методикою, аналогіч75мг вказаної в заголовку речовини у вигляді в'язною описаній у прикладі 1 для стадії D). Після викої маслянистої речовини. ЯМР 1H (500МГц, паровування розчинника одержують 34мг вказаної CDCl3) 1,38 (с, 9Н), 2,05 (уш. с, 1Н), 2,62 (м, 2Н), в заголовку сполуки у вигляді спіненої твердої ре2,89 (м, 2Н), 3,81-4,04 (м, 5Н), 4,64-4,88 (м, 2Н), човини. ЯМР 1H (500МГц, CD3OD) 2,59-2,66 (м, 5,38 (м, 1Н), 6,88 (м, 2Н), 7,05 (м, 3Н). ESI-MS 421 2Н), 2,92 (м, 2Н), 3,89-4,16-4,22 (м, 5Н), 4,70-4,84 (М+1). (м, 2Н), 5,42 (м, 1Н), 6,86 (м, 1Н), 7,06 (м, 1Н), 7,24 Стадія Р. Дигідрохлорид 7-[(3R)-3-аміно-4-(3,4(м, 1Н). ESI-MS 407 (М+1). дифторфеніл)бутаноїл]-5,6,7.8ПРИКЛАД 4 тетрагідроімідазо[1,2-аіпіразину 41 74912 42 Вказану в заголовку сполуку одержують з 720мл дихлорметану за методикою, аналогічною [(3R)-3-[(1,1-диметил-етоксикарбоніл)аміно]-4-(3,4описаній у прикладі 1 для стадії С. Неочищений дифторфеніл)бутаноїл]-5,6,7,8продукт очищають ВЕРХ (Gilson; колонка YMCтетрагідроімідазо[1,2-а]піразину (72мг, Pack Pro С18, 100x20мм I. D.; градієнт розчинників 0,171ммоль, зі стадії С) в 1,5мл метанолу, насичевід суміші: 10% ацетонітрилу, 90% води і 0,1% ного хлористим воднем, за методикою, аналогічтрифтороцтової кислоти до суміші: 90% ацетонітною описаній у прикладі 1 для стадії D. Після конрилу, 10% води і 0, % трифтороцтової кислоти), центрування одержують 66мг вказаної в заголовку одержуючи при цьому 366,3мг вказаної в заголовсполуки у вигляді спіненої твердої речовини. ЯМР ку сполуки у вигляді в'язкої маслянистої речовини. 1 H (500МГц, CD3OD) 2,96-3,13 (м, 4Н), 3,93 (м, ЯМР 1H (500МГц, CDCl3) 1,31-1,34 (м, 12Н), 2,671Н), 4,13 (м, 2Н), 4,26-4,38 (м, 2Н), 4,90-5,04 (м, 2,92 (м, 6Н), 4,03-4,12 (м, 4Н), 5,03-5,31 (м, 3Н), 2Н), 7,19-7,36 (м, 3Н), 7,58 (м, 1H). ESI6,93 (с, 1Н), 7,05 (м, 2Н). ESI-MS 450 (М+1). MS321(M+1). Стадія D. Дигідрохлорид 7-[(3R)-3-аміно-4-(3,4ПРИКЛАД 5 дифторфеніл)бутаноїл]-3-етил-5,6,7,8-тетрагідро1,2,4-триазоло[4,3-а]піразину Вказану в заголовку сполуку одержують з 7[(3R)-3-[(1,1-диметилетоксикарбоніл)аміно]-4-(3,4дифторфеніл)бутаноїл]-3-етил-5,6,7,8-тетрагідро1,2,4-триазоло[4,3-а]піразину (30мг, 0,067ммоль, зі стадії С) в 1,5мл метанолу, насиченого хлористим воднем, за методикою, аналогічною описаній у прикладі 1 для стадії D. Після випаровування розДигідрохлорид 7-[(3R)-3-аміно-4-(3,4чинника одержують 28мг вказаної в заголовку сподифторфеніл)бутаноїл]-3-етил-5,6,7,8-тетрагідролуки у вигляді в'язкої маслянистої речовини. ЯМР 1,2,4-триазоло[4,3-а]піразину 1 H (500МГц, CD3OD) 1,45 (т, 3Н), 2,93-3,07 (м, Стадія А. 8-хлор-3-етил-1,2,4-триазоло[4,36Н), 3,90-4,31 (м, 5Н), 5,08 (м, 2Н), 7,16 (с, 1H), а]тразин 7,31 (м, 2Н). ESI-MS 350 (М+Н). До З-хлор-2-гідразинопіразину (3,0г, ПРИКЛАД 6 20,75ммоль), одержаного з 2,3-дихлорпіразину і гідразину за методикою, аналогічною описаній в літературі (Huynh-Dinh та інш., J. Org. Chem. 1979, 44, 1028), додають 8мл триетилортопропіонату. Після кип'ятіння зі зворотним холодильником протягом 10 годин реакційну суміш охолоджують до температури навколишнього середовища і відфільтровували осад. Тверду речовину очищають флеш-хроматографією (100% етилацетат, потім 10% метанолу в етилацетаті), одержуючи при Гідро хлорид 7-[(3R)-3-аміно-4-(2,5цьому 2,73г вказаної в заголовку сполуки у вигляді дифторфеніл)бутаноїл]-3-(трифтор-метил)-5,6,7,81 твердої речовини. ЯМР H (500МГц, CDCl3) 1,54 тетрагідро-1,2,4-триазоло[4,3-а]піразину (т, 3Н, J=7,6Гц), 3,16 (кв, 2Н, J=7,8Гц), 7,70 (д, 1H, Стадія А. 3-(трифторметил)-1,2,4J=4,5Гц), 7,83 (д, 1Н, J=4,8Гц). триазоло[4,3-а]піразин Стадія В. Гідрохлорид 3-етил-5,6,7,8Суміш 2-гідразинопіразину (820мг, 7,45ммоль), тетрагідро-1,2,4-триазоло[4,3-а]піразину одержаного з 2-хлорпіразину і гідразину за метоВказану в заголовку сполуку одержують з 8дикою, аналогічною описаній в літературі [P. J. хлор-3-етил-1,2,4-триазоло[4,3-а]піразину (2,70г, Nelson і К. Т. Potts, J. Org. Chem. 1962, 27, 3243] за 14,8ммоль, зі стадії А) і оксиду платини (0,4г) в винятком того, що неочищений продукт екстрагу200мл метанолу на струшуючому змішувачі в атють сумішшю 10% метанол/дихлорметан і фільтмосфері водню (50 фунт/кв. дюйм) протягом 14 рують, а фільтрат концентрують і очищають годин. Після фільтрування через целіт і подальшофлеш-хроматографією на силікагелі, елююючи го концентрування одержують вказану в заголовку 100% етилацетатом, а потім 10% розчином мета1 сполуку у вигляді твердої речовини. ЯМР H нолу в дихлорметані), TFA (2,55г, 22,4ммоль) і (500МГц, CD3OD) 1,36 (т, 3Н, J=6,0Гц), 2,84 (кв, поліфосфорної кислоти (10мл) нагрівають до 2Н, J=6,0Гц), 3,70 (т, 2Н, J=8,0Гц), 4,28 (т, 2Η, 140°С при перемішуванні протягом 18 годин. РозJ=8,0Гц), 4,06 (с, 2Н). ESI-MS 153 (М+1). чин додають до льоду і нейтралізують додаванням Стадія С. 7-[(3R)-3-[(1,1гідроксиду амонію. Водний розчин екстрагують диметилетоксикарбоніл)аміно]-4-(3,4етилацетатом (х3), промивають соляним розчином дифторфеніл)-бутаноїл]-3-етил-5,6,7,8-тетрагідроі сушать над збезводненим сульфатом магнію. 1,2,4-триазоло[4,3-а]піразин Після концентрування і подальшої флешВказану в заголовку сполуку одержують з гідхроматографії (на силікагелі, гексан:етилацетат у рохлориду 3-етил-5,6,7,8-тетрагідро-1,2,4відношенні 1:1, потім 100% етилацетат) одержутриазоло[4,3-а]піразину (400мг, 2,12ммоль, зі стають вказану в заголовку сполуку у вигляді твердої дії В), (3R)-3-[(1,1-диметилетоксикарбоніл)аміно]-4речовини (861мг). ЯМР 1H (500МГц, CDCl3) 8,17(3,4-дифторфеніл)бутанової кислоти (668мг, 8,20 (м, 2Н), 9,54 (с, 1Н). LC/MS (M+l) 189. 2,12ммоль), DIPEA (1,1мл, 4,24ммоль), HOBT Стадія В. 3-(трифторметил)-5,6,7,8-тетрагідро(343,8мг, 2,54ммоль), EDC (609,6мг, 3,18ммоль) в 1,2,4-триазоло[4,3-а]піразин 43 74912 44 3-(трифторметил)-1,2,4-триазоло[4,3-а]піразин ка 3,50, 1мг, 0,15ммоль) і 3-(трифторметил)(540мг, 2,87ммоль, зі стадії А) гідрують в атмос5,6,7,8-тетрагідро-1,2,4-триазоло[4,3-а]піразину фері водню з 10% Pd/C (200мг) як каталізатор в (39,2мг, 0,20ммоль) за методикою, аналогічною етанолі (10мл) при температурі навколишнього описаній у прикладі 1 для стадії С. Неочищений середовища протягом 18 годин. Після фільтруванпродукт очищають препаративною ТШХ (на силіканя через целіт і подальшого концентрування одегелі, 100% етилацетат), одержуючи при цьому вкаржують маслянисту речовину темного кольору. До зану в заголовку сполуку (29мг) у вигляді твердої одержаної маслянистої речовини додають дихлоречовини. ЯМР 1H (500МГц, CDCl3) 1,37 (с, 9Н), рметан, і нерозчинний чорний осад відфільтрову2,61-3,00 (м, 4Н), 3,92-4,30 (м, 5Н), 4,93 (с, 1Н), ють. При концентруванні фільтрату одержують 4,95-5,12 (м, 1Н), 5,22-5,35 (уш., 1Н), 6,83-6,95 (м, вказану в заголовку сполуку у вигляді маслянистої 1Н), 7,02-7,12 (м, 1Н). LC/MS (M+1-t-Bu) 452. речовини (495мг). ЯМР 1H (500МГц, CDCl3) 2,21 Стадія В. Гідрохлорид 7-[(3R)-3-аміно-4-(2,4,5(уш., 1Н), 3,29 (т, 2Η, J=5,5Гц), 4,09 (т, 2Η, трифторфеніл)бутаноїл]-3-(трифторметил)-5,6,7,8J=5,5Гц), 4,24 (с, 2Н). LC/MS (M+1) 193. тетрагідро-1,2,4-триазоло[4.3-а]піразину Стадія С. 7-[(3R)-3-[(1,1Вказану в заголовку сполуку одержують з 7диметилетоксикарбоніл)аміно]-4-(2,5-дифтор[(3R)-3-[(1,1-диметилетоксикарбоніл)аміно]-4феніл)бутаноїл]-3-(трифторметил)-5,6,7,8(2,4,5-трифторфеніл)бутаноїл]-3-(трифторметил)тетрагідро-1,2,4-триазоло[4,3-а]піразин 5,6,7,8-тетрагідро-1,2,4-триазоло[4,3-а]піразину Вказану в заголовку сполуку одержують з (3R)(22мг 0,039ммоль, зі стадії А) за методикою, ана3-[(1,1-диметилетоксикарбоніл)аміно]-4-(2,5логічною описаній у прикладі 1 для стадії D. Після дифторфеніл)бутанової кислоти (проміжна сполуконцентрування одержують вказану в заголовку ка 1,50мг, 0,16ммоль) і 3-(трифторметил)-5,6,7,8сполуку (16,5мг) у вигляді твердої речовини. ЯМР 1 тетрагідро-1,2,4-триазоло[4,3-а]піразину (30мг, H (500МГц, CD3OD) 2,75-3,15 (м, 4Н), 3,82-4,35 0,16ммоль) за методикою, аналогічною описаній у (м, 5Н), 4,90-5,05 (м, 2Н), 7,16-7,25 (м, 1Н), 7,30прикладі 1 для стадії С. Неочищений продукт очи7,42 (м, 1Н). LC/MS (M+1) 408. щають препаративною ТШХ (на силікагелі, 100% Слідуючи значною мірою методикам, викладеетилацетату, потім 10% метанол/дихлоретан (х2)), ним в загальних рисах у прикладах 1-7, одержали одержуючи при цьому вказану в заголовку сполуку сполуки, перераховані в таблиці 1. (38,1мг) у вигляді твердої речовини. ЯМР 1H (500МГц, CDCl3) 1,38 (с, 9Н), 2,57-3,05 (м, 4Н), 3,85-4,30 (м, 5Н), 4,90 (с, 1Н), 4,95-5,15 (м, 1Н), 5,22-5,40 (уш., 1Н), 6,86-7,24 (м, 3Н). LC/MS (M+1t-Boc) 390. Стадія Р. Гідрохлорид 7-[(3R)-3-аміно-4-(2,5дифторфеніл)бутаноїл]-3-(трифторметил)-5,6,7,8тетрагідро-1,2,4-триазоло[4,3-а]піразину Вказану в заголовку сполуку одержують з 7[(3R)-3-[(1,1-диметилетоксикарбоніл)аміно]-4-(2,5дифторфеніл)бутаноїл]-3-(трифторметил)-5,6,7,8тетрагідро-1,2,4-триазоло[4,3-а]піразину (19,1мг, 0,039ммоль, зі стадії С) за методикою, аналогічною описаній у прикладі 1 для стадії D. При концентруванні одержують вказану в заголовку сполуку (16,1мг) у вигляді твердої речовини. ЯМР 1H (500МГц, CD3OD) 2,75-3,16 (м, 4Н), 3,86-4,35 (м, 5Н), 4,95-5,05 (м, 2Н), 7,03-7,20 (м, 3Н). LC/MS (M+1) 390. ПРИКЛАД 7 Гідрохлорид 7-[(3R)-3-аміно-4-(2,4,5трифторфеніл)бутаноїл]-3-(трифтор-метил)5,6,7,8-тетрагідро-1,2,4-триазоло[4,3-а]піразину Стадія А. 7-[(3R)-3-[(1,1диметилетоксикарбоніл)аміно]-4-(2,4,5-трифторфеніл)бутаноїл]-3-(трифторметил)-5,6,7,8тетрагідро-1,2,4-триазоло[4,3-а]піразин Вказану в заголовку сполуку одержують з (3R)3-[(1,1-диметилетоксикарбоніл)аміно]-4-(2,4,5трифторфеніл)бутанової кислоти (проміжна сполу Після того, як винахід описаний і проілюстровані деякі з його конкретних втілень, фахівцеві в даній області очевидно, що можна робити різні адаптації, зміни, модифікації, заміни, виключення або додавання процедур і умов (протоколів) без відступу від суті та об'єму винаходу. Наприклад, для будь-кого з показань, пов'язаних зі сполуками винаходу, вказаного вище, можна застосовувати ефективне дозування, яке відрізняється від визначеного, вказаного в описі дозування через варіації у сприйнятливості ссавця, що піддається лікуванню. Специфічні фармакологічні реакції, що спо 45 74912 46 стерігаються, можуть змінюватись відповідно до і в вані варіації або відмінності в результатах. Тому залежності від конкретно вибраних активних спомається на увазі, що винахід визначається об'єлук або від того, чи присутні фармацевтичні носії, мом формули винаходу, яка йде далі, і що така також як в залежності від типу композиції і способу формула винаходу інтерпретується настільки шивведення, що застосовується, і відповідно до цілей роко, наскільки прийнятно. і практики даного винаходу передбачаються очіку Комп’ютерна верстка О.Воробєй Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюBeta-aminotetrahydroimidazo-(1,2-а)-pyrazines and tetratriazolo-(4,3-а)-pyrazines as inhibitors of dipeptylpeptidase for the treatment or prevention of diabetes
Автори англійськоюEdmondson, Scott, D., Parmee Emma R., Weber, Ann, E.
Назва патенту російськоюБета-аминотетрагидроимидазо-(1,2-а)-пиразины и тетрагидротриазоло-(4,3-а)-пиразины как ингибиторы дипептидилпептидазы для лечения или предотвращения диабета
Автори російськоюПарми Эмма Р.
МПК / Мітки
МПК: A61P 3/10, A61P 13/08, A61P 5/50, A61P 3/04, A61P 9/10, A61P 25/28, A61P 31/18, A61P 1/04, A61P 13/12, A61K 45/06, A61P 35/04, A61K 31/4985, A61P 9/08, A61P 3/06, C07D 487/04, A61P 1/02, A61P 27/02, A61P 7/00, A61P 19/10, A61P 25/00, A61P 37/02, A61P 15/16, A61P 5/06, A61P 43/00, A61P 9/12, A61P 5/28, A61K 45/00
Мітки: лікування, запобігання, діабету, інгібітори, бета-амінотетрагідроімідазо-(1,2-а)-піразини, тетрагідротриазоло-(4,3-а)-піразини, дипептидилпептидази
Код посилання
<a href="https://ua.patents.su/23-74912-beta-aminotetragidroimidazo-12-a-pirazini-i-tetragidrotriazolo-43-a-pirazini-yak-ingibitori-dipeptidilpeptidazi-dlya-likuvannya-abo-zapobigannya-diabetu.html" target="_blank" rel="follow" title="База патентів України">Бета-амінотетрагідроімідазо-(1,2-а)-піразини і тетрагідротриазоло-(4,3-а)-піразини як інгібітори дипептидилпептидази для лікування або запобігання діабету</a>
Попередній патент: Привід дозувального пристрою машини для розсіювання мінеральних добрив
Наступний патент: Спосіб виготовлення зм’якшувального вкладиша в протез нижньої кінцівки
Випадковий патент: Спосіб приготування каталізатора синтезу метанолу