Сполуки піперазину, спосіб їх одержання і фармацевтична композиція, яка їх містить
Номер патенту: 89619
Опубліковано: 25.02.2010
Автори: МАНУРІ ЛЯ КУР Клотильд, Пегліон Жан-Луі, Десенж Еме, Міллан Марк, Гуман Бертран
Формула / Реферат
1. Сполука формули (І):
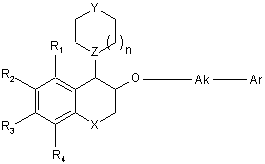 , (I)
, (I)
в якій:
R1, R2, R3 і R4, які можуть бути однаковими або відрізнятись, кожний являє собою атом або групу, яку вибирають з Н, галогену, лінійного або розгалуженого С1-С6алкілу, лінійного або розгалуженого С1-С6алкокси, фенілу і ціано,
Χ являє собою зв'язок, атом кисню або групу, яку вибирають з -(СН2)m-, -ОСН2- і -NR5-,
m являє собою 1 або 2,
R5 являє собою атом водню або групу, яку вибирають з лінійного або розгалуженого С1-С6алкілу, COR6 і СО2R6,
R6 являє собою лінійну або розгалужену С1-С6алкільну групу,
Υ являє собою атом кисню або групу, яку вибирають з ΝR7 і CHR8,
R7 являє собою атом водню або групу, яку вибирають з COR9 і лінійного або розгалуженого С1-С6алкілу, алкільна група необов'язково заміщена групою 5-оксо-4,5-дигідро-1Н-1,2,4-триазол-3-ілу або 2,3-дигідро-1,4-бензодіоксин-2-ілу,
R9 являє собою групу, яку вибирають з лінійного або розгалуженого С1-С6алкілу, арилу і гетероарилу,
R8 являє собою атом водню або аміногрупу, необов'язково заміщену однією або двома лінійними або розгалуженими С1-С6алкільними групами,
Ζ являє собою атом азоту або СH групу,
n являє собою 1 або 2,
Ak являє собою лінійний або розгалужений С1-С6алкіленовий ланцюг,
Аr являє собою арильну або гетероарильну групу,
її оптичні ізомери, а також її адитивні солі з фармацевтично прийнятною кислотою,
повинно бути зрозуміло, що
арильна група означає феніл, біфеніліл або нафтил, кожна з цих груп необов'язково заміщена однією або більше однаковими або різними групами, які вибирають з галогену, лінійного або розгалуженого С1-С6алкілу, лінійного або розгалуженого С1-С6алкокси, гідрокси, ціано, лінійного або розгалуженого С1-С6тригалоалкілу і лінійного або розгалуженого С1-С6тригалоалкокси,
і гетероарильна група означає ароматичну моно- або біциклічну 5-12-членну групу, яка містить один, два або три гетероатоми, які вибирають з кисню, азоту і сірки, повинно бути зрозуміло, що гетероарильна група може бути необов'язково заміщена однією або більше однаковими або різними групами, які вибирають з галогену, лінійного або розгалуженого С1-С6алкілу, лінійного або розгалуженого С1-С6алкокси, гідрокси, ціано і лінійного або розгалуженого С1-С6тригалоалкілу.
2. Сполука формули (І) за п. 1, в якій Υ являє собою ΝΗ.
3. Сполука формули (І) за п. 1 або 2, в якій Ζ являє собою атом азоту.
4. Сполука формули (І) за будь-яким з пп. 1-3, в якій n являє собою 1.
5. Сполука формули (І) за будь-яким з пп. 1-4, в якій Аr являє собою арильну групу.
6. Сполука формули (І) за будь-яким з пп. 1-5, в якій Χ являє собою зв'язок, атом кисню або групу, яку вибирають з -ОСН2- і -(СH2)m-, де m являє собою 1 або 2.
7. Сполука формули (І) за п. 1, яку вибирають з наступного:
транс-1-{2-[(3,5-дибромбензил)окси]-2,3-дигідро-1Н-інден-1-іл}піперазин, його енантіомери, а також адитивні солі з фармацевтичнo прийнятною кислотою,
транс-1-{3-[(3,5-дибромбензил)окси]-3,4-дигідро-2Н-хромен-4-іл}піперазин, його енантіомери, а також адитивні солі з фармацевтичнo прийнятною кислотою,
транс-1-{6-[(3,5-дибромбензил)окси]-6,7,8,9-тетрагідро-5Н-бензо[7]анулен-5-іл}-піперазин, його енантіомери, а також адитивні солі з фармацевтичнo прийнятною кислотою,
транс-1-{2-[(3,5-дибромбензил)окси]-1,2,3,4-тетрагідронафт-1-ил}піперазин, його енантіомери, а також адитивні солі з фармацевтичнo прийнятною кислотою,
транс-1-{2-[(3,5-дибромбензил)окси]-1,2,3,4-тетрагідронафт-1-ил}-1,4-діазепан, його енантіомери, а також адитивні солі з фармацевтичнo прийнятною кислотою,
1-{(1S,2R)-2-[(3,5-дибромбензил)окси]-2,3-дигідро-1Н-інден-1-іл}піперазин, його енантіомери, а також адитивні солі з фармацевтично прийнятною кислотою,
1-[(1S,2R)-2-[(3,5-дифторбензил)окси]-2,3-дигідро-1Н-інден-1-іл]піперазин, його енантіомери, а також адитивні солі з фармацевтичнo прийнятною кислотою,
1-[(1S,2R)-2-[(3,5-диметилбензил)окси]-2,3-дигідро-1Н-інден-1-іл]піперазин, його енантіомери, а також адитивні солі з фармацевтичнo прийнятною кислотою,
транс-1-{3-[(3,5-дихлорбензил)окси]-3,4-дигідро-2Н-хромен-4-іл}піперазин, його енантіомери, а також адитивні солі з фармацевтичнo прийнятною кислотою,
транс-1-{3-[3-фтор-5-(трифторметил)бензилокси]-3,4-дигідро-2Н-хромен-4-іл}піперазин, його енантіомери, а також адитивні солі з фармацевтичнo прийнятною кислотою,
і транс-1-{3-(3-хлор-5-фторбензилокси)-3,4-дигідро-2Н-хромен-4-іл}піперазин, його енантіомери, а також адитивні солі з фармацевтичнo прийнятною кислотою.
8. Спосіб одержання сполук формули (І) за п. 1 із сполуки формули (Va), яка має транс-конфігурацію:
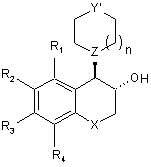 , (Va)
, (Va)
в якій R1, R2, R3, R4, Χ, n і Ζ є такими ж, як визначено тут вище, і Υ' являє собою атом кисню або групу, яку вибирають з ΝΡ1 і CHR'8, де R'8 являє собою атом водню або групу ΝΗΡ1, і Ρ1 являє собою захисну групу для аміногрупи,
сполуку формули (Va) піддають реакції, коли бажаним є одержати сполуки формули (І) відповідної транс-конфігурації, зі сполукою формули (VI):
G-Ak-Ar, (VI)
в якій Ak і Аr є такими ж, як визначено для формули (І), і G являє собою відхідну групу, таку як, наприклад, атом галогену, або групу р-толуолсульфонату, трифторметансульфонату або метансульфонату,
з одержанням сполуки формули (VIIa) відповідної транс-конфігурації:
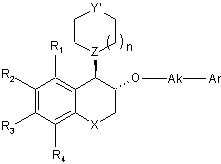 , (VIIa)
, (VIIa)
в якій R1, R2, R3, R4, Χ, n, Υ', Ζ, Ak і Аr є такими ж, як визначено тут вище, захист якої знімають, коли Y' містить захисну групу Ρ1, як визначено тут вище, і потім алкілують, коли бажаним є одержати сполуки, в яких Υ являє собою групу ΝR7, в якій R7 відрізняється від атома водню,
з одержанням сполуки формули (Іа), конкретний випадок сполук формули (І) відповідної транс-конфігурації:
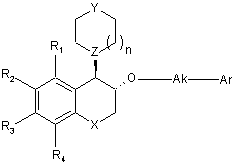 , (Ia)
, (Ia)
в якій R1, R2, R3, R4, Χ, n, Υ, Ζ, Ak і Аr є такими ж, яквизначено для формули (І),
або сполуку формули (Va) окислюють, коли бажаним є одержати сполуки формули (І) відповідної цис-конфігурації,
з одержанням рацемічної сполуки формули (VIII):
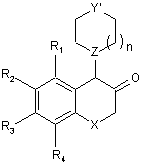 , (VIII)
, (VIII)
в якій R1, R2, R3, R4, Χ, Ζ, n і Υ' є такими ж, як визначено тут вище, яку відновлюють до відповідного спирту, діастереоізомери якої розділяють, і виділяють ізомер формули (Vb), відповідної цис-конфігурації:
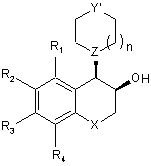 , (Vb)
, (Vb)
в якій R1, R2, R3, R4, X, Υ', Ζ і n є такими ж, як визначено тут вище, яку піддають реакції зі сполукою формули (VI), як визначено тут вище, з одержанням сполуки формули (VIIb), відповідної цис-конфігурації:
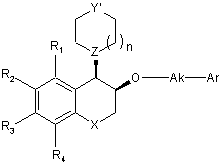 , (VIIb)
, (VIIb)
в якій R1, R2, R3, R4, X, n, Y', Z, Ak і Аr є такими ж, як визначено тут вище, захист якої знімають, коли Y' містить захисну групу Ρ1, як визначено тут вище, і потім алкілують, коли бажаним є одержати сполуки, в яких Υ являє собою групу NR7, в якій R7 відрізняється від атома водню,
з одержанням сполуки формули (Іb), конкретний випадок сполук формули (І), які мають цис-конфігурацію:
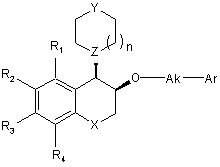 (Ib),
(Ib),
в якій R1, R2, R3, R4, Χ, Υ, Ζ, n, Ak і Аr є такими ж, як визначено для формули (І),
сполуки формул (Іа) і (Іb) очищують відповідно до звичайної техніки очищення, розділяють, коли бажано, на їх оптичні ізомери і перетворюють, коли бажано, в їх адитивні солі з фармацевтичнo прийнятною кислотою.
9. Фармацевтична композиція, яка містить як активний інгредієнт сполуку за будь-яким з пп. 1-7 у комбінації з одним або більше фармацевтичнo прийнятними, інертними, нетоксичними носіями.
10. Застосування сполук формули (І) за будь-яким з пп. 1-7 у виробництві ліків для застосування як інгібіторів зворотного захоплення серотоніну.
11. Застосування сполук формули (І) за будь-яким з пп. 1-7 у виробництві ліків для застосування як інгібіторів зворотного захоплення серотоніну і ΝΚ1 антагоністів.
12. Застосування сполук формули (І) за будь-яким з пп. 1-7 у виробництві ліків для застосування у лікуванні депресивних станів, станів тривожності, імпульсивних розладів, агресивної поведінки, наркотичної залежності, ожиріння і розладів апетиту, болю і запалення, недоумства, психотичних станів, порушень хронобіологічних ритмів, нудоти і кишково-шлункових розладів.
Текст
1. Сполука формули (І): C2 2 (19) 1 3 ми, які вибирають з галогену, лінійного або розгалуженого С1-С6алкілу, лінійного або розгалуженого С1-С6алкокси, гідрокси, ціано і лінійного або розгалуженого С1-С6тригалоалкілу. 2. Сполука формули (І) за п. 1, в якій Υ являє собою ΝΗ. 3. Сполука формули (І) за п. 1 або 2, в якій Ζ являє собою атом азоту. 4. Сполука формули (І) за будь-яким з пп. 1-3, в якій n являє собою 1. 5. Сполука формули (І) за будь-яким з пп. 1-4, в якій Аr являє собою арильну групу. 6. Сполука формули (І) за будь-яким з пп. 1-5, в якій Χ являє собою зв'язок, атом кисню або групу, яку вибирають з -ОСН2- і -(СH2)m -, де m являє собою 1 або 2. 7. Сполука формули (І) за п. 1, яку вибирають з наступного: транс-1-{2-[(3,5-дибромбензил)окси]-2,3-дигідро1Н-інден-1-іл}піперазин, його енантіомери, а також адитивні солі з фармацевтичнo прийнятною кислотою, транс-1-{3-[(3,5-дибромбензил)окси]-3,4-дигідро2Н-хромен-4-іл}піперазин, його енантіомери, а також адитивні солі з фармацевтичнo прийнятною кислотою, транс-1-{6-[(3,5-дибромбензил)окси]-6,7,8,9тетрагідро-5Н-бензо[7]анулен-5-іл}-піперазин, його енантіомери, а також адитивні солі з фармацевтичнo прийнятною кислотою, транс-1-{2-[(3,5-дибромбензил)окси]-1,2,3,4тетрагідронафт-1-ил}піперазин, його енантіомери, а також адитивні солі з фармацевтичнo прийнятною кислотою, транс-1-{2-[(3,5-дибромбензил)окси]-1,2,3,4тетрагідронафт-1-ил}-1,4-діазепан, його енантіомери, а також адитивні солі з фармацевтичнo прийнятною кислотою, 1-{(1S,2R)-2-[(3,5-дибромбензил)окси]-2,3-дигідро1Н-інден-1-іл}піперазин, його енантіомери, а також адитивні солі з фармацевтично прийнятною кислотою, 1-[(1S,2R)-2-[(3,5-дифторбензил)окси]-2,3-дигідро1Н-інден-1-іл]піперазин, його енантіомери, а також адитивні солі з фармацевтичнo прийнятною кислотою, 1-[(1S,2R)-2-[(3,5-диметилбензил)окси]-2,3-дигідро1Н-інден-1-іл]піперазин, його енантіомери, а також адитивні солі з фармацевтичнo прийнятною кислотою, транс-1-{3-[(3,5-дихлорбензил)окси]-3,4-дигідро2Н-хромен-4-іл}піперазин, його енантіомери, а також адитивні солі з фармацевтичнo прийнятною кислотою, транс-1-{3-[3-фтор-5-(трифторметил)бензилокси]3,4-дигідро-2Н-хромен-4-іл}піперазин, його енантіомери, а також адитивні солі з фармацевтичнo прийнятною кислотою, і транс-1-{3-(3-хлор-5-фторбензилокси)-3,4дигідро-2Н-хромен-4-іл}піперазин, його енантіомери, а також адитивні солі з фармацевтичнo прийнятною кислотою. 8. Спосіб одержання сполук формули (І) за п. 1 із сполуки формули (Va), яка має трансконфігурацію: 89619 4 Y' R1 Z R2 ( )n OH X R3 R4 , (Va) в якій R1, R2, R3, R4, Χ, n і Ζ є такими ж, як визначено тут вище, і Υ' являє собою атом кисню або групу, яку вибирають з ΝΡ1 і CHR'8, де R'8 являє собою атом водню або групу ΝΗΡ1, і Ρ1 являє собою захисну групу для аміногрупи, сполуку формули (Va) піддають реакції, коли бажаним є одержати сполуки формули (І) відповідної транс-конфігурації, зі сполукою формули (VI): G-Ak-Ar, (VI) в якій Ak і Аr є такими ж, як визначено для формули (І), і G являє собою відхідну групу, таку як, наприклад, атом галогену, або групу ртолуолсульфонату, трифторметансульфонату або метансульфонату, з одержанням сполуки формули (VIIa) відповідної транс-конфігурації: Y' R1 Z R2 ( )n O Ak Ar X R3 R4 , (VIIa) в якій R1, R2, R3, R4, Χ, n, Υ', Ζ, Ak і Аr є такими ж, як визначено тут вище, захист якої знімають, коли Y' містить захисну групу Ρ1, як визначено тут вище, і потім алкілують, коли бажаним є одержати сполуки, в яких Υ являє собою групу ΝR7, в якій R7 відрізняється від атома водню, з одержанням сполуки формули (Іа), конкретний випадок сполук формули (І) відповідної трансконфігурації: Y R1 Z R2 R3 ( )n O Ak Ar X R4 , (Ia) в якій R1, R2, R3, R4, Χ, n, Υ, Ζ, Ak і Аr є такими ж, як визначено для формули (І), або сполуку формули (Va) окислюють, коли бажаним є одержати сполуки формули (І) відповідної цис-конфігурації, з одержанням рацемічної сполуки формули (VIII): 5 89619 і потім алкілують, коли бажаним є одержати сполуки, в яких Υ являє собою групу NR7, в якій R7 відрізняється від атома водню, з одержанням сполуки формули (Іb), конкретний випадок сполук формули (І), які мають цисконфігурацію: Y' R1 Z R2 6 ( )n O Y X R3 R1 R4 , (VIII) в якій R1, R2, R3, R4, Χ, Ζ, n і Υ' є такими ж, як визначено тут вище, яку відновлюють до відповідного спирту, діастереоізомери якої розділяють, і виділяють ізомер формули (Vb), відповідної цисконфігурації: Y' R1 Z R2 ( )n OH X R3 R4 , (Vb) в якій R1, R2, R3, R4, X, Υ', Ζ і n є такими ж, як визначено тут вище, яку піддають реакції зі сполукою формули (VI), як визначено тут вище, з одержанням сполуки формули (VIIb), відповідної цисконфігурації: Y' R1 Z R2 R3 ( )n O Ak Ar X R4 , (VIIb) в якій R1, R2, R3, R4, X, n, Y', Z, Ak і Аr є такими ж, як визначено тут вище, захист якої знімають, коли Y' містить захисну групу Ρ1, як визначено тут вище, Даний винахід відноситься до сполук піперазину, до способу їх одержання і фармацевтичних композицій, які їх містять, а також до їх застосування як інгібіторів зворотного захоплення серотоніну. Враховуючи той факт, що вони є корисними у лікуванні депресивних станів (Goodnick and Goldstein, J Psychopharmacol 1998, 12 (Suppl B): S55-S87; Chser and Goa, Drugs 2001 61: 81-110; MacQueen et al., CNS Drug Rev 2001, 7: 1-24; Wagstaff et al. Drugs 2002 62: 655-703), станів тривожності, таких як генералізована тривожність, напади паніки і фобії (Feighner, J Clin Psychiatry Z R2 ( )n O Ak Ar X R3 R4 (Ib), в якій R1, R2, R3, R4, Χ, Υ, Ζ, n, Ak і Аr є такими ж, як визначено для формули (І), сполуки формул (Іа) і (Іb) очищують відповідно до звичайної техніки очищення, розділяють, коли бажано, на їх оптичні ізомери і перетворюють, коли бажано, в їх адитивні солі з фармацевтичнo прийнятною кислотою. 9. Фармацевтична композиція, яка містить як активний інгредієнт сполуку за будь-яким з пп. 1-7 у комбінації з одним або більше фармацевтичнo прийнятними, інертними, нетоксичними носіями. 10. Застосування сполук формули (І) за будь-яким з пп. 1-7 у виробництві ліків для застосування як інгібіторів зворотного захоплення серотоніну. 11. Застосування сполук формули (І) за будь-яким з пп. 1-7 у виробництві ліків для застосування як інгібіторів зворотного захоплення серотоніну і ΝΚ1 антагоністів. 12. Застосування сполук формули (І) за будь-яким з пп. 1-7 у виробництві ліків для застосування у лікуванні депресивних станів, станів тривожності, імпульсивних розладів, агресивної поведінки, наркотичної залежності, ожиріння і розладів апетиту, болю і запалення, недоумства, психотичних станів, порушень хронобіологічних ритмів, нудоти і кишково-шлункових розладів. 1999, 60 (Suppl 22): 18-22; Bakker et al., Θnt Clin Psychopharmacol 2000, 15 (Suppl 2): S25-S30; Davidson, Int Clin Psychopharmacol 2000 15 (suppl 1):S13-S17; Schneier, J Clin Psychiatry 2001, 62 (Suppl 1): 43-48), несприятливого впливу стресу або психологічного (Магonа-Lewicka and Nichols, Stress 1997, 2: 91-100; Mar et al., Pharmacol Biochem Behav 2002, 73: 703-12, Will et al., Моl Psychiatry 2003, 8: 925-932; Ballenger, J Clin Psychiatry 2004, 65: 1696-1707) або нейротоксичного (Malberg and Duman, Neuropsychopharrnacology 2003, 28: 1562-1571; Santarelli et al., Science 2003, 301: 805-809; Czeh et 7 al., Neuropsychopharmacology 2005, 30: 67-79; Malberg and Schechtег. Curr Pharm Des 2005, 11: 145455), імпульсивних станів, таких як "ODC" або обсесивно-компульсивний розлад поведінки (Njung'e and Handley, Br J Pharmacol 1991, 104: 105412; Ichimaru et al., Jpn J Pharmacol 1995, 68: 65-70; Pigott and Seay, J Clin Psychiatry 1999, 60: 101-106; Vythilingum et al., Int Clin Psychopharmacol 2000, 15 (Suppl 2) S7-S1313), агресивних станів (Knutson et al., Am J Psychiatry 1998, 155: 373-379; Lanctot et al., Neuropsychopharmacology 2002, 27: 646-654; New et al., Psychopharmacology 2004, 176: 451-458), ожиріння і розладів апетиту, таких як булімія (Proietto et al., Expert Opin Investig Drugs 2000, 9: 1317-1326; Ljung et al., J Intern Med 2001, 250: 219-224; Appolinario et al., CNS Drugs 2004, 18: 629-651; Appolinario and McElroy, Curr Drug Targets 2004, 5: 301-307), больових станів (Aragona et al., Eur J Pain 2005, 9: 33-38; Millan. et al., Neuropharmacology 2002, 42: 677-684; Duman et al., J Pharmacol Sci 2004, 94: 161-165; Otsuka et al., J Anesth 2004, 15:154-158); і, відносно таких груп, розладів поведінки і неврональної дегенерації, асоційованих з недоумством та іншими розладами старіння (Lyketos et al., Am J Psychiatry 2000, 157: 1686-1689; Lanctot. et al, J Neuropsyhiatry Clin Neurosci 2001, 13: 5-21; Lanctot et al, Neuropsychopharmacology 2002, 27: 646-654; Pollock et al, Am J Psychiatry 2002, 159: 460-465). До того ж, більшість сполук даного винаходу є також активними як нейрокінін NK1 антагоністи. Враховуючи той факт, що вони є корисними у лікуванні депресивних станів (Rupniak et al., Behav Pharmacol 2001, 12: 497-508; Rupniak et al., Neuropharmacology 2003, 44: 516-523; Kramer et al., Neuropsychopharmacology 2004, 29: 385-392; Dableh et al., Eur J Pharmacol 2005, 507: 99-105), станів тривожності, таких як генералізована тривожність, напади паніки і фобії (Rupniak et al., Behav Pharmacol 2001, 12: 497-508; Santarelli et al., Proc Natl AcadSci USA 2001, 98: 1912-1927; Varty et al, Neuropsychopharmacology 2002, 27: 371-379; Rupniak and Kramer, Neuropsychopharmacology 2002, 13: 169-177), несприятливого впливу стресу або психологічного (Ballard et al., Eur J Pharmacol 2001, 412: 255-264: Rupniak and Kramer, Neuropsychopharmacology 2002, 13: 169-177; Spooren et al., Eur J Pharmacol 2002, 435: 161-170; Steinberg et al., J Pharmacol Exp Ther 2002, 303: 1180-1188) або нейротоксичного (Van der Hart et al., Моl Psychiatry 2002, 7: 933-941; Morcuende еt al., Eur J Neurosci 2003, 18: 1828-1836; Guest et al.. Brain Res 2004, 1002: 1-10; Czeh et al., Neuropsychopharmacology 2005, 30: 67-79), імпульсивних станів, таких як обсесивно-компульсивні розлади поведінки (Culman et al., Br J Pharmacol 1995, 114: 1310-1316; Tschope et al., Br J Pharmacol 1992, 107: 750-755; Rupniak et al., Behav Pharmacol 2001, 12: 497-508; Millan et al., Neurapharmacology 2002, 42: 677-684), агресивних станів (Siegel and Schubert, Rev Neurosci 1995, 6: 47-61; De Felipe et al, Nature 1998, 392: 394-397; Rupniak et al, Behav Pharmacol 2001,12: 497-508), а також наркотичної залежності (Murtra et al, Nature 2000, 405: 180-483; Ripley et al, Neuropharmacology 89619 8 2002, 43; 12584268, Gadd et al, J Neurosci 2003, 23: 8271-8280), психотичних станів (Zachrisson et al, Eur Neuropsychopharmacol 2000, 10: 355-363) і екстрапірамідних моторних ефектів, викликаних антипсихотичними засобами (Andersen et al., J Pharmacol Exp Ther 1995, 274: 928-936, Steinberg et al., J Pharmacol Exp Ther 2002, 303: 1180-1188), сексуальних дисфункцій (Priest et al., Brain Res Моl Brain Res 1995, 28: 61-71; Daniels et al, Neurosci Lett 2003, 338: 111-114: Kramer et al, Science 1998, 281: 1640-1644; Kramer et al, Neuropsychopharmacology 2004, 29: 385-392). розладів хронобіологічних ритмів, таких як циркадні ритми (Shibata et al., Brain Res 1992, 597: 257-263; Challet et al. Brain Res 1998, 800: 32-39: Challet et al, Neuropharmacology 2001, 40: 403-415; Gannon et al., Neuropharmacology, in press), болю (Seguin et al., Pain 1995, 61: 325-343; De Felipe et al, Nature 1998, 392: 394-397; Sanger, Br J Pharmacol 2004, 141: 1303-1312) і/або запалення (Seabrook et al., Eur J Pharmacol 1996, 317: 129-135; Holzer, Digestion 1998, 59: 269-283; Joos and Pauwels, Curr Opin Pharmacol 2001, 1: 235-241; Sanger, Br J Pharmacol 2004, 141: 1303-1312), нудоти та інших шлунково-кишкових розладів (McAllister and Pratt Eur J Pharmacol 1998, 353: 141-148; Gardner et al., Regulatory Peptides 1996, 65: 45-53; Patel and Lindley, Expert Opin. Pharmacothsr 2003, 4: 22792296; Sanger, Br J Pharmacol 2004, 141: 13031312); і, відносно таких груп, розладів поведінки і неврональної дегенерації, асоційованих з недоумством та іншими розладами старіння (Raffa, Neurosci Biobehav Rev 1998, 22: 789-813). Сполуки, які активні як на ділянках ΝΚ1 рецепторів, так і на ділянках зворотного захоплення серотоніну (5-НТ) повинні мати комплементарні і синергічні механізми для регулювання імпульсивних, агресивних, больових і, насамперед, депресивних станів, Крім того, було показано, що блокування NK1 рецепторів потенціює вплив інгібіторів зворотного захоплення 5-НТ на серотонінергічну передачу: через той факт, що такі сполуки повинні привести до більш швидкого і більш сильного антидепресивного впливу (Guiard et al., J Neurochem 2004, 89: 54-63; Froger et al, J Neurosci 2001, 2J.: 8188-8197), Швидкі анксіолітичні впливи NK1 антагоністів повинні, крім того, бути комплементарними до анхсіолітичних впливів інгібіторів зворотного захоплення 5-НТ, які експресуються після довготривалого лікування. Що стосується анксіогенних впливів, які викликаються 5-НТ на початку лікування (Bagdy et al., Int J Neuropsychopharmacol 2001, 4: 399-408), вони повинні запобігатися властивостями ΝΚ1 антагоністів (Ballard et al, Eur J Pharmacol 2001, 412: 255-264; Rupniak et al, Neuropharmacology 2003, 44: 516-523). Оскільки інші небажані впливи, асоційовані з блокуванням зворотного захоплення 5-НТ залучаються, такі як блювотні впливи (Goldstein and Goodnick, J Psychopharmacol 1998, 12 (Suppl B): S55-S87; Edwards and Anderson, Drugs 1999, 57: 507-533; Waugh and Goa, CNS Drugs 2003, 17: 343-362) і спричинення сексуальних дисфункцій (Goldstein and Goodnick, J Psychopharmacol 1998, 12 (Suppl B): S55-S87; Montgomery et al., J Affect disord 2002, 9 89619 69: 119-140; Hirschfeld. J Clin Psychiatry 2003, 64 (Suppl 18): 20-24),NK1 антагоністи повинні також бути здатні до протидії таким впливам. Отже, сполуки, які .є як ΝΚ1 антагоністами, так і інгібіторами зворотного захоплення серотоніну, повинні мати терапевтичну перевагу над сполуками, які взаємодіють тільки з однією або іншою з цих двох цілей. Більш конкретно, даний винахід відноситься до сполук формули (І): Y R1 Z ( ) n O R2 Ak Ar (I) X R3 R4 в якій: R1, R2, R3 і R4 які можуть бути однаковими або відрізнятись, кожний являє собою атом або групу, яку вибирають з Н, галогену, лінійного або розгалуженого С1-С6алкілу, лінійного або розгалуженого С1-С6алкокси, фенілу і ціано, Χ являє собою зв'язок, атом кисню або групу, яку вибирають з -(СH2)m -, -ОСН2 і –NR5-, m являє собою 1 або 2, R5 являє собою атом водню або групу, яку вибирають з лінійного або розгалуженого С1С6алкілу, COR6 і CO2R6 R6 являє собою лінійну або розгалужену С1С6алкільну групу, Υ являє собою атом кисню або групу, яку вибирають з NR7 і CHR8, R7 являє собою атом водню або групу, яку вибирають з COR9 і лінійного або розгалуженого С1С6алкілу, алкільна група необов'язково заміщена групою 5-оксо-4,5-дигідро-1H-1,2,4-триазол-3-ілу або 2,3-дигідро-1,4-бензодіоксин-2-ілу, R9 являє собою групу, яку вибирають з лінійного або розгалуженого С1-С6алкілу, арилу і гетероарилу, R8 являє собою атом водню або аміногрупу, необов'язково заміщену однією або двома лінійними або розгалуженими С1-С6алкільними групами, Ζ являє собою атом азоту або СН групу, n являє собою 1 або 2, Ak являє собою лінійний або розгалужений С1С6алкіленовий ланцюг, Аr являє собою арильну або гетероарнльну групу, до їх оптичних ізомерів, а також до їх адитивних солей з фармацевтичнo прийнятною кислотою. Оптичні ізомери, як повинно бути зрозуміло, означають енантіомери і діастереоізомери. Серед фармацевтичнo прийнятних кислот можуть бути згадані, без будь-якого обмеження, хлористоводнева кислота, бромистоводнева кислота, сірчана кислота, фосфорна кислота, оцтова кислота, трифтороцтова кислота, молочна кислота, 10 піровиноградна кислота, малонова кислота, янтарна кислота, глутарова кислота, фумарова кислота, винна кислота., малеїнова кислота, лимонна кислота, аскорбінова кислота, щавлева кислота, метансульфонова кислота, бензолсульфонова кислота, камфорна кислота, дибензоїлвинна кислота. Арильна група, як повинно бути зрозуміло, означає феніл, біфеніліл або нафтил, кожна з цих груп необов'язково заміщена однією або більше однаковими або різними групами, які вибирають з галогену, лінійного або розгалуженого С1-С6алкілу, лінійного або розгалуженого С1-С6алкокси, гідрокси, ціано, лінійного або розгалуженого С1С6тригалоалкілу і лінійного або розгалуженого С1С6тригалоалкокси. Гетероарильна група, як повинно бути зрозуміло, означає ароматичну моно-або біциклічну 512-членну групу, яка містить один, два або три гетероатоми, які вибирають з кисню, азоту і сірки, повинно бути зрозуміло, що гетероарильна група може бути необов'язково заміщена однією або більше однаковими або різними групами, які вибирають з галогену, лінійного або розгалуженого С1С6алкілу, лінійного або розгалуженого С1С6алкокси, гідрокси, ціано і лінійного або розгалуженого С1-С6тригалоалкілу, Χ переважно являє собою зв'язок, атом кисню або групу, яку вибирають з –OCH2- і -(СН2)m- де m являє собою 1 або 2. Υ переважно являє собою ΝΗ. Ζ переважно являє собою атом азоту. n переважно являє собою 1. Ar переважно являє собою арильну групу. Переважні сполуки відповідно до винаходу являють собою: транс-1-{2-[(3,5-дибромбензил)окси]-2,3дигідро-1H-інден-1-іл}піперазин, його енантіомери, а також адитивні солі з фармацевтично прийнятною кислотою, транс-1-{3-[(3,5-дибромбензил)окси]-3,4дигідро-2Н-хромен-4-іл}піперазин, його енантіомери, а також адитивні солі з фармацевтично прийнятною кислотою, - транс-1-{6-[(3,5-дибромбензил)окси]-6,7,8,9тетрагідро-5Н-бензо[7]анулен-5-іл}піперазин, його енантіомери, а також адитивні солі з фармацевтично прийнятною кислотою, - транс-1-{2-[(3,5-дибромбензил)окси]-1,2,3,4тетрагідронафт-1-ил}піперазин, його енантіомери, а також адитивні солі з фармацевтично прийнятною кислотою, - транс-1-{2-[(3,5-дибромбензил)окси]-1,2,3,4тетрагідронафт-1-ил}-1,4-діазепан, його енантіомери, а також адитивні солі з фармацевтично прийнятною 1-{(1S,2R)-2-[(3,5-дибромбензил)окси]-2,3дигідро-1Н-інден-1-іл}піперазин, його енантіомери, а також адитивні солі з фармацевтично прийнятною кислотою. 1-{(1S,2R)-2-[(3,5-дибромбензил)окси]-2,3дигідро-1Н-інден-1-іл]піперазин, його енантіомери, а також адитивні солі з фармацевтично прийнятною кислотою, 11 89619 1-{(1S,2R)-2-[(3,5-дибромбензил)окси]-2,3дигідро-1Н-інден-1-іл]піперазин, його енантіомери, а також адитивні солі з фармацевтично прийнятною кислотою, транс-1-{3-[(3,5-дихлорбензил)окси]-3,4дигідро-2Н-хромен-4-іл}піперазин, його енантіомери, а також адитивні солі з фармацевтично прийнятною кислотою, транс-1-{3-[3-фтор-5(трифторметил)бензилокси}-3,4-дигідро-2Нхромен-4-іл)піперазин, його енантіомери, а також адитивні солі з фармацевтично прийнятною кислотою, - і транс-1-{3-(3-хлор-5-фторбензилокси)-3,4дигідро-2Н-хромен-4-іл}піперазин, його енантіомери, а також адитивні солі з фармацевтично прийнятною кислотою. Винахід відноситься також до способу одержання сполук формули (І), починаючи зі сполуки формули (Va), відповідної транс конфігурації: Y' R1 Z 12 з тим, щоб одержати сполуки формули (Іа), конкретний випадок сполук формули (І), які є відповідної транс конфігурації: Y R1 Z ( ) n O Ak R2 Ar (Ia) X R3 R4 в якій R1, R2, R3, R4, Χ, n, Υ, Ζ, Ak і Аr є такими ж, як визначено для формули (І), або сполуку формули (Va) є окислюють, коли бажаним є одержати сполуки формули (І) відповідної цис конфігурації, з тим, щоб одержати рацемічну сполуку формули (VIII): Y' ( ) n R1 OH R2 (Va) Z ( ) n O R2 (VIII) X R3 в якій R1, R2, R3, R4, X, n і Ζ є такими ж, як визначено тут вище, і Υ' являє собою атом кисню або групу, яку вибирають зNP1 і CHR'8, де R'8 являє собою атом водню або групу NHP1, і P1 являє собою захисну групу для функції аміну, сполуку формули (Va) піддають реакції, коли бажаним є одержати сполуки формули (І) відповідної транс конфігурації, зі сполукою формули (VI): G-Ak-Ar (VI) В якій Ak і Аr є такими ж, як визначено для формули (І), і G являє собою відвідну групу, таку як, наприклад, атом галогену або групу ртолуолсульфонату, трифторметансульфонату або метансульфонату, з тим, щоб одержати сполуку формули (VІІa) відповідної транс конфігурації: R4 в якій R1, R2, R3, R4, Χ, Ζ, n і Υ' є такими ж, як визначено тут вище, яку відновлюють до відповідного спирту, діастереоізомери якої розділяють, й ізомер формули (Vb), відповідної цис конфігурації, виділяють: Y' R1 Z n OH (Ib) X R3 ( ) n Ar (VIIa) в якій R1, R2, R3, R4, Χ, Υ', Ζ і n є такими ж, як визначено тут вище, яку піддають реакції зі сполукою формули (VI), як визначено тут вище, з тим, щоб одержати сполуку формули (VІІb), відповідної цис конфігурації: Y' X R3 ( ) R4 O Ak R2 Z R2 Y' R1 X R3 R4 R1 R4 в якій R1, R2, R3, R4, X, n і Ζ є такими ж, як визначено тут вище, захист якої знімають, коли Y' містить захисну групу Р1, як визначено тут вище, і потім алкілують, коли бажаним є одержати сполуки, в яких Υ являє собою групу ΝR7, в якій R7 відрізняється від атома водню, Z ( ) n O X R3 R4 Ak Ar (VIIb) 13 89619 в якій R1, R2, R3, R4, Х, n, Υ', Ζ, Ak і Аr є такими ж, як визначено тут вище, захист якої знімають, коли Y' містить захисну групу Р1, як визначено тут вище, і потім алкілують, коли бажанимє одержати сполуки, в яких Υ являє собою групу ΝR7, в якій R7 відрізняється від атома водню, з тим, щоб одержати сполуки формули (Іb), конкретний випадок сполук формули (І), які є відповідної цис конфігурації: 14 Y' R1 ( ) Z O Ak Ar Y' (Ib) R1 Z ( ) в якій R1, R2, R3, R4, Х, Υ, Ζ, n, Ak і Аr є такими ж, як визначено для формули (І), сполуки формул (Іа) і (Іb) можуть бути очищені відповідно до звичайної техніки очищення, розділені, коли бажано, на їх оптичні ізомери і перетворені, коли бажано, в їх адитивні солі з фармацевтичнo прийнятною кислотою. Сполуки формули (Іс), конкретний випадок сполук формули (I), в якій Ak являє собою групу СН(СН3)-: Y ( ) CH3 n O R2 (Ic) Ar n O R2 R4 CH3 Ar (XII) X R3 R4 в якій R1, R2, R3, R4, Χ, n, Υ', Ζ і Аr є такими ж, як визначено тут вище, яку розділяють на її ізомери і потім знімають захист, коли Υ' містить захисну групу Ρ1, як визначено тут вище, і алкілують, коли бажаним є одержати сполуки, в яких Υ являє собою групу ΝR7, в якій R7 відрізняється від атома водню, з тим, щоб одержати сполуки формули (Іс), Сполуки формули (Va1), конкретний випадок сполук формули (Va), в якій Ζ являє собою атом азоту, можуть бути одержані, починаючи зі сполуки формули (II): R1 X R3 (XI) X R3 X Z Ar в якій R1, R2, R3, R4, Χ, n, Υ', Ζ і Аr є такими ж, як визначено тут вище, яку гідрогенізують з тим, щоб одержати сполуку формули (XII): n O R1 n R4 R2 R3 ( ) R2 Y R1 Z R2 R4 (II) в якій R1, R2, R3, R4, Х, n, Υ, Ζ і Аr є такий же визначений для формули (І), можуть також бути одержані конденсацією спирту формули (Va) або (Vb) з кислотою формули (IX); НО2С-Аr (IX) в якій Аr є таким же, як визначено для формули (І), з тим, щоб одержати ефір формули (X): X R3 R4 в якій R1, R2, R3, R4 і X є такими ж, як визначено для формули (І), яку окислюють у сполуку формули (III); R1 Y' O R1 Z ( ) n O R2 R2 O (III) Ar (X) X R3 R4 X R3 R4 в якій R1, R2, R3, R4, Χ, n, Υ', Ζ і Аr є такими ж, як визначено тут вище, який піддають реакції з біс (циклопентадієніл)диметилтитан, з тим, щоб одержати сполуку формули (XI): в якій R1, R2, R3, R4 і Χ є такими ж, як визначено тут вище, яку піддають реакції зі сполукою формули (IV): HN ( ) Y' (IV) n в якій n є таким же, як визначено для формули (І) і Υ' є таким же, як визначено тут вище, 15 89619 16 з тим, щоб одержати сполуку формули (Vа1): -O Y' +N ( ) R1 N n R1 OH R2 (Va1) X R3 R4 R1 (XVI), X R3 в якій R1, R2, R3, R4, Χ, Υ' і n є такими ж, як визначено тут вище. Сполуки формули (Va2), конкретний випадок сполук формули (Va), в якій Ζ являє собою групу СН, n являє собою 1 і Y' являє собою ΝΡ1 групу, можуть бути одержані, починаючи зі сполуки формули (ХIII): O R2 R4 в якій R1, R2, R3, R4 і Χ є такими ж, як визначено тут вище, яку піддають реакції з відновлювальним агентом з тим, щоб одержати сполуку формули (XVII): ON+ O R1 R2 (XIII) X R3 R4 R4 в якій R1, R2, R3, R4 ί Χ є такими ж, як визначено тут вище, яку піддають реакції каталітичної гідрогенізації з тим, щоб одержати сполуку формули (XVIII): H N HO R2 R1 (XIV) OH R2 X R3 R4 N R1 R2 R4 в якій R1, R2, R3, R4 і Х є такими ж, як визначено тут вище, цис і транс ізомери яких розділяють, функцію аміну транс ізомеру захищають з тим, щоб одержати сполуку формули (Va2) відповідної транс конфігурації: P1 (XV) N X R1 R4 в якій R1, R2, R3, R4 і Х є такими ж, як визначено тут вище, яку піддають реакції з Охоnе з тим, щоб одержати сполуку формули (XVI): (XVIII) X R3 в якій R1, R2, R3, R4 і Χ є такими ж, як визначено тут вище, яку дегідратують з тим, щоб одержати сполуку формули (XV): R3 (XVII) X R3 в якій R1, R2, R3, R4 і Χ є такими ж, як визначено тут вище, яку піддають реакції з 4піридиллітшєм з тим, щоб одержати сполуку формули (XIV): N R1 OH R2 OH R2 X R3 R4 (Va2) 17 в якій R1, R2, R3, R4 і Х є такими ж, як визначено тут вище. Сполуки даного винаходу є інгібіторами зворотного захоплення серотоніну, і більшість з них також являють собою NK1 антагоністи. Вони є корисними як лікарські засоби у лікуванні депресивних станів, станів тривожності, імпульсивних розладів, агресивної поведінки, наркотичної залежності, ожиріння і розладів апетиту, болю і запалення, недоумства, психотичних станів, порушень хронобіологічних ритмів, нудоти і кишково-шлункових розладів. Даний винахід відноситься також до фармацевтичних композицій, які містять як активний інгредієнт сполуку формули (І) або її адитивну сіль з фармацевтично прийнятною кислотою, в комбінації з одним або більше фармацевтично прийнятним, інертним, нетоксичним ексципієнтом або носієм. Серед фармацевтичних композицій відповідно до винаходу можуть бути згадані більш конкретно ті, які прийнятні для орального, парентерального (внутрішньовенного, внутрішньом'язового або підшкірного), під- або через- шкірного, назального, ректального, під'язикового, очного або респіраторного введення, і особливо таблетки або драже, під'язикові таблетки, желатинові капсули, капсули, супозиторії, креми, мазі, шкірні гелі, ін'єктовані або придатні для пиття препарати, аерозолі, очні краплі і краплі для носа. Корисне дозування варіює відповідно до віку і ваги пацієнта, шляху введення, природи і тяжкості розладу і введення будь-якого пов'язаного лікування і знаходиться в діапазоні від 0,5 до 500мг на день за одне або більше введень. Наступні приклади ілюструють винахід. Використані вихідні матеріали являють собою відомі продукти або їх одержують відповідно до відомих методик. Різні Приготування дають проміжні сполуки синтезу, які є корисними у приготуванні сполук даного винаходу. Структури сполук, які описуються у Прикладах, були визначені відповідно до звичайних спектрофотометричних методик (інфрачервоний, ядерний магнітний резонанс, мас-спектрометрія). Точки плавлення були визначені або на столику Кофлера (ВK) або на гарячій плитці під мікроскопом (МK). Приготування А: 6-Бром-1,2-дигідронафтален Стадія А: 7-Бром-1,2,3,4-тетрагідронафт-1-ол До 9,5г 7-бром-3,4-дигідронафтален-1(2Н)-ону (42ммоль), одержаного відповідно до способу, розритого в Synth. Comm. 1994, 2777, розчиненого в 100мл етанолу, додають, при 0°С і двома порціями, 0,8г боргідриду натрію (21ммоль). Реакційній суміші потім дають повернутись до температури навколишнього середовища протягом 30 хвилин, і потім випаровують етанол. Залишок додають в 100мл толуолу і 100мл води. Після розділення, водну фазу екстрагують 50мл толуолу. Фази толуолу об'єднують, промивають насиченим водним розчином хлориду натрію і потім випаровують з тим, щоб одержати 7-бром-1,2,3,4-тетрагідронафт1-ол у формі олії. Стадія В: 6-Бром-1,2-дигідронафтален 89619 18 Розчин 8,6г сполуки, одержаної на Стадії вище (37,9ммоль), в 200мл толуолу нагрівають до 100°С. При цій температурі додають краплями, протягом однієї години, розчин 0,3г паратолуолсульфонової кислоти (1,2ммоль), розчинений в 400мл толуолу. Реакційну суміш згодом охолоджують до 25°С і потім гідролізують, використовуючи 100мл води. Органічну фазу екстрагують і потім висушують, фільтрують і випаровують з тим, щоб одержати 6-бром-1,2-дигідронафтален у формі олії. Приготування В: 7-Бром-2.3-дигідро-1бензоксепін Стадія А: 4-[5-Бром-2-(бут-3-єн-1ілокси)феніл]-4-гідроксибутан-2-он До 300мл ацетону додають 10г 5-бром-2гідроксибензальдегіду (49,7ммоль), 13,7г карбонату калію (99,5ммоль) і 10,1мл 4-бромбут-1-ену (99,5ммоль); Реакційну суміш потім нагрівають зі зворотним холодильником протягом 36 годин перед тим, як її охолоджувати, фільтрують і випаровують досуха з тим, щоб одержати 4-[5-бром-2-(бут-3-ен-1ілокси)феніл]-4-гідроксибутан-2-он у формі олії. Стадія В: 4-Бром-1-(бут-3-ен-1-ілокси)-2вінілбензол До 90мл безводного тетрагідрофурану додають 1,6г 60% гідриду натрію в олії (39,8ммоль) і потім, при 0°С і несподівано, 10,67г метил(трифеніл)фосфоній броміду (29,9ммоль). Суміші дають повернутись до температури навколишнього середовища і перемішують протягом 30 хвилин при 25°С. Розчин 8г сполуки, одержаної на Стадії вище, (24,9ммоль), в 30мл безводного тетрагідрофурану, потім додають краплями до реакційної суміші, при температурі навколишнього середовища. Екзотермічну реакцію від 25°С до 35°С спостерігають протягом 45 хвилин. Перемішування проводять протягом наступних 2 годин при температурі навколишнього середовища; реакційну суміш потім фільтрують і фільтрат виливають в суміш 100мл етилацетату, 200мл насиченого водного розчину хлориду натрію і 50г льоду. Після екстрагування етилацетатом об'єднані органічні фази промивають водою, висушують, фільтрують і випаровують досуха. Залишок, який одержують, очищують фільтруванням над 100г силікагелю (елюент: толуол 100%) з тим, щоб одержати 4бром-1-(бут-3-ен-1-ілокси)-2-вінілбензол у формі олії. Стадія С: 7-Бром-2,3-дигідро-1-бензоксепін 5г сполуки, одержаної на Стадії вище, (19,8ммоль), розчиняють в 500мл толуолу, і розчин потім дегазують протягом 30 хвилин, використовуючи азот. Додають 335мг (0,39ммоль) [1,3біс(2,4,6-триметилфеніл)-2імідазолідиніліден)дихлор(феніл-метилен)(трициклогексилфосфін)рутеній], або каталізатор Крабба II. Реакційну суміш потім нагрівають при 50°С протягом 30 хвилин; толуол потім випаровують і залишок, який одержують, очищують на колонці 70г силікагелю (елюент: циклогексан/толуол: 95/5) з тим, щоб одержати 7-бром-2,3-дигідро-1бензоксепін. 19 Приклад 1: транс-1-{2-[(3,5Дибромбензил)окси]-2,3-дигідро-1Н-інден-1іл}піперазин дигідрохлорид Стадія А: трет-Бутил транс-4-(2-гідрокси-2,3дигідро-1Н-інден-1-іл)піперазин-1-карбоксилат 11,6г трет-бутил піперазин-1-карбоксилат (62ммоль) і 8,2г оксиду індену (62ммоль) розчиняють в 30мл ацетонітрилу. Реакційну суміш потім нагрівають при 60°С протягом ночі і випаровують досуха. Залишок, який одержують, очищують флеш-хроматографією на 1кг силікагелю (елюент: дихлорметан/етанол 95/5) з тим, щоб одержати трет-бутил транс-4-(2-гідрокси-2,3-дигідро-1Нінден-1-іл)піперазин-1-карбоксилат у формі білої меренги. Стадія В: трет-Бутил транс-4-{2-[(3,5дибромбензил)окси]-2,3-дигідро-1Н-інден-1іл}піперазин-1-карбоксилат До 3г сполуки, одержаної на Стадії вище, (9,42ммоль), в 30мл безводного диметилформаміду додають 452мг гідриду натрію як 60% суспензію в 11,3 олії (ммоль, 1,2 еквіваленти). Після перемішування протягом 30 хвилин при температурі навколишнього середовища додають 3,1г 3,5дибромбензил броміду (9,42ммоль). Спостерігають злегка екзотермічну реакцію. Реакційну суміш потім перемішують протягом ночі при температурі навколишнього середовища, і згодом диметилформамід випаровують. Залишок, який одержують, додають в дихлорметан. Після промивання водою, сушіння, фільтрування і випаровування, одержують 6г залишку, який очищують флешхроматографією на 500г силікагелю (елюент: дихлорметан/етилацетат 90/10) з тим, щоб одержати трет-бутил транс-4-{2-[(3,5-дибром-бензил)окси]2,3-дигідро-1Н-інден-1-іл}піперазин-1-карбоксилат у формі меренги. Стадія С: транс-1-{2-[(3,5-Дибромбензил)окси]2,3-дигідро-1Н-інден-1-іл}піперазин дигідрохлорид 3,5г сполуки, одержаної на Стадії вище (6,18ммоль), розчиняють в 250мл етилацетату і потім газоподібний водневий хлорид барботують через розчин. Температурі дають зрости до 45°С, і перемішування потім проводять протягом 2 годин при температурі навколишнього середовища. Реакційну суміш потім концентрують до двох третіх і потім додають 50мл ефіру. Одержаний осад відфільтровують і потім сушать з тим, щоб одержати транс-1-{2-[(3,5-дибромбензил)окси]-2,3-Дигідро1H-інден-1-іл}піперазин дигідрохлорид у формі твердої речовини бежевого кольору. Точка плавлення (МK): 154-167°С. ІЧ (чист.): 2650-2437, 1588-1559, 1087,848740см-1. Приклад 2: (-) ізомер транс-1-{2-[(3,5дибромбензил)окси]-2,3-дигідро-1Н-інден-1іл}піперазин дигідрохлориду Після повторного перетворення в основу, рацемічну сполуку Прикладу 1 розділяють препаративною хіральною ВЕРХ хроматографією (елюент: ізопропанол/ацетонітрил/діетиламін 100/900/1) на фазі Chiralpak AD. Перший з ізомерів, які розділяють таким чином, перетворюють в сіль, використовуючи хлористоводневу кислоту, з тим, щоб одержати дигідрохлорид (-) ізомеру транс-1-{2-[(3,5 89619 20 дибромбензил)окси]-2,3-дигідро-1Н-інден-1іл}піперазину. Точка плавлення (МK): 117-125°С. Оптичне обертання: [a]D=-27,86 (с=1%, МеОН, 20°С, 589нм). Приклад 3: (+) ізомер транс-1-{2-[(3,5дибромбензил)окси]-2,3-дигідро-1Н-інден-1іл}піперазиндигідрохлорид Другий з ізомерів, які розділяють у Прикладі 2, перетворюють в сіль, використовуючи хлористоводневу кислоту, з тим, щоб одержати дигідрохлорид (+) ізомеру транс-1-{2-[(3,5дибромбензил)окси]-2,3-дигідро-1Н-інден-1-іл}піперазину. Точка плавлення (МK): 115-121°С Оптичне обертання: [a]D=+27,29 (с=1%, МеОН, 20°С, 589нм) Приклад 4: транс-1-{3-[(3,5Дибромбензил)окси]-3,4-дигідро-2Н-хромен-4іл}піперазин дигідрохлорид Стадія А: транс-3-Бромхроман-4-ол До 15г 2Н-хромену (0,113моль), розчиненого в 330мл суміші тетрагідрофуран/вода 50/50, додають 22,1г N-бромсукциніміду (0,124моль, 1,1 еквівалентів), і суміш потім перемішують протягом однієї години при температурі навколишнього середовища. Реакційну суміш потім розбавляють водою, і згодом екстрагують двічі етилацетатом. Об'єднані органічні фази промивають водою, висушують, фільтрують і випаровують досуха з тим, щоб одержати транс-3-бромхроман-4-ол у формі твердої речовини блідо-жовтого кольору. Точка плавлення (ВK): 96-98°С. Стадія В: 1а,7b-Дигідро-2Н-оксирено[с]хромен 4,4г гранул гідроксиду калію (78,5ммоль) додають до 10г сполуки, одержаної на Стадії вище, (43,6ммоль), розчиненої в 170мл тетрагідрофурану і 85мл води. Після перемішування протягом 2 годин при 25°С реакційну суміш розбавляють водою і екстрагують двічі ефіром. Органічні фази об'єднують і промивають водою, висушують, фільтрують і випаровують досуха, з тим, щоб одержати 1а,7b-дигідро-2Н-оксирено[с]хромен у формі блідо-жовтої олії. Стадія С: трет-Бутил транс-4-(3-гідрокси-3,4дигідро-2Н-хромен-4-іл)піперазин-1-карбоксилат 4,9г сполуки, одержаної на Стадії вище, (33ммоль), обробляють 6,1г трет-бутил піперазин1-карбоксилату (33ммоль) відповідно до способу, який описаний на Стадії А Прикладу 1. Олію, яку одержують, очищують флеш-хроматографією на 500г силікагелю (елюент: дихлорметан/етанол 95/5) з тим, щоб одержати очікуваний продукт у формі олії. Стадія D: трет-Бутил транс-4-{3-[(3,5дибромбензил)окси]-3,4-дигідро-2Н-хромен-4іл}піперазин-1-карбоксилат 3г сполуки, одержаної на Стадії вище, (8,9ммоль), обробляють відповідно до способу, який описаний на Стадії В Прикладу 1. Олію, яку одержують, очищують флеш-хроматографією на 300г силікагелю, з тим, щоб одержати очікуваний продукт у формі білої меренги. 21 Стадія Е: транс-1-{3-[(3,5-Дибромбензил)окси]3,4-дигідро-2Н-хромен-4-іл}-піперазин дигідрохлорид 2,9г сполуки, одержаної на Стадії вище, (4,97ммоль), обробляють відповідно до способу, який описаний на Стадії С Прикладу 1. Одержаний продукт кристалізують з ефіру, фільтрують і висушують з тим, щоб одержати очікуваний продукт у формі білих кристалів. Точка плавлення (МK): 130-135°С. ІЧ (чист.): 2632-2435, 1612-1586-1559, 1231-1 1104, 850-760-740см . Приклад 5: (-) ізомер транс-1-{3-[(3,5дибромбензил)окси]-3,4-дигідро-2Н-хромен-4іл}піперазин дигідрохлориду Після повторного перетворення в основу, рацемічну сполуку Прикладу 4 розділяють препаративною хіральною ВЕРХ хроматографією (елюент: етанол/діетиламін 1000/1) на фазі Chiralpak AD. Перший з ізомерів, які розділяють таким чином, перетворюють на сіль, використовуючи хлористоводневу кислоту, з тим, щоб одержати дигідрохлорид (-) ізомеру транс-1-{3-[(3,5дибромбензил)окси]-3,4-дигідро-2Н-хромен-4іл}піперазину. Точка плавлення (МK): 128-132°С. Оптичне обертання: [a]D=-40,36 (с=1%, МеОН, 20°С, 589нм). Приклад 6: (+) ізомер транс-1-{3-[(3,5дибромбензил)окси]-3,4-дигідро-2Н-хромен-4іл}піперазин дигідрохлориду Другий з ізомерів, які розділяють у Прикладі 5, перетворюють в сіль, використовуючи хлористоводневу кислоту, з тим, щоб одержати дигідрохлорид (+) ізомер транс-1-{3-[(3,5дибромбензил)окси]-3,4-дигідро-2Н-хромен-4-іл}піперазину. Точка плавлення (МK): 126-130°С. Оптичне обертання: [a]D=+40,92 (с=1%, МеОН, 20°С, 589нм). Приклад 7: транс-1-{6-[(3,5Дибромбензил)окси]-6,7,8,9-тетрагідро-5Н-бензо[7]анулен-5-іл}піперазин дигідрохлорид Стадія А: трет-Бутил транс-4-(6-гідрокси6,7,8,9-тетрагідро-5Н-бензо[7]анулен-5-іл)піперазин-1-карбоксилат Очікуваний продукт одержують відповідно до методики, яка описана на Стадіях А, В і С Прикладу 4, замінюючи 2Н-хромен на 6,7-дигідро-5Нбензо[7]анулен. Стадія В: транс-1-{6-[(3,5-Дибромбензил)окси]6,7,8,9-тетрагідро-5Н-бензо[7]анулен-5іл}піперазин дигідрохлорид Очікуваний продукт одержують відповідно до методики, яка описана на Стадіях В і С Прикладу 1, починаючи зі сполуки, одержаної на Стадії вище. Точка плавлення (МK): 126-130°С. ІЧ (чист.): 2665-2458, 1589-1559, 1104-1087, 850-740см-1. Приклад 8: транс-1-{4-[(3,5Дибромбензил)окси]-2,3,4,5-тетрагідро-1бензоксепін-5-іл}піперазин дигідрохлорид Стадія А: 1а,2,3,8bТетрагідрооксирено[d][1]бензоксепін 89619 22 До 0,5г 2,3-дигідро-1-бензоксепіну (3,42ммоль), одержаного відповідно до способу, описаного у J. Org. Chem., 1969, 34 (1), 207, розчиненого в 30мл суміші етилацетат/вода 50/50, додають 1,44г гідрокарбонату натрію (17,1ммоль) і потім, протягом 1 години, розчин 2,1г Охоnе® (3,42ммоль) в 15мл води. Після завершення додавання, перемішування проводять протягом наступної години і потім органічну фазу відокремлюють. Водну фазу знову екстрагують 10мл етилацетату, і об'єднані органічні фази промивають водою, висушують, фільтрують і випаровують досуха з тим, щоб одержати очікуваний продукт у формі олії. Стадія В: трет-Бутил транс-4-(4-гідрокси2,3,4,5-тетрагідро-1-бензоксепін-5-іл)піперазин-1карбоксилат Очікуваний продукт одержують відповідно до методики, яка описана на Стадії А Прикладу 1, починаючи зі сполуки, одержаної на Стадії вище. Стадія С: транс-1-{4-[(3,5-Дибромбензил)окси]2,3,4,5-тетрагідро-1-бензоксепін-5-іл}піперазин дигідрохлорид Очікуваний продукт одержують відповідно до методики, яка описана на Стадіях В і С Прикладу 1, починаючи зі сполуки, одержаної на Стадії вище. Точка плавлення (МK): 132-139°С. ІЧ (чист.): 3334, 2660-2571-2447, 1222-1111, 785-735см-1. Приклад 9: транс-1-{3-[(3,5Дибромбензил)окси]-3,4-дигідро-2Н-хромен-4іл}піперидин-4-амін дигідрохлорид Стадія А: трет-Бутил транс-[1-(3-гідрокси-3,4дигідро-2Н-хромен-4-іл)піперидин-4-іл]карбамат До 3г сполуки, одержаної на Стадії В Прикладу 4, розчиненої в 45мл ацетонітрилу, додають 4г трет-бутил піперидин-4-ілкарбамату (20,2ммоль). Суміш потім нагрівають зі зворотним холодильником протягом 12 годин і згодом випаровують досуха. Одержують жовту олію, який очищують флешхроматографією на силікагелі (елюент: дихлорметан/етанол 95/5) з тим, щоб одержати очікуваний продукт у формі меренги блідо-жовтого кольору. Стадія В: трет-Бутил транс-1-{3-[(3,5дибромбензил)окси]-3,4-дигідро-2Н-хромен-4-іл}-4піперидилкарбамат Очікуваний продукт одержують відповідно до методики, яка описана на Стадії В Прикладу 1, починаючи зі сполуки, одержаної на Стадії вище. Стадія С: транс-1-{3-[(3,5-Дибромбензил)окси]3,4-дигідро-2Н-хромен-4-іл}піперидин-4-амін дигідрохлорид Очікуваний продукт одержують відповідно до методики, яка описана на Стадії С Прикладу 1, починаючи зі сполуки, одержаної на Стадії вище. Точка плавлення (МK): 160-165°С. ІЧ (чист.): 3174-2300, 1232-1105-1041, 761-1 740см . Приклад 10: транс-4-{2-[(3,5Дибромбензил)окси]-1,2,3,4-тетрагідронафт-1ил}морфолін гідрохлорид Стадія А: 1а,2,3,7b-Тетрагідронафто[1,2b]оксирен 36,5г 1,2-дигідронафталену (280,3ммоль) обробляють з Охоnе® відповідно до способу, описа 23 ного на Стадії А Прикладу 8, з тим, щоб одержати очікуваний продукт у формі олії. Стадія В: транс-1-Морфолін-4-іл-1,2,3,4тетрагідронафт-2-ол До 3,95г сполуки, одержаної на Стадії вище, (27,02ммоль), розчиненої в 65мл ацетонітрилу, додають 2,35мл морфоліну (27,02ммоль), і потім 185мг ZnCl2 (1,35ммоль). Після нагрівання зі зворотним холодильником протягом 12 годин, суміш випаровують досуха і залишок, який одержують, очищують флеш-хроматографією на силікагелі (дихлорметан/етанол 95/5), з тим, щоб одержати очікуваний продукт у формі твердої речовини світло-коричневого кольору. Точка плавлення (ВK): 88-90°С. Стадія С: транс-4-{2-[(3,5-Дибромбензил)окси]1,2,3,4-тетрагідронафт-1-ил}морфолін 3г сполуки, одержаної на Стадії вище, (12,85ммоль), обробляють відповідно до способу, який описаний на Стадії В Прикладу 1. Одержують олію, яку очищують флеш-хроматографією на силікагелі (елюент: дихлорметан) з тим, щоб одержати очікуваний продукт у формі олії. Стадія D: транс-4-{2-[(3,5-Дибромбензил)окси]1,2,3,4-тетрагідронафт-1-ил}морфолін гідрохлорид До 1,9г сполуки, одержаної на Стадії вище, (3,95ммоль), розчиненої в 40мл етилацетату, додають 2,96мл 2М ефірного розчину НСI (5,92ммоль). Після фільтрування і сушіння кристалів, одержують очікуваний продукт. Точка плавлення: (МK)=175-180°С. Приклад 11: транс-1-{2-[(3,5Дибромбензил)окси]-5-метокси-2,3-дигідро-1Hінден-1-іл}піперазин Стадія А: 4-Метокси-6,6а-дигідро-1аНіндено[1,2-b]оксирен Очікуваний продукт одержують відповідно до методики, яка описана на Стадіях А і В Прикладу 4, починаючи з 6-метокси-1Н-індену. Стадія В: трет-Бутил транс-4-{2-[(3,5дибромбензил)окси]-5-метокси-2,3-дигідро-1Нінден-1-іл}піперазин-1-карбоксилат Очікуваний продукт одержують відповідно до методики, яка описана на Стадіях А і В Прикладу 1, починаючи зі сполуки, одержаної на Стадії вище. Стадія С: транс-1-{2-[(3,5-Дибромбензил)окси]5-метокси-2,3-дигідро-1Н-інден-1-іл}піперазин 1,3г сполуки, одержаної на Стадії вище, (2,17ммоль), обробляють відповідно до способу, який описаний на Стадії С Прикладу 1. Після випаровування досуха, продукт, який одержують, додають у воду, і водну фазу доводять до рН8 за допомогою додавання розчину гідроксиду натрію (IN) і екстрагують ефіром. Органічну фазу промивають водою, висушують, фільтрують і випаровують досуха. Залишок, який одержують, кристалізують з ізопропілового ефіру. Кристали відфільтровують і висушують з тим, щоб одержати очікуваний продукт. Точка плавлення (МK): 101-104°С. Приклад 12: транс-1-{2-[(3,5Дибромбензил)окси]-7-метокси-1,2,3,4-тетрагідронафт-1-ил}піперазин дигідрохлорид 89619 24 Стадія А: 2-Бром-7-метокси-1,2,3,4тетрагідронафт-1-ол 20г 6-метокси-1,2-дигідронафталену (126ммоль) обробляють відповідно до способу, який описаний на Стадії А Прикладу 4, з тим, щоб одержати очікуваний продукт. Стадія В: трет-Бутил транс-4-(2-гідрокси-7метокси-1,2,3,4-тетрагідронафт-1-ил)піперазин-1карбоксилат До 2г сполуки, одержаної на Стадії вище, (7,78ммоль), розчиненої в 30мл тетрагідрофурану, додають 1,24г гідриду натрію як 60% суспензію в 31,1 олії (ммоль) і перемішування проводять протягом 4 годин при температурі навколишнього середовища. Реакційну суміш фільтрують. Фільтрат, який містить 6-метокси-1а,2,3,7b-тетрагідронафто[1,2-b]оксирену у розчині, потім піддають реакції з 1,5г трет-бутил піперазин-1-карбоксилату (7,78ммоль) і 5мл диметилформаміду. Тетрагідрофуран відганяють з реакційної суміші, яку потім нагрівають при 110°С протягом 24 годин. Суміш охолоджують, виливають у воду і екстрагують дихлорметаном. Органічну фазу висушують і потім фільтрують і випаровують досуха. Залишок, який одержують, очищують флеш-хроматографією на силікагелі (елюент: дихлорметан/етанол: 98/2) з тим, щоб одержати очікуваний продукт. Стадія С: транс-1-{2-[(3,5-Дибромбензил)окси]7-метокси-1,2,3,4-тетрагідронафт-1-ил}піперазин дигідрохлорид Очікуваний продукт одержують відповідно до методики, яка описана на Стадіях В і С Прикладу 1, починаючи зі сполуки, одержаної на Стадії вище. Точка плавлення (МK): 175-182°С. Приклад 13: транс-1-{2-[(3,5Дибромбензил)окси]-6-метокси-1,2,3,4тетрагідронафт-1-ил}піперазин дигідрохлорид Стадія А: 2-Бром-6-метокси-1,2,3,4тетрагідронафт-1-ол 10,8г 7-метокси-1,2-дигідронафталену (67,4ммоль) обробляють відповідно до способу, який описаний на Стадії А Прикладу 4, з тим, щоб одержати очікуваний продукт. Стадія В: трет-Бутил транс-4-(2-гідрокси-6метокси-1,2,3,4-тетрагідронафт-1-ил)піперазин-1карбоксилат До 9,7г сполуки, одержаної на Стадії вище, (37,8ммоль), розчиненої в 150мл тетрагідрофурану, додають 3г гідриду натрію як 60% суспензію в олії (75,6ммоль, 2 еквівалентів), і потім реакційну суміш перемішують протягом 24 годин при температурі навколишнього середовища. Після фільтрування, фільтрат, який містить 5-метокси-1а,2,3,7bтетрагідронафто[1,2-b]оксирену у розчині, піддають реакції з 8,4г трет-бутил піперазин-1карбоксилату (45,3ммоль) в 20мл диметилформаміду. Тетрагідрофуран потім відганяють, і реакційну суміш згодом нагрівають при 110°С протягом 1 години. Реакційну суміш потім охолоджують перед тим, як її виливають у воду, і екстрагують дихлорметаном. Органічну фазу потім висушують, фільтрують і випаровують досуха з тим, щоб одержати залишок, який очищують флеш-хроматографією 25 на силікагелі (елюент: дихлорметан/етанол:98/2) з тим, щоб одержати очікуваний продукт. Стадія С: транс-1-{2-[(3,5-Дибромбензил)окси]6-метокси-1,2,3,4-тетрагідро-нафт-1-ил}піперазин дигідрохлорид Очікуваний продукт одержують відповідно до методики, яка описана на Стадіях В і С Прикладу 1, починаючи зі сполуки, одержаної на Стадії вище. Точка плавлення (МK): 137-150°С. ІЧ (чист.): 2708-2387, 1615-1585-1558, 1167-1 1121, 880-843-740см . Приклад 14: транс-1-{2-[(3,5Дибромбензил)окси]-5-феніл-2,3-дигідро-1Н-інден1-іл}піперазин дигідрохлорид Очікуваний продукт одержують відповідно до методики Прикладу 4, починаючи з 6-феніл-1Ніндену. Точка плавлення (МK): 145-153°С. Приклад 15: транс-1-{2-[3,5Бибромбензил)окси]-1,2,3,4-тетрагідронафт-1ил}піперазин дигідрохлорид Стадія А: транс-2-Бром-1,2,3,4тетрагідронафт-1-ол До 13,0г (100ммоль) дигідронафталену, розчиненого в суміші 100мл води і 400мл тетрагідрофурану, при температурі навколишнього середовища, додають, несподівано, 19,6г (110ммоль) Nбромсукциніміду і перемішування проводять протягом 3 годин. Потім додають 200мл льодяної води і 200мл ефіру; перемішування проводять і фази розділяють. Водну фазу екстрагують 200мл ефіру; об'єднані органічні фази потім промивають 200мл насиченого водного розчину хлориду натрію і висушують і потім випаровують з тим, щоб одержати очікувану сполуку. Стадія В: 1а,2,3,7b-Тетрагідронафто[1,2b]оксирен До 27,5г сполуки, одержаної на Стадії вище, розчиняють в 180мл тетрагідрофурану, додають краплями, протягом 5 хвилин, при температурі навколишнього середовища, розчин 10г (180ммоль) гідроксиду калію в 10мл води. Після перемішування протягом 5 днів при температурі навколишнього середовища, 200мл води додають і екстрагування проводять з етиловим ефіром. Об'єднані органічні фази промивають і потім висушують. Після випаровування, продукт, який одержують, дистилюють у вакуумі (приблизно 0,1мм Hg) в апараті Kugelrohr. Очікуваний продукція дистилюється при близько 80°С. Стадія С: трет-Бутил 4-[транс-2-гідрокси1,2,3,4-тетрагідронафт-1-ил]піперазин-1карбоксилат При температурі навколишнього середовища, 4,4г (30ммоль) сполуки, одержаної на Стадії вище, і 5,6г (30ммоль) N-третбутилоксикарбонілпіперазину в 60мл ацетонітрилу змішують разом і потім нагрівають зі зворотним холодильником протягом 40 годин. Після випаровування і флеш-хроматографії на 500г силікагелю (елюент: дихлорметан/етанол 98/2), збирають очікуваний продукт. 89619 26 Стадія D: трет-Бутил 4-{транс-2-[(3,5дибромбензил)окси]-1,2,3,4-тетрагідронафт-1ил}піперазин-1-карбоксилат При температурі навколишнього середовища до 0,44г (11ммоль) гідриду натрію як суспензію в 20мл тетрагідрофурану додають, протягом декількох хвилин, 3,3г (10ммоль) сполуки, одержаної на Стадії вище, розчиненої в 20мл тетрагідрофурану. Суміш нагрівають при 50°С протягом 2 годин і потім додають, несподівано, 3,3г (10ммоль) 3,5дибром-бензил броміду, і потім 3,7г (10ммоль) тетра-n-бутиламоній йодиду, і нагрівання проводять протягом ночі при 70°С. Суміш потім виливають в 100мл води і проводять екстрагування двома порціями, кожна по 100 мл, етилового ефіру. Об'єднані органічні фази промивають і висушують. Після випаровування і флеш-хроматографії на 300г силікагелю (елюент:дихлорметан 100%, і потім дихлорметан/етилацетат 90/10), збирають очікувану сполуку. Стадія Е: транс-1-{2-[(3,5-Дибромбензил)окси]1,2,3,4-тетрагідронафт-1-ил}піперазин дигідрохлорид Газоподібний водневий хлорид барботують через 5,8г (10ммоль) вищезазначеної сполуки, розчиненої в 400мл етилацетату, при температурі навколишнього середовища, протягом декількох хвилин. Перемішування потім проводять протягом 3 годин при температурі навколишнього середовища; суміш потім концентрують наполовину (з'являється осад) і додають 100мл ефіру; перемішування потім проводять протягом ночі при температурі навколишнього середовища. Після відфільтровування, промивання і висушування осаду, очікувану сполуку збирають у рацемічній формі. Точка плавлення (М.K.): 110-125°С. ІЧ (чист.): 2656-2445, 1586-1555, 1107-1084, -1 847-740см . Приклад 16: (-) ізомер транс-1-{2-[(3,5дибромбензил)окси]-1,2,3,4-тетрагідронафт-1ил}піперазин дигідрохлориду Після повторного перетворення в основу, рацемічну сполуку, одержану у Прикладі 15, розділяють препаративною хіральною ВЕРХ хроматографією на колонці CHIRALPAK AD (елюент: ацетонітрил/ізопропанол/діетиламін 900/100/1). Перший з ізомерів, розділених таким чином, перетворюють гідрохлоридну сіль, використовуючи етанольну НСI, і потім осаджують з ефіру. Після фільтрування, промивання і сушіння, (-) енантіомер одержують в енантіомерному надлишку більше ніж 98%. Точка плавлення (М.K.): 113-126°С. Оптичне обертання: [а]=-14,5 (с=1%, МеОН, 20°С, =589нм) Приклад 17: (+) ізомер транс-1-{2-[(3,5дибромбензил)окси]-1,2,3,4-тетрагідро-нафт-1ил}піперазин дигідрохлориду Другий з ізомерів, які розділяють у Прикладі 16, перетворюють в гідрохлорид з тим, щоб одержати очікуваний продукт. Точка плавлення (М.K.): 118-126°С. Оптичне обертання: [а]=+14,4 (с=1%, МеОН, 20°С, =589нм) 27 Приклад 18: транс-1-{2-[(3,5Дибромбензил)окси]-1,2,3,4-тетрагідронафт-1-ил}1,4-діазепан дигідрохлорид Стадія А: трет-Бутилтранс-4-[2-гідрокси1,2,3,4-тетрагідронафт-1-ил]-1,4-діазепан-1карбоксилат При температурі навколишнього середовища 3,0г (20,5ммоль) сполуки, одержаної на Стадії В Прикладу 15, і 4,1г (20,5ммоль) N-третбутилоксикарбоніл-гомопіперазину в 41мл ацетонітрилу змішують разом і потім нагрівають зі зворотним холодильником протягом 48 годин. Після випаровування і флеш-хроматографії на 300г силікагелю (елюент: дихлорметан/етанол 98/2), збирають очікувану сполуку. Стадія В: трет-Бутил транс-4-{2-[(3,5дибромбензил)окси]-1,2,3,4-тетрагідронафт-1-ил}1,4-діазепан-1-карбоксилат При температурі навколишнього середовища до 0,76г (19ммоль) гідриду натрію як суспензію в 20мл додають тетрагідрофуран, протягом декількох хвилин, 6,0г (17,3ммоль) сполуки, одержаної на Стадії вище, розчиненої в 50мл тетрагідрофурану. Суміш нагрівають при 50°С протягом 2 годин і потім додають, несподівано, 5,7г (17,3ммоль) 3,5дибромбензил броміду, і потім 6,4г (17,3ммоль) тетра-n-бутиламоній йодиду, і нагрівання проводять протягом ночі при 70°С. Суміш потім виливають в 200мл води і екстрагують етиловим ефіром. Об'єднані органічні фази промивають і висушують. Після випаровування і флеш-хроматографії на 500г силікагелю (елюент: дихлорметан 100%, потім дихлорметан/етилацетат 95/5 і потім дихлорметан/етанол 95/5), збирають очікувану сполуку. Стадія С: транс-1-{2-[(3,5-Дибромбензил)окси]1,2,3,4-тетрагідронафт-1-ил}-1,4-діазепан дигідрохлорид Газоподібний водневий хлорид обережно барботують через 4,9г (8,2ммоль) сполуки, одержаної на Стадії вище, розчиненої в 250мл етилацетату, при температурі навколишнього середовища, протягом декількох хвилин. Перемішування проводять протягом ночі при температурі навколишнього середовища; суміш потім концентрують наполовину (з'являється осад) і перемішуванням проводять протягом наступних 2 годин. Після відфільтровування, промивання і висушування осаду, очікувану сполуку збирають у рацемічній формі. Точка плавлення (М.K.): 112-118°С. Приклад 19: (-) ізомер транс-1-{2-[(3,5дибромбензил)окси]-1,2,3,4-тетра-гідронафт-1-ил}1,4-діазепан дигідрохлорид Після повторного перетворення в основу, рацемічну сполуку, одержану у Прикладі 18, розділяють препаративною хіральною ВЕРХ хроматографією на колонці CHIRALPAK AD (елюент: метанол/діетиламін 1000/1). Перший з ізомерів, розділених таким чином, перетворюють на гідрохлоридну сіль, використовуючи етанольну НСI. Після фільтрування, промивання і сушіння, (-) енантіомер одержують в енантіомерному надлишку більше ніж 98%. Точка плавлення (М.K.): 122-126°С. ІЧ (чист.): 2622-2475,1589-1555,1107-1081,847740см-1. 89619 28 Приклад 20: (+) ізомер транс-1-{2-[(3,5дибромбензил)окси]-1,2,3,4-тетра-гідронафт-1-ил} -1,4-діазепан дигідрохлориду Другий з ізомерів, які розділяють у Прикладі 19, перетворюють у гідрохлорид, з тим, щоб одержати очікуваний продукт. Точка плавлення (М.K.): 119-140°С. Приклад 21: 1-{(1S,2R)-2-[(3,5Бибромбензил)окси]-2,3-дигідро-1Н-інден-1іл}піперазин дигідрохлорид Стадія А: (1S,2R)-1-{4-[(4Метилфеніл)сульфоніл]піперазин-1-іл}індан-2-ол До 8г (1S,2R)-1-аміноіндан-2-ол (53,6ммоль), розчиненого в 80мл диметил-формаміду, додають 15мл триетиламін (107,2ммоль) і 15,8г N,N-біс(2хлоретил)-р-толуолсульфонаміду (53,6ммоль). Суміш нагрівають при 80°С протягом 24 годин і потім випаровують диметилформамід. Залишок додають в дихлорметан, промивають, висушують, фільтрують і випаровують. Олію, яку одержують, очищують флеш-хроматографією на силікагелі (елюент: дихлорметан/етилацетат 95/5) з тим, щоб одержати очікуваний продукт у формі меренги. Стадія В: 1-{(1S,2R)-2-[(3,5Дибромбензил)окси]-2,3-дигідро-1Н-інден-1-іл}-4[(4-метилфеніл)сульфоніл]піперазин Очікуваний продукт одержують відповідно до методики, яка описана на Стадії В Прикладу 1, починаючи зі сполуки, одержаної на Стадії вище. Стадія С: 1-{(1S,2R)-2-[(3,5Дибромбензил)окси]-2,3-дигідро-1Н-інден-1іл}піперазин 1,1г сполуки, одержаної на Стадії вище, (1,77ммоль), нагрівають протягом 2 годин при 90°С у присутності 10мл розчину HBr/оцтова кислота (33%) і 808мг 4-гідроксибензойної кислоти (5,85ммоль). Охолодження проводять і NaOH (20%) додають до досягнення рН=10; потім проводять екстрагування дихлорметаном, висушування, фільтрування і випаровування. Олію, яку одержують, очищують флеш-хроматографією на 100г силікагелю (елюент: дихлорметан/етанол/аміак 90/10/1) з тим, щоб одержати очікуваний продукт у формі безбарвної олії. Стадія D: 1-{(1S,2R)-2-[(3,5Дибромбензил)окси]-2,3-дигідро-1Н-інден-1іл}піперазин дигідрохлорид До 1,2г сполуки, одержаної на Стадії вище, (2,57ммоль), розчиненої в етилацетаті, додають, при температурі навколишнього середовища, 2М розчин хлористоводневої кислоти в ефірі. Суміш перемішують протягом 30 хвилин і потім випаровують досуха. Залишок кристалізують з етилацетату, фільтрують : висушують з тим, щоб одержати очікуваний продукт (цис сполука) у формі кристалів білого кольору. Точка плавлення (МK): 162-176° Оптичне обертання [а]=-2,9 (с=1%, МеОН, 20°С, =589нм) ІЧ (чист.): 2663-2446,1585-1556,1104, 851740см-1. Приклад 22: 1-{(1R,2S)-2-[(3,5Дибромбензил)окси]-2,3-дигідро-1Н-інден-1іл}піперазин дигідрохлорид 29 Очікуваний продукт одержують відповідно до методики, яка описана у Прикладі 21, починаючи з (1R,2S)-1-аміноіндан-2-олу. Точка плавлення (МK): 142-150°С. Оптичне обертання [а]=+5,8 (с=1%, МеОН, 20°С, =589нм) Приклад 23: як 1-{4-[(3,5-Дибромбензил)окси]2,3,4,5-тетрагідро-1-бензоксепін-5-іл}піперазин дигідрохлорид Стадія А: трет-Бутил 4-(4-оксо-2,3,4,5тетрагідро-1-бензоксепін-5-іл)піперазин-1карбоксилат При 78°С, 0,88мл оксаліл хлориду (10ммоль) виливають в 25мл дихлорметану і потім, при цій же температурі, повільно додають 1,02мл диметил сульфоксиду (14,3ммоль). Перемішування проводять протягом 10 хвилин при -78°С. 2,5г (7,17ммоль) сполуки, одержаної на Стадії В Прикладу 8, розчиненої в 15мл дихлорметану, виливають в реакційну суміш. Перемішування проводять протягом 15 хвилин в -78°С і потім додають, протягом 20 хвилин, 5мл (35,9ммоль) триетиламіну. Суміші потім дають повернутись до 0°С і реакційну суміш потім виливають в 100мл льодяної води. Проводять екстрагування дихлорметаном, висушування, фільтрування і випаровування досуха з тим, щоб одержати очікуваний продукт у формі олії. Стадія В: трет-Бутил цис-4-(4-гідрокси-2,3,4,5тетрагідро-1-бензоксепін-5-іл)піперазин-1карбоксилат До 2,4г (6,93ммоль) сполуки, одержаної на Стадії вище, розчиненої в 50мл метанолу, додають, при 0°С і порціями, 130 MrNaBtH4 (3,5ммоль, 0,5 еквівалента). Перемішування проводять протягом 1 години при 0°С і метанол потім випаровують. Одержаний залишок додають в толуолі, промивають, висушують, фільтрують і випаровують. Залишок, який одержують, очищують флешхроматографією на силікагелі (елюент: толуол/етанол 95/5) з тим, щоб одержати очікуваний продукт у формі олії. Стадія С: цис-1-{4-[(3,5-Дибромбензил)окси]2,3,4,5-тетрагідро-1-бензоксепін-5-іл}піперазин дигідрохлорид Очікуваний продукт одержують відповідно до методики, яка описана на Стадіях В і С Прикладу 1, починаючи зі сполуки, одержаної на Стадії вище. Точка плавлення (МK): 166-191°С. Приклад 24: цис-1-[2-((3,5-Дибромбензилокси)1,2,3,4-тетрагідронафт-1-ил}піперазин дигідрохлорид Очікуваний продукт одержують відповідно до методики, яка описана у Прикладі 23, починаючи зі сполуки, одержаної на Стадії С Прикладу 15. Точка прикладу (МK): 155-159°С. Приклад 25: цис-1-{6-[(3,5Дибромбензил)окси]-6,7,8,9-тетаргідро-5Н-бензо[7]анулен-5-іл}піперазин дигідрохлорид Стадія А: трет-Бутил 4-(6-оксо-6,7,8,9тетрагідро-5Н-бензо[7]анулен-5-іл)піперазин-1карбоксилат До 4,4г (12,6ммоль) сполуки, одержаної на Стадії А Прикладу 7, розчиненої в 44мл диметил 89619 30 сульфоксиду, додають, при температурі навколишнього середовища, 8,8г стабілізованої 2йодоксибензойної кислоти (SIBX) (56,3ммоль, 4,4 еквівалентів). Перемішування проводять протягом 2 годин при 25°С, і суміш потім виливають у воду. Нерозчинний матеріал, який одержують, відфільтровують. Фільтрат екстрагують етилацетатом, висушують, фільтрують і випаровують досуха. Залишок, який одержують, очищують флешхроматографією на силікагелі (елюент: дихлорметан/етилацетат 95/5) з тим, щоб одержати очікуваний продукт. Точка плавлення (ВR): 85-95°С. Стадія В: трет-Бутил 4-(6-гідрокси-6,7,8,9тетрагідро-5Н-бензо[7]анулен-5-іл)піперазин-1карбоксилат 1,5г (4,3ммоль) сполуки, одержаної на Стадії вище, обробляють відповідно до способу, який описаний на Стадії В Прикладу 23. Жовта олія, яку одержують, очищують флеш-хроматографією на силікагелі (елюент: дихлорметан/етилацетат 95/5) з тим, щоб одержати очікуваний продукт у формі цис/транс суміші (цис/транс співвідношення =80/20). Стадія С: трет-Бутил цис-4-{6-[(3,5дибромбензил)окси]-6,7,8,9-тетрагідро-5Н-бензо[7]анулен-5-іл}піперазин-1-карбоксилат 650мг сполуки, одержаної на Стадії вище, (цис/транс=80/20) (1,87ммоль) обробляють відповідно до способу, який описаний на Стадії В Прикладу 1, з тим, щоб одержати олію, яку очищують флеш-хроматографією на силікагелі (елюент: ацетат циклогексан/етилу 95/5) з тим, щоб одержати очікуваний продукт. Стадія D: цис-1-{6-[(3,5-Дибромбензил)окси]6,7,8,9-тетрагідро-5Н-бензо[7]-анулен-5іл}піперазин дигідрохлорид 350мг сполуки, одержаної на Стадії вище, (0,58ммоль) обробляють відповідно до способу, який описаний на Стадії С Прикладу 1, і потім продукт, який одержують, кристалізують з ізопропілового ефіру з тим, щоб одержати очікуваний продукт у формі кристалів білого кольору. Точка плавлення (МK): 149-158°С. Приклад 26: транс-3-[(3,5-Дибромбензил)окси]4-піперазин-1-ілхроман-6-карбонітрил дигідрохлорид Стадія А: 6-Бром-1а,7b-дигідро-2Ноксирено[с]хромен 8,5г 6-бром-2Н-хромену (40,3ммоль), одержаного відповідно до способу синтезу, який описаний у J. Org. Chem., 1998, 63, 864, обробляють відповідно до способу, який описаний на Стадії А Прикладу 8, з тим, щоб одержати очікуваний продукт у формі олії. Стадія В: трет-Бутил транс-4-(6-бром-3гідрокси-3,4-дигідро-2Н-хромен-4-іл)-піперазин-1карбоксилат 7.6г сполуки, одержаної на Стадії вище, (33,5ммоль) обробляють відповідно до способу, який описаний на Стадії А Прикладу 1. Залишок, який одержують, очищують флеш-хроматографією на силікагелі (елюент: толуол/етанол 95/5) з тим, щоб одержати очікуваний продукт у формі олії. 31 Стадія С: трет-Бутил транс-4-(6-ціано-3гідрокси-3,4-дигідро-2Н-хромен-4-іл)піперазин-1карбоксилат 1г сполуки, одержаної на Стадії вище, (2,4ммоль) розчиняють в 10мл диметилформаміду. Розчин дегазують, використовуючи аргон, і потім додають 112мг тетракис(трифенілфосфін)паладію(0) (0,09ммоль) і 170мг ціаніду цинку (1,4ммоль). Нагрівання проводять при 80°С протягом 3 днів. Реакційну суміш потім охолоджують і виливають у воду. Суміш екстрагують етилацетатом, промивають водою, висушують, фільтрують і випаровують досуха. Залишок, який одержують, очищують флешхроматографією на силікагелі (елюент: дихлорметан/етилацетат 90/10) з тим, щоб одержати очікуваний продукт у формі олії. Стадія D: транс-3-[(3,5-Дибромбензил)окси]-4піперазин-1-ілхроман-6-карбонітрил дигідрохлорид Очікуваний продукт одержують відповідно до методики, яка описана на Стадіях В і С Прикладу 1, починаючи зі сполуки, одержаної на Стадії вище. Точка плавлення (МK): 185-200°С. Приклад 27: транс-7-[(3,5-Дибромбензил)окси]8-піперазин-1-іл-5,6,7,8-тетрагідронафтален-2карбонітрил дигідрохлорид Стадія А: 6-Бром-1а,2,3,7bтетрагідронафто[1,2-b]оксирен 7.4г сполуки Приготування А (35ммоль) обробляють Охоnе® відповідно до способу, який описаний на Стадії А Прикладу 8, з тим, щоб одержати очікуваний продукт у формі олії. Стадія В: трет-Бутил транс-4-(7-бром-2гідрокси-1,2,3,4-тетрагідронафт-1-ил)піперазин-1карбоксилат 6,5г трет-бутил піперазин-1-карбоксилату (35ммоль) і 7,9г сполуки, одержаної на Стадії вище, (35ммоль) розчиняють в 45мл диметилформаміду, і реакційну суміш потім нагрівають при 110°С протягом 24 годин. Після випаровування досуха одержують залишок, який очищують флешхроматографією на силікагелі (елюент: толуол/етанол 98/2) з тим, щоб одержати очікуваний продукт у формі олії. Стадія С: трет-Бутил транс-4-(7-ціано-2гідрокси-1,2,3,4-тетрагідронафт-1-ил)піперазин-1карбоксилат 4г сполуки, одержаної на Стадії вище, (9,7ммоль), обробляють відповідно до способу, який описаний на Стадії С Прикладу 26. Нагрівання проводять при 80°С протягом 2 годин. Реакційну суміш потім охолоджують і виливають у воду. Суміш екстрагують дихлорметаном, промивають водою, висушують, фільтрують і випаровують досуха. Залишок, який одержують, очищують флешхроматографією на силікагелі (елюент: дихлорметан/етанол 98/2) з тим, щоб одержати очікуваний продукт у формі олії. Стадія D: транс-7-[(3,5-Дибромбензил)окси]-8піперазин-1-іл-5,6,7,8-тетрагідро-нафтален-2карбонітрил дигідрохлорид Очікуваний продукт одержують відповідно до методики, яка описана на Стадіях В і С Прикладу 89619 32 1, починаючи зі сполуки, одержаної на Стадії вище. Точка плавлення (МK): 169-191°С. Приклад 28: транс-4-[(3,5-Дибромбензил)окси]5-піперазин-1-іл-2,3,4,5-тетрагідро-1-бензоксепін7-карбонітрил дигідрохлорид Стадія А: 7-Бром-1а,2,3,8bтетрагідрооксирено[d][1]бензоксепін 4г сполуки Приготування В обробляють Охоnе® відповідно до способу, який описаний на Стадії А Прикладу 8, з тим, щоб одержати очікуваний продукт у формі олії. Стадія В: трет-Бутил транс-4-(7-бром-4гідрокси-2,3,4,5-тетрагідро-1-бензоксепін-5іл)піперазин-1-карбоксилат 3,9г сполуки, одержаної на Стадії вище, (16,2ммоль) обробляють відповідно до способу, який описаний на Стадії А Прикладу 1. Нагрівання продовжується протягом подальших 3 днів. Таким чином одержують залишок, яка очищують флешхроматографією на силікагелі (елюент: дихлорметан/етанол 98/2) з тим, щоб одержати очікуваний продукт у формі олії. Стадія С: трет-Бутил транс-4-(7-ціано-4гідрокси-2,3,4,5-тетрагідро-1-бензоксепін-5іл)піперазин-1-карбоксилат 5,8г сполуки, одержаної на Стадії вище, (13,6ммоль) обробляють відповідно до способу, який описаний на Стадії С Прикладу 26. Нагрівання проводять при 80°С протягом 20 годин. Реакційну суміш потім охолоджують і виливають у воду. Суміш екстрагують дихлорметаном, промивають водою, висушують, фільтрують і випаровують досуха. Залишок, який одержують, очищують флеш-хроматографією на силікагелі (елюент: толуол/етанол 95/5) з тим, щоб одержати очікуваний продукт у формі олії. Стадія D: транс-4-[(3,5-Дибромбензил)окси]-5піперазин-1-іл-2,3,4,5-тетрагідро-1-бензоксепін-7карбонітрил дигідрохлорид Очікуваний продукт одержують відповідно до методики, яка описана на Стадіях В і С Прикладу 1, починаючи зі сполуки, одержаної на Стадії вище. Точка плавлення (МK): 163-195°С. Приклад 29: транс-5-[(4-{2-[(3,5Дибромбензил)окси]-2,3-дигідро-1H-інден-1іл}піперазин-1-іл)метил]-2,4-дигідро-3Н-1,2,4триазол-3-он дигідрохлорид Стадія А: транс-5-[(4-{2-[(3,5Дибромбензил)окси]-2,3-дигідро-1Н-інден-1іл}піперазин-1-іл)метил]-2,4-дигідро-3H-1,2,4триазол-3-он Після повторного перетворення в основу, сполуку, одержану на Стадії С Прикладу 1, (2,14ммоль) розчиняють в 30мл диметилформаміду. Додають 0,75мл (4,28ммоль) діізопропілетиламіну і 314мг (2,35ммоль) 5-(хлорметил)-2,4дигідро-3H-1,2,4-триазол-3-ону, одержаного відповідно до способу, який описаний в Tetrahedron Letters, 2000, 41, 8661. Суміш перемішують протягом 12 годин при температурі навколишнього середовища і потім випаровують досуха. Одержаний залишок додають в дихлорметан, промивають, висушують, фільтрують і випаровують. Олію, яку 33 одержують, очищують флеш-хроматографією на силікагелі з тим, щоб одержати очікуваний продукт. Стадія В: транс-5-[(4-{2-[(3,5Дибромбензил)окси]-2,3-дигідро-1Н-інден-1іл}піперазин-1-іл)метил]-2,4-дигідро-3H-1,2,4триазол-3-он дигідрохлорид 800мг сполуки, одержаної на Стадії вище, (1,42ммоль) розчиняють в 50мл етилацетату. Потім додають 2,8мл (5,68ммоль) 2М розчину хлористоводневої кислоти в ефірі. Після перемішування протягом 30 хвилин при температурі навколишнього середовища суміш випаровують досуха і залишок кристалізують з ацетонітрилу з тим, щоб одержати очікуваний продукт. Точка плавлення (МK): 198-202°С. Приклад 30: транс-1-{2-[(3,5Дибромбензил)окси]-2,3-дигідро-1Н-інден-1-іл}-4[(2S)-2,3-дигідро-1,4-бензодіоксин-2ілметил]піперазин дигідрохлорид Стадія A: трет-Бутил 4-[(2R)-2,3-дигідро-1,4бензодіоксин-2-ілкарбоніл]піперазин-1карбоксилат 5г (2R)-2,3-дигідро-1,4-бензодіоксин-2карбонової кислоти (27,8ммоль) розчиняють в 300мл ацетонітрилу. Додають 6г N,N'дициклогексилкарбодііміду (29,1ммоль) і потім 4,1г 1-гідроксибензотриазолу (30,6ммоль). Нарешті додають 6,2г трет-бутил піперазин-1-карбоксилату (33,4ммоль) і перемішування проводять протягом 12 годин при температурі навколишнього середовища. Реакційну суміш згодом фільтрують і фільтрат потім випаровують досуха. Олію, яку таким чином одержують, очищують флешхроматографією на силікагелі (елюент: толуолу/етилацетат 80/20) з тим, щоб одержати очікуваний продукт у формі олії. Стадія В: трет-Бутил 4-[(2S)-2,3-дигідро-1,4бензодіоксин-2-ілметил]-піперазин-1-карбоксилат 500мг сполуки, одержаної на Стадії вище, (1,44ммоль) розчиняють в 5мл безводного тетрагідрофурану. Потім додають краплями, при температурі навколишнього середовища, 4,4мл (4,3ммоль) 1М розчину борану в тетрагідрофурані. Суміш нагрівають зі зворотним холодильником протягом 2 годин, охолоджують, гідролізують повільно, використовуючи 5мл етанолу, і випаровують досуха. Одержаний залишок кристалізують з води, фільтрують і висушують з тим, щоб одержати очікуваний продукт. Точка плавлення (ВK)=97-99°С. Стадія С: 1-[(2S)-2,3-Дигідро-1,4-бензодіоксин2-ілметил]піперазин дигідрохлорид 7,5г сполуки, одержаної на Стадії вище, (22,4ммоль) перемішують протягом 2 днів, при температурі навколишнього середовища, у присутності 100мл 2,6 N розчину хлористоводневої кислоти в етанолі. Утворені кристалі відфільтровують і висушують з тим, щоб одержати очікуваний продукт у формі твердої білизни. Точка плавлення (ВK)=166-172°С. Стадія D: транс 1-{4-[(2S)-2,3-Дигідро-1,4бензодіоксин-2-ілметил]піперазин-1-іл}індан-2-ол До 1,6г (6,8ммоль) 1-[(2S)-2,3-дигідро-1,4бензодіоксин-2-ілметил]піперазин, одержаної за 89619 34 допомогою повторного перетворення сполуки вищезазначеної Стадії в основу, розчиненої в 10мл ацетонітрилу, додають 1,08г інден оксиду (8,16ммоль). Реакційну суміш нагрівають при 80°С протягом 30 годин і потім випаровують досуха. Олію, яку таким чином одержують, очищують флеш-хроматографією на силікагелі (елюент: дихлорметан/етанол/аміак 90/10/1) з тим, щоб одержати очікувану сполуку у формі меренги. Стадія Е: транс-1-{2-[(3,5-Дибромбензил)окси]2,3-дигідро-1Н-інден-1-іл}-4-[(2S)-2,3-дигідро-1,4бензодіоксин-2-ілметил]піперазин Очікуваний продукт одержують відповідно до методики, яка описана на Стадії В Прикладу 1, починаючи зі сполуки, одержаної на Стадії вище. Стадія F: транс-1-{2-[(3,5-Дибромбензил)окси]2,3-Дигідро-1H-інден-1-іл}-4-[(2S)-2,3-Дигідро-1,4бензодіоксин-2-ілметил]піперазин дигідрохлорид До 210мг сполуки, одержаної на Стадії вище, (0,34ммоль), розчиненої в 20мл етилацетату, додають, при температурі навколишнього середовища, 0,5мл (1ммоль) 2М розчину хлористоводневої кислоти в ефірі. Після перемішування протягом 30 хвилин реакційну суміш випаровують досуха. Одержаний залишок кристалізують з етилацетату, фільтрують і висушують з тим, щоб одержати очікуваний продукт у формі кристалів білого кольору. Точка плавлення (МK): 137-145°С. Приклад 31: (+)-цис-1-{(1S,2R)-2-[(3,5Бибромбензил)окси]-2,3-дигідро-1Н-інден-1-іл}-4(піридин-2-ілкарбоніл)піперазин дигідрохлорид Стадія А: цис-1-{(1S,2R)-2-[(3,5Дибромбензил)окси]-2,3-дигідро-1Н-інден-1-іл}-4(піридин-2-ілкарбоніл)піперазин До 263мг піридин-2-карбонової кислоти (2,14ммоль), розчиненої в 10мл тетрагідрофурану, додають 382мг карбонілдіімідазолу (2,35ммоль, 1,1 еквівалентів) і потім, після перемішування протягом 3 годин при температурі навколишнього середовища, розчин 1г (2,14ммоль) сполуки, одержаної на Стадії С Прикладу 21 в 20мл тетрагідрофурану. Проводять перемішування протягом 12 годин при 25°С і потім додавання води, екстрагування дихлорметаном, сушіння, фільтрування і випаровування досуха. Олію, яку одержують, очищують флеш-хроматографією на силікагелі (елюент: дихлорметан/етанол 95/5) з тим, щоб одержати очікуваний продукт у формі олії. Стадія В: цис-1-{(1S,2R)-2-[(3,5Дибромбензил)окси]-2,3-дигідро-1Н-інден-1-іл}-4(піридин-2-ілкарбоніл)піперазин дигідрохлорид 900мг сполуки, одержаної на Стадії вище, (1,57ммоль) обробляють відповідно до способу, який описаний на Стадії F Прикладу 30. Одержану тверду речовину відфільтровують і висушують з тим, щоб одержати очікуваний продукт у формі кристалів білого кольору. Точка плавлення (МK): 108-122°С. Оптичне обертання: [а]=+27,3 (с=1%, метанол, 20°С, =589нм) Приклад 32: 1-(транс-2-{1-[3,5Біс(трифторметил)феніл]етокси}-1,2,3,4тетрагідронафт-1-ил)піперазин дигідрохлорид, діастереоізомер 1 35 Стадія А: трет-Бутил 4-(транс-2-{[3,5біс(трифторметил)бензоїл]окси}-1,2,3,4тетрагідронафт-1-ил)піперазин-1-карбоксилат До 11,7г (35,2ммоль) сполуки, одержаної на Стадії С Прикладу 15, і 5,9мл (42,2ммоль) триетиламіну, розчиненого в 300мл дихлорметану, додають, при температурі навколишнього середовища, 7,05мл (38,7ммоль) біс(трифторметил)бензоїл хлориду в 50мл дихлорметану, краплями протягом 1 години 10 хвилин, і потім 0,5г диметиламінопіридину. Реакційну суміш потім нагрівають зі зворотним холодильником протягом 5 днів, і потім наступні 1,3мл кислотного хлориду додають і нагрівання зі зворотним холодильником продовжують протягом 20 годин. Після випаровування середовища, залишок, який одержують, фільтрують над 200г силікагелю (елюент: дихлорметан) з тим, щоб одержати очікуваний продукт. Стадія В: трет-Бутил 4-[транс-2-({1-[3,5біс(трифторметил)феніл]вініл}окси)-1,2,3,4тетрагідронафт-1-ил]піперазин-1-карбоксилат До 13,2г (23ммоль) сполуки, одержаної на Стадії вище, в 92мл тетрагідрофурану додають, при температурі навколишнього середовища, 46мл 2М розчину дициклопентадієнілдиметилтитану в толуолі, і реакційну суміш нагрівають при 85°С протягом 20 годин. Наступні 23мл 2М розчину дициклопентадієнілдиметилтитану в толуолі додають, краплями, при 85°С протягом 10 хвилин, і потім нагрівання при цій же температурі продовжують протягом наступних 24 годин. Суміші дають охолонути, додають 500мл пентану; суміш фільтрують над целітом і промивають пентаном, доки фільтрат не стане безбарвним. Після випаровування всіх об'єднаних фільтратів і флешхроматографії на 800г силікагелю (елюент: дихлорметан, і потім дихлорметан/етилацетат 98/2), одержують очікуваний продукт. Стадія С: трет-Бутил 4-(транс-2-{1-[3,5біс(трифторметил)феніл]етокси}-1,2,3,4тетрагідронафт-1-ил)піперазин-1-карбоксилат 8,34г (14,6ммоль) сполуки, одержаної на Стадії вище, розчиненої в 150мл етанолу, гідрогенізують при температурі навколишнього середовища і атмосферному тиску протягом 7 годин у присутності 1г 5% паладію-на-вуглеці. Після фільтрування над целітом, промивання етанолом і випаровування, очікуваний продукт одержують у формі суміші діастереоізомерів, що не піддається кількісному визначенню і розділенню. Стадія D: 1-(транс-2-{1-[3,5Біс(трифторметил)феніл]етокси}-1,2,3,4тетрагідронафт-1-ил)піперазин дигідрохлорид, діастереоізомер 1 Газоподібний водневий хлорид обережно барботують через 8,4г (14,6ммоль) сполуки, одержаної на Стадії вище, розчиненої в 500мл етилацетату, при температурі навколишнього середовища протягом декількох хвилин. Проводять перемішування протягом ночі при температурі навколишнього середовища і потім випаровування досуха. Залишок розчиняють в 100мл води і, при сильному перемішуванні, перетворюють в основу, використовуючи 8г карбонату натрію. Паста, яку осаджують, екстрагують двічі, використовуючи 100мл ди 89619 36 хлорметану кожного разу. Об'єднані органічні фази висушують і концентрують, і одержаний залишок хроматографують на 700г силікагелю (елюент: дихлорметан/етанол/аміак 95/5/0,5) з тим, щоб одержати перший діастереоізомер, який перетворюють в дигідрохлорид дією ефірної НСI. Після кристалізації з пентану одержують очікуваний продукт. Точка плавлення (М.K.): 98-102°С. Приклад 33: 1-(транс-2-{1-[3,5Біс(трифторметил)феніл]етокси}-1,2,3,4тетрагідронафт-1-ил)піперазин дигідрохлорид, діастереоізомер 2 Другий продукт, елюйований на Стадії D Прикладу 32, дає другий діастереоізомер, який перетворюють в дигідрохлорид. Точка плавлення (М.K.): 98-101°С. Приклад 34: 1-[(1S,2R)-2-Бензилокси-2,3дигідро-1H-інден-1-іл]піперазин дигідрохлорид Очікуваний продукт (цис сполука) одержують відповідно до методики Прикладу 21, замінюючи 3,5-дибромбензил бромід на Стадії В на бензил бромід. Точка плавлення: 104-125°С. Приклад 35: транс-1-{2-[(3,5Диметилбензил)окси]-2,3-дигідро-1Н-інден-1іл}піперазин дигідрохлорид Очікуваний продукт одержують відповідно до методики, яка описана на Стадіях D і Е Прикладу 15, починаючи зі сполуки, одержаної на Стадії А Прикладу 1 і 3,5-диметилбензил броміду. Точка плавлення: 161-70°С. Приклад 36: 1-[(1S,2R)-2-[(3,5Дифторбензил)окси]-2,3-дигідро-1H-інден-1-іл] піперазин дигідрохлорид Очікуваний продукт (цис сполука) одержують відповідно до методики Прикладу 21, замінюючи 3,5-дибромбензил бромід на Стадії В на 3,5дифторбензил бромід. Точка плавлення: 160-190°С. ІЧ (чист.): 2699-2451,1619-1599,1094,860770см-1. Приклад 37: 1-[(1S,2R)-2-Бензилокси-2,3дигідро-1Н-інден-1-іл]-4-метил-піперазин дигідрохлорид Очікуваний продукт одержують Nметилуванням сполуки Прикладу 34. Точка плавлення: 182-189°С. Приклад 38: 1-[(1S,2R)-2-[(3,5Диметилбензил)окси]-2,3-Дигідро-1Н-інден-1іл]піперазин дигідрохлорид Стадія А: 1-{(1S,2R)-2-[(3,5Диметилбензил)окси]-2,3-дигідро-1Н-інден-1-іл}-4[(4-метилфеніл)сульфоніл]піперазин Очікуваний продукт одержують відповідно до методики, яка описана на Стадіях А і В Прикладу 21, замінюючи 3,5-дибромбензил бромід на Стадії В на 3,5-диметилбензил бромід. Стадія В: 1-{(1S,2R)-2-[(3,5Диметилбензил)окси]-2,3-дигідро-1Н-інден-1іл}піперазин 3г натрію (130ммоль) додають до розчину 3,6г нафталіну (28ммоль) в 30мл 1,2-диметоксіетані. Реакційну суміш перемішують при температурі навколишнього середовища протягом 2 годин, 37 щоб утворити розчин натрій/нафталін/1,2диметоксіетану. 14,8мл (64ммоль) одержаний розчин додають, при температурі -70°С, до розчину 3г (6,1ммоль) сполуки, одержаної на Стадії вище, в 55мл 1,2-диметоксіетану. Колір розчину змінюється від білого до голубого. Перемішування проводять протягом 30 хвилин при -70°С, з наступним гідролізом, використовуючи 100мл води. Суміш потім екстрагують етилацетатом, висушують, фільтрують і випаровують досуха. Залишок, який одержують, очищують флеш-хроматографією на 200г силікагелю (елюент: дихлорметан/етанол/аміак 90/10/1) з тим, щоб одержати очікуваний продукт у формі олії. Стадія С: 1-{(1S,2R)-2-[(3,5Диметилбензил)окси]-2,3-дигідро-1Н-інден-1іл}піперазин дигідрохлорид 3,6мл (7,16ммоль, 2 еквівалентів) 2М розчин ефірного водневого хлориду додають до 1,2г (3,58ммоль) сполуки, одержаної на Стадії вище, в 50мл ацетонітрилу. Кристалізацію ініціюють за допомогою шкрябання, і потім перемішування проводять протягом 15 хвилин при температурі навколишнього середовища. Одержані білі кристали висушують з тим, щоб одержати очікуваний продукт. Точка плавлення: 170-193°С. ІЧ (чист): 2705-2468, 1164-1101, 854-767см-1. Приклад 39: транс-1-{2-[(3,Дифторбензил)окси]-2,3-дигідро-1Н-інден-1іл}піперазин дигідрохлорид Очікуваний продукт одержують відповідно до методики Прикладу 1, замінюючи 3,5дибромбензил бромід на Стадії В на 3,5дифторбензил бромід. Точка плавлення: 185-198°С. Приклад 40: транс-1-(2-{[3,5Біс(трифторметил)бензил]окси}-2,3-дигідро-1Нінден-1-іл)піперазин дигідрохлорид Очікуваний продукт одержують відповідно до методики Прикладу 1, замінюючи 3,5дибромбензил бромід на Стадії В на 3,5біс(трифторметил)бензил бромід. Точка плавлення: 140-160°С. -1 ІЧ (чист.): 2652-2441, 1168-1121, 756-706см . Приклад 41: транс-1-{2-[(3,5Дибромбензил)окси]-6-метокси-2,3-дигідро-1Нінден-1-іл}піперазин дигідрохлорид Очікуваний продукт одержують відповідно до методики Прикладу 4, замінюючи 2Н-хромен на Стадії А на 5-метокси-1Н-інден. Точка плавлення: 184-195°С. Приклад 42: транс-1-{2-[(3,5Дихлорбензил)окси]-6-метокси-2,3-дигідро-1Нінден-1-іл}піперазин дигідрохлорид Очікуваний продукт одержують відповідно до методики Прикладу 4, починаючи з 5-метокси-1Ніндену і 3,5-дихлорбензил броміду. Точка плавлення: 169-176°С. ІЧ (чист.): 2669-2651-2451, 1612-1592-1572, -1 1104-1084, 827-790см . Приклад 43: транс-1-{2-[(3,5Дихлорбензил)окси]-2,3-дигідро-1H-інден-1іл}піперазин дигідрохлорид 89619 38 Очікуваний продукт одержують відповідно до методики Прикладу 1, замінюючи 3,5дибромбензил бромід на Стадії В на 3,5дихлорбензил бромід. Точка плавлення: 115-127°С. Приклад 44: транс-1-(3-[(3,5Дихлорбензил)окси]-3,4-дигідро-2Н-хромен-4іл}піперазин дигідрохлорид Очікуваний продукт одержують відповідно до методики Прикладу 4, замінюючи 3,5дибромбензил бромід на Стадії D на 3,5дихлорбензил бромід. Точка плавлення: 110-118°С. ІЧ (чист.): 2712-2455, 1609-1586-1572, 1231-1 1104, 850-797-760см . Приклад 45: транс-1-{2-[(3,5Біс(трифторметил)бензил)окси]-1,2,3,4-тетрагідронафт-1-ил}піперазин дигідрохлорид Очікуваний продукт одержують відповідно до методики Прикладу 15, замінюючи 3,5дибромбензил бромід на Стадії D на 3,5біс(трифторметил)бензил бромід. Точка плавлення (МK): 98-101°С. Приклад 46: транс-1-{3-[3-Фтор-5(трифторметил)бензилокси]-3,4-дигідро-2Нхромен-4-іл}піперазин дигідрохлорид Очікуваний продукт одержують відповідно до методики Прикладу 4, замінюючи 3,5дибромбензил бромід на Стадії D на 3-фтор-5(трифторметил)бензил бромід. Точка плавлення: 102-113°С. Приклад 47: транс-1-{3-(3-Хлор-5фторбензилокси)-3,4-дигідро-2Н-хромен-4іл}піперазин дигідрохлорид Стадія А: трет-Бутил транс-4-{3-[(3-хлор-5фторбензил)окси]-3,4-дигідро-2Н-хромен-4іл}піперазин-1-карбоксилат Очікуваний продукт одержують відповідно до методики, яка описана на Стадіях A-D Прикладу 4, замінюючи 3,5-дибромбензил бромід на Стадії D на 3-хлор-5-фторбензил бромід. Стадія В: транс-1-{3-(3-Хлор-5фторбензилокси)-3,4-дигідро-2Н-хромен-4іл}піперазин дигідрохлорид Очікуваний продукт одержують відповідно до методики, яка описана на Стадії С Прикладу 1, починаючи зі сполуки, одержаної на Стадії вище. Точка плавлення: 90-95°С. Приклад 47 біс: транс-1-{3-(3-Хлор-5фторбензилокси)-3,4-дигідро-2Н-хромен-4іл}піперазин диметансульфонат Очікуваний продукт одержують реакцією сполуки Прикладу 47 з гідроксидом натрію, з наступним перетворенням продукту, одержаного таким чином, в сіль, використовуючи метансульфонову кислоту. Точка плавлення: 161-171°С. ІЧ (чист.): 2680-2587, 1611-1588, 1210-1167-1 1114, 1167,850-770-756см . Приклад 48: цис-4-[2-(3,5-Дибромбензилокси)1,2,3,4-тетрагідронафт-1-ил]-морфолін гідрохлорид Очікуваний продукт одержують відповідно до методики Прикладу 23, замінюючи, на Стадії А, 39 сполуку, одержану на Стадії В Прикладу 8, на сполуку, одержану на Стадії В Прикладу 10. Точка плавлення: 195-198°С. Приклад 49: транс-4-{3-[(3,5Дибромбензил)окси]-3,4-дигідро-2Н-хромен-4іл}морфолін гідрохлорид Очікуваний продукт одержують відповідно до методики, яка описана на Стадіях В-D Прикладу 10, починаючи зі сполуки, одержаної на Стадії В Прикладу 4. Точка плавлення: 143-148°С. Приклад 50: транс-4-{2-[(3,5Дибромбензил)окси]-1,2,3,4-тетрагідро-1нафтил}піперидин гідрохлорид Стадія А: 1-(4-Піридил)-1,2,3,4-тетрагідро-1нафтол 85мл 1,5М розчину n-бутиллітію в гексані додають, краплями, до розчину 20г 4-бромпіридину в 73мл ефіру, який охолоджують до -78°С. Перемішування проводять протягом 30 хвилин при цій температурі, потім вміщують розчин 1-тетралону в 73мл ефіру і, в кінці доповнення, суміші дають повернутись до температури навколишнього середовища. Після перемішування протягом ночі, вміщують насичений водний розчин хлориду амонію. Після розділення проводять екстрагування ефіром. Ефірні фази об'єднують і екстрагують 1N хлористоводневою кислотою. Об'єднані кислотні фази доводять до рН=8, використовуючи 20% розчин гідроксиду натрію, і екстрагують дихлорметаном. Після висушування виділяють очікуваний продукт, який очищують високошвидкісною хроматографією на силікагелі (елюент: дихлорметан/метанол 95/5) з тим, щоб одержати очікуваний продукт. Точка плавлення (В.К.)=160-162°С. Стадія В: 4-(3,4-Дигідро-1-нафтил)піридин 2г сполуки, одержаної на Стадії вище, 10мл води і 10мл сірчаної кислоти 95% змішують разом, нагрівають при 80°С протягом 30 хвилин, охолоджують до 0°С і доводять до рН=10, використовуючи 20% розчин гідроксиду натрію. Суміш екстрагують дихлорметаном, промивають водою, висушують і випаровують з тим, щоб одержати очікуваний продукт. Стадія С: 4-(2,3-Дигідронафто[1,2-b]оксирен7b(1аН)-іл)піридин 1-оксид При температурі від 20 до 25°С, розчин, який містить 5,4г продукту, який одержують на Стадії вище, 20г бікарбонату натрію, 35мл ацетону, 20мл води і 200мл етилацетату виливають у розчин 29,3г Охоnе® в 200мл води. Проводять перемішування протягом ночі при температурі навколишнього середовища, розбавлення водою і екстрагування етилацетатом. Після звичайної обробки виділяють очікуваний продукт. Стадія D: 1-(1-Оксидо-4-піридил)-1,2,3,4тетрагідро-2-нафтол До розчину 450мг продукту, який одержують на Стадії вище, в 10мл безводного тетрагідрофурану, у присутності сліду бромкрезолового зеленого, додають, несподівано і при температурі навколишнього середовища, 289мг ціаноборгідриду натрію. Ефірат трифториду бору додають доти, доки кольоровий індикатор не стане жовтим і сті 89619 40 льки разів, скільки необхідно, в ході реакції, щоб підтримати рН на рівні 4-5. У кінці реакції, додають концентровану хлористоводневу кислоту до рН=1, і перемішування проводять протягом 30 хвилин при температурі навколишнього середовища. Суміш доводять до значення рН=8, використовуючи розчин гідроксиду натрію і екстрагують етилацетатом, і після обробки виділяють очікуваний продукт (80% транс, 20% цис). Стадія Е: 1-(4-Піперидил)-1,2,3,4-тетрагідро-2нафтол 1,78г продукту, який одержують на Стадії вище, 1г оксиду платини, 0,75мл концентрованої хлористоводневої кислоти і 75мл етанолу змішують в реакторі і гідрогенізують під тиском 1 бар. Після проведення реакції протягом 6 годин при температурі навколишнього середовища проводять фільтрування; 8мл розчину гідроксиду натрію додають, етанол випаровують, мінімальну кількість води використовують для розчинення і рН доводять до значення 10. Після екстрагування і звичайної обробки одержують очікуваний продукт (80% транс, 20% цис). Стадія F: трет-Бутил 4-(2-гідрокси-1,2,3,4тетрагідро-1-нафтил)-1-піперидин-карбоксилат Розчин 2,1г ди(трет-бутил)дикарбонату в 50мл дихлорметану додають до 2,06г продукту, який одержують на Стадії вище, розчиненого в 50мл дихлорметану. Перемішування проводять протягом двох годин при температурі навколишнього середовища, з наступним випаровуванням досуха. Після очищення на силікагелі (елюент: дихлорметан/метанол 95/5), виділяють очікуваний продукт (80% транс, 20% цис). Стадія G: трет-Бутил 4-{2-[(3,5дибромбензил)окси]-1,2,3,4-тетрагідро-1-нафтил}1-піперидинкарбоксилат 241мг гідриду натрію 60% в олії вміщують у розчин 1,9г сполуки, одержаної на Стадії вище, в 20мл безводного тетрагідрофурану, охолоджують до 0°С. Перемішування проводять протягом 15 хвилин і потім додають, ще при цій же температурі, 20мг тетрабутиламоній йодиду і нарешті 1,9г 3,5-дибромбензил броміду. Суміші дають повернутись до температури навколишнього середовища і перемішують протягом 24 годин. Суміш випаровують досуха, додають у воду і дихлорметан і, після звичайної обробки і хроматографії на силікагелі (елюент: дихлорметан), виділяють очікуваний продукт у формі білої меренги (80% транс, 20% цис). Стадія Н: транс-4-{2-[(3,5-Дибромбензил)окси]1,2,3,4-тетрагідро-1-нафтил}-піперидин гідрохлорид 2г сполуки, одержаної на Стадії вище, в 20мл етанолу, обробляють 19мл 3,6N розчину етанольного водневого хлориду. Через 24 години утворений осад відфільтровують, промивають і висушують з тим, щоб одержати очікуваний продукт у формі гідрохлориду. (Цис сполука - у фільтраті). Точка плавлення: 152-167°С. Приклад 51: цис-1-Ацетил-3-[(3,5дибромбензил)окси]-4-(1-піперазиніл)-1,2,3,4тетрагідрохінолін дигідрохлорид Стадія А: 1-Ацетил-1,2-дигідрохінолін 41 23,43г бор гідриду натрію вміщують, порціями, в розчин 20г хіноліну в 200мл оцтової кислоти і 77,5мл оцтового ангідриду, охолоджують до 0°С. Суміш потім нагрівають протягом 2 годин при 60°С і перемішують протягом ночі при температурі навколишнього середовища. Суміш концентрують, розбавляють водою, доводять до значення рН=10 з розчином гідроксиду натрію і екстрагують ефіром. Об'єднані ефірні фази промивають IN хлористоводневою кислотою і потім в нейтральному рН і після звичайної обробки виділяють очікуваний продукт. Стадія В: 3-Ацетил-1а,2,3,7bтетрагідрооксирено[2,3-с]хінолін Очікуваний продукт одержують відповідно до методики, яка описана на Стадії А Прикладу 8, починаючи зі сполуки, одержаної на Стадії вище. Стадія С: трет-Бутил транс-4-[1-ацетил-3гідрокси-1,2,3,4-тетрагідро-4-хіноліл]-1піперазинкарбоксилат Очікуваний продукт одержують відповідно до методики, яка описана на Стадії А Прикладу 1, починаючи зі сполуки, одержаної на Стадії вище. Стадія D: цис-1-Ацетил-3-[(3,5дибромбензил)окси]-4-(1-піперазиніл)-1,2,3,4тетрагідрохінолін дигідрохлорид Очікуваний продукт одержують відповідно до методики Прикладу 23, починаючи зі сполуки, одержаної на Стадії вище. Точка плавлення: 164-167°С. Приклад 52: транс-1-{3-[(3,5Дибромбензил)окси]-3,4-дигідро-2Н-хромен-4-іл}N-метил-4-піперидинамін дигідрохлорид Стадія А: трет-Бутил транс-1-{3-[(3,5дибромбензил)окси]-3,4-дигідро-2Н-хромен-4-іл}N-метил-4-піперидилкарбамат 0,2г гідриду натрію (60% в олії) додають до 1г сполуки, одержаної на Стадії В Прикладу 9, і 0,42мл метил йодиду в 10мл тетрагідрофурану, підтримуючи температуру реакційної суміші при 0°С. Через 15 хвилин при цій температурі, суміш перемішують протягом 48 годин при температурі навколишнього середовища, розбавляють водою і екстрагують етилацетатом. Після звичайної обробки виділяють очікуваний продукт. Стадія В: транс-1-{3-[(3,5-Дибромбензил)окси]3,4-дигідро-2Н-хромен-4-іл}-N-метил-4піперидинамін дигідрохлорид Очікуваний продукт одержують відповідно до методики, яка описана на Стадії С Прикладу 1, починаючи зі сполуки, одержаної на Стадії вище. Точка плавлення: 192-195°С. Приклад 53: транс-1-{3-[(3,5Дибромбензил)окси]-3,4-дигідро-2Н-хромен-4-іл}N,N-диметил-4-піперидинамш дигідрохлорид Стадія А: транс-1-{3-[(3,5-Дибромбензил)окси]3,4-дигідро-2Н-хромен-4-іл}-N-метил-4піперидинамін Очікуваний продукт одержують за допомогою повторного перетворення сполуки Прикладу 52 в основу. Стадія В: транс-1-{3-[(3,5-Дибромбензил)окси]3,4-дигідро-2Н-хромен-4-іл}-N[,N-диметил-4піперидинамін 89619 42 Очікуваний продукт одержують відповідно до методики, яка описана на Стадії А Прикладу 52, починаючи зі сполуки, одержаної на Стадії вище. Стадія С: транс-1-{3-[(3,5-Дибромбензил)окси]3,4-дигідро-2Н-хромен-4-іл}-N,N-диметил-4піперидинамін дигідрохлорид Очікуваний продукт одержують перетворенням сполуки, одержаної на Стадії вище, в сіль, використовуючи хлористоводневу кислоту. Точка плавлення: 187-190°С. Приклад 54: транс-1-{3-[(3,5Диметоксибензил)окси]-3,4-дигідро-2Н-хромен-4іл}піперазин дигідрохлорид Очікуваний продукт одержують відповідно до методики Прикладу 4, замінюючи 3,5дибромбензил бромід на Стадії D на 3,5диметоксибензил бромід. Точка плавлення: 108-115°С. Приклад 55: транс-{3-Бензилокси-3,4-дигідро2Н-хромен-4-іл}піперазин дигідрохлорид Очікуваний продукт одержують відповідно до методики Прикладу 4, замінюючи 3,5дибромбензил бромід на Стадії D на бензил бромід. Точка плавлення: 66-80°С. Приклад 56: транс-1-{3-[(3-Фторбензил)окси]3,4-дигідро-2Н-хромен-4-іл}-піперазин дигідрохлорид Очікуваний продукт одержують відповідно до методики Прикладу 4, замінюючи 3,5дибромбензил бромід на Стадії D на 3фторбензил бромід. Точка плавлення: 180-184°С. Приклад 57: транс-1-{3-[(3-Хлорбензил)окси]3,4-дигідро-2Н-хромен-4-іл}-піперазин дигідрохлорид Очікуваний продукт одержують відповідно до методики Прикладу 4, замінюючи 3,5дибромбензил бромід на Стадії D на 3-хлорбензил бромід. Точка плавлення: 97-107°С. Приклад 58: транс-1-{3-[(3,4Дихлорбензил)окси]-3,4-дигідро-2Н-хромен-4іл}піперазин дигідрохлорид Очікуваний продукт одержують відповідно до методики Прикладу 4, замінюючи 3,5дибромбензил бромід на Стадії D на 3,4дихлорбензил бромід. Точка плавлення: 114-121°С. Приклад 59: транс-1-{2-[(3-Хлор-5фторбензил)окси]-2,3-дигідро-1H-інден-1іл}піперазин диметансульфонат Стадія А: транс-1-{2-[(3-Хлор-5фторбензил)окси]-2,3-дигідро-1Н-інден-1іл}піперазин дигідрохлорид Очікуваний продукт одержують відповідно до методики, яка описана на Стадіях В і С Прикладу 1, замінюючи 3,5-дибромбензил бромід на Стадії В на 3-хлор-5-фторбензил бромід. Стадія В: транс-1-{2-[(3-Хлор-5фторбензил)окси]-2,3-дигідро-1Н-інден-1іл}піперазин диметансульфонат Очікуваний продукт одержують за допомогою повторного перетворення сполуки, одержаної на 43 Стадії вище, в основу, з наступним перетворенням в сіль, використовуючи метансульфонову кислоту. Точка плавлення: 175-182°С. Приклад 60: транс-1-{3-[(3(Трифторметил)бензил)окси]-3,4-дигідро-2Нхромен-4-іл}піперазин диметансульфонат Стадія А: транс-1-{3-[(3(Трифторметил)бензил)окси]-3,4-дигідро-2Нхромен-4-іл}піперазин дигідрохлорид Очікуваний продукт одержують відповідно до методики Прикладу 4, замінюючи 3,5дибромбензил бромід на Стадії D на 3(трифторметил)бензил бромід. Стадія В: транс-1-{3-[(3(Трифторметил)бензил)окси]-3,4-дигідро-2Нхромен-4-іл}піперазин диметансульфонат Очікуваний продукт одержують за допомогою повторного перетворення сполуки, одержаної на Стадії вище в основу, з наступним перетворенням в сіль, використовуючи метансульфонову кислоту. Точка плавлення: 123-127°С. Приклад 61: транс-{3-[(3-Ціанобензил)окси]3,4-дигідро-2Н-хромен-4-іл}-піперазин диметансульфонат Стадія А: транс-1-{3-[(3-Ціанобензил)окси]-3,4дигідро-2Н-хромен-4-іл}піперазин дигідрохлорид Очікуваний продукт одержують відповідно до методики Прикладу 4, замінюючи 3,5дибромбензил бромід на Стадії D на 3ціанобензил бромід. Стадія В: транс-1-{3-[(3-Ціанобензил)окси]-3,4дигідро-2Н-хромен-4-іл}піперазин диметансульфонат Очікуваний продукт одержують за допомогою повторного перетворення сполуки, одержаної на Стадії вище, в основу, з наступним перетворенням в сіль, використовуючи метансульфонову кислоту. Точка плавлення: 118-121°С. Приклад 62: (+) ізомер транс-1-{3-(3-хлор-5фторбензилокси)-3,4-дигідро-2Н-хромен-4іл}піперазин дибензоїлтартрату (+) Стадія А: (+) ізомер трет-бутил транс-4-{3-[(3хлор-5-фторбензил)окси]-3,4-дигідро-2Н-хромен-4іл}піперазин-1-карбоксилату Очікувану сполуку одержують розділенням, за допомогою препаративної хіральної ВЕРХ хроматографії, рацемічної суміші, одержаної на Стадії А Прикладу 47. Стадія В: (+) ізомер транс-1-{3-(3-хлор-5фторбензилокси)-3,4-дигідро-2Н-хромен-4іл}піперазин дигідрохлориду Очікуваний продукт одержують відповідно до методики, яка описана на Стадії С Прикладу 1, починаючи зі сполуки, одержаної на Стадії вище. Стадія С: (+) ізомер транс-1-{3-(3-хлор-5фторбензилокси)-3,4-дигідро-2Н-хромен-4іл}піперазин дибензоїлтартрату (+) Очікуваний продукт одержують за допомогою повторного перетворення сполуки, одержаної на Стадії вище, в основу, з наступним перетворенням в сіль, використовуючи (+)-дибензоїлвинну кислоту. Точка плавлення: 100-107°С. 89619 44 Приклад 63: (-) ізомер транс-1-{3-(3-хлор-5фторбензилокси)-3,4-дигідро-2Н-хромен-4іл}піперазин дибензоїлтартрат (-) Стадія А: (-) ізомер трет-бутил транс-4-{3-[(3хлор-5-фторбензил)окси]-3,4-дигідро-2Н-хромен-4іл}піперазин-1-карбоксилату Очікувана сполука являє собою другий з енантіомерів, які розділяють на Стадії А Прикладу 62. Стадія В: (-) ізомер транс-1-{3-(3-хлор-5фторбензилокси)-3,4-дигідро-2Н-хромен-4іл}піперазин дигідрохлориду Очікуваний продукт одержують відповідно до методики, яка описана на Стадії С Прикладу 1, починаючи зі сполуки, одержаної на Стадії вище. Стадія С: (-) ізомер транс-1-{3-(3-хлор-5фторбензилокси)-3,4-дигідро-2Н-хромен-4іл}піперазин дибензоїлтапртрату (-) Очікуваний продукт одержують за допомогою повторного перетворення сполуки, одержаної на Стадії вище, в основу, з наступним перетворенням в сіль, використовуючи (-)-дибензоїлвинну кислоту. Точка плавлення: 100-107°С. Приклад 64: транс-1-{3-[(3,5Дифторбензил)окси]-3,4-дигідро-2Н-хромен-4іл}піперазин диметансульфонат Стадія А: транс-1-{3[(3,5Дифторбензил)окси]-3,4-дигідро-2Н-хромен-4іл}піперазин дигідрохлорид Очікуваний продукт одержують відповідно до методики Прикладу 4, замінюючи 3,5дибромбензил бромід на Стадії D на 3,5дифторбензил бромід. Стадія В: транс-1-{3-[(3-Дифторбензил)окси]3,4-дигідро-2Н-хромен-4-іл}піперазин диметансульфонат Очікуваний продукт одержують за допомогою повторного перетворення сполуки, одержаної на Стадії вище, в основу, з наступним перетворенням в сіль, використовуючи метансульфонову кислоту. Точка плавлення: 178-182°С. Приклад 65: транс-4-{3-[(3,5Дибромбензил)окси]-3,4-дигідро-2Н-хромен-4іл}піперидин гідрохлорид Очікуваний продукт одержують відповідно до методики Прикладу 50, замінюючи, на Стадії А, 1тетралон на 2,3-дигідро-4Н-хромен-4-он. Точка плавлення: 148-167°С. Приклад 66: транс-1-{3-[(3(Трифторметокси)бензил)окси]-3,4-дигідро-2Нхромен-4-іл}піперазин диметансульфонат Стадія А: транс-1-{3-[(3(Трифторметокси)бензил)окси]-3,4-дигідро-2Нхромен-4-іл}піперазин дигідрохлорид Очікуваний продукт одержують відповідно до методики Прикладу 4, замінюючи 3,5дибромбензил бромід на Стадії D на 3(трифторметокси)бензил бромід. Стадія В: транс-1-{3-[(3(Трифторметокси)бензил)окси]-3,4-дигідро-2Нхромен-4-іл}піперазин диметансульфонат Очікуваний продукт одержують за допомогою повторного перетворення сполуки, одержаної на Стадії вище, в основу, з наступним перетворенням в сіль, використовуючи метансульфонову кислоту. Точка плавлення: 132-135°С. 45 89619 Фармакологічні дослідження сполук за даним винаходом. Приклад 67: Визначення афінності для ділянок зворотного захоплення серотоніну у щурів. Афінність сполук для ділянки зворотного захоплення (5-НТТ) оцінюють шляхом конкурентних 3 експериментів з [ Н]-циталопрамом на мембранах фронтальної кори щурів. Кори гомогенізують, використовуючи Polytron в 40 об'ємах (вага/об'єм) холодного Трис-НСl (50мМ, рН7,4) інкубаційного буфера, який містить 120мМ NaCl і 5мМ KКСl, і потім центрифугують перший раз. Осад ресуспендують в тому ж буфері, інкубують протягом 10 хвилин при 37°С і потім рецентрифугують. Мембрани промивають надалі два рази і осад потім ресуспендують у відповідному об'ємі інкубаційного буфера. Мембрани потім інкубують протягом 2 годин при 25°С з тестованою сполукою у присут3 ності 0,7нм [ Н]-циталопраму. Неспецифічне зв'язування визначають з 10мкМ флуоксетином. У кінці інкубаційного періоду, зразки фільтрують через фільтри типу Unifilter GF/B, попередньо оброблені РЕІ (0,5%) і промиті декілька разів інкубаційним буфером. Радіоактивність, яка зберігається на фільтрах, підраховують після додавання сцинтиляційної рідини, за допомогою сцинтиляційного лічильника. Одержані ізотерми аналізують нелінійною регресією, щоб визначити значення ІС50, які перетворюють в Ki, використовуючи рівняння Cheng-Prusoff: Ki=IC50/(1+L/kD), в якій L являє собою концентрацію радіоліганду і ко являє собою константу дисоціації [ 3Н]циталопраму на ділянці зворотного захоплення серотоніну (0,7нм). Результати виражають як pKi=log Ki. Результати, які одержують для репрезентативних сполук винаходу, порівнюють у наступній таблиці: Сполука Приклад 1 Приклад 4 Приклад 21 Приклад 36 Приклад 38 Приклад 42 Приклад 44 Приклад 47 pKi r5-НТТ 8,35 7,10 7,91 8,97 8,73 7,71 7,31 7,45 Приклад 68: hNK1 зв'язування. Афінність сполук винаходу визначають шляхом конкурентних експериментів у присутності Комп’ютерна верстка Т. Чепелева 46 3 [ Н]-Субстанції Р (Sar-9, МеtO2-11,2-пропіл-3,43H). Людські клітини лімфобласту ІМ9, які ендогенно експресують рецептори NK1, центрифугують і додають в інкубаційний буфер, який містить 50мМ ТРИС, 150мМ NaCl, 4мМ СаСl2, інгібітори протеази при 1/100е (Cocktail SIGMA P8340) і 0,2% BSA. Об'єм інкубаційного буфера визначають так, 6 щоб одержати концентрацію 5 10 клітин/мл. Клітинне приготування потім інкубують разом з 1,5нм [3Н]-Субстанції Р і тестованою сполукою протягом 90 хвилин при температурі навколишнього середовища. Неспецифічне зв'язування визначають у присутності 1мкМ GR 205171. В кінці інкубаційного періоду, зразки фільтрують через фільтри типу Unifilter GF/B, попередньо оброблені РЕІ (0,1%) і промиті декілька разів фільтраційним буфером (50мМ ТРИС, 150мМ NaCl, 4мМ СаСl2). Радіоактивність, яка зберігається на фільтрах, підраховують після додавання сцинтиляційної рідини на фільтри. Числа аналізують нелінійною регресією, дозволяючи ізотермам бути нанесеними і значенням ІС50 бути визначеними. Останні потім перетворюють в константи інгібування (Ki) за допомогою рівняння Cheng-Prusoff: Ki=IC50/(1+L/KD), в якій L являє собою концентрацію [ 3Н]Субстанції Р і KD являє собою константу дисоціації [3Н]-Субстанції Р для людських NK1 рецепторів (0,53нм). Результати виражають як pKi=-logKi. Результати, які одержують для репрезентативних сполук винаходу, порівнюють у наступній таблиці: Сполука Приклад 1 Приклад 4 Приклад 7 Приклад 8 Приклад 9 Приклад 13 Приклад 15 Приклад 19 Приклад 40 рКі NK1 6,84 8,25 8,14 7,54 7,96 6,60 7,48 7,40 6,85 Приклад 69: Фармацевтична композиція. Формула для приготування 1000 таблеток, кожна з яких містить 10мг активного інгредієнта: Сполука Прикладу 1 10г Гідроксипропілцелюлоза 2г Пшеничний крохмаль 10г Лактоза 100г Стеарат магнію 3г Тальк 3г. Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюPiperazine derivatives, process for the preparation thereof and pharmaceutical composition comprising thereof
Автори англійськоюPeglion Jean-Louis, Dessinges Aimee, Goument Bertrand, Millan Mark, Mannoury La Cour Clotilde
Назва патенту російськоюСоединения пиперазина, способ их получения и фармацевтическая композиция, которая их содержит
Автори російськоюПеглион Жан-Луи, Десенж Эме, Гуман Бертран, Миллан Марк, Манури Ля Кур Клотильд
МПК / Мітки
МПК: C07D 403/02, A61K 31/495, C07D 295/15, C07D 401/04
Мітки: фармацевтична, містить, одержання, піперазину, сполуки, композиція, яка, спосіб
Код посилання
<a href="https://ua.patents.su/23-89619-spoluki-piperazinu-sposib-kh-oderzhannya-i-farmacevtichna-kompoziciya-yaka-kh-mistit.html" target="_blank" rel="follow" title="База патентів України">Сполуки піперазину, спосіб їх одержання і фармацевтична композиція, яка їх містить</a>
Попередній патент: 6-заміщені 2-хінолінони та 2-хіноксалінони як інгібітори полі(адф-рибоза)полімерази
Наступний патент: Багатосекційний сферичний роторний двигун внутрішнього згоряння
Випадковий патент: Сушарка