Солі сполук-інгібіторів віл
Формула / Реферат
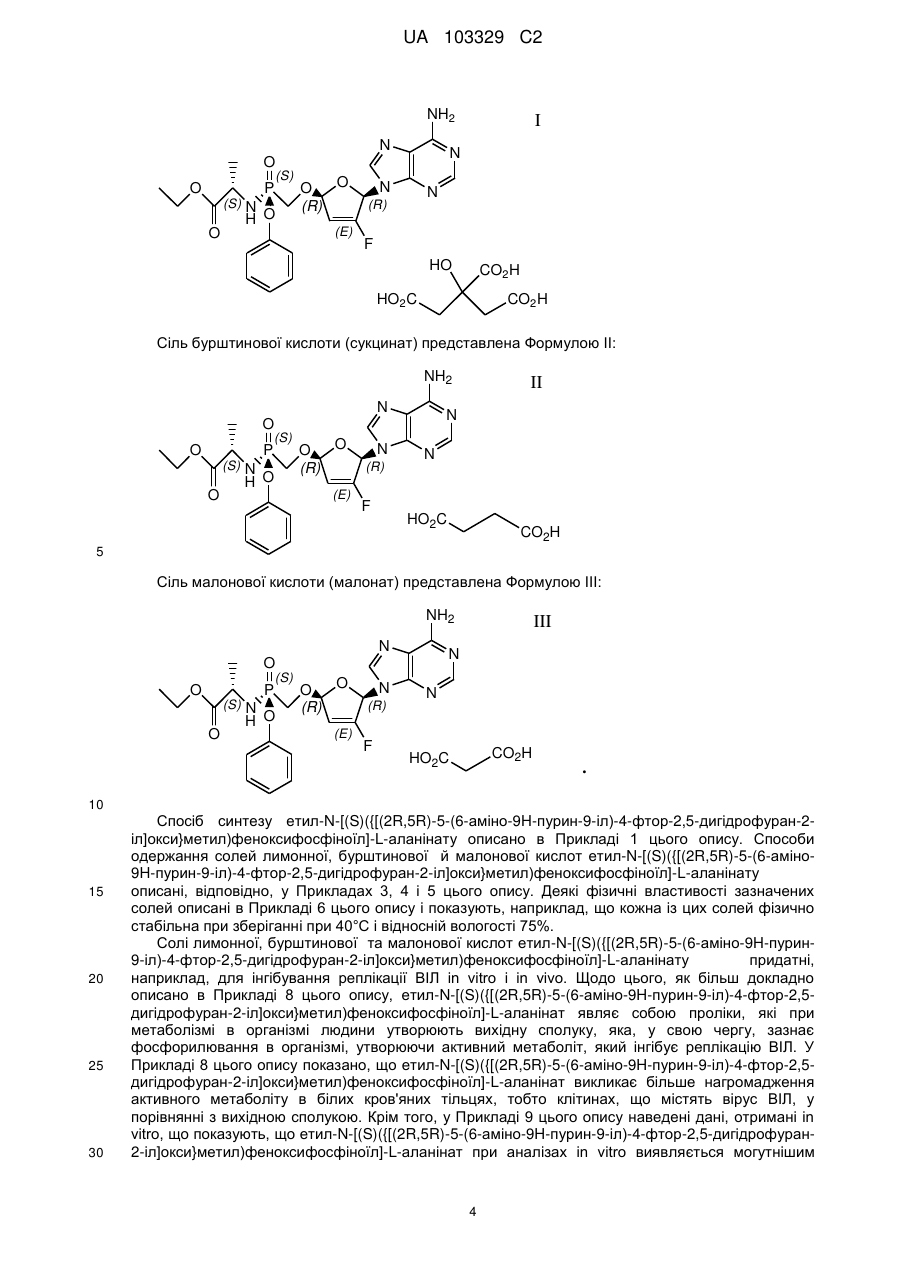
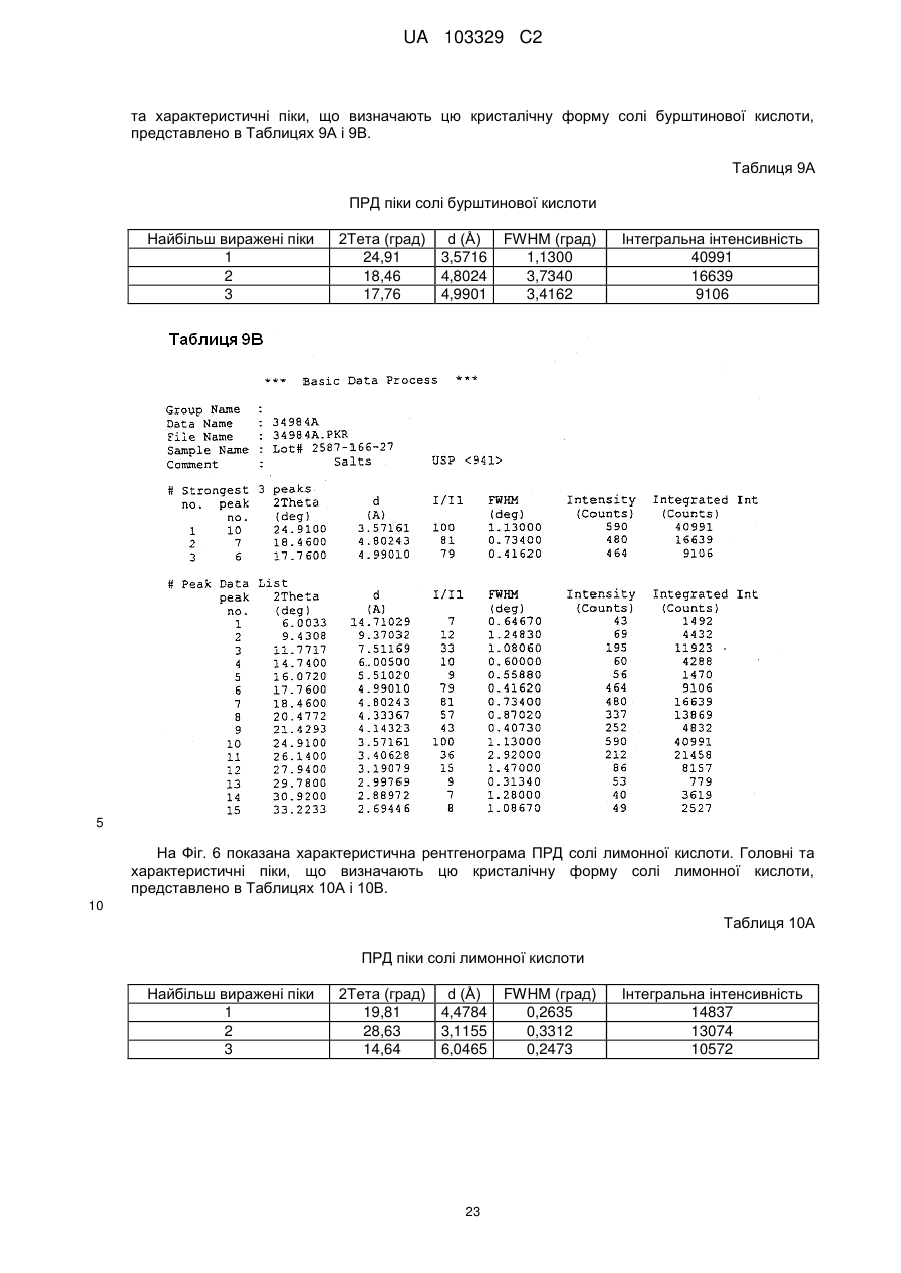
1.Сіль лимонної кислоти формули І або її гідрат:
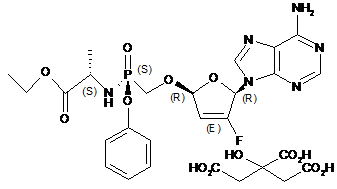 (I).
(I).
2. Сіль або гідрат за п. 1, які відрізняються тим, що є кристалічними.
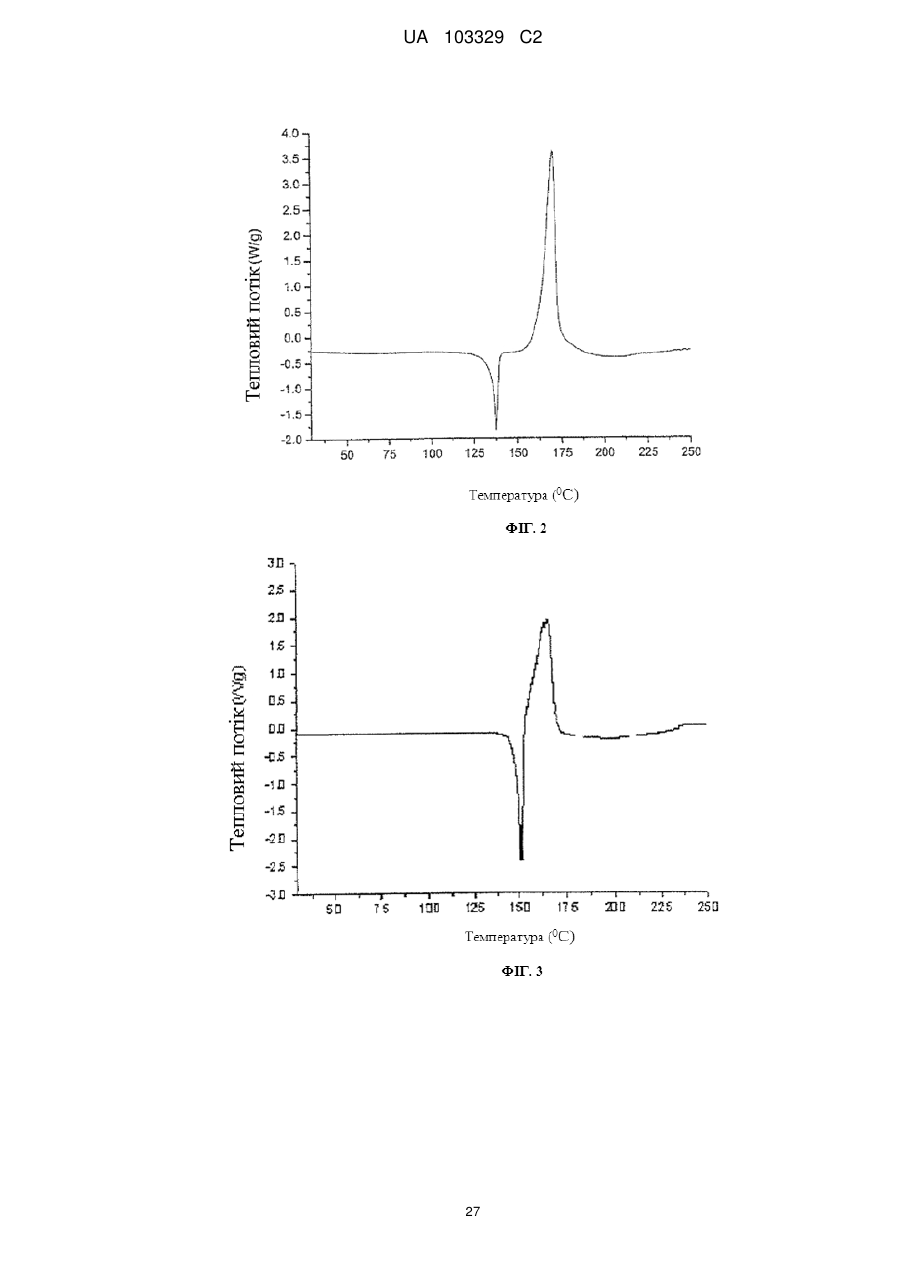
3. Сіль за п. 2, яка відрізняється тим, що смуги поглинання, які спостерігаються на порошковій рентгенограмі, характеризуються міжплощинними відстанями, що збігаються або по суті збігаються з відстанями, рівними 4,48, 3,12 і 6,05 ангстрем.
4. Сіль за п. 2, яка відрізняється тим, що смуги поглинання, які відповідають кутам дифракції 2-тета на порошковій рентгенограмі, збігаються або по суті збігаються з кутами, рівними 19,81, 28,63 і 14,64 градусам.
5. Сіль за п. 2, яка відрізняється тим, що представлена у формі гідрату, який є частково або повністю гідратованим.
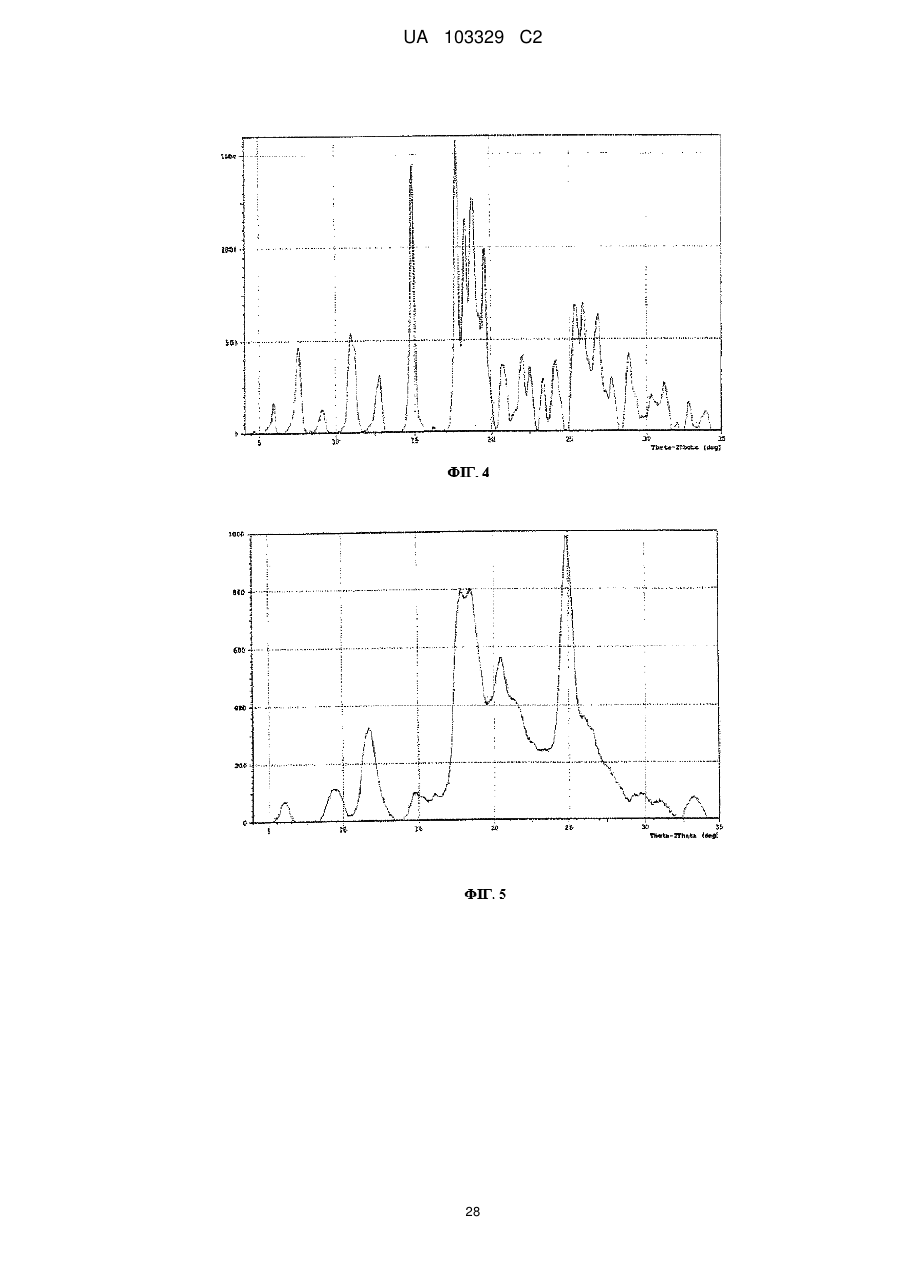
6. Сіль за п. 2, яка відрізняється тим, що вона являє собою безводну або по суті безводну сіль.
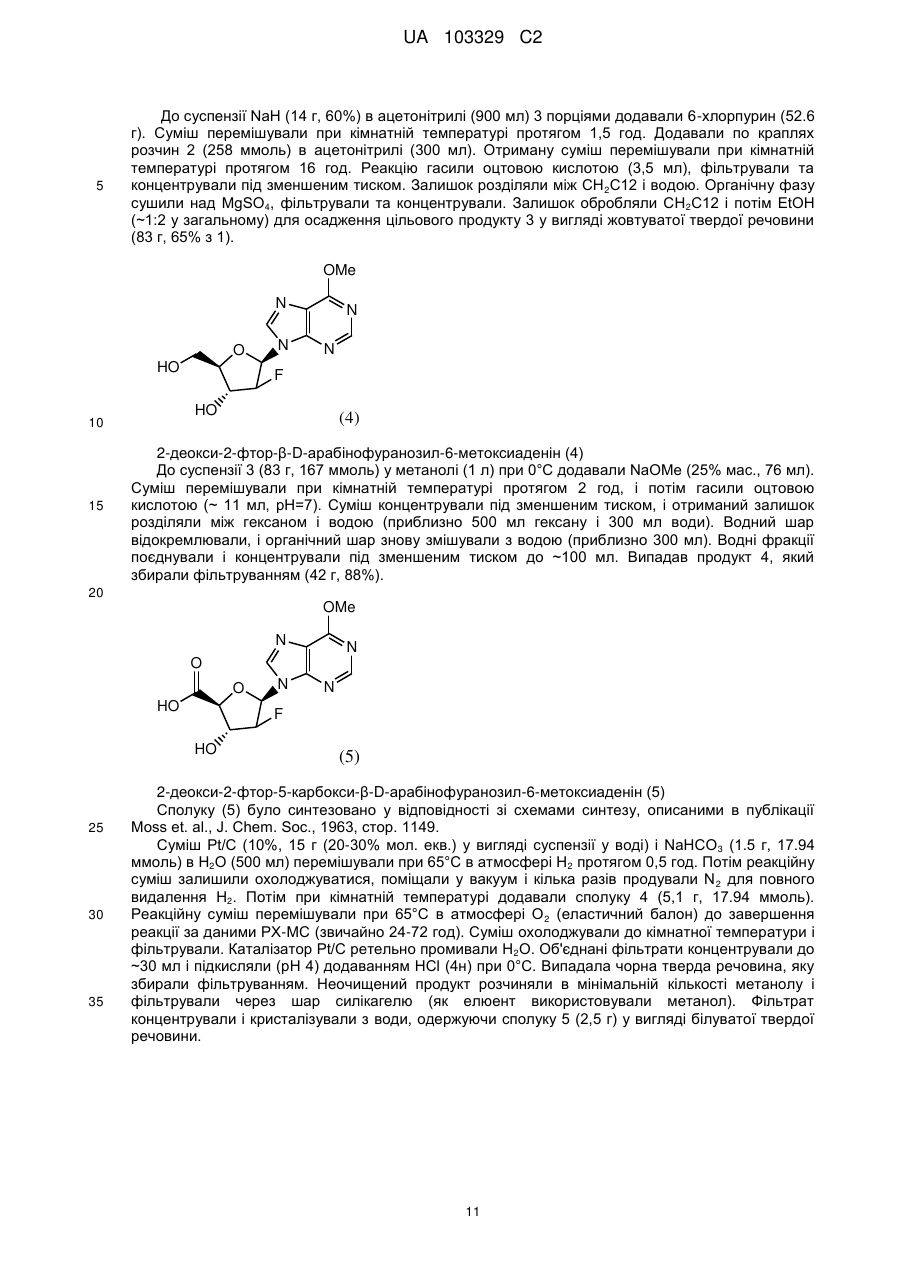
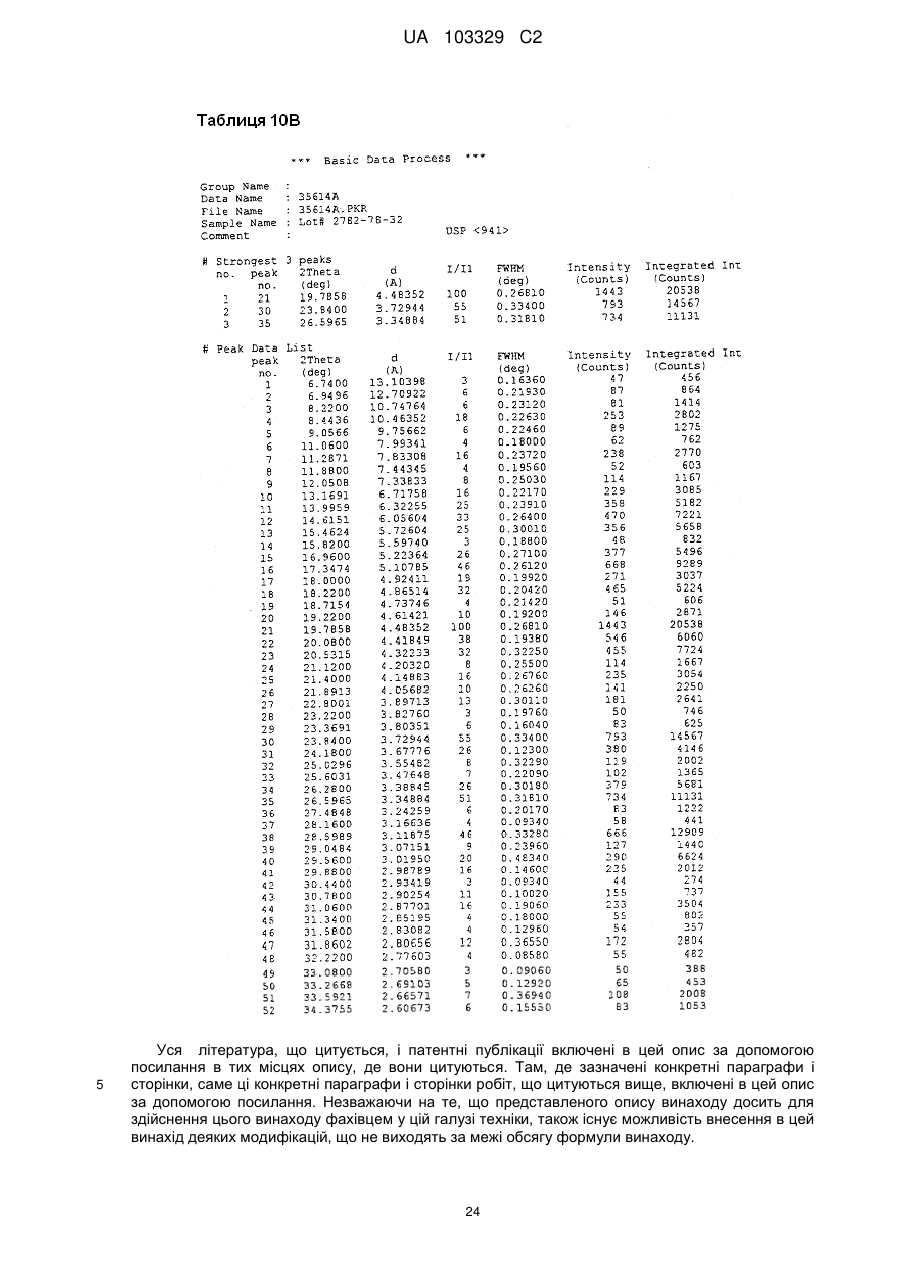
7. Сіль бурштинової кислоти формули II або її гідрат:
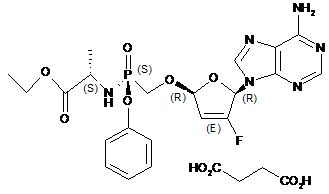 (II).
(II).
8. Сіль або гідрат за п. 7, які відрізняються тим, що є кристалічними.
9. Сіль за п. 8, яка відрізняється тим, що смуги поглинання, які спостерігаються на порошковій рентгенограмі, характеризуються міжплощинними відстанями, що збігаються або по суті збігаються з відстанями, рівними 3,57, 4,80 і 4,99 ангстрем.
10. Сіль за п. 8, яка відрізняється тим, що смуги поглинання, які відповідають кутам дифракції 2-тета на порошковій рентгенограмі, збігаються або по суті збігаються з кутами, рівними 24,91, 18,46 і 17,76 градусам.
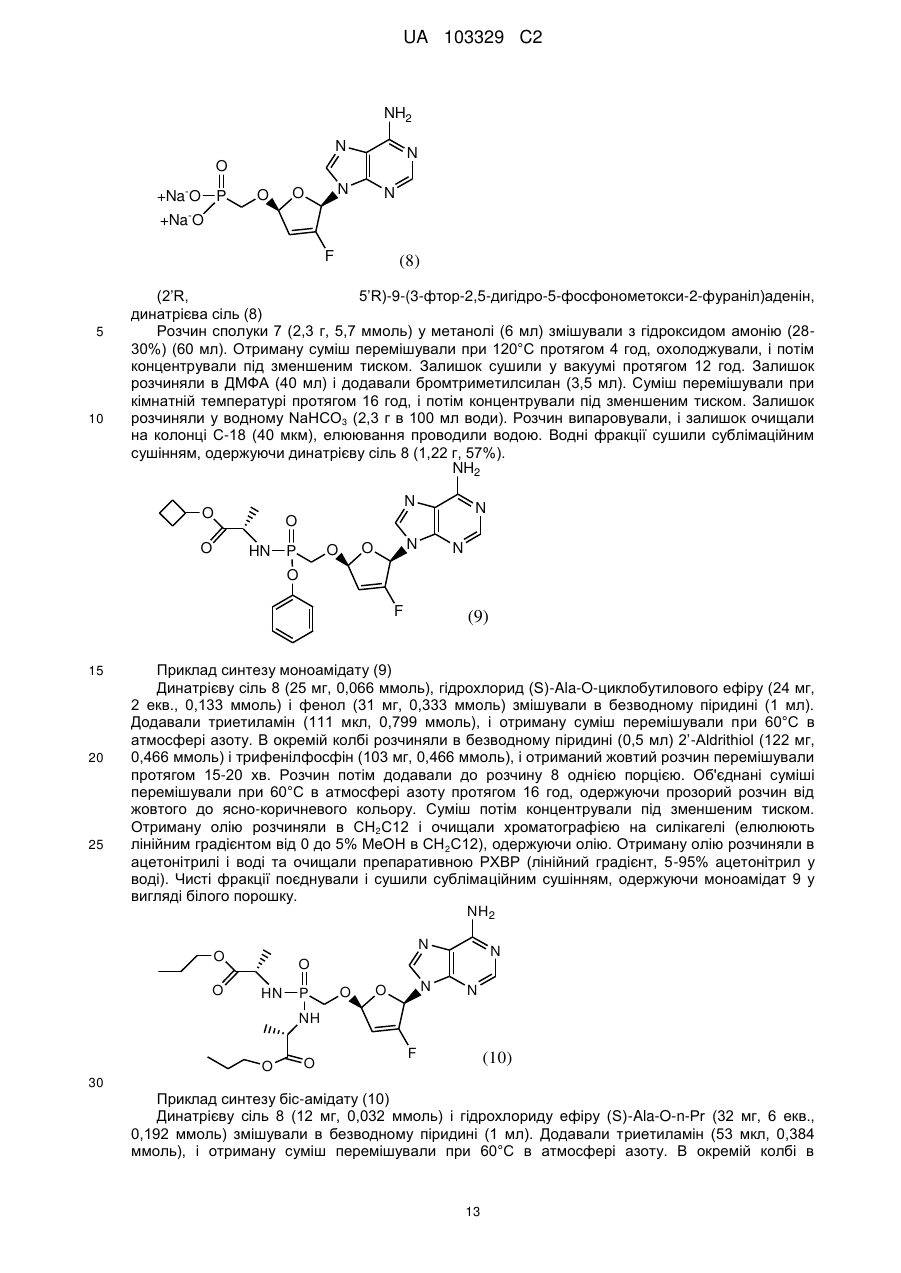
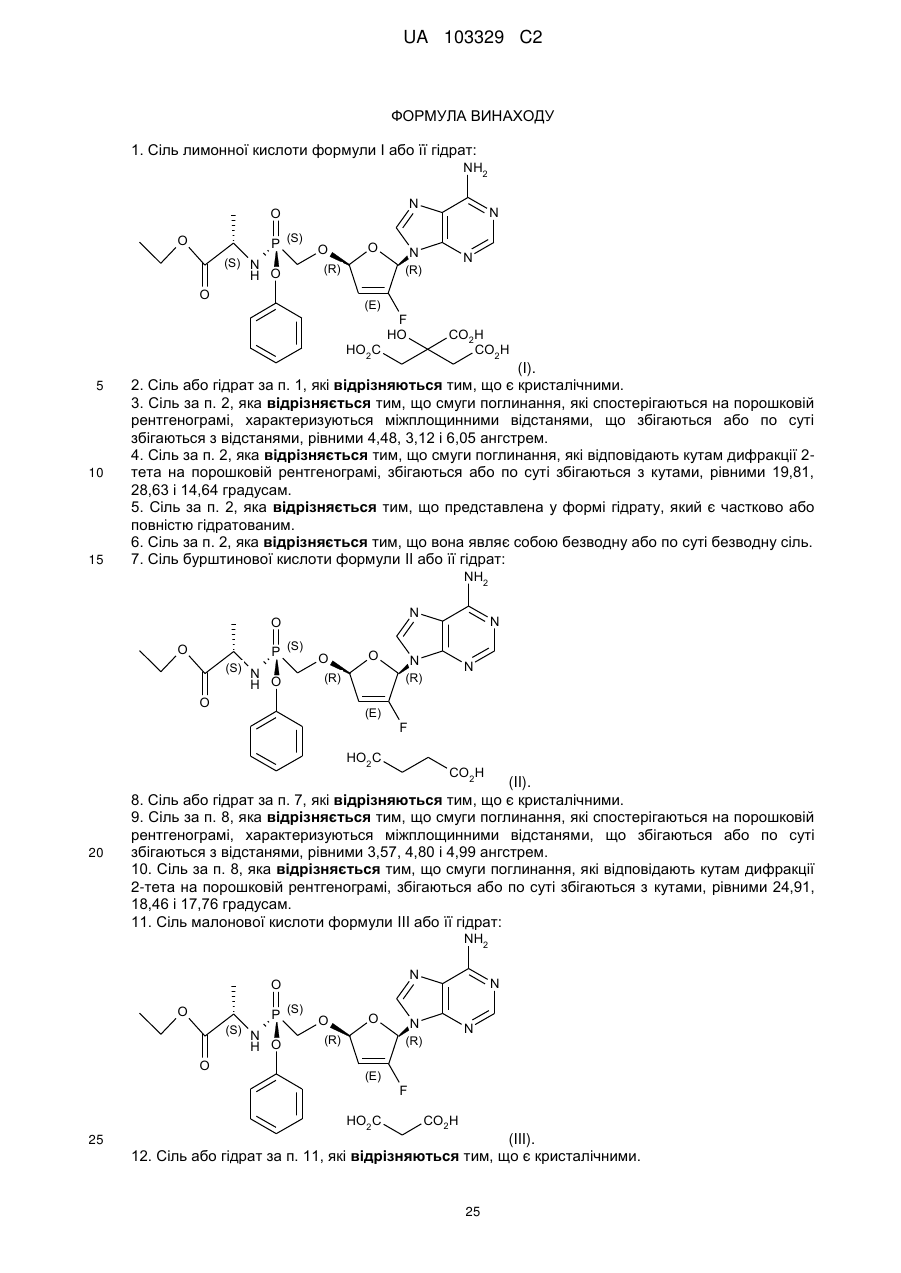
11. Сіль малонової кислоти формули III або її гідрат:
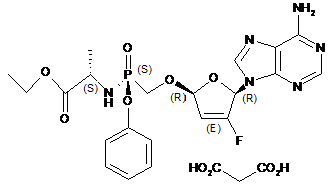 (III).
(III).
12. Сіль або гідрат за п. 11, які відрізняються тим, що є кристалічними.
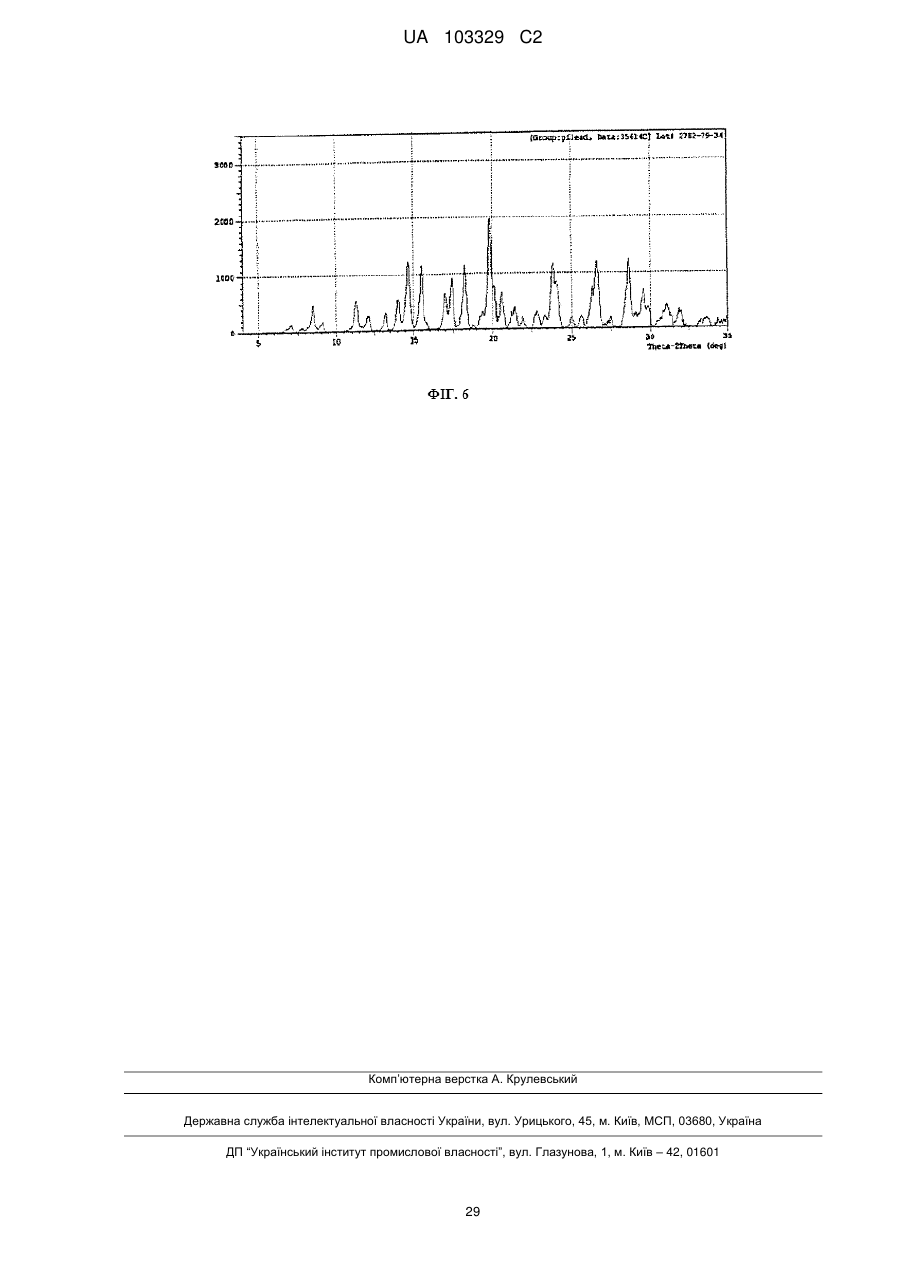
13. Сіль за п. 12, яка відрізняється тим, що смуги поглинання, які спостерігаються на порошковій рентгенограмі, характеризуються міжплощинними відстанями, що збігаються або по суті збігаються з відстанями, рівними 4,99, 5,93 і 4,72 ангстрем.
14. Сіль за п. 12, яка відрізняється тим, що смуги поглинання, які відповідають кутам дифракції 2-тета на порошковій рентгенограмі, збігаються або по суті збігаються з кутами, рівними 17,76, 14,92 і 18,80 градусам.
15. Фармацевтична композиція, що містить терапевтично ефективну кількість солі або гідрату за будь-яким з пп. 1-14 і фармацевтично прийнятний носій або наповнювач.
16. Фармацевтична композиція за п. 15, яка відрізняється тим, що додатково містить додатковий терапевтичний засіб.
17. Фармацевтична композиція за п. 16, яка відрізняється тим, що додатковий терапевтичний засіб має активність проти ВІЛ.
18. Сіль або гідрат за будь-яким з пп. 1-14, призначені для застосування у лікуванні або профілактичному запобіганні ВІЛ-інфекції.
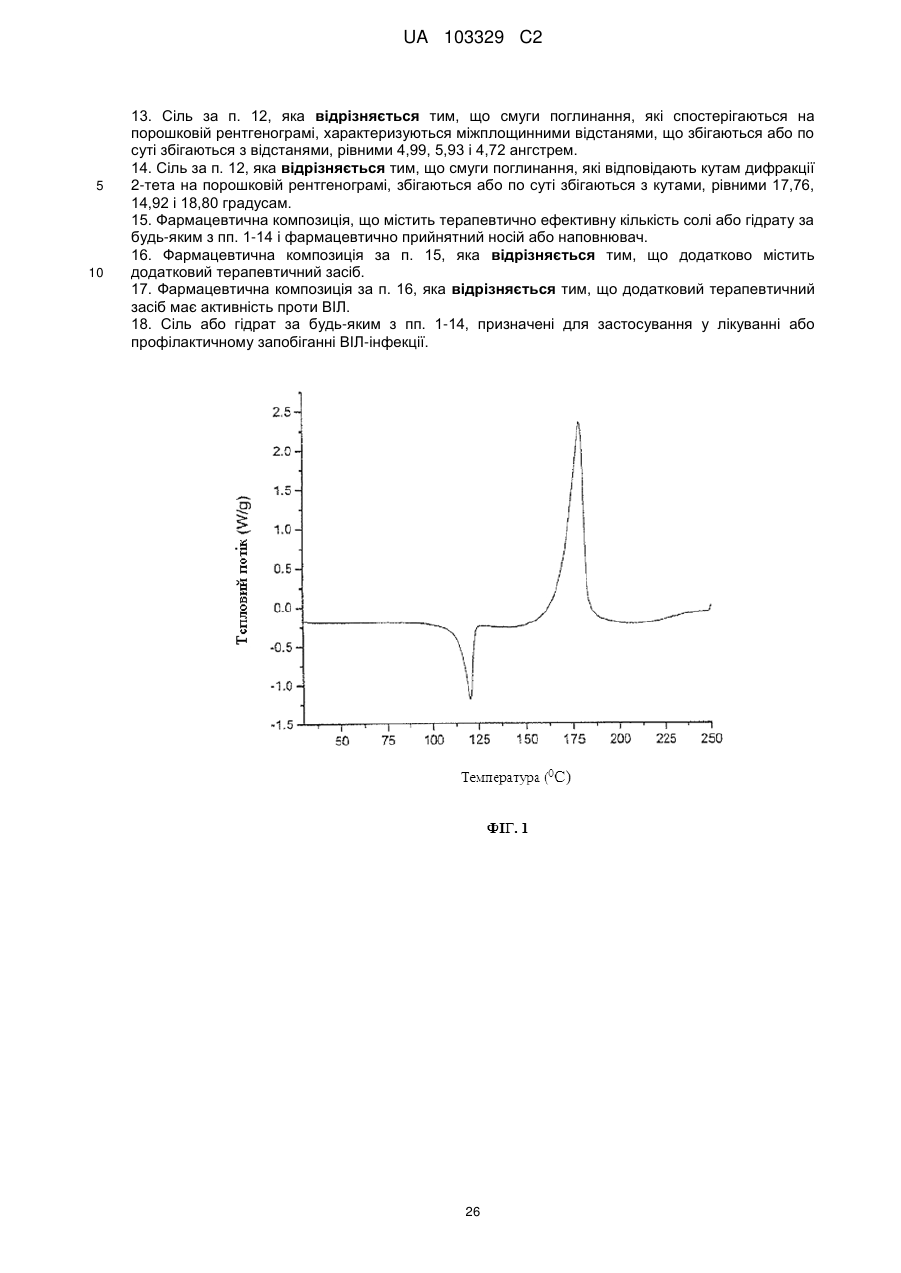
Текст
Реферат: Винахід стосується солей противірусних сполук, композицій, що містять такі солі, що застосовуються для лікування або профілактичного запобігання ВІЛ-інфекції. UA 103329 C2 (12) UA 103329 C2 UA 103329 C2 5 10 15 20 25 Галузь техніки У цілому, винахід відноситься до солей сполук, що мають антивірусну активність, і, зокрема, що мають активність проти ВІЛ. Рівень техніки Вірус імунодефіциту людину (ВІЛ) являє собою ретровірус, який може приводити до розвитку синдрому набутого імунодефіциту (СНІД), тобто стану людини, при якому його імунна система ослаблена і не може протистояти впливу загрозливих для життя інфекцій, що викликаються умовно-патогенними організмами (опортуністичних інфекцій). Інгібітори ВІЛ застосовують для лікування ВІЛ інфекції у ссавців (наприклад, для зниження і обмеження зараження та поширення інфекції ВІЛ), а також для діагностичного визначення ВІЛ. Застосування доступних у цей час інгібіторів ВІЛ певною мірою обмежене їх токсичністю та іншими побічними ефектами. Таким чином, існує потреба в розробці нових терапевтичних засобів для лікування та діагностики ВІЛ. Фармацевтична композиція, що містить терапевтичний засіб, повинна відтворювальним і надійним способом доставляти терапевтичний засіб пацієнтові, що потребує цього. Така відтворюваність доставки може бути досягнута, щонайменше частково, введенням стабільної, розчинної, твердої форми терапевтичного засобу у фармацевтичну композицію. Крім того, синтез цільової твердої форми терапевтичного засобу повинен бути зручним з технічної та економічної точок зору і повинен підходити для великомасштабного комерційного виробництва. Короткий опис винаходу Етил-N-[(S)({[(2R,5R)-5-(6-аміно-9H-пурин-9-іл)-4-фтор-2,5-дигідрофуран-2іл]окси}метил)феноксифосфіноїл]-L-аланінат являє собою інгібітор зворотної транскриптази, який блокує реплікацію вірусів ВІЛ in vivo і in vitro і при введенні людині викликає обмежені небажані побічні ефекти. Структура етил-N-[(S)({[(2R,5R)-5-(6-аміно-9H-пурин-9-іл)-4-фтор-2,5дигідрофуран-2-іл]окси}метил)феноксифосфіноїл]-L-аланінату представлена Формулою P: NH2 (P) N N O O P (S) N O 30 35 40 45 50 (S) H O O O (R) (E) N (R) N F Етил-N-[(S)({[(2R,5R)-5-(6-аміно-9H-пурин-9-іл)-4-фтор-2,5-дигідрофуран-2іл]окси}метил)феноксифосфіноїл]-L-аланінат має низьку температуру плавлення і являє собою аморфну тверду речовину, що погано піддається виділенню і очищенню, нестійку при зберіганні протягом тривалого періоду часу, і на основі якої важко одержати фармацевтичну композицію. Етил-N-[(S)({[(2R,5R)-5-(6-аміно-9H-пурин-9-іл)-4-фтор-2,5-дигідрофуран-2іл]окси}метил)феноксифосфіноїл]-L-аланінат також являє собою слабку основу, здатну утворювати солі з кислотами. Відповідно, один з аспектів цього винаходу відноситься до стабільних солей етил-N-[(S)({[(2R,5R)-5-(6-аміно-9H-пурин-9-іл)-4-фтор-2,5-дигідрофуран-2іл]окси}метил)феноксифосфіноїл]-L-аланінату, які мають більш високу стабільність фізичних властивостей, які легше виділити і ввести до складу лікарської форми, ніж вільну основу цієї сполуки. Солі згідно з цим винаходом придатні, наприклад, для лікування пацієнта-людини, інфікованого вірусом імунодефіциту людину (штами ВІЛ-1 або ВІЛ-2), який викликає СНІД. Солі згідно з цим винаходом також придатні, наприклад, для приготування лікарських засобів для лікування ВІЛ або порушень, пов'язаних з ВІЛ. Солі згідно з цим винаходом можна також використовувати, наприклад, для інгібування реплікації вірусів ВІЛ in vitro, і, таким чином, можуть бути використані в біологічних тестах як контрольні сполуки для ідентифікації інших інгібіторів зворотної транскриптази або для дослідження механізму дії зворотної транскриптази ВІЛ і її інгібування. Таким чином, один з аспектів цього винаходу відноситься до солей лимонної, бурштинової та малонової кислот етил-N-[(S)({[(2R,5R)-5-(6-аміно-9H-пурин-9-іл)-4-фтор-2,5-дигідрофуран-2іл]окси}метил)феноксифосфіноїл]-L-аланінату. Способи одержання вищевказаних солей розкриті у деяких прикладах здійснення, солі згідно з цим винаходом перебувають у безводному 1 UA 103329 C2 5 10 15 20 25 30 35 40 45 50 55 60 стані, у той час як в інших прикладах здійснення, солі згідно з цим винаходом щонайменше частково гідратовані. У деяких прикладах здійснення, солі згідно з цим винаходом існують у кристалічному стані. Таким чином, цей винахід включає солі лимонної, бурштинової та малонової кислот сполуки Формули P, а також їх гідрати. Гідрати згідно з винаходом можуть бути частково (наприклад, являти собою напівгідрати) або повністю гідратовані (наприклад, являти собою моногідрати). Цей винахід також включає названі солі в безводному або по суті в безводному стані. Аналогічно, згідно з винаходом, сіллю та їх гідрати включають аморфні і кристалічні стани, а також стани, що мають як аморфні, так і кристалічні характеристики. У цьому описі, термін “кристалічний” означає матеріал, що має молекулярну структуру з далеким порядком. Навпаки, “аморфні” матеріали не мають далекий порядок. Зрозуміло, що, у загальному випадку, кристалічні матеріали більш термодинамічно стабільні, ніж аморфні форми тих же самих речовин. Таким чином, за деякими відомими винятками, для застосування у фармацевтиці звичайно віддають перевагу кристалічним матеріалам. Засобом ступеня кристалічності сполук згідно з винаходом може служити, наприклад, виразність смуг поглинання (піків) ДСК (диференціальної скануючої калориметрії) і ПРД (рентгенівської дифракції порошків). Чим гостріше пік, тим вище ступінь кристалічності. Навпаки, чим ширше пік, тим нижче ступінь кристалічності. Як більш докладно описано в Прикладі 12 цього опису, у конкретних прикладах здійснення, сіль лимонної кислоти етил-N-[(S)({[(2R,5R)-5-(6-аміно-9H-пурин-9-іл)-4-фтор-2,5-дигідрофуран2-іл]окси}метил)феноксифосфіноїл]-L-аланінату відрізняється тим, що смуги поглинання, що спостерігаються в рентгенограмі порошку солі характеризуються міжплощинними відстанями, що становлять 4,48, 3,12 і 6,05 ангстрем; сіль бурштинової кислоти етил-N-[(S)({[(2R,5R)-5-(6аміно-9H-пурин-9-іл)-4-фтор-2,5-дигідрофуран-2-іл]окси}метил)феноксифосфіноїл]-L-аланінату відрізняється тим, що смуги поглинання, що спостерігаються в рентгенограмі порошку солі характеризуються міжплощинними відстанями, що становлять 3,57, 4,80 і 4,99 ангстрем; і сіль малонової кислоти етил-N-[(S)({[(2R,5R)-5-(6-аміно-9H-пурин-9-іл)-4-фтор-2,5-дигідрофуран-2іл]окси}метил)феноксифосфіноїл]-L-аланінату відрізняється тим, що смуги поглинання, що спостерігаються в рентгенограмі порошку солі характеризуються міжплощинними відстанями, що становлять 4,99, 5,93 і 4,72 ангстрем. В іншому конкретному прикладі здійснення, цей винахід відноситься до солі лимонної кислоти етил-N-[(S)({[(2R,5R)-5-(6-аміно-9H-пурин-9-іл)-4фтор-2,5-дигідрофуран-2-іл]окси}метил)феноксифосфіноїл]-L-аланінату, що має температуру плавлення, яка складає від 142°C до 150°C. Етил-N-[(S)({[(2R,5R)-5-(6-аміно-9H-пурин-9-іл)-4-фтор-2,5-дигідрофуран-2іл]окси}метил)феноксифосфіноїл]-L-аланінат являє собою амідатні проліки, які вступають в реакцію з протонними розчинниками і зазнають розкладання. Швидкість реакції залежить від pH і температури. Таким чином, утворення стабільної солі амідатних проліків і лимонної кислоти, бурштинової кислоти і/або малонової кислоти, кожна з яких містить нуклеофільні фрагменти, здатні реагувати з проліками (наприклад, реагувати з амідатним фрагментом проліків), є несподіваним і дивним результатом. Інший аспект цього винаходу відноситься до фармацевтичних композицій, кожна з яких включає терапевтично ефективну кількість солі згідно з цим винаходом і фармацевтично прийнятний носій або наповнювач. Фармацевтичні композиції згідно з цим винаходом також можуть включати додаткові терапевтичні засоби, наприклад, антивірусні, антибактеріальні, протигрибкові або протиракові засоби. Фармацевтичні композиції згідно з винаходом можуть перебувати у вигляді одиничних лікарських форм, наприклад, таблеток або капсул. Одиничні лікарські форми звичайно забезпечують ефективну добову дозу солі згідно з цим винаходом людині, що потребує цього. Ефективні добові дози солі згідно з цим винаходом звичайно становлять від 1 мг до 100 мг, наприклад, від 10 мг до 30 мг. Розкриті способи одержання солей лимонної, бурштинової та малонової кислот згідно з цим винаходом. Таким чином, наприклад, розкрито спосіб виготовлення солі лимонної кислоти етилN-[(S)({[(2R,5R)-5-(6-аміно-9H-пурин-9-іл)-4-фтор-2,5-дигідрофуран-2іл]окси}метил)феноксифосфіноїл]-L-аланінату, причому спосіб включає етап приведення в контакт приблизно одного еквівалента вільної основи етил-N-[(S)({[(2R,5R)-5-(6-аміно-9H-пурин9-іл)-4-фтор-2,5-дигідрофуран-2-іл]окси}метил)феноксифосфіноїл]-L-аланінату в придатному розчиннику (наприклад, ацетонітрилі) з кількістю лимонної кислоти, що приблизно складає від одного еквівалента до приблизно 1,2 еквівалентів, при температурі, що становить приблизно від 55°C до приблизно 75°C. Розкрито способи одержання солі бурштинової кислоти етил-N-[(S)({[(2R,5R)-5-(6-аміно-9Hпурин-9-іл)-4-фтор-2,5-дигідрофуран-2-іл]окси}метил)феноксифосфіноїл]-L-аланінату, причому 2 UA 103329 C2 5 10 15 20 25 30 35 40 45 спосіб включає етап приведення в контакт приблизно одного еквівалента вільної основи етил-N[(S)({[(2R,5R)-5-(6-аміно-9H-пурин-9-іл)-4-фтор-2,5-дигідрофуран-2іл]окси}метил)феноксифосфіноїл]-L-аланінату в придатному розчиннику (наприклад, 2-бутаноні) з кількістю бурштинової кислоти, що приблизно складає від одного еквівалента до приблизно 1,2 еквівалентів, при температурі, що становить приблизно від 60°C до приблизно 70°C, з утворенням сукцинату етил-N-[(S)({[(2R,5R)-5-(6-аміно-9H-пурин-9-іл)-4-фтор-2,5-дигідрофуран2-іл]окси}метил)феноксифосфіноїл]-L-аланінату. Також, розкрито спосіб одержання солі малонової кислоти етил-N-[(S)({[(2R,5R)-5-(6-аміно9H-пурин-9-іл)-4-фтор-2,5-дигідрофуран-2-іл]окси}метил)феноксифосфіноїл]-L-аланінату, причому спосіб включає етап приведення в контакт приблизно одного еквівалента вільної основи етил-N-[(S)({[(2R,5R)-5-(6-аміно-9H-пурин-9-іл)-4-фтор-2,5-дигідрофуран-2іл]окси}метил)феноксифосфіноїл]-L-аланінату у придатному розчиннику (наприклад, 2-бутаноні) з кількістю малонової кислоти, що приблизно складає від одного еквівалента до приблизно 1,2 еквівалентів, при температурі, що приблизно от 50°C до приблизно 70°C, з утворенням малонату етил-N-[(S)({[(2R,5R)-5-(6-аміно-9H-пурин-9-іл)-4-фтор-2,5-дигідрофуран-2іл]окси}метил)феноксифосфіноїл]-L-аланінату. Розкрито способи лікування або профілактичного запобігання СНІД, причому зазначені способи включають етап уведення людині, що страждає СНІД, терапевтично ефективної кількості солі згідно з винаходом або її гідрату. Короткий опис креслень На Фіг. 1 показаний характеристичний спектр солі малонової кислоти етил-N-[(S)({[(2R,5R)-5(6-аміно-9H-пурин-9-іл)-4-фтор-2,5-дигідрофуран-2-іл]окси}метил)феноксифосфіноїл]-Lаланінату, отриманий способом диференціальної скануючої калориметрії (ДСК). На Фіг. 2 показаний характеристичний спектр солі бурштинової кислоти етил-N[(S)({[(2R,5R)-5-(6-аміно-9H-пурин-9-іл)-4-фтор-2,5-дигідрофуран-2іл]окси}метил)феноксифосфіноїл]-L-аланінату, отриманий способом ДСК. На Фіг. 3 показаний характеристичний спектр солі лимонної кислоти етил-N-[(S)({[(2R,5R)-5(6-аміно-9H-пурин-9-іл)-4-фтор-2,5-дигідрофуран-2-іл]окси}метил)феноксифосфіноїл]-Lаланінату, отриманий способом ДСК. На Фіг. 4 показана характеристична порошкова рентгенограма (ПРД) солі малонової кислоти етил-N-[(S)({[(2R,5R)-5-(6-аміно-9H-пурин-9-іл)-4-фтор-2,5-дигідрофуран-2іл]окси}метил)феноксифосфіноїл]-L-аланінату. На Фіг. 5 показана характеристична порошкова рентгенограма (ПРД) солі бурштинової кислоти етил-N-[(S)({[(2R,5R)-5-(6-аміно-9H-пурин-9-іл)-4-фтор-2,5-дигідрофуран-2іл]окси}метил)феноксифосфіноїл]-L-аланінату На Фіг. 6 показана характеристична порошкова рентгенограма (ПРД) солі кислоти етил-N[(S)({[(2R,5R)-5-(6-аміно-9H-пурин-9-іл)-4-фтор-2,5-дигідрофуран-2іл]окси}метил)феноксифосфіноїл]-L-аланінату. Докладний опис прикладів реалізації винаходу При згадуванні в цьому описі торговельних найменувань, винахід незалежно включає як продукт, що має згадане торговельне найменування, так і активний фармацевтичний інгредієнт (інгредієнти) продукту, що має згадане торговельне найменування. Солі етил-N-[(S)({[(2R,5R)-5-(6-аміно-9H-пурин-9-іл)-4-фтор-2,5-дигідрофуран-2іл]окси}метил)феноксифосфіноїл]-L-аланінату Один аспект цього винаходу відноситься до солей лимонної, бурштинової та малонової кислот (цитрату, сукцинату і малонату) етил-N-[(S)({[(2R,5R)-5-(6-аміно-9H-пурин-9-іл)-4-фтор2,5-дигідрофуран-2-іл]окси}метил)феноксифосфіноїл]-L-аланінату. Сіль лимонної кислоти (цитрат) представлена Формулою I: 3 UA 103329 C2 NH2 N N O O P (S) (S) N O H O O O (R) (E) I N N (R) F HO CO2H HO2C CO2H Сіль бурштинової кислоти (сукцинат) представлена Формулою II: NH2 N N O O P (S) (S) N O H O O O (R) (E) N (R) F II N HO2C CO2H 5 Сіль малонової кислоти (малонат) представлена Формулою III: NH2 N N O O P (S) N O (S) H O O O (R) (E) N (R) F III N CO2H HO2C . 10 15 20 25 30 Спосіб синтезу етил-N-[(S)({[(2R,5R)-5-(6-аміно-9H-пурин-9-іл)-4-фтор-2,5-дигідрофуран-2іл]окси}метил)феноксифосфіноїл]-L-аланінату описано в Прикладі 1 цього опису. Способи одержання солей лимонної, бурштинової й малонової кислот етил-N-[(S)({[(2R,5R)-5-(6-аміно9H-пурин-9-іл)-4-фтор-2,5-дигідрофуран-2-іл]окси}метил)феноксифосфіноїл]-L-аланінату описані, відповідно, у Прикладах 3, 4 і 5 цього опису. Деякі фізичні властивості зазначених солей описані в Прикладі 6 цього опису і показують, наприклад, що кожна із цих солей фізично стабільна при зберіганні при 40°C і відносній вологості 75%. Солі лимонної, бурштинової та малонової кислот етил-N-[(S)({[(2R,5R)-5-(6-аміно-9H-пурин9-іл)-4-фтор-2,5-дигідрофуран-2-іл]окси}метил)феноксифосфіноїл]-L-аланінату придатні, наприклад, для інгібування реплікації ВІЛ in vitro і in vivo. Щодо цього, як більш докладно описано в Прикладі 8 цього опису, етил-N-[(S)({[(2R,5R)-5-(6-аміно-9H-пурин-9-іл)-4-фтор-2,5дигідрофуран-2-іл]окси}метил)феноксифосфіноїл]-L-аланінат являє собою проліки, які при метаболізмі в організмі людини утворюють вихідну сполуку, яка, у свою чергу, зазнає фосфорилювання в організмі, утворюючи активний метаболіт, який інгібує реплікацію ВІЛ. У Прикладі 8 цього опису показано, що етил-N-[(S)({[(2R,5R)-5-(6-аміно-9H-пурин-9-іл)-4-фтор-2,5дигідрофуран-2-іл]окси}метил)феноксифосфіноїл]-L-аланінат викликає більше нагромадження активного метаболіту в білих кров'яних тільцях, тобто клітинах, що містять вірус ВІЛ, у порівнянні з вихідною сполукою. Крім того, у Прикладі 9 цього опису наведені дані, отримані in vitro, що показують, що етил-N-[(S)({[(2R,5R)-5-(6-аміно-9H-пурин-9-іл)-4-фтор-2,5-дигідрофуран2-іл]окси}метил)феноксифосфіноїл]-L-аланінат при аналізах in vitro виявляється могутнішим 4 UA 103329 C2 5 10 15 20 25 30 35 40 45 50 55 60 лікарським засобом проти ВІЛ, ніж вихідна сполука. Крім того, у Прикладі 10 цього опису наведені дані, що показують, що таблетка, яка містить сіль лимонної кислоти етил-N[(S)({[(2R,5R)-5-(6-аміно-9H-пурин-9-іл)-4-фтор-2,5-дигідрофуран-2іл]окси}метил)феноксифосфіноїл]-L-аланінату, доставляє цей лікарський засіб у кровотік собак породи бігль з фармакокінетикою, аналогічною отриманій при пероральному введенні рідкого препарату лікарського засобу. Таким чином, сіль лимонної кислоти етил-N-[(S)({[(2R,5R)-5-(6аміно-9H-пурин-9-іл)-4-фтор-2,5-дигідрофуран-2-іл]окси}метил)феноксифосфіноїл]-L-аланінату являє собою фізично і хімічно стабільну композицію речовини, яка може бути введена перорально живому суб'єктові з метою надання терапевтично ефективної кількості етил-N[(S)({[(2R,5R)-5-(6-аміно-9H-пурин-9-іл)-4-фтор-2,5-дигідрофуран-2іл]окси}метил)феноксифосфіноїл]-L-аланінату, який являє собою більш ефективний засіб проти ВІЛ, ніж вихідна сполука. Фармацевтичні композиції Інший аспект цього винаходу відноситься до фармацевтичних композицій, що також називаються фармацевтичними складами, які містять терапевтично ефективну кількість однієї або більше солей згідно з винаходом, і фармацевтично прийнятний носій або наповнювач. У той час як солі згідно з винаходом можна вводити як такі, звичайно краще їх вводять у вигляді фармацевтичних композицій. Фармацевтичні композиції згідно з винаходом містять традиційні носії і наповнювачі, обирані відповідно до звичайної практики. Носій (носії) повинен бути “прийнятним”, тобто сумісним з іншими інгредієнтами композиції та фізіологічно нешкідливим для реципієнта. Таблетки містять такі компоненти, як допоміжні речовини, речовини, що сприяють ковзанню, наповнювачі, зв'язувальні речовини і подібні їм засоби. Водні композиції готовлять у стерильній формі, і, якщо вони призначені для неперорального введення, звичайно їх готують ізотонічними. Усі композиції можуть містити наповнювачі, наприклад, описані в публікації Handbook of Pharmaceutical Excipients (R.C. Rowe et al., Pharmaceutical Press, 5-те вид., 2006). Наповнювачі включають аскорбінову кислоту та інші антиоксиданти, хелатуючі агенти, наприклад, ЕДТА, вуглеводи, наприклад, декстрин, гідроксиалкілцелюлозу, гідроксиалкілметилцелюлозу, стеаринову кислоту та подібні ним речовини. Показник pH композицій становить приблизно від 3 до приблизно 11, але звичайно приблизно становить від 7 до 10. Композиції зручно виготовляти у вигляді одиничних лікарських форм (наприклад, таблеток), і вони можуть бути виготовлені будь-яким способом, добре відомим у фармакології. Загальний опис методик і композицій, можна знайти в публікації Remington’s Pharmaceutical Sciences (Mack Publishing Co., Easton, PA). Такі способи включають етап змішування активного інгредієнта з носієм, який складається з одного або більше допоміжних інгредієнтів. У загальному випадку, композиції готовлять, рівномірно і ретельно змішуючи активний інгредієнт з рідкими носіями або дрібно роздробленими твердими носіями, або носіями обох типів, після чого, при необхідності, продукт піддають формованню. Фармацевтичні композиції, що містять активний інгредієнт, можуть бути приготовлені в будьякій формі, що придатна для передбачуваного способу введення. Наприклад, для перорального введення можуть бути виготовлені таблетки, драже, пастилки, водні або олійні суспензії, порошки або гранули, що диспергуються, емульсії, тверді або м'які капсули, сиропи або еліксири. Композиції, призначені для перорального введення, можуть бути виготовлені будьяким способом, відомим в галузі техніки для приготування фармацевтичних композицій, і, для одержання прийнятного препарату, такі композиції можуть містити одну або більше речовин, що включають підсолоджувачі, смакові добавки, речовини, що офарблюють, і консерванти. Таблетки, що містять активний інгредієнт у суміші з нетоксичним фармацевтично прийнятним наповнювачем, який придатний для виготовлення таблеток, вважаються прийнятними. Такі наповнювачі можуть являти собою, наприклад, інертні розріджувачі, наприклад, карбонат кальцію або натрію, лактозу, моногідрат лактози, натрій-кроскармелозу, повідон, фосфат кальцію або натрію; засоби, що гранулюють і дезінтегрують, наприклад, маїсовий крохмаль або альгінову кислоту; зв'язувальні речовини, наприклад, целюлозу, мікрокристалічну целюлозу, крохмаль, желатин або камедь; і речовини, що сприяють ковзанню, наприклад, стеарат магнію, стеаринову кислоту або тальк. Таблетки можуть не мати покриття, або мати покриття, нанесене за однією з відомих методик включаючи мікрокапсулювання з метою вповільнення руйнування та абсорбції в шлунково-кишковому тракті і, таким чином, забезпечення дії протягом тривалого часу. Для цієї мети може бути використаний матеріал, що забезпечує вповільнену дію, наприклад, гліцерилмоностеарат або гліцерилдистеарат, як такий або в комбінації з воском. Композиції для перорального введення також можуть бути виготовлені у вигляді желатинових капсул, у яких активний інгредієнт змішаний з інертним твердим розріджувачем, 5 UA 103329 C2 5 10 15 20 25 30 35 40 45 50 55 60 наприклад, фосфатом кальцію або каоліном, або у вигляді м'яких желатинових капсул, у яких активний інгредієнт змішаний з водним або олійним середовищем, наприклад, арахісовою олією, рідким парафіном або маслиновою олією. Водні суспензії солей згідно з цим винаходом містять активні компоненти в суміші з наповнювачами, що придатні для виготовлення водних суспензій. Такі наповнювачі можуть включати суспензуючий агент, наприклад, натрій-карбоксиметилцелюлозу, метилцелюлозу, гідроксипропілметилцелюлозу, альгінат натрію, полівінілпіролідон, трагакантову камедь і аравійську камедь, і диспергуючі або змочувальні агенти, наприклад, природний фосфатид (наприклад, лецитин), продукт конденсації алкіленоксиду і жирної кислоти (наприклад, поліоксиетиленстеарат), продукт конденсації етиленоксиду з довголанцюговим аліфатичним спиртом (наприклад, гептадекаетиленоксицетанол), продукт конденсації етиленоксиду з частковим складним ефіром, отриманим з жирної кислоти та ангідриду гекситу (наприклад, поліоксиетиленсорбітанмоноолеат). Водна суспензія також може містити один або більше консервантів, наприклад, етил- або н-пропіл-п-гідроксибензоат, одну або більше речовин, що офарблюють, одну або більше смакових добавок і один або більше підсолоджувачів, наприклад, сахарозу або сахарин. Олійні суспензії можуть бути приготовлені суспендуванням активного інгредієнта в рослинній олії, наприклад, арахісовій олії, маслиновій олії, конопельній олії або кокосовій олії, або в мінеральній олії, наприклад, рідкому парафіні. Суспензії для перорального введення можуть містити загущувач, наприклад, бджолиний віск, твердий парафін або цетиловий спирт. Для одержання прийнятного смаку в препарат для перорального введення можуть бути додані підсолоджувачі, наприклад, перераховані вище, і смакові добавки. Такі композиції можуть бути законсервовані додаванням антиоксиданту, наприклад, аскорбінової кислоти. У порошках і гранулах, що диспергуються, згідно з винаходом, що придатні для виготовлення водної суспензії при додаванні води, активний інгредієнт перебуває в суміші з диспергуючим або змочувальним агентом, суспензуючим агентом і одним або більше консервантів. Придатні приклади диспергуючих або змочувальних агентів і суспензуючих агентів наведені вище. Препарат також може включати додаткові наповнювачі, наприклад, підсолоджувачі, смакові добавки і речовини, що офарблюють. Фармацевтичні композиції згідно з винаходом також можуть являти собою емульсії типу "олія у воді". Олійна фаза може являти собою рослинну олію, наприклад, маслинову олію або арахісову олію, мінеральну олію, наприклад, рідкий парафін, або суміш зазначених речовин. Придатні емульгатори включають природні камеді, наприклад, аравійську камедь і трагакантову камедь, природні фосфатиди, наприклад, соєвий лецитин, складні ефіри або часткові складні ефіри, отримані з жирних кислот і ангідридів гекситу, наприклад, сорбітанмоноолеат, і продукти конденсації таких часткових складних ефірів з етиленоксидом, наприклад, поліоксиетиленсорбітанмоноолеат. Емульсії також можуть містити підсолоджувачі і смакові добавки. Сиропи та еліксири можуть включати підсолоджувачі, наприклад, гліцерин, сорбіт або сахарозу. Такі композиції також можуть містити болезаспокійливий засіб, консервант, смакову добавку або речовину, що офарблює. Фармацевтичні композиції згідно з винаходом можуть являти собою стерильний препарат для ін’єкцій, наприклад, стерильну водну або олійну суспензію для ін’єкцій. Така суспензія може бути одержана способами, відомими в даній галузі техніки, і включати придатні диспергуючі або змочувальні агенти і суспендуючі агенти, згадані вище. Стерильний препарат, що ін’єціюється, також може являти собою стерильний розчин, що ін’єціюється, або суспензію в нетоксичному розріджувачі або розчиннику, прийнятному для парентерального введення, наприклад, розчин в 1,3-бутандіолі, або він може бути приготовлений у вигляді ліофілізованого порошку. Прийнятними носіями і розчинниками є вода, розчин Рінгера та ізотонічний розчин хлориду натрію. Крім того, як розчинник або суспендуючи середовище можуть бути використані стерильні нелетучі олії, що традиційно застосовуються. Для цієї мети може бути використана будь-яка м'яка (несмачна) нелетуча олія, що включає синтетичні моно- або дигліцериди. Крім того, для приготування препаратів, що ін’єціюються, також можуть бути використані жирні кислоти, наприклад, олеїнова кислота. Кількість активного інгредієнта, яка може бути змішана з матеріалом носія для одержання однієї лікарської форми, може бути різною, наприклад, залежно від обраного способу введення. Наприклад, склад з уповільненим вивільненням, призначений для перорального введення людині, може містити приблизно від 1 до 1000 мг активного матеріалу у комбінації з придатною кількістю матеріалу носія, яка може становити приблизно від 5 до приблизно 95% мас. від загальної маси композиції. Композиції, що придатні для закрапування в очі, включають очні краплі, у яких активний 6 UA 103329 C2 5 10 15 20 25 30 35 40 45 50 55 60 інгредієнт розчинений або суспендований у придатному носії, зокрема, у водному розчиннику для активного інгредієнта. Композиції, що придатні для топічного введення в ротову порожнину, включають таблетки для розсмоктування, що містять активний інгредієнт у смаковій основі, наприклад, сахарозі і трагакантовій камеді або аравійській камеді; пастилки, що містять активний інгредієнт в інертній основі, наприклад, желатині та гліцерині або сахарозі і камеді; і ополіскувачі для порожнини рота, що включають активний інгредієнт у придатному рідкому носії. Композиції для перректального введення можуть бути виготовлені у вигляді супозиторіїв на придатній основі, що включає, наприклад, олію какао або саліцилат. Композиції, що придатні для внутрішньолегеневого або інтраназального введення, включають частинки, розмір яких становить, наприклад, від 0,1 до 500 мікронів (включаючи частинки, розмір яких становить від 0,1 до 500 мікронів з кроком порядку мікрона, наприклад, 0,5, 1, 30 мікрон, 35 мікрон і т.д.), які вводять за допомогою швидкого вдиху через носовий хід або вдиху через рот таким чином, що препарат досягає альвеолярних мішечків. Придатні композиції включають водні або олійні розчини активного інгредієнта. Композиції, що придатні для введення у вигляді аерозолів або сухих порошків, можуть бути отримані традиційними способами і можуть бути введені разом з іншими терапевтичними засобами, наприклад, сполуками, що застосовуються для лікування або профілактики станів, пов'язаних з активністю ВІЛ. Композиції, що придатні для первагінального введення можуть бути виготовлені у вигляді песаріїв, тампонів, кремів, гелів, паст, пінок або спреїв, що містять крім активного інгредієнта придатні носії, відомі в даній галузі техніки. Композиції, що придатні для парентерального введення, включають водні і неводні стерильні розчини для ін'єкцій, які можуть містити антиоксиданти, буферні речовини, бактеріостатичні агенти і розчинені речовини, що надають композиції ізотонічні властивості у порівнянні з кров'ю передбачуваного реципієнта; і водні й неводні стерильні суспензії, які можуть включати суспендуючі агенти та загущувачі. Композиції поміщають в упакування для однократних дозувань або в контейнери для декількох доз, наприклад, у запаяні ампули і флакони; композиції можуть зберігатися у висушеному сублімаційним сушінням (ліофілізованому) стані, і перед використанням у них потрібно додати стерильний рідкий носій, наприклад, воду для ін'єкцій. Розчини і суспензії, що приготовляють для негайного введення, для ін'єкцій готовлять зі стерильних порошків, гранул і таблеток, подібних описаним вище. Кращі стандартні лікарські форми містять добову дозу або стандартну добову суб-дозу або придатну частину стандартної добової дози активного інгредієнта. Таким чином, наприклад, добова доза солі згідно з цим винаходом може бути надана у вигляді однієї таблетки або безлічі таблеток (наприклад, двох або трьох таблеток). Слід зазначити, що крім інгредієнтів, конкретно згаданих вище, композиції згідно з цим винаходом можуть включати інші засоби, що традиційно застосовуються в цій галузі техніки для приготування конкретного складу, наприклад, склади, що придатні для перорального введення, можуть включати смакові добавки. Фармацевтичні композиції, які також входять в обсяг винаходу, забезпечують контрольоване вивільнення активного інгредієнта, що дозволяє рідше робити введення лікарського засобу або поліпшувати фармакокінетичний або токсикологічний профіль активного інгредієнта. Відповідно, винахід також включає фармацевтичні композиції, що містять одну або більше солей згідно з винаходом, що перебувають у складах, придатних для вповільненого або контрольованого вивільнення. Ефективна доза солі згідно з цим винаходом залежить, наприклад, від того, чи використовується сіль для профілактики (звичайно для профілактики використовується менша доза ніж для терапевтичного застосування), від способу доставки і типу фармацевтичної композиції, і може бути визначена лікарем, що лікує, за допомогою традиційних досліджень зі збільшенням дози. Приблизно, ефективна доза становить приблизно від 0,0001 мг/кг маси тіла на добу до приблизно 100 мг/кг маси тіла на добу. Звичайно вона становить приблизно від 0,01 до приблизно 10 мг/кг маси тіла на добу. Частіше вона становить приблизно від 0,01 до приблизно 5 мг/кг маси тіла на добу. Ще частіше вона становить приблизно від 0,05 до приблизно 0,5 мг/кг маси тіла на добу. Наприклад, добова доза для дорослої людини, маса тіла якої становить приблизно 70 кг, звичайно становить від 1 мг до 1000 мг, краще від 5 мг до 500 мг, і може бути введена у вигляді однократного дозування або багаторазових дозувань. Наприклад, доза солі згідно з цим винаходом в стандартній лікарській формі, що вводиться один раз на добу, може становити від 1 мг до 100 мг, наприклад, від 30 мг до 60 мг, наприклад, 30 мг на добу або 60 мг на добу. 7 UA 103329 C2 5 10 15 20 25 30 35 40 45 50 55 60 Комбінована терапія Кожна з названих солей лимонної, бурштинової і малонової кислот етил-N-[(S)({[(2R,5R)-5(6-аміно-9H-пурин-9-іл)-4-фтор-2,5-дигідрофуран-2-іл]окси}метил)феноксифосфіноїл]-Lаланінату може бути введена у комбінації з іншими терапевтичними засобами для лікування або профілактики СНІД і/або одного або більше інших захворювань, наявних у людського суб'єкта, що страждає СНІД (наприклад, бактеріальних і/або грибкових інфекцій, інших вірусних інфекцій, наприклад, гепатиту B або гепатиту C, або ракових захворювань, наприклад, саркоми Капоші). Додатковий терапевтичний засіб (засоби) може бути включено до складу разом з однією або більше солями згідно з цим винаходом (наприклад, включене до складу таблетки). Приклади додаткових терапевтичних засобів, що включають засоби, ефективні при лікуванні або профілактиці вірусних, паразитних або бактеріальних інфекцій або пов'язаних з ними станів, або при лікуванні пухлин або пов'язаних з ними станів, включають 3’-азидо-3’-деокситимідин (зидовудин, AZT), 2’-деокси-3’-тіацитидин (3TC), 2’,3’-дидеокси-2’,3’-дидегідроаденозин (D4A), 2’,3’-дидеокси-2’,3’-дидегидротимідин (D4T), карбовір (карбоциклічний 2’,3’-дидеокси-2’,3’дидегідрогуанозин), 3’-азидо-2’,3’-дидеоксиуридин, 5-фтортимідин, (E)-5-(2-бромвініл)-2’деоксиуридин (BVDU), 2-хлордеоксиаденозин, 2-деоксикоформіцин, 5-фторурацил, 5фторуридин, 5-фтор-2’-деоксиуридин, 5-трифторметил-2’-деоксиуридин, 6-азауридин, 5фтороротову кислоту, метотрексат, триацетилуридин, 1-(2’-деокси-2’-фтор-1-(β-арабінозил)-5йодцитидин (FIAC), тетрагідро-імідазо(4,5,1-jk)-(1,4)-бензодиазепін-2(1H)-тіон (TIBO), 2’-норциклічний GMP, 6-метоксипуринарабінозид (ara-M), 6-метоксипуринарабінозид-2’-O-валерат; цитозинарабінозид (ara-C), 2’,3’-дидеоксинуклеозиди, наприклад, 2’,3’-дидеоксицитидин (ddC), 2’,3’-дидеоксиаденозин (ddA) і 2’,3’-дидеоксиінозин (ddI); aциклічні нуклеозиди, наприклад, ацикловір, пенцикловір, фамцикловір, ганцикловір, HPMPC, PMEA, PMEG, PMPA, PMPDAP, FPMPA, HPMPA, HPMPDAP, (2R,5R)-9-тетрагідро-5-(фосфонометокси)-2-фураніладенін, (2R,5R)-1-тетрагідро-5-(фосфонометокси)-2-фуранілтимін; інші антивірусні засоби, що включають рибавірин (аденінарабінозид), 2-тіо-6-азауридин, туберцидин, ауринтрикарбонову кислоту, 3-деазанеопланоцин, неопланоцин, римантидин, адамантин та фоскарнет (фосфоноформіат тринатрію); антибактеріальні засоби, що включають бактерицидні фторхінолони (ципрофлоксацин, пефлоксацин і подібні їм засоби); аміногликозидні бактерицидні антибіотики (стрептоміцин, гентаміцин, амікацин і подібні їм засоби); інгібітори βлактамази (цефалоспорини, пеніциліни і подібні їм засоби); інші антибактеріальні засоби, що включають тетрациклін, ізоніазид, рифампін, цефоперазон, клаїтроміцин і азитроміцин, протипаразитні або протигрибкові засоби, що включають пентамідин (1,5-біс(4’амінофенокси)пентан), 9-деазаїнозин, сульфаметоксазол, сульфадиазин, хінапірамін, хінін, флуконазол, кетоконазол, ітраконазол, амфотерицин B, 5-фторцитозин, клотримазол, гексадецилфосфохолін і ністатин; інгібітори екскреції із сечею, наприклад, пробеніцид; інгібітори транспорту нуклеозидів, наприклад, дипіридамол, дилазеп і нітробензилтіоінозин, імуномодулятори, наприклад, FK506, циклоспорин A, тімозин α-1; цитокіни, що включають TNF і TGF-β; інтерферони, що включають IFN-α, IFN-β, і IFN-γ; інтерлейкіни, що включають різні інтерлейкіни, фактори, що стимулюють ріст колоній макрофагів/гранулоцитів, що включають GM-CSF, G-CSF, M-CSF, антагоністи цитокінів, що включають анти-TNF антитіла, антиінтерлейкінові антитіла, розчинні інтерлейкінові рецептори, інгібітори протеїнкінази C і подібні їм засоби. Приклади придатних активних терапевтичних засобів або інгредієнтів, які можна використовувати в комбінації з солями згідно з цим винаходом, що мають активність проти ВІЛ, включають 1) інгібітори протеази ВІЛ, наприклад, ампренавір, атазанавір, фосампренавір, індинавір, лопінавір, ритонавір, лопінавір + ритонавір, нелфінавір, сакінавір, тіпранавір, бреканавір, дарунавір, TMC-126, TMC-114, мозенавір (DMP-450), JE-2147 (AG1776), AG1859, DG35, L-756423, RO0334649, KNI-272, DPC-681, DPC-684, і GW640385X, DG17, PPL-100, 2) ненуклеозидні інгібітори зворотної транскриптази ВІЛ, наприклад, каправірин, емівірин, делавіридин, ефавіренц, невірапін, (+) каланолід A, етравірин, GW5634, DPC-083, DPC-961, DPC-963, MIV-150 і TMC-120, TMC-278 (рилпівірин), ефавіренц, BILR 355 BS, VRX 840773, UK453,061, RDEA806, 3) нуклеозидні інгібітори зворотної транскриптази ВІЛ, наприклад, зидовудин, емтрицитабін, диданозин, ставудин, зальцитабін, ламівудин, абакавір, амдоксовір, елвуцитабін, аловудин, MIV-210, рацивір (-FTC), D-d4FC, емтрицитабін, фосфазид, фозивудин тідоксил, фозальвудин тідоксил, apricitibine (AVX754), амдоксовір, KP-1461, абакавір + ламівудин, абакавір + ламівудин + зидовудин, зидовудин + ламівудин, 4) нуклеотидні інгібітори зворотної транскриптази ВІЛ, наприклад, тенофовір, тенофовір дизопроксилфумарат + емтрицитабін, тенофовір дизопроксилфумарат + емтрицитабін + ефавіренц і адефовір, 5) інгібітор інтегрази ВІЛ, наприклад, курикумін, похідні курикуміну, цикорієву кислоту ((2R,3R)-2,3 8 UA 103329 C2 5 10 15 20 25 30 35 40 45 50 55 60 біс{[(E)-3-(3,4-дигідроксифеніл)проп-2-еноїл]окси}бутандіову кислоту), похідні цикорієвої кислоти, (1S,3R,4R,5R)-3-{[(2Z)-3-(3,4-дигідроксифеніл)проп-2-еноїл]окси}-1,4,5тригідроксициклогексанкарбонову (3,5-dicaffeoylquinic) кислоту, похідні (1S,3R,4R,5R)-3-{[(2Z)-3(3,4-дигідроксифеніл)проп-2-еноїл]окси}-1,4,5-тригідроксициклогексанкарбонової кислоти, ауринтрикарбонову кислоту, похідні ауринтрикарбонової кислоти, фенетиловий ефір кофеїнової (3-(3,4-дигідроксифеніл-2-пропенової) кислоти, похідні фенетилового ефіру кофеїнової кислоти, тирфостин, похідні тирфостину, кверцетин, похідні кверцетину, S-1360, зинтевір (zintevir) (AR177), L-870812 і L-870810, MK-0518 (ралтегравір), BMS-707035, MK-2048, BA-011, BMS-538158, GSK364735C, 6) інгібітор gp41, наприклад, енфувіртид, сіфувіртид, FB006M, TRI-1144, SPC3, DES6, Locus gp41, CovX і REP 9, 7) інгібітор CXCR4, наприклад, AMD-070, 8) інгібітор проникнення в клітину, наприклад, SPO1A, TNX-355, 9) інгібітор gp120, наприклад, BMS-488043 і Blockaide/CR, 10) інгібітори G6PD і NADH-оксидази, наприклад, імунітин, 10) інгібітор CCR5, наприклад, аплавірок, викривірок, INCB9471, PRO-140, INCB15050, PF-232798, CCR5mab004 і маравірок, 11) інтерферон, наприклад, пегільований rIFN-альфа 2b, пегільований rIFN-альфа 2a, rIFN-альфа 2b, IFN альфа-2b XL, rIFN-альфа 2a, консенсусний IFN альфа, інферген, ребіф, локтерон, AVI-005, PEG-інферген, пегільований IFN-бета, інтерферон альфа для перорального введення, ферон, реаферон, інтермакс альфа, r-IFN-бета, інферген + актімун, IFN-омега з DUROS і альбуферон, 12) аналоги рибавірину, наприклад, ребетол, копегус, левовірин, VX-497 і вірамідин (тарибавірин) 13) інгібітори NS5a, наприклад, A-831 і A-689, 14) інгібітори NS5b полімерази, наприклад, NM-283, валопіцитабін, R1626, PSI-6130 (R1656), HIV-796, BILB 1941, MK-0608, NM-107, R7128, VCH-759, PF-868554, GSK625433 і XTL-2125, 15) інгібітори NS3 протеази, наприклад, SCH-503034 (SCH-7), VX-950 (Телапревір), ITMN-191 і BILN-2065, 16) інгібітори альфа-глюкозидази 1, наприклад, MX-3253 (целгосивір) і UT-231B, 17) засоби захисту печінки, наприклад, IDN-6556, ME 3738, MitoQ і LB-84451, 18) ненуклеозидні інгібітори ВІЛ, наприклад, похідні бензімідазолу, похідні бензо-1,2,4-тіадіазину і похідні фенілаланіну, 19) інші лікарські засоби для лікування ВІЛ, наприклад, задаксин,нітазоксанід (алінеа), BIVN-401 (віростат), DEBIO-025, VGX-410C, EMZ-702, AVI 4065, бавітуксимаб, оглуфанід, PYN-17, KPE02003002, актилон (CPG-10101), KRN-7000, цивацир, GI-5005, ANA-975 (ізаторібін), XTL6865, ANA 971, NOV-205, тарвацин, EHC-18 і NIM811, 19) підсилювачі (енхансери) фармакокінетики, наприклад, BAS-100 і SPI452, 20) інгібітори РНКази H, наприклад, ODN-93 і ODN-112, 21) інші анти-ВІЛ засоби, наприклад, VGV-1, PA-457 (бевіримат), ампліген, HRG214, цитолін, полімун, VGX-410, KD247, AMZ 0026, CYT 99007, A-221 ВІЛ, BAY 50-4798, MDX010 (іплімумаб), PBS119, ALG889 і PA-1050040. Нижче як приклад перераховані деякі антивірусні засоби, ефективні проти ВІЛ, і номера патентів США, що їм відповідають, які можна використовувати у комбінації з солями згідно з цим винаходом. Приклади антивірусних засобів, ефективних проти ВІЛ, і відповідні номери патентів США Зіаген (Абакавір сульфат, US 5034394) Епзиком (Абакавір сульфат/ламівудин, US 5034394) Гепсера (Адефовір дипівоксил, US 4724233) Агенераза (Ампренавір, US 5646180) Рейатаз (Атазанавір сульфат, US 5849911) Рескриптор (Делавіридин мезилат, US 5563142) Хівід (Дидеоксицитидин; Зальцитабін, US 5028595) Відекс (Дидеоксиінозин; Диданозин, US 4861759) Сустива (Ефавіренц, US 5519021) Емтрива (Емтрицитабін, US 6642245) Лексива (Фосампренавір кальцію, US 6436989) Вірудин; Триаптен; Фоскавір (Фоскарнет натрію, US 6476009) Криксиван (Індинавір сульфат, US 5413999) Епівір (Ламівудин, US 5047407) Комбівір (Ламівудин/Зидовудин, US 4724232) Алувіран (Лопінавір) Калетра (Лопінавір/ритонавір, US 5541206) Вірацепт (Нелфінавір мезилат, US 5484926) Вірамун (Невірапін, US 5366972) Хопвір (Ритонавір, US 5541206) Інвіраза; Фортоваза (Сакінавір мезилат, US 5196438) Церит (Ставудин, US 4978655) Трувада (Тенофовір дизопроксил фумарат/емтрицитабін, US 5210085) 9 UA 103329 C2 5 10 15 20 25 Аптивус (Тіпранавір) Ретровір (Зидовудин; Азидотімідин, US 4724232) Способи інгібування ВІЛ Розкрито способи лікування Синдрому Набутого Імунодефіциту (СНІД), де кожний зі способів включає етап введення людині, що страждає СНІД, терапевтично ефективної кількості солі згідно з винаходом або гідрату солі згідно з винаходом. Лікування СНІД включає зниження щонайменше одного симптому СНІД і/або вповільнення або запобігання прогресуванню захворювання. Звичайно терапевтично ефективну кількість солі, вводять людині у вигляді фармацевтичної композиції, описаної в розділі “Фармацевтичні композиції”. Звичайно, фармацевтичну композицію вводять перорально, наприклад, у вигляді таблетки. Прикладами терапевтично ефективних добових доз однієї або більше солей згідно з винаходом або їх гідратів є від 1 мг до 100 мг, наприклад, від 10 мг до 30 мг. Солі згідно з винаходом можна вводити щодоби, наприклад, у вигляді однієї або більше таблеток, які містять кількість солі, що відповідає ефективній кількості, наприклад, 10 мг або 30 мг або 60 мг вільної основи при дисоціації солі у водному середовищі людського організму. Способи введення Одну або більше солей згідно з винаходом вводять будь-яким способом, що придатний для лікування наявного стану. Придатні способи введення включають пероральне, перректальне, перназальне, топічне (включаючи букальне і сублінгвальне), первагінальне і парентеральне (включаючи підшкірне, внутрішньом'язове, внутрішньовенне, внутрішньошкірне, інтратекальне і епідуральне) введення і подібні їм способи. Слід зазначити, що кращий спосіб може залежати, наприклад, від стану реципієнта. Перевага солей згідно з цим винаходом полягає в тому, що вони мають біодоступність при пероральному введенні та можуть бути введені перорально. Приклади і варіанти реалізації Приклад 1. Синтез етил-N-[(S)({[(2R,5R)-5-(6-аміно-9H-пурин-9-іл)-4-фтор-2,5-дигідрофуран2-іл]окси}метил)феноксифосфіноїл]-L-аланінату. O BzO F Br (2) BzO 30 35 40 2-деокси-2-фтор-3,5-ди-O-бензоїл-a-D-арабінофуранозилбромід (2) Сполуку (2) було синтезовано у відповідності зі схемами синтезу, описаними в публікаціях Tann et. al., JOC, 1985, тому 50 стор. 3644 і Howell et. al., JOC, 1988, том 53, стор. 85. До розчину 1,3,5-три-O-бензоїл-2-деокси-2-фтор-альфа-D-арабінофуранози (1) (120 г, 258 ммоль), що поставляється Davos або CMS Chemicals, в CH 2C12 (1 л) додавали 33% HBr/оцтову кислоту (80 мл). Суміш перемішували при кімнатній температурі протягом 16 год, охолоджували льодом з водою і повільно нейтралізували протягом 1-2 год додаванням NaHCO3 (150 г/ 1.5 л розчину). Фазу CH2C12 відокремлювали і концентрували під зменшеним тиском. Залишок розчиняли в етилацетаті і промивали NaHCO3 до повного видалення кислоти. Органічну фазу сушили над MgSO4, фільтрували та концентрували під зменшеним тиском, одержуючи продукт 2 у вигляді жовтої олії (~115 г). Cl N O BzO N F BzO 45 N N (3) 2-деокси-2-фтор-3, 5-ди-O-бензоїл-β-D-арабінофуранозил-9H-6-хлорпурин (3) Сполуку (3) було синтезовано у відповідності зі схемами синтезу, описаними в публікаціями Ma et. al.,J. Med. Chem., 1997, тому 40, стор. 2750; Marquez et. al., J. Med. Chem., 1990, тому 33, стор. 978; Hildebrand et. al., J. Org. Chem., 1992, тому 57, стор. 1808 і Kazimierczuk et. al., JACS, 1984, том 106, стор. 6379. 10 UA 103329 C2 5 До суспензії NaH (14 г, 60%) в ацетонітрилі (900 мл) 3 порціями додавали 6-хлорпурин (52.6 г). Суміш перемішували при кімнатній температурі протягом 1,5 год. Додавали по краплях розчин 2 (258 ммоль) в ацетонітрилі (300 мл). Отриману суміш перемішували при кімнатній температурі протягом 16 год. Реакцію гасили оцтовою кислотою (3,5 мл), фільтрували та концентрували під зменшеним тиском. Залишок розділяли між CH 2C12 і водою. Органічну фазу сушили над MgSO4, фільтрували та концентрували. Залишок обробляли CH2C12 і потім EtOH (~1:2 у загальному) для осадження цільового продукту 3 у вигляді жовтуватої твердої речовини (83 г, 65% з 1). OMe N O HO N F HO 10 15 N N (4) 2-деокси-2-фтор-β-D-арабінофуранозил-6-метоксиаденін (4) До суспензії 3 (83 г, 167 ммоль) у метанолі (1 л) при 0°C додавали NaOMe (25% мас., 76 мл). Суміш перемішували при кімнатній температурі протягом 2 год, і потім гасили оцтовою кислотою (~ 11 мл, pH=7). Суміш концентрували під зменшеним тиском, і отриманий залишок розділяли між гексаном і водою (приблизно 500 мл гексану і 300 мл води). Водний шар відокремлювали, і органічний шар знову змішували з водою (приблизно 300 мл). Водні фракції поєднували і концентрували під зменшеним тиском до ~100 мл. Випадав продукт 4, який збирали фільтруванням (42 г, 88%). 20 OMe N N O O HO 30 35 N F HO 25 N (5) 2-деокси-2-фтор-5-карбокси-β-D-арабінофуранозил-6-метоксиаденін (5) Сполуку (5) було синтезовано у відповідності зі схемами синтезу, описаними в публікації Moss et. al., J. Chem. Soc., 1963, стор. 1149. Суміш Pt/C (10%, 15 г (20-30% мол. екв.) у вигляді суспензії у воді) і NaHCO 3 (1.5 г, 17.94 ммоль) в H2O (500 мл) перемішували при 65°C в атмосфері H2 протягом 0,5 год. Потім реакційну суміш залишили охолоджуватися, поміщали у вакуум і кілька разів продували N 2 для повного видалення H2. Потім при кімнатній температурі додавали сполуку 4 (5,1 г, 17.94 ммоль). Реакційну суміш перемішували при 65°C в атмосфері O 2 (еластичний балон) до завершення реакції за даними РХ-МС (звичайно 24-72 год). Суміш охолоджували до кімнатної температури і фільтрували. Каталізатор Pt/C ретельно промивали H 2O. Об'єднані фільтрати концентрували до ~30 мл і підкисляли (pH 4) додаванням HCl (4н) при 0°C. Випадала чорна тверда речовина, яку збирали фільтруванням. Неочищений продукт розчиняли в мінімальній кількості метанолу і фільтрували через шар силікагелю (як елюент використовували метанол). Фільтрат концентрували і кристалізували з води, одержуючи сполуку 5 (2,5 г) у вигляді білуватої твердої речовини. 11 UA 103329 C2 OMe N N O EtO P N O O N F EtO (6) I 5 10 15 20 25 30 (2’R, 3’S, 4’R, 5’R)-6-Метокси-9-[тетрагідро 4-йод-3-фтор-5-(диетоксифосфініл)метокси-2фураніл]пурин (6) Сполуку (6) було синтезовано у відповідності зі схемами синтезу, описаними в публікації Zemlicka et. al., J. Amer. Chem., Soc., 1972, том 94, стор. 3213. До розчину 5 (22 г, 73.77 ммоль) у ДМФА (400 мл), додавали ДМФА динеопентилацеталь (150 мл, 538 ммоль) і метансульфонову кислоту (9,5 мл, 146,6 ммоль). Реакційну суміш перемішували при 80-93°C (внутрішня температура) протягом 30 хвилин, потім охолоджували до кімнатної температури і концентрували під зменшеним тиском. Залишок розділяли між етилацетатом і водою. Органічну фазу відокремлювали і промивали NaHCO 3 потім розсолом, сушили над MgSO4, фільтрували та концентрували під зменшеним тиском. Залишок і диетил(гідроксиметил)фосфонат (33 мл, 225 ммоль) розчиняли в CH2C12 (250 мл) і охолоджували до -40°C. Додавали по краплях розчин моноброміду йоду (30,5 г, 1,1 моль) в CH2C12 (100 мл). Суміш перемішували при -20 до -5°C протягом 6 год. Реакцію потім гасили NaHCO3 і Na2S2O3. Органічну фазу відокремлювали, і водну фазу екстрагували CH2C12. Об'єднані органічні фази промивали соляним розчином, сушили над MgSO 4, фільтрували та концентрували під зменшеним тиском. Залишок очищали хроматографією на силікагелі, одержуючи продукт 6 (6 г, 15.3%). Альтернативний спосіб синтезу 6 Розчин 5 (2.0 г, 6,7 ммоль) у ТГФ (45 мл) обробляли трифенілфосфіном (2,3 г, 8,7 ммоль) в атмосфері N2. Повільно додавали диізопропілазодикарбоксилат (1,8 г, 8,7 ммоль). Отриману суміш перемішували при кімнатній температурі протягом 1 год і потім концентрували під зменшеним тиском досуха. Залишок розчиняли в CH 2C12 (20 мл), і потім обробляли диетил(гідроксиметил)фосфонатом (4.5 г, 27 ммоль). Суміш охолоджували до -60°C і потім додавали холодний розчин моноброміду йоду (2 г, 9.6 ммоль) в CH 2C12 (10 мл). Реакційну суміш нагрівали до -10°C і потім витримували при -10°C протягом 1 год. Реакційну суміш розбавляли CH2C12, промивали насиченим водним NaHCO3, і потім водяним розчином тіосульфату натрію. Органічну фазу відокремлювали, сушили над MgSO 4 і концентрували під зменшеним тиском досуха. Реакційну суміш очищали хроматографією на силікагелі (елюювання проводили, використовуючи 25% етилацетату в CH 2C12, потім заміняючи на 3% метанол в CH2C12), одержуючи продукт 6 (0,9 г, 33 %). OMe N N O EtO P O N O N EtO F (7) 35 40 (2’R, 5’R)-6-Метокси-9-[3-фтор-2,5-дигідро-5-(диетоксифосфініл)метокси-2-фураніл]пурин (7) До розчину сполуки 6 (6 г, 11,3 ммоль) в оцтовій кислоті (2,5 мл) і метанолі (50 мл), додавали по краплях NaClO (10-13%) (50 мл). Реакційну суміш потім перемішували протягом 0,5 год і концентрували під зменшеним тиском. Залишок обробляли етилацетат і потім фільтрували для видалення твердих речовин. Фільтрат концентрували, і залишок очищали хроматографією на силікагелі, одержуючи продукт 7 (4 г, 88%). 12 UA 103329 C2 NH2 N N O +Na-O P O N O N +Na-O F 5 10 (8) (2’R, 5’R)-9-(3-фтор-2,5-дигідро-5-фосфонометокси-2-фураніл)аденін, динатрієва сіль (8) Розчин сполуки 7 (2,3 г, 5,7 ммоль) у метанолі (6 мл) змішували з гідроксидом амонію (2830%) (60 мл). Отриману суміш перемішували при 120°C протягом 4 год, охолоджували, і потім концентрували під зменшеним тиском. Залишок сушили у вакуумі протягом 12 год. Залишок розчиняли в ДМФА (40 мл) і додавали бромтриметилсилан (3,5 мл). Суміш перемішували при кімнатній температурі протягом 16 год, і потім концентрували під зменшеним тиском. Залишок розчиняли у водному NaHCO3 (2,3 г в 100 мл води). Розчин випаровували, і залишок очищали на колонці C-18 (40 мкм), елюювання проводили водою. Водні фракції сушили сублімаційним сушінням, одержуючи динатрієву сіль 8 (1,22 г, 57%). NH2 N O O N O HN N O O P N O F 15 20 25 (9) Приклад синтезу моноамідату (9) Динатрієву сіль 8 (25 мг, 0,066 ммоль), гідрохлорид (S)-Ala-O-циклобутилового ефіру (24 мг, 2 екв., 0,133 ммоль) і фенол (31 мг, 0,333 ммоль) змішували в безводному піридині (1 мл). Додавали триетиламін (111 мкл, 0,799 ммоль), і отриману суміш перемішували при 60°C в атмосфері азоту. В окремій колбі розчиняли в безводному піридині (0,5 мл) 2’-Aldrithiol (122 мг, 0,466 ммоль) і трифенілфосфін (103 мг, 0,466 ммоль), і отриманий жовтий розчин перемішували протягом 15-20 хв. Розчин потім додавали до розчину 8 однією порцією. Об'єднані суміші перемішували при 60°C в атмосфері азоту протягом 16 год, одержуючи прозорий розчин від жовтого до ясно-коричневого кольору. Суміш потім концентрували під зменшеним тиском. Отриману олію розчиняли в CH2C12 і очищали хроматографією на силікагелі (елюлюють лінійним градієнтом від 0 до 5% MeOH в CH 2C12), одержуючи олію. Отриману олію розчиняли в ацетонітрилі і воді та очищали препаративною РХВР (лінійний градієнт, 5-95% ацетонітрил у воді). Чисті фракції поєднували і сушили сублімаційним сушінням, одержуючи моноамідат 9 у вигляді білого порошку. NH2 N O O N O HN P O N O N NH O O F (10) 30 Приклад синтезу біс-амідату (10) Динатрієву сіль 8 (12 мг, 0,032 ммоль) і гідрохлориду ефіру (S)-Ala-O-n-Pr (32 мг, 6 екв., 0,192 ммоль) змішували в безводному піридині (1 мл). Додавали триетиламін (53 мкл, 0,384 ммоль), і отриману суміш перемішували при 60°C в атмосфері азоту. В окремій колбі в 13 UA 103329 C2 5 безводному піридині (0,5 мл) розчиняли 2’-Aldrithiol (59 мг, 0,224 ммоль) і трифенілфосфін (49 мг, 0,224 ммоль), і отриманий жовтий розчин перемішували протягом 15-20 хв. Розчин потім додавали однією порцією до розчину 8. Об'єднані суміші перемішували при 60°C в атмосфері азоту протягом 16 год, одержуючи прозорий розчин від жовтого до ясно-коричневого кольору. Суміш потім концентрували під зменшеним тиском. Отриману олію розчиняли в CH2C12, і очищали хроматографією на силікагелі (елюлюють лінійним градієнтом від 0 до 5% MeOH в CH2C12), одержуючи олію. Отриману олію розчиняли в ацетонітрилі і воді та очищали препаративною РХВР (лінійний градієнт, 5-95% ацетонітрил у воді). Чисті фракції поєднували і сушили сублімаційним сушінням, одержуючи біс-амідат у вигляді білого порошку. NH2 N N O P* EtO O N H O N O N O F 10 15 20 25 30 35 (11) Приклад синтезу моноамідату (11) Сполуку 8 (1.5 г, 4 ммоль) змішували з HCl сіллю етилового ефіру аланіну (1,23 г, 8 ммоль) і фенолом (1,88 г, 20 ммоль). Додавали безводний піридин (35 мл) і потім ТЕА (6,7 мл, 48 ммоль). Суміш перемішували при 60°C в атмосфері азоту протягом 15-20 хв. 2’-Aldrithiol (7,3 г) змішували в окремій колбі із трифенілфосфіном (6,2 г) у безводному піридині (5 мл), і отриману суміш перемішували протягом 10-15 хв, одержуючи прозорий ясно-жовтий розчин. Розчин потім додавали до отриманої раніше суміші і перемішували протягом ночі при 60°C. Суміш концентрували під зменшеним тиском для видалення піридину. Отриманий залишок розчиняли в етилацетаті і промивали насиченим розчином бікарбонату натрію (2x) і потім насиченим розчином хлориду натрію. Органічний шар сушили над сульфатом натрію, фільтрували і потім концентрували під зменшеним тиском. Отриману олію розчиняли в дихлорметані і завантажували на суху колонку CombiFlash, 40 г, елюлюють лінійним градієнтом 0-5% метанолу в дихлорметані протягом 10 хвилин і потім 5% метанолу в дихлорметані протягом 7-10 хвилин. Фракції, що містять цільовий продукт, поєднували і концентрували під зменшеним тиском, одержуючи піну. Піну розчиняли в ацетонітрилі та очищали препаративною РХВР, одержуючи 11 (0,95 г). Речовину 11 (950 мг) розчиняли в невеликій кількості ацетонітрилу і залишали при кімнатній температурі на ніч. Тверду речовину збирали фільтруванням і промивали невеликою кількістю ацетонітрилу. Фільтрат випаровували у вакуумі і потім завантажували на колонку Chiralpak ASH, урівноважену Буфером A, 2% етанолом в ацетонітрилі. Ізомер A, 12, елюлюювали Буфером A при швидкості 10 мл/хв протягом 17 хвилин. Після цього Буфер B, що представляє собою 50% розчин метанолу в ацетонітрилі, використовували для того щоб виділити ізомер B, 13, з колонки шляхом елюювання протягом 8 хвилин. Усі розчинники видаляли і потім ізомери повторно розчиняли окремо в ацетонітрилі та воді. Зразки сушили окремо сублімаційним сушінням (маса - 348 мг). Ізомер 12 представлений нижче. O EtO O N HN P O O N NH2 PhO N N F (12) 40 Приклад 2. Оцінка сольових форм етил-N-[(S)({[(2R,5R)-5-(6-аміно-9H-пурин-9-іл)-4-фтор2,5-дигідрофуран-2-іл]окси}метил)феноксифосфіноїл]-L-аланінату 14 UA 103329 C2 5 10 15 20 25 30 35 40 45 50 55 60 Для оцінки здатності кислот утворювати придатні кристалічні солі етил-N-[(S)({[(2R,5R)-5-(6аміно-9H-пурин-9-іл)-4-фтор-2,5-дигідрофуран-2-іл]окси}метил)феноксифосфіноїл]-L-аланінату досліджували наступні кислоти: Мінеральні кислоти (HX, де X = галоген; H3PO4); органічні сульфонові кислоти (RSO 3H, де R = Me, Et, PH, (t)-камфор-10-сульфонову кислоту; нафталін-2сульфонову кислоту; нафталін-1,5-дисульфонову кислоту); монокарбонові кислоти (RCO 2H, де R = H, Me, Et, Ph, транс-PhCH=CH, Cl2CH, PhCONHCH2), і дикарбонові кислоти (малонову, бурштинову, фумарову, адипінову, щавлеву, малеїнову). Тверді речовини були отримані при змішуванні Етил-N-[(S)({[(2R,5R)-5-(6-аміно-9H-пурин-9іл)-4-фтор-2,5-дигідрофуран-2-іл]окси}метил)феноксифосфіноїл]-L-аланінату з трьома з вищевказаних кислот, а саме з трифтороцтовою кислотою, малоновою кислотою і бурштиновою кислотою. Трифтороцтова кислота, однак, вважається фармацевтично неприйнятною. Етил-N-[(S)({[(2R,5R)-5-(6-аміно-9H-пурин-9-іл)-4-фтор-2,5-дигідрофуран-2іл]окси}метил)феноксифосфіноїл]-L-аланінат являє собою амідатні проліки, які зазнають розкладання в протонних розчинниках у кислотному або лужному середовищі. З цієї причини, кислоти, що містять потенційно нуклеофільні фрагменти, не були включені в перший етап оцінки. Потім була проведена оцінка солей лимонної кислоти, гліколевої кислоти, (S)-(+)- молочної кислоти, саліцилової кислоти, (S)-(-)-яблучної кислоти, (S)-(+)-мигдальної кислоти і (S)-(+)глютамінової кислоти. Зненацька було виявлено, що етил-N-[(S)({[(2R,5R)-5-(6-аміно-9H-пурин9-іл)-4-фтор-2,5-дигідрофуран-2-іл]окси}метил)феноксифосфіноїл]-L-аланінат утворює стабільну кристалічну сіль з лимонною кислотою. Цей результат був несподіваним, оскільки лимонна кислота включає гідроксильну групу, яка може діяти як нуклеофіл відносно амідатного фрагменту етил-N-[(S)({[(2R,5R)-5-(6-аміно-9H-пурин-9-іл)-4-фтор-2,5-дигідрофуран-2іл]окси}метил)феноксифосфіноїл]-L-аланінату, і потенційно здатна реагувати з ним з утворенням ковалентного зв'язку між Етил-N-[(S)({[(2R,5R)-5-(6-аміно-9H-пурин-9-іл)-4-фтор-2,5дигідрофуран-2-іл]окси}метил)феноксифосфіноїл]-L-аланінатом і гідроксильною групою лимонної кислоти з відщепленням або фенолу, або етилового ефіру аланіну. Приклад 3. Синтез малонової солі етил-N-[(S)({[(2R,5R)-5-(6-аміно-9H-пурин-9-іл)-4-фтор2,5-дигідрофуран-2-іл]окси}метил)феноксифосфіноїл]-L-аланінату Етил-N-[(S)({[(2R,5R)-5-(6-аміно-9H-пурин-9-іл)-4-фтор-2,5-дигідрофуран-2іл]окси}метил)феноксифосфіноїл]-L-аланінат у вигляді вільної основи розчиняли в теплому 2бутаноні (15 частин), і додавали при перемішуванні малонову кислоту (0,26 частин), одержуючи розчин. До цього розчину додавали гептан (5 частин) і повільно охолоджували приблизно до 5°C, осад збирали і промивали холодним 2-бутаноном/гептаном. Цільовий малонат етил-N[(S)({[(2R,5R)-5-(6-аміно-9H-пурин-9-іл)-4-фтор-2,5-дигідрофуран-2іл]окси}метил)феноксифосфіноїл]-L-аланінату був отриманий з виходом приблизно 80%. 1 Спектр ЯМР солі малонової кислоти має наступні характеристики: H ЯМР (400МГц, хлороформ-d) м.д. = 8.27 (s, 1 H), 8.26 (s, 1 H), 7.32-7.20 (m, 3 H), 7.15 (d, J= 7.8 Гц, 2 H), 6.78 (m, 1 H), 5.88 (br. s., 1 H), 5.78 (s, 1 H), 4.17 (m, 2 H), 4.15-4.07 (m, 3 H), 3.85 (dd, J=8.0, 8.0, 1 H), 3.38 (s, 2 H), 1.31 (d, J= 7.0 Гц, 3 H), 1.23 (t, J= 7.0 Гц, 3 H) 31 P ЯМР (162 МГц, хлороформ-d) м.д. = 20.64 (s) 19 F ЯМР (376 МГц, ацетонітрил-d3) м.д. = -135.19 (s) Приклад 4. Синтез солі бурштинової кислоти етил-N-[(S)({[(2R,5R)-5-(6-аміно-9H-пурин-9-іл)4-фтор-2,5-дигідрофуран-2-іл]окси}метил)феноксифосфіноїл]-L-аланінату. Етил-N-[(S)({[(2R,5R)-5-(6-аміно-9H-пурин-9-іл)-4-фтор-2,5-дигідрофуран-2іл]окси}метил)феноксифосфіноїл]-L-аланінат у вигляді вільної основи розчиняли в теплому 2бутаноні (15 частин), і додавали при перемішуванні бурштинову кислоту (0,28 частин) одержуючи розчин. Розчин повільно охолоджували до приблизно 5°C, осад збирали і промивали холодним 2-бутаноном/гептаном, одержуючи сукцинат етил-N-[(S)({[(2R,5R)-5-(6аміно-9H-пурин-9-іл)-4-фтор-2,5-дигідрофуран-2-іл]окси}метил)феноксифосфіноїл]-L-аланінату з виходом 80%. 1 Спектр ЯМР солі бурштинової кислоти має наступні характеристики: H ЯМР (400МГц, ацетонітрил-d3) м.д. = 8.26 (s, 1H), 8.15 (s, 1 H), 7.29 (dd, J = 7.6, 7.6 Гц, 2 H), 7.16 (d, J = 7.6 Гц, 1 H), 7.12 (d, J = 8.0 Гц, 2 H), 6.78 (in, 1 H), 6.17 (br s, 1H), 5.89 (m, 2 H), 4.12 - 3.95 (німультиплети, що перекриваються, 6 H), 2.53 (s, 4 H), 1.24 (d, J= 6.8, 3 H), 1.18 (t, J= 7.2, 3 H). 31 P ЯМР (162 МГц, Ацетонітрил-d3) м.д. = 21.60 (s) 19 F ЯМР (376 МГц, Ацетонітрил-d3) м.д. = -135.19 (s) Приклад 5. Синтез солі лимонної кислоти Етил-N-[(S)({[(2R,5R)-5-(6-аміно-9H-пурин-9-іл)-4фтор-2,5-дигідрофуран-2-іл]окси}метил)феноксифосфіноїл]-L-аланінату. Етил-N-[(S)({[(2R,5R)-5-(6-аміно-9H-пурин-9-іл)-4-фтор-2,5-дигідрофуран-2 15 UA 103329 C2 5 10 15 20 25 іл]окси}метил)феноксифосфіноїл]-L-аланінат у вигляді вільної основи (приблизно 30 г) розчиняли в гарячому ацетонітрилі (16 частин) і при перемішуванні додавали лимонну кислоту (0,38 частин). Отриманий розчин повільно охолоджували до приблизно 5°C, осад збирали, промивали холодним ацетонітрилом і сушили, одержуючи цитрат етил-N-[(S)({[(2R,5R)-5-(6аміно-9H-пурин-9-іл)-4-фтор-2,5-дигідрофуран-2-іл]окси}метил)феноксифосфіноїл]-L-аланінату з виходом приблизно 84%. 1 Спектр ЯМР солі лимонної кислоти має наступні характеристики: H ЯМР (400МГц, ДМСОd6) м.д. = 8.20 (s, 2H), 7.45 (2H, br s), 7.29 (dd, J = 7.6, 7.6 Гц, 2 H), 7.13 (dd, J = 7.2 Гц, J = 7.2 Гц 1 H), 7.12 (dd, J = 8.0 Гц, J = 8.0 Гц 2 H), 6.86 (d, J = 2.4 Гц, 1H), 6.14 (s, 1H), 5.97 (d, J = 3.6 Гц, 1 1H), 5.78 (dd, J = 12.2, 10.4 Гц, 1H), 4.05 (m, 1H), 4.02 (m, 2H), 3.98 (m, 1H), 3.89 (m, H), 2.76 (d, J = 15.6 Гц, 2H), 2.66 (d, J = 15.6 Гц, 2H), 1.16 (d, J = 7.2 Гц, 1H). 31 P ЯМР (162 МГц, ДМСО-d6) м.д. = 22.29 (s) 19 F ЯМР (376 МГц, ацетонітрил-d3) м.д. = -133.88 (s) МСВР (мас-спектрометрія високої роздільної здатності): m/z: 507.1561; Обчислено для C21H24FN6O6P: 507.1557. Анал. Обчислено для C21H24FN6O6P: C: 46.42; H: 4.62; N: 12.03; P: 4.43; F: 2.72; Знайдено: C: 45.83; H: 4.74; N: 11,81; P: 4.45; F: 2.80. Приклад 6. Фізико-хімічні властивості солей етил-N-[(S)({[(2R,5R)-5-(6-аміно-9H-пурин-9-іл)4-фтор-2,5-дигідрофуран-2-іл]окси}метил)феноксифосфіноїл]-L-аланінату Були синтезовані зразки солей малонової, бурштинової і лимонної кислот етил-N[(S)({[(2R,5R)-5-(6-аміно-9H-пурин-9-іл)-4-фтор-2,5-дигідрофуран-2іл]окси}метил)феноксифосфіноїл]-L-аланінату. Були визначені температури плавлення цих солей, що представляють собою грубу оцінку стабільності: чим вище температура плавлення, тим вище рівень стабільності. Як зазначено в Таблиці 1, найвищу температуру плавлення має сіль лимонної кислоти. Крім того, у Таблиці 1 представлені теплоти плавлення (ΔH (плавлення)) кожної з трьох солей. Найвищу теплота плавлення має сіль лимонної кислоти, що вказує на більш високий ступінь кристалічності у твердому стані, ніж у двох інших солей. Таблиця 1 Температури плавлення і теплоти плавлення солей сукцинату, малоната і цитрату етил-N[(S)({[(2R,5R)-5-(6-аміно-9H-пурин-9-іл)-4-фтор-2,5-дигідрофуран-2іл]окси}метил)феноксифосфіноїл]-L-аланінату Сіль Молекулярна маса Сіль бурштинової кислоти Сіль малонової кислоти Сіль лимонної кислоти 30 35 624,52 610,49 698,56 ΔH(плавлення) Дж/г 58,85 66,10 127,59 Tm (°C) 138,06 120,13 149,76 Вільна основа етил-N-[(S)({[(2R,5R)-5-(6-аміно-9H-пурин-9-іл)-4-фтор-2,5-дигідрофуран-2іл]окси}метил)феноксифосфіноїл]-L-аланінату являє собою аморфну, гігроскопічну речовину, хімічно нестабільну при зберіганні на відкритім повітрі при 40°C і 75% відносної вологості (RH). Як зазначено в Таблиці 2, відповідні солі бурштинової, малонової і лимонної кислот негігроскопічні при зберіганні протягом декількох діб при кімнатній температурі при відносній вологості, рівній 92%. Таблиця 2 Гігроскопічність твердих сольових форм етил-N-RS)(1[(2R,5R)-5-(6-аміно-9H-пурин-9-іл)-4-фтор2,5-дигідрофуран-2-іл]окси}метил)феноксифосфіноїл]-L-аланінату при кімнатній температурі Час (доба) 0 13 0 13 0 25 Сіль Сіль бурштинової кислоти Сіль малонової кислоти Сіль лимонної кислоти 16 20-25°C/92% RH 0,01 0,010 0,02 0,12 0,01 0,02 UA 103329 C2 5 Хімічну стійкість вільної основи, сукцинату, малоната і цитрату етил-N-[(S)({[(2R,5R)-5-(6аміно-9H-пурин-9-іл)-4-фтор-2,5-дигідрофуран-2-іл]окси}метил)феноксифосфіноїл]-L-аланінату у твердому стані досліджували на відкритому повітрі при 40°C і відносній вологості 75%. Як зазначено в Таблиці 3, сіль лимонної кислоти має більш високу хімічну стійкість у порівнянні з солями бурштинової і малонової кислот. Таблиця 3 Стабільність вільної основи етил-N-RS)({[(2R,5R)-5-(6-аміно-9H-пурин-9-іл)-4-фтор-2,5дигідрофуран-2-іл]оксиlметил)феноксифосфіноїл]-L-аланінату і відповідних солей бурштинової, лимонної та малонової кислот у твердому стані при 40°C і відносній вологості 75% на відкритому повітрі Форма Вільна основа Сіль бурштинової кислоти Сіль малонової кислоти Сіль лимонної кислоти 10 15 20 Час (доба) Вільна основа (%) Інші домішки (%) 0 7 14 22 0 9 16 22 30 0 9 16 22 30 0 4 12 17 27 99,01 82,95 66,89 55,90 98,95 95,15 92,47 90,43 85,92 97,82 94,66 92,97 93,48 85,84 98,00 97,27 97,20 95,86 94,59 0,99 17,05 33,11 44,10 1,05 4,85 7,53 9,57 14,08 2,18 5,34 7,03 6,52 14,16 2,00 2,73 2,80 4,14 5,41 Приклад 7. Склад таблеток, що містять активний інгредієнт у кількості, еквівалентній 10 мг і 30 мг вільної основи етил-N-[(S)({[(2R,5R)-5-(6-аміно-9H-пурин-9-іл)-4-фтор-2,5-дигідрофуран-2іл]окси}метил)феноксифосфіноїл]-L-аланінату Сіль лимонної кислоти і етил-N-RS)({[(2R,5R)-5-(6-аміно-9H-пурин-9-іл)-4-фтор-2,5дигідрофуран-2-іл]окси}метил)феноксифосфіноїл]-L-аланінату вводили в таблетки з вмістом 10 мг і 30 мг способом вальцювання. Спочатку змішували активний інгредієнт, безводну лактозу, мікрокристалічну целюлозу і натрій-кроскармелозу, потім у суміш додавали одну третину від загальної кількості речовини, що сприяє ковзанню, стеарату магнію, потім піддавали вальцюванню, і потім розмелювали. В отримані гранули додавали кількість речовини, що залишилася, яка сприяє ковзанню, стеарат магнію, і пресували в таблетки. У Таблиці 4 показаний склад таблеток, які включають сіль лимонної кислоти етил-N[(S)({[(2R,5R)-5-(6-аміно-9H-пурин-9-іл)-4-фтор-2,5-дигідрофуран-2іл]окси}метил)феноксифосфіноїл]-L-аланінату і містять або 10 мг, або 30 мг вільної основи сполуки, що одержується після дисоціації солі лимонної кислоти у водному середовищі. 17 UA 103329 C2 Таблиця 4 Компоненти % мас. Сіль лимонної a 13,79 кислоти d Безводна лактоза 66,00 Мікрокристалічна 15,21 целюлоза Натрій3,50 кроскармелоза Стеарат магнію Усього 5 10 15 20 25 30 35 40 45 Склад однієї таблетки (мг/лікарська форма) 10 мг 30 мг 13,79 a,b 41,37 a,c Фармакопейне джерело HSE Функція Активний інгредієнт Розріджувач/Наповнювач Зв'язувальна речовина/Наповнювач 66,00 198,00 NF 15,21 45,63 NF 3,50 10,50 NF Дезінтегруюча речовина 1,50 1,50 4,50 NF Речовина, що сприяє ковзанню 100,00 100,00 300,00 a - Еквівалент 10% 2/2 вільної основи сполуки. Дійсну масу лікарської речовини уточнюють відповідно до чистоти лікарської речовини. b - Еквівалент 10 мг вільної основи сполуки. c - Еквівалент 30 мг вільної основи сполуки. d - Уточнену кількість лікарської речовини вираховують з кількості безводної лактози. e - Абревіатура NF означає Національний формуляр, і абревіатура HSE означає внутрішнє фармакопейне джерело (House Compendial Reference), яке являє собою внутрішній стандарт, використовуваний в Gilead Sciences. Приклад 8. Порівняння вмісту активного метаболіту в лімфоцитах після введення в лімфоцити етил-N-[(S)({[(2R,5R)-5-(6-аміно-9H-пурин-9-іл)-4-фтор-2,5-дигідрофуран-2іл]окси}метил)феноксифосфіноїл]-L-аланінату (проліки) або вихідної сполуки. Етил-N-[(S)({[(2R,5R)-5-(6-аміно-9H-пурин-9-іл)-4-фтор-2,5-дигідрофуран-2іл]окси}метил)феноксифосфіноїл]-L-аланінат являє собою проліки, які гідролізуються в організмі людини, утворюючи продукт гідролізу, що називається далі “вихідною сполукою”. Вихідна сполука зазнає в організмі людини фосфорилювання з утворенням біологічно активного фосфорильованого продукту (що називається далі “активним метаболітом”), який інгібує активність ферменту зворотної транскриптази. Для характеристики внутрішньоклітинного метаболізму проліків і вихідної сполуки, лімфоцити обробляли або 1 мкм проліків, або 100 мкм вихідної сполуки протягом 2, 6 і 24 годин. Одноядерні клітини периферичної крові (ОКПК) були виділені з лейкоцитарних плівок людини (Stanford Blood Bank, Palo Alto, CA) центрифугуванням в Ficoll Paque Plus (GE Healthcare, Piscataway, NJ) відповідно до протоколу виробника. ОКПК, отримані від 3-4 незалежних донорів витримувалися в середовищі RPM1-1640, що містить 20% ембріональної бичачої сироватки і антибіотики (стан спокою), або були активовані в присутності інтерлейкіну 2 (20 одиниць/мл, Roche Biochemicals, Indianapolis, IN) і фітогемагглютиніну PHA-P (1 мкг/мл, Sigma) протягом 3-4 діб до початку експериментів. Трансформовані T-клітини людини CCRF-CEM були надані The American Type Culture Collection (Manassas, VA), їх культивували в RPMI-1640 середовищі з додаванням 10% ЕБС і 6 антибіотиків. У певні моменти часу відбирали аліквоту клітин (2-3x10 клітини), перераховували, гранулювали центрифугуванням, повторно суспендували в 0,5 мл середовища первісної обробки і наносили шарами на 0,5 мл олії Nyosil M25. Зразки центрифугували в мікроцентрифузі протягом 20 секунд при максимальній швидкості (приблизно 800 x g). Верхній шар середовища видаляли, і олійний шар двічі промивали 0,8 мл сольового розчину, що містить фосфатний буфер. Промивний буфері олійний шар обережно видаляли, клітинні гранули повторно суспендували в 0,5 мл 70% метанолу та інкубували протягом ночі при -70°C для прискорення лізису клітин. Клітинні лізати центрифугували, рідини над осадом збирали, сушили у вакуумі і повторно суспендували в 10 мкл ацетату тетрабутиламонію, що містить як внутрішній стандарт дифосфат [5-(6-аміно-пурин-9-іл)-2,5-дигідро-фуран-2-ілоксиметил]-фосфонової кислоти (нефторований аналог активного метаболіту). Для оцінки кількості внутрішньоклітинних нуклеотидів застосовували рідинну хроматографію високої роздільної здатності з утворенням нестійких іонних пар у комбінації з позитивною тандемною мас-спектрометрією з іонізацією електророзпиленням (РХ/МС/МС). 18 UA 103329 C2 5 10 15 20 Метод являв собою адаптацію методів, описаних для ациклічного фосфонатного нуклеотидного аналога адефовіру, його фосфорильованих метаболітів і природних нуклеотидів (Vela, J.E. et al. Simultaneous quantitation of the nucleotide analog adefovir, its pHospHorilated anabolites and 2’deoxyadenosine tripHospHate by ion-pairing LC/MC/MC. Journal of ChromatograpHy B Anal. Technol. Biomed. Life Sci., том 848, 2007, стор. 335-343). Стандартні криві і зразки контролю якості були отримані для всіх аналітів з екстрактів неопрацьованих клітин. Стандартні криві були побудовані по семи точкам у загальному діапазоні концентрацій від 0,03 до 20 2 пікомоль/мільйон клітин і були лінійними в надлишку r , рівному 0,99, для всіх аналітів. Нижні границі кількісної оцінки становили від 0,05 до 0,1 пікомоль/мільйон клітин для всіх аналітів. Для забезпечення точності в межах 20% разом з кожним аналітом на початку і наприкінці кожного дослідження досліджували контрольні зразки з низькою і високою концентрацією (звичайно 0,2 і 10 пікомоль/мільйон клітин, відповідно). Для забезпечення точного аналізу набагато більш низького внутрішньоклітинного нагромадження метаболітів, що спостерігаються після інкубації лімфоцитів з вихідною сполукою, вихідну сполуку інкубували при концентрації, що в 100 разів перевищувала (100 мкм) концентрацію проліків (1 мкм). Як зазначено в Таблиці 5, рівні активного метаболіту, створювані проліками, в 76, 290 і 140 разів перевищували рівні, створювані вихідною сполукою, після інкубації з CEM-CCRF, для ОКПК у стані спокою і активованих ОКПК, відповідно. Рівні активного метаболіту нормували на підставі позаклітинної концентрації після інкубації з 1 мкм проліків або з 100 мкм вихідної сполуки. Таблиця 5 Вихідна сполука Проліки Концентрації активного метаболіту, нормовані по дозі ((пікомоль/мільйон)/1 мкм концентрація в середовищі) CEM-CCRF ОКПК у стані спокою Активовані ОКПК 0,087 ± 0,014 0,012 ± 0,004 0,045 ± 0,004 6,57 ± 1,00 3,52 ± 0,96 6,45 ± 1,64 Значення показані як середнє ± стандартне відхилення, отримані в трьох незалежних експериментах, кожний з яких виконували по два рази 25 30 35 40 45 Приклад 9. Порівняння анти-ВІЛ активності проліків і вихідної сполуки. Терміни “проліки” і “вихідна сполука” мають значення, зазначені в Прикладі 8. Клітини MT-2 витримували в середовищі RPMI-1640 з додаванням антибіотиків і 10% ембріональної бичачої сироватки (ЕБС). Клітини MT-2 були інфіковані ВІЛ-1 IIIB при мультиплікації інфекції (multiplicity of infection (moi)), що становить 0,01, і поміщали на 96-ямкові планшети, використовуючи серійні розведення сполук, що випробовуються, при щільності, що становить 20000 клітин/лунку. Після інкубації протягом 5 діб, наявність цитопатичного ефекту, що індукується вірусом, визначали за допомогою аналізу життєздатності клітин CellTiter-GloTM (Promega, Madison, WI) і виражали у вигляді процентної частки сигналу, одержуваного від зразків з повністю подавленою реплікацією вірусу після вирахування сигналу, що одержується від неопрацьованих контрольних образів. Концентрацію кожного лікарського засобу, що інгібує цитопатичний ефект, що індукується вірусом, на 50% (EC50), визначали методом нелінійної регресії. Паралельно з контролем вірусу дикого типу визначали активність стосовно NRTIрезистивним мутантам і обчислювали, у скільки раз змінюється EC 50. Одноядерні клітини периферичної крові людини (ОКПК) були виділені з лейкоцитарних плівок донорів центрифугуванням в Ficoll Paque Plus; їх активували протягом 4-5 діб в середовищі RPMI-1640 з додаванням 20% ЕБС, антибіотиків, інтерлейкіну-2 (20 одиниць/мл) і фітогемагглютиніну PHA-P (1 μ/мл). Активовані ОКПК інфікували ВІЛ-1 BaL протягом 3 годин, промивали, висівали в 96-ямкові планшети (250000 клітин/лунка) та інкубували, використовуючи серійні розведення сполук, що випробовуються, протягом 5 діб, після чого збирали клітинні рідини над опадами, і визначали вироблення вірусу за допомогою комерційного аналізу ВІЛ-1 p24 ELISA (Beckman Coulter, Miami, FL). Концентрацію кожного з лікарських засобів, що інгібують p24 вироблення антигену на 50% (EC50), визначали регресійним аналізом. Дію додавання профрагментів на анти-ВІЛ активність оцінювали в MT-2 і стимульованих ОКПК, інфікованих ВІЛ-1. Як зазначено в Таблиці 6, проліки чинили в 71 і 2300 разів могутнішу дію, ніж вихідна сполука в MT-2 і активованих ОКПК, відповідно. 19 UA 103329 C2 Таблиця Анти-ВІЛ-1 активність проліків і вихідної сполуки в клітинній лінії, отриманій з лімфоїдної тканини, і первинних лімфоїдних клітинах EC50 (мкм) Вихідна сполука Проліки MT-2 10,6 ± 2,4 0,15 ± 0,04 ОКПК 8,5 ± 7,7 0,0037 ± 0,0001 Значення показані як середнє ± стандартне відхилення, отримані щонайменше у двох залежних експериментах, кожний з яких виконували по три рази. 5 10 15 20 25 Приклад 10. Біодоступність при пероральному введенні цитрату етил-N-[(S)({[(2R,5R)-5-(6аміно-9H-пурин-9-іл)-4-фтор-2,5-дигідрофуран-2-іл]окси}метил)феноксифосфіноїл]-L-аланінату після введення в таблетованій формі собакам породи бігль Група піддослідних тварин складалася з 3, що раніше зазнали впливу самців собак породи бігль. Тваринам не давали їжі протягом ночі до введення доз і до 4 годин після дозування. Собакам давали одну таблетку, що містить 41,38 мг цитрату проліків (що забезпечує 30 мг проліків в таблетці). Таблетка складалася з 13,79% солі лимонної кислоти проліків, 66% безводної лактози, 15,21% мікрокристалічної целюлози, 3,5% натрій-кроскармелози і 1,5% стеарату магнію (відсотки масові). Зразки плазми одержували перед введенням доз (0 годин) і M через 0,083, 0,25, 0,50, 1,0, 2,0, 4,0, 8,0, 12, 24 години. Зразки крові збирали в Vacutainer пробірки, що містять ЕДТА-K3. Зразки крові центрифугували при 4°C для відділення плазми. Аліквоту, яка складає 1 мкл від кожного зразка плазми, спочатку розбавляли 300 мкл суміші 80% ацетонітрил/вода, що містить 200 нм внутрішнього стандарту. Після центрифугування і осадження білка, відбирали 100 мкл рідини над осадом і аналізували її. Стандартні криві і зразки контролю якості були отримана в плазмі крові собак, яким не вводили проліки. Зразки аналізували частковою рідинною хроматографією в комбінації з потрійною квадрупольною масспектрометрією. Введення циатрату проліків у вигляді таблеток приводить до швидкого усмоктування проліків і вихідної сполуки, що виходить із проліків. Як видно з Таблиці 7, після введення проліків і вихідної сполуки, у плазмі спостерігається підвищення концентрації проліків і вихідної сполуки. Біодоступність незмінених проліків при пероральному введенні склала 11,4%. Ці результати не сильно відрізняються від результатів, що спостерігаються після перорального введення проліків у вигляді розчину, що вказує на ефективність застосування таблеток, що містять цитрат проліків, для доставки проліків і їх метаболітів у системний кровотік. Таблиця Середні фармакокінетичні параметри проліків і вихідної сполуки в плазмі крові після перорального введення проліків у вигляді таблетки, що містить цитрат проліків в середній дозі, що становить 3,05 мг/кг еквівалентів (Середнє, n=3) Значення Параметр Проліки 0,58 1,560 587 608 0,289 11,4 Tmax (година) Cmax (нМ) AUCo-t (нМ.годину) AUC0-8 (нМ.годину) t1/2 (година) % Fa Вихідна сполука 2,33 959 7,600 9,630 11,7 Не визначали a Обчислювали на підставі середнього значення AUCo-t у плазмі для 818 нМ.годину, що спостерігається через 30 хвилин після внутрішньовенного введення 0,5 мг/кг GS-9131 собакам породи бігль. Приклад 11. Диференціальна скануюча калориметрія (ДСК) солей лимонної, малонової і 20 UA 103329 C2 5 10 15 20 25 30 35 40 45 50 55 бурштинової кислот етил-N-[(S)({[(2R,5R)-5-(6-аміно-9H-пурин-9-іл)-4-фтор-2,5-дигідрофуран-2іл]окси}метил)феноксифосфіноїл]-L-аланінату. Диференціальна скануюча калориметрія являє собою спосіб точного вимірювання температури і потоків тепла, пов'язаних з термічними переходами в матеріалі. Відгуки ДСК солей етил-N-RS)({[(2R,5R)-5-(6-аміно-9H-пурин-9-іл)-4-фтор-2,5-дигідрофуран-2іл]окси}метил)феноксифосфіноїл]-L-аланінату згідно з винаходом були отримані з -1 використанням TA (New Castle, DE) ДСК 2010 при швидкості сканування, що становить 5°C хв . На Фіг. 1 показаний характеристичний відгук ДСК солі малонової кислоти етил-N-[(S)({[(2R,5R)5-(6-аміно-9H-пурин-9-іл)-4-фтор-2,5-дигідрофуран-2-іл]окси}метил)феноксифосфіноїл]-Lаланінату. У термограмі ДСК є одинична ендотерма, що відповідає температурі плавлення (120,43°C, ΔHf = 73,72 Дж/г), за якою іде одинична екзотерма, що відповідає розкладанню солі малонової кислоти. На Фіг. 2 показаний характеристичний відгук ДСК солі бурштинової кислоти етил-N[(S)({[(2R,5R)-5-(6-аміно-9H-пурин-9-іл)-4-фтор-2,5-дигідрофуран-2іл]окси}метил)феноксифосфіноїл]-L-аланінату. У термограмі ДСК солі бурштинової кислоти GS9131 є одинична емдотерма, що відповідає температурі плавлення (137,44°C, ΔHf = 66,18 Дж/г), за якою іде одинична екзодерма, що відповідає розкладанню солі. На Фіг. 3 показаний характеристичний відгук ДСК солі лимонної кислоти етил-NRS)({[(2R,5R)-5-(6-аміно-9H-пурин-9-іл)-4-фтор-2,5-дигідрофуран-2іл]окси}метил)феноксифосфіноїл]-L-аланінату. У термограмі ДСК солі лимонної кислоти є одинична ендотерма, що відповідає температурі плавлення (149,41°C, ΔH f = 85,72 Дж/г), за якою іде одинична екзотерма, що відповідає розкладанню солі лимонної кислоти. Сіль лимонної кислоти має набагато більш високу теплоту плавлення у порівнянні з солями малонової і бурштинової кислот, що вказує на більш високий ступінь кристалічності у твердому стані. Приклад 12. Рентгенодифракційний аналіз (РДА) солей лимонної, малонової і бурштинової кислот етил-N-[(S)({[(2R,5R)-5-(6-аміно-9H-пурин-9-іл)-4-фтор-2,5-дигідрофуран-2іл]окси}метил)феноксифосфіноїл]-L-аланінату. Рентгенограми рентгенівської дифракції порошків (ПРД) солей етил-N-[(S)({[(2R,5R)-5-(6аміно-9H-пурин-9-іл)-4-фтор-2,5-дигідрофуран-2-іл]окси}метил)феноксифосфіноїл]-L-аланінату згідно з цим винаходом були отримані двома способами. Відповідно до першого способу використовували прилад Shimadzu РДА 6000 з наступними параметрами: рентгенівська трубка Cu, 2,2 кВт, NF (нормальний фокус); монохроматор зі скрученого графіту; вертикальний гоніометр, радіус 185 мм; щілини розбіжності: 0,5°, 1,0°, 0,05 мм; щілини Соллера: 0,05°, 1°, 2°; прийомні щілини: 0,15 мм, 0,3 мм; сцинтиляційний детектор (NaI) HV 500-1200. У відповідності з другим способом використовували прилад Shimadzu РДА 6000 з наступними параметрами: рентгенівська трубка Cu, 35 кВ, струм 40 мА; безперервне сканування, монохроматор, щілина розбіжності, 1°; щілина Соллера 1°, приймальна щілина 0,3 мм. Дані ПРД для солей малонової і бурштинової кислот були отримані способом 1. Дані ПРД для солі лимонної кислоти були отримані способом 2. Зрозуміло, що експериментальні відхилення можуть трохи змінювати форму смуг поглинання (піків) ПРД. Таким чином, значення, наведені тут для ПРД рентгенограм солей згідно з цим винаходом, будуть збігатися або по суті збігатися зі значеннями, отриманими при повторних експериментах. У даному контексті "по суті співпадають" означає, що враховуються відхилення характерних положень та інтенсивностей піків (що є звичайним для будь-якої аналітичної методики). Наприклад, фахівець у даній галузі техніки повинен розуміти, що положення піків відбиває внутрішні зміни параметрів вимірювального обладнання. Наприклад, положення 2-тета піку звичайно змінюється в межах 0,1 градуса. Крім того, фахівець у цій галузі техніки повинен розуміти, що відносні інтенсивності піків також можуть коливатися залежно від ступеня кристалічності, кращої орієнтації, підготовки поверхні зразка та інших факторів, відомих у цій галузі техніки. Таким чином, відносні інтенсивності піків повинні розглядатися тільки як якісні характеристики. На Фіг. 4 показана характеристична рентгенограма ПРД солі малонової кислоти. Головні та характеристичні піки, що визначають цю кристалічну форму солі малонової кислоти, представлено в Таблицях 8A і 8B. 21 UA 103329 C2 Таблиця 8А ПРД солі малонової кислоти Найбільш виражені піки 1 2 3 5 10 2Тета (град) 17,76 14,92 18,80 d (Å) 4,9912 5,9342 4,7163 FWHM (град) 0,3190 0,3023 0,6572 Інтегральна інтенсивність 16049 14513 21597 Позначення в таблицях 8В, 9У и 10В: Basic data process - обробка основних даних Strongest 3 peaks - 3 найбільш виражених піки Peak data list - дані по піках Peak - пік 2theta - 2 тета Intensity (counts) - інтенсивність (рахунок) Integrated int. (counts) - інтегральна інтенсивність (рахунок) На Фіг. 5 показана характеристична рентгенограма ПРД солі бурштинової кислоти. Головні 22 UA 103329 C2 та характеристичні піки, що визначають цю кристалічну форму солі бурштинової кислоти, представлено в Таблицях 9A і 9B. Таблиця 9А ПРД піки солі бурштинової кислоти Найбільш виражені піки 1 2 3 2Тета (град) 24,91 18,46 17,76 d (Å) 3,5716 4,8024 4,9901 FWHM (град) 1,1300 3,7340 3,4162 Інтегральна інтенсивність 40991 16639 9106 5 На Фіг. 6 показана характеристична рентгенограма ПРД солі лимонної кислоти. Головні та характеристичні піки, що визначають цю кристалічну форму солі лимонної кислоти, представлено в Таблицях 10A і 10B. 10 Таблиця 10А ПРД піки солі лимонної кислоти Найбільш виражені піки 1 2 3 2Тета (град) 19,81 28,63 14,64 d (Å) 4,4784 3,1155 6,0465 23 FWHM (град) 0,2635 0,3312 0,2473 Інтегральна інтенсивність 14837 13074 10572 UA 103329 C2 5 Уся література, що цитується, і патентні публікації включені в цей опис за допомогою посилання в тих місцях опису, де вони цитуються. Там, де зазначені конкретні параграфи і сторінки, саме ці конкретні параграфи і сторінки робіт, що цитуються вище, включені в цей опис за допомогою посилання. Незважаючи на те, що представленого опису винаходу досить для здійснення цього винаходу фахівцем у цій галузі техніки, також існує можливість внесення в цей винахід деяких модифікацій, що не виходять за межі обсягу формули винаходу. 24 UA 103329 C2 ФОРМУЛА ВИНАХОДУ 1. Сіль лимонної кислоти формули І або її гідрат: NH2 N O P (S) O (S) N H O O O (R) O 10 15 N N (R) (E) HO2 C 5 N F HO CO2 H CO2 H (I). 2. Сіль або гідрат за п. 1, які відрізняються тим, що є кристалічними. 3. Сіль за п. 2, яка відрізняється тим, що смуги поглинання, які спостерігаються на порошковій рентгенограмі, характеризуються міжплощинними відстанями, що збігаються або по суті збігаються з відстанями, рівними 4,48, 3,12 і 6,05 ангстрем. 4. Сіль за п. 2, яка відрізняється тим, що смуги поглинання, які відповідають кутам дифракції 2тета на порошковій рентгенограмі, збігаються або по суті збігаються з кутами, рівними 19,81, 28,63 і 14,64 градусам. 5. Сіль за п. 2, яка відрізняється тим, що представлена у формі гідрату, який є частково або повністю гідратованим. 6. Сіль за п. 2, яка відрізняється тим, що вона являє собою безводну або по суті безводну сіль. 7. Сіль бурштинової кислоти формули II або її гідрат: NH2 N O P (S) O (S) N H O O O (R) O N N N (R) (E) F HO2 C 20 CO2 H (II). 8. Сіль або гідрат за п. 7, які відрізняються тим, що є кристалічними. 9. Сіль за п. 8, яка відрізняється тим, що смуги поглинання, які спостерігаються на порошковій рентгенограмі, характеризуються міжплощинними відстанями, що збігаються або по суті збігаються з відстанями, рівними 3,57, 4,80 і 4,99 ангстрем. 10. Сіль за п. 8, яка відрізняється тим, що смуги поглинання, які відповідають кутам дифракції 2-тета на порошковій рентгенограмі, збігаються або по суті збігаються з кутами, рівними 24,91, 18,46 і 17,76 градусам. 11. Сіль малонової кислоти формули III або її гідрат: NH2 N O P (S) O (S) O N H O O O (R) N N N (R) (E) F HO2 C 25 CO2 H (III). 12. Сіль або гідрат за п. 11, які відрізняються тим, що є кристалічними. 25 UA 103329 C2 5 10 13. Сіль за п. 12, яка відрізняється тим, що смуги поглинання, які спостерігаються на порошковій рентгенограмі, характеризуються міжплощинними відстанями, що збігаються або по суті збігаються з відстанями, рівними 4,99, 5,93 і 4,72 ангстрем. 14. Сіль за п. 12, яка відрізняється тим, що смуги поглинання, які відповідають кутам дифракції 2-тета на порошковій рентгенограмі, збігаються або по суті збігаються з кутами, рівними 17,76, 14,92 і 18,80 градусам. 15. Фармацевтична композиція, що містить терапевтично ефективну кількість солі або гідрату за будь-яким з пп. 1-14 і фармацевтично прийнятний носій або наповнювач. 16. Фармацевтична композиція за п. 15, яка відрізняється тим, що додатково містить додатковий терапевтичний засіб. 17. Фармацевтична композиція за п. 16, яка відрізняється тим, що додатковий терапевтичний засіб має активність проти ВІЛ. 18. Сіль або гідрат за будь-яким з пп. 1-14, призначені для застосування у лікуванні або профілактичному запобіганні ВІЛ-інфекції. 26 UA 103329 C2 27 UA 103329 C2 28
ДивитисяДодаткова інформація
Назва патенту англійськоюSalts of hiv inhibitor compounds
Автори російськоюGraetz, Benjamin, R., Polniaszek, Richard, P.
МПК / Мітки
МПК: A61P 31/18, A61K 31/7076, C07H 19/20
Мітки: сполук-інгібіторів, солі, віл
Код посилання
<a href="https://ua.patents.su/31-103329-soli-spoluk-ingibitoriv-vil.html" target="_blank" rel="follow" title="База патентів України">Солі сполук-інгібіторів віл</a>
Попередній патент: Застосування ніфуртимоксу для лікування хвороб, спричинених лямбліями
Наступний патент: Вакцина проти інфекційного бронхіту, одержана з ib-qx-подібних штамів
Випадковий патент: Інварний сплав на основі системи залізо-нікель