Синтетичні полісахариди та фармацевтична композиція, що їх містить
Номер патенту: 60352
Опубліковано: 15.10.2003
Автори: Ербер Жан-Марк, Дрігез Пьєр-Александр, ван Буккель Констант, Бастен Йоханнес, Дюшосуа Філіпп, Дреф-Тромп Корнеліа, Петіту Моріс
Формула / Реферат
1. Синтетичний полісахарид у кислотній формі та його фармацевтично прийнятні солі, аніонні форми якого відповідають одній з формул (І)-(V):
.
2. Полісахарид за п. 1, який відрізняється тим, що знаходиться у формі солі з натрієм чи калієм.
3. Полісахарид за пп. 1 чи 2, який відрізняється тим, що має формулу натрієвої солі метил-[O-(2,3,4,6-тетра-O-сульфо--D-глюкопіранозил)-(14)-O-(2,3,6-три-O-сульфо--D-глюкопіранозил)-(14)-O-(2,3,6-три-O-сульфо--D-глюкопіранозил)-(14)-O-(2,3-ди-O-метил-6-O-сульфо--D-глюкопіранозил)-(14)-O-(2,3,6-три-O-метил--D-глюкопіранозил)-(14)-[O-(2,3,6-три-O-метил--D-глюкопіранозил)-(14)-O-(2,3,6-три-O-метил--D-глюкопіранозил)-(14)]3-O-(2,3-ді-O-метил-6-O-сульфо--D-глюкопіранозил)-(14)-O-(2,3-ди-O-метил--D-глюкопіранозилуронова кислота)-(14)-O-(2,3,6-три-O-сульфо--D-глюкопіранозил)-(14)-O-(2,3-ди-O-метил--L-ідопіранозилуронова кислота)-(14)-3-O-метил-2,6-ди-O-сульфо--D-глюкопіранозиду].
4. Фармацевтична композиція, яка як активний інгредієнт містить полісахарид за будь-яким з пп. 1-3 у формі солі з фармацевтично прийнятною основою або у формі кислоти, у комбінації чи як суміш з інертним нетоксичним фармацевтично прийнятним наповнювачем.
5. Фармацевтична композиція за п. 4, яка відрізняється тим, що знаходиться у формі дозованих одиниць, в яких активний інгредієнт змішаний зі щонайменше одним фармацевтичним наповнювачем.
6. Фармацевтична композиція за п. 5, яка відрізняється тим, що кожна дозована одиниця містить 0,1-100 мг активного інгредієнта.
7. Фармацевтична композиція за п. 6, яка відрізняється тим, що кожна дозована одиниця містить 0,5-50 мг активного інгредієнта.
8. Полісахарид визначений у пп. 1-3 для виготовлення лікувального засобу, що корисний при асоційованих з дисфункцією коагуляції патологіях.
9. Полісахарид визначений у пп. 1-3 для виготовлення лікувального засобу, що корисний при лікуванні чи попередженні розладів систем серцево-судинних та судин мозку тромбоемболічних розладів, що асоційовані з артеріосклерозом та діабетом, тромбоемболічних розладів, що асоційовані з ретромбозом після тромболізу, з інфарктом, недоумством ішемічного походження, захворюваннями периферійних артерій, гемодіалізом чи фібриляціями передсердя, або інакше при використанні аорто-коронарних судинних шунтових протезів.
10. Полісахарид за п. 9, який відрізняється тим, що виготовлений лікувальний засіб використовують при лікуванні чи попередженні тромбоемболічних розладів.
11. Полісахарид за п. 10, який відрізняється тим, що виготовлений лікувальний засіб використовують при лікуванні чи попередженні нестабільної стенокардії, нападу, рестенозу після ангіопластики, ендартеректомії чи вставленні ендоваскулярних протезів.
Текст
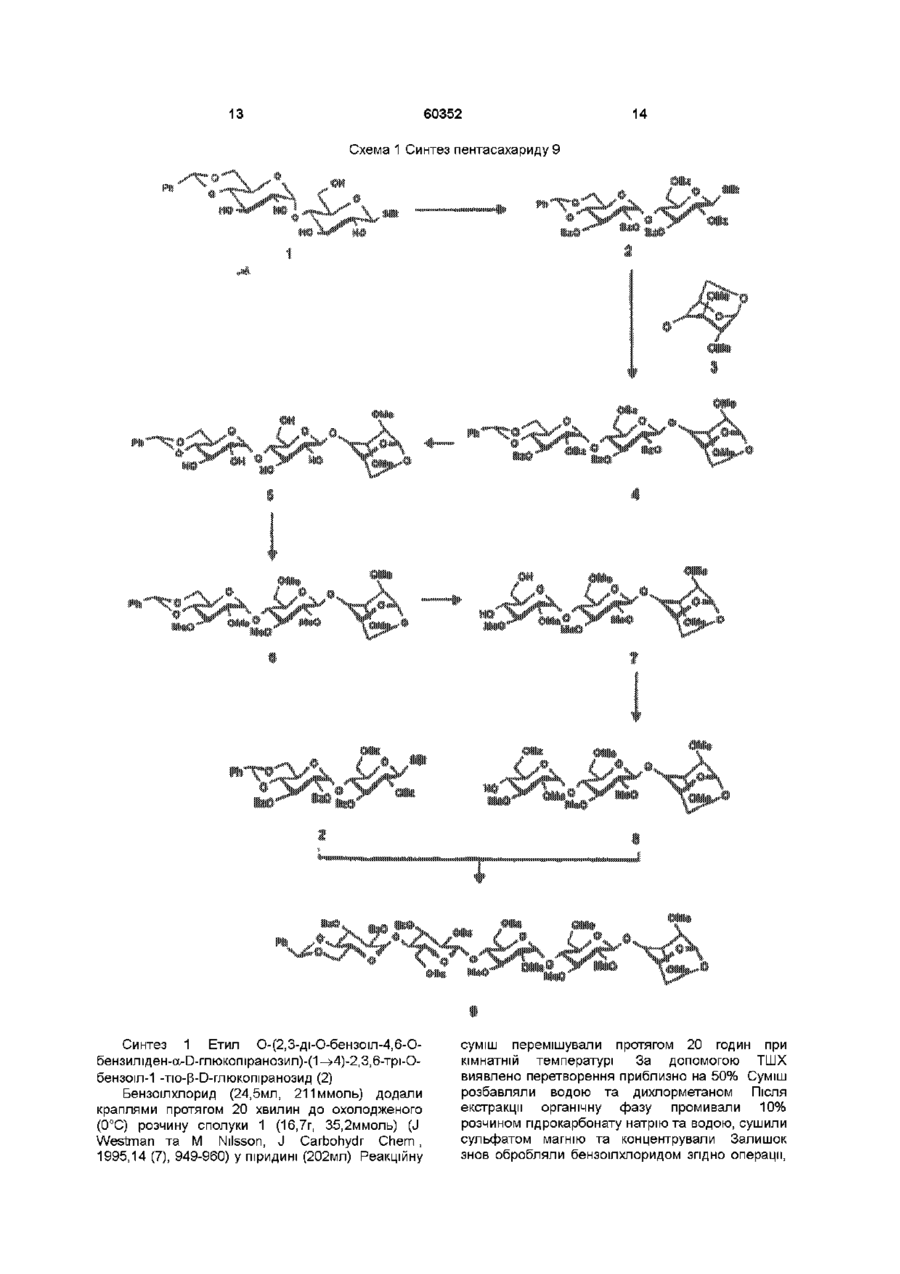
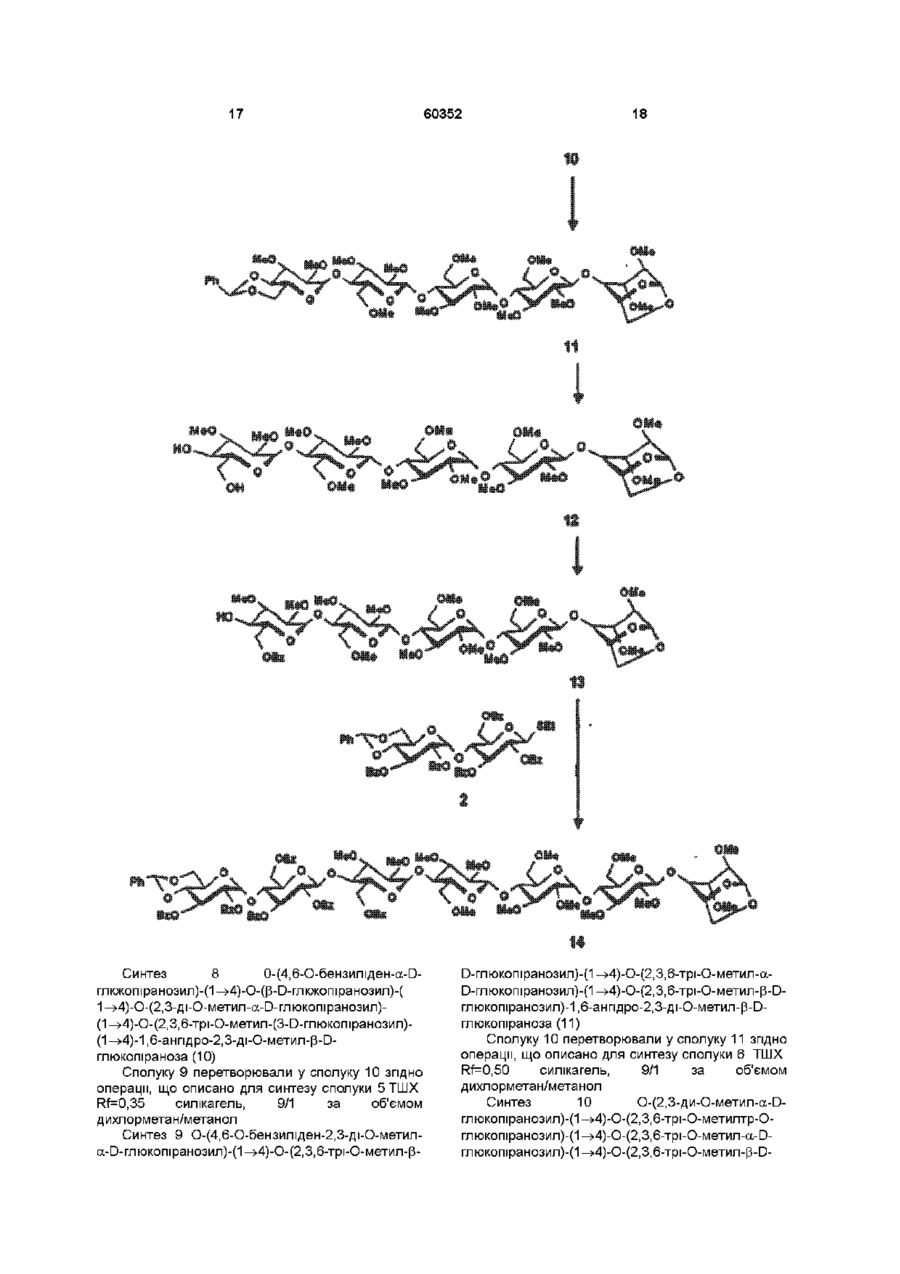
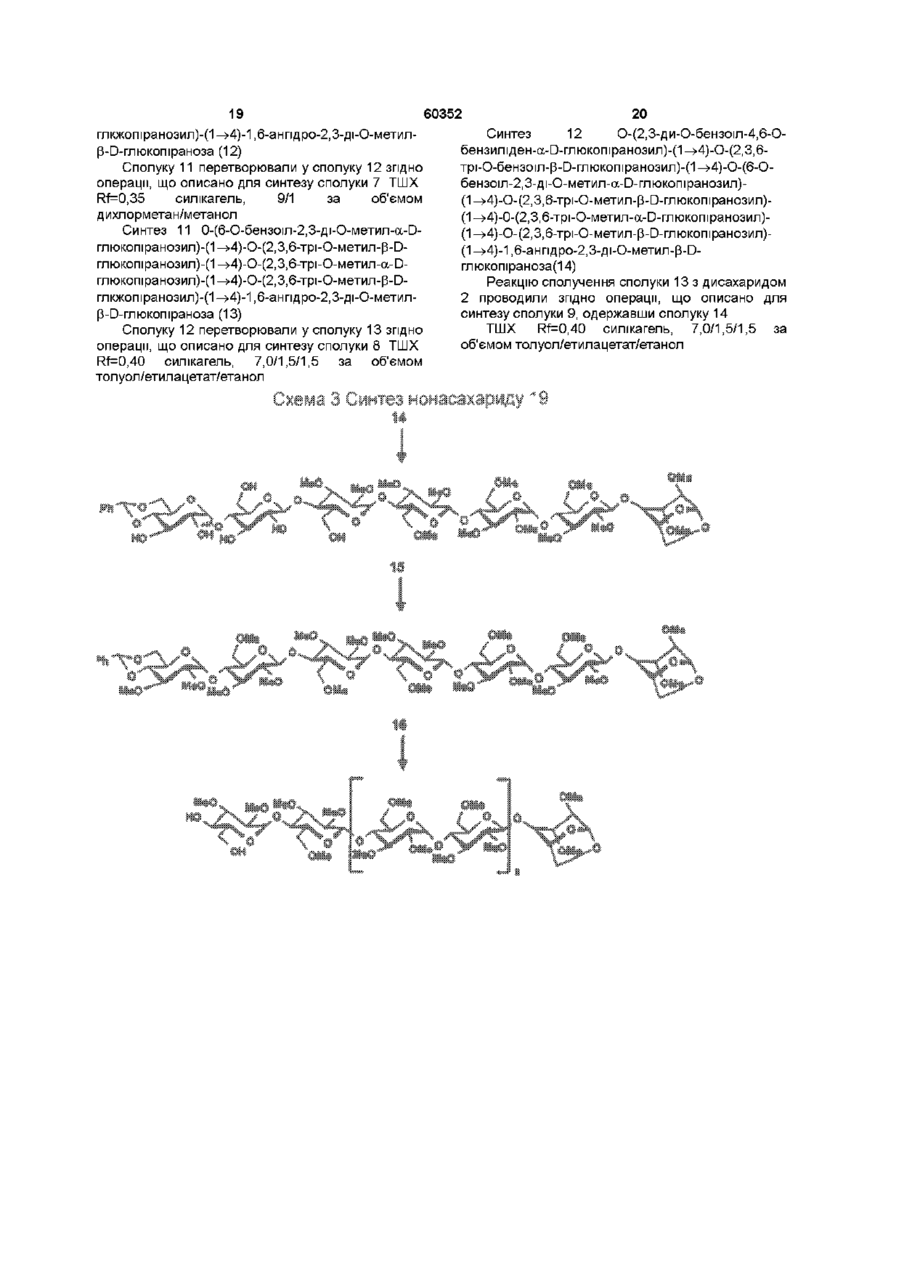
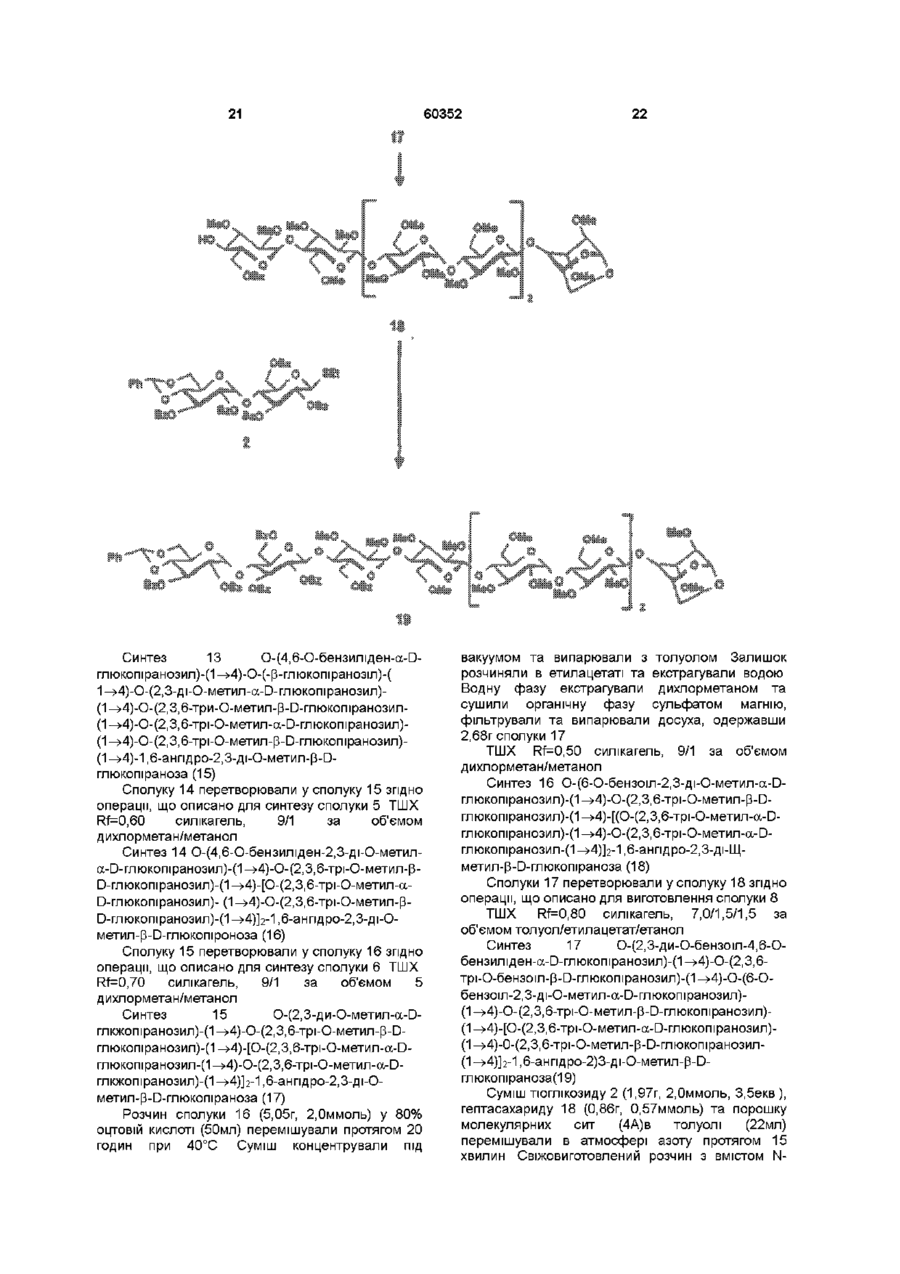
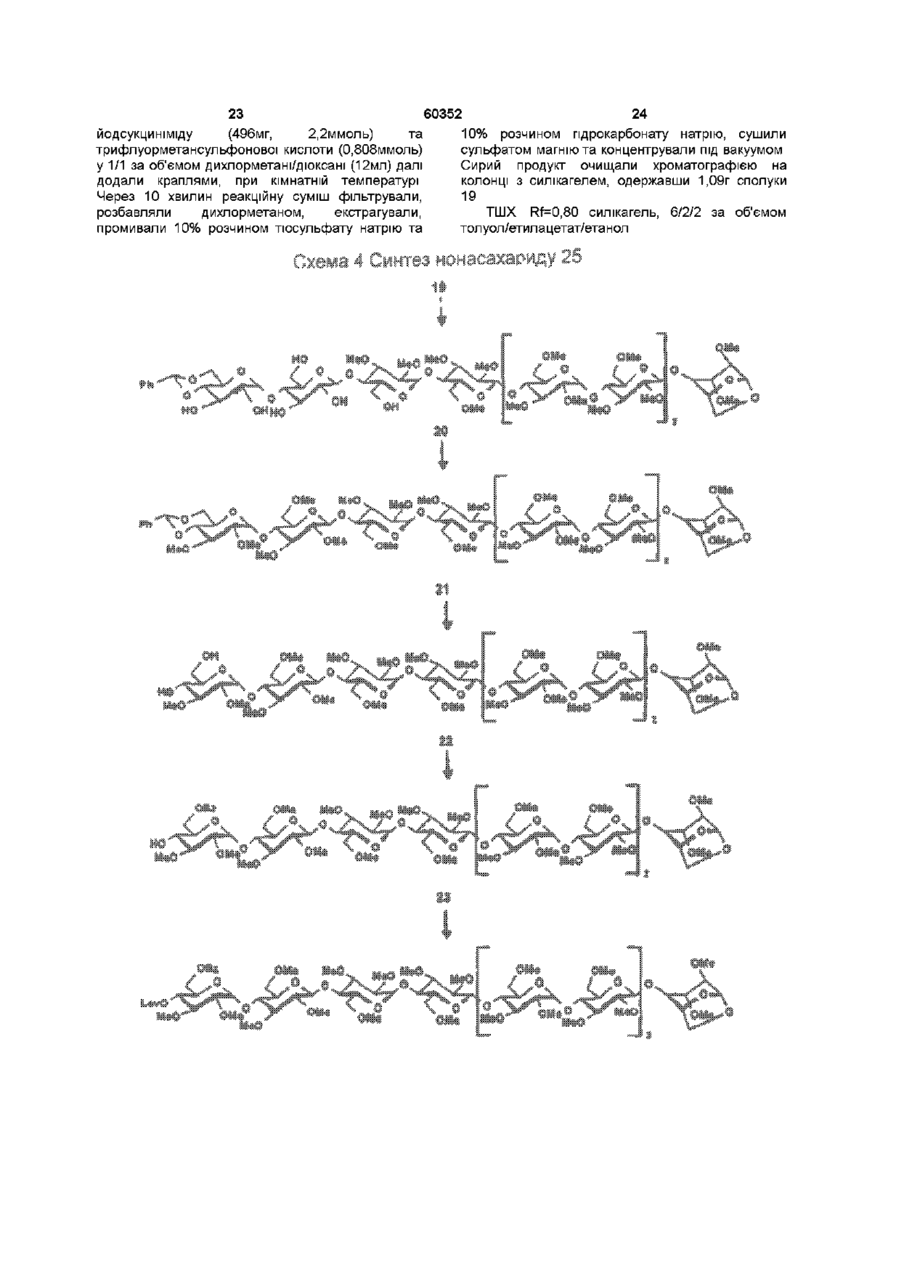
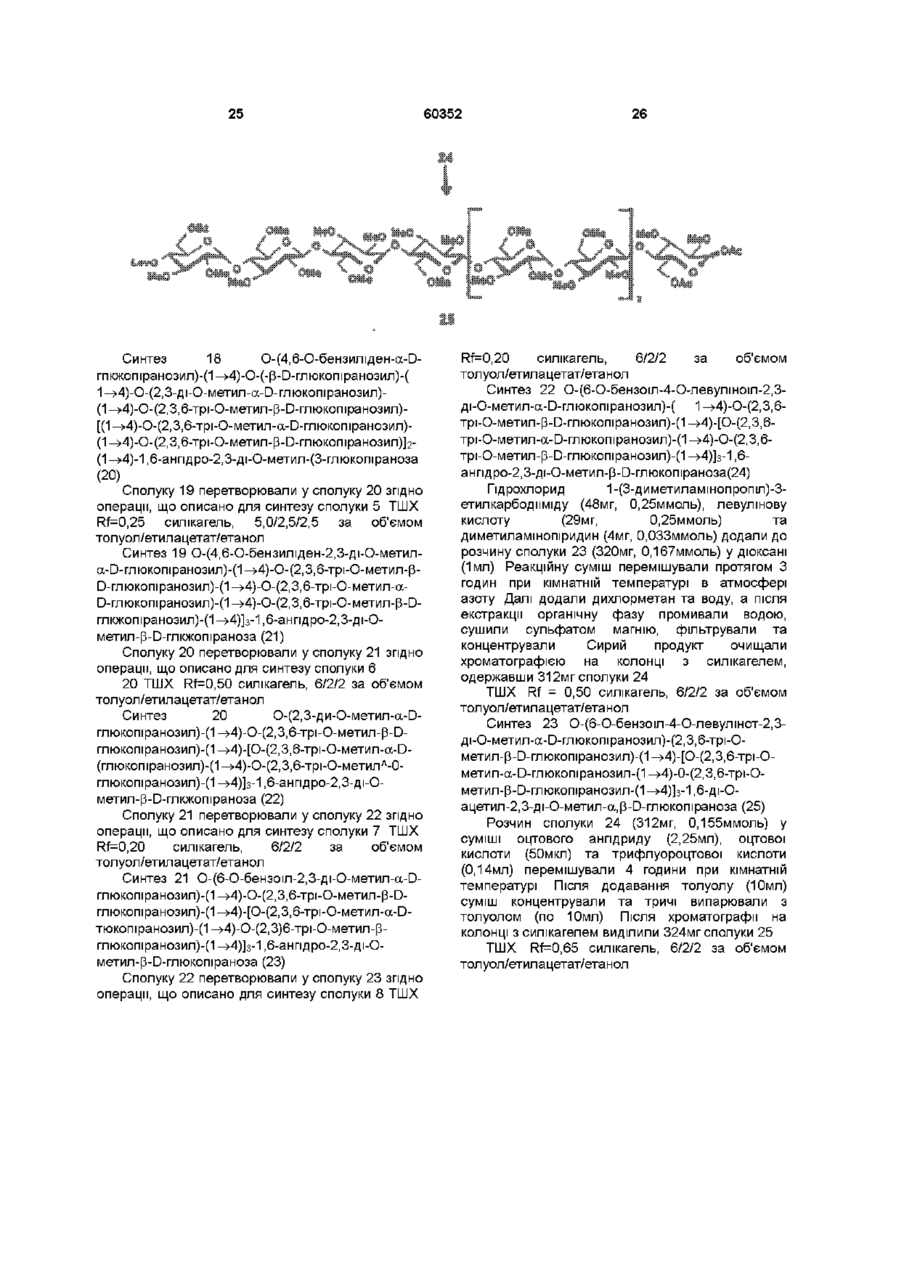
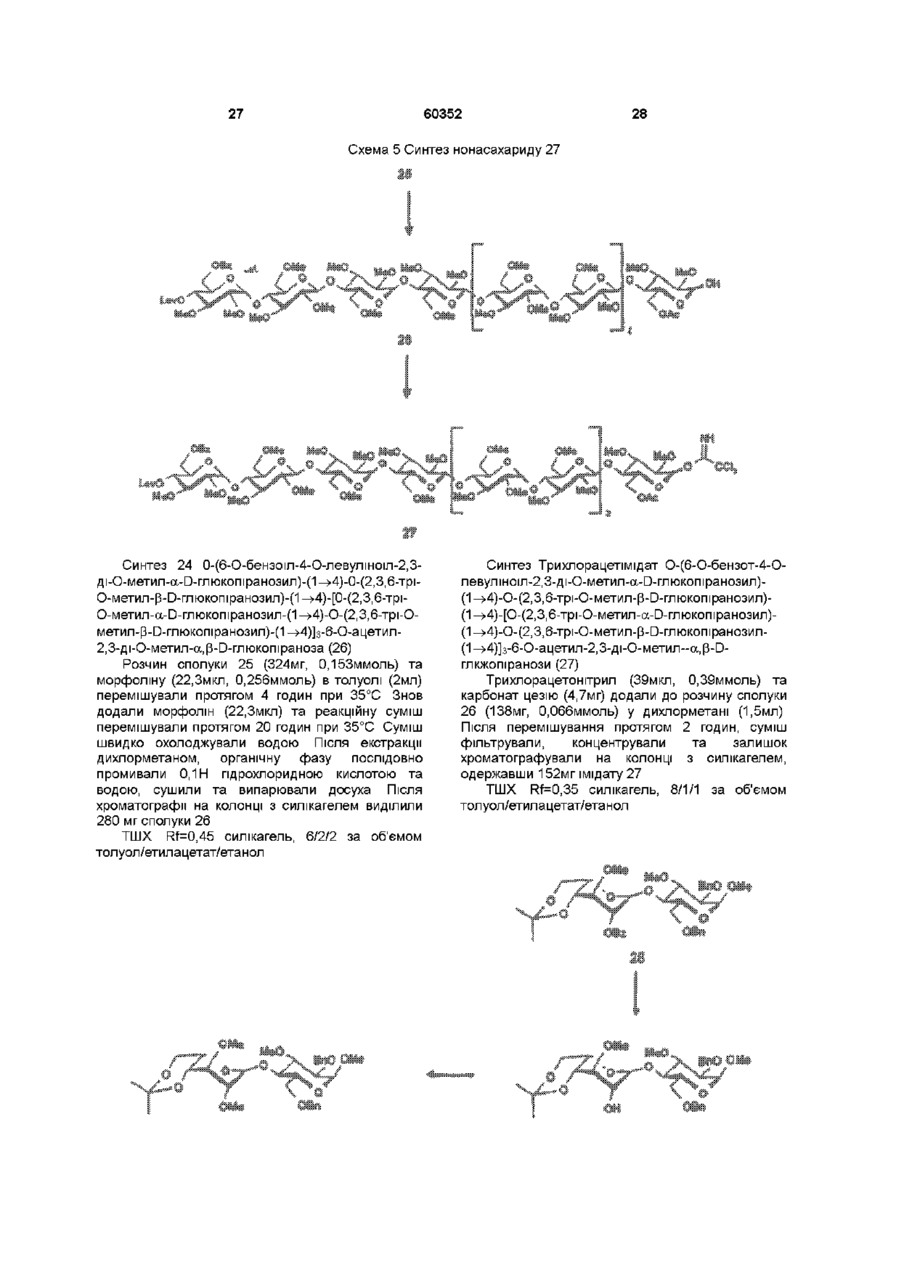
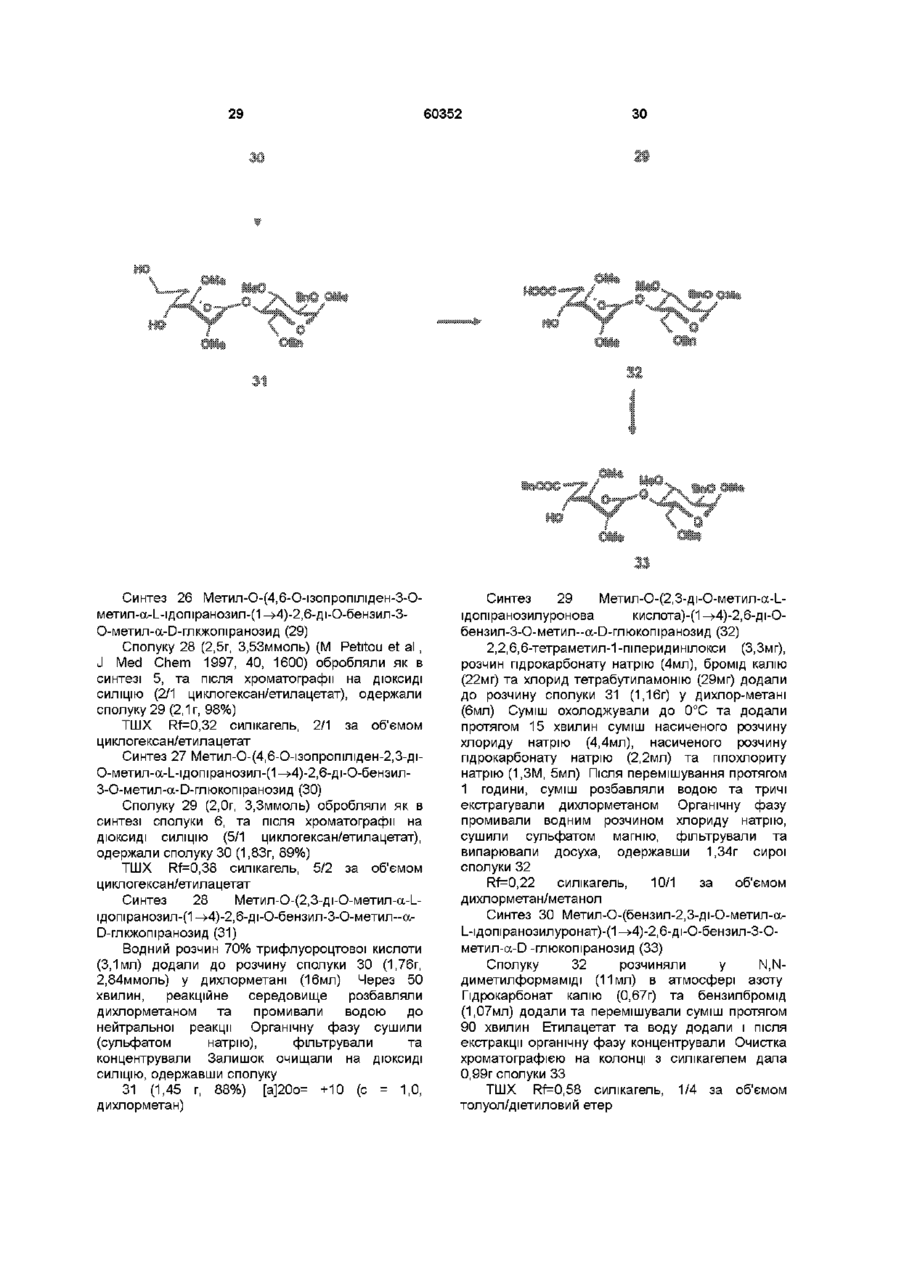
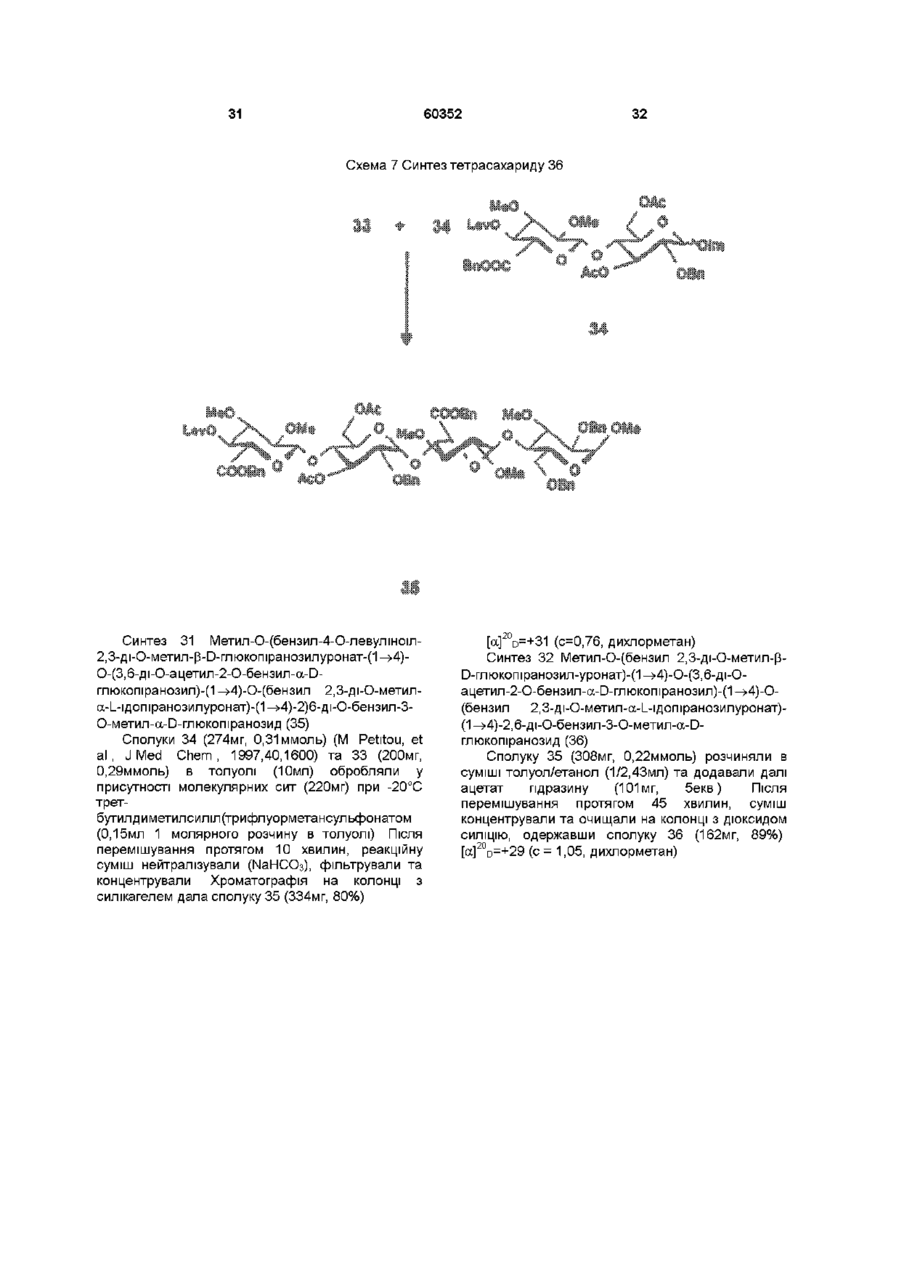
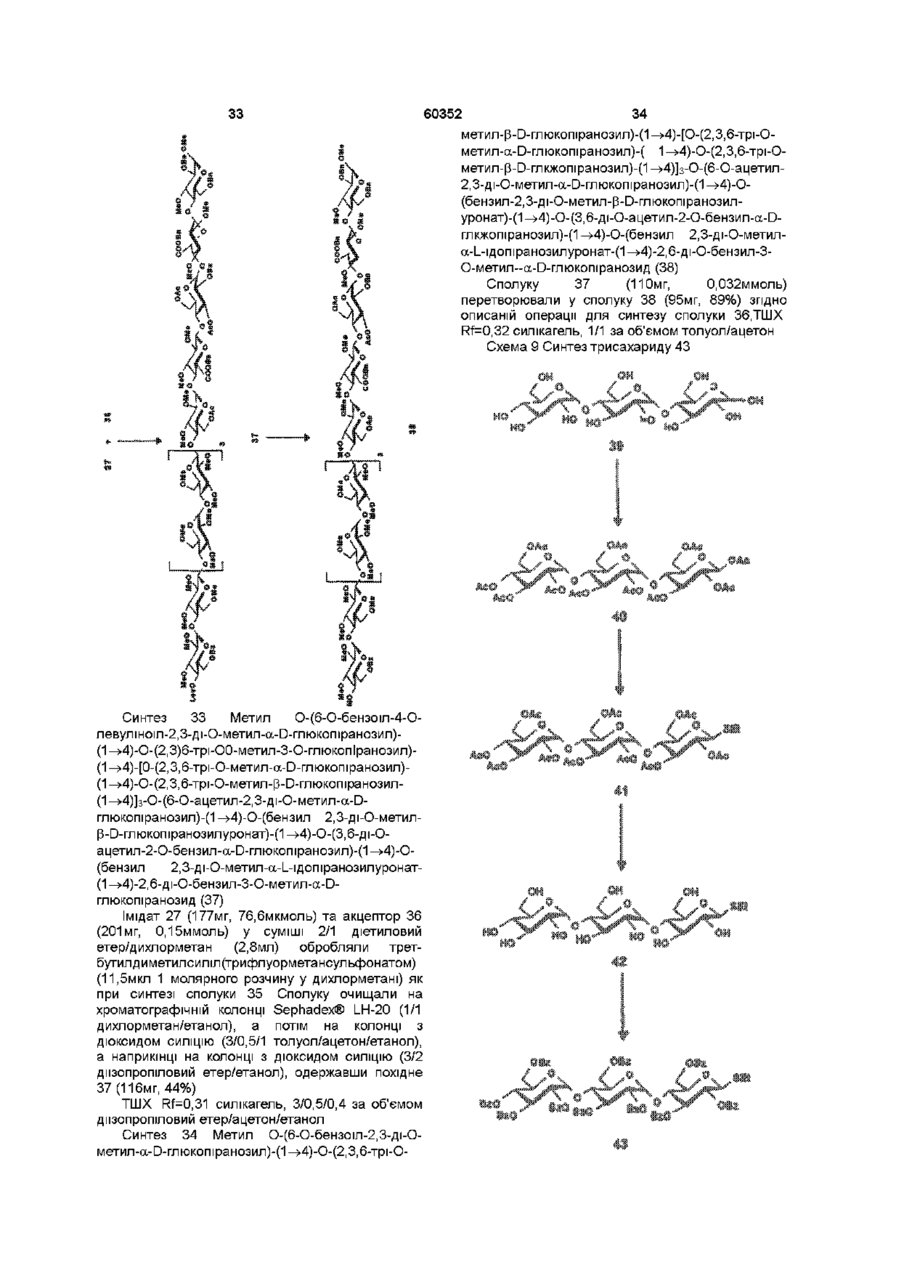
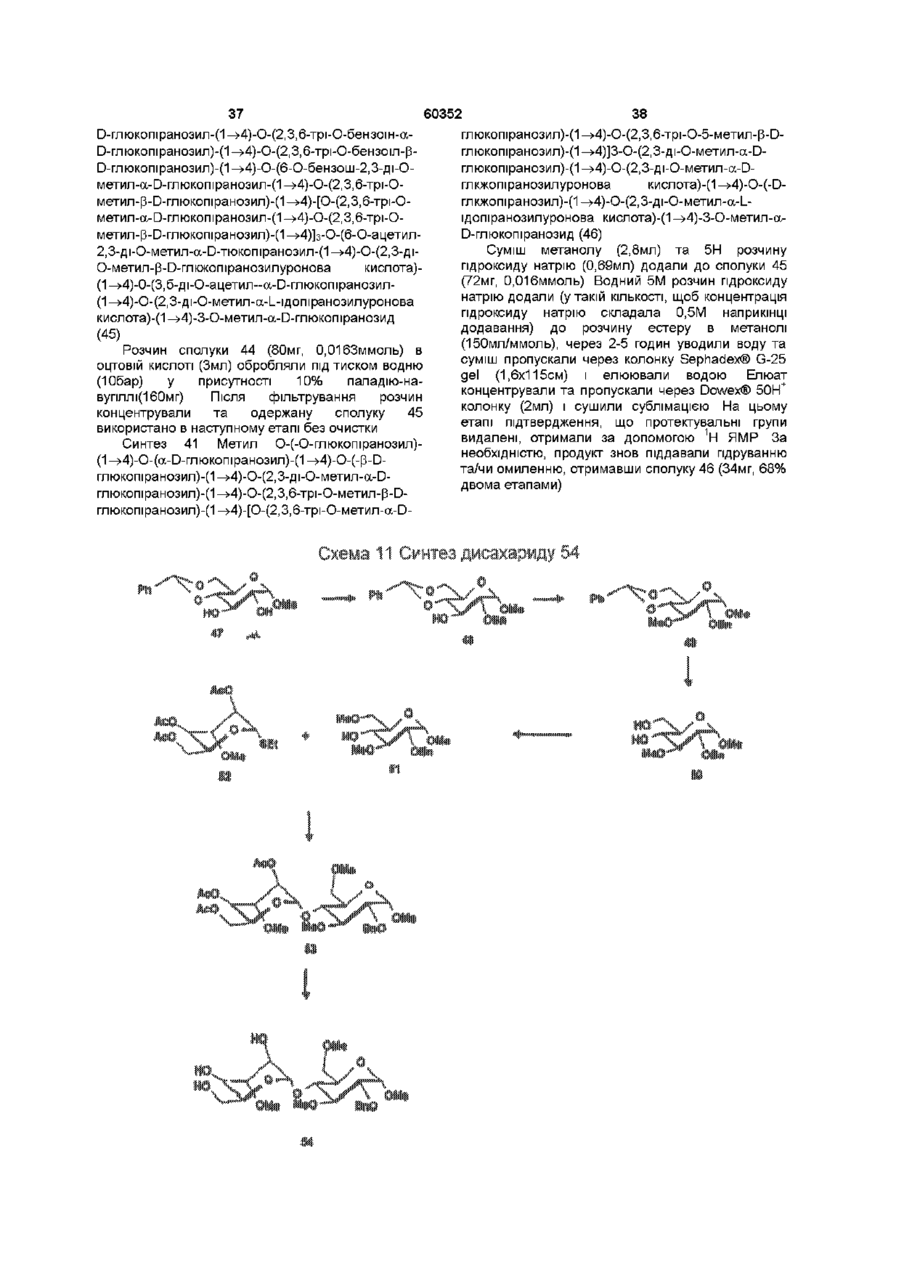
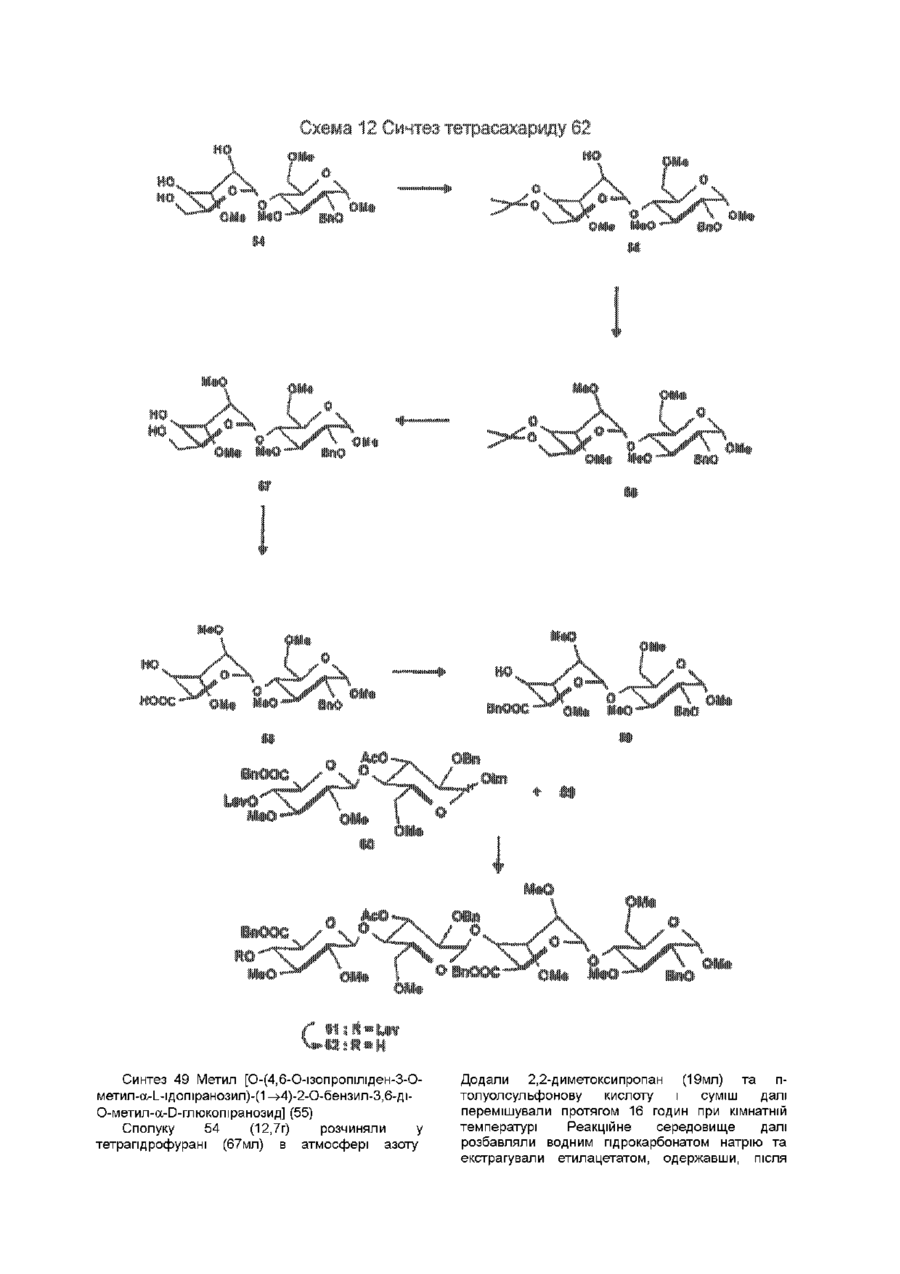
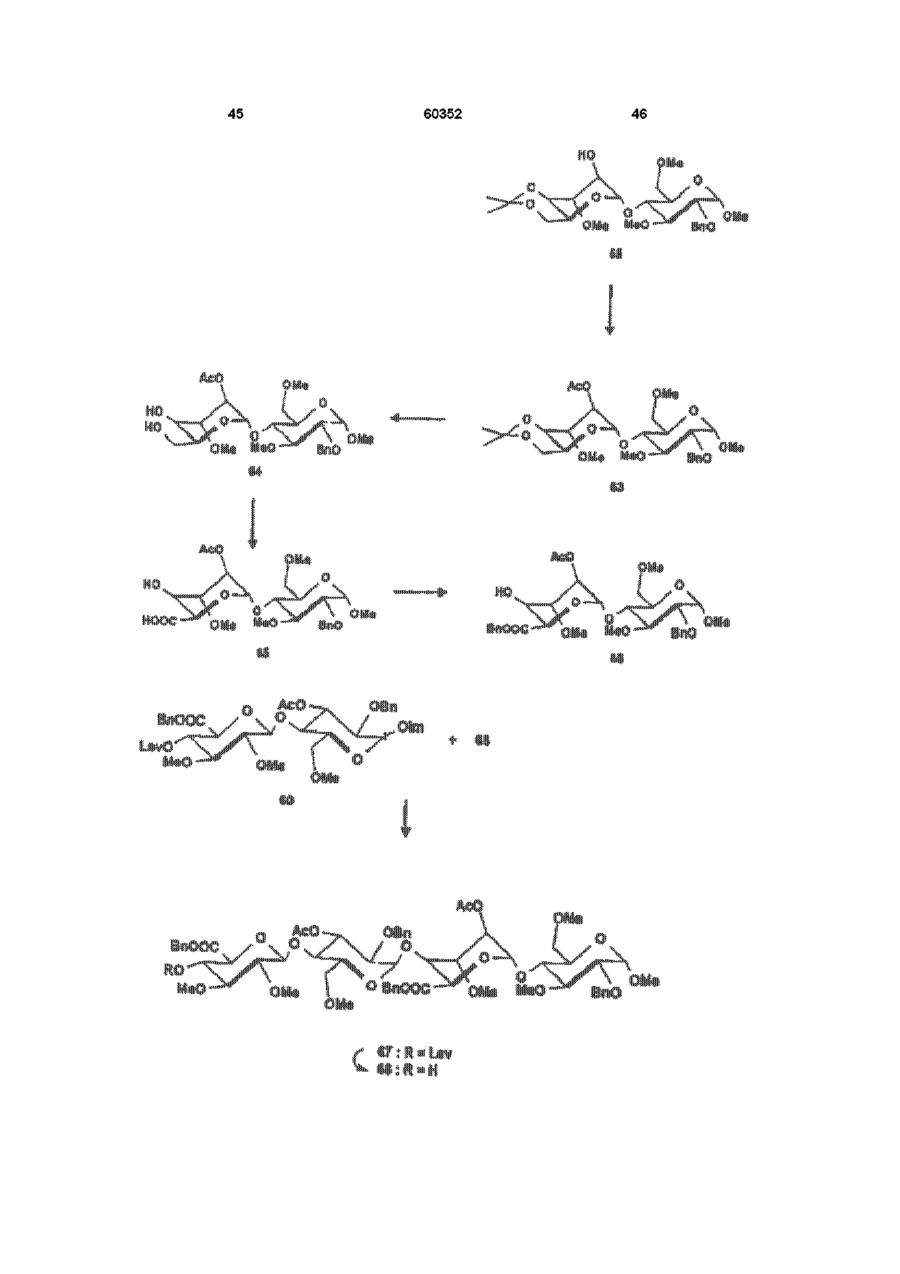
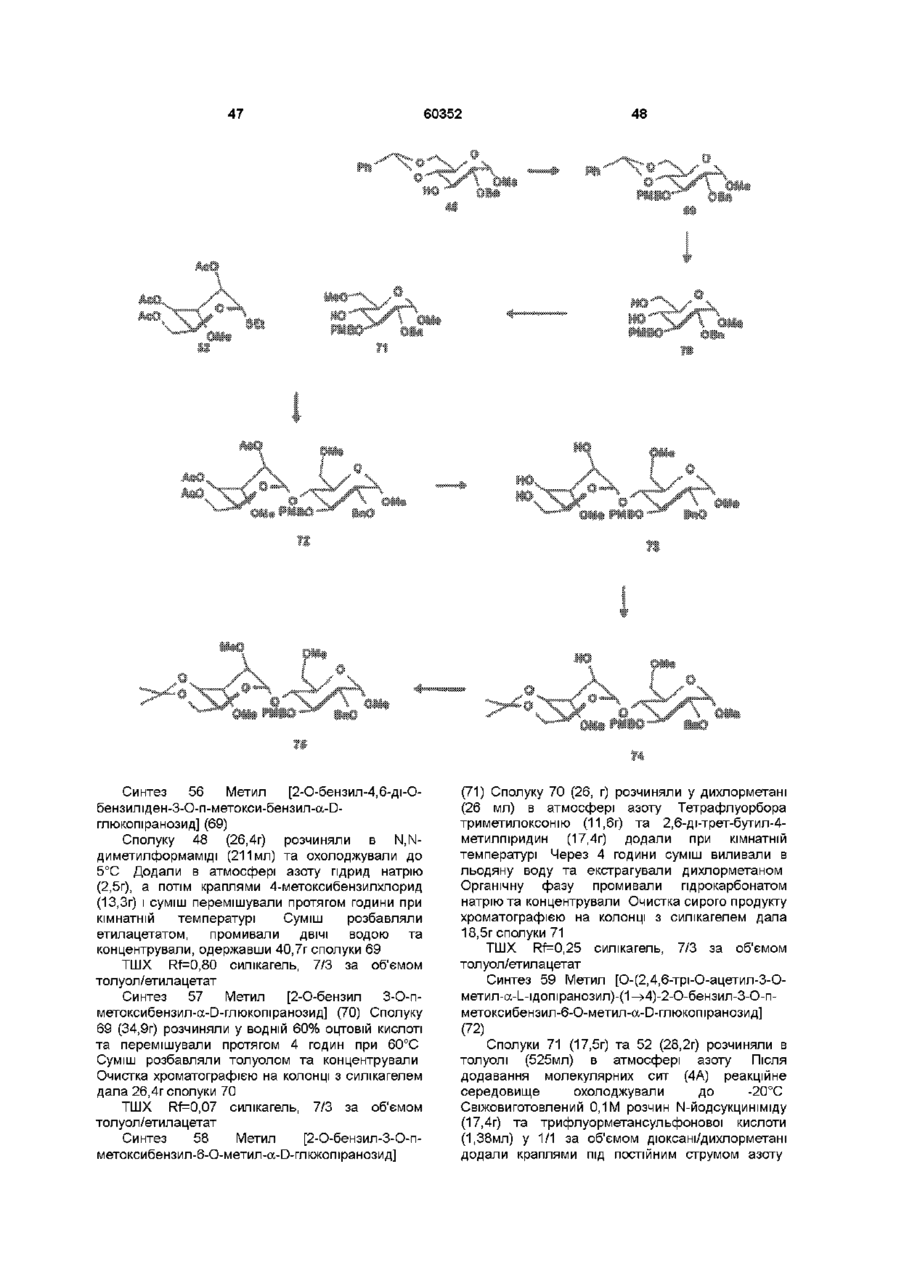
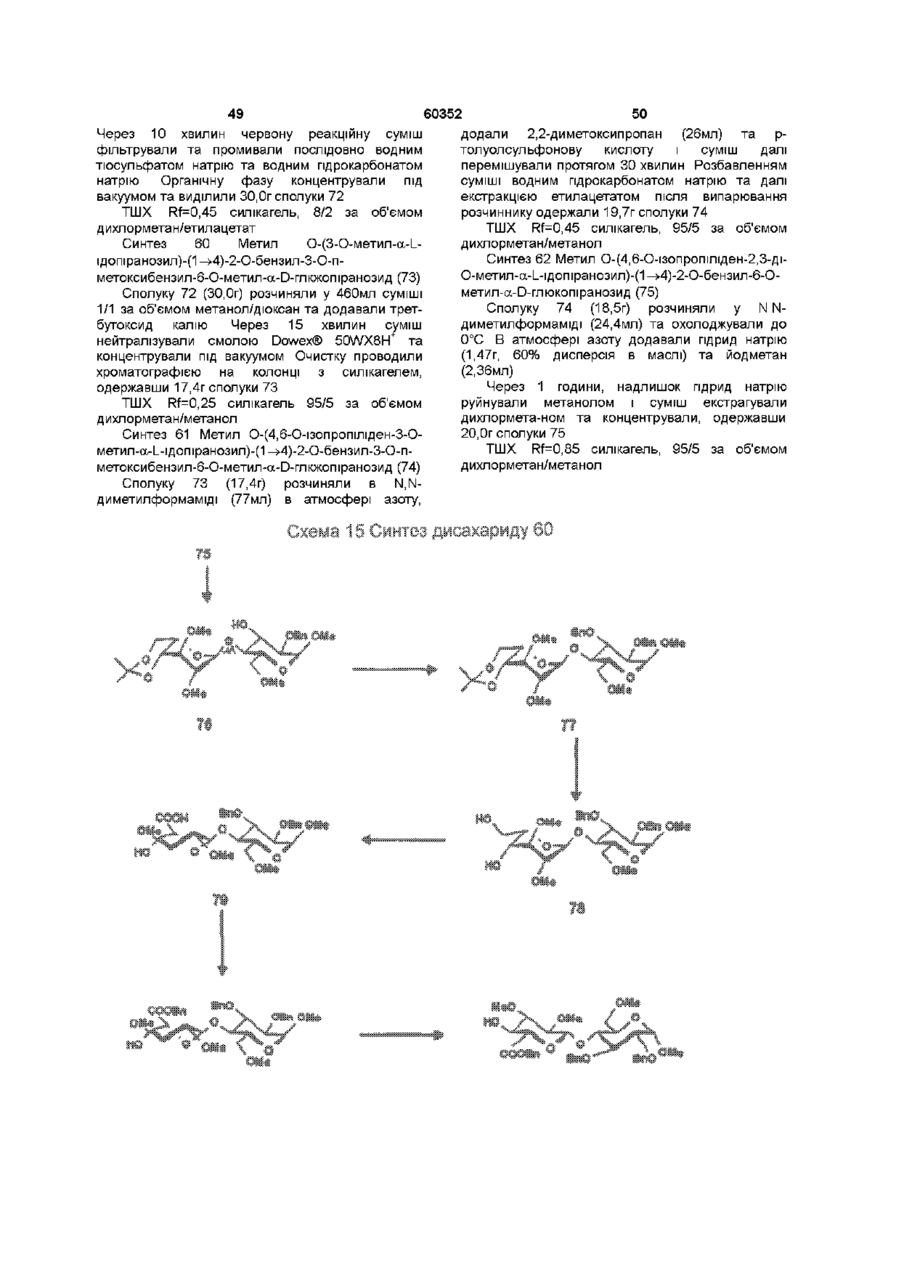
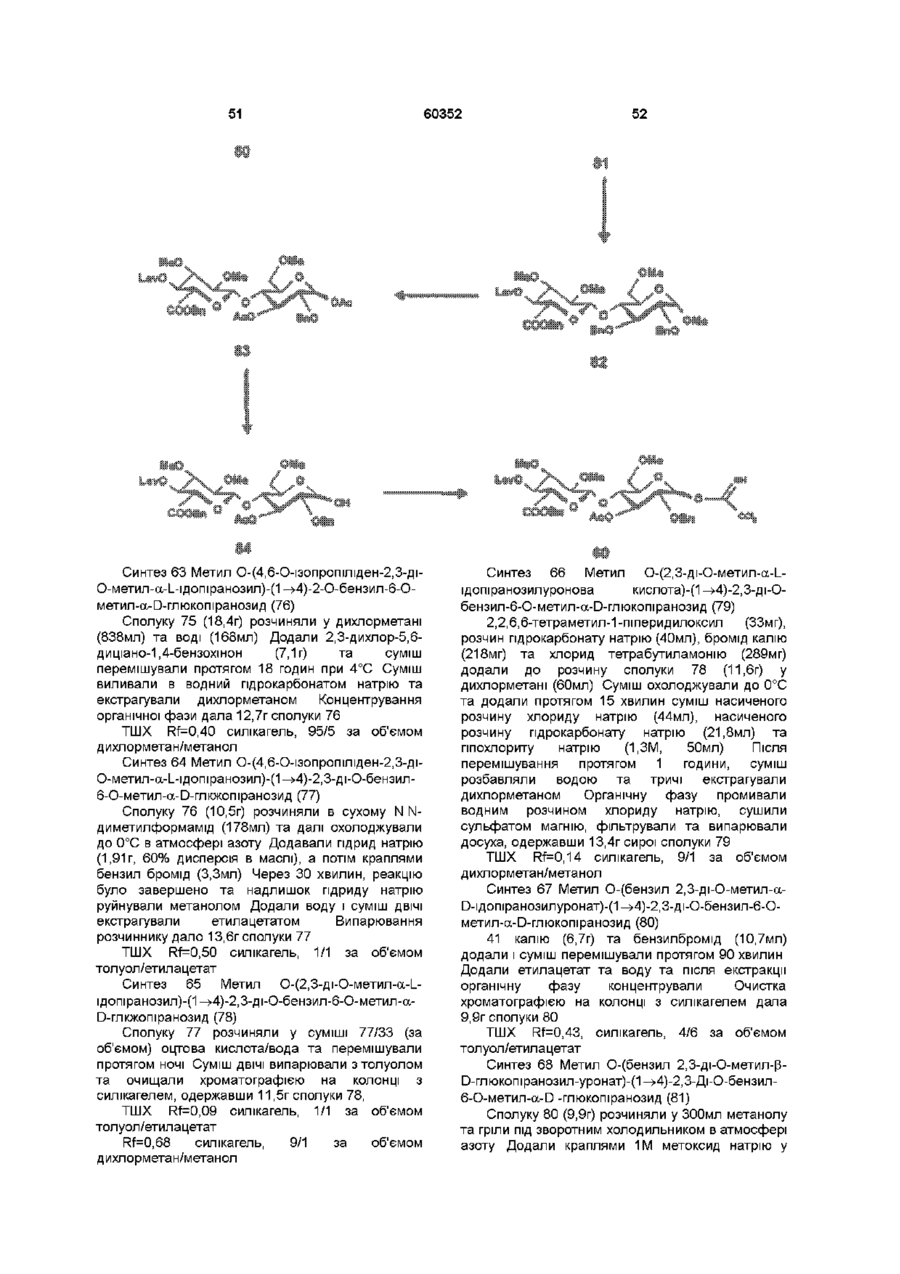
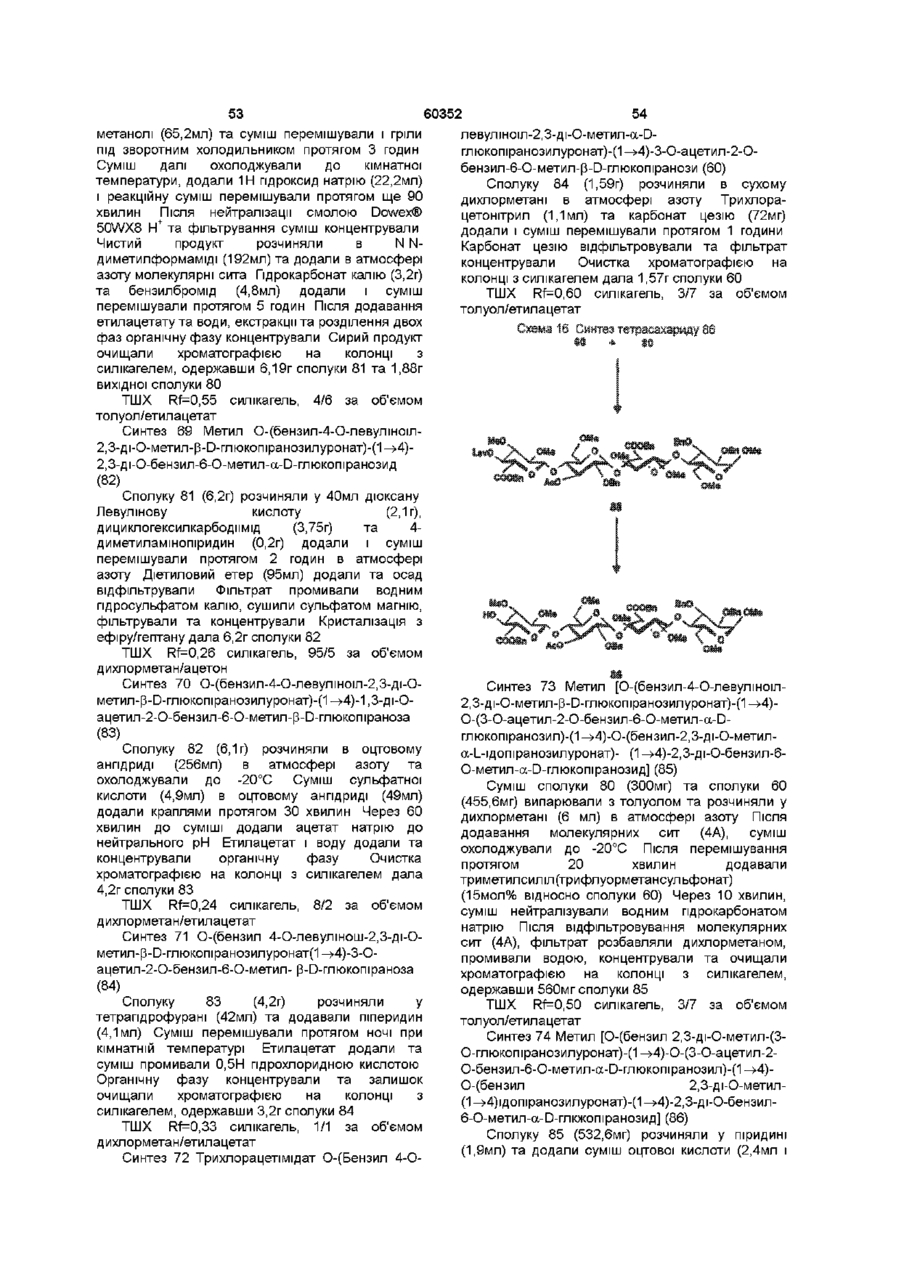
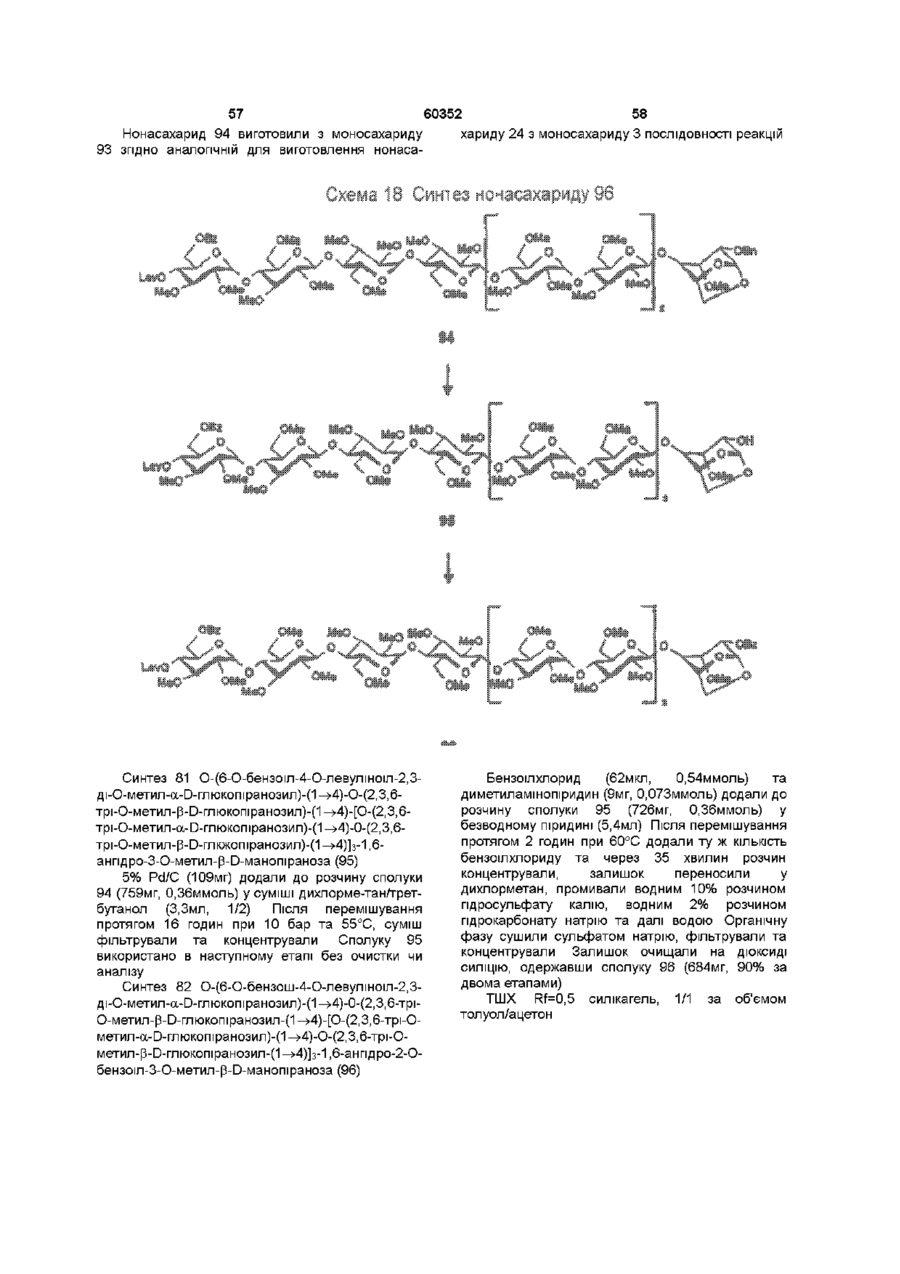
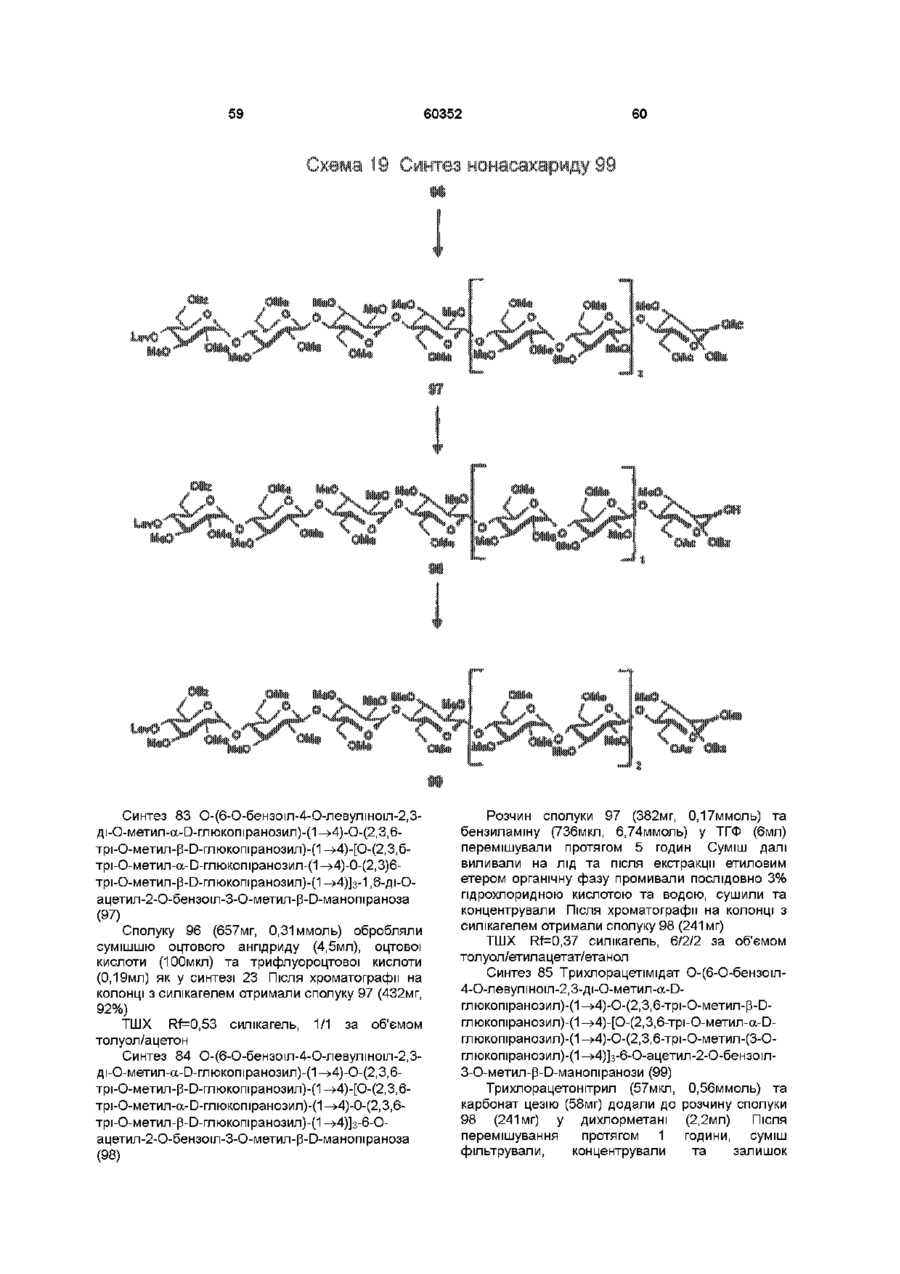
1 Синтетичний полісахарид у кислотній формі та його фармацевтично прийнятні солі, аніонні форми якого відповідають одній з формул (I)-(V) a s i Г at О ю C O О (О 60352 О 03 * л fcfe ао 2 Полісахарид за п 1, який відрізняється тим, що знаходиться у формі солі з натрієм чи калієм 3 Полісахарид за пп 1 чи 2, який відрізняється тим, що має формулу натрієвої солі метил-[О(2,3,4,6-тетра-О-сульфо-(Х-0-глюкопіранозил)(1 —>4)-О-(2,3,6-три-О-сульфо-а-0глюкопіранозил)-(1 —>4)-О-(2,3,6-три-О-сульфо Р -О-глюкопіранозил)-(1 —>4)-О-(2,3-ди-О-метил6-О-сульфо- (X -О-глюкопіранозил)-(1 —> 4)-О(2,3,6-три-О-метил-р -О-глюкопіранозил)-(1 —>4)[О-(2,3,6-три-О-метил- (X-D-глюкопіранозил)(1 —>4)-О-(2,3,6-три-О-метил-р -Dглюкопіранозил)-(1 —> 4)]з-О-(2,3-ді-О-метил-6-Осульфо- (X -О-глюкопіранозил)-(1 —> 4)-О-(2,3-ди-Ометил-р -D-глюкопіранозилуронова кислота)(1 —>4)-О-(2,3,6-три-О-сульфо-а-0глюкопіранозил)-(1 —> 4)-О-(2,3-ди-О-метил- a -Lідопіранозилуронова кислота)-(1 —> 4)-3-О-метил2,6-ди-О-сульфо-а-0-глюкопіранозиду] 4 Фармацевтична композиція, яка як активний інгредієнт містить полісахарид за будь-яким з пп 1-3 у формі солі з фармацевтично прийнятною основою або у формі кислоти, у комбінації чи як суміш з інертним нетоксичним фармацевтично прийнятним наповнювачем 5 Фармацевтична композиція за п 4, яка відрізняється тим, що знаходиться у формі дозованих одиниць, в яких активний інгредієнт змішаний зі щонайменше одним фармацевтичним наповнювачем 6 Фармацевтична композиція за п 5, яка відрізняється тим, що кожна дозована одиниця містить 0,1-100 мг активного інгредієнта 7 Фармацевтична композиція за п 6, яка відрізняється тим, що кожна дозована одиниця містить 0,5-50 мг активного інгредієнта 8 Полісахарид визначений у пп 1-3 для виготовлення лікувального засобу, що корисний при асоційованих з дисфункцією коагуляції патолопях 9 Полісахарид визначений у пп 1-3 для виготовлення лікувального засобу, що корисний при лікуванні чи попередженні розладів систем серцево-судинних та судин мозку тромбоемболічних розладів, що асоційовані з артеріосклерозом та діабетом, тромбоемболічних розладів, що асоційовані з ретромбозом після тромболізу, з інфарктом, недоумством ішемічного походження, захворюваннями периферійних артерій, гемодіалізом чи фібриляціями передсердя, або інакше при використанні аортокоронарних судинних шунтових протезів 10 Полісахарид за п 9, який відрізняється тим, що виготовлений лікувальний засіб використовують при лікуванні чи попередженні тромбоемболічних розладів 11 Полісахарид за п 10, який відрізняється тим, що виготовлений лікувальний засіб використовують при лікуванні чи попередженні нестабільної стенокардії, нападу, рестенозу після анпопластики, ендартеректомм чи вставленні ендоваскулярних протезів 60352 Винахід стосується синтетичних полісахаридів, що мають антикоагулянту та антитромботичну активність гепарину Гепарин належить до родини глікозамшогліканів (GAG), що є природними сульфатованими полісахаридами Гепаринові препарати є сумішшю ланцюгів, що мають число моносахаридних ланок в межах 10100 чи більше Ця гетерогенність за розміром молекул доповнюється структурною гетерогенністю стосовно не тільки природи складових моносахаридів, але також замісників на них (L Roden, "The Biochemistry Ghcoprotems and Glicosaminoghcans", ed W J Lennarz, Plenum Press, New York & London, 267-371, 1980) Кожна родина природних GAG звичайно має діапазон фармакологічної активності Усі скомбіновані в препаратах, які можна отримати з природних продуктів Так, наприклад, гепарини та гепаринсульфати мають антитромботичну активність, що поєднана з одночасною дією на кілька коагуляційних факторів Гепарин каталізує, зокрема через антитромбін III (АТІІІ), інгібування двох ферментів, що залучені в каскаді коагуляції крові, тобто фактору Ха та фактору Па (чи тромбіну) Препарати низькомолекулярних гепаринів (LMWH) містять створені 4-30 моносахаридами ланцюги і більш селективно впливають на фактор Ха, ніж на тромбін Деякі синтетичні олігосахариди, зокрема описані в ЕР 84999, виявляють селективність інгібування фактору Ха через антитромбін III без впливу на тромбін Відомо, ЩО інгібування фактору Ха потребує приєднання гепарину до АТІІІ через антитромбіновий зв'язуючий домен (ABD), а інгібування фактору На (тромбіну) потребує приєднання до АТІІІ через ABD, а також до тромбіну через гірше визначений зв'язуючий домен (TBD) Синтетичні олігосахариди, що відповідають ABD гепарину, ВІДОМІ І ВИЯВЛЯЮТЬ антитромботичну активність при тромбозі вен Ці сполуки описано в ЕР 529715, ЕР 621282 та патенті СА 2040905 Ефективність цих олігосахаридів при попередженні артеріального тромбозу, однак, порушена їх нездатністю інгібувати тромбін Синтез здатних інгібувати тромбін через активацію АТІІІ глікозамшогліканів гепаринового типу описано в патентній заявці PCT/FR 97/01344 В цій заявці описано нові біологічно активні ПОХІДНІ полісахаридів Зокрема, вони є антикоагулянтами та антитромботиками Крім того, оскільки ці полісахариди отримано синтетично, можливо селективно модифікувати їх структуру, зокрема для позбавлення від небажаних сульфатних замісників, що залучені у взаємодію з деякими основними білками, як-то тромбоцитний фактор 4 (PF4), який вивільняється в процесі активації тромбоцитів, призводячи до значної нейтралізації гепарину в зоні тромбу Так, можна отримати полісахариди, що є потужними антитромботичними та антикоагулянтними засобами, і які крім того можуть позбавляти in vivo від дм таких білків, як PF4, які нейтралізують дію гепарину, зокрема на тромбін Показано, зокрема, що ці сульфатовані та алкіловані полісахариди можуть бути потужними антитромботичними та антикоагулянтними засобами залежно від розташування алкільних та сульфатних груп на вуглеводневому каркасі В більш загальному плані виявлено, що створенням полісахарид них послідовностей можливо точно модифікувати активність типу GAG для отримання дуже активного продукту з властивостями гепарину Однак, використання в терапії людини деяких описаних в патентній заявці PCT/FR 97/01344 продуктів може призводити до деяких труднощів, зокрема, коли ці продукти мають довгий період напівіснування При попередженні чи лікуванні тромбозу вищезазначеними продуктами текучість крові треба встановлювати чи підтримувати протягом часу, що попереджує індукування кровотечі Життєво важлива природа асоційованих з цим функцій є такою, що для отримання цієї рівноваги краще використовувати тільки сполуки з коротким періодом напівіснування, з якими легше працювати Суть цього полягає в тому, що добре відома можливість ініціювання викликаної будь-якою випадковою причиною кровотечі у пацієнта Можлива також необхідність хірургічної операції з антитромботичним лікуванням За цими резонами краще використовувати сполуки з коротким періодом напівіснування Період напівіснування синтетичних полісахаридів згідно з винаходом визначали на щурах, на яких несподівано спостерігали, що цей період залежить від структури молекули і зокрема ABD, TBD (тромбінованого зв'язуючого доменту) та проміжної ділянки Тому винахід стосується синтетичних полісахаридів, що за будовою подібні сполукам з патентної заявки PCT/FR 97/01344, але мають специфічні властивості Резоном цього є несподівано короткий період напіввиведення цих сполук, який оцінено після внутрішньовенного уведення щурам за анти-Ха активністю меншим з півтори години Ці сполуки є гексадекасахаридами, що містять три особливих ПОСЛІДОВНОСТІ сульфатовану пентасахаридну ПОСЛІДОВНІСТЬ DEFGH, несульфатовану гепта сахари дну ПОСЛІДОВНІСТЬ Z(MN)3 та сульфатовану тетрасахаридну ПОСЛІДОВНІСТЬ VWXY Сполуки згідно з винаходом є синтетичними полісахаридами в формі кислот та їх фармацевтичне прийнятними солями з фармацевтичне прийнятними катіонами, аніонні форми яких відповідають одній з формул (І), (II), (II), (IV) та (V) 60352 Згідно З винаходом запропоновано полісахариди у формі кислот чи будь-яких їх фармацевтичне прийнятних солей У формі кислот функціональні групи -СОО та/або -SO3 знаходяться у формі -СООН та/або -SO3H, ВІДПОВІДНО Вираз "фармацевтичне прийнятні солі полісахаридів згідно з винаходом" означає полісахариди, в яких одна чи більше функціональних груп -СОО та/або -SO3 поєднані іонним зв'язком з фармацевтичне прийнятним катіоном металу Кращими солями згідно з винаходом є ті, в яких катіон вибрано з катіонів лужних металів, краще катіонів натрію чи калію Винахід стосується також способу виготовлення полісахаридів згідно з винаходом В своїй основі цей спосіб використовує ди- чи олігосахаридні синтони, що виготовлені описаними в літературі способами, з посиланням, зокрема, на ЕР 300099, ЕР 529715, ЕР 621282 та ЕР 649854, а також С van Boeckel, M Petitou, AngewChem IntEd Engl ,1993, 32, 1671-1690 Далі ці синтони сполучають разом, щоб отримати повністю протектовані попередники гексадекасахаридів згідно з винаходом, які далі селективно депротектують та сульфатують з отриманням гексадекасахаридів згідно з винаходом У вищезазначених реакціях сполучення донорний ди- чи олігосахарид, що активований по його аномерному атому карбону, реагує з акцепторним ди- чи олігосахарид ом, що має вільний гідроксил Гексадека сахарид и згідно з винаходом можна синтезувати згідно з такою ПОСЛІДОВНІСТЮ операцій, що стосується представлених визначеною вище формулою (І) зразків сахаридів Спочатку виготовляють протектований попередник GH (pGH), що має спиртову групу в положенні 4і, та протектований попередник EF (pEF), що має активований аномерний атом карбону Інтермедіати pGH та pEF реагують разом з утворенням EFGH Положення 4 нередуктивної кінцевої ланки дали депротектують для одержання попереднику pEFGH Паралельно згідно з цим способом виготовляють попередник частини YZ(MN)3D, що має активований аномерний атом карбону, pYZ(MN)3D Нередуктивну кінцеву ланку дали депротектують для одержання попереднику pYZ(MN)3DEFGH Тетрасахарид pEFGH реагує далі з pYZ(MN)3D з отриманням YZ(MN)3DEFGH Паралельно виготовляють попередник VWX, pVWX Реакція між pVWX та pYZ(MN)3DEFGH дає безпосередній попередник гексадекасахариду, який депротектують та сульфатують з отриманням очікуваного гексадекасахариду Фахівцям ясно, що можливі кілька стратегій синтезу залежно від вибраних акцепторів та донорів Наприклад, можливо виготовити донор VWXYZ(MN)3D та сполучити його з EFGH для отриманням потрібного гексадекасахариду Посилання можна зробити на наведені вище та на Monosacchandes, Their chemistry and their roles in natural products, P M Colhns&R J Ferner, J Wiley&Sons, 1995, атакожна CJ Boons, Tetrahedron, 1996, 52,1095-1121 Сполуки згідно з винаходом піддавали біохімічному та фармакологічному дослідженню, яке показало, що вони крім того мають набагато кращі властивості, ніж описані в патентній заявці PCT/FR 97/01344 Сполуки згідно з винаходом, які селективно зв'язуються з АТІІІ зі спорідненістю як у гепарину чи більшою, мають чудові антикоагулянти! та антитромботичні властивості у порівнянні з гепарином Повну антитромботичну активність продуктів формул (I-V) оцінювали підшкірне чи внутрішньовенне на пацюках в рамках моделі венозного застою та індукції тромбопластином згідно з описаним J Reyers et al в Thrombosis Researh, 1980, 18, 669-674 способом, а також в рамках моделі артеріального тромбозу, яка полягає в імплантуванні шунта між сонною артерією та шийною судиною щурів, як описано Umetsuetal в Thromb Haemost, 1978, 39, 74-83 В цих двох експериментальних моделях величина ED50 сполук згідно з винаходом має щонайменше той же порядок чи менше, що і ІНШІ 60352 10 тромбоемболічних патолопй венозного походження, як то емболія легенів, їх можна використовувати при лікуванні чи попередженні тромботичних ускладнень, що виникають при хірургічних операціях, чи у спряженні з іншими такими патолопями, як рак та бактеріальні чи вірусні інфекції У випадку їх використання при інсталяції чи протезуванні сполуками згідно з винаходом можна покривати протези для того, щоб вони були сумісні з кров'ю Зокрема, їх можна приєднувати до штраваскулярних протезів (стентів) У цьому випадку їх можна, як варіант, ХІМІЧНО модифікувати введенням придатних відгалужень на нередуктивному чи редуктивному КІНЦІ, що описано в ЕР 649854 ВІДОМІ синтетичні гепариноіди (EDso 1-50нмоль/кг) Сполуки згідно з винаходом отже мають особливі переваги в специфічності дії та антикоагулянтній активності Внаслідок їх біохімічної та фармацевтичної активності сполуки згідно з винаходом дуже перспективні як ліки, їх токсичність повністю сумісна з таким використанням Вони також дуже стабільні, а тому особливо придатні в якості активної речовини для фармацевтичних композицій Крім того, сполуки згідно з винаходом не нейтралізуються високими дозами таких катіонних тромбоцитних білків, як PF4, які вивільняються при активації тромбоцитів при тромбозі Сполуки згідно з винаходом тому мають особливі переваги при лікуванні та попередженні тромбозу артерій чи вен їх можна використовувати при різних патолопях, що супроводжують зміни гомеостазу коагуляційних систем, які виникають, зокрема, при розладах систем серцево-судинних та судин мозку, як-то асоційовані з артеріосклерозом та діабетом такі тромбоемболічні розлади, як нестабільна стенокардія, напад, рестеноз після анпопластики, ендартеректомм, вставки ендоваскулярних протезів, або тромбоемболічні розлади, що асоційовані з ретромбозом після тромболізу, інфарктом, недоумством ішемічного походження, захворюваннями периферійних артерій, з гемодіалізом, фібриляціями передсердя чи при використанні аортокоронарних судинних шунтових протезів Крім того, ці продукти можна використовувати при лікуванні та попередженні Сполуки згідно з винаходом можна використовувати також як ад'юванти при ендартеректомм, яку здійснюють пористими балонами Сполуки згідно з винаходом дуже стабільні, а тому особливо придатні в якості активної речовини для лікувальних засобів Так сполуки згідно з винаходом можна використовувати при виготовленні лікувальних засобів для лікування вищезазначених хвороб Згідно З подальшим аспектом винаходу запропоновано фармацевтичну композицію, що містить в якості активної речовини вищезазначений синтетичний полісахарид Винахід стосується переважно фармацевтичних композицій, що містять в якості активної речовини сполуку згідно з винаходом у формі кислоти чи одну з и фармацевтичне прийнятних солей, як варіант, у комбінації з одним чи більше інертними та прийнятними наповнювачами Взагалі, полісахариди згідно з винаходом можна використовувати при лікуванні асоційованих з коагуляційною дисфункцією патолопй В кожній дозованій одиниці активна речовина присутня в КІЛЬКОСТІ, що підходить до передбачуваної добової дози Взагалі, кожна дозована одиниця прийнятне пристосована згідно з дозуванням та типом передбачуваного застосування, наприклад, таблеток, желатинових капсул тощо, пакетиків, склянок, сиропів тощо, крапель, трансдермальних чи трансслизових пластирів, так, що такі дозовані одиниці містять 0,1-ЮОмг активної речовини, переважно, 0,5-50мг Сполуки згідно з винаходом можна використовувати також у комбінації з одною чи більше інших активних речовин, що корисні в рамках потрібної терапії, як-то, наприклад, з антитромботичними засобами, антикоагулянтами, засобами проти злипання тромбоцитів, як-то, наприклад, дипіридамол, аспірин, тиклопідин, клопідогрель, або антагоністами глікопротешового комплексу ІІЬ/ІІІа Фармацевтичні композиції сформовані для застосування тваринами, включаючи людину, при лікуванні вищезазначених захворювань Отримані так фармацевтичні композиції мають переваги в різних формах, як-то, наприклад, розчинів для ІН'ЄКЦІЙ ЧИ ПИТТЯ, покритих цукром таблеток, ординарних таблеток чи желатинових капсул Розчини для ІН'ЄКЦІЙ Є кращими 12 11 60352 фармацевтичними формами Фармацевтичні чи поліетиленгліколем Для парентерального, композиції згідно з винаходом корисні, зокрема назального чи штраокулярного призначення при лікуванні та попередженні розладів стінок можна використовувати водні суспензії, ІЗОТОНІЧНІ судин, як-то артеріосклероз, стани з СОЛЬОВІ розчини чи стерильні суспензії для ІН'ЄКЦІЙ, пперкоагулятивністю, що спостерігають, що містять фармакологічно сумісні диспергувальні наприклад, після хірурги пухлин та після та/або змочувальні засоби, наприклад, пропіленгдерегуляцм коагуляції, індукованої ліколь чи бутиленгліколь бактеріальними, вірусними чи ферментними Для трансслизового призначення активний активаторами Дози можна змінювати в широких інгредієнт можна сформувати з такими межах залежно від віку, маси та стану здоров'я промоторами, як жовчні солі, такі гідрофільні пацієнта, суворості та природи ускладнення, а полімери, як наприклад, пдроксипропілцелюлоза, також шляху призначення Таке дозування гід роксип-ропіл метил целюлоза, включає застосування одної чи більше доз гід роксіетил целюлоза, етилцелюлоза, приблизно 0,1-ЮОмг на добу, переважно, 0,5-50мг карбоксиметил целюлоза, декстрин, на добу, внутрішньом'язово чи підшкірно, полівшілпіролідон, пектини, крохмалі, желатин, безперервним уведенням чи через регулярні казеїн, акрилову кислоту, акрилові естери та їх інтервали співполімери, ВІНІЛОВІ полімери та співполімери, ВІНІЛОВІ спирти, алкоксиполімери, поліетиленокОб'єктом згідно з винаходом є тому також сидні полімери, поліестери чи їх суміші фармацевтична композиція, що містить як активну речовину одну з вищезазначених сполук, як Активний інгредієнт можна сформувати також варіант, у комбінації з іншими активними у формі мікрокапсул, як варіант, з одним чи більше речовинами Ці КОМПОЗИЦІЇ зроблено так, щоб їх підтримувачем чи адитивом можна було застосовувати перорально чи Активний інгредієнт може бути також у формі парентерально комплексу з циклодекстрином, наприклад, а-, р-, чи у-циклодекстрином, 2-пдроксипропіл-рУ фармацевтичних композиціях згідно з циклодекстрином чи метил-р-циклодекстрином винаходом перорального, під'язичного, підшкірного, внутрішньом'язового, Активний інгредієнт може також вивільнятися з внутрішньовенного, трансдермального, балону, що їх містить, або введеного у кров'яну трансслизового, місцевого чи ректального судину внутрішньосудинного подовжувачу призначення активний інгредієнт можна Фармакологічна ДІЙОВІСТЬ активної речовини тому застосовувати до людини та тварини у формі є недоторканою Підшкірне призначення є кращим одиниць, які змішано зі стандартними Нижченаведені способи, синтези та схеми фармацевтичними підтримувачами Прийнятні ілюструють синтези різних штермедіатів, що одиничні форми для застосування включають корисні при отриманні полісахаридів згідно з пероральні, як-то таблетки, желатинові капсули, винаходом порошки, гранули та пероральні суспензії чи Використано нижченаведені скорочення розчини, ПІД'ЯЗИЧНІ та защічні форми, підшкірні, TBDMS - трет-бутилдиметилсиліл, Lev - левуноїл, внутрішньомязові, внутрішньовенні, назальні чи Вп - бензил, Bz - бензоїл, ТШХ - тонкошарова штраокулярні, а також ректальні форми хроматографія, Olm - трихлорацетімідоїл, LSIMS При виготовленні твердих композицій у формі рідинна вторинноюнна мас-спектрометрія, ESIMS таблеток головний активний інгредієнт змішують з мас-спектрометрія з іонізацією розпиленням таким фармацевтичним середовищем, як желатин, електронів, TMS - триметилсиліл, TSP крохмаль, лактоза, стеарат магнію, тальк, триметилсилілтетрадейтерюпропюнат натрію, Tf гуміарабік тощо Таблетки можна покривати трифлат, MS - молекулярні сита, РМВ - пцукром чи іншими придатними матеріалами, метоксибензил, МР - п-метоксифеніл, TS - тозил, інакше, їх можна обробляти так, щоб досягти ЕТ - етил, Рп - феніл, Me - метил, Ас - ацетил затриманої чи довготривалої активності, або так, Dowex®, Sephadex®, Chelex® та Toyopearl® щоб вони вивільняли попередньо визначену зареєстровані торгові марки КІЛЬКІСТЬ активного інгредієнту безперервно У нижченаведених способах, синтезах та Виготовлення желатинових капсул здійснюють прикладах загальні операції стосовно змішуванням активного інгредієнту з каталітичного сполучення імідатів, розщеплення розріджувачем та засипанням отриманої суміші в левулінових естерів, каталітичного сполучення м'які ЧИ тверді желатинові капсули ТІОГЛІКОЗИДІВ, омилення, метилування та Порошки чи гранули для диспергування у воді селективного депротектування пможуть містити активний інгредієнт змішаним з метоксибензильних груп, депротекгування та диспергувальними чи змочувальними засобами, сульфатування олігосахаридів та полісахаридів або такими суспендувальними засобами, як пдрогенолізом бензилових естерів чи етерів, полівшілпіролідон, а також підсолоджуючими чи омилення естерів чи сульфатування можна смаковими засобами провести застосуванням загальних описаних При ректальному застосуванні це здійснюють нижче для прийнятних штермедіатів способів використанням супозиторієв, які виготовляють зі Приклади синтезів сполуки згідно з винаходом для зв'язувальними засобами, що плавляться при ілюстративності деталізовано нижче ректальній температурі, наприклад, маслом какао 13 60352 14 Схема 1 Синтез пентасахариду 9 Синтез 1 Етил О-(2,3-ді-О-бензоіл-4,6-Обензиліден-а-0-глюкопіранозил)-(1^4)-2,3,6-трі-Обензоіл-1 -Tio-p-D-глюкопіранозид (2) Бензоілхлорид (24,5мл, 211 ммоль) додали краплями протягом 20 хвилин до охолодженого (0°С) розчину сполуки 1 (16,7г, 35,2ммоль) (J Westman та М Nilsson, J Carbohydr Chem , 1995,14 (7), 949-960) у піридині (202мл) Реакційну суміш перемішували протягом 20 годин при кімнатній температурі За допомогою ТШХ виявлено перетворення приблизно на 50% Суміш розбавляли водою та дихлорметаном Після екстракції органічну фазу промивали 10% розчином гідрокарбонату натрію та водою, сушили сульфатом магнію та концентрували Залишок знов обробляли бензоілхлоридом згідно операції, 16 15 60352 що описано вище Сирий продую" очищали 8,22ммоль) додали краплями та перемішували хроматографією на колонці з силікагелем, суміш протягом 20 годин при кімнатній одержавши 22г сполуки 2 температурі Надлишок гідриду натрію руйнували ТШХ Rf=0,80, силікагель, 9/1 за об'ємом метанолом та суміш виливали в 50мл льодяної толуол/етанол води Після екстракції етилацетатом (3 рази по Синтез 2 О-(2,3-ди-О-бензот-4,6-О-бензиліден20мл), органічну фазу промивали розчином а-0-глюкопіранозил)-(1^4)-О-(2,3,6-трі-О-бензоілхлориду натрію, сушили сульфатом магнію та Р-О-глкжопіранозил)-(1 -^4)-1,6-анпдро-2,3-ді-Оконцентрували, одержавши 690мг of сполуки метил-р-О-глюкопіраноза (4) 6,ТШХ Rf=0,25 силікагель, 95/5 за об'ємом дихлорметан/метанол Суміш тюглікозиду 2 (1,05г, 1,05ммоль), Синтез 5 О-(2,3-ди-О-метил-а-0 сполуки 3 (200мг, 1,05ммоль) (Jeamoz et al , J Org глюкопіранозил)-(1^4)-О-(2,3,6-трі-О-метил-р-0Chem 1961, 26, 3939-3944) та порошку 14 глюкопіранозил)-(1 -^4)-1,6-анпдро-2,3-ді-Омолекулярних сит (4А) (1,1г) в толуолі (18мл) метил-р-О-глюкопіраноза (7) перемішували в атмосфері азоту протягом 15 хвилин Суміш доводили до -20°С та вводили Сполуку 6 (690мг, 1,03ммоль) розчиняли у свіжовиготовлений розчин N-йодсукциніміду 80% оцтовій кислоті (7,3мл) та перемішували (1,11 ммоль) та трифлуор-метансульфонової протягом 20 годин при 40°С Суміш концентрували кислоти (0,125ммоль) в 1/1 за об'ємом під вакуумом та випарювали з толуолом дихлорметані/дюксані (бмл) Через 10 хвилин Хроматографія на колонці з силікагелем з червону реакційну суміш фільтрували, розбавляли сумішшю 8/1/1 дихлорметан/етилацетат/метанол дихлорметаном, екстрагували, промивали дала 569мг сполуки 7, ТШХ Rf=0,40 силікагель, послідовно 10% розчином тіосульфату натрію, 9/1 за об'ємом дихлорметан/метанол 10% розчином гідрокарбонату натрію та водою, Синтез 6 0-(6-О-бензоіл-2,3-ді-О-метил-а-Осушили сульфатом магнію та концентрували під глюкопіранозил)-(1^4)-О-(2,3,6-трі-О-метил-р-0вакуумом Очистку залишку проводили глкжопіранозил)-(1 -^4)-1,6-анпдро-2,3-ді-О-метилхроматографією на колонці з силікагелем, P-D -глкжопіраноза (8) одержавши 1 ,25г сполуки 4 1 -бензилокси-1 Н-бензотріазол (227мг, ТШХ Rf=0,55 силікагель, 4/6 за об'ємом 1,05ммоль) та тріетиламш (1,15ммоль) додали до гептан/етилацетат розчину сполуки 7 (560мг, 0,96ммоль) у Синтез 3 О-(4,6-О-бензиліден-а-0дихлорметані та суміш далі перемішували глкжопіранозил)-(1^4)-О-(р-0- глюкопіранозил)протягом 20 годин при кімнатній температурі (1 -^4)-1,6-анпдро-2,3-ді-О-метил-р-0Реакційну суміш розбавляли дихлорметаном та глюкопіраноза (5) промивали 10% розчином гідрокарбонату натрію Трет-бутоксид калію (приблизно 50мг) додали та водою Органічну фазу сушили сульфатом до розчину сполуки 4 (1,24г, 1,11 ммоль) в 1/1 за магнію, фільтрували та випарювали досуха об'ємом метанолі/діоксани (7мл) Суміш Продукт очищали хроматографією на колонці з перемішували протягом години та додали ще 50мг силікагелем, одержавши 600мг сполуки 8 трет-бутоксид у калію і перемішували протягом ще ТШХ Rf=0,50 силікагель, 9/1 за об'ємом 60 хвилин Реакційну суміш нейтралізували дихлорметан/метанол + смолою Dowex® 50WX8 Н , фільтрували та Синтез 7 О-(2,3-ди-0-бензоіл-4,6-Оконцентрували під вакуумом Після хроматографії бензиліден-а-0-глюкопіранозил)-(1^4)-О-(2,3,6на колонці з силікагелем, виділили у формі масла трі-О-бензот-р-0-глюкопіранозил)-(1^4)-О-(6-О665мг сполуки 5 ТШХ Rf=O,50 силікагель, 85/15 за бензоіл-2,3-ді-О-метил-а-0-глюкотранозил-(1^4)об'ємом дихлорметан/метанол О-(2,3,6-трі-О-метил-р-0-глкжопіранозил)-(1^4)Синтез 4 О-(4,6-О-бензиліден-2,3-ді-О-метил1,6-анпдро-2,3-ді-О-метил-р-0-глкжопіраноза (9) a-D -глюкопіранозил)-(1^4)-О-р-(2,3,6-трі-ОСполуку 8 перетворювали у сполуку 9 згідно метил-р-О-3-глкжопіранозил)-(1 -^4)-1,6-анпдрооперації, що описана для синтезу сполуки 4, 2,3-ді-О-метил-р-0-глкжопіраноза (6) Реакцію сполучення проводили при 5°С Гідрид натрію (387мг, 9,65ммоль) додавали в ТШХ Rf=0,50 силікагель, 2/8 за об'ємом атмосфері азоту до охолодженого (5°С) розчин гептан/етилацетат сполуки 5 (660мг, 1,1 ммоль) в сухому тетрапдрофурані (8мл) Метил йодид (0,51 мл, 17 Синтез 8 0-(4,6-О-бензиліден-а-Оглкжопіранозил)-(1^4)-О-(р-0-глкжопіранозил)-( 1^4)-О-(2,3-ді-О-метил-а-0-глюкопіранозил)(1^4)-О-(2,3,6-трі-О-метил-(3-0-глюкопіранозил)(1 -^4)-1,6-анпдро-2,3-ді-О-метил-р-0глюкопіраноза (10) Сполуку 9 перетворювали у сполуку 10 згідно операції, що описано для синтезу сполуки 5 ТШХ Rf=0,35 силікагель, 9/1 за об'ємом дихлорметан/метанол Синтез 9 О-(4,6-О-бензиліден-2,3-ді-О-метила-0-глюкопіранозил)-(1^4)-О-(2,3,6-трі-О-метил-р 60352 18 0-глюкопіранозил)-(1^4)-О-(2,3,6-трі-О-метил-а0-глюкопіранозил)-(1^4)-О-(2,3,6-трі-О-метил-р-0глюкопіранозил)-1,6-анпдро-2,3-ді-О-метил-р-0глюкопіраноза (11) Сполуку 10 перетворювали у сполуку 11 згідно операції, що описано для синтезу сполуки 6 ТШХ Rf=0,50 силікагель, 9/1 за об'ємом дихлорметан/метанол Синтез 10 О-(2,3-ди-О-метил-а-0глюкопіранозил)-(1^4)-О-(2,3,6-трі-О-метилтр-Оглюкопіранозил)-(1^4)-О-(2,3,6-трі-О-метил-а-0глюкопіранозил)-(1^4)-О-(2,3,6-трі-О-метил-р-0 20 19 60352 Синтез 12 О-(2,3-ди-О-бензоіл-4,6-Оглкжопіранозил)-(1 -^4)-1,6-анпдро-2,3-ді-О-метилбензиліден-а-0-глюкопіранозил)-(1^4)-О-(2,3,6P-D-глюкопіраноза (12) трі-О-бензоіл-р-0-глюкопіранозил)-(1^4)-О-(6-ОСполуку 11 перетворювали у сполуку 12 згідно бензоіл-2,3-ді-О-метил-а-0-глюкопіранозил)операції, що описано для синтезу сполуки 7 ТШХ (1^4)-О-(2,3,6-трі-О-метил-р-0-глюкопіранозил)Rf=0,35 силікагель, 9/1 за об'ємом (1^4)-0-(2,3,6-трі-О-метил-а-О-глюкопіранозил)дихлорметан/метанол (1^4)-О-(2,3,6-трі-О-метил-р-0-глюкопіранозил)Синтез 11 0-(6-О-бензоіл-2,3-ді-О-метил-а-О(1 -^4)-1,6-анпдро-2,3-ді-О-метил-р-0глюкопіранозил)-(1^4)-О-(2,3,6-трі-О-метил-р-0глюкопіраноза(14) глюкопіранозил)-(1^4)-О-(2,3,6-трі-О-метил-а-0глюкопіранозил)-(1^4)-О-(2,3,6-трі-О-метил-р-0Реакцію сполучення сполуки 13 з дисахаридом глкжопіранозил)-(1 -^4)-1,6-анпдро-2,3-ді-О-метил2 проводили згідно операції, що описано для P-D-глюкопіраноза (13) синтезу сполуки 9, одержавши сполуку 14 ТШХ Rf=0,40 силікагель, 7,0/1,5/1,5 за Сполуку 12 перетворювали у сполуку 13 згідно об'ємом толуол/етилацетат/етанол операції, що описано для синтезу сполуки 8 ТШХ Rf=0,40 силікагель, 7,0/1,5/1,5 за об'ємом тол уол /ети л а цетат/ета н ол 21 Синтез 13 О-(4,6-О-бензиліден-а-0глюкопіранозил)-(1^4)-О-(-р-глюкопіранозіл)-( 1^4)-О-(2,3-ді-О-метил-а-0-глюкопіранозил)(1^4)-О-(2,3,6-три-О-метил-р-0-глюкопіранозил(1^4)-О-(2,3,6-трі-О-метил-а-0-глюкопіранозил)(1^4)-О-(2,3,6-трі-О-метил-р-0-глюкопіранозил)(1 -^4)-1,6-анпдро-2,3-ді-О-метил-р-0глюкопіраноза (15) Сполуку 14 перетворювали у сполуку 15 згідно операції, що описано для синтезу сполуки 5 ТШХ Rf=0,60 силікагель, 9/1 за об'ємом дихлорметан/метанол Синтез 14 О-(4,6-О-бензиліден-2,3-ді-О-метила-0-глюкопіранозил)-(1^4)-О-(2,3,6-трі-О-метил-р0-глюкопіранозил)-(1^4)-[О-(2,3,6-трі-О-метил-аD-глюкопіранозил)- (1 -^4)-О-(2,3,6-трі-О-метил-рО-глюкопіранозил)-(1 -^4)]2-1,6-анпдро-2,3-ді-Ометил-р-О-глюкопіроноза (16) Сполуку 15 перетворювали у сполуку 16 згідно операції, що описано для синтезу сполуки 6 ТШХ Rf=0,70 силікагель, 9/1 за об'ємом 5 дихлорметан/метанол Синтез 15 О-(2,3-ди-О-метил-а-0глкжопіранозил)-(1^4)-О-(2,3,6-трі-О-метил-р-0глюкопіранозил)-(1^4)-[О-(2,3,6-трі-О-метил-а-0глюкопіранозил-(1^4)-О-(2,3,6-трі-О-метил-а-0глкжопіранозил)-(1 -^4)]2-1,6-анпдро-2,3-ді-Ометил-р-О-глюкопіраноза (17) Розчин сполуки 16 (5,05г, 2,0ммоль) у 80% оцтовій кислоті (50мл) перемішували протягом 20 годин при 40°С Суміш концентрували під 60352 22 вакуумом та випарювали з толуолом Залишок розчиняли в етилацетаті та екстрагували водою Водну фазу екстрагували дихлорметаном та сушили органічну фазу сульфатом магнію, фільтрували та випарювали досуха, одержавши 2,68г сполуки 17 ТШХ Rf=0,50 силікагель, 9/1 за об'ємом дихлорметан/метанол Синтез 16 О-(6-О-бензоіл-2,3-ді-О-метил-а-0глюкопіранозил)-(1^4)-О-(2,3,6-трі-О-метил-р-0глюкопіранозил)-(1^4)-[(О-(2,3,6-трі-О-метил-а-0глюкопіранозил)-(1^4)-О-(2,3,6-трі-О-метил-а-0глюкопіранозил-(1 -^4)]2-1,6-анпдро-2,3-ді-Щметил-р-О-глюкопіраноза (18) Сполуки 17 перетворювали у сполуку 18 згідно операції, що описано для виготовлення сполуки 8 ТШХ Rf=0,80 силікагель, 7,0/1,5/1,5 за об'ємом толуол/етил ацетат/етанол Синтез 17 О-(2,3-ди-О-бензоіл-4,6-Обензиліден-а-0-глюкопіранозил)-(1^4)-О-(2,3,6трі-О-бензоіл-р-0-глюкопіранозил)-(1^4)-О-(6-Обензоіл-2,3-ді-О-метил-а-0-глюкопіранозил)(1^4)-О-(2,3,6-трі-О-метил-р-0-глюкопіранозил)(1^4)-[О-(2,3,6-трі-О-метил-а-0-глюкопіранозил)(1^4)-0-(2,3,6-трі-О-метил-р-О-глюкопіранозил(1 ->4)]2-1,6-анпдро-2)3-ді-О-метил-р-0глюкопіраноза(19) Суміш тюглікозиду 2 (1,97г, 2,0ммоль, 3,5екв), гептасахариду 18 (0,86г, 0,57ммоль) та порошку молекулярних сит (4А)в толуолі (22мл) перемішували в атмосфері азоту протягом 15 хвилин Свіжовиготовлений розчин з вмістом N 23 йодсукциніміду (496мг, 2,2ммоль) та трифлуорметансульфонової кислоти (0,808ммоль) у 1/1 за об'ємом дихлорметані/діоксані (12мл) далі додали краплями, при кімнатній температурі Через 10 хвилин реакційну суміш фільтрували, розбавляли дихлорметаном, екстрагували, промивали 10% розчином тіосульфату натрію та 60352 24 10% розчином гідрокарбонату натрію, сушили сульфатом магнію та концентрували під вакуумом Сирий продукт очищали хроматографією на колонці з силікагелем, одержавши 1,09г сполуки 19 ТШХ Rf=0,80 силікагель, 6/2/2 за об'ємом тол уол /ети л а цетат/ета н ол 25 Синтез 18 О-(4,6-О-бензиліден-а-0гпкжопіранозил)-(1^4)-О-(-р-0-глюкопіранозил)-( 1^4)-О-(2,3-ді-О-метил-а-0-глюкопіранозил)(1^4)-О-(2,3,6-трі-О-метил-р-0-глюкопіранозил)[(1^4)-О-(2,3,6-трі-О-метил-а-0-глюкопіранозил)(1^4)-О-(2,3,6-трі-О-метил-р-0-глюкопіранозил)]2(1^4)-1,6-анпдро-2,3-ді-О-метил-(3-глюкопіраноза (20) Сполуку 19 перетворювали у сполуку 20 згідно операції, що описано для синтезу сполуки 5 ТШХ Rf=0,25 силікагель, 5,0/2,5/2,5 за об'ємом тол уол /ети л а цетат/ета н ол Синтез 19 О-(4,6-О-бензиліден-2,3-ді-О-метила-0-глюкопіранозил)-(1^4)-О-(2,3,6-трі-О-метил-р0-глюкопіранозил)-(1^4)-О-(2,3,6-трі-О-метил-а0-глюкопіранозил)-(1^4)-О-(2,3,6-трі-О-метил-р-0глкжопіранозил)-(1 -^4)]з-1,6-анпдро-2,3-ді-Ометил-р-О-глкжопіраноза (21) Сполуку 20 перетворювали у сполуку 21 згідно операції, що описано для синтезу сполуки 6 20 ТШХ Rf=0,50 силікагель, 6/2/2 за об'ємом тол уол /ети л а цетат/ета н ол Синтез 20 О-(2,3-ди-О-метил-а-0глюкопіранозил)-(1^4)-О-(2,3,6-трі-О-метил-р-0глюкопіранозил)-(1^4)-[О-(2,3,6-трі-О-метил-а-0(глюкопіранозил)-(1^4)-О-(2,3,6-трі-О-метилл-0глюкопіранозил)-(1 -^4)]з-1,6-анпдро-2,3-ді-Ометил-р-О-глкжопіраноза (22) Сполуку 21 перетворювали у сполуку 22 згідно операції, що описано для синтезу сполуки 7 ТШХ Rf=0,20 силікагель, 6/2/2 за об'ємом тол уол /ети л а цетат/ета н ол Синтез 21 О-(6-О-бензоіл-2,3-ді-О-метил-а-0глюкопіранозил)-(1^4)-О-(2,3,6-трі-О-метил-р-0глюкопіранозил)-(1^4)-[О-(2,3,6-трі-О-метил-а-0тюкопіранозил)-(1^4)-О-(2,3)6-трі-О-метил-рглюкопіранозил)-(1 -^4)]з-1,6-анпдро-2,3-ді-Ометил-р-О-глюкопіраноза (23) Сполуку 22 перетворювали у сполуку 23 згідно операції, що описано для синтезу сполуки 8 ТШХ 60352 26 Rf=0,20 силікагель, 6/2/2 за об'ємом тол уол /ети л а цетат/ета н ол Синтез 22 О-(6-О-бензоіл-4-О-левулшоіл-2,3ді-О-метил-а-0-глюкопіранозил)-( 1^4)-О-(2,3,6трі-О-метил-р-0-глюкопіранозил)-(1^4)-[О-(2,3,6трі-О-метил-а-0-глюкопіранозил)-(1^4)-О-(2,3,6трі-О-метил-р-0-глюкопіранозил)-(1 -^4)]з-1,6анпдро-2,3-ді-О-метил-р-0-глюкопіраноза(24) Гідрохлорид 1-(3-диметиламшопропіл)-3етилкарбодмміду (48мг, 0,25ммоль), левулінову кислоту (29мг, 0,25ммоль) та диметиламшопіридин (4мг, О.ОЗЗммоль) додали до розчину сполуки 23 (320мг, 0,167ммоль) у діоксані (1мл) Реакційну суміш перемішували протягом З годин при кімнатній температурі в атмосфері азоту Далі додали дихлорметан та воду, а після екстракції органічну фазу промивали водою, сушили сульфатом магнію, фільтрували та концентрували Сирий продукт очищали хроматографією на колонці з силікагелем, одержавши 312мг сполуки 24 ТШХ Rf = 0,50 силікагель, 6/2/2 за об'ємом тол уол /ети л а цетат/ета н ол Синтез 23 О-(6-О-бензоіл-4-О-левулшот-2,3ді-О-метил-а-0-глюкопіранозил)-(2,3,6-трі-Ометил-р-0-глюкопіранозил)-(1^4)-[О-(2,3,6-трі-Ометил-а-О-глюкопіранозил-(1^4)-0-(2,3,6-трі-Ометил-р-О-глюкопіранозил-(1 -^4)]з-1,6-ді-Оацетил-2,3-ді-О-метил-а,р-0-глюкопіраноза (25) Розчин сполуки 24 (312мг, 0,155ммоль) у суміші оцтового ангідриду (2,25мл), оцтової кислоти (50мкл) та трифлуороцтової кислоти (0,14мл) перемішували 4 години при кімнатній температурі Після додавання толуолу (Юмл) суміш концентрували та тричі випарювали з толуолом (по Юмл) Після хроматографії на колонці з силікагелем виділили 324мг сполуки 25 ТШХ Rf=0,65 силікагель, 6/2/2 за об'ємом тол уол /ети л а цетат/ета н ол 27 60352 28 Схема 5 Синтез нонасахариду 27 Синтез 24 0-(6-О-бензоіл-4-О-левуліноіл-2,3ді-О-метил-а-О-глюкопіранозил)-(1^4)-0-(2,3,6-тріО-метил-р-О-глюкопіранозил)-(1^4)-[0-(2,3,6-тріО-метил-а-0-глюкопіранозил-(1^4)-О-(2,3,6-трі-Ометил-р-0-глюкопіранозил)-(1^4)]з-6-О-ацетил2,3-ді-О-метил-а,р-0-глюкопіраноза (26) Розчин сполуки 25 (324мг, 0,153ммоль) та морфоліну (22,3мкл, 0,256ммоль) в толуолі (2мл) перемішували протягом 4 годин при 35°С Знов додали морфолін (22,3мкл) та реакційну суміш перемішували протягом 20 годин при 35°С Суміш швидко охолоджували водою Після екстракції дихлорметаном, органічну фазу послідовно промивали 0,1Н пдрохлоридною кислотою та водою, сушили та випарювали досуха Після хроматографії на колонці з силікагелем виділили 280 мг сполуки 26 ТШХ Rf=0,45 силікагель, 6/2/2 за об'ємом тол уол /ети л а цетат/ета н ол Синтез Трихлорацетімідат О-(6-О-бензот-4-Олевулшоіл-2,3-ді-О-метил-а-0-глюкопіранозил)(1^4)-О-(2,3,6-трі-О-метил-р-0-глюкопіранозил)(1^4)-[О-(2,3,6-трі-О-метил-а-0-глюкопіранозил)(1^4)-О-(2,3,6-трі-О-метил-р-0-глюкопіранозил(1^4)]з-6-О-ацетил-2,3-ді-О-метил--а,р-0глкжопіранози (27) Трихлорацетонітрил (39мкл, 0,39ммоль) та карбонат цезію (4,7мг) додали до розчину сполуки 26 (138мг, 0,066ммоль) у дихлорметані (1,5мл) Після перемішування протягом 2 годин, суміш фільтрували, концентрували та залишок хроматографували на колонці з силікагелем, одержавши 152мг імідату 27 ТШХ Rf=0,35 силікагель, 8/1/1 за об'ємом тол уол /ети л а цетат/ета н ол 29 Синтез 26 Метил-О-(4,6-Счзопропіліден-3-Ометил-а-І_-ідопіранозил-(1^4)-2,6-ді-О-бензил-3О-метил-а-О-глкжопіранозид (29) Сполуку 28 (2,5г, 3,53ммоль) (М Petitou et al , J Med Chem 1997, 40, 1600) обробляли як в синтезі 5, та після хроматографії на дюксиді СИЛІЦІЮ (2/1 циклогексан/етилацетат), одержали сполуку 29 (2,1г, 98%) ТШХ Rf=0,32 силікагель, 2/1 за об'ємом циклогексан/етилацетат Синтез 27 Метил-О-(4,6-О-ізопропіліден-2,3-діО-метил-а-І_-ідопіранозил-(1^4)-2,6-ді-О-бензилЗ-О-метил-а-О-глюкопіранозид (ЗО) Сполуку 29 (2,0г, З.Зммоль) обробляли як в синтезі сполуки 6, та після хроматографії на дюксиді СИЛІЦІЮ (5/1 циклогексан/етилацетат), одержали сполуку ЗО (1,83г, 89%) ТШХ Rf=0,38 силікагель, 5/2 за об'ємом циклогексан/етилацетат Синтез 28 Метил-О-(2,3-ді-О-метил-а-І_ідопіранозил-(1^4)-2,6-ді-О-бензил-3-О-метил--аD-глкжопіранозид (31) Водний розчин 70% трифлуороцтової кислоти (3,1 мл) додали до розчину сполуки ЗО (1,76г, 2,84ммоль) у дихлорметані (16мл) Через 50 хвилин, реакційне середовище розбавляли дихлорметаном та промивали водою до нейтральної реакції Органічну фазу сушили (сульфатом натрію), фільтрували та концентрували Залишок очищали на дюксиді СИЛІЦІЮ, одержавши сполуку 31 (1,45 г, 88%) [а]20о= +10 (с = 1,0, дихлорметан) 60352 ЗО Синтез 29 Метил-О-(2,3-ді-О-метил-а-І_ідопіранозилуронова кислота)-(1^4)-2,6-ді-Обензил-З-О-метил-а-О-глюкопіранозид (32) 2,2,6,6-тетраметил-1-піперидинілокси (3,3мг), розчин гідрокарбонату натрію (4мл), бромід калію (22мг) та хлорид тетрабутиламонію (29мг) додали до розчину сполуки 31 (1,16г) у дихлор-метані (бмл) Суміш охолоджували до 0°С та додали протягом 15 хвилин суміш насиченого розчину хлориду натрію (4,4мл), насиченого розчину гідрокарбонату натрію (2,2мл) та гіпохлориту натрію (1,ЗМ, 5мл) Після перемішування протягом 1 години, суміш розбавляли водою та тричі екстрагували дихлорметаном Органічну фазу промивали водним розчином хлориду натрію, сушили сульфатом магнію, фільтрували та випарювали досуха, одержавши 1,34г сирої сполуки 32 Rf=0,22 силікагель, 10/1 за об'ємом дихлорметан/метанол Синтез ЗО Метил-О-(бензил-2,3-ді-О-метил-аІ_-ідопіранозилуронат)-(1^4)-2,6-ді-О-бензил-3-Ометил-a-D -глюкопіранозид (33) Сполуку 32 розчиняли у N,Nдиметилформаміді (11 мл) в атмосфері азоту Гідрокарбонат калію (0,67г) та бензилбромід (1,07мл) додали та перемішували суміш протягом 90 хвилин Етилацетат та воду додали і після екстракції органічну фазу концентрували Очистка хроматографією на колонці з силікагелем дала 0,99г сполуки 33 ТШХ Rf=0,58 силікагель, 1/4 за об'ємом толуол/діетиловий етер 31 60352 32 Схема 7 Синтез тетрасахариду 36 Синтез 31 Метил-О-(бензил-4-О-левулшоіл2,3-ді-О-метил-р-0-глюкопіранозилуронат-(1^4)О-(3,6-ді-О-ацетил-2-О-бензил-а-0глюкопіранозил)-(1^4)-О-(бензил 2,3-ді-О-метила-І_-ідопіранозилуронат)-(1^4)-2)6-ді-О-бензил-3О-метил-а-О-глюкопіранозид (35) Сполуки 34 (274мг, 0,31ммоль) (М Petitou, et al , J Med Chem , 1997,40,1600) та 33 (200мг, 0,29ммоль) в толуолі (Юмл) обробляли у присутності молекулярних сит (220мг) при -20°С третбутилдиметилсиліл(трифлуорметансульфонатом (0,15мл 1 молярного розчину в толуолі) Після перемішування протягом 10 хвилин, реакційну суміш нейтралізували (МаНСОз), фільтрували та концентрували Хроматографія на колонці з силікагелем дала сполуку 35 (334мг, 80%) [a] D-+31 (с=0,76, дихлорметан) Синтез 32 Метил-О-(бензил 2,3-ді-О-метил-р0-глюкопіранозил-уронат)-(1^4)-О-(3,6-ді-Оацетил-2-О-бензил-а-0-глюкопіранозил)-(1^4)-О(бензил 2,3-ді-О-метил-а-І_-ідопіранозилуронат)(1^4)-2,6-ді-О-бензил-3-О-метил-а-0глюкопіранозид (36) Сполуку 35 (308мг, 0,22ммоль) розчиняли в суміші толуол/етанол (1/2,43мл) та додавали далі ацетат гідразину (101 мг, 5екв) Після перемішування протягом 45 хвилин, суміш концентрували та очищали на колонці з дюксидом СИЛІЦІЮ, одержавши сполуку 36 (162мг, 89%) [a] D-+29 (с = 1,05, дихлорметан) 33 Синтез 33 Метил О-(6-О-бензоіл-4-Олевулшоіл-2,3-ді-О-метил-а-0-глюкопіранозил)(1^4)-О-(2,3)6-трі-О0-метил-3-О-глюкопІранозил)(1^4)-[0-(2,3,6-трі-О-метил-а-О-глюкопіранозил)(1^4)-О-(2,3,6-трі-О-метил-р-0-глюкопіранозил(1^4)]з-О-(6-О-ацетил-2,3-ді-О-метил-а-0глюкопіранозил)-(1^4)-О-(бензил 2,3-ді-О-метилР-0-глюкопіранозилуронат)-(1^4)-О-(3,6-ді-Оацетил-2-О-бензил-а-0-глюкопіранозил)-(1^4)-О(бензил 2,3-ді-О-метил-а-І_-ідопіранозилуронат(1^4)-2,6-ді-О-бензил-3-О-метил-а-0глюкопіранозид (37) Імідат 27 (177мг, 76,6мкмоль) та акцептор 36 (201 мг, 0,15ммоль) у суміші 2/1 діетиловий етер/дихлорметан (2,8мл) обробляли третбутилдиметилсиліл(трифлуорметансульфонатом) (11,5мкл 1 молярного розчину у дихлорметані) як при синтезі сполуки 35 Сполуку очищали на хроматографічній колонці Sephadex® LH-20 (1/1 дихлорметан/етанол), а потім на колонці з дюксидом СИЛІЦІЮ (3/0,5/1 толуол/ацетон/етанол), а наприкінці на колонці з дюксидом СИЛІЦІЮ (3/2 дмзопропіловий етер/етанол), одержавши похідне 37 (116мг, 44%) ТШХ Rf=0,31 силікагель, 3/0,5/0,4 за об'ємом дмзопропіловий етер/ацетон/етанол Синтез 34 Метил О-(6-О-бензоіл-2,3-ді-Ометил-а-0-глюкопіранозил)-(1^4)-О-(2,3,6-трі-О 60352 34 метил-р-0-глюкопіранозил)-(1^4)-[О-(2,3,6-трі-Ометил-а-О-глюкопіранозил)-( 1^4)-О-(2,3,6-трі-Ометил-р-0-глкжопіранозил)-(1^4)]з-О-(6-О-ацетил2,3-ді-О-метил-а-0-глюкопіранозил)-(1^4)-О(бензил-2,3-ді-О-метил-р-0-глюкопіранозилуронат)-(1^4)-О-(3,6-ді-О-ацетил-2-О-бензил-а-0глкжопіранозил)-(1^4)-О-(бензил 2,3-ді-О-метила-І_-ідопіранозилуронат-(1^4)-2,6-ді-О-бензил-3О-метил--а-0-глюкопіранозид (38) Сполуку 37 (110мг, 0,032ммоль) перетворювали у сполуку 38 (95мг, 89%) згідно описаній операції для синтезу сполуки Зб.ТШХ Rf=O,32 силікагель, 1/1 за об'ємом толуол/ацетон Схема 9 Синтез трисахариду 43 36 35 60352 Синтез 35 О-(2,3,4,6-тетра-О-ацетил-а-0глюкопіранозил)-(1^4)-О-(2,3,6-трі-О-ацетил-а-0глюкопіранозил)-(1^4)-1,2,3,6-тетра-О-ацетил-р-0 -глюкопіраноза (40) Комерційну мальтотрюзу (7г, 13,9ммоль) додали порціями до суспензії ацетату натрію (7г, 85ммоль) в оцтовому ангідриді (70мл) при 155°С Через 15 хвилин, розчин охолоджували та виливали в льодяну воду (700мл) Після екстракції етилацетатом, органічну фазу промивали водою, сушили сульфатом магнію, фільтрували та концентрували, одержавши 13,1гсполуки 40 ТШХ Rf=0,53 силікагель, 7/3 за об'ємом дихлорметан/етилацетат Синтез 36 Етил [О-(2,3,4,6-тетра-О-ацетил-а0-глюкопіранозил)-(1^4)-О-(2,3,6-трі-О-ацетил-аО-глюкопіранозил)-(1 -^4)-2,3,6-трі-О-ацетил-1 -ТюP-D-глюкопіранозид] (41) Сполуку 40 (13г, 13,5ммоль) розчиняли в толуолі (80мл) Етантюл (1,97мл, 26,9ммоль) та діетилетерат трифлуориду бору (13,7мл молярного розчину в толуолі) додали в атмосфері азоту Після перемішування протягом 60 годин, суміш розбавляли водою та дихлорметаном Після екстракції органічну фазу промивали 10% розчином гідрокарбонату натрію та водою, сушили, фільтрували та концентрували Сирий продукт очищали хроматографією на колонці з силікагелем, одержавши 8,6г сполуки 41 ТШХ Rf=0,60 силікагель, 7/3 за об'ємом дихлорметан/етилацетат Синтез 37 Етил [O-(a-D -глюкопіранозил)(1 -^4)-O-(a-D -глюкопіранозил)-(1 -^4)-1 -тю-p-Dглюкопіранозид ](42) Сполуку 41 перетворювали у сполуку 42 згідно описаній операції для синтезу сполуки 5 ТШХ Rf=0,80 силікагель, 13/7/1,6/4 за об'ємом етилацетат/піридин/оцтова кислота/вода Синтез 38 Етил [О-(2,3,4,6-тетра-О-бензоіл-а0-глюкопіранозил)-(1^4)-О-(2,3,6-трі-О-бензоіл-аСинтез 39 Метил [О-(2,3,4,6-тетра-О-бензоілО-глюкопіранозил)-(1 -^4)-2,3,6-трі-О-бензоіл-1 -Тюа-0-глюкопіранозил)-(1^4)-О-(2,3,6-трі-О-бензоілP-D-глюкопіранозид] (43) а-0-глюкопіранозил)-(1^4)-О-(2,3,6-трі-О-бензоілСполуку 42 перетворювали у сполуку 43 згідно (3-О-глюкопіранозил)-( 1 -^4)-О-(6-О-бензоіл-2,3-діописаній операції для синтезу сполуки 2 О-метил-а-0-глюкопіранозил)-(1^4)-О-(2,3,6-тріО-метил-р-0-глюкопіранозил)-(1^4)-[О-(2,3,6-тріО-метил-а-0-глюкопіранозил)-(1^4)-О-(2,3,6-тріО-метил-р-0-глюкопіранозил)-(1^4)]3-О-(6-Оацетил-2,3-ді-О-метил-а-0-глюкопіранозил)-(1^4)О-(бензил 2,3-ді-О-метил-(3-Оглюкопіранозилуронат)-(1^4)-О-(3,6-ді-О-ацетил2-О-бензил-а-0-глюкопіранозил-(1^4)-О-(бензил 2,3-ді-О-метил-а-І_-ідопіранозилуронат)-(1^4)-2,6ді-О-бензил-З-О-метил-а-О-глюкопіранозид] (44) Тюглікозид 43 (170мг, 106,7мкмоль) та акцептор 38 (90мг, 27мкмоль) сполучали згідно описаній для сполуки 4 операції Продукт спершу очищали хроматографією на Sephadex® LH 20 (1/1 дихлорметан/етанол), потім хроматографією на колонці з силікагелем (12/10 за об'ємом циклогексан/ацетон), одержавши 89,5мг (68%) сполуки 44 ТШХ Rf=0,43 силікагель, (12/10 за об'ємом циклогексан/ацетон) Синтез 40 Метил 0-(2,3,4,6-тетра-О-бензоіл-а 38 37 60352 0-глюкопіранозил-(1^4)-О-(2,3,6-трі-О-бензоін-аглюкопіранозил)-(1^4)-О-(2,3,6-трі-О-5-метил-р-0глюкопіранозил)-(1^4)]3-О-(2,3-ді-О-метил-а-00-глюкопіранозил)-(1^4)-О-(2,3,6-трі-О-бензоіл-рглюкопіранозил)-(1^4)-О-(2,3-ді-О-метил-а-00-глюкопіранозил)-(1^4)-О-(6-О-бензош-2,3-ді-Оглкжопіранозилуронова кислота)-(1^4)-О-(-0метил-а-0-глюкопіранозил-(1^4)-О-(2,3,6-трі-Оглкжопіранозил)-(1^4)-О-(2,3-ді-О-метил-а-іметил-р-0-глюкопіранозил)-(1^4)-[О-(2,3,6-трі-Оідопіранозилуронова кислота)-(1 ^4)-3-О-метил-аметил-а-0-глюкопіранозил-(1^4)-О-(2,3,6-трі-ОD-глюкопіранозид (46) метил-р-0-глюкопіранозил)-(1^4)]з-О-(6-О-ацетилСуміш метанолу (2,8мл) та 5Н розчину 2,3-ді-О-метил-а-0-тюкопіранозил-(1^4)-О-(2,3-дігідроксиду натрію (0,69мл) додали до сполуки 45 О-метил-р-О-глкжопіранозилуронова кислота)(72мг, 0,016ммоль) Водний 5М розчин гідроксиду (1^4)-0-(3,б-ді-О-ацетил--а-О-глюкопіранозилнатрію додали (у такій КІЛЬКОСТІ, щоб концентрація (1^4)-О-(2,3-ді-О-метил-а-І_-ідопіранозилуронова гідроксиду натрію складала 0,5М наприкінці кислота)-(1^4)-3-О-метил-а-0-глюкопіранозид додавання) до розчину естеру в метанолі (45) (150мл/ммоль), через 2-5 годин уводили воду та Розчин сполуки 44 (80мг, 0,0163ммоль) в суміш пропускали через колонку Sephadex® G-25 оцтовій кислоті (Змл) обробляли під тиском водню gel (1,6x115см) і елюювали водою Епюат (1 Обар) у присутності 10% паладію-наконцентрували та пропускали через Dowex® 50H+ вупллі(160мг) Після фільтрування розчин колонку (2мл) і сушили сублімацією На цьому концентрували та одержану сполуку 45 етапі підтвердження, що протектувальні групи використано в наступному етапі без очистки видалені, отримали за допомогою 1Н ЯМР За Синтез 41 Метил О-(-О-глюкопіранозил)необхідністю, продукт знов піддавали гідруванню (1 -^4)-О-(а-0-глюкопіранозил)-(1 -^4)-0-(-p-Dта/чи омиленню, отримавши сполуку 46 (34мг, 68% глюкопіранозил)-(1^4)-О-(2,3-ді-О-метил-а-0двома етапами) глюкопіранозил)-(1^4)-О-(2,3,6-трі-О-метил-р-0глюкопіранозил)-(1^4)-[О-(2,3,6-трі-О-метил-а-0 39 60352 40 Синтез 42 Метил [О-4,6-О-бензиліден-2-Обензил-а-О-глюкопіранозид] (48) Сполуку 47 (60г) (комерційне доступну) розчиняли в N Nдиметилформаміді (858мл) з бензилбромідом (50,5мл) Розчин охолоджували до +10°С та додали краплями при перемішуванні водний 20% розчин гідроксиду натрію Через 1 годину, температуру реакції підіймали до 20°С та перемішували суміш протягом ще 20 годин Розчин далі виливали у суміш води, льоду та толуолу і екстрагували Органічну фазу концентрували та очищали сирий продукт кристалізацією, одержавши 30,0г сполуки 48, як описано J М Kuster et al у Justus Liebigs Ann Chem , 1975, 2179-2189 Синтез 46 Етил 2,4,6-трі-О-ацетил-З-О-метил1-тю-а-І_-ідопіраноза (52) 1,2,4,6-тетра-О-ацетил-ЗО-метил-а-І_-ідопіранозу (виготовлено як описано для її пербензоільного аналога заміною бензоілхлориду оцтовим ангідридом, Jaurand et al , Bio Med Chem Lett, 1992, 2, 897-900) (48,4r) розчиняли в толуолі (175мл) Етантюл (20мл) та етерат трифлуориду бору (1MB толуолі, 134мл) додали в атмосфері азоту Після перемішування протягом 1 години, до суміші додали водний гідрокарбонат натрію (400мл) і перемішували протягом 1 години Суміш далі виливали в етилацетат Органічну фазу промивали ДВІЧІ водою та концентрували Очистка хроматографією на колонці з силікагелем дала 29,6 г сполуки 52 ТШХ Rf=0,60 силікагель, 7/3 за об'ємом толуол/етил ацетат Синтез 43 Метил [О-4,6-О-бензиліден-2-Обензил-З-О-метил-а-О-глюкопіранозид] (49) Сполуку 48 (26,4г) розчиняли в N,Nдиметилформаміді (211мл) та охолоджували до +5°С Додали в атмосфері азоту гідрид натрію (3,2г), а потім додали краплями йодметан (11,3г) і суміш перемішували протягом 1 години при кімнатній температурі Суміш розбавляли в етилацетаті, промивали ДВІЧІ водою та концентрували, одержавши 28 г сирої сполуки 49, як описано М Petitouetal y J Med Chem 1997,40,1600-1607 ТШХ Rf=0,70 силікагель (7/3 за об'ємом тол уол /ети л а цетат) Синтез 44 Метил [О-2-О-бензил-З-О-метил-аD-глкжопіранозид] (50) Сполуку 49 (28г) розчиняли у метанолі (468мл) Додали п-тол уол сул ьфо нову кислоту (1,35г) та суміш перемішували протягом 20 годин при 20°С Суміш розбавляли толуолом та концентрували Очистка хроматографією на колонці з силікагелем дала 21 г сполуки 50, ТШХ Rf=0,07 силікагель (6/4 за об'ємом тол уол /ети л а цетат) Синтез 45 Метил [О-2-О-бензил-3,6-ді-Ометил-а-О-глкжопіранозид] (51) Сполуку 50 (11,8г) розчиняли у дихлорметані (160мл) в атмосфері азоту Тетрафлуорбораттриметилоксонію (7,0г) та 2,6-ді-трет-бутил-4-метил піридин (10,6г) додали при кімнатній температурі Через 2 години суміш виливали в суміш води та льоду та екстрагували дихлорметаном Органічну фазу промивали гідрокарбонатом натрію та концентрували Очистка сирого продукту хроматографією на силікагелі дала 10,1г сполуки 51 ТШХ, Rf=0,25 силікагель (7/3 за об'ємом тол уол /ети л а цетат) ТШХ Rf=0,45 силікагель (6/4 за об'ємом тол уол /ети л а цетат) Синтез 47 Метил [О-(2,4,6-трі-О-ацетил-3-Ометил-а-І_-ідопіранозил)- (1^4)-2-О-бензил-3,6-діО-метил-6-О-метил-а-0-глюкопіранозид] (53) Сполуку 51 (10,1г) та сполуку 52 (16,0г) розчиняли в толуолі (304мл) в атмосфері азоту Після додавання порошку молекулярних сит (4А) реакційне середовище охолоджували to -20°C Свіжовиготовлений розчин 0,1 М N-йодсукциніміду (10,1г) та трифлуорметансульфонової кислоти (0,80мл) у суміші 1/1 за об'ємом дюксан/дихлорметан додали краплями під струмом азоту Через 10 хвилин червону реакційну суміш фільтрували та промивали послідовно водним тіосульфатом натрію та водним гідрокарбонатом натрію Органічну фазу концентрували та залишок очищали хроматографією на силікагелі, одержавши 21,1г сполуки 53 ТШХ Rf=0,03 силікагель (6/4 за об'ємом тол уол /ети л а цетат) Синтез 48 Метил [О-(3-О-метил-а-І_ідопіранозил)-(1^4)-2-О-бензил-3,6-ді-О-метил-аD-глкжопіранозид] (54) Сполуку 53 (21,1г) розчиняли у 295 мл суміші метанол/ діоксан (1/1 за об'ємом) та додавали трет-бутоксид калію Через ЗО хвилин, суміш нейтралізували смолою Dowex® 50WX8 у Н+ формі та концентрували під вакуумом Очистку проводили хроматографією на силікагелі, одержавши 12,7г сполуки 54 ТШХ Rf=0,08 силікагель (3/7 за об'ємом тол уол /ети л а цетат) Синтез 49 Метил [О-(4,6-О-ізопропіліден-3-Ометил-а-І_-ідопіранозил)-(1^4)-2-О-бензил-3,6-діО-метил-а-О-глюкопіранозид] (55) Сполуку 54 (12,7г) розчиняли у тетрапдрофурані (67мл) в атмосфері азоту Додали 2,2-диметоксипропан (19мл) та птолуолсульфонову кислоту і суміш далі перемішували протягом 16 годин при кімнатній температурі Реакційне середовище далі розбавляли водним гідрокарбонатом натрію та екстрагували етилацетатом, одержавши, після 44 43 60352 випарювання розчиннику, сирий залишок, який Додали гідрокарбонат калію (1,76г) та очищали хроматографією на силікагелі, бензилбромід (2,85мл) і суміш перемішували одержавши 10,4г сполуки 55 протягом 4 годин Додали етилацетат та воду і ТШХ Rf=0,35 силікагель (1/1 за об'ємом після екстракції органічну фазу концентрували тол уол /ети л а цетат) Очистка хроматографією на силікагелі дала 3,4г Синтез 50 Метил [О-(4,6-О-ізопропіліден-2,3сполуки 59 ді-О-метил-а-І_-ідопіранозил)-(1^4)-2-О-бензилТШХ Rf=0,43 силікагель, 4/6 за об'ємом 3,6-ді-О-метил-а-0-глкжопіранозид] (56) толуол/етилацетат Синтез 54 Метил [О-(бензил 4-О-левулшоілСполуку 55 (Ю,4г) розчиняли у 2,3-ді-О-метил-(3-О-глюкопіранозилуронат)-(1^4)тетрапдрофурані (140мл) та охолоджували до О-(3-О-ацетил-2-О-бензил-6-О-метил-а-І_10°С Гідрид натрію (1,38г, 60% дисперсія в маслі) глюкопіранозил)-(1^4)-О-(бензил 2,3-ді-О-метилта йодметан (1,84мл) додали в атмосфері азоту а-І_-ідопіранозилуронат)-(1^4)-2-О-бензил-3,6-діЧерез 4 години, надлишок гідриду натрію О-метил-а-О-глюкопіранозид] (61) руйнували метанолом та суміш екстрагували дихлорметаном і концентрували Залишок Суміш сполуки 59 (0,53г) та сполуки 60 (1,0г) очищали хроматографією на силікагелі, випарювали у присутності толуолу та розчиняли у одержавши 11,1 г сполуки 56 дихлорметані (16,2мл) в атмосфері азоту Після ТШХ Rf=0,55 силікагель (95/5 за об'ємом додавання порошку молекулярних сит (4А) суміш тол уол /ети л а цетат) охолоджували до 20°С Після перемішування Синтез 51 Метил [О-(2,3-ді-О-метил-а-І_протягом 15 хвилин додавали триметилідопіранозил)-(1^4)-2-О-бензил-3,6-ді-О-метил-асиліл(трифлуорметансульфонат) (15мол% D-глюкопіранозид] (57) відносно сполуки 60) Через 15 хвилин, суміш Сполуку 56 (11,1г) розчиняли у суміші 7/3 (за обробляли водним гідрокарбонатом натрію Після об'ємом) оцтової кислоти/води та перемішували відфільтровування молекулярних сит фільтрат протягом ночі Суміш ДВІЧІ випарювали у розбавляли дихлорметаном, промивали водою, присутності толуолу та очищали хроматографією концентрували та очищали хроматографією на на силікагелі, одержавши 9,2г сполуки 57 силікагелі, одержавши 0,75г сполуки 61 ТШХ Rf=0,09 силікагель (1/1 за об'ємом ЯМР Rf=0,45 силікагель (3/7 за об'ємом толуол етилацетат) тол уол /ети л а цетат) Синтез 52 Метил [О-(2,3-ді-О-метил-а-І_Синтез 55 Метил [О-(бензил 2,3-ді-О-метил-рідопіранозилуронова кислота)-(1^4)-2-О-бензил0-глюкопіранозилуронат)-(1^4)-О-(3-О-ацетил-23,6-ді-О-метил-а-0-глюкопіранозид](58) О-бензил-6-О-метил-а-0-глюкопіранозил)-(1^4)2,2,6,6-тетраметил-1-піперидинілоксил (13мг), О-(бензил-2,3-ді-О-метил-а-І_ідопіранозилуронат)насичений розчин гідрокарбонату натрію (16мл), (1^4)-2-О-бензил-3,6-ді-О-метил-а-0бромід калію (88мг) та хлорид тетрабутиламонію глюкопіранозид](62) (117мг) додали до розчину сполуки 57 (4,7г) у Сполуку 61 (0,74г) розчиняли у піридині дихлорметані (28мл) Суміш охолоджували до 0°С (3,0мл) та додали при кімнатній температурі суміш та додали протягом 15 хвилин суміш насиченого оцтової кислоти (4,1 мл) та гідрату гідразину розчину хлориду натрію (17,8мл), насиченого (0,47мл) у піридині (3,0мл) Після перемішування розчину гідрокарбонату натрію (8,8мл) та протягом 9 годин додавали дихлорметан та воду гіпохлориту натрію (1 ,ЗМ, 20мл) Після Органічну фазу ВІДДІЛЯЛИ та промивали перемішування протягом 1 години, середовище послідовно пдрохлоридною кислотою (1,0Н), розбавляли етилацетатом, промивали насиченим водним гідрокарбонатом натрію та водою розчином хлориду натрію, сушили сульфатом Органічну фазу концентрували та очищали магнію, фільтрували та випарювали досуха, хроматографією на силікагелі, одержавши 0,66г одержавши 3,5г сирої сполуки 58 сполуки 62 ТШХ Rf=0,14 силікагель, 9/1 за об'ємом ТШХ Rf=0,25 силікагель (98/2 за об'ємом дихлорметан/метанол дихлорметан/метанол) Синтез 53 Метил [О-(бензил-2,3-ді-О-метил-аТетрасахарид 68 виготовили далі подібним І_-ідопіранозилуронат)-(1^4)-2-О-бензил-3,6-ді-Очином згідно схеми реакцій 13, починаючи з метилчх-0-глкжопюанозид] (59) дисахариду 55 Сполуку 58 (3,5г) розчиняли в N,NСхема 13 Синтез тетрасахариду 68 диметилформаміді (29мл) в атмосфері азоту 45 60352 46 47 60352 Синтез 56 Метил [2-О-бензил-4,6-ді-Обензиліден-З-О-п-метокси-бензил-а-Оглюкопіранозид] (69) Сполуку 48 (26,4г) розчиняли в N,Nдиметилформаміді (211 мл) та охолоджували до 5°С Додали в атмосфері азоту гідрид натрію (2,5г), а потім краплями 4-метоксибензилхлорид (13,3г) і суміш перемішували протягом години при кімнатній температурі Суміш розбавляли етилацетатом, промивали ДВІЧІ ВОДОЮ та концентрували, одержавши 40,7г сполуки 69 ТШХ Rf=0,80 силікагель, 7/3 за об'ємом толуол/етил ацетат Синтез 57 Метил [2-О-бензил З-О-пметоксибензил-а-О-глюкопіранозид] (70) Сполуку 69 (34,9г) розчиняли у водній 60% оцтовій кислоті та перемішували протягом 4 годин при 60°С Суміш розбавляли толуолом та концентрували Очистка хроматографією на колонці з силікагелем дала 26,4г сполуки 70 ТШХ Rf=0,07 силікагель, 7/3 за об'ємом толуол/етил ацетат Синтез 58 Метил [2-О-бензил-З-О-пметоксибензил-6-О-метил-а-0-глкжопіранозид] 48 (71) Сполуку 70 (26, г) розчиняли у дихлорметані (26 мл) в атмосфері азоту Тетрафлуорбора триметилоксонію (11,6г) та 2,6-ді-трет-бутил-4метил піридин (17,4г) додали при кімнатній температурі Через 4 години суміш виливали в льодяну воду та екстрагували дихлорметаном Органічну фазу промивали гідрокарбонатом натрію та концентрували Очистка сирого продукту хроматографією на колонці з силікагелем дала 18,5г сполуки 71 ТШХ Rf=0,25 силікагель, 7/3 за об'ємом толуол/етил ацетат Синтез 59 Метил [О-(2,4,6-трі-О-ацетил-3-Ометил-а-І_-ідопіранозил)-(1^4)-2-О-бензил-3-О-пметоксибензил-6-О-метил-а-0-глюкопіранозид] (72) Сполуки 71 (17,5г) та 52 (28,2г) розчиняли в толуолі (525мл) в атмосфері азоту Після додавання молекулярних сит (4А) реакційне середовище охолоджували до -20°С Свіжовиготовлений 0,1 М розчин N-йодсукциніміду (17,4г) та трифлуорметансульфонової кислоти (1,38мл) у 1/1 за об'ємом дюксані/дихлорметані додали краплями під постійним струмом азоту 50 49 60352 Через 10 хвилин червону реакційну суміш додали 2,2-диметоксипропан (26мл) та ртолуолсульфонову кислоту і суміш далі фільтрували та промивали послідовно водним перемішували протягом ЗО хвилин Розбавленням тіосульфатом натрію та водним гідрокарбонатом суміші водним гідрокарбонатом натрію та далі натрію Органічну фазу концентрували під екстракцією етилацетатом після випарювання вакуумом та виділили 30,0г сполуки 72 розчиннику одержали 19,7г сполуки 74 ТШХ Rf=0,45 силікагель, 8/2 за об'ємом ТШХ Rf=0,45 силікагель, 95/5 за об'ємом дихлорметан/етилацетат дихлорметан/метанол Синтез 60 Метил О-(3-О-метил-а-І_Синтез 62 Метил О-(4,6-О-ізопропіліден-2,3-діідопіранозил)-(1^4)-2-О-бензил-3-О-пО-метил-а-І_-ідопіранозил)-(1^4)-2-О-бензил-6-Ометоксибензил-6-О-метил-а-0-глкжопіранозид (73) метил-а-О-глюкопіранозид (75) Сполуку 72 (30,0г) розчиняли у 460мл суміші Сполуку 74 (18,5г) розчиняли у N N1/1 за об'ємом метанол/діоксан та додавали третдиметилформаміді (24,4мл) та охолоджували до бутоксид калію Через 15 хвилин суміш + 0°С В атмосфері азоту додавали гідрид натрію нейтралізували смолою Dowex® 50WX8H та (1,47г, 60% дисперсія в маслі) та йод метан концентрували під вакуумом Очистку проводили (2,36мл) хроматографією на колонці з силікагелем, Через 1 години, надлишок гідрид натрію одержавши 17,4г сполуки 73 руйнували метанолом і суміш екстрагували ТШХ Rf=0,25 силікагель 95/5 за об'ємом дихлормета-ном та концентрували, одержавши дихлорметан/метанол 20,0г сполуки 75 Синтез 61 Метил О-(4,6-О-ізопропіліден-3-ОТШХ Rf=0,85 силікагель, 95/5 за об'ємом метил-а-І_-ідопіранозил)-(1^4)-2-О-бензил-3-О-пдихлорметан/метанол метоксибензил-6-О-метил-а-0-глкжопіранозид (74) Сполуку 73 (17,4г) розчиняли в N,Nдиметилформаміді (77мл) в атмосфері азоту, 51 Синтез 63 Метил О-(4,6-Счзопропіліден-2,3-діО-метил-а-І_-ідопіранозил)-(1^4)-2-О-бензил-6-Ометил-а-О-глюкопіранозид (76) Сполуку 75 (18,4г) розчиняли у дихлорметані (838мл) та воді (168мл) Додали 2,3-дихлор-5,6диціано-1,4-бензохшон (7,1г) та суміш перемішували протягом 18 годин при 4°С Суміш виливали в водний гідрокарбонатом натрію та екстрагували дихлорметаном Концентрування органічної фази дала 12,7г сполуки 76 ТШХ Rf=0,40 силікагель, 95/5 за об'ємом дихлорметан/метанол Синтез 64 Метил О-(4,6-О-ізопропіліден-2,3-діО-метил-а-І_-ідопіранозил)-(1^4)-2,3-ді-О-бензил6-О-метил-а-0-глкжопіранозид (77) Сполуку 76 (10,5г) розчиняли в сухому N Nдиметилформамід (178мл) та далі охолоджували до 0°С в атмосфері азоту Додавали гідрид натрію (1,91г, 60% дисперсія в маслі), а потім краплями бензил бромід (3,3мл) Через ЗО хвилин, реакцію було завершено та надлишок гідриду натрію руйнували метанолом Додали воду і суміш ДВІЧІ екстрагували етилацетатом Випарювання розчиннику дало 13,6г сполуки 77 ТШХ Rf=0,50 силікагель, 1/1 за об'ємом толуол/етил ацетат Синтез 65 Метил О-(2,3-ді-О-метил-а-І_ідопіранозил)-(1^4)-2,3-ді-О-бензил-6-О-метил-аD-глкжопіранозид (78) Сполуку 77 розчиняли у суміші 77/33 (за об'ємом) оцтова кислота/вода та перемішували протягом ночі Суміш ДВІЧІ випарювали з толуолом та очищали хроматографією на колонці з силікагелем, одержавши 11,5г сполуки 78, ТШХ Rf=0,09 силікагель, 1/1 за об'ємом толуол/етил ацетат Rf=0,68 силікагель, 9/1 за об'ємом дихлорметан/метанол 60352 52 Синтез 66 Метил О-(2,3-ді-О-метил-а-І_ідопіранозилуронова кислота)-(1^4)-2,3-ді-Обензил-6-О-метил-а-0-глюкопіранозид (79) 2,2,6,6-тетраметил-1-піперидилоксил (ЗЗмг), розчин гідрокарбонату натрію (40мл), бромід калію (218мг) та хлорид тетрабутиламонію (289мг) додали до розчину сполуки 78 (11,6г) у дихлорметані (60мл) Суміш охолоджували до 0°С та додали протягом 15 хвилин суміш насиченого розчину хлориду натрію (44мл), насиченого розчину гідрокарбонату натрію (21,8мл) та гіпохлориту натрію (1 ,ЗМ, 50мл) Після перемішування протягом 1 години, суміш розбавляли водою та тричі екстрагували дихлорметаном Органічну фазу промивали водним розчином хлориду натрію, сушили сульфатом магнію, фільтрували та випарювали досуха, одержавши 13,4г сирої сполуки 79 ТШХ Rf=0,14 силікагель, 9/1 за об'ємом дихлорметан/метанол Синтез 67 Метил О-(бензил 2,3-ді-О-метил-а0-ідопіранозилуронат)-(1^4)-2,3-ді-О-бензил-6-Ометил-а-О-глюкопіранозид (80) 41 калію (6,7г) та бензилбромід (10,7мл) додали і суміш перемішували протягом 90 хвилин Додали етилацетат та воду та після екстракції органічну фазу концентрували Очистка хроматографією на колонці з силікагелем дала 9,9г сполуки 80 ТШХ Rf=0,43, силікагель, 4/6 за об'ємом толуол/етил ацетат Синтез 68 Метил О-(бензил 2,3-ді-О-метил-р0-глюкопіранозил-уронат)-(1^4)-2,3-Ді-О-бензилб-О-метил-a-D -глюкопіранозид (81) Сполуку 80 (9,9г) розчиняли у ЗООмл метанолу та гріли під зворотним холодильником в атмосфері азоту Додали краплями 1М метоксид натрію у 54 53 60352 метанолі (65,2мл) та суміш перемішували і гріли левулшоіл-2,3-ді-О-метил-а-0під зворотним холодильником протягом 3 годин глюкопіранозилуронат)-(1^4)-3-О-ацетил-2-ОСуміш далі охолоджували до кімнатної бензил-6-О-метил-р-0-глюкопіранози (60) температури, додали 1Н гідроксид натрію (22,2мл) Сполуку 84 (1,59г) розчиняли в сухому і реакційну суміш перемішували протягом ще 90 дихлорметані в атмосфері азоту Трихлорахвилин Після нейтралізації смолою Dowex® цетонітрил (1,1 мл) та карбонат цезію (72мг) + 50WX8 Н та фільтрування суміш концентрували додали і суміш перемішували протягом 1 години Чистий продукт розчиняли в N NКарбонат цезію відфільтровували та фільтрат диметилформаміді (192мл) та додали в атмосфері концентрували Очистка хроматографією на азоту молекулярні сита Гідрокарбонат калію (3,2г) колонці з силікагелем дала 1,57г сполуки 60 та бензилбромід (4,8мл) додали і суміш ТШХ Rf=0,60 силікагель, 3/7 за об'ємом перемішували протягом 5 годин Після додавання толуол/етил ацетат етилацетату та води, екстракції та розділення двох фаз органічну фазу концентрували Сирий продукт очищали хроматографією на колонці з силікагелем, одержавши 6,19г сполуки 81 та 1,88г вихідної сполуки 80 ТШХ Rf=0,55 силікагель, 4/6 за об'ємом толуол/етил ацетат Синтез 69 Метил О-(бензил-4-О-левулшоіл2,3-ді-О-метил-р-0-глюкопіранозилуронат)-(1^4)2,3-ді-О-бензил-6-О-метил-а-0-глюкопіранозид (82) Сполуку 81 (6,2г) розчиняли у 40мл діоксану Левулінову кислоту (2,1г), дициклогексилкарбодммід (3,75г) та 4диметиламшопіридин (0,2г) додали і суміш перемішували протягом 2 годин в атмосфері азоту Діетиловий етер (95мл) додали та осад відфільтрували Фільтрат промивали водним гідросульфатом калію, сушили сульфатом магнію, фільтрували та концентрували Кристалізація з ефіру/гептану дала 6,2г сполуки 82 ТШХ Rf=0,26 силікагель, 95/5 за об'ємом дихлорметан/ацетон Синтез 70 О-(бензил-4-О-левулшоіл-2,3-ді-Ометил-р-0-глюкопіранозилуронат)-(1^4)-1,3-ді-Оацетил-2-О-бензил-6-О-метил-р-0-глюкопіраноза (83) Сполуку 82 (6,1г) розчиняли в оцтовому ангідриді (256мл) в атмосфері азоту та охолоджували до -20°С Суміш сульфатної кислоти (4,9мл) в оцтовому ангідриді (49мл) додали краплями протягом ЗО хвилин Через 60 хвилин до суміші додали ацетат натрію до нейтрального рН Етилацетат і воду додали та концентрували органічну фазу Очистка хроматографією на колонці з силікагелем дала 4,2г сполуки 83 ТШХ Rf=0,24 силікагель, 8/2 за об'ємом дихлорметан/етилацетат Синтез 71 О-(бензил 4-О-левулшош-2,3-ді-Ометил-р-0-глюкопіранозилуронат(1^4)-3-Оацетил-2-О-бензил-6-О-метил- p-D-глюкопіраноза (84) Сполуку 83 (4,2г) розчиняли у тетрапдрофурані (42мл) та додавали піперидин (4,1 мл) Суміш перемішували протягом ночі при кімнатній температурі Етилацетат додали та суміш промивали 0,5Н пдрохлоридною кислотою Органічну фазу концентрували та залишок очищали хроматографією на колонці з силікагелем, одержавши 3,2г сполуки 84 ТШХ Rf=0,33 силікагель, 1/1 за об'ємом дихлорметан/етилацетат Синтез 72 Трихлорацетімідат О-(Бензил 4-О Синтез 73 Метил [О-(бензил-4-О-левулшоіл2,3-ді-О-метил-р-0-глюкопіранозилуронат)-(1^4)О-(3-О-ацетил-2-О-бензил-6-О-метил-а-0глюкопіранозил)-(1^4)-О-(бензил-2,3-ді-О-метилa-L-ідопіранозилуронат)- (1^4)-2,3-ді-О-бензил-6О-метил-а-О-глюкопіранозид] (85) Суміш сполуки 80 (ЗООмг) та сполуки 60 (455,6мг) випарювали з толуолом та розчиняли у дихлорметані (6 мл) в атмосфері азоту Після додавання молекулярних сит (4А), суміш охолоджували до -20°С Після перемішування протягом 20 хвилин додавали триметилсиліл(трифлуорметансульфонат) (15мол% відносно сполуки 60) Через 10 хвилин, суміш нейтралізували водним гідрокарбонатом натрію Після відфільтровування молекулярних сит (4А), фільтрат розбавляли дихлорметаном, промивали водою, концентрували та очищали хроматографією на колонці з силікагелем, одержавши 560мг сполуки 85 ТШХ Rf=0,50 силікагель, 3/7 за об'ємом толуол/етил ацетат Синтез 74 Метил [О-(бензил 2,3-ді-О-метил-(3О-глюкопіранозилуронат)-(1^4)-О-(3-О-ацетил-2О-бензил-6-О-метил-а-0-глюкопіранозил)-(1^4)О-(бензил 2,3-ді-О-метил(1 -^4)ідопіранозилуронат)-(1 -^4)-2,3-ді-О-бензил6-О-метил-а-0-глкжопіранозид] (86) Сполуку 85 (532,6мг) розчиняли у піридині (1,9мл) та додали суміш оцтової кислоти (2,4мл і 56 55 60352 гідрату гідразину (0,3мл) у піридині (1,9мл) при (3,36г, 7,95ммоль) в сухому N,Nкімнатній температурі Після перемішування диметилформамиді (8мл) Після перемішування протягом 9 хвилин додавали дихлорметан та воду протягом 16 годин, суміш фільтрували (крізь Органічну фазу ВІДДІЛЯЛИ та промивали целіт), розбавляли етилацетатом (ЗООмл), послідовно 0,1Н пдрохлоридною кислотою, промивали водою (ЗхЮОмл), сушили (сульфатом водним гідрокарбонатом натрію та водою натрію), фільтрували, концентрували та очищали Органічну фазу концентрували та очищали хроматографією на дюксиді СИЛІЦІЮ, одержавши хроматографією на колонці з силікагелем, похідне 89 (3,23г, 80%) одержавши 451 мг сполуки 86 ТШХ Rf=0,36 силікагель, 2/3 за об'ємом циклогексан/етиловий етер ТШХ Rf=0,45 силікагель, 3/7 за об'ємом толуол/етил ацетат Синтез 77 1,6-анпдро-4-О-п-метоксифеніл-3Схема 17 Синтез моносахариду 93 О-метил-2-О-бензоіл-р-0-манопіраноза (90) Сполуку 89 (27,4г, 62,7ммоль) розчиняли в N,Nдиметилформаміді (315мл) Додали бензоат тетрабутиламонію (341 г, 940ммоль) та підтримували розчин при 150°С протягом 3 годин Після охолодження до кімнатної температури середовище розбавляли етилацетатом (ЗООмл), промивали водою до нейтральної реакції, сушили та концентрували Залишок, що ВІДПОВІДНИЙ сполуці 90, використано безпосередньо в наступному етапі ТШХ Rf=0,53 силікагель, 10/1 за об'ємом дихлорметан/етиловий етер Синтез 78 1,6-анпдро-4-О-п-метоксифеніл-3О-метил-р-О-манопіраноза (91) Метоксид натрію (13,5г, 250 ммоль) додали до розчину вищезазначеного сирого залишку 90 у дихлорметані/метанолі (540мл, 1/1) Після перемішування протягом 1 години реакційне середовище розбавляли дихлорметаном (500мл) та далі промивали водною 3% пдрохлоридною кислотою та водою Після сушки, фільтрування та концентрування, залишок очищали на дюксиді СИЛІЦІЮ, одержавши сполуку 91 (10,5г, 59% за двома етапами) Синтез 75 1,6-анпдро-4-О-а-п-метоксифеніл-2О-тозил-р-О-глюкопіраноза (88) Суміш епоксиду 87 (20г, 67ммоль) (М Cerny et at, Collect Czech Chem Commun, 1961,26,2542) та пметоксифенолу (33,3г, 268ммоль) нагрівали до 90°С під аргоном Коли суміш стала рідкою, додали порціями АІСІз (0,3г, 2,35ммоль) і після перемішування протягом ЗО хвилин та охолодження до кімнатної температури реакційне середовище розбавляли дихлорметаном (600мл), нейтралізували тріетиламіном (0,5мл), промивали водним розчином 1М гідроксиду натрію (120мл), насиченим водним розчином хлориду натрію (ЗхбОмл), 10% водним розчином гідросульфату калію (50мл) та насиченим водним розчином хлориду натрію Органічну фазу сушили далі (сульфатом натрію), фільтрували та концентрували Залишок очищали осадженням з ефіру та хроматографією на дюксиді СИЛІЦІЮ, одержавши сполуку 88 (19,4г, 69%) ТШХ Rf=0,37 силікагель, 6/1 за об'ємом дихлорметан/етиловий етер Синтез 76 1,6-анпдро-4-О-п-метоксифеніл-3О-метил-2-О-тозил-З-О-глюкопіраноза (89) Метилйодид (54мл, 954ммоль) та оксид аргентуму (18,4г, 79,5ммоль) додали до розчину сполуки 88 ТШХ Rf=0,29 силікагель, 1/1 за об'ємом толуол/етиловий етер Синтез 79 1,6-анпдро-2-0-бензил-4-О-пметоксифеніл-З-О-метил-р-О-манопіраноза (92) Бензилбромід (6,2мл, 51,9ммоль) додали до розчину сполуки 91 (9,8г, 34,6ммоль) в N,Nдиметилформаміді (180мл), потім при 0°С додали 95% гідрид натрію (1,16г, 48,4ммоль) Після перемішування протягом 16 годин, додали метанол (Змл) при 0°С та реакційну суміш розбавляли етилацетатом (200мл), промивали водою, сушили, фільтрували та концентрували Залишок, що ВІДПОВІДНИЙ сполуці 92, використано безпосередньо в наступному етапі без очистки Однак, аналітичну фракцію отримали після хроматографії на дюксиді СИЛІЦІЮ [a] D - -49 (с = 0,73, дихлорметан) Синтез 80 1,6-анпдро-2-О-бензил-3-О-метилP-D-манопіраноза (93) Вищезазначену сиру сполуку 92 розчиняли у суміші тетрапдрофурану/води (311мл, 17/1)та додали при 0°С амоній-церій-нітрат (76г, 138ммоль) Після перемішування протягом ЗО хвилин, реакційну суміш розбавляли дихлорметаном (1 1) та промивали водним 2% розчином гідрокарбонату натрію, а потім водою Після сушки, фільтрування та концентрування, залишок очищали на дюксиді СИЛІЦІЮ, одержавши сполуку 93 (6,63г, 72% за двома етапами) [а] °о = -68 (с = 1,02, дихлорметан) 57 60352 58 Нонасахарид 94 виготовили з моносахариду 93 згідно аналогічній для виготовлення нонаса хариду 24 з моносахариду 3 ПОСЛІДОВНОСТІ реакцій Синтез 81 О-(6-О-бензоіл-4-О-левуліноіл-2,3ді-О-метил-а-0-глюкопіранозил)-(1^4)-О-(2,3,6трі-О-метил-р-0-глюкопіранозил)-(1^4)-[О-(2,3,6трі-О-метил-а-О-глюкопіранозил)-(1^4)-0-(2,3,6трі-О-метил-р-0-глкжопіранозил)-(1 -^4)]з-1,6анпдро-З-О-метил-р-О-манопіраноза (95) 5% Pd/C (109мг) додали до розчину сполуки 94 (759мг, О.Збммоль) у суміші flnxnopMe-TaHfrpeTбутанол (3,3мл, 1/2) Після перемішування протягом 16 годин при 10 бар та 55°С, суміш фільтрували та концентрували Сполуку 95 використано в наступному етапі без очистки чи аналізу Синтез 82 О-(6-О-бензош-4-О-левуліноіл-2,3ді-О-метил-а-О-глюкопіранозил)-(1^4)-0-(2,3,6-тріО-метил-р-0-глюкопіранозил-(1^4)-[О-(2,3,6-трі-Ометил-а-0-глюкопіранозил)-(1^4)-О-(2,3,6-трі-Ометил-р-О-глюкопіранозил-(1 -^4)]з-1,6-анпдро-2-Обензоіл-З-О-метил-р-О-манопіраноза (96) Бензоілхлорид (62мкл, 0,54ммоль) та диметиламшопіридин (9мг, 0,073ммоль) додали до розчину сполуки 95 (726мг, О.Збммоль) у безводному піридині (5,4мл) Після перемішування протягом 2 годин при 60°С додали ту ж КІЛЬКІСТЬ бензоілхлориду та через 35 хвилин розчин концентрували, залишок переносили у дихлорметан, промивали водним 10% розчином гідросульфату калію, водним 2% розчином гідрокарбонату натрію та далі водою Органічну фазу сушили сульфатом натрію, фільтрували та концентрували Залишок очищали на дюксиді СИЛІЦІЮ, одержавши сполуку 96 (684мг, 90% за двома етапами) ТШХ Rf=0,5 толуол /ацетон силікагель, 1/1 за об'ємом 59 60352 Синтез 83 О-(6-О-бензоіл-4-О-левуліноіл-2,3ді-О-метил-а-0-глюкопіранозил)-(1^4)-О-(2,3,6трі-О-метил-р-0-глюкопіранозил)-(1^4)-[О-(2,3,бтрі-О-метил-а-О-глюкопіранозил-(1^4)-0-(2,3)6трі-О-метил-р-0-глюкопіранозил)-(1 -^4)]з-1,6-ді-Оацетил-2-О-бензоіл-3-О-метил-р-0-манопіраноза (97) Сполуку 96 (657мг, 0,31 ммоль) обробляли сумішшю оцтового ангідриду (4,5мл), оцтової кислоти (ЮОмкл) та трифлуороцтової кислоти (0,19мл) як у синтезі 23 Після хроматографії на колонці з силікагелем отримали сполуку 97 (432мг, 92%) ТШХ Rf=0,53 силікагель, 1/1 за об'ємом толуол /ацетон Синтез 84 О-(6-О-бензоіл-4-О-левулшоіл-2,3ді-О-метил-а-0-глюкопіранозил)-(1^4)-О-(2,3,6трі-О-метил-р-0-глюкопіранозил)-(1^4)-[О-(2,3,6трі-О-метил-а-О-глюкопіранозил)-(1^4)-0-(2,3,6трі-О-метил-р-0-глюкопіранозил)-(1^4)]з-6-Оацетил-2-О-бензоіл-3-О-метил-р-0-манопіраноза (98) 60 Розчин сполуки 97 (382мг, 0,17ммоль) та бензиламшу (736мкл, 6,74ммоль) у ТГФ (бмл) перемішували протягом 5 годин Суміш далі виливали на лід та після екстракції етиловим етером органічну фазу промивали послідовно 3% пдрохлоридною кислотою та водою, сушили та концентрували Після хроматографії на колонці з силікагелем отримали сполуку 98 (241 мг) ТШХ Rf=0,37 силікагель, 6/2/2 за об'ємом тол уол /ети л а цетат/ета н ол Синтез 85 Трихлорацетімідат О-(6-О-бензоіл4-О-левулшоіл-2,3-ді-О-метил-а-0глюкопіранозил)-(1^4)-О-(2,3,6-трі-О-метил-р-0глюкопіранозил)-(1^4)-[О-(2,3,6-трі-О-метил-а-0глюкопіранозил)-(1^4)-О-(2,3,6-трі-О-метил-(3-Оглюкопіранозил)-(1^4)]з-6-О-ацетил-2-О-бензоілЗ-О-метил-р-О-манопіранози (99) Трихлорацетонітрил (57мкл, 0,56ммоль) та карбонат цезію (58мг) додали до розчину сполуки 98 (241 мг) у дихлорметані (2,2мл) Після перемішування протягом 1 години, суміш фільтрували, концентрували та залишок
ДивитисяДодаткова інформація
Назва патенту англійськоюSynthetic polysaccharides, a method for preparing thereof and pharmaceutical composition containing them
Автори англійськоюHerbert Jean-Marc, Petitou, Maurice
Назва патенту російськоюСинтетические полисахариды, способ их производства и фармацевтические композиции, содержащие их
Автори російськоюЭрбер Жан-Марк
МПК / Мітки
МПК: A61P 7/02, C08B 37/00, A61K 31/737, A61P 9/10, A61K 31/726
Мітки: синтетичні, композиція, містить, фармацевтична, полісахариди
Код посилання
<a href="https://ua.patents.su/32-60352-sintetichni-polisakharidi-ta-farmacevtichna-kompoziciya-shho-kh-mistit.html" target="_blank" rel="follow" title="База патентів України">Синтетичні полісахариди та фармацевтична композиція, що їх містить</a>
Попередній патент: Комплектний розподільний пристрій зовнішньої установки крпз-35
Наступний патент: Спосіб одержання гранульованих мінеральних добрив
Випадковий патент: Фармацевтична композиція, що містить ефір дгк, для парентерального введення