Похідна (аза)індолу, заміщена в положенні 5, фармацевтична композиція, що містить її, проміжні сполуки та спосіб їх одержання
Номер патенту: 100867
Опубліковано: 11.02.2013
Автори: Мангано Джорджина, Мауджері Катеріна, Гарофало Барбара, Колетта Ізабелла, Фурлотті Гвідо, Драгоне Патріція, Алісі Марія Алессандра, Гарроне Беатріче, Каццолла Нікола
Формула / Реферат
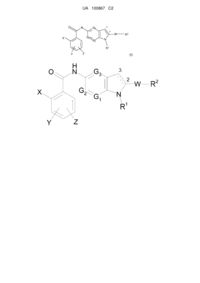
1. Похідна (аза)індолу, заміщена в положенні 5, формули (І):
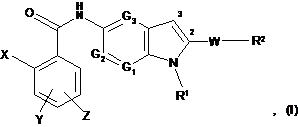
у якій:
X являє собою атом галогену або (С1-С3)алкіл, трифторметил, нітрогрупу, аміногрупу, ціаногрупу, ді(С1-С3)алкіламіногрупу, гідроксигрупу, (С1-С3)алкоксигрупу, фенільну або (С1-С3)алкілфенільну групу;
Υ та Ζ, які можуть бути однаковими або різними, являють собою водень або атом галогену, або (С1-С3)алкіл, трифторметил, нітрогрупу, аміногрупу, ді(С1-С3)алкіламіногрупу, гідроксигрупу, (С1-С3)алкоксигрупу, феніл, СООН, (С1-С3)алкіл-СООН, (С2-С3)алкеніл-СООН, COOR, де R являє собою лінійну або розгалужену (С1-С6)алкільну або гідроксіалкільну групу, CONH2, SO2CH3, SO2NHCH3 або NHSO2CH3 групу;
G1, G2 та G3, які можуть бути однаковими або різними, являють собою атом азоту або СН групу;
R1 являє собою (С1-С6)алкіл, (С3-С7)циклоалкіл, (С1-С6)алкілORI, (CH2)nNRIIRIII, (CH2)nCONRIIRIII, (CH2)nCORI, (CH2)nCOORII, (CH2)nOCORI, SO2RI, (CH2)nNRIISO2RI, (CH2)nSO2RI групу, необов'язково заміщену за допомогою 1-3 гідроксигруп, де n являє собою ціле число від 1 до 6, RI являє собою (С1-С3)алкіл або (С1-С3)алкілОН групу, та RII та RIII, які можуть бути однаковими або різними, являють собою атом водню або (С1-С3)алкільну групу;
W являє собою σ-зв'язок або (С1-С6)алкіл, (С2-С6)алкеніл, О(С1-С6)алкіл, О(С2-С6)алкеніл, C(O)NH, (CH2)pCO(CH2)q або (CH2)pC(OH)(CH2)q групу, де p та q, які можуть бути однаковими або різними, являють собою ціле число від 0 до 3;
R2 являє собою фенільну, піридинову або (С3-С7)циклоалкільну групу, необов'язково заміщену за допомогою 1-3 замісників, які можуть бути однаковими або різними, що представлені L-M групою, у якій L являє собою σ-зв'язок або (С1-С6)алкільну, (С2-С6)алкенільну, (С2-С6)алкінільну, О(С1-С6)алкільну, О(С2-С6)алкенільну, О(С2-С6)алкінільну групу, та Μ являє собою водень або атом галогену, або ОН, CF3, NO2, CN, COORII, SO2NHRII, CH2CONRIIRIII, NRIIRIII, SO2RIV, NHSO2RIV, PORIVRV або OPORIVRV групу, де RII та RIII, які можуть бути однаковими або різними, приймають значення, описані вище, та RIV та RV, які можуть бути однаковими або різними, являють собою (С1-С3)алкільну групу, за умови,
що, коли G1, G2 та G3 всі являють собою СН групу, R1 являє собою (С1-С6)алкільну або (С3-С7)циклоалкільну групу, необов'язково заміщену за допомогою 1-3 гідроксигруп, W являє собою σ-зв'язок, та зв'язок між атомами вуглецю у 2 та 3 положенні являє собою подвійний зв'язок,
R2 не являє собою фенільну або піридинову групу, необов'язково заміщену за допомогою 1-3 замісників, які можуть бути однаковими або різними, що вибирають з таких як: галоген, (С1-С6)алкіл, необов'язково заміщений гідроксигрупою, трифторметил, нітрогрупа, аміногрупа, ді(С1-С3)алкіламіногрупа, гідроксигрупа, (С1-С3)алкоксигрупа, СООН, COORII, SO2CH3, SO2NHCH3, NHSO2CH3, PORIVRV, OPORIVRV, (С1-С6)алкіл-COOH та (С2-С6)алкеніл-СООН; та за умови,
що, коли G1 являє собою Ν та G2 та G3 являють собою СН групу, R2 не являє собою двовалентну ароматичну групу, заміщену за допомогою однієї L-M групи, представленої О(С1-С6)алкільною, О(С2-С6)алкенільною та О(С2-С6)алкінільною групою; та її фізіологічно прийнятні солі приєднання, стереоізомери, енантіомери, гідрати, сольвати та поліморфні форми.
2. Похідна (аза)індолу за п. 1, у якій зазначений X вибирають з брому, хлору, фтору, (С1-С3)алкілу, трифторметилу, нітрогрупи, ціаногрупи та (С1-С3)алкоксигрупи.
3. Похідна (аза)індолу за п. 1, у якій зазначений X вибирають з брому, хлору, трифторметилу та нітрогрупи.
4. Похідна (аза)індолу за п. 1, у якій зазначений Υ та Ζ, які можуть бути однаковими або різними, вибирають з водню, брому, хлору, фтору, нітрогрупи, СООН, (С1-С3)алкілу, трифторметилу та (С1-С3)алкоксигрупи.
5. Похідна (аза)індолу за п. 1, у якій зазначений Υ та Ζ, які можуть бути однаковими або різними, вибирають з водню, брому, хлору, трифторметилу, нітрогрупи, СООН, метилу, етилу, метоксигрупи та етоксигрупи.
6. Похідна (аза)індолу за п. 1, у якій зазначений R1 вибирають з (С1-С3)алкілу, (С1-С3)алкілORI, (CH2)nNRIIRIII, (CH2)nCONRIIRIII, (CH2)nСОRI, (CH2)nCOORII, (CH2)nOCORI, SO2RI, (CH2)nNRIISO2RI, (CH2)nSO2RI групи, необов'язково заміщеної за допомогою 1-3 гідроксигруп, де n являє собою ціле число від 1 до 4, RI являє собою (С1-С3)алкіл або (C1-С3)алкілОН групу, та RII та RIII, які можуть бути однаковими або різними, являють собою атом водню або (С1-С3)алкільну групу.
7. Похідна (аза)індолу за п. 1, у якій зазначений R1 вибирають з (С1-С3)алкілу, (С1-C3алкілORI, (CH2)nNRIIRIII, (CH2)nCORI, (CH2)nCOORII, (CH2)nOCORI, SO2RI, (CH2)nNRIISO2RI, (CH2)nSO2RI групи, необов'язково заміщеної за допомогою 1-3 гідроксигруп, де n являє собою ціле число від 1 до 3, RI являє собою СН3, С2Н5, СН2ОН, С2Н4ОН групу, та RI та RII, які можуть бути однаковими або різними, являють собою атом водню або СН3 або С2Н5 групу.
8. Похідна (аза)індолу за п. 1, у якій зазначений W вибирають з σ-зв'язку або (С1-С3)алкілу, (С2-С4)алкенілу, О(С1-С3)алкілу, О(С2-С3)алкенілу, C(O)NH, (CH2)pCO(CH2)q або (CH2)pC(OH)(CH2)q групи, де p та q, які можуть бути однаковими або різними, являють собою ціле число від 1 до 3.
9. Похідна (аза)індолу за п. 1, у якій зазначений W вибирають з σ-зв'язку або СН2, C2H4, СН=СН, ОСН2, ОС2Н4, ОСН=СН, C(O)NH, (CH2)pCO(CH2)q або (CH2)pC(OH)(CH2)q групи, де p та q, які можуть бути однаковими або різними, являють собою ціле число від 1 до 2.
10. Похідна (аза)індолу за п. 1, у якій зазначений R2 вибирають з фенільної, піридинової або (С3-С7)циклоалкільної групи, необов'язково заміщеної за допомогою 1-2 замісників, які можуть бути однаковими або різними, що представлені L-M групою, у якій L являє собою σ-зв'язок або (С1-С3)алкільну, (С2-С4)алкенільну, (С2-С4)алкінільну, О(С1-С3)алкільну, О(С2-С4)алкенільну, О(С2-С4)алкінільну групу, та Μ являє собою водень або атом галогену, або CF3, CN, COORII, SO2NHRII, CH2CONRIIRIII, NRIIRIII, SO2RIV, NHSO2RIV, PORIVRV або OPORIVRV групу, де RII та RIII, які можуть бути однаковими або різними, являють собою атом водню або (С1-С3)алкільну групу, та RIV та RV, які можуть бути однаковими або різними, являють собою (С1-С3)алкільну групу.
11. Похідна (аза)індолу за п. 1, у якій зазначений R2 вибирають з фенільної, піридинової або (С3-С7)циклоалкільної групи, необов'язково заміщеної за допомогою 1 замісника, що представлений L-M групою, у якій L являє собою σ-зв'язок або СН2, С2Н4, СН=СН, С=С, ОСН2, ОС2Н4, ОСН=СН, ОС![]() С групу, та Μ являє собою водень або атом галогену, або CF3, CN, COORII, SO2NHRII, CH2CONRIIRIII, NRIIRIII, SO2RIV, NHSO2RIV, PORIVRV або OPORIVRV групу, де RII та RIII, які можуть бути однаковими або різними, являють собою атом водню або СН3, С2Н5 групу, та RIV та RV, які можуть бути однаковими або різними, являють собою СН3 або С2Н5 групу.
С групу, та Μ являє собою водень або атом галогену, або CF3, CN, COORII, SO2NHRII, CH2CONRIIRIII, NRIIRIII, SO2RIV, NHSO2RIV, PORIVRV або OPORIVRV групу, де RII та RIII, які можуть бути однаковими або різними, являють собою атом водню або СН3, С2Н5 групу, та RIV та RV, які можуть бути однаковими або різними, являють собою СН3 або С2Н5 групу.
12. Похідна (аза)індолу за п. 1, у якій зазначений W являє собою σ-зв'язок або СН2 або С2Н4 групу, та зазначений R2 являє собою фенільну групу, необов'язково заміщену за допомогою 1-3 замісників, які можуть бути однаковими або різними, що вибирають з Вr, Сl та F атома, СН3, С2Н5, ОСН3, ОС2Н5, CN, CH2CN та CH2CONH2 групи.
13. Похідна (аза)індолу за п. 1, у якій зазначений W являє собою σ-зв'язок або СН2 або С2Н4 групу, та R2 являє собою піридинову групу, необов'язково заміщену за допомогою 1-3 замісників, які можуть бути однаковими або різними, що вибирають з Вr, Сl та F атома, СН3, С2Н5, ОСН3, ОС2Н5, CN, CH2CN та CH2CONH2 групи.
14. Похідна (аза)індолу за п. 1, у якій зазначений W являє собою σ-зв'язок або СН2 або С2Н4 групу, та R2 являє собою циклогексильну групу, необов'язково заміщену за допомогою 1-3 замісників, які можуть бути однаковими або різними, що вибирають з Вr, Сl та F атома, СН3, С2Н5, ОСН3, ОС2Н5, CN, CH2CN та CH2CONH2 групи.
15. Спосіб одержання похідної (аза)індолу, заміщеної в положенні 5, формули (І):
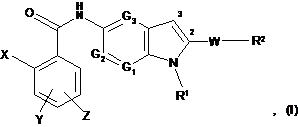
у якій:
X являє собою атом галогену або (С1-С3)алкіл, трифторметил, нітрогрупу, аміногрупу, ціаногрупу, ді(С1-С3)алкіламіногрупу, гідроксигрупу, (С1-С3)алкоксигрупу, фенільну або (С1-С3)алкілфенільну групу;
Υ та Ζ, які можуть бути однаковими або різними, являють собою водень або атом галогену, або (С1-С3)алкіл, трифторметил, нітрогрупу, аміногрупу, ді(С1-С3)алкіламіногрупу, гідроксигрупу, (С1-С3)алкоксигрупу, феніл, СООН, (С1-С3)алкіл-СООН, (С2-С3)алкеніл-СООН, COOR, де R являє собою лінійну або розгалужену (С1-С6)алкільну або гідроксіалкільну групу, CONH2, SO2CH3, SO2NHCH3 або NHSO2CH3 групу;
G1, G2 та G3, які можуть бути однаковими або різними, являють собою атом азоту або СН групу;
R1 являє собою (С1-С6)алкіл, (С3-С7)циклоалкіл, (С1-С6)алкілORI, (CH2)nNRIIRIII, (CH2)nCONRIIRIII, (CH2)nCORI, (CH2)nCOORII, (CH2)nOCORI, SO2RI, (CH2)nNRIISO2RI, (CH2)nSO2RI групу, необов'язково заміщену за допомогою 1-3 гідроксигруп, де n являє собою ціле число від 1 до 6, RI являє собою (С1-С3)алкіл або (С1-С3)алкілОН групу, та RII та RIII, які можуть бути однаковими або різними, являють собою атом водню або (С1-С3)алкільну групу;
W являє собою σ-зв'язок або (С1-С6)алкіл, (С2-С6)алкеніл, О(С1-С6)алкіл, О(С2-С6)алкеніл, C(O)NH, (CH2)pCO(CH2)q або (CH2)pC(OH)(CH2)q групу, де p та q, які можуть бути однаковими або різними, являють собою ціле число від 0 до 3;
R2 являє собою фенільну, піридинову або (С3-С7)циклоалкільну групу, необов'язково заміщену за допомогою 1-3 замісників, які можуть бути однаковими або різними, що представлені L-M групою, у якій L являє собою σ-зв'язок або (С1-С6)алкільну, (С2-С6)алкенільну, (С2-С6)алкінільну, О(С1-С6)алкільну, О(С2-С6)алкенільну, О(С2-С6)алкінільну групу, та Μ являє собою водень або атом галогену, або ОН, CF3, NO2, CN, COORII, SO2NHRII, CH2CONRIIRIII, NRIIRIII, SO2RIV, NHSO2RIV, PORIVRV або OPORIVRV групу, де RII та RIII, які можуть бути однаковими або різними, приймають значення, описані вище, та RIV та RV, які можуть бути однаковими або різними, являють собою (С1-С3)алкільну групу, за умови,
що, коли G1, G2 та G3 всі являють собою СН групу, R1 являє собою (С1-С6)алкільну або (С3-С7)циклоалкільну групу, необов'язково заміщену за допомогою 1-3 гідроксигруп, W являє собою σ-зв'язок, та зв'язок між атомами вуглецю у 2 та 3 положенні являє собою подвійний зв'язок,
R2 не являє собою фенільну або піридинову групу, необов'язково заміщену за допомогою 1-3 замісників, які можуть бути однаковими або різними, що вибирають з таких як: галоген, (С1-С6)алкіл, необов'язково заміщений гідроксигрупою, трифторметил, нітрогрупа, аміногрупа, ді(С1-С3)алкіламіногрупа, гідроксигрупа, (С1-С3)алкоксигрупа, СООН, COORII, SO2CH3, SO2NHCH3, NHSO2CH3, POR1VRV, OPORIVRV, (С1-С6)алкіл-COOH та (С2-С6)алкеніл-СООН; та за умови,
що, коли G1 являє собою Ν та G2 та G3 являють собою СН групу, R2 не являє собою двовалентну ароматичну групу, заміщену за допомогою однієї L-M групи, представленої О(С1-С6)алкільною, О(С2-С6)алкенільною та О(С2-С6)алкінільною групою; та її фізіологічно прийнятних солей приєднання, стереоізомерів, енантіомерів, гідратів, сольватів та поліморфних форм, в якому здійснюють
а) введення у реакцію сполуки формули (II):
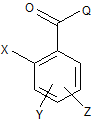 , (ІІ)
, (ІІ)
у якій
Χ, Υ та Ζ приймають значення, представлені вище, та Q являє собою атом галогену або гідроксигрупу,
зі сполукою формули (III):
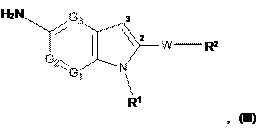
у якій
G1, G2, G3, R1, R2 та W приймають значення, представлені вище, з одержанням сполуки формули (І):
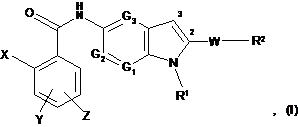
у якій
X, Y, Z, G1, G2, G3, R1, R2 та W приймають значення, представлені вище, та
b) утворення, при бажанні, фізіологічно прийнятної солі приєднання сполуки формули (І) зі стадії (а).
16. Спосіб за п. 15, який відрізняється тим, що стадію (а) проводять шляхом введення у реакцію сполуки формули (II), у якій Q являє собою Сl, з аміном формули (III) у присутності прийнятного акцептора кислоти.
17. Спосіб за п. 15, який відрізняється тим, що зазначену стадію (а) проводять шляхом введення у реакцію сполуки формули (II), у якій Q являє собою ОН, з аміном формули (III) у присутності прийнятного сполучного агента.
18. Спосіб за п. 15, який відрізняється тим, що зазначену стадію (а) проводять в твердій фазі, що включає сполуку формули (III), приєднану до препаративної смоли.
19. Спосіб за п. 18, який відрізняється тим, що зазначена препаративна смола являє собою смолу на основі альдегіду.
20. Спосіб за будь-яким з пп. 18 та 19, який відрізняється тим, що зазначений спосіб додатково включає стадію відщеплення для від'єднання зазначеної сполуки формули (І) від зазначеної смоли.
21. Спосіб за п. 20, який відрізняється тим, що зазначену стадію відщеплення проводять шляхом обробки трифтороцтовою кислотою.
22. Спосіб за п. 15, який відрізняється тим, що зазначений спосіб додатково включає стадію відновлення для перетворення подвійного зв'язку між 2- та 3-положенням в простий зв'язок.
23. Спосіб за п. 22, який відрізняється тим, що зазначену стадію відновлення проводять шляхом обробки відновлювальним елементом у присутності сильної кислоти.
24. Спосіб за п. 15, який відрізняється тим, що, коли зазначена R1 група являє собою (CH2)nCOORII групу, у якій RII являє собою алкільну групу, в зазначеному способі додатково проводять стадію гідролізу з одержанням відповідної кислоти.
25. Спосіб за п. 24, який відрізняється тим, що зазначену стадію гідролізу проводять у присутності сильної основи.
26. Проміжна сполука формули (III):
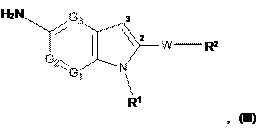
у якій
G1, G2 та G3, які можуть бути однаковими або різними, являють собою атом азоту або СН групу;
R1 являє собою (С1-С6)алкіл, (С3-С7)циклоалкіл, (С1-С6)алкілORI, (CH2)nCONRIIRIII, (CH2)nCORI, (CH2)nCOORII, (CH2)nOCORI, SO2RI, (CH2)nNRIISO2RI, (CH2)nSO2RI групу, необов'язково заміщену за допомогою 1-3 гідроксигруп, де n являє собою ціле число від 1 до 6, RІ являє собою (С1-С3)алкіл або (С1-С3)алкілОН групу, та RII та RIII, які можуть бути однаковими або різними, являють собою атом водню або (С1-С3)алкільну групу;
W являє собою σ-зв'язок або (С1-С6)алкіл, (С2-С6)алкеніл, О(С1-С6)алкіл, О(С2-С6)алкеніл, C(O)NH, (CH2)pCO(CH2)q або (CH2)pC(OH)(CH2)q групу, де р та q, які можуть бути однаковими або різними, являють собою ціле число від 0 до 3; та
R2 являє собою фенільну, піридинову або (С4-С7)циклоалкільну групу, необов'язково заміщену за допомогою 1-3 замісників, які можуть бути однаковими або різними, що представлені L-M групою, у якій L являє собою σ-зв'язок або (С1-С6)алкільну, (С2-С6)алкенільну, (С2-С6)алкінільну, О(С1-С6)алкільну, О(С2-С6)алкенільну, О(С2-С6)алкінільну групу, та Μ являє собою водень або атом галогену, або ОН, CF3, NO2, CN, COORII, SO2NHRII, CH2CONRIIRIII, NRIIRIII, SO2RIV, NHSO2RIV, PORIVRV або OPORIVRV групу, де RII та RIII, які можуть бути однаковими або різними, приймають значення, описані вище, та RIV та RV, які можуть бути однаковими або різними, являють собою (С1-С3)алкільну групу, за умови,
що, коли G1, G2 та G3 всі являють собою СН групу, R1 являє собою (С1-С6)алкільну або (С3-С7)циклоалкільну групу, необов'язково заміщену за допомогою 1-3 гідроксигруп, W являє собою σ-зв'язок, та зв'язок між атомами вуглецю у 2 та 3 положенні являє собою подвійний зв’язок,
R2 не являє собою фенільну або піридинову групу, необов'язково заміщену за допомогою 1-3 замісників, які можуть бути однаковими або різними, що вибирають з таких як: галоген, (С1-С6)алкіл, необов'язково заміщений гідроксигрупою, трифторметил, нітрогрупа, аміногрупа, ді(С1-С3)алкіламіногрупа, гідроксигрупа, (С1-С3)алкоксигрупа, СООН, COORII, SO2CH3, SO2NHCH3, NHSO2CH3, PORIVRV, OPORIVRV, (С1-С6)алкіл-COOH та (С2-С6)алкеніл-СООН; та за умови,
що, коли G1 являє собою Ν та G2 та G3 являють собою СН групу, R2 не являє собою двовалентну ароматичну групу, заміщену за допомогою однієї L-M групи, представленої О(С1-С6)алкільною, О(С2-С6)алкенільною, та О(С2-С6)алкінільною групою.
27. Проміжна сполука за п. 26, яка відрізняється тим, що зазначений R1 визначений за будь-яким з пп. 6 або 7.
28. Проміжна сполука за п. 26, яка відрізняється тим, що зазначений W визначений за будь-яким з пп. 8 або 9.
29. Проміжна сполука за п. 26, яка відрізняється тим, що зазначений R2 визначений за будь-яким з пп. 10 або 11.
30. Проміжна сполука за п. 26, яка відрізняється тим, що зазначені W та R2 визначені за будь-яким з пп. 12-14.
31. Фармацевтична композиція, що містить ефективну кількість похідної (аза)індолу, заміщеної в положенні 5, формули (І):
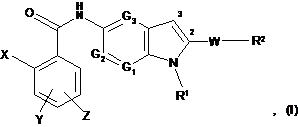
у якій:
X являє собою атом галогену або (С1-С3)алкіл, трифторметил, нітрогрупу, аміногрупу, ціаногрупу, ді(С1-С3)алкіламіногрупу, гідроксигрупу, (С1-С3)алкоксигрупу, фенільну або (С1-С3)алкілфенільну групу;
Υ та Ζ, які можуть бути однаковими або різними, являють собою водень або атом галогену, або (С1-С3)алкіл, трифторметил, нітрогрупу, аміногрупу, ді(С1-С3)алкіламіногрупу, гідроксигрупу, (С1-С3)алкоксигрупу, феніл, СООН, (С1-С3)алкіл-СООН, (С2-С3)алкеніл-СOOН, COOR, де R являє собою лінійну або розгалужену (С1-С6)алкільну або гідроксіалкільну групу, CONH2, SO2CH3, SO2NHCH3 або NHSO2CH3 групу;
G1, G2 та G3, які можуть бути однаковими або різними, являють собою атом азоту або СН групу;
R1 являє собою (С1-С6)алкіл, (С3-С7)циклоалкіл, (С1-С6)алкілORI, (CH2)nNRIIRIII (CH2)nCONRIIRIII, (CH2)nCORI, (CH2)nCOORII, (CH2)nOCORI, SO2RI, (CH2)nNRIISO2RI, (CH2)nSO2RI групу, необов'язково заміщену за допомогою 1-3 гідроксигруп, де n являє собою ціле число від 1 до 6, RI являє собою (С1-С3)алкіл або (С1-С3)алкілОН групу, та RII та RIII, які можуть бути однаковими або різними, являють собою атом водню або (С1-С3)алкільну групу;
W являє собою σ-зв'язок або (С1-С6)алкіл, (С2-С6)алкеніл, О(С1-С6)алкіл, О(С2-С6)алкеніл, C(O)NH, (CH2)pCO(CH2)q або (CH2)pC(OH)(CH2)q групу, де р та q, які можуть бути однаковими або різними, являють собою ціле число від 0 до 3;
R2 являє собою фенільну, піридинову або (С3-С7)циклоалкільну групу, необов'язково заміщену за допомогою 1-3 замісників, які можуть бути однаковими або різними, що представлені L-M групою, у якій L являє собою σ-зв'язок або (С1-С6)алкільну, (С2-С6)алкенільну, (С2-С6)алкінільну, О(С1-С6)алкільну, О(С2-С6)алкенільну, О(С2-С6)алкінільну групу, та Μ являє собою водень або атом галогену, або ОН, CF3, NO2, CN, COORII, SO2NHRII, CH2CONRIIRIII, NRIIRIII, SO2RIV, NHSO2RIV, PORIVRV, або OPORIVRV групу, де RII та RIII, які можуть бути однаковими або різними, приймають значення, описані вище, та RIV та RV, які можуть бути однаковими або різними, являють собою (С1-С3)алкільну групу, за умови,
що, коли G1, G2 та G3 всі являють собою СН групу, R1 являє собою (С1-С6)алкільну або (С3-С7)циклоалкільну групу, необов'язково заміщену за допомогою 1-3 гідроксигруп, W являє собою σ-зв'язок, та зв'язок між атомами вуглецю у 2 та 3 положенні являє собою подвійний зв'язок,
R2 не являє собою фенільну або піридинову групу, необов'язково заміщену за допомогою 1-3 замісників, які можуть бути однаковими або різними, що вибирають з таких як: галоген, (С1-С6)алкіл, необов'язково заміщений гідроксигрупою, трифторметил, нітрогрупа, аміногрупа, ді(С1-С3)алкіламіногрупа, гідроксигрупа, (С1-С3)алкоксигрупа, СООН, COORII, SO2CH3, SO2NHCH3, NHSO2CH3, PORIVRV, OPORIVRV, (С1-С6)алкіл-СООН та (С2-С6)алкеніл-СООН; та за умови,
що, коли G1 являє собою N та G2 та G3 являють собою СН групу, R2 не являє собою двовалентну ароматичну групу, заміщену за допомогою однієї L-M групи, представленої О(С1-С6)алкільною, О(С2-С6)алкенільною та О(С2-С6)алкінільною групою; та її фізіологічно прийнятних солей приєднання, стереоізомерів, енантіомерів, гідратів, сольватів та поліморфних форм та щонайменше один фармацевтично прийнятний інертний інгредієнт.
Текст
Реферат: 1 2 Похідна (аза)ідолу, заміщена в положенні 5, формули (І), у якій Χ, Υ, Z, G1, G2, G3, R , W та R приймають значення, представлені в описі, фармацевтична композиція, що містить її, а також проміжні сполуки та спосіб їх одержання. UA 100867 C2 O 3 2 R2 X R1 Y Z (І) UA 100867 C2 5 10 15 20 25 30 35 40 45 50 55 60 Даний винахід відноситься до (аза)індольної похідної, заміщеної у положенні 5, до фармацевтичної композиції, що містить її, до проміжних сполук та до способу їх одержання. Більш особливо, даний винахід відноситься до (аза)індольної похідної, заміщеної у положенні 5, яка має інгібуючу активність по відношенню до mPGEs-1. Відомо, що простагландини (PG) являють собою окислені жирні кислоти, синтезовані та вивільнені у позаклітинний простір, та потім у плазму, сечу та інші біологічні рідини. Вони є важливими біорегуляторами, а також медіаторами запалення, що модулюють внутрішньоклітинні реакції та міжклітинні зв'язки. Простагландини E2 (PGE2) відіграють важливу фізіологічну роль: регулювання функції нирок, судинного гомеостазу, відновлення кісток, викликання лихоманки, шлунково-кишкової функції та вагітності. Окрім цих фізіологічних функцій, PGE 2 простагландини поводять себе як сильні медіатори гострого запалення (включаючи гіпералгезію, вазодилатацію та виведення рідин із судин: Vane J.R. та Botting R.M. 1997 "Anti-inflammatory drugs and their mechanism of action" Inflamm. Res. 47 (2): p. 78) та хронічного запалення. Зокрема, PGE2 простагландини є особливо поширеними при запальних патологіях суглобів. PGE2 простагландини також відіграють роль у болі та є сильними піретичними агентами (Ayoub S.S. et al., 2004 "A ceta-minophen-induced hypothermia in mice is mediated by a prostaglandin endoperoxide synthase 1 gene-derived protein", PNAS 101: 11165-11169; Ivanov A. et al. 2002 "Prostaglandin E2-synthesizing enzymes in fever: differential transcriptional regulation", Am. J. Physiol. Regul. Integr. Comp. Physiol. 283: R1104R1117). Фермент, що відповідає за синтез PGE2 простагландинів, являє собою простагландин E синтазу (PGES), яка перетворює ендопероксид PGH2, утворений з арахідонової кислоти, шляхом дії циклооксигеназ, у PGE2. Активність PGES була знайдена як у цитозольній фракції, так і мембрана-зв'язаній у різних типах клітин. Було ідентифіковано три ферментні форми (Kudo I. et al. 2005 "Prostaglandin E synthase, a terminal enzyme for prostaglandin E2 biosynthesis", Journal of Biochemistry and Molecular Biology 38, 633-638); серед них, мікросомальний PGES-1(mPGES-1) являє собою мембрана-зв'язаний фермент, який потребує глутатіон як невід'ємний кофактор для його активності. Експресування mPGES-1 викликається про-запальним стимулюванням, таким як IL-1β або LPS (Proc. Natl. Acad. Sci. 96: 7220, 1999). Він є спів-локалізованим разом з COX-2 на ендоплазматичному ретикумі та на оболонці ядра (Lazarus M. et al. 2002 "Biochemical characterization of mouse microsomal prostaglandin E synthase-1 and its colocalization with cyclooxygenase-2 in peritoneal macrophages" Arch. Biochem. Biophys. 397: 336; Murakami M. et al. 2000 "Regulation of prostaglandin E2 biosynthesis by inducible membrane-associated prostaglandin E2 synthase that acts in concert with cyclooxygenase-2" J. Biol. Chem. 275: 32783; Yamagata K. et al. 2001 "Coexpression of microsomal-type prostaglandin E synthase with cyclooxygenase-2 in brain endothelial cells of rats during endotoxin-induced fever" J. Neurosci. 15; 21 (8): 2669-77). Хоча два ферменти (COX-2 та mPGES-1) мають функціональний зв'язок та спів-експресію, їх швидкість індукції відрізняється у деяких клітинних системах, показуючи різні регуляторні механізми індукції (J. Immunol. 167: 469, 2001). Лікарські засоби, які інгібують фермент COX-2, як показано, є ефективними у зменшенні запалення та болю при хронічних запальних патологіях, таких як артрит, але їх тривале застосування може викликати ураження тканини, що спричиняється перевиробництвом цитокінів, наприклад, TNFα та IL-1β (Stichtenoth D.O. 2001 "Microsomal prostaglandin E synthase is regulated by proinflammatory cytokines and glucocorticoids in primary rheumatoid synovial cells" J. Immunol. 167: 469). Крім того, тривале застосування цих лікарських засобів пов'язане із серцево-судинними побічними ефектами. Це призвело до вилучення з ринку декількох селективних COX-2 інгібіторів та до перегляду показань для цілого класу цих лікарських засобів. Останні науково-дослідницькі роботи направлені на подолання побічних ефектів COX-2 інгібіторів шляхом дослідження mPGES-1 інгібіторів з метою розробки лікарських засобів, які є активними у лікуванні запалення та болю. (B. Samuelsson et al. "Membrane Prostaglandin E Synthase-1: A Novel Therapeutic Target" Pharmacol. Rev. 59:207-224, 2007). Крім того, численні дослідження показали, що PGE2 простагландини є факторами, що стимулюють розвинення пухлин (L.R. Howe, "Inflammation and breast cancer. Cyclooxygenase/prostaglandin signaling and breast cancer", Breast cancer research 2007, 9:210, Castellone M.D. et al. 2005 "Prostaglandin E2 promotes colon cancer growth through a novel Gs-AxinB-catenin", Science 310, 1504-1510; Mehrotra S., et al. 2006 "Microsomal Prostaglandin E 2 in breast cancer: a potential target for therapy", J. Pathol. 208(3): 356-63; Nakano et al. 2006 "Induction of macrophagic prostaglandin E2 synthesis by glioma cells" J. Neurosurgery 104 (4), 574-582), що залучені у функції ангіогенезу, клітинної проліферації та клітинної міграції. Також знайдено, що 1 UA 100867 C2 5 10 15 20 25 30 35 40 45 50 селективні FANS та COX-2 інгібітори інгібують різні типи пухлин, включаючи пухлини колоректальної області, стравоходу, молочної залози, легені та сечового міхура, шляхом інгібування PGE2. PGE2 простагландини, одержані з COX-2, викликають ріст пухлини шляхом прикріплення до діючих рецепторів та активування сигналів для контролювання клітинної проліферації, міграції, апоптозу та ангіогенезу (Wang D. et al. 2006 "Prostaglandin and cancer" Gut. 55 (1): 115-22; Han C. et al. 2006 "Prostaglandin E2 receptor EP1 transactivates EGFR/MET receptor tyrosine kinases and enhances invasiveness in human hepatocellular carcinoma cells", Journal of Cellular Physiology 207: 261-270). Наразі була знайдена похідна (аза)ідолу, заміщена в положенні 5, яка має селективну інгібуючу активність на mPGES-1. Передбачають, що формулювання "похідна (аза)ідолу" являє собою сполуку формули (I), представлену у цьому описі нижче, у якій основне ядро, представлене індольним кільцем, може мати один або більше атомів вуглецю у 4, 6, та 7 положенні, що необов'язково замінені атомом азоту, та простий або подвійний зв'язок між атомами вуглецю у 2- та 3-положенні. У першому аспекті, даний винахід відноситься до похідної (аза)ідолу, заміщеної в положенні 5, формули (I): Формула (I) у якій: X являє собою атом галогену або (C1-C3)алкіл, трифторметил, нітрогрупу, аміногрупу, ціаногрупу, ді(C1-C3)алкіламіногрупу, гідроксигрупу, (C1-C3)алкоксигрупу, фенільну або (C1C3)алкілфенільну групу; Y та Z, які можуть бути однаковими або різними, являють собою водень або атом галогену, або (C1-C3)алкіл, трифторметил, нітрогрупу, аміногрупу, ді(C1-C3)алкіламіногрупу, гідроксигрупу, (C1-C3)алкоксигрупу, феніл, COOH, (C1-C3)алкіл-COOH, (C2-C3)алкеніл-COOH, COOR, де R являє собою лінійну або розгалужену (C1-C6)алкільну або гідроксиалкільну групу, CONH2, SO2CH3, SO2NHCH3 або NHSO2CH3 групу; G1, G2 та G3, які можуть бути однаковими або різними, являють собою атом азоту або CH групу; 1 I II III R являє собою (C1-C6)алкіл, (C3-C7)циклоалкіл, (C1-C6)алкілOR , (CH2)nNR R , II III I II I I II I I (CH2)nCONR R , (CH2)nCOR , (CH2)nCOOR , (CH2)nOCOR , SO2R , (CH2)nNR SO2R , (CH2)nSO2R групу, необов'язково заміщену за допомогою 1-3 гідрокси груп, де n являє собою ціле число від I II III 1 до 6, R являє собою (C1-C3)алкіл, або (C1-C3)алкілOH групу, та R та R , які можуть бути однаковими або різними, являють собою атом водню або (C1-C3)алкільну групу; W являє собою σ зв'язок, або (C1-C6)алкіл, (C2-C6)алкеніл, O(C1-C6)алкіл, O(C2-C6)алкеніл, C(O)NH, (CH2)pCO(CH2)q, або (CH2)pC(OH)(CH2)q групу, де p та q, які можуть бути однаковими або різними, являють собою ціле число від 0 до 3; 2 R являє собою фенільну, піридинову або (C 3-C7)циклоалкільну групу, необов'язково заміщену за допомогою 1-3 замісників, які можуть бути однаковими або різними, що представлені L-M групою, у якій L являє собою σ зв'язок, або (C1-C6)алкільну, (C2-C6)алкенільну, (C2-C6)алкінільну, O(C1-C6)алкільну, O(C2-C6)алкенільну, O(C2-C6)алкінільну групу, та M являє II II II III собою водень або атом галогену, або OH, CF 3, NO2, CN, COOR , SO2NHR , CH2CONR R , II III IV IV IV V IV V II III NR R , SO2R , NHSO2R , POR R , або OPOR R групу, де R та R , які можуть бути IV V однаковими або різними, приймають значення, описані вище, та R та R , які можуть бути однаковими або різними, являють собою (C1-C3)алкільну групу, за умови, що 1 коли G1, G2, та G3 всі являють собою CH групу, R являє собою (C1-C6)алкільну або (C3C7)циклоалкільну групу, необов'язково заміщену за допомогою 1-3 гідрокси груп, W являє собою σ зв'язок, та зв'язок між атомами вуглецю у 2 та 3 положенні являє собою подвійний зв'язок, 2 R не являє собою фенільну або піридинову групу, необов'язково заміщену за допомогою 13 замісників, які можуть бути однаковими або різними, що вибирають з таких як: галоген, (C 1 2 UA 100867 C2 5 10 15 20 25 30 35 40 45 50 55 60 C6)алкіл, необов'язково заміщений гідрокси групою, трифторметил, нітрогрупа, аміногрупа, II ді(C1-C3)алкіламіногрупа, гідроксигрупа, (C1-C3)алкоксигрупа, COOH, COOR , SO2CH3, IV V IV V SO2NHCH3, NHSO2CH3, POR R , OPOR R , (C1-C6)алкіл-COOH, та (C2-C6)алкеніл-COOH; та за умови, що 2 коли G1 являє собою N, та G2 та G3 являють собою CH групу, R не являє собою двовалентну ароматичну групу, заміщену за допомогою однієї L-M групи, представленої O(C1C6)алкільною, O(C2-C6)алкенільною та O(C2-C6)алкінільною групою; та її фізіологічно прийнятних солей приєднання, стереоізомерів, енантіомерів, гідратів, сольватів та поліморфних форм. Пунктирна лінія між атомами вуглецю у 2 та 3 положенні означає, що такий зв'язок може бути простим або подвійним звязком. Ланцюг різних алкільних груп, який може бути присутнім у сполуці формули (I), може бути лінійним або розгалуженим. У випадку певних замісників, сполука формули (I) відповідно до даного винаходу може містити асиметричний атом вуглецю і, таким чином, може бути у формі стереоізомерів та енантіомерів. Типові приклади таких замісників включають 2-бутанол, 2-метилбутил, 2-бутенову кислоту, 2-метилпропанову кислоту та 1,2-пентандіол. Переважно, галоген являє собою бром, хлор або фтор. Кращими значеннями X є галоген, (C1-C3)алкіл, трифторметил, нітро група, ціано група та (C1-C3)алкокси група. Особливо кращими значеннями X є Cl, Br, F, трифторметил та нітро група. Кращими значеннями Y та Z є H, галоген, нітро група, COOH, (С 1-C3)алкіл, трифторметил та (С1-C3)алкокси група. Особливо кращими значеннями Y та Z є Cl, Br, F, трифторметил, нітро група, COOH, метил, етил, метокси група та етокси група. 1 I II III II III Кращі значення R включають (C1-C3)алкіл, (C1-C3)алкілOR , (CH2)nNR R , (CH2)nCONR R , I II I I II I I (CH2)nCOR , (CH2)nCOOR , (CH2)nOCOR , SO2R , (CH2)nNR SO2R , (CH2)nSO2R групу, необов'язково заміщену за допомогою 1-3 гідрокси груп, де n являє собою ціле число від 1 до 4, I II III R являє собою (C1-C3)алкіл або (C1-C3)алкілOH групу, та R та R , які можуть бути однаковими або різними, являють собою атом водню або (C1-C3)алкільну групу. 1 I II III Особливо кращі значення R включають (C1-C3)алкіл, (C1-C3)алкілOR , (CH2)nCONR R , I II I I II I I (CH2)nCOR , (CH2)nCOOR , (CH2)nOCOR , SO2R , (CH2)nNR SO2R , (CH2)nSO2R групу, необов'язково заміщену за допомогою 1-3 гідрокси груп, де n являє собою ціле число від 1 до 3, I II III R являє собою CH3, C2H5, CH2OH, або C2H4OH групу, та R та R , які можуть бути однаковими або різними, являють собою атом водню або CH3, C2H5 групу. Кращі значення W включають σ зв'язок, або (C 1-C3)алкіл, (C2-C4)алкеніл, O(C1-C3)алкіл, O(C2C3)алкеніл, C(O)NH, (CH2)pCO(CH2)q, або (CH2)pC(OH)(CH2)q групу, де p та q, які можуть бути однаковими або різними, являють собою ціле число від 1 до 3. Особливо кращі значення W включають σ зв'язок, або CH 2, C2H4, CH=CH, OCH2, OC2H4, OCH=CH, C(O)NH, (CH2)pCO(CH2)q, або (CH2)pC(OH)(CH2)q групу, де p та q, які можуть бути однаковими або різними, являють собою ціле число від 1 до 2. 2 Кращі значення R включають фенільну, піридинову або (C3-C7)циклоалкільну групу, необов'язково заміщену за допомогою 1-2 замісників, які можуть бути однаковими або різними, що представлені L-M групою, у якій L являє собою σ зв'язок, або (C1-C3)алкільну, (C2C4)алкенільну, (C2-C4)алкінільну, O(C1-C3)алкільну, O(C2-C4)алкенільну, O(C2-C4)алкінільну групу, II II II III та M являє собою водень або атом галогену, або CF3, CN, COOR , SO2NHR , CH2CONR R , II III IV IV IV V IV V II III NR R , SO2R , NHSO2R , POR R , або OPOR R групу, де R та R , які можуть бути IV V однаковими або різними, являють собою атом водню або (C1-C3)алкіл групу, та R та R , які можуть бути однаковими або різними, являють собою (C1-C3)алкільну групу. 2 Особливо кращі значення R включають фенільну, піридинову або (C3-C7)циклоалкільну групу, необов'язково заміщену за допомогою 1 замісника, що представлений L-M групою, у якій L являє собою σ зв'язок, або CH2, C2H4, CH=CH, C≡C, OCH2, OC2H4, OCH=CH, °C≡C групу, та M II II II III II III являє собою водень або атом галогену, або CF 3, CN, COOR , SO2NHR , CH2CONR R , NR R , IV IV IV V IV V II III SO2R , NHSO2R , POR R , або OPOR R групу, де R та R , які можуть бути однаковими або IV V різними, являють собою атом водню або CH3, C2H5 групу, та R та R , які можуть бути однаковими або різними, являють собою CH3 або C2H5 групу. 2 Перше особливо краще значення групи W-R являє собою таке, у якому W являє собою σ 2 зв'язок або CH2 або C2H4 групу, та R являє собою фенільну групу, необов'язково заміщену за допомогою 1-3 замісників, які можуть бути однаковими або різними, що вибирають з Br, Cl, та F атому, та CH3, C2H5, OCH3, OC2H5, CN, CH2CN, та CH2CONH2 групи. 2 Друге особливо краще значення групи W-R являє собою таке, у якому W являє собою σ 2 зв'язок, або CH2 або C2H4 групу, та R являє собою піридинову групу, необов'язково заміщену за допомогою 1-3 замісників, які можуть бути однаковими або різними, що вибирають з Br, Cl, та F атому, та CH3, C2H5, OCH3, OC2H5, CN, CH2CN, та CH2CONH2 групи. 3 UA 100867 C2 2 5 10 15 20 Третє особливо краще значення групи W-R являє собою таке, у якому W являє собою σ 2 зв'язок, або CH2 або C2H4 групу, та R являє собою циклогексильну групу, необов'язково заміщену за допомогою 1-3 замісників, які можуть бути однаковими або різними, що вибирають з Br, Cl, та F атому, та CH3, C2H5, OCH3, OC2H5, CN, CH2CN, та CH2CONH2 групи. В залежності від природи замісників, сполука формули (I) може утворювати солі приєднання з фізіологічно прийнятними органічними або неорганічними кислотами або основами. Типові приклади фізіологічно прийнятних неорганічних кислот включають соляну кислоту, бромистоводневу кислоту, сірчану кислоту, фосфорну кислоту та азотну кислоту. Типові приклади підходящих фізіологічно прийнятних органічних кислот включають оцтову кислоту, аскорбінову кислоту, бензойну кислоту, лимонну кислоту, фумарову кислоту, молочну кислоту, малеїнову кислоту, метансульфонову кислоту, щавлеву кислоту, паратолуолсульфонову кислоту, бурштинову кислоту, дигалову кислоту та винну кислоту. Типові приклади підходящих фізіологічно прийнятних неорганічних основ включають: амоній, кальцій, магній, натрій та калій. Типові приклади підходящих фізіологічно прийнятних органічних основ включають: аргінін, бетаїн, кафеїн, холін, N, N-дибензилетилендіамін, діетиламін, 2-діетиламіноетанол, 2діметиламіноетанол, етаноламін, етилендіамін, N-етилморфолін, N-етилпіперидин, Nметилглюкамін, глюкамін, глюкозамін, гістидин, N-(2-гідроксиетил)піперидин, N-(2гідроксиетил)піролідин, ізопропіламін, лізин, метилглюкамін, морфолін, піперазин, піперидин, теобромін, триетиламін, триметиламін, трипропіламін та трометамін. У другому аспекті, даний винахід відноситься до способу одержання похідної (аза)ідолу, заміщеної в положенні 5, формули (I): 25 30 Формула (I) 1 2 у якій X, Y, Z, G1, G2, G3, W, R та R приймають значення, представлені вище, та її фізіологічно прийнятних солей приєднання, стереоізомерів, енантіомерів, гідратів, сульфатів та поліморфних форм, a) шляхом введення у реакцію сполуки формули (II): 35 у якій X, Y та Z приймають значення, представлені вище, та Q являє собою атом галогену або гідрокси групу, зі сполукою формули (III): 40 у якій 1 2 G1, G2, G3, R , R та W приймають значення, представлені вище, 4 UA 100867 C2 з одержанням сполуки формули (I): 5 10 15 20 25 30 35 40 45 Формула (I) у якій 1 2 X, Y, Z, G1, G2, G3, R , R та W приймають значення, представлені вище, та b) утворюючи, при бажані, фізіологічно прийнятну сіль приєднання сполуки формули (I) зі стадії (a). Відповідно до першого варіанту втілення, описану вище стадію (a) проводять шляхом введення у реакцію сполуки формули (II), у якій Q являє собою Cl, з аміном формули (III) у присутності прийнятного акцептора кислоти у відповідності зі стандартними способами. Відповідно до другого варіанту втілення, описану вище стадію (a) проводять шляхом введення у реакцію сполуки формули (II), у якій Q являє собою OH, з аміном формули (III) у присутності прийнятного сполучного агенту у відповідності зі стандартними способами. Далі, реакція стадії (a) також може бути проведена в твердій фазі шляхом попереднього прикріплення сполуки формули (III) до препаративної смоли, такої як, наприклад, PL-FMP смола, виробленої Polymer Laboratories. У цьому випадку, стадію відщеплення, у якій отриману сполуку формули (I) відділяють від смоли, проводять після стадії (a). Таку стадію відщеплення здійснюють за допомогою звичайних способів, таких як, наприклад, обробка трифтороцтовою кислотою. Коли приймають, що сполука формули (I) має простий зв'язок між атомами вуглецю у 2- та 3-положенні, стадію відновлення проводять після стадії (a). Таку стадію відновлення здійснюють за допомогою звичайних способів, таких як, наприклад, обробка оловом у присутності сильної кислоти. 1 ІІ II Коли R представлений (CH2)nCOOR групою, та R являє собою алкільну групу, відповідна II кислота, у якій R являє собою атом водню, може бути одержана шляхом гідролізу, у відповідності до стандартних способів, таких як, наприклад, у присутності сильної основи, такої як NaOH. Проміжні сполуки формули (III) є новими. Відповідно до третього аспекту, даний винахід також відноситься до сполуки формули (III): у якій G1, G2, та G3, які можуть бути однаковими або різними, являють собою атом азоту або CH групу; 1 I II III R являє собою (C1-C6)алкіл, (C3-C7)циклоалкіл, (C1-C6)алкілOR , (CH2)nCONR R , I II I I II I I (CH2)nCOR , (CH2)nCOOR , (CH2)nOCOR , SO2R , (CH2)nNR SO2R , (CH2)nSO2R групу, необов'язково заміщену за допомогою 1-3 гідрокси груп, де n являє собою ціле число від 1 до 6, I II III R являє собою (C1-C3)алкіл, або (C1-C3)алкілOH групу, та R та R , які можуть бути однаковими або різними, являють собою атом водню або (C1-C3)алкільну групу; W являє собою σ зв'язок, або (C1-C6)алкіл, (C2-C6)алкеніл, O(C1-C6)алкіл, O(C2-C6)алкеніл, C(O)NH, (CH2)pCO(CH2)q, або (CH2)pC(OH)(CH2)q групу, де p та q, які можуть бути однаковими або різними, являють собою ціле число від 0 до 3; та 2 R являє собою фенільну, піридинову або (C 4-C7)циклоалкільну групу, необов'язково заміщену за допомогою 1-3 замісників, які можуть бути однаковими або різними, що 5 UA 100867 C2 5 10 15 20 25 30 35 40 45 50 55 60 представлені L-M групою, у якій L являє собою σ зв'язок, або (C 1-C6)алкільну, (C2-C6)алкенільну, (C2-C6)алкінільну, O(C1-C6)алкільну, O(C2-C6)алкенільну, O(C2-C6)алкінільну групу, та M являє II II II III собою водень або атом галогену, або OH, CF 3, NO2, CN, COOR , SO2NHR , CH2CONR R , II III IV IV IV V IV V II III NR R , SO2R , NHSO2R , POR R , або OPOR R групу, де R та R , які можуть бути IV V однаковими або різними, приймають значення, описані вище, та R та R , які можуть бути однаковими або різними, являють собою (C1-C3)алкільну групу, за умови, що 1 коли G1, G2, та G3 всі являють собою CH групу, R являє собою (C1-C6)алкільну або (C3C7)циклоалкільну групу, необов'язково заміщену за допомогою 1-3 гідрокси груп, W являє собою σ зв'язок, та зв'язок між атомами вуглецю у 2 та 3 положенні являє собою подвійний звязок, 2 R не являє собою фенільну або піридинову групу, необов'язково заміщену за допомогою 13 замісників, які можуть бути однаковими або різними, що вибирають з таких як: галоген, (C 1C6)алкіл, необов'язково заміщений гідрокси групою, трифторметил, нітрогрупа, аміногрупа, II ді(C1-C3)алкіламіногрупа, гідроксигрупа, (C1-C3)алкоксигрупа, COOH, COOR , SO2CH3, IV V IV V SO2NHCH3, NHSO2CH3, POR R , OPOR R , (C1-C6)алкіл-COOH, та (C2-C6)алкеніл-COOH; та за умови, що 2 коли G1 являє собою N, та G2 та G3 являють собою CH групу, R не являє собою двовалентну ароматичну групу, заміщену за допомогою однієї L-M групи, представленої O(C1C6)алкільною, O(C2-C6)алкенільною, та O(C2-C6)алкінільною групою. 1 I II III I Кращі значення R включають (C1-C3)алкіл, (C1-C3)алкілOR , (CH2)nCONR R , (CH2)nCOR , II I I II I I (CH2)nCOOR , (CH2)nOCOR , SO2R , (CH2)nNR SO2R , (CH2)nSO2R групу, необов'язково заміщену I за допомогою 1-3 гідрокси груп, де n являє собою ціле число від 1 до 4, R являє собою (C1II III C3)алкільну або (C1-C3)алкілOH групу, та R та R , які можуть бути однаковими або різними, являють собою атом водню або (C1-C3)алкільну групу. 1 I II III Особливо кращі значення R включають (C1-C3)алкіл, (C1-C3)алкілOR , (CH2)nCONR R , I II I I II I I (CH2)nCOR , (CH2)nCOOR , (CH2)nOCOR , SO2R , (CH2)nNR SO2R , (CH2)nSO2R групу, необов'язково заміщену за допомогою 1-3 гідрокси груп, де n являє собою ціле число від 1 до 3, I II III R являє собою CH3, C2H5, CH2OH, або C2H4OH групу, та R та R , які можуть бути однаковими або різними, являють собою атом водню або CH3, C2H5 групу. Кращі значення W включають σ зв'язок, або (C1-C3)алкіл, (C2-C4)алкеніл, O(C1-C3)алкіл, O(C2C3)алкеніл, C(O)NH, (CH2)pCO(CH2)q, або (CH2)pC(OH)(CH2)q групу, де p та q, які можуть бути однаковими або різними, являють собою ціле число від 1 до 3. Особливо кращі значення W включають σ зв'язок, або CH2, C2H4, CH=CH, OCH2, OC2H4, OCH=CH, C(O)NH, (CH2)pCO(CH2)q, або (CH2)pC(OH)(CH2)q групу, де p та q, які можуть бути однаковими або різними, являють собою ціле число від 1 до 2. 2 Кращі значення R включають фенільну, піридинову або (C4-C7)циклоалкільну групу, необов'язково заміщену за допомогою 1-2 замісників, які можуть бути однаковими або різними, що представлено L-M групою, у якій L являє собою σ зв'язок, або (C1-C3)алкільну, (C2C4)алкенільну, (C2-C4)алкінільну, O(C1-C3)алкільну, O(C2-C4)алкенільну, O(C2-C4)алкінільну групу, II II II III та M являє собою водень або атом галогену, або CF3, CN, COOR , SO2NHR , CH2CONR R , II III IV IV IV V IV V II III NR R , SO2R , NHSO2R , POR R , або OPOR R групу, де R та R , які можуть бути IV V однаковими або різними, являють собою атом водню або (C1-C3)алкіл групу, та R та R , які можуть бути однаковими або різними, являють собою (C1-C3)алкільну групу. 2 Особливо кращі значення R включають фенільну, піридинову або (C4-C7)циклоалкільну групу, необов'язково заміщену за допомогою 1 заміснику, що представлено L-M групою, у якій L являє собою σ зв'язок, або CH2, C2H4, CH=CH, C≡C, OCH2, OC2H4, OCH=CH, °C≡C групу, та M II II II III II III являє собою водень або атом галогену, або CF 3, CN, COOR , SO2NHR , CH2CONR R , NR R , IV IV IV V IV V II III SO2R , NHSO2R , POR R , або OPOR R групу, де R та R , які можуть бути однаковими або IV V різними, являють собою атом водню або CH3, C2H5 групу, та R та R , які можуть бути однаковими або різними, являють собою CH3 або C2H5 групу. 2 Перше особливо краще значення групи W-R являє собою таке, у якому W являє собою σ 2 зв'язок, або CH2 або C2H4 групу, та R являє собою фенільну групу, необов'язково заміщену за допомогою 1-3 замісників, які можуть бути однаковими або різними, що вибирають з Br, Cl, та F атому, CH3, C2H5, OCH3, OC2H5, CN, CH2CN, та CH2CONH2 групи. 2 Друге особливо краще значення групи W-R являє собою таке, у якому W являє собою σ 2 зв'язок, або CH2 або C2H4 групу, та R являє собою піридинову групу, необов'язково заміщену за допомогою 1-3 замісників, які можуть бути однаковими або різними, що вибирають з Br, Cl, та F атому, CH3, C2H5, OCH3, OC2H5, CN, CH2CN, та CH2CONH2 групи. 2 Третє особливо краще значення групи W-R являє собою таке, у якому W являє собою σ 2 зв'язок, або CH2 або C2H4 групу, та R являє собою циклогексильну групу, необов'язково 6 UA 100867 C2 5 10 15 20 25 30 35 40 45 50 55 60 заміщену за допомогою 1-3 замісників, які можуть бути однаковими або різними, що вибирають з Br, Cl, та F атому, CH3, C2H5, OCH3, OC2H5, CN, CH2CN, та CH2CONH2 групи. Дослідження на біологічні властивості сполуки формули (I) відповідно до даного винаходу показали, що він має неочікувану селективну властивість інгібування mPGES-1та явну антиноцицептивну активність при запальному болі. У четвертому аспекті, таким чином, даний винахід відноситься до фармацевтичної композиції, що містить ефективну кількість сполуки формули (I), або її фізіологічно прийнятної солі приєднання, стереоізомеру, енантіомеру, гідрату, сольвату або поліморфної форми, та щонайменше один фармацевтично прийнятний інертний інгредієнт. У даному описі та у пунктах Формули винаходу, термін "ефективна кількість" відноситься до кількості, яка забезпечує одержання визначного покращення щонайменше у одному симптомі або параметрі специфічного розладу. Фармацевтична композиція відповідно до даного винаходу буде використовуватися у лікуванні або профілактиці розладів, пов'язаних з виробленням простагландину E 2 (PGE2), наприклад, таких як запальні процеси, біль, пухлини, нейродегенеративні розлади та атеросклероз. Переважно, фармацевтична композиція відповідно до даного винаходу буде використовуватися у лікуванні болю при хронічних запальних патологіях, таких як артрит, або пухлин, особливо пухлин колоректальної області, стравоходу, молочної залози, легені та сечового міхура. Переважно, фармацевтичні композиції даного винаходу одержують у прийнятних лікарських формах, що включають ефективну дозу щонайменше однієї сполуки формули (I) або її фізіологічно прийнятної солі приєднання, стереоізомеру, енантіомеру, гідрату, сольвату або поліморфної форми, та щонайменше один фармацевтично прийнятний інертний інгредієнт. Приклади прийнятних лікарських форм включають таблетки, капсули, покриті таблетки, гранули, розчини та сиропи для перорального введення; креми, мазі та антисептичні пластири для місцевого застосування; супозиторії для ректального введення та стерильні розчини для введення шляхом ін'єкції або аерозоль або очне застосування. Лікарські форми також можуть містити інші звичайно використовувані інгредієнти, наприклад: консерванти, стабілізатори, поверхнево-активні речовини, буфери, солі для регулювання осмотичного тиску, емульгатори, підсолоджувачі, барвники, ароматизатори та подібні. Якщо необхідно для певних видів терапії, фармацевтична композиція даного винаходу може містити інші фармакологічно активні інгредієнти, одночасне застосування яких є корисним. Кількість сполуки формули (I) або її фізіологічно прийнятної солі приєднання, стереоізомеру, енантіомеру, гідрату, сольвату або поліморфної форми, та щонайменше одного фармацевтично прийнятного інертного інгредієнту у фармацевтичній композиції даного винаходу може змінюватися у широких межах в залежності від відомих факторів, наприклад, таких як: тип хвороби, яку лікують, серйозність хвороби, маса тіла пацієнта, лікарська форма, обраний шлях введення, число щоденних введень та ефективність вибраної сполуки формули (I). Однак, оптимальна кількість може бути легко та планово визначена спеціалістом, кваліфікованим у даній галузі техніки. Як правило, кількість сполуки формули (I) або її фізіологічно прийнятної солі приєднання, стереоізомеру, енантіомеру, гідрату, сольвату або поліморфної форми, та щонайменше одного фармацевтично прийнятного інертного інгредієнту у фармацевтичній композиції даного винаходу буде такою, що вона забезпечує рівень введення від 0,0001 до 100 мг/кг/день та навіть більш переважно від 0,01 до 10 мг/кг/день. Зрозуміло, що фармацевтичні композиції даного винаходу не повинні обов'язково містити повну кількість сполуки формули (I), так як зазначена ефективна кількість може бути додана шляхом введення множини доз фармацевтичної композиції даного винаходу. Лікарські форми фармацевтичної композиції даного винаходу можуть бути одержані відповідно до технологій, які добре відомі хімікам-фармацевтам, включаючи змішування, гранулювання, пресування, розчинення, стерилізацію та подібні. Наступні приклади слугують для додаткової ілюстрації даного винаходу, однак, не обмежуючи його. Приклад 1 Одержання проміжних сполук a) 1-етил-2-(4-метилфеніл)-1H-піроло[2,3-b]піридин-5-амін До розчину 2-аміно-3-бром-5-нітропіридину (1,2 г, 5,5 ммоль) у безводному ТГФ (23 мл), PdCl2 (52 мг, 0,29 ммоль) при перемішуванні додають 1,1'-біс(ди-трет-бутилфосфіно)фероцен 7 UA 100867 C2 5 10 15 20 25 30 35 40 45 50 55 60 (D-tBPF, 0,17 г, 0,39 ммоль), діізопропіламін (0,81 г, 8,0 ммоль), та CuI (22 мг, 0,11 ммоль). До цієї суміші 4-етинілтолуол (1,0 мл, 7,9 ммоль) додають по краплях впродовж 2,25 годин. Отриману таким чином суміш фільтрують у вакуумі через целіт, залишок промивають кілька разів за допомогою EtOAc. Після упарювання розчиннику, залишок очищують за допомогою колонкової хроматографії на силікагелі (Et2O/н-гексан, Et2O 30 %→60 %), що приводить до одержання 5-нітро-3(фенілетиніл)піридин-2-аміну у вигляді жовтої твердої речовини: 1 H-ЯМР (CDCl3): 8,93 (d, J=2,7 Гц, 1H); 8,36 (d, J=2,7 Гц, 1H); 7,42 (AA' з AA'BB' системи, 2H); 7,19 (BB' з AA'BB' системи, 2H); 5,85 (bs, 2H); 2,39 (s, 3H). До суспензії трет-бутоксиду калію (0,41 г, 3,7 ммоль) у безводному ДМФА (5 мл) по краплях при кімнатній температурі перемішуватись додають розчин 5-нітро-3-(фенілетиніл)піридин-2аміну (0,70 г, 2,8 ммоль) у ДМФА (25 мл). Через 1,5 дні додають йодетан (0,38 мл, 4,7 ммоль) та все перемішують впродовж ще 1,5 дні. Потім до реакційної суміші додають H 2O (50 мл) та EtOAc (100 мл). Цю суміш виливають у ділильну лійку, органічний шар відділяють, водний шар повністю екстрагують за допомогою EtOAc (50 мл) та об'єднані органічні шари промивають сольовим розчином (2 × 100 мл). Органічний розчинник видаляють випарюванням при зниженому тиску та залишок очищують за допомогою колонкової хроматографії на силікагелі (Et2O/н-гексан, Et2O 10 %→20 %), що приводить до одержання 1-етил-2-(4-метилфеніл)-5-нітро1H-піроло[2,3-b]піридину: 1 H-ЯМР (CDCl3): 9,21 (d, J=2,7 Гц, 1H); 8,71 (d, J=2,7 Гц, 1H); 7,40 (AA' з AA'BB' системи, 2H); 7,32 (BB' з AA'BB' системи, 2H); 6,60 (s, 1H); 4,41 (q, J=7,2 Гц, 2H); 2,45 (s, 3H); 1,31 (t, J=7,2 Гц, 3H). Розчин 1-етил-2-(4-метилфеніл)-5-нітро-1H-піроло[2,3-b]піридину (0,36 г, 1,3 ммоль) у EtOAc/EtOH (абсолютний)= 4:7 суміш (110 мл) гідрогенують у H 2 атмосфері у присутності 10 % Pd(C) (110 мг) впродовж 2 годин. Залишок фільтрують у вакуумі через целіт для видалення каталізатору та розчинник випарюють, що приводить до одержання сирого 1-етил-2-(4метилфеніл)-1H-піроло[2,3-b]піридин-5-аміну, який використовують без будь-якого додаткового очищення: 1 H-ЯМР (CDCl3): 7,91 (d, J=3,0 Гц, 1H); 7,39 (AA" з AA'BB" системи, 2H); 7,32-7,18 (m, 3H); 6,25 (s, 1H); 4,30 (q, J=7,5 Гц, 2H); 3,32 (bs, 2H); 2,41 (s, 3H); 1,27 (t, J=7,5 Гц, 3H). b) 1-ізопропіл-2-(4-метилфеніл)-1H-піроло[2,3-b]піридин-5-амін Використовують спосіб, описаний вище у Прикладі 1a), за винятком того, що ізопропілбромід використовують замість йодетану. 1 1-ізопропіл-2-(4-метилфеніл)-5-нітро-1H-піроло[2,3-b]піридин: H-ЯМР (CDCl3): 9,18 (d, J=2,4 Гц, 1H); 8,67 (d, J=2,4 Гц, 1H); 7,34 (AA'BB' система, 4H); 6,52 (s, 1H); 4,70 (ept., J=6,9 Гц, 1H); 2,45 (s, 3H); 1,70 (d, J=6,9 Гц, 6H) 1 1-ізопропіл-2-(4-метилфеніл)-1H-піроло[2,3-b]піридин-5-амін: H-ЯМР (CDCl3): 7,85 (d, J=1,4 Гц, 1H); 7,27 (AA" з AA'BB" системи, 2H); 7,16-7,05 (m, 3H); 6,11 (s, 1H); 4,56 (ept., J=7,0 Гц, 1H); 3,85 (bs, 2H); 2,33 (s, 3H), 1,59 (d, J=7,0 Гц, 6H). c) 1-(2-метоксиетил)-2-(4-метилфеніл)-1H-піроло[2,3-b]піридин-5-амін Використовують спосіб, описаний вище у Прикладі 1a), за винятком того, що 2метоксиетилбромід використовують замість йодетану. 1-(2-метоксиетил)-2-(4-метилфеніл)-5-нітро-1H-піроло[2,3-ib]піридин: 1 H-ЯМР (CDCl3): 9,21 (d, J=2,4 Гц, 1H); 8,71 (d, J=2,4 Гц, 1H); 7,49 (AA" з AA'BB" системи, 2H); 7,32 (BB" з AA'BB" системи, 2H); 6,62 (s, 1H); 4,54 (t, J=5,6 Гц, 2H); 3,70 (t, J=5,6 Гц, 2H); 3,19 (s, 3H); 2,45 (s, 3H). 1-(2-метоксиетил)-2-(4-метилфеніл)-1H-піроло[2,3-b]піридин-5-амін: 1 H-ЯМР (CDCl3): 7,89 (d, J=2,7 Гц, 1H); 7,46 (AA" з AA'BB" системи, 2H); 7,25 (BB" з AA'BB" системи, 2H); 7,19 (d, J=2,4 Гц, 1H); 6,27 (s, 1H); 4,42 (t, J=6,0 Гц, 2H); 3,68 (t, J=6,0 Гц, 2H); 3,40 (bs, 1H); 3,17 (s, 3H); 2,40 (s, 3H). d) 1-етил-2-(4-фторфеніл)-1H-піроло[2,3-b]піридин-5-амін Використовують спосіб, описаний вище у Прикладі 1a), за винятком того, що 1-етиніл-4фторбензол використовують замість 4-етинілтолуолу. 3-[(4-фторфеніл)етиніл]-5-нітропіридин-2-амін: 1 H-ЯМР (CDCl3/CD3OD): 8,78 (d, J=2,3 Гц, 1H); 8,24 (d, J=2,3 Гц, 1H); 7,43 (m, 2H); 6,97 (m, 2H), 2,05 (s, 3H). 1-етил-2-(4-фторфеніл)-5-нітро-1H-піроло[2,3-b]піридин 1 H-ЯМР (CDCl3): 9,30 (d, J=2,5 Гц, 1H); 8,80 (d, J=2,5 Гц, 1H); 7,60 (m, 2H); 7,30 (m, 2H); 6,70 (s, 1H); 4,48 (q, J=7,6 Гц, 2H); 1,39 (t, J=7,6 Гц, 3H) 1-етил-2-(4-фторфеніл)-1H-піроло[2,3-b]піридин-5-амін: 8 UA 100867 C2 1 5 10 15 20 25 30 35 40 45 50 55 60 H-ЯМР (CDCl3): 7,90 (d, J=2,4 Гц, 1H); 7,42 (m, 2H); 7,25-7,05 (m, 3H), 6,21 (s, 1H); 4,24 (q, J=7,2 Гц, 2H); 3,50 (bs, 2H); 1,22 (t, J=7,2 Гц, 3H). e) 2-(4-фторфеніл)-1-(2-метоксиетил)-1H-піроло[2,3-b]піридин-5-амін Використовують спосіб, описаний вище у Прикладі 1a), за винятком того, що 1-етиніл-4фторбензол та 2-метоксиетилбромід використовують замість 4-етинілтолуолу та йодетану, відповідно. 2-(4-фторфеніл)-1-(2-метоксиетил)-5-нітро-1H-піроло[2,3-b]піридин: 1 H-ЯМР (CDCl3): 9,23 (d, J=2,6 Гц, 1H); 8,74 (d, J=2,6 Гц, 1H); 7,90-7,20 (2m, 5 H); 6,64 (s, 1H); 4,51 (t, J=5,6 Гц, 2H); 3,75 (t, J=5,6 Гц, 2H); 3,20 (s, 3H); 2-(4-фторфеніл)-1-(2-метоксиетил)-1H-піроло[2,3-b]піридин-5-амін: 1 H-ЯМР (CDCl3): 8,00 (d, J=2,2 Гц, 1H); 7,63 (m, 2H); 7,40-7,10 (m, 3H), 6,34 (s, 1H); 4,47 (t, J=5,8 Гц, 2H); 3,80 (t, J=5,8 Гц, 4H); 3,25 (s, 3H). f) етил 4-(5-аміно-2-феніл-1H-індол-1-іл)бутаноат До розчину 2-феніл-5-нітроіндолу (отриманого як описано у J. Org.Chem. (1966), 31 (1), 65-9) (1,5 г; 6,3 ммоль) у CH3CN (50 мл) додають K2CO3 (1,7 г; 12,6 ммоль). До суміші, отриманої таким чином, потім додають по краплях етил 4-бромбутаноат (3,3 г; 16 ммоль) та отриману суміш нагрівають до 120 °C при перемішуванні впродовж 18 годин. Після охолодження, суміш виливають у воду (500 мл) та сирий продукт фільтрують, сушать у вакуумі, що приводить до одержання етил 4-(5-нітро-2-феніл-1H-індол-1-іл)бутаноату, який використовують у наступній реакції без будь-якого додаткового очищення. 1 H-ЯМР (ДМСО-d6) 1,08 (t, J=7,16 Гц, 3 H); 1,80 (quin, J=7,23 Гц, 2 H); 2,15 (t, J=7,00 Гц, 2 H); 3,91 (q, J=7,02 Гц, 2 H); 4,34 (t, J=7,31 Гц, 2 H); 6,84 (s, 1 H); 7,47-7,62 (m, 5 H); 7,80 (d, J=9,06 Гц, 1 H); 8,08 (dd, J=9,21, 2,19 Гц, 1 H); 8,59 (d, J=2,34 Гц, 1 H). До суспензії 10 % Pd/C (67 мг, 0,06 ммоль) у 95 % етанолі (50 мл) розчин 4-(5-нітро-2-феніл1H-індол-1-іл)бутаноату (2,2 г; 6 ммоль) у 95 % етанолі (100 мл) додають (0,1 г; 0,1 ммоль) та суміш піддають гідрогенуванню у гідрогенаторі Пара (H 2, 30 псі) впродовж 4 годин. Залишок фільтрують у вакуумі через целіт для видалення каталізатору та розчинник випарюють, що приводить до одержання сирого етил 4-(5-аміно-2-феніл-1H-індол-1іл)бутаноату, який використовують без будь-якого додаткового очищення. 1 H ЯМР (ДМСО-d6) 1,09 (t, J=7,16 Гц, 3 H); 1,78 (quin, J=7,16 Гц, 2 H); 2,09 (t, J=7,16 Гц, 2 H); 3,92 (q, J=7,21 Гц, 2 H); 4,20 (t, J=7,31 Гц, 2 H); 6,44 (s, 1 H); 6,87 (dd, J=8,62, 2,19 Гц, 1 H); 7,14 (d, J=2,05 Гц, 1 H); 7,35-7,59 (m, 6 H); 8,08 (br. s., 2 H). g) етил 3-(5-аміно-2-феніл-1H-індол-1-іл)пропаноат Використовують спосіб, описаний вище у Прикладі 1f), за винятком того, що етил 3бромпропаноат використовують замість етил 4-бромбутаноату. етил 3-(5-нітро-2-феніл-1H-індол-1-іл)пропаноат: 1 H ЯМР (ДМСО-d6) 1,02 (t, J=7,02 Гц, 3 H); 2,61 (t, J=7,31 Гц, 2 H); 3,88 (q, J=7,02 Гц, 2 H); 4,57 (t, J=7,16 Гц, 2 H); 6,83 (s, 1 H); 7,46-7,65 (m, 5 H); 7,80 (d, J=9,06 Гц, 1 H); 8,08 (dd, J=9,06, 2,34 Гц, 1 H); 8,57 (d, J=2,34 Гц, 1 H). етил 3-(5-аміно-2-феніл-1H-індол-1-іл)пропаноат 1 H ЯМР (ДМСО-d6) 1,05 (t, J=7,16 Гц, 3 H); 2,54 (br. s., J=7,50, 7,50 Гц, 2 H); 3,90 (q, J=7,02 Гц, 2 H); 4,36 (t, J=7,31 Гц, 2 H); 4,55 (br. s., 2 H); 6,24 (s, 1 H); 6,57 (dd, J=8,62, 2,19 Гц, 1 H); 6,70 (d, J=2,05 Гц, 1 H); 7,21 (d, J=8,77 Гц, 1 H); 7,34-7,55 (m, 5 H). h) етил (5-аміно-2-феніл-1H-індол-1-іл)ацетат Використовують спосіб, описаний вище у Прикладі 1f), за винятком того, що етил 2бромацетат використовують замість етил 4-бромбутаноату. етил (5-нітро-2-феніл-1H-індол-1-іл)ацетат: 1 H ЯМР (ДМСО-d6) 1,11 (t, J=7,02 Гц, 3 H); 4,09 (q, J=7,02 Гц, 2 H); 5,15 (s, 2 H); 6,90 (d, J=0,58 Гц, 1 H); 7,46-7,60 (m, 5 H); 7,73 (d, J=9,35 Гц, 1 H); 8,08 (dd, J=9,06, 2,34 Гц, 1 H); 8,60 (d, J=2,34 Гц, 1 H). етил (5-аміно-2-феніл-1H-індол-1-іл)ацетат: 1 Η ЯМР (CDCl3) 1,23 (t, J=7,16 Гц, 3 H); 2,97 (br. s., 2 H); 4,20 (q, J=7,02 Гц, 2 H); 4,74 (s, 2 H); 6,45 (s, 1 H); 6,79 (dd, J=8,77, 2,05 Гц, 1 H); 7,06 (s, 1 H); 7,08 (d, J=5,85 Гц, 1 H); 7,34-7,52 (m, 5 H). i) 1-[2-(диметиламіно)етил]-2-феніл-1H-індол-5-амін Використовують спосіб, описаний вище у Прикладі 1f), за винятком того, що 2-хлор-N, Nдиметилетанаміну гідрохлорид використовують замість етил 4-бромбутаноату N, N-диметил-2-(5-нітро-2-феніл-1H-індол-1-іл)етанамін: 1 H ЯМР (ДМСО-d6) 1,98 (s, 6 H); 2,41 (t, J=6,87 Гц, 2 H); 4,36 (t, J=6,87 Гц, 2 H); 6,81 (s, 1 H); 7,45-7,65 (m, 5 H); 7,77 (d, J=9,06 Гц, 1 H); 8,07 (dd, J=9,06, 2,34 Гц, 1 H); 8,56 (d, J=2,34 Гц, 1 H). 9 UA 100867 C2 5 10 15 20 25 30 35 40 45 50 55 1-[2-(диметиламіно)етил]-2-феніл-1H-індол-5-амін: 1 H ЯМР (ДМСО-d6) 2,00 (s, 6 H); 2,38 (t, J=7,31 Гц, 2 H); 4,13 (t, J=7,31 Гц, 2 H); 4,52 (br. s., 2 H); 6,23 (s, 1 H); 6,57 (dd, J=8,62, 2,19 Гц, 1 H); 6,69 (d, J=1,75 Гц, 1 H); 7,19 (d, J=8,48 Гц, 1 H); 7,35-7,58 (m, 5 H). l) 1-(2-метоксиетил)-2-феніл-1H-індол-5-амін Використовують спосіб, описаний вище у Прикладі 1f), за винятком того, що 1-бром-2метоксиетан використовують замість етил 4-бромбутаноату 1-(2-метоксиетил)-5-нітро-2-феніл-1H-індол 1 H ЯМР (ДМСО-d6) 3,04 (s, 3 H); 3,53 (t, J=5,41 Гц, 2 H); 4,44 (t, J=5,41 Гц, 2 H); 6,83 (s, 1 H); 7,46-7,66 (m, 5 H); 7,79 (d, J=9,06 Гц, 1 H); 8,06 (dd, J=9,06, 2,34 Гц, 1 H); 8,57 (d, J=2,34 Гц, 1 H). 1-(2-метоксиетил)-2-феніл-1H-індол-5-амін l) 4-(5-аміно-2-феніл-1H-індол-1-іл)бутан-2-он Використовують спосіб, описаний вище у Прикладі 1f), за винятком того, що 4-хлорбутан-2он використовують замість етил 4-бромбутаноату 4-(5-нітро-2-феніл-1H-індол-1-іл)бутан-2-он: 1 H ЯМР (ДМСО-d6) 2,00 (s, 3 H); 2,85 (t, J=7,50 Гц, 2 H); 4,45 (t, J=7,50 Гц, 2 H); 6,83 (d, J=0,58 Гц, 1 H); 7,47-7,62 (m, 5 H); 7,79 (d, J=9,35 Гц, 1 H); 8,07 (dd, J=9,06, 2,34 Гц, 1 H); 8,58 (d, J=2,34 Гц, 1 H). 4-(5-аміно-2-феніл-1H-індол-1-іл)бутан-2-он: 1 H ЯМР (ДМСО-d6) 1,98 (s, 3 H); 2,77 (t, J=7,68 Гц, 2 H); 4,25 (t, J=7,68 Гц, 2 H); 4,52 (br. s., 2 H); 6,24 (s, 1 H); 6,57 (dd, J=8,64, 2,06 Гц, 1 H); 6,69 (d, J=1,92 Гц, 1 H); 7,20 (d, J=8,51 Гц, 1 H); 7,32-7,63 (m, 5 H). m) 2-(4-фторфеніл)-1-(2-метоксиетил)-1H-індол-5-амін До розчину 5-нітроіндолу (3,5 г; 21,6 ммоль) у ДМФА (100 мл) додають Cs 2CO3 (13,9 г; 42,6 ммоль). Суміш, отриману таким способом, перемішують впродовж 1 години при кімнатній температурі, потім по краплях додають 1-бром-2-метоксиетан (5,9 г; 42,6 ммоль). Отриману суміш нагрівають до 120 °C при перемішуванні впродовж 4 годин. Після охолодження, суміш виливають у воду (500 мл) та сирий продукт фільтрують, сушать у вакуумі, що приводить до одержання 1-(2-метоксиетил)-5-нітро-1H-індолу, який використовують у наступній реакції без будь-якого додаткового очищення. 1 H ЯМР (ДМСО-d6) 3,21 (s, 3 H); 3,68 (t, J=5,26 Гц, 2 H); 4,43 (t, J=5,26 Гц, 2 H); 6,75 (dd, J=3,22, 0,58 Гц, 1 H); 7,62 (d, J=3,22 Гц, 1 H); 7,70 (d, J=9,35 Гц, 1 H); 8,02 (dd, J=9,06, 2,34 Гц, 1 H); 8,56 (d, J=2,34 Гц, 1 H). До суспензії, що містить ацетат цезію, висушеного у вакуумі впродовж ночі при 140 °C (7,3 г; 38 ммоль), у Ν,Ν-диметилацетаміді (DMA, 10 мл), у інертній атмосфері, додають ацетат паладію (0,22 г; 0,98 ммоль), трифенілфосфін (1 г; 3,8 ммоль), 1-(2-метоксиетил)-5-нітро-1H-індол (4,2 г; 19,1 ммоль) та 1-йод-4-фторбензол (4,7 г; 21 ммоль). Реакційну суміш залишають при перемішуванні при 140 °C у інертній атмосфері впродовж 18 годин. Потім суміш охолоджують до кімнатної температури, додають дихлорметан (100 мл) та отриману таким чином суміш фільтрують у вакуумі через целіт. Органічний розчин переносять у ділильну лійку, промивають за допомогою H 2O (2 × 100 мл) та сушать над Na2SO4. Органічний розчинник видаляють випарюванням при зниженому тиску та залишок очищують шляхом флеш хроматографії на силікагелі (н-гексан/EtOAc, н-гексан100→60 %), що приводить до одержання 2-(4-фторфеніл)-1-(2-метоксиетил)-5-нітро-1H-індолу (0,9 г), який використовують без будь-якого додаткового очищення. 1 H ЯМР (ДМСО-d6) 3,05 (s, 3 H); 3,53 (t, J=5,33 Гц, 2 H); 4,41 (t, J=5,41 Гц, 2 H); 6,83 (s, 1 H); 7,32-7,44 (m, 2 H); 7,62-7,73 (m, 2 H); 7,79 (d, J=9,21 Гц, 1 H); 8,06 (dd, J=9,06, 2,34 Гц, 1 H); 8,57 (d, J=2,34 Гц, 1 H). До суспензії, що містить 2-(4-фторфеніл)-1-(2-метоксиетил)-5-нітро-1H-індол (0,9 г; 2,9 ммоль) у абсолютному етанолі (100 мл), додають дигідрат дихлориду олова (3,3 г; 14,6 ммоль). Реакційну суміш залишають при перемішуванні при 75 °C впродовж 48 годин. Потім суміш охолоджують до кімнатної температури, розчинник частково випарюють при зниженому тиску та виливають у воду (100 мл) та лід. NaHCO3 (насичений розчин) додають до pH 8 та цю суміш залишають при перемішуванні впродовж 20 хвилин. Цей розчин переносять у ділильну лійку, та екстрагують етилацетатом (2 × 50 мл). Органічні фази об'єднують, та отриману органічну фазу промивають за допомогою H2O (2 × 100 мл) та сушать над Na2SO4. Органічний розчинник видаляють випарюванням при зниженому тиску та залишок очищують шляхом флеш хроматографії на силікагелі (н-гексан/EtOAc, н-гексан100→60 %), що приводить 10 UA 100867 C2 5 10 15 20 25 30 35 40 45 50 55 60 до одержання 2-(4-фторфеніл)-1-(2-метоксиетил)-1H-індол-5-аміну (0,7 г), який використовують без будь-якого додаткового очищення. 1 H ЯМР (ДМСО-d6) 3,07 (s, 3 H); 3,51 (t, J=5,70 Гц, 2 H); 4,18 (t, J=5,85 Гц, 2 H); 4,53 (br. s., 2 H); 6,22 (s, 1 H); 6,56 (dd, J=8,62, 2,19 Гц, 1 H); 6,69 (d, J=1,46 Гц, 1 H); 7,22 (d, J=8,77 Гц, 1 H); 7,30 (t, J=8,92 Гц, 2 H); 7,59 (dd, J=9,06, 5,55 Гц, 2 H). n) 3-(5-аміно-2-феніл-1H-індол-1-іл)пропіл-ацетат До розчину, що містить етил 3-(5-нітро-2-феніл-1H-індол-1-іл)пропаноат (отриманий як описано у прикладі 1g) (2,1 г; 6,2 ммоль) у ТГФ (20 мл) додають боргідрид натрію (0,98 г, 24,8 ммоль) та EtOH абсолютний (25 мл); реакційну суміш залишають при кімнатній температурі перемішуватись протягом 18 годин. Потім додають воду (5 мл) та HCl 2N до pH 6. Цей розчин переносять у ділильну лійку, та екстрагують етилацетатом (2 × 50 мл). Органічні фази об'єднують, та сушать над Na2SO4. Розчинник видаляють випарюванням при зниженому тиску та залишок очищують шляхом флеш хроматографії на силікагелі (н-гексан/EtOAc, н-гексан 100→70 %), що приводить до одержання 3-(5-нітро-2-феніл-1H-індол-1-іл)пропан-1-олу (1,5 г), який використовують без будь-якого додаткового очищення. 1 H ЯМР (CDCl3) 1,81-1,93 (m, J=6,58, 6,58, 6,43, 6,14 Гц, 2 H); 3,36 (t, J=5,70 Гц, 2 H); 3,50 (br. s., 1 H); 4,38 (t, J=7,02 Гц, 2 H); 6,69 (s, 1 H); 7,28-7,61 (m, 6 H); 8,06 (dd, J=9,06, 2,34 Гц, 1 H); 8,55 (d, J=2,05 Гц, 1 H). До розчину, що містить етил 3-(5-нітро-2-феніл-1H-індол-1-іл)пропан-1-ол (2,2 г; 7,4 ммоль) та триетиламін (1,24 мл; 8,9 ммоль) у CH2Cl2 (20 мл), по краплях додають ацетилхлорид (0,6 мл; 8,9 ммоль); реакційну суміш залишають при кімнатній температурі перемішуватись протягом 2 години. Потім додають воду (20 мл) та NaHCO 3 (насичений розчин) до pH 7. Двофазний розчин переносять у ділильну лійку, екстрагують за допомогою CH2Cl2 (2 × 50 мл). Органічні фази об'єднують, промивають сольовим розчином (2 × 100 мл) та сушать над Na 2SO4. Розчинник видаляють випарюванням при зниженому тиску, що приводить до одержання 3-(5-нітро-2феніл-1H-індол-1-іл)пропіл-ацетату (1,5 г), який використовують без будь-якого додаткового очищення. 1 H ЯМР (ДМСО-d6) 1,79 (s, 3 H); 1,86 (qd, J=6,63, 6,43 Гц, 2 H); 3,75 (t, J=5,99 Гц, 2 H); 4,41 (t, J=7,16 Гц, 2 H); 6,85 (s, 1 H); 7,47-7,64 (m, 5 H); 7,79 (d, J=9,06 Гц, 1 H); 8,08 (dd, J=9,06, 2,34 Гц, 1 H); 8,59 (d, J=2,05 Гц, 1 H). До суспензії 10 % Pd/C (87 мг, 0,08 ммоль) у 95° етанолі (100 мл) додають розчин 3-(5-нітро2-феніл-1H-індол-1-іл)пропіл-ацетату (2,76 г; 8 ммоль) у 95° етанолі (200 мл) та суміш піддають гідрогенуванню у гідрогенаторі Пара (H2, 30 псі) впродовж 4 годин. Залишок фільтрують у вакуумі через Целіт для видалення каталізатору та розчинник випарюють, що приводить до одержання сирого 3-(5-аміно-2-феніл-1H-індол-1-іл)пропілацетату, який використовують без будь-якого додаткового очищення. o) 2-(5-аміно-2-феніл-1H-індол-1-іл)етилацетат Використовують спосіб, описаний вище у Прикладі 1n), за винятком того, що етил (5-нітро-2феніл-1H-індол-1-іл)ацетат (отриманий як описано у прикладі 1h) використовують замість 3-(5нітро-2-феніл-1H-індол-1-іл)пропаноату. 2-(5-нітро-2-феніл-1H-індол-1-іл)етанол: 1 H ЯМР (ДМСО-d6) 3,63 (t, J=5,85 Гц, 2 H); 4,32 (t, J=5,85 Гц, 2 H); 6,46 (br. s., 1 H); 6,83 (s, 1 H); 7,43-7,71 (m, 5 H); 7,77 (d, J=9,06 Гц, 1 H); 8,06 (dd, J=9,06, 2,34 Гц, 1 H); 8,57 (d, J=2,34 Гц, 1 H). етил 2-(5-нітро-2-феніл-1H-індол-1-іл)ацетат: 1 H ЯМР (ДМСО-d6) 1,70 (s, 3 H); 4,16 (t, J=5,26 Гц, 2 H); 4,57 (t, J=5,26 Гц, 2 H); 6,83 (s, 1 H); 7,35-7,70 (m, 5 H); 7,81 (d, J=9,35 Гц, 1 H); 8,09 (dd, J=9,35, 2,34 Гц, 1 H); 8,58 (d, J=2,34 Гц, 1 H). p) 2-циклогексил-1-етил-1H-індол-5-амін До розчину, що містить 2-йод-4-нітроанілін (25 г; 95 ммоль) та триетиламін (43 мл; 312 ммоль) у CH2Cl2 (250 мл), по краплях додають розчин, що містить метансульфоніл-хлорид (36 г; 312 ммоль). Реакційну суміш залишають при кімнатній температурі перемішуватись протягом 18 години, потім додають NH4Cl (насичений розчин) (250 мл). Двофазний розчин переносять у ділильну лійку, органічну фазу відділяють, сушать над Na 2SO4 та розчинник видаляють випарюванням при зниженому тиску. Залишок суспендують у EtOH (200 мл) та нагрівають при перемішуванні до осадження жовтої твердої речовини. Сирий продукт фільтрують, промивають за допомогою EtOH (750 мл), та сушать у вакуумі, що приводить до одержання N-(2-йод-4нітрофеніл)-N-(метилсульфоніл)метансульфонаміду (32 г), який використовують у наступній реакції без будь-якого додаткового очищення. 1 H ЯМР (ДМСО-d6) 3,68 (s, 6 H); 7,93 (d, J=8,77 Гц, 1 H); 8,29 (dd, J=8,48, 2,34 Гц, 1 H); 8,73 (d, J=2,63 Гц, 1 H). 11 UA 100867 C2 5 10 15 20 25 30 35 40 45 50 55 60 До суміші, що містить N-(2-йод-4-нітрофеніл)-N-(метилсульфоніл)-метансульфонамід (31 г; 75 ммоль) у EtOH (230 мл), додають воду (115 мл) та LiOH (9 г; 375 ммоль). Реакційну суміш нагрівають при зрошенні впродовж 2 годин, потім охолоджують до кімнатної температури, розчинник випарюють при зниженому тиску. Додають NH 4Cl (насичений розчин, 250 мл) та суміш перемішують до осадження жовтої твердої речовини. Сирий продукт фільтрують та сушать у вакуумі, що приводить до одержання N-(2-йод-4-нітрофеніл)метансульфонаміду (24 г), який використовують у наступній реакції без будь-якого додаткового очищення. 1 H ЯМР (ДМСО-d6) 3,01 (s, 3 H); 7,41 (d, J=9,06 Гц, 1 H); 8,10 (dd, J=9,21, 2,78 Гц, 1 H); 8,53 (d, J=2,92 Гц, 1 H); 9,55 (br. s., 0 H). До суміші, що містить N-(2-йод-4-нітрофеніл)метансульфонамід (13,5 г; 39,5 ммоль), триетиламін (17,9 мл; 129 ммоль), етинілциклогексан (8,55 г; 79 ммоль) у ДМФА (60 мл), додають CuI (1,5 г; 7,9 ммоль) та дихлорбіс(трифенілфосфін)паладій(ІІ) [Cl 2(PPh3)2Pd] (2,77 г; 3,95 ммоль). Реакційну суміш залишають при перемішуванні при 70 °C впродовж 18 годин. Після охолодження до кімнатної температури, додають EtOAc (100 мл), неорганічний осад відфільтровують та цей розчин переносять у ділильну лійку та промивають за допомогою NaHCO3 (насичений розчин, 3 × 200 мл) та води (2 × 150 мл). Органічну фазу сушать над Na2SO4, розчинник видаляють випарюванням при зниженому тиску. Сирий продукт, отриманий таким чином, кристалізують (ізопропіловій ефір), що приводить до одержання 2-циклогексил-1(метилсульфоніл)-5-нітро-1H-індолу (11,7 г). 1 H ЯМР (ДМСО-d6) 1,14-1,53 (m, 5 H); 1,62-1,93 (m, 3 H); 2,02-2,20 (m, 2 H); 3,08-3,27 (m, 1 H); 3,46 (s, 3 H); 6,87 (s, 1 H); 8,09 (d, J=9,10 Гц, 1 H); 8,17 (dd, J=9,10, 2,05 Гц, 1 H); 8,52 (d, J=2,05 Гц, 1 H). До розчину, що містить 2-циклогексил-1-(метилсульфоніл)-5-нітро-1H-індол (5,8 г; 18 ммоль) у ТГФ (50 мл), по краплях додають тетрабутиламонію фторид (1M розчин у THF; 18 мл; 18 ммоль). Реакційну суміш нагрівають при зрошенні впродовж 18 годин, потім охолоджують до кімнатної температури. Додають воду (50 мл) та EtOAc (50 мл), двофазний розчин переносять у ділильну лійку, органічний шар відділяють та сушать над Na 2SO4, та розчинник видаляють випарюванням при зниженому тиску. Залишок очищують шляхом флеш хроматографії на силікагелі (н-гексан/EtOAc, н-гексан100→80 %), що приводить до одержання 2-циклогексил-5нітро-1H-індолу (3,2 г), який використовують без будь-якого додаткового очищення. 1 H ЯМР (ДМСО-d6) 1,12-1,58 (m, 5 H); 1,64-1,87 (m, 3 H); 1,95-2,12 (m, 2 H); 2,67-2,85 (m, 1 H); 6,41 (d, J=1,98 Гц, 1 H); 7,43 (d, J=8,92 Гц, 1 H); 7,92 (dd, J=8,92, 2,31 Гц, 1 H); 8,43 (d, J=2,31 Гц, 1 H); 11,66 (br.s., 1 H). До розчину 2-циклогексил-5-нітро-1H-індолу (5 г; 20,5 ммоль) у ДМФА (100 мл) додають гідрид натрію (50 % суспензія) (1 г, 20,5 ммоль); суміш залишають при перемішуванні впродовж 30 хвилин, потім по краплях додають етил-йодид (2,5 мл; 30,8 ммоль) у ДМФА (10 мл) та отриману суміш залишають при кімнатній температурі перемішуватись протягом 18 годин. Реакційну суміш виливають у NaHCO3 (насичений розчин, 100 мл) та перемішують впродовж 30 хвилин. Тверду речовину фільтрують у вакуумі, що приводить до одержання 2-циклогексил-1етил-5-нітро-1H-індолу (4,8 г), який використовують без будь-якого додаткового очищення. 1 H ЯМР (ДМСО-d6) 1,16-1,56 (m, 5 H); 1,29 (t, J=7,09 Гц, 3 H); 1,67-1,89 (m, 3 H); 1,90-2,05 (m, 2 H); 2,69-2,86 (m, 1 H); 4,28 (q, J=7,16 Гц, 2 H); 6,52 (s, 1 H); 7,62 (d, J=9,06 Гц, 1 H); 7,96 (dd, J=9,06, 2,34 Гц, 1 H); 8,45 (d, J=2,34 Гц, 1 H). До суспензії 10 % Pd/C (380 мг, 0,36 ммоль) у 95° етанолі (50 мл) додають розчин 2циклогексил-1-етил-5-нітро-1H-індолу (4,8 г; 18 ммоль) у 95° етанолі (100 мл) та суміш піддають гідрогенуванню у гідрогенаторі Пара (H2, 30 псі) впродовж 4 годин. Залишок фільтрують у вакуумі через целіт для видалення каталізатору та розчинник випарюють, що приводить до одержання сирого 2-циклогексил-1-етил-1H-індол-5-аміну (4 г), який використовують без будьякого додаткового очищення. + Моноізотопна маса = 242,18; GC/MS (M) m/z=242. q) 2-фенетил-1-етил-1H-індол-5-амін До розчину 2-йод-4-нітроаніліну (1,02 г, 3,86 ммоль) у дихлорметані (10 мл), при перемішуванні додають триетиламін (1,77 мл, 12,7 ммоль). До цієї суміші краплинами, дуже повільно та у льодяній бані додають розчин метансульфонілхлориду (0,98 мл, 12,7 ммоль) у дихлорметані (2 мл). Суміш, отриману таким чином, залишають при кімнатній температурі перемішуватись протягом ночі. Через день реакційну суміш нейтралізують насиченим водним розчином NH4Cl. Органічну фазу відділяють, та, після упарювання розчиннику, залишок промивають етанолом та фільтрують, що приводить до одержання N-(2-йод-4-нітрофеніл)-N(метилсульфоніл)-метансульфонаміду у вигляді жовтої твердої речовини. N-(2-йод-4-нітрофеніл)-N-(метилсульфоніл)метансульфонамід: 12 UA 100867 C2 1 5 10 15 20 25 30 35 40 45 50 55 60 H-ЯМР (ДМСО-d6): 8,73 (d, J=2,6 Гц, 1H); 8,29 (dd, J=8,8, 2,6 Гц, 1H); 7,93 (d, J=8,8 Гц, 1H); 3,68 (s, 6H). LiOH (0,21 мг, 8,9 ммоль) у суміші етанол/вода 2/1 (18 мл) додають до розчину N-(2-йод-4нітрофеніл)-N-(метилсульфоніл)метансульфонаміду (0,75 г, 1,78 ммоль). Реакційну суміш нагрівають при зрошенні впродовж двох годин. Після охолодження при кімнатній температурі, реакційну суміш нейтралізують за допомогою H 2O, NH4Cl та HCl 2N, потім видаляють етанол, та водну фазу екстрагують етилацетатом (3 × 20 мл). Органічний розчинник видаляють шляхом упарювання при зниженому тиску, що приводить до одержання N-(2-йод-4нітрофеніл)метансульфонаміду без додаткового очищення. N-(2-йод-4-нітрофеніл)метансульфонамід: 1 H-ЯМР (ДМСО-d6): 9,53 (br. s., 1H); 8,59 (d, J=2,2 Гц, 1H); 8,19 (dd, J=8,8, 2,7, 1H); 7,55 (d, J=8,8, 1H); 3,14 (s, 3H). CuI (0,06 г, 0,34 ммоль), який попередньо витримали в печі протягом принаймні 48 годин, біс(трифенілфосфіно)паладій дихлорид (0,2 г, 0,17 ммоль), триетиламін (1,1 мл, 7,82 ммоль) та 4-феніл-1-бутин (0,44 г, 3,4 ммоль) додають до розчину N-(2-йод-4нітрофеніл)метансульфонаміду (0,6 г, 1,7 ммоль) у безводному ДМФА (20 мл), який утримували в атмосфері азоту. Реакційну суміш залишають при перемішуванні протягом ночі. Наступного ранку, після охолодження, реакційну суміш виливають в H 2O та лід (200 мл), залишаючи при перемішуванні впродовж декількох годин. Після фільтрування, виділяють коричневу тверду речовину, перекристалізовують з суміші етилацетат/гексан 1:1, а потім з суміші iPrOH/EtOH 9:1. Осад фільтрують, що приводить до одержання 1-(метилсульфоніл)-5-нітро-2-(2-фенетил)-1Hіндолу. 1-(метилсульфоніл)-5-нітро-2-(2-фенетил)-1H-індол: 1 H-ЯМР (ДМСО-d6): 8,53 (d, J=2,0 Гц, 1H); 8,18 (dd, J=8,4, 2,5, 1H); 8,10 (d, 1H); 7,29 (m, 5H); 6,91 (s, 1H); 3,52 (s, 3H); 3,29 (m, 2H); 3,05 (m, 2H). Тетрабутиламонійфторид (TBAF, 0,37 мл, 1,29 ммоль) додають до розчину 1(метилсульфоніл)-5-нітро-2-(2-фенетил)-1H-індолу (0,25 г, 0,95 ммоль) в ТГФ (5 мл). Реакційну суміш нагрівають при зрошенні протягом ночі при перемішуванні. Наступного ранку, після охолодження, реакційну суміш виливають в H2O, залишаючи при перемішуванні впродовж ночі. Після фільтрування, тверду речовину очищають за допомогою флеш-хроматографії на силікагелі (н-гексан/EtOAc, н-гексан 90 → 80 %), що приводить до одержання 2-фенетил-5нітро-1H-індолу. 2-фенетил-5-нітро-1H-індол: 1 H ЯМР (300 MГц, ДМСО-d6) δ 11,76 (br. s., 1H), 8,42 (d, J=2,31 Гц, 1H), 7,93 (dd, J=2,31, 8,92 Гц, 1H), 7,45 (d, J=8,92 Гц, 1H), 7,11-7,34 (m, 5H), 6,45 (s, 1 H), 2,97-3,15 (m, 4H) 60 % дисперсію NaH (0,5 г, 2,02 ммоль) додають до розчину 2-фенетил-5-нітро-1H-індолу (0,16 г, 0,6 ммоль) в ДМФА (30 мл). Реакційну суміш витримували при перемішуванні протягом 30 хвилин. Потім додають етилйодид (0,15 мл, 1,9 ммоль), та суміш залишають при перемішуванні протягом ночі при кімнатній температурі. Наступного ранку суміш виливають в H2O та залишають при перемішуванні протягом ночі, отримуючи осад, який відфільтровують, що приводить до одержання 2-фенетил-1-етил-5-нітро-1H-індолу. 2-фенетил-1-етил-5-нітро-1H-індол: 1 H ЯМР (300 MГц, ДМСО-d6) δ 8,46 (d, J=2,05 Гц, 1 H), 7,97 (dd, J=2,34, 9,06 Гц, 1H), 7,62 (d, J=9,06 Гц, 1H), 7,13-7,40 (m, 5H), 6,58 (s, 1H), 4,26 (q, J=7,31 Гц, 2H), 2,99-3,18 (m, 4H), 1,25 (t, J=7,20 Гц, 3H) SnCl2 (1,2 г, 6,3 ммоль) додають до розчину 2-фенетил-1-етил-5-нітро-1H-індолу (0,17 г, 0,57 ммоль) в ТГФ (50 мл). Суміш утримують при перемішуванні при 70 °C протягом ночі. Після охолодження, суміш виливають в H2O, нейтралізують за допомогою NaHCO3, та екстрагують етилацетатом (3 × 50 мл). Після упарювання розчиннику при зниженому тиску, тверду речовину очищають на хроматографічній колонці застосовуючи CHCl3 як елюєнт, що приводить до одержання 2-фенетил-1-етил-1H-індол-5-аміну. 2-фенетил-1-етил -1H-індол-5-амін: 1 H ЯМР (300 MГц, ДМСО-d6) δ 7,25-7,37 (m, 4H), 7,15-7,25 (m, 1H), 7,11 (d, J=8,48 Гц, 1H), 6,72 (d, J=2,05 Гц, 1H), 6,53 (dd, J=2,19, 8,62 Гц, 1H), 6,02 (s, 1H), 5,46 (br. s., 2H), 4,05 (q, J=7,11 Гц, 2H), 2,81-3,15 (m, 4H), 1,18 (t, J=7,16 Гц, 3H) r) 2-бензил-1-етил-1H-індол-5-амін Проміжна сполука r) була одержана з використанням способу, подібного до описаного для проміжної сполуки q), застосовуючи 3-феніл-1-пропін (0,16 г, 1,4 ммоль) замість 4-феніл-1бутину. 2-бензил-1-(метансульфоніл)-5-нітро-1H-індол: 13 UA 100867 C2 1 5 10 15 20 25 30 35 40 45 50 55 H-ЯМР (ДМСО-d6): 8,54 (d, J=2,3 Гц, 1H); 8,17 (m, 1H); 8,08 (m, 1H); 7,35 (m, 5H); 6,53 (s, 1H); 4,37 (s, 2H); 3,37 (s, 3H). 2-бензил-5-нітро-1H-індол: 1 H-ЯМР (ДМСО-d6): 11,74 (bs, 1H); 8,44 (d, J=2,3 Гц, 2H); 7,92 (dd, J=8,9, 2,3 Гц, 1H); 7,44 (d, J=8,9, 1H); 7,32 (m, 4H); 7,24 (m, 1H); 6,44 (s, 1H); 4,12 (s, 2H). 2-бензил-1-етил-5-нітро-1H-індол: 1 H-ЯМР (ДМСО-d6): 8,48 (d, J=2,3 Гц, 1H); 7,98 (dd, J=9,1, 2,3 Гц, 1H); 7,60 (d, J=9,1 Гц, 1H); 7,30 (m, 5H); 6,43 (s, 1H); 4,22 (m, 4H); 1,09 (t, J=7,2 Гц, 3H). 2-бензил-1-етил-1H-індол-5-амін: 1 H-ЯМР (ДМСО-d6): 7,22 (m, 5H); 7,04 (d, J=8,5 Гц, 1H); 6,84 (d, J=2,3 Гц, 1H); 6,59 (dd, J=8,5, 2,3 Гц, 1H); 6,05 (s, 1H); 4,05 (s, 2H); 3,94 (q, J=7,2 Гц, 2H); 3,22 (bs, 2H); 1,10 (t, J=7,2 Гц, 3H). s) феніламід 5-аміно-1-(3-триізопропілсиланілоксипропіл)-1H-індол-2-карбонової кислоти N2H4*H2O (25 мл) додають по краплях до розчину 1-фтор-4-нітробензолу. Суміш утримують при перемішуванні, спочатку при кімнатній температурі на3 години, а потім при зрошенні впродовж 1 години. Після охолодження, одержаний осад фільтрують та промивають H 2O, що приводить до одержання 4-нітрофенілгідразину, який застосовували в наступній реакції без будь-якого додаткового очищення. + + 4-нітрофенілгідразин: M/z (APCl ) 154 (MH ) Суспензію в воді (150 мл) 4-нітрофенілгідразину (15 г, 23 ммоль) та етилового складного ефіру 2-оксо-пропіонової кислоти (12 г, 100 ммоль) залишають при перемішуванні, при кімнатній температурі на 6 годин. Одержаний осад відфільтрують та промивають, що привело до одержання етилового складного ефіру 2-[(4-нітрофеніл)-гідразино]-пропіонової кислоти. 1 H-ЯМР (ДМСО-d6): 10,45 (s, 1H); 8,21-8,15 (m, 2H); 7,42-7,36 (m, 2H); 4,28-4,15 (m, 2H); 2,15 (s, 3H); 1,36-1,22 (m, 3H). Поліфосфорну кислоту (PPA, 50 г) додають до розчину етилового складного ефіру 2-[(4нітрофеніл)-гідразино]-пропіонової кислоти (6 г, 23 ммоль) в толуолі (70 мл). Суміш кип'ятять зі зрошенням впродовж 3 годин, потім охолоджують до 0-10 °C, та додають NH4Cl до pH 8-9. Суміш екстрагують етилацетатом (EtOAc), а потім розчинник видаляють випарюванням при зниженому тиску. Залишок очищують шляхом флеш-хроматографії на силікагелі (нгексан/EtOAc, 80/20) та кристалізують з CH2Cl2, що приводить до одержання етилового складного ефіру 5-нітро-1H-індол-2-карбонової кислоти. Етиловий складний ефір 5-нітро-1H-індол-2-карбонової кислоти: 1 H-ЯМР (ДМСО-d6): 12,55 (s, 1H); 8,73 (s, 1H); 8,14 (d, 1H); 7,62 (d, 1 H); 7,45 (s, 1 H); 4,454,32 (m, 2H); 1,43-1,30 (m, 3H). Безводний K2CO3 (2,36 г, 17,1 ммоль), 18-краун-6 (1,14 г, 4,28 ммоль) та 3триізопропілсиланілоксипропілбромід (3,78 г, 12,82 ммоль) додають до розчину етилового складного ефіру 5-нітро-1H-індол-2-карбонової кислоти (2 г, 8,85 ммоль) у безводному ацетонітрилі (50 мл). Суміш нагрівають при 80 °C впродовж 4 годин. Після упарювання розчиннику при зниженому тиску, додають воду, і отриману суміш екстрагують за допомогою дихлорметану. Після упарювання розчиннику при зниженому тиску, тверду речовину очищають шляхом флеш-хроматографії на силікагелі (н-гексан/EtOAc, 50/10), що приводить до одержання етилового складного ефіру 5-нітро-1-(триізопропілсиланіл-оксипропіл)-1H-індол-2-карбонової + + кислоти: M/z (APCl ) 449 (MH ) Етиловий складний ефір 5-нітро-1-(триізопропілсиланілоксипропіл)-1H-індол-2-карбонової кислоти (2,76 г, 6,2 ммоль) розчиняють в розчині KOH 5 % в EtOH/H2O 1/1 (80 мл) та залишають при кімнатній температурі перемішуватись протягом 16 годин. Потім етанол упарюють і додають 1N HCl до розчину поки pH не досягне 5. Потім розчин екстрагують за допомогою EtOAc. Після упарювання розчиннику при зниженому тиску, тверду речовину промивають за допомогою нгексану/дихлорметану 10/1 та фільтрують, що приводить до одержання 5-нітро-1(триізопропілсиланілоксипропіл)-lH-індол-2-карбонової кислоти. 5-нітро-1-(триізопропілсиланілоксипропіл)-lH-індол-2-карбонова кислота: + + M/z (APCI ) 421 (MH ) Суміш 5-нітро-1-(триізопропілсиланілоксипропіл)-1H-індол-2-карбонової кислоти (0,448 г, 1,065 ммоль), O-бензотріазол-1-іл-N, N,N',N'-тетраметилуроній-тетрафторборату (TBTU) (0,478 г, 1,49 ммоль) та триетиламіну (0,22 мл, 1,59 ммоль) у безводному акрилонітрилі (14 мл) утримують при кімнатній температурі з перемішуванням протягом 30 хвилин. До цієї суміші додають анілін (0,109 г, 1,175 ммоль). Суміш залишають при 50°-55 °C на приблизно 3 години, а потім розбавляють за допомогою H2O та екстрагують етилацетатом (EtOAc). Після упарювання розчиннику при зниженому тиску, одержану тверду речовину очищають шляхом флеш 14 UA 100867 C2 5 10 хроматографії на силікагелі (н-гексан/EtOAc, 50/10), що приводить до одержання феніламіду 5нітро-1-(триізопропілсиланіл-оксипропіл)-lH-індол-2-карбонової кислоти: + + M/z (APCI ) 496 (MH ) Каталітичні кількості 10 % Pd/C додають до розчину феніламіду 5-нітро-1(триізопропілсиланілоксипропіл)-lH-індол-2-карбонової кислоти (0,323 г, 0,65 ммоль) в MeOH (100 мл), і суміш гідрують при 29 псі протягом 12 годин. Розчин фільтрують через целіт™ та фільтрат упарюють при зниженому тиску, що приводить до одержання твердої речовини, яку застосовують без будь-якого додаткового очищення. Феніламід 5-аміно-1-(триізопропілсиланілоксипропіл)-lH-індол-2-карбонової кислоти: M/z + + (APCI ) 466 (MH ). Приклад 2 Одержання сполук даного винаходу a) Приклад першого варіанту способу одержання: 15 20 До розчину 5-аміно(аза)індолу (III) (2 ммоль) в дихлорметані (10 мл) додають триетиламін (2,2 ммоль), з наступним додаванням, по краплях, ацилхлориду (II) (2,2 ммоль), розчиненого в дихлорметані (10 мл). Відразу після закінчення додавання, суміш залишають при кімнатній температурі перемішуватись протягом 20 годин. Потім додають воду (50 мл) та органічну фазу відділяють і сушать над Na2SO4. Розчин упарюють при зниженому тиску. Одержаний сирий продукт очищають, що приводить до одержання сполуки формули (I), у якій X, Y, Z, G 1, G2, G3, 1 2 R , W та R приймають значення, представлені вище. b) Приклад другого варіанту способу одержання: 25 30 35 До суспензії 5-аміно(аза)індолу (III) (0,9 ммоль) додають смолу Amberlyst A21 (0,9 г) в дихлорметані (3 мл) та ацилхлорид (II) (0,28 ммоль) в дихлорметані (3 мл). Суміш залишають при перемішуванні на 20 годин. Потім смолу Amberlyst A21 видаляють фільтруванням і промивають дихлорметаном (5 мл). Органічні фази об'єднують, розбавляють диметилформамідом (1 мл) і перемішують зі смолою Amberlyst 15 (0,9 г) на 5 годин. Цю обробку повторюють два рази. Смолу Amberlyst 15 видаляють фільтруванням і розчин упарюють при 1 центрифугуванні, що приводить до одержання сполуки формули (I), у якій X, Y, Z, G 1, G2, G3, R , 2 W та R приймають значення, представлені вище. c) Приклад третього варіанту способу одержання: 15 UA 100867 C2 5 10 15 20 В інертній атмосфері, бензойну кислоту (II) (0,67 ммоль) та 5-аміно(аза)індол (III) (0,45 ммоль) розчиняють в дихлорметані (8 мл) та диметилформаміді (0,8 мл). Після перемішування суміші при кімнатній температурі впродовж 10 хвилин, додають PS-карбодіімідову смолу (0,73 г). Після перемішування реакційної суміші впродовж 20 годин, смолу видаляють за допомогою фільтрування та промивають дихлорметаном (2 x 5 мл). Розчин упарюють при центрифугуванні, 1 2 що приводить до одержання сполуки формули (I), у якій X, Y, Z, G 1, G2, G3, R , W та R приймають значення, представлені вище. d) Приклад четвертого варіанту способу одержання: До розчину бензойної кислоти (II) (10 ммоль) в диметилформаміді (40 мл) з перемішуванням при 0 °C, додають 1-гідроксибензотріазол (HOBt) (10 ммоль) та дициклогексилкарбодіімід (DCC) (10 ммоль). Суміш залишають при перемішуванні при 0 °C на 30 хвилин та додають 5аміно(аза)індол (III) (9 ммоль), розчинений в диметилформаміді (20 мл). Суміш залишають з перемішуванням при 0 °C на додаткові 30 хвилин, а потім при кімнатній температурі на 18 годин. Суміш фільтрують, додають 2N соляну кислоту до pH 2, і одержаний таким чином осад відфільтровують та очищають, що приводить до одержання сполуки формули 1 2 (I), у якій X, Y, Z, G1, G2, G3, R , W та R приймають значення, представлені вище. e) Приклад п'ятого варіанту способу одержання: 25 30 35 До суспензії ацетату цезію, висушеної у вакуумі протягом ночі при 140 °C (6,02 ммоль) в Ν,Ν-диметилацетаміді (DMA) (3 мл) у інертній атмосфері, додають ацетат паладію (0,017 ммоль), трифенілфосфін (0,067 ммоль), 5-аміно(аза)індол (IV)' (3,35 ммоль) та арилйодид (V) (3,68 ммоль). Реакційну суміш залишають з перемішуванням при 140 °C у інертній атмосфері на 18 годин. Реакційну суміш охолоджують до кімнатної температури, додають дихлорметан (50 мл) і отриману суміш фільтрують у вакуумі через целіт. Відфільтрований органічний розчин переносять у ділильну лійку. Органічну фазу промивають за допомогою H 2O (2 × 50 мл), сушать над Na2SO4 та упарюють при зниженому тиску. 16 UA 100867 C2 5 Залишок очищують, що приводить до одержання сполуки формули (I), у якій X, Y, Z, G 1, G2, 1 2 G3, R , W та R приймають значення, представлені вище. f) Приклад одержання твердої фази з використанням смоли PL-FMP: Наступний приклад одержання твердої фази із застосуванням препаративної смоли представлений з конкретним посиланням на сполуки даного винаходу, де зазначені вище групи 1 I 2 I G1, G2, G3 являють собою CH, і R являє собою SO2R , а X, Y, Z, W, R та R приймають значення, представлені вище. Крім того, наступний приклад включає стадії 1 та 2 для приготування початкової сполуки B1 способу даного винаходу, оскільки проміжну сполуку A1 спочатку отримують in situ без відділення від препаративної смоли. 10 15 20 25 30 35 Стадія (1): 15 г PL-FMP смоли (0,9 ммоль/г) в розчині 1 % AcOH в ДМФА (300 мл) перемішують при кімнатній температурі впродовж 2 годин. Потім додають N-(4-аміно-2йодфеніл)алкілсульфонамід (54 ммоль) та 11,5 г натрію триацетоксиборгідриду (54 ммоль). PLFMP Смола (вироблена Polymer Laboratories, UK) являє собою смолу на основі альдегіду, прийнятну для прикріплення амінів шляхом відновного амінування. Цю суміш перемішують при кімнатній температурі впродовж 24 годин, потім цю смолу фільтрують та промивають за допомогою ДМФА (3 × 150 мл), ДМФА / MeOH в 1/1 об'ємному співвідношенні (3 × 150 мл), MeOH (3 × 150 мл), CH2Cl2 / MeOH в 1/1 об'ємному співвідношенні (3 × 100 мл), та CH2Cl2 (3 × 100 мл). Смолу сушать у вакуумі при кімнатній температурі, що приводить до одержання 18,3 г смоли (A1), яку використовують без будь-якого додаткового очищення. Стадія (2): 1,172 г смоли (A1) (0,8 ммоль, теоретично) додають до суміші ДМФА (10 мл), B2 алкіну (5 ммоль), CuI (32 мг, 0,17 ммоль), 58 мг дихлорбіс(трифенілфосфін)паладію (ІІ) [Cl2(PPh3)2Pd] (0,8 ммоль) та 2 мл триетиламіну (22 ммоль). Цю суміш нагрівають при 70 °C та перемішують впродовж 48 годин. Реакцію гасять охолодженням до кімнатної температури. Смолу фільтрують та промивають за допомогою ДМФА (3 × 10 мл), ДМФА / H2O в 95/5 об'ємному співвідношенні (3 × 10 мл), ДМФА / H2O в 90/10 об'ємному співвідношенні (3 × 10 мл), ДМФА / H 2O в 80/20 об'ємному співвідношенні (3 × 10 мл), ДМФА / H2O в 50/50 об'ємному співвідношенні (3 × 10 мл), ДМФА (3 × 10 мл), ДМФА / MeOH в 50/50 об'ємному співвідношенні (3 × 10 мл), MeOH (3 × 10 мл), MeOH / CH2Cl2 в 50/50 об'ємному співвідношенні (3 × 10 мл), та CH 2Cl2 (3 × 10 мл). Смолу B1, отриману таким чином, використовують без будь-якого додаткового очищення. Стадія (3): 1,38 мл Ν,Ν-діізопропілетиламіну (DIEA, 8,0 ммоль) та ацилхлориду (6,5 ммоль) (C2) додають до суспензії смоли (B1) в CH2Cl2 (10 мл). Суміш перемішують при кімнатній температурі впродовж 18 годин, потім смолу фільтрують та промивають за допомогою CH 2Cl2 (3 × 10 мл), CH2Cl2 / ДМФА в 1/1 об'ємному співвідношенні (3 × 10 мл), ДМФА (3 × 10 мл), ДМФА / 17 UA 100867 C2 5 10 15 20 H2O в 9/1 об'ємному співвідношенні (3 × 10 мл), ДМФА (3 × 10 мл), ДМФА / MeOH в 1/1 об'ємному співвідношенні (3 × 10 мл), MeOH (3 × 10 мл), CH 2Cl2/ MeOH в 1/1 об'ємному співвідношенні (3 × 10 мл), CH2Cl2 (3 × 10 мл). Смолу (C1), отриману таким чином, використовують без будь-якого додаткового очищення. Стадія (4): Смолу (C1) додають до розчину триетилсилану (0,15 мл) в TFA /DCM в 1/1 об'ємному співвідношенні (15 мл) та перемішують при кімнатній температурі впродовж 15 хвилин. Смолу фільтрують та промивають розчином триетилсилану (0,15 мл) в TFA/DCM в 1/1 об'ємному співвідношенні (5 мл). Цей розчин випарюють у вакуумі, що приводить до одержання сирого продукту, який очищують препаративною ВЕРХ, що приводить до одержання сполуки (I), 2 I у якій X, Y, Z, W, R та R приймають значення, представлені вище. g) Приклад відновлення подвійного зв'язку в положенні 2-3: 5-аміно(аза)індольну похідну (1 ммоль) розчиняють в розчині EtOH (3 мл) та HCl конц. (1,5 мл). Потім додають олово (5 ммоль) та суміш нагрівають при зрошенні впродовж 6 годин. Суміш фільтрують, розчин виливають в 20 % KOH розчин (5 мл), та екстрагують за допомогою Et 2O (3 × 10 мл). Органічну фазу фільтрують на Целіті та сушать над Na 2SO4. Цей розчин випарюють при зниженому тиску. Отриманий сирий продукт очищують, що приводить до одержання 1 2 сполуки формули (І`), у якій X, Y, Z, G 1, G2, G3, R , W та R приймають значення, представлені вище. h) Приклад одержання кислоти з відповідного складного ефіру: 25 30 (Аза)індолскладноефірну похідну (0,32 ммоль) розчиняють в розчині THF/EtOH в 1/1 об'ємному співвідношенні (3 мл), потім розчин NaOH 1N додають (1,2 мл) та суміш перемішують при кімнатній температурі впродовж 3 годин. Органічні розчинники видаляють у вакуумі та 1N HCl розчин додають до осадження кислоти. Цей продукт фільтрують, промивають водою та сушать у вакуумі, що приводить до одержання 2 сполуки формули (I), у якій X, Y, Z, G1, G2, G3, n, W та R приймають значення, представлені вище. i) Приклад шостого варіанту способу одержання: 18 UA 100867 C2 5 10 У інертній атмосфері, бензойну кислоту (II) (0,74 ммоль), TBTU (0,86 ммоль) та триетиламін (0,98 ммоль) розчиняють у безводному ацетонітрилі (3 мл). Після витримування суміші при кімнатній температурі при перемішуванні впродовж 30 хвилин, додають розчин сполуки (V) (0,61 ммоль) у безводному ацетонітрилі (3 мл). Цю суміш залишають при кімнатній температурі перемішуватись впродовж 3 годин, потім розбавляють за допомогою H 2O та екстрагують етилацетатом (EtOAc). Після упарювання розчиннику при зниженому тиску, отриману кислоту (0,16 ммоль) розчиняють в MeOH (15 мл). До розчину додають HCl 2N (2,5 мл), та суміш залишають при кімнатній температурі впродовж 3 годин. Потім розчинник випарюють при зниженому тиску, та залишок розчиняють в DCM та промивають насиченим розчином NaHCO3. Після випарювання органічного розчиннику, залишок очищують, що приводить до одержання сполуки (I), у якій Y, Z, G 1, G2 та G3 приймають значення, представлені вище, W являє собою 2 амідний зв'язок, та R являє собою фенільну групу. 15 Таким чином отримують сполуки формули (I), показані у Таблиці 1, представленій нижче. У Таблиці 1 застосовують абревіатури з наступним значенням: Очищення A Очищення B Очищення C EtOAc Hex MeOH EtOH CH3CN H2O HCOOH iPrOH Pr2O = = = = = = = = = = = = Кристалізація Флеш хроматографія на силікагелі Препаративна ВЕРХ (X Місток преп. C18; 5 мкм, 30 × 150 мм) Етилацетат Гексан Метанол Етанол Ацетонітрил Вода Мурашина кислота Ізопропанол Дипропіловий ефір Таблиця 1 Сполука Структурна формула Приклад Очищення МоноLC/MS ізотопна + (M+H) маса 1 H ЯМР (300 МГц) 1 1 2(a) B (Hex/ EtOAc; hex 90 → 40 %) 19 H-ЯМР (CDCl3): 8,41(d, J=2,4 Гц, 1H); 8,32 (d, J=2,4 Гц, 1H); 8,19 (s, 1H); 389,13 390,3 7,74 (m, 1H);7,507,20 (om, 7H); 6,42 (s, 1H); 4,34 (q, J=7,2 Гц, 2H); 2,42 (s, 3H); 1,27 (t, J=7,2 Гц, 3H). UA 100867 C2 Таблиця 1 Сполука Структурна формула Приклад Очищення МоноLC/MS ізотопна + (M+H) маса 1 H ЯМР (300 МГц) 1 2 2(a) B (Hex/ EtOAc=8/2) 403,15 404,4 3 2(a) B (Hex/ EtOAc=6/4) 419,14 420,4 4 2(a) B (Hex/ EtOAc=6/4 393,10 394,3 5 2(a) B (Hex/ EtOAc; hex 70 → 60 %) 423,11 424,2 6 2(a) B (Hex/ EtOAc=6/4) 422,12 423,3 20 H-ЯМР (CDCl3): 8,405 (d, J=2,4 Гц, 1H); 8,30 (d, J=2,4 Гц, 1H); 8,00 (s, 1H); 7,83 (m, 1H); 7,507,20 (om, 7H); 6,37 (s, 1 H); 4,67 (ept. J=6,9 Гц, 1 H); 2,43 (s, 3H); 1,69 (d, J=6,9 Гц, 6H). 1 H-ЯМР (CDCl3): 8,45 (d, J=2,1 Гц, 1H); 8,34 (d, J=2,1 Гц, 1H); 8,13 (bs, 1H); 7,79 (m, 1H); 7,55-7,20 (om, 7H); 6,46 (s, 1H); 4,49 (t, J=6,0 Гц, 2H); 3,68 (t, J=6,0 Гц, 2H); 3,17 (s, 3H); 2,42 (s, 3H). 1 H-ЯМР (CDCl3): 8,47 (d, J=2,4 Гц, 1H); 8,33 (d, J=2,4 Гц, 1H); 8,07 (s, 1H); 7,78 (m, 1H); 7,607,10 (2 m, 7H), 6,45 (s, 1H); 4,34 (q, J=6,9 Гц, 2H);1,28 (t, J=6,9 Гц 3H) 1 H-ЯМР (CDCl3): 8,44 (d, J=2,1 Гц); 8,33 (d, J=2,1 Гц); 8,10 (bs, 1H), 7,78 (m, 1H), 7,65-7,10 (3 m, 7H); 6,46 (s, 1H);); 4,44 (t, J=5,7 Гц, 2H); 3,72 (t, J=5,7 Гц, 2H);); 3,18(s, 3H); 1 H-ЯМР (300 МГц, ДМСО-d6) 3,07 (s, 3 H) 3,54 (t, J=5,61 Гц, 2 H) 4,31 (t, J=5,45 Гц, 2 H) 6,52 (s, 1 H) 7,29-7,69 (m, 10 H) 8,03 (d, J=1,65 Гц, 1 H) 10,32 (s, 1 H) UA 100867 C2 Таблиця 1 Сполука Структурна формула Приклад Очищення МоноLC/MS ізотопна + (M+H) маса 1 H ЯМР (300 МГц) 1 7 B 2(a) (Hex/ EtOAc 100 → 460,13 461,7 70 %) 8 2(a) B (Hex/ EtOAc; hex 100 → 60 %) 446,14 447,7 9 2(a) A (Hex/ EtOAc=8/2) 417,16 418,7 10 2(a) A (Hex/ EtOAc=8/2) 380,17 381,6 11 2(a) B (Hex/ EtOAc; hex 100 → 70 %) 432,12 433,8 21 H-ЯМР (300 МГц, ДМСО-d6) 1,10 (t, J=7,27 Гц, 3 H) 1,80 (quin, J=7,10 Гц, 2 H) 2,09 (t, J=7,10 Гц, 2 H) 3,93 (q, J=7,27 Гц, 2 H) 4,25 (t, J=7,10 Гц, 2 H) 6,54 (s, 1 H) 7,38-7,65 (m, 11 H) 8,06 (d, J=1,98 Гц, 1 H) 10,33 (s, 1 H) 1 H-ЯМР (300 МГц, ДМСО-d6) 1,05 (t, J=7,27 Гц, 3 H) 2,59 (t, J=7,27 Гц, 2 H) 3,90 (q, J=7,27 Гц, 2 H) 4,48 (t, J=7,27 Гц, 2 H) 6,54 (s, 1 H) 7,38-7,66 (m, 11 H) 8,04 (d, J=1,98Гц, 1 H) 10,33 (s, 1 H) 1 H-ЯМР (300 МГц, ДМСО-d6) 2,00 (s, 6 H) 2,41 (t, J=7,10 Гц, 2 H) 4,26 (t, J=7,10 Гц, 2 H) 6,52 (s, 1 H) 7,38-7,63 (m, 11 H) 8,04 (d, J=1,65 Гц, 1 H) 10,32 (s, 1 H) 1 H-ЯМР (300 МГц, ДМСО-d6) 1,17-1,57 (m, 6 H) 1,25 (t, J=7,10 Гц, 3 H) 1,611,87 (m, 2 H) 1,882,06 (m, 2 H) 2,612,83 (m, 1 H) 4,16 (q, J=6,94 Гц, 2 H) 6,17 (s, 1 H) 7,26-7,38 (m, 2 H) 7,39-7,62 (m, 4 H) 7,88 (s, 1 H) 10,21 (s, 1 H) 1 H-ЯМР (300 МГц, ДМСО-d6) 1,13 (t, J=7,10 Гц, 3 H) 4,09 (q, J=6,94 Гц, 2 H) 5,00 (s, 2 H) 6,61 (s, 1 H) 7,35-7,64 (m, 11 H) 8,06 (s, 1 H) 10,35 (s, 1 H) UA 100867 C2 Таблиця 1 Сполука Структурна формула Приклад Очищення МоноLC/MS ізотопна + (M+H) маса 1 H ЯМР (300 МГц) 1 12 2(a) B (Hex/ EtOAc=9/1) 404,13 405,6 13 2(a) A (Hex/ EtOAc=8/2) 446,14 447,2 14 2(a) A (Hex/ EtOAc=8/2) 432,12 433,4 15 2(a) B (Hex/ EtOAc=7/3 416,13 417,3 2(f) C (CH3CN/ H2O+0,1 % HCOOH 30 → 65 %, 15 хвилин) 438,08 439,5 2(f) C (CH3CN/ H2O+0,1 % HCOOH 30 → 65 %, 15 хвилин) 424,06 425,2 16 17 22 H-ЯМР (300 МГц, ДМСО-d6) 3,06 (s, 3 H) 3,54 (t, J=5,61 Гц, 2 H) 4,34 (t, J=5,78 Гц, 2 H) 6,53 (s, 1 H) 7,35-7,68 (m, 11 H) 8,03 (d, J=1,98 Гц, 1 H) 10,32 (s, 1 H) 1 H-ЯМР (300 МГц, ДМСО-d6) 1,76-1,93 (m, 2 H) 1,80 (s, 3 H) 3,72 (t, J=5,94 Гц, 2 H) 4,32 (t, J=6,94 Гц, 2 H) 6,54 (s, 1 H) 7,38-7,64 (m, 11 H) 8,05 (d, J=1,65 Гц, 1 H) 10,33 (s, 1 H) 1 H-ЯМР (300 МГц, ДМСО-d6) 1,73 (s, 3 H) 4,15 (t, J=5,28 Гц, 2 H) 4,47 (t, J=5,28 Гц, 2 H) 6,54 (s, 1 H) 7,37-7,66 (m, 11 H) 8,05 (d, J=1,65 Гц, 1 H) 10,34 (s, 1 H) 1 H-ЯМР (300 МГц, ДМСО-d6) 1,99 (s, 3 H) 2,82 (t, J=7,43 Гц, 2 H) 4,37 (t, J=7,43 Гц, 2 H) 6,54 (s, 1 H) 7,24-7,74 (m, 11 H) 8,05 (d, J=1,32 Гц, 1 H) 10,33 (s, 1 H) 1 H-ЯМР (300 МГц, ДМСО-d6) 2,37 (s, 3 H) 3,01 (s, 3 H) 6,87 (s, 1 H) 7,24 (d, J=7,60 Гц, 2 H) 7,397,65 (m, 7 H) 7,92 (d, J=8,92 Гц, 1 H) 8,18 (d, J=1,65 Гц, 1 H) 10,60 (s, 1 H) 1 H-ЯМР (300 МГц, ДМСО-d6) 3,04 (s, 3 H) 6,92 (s, 1 H) 7,397,64 (m, 10 H) 7,92 (d, J=9,08 Гц, 1 H) 8,19 (d, J=1,98Гц, 1 H) 10,60 (s, 1 H) UA 100867 C2 Таблиця 1 Сполука Структурна формула Приклад Очищення МоноLC/MS ізотопна + (M+H) маса 1 H ЯМР (300 МГц) 1 18 19 20 21 22 C (CH3CN/H2O+0,1 % 2(f) HCOOH 30 → 430,11 431,4 65 %, 15 хвилин) 2(f) C (CH3CN/ H2O+0,1 % HCOOH 30 → 65 %, 15 хвилин) 425,06 426,4 2(f) C (CH3CN/ H2O+0,1 % HCOOH 30 → 65 %, 15 хвилин) 449,06 450,3 2(f) C (CH3CN/ H2O+0,1 % HCOOH 30 → 65 %, 15 хвилин) 452,10 453,4 2(f) C (CH3CN/ H2O+0,1 % 492,05 493,4 HCOOH 30^65 %, 15 хвилин) 23 H-ЯМР (300 МГц, ДМСО-d6) 1,16-1,51 (m, 5 H) 1,60-1,90 (m, 3 H) 2,10 (d, J=7,76 Гц, 2 H) 3,043,19 (m, 1 H) 3,21 (s, 3 H) 6,66 (s, 1 H) 7,42-7,61 (m, 5 H) 7,83 (d, J=9,25 Гц, 1 H) 8,04 (d, J=1,98 Гц, 1 H) 10,51 (s, 1 H) 1 H-ЯМР (300 МГц, ДМСО-d6) 3,79 (s, 3 H) 7,10 (s, 1 H) 7,357,66 (m, 6 H) 7,76 (d, J=7,76 Гц, 1 H) 7,868,04 (m, 2 H) 8,22 (d, J=1,82 Гц, 1 H) 8,69 (ddd, J=4,87, 1,73,0,83 Гц, 1 H) 10,59 (s, 1 H) 1 H-ЯМР (300 МГц, ДМСО-d6) 3,08 (s, 3 H) 7,10 (s, 1 H) 7,367,69 (m, 5 H) 7,747,82 (m, 2 H) 7,867,97 (m, 3 H) 8,23 (d, J=1,98 Гц, 1 H) 10,64 (s, 1 H) 1 H-ЯМР (300 МГц, ДМСО-d6) 2,95-3,10 (m, 2 H) 3,22 (t, J=7,76 Гц, 2 H) 3,27 (s, 3 H) 6,69 (s, 1 H) 7,16-7,26 (m, J=8,48, 4,38,4,22,4,22 Гц, 1 H) 7,31 (d, J=4,46 Гц, 4 H) 7,40-7,64 (m, 5 H) 7,84 (d, J=8,92 Гц, 1 H) 8,05 (t, J=1,57Гц, 1 H) 10,52 (s, 1 H) 1 H-ЯМР (300 МГц, ДМСО-d6) 3,06 (s, 3 H) 7,09 (s, 1 H) 7,407,73 (m, 6 H) 7,757,82 (m, 1 H) 7,858,00 (m, 3 H) 8,22 (d, J=1,65 Гц, 1 H) 10,63 (s, 1 H) UA 100867 C2 Таблиця 1 Сполука МоноLC/MS ізотопна + (M+H) маса Приклад Очищення 2(f) C (CH3CN/ H2O+0,1 % HCOOH 30 → 65 %, 15 хвилин) 458,03 459,5 2(f) C (CH3CN/ H2O+0,1 % HCOOH 30 → 65 %, 15 хвилин) 463,08 464,4 2(f) C (CH3CN/ H2O+0,1 % HCOOH 30 → 65 %, 15 хвилин) 466,11 467,4 26 2(f) C (CH3CN/ H2O+0,1 % HCOOH 30 → 65 %, 15 хвилин) 468,09 469,4 27 2(g) B (Hex/ EtOAc=8/2) 390,15 391,6 Структурна формула 1 H ЯМР (300 МГц) 1 23 24 25 24 H-ЯМР (300 МГц, ДМСО-d6) 3,05 (s, 3 H) 6,97 (s, 1 H) 7,407,70 (m, 9 H) 7,92 (d, J=9,08 Гц, 1 H) 8,20 (d, J=1,82 Гц, 1 H) 10,62 (s, 1 H) 1 H-ЯМР (300 МГц, ДМСО-d6) 3,05 (s, 3 H) 4,12 (s, 2 H) 6,94 (s, 1 H) 7,33-7,72 (m, 9 H) 7,92 (d, J=8,92 Гц, 1 H) 8,19 (d, J=1,65Гц, 1 H) 10,61 (s, 1 H) 1 H-ЯМР (300 МГц, ДМСО-d6) 2,12 (s, 3 H) 2,22 (s, 3 H) 2,24 (s, 3 H) 3,04 (s, 3 H) 6,73 (s, 1 H) 7,04 (s, 1 H) 7,17 (s, 1 H) 7,42-7,65 (m, 5 H) 7,91 (d, J=9,08 Гц, 1 H) 8,16 (d, J=1,98 Гц, 1 H) 10,58 (s, 1 H) 1 H-ЯМР (300 МГц, ДМСО-d6) 2,18 (s, 3 H) 3,04 (s, 3 H) 3,80 (s, 3 H) 6,75 (s, 1 H) 6,81 (dd, J=8,26, 2,48 Гц, 1 H) 6,87 (d, J=2,64 Гц, 1 H) 7,32 (d, J=8,42 Гц, 1 H) 7,41-7,66 (m, 5 H) 7,91 (d, J=8,92 Гц, 1 H) 8,16 (d, J=1,82 Гц, 1 H) 10,58 (s, 1 H) 1 H-ЯМР (300 МГц, ДМСО-d6) 0,93 (t, J=7,10 Гц, 3 H) 2,32 (s, 3 H) 2,69-2,89 (m, 2 H) 3,13-3,40 (m, 2 H) 4,61 (dd, J=10,24, 9,25 Гц, 1 H) 6,48 (d, J=8,26 Гц, 1 H) 7,057,61 (m, 10 H) 10,11 (s, 1 H) UA 100867 C2 Таблиця 1 Сполука Структурна формула Приклад Очищення МоноLC/MS ізотопна + (M+H) маса 1 H ЯМР (300 МГц) 1 28 2(h) A (EtOH/H20=2:8) 29 2(h) A (EtOH/H2O=2:8) H-ЯМР (300 МГц, ДМСО-d6) 1,79 (qd, J=7,20, 7,06 Гц, 2 H) 2,04 (t, J=7,20 Гц, 2 H) 4,22 (t, J=7,27 Гц, 432,12 433,5 2 H) 6,54 (s, 1 H) 7,34-7,69 (m, 11 H) 8,06 (d, J=1,61 Гц, 1 H) 10,33 (s, 1 H) 12,28 (br. s., 1 H) 1 H-ЯМР (300 МГц, ДМСО-d6) 2,54 (t, J=7,90 Гц, 2 H) 4,42 (t, J=7,90 Гц, 2 H) 418,11 419,8 6,54 (s, 1 H) 7,377,64 (m, 11 H) 8,04 (d, J=1,83 Гц, 1 H) 10,33 (s, 1 H) 12,31 (br. s., 1 H) 1 30 2(h) A (EtOH/H20=2:8) H-ЯМР (300 МГц, ДМСО-d6) 4,89 (s, 2 H) 6,60 (s, 1 H) 7,34404,09 405,6 7,65 (m, 11 H) 8,05 (s, 1 H) 10,34 (s, 1 H) 13,00 (br. s., 1 H) 1 31 2(a) 32 2(a) 33 2(a) H-ЯМР (300 МГц, ДМСО-d6) 2,35-2,46 (m, 2 H) 4,31-4,44 (m, 2 H) 6,54 (s, 1 H) A 417,12 418,2 6,84 (br. s, 1 H) 7,33 (EtOAc/EtOH=5:1) (br. s, 1 H) 7,37-7,68 (m, 11 H) 8,04 (d, J=1,98 Гц, 1 H) 10,32 (s, 1 H) 1 H-ЯМР (300 МГц, ДМСО-d6) 2,63 (t, J=7,60 Гц, 2 H) 2,72 (s, 3 H); 2,73 (s, 3 H); A 445,16 446,3 4,40 (t, J=7,89 Гц, 2 (EtOAc) H); 6,54 (s, 1 H); 7,35-7,66 (m, 11 H); 8,05 (d, J=1,75 Гц, 1 H); 10,33 (s, 1 H). 1 H-ЯМР (300 МГц, ДМСО-d6) δ 10,22 (s, 1H), 7,90 (s, 1H), 7,53-7,61 (m, 2H), 7,40-7,53 (m, 2H), A (Es/AcOEt) 402,92 403,3 7,26-7,39 (m, 6H), 7,15-7,26 (m, 1H), 6,26 (s, 1H), 4,14 (q, J=7,02 Гц, 2H), 3,04 (s, 4H), 1,22 (t, J=7,02 Гц, 3H) 25 UA 100867 C2 Таблиця 1 Сполука Структурна формула Приклад Очищення МоноLC/MS ізотопна + (M+H) маса 1 H ЯМР (300 МГц) 1 34 2(a) A 388,89 389,0 (iPrOH/AcOEt/Pr2O) 35 2(0 B (Es/AcOEt;Es 90 → 482,45 482,3 66 %) 36 B 2(a) (Es/AcOEt;Es 90 → 443,30 443,2 60 %) 37 B 2(a) (Es/AcOEt;Es 90 → 476,85 477,2 60 %) 26 H-ЯМР (ДМСО-d6): 10,23 (s, 1H); 7,89 (s, 1H); 7,49 (m, 4H); 7,26 (m, 7H); 6,17 (s, 1H); 4,15 (s, 2H); 4,09 (q, J=6,9 Гц, 2H); 1,04 (t, J=7,1 Гц, 3H). 1 H-ЯМР (ДМСО-d6): 10,41 (bs, 1H); 10,21 (bs, 1H); 8,09 (s, 1H); 7,85 (d, J=8,5 Гц, 1H); 7,82 (m, 3H); 7,71 (m, 2H); 7,59 (d, J=8,5 Гц, 1H); 7,49 (d, J=8,5 Гц, 1H); 7,25 (t, J=8,5 Гц, 2H); 7,31 (s, 1H); 7,11 (t, J=8,5 Гц, 1H); 4,61 (t, J=7,5 Гц, 2H); 4,47 (t, J=5,0 Гц, 1H); 3,41 (d, J=7,5 Гц, 2H); 1,91 (m, 2H). 1 H-ЯМР (300 МГц, ДМСО-d6) δ 10,53 (s, 1H), 8,00 (d, J=1,98 Гц, 1H), 7,63-7,73 (m, 2H), 7,45-7,61 (m, 4H), 7,27-7,41 (m, 3H), 6,53 (s, 1 H), 4,89 (t, J=5,28 Гц, 1H), 4,20 (t, J=6,28 Гц, 2H), 3,63 (q, J=6,17 Гц, 2H) 1 H-ЯМР (300 МГц, ДМСО-d6) δ 10,39 (s, 1H), 7,98 (d, J=1,98 Гц, 1H), 7,73-7,84 (m, 2H), 7,54-7,71 (m, 5H), 7,51 (d, J=8,92 Гц, 1H), 7,36 (dd, J=2,15, 8,75 Гц, 1H), 6,56 (s, 1H), 4,88 (t, J=6,11 Гц, 1H), 4,21 (t, J=6,11 Гц, 2H), 3,63 (q, J=6,06 Гц, 2H) UA 100867 C2 Таблиця 1 Сполука Структурна формула Приклад Очищення МоноLC/MS ізотопна + (M+H) маса 1 H ЯМР (300 МГц) 1 H-ЯМР (300 МГц, ДМСО-d6) δ 10,60 (s, 1H), 7,97 (d, J=1,98 Гц, 1 H), 7,60-7,81 B (m, 5H), 7,51 (d, 2(a) (Es/AcOEt;Es 90 → 460,40 461,4 J=8,92 Гц, 1 H), 7,2660 %) 7,41 (m, 3H), 6,53 (s, 1 H), 4,89 (t, J=5,45 Гц, 1H), 4,20 (t, J=6,11 Гц, 2H), 3,63 (q, J=6,17 Гц, 2H) 38 5 10 15 20 Приклад 3 In vitro біологічна активність Використовуване дослідження робить можливою оцінку інгібуючої здатності тестових сполук на вироблення PGE2 та селективності по відношенню до вироблення PGF 2α. Використовують клітинну лінію легеневої аденокарциноми людини A549, яка є особливо чутливою до стимулювання за допомогою про-запальних цитокінів, наприклад, IL-1β, та, у відповідь на це стимулювання, є особливо активною у виробленні та вивільненні двох простаноїдів: PGE 2 та PGF2α (Thoren S. Jakobsson P-J, 2000). Зазначені клітини стимулюють за допомогою IL-1β (10 нг/мл) та одночасно обробляють тестовою сполукою впродовж 22 годин у прийнятному культуральному середовищі (DMEM – Дулбекко-модифіковане середовище Ігла), збагаченому 5 % телячою ембріональною сироваткою та L-глутаміном (4 мM кінцева) у інкубаторі при 37 °C та з CО2 концентрацією 5 %. Наприкінці інкубування, кількість PGE2 та PGF2α, виробленого та вивільненого у надосадову рідину, досліджують, використовуючи EIA набір (вироблений та проданий Cayman Chemicals, Ann Arbor, мл, USA). Використовувана порівняльна сполука являє собою індометацин при концентрації 10 нM (Sigma-Aldrich), який являє собою нестероїдний протизапальний лікарський засіб, який інгібує у рівному ступені як PGE2, так і PGF2α. Результати, виражені як відсоток інгібування вироблення PGE2 та PGF2α при концентрації 10 мкМ, представлені у Таблиці 2, у якій "на" (неактивний) позначає інгібуючу активність менше, ніж 20 %. Таблиця 2 Сполука % інгібування при 10 мкМ PGE2 PGF2α 59 на 76 на 78 на 78 на 61 на 69 на 94 44 41 на 83 44 88 13 40 на 73 на 42 на 100 100 1 7 10 12 13 21 22 33 34 35 36 37 38 Індометацин (10 нM) 25 Для ілюстративних цілей, у Таблиці 3 порівнюються pІC50 значення деякої кількості сполук даного винаходу, де pІC50 являє собою від'ємний логарифм IC50, який, у свою чергу, являє 27 UA 100867 C2 собою концентрацію сполуки, яка інгібує вироблення PGE2 або PGF2α на 50 % по відношенню до клітин, які стимулюють, але не обробляють тією ж сполукою. У Таблиці 3, "нв" означає, що параметр є невизначуваним. Таблиця 3 Сполука pІC50 PGE2 7 10 12 13 21 22 34 35 36 37 38 5,4 5,8 5,5 5,1 6,3 5,8 5,6 5,6 4,3 5,2 4,6 8,3 Індометацин PGF2α нв нв нв нв нв 4,6 нв 4,5 нв нв нв 8,6 5 10 15 20 Приклад 4 In vivo біологічна активність Тестову сполуку оцінюють у моделі викликаного оцтовою кислотою витягування у мишей (Stock J.L. et al., J. Clin. Inv. 2001, 107: 325-331). Зазначене дослідження робить можливою оцінку антиноцицептивної активності сполук даного винаходу у моделі запального болю. Для дослідження використовують мишей CD-1жіночої статі вагою 25-30 г. Тварин обробляють внутрішньочеревинно тестовою сполукою (0,1-10 мг/кг), суспендованою у метилцелюлозі (MTC). Контрольних тварин обробляють тільки носієм (MTC) тим же шляхом. Через 30 хвилин після обробки, тварини отримують внутрішньочеревинну ін'єкцію оцтової кислоти (0,7 об'єм/об'єм у фізіологічному розчині, 16 мкл/г маси тіла) для того, щоб викликати запальний біль та перевірити ефекти тестової сполуки на ноцицептивну відповідь. Відразу після введення оцтової кислоти та впродовж наступних 20 хвилин, підраховують кількість витягувань, які являють собою параметр для оцінки ноцицептивної відповіді. Як показано у Таблиці 4, сполука даного винаходу викликає, дозо-залежним способом, зменшення у кількості витягувань впродовж 20 хвилин після введення оцтової кислоти, у порівнянні з тваринами, яких обробляли тільки MTC. Таблиця 4 Обробка Носій Сполука 10 25 30 Доза (мг/кг) 0,01 0,1 1 10 Кількість витягувань 50±3,3 47±4,3 34±3,2 33±3,9 21±3,2 % інгібування 5,9±8,76 33,2±6,16 33,6±8,04 57,5±6,57 Приклад 5 Селективність між ізоформами PGES Використовуване дослідження робить можливою оцінку здатності сполук даного винаходу інгібувати вироблення PGE2 у клітинній лінії лімфоми людини U-937, яка переважно експресує ферментативну ізоформу (cPGES), яка відповідає за вироблення PGE2 при основних умовах, за відсутності про-запального стимулювання. Зазначена ферментативна форма відрізняється від форми, що переважно експресується у A549 клітинах (mPGES-1) після про-запального стимулювання. Відсутність інгібуючої активності по відношенню до PGE2 у цій клітинній моделі забезпечує селективність сполуки у порівнянні з ферментативною формою, яка відповідає за вироблення PGE2 у присутності запального стимулювання. 28
ДивитисяДодаткова інформація
Назва патенту англійською(aza)indole derivative substituted in position 5, pharmaceutical composition comprising thereof, intermediates and process for the preparation thereof
Автори англійськоюAlisi, Maria Alessandra, Furlotti, Guido, Cazzolla, Nicola, Maugeri, Caterina, Dragone Patrizia, Garofalo, Barbara, Coletta, Isabella, Mangano, Giorgina, Garrone, Beatrice
Назва патенту російськоюПроизводная (аза)индола, замещенная в положении 5, фармацевтическая композиция, которая содержит ее, промежуточные соединения и способ их получения
Автори російськоюАлиси Мария Алессандра, Фурлотти Гвидо, Каццолла Никола, Мауджери Катерина, Драгоне Патриция, Гарофало Барбара, Колетта Изабелла, Мангано Джорджина, Гарроне Беатриче
МПК / Мітки
МПК: C07D 209/08, C07D 209/18, A61K 31/437, C07D 401/04, C07D 209/12, A61P 29/00, A61K 31/404, C07D 471/04
Мітки: одержання, фармацевтична, положенні, сполуки, містить, спосіб, композиція, азаіндолу, похідна, проміжні, заміщена
Код посилання
<a href="https://ua.patents.su/36-100867-pokhidna-azaindolu-zamishhena-v-polozhenni-5-farmacevtichna-kompoziciya-shho-mistit-promizhni-spoluki-ta-sposib-kh-oderzhannya.html" target="_blank" rel="follow" title="База патентів України">Похідна (аза)індолу, заміщена в положенні 5, фармацевтична композиція, що містить її, проміжні сполуки та спосіб їх одержання</a>
Попередній патент: Продукт твердої дисперсії, що містить сполуки на основі n-арилсечовини
Наступний патент: Лінія зволоженого пресування подрібненої органіки та виробництва паливних брикетів/гранул
Випадковий патент: Вогнестійкий електричний кабель