Спосіб одержання сполук дигідроінденаміду, фармацевтична композиція, що містить дані сполуки, та їх застосування як інгібітора протеїнкінази
Формула / Реферат
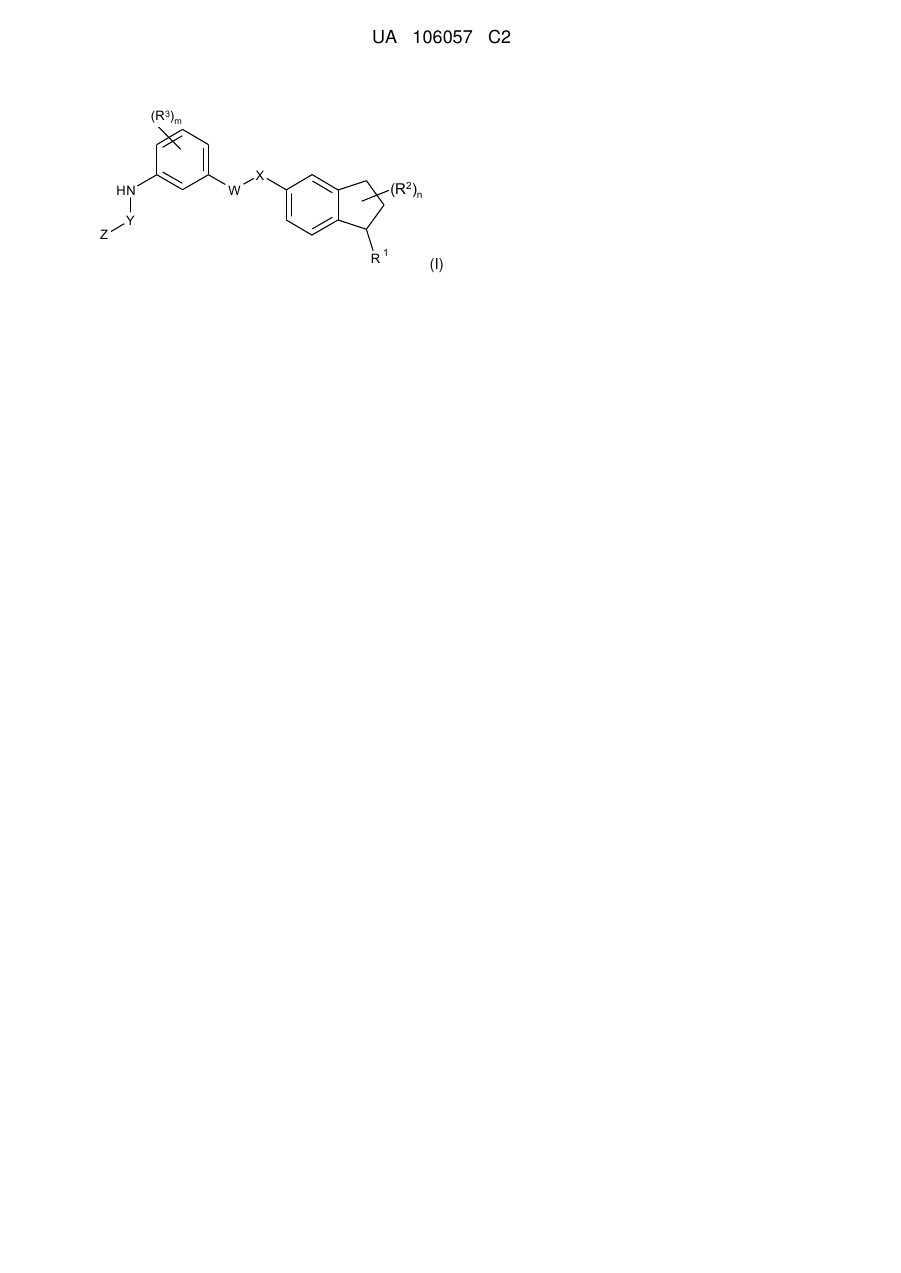
1. Сполука Формули І
 Формула І
Формула І
або її фармацевтично прийнятна сіль, в якій:
R1 є насиченою циклічною аміногрупою, що являє собою 5- або 6-членне кільце і може бути необов'язково заміщена одним R1a;
R1a є Н, С1-6алкілом, С1-6гідроксіалкілом; NRbRc, C(O)Rd;
R2 є Н;
R3 є С1-6алкілом;
WX є амідним зв'язоком;
Y є піримідилом;
Z є піридилом або піримідилом;
Rb, Rc і Rd є C1-6алкілом;
n є нуль;
m є один.
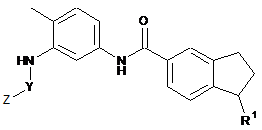
2. Сполука або її фармацевтично прийнятна сіль за п. 1 формули II:
 , Формула II
, Формула II
в якій R1 визначено в п. 1
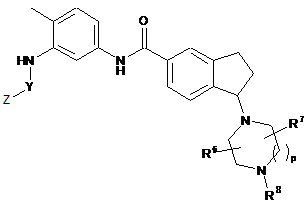
3. Сполука або її фармацевтично прийнятна сіль за будь-яким з пп. 1, 2 Формули IIа:
 , Формула IIa
, Формула IIa
в якій:
R6 і R7 незалежно вибирають з Н, С1-6алкілу, С1-6гідроксіалкілу або С1-6ціаноалкілу;
R8 є Н, С1-6алкілом, С2-6гідроксіалкілом, С1-6ціаноалкілом або С(О)Rd;
Y визначено в п. 1;
Z визначено в п. 1;
Rd визначено в п. 1;
р є один.
4. Сполука або її фармацевтично прийнятна сіль за будь-яким з пп. 1, 2 Формули ІІb:
 , Формула ІІb
, Формула ІІb
в якій:
R9 і R10 незалежно вибирають з С1-6алкілу;
R11 є Н, NRbRc, С1-6алкілом, С1-6гідроксіалкілом або С1-6ціаноалкілом;
Y визначено в п. 1;
Z визначено в п. 1;
Rb, Rc і Rd незалежно вибирають з С1-6алкілу;
q є один.
5. Сполука або її фармацевтично прийнятна сіль за будь-яким з пунктів пп. 1-4, де сполуку вибирають з групи, що складається з:
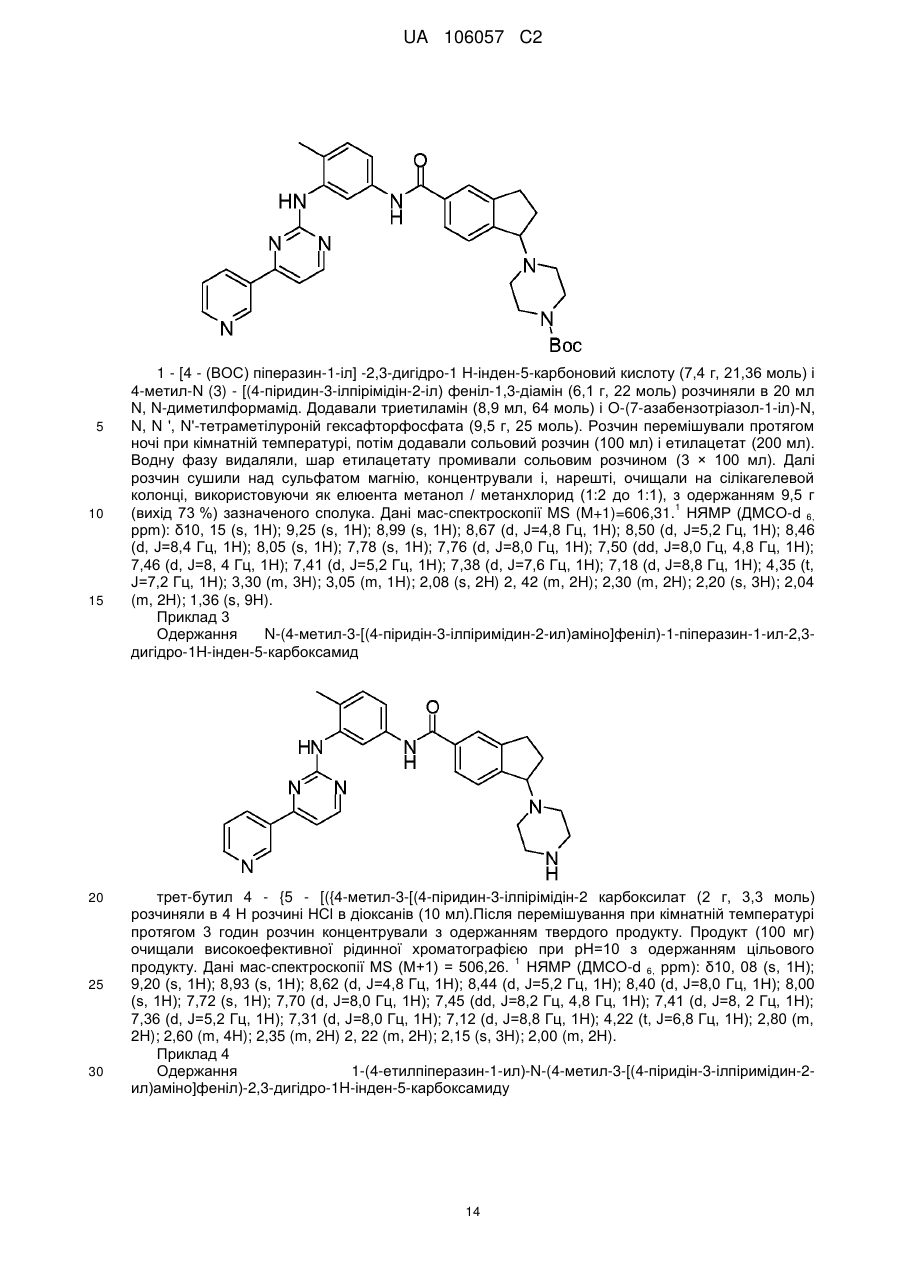
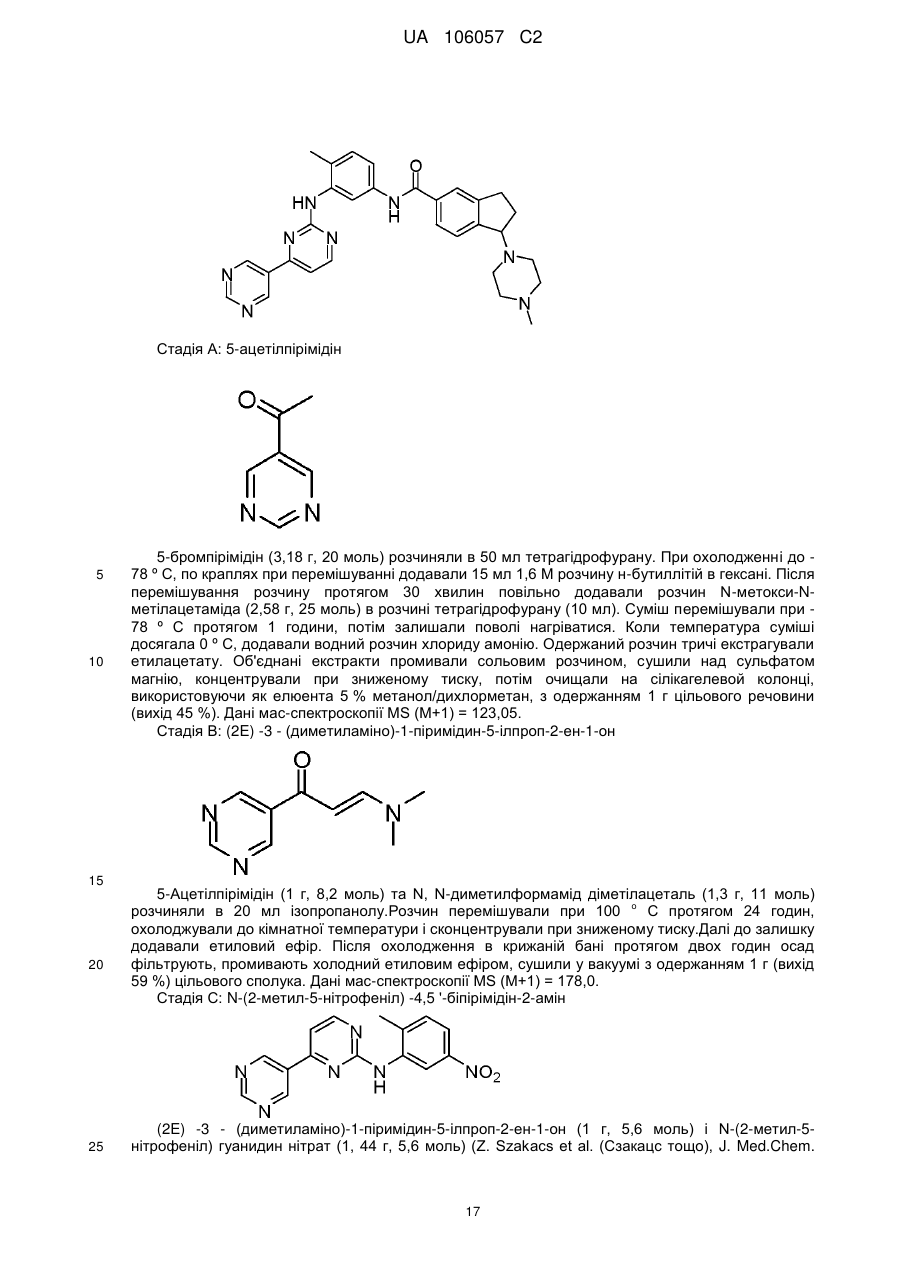
1-(4-метилпіперазин-1-іл)-N-(4-метил-3-[(4-піридин-3-ілпіримідин-2-іл)аміно]феніл)-2,3-дигідро-1Н-інден-5-карбоксаміду;
трет-бутил-4-{5-[{(4-метил-3-[(4-піридин-3-ілпіримідин-2-іл)аміно]феніл)аміно}карбоніл]-2,3-дигідро-1Н-інден-1-іл}піперазин-1-карбоксилату;
N-(4-мeтил-3-[(4-пipидин-3-iлпipимiдин-2-iл)aмiнo]фeнiл)-1-пiпepaзин-1-iл-2,3-дигiдpo-1H-інден-5-карбоксаміду;
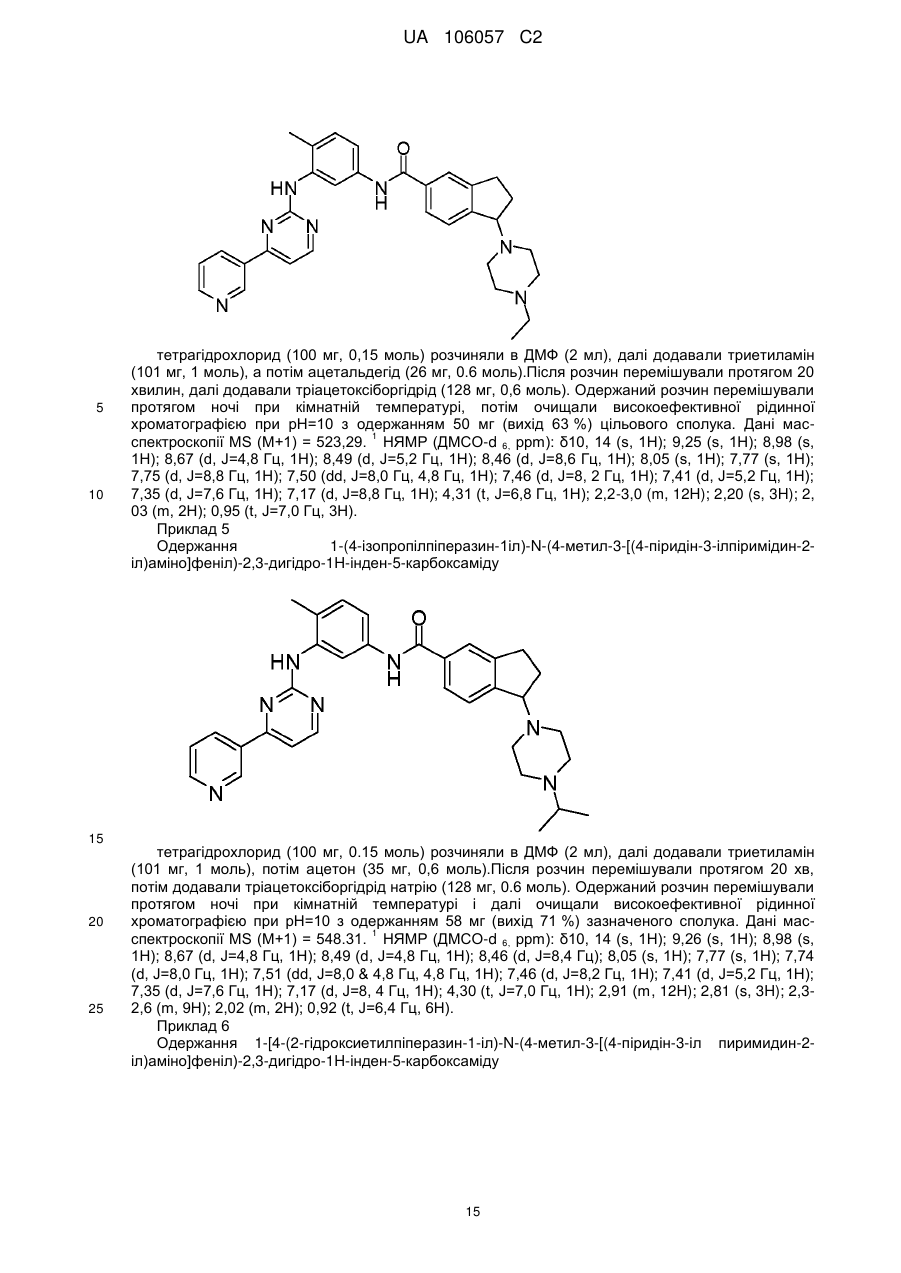
1-(4-етилпіперазин-1-іл)-N-(4-метил-3-[(4-піридин-3-ілпіримідин-2-іл)аміно]феніл)-2,3-дигідро-1H-інден-5-карбоксаміду;
1-(4-ізопропілпіперазин-1-іл)-N-(4-метил-3-[(4-піридин-3-ілпіримідин-2-іл)аміно]феніл)-2,3-дигідро-1Н-інден-5-карбоксаміду;
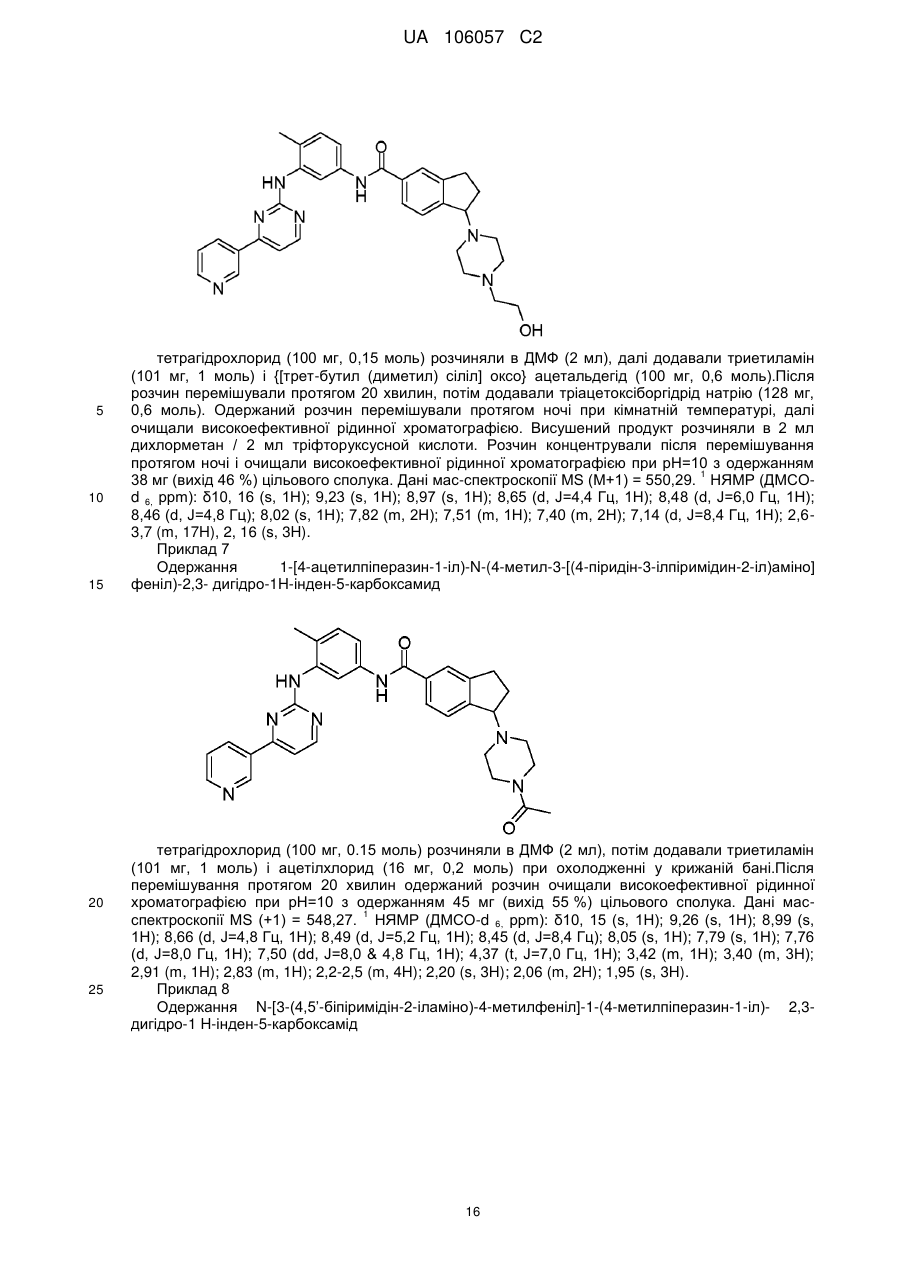
1-[4-(2-гідроксіетил)піперазин-1-іл]-N-(4-метил-3-[(4-піридин-3-ілпіримідин-2-іл)аміно]феніл)-2,3-дигідро-1H-інден-5-карбоксаміду;
1-[4-ацетилпіперазин-1-іл)-N-(4-метил-3-[(4-піридин-3-ілпіримідин-2-іл)аміно]феніл)-2,3-дигідро-1Н-інден-5-карбоксаміду;
N-[3-(4,5'-бiпipимiдин-2-iлaмiнo)-4-мeтилфeнiл]-1-(4-мeтилпiпepaзин-1-iл)-2,3-дигiдpo-1H-інден-5-карбоксаміду;
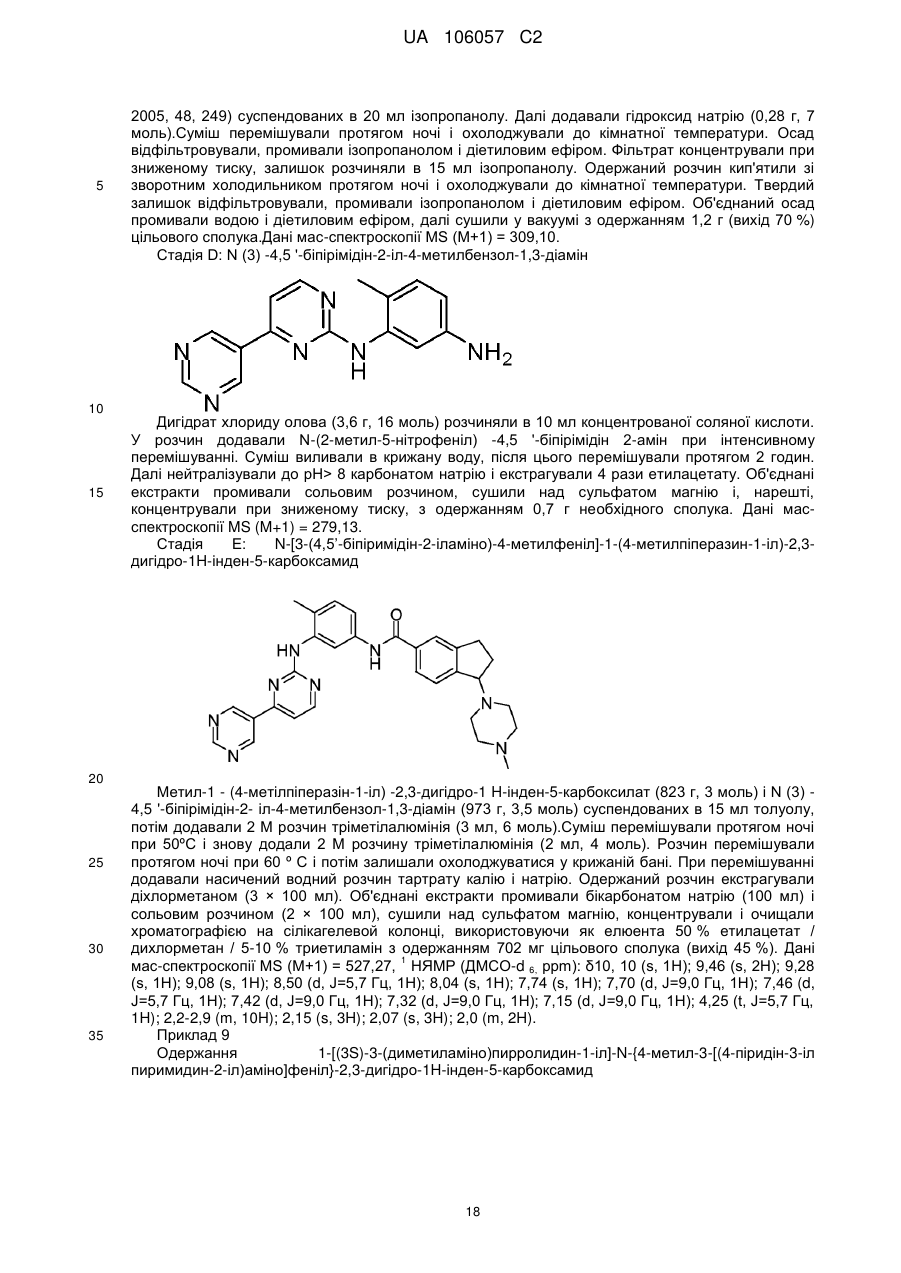
1-[(3S)-3-(диметиламіно)піролідин-1-іл]-N-{4-метил-3-[(4-піридин-3-ілпіримідин-2-іл)аміно]феніл}-2,3-дигідро-1Н-інден-5-карбоксаміду;
1-[(3R)-3-(диметиламіно)піролідин-1-іл]-N-{4-метил-3-[(4-піридин-3-ілпіримідин-2-іл)аміно]феніл}-2,3-дигідро-1Н-інден-5-карбоксаміду;
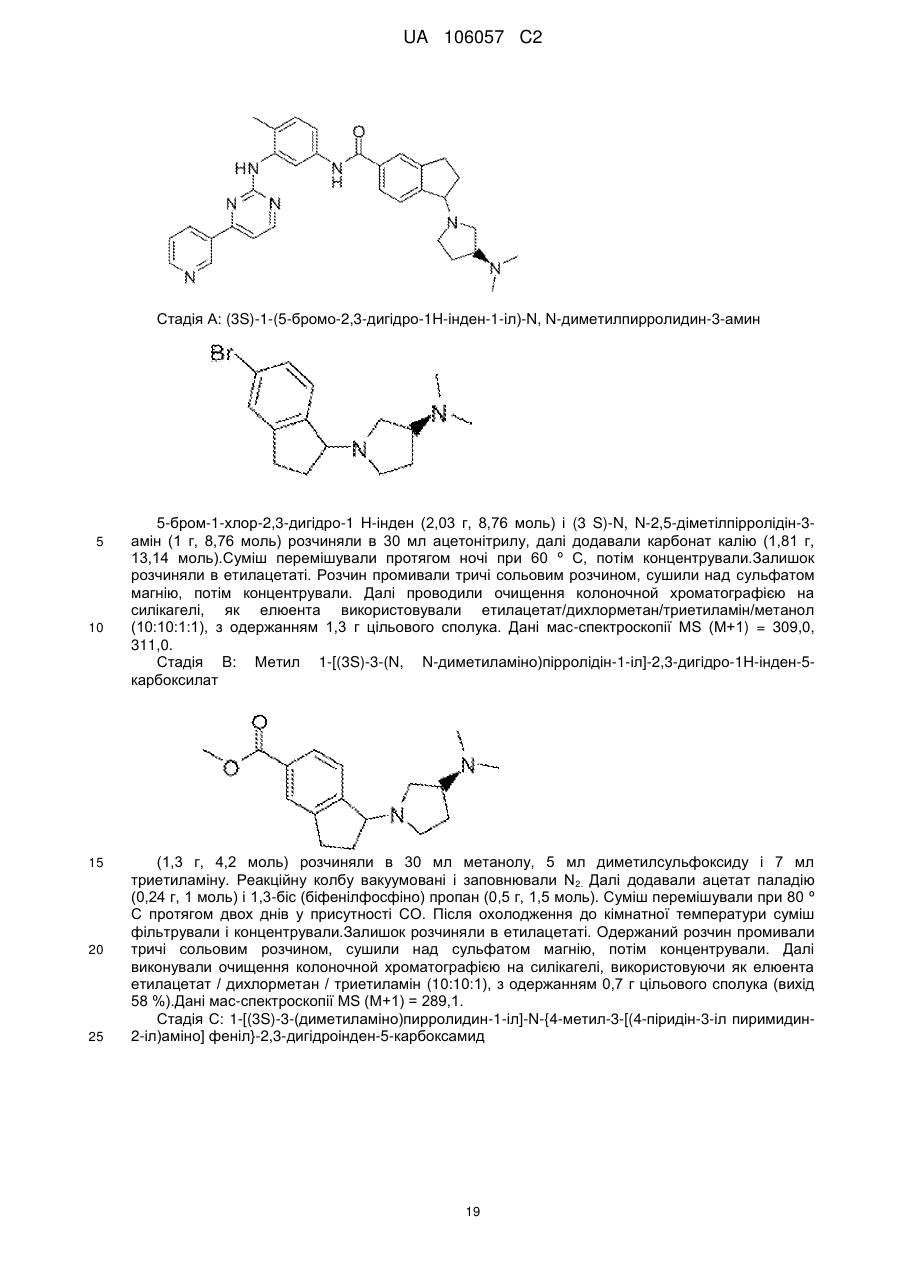
(1S)-1-(4-метилпіперазин-1-іл)-N-(4-метил-3-[(4-піридин-3-ілпіримідин-2-іл)аміно]феніл)-2,3-дигідро-1H-інден-5-карбоксаміду;
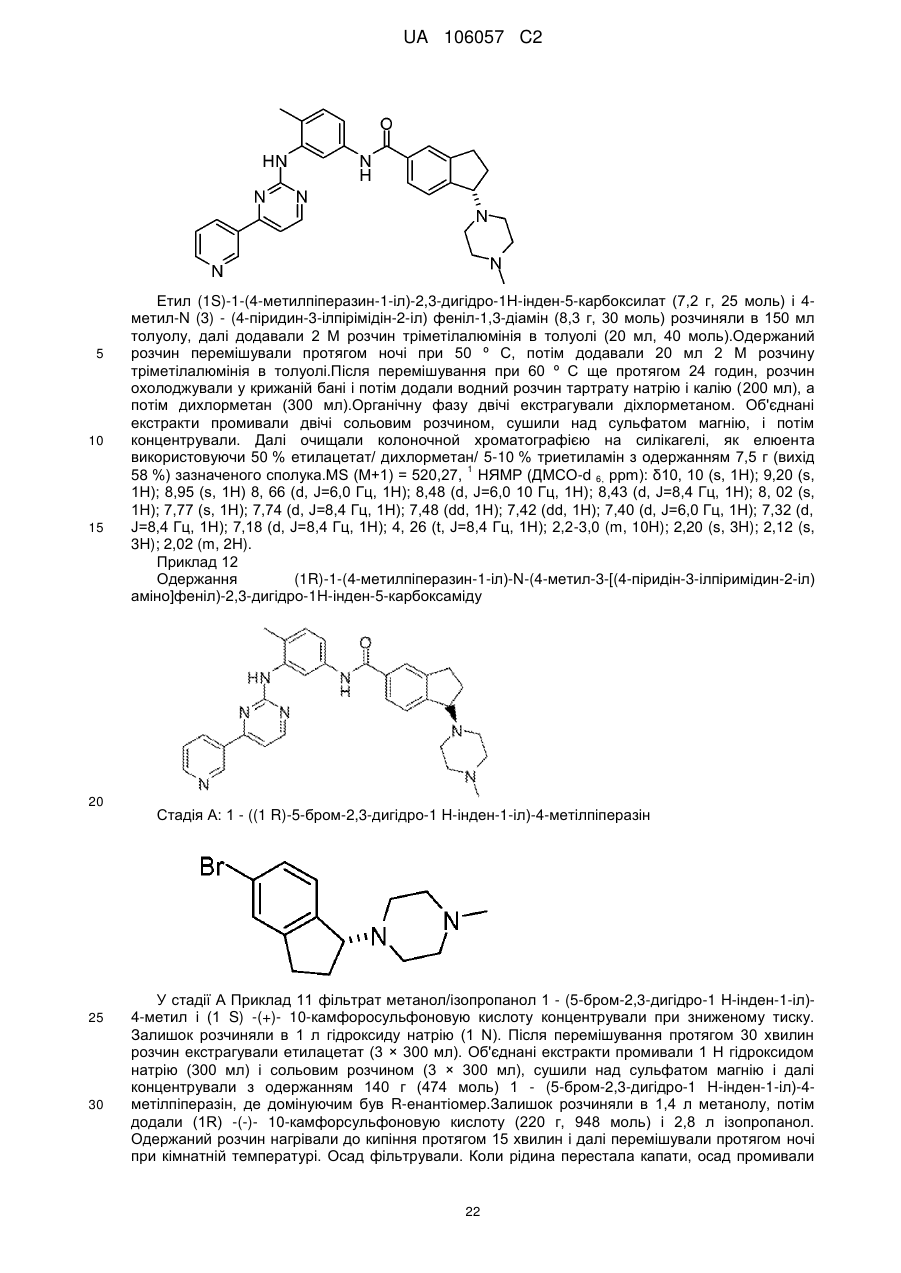
(1R)-1-(4-метилпіперазин-1-іл)-N-(4-метил-3-[(4-піридин-3-ілпіримідин-2-іл)аміно]феніл)-2,3-дигідро-1Н-інден-5-карбоксаміду;
(1S)-N-[3-(4,5'-біпіримідин-2-іламіно)-4-метилфеніл]-1-(4-метилпіперазин-1-іл)-2,3-дигідро-1H-інден-5-карбоксаміду;
(1R)-N-[3-(4,5'-біпіримідин-2-іламіно)-4-метилфеніл]-1-(4-метилпіперазин-1-іл)-2,3-дигідро-1H-інден-5-карбоксаміду;
(1S)-1-(4-метилпіперазин-1-іл)-N-(4-метил-3-[(4-піридин-4-ілпіримідин-2-іл)аміно]феніл)-2,3-дигідро-1Н-інден-5-карбоксаміду і
(1S)-1-(4-метилпіперазин-1-іл)-N-(4-метил-3-[(4-піридин-3-ілпіримідин-2-іл)аміно]феніл)-2,3-дигідро-1Н-інден-5-карбоксамідсульфату.
6. Фармацевтична композиція, яка містить сполуку або її фармацевтично прийнятну сіль за будь-яким з пп. 1-5, а також щонайменше один фармацевтично прийнятний носій.
7. Спосіб лікування захворювання або розладу, пов'язаного з активністю протеїнкінази у пацієнта, за яким пацієнту вводять ефективну кількість сполуки або її фармацевтично прийнятної солі за будь-яким з пп. 1-5.
8. Спосіб за п. 7, в якому зазначені протеїнкінази вибирають з Abl, Всr-Abl, c-Kit і PDGFR.
9. Спосіб за п. 8, в якому зазначені протеїнкінази є мутантними кіназами, вибраними з мутантних Abl-кіназ, мутантних Всr-Abl-кіназ, мутантних c-Kit-кіназ або мутантних PDGFR-кіназ.
10. Застосування сполуки або її фармацевтично прийнятної солі за будь-яким з пп. 1-5 у виробництві лікарських препаратів для лікування розладів або захворювань, де зазначені захворювання або розлади пов'язані з активністю протеїнкінази або порушенням проліферації клітин.
11. Застосування за п. 10, де зазначені розлади або захворювання, пов'язані з протєїнкіназами, вибирають з раку, запалення, автоімунного захворювання, розладів метаболізму, інфекцій, розладів центральної нервової системи або серцево-судинного захворювання.
12. Застосування за п. 10, де зазначені захворювання або розлади, пов'язані з порушенням клітинної проліферації, являють собою різні види раку.
13. Застосування за п. 12, де зазначені захворювання або розлади вибирають з лейкемії, мієлопроліферативного синдрому, гематозу, гастроінтестинальних стромальних пухлин, раку товстої кишки, раку грудей, раку шлунка, оофороми, раку шийки матки, раку легені, раку нирок, раку простати, раку сечового міхура, раку підшлункової залози, нейробластоми, пухлини тучних клітин, пухлини мозку, герміноми, меланоми, злоякісних утворень або саркоми, такої як вибухаюча дерматофібросаркома.
14. Застосування за п. 11, де зазначені захворювання або розлади вибирають з аутоімунних, запальних захворювань.
15. Застосування за п. 14, де зазначені захворювання або розлади вибирають з діабету, дерматиту, ревматоїдного артриту, алергічного риніту, астми, анкілозуючого спондиліту, псоріазу або хвороби Крона.
16. Застосування за п. 11, де зазначені захворювання або розлади вибирають з ангіогенезу або фіброзу.
17. Застосування за п. 16, де зазначені захворювання або розлади вибирають з атероматозу, стенозу кровоносної судини, легеневої гіпертензії, захворювання сітківки, легеневого проміжного фіброзу, цирозу печінки, склеродермії, гломерулосклерозу або фіброзу міокарда.
Текст
Реферат: Винахід стосується нового виду дигідроінденових амідних сполук загальної формули І або їх фармацевтично прийнятних солей, які можна застосовувати як інгібітор протеїнкінази. Винахід пропонує спосіб отримання подібних сполук, фармацевтичних композицій, що містять сполуки, спосіб запобігання або лікування захворювань, пов'язаних з порушенням активності протеїнкіназ, зокрема Abl, Bcr-Abl, с-Kit і PDGFR, використовуючи їх як інгібітор протеїнкінази, а також їх отримання та застосування у виробництві ліків для запобігання або лікування захворювань, пов'язаних з порушенням активності протеїнкіназ, зокрема Abl, Bcr-Abl, c-Kit і PDGFR. UA 106057 C2 (12) UA 106057 C2 (R3)m HN Z W X (R2)n Y R 1 (I) UA 106057 C2 5 10 15 20 25 30 35 40 45 50 55 60 Область техніки Даний винахід відноситься до нового типу сполук дигідроінден аміду, або їх фармацевтично прийнятних солей, їх одержання, фармацевтичних композицій, що містять дані сполуки, способів їх застосування для запобігання або лікування захворювань, пов'язаних з ненормальною активністю протеїн кіназ, особливо в разі захворювань, пов'язаних з ненормальною активністю Abl, Bcr-Abl, c-Kit і PDGFR, а також їх застосування для виробництва медикаментів для запобігання або лікування зазначених захворювань. Попередній рівень техніки Протеїнкінази є ферменти, які здійснюють перенесення фосфатної групи від нуклеозид трифосфату на конкретний сериновий, треоніновий або тірозиновий залишок. Форфолування білка призводить до активації шляхів сигнальної трансдукції, що грають вирішальну роль у різних біологічних процесах, включаючи зростання клітин, метаболізм, диференціацію і смерть. Відомо, що порушення сигналів, викликані неправильним або ненормальною активністю протеїнкінази пов'язані з великим числом хвороб, включаючи рак, запалення, аутоімунні захворювання, порушення обміну речовин, інфекції, розлади центральної нервової системи, серцево-судинні захворювання і т.д. Тому, протеїнкінази є привабливим об'єктом при розробці ліків (Коген (Cohen, Nat Rev.Drug Discovery 2002, 1, 309). Гени abl і bcr є нормальні гени, розташовані на хромосомах 9 і 22, відповідно. Два гібридних гена, утворюються шляхом сегментного обміну між даними двома генами:bcr-abl гена, розташованого на хромосомі 22q-і abl-bcr гена, розташованого на хромосомі 9q+. Білок 210 kD (з210Bcr-Abl) кодується bcr-abl геном хромосоми Philadelphia. Фрагмент Abl білка Bcr-Abl включає Abl тирозинкінази, точно регульовану в прототипі с-Abl, але постійно активується білком злиття Bcr-Abl, що призводить до порушення клітинного росту. Білок Bcr-Abl виявлений у 95 % пацієнтів з хронічною гранулоцітною лейкемією (ХГЛ) та у 10-25 % пацієнтів з гострим лімфобластним лейкозом (ГЛЛ). Іматиніб, відомий під торговою назвою Gleevec, є інгібітором тирозинкінази Bcr-Abl і був клінічно схвалений в якості ефективного складу для лікування ХГЛ (Друкер та ін (Druker et al. N. Engl. J. Med. 2006, 355, 2408)). Однак, незважаючи на постійне лікування з використанням іматинібу, у деяких пацієнтів з ХГЛ спостерігаються рецидиви на заключній фазі або на стадії бластної кризи внаслідок несприйнятливості до ліків. Обгрунтуванням несприйнятливості до ліків на молекулярному рівні є виникнення мутантів, стійких до впливу іматинібу в кіназном домені Bcr-Abl білка. Зараз відомо більше 22 мутантів, серед яких найбільш поширеними є M244V, G250E, Q252H, Y253H, E255K, E255V, F 311L, T351I, F317L, F359V, V379I, L387M, H396P, H396R та ін(Нарди та ін (Nardi, et al. Curr. Opin. Hema tol.2004, 11, 35)). c-Kit (CD117, рецептор фактора стовбурових клітин), який кодується с-kit протоонкогенів, є рецептор фактора росту з тірозінкіназной активністю. Він може активуватися при зв'язуванні з фактором стовбурових клітин (SCF). Мутації в c-kit призводять до постійної активації функції cKit тирозинкінази, яка далі призводить до активності тирозинкінази незалежно від лігандів, аутофосфорілірованію с-Kit і порушення клітинної проліферації. Сверхекспрессія і мутації c-Kit виявлені в більшості гастроінтестинальних стромальних пухлинах (ГІСО). Гастроінтестинальні стромальні пухлини є серією мезенхімальних пухлин, які можуть виникати з попередників клітин тканин шлунково-кишкового тракту. Головним чином, вони виникають у населення середнього та старшого віку. Приблизно 70 % пухлин виникають у шлунку, 20-30 % пухлин - у тонкому кишечнику і менше 10 % - в стравоході, ободової і прямої кишці. Добре відомо, що гастроінтестинальні стромальні пухлини є стійкими до впливів класичної хіміотерапії, проте відносно ефективним є інгібування c-Kit за допомогою іматинібу, оскільки передбачається, що cKit грають вирішальну роль в патогенезі даних хвороб (Джоенсу та інJoensuu et al. N. En gl.J. Med. 2001, 344, 1052). С-Kit сверхекспрессіруются і мутує і при інших різних видах раку, включаючи мастоціт, нейробластів, Герміна, меланому, багатоклітинний рак легені, рак грудей, оофорит і гостру лейкемію мієлоїдну (див.Едлінг та ін.Edlin g et al.Int. J. Biochem. Cell Biol. 2007, 39, 1995; Lennartsson et al.Curr. Cancer Drug Targets, 2006, 6, 65). Крім участі у розвитку ракових захворювань, SCF/c-Kit також пов'язані з аутоімунними або запальними захворюваннями. SCF експресуються різними структурними та запальними клітинами дихальних шляхів. Велика кількість шляхів активується шляхом комбінації SCF і c-Kit, включаючи шляхи, які використовують фосфоінозитиду-3-кіназу (PI3), фосфоліпазу С (PLC)гама, Src протеїн, Янус-кіназу (JAK)/переносники сигналу і активатори транскрипції (STAT), а також мітоген-активована протеинкиназу (MAP). Суппресія SCF/c-Kit шляху може істотно знизити рівень гістаміну, зменшити пенентрацію тучних клітин і еозинофілів, знизити вивільнення інтерлейкіну (IL)-4 і підвищену біологічну активність дихальних шляхів. Тому SCF/cKit є потенційним об'єктом впливу, контролюючим гладкі клітини і еозинофіли, а також 1 UA 106057 C2 5 10 15 20 25 30 35 40 контролюючим активацію аутоімунних, запальних захворювань, включаючи дерматити, ревматоїдний артрит, алергічний риніт, астму, анкілозуючий спондиліт, псоріаз і хвороба Крона (див.Ребер та ін.Reber et al. Eur. J. Pharmacol. 2006, 533, 327; Paniagua et al. Nat. Clin. Prac. Rheum. 2007, 3, 190). Рецептори фактору росту тромбоцитів (PDGFR), такі як PDGFR-α і PDGFR-β, є трансмембранним тірозінкіназними рецепторами, ліганди яких утворені двома ланцюгами (PDGF-A), або двома ланцюгами B (PDGF-B), або гетеродімер одного ланцюга A і одного ланцюга B (PDGF-AB). Рецептори фактору росту тромбоцитів зазнають димеризації при зв'язуванні лігандів, з наступною активацією тирозинкінази і передачею сигналу по низхідній. Вивчення на тваринах in vivo-на PDGFs і PDGFRs показали, що PDGFR-α сигналізація грає роль в розвитку гаструляції, мозкових і серцевих гангліонарних пластин, гонад, легких, кишкового тракту, шкіри, центральної нервової системи та кісток. Також відома роль сигналізування PDGFR-β в ангіогенезі і ранньому гемопоез. Сигналізація рецепторів фактору росту тромбоцитів також пов'язана з іншими різними захворюваннями. Аутокрінная активація шляхів сигналізації факторів зростання пов'язана з деякими видами гліоматоза дрібних кровоносних судин, мієлопроліферативні синдромами, пухлинами, множинної мієломи, а також саркомою, включаючи вибухаючої дерматофібросаркому. Паракрінной сигналізування факторів росту зазвичай виявляється при епітеліальних раку. Він ініціює інгаляцію матриці, і може брати участь в епітеліально-мезенхімальних переході і тому мати вплив на розвиток пухлин, анігіогенеза, інвазію і метастаз. Фактори зростання тромбоцитів зумовлюють органічні паталогические зміни судинних захворювань, таких як артероматоз, стеноз артерії, легенева гіпертензія, хвороби сітківки, а також гепатофібрози, включаючи легеневий інтестинального фіброз, цироз печінки, склеродермію, гломерулосклероз та фіброз міокарда (див. Андрае та ін (Andrae et al.Gene Dev. 2008, 22, 1276)). Тому, сверекспрессія PDGFR може допомогти запобігти і лікувати вищезгадані захворювання. Крім того, сверхекспрессія PDGFR може також допомогти в лікуванні різних аутоімунних і запальних хвороб, включаючи діабет, зокрема діабет типу I, ревматоїдний артіт, псоріаз, хвороба Крона та ін(Паніагуа та ін.(Paniagua et al. Nat. Clin. Prac. Rheum. 2007, 3, 190; Louvet et al. Proc. Natl. Acad. Sci. USA, 2008, 105, 18895)). Винахід також належить до нового типу похідних дигідроінденаміду, які можуть пригнічувати активність протеїнкінази, особливо однієї або декількох кіназ, описаних вище. Дані сполуки, тому, будуть корисними при запобіганні або лікуванні захворювань, пов'язаних з порушенням або розладом активності протеїнкінази, особливо в разі захворювань, пов'язаних з порушенням активності Abl, Bcr-Abl, c-Kit і PDGFR протеїнкінази. Короткий опис винаходу Винахід являє собою сполуки Формули I: R 1a; Формула I або їх фармацевтично прийнятні солі, або проліки, де: 1 R є насиченою циклічної аміногрупою, яка може необов'язково бути заміщена 1, 2, 3 або 4 1a a 45 50 55 a b c R є Н, галоген, ціаногрупу, С1-6 алкіл, С1-6-гідроксіалкіл, С1-6-галоалкіл, С1-6-ціаноалкіл, OR , SR , NR R , d b d b c d a d NR C (O) R , NR S (O)2 R , C (O) NR R , C (O) R , C (O) OR , S (O)2 R , C2-6 алкенів, C2-6 Алкіної, арил, гетероаріл, циклоалкіл, або гетероциклоалкіл, де вказаний C 1-6 алкіл, C2-6 алкенів, C2-6 Алкіної, арил, гетероаріл, циклоалкіл і гетероциклоалкіл можуть бути необов'язково a a b c b заміщені 1, 2 або 3 групами незалежно вибраними з ціаногрупи, галогену, OR , SR , NR R , NR d b d b c b c, d, a, d, (CO) R , NR S (O)2 R , C (O) NR R , S (O)2 NR R C (O) R C (O) OR S (O)2 R C1-6 галоалкіла, C1-6 гідроксіалкіл, C1-6 ціаноалкілу, аріла, гетероарілу, циклоалкілу і гетероциклоалкілу.Інакше, 1a дві групи R разом з приєднаними до них атомами можуть утворювати циклоалкіл або гетероциклоалкіл 3, 4, 5, 6 або 7-членного кільця, і можуть необов'язково бути заміщені 1, 2 або a a b c b d 3 групами, обраними незалежно з ціаногрупи, галогену, OR , SR , NR R , NR (CO)R , b d b c b c d, a d NR S(O)2R , C(O) NR R , S(O)2 NR R , C(O)R C(O)OR , S(O)2R , C1-6 галогеналкілу, C1-6 гідроксіалкіл, C1-6 ціаноалкілу, C2-6 алкенів, C2-6 алкіну, арілу, гетероарілу, циклоалкілу і гетероциклоалкілу; 2 a a b c R є H, галоген, ціаногрупу, OR , SR , NR R , C1-6 алкіл, C1-6 гідроксіалкіл, C1-6 галогеналкіл, 2 C1-6 ціаноалкіл, C2-6 алкенів, C2-6 алкінів; Інакше, дві R групи разом з приєднаними до них атомами можуть утворювати циклоалкіл і гетероциклоалкіл, що представляє собою 3, 4, 5, 6 b 2 UA 106057 C2 5 10 15 20 25 30 35 40 45 50 55 або 7-членні кільце, і можуть бути необов'язково заміщені 1, 2 або 3 групами, обраними a a b c b d b d b c незалежно з ціаногрупи, галогену, OR , SR , NR R , NR (CO)R , NR S(O)2R , C(O) NR R , S(O)2 b c d a d NR R , C(O)R , C(O)OR , S(O)2 R , C1-6 галогеналкілу, C1-6 гідроксіалкіл, C1-6 ціаноалкілу, C2-6 алкенів і C2-6 алкінів; 3 a a b c R є H, галогеном, ціаногрупой, OR , SR , NR R , C1-6 алкіл, C1-6 гідроксіалкілом, C 1-6 галогеналкіли, C1-6 ціаноалкілом, C2-6 алкенілом, C2-6 алкінілом, циклоалкілом або 3 гетероциклоалкілом. Інакше, дві R групи разом з приєднаними до них атомами можуть утворювати циклоалкіл і гетероциклоалкіл 3, 4, 5, 6 або 7-членні кільце, і можуть бути a необов'язково заміщені 1, 2 або 3 групами, обраними незалежно з ціаногрупи, галогену, OR , a b c SR , NR R , C1-6 алкіла, C1-6 галогеналкілу, C1-6 гідроксіалкіл, C1-6 ціаноалкілу, C2-6 алкенів і C 2-6 алкінів; WX є амідним зв'язком; 4; Y є гетероарілом, який може бути необов'язково заміщений на 1, 2 або 3 R Z є гетероциклоалкілом або гетероарілом, який може бути необов'язково заміщений 1, 2 або 5 3R ; 4 5 a a b c R і R незалежно один від одного обирають з галогену, ціаногрупи, OR , SR , NR R , C1-6 b алкіла, C1-6 гідроксіалкіл, C1-6 галогеналкілу, C1-6 ціаноалкілу, C2-6 алкенів, C2-6 Алкіної, NR (CO) d b c b d b c d a d, R , C(O)NR R , NR S(O)2R , S(O)2 NR R , C(O)R , C(O) OR , S(O)2 R циклоалкілу, 4 5 гетероциклоалкілу, арилу і гетероарилу. Альтернативно, дві R або дві R групи, разом з приєднаними до них атомами можуть утворювати циклоалкіл або гетероциклоалкіл, що представляє собою 5, 6 або 7-членне кільце, і можуть необов'язково бути заміщені 1, 2 або 3 a a b c групами, незалежно вибраними з галогену, ціаногрупи, OR , SR , NR R , C1-6 алкіла, C1-6 галогеналкілу, C1-6 гідроксіалкіл, C1-6 ціаноалкілу, C2-6 алкенів і C2-6 алкінів; a b c d R , R , R і R незалежно один від одного обирають з H, C1-6 алкіла, C1-6 галогеналкілу, C1-6 гідроксіалкіл, C1-6 ціаноалкілу, C2-6 алкенів, C2-6 алкіної, циклоалкілу, гетероциклоалкілу, аріла і b c гетероарілу; Альтернативно, R і R групи разом з приєднаними до них атомами азоту можуть утворювати гетероциклоалкіл, що представляє собою 4, 5, 6 або 7-членне кільце, і можуть бути необов'язково заміщені 1, 2 або 3 групами, незалежно вибраними з галогену, ціаногрупи, C 1-6 алкіла, C1-6 галогеналкілу, C1-6 гідроксіалкіл, C1-6 ціаноалкілу, C2-6 алкенів, C2-6 алкінів, циклоалкілу, гетероциклоалкілу, арілу і гетероарілу; n є цілим числом від нуля до чотирьох; m є цілим числом від нуля до двох. Серед багатьох сполук Формули I, а також їх солей або проліків кращими є сполуки по даному винаходу Формули II: Формула II або їх фармацевтично прийнятні солі або проліки, де: 1 R являє собою насичену циклічну аміногрупу, яку можна вибрати з піпірідініла, піперазин, піролідин, азетідініла і морфоліну, кожна з яких необов'язково може бути заміщена 1, 2, 3, або 4 1a; R 1a R є H, галоген, ціаногрупу, C1-6 алкіл, C1-6 гідроксіалкіл, C1-6 галогеналкіл, C1-6 ціаноалкіл, a a b c b d b d b c d a d OR , SR , NR R , NR C(O) R , NR S(O)2 R , C(O)NR R , C(O)R , C(O)OR , S (O)2 R , C2-6 алкенів, C2-6 алкінів, арил, гетероаріл, циклоалкіл або гетероциклоалкіл, де зазначені C 1-6 алкіл, C2-6 алкенів, C2-6 алкіної, арил, гетероаріл, циклоалкіл і гетероциклоалкіл можуть бути необов'язково a заміщені 1, 2 або 3 групами, вибраними незалежно один від одного з ціаногрупи, галогену, OR , a b c b d b d b c b c d a d SR , NR R , NR (CO)R , NR S (O)2R , C(O)NR R , S(O)2 NR R , C(O)R , C(O)OR , S(O)2R , C1-6 галогеналкілу, C1-6 гідроксіалкіл, C1-6 ціаноалкілу, арілу, гетероарілу, циклоалкілу і 1a гетероциклоалкілу; Інакше, дві R групи разом з приєднаними до них атомами можуть утворювати циклоалкіл або гетероциклоалкіл 3, 4, 5, 6 або 7-членного кільця, а також можуть бути необов'язково заміщені 1, 2 або 3 групами, вибраними незалежно один від одного з a a b c b d b d b c b c, d ціаногрупи, галогену, OR , SR , NR R , NR (CO)R , NR S(O)2R , C(O)NR R , S(O)2NR R C(O)R , a d C(O)OR , S(O)2 R , C1-6 галогеналкілу, C1-6 гідроксіалкіл, C1-6 ціаноалкілу, C2-6 алкенів, C2-6 алкіної, арілу, гетероарілу, циклоалкілу і гетероциклоалкілу; Y обирають з Піріді, піріміділа, пірідазініла, піразин, триазинов, триазолу, ізотіазоліла, імідазолу, оксазол, ізоксазол, триазолу або піразолу, а також може бути необов'язково 4; заміщений 1, 2, або 3 R 3 UA 106057 C2 5 10 15 20 25 30 35 40 45 50 Z вибирають з Піріді, піріміділа, пірідазініла, піразин, триазинов, тіазоліл, ізотіазоліла, імідазолу, оксазол, ізоксазол, триазолу, піразолу, азотистого оксазол, пірідінола, піролпіріміділа, піразол-піридил, піразол-піріміділа, хіноліну, ізохіноліну, хіназоліла, піперазиніл або 5 морфоліну, а також можуть бути необов'язково заміщені 1, 2 або 3 R ; 4 5 a a b c R і R вибирають незалежно один від одного з галогену, ціаногрупи, OR , SR , NR R , C1-6 алкіла, C1-6 гідроксіалкіл, C1-6 галогеналкілу, C1-6 ціаноалкілу, C2-6 алкенів, C2-6 Алкіної, b d, b c, b d, b c, d, a d, NR (CO)R C (O) NR R NR S (O)2R S(O)2 NR R C(O)R C(O)OR , S(O)2R циклоалкілу, 4 5 гетероциклоалкілу, аріла і гетероарілу.Інакше, дві R або R групи разом з приєднаними до них атомами можуть утворювати циклоалкіл або гетероциклоалкіл, що представляє собою 5, 6 або 7-членні кільце, а також можуть бути необов'язково заміщені 1, 2 або 3 групами, обраними a a b c незалежно з галогену, ціаногрупи, OR , SR , NR R , C 1-6 алкіла, C1-6 галогеналкілу, C1-6 гідроксіалкіл, C1-6 ціаноалкілу, C2-6 алкенів і C2-6 алкінів; a b c d R , R , R і R незалежно один від одного обирають з H, C1-6 алкіла, C1-6 галогеналкілу, C1-6 гідроксіалкіл, C1-6 ціаноалкілу, C2-6 алкенів, C2-6 Алкіної, аріла, гетероарілу, циклоалкілу і b c гетероциклоалкілу. Альтернативно, R і R разом з приєднаними до них атомами азоту можуть утворювати 4, 5, 6 або 7-членне кільце, і можуть бути необов'язково заміщені 1, 2 або 3 групами, обраними незалежно з галогену, ціаногрупи, C1-6 алкіла, C1-6 галогеналкілу, C1-6 гідроксіалкіл, C1-6 ціаноалкілу, C 2-6 алкенів, C2-6 Алкіної, аріла, гетероарілу, циклоалкілу і гетероциклоалкілу; Серед численних сполук Формули I, а також їх солей і проліків найбільш переважними сполуки за даним винаходом є сполуки Формули IIa: Формула IIa або їх фармацевтично прийнятні солі або проліки, де: 6 7 R і R незалежно один від одного обирають з H, галогену, ціаногрупи, C 1-6 алкіла, C1-6 6 7 гідроксіалкіл, C1-6 галогеналкілу, C1-6 ціаноалкілу, C2-6 алкенів, C2-6 Алкіної.Інакше, R і R разом з приєднаними до них атомами утворюють карбоцікл або гетероцикли, що представляє собою 5, 6 або 7-членного кільця, і можуть бути необов'язково заміщені 1, 2 або 3 групами, вибраними a, a, b c, незалежно один від одного з галогену, ціаногрупи, OR SR NR R C1-6 алкіла, C1-6 гідроксіалкіл, C1-6 галогеналкілу, C1-6 ціаноалкілу, C2-6 алкенів і C 2-6 алкінів; 8 b c d R є H, C1-6 алкіл, C2-6 гідроксіалкіл, C2-6 галогеналкіл, C1-6 галогеналкіл, C(O)NR R , C(O)R , a d C(O)OR , S(O)2R , C3-6 алкенів, C3-6 алкіної, арил, гетероаріл, циклоалкіл і гетероциклоалкіл.Причому зазначені C1-6 алкіл, C3-6 алкенів, C3-6 алкіної, арил, гетероаріл, циклоалкіл і гетероциклоалкіл можуть бути необов'язково заміщені 1, 2 або 3 групами, a a b c вибраними незалежно один від одного з галогену, ціаногрупи, OR , SR і NR R ; Y обирають з Піріді, піріміділа, пірідазініла, піразин, триазинов, триазолу, ізотіазоліла, імідазолу, оксазол, ізоксазол, триазолу або піразолу, а також він може бути необов'язково 4 заміщений 1, 2, або 3 R ; Z вибирають з Піріді, піріміділа, пірідазініла, піразин, триазинов, тіазоліл, ізотіазоліла, імідазолу, оксазол, ізоксазол, триазолу, піразолу, азотистого оксазол, піріндола, піролпіріміділа, піразол-піридил, піразол-піріміділа, хіноліну, ізохіноліну, хіназоліла, піперазиніл або 5 морфоліну, а також може бути необов'язково заміщений 1, 2 або 3 R ; 4 5 a, a, b c, R і R вибирають незалежно один від одного з галогену, ціаногрупи, OR SR NR R C1-6 алкіла, C1-6 гідроксіалкіл, C1-6 галогеналкілу, C1-6 ціаноалкілу, C2-6 алкенів, C2-6 алкіної, b d b c b d b c, d, a, d, NR (CO)R , C(O)NR R , NR S(O)2 R , S(O) 2 NR R C (O) R C(O)OR S (O) 2 R циклоалкілу, 4 5 гетероциклоалкілу, аріла і гетероарілу. Інакше, дві R або R групи разом з приєднаними до них атомами можуть утворювати циклоалкіл і гетероциклоалкіл, що представляє собою 5, 6 або 7членне кільце, а також можуть бути необов'язково заміщені 1, 2 або 3 групами, обраними a a b c незалежно з галогену, ціаногрупи, OR , SR , NR R , C1-6 алкіла, C1-6 галогеналкілу, C1-6 гідроксіалкіл, C1-6 ціаноалкілу, C2-6 алкенів і C2-6 алкінів; a b c d R , R , R і R незалежно один від одного обирають з H, C1-6 алкіла, C1-6 галогеналкілу, C1-6 гідроксіалкіл, C1-6 ціаноалкілу, C2-6 алкенів, C2-6 Алкіної, аріла, гетероарілу, циклоалкілу і b c гетероциклоалкілу.Інакше, R і R разом з приєднаними до них атомами азоту можуть утворювати гетероциклоалкіл, що представляє собою 4, 5, 6 або 7-членні кільце, і можуть бути 4 UA 106057 C2 5 10 15 20 25 30 35 40 45 50 необов'язково заміщені 1, 2 або 3 групами, обраними незалежно з галогену, ціаногрупи, C 1-6 алкіла, C1-6 галогеналкілу, C1-6 гідроксіалкіл, C1-6 ціаноалкілу, C2-6 алкенів, C2-6 алкіної, аріла, гетероарілу, циклоалкілу ігетероциклоалкілу; p являє собою ціле число від нуля до двох. Серед безлічі сполук Формули I, а також їх солей і проліків, іншими найбільш переважними сполуки по даному винаходу є речовини формули: Формула IIb або їх фармацевтично прийнятні солі або проліки, де: 9 10 R і R незалежно один від одного обирають з H, C1-6 алкіла, C2-6 гідроксіалкіл, C 2-6 b c, d a, d галогеналкілу, C1-6 галогеналкілу, C(O)NR R C(O)R , C(O)OR S(O)2 R , C3-6 алкенів, C3-6 алкіної, аріла, гетероарілу, циклоалкілу і гетероциклоалкілу.Причому зазначений C1-6 алкіл, C3-6 алкенів, C3-6 алкіної, арил, гетероаріл, циклоалкіл і гетероциклоалкіл незалежно один від одного a a можуть бути заміщені 1, 2 або 3 групами незалежно вибраними з галогену, ціаногрупи, OR , SR b c. 9 10 і NR R Інакше, R і R разом з приєднаними до них атомами можуть утворювати циклоалкіл або гетероциклоалкіл, що представляє собою 5, 6 або 7-членні кільце, і можуть бути a необов'язково заміщені 1, 2 або 3 групами, обраними незалежно з галогену, ціаногрупи, OR , SR a, b c, NR R C 1-6 алкіла, C 1-6 гідроксіалкіл, C 1-6 галогеналкілу, C 1-6 ціаноалкілу, C2-6 алкенів, C2-6 Алкіної, аріла, гетероарілу, циклоалкілу і гетероциклоалкілу; 11 a a b c R представляє собою H, галоген, ціаногрупу, OR , SR , NR R , C 1-6 алкіл, C1-6 гідроксіалкіл, C 1-6 галогеналкіл, C1-6 ціаноалкіл, C2-6 алкенів, C 2-6 алкінів; Y обирають з Піріді, піріміділа, пірідазініла, піразин, триазинов, тіазоліл, ізотіазоліла, імідазолу, оксазол, ізоксазол, триазолу або піразолу, а також він може бути необов'язково 4; заміщений 1, 2 або 3 R Z вибирають з Піріді, піріміділа, пірідазініла, піразин, триазинов, тіазоліл, ізотіазоліла, імідазолу, оксазол, ізоксазол, триазолу, піразолу, азотистого оксазол, пірідінола, піролпіріміділа, піразол-піридил, піразол-піріміділа, хіноліну, ізохіноліну, хіназоліла, піперазиніл або 5; морфоліну, а також він може бути необов'язково заміщений 1, 2 або 3 R 4 5 a a b c R і R вибирають незалежно один від одного з галогену, ціаногрупи, OR , SR , NR R , C1-6 алкіла, C1-6 гідроксіалкіл, C1-6 галогеналкілу, C 1-6 ціаноалкілу, C 2-6 алкенів, C 2-6 Алкіної, b d b c, NR (CO)R , C(O)NR R b d b c d a d NR S(O)2R , S(O)2 NR R , C(O)R , C(O)OR , S(O)2R , циклоалкілу, гетероциклоалкілу, аріла і 4 5 гетероарілу.Інакше, дві R або R групи разом з приєднаними до них атомами можуть утворювати циклоалкіл або гетероциклоалкіл, що представляє собою 5, 6 або 7-членні кільце, а також можуть бути необов'язково заміщені 1, 2 або 3 групами, обраними незалежно з галогену, a a b c ціаногрупи, OR , SR , NR R , C1-6 алкіла, C1-6 галогеналкілу, C1-6 гідроксіалкіл, C1-6 ціаноалкілу, C2-6 алкенів і C2-6 алкінів; a b c d R , R , R і R незалежно один від одного обирають з H, C1-6 алкіла, C1-6 галогеналкілу, C1-6 гідроксіалкіл, C1-6 ціаноалкілу, C2-6 алкенів, C2-6 Алкіної, аріла, гетероарілу, циклоалкілу і b c гетероциклоалкілу.Інакше, R і R разом з приєднаними до них атомами азоту можуть утворювати гетероциклоалкіл, що представляє собою 4, 5, 6 або 7-членні кільце, і можуть бути необов'язково заміщені 1, 2 або 3 групами, обраними незалежно з галогену, ціаногрупи, C 1-6 алкіла, C1-6 галогеналкілу, C1-6 гідроксіалкіл, C1-6 ціаноалкілу, C2-6 алкенів, C2-6 Алкіної, аріла, гетероарілу, циклоалкілу і гетероциклоалкілу; q є ціле число від нуля до трьох. Іншим об'єктом даного винаходу є спосіб регулювання активності протеїнкінази, причому зазначений спосіб включає вплив на згадану протеинкиназу зазначених вище сполук або фармацевтично прийнятних солей або їх проліків. Переважно, згадані протеїнкінази вибирають з Abl, Bcr-Abl, c-Kit і PDGFR. Також, зазначені протеїн кінази включають мутантні кінази, вибрані з мутантних Abl-кінази, Bcr-Abl кінази, c-Kit кінази і PDGFR кінази. Іншим об'єктом винаходу є використання згаданих вище сполук або їх фармацевтично прийнятних ліків для виробництва медикаментів для лікування захворювань або розладів, пов'язаних з активністю протеїнкінази або ненормальною проліферацією клітин. 5 UA 106057 C2 5 10 15 20 25 30 35 40 45 50 55 60 Ще одним об'єктом винаходу є спосіб лікування захворювань або розладів пацієнтів, пов'язаних з активністю кіназ, що включає введення ефективних доз вищезгаданих сполук або їх фармацевтично прийнятних солей або проліків пацієнтам. Детальний опис винаходу Нижче будуть описані ілюстративні приклади. Однак, дані втілення є виключно демонстраційними і не обмежують обсяг цього винаходу. Слід застосовувати такі використовуються в цьому описі визначення, якщо не вказано інше. "Галоген" включає фтор (F), хлор (Cl), бром (Br) і йод (I). "Алкіл" відноситься до лінійних або розгалуженим насиченим вуглеводневим групам. Приклади алкіл включають З 1-20 алкіл, переважно С 1-6 алкіл, такі як метил (Ме), етил (Et), пропив (такі як н-пропив і ізопропіл), бутил (такі як н-бутил, ізобутіл і тре -бутил), аміл (такі як наміл, ізоаміл і неоаміл), н-гексил і т.д.У кожній замещенной алкіл-або алкіл-замещенной групі, згаданій вище, "алкіл" має таке ж значення, як описано вище. "Гідроксіалкіл" відноситься до алкіл, заміщенням гідроксилом. "Галогеналкіл" відноситься до алкіл, заміщенням одним або кількома галогенами, таким як CН2F, CHF2, CF3, C2F5, CCl3 і т.д. "Ціаноалкіл" або "ціанозамещенний алкіл" відноситься до алкіл, заміщенням ціано-групою. "Алкен" відноситься до алкіл, що містить одну або декілька подвійних зв'язків вуглецьвуглець, таким як вініл, пропеніл, 1,3-бутадіеніл, цис-бутен, транс-бутен і т.д. "Алкіної" відноситься до алкіл, що містить одну або кілька потрійних зв'язків вуглецьвуглець, таким як ацетиленом, пропініл і т.д. "Циклоалкіл" відноситься до неароматичних вуглецевого кільцю, включаючи циклоалкіл, циклоалкеніл і циклоалкініл. Циклоалкіл може містити мноцікліческую або поліциклічну цикли (таку як 2, 3 або 4 сконденсованих кільця), включаючи спіроцікли. Циклоалкіл може містити 3-20 атомів вуглецю, а також як і 0, 1, 2 або 3 подвійних зв'язку та/або 0, 1 або 2 потрійних зв'язку. Циклоалкіл також може включати одне кільце або кілька конденсованих ароматичних кілець (тобто із загальною зв'язком), наприклад пентан, пента, гексан і подібні заміщені похідними бензолу. Циклоалкіл, що містить одну або кілька конденсованих ароматичних кілець, може бути приєднаний до інших груп через групу, що входить до складу ароматичного кільця або групу, що не входить в ароматичне кільце. Приклади циклоалкілов включають циклопропіл, циклобутіл, циклопентіл, циклогексил, циклогептіл, циклопентеніл, циклогексеніл, циклогексадіеніл, циклогептатріеніл, циклогексил, циклогептіл, циклопентеніл, циклогексеніл, циклогексадіеніл, циклогептатріеніл, адамантил і т.д. "Гетероциклоалкіл" відноситься до неароматичних кільцю, де один або кілька атомів кільця є гетероатомами, такими як N, O або S. Гетероциклоалкіл може включати моноцікліческіх або поліциклічну цикли (наприклад, містить 2, 3 або 4 конденсованих кільця), включаючи спіроцікли.Перевага приклади гетероциклоалкілов включають, але не обмежуються, азірідін, азетідін, тетрагідрофуран, тетрагідротіофена, піролідин, оксазолідін, тіазолідін, імідазолідін, ізоксазолідін, ізотіазолідін, піразолідін, морфолин, тіоморфолін, піперазин, піперидин і т.д. Гетероциклоалкіл може також включати одне гетероциклическое кільце або кілька конденсованих ароматичних кілець (тобто із загальною зв'язком), наприклад, 2, 3дігідробензофуран, 1,3-бензодіоксолан, бензо-1,4-діоксан, метілфталамід і нафталамід. Гетероциклоалкіл, що містить одну або кілька конденсованих ароматичних кілець може бути приєднаний до інших груп через угрупування, що входить в ароматичне або неароматичних кільце. "Ароматичне кільце" належить до моноцікліческіх або поліциклічними (такому як 2, 3 або 4 конденсованих кільця) ароматичного вуглеводню, такому як бензол, нафталін, антрацен, Фенантрен і т.д. "Гетеро-ароматичне кільце" належить до ароматичних гетероциклів, які мають щонайменше один або кілька гетероатомів в кільці, таких як S, O або N. Гетероароматичних кільце може містити моноцікліческіх або поліциклічну цикли (наприклад, містить 2, 3 або 4 конденсованих кільця).Будь атом азоту в гетероароматичних кільці може бути окислений з утворенням оксиду азоту. Перевага гетероароматичних кільця включають, але не обмежуються ними: піридин, піримідин, піразин, пірадізін, триазинов, фуран, тіофуран, імідазол, триазол, тетразол, тіазол, ізотіазіол, 1,2,4-тіадіазол, пірол, піразол, оксазол, ізоксазол, оксадіазол, бензофуран, бензотіофен, бензотіазол, індол, індазол, хінолін, ізохінолін, Пірін, карбазол, бензімідазол, піріндол, пірол-піримідин, піразол-піридин, піразол-піримідин і т.д. "Необов'язково" означає, що випадок або ситуація, що описуються далі можуть мати місце або можуть не мати місця. Згадане визначення включає приклади випадків чи ситуацій, що описуються в даному документі, коли вони відбуваються або не відбуваються. 6 UA 106057 C2 5 10 15 20 25 30 35 40 45 50 55 60 "Ефективна терапевтична доза" відноситься до введення ефективного кількості з'єднань формули ссавцю в разі необхідності такого лікування. Ефективна терапевтична доза може бути змінена, залежно від специфічної активності медикаменту, а також віку, фізіологічного стану, наявності інших захворювань і харчового статусу пацієнта. Крім того, визначення застосовуваної ефективної терапевтичної дози залежить від іншої можливої терапії, одержуваної пацієнтом в даний проміжок часу. "Лікування" означає будь-яку терапію для лікування захворювань ссавців, включаючи: (I) запобігання захворювання, тобто запобігання виникненню клінічних симптомів захворювання; (Ii) придушення захворювання, тобто запобігання розвитку клінічних симптомів захворювання та/або (Iii) полегшення захворювання, тобто досягнення усунення клінічних симптомів. У багатьох випадках, сполуки по даному винаходу можуть знаходиться у вигляді кислої і/або основної солі внаслідок наявності аміно та/або карбоксильної групи або подібною. "Сполуки" в цьому документі ставиться до всіх стереоізомерів, геометричних ізомерів, динамічним ізомери та ізотопів. Сполуки згідно даного винаходу може бути асиметричною, наприклад, що містить один або кілька стереоізомерів. Якщо не вказано інше, включаються всі стереоізомери, такі як Енантіомери і діастереомери. Сполуки, що містять асиметрічні заміщений атом вуглецю, можна виділити в оптично активної чистої або рацемической формі. Оптично активну форму можна виділити з рацемічної суміші, або синтезувати, використовуючи хіральні матеріали або хіральні реагенти. Сполуки згідно даного винаходу також включають динамічні ізомери. Динамічні ізомери отримують шляхом обміну між одинарної і прилеглої подвійним зв'язком, що супроводжується міграцією протона. Сполуки згідно даного винаходу також включає кінцеве сполука або його проміжне, що включає атоми ізотопів. Атоми ізотопів володіють таким же атомним номером, але розрізняються масовим числом. Наприклад, ізотопи водню включають дейтерій і тритій. Сполуки згідно даного винаходу також включають фармацевтичні прийнятні солі, одержувані шляхом конвертації основної групи вихідного сполука в форму солі. Фармацевтично прийнятні солі включають, але не обмежуються ними: неорганічні або органічні кислі солі основних груп, таких як ціанамід. Фармацевтично прийнятні солі згідно з цим документом можна синтезувати з початкової сполуки, тобто основна група вихідного сполука взаємодіє з 1-4 еквівалентами кислоти в системах розчинників. Відповідні солі перераховані в Remington's th Pharmaceutical Science, 17 ed, Mark Publishing Company, Easton, Pa, 1985, p.1418 and Journal of Pharmaceutical Science, 66, 2 (1977). Фармацевтично прийнятні солі приєднання кислоти можна отримати з неорганічних або органічних солей. Солі, одержувані додаванням кислоти можна отримати з неорганічних солей, включаючи соляну кислоту, бромоводородную кислоту, сірчану кислоту, азотну кислоту, фосфорну кислоту і т.д. Солі приєднання кислоти можна отримати з органічних кислот, включаючи оцтову кислоту, пропионовую кислоту, гліколеву кислоту, пировиноградную кислоту, щавлеву кислоту, яблучну кислоту, малонової кислоти, янтарну кислоту, малеїнову кислоту, фумарову кислоту, винну кислоту, лимонну кислоту, бензойну кислоту, коричну кислоту, мигдалеву кислоту, метансульфоновую кислоту, етілсульфоновую кислоту, толуол-псульфонова кислоту, саліцилову кислоту і т.д. Використовуваний у цьому винаході термін "фармацевтично прийнятні носії" включає будьякі і всі розчинники, дисперсні середовища, покриття, антибактеріальні або протигрибкові агенти, ізотонічні агенти або кошти, що уповільнюють абсорбцію, і подібні. Такі середовища і агенти, які використовуються в фармацевтично активних сполуках добре відомі з рівня техніки. Їх використання в терапевтичних композиціях є передбачуваним, за винятком випадків, коли якінебудь звичайні середовища або агенти є несумісними з активними речовинами. Також в композиції можна включати додаткові активні інгредієнти. Композиції, що описуються в даному документі переважно готують у вигляді одиничної лікарської форми. Термін "одинична лікарська форма" відноситься до фізично окремої одиниці одноразової дози, яка підходить для введення людині або іншій ссавцю. З метою досягнення потрібного ефективного лікування, виходячи з розташування, кожна одиниця містить заздалегідь визначену кількість активних речовин, а також відповідні підходящі фармацевтичні ексципієнти (такі як таблетки, капсули, ампули). Сполуки Формули I є ефективними в широкому діапазоні доз, і звичайно вводяться в ефективному кількості. Переважно, щодо перорального введення, кожна одиниця дози може містити від 10 мг до 2 г сполука Формули I, більш 7 UA 106057 C2 5 10 15 20 25 30 35 40 45 50 55 60 переважно від 10 до 700 мг; в той час як по відношенню до парентерального введення кожна одиниця дози може містити від 10 мг до 700 мг; більш переважно від 50 мг до 200 мг. Однак, слід підкреслити, що дійсне вводиться кількість з'єднань Формули I визначається лікарем, виходячи з певних умов, включаючи різновидвиліковує хвороби, обраний спосіб введення, конкретне сполука і його відносну активність, а також вік, масу тіла, відгук і тяжкість симптомів захворювання у пацієнта, і т.п. Для одержання твердих композицій, таких як таблетки, основні активні компоненти змішують з фармацевтичним ексципієнтами (або носіями) з утворенням твердої попередньої композиції, де міститься гомогенна суміш сполук згідно даного винаходу. Коли дану попередню композицію називають гомогенною сумішшю, мають на увазі, що активні компоненти рівномірно розподілені по всій композиції, що дозволяє легко розділити композицію на одиничні лікарські форми з однаковою ефективністю, такі як таблетки, пігулки або капсули. Таблетки або пігулки згідно даноговинаходу можуть бути покритими або сформовані в інші зразки, з метою одержання лікарської форми, що володіє перевагою продовження ефективності, або забезпечення захисту таблетки або пігулки від кислотного середовища шлунка. Наприклад, пігулка або пігулка може включати компоненти внутрішньої і зовнішньої дози, де остання існує у вигляді покриття зверху. Зазначені два типи компонентів можуть відділятися ентеросолюбільной шаром, що запобігає розпад в шлунку і дозволяє внутрішньому компоненту цілком проникнути в дванадцятипалу кишку або уповільнено вивільнятися. Як енеросолюбільного шару або покриття можна використовувати різноманітні матеріали, зазначені матеріали містять полімерні кислоти, а також суміші полімерних кислот і наступних матеріалів, таких як шелак, гексадеканол і ацетатцеллюлозе. Композиції, що використовуються для інгаляцій і інсуффляціі включають фармацевтичні прийнятні водні або органічні розчинники, або розчини і суспензії суміші, а також порошки. Рідкі або тверді композиції можуть містити відповідні фармацевтичні ексципієнти, згадані вище. Переважно, дані композиції вводяться перорально або назально з метою досягнення часткового або системного впливу. Дані композиції в бажаних фармацевтичні прийнятних розчинниках можна розпорошувати за допомогою інертних газів: розпорошується розчин можна помістити безпосередньо в пристрій для розпилення, або, пристрій розпилення можна під'єднати до дихальної масці або в імпульсний агрегат для створення позитивного тиску. Композиції розчинів, суспензій або порошків можна вводити за допомогою пристрою відповідним чином доставки лікарських форм, переважно пероральним або назальним. У цьому винаході сполуки та їх фармацевтично прийнятні солі також включають форми сольватамі або гідратів. Загалом, форми сольватамі або гідратів рівноцінні формам несольватамі і не-гідратів, і входять в обсяг цього винаходу. Деякі сполука згідно даноговинаходу можуть ймовірно існувати у вигляді полікристалів або бути аморфними. Якщо коротко, всі фізичні форми можна використовувати рівноцінно, і всі вони входять в обсяг цього винаходу. Даний винахід також включає проліків сполук. Проліки є фармацевтичне речовина, отримана з вихідного ліки, і при попаданні в організм за допомогою метаболізму переходить в початковий ліки. Проліки можна отримати шляхом введення однієї або кількох функціональних груп у вихідне ліки, які вивільниться при розпаді заміщуючих груп in-vivo. Одержання і використання проліків можна знайти в документі T. Хігучі і В. Стелла (T. Higuchi and V. Stella), "Pro-drugs as Novel Delivery Systems", Vol. 14 °F the ACS Symposium Series, and Bioreversible Carriers in Drug Design, ed.Edward B. Roche, American Pharmaceutial Association and Pergmon Press, 1987. Даний винахід також пропонує фармацевтичні композиції, що містять сполуки формули I або їх фармацевтично прийнятні солі, або проліки, і, щонайменше, один тип фармацевтичні прийнятного носія. Фармацевтичні композиції за цим винаходу можна вводити перорально, ін'єкцією, спреєм у вигляді інгаляцій, підшкірно, ректально, назально, вагінально, в черевну порожнину, у вигляді впровадження, або за допомогою трансдермального пластиру і т.д. З іншого боку, даний винахід також пропонує спосіб регулювання активності протеїнкінази за допомогою сполука Формули I. Термін "регулювання кіназной активності" в цьому описі означає зниження активності протеїнкінази в деякій мірі при впливі на кіназу сполук дігдіроінденаміда згідно даноговинаходу, у порівнянні з активністю без застосування сполук. Тому, даний винахід пропонує спосіб регулювання активності протеїнкінази шляхом впливу на протеїн сполук дигідроінденаміда. Зокрема, протеїнкінази, описані в цьому винаході, є протеїн-тирозинкінази, включаючи Abl, Bcr-Abl, c-Kit і PDGFR. Крім того, протеїнкінази у цьому винаході включають також мутантні кінази, такі як Abl і BcrAbl кінази, мутантні c-Kit кінази і мутантні PDGFR кінази. Мутантні Abl і Bcr-Abl кінази включають, 8 UA 106057 C2 5 10 15 20 наприклад, один або кілька таких мутантів: M244V, G250E, Q252H, Y 253F, Y253H, E255K, E255V, F311L, T351I, F317L, M351T, F359V, V379I, L387M, H396P, H396R і т.д. З іншого боку, даний винахід пропонує спосіб лікування захворювань або розладів, що дозволяє регулювати активність протеїнкінази. Захворювання або розлади, пов'язані з активністю протеїнкінази включають рак, запалення, аутоімунні захворювання, розлади метаболізму, інфекції, розлади центральної нервової системи, серцево-судинні захворювання і т.п. Іншим об'єктом даного винаходу є сполуки, що описуються в даному документі, які можна використовувати для лікування захворювань або розладів, пов'язаних з абнормальной проліферацією клітин, таких як рак, включаючи лейкемію, мієлопроліферативних синдром, гематоз, гастроінтестинальна стромальна пухлина, рак товстої кишки, рак грудей, рак шлунка, оофорома, рак шийки матки, рак легені, рак нирок, рак простати, рак сечового міхура, рак підшлункової залози, нейробластома, пухлина тучних клітин, пухлина мозку, гермінома, меланома, злоякісні утворення, саркома, така як вибухаючої дерматофібросаркома і т. п. Іншим об'єктом даного винаходу є можливість використання описуваних тут сполук для лікування захворювань, пов'язаних з аутоімунними розладами або запальними захворюваннями, включаючи діабет, дерматит, ревматоїдний артрит, алергічний риніт, астму, анкілозуючий спондиліт, псоріаз, хвороба Крона і т.д. Іншим об'єктом даного винаходу є можливість лікування судинних захворювань, таких як атероматоз, стеноз кровоносної судини, легенева гіпертензія, захворювання сітківки, а також фіброзів, таких як легеневий проміжний фіброз, гепатофіброз, цироз печінки, склеродермія, гломерулосклероз, фіброз міокарда і т.д. Ще одним об'єктом даного винаходу є способи одержання сполук Формули I. Сполука згідно даноговинаходу можна отримати за допомогою таких способів і процедур. 25 30 35 Схема 1 Проміжне сполука формули 1-5 можна отримати згідно зі Схемою 1. 5-бромо-2,3дигідроінден-1-он і CuCN кип'ятять в ДМФ з одержанням ціанової интермедиата 11.Интермедиат 1-1 можна відновити в проміжне сполука 1-2, що є спиртом, взаємодією з відновником, таким як борогідрід натрію в розчиннику, такому як метанол. Проміжне сполука 1-2 може взаємодіяти з тіонілхлоридом, що призведе до утворення хлор-групи, яку можна замістити циклічної аміногрупой у присутності триетиламіну або карбонату калію з одержанням интермедиата 1-4. Ціаногрупу в інтермедіату 1-4 можна піддати гідролізу з утворенням карбонової кислоти, яку далі обробляють метанолом і тіонілхлоридом з одержанням сполука 15. Два енантіомеру сполука 1-4 або сполуки 1-5 можна розділити хіральні високоефективної рідинної хроматографією або кристалізацією з використанням камфорсульфоновой кислоти. 40 9 UA 106057 C2 5 10 15 20 25 30 35 40 Схему 2). В іншому випадку, R1-заміщених 2,3-дигідроінденовую карбонову кислоту (або її ефір) можна отримати способом, зображеним на Схемі 2. 5-бром-2,3-дигідроінден-1-он можна відновити в проміжне спиртове сполука 2-1 взаємодією з відновником, таким як борогідрід натрію в розчиннику типу метанолу. Після гідрокси-групу проміжного сполука 2-1 можна перевести в хлоро-групу за допомогою тіонілхлориду, хлорид 2-2 можна замістити циклічної аміногрупой, використовуючи триетиламін або карбонат калію в якості підстави з одержанням интермедиата 2-3. Интермедиат 2-3 взаємодіє з СВ в присутності паладію, наприклад діацетату паладію/1,3біс-(фенілфосфін) пропану (дппп) або біс-(тріфенілфосфін) паладій дихлорида (II) [(PPh 3)2 PdCl2] в якості каталізатора з утворенням проміжного сполука формули 2-4 у вигляді суміші двох енантіомерів.Якщо R в з'єднанні 2-4 є Н, сполука 2-4 можна отримати взаємодією сполуки 2-3 з бутиллітій, з подальшим гасінням діоксидом вуглецю. Сполука 2-3 і два енантіомеру сполука 2-4 можна розділити хіральні високоефективної рідинної хроматографією, або способами з використанням хіральних кислот, таких як кристалізація за допомогою камфорсульфокіслоти. Схема 3 Кінцеві сполуки формули 3-4 можна отримати, як показано на Схемі 3. Карбоновий ефір интермедиата 3-1 можна піддати лужному гідролізу, наприклад в присутності гідроксиду натрію, з утворенням карбонової кислоти 3-2, яку далі конденсують з похідним аніліну, отримуючи кінцеве сполука формули 3-4 за допомогою сполучного агента, такого як бензотриазол-1ілоксітріс (диметиламіно) фосфония гексафторфосфат (БОФ) або О-(7-азабензотріазол-1-іл) N, N, N `, N` - тетраметілуроній гексафторфосфат (гату). Крім того, карбоновий кислоту 3-2 можна обробити тіонілхлоридом, отримавши хлорид кислоти 3-3, який далі взаємодіє з похідним аніліну, з утворенням сполуки формули 3-4. Кінцеві сполуки формули 3-4 можна також отримати реакцією між ефіром 3-1 і похідних аніліну в присутності тріалкілалюмінія типу тріметілалюмінія або триетилалюмінію як сполучний агент. Приклад 1 Получение 1-(4-метилпіперазин-1-ил)-N-(4-метил-3-[(4-піридін-3-ілпіримідин-2ил)аміно]феніл)-2,3-дигідро-1H-інден-5-карбоксамид. Стадія A: 1-оксо-2,3-дигідро-1H-інден-5-карбонітріл 5-бромо-2,3-дигідро-1 H-Индин-1-он (21,1 г, 100 моль) і ціанід міді (17.9 г 200 моль) змішали в 200 мл диметилформаміді і перемішували протягом ночі при 140ºC. Після того, як розчин охолодили до кімнатної температури, додавали 500 мл етилацетату і осад відфільтрували з 10 UA 106057 C2 5 10 використанням кизельгуру. Осад промивали кілька разів етилацетату. Об'єднаний фільтрат двічі промивали 1 Н соляною кислотою і далі тричі сольовим розчином, після сушили над безводним сульфатом магнію, відфільтровували і концентрували. Неочищений продукт очищали на силікагелі, елюіруя сумішшю етилацетат / гексан (1:2), з одержанням 7,9 г необхідного сполука (50 % вихід). Дані мас-спектроскопії MS (M+1) = 158,05. Стадія B: 1-гідрокси-2,3-дигідро-1 H-інден-5-карбонітріл 1-оксо-2,3-дигідро-1 H-інден-5-карбонітріл (7,85 г, 50 моль) розчиняли в 50 мл метанолу.До суміші поступово додавали боргідрид (2,3 г, 60 моль) протягом 30 хв. Після 2 години перемішування розчин концентрували. Залишок розчиняли в етилацетаті, і одержаний розчин двічі промивали бікарбонатом натрію, потім тричі сольовим розчином і сушили над сульфатом магнію, далі фільтрували і концентрували, з одержанням 8 г бажаного сполука (100 % вихід). Дані мас-спектроскопії MS (M+1) = 160,07. 15 Стадія C: 1 - (4-метілпіперазін-1-іл) - 2,3-дигідро-1H-інден-5-карбонітріл 20 25 30 35 40 1-гідрокси-2,3-дигідро-1 H-інден-5-карбонітріл (4,77 г, 30 моль) розчиняли в 10 мл дихлорметан. При охолодженні льодом додавали по краплях тіонілхлориду (6,6 мл, 90 моль) протягом 15 хвилин. Розчин після перемішування протягом 3 годин концентрували. Залишок розчиняли в етилацетаті, і одержаний розчин тричі промивали охолодженим сольовим розчином, сушили над безводним сульфатом магнію та концентрували з одержанням 1-хлор2,3-дигідро-1 H-інден-5-карбонітріла. Одержаний 1-хлор-2,3-дигідро-1 H-інден-5-карбонітріл розчиняли в 80 мл ацетонітрилу і далі додали 1-метил піперазин (6 г, 60 моль) і карбонат калію (4,14 г, 30 моль).Після розчин перемішували протягом ночі при 60 º C, ацетонитрил видаляли концентруванням при зниженому тиску. Далі додавали етилацетат. Одержаний розчин тричі промивали сольовим розчином, сушили над сульфатом магнію, концентрували і очищали на силікагелі, використовуючи як елюента 5 % метанол/дихлорметан, отримавши, таким чином, 4,3 г цільового сполука (вихід 60 %). Дані мас-спектроскопії MS (M+1) = 242,16. Стадія D: Метил 1 - (4-метілпіперазін-1-іл) -2,3-дигідро-1 H-інден-5-карбоксилат 1 - (4-метілпіперазін-1-іл) -2,3-дигідро-1 H-інден-5-карбонітріл (2,41 г, 10 моль) розчиняли в 10 мл 2 N розчину гідроксиду натрію.Розчин перемішували протягом ночі при 100 º C і потім концентрували. Одержаний після вакуумної перегонки залишок розчиняли в 30 мл метанолу. По краплях при перемішуванні протягом 1 години додавали тіонілхлориду (3,3 мл). Суміш кип'ятили зі зворотним холодильником протягом ночі і потім концентрували. Спершу додавали воду, далі для перекладу розчину в основний додавали карбонат калію. Розчин тричі екстрагували етилацетату. Об'єднані екстракти промивали сольовим розчином, сушили над сульфатом магнію, потім концентрували. Далі виконували очищення на сілікагелевой колонці, використовуючи як елюента 5 % метанол/дихлорметан, отримавши 2,1 г (вихід 77 %) цільового речовини. Дані мас-спектроскопії MS (M+1) = 275,17. Стадія E: Одержання 1-(4-метілпіперазін-1-іл)-N-(4-метил-3-[(4-піридин-3-іл 11 UA 106057 C2 5 10 15 20 25 30 35 Метил 1 - (4-метілпіперазін-1-іл) -2,3-дигідро-1 H-інден-5-карбоксилат (1,37 г, 5 моль) і та ін(Szakacs et al).J. Med. Chem. 2005, 48:249) (1,66 г, 6 моль) розчиняли в 30 мл толуолу. Далі додавали 2 M розчин тріметілалюмінія в толуолі (5 мл, 10 моль) і суміш перемішували протягом ночі при 50 º C. Реакція пройшла не повністю. Далі додавали іншу порцію 2 M тріметілалюмінія в толуолі (3 мл, 6 моль). Суміш охолоджували в льоду і перемішували протягом ночі при 60 º C. При перемішуванні додавали водний розчин насичений тартрату калію і натрію (50 мл). Розчин екстрагували діхлорметаном (3 × 100 мл).Об'єднані екстракти промивали бікарбонатом натрію (100 мл) і далі сольовим розчином (2 × 100 мл), сушили над сульфатом магнію, потім концентрували. Очищення проводили на сілікагелевой колонці, використовуючи як елюента 50 % етілацетат/діхлорметаен/5-10 % триетиламіну, з одержанням 1,5 г цільового сполука 1 (вихід 58 %). Дані мас-спектроскопії MS(M+1)=520,27. HЯМР (ДМСО (диметилсульфоксид)-d 6, ppm): δ10, 10 (s, 1H); 9,20 (s, 1H); 8,95 (s, 1H); 8,62 (d, J=4, 8 Гц, 1H); 8,42 (d, J=4,8 Гц, 1H); 8,40 (d, J=9,0 Гц, 1H); 8,00 (s, 1H); 7, 75 (s, 1H); 7,72 (d, J=9,0 Гц, 1H); 7,45 (dd, J=8,2 Гц, 4,8 Гц, 1H); 7,40 (d, J=8,0 Гц, 1H); 7,38 (d, J=4,8 Гц, 1H); 7,28 (d, J=9,0 Гц, 1H); 7,15 (d, J=9,0 Гц, 1H); 4,26 (t, J=9,0 Гц, 1H); 2,2-2,9 (m, 1H); 2,15 (s, 3H); 2,08 (s, 3H); 2,0 (m, 2H). Приклад 2 Одержання трет-бутил Стадія A: 5-бром-2,3-дигідро-1 H-інден-1-ол 5-бром-2,3-дигідро-1 H-інден-1-он (210 г, 1000 моль) суспендованих в 1 л метанолу, далі поступово протягом 1 години додавали боргідрид натрію (41,6 г, 1100 моль) при перемішуванні.Розчинник упаривали при 50 º C і зниженому тиску, після перемішування продовжували ще протягом 1 години.Далі додавали етилацетат (1 л), потім додавали насичений розчин бікарбонату натрію (500 мл). Перемішування продовжували протягом деякого часу, далі розчин переносили в ділильну воронку, водну фазу видаляли. Органічну фазу двічі промивали насиченим розчином бікарбонату натрію і двічі сольовим розчином, потім сушили (сульфат магнію) і, нарешті, концентрували, з одержанням 198 г (93 %) цільового речовини. Стадія B: 5-бром-1-хлор-2,3-дигідро-1 H-інден 5-бром-2,3-дигідро-1 H-інден-1-ол (198 г, 934 моль) розчиняли в 500 мл дихлорметан. При охолодженні льодом по краплях протягом 2 годин до розчину в діхлорметане додавали тіонілхлориду (275 мл, 3770 моль). Розчин концентрували при 30 º C і зниженому тиску і потім перемішували протягом 2 годин при кімнатній температурі. Залишок розчиняли в етилацетаті (1 л), і одержаний розчин промивали крижаною водою (3 × 500 мл), потім сольовим розчином (2 × 300 мл), сушили над сульфатом магнію, потім концентрували з одержанням 5-бром-1-хлор-2,3дигідро-1 H-індена. Стадія C: трет-бутил 4 - (5 - бром-2,3-дигідро-1 H-інден-1-іл) піперазин-1-карбоксилат 12 UA 106057 C2 5 10 15 20 25 30 5-бром-1-хлор-2,3-дигідро-1 H-інден (10г, 43моль) розчиняли в 80 мл ацетонітрилу, далі додавали трет-бутил піперазин-1-карбоксилат (9,7 г, 52 моль) і потім карбонат натрію (4,8г, 45 моль). Суміш перемішували протягом ночі при 60 º C. Нерозчинний залишок відокремлювали фільтрацією, далі фільтрат концентрували. Залишок відокремлювали на сілікагелевой колонці, використовуючи як елюента етилацетат/гексан (1:2 до 1:1), з одержанням 12 г (вихід 72 %) цільового сполука.Дані мас-спектроскопії MS (M+1) = 381,11, 383,11. Стадія D: трет-бутил 4 - [5 - (етоксикарбоніл) -2,3-дигідро -1 H-інден-1-іл) піперазин-1карбоксилат трет-бутил 4 - (5-бром-2,3-дигідро-1H-інден-1-іл) піперазин-1-карбоксилат (11 г, 28,87 моль) розчиняли в етанолі (50 мл), потім додавали диметилсульфоксид (5 мл) і триетиламін (5 мл). Систему вакуумовані і заповнювали N2. Додавали ацетат паладію (2 г) і 1,3-біс (діфенілфосфіно) пропан (3 г). Систему вакуумовані і заповнювали N 2.Систему знову вакуумовані і перемішували при 100ºC протягом 24 годин з підключеними балонами СО. Після охолодження до кімнатної температури, суміш відфільтровували за допомогою кизельгуру, який далі ретельно промивали етанолом.Фільтрат концентрували. Залишок розчиняли в етилацетаті (500 мл), одержаний розчин промивали сольовим розчином (3 × 200 мл), сушили над сульфатом магнію, концентрували і, нарешті, відокремлювали на сілікагелевой колонці, використовуючи як елюента етилацетат / гексан (1:2 до 1: 1), з одержанням 8,5 г (вихід 79 %) цільового сполука. Дані мас-спектроскопії MS (M+1) = 375,22. Стадія E: 1 - [4 - (BOC) піперазин-1-іл] -2,3-дигідро-1 H-інден-5-карбонова кислота Трет-бутил (8 г, 21,36 моль) розчиняли в 20 мл метанолу, додавали 30 мл гідроксиду натрію (1 Н).Розчин перемішували протягом ночі при кімнатній температурі і ще дві години при 50 º C, потім концентрували.Залишок розчиняли у воді (50 мл) і одержаний розчин підкислюють до pH 5 за допомогою 1 Н розчину HCl, далі екстрагували етилацетат (3 × 100 мл).Екстракти об'єднували, сушили над сульфатом магнію, далі концентрували з одержанням цільового сполука. Дані мас-спектроскопії MS (M+1) = 347,19. Стадія F: трет-бутил 4-{5-[({4-метил-3-[(4-піридін-3-ілпіримідин-2ил)аміно]феніл}аміно)карбоніл]-2,3-дигідро-1H-інден-1-іл}піперазин-1-карбоксилат 13 UA 106057 C2 5 10 15 20 25 30 1 - [4 - (BOC) піперазин-1-іл] -2,3-дигідро-1 H-інден-5-карбоновий кислоту (7,4 г, 21,36 моль) і 4-метил-N (3) - [(4-піридин-3-ілпірімідін-2-іл) феніл-1,3-діамін (6,1 г, 22 моль) розчиняли в 20 мл N, N-диметилформамід. Додавали триетиламін (8,9 мл, 64 моль) і O-(7-азабензотріазол-1-іл)-N, N, N ', N'-тетраметілуроній гексафторфосфата (9,5 г, 25 моль). Розчин перемішували протягом ночі при кімнатній температурі, потім додавали сольовий розчин (100 мл) і етилацетат (200 мл). Водну фазу видаляли, шар етилацетату промивали сольовим розчином (3 × 100 мл). Далі розчин сушили над сульфатом магнію, концентрували і, нарешті, очищали на сілікагелевой колонці, використовуючи як елюента метанол / метанхлорид (1:2 до 1:1), з одержанням 9,5 г 1 (вихід 73 %) зазначеного сполука. Дані мас-спектроскопії MS (M+1)=606,31. HЯМР (ДМСО-d 6, ppm): δ10, 15 (s, 1H); 9,25 (s, 1H); 8,99 (s, 1H); 8,67 (d, J=4,8 Гц, 1H); 8,50 (d, J=5,2 Гц, 1H); 8,46 (d, J=8,4 Гц, 1H); 8,05 (s, 1H); 7,78 (s, 1H); 7,76 (d, J=8,0 Гц, 1H); 7,50 (dd, J=8,0 Гц, 4,8 Гц, 1H); 7,46 (d, J=8, 4 Гц, 1H); 7,41 (d, J=5,2 Гц, 1H); 7,38 (d, J=7,6 Гц, 1H); 7,18 (d, J=8,8 Гц, 1H); 4,35 (t, J=7,2 Гц, 1H); 3,30 (m, 3H); 3,05 (m, 1H); 2,08 (s, 2H) 2, 42 (m, 2H); 2,30 (m, 2H); 2,20 (s, 3H); 2,04 (m, 2H); 1,36 (s, 9H). Приклад 3 Одержання N-(4-метил-3-[(4-піридін-3-ілпіримідин-2-ил)аміно]феніл)-1-піперазин-1-ил-2,3дигідро-1H-інден-5-карбоксамид трет-бутил 4 - {5 - [({4-метил-3-[(4-піридин-3-ілпірімідін-2 карбоксилат (2 г, 3,3 моль) розчиняли в 4 Н розчині HCl в діоксанів (10 мл).Після перемішування при кімнатній температурі протягом 3 годин розчин концентрували з одержанням твердого продукту. Продукт (100 мг) очищали високоефективної рідинної хроматографією при pH=10 з одержанням цільового 1 продукту. Дані мас-спектроскопії MS (M+1) = 506,26. HЯМР (ДМСО-d 6, ppm): δ10, 08 (s, 1H); 9,20 (s, 1H); 8,93 (s, 1H); 8,62 (d, J=4,8 Гц, 1H); 8,44 (d, J=5,2 Гц, 1H); 8,40 (d, J=8,0 Гц, 1H); 8,00 (s, 1H); 7,72 (s, 1H); 7,70 (d, J=8,0 Гц, 1H); 7,45 (dd, J=8,2 Гц, 4,8 Гц, 1H); 7,41 (d, J=8, 2 Гц, 1H); 7,36 (d, J=5,2 Гц, 1H); 7,31 (d, J=8,0 Гц, 1H); 7,12 (d, J=8,8 Гц, 1H); 4,22 (t, J=6,8 Гц, 1H); 2,80 (m, 2H); 2,60 (m, 4H); 2,35 (m, 2H) 2, 22 (m, 2H); 2,15 (s, 3H); 2,00 (m, 2H). Приклад 4 Одержання 1-(4-етилпіперазин-1-ил)-N-(4-метил-3-[(4-піридін-3-ілпіримідин-2ил)аміно]феніл)-2,3-дигідро-1H-інден-5-карбоксамиду 14 UA 106057 C2 5 10 15 20 25 тетрагідрохлорид (100 мг, 0,15 моль) розчиняли в ДМФ (2 мл), далі додавали триетиламін (101 мг, 1 моль), а потім ацетальдегід (26 мг, 0.6 моль).Після розчин перемішували протягом 20 хвилин, далі додавали тріацетоксіборгідрід (128 мг, 0,6 моль). Одержаний розчин перемішували протягом ночі при кімнатній температурі, потім очищали високоефективної рідинної хроматографією при pH=10 з одержанням 50 мг (вихід 63 %) цільового сполука. Дані мас1 спектроскопії MS (M+1) = 523,29. HЯМР (ДМСО-d 6, ppm): δ10, 14 (s, 1H); 9,25 (s, 1H); 8,98 (s, 1H); 8,67 (d, J=4,8 Гц, 1H); 8,49 (d, J=5,2 Гц, 1H); 8,46 (d, J=8,6 Гц, 1H); 8,05 (s, 1H); 7,77 (s, 1H); 7,75 (d, J=8,8 Гц, 1H); 7,50 (dd, J=8,0 Гц, 4,8 Гц, 1H); 7,46 (d, J=8, 2 Гц, 1H); 7,41 (d, J=5,2 Гц, 1H); 7,35 (d, J=7,6 Гц, 1H); 7,17 (d, J=8,8 Гц, 1H); 4,31 (t, J=6,8 Гц, 1H); 2,2-3,0 (m, 12H); 2,20 (s, 3H); 2, 03 (m, 2H); 0,95 (t, J=7,0 Гц, 3H). Приклад 5 Одержання 1-(4-ізопропілпіперазин-1іл)-N-(4-метил-3-[(4-піридін-3-ілпіримідин-2іл)аміно]феніл)-2,3-дигідро-1H-інден-5-карбоксаміду тетрагідрохлорид (100 мг, 0.15 моль) розчиняли в ДМФ (2 мл), далі додавали триетиламін (101 мг, 1 моль), потім ацетон (35 мг, 0,6 моль).Після розчин перемішували протягом 20 хв, потім додавали тріацетоксіборгідрід натрію (128 мг, 0.6 моль). Одержаний розчин перемішували протягом ночі при кімнатній температурі і далі очищали високоефективної рідинної хроматографією при pH=10 з одержанням 58 мг (вихід 71 %) зазначеного сполука. Дані мас1 спектроскопії MS (M+1) = 548.31. HЯМР (ДМСО-d 6, ppm): δ10, 14 (s, 1H); 9,26 (s, 1H); 8,98 (s, 1H); 8,67 (d, J=4,8 Гц, 1H); 8,49 (d, J=4,8 Гц, 1H); 8,46 (d, J=8,4 Гц); 8,05 (s, 1H); 7,77 (s, 1H); 7,74 (d, J=8,0 Гц, 1H); 7,51 (dd, J=8,0 & 4,8 Гц, 4,8 Гц, 1H); 7,46 (d, J=8,2 Гц, 1H); 7,41 (d, J=5,2 Гц, 1H); 7,35 (d, J=7,6 Гц, 1H); 7,17 (d, J=8, 4 Гц, 1H); 4,30 (t, J=7,0 Гц, 1H); 2,91 (m, 12H); 2,81 (s, 3H); 2,32,6 (m, 9H); 2,02 (m, 2H); 0,92 (t, J=6,4 Гц, 6H). Приклад 6 Одержання 1-[4-(2-гідроксиетилпіперазин-1-іл)-N-(4-метил-3-[(4-піридін-3-іл пиримидин-2іл)аміно]феніл)-2,3-дигідро-1H-інден-5-карбоксаміду 15 UA 106057 C2 5 10 15 20 25 тетрагідрохлорид (100 мг, 0,15 моль) розчиняли в ДМФ (2 мл), далі додавали триетиламін (101 мг, 1 моль) і {[трет-бутил (диметил) сіліл] оксо} ацетальдегід (100 мг, 0,6 моль).Після розчин перемішували протягом 20 хвилин, потім додавали тріацетоксіборгідрід натрію (128 мг, 0,6 моль). Одержаний розчин перемішували протягом ночі при кімнатній температурі, далі очищали високоефективної рідинної хроматографією. Висушений продукт розчиняли в 2 мл дихлорметан / 2 мл тріфторуксусной кислоти. Розчин концентрували після перемішування протягом ночі і очищали високоефективної рідинної хроматографією при pH=10 з одержанням 1 38 мг (вихід 46 %) цільового сполука. Дані мас-спектроскопії MS (M+1) = 550,29. HЯМР (ДМСОd 6, ppm): δ10, 16 (s, 1H); 9,23 (s, 1H); 8,97 (s, 1H); 8,65 (d, J=4,4 Гц, 1H); 8,48 (d, J=6,0 Гц, 1H); 8,46 (d, J=4,8 Гц); 8,02 (s, 1H); 7,82 (m, 2H); 7,51 (m, 1H); 7,40 (m, 2H); 7,14 (d, J=8,4 Гц, 1H); 2,63,7 (m, 17H), 2, 16 (s, 3H). Приклад 7 Одержання 1-[4-ацетилпіперазин-1-іл)-N-(4-метил-3-[(4-піридін-3-ілпіримідин-2-іл)аміно] феніл)-2,3- дигідро-1H-інден-5-карбоксамид тетрагідрохлорид (100 мг, 0.15 моль) розчиняли в ДМФ (2 мл), потім додавали триетиламін (101 мг, 1 моль) і ацетілхлорид (16 мг, 0,2 моль) при охолодженні у крижаній бані.Після перемішування протягом 20 хвилин одержаний розчин очищали високоефективної рідинної хроматографією при pH=10 з одержанням 45 мг (вихід 55 %) цільового сполука. Дані мас1 спектроскопії MS (+1) = 548,27. HЯМР (ДМСО-d 6, ppm): δ10, 15 (s, 1H); 9,26 (s, 1H); 8,99 (s, 1H); 8,66 (d, J=4,8 Гц, 1H); 8,49 (d, J=5,2 Гц, 1H); 8,45 (d, J=8,4 Гц); 8,05 (s, 1H); 7,79 (s, 1H); 7,76 (d, J=8,0 Гц, 1H); 7,50 (dd, J=8,0 & 4,8 Гц, 1H); 4,37 (t, J=7,0 Гц, 1H); 3,42 (m, 1H); 3,40 (m, 3H); 2,91 (m, 1H); 2,83 (m, 1H); 2,2-2,5 (m, 4H); 2,20 (s, 3H); 2,06 (m, 2H); 1,95 (s, 3H). Приклад 8 Одержання N-[3-(4,5’-біпіримідін-2-іламіно)-4-метилфеніл]-1-(4-метилпіперазин-1-іл)- 2,3дигідро-1 H-інден-5-карбоксамід 16 UA 106057 C2 Стадія A: 5-ацетілпірімідін 5 10 15 20 25 5-бромпірімідін (3,18 г, 20 моль) розчиняли в 50 мл тетрагідрофурану. При охолодженні до 78 º C, по краплях при перемішуванні додавали 15 мл 1,6 M розчину н-бутиллітій в гексані. Після перемішування розчину протягом 30 хвилин повільно додавали розчин N-метокси-Nметілацетаміда (2,58 г, 25 моль) в розчині тетрагідрофурану (10 мл). Суміш перемішували при 78 º C протягом 1 години, потім залишали поволі нагріватися. Коли температура суміші досягала 0 º C, додавали водний розчин хлориду амонію. Одержаний розчин тричі екстрагували етилацетату. Об'єднані екстракти промивали сольовим розчином, сушили над сульфатом магнію, концентрували при зниженому тиску, потім очищали на сілікагелевой колонці, використовуючи як елюента 5 % метанол/дихлорметан, з одержанням 1 г цільового речовини (вихід 45 %). Дані мас-спектроскопії MS (M+1) = 123,05. Стадія B: (2E) -3 - (диметиламіно)-1-піримідин-5-ілпроп-2-ен-1-он 5-Ацетілпірімідін (1 г, 8,2 моль) та N, N-диметилформамід діметілацеталь (1,3 г, 11 моль) о розчиняли в 20 мл ізопропанолу.Розчин перемішували при 100 С протягом 24 годин, охолоджували до кімнатної температури і сконцентрували при зниженому тиску.Далі до залишку додавали етиловий ефір. Після охолодження в крижаній бані протягом двох годин осад фільтрують, промивають холодний етиловим ефіром, сушили у вакуумі з одержанням 1 г (вихід 59 %) цільового сполука. Дані мас-спектроскопії MS (M+1) = 178,0. Стадія C: N-(2-метил-5-нітрофеніл) -4,5 '-біпірімідін-2-амін (2E) -3 - (диметиламіно)-1-піримідин-5-ілпроп-2-ен-1-он (1 г, 5,6 моль) і N-(2-метил-5нітрофеніл) гуанидин нітрат (1, 44 г, 5,6 моль) (Z. Szakacs et al. (Сзакацс тощо), J. Med.Chem. 17 UA 106057 C2 5 10 15 20 25 30 35 2005, 48, 249) суспендованих в 20 мл ізопропанолу. Далі додавали гідроксид натрію (0,28 г, 7 моль).Суміш перемішували протягом ночі і охолоджували до кімнатної температури. Осад відфільтровували, промивали ізопропанолом і діетиловим ефіром. Фільтрат концентрували при зниженому тиску, залишок розчиняли в 15 мл ізопропанолу. Одержаний розчин кип'ятили зі зворотним холодильником протягом ночі і охолоджували до кімнатної температури. Твердий залишок відфільтровували, промивали ізопропанолом і діетиловим ефіром. Об'єднаний осад промивали водою і діетиловим ефіром, далі сушили у вакуумі з одержанням 1,2 г (вихід 70 %) цільового сполука.Дані мас-спектроскопії MS (M+1) = 309,10. Стадія D: N (3) -4,5 '-біпірімідін-2-іл-4-метилбензол-1,3-діамін Дигідрат хлориду олова (3,6 г, 16 моль) розчиняли в 10 мл концентрованої соляної кислоти. У розчин додавали N-(2-метил-5-нітрофеніл) -4,5 '-біпірімідін 2-амін при інтенсивному перемішуванні. Суміш виливали в крижану воду, після цього перемішували протягом 2 годин. Далі нейтралізували до pH> 8 карбонатом натрію і екстрагували 4 рази етилацетату. Об'єднані екстракти промивали сольовим розчином, сушили над сульфатом магнію і, нарешті, концентрували при зниженому тиску, з одержанням 0,7 г необхідного сполука. Дані масспектроскопії MS (M+1) = 279,13. Стадія E: N-[3-(4,5’-біпіримідін-2-іламіно)-4-метилфеніл]-1-(4-метилпіперазин-1-іл)-2,3дигідро-1H-інден-5-карбоксамид Метил-1 - (4-метілпіперазін-1-іл) -2,3-дигідро-1 H-інден-5-карбоксилат (823 г, 3 моль) і N (3) 4,5 '-біпірімідін-2- іл-4-метилбензол-1,3-діамін (973 г, 3,5 моль) суспендованих в 15 мл толуолу, потім додавали 2 M розчин тріметілалюмінія (3 мл, 6 моль).Суміш перемішували протягом ночі при 50ºC і знову додали 2 M розчину тріметілалюмінія (2 мл, 4 моль). Розчин перемішували протягом ночі при 60 º C і потім залишали охолоджуватися у крижаній бані. При перемішуванні додавали насичений водний розчин тартрату калію і натрію. Одержаний розчин екстрагували діхлорметаном (3 × 100 мл). Об'єднані екстракти промивали бікарбонатом натрію (100 мл) і сольовим розчином (2 × 100 мл), сушили над сульфатом магнію, концентрували і очищали хроматографією на сілікагелевой колонці, використовуючи як елюента 50 % етилацетат / дихлорметан / 5-10 % триетиламін з одержанням 702 мг цільового сполука (вихід 45 %). Дані 1 мас-спектроскопії MS (M+1) = 527,27, HЯМР (ДМСО-d 6, ppm): δ10, 10 (s, 1H); 9,46 (s, 2H); 9,28 (s, 1H); 9,08 (s, 1H); 8,50 (d, J=5,7 Гц, 1H); 8,04 (s, 1H); 7,74 (s, 1H); 7,70 (d, J=9,0 Гц, 1H); 7,46 (d, J=5,7 Гц, 1H); 7,42 (d, J=9,0 Гц, 1H); 7,32 (d, J=9,0 Гц, 1H); 7,15 (d, J=9,0 Гц, 1H); 4,25 (t, J=5,7 Гц, 1H); 2,2-2,9 (m, 10H); 2,15 (s, 3H); 2,07 (s, 3H); 2,0 (m, 2H). Приклад 9 Одержання 1-[(3S)-3-(диметиламіно)пирролидин-1-іл]-N-{4-метил-3-[(4-піридін-3-іл пиримидин-2-іл)аміно]феніл}-2,3-дигідро-1H-інден-5-карбоксамид 18 UA 106057 C2 Стадія A: (3S)-1-(5-бромо-2,3-дигідро-1H-інден-1-іл)-N, N-диметилпирролидин-3-амин 5 10 15 20 25 5-бром-1-хлор-2,3-дигідро-1 H-інден (2,03 г, 8,76 моль) і (3 S)-N, N-2,5-діметілпірролідін-3амін (1 г, 8,76 моль) розчиняли в 30 мл ацетонітрилу, далі додавали карбонат калію (1,81 г, 13,14 моль).Суміш перемішували протягом ночі при 60 º C, потім концентрували.Залишок розчиняли в етилацетаті. Розчин промивали тричі сольовим розчином, сушили над сульфатом магнію, потім концентрували. Далі проводили очищення колоночной хроматографією на силікагелі, як елюента використовували етилацетат/дихлорметан/триетиламін/метанол (10:10:1:1), з одержанням 1,3 г цільового сполука. Дані мас-спектроскопії MS (M+1) = 309,0, 311,0. Стадія B: Метил 1-[(3S)-3-(N, N-диметиламіно)пірролідін-1-іл]-2,3-дигідро-1H-інден-5карбоксилат (1,3 г, 4,2 моль) розчиняли в 30 мл метанолу, 5 мл диметилсульфоксиду і 7 мл триетиламіну. Реакційну колбу вакуумовані і заповнювали N 2. Далі додавали ацетат паладію (0,24 г, 1 моль) і 1,3-біс (біфенілфосфіно) пропан (0,5 г, 1,5 моль). Суміш перемішували при 80 º C протягом двох днів у присутності CO. Після охолодження до кімнатної температури суміш фільтрували і концентрували.Залишок розчиняли в етилацетаті. Одержаний розчин промивали тричі сольовим розчином, сушили над сульфатом магнію, потім концентрували. Далі виконували очищення колоночной хроматографією на силікагелі, використовуючи як елюента етилацетат / дихлорметан / триетиламін (10:10:1), з одержанням 0,7 г цільового сполука (вихід 58 %).Дані мас-спектроскопії MS (M+1) = 289,1. Стадія C: 1-[(3S)-3-(диметиламіно)пирролидин-1-іл]-N-{4-метил-3-[(4-піридін-3-іл пиримидин2-іл)аміно] феніл}-2,3-дигідроінден-5-карбоксамид 19 UA 106057 C2 5 10 15 20 (0,2 г, 0,69 моль) та 4-метил-N (3) - (4-піридин-3-ілпірімідін-2-іл) феніл-1,3-діамін (0,22 г, 0,8 моль) розчиняли в 5 мл толуолу.Далі додавали 2 M розчин тріметілалюмінія в толуолі (1,3 мл, 2,6 моль). Суміш перемішували при 60ºC протягом 2 днів і далі охолоджували у крижаній бані. Потім додавали тартрат калію і натрію у водному розчині (15 мл) і дихлорметан (50 мл). Органічну фазу відокремили і водну екстрагували двічі діхлорметаном. Об'єднану органічну фазу промивали сольовим розчином, сушили над сульфатом магнію, потім концентрували. Далі очищали високоефективної рідинної хроматографією з одержанням 0,22 г (60 % виходу) 1 цільового речовини. Дані мас-спектроскопії MS (M+1) = 534,29. HЯМР (CD 3 OD, ppm): δ9, 19 (s, 1H); 8,54 (d, J=5,2 Гц, 1H); 8,50 (d, J=8,4 Гц, 1H); 8,36 (d, J=5,2 Гц, 1H); 8,10 (s, 1H); 7,72 (s, 1H); 7,67 (d, J=8,4 Гц, 1H); 7,44 (d, J=5,2 Гц, 1H); 7,41 (d, J=8,4 Гц, 1H); 7,32 (d, J=8,4 Гц, 1H) 7, 28 (d, J=5,2 Гц, 1H); 7,15 (d, J=8,4 Гц, 1H); 4,18 (m, 2H); 3,01 (m, 1H), 2, 90 (m, 1H); 2,80 (m, 2H); 2,72 (m, 2H); 2,60 (m, 1H); 2,37 (m, 1H); 2,22 (s, 3H); 2,16 (m, 1H); 2,14 (s, 6H); 1,95 (m, 1H); 1,62 (m, 1H). Приклад 10 Одержання 1-[(3R)-3-(диметиламіно)пірролідін-1-іл]-N-{4-метил-3-[(4-піридін-3-іл пірімидін-2іл)аміно]феніл}-2,3-дигідро-1H-інден-5-карбоксаміду Зазначена сполука одержана способом, описаним в Прикладі 9. Дані мас-спектроскопії MS 1 (M+1) = 524,29, HЯМР (CD 3 OD, ppm): δ 9,19 (s, 1H); 8,54 (d, J=5,2 Гц, 1H); 8,50 (d, J=8,8 Гц, 1H); 8,36 (d, J=5,2 Гц, 1H); 8,10 (s, 1H); 7,72 (s, 1H); 7,6,7 (d, J=7,2 Гц, 1H); 7,44 (d, J=7,2 Гц, 1H); 7,41 (d, J=8,8 Гц, 1H); 7,32 (d, J=7,2 Гц, 1H); 7,28 (d, J=5,2 Гц, 1H); 7,15 (d, J=7,2 Гц, 1H), 4, 18 (m, 1H); 3,02 (m, 1H); 2,95 (m, 1H); 2,85 (m, 2H); 2,75 (m, 2H); 2,65 (m, 1H), 2,39 (m, 1H); 2,24 (s, 3H); 2,20 (m, 1H); 2,15 (s, 3H); 1,98 (m, 1H); 1, 65 (m, 1H). 25 Приклад 11 Одержання (1S)-1-(4-метилпіперазин-1-іл)-N-(4-метил-3-[(4-піридін-3-ілпіримідин-2-іл) аміно] феніл) -2,3-дигідро-1 H-інден-5-карбоксаміду 30 Стадія A: 1 - ((1 S)-5-бром-2,3-дигідро-1 H-інден-1-іл)-4-метілпіперазін 20 UA 106057 C2 5 10 15 20 25 30 35 5-бром-1-хлор-2, 3 - дигідро-1 H-інден (220 г, 950 моль) розчиняли в ацетонітрилі (1 л) і додавали 1-метілпіперазін (150 г, 1500 моль) і карбонат калію (131 г, 950 моль).Суміш перемішували протягом ночі при 60ºC. Твердий осад фільтрували, фільтрат концентрували. Залишок розчиняли в етилацетаті (1 л) і одержаний розчин промивали двічі гідроксидом натрію (2 × 300 мл), потім сольовим розчином тричі (3 × 300 мл), сушили над сульфатом магнію, концентрували і очищали хроматографією на сілікагелевой колонці, використовуючи як елюента 5 % метанол/дихлорметан з одержанням 202 р продукту (вихід 72 %). Дані мас-спектроскопії MS (M+1) = 295,07, 297,07. Одержаний продукт (202 г, 684,6 моль) розчиняли в 2000 мл метанолу і далі додавали (1 S) -(+)- 10-камфорсульфоновую кислоту (318 г, 1369 моль), потім 4000 мл ізопропанолу. Розчин кип'ятили зі зворотним холодильником при нагріванні протягом 10 хвилин, потім перемішували протягом ночі при кімнатній температурі. Осад фільтрували. Коли рідина перестала капати, осад промивали ізопропанолом і потім розчиняли в 600 мл метанолу. Далі додавали ізопропанол (1500 мл), розчин нагрівали до кипіння протягом 15 хвилин, і далі перемішували протягом ночі при кімнатній температурі. Осад фільтрували. Коли рідина перестала капати, осад промивали ізопропанолом і потім розчиняли в 1 Н гідроксиді натрію (600 мл). Розчин перемішували протягом 30 хвилин і потім тричі екстрагували етилацетат (3 × 300 мл). Об'єднаний екстракт промивали 1 Н гідроксидом натрію (300 мл) і сольовим розчином (2 × 300 мл), сушили над сульфатом магнію, потім концентрували з одержанням 50 г цільового сполука.Хіральна чистота склала 99,7 %, певна хіральні високоефективної хроматографією. Рентгенівський монокристальних структурний аналіз цільового сполука показав, що хіральних центр в 1 положенні 2,3-дігідрпо-1 H-індена знаходиться в S конфігурації.Дані мас-спектроскопії MS (M+1) = 295,07, 297,07. Стадія B: Етил (1 S) -1 - (4-метілпіперазін-1-іл) -2,3 - дигідро-1 H-інден-5-карбоксилат 1 - ((1 S)-5-бром-2,3-дигідро-1 H-інден-1-іл)-4-метілпіперазін (29.6 г, 100 моль) розчиняли в 300 мл етанолу, 30 мл ДМСО і 42 мл триетиламіну. Систему вакуумовані і заповнювали N2. Після додавали ацетат паладію (2,4 г, 10 моль) і 1,3-біс (діфенілфосфіно) пропан (3,3 г, 10 моль), систему вакуумовані і заповнювали N 2. Після ще одного вакуумування суміш перемішували при 90ºC протягом 2 днів в атмосфері CO. Далі охолоджували до кімнатної температури, розчин фільтрували за допомогою кизельгуру і потім концентрували. Залишок розчиняли в етилацетаті (500 мл) і одержаний розчин промивали сольовим розчином (3 × 200 мл), сушили над сульфатом магнію, концентрували і потім відділяли хроматографією на сілікагелевой колонці, використовуючи як елюента 50 % етилацетат / 45 % дихлорметан / 5 % триетиламін з одержанням 17,3 г цільового сполука (вихід 60 %).Дані мас-спектроскопії MS (M+1) = 289,18. Стадія C: (1S)-1-(4-метилпіперазин-1-іл)-N-(4-метил-3-[(4-піридін-3-ілпіримідин-2іл)аміно]феніл)-2,3-дигідро-1H-інден-5-карбоксамид 40 21 UA 106057 C2 5 10 15 20 25 30 Етил (1S)-1-(4-метилпіперазин-1-іл)-2,3-дигідро-1H-інден-5-карбоксилат (7,2 г, 25 моль) і 4метил-N (3) - (4-піридин-3-ілпірімідін-2-іл) феніл-1,3-діамін (8,3 г, 30 моль) розчиняли в 150 мл толуолу, далі додавали 2 M розчин тріметілалюмінія в толуолі (20 мл, 40 моль).Одержаний розчин перемішували протягом ночі при 50 º C, потім додавали 20 мл 2 M розчину тріметілалюмінія в толуолі.Після перемішування при 60 º C ще протягом 24 годин, розчин охолоджували у крижаній бані і потім додали водний розчин тартрату натрію і калію (200 мл), а потім дихлорметан (300 мл).Органічну фазу двічі екстрагували діхлорметаном. Об'єднані екстракти промивали двічі сольовим розчином, сушили над сульфатом магнію, і потім концентрували. Далі очищали колоночной хроматографією на силікагелі, як елюента використовуючи 50 % етилацетат/ дихлорметан/ 5-10 % триетиламін з одержанням 7,5 г (вихід 1 58 %) зазначеного сполука.MS (M+1) = 520,27, HЯМР (ДМСО-d 6, ppm): δ10, 10 (s, 1H); 9,20 (s, 1H); 8,95 (s, 1H) 8, 66 (d, J=6,0 Гц, 1H); 8,48 (d, J=6,0 10 Гц, 1H); 8,43 (d, J=8,4 Гц, 1H); 8, 02 (s, 1H); 7,77 (s, 1H); 7,74 (d, J=8,4 Гц, 1H); 7,48 (dd, 1H); 7,42 (dd, 1H); 7,40 (d, J=6,0 Гц, 1H); 7,32 (d, J=8,4 Гц, 1H); 7,18 (d, J=8,4 Гц, 1H); 4, 26 (t, J=8,4 Гц, 1H); 2,2-3,0 (m, 10H); 2,20 (s, 3H); 2,12 (s, 3H); 2,02 (m, 2H). Приклад 12 Одержання (1R)-1-(4-метилпіперазин-1-іл)-N-(4-метил-3-[(4-піридін-3-ілпіримідин-2-іл) аміно]феніл)-2,3-дигідро-1H-інден-5-карбоксаміду Стадія A: 1 - ((1 R)-5-бром-2,3-дигідро-1 H-інден-1-іл)-4-метілпіперазін У стадії А Приклад 11 фільтрат метанол/ізопропанол 1 - (5-бром-2,3-дигідро-1 H-інден-1-іл)4-метил і (1 S) -(+)- 10-камфоросульфоновую кислоту концентрували при зниженому тиску. Залишок розчиняли в 1 л гідроксиду натрію (1 N). Після перемішування протягом 30 хвилин розчин екстрагували етилацетат (3 × 300 мл). Об'єднані екстракти промивали 1 Н гідроксидом натрію (300 мл) і сольовим розчином (3 × 300 мл), сушили над сульфатом магнію і далі концентрували з одержанням 140 г (474 моль) 1 - (5-бром-2,3-дигідро-1 H-інден-1-іл)-4метілпіперазін, де домінуючим був R-енантіомер.Залишок розчиняли в 1,4 л метанолу, потім додали (1R) -(-)- 10-камфорсульфоновую кислоту (220 г, 948 моль) і 2,8 л ізопропанол. Одержаний розчин нагрівали до кипіння протягом 15 хвилин і далі перемішували протягом ночі при кімнатній температурі. Осад фільтрували. Коли рідина перестала капати, осад промивали 22 UA 106057 C2 5 10 15 20 25 ізопропанолом і розчиняли в 600 мл метанолу. Після додавали ізопропанол (1500 мл), розчин нагрівали до кипіння протягом 15 хвилин і потім перемішували протягом ночі при кімнатній температурі. Осад фільтрували. Далі після скапиванія рідини осад промивали ізопропанолом і потім розчиняли в 800 мл гідроксиду натрію (1 Н).Суміш перемішували протягом 30 хвилин, потім екстрагували тричі етилацетат (3 × 300 мл). Об'єднані екстракти промивали 1 Н розчином гідроксиду натрію (500 мл) і сольовим розчином (2 × 400 мл), сушили над сульфатом магнію і потім концентрували з одержанням 60 г бажаного сполука.Хіральна чистота становила 99,8 % за даними хіральні високоефективної рідинної хроматографії. Дані мас-спектроскопії MS (M+1) = 295,07, 297,07. Стадія B: Етил (1R)-1-(4-метилпіперазин-1-іл)-2,3-дигідро-1H-інден-5-карбоксилат Виходячи з 1 - ((1R)-5-бром-2,3-дигідро-1 H-інден-1-іл)-4-метілпіперазіна, Дану сполуку одержували згідно способу, описаного на стадії В прикладу 11.Дані мас-спектроскопії MS (M+1) = 289,18. Стадія C: (1R)-1-(4-метилпіперазин-1-іл)-N-(4-метил-3-[(4-піридін-3-ілпіримідин-2-іл)аміно] феніл)-2,3-дигідро-1H-інден-5-карбоксамид Дану сполуку одержували конденсацією етил і 4-метил-N (3) - (4-піридин-3-ілпірімідін-2-іл) феніл-1,3-диамина згідно способу, описаного на стадії C прикладу 11. Дані мас-спектроскопії M 1 S (M+1) = 520.27. HЯМР (ДМСО-d6, ppm): δ10, 15 (s, 1H); 9,22 (s, 1H); 8,98 (s, 1H); 8,64 (d, J=6,0 Гц, 1H); 8,46 (d, J=6,0 Гц, 1H); 8,42 (d, J=8,4 Гц, 1H); 8,02 (s, 1H); 7,75 (s, 1H); 7,72 (d, J=9,0 Гц, 1H); 7,50 (dd, 1H); 7,45 (dd, 1H); 7,40 (d, J=5,4 Гц, 1H); 7,35 (d, J=8,4 Гц, 1H); 7,18 (d, J=9,0 Гц, 1H); 4,26 (t, J=6,0 Гц, 1H); 2,2-3,0 (m, 10H); 2,20 (s, 3H); 2,12 (s, 3H); 2,3 (m, 2H). Приклад 13 Одержання (1S)-N-[3-(4,5’-біпіридін-2-іл аміно)-4-метилфеніл]-1-(4-метилпіперазин-1-іл)-2,3дигідро-1H-інден-5-карбоксаміду 23 UA 106057 C2 5 10 15 Дану сполуку одержували конденсацією етил і N-(3) -4,5 '-біпірімідін-2-іл-4-метілфеніл-1,3диаміну за способом, описаним на стадії C прикладу 11. Дані мас-спектроскопії MS (M+1) = 1 521,27, HЯМР (ДМСО-d6, ppm): δ10, 10 (s, 1H); 9,40 (s, 2H); 9,28 (s, 1H); 9,08 (s, 1H); 8,50 (d, J=4,8 Гц, 1H); 8,04 (s, 1H); 7,74 (s, 1H); 7,70 (d, J=9,0 Гц, 1H); 7,46 (d, J=4,8 Гц, 1H); 7,42 (d, J=7,8 Гц, 1H); 7,32 (d, J=7,8 Гц, 1H); 7,15 (d, J=9,0 Гц, 1H); 4,25 (t, J=7,8 Гц, 1H); 2,2-2,9 (m, 10H); 2,15 (s, 3H); 2,07 (s, 3H); 2,0 (m, 2H). Приклад 14 Одержання(1R)-N-[3-(4,5’-біпіримідін-2-иламіно)-4-метилфеніл]-1-(4-метилпіперазин-1-іл)2,3-дигідро-1H-інден-5-карбоксаміду Дану сполуку одержували конденсацією і N-(3) -4,5 '-біпірімідін-2-іл-4-метілфеніл-1,3-діамін, 1 згідно способу, описаного на стадії C прикладу 11.Дані мас-спектроскопії M S (M+1) = 521,27, HЯМР (ДМСО-d 6, ppm): δ10, 10 (s, 1H); 9,40 (s, 2H); 9,28 (s, 1H); 9,08 (s, 1H); 8,50 (d, J=5,7 Гц, 1H); 8,04 (s, 1H); 7,74 (s, 1H); 7,70 (d, J=8,4 Гц, 1H); 7,46 (d, J=5,7 Гц, 1H); 7,42 (d, J=8,4 Гц, 1H); 7,32 (d, J=8,40 Гц, 1H); 7,15 (d, J=8,4 Гц, 1H); 4,25 (t, J=7,5 Гц, 1H); 2,2-2,9 (m, 10H); 2,15 (s, 3H); 2,07 (s, 3H); 2,0 (m, 2H). Приклад 15 Одержання (1S)-1-(4-метилпіперазин-1-іл)-N-(4-метил-3-[(4-піридін-4-ілпіримідин-2-іл) аміно]феніл)-2,3-дигідро-1H-інден-5-карбоксамид 20 Стадія A: N-(2-метил-5-нітрофеніл)-4-піридин-4-ілпірімідін-2-амін 25 Дану сполуку одержували реакцією конденсації між (2 E)-3-(диметиламіно)-1-піридін-4ілпроп-2-ен-1-оном і N-(2-метил-5-нітрофеніл) гуанідін нітратом, згідно способу, описаному на Стадії З прикладу 8.Дані мас-спектроскопії MS (M+1) = 308,11. Стадія B: 4-метил-N (3) - (4-піридин-4-ілпірімідін-2-іл) бензол-1,3-діамін 24 UA 106057 C2 5 10 15 Дану сполуку одержували відновленням N-(2-метил-5-нітрофеніл)-4-піридин-4-ілпірімідін-2аміну згідно способу, описаного на Стадії D прикладу 8. Дані мас-спектроскопії MS (M+1) = 278,13. Стадія C: феніл) -2,3-дигідро-1 H-інден-5-карбоксамід Дану сполуку одержували реакцією конденсації між етил і згідно способу описаному на 1 стадії З прикладу 11. Дані мас-спектроскопії MS (M+1) = 520,27, HЯМР (ДМСО-d 6, ppm): δ 10,14 (s, 1H); 9,04 (s, 1H); 8,07 (d, J=4,4 Гц, 2H); 8,55 (d, J=4,8 Гц, 1H); 8,06 (s, 1H); 8,04 (d, J=4,4 Гц, 2H); 7,78 (s, 1H); 7,75 (d, J=8,8 Гц, 1H); 7,45 (d, J=7,6 Гц, 1H); 7,44 (d, J=4, 8 Гц, 1H); 7,35 (d, J=7,6 Гц, 1H); 7,18 (d, J=8,8 Гц, 1H); 4,31 (t, J=7,2 Гц, 1H); 2,0-3,0 (m, 10H); 2,19 (s, 3H); 2,12 (s, 3H); 2,04 (m, 2H). Приклад 16 Одержання (1S)-1-(4-метилпіперазин-1-іл)-N-(4-метил-3-[(4-піридін-3-ілпіримідин-2-іл) аміно]феніл)-2,3-дигідро-1H-інден-5-карбоксамід сульфату Стадія A: (1 S) -1 - (4-метілпіперазін-1-іл) -2,3-дигідроінден-5-карбонова кислота 20 У захисній атмосфері N2, 1-((1 S)-5-бром-2,3-дигідро-1H-інден-1-іл)-4-метілпіперазін (660 г, 2,235 моль) і ТГФ (3,3 л) додавали в 10 л трехгорлую колбу, потім розчин перемішували до повного розчинення. Температуру суміші знижували до -78 º C в рідкій азотно-ацетонової лазні. 25 UA 106057 C2 5 10 15 20 25 30 35 н-Бутиллітій (н-BuLi) (2,5 M в розчині гексану) (1072 мл, 2,682 моль, 1,2-кратний) по краплях додавали до розчину при температурі -78 º C ~ -82 º C. Після перемішували протягом 10 хвилин, коли аналіз РХ-МС (Рідинна хроматографія-мас-спектрометрія) показав завершення реакції вихідних речовин, обережно додавали сухий лід (170 г, 3,86 моль, 1,73-надлишок).Розчин далі перемішували протягом 10 хвилин при температурі -60ºC~-75ºC. Після завершення реакції холодну баню видаляли і додавали водний розчин 2 Н HCl для регулювання величини pH до значення pH=2.Більшу частину води упаривали на роторному випарнику. Далі суміш сушили протягом ночі при 50 º C ~ 60 º C у вакуумній сушильній печі з одержанням цільового сполука (1289 г, дійсний продукт 583 г забезпечує 100 % вихід). Даний сирий продукт безпосередньо використовували в наступній стадії. Стадія B: (1 S) -1 - (4-метілпіперазін-1-іл) -2,3-дигідро-інден-5-карбоніл хлорид гідрохлорид SOCl2 (2,5 л) додавали в 5 л трехгорлую колбу.кислоту (1289 г, дійсний зміст 583 г, еквівалентно 2,235 моль) додавали партіями протягом 1 години. Розчин нагрівали при кип'ятінні протягом ночі, потім охолоджували до кімнатної температури. Більшу частину SOCl 2 видаляли за допомогою роторного випарника. Після додавання етилацетату (1,5 л), розчин охолоджували до 0ºC, фільтрували з підсмоктуванням з одержанням білого осаду, який потім сушили у вакуумі з одержанням цільового сполука (близько 1325 г, вихід 100 %). Стадія C: (1S)-1-(4-метилпіперазин-1-іл)-N-(4-метил-3-[(4-піридін-3-ілпіримідин-2-іл)аміно] феніл)-2,3-дигідро-1H-інден-5-карбоксамид N-(5-аміно-2-метілфеніл) -4-(3-піридил)-2-амінопірімідін (681 г, 2,46 моль, 1,1-кратний) розчиняли в піридині (3 л).(1 S)-1-(4-метілпіперазін-1-іл)-2,3-дигідро-1 H-інден-5-карбоніл хлорид гідрохлорид (1325 г, дійсне максимальний вміст 626 г, еквівалентно 2,235 моль, 1-кратний) повільно додавали протягом 300 хвилин при перемішуванні.Розчин дуже нагрівався, оскільки реакція протікала досить бурхливо, проте охолодження не вимагалося. Після розчин перемішували протягом ночі при кімнатній температурі, розчин далі при перемішуванні додавали до водного розчину 2 Н гідроксиду натрію (2 л), відразу ж додавали дихлорметан (2 л). Після перемішування протягом деякого часу розчин переносили в 5 літрову ділильну воронку і відокремлювали шар дихлорметан. Водну фазу екстрагували діхлорметаном (2 × 500 мл). Екстракти об'єднували, сушили над безводним сульфатом магнію, потім концентрували. Залишок розчиняли в діхлорметане, і потім очищали колоночной хроматографією на силікагелі, як елюента використовуючи дихлорметан / 5 % метанол / 1 % триетиламін. Фракції, що містять потрібний продукт, об'єднували і концентрували при зниженому тиску. Залишок розчиняли в 1 л теплої етилацетату і після перемішування стали випадати кристали. Осад фільтрували і сушили у вакуумі при 50 º C з одержанням цільового продукту (617 г, 53 % загальний вихід трьох стадій). Дані мас-спектроскопії MS (M+1) = 520,27. Стадія D: (1S)-1-(4-метилпіперазин-1-іл)-N-(4-метил-3-[(4-піридін-3-ілпіримідин-2іл)аміно]феніл)-2,3-дигідро-1H-інден-5-карбоксамід сульфат 26 UA 106057 C2 5 10 15 20 25 30 35 40 45 (248 г, 0,477 моль) розчиняли в етанолі (4,76 л). Після перемішування протягом 20 хвилин розчин фільтрували на фільтрі з відсмоктуванням. Фільтрат додавали в трехгорлую 20 л колбу. Повільно через воронку додавали розчин сірчаної кислоти (46,74 г, 0,477 моль, 1-кратний), розбавлений етанолом (532 мл) при перемішуванні з одержанням жовтуватою суспензії. Потім додавали етанол (9,5 л). Суміш кип'ятили зі зворотним холодильником протягом 2 годин до тих пір, поки суспензія не набувала молочно-білий колір. Суспензію охолоджували до кімнатної температури, фільтрували на фільтрі з підсмоктуванням, потім сушили з одержанням цільового продукту (183 г, 57,5 %). рН фільтрату переводили в основній (pH ≈ 11) водним розчином NaOH, потім екстрагували діхлорметаном (4×200 мл).Екстракт сушили і концентрували з одержанням (98 г, 39,5 %).Температура плавлення зазначеного продукту: 187~189ºC. Елементарний аналіз C31H36N7O7S1.5, розрахований значення: C 55,84; H 5,44; N 14,71; експериментальне значення: C 55,72; H 5,70; N 14,40. Регулювання активності протеїнкінази і інгібування проліферації клітин сполуками за винаходом можна виявити за допомогою способів, описаних нижче. Приклад А: Дослідження ферментативної активності Abl, c-Kit і PDGFR кінази Активність з'єднань згідно даноговинаходу Abl, c-Kit і PDGFR кіназ досліджували Тестом зсуву рухливості (МСП, mobility shift assay).АТФ концентрація вимірювалася для кожної кінази в Км, тобто Abl Km ATP=12 мкM, c-Kit Km ATP=87 мкM, PDGFR Km ATP=38 мкM. Матеріали: Abl (придбана у компанії Carna, Lot No.06 CBS-2988C); c-Kit (придбана у компанії BPS, Cat.No.40250, Lot No.1003); PDGFR (придбана у компанії BPS, Cat.No.40263, Lot No.1001); ДМСО (придбана у компанії Sigma, Cat.No. D2650, Lot No. 474382); 96-ямковий культуральний планшет (придбана у компанії Corning, Cat. No.3365, Lot No. 22008026); 384 - ямковий культуральний планшет (придбаний у компанії Corning, Cat.No.3573, Lot No.12608008); Staurosporine (придбаний у компанії Sigma, Cat.No. S4400-1MG, Lot No. 046K4080). Способи: 1.Одержання кіназного буфера і зупиняє буфера; (1) Кіназний буфер: 62,5 МM HEPES, pH 7,5; 0,001875 % Brij-35, 12,5 МM MgCl 2, 2,5 МM DTT (дітіотреітол); (2) Роблячий буфер: 100 МM HEPES, pH 7,5; 0,015 % Brij-35; 0,2 % покривне речовина № 3, 50 МM ЕДТА; (3) Одержання кіназного розчину: кіназний розчин отримували розчиненням кіназ в кіназном буфері, описаному вище.По відношенню до c-Kit кінази попередню активаційну обробку потрібно виконувати наступним чином: 700 нМ c-Kit, 2 vM ATP, 4 МM DTT і 10 МM MgCl 2 о розчиняли в кіназном буфері.Після інкубування при 28 С протягом 15 хвилин розчин додавали до кіназному буферу; (4) Одержання поліпептидного розчину: Поліпептид FAM і АТФ розчиняли в кіназном буфері; (5) Кіназний розчин переносили в культуральний планшет.Отримані концентрації АТФ в Abl, c-Kit і PDGFR становить 0,45 Нm, 12 Нm, 8 Нm, відповідно; (6) Поліпептидний розчин переносили в культуральний планшет.Отримані концентрації АТФ в Abl, c-Kit і PDGFR оточенні становили 12 мкМ, 87 мкМ і 38 мкМ, відповідно.Отримані концентрації MgCl 2 у всіх випадках становили 10 мМ; (7) Суміш в кожній лунці планшета інкубували при 28° С протягом однієї години для Abl, 40 хвилин для c-Kit і 5 годин для PDGFE. Далі для припинення реакції додавали зупиняє буфер; (8) Дані, зібрані за допомогою устаткування Caliper далі обробили за допомогою програмного забезпечення XLift для розрахунку величин IC50. Необхідні концентрації (IC 50, нМ) кожного сполука згідно даноговинаходу, що призводять до 50 % інгібування, наведено в Таблиці 1.При цьому, для порівняння наведено величини IC 50, 27 UA 106057 C2 призводять до інгібування даних трьох кіназ в аналогічних експериментальних умовах у разі іматинібу. Як позитивний контролю в цьому дослідженні використовували стауроспорін. Таблиця 1 Сполука Приклад 1 Приклад 2 Приклад 3 Приклад 4 Приклад 5 Приклад 6 Приклад 7 Приклад 8 Приклад 9 Приклад 10 Приклад 11 Приклад 12 Приклад 13 Приклад 14 Прикладу 15 Іматиніб Стауроспорін 5 10 15 20 25 30 IC 50 (Нm) Abl 5,8 2044 6,2 6,3 5.4. 12. 411 5,3 121 70 2.2. 256 2.4. 266 23 207 162 c-Kit PDGFR 22 1186 16 26 23 32 529 32 51 32 8,5 2251 15 2260 526 703 2,0 17 233 12. 15 18 20 41 22 15 21 9,6 53 13 65 24 39 0,50 Як показано в таблиці 1, сполука за винаходом мають дуже високу інгібуючої активністю щодо Abl, c-Kit і PDGFR: величини IC50 в діапазоні від 2,2 нМ до 2044 нМ при інгібуванні Abl, величини IC50 в діапазоні від 8,5 нМ до 2260 нМ при інгібуванні c-Kit і величини IC50 в діапазоні від 9,6 нМ до 233 нМ у разі інгібування PDGFR. За винятком прикладів 2, 7, 12 і 14, сполука за винаходом володіють більшою активністю в порівнянні з іматинібом при інгібуванні трьох кіназ даного типу. Приклад В: Дослідження кіназной активності мутантів Abl і c-Kit Інгібіторна активність сполук згідно даноговинаходу мутантів Abl, c-Kit і PDGFR кіназ (33 визначали в дослідженні мічених ізотопом фосфору АТФ Р-АТФ). 1. Використовуючи свіжоприготований реакційний буфер отримували розчин субстрату: 20 mM HEPES, pH 7,5, 10 МM MgCl 2, 1 МM ЕГТА, 0,02 % Brij 35, 0,02 мг / мл BSA, 0,1 МM Na 3 VO 4, 2 МM DTT, 1 % ДМСО. Для c-Kit і c-Kit (V654A), додатково, в буфер додали 2 МM MnCl 2; 2. До вищевказаного розчину субстрату додавали необхідний кофермент; 3. Додавали кінази і акуратно перемішували; 4. Досліджувані сполуки розчиняли в ДМСО, далі додавали вищевказаний кіназний расттвор за допомогою акустичного методу (Echo550, діапазон нанолітри) і інкубували протягом 20 хвилин; 33 5. Для ініціювання реакції до зазначеного вище реакційного розчину додавали P-ATP; 6. Суміш інкуббували протягом 2 годин при кімнатній температурі; 7. Активність кіназ визначали фільтрацією-комбінацією; 8. Дані обробляли в Excel і вичитали контрольні дані.Для одержання величин IC50 будували криву за допомогою програмного забезпечення GraphPad Prism. Величини IC50 сполука за прикладом 11, яке може інгібувати Abl і 7 мутантів, а також c-Kit та 5 мутантів перераховані в Таблиці 2.Також, для порівняння в Таблиці 2 також перераховані величини IC 50 для Нілотініб, інгібуючої ті ж мутанти в аналогічних експериментальних умовах.Як позитивний контролю в цьому дослідженні використовували стауроспорін. Таблиця 2 Кіназа Abl Abl (T315I) ATФ концентрація (МкM) 10 10 Приклад 11 IC50 (Нm) Нілотініб IC50 (Нm) Стауроспорін IC50 (Нm) 0,21 14090 1,19 > 20000 14,5 3,38 28
ДивитисяДодаткова інформація
Назва патенту англійськоюPreparation method of dihydroindene amide compounds, their pharmaceutical compositions containg compounds thereof and use as protein kinases inhibitor
Автори російськоюYang, Xuqing, Xue, Long, Luo, Juan
МПК / Мітки
МПК: A61P 35/02, A61P 9/00, A61P 27/00, A61P 17/06, A61P 35/00, A61P 9/10, A61P 29/00, A61K 31/16, C07C 233/64
Мітки: фармацевтична, одержання, інгібітора, протеїнкінази, дигідроінденаміду, спосіб, застосування, сполуки, композиція, дані, сполук, містить
Код посилання
<a href="https://ua.patents.su/36-106057-sposib-oderzhannya-spoluk-digidroindenamidu-farmacevtichna-kompoziciya-shho-mistit-dani-spoluki-ta-kh-zastosuvannya-yak-ingibitora-protenkinazi.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання сполук дигідроінденаміду, фармацевтична композиція, що містить дані сполуки, та їх застосування як інгібітора протеїнкінази</a>
Попередній патент: Сполуки 2-метил-1-феніл-2-(піридин-2-іл)пропан-1-аміну та їх застосування для лікування депресії
Наступний патент: Каталізатори
Випадковий патент: Спосіб футерування барабанного млина