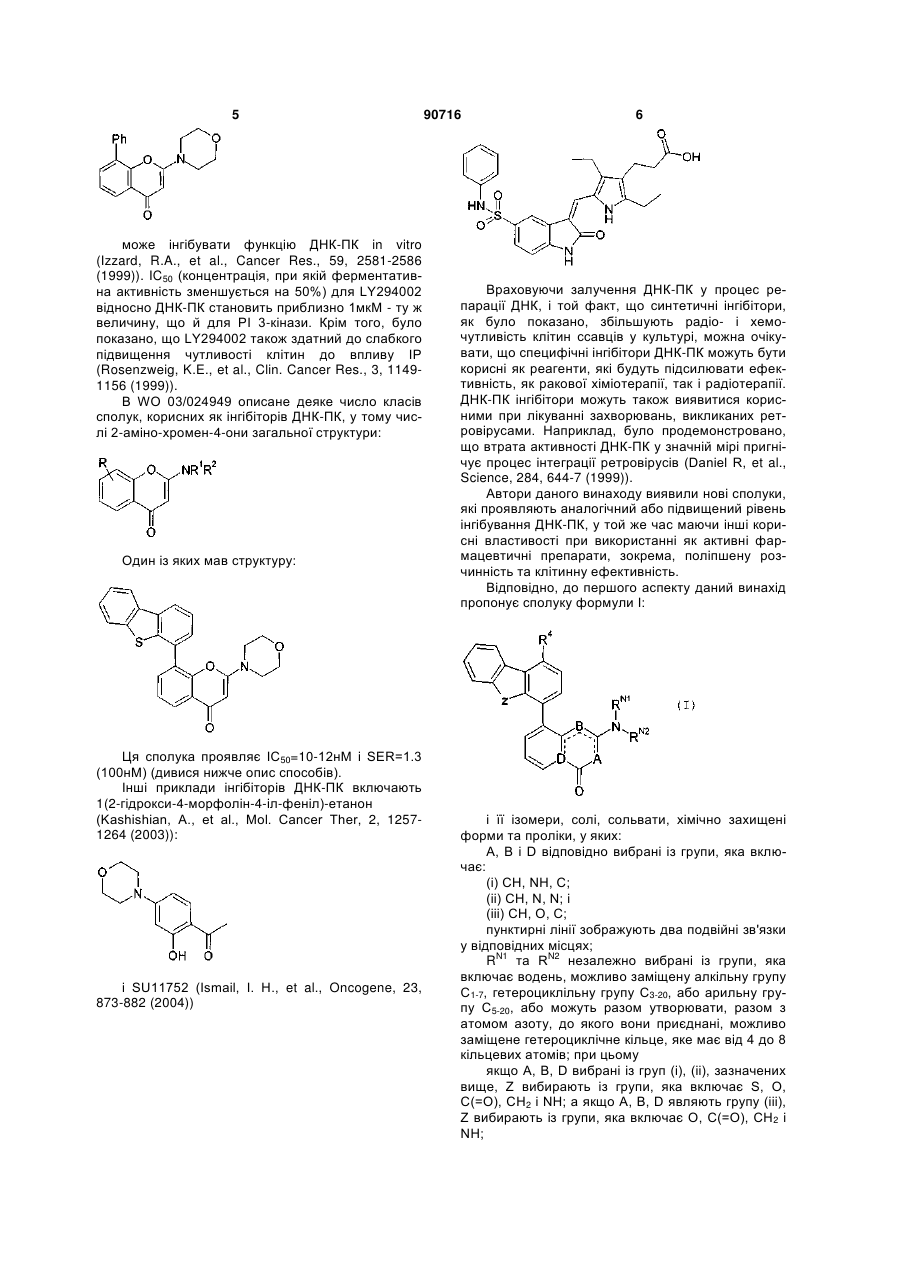
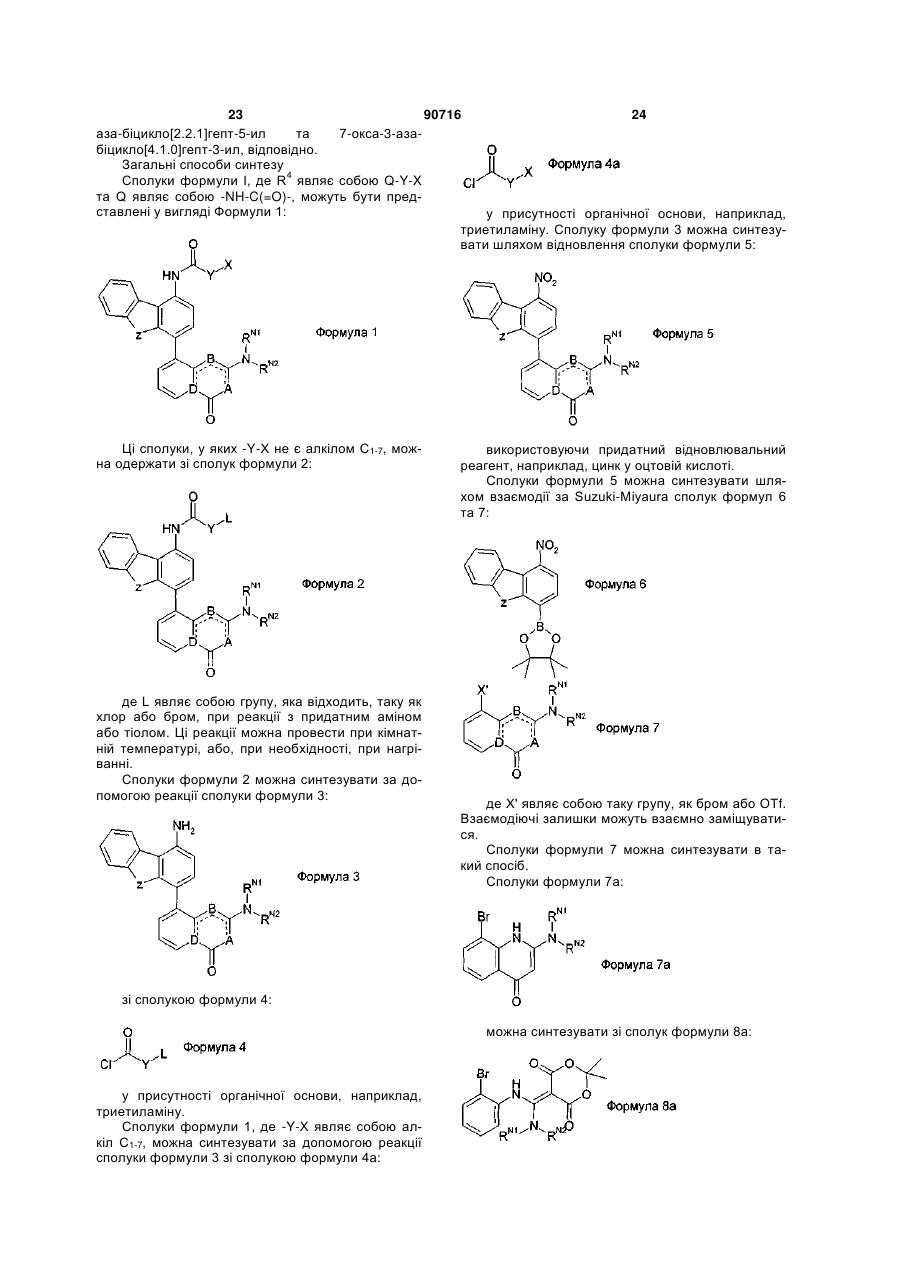
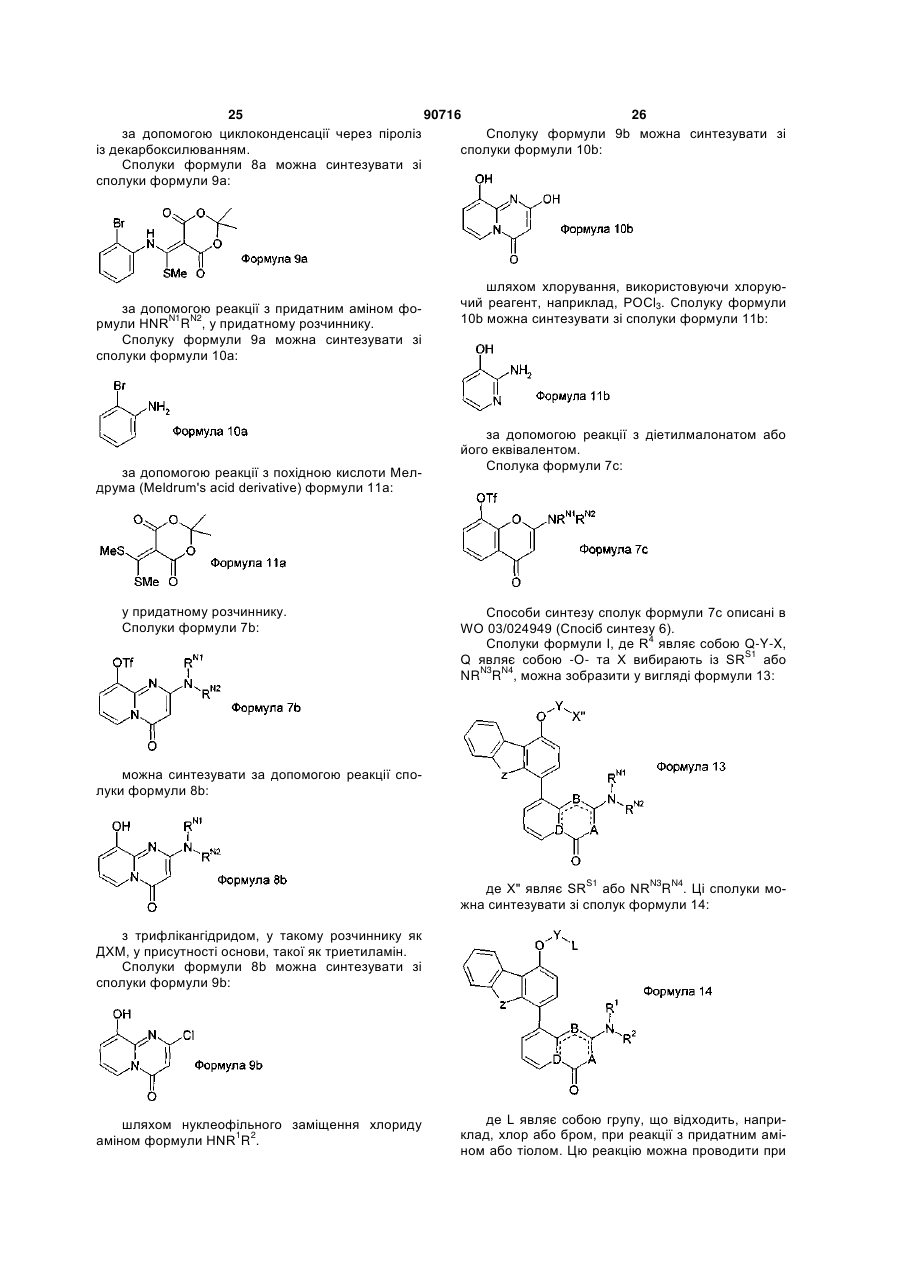
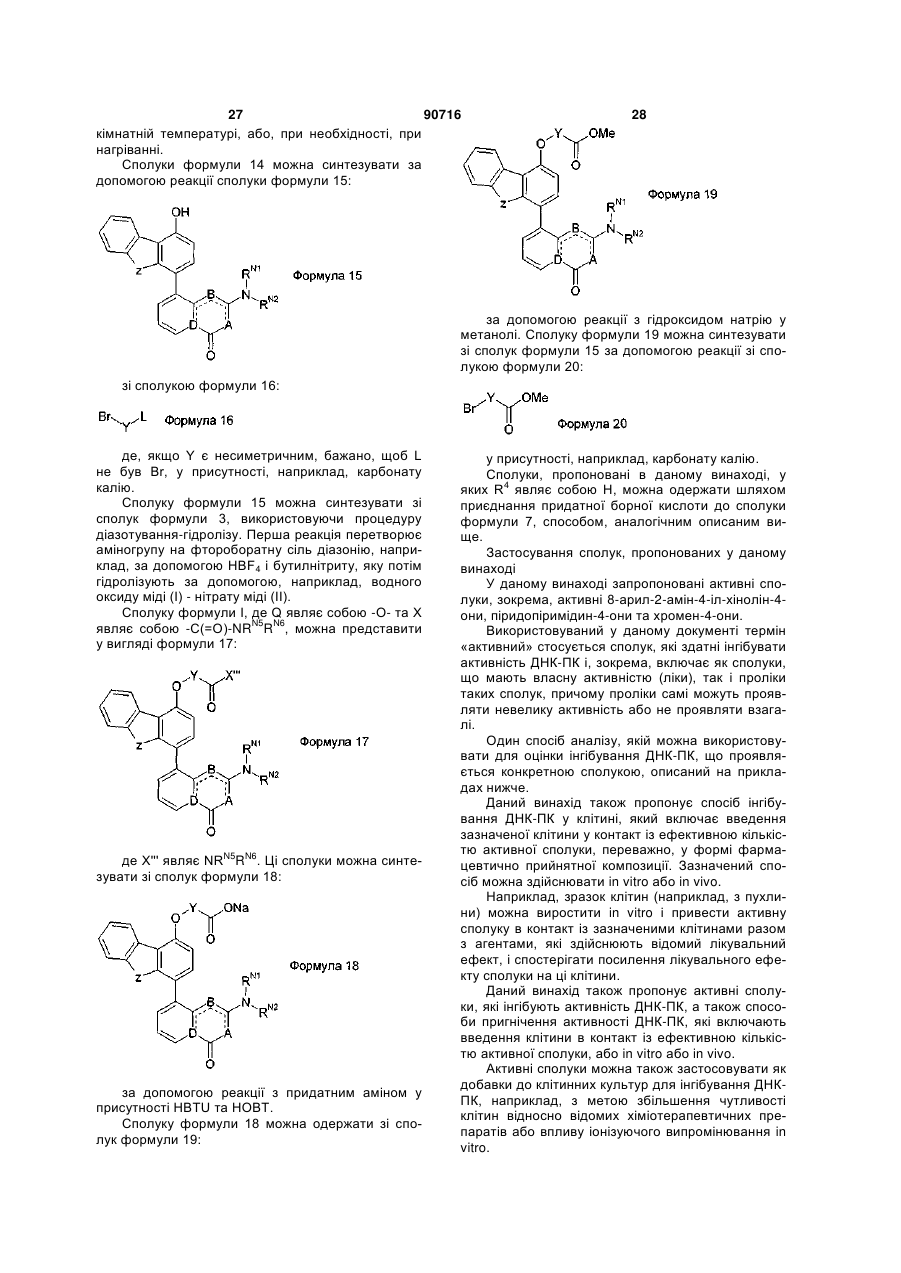
Інгібітори днк-протеїнкінази
Номер патенту: 90716
Опубліковано: 25.05.2010
Автори: Сміт Грейм Камерон Маррі, Кертін Нікола Джейн, Хардкасл Іан Роберт, Калверт Хіларі Алан, Сараванан Каппусамі, Хаммерсон Марк Джеффрі, Кокрофт Сяо-Лін Фань, Мінер Кейт Аллан, Гріффін Роджер Джон, Н'юелл Девід Річард, Голдінг Бернард Томас, Дезаж-Ель Мурр Марін, Мартін Нілл Моррісон Барр, Фріджеріо Марк
Формула / Реферат
1. Сполука формули І:
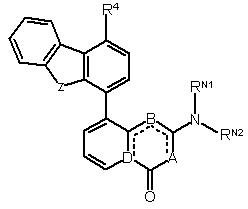 (I)
(I)
та її ізомери, солі, сольвати, хімічно захищені форми та проліки, де
А, В та D, відповідно, вибрані із групи, яка включає:
(і) СН, NH, С;
(іі) СН, N, N; та
(ііі) СН, О, С;
пунктирні лінії зображують два подвійні зв'язки у відповідних положеннях;
RN1 та RN2 незалежно вибрані із групи, яка включає водень, необов’язково заміщену алкільну групу С1-7, гетероциклільну групу С3-20 або арильну групу C5-20, або разом вони можуть утворювати, разом з атомом азоту, до якого вони приєднані, необов’язково заміщене гетероциклічне кільце, яке має від 4 до 8 кільцевих атомів;
якщо А, В, D вибрані із груп (і), (іі), зазначених вище, Z вибирають із групи, яка містить S, О, С(=O), СН2 та NH; а якщо А, В, D являють групу (ііі), Z вибирають із О, С(=O), СН2 та NH;
R4 вибраний із групи, яка включає Н, ОН, NO2, NH2 та Q-Y-X,
де
Q являє собою -NH-C(=O)- або -O-;
Y являє собою необов’язково заміщену алкіленову групу С1-5;
Х вибраний з SRS1 або NRN3RN4, де
RS1 або RN3 та RN4 незалежно вибрані із групи, яка включає водень, необов’язково заміщені алкільну С1-7, арильну C5-20 або гетероциклільну С3-20 групи, або RN3 та RN4 можуть разом утворювати, разом з атомом азоту, до якого вони приєднані, необов’язково заміщене гетероциклічне кільце, яке має від 4 до 8 кільцевих атомів;
якщо Q являє собою -O-, Х можна додатково вибрати з -С(=O)-NRN5RN6, де RN5 та RN6 незалежно вибрані із групи, яка включає водень, необов’язково заміщену алкільну С1-7, арильну C5-20 або гетероциклільну C3-20 групи, або RN5 та RN6 можуть разом утворювати, разом з атомом азоту, до якого вони приєднані, необов’язково заміщене гетероциклічне кільце, яке має від 4 до 8 кільцевих атомів, і
якщо Q являє собою -NH-C(=O)-, -Y-X можна додатково вибрати з алкілу С1-7;
за умови, що, якщо А, В, D являють групу (ііі) та RN1 та RN2 разом з атомом вуглецю, з яким вони зв'язані хімічним зв'язком, утворюють морфоліногрупу, R4 не може бути Н.
2. Сполука за п. 1, яка відрізняється тим, що R4 являє собою Q-Y-X.
3. Сполука за п. 1 або за п. 2, яка відрізняється тим, що Q являє собою -NH-C(=O)- та Х являє собою NRN3RN4.
4. Сполука за п. 1 або за п. 2, яка відрізняється тим, що Q являє собою -O-, Х являє собою NRN3RN4, та Y являє собою необов’язково заміщену алкіленову групу С1-3.
5. Сполука за будь-яким з пп. 1-4, яка відрізняється тим, що Z вибирають із S та О, де це доцільно.
6. Сполука за будь-яким з пп. 1-5, яка відрізняється тим, що RN1 та RN2 утворюють разом з атомом азоту, до якого вони приєднані, гетероциклічне кільце, яке має від 4 до 8 кільцевих атомів.
7. Сполука за будь-яким з пп. 1-5, яка відрізняється тим, що RN1 та RN2 утворюють разом з атомом азоту, до якого вони приєднані, групу, вибрану з морфоліно- і тіоморфоліногруп.
8. Композиція, яка містить сполуку за будь-яким з пп. 1-7 і фармацевтично прийнятний носій або розріджувач.
9. Сполука за будь-яким з пп. 1-7 для застосування у способі лікування.
10. Застосування сполуки за будь-яким з пп. 1-7 для одержання лікарського препарату для лікування захворювання, що піддається лікуванню при інгібуванні ДНК-ПК.
11. Застосування сполуки за будь-яким з пп. 1-7 при одержанні лікарського препарату для:
(a) застосування як додаткового засобу у раковій терапії або для посилення впливу на пухлинні клітини при лікуванні іонізуючим опромінюванням або хіміотерапевтичними препаратами; або
(b) лікування захворювань, викликаних ретровірусами.
12. Сполука за будь-яким з пп. 1-7 для застосування при лікуванні захворювання, яке піддається лікуванню при інгібуванні ДНК-ПК.
13. Сполука за будь-яким з пп. 1-7 для:
а) застосування як додаткового засобу у раковій терапії або для посилення впливу на пухлинні клітини при лікуванні іонізуючим опромінюванням або хіміотерапевтичними препаратами; або
(b) лікування захворювань, викликаних ретровірусами.
14. Спосіб пригнічення ДНК-ПК in vitro або in vivo, в якому піддають контактуванню клітини з ефективною кількістю сполуки за будь-яким з пп. 1-7.
Текст
1. Сполука формули І: 2 3 90716 4 6. Сполука за будь-яким з пп. 1-5, яка відрізняY являє собою необов’язково заміщену алкіленову ється тим, що RN1 та RN2 утворюють разом з атогрупу С1-5; S1 N3 N4 Х вибраний з SR або NR R , де мом азоту, до якого вони приєднані, гетероциклічRS1 або RN3 та RN4 незалежно вибрані із групи, яка не кільце, яке має від 4 до 8 кільцевих атомів. 7. Сполука за будь-яким з пп. 1-5, яка відрізнявключає водень, необов’язково заміщені алкільну N1 N2 ється тим, що R та R утворюють разом з атоС1-7, арильну C5-20 або гетероциклільну С3-20 групи, N3 N4 або R та R можуть разом утворювати, разом з мом азоту, до якого вони приєднані, групу, вибраатомом азоту, до якого вони приєднані, неону з морфоліно- і тіоморфоліногруп. бов’язково заміщене гетероциклічне кільце, яке 8. Композиція, яка містить сполуку за будь-яким з має від 4 до 8 кільцевих атомів; пп. 1-7 і фармацевтично прийнятний носій або якщо Q являє собою -O-, Х можна додатково виброзріджувач. рати з -С(=O)-NRN5RN6, де RN5 та RN6 незалежно 9. Сполука за будь-яким з пп. 1-7 для застосуванвибрані із групи, яка включає водень, неоня у способі лікування. бов’язково заміщену алкільну С1-7, арильну C5-20 10. Застосування сполуки за будь-яким з пп. 1-7 або гетероциклільну C3-20 групи, або RN5 та RN6 для одержання лікарського препарату для лікуможуть разом утворювати, разом з атомом азоту, вання захворювання, що піддається лікуванню при до якого вони приєднані, необов’язково заміщене інгібуванні ДНК-ПК. гетероциклічне кільце, яке має від 4 до 8 кільцевих 11. Застосування сполуки за будь-яким з пп. 1-7 атомів, і при одержанні лікарського препарату для: якщо Q являє собою -NH-C(=O)-, -Y-X можна до(a) застосування як додаткового засобу у раковій датково вибрати з алкілу С1-7; терапії або для посилення впливу на пухлинні кліза умови, що, якщо А, В, D являють групу (ііі) та тини при лікуванні іонізуючим опромінюванням або RN1 та RN2 разом з атомом вуглецю, з яким вони хіміотерапевтичними препаратами; або зв'язані хімічним зв'язком, утворюють морфоліног(b) лікування захворювань, викликаних ретровірурупу, R4 не може бути Н. сами. 2. Сполука за п. 1, яка відрізняється тим, що R4 12. Сполука за будь-яким з пп. 1-7 для застосуявляє собою Q-Y-X. вання при лікуванні захворювання, яке піддається 3. Сполука за п. 1 або за п. 2, яка відрізняється лікуванню при інгібуванні ДНК-ПК. тим, що Q являє собою -NH-C(=O)- та Х являє со13. Сполука за будь-яким з пп. 1-7 для: бою NRN3RN4. а) застосування як додаткового засобу у раковій 4. Сполука за п. 1 або за п. 2, яка відрізняється терапії або для посилення впливу на пухлинні клітим, що Q являє собою -O-, Х являє собою тини при лікуванні іонізуючим опромінюванням або N3 N4 NR R , та Y являє собою необов’язково заміщехіміотерапевтичними препаратами; або ну алкіленову групу С1-3. (b) лікування захворювань, викликаних ретровіру5. Сполука за будь-яким з пп. 1-4, яка відрізнясами. ється тим, що Z вибирають із S та О, де це доці14. Спосіб пригнічення ДНК-ПК in vitro або in vivo, в льно. якому піддають контактуванню клітини з ефективною кількістю сполуки за будь-яким з пп. 1-7. Даний винахід стосується сполук, які діють як інгібітори ДНК-протеїнкінази (ДНК-ПК), способів їх застосування та синтезу. ДНК-залежна протеїнкіназа (ДНК-ПК) являє собою ядерну серинову/треонінову протеїнкіназу, яка активується при зв'язуванні з ДНК. Як показали біохімічні та генетичні дані, ця кіназа складається з великої каталітичної субодиниці, яка позначається як ДНК-ПКcs, і регуляторного компонента, який позначається як Ku. Як було показано, ДНК-ПК являє собою ключовий компонент як апарата репарації двониткових розривів (ДНР) ДНК, так і апарата V(D)J - рекомбінації. Крім того, у недавній роботі була продемонстрована участь компонентів ДНК-ПК у декількох інших процесах, у тому числі, модуляції хроматинової структури та збереженні теломір (Smith, G. С. М. та Jackson, S.P., Genes ma Dev., 13, 916-934 (1999)). Двониткові розриви ДНК розглядають як найбільш смертоносне пошкодження, з яким може мати справу клітина. Щоб боротися із серйозною небезпекою, яку являє собою ДНР ДНК, еукаріоти чні клітини виробили декілька механізмів, які опосередкують їх репарацію. У вищих еукаріот, основним елементом зазначених механізмів є негомологічне з'єднання кінців (Non-homologous end Joining, NHEJ) ДНК, також відоме як незаконна рекомбінація. ДНК-ПК відіграє ключову роль у зазначеному механізмі. Збільшена активність ДНКПК була продемонстрована як in vitro, так і in vivo, і корелює з резистентністю пухлинних клітин до іонізуючої радіації (IP) і біфункціональним алкілувальним агентам (Muller С, et al., Blood, 92, 22132219 (1998), Sirzen F., et al., Eur. J. Cancer, 35, 111116 (1999)). Тому припустили, що збільшена активність ДНК-ПК являє собою один з механізмів резистентності клітин і пухлин. Із цієї причини, інгібування ДНК-ПК синтетичними інгібіторами може виявитися ефективним при лікуванні пухлин, для яких підвищену експресію розглядають як механізм резистентності. Раніше було виявлено, що інгібітор РІ 3-кінази LY294002: 5 може інгібувати функцію ДНК-ПК in vitro (Izzard, R.A., et al., Cancer Res., 59, 2581-2586 (1999)). IC50 (концентрація, при якій ферментативна активність зменшується на 50%) для LY294002 відносно ДНК-ПК становить приблизно 1мкМ - ту ж величину, що й для РІ 3-кінази. Крім того, було показано, що LY294002 також здатний до слабкого підвищення чутливості клітин до впливу IP (Rosenzweig, K.E., et al., Clin. Cancer Res., 3, 11491156 (1999)). В WO 03/024949 описане деяке число класів сполук, корисних як інгібіторів ДНК-ПК, у тому числі 2-аміно-хромен-4-они загальної структури: Один із яких мав структуру: Ця сполука проявляє ІС50=10-12нМ і SER=1.3 (100нМ) (дивися нижче опис способів). Інші приклади інгібіторів ДНК-ПК включають 1(2-гідрокси-4-морфолін-4-іл-феніл)-етанон (Kashishian, Α., et al., Моl. Cancer Ther, 2, 12571264 (2003)): і SU11752 (Ismail, I. H., et al., Oncogene, 23, 873-882 (2004)) 90716 6 Враховуючи залучення ДНК-ПК у процес репарації ДНК, і той факт, що синтетичні інгібітори, як було показано, збільшують радіо- і хемочутливість клітин ссавців у культурі, можна очікувати, що специфічні інгібітори ДНК-ПК можуть бути корисні як реагенти, які будуть підсилювати ефективність, як ракової хіміотерапії, так і радіотерапії. ДНК-ПК інгібітори можуть також виявитися корисними при лікуванні захворювань, викликаних ретровірусами. Наприклад, було продемонстровано, що втрата активності ДНК-ПК у значній мірі пригнічує процес інтеграції ретровірусів (Daniel R, et al., Science, 284, 644-7 (1999)). Автори даного винаходу виявили нові сполуки, які проявляють аналогічний або підвищений рівень інгібування ДНК-ПК, у той же час маючи інші корисні властивості при використанні як активні фармацевтичні препарати, зокрема, поліпшену розчинність та клітинну ефективність. Відповідно, до першого аспекту даний винахід пропонує сполуку формули І: і її ізомери, солі, сольвати, хімічно захищені форми та проліки, у яких: А, В і D відповідно вибрані із групи, яка включає: (і) СН, NH, С; (іі) СН, Ν, Ν; і (ііі) СН, О, С; пунктирні лінії зображують два подвійні зв'язки у відповідних місцях; RN1 та RN2 незалежно вибрані із групи, яка включає водень, можливо заміщену алкільну групу С1-7, гетероциклільну групу С3-20, або арильну групу С5-20, або можуть разом утворювати, разом з атомом азоту, до якого вони приєднані, можливо заміщене гетероциклічне кільце, яке має від 4 до 8 кільцевих атомів; при цьому якщо А, В, D вибрані із груп (і), (іі), зазначених вище, Ζ вибирають із групи, яка включає S, О, С(=О), СН2 і ΝΗ; а якщо А, В, D являють групу (ііі), Ζ вибирають із групи, яка включає О, С(=О), СН2 і ΝΗ; 7 90716 8 R4 вибраний із групи, яка включає Н, ОН, ΝΟ2, но вибирають із групи, яка містить водень, можлиΝΗ2 та Q-Y-X во заміщену алкільну С1-7, арильну С5-20 або гетеде роциклільну групи С3-20, або RN5 та RN6 можуть Q являє собою -NH-C(=O)- або -О-; разом утворювати з атомом азоту, до якого вони Υ являє собою можливо заміщену алкіленову приєднані, можливо заміщене гетероциклічне кігрупу С1-5; льце, яке має від 4 до 8 кільцевих атомів і X вибирають із SRS1 або NRN3RN4, у яких, якщо Q являє собою -NH-C(=O)-, -Y-X можна RS1 або RN3 та RN4 незалежно вибирають із додатково вибрати з алкілу С1-7; групи, яка містить водень, можливо заміщену алкіза умови, що якщо А, В, D являють групу (ііі) та льну С1-7, арильну С5-20 або гетероциклільну групи RN1 та RN2 разом з атомом вуглецю, з яким вони С3-20, або RN3 та RN4 можуть разом утворювати, зв'язані, утворюють морфолін-групу, R4 не може разом з атомом азоту, до якого вони приєднані, бути Н. можливо заміщене гетероциклічне кільце, яке має Варіанти А, В та D приводять до сполук настувід 4 до 8 кільцевих атомів; пних формул: якщо Q являє собою -О-, X можна додатково вибрати з -C(=O)-NRN5RN6, де RN5 та RN6 незалеж Відповідно до другого аспекту даного винаходу запропонована композиція, яка містить сполуку відповідно до першого аспекту і фармацевтично прийнятний носій або розріджувач. Відповідно до третього аспекту даного винаходу запропонована сполука відповідно до першого аспекту для використання в терапії. Відповідно до четвертого аспекту даного винаходу запропоноване застосування сполуки відповідно до першого аспекту для приготування лікарського препарату для лікування захворювання, яке піддається лікуванню при інгібуванні ДНК-ПК. Переважно лікарський препарат відповідно до четвертого аспекту селективно інгібує активність ДНК-ПК у порівнянні з РІ 3-кіназою і/або ATM. Се лективність особливо важлива, оскільки пригнічення інших членів сімейства РІ 3-кіназ може привести до небажаних побічних ефектів, зв'язаних із втратою функції цих ферментів. Зокрема, ці сполуки можна використовувати при приготуванні лікарського препарату для: (a) застосування як додатковий засіб у раковій терапії або для посилення впливу на пухлинні клітини при лікуванні іонізуючим випромінюванням або хіміотерапевтичними препаратами; або (b) лікування захворювань, викликаних ретровірусами. Відповідно до ще одного аспекту, даний винахід пропонує активну сполуку, описану в даному документі, для застосування при лікуванні людини 9 90716 10 або тварини, краще у формі фармацевтичної ком4 були кільцевими гетероатомами. Кільцеві гетепозиції. роатоми кільця краще вибирати із групи, яка місВідповідно до іншого аспекту, даний винахід тить О, N, S і P. "C3-20" означає кільцеві атоми, або пропонує спосіб пригнічення ДНК-ПК in vitro або in вуглецеві атоми або гетероатоми. vivo, який включає приведення клітини в контакт із Приклади гетероциклічних груп С3-20, які мають ефективною кількістю активної сполуки, описаної в кільцевий атом азоту, включають, але не обмежуданому документі. ються ними, групи, одержані з азиридину, азетиВизначення дину, піролідинів (тетрагідропіролу), піроліну (наАлкіл С1-7: Термін "алкіл С1-7", використовуваприклад, 3-піроліну, 2,5-дигідропіролу), 2Н-піролу ний у цьому документі, стосується одновалентної або 3H-піролу (ізопіролу, ізоазолу), піперидину, групи, одержаної шляхом видалення атома водню дигідропіридину, тетрагідропіридину та азепіну. з вуглеводневої сполуки С1-7, що має від 1 до 7 Приклади гетероциклічних груп С3-20, які мають атомів вуглецю, яка може бути аліфатичною або один кільцевий атом кисню, включають, але не аліциклічною або їх комбінацією, і яка може бути обмежуються ними, групи, одержані з оксирану, насиченою, частково ненасиченою або повністю оксетану, оксолану (тетрагідрофурану), оксолу ненасиченою. (дигідрофурану), океану (тетрагідропірану), дигідПриклади насичених лінійних алкільних груп ропірану, пірану (С6) і оксепіну. Приклади заміщеС1-7 включають, але не обмежуються ними, метил, них гетероциклічних груп С3-20 включають цукри, у етил, н-пропіл, н-бутил і н-пентил (аміл). циклічній формі, наприклад, фуранози та піранози, Приклади насичених розгалужених алкільних у тому числі, наприклад, рибозу, ліксозу, ксилозу, груп С1-7 включають, але не обмежуються ними, галактозу, сахарозу, фруктозу та арабінозу. ізо-пропіл, ізо-бутил, втор-бутил, трет-бутил та Приклади гетероциклічних груп С3-20, які мають нео-пентил. кільцевий атом сірки, включають, але не обмежуПриклади насичених аліциклічних алкільних ються ними, групи, одержувані з тіїрану, тіетану, груп С1-7 (також називаних "циклоалкільними С3-7" тіолану (тетрагідротіофену), тіану (тетрагідротіопігрупами) включають, але не обмежуються ними, рану) і тієпану. такі групи, як циклопропіл, циклобутил, циклопенПриклади гетероциклічних груп С3-20, які мають тил і циклогексил, а також такі заміщені групи (надва кільцевих атоми кисню, включають, але не приклад, групи, які містять такі групи), як метилциобмежуються ними, групи, одержані з діоксалану, клопропіл, диметилциклопропіл, метилциклобутил, діоксану та діоксепану. диметилциклобутил, метилциклопентил, диметилПриклади гетероциклічних груп С3-20, які мають циклопентил, метилциклогексил, диметилциклогедва кільцевих атоми азоту, включають, але не обксил, циклопропілметил і циклогексилметил. межуються ними, групи, одержані з імідазолідину, Приклади ненасичених алкільних груп С1-7, які піразолідину (діазолідину), імідазоліну, піразоліну мають одну або декілька подвійних зв'язків вуг(дигідропіразолу) і піперазину. лець-вуглець (також називані «алкенільними С2-7» Приклади гетероциклічних груп С3-20, які мають групами) включають, але не обмежуються ними, один кільцевий атом азоту й один кільцевий атом етеніл (вініл, -СН=СН2), 2-пропеніл (аліл, -СНкисню, включають, але не обмежуються ними, груСН=СН2), ізопропеніл (-С(СН3)=СН2), бутеніл, пенпи, одержані з тетрагідрооксазолу, дигідрооксазотеніл і гексеніл. лу, тетрагідроізооксазолу, дигідроізооксазолу, Приклади ненасичених алкільних груп С1-7, які морфоліну, тетрагідрооксазину, дигідрооксазину мають одну або декілька потрійних зв'язків вугта оксазину. лець-вуглець (також називані "алкінільними С2-7" Приклади гетероциклічних груп С3-20, які мають групами) включають, але не обмежуються ними, два кільцевих атоми кисню, включають, але не етиніл (етиніл) і 2-пропініл (пропаргил). обмежуються ними, групи, одержані з оксатіолану Приклади ненасичених аліциклічних (карбоцита оксатіану (тіоксану). клічних) алкільних груп С1-7, які мають одну або Приклади гетероциклічних груп С3-20, які мають декілька подвійних зв'язків вуглець-вуглець (також один кільцевий атом азоту й один кільцевий атом називані "циклоалкенільними С3-7" групами) вклюсірки, включають, але не обмежуються ними, гручають, але не обмежуються ними, такі незаміщені пи, одержані з тіазоліну, тіазолідину та тіоморфогрупи, як циклопропеніл, циклобутеніл, циклопенліну. теніл і циклогексеніл, а також такі заміщені групи Інші приклади гетероциклічних груп С3-20 вклю(наприклад, групи, які містять такі групи) як циклочають, але не обмежуються ними, оксадіазин і пропенілметил і циклогексенілметил. оксатіазин. Гетероцикл С3-20: Термін "гетероциклічний С3Приклади гетероциклічних груп, які додатково мають одну або декілька оксо (=O) груп, включа20", використовуваний у даному документі, стосується одновалентної групи, одержаної шляхом ють, але не обмежуються ними, групи, одержані з: видалення атома водню від кільцевого атома гегетероциклів С5, таких як фуранон, пірон, піротероциклічної сполуки С3-20, вищевказана сполука лідон (піролідинон), піразолон (піразолінон), імідамає одне кільце, або два або декілька кілець (назолідон, тіазолон і ізотіазолон; приклад, спіральні, конденсовані, мостикові), і має гетероциклів С6, таких як піперидинон (піперивід 3 до 20 кільцевих атомів, атомів, з яких від 1 до дон), піперидиндіон, піперазинон, піперазиндіон, 10 являють собою кільцеві гетероатоми, і в якому піридазинон і піримідинон (наприклад, цитозин, принаймні одне з вищевказаних кілець (кільця) тимін, урацил) і барбітурова кислота; являє собою гетероциклічне кільце. Краще, щоб кожне кільце мало від 3 до 7 атомів, з яких від 1 до 11 90716 12 конденсованих гетероциклів, таких як оксиндіазин; наприклад, цитозин, тимін, урацил), пірадол, пуринон (наприклад, гуанін), бензоксазолінон, зину (1,4-діазин), триазину, тетразолу й оксадіазобензопірон (наприклад, кумарин); лу (фуразан). циклічних ангідридів (-С(=О)-О-С(=О)- у кільці), Приклади гетероциклічних груп С5-20 (деякі з які включають, але не обмежуються ними, малеїяких являють собою гетероарильні групи С5-20), які новий ангідрид, бурштиновий ангідрид і глутаромістять конденсовані кільця, включають, але не вий ангідрид; обмежуються ними, гетероциклічні групи C9, одерциклічних карбонатів (-O-С(=O)-O- у кільці), тажані з бензофурану, ізобензофурану, індолу, ізоінких як етиленкарбонат і 1,2-пропіленкарбонат; долу, пурину (наприклад, аденін, гуанін), бензотіімідів (-C(=O)-NR-C(=O)- у кільці), які включаофену, бензімідазолу; гетероциклічні групи С10, ють, але не обмежуються ними, сукцинімід, малеіодержані з хіноліну, ізохіноліну, бензодіазину, пімід фталімід і глутаримід; ридопіридину, хіноксаліну; гетероциклічні групи лактонів (циклічних ефірів, -О-С(=О)- у кільці), С13, одержані з карбазолу, дибензотіофену, дибензофурану; гетероциклічні групи С14, одержані з які включають але не обмежуються ними, акридину, ксантену, феноксатину, феназину, фепропіолактон, -бутиролактон, -валеролактон (2ноксазину, фенотіазіну. піперидон) і -капролактон; Вищевказані алкільні С1-7, гетероциклічні С3-20 і лактамів (циклічних амідів, -NR-C(=O)- у кільарильні С5-20 групи, поодинці або як частина іншого ці), які включають але не обмежуються ними, замісника, самі можуть бути заміщені однією або пропіолактам, -бутиролактам (2-піролідон), декількома групами, вибраними з них самих і довалеролактам і -капролактам; даткових замісників, перерахованих нижче. циклічних карбаматів (-O-C(=O)-NR- у кільці), Гало: -F, -СІ, -Br та -І. таких як 2-оксазолідон; Гідрокси: -ОН. циклічних сечовин (-NR-C(=O)-NR- у кільці), Ефір: -OR, де R являє собою ефірний замістаких як 2-імідазолідон і піримідин-2,4-діон (наприник, наприклад, алкільну групу С1-7 (також називаклад, тимін, урацил). ну алкокси групою С1-7, що розглянута нижче), геАрил С5-20: Термін "арил С5-20", використовуватероциклільну групу С3-20 (також називану ний у даному документі, стосується одновалентної гетероциклокси групою С3-20), або арильну групу групи, одержаної шляхом видалення атома водню С5-20 (також називану арилокси групою С5-20), пез атома ароматичного кільця ароматичної сполуки реважно алкільну групу С1-7. С5-20, вищевказана сполука, яка має одне кільце Алкокси С1-7: -OR, де R являє собою алкільну або два або декілька кілець (наприклад, конденсогрупу С1-7. Приклади алкокси груп С1-7 включають, ваних) і має від 5 до 20 кільцевих атомів, у якій але не обмежуються ними, -ОСН3 (метокси), принаймні одне з вищевказаних кілець (кільця) ОСН2СН3 (етокси) і -ОС(СН3)3 (тетра-бутокси). являє собою ароматичне кільце. Краще, щоб кожОксо (кето, -он): =O. Приклади циклічних споне кільце мало від 5 до 7 кільцевих атомів. лук і/або груп, що мають, як замісник, оксо групу Всі кільцеві атоми можуть являти собою атоми (=O) включають, але не обмежуються ними, карвуглецю, як в "карбоарильних групах", у цьому боцикли, такі як циклопентанон і циклогексанон; випадку цю групу можна просто назвати "карбоагетероцикли, такі як пірон, піролідон, піразолон, рильною С5-20" групою. піразолінон, піперидон, піперидиндіон, піперазинПриклади арильних груп С5-20, які не мають кідіон і імідазолідон; циклічні ангідриди, у тому числьцевих гетероатомів (наприклад, карбоарильні лі, але не обмежуючись ними, малеїновий ангідгрупи С5-20) включають, але не обмежуються ними, рид і бурштиновий ангідрид; циклічні карбонати, групи, одержані з бензолу (наприклад, феніл) (С6), такі як пропіленкарбонат; іміди, у тому числі, але нафталіну (С10), антрацену (С14), фенантрену не обмежуючись ними, сукцинімід і малеімід; лак(С14), нафтацену (С18) і пірену (С16). тони (циклічні ефіри, -O-С(=O)- у кільці), у тому Приклади арильних груп, які містять конденсочислі, але не обмежуючись ними, -пропіолактон, вані кільця, одне із яких не є ароматичним кільцем, -бутиролактон, -валеролактон і -капролактон; і включають, але не обмежуються ними, групи, оделактами (циклічні аміди, -NH-C(=O)- у кільці), у ржані з індену та флуорену. тому числі, але не обмежуючись ними, Як альтернатива, кільцеві атоми можуть містипропіолактам, -бутиролактам (2-піролідон), ти один або декілька гетероатомів, включаючи, валеролактам і -капролактам. але не обмежуючись ними, кисень, азот і сірку, як Іміно (імін): =NR, де R являє собою іміно замів "гетероарильних групах". У цьому випадку, групу сник, наприклад, водень, алкільну групу С1-7, гетеможна просто назвати "гетероарильною С5-20" груроциклільну групу С3-20, або арильну групу С5-20, пою, у якій "С5-20" означає кільцеві атоми, або вугпереважно водень або алкільну групу С1-7. Приклецеві атоми або гетероатоми. Краще, щоб кожне лади ефірних груп включають, але не обмежуютькільце мало 5-7 кільцевих атомів, з яких від 0 до 4 ся ними, =NH, =NMe, =NEt та =NPh. атомів являли собою кільцеві гетероатоми. Форміл (карбальдегід, карбоксальдегід): Приклади гетероарильних груп С5-20 включаС(=О)Н. ють, але не обмежуються ними, гетероарильні Ацил (кето): -C(=O)R, де R являє собою ацигрупи С5, одержані з фурану (оксол), тіофену (тільний замісник, наприклад, алкільну групу С1-7 ол), піролу (азол), імідазолу (1,3-діазол), піразолу (також називану алкілацилом С1-7 або алканоїлом (1,2-діазол), триазолу, оксазолу, ізоксазолу, тіазоС1-7), гетероциклільну групу С3-20 (також називану лу, ізотіазолу, оксадіазолу й оксатриазолу; і гетегетероциклоацилом С3-20) або арильну групу С5-20 роарильні групи С6, одержані з ізоксазину, піриди(також називану С5-20 арилацилом), переважно ну (азин), піридазину (1,2-діазин), пірімідину (1,3 13 90716 14 алкільну групу С1-7. Приклади ацильних груп вклюNMeCONHC(O)Et, -NMeCONMe(O)Me, чають, але не обмежуються ними, -С(=О)СН3 (ацеNMeCONEt(O)Et і -NMeCONHC(O)Ph. тил), -С(=О)СН2СН3 (пропіоніл), -С(=О)С(СН3)3 Карбамат: -NR1-C(O)-OR2 де R1 являє собою (бутирил) і -C(=O)Ph (бензоїл, фенон). аміно замісник, відповідно до визначення аміногКарбокси (карбонова кислота): -СООН. руп, та R2 являє собою ефірну групу, відповідно до Складний ефір (карбоксилат, ефір карбонової визначення ефірних груп. Приклади карбаматних кислоти, оксикарбоніл): -C(=O)OR, де R являє согруп включають, але не обмежуються ними, -NHбою ефірний замісник, наприклад, алкільну групу C(O)-O-Me, -NMe-C(O)-O-Me, -NH-C(O)-O-Et, -NМеС1-7, гетероциклільну групу С3-20 або арильну групу С(О)-О-трет-бутил і -NH-C(O)-O-Ph. С5-20, переважно, алкільну групу С1-7. Приклади Тіоамід (тіокарбаміл): -C(=S)NR1R2, де R1 та R2 ефірних груп включають, але не обмежуються нинезалежно являють собою аміно замісники, відпоми, -С(=О)ОСН3, -С(=О)ОСН2СН3, -С(=О)ОС(СН3)3 відно до визначення аміногруп. Приклади амідогта -C(=O)OPh. руп включають, але не обмежуються ними, Ацилокси (обернений ефір): -OC(=O)R, де R C(=S)NH2, -C(=S)NHCH3, -C(=S)N(CH3)2 і являє собою ацилокси замісник, наприклад, алкіC(=S)NHCH2CH3. льну групу С1-7, гетероциклільну групу С3-20 або Тетразоліл: п'ятичленне ароматичне кільце, арильну групу С5-20, переважно, алкільну групу С1яке має чотири атоми азоту та один атом вуглецю, 7. Приклади ацилокси груп включають, але не обмежуються ними, -ОС(=О)СН3 (ацетокси), ОС(=О)СН2СН3, -ОС(=О)С(СН3)3, -OC(=O)Ph та OC(=O)CH2Ph. Амідо (карбамоїл, карбаміл, амінокарбоніл, карбоксамід): -C(=O)NR1R2, де R1 та R2 незалежно Аміно: -NR1R2, де R1 та R2 незалежно являють являють собою аміно замісники, відповідно до висобою аміно замісники, наприклад, водень, алкізначення аміно груп. Приклади амідогруп включальну групу С1-7 (також називану алкіламіном С1-7 ють, але не обмежуються ними, -C(=O)NH2, або ді-С1-7-алкіламіном), гетероциклільну групу С3C(=O)NHCH3, -C(=O)N(CH3)2, -C(=O)NHCH2CH3 і 20 або арильну групу С5-20, переважно, Η або алкіC(=O)N(CH2CH3)2, а також амідогрупи, у яких R1 та 2 льну групу С1-7, або, у випадку "циклічної" аміногR , разом з атомом азоту, до якого вони приєднані, рупи, R1 та R2, узяті разом з атомом азоту, до якоутворюють гетероциклічну структуру, як, наприго вони приєднані, утворюють гетероциклічне клад, у піперидинкарбонілі, морфолінкарбонілі, кільце, яке має від 4 до 8 кільцевих атомів. Приктіоморфолінкарбонілі та піперазинкарбонілі. 1 2 1 лади аміногруп включають, але не обмежуються Ациламід (ациламін): -NR C(=O)R , де R явними, -NH2, -NHCH3, -NHC(CH3)2, -N(CH3)2, ляє собою амідний замісник, наприклад, водень, N(CH2CH3)2 та -NHPh. алкільну групу С1-7, гетероциклільну групу С3-20 або Приклади циклічних аміногруп включають, але арильну групу С5-20, переважно, водень або алкі2 не обмежуються ними, азиридино, азетидино, пільну групу С1-7, та R являє собою ацильний заміролідино, піперидино, піперазино, морфоліно та сник, наприклад, алкільну групу С1-7, гетероциклітіоморфоліно. льну групу С3-20 або арильну групу С5-20, Іміно: =NR, де R являє собою іміно замісник, переважно, водень або алкільну групу С1-7. Прикнаприклад, водень, алкільну групу С1-7, гетероциклади ациламідних груп включають, але не обмелільну групу С3-20 або арильну групу С5-20, переважуються ними, -NHC(=O)CH3, -NHC(=O)CH2CH3 та жно, Η або алкільну групу С1-7. -NHC(=O)Ph. R1 та R2 можуть разом утворювати Амідин: -C(=NR)NR2, де кожний R являє собою циклічну структуру, як, наприклад, у сукцинімідилі, замісник амідину, наприклад, водень, алкільну малеімідилі та фталімідилі: групу С1-7, гетероциклільну групу С3-20 або арильну групу С5-20, переважно, Η або алкільну групу С1-7. Прикладом амідин групи є -C(=NH)NH2. Карбазоїл (гідразинокарбоніл): -C(O)-NN-R1 де R1 являє собою аміно замісник, відповідно до визначення аміно груп. Приклади азино груп включають, але не обмежуються ними, -C(O)-NN-H, C(O)-NN-Me, -C(O)-NN-Et, -C(O)-NN-Ph та -C(O)NN-CH2-Ph. Нітро: -NO2. Ацилуреїд: -N(R1)C(O)NR2C(O)R3, де R1 та R2 Нітрозо: -NO. незалежно являють собою уреїдні замісники, наАзидо: -N3. приклад, водень, алкільну групу С1-7, гетероцикліЦіано (нітрил, карбонітрил): -CN. льну групу С3-20 або арильну групу С5-20, переважІзоціано: -NC. но, водень або алкільну групу С1-7. R3 являє собою Ціанато: -OCN. ацильну групу, відповідно до визначення ацильних Ізоціанато: -NCO. груп. Приклади ацилуреїдних груп включають, але Тіоціано (тіоціанато): -SCN. не обмежуються ними, -NHCONHC(O)H, Ізотіоціано (ізотіоціанато): -NCS. NHCONMeC(O)H, -NHCONEtC(O)H, Сульфгідрил (тіол, меркапто): -SH. NHCONMeC(O)Me, -NHCONEtC(O)Et, Тіоефір (сульфід): -SR, де R являє собою тіоNMeCONHC(O)Et, -NMeCONHC(O)Me, ефірний замісник, наприклад, алкільну групу С1-7 15 90716 16 (також називану алкілтіо групою С1-7), гетероцикліС5-20, переважно, алкільну групу С1-7. Приклади льну групу С3-20 або арильну групу С5-20, переважсульфінілокси груп включають, але не обмежуютьно, алкільну групу С1-7. Приклади С1-7 алкілтіо груп ся ними, -OS(=O)CH3 і -OS(=O)CH2CH3. включають, але не обмежуються ними, -SCH3 і Сульфаміно: -NR1S(=O)2OH, де R1 являє соSCH2CH3. бою аміно замісник, відповідно до визначення аміДисульфід: -SS-R, де R являє собою дисульно груп. Приклади сульфаміно груп включають, фідний замісник, наприклад, алкільну групу С1-7, але не обмежуються ними, -NHS(=O)2OH та гетероциклільну групу С3-20 або арильну групу С5N(CH3)S(=O)2OH. Сульфінаміно: -NR1S(=O)R, де R1 являє собою 20, переважно, алкільну групу С1-7 (також називану алкілдисульфідом С1-7). Приклади алкілдисульфіаміно замісник, відповідно до визначення аміно дних груп С1-7 включають, але не обмежуються груп, та R являє собою замісник сульфінаміну, ними, -SSCH3 і -SSCH2CH3. наприклад, алкільну групу С1-7, гетероциклільну Сульфон (сульфоніл): -S(=O)2R, де R являє групу С3-20, або арильну групу С5-20, переважно, собою замісник сульфону, наприклад, алкільну алкільну групу С1-7. Приклади сульфінаміно груп групу С1-7, гетероциклільну групу С3-20 або арильну включають, але не обмежуються ними, групу С5-20, переважно, алкільну групу С1-7. ПрикNHS(=O)CH3 та -N(CH3)S(=O)C6H5. лади сульфонових груп включають, але не обмеСульфамід: -S(=O)NR1R2, де R1 та R2 являють жуються ними, -S(=O)2CH3 (метансульфоніл, месобою незалежні аміно замісники, як визначено зил), -S(=O)2CF3 (трифліл), -S(=O)2CH2CH3, для аміно груп. Приклади сульфамід груп включаS(=O)2C4F9 (нонафліл), -S(=O)2CH2CF3 (трезил), ють, але не обмежуються ними, -S(=O)NH2, S(=O)2Ph (фенілсульфоніл), 4S(=O)NH(CH3), -S(=O)N(CH3)2, -S(=O)NH(CH2CH3), метилфенілсульфоніл (тозил), 4-S(=O)N(CH2CH3)2 та -S(=O)NHPh. бромфенілсульфоніл (брозил) і 4-нітрофеніл (ноСульфонамін: -NR1S(=O)2R, де R1 являє собою зил). аміно замісник, як визначено для аміно груп, та R Сульфін (сульфініл, сульфоксид): -S(=O)R, де являє собою замісник сульфонаміну, наприклад, R являє собою замісник сульфіна, наприклад, алалкільну групу С1-7, гетероциклільну групу С3-20, кільну групу С1-7, гетероциклільну групу С3-20 або або арильну групу С5-20, переважно, алкільну групу арильну групу С5-20, переважно, алкільну групу С1С1-7. Приклади сульфонамін груп включають, але не обмежуються ними, -NHS(=O)2CH3 та 7. Приклади сульфін груп включають, але не обмежуються ними, -S(=O)CH3 та -S(=O)CH2CH3. N(CH3)S(=O)2C6H5. Особливий клас сульфонаміСульфонілокси: -OS(=O)2R, де R являє собою нових груп являють собою групи, одержані із сульзамісник сульфонілокси, наприклад, алкільну групу тамів - у цих групах один з R1 та R являє собою С1-7, гетероциклільну групу С3-20, або арильну груарильну групу С5-20, переважно, феніл, тоді як інпу С5-20, переважно, алкільну групу С1-7. Приклади ший з R1 та R являє собою бідентатну групу, яка сульфонілокси груп включають, але не обмежуутворює хімічний зв'язок з арильною групою С5-20, ються ними, -OS(=O)2CH3 та -OS(=O)2CH2CH3. такий як бідентатна група, одержана з алкільної Сульфінілокси: -OS(=O)R, де R являє собою групи С1-7. Приклади таких груп включають, але не замісник сульфінілокси, наприклад, алкільну групу обмежуються ними: С1-7, гетероциклільну групу С3-20 або арильну групу Фосфорамідат: -OP(=O)(OR1)-NR22, де R1 та R2 являють собою замісники фосфорамідату, наприклад, -Н, (можливо заміщену) алкільну групу С1-7, гетероциклільну групу С3-20 або арильну групу С520, переважно, -Н, алкільну групу С1-7 або арильну групу С5-20. Приклади фосфорамідатних груп включають, але не обмежуються ними, OP(=O)(OCH2CH3)-N(CH3)2, -OP(=O)(OCH2CH3)-N(iPr)2 та -OP(=O)(OCH2CH2CN)-N(i-Pr)2. У багатьох випадках, самі замісники можуть бути заміщеними. Наприклад, алкокси група С1-7 може бути заміщена, наприклад, алкілом С1-7 (та кож називаним С1-7алкіл-С1-7алкокси групою), наприклад, циклогексилметокси, гетероциклільною групою С3-20 (також називаною С5-20арил-С17алкокси групою), наприклад, фталімідоетокси, або арильною групою С5-20 (також називаною С520арил-С1-7алкокси групою), наприклад, бензилокси. Алкілен С1-5: Термін "алкілен С1-5", використовуваний у даному документі, стосується бідентатної групи, одержаної шляхом видалення двох атомів водню, або обох від одного і того самого атома вуглецю або кожного від двох різних атомів вугле 17 90716 18 цю, аліфатичної лінійної вуглеводневої сполуки, включає н-, ізо-, втор- та трет-бутил; метоксифеніл яка має від 1 до 5 вуглецевих атомів (якщо не завключає орто-, мета- та пара-метоксифеніл). значено інакше), та може бути насиченою, часткоВищевказане виключення не стосується тауво ненасиченою або повністю ненасиченою. Таким томерним форм, наприклад, кето-, єнол- і єнолятчином, термін "алкілен" включає підкласи алкеніформ, як, наприклад, у наступних таутомерних лену, алкінілену, і т.п., обговорювані нижче. парах: кето/єнольний (показані нижче), імін/енамін, Приклади насичених алкіленових груп С1-5 амід/іміновий спирт, амідин/амідин, нітрозо/оксим, включають, але не обмежуються ними, -(СН2)n- де тіокетон/енетіол, N-нітрозо/гідроксіазо та нітn являє собою ціле число від 1 до 5, наприклад, ро/аци-нітро. СН2- (метилен), -СН2СН2- (етилен), -СН2СН2СН2(пропілен) і -СН2СН2СН2СН2- (бутилен). Приклади частково ненасичених алкіл енових груп С1-5 включають, але не обмежуються ними, СН=СН- (вінілен), -СН=СН-СН2-, -СН2-СН=СН2-, СН=СН-СН2-СН2-, -СН=СН-СН2-СН2-СН2-, СН=СН-СН=СН- та -СН=СН-СН=СН-СН2-. Групи замісників, перераховані вище, можуть Відзначимо, що в термін «ізомер» спеціально бути замісниками в алкіленовій групі. включені сполуки з одним або декількома ізотопЗастосування інших форм ними замісниками. Наприклад, Η може бути в Інші форми являють собою добре відомі іонні, будь-якій ізотопній формі, у тому числі 1Н, 2Н (D) сольові, сольватні та захищені форми зазначених та 3Н (Т); С може бути в будь-якій ізотопній формі, замісників. Наприклад, посилання на карбонову у тому числі 12С, 13С та 12С, 13С; О може бути в кислоту (-СООН) також включають аніонну (карбобудь-якій ізотопній формі, у тому числі 16О та 18О; і ксилатну) форму (-СОО ), її сіль або сольват, а т.п. також звичайні захищені форми. Подібним чином, Якщо спеціально не зазначено, посилання на посилання на аміногрупу включає протоновану конкретну сполуку включає всі ці ізомерні форми, у форму (-N+HR1R2), сіль або сольват аміногрупи, тому числі (цілком або частково) рацемічні та інші наприклад, гідрохлоридну сіль, а також звичайні їх суміші. Способи приготування (наприклад, асизахищені форми аміногрупи. Подібним чином, пометричний синтез) і розділення (наприклад, фраксилання на гідроксильну групу також включають ційна кристалізація та хроматографічні методи) таких ізомерних форм відомі в даній галузі або їх аніонну форму (-O ), її сіль або сольват, а також легко одержати шляхом адаптування відомим чизвичайні захищені форми гідроксильної групи. ном способів, розглянутих у даному документі, або Ізомери, солі, сольвати, захищені форми та вже відомих способів. проліки Якщо спеціально не зазначено, посилання на Деякі сполуки можуть існувати в одній або деконкретну сполуку також включає її іонні, сольові, кількох особливих геометричних, оптичних, енансольватні та захисні форми, наприклад, розглянуті тіомерних, діастереомерних, епімерних, стереоінижче. зомерних, таутомерних, конформаційних або Може бути зручно або вигідно одержувати, аномерних формах, у тому числі, але не обмежуочищати і/або маніпулювати з відповідною сіллю ючись ними, цис- та транс-формах; Е- та Z- форактивної сполуки, наприклад, фармацевтично примах; с-, t- та r-формах; ендо- та екзо-формах; R-, йнятною сіллю. Приклади фармацевтично прийняS- та мезо-формах; D- та L-формах; d- та lтних солей обговорені в Berge, et al., J. Pharm. формах; (+) та (-) формах; кето-, єнол- та єнолятSci., 66, 1-19 (1977). формах; син- та анти-формах; синклінальних та Наприклад, якщо сполука є аніонною, або має антиклінальних формах; - та -формах; аксіальфункціональну групу, що може бути аніонною (наних і екваторіальних формах; формах човна, крісприклад, -СООН може бути -СОО ), тоді можна ла, конверта та напівкрісла та твіст-формах; і їх одержати сіль із придатним катіоном. Приклади комбінаціях, надалі колективно називаних "ізомепридатних неорганічних катіонів включають, але рами" (або "ізомерними формами"). не обмежуються ними, іони лужних металів, такі як Відмітимо, що за винятком обговорюваних ниNa+ і K+, катіони лужноземельних металів, такі як жче таутомерних форм, спеціально виключених з Са2+ і Mg2+, інші катіони, такі як Аl3+. Приклади терміна «ізомери», використовуваного в цьому придатних органічних катіонів включають, але не документі, існують структурні (або конституціонаобмежуються ними, іон амонію (тобто, NH4+) і зальні) ізомери (наприклад, ізомери, які розрізняміщені іони амонію (наприклад, NH3R+, NH2R2+, ються зв'язками між атомами більше, ніж просто NHR3+, NR4+). Приклади деяких придатних заміщеположенням атомів у просторі). Наприклад, посиних іонів амонію являють собою іони, одержані з: лання на метокси групу, -ОСН3, не слід розглядати етиламіну, діетиламіну, дициклогексиламіну, триеяк посилання на її структурний ізомер, гідроксиметиламіну, бутиламіну, етилендіаміну, етаноламіну, тильну групу, -СН2ОН. Аналогічним чином, посидіетаноламіну, піперазину, бензиламіну, фенілбелання на орто-хлорфеніл не слід розглядати як нзиламіну, холіну, меглюміну та трометаміну, а посилання на його структурний ізомер, метатакож амінокислот, таких як лізин і аргінін. Прикхлорфеніл. Однак посилання на клас структур моладом звичайного четвертинного іону амонію є жуть прекрасно включати структурно ізомерні фоN(CH3)4+. рми, що відносяться до цього класу (наприклад, Якщо сполука є катіонним, або має функціонаалкіл С1-7 включає н-пропіл та ізо-пропіл; бутил льну групу, що може бути катіонною (наприклад, 19 90716 20 NH2 може бути -NH3+), тоді з придатним аніоном ролізом при використанні великого надлишку води може бути утворена сіль. Приклади придатних в присутності кислоти. неорганічних аніонів включають, але не обмежуНаприклад, аміногрупу можна захистити, наються ними, аніони, одержані з наступних неоргаприклад, у вигляді аміду або уретану, наприклад, у нічних кислот: соляної, бромистоводневої, йодисвигляді: метиламіду (-NHCO-CH3); бензилоксіаміду товодневої, сірчаної, сірчистої, азотної, азотистої, (-NHCO-OCH2C6H5, -NH-Cbz); у вигляді тфосфорної та фосфористої. Приклади придатних бутоксіаміду (-NHCO-OC(CH3)3, -NH-Boc); 2органічних аніонів включають, але не обмежуютьбіфеніл-2-пропоксіаміду (-NHCOся ними, аніони, одержані з наступних органічних OC(CH3)2C6H4C6H5, -NH-Bpoc), у вигляді 9кислот: оцтової, пропіонової, бурштинової, глікофлуоренілметоксіаміду (-NH-Fmoc), як 6левої, стеаринової, пальмітинової, молочної, ябнітровератрилоксіамід (-NH-Nvoc), у вигляді 2лучної, памоїнової, виннокам'яної, лимонної, глютриметилсилілетилоксіаміду (-NH-Teoc), у вигляді конової, аскорбінової, малеїнової, 2,2,2-трихлоретилоксіаміду (-NH-Troc), у вигляді гідроксималеїнової, фенілоцтової, глутамінової, алілоксіаміду (-NH-Alloc), у вигляді 2(аспарагінової, бензойної, коричної, піровиноградфенілсульфоніл)етилоксіаміду (-NH-Psec); або, у ної, саліцилової, сульфанілової, 2придатних випадках, у вигляді N-оксиду (>NO$). ацетоксибензойної, фумарової, фенілсульфоноНаприклад, групу карбонової кислоти можна вої, толуолсульфонової, метансульфонової, етанзахистити у вигляді складного ефіру, наприклад, у сульфонової, етандисульфонової, щавлевої, панвигляді: алкілового ефіру С1-7 (наприклад, метилототенової, ізотіонової, валеріанової, лактобіонової вого ефіру; трет-бутилового ефіру); галоалкілового та глюконової. Приклади придатних полімерних ефіру С1-7 (наприклад, тригалоалкілового ефіру С1аніонів включають, але не обмежуються ними, 7); три-С1-7алкілсиліл-С1-7алкілового ефіру; або С5аніони, одержувані з наступних полімерних кислот: 20арил-С1-7алкілового ефіру (наприклад, бензилодубильної кислоти, карбоксиметилцелюлози. вого ефіру; нітробензилового ефіру); або у вигляді Може бути зручно або вигідно одержувати, аміду, наприклад, у вигляді метиламіду. очищати і/або маніпулювати із сольватом активної Наприклад, ті олову групу можна захистити у сполуки. У даному документі термін ''сольват" вивигляді тіоефіру (-SR), наприклад, у вигляді: бенкористовують у загальноприйнятому змісті для зилтіоефіру; ацетамідометилового ефіру (-Sпозначення комплексу розчиненої речовини (наCH2NHC(=O)CH3). приклад, активної сполуки, солі активної сполуки) і Може бути зручно або вигідно одержувати, розчинника. Якщо розчинник являє собою воду, очищати і/або маніпулювати з активною речовисольват можна просто розглядати як гідрат, наною у формі проліків. Термін "проліки", використоприклад, моно-гідрат, ди-гідрат, три-гідрат, і т.д. вуваний у даному документі, стосується сполуки, Може бути зручно або вигідно одержувати, яка, у процесі метаболізму (наприклад, in vivo), очищати і/або маніпулювати з активною речовиперетворюється на необхідну активну сполуку. Як ною в хімічно захищеній формі. Термін "хімічно правило, проліки є неактивним, або менш активзахищена форма", використовуваний у даному ним, ніж активна сполука, але може забезпечити документі, стосується сполуки, у якій одна або придатну обробку, введення або метаболічні власдекілька реактивних функціональних груп захищетивості. ні від небажаних хімічних реакцій, тобто, знахоНаприклад, деякі проліки є складними ефірадяться у формі захищеної або захищаючої групи ми активних сполук (наприклад, фізіологічно при(також відомої як замаскована або маскувальна йнятним метаболічно нестійким ефіром). Під час група, або блокована або блокувальна група). При метаболізму, ефірна група (-C(=O)OR) розщеплюзахисті реактивної функціональної групи, реакції з ється з утворенням активних ліків. Такі ефіри моіншими незахищеними реактивними функціональжуть бути одержані шляхом етерифікації, наприними групами можуть відбуватися, не впливаючи клад, кожної з карбоновокислотних груп (-С(-О)ОН) на захищену групу; захисна група може бути вилуу вихідній сполуці, при попередньому, де можливо, чена, звичайно на наступній стадії, істотно не торзахисті будь-яких інших реактивних груп, які є прикаючись решти молекули. Див., наприклад, сутніми у вихідній сполуці, з наступним зняттям Protective Groups in Organic Synthesis (Т. Green та захисту, при потребі. Приклади таких метаболічно Р. Wuts, Wiley, 1999). нестабільних ефірів включають ефіри, у яких R Наприклад, гідрокси група може бути захищеявляє собою алкіл С1-7 (наприклад, -Me, -Et); аміна у вигляді ефіру (-OR) або складного ефіру (ноалкіл С1-7 (наприклад, аміноетил; 2-(N,NOC(=O)R), наприклад, у вигляді: трет-бутилового діетиламіно)етил; 2-(4-морфолін)етил); і ацилоксиефіру; бензилового, бензгідрилового (дифенілмеС1-7-алкіл (наприклад, ацилоксиметил; ацилоксіетилового), або тритилового (трифенілметилового) тил; наприклад, півалоїлоксиметил; ацетоксимеефіру; триметилсилілового або треттил; 1-ацетоксіетил; 1-(1-метокси-1-метил)етилбутилдиметилсилілового ефір; або ацетилового карбоксилоксіетил; 1-(бензоїлокси)етил; ізопропоефіру (-ОС(=О)СН3, -ОАс). кси-карбонілоксиметил; 1-ізопропоксиНаприклад, альдегідна або кетонова група карбонілоксіетил; циклогексил-карбонілоксиметил; може бути захищена у вигляді ацеталю або кета1-циклогексил-карбонілоксіетил; циклогексилоксилю, відповідно, у яких карбонільна група (>С=О) карбонілоксиметил; 1-циклогексилоксипереведена в діефірну (>C(OR)2) за допомогою карбонілоксіетил; (4реакції, наприклад, з первинним спиртом. Альдегітетрагідропіранілокси)карбонілоксиметил; 1-(4дна або кетонова група легко відновлюється гідтетрагідропіранілокси)-карбонілоксіетил; (4 21 90716 22 тетрагідропіраніл)карбонілоксиметил; і 1-(4переважно приєднаний до 4-атома азоту. Кращі Nтетрагідропіраніл)карбонілоксіетил). замісники включають можливо заміщений алкіл С1Деякі проліки також ферментативно активу4, можливо заміщений арил С6 і ацил (з алкільною ються, генеруючи активну сполуку, або сполуку, групою С1-4 як замісник ацилу). яка, після подальшої хімічної реакції, генерує акΖ переважно вибирають із S і О, де можливо, і тивну сполуку. Наприклад, проліки можуть являти найбільш кращим вибором є S. собою похідну цукру або інший глікозидний кон'юRN5 та RN6 гат, або можуть являти собою похідну ефіру аміПереважні значення для RN5 та RN6 можуть бунокислоти. ти тими ж, що й для RN3 та RN4, які розглянуті виСелективне інгібування ще. «Селективне інгібування» означає інгібування RN1 тa RN2 одного ферменту більшою мірою, ніж інгібування У сполуках формули І, де RN1 та RN2 утворюіншого або декількох інших ферментів. Зазначену ють, разом з атомом азоту, до якого вони приєдселективність можна виміряти шляхом порівняння нані, гетероциклічне кільце, яке має від 4 до 8 концентрації сполуки, необхідної для інгібування атомів, останнє може утворювати частину гетерона 50% активності (ІС50) одного ферменту, щодо циклільної групи C4-20, описаної вище (за винятком концентрації тієї ж самої сполуки, необхідної для мінімуму з 4 кільцевих атомів), яка повинна містиінгібування на 50% активності ((ІС50) іншого ферти принаймні один кільцевий атом азоту. Бажано, менту (див. нижче). Зазначений результат виращоб RNI та RN2 утворювали, разом з атомом азоту, жають у вигляді відношення. Якщо це відношення до якого вони приєднані, гетероциклічне кільце, більше 1, тоді досліджувана сполука проявляє яке має 5, 6 або 7 атомів, більш переважно, 6 кідеяку селективність у своїй інгібуючій дії. льцевих атомів. Сполуки, згідно із даним винаходом, переважОдиночні кільця, які мають один атом азоту, но проявляють селективність більше 3, 10, 20 або включають азетидин, піролідин (тетрагідропірол), 50 відносно до ДНК-ПК у порівнянні з РІ 3-кіназою. піролін (наприклад, 3-піролін, 2,5-дигідропірол), Сполуки, згідно із даним винаходом, переваж2Н-пірол або 3H-пірол (ізопірол, ізоазол), піперино проявляють селективність більше 5, 10, 50 або дин, дигідропіридин, тетрагідропіридин і азепін; які 100 у відношенні ДНК-ПК у порівнянні з ATM. мають два атоми азоту, включають імідазолідин, Переважно визначати значення ІС50, викориспіразолідин (діазолідин), імідазолін, піразолін (дитовувані для оцінки селективності, за допомогою гідропіразол) і піперазин; які мають один азот та способів, описаних у патенті WO 03/024949, що один кисень включають тетрагідрооксазол, дигідвключений у даний документ за допомогою посирооксазол, тетрагідроізоксазол, дигідроізоксазол, лання. морфолін, тетрагідрооксазин, дигідрооксазин і Кращі варіанти реалізації оксазин; які мають один азот і одну сірку включаR4 ють тіазолін, тіазолідин і тіоморфолін. Краще, щоб R4 являв собою Q-Y-X. Кращі кільця являють собою кільця, які містять Якщо Q являє собою -NH-C(=O)-, X переважно один гетероатом на додаток до азоту, і зокрема, являє собою NRN3RN4. Також краще, щоб Υ являв кращими гетероатомами є кисень і сірка. Таким собою можливо заміщену алкіленову групу С1-3, чином, кращі групи включають морфоліно, тіомобільш краще, можливо заміщену алкіленову групу рфоліно, тіазолінил. Кращі групи без додаткового С1-2 і найкраще, алкіленову групу С1-2. гетероатома включають піролідино. Якщо Q являє собою -О- та X являє собою Найбільш кращими групами є морфоліно та тіNRN3RN4, тоді Υ переважно являє собою можливо оморфоліно. заміщену алкіленову групу С1-3, більш переважно, Як згадувалося вище, зазначені гетероциклічні можливо заміщену алкіленову групу С1-2 і найкрагрупи самі можуть бути заміщені; кращим заміснище, алкіленову групу С1-2. ком є алкільна група С1-7. Якщо гетероциклічна Відповідно до деяких варіантів реалізації вигрупа являє собою морфоліно, заміщуваною грунаходу, RN3 та RN4 переважно незалежно вибирапою або групами переважно є метил або етил, і ють із Η і можливо заміщеного алкілу С1-7, більш більш краще, метил. Найкраще, щоб єдиний метипереважно, Η можливо заміщеного алкілу С1-4 і льний замісник розташовувався в 2 положенні. найкраще Η і можливо заміщеного алкілу С1-3 (наНа додаток до одиничних кільцевих груп, пеприклад, метилу, етилу, ізо-пропілу). Кращі можрерахованим вище, передбачені також кільця з ливі замісники включають, але не обмежуються містками або поперечними зв'язками. Прикладами ними, гідрокси, метокси, -ΝΗ2, можливо заміщений цих типів кільця, де група містить атом азоту та С6-арил і можливо заміщений гетероцикліл С5-6. кисню, є: Відповідно до інших варіантів реалізації винаходу, RN3 та RN4 утворюють, разом з атомом азоту, до якого вони приєднані, можливо заміщене азотвмісне гетероциклічне кільце, яке має від 4 до 8 кільцевих атомів. Краще, щоб гетероциклічне кільце мало 5-7 кільцевих атомів. Приклади кращих груп включають морфоліно, піперидиніл, піперазиніл, гомопіперазиніл і тетрагідропіроло, при Їх називають 8-окса-3-аза-біцикло[3.2.1]окт-3цьому особливо кращим є піперазиніл. Ці групи ил, 6-окса-3-аза-біцикло[3.1.0]гекс-3-ил, 2-окса-5можуть бути заміщені, і особливо кращою групою є можливо заміщений піперазиніл, у якому замісник 23 90716 24 аза-біцикло[2.2.1]гепт-5-ил та 7-окса-3-азабіцикло[4.1.0]гепт-3-ил, відповідно. Загальні способи синтезу Сполуки формули І, де R4 являє собою Q-Y-X та Q являє собою -NH-C(=O)-, можуть бути представлені у вигляді Формули 1: у присутності органічної основи, наприклад, триетиламіну. Сполуку формули 3 можна синтезувати шляхом відновлення сполуки формули 5: Ці сполуки, у яких -Y-X не є алкілом С1-7, можна одержати зі сполук формули 2: де L являє собою групу, яка відходить, таку як хлор або бром, при реакції з придатним аміном або тіолом. Ці реакції можна провести при кімнатній температурі, або, при необхідності, при нагріванні. Сполуки формули 2 можна синтезувати за допомогою реакції сполуки формули 3: використовуючи придатний відновлювальний реагент, наприклад, цинк у оцтовій кислоті. Сполуки формули 5 можна синтезувати шляхом взаємодії за Suzuki-Miyaura сполук формул 6 та 7: де X' являє собою таку групу, як бром або OTf. Взаємодіючі залишки можуть взаємно заміщуватися. Сполуки формули 7 можна синтезувати в такий спосіб. Сполуки формули 7а: зі сполукою формули 4: можна синтезувати зі сполук формули 8а: у присутності органічної основи, наприклад, триетиламіну. Сполуки формули 1, де -Y-X являє собою алкіл С1-7, можна синтезувати за допомогою реакції сполуки формули 3 зі сполукою формули 4а: 25 90716 26 за допомогою циклоконденсації через піроліз Сполуку формули 9b можна синтезувати зі із декарбоксилюванням. сполуки формули 10b: Сполуки формули 8а можна синтезувати зі сполуки формули 9а: за допомогою реакції з придатним аміном формули HNRN1RN2, у придатному розчиннику. Сполуку формули 9а можна синтезувати зі сполуки формули 10а: за допомогою реакції з похідною кислоти Мелдрума (Meldrum's acid derivative) формули 11а: у придатному розчиннику. Сполуки формули 7b: шляхом хлорування, використовуючи хлоруючий реагент, наприклад, РОСl3. Сполуку формули 10b можна синтезувати зі сполуки формули 11b: за допомогою реакції з діетилмалонатом або його еквівалентом. Сполука формули 7с: Способи синтезу сполук формули 7с описані в WO 03/024949 (Спосіб синтезу 6). Сполуки формули І, де R4 являє собою Q-Y-X, Q являє собою -О- та X вибирають із SRS1 або NRN3RN4, можна зобразити у вигляді формули 13: можна синтезувати за допомогою реакції сполуки формули 8b: де X" являє SRS1 або NRN3RN4. Ці сполуки можна синтезувати зі сполук формули 14: з трифлікангідридом, у такому розчиннику як ДХМ, у присутності основи, такої як триетиламін. Сполуки формули 8b можна синтезувати зі сполуки формули 9b: шляхом нуклеофільного заміщення хлориду аміном формули HNR1R2. де L являє собою групу, що відходить, наприклад, хлор або бром, при реакції з придатним аміном або тіолом. Цю реакцію можна проводити при 27 90716 кімнатній температурі, або, при необхідності, при нагріванні. Сполуки формули 14 можна синтезувати за допомогою реакції сполуки формули 15: 28 за допомогою реакції з гідроксидом натрію у метанолі. Сполуку формули 19 можна синтезувати зі сполук формули 15 за допомогою реакції зі сполукою формули 20: зі сполукою формули 16: де, якщо Υ є несиметричним, бажано, щоб L не був Br, у присутності, наприклад, карбонату калію. Сполуку формули 15 можна синтезувати зі сполук формули 3, використовуючи процедуру діазотування-гідролізу. Перша реакція перетворює аміногрупу на фтороборатну сіль діазонію, наприклад, за допомогою HBF4 і бутилнітриту, яку потім гідролізують за допомогою, наприклад, водного оксиду міді (І) - нітрату міді (II). Сполуку формули І, де Q являє собою -О- та X являє собою -С(=О)-NRN5RN6, можна представити у вигляді формули 17: де X''' являє NRN5RN6. Ці сполуки можна синтезувати зі сполук формули 18: за допомогою реакції з придатним аміном у присутності HBTU та НОВТ. Сполуку формули 18 можна одержати зі сполук формули 19: у присутності, наприклад, карбонату калію. Сполуки, пропоновані в даному винаході, у яких R4 являє собою Н, можна одержати шляхом приєднання придатної борної кислоти до сполуки формули 7, способом, аналогічним описаним вище. Застосування сполук, пропонованих у даному винаході У даному винаході запропоновані активні сполуки, зокрема, активні 8-арил-2-амін-4-іл-хінолін-4они, піридопіримідин-4-они та хромен-4-они. Використовуваний у даному документі термін «активний» стосується сполук, які здатні інгібувати активність ДНК-ПК і, зокрема, включає як сполуки, що мають власну активністю (ліки), так і проліки таких сполук, причому проліки самі можуть проявляти невелику активність або не проявляти взагалі. Один спосіб аналізу, якій можна використовувати для оцінки інгібування ДНК-ПК, що проявляється конкретною сполукою, описаний на прикладах нижче. Даний винахід також пропонує спосіб інгібування ДНК-ПК у клітині, який включає введення зазначеної клітини у контакт із ефективною кількістю активної сполуки, переважно, у формі фармацевтично прийнятної композиції. Зазначений спосіб можна здійснювати in vitro або in vivo. Наприклад, зразок клітин (наприклад, з пухлини) можна виростити in vitro і привести активну сполуку в контакт із зазначеними клітинами разом з агентами, які здійснюють відомий лікувальний ефект, і спостерігати посилення лікувального ефекту сполуки на ці клітини. Даний винахід також пропонує активні сполуки, які інгібують активність ДНК-ПК, а також способи пригнічення активності ДНК-ПК, які включають введення клітини в контакт із ефективною кількістю активної сполуки, або in vitro або in vivo. Активні сполуки можна також застосовувати як добавки до клітинних культур для інгібування ДНКПК, наприклад, з метою збільшення чутливості клітин відносно відомих хіміотерапевтичних препаратів або впливу іонізуючого випромінювання in vitro. 29 90716 30 Активні сполуки також можна застосовувати як альфа, IL-2, G-CSF, GM-CSF: Препарати диферечастину дослідження in vitro, наприклад, для винціації; похідні ретиноєвої кислоти: Радіосенсибілізначення, чи принесе потенційному хазяїну можзатори; метронідазол, мізонідазол, десметилмізоливу користь лікування зазначеною сполукою. нідазол, пімонідазол, етанідазол, німоразол, RSU Винахід також пропонує активні сполуки для 1069, ЕО9, RB 6145, SR4233, нікотинамід, 5застосування в способі лікування людей і тварин. бромдеозиуридин, 5-йоддеоксиуридин, бромдеокЗазначений спосіб може включати введення такосицитидин: Платинові координаційні комплекси; му пацієнту терапевтично ефективної кількості цисплатин, карбоплатин: Антрацендіон; мітоксантактивної сполуки, переважно, у формі фармацеврон, AQ4N заміщена сечовина, гідроксисечовина; тичної композиції. Похідні метилгідразину, N-метилгідразин (МІН), Термін «лікування», використовуваний у дапрокарбазин; Адренокортикальний супресивний ному документі в контексті лікування стану, стосузасіб, мітотан (ο.p'-ΌΌΌ), аміноглютетімід: Цитокіється, у цілому, лікування або терапії, людини або ни; інтерферон ( , , ), інтерлейкін; Гормони та тварини (наприклад, при застосуванні у ветеринаантагоністи; адренокортикостероїди/антагоністи, рії), при якому досягається деякий бажаний терапреднізон і еквіваленти, дексаметазон, аміноглюпевтичний ефект, наприклад, пригнічення розвитку тетімід; Прогестини, гідроксипрогестеронкапроат, захворювання, і включає зниження швидкості розмедроксипрогестеронацетат, мегестролацетат; витку захворювання, припинення розвитку захвоЕстрогени, діетилстилбестрол, етинілестрадірювання, поліпшення стану та вилікування стану. ол/еквіваленти; Антиестрогени, тамоксифен; АндЦей термін також включає лікування як профілакрогени, тестостеронпропіонат, фтороксиместетичних захід (тобто, профілактику). рон/еквіваленти; Антиандрогени, флутамід, Використовуваний у даному документі термін аналоги гонадоліберин-виділяючого гормону, леу«терапевтично ефективна кількість» стосується пролід; Нестероидні антиандрогени, флутамід; такої кількості активної сполуки або матеріалу, інгібітори EGFR, інгібітори VEGF; Інгібітори протекомпозиції або дози, що містять активну сполуку, асполук. яка є ефективною з погляду одержання бажаного Рак терапевтичного ефекту, що відповідає розумному У даному винаході запропоновані активні споспіввідношенню користь/ризик. луки, які є протираковими препаратами або допоВикористовуваний у даному документі термін міжними засобами при лікуванні раку. Звичайний «ад'юнкт», або «допоміжний засіб» стосується спеціаліст у даній галузі може без труднощів вивикористання активних сполук разом з відомими значити, чи лікує досліджувана сполука раковий терапевтичними засобами. Такі засоби включають стан, що характеризується яким-небудь певним цитотоксичні режими прийому ліків і/або іонізуючотипом клітини, одним або в комбінації. го випромінювання, використовувані при лікуванні Приклади ракових захворювань включають, різних видів раку. Приклади протиракових препаале не обмежуються ними, рак легенів, недрібнократів-ад'юнктів, які можна комбінувати зі сполукалітинний рак легенів, рак шлунково-кишкового трами, пропонованими в даному винаході, включають, кту, рак кишечнику, рак товстої кишки, карциному але не обмежуються ними, наступні алкілувальні молочної залози, карциному яєчників, рак простапрепарати: азотисті іприти, мехлоретамін, циклоти, тестикулярний рак, рак печінки, рак нирки, рак фосфамід, іфосфамід, мелфалан, хлорамбуцил: сечового міхура, рак підшлункової залози, рак моНітрозоуреази: кармустин (BCNU), ломустин зку, саркому, остеосаркому, саркому Капоші, ме(CCNU), семустин (метил-CCNU), етиленіланому та лейкемії. мін/метилмеламін, триетиленмеламін (ТЕМ), триеМожна лікувати будь-який тип клітин, у тому тилентіофосфорамід (тіотепа), гексаметилмеламін числі, але не обмежуючись ними, клітини легенів, (НММ, алтретамін): Алкілсульфонати; бісульфан; шлунково-кишкового тракту (у тому числі, наприТриазини, дакарбазин (DTIC): Антиметаболіти; клад, кишечнику, товстої кишки), грудей (молочної аналоги фолевої кислоти, метотрексат, триметрезалози), яєчника, простати, печінки (печінкові), ксат, аналоги пірімідину, 5-фторурацил фтордезонирки (ниркові), сечового міхура, підшлункової ксиуридин, гемцитабін, цитозинарабінозид (Аrа, залози, мозку та шкіри. цитарабін), 5-азацитидин, 2,2'Протиракове лікування, описане вище, може дифтордеоксоцитидин: Аналоги пурину; 6бути застосоване як єдина терапія або може меркаптопурин, 6-тіогуанин, азатіоприн, 2'включати, на додаток до сполуки, що запропонодеоксокоформіцин (пентостатин, еритрогідроксивана у даному винаході, звичайні хірургічні, радіононіладенін (EHNA), флударабінфосфат, 2терапевтичні або хіміотерапевтичні способи лікуХлордеоксоаденозин (кладрибін, 2-CdA): Інгібітори вання. Така хіміотерапія може включати одну або топоізомерази; камптотецин, топотекан, іринотедекілька з наступних категорій протипухлинних кан, рубітекан: Природні продукти; антимітотичні препаратів: ліки, паклітаксел, винса алкалоїди, винбластин (і) інші антипроліферативні/протипухлинні ліки (VLB), винкристин, винорелбін, Taxotere (доцетаі їх комбінації, використовувані в медичній онколоксел), естрамустин, естрамустинфосфат; епіпогії, такі як алкілувальні препарати (наприклад, цисдофілотоксини, етопозид, теніпозид: Антибіотики; платин, оксаліплатин, карбоплатин, циклофосфаактимоміцин D, дауноміцин (рибодоміцин), доксомід, азотистий іприт, мелфалан, хлорамбуцил, рибіцин (адріаміцин), мітоксантрон, ідарубіцин, бусульфан, темозоламід і нітросоуреаз); антимеблеоміцини, плікаміцин (мітраміцин), мітоміцин С, таболіти (наприклад, гемцитабін і антифолати, такі дастиноміцин: Ферменти; L-аспарагіназа, PHKse А: як фторпіримідини подібні 5 фторурацилу та тегаМодифікатори біологічної реакції; інтерферонфуру, ралтитрекседу, метотрексату, цитозинарабі 31 90716 32 нозиду та гідроксисечовині); протипухлинні антибікінази (наприклад, AZD1152, РН739358, VX-680, отики (наприклад, антрацикліни подібні адріаміциMLN8054, R763, МР235, МР529, VX-528 та ну, блеоміцину, доксорубицину, дауноміцину, епіАХ39459) та інгібітори циклін-залежної кінази, такі рубіцину, ідарубіцину, мітоміцину-С, як інгібітори CDK2 і/або CDK4; дактиноміцину та мітраміцину); антимітотичні пре(ν) антиангіогенні препарати, наприклад, препарати (наприклад, винса алкалоїди подібні винкпарати, які пригнічують вплив судинного ендотеліристину, винбластину, виндезину та винорелбіну ального фактора росту [наприклад, антитіло факта таксоїди подібні таксолу та таксотеру й інгібітотора росту антисудинних ендотеліальних клітин ри полокінази); та інгібітори топоізомерази (наприbevacizumab (Avastin) і інгібітори рецептора тироклад, епіподофілотоксини подібні етопозиду та зинкінази VEGF, такі як 4-(4-бром-2-фторанілін)-6теніпозиду, амсакрину, токотекану та камптотехіметокси-7-(1-метилпіперидин-4ну); ілметокси)хіназолін (ZD6474; Приклад 2 з WO (iі) цитостатичні препарати, такі як антиестро01/32651), 4-(4-фтор-2-метиліндол-5-ілокси)-6гени (наприклад, тамоксифен, фулвестрант, тореметокси-7-(3-піролідин-1-ілпропокси)-хіназолін міфен, ралоксифен, дролоксифен та йодоксифен), (AZD2171; Приклад 240 з WO 00/47212), ваталаніб антиандрогени (наприклад, бікалутамід, флутамід, (РТK787; WO 98/35985) і SU11248 (сунітиніб; WO нілутамід і ципротеронацетат), антагоністи LHRH 01/60814), сполуки, описані в міжнародних патентабо агонисти LHRH (наприклад, гозерелін, лепроних заявках WO 97/22596, WO 97/30035, WO релін і бузерелин), прогестогени (наприклад, меге97/32856 та WO 98/13354 і сполуки, які діють за стролацетат), інгібітори ароматази (наприклад, у рахунок інших механізмів (наприклад, ліномід, інгівигляді анастрозолу, летрозола, воразолу та екбітори функції інтегрину avb3 і ангіостатин)]; семестану) та інгібітори 5*-редуктази, такі як фіна(vi) судиноруйнуючі препарати, такі як Комбрестерид; тастатин А4 і сполуки, описані в міжнародних па(ііі) протиінвазійні препарати (наприклад, інгібітентних заявках WO 99/02166, WO 00/40529, WO тори сімейства c-Src кінази подібні 4-(6-хлор-2,300/41669, WO 01/92224, WO 02/04434 і WO метилендіоксіанілін)-7-[2-(4-метилпіперазин-102/08213; іл)етокси]-5-тетрагідропіран-4-ілоксихіназоліну (vii) антисмислові терапії, наприклад, терапії, (AZD0530; Міжнародна патентна заявка WO які спрямовані на перераховані вище мішені, такі 01/94341) та N-(2-хлор-6-метилфеніл)-2-{6-[4-(2як ISIS 2503, анти-рас антисмислова (anti-ras гідроксіетил)піперазин-1-іл]-2-метилпіримідин-4antisense); іламіно}тіазол-5-карбоксамід (дазатиніб, BMS(viii) підходи на основі генної терапії, у тому 354825; J. Med. Chem., 2004, 47, 6658-6661), і інгічислі, наприклад, підходи, що використовують забітори металопротеїнази подібні маримастату, міщення аберантних генів, таких як аберантні р53 інгібітори рецепторної функції активатора плазміабо BRCA1 або BRCA2, підходи GDEPT (генонапногена урокінази або антитіла відносно рямлена ферментна терапія проліками), наприHeparanase); клад, що використовують цитозиндеаміназу, тімі(iv) інгібітори функції фактора росту: напридинкіназу або бактеріальний нітроредуктазний клад, такі інгібітори включають антитіла факторів фермент і підходи з метою збільшення переносиросту та антитіла рецепторів фактора росту (намості пацієнтом хіміотерапії або радіотерапії, такі приклад, анти еrb2 антитіло trastuzumab як багатопрепаратна резистентна генна терапія; і [Herceptin], анти-EGFR антитіло panitumumab, анти (іх) імунотерапевтичні підходи, у тому числі, erb1 антитіло cetuximab [Erbitux, C225] і будь-які наприклад, підходи ex vivo і in vivo збільшення антитіла факторів росту або рецепторів фактора імуногенності пухлинних клітин пацієнта, наприросту, описані Stern et al. Critical reviews in клад, трансфекція цитокінами, такими як інтерлейoncology/haematology, 2005, Vol. 54, pp. 11-29); такі кін 2, інтерлейкін 4 або гранулоцит-макрофаг коінгібітори також включають інгібітори тирозинкіналонія стимулюючим фактором, підходи які зи, наприклад, інгібітори сімейства епідермального зменшують анергію Τ клітин, підходи, які викорисфактора росту (наприклад, інгібітори сімейства товують трансфектні імунокомпетентні клітини, тирозинкінази EGFR, такі як N-(3-хлор-4такі як цитокінові трансфектні дендритні клітини, фторфеніл)-7-метокси-6-(3підходи, із застосуванням ліній пухлинних клітин, морфолінпропокси)хіназолін-4-амін (gefitinib, трансфікованих цитокінами та підходи, які викориZD1839), N-(3-етинілфеніл)-6,7-біс(2стовують антиідіотипічні антитіла. метоксіетокси)хіназолін-4-амін (erlotinib, OSI 774) Введення та 6-акриламід-N-(3-хлор-4-фторфеніл)-7-(3Активну сполуку або фармацевтичну композиморфолінпропокси)-хіназолін-4-амін (СІ 1033), інгіцію, яка містить активну сполуку, можна ввести бітори тирозинкінази еrb2 такі як, лапатиніб, інгібіпацієнту будь-яким звичайним способом введення, тори сімейства факторів росту гепатоциту, інгібітоабо системно/периферично або в місце необхіднори сімейства факторів росту похідних тромбоциту, го впливу, у тому числі, але не обмежуючись ними, такі як іматиніб, інгібітори серин/треонин кіназ (натакими способами: пероральним (наприклад, шляприклад, сигнальні інгібітори Ras/Raf такі як, інгібіхом прийому усередину); топічним (у тому числі, тори фарнесилтрансферази, наприклад, сорафенаприклад, трансдермальним, інтраназальним, ніб (BAY 43-9006)), інгібітори клітинної сигналізації очним, букальним і під'язичним способами); пульчерез МЕK і/або АKТ кінази, інгібітори сімейства мональним (наприклад, шляхом інгаляції або інфакторів росту гепатоциту, c-kit-інгібітори, інгібітосуфляційної терапії, використовуючи, наприклад, ри abl-кінази, інгібітори кінази IGF рецепторів (інаерозоль, наприклад, через рот або ніс); ректальсулін-подібного фактора росту); інгібітори аурораним; вагінальним; парентеральним, наприклад, 33 90716 34 шляхом ін'єкцій, у тому числі, підшкірної, інтрадеприготовляють шляхом рівномірного та ретельнормальної, внутрішньом'язової, внутрішньовенної, го перемішування активної сполуки з рідкими носівнутрішньоартеріальної, внутрішньосерцевої, інями або тонко розмеленими твердими носіями або тратекальної, інтраспинальної, внутрішньокапсуобома, і потім, при необхідності, шляхом надання лярної, субкапсульної, інтраорбітальної, внутрішпродукту форми. ньочеревної, внутрішньотрахеальної, в місце, Склади можуть бути у формі рідин, розчинів, розташоване під кутикулою, внутрішньосуглобної, суспензій, емульсій, еліксирів, сиропів, таблеток, убарахноїдальної і в ямку під грудьми; за допомокоржів, гранул, порошків, капсул, крохмальних кагою імплантату з лікарським препаратом, наприпсул, пігулок, ампул, супозиторіїв, маткових кілець, клад, підшкірно або внутрішньом'язово. мазей, гелів, паст, кремів, спреїв, пін, лосьйонів, Об'єкт лікування може являти собою еукаріот, масел, кульок, електуарій і аерозолів. тварину, хребетну тварину, ссавця, гризуна (наСклади, які придатні для перорального ввеприклад, морська свинка, хом'ячок, щур, миша), дення (наприклад, шляхом прийому всередину) мишоподібну тварину (наприклад, миша), тварину можна представити у вигляді дискретних об'єктів, із родини собачих (наприклад, собака), тварину із таких як капсули, крохмальні капсули або таблетродини котячих (наприклад, кішка), тварину із сіки, кожний, з яких містить заздалегідь встановлену мейства кінських (наприклад, кінь), примат, мавпокількість активної сполуки; у вигляді порошків або подібний (наприклад, мавпа або людиноподібна гранул; у вигляді розчину або суспензії у водній мавпа), мавпа (наприклад, мавпа, павіан), людиабо неводній рідині; або у вигляді рідкої емульсії ноподібна мавпа (наприклад, горила, шимпанзе, масло-у-воді або рідкій емульсії вода-у-маслі; у орангутанг, гібон), або людина. вигляді кульки; у вигляді електуарію; або у вигляді Склади пасти. Якщо можливе введення однієї зазначеної акТаблетка може бути виготовлена звичайними тивної сполуки, краще вводити її у вигляді фармаспособами, наприклад, стисканням або пресуванцевтичної композиції (наприклад, складу), який ням, можливо з одним або декількома додатковимістить принаймні одну активну сполуку, як описами інгредієнтами. Стиснені таблетки можуть бути но вище, разом з одним або декількома фармацеприготовлені шляхом стискання на придатному втично прийнятними носіями, ад'ювантами, наповверстаті активної сполуки в сипучу форму, таку як нювачами, розріджувачами, буферними порошок або гранули, можливо змішану з одним розчинами, стабілізаторами, консервантами, змаабо декількома зв'язувальними речовинами (нащувальними речовинами або іншими матеріалаприклад, повідоном, желатином, гуміарабіком, соми, добре відомими спеціалістам у даній галузі, і, рбітолом, трагакантом, гідроксипропілметилцелюможливо, іншими терапевтичними або профілаклозою); наповнювачами або розріджувачами тичними препаратами. (наприклад, лактозою, мікрокристалічною целюлоТаким чином, даний винахід також пропонує зою, біфосфатом кальцію); змащувальними речофармацевтичні композиції, описані вище, і способи винами, (наприклад, стеаратом магнію, тальком, виготовлення фармацевтичної композиції, які діоксидом кремнію); дезінтеграторами (наприклад, включають змішування принаймні однієї активної натрій крохмаль глюколатом, поперечно зшитим сполуки, описаної вище, разом з одним або декіповідоном, поперечно зшитою натрій карбоксимелькома фармацевтично прийнятними носіями, тилцелю лозою); поверхнево-активними або диснаповнювачами, буферними розчинами, ад'юванпергуючими або змочувальними речовинами (натами, стабілізаторами або іншими матеріалами, приклад, лаурилсульфатом натрію); і описаними в даному документі. консервантами (наприклад, метил-пВикористовуваний у даному документі термін гідроксибензоатом, пропіл-п-гідроксибензоатом, «фармацевтично прийнятний» стосується сполук, сорбіновою кислотою). Пресовані таблетки можна матеріалів, композицій, і/або форм дозування, які, приготувати шляхом пресування на придатному у рамках устояної думки медичного співтоваристверстаті суміші розмеленої в порошок зволоженої ва, можуть бути використані в контакті із тканинасполуки з інертним рідким розріджувачем. Таблетми пацієнта (наприклад, людини), без прояву надки можуть бути при необхідності покриті оболонмірної токсичності, подразнення, алергійної реакції кою або мати шорсткувату поверхню й можуть або іншої проблеми або ускладнення. відповідаюбути приготовлені таким чином, щоб забезпечити чи розумному співвідношенню користь/ризик. Кожповільне або контрольоване вивільнення активноний носій, наповнювач і т.д. повинен бути також го компонента, використовуючи, наприклад, гідро«прийнятним» у смислі можливості сполучення з ксипропілметилцелюлозу в різних пропорціях для іншими інгредієнтами складу. досягнення необхідного профілю вивільнення. Придатні носії, наповнювачі і т.д. можна знайТаблетки можуть бути оснащені ентеральним покти у звичайних фармацевтичних підручниках, нариттям, яке забезпечує вивільнення в різних часприклад, Remington's Pharmaceutical Sciences, 18th тинах травного тракту, крім шлунка. edition, Mack Publishing Company, Easton, Pa., Склади, які придатні для локального введення 1990. (наприклад, трансдермального, інтраназального, Склади можуть бути представлені в дозованій очного, букального та під'язичного) можна приголікарській формі й приготовлені будь-якими спотувати у вигляді мазі, крему, суспензії, лосьйону, собами, добре відомими у фармації. Ці способи порошку, розчину, пасти, гелю, спрею, аерозолю включають стадію сполучення активного компонеабо масла. Альтернативним чином, технологія нта з носієм, до складу якого входять один або приготування лікарського засобу може включати декілька додаткових інгредієнтів. У цілому, склади пов'язку або перев'язний матеріал, такий як бан 35 90716 36 даж або лейкопластир, просочений активними віск разом з олією і/або жиром складають так звасполуками й можливо одним або декількома напону емульгувальну основу мазі, що утворює маслявнювачами або розріджувачами. ну дисперговану фазу кремових складів. Склади, які придатні для місцевого введення Придатні емульгатори та стабілізатори емульчерез ротову порожнину, включають коржі, які міссії включають Tween 60, Span 80, цетостеарилотять активну сполуку в ароматній основі, звичайно вий спирт, міристиловий спирт, гліцерилмоностеасахарозі та гуміарабіку або трагаканті; пастилки, рат і лаурилсульфат натрію. Вибір придатних олій які містять активну сполуку в інертній основі, такій або жирів для приготування складів базується на як желатин і гліцерин, або сахарозі та гуміарабіку; і досягненні необхідних косметичних властивостей, рідини для полоскання рота, які містять активну оскільки розчинність активної сполуки в більшості речовину в придатному рідкому носії. олій, які ймовірно можуть бути використані у фарСклади, які придатні для локального введення мацевтичних емульсійних складах, може бути дув око, також включають очні краплі, у яких активна же низькою. Відповідно, крем переважно не повисполука розчинена або суспендована в придатнонен бути жирним, залишати плям і має являти му носії, головним чином, водному розчиннику для собою продукт, що не линяє, має придатну консисактивної сполуки. тенцією для запобігання витікання з тюбиків і інСклади, які придатні для введення в ніс, у яких ших контейнерів. Можна використовувати алкіленосій являє собою тверду речовину, включають фіри із прямим та розгалуженим ланцюгом, моно- і великий порошок, який має розмір частинок, надвоосновні, такі як діізоадипат, ізоцетилстеарат, приклад, у діапазоні від приблизно 20 до приблизпропіленгліколевий складний діефір кокосових но 500 мікрон, який вводять тим же способом, що жирних кислот, ізопропілміристат, децилолеат, й нюхальний тютюн, тобто шляхом швидкого вдиізопропілпальмітат, бутилстеарат, 2хання через носовий прохід порошку з ємності, яку етилгексилпальмітат або суміш складних ефірів з тримають близько від носа. Придатні склади, у розгалуженим ланцюгом, відомих як Crodamol яких носій є рідиною для введення у вигляді, наCAP, при цьому останні три є кращими ефірами. Їх приклад, носового спрею, носових крапель або можна використовувати поодинці або в комбінації, шляхом аерозольного введення через розпилюзалежно від необхідних властивостей. вач, включають водні або масляні розчини активЯк альтернатива, можна використовувати ліпіної сполуки. ди з високою температурою плавлення, такі як Склади, які придатні для введення шляхом інбезбарвний м'який парафін і/або рідкий парафін галяції, включають склади, представлені у вигляді або інші мінеральні масла. аерозольного спрею з упаковки з підвищеним тисСклади придатні для ректального введення ком, з використанням придатної стисненої речовиможуть бути представлені у вигляді супозиторію з ни, такої як дихролдифторметан, трихлорфтормепридатною основою, що містить, наприклад, олію тан, дихлортетрафторетан, діоксид вуглецю або або саліцилат. інші придатні гази. Склади придатні для вагінального введення Склади, які придатні для локального введення можуть бути представлені у вигляді маткових кічерез шкіру, включають мазі, креми та емульсії. лець, тампонів, кремів, гелів, паст, пін або спреїв, Якщо склад приготовляють у вигляді мазі, активну які містять на додаток до активної сполуки придатречовину можна при необхідності застосовувати ні носії, відомі спеціалістам у даній галузі. або з парафіновою основою або основою, що зміСклади придатні для парентерального ввешується з водою. Альтернативним чином, активдення (наприклад, шляхом ін'єкції, у тому числі, ний компонент можна приготувати в кремі з осношкірної, підшкірної, внутрішньом'язової, внутрішвою масло-у-воді. При необхідності, водна фаза ньовенної та інтрадермальної) включають водні та основи крему може включати, наприклад, принайневодні ізотонічні стерильні розчини для ін'єкцій, мні близько 30% (по масі) багатоатомного спирту, які не містять піроген та які можуть містити антиотобто спирту, що має дві або більше гідроксильних ксиданти, буферні розчини, консерванти, стабілігруп, таких як пропіленгліколь, бутан-1,3-діол, мазатори, бактеріостати та розчинені речовини, які нітол, сорбітол, гліцерол і поліетиленгліколь і їх роблять склад ізотонічним із кров'ю передбачувасуміші. Переважно, топічні склади містять сполуку, ного реципієнта; і водні та неводні стерильні суяка підсилює поглинання або проникнення активспензії, які можуть включати суспендуючі препараної речовини через шкіру або інші уражені місця. ти та загусники, і ліпосоми або інші системи Приклади таких підсилювачів дермального пронимікрочастинок, які націлюють сполуку на компонекнення включають диметилсульфоксид і спорідненти крові або один або декілька органів. Приклади ні аналоги. придатних ізотонічних наповнювачів, які можна При приготуванні складу у вигляді емульсії використовувати в таких складах, включають фізідля локального застосування, масляна фаза може ологічний розчин для ін'єкцій, розчин Рінгера або при необхідності містити емульгувальну речовину лактований розчин Рінгера. Як правило, концент(інакше відому як емульгатор) або може містити рація активного компонента в розчині становить суміш принаймні одного емульгатора з жиром або приблизно від 1нг/мл до приблизно 10мкг/мл, наолією або з обома. Бажано включати до складу приклад, від приблизно 10нг/мл до приблизно гідрофільний емульгатор разом з ліпофільним 1мкг/мл. Склади можуть бути представлені у виемульгатором, що діє як стабілізатор. Також бажагляді герметичних контейнерів, які містять одну но включати і олію і жир. Разом, емульгатор (емуабо декілька доз, наприклад, у вигляді ампул і льгатори) з або без стабілізатора (стабілізаторів) флаконів, і можуть зберігатися в умовах сухого складають так званий емульгувальний віск, і цей замороження (ліофілізованому стані), що вимагає 37 90716 38 при приготуванні ін'єкцій тільки додавання стеринафтил (naph), метокси (Me), етокси (Et), бензоїл льного рідкого носія, наприклад, води, безпосере(Bz) і ацетил (Ас). дньо перед використанням. Ін'єкційні розчини та Для зручності, багато хімічних сполук наведені суспензії для негайного використання можна прив тексті у вигляді добре відомих скорочень, у тому готувати зі стерильних порошків, гранул і таблечислі, але не обмежуючись ними, метанол (Меток. Склади можуть бути у формі ліпосом або інОН), етанол (EtOH), ізо-пропанол (і-РrOН), метиших систем мікрочастинок, які націлюють активну летилкетон (МЕK), ефір або діетиловий ефір речовину на компоненти крові або один або декі(Еt2О), оцтова кислота (АсОН), дихлорметан (мелька органів. тиленхлорид, ДХМ), трифтороцтова кислота Дозування (ТФК), диметилформамід (ДМФ), тетрагідрофуран Слід брати до уваги, що придатні дози актив(ТГФ) і диметилсульфоксид (ДМСО). них сполук і композицій, які містять активні сполуЗагальні подробиці експерименту ки, можуть варіюватися від пацієнта до пацієнта. Хімічні реактиви були придбані в Aldrich Як правило, визначення оптимальної дози буде Chemical Company, Lancaster Synthesis Ltd і Acros включати пошук балансу між рівнем терапевтичної Organics (Fisher Scientific UK Ltd). ТГФ дистилювакористі та будь-яким ризиком або шкідливими поли з натрій/бензофенону безпосередньо перед бічними ефектами, викликаними курсами лікуванвикористанням. Метонол і етанол дистилювали з ня, пропонованими в даному винаході. Вибраний магній/йоду. ДХМ висушували шляхом дистиляції рівень дозування буде залежати від різних фактонад пентоксидом фосфору. Ацетон висушували рів, у тому числі, але не обмежуючись ними, актишляхом дистиляції над гідридом кальцію. Всі розвності конкретної сполуки, способу введення, часу чинники, не використовувані швидко, зберігали введення, швидкості виведення сполуки, тривалонад молекулярними ситами (4А, 3-5мм гранули) в сті лікування, інших ліків, сполук і/або матеріалів, атмосфері азоту. Безводний ДМФ одержували з використовуваних у комбінації, і віку, статі, ваги, Aldrich у бутилях SureSeal . Триетиламін висушузахворювання, загального стану здоров'я й попевали шляхом дистиляції над гідридом кальцію й редньої медичної історії пацієнта. В остаточному зберігали над гідроксидом калію, в атмосфері азопідсумку, кількість сполуки та спосіб введення буту. дуть визначені за розсудом лікаря, хоча, в цілому, Аналізи методом тонкошарової хроматографії доза повинна буде створити локальні концентрації (ТШХ) виконували з використанням силікагелю в місці впливу, які досягають необхідного ефекту, Merck 60F254, попередньо нанесеного на алюмінієне викликаючи істотних шкідливих або небезпечві листи, які потім висушували й візуалізували, них побічних ефектів. використовуючи короткохвильове (254нм) ультраВведення in vivo можна здійснити за допомофіолетове світло або шляхом обробки нінгідрином гою одиничної дози, безупинно або періодично або сірчаною кислотою, потім ваніліном. Аналізи (наприклад, у розділених дозах через придатні методом випарної колонкової хроматографії викоінтервали) протягом всього курсу лікування. Спонували при середньому тиску, використовуючи соби визначення найбільш ефективних способів і силікагель Davisil (40-63мкм). доз введення добре відомі спеціалістам у даній Температури плавлення визначали, викорисгалузі й будуть варіюватися залежно від складу, товуючи прилад Stuart Scientific SMP3, і не кореквикористовуваного в терапії, мети терапії, клітинитували. Спектри 1Н і 13С ядерного магнітного резомішені, яка піддається лікуванню, і пацієнта, що нансу, (ЯМР) одержували, використовуючи піддається лікуванню. Однократне або багатораспектрометр Bruker Spectrospin АС 300Е (1H зове введення можна здійснити на основі рівня й 300МГц або 13С 75МГц) або спектрометр Bruker схеми дозування, вибраних лікарем. Spectrospin AC 500E spectrometer (1H 500МГц або 13 Як правило, придатна доза активного компоС 125МГц). Хімічні зсуви виражають у частинах нента знаходиться в інтервалі від приблизно на мільйон ( ) тетраметилсульфону, використову100мкг до приблизно 25 мкг на кілограм ваги паціючи піки залишку розчинника як внутрішні стандаєнта в день. Якщо активна сполука являє собою рти. Мультиплетності вказують за допомогою s сіль, ефір, проліки і т.п., кількість, що вводиться (синглет), d (дублет), t (триплет), q (квартет), m розраховують на основі вихідної сполуки й, таким (мультиплет), br (смуга) або їх комбінацій. РХ/МС чином, фактична вага, яку слід використовувати спектри одержували, використовуючи прилад при введенні, пропорційно збільшується. Micromass Platform, який працює в режимі електПриклади ророзпилювання позитивних або негативних іонів. Наступні приклади наведені винятково з меРозділення досягали, використовуючи колонку тою ілюстрування даного винаходу й не припускаС18 (50x4.6мм; Supelco Discovery або Waters ють обмежити об'єм винаходу, описаного в цьому Symmetry) і 15 хвилинне градієнтне елюювання документі. 0.05% мурашиної кислоти та метанолу (10-90%). Скорочення ІЧ спектри реєстрували на Bio-Rad FTS 3000MX Для зручності, багато хімічних груп наведені в diamond ATR у вигляді нерозбавленої проби. тексті у вигляді добре відомих скорочень, у тому Синтез ключових проміжних речовин числі, але не обмежуючись ними, метил (Me), етил (і) 1-нітро-дибензотіофен-4-іловий ефір три(Et), н-пропіл (nРr), ізо-пропіл (іРr), н-бутил (nBu), фторметансульфонової кислоти (6) трет-бутил (tBu), н-гексил (nНех), циклогексил (сНех), феніл (Ph), біфеніл (biPh), бензил (Вn), 39 а) Дибензотіофен-4-ол (і) До охолодженого (-78°С) розчину дибензотіофену (20.8г, 113ммоль) у безводному ТГФ (400мл) додавали трет-бутиллтй (1.7Μ у пентані; 100мл, 170ммоль). Реакційну суміш перемішували при 78°С протягом 1 години й потім залишали нагріватися до кімнатної температури та перемішували так протягом 16 годин. Потім суміш охолоджували до 0°С і до реакційної суміші бурштинового кольору додавали повільним струмком через канюлю етилмагнійбромід (1M у ТГФ; 170мл, 170ммоль). Реакційну суміш знову залишали нагріватися до кімнатної температури, після чого її перемішували протягом 30 хвилин. До реакційної посудини прикріплювали дефлегматор, а потім кисень барботували через розчин протягом 40 хвилин. Потім суміш перемішували протягом ще однієї години, перш ніж обережно вилити її на подрібнений лід і підкислити до рН 3 концентрованою HCl. Потім суміш екстрагували, використовуючи етилацетат (3x80мл). Потім органічні екстракти обробляли 3M розчином гідроксиду натрію, доти, поки рН не досягав 10. Основний водний шар відокремлювали, підкисляли до рН 3, використовуючи 2М HCl, що викликало осадження маслянистої твердої речовини. Тверду речовину розчиняли в діетиловому ефірі (150мл), висушували, використовуючи MgSO4, фільтрували й концентрували у вакуумі й потім перекристалізовували із суміші етанол:вода (1:1) (250мл), з одержанням темно-жовтої забарвленої твердої речовини, яка відповідала вищезгаданій сполуці (21.6г, 96%) і не вимагала подальшого очищення, m/z (LC-MS, ESP), RT=3.64хв, (М+Н)=201.1 (b) 4-Метокси-дибензотіофен (іі) До розчину дибензотіофен-4-олу (і) (14.2г, 71.0ммоль) в ацетоні (500мл) додавали порошкоподібний карбонат калію (14.72г, 106.5ммоль) і метилйод (4.43мл, 71ммоль). Суміш нагрівали з метою зрошення й так перемішували протягом 16 годин. Потім суміш охолоджували та відфільтровували через фільтр Celite . Фільтрат, що утворився, концентрували у вакуумі з одержанням маслянистого залишку, який розбавляли в дихлорметані (100мл) і промивали 1M NaOH і на 90716 40 сиченим соляним розчином. Органічний шар висушували за допомогою MgSO4, фільтрували та концентрували у вакуумі, з одержанням темножовтої забарвленої твердої речовини, яка відповідала вищезгаданій сполуці та була використана без будь-якого подальшого очищення. (15.2г, 100 %) m/z (LC-MS, ESP), RT=4.22хв, (M+H)=215.1 (c) 4-Метокси-1-нітро-дибензотіофен (iiі) 4-Метокси-дибензотіофен (іі) (4.3г, 20.0ммоль) розчиняли в льодяній оцтовій кислоті (60мл) і до цього розчину додавали димлячу азотну кислоту (3.37мл) по краплях, що гарантувало, що температура суміші не підніметься вище 25°С. Жовту суспензію перемішували протягом ще 45 хвилин, після чого обережно наливали у воду (200мл) і перемішували протягом 15 хвилин. Тверду жовту речовину видаляли фільтрацією та ретельно промивали великою кількістю води й потім гексаном. Потім одержаний у такий спосіб залишок висушували у вакуумній печі, з одержанням вищезгаданої сполуки у вигляді жовтої твердої речовини, яку використовували без подальшого очищення. (5.19г, 97 %) m/z (LC-MS, ESP), RT=4.15хв, (M+H)=260.1 (d) 1-Нітро-дибензотіофен-4-ол (iv) Твердий піперидингідрохлорид (1кг, 8.7моль) додавали до 4-метокси-1-нітро-дибензотіофену (ііі) (35.44г, 187ммоль) і реакційну суміш добре перемішували, перед тим як нагріти до 165°С при безперервному перемішуванні. Суміш підтримували в такому стані протягом 8 годин, охолоджували, розбавляли водою (500мл) і екстрагували в дихлорметані (3x200мл). 3M розчин гідроксиду натрію додавали до органічного екстракту, доти поки з розчину не осаджувалася темна тверда речовина. Фільтрат видаляли, і рідину підкисляли до рН 1, використовуючи концентровану HCl. Яскраво жовту тверду речовину, яка потім утворилася при підкисленні, видаляли фільтрацією, промивали водою й висушували, одержуючи вищезгадану сполуку, яка було досить чистою для використання без подальшого очищення. (35.44г, 77%) m/z (LCMS, ESP), RT=3.69хв, (М+Н)=246.2, (М-Н)=244.1 (e) 1-Нітро-дибензотіофен-4-іловий ефір (6) трифтор-метансульфонової кислоти 41 90716 42 До охолодженої (-5°С) суспензії 1-нітроУ чисту, суху колбу в атмосфері аргону помідибензотіофен-4-олу (iv) (5.37г, 22.0ммоль) у дихщали 1-нітро-дибензотіофен-4-іловий ефір трилорметані (75мл) додавали триетиламін (9.20мл, фтор-метансульфонової кислоти (6) (250мг, 66.00ммоль), що дозволяло повністю розчинити 0.66ммоль), біс(пінаколато)дибор (185мг, суспензію. Потім до цієї суміші по краплях через 0.73ммоль), ацетат калію (390мг, 3.98ммоль), шприц додавали трифторметансульфоновий ангіPdCl2(dppf) (27мг, 0.033ммоль), і dppf (19мг, дрид (5.85мл, 33.00ммоль). Суміш перемішували 0.033ммоль). Колбу вакуумували під вакуумом і при цій температурі протягом 1 години та потім три рази промивали аргоном. Додавали діоксан виливали на подрібнений лід. Лід залишали пла(20мл) і реакційну суміш перемішували при 90°С витися, і суміш екстрагували, використовуючи протягом 12 годин. Реакційну суміш розбавляли СН2Сl2 (3x20мл). Потім об'єднані органічні шари ДХМ (100мл) і органічний шар послідовно промивисушували (MgSO4), фільтрували та концентрували водою (3x30мл), соляним розчином (1x30мл), вали у вакуумі, одержуючи легку бурштинову олію, висушували (Na2SO4) і випаровували розчинник у яку елюювали через шар діоксиду кремнію (нерозвакуумі, з одержанням нітроборонатового ефіру бавленим СН2Сl2) з одержанням вищезгаданої (7), який використовували без подальшого очисполуки у формі досить чистої, щоб використовущення. вати без подальшого очищення. (8.30г, 99%) m/z (іі) 1-Нітро-4-(4,4,5,5-тетраметил-1,3,2(LC-MS, ESP), RT=4.40хв, не іонізувався. діоксаборолан-2-іл)дибензофуран (12) (f) 1-Нітро-4-(4,4,5,5-тетраметил-1,3,2діоксаборолан-2-іл)дибензотіофен (7) (а) Дибензофуран-4-ол (7) n-BuLi (120мл, 300ммоль) додавали до розчину дибензофурану (27.4г, 163ммоль) у сухому ТГФ при -78°С. Реакційну суміш повільно нагрівали при 40°С і перемішували протягом 18 годин. Потім реакційну суміш охолоджували до -5°С, по краплях додавали MeMgBr (100мл, 300ммоль). Після того як додавання було завершено, реакційну суміш перемішували при кімнатній температурі протягом 1 години. Встановлювали конденсатор з барбатером і барботували кисень через реакційну суміш протягом 4 годин, під час яких реакційна суміш повільно нагрівалася при 40°С. Триваюче барботування кисню не збільшувало протікання реакції. Реакцію гасили, обережно виливаючи реакційну суміш на лід. рН регулювали до 3 шляхом додавання концентрованої HCl, і продукт екстрагували в ДХМ. Залишок очищали способом випарної хроматографії, використовуючи ДХМ/ЕР (6:4) як елюант. Після випаровування, виділяли також деяку кількість дибензофурану (13г, 47%), який не прореагував. Продукт (10.9г, 59ммоль, 36%) одержували у вигляді білої твердої речовини: Rf=0.18 (ДХМ-ЕР 6:4); т.пл.: 102°С; max (EtOH)/нм 234; ІЧ (см-1) 3258, 3049, 1635, 1603, 1477, 1436, 1347, 1309, 1245, 1189, 1158; 1H ЯМР, (300MГц, CDCl3) 5.40 (1H, s, OH), 7.05 (1H, d, JH2-H3=8Гц, H-3), 7.27 (1H, d, J=8Гц), 7.38 (1H, t, J=7Гц), 7.47-7.56 (2H, m), 7.61 (1H, d, J=8Гц), 7.97 (1H, d, J=8Гц); 13С ЯМР, (75MГц, CDCl3) 111.84, 112.79, 113.95, 121.00, 122.97, 123.72, 124.63 (Cq), 125.90 (Cq), 127.26, 141.35 (Cq), 144.31 (Cq), 156.04 (Cq); MS (El) m/z 184.0 M+; HRMS розраховано для C12H8O2 [M+H]+ 184.0519, знайдено 184.0517. (b) 4-Метокси-дибензофуран (8) Карбонат калію (1.4г, 10.11ммоль) та метилйодид (0.42мл, 6.74ммоль) додавали до розчину дибензофуран-4-олу (1.24г, 6.74ммоль) в ацетоні (65мл). Реакцію нагрівали при зрошенні та перемішували протягом 18 годин. Після охолодження, реакційну суміш добре промивали 1Μ гідроксидом натрію, водою та соляним розчином. Органічний шар висушували на сульфаті магнію, фільтрували й потім концентрували, одержуючи продукт (1.33г, 6.74ммоль, 100%) у вигляді білої голки, який використовували без подальшого очищення: Rf=0.37 (AcOEt-EP 1:19); т.пл.: 49-50°С; max (EtOH)/нм 279; ІЧ (см-1) 3054, 2839, 1900, 1633, 1496, 1451, 1423, 1330, 1309, 1267, 1188, 1089, 931, 893, 782, 737; 1H ЯМР, (300MГц, CDCl3) 4.03 (3H, s, ОСН3), 6.94 (1Н, d, JH2-H3=8Гц, Н-3), 7.26 (1H, J=8Гц), 7.36 (1H, t, J=7Гц), 7.48 (1H, t, J=7Гц), 7.54 (1H, d, J=7Гц), 7.69 (1H, d, J=8Гц), 7.94 (1H, d, J=8Гц); 13С ЯМР, (75MГц, CDCl3) 56.11 (OCH3), 109.31, 111.96, 112.82, 120.85, 122.86, 123.46, 124.43 (Cq), 125.72 (Cq), 127.21, 145.20 (Cq), 145.63 (Cq), 156.04 (Cq); MC (El) m/z 199.1 M+; HRMS розраховано для С13Н10O2 [М+Н]+ 199.0754, знайдено 199.0754. (c) 4-Метокси-1-нітро-дибензофуран (9) 43 90716 44 До розчину 4-метокси-дибензофурану (3.15г; додавання температуру реакційної суміші підтри15.89ммоль) у льодяній оцтовій кислоті (50мл) мували до -30°С. Через 3 години, реакційну суміш додавали по краплях димлячу азотну кислоту промивали насиченим розчином карбонату натрію (2.6мл; 63.50ммоль). Під час додавання реакційну (50мл) і екстрагували ДХМ (3x30мл). Органічний суміш підтримували при 20°С і перемішували прошар висушували над сульфатом магнію та випатягом 3 годин. Після завершення, реакційну суміш ровували з одержанням коричневої твердої речообережно наливали в охолоджену льодом воду; вини. Цю тверду речовину очищали на шарі діокрН регулювали до 7, додаючи 1Μ гідроксид насиду кремнію, використовуючи ДХМ/ЕР (6:4) як трію, і продукт екстрагували в ДХМ. Органічний елюант, одержуючи титульну сполуку (4.536г, шар висушували на сульфаті магнію, фільтрували 12.56ммоль, 94%) у вигляді білої твердої речовий потім концентрували. Залишок очищали спосони: Rf=0.33 (ДХМ -ЕР 1:4); т.пл.: 102-103°С; max бом випарної хроматографії, використовуючи ети(EtOH)/нм 243; ІЧ (см-1) 1643, 1572, 1528, 1488, лацетат/ЕР (1:19) як елюант. Перша речовина, яка 1427, 1348, 1317, 1246, 1209, 1132, 1068, 981, 921, залишала колонку, була 4-метокси-3-нітро828, 792, 742, 700; 1H ЯМР, (300MГц, CDCl3) 7.39 дибензофураном (270мг, 1.11ммоль, 7%), потім (1Н, m); 7.55 (1H, d, J=8Гц); 7.65 (2H, m); 8.20 (1H, одержували вищезгадану сполуку (1.85г, d, J=8Гц); 8.51 (1H, d, J=8Гц); 13С ЯМР, (75MГц, 7.62ммоль, 48%) у вигляді кремової твердої речоCDCl3) 112.35, 117.12 (CF3), 119.49, 120.55 (CF3), вини: Rf=0.13 (ЕtOАс-ЕР 1:19); т.пл.: 155-156°С; 120.75, 121.38 (CF3), 122.81 (CF3), 124.92, 126.60, -1 max (EtOH)/нм 239; ІЧ (см ) 3092, 2917, 2851, 131.24, 137.88 (Cq), 142.32 (Cq), 148.21 (Cq), 2042, 1876, 1630, 1568, 1506, 1438, 1396, 1342, 157.99 (Cq); MS (El) m/z 361.1 M+; HRMS розрахо1297, 1274, 1239, 1205, 1159, 1129, 1091, 1002, вано для C13H6F3NO6S [M+H]+ 360.9862, знайдено 938, 888, 831, 812, 738, 676; 1H ЯМР, (300MГц, 360.9861. CDCl3) 4.06 (3H, s, OCH3), 6.92 (1Н, d, J=8Гц), (f) 1-Hiтpo-4-(4,4,5,5-тетраметил-1,3,27.18 (1Н, t, J=8Гц), 7.36 (2H, m), 8.17 (1Н, d, J=8Гц), діоксаборолан-2-іл)дибензофуран (12) 8.63 (1H, d, J=8Гц); 13С ЯМР, (75MГц, CDCl3) У пробірці Шленка біс(пінаколато)дибор 56.81 (OCH3), 107.53, 111.81, 120.50 (Cq), 121.14 (3.075мг, 12.11ммоль) і ацетат калію (1.17г, (Cq), 122.27, 123.71, 126.32, 129.55, 136.29 (Cq), 18.16ммоль) розчиняли в діоксані (10мл) і дегазу145.20 (Cq), 150.53 (Cq), 157.02 (Cq); MC (El) m/z вали. Одночасно, 4-гідрокси-1-нітро243.1 M+; HRMS розраховано для C13H9NO4 [M+H]+ дибензофуран-4-O-трифлат (2.186г, 6.05ммоль), 243.0526, знайдено 243.0528. PdCl2dppf (247мг, 0.30ммоль) і dppf (167мг, (d) 1-Нітро-дибензофуран-4-ол (10) 0.30ммоль) розчиняли в діоксані (10мл) і дегазу4-метокси-1-нітро-дибензофуран (2г, вали. У пробірці Шленка розчини змішували ра8.22ммоль) нагрівали при 150°С протягом 18 годин зом, перемішували та нагрівали при 110°С протяу піридингідрохлориді (17г). Реакцію залишали гом 18 годин. Після охолодження, додавали ДХМ охолоджуватися до 90°С, і додавали 20мл води. (20мл). Розчин промивали водою (20мл), потім Після охолодження, продукт екстрагували в ДХМ. висушували на сульфаті магнію та випаровували. Органічний шар висушували на сульфаті магнію, Залишок очищали способом випарної хроматогфільтрували й потім концентрували. Залишок рафії, використовуючи ДХМ/ЕР (6:4) як елюант та очищали способом випарної хроматографії, викоустановлювали градієнт відносно ДХМ/АсОН (98:2) ристовуючи ДХМ як елюант. Продукт (1.88г, для повного видалення продукту, який міститься в 8.22ммоль, 100%) одержували у вигляді жовтої колонці. Продукт концентрували та промивали твердої речовини: Rf=0.13 (AcOEt-EP 1:4); т.пл.: карбонатом натрію (3x20мл) для видалення оцтової кислоти. Після випаровування, продукт 175°С; max (EtOH)/нм 239; ІЧ (см-1) 1626, 1577, (1.783мг, 5.26ммоль, 87%) перекристалізовували в 1487, 1442, 1273, 1240, 1197, 1153, 1076, 1016, ДХМ і одержували у вигляді жовтих кристалів: 983, 912, 817.; 1Н ЯМР, (300MГц, CDCl3) 6.35 (1Н, Rf=0.30 (AcOEt-EP 1:49); т.пл.: 185°С; s, ОН), 7.03 (1Н, d, J=8Гц), 7.42 (1Н, m, J=8Гц), max (EtOH)/нм 347; ІЧ (см1) 2981, 1701, 1624, 1597, 7.56 (2H, m), 8.18 (1H, d, J=8Гц), 8.70 (1H, d, 1521, 1474, 1447, 1369, 1329, 1309, 1192, 1172, J=8Гц); 13С ЯМР, (75MГц, CDCl3) 111.69, 112.56, 1137, 1043, 979, 883, 852, 818, 785, 754, 732, 663; 120.85 (Cq), 121.56 (Cq), 122.57, 124.00, 126.72, 1 H ЯМР, (300MГц, CDCl3) 1.48 (12Н, s, 4xCH3), 129.83, 136.30 (Cq), 143.98 (Cq), 146.79 (Cq), + 7.46 (1Η, t, J=6Гц), 7.63 (1H, t, J=6Гц), 7.76 (1H, d, 156.99 (Cq); MS (El) m/z 229.1 M ; HRMS розрахоJ=9Гц), 8.01 (1H, d, J=9Гц), 8.19 (1H, d, J=9Гц), 8.66 вано для C12H7NO4 [M+H]+ 229.0370, знайдено 229.0369. (1H, d, J=9Гц); 13C ЯМР, (125MГц, CDCl3) 24.82 (e) 1-Нітро-дибензофуран-4-іловий ефір три(4xCH3), 84.78 (2xCq-O), 112.14, 118.07 (Cq), фтор-метансульфонової кислоти (11) 118.61, 120.29 (Cq), 123.42, 125.82, 129.47, 133.50, 1-Нітро-дибензофуран-4-ол (3,01г; 13.36ммоль 144.81 (Cq), 157.33 (Cq), 161.39 (Cq); MC (El) m/z розчиняли в ДХМ (50мл), охолоджували до -40°С і 339.2 M+; HRMS розраховано для C18H18BNO5 додавали триетиламін (5.5мл, 40ммоль). Через [M+H]+ 339.1273, знайдено 339.1270. 5хв, до реакційної суміші додавали по краплях (iii) Синтез 9-трифлат-2-морфолін-4-ілтрифліковий ангідрид (3.45мл, 20ммоль). Під час піридо[2,1-а]піримідин-4-ону (17) 45 (а) 2,9-Дигідрокси-піридино[2,1-а]піримідин-4он (14) Суміш біс-(2,4,6-трихлорфенілового) ефіру малонової кислоти (17.33г; 37.5ммоль) і 3-гідрокси2-аміно-піридину (13) (4.12г; 37.5ммоль), розчинену в бромбензолі (37мл), нагрівали при зрошенні протягом 3 годин. Після охолодження, реакційну суміш фільтрували, і тверду речовину промивали етанолом. Тверду речовину розчиняли в 1M NaOH і додавали краплі АсОН, осаджуючи продукт у вигляді світло-жовтої твердої речовини (6.53г). Вихід=98%. т.пл.: 320°С (розкладання); Rf=0.11, МеОН:ДХМ (3:17); УФ: max=252нм; ІЧ: (см-1) 2862, 1688, 1564, 1374, 1295, 1102, 783; 1H ЯМР, (ДМСО, 300MГц), (ppm): 5.22 (1H, s, CH-3), 7.12 (1H, t, JH6H7=7Гц, Harom-7), 7.27 (1H, d, JH7-H8=8Гц, Harom-8), 8.43 (1H, d, JH6-H7=7Гц, Harom-6); 13C ЯМР, (CDCl3, 75MГц), (ppm): 103.25, 116.46, 117.05, 119.03, 143.97, 148.82, 157.26, 157.50. (b) 2-Хлор-9-гідрокси-піридино[2,1-а]піримідин4-он (15) У круглодонній колбі, 2,9-дигідроксипіридино[2,1-а]піримідин-4-он (14) (1.07г; 6.0ммоль) розчиняли в оксихлориді фосфору (7.5мл). Цей розчин нагрівали, зрошуючи протягом 48 годин. Після охолодження, реакційну суміш акуратно виливали в крижану холодну воду (100мл) і встановлювали рН 7 шляхом додавання насиченого розчину карбонату калію. Водний шар екстрагували дихлорметаном. Органічний шар висушували над сульфатом магнію та випаровували, одержуючи коричневу тверду речовину. Цю тверду речовину очищали способом випарної хроматографії, використовуючи дихлорметан як елюант, одержуючи вищезгадану сполуку у вигляді білої твердої речовини (712мг). Вихід=60%. т.пл.: 162°С; Rf=0.34, МеОН:ДХМ (1:19); Мас спектр: (m/z) 196.93 [M+1]+ (Rt=4.67хв, 12хв градієнт); УФ: -1 max=210нм; ІЧ: (см ) 3103, 1684, 1630, 1511, 1458, 1 1297, 1105; H ЯМР, (CDCl3, 300MГц), (ppm): 6.4 (1Н, s, CH-3), 7.11 (1H, t, JH6-H7=7Гц, Harom-7), 7.25 (1H, d, JH7-H8=8Гц, Harom-8), 8.51 (1H, d, JH6-H7=7Гц, Harom-6); 13C ЯМР, (CDCl3, 75MГц), (ppm): 103.25, 116.46, 117.05, 119.03, 143.97, 148.82, 157.26, 157.50. (c) 9-Гідрокси-2-морфолін-4-іл-піридо[2,1-а] піримідин-4-он (16) 90716 46 У круглодонній колбі, розчиняли 2-хлоро-9гідрокси-піридино[2,1-а]піримідин-4-он (15) (141.7мг; 0.721ммоль) та морфолін (314мкл; 3.605ммоль) в етанолі (5мл). Цей розчин нагрівали, зрошуючи протягом 18 годин при енергійному перемішуванні. Після охолодження, розчинник випаровували. Жовту неочищену тверду речовину перекристалізовували в етанолі, з одержанням 173.8мг білих кристалів. Вихід=97%. т.пл.: 245°С; Rf=0.27, МеОН:ДХМ (1:19) ; Мас спектр: (m/z) 248.08 [M+1]+ (Rt=4.92хв, 12хв градієнт) ; УФ: -1 max=267нм; ІЧ: (см ) 3302, 1690, 1644, 1551, 1427, 1 1224, 1110; H ЯМР, (CDCl3, 500MГц), (ppm): 3.56 (4H, m, N-СН2-морфолін), 3.75 (4H, m, О-СН2морфолін), 5.55 (1H, s, CH-3), 6.80 (1Н, t, JH6H7=7Гц, Harom-7), 7.02 (1Н, dd, JH7-H8=8Гц, JH6-H8=13Гц, Harom-8), 7.33 (1H, s, OH), 8.37 (1H, dd, JH613 C ЯМР, (CDCl3, H7=7Гц, JH6-H8=1.3Гц, Harom-6); 125MГц), (ppm): 45.27, 67.02, 82.16, 113.46, 114.18, 119.05, 143.00, 147.51, 159.00, 161.00. (d) 9-Трифлат-2-морфолін-4-іл-піридо[2,1-а] піримідин-4-он (17) У тригорловій круглодонній колбі з термометром розчиняли 9-гідрокси-2-морфолін-4-ілпіридино[2,1-а]піримідин-4-он (16) (2.11г; 8.54ммоль) у ДХМ (70мл), охолодженому до -30°С і додавали триетиламін (3.572мл; 25.63ммоль). Через 5 хвилин, трифліковий ангідрид (2.101мл; 12.81ммоль), розчинений в 10мл ДХМ, додавали по краплях через додаткову лійку до реакційної суміші протягом 30 хвилин. Під час додавання температуру реакційної суміші підтримували на 20°С. Через3 години, реакційну суміш промивали насиченим розчином Na2CO3 (50мл) і екстрагували ДХМ (3x30мл). Органічний шар висушували над сульфатом магнію та випаровували, одержуючи коричневу тверду речовину. Цю тверду речовину очищали способом випарної хроматографії, використовуючи дихлорметан як елюант, одержуючи вищезгадану сполуку у вигляді жовтогарячої твердої речовини (2.91г). Вихід=90%. т.пл.: 146-147°С; Rf=0.42; МеОН: ДХМ (1:19); Мас спектр: (m/z) 380.16 [M+1]+ (Rt=3.34хв, 12хв градієнт); УФ: -1 max=271нм; ІЧ: (см ) 1705, 1644, 1551, 1189, 1112, 1 939, 769; H ЯМР, (CDCl3, 300MГц), (ppm): 3.56 (4H, m, N-СН2-морфолін), 3.71 (4H, m, O-СН2морфолін), 5.53 (1Н, s, СН-3), 6.80 (1Н, t, JH6H7=7Гц, Harom-7), 7.46 (1Н, dd, JH7-H8=8Гц, JH6 47 90716 48 =1.3Гц, Harom-8), 8.79 (1H, dd, JH6-H7=7Гц, JH6121.10, 125.34, 127.86, 128.13, 141.46, 145.79, H8 13 158.07, 160.42. C ЯМР, (CDCl3, 75MГц), H8=1.3Гц, Harom-6); (iv) Синтез 8-бром-2-морфолін-4-іл-1Н-хінолін(ppm): 45.19, 66.87, 81.76, 110.16, 112.61, 116.85, 4-он (21) (a) 5-(Біс-метилсульфаніл-метилен)-2,2диметил-[1,3]діоксан-4,6-діон (18) В 250мл двугорловій колбі одержували добре перемішаний розчин 2,2-диметил-1,3-діоксан-4,6діону (12) (кислота Мелдрума) (4.09г; 28.4ммоль) у ДМСО (14мл). До цієї суміші швидко додавали послідовно триетиламін (7.92мл; 56.8ммоль) і дисульфід вуглецю (1.71мл; 28.4ммоль). Потім, перед охолодженням на льодяній бані, суміш енергійно перемішували протягом 1 години при кімнатній температурі. До реакційної суміші при охолодженні (крижана баня) повільно додавали йодметан (3.54мл; 56.8мл). Після того, як додавання було завершено, реакційну суміш залишали нагріватися до кімнатної температури й потім перемішували протягом ще 4 годин, перед тим як розбавити крижаною холодною водою (25мл). При крацюванні суміші осаджувався продукт, який відфільтровували та промивали бензином. Продукт був одержаний у вигляді твердої жовтої речовини (2.76г) і був досить чистим для використання в наступних реакціях. Вихід=45%. т.пл.: 118°С (література28: 116-118С); ІЧ: (см-1) 3728, 1668, 1373, 1302, 1264, 1199; 1H ЯМР, (CDCl3, 300MГц), (ppm): 1.54 (6H, s, 2CH3), 2.58 (6H, s, 2CH3-S); 13C ЯМР, (CDCl3, 75MГц), (ppm): 21.86, 27.22, 103.32, 160.33, 194. (b) 5-[2-Броманілін-(метилтіо)-метилен]-2,2диметил-4,6-діон (19) В 10мл круглодонній колбі з холодильником і барбатером азоту, ізопропіліденбісметилтіоліденмалонат (18) (900мг; 3.63ммоль) і 2-броманілін (15) (624мг; 3.63ммоль) розчиняли в 2,2,2трифтопентанолі (3.6мл). Суміш перемішували та нагрівали зі зрошенням протягом 22 годин. Після охолодження, розчинник випаровували. Залишок перекристалізовували з метанолу, одержуючи вищезгадану сполуку у вигляді білих кристалів (1.192г). Вихід=88%. т.пл.: 159°C; Rf=0.31, ДХМ; ІЧ: (см-1) 2990, 1706, 1653, 1535, 1370, 1199; УФ: 1 H ЯМР, (CDCl3, 300MГц), (ppm): max=313нм; 1.69 (6H, s, 2CH3), 2.15 (3H, s, CH3-S), 7.18 (1H, dt, JH4-H5=8Гц, JН4-H6=2Гц, Harom-4), 7.35 (2H, m, Harom-5 та Harom-6), 7,61 (1H, dd, JH3-H4=8Гц, JH3-H5=1.2Гц, Harom-3), 12.51 (1H, s, N-H); 13C ЯМР, (CDCl3, 75MГц), (ppm): 18.75, 26.48, 87.54, 103.32, 120.45, 127.78, 128.46, 129.48, 133.57, 136.91, 163.87, 178.70. (c) 5-[(2-Бром-анілін)-морфолін-4-іл-метилен]2,2-диметил-[1,3]діоксан-4,6-діон (20) В 10мл круглодонній колбі з холодильником і барбатером азоту, 5-[2-броманілін-(метилтіо)метилен]-2,2-диметил-4,6-діон (19) (234мг; 0.629ммоль) і морфолін (110мкл; 1.257ммоль) розчиняли в 2,2,2-трифтопентанолі (1мл). Суміш перемішували та нагрівали, зрошуючи, протягом 18 годин. Після охолодження, розчинник випаровували. Залишок перекристалізовували з метанолу, одержуючи вищезгадану сполуку у вигляді білих кристалів (0.124г). Вихід=50%. т.пл.: 212213°С; Rf=0.05; ДХМ; ІЧ: (см-1) 1627, 1342, 1305, 1100, 1022, 934; УФ: max=241нм; 1H ЯМР, (CDCl3, 300MГц), (ppm): 1.77 (6H, s, 2CH3), 3.24 (4H, t, Jab=5Гц, 2CH2-N морфолін), 3.66 (4H, t, Jab=5Гц, 2СН2-О морфолін), 7.18 (2Н, m, Harom-4 та Harom-6), 7.40 (1H, t, JH5-H6=8Гц, Harom-5), 7.69 (1H, dd, JH313 C H4=8Гц, JH3-H5=1.4Гц, Harom-3), 9.62 (1H, s, N-H); ЯМР, (CDCl3, 75MГц), (ppm): 26.83, 51.14, 65.62, 87.54, 102.84, 120.45, 127.15, 128.92, 129.03, 134.48, 138.46, 164.92, 178.70. (d) 8-Бром-2-морфолін-4-іл-1Н-хінолін-4-он (21) У пробірці Шленка 5-[(2-броманілін)-морфолін4-іл-метилен]-2,2-диметил-[1,3]діоксан-4,6-діон (20) (103.3мг; 0.2513ммоль) розчиняли в дифеніловому ефірі (0.7мл). Суміш перемішували та нагрівали, зрошуючи, протягом 4 годин. Після охолодження, додавали нафтовий ефір. Продукт збирали шляхом відсмоктування. Залишок очищали способом випарної хроматографії, використовуючи дихлорметан/метанол (95:5) як елюант. Продукт одержували у вигляді коричневого масла (65.1мг). Вихід=84%. Rf=0.25, МеОН:ДХМ (1:19); Мас спектр: (m/z) 310.98 [M+1]+ (Rt=5.24хв, 12хв 49 90716 50 градієнт); ІЧ: (см-1) 3395, 2959, 2849, 1617, 1577, Harom-7), 8.09 (1H, d, JH5-H6=8Гц, Harom-5); 13C ЯМР, 1487, 1421, 1384, 1327, 1263, 1229, 1188, 1152, (CDCl3, 75MГц), (ppm): 46.35, 66.59, 92.50, 1111, 1066, 999, 902, 785; УФ: max=254нм; 1H ЯМР, 114.53, 123, 123.50, 124.73, 134.45, 138, 156.06, 172.6. (CDCl3, 300MГц), (ppm): 3.72 (4H, t, Jab=5Гц, (ν) Синтез 9-(1-аміно-дибензотіофен-4-іл)-22CH2-N морфолін), 3.75 (4H, t, Jab=5Гц, 2CH2-O морфолін-4-іл-піридо[2,1-а]піримідин-4-ону (23) морфолін), 5.95 (1Н, s, H-3), 7.04 (1Н, t, JH6-H7=8Гц, Harom-6), 7.69 (1Н, dd, JH6-H7=8Гц, JH5-H7=1.3Гц, (а) 9-(1-Нітро-дибензотіофен-4-іл)-2-морфолін4-іл-піридо[2,1-а]пірітідин-4-он (22) У пробірці Шленка 1-нітро-4-(4,4,5,5тетраметил-1,3,2-діоксаборолан-2іл)дибензотіофен (7) (983мг; 2.8ммоль) і карбонат цезію (2.705г; 8.3ммоль) розчиняли в ТГФ (8мл). Аргон барботували в розчин, який обробляли ультразвуком протягом 15 хвилин. Одночасно, 9трифлат-2-морфолін-4-іл-піридо[2,1-а]піримідин-4он (6) (1.154г; 3.045ммоль) і PdCl2dppf (112.7мг; 0.138ммоль) розчиняли в ТГФ (8мл). Аргон барботували в розчин, який обробляли ультразвуком протягом 15 хвилин. Розчини змішували разом у пробірці Шленка, перемішували та нагрівали при 80°С протягом 18 годин. Після охолодження, додавали ДХМ (20мл). Розчин промивали водою (20мл), потім висушували на сульфаті магнію та випаровували. Залишок очищали способом випарної хроматографії, використовуючи етилацетат/ДХМ (1:1) як елюант. Після випаровування, одержували продукт у вигляді жовтої твердої речовини (1.168г). Вихід=92%. Rf=0.37; АсОЕt:ДХМ (1:1); Мас спектр: (m/z) 459.3 [M+1]+ (Rt=4.69хв) (b) 9-(1-Аміно-дибензотіофен-4-іл)-2морфолін-4-іл-піридо[2,1-а]піримідин-4-он (23) У круглодонній колбі, 9-(1-нітродибензотіофен-4-іл)-2-морфолін-4-іл-піридо[2,1а]піримідин-4-он (17) (618.8мг; 1.351ммоль) суспендували в АсОН (10мл). До цього розчину додавали порошок цинку (883.3мг; 13.51ммоль) і реакційну суміш перемішували при кімнатній температурі всю ніч. Реакційну суміш фільтрували через Celite , промивали послідовно метанолом (4x50мл) і ДХМ (4x50мл). Об'єднані органічні шари випаровували при зниженому тиску. Залишок перемішували з водою (100мл) і до розчину додавали водний амоній (25мл). Осад, що утворився, збирали фільтрацією. Залишок був висушений і не вимагав подальшого очищення. Продукт одержували у вигляді твердої жовтої речовини (575.3мг). Вихід=99%. Rf=0.36; АсОЕt:ДХМ (1:1); Мас спектр: (m/z) 429.47[M+1]+ (Rt=4.17xв) (vi) Синтез 8-(1-аміно-дибензотіофен-4-іл)-2морфолін-4-іл-1Н-хінолін-4-ону (25) (а) 2-Морфолін-4-іл-8-(1-нітро-дибензотіофен4-іл)-1Н-хінолін-4-он (24) У пробірці Шленка 1-нітро-4-(4,4,5,5тетраметил-1,3,2-діоксаборолан-2іл)дибензотіофен (6) (983мг; 2.768ммоль) і карбонат цезію (2.705г; 8.3047ммоль) розчиняли в ТГФ (8мл). Аргон барботували в розчин, який обробляли ультразвуком протягом 15 хвилин. Одночасно, 8-бром-2-морфолін-4-іл-1Н-хінолін-4-он (21) (941.4мг; 3.045ммоль) і PdCl2dppf (112.7мг; 0.138ммоль) розчиняли в ТГФ (8мл). Аргон барботували в розчин, який обробляли ультразвуком протягом 15 хвилин. Розчини змішували разом у пробірці Шленка, перемішували й нагрівали при 80°С протягом 18 годин. Після охолодження, до давали ДХМ (20мл). Розчин промивали водою (20мл), потім висушували на сульфаті магнію та випаровували. Залишок очищали способом випарної хроматографії, використовуючи етилацетат/ДХМ (1:1) як елюант. Після випаровування, одержували продукт у вигляді жовтої твердої речовини (255.5мг). Вихід=20%. Rf=0.24, АсОЕt:ДХМ (1:1); Мас спектр: (m/z) 458.4 [M+1]+ (Rt=5.33хв) (b) 8-(1-Аміно-дибензотіофен-4-іл)-2морфолін-4-іл-1Н-хінолін-4-он (25) У круглодонній колбі, 2-морфолін-4-іл-8-(1нітро-дибензотіофен-4-іл)-1Н-хінолін-4-он (24) (365мг; 0.798ммоль) суспендували в АсОН (5мл). До цього розчину додавали порошок цинку (5223.3мг; 7.98ммоль) і реакційну суміш перемішу 51 90716 52 вали при кімнатній температурі всю ніч. Реакційну Залишок був висушений і не вимагав подальшого очищення. Одержували продукт у вигляді жовтої суміш фільтрували через Celite , промивали поствердої речовини (291.3мг). Вихід=85.4%. Мас лідовно метанолом (4x25мл) і ДХМ (4x25мл). спектр: (m/z) 428.4 [M+1]+ (Rt=3.83хв). Об'єднані органічні шари випаровували при зни(vii) Синтез 9-(1-аміно-дибензофуран-4-іл)-2женому тиску. Залишок перемішували з водою морфолін-4-іл-піридо[2,1-а]піримідин-4-ону (27) (50мл) і до розчину додавали водний амоній (15мл). Осад, що утворився, збирали фільтрацією. (а) 9-(1-Нітро-дибензотіофен-4-іл)-2-морфолін4-іл-піридо[2,1-а]піримідин-4-он (26) У пробірці Шленка, 1-нітро-4-(4,4,5,5тетраметил-1,3,2-діоксаборолан-2іл)дибензофуран (12) (500мг, 1.47ммоль) і карбонат калію (480мг, 3.69ммоль) розчиняли в діоксані (10мл) і дегазували. Одночасно, 9-гідрокси-2морфолін-4-іл-піридо[1,2-а]піримідин-4-он-9-Отрифлат (17) (466мг, 1.23ммоль) і Pd(PPh3)4 (71мг, 0.06ммоль) розчиняли в діоксані (10мл) і дегазували. Розчини змішували разом у НВЧ-посудині, яку поміщали в мікрохвильовий реактор при 180°С на 30хв. Після охолодження, додавали ДХМ (20мл). Розчин промивали водою (20мл), потім висушували на сульфаті магнію та випаровували. Залишок розтирали в порошок у гарячому метанолі, і продукт (375мг, 0.85ммоль, 69%) відфільтровували у вигляді коричневої твердої речовини: Rf=0.51 (AcOEt); т.пл.: 262°С; max (EtOH)/нм 268; ІЧ (см-1) 1706, 1673, 1631, 1599, 1541, 1511, 1430, 1338, 1306, 1230, 1194, 1116, 1070, 1028, 999, 975, 860; 1H ЯМР, (300MГц, CDCl3) 3.26 (4Н, m, 2xNСН2-морфолін), 3.47 (4Η, m, 2xО-СН2-морфолін), 5.57 (1Н, s, H-3), 7.03 (1Н, t, JH6-H7=7Гц, Н-7), 7.44 (1Н, t, J=7Гц), 7.58 (2Н, m), 7.74 (1Н, d, J=7Гц), 7.86 (1Н, d, J=7Гц), 8.24 (1Н, d, J=8Гц), 8.66 (1Н, d, J=8Гц), 9.10 (1Н, d, J=8Гц, Н-6); 13С ЯМР, (125MГц, CDCl3) 44.41 (2xСН2-N-морфолін), 66.32 (2XСН2О-морфолін), 81.09 (С-3), 111.58, 112.05, 119.26, 120.67, 123.89, 126.28, 127.57, 128.32, 128.76, 128.95, 130.01, 138.39, 142.88, 143.92, 148.48, 154.66, 157.04 (Cq), 158.67 (Cq), 160.28 (Cq); MS (ΕΘ) m/z 443.35 M+; HRMS розраховано для C24H19N4O5 [M+H]+ 443.1350, знайдено 443.1352. (b) 9-(1-Аміно-дибензофуран-4-іл)-2-морфолін4-іл-піридо[2,1-а]піримідин-4-oн (27) У круглодонній колбі 9-(1-нітро-дибензофуран4-іл)-2-морфолін-4-іл-піридо[1,2-а] піримідин-4-он (26) (300мг, 0.68ммоль) суспендували в АсОН (5мл). До цього розчину додавали порошок цинку (445мг, 6.8ммоль) і реакційну суміш перемішували при кімнатній температурі всю ніч. Реакційну суміш фільтрували через целіт і промивали послідовно метанолом (4x50мл) і ДХМ (4x50мл). Об'єднані органічні шари випаровували при зниженому тиску. Залишок перемішували з водою (100мл), і до розчину додавали водний амоній (25мл). Осад, що утворився, збирали фільтрацією. Цю тверду речовину очищали способом випарної хроматографії, використовуючи AcOEt як елюант, одержуючи вищезгадану сполуку (269мг, 0.65ммоль, 96%) у вигляді білої твердої речовини: Rf=0.32 (AcOEt); т.пл.: 294°С; max (EtOH)/нм 238; ІЧ (см-1) 3340, 3224, 2937, 2872, 2258, 1697, 1637, 1623, 1543, 1493, 1440, 1373, 1309, 1258, 1234, 1191, 1150, 1109, 1073, 999, 909, 856, 776; 1H ЯМР, (300MГц, MeOD) 3.36 (4Н, m, 2xΝ-СН2-морфолін), 3.52 (4Η, m, 2xО-СН2-морфолін), 6.72 (1Н, d, J=7Гц), 6.88 (1Н, t, J=7Гц), 7.31-7.47 (5H, m), 7.90 (2H, m), 8.90 (1H, d, J=7Гц); 13С ЯМР, (75MГц, MeOD) 46.23 (2xСН2-N-морфолін), 68.02 (2xСН2-О-морфолін), 110.44, 112.78, 114.57, 122.46, 124.53, 125.58 (Cq), 127.53, 128.01, 131.81, 133.58, 138.88, 145.06 (Cq), 150.82 (Cq), 156.70 (Cq), 156.90 (Cq), 161.68 (Cq), 162.11 (Cq); MC (El) m/z 413.19 M+; Anal. Розраховано для 0.86моль C24H20N4O3+0.14моль МеОН: С, 69.48, Η, 4.99, Ν, 13.41. Знайдено: С, 69.22, Η, 4.79, Ν, 13.38; HRMS розраховано для C24H21N4O3 [M+H]+ 413.1608, Знайдено 413.1609. (viii) Синтез 9-(1-аміно-дибензофуран-4-іл)-2морфолін-4-іл-піридо[2,1-а]піримідин-4-ону (29) 53 90716 54 (а) 2-Морфолін-4-іл-8-(1-нітро-дибензофуран4-іл)-1Н-хінолін-4-он (28) У пробірці Шленка 1-нітро-4-(4,4,5,5тетраметил-1,3,2-діоксаборолан-2іл)дибензофуран (12) (500мг, 1.47ммоль) і карбонат калію (480мг, 3.69ммоль) розчиняли в діоксані (10мл) і дегазували. Одночасно, 8-бром-2морфолін-4-іл-1H-хінолін-4-он (21) (380мг, 1.23ммоль) і Pd(PPh3)4 (71мг, 0.06ммоль) розчиняли в діоксані (10мл) і дегазували. Розчини змішували разом у НВЧ-посудині, яку поміщали в мікрохвильовий реактор при 180°С на 30хв. Після охолодження, додавали ДХМ (20мл). Розчин промивали водою (20мл), потім висушували на сульфаті магнію та випаровували. Залишок очищали способом випарної хроматографії, використовуючи AcOEt/EP (8:2) як елюант, одержуючи вищезгадану сполуку (303мг, 0.74ммоль, 60%) у вигляді жовтої твердої речовини: Rf=0.67 (AcOEt); т.пл.: 247°С; max (EtOH)/нм 251; ІЧ (см-1) 3421, 2852, 2360, 2333, 1614, 1573, 1500, 1435, 1429, 1348, 1309, 1233, 1199, 1152, 1124, 1039, 991, 917, 866, 823; 1H ЯМР, (300MГц, CDCl3) 3.04 (4Н, m, 2xСН2-N-морфолін), 3.54 (4Η, m, 2xСН2-Оморфолін), 5.92 (1Н, s, Н-3), 7.19-7.45 (2Н, m), 7.51-7.58 (2Н, m), 7.65-7.70 (2Н, m), 8.31 (2Н, m), 8.67 (1Н, d, J=7Гц); MS (El) m/z 442.29 Μ+; HRMS розраховано для C25H20N3O5 [M+H]+ 442.1397, знайдено 442.1398. (b) 8-(1-Аміно-дибензофуран-4-іл)-2-морфолін4-іл-1Н-хінолін-4-он (29) У круглодонній колбі, 2-морфолін-4-іл-8-(1нітро-дибензотіофен-4-іл)-1Н-хінолін-4-он (28) (290мг, 0.66ммоль) суспендували в оцтовій кислоті (5мл). До цього розчину додавали порошок цинку (430мг, 6.58ммоль) і реакційну суміш перемішували при кімнатній температурі всю ніч. Реакційну суміш фільтрували через целіт і потім послідовно промивали метанолом (4x25мл) і ДХМ (4x25мл). Об'єднані органічні шари випаровували при зни женому тиску. Залишок перемішували з водою (50мл), і до розчину додавали водний амоній (15мл). Осад, що утворився, збирали фільтрацією. Залишок був висушений і не вимагав подальшого очищення. Продукт (246мг, 0.60ммоль, 91%) одержували у вигляді коричневого масла: Rf=0.44 (AcOEt); max (EtOH)/нм 315; ІЧ (см-1) 1708, 1572, 1374, 1278, 1190, 1116, 1049, 1010, 931, 880, 827, 748, 722, 688, 688; 1H ЯМР, (300MГц, CDCl3) 3.11 (4H, m, 2xСН2-Н-морфолін), 3.58 (4Η, m, 2xCH2-Oморфолін), 5.98 (1Н, s, Н-3), 6.85 (1H, d, J=8Гц), 7.25-7.51 (3H, m), 7.52-7.68 (3H, m), 8.05 (1Н, t, J=8Гц), 8.67 (1H, d, J=8Гц); 13С ЯМР, (75MГц, MeOD) 48.02 (2xСН2-N-морфолін), 67.44 (2XСН2О-морфолін), 111.94, 112.63, 122.96, 125.05, 125.57, 127.63, 127.87, 131.55, 132.68, 135.32, 146.21, 156.79; МС (ΕΘ) m/z 412.25 М+; HRMS розраховано для C25H22N3O3 [M+H]+ 412.1656, знайдено 412.1654. (іх) Синтез 9-(1-гідрокси-дибензотіофен-4-іл)2-морфолін-4-іл-піридо[2,1-а]піримідин-4-ону (31) У круглодонній колбі, 9-(1-амінодибензотіофен-4-іл)-2-морфолін-4-іл-піридо[2,1а]піримідин-4-он (23) (137.2мг; 0.32ммоль) суспендували в етанолі (15мл). При кімнатній температу рі по краплях додавали HBF4 (664мкл; 4.81ммоль). Після перемішування протягом 15 хвилин, реакційна суміш ставала прозорим розчином, який охолоджували при 0°С і додавали трет 55 90716 56 бутилнітрит (76.1мкл; 0.64ммоль). Через 30 хвиву тверду речовину. Залишок очищали способом лин, реакційну суміш розбавляли ефіром (25мл). випарної хроматографії, використовуючи метаУтворювався осад, який відфільтровували, потім нол/ДХМ (2:98) як елюант. Побічний продукт, обупромивали ефіром (2x5мл) і висушували. Цю твемовлений дезамінуванням виділяли з 17% вихорду речовину додавали до розчину азотномідної дом (22.5мг). Одержували продукт у вигляді жовтої солі (23.193г; 96ммоль) у воді (500мл), який міствердої речовини (26.3мг). Вихід=19%. Мас спектр: тить оксид міді (45.78мг; 0.32ммоль), і перемішу(m/z) 430.3 [M+1]+ (Rt=4.23хв) вали протягом 1 години при кімнатній температурі. (х) Синтез 8-(1-аміно-дибензофуран-4-іл)-2Водний розчин фільтрували, одержуючи коричнеморфолін-4-іл-1-бензопіран-4-ону (33) (a) 2-Морфолін-4-іл-8-(1-нітро-дибензофуран4-іл)-1-бензопіран-4-он (32) До розчину 1-нітро-4-(4,4,5,5-тетраметил-1,3,2діоксаборолан-2-іл)-дибензофурану (12, 0.30ммоль, 0.10г) у безводному діоксані (2мл) додавали 2-морфолін-4-іл-4-оксо-4Н-1-бензопіран-8іловий ефір трифторметансульфонової кислоти (0.24ммоль, 0.091г, див. WO 03/024949), карбонат калію (0.6ммоль, 0.083г) і тетракіс(трифенілфосфін)паладій (0.015ммоль, 0.018г). Реакційну посудину герметизували та нагрівали під впливом мікрохвильового випромінювання (140°С, 10 хвилин, встановлення низького рівня поглинання). Після завершення, реакційну суміш фільтрували через тонкий шар діоксиду кремнію й осад на фільтрі промивали СН2Сl2. Потім розчинники видаляли у вакуумі, одержуючи світлокоричневий твердий залишок (0.13г, 100%), який використовували без подальшого очищення, m/z 443.4 [М+Н]+ (Rt=4.76хв) (b) 8-(1-Аміно-дибензофуран-4-іл)-2-морфолін4-іл-1-бензопіран-4-он (33) До розчину 2-морфолін-4-іл-8-(1-нітродибензофуран-4-іл)-1-бензопірану-4-ону (32, 2.5ммоль, 1.11г) в оцтовій кислоті (50мл) порціями протягом десяти хвилин додавали цинковий пил (25ммоль, 1.64г). Потім суміш перемішували при кімнатній температурі протягом 2 годин, після чого її фільтрували через прокладку Celite , яку промивали метанолом (20мл) і СН2Сl2 (20мл). Розчинники видаляли у вакуумі, одержуючи суспензію, яку потім розбавляли гідроксидом амонію (30мл) і тверду речовину, яка утворилася, видаляли фільтрацією. Залишок очищали способом випарної хроматографії (SiO2), використовуючи МеОН:СН2СI2-1:99 як елюант, одержуючи необхідний продукт (75%) в аналітично чистій формі, m/z 413.5 [М+Н]+ (Rt=4.27хв) Приклад 1: Паралельний синтез із 9-трифлат2-морфолін-4-іл-піридо[2,1-а]піримідин-4-ону (17) Придатну борвмісну кислоту (0.395ммоль) і карбонат калію (109.3мг; 0.7914ммоль) поміщали в пробірку, що обертається. Колбу вакуумували та продували аргоном. Цю операцію виконували 3 рази. У пробірці Шленка, 9-трифлат-2-морфолін-4іл-піридо[2,1-а]піримідин-4-он (17) (100мг; 0.2638ммоль; на пробірку, що обертається) розчиняли в діоксані (2мл; на пробірку, що обертається). Аргон барботували в розчин, який диспергували за допомогою ультразвуку протягом 15 хвилин. В іншій пробірці Шленка, теракіс-(трифенілфосфін)паладій (15.2мг; 0.013ммоль; на пробірку, що обертається) розчиняли в діоксані (2мл; на пробірку, що обертається). Аргон барботували в розчин, який обробляли ультразвуком протягом 15 хвилин. 2мл кожного розчину змішували разом в пробірці, що обертається, перемішували та нагрівали при 95°С протягом 48 годин. Після охолодження, розчин фільтрували через твердофазову екстракційну колону Radleys Discovery Technologie, яка містить 500мг діоксиду кремнію, який поміщали на паралельну систему очищення. Колонку промивали етилацетатом (20мл), і збирали у вигляді Фази 1. Потім колонку промивали дихлорметаном/метанолом (85:15) (20мл) і збирали у вигляді Фази 2. Обидві фази контролювалися на вміст продукту за допомогою РХ/МС. У деяких випадках, фаза 2 містила тільки домішки, в інших випадках обидві фази поєднували та випаровували. Залежно від продукту, очищення виконували способом ВЕРХ або способом випарної хроматографії. 57 90716 58 розчин, який обробляли ультразвуком протягом 15 хвилин. В іншій пробірці Шленка, теракіс(трифенілфосфін)-паладій (18.7мг; 0.016ммоль; на пробірку, що обертається) розчиняли в діоксані (2мл; на пробірку, що обертається). Аргон барботували в розчин, який обробляли ультразвуком протягом 15 хвилин. 2мл кожного розчину змішували разом в пробірці, що обертається, перемішували та нагрівали при 95°С протягом 48 годин. Після охолодження, розчин фільтрували через твердофазову екстракційну колону Radleys Discovery Technologie, яка містить 500мг діоксиду кремнію, який поміщали на паралельну систему очищення. Колонку промивали етилацетатом Результати ЯМР (20мл), і збирали у вигляді Фази 1. Потім колонку 34а: 1H ЯМР, (CDCl3, 300MГц), (ppm): 3.36 промивали дихлорметаном/метанолом (85:15) (4H, m, N-СН2-морфолін); 3.56 (4H, m, О-СН2(20мл) і збирали у вигляді Фази 2. Обидві фази морфолін); 5.64 (1Н, s, CH-3); 7.01 (1H, t, JH6контролювали на вміст продукту за допомогою РХ/МС. У деяких випадках, фаза 2 містила тільки H7=7Гц, Harom-7); 7.45-7.49 (2H, m); 7.56-7.57 (2Н, m); 7.79-7.82 (1Н, m); 7.86-7.89 (1Н, dd); 8.19-8.23 домішки, в інших випадках обидві фази поєднува(2H, m); 9.04 (1H, dd). ли та випаровували. Залежно від продукту, очи13 щення виконували способом ВЕРХ або способом С-ЯМР, (CDCl3, 300MГц), (ppm): 44.83 (CH2випарної хроматографії. N-морфолін); 66.84 (СН-О-морфолін); 81.37 (СН3); 112.47 (СН-7); 121.69; 122.10; 122.92; 124.62; 124.85; 127.39; 128.27; 128.91; 132.41; 134.77; 135.88; 136.36; 137.54; 139.60; 140.13; 148.84; 159.38 (Cq); 160.54 (С=О). 34b: 1H ЯМР, (CDCl3, 300MГц), (ppm): 3.35 (4H, t, N-СН2-морфолін); 3.54 (4H, t, О-СН2морфолін); 5.66 (1Н, s, СН-3); 7.08 (1Н, t, JH6Harom-7); 7.38-7.51 (4H, m, HaromH7=7Гц, дибензофуран); 7.67 (1H, dd, JH7-H8=7.6Гц, JH6H8=1.3Гц, Harom-8); 7.94 (1H, dd, J=7Гц, J=1.6Гц, Harom-дибензофуран); 8.01-8.05 (2H, m, Haromдибензофуран); 9.06 (1H, dd, JH6-H7=7Гц, JH6H8=1.3Гц, Harom-6). 1З С-ЯМР, (CDCl3, 300MГц), (ppm): 44.80 (CH2N-морфолін); 66.80 (CH-O-морфолін); 81.37 (CHРезультати ЯМР 3); 111.98; 112.65, 121.14, 121.75, 122.76; 123.31; 35а: 1H ЯМР, (CDCl3. 300MГц), (ppm): 2.93 124.38; 124.89; 127.80; 128.03; 129.28; 131.42; (4H, t, J=5Гц, CH2-N морфолін), 3.57 (4H, t, J=5Гц, 138.06; 156.30; 159.48; 160.69. СН2-O морфолін), 5.67 (1Н, s, H-3), 7.34 (t, 1Н, 21c: 1H ЯМР, (CDCl3, 300MГц), (ppm): 3.42 J=8Гц, Harom), 7.42-7.74 (m, 8H, Harom), 8.15-8.23 (m, (4H, m, N-СН2-морфолін); 3.56 (4H, m, О-СН22H, Harom), 8.33 (d, 1H, J=8Гц, Harom) морфолін); 5.40 (1H, s, CH-3); 6.87 (1H, t, JH613 С-ЯМР, (CDCl3, 300MГц), (ppm): 46.94 (CH2H7=7Гц, Harom-7); 7.26-7.83 (10Н, m, Harom-біфеніл та N Морфолін), 66.22 (СН2-O Морфолін), 93.44 (СНHarom-8); 8.87 (1H, dd, JH6-H7=7.1Гц, JH6-H8=1.6Гц, 3), 122.38 (СН), 122.46 (СН), 123.30 (СН), 123.43 Harom-6). (СН), 124.62 (СН), 125.29 (СН), 125.80 (СН), 126.86 Приклад 2: паралельний синтез із 8-бром-2(СН), 127.69 (СН), 127.93 (СН), 131.22 (СН), 132.56 морфолін-4-іл-1Н-хінолін-4-ону (21) (СН), 135.60 (СН), 135.81 (СН), 137.41 (СН), 139.75 (СН), 140.74 (СН), 154.24 (С4=О), 178.86 (С2) 35b: 1H ЯМР, (CDCl3, 300MГц), (ppm): 2.93 (4H, s, N-СН2-морфолін); 3.50 (4H, s, О-СН2морфолін); 5.69 (1Н, s, CH-3); 7.19-7.45 (6H, m, Harom-дибензофуран та Harom-7); 7.64 (1H, s, Harom8); 7.95 (3H, m, Harom-дибензофуран); 8.30 (1H, s, Harom-6), 13 С-ЯМР, (CDCl3, 300MГц), (ppm): 46.87 (CH2Придатну борвмісну кислоту (0.486ммоль) і N-морфолін); 66.27 (CH-O-морфолін); 92.17 (CHкарбонат калію (269.2мг; 1.946ммоль) поміщали у 3); 112.10; 121.44; 121.80; 123.43; 123.92; 124.42; пробірку, що обертається. Колбу вакуумували та 125.82; 126.67; 128.49; 129.11; 133.84; 136.04; продували аргоном. Цю операцію виконували 3 153.32; 154.44; 156.31; 178.93. рази. У пробірці Шленка, 8-бром-2-морфолін-4-ілПриклад 3: Синтез 2-аміно-N-[4-(2-морфолін-41Н-хінолін-4-он (21) (100мг; 0.324ммоль; на пробііл-4-оксо-4Н-піридо[2,1-а]піримідин-9-іл)рку, що обертається) розчиняли в діоксані (2мл; на дибензотіофен-1-іл]-ацетамідів (36) пробірку, що обертається). Аргон барботували в 59 90716 60 давали триетиламін (109.3мкл; 0.784ммоль) і хлорацетилхлорид (31.03мкл; 0.392ммоль) і реакційну суміш перемішували при кімнатній температурі протягом 4 годин. Аліквоти (0.5мл) продукту реакції додавали в кожну з 9 пробірок, які містять різний амін (3ек.), що розміщені у парниковій робочій установці. Реакційні суміші перемішували паралельно при кімнатній температурі протягом 18 годин. Кожну пробірку розбавляли мінімальною кількістю метанолу (макс. 1.5мл) і переносили в склянку РХ/МС. Всі склянки для РХ/МС піддавали контролю якості та напівпрепаративної ВЕРХ із метою У кругл од онній колбі 9-(1-аміноочищення. дибензотіофен-4-іл)-2-морфолін-4-іл-піридо[2,1а]піримідин-4-он (9) (152.7мг; 0.356ммоль) розчиняли в сухому DMA (4.5мл). До цього розчину до Приклад 4: Синтез 3-аміно-N-[4-(2-морфолін-4-іл-4-оксо-4Н-піридо[2,1-а]піримідин-9-іл)-дибензотіофен1-іл]-пропіонамідів (37)
ДивитисяДодаткова інформація
Назва патенту англійськоюDna-pk inhibitors
Автори англійськоюSmith Graeme Cameron Murray, Martin Niall Morrison Barr, Hummersone Marc Geoffrey, Menear Keith Allan, Cockcroft Xiao-Ling Fan, Frigerio Mark, Griffin Roger John, Golding Bernard Thomas, Hardcastle Ian Robert, Newell David Richard, Calvert Hilary Alan, Curtin Nicola Jane, Saravanan Kappusamy, Desage-El Murr Marine
Назва патенту російськоюИнгибиторы днк-протеинкиназы
Автори російськоюСмит Грейм Камерон Марри, Мартин Нилл Моррисон Барр, Хаммерсон Марк Джеффри, Минер Кейт Аллан, Кокрофт Сяо-Лин Фань, Фриджерио Марк, Гриффин Роджер Джон, Голдинг Бернард Томас, Хардкасл Иан Роберт, Ньюэлл Девид Ричард, Калверт Хилари Алан, Кертин Никола Джейн, Сараванан Каппусами, Дезаж-Эль Мурр Марин
МПК / Мітки
МПК: A61K 31/517, C07D 409/12, A61P 35/00, A61K 31/353, C07D 405/04, C07D 407/04, C07D 409/04, A61K 31/4709, C07D 471/04, C07D 407/12
Мітки: інгібітори, днк-протеїнкінази
Код посилання
<a href="https://ua.patents.su/37-90716-ingibitori-dnk-protenkinazi.html" target="_blank" rel="follow" title="База патентів України">Інгібітори днк-протеїнкінази</a>
Попередній патент: Блістерна упаковка
Наступний патент: Спосіб виробництва багатошарової скляної панелі (варіанти)
Випадковий патент: Спосіб ферментного синтезу (7s)-1-(3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл)-n-метилметанаміну та використання в синтезі івабрадину та його солей