Інгібітори дії akt
Номер патенту: 93296
Опубліковано: 25.01.2011
Автори: САНДЕРСОН Філіп Е., Лейтон Марк Е., Келлі Майкл Дж., ІІІ
Формула / Реферат
1. Сполука формули С:
 ,
,
в якій
а є 0 або 1; b є 0 або 1; m дорівнює 0, 1 або 2; р дорівнює 0, 1 або 2;
пунктирна лінія означає необов'язковий подвійний зв'язок;
R2 незалежно вибирають з (С1-С6)алкілу, (С1-С6)алкокси, СО2Н, галогену, ОН і NH2;
кільце Y являє собою (С4-С7)циклоалкіл;
R1 вибирають з Н, оксо, (С=О)aОb(С1-С10)алкілу, (С=О)аОb-арилу, (C=O)aОb(С2-С10)алкенілу, (С=O)aОb(С2-С10)алкінілу, СО2Н, галогену, ОН, Оb(С1-С6)перфторалкілу, (C=O)aNR7R8, CN, (С=О)aОb(С3-С8)циклоалкілу, S(O)mNR7R8, SH, S(О)m-(С1-С10)алкілу і (C=O)aОb-гетероциклілу, при цьому вказані алкіл, арил, алкеніл, алкініл, циклоалкіл і гетероцикліл необов'язково заміщені одним або більше замісниками, що вибираються з R6;
R6 являє собою (С=O)aОbС1-С10алкіл, (С=О)aОbарил, С2-С10алкеніл, С2-С10алкініл, (С=О)aОbгетероцикліл, СО2Н, галоген, CN, ОН, ОbС1-С6перфторалкіл, Oa(C=O)bNR7R8, оксо, СНО, (N=O)R7R8, S(O)mNR7R8, SH, S(О)m-(C1-С10)алкіл або (С=О)aОbС3-С8циклоалкіл, при цьому вказані алкіл, арил, алкеніл, алкініл, гетероцикліл і циклоалкіл необов'язково заміщені одним або більше замісниками, що вибираються з R6a;
R6a вибирають з (С=О)aОb(С1-С10)алкілу, Оa(С1-С3)перфторалкілу, (С0-C6)aлкiлeн-S(O)mRa, SH, оксо, ОН, галогену, CN, (С2-С10)алкенілу, (С2-С10)алкінілу, (С3-С6)циклоалкілу, (С0-С6)алкіленарилу, (С0-С6)алкіленгетероциклілу, (С0-С6)алкілен-N(Rb)2, C(O)Ra, (C0-C6)aлкiлeн-CO2Ra, С(О)Н і (С0-С6)алкілен-СО2Н, при цьому вказані алкіл, алкеніл, алкініл, циклоалкіл, арил і гетероцикліл необов'язково мають до трьох замісників, що вибираються з Rb, ОН, (С1-С6)алкокси, галогену, СО2Н, CN, Oa(C=O)b(C1-С6)алкілу, оксо і N(Rb)2;
R7 і R8 незалежно вибирають з Н, (С=О)aОb(С1-С10)алкілу, (С=О)aОb(С3-С8)циклоалкілу, (С=О)aОb-арилу, (С=О)aОb-гетероциклілу, (С2-С10)алкенілу, (С2-С10)алкінілу, SH, SO2Ra і (C=O)aNRb2, і вказані алкіл, циклоалкіл, арил, гетероцикліл, алкеніл і алкініл необов'язково заміщені одним або більше замісниками, що вибираються з R6a, або можлива присутність R7 і R8 разом з азотом, з яким вони з'єднуються, у вигляді моноциклічного або біциклічного гетероциклу з 3-7 членами в кожному кільці і необов'язково містять, в доповнення до азоту, один або два додаткових гетероатоми, вибираних з N, О і S, при цьому вказаний моноциклічний або біциклічний гетероцикл необов'язково заміняють одним або більше замісниками, що вибираються з R6a;
Ra являє собою (С1-С6)алкіл, (С3-С6)циклоалкіл, арил або гетероцикліл; і
Rb незалежно являє собою Н або (С1-С6)алкіл;
або її фармацевтично прийнятна сіль, таутомер або стереоізомер.
2. Сполука формули Е:
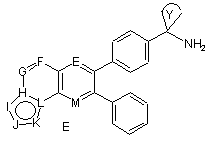 ,
,
в якій
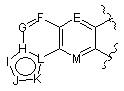
являє собою
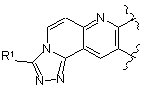 або
або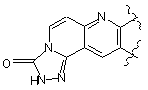 ,
,
кільце Y є циклобутилом;
R1 являє собою Н, піримідил, метилімідазол, ОН, метил або циклопропіл;
або її фармацевтично прийнятна сіль.
3. Сполука за п. 2, яка являє собою
1-{4-[3-(1-метил-1Н-імідазол-4-іл)-9-феніл[1,2,4]триазоло[3,4-f]-1,6-нафтиридин-8-іл]феніл}циклобутанаміну дигідрохлорид;
або її фармацевтично прийнятна сіль.
4. Сполука за п. 2, яка являє собою
трет-бутил{1-[4-(9-феніл[1,2,4]триазоло[3,4-f]-1,6-нафтиридин-8-іл)феніл]циклобутил}-карбамат;
або її фармацевтично прийнятна сіль.
5. Сполука за п. 2, яка являє собою
1-[4-(9-феніл-3-піримідин-2-іл[1,2,4]триазоло[3,4-f]-1,6-нафтиридин-8-іл)феніл]-циклобутанамін;
або її фармацевтично прийнятна сіль.
6. Сполука, що являє собою
8-[4-(1-аміноциклобутил)феніл]-9-феніл[1,2,4]триазоло[3,4-f]-1,6-нафтиридин-3(2Н)-он;
або її фармацевтично прийнятна сіль.
7. Сполука за п. 2, яка являє собою
1-[4-(3-метил-9-феніл[1,2,4]триазоло[3,4-f]-1,6-нафтиридин-8-іл)феніл]циклобутанамін;
або її фармацевтично прийнятна сіль.
8. Сполука за п. 2, що являє собою
1-[4-(3-циклопропіл-9-феніл[1,2,4]триазоло[3,4-f]-1,6-нафтиридин-8-іл)феніл]-циклобутанамін;
або її фармацевтично прийнятна сіль.
9. Фармацевтична композиція, що містить фармацевтичний носій і дисперговану в ній терапевтично ефективну кількість сполуки за п. 1.
10. Застосування сполуки за п. 1 для приготування лікарського засобу, призначеного для лікування і попередження раку у ссавця, що потребує такого лікування.
Текст
1. Сполука формули С: 2 (19) 1 3 93296 (С2-С10)алкінілу, SH, SO2Ra і (C=O)aNRb2, і вказані алкіл, циклоалкіл, арил, гетероцикліл, алкеніл і алкініл необов'язково заміщені одним або більше замісниками, що вибираються з R6a, або можлива 7 8 присутність R і R разом з азотом, з яким вони з'єднуються, у вигляді моноциклічного або біциклічного гетероциклу з 3-7 членами в кожному кільці і необов'язково містять, в доповнення до азоту, один або два додаткових гетероатоми, вибираних з N, О і S, при цьому вказаний моноциклічний або біциклічний гетероцикл необов'язково заміняють одним або більше замісниками, що вибираються з R6a; Ra являє собою (С1-С6)алкіл, (С3-С6)циклоалкіл, арил або гетероцикліл; і Rb незалежно являє собою Н або (С1-С6)алкіл; або її фармацевтично прийнятна сіль, таутомер або стереоізомер. 2. Сполука формули Е: Y NH2 G H I F L K J E M E , в якій G H I J F E L M K являє собою N N R1 N N 4 кільце Y є циклобутилом; R1 являє собою Н, піримідил, метилімідазол, ОН, метил або циклопропіл; або її фармацевтично прийнятна сіль. 3. Сполука за п. 2, яка являє собою 1-{4-[3-(1-метил-1Н-імідазол-4-іл)-9феніл[1,2,4]триазоло[3,4-f]-1,6-нафтиридин-8іл]феніл}циклобутанаміну дигідрохлорид; або її фармацевтично прийнятна сіль. 4. Сполука за п. 2, яка являє собою трет-бутил{1-[4-(9-феніл[1,2,4]триазоло[3,4-f]-1,6нафтиридин-8-іл)феніл]циклобутил}-карбамат; або її фармацевтично прийнятна сіль. 5. Сполука за п. 2, яка являє собою 1-[4-(9-феніл-3-піримідин-2-іл[1,2,4]триазоло[3,4-f]1,6-нафтиридин-8-іл)феніл]-циклобутанамін; або її фармацевтично прийнятна сіль. 6. Сполука, що являє собою 8-[4-(1-аміноциклобутил)феніл]-9феніл[1,2,4]триазоло[3,4-f]-1,6-нафтиридин-3(2Н)он; або її фармацевтично прийнятна сіль. 7. Сполука за п. 2, яка являє собою 1-[4-(3-метил-9-феніл[1,2,4]триазоло[3,4-f]-1,6нафтиридин-8-іл)феніл]циклобутанамін; або її фармацевтично прийнятна сіль. 8. Сполука за п. 2, що являє собою 1-[4-(3-циклопропіл-9-феніл[1,2,4]триазоло[3,4-f]1,6-нафтиридин-8-іл)феніл]-циклобутанамін; або її фармацевтично прийнятна сіль. 9. Фармацевтична композиція, що містить фармацевтичний носій і дисперговану в ній терапевтично ефективну кількість сполуки за п. 1. 10. Застосування сполуки за п. 1 для приготування лікарського засобу, призначеного для лікування і попередження раку у ссавця, що потребує такого лікування. O N N або HN N , Даний винахід стосується заміщених сполук нафтиридину, які є інгібіторами дії однієї або більше ізоформ серин/треонін кінази, Akt (також званої РКВ; далі в даному винаході званої "Akt"). Даний винахід також стосується фармацевтичних композицій, що містять такі сполуки, і способів застосування запропонованих сполук при лікуванні раку. Апоптоз (запрограмована смерть клітини) грає значну роль в ембріональному розвитку і патогенезі різних захворювань, такому як дегенеративні захворювання нервової системи, серцево-судинні захворювання і рак. Результатом роботи останніх років стала ідентифікація ряду про- і антіапоптозних генних продуктів, залучених до регуляції або здійснення запрограмованої смерті клітини. Експресія антиапоптозних генів, таких як Всl2 або BclxL, інгібує апоптозну смерть клітини, викликану різними стимулами. З іншого боку, експресія проапоптозних генів, таких як Вах або Bad, призводить до запрограмованої смерті клітини (Adams et al. Science, 281: 1322-1326 (1998)). Здійснення запрограмованої смерті клітини опосередковується каспаза-1-зв'язаними протеїназами, що включають каспазу-3, каспазу-7, каспазу-8 і каспазу-9 і т.д. (Thornberry et al. Science, 281: 1312-1316 (1998)). Виявлено, що шляхи фосфатидилінозитол-3'ОН кінази (PI3K)/Akt мають велике значення для регуляції клітинної смерті/виживання клітини (Kulik et al. МоІ. Cell. Biol. 17: 1595-1606 (1997); Franke et al. Cell, 88: 435-437 (1997); Kauffmann-Zeh et al. Nature 385: 544-548 (1997) Hemmings Science, 275: 628-630 (1997); Dudek et al., Science, 275: 661-665 (1997)). Фактори виживаності, такі як фактор росту тромбоцитів (ФРТ), фактор росту нерва (ФРН) і інсуліноподібний фактор росту-1 (ІФР-1), сприяють виживаності клітини в різних умовах шляхом індукції дії РІ3К (Kulik et al. 1997, Hemmings 1997). Активація РІ3К призводить до продукції фосфатидилінозитол(3,4,5)-трифосфату (Ptdlns (3,4,5)-P3), який в свою чергу зв'язується з серин/треонін кіназою Akt, що містить плекстрин-гомологічний домен (ПГ), і сприяє її активації (Franke et al. Cell, 81: 727736 (1995); Hemmings Science, 277: 534 (1997); Downward, Curr. Opin. Cell Biol. 10: 262-267 (1998), Alessi et al., EMBO J. 15: 6541-6551 (1996)). Специфічні інгібітори РІ3К, або домінантні негативні 5 мутанти Akt усувають дію стимуляції виживаності у цих факторів росту або цитокінів. Раніше було розкрито, що інгібітори РІ3К (LY294002 або вортманін) блокують активацію Akt за допомогою upstream-кіназ. Додатково, введення конститутивно активних мутантів РІ3К або Akt сприяє виживанню клітини в умовах, при якихзазвичай відбувається апоптозна смерть клітини (Kulik et al. 1997, Dudek et al. 1997). Були ідентифіковані три члени субсімейства Akt, регульованих вторинним месенджером серин/треонін протеїнкіназ, що називаються Akt1/PKBa, Akt2/PKBp і Akt3/PKBy (далі в даному винаході званих "Akt1", "Akt2" і "Akt3"), відповідно, вказані ізоформі є гомологічними, зокрема, в областях, які кодують каталітичну домени. Ізоформі Akt активуються за допомогою процесів фосфорилування, що відбуваються у відповідь на сигнали РІ3К. РІ3К фосфорилують мембранні інозитолфосфоліпіди, утворюючи вторинні месенджери фосфатидил-інозитол 3,4,5-трисфосфату і фосфатидилінозитол 3,4-бісфосфату, які зв'язуються з ПГдоменом Akt. Модель активації Akt, що розглядається, передбачає рекрутинг ферменту за допомогою 3'-фосфорилованих фосфоінозитидів до мембрани, де відбувається фосфорилування регуляторних сайтів Akt upstream-кіназами (В.А. Hemmings, Science 275: 628-630 (1997); В.А. Hemmings, Science 276: 534 (1997); J. Downward, Science 279: 673-674 (1998)). Фосфорилування Akt1 відбувається на двох регуляторних сайтах, а саме, на Thr308 в каталітичному домені петлі активації і на Ser473 поблизу карбоксильного кінця (D.R. Alessi et al. EMBO J. 15: 6541-6551 (1996) and R. Meier et al. J. Biol. Chem. 272: 30491-30497 (1997)). Такі ж регуляторні сайта фосфорилування зустрічаються в Akt2 i Akt3. Проводилося клонування upstream-кінази, що фосфорилує Akt на сайті петлі активації, яка була названа 3'-фосфоінозитидзалежною протеїнкіназою 1 (PDK1). PDK1 фосфорилує не тільки Akt, але також р70 рибосомальну S6 кіназу, p90RSK, сироваткову і глюкокортикоїд-регульовану кінази (SGK) і протеїнкіназу С. До теперішнього часу не ідентифікована upstream-кіназа, що фософрилує регуляторний сайт Akt поблизу карбоксильного кінця, але останні повідомлення вказують на роль інтегринзв'язаної кінази (ILK-1), серин/треонін протеїнкінази або аутофосфорилування. Аналіз рівнів Akt в людських пухлинах показав надекспресію Akt2 в значній кількості випадків раку яєчника (J.Q. Cheng et al. Proc. Natl. Acad. Sci. U.S.A. 89: 9267-9271 (1992)) і раку підшлункової залози (J.Q. Cheng et al. Proc. Natl. Acad. Sci. U.S.A. 93: 3636-3641 (1996)). Аналогічно, була виявлена надекспресія Akt3 в клітинних лініях ракових клітин при раці молочної залози і простати (Nakatani et al. J. Biol. Chem. 274: 21528-21532 (1999). Пухлинний супресор PTEN, що являє собою білкову і ліпідну фосфатазу, яка специфічно видаляє 3'фосфат з Ptdlns (3,4,5)-P3, є негативним регулятором шляху РІ3К/Akt (Li et al. Science 275: 1943-1947 (1997), Stambolic et al. Cell 95: 29-39 (1998), Sun et al. Proc. Natl. Acad. Sci. U.S.A. 96: 93296 6 6199-6204 (1999)). Мутації в зародковій лінії PTEN відповідають за прояв синдромів раку у людини, таких як хвороба Коудена (Liaw et al. Nature Genetics 16: 64-67 (1997)). Делецію PTEN виявляють в більшості людських пухлин і пухлинних клітинних лініях, при цьому функціонально PTEN не показує підвищення рівня активованого Akt (Li et al. supra, Guldberg et al. Cancer Research 57: 36603663 (1997), Risinger et al. Cancer Research 57: 4736-4738 (1997)). Ці спостереження показують, що шлях РІ3К/Akt грає важливу роль в регуляції виживаності або апоптозу клітини при онкогенезі. Можна досягнути інгібування активації і дії Akt шляхом інгібування РІ3К інгібіторами, такими як LY294002 і вортманіном. Разом з тим, інгібування РІ3К здатне впливати на всі без виключення три ізозими Akt, а також інші сигнальні молекули, що містять ПГ-домени, які залежать від Pdtlns (3,4,5)P3, такі як Тес-сімейство тирозинкіназ. Крім того, було розкрито, що Akt можна активувати сигналами росту, які не залежать від РІ3К. Альтернативно, дію Akt можна інгібувати шляхом блокування дії upstream-кінази PDK1. Не існує розкритих специфічних інгібіторів PDK1. У цьому випадку інгібування PDK1 також буде призводити до інгібування множинних протеїнкіназ, активність яких залежить від PDK1, таких як атипічні ізоформі РКС, SGK і S6 кінази (Williams et al. Curr. Biol. 10: 439-448 (2000). Сполуки винаходу, що розглядається, мають несподівані вигідні властивості в порівнянні із сполуками циклопропілзаміщеного нафтиридину, детально описаними в патенті WO 2006/135627. Завдання, на рішення якого направлений даний винахід, полягає в забезпеченні нових сполук, які являють собою інгібітори Akt. Іншим завданням даного винаходу є розробка фармацевтичних композицій, які містять нові сполуки, що являють собою інгібітори Akt. Ще одним завданням даного винаходу є спосіб лікування раку, який містить введення вказаних інгібіторів дії Akt. Даний винахід забезпечує сполуки заміщеного нафтиридину, які інгібують дію Akt. Зокрема, розкриті в даному винаході сполуки селективно інгібують одну або дві ізоформі Akt. Даний винахід також забезпечує композиції, що містять такі інгібувальні сполуки і способи інгібування дії Akt шляхом введення сполуки хворому, що потребує лікування раку. Сполуки даного винаходу корисні для інгібування дії серин/треонін кінази Akt. У варіанті здійснення інгібітори винаходу, що розглядається, являють собою сполуки формули С: 7 в якій а є 0 або 1; b є 0 або 1; m дорівнює 0, 1 або 2; ρ дорівнює 0, 1 або 2; R2 незалежно вибирають з (С1-С6)алкілу, (С1С6)алкокси, СО2Н, галогену, ОН і ΝΗ2; кільце Υ являє собою (С4-С7)циклоалкіл; R1 вибирають з Н, оксо, (С=О)аОb(С1С10)алкілу, (С=О)аОb-арилу, (С=О)аОb(С2С10)алкенілу, (С=О)аОb(С2-С10)алкінілу, СО2Н, галогену, ОН, Оb(С1-С6)перфторалкілу, (C=O)aNR7R8, CN, (С=О)аОb(С3-С8)циклоалкілу, S(O)mNR7R8, SH, S(O)m-(С1-С10)алкілу і (С=О)аОb-гетероциклілу, при цьому вказані алкіл, арил, алкеніл, алкініл, циклоалкіл і гетероцикліл необов'язково заміняються одним або більше замісниками, що вибираються з R6; R6 являє собою (С=О)аОbС1-С10алкіл, (С=О)аОbарил, С2-С10алкеніл, С2-С10алкініл, (С=О)аОbгетероцикліл, СО2Н, галоген, CN, ОН, ОbС1-С6перфторалкіл, Oa(C=O)bNR7R8, оксо, СНО, (N=O)R7R8, S(O)mNR7R8, SH, S(О)m-(С1-С10)алкіл або (С=О)аОbС3-С8циклоалкіл, при цьому вказані алкіл, арил, алкеніл, алкініл, гетероцикліл і циклоалкіл необов'язково заміняються одним або більше замісниками, що вибираються з R6a; R6a вибирають з (С=О)аОb(С1-С10)алкілу, Оа(С1С3)перфторалкілу, (С0-С6)алкілен-S(О)mRа, SH, оксо, ОН, галогену, CN, (С2-С10)алкенілу, (С2С10)алкінілу, (С3-С6)циклоалкілу, (С0-С6)алкіленарилу, (С0-С6)алкілен-гетероциклілу, (C0C6)aлкiлeн-N(Rb)2, C(O)Ra, (С0-С6)алкілен-СО2Rа, С(О)Н і (С0-С6)алкілен-СО2Н, при цьому вказані алкіл, алкеніл, алкініл, циклоалкіл, арил і гетероцикліл необов'язково замінюються трьома замісниками, що вибираються з Rb, ОН, (С1-С6)алкокси, галогену, СО2Н, CN, Оа(С=О)b(С1-С6)алкілу, оксо і N(Rb)2; R7 і R8 незалежно вибирають з Н, (С=О)аОb(С1С10)алкілу, (С=О)аОb(С3-С8)циклоалкілу, (С=О)аОbарилу, (С=О)аОb-гетероциклілу, (С2-С10)алкенілу, a b (С2-С10)алкінілу, SH, SO2R і (C=O)aNR 2, при цьому вказані алкіл, циклоалкіл, арил, гетероцикліл, алкеніл і алкініл необов'язково заміняються одним або більше замісниками, що вибираються з R6a, або можлива присутність R7 і R8 разом з азотом, з яким вони сполучаються у вигляді моноциклічного або біциклічного гетероциклу з 3-7 членами в кожному кільці і необов'язково містять, в доповнення до азоту, один або два додаткових гетероатоми, вибираних з Ν, Ο і S, при цьому вказаний моноциклічний або біциклічний гетероцикл необов'язково заміняють одним або більше замісниками, що вибираються з R6a; Ra являє собою (С1-С6)алкіл, (С3С6)циклоалкіл, арил, або гетероцикліл; і Rb незалежно являє собою Н, (С1-С6)алкіл, арил, гетероцикліл, (С3-С6)циклоалкіл, (С=О)аОb(С1-С6)алкіл або S(O)mRa; або їх фармацевтично прийнятні солі або стереоізомери. В іншому варіанті здійснення даного винаходу інгібітори дії Akt представлені сполуками формули Е: 93296 8 в якій являє собою або кільце Υ є циклобутилом; R1 являє собою Н, піримідил, метилімідазол, ОН, метил або циклопропіл; або їх фармацевтично прийнятними солями. Сполукою винаходу, що розглядається, є 1-{4-[3-(1-метил-1H-імідазол-4-іл)-9феніл[1,2,4]триазоло[3,4-f]-1,6-нафтиридин-8іл]феніл}циклобутанаміну дигідрохлорид (1-9); або її фармацевтично прийнятна сіль. Сполукою винаходу, що розглядається, є трет-бутил {1-[4-(9-феніл[1,2,4]триазоло[3,4-f]1,6-нафтиридин-8іл)феніл]циклобутил}карбамат(1-15); або її фармацевтично прийнятна сіль. Сполукою винаходу, що розглядається, є 1-[4-(9-феніл-3-піримідин-2іл[1,2,4]триазоло[3,4-f]-1,6-нафтиридин-8іл)феніл]циклобутанамін (1-10); або її фармацевтично прийнятна сіль. Сполукою винаходу, що розглядається, є 8-[4-(1-аміноциклобутил)феніл]-9феніл[1,2,4]триазоло[3,4-f]-1,6-нафтиридин-3(2Н)ОН (1-16); або її фармацевтично прийнятна сіль. Сполукою винаходу, що розглядається, є 1-[4-(3-метил-9-феніл [1,2,4]триазоло[3,4-f]-1,6нафтиридин-8-іл)феніл]циклобутанамін (1-17); або її фармацевтично прийнятна сіль. Сполукою винаходу, що розглядається, є 1-[4-(3-циклопропіл-9-феніл[1,2,4]триазоло[3,4f]-1,6-нафтиридин-8-іл)феніл]циклобутанамін (123); або її фармацевтично прийнятна сіль. Сполуки даного винаходу можуть мати асиметричні центри, хіральні осі і хіральні площини (як описано в E.L. Eliel and S.H. Wilen, Stereochemistry of Carbon Compounds, John Wiley & Sons, New York, 1994, з. 1119-1190)), і зустрічатися у вигляді рацематів, рацемічних сумішей і у вигляді окремих діастереомерів, з всіма можливими своїми ізомерами і сумішами, що включають оптичні ізомери, і всі з перерахованих стереоізомерів входять в обсяг даного винаходу. Додатково, розкриті в даному винаході сполуки можуть існувати в формі таутомерів, і передбачається, що обидві таутомерні формі входять в обсяг даного винаходу навіть в тому випадку, якщо наведене зображення тільки однієї таутомерної структури. Наприклад: 9 Тетразоли існують у вигляді суміші 1Н/2Н таутомерів. Таутомерні формі тетразольних груп також входять в обсяг винаходу, що розглядається. Також передбачається, що даний винахід охоплює проліки сполук, що розкриваються в ньому. Проліки будь-якої з вказаних сполук можна виготовляти, використовуючи загальновідомі фармакологічні технології. Якщо будь-яка із змінних (наприклад, R і т.д.) зустрічається частіше за один раз в будь-якому елементі, її визначення в кожному випадку є незалежним від інших випадків. Разом з тим, комбінації замісників і змінних допустимі тільки у випадку, якщо такі комбінації створюють стійкі сполуки. Лінії, зображені всередині кільцевих систем замісників, означають, що вказаний зв'язок можна приєднати до будь-якого з атомів кільця, що заміняються. Якщо кільцева система є біциклічною, передбачається, що вказаний зв'язок приєднується до будь-якого з відповідних атомів на будь-якому кільці біциклічної групи. Розуміється, що в сполуки винаходу, що розглядається, фахівець в даній галузі техніки може включати один або більше атомів кремнію (Si) замість одного або більше атомів вуглецю, для одержання сполук, що є хімічно стійкими, які можна легко синтезувати способами, відомими в даній галузі техніки із загальнодоступних вихідних матеріалів. Вуглець і кремній відрізняються за їх ковалентним радіусом, що призводить до відмінностей в довжині хімічного зв'язку і стеричної структури при порівнянні аналогічних зв'язків С-елемента і Si-елемента. Ці відмінності призводять до ледве помітних змін розміру і формі кремнійвмісних сполук в порівнянні з вуглецьвмісними сполуками. Фахівцеві в даній галузі техніки відомо, що відмінності в розмірі і формі можуть призводити до ледве помітних або значних змін ефективності, розчинності, пакувальних властивостей, до відсутності активності в мішені і так далі. (Diass, J.O. et al. Organometallics (2006) 5: 1188-1198; Showell, G.A. et al. Bioorganic & Medicinal Chemistry Letters (2006) 16: 2555-2558). Розуміється, що рядовий фахівець в даній галузі техніки може вибирати замісники і заміняючі структури в сполуках винаходу, що розглядається, щоб одержувати хімічно стійкі сполуки, які можна 93296 10 легко синтезувати способами, відомими в даній галузі техніки, а також способами, сформульованими нижче, із загальнодоступних вихідних матеріалів. Якщо замісник сам по собі заміняється більше ніж однією групою, розуміється, що ці множинні групи можуть розташовуватися на одному і тому ж атомі вуглецю або на іншому атомі вуглецю за умови одержання стійкої структури. Вираз "необов'язково заміщений одним або більше замісниками" повинен вважатися еквівалентним виразу "необов'язково заміщений щонайменше одним замісником", і в таких випадках кількість замісників в переважному варіанті здійснення буде складати від нуля до чотирьох, і більш переважний варіант здійснення буде мати від нуля до трьох замісників. Термін "алкіл", що використовується в даному винаході, включає і розгалужені і лінійні насичені аліфатичні вуглеводневі групи, що мають певну кількість атомів вуглецю. Наприклад, визначено, що С1-С10, вказаний в "(С1-С10)алкіл", включає групи, що мають 1, 2, 3, 4, 5, 6, 7, 8, 9 або 10 атомів вуглецю в лінійній або розгалуженій структурі. Наприклад, "(С1-С10)алкіл" конкретно включає метил, етил, н-пропіл, ізопропіл, н-бутил, трет-бутил, ізобутил, пентил, гексил, гептил, октил, ноніл, децил і т.д. Термін "циклоалкіл" означає моноциклічну насичену аліфатичну вуглеводневу групу, що має певну кількість атомів вуглецю. Наприклад, "циклоалкіл" включає циклопропіл, метилциклопропіл, 2,2-диметилциклобутил, 2-етилциклопентил, циклогексил і т.д. "Алкокси" представляє або циклічну або нециклічну алкільну групу вказаної кількості атомів вуглецю, сполучених кисневим містком. Таким чином, "алкокси" тому охоплює наведені вище визначення алкілу і циклоалкілу. Якщо не вказана будь-яка кількість атомів вуглецю, термін "алкеніл" стосується неароматичного вуглеводневого радикала, прямого, розгалуженого або циклічного, що містить від 2 до 10 атомів вуглецю і щонайменше один вуглець-вуглецевий подвійний зв'язок. Переважно присутній один вуглець-вуглецевий подвійний зв'язок, і можуть бути присутнім до чотирьох неароматичних вуглецьвуглецевих подвійних зв'язків. Таким чином, "(С2 11 С10)алкеніл" означає алкенільний радикал, що має від 2 до 10 атомів вуглецю. Алкенільні групи включають етеніл, пропеніл, бутеніл, 2-метилбутеніл і циклогексеніл. Пряма, розгалужена або циклічна частина алкенільної групи може містити подвійні зв'язки і може бути заміщена, якщо вказана заміщена алкенільна група. Термін "алкініл" стосується прямого, розгалуженого або циклічного вуглеводневого радикала, що містить від 2 до 10 атомів вуглецю і щонайменше один вуглець-вуглецевий потрійний зв'язок. Можуть бути присутніми до трьох вуглецьвуглецевих потрійних зв'язків. Таким чином, "(С2С10)алкініл" означає алкінільний радикал, що має від 2 до 10 атомів вуглецю. Алкінільні групи включають етиніл, пропініл, бутиніл, 3-метилбутиніл і т.д. Пряма, розгалужена або циклічна частина алкінільної групи може містити потрійні зв'язки і може бути заміщена, якщо вказана заміщена алкінільна група. У деяких випадках можуть бути вказані замісники з кількістю атомів вуглецю в діапазоні, який включає нуль, такі як (С0-С6)алкіленарил. Якщо присутній арил є фенілом, це визначення буде включати безпосередньо феніл, а також -CH2Ph, CH2CH2Ph, CH(CH3)CH2CH(CH3)Ph, і так далі. Термін "арил", що використовується в даному винаході, означає будь-яке стійке моноциклічне або біциклічне вуглецеве кільце, що має до 7 атомів в кожному кільці, в якому щонайменше одне кільце є ароматичним. Приклади таких арильних елементів включають феніл, нафтил, тетрагідронафтил, інданіл і біфеніл. У випадках, якщо арильний замісник є біциклічним і одне кільце є неароматичним, розуміється, що приєднання відбувається за допомогою ароматичного кільця. Термін "гетероарил", що використовується в даному винаході, являє собою моноциклічне або біциклічне кільце, що має до 7 атомів в кожному кільці, в якому щонайменше одне кільце є ароматичним і містить від 1 до 4 гетероатомів, вибираних з групи, що складається з О, N і S. Гетероарильні групи в межах наведеного визначення включають, без обмеження, акридиніл, карбазоліл, цинолініл, хіноксалініл, піразоліл, індоліл, бензотриазоліл, фураніл, тієніл, бензотієніл, бензофураніл, хінолініл, ізохінолініл, оксазоліл, ізоксазоліл, індоліл, піразиніл, піридазиніл, піридиніл, піримідиніл, піроліл, тетрагідрохінолін. Як і в наведеному нижче визначенні гетероциклілу, розуміється, що "гетероарил" включає похідне N-оксиду будь-якого азотовмісного гетероарилу. Якщо гетероарильний замісник є біциклічним і одне кільце є неароматичним або не містить гетероатомів, розуміється, що приєднання відбувається за допомогою ароматичного кільця або за допомогою гетероатому, що відповідно містить кільце. Такі гетероарильні групи для Q-замісника включають, без обмеження, 2бензімідазоліл, 2-хінолініл, 3-хінолініл, 4-хінолініл, 1-ізохінолініл, 3-ізохінолініл і 4-ізохінолініл. Під терміном "гетероцикл", що використовується в даному винаході, або "гетероцикліл" розуміється ароматичний або неароматичний гетероцикл з кількістю членів від 3 до 10, що містить від 1 до 4 гетероатомів, вибираних з групи, що склада 93296 12 ється з О, N і S, і включає біциклічні групи. Таким чином, "гетероцикліл" включає вищезазначені гетероарили, а також їх дигідро- i тетрагідроаналоги. Додаткові приклади "гетероциклілу" включають, без обмеження, наступне: бензоімідазоліл, бензоімідазолоніл, бензофураніл, бензофуразаніл, бензопіразоліл, бензотриазоліл, бензотіофеніл, бензоксазоліл, карбазоліл, карболініл, цинолініл, фураніл, імідазоліл, індолініл, індоліл, індолазиніл, індазоліл, ізобензофураніл, ізоіндоліл, ізохіноліл, ізотіазоліл, ізоксазоліл, нафтпіридиніл, оксадіазоліл, оксазоліл, оксазолін, ізоксазолін, оксетаніл, піраніл, піразиніл, піразоліл, піридазиніл, піридопіридиніл, піридазиніл, піридил, піримідил, піроліл, хіназолініл, хіноліл, хіноксалініл, тетрагідропіраніл, тетразоліл, тетразолопіридил, тіадіазоліл, тіазоліл, тієніл, триазоліл, азетидиніл, 1,4-діоксаніл, гексагідроазепініл, піперазиніл, піперидиніл, піридин-2оніл, піролідиніл, морфолініл, тіоморфолініл, дигідробензоімідазоліл, дигідробензофураніл, дигідробензотіофеніл, дигідробензоксазоліл, дигідрофураніл, дигідроімідазоліл, дигідроіндоліл, дигідроізооксазоліл, дигідроізотіазоліл, дигідрооксадіазоліл, дигідрооксазоліл, дигідропіразиніл, дигідропіразоліл, дигідропіридиніл, дигідропіримідиніл, дигідропіроліл, дигідрохінолініл, дигідротетразоліл, дигідротіадіазоліл, дигідротіазоліл, дигідротієніл, дигідротриазоліл, дигідроазетидиніл, метилендіоксибензоїл, тетрагідрофураніл і тетрагідротієніл, і N-оксиди вказаних сполук. Приєднання гетероциклічного замісника може відбуватися за допомогою атома вуглецю або гетероатому. Фахівцям в даній галузі техніки буде очевидно, що термін "галоген", що використовується в даному винаході, включає хлор (СІ), фтор (F), бром (Вr) і йод (І). В одному варіанті здійснення R1 вибирають з оксо, NH2, OH, SH, Оа(С1-С6)алкілу, при цьому вказаний алкіл необов'язково заміняють R6a. В одному варіанті здійснення R незалежно вибирають з Η і (С1-С6)алкілу. В одному варіанті здійснення формули С R1 вибирають з оксо, (С=О)аОb(С1-С10)алкілу, (С=О)аОb-арила, (С=О)аОb(С2-С10)алкенілу, (С=О)аОb(С2-С10)алкінілу, СО2Н, галогену, ОН, Оb(С1-С6)перфторалкілу, (C=O)aNR7R8, CN, (C=O)аОb(С3-С8)циклоалкілу, S(O)2NR7R8, SH, S(О)2-(С1-С10)алкілу і (С=О)аОb-гетероциклілу, при цьому вказані алкіл, арил, алкеніл, алкініл, циклоалкіл і гетероцикліл необов'язково заміняють R6a. В іншому варіанті здійснення формули С R1 вибирають з оксо, (С=О)аОb(С1-С10)алкілу, СО2Н, галогену, ОН, CN, (С1-С6)алкокси, S(O)2NR7R8, SH, S(О)2-(С1-С10)алкілу і О(С=ОС1-С6)алкілу і N(Rb)2, при цьому вказаний алкіл необов'язково заміняють R6a. В іншому варіанті здійснення формули С R1 вибирають з оксо, NH2, ОН, SH, Оа(С1-С6)алкілу, при цьому вказаний алкіл необов'язково заміняють R6a. В іншому варіанті здійснення формули С R2 вибирають з оксо, (С=О)аОb(С1-С10)алкілу, СО2Н, галогену, ОН, CN, (С1-С6)алкокси, О(С=ОС1С6)алкілу, (С2-С10)алкенілу і N(Rb)2, при цьому вказаний алкіл необов'язково заміняють Rb, ОН, (С1 13 С6)алкокси, галогеном, СО2Н, CN, О(С=ОС1С6)алкілом, оксо і N(Rb)2. В іншому варіанті здійснення формули С R1 вибирають з Н, гетероциклілу, (С3-С6)циклоалкілу, ОН, (С1-С6)алкілу, NН(С1-С6)алкілу, NHгетероциклілу, NH-циклоалкілу, при цьому вказані гетероцикліл, циклоалкіл і алкіл необов'язково заміняють наступним: галогеном, (С1-С6)алкілом, (С1-С6)алкіл-NH2, ОН, О(С1-С6)алкілом і R2 вибирають з Η і галогену. В іншому варіанті здійснення формули С кільце Υ є циклобутилом; R1 вибирають з Н, гетероциклілу, (С3-С6)циклоалкілу, ОН, (С1-С6)алкілу, NH(С1-С6)алкілу, NH-гетероциклілу, NHциклоалкілу, при цьому вказані гетероцикліл, циклоалкіл і алкіл необов'язково заміняють галогеном, (С1-С6)алкілом, (С1-С6)алкіл-NН2, ОН, О(С1С6)алкілом і R2 є Η або F. В іншому варіанті здійснення формули С кільце Υ є циклобутилом; R1 являє собою Η або (С1С6)алкіл; і R2 є Η або F. В обсяг винаходу, що розглядається, включені вільні формі сполук формули С або Δ, а також їх фармацевтично прийнятні солі і стереоізомери. Деякі з виділених конкретних сполук, наведених тут як приклад, є протонованими солями сполук аміну. Термін "вільна форма" стосується сполук аміну в несольовій формі. Фармацевтично прийнятні солі, що входять в даний винахід, не тільки включають виділені солі, що наводяться як приклади для конкретних сполук, що описуються в даному винаході, але також і всі типові фармацевтично прийнятні солі вільної формі сполук формул С або Е. Можна виділяти вільну форму описаних конкретних сольових сполук, використовуючи способи, відому в даній галузі техніки. Наприклад, вільну форму можна відновлювати обробкою солі відповідним розведеним водним розчином основи, таким як розведений водний NaOH, калію карбонат, аміак і натрію бікарбонат. Вільні формі деяким чином можуть відрізнятися від своїх відповідних сольових форм за рядом фізичних властивостей, таких як розчинність в полярних розчинниках, але з іншого боку, для завдань даного винаходу кислотні і основні солі фармацевтично еквівалентні своїм відповідним вільним формам. Фармацевтично прийнятні солі сполук, що розглядаються можна синтезувати із сполук даного винаходу, які містять основну або кислу функціональну групу, шляхом загальноприйнятих хімічних способів. Зазвичай солі основних сполук готують або іонообмінною хроматографією або шляхом реакції вільної основи зі стехіометричною кількістю або з надлишком бажаної солеутворювальної неорганічної або органічної кислоти у відповідному розчиннику або в різних комбінаціях розфакторів. Аналогічно, солі кислих сполук утворюють за допомогою реакцій з відповідною неорганічною або органічною основою. Таким чином, фармацевтично прийнятні солі сполук даного винаходу включають загальноприйняті нетоксичні солі сполук даного винаходу у вигляді солей, утворених реакцією лужного поєднання, що розглядається, з неорганічною або органічною кислотою. Наприклад, загальноприй 93296 14 няті нетоксичні солі включають солі, одержані з неорганічних кислот, таких як хлористоводнева, гідроброміста, сірчана, сульфамова, фосфорна, азотна і т.п., а також солі, виготовлені з органічних кислот, таких як оцтова, пропіонова, бурштинова, гліколева, стеарїнова, молочна, яблучна, виннокам'яна, лимонна, аскорбінова, памова, малеїнова, гідроксималеїнова, фенілоцтова, глутамінова, бензойна, саліцилова, сульфанілова, 2ацетоксибензойна, фумарова, толуолсульфонова, метансульфонова, етандисульфонова, щавлева, ізетіонова, трифтороцтова (ТФО) і т.п. Якщо сполука даного винаходу є кислотним, вираз придатні "фармацевтично прийнятні солі", стосується солей, виготовлених з фармацевтично прийнятних нетоксичних основ, що включають неорганічні основи і органічні основи. Солі, одержані з неорганічних основ, включають солі алюмінію, амонію, кальцію, міді, тривалентного заліза, двовалентного заліза, літію, магнію, солі тривалентного марганцю, двовалентного марганцю, калію, натрію, цинку і т.п. Особливо переважними є солі амонію, кальцію, магнію, калію і натрію. Солі, одержані з фармацевтично прийнятних органічних нетоксичних основ, включають солі первинних, повторних і третинних амінів, заміщених амінів, що включають заміщені аміни природного походження, циклічні аміни і катіонообмінні смоли, такі як аргінін, бетаїн кофеїн, холін, Ν,Ν'дибензилетилендіамін, діетиламін, 2діетиламінетанол, 2-диметиламінетанол, етаноламін, етилендіамін, N-етилморфолін, Nетилпіперидин, глюкамін, глюкозамін, гістидин, гідрабамін, ізопропіламін, лізин, метилглюкамін, морфолін, піперазин, піперидин, поліамінові смоли, прикаїн, пурини, теобромін, триетиламін, триметиламін, трипропіламін, трометамін і т.п. Виготовлення фармацевтично прийнятних солей, описаних вище, і інших звичайних фармацевтично прийнятних солей більш детально описане в публікації Berg et al., "Pharmaceutical Salts," J. Pharm. Sci., 1977, 66: 1-19. Також необхідно вказати, що сполуки даного винаходу ймовірніше усього являють собою внутрішні солі або цвіттер-іони, оскільки при фізіологічних умовах присутня в сполуці депротонована кислотна функціональна група, така як карбоксильна група, може бути аніонною, і тоді такий електронний заряд може бути врівноважений внутрішнім чином з катіонним зарядом протонованої або алкільованої лужної групи, таким як атом четвертинного азоту. Сполуки винаходу, що розглядається, являють собою інгібітори дії Akt і, таким чином, є корисними при лікуванні раку, зокрема ракових захворювань, пов'язаних з дисрегуляцією дії Akt і downstream клітинних мішеней Akt. Такі ракові захворювання включають, без обмеження, рак яєчника, підшлункової залози, молочної залози і рак простати, а також подібні раковим захворювання (включаючи гліобластому), при яких відбувається мутація пухлинного супресора PTEN (Cheng et al., Proc. Natl. Acad. Sci. (1992) 89: 9267-9271; Cheng et al., Proc. Natl. Acad. Sci. (1996) 93: 3636-3641; Bellacosa et al., Int. J. Cancer (1995) 64: 280-285; Nakatani et al., 15 J. Biol. Chem. (1999) 274: 21528-21532; Graff, Expert. Opin. Ther. Targets (2002) 6(1): 103-113; і Yamada and Araki, J. Cell Science. (2001) 114: 23752382; Mischel and Cloughesy, Brain Pathol. (2003) 13(1): 52-61). Сполуки, композиції і способи, що забезпечуються в даному винаході, вважаються особливо корисними для лікування раку. Ракові захворювання, які можна лікувати за допомогою сполук, композицій і способів даного винаходу, включають без обмеження наступні захворювання: пухлини серця: саркома (ангіосаркома, фібросаркома, рабдоміосаркома, ліпосаркома), міксома, рабдоміома, фіброма, ліпома і тератома; захворювання легень: недрібноклітинний рак легені, бронхогенна карцинома (плоскоклітинний рак, недиференційований дрібноклітинний, недиференційований великоклітинний рак, аденокарцинома), альвеолярна (бронхіолярна) карцинома, бронхіальна аденома, саркома, лімфома, хондроматозна гамартома, мезотеліома; захворювання шлунково-кишкового тракту: рак стравоходу (плоскоклітинна карцинома, аденокарцинома, лейоміосаркома, лімфома), рак шлунку (карцинома, лімфома, лейоміосаркома), рак підшлункової залози (проточна аденокарцинома, інсулінома, глюкагонома, гастринома, карциноїдні пухлини, віпома), рак тонкої кишки (аденокарцинома, лімфома, карциноїдні пухлини, саркома Капоші, лейоміома, гемангіома, ліпома, нейрофіброма, фіброма), рак товстої кишки (аденокарцинома, тубулярна аденома, ворсинчаста аденома, гамартома, лейоміома), рак товстої кишки, колоректальний, ректальний рак; захворювання урогенітального тракту: рак нирки (аденокарцинома, пухлина Вільмса [нефробластома], лімфома, лейкоз), рак сечового міхура і уретри (плоскоклітинна карцинома, перехідно-клітинна карцинома, аденокарцинома), рак простати (аденокарцинома, саркома), рак яєчка (семінома, тератома, ембріональна карцинома, тератокарцинома, хоріокарцинома, саркома, інтерстиційно-клітинна карцинома, фіброма, фіброаденома, аденоматоїдні пухлини, ліпома); захворювання печінки: гепатома (гепатоцелюлярна карцинома), холангіокарцинома, гепатобластома, ангіосаркома, гепатоцелюлярна аденома, гемангіома; захворювання кісток: остеогенна саркома (остеосаркома), фібросаркома, злоякісна фіброзна гістіоцитома, хондросаркома, саркома Евінга, злоякісна лімфома (ретикулярно-клітинна саркома), множинна мієлома, злоякісна гігантсько-клітинна пухлина хордома, остеохондрома (кістково-хрящові екзостози), доброякісна хондрома, хондробластома, хондроміксофіброма, остеоїдна остеома і гігантсько-клітинні пухлини; захворювання нервової системи: пухлини черепа (остеома, гемангіома, гранулема, ксантома, деформуючий остит), м'яких мозкових оболонок (менінгіома, менінгиосаркома, гліоматоз), мозку (астроцитома, медулобластома, гліома, епендимома, гермінома [пінеалома], мультиформна гліобластома, олігодендрогліома, шванома, ретинобластома, природжені пухлини), спинного мозку (нейрофіброма, менінгіома, гліома, саркома); гінекологічні захворювання: пухлини матки (ендометріальна карцинома), шийки матки 93296 16 (цервікальна карцинома, передпухлинна цервікальна дисплазія), яєчників (яєчникова карцинома [серозна цистаденокарцинома, муцинозна цистаденокарцинома, некласифікована карцинома], пухлини гранульозних і текальних клітин, пухлини клітин Сертолі-Лейдіга, дисгермінома, злоякісна тератома), вульви (плоскоклітинна карцинома, інтраепітеліальна карцинома, аденокарцинома, фібросаркома, меланома), піхви (світлоклітинна карцинома, плоскоклітинна карцинома, ботріоїдна саркома (ембріональна рабдоміосаркома), фалопієвих труб (карцинома); гематологічні захворювання: кров (мієлоїдний лейкоз [гострий і хронічний], гострий лімфообластний лейкоз, хронічний лімфоцитарний лейкоз, мієлопроліферативні хвороби, множинна мієлома, мієлодиспластичний синдром), хвороба Ходжкіна, нехожкінська лімфома [злоякісна лімфома]; захворювання шкіри: злоякісна меланома, базальноклітинна карцинома, плоскоклітинна карцинома, саркома Капоші, диспластичні невуси, ліпома, ангіома, дерматофіброма, келоїди, псоріаз; і захворювання надниркових залоз: нейробластома. Таким чином, термін "злоякісна клітина", згідно з даним винаходом, включає клітину, уражену будь-яким з вищезгаданих станів. Ракові захворювання, які можна лікувати за допомогою сполук, композицій і способів даного винаходу, включають, без обмеження, рак молочної залози, простати, товстої кишки, колоректальний рак, рак легені, недрібноклітинний рак легені, рак мозку, яєчка, шлунку, підшлункової залози, шкіри, тонкої кишки, товстої кишки, горла, голови і шиї, ротової порожнини, кістки, печінки, сечового міхура, нирки, щитоподібної залози і крові. Ракові захворювання, які можна лікувати за допомогою сполук, композицій і способів даного винаходу, включають, без обмеження, рак молочної залози, простати, товстої кишки, яєчників, колоректальний рак, рак легені і недрібноклітинний рак легені. Ракові захворювання, які можна лікувати за допомогою сполук, композицій і способів даного винаходу, включають, без обмеження, рак молочної залози, товстої кишки (колоректальний рак) і легені (недрібноклітинний рак легені). Ракові захворювання, які можна лікувати за допомогою сполук, композицій і способів даного винаходу, включають, без обмеження, лімфому і лейкоз. Сполуки винаходу, що розглядається, корисні для лікування раку молочної залози. Сполуки винаходу, що розглядається, корисні для лікування раку простати. Сигнальний шлях Akt регулює множину найважливіших етапів ангіогенезу. Shiojima and Walsh, Circ. Res. (2002) 90: 1243-1250. Відомо про корисність інгібіторів ангіогенезу для лікування раку за літературним даними, наприклад, див. J. Rak et al. Cancer Research, 55: 4575-4580, 1995 and Dredge et al., Expert Opin. Biol. Ther. (2002) 2(8): 953-966. Доведена роль ангіогенезу при раку для деяких видів ракових захворювань і тканин: карциноми молочної залози (G. Gasparini and A.L. Harris, J. Clin. Oncol., 1995, 13: 765-782; M. Toi et al., Japan. J. Cancer Res., 1994, 85: 1045-1049); карциноми 17 сечового міхура (A.J. Dickinson et al., Br. J. Urol., 1994, 74: 762-766); карциноми товстої кишки (L.M. Ellis et al., Surgery, 1996, 120(5): 871-878); і пухлин порожнини рота (J.K. Williams et al., Am. J. Surg., 1994, 168: 373-380). Інші ракові захворювання включають запущені пухлини, волосатоклітинний лейкоз, меланому, запущені пухлині голови і шиї, метастатичний рак ниркових клітин, неходжкінську лімфому, метастатичний рак молочної залози, аденокарциному молочної залози, запущена меланому, рак підшлункової залози, шлунку, гліобластому, рак легені, яєчників, недрібноклітинний рак легені, рак простати, дрібноклітинний рак легені, карциному ниркових клітин, різні солідні пухлини, множинну мієлому, метастатичний рак простати, злоякісну гліому, рак нирки, лімфому, рефрактерне метастазування, рефрактерну множинну мієлому, цервікальний рак, саркому Капоші, рекурентну анапластичну гліому і метастатичний рак товстої кишки (Dredge et al., Expert Opin. Biol. Ther. (2002) 2(8): 953-966). Таким чином, інгібітори Akt, розкриті в заявці, що розглядається, також є корисними при лікуванні ракових захворювань, пов'язаних з ангіогенезом. Пухлини, в яких відбувається неоваскуляризація, виявляють підвищену схильність до метастазування. Фактично, ангіогенез є суттєвим для росту пухлини і метастазування. (S.P. Cunningham, et al., Can. Research, 61: 3206-3211 (2001)). Таким чином, інгібітори Akt, розкриті в даний заявці, також корисні для профілактики або зменшення метастазування пухлинних клітин. Додатково в обсяг даного винаходу включений спосіб лікування або попередження захворювання, в яке залучений ангіогенез, вказаний спосіб полягає в тому, що ссавцеві, потребуючому такого лікування, вводять терапевтично ефективну кількість сполуки даного винаходу. Неоваскулярні патології ока являють собою приклад станів, при яких ураження основної маси тканин може бути зумовлене аберантною інфільтрацією кровоносних судин в оці (див. патент WO 00/30651, опублікований 2 червня 2000 року). Небажана інфільтрація може виникати з причини ішемічної ретинопатії, наприклад, внаслідок діабетичної ретинопатії, ретинопатії при передчасних родах, оклюзії вен сітчатки ока і т.д., або внаслідок дегенеративних захворювань, таких як хоріоїдальна неоваскуляризація, що спостерігається при старечій макулярній дегенерації. Таким чином, інгібування росту кровоносних судин за допомогою введення сполук даного винаходу здатне запобігати інфільтрацію кровоносних судин і діяти як попередження або лікування захворювань, пов'язане з ангіогенезом, таких як очні хвороби, наприклад, ретинальна васкуляризація, діабетична ретинопатія, стареча макулярна дегенерація і подібних хвороб. Додатково в обсяг даного винаходу включений спосіб лікування або попередження доброякісних захворювань, які пов'язані з ангіогенезом і включають, без обмеження, очні хвороби (такі як ретинальна васкуляризація, діабетична ретинопатія і стареча макулярна дегенерація), атеросклероз, артрит, псоріаз, ожиріння і хворобу Альцгеймера 93296 18 (Dredge et al., Expert Opin. Biol. Ther. (2002) 2(8): 953-966). В іншому варіанті здійснення спосіб лікування або профілактики хвороби, пов'язаної з ангіогенезом, включає очні хвороби (такі як ретинальна васкуляризація, діабетична ретинопатія і стареча макулярна дегенерація), атеросклероз, артрит і псоріаз. Додатково в обсяг даного винаходу включений спосіб лікування гіперпроліферативних порушень, таких як рестеноз, запалення, аутоімунні захворювання і алергія/астма. Додатково в обсяг винаходу, що розглядається, входить використання сполук, що розглядаються для покриття стентів, тобто використання сполук, що розглядаються в стентах з покриттям для лікування і/або профілактики рестенозу (WO03/032809). Додатково в обсяг винаходу, що розглядається, включене використання сполук, що розглядаються для лікування і/або попередження остеоартриту (WO 03/035048). Додатково в обсяг даного винаходу включений спосіб лікування гіперінсулінімії. Сполуки даного винаходу також корисні для виготовлення лікарського засобу для лікування описаних вище захворювань, зокрема, раку. В одному варіанті здійснення даного винаходу, що розглядається, сполуки являють собою селективний інгібітор, інгібувальна ефективність якого залежить від ПГ-домену. У вказаному варіанті здійснення сполука виявляє зменшення інгібувальної активності in vitro або зменшення активності інгібування не in vitro усічених білків Akt, позбавлених ПГ-домену. У додатковому варіанті здійснення сполуку, що розглядається, вибирають з групи, що складається з селективного інгібітору Akt1, селективного інгібітору Akt2 і селективного інгібітору і Akt1 і Akt2. В іншому варіанті здійснення сполуку, що розглядається, вибирають з групи, що складається з селективного інгібітору Akt1, селективного інгібітору Akt2, селективного інгібітору Akt3 і селективного інгібітору двох з трьох ізоформ Akt. В іншому варіанті здійснення сполука, що розглядається, являє собою селективний інгібітор всіх трьох ізоформ Akt, але не є інгібітором однією, двох або всіх вказаних ізоформ Akt, які зазнали модифікації з делецією ПГ-домену, делецією шарнірної ділянки або делецією і ПГ-домену і шарнірної ділянки. Додатково, метою даного винаходу є спосіб інгібування дії Akt, який містить введення потребуючому цього ссавцеві фармацевтично ефективної кількості сполуки, що розглядається. Сполуки даного винаходу можна вводити ссавцем, включаючи людей, як єдиними, так і в комбінації з фармацевтично прийнятними носіями, наповнювачами або розріджувачами, в фармацевтичній композиції згідно зі стандартною фармацевтичною практикою. Сполуки можна вводити перорально або парентерально, включаючи внутрішньовенний, внутрішньом'язовий, внутрішньочеревинний, підшкірний, ректальний і місцевий шляхи введення. 19 Фармацевтичні композиції, що містять активний компонент, можна виготовляти в формі, придатній для перорального застосування, наприклад, у вигляді таблеток, пілюль, пастилок, водних або масляних суспензій, диспергованих порошків або гранул, емульсій, твердих або м'яких капсул, або сиропів або еліксирів. Композиції, призначені для перорального застосування, можна виготовляти згідно з будь-яким способом, відомим в галузі виробництва фармацевтичних композицій, і такі композиції можуть містити одну або більше речовин, вибираних з групи, що складається з підсолоджувачів, ароматизаторів, барвників і консервантів, для одержання фармацевтично витончених і приємних на смак рецептур. Таблетки містять активний компонент в суміші з нетоксичними фармацевтично прийнятними наповнювачами, які підходять для виготовлення таблеток. Ці наповнювачі можуть являти собою, наприклад, інертні розріджувачі, такі як карбонат кальцію, карбонат натрію, лактоза, фосфат кальцію або фосфат натрію; гранулюючі і дезінтегрувальні агенти, наприклад, мікрокристалічна целюлоза, натрійкроскармелоза, кукурудзяний крохмаль або альгінова кислота; зв'язуючі агенти, наприклад, крохмаль, желатин, полівінілпіролідон або гуміарабік, і мастильні агенти, наприклад, стеарат магнію, стеарїнова кислота або тальк. Таблетки можуть бути без покриття, або їх можна покривати загальновідомими способами, щоб замаскувати неприємний смак ліків або уповільнити розщеплення і засвоєння ліків в шлунково-кишковому тракті, і таким чином, забезпечити тривалу дію протягом більш довгого періоду. Наприклад, можна використовувати водорозчинний матеріал, що маскує смак, такий як гідроксипропілметилцелюлоза або гідроксипропілцелюлоза, або матеріал-уповільнювач, такий як етилцелюлоза, ацетатбутират целюлози. Рецептури для перорального застосування також можуть мати вигляд твердих желатинових капсул, в яких активний компонент змішують з інертним твердим розріджувачем, наприклад, карбонатом кальцію, фосфатом кальцію або каоліном, або бути у вигляді м'яких желатинових капсул, в яких активний компонент змішують з водорозчинним носієм, таким як поліетиленгліколь, або з масляним середовищем, наприклад, з арахісовою олією, вазеліновим маслом або оливковою олією. Водні суспензії містять активну речовину в суміші з наповнювачами, придатними для виготовлення водних суспензій. Такі наповнювачі являють собою суспендувальні агенти, наприклад, натрійкарбоксиметилцелюлозу, метилцелюлозу, гідроксипропілметилцелюлозу, альгінат натрію, полівінілпіролідон, трагакантову смолу і гуміарабік; диспергувальні або зволожуючі агенти можуть являти собою фосфатиди природного походження, наприклад, лецитин, або продукти конденсації алкіленоксиду з жирними кислотами, наприклад, зі стеаратом поліоксіетилену, або продукти конденсації етиленоксиду з довголанцюжковими багатоатомними аліфатичними спиртами, наприклад, гептдекаетилен-оксицетанолом, або продукти конденсації етиленоксиду з неповним складним ефіром, одержаним з жирних кислот і гекситолу, таких як 93296 20 поліоксіетиленсорбітол-моноолеат, або продукти конденсації етиленоксиду з неповним складним ефіром, одержаним з жирних кислот і ангідридів гекситолу, наприклад, з поліетиленсорбітолмоноолеатом. Водні суспензії можуть також містити один або більше консервантів, наприклад, етил, або н-пропіл-п-гідроксибензоат, один або більше барвників, один або більше ароматизаторів, і один або більше підсолоджувачів, таких як сахароза, сахарин або аспартам. Можна створювати рецептуру масляних суспензій шляхом суспендування активного компонента в рослинній олії, наприклад, в арахісовій олії, оливковій олії, кунжутній олії або кокосовій олії, або в мінеральному маслі, такому як вазелінове масло. Масляні суспензії можуть містити загусник, наприклад, бджолиний віск, твердий вазелін або цетиловий спирт. Можна додавати підсолоджувальні агенти і ароматизатори, такі як вказані вище, для одержання приємної на смак пероральної рецептури. Такі композиції можна зберігати з додаванням антиоксиданту, такого як бутил-гідроксіанузол або альфа-токоферол. Дисперговані порошки і гранули, придатні для виготовлення водної суспензії шляхом додавання води, забезпечують активний компонент в суміші з диспергуючим або зволожуючим агентом, суспендувальним агентом і одним або більше консервантів. Приклади придатних диспергувальних або зволожуючих агентів і суспендувальних агентів наведені вище. Також можуть бути присутнім додаткові наповнювачі, наприклад, підсолоджувачі, ароматизатори і барвники. Такі композиції можна зберігати додаванням антиоксиданту, такого як аскорбінова кислота. Фармацевтичні композиції даного винаходу можуть також бути у вигляді емульсії масло-в-воді. Масляна фаза може являти собою рослинну олію, наприклад, оливкову олію або арахісову олію, або мінеральне масло, наприклад вазелінове масло, або їх суміші. Відповідні емульгувальні агенти можуть являти собою фосфатиди природного походження, наприклад лецитин соєвих бобів, і складний ефір або неповний складний ефір, одержаний з жирних кислот і ангідридів гекситолу, наприклад, сорбітол-моноолеат, і продукти конденсації вказаного неповного складного ефіру з етиленоксидом, наприклад, поліоксіетиленсорбітол-моноолеатом. Емульсії можуть також містити підсолоджувачі, ароматизатори, консерванти і антиоксиданти. Рецептури сиропів і еліксирів можна створювати з підсолоджувачами, наприклад, гліцерином, пропіленгліколем, сорбітолом або сахарозою. Такі рецептури також можуть містити пом'якшувальний агент, консервант, ароматизатори і барвники і антиоксидант. Фармацевтичні композиції можуть являти собою форму стерильних водних розчинів для ін'єкцій. З можливих для використання придатних носіїв і розфакторів можна застосовувати воду, розчин Рінгера і ізотонічний розчин хлориду натрію. Стерильна рецептура для ін'єкцій також може являти собою стерильну мікроемульсію масло-вводі для ін'єкцій, в якій активний компонент розчинений в масляній фазі. Наприклад, активний ком 21 понент можна спочатку розчиняти в суміші соєвої олії і лецитину. Потім масляний розчин вводять в суміш води і гліцерину і обробляють для одержання мікроемульсії. Розчини для ін'єкцій або мікроемульсії можна вводити в кровоносне русло хворого шляхом місцевої болюсної ін'єкції. Альтернативно, може мати перевагу таке введення розчину або мікроемульсії, при якому буде підтримуватися постійна циркулююча концентрація сполуки, що розглядається. Можна використовувати пристрій для безперервної внутрішньовенної доставки для підтримки такої постійної концентрації. Прикладом такого пристрою є внутрішньовенна помпа моделі 5400 Deltec CADD- PLUS™. Фармацевтичні композиції можуть являти собою форму стерильної ін'єкційної водної або маслянистої суспензії для внутрішньом'язового і підшкірного введення. Рецептуру такої суспензії можна створювати згідно зі загальноприйнятою методикою, використовуючи вказані вище відповідні диспергувальні або зволожуючі агенти і суспендувальні агенти. Стерильна рецептура для ін'єкцій може також являти собою стерильний ін'єкційний розчин або суспензію в нетоксичному, придатному для парентерального введення розріджувачі або розчиннику, наприклад, в розчині 1,3-бутандіолу. Додатково, як суспендувальне або розчинювальне середовище загальноприйнято використовують стерильні жирні масла. З цією метою можна використовувати будь-яке м'яке жирне масло, що включає синтетичні моно- або дигліцериди. Додатково, для виготовлення ін'єкційних форм можуть застосовуватися жирні кислоти, такі як олеїнова кислота. Сполуки формули С або Δ можна також вводити в формі свічки для ректального введення лікарського засобу. Такі композиції можна виготовляти шляхом змішування лікарського засобу з відповідним неподразнювальним наповнювачем, який є твердим при звичайній температурі, але стає рідким при ректальній температурі, і тому буде танути в прямій кишці з вивільненням лікарського засобу. Такі речовини включають олію какао, оброблений гліцерином желатин, гідрогеновані рослинні олії, суміші поліетиленгліколей різної молекулярної ваги і складного ефіру жирних кислот поліетиленгліколю. Для місцевого застосування використовують креми, мазі, гелі, розчини або суспензії і т.д., що містять сполуки формули С або Е. (Для цілей даної заявки місцеве застосування повинно включати ополіскувачі для порожнини рота і полоскання). Сполуки даного винаходу можна вводити в інтраназальній формі за допомогою місцевого застосування відповідних інтраназальних носіїв і пристроїв доставки, або шляхом черезшкірного введення, використовуючи відомі рядовим фахівцям в даній галузі техніки трансдермальні формі шкіряних пластирів. Введення дози в формі трансдермальной системи доставки буде, безумовно, безперервним, на відміну від періодичного введення за схемою дозування. Сполуки даного винаходу можна також вводити у вигляді супозиторіїв, з використанням основи, такої як олія какао, оброб 93296 22 лений гліцерином желатин, гідрогеновані рослинні олії, суміші поліетиленгліколей різної молекулярної ваги і складного ефіру жирних кислот поліетиленгліколю. При введенні людині композицій згідно з даним винаходом щоденна доза зазвичай повинна визначатися лікуючим лікарем, при цьому доза зазвичай варіює відповідно до віку, ваги і індивідуальної реакції хворого, а також згідно зі ступенем тяжкості симптомів у хворого. Можна вибирати схему введення із застосуванням сполук винаходу, що розглядається, відповідно до ряду факторів, що включають тип, вид, вік, вагу, стать і тип ракового захворювання, яке необхідно лікувати; ступінь тяжкості (тобто стадії) раку, який лікують; шлях введення; функцію нирок і печінки пацієнта; і конкретної сполуки, що застосовується, або її солі. Зазвичай кваліфікований лікар або ветеринар можуть легко визначити і призначити ефективну кількість лікарського засобу, необхідного для лікування, наприклад, для попередження, уповільнення (повного або часткового) або припинення розвитку хвороби. Наприклад, сполуки винаходу, що розглядається, можна вводити в загальній щоденній дозі до 10000 мг. Сполуки винаходу, що розглядається, можна вводити щодня однократно (QD), або розділяти на багаторазові щоденні дози, наприклад, вводячи сполуки два рази на день (BID) і три рази на день (TID). Сполуки винаходу, що розглядається, можна вводити в загальній щоденній дозі до 10000 мг, наприклад, 2000 мг, 3000 мг, 4000 мг, 6000 мг, 8000 мг або 10000 мг, і вказані дози можна вводити в однократній щоденній дозі або можна розділяти на багаторазові щоденні дози, як описано вище. Наприклад, сполуки винаходу, що розглядається, можна вводити в загальній щоденній дозі до 1000 мг. Сполуки винаходу, що розглядається, можна вводити однократно щодня (QD), або розділяти на багаторазові щоденні дози, наприклад, два рази на день (BID), і три рази на день (TID). Сполуки винаходу, що розглядається, можна вводити в загальній щоденній дозі до 1000 мг, наприклад, 200 мг, 300 мг, 400 мг, 600 мг, 800 мг або 1000 мг, і вказані дози можна вводити в однократній щоденній дозі, або їх можна розділяти на багаторазові щоденні дози, як описано вище. Додатково, введення може бути безперервним, тобто, щоденним, або періодичним. Терміни "періодичне" або "періодичність", що використовуються в даному винаході, означають початок і припинення введення з регулярними або нерегулярними інтервалами. Наприклад, періодичне введення сполуки винаходу, що розглядається, може являти собою введення від одного до шести днів на тиждень, або воно може означати введення циклами (наприклад, щоденне введення протягом від двох до восьми послідовних тижнів, потім перерва без введення протягом одного тижня), або періодичне введення може означати введення через день. На додаток, сполуки винаходу, що розглядається, можна вводити згідно з будь-якою зі схем, описаних вище, послідовно протягом декількох тижнів, з подальшою перервою. Наприклад, спо 23 луки винаходу, що розглядається, можна вводити згідно з будь-якою зі схем, описаних вище, від двох до восьми тижнів, з подальшою перервою протягом одного тижня, або два рази на день в дозі 100-500 мг протягом від трьох до п'яти днів на тиждень. В іншому конкретному варіанті здійснення сполуки винаходу, що розглядається, можна вводити три рази на день протягом двох послідовних тижнів, з подальшою перервою на один тиждень. Також можна застосовувати будь-яку одну або більше конкретного дозування і схем дозування сполук винаходу, що розглядається, для будьякого одного або більше терапевтичних агентів, які застосовуються при комбінованій терапії (далі званих "другим терапевтичним агентом"). Крім того, можна додатково змінювати конкретну дозу і схему дозування цього другого терапевтичного агента, і визначати оптимальну дозу, схему дозування і шлях введення будуть з урахуванням конкретного другого терапевтичного агента, що застосовується. Безумовно, шлях введення сполук винаходу, що розглядається, не залежить від шляху введення другого терапевтичного агента. В одному варіанті здійснення шляхом введення сполуки винаходу, що розглядається, є пероральне введення. В іншому варіанті здійснення введення сполуки винаходу, що розглядається, здійснюють внутрішньовенним вливанням. Таким чином, згідно з вказаними варіантами здійснення, сполуку винаходу, що розглядається, вводять перорально або внутрішньовенно, і другий терапевтичний агент можна вводити перорально, парентерально, інтраперитонеально, внутрішньовенно, внутрішньоартеріально, черезшкірно, сублінгвально, внутрішньом'язово, ректально, трансбукально, інтраназально, за допомогою ліпосом, шляхом інгаляції, вагінально, інтраокулярно, локалізованою доставкою за допомогою катетера або стента, підшкірно, в жирову тканину, інтраартикулярно, інтратекально або в фармацевтичній формі з уповільненим вивільненням дози. На додаток, сполуку винаходу, що розглядається, і другий терапевтичний засіб можна вводити однаковим способом введення, тобто обидві застосовувані речовини вводять, наприклад, перорально або внутрішньовенно. Разом з тим, також в обсяг даного винаходу входить спосіб введення сполуки винаходу, що розглядається, одним шляхом введення, наприклад, перорально, і другого терапевтичного агента іншим шляхом введення, наприклад, внутрішньовенно, або будь-якими іншими способами введення, описаними вище. Перша процедура лікування, а саме введення сполуки винаходу, що розглядається, може відбуватися перед другою процедурою лікування, тобто перед введенням другого терапевтичного засобу, після введення другого терапевтичного засобу одночасно із застосуванням другого терапевтичного засобу або в їх комбінованому застосуванні. Наприклад, для сполуки винаходу, що розглядається, може бути встановлений загальний період лікування. Другий терапевтичний засіб можна вводити до початку застосування сполуки винаходу, 93296 24 що розглядається, або після лікування сполукою винаходу, що розглядається. Додатково, протиракову терапію можна провести під час періоду введення сполуки винаходу, що розглядається, але немає необхідності її провести протягом всього періоду застосування сполуки винаходу, що розглядається. Сполуки, що розглядаються, також є корисними в комбінації з терапевтичними, хіміотерапевтичними і протираковими засобами. В обсяг винаходу входять комбінації розкритих в даному винаході сполук з терапевтичними, хіміотерапевтичними і протираковими засобами. Приклади таких засобів можна знайти у виданні Cancer Principles and Practice of Oncology, V.T. Devita and S. Hellman (editors), 6th edition (February 15, 2001), Lippincott Williams & Wilkins Publishers. Рядовий фахівець в даній галузі техніки зможе відрізнити, які комбінації засобів будуть корисні, на основі конкретних характеристик лікарських засобів і онкологічного діагнозу. Такі агенти включають наступне: модулятори рецепторів естрогену, модулятори рецепторів андрогену, модулятори ретиноїдних рецепторів, цитотоксичні/цитостатичні агенти, антипроліферативні агенти, інгібітори преніл-протеїн трансферази, інгібітори HMG-COA редуктази і інші інгібітори ангіогенезу, інгібітори протеази ВІЛ, інгібітори зворотної транскриптази, інгібітори клітинної проліферації і сигнальних шляхів виживаності, бісфосфонати, інгібітори ароматази, препарати siPHK, інгібітори -секретази, агенти, що впливають на рецептор тирозинкіназ (РТК), і агенти, які впливають на контрольні точки клітинного циклу. Сполуки, що розглядаються, особливо корисні при спільному застосуванні з променевою терапією. Сполука винаходу, що розглядається, може також бути корисною для лікування раку в комбінації з наступними терапевтичними агентами: абарелікс (Plenaxis depot®); алдеслейкін (Prokine®); алдеслейкін (Proleukin®); алемтузумаб (Campath®); алітретиноїн (Panretin®); алопуринол (Zyloprim®); алтретамін (Hexalen®); аміфостин (Ethyol®); анастрозол (Arimidex®); триоксид миш'яку (Trisenox®); аспарагіназа (Elspar®); азацитидин (Vidaza®); бевакузимаб (Avastin®); бексаротен, капсули (Targretin®); бексаротен, гель (Targretin®); блеоміцин (Blenoxane®); бортезоміб (Velcade®); бусульфан, внутрішньовенна форма (Busulfex®); бусульфан, пероральна форма (Myleran®); калустерон (Methosarb®); капецитабін (Xeloda®); карбоплатин (Paraplatin®); кармустин (BCNUo, BiCNU®); кармустин (Gliadel®); кармустин з імплантом поліфепросан 20 (Gliadel Wafer®); целекоксиб (Celebrex®); цетуксимаб (Erbitux®); хлорамбуцил (Leukeran®); цисплатин (Platinol®); кладрибін (Leustatino, 2-CdA®); клофарабін (Cloral®); циклофосфамід (Cytoxano, Neozar®); циклофосфамід (Cytoxan Injection®); циклорфосфамід (Cytoxan Tablet®); цитарабін (Cytosar-U®); цитарабін ліпосомальний (DepoCyt®); дакарбазин (DTIC-Dome®); дактиноміцин, актиноміцин D (Cosmegen®); дарбепоетин-альфа (Aranesp®); даунорубіцин ліпосомальний (DanuoXome®); даунорубіцин, дауноміцин (Daunorubicin®); даунорубіцин, дауноміцин (Cerubidine®); денилейкін дифтитокс (Ontak®); 25 дексразоксан (Zinecard®); доцетаксел (Taxotere®); доксорубіцин (Adriamycin PFS®); доксорубіцин (Adriamycino, Rubex®); доксорубіцин (Adriamycin PFS Injection®); доксорубіцин ліпосомальний (Doxil®); пропіонат дромостанолону (dromostanolone®); пропіонат дромостанолону (masterone injection®); розчин Елліотта В (Elliot's В Solution®); епірубіцин (ЕИепсе®); епоетин альфа (epogen®); ерлотиніб (Tarceva®); естрамустин (Emcyt®); етопозиду фосфат (Etopophos®); етопозид, VP-16 (Venesid®); ексеместан (Aromasin®); філграстим (Neurogen®); флоксуридин (внутрішньоартеріальний) (FUDR®); флударабін (Fludara®); фтороурацил, 5-FU (Adrucil®); фулвестрант (Faslodex®); гефітиніб (Iressa®); гемцитабін (Gemzar®); гемтузумаб озогаміцин (Mylotarg®); госерелін ацетат (Zoladex Implant®); госерелін ацетат (Zoladex®); гістрелін ацетат (Histrelin implant®); гідроксечовина (Hydrea®); ібритумомаб Тіуксетан (Zevalin®); ідарубіцин (Idamycin®); іфосфамід (IFEX®); іматиніб мезилат (Gleevec®); інтерферон-альфа 2а (Roferon At); інтерферон-альфа2b (Intron At); іринотекан (Camptosar®); леналідомід (Revlimid®); летрозол (Femara®); лейковорин (Wellcovorino, Leucovorin®); лейпролід ацетат (Eligard®); левамізол (Ergamisol®); ломустин, CCNU (CeeBU®); меклоретамін, нітроїприт (Mustargen®); мегестрол ацетат (Megace®); мелфалан, L-PAM (Alkeran®); меркаптопурин, 6-MP (Purinethol®); месна (Mesnex®); месна (Mesnex tabs®); метотрексат (Methotrexate®); метоксален (Uvadex®); мітоміцин С (Mutamycin®); мітотан (Lysodren®); мітоксантрон (Novantrone®); нандролон фенпропіонат (Durabolin-50®); неларабін (Arranon®); нофетумомаб (Verluma®); опрелвекин (Neumega®); оксаліплатин (Eloxatin®); паклітаксел (Рахепе®); паклітаксел (Taxol®); паклітаксел протеїнзв'язані частинки (Abraxane®); парліфермін (Kepivance®); памідронат (Aredia®); пегадемаза (Adagen (Pegademase Bovine)np®); пегаспаргаза (Oncaspar®); пегфилграстим (Neulasta®); динатрий пеметрексед (Alimta®); пентостатин (Nipent®); піпоброман (Vercyte®); плікаміцин, мітраміцин (Mithracin®); натрій порфімер (Photofrin®); прокарбазин (Matulane®); квінакрин (Atabrine®); расбуриказа (Elitek®); ритуксимаб (Rituxan®); сарграмостим (Leukine®); сарграмостим (Prokine®); сорафеніб (Nexavar®); стрептозоцин (Zanosar®); сунітиніб малеат (Sutent®); тальк (Sclerosol®); тамоксифен (Nolvadex®); темозоломід (Temodar®); теніпозид, VM-26 (Vumon®); тестолактон (Teslac®); тіогуанін, 6-TG (Thioguanine®); тіотепа (Thioplex®); топотекан (Hycamtin®); тореміфен (Fareston®); тоситумомаб (Веххаг®); тоситумомаб/І-131 тоситумомаб (Веххаr®); трастузумаб (Herceptin®); третиноїн, ATRA (Vesanoid®); нітроіприт урацил (Uracil Mustard Capsules®); валрубіцин (Valstar®); вінбластин (Velban®); вінкристин (Oncovin®); вінорелбін (Navelbine®); золедронат (Zometa®) і вориностат (Zolinza®). Сполуки винаходу, що розглядається, корисні для лікування раку в комбінації з таксанами. Сполуки винаходу, що розглядається, корисні для лікування раку в комбінації з доцетакселом (Taxotere®). 93296 26 Сполуки винаходу, що розглядається, корисні для лікування раку в комбінації з вориностатом (Zolinza®). Сполуки винаходу, що розглядається, корисні для лікування раку в комбінації з інгібітором ауроракінази, МК 0457. Сполуки винаходу, що розглядається, корисні для лікування раку в комбінації з інгібітором mTor, АР 23573. Сполуки винаходу, що розглядається, корисні для лікування раку в комбінації з інгібітором IGF1R, МК 0646. Сполуки винаходу, що розглядається, корисні для лікування раку в комбінації з сатраплатином. Сполуки винаходу, що розглядається, корисні для лікування раку в комбінації з лапатинібом (Tykerb®). Таким чином, галузь винаходу, що розглядається, охоплює використання сполук, вказаних в формулі даного винаходу, в комбінації з іншими сполуками, вибираним з наступних сполук: модулятор рецепторів естрогену, модулятор рецепторів андрогену, модулятор ретиноїдних рецепторів, цитотоксичний/цитостатичний агент, антипроліферативний агент, інгібітор преніл-протеїн трансферази, інгібітор HMG-COA редуктази, інгібітор протеази ВІЛ, інгібітор зворотної транскриптази, інгібітор ангіогенезу, агоністи PPAR-, агоністи PPAR-, інгібітор природженої множинної лікарської стійкості, протиблювотний засіб, засіб, корисний для лікування анемії, засіб, корисний для лікування нейтропенії, лікарський засіб, що підвищує імунітет, інгібітор клітинної проліферації і сигнальних шляхів виживаності, бісфосфонат, інгібітор ароматази, препарат siPHK, інгібітор -секретази, агенти, що впливають на рецептор тирозинкіназ (РТК), агент, що впливає на контрольні точки клітинного циклу, і будь-який з вищезазначених терапевтичних агентів. Термін "введення" і його варіанти (наприклад, "введення" сполуки) відносно сполуки даного винаходу означає, що сполука або проліки сполуки поступає в систему тварини, що потребує лікування. Якщо сполука даного винаходу або її проліки представлена в комбінації з одним або більше іншими активними агентами (наприклад, цитотоксичний агент і т.д.), загальноприйнято вважати, що термін "введення" і його варіанти включають паралельне і послідовне застосування сполуки або її проліків і інших агентів. Термін "сполука", що використовується в даному винаході, охоплює продукт, що містить вказані компоненти у вказаній кількості, а також будьякий продукт, який прямим або опосередкованим способом одержують з комбінації вказаних компонентів у вказаній кількості. Термін "терапевтично ефективна кількість", що використовується в даному винаході, означає кількість активної сполуки або фармацевтичного агента, яка викликає шукану біологічну або медичну реакцію в тканині, системі, у тварини або людини, очікувану дослідником, ветеринаром, лікарем або іншим клінічним фахівцем. Термін "лікування раку" стосується введення ссавцеві, ураженому злоякісною патологією, і сто 27 сується дії, яка полегшує злоякісну патологію шляхом знищення злоякісних клітин, а також дії, яка призводить до уповільнення росту і/або метастазування раку. У варіанті здійснення інгібітор ангіогенезу, який застосовують як друга сполука, вибирають з інгібітору тирозинкінази, інгібітору фактора росту епідермісу, інгібітору фактора росту фібробластів, інгібітору фактора росту тромбоцитів, інгібітору ММР (матриці металопротеази), блокатора інтегрину, інтерферону-, інтерлейкіну-12, полісульфату пентозану, інгібітору циклооксигенази, карбоксіамідотриазолу, комбретастатину А-4, скваламіну, 6-О-хлорацетилкарбоніл)фумагілолу, талідоміду, ангіостатину, тропоніну-1 або антитіла до VEGF. В одному варіанті здійснення модулятором рецептора естрогену є тамоксифен або ралоксифен. Також в обсяг формули винаходу входить спосіб лікування раку, який містить введення терапевтично ефективної кількості сполуки винаходу, що розглядається, в комбінації з променевою терапією і/або в комбінації з другою сполукою, що вибирається з наступних сполук: модулятор рецептора естрогену, модулятор рецепторів андрогену, модулятор ретиноїдних рецепторів, цитотоксичний/цитостатичний агент, антипроліферативний агент, інгібітор преніл-протеїн трансферази, інгібітор HMG-COA редуктази, інгібітор протеази ВІЛ, інгібітор зворотної транскриптази, інгібітор ангіогенезу, агоністи PPAR-, агоністи PPAR-, інгібітор природженої множинної лікарської стійкості, протиблювотний засіб, засіб, корисний для лікування анемії, засіб, корисний для лікування нейтропенії, лікарський засіб для підвищення імунітету, інгібітор клітинної проліферації і сигнальних шляхів виживаності, бісфосфонат, інгібітор ароматази, препарат siPHK, інгібітор -секретази, агенти, що впливають на рецептор тирозинкіназ (РТК), агент, що впливає на контрольні точки клітинного циклу, і будь-який з вищезазначених терапевтичних агентів. Винахід, що розглядається, також включає фармацевтичну композицію, корисну для лікування або профілактики раку, яка містить терапевтично ефективну кількість сполуки винаходу, що розглядається, і другої сполуки, вибираного з наступного: модулятор рецепторів естрогену, модулятор рецепторів андрогену, модулятор ретиноїдних рецепторів, цитотоксичний/цитостатичний агент, антипроліферативний агент, інгібітор преніл-протеїн трансферази, інгібітор HMG-COA редуктази, інгібітор протеази ВІЛ, інгібітор зворотної транскриптази, інгібітор ангіогенезу, агоністи PPAR-, агоністи PPAR-, інгібітор клітинної проліферації і сигнальних шляхів виживаності, бісфосфонат, інгібітор ароматази, препарат siPHK, інгібітор -секретази, агенти, що впливають на рецептор тирозинкіназ (РТК), агенти, що впливають на контрольні точки клітинного циклу, і будьякі з вищезазначених терапевтичних агентів. Всі вказані патенти, публікації і патентні заявки, що знаходяться на розгляді, включені в даний винахід посиланням. У хімічному описі і в наведених далі прикладах використані наступні скорочення: AEBSF (п 93296 28 аміноетилбензолсульфонілфторид); БСА (бичачий сироватковий альбумін); BuLi (н-бутиллітій); CDCI3 (хлороформ-d); Сull (йодид міді); CuSO4 (сульфат міді); DCE (ДХЕ - дихлоретан); DCM (ДХМ - дихлорметан); DEAD (діетилазодикарбоксилат); DMF (ДМФ - Ν,Ν-диметилформамід); DMSO (ДМСО диметилсульфоксид); DTT (ДТТ - дитіотреїтол); EDTA (ЕДТА - етилендіамінтетраоцтова кислота); EGTA (ЕГТА - етиленгліколь-тетраоцтова кислота); ЕtOАС (етилацетат); ЕtOН (етанол); HOAC (оцтова кислота); HPLC (ВЕРХ - високоефективна рідинна хроматографія); HRMS (мас-спектрометрія з високою роздільністю); ІРА (ІПС - ізопропіловий спирт); LC/MS (спосіб рідинної хроматографії/масспектрометрії); LiHMDS (літію біс(триметилсиліл)амід); LRMS (мас-спектрометрія з низьким розділенням); МеОН (метанол); MPB(CN)H3 (макропористий ціаноборгідрид); NaHCO3 (бікарбонат натрію); Na2SO4 (сульфат натрію); Na(OAc)3BH (натрію триацетоксиборгідрид); NH4OAC (ацетат амонію); NBS (Nбромсукцинамід); ЯМР (ядерний магнітний резонанс); PBS (ФБР - фосфатно-буферний розчин); PCR (ПЛР - полімеразна ланцюгова реакція); Pd(dppf) [1,Гбіс(дифенілфосфіно)ферроцен](паладій); Pd(Ph3)4 (паладій(О)тетракис-трифенілфосфін); РОС13 (фосфорний оксихлорид); PS-DIEA (полістирол діізопропілетиламін); PS-PPh3 (полістиролтрифенілфосфін); ТВАВ (ТБАБ - тетрабутиламонію бромід); TBAF (ТБАФ - тетрабутиламонію фторид); THF (ТГФ - тетрагідрофуран); TFA (ТФО трифтороцтова кислота); TMSCH2N2 (триметилсилілдіазометан) і Ас (ацетил); ВОС (БОК - третбутоксикарбоніл); Ви (бутил); Саl (розрахована величина); Calc'd (розрахована величина); DIEA (діізопропілетиламін); DMAP (4диметиламінопіридин); EDC (N-етил-N'-(3диметиламінопропіл)карбодіімід); Eq (еквіваленти); Et (етил); HOBt (ГОБТ - гідроксибензотриазол); ІРА (ІПС - ізопропанол); LC/MS (рідинний хроматограф/мас-спектрометр); Me (метил); MeCN (ацетонітрил); NMP (НМП -N-метилпіролідинон); Рr (пропіл); Руr (піридин); Sat (насичений), Tosic, TCK (птолуолсульфонова кислота) і Вn (бензил); t-Bu (трет-бутил); dba (ДБА -дибензилиденацетон); DIPEA (діізопропілетиламін); ІРАС (ізопропілацетат); МТВЕ (трет-бутилметил ефір); ОАС (ацетат); RT (КТ - кімнатна температура); Wt - вага; і XRPD (рентгенівська порошкова дифракція). Сполуки даного винаходу можна виготовляти за допомогою здійснення реакцій, наведених в розділі Схеми реакцій нижче, в доповнення до інших стандартних маніпуляцій, відомих в літературі або показаних як приклади експериментів. Приклади наведених нижче схем реакцій, таким чином, не обмежені перерахованими сполуками або будь-якими конкретними замісниками, що використовуються в ілюстративних цілях. Нумерація замісників, що вживається в схемах реакцій, не має обов'язкової кореляції з нумерацією, наведеною в формулі винаходу, і часто, для ясності, там, де допускаються декілька замісників згідно з визначеннями формули С або Е, показаної вище, вказаний єдиний замісник, приєднаний до сполуки. 29 Короткий огляд схем реакцій Нижче наведені схеми реакції. Схеми реакції ІIII детально характеризують виготовлення сполук, що розглядаються. Необхідні проміжні продукти в деяких випадках є комерційно доступними, або їх можна виготовити згідно з методикою, описаною в літературі. Як показано в схемі реакції І, спочатку реагує похідне циклоалкіл(феніл)оцтової кислоти, в цьому випадку циклобутил, і трансформується в умовах по Курціусу для одержання карбамату I-1. Ціанування, в цьому випадку каталізоване паладієм, дає нітрил I-2. Депротонування продукту I-2 з подальшою реакцією з нуклеофільним бензильним реактивом Грін'яра і гідролітичне виділення продукту реакції дає кетон I-3. Конденсація продукту I-3 з альдегідом I-4 при лужних умовах дає хлорнафтиридин I-5. Заміщення хлору гідразином дає гідразид I-6. Ацилування дає ацилгідразид I-7, який циклізується при кислих умовах, і дає триазолонафтиридин I-8. При знятті захисних груп з аміну в цьому випадку за допомогою НСl одержують I-9. Плавлений триазол можна виготовляти шляхом ацилування гідразиду I-6 з активованим карбонільним еквівалентом, таким як карбонілдіімідазо, або з мурашиною кислотою в присутності карбодііміду, без необхідності етапу циклізації. Альтернативно, хлорнафтиридин I-5 може реагувати з дериватизованим гідразином, таким як кар 93296 30 боксилат алкілгідразину, за умов кислотного каталізу, для одержання адукту гідразину, який зазнає циклізації в триазол при лужних умовах. Сполука винаходу, що розглядається, в якій R1 є аміноалкільною групою, можна виготовляти згідно зі способами, в загальних рисах описаними в схемі реакції II. Гідразид I-6 реагує з карбодіімідом для одержання сечовини, яка зазнає циклізації in situ за кислих умов для одержання алкіламінотриазолу II-1. Потім здійснюють зняття захисних груп продукту II-2. Альтернативний синтез хлорнафтиридину I-5 показаний в схемі реакції III. Похідне (4галогенфеніл)ацетонітрилу III-1, в цьому випадку бромзаміщене, спочатку зазнає алкілування при лужних умовах для одержання циклобутану III-2, який гідратується перекисом водню в присутності основи, для одержання аміду ІІІ-3. Потім амід зазнає окислювальної транформації в присутності трет-бутанолу для одержання карбамату ІII-4. Ціанування, в цьому випадку каталізоване паладієм, дає нітрил I-2. Реакція продукту I-2 з надлишком нуклеофільного бензильного реактиву Грін'яра і гідролітичне виділення продукту реакції дає кетон I-3. Зняття захисних груп альдегіду I-4 кислотою, такою як ТФО, дає амінопіридин ІII-5. Конденсація I-3 з альдегідом ІII-5 при лужних умовах дає хлорнафтиридин I-5. Схема реакції І 31 93296 32 Схема реакції II Схема реакції III Приклади Наведені приклади і схеми призначені для додаткового розуміння даного винаходу. Передбачається, що конкретні речовини, які використовують ся, види і умови є додатковими ілюстративними даними даного винаходу і не обмежують його належний обсяг. 33 трет-Бутил [1-(4хлорфеніл)циклобутил]карбамат (1-1) У круглу плоскодонну колбу додавали 1-(4хлорфеніл)циклобутанкарбоксильну кислоту (40,4 г, 192 ммоль), ди-трет-бутилу дикарбонат (46,0 г, 211 ммоль), азид натрію (43,6 г, 671 ммоль), тетрабутиламонію бромід (9,7 г, 28,7 ммоль), трифторметансульфонат цинку (2,30 г, 6,32 ммоль) і ТГФ (1 л). Реакційну суміш нагрівали до 60°С при перемішуванні на гарячій масляній бані, сполученій з водним охолоджуючим рефлюксним конденсатором, в атмосфері азоту протягом 18 годин. До сирої реакційної суміші додавали насичений розчин бікарбонату натрію, суспендували в етилацетаті і промивали насиченим розчином бікарбонату натрію з подальшим промиванням водою, сольовим розчином, висушували над сульфатом натрію, фільтрували і упарювали. Одержаний залишок очищували хроматографією на силікагелі (0-3% ІПС/ДХМ) для одержання трет-бутил [1-(4хлорфеніл)циклобутил]карбамату (1-1) у вигляді білої твердої речовини. HRMS (M+Na)+: що спостерігається = 304,1075, розрахована = 304,1075. трет-Бутил [1-(4ціанофеніл)циклобутил]карбамат (1-2) До розчину трет-бутил [1-(4хлорфеніл)циклобутил]карбамату (1-1) (5,32 г, 18,9 ммоль) в безводному 1,4-діоксані (70 мл) додавали ціанід цинку (2,44 г, 20,8 ммоль), з подальшим додаванням біс(три-трет-бутилфосфін)паладію(0) (0,965 г, 1,89 ммоль). Реакційну суміш нагрівали до 100°С з перемішуванням на гарячій масляній бані, сполученій з водним охолоджуючим рефлюксним конденсатором, в атмосфері азоту протягом 1,5 годин. Реакційну суміш фільтрували і упарювали у вакуумі. Одержаний залишок очищували хроматографією на силікагелі (0-5% ІПС/ДХМ) для одержання трет-бутил [1-(4ціанофеніл)циклобутилу] (1-2) у вигляді воскової + білувато-жовтої твердої речовини. HRMS (М+Н) : що спостерігається = 273,1598, розрахована = 273,1597. трет-Бутил {1-[4(фенілацетил)феніл]циклобутил}карбамат (1-3) Розчин трет-бутил [1-(4ціанофеніл)циклобутил]карбамату (1-2) (16,6 г, 61,0 ммоль) в безводному ТГФ (300 мл) охолоджували до -78°С, з перемішуванням в атмосфері азоту. Потім по краплі протягом 5 хвилин додавали 2,0 Μ розчин ізопропілмагній хлориду в ТГФ (30,5 мл, 61,0 ммоль). Реакційну суміш залишали для перемішування при -78°С в атмосфері азоту протягом 10 хвилин. Потім по краплі протягом 10 хвилин додавали 2,0 Μ розчин бензилмагнію хлориду в ТГФ (116 мл, 232 ммоль). Реакційну суміш залишали для нагрівання до 0°С. Через 2 години реакційну суміш гасили додаванням насиченого розчину хлориду амонію при 0°С. Реакційну суміш залишали для нагрівання до кімнатної температури, суспендували в етилацетаті, промивали насиченим розчином хлориду амонію, насиченим розчином бікарбонату натрію, з подальшим промиванням водою, соляним розчином, висушували над сульфатом натрію, фільтрували і упарю 93296 34 вали у вакуумі. Одержаний залишок очищували хроматографією на силікагелі (1-40% EtOАС/5% ДХМ/гексан) для одержання трет-бутил {1-[4(фенілацетил)феніл]циклобутил}карбамату (1-3) у вигляді воскової білуватої твердої речовини. HRMS (M+Na)+: що спостерігається = 388,1892, розрахована = 388,1883. трет-Бутил {1-[4-(5-хлор-3-феніл-1,6нафтиридин-2-іл)феніл]циклобутил}карбамат (1-5) У круглу плоскодонну колбу додавали третбутил {1-[4(фенілацетил)феніл]циклобутил}карбамат (1-3) (2,7 г, 6,1 ммоль), трет-бутил (2-хлор-3формілпіридин-4-іл)карбамат (1-4) (1,6 г, 6,1 ммоль), карбонат калію (5,0 г, 6,0 ммоль) і ДМФ (20 мл). Реакційну суміш нагрівали до 80°С з перемішуванням на гарячій масляній бані в атмосфері азоту протягом 15 годин. Потім реакційну суміш нагрівали до 120°С протягом 1 години. Реакційну суміш залишали для охолоджування до кімнатної температури, додавали воду, суспендували в етилацетаті, промивали насиченим розчином бікарбонату натрію з подальшим промиванням водою, соляним розчином, висушували над сульфатом натрію, фільтрували і упарювали у вакуумі. Одержаний залишок очищували хроматографією на силікагелі (5-50% EtOAC/5% ДХМ/гексан) для одержання трет-бутил {1-[4-(5хлор-3-феніл-1,6-нафтиридин-2іл)феніл]циклобутил}карбамату (1-5) у вигляді бі+ луватої твердої речовини. HRMS (М+Н) : що спостерігається = 486,1954, розрахована = 486,1943. трет-Бутил {1-[4-(5-гідразино-3-феніл-1,6нафтиридин-2-іл)феніл]циклобутил}карбамат (1-6) У пробірку для мікрохвильової печі додавали трет-бутил {1-[4-(5-хлор-3-феніл-1,6-нафтиридин2-іл)феніл]циклобутил}карбамат (1-5) (4,05 г, 8,34 ммоль), безводний гідразин (5,24 мл, 167 ммоль) і 1,4-діоксан (15 мл). Потім реакційну суміш нагрівали за допомогою мікрохвильового випромінювання протягом 5 хвилин при 100°С (високий рівень поглинання). Реакційну суміш залишали для охолоджування до кімнатної температури, суспендували в етилацетаті, промивали насиченим розчином бікарбонату натрію з подальшим промиванням водою, соляним розчином, висушували над сульфатом натрію, фільтрували і упарювали у вакуумі для одержання трет-бутил {1-[4-(5-гідразино-3феніл-1,6-нафтиридин-2іл)феніл]циклобутил}карбамату (1-6) у вигляді твердої речовини оранжевого кольору/піни. MS (M+H)+: що спостерігається = 482,3, розрахована = 482,59. трет-Бутил {1-[4-(5-{2-[(1-метил-1Н-імідазол-4іл)карбоніл]гідразино}-3-феніл-1,6-нафтиридин-2іл)феніл]циклобутил}карбамат (1-7) У круглу плоскодонну колбу додавали третбутил {1-[4-(5-гідразино-3-феніл-1,6-нафтиридин2-іл)феніл]циклобутил}карбамат (1-6) (3,94 г, 8,18 ммоль), EDC (1,34 г, 10,6 ммоль), ГОБТ (1,44 г, 10,6 ммоль), 1-метил 1Н-імідазол-4-карбоксильну кислоту (1,34 г, 10,6 ммоль) і ДМФ (40 мл). Реакційну суміш нагрівали до 60°С, з перемішуванням в атмосфері азоту на гарячій масляній бані. Через 35 45 хвилин реакційну суміш залишали для охолоджування до кімнатної температури, суспендували в етилацетаті, промивали насиченим розчином бікарбонату натрію, з подальшим промиванням водою, соляним розчином, висушували над сульфатом натрію, фільтрували і упарювали у вакуумі для одержання трет-бутил {1-[4-(5-{2-[(1-метил-1Німідазол-4-іл)карбоніл]гідразино}-1,3-феніл-1,6нафтиридин-2-іл)феніл]циклобутил}карбамату (17) у вигляді піни червоного кольору. MS (М+Н)+: що спостерігається = 590,3, розрахована = 590,69. трет-Бутил (1-{4-[3-(1-метил-1H-імідазол-4-іл)9-феніл[1,2,4]триазоло[3,4-f]-1,6-нафтиридин-8іл]феніл}циклобутил)карбамат (1-8) У круглу плоскодонну колбу додавали третбутил {1-[4-(5-{2-[(1-метил-1Н-імідазол-4іл)карбоніл]гідразино}-3-феніл-1,6-нафтиридин-2іл)феніл]циклобутил}карбамат (1-7) (2,73 г, 4,63 ммоль), оцтову кислоту (5,30 мл, 93 ммоль) і 1,4діоксан (20 мл). Реакційну суміш нагрівали до 80°С з перемішуванням у відкритому стані в атмосфері (накритій) на гарячій масляній бані. Через 3 години реакційну суміш залишали для охолоджування до кімнатної температури, суспендували в етилацетаті, промивали насиченим розчином бікарбонату натрію, з подальшим промиванням водою, соляним розчином, висушували над сульфатом натрію, фільтрували і упарювали у вакуумі. Одержаний залишок очищували хроматографією на силікагелі 1-15% ІПС/ДХМ. Відповідні фракції об'єднували і розчинник видаляли у вакуумі. Одержаний залишок повторно очищували зворотно-фазовою коло 93296 36 нковою хроматографією (Sunfire С18) елюювали з градієнтом 5-95% ацетонітрил/(0,1% ТФО/вода). Відповідні фракції залишали у вигляді вільних основ шляхом суспендування в етилацетаті, промивали насиченим розчином бікарбонату натрію з подальшим промиванням водою, соляним розчином, висушували над сульфатом натрію, фільтрували і упарювали у вакуумі для одержання третбутил (1-{4-[3-(1-метил-1Н-імідазол-4-іл)-9феніл[1,2,4]триазоло[3,4-і]-1,6-нафтиридин-8іл]феніл}циклобутил)карбамату (1-8) у вигляді білуватої твердої речовини. MS (М+Н)+: що спостерігається = 572,3, розрахована = 572,7. 1-{4-[3-(1-метил-1Н-імідазол-4-іл) 9феніл[1,2,4]триазоло[3,4-f]-1,6-нафтиридин-8іл]феніл}циклобутанамін дигідрохлорид (1-9) До розчину трет-бутил (1-{4-[3-(1-метил-1Німідазол-4-іл)-9-феніл[1,2,4]триазоло[3,4-f]-1,6нафтиридин-8-іл]феніл}циклобутил)карбамату (18) (2,52 г, 4,41 ммоль) в МеОН (5 мл) і ДХМ (15 мл) додавали 4N розчин НСl в EtOAC (22 мл, 88 ммоль). Герметичну реакційну суміш залишали для перемішування при кімнатній температурі. Через 4 години реакційну суміш упарювали у вакуумі для одержання 1-{4-[3-(1-метил-1Н-імідазол-4іл)-9-феніл[1,2,4]триазоло[3,4-f]-1,6-нафтиридин-8іл]феніл}циклобутанамін дигідрохлориду (1-9) у вигляді твердої речовини жовтого кольору. HRMS (М+Н)+: що спостерігається = 472,2249, розрахована = 472,2244. Наступні сполуки виготовляли способом, подібним способу з прикладів 1-9: 37 93296 38 39 93296 40 41 8-[4-(1 -Аміноциклобутіл)феніл]-9феніл[1,2,4]триазоло[3,4-f|-1,6-нафтиридин-3-ол (1-16) У круглу плоскодонну колбу додавали третбутил {1-[4-(5-гідразино-3-феніл-1,6-нафтиридин2-іл)феніл]циклобутил}карбамат (1-6) (2,77 г, 5,75 ммоль) і 1,Г-карбоніл-біс(1Н-імідазол) (4,10 г, 4,40 ммоль) в 1,4 діоксані (30 мл). Потім герметично закриту реакційну суміш нагрівали при 95°С в атмосфері азоту. До сирої реакційної суміші додавали насичений розчин бікарбонату натрію (100 мл) і етилацетату. Органічний шар промивали насиченим розчином бікарбонату натрію з подальшим промиванням водою, соляним розчином, висушували над сульфатом натрію, фільтрували і упарювали. Потім одержаний залишок очищували хроматографією на силікагелі, елюювали ІПС/ДХМ з градієнтом 0-10%. Після цього об'єднували відповідні фракції і розчинник видаляли у вакуумі для одержання трет-бутил {1-[4-(3-гідрокси-9феніл[1,2,4]триазоло[3,4-f]-1,6-нафтиридин-8 93296 42 іл)феніл]циклобутил}карбамату (1-6а) у вигляді твердої речовини коричневого кольору. MS (M+H)+: що спостерігається = 508,1, розрахована = 508,6. До розчину трет-бутил {1-[4-(3-гідрокси-9феніл[1,2,4]триазоло[3,4-і]-1,6-нафтиридин-8іл)феніл]циклобутил}карбамату (1-6а) (1,14 г, 2,25 ммоль) в МеОН (5 мл) і ДХМ (15 мл) додавали 4N розчин НСl в ЕtOАС (22 мл, 88 ммоль) при кімнатній температурі. Через 4 години реакційну суміш упарювали у вакуумі для одержання 8-[4-(1аміноциклобутил)феніл]-9феніл[1,2,4]триазоло[3,4-г]-1,6-нафтиридин-3-ол гідрохлориду (1-16) у вигляді твердої речовини жовтого кольору. HRMS (М+Н)+: що спостерігається = 408,1803, розрахована = 408,1819. Проведений далі рентгенівський кристалографічний аналіз жовтої твердої речовини вказує, що тверда сполука 1-16 існує і має наступну хімічну структуру: 43 8-[4-(1-Аміноциклобутіл)феніл]-9феніл[1,2,4]триазоло[3,4-f]-1,6-нафтиридин-3(2Н) трет-Бутил {1-[4-(9-феніл[1,2,4]триазоло[3,4-f]1,6-нафтиридин-8-іл)феніліциклобутил} карбамат (1-15) У круглу плоскодонну колбу додавали EDC (569 мг, 2,97 ммоль), ГОБТ (401 мг, 10,6 ммоль), мурашину кислоту (248 мг, 5,40 ммоль), ДХМ (20 мл) і НМП (2,5 мл). Потім реакційну суміш перемішували при кімнатній температурі в атмосфері азоту протягом 30 хвилин. Після цього додавали трет-бутил {1-[4-(5-гідразино-3-феніл-1,6нафтиридин-2-іл)феніл]циклобутил}карбамат (1-6) (1,30 г, 2,70 ммоль). Потім реакційну суміш залишали для перемішування протягом ночі при кімнатній температурі в атмосфері азоту. Потім реакційну суміш суспендували в етилацетаті, промивали насиченим розчином бікарбонату натрію, з промиванням водою, соляним розчином, висушували над сульфатом натрію, фільтрували і упарювали у вакуумі. Одержаний залишок очищували хроматографією на силікагелі ЕtOАС/ДХМ, 50-90%, потім 1-15% ІПС/ДХМ. Відповідні фракції об'єднували і розчинник видаляли у вакуумі для 93296 44 ОН гідрохлорид одержання трет-бутил {1-[4-(9феніл[1,2,4]триазоло[3,4-f]-1,6-нафтиридин-8іл)феніл]циклобутил}карбамату (1-6b) у вигляді твердої речовини коричневого кольору. MS (М+Н)+: що спостерігається = 492,2, розрахована = 492,6. 1-[4-(9-Феніл[1,2,4]триазоло[3,4-f]-1,6нафтиридин-8-іл)феніл]циклобутанамін гідрохлорид (1-15) До розчину трет-бутилу {1-[4-(9феніл[1,2,4]триазоло[3,4-f]-1,6-нафтиридин-8іл)феніл]циклобутил}карбамату (1-6b) (1,07 г, 2,177 ммоль) в МеОН (5 мл) і ДХМ (15 мл) додавали 4N розчин НСl в ЕtOАС (5,44 мл, 21,77 ммоль). Герметично закриту реакційну суміш залишали для перемішування при кімнатній температурі. Через 4 години реакційну суміш фільтрували для одержання 1 [4-(9-феніл[1,2,4]триазоло[3,4f]-1,6-нафтиридин-8-іл)феніл]циклобутанаміну гідрохлориду (1-15) у вигляді твердої речовини коричневого кольору. HRMS (М+Н)+: що спостерігається = 392,1872, розрахована - 392,1870. 45 93296 46 СХЕМА 1С 1-(4-Бромфеніл)циклобутанкарбонітрил (1-2с) Сполуку ТБАБ (1,61 г, 0,5 ммоль), дибромпропан (22,2 г, 110 ммоль) і нітрил 1-1с (19,6 г, 100 ммоль) додавали з перемішуванням до розчину КОН (31,17 г, 500 ммоль) в суміші з 15 мл води і 200 мл толуолу (підтримували температуру від 72 до 79°С). Реакційну суміш нагрівали парою і перемішували при 99-108°С протягом 2,5 годин. Реакційну суміш охолоджували до 80°С і додавали 200 мл гептану. Після охолоджування з перемішуванням суміші до КТ прозору верхню фазу розчину фільтрували, промивали водою (3×30 мл) і упарювали у вакуумі для одержання маслянистого продукту 1-2с. 1-(4-Бромфеніл)циклобутанкарбоксамід (1-3с) Н2О2 (30% 11,3 мл, 118 ммоль) додавали протягом 3 годин до суміші нітрила 1-2с (13,88 г, приблизно 58,9 ммоль), що перемішується і К2СО3 (1,62 г, 11,8 ммоль) в 59 мл диметилсульфоксиду при температурі від 40 до 87°С з охолоджуванням на водяній бані. Суміш, що одержується, охолоджували до 27°С і додавали воду (100 мл) протягом 30 мін. Одержували прозорий продукт 1-3с. Додаткову кількість води (100 мл) додавали протягом 1 години. Одержану суспензію витримували при КТ протягом 16 годин перед фільтруванням. Осад ополіскували 100 мл води і потім 100 мл гептану. Після висушування у вакуумній печі при 50°С одержували продукт 1-3с у вигляді білої твердої речовини. трет-Бутил [1-(4бромфеніл)циклобутил]карбамат (1-4с) Рb(ОАс)4 (25,7 г, 25,7 ммоль) додавали до розчину, що перемішується аміду 1-3с (12,7 г, 50 ммоль) в 64 мл t-BuOH при температурі від 57°С до 86°С з охолоджуванням на водяній бані. Суміш, що одержується, перемішували при 65-86°С протягом 0,5 години. Суміш охолоджували до 26°С і додавали 12,7 г Ка2СО3, з подальшим додаванням 65 мл МТВЕ. Через 10 хвилин суміш фільтрували. Осад ополіскували 10 л МТВЕ, об'єднаний фільтрат промивали 20 мл води і потім промивали органічний шар 3 рази по 10 мл 10% КНСО3 (увага: пузиріння), висушували над Na2SO4 і упарювали у вакуумі. Тверду речовину, що одержується, ополіскували за допомогою 8 мл ІПС і 8 мл гептану і висушували у вакуумній печі при 40°С для одержання продукту 1-4с у вигляді сірої твердої речовини. трет-Бутил [1-(4ціанофеніл)циклобутил]карбамат (1-2) Суспензію Рd2dbа3, що перемішується (101 мг; 1% моль) і dppf (122 мг; 2% моль) в ДМФ (25 мл) розбризкували з азотом протягом 5 хвилин і потім нагрівали до 65°С і витримували 30 хвилин. У цей часовий відрізок додавали арилбромід 1-4с (3,6 г, 11 ммоль), цинковий порошок (51 мг; 6% моль) і ціанід цинку (777 мг; 0,60 екв.), з обполіскуванням ДМФ (5 мл). Розчин нагрівали до 92-95°С і витримували протягом 4 годин. Розчин охолоджували до КТ протягом ночі і фільтрували через подушку Solka Floc, ополіскували осад ДМФ (5 мл). Воду (30 мл) додавали протягом 3,5 годин при 25-33°С разом із затравкою. Після утримування протягом ночі при КТ одержаний прозорий розчин фільтрували, промивали водним метанолом і висушували протягом ночі, щоб одержати продукт 1-2 у вигляді жовтої твердої речовини. трет-Бутил {1-[4фенілацетил)феніл]циклобутил}карбамат (1-3) Бензильний реактив Грін'яра (19 мл, 38,5 ммоль) додавали до перемішуваного трохи каламутного розчину нітрилу 1-2 (3 г, 11 ммоль) в ТГФ (25 мл) і охолоджували приблизно до -20°С з такою швидкістю, щоб температура реакції не підвищувалася вище за -10°С. Розчин витримували протягом 3-4 годин, підтримуючи температуру реакції в діапазоні від -10°С до -20°С. Перемішаний розчин охолоджували до -30°С і додавали в розчин водної лимонної кислоти 15% ваг. (60 мл), який заздалегідь охолоджували до 5-10°С, і підтримували температуру нижче за 15°С. Розділяли шари і водний шар промивали з МТВЕ. Органічні шари об'єднували, промивали половиною насиченого соляного розчину (60 мл) і упарювали при зниженому тиску. Додавали гептан і 47 93296 48 упарювали суміш до стану суспензії, яку фільтрували, промивали гептаном (15 мл) і висушували в атмосфері азоту для одержання 1-3. 4-Аміно-2-хлорнікотинальдегід (1-5с) Трифтороцтову кислоту (17,4 мл, 234 ммоль) обережно додавали до перемішеної суміші БОКальдегіду 1-4 (20 г, 78,1 ммоль) і дихлорметану (60 мл), підтримуючи температуру нижче 25°С. Розчин нагрівали до 35°С, витримували протягом ночі (з енергійним розсиченням газом) і потім охолоджували до кімнатної температури. Додавали 25 мл МТВЕ і одержаний білий рідкий розчин витримували протягом однієї години, фільтрували і ополіскували фільтрувальний осад МТВЕ (10 мл × 2). Сіль ТФО 1-5с у вигляді твердої речовини висушували у вакуумі. трет-Бутил {1-[4-(5-хлор-3-феніл-1,6нафтиридин-2-іл)феніл]циклобутил)карбамат (1-5) Розчин гідроксиду калію 45% ваг. (18 мл; 5 екв.), додавали по краплі протягом понад 20 хвилин до суміші солі хлорпіридину, що перемішується ТФО 1-5с (19,5 г), циклобутилумінокетону 1-3 (26 г) і ізопропанолу (200 мл), підтримуючи температуру нижче 24°С. Через 1 годину додавали воду (100 мл) і ще через одну годину одержану суспензію фільтрували, промивали сумішшю 2:1 ІПС/вода (30 мл, потім 24 мл), потім водою (80 мл, потім 2×60 мл). Тверду речовину висушували в струмі азоту з одержанням 1-5 у вигляді не зовсім білої твердої речовини. трет-Бутил {1-[4-(5-гідразино-3-феніл-1,6нафтиридин-2-іл)феніл]циклобутил}карбамат (1-6) Безводний гідразин (25 мл, 797 ммоль) додавали до перемішеного розчину хлорнафтиридину (1-5) (25,12 г, 51,7 ммоль) в 1,4-діоксані (200 мл) в атмосфері азоту, і реакційну суміш нагрівали до 95°С. Через 30 хвилин розчин охолоджували до кімнатної температури, додавали етилацетат (400 мл) і розчин промивали насиченим розчином бікарбонату натрію з подальшим промиванням водою і соляним розчином, висушували над сульфатом натрію, фільтрували і упарювали у вакуумі для одержання (1-6) у вигляді твердої речовини оранжевого кольору. трет-Бутил {1-[4-(9-феніл-3-піримідин-2іл[1,2,4]триазоло[3,4-f]-1,6-нафтиридин-8іл)феніл]циклобутил}карбамат (1-6d) У круглу плоскодонну колбу додавали третбутил {1-[4-(5-гідразино-3-феніл-1,6-нафтиридин2-іл)феніл]циклобутил}карбамат (1-6) (267 мг, 0,554 ммоль), EDC (138 мг, 0,721 ммоль), ГОБТ (97 мг, 0,721 ммоль), піримідин-2-карбоксильну кислоту (89 мг, 0,721 ммоль), DIPEA (0,367 мл, 2,218 ммоль) і ДМФ (3 мл). Реакційну суміш закривали і нагрівали за допомогою мікрохвильового випромінювання при 100°С протягом 5 хвилин. Суміш охолоджували, додавали оцтову кислоту (0,476 мл, 8,32 ммоль), і потім реакційну суміш закривали і нагрівали мікрохвильовим випромінюванням при 80°С протягом 5 хвилин. Реакційну суміш залишали для охолоджування до кімнатної температури, суспендували в етилацетаті, промивали насиченим розчином бікарбонату натрію з подальшим промиванням водою, соляним розчином, висушували над сульфатом натрію, фільтрували і упарювали у вакуумі. Одержаний залишок очищували хроматографією на силікагелі 0-10% ІПС/ДХМ. Відповідні фракції об'єднували і розчинник видаляли у вакуумі для одержання трет-бутил {1-[4-(9-феніл-3-піримідин-2-іл[1,2,4]триазоло[3,4f]-1,6-нафтиридин-8іл)феніл]циклобутил}карбамату (1-6d) у вигляді твердої речовини оранжевого кольору. MS (M+H)+: що спостерігається = 570,2, розрахована = 570,7. 1-[4-(9-феніл-3-піримідин-2іл[1,2,4]триазоло[3,4-f]-1,6-нафтиридин-8іл)феніл]циклобутамін гідрохлорид (1-10) До розчину трет-бутил {1-[4-(9-феніл-3піримідин-2-іл[1,2,4]триазоло[3,4-f]-1,6нафтиридин-8-іл)феніл]циклобутил}карбамату (16d) (71 мг, 0,125 ммоль) в МеОН (2 мл) і ДХМ (3 мл) додавали 4N розчин НСl в ЕtOАС (3 мл, 12 ммоль). Герметично запечатану реакційну суміш залишали для перемішування при кімнатній температурі. Через 4 години реакційну суміш упарювали. Через 4 години реакційну суміш упарювали у вакуумі. Одержаний залишок очищували зворотнофазовою колонковою хроматографією (Sunfire 49 93296 50 С18), елюювали з градієнтом 1-50% ацетонітрил/(0,1% ТФО/вода). Відповідні фракції упарювали у вакуумі. Одержаний залишок потім розчиняли в ДХМ (5 мл) і МеОН (5 мл), після цього додавали 4N розчин НСl в ЕtOАС (5 мл, 20 ммоль), потім упарювали у вакуумі для одержання 1-[4-(9-феніл] 3-піримідин-2-іл[1,2,4]триазоло[3,4-f]-1,6нафтиридин-8-іл)феніл]циклобутанамін гідрохлориду (1-10) у вигляді коричневої твердої речовини. HRMS (М+Н)+: що спостерігається = 470,2098, розрахована = 470,2088. Проміжний продукт (1-5е) Перемішану суспензію хлорнафтиридину 1-5 (1,8 г), метилгідразинкарбоксилату (0,318 г) і ізопропанолу (20 л) нагрівали до 66°С до стану гомогенності. Додавали 5-6 N НСl в ІПС (0,05 мл) і підвищували температуру до 70°С протягом 16 годин, потім охолоджували до КТ. Після охолоджування до КТ 45% ваг. розчину гідроксиду калію (0,52 мл) змішували з водою (5,5 мл) і додавали протягом 15 хвилин. Через 30 хвилин додавали водну оцтову кислоту (0,7 мл в 6 мл води) з подальшим додаванням води (2 мл). Одержану суспензію витримували при КТ протягом трьох годин, фільтрували і промивали сумішшю 1:1 ІПС/вода (2×2,4 мл). Продукт висушували в струмі азоту, потім приводили в пастоподібний стан в метиленхлориді при 20°С протягом 4 годин, фільтрували і висушували в струмі азоту для одержання продукту 1-5е у вигляді не зовсім білої твердої речовини. 8-[4-(1-Аміноциклобутіл)феніл]-9феніл[1,2,4]триазоло[3,4-f]-1,6-нафтиридин3(2Н)ОН (1-16) Розчин водної концентрованої НСl (12,1 М, 1,64 мл) в етанолі (2,0 мл) додавали по краплі протягом 30 хвилин до перемішеної суспензії 1-5е (500 мг, 0,985 ммоль) в етанолі (1,7 мл) і води (0,2 мл) при 50°С. Через 3 години після додавання кислоти в реакційну суміш вводили затравку і витримували протягом ночі при 50°С, охолоджували до кімнатної температури і фільтрували. До етанолу (2 мл) додавали ацетилхлорид (0,5 г, 7 ммоль) протягом 1 години при 0°С. Потім розчин охолоджували до кімнатної температури і витримували протягом 30 хвилин. Фільтрувальний осад промивав вказаним розчином (1 мл × 2), потім етилацетатом (4 мл × 2), після чого висушували у вакуумній печі при 75,0°С з очищенням азотом (50 тор) до повного перетворення з формі IV 1-16 в Форму II, що виявляли за XRPD. Спосіб, що використовується в схемі 1А, дає кристалічну сіль біс-НСІ 1-16 вказаної формі І. Способи, описані в схемі IE, дають на виході три нові поліморфи солі біс-НСІ 1-16, позначені як формі II, III і IV. Було виявлено, що висушування як формі III, так і формі IV при зниженому тиску з очищенням азотом призводить до їх повного перетворення на форму II. Коли суміші форм І і II в підкисленому етанолі приводили в пастоподібний стан, в результаті одержували форму III у вигляді суспензії. Відділення формі III і її висушування, як описано вище, призводить до одержання формі II. Моно-НСІ варіант 1-16 також одержували за допомогою розчинення у воді. Через 6 годин водна суспензія ставала світло-жовтою і зазнавала фільтрування. Титрування хлоридом срібла вказаної твердої речовини показує присутність одного еквівалента хлориду. Нарешті, обробка солі біс-НСІ 116 водним КОН (2 екв.) дає в результаті нейтральний продукт 1-16, що визначали титруванням хлоридом. 51 93296 52 трет-Бутил (1-[4-(3-метил-9феніл[1,2,4]триазоло[3,4-f]-1,6-нафтиридин-8іл)феніл]циклобутил)карбамат (1-6f) У круглу плоскодонну колбу додавали EDC (4,63 г, 24,17 ммоль), ГОБТ (3,27 г, 24,17 ммоль), безводний ДХМ (50 мл) і оцтову кислоту (13,2 мл, 13,86 ммоль). Потім реакційну суміш перемішували при кімнатній температурі в атмосфері азоту протягом 30 хвилин. Після цього додавали третбутил {1-[4-(5-гідразино-3-феніл-1,6-нафтиридин2-іл)феніл]циклобутил}карбамат (1-6) (10,58 г, 21,97 ммоль). Потім реакційну суміш залишали для перемішування протягом ночі (18 годин) при кімнатній температурі в атмосфері азоту, потім нагрівали до 80°С протягом 2 годин. Після цього реакційну суміш суспендували в етилацетаті, повільно вливали в насичений розчин бікарбонату натрію, з подальшим промиванням водою і соляним розчином, висушували над сульфатом натрію, фільтрували і упарювали у вакуумі. Одержаний залишок очищували хроматографією на силікагелі 1-20% ІПС/ДХМ. Відповідні фракції поєднували і розчинник видаляли у вакуумі для одержання трет-бутил {1-[4-(3-метил-9феніл[1,2,4]триазоло[3,4-f]-1,6-нафтиридин-8іл)феніл]циклобутил}карбамату (1-6f) у вигляді коричневої твердої речовини. MS (M+H)+: що спостерігається = 506,2, розрахована = 506,6. 1-[4-(3-метил-9-феніл[1,2,4]триазоло[3,4-f]-1,6нафтиридин-8-іл)феніл]циклобутанамін гідрохлорид (1-17) До розчину трет-бутил {1-[4-(3-метил-9феніл[1,2,4]триазоло[3,4-f]-1,6-нафтиридин-8іл)феніл]циклобутил}карбамату (1-6f) (9,23 г, 18,26 ммоль) в МеОН (20 мл) і ДХМ (100 мл) додавали 4N розчин НСl в ЕtOАС (91 мл, 365 ммоль). Герметично запечатану реакційну суміш залишали для перемішування при кімнатній температурі. Через 18 годин реакційну суміш фільтрували для одержання 1-[4-(3-метил-9феніл[1,2,4]триазоло[3,4-f]-1,6-нафтиридин-8іл)феніл]циклобутанамін гідрохлориду (1-17) у вигляді білуватої твердої речовини. HRMS (М+Н)+: що спостерігається = 406,2047, розрахована = 406,2026. трет-Бутил {1-[4-(3-циклопропіл-9феніл[1,2,4]триазоло[3,4-f]-1,6-нафтиридин-8іл)феніл]циклобутил}карбамат (1-6g) У круглу плоскодонну колбу додавали EDC (535 мг, 2,79 ммоль), ГОБТ (377 мг, 2,79 ммоль), безводний ДХМ (17,5 мл), безводний НМП (2,5 мл) і циклопропанкарбонову кислоту (248 мг, 5,40 ммоль). Потім реакційну суміш перемішували при кімнатній температурі в атмосфері азоту протягом 30 хвилин. Потім додавали трет-бутил {1-[4-(5 гідразино-3-феніл-1,6-нафтиридин-2іл)феніл]циклобутил}карбамат (1-6) (1,221 г, 2,54 ммоль). Після цього реакційну суміш залишали для перемішування протягом ночі (18 годин) при кімнатній температурі в атмосфері азоту. Додавали оцтову кислоту (2,178 мл, 38,0 ммоль) і реакційну суміш нагрівали на гарячій масляній бані при 80°С протягом 2 годин. Реакційну суміш залишали для охолоджування до кімнатної температури і додавали етилацетат, після чого суміш промивали 53 насиченим розчином бікарбонату натрію, води і соляного розчину, висушували над сульфатом натрію, фільтрували і упарювали у вакуумі. Одержаний залишок очищували хроматографією на силікагелі 90% EtOAC/ТДХМ (ізократичною). Відповідні фракції об'єднували, і розчинник видаляли у вакуумі для одержання трет-бутил {1-[4-(3циклопропіл-9-феніл[1,2,4]триазоло[3,4-f]-1,6нафтиридин-8-іл)феніл]циклобутил}карбамату (l6g) у вигляді рожевої твердої речовини. HRMS (M+H)+: що спостерігається = 532,2729, розрахована = 532,2707. 1-[4-(3-циклопропіл-9-феніл[1,2,4]триазоло[3,4f]-1,6-нафтиридин-8-іл)фенілциклобутанаміну гідрохлорид (1-23) До розчину трет-бутил {1-[4-(3-циклопропіл-9феніл[1,2,4]триазоло[3,4-f]-1,6-нафтиридин-8іл)феніл]циклобутил}карбамату (МJK-9)_(899,4 мг, 18,26 ммоль) в МеОН (5 мл) і ДХМ (15 мл) додавали 4N розчин НСl в ЕtOАС (4,23 мл, 16,92 ммоль). Герметично запечатану реакційну суміш залишали для перемішування при кімнатній температурі. Через 18 годин реакційну суміш фільтрували для одержання 1-[4-(3-метил-9феніл[1,2,4]триазоло[3,4-f]-1,6-нафтиридин-8іл)феніл]циклобутанамін гідрохлориду (1-23) у вигляді жовтої твердої речовини. HRMS (М+Н)+: що спостерігається = 432,2186, розрахована = 432,2183. ПРИКЛАД 1 Клонування ізоформ Akt і ΓPH-Akt1 людини Вектор pS2neo (депонований в Американській колекції типових культур АТСС 3 квітня 2001 року під найменуванням АТСС РТА-3253) був виготовлений таким чином: вектор pRmHA3 (виготовлений згідно з описом в Nucl. Acid. Res. 16: 1043-1061 (1988)) піддавали усіканню за допомогою Bg1II і виділяли фрагмент в 2734 пару основ (п.о.). Вектор pUChsneo (виготовлений, як описано в журналі ЕМВО J. 4: 167-171 (1985)) також піддавали усіканню Bglll і виділяли групу в 4029 п.о. Обидва вказані виділені фрагменти зшивали разом для створення вектора, званого pS2neo-1. Ця плазміда містить полілінкер між промотором металотіоніну і додатковим сайтом полі-Α алкогольдегідрогенази. Також вказана плазміда несе новий ген резистентності, що переноситься промотором теплового шоку. Вектор pS2neo-1 піддавали усіканню за допомогою Psp5II і BsiWI. Синтезували два комплементарних олігонулеотиди і потім піддавали гібридизації (CTGCGGCCGC (SEQ ID NO: 1) і GTACGCGGCCGCAG (SEQ ID NO: 2)). Усічений pS2neo-1 і гібридизовані олігонулеотиди зшивали разом для створення другого вектора, pS2neo. При цій конверсії додавали ділянку NotI для полегшення лінеаризації перед трансфекцією в клітини S2. Ген людини Akt1 ампліфікували ПЛР (Clontech) з кДНК людської селезінки (Clontech) з використанням 5' праймера 5'CGCGAATTCAGATCTACCATGAGCGACGTGGCT ATTGTG 3' (SEQ ID NO: 3) і праймера 3': 5'CGCTCTAGAGGATCCTCAGGCCGTGCTGCTGG C3' (SEQ ID NO: 4). 5' праймер включав сайти EcoRI і Bg1II. З метою клонування 3' праймер 93296 54 включав сайт Xbal і BamHI. Продукт ПЛР, що одержується, субклонували в pGEM3Z (Promega) як фрагмент EcoRJ/Xbal. З метою експресії/очищення середній маркер Τ додавали до 5' кінця повнорозмірного гена Akt1, використовуючи ПЛР праймер 5'GTACGATGCTGAACGATATCTTCG 3' (SEQ ID NO: 5). Одержаний продукт ПЛР охоплював сайт 5' Kpn1 і сайт 3' BamHI, які використовували для клонування фрагмента в рамці зчитування з маркером біотину, що містить вектор експресії клітини комахи, pS2neo. Для експресії плекстрин-гомологічного домену (ПГ) виконували делецію версії Akt1 (Γaa 4-129, яка включала делецію частини шарнірної області Akt1), проводили ПЛР для мутегенезу делецією, використовуючи як матрицю повнорозмірний ген Akt1 у векторі pS2neo. ПЛР проводили в 2 етапи, використовуючи внутрішні праймери, що перекриваються (5'GAATACATGCCGATGGAAAGCGACGGGGCTGA AGAGATGGAGGTG 3' (SEQ ID NO:6) і 5'CCCCTCCATCTCTTCAGCCCCGTCGCTTTCCAT CGGCATGTATTC 3' (SEQ ID NO: 7)), що охоплюють делецію і 5' і 3' фланкуючих праймерів, в які входили сайт Kpn1 і середній маркер Τ на 5' кінці. Кінцевий продукт ПЛР розщеплювали за допомогою Kpn1 і Smal і лігували в pS2neo повнорозмірного Akt1 Kpn1/усічений Smal вектора, ефективно заміняючи 5' кінець клону делетованою версією. Людський ген Аkt3 ампліфікували шляхом ПЛР з кДНК мозку дорослої людини (Clontech) з використання олігопраймера з амінокінцем 5' GAATTCAGATCTACCATGAGCGATGTTACCATTGT G 3' (SEQ ID NO: 8) і олігопраймера з карбоксикінцем 5' TCTAGATCTTATTCTCGTCCACTTGCAGAG 3' (SEQ ID NO:9). Для клонування вказані праймери включали сайт 5' EcoRI/Bglll і сайт 3' Xbal/BgІII. Продукт ПЛР, що одержується, клонували в сайти EcoRI і Xbal вектора pGEM4Z (Promega). Для експресії/очищення середній маркер Τ додавали до 5' кінця клону повнорозмірного Akt3 з використанням ПЛР праймера 5'GGTACCATGGAATACATGCCGATGGAAAGCGAT GTTACCATTGTGAAG 3' (SEQ ID NO: 10). Продукт ПЛР, що одержується, охоплював сайт 5' Kpn1, що дозволяло проводити в рамці клонування з маркером біотину, що містить вектор експресії клітини комахи, pS2neo. Людський ген Akt2 ампліфікували шляхом ПЛР з кДНК тимусу людини (Clontech) з використання олігопраймера з амінокінцем: 5' AAGCTTAGATCTACCATGAATGAGGTGTCTGTC 3' (SEQ ID NO: 11); і олігопраймера з карбоксикінцем: 5'GAATTCGGATCCTCACTCGCGGATGCTGGC 3' (SEQ ID NO: 12). У цілях клонування вказані праймери включали сайти 5' Hindlll/BgІII і сайт 3' EcoRI/BamHI. Продукт ПЛР, що одержується, клонували в сайти HindIII/EcoRI вектора pGem3Z (Promega). Для експресії/очищення середній маркер Τ додавали до 5' кінця клону повнорозмірного Akt2, з використанням ПЛР праймера 5'GGTACCATGGAATACATGCCGATGGAAAATGAG GTGTCTGTCATCAAAG 3' (SEQ ID NO: 13). Про 55 дукт ПЛР, що одержується, клонували у вектор pS2neo, як описано вище. ПРИКЛАД 2 Експресія ізоформ Akt і ΓPH-Akt1 людини Проводили очищення ДНК, що містить клоновані Akt1, Akt2, Akt3 і ΓΡΗ-Akt1 гени в pS2neo векторі експресії, і використовували її для трансфекції в клітини S2 Drosophila (ATCC) за фосфатнокальцієвою методикою. Відбирали пули клітин, резистентних до антибіотиків (G418, 500 мкг/мл). Клітини вирощували до об'єму 1,0 л (приблизно 7,0×106/мл), додавали біотин і CuSO4 в кінцевій концентрації 50 мкМ і 50 мМ, відповідно. Клітини вирощували протягом 72 годин при 27°С і збирали центрифугуванням. Клітинну пасту заморожували при -70°С до використання. ПРИКЛАД 3 Очищення ізоформ Akt і ΓPH-Akt1 людини Клітинну пасту з одного літра клітин S2, описаних в прикладі 2, піддавали лізуванню ультразвуком з 50 мл 1% CHAPS в буфері А: (50 мМ Трис рН 7,4, 1 мМ ЕДТА, 1 мМ ЕГТА, 0,2 мМ AEBSF, 10 мкг/мл бензамідину, по 5 мкг/мл лейпептину, апротиніну і пепстатину, 10% розчин гліцерину і 1 мМ ДТТ). Розчинну фракцію очищували на протеїн Gсефарозній колонці з швидким потоком (Protein G Sepharose fast flow column - Pharmacia), яку завантажували 9 мг/мл анти-Т-середнім моноклональним антитілом, і елюювали пептидом EYMPME (SEQ ID NO: 14) в об'ємі 75 мкМ в буфері А, що містить 25% гліцерину. З'єднували фракції, що містять Akt/PKB, і чистоту білка оцінювали електрофорезом в SDS-PAGE. Проводили кількісний аналіз очищеного білка з використанням стандартного Бредфордського протоколу. Очищений білок піддавали швидкому заморожуванню в рідкому азоті і зберігали при -70°С. Akt і Akt з делеціями плекстрин-гомологічного домену очищували з клітин S2, передбачаючи активацію. Akt і Akt з делеціями плекстрингомологічного домену піддавали активації (Alessi et al. Current Biology 7:261-269) в реакції, що містить 10 нм PDK1 (Upstate Biotechnology, Inc.), ліпідні везикули (10 мкМ фосфатидилінозитол-3,4,5трифосфату - Metreya, Inc, 100 мкМ фосфатидилхоліну і 100 мкМ фосфатидилсерину - Avanti Polar lipids, Inc.) і активуючий буфер (50 мМ Трис з рівнем рН 7,4, 1,0 мМ ДТТ, 0,1 мМ ЕГТА, 1,0 мкМ мікроцистину-LR, 0,1 мМ АТФ, 10 мМ MgCl2, 333 мкг/мл БСА і 0,1 мМ ЕДТА). Реакційну суміш інкубували при 22°С протягом 4 годин. Аліквотні кількості піддавали швидкому заморожуванню в рідкому азоті. ПРИКЛАД 4 Аналізи Akt-кінази Проводили аналіз активованих Akt ізоформ і конструкцій з делецією плекстрин-гомологічного домену, використовуючи біотинільовану пептидну матрицю кінази глікогенсинтетази (GSK). Міру фосфорилування пептиду визначали за гомогенною флюоресценцією з розрізненням у часі (HTRF), з використанням навантаженого лантанідним хелатом моноклонального антитіла (Lance), специфічного для фосфопептиду, в комбінації зі стрептавідин-зв'язаним алофікоціаніном (SA-APC), 93296 56 флуорофором, який буде зв'язуватися з групою біотину на пептиді. Якщо Lance-антитіло і алофікоціанін (АРС) знаходяться в близькості (тобто, з'єднані з однією і тією ж фосфопептидною молекулою), відбувається невипромінювальна передача енергії від Lance-антитіла до АРС, що супроводжується емісією світла від АРС з довжиною хвилі 665 нм. Матеріали, необхідні для аналізу: A. Активований ізозим Akt або конструкція з делецією плекстрин-гомологічного домену. B. Akt-пептидна матриця: Пептид GSK3 (S21) #3928 біотин-GGRARTSSFAEPG (SEQ ID NO: 15), Macromolecular Resources. C. Lance-мічене антифосфо-О8КЗамоноклональне антитіло (Cell Signaling Technology, клон # 27). D. Стрептавідин-зв'язаний алофікоціанин (SAAPC) (Каталог Prozyme № PJ25S лот #896067). Δ. U-донні мікротитрувальні планшети Microfluor®B (Dynex Technologies, № в каталозі 7205). F. HTRF - мікропланшетний аналізатор Discovery®, Packard Instrument Company. G. 100 × Коктейль інгібіторів протеази (КІП): 1 мг/мл бензамідину, 05 мг/мл пепстатину, 0,5 мг/мл лейпептину, 0,5 мг/мл апротиніну. Н. 10 × Тестовий буфер: 500 мМ HEPES з рівнем рН 7,5, 1% ПЕГ, мМ ЕДТА, 1 мМ ЕГТА, 1% БСА, 20 мМ β-гліцерину фосфату. І. Блокуючий буфер: 50 мМ HEPES з рівнем рН 7,3, 16,6 мМ ЕДТА, 0,1% БСА, 0,1% Тритон Х100, 0,17 нМ Lance-міченого моноклонального антитіла - клон # 27, 0,0067 мг/мл SA-APC. J. Робочий розчин ATФ/MgCl2: 1 × тестовий буфер, 1 мМ ДТТ, 1 × КІП, 125 мМ КСl, 5% гліцерину, 25 мМ MgCl2, 375 ТМ АТФ. К. Ферментний робочий розчин: 1 × тестовий буфер, 1 мМ ДТТ, 1 × КІП, 5% гліцерину, активованого Akt. Кінцеві концентрації ферменту вибирають таким чином, щоб аналіз відбувався з прямо пропорційною реакцією. L. Пептидний робочий розчин: 1 × тестовий буфер, 1 мМ ДТТ, 1 × КІП, 5% гліцерину, 2 ТМ GSK3 біотинілованого пептиду # 3928. Постановку реакції починали шляхом додавання робочого розчину 16 TL ATФ/MgCl2 у відповідну ямку 96 ямкового мікротитрувального планшета. Додавали інгібітор або носій (1,0 ТІ) з подальшим додаванням 10 ТІ пептидного робочого розчину. Реакцію починали шляхом додавання 13 ТІ ферментного робочого розчину і змішування. Реакцію залишали для здійснення протягом 50 хвилин і потім зупиняли додаванням 60 ТІ HTRF блокуючого буфера. Після зупинки реакційну суміш інкубували при кімнатній температурі протягом щонайменше 30 хвилин і потім прочитували на пристрої Discovery. Методика тесту свічення стрептавідину в планшеті (Streptavidin Flash Plate): Етап 1: 1 мкл розчину тестової сполуки в 100% ДМСО додавали до 20 мкл 2 × матричного розчину (20 мкМ GSK3 пептиду, 300 мкМ АТФ, 20 мМ MgCl2, 20 мкКі/мл [33Ρ]ΑΤΦ, 1 × тестового буфера, 5% глі 57 церину, 1 мМ ДТТ, 1 × КІП, 0,1% БСА і 100 мМ КСl). Починали реакції фосфорилування шляхом додавання 19 мкл 2 × ферментного розчину (активовані Akt/PKB, 6,4 нМ, 1 × тестового буфера, 5% гліцерину, 1 мМ ДТТ, 1 × КІП і 0,1% БСА). Потім реакційну суміш інкубували при кімнатній температурі протягом 45 хвилин. Етап 2: Реакцію зупиняли шляхом додавання 170 мкл ЕДТА в об'ємі 125 мМ. Після припинення реакції 200 мкл реакційної суміші переносили в планшет Streptavidin Flashplate® PLUS (NEN Life Sciences, № в каталозі SMP103). Планшет інкубували при кімнатній температурі протягом (10 хвилин на планшетному шейкері. Вміст кожної ямки аспірували і ямку ополіскували 2 рази 200 мкл Трисбуферного розчину (TBS) на ямку. Потім ямку промивала 3 рази протягом 5 хвилин TBS в об'ємі 200 мкл на ямку і під час етапів промивання планшети інкубували при кімнатній температурі на планшетному шейкері. Планшети покривали повітрянепроникною стрічкою і робили підрахунок з використанням лічильника Packard TopCount з відповідними параметрами настройки для підрахунку спалахів світла [33Р] в планшетах Flashplates. Методика тесту стрептавідину на фильтрувальній пластині (Streptavidin Filter Plate): Етап 1: Проводили ферментативні реакції, як описано на етапі 1 тесту свічення стрептавідину в планшеті. Етап 2: Реакцію зупиняли шляхом додавання 20 мкл 7,5 М гуанідину гідрохлориду. Після припинення реакції 50 мкл реакційної суміші переносили на фільтрувальну пластину зі стрептавідином (SAM2™ Biotin Capture Plate, Promega, № в каталозі V7542) і реакційну суміш інкубували на фільтрі протягом 1-2 хвилин перед впливом вакуумом. Потім промивали планшету, використовуючи вакуумний колектор таким чином: 1) 47200 мкл/ямку 2 М NaCl; 2) 6×200 мкл/ямку 2М NaCl 1% Н3РО4; 3) 2×200 мкл/ямку диН2О; і 4) 2×100 мкл/ямку 95% етанолу. Після цього мембрани залишали на повітрі до повного висушування перед додаванням сцинтиляційної рідини. Дно планшета заклеювали білою підтримуючою стрічкою і додавали сцинтиляційну рідину Microscint 20 (Packard Instruments, № в каталозі 6013621) в об'ємі 30 мкл/ямку. Верх планшета закривали повітрянепроникною стрічкою і робили підрахунок з використанням лічильника Packard TopCount з відповідними параметрами настройки для підрахунку в планшетах [33Р] зі сцинтиляційною рідиною. Методика тесту фосфоцелюлози на фільтрувальній пластині: Етап 1: Проводили ферментативні реакції, як описано на етапі 1 тесту свічення стрептавідину в планшеті (див. вище) з використанням як матриці послідовності KKGGRARTSSFAEPG (SEQ ID NO: 16) замість послідовності біотин-GGRARTSSFAEPG. Етап 2: 93296 58 Реакцію зупиняли шляхом додавання 20 мкл 0,75% Н3РО4. Після припинення реакції 50 мкл реакційної суміші переносили на фільтрувальний планшет (UNIFILTER™, Whatman P81 Strong Cation Exchanger, білі полістиролові 96-ямкові планшети, Polyfiltronics, № в каталозі 7700-3312), і реакційну суміш інкубували на фільтрі протягом 12 хвилин перед впливом вакуумом. Потім промивали планшет, використовуючи вакуумний колектор таким чином: 1) 9×200 мкл/ямку, 0,75% Н3РО4; і 2) 2×200 мкл/ямку диН2О. Дно планшета заклеювали білою підтримуючою стрічкою і додавали сцинтиляційну рідину Microscint 20 в об'ємі 30 мкл/ямку. Верх планшета закривали повітрянепроникною стрічкою і робили підрахунок з використанням лічильника Packard TopCount з відповідними параметрами настройки для підрахунку в планшетах [33Р] з сцинтиляційною рідиною. Аналіз РКА: У кожному окремому аналізі РКА використовували наступні компоненти: A. 5 × РКА - тестовий буфер (200 мМ Трис з рівнем рН 7,5, 100 мМ MgCl2, 5 мМ βмеркаптоетанолу, 0,5 мМ ЕДТА). B. 50 мкМ вихідного розчину Kemptide (Sigma), розведеного у воді. C. 33Р-АТФ, приготований шляхом розведення 1,0 мкл 33Р-АТФ [10 мКі/мл] в 200 ТІ 50 мкМ вихідного розчину неміченого АТФ. D. 10 мкл вихідного розчину 70 нМ каталітичної субодиниці РКА (каталог UBI # 14-114), розведеного в БСА в кількості 0,5 мг/мл. E. Робочий розчин PKA/Kemptide: рівні об'єми 5 × тестового буфера РКА, розчину Kemptide і каталітичної субодиниці РКА. Постановку реакції здійснювали в 96-ямковому тестовому планшеті з глибокою ямкою. Інгібітор або носій (10 ТІ) додавали до 10 ТІ розчину 33РАТФ. Реакцію починали шляхом додавання в кожну ямку 30 ТІ робочого розчину PKA/Kemptide. Реакційні компоненти змішували і інкубували при кімнатній температурі протягом 20 мін. Реакції припиняли шляхом додавання 50 ТІ 100 ммоль ЕДТА і 100 ммоль пірофосфату натрію і змішували. Продукт ферментної реакції (фосфорилований розчин Kemptide) збирали на р81 фосфоцелюлозний 96-ямковий фільтрувальний планшет (Millipore). Для підготовки планшета кожну ямку в фільтрувальному планшеті р81 заповнювали фосфорною кислотою в об'ємі 75 мМ. Ямку звільняла через фільтр, впливаючи вакуумом на дно планшета. У кожну ямку додавали фосфорну кислоту (75 мм, 170 мкл). Аліквоти в об'ємі 30 мкл з кожної зупиненої РКА реакції додавали у відповідну ямку на фільтрувальному планшеті, що містить фосфорну кислоту. Після вакуумного впливу пептид затримувався на фільтрі, і фільтри промивали 5 разів фосфорною кислотою в об'ємі 75 ммоль. Після заключного промивання фільтри залишали для повітряного сушіння. У кожну ямку додавали сцинтиляційну рідину (30 мкл) і проводили підрахунок фільтрів на TopCount (Packard). Аналіз протеїнкінази С (РКС): 59 У кожному аналізі РКС застосовували наступні компоненти: A. 10 × буфер РКС коактивації: 2,5 мМ ЕГТА, 4 мМ СаСІ2. B. 5 × буфер РКС активації: 1,6 мг/мл фосфатидилсерину, 0,16 мг/мл діацилгліцерину, 100 мМ Трис рН 7,5, 50 мМ MgCІ2, 5 ΜΜ/βмеркаптоетанолу. C. 3Р-АТФ, приготований шляхом розведення 1,0 мкл 33Р-АТФ [10 мКі/мл] в 100 мкл вихідного розчину неміченого АТФ в об'ємі 100 мкМ. D. Основний мієліновий білок (350 мкг/мл, UBI), розведений у воді. E. РКС (50 нг/мл, № в каталозі UBI # 14-115), розведений в 0,5 мг/мл БСА. F. Робочий розчин РКС/основний мієлінового білка: його готували шляхом змішування наступних компонентів: по 5 об'ємів РКС-буфера коактивації і основного мієлінового білка змішували з РКС-буфером активації і РКС по 10 об'ємів кожного. Постановку тестів проводили в 96-ямкових глибоких тестових планшетах. До 5,0 мкл 33Р-АТФ додавали інгібітор або носій (10 ТІ). Реакції починали з додавання робочого розчину РКС/основний мієлінового білка і перемішування. Реакційну суміш інкубували при 30°С протягом 20 хвилин. Реакції зупиняли шляхом додавання 50 ТІ 100 мМ ЕДТА і 100 мМ пірофосфату натрію і перемішування. Фосфорилований основний мієліновий білок збирали на полівініліден-дифторидних (PVDF) мембранах в 96-ямкові фільтрувальні планшети і проводили кількісний аналіз шляхом підрахунку сцинтиляцій. Сполуки винаходу, що розглядається, описані в схемах і таблицях, піддавали вищеописаному аналізу, і було виявлено, що ІС50 становить (50 мкМ в порівнянні з одним або більше з Akt1, Akt2 і Akt3. ПРИКЛАД 5 Клітинний аналіз для визначення інгібування Akt/PKB Клітини (наприклад, клітинні лінії пухлинних клітин LnCaP або PTEN(-/-) з активованим Akt/PKB) висівали в чашки об'ємом 100 мМ. Коли клітини показували близько 70% конфлюентності, в клітини повторно вводили 5 молів свіжого середовища, і в розчин додавали тестову сполуку. Контролі включали клітини, що не зазнавали обробки, клітини, оброблені носієм і клітини, оброблені або LY294002 (Sigma) або вортманіном (Sigma) в об'ємі 20 мкМ або 200 нМ, відповідно. Клітини інкубували протягом 2, 4 або 6 годин і видаляли середовище. Потім клітини промивали ФБР, очищували і переносили в центрифужні пробірки. Клітини осаджували центрифугуванням і знову промивали ФБР. Нарешті, клітинний дебрис ресуспендували в лізуючому буфері (20 мМ Трис рН 8, 140 мМ NaCl, 2 мМ ЕДТА, 1% Тритони, 1 мМ пірофосфату Na, 10 мΜ/β-гліцеролфосфату, 10 мМ NaF, 0,5 мМ NaVO4, 1 мкМ мікросистину (Microsystine) і 1 × коктейлю інгібітору протеаз), помішували на лід протягом 15 хвилин і м'яко перемішували на вортексі для лізису клітин. Лізат центрифугували на настільній ультрацентрифузі Beckman при 100000×g 93296 60 при 4°С протягом 20 хвилин. Супернатантний білок піддавали кількісному аналізу згідно зі стандартним Бредфордським протоколом (BioRad) і зберігали при -70°С до використання. Білки піддавали імунопреципітації (ІП) з очищених лізатів таким чином: для білків Akt1/ΡΚΒ лізати змішували з розчином Santa Cruz sc-7126 (D-17) в NETN (100 мМ NaCl, 20 мМ Трис з рівнем рН 8,0, 1 мМ ЕДТА, 0,5% NP-40) і додавали протеїн A/G агарозу (Santa Cruz sc-2003). Для білків Akt2/PKB лізати змішували в NETN з анти-Аkt2 агарозою (Upstate Bioteclinology # 16-174) і для Ακί3/ΡΚΒβ лізати змішували в NETN з анти-Акt3 агарозою (Upstate Bioteclinology # 16-175). ІП інкубували протягом ночі при 4°С, промивали і сепарували способом SDS-PAGE. Для загального аналізу використовували Вестерн-блоти, щоб дослідити Akt, pThr308 Akt1, pSer473 Akt1 і відповідні сайти фосфорилування на Akt2 і Akt3, і розташовані downstream Aktмішені, з використанням специфічних антитіл (Cell Signaling Technology): антизагальний Akt (№ в каталозі 9272), антифосфо-Akt-cepHH 473 (№ в каталозі 9271) і антифосфо-Акt-треонін 308 (№ в каталозі 9275). Після інкубування з відповідним первинним антитілом, розведеним в ФБР + 0,5% знежиреного сухого молока (NFDM) при 4°С протягом ночі блоти промивали, інкубували протягом 1 години при кімнатній температурі з вторинним антитілом, міченим пероксидазою хріну (HRP) в ФБР + 0,5% NFDM. Виявлення білків проводили з реактивами ECL (Amersham/Pharmacia Biotech RPN2134). ПРИКЛАД 6 Херегулін-індукована активація Akt Клітини MCF7 (клітинна лінія раку молочної залози людини, яка являє собою PTEN+/+) висівали на 100 мМ планшет в кількості 1×106 клітин. Коли клітини показували близько 70-80% конфлюентності, в клітини повторно вводили 5 мл свіжого середовища і інкубували протягом ночі. На наступний ранок в розчин додавали сполуку, клітини інкубували протягом 1-2 годин, і після вказаного часу додавали херегулін (для індукції активації Akt) протягом 30 хвилин і потім клітини аналізували, як описано вище. ПРИКЛАД 7 Інгібування росту пухлини Ефективність in vivo інгібітору росту пухлинних клітин можна підтвердити згідно з декількома протоколами, відомими в даній галузі техніки. Клітинні лінії пухлинних клітин людини, в яких виявляють дерегуляцію шляху РІ3К (такі як LnCaP, РС3, С33а, OVCAR-3, MDA-MB-468, A2780 або подібні) вводили на день 0 підшкірно в лівий бік самицям голих мишей у віці 6-10 тижнів (а також самцям мишей [у віці 10-14 тижнів], що використовуються для ксенотрансплантатів пухлини простати [LnCaP і РС3]) (використовували мишей породи Harlan). Мишей рандомізованно розділяли на групи, в яких застосовували носій, сполуку або комбіноване лікування. Щоденне підшкірне введення починали на день 1 і продовжували протягом експерименту. Альтернативно, інгібувальну тестову сполуку можна вводити безперервно шляхом ін
ДивитисяДодаткова інформація
Назва патенту англійськоюAkt activity inhibitors
Автори англійськоюKelly, Michael, J., III, Layton Mark E, Sanderson Philip E.
Назва патенту російськоюИнгибиторы действия akt
Автори російськоюКелли Майкл Дж., Лейтон Марк Э., Сандерсон Филип Э.
МПК / Мітки
МПК: A61P 35/00, C07D 401/04, C07D 417/04, C07D 403/06, C07D 407/04, C07D 409/04, C07D 413/04, C07D 471/14, A61K 31/4353, C07D 401/06, C07D 403/04
Мітки: дії, інгібітори
Код посилання
<a href="https://ua.patents.su/37-93296-ingibitori-di-akt.html" target="_blank" rel="follow" title="База патентів України">Інгібітори дії akt</a>
Попередній патент: Установка для глибокого біологічного очищення стічних вод
Наступний патент: Акустичний спосіб контролю підповерхневих напружень в твердих середовищах
Випадковий патент: Спосіб виробництва дріжджового тіста