Похідні індолу, фармацевтична композиція на їх основі, спосіб їх одержання (варіанти), проміжна сполука
Номер патенту: 79447
Опубліковано: 25.06.2007
Автори: Шюе Яфень, Хеллберґ Свен, Берґ Стефан, Нюлеф Мартін
Формула / Реферат
1. Сполука формули Іa та Ib:
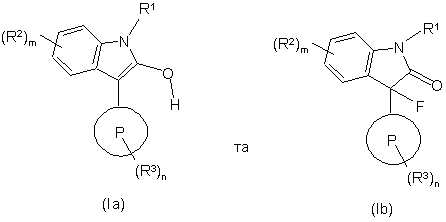 ,
,
де:
Р представляє 5- або 6-членне гетероароматичне кільце, що містить один або два гетероатоми, вибрані незалежно з N, О та S, з яких принаймні один атом є нітрогеном;
R1 представляє гідроген;
R2 та R3 незалежно вибрано з групи: галоген, нітро, С1-6алкіл, С2-6алкеніл, С2-6алкініл, С0-6алкілС3-6циклоалкіл, С0-6алкіларил, С0-6алкілгетероарил, СНО, С0-6алкілОR4, ОС1-6алкілОR4, С0-6алкілSR4, ОС1-6алкілSR4, (CO)R4, (CO)OR4, O(CO)R4, флуорметил, дифлуорметил, трифлуорметил, флуорметокси, дифлуорметокси, трифлуорметокси, ОС1-6алкілціано, С0-6алкілціано, С1-6алкілСО2R4, ОС1-6алкілСO2R4, O(CO)OR4, ОС1-6алкілСОR4, С1-6алкілСОR4, NR40R5, С0-6алкілNR4R5, ОС1-6алкілNR4R5, С0-6алкілСОNR4R5, ОС1-6aлкiлCONR4R5, OС1-6aлкiлNR4(CO)R5, С0-6aлкiлNR4(CO)R5, С0-6aлкiлNR4(CO)NR4R5, O(CO)NR4R5, NR4(CO)OR5, С0-6aлкiл(SO2)NR4R5, OС1-6aлкiл(SO2)NR4R5, С0-6aлкiлNR4(SO2)R5, OС1-6aлкiлNR4(SO2)R5, С0-6aлкiл(SO)NR4R5, OС1-6aлкiл(SO)NR4R5, SO3R4, С0-6aлкiлNR4(SO2)NR4R5, С0-6aлкiлNR4(SO)R5, OС0-6aлкiлNR4(SO)R5, ОС0-6алкілSO2R4, С0-6алкілSO2R4, С0-6aлкiлSOR4, ОС1-6алкілSOR4 та група Х1R6, де X1 представляє безпосередній зв'язок, О, CONR7R8, SO2NR9R10, SO2R11 або NR12R13; причому R6 зчеплений з R8, R10, R11 та R13,
R7, R9 та R12, кожний незалежно, представляють гідроген або С1-6алкіл;
R8, R10, R11 та R13 представляють С1-6алкіл;
R6 представляє феніл або 5-, 6- або 7-членну гетероциклічну групу, що містить один або два гетероатоми, вибрані незалежно з N, О та S, ця гетероциклічна група може бути насиченою чи ненасиченою, або вказаний феніл чи 5-, 6- або 7-членна гетероциклічна група можуть, як варіант, бути конденсованими з 5- або 6-членним насиченим або ненасиченим кільцем, що містить атоми, вибрані незалежно з С, N, О та S, ці феніл або гетероциклічна група можуть бути заміщеними одним або двома замісниками вибраними з W;
m дорівнює 0, 1, 2, 3 або 4;
n дорівнює 0, 1, 2, 3 або 4;
R4 вибрано з групи: гідроген, С1-6алкіл, С2-6алкеніл, С2-6алкініл, С0-6алкілС3-6циклоалкіл, С0-6алкіларил, С0-6алкілгетероарил, С1-6алкілNR14R15 та 5- або 6-членна гетероциклічна група, що містить один чи два гетероатоми, вибрані незалежно з N, О та S, причому вказана гетероциклічна група може, як варіант, бути заміщеною групою Y;
R5 вибрано з групи: гідроген, С1-6алкіл, С2-6алкеніл, С2-6алкініл, С0-6алкілС3-6циклоалкіл, С0-6алкіларил, С0-6алкілгетероарил та С1-6алкілNR14R15; причому R4 та R5 можуть разом утворювати 4-, 5-, 6- або 7-членну гетероциклічну групу, що містить один або більше гетероатомів, вибраних незалежно з N, О та S, причому вказана гетероциклічна група може, як варіант, бути заміщеною групою Y; причому будь-який С1-6алкіл, С2-6алкеніл, С2-6алкініл, С0-6алкілС3-6циклоалкіл, С0-6алкіларил та С0-6алкілгетероарил, що визначено для R2- R5, може бути заміщеним одною або більше групами Z;
R14 та R15 незалежно вибрані з групи: гідроген, С1-6алкіл та С0-6алкілС3-6циклоалкіл, причому R14 та R15 можуть разом утворювати 5- або 6-членну гетероциклічну групу, що містить один або більше гетероатомів, вибраних незалежно з N, О та S, причому вказана гетероциклічна група може, як варіант, бути заміщеною групою Y;
W та Z незалежно вибрано з групи: оксо, галоген, нітро, CN, OR16, С1-6алкіл, С0-6алкіларил, С0-6алкілС3-6циклоалкіл, флуорметил, дифлуорметил, трифлуорметил, флуорметокси, дифлуорметокси, трифлуорметокси, OС1-6алкілNR16R17, NR16R17, CONR16R17, NR16(CO)R17, O(CO)С1-6алкіл, (СО)ОС1-6алкіл, COR16, (SO2)NR16R17, SO2R16, SOR16, (CO)С1-6алкілNR16R17, (SO2)С1-6алкілNR16R17, 5- або 6-членна гетероциклічна група, що містить один або два гетероатоми, вибрані незалежно з N, О та S, феніл та гетероарил, ці гетероциклічна група, феніл або гетероарил можуть, як варіант, бути заміщеними групою Y;
Y вибрано з групи: оксо, галоген, нітро, CN, OR16, С1-6алкіл, С0-6алкіларил, С0-6алкілС3-6циклоалкіл, флуорметил, дифлуорметил, трифлуорметил, флуорметокси, дифлуорметокси, трифлуорметокси, OС1-6алкілNR16R17, NR16R17, CONR16R17, NR16(CO)R17, O(СО)С1-6алкіл, (CO)OС1-6алкіл, COR16, (SO2)NR16R17, SO2R16, SOR16, (CO)С1-6алкілNR16R17, (SO2)С1-6алкілNR16R17, феніл, С0-6алкіларил та гетероарил, причому феніл, С0-6алкіларил та гетероарил можуть бути, як варіант, заміщеними замісником, вибраним з групи: галоген, нітро, CN, OR16, С1-6алкіл, флуорметил, дифлуорметил, трифлуорметил, флуорметокси, дифлуорметокси та трифлуорметокси;
R16 та R17 незалежно вибрані з групи: гідроген та С1-6алкіл, причому R16 та R17 можуть разом утворювати 5- або 6-членну гетероциклічну групу, що містить один або більше гетероатомів, вибраних незалежно з N, О та S; як вільна основа або її фармацевтично прийнятна сіль.
2. Сполука за п. 1, де Р представляє 6-членне гетероароматичне кільце, що містить один або два атоми нітрогену.
3. Сполука за п. 1, де Р представляє піридин.
4. Сполука за п. 1, де кільце Р представляє піримідин.
5. Сполука за будь-яким одним з пп. 1-4, причому вказаною сполукою є сполука формули Іа.
6. Сполука за будь-яким одним з пп. 1-5, де R2 та R3 незалежно вибрані з групи: галоген, нітро, С0-6алкілгетероарил, трифлуорметил, С0-6алкілціано, С0-6алкілNR4R5, С0-6алкілСОNR4R5, ОС1-6алкілNR4R5, С0-6aлкiл(SO2)NR4R5 та група Х1R6, де X1 представляє безпосередній зв'язок; R6 представляє 5-членну гетероциклічну групу, що містить один або два гетероатоми, вибрані незалежно з N, О та S, і ця гетероциклічна група може бути заміщеною одним або двома замісниками W, переважно С1-6алкілом;
m дорівнює 0, 1, 2; а
n дорівнює 1 чи 2.
7. Сполука за будь-яким одним з пп. 1 - 6, де:
R4 незалежно вибрано з групи: гідроген, С1-6алкіл, С0-6алкілС3-6циклоалкіл, С0-6алкіларил, С0-6алкілгетероарил, С1-6алкілNR14R15 та 5- або 6-членна гетероциклічна група, що містить один або два гетероатоми, вибрані незалежно з N, О та S, причому вказана гетероциклічна група може, як варіант, бути заміщеною групою Y;
R5 вибрано з групи: гідроген, С1-6алкіл; причому R4 та R5 можуть разом утворювати 4-, 5-, 6- або 7-членну гетероциклічну групу, що містить один або більше гетероатомів, вибраних незалежно з N, О та S, причому вказана гетероциклічна група може, як варіант, бути заміщеною групою Y; причому будь-який С1-6алкіл, С0-6алкіларил, визначений для R2 - R5, може бути заміщеним одною або більше групами Z;
R14 та R15 представляють незалежно С1-6алкіл, причому R14 та R15 можуть разом утворювати 5- або 6-членну гетероциклічну групу, що містить один або більше гетероатомів, вибраних незалежно з N, О та S;
Z незалежно вибрано з групи: галоген, С1-6алкіл, CN, NR16R17
Y вибрано з групи: С1-6алкіл, С0-6алкіларил, NR16R17, феніл, причому феніл може бути, як варіант, заміщеним нітро та трифлуорметилом;
R16 та R17 представляють С1-6алкіл, причому R16 та R17 можуть разом утворювати 5-або 6-членну гетероциклічну групу, що містить один або більше гетероатомів, вибраних незалежно з N, О та S.
8. Сполука за будь-яким одним з пп. 1-3 та пп. 5-7, де Р представляє піридин; R2 представляє CN; R3 представляє С0-6алкілNR4R5; причому R4 та R5 можуть разом утворювати 4-, 5-, 6- або 7-членну гетероциклічну групу, що містить один або більше гетероатомів, вибраних незалежно з N, О та S.
9. Сполука за п.1, яка вибрана з групи: 2-(5-ціано-2-гідроксі-1Н-індол-3-іл)-N-[2-(диметиламіно)етил]ізонікотинамід;
2-гідрокси-3-{4-[(4-метилпіперазин-1-іл)карбоніл]піридин-2-іл}-1Н-індол-5-карбонітрилу гідрохлорид;
2-гідрокси-3-{5-[(4-метилпіперазин-1-іл)карбоніл]піридин-2-іл}-1Н-індол-5-карбонітрил;
2-гідрокси-3-[5-(морфолін-4-ілметил)піридин-2-іл]-1Н-індол-5-карбонітрилу гідрохлорид;
2-гідрокси-3-[6-(2-морфолін-4-ілетокcи)піримідин-4-іл]-1Н-індол-5-карбонітрил;
2-гідрокси-3-{5-[(4-метилпіперазин-1-іл)метил]піридин-2-іл}-1Н-індол-5-карбонітрилу гідрохлорид;
6-(5-ціано-2-гідроксі-1Н-індол-3-іл)-N-[2-(диметиламіно)етил]-N-метилнікотинаміду гідрохлорид;
2-гідрокси-3-{5-[(4-метилпіперазин-1-іл)сульфоніл]піридин-2-іл}-1Н-індол-5-карбонітрилу гідрохлорид;
6-(5-ціано-2-гідроксі-1Н-індол-3-іл)-N-(2-піролідин-1-ілетил)піридин-3-сульфонаміду гідрохлорид;
2-гідрокси-3-[5-(морфолін-4-ілметил)піридин-2-іл]-1Н-індол-5-карбонітрил;
2-гідрокси-3-[5-(піролідин-1-ілметил)піридин-2-іл]-1Н-індол-5-карбонітрилу гідрохлорид;
2-гідрокси-3-{5-[(4-метил-1,4-діазепан-1-іл)метил]піридин-2-іл}-1Н-індол-5-карбонітрилу гідрохлорид;
2-гідрокси-3-{5-[(4-піролідин-1-ілпіперидин-1-іл)метил]піридин-2-іл}-1Н-індол-5-карбонітрилу гідрохлорид;
3-(5-{[3-(диметиламіно)піролідин-1-іл]метил}піридин-2-іл)-2-гідрокси-1Н-індол-5-карбонітрил;
2-гідрокси-3-{5-[(4-метилпіперидин-1-іл)метил)піридин-2-іл}-1Н-індол-5-карбонітрил;
2-гідрокси-3-{5-[(4-фенілпіперазин-1іл)метил]піридин-2-іл}-1Н-індол-5-карбонітрил;
3-[5-(азетидин-1-ілметил)піридин-2-iл]-2-гідрокси-1Н-індол-5-карбонітрил;
2-гідрокси-3-[5-({4-[2-нітро-4-(трифлуорметил)феніл]піперазин-1-іл}метил)піридин-2-іл]-1Н-індол-5-карбонітрил;
3-(5-{[(2-ціаноетил)(етил)аміно]метип}піридин-2-іл)-2-гідроксі-1Н-індол-5-карбонітрил;
3-(5-{[(4-хлорбензил)(метил)аміно]метил}піридин-2-іл)-2-гідроксі-1Н-індол-5-карбонітрил;
3-(5-{[(2-фурилметил)(метил)аміно]метил}піридин-2-іл)-2-гідроксі-1Н-індол-5-карбонітрил;
2-гідрокси-3-(5-{[метил(феніл)аміно]метил}піридин-2-іл)-1Н-індол-5-карбонітрил;
2-гідрокси-3-{5-[(3-метилпiперидин-1-іл)метил]піридин-2-іл}-1Н-індол-5-карбонітрил;
3-(5-{[циклогексил(метил)аміно]метил}піридин-2-іл)-2-гідроксі-1Н-індол-5-карбонітрил;
2-гідрокси-3-[5-(піперидин-1-ілметил)піридин-2-іл]-1Н-індол-5-карбонітрил;
3-{5-[(4-метилпіперазин-1-іл)сульфоніл]піридин-2-іл}-1Н-індол-2-олу гідрохлорид;
6-хлор-3-{5-[(4-метилпіперазин-1-іл)сульфоніл]піридин-2-іл}-1Н-індол-2-олу гідрохлорид;
3-[5-(морфолін-4-ілкарбоніл)піридин-2-іл]-5-нітро-1Н-індол-2-ол;
6-бром-3-[5-(морфолін-4-ілметил)піридин-2-іл]-1Н-індол-2-олу гідрохлорид;
2-гідрокси-3-[5-(морфолін-4-ілметил)піридин-2-іл]-1Н-індол-6-карбонітрилу гідрохлорид;
5-бром-3-[5-(морфолін-4-ілметил)піридин-2-іл]-1Н-індол-2-олу гідрохлорид;
5,6-дибром-3-[5-(морфолін-4-ілметил)піридин-2-іл]-1Н-індол-2-олу гідрохлорид;
3-флуор-3-[5-(морфолін-4-ілметил)придин-2-іл]-2-оксоіндолін-6-карбонітрилу гідрохлорид;
3-{5-[(4-бензилпіперазин-1-іл)сульфоніл]піридин-2-іл}-2-гідроксі-1Н-індол-5-карбонітрилу гідрохлорид;
2-гідрокси-3-(5-{[4-(3-метилбутил)піперазин-1-іл]сульфоніл}піридин-2-іл)-1Н-індол-5-карбонітрилу гідрохлорид;
2-гідрокси-3-{5-[(4-ізопропілпіперазин-1-іл)сульфоніл]піридин-2-іл}-1Н-індол-5-карбонітрилу гідрохлорид;
3-{5-[(4-етилпіперазин-1-іл)сульфоніл]піридин-2-іл}-2-гідроксі-1Н-індол-5-карбонітрилу гідрохлорид;
3-[5-(морфолін-4-ілметил)піридин-2іл]-5-піридин-3-іл-1Н-індол-2-ол;
3-[5-(морфолін-4-ілметил)піридин-2-іл]-5-тієн-2-іл-1Н-індол-2-олу гідрохлорид;
5-(2-фурил)-3-[5-(морфолін-4-ілметил)піридин-2-іл]-1Н-індол-2-олу гідрохлорид;
3-{3-бром-5-[(4-метилпіперазин-1-іл)сульфоніл]піридин-2-іл}-5-нітро-1Н-індол-2-олу гідрохлорид;
3-[5-(морфолін-4-ілметил)піридин-2-іл]-5-(трифлуорметил)-1Н-індол-2-олу гідрохлорид;
2-гідрокси-3-{5-[(4-метилпіперазин-1-іл)сульфоніл]піридин-2-іл}-1Н-індол-6-карбонітрилу гідрохлорид;
N-[(1-етилпіролідин-2-іл)метил]-6-(2-гідрокси-5-нітро-1Н-індол-3-іл)нікотинаміду гідрохлорид;
6-(2-гідрокси-5-нітро-1Н-індол-3-іл)-N-(2-морфолін-4-ілетил)нікотинаміду гідрохлорид;
6-(2-гідрокси-5-нітро-1Н-індол-3-іл)-N-метил-N-(1-метилпіперидин-4-іл)нікотинаміду гідрохлорид;
5-нітро-3-{5-[(4-піролідин-1-ілпіперидин-1-іл)карбоніл]піридин-2-іл}-1Н-індол-2-олу гідрохлорид;
3-(5-{[3-(диметиламіно)піролідин-1-іл]карбоніл}піридин-2-іл)-5-нітро-1Н-індол-2-олу гідрохлорид;
N-[2-(диметиламіно)-1-метилетил]-6-(2-гідрокси-5-нітро-1Н-індол-3-іл)нікотинаміду гідрохлорид;
6-(2-гідрокси-5-нітро-1Н-індол-3-іл)-N-(2-піролідин-1-ілетил)нікотинаміду фумарат;
3-{5-[(4-метилпіперазин-1-іл)карбоніл]піридин-2-іл}-5-нітро-1Н-індол-2-олу фумарат;
6-(5-ціано-2-гідроксі-1Н-індол-3-іл)-N-(2-піролідин-1-ілетил)нікотинаміду фумарат;
6-(5-цiaнo-2-гiдpoкcі-1H-iндoл-3-iл)-N-мeтил-N-(2-пipoлiдин-1-iлeтил)пipидин-3-сульфонаміду гідрохлорид;
6-(5-ціано-2-гідроксі-1Н-індол-3-іл)-N-[2-(диметиламіно)етил]піридин-3-сульфонаміду фумарат;
6-(5-ціано-2-гідроксі-1Н-індол-3-іл)-N-[2-(диметиламіно)етил]-N-етилпіридин-3-сульфонаміду фумарат;
6-(5-ціано-2-гідроксі-1Н-індол-3-іл)-N-[(1-етилпіролідин-2-іл)метил]піридин-3-сульфонаміду фумарат;
2-гідрокси-3-{5-[(4-метил-1,4-діазепан-1-іл)сульфоніл]піридин-2-іл}-1Н-індол-5-карбонітрилу фумарат;
2-гідрокси-3-[5-(морфолін-4-ілсульфоніл)піридин-2-іл]-1Н-індол-5-карбонітрил;
3-{5-[(4-метилпіперазин-1-іл)сульфоніл]піридин-2-іл}-5-(2-метил-1,3-тіазол-4-іл)-1Н-індол-2-олу гідрохлорид;
3-{5-[(4-метилпіперазин-1-іл)сульфоніл]піридин-2-іл}-5-(1,3-тіазол-4-іл)-1Н-індол-2-олу фумарат;
3-{5-[(4-метилпіперазин-1-іл)сульфоніл]піридин-2-іл}-5-(1,3-оксазол-5-іл)-1Н-індол-2-ол;
3-[5-(морфолін-4-ілметил)піридин-2-іл]-5-нітро-1Н-індол-2-олу гідрохлорид.
10. Фармацевтична композиція, що містить як активний інгредієнт терапевтично ефективну кількість сполуки за будь-яким одним з пп. 1-9 в асоціації з фармацевтично прийнятними носіями або розріджувачами.
11. Фармацевтична композиція за п. 10, призначена для застосування у попередженні та/або лікуванні станів, асоційованих з глікогенсинтазною кіназою-3.
12. Сполука за будь-яким одним з пп. 1-9, призначена для застосування у терапії.
13. Застосування сполуки за будь-яким одним з пп. 1-9 у виробництві медикаменту для попередження та/або лікування станів, асоційованих з глікогенсинтазною кіназою-3.
14. Застосування сполуки за будь-яким одним з пп. 1-9 у виробництві медикаменту для попередження та/або лікування деменції, хвороби Альцгеймера, хвороби Паркінсона, лобово-скроневої деменції типу Паркінсона, комплексу деменції Паркінсона-Гуама, ВІЛ- деменції, хвороб з асоційованими патологіями сплетіння нейрофібрил та деменції боксерів.
15. Застосування сполуки за п. 14, коли хвороба є хворобою Альцгеймера.
16. Застосування сполуки за будь-яким одним з пп. 1-9 у виробництві медикаменту для попередження та/або лікування бічного аміотрофічного склерозу, кірково-базальної дегенерації, синдрому Дауна, хвороби Гентингтона, постенцефалітного паркінсонізму, прогресивного супрануклеарного паралічу, хвороби Піка, хвороби Нейманна-Піка, інсульту, травми голови та інших хронічних нейродегенеративних хвороб, біполярної хвороби, афективних розладів, депресії, шизофренії, когнітивніх розладів, втрати волосся та контрацептивного лікування.
17. Застосування сполуки за будь-яким одним з пп. 1 - 9 у виробництві медикаменту для попередження та/або лікування передбожевільних станів, помірного погіршання пізнавальної здатності, асоційованого з віком погіршання пам'яті, асоційованої з віком нестачі пізнавальної здатності, погіршання пізнавальної здатності без деменції, помірної нестачі пізнавальної здатності, помірного нейрокогнітивного зниження, старечого безпам'ятства, погіршання пам'яті та погіршання пізнавальної здатності, судинної деменції, деменції з тільцями Леві, лобово-скроневої деменції та андрогенетичної алопеції.
18. Спосіб попередження та/або лікування станів, асоційованих з глікогенсинтазною кіназою-3, який передбачає введення ссавцю, включаючи людину, що потребує такого попередження та/або лікування, терапевтично ефективної кількості сполуки формул Іа чи Іb за будь-яким одним з пп. 1-9.
19. Спосіб попередження та/або лікування деменції, хвороби Альцгеймера, хвороби Паркінсона, лобово-скроневої деменції типу Паркінсона, комплексу деменції Паркінсона-Гуама, ВІЛ-деменції, хвороб з асоційованими патологіями сплетіння нейрофібрил та деменції боксерів, який передбачає введення ссавцю, включаючи людину, що потребує такого попередження та/або лікування, терапевтично ефективної кількості сполуки формул Іа чи Іb за будь-яким одним з пп. 1-9.
20. Спосіб за п. 19, коли хвороба є хворобою Альцгеймера.
21. Спосіб попередження та/або лікування бічного аміотрофічного склерозу, кірково-базальної дегенерації, синдрому Дауна, хвороби Гентингтона, постенцефалітного паркінсонізму, прогресивного супрануклеарного паралічу, хвороби Піка, хвороби Нейманна-Піка, інсульту, травми голови та інших хронічних нейродегенеративних хвороб, біполярної хвороби, афективних розладів, депресії, шизофренії, когнітивних розладів, втрати волосся та контрацептивного лікування, який передбачає введення ссавцю, включаючи людину, що потребує такого попередження та/або лікування, терапевтично ефективної кількості сполуки формул Іа чи Іb за будь-яким одним з пп. 1-9.
22. Спосіб попередження та/або лікування передбожевільних станів, помірного погіршання пізнавальної здатності, асоційованого з віком погіршання пам'яті, асоційованої з віком нестачі пізнавальної здатності, погіршання пізнавальної здатності без деменції, помірної нестачі пізнавальної здатності, помірного нейрокогнітивного зниження, старечого безпам'ятства, погіршання пам'яті та погіршання пізнавальної здатності, судинної деменції, деменції з тільцями Леві, лобово-скроневої деменції та андрогенетичної алопеції, який передбачає введення ссавцю, включаючи людину, що потребує такого попередження та/або лікування, терапевтично ефективної кількості сполуки формул Іа чи Іb за будь-яким одним з пп. 1-9.
23. Спосіб отримання сполуки формули Іа за п. 1, у якому: здійснюють взаємодію сполуки формули В (XV, XVIII, XVІІІa, XXI, XXIII), де L1 представляє відщеплювану групу, таку як галоген, наприклад, флуор, хлор або бром, зі сполукою формули С (сполуки формул III, V, IX, XII, XIII); де R1, R2 та m визначено у п. 1, з отриманням сполуки формули Іа
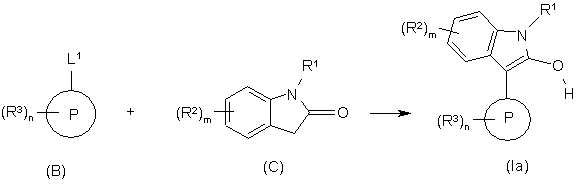
у прийнятному розчиннику при температурі між +10 °С та +150 °С.
24. Спосіб отримання сполуки формули Іа за п. 1, у якому:
здійснюють взаємодію сполуки формули XXV, де halo представляє галоген, наприклад, флуор, хлор або бром, зі сполукою формули С (сполуки формул ІІІ, V, IX, XII, XIII); де R1, R2 та m визначено у п. 1, з отриманням сполуки формули Іа
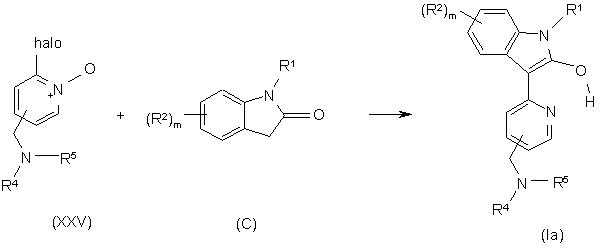 ,
,
у прийнятному розчиннику при температурі між +10°С та +150°С.
25. Спосіб отримання сполуки формули Іа за п. 1, у якому:
здійснюють взаємодію сполуки формули XXVII з прийнятним аміном HNR4R5, з отриманням сполуки формули Іа
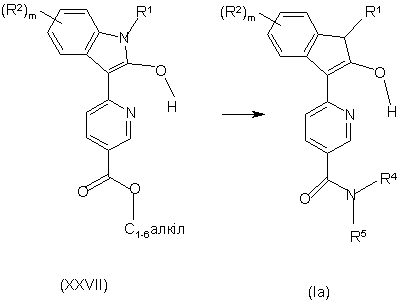 ,
,
причому
і) реакцію сполуки формули XXVII з прийнятним аміном R4R5NH проводять у придатному розчиннику у присутності придатного реагенту при температурі реакції між 0 °С та температурою кипіння із зворотним холодильником, або
іі) реакцію сполуки формули XXVII з прийнятним аміном R4R5NH проводять з чистим аміном R4R5NH або у придатному розчиннику, з придатною основою чи без неї при температурі між -20 °С та +150 °С.
26. Спосіб отримання сполуки формули Іа за п. 1, у якому:
шляхом відновлення N-оксиду у сполуці формули XXVIII отримують сполуку формули Іа
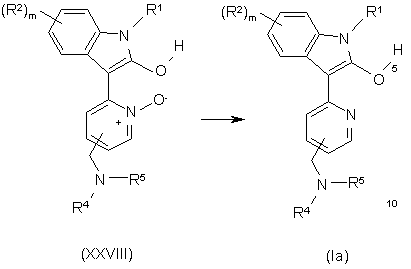 ,
,
застосовуючи придатний реагент у придатному розчиннику при температурі між 0 °С та +100 °С.
27. Спосіб отримання сполуки формули Іb за п. 1, в якому:
здійснюють флуорування сполуки формули Іa, з отриманням сполуки формули Іb;
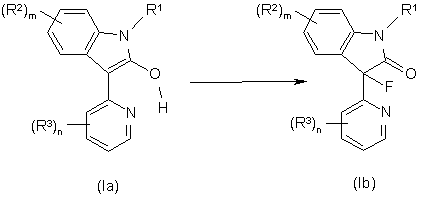 ,
,
у прийнятному розчиннику у присутності придатного реагенту флуорування та придатної основи при температурі реакції між -40 °С та +80 °С.
28. Сполука формули XXVII
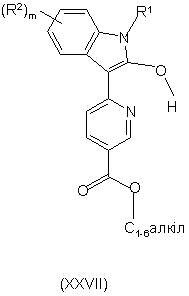 ,
,
де R1 представляє гідроген; R2 вибрано з групи: галоген; нітро, С1-6алкіл, флуорметил, дифлуорметил, трифлуорметил, флуорметокси, дифлуорметокси, трифлуорметокси, ОС1-6алкілNR4R5, С0-6алкілціано, С0-6алкілСОNR4R5, С0-6aлкiл(SO2)NR4R5, С0-6алкілNR4R5 та група X1R6, де Х1 представляє безпосередній зв'язок, О, CONR7R8, SO2NR9R10, SO2R11 або NR12R13; R7, R9 тa R12, кожний незалежно, представляють гідроген або С1-3алкіл; R8, R10, R11 та R13 представляють С0-4алкіл; R6 представляє феніл або 5-, 6- або 7-членну гетероциклічну групу, що містить один або два гетероатоми, вибрані незалежно з N, О та S, ця гетероциклічна група може бути насиченою чи ненасиченою, або вказаний феніл чи 5-, 6- або 7-членна гетероциклічна група можуть, як варіант, бути конденсованими з 5- або 6-членним насиченим або ненасиченим кільцем, що містить атоми, вибрані незалежно з С, N, О та S, причому феніл або гетероциклічна група можуть бути заміщеними одним або двома замісниками, вибраними з W; a R6 зчеплений з R8, R10, R11 та R13;
R4 вибрано з групи: гідроген, С1-6алкіл, С2-6алкеніл, С2-6алкініл, С0-6алкілС3-6циклоалкіл, С0-6алкіларил, С0-6алкілгетероарил, С1-6aлкiлNR14R15 та 5- або 6-членна гетероциклічна група, що містить один або два гетероатоми, вибрані незалежно з N, О та S, причому вказана гетероциклічна група може, як варіант, бути заміщеною групою Y;
R5 вибрано з групи: гідроген, С1-6алкіл, С2-6алкеніл, С2-6алкініл, С0-6алкілС3-6циклоалкіл, С0-6алкіларил, С0-6алкілгетероарил та С1-6aлкiлNR14R15; причому R4 та R5 можуть разом утворювати 4-, 5-, 6- або 7-членну гетероциклічну групу, що містить один або більше гетероатомів, вибраних незалежно з N, О ти S, причому вказана гетероциклічна група може, як варіант, бути заміщеною групою Y; причому будь-який С1-6алкіл, С2-6алкеніл, С2-6алкініл, С0-6алкілС3-6циклоалкіл, С0-6алкіларил та С0-6алкілгетероарил, визначений для R2 - R5, може бути заміщеним одною або більше групами Z;
m дорівнює 0, 1, 2, 3 або 4.
29. Сполука за п. 28, де R1 представляє гідроген; R2 вибрано з нітро та ціано;
m дорівнює 1.
30. Сполука за п. 28, яка вибрана з групи:
етил 6-(2-гідрокси-5-нітро-1Н-індол-3-іл)нікотинат;
етил 6-(2-гідрокси-5-ціано-1Н-індол-3-іл)нікотинат;
як вільна основа або її сіль.
31. Сполука формули XXVIII
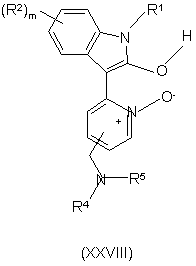 ,
,
де
R1 представляє гідроген; R2 вибрано з групи: галоген, нітро, С1-6алкіл, флуорметил, дифлуорметил, трифлуорметил, флуорметокси, дифлуорметокси, трифлуорметокси, ОС1-6алкілNR4R5, С0-6алкілціано, С0-6алкілСОNR4R5, С0-6aлкiл(SO2)NR4R5, С0-6алкілNR4R5 та група Х1R6, деХ1 представляє безпосередній зв'язок, О, CONR7R8, SO2NR9R10, SO2R11 або NR12R13; R7, R9 та R12, кожний незалежно, представляють гідроген або С1-3алкіл; R8, R10, R11 та R13 представляють С0-4алкіл; R6 представляє феніл або 5-, 6- або 7-членну гетероциклічну групу, що містить один або два гетероатоми, вибрані незалежно з N, О та S, ця гетероциклічна група може бути насиченою чи ненасиченою, або вказаний феніл чи 5-, 6- або 7-членна гетероциклічна група можуть, як варіант, бути конденсованими з 5- або 6-членним насиченим або ненасиченим кільцем, що містить атоми, вибрані незалежно з С, N, О та S, причому феніл або гетероциклічна група можуть бути заміщеними одним або двома замісниками, вибраними з W; a R6 зчеплений з R8, R10, R11 та R13;
R4 вибрано з групи: гідроген, С1-6алкіл, С2-6алкеніл, С2-6алкініл, С0-6алкілС3-6циклоалкіл, С0-6алкіларил, С0-6алкілгетероарил, С1-6aлкiлNR14R15 та 5- або 6-членна гетероциклічна група, що містить один або два гетероатоми, вибрані незалежно з N, О та S, причому вказана гетероциклічна група може, як варіант, бути заміщеною групою Y;
R5 вибрано з групи: гідроген, С1-6алкіл, С2-6алкеніл, С2-6алкініл, С0-6алкілС3-6циклоалкіл, С0-6алкіларил, С0-6алкілгетероарил та С1-6aлкiлNR14R15; причому R4 та R5 можуть разом утворювати 4-, 5-, 6- або 7-членну гетероциклічну групу, що містить один або більше гетероатомів, вибраних незалежно з N, О та S, причому вказана гетероциклічна група може, як варіант, бути заміщеною групою Y, причому будь-який С1-6алкіл, С2-6алкеніл, С2-6алкініл, С0-6алкілС3-6циклоалкіл, С0-6алкіларил та С0-6алкілгетероарил, визначений для R2- R5, може бути заміщеним одною або більше групами Z;
m дорівнює 0, 1, 2, 3 або 4.
32. Сполука за п. 31, де R1 представляє гідроген; R2 представляє групу X1R6, де X1 представляє безпосередній зв'язок; R6 представляє 5- або 6-членну гетероциклічну групу, що містить один або два гетероатоми, вибрані незалежно з N, О та S; m дорівнює 1.
33. Сполука за п. 31, яка вибрана з групи:
3-[5-(морфолін-4-ілметил)-1-оксидопіридин-2-іл]-5-піридин-3-іл-1Н-індол-2-ол;
3-[5-(морфолін-4-ілметил)-1-оксидопіридин-2-іл]-5-тієн-2-іл-1Н-індол-2-ол;
5-(2-фурил)-3-[5-(морфолін-4-ілметил)-1-оксидопіридин-2-іл]-1Н-індол-2-ол;
як вільна основа або її сіль.
34. Застосування сполук за пп. 28-33 для отримання сполуки формул Iа або Іb за будь-яким одним з пп. 1-9.
Текст
1. Сполука формули Іa та Ib: R1 (R2 ) m N R1 (R2 )m N O O H P F та P (R3 )n (Ia) (R 3) n , де: Р представляє 5- або 6-членне гетероароматичне кільце, що містить один або два гетероатоми, вибрані незалежно з N, О та S, з яких принаймні один атом є нітрогеном; R1 представляє гідроген; R2 та R3 незалежно вибрано з групи: галоген, нітро, С1-6алкіл, С2-6алкеніл, С2-6алкініл, С0-6алкілС 3(Ib) UA (21) 20040806742 (22) 28.03.2003 (24) 25.06.2007 (86) PCT/SE03/00508, 28.03.2003 (31) 0200979-3 (32) 28.03.2002 (33) SE (46) 25.06.2007, Бюл. № 9, 2007 р. (72) Берґ Стефан , SE, Хеллберґ Свен , SE, Нюлеф Мартін , SE, Шюе Яфень , SE (73) АСТРАЗЕНЕКА АБ, SE (56) WO 0125220 A1, 01.04.2001 WO 0210158 A2, 07.02.2002 WO 0071129 A1, 30.11.2000 WO 0132653 A1, 10.05.2001 WO 9742187 A1, 13.11.1997 EP 0667340 A1, 16.08.1995 2 (11) (54) ПОХІДНІ ІНДОЛУ, ФАРМАЦ ЕВТИЧНА КОМПОЗИЦІЯ НА ЇХ ОСНОВІ, СПОСІБ ЇХ ОДЕРЖАННЯ (ВАРІАНТИ), ПРОМІЖНА СПОЛУКА 79447 (13) ДО ПАТЕНТУ НА ВИНАХІД (19) ДЕРЖАВНИЙ Д ЕПАРТАМЕНТ ІНТЕЛ ЕКТУАЛЬНОЇ ВЛАСНОСТІ C07D 401/06 (2007.01) A61P 9/10 (2007.01) МІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ C07D 401/04 (2007.01) 3 79447 4 С0-6алкіларил, С0-6алкілгетероарил, трифлуорметил, флуорметокси, дифлуорметокси, СНО, С0-6алкілОR4, ОС1-6алкілОR4, С0-6алкілSR4, трифлуорметокси, OС1-6алкілNR16R17, NR16R17, ОС1-6алкілSR4, (CO)R4, (CO)OR 4, O(CO)R 4, флуорCONR16R17, NR16(CO)R17, O(CO)С1-6алкіл, (СО)ОС1метил, дифлуорметил, трифлуорметил, флуормеCOR16, (SO2)NR16R17, SO 2R16 , SOR16, 6алкіл, токси, дифлуорметокси, трифлуорметокси, ОС1(CO)С1-6алкілNR16R17, (SO2)С1-6алкілNR16R17, 5- або 4 6-членна гетероциклічна група, що містить один 6алкілціано, С 0-6алкілціано, С 1-6алкілСО2R , ОС 14 O(CO)OR 4, ОС1-6алкілСОR4, С1або два гетероатоми, вибрані незалежно з N, О та 6алкілСO2R , 4 NR40R5, С0-6алкілNR4R5, ОС1S, феніл та гетероарил, ці гетероциклічна група, 6алкілСОR , 4 5 С0-6алкілСОNR4R5, ОС1феніл або гетероарил можуть, як варіант, бути 6алкілNR R , 4 5 OС1-6aлкiлNR4(CO)R5, С0заміщеними групою Y; 6aлкiлCONR R , 4 5 С0-6aлкiлNR4(CO)NR4R5, Y вибрано з групи: оксо, галоген, нітро, CN, OR16, 6aлкiлNR (CO)R , 4 5 4 5 4 5 O(CO)NR R , NR (CO)OR , С0-6aлкiл(SO2)NR R , С1-6алкіл, С0-6алкіларил, С0-6алкілС 3-6циклоалкіл, OС1-6aлкiл(SO2)NR4R5, С0-6aлкiлNR4(SO2)R5, OС1флуорметил, дифлуорметил, трифлуорметил, 4 5 С 0-6aлкiл(SO)NR4R5, OС1флуорметокси, дифлуорметокси, трифлуорметок6aлкiлNR (SO2)R , 4 5 4 4 4 5 си, OС1-6алкілNR16R17, NR16R17 , CONR16R17, 6aлкiл(SO)NR R , SO3R , С 0-6aлкiлNR (SO2)NR R , 4 5 4 5 16 17 С0-6aлкiлNR (SO)R , OС0-6aлкiлNR (SO)R , ОС0NR (CO)R , O(СО)С 1-6алкіл, (CO)OС1-6алкіл, 4 4 4 COR16, (SO 2)NR16R17, SO2R16, SOR 16, (CO)С16алкілSO2R , С 0-6алкілSO2R , С 0-6aлкiлSOR , ОС 14 1 6 1 16 17 16 17 6алкілSOR та група Х R , де X представляє без6алкілNR R , (SO2)С 1-6алкілNR R , феніл, С 07 8 9 10 посередній зв'язок, О, CONR R , SO2NR R , 6алкіларил та гетероарил, причому феніл, С 0SO2R11 або NR12R13; причому R6 зчеплений з R8, 6алкіларил та гетероарил можуть бути, як варіант, R10, R11 та R13 , заміщеними замісником, вибраним з групи: галоR7, R9 та R12, кожний незалежно, представляють ген, нітро, CN, OR 16, С1-6алкіл, флуорметил, дифгідроген або С1-6алкіл; луорметил, трифлуорметил, флуорметокси, дифR8, R10 , R11 та R 13 представляють С 1-6алкіл; луорметокси та трифлуорметокси; R6 представляє феніл або 5-, 6- або 7-членну геR16 та R17 незалежно вибрані з групи: гідроген та тероциклічну груп у, що містить один або два гетеС1-6алкіл, причому R16 та R17 можуть разом утвороатоми, вибрані незалежно з N, О та S, ця гетерювати 5- або 6-членну гетероциклічну гр упу, що роциклічна група може бути насиченою чи містить один або більше гетероатомів, вибраних ненасиченою, або вказаний феніл чи 5-, 6- або 7незалежно з N, О та S; як вільна основа або її фачленна гетероциклічна група можуть, як варіант, рмацевтично прийнятна сіль. бути конденсованими з 5- або 6-членним насиче2. Сполука за п. 1, де Р представляє 6-членне геним або ненасиченим кільцем, що містить атоми, тероароматичне кільце, що містить один або два вибрані незалежно з С, N, О та S, ці феніл або атоми нітрогену. гетероциклічна група можуть бути заміщеними 3. Сполука за п. 1, де Р представляє піридин. одним або двома замісниками вибраними з W; 4. Сполука за п. 1, де кільце Р представляє піриміm дорівнює 0, 1, 2, 3 або 4; дин. n дорівнює 0, 1, 2, 3 або 4; 5. Сполука за будь-яким одним з пп. 1-4, причому R4 вибрано з групи: гідроген, С1-6алкіл, С2-6алкеніл, вказаною сполукою є сполука формули Іа. С2-6алкініл, С0-6алкілС 3-6циклоалкіл, С0-6алкіларил, 6. Сполука за будь-яким одним з пп. 1-5, де R2 та 14 15 С0-6алкілгетероарил, С1-6алкілNR R та 5- або 6R3 незалежно вибрані з групи: галоген, нітро, С0членна гетероциклічна група, що містить один чи 6алкілгетероарил, трифлуорметил, С 0-6алкілціано, два гетероатоми, вибрані незалежно з N, О та S, С0-6алкілNR4R5, С0-6алкілСОNR4R5, ОС14 5 4 5 1 6 причому вказана гетероциклічна група може, як 6алкілNR R , С 0-6aлкiл(SO2)NR R та гр упа Х R , де варіант, бути заміщеною групою Y; X1 представляє безпосередній зв'язок; R6 пред5 R вибрано з групи: гідроген, С1-6алкіл, С2-6алкеніл, ставляє 5-членну гетероциклічну групу, що містить С2-6алкініл, С0-6алкілС 3-6циклоалкіл, С0-6алкіларил, один або два гетероатоми, вибрані незалежно з N, С0-6алкілгетероарил та С 1-6алкілNR14R15; причому О та S, і ця гетероциклічна група може бути заміR4 та R5 можуть разом утворювати 4-, 5-, 6- або 7щеною одним або двома замісниками W, перевачленну гетероциклічну груп у, що містить один або жно С 1-6алкілом; більше гетероатомів, вибраних незалежно з N, О m дорівнює 0, 1, 2; а та S, причому вказана гетероциклічна група може, n дорівнює 1 чи 2. як варіант, бути заміщеною групою Y; причому 7. Сполука за будь-яким одним з пп. 1 - 6, де: будь-який С1-6алкіл, С2-6алкеніл, С2-6алкініл, С0R4 незалежно вибрано з групи: гідроген, С1-6алкіл, С0-6алкіларил та С 0С0-6алкілС 3-6циклоалкіл, С0-6алкіларил, С06алкілС 3-6циклоалкіл, 2 5 14 15 та 5- або 66алкілгетероарил, що визначено для R - R , може 6алкілгетероарил, С 1-6алкілNR R бути заміщеним одною або більше групами Z; членна гетероциклічна група, що містить один або R14 та R15 незалежно вибрані з групи: гідроген, С1два гетероатоми, вибрані незалежно з N, О та S, 14 та причому вказана гетероциклічна група може, як 6алкіл та С 0-6алкілС 3-6циклоалкіл, причому R R15 можуть разом утворювати 5- або 6-членну геваріант, бути заміщеною групою Y; тероциклічну груп у, що містить один або більше R5 вибрано з групи: гідроген, С1-6алкіл; причому R4 гетероатомів, вибраних незалежно з N, О та S, та R5 можуть разом утворювати 4-, 5-, 6- або 7причому вказана гетероциклічна група може, як членну гетероциклічну груп у, що містить один або варіант, бути заміщеною групою Y; більше гетероатомів, вибраних незалежно з N, О W та Z незалежно вибрано з групи: оксо, галоген, та S, причому вказана гетероциклічна група може, нітро, CN, OR16, С1-6алкіл, С0-6алкіларил, С0як варіант, бути заміщеною групою Y; причому будь-який С1-6алкіл, С0-6алкіларил, визначений для 6алкілС 3-6циклоалкіл, флуорметил, дифлуорметил, 6циклоалкіл, 5 79447 6 R2 - R5, може бути заміщеним одною або більше 2-гідрокси-3-[5-({4-[2-нітро-4групами Z; (трифлуорметил)феніл]піперазин-1R14 та R 15 представляють незалежно С 1-6алкіл, іл}метил)піридин-2-іл]-1Н-індол-5-карбонітрил; причому R14 та R15 можуть разом утворювати 53-(5-{[(2-ціаноетил)(етил)аміно]метип}піридин-2або 6-членну гетероциклічну групу, що містить іл)-2-гідроксі-1Н-індол-5-карбонітрил; один або більше гетероатомів, вибраних незалеж3-(5-{[(4-хлорбензил)(метил)аміно]метил}піридинно з N, О та S; 2-іл)-2-гідроксі-1Н-індол-5-карбонітрил; Z незалежно вибрано з групи: галоген, С1-6алкіл, 3-(5-{[(2-фурилметил)(метил)аміно]метил}піридинCN, NR16R17 2-іл)-2-гідроксі-1Н-індол-5-карбонітрил; Y вибрано з групи: С1-6алкіл, С0-6алкіларил, 2-гідрокси-3-(5-{[метил(феніл)аміно]метил}піридинNR16R17, феніл, причому феніл може бути, як варі2-іл)-1Н-індол-5-карбонітрил; ант, заміщеним нітро та трифлуорметилом; 2-гідрокси-3-{5-[(3-метилпiперидин-1R16 та R17 представляють С 1-6алкіл, причому R16 та іл)метил]піридин-2-іл}-1Н-індол-5-карбонітрил; R17 можуть разом утворювати 5-або 6-членну ге3-(5-{[циклогексил(метил)аміно]метил}піридин-2тероциклічну груп у, що містить один або більше іл)-2-гідроксі-1Н-індол-5-карбонітрил; гетероатомів, вибраних незалежно з N, О та S. 2-гідрокси-3-[5-(піперидин-1-ілметил)піридин-2-іл]8. Сполука за будь-яким одним з пп. 1-3 та пп. 5-7, 1Н-індол-5-карбонітрил; де Р представляє піридин; R2 представляє CN; R3 3-{5-[(4-метилпіперазин-1-іл)сульфоніл]піридин-2представляє С 0-6алкілNR4R5; причому R4 та R5 моіл}-1Н-індол-2-олу гідрохлорид; жуть разом утворювати 4-, 5-, 6- або 7-членну ге6-хлор-3-{5-[(4-метилпіперазин-1тероциклічну груп у, що містить один або більше іл)сульфоніл]піридин-2-іл}-1Н-індол-2-олу гідрогетероатомів, вибраних незалежно з N, О та S. хлорид; 9. Сполука за п.1, яка вибрана з групи: 2-(5-ціано3-[5-(морфолін-4-ілкарбоніл)піридин-2-іл]-5-нітро2-гідроксі-1Н-індол-3-іл)-N-[21Н-індол-2-ол; (диметиламіно)етил]ізонікотинамід; 6-бром-3-[5-(морфолін-4-ілметил)піридин-2-іл]-1Н2-гідрокси-3-{4-[(4-метилпіперазин-1індол-2-олу гідрохлорид; іл)карбоніл]піридин-2-іл}-1Н-індол-5-карбонітрилу 2-гідрокси-3-[5-(морфолін-4-ілметил)піридин-2-іл]гідрохлорид; 1Н-індол-6-карбонітрилу гідрохлорид; 2-гідрокси-3-{5-[(4-метилпіперазин-15-бром-3-[5-(морфолін-4-ілметил)піридин-2-іл]-1Ніл)карбоніл]піридин-2-іл}-1Н-індол-5-карбонітрил; індол-2-олу гідрохлорид; 2-гідрокси-3-[5-(морфолін-4-ілметил)піридин-2-іл]5,6-дибром-3-[5-(морфолін-4-ілметил)піридин-2-іл]1Н-індол-5-карбонітрилу гідрохлорид; 1Н-індол-2-олу гідрохлорид; 2-гідрокси-3-[6-(2-морфолін-4-ілетокcи)піримідин3-флуор-3-[5-(морфолін-4-ілметил)придин-2-іл]-24-іл]-1Н-індол-5-карбонітрил; оксоіндолін-6-карбонітрилу гідрохлорид; 2-гідрокси-3-{5-[(4-метилпіперазин-13-{5-[(4-бензилпіперазин-1-іл)сульфоніл]піридин-2іл)метил]піридин-2-іл}-1Н-індол-5-карбонітрилу іл}-2-гідроксі-1Н-індол-5-карбонітрилу гідрохлорид; гідрохлорид; 2-гідрокси-3-(5-{[4-(3-метилбутил)піперазин-16-(5-ціано-2-гідроксі-1Н-індол-3-іл)-N-[2іл]сульфоніл}піридин-2-іл)-1Н-індол-5(диметиламіно)етил]-N-метилнікотинаміду гідрокарбонітрилу гідрохлорид; хлорид; 2-гідрокси-3-{5-[(4-ізопропілпіперазин-12-гідрокси-3-{5-[(4-метилпіперазин-1іл)сульфоніл]піридин-2-іл}-1Н-індол-5іл)сульфоніл]піридин-2-іл}-1Н-індол-5карбонітрилу гідрохлорид; карбонітрилу гідрохлорид; 3-{5-[(4-етилпіперазин-1-іл)сульфоніл]піридин-26-(5-ціано-2-гідроксі-1Н-індол-3-іл)-N-(2-піролідиніл}-2-гідроксі-1Н-індол-5-карбонітрилу гідрохлорид; 1-ілетил)піридин-3-сульфонаміду гідрохлорид; 3-[5-(морфолін-4-ілметил)піридин-2іл]-5-піридин-32-гідрокси-3-[5-(морфолін-4-ілметил)піридин-2-іл]іл-1Н-індол-2-ол; 1Н-індол-5-карбонітрил; 3-[5-(морфолін-4-ілметил)піридин-2-іл]-5-тієн-2-іл2-гідрокси-3-[5-(піролідин-1-ілметил)піридин-2-іл]1Н-індол-2-олу гідрохлорид; 1Н-індол-5-карбонітрилу гідрохлорид; 5-(2-фурил)-3-[5-(морфолін-4-ілметил)піридин-22-гідрокси-3-{5-[(4-метил-1,4-діазепан-1іл]-1Н-індол-2-олу гідрохлорид; іл)метил]піридин-2-іл}-1Н-індол-5-карбонітрилу 3-{3-бром-5-[(4-метилпіперазин-1гідрохлорид; іл)сульфоніл]піридин-2-іл}-5-нітро-1Н-індол-2-олу 2-гідрокси-3-{5-[(4-піролідин-1-ілпіперидин-1гідрохлорид; іл)метил]піридин-2-іл}-1Н-індол-5-карбонітрилу 3-[5-(морфолін-4-ілметил)піридин-2-іл]-5гідрохлорид; (трифлуорметил)-1Н-індол-2-олу гідрохлорид; 3-(5-{[3-(диметиламіно)піролідин-12-гідрокси-3-{5-[(4-метилпіперазин-1іл]метил}піридин-2-іл)-2-гідрокси-1Н-індол-5іл)сульфоніл]піридин-2-іл}-1Н-індол-6карбонітрил; карбонітрилу гідрохлорид; 2-гідрокси-3-{5-[(4-метилпіперидин-1N-[(1-етилпіролідин-2-іл)метил]-6-(2-гідрокси-5іл)метил)піридин-2-іл}-1Н-індол-5-карбонітрил; нітро-1Н-індол-3-іл)нікотинаміду гідрохлорид; 2-гідрокси-3-{5-[(4-фенілпіперазин6-(2-гідрокси-5-нітро-1Н-індол-3-іл)-N-(2-морфолін1іл)метил]піридин-2-іл}-1Н-індол-5-карбонітрил; 4-ілетил)нікотинаміду гідрохлорид; 3-[5-(азетидин-1-ілметил)піридин-2-iл]-2-гідрокси6-(2-гідрокси-5-нітро-1Н-індол-3-іл)-N-метил-N-(11Н-індол-5-карбонітрил; метилпіперидин-4-іл)нікотинаміду гідрохлорид; 7 79447 8 5-нітро-3-{5-[(4-піролідин-1-ілпіперидин-116. Застосування сполуки за будь-яким одним з пп. іл)карбоніл]піридин-2-іл}-1Н-індол-2-олу гідрохло1-9 у виробництві медикаменту для попередження рид; та/або лікування бічного аміотрофічного склерозу, 3-(5-{[3-(диметиламіно)піролідин-1кірково-базальної дегенерації, синдрому Дауна, іл]карбоніл}піридин-2-іл)-5-нітро-1Н-індол-2-олу хвороби Гентингтона, постенцефалітного паркінгідрохлорид; сонізму, прогресивного супрануклеарного параліN-[2-(диметиламіно)-1-метилетил]-6-(2-гідрокси-5чу, хвороби Піка, хвороби Нейманна-Піка, інсульнітро-1Н-індол-3-іл)нікотинаміду гідрохлорид; ту, травми голови та інших хронічних 6-(2-гідрокси-5-нітро-1Н-індол-3-іл)-N-(2-піролідиннейродегенеративних хвороб, біполярної хвороби, 1-ілетил)нікотинаміду фумарат; афективних розладів, депресії, шизофренії, когні3-{5-[(4-метилпіперазин-1-іл)карбоніл]піридин-2тивніх розладів, втрати волосся та контрацептивіл}-5-нітро-1Н-індол-2-олу фумарат; ного лікування. 6-(5-ціано-2-гідроксі-1Н-індол-3-іл)-N-(2-піролідин17. Застосування сполуки за будь-яким одним з пп. 1-ілетил)нікотинаміду фумарат; 1 - 9 у виробництві медикаменту для попереджен6-(5-цiaнo-2-гiдpoкcі-1H-iндoл-3-iл)-N-мeтил-N-(2ня та/або лікування передбожевільних станів, попipoлiдин-1-iлeтил)пipидин-3-сульфонаміду гідромірного погіршання пізнавальної здатності, асоціхлорид; йованого з віком погіршання пам'яті, асоційованої 6-(5-ціано-2-гідроксі-1Н-індол-3-іл)-N-[2з віком нестачі пізнавальної здатності, погіршання (диметиламіно)етил]піридин-3-сульфонаміду фупізнавальної здатності без деменції, помірної немарат; стачі пізнавальної здатності, помірного нейрокогні6-(5-ціано-2-гідроксі-1Н-індол-3-іл)-N-[2тивного зниження, старечого безпам'ятства, погі(диметиламіно)етил]-N-етилпіридин-3ршання пам'яті та погіршання пізнавальної сульфонаміду фумарат; здатності, судинної деменції, деменції з тільцями 6-(5-ціано-2-гідроксі-1Н-індол-3-іл)-N-[(1Леві, лобово-скроневої деменції та андрогенетичетилпіролідин-2-іл)метил]піридин-3-сульфонаміду ної алопеції. фумарат; 18. Спосіб попередження та/або лікування станів, 2-гідрокси-3-{5-[(4-метил-1,4-діазепан-1асоційованих з глікогенсинтазною кіназою-3, який іл)сульфоніл]піридин-2-іл}-1Н-індол-5передбачає введення ссавцю, включаючи людину, карбонітрилу фумарат; що потребує такого попередження та/або лікуван2-гідрокси-3-[5-(морфолін-4-ілсульфоніл)піридин-2ня, терапевтично ефективної кількості сполуки іл]-1Н-індол-5-карбонітрил; формул Іа чи Іb за будь-яким одним з пп. 1-9. 3-{5-[(4-метилпіперазин-1-іл)сульфоніл]піридин-219. Спосіб попередження та/або лікування деменіл}-5-(2-метил-1,3-тіазол-4-іл)-1Н-індол-2-олу гідції, хвороби Альцгеймера, хвороби Паркінсона, рохлорид; лобово-скроневої деменції типу Паркінсона, ком3-{5-[(4-метилпіперазин-1-іл)сульфоніл]піридин-2плексу деменції Паркінсона-Гуама, ВІЛ-деменції, іл}-5-(1,3-тіазол-4-іл)-1Н-індол-2-олу фумарат; хвороб з асоційованими патологіями сплетіння 3-{5-[(4-метилпіперазин-1-іл)сульфоніл]піридин-2нейрофібрил та деменції боксерів, який передбаіл}-5-(1,3-оксазол-5-іл)-1Н-індол-2-ол; чає введення ссавцю, включаючи людину, що по3-[5-(морфолін-4-ілметил)піридин-2-іл]-5-нітро-1Нтребує такого попередження та/або лікування, індол-2-олу гідрохлорид. терапевтично ефективної кількості сполуки фор10. Фармацевтична композиція, що містить як акмул Іа чи Іb за будь-яким одним з пп. 1-9. тивний інгредієнт терапевтично ефективну кіль20. Спосіб за п. 19, коли хвороба є хворобою Алькість сполуки за будь-яким одним з пп. 1-9 в асоціцгеймера. ації з фармацевтично прийнятними носіями або 21. Спосіб попередження та/або лікування бічного розріджувачами. аміотрофічного склерозу, кірково-базальної деге11. Фармацевтична композиція за п. 10, призначенерації, синдрому Дауна, хвороби Гентингтона, на для застосування у попередженні та/або лікупостенцефалітного паркінсонізму, прогресивного ванні станів, асоційованих з глікогенсинтазною супрануклеарного паралічу, хвороби Піка, хвороби кіназою-3. Нейманна-Піка, інсульту, травми голови та інших 12. Сполука за будь-яким одним з пп. 1-9, признахронічних нейродегенеративних хвороб, біполярчена для застосування у терапії. ної хвороби, афективних розладів, депресії, ши13. Застосування сполуки за будь-яким одним з пп. зофренії, когнітивних розладів, втрати волосся та 1-9 у виробництві медикаменту для попередження контрацептивного лікування, який передбачає та/або лікування станів, асоційованих з глікогенсивведення ссавцю, включаючи людину, що потрентазною кіназою-3. бує такого попередження та/або лікування, тера14. Застосування сполуки за будь-яким одним з пп. певтично ефективної кількості сполуки формул Іа 1-9 у виробництві медикаменту для попередження чи Іb за будь-яким одним з пп. 1-9. та/або лікування деменції, хвороби Альцгеймера, 22. Спосіб попередження та/або лікування перехвороби Паркінсона, лобово-скроневої деменції дбожевільних станів, помірного погіршання пізнатипу Паркінсона, комплексу деменції Паркінсонавальної здатності, асоційованого з віком погіршанГуама, ВІЛ- деменції, хвороб з асоційованими паня пам'яті, асоційованої з віком нестачі тологіями сплетіння нейрофібрил та деменції бокпізнавальної здатності, погіршання пізнавальної серів. здатності без деменції, помірної нестачі пізнава15. Застосування сполуки за п. 14, коли хвороба є льної здатності, помірного нейрокогнітивного знихворобою Альцгеймера. ження, старечого безпам'ятства, погіршання пам'яті та погіршання пізнавальної здатності, 9 79447 10 судинної деменції, деменції з тільцями Леві, лобо26. Спосіб отримання сполуки формули Іа за п. 1, во-скроневої деменції та андрогенетичної алопеу якому: ції, який передбачає введення ссавцю, включаючи шляхом відновлення N-оксиду у сполуці формули людину, що потребує такого попередження та/або XXVIII о тримують сполуку формули Іа (R 2)m R1 (R2) m R1 лікування, терапевтично ефективної кількості споN N луки формул Іа чи Іb за будь-яким одним з пп. 1-9. H H 5 23. Спосіб отримання сполуки формули Іа за п. 1, O O у якому: здійснюють взаємодію сполуки формули ON N + В (XV, XVIII, XVІІІa, XXI, XXIII), де L1 представляє відщеплювану гр упу, таку як галоген, наприклад, флуор, хлор або бром, зі сполукою формули С N R5 N R5 10 (сполуки формул III, V, IX, XII, XIII); де R1, R2 та m R4 4 R визначено у п. 1, з отриманням сполуки формули (ХХ VIII) Іа (Ia) , R (R ) застосовуючи придатний реагент у придатному N L розчиннику при температурі між 0 °С та +100 °С. R O N H 27. Спосіб отримання сполуки формули Іb за п. 1, (R ) + (R ) O P P (R ) в якому: (C ) (Ia) (B) здійснюють флуорування сполуки формули Іa, з у прийнятному розчиннику при температурі між отриманням сполуки формули Іb; (R2) m R1 (R2)m R1 +10 °С та +150 °С. N N 24. Спосіб отримання сполуки формули Іа за п. 1, у якому: O O F здійснюють взаємодію сполуки формули XXV, де N H N halo представляє галоген, наприклад, флуор, хлор (R3)n (R3)n або бром, зі сполукою формули С (сполуки формул ІІІ, V, IX, XII, XIII); де R1 , R2 та m визначено у п. (Ib) (Ia) 1, з отриманням сполуки формули Іа , (R ) R у прийнятному розчиннику у присутності придатноN halo го реагенту флуорування та придатної основи при R O O температурі реакції між -40 °С та +80 °С. N N H N O 28. Сполука формули XXVII + (R ) 1 2 1 3 m 1 2 n m 3 n 2 1 m 1 + 2 N m (R2)m R5 N R4 (ХХV) R1 N R5 R4 (C) ( Ia) O , у прийнятному розчиннику при температурі між +10°С та +150°С. 25. Спосіб отримання сполуки формули Іа за п. 1, у якому: здійснюють взаємодію сполуки формули XXVII з прийнятним аміном HNR4R5, з отриманням сполуки формули Іа (R2) m R1 (R2)m R1 O H O С1-6алкіл (ХХVII) N H R4 O N R5 (Ia) , причому і) реакцію сполуки формули XXVII з прийнятним аміном R4R5NH проводять у придатному розчиннику у присутності придатного реагенту при температурі реакції між 0 °С та температурою кипіння із зворотним холодильником, або іі) реакцію сполуки формули XXVII з прийнятним аміном R4R5NH проводять з чистим аміном R4R5NH або у придатному розчиннику, з придатною основою чи без неї при температурі між -20 °С та +150 °С. H O С1-6алкіл , де R представляє гідроген; R2 вибрано з групи: галоген; нітро, С1-6алкіл, флуорметил, дифлуорметил, три флуорметил, флуорметокси, дифлуорметокси, трифлуорметокси, ОС1-6алкілNR4R5, С0С0-6алкілСОNR4R5, С06алкілціано, 4 5 4 5 1 6 6aлкiл(SO2)NR R , С 0-6алкілNR R та гр упа X R , де Х1 представляє безпосередній зв'язок, О, CONR7R8, SO2NR9R10 , SO 2R11 або NR12R13 ; R7, R9 тa R12, кожний незалежно, представляють гідроген або С1-3алкіл; R8, R10, R11 та R13 представляють С 06 4алкіл; R представляє феніл або 5-, 6- або 7членну гетероциклічну груп у, що містить один або два гетероатоми, вибрані незалежно з N, О та S, ця гетероциклічна група може бути насиченою чи ненасиченою, або вказаний феніл чи 5-, 6- або 7членна гетероциклічна група можуть, як варіант, бути конденсованими з 5- або 6-членним насиченим або ненасиченим кільцем, що містить атоми, вибрані незалежно з С, N, О та S, причому феніл або гетероциклічна група можуть бути заміщеними 1 O O O (ХХVII) N N N 11 79447 12 одним або двома замісниками, вибраними з W; a або С1-3алкіл; R8, R10, R11 та R13 представляють С 06 R6 зчеплений з R8, R10, R11 та R13 ; 4алкіл; R представляє феніл або 5-, 6- або 7R4 вибрано з групи: гідроген, С1-6алкіл, С2-6алкеніл, членну гетероциклічну груп у, що містить один або С2-6алкініл, С0-6алкілС 3-6циклоалкіл, С0-6алкіларил, два гетероатоми, вибрані незалежно з N, О та S, С0-6алкілгетероарил, С1-6aлкiлNR14R15 та 5- або 6ця гетероциклічна група може бути насиченою чи членна гетероциклічна група, що містить один або ненасиченою, або вказаний феніл чи 5-, 6- або 7два гетероатоми, вибрані незалежно з N, О та S, членна гетероциклічна група можуть, як варіант, причому вказана гетероциклічна група може, як бути конденсованими з 5- або 6-членним насичеваріант, бути заміщеною групою Y; ним або ненасиченим кільцем, що містить атоми, R5 вибрано з групи: гідроген, С1-6алкіл, С2-6алкеніл, вибрані незалежно з С, N, О та S, причому феніл С2-6алкініл, С0-6алкілС 3-6циклоалкіл, С0-6алкіларил, або гетероциклічна група можуть бути заміщеними С0-6алкілгетероарил та С 1-6aлкiлNR14R15; причому одним або двома замісниками, вибраними з W; a R4 та R5 можуть разом утворювати 4-, 5-, 6- або 7R6 зчеплений з R8, R10, R11 та R13 ; членну гетероциклічну груп у, що містить один або R4 вибрано з групи: гідроген, С1-6алкіл, С2-6алкеніл, більше гетероатомів, вибраних незалежно з N, О С2-6алкініл, С0-6алкілС 3-6циклоалкіл, С0-6алкіларил, ти S, причому вказана гетероциклічна група може, С0-6алкілгетероарил, С1-6aлкiлNR14R15 та 5- або 6як варіант, бути заміщеною групою Y; причому членна гетероциклічна група, що містить один або будь-який С1-6алкіл, С2-6алкеніл, С2-6алкініл, С0два гетероатоми, вибрані незалежно з N, О та S, С0-6алкіларил та С 0причому вказана гетероциклічна група може, як 6алкілС 3-6циклоалкіл, 2 5 варіант, бути заміщеною групою Y; 6алкілгетероарил, визначений для R - R , може бути заміщеним одною або більше групами Z; R5 вибрано з групи: гідроген, С1-6алкіл, С2-6алкеніл, m дорівнює 0, 1, 2, 3 або 4. С2-6алкініл, С0-6алкілС 3-6циклоалкіл, С0-6алкіларил, 29. Сполука за п. 28, де R1 представляє гідроген; С0-6алкілгетероарил та С 1-6aлкiлNR14R15; причому 2 R вибрано з нітро та ціано; R4 та R5 можуть разом утворювати 4-, 5-, 6- або 7m дорівнює 1. членну гетероциклічну груп у, що містить один або 30. Сполука за п. 28, яка вибрана з групи: більше гетероатомів, вибраних незалежно з N, О етил 6-(2-гідрокси-5-нітро-1Н-індол-3-іл)нікотинат; та S, причому вказана гетероциклічна група може, етил 6-(2-гідрокси-5-ціано-1Н-індол-3-іл)нікотинат; як варіант, бути заміщеною групою Y, причому як вільна основа або її сіль. будь-який С1-6алкіл, С2-6алкеніл, С2-6алкініл, С031. Сполука формули XXVIII С0-6алкіларил та С 06алкілС 3-6циклоалкіл, 2 5 (R2 )m R1 6алкілгетероарил, визначений для R - R , може H бути заміщеним одною або більше групами Z; N m дорівнює 0, 1, 2, 3 або 4. O 32. Сполука за п. 31, де R1 представляє гідроген; OR2 представляє групу X1R6, де X1 представляє N + безпосередній зв'язок; R6 представляє 5- або 6членну гетероциклічну груп у, що містить один або два гетероатоми, вибрані незалежно з N, О та S; m N R5 дорівнює 1. 4 R 33. Сполука за п. 31, яка вибрана з групи: 3-[5-(морфолін-4-ілметил)-1-оксидопіридин-2-іл]-5(ХХVIII) , піридин-3-іл-1Н-індол-2-ол; де 3-[5-(морфолін-4-ілметил)-1-оксидопіридин-2-іл]-5R1 представляє гідроген; R2 вибрано з групи: галотієн-2-іл-1Н-індол-2-ол; ген, нітро, С1-6алкіл, флуорметил, дифлуорметил, 5-(2-фурил)-3-[5-(морфолін-4-ілметил)-1трифлуорметил, флуорметокси, дифлуорметокси, оксидопіридин-2-іл]-1Н-індол-2-ол; 4 5 трифлуорметокси, ОС1-6алкілNR R , С0як вільна основа або її сіль. 4 5 С0-6алкілСОNR R , С06алкілціано, 34. Застосування сполук за пп. 28-33 для отри4 5 4 5 1 6 6aлкiл(SO2)NR R , С 0-6алкілNR R та група Х R , мання сполуки формул Iа або Іb за будь-яким од1 деХ представляє безпосередній зв'язок, О, ним з пп. 1-9. CONR7R8, SO2NR9R10 , SO 2R11 або NR12R13 ; R7, R9 12 та R , кожний незалежно, представляють гідроген Представлений винахід стосується нових сполук формули Іа та Іb, як вільних основ або їх фармацевтично прийнятних солей, фармацевтичних композицій, що містять вказані сполуки та застосування вказаних сполук у терапії. Представлений винахід стосується також способу отримання сполук формули Іа та Іb та нових інтермедіатів, використаних при цьому. Глікоген-синтазною кіназою 3 (GSK3) є серин/треонін-білкова кіназа, що складається з двох ізоформ (a та b), які кодовано відмінними генами але є високо гомологічними у каталітичному домені. GSK3 сильно експресується у центральній та периферійній нервовій системі. GSK3 фосфорилує кілька субстратів, включаючи тау, b-катенін, глікоген-синтазу, піруват дегідрогеназу та фактор елонгації ініціації 2b (elF2b). 13 79447 14 Інсулін та фактори росту активують білкову кіназу шеною у нейронів, уразливих стосовно апоптозу, тип загибелі клітин звичайно, можна думати, відb, яка фосфорилує GSK3 на сериновому залишку 9 та інактивує її. бувається при хронічних та гострих дегенеративних хворобах, як-то хвороба Альцгеймера, хвоДеменції при хворобі Альцгеймера та таупароба Паркінсона, бічний аміотрофічний склероз, тії. хвороба Гентингтона та ВІЛ-деменція, ішемічний Хвороба Альцгеймера характеризується неприступ та травма голови. Літій є нейрозахиснистачею пізнавальної здатності, холінергічною дисфункцією та загибеллю нейронів, сплетінням ком при інгібуванні апоптозу у клітинах та у тканині мозку при доза, що призводять до інгібуваннейрофібрил та сенільними бляшками, що скланя GSK3b. Відтак інгібітори GSK3b могли б бути даються з відкладень амілоїду-b. Послідовність корисними для зміни перебігу нейродегенеративцих виявів при хворобі Альцгеймера є неясною, них хвороб. але можна вважати, вони є пов'язаними. ГлікоБіполярні розлади (БР) ген-синтазна кіназа 3b (GSK3b) або фосфорилуБіполярні розлади характеризуються маніавальна кіназа Тау (t) селективно фосфорилує кальними приступами та депресивними пристумікроканалець, асоційований білок t у нейронах пами. Літій мав би бути використаним для лікуна ділянках, що є гіперфосфорилованими у мозвання БР на основі його стабілізуючої дії на ках при хворобі Альцгеймера. Гіперфосфорилонастрій. Недоліком літію є вузьке терапевтичне ваний білок t має нижчу афінність стосовно міквікно та небезпека передозування, що може вироканальців та накопичується як спаровані кликати інтоксикацію літієм. Нещодавні виявленспіральні нитки, які є головними компонентами, ня, що літій інгібує GSK3 при терапевтичних конщо складають сплетіння нейрофібрил та нейроцентраціях, підвищило можливість того, що цей пільні нитки у мозках при хворобі Альцгеймера. фермент представляє ключову ціль дії літію у Це призводить до деполімеризації мікроканальтканині мозку [Stambolic et al., Curr. Biol. 6:1664ців, яка викликає загибель підкладки аксонів та 1668, 1996; Klein та Melton; PNAS 93:8455невритну дистрофію Сплетіння нейрофібрил по8459,1996]. Інгібування GSK3B може тому бути стійно знаходять при хворобах, як-то хвороба терапевтично релевантним у лікуванні БР а таАльцгеймера, . бічний аміотрофічний склероз, кож у пацієнтів при хворобі Апьцгеймера, що мапаркінсонізм-деменція Гуама, корково-базальна ють афективні розлади. дегенерація, деменція боксерів та травма голови, Шизофренія синдром Дауна, постенцефалітний паркінсонізм, GSK3 залучено у каскади передачі сигналу прогресивний супрануклеарний параліч, хвороба багатьох клітинних процесів, особливо при нерНейманна-Піка та хвороба Піка. Додавання амівовому розвитку. [Kozlo vsky et al (Am J Psychiatry лоїду-b до первинної культури гіпокампу призво2000 Can; 157(5):831-3)] знайшли, що рівні GSK3b дить до гіперфосфорилування t та спареної спіна 41% нижчі у пацієнтів з шизофренією, ніж у рально-нитко-подібної структури через індукцію порівнюваних суб'єктів. Це дослідження вказує, активності GSK3B, а потім розладу аксонного що шизофренія залучає патологію нейророзвитку транспорту та нейронної загибелі [Imahori та та що анормальне регулювання GSK3 може граUchida., J. Biochem 121:179-188,1997]. GSK3B ти роль при шизофренії. Далі, зменшені рівні bпреференційно відмічає сплетіння нейрофібрил катеніну доведені у пацієнтів, виявляючих шизота показана як активна перед сплетінням і у нейфренію [Cotter et al., Neuroreport 9:1379-1383 ронах у мозках при хворобі Альцгеймера. Рівні (1998)]. білку GSK3 є також збільшеними на 50% у тканиДіабет ні мозку від пацієнтів з хворобою Альцгеймера. Інсулін стимулює синтез глікогену у скелетДалі, GSK3b фосфорилує піруват-де гідрогеназу, них м'язах шляхом дефосфорилування та відтак ключовий фермент у гліколітичному шляху обміактивацією глікоген-синтази. У станах відпочинку ну та попереджує перетворення пірувату в ацеGSK3 фосфорилує та інактивує глікоген-синтазу тил-Со-А [Hoshi et a!., PNAS 93:2719-2723,1996]. шляхом дефосфорилування. GSK3 також зверхеАцетил-Со-А є критичним стосовно синтезу ацекспресується у м'язах з пацієнтів з діабетом типу тилхоліну, нейротрансмітер з когнітивними функII [Nikoulina et al., Diabetes 2000 Feb;49(2):263-71]. ціями. Відтак, інгібування GSK3b може мати коІнгібування GSK3 збільшує активність глікогенрисну дію у прогресії, а також когнітивному синтази, зменшуючи тим рівні глюкози її перетводефіциті, асоційованими з хворобою Альцгеймеренням у глікоген. Інгібування GSK3 може тому ра та іншими вищенаведеними хворобами. бути терапевтично релевантним у лікуванні діаХронічні та гострі нейродегенеративні хворобету типу І та типу II та діабетичної невропатії. би. Втрата волосся Опосередкована фактором росту активація GSK3 фосфорилує та розкладає b-катенін. bшляху обміну РІЗК /Akt, як показано, грає ключокатенін є ефектором шляху обміну для синтезу ву роль у виживанні нейронів. Активація цього кератоніну, стабілізація b-катеніну може збільшушляху обміну призводить до інгібування GSK3b. вати розвиток волосся. Миші, що експресують Нещодавні дослідження [Bhat et. al., PNAS стабілізований b-катенін мутацією ділянок, фос97:11074-11079 (2000)] вказують, що активність форилованих GSK3, піддаються процесу типу GSK3b є збільшеною у клітинній та тваринній нового морфогенезу волосся [Gat et al., Cell 1998 моделі нейродегенерації, як-то церебральна Νον 25;95 (5):605-14)]. Нові фолікули утворюють ішемія або після втрати фактору росту. Наприсальні залози та дермальні сосочки, що звичайно клад, активна ділянка фосфорилування є збільстворюються тільки при ембріогенезі. Відтак інгі 15 79447 16 бування GSK3 може забезпечувати лікування членна гетероциклічна група можуть, як варіант, проти облисіння. бути конденсованими з 5- або 6-членним насичеПероральні контрацептиви ним або ненасиченим кільцем, що містить атоми, [Vijajaraghavan et al. (Biol Reprod 2000 Jun; 62 вибрані незалежно з С, Ν, Ο та S, ці феніл або (6): 1647-54)] доповіли, що GSK3 багато у р ухлигетероциклічна група можуть бути заміщеними вому сперматозоїді у порівняні з нерухливим. одним або двома замісниками вибраними з W; Імуноцитoхімією виявлено, що GSK3 наявний у m дорівнює 0, 1, 2, 3 або 4; джгутиковій та передній частині голівки спермаn дорівнює 0, 1, 2, 3 або 4; тозоїду. Це свідчи ть, що GSK3 може бути ключоR4 вибрано з групи: гідроген, С1-6алкіл, С2вим елемент, що лежить в основі ініціації рухлиалкеніл, С2-6алкініл, С0-6алкілС 3-6циклоалкіл, С06 14 15 вості у придатку яєчка та регулювання функції 6алкіларил, С 0-6алкілгетероарил, С 1-6алкілNR R зрілого сперматозоїду. Інгібітори GSK3 можуть та 5- або 6-членна гетероциклічна група, що місбути корисними як контрацептиви для самців. тить один або два гетероатоми, вибрані незалеОб'єктом представленого винаходу є забезжно з Ν, Ο та S, причому вказана гетероциклічна печення сполуки з інгібувальною дією на GSK3, а група може, як варіант, бути заміщеною групою Y; також з гарною біозасвоюваністю. R5 вибрано з групи: гідроген, С1-6алкіл, С21. Відповідно, представлений винахід стосу6алкеніл, С 2-6алкініл, С 0-6алкілС 3-6циклоалкіл, С 0ється сполук формул Іа та Іb: С0-6алкілгетероарил та С 16алкіларил, 14 15 4 5 6алкілNR R ; причому R та R можуть разом утворювати 4-, 5-, 6- або 7-членну гетероциклічну груп у, що містить один або більше гетероатомів, вибраних незалежно з Ν, Ο та S, причому вказана гетероциклічна група може, як варіант, бути заміщеною групою Y; причому будь-який С 1С2-6алкеніл, С2-6алкініл, С0-6алкілС 34алкіл, С0-6алкіларил; та С06циклоалкіл, 2 5 6алкілгетероарил, визначений для R -R , може бути заміщеним одною або більше групами Z; де: R14 та R15 незалежно вибрані з групи: гідроΡ представляє 5- або 6-членне гетероаромаген, С1-4алкіл та С 0-6алкілС 3-6циклоалкіл, причому тичне кільце, що містить один або два гетероR14 та R15 можуть разом утворювати 5- або 6атоми, вибрані незалежно з Ν, Ο та S, з яких причленну гетероциклічну груп у, що містить один наймні один атом є нітрогеном; або більше гетероатомів, вибраних незалежно з 1 R представляє гідроген; Ν, Ο та S, причому вказана гетероциклічна група 2 3 R та R незалежно вибрано з групи: галоген, може, як варіант, бути заміщеною групою Y; нітро, С1-6алкіл, С2-6алкеніл, С2-6алкініл, С0W та Ζ незалежно вибрано з групи: оксо, гаС0-6алкіларил, С06алкілС 3-6циклоалкіл, логен, нітро, CN, OR 16, С1-4алкіл, С0-6алкіларил, 4 СНО, С0-6алкілOR , ОС16алкілгетероарил, С0-6алкілС 3-6циклоалкіл, флуорметил, дифлуор4 4 4 4 6алкілOR , С 1-6алкілSR , ОС 1-6алкілSR , (CO)R , метил, трифлуорметил, флуорметокси, дифлуо4 4 (CO)OR , O(CO)R , флуорметил, дифлуорметил, рметокси, трифлуорметокси, OС1-6алкілNR16R17, трифлуорметил, флуорметокси, дифлуорметокNR16R17, CONR16R 17 NR16(CO)R17, О(СО)С 1-6алкіл, си, трифлуорметокси, ОС1-6алкілціано, С0(СО)С1-6алкіл, COR16, (SO2)NR16R17, SO 2R16 , С1-6алкілСО2R4, ОС1-6алкілСО2R4, 6алкілціано, SOR16, (CO)С1- 6aлкiлNR16R17, ((SO2)С1O(CO)OR 4, OС1- 6алкілСOR4, С1-6алкілСОR4, алкілNR16R17, 5- або 6-членна гетероциклічна 6 4 5 4 5 4 5 NR OR , С0-6алкілNR R , ОС1-6алкілNR R , С0група, що містить один або два гетероатоми, ви4 5 OС1-6алкілCONR4R5, ОС16алкілCONR R , брані незалежно з Ν, Ο та S, феніл та гетеро4 5 4 5 С0-6алкілNR (CО)R , С06алкілNR (CО)R , арил, ці гетероциклічна група, феніл або гетеро4 4 5 4 5 4 5 6алкілNR (CO)NR R , O(CO)NR R , NR (CO)OR , арил можуть, як варіант, бути заміщеними групою 4 s 4 5 С0-6алкіл(SO2)NR R , ОС1-6алкіл(SО2)NR R , С0Y; 4 5 4 5 OС1-4алкілNR (SO2)R , С06алкілNR (SO2)R , Υ вибрано з групи: оксо, галоген, нітро, CN, 4 5 4 5 4 6алкіл(SO)NR R , OС 1-6алкіл(SO)NR R , SO3R , OR16, С 1-6алкіл, С0-6алкіларил, С0-6алкілС 34 4 5 4 5 Co-6aлкiлNR (SO2)NR R , С0-6алкілNR (SO)R , 6циклоалкіл, флуорметил, дифлуорметил, трифOС0-6алкілNR4(SO)R5, ОС0-6алкілSО2R4, С0луорметил, флуорметокси, дифлуорметокси, 4 4 4 6алкілSO2R , С 0-6SOR , ОС 1-6алкілSOR та гр упа трифлуорметокси, OCONR16R17, CONR16R17 , 1 6 1 1 X R , де Х представляє безпосередній X пред16 17 NR (CO)R , O(CO)С1-6алкіл, (СО)ОС1-6алкіл, ставляє безпосередній зв'язок, О, CONR7R8, COR16, (SO2)NR16R 17, SO 2R16 , SOR16, (CO)С19 10 11 12 13 6 SO2NR R , SO2R або NR R ; і причому R 16 17 (SО2)С1- 6алкілNR13R17, феніл, С06алкілNR R зчеплений з R8, R10, R11 та R13; 6алкіларил та гетероарил, причому феніл, С 0R7, R9Ta R12, кожний незалежно, представ6алкіларил та гетероарил можуть бути, як ларил ляють гідроген або С1-4алкіл; та гетероарил, причому феніл, С0-6алкіларил та 8 10 11 13 R , R , R та R представляють С 1-6алкіл; гетероарил можуть бути, як варіант, заміщеними 6 R представляє феніл або 5-, 6- або 7-членну замісником, вибраним з групи: галоген, нітро, CN, гетероциклічну групу, що містить один або два OR16, С1-4алкіл, флуорметил, дифлуорметил, гетероатоми, вибрані незалежно з Ν, Ο та S, ця трифлуорметил, флуорметокси, дифлуорметокси гетероциклічна група може бути насиченою або та трифлуорметокси; ненасиченою, або вказаний феніл чи 5-, 6- або 7 17 79447 18 4 5 4 5 R16 та R 17 незалежно вибрані з групи: гідроген 6алкілNR R ; де R та R можуть разом утворювата С1-6алкіл, причому R16 та R17 можуть разом ти 4-, 5-, 6- або 7-членну гетероциклічну групу, утворювати 5- або 6-членну гетероциклічну групу, що містить один або більше гетероатомів, вибращо містить один або більше гетероатомів, вибраних незалежно з Ν, Ο та S. них незалежно з Ν, Ο та S; Згідно з ще одним аспектом винаходу сполуяк вільних основ або їх фармацевтично прики вибрано з групи: йнятних солей. 2-(5-Ціано-2-гідрокси-1Н-індол-3-іл)-N-[2Згідно з одним аспектом винаходу запропо(диметиламіно)етил]ізонікотинамід; новано сполуки формул Іа та Іb, де Ρ представ2-Гідрокси-3-{4-[(4-метилпіперазин-1ляє 6-членне гетероароматичне кільце, що місіл)карбоніл]піридин-2-іл}-1Н-індол-5-карбонітрилу тить один або два атоми нітрогену. гідрохлорид; Згідно з першим втіленням цього аспекту ви2-Гідрокси-3-(5-[(4-метилпіперазин-1находу запропоновано сполуки формул Іа та Іb, іл)карбоніл]піридин-2-іл}-1Н-індол-5-карбонітрил; де Ρ представляє піридин. 2-Гідрокси-3-[5-(морфолін-4-ілметил)піридинЗгідно з ще одним втіленням цього аспекту 2-іл]-1Н-ізоіндол-5-карбонітрилу гідрохлорид; винаходу запропоновано сполуки формул Іа та 2-Гідрокси-3-[6-(2-морфолін-4Іb, де Ρ представляє піримідин. ілетокси)піримідин-4-іл]-1Н-індол-5-карбонітрил; Згідно з ще одним аспектом представленого 2-Гідрокси-3-{5-[(4-метилпіперазин-1винаходу запропоновано сполуки формули Іа. іл)метил]піридин-2-іл}-1Н-індол-5-карбонітрилу Згідно з ще одним аспектом представленого гідрохлорид; винаходу запропоновано сполуки формул Іа та 6-(5-Ціано-2-гідрокси-1Н-індол-3-іл)-N-[2Іb, де R2 та R3 незалежно вибрано з груп: гало(диметиламіно)етил]-N-метилнікотинаміду гідроген, нітро, С0-6алкілгетероарил, трифлуорметил, хлорид; С0-6алкілціано, С0-6алкілNR4R5, С0-6алкілCONR4R5, 2-Гідрокси-3-{5-[(4-метилпіперазин-1OС0-6алкілNR4R5, С0-6алкілSO2)NR4R5 та група іл)сульфоніл]піридин-2-іл}-1Н-індол-5X1R 6, де X1 представляє безпосередній зв'язок; карбонітрилу гідрохлорид; R6 представляє 5-членну гетероциклічну гр упу, 6-(5-Ціано-2-гідрокси-1Н-індол-3-іл)-N-(2що містить один або двагетероатоми, вибрані піролідин-1-ілетил)піридин-3-сульфонаміду гідронезалежно з Ν, Ο та S, ця гетероциклічна група хлорид; може бути заміщеною одним або двома замісни2-Гідрокси-3-[5-(морфолін-4-ілметил)піридинками W, переважно С1-6алккіл; m дорівнює 0, 1, 2; 2-іл]-1Н-індол-5-карбонітрил; а n дорівнює 1 або 2. 2-Гідрокси-3-[5-(піролідин-1-ілметил)піридинЗгідно з ще одним аспектом представленого 2-іл]-1Н-індол-5-карбонітрилу гідрохлорид; винаходу запропоновано сполуки формул Іа та 2-Гідрокси-3-{5-[(4-метил-1,4-діазепан-1Іb, де R4 незалежно вибрано з групи: гідроген, С1іл)метил]піридин-2-іл}-1Н-індол-5-карбонітрилу гідрохлорид; 6алил, С 0-6алкілС 3-6циклоалкіл, С 0-6алкіларил, С 014 15 та 5- або 62-Гідрокси-3-{5-[(4-піролідин-1-ілпіперидин-16алкілгетероарил, С 1-6алкілNR R членна гетероциклічна група, що містить один іл)метил]піридин-2-іл}-1Н-індол-5-карбонітрилу або два гетероатоми, вибрані незалежно з Ν, Ο гідрохлорид; та S, де вказана гетероциклічна група може, як 3-(5-{[3-(Диметиламіно)піролідин-1варіант, бути заміщеною групою Y; R5 вибрано з іл]метил}піридин-2-іл)-2-гідрокси-1Н-індол-5групи: гідроген, С1-6алкіл; де R4 та R5 можуть ракарбонітрил; зом утворювати 4-, 5-, 6- або 7-членну гетероцик2-Гідрокси-3-{5-[(4-метилпіперидин-1лічну гр упу, що містить один або більше гетероіл)метил)піридин-2-іл}-1Н-індол-5-карбонітрил; атомів, вибраних незалежно з Ν, Ο та S, де 2-Гідрокси-3-{5-[(4-фенілпіперазин-1вказана гетероциклічна група може, як варіант, іл)метил]піридин-2-іл}-1Н-індол-5-карбонітрил; бути заміщеною групою Y; причому будь-який С 13-[5-(азетидин-1-ілметил)піридин-2-іл]-22 5 гідрокси-1Н-ізоіндол-5-карбонітрил; 6алкіл, С 0-6алкіларил, визначений для R -R , може бути заміщеним одною або більше групами Z; 2-Гідрокси-3-[5-({4-[2-нітро-4R14 та R15 незалежно представляють С 1-6алкіл, де (трифлуорметил)феніл]піперазин-1R14 та R15 можуть разом утворювати 5- або 6іл}метил)піридин-2-іл)-1Н-індол-5-карбонітрил; членну гетероциклічну груп у, що містить один 3-(5-{[(2або більше гетероатомів, вибраних незалежно з Ціаноетил)(етил)аміно]метил}піридин-2-іл)-2N, О та S; Ζ незалежно вибрано з групи: галоген, гідрокси-1Н-індол-5-карбонітрил; С1-6алкіл, CN, NR16R17; Y вибрано з групи: С13-(5-{[(416 17 Хлорбензил)(метил)аміно]метил)піридин-2-іл)-26алкіл, С 0-6алкіларил, NR R , феніл, де феніл може бути, як варіант, заміщеним нітро та трифгідрокси-1Н-індол-5-карбонітрил; луорметилом; R16 та R17 представляють С 1-6алкіл, 3-(5-{[(2де R16 та R17 можуть разом утворювати 5- або 6Фурилметил)(метил)аміно]метил}піридин-2-іл)-2членну гетероциклічну груп у, що містить один гідрокси-1Н-індол-5-карбонітрил; або більше гетероатомів, вибраних незалежно з 2-Гідрокси-3-(5Ν, Ο та S. {[метил(феніл)аміно]метил}піридин-2-іл)-1НЗгідно з ще одним аспектом представленого індол-5-карбонітрил; винаходу запропоновано сполуки формул Іа та 2-Гідрокси-3-{5-[(3-метилпіперидин-1Іb, де Ρ представляє піридин; R1 представляє іл)метил]піридин-2-іл}-1Н-індол-5-карбонітрил; гідроген; R2 представляє CN; R 3 представляє С 0 19 79447 20 3-(56-(2-Гідрокси-5-нітро-1Н-індол-3-іл)-N-(2{[Циклогексил(метил)аміно]метил}піридин-2-іл)-2піролідин-1 -ілетил)нікотинаміду фумарат; гідрокси-1Н-індол-5-карбонітрил; 3-{5-[(4-Метилпіперазин-12-Гідрокси-3-[5-(піперидин-1-ілметил)піридиніл)карбоніл]піридин-2-іл}-5-нітро-1Н-індол-2-олу 2-іл]-1Н-індол-5-карбонітрил; фумарат; 3-{5-[(4-Метилпіперазин-16-{5-Ціано-2-гідрокси-1Н-індол-3-іл)-N-(2іл)сульфоніл]піридин-2-іл}-1Н-індол-2-олу гідропіролідин-1-ілетил)нікотинаміду фумарат; хлорид; 6-(5-Ціано-2-гідрокси-1Н-індол-3-іл)-N-метил6-Хлор-3-(5-[(4-метилпіперазин-1N-(2-піролідин-1-ілетил)піридин-3-сульфонамід іл)сульфоніл]піридин-2-іл}-1Н-індол-2-олу гідрогідрохлорид; хлорид; 6-(5-Ціано-2-гідрокси-1Н-індол-3-іл)-N-[23-[5-(Морфолін-4-ілкарбоніл)піридин-2-іл]-5(диметиламіно)етил]піридин-3-сульфонаміду фунітро-1Н-індол-2-ол; марат; 6-Бром-3-[5-(морфолін-4-ілметил)піридин-26-(5-Ціано-2-гідрокси-1Н-індол-3-іл)-N-[2іл]-1Н-індол-2-олу гідрохлорид; (диметиламіно)етил]-N-етилпіридин-32-Гідрокси-3-[5-(морфолін-4-ілметил)піридинсульфонаміду фумарат; 2-іл]-1Н-індол-6-карбонітрилу гідрохлорид; 6-(5-Ціано-2-гідрокси-1Н-індол-3-іл)-N-[(15-Бром-3-[5-(морфолін-4-ілметил)піридин-2етилпіролідин-2-іл)метил]піридин-3іл]-1Н-індол-2-олу гідрохлорид; сульфонаміду фумарат; 5,6-Дибром-3-[5-(морфолін-42-Гідрокси-3-{5-[(4-метил-1,4-діазепан-1ілметил)піридин-2-іл]-1Н-індол-2-олу гідрохлорид; іл)сульфоніл]піридин-2-іл}-1Н-індол-53-Флуор-3-[5-(морфолін-4-ілметил)піридин-2карбонітрилу фумарат; іл]-2-оксоіндолін-6-карбонітрилу гідрохлорид; 2-Гідрокси-3-[5-(морфолін-43-{5-[(4-Бензилпіперазин-1ілсульфоніл)піридин-2-іл]-1Н-індол-5іл)сульфоніл]піридин-2-іл}-2-гідрокси-1Н-індол-5карбонітрил; карбонітрилу гідрохлорид; 3-{5-[(4-Mетилпіперазин-12-Гідрокси-3-(5-([4-(3-метилбутил)піперазиніл)сульфоніл]піридин-2-іл}-5-(2-метил-1,3-тіазол1-іл]сульфоніл}піридин-2-іл)-1Н-індол-54-іл)-1Н-індол-2-олу гідрохлорид; карбонітрилу гідрохлорид; 3-{5-[(4-Nетилпіперазин-12-Гідрокси-3-{5-[(4-ізопропілпіперазин-1іл)сульфоніл]піридин-2-іл}-5-(1,3-тіазол-4-іл)-1Ніл)сульфоніл]піридин-2-іл}-1Н-індол-5індол-2-олу фумарат; карбонітрилу гідрохлорид; 3-{5-[(4-Nетилпіперазин-13-{5-[(4-Етилпіперазин-1іл)сульфоніл]піридин-2-іл}-5-(1,3-оксазол-5-іл)іл)сульфоніл]піридин-2-іл}-2-гідрокси-1Н-індол-51Н-індол-2-ол; карбонітрилу гідрохлорид; 3-[5-(Mорфолін-4-ілметил)піридин-2-іл]-53-[5-(Морфолін-4-ілметил)піридин-2-іл]-5нітро-1Н-індол-2-олу гідрохлорид. піридин-3-іл-1Н-індол-2-ол; Нижченаведено визначення різних термінів, 3-[5-(Морфолін-4-ілметил)піридин-2-іл]-5використаних у описі та формулі представленого тіен-2-іл-1Н-індол-2-олу гідрохлорид; винаходу. 5-(2-Фурил)-3-[5-(морфолін-4Для запобігання неясності треба розуміти, що ілметил)піридин-2-іл]-1Н-індол-2-олу гідрохлорид; там, де у цьому описі групу охарактеризовано 3-{3-Бром-5-[(4-метилпіперазин-1'вищезазначено' або 'визначено вище', вказана іл)сульфоніл]піридин-2-іл}-5-нітро-1Н-індол-2-олу груп стосується першої появи та найширшого гідрохлорид; визначення а також кожного та усіх інших визна3-[5-(Морфолін-4-ілметил)піридин-2-іл]-5чень для такої групи. (трифлуорметил)-1Н-індол-2-олу гідрохлорид; Для запобігання неясності треба розуміти, що 2-Гідрокси-3-{5-[(4-метилпіперазин-1у цьому описі 'С0-6' означає карбонову груп у, що іл)сульфоніл]піридин-2-іл}-1Н-індол-6має 0, 1, 2, 3, 4,5 або 6 атоми карбону. карбонітрилу гідрохлорид; Для запобігання неясності треба розуміти, що N-[(1-Етилпіролідин-2-іл)метил]-б-(2-гідроксиу цьому описі 'С1-6' означає карбонову груп у, що 5-нітро-1Н-індол-3-іл)нікотинаміду гідрохлорид; має 1, 2, 3, 4, 5 або 6 атоми карбону. 6-(2-Гідрокси-5-нітро-1Н-iндол-3-1л)-N-(2У цьому описі, якщо не визначено інакше, теморфолiн-4-iлетил)нiкотинаміду гідрохлорид; рмін «алкіл» залучає алкіли з лінійним та розга6-(2-Гідрокси-5-нітро-1Н-індол-3-іл)-N-метиллуженим ланцюгом та ним може бути, але без N-(1-метилпіперидин-4-іл)нікотинаміду гідрохлообмеження, метил, етил, н-пропіл, і-пропіл, нрид; бутил, і-бутил, втор-бутил, трет-бутил, н-пентил, 5-Нітро-3-{5-[(4-піролідин-1-ілпіперидин-1і-пентил, трет-пентил, нео-пентил, н-гексил або ііл)карбоніл]піридин-2-іл}-1Н-індол-2-олу гідрогексил, трет-гексил. хлорид; У цьому описі, якщо не визначено інакше, те3-(5-{[3-(Диметиламіно)піролідин-1рмін «циклоалкіл» стосується, як варіант, замііл]карбоніл}піридин-2-іл)-5-нітро-1Н-індол-2-олу щеної, насиченої циклічної вуглеводневої кільцегідрохлорид; вої системи. Термін «С3-6циклоалкіл» може N-[2-(Диметиламіно)-1-метилетил]-6-(2стосуватися, але без обмеження, циклопропілу, гідрокси-5-нітро-1Н-індол-3-іл)нікотинаміду гідроциклобутилу, циклопентилу чи циклогексилу. хлорид; У цьому описі, якщо не визначено інакше, термін «алкіларил», залучає заміщені та не 21 79447 22 заміщені алкіларили, які можуть бути заміщеними обмеження фурил, ізоксазоліл, ізотіазоліл, оксана алкілі та/або арилі та можуть представляти, золіл, піразиніл, піразоліл, піридазиніл, піридил, але без обмеження, С0-6алкіларил, бензил або піримідил, піроліл, тіазоліл, тієніл, імідазоліл, етилфеніл. імідазолідиніл, імідазолініл, морфолініл, піпераУ цьому описі, якщо не визначено інакше, тезиніл, піпери-дил, піперидоніл, піразолідиніл, пірмін «гетероарил» може бути моноциклічною разолініл, піролідиніл, піролініл, тетрагідропірагетероароматичною або дициклічною конденсоніл, тіоморфолініл, феніл, циклогексил або ваною з кільцем гетероароматичною групою. циклопентил. Приклади вказаного гетероарилу залучають, але У цьому описі, якщо не визначено інакше, тебез обмеження, піридил, піроліл, фурил, тієніл, рмін «6-членне гетероароматичне кільце, що місімідазоліл, оксазоліл, ізоксазоліл, тіазоліл, піратить один або два атоми нітрогену» залучає, але золіл, бензофурил, індоліл, ізоіндоліл, бензимібез обмеження, піразиніл, піридазиніл, піридил дазоліл, піридазиніл, піримідиніл, піразиніл, тетабо піримідил. разоліл та триазоліл. У цьому описі, якщо не визначено інакше, теУ цьому описі, якщо не визначено інакше, термін «5-членна гетероциклічна група, що містить рмін «алкеніл» залучає алкеніли з лінійним та один або два гетероатоми атоми, вибрані незарозгалуженим ланцюгом, але посилання на індилежно з Ν, Ο та S», залучає, але без обмеження, відуальні алкеніли, як-то 2-бутеніл, є специфічпіразоліл, піроліл, тіазоліл, оксазоліл, тієніл, фуними тільки для варіанту лінійного ланцюга. Террил, імідазоліл, ізотіазоліл або ізоксазоліл. мін 'С2-6алкеніл, що має 2-6 атомів карбону та У випадку, де нижній індекс дорівнює 0, груодин або два подвійні зв'язки, може стосуватися, па, якої стосується нижній індекс, відсутня, тобто але без обмеження, вінілу, алілу, пропенілу, ііснує безпосередній зв'язок між групами. пропенілу, бутенілу, і-бутенілу, кротилу, пентеніУ цьому описі, якщо не визначено інакше, галу, і-пентенілу або гексенілу. логен може представляти флуор, хлор, бром або У цьому описі, якщо не визначено інакше, тейод. рмін «алкініл» залучає алкініли з лінійним та розПредставлений винахід стосується застосугалуженим ланцюгом, але посилання на індивідування сполук формули Іа та Іb, які визначено виальні алкініли, як-то 2-бутиніл, стосується тільки ще, а також їх солей. Солі для застосування у варіанту лінійного ланцюга. Термін 'С2-С6 алкініл, фармацевтичних композиціях повинні бути фарщо має 2-6 атомів карбону та один або два помацевтично прийнятними солями, але інші солі трійні зв'язки', може стосуватися, але без обмеможуть бути корисними у продукуванні сполук ження етинілу, пропаргілу, бутинілу, і-бутинілу, формули Іа та Іb. пентинілу, і-пентинілу або гексинілу. Можна застосовувати органічні та неорганічні У цьому описі, якщо не визначено інакше, текислоти, отримуючи нетоксичні фармацевтично рмін «5- або 6-членне гетероароматичне кільце, прийнятні солі сполук цього винаходу. Фармацевщо містить один або два гетероатоми, вибрані тично прийнятні солі залучають, але без обменезалежно з Ν, Ο та S, з яких принаймні один ження гідрохлорид та фумарат. Ці солі легко атом вибрано з нітрогену» залучає, але без оботримують засобами, відомими у рівні техніки. меження, ізоксазоліл, ізотіазоліл, оксазоліл, піраДеякі сполуки формул Іа та Іb можуть мати зиніл, піразоліл, піридазиніл, піридил, піримідил, хіральні центри та/або геометричні ізомерні піроліл, тіазоліл, імідазоліл. центри (Е- та Z-ізомери), і треба розуміти, що У цьому описі, якщо не визначено інакше, тевинахід охоплює усі такі оптичні, діастереоізомерміни «5- або 6-членна гетероциклічна група, що рні та геометричні ізомери. містить один або більше гетероатомів, вибраних В рамках представленого винаходу треба ронезалежно з Ν, Ο та S, або «5-, 6- або 7-членна зуміти, що сполука формули Іа або її сіль може гетероциклічна група, що містить один або два виявляти таутомерію, як показано у Фіг.1. Треба гетероатоми, вибрані незалежно з Ν, Ο та S, яка розуміти, що винахід о хоплює будь-які таутомерні може бути насиченою або ненасиченою» або «4-, форми сполук формули Іа та без обмеження 5-, 6- або 7-членна гетероциклічна група, що місбудь-яку одну таутомерну форму з малюнків фотить один або більше гетероатомів, вибраних рмул: незалежно з Ν, Ο та S» може стосуватися, але без обмеження, азепанілу, азитидинілу, імідазоллідинілу, імідазолінілу, морфолінілу, піперазинілу, піперидилу, піперидонілу, піразоллідинілу, піразолінілу, піролідинілу, піролінілу, тетрагідропіранілу, тіоморфолінілу, фурилу, ізоксазолілу, ізотіазолілу, оксазолілу, піразинілу, піразолілу, піридазинілу, піридилу, піримідилу, піролілу, тіазолілу, тієнілу, імідазолілу. У цьому описі, якщо не визначено інакше, термін «5- або 6-членне насичене або не-. насичене кільце, що містить атоми, вибрані незалежно з С, Ν, Ο та S», залучає ароматичні, гетероаромаде Р, R1, R 2, R3 , m та n визначено вище. тичні кільця та гетероциклічні кільця, що є насиОб'єктом винаходу є забезпечення сполук ченими або ненасиченими. Приклади таких гетеформул Іа чи Іb для терапевтичного застосуванроциклічних кілець залучають, але без 23 79447 24 ня, особливо сполук, що є корисними для попезиції до рН 5, та, як варіант, сурфактант для поредження та/або лікування станів, асоційованих з ліпшення розчинності. глікоген-синтазною кіназою-3 (GSK3) у ссавців, Рідкий розчин, що містить сполуку формули включаючи людин. Особливо, сполук формул Іа Іа або Іb, або її сіль, розчиняють у воді. чи Іb, що виявляють селективну афінність стосовно GSK-3. Розчин мг/мл Фармацевтичні композиції Активна сполука 5,0% за масою/об'ємом Згідно з одним аспектом представленого виЧиста вода До 100% находу запропоновано фармацевтичні композиції, що містять сполуку формул Іа або Іb, як вільМедичне застосування ну основу або її фармацевтично прийнятну сіль, Несподівано показано, що сполуки, визначені для застосування у попередженні та/або лікувану представленому винаході, як вільні основи або ні станів, асоційованих з глікоген-синтазною кінаїх фармацевтично прийнятні солі, є добре придазою-3. тними для інгібування глікоген-синтазної кінази-3 Композиції можуть мати форму, придатну для (GSK3). Відповідно, сполуки представленого виперорального застосування, наприклад, таблетнаходу, можна очікувати, будуть корисними у ки, для парентеральної ін'єкції як стерильні розпопередженні та/або лікуванні станів, асоційовачин або суспензія. Загалом вищенаведені компоних з активністю глікоген-синтазної кінази-3, тобзиції можна отримати звичайним чином, то сполуки можна використовувати для продукузастосовуючи фармацевтичні носії або розріджування інгібіторної дії GSK3 у ссавців, включаючи вачі. Придатною добовою дозою сполук формули людину, що потребує такого попередження Іа або Іb у лікуванні ссавця, включаючи людину, є та/або лікування. GSK3 сильно експресується у приблизно 0,01-250мг/кг маси тіла при пероральцентральній та периферійній нервовій системі та ному застосуванні та приблизно 0,001 до 250мг/кг в інших тканинах. Відтак, можна очікувати, що маси тіла при парентеральному застосуванні. сполуки винаходу є добре придатними для попеТипова добова доза активних інгредієнтів варіює редження та/або лікування станів, асоційованих з в широких межах та залежить від різних фактоглікоген-синтазною кіназою-3 у центральній та рів, як-то обґрунтовані показання, шлях застосупериферійній нервовій системі. Зокрема, сполуки вання, вік, маса та стать пацієнта, її може визнавинаходу, можна очікувати, будуть придатними чити лікар. для попередження та/або лікування станів, особСполуку формули Іа або Іb, або її фармацевливо асоційованих з деменцією, хворобою Альцтично прийнятну сіль, можна використовувати на геймера, хворобою Паркінсона, лобовосаму по собі але слід звичайно застосовувати у скроневою деменцією типу Паркінсона, комплекс формі фармацевтичної композиції, в якій сполудеменції Паркінсона Гуама, ВІЛ-деменцією, хвока/сіль формул Іа чи Іb (активний інгредієнт) є в робами з асоційованими патологіями сплетіння асоціації з фармацевтично прийнятним розріджунейрофібрил та деменцією боксерів. вачем або носієм. Залежно від режиму застосуІнші стани вибирають з групи, в яку залучено вання, фармацевтична композиція може містити бічний аміотрофічний склероз, корково-базальну від 0,05 до 99% (масова частка), наприклад, від дегенерацію, синдром Дауна, хворобу Гентингто0,10 до 50% активного інгредієнту, усі проценти є на, постенцефалітний паркінсонізм, прогресивний процентами від загальної маси композиції. супрануклеарний параліч, хворобу Піка, хворобу Розріджувач або носій залучає воду, водний Нейманна-Піка, інсульт, травму голови та інші поліетиленгліколь, магній карбонат, магній стеахронічні нейродегенеративні хвороби, біполярну рат, тальк, цукор (як-то лактоза), пектин, декхворобу, афективні розлади, депресію, шизофстрин, крохмаль, камедь трагаканту, мікрокрисренію, когнітивні розлади, втрату волосся та конталічну целюлозу, метилцелюлозу, натрій трацептивне лікування. карбоксиметилцелюлозу або масло какао. Наступні стани вибрано з групи, що складаКомпозиція винаходу може бути у таблетках ється з передбожевільних станів, помірного погіабо придатній для ін'єкцій формі. Таблетка може ршання пізнавальної здатності, асоційованого з додатково містити дезинтегратор та/або може віком погіршання пам'яті, асоційованої з віком бути покритою (наприклад, ентеросолюбільним нестачі пізнавальної здатності, погіршання пізнапокриттям, або покритою агентом для покриття, вальної здатності без деменції, помірної нестачі як-то гідроксипропілметилцелюлоза). пізнавальної здатності, помірного нейрокогнітивВинахід далі забезпечує спосіб отримання ного зниження, старечого безпам'ятства, погірфармацевтичної композиції винаходу, який залушання пам'яті та погіршання пізнавальної здатчає змішування сполуки формули І, або її фарності, судинної деменції, деменції з тільцями Леві мацевтично прийнятної солі, які вищезазначено, та рогенетичної алопеції. Одне втілення винахоз фармацевтично прийнятним розріджувачем або ду стосується попередження та/або лікування носієм. деменції та хвороби Альцгеймера. Прикладом фармацевтичної композиції винаДоза, потрібна для терапевтичного або попеходу є придатний для ін'єкцій розчин, що містить реджувального лікування конкретної хвороби сполуку винаходу, або її фармацевтично прийняобов'язково змінюватиметься залежно від госпотну сіль, які визначено вище, та стерильну воду, даря, якого лікують, шляху застосування та сувоа, якщо необхідно, натрій гідроксид або гідрохлорості хвороби, що лікують. ридну кислоту для доведення рН кінцевої компоПредставлений винахід стосується також застосування сполук формул Іа чи Іb, які визначено 25 79447 26 вище, у виробництві медикаменту для попередження та/або лікування станів, асоційованих з глікоген-синтазною кіназою-3. Термін «терапія» також залучає «попередження», якщо не визначено інші специфічні показання. Терміни «терапевтичний» та «терапевтично» слід розуміти відповідно. яке можна провадити реакцією з придатним Винахід також стосується способу поперестанум-реагентом, як-то триалкілстанум-R6, надження та/або лікування станів, асоційованих з приклад, трибутилстанум-R6 у присутності придаглікоген-синтазною кіназою-3, що залучає застотного каталізатору, як-то сування до ссавця, включаючи людину, що побіс(трифенілфосфін)паладій(ІІ) хлорид, тетратребує такого попередження та/або лікування, кіс{трифенілфосфін)паладій(0) або терапевтично ефективної кількості сполуки форбіс(трифенілфосфін)паладій(ІІ) ацетат, у придатмул Іа чи Іb, які визначено вище. ному розчиннику, як-то тетрагідрофуран, ацетоніНемедичне застосування трил, толуол або Ν,Ν-диметилформамід та у теНа додаток до їх застосування у терапевтичмпературних межах між 25°С та температурою ній медицині сполуки формул Іа чи Іb як вільні кипіння під зворотним холодильником. Реакції основи або їх фармацевтично прийнятні солі, є можна сприяти присутністю тетраетиламоній також корисними як фармакологічний інструменхлориду. тарій у розробці та стандартизації тест-систем in (ііі) відновлення сполуки формули VI для vitro та in vi vo для оцінки дії інгібіторів на активотримання сполуки формули VII, ність GSK3 у лабораторних тварин, як-то коти, собаки, кролі, мали, щури та миші, як частини дослідження нових терапевтичних засобів. Способи отримання Представлений винахід стосується також способів отримання сполук формули Іа або Іb. При описі таких способів зрозуміло, що там, де прийнятно, треба додавати придатні захисні групи, а далі видаляти з різних реагентів та інтермеяке можна провадити у придатному розчиндіатів відомим фахівцям з органічного синтезу нику, як-то толуол, тетрагідрофуран, діетилетер чином. Звичайні способи застосування таких заабо суміш тетрагідрофурану та спирту, як-то мехисних груп, а також приклади придатних захистанол або етанол, у присутності придатного відних гр уп, наприклад, описано у [«Protective новнику, як-то літій борогідрид або натрій борогіGroups у Organic Synthesis», T.W. Greene, P.G.M дрид та при температурі реакції між 0сС та Wutz, Wiley-lnterscience, New York, 1999]. температурою кипіння під зворотним холодильОтримання інтермедіатів ником. Спосіб, де halo представляє галоген, R3, R4, (iv) окиснення сполуки формули VII для R5, R6, X1, n та m, якщо не визначено інакше, виотримання сполуки формули VIII, значено вище, залучає, (і) галогенування сполуки формули II, де R2 представляє галоген, для отримання сполуки формули III, де halo представляє галоген, наприклад, бром, хлор або йод, можна провадити ароматичним електрофільним заміщенням, застосовуючи придатний засіб галогенування, як-то Вr2, СІ2, l2, ICI, SO2CI 2 або інший придатний засіб галогенування, як-то Nбромсукцинімід у прийнятному розчиннику, як-то ацетонітрил, оцтова кислота, НСІ/етанол або вода, з придатною основою чи без неї, наприклад, ацетатом лужного металу, як-то натрій ацетат, при температурі реакції між -20°С та кімнатною температурою. (іі) перетворення сполуки формули IV, де halo представляє галоген, наприклад, бром або йод, для отримання сполуки формули V, де X1 представляє безпосередній зв'язок, а R6 визначено вище, яке можна провадити у придатному розчиннику, як-то хлороформ, тетрагідрофуран або піридин у присутності придатного окисненику, як-то xpoм (VI) оксид або манган(І\/) оксид, та при температурі реакції між 0°С та +100°С. (ν) перетворення сполуки формули VIII для отримання сполуки формули IX, яке можна провадити у придатному розчиннику, як-то спирт, наприклад, метанол у присутності придатного реагенту, як-то тозилметил ізоціанід та придатної основи, як-то калій карбонат 27 79447 28 або натрій карбонат, при температурі реакції між 0°С та температурою кипіння під зворотним хоактивацією кислотної функціональної групи у лодильником. сполуці формули XIV, (vi) перетворення сполуки формули X для a) засобом галогенування, як-то тіонілхлорид отримання сполуки формули XI, або оксалілхлорид, у придатному розчиннику, якто метиленхлорид, хлороформ або толуол, або застосовуючи реагент без добавок, реакція може відбуватися при температурі між 0°С та +80°С, з наступною реакцією з прийнятним аміном R4R5NH у придатному розчиннику, як-то метиленхлорид, хлороформ, толуол або ацетонітрил, з придатною основою чи без неї, як-то карбонат або гідроксид лужного металу, лужно-земельного металу, як-то натрій карбонат, калій карбонат, яке можна провадити у придатному розчинкальцій карбонат, натрій гідроксид або калій гіднику, як-то карбон дисульфід у присутності прироксид, або алкіламіновою основою, як-то тридатних реагентів, як-то алюміній трихлорид та етиламін, реакція може відбуватися при темперахлорацетилхлорид, при температурі реакції між турі між -20°С та +80°С, або 0°С та температурою кипіння під зворотним хоb) придатним сполучальним реагентом, як-то лодильником. 1,3-діізопропілкарбодіімід, 1-{3(vii) Перетворення сполуки формули XI для (диметиламіно)пропіл]-3-етилкарбодііміду гідроотримання сполуки формули XII, хлорцц, 1,3-дициклогексилкарбодіімід, О(бензотриазол-і-іл)-N,N,N',N'-тетраметилуроній тетрафлуорборат, О-(бензотриазол-1-іл)Ν,Ν,Ν',Ν'-тетраметилуроній гексафлуорфосфат, 1,1'-карбонілдіімідазол або О-(7азабензотриазол-1нл)-N,N,N',N'тетраметилурон1й гексафлуорфосфат, де реакції можна сприяти додаванням 1гідроксибензотриазолу гідрату, у придатному розчиннику, як-то метиленхлорид, Ν,Νяке можна провадити у придатному розчиндиметилформамід або тетрагідрофуран, реакція нику, як-то толуол, діоксан або тетрагідрофуран у може відбуватися при температурі між +20°С та присутності придатного реагенту, як-то тіофор+130°С, а потім додаванням прийнятного аміну мамід та придатної основи, як-то триалкіламін, R4R5NH, при температурі реакції між +20°С та наприклад, триетиламін, або калій карбонат та +130°С. при температурі реакції між +25°С та температу(х) перетворення сполуки формули XVI, де рою кипіння під зворотним холодильником. halo представляє галоген, наприклад, флуор, (viii) перетворення сполуки формули XI для хлор або бром, у сполуку формули XV можна отримання сполуки формули XIII, провадити яке можна провадити у придатному розчиннику, як-то оцтова кислота, у присутності придатного реагенту, як-то тіоацетамід, при температурі реакції між +25°С та температурою кипіння під зворотним холодильником. (іх) перетворення сполуки формули XIV, де halo представляє галоген, наприклад, флуор, хлор або бром, у сполуку формули XV можна провадити реакцією з прийнятним аміном R4R5NH у придатному розчиннику, як-то метиленхлорид, хлороформ, толуол або ацетонітрил, з придатною основою чи без неї, як-то натрій карбонат, калій карбонат, кальцій карбонат, натрій гідроксид або калій гідроксид або алкіламіновою основою, як-то триетиламін, реакція може відбуватися при температурі між -20°С та +80°С. (хі) Перетворення сполуки формули XVII, де halo представляє галоген, наприклад, флуор, хлор або бром, у сполуку формули XVIII можна провадити 29 активацією сульфонової кислотної функціональної групи у сполуці формули XVII придатним галогенувальним реагентом, як-то тіонілхлорид або фосфороксихлорид у придатному розчиннику, як-то метиленхлорид, хлороформ, ацетонітрил або толуол, та · можна додавати сульфолан як співрозчинник для полегшення реакції. Каталітична кількість N,N-диметилацетаміду може прискорювати реакцію, реакція може відбуватися при температурі між 0°С та +120°С, а потім реакцією з прийнятним заміщеним аміном R4R5NH у придатному розчиннику, як-то метиленхлорид, хлороформ, толуол або ацетонітрил, з придатною основою чи без неї, як-то натрій карбонат, калій карбонат, кальцій карбонат, натрій гідроксид або калій гідроксид, або алкіламіновою основою, якто триетиламін, реакція може відбуватися при температурі між -20°С та +80°С. (хіі) перетворення сполуки формули XIX, де halo представляє галоген, наприклад, флуор, хлор або бром, a R3 представляє гідроген або галоген, наприклад, флуор, хлор або бром, у сполуку формули XVI На можна провадити реакцією з прийнятним аміном R4R5NH у придатному розчиннику, як-то метиленхлорид, хлороформ, толуол або ацетонітрил, з придатною основою чи без неї, як-то натрій карбонат, калій карбонат, кальцій карбонат, натрій гідроксид або калій гідроксид, або алкіламіновою основою, якто триетиламін, реакція може відбуватися при температурі між -20°С та +80°С. (хііі) реакцію сполуки формули XX, де halo представляє галоген, у сполуку формули XXI можна провадити реакцією з прийнятним аміном R4R5NH у придатному розчиннику, як-то метиленхлорид, хло 79447 30 роформ, ацетонітрил або Ν,Ν-диметилформамід, з придатною основою чи без неї, як-то натрій карбонат, калій карбонат, кальцій карбонат, натрій гідроксид або калій гідроксид, або алкіламіновою основою, як-то триетиламін, реакція може відбуватися при температурі між 0°С та +120°С. (xi v) реакцію сполуки формули XXII, де halo представляє галоген, наприклад, флуор хлор, бром, у сполуку формули XXIII можна провадити реакцією з прийнятним реагентом R4OH у придатному розчиннику, як-то ацетонітрил, метиленхлорид, хлороформ, толуол або Ν,Νдиметилформамід, у присутності придатної основи, як-то натрій карбонат, калій карбонат, кальцій карбонат, натрій гідроксид, калій гідроксид або натрій гідрид, або алкіламіновою основою, як-то триетиламін, реакція може відбуватися при температурі між 0°С та +80°С. (xv) Перетворення сполуки формули XXIV, де halo представляє галоген, наприклад, флуор, хлор, бром, у сполуку формули XXV можна провадити реагуванням сполуки формули XXIV з прийнятним аміном R4R5NH у придатному розчиннику, як-то метиленхлорид, хлороформ, ацетонітрил або Ν,Ν-диметилформамід, з придатною основою чи без неї, як-то натрій карбонат, калій карбонат, кальцій карбонат, натрій гідроксид або калій гідроксид або, алкіламіновою основою, як-то триетиламін або, макропористою полісти-рольною аніонообмінною смолою, як-то МР-Карбонат або, перехресно зчеплений полістирол-кодивінілбензол, як-то PS-діізопропілетиламін, та реакція може відбуватися при температурі між 0°С та +120°С. (xvi) реагування сполуки формули XXVI, де R4 представляє С 1-6алкіл, a halo представляє галоген, наприклад, флуор, хлор або бром, зі сполукою формули С (де R2 та m визначено вище, наприклад, сполук формул III, V, IX, XII або XIII), отримуючи сполуку формули XXVII, 31 можна провадити у прийнятному розчиннику, як-то етер, наприклад, тетрагідрофуран або 1,4діоксан, ароматичний вуглеводневий розчинник, як-то толуол або диполярний апротон-ний розчинник, як-то Ν,Ν-диметилформамід, Ν,Νдиметилацетамід, М-метилпіролідин-2-он або диметилсульфоксид, реакція може відбуватися при температурі між +10°С та +150°С. Реакцію переважно провадять у присутності основи. Придатною основою може бути органічний амін, як-то піридин, 2,6-лутидин, колідин, 4диметиламінопіридин, триетиламін, морфолін, Nметилморфолін, діазадицикло{5,4,0]ундец-7-ен, тетраметилгуанідин або карбонат або гідроксид лужного металу або лужно-земельного металу, як-то натрій карбонат, калій карбонат, кальцій карбонат, натрій гідроксид або калій гідроксид. Альтернативно, такою основою може бути гідрид лужного металу, як-то натрій гідрид, або амід лужного металу або лужно-земельного металу, як-то натрій амід, натрій біс(триметилсиліл)амід, калій амід або калій біс(триметилсиліл)амід. (xvii) реагування сполуки формули XXV, де halo представляє галоген, наприклад, флуор, хлор або бром, зі сполукою формули С (де R2 та m визначено вище, наприклад, сполукою формул III, V, IX, XII або XIII), о тримуючи сполуку формули XXVIII, можна провадити у прийнятному розчиннику, як-то етер, наприклад, тетрагідрофуран або 1,4-діоксан, ароматичний вуглеводневий розчинник, як-то толуол або диполярний апротонний розчинник, як-то Ν,Ν-диметилформамід, Ν,Νдиметилацетамід, N-метилпіролідин-2-он або диметилсульфоксид, реакція може відбуватися при температурі між +10°С та +150°С. Реакцію переважно провадять у присутності основи. Придатною основою може бути органічний амін, як-то піридин, 2,6-лутидин, колідин, 4диметиламінопіридин, триетиламін, морфолін, Nметилморфолін, діазадицикло[5,4,0]ундец-7-ен, тетраметилгуанідин або карбонат або гідроксид лужного металу або лужно-земельного металу, як-то натрій карбонат, калій карбонат, кальцій карбонат, натрій гідроксид або калій гідроксид. Альтернативно, такою основою може бути гідрид 79447 32 лужного металу, як-то натрій гідрид, або лужного металу або амід лужно-земельного металу, як-то натрій амід, натрій біс(триметилсиліл)амід, калій амід або калій біс(триметилсиліл)амід. Способи отримання кінцевих продуктів Іншим об'єктом винаходу є способи a, b, c, d та є отримання сполук загальних формул Іа та Іb, де halo представляє галоген, Р, R1, R2, R3, R4, R5, m та n, якщо не визначено інакше, визначено вище, та їх солей. Ці способи залучають: а) реагування сполуки формули В (XV, XVIII, XVIIIa, XXI, XXIII), де L1 представляє відщеплювану гр уп у, як-то галоген, наприклад, флуор, хлор або бром, зі сполукою формули С (наприклад, сполуками формул III, V, IX, XII, XIII); де R1, R2 та m визначено вище, отримуючи сполуку формули Іа; Реакцію способу можна провадити у прийнятному розчиннику, як-то етер, наприклад, тетрагідрофуран або 1,4-діоксан, ароматичний вуглеводневий розчинник, як-то толуол або ди-полярний апротонний розчинник, як-то Ν,Νдиметилформамід, Ν,Ν-диметилацетамід, Nметилпіролідин-2-он або диметилсульфоксид, реакція може відбуватися при температурі між +10оСта+150°С. Реакцію переважно провадять у присутності основи. Придатною основою може бути органічний амін, як-то піридин, 2,6-лутидин, колідин, 4диметиламінопіридин, триетиламін, морфолін, Nметилморфолін, діазадицикло[5,4,0]ундец-7-ен, тетраметилгуанідин або карбонат або гідроксид лужного металу або лужно-земельного металу, як-то натрій карбонат, калій карбонат, кальцій карбонат, натрій гідроксид або калій гідроксид. Альтернативно, такою основою може бути гідрид лужного металу, як-то натрій гідрид, або лужного металу або амід лужно-земельного металу, як-то натрій амід, натрій біс(триметилсиліл)амід, калій амід або калій біс(триметилсиліл)амід. Коли бажано, для отримання солі вільну основу можна обробляти кислотою, як-то гідрогалогенід, як-то гідрогенхлорид, або карбоновою кислотою, як-то фумарова кислота, у придатному розчиннику, якто тетрагідрофуран, діетилетер, метанол, етанол, хлороформ або метиленхлорид, або їх суміші, реакція може відбуватися між -30°С до +50°С. b) реагування сполуки формули XXV, де halo представляє галоген, наприклад, флуор, хлор або бром, зі сполукою формули С (наприклад, сполукою формул III, V, IX, XII, XIII); де R1, R2 та m визначено вище); отримуючи сполуку формули Іа; 33 Реакцію способу b можна провадити у прийнятному розчиннику, як-то етер, наприклад, тетрагідрофуран або 1,4-діоксан, ароматичний вуглеводневий розчинник, як-то толуол, або диполярний апротонний розчинник, як-то Nдиметилформамід, Ν,Ν-диметилацетамід, Nметилпіролідин-2-он або диметилсульфоксид, реакція може відбуватися при температурі між +10°С та +150°С. Реакцію переважно провадять у присутності основи. Такою основою може бути органічний амін, як-то піридин, 2,6-лутидин, колідин, 4диметиламінопіридин, триетиламін, морфолін, Nметилморфолін, діазадицикло[5,4,0]ундец-7-ен, тетраметилгуанідин або карбонат або гідроксид лужного металу або лужно-земельного металу, як-то натрій карбонат, калій карбонат, кальцій карбонат, натрій гідроксид або калій гідроксид. Альтернативно, такою основою може бути гідрид лужного металу, як-то натрій гідрид, лужного металу або амід лужноземельного металу, як-то натрій амід, натрій біс(триметилсиліл)амід, калій амід або калій біс(триметилсиліл)амід. N-оксид можна видалити, застосовуючи придатний реагент, як-то фосфортрихлорид, у придатному розчиннику, як-то метиленхлорид, хлороформ, толуол або етилацетат, реакція може відбуватися при температурі між 0°С та +100°С. Коли бажано, для отримання солі вільну основу можна обробляти кислотою, як-то гідрогалогенід, як-то гідрогенхлорид, або карбонова кислота, як-то фумарова кислота у придатному розчиннику, як-то тетрагідрофуран, діетилетер, метанол, етанол, хлороформ або метиленхлорид, або їх суміші, реакція може відбуватися між 30°С та +50°С. c) реагування сполуки формули XXVII, де R4 представляє С 1-6алкіл, з прийнятним аміном HNR4R5, отримуючи сполуку формули Іа; Реакцію способу с можна провадити: і) реакцією сполуки формули XXVII з прийнятним аміном R4R5NH у придатному розчиннику, 79447 34 як-то бензол, метиленхлорид, хлороформ, толуол або ацетонітрил у присутності придатного реагенту, як-то триметилалюміній, при температурі реакції між 0°С та температурою кипіння під зворотним холодильником або, іі) реакцією сполуки формули XXVII з прийнятним аміном R4R5NH без розчиннику або у придатному розчиннику, як-то метиленхлорид, хлороформ, толуол або ацетонітрил, з придатною основою чи без неї, як-то карбонат або гідроксид лужного металу, лужно-земельного металу, як-то натрій карбонат, калій карбонат, кальцій карбонат, натрій гідроксид або калій гідроксид, або алкіламіном, як-то триетиламін, реакція може відбуватися при температурі між -20°С та +150°С. Коли бажано для отримання солі вільну основу можна обробляти кислотою, як-то гідрогалогенід, як-то гідрогенхлорид, або карбонова кислота, як-то фумарова кислота, у придатному розчиннику, як-то тетрагідрофуран, діетилетер, метанол, етанол, хлороформ або метиленхлорид, або їх суміші, реакція може відбуватися між 30°С та +50°С. d) відновленням N-оксиду у сполуці формули XXVIII, отримуючи сполуку формули Іа; N-оксид можна відновлювати, застосовуючи придатний реагент, як-то фосфортрихлорид, у придатному розчиннику, як-то метиленхлорид, хлороформ, толуол або етилацетат, реакція може відбуватися при температурі між 0°С та +100°С. Коли бажано, для отримання солі вільну основу можна обробляти кислотою, як-то гідрогалогенід, як-то гідрогенхлорид, або карбонова кислота, як-то фумарова кислота, у придатному розчиннику, як-то тетрагідрофуран, діетилетер, метанол, етанол, хлороформ або метиленхлорид або суміші їх, реакція може відбуватися між -30°С до +50°С. e) флуор ування сполуки формули Іа, отримуючи сполуку формули Іb; 35 79447 36 Реакцію способу є можна провадити у прийн1-[(6-Хлор-1-оксидопіридин-3-іл)метил]-4ятному розчиннику, як-то етер, наприклад, тетраметил-1,4-діазепан; гідрофуран або 1,4-діоксан, або їх суміші у прису2-Хлор-5-[(4-піролідин-1-ілпіперидин-1тності придатного реагенту флуор ування, як-то 1іл)метил]піридин 1-оксид; флуор-2,4,6-триметилпіридиній трифлат. та при1-[(6-Хлор-1-оксидопiридин-3-іл)метил]-N,Nдатної основи, як-то н-бутиллітій або натрій диметилпіролідин-3-амін; біс(триметилсиліл)амід, при температурі реакції 2-Хлор-5-[(4-метилпіперидин-1між -40°С та +80°С. іл)метил]піридин 1-оксид; Коли бажано, для отримання солі вільну ос1-[(6-Хлор-1-оксидопіридин-3-іл)метил]-4нову можна обробляти кислотою, як-то гідрогалофенілпіперазин; генід, як-то гідрогенхлорид, або карбонова кисло1-[(6-Хлор-1-оксидопіридин-3-іл)метил]-4-[2та, як-то фумарова кислота, у придатному нітро-4-(трифлуорметил)феніл]піперазин; розчиннику, як-то тетрагідрофуран, діетилетер, 3-[[(6-Хлор-1-оксидопіридин-3метанол, етанол, хлороформ або метиленхлоіл)метил](етил)аміно]пропаннітрил; рид, або їх суміші, реакція може відбуватися між N-(4-Хлорбензил)-N-[(6-хлор-130°С до +50°С. оксидопіридин-3-іл)метил]-N-метиламін; Інтермедіати N-[(6-Хлор-1-оксидопіридин-3-іл)метил]-N-(2Представлений винахід стосується також нофурилметил)-N-метиламін; вих інтермедіатів та застосування цих інтермедіΝ-[(6-Χлоρ-1-оксидопіридин-3-іл)метил]-Nатів при отриманні сполук формул Іа та Іb, що метил-N-феніламін; визначено вище. 5-(азетидин-1-ілметил)-2-хлорпіридин 1Згідно з одним аспектом винаходу інтермедіоксид; атом є сполука формули XXV 2-Хлор-5-[(3-метилпіперидин-1іл)метил]піридин 1-оксид; N-[(6-Хлор-1-оксидопіридин-3-іл)метил]-Nциклогексил-N-метиламін; 2-Хлор-5-(піперидин-1-ілметил)піридин 1оксид; як вільні основи або їх солі. Згідно з ще одним аспектом представленого винаходу інтермедіатом є сполука формули В (XV, XVIII, XVIIIa, XXI, XXIII) де halo представляє галоген; R3 вибрано з групи: галоген, нітро, С1-6алкіл, флуорметил, дифлуорметил, трифлуорметил, флуорметокси, дифлуорметокси, трифлуорметокси, OС14 5 4 5 6алкілNR R , С 1-6алкілціано, С 0-6алкілCONR R , 4 5 4 s С0-6алкіл(SO2)NR R , С0-6алкілNR R та група X1R 6, де X1 представляє безпосередній зв'язок, О, CONR7RS, SO2NR9R10, SO 2R11 або NR12R13; R7 , R9 та R12, кожний незалежно, представляють гідде Ρ представляє 5- або 6-членне гетеророген або С1-3алкіл; R8, R10, R11 та R13 представароматичне кільце, що містить один або два ге6 ляють С 0-4алкіл; R представляє феніл або 5-, 6тероатоми, вибрані незалежно з Ν, Ο та S, з яких або 7-членну гетероциклічну групу, що містить принаймні один атом вибрано з нітрогену, a L1 один або два гетероатоми, вибрані незалежно з представляє відщеплювану груп у, як-то галоген, Ν, Ο та S, ця гетероциклічна група може бути наприклад, флуор, хлор або бром; де R3 вибрано насиченою або ненасиченою, або вказаний феніл з групи: галоген, нітро, С1-6алкіл, флуорметил, чи 5-, 6- або 7-членна гетероциклічна група модифлуорметил, трифлуорметил, флуорметокси, жуть, як варіант, бути конденсованими з 5- або 6дифлуорметокси, трифлуорметокси, OС14 5 4 s членним насиченим або ненасиченим кільцем, 6алкілNR R , С 0-6алкілціано, С 0-6алкілCONR R , 4 5 4 5 1 6 що містить атоми, вибрані незалежно з С, Ν, Ο та С0-6алкіл(SО2)NR R , С0-6алкілNR R та груп X R , S, та ці феніл або гетероциклічна група можуть де X1 представляє безпосередній зв'язок, О, бути заміщеними одним або двома замісниками, CONR7R8, SO2NR9R10 , SO2R 11 або NR12R13; R7 , R9 вибраними з W; a R6 зчеплений з R8, R10, R11 та та R12, кожний незалежно, представляють гідроR13. ген або С1-3алкіл; R8, R10, R11 та R13 представляЗгідно з одним втіленням цього аспекту зають С0-4алкіл; R6 представляє феніл або 5-, 6пропоновано сполуки формули XXV, де R3 предабо 7-членну гетероциклічну групу, що містить ставляє С 1-6алкілNR4R5; a n дорівнює 1. один або два гетероатоми, вибрані незалежно з У згідно з ще одним аспектом запропоновано Ν, Ο та S, ця гетероциклічна група може бути сполуки: насиченою або ненасиченою, або вказаний феніл 1-[(6-Хлорпіридин-3-іл)метил]-4чи 5-, б- або 7-членна гетероциклічна група мометилпіперазин; жуть, як варіант, бути конденсованими з 5- або 62-Хлор-5-(морфолін-4-ілметил)піридин 1членним насиченим або ненасиченим кільцем, оксид; що містить атоми, вибрані незалежно з С, Ν, Ο та 2-Хлор-5-(піролідин-1-ілметил)піридин 1S, та ці феніл або гетероциклічна група можуть оксид; бути заміщеними одним або двома замісниками, 37 79447 38 вибраними з W; a R6 зчеплений з R8, R10, R11 та жуть, як варіант, бути конденсованими з 5- або 6R13. членним насиченим або ненасиченим кільцем, Згідно з одним втіленням цього аспекту защо містить атоми, вибрані незалежно з С, Ν, Ο та пропоновано сполуки формули В (XV, XVIII, S, та ці феніл або гетероциклічна група можуть XVIIIa, XXI, XXIII), де Ρ представляє піридинове бути заміщеними одним або двома замісниками, або піримідинове кільце, a L1 представляє відщевибраними з W; a R6 зчеплений з R8, R10, R11 та плювану гр упу, як-то галоген, наприклад, хлор; де R13. R3 вибрано з С 0-6алкілCONR4R5, С0Згідно з одним втіленням цього аспекту за4 5 та С0-6алкілNR4R5; n дорівпропоновано сполуки формули С (III, V, IX, XII, 6алкіл(SО2)NR R нює 1. XIII), де R1 представляє гідроген; R2 вибрано з Згідно з ще одним аспектом запропоновано групи: галоген та гр упа X1R6, де X1 представляє сполуки: безпосередній зв'язок; R6 представляє 5- або 62-Хлор-N-[2членну гетероциклічну груп у, що містить один (диметиламіно)етил]ізонікотинамід; або два гетероатоми, вибрані незалежно з Ν, Ο 1-(2-Хлорізонікотиноїл)-4-метилпіперазин; та S; m дорівнює 1 або 2. 6-Хлор-N-[2-(диметиламiно)етил]-NЗгідно з ще одним аспектом запропоновано метилнікотинамід; сполуки: 4-{2-[(6-Хлорпіримідин-45,6-Дибром-1,3-дигідроіндол-2-он; іл)окси]етил}морфолін; 5-Піридин-3-іл-1,3-дигідро-2Н-індол-2-он; 1-Бензил-4-[(6-хлорпіридин-35-Тієн-2-іл-1,3-дигідро-2Н-індол-2-он; іл)сульфоніл]піперазин; 5-(2-Фурил)-1,3-дигідро-2Н-індол-2-он; 1-[(6-Хлорпіридин-3-іл)сульфоніл]-4-(35-(1,3-Оксазол-5-іл)-1,3-дигідро-2Н-індол-2метилбутил)піперазин; он; 1-[(6-Хлорпіридин-3-іл)сульфоніл]-45-(1,3-Тіазол-4-іл)-1,3-дигідро-2Н-індол-2-он; ізопропілпіперазин; 5-(2-Метил-1,3-тіазол-4-іл)-1,3-дигідро-2Н1-(6-Хлорпіридин-3-іл)сульфоніл)-4індол-2-он; етилпіперазин; як вільні основи або їх солі. 1-[(5-Бром-6-хлорпіридин-3-іл)сульфоніл]-4Згідно з ще одним аспектом винаходу інтерметилпіперазин; медіатом є сполука формули XXVII 6-Хлор-N-метил-N-(2-піролідин-1ілетил)піридин-3-сульфонамід; 6-Хлор-N-[2-(диметиламіно)етил]піридин-3сульфонамід; 6-Хлор-N-[2-(диметиламіно)етил]-Nетилпіридин-3-сульфонамід; 6-Хлор-N-[(1-етилпіролідин-2іл)метил]піридин-3-сульфонамід; 1-[(6-Хлорпіридин-3-іл)сульфоніл]-4-метил1,4-діазепан; 4-[(6-Хлорпіридин-3-іл)сульфоніл)морфолін; як вільні основи або їх солі. Згідно з ще одним аспектом винаходу інтермедіатом є сполука формули С (III, V, IX, XII, XIII) де R1 представляє гідроген; R2 вибрано з групи: галоген, нітро, С1-6алкіл, флуорметил, дифлуорметил, трифлуорметил, флуорметокси, дифлуорметокси, трифлуорметокси, ОС14 5 4 5 6алкілNR R , С 0-6алкілціано, С 0-6алкілCONR R , 4 5 4 5 С0-6алкіл(SO2)NR R , С0-6алкілNR R та група X1R 6, де X1 представляє безпосередній зв'язок, О, CONR 7R8, SO 2NR9R10, SO2R11 або NR12R13; R7 , R9Ta R12, кожний незалежно, представляють гідде R1 представляє гідроген; R2 вибрано з роген або С 1-3алкіл; R8, R10, R11 та R13 представгрупи: галоген, нітро, С1-6алкіл, флуорметил, диляють С 0-4алкіл; R6 представляє феніл або 5-, 6флуорметил, трифлуорметил, флуорметокси, або 7-членну гетероциклічну групу, що містить дифлуорметокси, трифлуорметокси, ОС14 5 4 5 один або два гетероатоми, вибрані незалежно з 6алкілNR R , С 0-6алкілціано, С 0-6алкілCONR R , 4 5 4 s Ν, Ο та S, ця гетероциклічна група може бути С0-6алкіл(SO2)NR R , С0-6алкілNR R та група насиченою чи ненасиченою, або вказаний феніл X1R 6, де X1 представляє безпосередній зв'язок, 7 8 9 10 11 12 13 7 чи 5-, 6- або 7-членна гетероциклічна група моО, CONR R , SO 2NR R , SO2R або NR R ; R , жуть, як варіант, бути конденсованими з 5- або 6R9Ta R12, кожний незалежно, представляють гід8 10 11 13 членним насиченим або ненасиченим кільцем, роген або С1-3алкіл; R , R , R та R представ6 що містить атоми, вибрані незалежно з С, Ν, Ο та ляють С 0-4алкіл; R представляє феніл або 5-, 6S, та ці феніл або гетероциклічна група можуть або 7-членну гетероциклічну групу, що містить бути заміщеними одним або двома замісниками, один або два гетероатоми, вибрані незалежно з вибраними з W; a R6 зчеплений з R8, R10, R11 та Ν, Ο та S, ця гетероциклічна група може бути R13. насиченою чи ненасиченою, або вказаний феніл чи 5-, 6- або 7-членна гетероциклічна група мо 39 79447 40 Згідно з одним втіленням цього аспекту заЗгідно з ще одним аспектом запропоновано пропоновано сполуки формули XXVII, де R1 предсполуки: ставляє гідроген; R2 вибрано з групи: нітро та 5-(Гідроксиметил)-1,3-дигідро-2Н-індол-2-он; ціано; m дорівнює 1. 2-Оксоіндолін-5-карбальдегід; Згідно з ще одним аспектом запропоновано 5-(Хлорацетил)-1,3-дигідро-2Н-індол-2-он; сполуки: як вільні основи або їх солі. Етил 6-(2-гідрокси-5-нітро-1 Н-індол-3Згідно з одним аспектом винаходу запропоіл)нікотинат; новано застосування сполук будь-якої з формул Етил 6-(2-гідрокси-5-ціано-1 Н-індол-3XXV; В (XV, XVIII, XVIIIa, XXI, XXIII); С (III, V, IX, іл)нікотинат; XII, XIII); XXVII; XXVIII; для отримання сполук фояк вільні основи або їх солі. рмул Іа чи Іb. Згідно з ще одним аспектом винаходу інтерРобочі приклади медіатом є сполука формули XXVIII Винахід ілюстровано, але без обмеження, наступними прикладами, якщо не визначено інакше: (і) температуру представлено у градусах Цельсія (°С); операції провадять при кімнатній температурі, тобто при температурі у межах 18-25°С; (іі) вихід представлено тільки для ілюстрації та не обов'язково він може бути отриманим належним способом; отримання повторюютьякщо потрібно більше матеріалу; (ііі) при наявності дані ЯМР мають форму дельта-значень у частках на мільйон (млн.-1) відносно розчиннику або відносно тетраметилсилану (TMS) як внутрішнього стандарту; 1 2 де R представляє гідроген; R вибрано з (iv) хімічні символи мають їх звичайні значенгрупи: галоген, нітро, С1-6алкіл, флуорметил, диня; використовують одиниці та символи SI; флуорметил, трифлуорметил, флуорметокси, (ν) співвідношення розчинників представлено дифлуорметокси, трифлуорметокси, ОС1як об'ємні частки (ν/ν); та 4 5 4 5 6алкілNR R , С 0-6алкілціано, С 0-6алкілСONR R , (vi) мас-спектри: де вказано, іонізацію здійсС0-6алкіл(SO2)NR4R5, С0-6алкілNR4R5 тa група нюють як хімічну іонізацію (XI), електронним уда1 6 1 X R , де X представляє безпосередній зв'язок, ром (ЕУ), бомбардуванням швидкими атомами О, CONR7R8, SO 2NR9R10, SO2R11 або NR12R13; R7 , (БША) або електророзпиленням (ЕР) якщо не 9 12 R та R , кожний незалежно, представляють гідвизначено інакше; представлено значення для 8 10 11 13 роген або С1-3алкіл; R , R , R та R представm/z; загалом, представлено тільки вихідну масу 6 ляють С 0-4алкіл; R представляє феніл або 5-, 6іонів. або 7-членну гетероциклічну групу, що містить Приклад 1 один або два гетероатоми, вибрані незалежно з 2-Хлор-N-[2Ν, Ο та S, ця гетероциклічна група може бути (диметиламіно)етил]ізонікотинамід насиченою чи ненасиченою, або вказаний феніл До розчину 2-хлорізонікотинової кислоти чи 5-, 6- або 7-членна гетероциклічна група мо(0,50 г, 3,17ммоль) у Ν,Ν-диметилформамід жуть, як варіант, бути конденсованими з 5- або 6(20мл) додають 1,1'-карбонілдіімідазол (0,565г, членним насиченим або ненасиченим кільцем, 3,49ммоль). Розчин гріють при 70°С протягом 30 що містить атоми, вибрані незалежно з С, Ν, Ο та хвилин. Реакційну суміш о холоджують до кімнатS, та ці феніл або гетероциклічна група можуть ної температури та додають Ν,Ν-диметилетанбути заміщеними одним або двома замісниками, 1,2-діамін (0,31г, 3,49ммоль). Розчин перемішу6 8 10 11 вибраними з W; a R зчеплений з R , R , R R та ють при кімнатній температурі протягом ночі. 13 R . Розчинник випарюють у вакуумі та залишок очиЗгідно з одним втіленням цього аспекту защають на колонці з силікагелем, застосовуючи пропоновано сполуки формули XXVIII, де R1 хлороформ/метанол/конц. NН3(водн.), (90:10:1) як 2 1 6 представляє гідроген; R представляє групу X R , елюент, отримуючи 40мг (5,7% виходу) потрібної 1 6 де X представляє безпосередній зв'язок; R сполуки як безбарвне масло: 1Н ЯМР (CDCI3, представляє 5- або 6-членну гетероциклічну гру400МГц) d 8,51 (d, J=5Гц, 1Η), 7,68 (s, 1Η), 7,56 пу, що містить один або два гетероатоми, вибрані (dd, J=5,1Гц, 1Η), 6,92-7,08 (br s, 1Η), 3,58-3,48 незалежно з Ν, Ο та S; m дорівнює 1 (m, 2Η), 2,59-2,52 (m, 2Η), 2,28 (s, 6 Η); MC (TSP) Згідно з ще одним аспектом запропоновано m/z 228(M++1). сполуки: Приклад 2 3-[5-(Морфолін-4-іл метил )-1-оксидопіридин1-(2-Хлорізонікотиноїл)-4-метилпіперазин 2-іл]-5-піридин-3-іл-1Н-ізоіндол-2-ол; Потрібну сполуку отримують як описано у 3-[5-(Морфолін-4-ілметил)-1-оксидопіридин-2прикладі 1, застосовуючи 2-хлорізонікотинову іл]-5-тієн-2-іл-1Н-індол-2-ол; кислоту та 1-метилпіперазин. Сирий продукт 5-(2-Фурил)-3-[5-(морфолін-4-ілметил)-1очищають на колонці з силікагелем, застосовуюоксидопіридин-2-іл]-1Н-індол-2-ол; чи хлороформ/метанол/конц. NН3(водн.), як вільні основи або їх солі. (100:10:1) як елюент, отримуючи потрібну сполуку як безбарвне масло. Вихід: 68%: 1Н ЯМР 41 79447 42 водним натрій сульфатом та розчинник видаля(CDCI3, 400МГц) d 8,51 (d, J=5Гц, 1Η), 7,57 (s, 1Η), ють у вакуумі, отримуючи 1,0г (74% виходу) 7,43 (dd, J=5,1Гц, 1 Η), 3,66-3,58 (m, 2Η), 3,283,21 (m, 2Η), 2,41-2,34 (m, 2Η), 2,30-2,24 (m, 2Η), потрібної сполуки як жовте масло: 1Н ЯМР + 2,20 (s, 3Η); MC (TSP) m/z 240 (M +1). (CDCI3, 400МГц) d 8,31 (d, J=2Гц, 1Η), 7,65 (dd, Приклад 3 J=8,2Гц, 1Η), 7,29 (d, J=8Гц, 1Η), 3,49 (s, 2Η), 2,46 6-Хлор-N-[2-(диметиламіно)етил]-N(br s, 8Η), 2,28 (s, 3Η), 13C ЯМР (CDCI3, 100МГц) d метилнікотинамід 150,2, 150,1, 139,5, 132,8, 124,0, 59,2, 55,0, 53,0, До розчину Ν,Ν,Ν'-триметилетилендіаміну 46,0, MC (ЕР) m/z 226 (M++1). (1,0г, 10ммоль) та триетиламіну (2,0г, 20ммоль) у Приклад 6 метиленхлориді (25мл) додають 62-Хлор-5-(морфолін-4-ілметил)піридин Nхлорнікотинілхлорид (1,7г, 10ммоль) у метиленоксид хлориді (50мл) при кімнатній температурі. Після 2 Суміш 2-хлор-5-(хлорметил)піридин 1-оксиду годин при кімнатній температурі розчинник вида(1,16г, 6,52ммоль; описано [Tilley, J. W. et аг, J. ляють у вакуумі та залишок розподіляють між 2Μ Heterocyclic Chem. 1979,16,333]), морфоліну водним розчином NaOH та метиленхлоридом. (1,14г, 13,0ммоль), та калій карбонату (0,90г, Поєднані екстракти сушать безводним натрій 6,52ммоль) в ацетонітрилі (30мл) перемішують сульфатом та розчинник видаляють у вакуумі, при кімнатній температурі протягом 72 годин. отримуючи 2,6г сирого продукту. Залишок очиРозчинник видаляють у вакуумі та залишок очищають на колонці з силікагелем, застосовуючи щають на колонці з силікагелем, застосовуючи ацетонітрил/триетиламін, (90:10) як елюент, хлороформ/етанол, (9:1) як елюент, що дає 1,21г отримуючи 2,1г (87% виходу) потрібної сполуки (81% виходу) потрібної сполуки як безбарвний як ярко-жовте масло: 1Н ЯМР (ДМСО-d6, 400МГц) твердий продукт: темп.пл. 72-74°С; 1Н ЯМР d 8,62 (d, J=2Гц, 1Η), 8,06 (dd, J=8,2Гц, 1Η), 7,76 (CDCI3, 400МГц) d 8,34 (s, 1Η), 7,39 (d, J=8Гц, 1Η), (d, J=8Гц, 1Η), 7,76 (d, J=8Гц, 1Η), 3,70 (s, 1Η), 7,16 (dd, J=8,2Гц, 1Η), 3,65 (t, J=5Гц, 4Η), 3,40 (s, 3,19 (d, J=19Гц, 1Η), 2,64 (s, 1Η), 2,51 (s, 1Η), 2,37 2Η), 2,40 (t, J=4Гц, 4Η); 13C ЯМР (CDCI3,100МГц) (s, 3Η), 2,13 (s, 3Η), MC (TSP) m/z 242 (М++1). d 140,4 (br), 135,9, 126,6, 126,6, 66,8, 59,2, 53,4; Приклад 4 MC (ESP) m/z 229 (M++1). 4-{2-[(6-Хлорпіримідин-4Приклад 7 іл)оксі]етил}морфолін 6-Хлор-N-(2-піролідин-1-ілетил)піридин-3До розчину N-(2-гідроксіетил)морфоліну сульфонамід (1,09г, 8,27ммоль) у Ν,Ν-диметилформаміді (5мл) Потрібну сполуку отримують як описано у порціями додають натрій гідрид (0,364г, прикладі 3, застосовуючи 2-піролідин-1-іл9,10ммоль, 60% дисперсія у маслі) та перемішуетиламін та 6-хлорпіридин-3-сульфонілхлорид ють при кімнатній температурі протягом 1 години [описано Naegeli, С. et al. Helv. Chim. Actal. та протягом 1,5 годин при температурі 45°С. Зе1938,21,1746-1750]. Очистка на колонці з силікаленуватий розчин додають краплями до розчину гелем, застосовуючи етилацетат/триетиламін, 4,6-дихлорпіримідину (3,0г, 20,1ммоль) у Ν,Ν(9:1) як елюент, дає потрібну сполуку. Ви хід: 58%: 1 диметилформаміді (5мл), розчинник видаляють у Н ЯМР: (CDCI3, 400МГц) d 8,79 (d, J=2Гц, 1Η), вакуумі та залишок розподіляють між водою та 8,05 (dd, J=8, J Гц, 1Η), 7,42 (d, J=9Гц, 1Η), 3,00 (t, етилацетатом. Органічний шар сушать безводJ=6Гц, 2Η), 2,50 (t, J=6Гц, 2Η), 2,33 (m, 4Η), 1,67 ним натрій сульфатом та розчинник видаляють у (m, 4Η); 13СЯМР (CDCI3,100МГц) d 155,7, 148,8, вакуумі. Сирий продукт очищають на колонці з 137,8, 136,1, 125,0, 54,1, 53,9, 41,6, 23,9; MC силікагелем, застосовуючи етилацетат як елю(TSP) m/z 290 (M++1). ент, отримуючи 1,17г (58% виходу) потрібної споПриклад 8 луки як жовте масло: 1Н ЯМР (CDCI3, 400МГц) d 2-Хлор-5-(піролідин-1-ілметил)піридин 18,57 (s, 1Η), 6,80 (s, 1Η), 4,53 (t, J=6Гц, 2Η), 3,72 оксид (t, J=5Гц, 4Η), 2,77 (t, J=6Гц, 2Η), 2,55 (t, J=4Гц, До розчину 2-хлор-5-(хлорметил)піридин 14Η), 13С ЯМР (CDCI3, 100МГц) d 170,0, 160,7, оксиду (477мг, 2,68ммоль; описано [Tilley, J. W. et 158,1,108,0, 66,9, 64,6, 57,1, 53,9, МС (ЕР) m/z al, J. Heterocyclic Chem. 1979,16, 333]) в ацетоніт244 (M++1). рилі (10мл) додають піролідин (381мг, Приклад 5 5,36ммоль), та реакційну суміш перемішують при 1-[(6-Хлорпіридин-3-іл)метил]-4кімнатній температурі протягом ночі. Розчинник метилпіперазин випарюють, та залишок розчиняють у 2Μ НСІ До суспензії 2-хлор-5-(хлорметил)піридину (водн.) та промивають етилацетатом. Водний (0,971г, 5,99ммоль) в ацетонітрилі (50мл) додашар підлужують до рН 8 NaHCO3 (насич), та сують розчин N-метилпіперазину (1,20г, 12,0ммоль) міш екстрагують чотири рази етилацетатом. Пов ацетонітрилі, а потім калій карбонат (0,83г, єднані органічні шари сушать безводним натрій 5,99ммоль) та перемішують при кімнатній темпесульфатом та розчинник випарюють, отримуючи ратурі протягом 1 години та протягом 1,5 годин 0,43г (75% виходу) потрібної сполуки як червоне при температурі 45°С. Отриманий жовтий розчин масло: 1Н ЯМР (CDCI3, 400МГц) d 8,37 (d, J=1Гц, кип'ятять під зворотним холодильником протягом 1Η), 7,44 (d, J=8Гц, 1Η), 7,23 (dd, J=8,2Гц, 1Η), 40 хвилин. Суміші дають охолонути протягом 10 3,57 (s, 2Η), 2,51 (m, 4Η), 1,80 (m, 4H); 13C ЯМР хвилин і розчинник видаляють у вакуумі, а зали(CDCI3,100МГц) d 140,1, 139,9, 137,2, 126,4, шок розподіляють між водою, NaCI (насич.) та 126,4, 56,4, 54,0, 23,5; MC (ES) m/z 213 (M++1). етилацетатом. Водний шар ще екстрагують етиПриклад 9 лацетатом. Поєднані органічні шари сушать без 43 79447 44 1-[(6-Хлор-1 -оксидопіридин-3-іл)метил!-42Η), 2,80-2,75 (m, 2Η), 2,00 (dt, J=12, 2Гц, 2Η), метил-1,4-діазепан 1,63-1,58 (m, 2Η), 1,45-1,30 (m, 1Η), 1,22 (m, 2Η), До розчину 2-хлор-5-(хлорметил)піридин 10,92 (d, J=6Гц, 3Η); МС (ЕР) m/z 241 (М++1). оксиду (940мг, 5,28ммоль; описано [Tilley, J. W. et Приклад 13 al, J. Heterocyclic Chem. 1979,16,333]) в ацетоніт1-[(6-Хлор-1-оксидопіридин-3-іл)метил]-4рилі (30мл) додають N-метилгомопіперазин фенілпіперазин (1,21г, 10,6ммоль), та калій карбонат (730мг, PS-Діізопропілетиламін (3,54ммоль/г, 0,4г, 5,28ммоль). Реакційну суміш перемішують при 1,40ммоль) промивають тетрагідрофураном та кімнатній температурі протягом 3,5 діб. Розчиндодають 2-хлор-5-(хлорметил)піридин 1-оксид ник видаляють у вакуумі, та залишок розподіля(100мг, 0,56ммоль; описано [Tilley, J. W. et al, J. ють між розсолом та етилацетатом. Водний шар Heterocyclic Chem. 1979,16,333]), а потім тетрагіекстрагують ще двома порціями етилацетату та дрофуран (1мл). Розчин 1-фенілпіперазину одною порцією тетрагідрофурану. Поєднані орга(182мг, 1,12ммоль) у те трагідрофурані (1мл) та нічні шари сушать безводним натрій сульфатом, каталітичну кількість калій йодиду додають і сута випарюють, отримуючи 0,86г (64% виходу) міш обережно перемішують (100r/хвилин) при потрібної сполуки як оранжеве масло: 1Н ЯМР кімнатній температурі протягом одного тижня. PS-ізоціанат (1,76ммоль/г, 0,80г, 1,40ммоль) (ацетон-d6, 400МГц) d 8,30 (dd, J=2Гц, 1Η), 7,60 (d, J=8Гц, 1Η), 7,29 (dd, J=8, 2Гц, 1Η), 3,65 (s, 2Η), промивають тетрагідрофураном та додають до суміші з додаванням тетрагідрофурану (1мл). 2,74-2,69 (m, 4Η), 2,62-2,54 (m, 4Η), 2,29 (s, 3Η), Суспензію обережно перемішують (100г/хвилин) 1,81-1,75 (m, 2Η); MC (ЕР) m/z 256 (М++1). при кімнатній температурі протягом 19 годин. Наступні приклади, 10-11, отримують як опиСуспензію фільтрують (поліетиленовий фільтр сано у прикладі 9: Приклад 10 20мкм) та смолу промивають метиленхлоридом, тетрагідрофураном та етанолом. Летючі продукти 2-Хлор-5-[(4-піролідин-1-ілпіперидин-1видаляють у вакуумі та залишок суспендують у іл)метил]піридин 1-оксид 1:1-суміші тетрагідрофурану та е танолу (8мл) з Вихідний матеріал: 4-(1наступним додаванням Ν-етил-Ν,Νпіролідиніл)піперидин. Вихід: 93%: 1Н ЯМР діізопропіламіну (50мкл, 0,28ммоль). Суміш до(CDCI3, 400МГц) d 8,33 (d, J=1Гц, 1Η), 7,41 (d, дають до PS-Тіофенолу (1,35ммоль/г, 0,21г, J=8Гц, 1Η), 7,21 (dd, J=8,2Гц, 1Η), 3,41 (s, 2Η), 0,28ммоль) та МР-Карбонату (3,20ммоль/г, 90мг, 2,83-2,78 (m, 2Η), 2,58-2,53 (m, 4Η), 2,15-2,00 (m, 0,28ммоль), що попередньо набрякли у тетрагід3Η), 1,88-1,83 (m, 2Η), 1,81-1,75 (m, 4Η), 1,61-1,53 рофурані. Суміш перемішують (100г/хвилин) при (m, 2Η); МС (ЕР) m/z 296 (М++1). кімнатній температурі протягом ночі з наступним Приклад 11 фільтруванням. Смолу промивають метиленхло1-[(6-Хлор-1-оксидопіридин-3-іл)метил]-N,Nридом, тетрагідрофураном та етанолом та фільдиметилпіролідин-3-амін трат концентрують у вакуумі, отримуючи 141мг Вихідний матеріал: 3(83% виходу) потрібної сполуки: 1Н ЯМР (CDCI3, (диметиламіно)піролідин. Вихід: 67%: 1Н Я МР 400МГц) d 8,42 (s, 1Η), 7,45 (d, J=8Гц, 1Η), 7,30(ацетон-d6, 400МГц) d 8,28 (d, J=1Гц, 1Η), 7,60 (d, 7,26 (m, 2Η), 7,25-7,21 (m, 1Η), 6,95-6,90 (m, 2Η), J=8Гц, 1Η), 7,27 (dd, J=8,2Гц, 1Η), 3,66-3,53 (m, 6,89-6,85 (m, 1Η), 3,51 (s, 2Η), 3,22-3,18 (m, 4Η), 2Η), 2,76-2,63 (m, 2Η), 2,58-2,50 (m, 1Η), 2,43-2,35 2,65-2,60 (m, 4Η); MC (ЕР) m/z 304 (M++1). (m, 1Η), 2,24-2,21 (m, 1Η), 2,12 (s, 6Η), 1,96-1,89 Наступні приклади, 14-19, отримують як опи(m, 1Η), 1,74-1,64 (m, 1Η); МС (ЕР) m/z 256 сано у прикладі 13: (М++1). Приклад 14 Приклад 12 1-[(6-Хлор-1-оксидопіридин-3-іл)метил]-4-[22-Хлор-5-[(4-метилпіперидин-1нітро-4-(тоифлуорметил)феніл]піперазин іл)метил]піридин 1-оксид Вихідний матеріал: 1-[2-нітро-4До розчину 2-хлор-5-(хлорметил)піридин 1(трифлуорметил)феніл]піперазин. Вихід: 100%: оксиду (222мг, 1,25ммоль; описано [Tilley, J. W. et 1 Н ЯМР: (CDCI3, 400МГц) d 8,43 (d, J=1Гц, 1Η), al, J. Heterocyclic Chem. 1979,16,333]) у тетрагід8,06 (d, J=2Гц, 1Η), 7,68 (dd, J=9,2Гц, 1Η), 7,45 (d, рофурані (2мл) додають розчин 4J=8Гц, 1Η), 7,19 (dd, J=8,2Гц, 1Η), 7,16 (d, J=9Гц, метилпіперидині (247мг, 2,49ммоль) у тетрагідрофурані (1,5мл), каталітичну кількість калій йо1Η), 3,54 (s, 2Η), 3,18 (t, J=5Гц, 4Η), 2,64 (t, J=5Гц, 4Η); MC (ЕР) m/z 417 (M++1). диду та МР-Карбонат (2,55ммоль/г, 1,47г, Приклад 15 3,74ммоль). Суміш обережно перемішують при 3-{[(6-Хлор-1-оксидопіридин-3кімнатній температурі протягом одного тижня. іл)метил](етил)аміно}пропаннітрил Суміш фільтрують (поліетиленовий фільтр 20мкм) та кульки промивають кількома порціями Вихідний матеріал: 3(етиламіно)пропіонітрил. Вихід: 82%: 1Н ЯМР метиленхлориду. Фільтрат промивають натрій гідрокарбонат (водн. насич.), суша ть безводним (CDCI3, 400МГц) d 8,35 (d, J=1Гц, 1Η), 7,46 (d, натрій сульфатом та розчинник випарюють, J=8Гц, 1Η), 7,32 (dd, J=9,1Гц, 1Η), 3,60 (s, 2Η), отримуючи сирий продукт як очищають хромато2,82 (t, J=1Гц, 2Η), 2,60 (q, J=7Гц, 2Η), 2,47 (t, графією на колонці, застосовуючи хлороJ=7Гц, 2Η), 1,07 (t, J=7Гц, 3Η); MC (EP) m/z 240 форм/етанол, (95:5) як елюент, отримуючи 168мг (М++1). (56% виходу) потрібної сполуки як жовте масло: Приклад 16 1 N-[(4-Хлорбензил)-N-[(6-хлор-1Н ЯМР (CDCI3, 400МГц) d 8,37 (d, J=1Гц, 1Η), oксидопіридин-3-іл)метил]-N-метиламін 7,41 (d, J=8Гц, 1Η), 7,20 (dd, J=8,2Гц, 1Η), 3,41 (s, 45 79447 46 Вихідний матеріал: н-хлор-N5,6-Дибром-1,3-дигідроіндол-2-он метилбензиламін. Вихід: 100%: 1Н ЯМР 6-Бромоксііндол (0,168г, 0,8ммоль) розчиняють у оцтову кислоту (4мл) та перемішують про(CDCI3/ДМСО-d6, 7:1, 400МГц) d 8,39 (s, 1Η), 7,46 тягом 5 хвилин при кімнатній температурі. N(dd, J=8,1Гц, 1Η), 7,34-7,26 (m, 4Η), 7,24-7,20 (m, Бромсукцинімід (0,14г, 0,8ммоль) додають та 1Η), 3,54 (d, J=2Гц, 2Η), 3,45 (s, 2Η), 2,20 (d, жовту реакційну суміш перемішують протягом 3 J=2Гц, 3Η); MC (ЕР) m/z 297 (M++1). годин при температурі довкілля. Суміш виливаПриклад 17 N-[(6-Хлор-1-оксіідопіридин-3-іл')метил]-N-[2ють на лід та утворений осад збирають фільтруванням та сушать у вакуумі, отримуючи 0,192г фурилметил)-N-метиламін (83% виходу) потрібної сполуки як білий твердий Вихідний матеріал: N-метилфурфуриламін. продукт: 1Н ЯМР (ДMC O-d6, 400МГц) d 10,61 (s, Вихід: 71%: 1Н ЯМР (CDCI3, 400МГц) d 8,37 (d, 1Η), 7,60 (s, 1Η), 7,14 (s, 1Η), 3,52 (s, 2Η). J=1Гц, 1Η), 7,43 (d, J=8Гц, 1Η), 7,39 (dd, J=2,1Гц, Приклад 24 1Η), 7,22 (dd, J=8,2Гц, 1Η), 6,34 (dd, J=3,2Гц, 1Η), 1-Бензил-4-[(6-хлорпіридин-36,22,6,20 (m, 1Η), 3,61 (s, 2Η), 3,46. (s, 2Η), 2,26 іл)сульфоніл]піперазин (s, 3Η); MC (EP) m/z 253 (MM). До розчину бензилпіперазину (0,45мл, Приклад 18 2,59ммоль) у метиленхлориді (15мл), охолоджеN-[(6-Хлор-1-оксидопіридин-3-іл)метил]-Nному на льодяній бані, додають повільно 6метил-N-феніламін хлорпіридин-3-сульфонілхлорид (0,50г, Вихідний матеріал: N-метиланілін. Вихід: 2,36ммоль; описано [Naegeli, С. et al. Helv. Chim. 100%: 1Н ЯМР (CDCI3, 400МГц) d 8,26 (d, J=1Гц, Actal. 1938, 21,1746-1750]), розчинений у мети1Η), 7,42 (d, J=8Гц, 1Η), 7,26-7,20 (m, 2Η), 7,10ленхлориді (10мл). Реакційну суміш перемішують 7,06 (m, 1Η), 6,81-6,75 (m, 1Η), 6,71-6,67 (m, 2Η), протягом 30 хвилин та утворений білий осад фі4,45 (s, 2Η), 3,02 (s, 3Η); МС (ЕР) m/z 249 (М++1). льтрують та промивають метиленхлоридом та Приклад 19 водою, що дає після сушки 0,68г (82% виходу) 5-(азетидин-1-ілметил )-2-хлорпіридин 1потрібної сполуки: 1Н ЯМР (ДМСО-d6, 400МГц) d оксид Вихідний матеріал: азетидин. Вихід: 100%: 8,70 (d, J=3Гц, 1Η), 8,14 (dd, J=8,3Гц, 1Η), 7,76 (d, J=8Гц, 1Η), 7,50-7,43 (m, 2Η), 7,38-7,30 (m, 3Η), МС (ЕР) m/z 199 (М++1). 4,23 (br s, 2Η), 3,79-3,63 (m, 2Η), 3,45-3,18 (m, Приклад 20 2Η), 3,11-2,96 (m, 2Η), 2,96-2,81 (m, 2Η); MC (ЕР) 2-Хлор-5-[(3-метилпіперидин-1m/z 352 (М++1). іл)метил]піридин 1-оксид PS-Діізопропілетиламін (3,54ммоль/г, 0,4г, Приклад 25 1-[(6-Хлорпіридин-3-іл)сульфоніл]-4-(31,40ммоль) промивають тетрагідрофураном та метилбутил)піперазин додають 2-хлор-5-(хлорметил)піридин 1-оксид До розчину 1-(3-метилбутил)піперазину (100мг, 0,56ммоль; описано [Tilley, J. W. et al, J. (0,41г, 2,60ммоль; описано [Yamane, Т. et al. Heterocyclic Chem. 1979,16,333]), а потім тетрагідрофуран (1мл). Розчин 3-метилпіперидину у Chem. Pharm. Bull. 1993,41,148-155]) у метиленхлориді (15мл) охолодженому на льодяній бані, тетрагідрофурані (1,5мл) та каталітичну кількість додають повільно 6-хлорпіридин-3калій йодиду додають та суміш обережно пересульфонілхлорид (0,50г, 2,36ммоль; описано мішують (80г/хвилин) при кімнатній температурі [Naegeli, С. et al. Helv. Chim. Actal. 1938,21,1746протягом 5 діб. PS-ізоціанат (1,10ммоль/г, 1,27г, 1,40ммоль) промивають тетрагідрофураном та 1750]), розчинений у метиленхлориді (10мл). Реакційну суміш перемішують протягом 30 хвилин додають до суміші з наступним додаванням тетта додають розчин 5% НСІ (водн.) (30мл) та фази рагідрофурану (2мл). Суспензію обережно перерозділяють. Водний шар підлужують насиченим мішують (80г/хвилин) при кімнатній температурі водним розчином натрій гідрокарбонату до рН 9 протягом ночі. N-Етил-N,N-діізопропіламін (50мкл, 0,28ммоль) та МР-Карбонат (2,55ммоль/г, та суміш екстрагують метиленхлоридом. Органічні шари поєднують, сушать безводним натрій 0,66г, 1,68ммоль) додають та змішують і обережсульфатом та розчинник видаляють у вакуумі, що но перемішують протягом 24 годин. Суміш фільтдає 650мг (83% виходу) потрібної сполуки як бірують (поліетиленовий фільтр 20мкм) та смолу промивають метиленхлоридом. Летючі продукти лий твердий продукт: 1Н ЯМР (CDCI3, 400МГц) d видаляють у вакуумі, отримуючи 138мг (99% ви8,75 (d, J=2Гц, 1Η), 7,97 (dd, J=8,2Гц, 1Η), 7,51 (d, ходу) потрібної сполуки: МС (ЕР) m/z 241 (М++1). J=8Гц, 1Η), 3,33-3,05 (m, 4Η), 2,86-2,29 (m, 6H), Наступні приклади, 21-22, отримують як опи1,66-1,50 (m, 1Η), 1,5-1,28 (m, 2Η), 0,88 (d, J=7Гц, сано у прикладі 20: 6Η); MC (ЕР) m/z 332 (M+ +1). Приклад 21 Приклад 26 N-[(6-Хлор-1-оксидопіридин-3-іл)метил]-N1-[(6-Хлорпіридин-3-іл)сульфонал]-4циклогексил-N-метиламін ізопропілпіперазин Вихідний матеріал: N-метилциклогексиламін. Потрібну сполуку отримують як описано у Вихід: 96%: МС (ЕР) m/z 255 (М++1). прикладі 25, застосовуючи N-ізопропілпіперазин Приклад 22 та 6-хлорпіридин-3-сульфонілхлорид [описано 2-Хлор-5-(піперидин-1-ілметил)піридин 1Naegeli, С. et al. Helv. Chim. Actal. 1938,21, 1746оксид 1750]. Вихід: 89%: 1H ЯМР (CDCI3, 400МГц) d 8,73 Вихідний матеріал: піперидин: МС (ЕР) m/z (d, J=3Гц, 1Η), 7,96 (dd, J=8,3Гц, 1Η), 7,48 (d, 227 (М++1) J=8Гц, 1Η), 3,12-3,01 (m, 4Η), 2,76-2,63 (m, 1Η), Приклад 23 2,63-2,54 (m, 4Η), 0,99 (d, J=7Гц, 6Η); 13C ЯМР 47 79447 48 натрій гідрокарбонату та екстрагують метилен(CDCI3, 100МГц) d 156,1, 149,3, 138,2, 131,7, хлоридом. Органічну фазу сушать безводним 125,0, 54,8, 48,0, 46,7, 18,7; MC (ЕР) m/z 304 (М+ +1). натрій сульфатом та випарюють у вакуумі, отримуючи 0,7г (60% виходу) потрібної сполуки: МС Приклад 27 (EP) m/z 292 (M++1). 1-[(6-Хлорпіридин-3-іл)сульфоніл)-4Приклад 32 етилпіперазин 6-Хлор-N-[(1-етилпіролідин-2Потрібну сполуку отримують як описано у прикладі 25, застосовуючи N-етилпіперазин та 6іл]метил]пiридин-3-сульфонамід Потрібну сполуку отримують як описано у хлорпіридин-3-сульфонілхлорид [описано прикладі 31, застосовуючи (1-етилпіролідин-2Naegeli, С. et al. Helv. Chim. Actal. 1938, 21,1746іл)метиламін. Вихід: 58%: МС (ЕР) m/z 304 (М+ 1750]. Вихід:83%: 1H ЯМР: (CDCI3, 400МГц) d 8,75 +1). (d, J=3Гц, 1Η), 7,97 (dd, J=8,3Гц, 1Η), 7,50 (d, Приклад 33 J=8Гц, 1Η), 3,16-3,06 (m, 4Η), 2,60-2,46 (m, 4Η), 1-[(6-Хлорпіридин-3-іл)сульфоніл)-4-мeтил2,42 (q, J=7Гц, 2Η), 1,04 (t, J=7Гц, 3Η); 13С ЯМР 1,4-діазепан (CDCI3, 100МГц) d 155,8, 148,9, 137,8, 131,3, Потрібну сполуку отримують як описано у 124,7, 51,9, 51,6, 46,0, 11,9; MC (EP) m/z 290 прикладі 31, застосовуючи 1(M++1). метилгомопіперазин. Вихід: 60%: МС (ЕР) m/z Приклад 28 290 (М+ +1). 1-[{5-Бром-6-хлорпіридин-3-іл)сульфонал]-4Приклад 34 метилпіперазин 4-[(6-Хлорпіридин-3-іл)сульфоніл]морфолін Потрібну сполуку отримують як описано у Потрібну сполуку отримують як описано у прикладі 3, застосовуючи 1-метилпіперазин та 5прикладі 31, застосовуючи морфолін. Сирий пробром-6-хлорпіридин-3-сульфонілхлорид. Вихід: дукт очищають на колонці з силікагелем, засто91%: 1Н ЯМР (CDCI3, 400МГц) d 8,59 (d, J=2Гц, совуючи гептан/етилацетат, (1:1) як елюент: Ви1Η), 7,67 (d, J=2Гц, 1Η), 3,08-3,01 (m, 4Η), 2,43 (t, 13 хід: 60%: МС (ЕР) m/z 263 (М+ +1). J=5Гц, 4Η), 2,22 (s, 3Η); С ЯМР (CDCI3, 100МГц) Приклад 35 d 155,5, 146,8, 141,2, 132,7, 121,4, 54,2, 46,3, 46,1. Етил 6-(2-гідрокси-5-нітро-1Н-ізоіндол-3Приклад 29 іл)нікотинат 6-Хлор-N-метил-N-(2-піролідин1До охолодженого розчину 5-нітрооксііндолу ілетил)піридин-3-сульфонамід (5,27г, 29,6ммоль) у Ν,Ν-диметиламіді (50мл) До розчину 6-хлорпіридин-3додають натрій гідрид (1,4г, 35ммоль) протягом 5 сульфонілхлориду (636мг, 3ммоль; описано хвилин при 0°С. Після 10 хвилин при 0°С дода[Naegeli, C. et al. Helv, Chim. Actal. 1938,21,1746ють краплями 6-хлорнікотинової кислоти етило1750]) у метиленхлориді (10мл) додають краплявий естер (5,0г, 26,9ммоль) та реакційну суміш ми метил-(2-піролідин-1-ілетил)амін (384мг, гріють до 135°С протягом 45 хвилин. Суміш роз3ммоль; описано [J. Amer. Chem. Soc. 1955, 77, бавляють водою (200мл) та насиченим NH4CI 3632-3634]), розчинений у метиленхлориді (водн.) (100мл). Утворений осад фільтрують та (10мл). Реакційну суміш перемішують протягом промивають водою, метанолом, етилацетатом та ночі при кімнатній температурі, а потім екстрагудіетилетером. Залишок зелено-жовтого твердого ють водною НСІ (3%). Кислотний водний шар продукту сушать, отримуючи 4,1г (47% виходу) підлужують насиченим водним розчином натрій потрібної сполуки: 1Н ЯМР (ДМСО-d6, 300МГц) d гідрокарбонату та екстрагують метиленхлоридом. 14,57 (s, 1Η), 11,24 (s, 1Η), 8,73 (s, 1Η), 8,26 (s, Органічну фазу сушать безводним натрій суль1Η), 8,10 (d, J=9Гц, 1Η), 7,92 (d, J=8Гц, 1Η), 7,67 фатом та випарюють у вакуумі, отримуючи 0,75г (d, J=9Гц, 1Н), 7,03 (d, J=9Гц, 1Н),4,31 (q, J=7Гц, (80% виходу) потрібної сполуки: МС (ЕР) m/z 304 2Н), 1,32 (t, J=7Гц, 3Η). (М+ +1). Приклад 36 Приклад 30 Етил 6-(2-гідрокси-5-ціано-1Н-індол-36-Хлор-N-[2-(диметиламіно)етил]піридин-3іл)нікотинат сульфонамід До розчину 5-ціанооксііндолу (360мг, Потрібну сполуку отримують як описано у 2,27ммоль) у Ν,Ν-диметилформаміді (5мл) доприкладі 29, застосовуючи 6-хлорпіридин-3дають натрій гідрид (106мг, 4,41ммоль). Зеленусульфонілхлорид та N,N-диметилетан-1,2-діамін. + вату реакційну суміш перемішують протягом 50 Вихід: 72%: МС (ЕР) m/z 264 (М +1). хвилин і додають 6-хлорнікотинової кислоти етиПриклад 31 ловий естер (350мг, 1,89ммоль), розчинений у 6-Хлор-N-[2-('диметиламіно)етил]-NΝ,Ν-диметилформаміді (5мл). Реакційну суміш етилпіридин-3-сульфонамід гріють при 110°С протягом 30 хвилин та воду До розчину N-етил-N,N-диметилетан-1,2(50мл) і насичений водний розчин хлориду амодіамін (0,62мл, 4,4ммоль) у метиленхлориді нію (20мл) додають, а потім екстрагують етила(10мл) додають 6-хлорпіридин-3цетатом. Фази розділяють та органічна фаза міссульфонілхлорид (0,85г, 4ммоль; описано тить потрібну сполуку як осад, що [Naegeli, С. et al. Helv. Chim. Actal. 1938, 21,1746відфільтровують. Розчинник концентрують у ва1750]), розчинений у метиленхлориді (10мл) кракуумі та осаджується додатковий продукт, що плями. Реакційну суміш перемішують протягом фільтрують, отримуючи загалом 200мг (34% ви30 хвилин при кімнатній температурі, а потім ексходу) потрібної сполуки: 1Н ЯМР (ДМСО-d6, трагують водною НСІ (5%). Кислотний водний 300МГц) d 14,50 (br s, 1Η), 11,00 (s, 1Η), 8,73 (s, шар підлужують насиченим водним розчином 49 79447 50 1Η), 7,95 (s, 2Η), 7,80 (s, 1Η), 7,48 (s, 1Η), 6,95*4 (2мл) та 5-(гідроксиметил)-1,3-дигідро-2Н-індолJ=7Гц, 1Η), 4,50-4,15 (m, 2Η), 1,32 (t, J=7Гц, 3Η). 2-он (130мг, 0,8ммоль), розчинений у піридині Приклад 37 (3мл). Реакцію гасять після 15 хвилин додаван5-Піридин-3-іл-1,3-дигідро-2Н-індол-2-он ням води (50мл) та екстрагують етилацетатом. Суміш 5-бромоксііндолу (0,95г, 4,48ммоль), 3Органічні фази сушать безводним натрій сульфа(три-н-бутилстаніл)піридин (1,65г, 4,48ммоль), том та випарюють у вакуумі. Сирий продукт очитетраетил амоній хлорид (2,23г, 13,4ммоль) та щають на колонці з силікагелем, застосовуючи біс(трифенілфосфін паладій(ІІ) хлорид (0,16г, метиленхлорид/метанол, (10:1) як елюент, отри0,22ммоль) в ацетонітрилі (20мл) гріють при теммуючи 60мг (46% виходу) потрібної сполуки. пературі кипіння під зворотним холодильником Приклад 42 протягом ночі. Після охолодження до температу5-(1,3-Оксазол-5-іл]-1,3-дигідро-2Н-індол-2-он ри довкілля суміш розбавляють хлороформом Суміш 2-оксоіндолін-5-карбальдегіду (60мг, (100мл) та додають розчин калій флуориду (10%, 0,38ммоль), тозилметилізоціаніду (145мг, 250мл). Суміш фільтрують через броунмілерит та 0,75ммоль) та калій карбонату (103мг, шари розділяють. Органічний шар сушать безво0,75ммоль) у метанолі (20мл) гріють при темпедним натрій сульфатом та розчинник видаляють ратурі кипіння під зворотним холодильником проу вакуумі Залишок очищають на колонці з силікатягом 2 годин. Суміш концентрують у вакуумі та гелем, застосовуючи хлороформ/етанол, (50:1) як розбавляють водним насиченим розчином натрій елюент, що дає 165мг (18% виходу) потрібної гідрокарбонату та екстрагують метиленхлоридом. сполуки як білий твердий продукт: 1Н Я МР Поєднані органічні шари сушать безводним натрій сульфатом та випарюють у вакуумі. Сирий (ДМСО-d6, 400МГц) d 9,64 (br s, 1Η), 7,97 (d, продукт очищають на колонці з силікагелем, заJ=2Гц, 1Η), 7,66 (dd, J=5,1Гц, 1Η), 7,21-7,10 (m, 1Η), 6,73 (s, 1Η), 6,73-6,65 (m, 1Η), 6,65-6,54 (m, стосовуючи гептан/етилацетат, (1:4) як елюент, отримуючи 40мг (53% виходу) потрібної сполуки: 1Η), 6,08 (d, J=8Гц, 1Η), 2,69 (s, 2Η); MC (ЕР) m/z 1 211 (M+ +1). Н ЯМР (ДМСO-d6, 300МГц) d 10,54 (br s, 1Η), Приклад 38 8,36 (br s, 1Η), 7,64-7,44 (m, 3Η), 6,89 (d, J=8Гц, 5-Тіен-2-іл-1,3-дигідро-2Н-індол-2-он 1Η), 3,54 (br s, 2H). Потрібну сполуку отримують як описано у Приклад 43 прикладі 37, застосовуючи 5-бромоксііндол та 5-(Хлорацетил)-1,3-дигідро-2Н-індол-2-он три-н-бутил(2-тієніл)станум: МС (ЕР) m/z 216 (М+ До суміші алюміній трихлориду (17г, +1). 128ммоль) та хлорасетилхлориду (3г, 2,65ммоль) Приклад 39 у карбон дисульфіді (40мл) додають оксііндол 5-(2-Фурил)-1,3-дигідро-2Н-індол-2-он (2,73г, 20,5ммоль) та суміш перемішують при Потрібну сполуку отримують як описано у температурі кипіння під зворотним холодильниприкладі 37, застосовуючи 5-бромоксііндол та ком протягом 3,5 годин. Суміш охолоджують до три-н-бутил(2-фурил)станум: МС (ЕР) m/z 200 (М+ кімнатної температури та обережно гасять охо+1). лодженою водою (50мл), гашену реакційну суміш Приклад 40 перемішують протягом 2 годин та утворений осад 5-(гідроксиметил)-1,3-дигідро-2Н-індол-2-он фільтрують та промивають два рази водою. ТвеДо охолодженої льодом суміші метил 2рдий продукт сушать, отримуючи 2,3г (53% вихооксоіндолін-5-карбоксилату (0,5г, 2,6ммоль) у ду) потрібної сполуки: 1Н ЯМР (ДМСO-d6, суміші тетрагідрофуран/етанол (15:0,3мл) дода300МГц) d 10,82 (br s, 1Η), 7,87 (d, J=8Гц, 1Η), ють літій борогідрид (115мг, 5,2ммоль) одною 7,82 (s, 1Η), 6,92 (d, J=8Гц, 1Η), 5,08 (s, 2Η), 3,57 порцією. Після 30 хвилин ще порцію літій борогі(s, 2Η). дриду (100мг, 4,5ммоль) додають та реакційний Приклад 44 розчин перемішують протягом 4 годин при кімна5-(1,3-Тіазол-4-іл)-1,3-дигідро-2Н-індол-2-он тній температурі. Третю порцію літій борогідриду Суспензію 5-(хлорацетил)-1,3-дигідро-2Н(200мг, 9,2ммоль) та етанол (0,3мл) додають та індол-2-ону (630мг, 3ммоль), тіоформаміду (30мл, реакційний розчин перемішують протягом 14 го30ммоль; описано [J. Med. Chem. 1995, 858-868]) дин при кімнатній температурі. Реакцію гасять та триетиламіну (0,42мл, 3ммоль) у діоксані гріводою (10мл) та водним насиченим розчином ють при 110°С протягом 3 годин. Додатково доамоній хлориду (30мл) та екстрагують етилацедають 5 тіоформамід (10мл, 10ммоль) та реактатом. Поєднані органічні фази сушать безводційну суміш перемішують при 110°С протягом 2 ним натрій сульфатом та випарюють у вакуумі. годин. Це поєднують з новою . партією, починаюСирий продукт очищають на колонці з силікагечи з 230мг 5-(хлорацетил)-1,3-дигідро-2Н-індол-2лем, застосовуючи метиленхлорид/метанол, ону та поєднану реакційну суміш концентрують (10:1) як елюент, отримуючи 140мг (33% виходу) до приблизно 10мл і додають водний насичений потрібної сполуки: 1Н ЯМР (ДМСO-d6, 300МГц) d розчин натрій гідрокарбонату (50мл) та розчин 10,3 (br s, 1Η), 7,14 (s, 1Η), 7,09 (d, J=8Гц, 1Η), екстрагують етилацетатом. Поєднані органічні 6,74 (d, J=8Гц, 1Η), 5,03 (t, J=6Гц, 1Η), 4,41 (7, шари сушать безводним натрій сульфатом та J=6Гц, 2Η), 3,44 (s, 2Η). випарюють у вакуумі. Сирий продукт очищають Приклад 41 на колонці з силікагелем, застосовуючи геп2-оксоіндолін-5-карбальдегід тан/етилацетат, (1:2) як елюент, отримуючи Хром(\/І) оксид (240мг, 2,4ммоль) додають до 400мг (35% виходу) потрібної сполуки: 1Н ЯМР охолодженого льодом піридину (3мл), в отриману (ДМСO-d6, 300МГц) d 10,47 (s, 1Η), 9,15 (s, 1Η), жовту суспензію додають додатково піридин 51 79447 52 7,97 (s, 1Η), 7,83 (br s, 2Η), 6,87 (d, J=8Гц, 1Η), та залишок розподіляють між етилацетатом та 3,54 (s, 2Η); MC (ЕР) m/z 217 (М++1). водою. 2Μ водний розчин НСІ додають до рН 2 Приклад 45 та суміш екстрагують етилацетатом. До водного 5-(2-Метил-1,3-тіазол-4-іл)-1,3-дигідро-2Ншару 45% водний розчин NaOH додають до рН індол-2-он 11 та суспензію екстрагують етилацетатом. ВодСуспензію 5-(хлорацетил)-1,3-дигідро-2Нний шар концентрують у вакуумі та сирий продукт індол-2-ону (1,5г, 7,15ммоль) та тіоацетаміду очищають препаративною ВЕРХ (колонка Xterra, (540мг, 7,15ммоль) у оцтовій кислоті (18мл) грі19x300мм, елюент: буфер 0,05Μ ацетату амоють при 80°С протягом 3 годин. Суміш охолонію/ацетонітрил, 9:1 до 3:7), отримуючи 15мг (5% джують до кімнатної температури та утворений виходу) потрібної сполуки як червоний твердий осад фільтрують та промивають етилацетатом продукт: 1Н ЯМР (ДМСO-d6, 400МГц) d 14,88 (br два рази та діетилетером два рази та твердий s, 1Η), 11,03 (br s, 1H), 9,10 (br s, 1H), 8,28 (d, продукт суша ть під вакуумом, отримуючи 1,5г J=6Гц, 1Η), 8,04-7,96 (m, 1Η), 7,95-7,83 (m, 1Η), (91% виходу) потрібної сполуки: 1Н ЯМР (ДМСO7,42-7,34 (m, 1Η), 7,13-7,02 (m, 2Η), 3,62-3,50 (m, d6, 300МГц) d 10,49 (s, 1Η), 7,90-7,70 (m, 3Η), 2Η), 2,86-2,69 (m, 2Η), 2,58-2,29 (m, 6Η); MC 6,85-6,75 (m, 1Η), 3,55 (s, 2Η), 2,70 (s, 3Н). (TSP) m/z 350 (MM). Приклад 46 Приклад 50 3-[5-(Морфолін-4-ілметил]-1-оксидопіридин-22-Гідрокси-3-(4-[(4-метилпіперазин-1іл]-5-піридин-3-іл-1Н-індол-2-ол іл)карбоніл]піридин-2-іл)-1Н-індол-5-карбонітрилу У суспензію натрій гідриду (0,05г, 1,2ммоль, гідрохлорид 60% дисперсія у маслі, попередньо промита гекРеакцію провадять як описано у прикладі 49, саном) у Ν,Ν-диметилформаміді (3мл) додають застосовуючи 5-ціанооксііндол та 1-(2розчин 5-піридин-3-іл-1,3-дигідро-2Н-індол-2-ону хлорізонікотиноїл)-4-метилпіперазин. Сирий про(0,19г, 0,90ммоль) у Ν,Ν-диметилформаміді дукт очищають на колонці з силікагелем, засто(4мл). Суміш перемішують протягом 20 хвилин в совуючи хлороформ/етанол/концентрований воатмосфері азоту. 2-Хлор-5-(морфолін-4дний розчин гідроксиду амонію, (100:10:1) як ілметил)піридин 1-оксид (0,14г, 0,60ммоль), розелюент. Основу (20мг), розчинену у хлороформі чинений у Ν,Ν-диметилформаміді (3мл) додають та розчин НСІ у діетилетері додають до кислоткраплями та суміш перемішують при кімнатній ного рН. Утворений осад фільтрують та промитемпературі протягом 2 годин, а тоді гріють при вають діетилетером. Сушка у вакуумі дає 10мг 130°С протягом 1,5 годин. Розчинник випарюють потрібної сполуки як червоний твердий продукт. у вакуумі та залишок розподіляють між 2Μ НСІ та Вихід: 2%: 1Н ЯМР (D2O, 400МГц) d 7,82-7,77 (m, етилацетатом та фази розділяють. Водний шар 1Η), 7,18-7,11 (m, 1Η), 7,09-7,05 (m, 1Η), 7,04-6,98 підлужують додаванням натрій гідрокарбонату (m, 1Η), 6,78-6,71 (m, 1Η), 6,67- 6,61 (m, 1Η), 4,05(насич.) та екстрагують етилацетатом. Органіч3,94 (m, 1Η), 3,93-3,82 (m, 1Η), 3,67-3,48 (m, 2Η), ний шар сушать безводним натрій сульфатом та 3,48-3,37 (m, 1Η), 3,35-3,04 (m, 3Η), 2,92-2,80 (m, розчинник видаляють у вакуумі, що дає 200мг 3Η); MC (TSP) m/s 362 (М++1). потрібної сполуки як жовтий твердий продукт: МС Приклад 51 (EP)m/z403(M++1). 2-Гідрокси-3-{5-[(4-метилпіперазин-1Приклад 47 іл)карбонуnпіридин-2-іл)-1Н-індол-5-карбонітрил 3-[5-(Морфолін-4-ілметил)-1-оксидопіридин-2Суміш 5-ціанооксііндолу (213мг, 1,35ммоль) іл]-5-тіен-2-іл-1Н-індол-2-ол та натрій гідриду (72мг, 1,80ммоль, 60% дисперПотрібну сполуку отримують як описано у сія у маслі) у Ν,Ν-диметилформаміді (4мл) переприкладі 46, застосовуючи 5-тіен-2-іл-1,3-дигідромішують при кімнатній температурі протягом 10 2Н-індол-2-он: МС (ЕР) m/z408 (M+ +1). хвилин. Розчин 1-[(6-хлорпіридин-3-іл)карбоніл]Приклад 48 4-метилпіперазину (216мг, 0,901ммоль; описано 5-(2-Фурил)-3-[5-(морфолін-4-ілметил)-1[Thunus, L. Ann. Pharm. Fr. 1977, 35(5-6), 197оксидопіридин-2-іл]-1Н-індол-2-ол 203]) у Ν,Ν-диметилформаміді (2мл) додають Потрібну сполуку отримують як описано у краплями. Реакційну суміш перемішують при кімприкладі 46, застосовуючи 5-(2-фурил)-1,3натній температурі протягом 3 годин, тоді при дигідро-2Н-індол-2-он: МС (ЕР) m/z 392 (М++1). 50°С протягом 2,5 годин. Розчинник видаляють у Приклад 49 вакуумі та залишок розподіляють між хлорофор2-(5-Ціано-2-riдpoкcи-1H-iндoл-3-iл)-N-[2мом та водою. Фази розділяють та рН водної фа(димeтилaмiнo)eтилliзoнiкoтинaмiд зи доводять до 82Μ водним розчином НСІ. ВодУ суспензію натрій гідриду (0,15г, 3,70ммоль, ний шар екстрагують етилацетатом та органічні 60% дисперсія у маслі, попередньо промита гекшари сушать безводним натрій сульфатом, поєдсаном) у Ν,Ν-диметилформаміді (3мл) додають нують та розчинник видаляють у вакуумі, що дає розчин 5-ціанооксііндолу (0,29г, 1,84ммоль) у оранжевий напівтвердий матеріал, який очищаΝ,Ν-диметилформаміді (4мл). Суміш перемішують на колонці з силікагелем, застосовуючи хлоють протягом 30 хвилин в атмосфері азоту. 2роформ/метанол, (8:2) як елюент, що дає 24мг Хлор-N-[2-(диметиламіно)етил]ізонікотинамід (7% виходу) потрібної сполуки як жовтий твердий (0,21г, 0,92ммоль), розчинений у Ν,Νпродукт: темп.пл. з розкладанням >295°С; 1Н диметилформаміді (4мл) додають краплями та ЯМР: (CDCI3, 400 МГц) d 7,95 (s, 1Η), 7,91 (s, 1Η), суміш перемішують при кімнатній температурі 7,74 (dd, J=9,2Гц, 1Η), 7,69 (s, 1Η), 7,48 (d, J=9Гц, протягом 30 хвилин, а тоді гріють при 150°С про1Η), 7,36 (dd, J=8,1Гц, 1Η), 7,06 (d, J=8Гц, 1Η), тягом 45 хвилин. Розчинник випарюють у вакуумі 53 79447 54 3,69 (br s, 4Η); 2,48 (br s, 4H), 2,36 (s, 3H); MC диметилформаміді (1,5мл). Суміш перемішують (TSP) m/z 362 (М++1). при кімнатній температурі протягом 3 годин. РозПриклад 52 чинник видаляють у вакуумі та залишок суспен2-Гідрокси-3-[5-(морфолін-4-ілметил]піридиндують у 2Μ водному розчині НСІ та промивають 2-іл]-1Н-індол-5-карбонітрилу гідрохлорид два рази етилацетатом. Водний шар підлужують У суспензію 5-ціанооксііндолу (720мг, до рН 8 додаванням 45% водного розчину NaOH. 4,55ммоль) у Ν,Ν-диметилформамід (5мл) додаОтриману суспензію екстрагують двічі етилацеють натрій гідрид (248мг, 6,2ммоль, 60% диспертатом. Поєднані фази промивають розсолом, сія у маслі).Після 15 хвилин, додають 4-[(6сушать безводним натрій сульфатом та розчинхлорпіридин-3-іл)метил]морфолін (323мг, ник видаляють у вакуумі. Сирий продукт очища1,52ммоль; описано [Maienfisch, P. et al. J. Med. ють на колонці з силікагелем, застосовуючи як Chem. 2000,43, 5003]) до розчину. Реакційну суелюент суміш хлороформ/етанол (9:1) до суміші міші гріють при температурі кипіння під зворотхлороформ/метанол (8:2), що дає 172мг (31% ним холодильником протягом 1 години. Розчинвиходу) потрібної сполуки як жовтий твердий ник видаляють у вакуумі та залишок продукт: 1Н ЯМР (ДМСO-d6, 400МГц) d 10,89 (brs, розподіляють між етилацетатом та водою. 2Μ 1Η), 8,62 (s, 1Η), 8,02 (s, 1Η), 7,30 (d, J=1Гц, 1Η), водний розчин НСІ додають до суміші етилацета6,97 (d, J=8Гц, 1Η), 6,83 (br s, 1Η), 4,52 (t, J=5Гц, ту та води до слабко кислотного рН, а тоді дода2Η), 3,60 (t, J=4Гц, 4Η), 2,77 (m, 2Η), 2,54 (m, 4Η); ють до насичення розчин натрій гідрокарбонату MC (TSP) m/z 366 (M++1). (насич.). Суміш екстрагують етилацетатом. ОргаПриклад 54 нічний шар промивають розсолом, сушать безво2-Гідрокси-3-(5-[(4-метилпіперазин-1дним натрій сульфатом та розчинник видаляють іл)метил]піридин-2-іл)-1Н-індол-5-карбонітрилу у вакуумі. Сирий продукт розчиняють у суміші гідрохлорид метанолу та етилацетату та охолоджують на Суміш 5-ціанооксііндолу (694мг, 4,39ммоль) льоді. Розчин НСІ у діетилетері додають до киста натрій гідриду (234мг, 5,85ммоль, 60% дисперлотного рН. Приблизно половину об'єму розчинсія у маслі) у Ν,Ν-диметилформаміді (2,5мл) пенику видаляють у вакуумі. Осаджений гідрохлоремішують при кімнатній температурі протягом 15 рид фільтрують, промивають етилацетатом та хвилин. До зеленуватого розчину додають розчин сушать у вакуумі. Сіль знов перетворюють в ос1-[(6-хлорпіридин-3-іл)метил]-4-метилпіперазину нову розподілом між етилацетатом та насиченим (330мг, 1,46ммоль) у Ν,Ν-диметилформаміді водним розчином натрій гідрокарбонату. Отрима(1,2мл) та суміш гріють при 150°С протягом 30 ний матеріал (142мг) очищають на колонці з силіхвилин. Суміші дають охолонути та розчинник кагелем, застосовуючи хлороформ/етанол, (9:1) видаляють у вакуумі. Залишок суспендують у 2Μ як елюент, що дає 34мг (7% виходу) потрібної водному розчині НСІ та промивають два рази сполуки як основи, як жовтий твердий продукт: 1Н етилацетатом. Водний шар підлужують розчином ЯМР (CDCI3, 400МГц) d 14,96 (br s, 1Η), 8,83 (br s, натрій гідрокарбонату (насич.) до насичення, а 1H), 7,79 (dd, J=9,1Гц, 1Η), 7,69 (s, 1Η), 7,63 (s, потім тричі екстрагують етилацетатом. Органічні 1Η), 7,50 (d, J=9Гц, 1Η), 7,29-7,26 (m, 1Η), 7,06 (d, шари поєднують, сушать безводним натрій сульJ=8Гц, 1Η), 3,75-3,72 (m, 4Η), 3,44 (s, 2Η), 2,50фатом та розчинник видаляють під вакуумом. 2,49 (m, 4Η). Основу розчиняють у суміші метаОтриманий матеріал очищають двічі хроматогнолу, ди хлорметану та етилацетату (загальний рафією на колонці на оксиді силіцію, застосовуюоб'єм 15мл), охолодженому на льоді. Розчин НСІ чи суміш хлороформ/метанол/концентрований у діетилетері (1М) додають до кислотного рН. водний розчин гідроксиду амонію, (90:10:0,5) як Приблизно половину об'єму розчиннику видаляелюент, що дає 56мг масла. 38мг масла очищають у вакуумі та додають етилацетат. Осаджений ють препаративною ВЕРХ (колонка: Xterra, гідрохлорид фільтрують, промивають етилацета19x300мм, елюент: буфер 0,05Μ ацетат амотом та сушать у вакуумі при 40°С, що дає 33мг нію/ацетонітрил, 9:1-3:7), що дає 29мг (6% вихо(87% виходу від основи) як жовтий твердий проду) потрібної сполуки як жовтий твердий продукт: темп.пл. з розкладанням >240°С; 1Н ЯМР (CDCI3, дукт: 1Н ЯМР (ДМСO-d6, 400МГц) d 14,75 (br s, 1Η), 11,36 (brs, 1Η), 10,98 (s, 1Η), 8,30 (s, 1Η), 400МГц) d 8,74 (s, 1Η), 7,78 (d, J=9Гц, 1Η), 7,70 (s, 8,07-8,02 (m, 2Η), 7,90 (d, J=9Гц, 1Η), 7,32 (d, 1Η), 7,64 (s, 1Η), 7,50 (d, J=9Гц, 1Η), 7,29 (m, 1Η), J=8Гц, 1Η), 7,02 (d, J=8Гц, 1Η), 4,29 (s, 2Η), 3,987,06 (d, J=8Гц, 1Η), 3,44 (s, 2Η), 2,52 (br s, 8Η), 3,94 (m, 2Η), 3,82-3,75 (m, 2Η), 3,37-3,32 (m, 2Η), 2,31 (s, 3Η); 13C ЯМР (CDCI3 , 100МГц) d 169,1, 13 3,11-3,08 (m, 2Η); C ЯМР (ДМСO-d6, 100МГц) d 149,6, 141,7, 136,1, 134,2, 125,4, 124,7, 123,6, 168,9, 148,4, 142,6, 139,7, 137,4, 124,8, 124,8, 121,0, 119,7, 118,4, 109,3, 103,2, 85,4, 59,0, 55,0, 120,8, 119,4, 118,4, 113,1, 108,9, 101,5, 85,6, 63,0, 52,9, 45,9. 55,5, 50,2; МС (TSP) m/z 335 (MM). 10мг твердого продукту розчиняють у суміші Приклад 53 етилацетату, метиленхлориду та невеликого об'2-Гідрокси-3-[6-(2-морфолін-4єму метанолу (загальний об'єм 10мл). Розчин ілетокси)піримідин-4-іл]-1Н-індол-5-карбонітрил охолоджують на льоді та додають НСІ у діетилеДо розчину 5-ціанооксііндолу (411мг, тері до кислотного рН (1М). Приблизно 2/3 об'єму 2,60ммоль) у Ν,Ν-диметилформаміді (4мл) дорозчиннику видаляють у вакуумі та додають етидають натрій гідрид (181мг, 4,52ммоль, 60% дислацетат. Осаджений гідрохлорид фільтрують, персія у маслі). Через 10 хвилин додають краппромивають етилацетатом та сушать у вакуумі, лями розчин 4-{2-[(6-хлорпіримідин-4що дає 12мг потрібної сполуки як оранжевий твеіл)окси]етил}морфоліну (367мг, 1,51ммоль) у Ν,Νрдий продукт: 1НЯМР (D2O, 400МГц) d 7,78 (s, 55 79447 56 1Η), 7,68-7,65 (m, 1Η), 7,47 (s, 1Η), 7,34-7,31 (m, Реакцію провадять як описано у прикладі 55, 1Η), 7,14-7,11 (m, 1Η), 6,93-6,6,90 (m, 1Η), 3,62застосовуючи 6-хлор-N-(2-піролідин-13,48 (m, 10H), 2,77 (s, 3H); MC (TSP) m/z 348 ілетил)піридин-3-сульфонамід. Очистка на коло(M++1). нці з силікагелем, застосовуючи хлороПриклад 55 форм/метанол/концентрований водний розчин 6-(5-Ціано-2-гiдpoкcи-1H-iндoл-3-iл)-N-[2гідроксиду амонію, (80:19:1) як елюент, дає по(димeтилaмiнo)eтил[-N-мeтилнiкoтинaмiдv гідротрібну сполуку як основу. Ви хід: 9,8%. 15мг оснохлорид ви розчиняють у суміші метиленхлоСуміш натрій гідриду (330мг, 8,2ммоль, 60% рид/тетрагідрофуран/метанол (3мл загальний дисперсія у маслі, попередньо промита гексаном) об'єм) та обробляють 5Μ НСІ у діетилетері. Гіду Ν,Ν-диметилформаміді (2мл) додають до 5рохлорид сушать при 40°С у вакуумі, отримуючи ціанооксііндолу (980мг, 6,2ммоль) у Ν,Ν11мг потрібної сполуки як оранжевий порошок: 1Н диметилформаміді (4мл). Утворену коричневу ЯМР (D20, 400МГц) d 7,96 (s, 1Η), 7,47 {d, J=9Гц, суміші перемішують при кімнатній температурі 1Η), 6,87 (s, 1Η), 6,74 (d, J=8Гц, 1Η), 6,66 (d, протягом 20 хвилин та додають 6-хлор-N-[2J=9Гц, 1Η), 6,50 (d, J=8Гц, 1Η), 3,61 (m, 2Η), 3,25 (диметиламіно)етил]-N-метилнікотинамід (500мг, (m, 4Η), 3,02 (m, 2Η), J,97 (у, 4Η); МС (TSP) wz/2 2,1ммоль) у Ν,Ν-диметилформаміді (3мл). Отри412 (M++1). маний червоний розчин гріють при 150°С протяПриклад 58 гом 30 хвилин та тоді дають досягти кімнатної 2-Гідрокси-3-[5-(морфолін-4-ілметил)піридинтемператури протягом ночі. Розчинник видаля2-іл]-1Н-індол-5-карбонітрил ють у вакуумі та залишок розподіляють між 2Μ У суспензію натрій гідриду (105мг, 2,62ммоль, водним розчином НСІ та етилацетатом. Суміш 60% у маслі) у Ν,Ν-диметилформаміді (2мл) допідлужують до рН 8 додаванням розчину натрій дають 5-ціанооксііндол (310мг, 1,96ммоль). Сугідрокарбонату (насич.) та екстрагують етилацеміш перемішують при кімнатній температурі протатом. Поєднані екстракти сушать безводним тягом 10 хвилин. До отриманого жовтуватого натрій сульфатом та розчинник видаляють у варозчину додають 2-хлор-5-(морфолін-4куумі, отримуючи 450мг сирого продукту. Залиілметил)піридин 1-оксид (299мг, 1,31ммоль) та шок очищають на колонці з силікагелем, застососуміш гріють під азотом при 130°С протягом 30 вуючи хлороформ/ метанол/концентрований хвилин. Темній реакційній суміші дають охолонуводний розчин гідроксиду амонію, (80:19:1) як ти та розчинник видаляють у вакуумі. Залишок елюент. Фракції, що містить продукт збирають, розподіляють між 2Μ водним розчином НСІ та випарюють у вакуумі та сушать при 25°С у вакууетилацетатом. Водний шар обережно насичують мі, отримуючи 70мг. Залишок очищають препарарозчином натрій гідрокарбонату (насич.) та ексттивною ВЕРХ (колонка:; Xterra, 19x300мм, елюрагують двічі етилацетатом. Два останні органічні ент: буфер 0,05Μ ацетат амонію/ацетонітрил, шари поєднують, сушать безводним натрій суль9:1-3:7). Фракції, що містять продукт збирають, фатом та розчинник видаляють у вакуумі. Заливипарюють у вакуумі та сушать при 25°С у вакуушок розчиняють в етилацетаті (50мл) та додають мі, отримуючи 35мг (4,6% виходу) потрібної споконцентрований розчин фосфор трихлориду луки як основу: 1Н ЯМР (D2O, 400МГц) d 7,89 (s, (0,5мл, 5,7ммоль) в етилацетаті (3мл). Утворю1Η), 7,59 (d, J=9Гц, 1Η), 6,96 (s, 1Η), 6,92 (d, ється жовтуватий осад. С уміш перемішують при J=8Гц, 1Η), 6,84 (d, J=9Гц, 1Η), 6,65 (d, J=8Гц, кімнатній температурі протягом ночі та тоді гріють 1Η), 3,76 (s, 2Η), 3,30 (s, 2Η), 3,07 (s, 3Н), 2,84 (s, при 60°С протягом 30 хвилин та під кінець при 6Η). 10мг основи розчиняють у діетилетері та температурі кипіння під зворотним холодильниобробляють 5Μ НСІ у діетилетері. Гідрохлорид ком протягом 10 хвилин. Суміші дають охолонути сушать при 25°С у вакуумі, отримуючи 6мг потріта тоді розбавляють етилацетатом та промивабної сполуки як оранжевий порошок: МС (ESP) ють насиченим водним розчином натрій гідрокаm/z 364 (М++1). рбонату. Водний шар екстрагують повторно етиПриклад 56 лацетатом. Поєднані органічні шари сушать 2-Гідрокси-3-[5-[(4-метилпіперазин-1безводним натрій сульфатом та розчинник видаіл)сульфоніл)піридин-2-іл)-1Н-індол-5ляють у вакуумі. Залишок очищають на колонці з карбонітрилу гідрохлорид силікагелем, застосовуючи хлороРеакцію провадять як описано у прикладі 55, форм/етилацетат, (9:1) як елюент, що дає 195мг застосовуючи 1-(6-хлорпіридин-3-сульфоніл)-4(45% виходу) потрібної сполуки як жовтий тверметилпіперазин [описано Thunus L, Annales дий продукт: темп.пл. 228-230°С; 1Н ЯМР (ДМСOPharmaceutiques J Francaises 1977,35,197-203]. d6, 400МГц) d 14,79 (br s, 1Η), 10,87 (s, 1Η), 8,10 Вихід: 9,8%: 1H ЯМР (D2O, 400МГц) d 8,12 (s, 1Η), (s, 1Η), 7,91 (s, 1Η), 7,84 (d, J=9Гц, 1Η), 7,79 (dd, 7,60 (d, J=10Гц, 1Η), 7,13 (s, 1Η), 7,00 (dd, J=9,1Гц, 1Η), 7,28 (d, J=8Гц, 1Η), 7,00 (d, J=8Гц, J=8,2Гц, 1Η), 6,93 (d, J=9Гц, 1Η), 6,73 (dd, 1Η), 3,58 (t, J=4Гц, 4Η), 3,39 (s, 2Η), 2,38 (br s, J=8,2Гц, 1Η), 3,91 (d, J=13Гц, 2Η), 3,60 (d, J=11Гц, 4Η); 13C Я МР (ДМСO-d6,100МГц) d 168,6, 148,4, 2H), 3,24 (арр. t, J=11Гц, 2Η), 3,02 (арр. t, J=12Гц, 142,0 136,9, 135,9, 125,2, 124,0, 122,3, 121,0, 2Η), 2,89 (s, 3Η); МС (TSP) m/z 398 (M++1). 118,7, 118,3, 108,7, 101,2, 84,4, 30 66,1, 58,3, 52,8; Приклад 57 МС (ЕР) m/z 335 (М++1). 6-[(5-Ціано-2-гідрокси-1Н-індол-3-іл)-N-(2Приклад 59 піролідин-1-ілетил)піридин-3-сульфонамід гідро2-Гідрокси-3-[5-(піролідин-1-ілметил!піридинхлорид 2-іл]-1Н-індол-5-карбонітрил у гідрохлорид 57 79447 58 У суспензію натрій гідриду (60% у мінеральдодають розчин 1-((6-хлор-1-оксидопіридин-3ному маслі, 72мг, 1,80ммоль) у Ν,Νіл)метил]-4-метил-1,4-діазепану (842мг, диметилформаміді (1мл) додають 53,29ммоль) у Ν,Ν-диметилформаміді (3мл). Реаціанооксііндол (213мг, 1,35ммоль) та суміш перекційну суміші гріють при 130°С в атмосфері азоту мішують при температурі довкілля протягом 15 протягом 30 хвилин. Темній суміші дають охолохвилин. До отриманого коричнюватого розчину нути та розчинник видаляють у вакуумі, до залидодають розчин 2-хлор-5-(піролідин-1шкового масла додають 2Μ НСІ (водн.) та отриілметил)піридин 1-оксиду (191мг, 0,90ммоль) у ману суспензію промивають два рази Ν,Ν-диметилформаміді (1,5мл). Отриманий черетилацетатом. Водний шар нейтралізують 45% воний розчин гріють при 125°С протягом 20 хвиNaOH та підлужують до насичення натрій гідролин та тоді дають охолонути. С уміш розчиняють у карбонатом (насич) та екстрагують два рази ети2Μ НСІ (водн.) та промивають етилацетатом. лацетатом та одноразово тетрагідрофураном. Органічний шар екстрагують 2Μ НСІ (водн.). ПоЕкстракти поєднують, суша ть безводним натрій єднані водні шари підлужують до насичення насульфатом та розчинник видаляють у вакуумі, що трій гідрокарбонатом (насич.) та екстрагують два дає 1,0г сирого N-оксиду: МС (ЕР) m/z 278 (М++1). рази етилацетатом. Екстракти поєднують, сушать Частину матеріалу (841мг, 2,23ммоль) розчинябезводним натрій сульфатом та розчинник видають в ацетонітрилі (70мл) протягом нагрівання. ляють у вакуумі, отримуючи 270мг сирого продукДо теплого розчину додають фосфор трихлорид ту, матеріал розчиняють в етилацетаті (15мл) та (1мл, 11,1ммоль), спочатку краплями, а тоді швидодають розчин фос- · фор трихлориду (0,25мл, дше. Отриману оранжеву суспензію гріють при 2,87ммоль) в етилацетаті (3мл). Оранжевий осад температурі кипіння під зворотним холодильнинегайно утворюється. Суміш гріють при темпераком протягом 1 години та тоді дають охолонути, турі кипіння під зворотним холодильником протяосад фільтрують, промивають ацетонітрилом та гом 30 хвилин та тоді дають охолонути. Суміш сушать у вакуумі, що дає 780мг оранжевого зарозподіляють між етилацетатом та насиченим лишку. Частину матеріалу (240мг) розчиняють у водним розчином натрій гідрокарбонату. Водний воді. Розчин натрій гідрокарбонату (насич.) дошар екстрагують ще двома порціями етилацетадають до насичення та суміш екстрагують три ту. Поєднані органічні шари сушать безводним рази етилацетатом та одноразово тетрагідрофунатрій сульфатом та розчинник випарюють, раном. Поєднані органічні шари сушать безводотримуючи сирий продукт, який очищають на ним натрій сульфатом та магній сульфатом і розколонці з силікагелем, застосовуючи як елюент чинник випарюють, отримуючи 165мг масла, яке хлороформ/метанол/концентрований водний очищають на колонці з силікагелем, застосовуюрозчин гідроксиду амонію, (90:10:0,5), що дає чи хлороформ/метанол/концентрований водний 85мг (37% виходу) потрібної сполуки як вільної розчин гідроксиду амонію, (80:20:1) як елюент, основи, як оранжевий твердий продукт: 1Н ЯМР отримуючи 84мг потрібної сполуки як вільну основу, як коричнюватий твердий продукт: 1Н ЯМР (CDCI3, 400МГц) d 14,9 (br s, 1Η), 9,02 (s, 1Η), 7,78 (dd, J=9,2Гц, 1Η), 7,68 (s, 1Η), 7,60 (s, 1Η), 7,46 (d, (ДМСO-d6, 400МГц) d 14,70 (brs, 1Η), 10,79 (brs, J=9Гц, 1Η), 7,25-7,22 (m, 1Η), 7,05 (d, J=8Гц, 1Η), 1Η), 8,11 (s, 1Η), 7,92 (s, 1Η), 7,87 (d, J=9Гц, 1Η), 3,56 (s, 2Η), 2,55-2,51 (m, 4Η), 1,83-1,79 (m, 4Η); 7,79 (d, J=8Гц, 1Η), 7,25 (d, J=7Гц, 1Η), 6,98 (d, MC (ЕР) m/z 319 (М++1). Основу (65мг) розчиняJ=7Гц, 1Η), 3,53 (s, 2Η), 2,69-2,57 (m, 8Η), 2,30 (s, ють у суміші етилацетату (20мл), метиленхлори3Η), 1,78-1,70 (m, 2Η). Основу (66мг) перетворюду (10мл) та метанолу (2мл) та тоді охолоджують ють у гідрохлорид, застосовуючи спосіб, що опина льодяній бані. Розчин НСІ у діетилетері (1М) сано у прикладі 59. Вихід: 99% (розраховано від додають до кислотного рН. Приблизно 60% об'основи) потрібної сполуки як оранжевий твердий єму розчиннику випарюють та до залишку супродукт: 1Н Я МР (D2 O, 400МГц) d 7,91 (s, 1Η), спензії додають етилацетат. Отриманий оранже7,65 (dd, J=9,2Гц, 1Η), 7,01-6,95 (m, 3Η), 6,74 (d, вий гідрохлорид фільтрують, промивають J=7Гц, 1Η), 4,32 (s, 2Η), 3,80-3,54 (m, 8Η), 2,97 (s, етилацетатом та сушать у вакуумі при 40°С, що 3Η), 2,31 (brs, 2Η). дає 65мг (95% виходу від основи) потрібної споНаступні приклади, 61-62, отримують як опилуки як коричнюватий твердий продукт: 1Н Я МРсано у прикладі 60: (ДМСO-d6, 400МГц) d 14,70 (br s, 1Η), 11,00 (br s, Приклад 61 1Η), 10,97 (s, 1Η), 8,31 (s, 1Η), 8,07 (dd, J=9,1Гц, 2-Гідрокси-3-{5-[(4-піролідин-1-ілпіперидин-11Η), 8,02 (s, 1Η), 7,91 (d, J=8Гц, 1Η), 7,32 (d, іл)метил]піридин-2-іл)-1Н-індол-5-карбонітрилу J=1Гц, 1Η), 7,02 (d, J=7Гц, 1Η), 4,29 (d, J=6Гц, гідрохлорид 2Η), 3,45-3,39 (m, 2Η), 3,09-3,02 (m, 2Η), 2,04-1,98 Вихідний матеріал: 2-хлор-5-[(4-піролідин-1(m, 2Η), 1,92-1,87 (m, 2Η). ілпіперидин-1-іл)метил)піридин 1-оксид. Продукт Приклад 60 очищають на колонці з силікагелем, застосовую2-Гідрокси-3-{(5-[(4-метил-1,4-діазепан-1чи хлороформ/метанол/концентрований водний іл)метил]піридин-2-іл)-1Н-індол-5-карбонітрилу розчин гідроксиду амонію, (90:10:0,5), як елюент. гідрохлорид Вихід: 15% потрібної сполуки як основи, як оранУ суспензію натрій гідриду (60% у мінеральжевий твердий продукт: 1Н Я МР (CDCI3, 400МГц) ному маслі, 263мг, 6,58ммоль) у Ν,Νd 8,75 (br s, 1Η), 7,76 (dd, J=9,2Гц, 1Η), 7,69 (s, диметилформаміді (3мл) додають порціями 51Η), 7,64 (s, 1Η), 7,49 (d, J=9Гц, 1Η), 7,29-7,25 (m, ціанооксііндол (0,78г, 4,94ммоль). Суміш перемі1Η), 7,05 (d, J=8Гц, 1Η), 3,41 (s, 2Η), 2,88 (d, шують при температурі довкілля протягом 10 J=11Гц, 2Η), 2,58 (br s, 4H), 2,11-1,99 (m, 3H), 1,90 хвилин. До отриманого коричнюватого розчину (d, J=12Гц, 2Η), 1,80 (brs, 4Η), 1,65-1,53 (m, 2Η); 59 79447 60 MC (ЕР) m/z 402 (М++1). Основу (72мг) розчинярий продукт очищають на колонці з силікагелем, ють у суміші етилацетату (5мл), метиленхлориду застосовуючи як елюент хлороформ/метанол, (10мл) та тоді охолоджують на льодяній бані. (95:5), а потім препаративною ВЕРХ (колонка: Розчин НСІ у діетилетері є (1М) додають до кисXterra, С8 , 7мкм, 19x300мм; елюент: 0,1Μ амонійлотного рН. Отриманий оранжевий гідрохлорид ацетатний буфер/ацетонітрил, 8:2 до 4:6), що дає фільтрують, промивають етилацетатом та су4мг (2% виходу) потрібної сполуки як оранжевий шать під вакуумом при кімнатній температурі, що твердий продукт: 1Н ЯМР (ацетон-d6, 400МГц) d дає 68мг (80% виходу, розраховано від основи) 9,88 (br s, 1Η), 8,11 (d, J=1Гц, 1Η), 7,90 (dd, потрібної сполуки як оранжевий твердий продукт: J=9,2Гц, 1Η), 7,85 (d, J=9Гц, 1Η), 7,82 (d, J=1Гц, 1 Н ЯМР (D2O, 400МГц) d 7,90 (s, 1Η), 7,71 (d, 1Η), 7,26 (dd, J=8,2Гц, 1Η), 7,11 (d, J=8Гц, 1Η), J=9Гц, 1Η), 7,25 (s, 1Η), 7,15 (d, J=9Гц, 1Η), 7,12 3,44 (s, 2Η), 2,91-2,86 (m, 2Η), 2,10-1,98 (m, 2Η), (d, J=8Гц, 1Η), 6,89.(d, J=8Гц, 1Η), 4,00 (br s, 2Η), 1,65-1,59 (m, 2Η), 1,40-1,35 (m, 1Η), 1,28-1,16 (m, 3,55-3,41 (m, 5Η), 2,92-2,82 (m, 2Η), 2,43 (d, 2Η), 0,92 (d, J=7Гц, 3Η); МС (ЕР) m/z 347 (М++1). J=13Гц, 2Η), 2,09 (brs, 4H), 1,98-1,87 (m, 2H). Приклад 64 Приклад 62 2-Гідрокси-3-{5-[(4-Фенілпіперазин-13-(5-{[3-(диметиламіно)піролідин-1іл]метил]піридин-2-іл)-1Н-індол-5-карбонітрил іл]метил]піридин-2-іл)-2-гідрокси-1Н-індол-5У суспензію натрій гідриду (60% дисперсія у карбонітрил мінеральному маслі, 45мг, 1,12ммоль) у Ν,ΝВихідний матеріал: 1-[(6-хлор-1диметилформаміді (1мл) додають 5оксидопіридин-3-іл)метил]-N,N-диметилпіролідинціанооксііндол (133мг, 0,84ммоль). Суміш пере3-амін. Сирий продукт очищають на колонці з мішують протягом 15 хвилин та додають суспенсилікагелем, застосовуючи як елюент хлорозію 1-[(6-хлор-1-оксидопіридин-3-іл)метил]-4форм/метанол/концентрований водний розчин фенілпіперазину (0,56ммоль) у Ν,Νгідроксиду амонію, (85:15:1). Отриманий матеріал диметилформаміді (2,3мл). Реакційну суміші гріочищають далі препаративною ВЕРХ (колонка: ють при 130°С протягом 10 хвилин та тоді дають Xterra, C 8 , 7мкм, 19x300мм; елюент: 0,1Μ амонійохолонути до кімнатної температури. Темну реаацетатний буфер/ацетонітрил, 8:2 до 4:6), що дає кційну суміші кислотно/основно екстрагують, запотрібну сполуку як оранжевий твердий продукт. стосовуючи автоматичний пристрій АІІе х. Залучено такі етапи: додавання НСІ (водн.), промивка Вихід: 6%: 1Н ЯМР (CDCI3, 400МГц) d 9,12 (br s, етилацетатом (для видалення надлишку 51Η), 7,77 (d, J=9Гц, 1Η), 7,71 (s, 1Η), 7,63 (s, 1Η), ціанооксііндолу), підлужування (насич.) розчином 7,49 (d, J=9Гц, 1Η), 7,28-7,24 (m, 1Η), 7,06 (d, натрій гідрокарбонату та під кінець повторні екстJ=8Гц, 1Η), 3,60-3,48 (m, 2Η), 2,95-2,89 (m, 1Η), ракції етилацетатом. Поєднані органічні екстрак2,82-2,76 (m, 1Η), 2,72-2,68 (m, 1Η), 2,64-2,58 (m, ти сушать безводним натрій сульфатом та роз1Η), 2,53-2,48 (m, 1Η), 2,27 (s, 6Η), 2,09-2,00 (m, чинник видаляють у вакуумі. Залишок 1Η), 1,87-1,79 (m, 1Η); MC (ЕР) m/z 362 (MM). розчиняють в етилацетаті (10мл) та додають фоПриклад 63 сфор три хлорид (0,2мл, 2,24ммоль). Утворену 2-Гідрокси-3-{5-[(4-метилпіперидин-1суспензію перемішують при температурі довкілля іл)метил]піридин-2-іл)-1Н-індол-5-карбонітрил протягом 1,5 годин та тоді гріють при температурі У суспензію натрій гідриду (60% у мінералькипіння під зворотним холодильником протягом ному маслі, 54мг, 1,35ммоль) у Ν,Ν30 хвилин. Реакційній суміші дають охолонути до диметилформаміді (1мл) додають 5кімнатної температури. Суміш промивають насиціанооксііндол (161мг, 1,02ммоль) та суміш переченим водним розчином натрій гідрокарбонату, мішують при температурі довкілля протягом 10 застосовуючи автоматичний пристрій АІІех. Водхвилин. До отриманого коричнюватого розчину ний шар повторно екстрагують етилацетатом. додають розчин 2-хлор-5-[(4-метилпіперидин-1Поєднані органічні шари сушать безводним наіл)метил]піридин 1-оксиду (163мг, 0,677ммоль) у трій сульфатом та розчинник випарюють, отриΝ,Ν-диметилформаміді (1,5мл). Реакційну суміші муючи 20мг оранжевого продукту, який очищають гріють при 130°С протягом 25 хвилин та тоді дана оксиді силіцію, застосовуючи хлороють охолонути. Розчинник видаляють у вакуумі форм/етанол, (95:5) як елюент. Отриманий матета до залишку додають 2Μ НСІ (водн.). Отримаріал (10мг) очищають далі препаративною ВЕРХ ний осад розподіляють між насиченим водним (колонка: Xterra, С8, 7мкм, 19x300мм; елюент: розчином натрій гідрокарбонату та етилацетатом. 0,1Μ амоній-ацетатний буфер/ацетонітрил, 8:2 до Водний шар екстрагують ще двома порціями 4:6), що дає 5мг (1,1% виходу) потрібної сполуки: етилацетату. Поєднані органічні шари сушать 1 безводним натрій сульфатом та розчинник видаН ЯМР (ДМСO-d6, 400МГц) d 14,78 (br s, 1Η), ляють у вакуумі, що дає сирий продукт, матеріал 10,86 (s, 1Η), 8,14 (s, 1Η), 7,91 (s, 1Η), 7,86-7,82 розчиняють в етилацетаті (25мл) та додають фо(m, 2Η), 7,27 (d, J=8Гц, 1Η), 7,23-7,16 (m, 2Η), 7,00 сфор трихлорид (0,24мл, 2,71ммоль). Оранжевий (d, J=8Гц, 1Η), 6,93 (d, J=8Гц, 2Η), 6,77 (t, J=7Гц, осад негайно утворюється. Суміш гріють при те1Η), 3,46 (s, 2Η), 3,16-3,12 (m, 4Η), 2,57-2,53 (m, мпературі кипіння під зворотним холодильником 4Η); MC (ЕР) m/z 410 (M++1). протягом 30 хвилин та тоді дають охолонути. Наступні приклади, 65-70, отримують як опиСуміш розподіляють між етилацетатом та насисано у прикладі 64: ченим водним розчином натрій гідрокарбонату. Приклад 65 Водний шар екстрагують ще порцією етилацета3-[5-(азетидин-1-ілметил)піридин-2-іл]-2ту. Поєднані органічні шари сушать безводним гідрокси-1Н-індол-5-карбонітрил натрій сульфатом та розчинник випарюють. Си
ДивитисяДодаткова інформація
Назва патенту англійськоюIndole derivates, pharmaceutical composition based thereon, process for their preparation (variants), intermediate compound
Автори англійськоюBerg Stefan
Назва патенту російськоюПроизводные индола, фармацевтическая композиция на их основе, способ их получения (варианты), промежуточное соединение
Автори російськоюБерг Стефан
МПК / Мітки
МПК: A61P 25/14, C07D 401/06, C07D 403/14, C07D 401/12, A61P 9/10, C07D 213/68, C07D 413/14, C07D 401/04, C07D 403/04, A61P 31/18, A61K 31/5377, A61K 31/455, A61P 25/18, A61P 3/10, A61P 15/00, A61P 15/16, A61P 43/00, A61K 31/496, C07D 213/61, C07D 417/14, A61P 21/02, A61P 17/14, C07D 409/04, A61K 31/4439, C07D 213/81, C07D 409/14, C07D 209/34, A61P 25/28, C07D 417/04, C07D 405/04, A61K 31/551, C07D 401/14, C07D 213/89, A61P 25/00, C07D 405/14, A61K 31/4545, A61P 25/16, A61P 25/24, C07D 213/71, C07D 413/04
Мітки: фармацевтична, спосіб, варіанти, проміжна, похідні, індолу, одержання, сполука, основі, композиція
Код посилання
<a href="https://ua.patents.su/38-79447-pokhidni-indolu-farmacevtichna-kompoziciya-na-kh-osnovi-sposib-kh-oderzhannya-varianti-promizhna-spoluka.html" target="_blank" rel="follow" title="База патентів України">Похідні індолу, фармацевтична композиція на їх основі, спосіб їх одержання (варіанти), проміжна сполука</a>
Попередній патент: Пристрій для попередження водія автотранспорту про близькість аварійно небезпечного об’єкта
Наступний патент: Похідні 3-арил-2,5-дигідрокси-1,4-бензохінону, спосіб їх одержання і фармацевтична композиція, яка їх містить
Випадковий патент: Канал вимірювання радіальної швидкості літальних апаратів з оптико-електронним модулем та можливістю розпізнавання ла для лівс полігонного випробувального комплексу










































