Похідні триазолу як антагоністи рецепторів тахікінінів
Номер патенту: 79113
Опубліковано: 25.05.2007
Автори: Гардінієр Кевін Мет'ю, Савін Кеннет Аллен, Мехл Брайан Стефан, Амегадзі Алберт Кудзові, Ремік Дейвід Майкл, Робертсон Майкл Алан, Гонг Жан Ерік, Джангхейм Луіс Ніколаус, Хембре Ерік Джеймз
Формула / Реферат
1. Сполука Формули І:
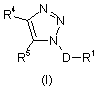 ,
,
де:
D - С1-С3-алкандіїл;
R1 - феніл,
факультативно заміщений замісниками в кількості від одного до трьох, незалежно один від одного вибраними з групи, до якої входять галоген, С1-С4-алкіл, С1-С4-алкокси-, ціаногрупа, дифторметил, трифторметил та трифторметоксигрупа;
R4 - радикал, вибраний з групи, до якої входять:
 ,
,  ,
, 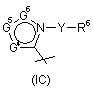 ,
,
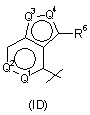 ,
, 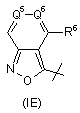 ,
,
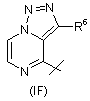 ,
, 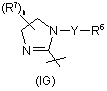 та
та 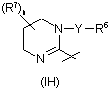 ,
,
де
-А1-А2-А3-А4-, спільно з атомами, до яких вони приєднані, утворюють ароматичну карбоциклічну або гетероциклічну групу, в якій кожний з А1, А2, А3 та А4 незалежно один від одного є -CR8- або азот, де принаймні один з А1, А2, А3 та А4 має бути -CR8-; -G1-G2-G3-, спільно з атомами, до яких вони приєднані, утворюють ароматичну гетероциклічну групу, в якій кожний із G1, G2 та G3 незалежно один від одного є -CR8-, азот, кисень або сірка, де тільки один із G1, G2 та G3 може бути киснем або сіркою;
-G4-G5-G6-, спільно з атомами, до яких вони приєднані, утворюють ароматичну гетероциклічну групу, в якій кожен із G4, G5 та G6 незалежно один від одного є -CR8- або азот;
кожний із R8 незалежно один від одного вибраний з групи, до якої входять водень, галоген, С1-С4-алкіл, заміщений С1-С4-алкіл, С3-С6-циклоалкіл, -NR12R13, трифторметил та трифторметоксигрупа;
кожний з R12 та R13 незалежно один від одного є водень, С1-С4-алкіл або -С(О)-СН3; або R12 та R13, спільно з атомом азоту, до якого вони приєднані, утворюють 4-7-членний цикл;
кожний з Q1, Q2, Q5 та Q6 незалежно один від одного є -СН- або азот;
кожний з Q3 та Q4 незалежно один від одного є кисень або азот, де принаймні один з Q3 та Q4 має бути азотом;
R6 - С1-С4-алкіл, С3-С6-циклоалкіл, феніл або піридил,
причому феніл або піридил факультативно заміщені замісниками в кількості від одного до трьох, незалежно один від одного вибраними з групи, до якої входять галоген, ціаногрупа, С1-С4-алкіл, С1-С4-алкоксигрупа, трифторметил, трифторметокси-, морфоліногрупа та -NR14R15;
кожен з R14 та R15 незалежно один від одного є водень або С1-С4-алкіл, або R14 та R15, спільно з атомом азоту, до якого вони приєднані, утворюють 4-7-членний цикл;
Х - зв'язок, С1-С3-алкандіїл, -СН(ОН)-, -С(О)-, -О-, -S(О)р- або -C=N-OR9-;
p - 0, 1 або 2;
R9 - водень, С1-С4 алкіл або бензил;
Y - зв'язок, С1-С3-алкандіїл, або -С(О)-;
n - 0, 1 або 2;
кожний із R7 незалежно один від одного є С1-С4-алкіл;
R5 - водень, галоген, трифторметил, С1-С4-алкіл, С3-С6-циклоалкіл, фурил, тієніл, піроліл, імідазоліл, -NR16R17, піридилоксигрупа, феніл, фенокси-, фенілтіо-, аніліногрупа,
причому феніл, фенокси-, фенілтіо- або аніліногрупа можуть бути факультативно заміщені при фенільному циклі одним або двома замісниками, незалежно один від одного вибраними з групи, до якої входять галоген, С1-С4-алкіл, С1-С4-алкоксигрупа та -S(O)q(С1-С4-алкіл),
або радикал, вибраний з групи, до якої входять:
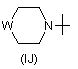 та
та 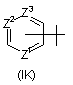 ;
;
де W - зв'язок, -СН2-, -O-, -NR11- або -S(O)q-;
q - 0, 1 або 2;
R11 вибраний з групи, до якої входять водень, С1-С4-алкіл, ацетил, феніл, бензил та -S(O)2СН3;
кожний з Z1, Z2 та Z3 незалежно один від одного є -СН- або азот;
кожний з R16 та R17 незалежно один від одного є водень або С1-С4-алкіл, за умови, що як R16 так і R17 не можуть бути воднем;
або фармацевтично прийнятні солі цієї сполуки;
за умови, що сполука не є 5-(1-бензил-1,2,3-триазол-4-іл)-1-фенілтетразолом.
2. Сполука за п. 1, де
D - метилен;
R1 - феніл,
факультативно заміщений одним або двома замісниками, незалежно один від одного вибраними з групи, до якої входять галоген, С1-С4-алкіл, трифторметил та трифторметоксигрупа;
R4 - радикал, вибраний з групи, до якої входять:
 ,
, 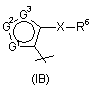 ,
, 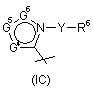 ,
,
 ,
, 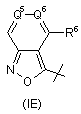 ,
,
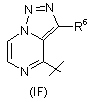 ,
, 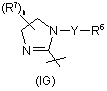 та
та 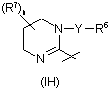 ,
,
де
-Al-A2-A3-A4- вибраний з групи, до якої входять -N-CR8-CR8-CR8-, -CR8-CR8-CR8-CR8-, -CR8-N-CR8-CR8-, -N-N-CR8-CR8-, -CR8-N-CR8-N-, -N-CR8-CR8-N- та -CR8-CR8-CR8-N-,
-G1-G2-G3- вибраний з групи, до якої входять -N-O-CR8-, -O-N-CR8-,
-CR8-N-O-, -N-N-NH-, -NH-N-N-, -CR8-N-NH-, -N-CR8-NH- та -N-CR8-S-;
-G4-G5-G6- вибраний з групи, до якої входять -N-N-CR8-, -N-CR8-CR8- та -N-N-N-;
кожний із R8 незалежно один від одного вибраний з групи, до якої входять водень, С1-С4-алкіл, заміщений С1-С4-алкіл, С3-С6-циклоалкіл, -NR12R13 та трифторметил;
R12 - водень;
R13 - водень або -С(O)-СН3;
Q1 - азот;
Q2 - -СН- або азот;
Q3 - азот або кисень;
Q4 - азот або кисень;
Q5 - -СН- або азот;
Q6 - азот;
R6 - феніл,
причому феніл факультативно заміщений одним або двома замісниками, незалежно один від одного вибраними з групи, до якої входять галоген, ціаногрупа, С1-С4-алкіл, С1-С4-алкоксигрупа, трифторметил та морфоліногрупа;
Х - зв'язок, С1-С3-алкандіїл, -СН(ОН)-, -С(O)- або -C=N-OR9-;
R9 - водень;
Y - зв'язок або С1-С3-алкандіїл;
n - 0 або 2;
кожний із R7 незалежно один від одного є С1-С4-алкіл;
R5 - галоген, С1-С4-алкіл, С3-С6-циклоалкіл, феніл, -NR16R17 або радикал, вибраний з групи, до якої входять:
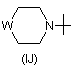 та
та 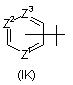 ;
;
де W - -O-, -NR11- або -S(O)q-;
q - 0, 1 або 2;
R11 - С1-С4-алкіл;
кожний з Z1, Z2 та Z3 незалежно один від одного є -CН- або азот;
R16 - С1-С4-алкіл;
R17 - С1-С4-алкіл;
або фармацевтично прийнятні солі цієї сполуки.
3. Сполука за будь-яким із пп. 1, 2, де R6 - 2-хлорфеніл.
4. Сполука за будь-яким із пп. 1-3, де Х - -С(O)-.
5. Сполука за будь-яким із пп. 1-4, де R5 - феніл.
6. Сполука за будь-яким із пп. 1-4, де R5 - радикал Формули (ІK), в якій Z2 - азот.
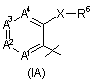
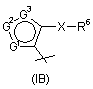
7. Сполука за будь-яким із пп. 1-6, де R4 - радикал Формули (ІА), (IВ) або (IC).
8. Сполука за п. 7, де R4 - радикал Формули (ІА).
9. Сполука за п. 1, яка вибрана з групи, до якої входять:
{4-аміно-2-[1-(3,5-біс-трифторметилбензил)-5-піридин-4-іл-1Н-[1,2,3]триазол-4-іл]-піридин-3-іл}-(2-хлорфеніл)-метанон,
{5-аміно-3-[1-(3,5-біс-трифторметилбензил)-5-тридин-4-іл-1Н-[1,2,3]триазол-4-іл]-піридазин-4-іл}-(2-хлорфеніл)-метанон,
{2-[1-(3,5-біс-трифторметилбензил)-5-піридин-3-іл-1Н-[1,2,3]триазол-4-іл]-піридин-3-іл}-(2-хлорфеніл)-метанон,
{2-[1-(3,5-біс-трифторметилбензил)-5-піридин-4-іл-1Н-[1,2,3]триазол-4-іл]-піридин-3-іл}-фенілметанон,
{5-аміно-3-[1-(3,5-біс-трифторметилбензил)-5-піримідин-5-іл-1Н-[1,2,3]триазол-4-іл]-піридазин-4-іл}-(2-хлорфеніл)-метанон,
{4-аміно-2-[1-(3,5-біс-трифторметилбензил)-5-морфолін-4-іл-1Н-[1,2,3]триазол-4-іл]-піридин-3-іл}-(2-хлорфеніл)-метанон,
{2-[1-(3,5-біс-трифторметилбензил)-5-піразин-2-іл-1Н-[1,2,3]триазол-4-іл]-піридин-3-іл}-(2-хлорфеніл)-метанон,
{3-[1-(3,5-біс-трифторметилбензил)-5-піридин-3-іл-1Н-[1,2,3]триазол-4-іл]-піридазин-4-іл}-(2-хлорфеніл)-метанон,
{3-[1-(3,5-біс-трифторметилбензил)-5-піримідин-5-іл-1Н-[1,2,3]триазол-4-іл]-піридазин-4-іл}-(2-хлорфеніл)-метанон,
{2-[1-(3,5-біс-трифторметилбензил)-5-піридин-4-іл-1Н-[1,2,3]триазол-4-іл]-піридин-3-іл}-(2-трифторметилфеніл)-метанон,
{2-[1-(3,5-біс-трифторметилбензил)-5-піридин-4-іл-1Н-[1,2,3]триазол-4-іл]-піридин-3-іл}-(2-фторфеніл)-метанон,
{3-[1-(3,5-біс-трифторметилбензил)-5-піридин-4-іл-1Н-[1,2,3]триазол-4-іл]-піридин-2-іл}-(2-хлорфеніл)-метанон,
[3-[1-(3,5-біс-трифторметилбензил)-5-піридин-4-іл-1Н-[1,2,3]триазол-4-іл]-5-(1-гідрокси-1-метилетил)-ізоксазол-4-іл]-(2-хлорфеніл)-метанон,
[3-[1-(3,5-біс-трифторметилбензил)-5-піридин-3-іл-1Н-[1,2,3]триазол-4-іл]-5-(1-гідрокси-1-метилетил)-ізоксазол-4-іл]-(2-хлорфеніл)-метанон та
{2-[1-(3,5-біс-трифторметилбензил)-5-піридин-4-іл-1Н-[1,2,3]триазол-4-іл]-піридин-3-іл}-(2-хлорфеніл)-метанол.
10. Сполука за п. 1, яка є {2-[1-(3,5-біс-трифторметилбензил)-5-піридин-4-іл-1Н-[1,2,3]триазол-4-іл]-піридин-3-іл}-(2-хлорфеніл)-метаноном.
11. Сполука за п. 1, яка є {4-аміно-2-[1-(3,5-бістрифторметилбензил)-5-феніл-1Н-[1,2,3]триазол-4-іл]-піридин-3-іл}-(2-хлорфеніл)-метаноном.
12. Сполука за п. 1, яка є {5-аміно-3-[1-(3,5-біс-трифторметилбензил)-5-феніл-1Н-[1,2,3]триазол-4-іл]-піридазин-4-іл}-(2-хлорфеніл)-метаноном.
13. Сполука за п. 1, яка є {2-[1-(3,5-біс-трифторметилбензил)-5-піридин-3-іл-1Н-[1,2,3]триазол-4-іл]-піридин-3-іл}-(2-хлорфеніл)-метаноном.
14. Сполука за п. 1, яка є {2-[1-(3,5-біс-трифторметилбензил)-5-піридин-4-іл-1Н-[1,2,3]триазол-4-іл]-піридин-3-іл}-(2-хлорфеніл)-метанолом.
15. Сполука, яка є напівгідратом {4-аміно-2-[1-(3,5-бістрифторметилбензил)-5-феніл-1Н-[1,2,3]триазол-4-іл]-піридин-3-іл}-(2-хлорфеніл)-метанону.
16. Сполука, яка вибрана з групи, до якої входять:
[1-(3,5-біс-трифторметилбензил)-5-феніл-1Н-[1,2,3]триазол-4-іл]-[5-(2-хлорфеніл)-3-(тетрагідропіран-2-ілоксиметил)-ізоксазол-4-іл]-метанон,
[1-(3,5-біс-трифторметилбензил)-5-феніл-1Н-[1,2,3]триазол-4-іл]-[5-(2-хлорфеніл)-3-(2,2-диметоксіетил)-ізоксазол-4-іл]-метанон,
[1-(3,5-біс-трифторметилбензил)-5-феніл-1Н-[1,2,3]триазол-4-іл]-[5-(2-хлорфеніл)-3-[ 1,3]діоксолан-2-ілметил-ізоксазол-4-іл]-метанон,
[1-(3,5-біс-трифторметилбензил)-5-піразин-2-іл-1Н-[1,2,3]триазол-4-іл]-[5-(2-хлорфеніл)-3-(тетрагідропіран-2-ілоксиметил)-ізоксазол-4-іл]-метанон,
трет-бутиловий складний ефір {2-[[1-(3,5-біс-трифторметилбензил)-5-
піридин-4-іл-1Н-[1,2,3]триазол-4-карбоніл]-(2-хлорбензил)-аміно]-етил}-карбамінової кислоти,
трет-бутиловий складний ефір {2-[[1-(3,5-біс-трифторметилбензил)-5-хлор-1Н-[1,2,3]триазол-4-карбоніл]-(2-хлор-бензил)-аміно]-етил}-карбамінової кислоти,
трет-бутиловий складний ефір (2-{[1-(3,5-біс-трифторметилбензил)-5-хлор-1Н-[1,2,3]триазол-4-карбоніл]-[1-(2-хлорфеніл)-етил]-аміно}-етил)-карбамінової кислоти,
трет-бутиловий складний ефір (2-{[1-(3,5-біс-трифторметилбензил)-5-піридин-4-іл-1Н-[1,2,3]триазол-4-карбоніл]-[1-(2-хлорфеніл)-етил]-аміно}-етил)-карбамінової кислоти,
трет-бутиловий складний ефір {2-[[1-(3,5-біс-трифторметилбензил)-5-морфолін-4-іл-1Н-[1,2,3]триазол-4-карбоніл]-(2-хлорбензил)-аміно]-етил}-карбамінової кислоти,
трет-бутиловий складний ефір (2-{[1-(3,5-біс-трифторметилбензил)-5-морфолін-4-іл-1Н-[1,2,3]триазол-4-карбоніл]-[1-(2-хлорфеніл)-етил]-аміно}-етил)-карбамінової кислоти,
дигідрохлорид (2-аміноетил)-(2-хлорбензил)-аміду 1-(3,5-біс-трифторметилбензил)-5-піридин-4-іл-1Н-[1,2,3]триазол-4-карбонової кислоти,
гідрохлорид (2-аміноетил)-(2-хлорбензил)-аміду 1-(3,5-біс-трифторметилбензил)-5-морфолін-4-іл-1Н-[1,2,3]триазол-4-карбонової кислоти,
дигідрохлорид (2-аміноетил)-[1-(2-хлорфеніл)-етил]-аміду 1-(3,5-біс-трифторметилбензил)-5-морфолін-4-іл-1Н-[1,2,3]триазол-4-карбонової кислоти та
дигідрохлорид (2-аміноетил)-[1-(2-хлорфеніл)-етил]-аміду 1-(3,5-біс-трифторметилбензил)-5-піридин-4-іл-1Н-[1,2,3]триазол-4-карбонової кислоти.
17. Фармацевтична композиція, яка містить сполуку за будь-яким із пп. 1-15 або фармацевтично прийнятну сіль цієї сполуки разом із фармацевтично прийнятними носієм, наповнювачем або розріджувачем.
18. Застосування сполуки Формули І:
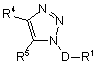 ,
,
де:
D - С1-С3-алкандіїл;
R1 - феніл,
факультативно заміщений замісниками в кількості від одного до трьох, незалежно один від одного вибраними з групи, до якої входять галоген, С1-С4-алкіл, С1-С4-алкокси-, ціаногрупа, дифторметил, трифторметил та трифторметоксигрупа;
R4 - радикал, вибраний з групи, до якої входять:
 ,
,  ,
, 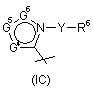 ,
,
 ,
,  ,
,
 ,
, 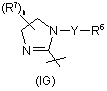 та
та 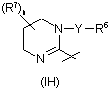 ,
,
де
-А1-А2-А3-А4-, спільно з атомами, до яких вони приєднані, утворюють ароматичну карбоциклічну або гетероциклічну групу, в яких кожний із А1, А2, А3 та А4 незалежно один від одного є -CR8- або азот, де принаймні один з А1, А2, А3 та А4 повинен бути -CR8-;
-G1-G2-G3-, спільно з атомами, до яких вони приєднані, утворюють ароматичну гетероциклічну групу, в якій кожний з G1, G2 та G3 незалежно один від одного є -CR8-, азот, кисень або сірка, де тільки один із G1, G2 та G3 може бути киснем або сіркою;
-G4-G5-G6-, спільно з атомами, до яких вони приєднані, утворюють ароматичну гетероциклічну групу, в якій кожний із G4, G5 та G6 незалежно один від одного є -CR8- або азот;
кожний із R8 незалежно один від одного вибраний з групи, до якої входять водень, галоген, С1-С4-алкіл, заміщений С1-С4-алкіл, С3-С6-циклоалкіл, -NR12R13, трифторметил та трифторметоксигрупа;
кожний з R12 та R13 незалежно один від одного є водень, С1-С4-алкіл або -С(О)-СН3, або R12 та R13, спільно з атомом азоту, до якого вони приєднані, утворюють 4-7-членний цикл;
кожний з Q1, Q2, Q5 та Q6 незалежно один від одного є -СН- або азот;
кожний з Q3 та Q4 незалежно один від одного є кисень або азот, де принаймні один із Q3 та Q4 повинен бути азотом;
R6 - С1-С4-алкіл, С3-С6-циклоалкіл, феніл або піридил,
причому феніл або піридил факультативно заміщені замісниками в кількості від одного до трьох, незалежно один від одного вибраними з групи, до якої входять галоген, ціаногрупа, С1-С4-алкіл, С1-С4-алкоксигрупа, трифторметил, трифторметокси, морфоліногрупа та -NR14R15;
кожний з R14 та R15 незалежно один від одного є водень або С1-С4-алкіл, або R14 та R15, спільно з атомом азоту, до якого вони приєднані, утворюють 4-7-членний цикл;
Х - зв'язок, С1-С3-алкандіїл, -СН(ОН)-, -С(O)-, -O-, -S(O)р- або -C=N-OR9-;
р - 0, 1 або 2;
R9 - водень, С1-С4-алкіл або бензил;
Y - зв'язок, С1-С3-алкандіїл або -С(O)-;
n - 0, 1 або 2;
кожний із R7 незалежно один від одного є С1-С4 алкіл;
R5 - водень, галоген, трифторметил, С1-С4-алкіл, С3-С6-циклоалкіл, фурил, тієніл, піроліл, імідазоліл, -NR16R17, піридилоксигрупа, феніл, фенокси-, фенілтіо-, аніліногрупа,
причому феніл, фенокси-, фенілтіо- або аніліногрупа можуть бути факультативно заміщені при фенільному циклі одним або двома замісниками, незалежно один від одного вибраними з групи, до якої входять галоген, С1-С4-алкіл, С1-С4-алкоксигрупа та -S(O)q(С1-С4-алкіл), або радикал, вибраний з групи, до якої входять:
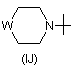 та
та 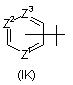 ;
;
де W - зв'язок, -СН2-, -O-, -NR11- або -S(O)q-;
q - 0, 1 або 2;
R11 вибраний з групи, до якої входять водень, С1-С4-алкіл, ацетил,
феніл, бензил та -S(O)2СН3;
кожний з Z1, Z2 та Z3 незалежно один від одного є -СН- або азот;
кожний з R16 та R17 незалежно один від одного є водень або С1-С4-алкіл;
або фармацевтично прийнятної солі цієї сполуки;
для виготовлення лікарського засобу для лікування неспокою, страху або тривоги, депресії, синдрому подразненої кишки або блювання.
19. Застосування за п. 18, яке відрізняється тим, що лікарський засіб призначений для лікування неспокою, страху або тривоги.
20. Застосування за п. 19, яке відрізняється тим, що лікарський засіб призначений для лікування розладу генералізованої тривоги.
21. Застосування за п. 18, яке відрізняється тим, що лікарський засіб призначений для лікування блювання.
Текст
з ацетатом амонію або гідразином в кислотних умовах, наприклад, в оцтовій кислоті. Якщо R x є метиленова група, застосовують як реагент ацетат амонію і одержують сполуки Формули (І), в яких Q5 є CR8- та Q6 є азот, або застосовують як реагент гідразин, якщо Rx є зв'язок, для одержання сполук Формули (І), в яких Q5 та Q 6 є атомами азоту. Спосіб 1 за Схемою 16 ілюструє одержання сполук Формули (63), які охоплюються Формулою (І), шляхом проведення реакції діаміну Формули (60) зі складними ефірами Формули (3). Мається на увазі, що цю реакцію можна проводити, якщо Rx є або зв'язок, або метилен, з одержанням сполук Формули (І), в яких R4 є радикал відповідно Формули (IG) або (ІН). Реакцію можна проводити у присутності придатниого розчинника, наприклад, толуолу або бензолу. Розчин діаміну в толуолі обробляють триметилалюмінієм, а потім додають відповідний складний ефір у вигляді розчину у придатному розчиннику, наприклад, у толуолі або бензолі. Реакційну суміш нагрівають до завершення реакції. Продукт реакції можна виділяти та очищати, застосовуючи способи, добре відомі в галузі. До цих способів належать екстракція, випарювання, хроматографія та перекристалізація. Сполуки Формули (60) можна одержати шляхом відновлювального амінування, як правило, поєднуючи N-захищений аміноальдегід із придатним аміном, або, за альтернативним варіантом, шляхом поєднання монозахищеного діаміну з придатним альдегідом та з придатним відновлювальним агентом, наприклад, із триацетоксиборгідридом натрію, ціанборгідридом натрію або боргідридом натрію. До придатних розчинників належать метанол, 1,2-дихлоретан або етанол. Основним інформаційним джерелом з умов проведення цієї реакції може бути монографія [Larock R.C., Comprehensive Organic Transformations, 2nd ed., Wiley-VCH: New York, 1999, с.835-846]. Після цієї реакції можна провести відщеплення груп захисту. Як альтернативний варіант, Спосіб 2 ілюструє сполуки Формули (63), які охоплюються Формулою (І), які можна одержати шляхом алкілування сполук Формули (62). Алкілування цього типу добре відомі в літературі. Придатним розчинником для таких реакцій є диметилформамід. До придатних ненуклеофільних основ належить карбонат калію. До реакційної суміші додають каталітичну кількість йодиду натрію. Сполуки Формули (62) зручно одержувати шляхом проведення реакції складних ефірів Формули (3) та наявних на ринку діамінів у присутності триметилалюмінію. Одержані продукти можна очистити способами, описаними вище. Спосіб 3 ілюструє одержання сполук Формули (63) шляхом проведення реакції придатного аміно-аміду Формули (64) у присутності пентахлориду фосфору в придатному розчиннику, наприклад, у хлороформі, при нагріванні зі зворотним холодильником, стадія хх. Сполуки Формули (63) можна очистити способами, описаними вище. Для фахівця зрозуміло, що сполуки Формули (64) можна одержати шляхом перетворення сполук Формули (43) Схеми 12. Для фахівця зрозуміло, що імідазоліни Формули (63) (в яких R x є зв'язок) можна піддати подальшій ароматизації з одержанням сполук Формули (63), в яких R 4 є радикал Формули (IС) та -G4-G 5-G6- є -N-CR8CR8-; ці сполуки охоплюються Формулою (І). Методика дегідрування включає розчинення імідазоліну в розчиннику, наприклад, у ксилолі, та додання паладієвого каталізатора, наприклад 10% паладію на вугіллі. Реакційну суміш нагрівають до завершення реакції дегідрування. Умови дегідрування описано в роботі [Amemiya Y.; Miller D.D.; Hsu F.L.; Synth. Comm. 1990, т.20 (16) 2483-2489]. Продукти реакції можна виділяти та очищати, застосовуючи способи, добре відомі в галузі. До цих способів належать екстракція, випарювання, хроматографія та перекристалізація. Загальний Підготовчий синтез А Розчиняють придатну наявну на ринку галогенвмісну сполуку (1екв.) та азид натрію (3екв.) у суміші DMSO та води (10:1, приблизно 10мл/г NaN3). Перемішують протягом 2-12год при кімнатній температурі, після чого додають воду та екстрагують діетиловим ефіром. Промивають органічний шар водою (2´) та розсолом. Сушать (Na2SO4), фільтрують та концентрують досуха, одержуючи бажану сполуку. Можна використовува ти її без додаткового очищення. За методикою Загального Підготовчого синтезу А можуть бути одержані та виділені такі сполуки: Підготовчий синтез 20 (2-бром-піридин-3-іл)-(2-хлорфеніл)-метанол Додають LDA (400мл, 0,8моль) при -78°С до 2-бромпіридину (105г, 0,667моль), розчиненого в THF (3,2л), та перемішують. Через 2год додають 2-хлорбензальдегід (103г, 0,733моль), розчинений в THF (300мл), та дають можливість реакційній суміші поступово нагрітися до кімнатної температури. Обробляють реакційну суміш 1Μ НСI (1,7л) та екстрагують діетиловим простим ефіром. Об'єднують органічні шари та промивають водою та розсолом. Сушать над сульфатом натрію, фільтрують та концентрують під зниженим тиском. Очищають флеш-хроматографією з елююванням сумішшю гексан:етилацетат (градієнт від 10:1 до 1:1), і одержують вказану в заголовку сполук у: 1Н Я МР (300МГц, CDCI3), d 8,28 (dd, 1H, J=1,83, 4,73), 7,67 (dd, 1H, J=1,83, 7,63), 7,48-7,19 (m, 5H), 6,41 (s, 1H), 3,10 (bs, 1H); MS (IS) m/z 298,0 (M+1), 300,0 (M+1). Елементний аналіз для C12H9BrClNO: обчислено: С, 48,27; Η, 3,04; Ν, 4,69; знайдено: С, 49,06; Η, 3,18; Ν, 4,64. R f=0,29 (гептан:етилацетат, 2:1). За методикою Підготовчого синтезу 20, із застосуванням придатних вихідних матеріалів, можуть бути одержані та виділені нижченаведені сполуки. Підготовчий синтез 29 (3-бром-піридин-4-іл)-(2-хлорфеніл)-метанол Додають н-BuLi (48,2мл, 77,1ммоль, 1,6-н. у гексані) до охолодженого до -70°С розчину діізопропіламіну (10,8мл, 77,1ммоль), розчиненого в THF (130мл), у висушеній над полум'ям колбі. Через 30хв додають краплями 3-бромпіридин (2,48мл, 25,7ммоль), та перемішують суміш при -70°С. Через 4год додають краплями 2-хлор-бензальдегід (2,95мл, 26,2ммоль), перемішують при -70°С. Через 1год нагрівають реакційну суміш до кімнатної температури, гасять реакцію доданням краплями 60 мл насиченого розчину NH4CI. Екстрагують Et 2O (3´), промивають розсолом, сушать об'єднані органічні шари над MgSO4 та концентрують. Очищають залишок флеш-хроматографією на силікагелі з елююванням сумішшю 0-40% EtOAc/гексан, з одержанням вказаної в заголовку сполуки: MS(IS) 299 (М+1); ТШХ (50% EtOAc/гексан) Rf=0,23. Підготовчий синтез 30 (5-бром-піримідин-4-іл)-(2-хлорфеніл)-метанол Повільно додають свіжоприготовлений діізопропіламід літію (0,5Μ в простому ефірі) при нагріванні зі зворотним холодильником до розчину 5-бромпіримідину (4,03г, 25,3ммоль) та 2-хлор-бензальдегіду (3,55г, 25,2ммоль) в діетиловому ефірі (100мл). Після завершення додання перемішують при нагріванні зі зворотним холодильником протягом додаткових 2год, після чого гасять доданням 2-н. НСI (50мл). Промивають органічний шар водою (4´50мл), сушать, фільтрують та концентрують. Очищають неочищений матеріал флеш-хроматографією, використовуючи лінійний градієнт від 100% гексану до суміші 50% EtOAc/гексан, з одержанням вказаної в заголовку сполуки: MS (IS) 298,9 (М+1); 1Н Я МР (400МГц, CDCI3) d 9,19 (s, 1H), 8,77 (s, 1H), 7,40 (dd, 1H, J=1,4, 8,4), 7,23 (dt, 1H, J=1,9, 7,9), 7,15 (dt, 1H, J=1,4, 7,7), 6,92 (dd, 1H, J=1,5, 7,9), 6,34 (d, 1H, J=6,4), 4,75 (d, 1H, J=6,7). Підготовчий синтез 31 Tpет-бутиловий складний ефір {2-[(2-хлорфеніл)-гідрокси-метил]-феніл}-карбамінової кислоти Додають TMEDA (8,3мл, 55,0ммоль) до розчину трет-бутилового складного ефіру феніл-карбамінової кислоти (4,83г, 25,0ммоль) в THF (50мл) при -40°С у висушеній над полум'ям колбі. Через 5хв краплями протягом 10хв додають втор-ВuLi (43мл, 55,0ммоль, 1,3Μ в циклогексані). Дають можливість розчину нагрітися до кімнатної температури. Через 30хв додають насичений водний розчин NH4CI (приблизно 15мл) та перемішують протягом 30хв. Концентрують, розподіляють між сумішшю 20% і-РrОН/СНСl3 та насиченим водним розчином NaHCO3 та розділяють. Промивають органічний шар розсолом, сушать над MgSO4 та концентрують. Очищають залишок флеш-хроматографією на силікагелі з елююванням сумішшю 0-20% етилацетат/гексан, з одержанням вказаної в заголовку сполуки: ТШХ (10% етилацетат/гексан) Rf=0,20. Підготовчий синтез 32 (2-бромпіридин-3-іл)-(2-хлорфеніл)-метанон Додають 85% оксид марганцю (IV) (500г, 5,75моль) до суспензії (2-бромпіридин)-(2-хлорфеніл)метанолу (392г, 1,131моль) у толуолі (2,5л), нагрівають до кипіння та перемішують. Через 1год охолоджують до температури навколишнього середовища та фільтрують через целіт (CeliteÒ). Концентрують одержаний розчин під зниженим тиском. Очищають перекристалізацією із суміші МТВЕ:гептан (2:1), з одержанням вказаної в заголовку сполуки, 312,4г (80%). 1Н ЯМР (300МГц, CDCI3), d 8,50 (dd, 1H, J=1,83, 4,73), 7,78 (dd, 1H, J=1,83, 7,63), 7,60 (dd, 1H, J=1,53, 7,63), 7,53-7,34 (m, 4H); MS (IS) m/z 296,0-(M+1), 298,0 (M+1); т.пл.=76,3°С. Елементний аналіз для C12H7BrClNO: обчислено: С, 48,60; Η, 2,38; Ν, 4,72; знайдено: С, 48,71; Η, 2,4S; Ν, 4,61; R f=0,40 (гексан:етилацетат, 2:1). За методикою Підготовчого синтезу 32 можуть бути одержані та виділені кристалізацією або хроматографією нижченаведені сполуки. Підготовчий синтез 44 (2-аміно-феніл)-(2-хлорфеніл)-метанон Розчиняють wpem-бутиловий складний ефір [2-(2-хлор-бензоїл)-феніл]-карбамінової кислоти (850мг, 2,6ммоль) в насиченому розчині НСI в АсОН (10мл, приблизно 3-н. в НСI), перемішують при кімнатній температурі протягом 3год. Концентрують, додають СНСІ3 та концентрують (3´) до видалення залишку АсОН. Розчиняють залишок в суміші 20% і-PrOH/СНСІ3, промивають насиченим розчином NaНСО3 (2´) та розсолом. Сушать об'єднані органічні шари над MgSO4 та концентрують з одержанням вказаної в заголовку сполуки (495мг, 83%): MS(IS) 232 (М+1). Підготовчий синтез 45 (2-хлорфеніл)-(2-йод-феніл)-метанон Додають концентровану НСl (0,5мл) до розчину (2-аміно-феніл)-(2-хлорфеніл)-метанону (495мг, 2,14ммоль) у льодяній АсОН (1,1мл). Охолоджують розчин до 10°С; додають краплями розчин нітриту натрію (156мг, 2,26ммоль) у воді (1мл) протягом 30хв. Через додаткові 30хв додають воду (4°С, 2мл) та EtOAc (4°C, 4мл). Додають краплями протягом 25хв розчин KІ (425мг, 2,56ммоль) та І2 (319мг, 1,25ммоль) у воді (2мл). Перемішують при 5-15°С протягом 2,5год у атмосфері N2. Екстрагують EtOAc (3´), промивають 1-н. водним розчином Na2S2O3 (3´), насиченим водним розчином NaHCO3 (3´) та розсолом. Сушать об'єднані органічні шари над Na2SO4 та концентрують. Очи щають залишок флеш-хроматографією на силікагелі з елююванням сумішшю 0-10% EtOАс/гексан, з одержанням вказаної в заголовку сполуки (498мг, 68%): MS(IS) 343 (М+1); ТШХ (10% EtOAc/гексан) Rf=0,39. Підготовчий синтез 46 4,5-дигідро-2Н-піридазин-3-он Розчиняють бурштиновий семіальдегід (15% (мас.)/НаО, 1екв.) у суміші оцтової кислоти/Н 2О (1,5/1), додають гідразин (2,5екв.) за допомогою шприца. Приєднують зворотний холодильник та встановлюють на 120°С баню, перемішують. Через 2год нейтралізують насиченим водним NаНСО3, екстрагують EtOAc, сушать над MgSO4, фільтрують та видаляють розчинник у вакуумі, з одержанням вказаної в заголовку сполуки: 1Н ЯМР (CDCI3): d 8,56 (br s, 1H), 7,15 (s, 1H), 2,53 (m, 4H). Загальний Підготовчий синтез В Змішують придатний дигідропіридазинон (1екв.) із розчином 5% KOH/EtOH та відповідним бензальдегідом. Приєднують зворотний холодильник та нагрівають при перемішуванні при 60°С. Через 1год додають концентрований водний розчин НСI до рН 3, екстрагують EtOAc, сушать над MgSO4, фільтрують та видаляють розчинник у вакуумі. Очи щають хроматографією на силікагелі з одержанням вказаної в заголовку сполуки. За методикою Загального Підготовчого синтезу В, можуть бути одержані та виділені нижченаведені сполуки: Загальний Підготовчий синтез С В герметизованій посудині змішують придатний бензилпіридазин (1екв.) з розчином оцтової кислоти та дигідратом дихромату натрію (2екв.). Нагрівають при 125°С при перемішуванні. Через 24год концентрують, нейтралізують насиченим водним NaНСО3, екстрагують EtOAc, сушать над MgSO 4, фільтрують та концентрують. Очи щають хроматографією на силікагелі з одержанням вказаної в заголовку сполуки. За методикою Загального Підготовчого синтезу С можуть бути одержані та виділені нижченаведені сполуки. Загальний Підготовчий синтез D Змішують придатний гідрокси-піридазин (1екв.) та нерозбавлений бромоксид фосфору, нагрівають при 100°С та перемішують. Через 1год виливають гарячу суміш на лід, додають 5-н. NaOH до рН 10, екстрагують EtOAc. Суша ть над MgSO4, фільтр ують та концентрують. Очищають хроматографією на силікагелі з одержанням вказаної в заголовку сполуки. За методикою Загального Підготовчого синтезу D, можуть бути одержані та виділені нижченаведені сполуки. Підготовчий синтез 53 4-етинілпіридин Додають K2СО3 (3,32г, 24,0ммоль) до розчину 4-триметилсиланілетиніл-піридину (3,51г, 20,0ммоль) у МеОН (40мл). Через 10хв додають насичений водний розчин NH4CI (приблизно 10мл) та перемішують. Через 10хв додають MgSO4, фільтрують та концентрують при кімнатній температурі. Очи щають дистиляцією за Кугельрором (Kugelrohr) (50-55°С), з одержанням вказаної в заголовку сполуки (1,31г, 64%): MS(IS) 104 (М+1). 1Н Я МР (400МГц, CDCI3): 3,29 (s, 1Н); 7,34 (d, 2H, J=5,9Гц); 8,59 (d, 2H, J=5,9Гц). Підготовчий синтез 54 5-триметилсиланілетинілпіримідин Розчиняють 5-бромпіримідин (50,0г, 314,4ммоль) у триетиламіні (400мл), додають йодид міді (І) (1,20г, 6,2ммоль) та перемішують суміш у атмосфері азоту. Через 15хв додають триметилсилілацетилен (53,3мл, 377,3ммоль), потім дихлорбіс(трифенілфосфін)паладій (II) (8,82г, 12,5ммоль) та перемішують при кімнатній температурі. Через 3год фільтрують одержаний розчин через целіт, промиваючи простим ефіром. Концентрують фільтрат під зниженим тиском. Очищають флеш-хроматографією на силікагелі з елююванням спочатку гексаном (100%), потім сумішшю гексан:етилацетат (3:1), з одержанням вказаної в заголовку сполуки: 1Н ЯМР (CDCI3) d 9,10 (s, 1Н), 8,77 (s, 2H), 0,27 (s, 9H). Підготовчий синтез 55 4-триметилсиланілетиніл-піридин Нагрівають суміш гідрохлориду 4-бромпіридину (1,0екв.), етиніл-триметил-силану (2,0екв.), PdCl2(PPh3)2 (0,1екв.), Cul (0,2екв.) та діізопропілетиламіну (10екв.) в DMF при 70°С протягом 18год. Розводять метиленхлоридом та промивають водою. Сушать над MgSO4, фільтрують та концентрують у вакуумі. Очищають залишок флеш-хроматографією на силікагелі з одержанням вказаної в заголовку сполуки. MS (IS) 176,0 (M+1); ТШХ (20% діетиловий ефір у гексані): Rf=0,1. За методикою Підготовчого синтезу 55, із застосуванням 2-йодпіразину, можуть бути одержані та виділені нижченаведені сполуки. Підготовчий синтез 57 2-трибутилстананілетиніл-піридин Розчиняють 2-етинілпіридин (7,14г, 69,23ммоль) в THF (350мл) та охолоджують одержаний розчин до 10°С (лід/метанол) у атмосфері азоту. Додають краплями н-бутиллітій (1,6Μ у гексані, 47,6мл, 76,16ммоль) та перемішують суміш. Через 15хв додають краплями хлорид трибутилолова (20,7мл, 76,2мл). Нагрівають суміш до кімнатної температури протягом ночі. Гасять реакцію водою, розбавляють діетиловим ефіром та промивають насиченим хлоридом амонію, а потім розсолом. Сушать над сульфатом натрію, фільтрують та концентрують. Одержання вказаної в заголовку сполуки не потребує додаткового очищення: 1Н ЯМР (CDCI3) d 8,50-8,54 (m, 1Н), 7,51-7,59 (m, 1H), 7,35-7,43 (m, 1H), 7,11-7,18 (m, 1H), 1,59-1,64 (m, 6H), 1,32-1,42 (m, 6H), 1,05-1,10 (m, 6H), 0,88-0,94 (m, 9H). Підготовчий синтез 58 Трибутил-циклопропілетиніл-станан До розчину н-бутиллітію (2,5Μ у гексані, 159мл, 0,398моль) в THF (800мл) при -10°С в атмосфері азоту додають краплями 5-хлорпентин (20г, 0,195моль), підтримуючи температур у нижче 10°С. Після завершення додання дають можливість реакційній суміші нагріватися до кімнатної температури та перемішують протягом 6год, потім додають хлорид трибутилолова (70г, 0,215моль) та перемішують протягом ночі. Виливають реакційну суміш в гексан (500мл), промивають насиченим бікарбонатом натрію (300мл) та розсолом (300мл), сушать сульфатом натрію, фільтрують та концентрують, з одержанням вказаної в заголовку сполуки (70г, 100%), яка може бути використана без додаткового очищення: мас-спектрометрія (m/е): 357 (М+Н+); 1Н ЯМР (CDCI3) d 1,70-1,49 (m, 6H), 1,49-1,24 (m, 7H), 1,10-0,65 (m, 19Н). Підготовчий синтез 59 4-[3-(3,5-біс-трифторметил-бензил)-5-трибутилстананіл-3Н-[1,2,3]триазол-4-іл]-морфолін Додають 1-азидометил-3,5-біс-трифторметилбензол (1,21г, 4,5ммоль) до розчину 4трибутилстананілетиніл-морфоліну у толуолі (5мл) (1,20г, 3,0ммоль). [Див. Berger D., et al., Helv. Chim. Ada (1996) 79(1): 179-91]. Продувають струменем N2, герметизують реакційну посудину та нагрівають при 100°С протягом ночі. Концентрують, розчиняють залишок у СНСІ3, сушать над MgSO4, концентрують. Очищають флеш-хроматографією на силікагелі з елююванням сумішшю 0-30% EtOAc/гексану, з одержанням вказаної в заголовку сполуки (710мг, 66%); MS(IS) 669 (М+1); ТШХ: Rf=0,53 (25% EtOAc/гексан). Підготовчий синтез 60 4-[3-(3,5-біс(трифторметил)бензил)-5-трибутилстананіл-3Н-[1,2,3]триазол-4-іл]-піридин Додають триметилсиланолат калію (0,651г, 4,56ммоль, чистота 90%) однією порцією до розчину 4[(триметилсиланіл)етиніл]піридину (40,0г, 228ммоль, [Ziessel R., et al. J. Org. Chem. 1996, 61, 6535]) та оксиду біс(трибутилолова) (95,2г, 160ммоль) в THF (400мл), підтримуючи температур у між 25-30°С за допомогою водяної бані. Через приблизно 1год концентрують розчин у роторному випарнику (50°С) з одержанням масла, яке містить 78-85% 4-[(трибутилстананіл)етиніл]піридину, 15-22% 4-етинілпіридину та надлишок оксиду біс(трибутилолова). Додають до масла 1-азидометил-3,5-біс(трифторметил)бензол (73,7г, 274ммоль) та нагрівають при 110°С, відганяючи усі леткі компоненти, які слід видалити для досягнення бажаної температури. Нагрівають розчин до завершення реакції за даними 1Н-ЯМР аналізу (приблизно 22год). Після охолодження до 50°С, розбавляють реакційну суміш гептаном (600мл) та перемішують при кімнатній температурі. Фільтрують суміш для видалення твердих речовин. Очищають суміш виливанням розчину гептану в колонку із силикагелем (810г силікагелю у лійці зі скляною фритою місткістю 2л) та елююють послідовно гептаном (5,2л), сумішшю EtOAc:гептан (1:10, 5,1л) та сумішшю EtOAc:гептан (1:3, 12,6л). Змішують фракції, що містять продукт, та концентрують у роторному випарнику з одержанням 124г (вихід 82%) вказаної в заголовку сполуки; т.пл. 61,9-63,1°С. Елементний аналіз для C 28H36F6N4Sn: обчислено: С, 50,86; Н, 5,49; N, 8,47. Знайдено: С, 51,08, Н, 5,61; N, 8,50. За методикою Підготовчого синтезу 60, із придатними вихідними матеріалами, можуть бути одержані та виділені нижченаведені сполуки. Загальний Підготовчий синтез Ε Нагрівають суміш придатного етинілстанану (1,0екв.) та придатного бензил азиду (1,0екв.) у толуолі до завершення реакції. Концентрують для видалення розчинника у вакуумі. Очи щають залишок флешхроматографією на силікагелі з одержанням бажаного продукту. За методикою Загального Підготовчого синтезу Ε можуть бути одержані та виділені нижченаведені сполуки. Підготовчий синтез 69 Метиловий складний ефір 3-оксо-3-піримідин-5-іл-пропіонової кислоти Додають 25% (мас.) розчин метилату натрію в метанолі (4,5мл, 19,8ммоль) до толуолу (40мл) та нагрівають до 85°С у атмосфері Ν 2. Розчиняють етиловий складний ефір піримідин-5-карбонової кислоти (2,0г, 13,2ммоль) у метилацетаті (2,1мл) та додають краплями до толуольного розчину. Нагрівають реакційну суміш протягом 1год та додають краплями суспензію метилату натрію (715мг, 13,2ммоль) у метилацетаті (15мл). Нагрівають реакційну суміш при 85°С протягом ночі, охолоджують до кімнатної температури та виливають у розчин льодяної оцтової кислоти (12мл) у воді (150мл). Після перемішування протягом 1год при кімнатній температурі екстрагують етилацетатом (3´100мл), промивають органічну фазу розсолом (200мл), суша ть над сульфатом натрію, фільтрують та концентрують під зниженим тиском з одержанням вказаної в заголовку сполуки у вигляді суміші таутомерів: 1Н ЯМР (CDCI3) енольна форма d 12,43 (s, 1Н), 9,26 (s, 1H), 9,10 (s, 2H), 5,76 (s, 1H), 3,86 (s, 3H); кетоформа d 9,42 (s, 1H), 9,30 (s, 2Н), 4,06 (s, 3Н), 3,74 (s, 2H). Підготовчий синтез 70 Метиловий складний ефір 3-оксо-3-піразин-2-іл-пропіонової кислоти Розчиняють NaOMe (1,5екв.) у толуолі та нагрівають до 90°С. Додають краплями розчин 2піразинметилового складного ефіру (1,0екв.) та метилацетату (2,0екв.) у толуолі та нагрівають при 90°С. Через 20год концентрують у вакуумі при кімнатній температурі. Суспендують у надлишку метилацетату та нагрівають зі зворотним холодильником 20год. Охолоджують до кімнатної температури. Додають воду. Екстрагують EtOAc, сушать (Na2SO4), фільтрують та концентрують у вакуумі з одержанням вказаної в заголовку сполуки: ТШХ Rf=0,58 (1:1 EtOAc/гексан). Підготовчий синтез 71 Етиловий складний ефір 1-(3,5-біс-трифторметил-бензил)-5-піридин-4-іл-1Н-[1,2,3]триазол-4-карбонової кислоти Додають до розчину етилізонікотиноїлацетату (2,52г, 13,0ммоль) та 3,5-біс-трифторбензилазиду (3,54г, 13,1ммоль) в DMSO (20мл) подрібнений K2СО3 (5,72г, 41,4ммоль). Нагрівають суміш до 40°С та перемішують протягом 18год, потім розбавляють Н 2О та додають 1-н. НСI до рН=7. Екстрагують суміш EtOAc (2´50мл). Змішують органічні фази та промивають Н 2О (2´50мл) та розсолом (50мл), після чого сушать, фільтрують та концентрують органічний шар. Розтирають неочищений матеріал із гексаном, після чого перекристалізують тверду речовину із суміші 40% EtOAc/гексан з одержанням вказаної в заголовку сполуки (2,80г, 48%). MS (EI+) 445,2 (М+Н); 1Н ЯМР (400МГц, CDCI3): d 8,74 (dd, 2H, J=1,5, 4,4), 7,80 (s, 1H), 7,45 (s, 2H), 7,13 (dd, 2H, J=2,0, 4,4), 5,56 (s, 2H), 4,27 (q, 2H, J=7,3), 1,28 (t, 3H, J=7,3). Елементний аналіз (C19H14F 6N4O 2: обчислено С, 51,36; Η, 3,18; Ν, 12,61. Знайдено С, 51,35; Η, 3,21; Ν, 12,52. За методикою Підготовчого синтезу 71, можуть бути одержані та виділені нижченаведені сполуки. Підготовчий синтез 78 Етиловий складний ефір 1-(3,5-біс-трифторметил-бензил)-5-гідрокси-1Н-[1,2,3]триазол-4-карбонової кислоти Змішують розчин етилату натрію (5,5мл, 21% (мас.) в етанолі) та діетилмалонат (2,50мл, 16,5ммоль) в етанолі (26мл) із розчином 1-азидометил-3,5-біс-трифторметил-бензолу (4,40г, 16,3ммоль) в етанолі (6мл) та нагрівають при 80°С. Через 7год охолоджують до кімнатної температури. Концентрують суміш у вакуумі та розчиняють в'язке масло у Н 2 О (20мл). Додають водний розчин 1-н. НСI до рН 2-3. Відфільтровують білий осад та сушать під зниженим тиском з одержанням вказаної в заголовку сполуки: MS (IS) 384,0 (М+Н), MS (ES-) 382,1 (М-Н); 1Н Я МР (400МГц, CDCI3) d 8,05 (s, 1H), 7,92 (s, 2H), 5,41 (s, 2H), 4,15 (q, 2H, J=7,3), 1,22 (t, 3H, J=7,3). Підготовчий синтез 79 Етиловий складний ефір 1-(3,5-біс-трифторметил-бензил)-5-хлор-1Н-[1,2,3]триазол-4-карбонової кислоти Змішують РСІ5 (5,73г, 27,5ммоль) із розчином етилового складного ефіру 1-(3,5-біс-трифторметилбензил)-5-гідрокси-1Н-[1,2,3]триазол-4-карбонової кислоти (5,30г, 13,8ммоль) у толуолі (150мл) та нагрівають при 50°С. Через 2год охолоджують до кімнатної температури, концентрують розчин та розчиняють неочищений матеріал в діетиловому ефірі (100мл). Промивають органічний розчин насиченим NaНСО3 (2´100мл) та розсолом (100мл), сушать, фільтрують та концентрують. Очи щають неочищений матеріал шляхом пропускання через коротку колонку із силікагелем, використовуючи лінійний градієнт від 50% до 80% EtOAc/гексан, після чого перекристалізують із суміші діетиловий ефір:петролейний ефір (1:1, 150мл). MS (IS) 402,0 (М+Н). 1Н Я МР (400МГц, CDCI3) d 7,88 (s, 1H), 7,76 (s, 2H), 5,67 (s, 2H), 4,43 (q, 2H, J=7,0), 1,40 (t, 3H, J=7,0). Загальний Підготовчий синтез F Додають розчин LiOH2O (10екв.) у воді до розчину придатного складного ефіру (1екв.) у діоксані. Перемішують у атмосфері N2 протягом ночі. Підкислюють до рН=1-2 5-н. розчином НСI та відфільтровують осад. Висушування матеріалу у вакуумі дає бажаний продукт. За методикою Загального Підготовчого синтезу F, із застосуванням придатних ви хідних матеріалів, можуть бути одержані та виділені нижченаведені сполуки. Загальний Підготовчий синтез G Додають Ν,Ο-диметил-гідроксиламін (1,3екв.), EDCI (1,3екв.) та DMAP (0,6-1,3екв.) до розчину придатної карбонової кислоти (1екв.) у СН 2СІ2 (0,3М). Перемішують розчин при кімнатній температурі протягом 5-24год, потім розбавляють СН 2СІ2 та промивають водою, насиченим NaНСО3 та розсолом. Сушать, фільтрують та концентрують органічний розчин, після чого очищають неочищений матеріал флешхроматографією або перекристалізацією. За методикою Загального Підготовчого синтезу G можуть бути одержані та виділені нижченаведені сполуки. Підготовчий синтез 96 [1-(3,5-біс-трифторметил-бензил)-5-піридин-3-іл-1Н-[1,2,3]триазол-4-іл]-метанол Розчиняють метиловий складний ефір 1-(3,5-біс-трифторметил-бензил)-5-піридин-3-іл-1Н[1,2,3]триазол-4-карбонової кислоти в МеОН. Додають NaBH4 (2,64г, 3екв.) та нагрівають зі зворотним холодильником протягом ночі (70°С). Охолоджують до кімнатної температури та повільно виливають в ділильну лійку, що містить однаковий з сумішшю об'єм води. Екстрагують СН 2СІ2. Концентрують та перекристалізують із суміші EtOAc/гексан з одержанням 7,0г (75%) вказаної в заголовку сполуки. MS (IS) 403,2 (M+1); 1Н ЯМР: (400МГц, CD3OD) d: 8,65 (dd, J=5,2, 1,6Гц, 1H) 8,53-8,52 (m, 1H), 7,89 (s, 1H), 7,86-7,83 (m, 1H), 7,60 (s, 2H), 7,56-7,53 (m, 1H), 5,83 (s, 2H), 4,59 (s, 2H). Підготовчий синтез 97 1-(3,5-біс-трифторметил-бензил)-5-хлор-1Н-[1,2,3]триазол-4-карбальдегід Додають розчин LiBH4 (65мл, 2М, в THF) до розчину етилового складного ефіру 1-(3,5-бістрифторметил-бензил)-5-хлор-1Н-[1,2,3]триазол-4-карбонової кислоти (15,0г, 37,3ммоль) в THF (150мл) при 0°С. Після завершення додання перемішують розчин при кімнатній температурі протягом 6год, потім охолоджують знову до 0°С. Обережно гасять повільним доданням 5-н. НСl (50мл). Перемішують при кімнатній температурі протягом 30хв, потім нейтралізують 5-н. розчином NaOH. Розбавляють суміш водою (100мл) та екстрагують EtOAc (2´50мл). Змішують органічні фази та промивають водою (100мл) та розсолом (100мл), після чого сушать, фільтрують та концентрують з одержанням спирту, який використовують у наступній реакції без додаткового очищення. Додають перйодатний реактив Десса-Мартіна (19,0г, 44,8ммоль) при 0°С до розчину вищезгаданого спирту у СН2СІ 2 (100мл). Перемішують розчин при 0°С протягом 15хв, потім при кімнатній температурі протягом 2год. Додають додатковий перйодатний реактив Десса-Мартіна (1,7г, 4,0ммоль) та перемішують при кімнатній температурі протягом 1год. Виливають розчин у холодний 5-н. NaOH (70мл) та екстрагують діетиловим ефіром (3´150мл). Змішують органічні фази та промивають 1-н. NaOH (100мл), водою (100мл) та розсолом (100мл), після чого сушать, фільтрують та концентрують. Очищають неочищений матеріал флеш-хроматографією з одержанням вказаної в заголовку сполуки. MS (IS) 358,1 (М+Н). 1Н ЯМР (400МГц, CDCI3) d 10,13 (s, 1H), 7,90 (s, 1H), 7,76 (s, 2H), 5,67 (s, 2H). За методикою Підготовчого синтезу 97, із застосуванням відповідного складного ефіру, одержана і виділена нижченаведена сполука. Підготовчий синтез 99 1-[1-(3,5-біс-трифторметил-бензил)-5-хлор-1Н-[1,2,3]триазол-4-іл]-3-(2-хлорфеніл)-проп-2-ін-1-ол Розчиняють 1-хлор-2-етиніл-бензол (22,1г, 162ммоль) в THF (300мл) та повільно додають метилмагнійбромід (50мл, 3,0Μ в діетиловому е фірі). Перемішують розчин при кімнатній температурі протягом 40хв, потім додають розчин 1-(3,5-біс-трифторметил-бензил)-5-хлор-1Н-[1,2,3]триазол-4карбальдегіду (29,6г, 82,8ммоль) в THF (160мл). Перемішують одержаний розчин при кімнатній температурі протягом 2год, після чого виливають у холодну воду (500мл) і 1-н. НСl (150мл) та екстрагують EtOAc (3´200мл). Змішують органічні фази та промивають насиченим NaHCO3 (200мл) та розсолом (200мл), після чого сушать, фільтрують та концентрують. Очи щають неочищений матеріал розтиранням із сумішшю 30% діетилового ефіру з гексаном з одержанням вказаної в заголовку сполуки. MS (IS) 494,0 (M+1), MS (ES-) 492,0 (М-1); 1Н ЯМР (400МГц, CDCI3) d 7,87 (s, 1H), 7,79 (s, 2H), 7,47 (dd, 1H, J=1,9, 7,3), 7,37 (dd, 1H, J=1,4, 7,9), 7,25 (dt, 1H, J=2,0, 7,3), 7 ,19 (dt, 1H, J=1,5, 7,3), 5,92 (d, 1H, J=6,7), 5,62 (s, 2H), 2,79 (d, 1H, J=6,4). За методикою Підготовчого синтезу 99, із застосуванням придатного альдегіду, може бути одержана та виділена нижченаведена сполука. Підготовчий синтез 101 1-[1-(3,5-біс-трифторметил-бензил)-5-хлор-1Н-[1,2,3]триазол-4-іл]-3-(2-хлорфеніл)-пропінон Розчиняють 1-[1-(3,5-біс-трифторметил-бензил)-5-хлор-1Н-[1,2,3]триазол-4-іл]-3-(2-хлорфеніл)-проп-2ін-1-ол (33,5г, 67,8ммоль) у СН 2СІ2 (300мл) та додають МnО2 (50,0г, 556ммоль). Перемішують суміш при кімнатній температурі протягом ночі, після чого фільтрують через шар целіту та концентрують фільтрат. Очищають неочищений матеріал розтиранням із сумішшю 30% діетилового ефіру з гексаном. MS (IS) 492,1 (М+1). 1Н Я МР (400МГц, CDCI3) d 7,89 (s, 1Η), 7,81 (s, 2H), 7,47 (dd, 1H, J=1,5, 7,8), 7,46 (dd, 1H, J=1,4, 7,8), 7,40 (dt, 1H, J=1,5, 7,4), 7,29 (dt, 1H, J=1,5, 7,4), 5,68 (s, 2H). Підготовчий синтез 102 1-[1-(3,5-біс-трифторметил-бензил)-5-феніл-1Н-[1,2,3]триазол-4-іл]-3-(2-хлорфеніл)-пропінон Охолоджують розчин 1-хлор-2-етинілбензолу (4,0мл, 32,8ммоль) у безводному THF (25мл) в атмосфері азоту до 0°С. Додають за допомогою шприца етилмагнійбромід (3,0Μ в діетиловому е фірі, 9,7мл, 29,3ммоль) при перемішуванні. Через 30хв відстороняють льодяну баню, та додають за допомогою шприца розчин метокси-N-метиламіду 1-(3,5-біс-трифторметил-бензил)-5-феніл-1Н-[1,2,3]триазол-4-карбонової кислоти (10,73г, 23,4ммоль) в THF (35мл). Через 2год гасять насиченим водним розчином NH4CI та екстрагують етилацетатом, сушать над MgSO 4, фільтрують та концентрують у вакуумі. Очи щають хроматографією (силікагель, градієнт гексан/етилацетат) з одержанням вказаної в заголовку сполуки: MS (IS) 534,0 (М+1), 1Н Я МР (CDCI3): d 7,82 (s, 1Н), 7,56-7,12 (m, 11Н), 5,59 (s, 2H). За методикою Підготовчого синтезу 102, із застосуванням придатних вихідних матеріалів, одержані і виділені нижченаведені сполуки. Підготовчий синтез 107 [1-(3,5-біс-трифторметил-бензил)-5-феніл-1Н-[1,2,3]триазол-4-іл]-[5-(2-хлорфеніл)-3-(2,2-диметоксиетил)-ізоксазол-4-іл]-метанон Змішують 1-[1-(3,5-біс-трифторметил-бензил)-5-феніл-1Н-[1,2,3]триазол-4-іл]-3-(2-хлорфеніл)-пропінон (600мг, 1,126ммоль) та 40мл бензолу, додають 1,1-диметокси-3-нітропропан (253,2мг, 0,225мл, 1,689ммоль), 1,4-фенілендіізоціанат та 30 крапель триетиламіну (приблизно 0,25мл). Нагрівають суміш зі зворотним холодильником. Через 8год додають ще 500мг 1,4-фенілендіізоціанату та 200мг 1,1-диметокси3-нітропропрану, після чого 20 крапель триетиламіну. Продовжують нагрівання протягом ще 20год і потім охолоджують до кімнатної температури. Розбавляють суміш 1мл води, перемішують протягом 10хв, пропускають суміш через шар целіту (1см) та екстрагують тричі СН 2СІ2 (порціями по 100мл кожна) та один раз EtOAc (50мл). Сушать змішані органічні фази над MgSO4, фільтрують та концентрують. Очи щають хроматографією (силікагель, градієнт гексан/етилацетат) з одержанням 550мг вказаної в заголовку сполуки. MS (ASPCI): m/z=633,9 (М+1 (-ОМе)), 635,1 (М-1); 1Н ЯМР (250МГц, CDCI3) d 7,72 (s, 1Н), 7,59 (dd, J=6,2, 2,7Гц, 1H), 7,48-7,10 (m, 10H), 5,37 (s, 2H), 4,70 (t, J=6,2Гц, 1H), 3,41 (s, 6H), 3,70 (q, J=6,25Гц, 2H), 3,21 (s, 6H), 3,1-3,2 (m, 2H). За методикою Підготовчого синтезу 107, із застосуванням придатних вихідни х матеріалів, можуть бути одержані та виділені нижченаведені сполуки. Загальний Підготовчий синтез Η Розчиняють відповідний алкін (1екв.) у толуолі (0,1М) та обробляють розчин придатним нітроалкокситетрагідропіраном (5екв.), 1,4-діізоціанат-бензолом (5екв.) та триетиламіном (5екв.). Нагрівають розчин при 110°С протягом ночі, потім додають воду та фільтрують через шар целіту. Промивають тверду речовину EtOAc, і промивають фільтрат розсолом. Сушать, фільтрують та концентрують органічний розчин, і використовують матеріал без додаткового очищення. Розчиняють згаданий вище матеріал в Ме ОН (ОДМ) та обробляють АсОН або n-TsOH·H2O (2екв.). Перемішують розчин при кімнатній температурі протягом 18год. Концентрують розчин та повторно розчиняють неочищений матеріал в EtOAc. Промивають органічний розчин насиченим NaHCO3, після чого сушать, фільтрують та концентрують. Очи щають неочищений матеріал флеш-хроматографією з одержанням вказаної в заголовку сполуки. За методикою Загального Підготовчого синтезу Η одержані і виділені нижченаведені сполуки. Загальний Підготовчий синтез J Розчиняють придатний 5-хлортриазол (1екв.) у придатному аміні (20-120екв.) та перемішують при 80110°С. Згаданий амін може бути розчиненим у придатному розчиннику, наприклад, МеОН або THF. Через 220год розбавляють розчин EtOAc (25мл) та промивають 1-н. розчином НСl (20мл), водою (20мл), та насиченим NaHCO3 (20мл). Сушать, фільтрують та концентрують органічну фаз у, після чого очищають неочищений матеріал флеш-хроматографією. За методикою Загального Підготовчого синтезу J одержані і виділені нижченаведені сполуки. Загальний Підготовчий синтез K Розчиняють придатний захищений спирт (1екв.) в суміші THF, води та НОАс та нагрівають при 60°С. Перемішують 5-24год, концентрують у вакуумі, екстрагують ЕtOАс, промивають водою, насиченим водним розчином NaHCO3, розсолом, сушать (Na2SO4), фільтрують та концентрують у вакуумі. Очи щають хроматографією з одержанням вказаної в заголовку сполуки. За методикою Загального Підготовчого синтезу К одержані і виділені нижченаведені сполуки. Підготовчий синтез 134 [1-(3,5-біс-ірифторметил-бензил)-5-(1,1-діоксо-1l6-тіоморфолін-4-іл)-1Н-[1,2,3]іриазол-4-іл]-[5-(2хлорфеніл)-3-(2-гідрокси-етил)-ізоксазол-4-іл]-метанон Змішують [1-(3,5-біс-трифторметил-бензил)-5-(тіоморфолін-4-іл)-1Н-[1,2,3]триазол-4-іл]-[5-(2хлорфеніл)-3-гідроксиметил-ізоксазол-4-іл]-метанон (0,17г, 0,26ммоль) із дихлорметаном (3,0мл), додають 3-хлорпероксибензойну кислоту (0,12г, 0,50ммоль) та перемішують при кімнатній температурі. Через 2год розбавляють EtOAc, промивають 1-н. розчином NaOH, водою та розсолом, сушать, фільтрують та концентрують. Очищають флеш-хроматографією, використовуючи лінійний градієнт від 50% до 80% EtOAc в гексані з одержанням вказаної в заголовку сполуки. MS (IS) 678,0 (М+Н). 1Н ЯМР (400МГц, CD3COCD3) d 8,09 (s, 1H), 7,99 (s, 2H), 7,65 (m, 1H), 7,42 (m, 2H), 7,35 (m, 1H), 5,86 (s, 2H), 3,89 (m, 3H), 3,62 (m, 4H), 3,26 (m, 4H), 3,14 (m, 2H). Загальний Підготовчий синтез L Додають перйодатний реактив Десса-Мартіна (1,5екв.) до розчину придатного спирту (1екв.) у дихлорметані (0,05Μ-0,5Μ). Перемішують при 0°С протягом 30хв, потім при кімнатній температурі протягом 1-5год. Розбавляють діетиловим ефіром та промивають холодним 0,1-н. NaOH, водою та розсолом. Сушать, фільтрують та концентрують органічну фазу, і очищають неочищений матеріал флешхроматографією з одержанням вказаної в заголовку сполуки. За альтернативним варіантом, у атмосфері N2, завантажують у висушену в сушильній шафі колбу оксалілхлорид (2Μ в СН 2СІ2, 1,2екв.) та о холоджують на бані із сухим льодом та ацетоном. Повільно додають за допомогою шприца DMSO (3екв.) та перемішують 15хв. Повільно додають за допомогою шприца придатний спирт (1екв.), у безводному СН 2СІ2 (0,4М), та перемішують 1год. Повільно додають за допомогою шприца TEA (5екв.) та перемішують 2год, даючи о холоджувальній бані спонтанно нагріватися. Гасять Н2О, екстрагують діетиловим ефіром, сушать над MgSO4, фільтрують та концентрують у вакуумі з одержанням вказаної в заголовку сполуки. За методикою Загального Підготовчого синтезу L одержані і виділені нижченаведені сполуки. Загальний Підготовчий синтез Μ У посудині для роботи під тиском ацеталь, що становить інтерес (1екв.), розводять сумішшю оцтової кислоти/Н2О (2:1, 0,1М). Герметизують та нагрівають при 125°С протягом 48год. Концентрують, нейтралізують насиченим водним розчином NaНСО3, екстрагують етилацетат, суша ть над MgSO4, фільтрують та концентрують у вакуумі. За методикою Загального Підготовчого синтезу М, із застосуванням придатних вихідних матеріалів, одержані і виділені нижченаведені сполуки.
ДивитисяДодаткова інформація
Назва патенту англійськоюTriazole derivatives as tachykinin receptor antagonists
Автори англійськоюHembre, Erik, James, Hong Jian Eric, Remick David Michael
Назва патенту російськоюПроизводные триазола как антагонисты рецепторов тахикининов
Автори російськоюХембре Эрик Джеймз, Гонг Жан Эрик, Мехл Брайан Стефан, Ремик Дейвид Майкл
МПК / Мітки
МПК: A61P 25/18, C07D 413/14, A61P 25/00, A61K 31/437, C07D 417/14, A61P 43/00, A61K 31/541, C07D 401/14, A61K 31/501, A61K 31/4985, A61K 31/506, A61K 31/5377, A61P 1/04, A61P 25/24, A61K 31/4192, A61P 25/22, A61K 31/444, A61K 31/422, C07D 498/04, A61K 31/4196, C07D 249/08, A61P 25/04, A61K 31/4439, C07D 249/06, A61K 31/497, C07D 487/04, A61P 1/08, A61P 11/06, C07D 401/04, A61P 17/00, C07D 403/04, C07D 413/04, C07D 403/14, A61K 31/5025
Мітки: тахікінінів, триазолу, похідні, антагоністи, рецепторів
Код посилання
<a href="https://ua.patents.su/84-79113-pokhidni-triazolu-yak-antagonisti-receptoriv-takhikininiv.html" target="_blank" rel="follow" title="База патентів України">Похідні триазолу як антагоністи рецепторів тахікінінів</a>
Попередній патент: Пристрій для нанесення покриття на безперервнолиту металеву заготовку зануренням у металевий розплав
Наступний патент: Сепаратор
Випадковий патент: Спосіб одержання 13аlрhа-3-гідрокси-17-кетостероїдів андростанового ряду












