Сполуки піперазину та піперидину, спосіб їх одержання, фармацевтична композиція та спосіб лікування розладів цнс (варіанти)
Номер патенту: 72337
Опубліковано: 15.02.2005
Автори: Лонг Стівен К., Крузе Корнеліс Г., ван Шарренбург Густаф Й. М., ван дер Гейден Йоганнес А. М., Фенстра Рулоф В.
Формула / Реферат
1. Сполуки формули (І)
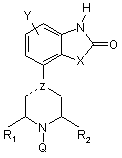 ,
,
де
Y - водень, галоген, алкіл(1-3С) або CN, СF3, ОСF3, SСF3, алкокси(1-3С), аміно або моно- чи діалкіл(1-3С)заміщений аміно або гідрокси,
X - O, S, SO aбo SO2,
---Z являє собою —С, =С або —N,
R1 та R2 незалежно один від одного - водень або алкіл(1-3С),
Q - бензил або 2-, 3- або 4-піридилметил, причому ці групи можуть бути заміщені
одним або кількома замісниками з групи галоген, нітро, ціано, аміно, моно- або (1-3С)алкіламіно, (1-3С)алкокси, СF3, ОСF3, 3СF3, (1-4С)алкіл, (1-3С)алкілсульфоніл або
гідрокси, та їхні солі й пролікарські препарати.
2. Сполуки за п. 1, де Y, R1 та R2 - водень, Х - кисень, Q - (заміщений) бензил, а ---Z має значення, наведені в п.1.
3. Сполуки за п. 1, де Q - бензил, а ---Z являє собою —N.
4. Спосіб одержання сполук за п.1 шляхом реакції сполуки формули (І), де Q - водень, зі сполукою формули Q-Hal, де Q має значення, наведене у п. 1, a Hal - галоген.
5. Фармацевтична композиція, що містить принаймні одну сполуку за п. 1 як діючу речовину.
6. Спосіб виготовлення фармацевтичної композиції, який відрізняється тим, що сполуці за п.1 надають форму, придатну для прийому.
7. Спосіб лікування розладів ЦНС, який відрізняється тим, що застосовують сполуку за п.1.
8. Спосіб лікування тривожних станів та/або депресій, який відрізняється тим, що застосовують сполуку за п.1.
9. Спосіб лікування хвороби Паркінсона, який відрізняється тим, що застосовують сполуку за п.1.
10. Спосіб лікування наркоманії, який відрізняється тим, що застосовують сполуку за п.1.
Текст
Винахід стосується нової групи похідних піперазину та піперідину, які посідають цікавих фармакологічних властивостей завдяки сполученню (часткового) агонізму до членів підродини рецепторів допаміну U2 та спорідненості до відповідних рецепторів серотонину та/або норадренергину. З ЕР 0189612 відомо, що похідні піперазину, у яких один атом азоту є заміщений фенілгетероциклічною групою, посідають психотропну активність. Далі, з ЕР 0190472 відомо, що бензофуран- та бензодіоксол-похідні піперазину, заміщені у іншому атомі азоту піперазинової групи, також посідають психотропну активність. Нарешті, з ЕР 0169148 відомі болезаспокійливі властивості 1,3-дігідро-4-(1-етил-1,2,3,6тетрагідропіридин-4-іл)-2Н-індол-2-ону та подібних сполук. Зараз несподівано встановлено, що невеличка група похідних піперазину та піперідину формули (І) (І) де Υ - водень, галоген, алкіл(1-3С), або CN, CF3, OCF3, SCF3, алкоксі(1-3С), амін або моно- чи діалкіл(13С)-заміщений амін або гідроксил, X - О, S, SO або SO2 -Ζ представляє -С, -С або -Ν, R1 та R2 незалежно один від одного представляють водень або алкіл(1-3С), Q - бензил або 2,3- або 4-піридилметил, причому ці групи можуть бути заміщені одним або кількома замінниками з групи галоген, нітро, ціано, аміно, моно- або (1-3С)алкіламін, (1-3С)алкоксі, CF3, OCF3, SCF 3, (1-4С)алкіл, (1-3С)алкілсульфонил або гідроксі та їхні солі й пролікарські препарати посідають сполучення (часткового) агонізму до членів підродини рецепторів допаміну D2 та спорідненості до відповідних рецепторів серотонину та/або норадренергину. Переважними сполуками за винаходом є сполуки формули (І), де Y, R 1 та R2 - водень, X представляє кисень, a -Z та Q мають вищенаведені значення, та їхні солі. Особлива перевага віддається сполукам, де Y, R1 та R2 - водень, X - кисень, -Z представляє -N, a Q бензил, можливо, заміщений. Сполуки за винаходом виявляють спорідненість до принаймні двох членів підродини рецепторів допаміну D2 (інтервал рКі 6,0-9,5) та рецепторів (інтервал рКі 5,0-8,0) серотонину (5-НТ1A, 5НТ5А, 5НТ7) та/або рецепторів норадренергину (&1, &2), замірюваних відомими методами (наприклад, Creese І., Schneider R. and Snyder S.H., [3Н]-Spiroperidol labels dopamine receptors in rat pitutiary and brain, Eur. J. Pharmacol. 1997, 46: 377-381 та Gozlan Η., El Mestikawy S., Pichat L., Glowinsky J. and Hamon M., 1983, Idetification of presynaptic serotonin autoreceptors using a new ligand 3H-РАТ, Nature 1983, 305: 140-142). Ці сполуки виявляють змінну активність у ролі (часткових) агоністів до членів підродини рецепторів допаміну D2 та, як не дивно, до рецептору серотонину 5-НТ1A та/або норадренергину &1. Ця активність в цілому вимірюється утворенням аденілатциклази у клітинних лініях, що відбивають ці клоновані рецептори (наприклад, рецептори людського D2 та рецептори 5-НТ1A, відбиті у клітинній лінії СНО за методами, що описані у Solomon Y., Landos С, Rodbell Μ., 1974, A highly selective adenylyl cyclase assay, Anal. Biochem. 1974, 58: 541-548 та Weiss S., Sebben M. And Bockaert J.J., Corticotropine-peptide regulation of intracellular cyclic AMP production in cortical neurons in primary culture, J. Neurochem. 1985, 45: 869-874). Унікальне сполучення (часткового) агонізму до членів підродини рецепторів допаміну D2 та спорідненості до відповідних рецепторів серотонину та/або норадренергину призводить до незвичайно широкого спектру дії у кількох моделях на тваринах, що дозволяє передбачити їхню активність при психічних та/або неврологічних розладах. Сполуки виявляють напрочуд високу ефективність у терапевтичній моделі анксіолітичноантидепресивної дії: моделі обумовленої ультразвукової вокалізації у щурів (див., наприклад, Molewijk Η.Ε., Van der Poel A.M., Mos J., Van der Heyden J.A.M. and Olivier B. (1995), Conditioned ultrasonic vocalizations in adult male rats as a paradigm for screening anti-panic drugs, Psychopharmacology 1995, 117: 32-40). Активність даних сполук у цієї моделі становила кілька мікрограмів на кг, що на багато порядків (від 100 до 3000 разів) вище у порівнянні з речовинами, описаними у ЕР 0190472 та ЕР 0398413. Крім того, ці сполуки виявляють дію у моделях, що дозволяють передбачити антидепресивну активність у більш високих дозах (тест вимушеного плавання, див., наприклад, Porsolt R.D., Anton G., Bla vet N. and Jalfre Μ., 1978, Behavioral espair in rats: A new model sensitive to antidepressant treatments, Eur. J. Pharmacol., 1978, 47: 379-391 та диференційоване підсилення слабких рівнів реагування у щурів, див., наприклад, McGuire P.S. and Seiden L.S., The effects of tricyclic antidepressants on performance under a differentialreinforcement-of-low-rate scheule in rats, J. Pharmacol. Exp. Ther., 1980, 214: 635-641). Залежно від ступеню часткового агонізму до підродини рецепторів допаміну ці сполуки поводяться або як повні агоністи рецепторів допаміну в моделі вимушеного лазання у мишів, або в присутності повного агоніста рецептора допаміну поводяться як антагоністи допаміну при, наприклад, викликаному апоморфіном лазанні у мишів (антагонізм до викликаного апоморфіном лазания у мишів, наприклад, Costall В., Naylor RJ. and Nohria V., Differential actions of typical and atypical agents on two behavioural effects of apomorphine in the mouse, Brit. J. Pharmacol., 1978, 63: 381-382; придушення локомоторної активності, наприклад, File S.E. and Hyde J.R.G., A test of anxiety that distinguishes between the actions of benzodiazepines and those of other minor tranquillisers or stimulants, Pharmacol. Biochem. Behav. 1979, 11: 65-69). Сполуки згідно з винаходом виявляють величезну ефективність у тваринних моделях, що дають змогу передбачати дію проти хвороби Паркінсона. Серед них можна зазначити викликану 6-OH-DA вертляву поведінку в щурів (Ungerstedt U., 6-OH-DA induced degeneration of central monoamine neurons, Eur. J. Pharmacol. 1968, 5: 107-110), виразки МФТП у мавп Мармосет (Nomoto M., Jenner P., Marsden C.D., The dopamine agonist D2 agonist LY 141865 but not the D 1 agonist SKF 38393, reverses Parkinsonism induced by 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine (MPTP) in the common Marmoset, Neurosci. Lett. (1985) 57: 37-41). Вражає та обставина, що сполуки за винаходом не дають небажаних бічних ефектів, як більшість відомих допамінергійних засобів, таких, як наведені стереотипи, нудота, запаморочення та блювання. Ці сполуки придатні до лікування розладів або хвороб центральної нервової системи, спричинених ураженнями допамінергійної, та/або серотонергійної, та/або норадренергійної систем, наприклад, наркоманії (в тому числі ломки), тривожних станів (наприклад, загальної збентеженості, паніки, нав'язливих примусових розладів), депресії, аутизму, шизофренії, хвороби Паркінсона, розладів розпізнавання та пам'яті. Кислотами, з якими сполуки за винаходом можуть утворювати прийнятні кислі солі, є, наприклад, соляна, сірчана, фосфорна, азотна та такі органічні кислоти, як лимонна, фумарова, малеїнова, винна, оцтова, бензойна, р-толуолсульфонова, метансульфонова та нафталінсульфонова. Пролікарські препарати - це похідні сполук формули (І), у котрих присутня група, яка легко видаляється після прийому. Прийнятні є такі, наприклад, пролікарські препарати, як сполуки, що містять одну з наступних груп: амідин, енамін, основи Манніха, похідні гідроксіметилену, похідні О(ацілоксіметиленкарбамату), карбамат або енамінон. Сполуки за винаходом та їхні солі можна переробляти на придатні до введення форми відомими способами з застосуванням допоміжних речовин, наприклад, рідких та твердих носіїв. Сполуки за винаходом можна одержувати способами, відомими для синтезу аналогічних сполук. Спосіб А Сполуки формули (І), де -Z представляє -N або -С, можна одержувати реакцією відповідної сполуки, де Q - водень, зі сполукою Q-Hal, де Q має вищенаведене значення, a Hal - галоген, переважно бром. Цю реакцію можна вести у розчиннику, наприклад, ацетонітрилі, у пристуності основи, наприклад, етилдіізопропиламіну або тріетиламіну. Вихідні сполуки, де Q - водень, a -Z -N, відомі або можуть бути одержані, як описано у ЕР 0189612. Вихідні сполуки, де Q - водень, a --Z -С, можна одержати, як описано нижче у схемі А.і (сполука ІІІ-Н). Спосіб В Сполуки В1, тобто ті сполуки формули (І), де -Z представляє =С, можна одержати за способом, наведеним нижче на схемі А.і: Вихідні сполуки для етапу (іі) можна одержати за методикою, описаною у J. Org. Chem. 45 (1980), 4789, а сам етап (іі) вести, як описано у J. Org. Chem. 47 (1982), 2804. Етап (ііі) провадиться за відомою схемою для цього типу хімічних реакцій. Винахід надалі пояснюється прикладами: Приклад 1 Загальна методика для способу А a) До 1ммоля галіду Q-Hal додають 0,8ммоля І-Н (---Ζ = -Ν), розчинених у 7,5мл СН 3CN. Потім додають 0,43мл (2,5ммоля) (i-Pr)2NEt і одержану суміш перемішують 3 години при 85°С. Після реакції суміш охолоджують до кімнатної температури, додають 7,5мл діхлорметану, одержаний розчин ставлять на твердофазну екстракційну колонку (Varian 5g type Si), після чого фракцію, що містить цільовий продукт, ставлять на твердофазну екстракційну колонку (Varian 5g 0,8мг-екв/г з могутнім катіонообмінником (SCX), кондиціоновану МеОН, додають СН 2СІ2, після чого колонку двічі промивають МеОН. Потім останню колонку промивають 0,1Μ NH3/MeOH та виконують елюювання 1,0М NН3/МеОН. Елюат концентрують у вакуумі, видаляючи розчинник, а залишок (i-Pr)2NEt дає цільовий продукт. Можливо також провадити очистку за стандартною хроматографічною методикою. В одному випадку (тобто А1) розчинником слугував діметилформамід (ДМФ) (див. далі). b) 10,2г І-НхНСI (40ммолів) суспендують у 150мл ДМФ, до одержаної суміші додають при перемішуванні 21мл (120ммолів) (i-Pr)2NEt. Протягом 10 хвилин додають розчин 7,0г (41ммоль) бензилбромиду в 25мл ДМФ при кімнатній температурі. Цей процес є трохи екзотермічний (5-10°С). Перемішування триває 3 години при кімнатній температурі, після чого реакційну суміш виливають до 700мл води. Далі провадять екстракцію 3x250мл етилацетату, органічні фракції зливають разом, промивають 2x250мл води та сушать на MgSO4. Після видалення сушильного агенту фільтрацією та розчинника у вакуумі одержують 10,5г сирого продукту. Останній очищують рідинною колонковою хроматографією (SiO2, елюент СН2СІ2/МеОН 98/2) та одержують 8,5г (вихід 69%) чистого продукту А1 у вигляді вільної основи з точкою топлення 189 190°С. Сполуки А2-А46, наведені у таблиці А, одержують за методикою а) способу А. Таблиця А d = розкладання fb = вільна основа Сполука А1 А2 A3 А4 А5 А6 А7 А8 А9 А10 A11 А12 А13 А14 А15 А16 А17 А18 А19 А20 А21 А22 А23 А24 А25 А26 А27 А28 А29 А30 А31 А32 А33 А34 А35 А36 A37 A38 А39 А40 А41 А42 А43 Гал Вr Вr Вr Вr Вr Вr Вr Вr Вr Вr Вr Вr СІ Вr Вr Вr Вr Вr Вr Вr Вr Вr Вr Вr Вr Вr Вr Вr Вr Вr Вr Вr CI Вr Вr Вr Вr Вr Вr Вr Вr Вr Вr сіль fb fb fb fb fb fb fb fb fb fb fb fb fb fb fb fb fb fb fb fb fb fb fb fb fb fb fb fb fb fb fb fb fb fb fb fb fb fb fb fb fb fb fb точка топлення °С 189-90 220-22 d 170-2 d 220-2 d 130-2 d 223-5 d 235-7 d 190-2 d 200-2 d 122-4 d >250 d 160-70 d 165-7 d 177-9 150-2 146-8 193-5 170-1 195-7 171-3 191-6 d 183-6 132-4 194-206 d 124-7 184-6 216-8 d 115-20 175-8 186-8 197-200 159-63 152-8 d 178-83 215-9 198-200 190-5 166-76 188-90 210-4 180-6 159-63 178-80 2 3 Вr F позиції заміщення 4 5 F F CN F 6 F OMe SO2 Me СІ F F Cl Me F SCF3 Cl Me Cl F Br Br F F OCF3 Cl Me OMe F OCF3 OMe F F F Cl CF3 F CF3 F tBut Cl CF3 F Me F Br Me CF3 Cl F CF3 F F CN Me Me Me CN CF3 СІ F F F F F СІ Таблиця А (продовження) Сполука А44 А45 Гал СІ СІ сіль fb fb точка топлення °С 188-90 d 175-9 Q 2-піридилметил 3-піридилметил А46 СІ fb 230-5 d 4-піридилметил Приклад 2 Етапи іі та iiі (схема А.і) В інертній атмосфері 16,5г (78,2ммоля) N-(трет-бутилоксікарбонил)-мета-фтораніліну розчинюють у 230мл сухого тетрагідрофурану (ТГФ), після чого розчин охолоджують до -75°С (суха крига, ацетон). Повільно додають з перемішуванням розчин трет-бутил-літію в гептані (біля 156ммолів, 2моль-еківалента), після чого реакційну суміш перемішують 0,5 години при -70°С и ще 2 години при -25°С. Знову охолоджують реакційну суміш до -75°С и додають розчин 14,4мл N-бензилпіперідону (78ммолів, 1моль-еквівалент) у 25мл сухого ТГФ. Реакційну суміш доводять до кімнатної температури та перемішують ще 16 годин. Після того обережно додають 250мл 2М НСI та тричі екстрагують одержану суміш EtOAc. Водн у фазу при перемішуванні виливають до 84г NаНСО3 і знов екстрагують EtOAc. Одержану органічну фазу суша ть на Na2SO4. Після видалення сушильного агенту фільтрацією та розчинника у вакуумі одержують 15г темножовтої олії. Останній очищують рідинною колонковою хроматографією (SiO2, елюент СН2СІ2/МеОН 9/1) і одержують 7,5г (ви хід 30%) світло-жовтої піни. 1г піни розтирають при перемішуванні з діетилетером та невеличкою кількістю EtOAc. Через 50 годин твердий матеріал відфільтровують І промивають діетилетер/гексаном, одержуючи 0,5г майже білої твердої речовини х1 з точкою топлення 125-128°С. Етап iv (схема А.і) 6,3г (19,4ммоля) х1 (схема) розчинюють з перемішуванням у 250мл діоксану, далі додають 150мл концентрованої НСI, одержану суміш нагрівають 1,5 години зі зворотним холодильником. Доводять суміш до кімнатної температури, після чого виливають її на 140г NaHCO3, потім додають біля 250мл EtOAc та достатню кількість води, щоб повністю розчинити тверду фаз у, при рН>7. Розділяють фази та двічі екстрагують водну фазу EtOAc. Три органічні фракції зливають разом та яка застигає, коли постоїть. Останню очищують рідинною колонковою хроматографією (SiO2, елюент EtOAc) і одержують 4,56г (вихід 30%) майже білого продукту. Його супендують у гексані та перемішують 20 годин. Фільтрацією та сушкою одержують 3,5г (вихід 59%) білої твердої речовини В1 у вигляді вільної основи з точкою топлення біля 153°С. Приклад 3 Приготування проміжного III-Н за схемою А.і 2,71г (8,9ммолів) В1 за схемою А.і розчинюють у 250мл абсолютного ЕtOН. До розчину додають 0,6г 20% Ρd(ΟΗ): (носій - вуглець), після чого гідрогенізують суміш 18 годин при кімнатній температурі. Далі реакційну суміш фільтрують на мембранному фільтрі типу Hуflо Supercel і осад промивають 97/3 метанол/триетиламіну. Фільтрат концентрують у вакуумі, одержані 1,87г майже білої твердої фази суспендують у ЕtOAc та перемішують 20 годин. Після фільтрації та сушки одержують 1,56г (вихід 81%) проміжною ІІІ-Н (схема А.і).
ДивитисяДодаткова інформація
Назва патенту англійськоюPyperazine and pyperadine compounds, a method for the preparation thereof, pharmaceutical composition and a method for the treatment of cns disorders (variants)
Автори англійськоюVeenstra Roelof W., Kruse Cornelis G., Kruse, Cornelis G.
Назва патенту російськоюСоединения пиперазина и пиперидина, способ их получения, фармацевтическая композиция и способ лечения расстройств цнс (варианты)
Автори російськоюФенстра Рулоф В., Крузе Корнелис Г.
МПК / Мітки
МПК: A61K 31/4523, A61P 25/24, A61P 25/22, A61P 25/30, C07D 413/04, A61K 31/496, A61P 25/16, A61P 25/00, C07D 263/58, A61P 43/00, C07D 413/12
Мітки: одержання, піперазину, цнс, спосіб, лікування, композиція, варіанти, піперидину, сполуки, розладів, фармацевтична
Код посилання
<a href="https://ua.patents.su/4-72337-spoluki-piperazinu-ta-piperidinu-sposib-kh-oderzhannya-farmacevtichna-kompoziciya-ta-sposib-likuvannya-rozladiv-cns-varianti.html" target="_blank" rel="follow" title="База патентів України">Сполуки піперазину та піперидину, спосіб їх одержання, фармацевтична композиція та спосіб лікування розладів цнс (варіанти)</a>
Попередній патент: Спосіб годівлі перепелів
Наступний патент: Автоматизована система тренування коней та спосіб автоматизованого тренування коней
Випадковий патент: П'єзоелектричний перетворювач механічних величин








