Антагоністи рецептора il-8
Формула / Реферат
1. Сполука відповідно до Формули (І):
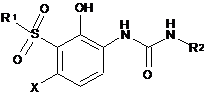 , (I)
, (I)
в якій
X вибраний з групи, що складається з галогену, С1-3алкілу, С1-3алкокси, ціано, CF3 і OCF3;
R2 вибраний з групи, що складається з С3-6циклоалкілу, фенілу й гетероарилу, причому феніл або гетероарил за необхідності заміщені одним або двома замісниками, незалежно вибраними з групи, що складається з С1-3алкілу, галогену, CF3, OCF3, фенілокси і бензилокси; або
R2 означає феніл, заміщений метилендіокси, або феніл, заміщений (дигалогензаміщеним)-метилендіокси;
R1 означає С4-8гетероцикліл(СН2)n-, в якому гетероцикліл являє собою 2-піролідиніл, 3-піролідиніл, 4-піперидиніл, 3-піперидиніл або 3-азетидиніл, причому кожна група за необхідності заміщена одним або двома замісниками, незалежно вибраними з групи, що складається зС1-3алкілу, C(O)OR4 і C(O)R5;
R4 і R5 незалежно означають С1-3алкіл;
n = 0 або 1; або
R1 вибраний з наступних кільцевих систем (а-k):
a)  , b)
, b) 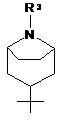 , c)
, c)  , d)
, d)  ,
,
e) 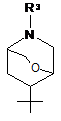 , f)
, f) 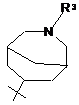 , g)
, g) 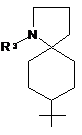 , h)
, h) 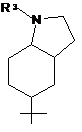 ,
,
i) 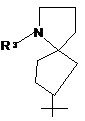 , j)
, j) 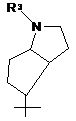 , k)
, k) 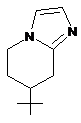 ;
;
R3 означає Н або С1-3алкіл;
або її фармацевтично прийнятна сіль.
2. Сполука за п. 1, у якій X означає галоген.
3. Сполука за п. 1, у якій X означає хлор.
4. Сполука за п. 1, у якій R2 означає феніл, за необхідності заміщений одним або двома замісниками, незалежно вибраними з групи, що складається з С1-3алкілу, галогену, OCF3 і фенілокси.
5. Сполука за п. 4, у якій R2 вибраний з групи, що складається з 3-фтор-2-метилфенілу, 2-трифторметилоксифенілу, 2-хлор-3-фторфенілу, 2-етилфенілу або 2-фенілоксифенілу.
6. Сполука за п. 5, у якій R2 означає 3-фтор-2-метилфеніл або 2-хлор-3-фторфеніл.
7. Сполука за п. 1, у якій R2 означає піридиніл, за необхідності заміщений одним атомом галогену.
8. Сполука за п. 7, у якій R2 означає 2-хлор-3-піридиніл.
9. Сполука за п. 1, у якій n = 0.
10. Сполука за п. 1, у якій n = 1 та R1 означає 2-піролідиніл або 3-піролідиніл.
11. Сполука за п. 1, у якій R1 означає 3-екзо-8-метил-8-азабіцикло[3.2.1]окт-3-ил або 3-екзо-8-азабіцикло[3.2.1]окт-3-ил.
12. Сполука за п. 1, вибрана з групи, що складається з:
N-(4-хлор-2-гідроксі-3-{[(3-екзо)-8-метил-8-азабіцикло[3.2.1]окт-3-ил]сульфоніл}феніл)-N'-(3-фтор-2-метилфеніл)сечовини;
N-[3-(3-азетидинілсульфоніл)-4-хлор-2-гідроксифеніл]-N'-(2-хлор-3-піридиніл)сечовини;
N-[3-(3-азетидинілсульфоніл)-4-хлор-2-гідроксифеніл]-N'-(2-хлор-3-фторфеніл)сечовини;
N-[3-(3-азетидинілсульфоніл)-4-хлор-2-гідроксифеніл]-N'-(3-фтор-2-метилфеніл)сечовини; або її фармацевтично прийнятна сіль.
13. Сполука за п. 1, вибрана з групи, що складається з:
N-{3-[(3-екзо)-8-азабіцикло[3.2.1]окт-3-илсульфоніл]-4-хлор-2-гідроксифеніл}-N'-(2-хлор-3-піридиніл)сечовини;
N-{3-[(3-екзо)-8-азабіцикло[3.2.1]окт-3-илсульфоніл]-4-хлор-2-гідроксифеніл}-N'-(3-фтор-2-метилфеніл)сечовини;
N-{3-[(3-екзо)-8-азабіцикло[3.2.1]окт-3-илсульфоніл]-4-хлор-2-гідроксифеніл}-N'-[2-(фенілокси)феніл]сечовини;
N-{3-[(3-екзо)-8-азабіцикло[3.2.1]окт-3-илсульфоніл]-4-хлор-2-гідроксифеніл}-N'-(2-хлор-3-фторфеніл)сечовини;
або її фармацевтично прийнятна сіль.
14. Сполука за п. 1, вибрана з групи, що складається з:
N-{4-хлор-2-гідрокси-3-[(3-піролідинілметил)сульфоніл]феніл}-N'-(3-фтор-2-метилфеніл)сечовини;
N-{4-хлор-2-гідрокси-3-[(3-піролідинілметил)сульфоніл]феніл}-N'-{2-[(трифторметил)окси]феніл}сечовини;
N-(2-хлор-3-фторфеніл)-N'-{4-хлор-2-гідрокси-3-[(3-піролідинілметил)сульфоніл]феніл}сечовини;
N-{4-хлор-2-гідрокси-3-[(3R)-3-піролідинілсульфоніл]феніл}-N'-(2-етилфеніл)сечовини;
N-{4-хлор-2-гідрокси-3-[(3R)-3-піролідинілсульфоніл]феніл}-N'-(2,2-дифтор-1,3-бензодіоксол-4-іл)сечовини;
N-{4-хлор-2-гідрокси-3-[(3R)-3-піролідинілсульфоніл]феніл}-N'-{2-[(трифторметил)окси]феніл}сечовини;
N-{4-хлор-2-гідрокси-3-[(3S)-3-піролідинілсульфоніл]феніл}-N'-(2-хлор-3-піридиніл)сечовини;
N-{4-хлор-2-гідрокси-3-[(3S)-3-піролідинілсульфоніл]феніл}-N'-(3-фтор-2-метилфеніл)сечовини;
N-{4-хлор-2-гідрокси-3-[(3R)-3-піролідинілсульфоніл]феніл}-N'-[2-(фенілокси)феніл]сечовини;
N-(2-хлор-3-фторфеніл)-N'-{4-хлор-2-гідрокси-3-[(3S)-3-піролідинілсульфоніл]феніл}сечовини;
N-(2-хлор-3-фторфеніл)-N'-{4-хлор-2-гідрокси-3-[(3R)-3-піролідинілсульфоніл]феніл}сечовини;
або її фармацевтично прийнятна сіль.
15. Сполука за п. 1, вибрана з групи, що складається з:
N-[4-хлор-2-гідрокси-3-(4-піперидинілсульфоніл)феніл]-N'-(2,2-дифтор-1,3-бензодіоксол-4-іл)сечовини;
N-[4-хлор-2-гідрокси-3-(4-піперидинілсульфоніл)феніл]-N'-(2-хлор-3-піридиніл)сечовини;
N-[4-хлор-2-гідрокси-3-(4-піперидинілсульфоніл)феніл]-N'-(2-етилфеніл)сечовини;
N-[4-хлор-2-гідрокси-3-(4-піперидинілсульфоніл)феніл]-N'-{2-[(трифторметил)окси]феніл}сечовини;
N-[4-хлор-2-гідрокси-3-(4-піперидинілсульфоніл)феніл]-N'-(3-фтор-2-метилфеніл)сечовини;
N-[4-хлор-2-гідрокси-3-(3-піперидинілсульфоніл)феніл]-N'-(2-етилфеніл)сечовини;
N-[4-хлор-2-гідрокси-3-(3-піперидинілсульфоніл)феніл]-N'-(2-хлор-3-піридиніл)сечовини;
N-[4-хлор-2-гідрокси-3-(3-піперидинілсульфоніл)феніл]-N'-{2-[(трифторметил)окси]феніл}сечовини;
N-[4-хлор-2-гідрокси-3-(4-піперидинілсульфоніл)феніл]-N'-[2-(фенілокси)феніл]сечовини;
4-{[6-хлор-3-({[(3-фтор-2-метилфеніл)аміно]карбоніл}аміно)-2-гідроксифеніл]сульфоніл}-1-піперидинетилкарбоксилату;
4-({6-хлор-2-гідрокси-3-[({[2-(фенілокси)феніл]аміно}карбоніл)аміно]феніл}сульфоніл)-1-піперидинетилкарбоксилату;
N-(2-хлор-3-фторфеніл)-N'-[4-хлор-2-гідрокси-3-(4-піперидинілсульфоніл)феніл]сечовини;
4-{[6-хлор-3-({[(2-хлор-3-фторфеніл)аміно]карбоніл}аміно)-2-гідроксифеніл]сульфоніл}-1-піперидинетилкарбоксилату;
N-{4-хлор-2-гідрокси-3-[(3S)-3-піперидинілсульфоніл]феніл}N'-(3-фтор-2-метилфеніл)сечовини;
N-{4-хлор-2-гідрокси-3-[(3S)-3-піперидинілсульфоніл]феніл}-N'-(2-хлор-3-піридиніл)сечовини;
N-(2-хлор-3-фторфеніл)-N'-{4-хлор-2-гідрокси-3-[(3S)-3-піперидинілсульфоніл]феніл}сечовини;
N-[4-хлор-2-гідрокси-3-(3-піперидинілсульфоніл)феніл]-N'-(3-фтор-2-метилфеніл)сечовини;
N-(2-хлор-3-фторфеніл)-N'-[4-хлор-2-гідрокси-3-(3-піперидинілсульфоніл)-феніл]сечовини;
N-[4-хлор-2-гідрокси-3-(3-піперидинілсульфоніл)феніл]-N'-(2,3-дихлорфеніл)сечовини;
N-{4-хлор-2-гідрокси-3-[(3S)-3-піперидинілсульфоніл]феніл}-N'-(2-хлор-3-піридиніл)сечовини;
або її фармацевтично прийнятна сіль.
16. Сполука за п. 1, вибрана з групи, що складається з:
N-{4-хлор-2-гідрокси-3-[(3S)-3-піперидинілсульфоніл]феніл}-N'-(3-фтор-2-метилфеніл)сечовини;
N-[4-хлор-2-гідрокси-3-(3-піперидинілсульфоніл)феніл]-N'-(3-фтор-2-метилфеніл)сечовини;
N-(2-хлор-3-фторфеніл)-N'-{4-хлор-2-гідрокси-3-[(3S)-3-піперидинілсульфоніл]феніл}сечовини;
N-(2-хлор-3-фторфеніл)-N'-(4-хлор-2-гідрокси-3-(3-піперидинілсульфоніл)феніл)сечовини;
або її фармацевтично прийнятна сіль.
17. Сполука за будь-яким з пп. 12-16, у якій фармацевтично прийнятна сіль є гідрохлоридом.
18. Сполука за п. 1, у якій фармацевтично прийнятна сіль вибрана з групи, яка включає гідрохлорид, гідробромід, сульфат, фосфат, метансульфонат, етансульфонат, ацетат, малат, тартрат, цитрат, лактат, оксалат, сукцинат, фумарат, малеат, бензоат, саліцилат, фенілацетат та манделат.
19. Сполука, вибрана з групи, що складається з:
N-{4-хлор-2-гідрокси-3-[(3S)-3-піперидинілсульфоніл]феніл}-N'-(3-фтор-2-метилфеніл)сечовини,
N-[4-хлор-2-гідрокси-3-(3-піперидинілсульфоніл)феніл]-N'-(3-фтор-2-метилфеніл)сечовини,
або її фармацевтично прийнятна сіль.
20. Сполука, вибрана з групи, що складається з:
N-{4-хлор-2-гідрокси-3-[(3S)-3-піперидинілсульфоніл]феніл}-N'-(3-фтор-2-метилфеніл)сечовини,
N-[4-хлор-2-гідрокси-3-(3-піперидинілсульфоніл)феніл]-N'-(3-фтор-2-метилфеніл)сечовини.
21. Сполука, що являє собою N-(2-хлор-3-фторфеніл)-N'-{4-хлор-2-гідрокси-3-[(3S)-3-піперидинілсульфоніл]феніл}сечовину або її фармацевтично прийнятну сіль.
22. Фармацевтична композиція, що містить сполуку за будь-яким з пп. 1 або 13-18 та фармацевтично прийнятний носій або розріджувач.
23. Фармацевтична композиція, що містить сполуку за будь-яким з пп. 19-21 та фармацевтично прийнятний носій або розріджувач.
24. Сполука за будь-яким з пп. 1 або 12-18 для застосування як активної терапевтичної речовини.
25. Сполука за будь-яким з пп. 1 або 12-18 для застосування в лікуванні опосередкованого хемокінами захворювання, де хемокін зв'язується з IL-8 α або β рецептором у людини.
26. Сполука за будь-яким з пп. 19-21 для застосування в лікуванні опосередкованого хемокінами захворювання, де хемокін зв'язується з IL-8 α або β рецептором у людини.
27. Сполука за будь-яким з пп. 1 або 12-18 для застосування в лікуванні захворювання, вибраного з групи, що складається з псоріазу, алергійного дерматиту, остеоартриту, ревматоїдного артриту, астми, хронічного обструктивного захворювання легень, респіраторного дистрес-синдрому дорослих, запального захворювання кишечнику, хвороби Крона, неспецифічного виразкового коліту, інсульту, септичного шоку, ендотоксичного шоку, грамнегативного сепсису, синдрому токсичного шоку, реперфузійного ушкодження серця і нирок, гломерулонефриту, тромбозу, реакції трансплантат проти хазяїна, хвороби Альцгеймера, відторгнення алотрансплантата, малярії, рестинозу, ангіогенезу, атеросклерозу, остеопорозу, гінгівіту, вірусних захворювань, таких як риновірусне захворювання, і небажаного вивільнення гематопоетичних стовбурових клітин.
28. Сполука за будь-яким з пп. 19-21 для застосування в лікуванні захворювання, вибраного з групи, що складається з псоріазу, алергійного дерматиту, остеоартриту, ревматоїдного артриту, астми, хронічного обструктивного захворювання легень, респіраторного дистрес-синдрому дорослих, запального захворювання кишечнику, хвороби Крона, неспецифічного виразкового коліту, інсульту, септичного шоку, ендотоксичного шоку, грамнегативного сепсису, синдрому токсичного шоку, реперфузійного ушкодження серця і нирок, гломерулонефриту, тромбозу, реакції трансплантат проти хазяїна, хвороби Альцгеймера, відторгнення алотрансплантата, малярії, рестинозу, ангіогенезу, атеросклерозу, остеопорозу, гінгівіту, вірусних захворювань, таких як риновірусне захворювання, і небажаного вивільнення гематопоетичних стовбурових клітин.
29. Застосування сполуки за п. 28, у якому захворювання вибране з групи, що складається з астми, хронічного обструктивного захворювання легень і респіраторного дистрес-синдрому дорослих.
30. Застосування за п. 29, у якому захворювання є хронічним обструктивним захворюванням легень.
31. Застосування сполуки за будь-яким з пп. 1 або 12-18 в одержанні лікарського засобу для застосування в лікуванні опосередковуваного хемокінами захворювання, де хемокін зв'язується з IL-8 α або β рецептором у людини.
32. Застосування за п. 31, де опосередковане хемокінами захворювання вибране з групи, що складається з псоріазу, алергійного дерматиту, остеоартриту, ревматоїдного артриту, астми, хронічного обструктивного захворювання легень, респіраторного дистрес-синдрому дорослих, запального захворювання кишечнику, хвороби Крона, неспецифічного виразкового коліту, інсульту, септичного шоку, ендотоксичного шоку, грамнегативного сепсису, синдрому токсичного шоку, реперфузійного ушкодження серця і нирок, гломерулонефриту, тромбозу, реакції трансплантат проти хазяїна, хвороби Альцгеймера, відторгнення алотрансплантата, малярії, рестинозу, ангіогенезу, атеросклерозу, остеопорозу, гінгівіту, вірусних захворювань, таких як риновірусне захворювання, і небажаного вивільнення гематопоетичних стовбурових клітин.
33. Спосіб синтезу сполуки за будь-яким з пп. 1 або 12-18, за яким:
a) сульфід відповідно до Формули (II):
 , (II)
, (II)
у якій R1 і X мають значення, визначені відповідно до Формули (І) у п. 1,
окислюють до сульфону відповідно до Формули (III):
 , (III)
, (III)
b) одержаний на попередній стадії сульфон гідролізують до амінофенолу відповідно до Формули (IV):
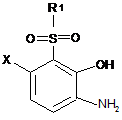 , (IV) і
, (IV) і
с) на одержаний на попередній стадії амінофенол діють ізоціанатом або попередником ізоціанату, що має формулу
R2C=N=O або R2CON3,
де R2 має значення, визначене для Формули (І), з одержанням сполуки формули (І), і приєднання до групи R1 і видалення від групи R1 кислотно-лабільної захисної групи в міру необхідності.
34. Сполука, вибрана з групи, що складається з:
Формули (II):
 , (ІІ)
, (ІІ)
Формули (III):
 , (ІІІ)
, (ІІІ)
Формули (IV):
 , (IV)
, (IV)
у яких R1 і X мають значення, визначені у Формулі (І) за п. 1.
35. Сполука, вибрана з групи, що складається з:
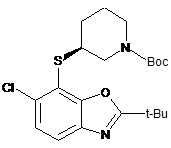 ;
; 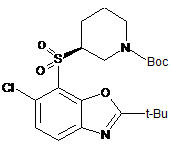 ;
; 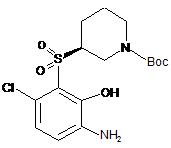 .
.
36. Сполука, вибрана з групи, що складається з:
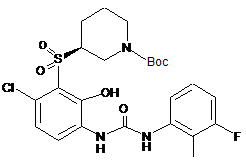 ;
;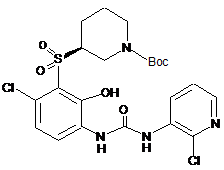 ;
;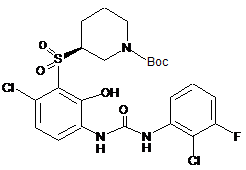 .
.
Текст
Реферат: Представлений винахід стосується сполук формули І O R1 S OH H N H N O X R2 O , (І) UA 98456 C2 (12) UA 98456 C2 способу їх одержання та проміжних сполук, а також фармацевтичних композицій на їх основі, що можуть застосовувати в лікуванні хворобливих станів, опосередкованих хемокіном – Інтерлейкін-8 (IL-8). UA 98456 C2 5 10 15 20 25 30 35 40 45 50 55 Цей винахід відноситься до нових сульфонових сполук, фармацевтичних композицій, способів їх одержання і їх застосування в лікуванні захворювань, опосередковуваних IL-8, GRO, GRO, GRO, NAP-2 і ENA-78. Стосовно Інтерлейкіну-8 (IL-8) використовували багато різних назв, таких як білок-1 атрактант/активатор нейтрофілів (NAP-1), моноцитарний хемотаксичний фактор нейтрофілів (MDNCF), нейтрофіл-активуючий фактор (NAF) і Т-лімфоцитарний хемотаксичний фактор. Інтерлейкін-8 є хемоатрактантом для нейтрофілів, базофілів та субпопуляції Т-клітин. Він продукується більшістю ядерних клітин, включаючи макрофаги, фібробласти, ендотеліальні й епітеліальні клітини, що піддані дії TNF, IL-1, IL-1 або LPS, і самими нейтрофілами під дією LPS або хемотаксичних факторів, таких як FMLP. M. Baggiolini et al., J. Clin. Invest. 84, 1045 (1989); J. Schroder et al, J. Immunol. 139, 3474 (1987) and J. Immunol. 144, 2223 (1990); Strieter, et al., Science 243, 1467 (1989) and J. Biol. Chem. 264, 10621 (1989); Cassatella et al., J. Immunol. 148, 3216 (1992). GRO, GRO, GRO і NAP-2 також належать до сімейства хемокінів . Як і IL-8, ці хемокіни також згадуються під різними назвами. Наприклад, GRO, , називають MGSA, , , відповідно (Melanoma Growth Stimulating Activity), див. Richmond et al., J. Cell Physiology 129, 375 (1986) і Chang et al., J. Immunol 148, 451 (1992). Усі хемокіни -сімейства, що містять ланку ELR, що безпосередньо передує ланці СХС, зв'язуються з IL-8 В рецептором (CXCR2). IL-8, GRO, GRO, GRO, NAP-2 i ENA-78 стимулюють безліч функцій in vitro. Було показано, що вони усі мають властивості хемоатрактантів у відношенні нейтрофілів, у той час як IL-8 і GRO демонстрували хемотактичну активність у відношенні Т-лімфоцитів і базофілів. Крім того, IL-8 може індукувати вивільнення гістаміну з базофілів і як у здорових, так і людей, що страждають на алергію. GRO- і IL-8 можуть, крім того, індукувати вивільнення лізосомальних ферментів і окисний вибух з нейтрофілів. Також було показано, що IL-8 збільшує поверхневу експресію Мас-1 (CD11b/CD18) на нейтрофілах без синтезу білка de novo. Це може сприяти посиленню адгезії нейтрофілів до клітин судинного ендотелію. Багато відомих захворювань характеризуються масивною інфільтрацією нейтрофілів. Як і IL-8, GRO, GRO, GRO і NAP-2 промотують акумуляцію й активацію нейтрофілів, ці хемокіни беруть участь у механізмі різноманітних гострих і хронічних запальних порушень, включаючи псоріаз і ревматоїдний артрит, Baggiolini et al., FEBS Lett. 307, 97 (1992); Miller et al., Crit. Rev. Immunol. 12, 17 (1992); Oppenheim et al., Annu. Rev. Immunol. 9, 617 (1991); Seitz et al., J. Clin. Invest. 87, 463 (1991); Miller et al., Am. Rev. Respir. Pis. 146, 427 (1992); Donnely et al., Lancet 341, 643 (1993). Крім того, хемокіни ELR (ті, які містять амінокислотну ланку ELR безпосередньо перед ланкою СХС) також беруть участь в ангіостазі, Strieter et al., Science 258. 1798 (1992). In vitro, IL-8, GRO, GRO, GRO і NAP-2 індукують зміну форми нейтрофілів, хемотаксис, вивільнення гранул і окисний вибух, зв'язуючись з рецепторами семітрансмембранного, Gбілок-зв'язаного сімейства й активуючи їх, особливо, зв'язуючись з рецепторами IL-8, особливо з рецептором IL-8 (CXCR2). Thomas et al., J. Biol. Chem. 266, 14839 (1991); і Holmes et al., Science 253, 1278 (1991). Має прецедент розробка непептидних маломолекулярних антагоністів членів цього сімейства рецепторів. Для огляду див. R. Freidinger у: Progress in Drug Research, Vol. 40, pp. 33-98, Birkhauser Verlag, Basel 1993. Отже, рецептор IL-8 являє собою багатообіцяючу мішень для розробки нових протизапальних засобів. Були охарактеризовані два високоафінних рецептори IL-8 людини (77 % гомології): CXCR1, що зв'язується тільки з IL-8 з високою спорідненістю, і CXCR2, що має високу спорідненість у відношенні IL-8, а також для GRO, GRO, GRO і NAP-2. Див. Holmes et al., вище; Murphy et al., Science 253, 1280 (1991); Lee et al., J. Biol. Chem. 267, 16283 (1992); LaRosa et al., J. Biol. Chem. 267, 25402 (1992); and Gayle et al., J. Biol. Chem. 268, 7283 (1993). Як і раніше існує потреба в лікуванні, у цій галузі, у сполуках, що є здатними до зв'язування з рецепторами CXCR1 і/або CXCR2. Тому стани, пов'язані зі збільшенням продукції IL-8 (який є відповідальним за хемотаксис нейтрофілів і субпопуляції Т-лімфоцитів в область запалення), очевидно, можуть виліковуватися за допомогою сполук, які є інгібіторами зв'язування рецептора IL-8. Даний винахід включає нові антагоністи рецептора IL-8, представлені Формулою (І), і композиції, що містять сполуки за винаходом і фармацевтично прийнятний носій або розріджувач. Даний винахід також включає нові антагоністи рецептора IL-8, представлені Формулою (І), і комбінації, що включають сполуки за винаходом й один або більше додаткових терапевтичних інгредієнтів. 1 UA 98456 C2 5 10 15 20 25 Даний винахід також включає спосіб лікування опосередковуваних хемокінами захворювань, причому, хемокіном є хемокін, що зв'язується з рецептором IL-8 або , і цей спосіб включає введення ефективної кількості сполуки Формули (І) або її фармацевтично прийнятної солі. Даний винахід також відноситься до способу інгібування зв'язування IL-8 на його рецепторах у ссавця, особливо у людини, який включає введення ефективної кількості сполуки Формули (І). Сполуки Формули (І), які можуть бути використані в даному винаході, представлені структурою: у якій X обраний з групи, що складається з галогену, С 1-3алкілу, С1-3алкокси, ціано, CF3 і OCF3; R2 обраний з групи, що складається з С3-6циклоалкілу, фенілу і гетероарилу, причому феніл або гетероарил за необхідності заміщені, один або два рази, незалежно, замісником, обраним з групи, що складається з С1-3алкілу, галогену, CF3, OCF3, фенілокси і бензилокси; або R2 означає феніл, заміщений метилендіокси або (дигалогензаміщеним)-метилендіокси; R1 означає С4-8гетероцикл(СН2)n, причому гетероцикл за необхідності заміщений, незалежно, один або два рази, замісником, обраним з групи, що складається з С 1-3алкілу, C(O)OR4 і C(O)R5; R4 і R5 незалежно означають С1-3алкіл; і n=0 або 1; або R1 обраний з наступних кільцевих систем (а-k): у яких R3 означає Н або С1-3алкіл; або їх фармацевтично прийнятна сіль. У рамках винаходу "С1-3алкіл" відноситься до прямої або розгалуженої насиченої вуглеводневої групи, що містить 1-3 атоми вуглецю. Приклади таких груп включають метил, етил, н-пропіл, або ізопропіл. 2 UA 98456 C2 5 10 15 20 25 30 35 40 45 50 У рамках винаходу "циклоалкіл" відноситься до насиченого моноциклічного вуглеводневого кільця з 3-6 атомів вуглецю. Приклади таких груп включають циклопропіл, циклобутил, циклопентил, циклогексил і т.п. У рамках винаходу "гетероцикл" відноситься до 4-8-членного насиченого або неароматичного ненасиченого моноциклічного кільця, що містить 1-3 гетероатоми, обрані з кисню, азоту або сірки. Приклади таких кілець включають піролідиніл, азетидиніл, піразолідиніл, піперидиніл, піперазиніл і т.п. У рамках винаходу "гетероарил" відноситься до 5-6 членного моноциклічного ароматичного кільця, що містить 1-3 гетероатоми, обрані з кисню, азоту і сірки. Приклади таких моноциклічних ароматичних кілець включають піридил, піроліл, піраніл, піразоліл, піримідил, піридазиніл, піразиніл і т.п. У рамках винаходу "галоген" відноситься до F, СІ, Вr або І. У рамках винаходу "С1-3алкокси" відноситься до прямої або розгалуженої алкокси-групи, що містить 1-3 атоми вуглецю. Прикладами алкокси, включених у рамки винаходу, є метокси, етокси, пропокси і проп-2-окси і т.п. У рамках винаходу "за необхідності заміщений", якщо не визначено специфічно, означає заміщений, незалежно в кожнім випадку, від одного до трьох разів такими групами, як галоген, С1-3алкіл, С1-3алкокси, гетероцикл, арил і гетероарил, так, що можливі замісники можуть бути також заміщені, за винятком галогену, від одного до трьох разів, незалежно, галогеном або С 12алкілом. Сполуки згідно із дійсним винаходом можуть містити один або більше асиметричних атомів вуглецю і можуть існувати в рацемічних і оптично активних формах. Усі ці сполуки і діастереомери знаходяться в рамках дійсного винаходу. Переважно, X вибирають з групи, що складається з галогену, С1-3алкілу, С1-3алкокси, ціано, CF3 і OCF3. В одному варіанті здійснення X означає галоген. В іншому варіанті здійснення X вибирають з групи, що складається з F, СІ і Вr. В іншому варіанті здійснення X означає СІ. Переважно, R2 вибирають з групи, що складається з С3-6циклоалкілу, фенілу і гетероарилу, причому феніл або гетероарил за необхідності заміщені, один або два рази, незалежно, замісником, обраним з групи, що складається з С1-3алкілу, галогену, CF3, OCF3, фенілокси і бензилокси; або R2 означає феніл, заміщений метилендіокси або (дигалогензамвщеним)-метилендіокси. В одному варіанті здійснення R2 означає феніл, за необхідності заміщений, незалежно, один або два рази замісником, обраним з групи, що складається з С 1-3алкілу, галогену, OCF3 або фенілокси. В одному варіанті здійснення R2 означає піридил, за необхідності заміщений один раз галогеном. В іншому варіанті здійснення R2 означає піридил, заміщений хлором. В іншому варіанті здійснення R2 означає феніл, заміщений дифторметилендіокси. В іншому варіанті здійснення R2 означає С3-6циклоалкіл. В іншому варіанті здійснення R2 означає галогенметилфеніл, тригалогенметилоксифеніл, дигалогенфеніл, етилфеніл або фенілоксифеніл. В іншому варіанті здійснення R2 означає 3-фтор-2-метилфеніл, 2-трифторметилоксифеніл, 2-хлор-3-фторфеніл, 2-етилфеніл або 2-фенілоксифеніл. В іншому варіанті здійснення R2 означає галогенпіридил. В іншому варіанті здійснення R2 означає 2-хлор-3-піридил. Переважно, R1 означає С4-8гетероцикл(СН2)n причому гетероцикл за необхідності заміщений, незалежно, кілька разів замісником, обраним з групи, що складається з С 1-3алкілу, C(O)OR4 і C(O)R5; і у якому R4 і R5 означають незалежно С1-3алкіл; і n=0 або 1; або R1 обраний з групи, що складається з наступних кільцевих систем (а-k): 3 UA 98456 C2 5 10 15 20 25 30 35 у яких R3 означає Н або С1-3алкіл. В одному варіанті здійснення R1 гетероцикл означає піролідиніл. В одному варіанті здійснення R1 гетероцикл обраний з групи, що складається з азетидинілу, піперидинілу і піролідинілу. В іншому варіанті здійснення R1 обраний з групи, що складається з піролідинілметилу, азетидинілу, піперидинілу, піролідинілу і етил-1-піперидинілкарбоксилату. В іншому варіанті здійснення R1 обраний з групи, що складається з 3-піролідинілметилу, 3азетидинілу, 4-піперидинілу, 3-піперидинілу, 3-піролідинілу і етил-1-піперидинілкарбоксилату. Переважно, n=0 або 1. В одному варіанті здійснення n=0. В іншому варіанті здійснення n=1. В одному варіанті здійснення R1 означає гетероцикл, обраний з групи, що складається з 2азабіцикло[2.2.1]гептилу, 8-азабіцикло[3.2.1]октилу, 8-метил-8-азабіцикло[3.2.1]октилу, 3азабіцикло[3.2.1]октилу, 2-азабіцикло[2.2.2]октилу і 2-окса-5-азабіцикло[2.2.2]октилу. В іншому варіанті здійснення R1 означає 3-екзо-8-метил-8-азабіцикло[3.2.1]окт-3-іл або 3екзо-8-азабіцикло[3.2.1]окт-3-іл. Придатні фармацевтично прийнятні солі відомі фахівцеві та включають основні солі неорганічних і органічних кислот, таких як соляна кислота, бромистоводнева кислота, сірчана кислота, фосфорна кислота, метансульфокислота, етансульфокислота, оцтова кислота, яблучна кислота, винна кислота, лимонна кислота, молочна кислота, щавлева кислота, бурштинова кислота, фумарова кислота, малеїнова кислота, бензойна кислота, саліцилова кислота, фенілоцтова кислота і мигдальна кислота. Крім того, фармацевтично прийнятні солі сполук Формули (І) можна також утворити з фармацевтично прийнятним катіоном, наприклад, якщо замісник включає карбоксильну групу. Придатні фармацевтично прийнятні катіони відомі фахівцеві та включають лужні, лужноземельні, амонієві та четвертинноамонієві катіони. Приклади сполук згідно з даним винаходом включають, але не обмежені ними: N-(4-хлор-2-гідрокси-3-{[(3-екзо)-8-метил-8-азабіцикло[3.2.1]окт-3-іл]сульфоніл}феніл)-N'-(3фтор-2-метилфеніл)карбамід; N-{4-хлор-2-гідрокси-3-[(3-піролідинілметил)сульфоніл]феніл}-N'-{2[(трифторметил)окси]феніл}карбамід; N-[3-(3-азетидинілсульфоніл)-4-хлор-2-гідроксифеніл]-N'-(2-хлор-3-піридиніл)карбамід; N-{4-хлор-2-гідрокси-3-[(3-піролідинілметил)сульфоніл]феніл}-N'-(3-фтор-2метилфеніл)карбамід; N-[3-(3-азетидинілсульфоніл)-4-хлор-2-гідроксифеніл]-N'-(2-хлор-3-фторфеніл)карбамід; 4 UA 98456 C2 5 10 15 20 25 30 35 40 45 50 55 N-[4-хлор-2-гідрокси-3-(4-піперидинілсульфоніл)феніл]-N'-(2,2-дифтор-1,3-бензодіоксол-4іл)карбамід; N-[3-(3-азетидинілсульфоніл)-4-хлор-2-гідроксифеніл]-N'-(3-фтор-2-метилфеніл)карбамід; N-[4-хлор-2-гідрокси-3-(4-піперидинілсульфоніл)феніл]-N'-(2-хлор-3-піридиніл)карбамід; N-{3-[(3-екзо)-8-азабіцикло[3.2.1]окт-3-ілсульфоніл]-4-хлор-2-гідроксифеніл}-N'-(2-хлор-3піридиніл)карбамід; N-(2-хлор-3-фторфеніл)-N'-{4-хлор-2-гідрокси-3-[(3піролідинілметил)сульфоніл]феніл}карбамід; N-[4-хлор-2-гідрокси-3-(4-піперидинілсульфоніл)феніл]-N'-(2-етилфеніл)карбамід; N-[4-хлор-2-гідрокси-3-(4-піперидинілсульфоніл)феніл]-N'-{2[(трифторметил)окси]феніл}карбамід; N-{4-хлор-2-гідрокси-3-[(3R)-3-піролідинілсульфоніл]феніл}-N'-(2-етилфеніл)карбамід; N-{3-[(3-екзо)-8-азабіцикло[3.2.1]окт-3-ілсульфоніл]-4-хлор-2-гідроксифеніл}-N'-(3-фтор-2метилфеніл)карбамід; N-{4-хлор-2-гідрокси-3-[(3R)-3-піролідинілсульфоніл]феніл}-N'-(2,2-дифтор-1,3-бензодіоксол4-іл)карбамід; N-[4-хлор-2-гідрокси-3-(4-піперидинілсульфоніл)феніл]-N'-(3-фтор-2-метилфеніл)карбамід; N-[4-хлор-2-гідрокси-3-(3-піперидинілсульфоніл)феніл]-N'-(2-етилфеніл)карбамід; N-[4-хлор-2-гідрокси-3-(3-піперидинілсульфоніл)феніл]-N'-(2-хлор-3-піридиніл)карбамід; N-[4-хлор-2-гідрокси-3-(3-піперидинілсульфоніл)феніл]-N'-{2[(трифторметил)окси]феніл}карбамід; N-{4-хлор-2-гідрокси-3-[(3R)-3-піролідинілсульфоніл]феніл}-N'-{2[(трифторметил)окси]феніл}карбамід; N-{4-хлор-2-гідрокси-3-[(3S)-3-піролідинілсульфоніл]феніл}-N'-(2-хлор-3-піридиніл)карбамід; N-{3-[(3-екзо)-8-азабіцикло[3.2.1]окт-3-ілсульфоніл]-4-хлор-2-гідроксифеніл}-N'-[2(фенілокси)феніл]карбамід; N-[4-хлор-2-гідрокси-3-(4-піперидинілсульфоніл)феніл]-N'-[2-(фенілокси)феніл]карбамід; 4-{[6-хлор-3-({[(3-фтор-2-метилфеніл)аміно]карбоніл}аміно)-2-гідроксифеніл]сульфоніл}-1піперидинетилкарбоксилат; N-{3-[(3-екзо)-8-азабіцикло[3.2.1]окт-3-ілсульфоніл]-4-хлор-2-гідроксифеніл}-N'-(2-хлор-3фторфеніл)карбамід; N-{4-хлор-2-гідрокси-3-[(3S)-3-піролідинілсульфоніл]феніл}-N'-(3-фтор-2метилфеніл)карбамід; 4-({6-хлор-2-гідрокси-3-[({[2-(фенілокси)феніл]аміно}карбоніл)аміно]феніл}сульфоніл)-1піперидинетилкарбоксилат; N-{4-хлор-2-гідрокси-3-[(3R)-3-піролідинілсульфоніл]феніл}-N'-[2-(фенілокси)феніл]карбамід; N-(2-хлор-3-фторфеніл)-N'-[4-хлор-2-гідрокси-3-(4-піперидинілсульфоніл)феніл]карбамід; 4-{[6-хлор-3-({[(2-хлор-3-фторфеніл)аміно]карбоніл}аміно)-2-гідроксифеніл]сульфоніл}-1піперидинетилкарбоксилат; N-(2-хлор-3-фторфеніл)-N'-{4-хлор-2-гідрокси-3-[(3S)-3піролідинілсульфоніл]феніл}карбамід; N-(2-хлор-3-фторфеніл)-N'-{4-хлор-2-гідрокси-3-[(ЗР)-3піролідинілсульфоніл]феніл}карбамід; N-{4-хлор-2-гідрокси-3-[(3S)-3-піперидинілсульфоніл]феніл}-N'-(3-фтор-2метилфеніл)карбамід; N-{4-хлор-2-гідрокси-3-[(3S)-3-піперидинілсульфоніл]феніл}-N'-(2-хлор-3-піридиніл)карбамід; N-(2-хлор-3-фторфеніл)-N'-{4-хлор-2-гідрокси-3-[(3S)-3піперидинілсульфоніл]феніл}карбамід; N-[4-хлор-2-гідрокси-3-(3-піперидинілсульфоніл)феніл]-N'-(3-фтор-2-метилфеніл)карбамід; N-(2-хлор-3-фторфеніл)-N'-[4-хлор-2-гідрокси-3-(3-піперидинілсульфоніл)феніл]карбамід; і N-[4-хлор-2-гідрокси-3-(3-піперидинілсульфоніл)феніл]-N'-(2,3-дихлорфеніл)карбамід; або їх фармацевтично прийнятну сіль. Переважно, сіль є гідрохлоридом. В одному варіанті здійснення сполуки згідно з даним винаходом включають, але не обмежені ними: N-[4-хлор-2-гідрокси-3-(4-піперидинілсульфоніл)феніл]-N'-(3-фтор-2-метилфеніл)карбамід; N-[4-хлор-2-гідрокси-3-(3-піперидинілсульфоніл)феніл]-N'-(2-хлор-3-піридиніл)карбамід; N-{4-хлор-2-гідрокси-3-[(3S)-3-піролідинілсульфоніл]феніл}-N'-(2-хлор-3-піридиніл)карбамід; N-[4-хлор-2-гідрокси-3-(4-піперидинілсульфоніл)феніл]-N'-[2-(фенілокси)феніл]карбамід; 5 UA 98456 C2 5 10 15 20 25 30 35 40 45 50 4-{[6-хлор-3-({[(3-фтор-2-метилфеніл)аміно]карбоніл}аміно)-2-гідроксифеніл]сульфоніл}-1піперидинетилкарбоксилат; N-{3-[(3-екзо)-8-азабіцикло[3.2.1]окт-3-ілсульфоніл]-4-хлор-2-гідроксифеніл}-N'-(2-хлор-3фторфеніл)карбамід; N-{4-хлор-2-гідрокси-3-[(3S)-3-піролідинілсульфоніл]феніл}-N'-(3-фтор-2метилфеніл)карбамід; 4-({6-хлор-2-гідрокси-3-[({[2-(фенілокси)феніл]аміно}карбоніл)аміно]феніл}сульфоніл)-1піперидинетилкарбоксилат; N-{4-хлор-2-гідрокси-3-[(3R)-3-піролідинілсульфоніл]феніл}-N'-[2-(фенілокси)феніл]карбамід; N-(2-хлор-3-фторфеніл)-N'-[4-хлор-2-гідрокси-3-(4-піперидинілсульфоніл)феніл]карбамід; 4-{[6-хлор-3-({[(2-хлор-3-фторфеніл)аміно]карбоніл}аміно)-2-гідроксифеніл]сульфоніл}-1піперидинетилкарбоксилат; N-(2-хлор-3-фторфеніл)-N'-{4-хлор-2-гідрокси-3-[(3S)-3піролідинілсульфоніл]феніл}карбамід; N-(2-хлор-3-фторфеніл)-N'-{4-хлор-2-гідрокси-3-[(3R)-3піролідинілсульфоніл]феніл}карбамід; N-{4-хлор-2-гідрокси-3-[(3S)-3-піперидинілсульфоніл]феніл}-N'-(3-фтор-2метилфеніл)карбамід; N-{4-хлор-2-гідрокси-3-[(3S)-3-піперидинілсульфоніл]феніл}-N'-(2-хлор-3-піридиніл)карбамід; N-(2-хлор-3-фторфеніл)-N'-{4-хлор-2-гідрокси-3-[(3S)-3піперидинілсульфоніл]феніл}карбамід; N-[4-хлор-2-гідрокси-3-(3-піперидинілсульфоніл)феніл]-N'-(3-фтор-2-метилфеніл)карбамід; N-(2-хлор-3-фторфеніл)-N'-[4-хлор-2-гідрокси-3-(3-піперидинілсульфоніл)феніл]карбамід; і N-[4-хлор-2-гідрокси-3-(3-піперидинілсульфоніл)феніл]-N'-(2,3-дихлорфеніл)карбамід; або їх фармацевтично прийнятну сіль. В іншому варіанті здійснення сполуки згідно з даним винаходом включають, але не обмежені ними: N-{3-[(3-екзо)-8-азабіцикло[3.2.1]окт-3-ілсульфоніл]-4-хлор-2-гідроксифеніл}-N'-(2-хлор-3фторфеніл)карбамід; N-{4-хлор-2-гідрокси-3-[(3S)-3-піперидинілсульфоніл]феніл}-N'-(3-фтор-2метилфеніл)карбамід; N-{4-хлор-2-гідрокси-3-[(3S)-3-піперидинілсульфоніл]феніл}-N'-(2-хлор-3-піридиніл)карбамід; N-(2-хлор-3-фторфеніл)-N'-{4-хлор-2-гідрокси-3-[(3S)-3піперидинілсульфоніл]феніл}карбамід; N-[4-хлор-2-гідрокси-3-(3-піперидинілсульфоніл)феніл]-N'-(3-фтор-2-метилфеніл)карбамід; N-(2-хлор-3-фторфеніл)-N'-[4-хлор-2-гідрокси-3-(3-піперидинілсульфоніл)феніл]карбамід; і N-[4-хлор-2-гідрокси-3-(3-піперидинілсульфоніл)феніл]-N'-(2,3-дихлорфеніл)карбамід; або їх фармацевтично прийнятну сіль. В іншому варіанті здійснення сполуки згідно з даним винаходом включають, але не обмежені ними: N-{4-хлор-2-гідрокси-3-[(3S)-3-піперидинілсульфоніл]феніл}-N'-(3-фтор-2метилфеніл)карбамід; N-{4-хлор-2-гідрокси-3-[(3S)-3-піперидинілсульфоніл]феніл}-N'-(2-хлор-3-піридиніл)карбамід; і N-(2-хлор-3-фторфеніл)-N'-{4-хлор-2-гідрокси-3-[(3S)-3піперидинілсульфоніл]феніл}карбамід; або їх фармацевтично прийнятну сіль. Способи одержання Сполуки за винаходом можуть синтезуватися способом, що включає стадії: А) окислювання сульфіду відповідно до Формули (II): до сульфону відповідно до Формули (III): 6 UA 98456 C2 B) гідроліз цього сульфону до амінофенолу відповідно до Формули (IV): 5 10 і C) дія на цей амінофенол ізоціанатом або попередником ізоціанату з одержанням кінцевого продукту. Даний винахід також включає нові проміжні сполуки, обрані з групи, що складається з Формул (II): (III): і (IV): 15 20 Сполуки Формули (І) можуть бути одержані з використанням процедур синтезу, деякі з яких проілюстровані нижче в Схемі 1. Синтез, передбачений у цих Схемах, може бути використаний для одержання сполук Формули (І), що мають різні групи, які вводять у реакцію, використовуючи додаткові замісники, які відповідно захищають, щоб домогтися сумісності з реакціями, описаними тут. Наступне видалення захисних груп, у цих випадках, потім призводить до сполук, що мають розкриту тут природу. Після формування карбамідного ядра інші сполуки цих формул можуть бути отримані з використанням стандартних методик взаємного перетворення функціональних груп, відомих з рівня техніки. 7 UA 98456 C2 де: а) арилфосфін, DMF; а1) і. ВuLi, ii. сірка; b) R1-LG, основа; с) окислювач; d) H2SO4 або НСІ; e) R2C=N=O або R2CON3 5 10 15 20 25 У прикладах, де R1 містять 3° або групу чи групи ароматичного аміну, сполуки Формули (І) можуть бути отримані відповідно до Схеми 1. Сульфоніл хлорид 1 (отриманий згідно WO01/68033A2, включеної в дійсний опис у відношенні розкриття одержання сполук відповідно до Схеми 1, 1) відновлюють до відповідного тіолу 2 у таких умовах, як трифенілфосфін в DMF. Альтернативно, сполука 2 може бути отримана гасінням відповідного аніону літію (див. WO01/68033A2, включену в дійсний опис у відношенні розкриття одержання сполук відповідно до Схеми 1, 1) сіркою (S8). Алкілування 2 потім здійснюють шляхом обробки з використанням R1-LG, де LG означає групу, що видаляється, таку як хлор, бром, йод або сульфонат, у присутності основи. Отримані сульфіди 3 потім окисляють до сульфонів 4 дією окислювача, такого як перекис водню. Гідроліз бензоксазольної групи приводить до амінофенолів 5, які, у свою чергу, піддають дії ізоціанату або придатного попередника ізоціанату, який може бути перетворений у ізоціанат in situ. Ця реакція приводить до кінцевого карбаміду 6. У випадках, коли R1 містить 1° або 2° амін, захищений групою Вос або подібною кислотнолабільною захисною групою, сполуки можуть бути отримані як показано в Схемі 2. Формування сульфону і гідроліз виконують як описано вище, однак, оскільки останній приводить до видалення групи Вос, вона повинна бути введена повторно, що може бути зроблено в придатних реакційних умовах, таких як Вос ангідрид і гідроксид натрію, призводячи до сполуки 5а. Після формування карбаміду групу Вос видаляють, одержуючи бажаний продукт 7 у кислих умовах, таких як 4н. соляна кислота в 1,4-діоксані. Нарешті, отриманий амін може бути далі перероблений за допомогою операції, відомої фахівцеві як відновне амінування, з одержанням 2° або 3° амінів 8. 8 UA 98456 C2 де: а) і) Н2SО4/водн. 1,4-діоксан; іі) NaOH, Boc2O; b) R2C=N=O або R2CON3; с) 4н. НСІ, 1,4діоксан; d) NaCNBH3, альдегід або кетон 5 10 15 20 25 30 35 Проміжні сполуки 4а, 5а, 6а, 7 і 8 являють собою нові проміжні сполуки в Схемі 2. Наступні приклади ілюструють винахід. Ці приклади не призначені для обмеження обсягу дійсного винаходу, а скоріше являють собою керівництво для фахівця з одержання і використання сполук, композицій і способів згідно із дійсним винаходом. Хоча описані конкретні варіанти здійснення дійсного винаходу, фахівцеві зрозуміло, що різні зміни і модифікації можуть бути зроблені без відходу від духу й обсягу винаходу. Усі посилання на ефір відносяться до простого діетилового ефіру; сольовий розчин відноситься до насиченого водного розчину NaCI, DCM відноситься до дихлорметану, THF відноситься до тетрагідрофурану, ЕtOАс відноситься до етилацетату, Hex і Нх відносяться до гексану, IMS відноситься до промислового метильованого спирту, ТВМЕ відноситься до простого mpem-бутил метилового ефіру, DMF відноситься до диметилформаміду, ВОС і Вос відносяться до трет-бутилоксикарбонілу. Якщо не зазначене інше, усі температури виражені в °С (градусах за шкалою Цельсія). Усі реакції проводять в інертній атмосфері при кімнатній температурі, якщо не зазначене інше. 1 Спектри Н ЯМР реєстрували на спектрометрі Jeol Delta2 (при 300 МГц). Хімічні зрушення виражені в частинах на мільйон (ррт, одиниці ). Структури розщеплення описують видимі мультиплетності та визначаються як s (синглет), d (дублет), t (триплет), q (квартет), quint (квінтет), m (мультиплет), br (широкий). Якщо не зазначене інше, "флеш" і "хроматографія на колонках" відносяться до флешхроматографії на колонці з силікагелем з використанням зазначених систем розчинників. Дані LC-MS були отримані або на РЕ Sciex Single Quadrupole LC/MS API-150, об'єднаному з системою LC Shimadzu (Контролер SCL-10A і подвійний УФ-детектор), або на Waters micromass ZQ, об'єднаному з модулем розділення Waters 2695. Вихідний матеріал 1: N-(3,4-дихлорфеніл)-2,2-диметилпропанамід: 3,4-дихлораніліну (150 г) розчиняли в 1,0 л ТВМЕ, і розчин охолоджували до 10 °C. Гідроксид натрію (140,7 г 30 %-ого водного розчину) додавали при механічному перемішуванні. Півалоїлхлорид (125,9 мл) додавали по краплинах, підтримуючи внутрішню температуру 35 °C. Після додавання температуру реакції підтримували рівною 30-35 °C ще 30 хв. Реакційній суміші потім давали остудитися до кімнатної температури і потім витримували при 0-5 °C протягом 1 години. Отриманий осад фільтрували і промивали 600 мл суміші вода/МеОН (90/10) і потім 900 мл води. Отриману тверду речовину висушували у вакуумній сушильній шафі при 55 °C 1 протягом 4 днів. Вихід: 162 г. Н-ЯМР (ДМСО-d6) 9,46 (s, 1H), 8,04 (d, J=2,4 Гц, 1Н), 7,65 (dd, J=9,0, 2,4 Гц, 1Н), 7,54 (d, J=9,0 Гц, 1Н), 1,22 (9Н, s). Вихідний матеріал 2: 9 UA 98456 C2 5 10 15 20 25 30 35 40 45 6-хлор-2-(1,1-диметилетил)-1,3-бензоксазол-7-сульфонілхлорид: N-(3,4-дихлорфеніл)-2,2-диметилпропанамід (121 г) розчиняли в 720 мл THF, і розчин охолоджували до -50 °C. Додавали бутиллітій (433 мл, 2,5н. у гексані), підтримуючи внутрішню температуру від -45 °C до -35 °C. (кінцева темп.: -35 °C). Витримували при -25 °C протягом 40 хв. Перевірка ВЕРХ реакційної суміші показала, що залишилося 5-10 % вихідного матеріалу. Додаткові 35 мл бутиллітію додавали при -30 °C, і реакційну суміш витримували при температурі від -30 до -25 °C протягом подальших 30 хвилин (ВЕРХ: ніяких значних змін). Реакційну суміш охолоджували до -45 °C і барботували SO2 через розчин до досягнення насиченості. Потім реакційну суміш перемішували при температурі від -10 до 0 °C протягом 45 хв. Через розчин барботували аргон (2 обсяги подвійного балону), після чого реакційну суміш охолоджували до -5 °C. Додавали сульфурилхлорид (58,8 мл), підтримуючи температуру нижче 22 °C. Потім реакційну суміш витримували при 10-15 °C протягом 1 години (ВЕРХ: повне завершення реакції). Додавали ЕtOАс, і суміш концентрували, промивали водою, насиченим водним бікарбонатом натрію і сольовим розчином, висушували над MgSO 4, і розчинник випарювали у вакуумі. Сирий матеріал кристалізували і розтирали з гарячим гексаном. Вихід: 1 87,2 г Н-ЯМР (ДМСО-d6) 7,60 (d, J=8,4 Гц, 1Н), 7,34 (d, J=8,4 Гц, 1Н), 1,43 (9H, s). Проміжна сполука 1: Вихідний матеріал 1, N-(3,4-дихлорфеніл)-2,2-диметилпропанамід (отриманий згідно WO01/68033A2, включеної в дійсний опис шляхом посилання у відношенні розкриття синтезу Вихідного матеріалу 1, також описаного вище) розчиняли в сухому THF (400 мл), потім охолоджували до -75 °C) в атмосфері аргону. n-BuLi (160 мл, 2,5М у гексані, 5 екв.) додавали по краплинах, підтримуючи температуру нижче -60 °C. Після додавання усього n-BuLi реакційну суміш перемішували при -5 °C протягом 1,5 год., потім охолоджували до -70 °C і додавали сірку ("квітки сірки") (13 г) з наступним перемішуванням при температурі від -70 °C до кімнатної температури протягом ночі. Після перемішування реакційної суміші при -10 °C розчин змінював колір з жовтого на коричнево/жовтогарячий. Реакційну суміш охолоджували до 0 °C, гасили 2н. розчином НСІ (200 мл) і перемішували протягом 10 хв. Органічний шар відокремлювали і підлужували 2н. розчином NaOH до рН 12-13, потім промивали ЕtOАс. Водний шар повторно підкисляли 2М розчином НСІ до рН приблизно 1 і екстрагували дихлорметаном (2Х), який промивали водою, висушували над Na2SO4 і концентрували. Сирий продукт очищали з використанням хроматографії на колонках 1:5 (ЕtOАс/Нех). Вихід: 6 г (30 %, жовтогаряче 1 масло). Н-ЯМР (CDCI3) 7,39-7,30 (m, 2Н), 4,08 (s, 1H), 1,50 (9Н, s). Альтернативно, Проміжну сполуку 1 одержували в такий спосіб: Трифенілфосфін (89 г) розчиняли в DCM (200 мл) і DMF (2,2 мл). Розчин охолоджували у ванні лід/метанол до -1 °C. До цього додавали розчин 6-хлор-2-(1,1-диметилетил)-1,3бензоксазол-7-сульфонілхлориду, Вихідного матеріалу 2 (отриманого згідно WO01/68033A2, включеної в дійсний опис шляхом посилання у відношенні розкриття синтезу Вихідного матеріалу 2, також описаного вище) (35 г) в DCM (100 мл) за 30 хвилин, підтримуючи температуру нижче 15 °C. Реакційну суміш перемішували при кімнатній температурі в атмосфері азоту протягом 18 годин. Реакційну суміш гасили, використовуючи 2н. соляну кислоту (200 мл). Фази розділяли, і органічну фазу упарювали у вакуумі. Залишок суспендували в 2н. гідроксиді натрію (400 мл) і швидко перемішували протягом 3 годин. Тверду речовину видаляли фільтрацією і промивали водою. Об'єднані фільтрат і змиви охолоджували у ванні з льодом/водою і підкисляли з використанням 5н. соляної кислоти до ~рН 1. Екстрагували, використовуючи ТВМЕ (400 мл). Органічну фазу висушували над сульфатом магнію й упарювали у вакуумі, одержуючи Проміжну сполуку 1 (22,85 г) у формі твердої речовини коричневого кольору. Проміжна сполука 2: (загальна процедура А) 50 10 UA 98456 C2 5 10 15 20 25 30 35 До суспензії (R)-(+)-3-гідроксипіперидингідрохлориду (1 г) в DCM (20 мл) додавали Et 3N (3,04 мл), потім ВОС2О (1,75 г) при 0 °C, і залишали на вихідні. Додавали воду (50 мл) і екстрагували DCM (100 мл). Об'єднані органічні фази промивали водою (2×50 мл), потім сольовим розчином (50 мл), висушували (Na2SO4) і концентрували. Залишок хроматографували на колонці (флеш, 1 елюювання з градієнтом 0-10 % MeOH/DCM). Вихід: 1,55 г. Н-ЯМР (CDCI3) 3,74-3,69 (2Н, m), 3,56-3,48 (1Н, m), 3,18-3,03 (2Н, m), 1,92-1,83 (1Н, m), 1,79-1,71 (2Н, m), 1,55-1,45 (1Н, m), 1,43 (9Н, s). Проміжна сполука 3: (загальна процедура В) До розчину Проміжної сполуки 2 (1 г) у DCM (10 мл) додавали Et 3N (1,38 мл), потім по краплинах при 0 °C MsCI (0,46 мл). Після перемішування при 0 °C протягом 1 години реакційну суміш нагрівали при кімнатній температурі, гасили водою (10 мл) і розділяли. Водний шар екстрагували DCM (2×20 мл). Об'єднані органічні фази промивали водою (40 мл), додавали 1 лопатку кремнезему, висушували (NaSO4) і концентрували. Вихід: 1,4148 г. Н-ЯМР (CDCI3) 4,71 (1Н, br s), 3,62 (2Н, br d), 3,49-3,27 (2Н, m), 3,04 (3Н, s), 2,01-1,76 (3Н, m), 1,79-1,71 (2Н, m), 1,55-1,45 (1Н, m), 1,45 (9Н, s). Проміжна сполука 4: (загальна процедура С) До суспензії NaH (0,30 г) в THF (20 мл) додавали по краплинах Проміжну сполуку 1 (використовуючи Вихідний матеріал 1) (1,22 г). Після перемішування протягом 1 години додавали Проміжну сполуку 3 (1,41 г) в THF, і реакційну суміш нагрівали при 80 °C і залишали протягом ночі. Реакційну суміш охолоджували до кімнатної температури, потім гасили водним насиченим NаНСО3 (50 мл). Реакційну суміш екстрагували DCM (2×50 мл). Об'єднані органічні фази промивали водою (100 мл), висушували (NaSO4) і концентрували. Залишок 1 хроматографували на колонці (флеш, 20 % EtOAC/Нх, силікагель). Вихід: 946,9 мг. Н-ЯМР (CDCI3) 7,50 (d, J=7,9 Гц, 1Н), 7,38 (d, J=7,9 Гц, 1Н), 3,82 (d, J=13,4 Гц, 1Н), 3,55-3,45 (m, 1H), 3,00-2,80 (m, 2H). Проміжна сполука 5: (загальна процедура D) До розчину Проміжної сполуки 4 (946,9 мг) в DCM (10 мл) додавали при -10 °C mСРВА (2,31 г) в DCM (10 мл). Реакційну суміш перемішували при -10 °C протягом 1 год., потім нагрівали до кімнатної температури. Реакційну суміш гасили водним насиченим NaHCO 3 (50 мл), потім екстрагували DCM (2×70 мл). Об'єднані органічні фази промивали водою (50 мл), висушували (Na2SO4) і концентрували. Залишок хроматографували на колонці (флеш, 30 % ЕtOАс/Нх, + силікагель). Вихід: 353,6 мг (35 %, жовте масло). MS (m/z, ES , M+H): 457,08. Проміжна сполука 6: (загальна процедура Е) 11 UA 98456 C2 5 10 15 20 25 30 35 До розчину Проміжної сполуки 5 (353 мг) в IMS (5 мл) додавали водний концентрований розчин НСІ (5 мл). Реакційну суміш нагрівали до 80 °C і залишали на ніч. Реакційну суміш охолоджували до кімнатної температури і концентрували, щоб видалити IMS. Залишок підлужували до рН 12 водним насиченим NaOH, додавали при 0 °C ЕtOАс (30 мл), ВОС2О (1 екв., 0,17 г) і залишали на ніч. Реакційну суміш розділяли, і водний шар екстрагували ЕtOАс (2×30 мл). Об'єднані органічні фази висушували (Na2SO4) і концентрували. Залишок хроматографували на колонці (флеш, елюювання з градієнтом 10 %-30 % ЕА/Нх). Вихід: + Виділяли дві фракції, які містять продукт: 58,0 мг і 180,9 мг. MS (m/z, ES , M+H): 291,01. Проміжна сполука 7: (загальна процедура F) 3-фтор-2-метиланілін (7,4 г) розчиняли в DCM (220 мл) при кімнатній температурі в атмосфері аргону. Після охолодження до 0 °C додавали водний насичений NaНСО3 (220 мл), потім трифосген (5,85 г). Реакційну суміш перемішували при 0 °C протягом 1 год. Після цього часу продукт екстрагували DCM (2×50 мл). Органічні фракції поєднували, висушували над MgSO4 і розчинник видаляли у вакуумі, одержуючи жовте масло. Додавання гексану приводило до осадження білої солі, яку відфільтровували. Видалення гексану у вакуумі привело до 1 жовтого масла (7,69 г, 86 %). Н-ЯМР (CDCI3) 7,09 (dd, 1Н), 6,92-6,85 (m, 2Н), 2,24 (s, 3Н). Проміжна сполука 8: (загальна процедура G) До розчину Проміжної сполуки 6 (60 мг) в DCM (3 мл) додавали Проміжну сполуку 7 (70 мг) і реакційну суміш залишали на вихідні. Реакційну суміш концентрували і залишок хроматографували на колонці (флеш, елюювання з градієнтом 20 %-30 % ЕtOАс/Нх). Вихід: 56,2 + мг. MS (m/z, ES , M+H): 542,01. Приклад 1: N-{4-хлор-2-гідрокси-3-[(3S)-3-піперидинілсульфоніл]феніл}-N'-(3-фтор-2метилфеніл)карбамід (загальна процедура Н) Проміжну сполуку 8 (56,2 мг) і 4н. НСІ/діоксан (3 мл) перемішували разом при кімнатній температурі і залишали на ніч. Проміжні сполуки 6, 5, 4, 3 і 2 одержували, як описано вище. Проміжну сполуку 1 одержували, використовуючи Вихідний матеріал 1, для того, щоб синтезувати Приклад 1. Реакційну суміш концентрували, і залишок розчиняли в мінімальній кількості МеОН, і додавали Et2O. Одержували тверду речовину, яку відфільтровували і висушували. Сирий вихід: 28,4 мг. Сирий продукт розчиняли в мінімальній кількості МеОН і додавали Et2O. Одержували тверду речовину, розчинник декантували, і тверду речовину + висушували. Вихід: 18,8 мг. MS (m/z, ES , M+H): 441,98. ЯМР (MeOD) 8,40 (1H, d, ArH), 7,46 (1H, d, ArH), 7,19-7,15 (2Н, m, ArH), 6,85 (1Н, t, ArH). 4,14 (1Н, dt, CH), 3,66 (1Н, dd, CH), 3,37 (2Н, d, СН2), 3,04 (1Н, dt, CH), 2,19 (3Н, S, АrСН3), 2,14-1,69 (4Н, гл, 2×СН2). Проміжна сполука 9: 12 UA 98456 C2 5 10 15 20 25 30 Трифосген (7,7 г) в DCM (40 мл) додавали при 0 °C до 3-аміно-2-хлорпіридину (10 г) в DCM (200 мл) і насиченому водному NaCHO3 (200 мл). Реакційну суміш перемішували протягом 1 год. Потім продукт екстрагували DCM (2×50 мл), висушували над Na 2SO4 і розчинник видаляли у вакуумі, одержуючи тверду речовину брудно-білого кольору. Розтирання з гексаном з наступною фільтрацією твердих частинок і видаленням розчинника з елюенту привело до продукту у формі безбарвного масла. Після промивання продукту аргоном і поміщення його в 1 рефрижератор, одержували кристалічну тверду речовину білого кольору (6 г). Н-ЯМР (CDCI3) 8,22 (br s, 1Н), 7,45 (d, 1Н), 7,27-7,20 (m, 1Н). Проміжна сполука 10: До розчину Проміжної сполуки 6 (60 мг) в DCM (3 мл) додавали Проміжну сполуку 9 (71 мг) і реакційну суміш залишали на вихідні. Реакційну суміш концентрували і залишок хроматографували на колонці (флеш, 20-30 % ЕtOАс/Нх, силікагель). Вихід: 60,0 мг. MS (m/z, + ES , M+H): 544,97. Приклад 2: N-{4-хлор-2-гідрокси-3-[(3S)-3-піпeридинілсульфоніл]фeніл}-N'-(2-хлор-3піридиніл)карбамід Проміжну сполуку 10 (60 мг) і 4н. НСІ/діоксан (3 мл) перемішували разом при кімнатній температурі і залишали на ніч. Проміжні сполуки 6, 5, 4, 3 і 2 одержували як описано вище. Проміжну сполуку 1 одержували, використовуючи Вихідний матеріал 1 для того, щоб синтезувати Приклад 2. Реакційну суміш концентрували, і залишок розчиняли в мінімальній кількості МеОН, і додавали ЕtOАс. Одержували тверду речовину, розчинник декантували, і + тверду речовину висушували. Вихід: 9,1 мг. MS (m/z, ES , M+H): 444,91. ЯМР (MeOD) 8,57 (1H, dd, ArH), 8,45 (1H, d, ArH), 8,04 (1Н, dd, ArH), 7,35 (1Н, dd, ArH), 7,19 (1H, d, ArH), 4,17-4,09 (1H, m, CH), 3,64 (1H, dd, CH), 3,39-3,33 (2H, m, CH2), 3,05 (1H, dt, CH), 2,15-1,74 (4H, m, 2×СН2). Проміжна сполука 11: До розчину Проміжної сполуки 6 (60 мг) в DCM (3 мл) додавали 2-хлор-3фторфенілізоціанат (79 мг) і реакційну суміш залишали на вихідні. Реакційну суміш концентрували і залишок хроматографували на колонці (флеш, елюювання з градієнтом 0-30 % + ЕtOАс/Нх). Вихід: 71,2 мг. Rf: 0,51 (50 % ЕА/Нх). MS (m/z, ES , М+Н): 561,95. Приклад 3: N-(2-хлор-3-фторфеніл)-N'-{4-хлор-2-гідрокси-3-[(3S)-3піперидинілсульфоніл]феніл} карбамід 13 UA 98456 C2 5 10 Проміжну сполуку 11 (71,2 мг) і 4н. НСІ/діоксан (3 мл) перемішували разом при кімнатній температурі і залишали на ніч. Проміжні сполуки 6, 5, 4, 3 і 2 одержували як описано вище. Проміжну сполуку 1 одержували, використовуючи Вихідний матеріал 1 для того, щоб синтезувати Приклад 3. Реакційну суміш концентрували і залишок розчиняли в мінімальній кількості МеОН і додавали Et2O. Одержували тверду речовину, яку відфільтровували і + висушували. Вихід: 50,1 мг (тверда речовина брудно-білого кольору). MS (m/z, ES , M+H): 461,96. ЯМР (MeOD) 8,42 (1Н, d, АrН), 7,93 (1Н, d, АrН), 7,26 (1Н, dt, АгН), 7,18 (1Н, d, АrН), 6,95 (1Н, dt, АrН), 4,21-4,11 (1Н, m, СН), 3,66 (1Н, dd, СН), 3,39-3,31 (2Н, m, СН2), 3,03 (1Н, dt, СН), 2,17-1,72 (4Н, m, 2×СН2). 14 UA 98456 C2 Проміжна сполука 18: 5 Два завантаження 2,2-дифтор-1,3-бензодіоксол-4-аміну (1 г і 3,58 г) обробляли трифосгеном (566 мг і 2,04 мг) і насиченим водним NaHCO 3 (20 мл і 80 мл) в DCM (20 мл і 80 мл) відповідно до процедури, описаної для Проміжної сполуки 9, одержуючи 3,27 г бажаного продукту після 1 об'єднання 2 завантажень. Н-ЯМР (CDCI3) 7,05 (t, 1Н), 6,90 (d, 1H), 6,82 (d, 1H). Проміжну сполуку 1 одержували, використовуючи Вихідний матеріал 1 для всіх синтезів. 10 15 UA 98456 C2 16 UA 98456 C2 17 UA 98456 C2 Проміжна сполука 19: 18 UA 98456 C2 5 10 15 20 25 30 N-BOC-нортропінон (6,3 г) розчиняли в МеОН (150 мл) і охолоджували до 0 °C. NaBH4 додавали частинами, і реакційну суміш перемішували при 0 °C протягом 2,5 год. Реакційну суміш гасили водою, підкисляли до рН3 і екстрагували DCM (×3). Об'єднані органічні шари висушували над Na2SO4 і концентрували, одержуючи бажаний продукт (5,0 г, 79 %, тверда речовина білого кольору). Rf: 0,38 (ЕtOАс/Нх: 1/1). Проміжна сполука 20: Проміжну сполуку 19 одержували з Проміжної сполуки 18 і Проміжної сполуки 1 (з використанням Вихідного матеріалу 1) відповідно до загальних процедур В, С, D і Е. Загальний + вихід: 29 %, MS (m/z, ES , M+H): 316,99. Проміжна сполука 21: У круглодонну колбу на 100 мл в атмосфері аргону додавали (R)-(-)-N-BOC-3-піролідинол (1,5 г). Потім додавали СВr4 (1,5 г), потім сухий THF (50 мл), і суміш охолоджували до 5 °C. Потім додавали PPh3 за 5 хвилин і розвиток реакції відслідковували за допомогою TLC. Тверду речовину видаляли фільтрацією і промивали ефіром. Фільтрат концентрували й очищали хроматографією на колонках з елююванням 1:3 ЕtOАс:Нх. Вихід: 2,3 г (>100 %, 1 використовуваних без подальшого очищення). Н-ЯМР (CDCl3) 4,48 (br s, 1Н), 3,82-3,65 (m, 2H), 3,62-3,46 (m, 2Н), 2,38-2,18 (m, 2H), 1,46 (s, 9H). Проміжна сполука 22: (загальна процедура І) Проміжну сполуку 1 (1,0 г), Проміжну сполуку 21 (1,24 г), і K 2СО3 (0,49 г) в метилетилкетоні (10 мл) перемішували при кімнатній температурі протягом ночі. Проміжну сполуку 1 одержували, використовуючи Вихідний матеріал 1. Реакційну суміш гасили водою, екстрагували ЕtOАс, і органічні шари висушували над Na2SO4 і концентрували. Сирий продукт очищали хроматографією на колонках з елююванням 1:4 ЕtOАс:Нх. Вихід: 0,60 г (36 %, коричневе масло). 1 Н-ЯМР (СОСІ3) 7,53 (d, J=8,3 Гц, 1Н), 7,39 (d, J=8,3 Гц, 1Н), 4,15-4,05 (m, 1Н), 3,70-3,50 (m, 2Н), 3,50-3,27 (m, 2Н), 2,28-2,10 (m, 1Н), 1,90-1,77 (m, 1Н), 1,47 (s, 9H), 1,44 (s, 9H). Проміжна сполука 23: 19 UA 98456 C2 5 10 15 20 25 30 Проміжну сполуку 22 (0,40 г) перемішували в DCM (4 мл) при -10 °C і додавали mСРВА (0,68 г). Отриману суміш перемішували при -10 °C протягом 30 хв. Реакційну суміш гасили розчином NaНСО3, екстрагували DCM, промивали водою. Органічні шари висушували над Na2SO4, концентрували й очищали хроматографією на колонках з елююванням 1:3 ЕtOАс:Нх. Вихід: 0,30 г (69 %, тверда речовина білого кольору). LC-MS (m/z, M+H): 443. Проміжна сполука 24: (загальна процедура J) Проміжну сполуку 23 (0,30 г) перемішували в THF (2 мл), потім додавали конц. НСІ і нагрівали при 80 °C протягом ночі. Реакційну суміш охолоджували, розчинник видаляли і суміш, що залишилася, підлужували 50 %-им водним розчином NaOH. Суміш охолоджували до 0 °C і додавали ЕtOАс, потім ВОС2О (0,155 г), і отриману суміш перемішували при кімнатній температурі протягом ночі. Суміш розбавляли ЕtOАс, і органічну фазу відокремлювали, висушували над Na2SO4 і концентрували. Сирий продукт очищали хроматографією на колонках з елююванням із градієнтом 33-75 % ЕtOАс в гексані (Кількісний) 0,25 г. LC-MS (m/z, M+H-tBu): 321,00. Проміжна сполука 25: Проміжну сполуку 25 одержували з Проміжної сполуки 1 (0,5 г) і N-BOC-4-бромпіперидину (0,59 г) відповідно до загальних процедур І, D і J. Вихід: 0,50 г (58 % у цілому). Проміжну сполуку 1 одержували, використовуючи Вихідний матеріал 1. Приклад 27: 4-({6-хлор-2-гідрокси-3-[({[2(фенілокси)феніл]аміно}карбоніл)аміно]феніл}сульфоніл)-1-піперидинетилкарбоксилат (загальна процедура K) Проміжну сполуку 25 (0,25 г) і 2-феноксифенілізоціанат (0,175 г) розчиняли в DMF (3 мл) і реакційні суміші перемішували при кімнатній температурі протягом ночі. Надлишок DMF випарювали, і суміш, що залишилася, завантажували на колонку і елюювали сумішшю 1:3 + ЕtOАс:Нх. Вихід: 400 мг (кількісний, тверда речовина білого кольору) MS (m/z, ES , M+H): 574,17. Приклад 28: N-[4-хлор-2-гідрокси-3-(4-піперидинілсульфоніл)феніл]-N'-[2(фенілокси)феніл]карбамід 20 UA 98456 C2 5 10 Приклад 27 (0,20 г) перемішували в СНСІ 3 (2 мл) при кімнатній температурі в атмосфері аргону. Додавали йодтриметилсилан (0,21 г), і суміш нагрівали зі зворотним холодильником протягом ночі. Реакція, однак, не починалася, поки не були додані два завантаження хлортриметилсилану (0,037 г за завантаження) і Nal (0,051 г за завантаження), і реакційну суміш не нагрівали при 75 °C протягом ще 6 годин. У цей час додавали МеОН, і суміш перемішували протягом ще 30 хвилин, після чого розчинники видаляли і додавали розчин аміаку в метанолі. Суміш екстрагували DCM, органічний шар промивали водою, висушували над Na2SO4 і концентрували. Сирий продукт розтирали із сумішшю DCM/ефір і потім очищали хроматографією на колонках з елююванням метанолом. Вихід: 10 мг (6 %, тверда речовина + ясно-коричневого кольору) MS (m/z, ES , M+H): 502,06. Проміжні сполуки 4-6, 8, 10-17, 20, 22-25 є новими проміжними сполуками. 21 UA 98456 C2 22 UA 98456 C2 5 10 15 20 25 30 35 40 45 50 Сполуки Формули (І) або їх фармацевтично прийнятна сіль можуть використовуватися в одержанні лікарського засобу для профілактичного або терапевтичного лікування будь-якого хворобливого стану в людини або іншого ссавця, який посилений або викликаний надмірною або нерегульованою продукцією цитокіну IL-8 клітинами такого ссавця, такими як, але не обмежуючись ними, моноцити і/або макрофаги, або інших хемокінів, які зв'язуються з IL-8 або рецептором, також називаним рецептором типу І або II. Відповідно, даний винахід відноситься до способу лікування захворювання, опосередковуваного хемокіном, причому хемокіном є хемокін, який зв'язується з IL-8 або рецептором, і цей спосіб включає введення ефективної кількості сполуки Формули (І) або її фармацевтично прийнятної солі. Зокрема, хемокінами є IL-8, GRO, GRO, GRO, NAP-2 або ENA-78. Сполуки Формули (І) вводять у кількості, достатній для інгібування функцій цитокіну, особливо IL-8, GRO, GRO, GRO, NAP-2 або ENA-78, такій, що вони біологічно даунрегулюються до нормальних рівнів фізіологічної функції, або в деякому випадку до недостатніх рівнів, що приводить до поліпшення у випадку хворобливого стану. Патологічні рівні IL-8, GRO, GRO, GRO, NAP-2 або ENA-78, наприклад, у контексті дійсного винаходу, складають: (і) рівні вільного IL-8, більше або такі, що дорівнюють 1 пікограм на мл; (іі) будь-які зв'язані з клітинами IL-8, GRO, GRO, GRO, NAP-2 або ENA-78 вище нормальних фізіологічних рівнів; або (ііі) присутність IL-8, GRO, GRO, GRO, NAP-2 або ENA-78 вище основних рівнів у клітинах або тканинах, у яких IL-8, GRO, GRO, GRO, NAP-2 або ENA-78, відповідно, продукуються. Існує багато хворобливих станів, при яких надмірна або нерегульована продукція IL-8 бере участь у посиленні і/або породженні захворювання. Хемокін-опосередковані захворювання включають псоріаз, алергійний дерматит, остеоартрит, ревматоїдний артрит, астму, хронічне обструктивне захворювання легень, респіраторний дистрес-синдром дорослих, запальне захворювання кишечнику, хворобу Крона, неспецифічний виразковий коліт, інсульт, септичний шок, ендотоксичний шок, грамнегативний сепсис, синдром токсичного шоку, реперфузійне ушкодження серця і нирок, гломерулонефрит, тромбоз, реакцію трансплантат проти хазяїна, хворобу Алгеймера, відторгнення алотрансплантату, малярію, рестиноз, ангіогенез, атеросклероз, остеопороз, гінгівіт, вірусні захворювання, такі як риновірусні захворювання, або небажане вивільнення гематопоетичних стовбурових клітин. Ці захворювання насамперед характеризуються масивною інфільтрацією нейтрофілів, інфільтрацією Т-клітин або ростом нових судин і зв'язані зі збільшеною продукцією IL-8, GRO, GRO, GRO, NAP-2 або ENA-78, яка є відповідальною за хемотаксис нейтрофілів у запальну ділянку або направлений ріст ендотеліальних клітин. На відміну від інших запальних цитокінів (IL-1, TNF і IL-6), IL-8, GRO, GRO, GRO, NAP-2 або ENA-78 мають унікальну властивість у тому, що вони промотують хемотаксис нейтрофілів, вивільнення ферментів, включаючи, але не обмежуючись ним, вивільнення еластази, а також продукцію й активацію супероксидів. Хемокіни, але особливо GRO, GRO, GRO, NAP-2 або ENA-78, що працюють через рецептор IL-8 типу І або II, можуть промотувати неоваскуляризацію пухлин, промотуючи направлений ріст ендотеліальних клітин. Тому інгібування індукованих IL-8 хемотаксису або активації приведе до безпосереднього зниження інфільтрації нейтрофілів. Недавні дослідження також демонструють роль хемокінів у лікуванні ВІЛ інфекцій, Littleman et al., Nature 381, pp. 661 (1996) and Koup et al., Nature 381, pp. 667 (1996). Дійсне дослідження також показує використання інгібіторів IL-8 у лікуванні атеросклерозу. Перше посилання, Boisvert et al., J. Clin. Invest, 1998, 101: 353-363, демонструє, через пересадження кісткового мозку, що відсутність рецепторів IL-8 на стовбурових клітинах (і, тому, на моноцитах/макрофагах) приводить до скорочення розвитку атеросклеротичних бляшок у мишей з дефіцитом рецепторів ЛПНЩ. Додаткові посилання: Apostolopoulos, et al., Arterioscler. Thromb. Vase. Biol. 1996, 16:1007-1012; Liu, et al., Arterioscler. Thromb. Vase. Biol. 1997, 17: 317323; Rus, et al., Atherosclerosis. 1996, 127: 263-271; Wang et al., J. Biol. Chem. 1996, 271: 8837 23 UA 98456 C2 5 10 15 20 25 30 35 40 45 50 55 60 8842; Yue, et al., Eur. J. Pharmacol. 1993, 240: 81-84; Koch, et al., Am. J. Pathol., 1993, 142: 14231431.; Lee, et al., Immunol. Lett. 1996, 53, 109-113; і Terkeltaub et al., Arterioscler. Thromb., 1994, 14: 47-53. Даний винахід також відноситься до засобу для лікування ушкоджень ЦНС за допомогою сполук-антагоністів рецептора хемокіну Формули (І). Таке лікування забезпечується в гострий період, а також для профілактики ушкодження у осіб, що вважаються схильними до такого ушкодження. Ушкодження ЦНС, як визначено тут, включають як відкриті, так і проникаючі травми голови, наприклад, при хірургічному втручанні, або закриті травматичні ушкодження голови, такі як ушкодження ділянки голови. Також у рамки цього визначення входять ішемічний інсульт, особливо в ділянці мозку. Ішемічний інсульт може бути визначений як осередкове неврологічне порушення, яке випливає з недостатнього кровопостачання специфічної ділянки мозку, звичайно як наслідок емболії, тромбів або місцевого атероматозного змикання кровоносної судини. Роль запальних цитокінів у цій ділянці виявлена, і дійсний винахід забезпечує засоби для потенційного лікування цих ушкоджень. Раніше були доступні відносно обмежені види лікування гострого ушкодження, такого як описано. TNF- являє собою цитокін прозапальної дії, включаючи експресію молекули адгезії лейкоцита до ендотелію. Лейкоцити інфільтруються в ділянці ішемічного ушкодження мозку, і отже, сполуки, що інгібують або знижують рівні TNF, очевидно, можуть бути використані для лікування ішемічного ушкодження головного мозку. Див. Liu et al., Stroke, Vol. 25., No. 7, pp. 1481-88 (1994), розкриття якого включене в дійсний опис шляхом посилання. Моделі закритих черепно-мозкових ушкоджень і лікування змішаними засобами 5-LO/CO обговорюються в Shohami et al., J. of Vaisc & Clinical Physiology and Pharmacology. Vol. 3, No. 2, pp. 99-107 (1992). Було виявлено, що лікування, яке зменшує формування набряку, поліпшує функціональний результат у тварин, що піддаються лікуванню. Сполуки Формули (І) вводять у кількості, достатній для інгібування IL-8, зв'язування з рецепторами IL-8 альфа або бета, що доводиться зменшенням хемотаксису й активації нейтрофілів. Відкриття того, що сполуки Формули (І) є інгібіторами зв'язування IL-8, засноване на ефектах сполук Формули (І) у тестах in vitro на зв'язування з рецептором, що описані тут. Було показано, що сполуки Формули (І) є інгібіторами рецепторів IL-8 типу II. У рамках винаходу термін "опосередковуване IL-8 захворювання або хворобливий стан" відноситься до будь-якого і усіх хворобливих станів, у яких IL-8, GRO, GRO, GRO, NAP-2 або ENA-78 відіграє роль або за рахунок продукції IL-8, GRO, GRO, GRO, NAP-2 або ENA-78 як таких, або за рахунок того, що IL-8, GRO, GRO, GRO, NAP-2 або ENA-78 викликають вивільнення інших монокінів, таких як, але не обмежуючись ними, IL-1, IL-6 або TNF. Хворобливий стан, у якому основною складовою є, наприклад, IL-1, і чия продукція або дія підсилюється або секретується у відповідь на IL-8, тому варто вважати хворобливим станом, опосередковуваним IL-8. У рамках винаходу термін "опосередковуване хемокіном захворювання або хворобливий стан" відноситься до будь-якого і усіх хворобливих станів, у яких відіграє роль хемокін, що зв'язується з IL-8 або рецептором, такий як, але не обмежуючись ними, IL-8, GRO, GRO, GRO, NAP-2 або ENA-78. Воно включає хворобливий стан, у якому IL-8 відіграє роль або за рахунок продукції IL-8 як такого, або за рахунок того, що IL-8 викликає вивільнення інших монокінів, таких як, але не обмежуючись ними, IL-1, IL-6 або TNF. Хворобливий стан, у якому основною складовою є, наприклад, IL-1, і чия продукція або дія підсилюється або секретується у відповідь на IL-8, тому варто вважати хворобливим станом, опосередковуваним IL-8. У рамках винаходу термін "цитокін" відноситься до будь-якого секретованого поліпептиду, що впливає на функції клітин і являє собою молекулу, що модулює взаємодії між клітинами в імунній, запальній або гематопоетичній реакції. Цитокін включає, але не обмежений ними, монокіни і лімфокіни, незалежно від того, які клітини їх продукують. Наприклад, монокін звичайно згадується як продукований і секретований одноядерною клітиною, такою як макрофаг і/або моноцит. Багато інших клітин, однак, також продукують монокіни, такі як NK-клітини, фібробласти, базофіли, нейтрофіли, ендотеліальні клітини, мозкові астроцити, клітини строми кісткового мозку, кератиноцити епідермісу і В-лімфоцити. Лімфокіни звичайно згадуються як продуковані лімфоцитами. Приклади цитокінів включають, але не обмежені ними, Інтерлейкін-1 (IL-1), Інтерлейкін-6 (IL-6), Інтерлейкін-8 (IL-8), Фактор некрозу пухлини альфа (TNF-) і Фактор некрозу пухлини бета (TNF-). У рамках винаходу термін "хемокін" відноситься до будь-якого секретованого поліпептиду, що впливає на функції клітин і являє собою молекулу, що модулює взаємодії між клітинами в 24 UA 98456 C2 5 10 15 20 25 30 35 40 45 50 55 60 імунній, запальній або гематопоетичній реакції, подібно до терміну "цитокін", розкритого вище. Хемокін насамперед секретується трансмембранно з клітин і викликає хемотаксис і активацію специфічних білих кров'яних тілець і лейкоцитів, нейтрофілів, моноцитів, макрофагів, Т-клітин, В-клітин, ендотеліальних клітин і гладеньком'язових клітин. Приклади хемокінів включають, але не обмежені ними, IL-8, GRO, GRO, GRO, NAP-2, ENA-78, IP-10, MIP-1, MIP-, PF4 і МСР 1, 2 і 3. Для використання сполуки Формули (І) або її фармацевтично прийнятної солі в терапії, її звичайно складають у фармацевтичну композицію відповідно до звичайної фармацевтичної практики. Цей винахід, тому, також відноситься до фармацевтичної композиції, що містить ефективну, нетоксичну кількість сполуки Формули (І) і фармацевтично прийнятний носій або розріджувач. Сполуки Формули (І), їх фармацевтично прийнятні солі й фармацевтичні композиції, що їх містять, можуть бути введені будь-яким зі шляхів, звичайно використовуваних для введення лікарського засобу, наприклад, перорально, топічно, парентерально або інгаляцією. Сполуки Формули (І) можуть вводитися в звичайних лікарських формах, отриманих шляхом комбінації сполуки Формули (І) зі стандартними фармацевтичними носіями відповідно до звичайних процедур. Сполуки Формули (І) можуть також вводитися в звичайних дозах у комбінації з відомою другою терапевтично активною сполукою. Ці процедури можуть включати змішування, грануляцію і пресування або розчинення інгредієнтів, залежно від бажаного препарату. Варто розуміти, що форма і характер фармацевтично прийнятного характеру або розріджувача диктується кількістю активного інгредієнта, з яким він повинний бути скомбінований, шляхом введення й іншими відомими перемінними. Носій(ї) повинний бути "прийнятним" у значенні сумісності з іншими інгредієнтами складу і не бути шкідливим для реципієнта. Фармацевтичний носій може бути, наприклад, твердим або рідким. Прикладами твердих носіїв є лактоза, фарфорова глина, сахароза, тальк, желатин, агар-агар, пектин, гуміарабік, стеарат магнію, стеаринова кислота і т.п. Прикладами рідких носіїв є сироп, арахісова олія, оливкова олія, вода і т.п. Точно так само носій або розріджувач можуть включати матеріал для затримки вивільнення, відомий з рівня техніки, такий як гліцерилмоностеарат або гліцерилдистеарат, індивідуально або з воском. Можуть бути використані усілякі фармацевтичні форми. Так, якщо використовується твердий носій, препарат може бути таблетований, поміщений у тверду желатинову капсулу у формі порошку або гранули або знаходитися у формі пастилок або льодяників. Кількість твердого носія широко варіює, але переважно складає від приблизно 25 мг до приблизно 1 г. Коли використовується рідкий носій, препарат може бути у формі сиропу, емульсії, м'якої желатинової капсули, стерильної рідини для ін'єкцій, такої як ампула або неводна рідка суспензія. Сполуки Формули (І) можуть вводитися топічно, що є несистемним введенням. Воно включає нанесення сполуки Формули (І) зовнішньо на епідерміс або порожнину рота та інстиляцію такої сполуки у вухо, око і ніс таким чином, що сполука в основному не надходить у кровотік. Навпроти, системне введення відноситься до перорального, внутрішньовенного, внутрішньоочеревинного і внутрішньом'язового введення. Склади, придатні для топічного введення, включають рідкі або напіврідкі препарати, придатні для проникнення через шкіру в зону запалення, такі як лініменти, лосьйони, креми, мазі або пасти і краплі, придатні для введення в око, вухо або ніс. Активний інгредієнт може складати, для топічного введення, від 0,001 % до 10 % мас/мас, наприклад від 1 % до 2 % мас. від маси складу. Він може, однак, складати 10 % мас/мас, але переважно складає менше 5 % мас/мас, більш переважно від 0,1 % до 1 % мас/мас, від маси складу. Лосьйони згідно із дійсним винаходом включають придатні для нанесення на шкіру або око. Лосьйон для очей може включати стерильний водний розчин, за необхідності такий, що містить бактерицид, і може бути отриманий способами, подібними до способів для одержання крапель. Лосьйони або лініменти для нанесення на шкіру можуть також включати засіб для прискорення висихання й охолодження шкіри, такі як спирт або ацетон, і/або зволожувач, такий як гліцерин або олія, така як касторова олія або арахісова олія. Креми, мазі або пасти згідно з даним винаходом являють собою напівтверді склади активного інгредієнта для зовнішнього нанесення. Вони можуть бути отримані шляхом змішування активного інгредієнта в тонко роздробленій або порошковій формі, індивідуально або в розчині або суспензії у водній або неводній рідині, за допомогою підходящих машин, із сальною або несальною основою. Основа може включати вуглеводні, такі як твердий, м'який або рідкий парафін, гліцерин, бджолиний віск, металеве мило; мазь на основі камеді; олію природного походження, таку як мигдальну, кукурудзяну, арахісову, касторову або оливкову 25 UA 98456 C2 5 10 15 20 25 30 35 40 45 50 55 60 олію; ланолін або його похідні, або жирну кислоту таку як стеаринова або олеїнова кислота, разом зі спиртом, таким як пропіленгліколь або макрогель. Склад може включати будь-який придатний поверхнево-активний засіб, такий як аніонна, катіонна або неіоногенна поверхневоактивна речовина, така як складний ефір сорбітану або його поліоксіетиленове похідне. Можуть також бути включені суспендуючі агенти, такі як натуральні смоли, похідні целюлози або неорганічні матеріали, такі як кремнієві кремнеземи, та інші інгредієнти, такі як ланолін. Краплі згідно з даним винаходом можуть включати стерильні водні або масляні розчини або суспензії і можуть бути отримані шляхом розчинення активного інгредієнта в придатному водному розчині бактерицидного і/або фунгіцидного засобу і/або будь-якого іншого придатного консерванту, і переважно включають поверхнево-активний засіб. Отриманий розчин може бути потім освітлений фільтрацією, перенесений у підходящий контейнер, який потім запечатують і стерилізують, обробляючи в автоклаві або підтримуючи в 98-100 °C протягом півгодини. Альтернативно, розчин може бути стерилізований фільтрацією і поміщений у контейнер асептичною методикою. Прикладами бактерицидних і фунгіцидних засобів, придатних для включення в краплі, є нітрат або ацетат фенілртуті (0,002 %), хлорид бензалконію (0,01 %) і хлоргексидинацетат (0,01 %). Придатні розчинники для одержання масляного розчину включають гліцерин, розведений спирт і пропіленгліколь. Сполуки Формули (І) можуть вводитися парентерально, тобто, внутрішньовенним, внутрішньом'язовим, підшкірним, внутрішньоносовим, внутрішньоректальним, внутрішньопіхвовим або внутрішньоочеревинним введенням. Підшкірні і внутрішньом'язові форми парентерального введення звичайно є кращими. Придатні лікарські форми для такого введення можуть бути отримані звичайними методиками. Сполуки Формули (І) можуть також вводитися інгаляцією, тобто, внутрішньоносовим і пероральним інгаляційним введенням. Придатні лікарські форми для такого введення, такі як склад аерозоля або інгалятор з відміряними дозами, можуть бути отримані звичайними методиками. Для всіх способів використання, розкритого тут для сполук Формули (І), добова доза при пероральному режимі переважно складає від приблизно 0,01 до приблизно 80 мг/кг повної маси тіла. Добова доза при парентеральному режимі переважно складає від приблизно 0,001 до приблизно 80 мг/кг повної маси тіла. Добова доза при топічному режимі переважно складає від 0,1 мг до 150 мг, що вводяться один - чотири, переважно два або три рази на день. Добова доза при режимі інгаляції переважно складає від приблизно 0,01 мг/кг до приблизно 1 мг/кг на добу. Фахівцеві також буде зрозуміло, що оптимальна кількість та інтервал введення індивідуальних доз сполуки Формули (І) або її фармацевтично прийнятної солі будуть визначені залежно від природи і ступеня серйозності стану, що піддається лікуванню, форми, шляху та місця введення, і конкретного пацієнта, що одержує лікування, і що такі оптимуми можуть бути визначені звичайними методиками. Фахівцеві також буде зрозуміло, що оптимальний курс лікування, тобто, число доз сполуки Формули (І) або її фармацевтично прийнятної солі, що вводиться на добу протягом визначеного числа днів, може бути встановлений фахівцем з використанням звичайних тестів для визначення курсу лікування. Комбінації: Сполука і фармацевтичні склади відповідно до винаходу можуть використовуватися в комбінації з або включати одне або більше інших терапевтичних засобів, наприклад, обраних з протизапальних засобів, антихолінергічних засобів (особливо антагоністів рецептора М 1/М2/М3), агоністів 2-адренорецептора, антиінфекційних засобів, таких як антибіотики, противірусні засоби або антигістаміни. Винахід, таким чином, відноситься, в подальшому аспекті, до комбінації, що включає сполуку Формули (І) або її фармацевтично прийнятну сіль, сольват або фізіологічно функціональне похідне, разом з одним або більше іншими терапевтично активними засобами, наприклад, обраними з протизапального засобу, такого як кортикостероїд або NSAID, антихолінергічного засобу, агоніста 2-адренорецептора, протиінфекційного засобу, такого як антибіотик або противірусний засіб, або антигістамін. Один варіант здійснення винаходу охоплює комбінації, що включають сполуку Формули (І) або її фармацевтично прийнятну сіль, сольват або фізіологічно функціональне похідне разом з агоністом 2-адренорецептора і/або антихолінергічним засобом, і/або інгібітором PDE-4, і/або антигістаміном. Фахівцеві буде зрозуміло, що, за необхідності, інший терапевтичний інгредієнт(інгредієнти) може використовуватися у формі солей, наприклад солей лужного металу або солей аміну, або солей приєднання з кислотою, або проліків, або у формі складних ефірів, наприклад, складних ефірів нижчого алкілу, або у формі сольватів, наприклад, гідратів, щоб оптимізувати активність і/або стабільність і/або фізичні властивості, такі як розчинність, терапевтичного інгредієнта. Також зрозуміло, що, за необхідності, терапевтичні інгредієнти можуть використовуватися в оптично чистій формі. 26 UA 98456 C2 5 10 15 20 25 30 35 40 45 50 55 В одному варіанті здійснення винахід охоплює комбінацію, що включає сполуку за винаходом разом з агоністом 2-адренорецептора. Приклади агоністів 2-адренорецептора включають сальметерол (який може бути рацематом або єдиним енантіомером, таким як Rенантіомер), сальбутамол (який може бути рацематом або єдиним енантіомером, таким як Rенантіомер), формотерол (який може бути рацематом або єдиним діастереомером, таким як RR-діастереомер), сальмефамол, фенотерол, кармотерол, етантерол, намінтерол, кленбутерол, пірбутерол, флербутерол, репротерол, бамбутерол, індакатерол, тербуталін, і їх солі, наприклад ксинафоат (1-гідрокси-2-нафталінкарбоксилат) сальметеролу, сульфат або вільна основа сальбутамолу, або фумарат формотеролу. В одному варіанті здійснення агоністи 2-адренорецептора є агоністами 2-адренорецептора тривалої дії, наприклад, сполуками, що забезпечують ефективну бронходилатацію протягом приблизно 12 годин або довше. Інші агоністи 2-адренорецептора включають описані у WO2002/066422, WO2002/070490, WO2002/076933, WO2003/024439, WO2003/072539, WO2003/091204, WO2004/016578, WO2004/022547, WO2004/037807, WO2004/037773, WO2004/037768, WO2004/039762, WO2004/039766, WO2001/42193 і WO2003/042160. Інші приклади агоністів 2-адренорецептора включають: 3-(4-{[6-({(2R)-2-гідрокси-2-[4-гідрокси-3-(гідроксиметил)феніл]етил}аміно)гексил]окси}бутил)бензолсульфонамід; 3-(3-{[7-({(2R)-2-гідрокси-2-[4-гідрокси-3-гідроксиметил)феніл]етил}аміно)гептил]окси}пропіл)-бензолсульфонамід; 4-{(1R)-2-[(6-{2-[(2,6-дихлорбензил)окси]етокси}гексил)аміно]-1-гідроксіетил}-2(гідроксиметил)фенол; 4-{(1R)-2-[(6-{4-[3-(циклопентилсульфоніл)феніл]бутокси}гексил)аміно]-1-гідроксіетил}-2(гідроксиметил)фенол; N-[2-гідроксил-5-[(1R)-1-гідрокси-2-[[2-4-[[(2R)-2-гідрокси-2фенілетил]аміно]феніл]етил]аміно]етил]феніл]формамід; N-2{2-[4-(3-феніл-4-метоксифеніл)амінофеніл]етил}-2-гідрокси-2-(8-гідрокси-2(1Н)-хінолінон5-іл)етиламін; і 5-[(R)-2-(2-{4-[4-(2-аміно-2-метил-пропокси)феніламіно]-феніл}етиламіно)-1-гідроксіетил]-8гідрокси-1Н-хінолін-2-он. Агоніст 2-адренорецептора може бути у формі солі, утвореної з фармацевтично прийнятною кислотою, обраною з сірчаної, хлористоводневої, фумарової, гідроксинафтоєвої (наприклад, 1- або 3-гідрокси-2-нафтоєвої), коричної, заміщеної коричної, трифенілоцтової, сульфамової, сульфанілової, нафталінакрилової, бензойної, 4-метоксибензойної, 2- або 4гідроксибензойної, 4-хлорбензойної і 4-фенілбензойної кислоти. Придатні протизапальні засоби включають кортикостероїди. Прикладами кортикостероїдів, що можуть використовуватися в комбінації зі сполуками за винаходом, є пероральні й інгаляційні кортикостероїди і їх проліки, що мають протизапальну активність. Приклади включають метилпреднізолон, преднізолон, дексаметазон, флутиказонпропіонат, S-фторметиловий ефір 6,9-дифтор-11-гідрокси-16-метил-17-[(4-метил-1,3-тіазол-5карбоніл)окси]-3-оксо-андроста-1,4-дієн-17р-тіокарбонової кислоти, S-фторметиловий ефір 6,9-дифтор-17-[(2-фуранілкарбоніл)окси]-11-гідрокси-16-метил-3-оксо-андроста-1,4-дієн17р-тіокарбонової кислоти (флутиказон фуроат), S-(2-оксо-тетрагідро-фуран-3S-іл)овий ефір 6,9-дифтор-11-гідрокси-16-метил-3-оксо-17-пропіонілокси-андроста-1,4-дієн-17ртіокарбонової кислоти, S-ціанометиловий ефір 6,9-дифтор-11-гідрокси-16а-метил-3-оксо17-(2,2,3,3-тетраметилциклопропілкарбоніл)окси-андроста-1,4-дієн-17-тіокарбонової кислоти і S-фторметиловий ефір 6,9-дифтор-11-гідрокси-16-метил-17-(1метилциклопропілкарбоніл)окси-3-оксо-андроста-1,4-дієн-17-тіокарбонової кислоти, складні ефіри беклометазону (наприклад, 17-пропіонат або 17,21-дипропіонат), будезонід, флунісолід, складні ефіри мометазону (наприклад, мометазон фуроат), триамцинолон ацетонід, рофлепонід, циклезонід (16,17-[[(R)-циклогексилметилен]біс(окси)]-11,21-дигідрокси-прегна1,4-дієн-3,20-діон), бутиксокорт пропіонат, RPR-106541 і ST-126. В одному варіанті здійснення кортикостероїди включають флутиказон пропіонат, S-фторметиловий ефір 6,9-дифтор-11гідрокси-16-метил-17-[(4-метил-1,3-тіазол-5-карбоніл)окси]-3-оксо-андроста-1,4-дієн-17тіокарбонової кислоти, S-фторметиловий ефір 6,9-дифтор-17-[(2-фуранілкарбоніл)окси]11-гідрокси-16-метил-3-оксо-андроста-1,4-дієн-17-тіокарбонової кислоти, S-ціанометиловий ефір 6,9-дифтор-11-гідрокси-16-метил-3-оксо-17-(2,2,3,3тетраметилциклопропілкарбоніл)окси-андроста-1,4-дієн-17-тіокарбонової кислоти і Sфторметиловий ефір 6,9-дифтор-11-гідрокси-16-метил-17-(1 27 UA 98456 C2 5 10 15 20 25 30 35 40 45 50 55 метилциклопропілкарбоніл)окси-3-оксо-андроста-1,4-дієн-17-тіокарбонової кислоти. В одному варіанті здійснення кортикостероїд являє собою S-фторметиловий ефір 6,9-дифтор-17-[(2фуранілкарбоніл)окси]-11-гідрокси-16-метил-3-оксо-андроста-1,4-дієн-17-тіокарбонової кислоти. Приклади кортикостероїдів також включають описані в WO2002/088167, WO2002/100879, WO2002/12265, WO2002/12266, WO2005/005451, WO2005/005452, WO2006/072599 і WO2006/072600. Нестероїдні сполуки, що мають агонізм у відношенні глюкокортикоїдів, які можуть володіти селективністю в плані трансрепресії над трансактивацією і можуть бути використані в комбінованій терапії, включають описані в наступних опублікованих заявках на патенти і патентах: WO2003/082827, WO1998/54159, WO2004/005229, WO2004/009017, WO2004/018429, WO2003/104195, WO2003/082787, WO2003/082280, WO2003/059899, WO2003/101932, WO2002/02565, WO2001/16128, WO2000/66590, WO2003/086294, WO2004/026248, WO2003/061651, WO2003/08277, WO2006/000401, WO2006/000398 і WO2006/015870. Нестероїдні сполуки, що мають агонізм у відношенні глюкокортикоїдів, які можуть володіти селективністю в плані трансрепресії над трансактивацією і можуть бути використані в комбінованій терапії, включають описані в наступних патентах: WO2003/082827, W01998/54159, WO2004/005229, WO2004/009017, WO2004/018429, WO2003/104195, WO2003/082787, WO2003/082280, WO2003/059899, WO2003/101932, WO2002/02565, WO2001/16128, WO2000/66590, WO2003/086294, WO2004/026248, WO2003/061651 і WO2003/08277. Приклади протизапальних засобів включають нестероїдні протизапальні препарати (NSAID). Приклади NSAID включають хромоглікат натрію, недохроміл натрію, інгібітори фосфодіестерази (PDE) (наприклад, теофілін, інгібітори PDE4 або змішані інгібітори PDE3/PDE4), антагоністи лейкотрієну, інгібітори синтезу лейкотрієну (наприклад монтелукаст), інгібітори iNOS, інгібітори триптази і еластази, антагоністи бета-2 інтегрину й агоністи або антагоністи рецептора аденозину (наприклад, агоністи аденозину 2а), антагоністи цитокіну (наприклад, антагоністи хемокіну, такі як антагоніст CCR3) або інгібітори синтезу цитокіну, або інгібітори 5-ліпооксигенази. В одному варіанті здійснення винахід охоплює інгібітори iNOS (індукованої синтази оксиду азоту) для перорального введення. Приклади інгібіторів iNOS включають розкриті в WO1993/13055, WO1998/30537, WO2002/50021, WO1995/34534 і WO1999/62875. Приклади інгібіторів CCR3 включають розкриті BWO2002/26722. В одному варіанті здійснення винахід відноситься до застосування сполук Формули (І) у комбінації з інгібітором фосфодіестерази 4 (PDE4), наприклад, у випадку складу, адаптованого для інгаляції. Інгібітор PDE4, який може бути використаний у цьому аспекті винаходу, може бути будь-якою сполукою, що відома як або яка діє як інгібітор PDE4, наприклад, як інгібітор PDE4B і/або PDE4D. РDЕ4-інгібуючі сполуки включають цис-4-ціано-4-(3-циклопентилокси-4метоксифеніл)циклогексан-1-карбонову кислоту, 2-карбометокси-4-ціано-4-(3циклопропілметокси-4-дифторметоксифеніл)циклогексан-1-он і цис-[4-ціано-4-(3циклопропілметокси-4-дифторметоксифеніл)циклогексан-1-ол]. Крім того, цис-4-ціано-4-[3(циклопентилокси)-4-метоксифеніл]циклогексан-1-карбонова кислота (також відома як циломіласт) і її солі, складні ефіри, проліки або фізичні форми, що описані в патенті США 5552438, виданому 3 вересня 1996. Інші РDЕ4-інгібуючі сполуки включають AWD-12-281 (N-(3,5-дихлор-4-піридиніл)-1-[4фторфеніл)метил]-5-гідрокси--оксо-1Н-індол-3-ацетамід) від Elbion (Hofgen, N. et al. 15th EFMC Int Symp Med Chem (Sept 6-10, Edinburgh) 1998, Abst P. 98; CAS reference No. 247584020-9); похідне 9-бензиладеніну, назване NCS-613 (INSERM); D-4418 від Chiroscience і Schering-Plough; бензодіазепіновий інгібітор PDE4, ідентифікований як СІ-1018 (PD-168787), Pfizer; похідне бензодіоксолу, розкрите Kyowa Hakko в WO99/16766; K-34 від Kyowa Hakko; V-11294A від Napp (Landells, L.J. et al. Eur Resp J [Annu Cong Eur Resp Soc (Sept 19-23, Geneva) 1998] 1998, 12 (Suppl. 28): Abst P2393); рофлуміласт (3-(циклопропілметокси)-N-(3,5-дихлор-4-піридиніл)-4(дифторметокси)бензамід) (див. ЕР 0706513 В1 на ім'я Вук Gulden Lomberg, наприклад див. Приклад 5); фталазинон (W01999/47505) від Вук-Gulden; Пумафентрин, (-)-p-[(4aR*,10bS*)-9eтокси-1,2,3,4,4а,10b-гексагідро-8-метокси-2-метилбензо[с][1,6]нафтиридин-6-іл]-N,Nдіізопропілбензамід, який є змішаним інгібітором PDE3/PDE4, що був отриманий і опублікований Byk-Gulden, нині Altana; арофілін, розроблений Almirall-Prodesfarma; VM554/UM565 від Vernalis; або Т-440 (Tanabe Seiyaku; Fuji, K. et al. J Pharmacol Exp Ther, 1998, 284(1): 162), і T2585. Інші РDЕ4-інгібуючі сполуки розкриті в опублікованих міжнародних заявках на патенти WO2004/024728, WO2004/056823, WO2004/103998 (наприклад, Приклад 399 або 544), 28
ДивитисяДодаткова інформація
Назва патенту англійськоюIl-8 receptor antagonists
Автори англійськоюBusch-Petersen Jacob
Назва патенту російськоюАнтагонисты рецептора il-8
Автори російськоюБуш-Петерсен Якоб
МПК / Мітки
МПК: A01N 43/76, C07D 413/00, C07D 213/70, A01N 43/40, C07D 263/52, C07D 263/60, A61K 31/44, A61K 31/42, C07D 213/63, C07D 498/00, C07D 211/84, C07D 211/72
Мітки: антагоністи, рецептора
Код посилання
<a href="https://ua.patents.su/40-98456-antagonisti-receptora-il-8.html" target="_blank" rel="follow" title="База патентів України">Антагоністи рецептора il-8</a>
Попередній патент: Спосіб одержання 5-алкоксиметилфурфуралових ефірів
Наступний патент: Текстильна тканина з полімерних волокон, спосіб її виготовлення та застосування
Випадковий патент: Спосіб акустичного контролю геометричних характеристик труб












