Антагоністи прогестеронового рецептора
Номер патенту: 98312
Опубліковано: 10.05.2012
Автори: Клеве Арвед, Хассельманн Райнер, Прюс Штефан, Гарке Гуннар, Шмідт Аня, Шульце-Мосгау Маркус, Брудні-Кльоппель Маргарете, Мьоллер Карстен, Фурманн Ульріке, Петроф Орлін, Роттманн Антьє
Формула / Реферат
1. Антагоніст прогестероновогорецептора загальної формули І:
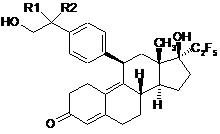 , формула І
, формула І
у якій R1 може бути атомом водню і R2 гідроксильною групою або R1 і R2 разом можуть бути оксогрупою.
2. Антагоніст прогестеронового рецептора загальної формули І за п. 1, що являє собою 11![]() -[4-(1,2-дигідроксіетил)феніл]-20,20,21,21,21-пентафторо-17-гідрокси-19-нор-17
-[4-(1,2-дигідроксіетил)феніл]-20,20,21,21,21-пентафторо-17-гідрокси-19-нор-17![]() -прегна-4,9-дієн-3-он.
-прегна-4,9-дієн-3-он.
3. Антагоніст прогестеронового рецептора загальної формули І за п. 1, що являє собою 11![]() -[4-[(1R)-1,2-дигідроксіетил]феніл]-20,20,21,21,21-пентафторо-17-гідрокси-19-нор-17
-[4-[(1R)-1,2-дигідроксіетил]феніл]-20,20,21,21,21-пентафторо-17-гідрокси-19-нор-17![]() -прегна-4,9-дієн-3-он.
-прегна-4,9-дієн-3-он.
4. Антагоніст прогестеронового рецептора загальної формули І за п. 1, що являє собою 11![]() -[4-[(1S)-1,2-дигідроксіетил]феніл]-20,20,21,21,21-пентафторо-17-гідрокси-19-нор-17
-[4-[(1S)-1,2-дигідроксіетил]феніл]-20,20,21,21,21-пентафторо-17-гідрокси-19-нор-17![]() -прегна-4,9-дієн-3-он.
-прегна-4,9-дієн-3-он.
5. Антагоніст прогестеронового рецептора загальної формули І за п. 1, що являє собою 20,20,21,21,21-пентафторо-17-гідрокси-11![]() -[4-(гідроксіацетил)феніл]-19-нор-17
-[4-(гідроксіацетил)феніл]-19-нор-17![]() -прегна-4,9-дієн-3-он.
-прегна-4,9-дієн-3-он.
6. Сполука за будь-яким з пп. 1-5 в ізольованій формі, переважно в твердій формі.
7. Сполука за будь-яким з пп. 3 або 4, де вона в значній мірі вільна від іншої сполуки за п. 3 або 4.
8. Ліки, що містять антагоністи прогестеронового рецептора за п. 1.
9. Ліки за п. 8, що містять 11![]() -[4-(1,2-дигідроксіетил)феніл]-20,20,21,21,21-пентафторо-17-гідрокси-19-нор-17
-[4-(1,2-дигідроксіетил)феніл]-20,20,21,21,21-пентафторо-17-гідрокси-19-нор-17![]() -прегна-4,9-дієн-3-он.
-прегна-4,9-дієн-3-он.
10. Ліки за п. 8, що містять 11![]() -[4-[(1R)-1,2-дигідроксіетил]феніл]-20,20,21,21,21-пентафторо-17-гідрокси-19-нор-17
-[4-[(1R)-1,2-дигідроксіетил]феніл]-20,20,21,21,21-пентафторо-17-гідрокси-19-нор-17![]() -прегна-4,9-дієн-3-он.
-прегна-4,9-дієн-3-он.
11. Ліки за п. 8, що містять 11![]() -[4-[(1S)-1,2-дигідроксіетил]феніл]-20,20,21,21,21-пентафторо-17-гідрокси-19-нор-17
-[4-[(1S)-1,2-дигідроксіетил]феніл]-20,20,21,21,21-пентафторо-17-гідрокси-19-нор-17![]() -прегна-4,9-дієн-3-он.
-прегна-4,9-дієн-3-он.
12. Ліки за п. 8, що містять 20,20,21,21,21-пентафторо-17-гідрокси-11![]() -[4-(гідроксіацетил)феніл]-19-нор-17
-[4-(гідроксіацетил)феніл]-19-нор-17![]() -прегна-4,9-дієн-3-он.
-прегна-4,9-дієн-3-он.
13. Ліки за будь-яким з пп. 8-12, придатні для перорального введення, переважно у вигляді одиничної дозованої форми.
14. Ліки за будь-яким з пп. 8-12, які містять від 0,01 мг до 100 мг сполуки за п. 1.
15. Застосування антагоністів прогестеронового рецептора за п. 1 для одержання ліків для лікування ендометріозу, міом або гормонозалежних пухлин, головним чином карциноми молочної залози, і для фармацевтичних препаратів для жіночої контрацепції.
16. Застосування за п. 15, де антагоністом прогестеронового рецептора є 11![]() -[4-(1,2-дигідроксіетил)феніл]-17
-[4-(1,2-дигідроксіетил)феніл]-17![]() -гідрокси-17
-гідрокси-17![]() -(1,1,2,2,2-пентафторетил)естра-4,9-дієн-3-он.
-(1,1,2,2,2-пентафторетил)естра-4,9-дієн-3-он.
17. Застосування за п. 15, де антагоністом прогестеронового рецептора є 11![]() -[4-[(1R)-1,2-дигідроксіетил]феніл]-20,20,21,21,21-пентафторо-17-гідрокси-19-нор-17
-[4-[(1R)-1,2-дигідроксіетил]феніл]-20,20,21,21,21-пентафторо-17-гідрокси-19-нор-17![]() -прегна-4,9-дієн-3-он.
-прегна-4,9-дієн-3-он.
18. Застосування за п. 15, де антагоністом прогестеронового рецептора є 11![]() -[4-[(1S)-1,2-дигідроксіетил]феніл]-20,20,21,21,21-пентафторо-17-гідрокси-19-нор-17
-[4-[(1S)-1,2-дигідроксіетил]феніл]-20,20,21,21,21-пентафторо-17-гідрокси-19-нор-17![]() -прегна-4,9-дієн-3-он.
-прегна-4,9-дієн-3-он.
19. Застосування за п. 15, де антагоністом прогестеронового рецептора є 20,20,21,21,21-пентафторо-17-гідрокси-11![]() [4-(гідроксіацетил)феніл]-19-нор-17
[4-(гідроксіацетил)феніл]-19-нор-17![]() -прегна-4,9-дієн-3-он.
-прегна-4,9-дієн-3-он.
20. 11![]() -(4-Етенілфеніл)-20,20,21,21,21-пентафторо-5,17-дигідрокси-19-нор-5
-(4-Етенілфеніл)-20,20,21,21,21-пентафторо-5,17-дигідрокси-19-нор-5![]() ,17
,17![]() -прегн-9-ен-3-он 2,2-диметилпропан-1,3-діїлкеталь як інтермедіат при одержанні антагоніста прогестеронового рецептора загальної формули І.
-прегн-9-ен-3-он 2,2-диметилпропан-1,3-діїлкеталь як інтермедіат при одержанні антагоніста прогестеронового рецептора загальної формули І.
21. 11![]() -[4-(1,2-Дигідроксіетил)феніл]-20,20,21,21,21-пентафторо-5,17-дигідрокси-19-нор-5
-[4-(1,2-Дигідроксіетил)феніл]-20,20,21,21,21-пентафторо-5,17-дигідрокси-19-нор-5![]() ,17
,17![]() -прегн-9-ен-3-он 2,2-диметилпропан-1,3-діїлкеталь як інтермедіат при одержанні антагоніста прогестеронового рецептора загальної формули І.
-прегн-9-ен-3-он 2,2-диметилпропан-1,3-діїлкеталь як інтермедіат при одержанні антагоніста прогестеронового рецептора загальної формули І.
22. 20,20,21,21,21-Пентафторо-17-гідроксі-5,10![]() -епокси-19-нор-5
-епокси-19-нор-5![]() ,17
,17![]() -прегн-9-(11)-ен-3-он 2,2-диметилпропан-1,3-діїлкеталь як інтермедіат при одержанні антагоніста прогестеронового рецептора загальної формули І.
-прегн-9-(11)-ен-3-он 2,2-диметилпропан-1,3-діїлкеталь як інтермедіат при одержанні антагоніста прогестеронового рецептора загальної формули І.
23. 11![]() -{4-[(4R)-2,2-диметил-1,3-діоксолан-4-іл]феніл}-20,20,21,21,21-пентафторо-5,17-дигідрокси-19-нор-5
-{4-[(4R)-2,2-диметил-1,3-діоксолан-4-іл]феніл}-20,20,21,21,21-пентафторо-5,17-дигідрокси-19-нор-5![]() ,17
,17![]() -прегн-9-ен-3-он 2,2-диметилпропан-1,3-діїлкеталь як інтермедіат при одержанні антагоніста прогестеронового рецептора загальної формули І.
-прегн-9-ен-3-он 2,2-диметилпропан-1,3-діїлкеталь як інтермедіат при одержанні антагоніста прогестеронового рецептора загальної формули І.
24. 11![]() -[4-[2-[[[(1,1-Диметилетил)диметилсиліл]окси]метил]-1,3-діоксолан-2-іл]феніл]-20,20,21,21,21-пентафторо-5,17-дигідрокси-19-нор-5
-[4-[2-[[[(1,1-Диметилетил)диметилсиліл]окси]метил]-1,3-діоксолан-2-іл]феніл]-20,20,21,21,21-пентафторо-5,17-дигідрокси-19-нор-5![]() ,17
,17![]() -прегн-9-ен-3-он 2,2-диметилпропан-1,3-діїлкеталь як інтермедіат при одержанні антагоніста прогестеронового рецептора 20,20,21,21,21-пентафторо-17-гідрокси-11
-прегн-9-ен-3-он 2,2-диметилпропан-1,3-діїлкеталь як інтермедіат при одержанні антагоніста прогестеронового рецептора 20,20,21,21,21-пентафторо-17-гідрокси-11![]() -[4-(гідроксіацетил)феніл]-19-нор-17
-[4-(гідроксіацетил)феніл]-19-нор-17![]() -прегна-4,9-дієн-3-ону.
-прегна-4,9-дієн-3-ону.
25. 20,20,21,21,21-Пентафторо-5,17-дигідрокси-11![]() -[4-[2-(гідроксиметил)-1,3-діоксолан-2-іл]феніл]-19-нор-5
-[4-[2-(гідроксиметил)-1,3-діоксолан-2-іл]феніл]-19-нор-5![]() ,17
,17![]() -прегн-9-ен-3-он 2,2-диметилпропан-1,3-діїлкеталь як інтермедіат при одержанні антагоніста прогестеронового рецептора 20,20,21,21,21-пентафторо-17-гідрокси-11
-прегн-9-ен-3-он 2,2-диметилпропан-1,3-діїлкеталь як інтермедіат при одержанні антагоніста прогестеронового рецептора 20,20,21,21,21-пентафторо-17-гідрокси-11![]() -[4-(гідроксіацетил)феніл]-19-нор-17
-[4-(гідроксіацетил)феніл]-19-нор-17![]() -прегна-4,9-дієн-3-ону.
-прегна-4,9-дієн-3-ону.
Текст
Реферат: Даний винахід стосується антагоністів прогестеронового рецептора загальної формули І: UA 98312 C2 (12) UA 98312 C2 R1 R2 HO OH CH3 C F 2 5 H H O , формула І у якій R1 може бути атомом водню і R2 гідроксильною групою або R1 і R2 разом можуть бути оксогрупою. UA 98312 C2 Дійсний винахід відноситься до антагоністів прогестеронового рецептора загальної формули І: 5 10 15 20 25 30 35 40 45 50 формула І у якій R1 може бути атомом водню і R2 гідроксильною групою або R1 і R2 разом можуть бути оксогрупою, до ліків (фармацевтичних композицій), що містять їх, і до їх використання у виробництві лікарських засобів. Винахід відноситься особливо до антагоністів прогестеронового рецептора 11-[4-(1,2-дигідроксіетил)-феніл]-20,20,21,21,21-пентафторо-17-гідрокси-19-нор-17-прегна4,9-дієн-3-ону і його окремих епімерів 11-[4-[(1R)-1,2-дигідроксіетил]-феніл]-20,20,21,21,21-пентафторо-17-гідрокси-19-нор-17прегна-4,9-дієн-3-ону і 11-[4-[(1S)-1,2-дигідроксіетил]-феніл]-20,20,21,21,21-пентафторо-17-гідрокси-19-нор-17прегна-4,9-дієн-3-ону і 20,20,21,21,21-пентафторо-17-гідрокси-11-[4-(гідроксіацетил)-феніл]-19-нор-17-прегна-4,9дієн-3-ону і до ліків, що містять їх, і до їх використання у виробництві лікарських засобів. Переважною сполукою цього винаходу є 20,20,21,21,21-пентафторо-17-гідрокси-11-[4(гідроксіацетил)-феніл]-19-нор-17-прегна-4,9-дієн-3-он. Сполука з антигістогенною активністю (конкурентні антагоністи прогестеронового рецептора) вперше стали відомими в 1982 році (RU 486; EP57115) і від тоді були дуже добре описані. Стероїди з антигістогенною активністю, які відрізняються від речовин згідно винаходу і мають фторований бічний ланцюг 17, були опубліковані в WO98/34947 і Fuhrmann et al., J. Med. Chem. 43, 5010-5016 (2000). Клас сполук, розкритий в WO98/34947, допускає безліч різних замісників в положенні 11 стероїдного ядра, але не поширюється на дизаміщені алкілфенільні групи. ЕР57115 надає ряд замісників в положенні 11 стероїдного ядра, але при цьому необхідно, щоб такі замісники містили атом азоту, фосфору або кремнію. Отже, не існує припущення, що фторовмісні стероїди, що мають замісник в положенні 17 і дизаміщений алкілфенільний замісник в положенні 11 стероїдного ядра, можуть володіти бажаними властивостями. Речовини, заявлені тут, є, принаймні частково, метаболітами речовини, заявленої в WO98/34947. Завдання дійсного винаходу полягає в тому, щоб надати нові конкурентні антагоністи прогестеронового рецептора і ліки, що містять їх, і отже створити альтернативні шляхи лікування гінекологічних захворювань. Це завдання було досягнуте за допомогою синтезу 11-[4-(1,2-дигідроксіетил)-феніл]20,20,21,21,21-пентафторо-17-гідрокси-19-нор-17-прегна-4,9-дієн-3-ону і 20,20,21,21,21пентафторо-17-гідрокси-11-[4-(гідроксіацетил)-феніл]-19-нор-17-прегна-4,9-дієн-3-ону. Епімери 11-[4-(1,2-дигідроксіетил)-феніл]-20,20,21,21,21-пентафторо-17-гідрокси-19-нор-17прегна-4,9-дієн-3-ону можуть бути окремо отримані або способами хроматографічного розділення на Chiracel OD-H колонці з сумішшю гексан/етанол 90:10 (об./об.) як рухома фаза, або виходячи з хіральних вихідних сполук, таких як (R)- або (S)-1-(4-бромофеніл)-1,2-етандіол. Тому, підходящими сполуками цього винаходу є ті, які були отримані хімічними шляхами. Відповідним чином винахід надає дигідроксисполуку цього винаходу, здебільшого вільну від його ізомеру, тобто коли, принаймні 90 %, точніше принаймні 95 %, переважно принаймні 98 %, і найпереважніше 100 % вільно від відповідного ізомеру. Оскільки сполуки винаходу повинні застосовуватися у фармацевтичних композиціях, переважно забезпечити тоді ізольовану форму, наприклад, у вигляді порошку, точніше у вигляді у більшій мірі чистого порошку, наприклад, у більшій мірі вільного від інших стероїдних сполук або інших біологічно активних агентів. 1 UA 98312 C2 5 10 15 20 25 30 35 40 45 50 55 60 Речовини загальної формули І є цінними фармацевтично активними компонентами. Вони можуть використовуватися серед іншого для виробництва фармацевтичних препаратів для лікування міом або ендометріозу, для жіночої контрацепції, для посткоїтального регулювання народжуваності, для викликання менструації, для викликання пологової діяльності, для гормонозамісної терапії, для лікування симптомів, пов'язаних з дисменореєю, для лікування гормональних порушень і для лікування гормонозалежних пухлин, напр., прогестеронової рецептор-позитивної карциноми молочної залози. їх ефективність як антагоністів прогестеронового рецептора визначали в абортованому тесті на щурах і за допомогою визначення індексу McPhail на кроликах. Речовини загальної формули І показують вищу метаболічну стабільність в людських мікросомах печінки (HLM), ніж антагоніст прогестеронового рецептора 11-(4-ацетилфеніл)20,20,21,21,21-пентафторо-17-гідрокси-19-нор-17-прегна-4,9-дієн-3-он, розкритий в WO98/34947. Це видно з покращуваної пероральної біологічної доступності сполук цього винаходу так, що вони можуть застосовуватися у фармацевтичних композиціях, придатних для перорального введення. Ліки (фармацевтичні композиції) згідно винаходу можуть бути придатні для системного або місцевого введення. Як правило, переважно пристосувати ліки для системного введення, наприклад шляхом ін'єкції або шляхом перорального введення. Якщо передбачається форма, що ін'єктується, вони можуть бути отримані звичайними способами, відомими в рівні техніки, для одержання стероїдів. Якщо передбачаються форми, що вводяться перорально, вони також можуть бути отримані звичайними способами, відомими у фармацевтичному рівні техніки, для одержання стероїдів. Переважні форми ліків включатимуть сполуки формули І і фармацевтично прийнятний носій, відповідно. Фармацевтична композиція винаходу може бути представлена у формі, підходящій для системного або місцевого введення, з яких форма, що системно вводиться, загалом є самою підходящою. Форма, що системно вводиться, може бути придатна для введення шляхом ін'єкції, наприклад, у вигляді стерильної форми, наприклад, емульсії. Форма, що системно вводиться, може бути придатна для перорального введення і такі форми, загалом є найбільш підходящими. Такі форми, як правило, мають бути одиничною дозованою формою, що містить задану кількість сполуки винаходу. Підходящі форми включають таблетки, желатинові капсули, порошки, гранулят тощо, з яких, як правило, є переважними таблетки. Такі дозовані форми можуть бути вироблені звичайним способом і фармацевтично прийнятним носієм може бути будь-який підходящий носій, особливо носій, відомий для використання в препаратах стероїдних лікарських засобів. Одинична дозована форма може містити 0,01-100 мг заявлених речовин. Приклади, які слідують далі, служать ілюстрацією винаходу, аж ніяк його не обмежуючи. Приклад 1: Синтез 11-[4-(1,2-дигідроксіетил)-феніл]-20,20,21,21,21-пентафторо-17-гідрокси19-нор-17-прегна-4,9-дієн-3-ону a) 11-(4-Етенілфеніл)-5-гідрокси-5а-естр-9-ен-3,17-діон 3-(2,2-диметилпропан-1,3-дііл)кеталь 3.3 г Магнієвої стружки поміщали в 14 мл абсолютного тетрагідрофурану в атмосфері інертного газу і додавали одну краплю 1,2-дибромоетану. Після початку реакції, повільно додавали по краплях розчин 25 г 4-бромостиролу в 137 мл абсолютного тетрагідрофурану так, щоб температура усередині зберігалася в інтервалі від 40 до 45 °C. Реакційну суміш потім перемішували одну годину до тих пір, поки магній повністю не прореагує. Потім до суміші додавали 2.26 г хлориду міді-(І). Повільно додавали по краплях розчин 8.5 г 5,10-епокси-5,10естр-9-(11)-ен-3,17-діон 3-(2,2-диметилпропан-1,3-дііл)-кеталю (для одержання див. також Tetrahedron Lett. 26, 2069-2072 (1985)) в 137 мл абсолютного тетрагідрофурану. Реакційну суміш перемішували одну годину при кімнатній температурі і потім виливали в насичений водний розчин хлористого амонію. Водну фазу екстрагували етилацетатом і органічні фази об'єднували, промивали насиченим водним розчином хлориду натрію і сушили над сульфатом натрію. Продукт фільтрували і концентрували у вакуумі. Колонкова хроматографія на силікагелі сумішшю гексан/етилацетат дає 6.76 г названої сполуки у вигляді безбарвної піни. 1 H-ЯMP (300 Мгц, CDCl3): д = 7.30 d (J=9 Гц, 2Н, арил); 7.18 d (J=9 Гц, 2Н, арил); 6.66 dd (J=17 Гц + 11 Гц, 1H, вініл); 5.70 dbr (J= 17 Гц, 1H, вініл); 5.20 dbr (J=11 Гц, 1H, вініл); 4.44 s (1H, 5-OH); 4.29 dbr (J=6.5 Гц, 1H, H-11); 3.53 m (2Н, 3-кеталь); 3.51 m (J=11.4 Гц, 1H, 3-кеталь); 3.42 m (J=11.4 Гц, 1H, 3-кеталь); 1.05 s (3Н, 3-кеталь); 0.85 s (3Н, 3-кеталь); 0.49 s (3Н, H-18). b) 11-(4-Етенілфеніл)-20,20,21,21,21-пентафторо-5,17-дигідрокси-19-нор-5,17-прегн-9ен-3-он 2,2-диметилпропан-1,3-дііл-кеталь 2 UA 98312 C2 5 10 15 20 25 30 35 40 45 50 Розчин 6.76 г сполуки, отриманої вище в а), у 140 мл абсолютного толуолу додавали при -78 °С до 27.9 г сконденсованого пентафторойодоетану в 140 мл абсолютного толуолу. Додавали 66.3 мл 1.5-молярного розчину комплексу метиллітій/бромід літію в діетиловому ефірі при цій температурі. Реакційну суміш потім перемішували одну годину при 0 °С. Суміш потім виливали в насичений водний розчин хлористого амонію. Продукт екстрагували етилацетатом, промивали насиченим водним розчином хлориду натрію, сушили над сульфатом натрію і концентрували у вакуумі. Хроматографія отриманого сирого продукту на силікагелі сумішшю гексан/етилацетат дає 3.73 мг названої сполуки у вигляді білої піни. 1 H-ЯMP (300 Мгц, CDCl3): д = 7.30 d (J=9 Гц, 2Н, арил); 7.17 d (J=9 Гц, 2Н, арил); 6.67 dd (J=17 Гц + 11 Гц, 1H, вініл); 5.71 dbr (J=17 Гц, 1H, вініл); 5.20 dbr (J=11 Гц, 1H, вініл); 4.45 s (1H, 5-OH); 4.31 dbr (J=6.5 Гц, 1H, H-11); 3.53 m (2Н, 3-кеталь); 3.51 m (J=11.4 Гц, 1H, 3-кеталь); 3.42 m (J=11.4 Гц, 1H, 3-кеталь); 1.05 s (3Н, 3-кеталь); 0.85 s (3Н, 3-кеталь); 0.54 s (3Н, Н-18). с) 11 -[4-(1,2-Дигідроксіетил)-феніл]-20,20,21,21,21-пентафторо-5,17-дигідрокси-19-нор5,17-прегн-9-ен-3-он 2,2-диметилпропан-1,3-дііл-кеталь 1.68 мл водного буферного розчину з рН 7.00 на основі дигідрофосфату калію і гідрофосфату дикалію і 206 мг триметиламін N-оксиду додавали до розчину 1 г сполуки, отриманої згідно Прикладу 1 b), у 8.4 мл тетрагідрофурану. По краплях при 0 °C додавали 4.3 мл розчину 250 мг тетроксиду осмію в 50 мл бутанолу. Реакційну суміш перемішували три год. при кімнатній температурі і потім виливали в насичений водний розчин тіосульфату натрію. Продукт екстрагували етилацетатом, промивали насиченим водним розчином хлориду натрію, сушили над сульфатом натрію і концентрували у вакуумі. Хроматографія отриманого сирого продукту на силікагелі сумішшю гексан/етилацетат дає 860 мг названої сполуки у вигляді білої піни. Отримали суміш епімерів бензилкарбінолу. 1 H-ЯМР (300 Мгц, CDCl3): д = 7.25 d (J=9 Гц, 2Н, арил); 7.20 d (J=9 Гц, 2Н, арил); 4.78 m (1H, CHOH); 4.44 s (1H, 5-OH); 4.32 dbr (J=6.5 Гц, 1H, H-11); 3.73 m (1H, CH2OH); 3.65 m (1H, CH2OH); 3.54 m (2Н, 3-кеталь); 3.52 m (J=11.0 Гц, 1H, 3-кеталь); 3.44 m (J=11.0 Гц, 1H, 3-кеталь); 1.04 s (3Н, 3-кеталь); 0.87 s (3Н, 3-кеталь); 0.51 s (3Н, Н-18). d) 11-[4-(1,2-Дигідроксіетил)-феніл]-20,20,21,21,21-пентафторо-17-гідрокси-19-нор-17прегна-4,9-дієн-3-он 200 мг сполуки, описаної вище в Прикладі 1 с), перемішували в 3 мл метанолу з 141 мкл напівконцентрованої водної сірчаної кислоти протягом однієї год. при кімнатній температурі. Суміш потім виливали в насичений водний розчин гідрокарбонату натрію і екстрагували етилацетатом. Органічну фазу промивали насиченим водним розчином хлориду натрію, сушили над сульфатом натрію, фільтрували і концентрували у вакуумі. Колонкова хроматографія на силікагелі сумішшю гексан/етилацетат дає 78 мг названої сполуки у вигляді безбарвної піни. Отримали суміш епімерів бензилкарбінолу. 1 H-ЯМР (300 Мгц, CDCl3): д = 7.25 d (J=9 Гц, 2Н, арил); 7.15 d (J=9 Гц, 2Н, арил); 5.77 s (1H, Н-4); 4.74 m (1H, CHOH); 4.42 dbr (J=7 Гц, 1H, H-11); 3.69 m (1H, CH2OH); 3.59 m (1H, CH2OH); 0.56 s (3Н, H-18). Приклад 2: Синтез 11-[4-[(1R)-1,2-дигідроксіетил]-феніл]-20,20,21,21,21-пентафторо-17гідрокси-19-нор-17-прегна-4,9-дієн-3-ону a) (R)-1-(4-Бромофеніл)-1,2-етандіол: 17.0 г Карбонату калію і 40.4 г гексаціаноферрату-(III) калію розчиняли в суміші 190 мл нбутанолу і 190 мл води. Потім додавали 30 мг осмату калію і 300 мг (DHQD)-2PHAL і розчин охолоджували до 0 °C. Потім при 0 °С додавали 7.5 г 4-бромостиролу і суміш перемішували всю ніч. Суміш обробляли додаванням 30 г сульфіту натрію. Реакційний розчин екстрагували 300 мл етилацетату. Органічну фазу сушили над сульфатом натрію і концентрували із одержанням 7.3 г білого порошку. Вихід: 7.3 г = 82.1 % від теорії. 1 H-ЯМР (300 Мгц, CDCl3): д = 7.50 d (J=9 Гц, 2Н, арил); 7.25 d (J=9 Гц, 2Н, арил); 4.80 dd (J=4.4 Гц + 3.6 Гц, 1H); 3.70 m (2H); 2.50 sbr (2Н, OH). Дані ЯМР продукту погоджуються з даними ЯМР, описаними в літературі (T. Barlow, A. Dipple, Chem. Res. Toxicol. 1998, //, 44-53). b) (R)-4-(4-Бромофеніл)-2,2-диметил-1,3-діоксолан: 3 UA 98312 C2 5 10 15 20 25 30 35 3.5 г Діолу, описаного в Прикладі 2 а), суспендували в 100 мл ацетону. Додавали 30 мл 2,2диметоксипропану і 0.3 мл концентрованої сірчаної кислоти. Через 2 год. до реакційної суміші додавали 100 мл насиченого розчину бікарбонату натрію І продукт екстрагували три рази 50 мл етилацетату. Органічні фази сушили над сульфатом натрію і концентрували у вакуумі із одержанням 3.7 г білого порошку. Фіг. 1 показує CD спектр (R)-4-(4-бромофеніл)-2,2-диметил1,3-діоксолану. Вихід: 3.7 г = 58.8 % від теорії. 1 H-ЯМР (400 Мгц, CDCl3): д = 7.48 d (J=9 Гц, 2Н, арил); 7.25 d (J=9 Гц, 2Н, арил); 5.04 dd (J=9 Гц + 8.2 Гц, 1H) 4.30 dd (J=9 Гц + 8.2 Гц, 1H); 3.16 dd (J=9 Гц + 9 Гц, 1H); 1.53 s (3H); 1.48 s (3H). c) 20,20,21,21,21-Пентафторо-17-гідрокси-5,10-епокси-19-нор-5,17-прегн-9-(11)-ен-3-он 2,2-диметилпропан-1,3-дііл-кеталь 50 г 5,10-Епокси-5,10-естр-9-(11)-ен-3,17-діон 3-(2,2-диметилпропан-1,3-дііл)-кеталю (для одержання див. також Tetrahedron Lett. 26, 2069-2072 (1985)) додавали при -70 °С до 116 г сконденсованого пентафторойодоетану в 500 мл абсолютного толуолу. Додавали 290 мл 1.5молярного розчину комплексу метиллітій/бромід літію в діетиловому ефірі при цій же температурі. Реакційну суміш потім перемішували одну годину при 0 °С. Суміш потім додавали до насиченого водного розчину хлористого амонію і екстрагували етилацетатом. Органічну фазу промивали насиченим водним розчином хлориду натрію, сушили над сульфатом натрію і концентрували у вакуумі. Сирий продукт розчиняли в 200 мл ацетону, і додавали 450 мл води. Продукт, який випадав, фільтрували і сушили у вакуумі. Вихід: 61.6 г (93 % від теорії). 1 Н-ЯМР (500 Мгц, CDCl3): д = 6.04 brd (J=2.5 Гц, 1H, вініл); 3.60 d (J=11.3, 1H); 3.46 d (J=11.3 Гц); 3.39 dd (J=11.3 Гц + 9.5 Гц, 1H); 2.51 dbr (J=10.6, 1H); 1.06 s (3H); 0.93 s (3H); 0.85 s (3H). d) 11-{4-[(4R)-2,2-Диметил-1,3-діоксолан-4-іл]-феніл}-20,20,21,21,21-пентафторо-5,17дигідрокси-19-нор-5, 17-прегн-9-ен-3-он 2,2-диметилпропан-1,3-дііл-кеталь 387 мг магнієвої стружки суспендували в 3 мл THF, і при перемішуванні додавали 50 мкл дибромоетану. Розчин 4.35 г кеталю, описаного в Прикладі 2 b), у 16 мл THF повільно додавали до суспензії при 65 °C. Отриманий розчин охолоджували до 0 °С. Додавали 21.5 мг CuCl і 2.75 г сполуки, отриманої в Прикладі 2 с), у 11 мл THF. Реакційну суміш перемішували 2 год. при 20 °С і потім додавали 28 мл 10 процентного розчину NH4Cl. Реакційну суміш екстрагували 20 мл MTB ефіру. Органічну фазу концентрували і отриманий порошок (5.9 г) очищали хроматографією на 120 г силікагелю сумішшю гексан/етилацетат як рухома фаза, із одержанням 3.2 г продукту у вигляді білого порошку. Вихід: 3.2 г = 85 % від теорії. 1 Н-ЯМР (600 Мгц, CDCl3): д = 7.23 d (J=9 Гц, 2Н, арил); 7.20 d (J=9 Гц, 2Н, арил); 5.03 dd (J=9 Гц + 8.4 Гц, 1H); 4.46 s (1H, ОН); 4.33 dbr (J=6.5 Гц, 1H); 4.27 dd (J=9 Гц + 8.4 Гц, 1H); 3.68 dd (J=9 Гц + 9 Гц, 1H); 1.56 s (3H); 1.49 s (3H); 1.07 s (3H); 0.86 s (3H); 0.50 s (3H). е) 11-[4-[(1R)-1,2-Дигідроксіетил]-феніл]-20,20,21,21,21-пентафторо-17-гідрокси-19-нор-17прегна-4,9-дієн-3-он 4 UA 98312 C2 5 10 15 20 25 30 35 40 45 2.5 г Сполуки, описаної вище в Прикладі 2 d), розчиняли в 20 мл THF, додавали 2.5 мл напівконцентрованої водної сірчаної кислоти і реакційну суміш перемішували три год. при 20 °С. Суміш потім виливали в 60 мл насиченого водного розчину гідрокарбонату натрію і екстрагували етилацетатом. Очищення за допомогою колонкової хроматографії на силікагелі сумішшю дихлорометан/ацетон дає 1.2 г названої сполуки у вигляді безбарвної піни. Фіг. 2 показує CD спектр 11-[4-[(1R)-1,2-дигідроксіетил]-феніл]-20,20,21,21,21-пентафторо-17гідрокси-19-нор-17-прегна-4,9-дієн-3-ону. Вихід: 1.2 г = 61.2 % від теорії. 1 H-ЯМР (300 Мгц, CDCl3): д = 7.25 d (J=9 Гц, 2Н, арил); 7.15 d (J=9 Гц, 2Н, арил); 5.77 s (1H, Н-4); 4.74 m (1H, CHOH); 4.42 dbr (J=7 Гц, 1H, H-11); 3.69 m (1H, CH2OH); 3.59 m (1H, CH2OH); 0.56 s (3Н, H-18). Приклад 3а: Синтез 20,20,21,21,21-пентафторо-17-гідрокси-11-[4-(гідроксіацетил)-феніл]19-нор-17-прегна-4,9-дієн-3-ону a) 20,20,21,21,21-Пентафторо-11-[4-(гідроксіацетил)-феніл]-5,17-дигідрокси-19-нор-5,17прегн-9-ен-3-он 2,2-диметилпропан-1,3-дііл-кеталь При кімнатній температурі по краплях до 3.6 мг триоксиду хрому в 7 мл дихлорометану додавали 283 мкл терт-бутил гідропероксиду. Потім додавали по краплях розчин 450 мг сполуки, отриманої вище в Прикладі 1 с), у 7 мл дихлорометану. Суміш перемішували три год. при кімнатній температурі. Реакцію зупиняли додаванням диметилсульфіду. Суміш промивали насиченим водним розчином хлориду натрію, сушили над сульфатом натрію і концентрували у вакуумі. Хроматографія отриманого сирого продукту на силікагелі сумішшю гексан/етилацетат дає 87 мг названої сполуки у вигляді білої піни. 1 Н-ЯМР (300 Мгц, CDCl3): д = 7.83 d (J=9 Гц, 2Н, арил); 7.37 d (J=9 Гц, 2Н, арил); 4.84 m (2Н, CH2OH); 4.37 dbr (J=6.5 Гц, 1H, H-11); 3.53 m (2H, 3-кеталь); 3.47 m (J=11.0 Гц, 1H, 3-кеталь); 3.42 m (J=11.0 Гц, 1H, 3-кеталь); 1.04 s (3Н, 3-кеталь); 0.85 s (3Н, 3-кеталь); 0.49 s (3H, H-18). b) 20,20,21,21,21-Пентафторо-17-гідрокси-11-[4-(гідроксіацетил)-феніл]-19-нор-17-прегна4,9-дієн-3-он Аналогічно способу, описаному в Прикладі 1 d), 87 мг сполуки, описаної вище в 3 а), взаємодіє в 1.4 мл метанолу з 62 мкл напівконцентрованої водної сірчаної кислоти із одержанням 25 мг названої сполуки у вигляді безбарвної піни. 1 Н-ЯМР (300 Мгц, CDCl3): д = 7.86 d (J=9 Гц, 2Н, арил); 7.34 d (J=9 Гц, 2Н, арил); 5.81 s (1H, Н-4); 4.85 dbr (J=5 Гц, 2Н, CH2OH); 4.50 dbr (J=7 Гц, 1H, H-11); 3.50 tbr (J=5 Гц, 1H, ОН); 0.57 s (3Н, H-18). Приклад 3b: Альтернативний синтез 20,20,21,21,21-пентафторо-17-гідрокси-11-[4(гідроксіацетил)-феніл]-19-нор-17-прегна-4,9-дієн-3-ону a) [[2-(4-Бромофеніл)-1,3-діоксолан-2-іл]-метокси]-(1,1-диметилетил)-диметилсилан 73,5 г 2-(4-Бромофеніл)-1,3-діоксолан-2-метанолу розчиняли в 800 мл N,Nдиметилформаміду. Додавали 38.6 г імідазолу і 51.3 г трет-бутилдиметилхлоросилану. Суміш перемішували 12 год. при 23 °C. Після цього реакційну суміш виливали в насичений водний розчин бікарбонату натрію. Суміш перемішували додатково 30 хв., потім суміш двічі екстрагували етилацетатом. Об'єднані органічні шари промивали розсолом і сушили над сульфатом натрію. Сирий продукт очищали колонковою хроматографією. Отримували 103.21 г продукту (97.5 % від теорії). 1 H-ЯМР (300 Мгц, CDCl3): д = 7.45 d (7=9 Гц, 2Н, арил); 7.37 d (J=9 Гц, 2Н, арил); 4.08 m (2Н, кеталь); 3.84 m (2Н, кеталь), 0.83 s (9H, t-бутил-Si); - 0.05 s (6H, Me-Si). 5 UA 98312 C2 b) 11-[4-[2-[[[(1,1-Диметилетил)-диметилсиліл]-окси]-метил]-1,3-діоксолан-2-іл]-феніл]20,20,21,21,21-пентафторо-5,17-дигідрокси-19-нор-5,17-прегн-9-ен-3-он 2,2-диметилпропан1,3-дііл-кеталь 5 10 15 20 25 30 35 0.3 мл Дибромоетану додали до суспензії 6.22 г магнієвої стружки в 80 мл THF. Після цього повільно додали розчин 95.5 г 3ba) у 900 мл THF. Температуру підтримували нижче 50 °C. Після цього суміш перемішували при 50 °С протягом 1 год. Потім реакційну суміш охолоджували до 0 °C і додали 400 мг CuCl. Після продовження перемішуванні протягом додаткових 10 хв., при 0 °С додали розчин 20 г сполуки, описаної вище в 2с), у 200 мл THF. Суміш перемішували 2 год. при 0 °С і потім давали нагрітися до 23 °С. Перемішування продовжили протягом додаткових 12 год. при 23 °С. Потім реакційну суміш виливали в насичений розчин хлористого амонію. Суміш перемішували додаткові 30 хв. і після цього її екстрагували етилацетатом 3 рази. Об'єднані органічні шари промивали розсолом і сушили над сульфатом натрію. Сирий продукт очищали колонковою хроматографією. Отримували 31 г продукту (97 % від теорії). 1 Н-ЯМР (300 Мгц, CDCl3): д = 7.40 d (J=9 Гц, 2Н, арил); 7.20 d (J=9 Гц, 2Н, арил); 4.49 s (1H, OH); 4.36 dbr (J=5.5 Гц, 1H); 4.12 m (2H, кеталь), 3,90 (2Н, кеталь), 3.79 m (4 H, кеталь); 3.50 m (2H), 1.09 s (3H); 0.94 s (3H); 0.90 (9Н, t-бутил-Si), 0.57 s (3H); 0.00 (6Н, Me-Si). с) 20,20,21,21,21-Пентафторо-5,17-дигідрокси-11-[4-[2-(гідроксиметил)-1,3-діоксолан-2-іл]феніл]-19-нор-5, 17-прегн-9-ен-3-он 2,2-диметилпропан-1,3-дііл-кеталь До розчину 470 мг сполуки 3bb) у 5 мл THF додали тетрабутиламонійфторид (0.6 мл 1молярного розчину в THF). Суміш перемішували 2 год. при 23 °С. Потім реакційну суміш виливали в насичений розчин хлористого амонію. Суміш перемішували додаткові 30 хв. і після цього її екстрагували етилацетатом. Органічний шар промивали розсолом і сушили над сульфатом натрію. Сирий продукт очищали колонковою хроматографією. Отримували 318 мг продукту (80 % від теорії). 1 H-ЯМР (300 Мгц, CDCl3): д = 7.34 d (J=9 Гц, 2Н, арил); 7.18 d (J=9 Гц, 2Н, арил); 4.44 s (1H, OH); 4.30 dbr (J=6.5 Гц, 1H, H-11); 4.10 m (2Н, кеталь), 3.88 m (2Н, кеталь); 3.70 m (4Н, кеталь), 3,50 m (2H); 1.02 s (3H); 0.88 s (3H); 0.50 s (3H). d) 20,20,21,21,21-Пентафторо-17-гідрокси-11-[4-(гідроксіацетил)-феніл]-19-нор-17прегна-4,9-дієн-3-он з 3bb: До розчину 15 г сполуки, описаної вище в Прикладі 3bb, в 150 мл THF додавали 15 мл напівконцентрованої водної сірчаної кислоти. Суміш перемішували 2.5 год. при 23 °С. Після цього реакційну суміш виливали в насичений водний розчин гідрокарбонату натрію. Суміш перемішували додаткові 30 хв. і після цього екстрагували етилацетатом. Органічний шар промивали розсолом і сушили над сульфатом натрію. Сирий продукт очищали колонковою хроматографією. Отримували 7.99 г продукту (80 % від теорії). 6 UA 98312 C2 5 10 15 d) 20,20,21,21,21-Пентафторо-17-гідрокси-11-[4-(гідроксіацетил)-феніл]-19-нор-17прегна-4,9-дієн-3-он з 3bc: Взаємодія 300 мг 3bc з напівконцентрованою водною сірчаною кислотою в THF аналогічно способу, описаному вище в Прикладі 3d, дає мг (85 % від теорії) продукту. Приклад 4: Аборт на самках щурів Антигістогенна дія антагоністів прогестеронового рецептора згідно винаходу тестувалася на вагітних щурах (6 щурів в групі) на 5 і 7 дні після спаровування в стандартних житлових і харчових умовах. Після успішного спаровування, вагітних тварин (присутність сперми в мазку з піхви на 1 день вагітності = d1 р.с.) випадково відбирали і ділили на групу обробки і контрольну групу. Кожній тварині потім вводили підшкірно 1.5 мг/кг досліджуваної речовини (11-[4-(1,2-дигідроксіетил)феніл]-20,20,21,21,21-пентафторо-17-гідрокси-19-нор-17-прегна-4,9-дієн-3-ону згідно Прикладу 1 або 20,20,21,21,21-пентафторо-17-гідрокси-11-[4-(гідроксіацетил)-феніл]-19-нор-17-прегна4,9-дієн-3-ону згідно Прикладу 3) або 1.0 мл/кг наповнювача (бензилбензоат/касторова олія: 1+4 [об./об.]) щодня з 5 по 7 день (d5 - d7 p.c). Розтин здійснювали на 9 день (d9 p.c). Як характеристику антигістогенної дії, матка досліджувалася на наявність сайтів імплантацій. Повна відсутність сайтів імплантацій, також як наявність патологічних, геморагічних або інших анормальних сайтів імплантацій на 9 день (d9 p.c.) оцінювалися як аборти. Результати аборту показані в Таблиці 1. 20 Таблиця 1 Результати аборту Денна доза [мг/кг] Досліджувана речовина Відсоток аборту [%] 1.5 100 1.5 100 11-[4-(1,2-Дигідроксіетил)-феніл]-20,20,21,21,21-пентафторо-17гідрокси-19-нор-17-прегна-4,9-дієн-3-он (Приклад 1) 20,20,21,21,21-Пентафторо-17-гідрокси-11-[4-(гідроксіацетил)феніл]-19-нор-17-прегна-4,9-дієн-3-он (Приклад 3) 25 30 35 Приклад 5: Визначення індексу McPhail на кроликах Антигістогенний ефект антагоністів прогестеронового рецептора згідно винаходу тестувався на 35-денних кроликах в стандартних житлових і харчових умовах. Як підготовчі заходи, тваринам вводили підшкірно 5.0 мкг/кг/день 17-естрадіолу з 1 по 4 день. Щоб визначити антигістогенний ефект, тваринам вводили підшкірно з 7 по 10 день 0.2 мг/кг/день прогестерону і 3 мг/кг/день досліджуваної речовини (11-[4-(1,2-дигідроксіетил)феніл]-20,20,21,21,21-пентафторо-17-гідрокси-19-нор-17-прегна-4,9-дієн-3-ону згідно Прикладу 1 або 20,20,21,21,21-пентафторо-17-гідрокси-11-[4-(гідроксіацетил)-феніл]-19-нор-17-прегна4,9-дієн-3-ону згідно Прикладу 3) одночасно. Як наповнювач використовували суміш бензилбензоату і касторової олії в співвідношенні 1+4 (об./об.). Розтин здійснювали на 11 день після початку дослідження. Матку видаляли і визначали гістологію. Індекс McPhail (міру гландулярної диференціації) визначали способом оптичної мікроскопії (оцінювання: 1 = немає гландулярних диференціації; 4 = максимальна гландулярна диференціація) як характеристику антигістогенного ефекту (зменшення гландулярної диференціації, викликане прогестероном). Отриманий індекс McPhail показаний в Таблиці 2. Таблиця 2 Індекс McPhail Денна доза [мг/кг] Досліджувана речовина 11-[4-(1,2-Дигідроксіетил)-феніл]-20,20,21,21,21-пентафторо17-гідрокси-19-нор-17-прегна-4,9-дієн-3-он (Приклад 1 + прогестерон) 20,20,21,21,21-Пентафторо-17-гідрокси-11-[4-(гідроксіацетил)феніл]-19-нор-17-прегна-4,9-дієн-3-он (Приклад 3 + прогестерон) 7 Індекс McPhail [середня величина] 3.0 + 0.2 1.0 3.0 + 0.2 1.0 UA 98312 C2 5 10 Приклад 6а: Метаболічна стабільність 11-[4-(1,2-дигідроксіетил)-феніл]-20,20,21,21,21пентафторо-17-гідрокси-19-нор-17-прегна-4,9-дієн-3-ону і 20,20,21,21,21-пентафторо-17гідрокси-11-[4-(гідроксіацетил)-феніл]-19-нор-17-прегна-4,9-дієн-3-ону у людських мікросомах печінки (HLM) Людську печінкову мікросому (HLM) використовували для оцінки метаболічної стабільності речовин загальної формули І. Вирощування проводили в двох екземплярах з HLM і NADPH-генеруючими системами, використовуючи баню, що струшується, при 37 °C. Інкубаційна суміш (що складається з розчину коферменту, фосфатно-калієвого буферу і мікросомного препарату) була свіжоприготована згідно Таблиці нижче. Буфер Відтворення порядку в буфері: NADP Глюкоза-6-фосфат Глюкоза-6-фосфат дегідрогеназа MgCl2 KCl Концентрація протеїну (HLM) 15 20 25 30 Фосфат калію, 100 мМ, рН 7.4 1.2 мМ 8.0 мМ 1.4 од./мл 5.0 мМ 38.0 мМ 1.0 мг/мл Інкубаційний об'єм складав 0.25 мл. Інкубаційну суміш преінкубували протягом трьох хв. при 37 °C. Взаємодію починали додаванням досліджуваної речовини (кінцева концентрація 50 мкМ). Взаємодія закінчувалася після інкубації протягом 60 хв. додаванням 250 мкл метанолу і суміш потім центрифугували для осадження протеїну. Зразки зберігали при -18 °С для подальшого ОФ-ВЕРХ аналізу. Згідно ОФ-ВЕРХ аналізу, близько 70 % використаного 11-[4-(1,2-дигідроксіетил)-феніл]20,20,21,21,21-пентафторо-17-гідрокси-19-нор-17-прегна-4,9-дієн-3-ону і близько 80 % використаного 20,20,21,21,21-пентафторо-17-гідрокси-11-[4-(гідроксіацетил)-феніл]-19-нор17-прегна-4,9-дієн-3-ону були отримані назад в надосадковій рідині. Приклад 6b: Метаболічна стабільність 11-(4-ацетилфеніл)-20,20,21,21,21-пентафторо-17гідрокси-19-нор-17-прегна-4,9-дієн-3-ону у людських мікросомаж печінки (HLM) Людську печінкову мікросому (HLM) використовували для оцінки метаболічної стабільності речовин загальної формули І. Вирощування проводили в двох екземплярах з HLM і NADPH-генеруючими системами, використовуючи баню, що струшується, при 37 °С. Інкубаційна суміш (що складається з розчину коферменту, фосфатно-калієвого буферу і мікросомного препарату) була свіжоприготована згідно Таблиці нижче. Буфер Відтворення порядку в буфер: NADP Глюкоза-6-фосфат Глюкоза-6-фосфат дегідрогеназа MgCl2 KCl Концентрація протеїну (HLM) 35 40 Фосфат калію, 100 мМ, рН 7.4 1.2 мМ 8.0 мМ 1.4 од./мл 5.0 мМ 38.0 мM 0.4 мг/мл Інкубаційний об'єм складав 0.25 мл. Інкубаційну суміш преінкубували протягом трьох хв. при 37 °C. Взаємодію починали додаванням досліджуваної речовини (кінцева концентрація 10 мкМ). Взаємодія закінчувалася після інкубації протягом 60 хв. додаванням 250 мкл метанолу і суміш потім центрифугували для осадження протеїну. Зразки зберігали при -18 °С для подальшого ОФ-ВЕРХ аналізу. Згідно ОФ-ВЕРХ аналізу, 60 % використаного 11-(4-ацетилфеніл)-20,20,21,21,21пентафторо-17-гідрокси-19-нор-17-прегна-4,9-дієн-3-ону було отримано назад в надосадковій рідини. Приклад 7: Антигістогенна дія 11-[4-(1,2-дигідроксіетил)-феніл]-20,20,21,21,21-пентафторо17-гідрокси-19-нор-17-прегна-4,9-дієн-3-ону і 20,20,21,21,21-пентафторо-17-гідрокси-11-[4 8 UA 98312 C2 5 10 15 20 25 30 (гідроксіацетил)-феніл]-19-нор-17-прегна-4,9-дієн-3-ону на стабільну трансфікацію людських нейробластомних клітин (клітини SK-N-MC) з рецептором людського прогестерону А або прогестерону В і на MTV-LUC репортерку конструкцію. SK-N-MC клітини (людські нейробластомні клітини), стабільно трансфіковані плазмідами, які експресують людський прогестероновий рецептор В (pRChPR-B-neo) або людський прогестероновий рецептор А (pRChPR-A-neo) і репортерну конструкцію (pMMTV-LUC), інкубували протягом 24 год., або у відсутності (негативний контроль) або у присутності зростаючих кількостей 11-[4-(1,2-дигідроксіетил)-феніл]-20,20,21,21,21-пентафторо-17гідрокси-19-нор-17-прегна-4,9-діен-3-ону або 20,20,21,21,21-пентафторо-17-гідрокси-11-[4(гідроксіацетил)-феніл]-19-нор-17-прегна-4,9-дієн-3-ону (0.01 нмоль/л, 0.1 нмоль/л, 1 нмоль/л, 10 нмоль/л, 100 нмоль/л і 1 мкмоль/л), з метою визначити агоністичну ефективність. Як позитивний контроль стимулювання репортерного гена, клітини обробляли штучним гістогенним промегестоном (0.01 нмоль/л, 0.1 нмоль/л, 1 нмоль/л, 10 нмоль/л, 100 нмоль/л і 1 мкмоль/л). Щоб визначити антагоністичну активність, клітини обробляли 0.1 нмоль/л промегестону і додатково зростаючими кількостями 11-[4-(1,2-дигідроксіетил)-феніл]-20,20,21,21,21пентафторо-17-гідрокси-19-нор-17-прегна-4,9-дієн-3-ону або 20,20,21,21,21-пентафторо-17гідрокси-11-[4-(гідроксіацетил)-феніл]-19-нор-17-прегна-4,9-дієн-3-ону (0.01 нмоль/л, 0.1 нмоль/л, 1 нмоль/л, 10 нмоль/л, 100 нмоль/л і 1 мкмоль/л). Як позитивний контроль пригноблення транскрипції репортерного гена, клітини інкубували зростаючими кількостями антагоніста прогестеронового рецептора 11-(4-ацетилфеніл)-20,20,21,21,21-пентафторо-17гідрокси-19-нор-17-прегна-4,9-дієн-3-ону (1 пмоль/л, 0.01 нмоль/л, 0.1 нмоль/л, 1 нмоль/л, 10 нмоль/л і 100 нмоль/л). Активність LUC репортерного гена (LUC = люцифераза) визначали в клітинних лізатах і визначали як RLU (relative light units - відносна світлова одиниця). Всі виміряні величини дані як % ефективності (відносно LUC активності як середнє плюс/мінус допустиме відхилення (n = 3 експерименти)) і як EC50 або IC50 концентрації. Уточнена сторінка а) Агоністична активність : Ні 11-[4-(1,2-дигідроксіетил)-феніл]-20,20,21,21,21-пентафторо-17-гідрокси-19-нор-17прегна-4,9-дієн-3-он ні 20,20,21,21,21-пентафторо-17-гідрокси-11-[4-(гідроксіацетил)-феніл]-19нор-17-прегна-4,9-дієн-3-он не проявляють стимулювання LUC активності PR-A або PR-B (на відміну від промегестонового позитивного контролю, який стимулює репортерний ген залежно від дози). Таблиця 3 показує агоністичну активність двох досліджуваних речовин і промегестону. Таблиця 3 Агоністична активність 11-[4-(1,2-дигідроксіетил)-феніл]-20,20,21,21,21-пентафторо-17гідрокси-19-нор-17-прегна-4,9-дієн-3-ону або 20,20,21,21,21-пентафторо-17-гідрокси-11-[4(гідроксіацетил)-феніл]-19-нор-17-прегна-4,9-дієн-3-ону Сполуки Промегестон 11-[4-(1,2-Дигідроксіетил)-феніл]20,20,21,21,21-пентафторо-17-гідрокси19-нор-17-прегна-4,9-дієн-3-он 20,20,21,21,21-Пентафторо-17-гідрокси11-[4-(гідроксіацетил)-феніл]-19-нор17-прегна-4,9-дієн-3-он 35 Прогестероновий рецептор Прогестероновий A (PR-A) рецептор В (PR-B) Активність Активність Ефективність Ефективність EC50 EC50 [%] [%] [нмоль/л] [нмоль/л] 0.23±0.03 100 0.03±0.00 100 (n=3) (n=3) (n=3) (n=3) 0±0 (n=3) немає дії (n=3) 0±0 (n=3) немає дії (n=3) 0±0 (n=3) немає дії (n=3) 0±0 (n=3) немає ди (n=3) b) антагоністична активність: 11-[4-(1,2-Дигідроксіетил)-феніл]-20,20,21,21,21-пентафторо-17-гідрокси-19-нор-17прегна-4,9-дієн-3-он і 20,20,21,21,21-пентафторо-17-гідрокси-11-[4-(гідроксіацетил)-феніл]-19нор-17-прегна-4,9-дієн-3-он показують залежне від дозування інгібування LUC активності, що стимулює 0.1 нмоль/л промегестону (100 %) для обох ізоформ прогестеронових рецепторів. 9 UA 98312 C2 Таблиця 4 показує агоністинну активність двох досліджуваних речовин у порівнянні з 11-(4ацетилфеніл)-20,20,21,21,21-пентафторо-17-гідрокси-19-нор-17-прегна-4,9-дієн-3-оном. Таблиця 4 Антагоністична активність 11-[4-(1,2-дигідроксіетил)-феніл]-20,20,21,21,21-пентафторо-17гідрокси-19-нор-17-прегна-4,9-дієн-3-ону або 20,20,21,21,21-пентафторо-17-гідрокси-11-[4(гідроксіацетил)-феніл]-19-нор-17-прегна-4,9-дієн-3-ону Прогестероновий рецептор Прогестероновий рецептор A (PR-A) В (PR-B) Активність Ефективність Активність Ефективність IC50 [нмоль/л] [%] IC50 [нмоль/л] [%] Сполуки 11-(4-Ацетилфеніл)-20,20,21,21,21пентафторо-17-гідрокси-19-нор-17прегна-4,9-дієн-3-он 11-[4-(1,2-Дигідроксіетил)-феніл]20,20,21,21,21-пентафторо-17гідрокси-19-нор-17-прегна-4,9-дієн-3он 20,20,21,21,21-Пентафторо-17гідрокси-11-[4-(гідроксіацетил)феніл]-19-нор-17-прегна-4,9-дієн-3он 5 10 15 0.014±0.01 (n=2) 100±0 (n=2) 0.02±0.01 (n=3) 100±0 (n=3) 1.87±0.23 (n=3) 100±0 (n=3) 3.47±0.46 (n=3) 100±0 (n=3) 0.18±0.06 (n=3) 100±0 (n=3) 0.28±0.08 (n=3) 100±0 (n=3) Ці дані показують, що 11-[4-(1,2-дигідроксіетил)-феніл]-20,20,21,21,21-пентафторо-17гідрокси-19-нор-17-прегна-4,9-дієн-3-он і 20,20,21,21,21-пентафторо-17-гідрокси-11-[4(гідроксіацетил)-феніл]-19-нор-17-прегна-4,9-дієн-3-он є абсолютними антагоністами обоє ізоформ прогестеронових рецепторів в SK-N-MC клітинах, які стабільно експресовані прогестероновим рецептором А або прогестероновим рецептором В. Жодна сполуки не проявляє якої-небудь вибірковості відносно однієї ізоформи прогестеронового рецептора. Проте, 11-[4-(1,2-дигідроксіетил)-феніл]-20,20,21,21,21-пентафторо-17-гідрокси-19-нор-17прегна-4,9-дієн-3-он у близько 130 разів менш активний, ніж 11-(4-ацетилфеніл)20,20,21,21,21-пентафторо-17-гідрокси-19-нор-17-прегна-4,9-дієн-3-он по відношенню до прогестеронових рецепторів. 20,20,21,21,21-Пентафторо-17-гідрокси-11-[4-(гідроксіацетил)феніл]-19-нор-17-прегна-4,9-дієн-3-он у близько 13 разів слабкіший, ніж 11 -(4-ацетилфеніл)20,20,21,21,21-пентафторо-17-гідрокси-19-нор-17-прегна-4,9-дієн-3-он. Стабільно трансфіковані клітинні лінії експресуютьприблизно 500 фМ (фемтомоль) PR-A або PR-B. ФОРМУЛА ВИНАХОДУ 20 1. Антагоніст прогестеронового рецептора загальної формули І: R1 R2 HO OH CH3 C F 2 5 H H O 25 , формула І у якій R1 може бути атомом водню і R2 гідроксильною групою або R1 і R2 разом можуть бути оксогрупою. 2. Антагоніст прогестеронового рецептора загальної формули І за п. 1, що являє собою 11 -[4(1,2-дигідроксіетил)феніл]-20,20,21,21,21-пентафторо-17-гідрокси-19-нор-17 -прегна-4,9-дієн-3он. 10 UA 98312 C2 5 10 15 20 25 30 35 40 45 50 3. Антагоніст прогестеронового рецептора загальної формули І за п. 1, що являє собою 11 -[4[(1R)-1,2-дигідроксіетил]феніл]-20,20,21,21,21-пентафторо-17-гідрокси-19-нор-17 -прегна-4,9дієн-3-он. 4. Антагоніст прогестеронового рецептора загальної формули І за п. 1, що являє собою 11 -[4[(1S)-1,2-дигідроксіетил]феніл]-20,20,21,21,21-пентафторо-17-гідрокси-19-нор-17 -прегна-4,9дієн-3-он. 5. Антагоніст прогестеронового рецептора загальної формули І за п. 1, що являє собою 20,20,21,21,21-пентафторо-17-гідрокси-11 -[4-(гідроксіацетил)феніл]-19-нор-17 -прегна-4,9дієн-3-он. 6. Сполука за будь-яким з пп. 1-5 в ізольованій формі, переважно в твердій формі. 7. Сполука за будь-яким з пп. 3 або 4, де вона в значній мірі вільна від іншої сполуки за п. 3 або 4. 8. Ліки, що містять антагоністи прогестеронового рецептора за п. 1. 9. Ліки за п. 8, що містять 11 -[4-(1,2-дигідроксіетил)феніл]-20,20,21,21,21-пентафторо-17гідрокси-19-нор-17 -прегна-4,9-дієн-3-он. 10. Ліки за п. 8, що містять 11 -[4-[(1R)-1,2-дигідроксіетил]феніл]-20,20,21,21,21-пентафторо-17гідрокси-19-нор-17 -прегна-4,9-дієн-3-он. 11. Ліки за п. 8, що містять 11 -[4-[(1S)-1,2-дигідроксіетил]феніл]-20,20,21,21,21-пентафторо-17гідрокси-19-нор-17 -прегна-4,9-дієн-3-он. 12. Ліки за п. 8, що містять 20,20,21,21,21-пентафторо-17-гідрокси-11 -[4(гідроксіацетил)феніл]-19-нор-17 -прегна-4,9-дієн-3-он. 13. Ліки за будь-яким з пп. 8-12, придатні для перорального введення, переважно у вигляді одиничної дозованої форми. 14. Ліки за будь-яким з пп. 8-12, які містять від 0,01 мг до 100 мг сполуки за п. 1. 15. Застосування антагоністів прогестеронового рецептора за п. 1 для одержання ліків для лікування ендометріозу, міом або гормонозалежних пухлин, головним чином карциноми молочної залози, і для фармацевтичних препаратів для жіночої контрацепції. 16. Застосування за п. 15, де антагоністом прогестеронового рецептора є 11 -[4-(1,2дигідроксіетил)феніл]-17 -гідрокси-17 -(1,1,2,2,2-пентафторетил)естра-4,9-дієн-3-он. 17. Застосування за п. 15, де антагоністом прогестеронового рецептора є 11 -[4-[(1R)-1,2дигідроксіетил]феніл]-20,20,21,21,21-пентафторо-17-гідрокси-19-нор-17 -прегна-4,9-дієн-3-он. 18. Застосування за п. 15, де антагоністом прогестеронового рецептора є 11 -[4-[(1S)-1,2дигідроксіетил]феніл]-20,20,21,21,21-пентафторо-17-гідрокси-19-нор-17 -прегна-4,9-дієн-3-он. 19. Застосування за п. 15, де антагоністом прогестеронового рецептора є 20,20,21,21,21пентафторо-17-гідрокси-11 [4-(гідроксіацетил)феніл]-19-нор-17 -прегна-4,9-дієн-3-он. 20. 11 -(4-Етенілфеніл)-20,20,21,21,21-пентафторо-5,17-дигідрокси-19-нор-5 ,17 -прегн-9-ен3-он 2,2-диметилпропан-1,3-діїлкеталь як інтермедіат при одержанні антагоніста прогестеронового рецептора загальної формули І. 21. 11 -[4-(1,2-Дигідроксіетил)феніл]-20,20,21,21,21-пентафторо-5,17-дигідрокси-19-нор5 ,17 -прегн-9-ен-3-он 2,2-диметилпропан-1,3-діїлкеталь як інтермедіат при одержанні антагоніста прогестеронового рецептора загальної формули І. 22. 20,20,21,21,21-Пентафторо-17-гідроксі-5,10 -епокси-19-нор-5 ,17 -прегн-9-(11)-ен-3-он 2,2-диметилпропан-1,3-діїлкеталь як інтермедіат при одержанні антагоніста прогестеронового рецептора загальної формули І. 23. 11 -{4-[(4R)-2,2-диметил-1,3-діоксолан-4-іл]феніл}-20,20,21,21,21-пентафторо-5,17дигідрокси-19-нор-5 ,17 -прегн-9-ен-3-он 2,2-диметилпропан-1,3-діїлкеталь як інтермедіат при одержанні антагоніста прогестеронового рецептора загальної формули І. 24. 11 -[4-[2-[[[(1,1-Диметилетил)диметилсиліл]окси]метил]-1,3-діоксолан-2-іл]феніл]20,20,21,21,21-пентафторо-5,17-дигідрокси-19-нор-5 ,17 -прегн-9-ен-3-он 2,2-диметилпропан1,3-діїлкеталь як інтермедіат при одержанні антагоніста прогестеронового рецептора 20,20,21,21,21-пентафторо-17-гідрокси-11 -[4-(гідроксіацетил)феніл]-19-нор-17 -прегна-4,9дієн-3-ону. 25. 20,20,21,21,21-Пентафторо-5,17-дигідрокси-11 -[4-[2-(гідроксиметил)-1,3-діоксолан-2іл]феніл]-19-нор-5 ,17 -прегн-9-ен-3-он 2,2-диметилпропан-1,3-діїлкеталь як інтермедіат при 11 UA 98312 C2 одержанні антагоніста прогестеронового рецептора 20,20,21,21,21-пентафторо-17-гідрокси11 -[4-(гідроксіацетил)феніл]-19-нор-17 -прегна-4,9-дієн-3-ону. Комп’ютерна верстка А. Крулевський Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 12
ДивитисяДодаткова інформація
Назва патенту англійськоюProgesterone receptor antagonists
Автори англійськоюFuhrmann Ulrike, Schmidt, Anja, Cleve, Arwed, Petrov, Orlin, Garke, Gunnar, Pruehs, Stefan, Brudny-Kloeppel, Margarete, Rottmann, Antje, Hasselmann, Rainer, Schultze-Mosgau, Marcus, Moeller, Carsten
Назва патенту російськоюАнтагонисты прогестеронового рецептора
Автори російськоюФурманн Ульрике, Шмидт Аня, Клеве Арвед, Петроф Орлин, Гарке Гуннар, Прюс Штефан, Брудни-Кльоппель Маргарете, Роттманн Антье, Хассельманн Райнер, Шульце-Мосгау Маркус, Мьоллер Карстен
МПК / Мітки
МПК: C07J 1/00, C07J 51/00, C07J 21/00, A61P 5/36, A61K 31/567
Мітки: рецептора, прогестеронового, антагоністи
Код посилання
<a href="https://ua.patents.su/14-98312-antagonisti-progesteronovogo-receptora.html" target="_blank" rel="follow" title="База патентів України">Антагоністи прогестеронового рецептора</a>
Попередній патент: Сполука 2-алкіліндазолу для лікування певних розладів, пов’язаних з цнс, спосіб її одержання (варіанти) та фармацевтична композиція на її основі
Наступний патент: Бітумінізована покрівельна плитка та спосіб її одержання
Випадковий патент: Склад для просочування фільтруючого матеріалу












