Амінопіридинові похідні із селективною інгібуючою активністю у відношенні аврори а
Номер патенту: 95972
Опубліковано: 26.09.2011
Автори: Міта Такасі, Като Тецуя, Масутані Коута, Ноносіта Кацумаса, Охкубо Міцуру, Івасава Йосіказу, Каванісі Нобухіко
Формула / Реферат
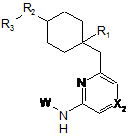
1. Сполука загальної формули І:
 , (І)
, (І)
де:
R1 являє собою атом водню, F, CN, COORa1, CONRa2Ra2', NRa3СORa3' CONRa4ORa4', NRa5CONRa5'Ra5", NRa6COORa6', SO2NRa7Ra7', NRa8SO2Ra8', CORa9, SO2Ra10, NO2, ORa11 або NRa12Ra12',
де:
кожний з Ra1, Ra3, Ra4, Ra5, Ra6 і Ra8 незалежно являє собою атом водню або нижчий алкіл;
кожний 3 Ra2, Ra2', Ra5', Ra5", Ra7, Ra7', Ra12' i Ra12' незалежно являє собою атом водню або нижчий алкіл, що може бути заміщений одним або декількома однаковими або різними замісниками, вибраними з <групи-замісника L1>, де <група-замісник L1> являє собою атом галогену, гідрокси, нітро, ціано, аміно, карбамоїл, аміносульфоніл, іміно, нижчу алкіламіногрупу, ди(нижчий)алкіламіногрупу, нижчий алкілсульфоніл, нижчу алкілсульфоніламіногрупу, нижчий алкокси, нижчий алкоксикарбоніл, нижчу алкоксикарбоніламіногрупу, нижчий алканоїл, нижчий алканоїлокси, нижчий алкілтіо і карбоксил; однак за умови, що кожні з Ra2 і Ra2'; Ra5' і Ra5"; Ra7 і Ra7'; Ra12 і Ra12', незалежно, разом з атомом азоту, до якого вони приєднані, можуть утворювати 5-членну або 6-членну ароматичну або аліфатичну гетероциклічну групу, що може бути заміщена одним або декількома однаковими або різними замісниками, вибраними з <групи-замісника L2>, де <група-замісник L2> являє собою атом галогену, гідрокси, аміно і гідроксиметил;
кожний з Ra3', Ra4', Ra6', Rа8', Ra9, Ra10 i Ra11 незалежно являє собою атом водню або нижчий алкіл, що може бути заміщений одним або декількома однаковими або різними замісниками, вибраними з <групи-замісника L1>; або R1 являє собою нижчий алкіл, що може бути заміщений одним або декількома однаковими або різними замісниками, вибраними з <групи-замісника М>, де <група-замісник М> являє собою атом галогену, гідрокси, нітро, ціано, аміно, карбамоїл, аміносульфоніл, іміно, нижчу алкіламіногрупу, ди(нижчий)алкіламіногрупу, нижчий алкілсульфоніл, нижчу алкілсульфоніламіногрупу, нижчий алкокси, нижчий алкоксикарбоніл, нижчу алкоксикарбоніламіногрупу, нижчий алканоїл, нижчий алканоїлокси, нижчий алкілтіо і карбоксил; або
R1 являє собою гетероциклічну групу, вибрану з наступних груп, де Y1 і Y2 є однаковими або різними, і кожний з них являє собою атом водню або нижчий алкіл, що може бути заміщений:
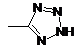 ,
, 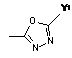 ,
, ![]() ,
,
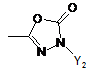 ,
, 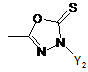 ,
, 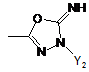 ,
,
R2 являє собою О, S, SO, SO2, NH, NRb або CRс1Rс2, де Rb являє собою нижчий алкіл, що може бути заміщений, і Rс1 і Rc2, що можуть бути однаковими або різними, являють собою атом водню або нижчий алкіл;
R3 являє собою феніл, що може бути заміщений;
Х2 являє собою СН, СХ2а або N, де:
Х2а являє собою нижчий алкіл; або
Х2а являє собою замісник, вибраний із <групи-замісника А1>, або нижчий алкіл, що заміщений одним або декількома однаковими або різними замісниками, вибраними з <групи-замісника А1>, де <група-замісник А1> являє собою атом галогену; ціано; гідрокси; нижчу алкіламіногрупу; ди(нижчий)алкіламіногрупу; нижчий алкокси, що може бути заміщений однією або декількома гідроксигрупами; нижчий алкілтіо і нижчий алкілсульфоніл; або
Х2а являє собою COORx1, CONRx2Rx3, NHCORx1, NHCONRx2Rx3, NHSO2NRx2Rx3, NRx4Rx5 або CH2NRx4Rx5, де:
Rx1 являє собою атом водню або нижчий алкіл, що може бути заміщений;
кожний з Rx2 і Rx3, що можуть бути однаковими або різними, являє собою атом водню, нижчий алкіл, який може бути заміщений, або циклоалкіл, що може бути заміщений; або альтернативно Rx2 і Rx3 разом з атомом азоту, до якого вони приєднані, утворюють 5- або 6-членну аліфатичну гетероциклічну групу, яка містить щонайменше один атом, вибраний з N, О і S, і яка може бути заміщена; і
Rx4 і Rx5, що можуть бути однаковими або різними, являють собою атом водню, нижчий алкіл, що може бути заміщений, або циклоалкіл, що може бути заміщений; або
Х2а являє собою 5- або 6-членну аліфатичну гетероциклічну групу, яка містить щонайменше один атом, вибраний з N, О і S, і яка може бути заміщена, в якій два атоми водню, що приєднані до одного і того самого атома вуглецю аліфатичної гетероциклічної групи, можуть бути заміщені оксогрупою, а сусідні два атоми вуглецю, що складають аліфатичне гетероциклічне кільце, можуть утворювати подвійний зв'язок; або нижчий алкіл, що заміщений аліфатичною гетероциклічною групою; або
Х2а являє собою 5- або 6-членну ароматичну гетероциклічну групу, яка містить щонайменше один атом, вибраний з N, О і S, і яка може бути заміщена; або нижчий алкіл, що заміщений ароматичною гетероциклічною групою;
W являє собою наступний залишок:
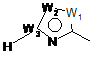 ,
,
де:
W1 являє собою СН, N, NH, О або S;
W2 являє собою СН, CW2a, N, NW2a, О або S, де кожний W2a і W2b незалежно являє собою атом водню, атом галогену, ціано, нижчий алкіл, що містить від одного до двох атомів вуглецю, циклоалкіл, що містить від трьох до п'яти атомів вуглецю, або нижчий алкіл, що містить від одного до двох атомів вуглецю, що може бути заміщений одним або декількома атомами галогену;
W3 являє собою С або N; і
щонайменше один з W1, W2 і W3 являє собою атом вуглецю; однак два з W1, W2 i W3 одночасно не можуть являти собою О і S,
або її фармацевтично прийнятна сіль або складний ефір.
2. Сполука за п. 1 або її фармацевтично прийнятна сіль або складний ефір, де W вибраний з:
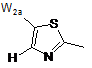 ,
, 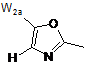 ,
, 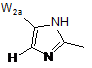 ,
,
 ,
,  ,
, 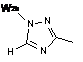 ,
, 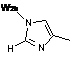 ,
,
 ,
, 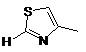 ,
, 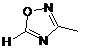 ,
, 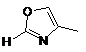 ,
,
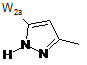 ,
,  ,
,  .
.
3. Сполука за п. 2 або її фармацевтично прийнятна сіль або складний ефір, де R3 являє собою феніл, 2-е і 3-е положення якого заміщені двома однаковими або різними замісниками, вибраними з F, Сl, CF3 і CN.
4. Сполука за п. 3 або її фармацевтично прийнятна сіль або складний ефір, де <група-замісник L1> являє собою атом галогену, гідрокси, аміно, карбамоїл, нижчу алкіламіногрупу, ди(нижчий)алкіламіногрупу і нижчий алкокси; і <група-замісник М> являє собою гідрокси, карбамоїл, аміносульфоніл, нижчу алкілсульфоніламіногрупу і карбоксил.
5. Сполука за п. 4 або її фармацевтично прийнятна сіль або складний ефір, де Х2 являє собою СН або N.
6. Сполука за п. 5 або її фармацевтично прийнятна сіль або складний ефір, де R1 являє собою ОН, СООН або CONRa2Ra2’, де Ra2 і Ra2' є однаковими або різними, і кожний з них являє собою атом водню або нижчий алкіл, що містить від одного до трьох атомів вуглецю; або R1 вибраний з наступного:
![]() ,
, ![]() ,
,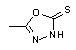 ,
,
і R2 являє собою О, S, SO або SO2.
7. Сполука за п. 6 або її фармацевтично прийнятна сіль або складний ефір,
де: W вибраний з:
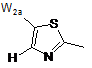 ,
,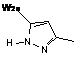 ,
,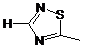 ,
,
де W2a являє собою атом водню, атом галогену, ціано або метил, що може бути заміщений одним-трьома атомами фтору.
8. Сполука за п. 7 або її фармацевтично прийнятна сіль або складний ефір, де W являє собою будь-який з наступних залишків:
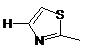 ,
,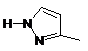 .
.
9. Сполука, що являє собою:
(a) транс-4-(3-хлор-2-фторфенокси)-1-((6-(1,3-тіазол-2-іламіно)піридин-2-іл)метил)циклогексанкарбонову кислоту;
(b) транс-4-(2-фтор-3-(трифторметил)фенокси)-1-((6-(1,3-тіазол-2-іламіно)піридин-2-іл)метил)циклогексанкарбонову кислоту;
(c) транс-4-(2,3-дихлорфенокси)-1-((6-(1,3-тіазол-2-іламіно)піридин-2-іл)метил)циклогексанкарбонову кислоту;
(d) транс-4-(2-фтор-3-(трифторметил)фенокси)-1-((6-(1Н-піразол-3-іламіно)піридин-2-іл)метил)циклогексанкарбонову кислоту;
(e) транс-4-(3-хлор-2-фторфенокси)-1-((6-(1Н-піразол-3-іламіно)піразин-2-іл)метил)циклогексанкарбоксамід;
(f) 5-(транс-4-(2-фтор-3-(трифторметил)фенокси)-1-((6-(1Н-піразол-3-іламіно)піридин-2-іл)метил)циклогексил)-1,3,4-оксадіазол-2(3Н)-он;
(g) 5-(транс-4-(3-хлор-2-фторфенокси)-1-((6-(1Н-піразол-3-іламіно)піридин-2-іл)метил)циклогексил)-1,3,4-оксадіазол-2(3Н)-он;
(h) 5-(транс-4-(3-хлор-2-фторфенокси)-1-((6-(1Н-піразол-3-іламіно)піразин-2-іл)метил)циклогексил)-1,3,4-оксадіазол-2(3Н)-он або
(і) 5-(транс-4-((2,3-дихлорфеніл)сульфоніл)-1-((6-(1Н-піразол-3-іламіно)піридин-2-іл)метил)циклогексил)-1,3,4-оксадіазол-2(3Н)-он;
або її фармацевтично прийнятна сіль або складний ефір.
10. Сполука, яка являє собою
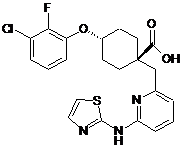
транс-4-(3-хлор-2-фторфенокси)-1-((6-(1,3-триазол-2-іламіно)піридин-2-іл)метил)циклогексанкарбонову кислоту,
або її фармацевтично прийнятна сіль або складний ефір.
11. Сполука, яка являє собою

5-(транс-4-(3-хлор-2-фторфенокси)-1-((6-(1Н-піразол-3-іламіно)піридин-2-іл)метил)циклогексил)-1,3,4-оксадіазол-2(3Н)-он,
або її фармацевтично прийнятна сіль або складний ефір.
12. Фармацевтична композиція, що містить разом з фармацевтично прийнятним носієм або розріджувачем щонайменше одну сполуку за п. 1 як активний інгредієнт.
13. Селективний інгібітор Аврори А, що містить разом з фармацевтично прийнятним носієм або розріджувачем щонайменше одну сполуку за п. 1 як активний інгредієнт.
14. Протипухлинний засіб, що містить разом з фармацевтично прийнятним носієм або розріджувачем щонайменше одну сполуку за п. 1 як активний інгредієнт.
15. Комбінований препарат для одночасного, окремого або послідовного введення при лікуванні раку, який містить два окремих препарати:
*препарат, що містить разом з фармацевтично прийнятним носієм або розріджувачем сполуку за п. 1; і
*препарат, що містить разом з фармацевтично прийнятним носієм або розріджувачем один протипухлинний засіб, вибраний із групи, що складається з протипухлинних алкілуючих засобів, протипухлинних антиметаболітів, протипухлинних антибіотиків, протипухлинних засобів рослинного походження, протипухлинних комплексних сполук платини, протипухлинних похідних камптотецину, протипухлинних інгібіторів тирозинкінази, моноклональних антитіл, інтерферонів, модифікаторів біологічної відповіді й інших протипухлинних засобів або їх фармацевтично прийнятної солі, де:
протипухлинні алкілуючі засоби являють собою N-оксид азотистого іприту, циклофосфамід, іфосфамід, мелфалан, бусульфан, мітобронітол, карбоквон, тіотепу, ранімустин, німустин, темозоломід і кармустин;
протипухлинні антиметаболіти являють собою метотрексат, 6-меркаптопурин рибозид, меркаптопурин, 5-фторурацил, тегафур, доксифлуридин, кармофур, цитарабін, окфосфат цитарабіну, еноцитабін, S-1, гемцитабін, флударабін і динатрію пеметрексед;
протипухлинні антибіотики являють собою актиноміцин D, доксорубіцин, даунорубіцин, неокарциностатин, блеоміцин, пепломіцин, мітоміцин С, акларубіцин, пірарубіцин, епірубіцин, зиностатин стималамер, ідарубіцин, сиролімус і валрубіцин;
протипухлинні засоби рослинного походження являють собою вінкристин, вінбластин, віндезин, етопозид, собузоксан, доцетаксел, паклітаксел і вінорелбін;
протипухлинні комплексні сполуки платини являють собою цисплатин, карбоплатин, недаплатин і оксаліплатин;
протипухлинні похідні камптотецину являють собою іринотекан, топотекан і камптотецин;
протипухлинні інгібітори тирозинкінази являють собою гефітиніб, іматиніб, сорафеніб, сунітиніб, дазатиніб і ерлотиніб;
моноклинальні антитіла являють собою цетуксимаб, ритуксимаб, бевацизумаб, алемтузумаб і трастузумаб;
інтерферони являють собою інтерферон ![]() , інтерферон
, інтерферон ![]() -2а, інтерферон
-2а, інтерферон ![]() -2b, інтерферон
-2b, інтерферон ![]() , інтерферон
, інтерферон ![]() -1a і інтерферон
-1a і інтерферон ![]() -n1;
-n1;
модифікатори біологічної відповіді являють собою крестин, лентинан, сизофіран, піцибаніл або убенімекс, і
інші протипухлинні засоби являють собою мітоксантрон, L-аспарагіназу, прокарбазин, дакарбазин, гідроксикарбамід, пентостатин, третиноїн, алефацепт, дарбепоетин альфа, анастрозол, екземестан, бікалутамід, лейпрорелін, флутамід, фулвестрант, октанатрію пегаптаніб, денілейкін дифтитокс, алдеслейкін, тиротропін альфа, триоксид миш'яку, бортезоміб, капецитабін і гозерелін.
16. Комбінований препарат за п. 15, де один або обидва з двох окремих препаратів являють собою препарат(и) для перорального введення.
17. Комбінований препарат за п. 15, що додатково об'єднаний щонайменше з одним препаратом, який містить разом з фармацевтично прийнятним носієм або розріджувачем протипухлинний засіб, вибраний із групи, що складається з протипухлинних алкілуючих засобів, протипухлинних антиметаболітів, протипухлинних антибіотиків, протипухлинних засобів рослинного походження, протипухлинних комплексних сполук платини, протипухлинних похідних камптотецину, протипухлинних інгібіторів тирозинкінази, моноклональних антитіл, інтерферонів, модифікаторів біологічної відповіді й інших протипухлинних засобів, де визначення кожного протипухлинного засобу є таким же, як у п. 15, або їх фармацевтично прийнятної солі.
18. Комбінований препарат за п. 15, де: серед комбінованих препаратів
*один являє собою препарат, що містить разом з фармацевтично прийнятним носієм або розріджувачем
(a) транс-4-(3-хлор-2-фторфенокси)-1-((6-(1,3-тіазол-2-іламіно)піридин-2-іл)метил)циклогексанкарбонову кислоту;
(b) транс-4-(2-фтор-3-(трифторметил)фенокси)-1-((6-(1,3-тіазол-2-іламіно)піридин-2-іл)метил)циклогексанкарбонову кислоту;
(c) транс-4-(2,3-дихлорфенокси)-1-((6-(1,3-тіазол-2-іламіно)піридин-2-іл)метил)циклогексанкарбонову кислоту;
(d) транс-4-(2-фтор-3-(трифторметил)фенокси)-1-((6-(1Н-піразол-3-іламіно)піридин-2-іл)метил)циклогексанкарбонову кислоту;
(e) транс-4-(3-хлор-2-фторфенокси)-1-((6-(1Н-піразол-3-іламіно)піразин-2-іл)метил)циклогексанкарбоксамід;
(f) 5-(транс-4-(2-фтор-3-(трифторметил)фенокси)-1-((6-(1Н-піразол-3-іламіно)піридин-2-іл)метил)циклогексил)-1,3,4-оксадіазол-2(3Н)-он;
(g) 5-(транс-4-(3-хлор-2-фторфенокси)-1-((6-(1Н-піразол-3-іламіно)піридин-2-іл)метил)циклогексил)-1,3,4-оксадіазол-2(3Н)-он;
(h) 5-(транс-4-(3-хлор-2-фторфенокси)-1-((6-(1Н-піразол-3-іламіно)піразин-2-іл)метил)циклогексил)-1,3,4-оксадіазол-2(3Н)-он або
(і) 5-(транс-4-((2,3-дихлорфеніл)сульфоніл)-1-((6-(1Н-піразол-3-іламіно)піридин-2-іл)метил)циклогексил)-1,3,4-оксадіазол-2(3Н)-он;
або його фармацевтично прийнятну сіль або складний ефір; і
* інший являє собою препарат, що містить разом з фармацевтично прийнятним носієм або розріджувачем паклітаксел або доцетаксел.
19. Фармацевтична композиція, що містить разом з фармацевтично прийнятним носієм або розріджувачем сполуку за п. 1 або її фармацевтично прийнятну сіль; і протипухлинний засіб, вибраний із групи, що складається з протипухлинних алкілуючих засобів, протипухлинних антиметаболітів, протипухлинних антибіотиків, протипухлинних засобів рослинного походження, протипухлинних комплексних сполук платини, протипухлинних похідних камптотецину, протипухлинних інгібіторів тирозинкінази, моноклональних антитіл, модифікаторів біологічної відповіді й інших протипухлинних засобів, де визначення кожного протипухлинного засобу є таким же, як у п. 15, або їх фармацевтично прийнятну сіль.
20. Фармацевтична композиція за п. 19, що містить сполуку за п. 1 або її фармацевтично прийнятну сіль або складний ефір і паклітаксел або доцетаксел.
Текст
1. Сполука загальної формули І: R2 R3 R1 2 (19) 1 3 95972 М> являє собою атом галогену, гідрокси, нітро, ціано, аміно, карбамоїл, аміносульфоніл, іміно, нижчу алкіламіногрупу, ди(нижчий)алкіламіногрупу, нижчий алкілсульфоніл, нижчу алкілсульфоніламіногрупу, нижчий алкокси, нижчий алкоксикарбоніл, нижчу алкоксикарбоніламіногрупу, нижчий алканоїл, нижчий алканоїлокси, нижчий алкілтіо і карбоксил; або R1 являє собою гетероциклічну групу, вибрану з наступних груп, де Y1 і Y2 є однаковими або різними, і кожний з них являє собою атом водню або нижчий алкіл, що може бути заміщений: Y1 N N N NH , O O N Y1 N Y2 , O N , S N Y2 NH O N N Y2 , , , R2 являє собою О, S, SO, SO2, NH, NRb або CRс1Rс2, де Rb являє собою нижчий алкіл, що може бути заміщений, і Rс1 і Rc2, що можуть бути однаковими або різними, являють собою атом водню або нижчий алкіл; R3 являє собою феніл, що може бути заміщений; Х2 являє собою СН, СХ2а або N, де: Х2а являє собою нижчий алкіл; або Х2а являє собою замісник, вибраний із , або нижчий алкіл, що заміщений одним або декількома однаковими або різними замісниками, вибраними з , де являє собою атом галогену; ціано; гідрокси; нижчу алкіламіногрупу; ди(нижчий)алкіламіногрупу; нижчий алкокси, що може бути заміщений однією або декількома гідроксигрупами; нижчий алкілтіо і нижчий алкілсульфоніл; або Х2а являє собою COORx1, CONRx2Rx3, NHCORx1, NHCONRx2Rx3, NHSO2NRx2Rx3, NRx4Rx5 або CH2NRx4Rx5, де: Rx1 являє собою атом водню або нижчий алкіл, що може бути заміщений; кожний з Rx2 і Rx3, що можуть бути однаковими або різними, являє собою атом водню, нижчий алкіл, який може бути заміщений, або циклоалкіл, що може бути заміщений; або альтернативно R x2 і Rx3 разом з атомом азоту, до якого вони приєднані, утворюють 5- або 6-членну аліфатичну гетероциклічну групу, яка містить щонайменше один атом, вибраний з N, О і S, і яка може бути заміщена; і Rx4 і Rx5, що можуть бути однаковими або різними, являють собою атом водню, нижчий алкіл, що може бути заміщений, або циклоалкіл, що може бути заміщений; або Х2а являє собою 5- або 6-членну аліфатичну гетероциклічну групу, яка містить щонайменше один атом, вибраний з N, О і S, і яка може бути заміщена, в якій два атоми водню, що приєднані до одного і того самого атома вуглецю аліфатичної гетероциклічної групи, можуть бути заміщені оксогрупою, а сусідні два атоми вуглецю, що складають аліфатичне гетероциклічне кільце, можуть 4 утворювати подвійний зв'язок; або нижчий алкіл, що заміщений аліфатичною гетероциклічною групою; або Х2а являє собою 5- або 6-членну ароматичну гетероциклічну групу, яка містить щонайменше один атом, вибраний з N, О і S, і яка може бути заміщена; або нижчий алкіл, що заміщений ароматичною гетероциклічною групою; W являє собою наступний залишок: W2 W 1 W3 N H , де: W1 являє собою СН, N, NH, О або S; W2 являє собою СН, CW 2a, N, NW 2a, О або S, де кожний W 2a і W 2b незалежно являє собою атом водню, атом галогену, ціано, нижчий алкіл, що містить від одного до двох атомів вуглецю, циклоалкіл, що містить від трьох до п'яти атомів вуглецю, або нижчий алкіл, що містить від одного до двох атомів вуглецю, що може бути заміщений одним або декількома атомами галогену; W3 являє собою С або N; і щонайменше один з W 1, W 2 і W 3 являє собою атом вуглецю; однак два з W 1, W2 i W 3 одночасно не можуть являти собою О і S, або її фармацевтично прийнятна сіль або складний ефір. 2. Сполука за п. 1 або її фармацевтично прийнятна сіль або складний ефір, де W вибраний з: W 2a W 2a S O N H W 2a N H , , NH N H , N S N H W2b N O , N H , , W2b , S N N H O N S , H N , H N , O N H W 2a , W2a N N N NH N , , H . 3. Сполука за п. 2 або її фармацевтично прийнятна сіль або складний ефір, де R3 являє собою фе H 5 ніл, 2-е і 3-е положення якого заміщені двома однаковими або різними замісниками, вибраними з F, Сl, CF3 і CN. 4. Сполука за п. 3 або її фармацевтично прийнятна сіль або складний ефір, де являє собою атом галогену, гідрокси, аміно, карбамоїл, нижчу алкіламіногрупу, ди(нижчий)алкіламіногрупу і нижчий алкокси; і являє собою гідрокси, карбамоїл, аміносульфоніл, нижчу алкілсульфоніламіногрупу і карбоксил. 5. Сполука за п. 4 або її фармацевтично прийнятна сіль або складний ефір, де Х2 являє собою СН або N. 6. Сполука за п. 5 або її фармацевтично прийнятна сіль або складний ефір, де R1 являє собою ОН, СООН або CONRa2Ra2’, де Ra2 і Ra2' є однаковими або різними, і кожний з них являє собою атом водню або нижчий алкіл, що містить від одного до трьох атомів вуглецю; або R1 вибраний з наступного: 95972 6 (g) 5-(транс-4-(3-хлор-2-фторфенокси)-1-((6-(1Нпіразол-3-іламіно)піридин-2-іл)метил)циклогексил)1,3,4-оксадіазол-2(3Н)-он; (h) 5-(транс-4-(3-хлор-2-фторфенокси)-1-((6-(1Нпіразол-3-іламіно)піразин-2-іл)метил)циклогексил)1,3,4-оксадіазол-2(3Н)-он або (і) 5-(транс-4-((2,3-дихлорфеніл)сульфоніл)-1-((6(1Н-піразол-3-іламіно)піридин-2іл)метил)циклогексил)-1,3,4-оксадіазол-2(3Н)-он; або її фармацевтично прийнятна сіль або складний ефір. 10. Сполука, яка являє собою F O Cl O OH S N N Y1 , , , і R2 являє собою О, S, SO або SO2. 7. Сполука за п. 6 або її фармацевтично прийнятна сіль або складний ефір, де: W вибраний з: W 2a W2a S N S H N N H , , , де W 2a являє собою атом водню, атом галогену, ціано або метил, що може бути заміщений однимтрьома атомами фтору. 8. Сполука за п. 7 або її фармацевтично прийнятна сіль або складний ефір, де W являє собою будь-який з наступних залишків: S H N H N N , . 9. Сполука, що являє собою: (a) транс-4-(3-хлор-2-фторфенокси)-1-((6-(1,3тіазол-2-іламіно)піридин-2іл)метил)циклогексанкарбонову кислоту; (b) транс-4-(2-фтор-3-(трифторметил)фенокси)-1((6-(1,3-тіазол-2-іламіно)піридин-2іл)метил)циклогексанкарбонову кислоту; (c) транс-4-(2,3-дихлорфенокси)-1-((6-(1,3-тіазол-2іламіно)піридин-2-іл)метил)циклогексанкарбонову кислоту; (d) транс-4-(2-фтор-3-(трифторметил)фенокси)-1((6-(1Н-піразол-3-іламіно)піридин-2іл)метил)циклогексанкарбонову кислоту; (e) транс-4-(3-хлор-2-фторфенокси)-1-((6-(1Нпіразол-3-іламіно)піразин-2іл)метил)циклогексанкарбоксамід; (f) 5-(транс-4-(2-фтор-3-(трифторметил)фенокси)1-((6-(1Н-піразол-3-іламіно)піридин-2іл)метил)циклогексил)-1,3,4-оксадіазол-2(3Н)-он; N H транс-4-(3-хлор-2-фторфенокси)-1-((6-(1,3триазол-2-іламіно)піридин-2іл)метил)циклогексанкарбонову кислоту, або її фармацевтично прийнятна сіль або складний ефір. 11. Сполука, яка являє собою 5-(транс-4-(3-хлор-2-фторфенокси)-1-((6-(1Нпіразол-3-іламіно)піридин-2-іл)метил)циклогексил)1,3,4-оксадіазол-2(3Н)-он, або її фармацевтично прийнятна сіль або складний ефір. 12. Фармацевтична композиція, що містить разом з фармацевтично прийнятним носієм або розріджувачем щонайменше одну сполуку за п. 1 як активний інгредієнт. 13. Селективний інгібітор Аврори А, що містить разом з фармацевтично прийнятним носієм або розріджувачем щонайменше одну сполуку за п. 1 як активний інгредієнт. 14. Протипухлинний засіб, що містить разом з фармацевтично прийнятним носієм або розріджувачем щонайменше одну сполуку за п. 1 як активний інгредієнт. 15. Комбінований препарат для одночасного, окремого або послідовного введення при лікуванні раку, який містить два окремих препарати: *препарат, що містить разом з фармацевтично прийнятним носієм або розріджувачем сполуку за п. 1; і *препарат, що містить разом з фармацевтично прийнятним носієм або розріджувачем один протипухлинний засіб, вибраний із групи, що складається з протипухлинних алкілуючих засобів, протипухлинних антиметаболітів, протипухлинних 7 антибіотиків, протипухлинних засобів рослинного походження, протипухлинних комплексних сполук платини, протипухлинних похідних камптотецину, протипухлинних інгібіторів тирозинкінази, моноклональних антитіл, інтерферонів, модифікаторів біологічної відповіді й інших протипухлинних засобів або їх фармацевтично прийнятної солі, де: протипухлинні алкілуючі засоби являють собою Nоксид азотистого іприту, циклофосфамід, іфосфамід, мелфалан, бусульфан, мітобронітол, карбоквон, тіотепу, ранімустин, німустин, темозоломід і кармустин; протипухлинні антиметаболіти являють собою метотрексат, 6-меркаптопурин рибозид, меркаптопурин, 5-фторурацил, тегафур, доксифлуридин, кармофур, цитарабін, окфосфат цитарабіну, еноцитабін, S-1, гемцитабін, флударабін і динатрію пеметрексед; протипухлинні антибіотики являють собою актиноміцин D, доксорубіцин, даунорубіцин, неокарциностатин, блеоміцин, пепломіцин, мітоміцин С, акларубіцин, пірарубіцин, епірубіцин, зиностатин стималамер, ідарубіцин, сиролімус і валрубіцин; протипухлинні засоби рослинного походження являють собою вінкристин, вінбластин, віндезин, етопозид, собузоксан, доцетаксел, паклітаксел і вінорелбін; протипухлинні комплексні сполуки платини являють собою цисплатин, карбоплатин, недаплатин і оксаліплатин; протипухлинні похідні камптотецину являють собою іринотекан, топотекан і камптотецин; протипухлинні інгібітори тирозинкінази являють собою гефітиніб, іматиніб, сорафеніб, сунітиніб, дазатиніб і ерлотиніб; моноклинальні антитіла являють собою цетуксимаб, ритуксимаб, бевацизумаб, алемтузумаб і трастузумаб; інтерферони являють собою інтерферон , інте рферон -2а, інтерферон -2b, інтерферон , інтерферон -1a і інтерферон -n1; модифікатори біологічної відповіді являють собою крестин, лентинан, сизофіран, піцибаніл або убенімекс, і інші протипухлинні засоби являють собою мітоксантрон, L-аспарагіназу, прокарбазин, дакарбазин, гідроксикарбамід, пентостатин, третиноїн, алефацепт, дарбепоетин альфа, анастрозол, екземестан, бікалутамід, лейпрорелін, флутамід, фулвестрант, октанатрію пегаптаніб, денілейкін дифтитокс, алдеслейкін, тиротропін альфа, триоксид миш'яку, бортезоміб, капецитабін і гозерелін. 16. Комбінований препарат за п. 15, де один або обидва з двох окремих препаратів являють собою препарат(и) для перорального введення. 17. Комбінований препарат за п. 15, що додатково об'єднаний щонайменше з одним препаратом, який містить разом з фармацевтично прийнятним носієм або розріджувачем протипухлинний засіб, вибраний із групи, що складається з протипухлинних алкілуючих засобів, протипухлинних антиметаболітів, протипухлинних антибіотиків, протипухлинних засобів рослинного походження, протипухлинних комплексних сполук платини, про 95972 8 типухлинних похідних камптотецину, протипухлинних інгібіторів тирозинкінази, моноклональних антитіл, інтерферонів, модифікаторів біологічної відповіді й інших протипухлинних засобів, де визначення кожного протипухлинного засобу є таким же, як у п. 15, або їх фармацевтично прийнятної солі. 18. Комбінований препарат за п. 15, де: серед комбінованих препаратів *один являє собою препарат, що містить разом з фармацевтично прийнятним носієм або розріджувачем (a) транс-4-(3-хлор-2-фторфенокси)-1-((6-(1,3тіазол-2-іламіно)піридин-2іл)метил)циклогексанкарбонову кислоту; (b) транс-4-(2-фтор-3-(трифторметил)фенокси)-1((6-(1,3-тіазол-2-іламіно)піридин-2іл)метил)циклогексанкарбонову кислоту; (c) транс-4-(2,3-дихлорфенокси)-1-((6-(1,3-тіазол-2іламіно)піридин-2-іл)метил)циклогексанкарбонову кислоту; (d) транс-4-(2-фтор-3-(трифторметил)фенокси)-1((6-(1Н-піразол-3-іламіно)піридин-2іл)метил)циклогексанкарбонову кислоту; (e) транс-4-(3-хлор-2-фторфенокси)-1-((6-(1Нпіразол-3-іламіно)піразин-2іл)метил)циклогексанкарбоксамід; (f) 5-(транс-4-(2-фтор-3-(трифторметил)фенокси)1-((6-(1Н-піразол-3-іламіно)піридин-2іл)метил)циклогексил)-1,3,4-оксадіазол-2(3Н)-он; (g) 5-(транс-4-(3-хлор-2-фторфенокси)-1-((6-(1Нпіразол-3-іламіно)піридин-2-іл)метил)циклогексил)1,3,4-оксадіазол-2(3Н)-он; (h) 5-(транс-4-(3-хлор-2-фторфенокси)-1-((6-(1Нпіразол-3-іламіно)піразин-2-іл)метил)циклогексил)1,3,4-оксадіазол-2(3Н)-он або (і) 5-(транс-4-((2,3-дихлорфеніл)сульфоніл)-1-((6(1Н-піразол-3-іламіно)піридин-2іл)метил)циклогексил)-1,3,4-оксадіазол-2(3Н)-он; або його фармацевтично прийнятну сіль або складний ефір; і * інший являє собою препарат, що містить разом з фармацевтично прийнятним носієм або розріджувачем паклітаксел або доцетаксел. 19. Фармацевтична композиція, що містить разом з фармацевтично прийнятним носієм або розріджувачем сполуку за п. 1 або її фармацевтично прийнятну сіль; і протипухлинний засіб, вибраний із групи, що складається з протипухлинних алкілуючих засобів, протипухлинних антиметаболітів, протипухлинних антибіотиків, протипухлинних засобів рослинного походження, протипухлинних комплексних сполук платини, протипухлинних похідних камптотецину, протипухлинних інгібіторів тирозинкінази, моноклональних антитіл, модифікаторів біологічної відповіді й інших протипухлинних засобів, де визначення кожного протипухлинного засобу є таким же, як у п. 15, або їх фармацевтично прийнятну сіль. 20. Фармацевтична композиція за п. 19, що містить сполуку за п. 1 або її фармацевтично прийнятну сіль або складний ефір і паклітаксел або доцетаксел. 9 Даний винахід стосується нових амінопіридинових похідних, що застосовні у фармацевтичній галузі, і більш конкретно, амінопіридинових похідних, що інгібують ріст пухлинних клітин на основі селективної інгібуючої активності у відношенні кінази Аврора А і володіють протипухлинним ефектом, а також селективного інгібітору кінази Аврора А, і протипухлинного засобу, що містить такі похідні. Кіназа Аврора являє собою серин/треонінкіназу, що бере участь у розподілі клітин. В даний час відомі три підтипи кінази Аврора, А, В і С, що високогомологичні один одному. Аврора А бере участь у дозріванні і розподілі центросоми або у формуванні тіла веретена. З іншого боку, вважається, що Аврора В бере участь в агрегації і кон'югації хромосоми, звірочній (контрольній) точці веретена і розподілі цитоплазми [Nat. Rev. Моl. Cell Biol., No. 4, pp. 842-854]. Також вважається, що Аврора С діє аналогічним чином у результаті взаємодії з Авророю В [J. Biol. Chem., Epub ahead (2004)]. На підставі того факту, що раніше в більшості ракових клітин була підтверджена висока експресія кінази Аврора А; що висока експресія кінази Аврора А в нормальних клітинах приводить до трансформації ліній нормальних клітин гризунів і т.п., вважається, що Аврора А, що є одним з онкогенів, повинна бути придатною мішенню для протипухлинного засобу [ЕМВО J., № 17, стор. 3052-3065 (1998)]. Відповідно до іншого повідомлення, ракові клітини, де Аврора А експресується у високій мірі, мають резистентність до паклітакселу [Cancer Cell, Vol. 3, pp. 51-62 (2003)]. У той же час у відношенні інгібітору кінази Аврора вважається, що розробка лікарських засобів, селективних до визначеного її підтипу, є важкою задачею, якщо врахувати високу гомологію серед підтипів, структурний аналіз білка і т.п.; і хоча відомі повідомлення про лікарські засоби, такі як ZM447439, що одночасно інгібують як Аврору А, так і Аврору В [J. Cell Biol., № 161, стор. 267-280 (2003); J. Cell Biol. , № 161, стор. 281-294, (2003); Nat Med., № 10, стор. 262-267, (2004)], повідомлень із приводу лікарських засобів, селективних у відношенні Аврори А, невідомо. Таким чином, у зазначених повідомленнях протипухлинний ефект описаний лише для того випадку, коли вводиться тільки один лікарський засіб, що одночасно інгібує як Аврору А, так і Аврору В. Крім того, повідомлялося також, що в лікарському засобі, що одночасно інгібує як Аврору А, так і Аврору В, інгібуюча дія у відношенні кінази Аврора послабляє активність паклітакселу [J. Cell Biol., № 161, стор. 281-294, (2003)]. В даний час були подані патентні заявки, що стосуються сполук, які володіють інгібуючої активністю у відношенні кінази Аврора (WO 02/057259, патент США № 6664247 і т.д.), і патентні заявки, що стосуються амінопіридинових похідних були подані також (патент США № 6586424 і т.д). За даних обставин автори даного винаходу подали 95972 10 патентну заявку, що стосується амінопіридинового похідного, яке володіє чудовою селективною інгібуючої активністю у відношенні Аврори A (WO 2006/046734). Проблеми, що повинний вирішити даний винахід, полягають в створенні нових амінопіридинових похідних, що володіють чудовою селективною інгібуючою активністю у відношенні Аврори А і інгібуючою активністю у відношенні росту клітин на підставі вищевикладеного, а також у досягненні синергічної дії шляхом комбінованого застосування з іншим протипухлинним засобом(ми). Крім того, проблеми, що повинний вирішити даний винахід, також полягають в створенні, у випадку перорального введення, нових амінопіридинових похідних, що володіють чудовою селективною інгібуючою активністю у відношенні Аврори А. Для рішення зазначених вище проблем автори даного винаходу синтезували ряд нових амінопіридинових похідних і знайшли, що сполука, представлена наступної формулою (І), на підставі вищевикладеного володіє чудовою селективною інгібуючою активністю у відношенні Аврори А і інгібуючою активністю у відношенні росту клітин, а також досягає синергічної дії шляхом комбінованого застосування з іншими протипухлинними засобами, тим самим здійснюючи винахід. Що стосується тих типів раку, які не можна цілком вилікувати за допомогою відомих протипухлинних засобів, таких як паклітаксел, оскільки через побічні ефекти або резистентність до лікарського засобу неможливо застосовувати достатню кількість таких засобів, очікується, що пероральне введення сполуки згідно з даним винаходом або комбіноване введення сполуки згідно з даним винаходом з іншим протипухлинним засобом дасть чудовий протипухлинний ефект (включаючи посилення активності, обумовлене іншим протипухлинним засобом) і ефект по ослабленню побічних ефектів. Таким чином, винахід стосується сполуки загальної формули І: де: R1 являє собою атом водню, F, CN, COORa1, CONRa2Ra2', NRa3CORa3', CONRa4ORa4', , NRa5CONRa5'Ra5'', NRa6COORa6 , SO2NRa7Ra7’, NRa8SO2Ra8’, CORa9, SO2Ra10, NO2, ORa11 або NRa12Ra12’, де: кожний з Ra1, Ra3, Ra4, Ra5, Ra6 і Ra8 незалежно являє собою атом водню або нижчий алкіл; 11 кожний з Ra2, Rа2’, Ra5, Rа5", Ra7, Ra7', Ra12 і Ra12' незалєжно являє собою атом водню або нижчий алкіл, що може бути заміщений одним або декількома однаковими або різними замісниками, вибраними з , де являє собою атом галогену, гідрокси, нітро, ціано, аміно, карбамоїл, аміносульфоніл, іміно, нижчу алкіламіногрупу, ді(нижчий)алкіламіногрупу, нижчий алкілсульфоніл, нижчу алкілсульфоніламіногрупу, нижчий алкокси, нижчий алкоксикарбоніл, нижчу алкоксикарбоніламіногрупу, нижчий алканоїл, нижчий алканоїлокси, нижчий алкілтіо і карбоксил; однак за умови, що кожні з Ra2 і Ra2’; Ra5' і Ra5''; Ra7 і Ra7'; Ra12 і Ra12’ незалежно, разом з атомом азоту, до якого вони приєднані, можуть утворювати 5-членну або 6-членну ароматичну або аліфатичну гетероциклічну групу, що може бути заміщена одним або декількома однаковими або різними замісниками, вибраними з , де являє собою атом галогену, гідрокси, аміно і гідроксиметил; кожний з Ra3', Ra4', Ra6', Ra6', Ra9, Ra10 і Ra11 незалежно являє собою атом водню або нижчий алкіл, що може бути заміщений одним або декількома однаковими або різними замісниками, вибраними з ; або R1 являє собою нижчий алкіл, що може бути заміщений одним або декількома однаковими або різними замісниками, вибраними з , де група-замісник М> являє собою атом галогену, гідрокси, нітро, ціано, аміно, карбамоїл, аміносульфоніл, іміно, нижчу алкіламіногрупу, ді(нижчий)алкіламіногрупу, нижчий алкілсульфоніл, нижчу алкілсульфоніламіногрупу, нижчий алкокси, нижчий алкоксикарбоніл, нижчу алкоксикарбоніламіногрупу, нижчий алканоїл, нижчий алканоїлокси, нижчий алкілтіо і карбоксил; або R1 являє собою гетероциклічну групу, вибрану з наступних груп, де Х1 і Х2 є однаковими або різними, і кожний з них являє собою атом водню або нижчий алкіл, що може бути заміщений: R2 являє собою О, S, SO, SO2, NH, NRb або CRc1Rc2, де Rb являє собою нижчий алкіл, що може бути заміщений, і Rc1 і Rc2, що можуть бути однаковими або різними, являють собою атом водню або нижчий алкіл; R3 являє собою феніл, що може бути заміщений; Х2 являє собою СН, СХ2а або N, де: Х2а являє собою нижчий алкіл; або Х2а являє собою замісник, вибраний із , або нижчий алкіл, що заміщений одним або декількома однаковими або різними замісниками, вибраними з , де являє собою атом галогену; ціано; гідрокси; нижчу алкіламіногрупу; 95972 12 ді(нижчий)алкіламіногрупу; нижчий алкокси, що може бути заміщений однією або декількома гідроксигрупами; нижчий алкілтіо; і нижчий алкілсульфоніл; або Х2а являє собою COORx1, CONRx2Rx3, NHCORx1, NHCONRx2Rx3, NHSO2NRx2Rx3, NRx4Rx5 або CH2NRx4Rx5, де: Rx1 являє собою атом водню або нижчий алкіл, що може бути заміщений; кожний з Rx2 і Rx3, що можуть бути однаковими або різними, являє собою атом водню, нижчий алкіл, що може бути заміщений, або циклоалкіл, що може бути заміщений; або, альтернативно, Rx2 і Rx3 разом з атомом азоту, до якого вони приєднані, утворюють 5- або 6-членну аліфатичну гетероциклічну групу, що містить, щонайменше, один атом, вибраний з Н, П і S, і яка може бути заміщена; і Rx4 і Rx5, що можуть бути однаковими або різними, являють собою атом водню, нижчий алкіл, що може бути заміщений, або циклоалкіл, що може бути заміщений; або Х2а являє собою 5- або 6-членну аліфатичну гетероциклічну групу, що містить, щонайменше, один атом, вибраний з N, O і S, і яка може бути заміщена, у якій два атоми водню, що приєднані до того самого атому вуглецю аліфатичної гетероциклічної групи, можуть бути заміщені оксогрупою, а сусідні два атоми вуглецю, що складають аліфатичне гетероциклічне кільце, можуть утворювати подвійний зв'язок; або нижчий алкіл, який заміщений аліфатичною гетероциклічною групою; або Х2а являє собою 5- або 6-членну ароматичну гетероциклічну групу, що містить, щонайменше, один атом, вибраний з N, O і S, і яка може бути заміщена; або нижчий алкіл, що заміщений ароматичною гетероциклічною групою; W являє собою наступний залишок: де: W1 являє собою СН, Н, NН, О або S; W2 являє собою СН, CW 2a, N, NW 2b, О або S, де кожен W2a і W 2b незалежно являє собою атом водню, атом галогену, ціано, нижчий алкіл, що містить від одного до двох атомів вуглецю, циклоалкіл, що містить від трьох до п'яти атомів вуглецю, або нижчий алкіл, що містить від одного до двох атомів вуглецю, що може бути заміщений одним або декількома атомами галогену; W3 являє собою С або N; і, щонайменше, один з W1 W 2 і W3 являє собою атом вуглецю; однак два з W1 W 2 і W3 одночасно не можуть являти собою О і S, або її фармацевтично прийнятної солі або складного ефіру. Винахід також стосується комбінованого препарату для одночасного, окремого або послідовного введення при лікуванні раку, що містить два окремих препарати, що являють собою: * препарат, що містить разом з фармацевтично прийнятним носієм або розріджувачем сполуку, 13 представлену описаною вище формулою (І), або її фармацевтично прийнятну сіль або складний ефір; і * препарат, що містить разом з фармацевтично прийнятним носієм або розріджувачем один протипухлинний засіб, вибраний із групи, що складається з протипухлинних алкілуючих засобів, протипухлинних антиметаболітів, протипухлинних антибіотиків, протипухлинних засобів рослинного походження, протипухлинних координаційних сполук платини, протипухлинних похідних камптотецину, протипухлинних інгібіторів тирозинкінази, моноклональних антитіл, інтерферонів, модифікаторів біологічної відповіді й інших протипухлинних засобів, а також їх фармацевтично прийнятної солі(ей) або складного ефіру(ів), де протипухлинний алкілуючий засіб являє собою N-оксид азотистого іприту, циклофосфамід, іфосфамід, мелфалан, бусульфан, мітобронітол, карбоквон, тіотепа, ранімустин, німустин, темозоломід або кармустин; протипухлинний антиметаболіт являє собою метотрексат, 6-меркаптопуринрибозид, меркаптопурин, 5-фторурацил, тегафур, доксифлуридин, кармофур, цитарабін, окфосфат цитарабіну, еноцитабін, S-1, гемцитабін, флударабін або динатрію пеметрексед; протипухлинний антибіотик являє собою актиноміцин D, доксорубіцин, даунорубіцин, неокарциностатин, блеоміцин, пепломіцин, мітоміцин С, акларубіцин, пірарубіцин, епірубіцин, зиностатин стималамер, ідарубіцин, сиролімус або валрубіцин; протипухлинний засіб рослинного походження являє собою вінкристин, вінбластин, віндезин, етопозид, собузоксан, доцетаксел, паклітаксел або вінорелбін; протипухлинна координаційна сполука платини являє собою цисплатин, карбоплатин, недаплатин або оксаліплатин; протипухлинне похідне камптотецину являє собою іринотекан, топотекан або камптотецин; протипухлинний інгібітор тирозинкінази являє собою гефітиніб, іматиніб, сорафеніб, сунітиніб, дазатиніб або ерлотиніб; моноклональне антитіло являє собою цетуксимаб, ритуксимаб, бевацизумаб, алемтузумаб або трастузумаб; інтерферон являє собою інтерферон , інтерферон -2а, інтерферон -2b, інтерферон в, інтерферон -1a або інтерферон -n1; модифікатор біологічної відповіді являє собою крестин, лентинан, сизофіран, піцибаніл або убенімекс; і інший протипухлинний засіб являє собою мітоксантрон, L-аспарагіназу, прокарбазин, дакарбазин, гідроксикарбамід, пентостатин, третиноїн, алефацепт, дарбепоетин-альфа, анастрозол, екземестан, бікалутамід, леупролелін, флутамід, фулвестрант, октанатрію пегаптаніб, денілейкін дифтитокс, алдеслейкін, тиротропін альфа, триоксид миш'яку, бортезоміб, капецитабін або гозерелін. 95972 14 Винахід додатково стосується фармацевтичної композиції, що містить разом з фармацевтично прийнятним носієм або розріджувачем сполуку, представлену описаною вище формулою (І), або її фармацевтично прийнятну сіль або складний ефір, і протипухлинний засіб, вибраний із групи, що складається з протипухлинних алкілуючих засобів, протипухлинних антиметаболітів, протипухлинних антибіотиків, протипухлинних засобів рослинного походження, протипухлинних координаційних сполук платини, протипухлинних похідних камптотецину, протипухлинних інгібіторів тирозинкінази, моноклональних антитіл, модифікаторів біологічної відповіді й інших протипухлинних засобів (тут визначення кожного протипухлинного засобу є таким же, як у наведеному вище визначенні) або їх фармацевтично прийнятної солі або складного ефіру. Крім того, винахід додатково стосується способу лікування раку, що включає одночасне, окреме або послідовне введення терапевтично ефективної кількості сполуки, представленої описаної вище формулою (І), або її фармацевтично прийнятної солі або складного ефіру в комбінації з терапевтично ефективною кількістю протипухлинного засобу, вибраного з групи, що складається з протипухлинних алкілуючих засобів, протипухлинних антиметаболітів, протипухлинних антибіотиків, протипухлинних засобів рослинного походження, протипухлинних координаційних сполук платини, протипухлинних похідних камптотецину, протипухлинних інгібіторів тирозинкінази, моноклональних антитіл, інтерферонів, модифікаторів біологічної відповіді й інших протипухлинних засобів (тут визначення кожного протипухлинного засобу є таким же, як у наведеному вище визначенні) або їх фармацевтично прийнятної солі або складного ефіру. Крім того, винахід стосується застосування селективного інгібітору Аврори А, для виробництва лікарського засобу, призначеного для лікування раку; і застосування селективного інгібітору Аврори А, у комбінації з протипухлинним засобом для виробництва лікарського засобу, призначеного для лікування раку; і також стосується способу лікування раку в ссавця (зокрема, у людини), що включає введення згаданому ссавцю терапевтично ефективної кількості селективного інгібітору Аврори А; і способу лікування раку у ссавця (зокрема, людини), що включає введення згаданому ссавцю терапевтично ефективної кількості селективного інгібітору Аврори А в комбінації з терапевтично ефективною кількістю протипухлинного засобу. Винахід стосується фармацевтичної композиції, що містить як активний інгредієнт селективний інгібітор Аврори А; і фармацевтичної композиції, що містить як активний інгредієнт селективний інгібітор Аврори А, разом із протипухлинним засобом. Далі будуть пояснені символи і терміни, застосовувані в даному описі винаходу. Термін "нижчий алкіл" в описаній вище формулі (І) означає алкільну групу з лінійним або розгалуженим ланцюгом, що містить від 1 до 6 атомів вуглецю, і приклади такої групи включають, напри 15 клад, метил , етил, пропіл, ізопропіл, бутил, ізобутил, втор-бутил, трет-бутил, пентил і гексил, серед яких переважним є метил . Термін "циклоалкіл" в описаній вище формулі (І) означає 3-8-членну аліфатичну циклічну групу, таку як, наприклад, циклопропіл, циклобутил, циклопентил, циклогексил, циклогептил і циклооктил. Термін "гетероциклічна група" у формулі (І) стосується "ароматичного гетероциклічної групі" або "аліфатичної гетероциклічної групі". У даному описі термін "ароматична гетероциклічна група" стосується ароматичної гетероциклічної групі, що містить на додаток до атому(ів) вуглецю, щонайменше, один гетероатом, такий як атом азоту, атом кисню або т.п., і приклади такої групи включають 5-7-членну моноциклічну гетероциклічну групу, гетероциклічну групу з конденсованим циклом, утворену шляхом конденсації 3-8-членного циклу з моноциклиічною гетероциклічною групою і т.п. Зокрема, можна згадати тієнільну групу, піролільну групу, тіазолільну групу, імідазолільну групу, піразолільну групу, оксазолільну групу, піридильну групу, піразинільну групу, піримідинільну групу, піридазинільну групу, ізоксазолільну групу, ізохінолільну групу, ізоіндолільну групу, індазолільну групу, індолільну групу, хіноксалінільну групу, хінолільну групу, бензоімідазолільну групу, бензофуранільну групу і т.п. З іншого боку, термін "аліфатична гетероциклічна група" стосується насиченої або ненасиченої аліфатичної гетероциклічної групи, що містить на додаток до атому(ів) вуглецю, щонайменше, один атом, вибраний з атома азоту, атома кисню й атома сірки, і що містить моноциклічний цикл або біциклічний або трициклічний конденсований цикл. Приклади такої групи включають азетидильну групу, піролідинільну групу, піперидинільну групу, піперазинільну групу, морфоліногрупу, тетрагідрофуранільну групу, імідазолідинільну групу, тіоморфоліногрупу, тетрагідрохінолільну групу, тетрагідроізохінолільну групу і т.п. Термін "5- або 6-членна аліфатична гетероциклічна група" в описаній вище формулі (І) означає 5- або 6-членну аліфатичну циклічну групу, що містить, щонайменше, один атом, вибраний з атому азоту, атому кисню й атому сірки на додаток до атомів вуглецю, і приклади такої групи включають піролідиніл, піперидиніл, піперазиніл, морфоліно, тетрагідрофураніл, імідазолідиніл і тіоморфоліно. Крім того, в аліфатичної гетероциклічної групі два атоми водню, що приєднані до того самого атому вуглецю, можуть бути заміщені оксогрупою, а також сусідні атоми вуглецю, що складають цикл аліфатичної гетероциклічної групи, можуть бути з'єднані подвійним зв'язком. Термін "5- або 6-членна ароматична гетероциклічна група" в описаній вище формулі (І) означає 5- або 6-членну ароматичну циклічну групу, що містить, щонайменше, один атом, вибраний з атому азоту, атому кисню й атому сірки на додаток до атомів вуглецю, і приклади такої групи включають тієніл, піроліл, фурил, тіазоліл, імідазоліл і оксазоліл. Термін "атом галогену" в описаній вище формулі (І), являє собою, наприклад, атом фтору, атом хлору, атом брому або атом іоду. Серед них 95972 16 переважним є, наприклад, атом фтору, атом хлору або атом брому. Термін "нижча алкіламіногрупа" в описаній вище формулі (І) означає групу, в якій аміногрупа є N-заміщеною описаним вище "нижчим алкілом", і приклади такої групи включають N-метиламіно, Nетиламіно, N-пропіламіно, N-ізопропіламіно, Nбутиламіно, N-ізобутиламіно, N-трет-бутиламіно, N-пентиламіно і N-гексиламіно. Термін "ді(нижчий)алкіламіногрупа" в описаній вище формулі (І) означає групу, в якій аміногрупа є N,N-двозаміщеною описаним вище "нижчим алкілом", і приклади такої групи включають N,N диметиламіно, N,N -диетиламіно, N,N дипропіламіно, N,N -діізопропіламіно, N,N дибутиламіно, N,N -діізобутиламіно, N,N -ди-третбутиламіно, N,N-дипентиламіно, N,Nдигексиламіно, N-етил-N-метиламіно і N-метил-Nпропіламіно. Термін "нижчий алкілсульфоніл" в описаній вище формулі (І) означає групу, в якій описаний вище "нижчий алкіл" приєднаний до сульфонілу, і приклади такої групи включають метилсульфоніл, етилсульфоніл і бутилсульфоніл. Термін "нижча алкілсульфоніламіногрупа" в описаній вище формулі (І) означає групу, в якій описаний вище "нижчий алкілсульфоніл" приєднаний до аміногрупи, і приклади такої групи включають метилсульфоніламіно, етилсульфоніламіно і бутилсульфоніламіно. Термін "нижчий алкокси" в описаній вище формулі (І) означає групу, в якій "нижчий алкіл" приєднаний до атому кисню, і приклади такої групи включають метокси, етокси, пропокси, ізопропокси, бутокси, ізобутокси, втор-бутокси, трет-бутокси, пентилокси, неопентилокси, гексилокси і ізогексилокси. Термін "нижчий алкоксикарбоніл" в описаній вище формулі (І) означає групу, в якій "нижчий алкокси" приєднаний до карбонілу, і приклади такої групи включають метоксикарбоніл, етоксикарбоніл, пропоксикарбоніл, ізопропоксикарбоніл, бутоксикарбоніл, ізобутоксикарбоніл, вторбутоксикарбоніл, трет-бутоксикарбоніл, пентилоксикарбоніл, неопентилоксикарбоніл, гексилоксикарбоніл і ізогексилоксикарбоніл. Термін "нижча алкоксикарбоніламіногрупа" в описаній вище формулі (І) означає групу, в якій "нижчий алкоксикарбоніл" приєднаний до аміногрупи, і приклади такої групи включають метоксикарбоніламіно, етоксикарбоніламіно, пропоксикарбоніламіно, ізопропоксикарбоніламіно, бутоксикарбоніламіно, ізобутоксикарбоніламіно, втор-бутоксикарбоніламіно, третбутоксикарбоніламіно, пентилоксикарбоніламіно, неопентилоксикарбоніламіно, гексилоксикарбоніламіно і ізогексилоксикарбоніламіно. Термін "нижчий алканоїл" в описаній вище формулі (І) означає групу, в якій описаний вище "нижчий алкіл" приєднаний до карбонілу, і приклади такої групи включають ацетил, пропіоніл, бутирил, ізобутирил, валерил, ізовалерил, півалоїл і пентаноїл. Термін "нижчий алканоїлокси" в описаній вище формулі (І) означає групу, в якій описаний вище 17 "нижчий алканоїл" приєднаний до атому кисню, і приклади такої групи включають ацетилокси, пропіонілокси, бутирилокси, ізобутирилокси, валерилокси, ізовалерилокси, півалоїлокси і пентаноїлокси. Термін "нижчий алкілтіо" в описаній вище формулі (І) означає замісник, де описаний вище "нижчий алкіл" приєднаний до атому сірки, і приклади такої групи включають метилтіо, етилтіо і бутилтіо. Термін "селективний інгібітор Аврори А", застосовний у даному описі винаходу, являє собою сполуку або лікарський засіб, що селективно інгібує Аврору А в порівнянні з Авророю В. "Селективний інгібітор Аврори А" переважно являє собою сполуку або лікарський засіб, інгібуючі активності якого у відношенні Аврори А, щонайменше, у десять разів більше активностей у відношенні Аврори В; і більш переважно, сполуку або лікарський засіб, інгібуючі активності якого у відношенні Аврори А, щонайменше, у сто разів вище активностей у відношенні Аврори В. Пояснення терміна "її фармацевтично прийнятна сіль складного ефіру" або термін "фармацевтично прийнятний носій або розріджувач", застосовувані в описі винаходу, будуть дані пізніше. Термін "лікування раку", застосовуваний в описі винаходу, означає інгібування росту ракових клітин шляхом введення протипухлинного засобу пацієнту з раковим захворюванням. Переважно, таке лікування уможливлює ретрогресію росту ракового новоутворення, тобто зменшення розміру ракового новоутворення, що піддається вимірюванню. Більш переважно, таке лікування цілком усуває ракове новоутворення. Термін "рак", застосовуваний в описі винаходу, стосується солідного раку і злоякісного захворювання кровотворної системи. У даному описі приклади солідного раку включають пухлину мозку, рак голови і шиї, рак стравоходу, рак щитовидної залози, дрібноклітинний рак легенів, недрібноклітинний рак легенів, рак молочної залози, рак шлунка, рак жовчного міхура і жовчної протоки, рак печінки, рак підшлункової залози, рак ободової кишки, рак прямої кишки, рак яєчника, хоріонепітеліому, рак матки, рак шийки матки, рак ниркової балії і сечоводу, рак сечового міхура, рак передміхурової залози, рак статевого члена, рак яєчка, ембріональний рак, пухлину Вільмса, рак шкіри, злоякісну меланому, нейробластому, остеосаркому, пухлину Юїнга і саркому м'яких тканин. З іншого боку, приклади злоякісного захворювання кровотворної системи включають гострий лейкоз, хронічний лімфолейкоз, хронічний мієлоцитарний лейкоз, істинну поліцитемію, злоякісну лімфому, множинну мієлому і неходжкінську лімфому. Термін "препарат", застосовуваний в описі винаходу, включає препарати для перорального введення і препарати для парентерального введення. Приклади препаратів для перорального введення включають таблетки, капсули, порошки і гранули, у той час як приклади парентеральних препаратів включають стерилізовані рідкі препарати, такі як розчини або суспензії, зокрема, ін'єкції або вливання за допомогою крапельниці. Переважно, вони являють собою внутрішньовенні ін'єкції 95972 18 або внутрішньовенні вливання за допомогою крапельниці, і більш переважно внутрішньовенні вливання за допомогою крапельниці. Термін "комбінований препарат", застосовуваний в описі винаходу, стосується препаратів, що містять два або більше препарати для одночасного, окремого або послідовного введення при лікуванні, і такий препарат може являти собою препарат або фармацевтичну композицію такзваного складального типу. Термін "комбінований препарат" також включає препарат, що містить один або кілька препаратів, додатково об'єднаних з комбінованим препаратом, що містить два окремих препарати, застосовуваних при лікуванні раку. Описані вище два окремих препарати можна додатково поєднувати в комбінації з фармацевтично прийнятним носієм або розріджувачем, щонайменше, з одним препаратом, що містить, щонайменше, один протипухлинний засіб, вибраний із групи, що складається з протипухлинних алкілуючих засобів, протипухлинних антиметаболітів, протипухлинних антибіотиків, протипухлинних засобів рослинного походження, протипухлинних координаційних сполук платини, протипухлинних похідних камптотецину, протипухлинних інгібіторів тирозинкінази, моноклональних антитіл, інтерферонів, модифікаторів біологічної відповіді й інших протипухлинних засобів (тут визначення кожного протипухлинного засобу є таким же, як у наведеному вище визначенні), або їх фармацевтично прийнятної солі або складного ефіру. У такому випадку згаданий вище, щонайменше, один препарат, що об'єднаний додатково, можна вводити одночасно, окремо або послідовно стосовно двох окремих препаратів. Наприклад, комбінований препарат, що містить три препарати, може включати той, який складається з препарату, що включає препарат, що містить сполуку, представлену описаної вище формулою (І), препарат, що містить 5-фторурацил, і препарат, що містить лейковорин. Тут у згаданому вище комбінованому препараті будь-який з двох або обоидва разом окремі препарати можуть являти собою препарат для перорального введення; а також один може являти собою препарат для перорального введення, у той час як інший може являти собою препарат для парентерального введення (ін'єкції або вливання за допомогою крапельниці). Препарат відповідно до винаходу звичайно може містити терапевтично ефективну кількість сполуки згідно з даним винаходом разом з фармацевтично прийнятним носієм або розріджувачем. Вважається, що така методика готування лікарського засобу добре відома і повинна являти собою технічні зведення, загальновідомі для фахівців у даній галузі. Переважно, препарати для перорального введення, внутрішньовенного вливання за допомогою крапельниці або ін'єкції можна одержувати в комбінації з фармацевтично прийнятним носієм або розріджувачем різними способами, що добре відомі в даній галузі. У випадку застосування комбінованого препарату згідно з даним винаходом термін "введення", застосовуваний у даному описі винаходу, стосується парентерального введення і/або перораль 19 ного введення і переважно - перорального введення. Таким чином, при введенні комбінованого препарату обидва введення можуть бути парентеральними; одне введення може бути парентеральним, у той час як інше може бути пероральним; або обидва введення можуть бути пероральними. Переважно, обидва препарати в комбінованому препараті вводяться перорально. Тут термін "парентеральне введення", наприклад, являє собою внутрішньовенне введення, підшкірне введення або внутрішньом'язове введення, і переважно, він являє собою внутрішньовенне введення. Навіть коли поєднуються і вводяться три або більше препарати, кожен препарат можна вводити перорально. В одному з варіантів здійснення даного винаходу сполуку, представлену описаною вище формулою (І), можна вводити одночасно з іншим протипухлинним засобом(ами). Крім того, спочатку можна вводити сполуку, представлену описаною вище формулою (І), а потім послідовно - інший протипухлинний засіб; або, альтернативно, спочатку можна вводити інший протипухлинний засіб, а потім послідовно сполуку, представлену описаною вище формулою (І). Також спочатку можна вводити сполуку, представлену описаною вище формулою (І), а потім через якийсь час окремо вводити інше протипухлинний засіб; або, альтернативно, спочатку можна вводити інше протипухлинний засіб, а потім через якийсь час окремо вводити сполуку, представлену описаною вище формулою (І). Порядок і часовий інтервал введення відповідним чином може бути вибраний фахівцем у даній галузі відповідно, наприклад, до застосовуваного препарату, що містить сполуку, представлену описаною вище формулою (І), і препарату, що містить протипухлинний засіб,що застосовується в комбінації з ним, типом ракових клітин, що піддаються лікуванню, і станом пацієнта. Наприклад, у випадку введення сполуки, представленої описаною вище формулою (І), і паклітакселу або доцетакселу, переважно спочатку вводити паклітаксел або доцетаксел, а потім через якийсь час послідовно або окремо вводити сполуку, представлену описаною вище формулою (І). Термін "одночасно", застосовуваний в описі винаходу, стосується застосування препаратів для лікування в значній мірі в той самий час, тоді як термін "окремо" стосується окремого застосування препаратів для лікування в різний час, так що, наприклад, один засіб застосовують у перший день, а інший засіб застосовують на другий день лікування. Термін "послідовно" стосується застосування препаратів у такому порядку, що, наприклад, спочатку застосовують один засіб, а через заданий період часу застосовують інший засіб для лікування. Термін "протипухлинний алкілуючий засіб", застосовуваний у даному описі винаходу, стосується алкілуючого засобу, що володіє протипухлинною активністю, і тут термін "алкілуючий засіб" звичайно стосується засобу, що віддає алкільну групу в реакції алкілування, при якій атом водню органічної сполуки заміщається алкільною групою. Термін "протипухлинний алкілуючий засіб" можна проілю 95972 20 струвати прикладами у вигляді N-оксиду азотистого іприту, циклофосфаміду, іфосфаміду, мелфалану, бусульфану, мітобронітолу, карбоквону, тіотепи, ранімустину, німустину, темозоломіду або кармустину. Термін "протипухлинний антиметаболіт", застосовуваний в описі винаходу, стосується антиметаболіту, що володіє протипухлинною активністю, і тут термін "антиметаболіт" включає, у широкому сенсі, речовини, що порушують нормальний обмін речовин, і речовинии, що інгібують систему переносу електронів для запобігання утворення багатих енергією проміжних продуктів, завдяки їх структурній або функціональній схожості з метаболітами, що важливі для живих організмів (такими як вітаміни, коферменти, амінокислоти і сахариди). Термін "протипухлинні антиметаболіти" можна проілюструвати прикладами у вигляді метотрексату, 6-меркаптопуринрибозиду, меркаптопурину, 5-фторурацилу, тегафуру, доксифлуридину, кармофуру, цитарабіну, окфосфату цитарабіну, еноцитабіну, S-1, гемцитабіну, флударабіну або динатрію пеметрекседу, а переважними є 5фторурацил, S-1, гемцитабін і т.п. Термін "протипухлинний антибіотик", застосовуваний в описі винаходу, стосується антибіотика, що володіє протипухлинною активністю, і тут "антибіотик" включає речовинии, що продукуються мікроорганізмами або виходять шляхом органічного синтезу і інгібують ріст клітин і інші функції мікроорганізмів і інших живих організмів. Термін "протипухлинний антибіотик" можна проілюструвати прикладами у вигляді актиноміцину D, доксорубіцину, даунорубіцину, неокарциностатину, блеоміцину, пепломіцину, мітоміцину С, акларубіцину, пірарубіцину, епірубіцину, зиностатин стималамеру, ідарубіцину, сиролімусу або валрубіцині. Термін "протипухлинний засіб рослинного походження", застосовуваний в описі винаходу, включає сполуки, що володіють протипухлинними активностями, що походять з рослин, або сполуки, одержувані шляхом застосування у відношенні вищезгаданих сполук хімічної модифікації. Термін "протипухлинний засіб рослинного походження" можна проілюструвати прикладами у вигляді вінкристину, вінбластину, віндезину, етопозиду, собузоксану, доцетакселу, паклітакселу і вінорелбіну, і переважними є доцетаксел і паклітаксел. Термін "протипухлинне похідне камптотещину", застосовуваний в описі винаходу, стосується сполук, що є структурно родинними камптотецину і інгібують ріст ракових клітин, включаючи камптотецин сам по собі. Термін "протипухлинне похідне камптотецину" спеціально не обмежується, хоча його можна проілюструвати прикладами у вигляді камптотецину, 10-гідроксикамптотецину, топотекану, іринотекану або 9-амінокамптотецину, з тим, що переважними є камптотецин, топотекан і іринотекан. Крім того, іринотекан піддається перетворенню в процесі обміну речовин in vivo і володіє протипухлинним ефектом як SN-38. Вважається, що механізм дії й активність похідних камптотецину практично повинні бути такими ж як у камптотецину (див., наприклад, публікацію Nitta і ін., Can to Kagaku Ryoho, 14, 850-857 (1987)). 21 Термін "протипухлинна координаційна сполука платини (платинового комплексу)", застосовуваний в описі винаходу, стосується координаційної сполуки платини, що володіє протипухлинною активністю, і термін "координаційна сполука платини" стосується тут координаційної сполуки платини, що забезпечує платину в іонній формі. Переважні сполуки платини включають цисплатин; цисдіаміндіаквоплатина(ІІ)-іон; хлорид хлор(діетилентриамін)платини(ІІ); дихлор(етилендіамін)платину (II); діамін-(1,1циклобутандикарбоксилато)платину(ІІ) (карбоплатин); спіроплатин; іпроплатин; діамін-(2етилмалонато)платину (II); етилендіамінмалонатоплатину(ІІ); аква-(1,2діамінодициклогексан)сульфатоплатину(ІІ); аква(1,2-діамінодициклогексан)малонатоплатину(ІІ); (1,2-діаміноциклогексан)малонатоплатину(ІІ); (4карбоксифталато)(1,2діаміноциклогексан)платину(ІІ); (1,2діаміноциклогексан)-(ізоцитрато)платину(ІІ), (1,2діаміноциклогексан)оксалатоплатину(ІІ); ормаплатин; тетраплатин; карбоплатин, недаплатин і оксаліплатин, і переважними є карбоплатин або оксаліплатин. Крім того, відомі і маються в продажу і/або можуть бути одержані фахівцем у даній галузі за допомогою традиційних методик інші протипухлинні координаційні сполуки платини, згадані в описі винаходу. Термін "протипухлинний інгібітор тирозинкінази", застосовуваний в описі винаходу, стосується інгібітору тирозинкінази, що володіє протипухлинною активністю, і термін "інгібітор тирозинкінази" стосується тут хімічної речовини, що інгбує "тирозинкіназу", яка переносить г-фосфатну групу АТФ до гідроксигрупи специфічного тирозину в білку. Термін "протипухлинний інгібітор тирозинкінази" можна проілюструвати прикладами у вигляді гефитинібу, іматинібу, сорафенібу, сунітинібу, дазатинібу або ерлотинібу. Термін "моноклональне антитіло", застосовуваний в описі винаходу, що також відомий як одноклональне антитіло, стосується антитіла, яке продукується клітиною, що продукує моноклональне антитіло, і їхні приклади включають цетуксимаб, бевацизумаб, ритуксимаб, алемтузумаб і трастузумаб. Термін "інтерферон", застосовуваний в описі винаходу, стосується інтерферону, що володіє протипухлинною активністю, і являє собою глікопротеїн з молекулярною масою приблизно 20000, що продукується і виділяється більшістю тваринних клітин при вірусній інфекції. Він володіє не тільки ефектом інгібування росту вірусу, але також різними імуноефекторними механізмами, включаючи інгібування росту клітин (зокрема, пухлинних клітин) і підвищення активності природних клітинкілерів, тому визначається як один з типів цитокінів. Приклади "інтерферону" включають інтерферон , інтерферон -2а, інтерферон -2b, інтерферон в, інтерферон -1a і інтерферон -n1. Термін "модифікатор біологічної відповіді", застосовуваний в описі винаходу, означає так званий модифікатор біологічної відповіді або BRM і звичайно являє собою загальне позначення речовин 95972 22 або лікарських засобів, призначених для модифікації захисних механізмів живих організмів або біологічних відповідей, таких як виживання, ріст або диференціювання клітин тканин, для того, щоб направити їх з користю для індивіда проти пухлини, інфекції або інших захворювань. Приклади "модифікатора біологічної відповіді" включають крестин, лентинан, сизофіран, піцибаніл і убенімекс. Термін "інший протипухлинний засіб", застосовуваний в описі винаходу, стосується протипухлинного засобу, що не належить до жодного з описаних вище засобів, що володіє протипухлинними активностями. Приклади "іншого протипухлинного засобу" включають мітоксантрон, L-аспарагіназу, прокарбазин, дакарбазин, гідроксикарбамід, пентостатин, третиноїн, алефацепт, дарбепоетин альфа, анастрозол, екземестан, бікалутамід, лейпрорелін, флутамід, фулвестрант, октанатрію пегалтаніб, денілейкин дифтитокс, алдеслейкін, тиротропін альфа, триоксид миш'яку, бортезоміб, капецитабін і гозерелін. Всі описані вище терміни "протипухлинний алкілуючий засіб", "протипухлинний антиметаболіт", "протипухлинний антибіотик", "протипухлинний засіб рослинного походження", "протипухлинна координаційна сполука платини", "протипухлинне похідне камптотецину", "протипухлинний інгібітор тирозинкінази", "моноклональне антитіло", "інтерферон", "модифікатор біологічної відповіді" і "інший протипухлинний засіб" відомі й або маються в продажу, або можуть бути одержані фахівцем у даній галузі за допомогою способів, що відомі по суті або добре відомі, або за допомогою традиційних способів. Спосіб одержання гефитинібу описаний, наприклад, у патенті США № 5770599; спосіб одержання цетуксимабу описаний, наприклад, у заявці WO 96/40210; спосіб одержання бевацизумабу описаний, наприклад, у заявці WO 94/10202; спосіб одержання оксаліплатину описаний, наприклад, у патентах США №№ 5420319 і 5959133; спосіб одержання гемцитабіну описаний, наприклад, у патентах США №№ 5434254 і 5223608; і спосіб одержання камптотецину описаний у патентах США №№ 5162532, 5247089, 5191082, 5200524, 5243050 і 5321140; спосіб одержання іринотекану описаний, наприклад, у патенті США № 4604463; спосіб одержання топотекану описаний, наприклад, у патенті США № 5734056; спосіб одержання темозоломіду описаний, наприклад, у патенті JP-B № 4-5029; і спосіб одержання ритуксимабу описаний, наприклад, у патенті JP-W № 2503143. Згадані вище протипухлинні алкілуючі засоби маються в продажі, що проілюстровано наступними прикладами: N-оксид азотистого іприту від компанії Mitsubishi Pharma Corp. у вигляді препарату Нітромін (торгова марка Nitromin); циклофосфамід від компанії Shionogi & Co., Ltd. у вигляді препарату Ендоксан (торгова марка Endoxan); іфосфамід від компанії Shionogi & Co., Ltd. у вигляді препарату Іфомід (торгова марка Ifomide); мелфалан від компанії GlaxoSmithKline Corp. у вигляді препарату Алкеран (торгова марка Alkeran); бусульфан від компанії Takeda Pharmaceutical Co., Ltd. у вигляді 23 препарату Маблін (торгова марка Mablin); мітобронітол від компанії Kyorin Pharmaceutical Co., Ltd. у вигляді препарату Мієброл (торгова марка Myebrol); карбоквон від компанії Sankyo Co., Ltd. у вигляді препарату Есквінон (торгова марка Esquinon); тіотепа від компанії Sumitomo Pharmaceutical Co., Ltd. у вигляді препарату Теспамін (торгова марка Tespamin); ранімустин від компанії Mitsubishi Pharma Corp. у вигляді препарату Цимерин (торгова марка Cymerin); німустин від компанії Sankyo Co., Ltd. у вигляді препарату Нідран (торгова марка Nidran); темозоломід від компанії Schering Corp. у вигляді препарату Темодар (торгова марка Temodar); і кармустин від компанії Guilford Pharmaceuticals Inc. у вигляді препарату Гліадел Вафер (торгова марка Gliadel Wafer). Згадані вище протипухлинні антиметаболіти маються в продажі, що проілюстровано у вигляді наступних прикладів: метотрексат від компанії Takeda Pharmaceutical Co., Ltd. у вигляді препарату Метотрексат (торгова марка Methotrexate); 6меркаптопурин рибозид від компанії Aventis Corp. у вигляді препарату Тіоінозин (торгова марка Thioinosine); меркаптопурин від компанії Takeda Pharmaceutical Co., Ltd. у вигляді препарату Лейкерин (торгова марка Leukerin); 5-фторурацил від компанії Kyowa Hakko Kogyo Co., Ltd. у вигляді препарату 5-FU (торгова марка); тегафур від компанії Taiho Pharmaceutical Co., Ltd. у вигляді препарату Футрафул (торгова марка Futraful); доксифлуридин від компанії Nippon Roche Co., Ltd. у вигляді препарату Фурутулон (торгова марка Furutulon); кармофур від компанії Yamanouchi Pharmaceutical Co., Ltd. у вигляді препарату Ямафур (торгова марка Yamafur); цитарабін від компанії Nippon Shinyaku Co., Ltd. у вигляді препарату Цилоцид (торгова марка Cylocide); окфосфат цитарабіну від компанії Nippon Kayaku Co., Ltd. у вигляді препарату Страсид (торгова марка Strasid); еноцитабін від компанії Asahi Kasei Corp. у вигляді препарату Санрабін (торгова марка Sanrabin); S-1 від компанії Taiho Pharmaceutical Co., Ltd. у вигляді препарату TS-1 (торгова марка); гемцитабін від компанії Eli Lilly & Co. у вигляді препарату Гемзар (торгова марка Gemzar); флударабін від компанії Nippon Schering Co., Ltd. у вигляді препарату Флудара (торгова марка Fludara); і динатрію пеметрексед від компанії Eli Lilly & Со. у вигляді препарату Алімта (торгова марка Alimta). Згадані вище протипухлинні антибіотики маються в продажі, що проілюстровано наступними прикладами: актиноміцин D від компанії Banyu Pharmaceutical Co., Ltd. у вигляді препарату Космеген (торгова марка Cosmegen); доксорубіцин від компанії Kyowa Hakko Kogyo Co., Ltd. у вигляді препарату Адріацин (торгова марка Adriacin) ; даунорубіцин від компанії Meiji Seika Kaisha Ltd. у вигляді препарату Дауноміцин (Daunomycin); неокарциностатин від компанії Yamanouchi Pharmaceutical Co., Ltd. у вигляді препарату Неокарциностатин (торгова марка Neocarzinostatin); блеоміцин від компанії Nippon Kayaku Co., Ltd. у вигляді препарату Блео (торгова марка Вlео); пепроміцин від компанії Nippon Kayaku Co, Ltd. у вигляді препарату Пепро (торгова марка Рерго); мі 95972 24 томіцин С від компанії Kyowa Hakko Kogyo Co., Ltd. у вигляді препарату Мітоміцин (торгова марка Mitomycin); акларубіцин від компанії Yamanouchi Pharmaceutical Co., Ltd. у вигляді препарату Аклацинон (торгова марка Aclacinon); пірарубіцин від компанії Nippon Kayaku Co., Ltd. у вигляді препарату Пінорубіцин (торгова марка Pinorubicin); епірубіцин від компанії Pharmacia Corp. у вигляді препарату Фарморубіцин (торгова марка Pharmorubicin); зиностатин стималамер від компанії Yamanouchi Pharmaceutical Co., Ltd. у вигляді препарату Сманкс (торгова марка Smancs); ідарубіцин від компанії Pharmacia Corp. у вигляді препарату Ідаміцин (торгова марка Idamycin); сиролімус від компанії Wyeth Corp. у вигляді препарату Рапамун (торгова марка Rapamune); і валрубіцин від компанії Anthra Pharmaceuticals Inc. у вигляді препарату Валстар (торгова марка Valstar). Згадані вище протипухлинні засоби рослинного походження маються в продажу, що проілюстровано наступними прикладами: вінкристин від компанії Shionogi & Co., Ltd. у вигляді препарату Онковін (торгова марка Oncovin); вінбластин від компанії Kyorin Pharmaceutical Co., Ltd. у вигляді препарату Вінбластин (торгова марка Vinblastine); віндезин від компанії Shionogi & Co., Ltd. у вигляді препарату Філдезин (торгова марка Fildesin); етопозид від компанії Nippon Kayaku Co., Ltd. у вигляді препарату Ластет (торгова марка Lastet); собузоксан від компанії Zenyaku Kogyo Co., Ltd. у вигляді препарату Перазолін (торгова марка Perazolin); доцетаксел від компанії Aventis Corp. у вигляді препарату Таксотер (торгова марка Taxsotere); паклітаксел від компанії Bristol-Myers Squibb Co. у вигляді препарату Таксол (торгова марка Тахої); і вінорелбін від компанії Kyowa Hakko Kogyo Co., Ltd. у вигляді препарату Навелбін (торгова марка Navelbine). Згадані вище протипухлинні координаційні сполуки платини маються в продажу, що проілюстровано наступними прикладами: цисплатин від компанії Nippon Kayaku Co., Ltd. у вигляді препарату Ранда (торгова марка Randa); карбоплатин від компанії Bristol-Myers Squibb Co. у вигляді препарату Параплатин (торгова марка Paraplatin); недаплатин від компанії Shionogi & Co., Ltd. у вигляді препарату Аквапла (торгова марка Aqupla); і оксаліплатин від компанії Sanofi-Synthelabo Co. у вигляді препарату Елоксатин (торгова марка Eloxatin). Згадані вище протипухлинні похідні камптотецину маються в продажу, що проілюстровано наступними прикладами: іринотекан від компанії Yakult Honsha Co., Ltd. у вигляді препарату Кампто (торгова марка Campto); топотекан від компанії GlaxoSmithKline Со., у вигляді препарату Гікамтин (торгова марка Hycamtin); і камптотецин від компанії Aldrich Chemical Co., Inc., U.S.A. Згадані вище протипухлинні інгібітори тирозинкінази маються в продажу, що проілюстровано наступними прикладами: гефітиніб від компанії AstraZeneca Corp. у вигляді препарату Іреса (торгова марка Iressa); іматиніб від компанії Novartis AG у вигляді препарату Глівек (торгова марка Gleevec); сорафеніб від компанії Bayer у вигляді 25 препарату Нексавар (торгова марка Nexavar); сунітиніб від компанії Pfizer у вигляді препарату Сутент (торгова марка Sutent); дазатиніб від компанії Bristol Myers Squibb у вигляді препарату Спруцел (торгова марка Sprycel); і ерлотиніб від компанії OSI Pharmaceuticals Inc. у вигляді препарату Тарцева (торгова марка Tarceva). Згадані вище моноклональні антитіла маються в продажу, що проілюстровано наступними прикладами: цетуксимаб від компанії Bristol-Myers Squibb Co. у вигляді препарату Ербітукс (торгова марка Erbitux); бевацизумаб від компанії Genentech, Inc. у вигляді препарату Авастин (торгова марка Avastin); ритуксимаб від компанії Biogen Idee Inc. у вигляді препарату Ритуксан (торгова марка Rituxan); алемтузумаб від компанії Berlex Inc. у вигляді препарату Кампат (торгова марка Campath); і трастузумаб від компанії Chugai Pharmaceutical Co., Ltd. у вигляді препарату Герцептин (торгова марка Herceptin). Згадані вище інтерферони маються в продажу, що проілюстровано наступними прикладами: интерферон-б від компанії Sumitomo Pharmaceutical Co., Ltd. у вигляді препарату Суміферон (торгова марка Sumiferon); інтерферон а-2а від компанії Takeda Pharmaceutical Co., Ltd. у вигляді препарату Канферон-А (торгова марка Canferon-A); інтерферон а-2Ь від компанії Schering-Plough Corp. у вигляді препарату Інтрон А (торгова марка Intron А); інтерферон в від компанії Mochida Pharmaceutical Co., Ltd. у вигляді препарату ЕСНв (торгова марка); інтерферон г-1а від компанії Shionogi & Co., Ltd. у вигляді препарату Імуномакс-г (торгова марка Imunomax-г); і інтерферон г-зА від компанії Otsuka Pharmaceutical Co., Ltd. у вигляді препарату Огамма (торгова марка Ogamma). Згадані вище модифікатори біологічної відповіді маються в продажу, що проілюстровано наступними прикладами: крестин від компанії Sankyo Co., Ltd. у вигляді препарату Крестин (торгова марка Krestin); лентинан від компанії Aventis Соф. у вигляді препарату Лентинан (торгова марка Lentinan); сизофіран від компанії Kaken Seiyaku Co., Ltd. у вигляді препарату Соніфіран (торгова марка Sonifiran); піцибаніл від компанії Chugai Pharmaceutical Co., Ltd. у вигляді препарату Піцибаніл (торгова марка Picibanil); і убенімекс від компанії Nippon Kayaku Co., Ltd. у вигляді препарату Бестатин (торгова марка Bestatin). Згадані вище інші протипухлинні засоби маються в продажу, що проілюстровано наступними прикладами: мітоксантрон від компанії Wyeth Lederle Japan, Ltd. у вигляді препарату Новантрон (торгова марка Novantrone); L-аспарагіназа від компанії Kyowa Hakko Kogyo Co., Ltd. у вигляді препарату Леуназ (торгова марка Leunase); прокарбазин від компанії Nippon Roche Co., Ltd. у вигляді препарату Натулан (торгова марка Natulan); дакарбазин від компанії Kyowa Hakko Kogyo Co., Ltd. у вигляді препарату Дакарбазин (торгова марка Dacarbazine); гідроксикарбамід від компанії Bristol-Myers Squibb Co. у вигляді препарату Гідреа (торгова марка Hydrea); пентостатин від компанії Kagaku Oyobi Kessei Ryoho Kenkyusho у вигляді препарату Кофорин (торгова марка Coforin); тре 95972 26 тиноїн від компанії Nippon Roche Co., Ltd. у вигляді препарату Весаноїд (торгова марка Vesanoid); алефацепт від компанії Biogen Idee Inc. у вигляді препарату Амевів (торгова марка Amevive); дарбепоетин-альфа від компанії Amgen Inc. у вигляді препарату Аранесп (торгова марка Aranesp); анастрозол від компанії AstraZeneca Corp. у вигляді препарату Арімідекс (торгова марка Arimidex); екземестан від компанії Pfizer Inc. у вигляді препарату Аромазин (торгова марка Aromasin); бікалутамід від компанії AstraZeneca Corp. у вигляді препарату Казодекс (торгова марка Casodex); лейпрорелін від компанії Takeda Pharmaceutical Co., Ltd. у вигляді препарату Лейплін (торгова марка Leuplin); флутамід від компанії Schering-Plough Corp. у вигляді препарату Ейлексин (торгова марка Eulexin); фулвестрант від компанії AstraZeneca Corp. у вигляді препарату Фаслодекс (торгова марка Faslodex); октанатрію пегаптаніб від компанії Gilead Sciences, Inc. у вигляді препарату Макуген (торгова марка Macugen); денілейкін дифтитокс від компанії Ligand Pharmaceuticals Inc. у вигляді препарату Онтак (торгова марка Ontak); алдеслейкін від компанії Chiron Corp. у вигляді препарату Пролейкін (торгова марка Proleukin); тиротропін-альфа від компанії Genzyme Corp. у вигляді препарату Тироген (торгова марка Thyrogen); триоксид миш'яку від компанії Cell Therapeutics, Inc. у вигляді препарату Триценокс (торгова марка Trisenox); бортезоміб від компанії Millennium Pharmaceuticals, Inc. у вигляді препарату Велкад (торгова марка Velcade); капецитабін від компанії Hoffmann-La Roche, Ltd. у вигляді препарату Кселода (торгова марка Xeloda); і гозерелін від компанії AstraZeneca Corp. у вигляді препарату Золадекс (торгова марка Zoladex). Термін "протипухлинний засіб", застосовуваний в описі винаходу, включає описане вище "протипухлинний алкілуючий засіб", "протипухлинний антиметаболіт", "протипухлинний антибіотик", "протипухлинний засіб рослинного походження", "протипухлинна координаційна сполука платини", "протипухлинне похідне камптотецину", "протипухлинний інгібітор тирозинкінази", "моноклональне антитіло", "інтерферон", "модифікатор біологічної відповіді " і "інший протипухлинний засіб". Термін "амінопіридинове похідне", застосовуваний в описі винаходу, включає, але не обмежується перерахованим, будь-яку сполуку, що містить піридильну групу або групу, аналогічну піридиновій групі, кожна з який заміщена аміногрупою. Сказане ілюструється сполукою описаної вище загальної формули (І), і, переважно, кожною зі згаданих нижче сполук від (а) до (e): сполука, що являє собою: (a) транс-4-(3-хлор-2-фторфенокси)-1-((6-(1,3тіазол-2-іламіно)піридин-2іл)метил)циклогексанкарбонову кислоту (приклад 1 і 2); (b) транс-4-(2-фтор-3(трифторметил)фенокси)-1-((6-(1,3-тіазол-2іламіно) піридин-2-іл)метил )циклогексанкарбонову кислоту (приклад 4); (c) транс-4-(2,3 -дихлорфенокси)-1 -((6-(1,3тіазол-2-іламіно)піридин-2 27 іл)метил)циклогексанкарбонову кислоту (приклад 5); (d) транс-4-(2-фтор-3(трифторметил)фенокси)-1-((6-(1Н-піразол-3іламіно) піридин-2-іл)метил )циклогексанкарбонову кислоту (приклад 7); (e) транс-4-(3-хлор-2-фторфенокси)-1-((6-(1Нпіразол-3-іламіно)піразин-2-іл) метил )циклогексанкарбоксамід (приклад 11); (f) 5-(транс-4-(2-фтор-3(трифторметил)фенокси)-1-((6-(1H-піразол-3іламіно) піридин-2-іл)метил )циклогексил)-1,3,4оксадіазол-2(3Н)-он (приклад 13); (g) 5-(транс-4-(3-хлор-2-фторфенокси)-1-((6(1Н-піразол-3-іл аміно)піридин-2-іл)метил )циклогексил)-1,3,4-оксадіазол-2(ЗН)-он (приклад 14); (h) 5-(транс-4-(3-хлор-2-фторфенокси)-1-((6(1Н-піразол-3-іламіно)піразин-2іл)метил)циклогексил)-1,3,4-оксадіазол-2(3Н)-он (приклад 17); або (і) 5-(транс-4-((2,3-дихлорфеніл)сульфоніл)-1((6-(1Н-піразол-3-іламіно)піридин-2-іл)метил )циклогексил)-1,3,4-оксадіазол-2(3Н)-он (приклад 24), або її фармацевтично прийнятну сіль або складний ефір. Варіанти здійснення сполуки, представленої описаною вище загальною формулою (І), будуть проілюстровані більш докладно. R1 являє собою атом водню, F, CN, COORa1, CONRa2Ra2', NRa3CORa3', CONRa4ORa4’, NRa5CONRa5’Ra5’, NRa6COORa6’, SO2NRa7Ra7’, NRa8SO2Ra8’, CORa9, SO2Ra10, NO2, ORa11 або NRa12Ra12, де: кожний з Ra1, Ra3, Ra4, Ra5, Ra6 і Ra8 незалежно являє собою атом водню або нижчий алкіл; кожний з Ra2, Ra2', Ra5', Ra5", R7, Ra7', Ra12 і Ra12' незалежно являє собою атом водню або нижчий алкіл, що може бути заміщений одним або декількома, однаковими або різними замісниками, вибраними з , в якій являє собою атом галогену, гідрокси, нітро, ціано, аміно, карбамоїл, аміносульфоніл, іміно, нижчу алкіламіногрупу, ді(нижчий)алкіламіногрупу, нижчий алкілсульфоніл, нижчу алкілсульфоніламіногрупу, нижчий алкокси, нижчий алкоксикарбоніл, нижчу алкоксикарбоніламіногрупу, нижчий алканоїл, нижчий алканоїлокси, нижчий алкілтіо і карбоксил; однак за умови, що кожні з Ra2, Ra2', Ra5', Ra5", R7, Ra7', Ra12 і Ra12' - незалежно, разом з атомом азоту, до якого вони приєднані, можуть утворювати 5членну або 6-членну ароматичну або аліфатичну гетероциклічну групу, що може бути заміщена одним або декількома, однаковими або різними замісниками, вибраними з , в якій являє собою атом галогену, гідрокси, аміно, і гідроксиметил; кожний з Ra3', Ra4', Ra6', Ra8', Ra9, Ra10 і Ra11 незалежно являє собою этом водню або нижчий алкіл, що може бути заміщений одним або декількома, однаковими або різними замісниками, вибраними з ; або R1 являє собою нижчий алкіл, що може бути заміщений одним або декількома, однаковими або 95972 28 різними замісниками, вибраними з , в якій являє собою атом галогену, гідрокси, нітро, ціано, аміно, карбамоїл, аміносульфоніл, іміно, нижчу алкіламіногрупу, ді(нижчий)алкіламіногрупу, нижчий алкілсульфоніл, нижчу алкілсульфоніламіногрупу, нижчий алкокси, нижчий алкоксикарбоніл, нижчу алкоксикарбоніламіногрупу, нижчий алканоїл, нижчий алканоїлокси, нижчий алкілтіо і карбоксил; або R1 являє собою гетероциклічну групу, вибрану з наступних груп, де Х1 і Y2 є однаковими або різними, і кожний являє собою атом водню або нижчий алкіл, що може бути заміщений: Переважно R1 являє собою ОН, СООН або CONRa2Ra2', в якій Ra2 і Ra2' є однаковими або різними, і кожний являє собою атом водню або нижчий алкіл, що містить від одного до трьох атомів вуглецю; або Ri вибраний з наступних груп: являє собою атом галогену, гідрокси, нітро, ціано, аміно, карбамоїл, аміносульфоніл, іміно, нижчу алкіламіногрупу, ді(нижчий)алкіламіногрупу, нижчий алкілсульфоніл, нижчу алкілсульфоніламіногрупу, нижчий алкокси, нижчий алкоксикарбоніл, нижчу алкоксикарбоніламіногрупу, нижчий алканоїл, нижчий алканоїлокси, нижчий алкілтіо і карбоксил; переважно, являє собою атом водню, гідрокси, аміно, карбамоїл, нижчу алкіламіногрупу, нижчу алкіламіногрупу і нижчий алкокси. являє собою атом галогену, гідрокси, аміно і гідроксиметил; переважно, гідрокси і гідроксиметил. являє собою атом галогену, гідрокси, нітро, ціано, аміно, карбамоїл, аміносульфоніл, іміно, нижчу алкіламіногрупу, ді(нижчий)алкіламіногрупу, нижчий алкілсульфоніл, нижчу алкілсульфоніламіногрупу, нижчий алкокси, нижчий алкоксикарбоніл, нижчу алкоксикарбоніламіногрупу, нижчий алканоїл, нижчий алканоїлокси, нижчий алкілтіо і карбоксил; переважно, гідрокси, карбамоїл, аміносульфоніл, нижчу алкілсульфоніламіногрулпу і карбоксил. R2 являє собою О, S, SO, SO2, NH, NRb або CRс1Rс2, в якій Rb являє собою нижчий алкіл, що може бути заміщений, і Re і і Rc2, що можуть бути однаковими або різними, являють собою атом водню або нижчий алкіл, що може бути заміщений. Переважно, R2 являє собою О, S, SO, або SO2; більш переважно, О. 29 R3 являє собою феніл, що може бути заміщений; переважно, R3 являє собою феніл, що заміщений; більш переважно, R3 являє собою феніл, який у 2-ому і 3-ьому положеннях заміщений двома однаковими або різними замісниками, вибраними з F, СІ, CF3 і CN. Х2 являє собою СН, СХ2а або N, де: Х2а являє собою нижчий алкіл; або Х2а являє собою замісник, вибраний з , або нижчий алкіл, що заміщений одним або декількома, однаковими або різними замісниками, вибраними з , де являє собою атом галогену; ціано; гідрокси; нижчу алкіламіногрупу; ді(нижчий)алкіламіногрупу; нижчий алкокси, що може бути заміщений однією або декількома гідроксигрупами; нижчий алкілтіо; і нижчий алкілсульфоніл; або Х2а являє собою COORx1, CONRx2Rx3, NHCORx1, NHCONRx2Rx3, NHSO2NRx2Rx3, NRx4Rx5 або CH2NRx4Rx5, де: Rx1 являє собою атом водню або нижчий алкіл, що може бути заміщений; кожний з Rx2 і Rx3, що можуть бути однаковими або різними, являє собою атом водню, нижчий алкіл, що може бути заміщений, або циклоалкіл, що може бути заміщений; або, альтернативно, Rx2 і RX3 разом з атомом азоту, до якого вони приєднані, утворюють 5- або 6-членну аліфатичну гетероциклічну групу, що містить, щонайменше, один атом, вибраний з N, O і S, і яка може бути заміщена; і RX4 і RX5, що можуть бути однаковими або різними, являють собою атом водню, нижчий алкіл, що може бути заміщений, або циклоалкіл, що може бути заміщений; або Х2а являє собою 5- або 6-членну аліфатичну гетероциклічну групу, що містить, щонайменше, один атом, вибраний з N, O і S, і яка може бути заміщена, в якій два атоми водню, що приєднані до того самого атому вуглецю аліфатичної гетероциклічної групи, можуть бути заміщені оксогрупою, а сусідні два атоми вуглецю, що складають аліфатичне гетероциклічне кільце, можуть утворювати подвійний зв'язок; або нижчий алкіл, який заміщений аліфатичною гетероциклічною групою; або Х2а являє собою 5- або 6-членну ароматичну гетероциклічну групу, що містить, щонайменше, один атом, вибраний з N, O і S, і яка може бути заміщена; або нижчий алкіл, що заміщений ароматичною гетероциклічною групою. Переважно, Х2 являє собою СН, СХ2а або N, де Х2а являє собою нижчий алкіл. Більш переважно, Х2 являє собою СН або N. являє собою атом галогену; ціано; гідрокси; нижчу алкіламіногрупу; ді(нижчий)ал кіл аміногрупу; нижчий алкокси, що може бути заміщений однією або декількома гідроксигрупами; нижчий алкілтіо; і нижчий алкілсульфоніл; переважно, атом галогену, гідрокси, нижчу алкіламіногрупу і нижчий алкілсульфоніл. W являє собою наступний залишок: 95972 30 де: W1 являє собою СН, N, NН, О або S; W2 являє собою СН, CW 2a, N, NW 2b, О або S, де кожний з W 2a і W 2b незалежно являє собою атом водню, атом галогену, ціано, нижчий алкіл, що містить від одного до двох атомів вуглецю, циклоалкіл, що містить від трьох до п'яти атомів вуглецю, або нижчий алкіл, що містить від одного до двох атомів вуглецю, що може бути заміщений одним або декількома атомами галогену; W3 являє собою С або N; і щонайменше, один з W1 W 2 і W3 являє собою атом вуглецю; однак два з W1 W 2 і W3 одночасно не можуть являти собою О і S. W переважно вибраний з: W більш переважно вибраний з: де W 2a являє собою атом водню, атом галогену, ціано або метил, що може бути заміщений одним-трьома атомами фтору. Зокрема, W переважно вибраний з: Ще більш переважно, W вибраний з: Переважний варіант здійснення сполуки, представленого описаною вище загальною формулою (І), також можна виразити в такий спосіб: (1) Сполука описаної вище формули (І) або її фармацевтично прийнятна сіль або складний ефір, де W вибраний з: 31 (2) Сполука, описана в п. (1), або її фармацевтично прийнятна сіль або складний ефір, де R3 являє собою феніл, що у 2-ому і 3-ому положеннях заміщений двома однаковими або різними замісниками, вибраними з F, СІ, CF3 і CN. (3) Сполука, описана в п. (2), або її фармацевтично прийнятна сіль або складний ефір, де являє собою атом галогену, гідрокси, аміно, карбамоїл, нижчу алкіламіногрупу, ді(нижчий)алкіламіногрупу і нижчий алкокси; і являє собою гідрокси, карбамоїл, аміносульфоніл, нижчу алкілсульфоніламіногрупу і карбоксил. (4) Сполука, описана в п. (3), або її фармацевтично прийнятна сіль або складний ефір, де Х2 являє собою СН або N. (5) Сполука, описана в п. (4), або її фармацевтично прийнятна сіль або складний ефір, де R1 являє собою ОН, СООН або CONRa2Ra2', де Ra2 і Ra2' є однаковими або різними, і кожний з них являє собою атом водню або нижчий алкіл, що містить від одного до трьох атомів вуглецю; або R1 вибраний з наступних груп: і R2 являє собою О, S, SO або SO2. (6) Сполука, описана в п. (5), або її фармацевтично прийнятна сіль або складний ефір, де: W вибраний з: де W 2a являє собою атом водню, атом галогену, ціано або метил, що може бути заміщений одним-трьома атомами фтору. (7) Сполука, описана в п. (6), або її фармацевтично прийнятна сіль або складний ефір, де W являє собою будь-який з наступних залишків: (8) Сполука, що являє собою: 95972 32 (a) транс-4-(3-хлор-2-фторфенокси)-1-((6-(1,3тіазол-2-іламіно)піридин-2-іл) метил )циклогексанкарбонову кислоту; (b) транс-4-(2-фтор-3(трифторметил)фенокси)-1-((6-(1,3-тіазол-2іламіно) піридин-2-іл)метил )циклогексанкарбонову кислоту; (c) транс-4-(2,3-дихлорфенокси)-1-((6-(1,3тіазол-2-іламіно)піридин-2іл)метил)циклогексанкарбонову кислоту; (d) транс-4-(2-фтор-3(трифторметил)фенокси)-1-((6-(1Н-піразол-3іламіно) піридин-2-іл)метил )циклогексанкарбонову кислоту; (є) транс-4-(3-хлор-2-фторфенокси)-1-((6-(1Нпіразол-3-іламіно)піразин-2-іл) метил )циклогексанкарбоксамід; (f) 5-(транс-4-(2-фтор-3(трифторметил)фенокси)-1-((6-(1Н-піразол-3іламіно) піридин-2-іл)метил )циклогексил)-1,3,4оксадіазол-2(3Н)-он; (g) 5-(транс-4-(3-хлор-2-фторфенокси)-1-((6(1Н-піразол-3-іламіно)піридин-2-іл)метил )циклогексил)-1,3,4-оксадіазол-2(3Н)-он; (h) 5-(транс-4-(3-хлор-2-фторфенокси)-1-((6(1Н-піразол-3-іламіно)піразин-2-іл)метил )циклогексил)-1,3,4-оксадіазол-2(3Н)-он; або (і) 5-(транс-4-((2,3-дихлорфеніл)сульфоніл)-1((6-(1Н-піразол-3-іламіно)піридин-2-іл)метил )циклогексил)-1,3,4-оксадіазол-2(3Н)-он, або їх фармацевтично прийнятну сіль або складний ефір. Також при ще одному варіанті здійснення винахід стосується сполуки загальної формули (І0): де: R10 являє собою атом водню, F, CN, ОН, СН2ОН, СООН або CONRa10Ra20, де Rа10 і Ra20, що можуть бути однаковими або різними, являють собою атом водню або нижчий алкіл; R20 являє собою О, S, NH, NRb або CRс1Rс2, де Rb являє собою нижчий алкіл, і Rc1 і Rc2, що можуть бути однаковими або різними, являють собою атом водню або нижчий алкіл; R3 являє собою феніл, що може бути заміщений; Х1 являє собою СН, СХ1а або N, де X1a являє собою нижчий алкіл, що може бути заміщений; Х2 являє собою СН, СХ2а або N, де: Х2а являє собою нижчий алкіл; або Х2а являє собою замісник, вибраний з , або нижчий алкіл, що заміщений одним або декількома, однаковими або різними замісниками, вибраними з , де являє собою атом галогену; ціано; гідрокси; нижчу алкіламіногрупу; ді(нижчий)алкіламіногрупу; нижчий алкокси, що 33 може бути заміщений однією або декількома гідроксигрупами; нижчий алкілтіо; і нижчий алкілсульфоніл; або Х2а являє собою COORx1, CONRx2Rx3, NHCORx1, NHCONRx2Rx3, NHSO2NRx2Rx3, NRx4Rx5 або CH2NRx4Rx5, де: Rx1 являє собою атом водню або нижчий алкіл, що може бути заміщений; кожний з RX2 і Rx3, що можуть бути однаковими або різними, являє собою атом водню, нижчий алкіл, що може бути заміщений, або циклоалкіл, що може бути заміщений; або, альтернативно, Rx2 і RX3 разом з атомом азоту, до якого вони приєднані, утворюють 5- або 6-членну аліфатичну гетероциклічну групу, що містить, щонайменше, один атом, вибраний з N, O і S, і яка може бути заміщена; і RX4 і RX5, які можуть бути однаковими або різними, являють собою атом водню, нижчий алкіл, що може бути заміщений, або циклоалкіл, що може бути заміщений; або Х2а являє собою 5- або 6-членну аліфатичну гетероциклічну групу, що містить, щонайменше, один атом, вибраний з N, O і S, і яка може бути заміщена, в якій два атоми водню, що приєднані до того самого атому вуглецю аліфатичної гетероциклічної групи, можуть бути заміщені оксогрупою, а сусідні два атоми вуглецю, що складають аліфатичне гетероциклічне кільце, можуть утворювати подвійний зв'язок; або нижчий алкіл, який заміщений аліфатичною гетероциклічною групою; або Х2а являє собою 5- або 6-членну ароматичну гетероциклічну групу, що містить, щонайменше, один атом, вибраний з N, O і S, і яка може бути заміщена; або нижчий алкіл, що заміщений ароматичною гетероциклічною групою; однак за умови, що серед Х1 і Х2 кількість атомів азоту дорівнює 0 або 1; W являє собою наступний залишок: де: W1 являє собою СН, N, NH, О або S; W2 являє собою СН, CW 2a, N, NW 2b, О або S, де кожний з W 2a і W 2b незалежно являє собою атом водню, атом галогену, ціано, нижчий алкіл, що містить від одного до двох атомів вуглецю, циклоалкіл, що містить від трьох до п'яти атомів вуглецю, або нижчий алкіл, що містить від одного до двох атомів вуглецю, що може бути заміщений одним або декількома атомами галогену; W3 являє собою С або N; і щонайменше, один з W 1, W 2 і W 3 являє собою атом вуглецю; однак два з W1, W 2 і W 3 одночасно не можуть являти собою О і S, або до її фармацевтично прийнятної солі або складного ефіру. Крім того, у комбінованому препараті згідно з даним винаходом, що містить два окремих препарати, переважно, будь-який з двох окремих препаратів або обидва є препаратами для перорального введення. 95972 34 Комбінований препарат згідно з даним винаходом, що містить два окремих препарати, переважно є таким препаратом, де один із препаратів являє собою препарат, що містить разом з фармацевтично прийнятним носієм або розріджувачем наступні сполуки: (a) транс-4-(3-хлор-2-фторфенокси)-1-((6-(1,3тіазол-2-іламіно)піридин-2-іл) метил )циклогексанкарбонову кислоту; (b) транс-4-(2-фтор-3(трифторметил)фенокси)-1-((6-(1,3-тіазол-2іламіно) піридин-2-іл)метил )циклогексанкарбонову кислоту; (c) транс-4-(2,3-дихлорфенокси)-1-((6-(1,3тіазол-2-іламіно)піридин-2іл)метил)циклогексанкарбонову кислоту; (d) транс-4-(2-фтор-3(трифторметил)фенокси)-1-((6-(1Н-піразол-3іламіно) піридин-2-іл)метил )циклогексанкарбонову кислоту; (e) транс-4-(3-хлор-2-фторфенокси)-1-((6-(1Нпіразол-3-іламіно)піразин-2-іл) метил )циклогексанкарбоксамід; (f) 5-(транс-4-(2-фтор-3(трифторметил)фенокси)-1-((6-(1H-піразол-3іламіно) піридин-2-іл)метил )циклогексил)-1,3,4оксадіазол-2(3Н)-он; (g) 5-(транс-4-(3-хлор-2-фторфенокси)-1-((6-(1 Н-піразол-3-іламіно)піридин-2-іл)метил )циклогексил)-1,3,4-оксадіазол-2(3Н)-он; (h) 5-(транс-4-(3-хлор-2-фторфенокси)-1-((6(1H-піразол-3-іламіно)піразин-2іл)метил)циклогексил)-1,3, 4-оксадіазол-2(3Н)-он; або (і) 5-(транс-4-((2,3-дихлорфеніл)сульфоніл)-1((6-(1Н-піразол-3-іламіно) піридин-2-іл)метил )циклогексил)-1,3,4- оксадіазол-2(3Н)-он, або їх фармацевтично прийнятну сіль або складний ефір; і інший препарат являє собою препарат, що містить паклітаксел або доцетаксел, або їх фармацевтично прийнятну сіль або складний ефір разом з фармацевтично прийнятним носієм або розріджувачем. Крім того, комбінований препарат, що містить разом з фармацевтично прийнятним носієм або розріджувачем два окремих препарати, відповідно до винаходу можна додатково поєднувати, щонайменше, з одним препаратом, що містить протипухлинний засіб, вибраний із групи, що складається з протипухлинних алкілуючих засобів, протипухлинних антиметаболітів, протипухлинних антибіотиків, протипухлинних засобів рослинного походження, протипухлинних координаційних сполук платини, протипухлинних похідних камптотецину, протипухлинних інгібіторів тирозинкінази, моноклональних антитіл, інтерферонів, модифікаторів біологічної відповіді й інших протипухлинних засобів (тут визначення кожного протипухлинного засобу є таким самим, як у наведеному вище визначенні) або їх фармацевтично прийнятної солі або складного ефіру. Фармацевтична композиція згідно з даним винаходом разом з фармацевтично прийнятним носієм або розріджувачем також переважно містить наступні сполуки: 35 (a) транс-4-(3-хлор-2-фторфенокси)-1-((6-(1,3тіазол-2-іламіно)піридин-2-іл) метил )циклогексанкарбонову кислоту; (b) транс-4-(2-фтор-3(трифторметил)фенокси)-1-((6-(1,3-тіазол-2іламіно) піридин-2-іл)метил )циклогексанкарбонову кислоту; (c) транс-4-(2,3 -дихлорфенокси)-1 -((6-( 1,3 тіазол-2-іламіно)піридин-2-іл) метил )циклогексанкарбонову кислоту; (d) транс-4-(2-фтор-3(трифторметил)фенокси)-1-((6-(1Н-піразол-3іламіно) піридин-2-іл)метил )циклогексанкарбонову кислоту; (є) транс-4-(3-хлор-2-фторфенокси)-1-((6-(1Hпіразол-3-іламіно)піразин-2-іл) метил)циклогексанкарбоксамід; (f) 5-(транс-4-(2-фтор-3(трифторметил)фенокси)-1-((6-(1Н-піразол-3іламіно) піридин-2-іл)метил )циклогексил)-1,3,4оксадіазол-2(3Н)-он; (g) 5-(транс-4-(3-хлор-2-фторфенокси)-1-((6(1Н-піразол-3-іламіно)піридин-2-іл)метил )циклогексил)-1,3,4-оксадіазол-2(3Н)-он; (h) 5-(транс-4-(3-хлор-2-фторфенокси)-1-((6(1H-піразол-3-іламіно)піразин-2іл)метил)циклогексил)-1,3,4-оксадіазол-2(3Н)-он; або (і) 5-(транс-4-((2,3-дихлорфеніл)сульфоніл)-1((6-(1Н-піразол-3-іламіно)піридин-2іл)метил)циклогексил)-1,3,4-оксадіазол-2(3Н)-он, або їх фармацевтично прийнятну сіль або складний ефір; і паклітаксел або доцетаксел, або їх фармацевтично прийнятну сіль або складний ефір разом з фармацевтично прийнятним носієм або розріджувачем. Далі будуть пояснені інгібуючі активності сполуки загальної формули (І) згідно з даним винаходом у відношенні Аврори А і Аврори В. Інгібуюча активність у відношенні Аврори А (1) Очищення Аврори А кДНК His-міченої по N-кінцю людської кінази Аврора А інтегрували в експресуючий вектор, що потім у високій мірі експресувався в клітинах Escherichia coli BL21-CodonPlus(DE3)-RIL. Клітини Escherichia coli збирали і піддавали лізису, а потім His-мічений людський білок Аврора А наносили на нікель-хелатну колонку і елюювали з колонки імідазолом. Активні фракції знесолювали на колонці для гель-фільтрації (знесолення), одержуючи при цьому очищений фермент. (2) Вимірювання активності Аврори А Субстрат, застосовуваний для вимірювання активності Аврори А, являв собою синтетичний пептид (5-FAM (5-карбоксифлуоресцеїн)-уаміномасляна кислота-Ala-Leu-Arg-Arg-Ala-SerLeu-Gly-NH2) (SEQ ID NO:1), що був одержаний від компанії Toray Research Center, Inc. Для реакції фосфорилування посилаються на спосіб Upstate, Inc. [Kinase Profiler™ протоколи іспитів], і детектували фосфорилування субстрату, застосовуючи ІМАР-методику (Molecular Devices, Co. Ltd.) (Gaudet EW. і ін, J.Biomol. Screen, 8, 164175(2003)). Більш конкретно, реакцію фосфорилування і детектування здійснювали в такий спосіб: 95972 36 Реакцію фосфорилування проводили з використанням 384-ямкового планшета, реакційний об'єм складав 10 мкл/ямка. Реакційний буфер складався з 50 мМ Трис-хлоридного буфера (рН 7,4), 15 мМ ацетату магнію і 0,2 мМ етилендіамінN, N, N’, N’-тетраоцтової кислоти (EDTA). До нього додавали очищений білок Аврора А, 100 нМ пептидного субстрату і 20 мкМ аденозин-5'трифосфату (АТФ), і потім здійснювали реакцію при 30°С протягом 120 хвилин. Після цього, для того, щоб завершити і детектувати реакцію, у кожну ямку додавали по 30 мкл зв'язувального реагенту (ІМАР Progressive Binding Reagent, R7284) ІМАР (зареєстрована торгова марка), що був розведений (1:400) іхМАРзв'язувальним буфером А (ІМАР Progressive Binding Buffer А, 5хсток-розчин, R7282). Розчин витримували в темряві ще протягом 60 хвилин, і потім вимірювали поляризацію флуоресценції, використовуючи високопродуктивний зчитувальний пристрій для мікропланшетів (довжина хвилі збудження: 485 нм; довжина хвилі випромінювання: 520 нм). У реакційну систему додавали сполуку, що піддається тестуванню, при цьому готували серії розведень сполуки в диметилсульфоксиді (ДМСО), і потім додавали 0,5 мкл такого розчину для тестування в кожну ямку. Для кожного розчину забезпечували контрольну ямку шляхом додавання в ямку 0,5 мкл ДМСО замість розчину ДМСО, що містить сполуку, яка піддається тестуванню. Інгібуюча активність у відношенні Аврори В (1) Вимірювання активності Аврори В (Спосіб А) Для реакції фосфорилування застосовували набір реактивів для проведення аналізу ІМАР (зареєстрована торгова марка) (Аврора В), наданий компанією Сагпа Biosciences, Inc., і детектували фосфорилування субстрату з використанням ІМАР-технології. Застосовуваний набір реактивів для аналізу складався з буфера для аналізу, комплексу, що складається з GST-міченої людської Аврори В (Аиг)/комплексу His-міченихлюдських білків INCENP (амінокислотна послідовність: 803916, AAU04398.1) і розчину АТФ/субстрат. Використовуючи ті ж засоби, проводили реакцію фосфорилування відповідно до частково зміненої інструкції, прикладеної до набору, і потім детектували фосфорилування субстрату, використовуючи ІМАР-технологію. Для реакції фосфорилування використовували 384-ямковий планшет, а реакційний об'єм складав 10 мкл/ямка. Склад реакційного буфера (буфер для аналізу) складався з 20 мМ буфера HEPES (рН 7,4), 0,01% Tween-20, і 2 мМ дитіотрейтолу (DTT). До буфера додавали комплекс Aur/комплекс білка INCENP, 100 нМ субстрату, 40 мкМ АТФ і 1 мМ магнієвої солі, і потім проводили реакцію при 25°С протягом 45 хвилин. Після цього для завершення і детектування реакції в кожну ямку додавали по 30 мкл зв'язувального реагенту (ІМАР Progressive Binding Reagent, R7284) ІМАР (зареєстрована торгова марка), що розбавляли (1:400) 1xIMAP-зв'язувальним буфером А (ІМАР Progressive Binding Buffer А, 5хсток-розчин, 37 95972 38 R7282). Розчин витримували в темряві ще протягом 60 хвилин і потім вимірювали поляризацію флуоресценції, використовуючи високопродуктивний зчитувальний пристрій для мікропланшетів (довжина хвилі збудження: 485 нм; довжина хвилі випромінювання: 520 нм). У реакційну систему додавали тестовану сполуку, при цьому готували серії розведень сполуки в ДМСО, і потім по 0,5 мкл такого розчину додавали для тестування в кожну ямку. Для кожного розчину створювали контрольну ямку, додаючи в неї 0,5 мкл ДМСО замість розчину ДМСО, що містить сполуку, яка піддається тестуванню. (2) Вимірювання активності Аврори В (Спосіб В) (a) Очищення Аврори В кДНК людської Аврори В, що містить His-мітку, з'єднану з N-кінцем, інтегрували в експресуючий вектор, що потім з високою мірою експресувався в клітинах бактерії Escherichia coli BL21CodonPlus(DE3)-RIL. Клітини Escherichia coli збирали, піддавали солюбілізації, і потім His-мічений білок Аврора В адсорбували на нікель-хелатній колонці і елюювали з колонки імідазолом. Активні фракції знесолювали на колонці для гельфільтрації (знесолення), одержуючи при цьому очищений фермент. (b) Вимірювання активності Аврори В При вимірюванні активності Аврори В використовуваний субстрат являв собою Kemptide (LeuArg-Arg-Ala-Ser-Leu-Gly) (SEQ ID N0:2), а синтетичний пептид був наданий компанією Sigma-Aldrich, Inc. Реакцію проводили з використанням частково модифікованого способу вимірювання активності Аврори А. Кількість реакційної рідини складала 21,1 мкл, а до складу реакційного буфера (буфер R2) входило 50 мМ Трис-гідрохлоридного буфера (рН 7,4), 15 мМ ацетату магнію і 0,2 мМ етилендіамін-N,N,N',N'-тетраацетату (EDTA). До нього додавали очищену Аврору В, 100 мкМ субстратного пептиду, 100 мкМ не утримуючого мітки аденозин33 трифосфату (АТФ) і 1 мкКі АТФ, міченого - С (2500 Кі/ммоль або більше), і давали суміші можливість взаємодіяти при 30°С протягом 20 хвилин. Потім до реакційної системи додавали 10 мкл 350 мМ фосфатного буфера, щоб зупинити реакцію. Субстратний пептид адсорбували на 96-ямковому планшеті з паперового фільтра Р81 і потім кілька разів промивали 130 мМ фосфатним буфером. Радіоактивність пептиду вимірювали за допомогою рідинного сцинтиляційного лічильника. АТФ, міче33 ний - С, був наданий компанією Amersham Biosciences Co., Ltd. Сполуку, що піддається тестуванню, додавали в реакційну систему, при цьому спочатку готували серії розведень сполуки в ДМСО, і 1,1 мкл такого розчину додавали в реакційну систему. Контрольний зразок забезпечували шляхом додавання до реакційної системи 1,1 мкл ДМСО. За допомогою згаданого вище способу (при вимірюванні активності Аврори В застосовували спосіб А) одержані результати вимірювання активностей Аврори А і Аврори В, наведені в таблиці 1. Сполука відповідно до винаходу володіла чудовою селективною інгібуючою активністю у відношенні Аврори А. Подібні результати одержували, якщо при вимірюванні активності Аврори В використовували спосіб В. Далі буде з'ясована активність сполуки загальної формули (І) згідно з даним винаходом по придушенню росту клітин. Спосіб оцінки фармацевтичного ефекту із застосуванням клітин а) Реагент 39 Фетальна теляча сироватка (FCS) була надана компанією Moregate Biotech, живильне середовище DMEM було надано компанією Invitrogen Corp. Реагент WST-8 був наданий компанією Kishida Chemical Co., Ltd. b) Клітини Ракові клітини шийки матки людини (HeLa S3) були одержані від компанії American Type Culture Collection (ATCC). c) Спосіб оцінки ефекту Готували суспензію клітин у середовищі DMEM, що містить 10% FCS, і розподіляли суспензію клітин на 96-ямковому пластиковому планшеті з мірою завантаження 750 клітин/100 мікролітрів на ямку. Планшет інкубували при 37°С протягом ночі в атмосфері, що складається з 95% повітря і 5% СО2. Готували калібровані розчини лікарського засобу шляхом розведення в диметилсульфоксиді і додатково розбавляли середовищем DMEM, що містить 10% FCS. Потім розчини кожного з розведень наносили на окремий планшет, в ямки якого вносили по 100 мікролітрів клітинної суспензії на ямку. Планшет додатково інкубували при 37°С протягом трьох днів в атмосфері, що містить 5% СО2 і 95% повітря. Ріст клітин після інкубування вимірювали способом WST-8 (Н. Tominaga і ін., Anal. Commun., 36, 47-50 (1999)). У даному описі спосіб WST-8 стосується способу, при якому в кожну ямку додають по 20 мікролітрів розчину реагенту WST-8, інкубування проводять при 37°С протягом 60 хвилин, планшет струшують, і колориметричним способом вимірюють кількість продукованого формазану, щоб визначити відсоток інгібування для лікарського засобу. Визначали концентрацію сполуки, необхідну для 50% інгібування росту (ІС50, мкМ) . Як видно з таблиці 2, сполука згідно з даним винаходом володіла чудовим інгібуючим ефектом у відношенні росту ракових клітин, одержаних від людини (HeLa S3) 95972 40 Спосіб оцінки ефекту застосування в клітинах комбінованих лікарських засобів a) Реагент Фетальна теляча сироватка (FCS) була надана компанією Moregate Biotech, живильне середовище DMEM було надано компанією Invitrogen Corp., доцетаксел (торгова марка: Тахеrе) від компанії Sigma-Aldrich, Inc., і реагент WST-8 від компанії Kishida Chemical Co., Ltd. b) Клітини Клітини людської злоякісної пухлини шейки матки (HeLa S3) були одержані від компанії American Type Culture Collection (ATCC). c) Спосіб оцінки ефекту Готували суспензію клітин у середовищі DMEM, що містить 10% FCS, і розподіляли суспензію клітин на двох 96-ямкових пластикових планшетах з мірою завантаження 750 клітин/100 мікролітрів на ямку. Планшети інкубували при 37°С протягом ночі в атмосфері, що складається з 95% повітря і 5% СО2. Готували калібровані розчини в диметилсульфоксиді, і додатково розбавляли їх ДМСО або середовищем DMEM, що містить 10% FCS, а також містить 0,6 нМ доцетакселу. Потім кожний з розведених розчинів додавали до ямок одного з планшетів, в які було внесено по 100 мікролітрів клітин на ямку. Кінцева концентрація доцетакселу на даній стадії складала 0,3 нМ. Також у випадку введення тільки однієї сполуки згідно з даним винаходом концентрації складали 0,003, 0,01, 0,03, 0,1, 0,3, 1, 3 і 10 мкМ. Планшети додатково інкубували при 37°С протягом трьох днів в атмосфері, що складається з 95% повітря і 5% СО2. Після інкубації способом WST-8 (H. Tominaga і ін., Anal. Commun., 36, 47-50 (1999)) вимірювали ріст клітин. У даному описі спосіб WST-8 стосується способу, при якому в кожну ямку додають по 20 мікролітрів розчину реагенту WST-8, інкубування проводять при 37°С протягом 60 хвилин, планшет струшують, і колориметричним способом вимірюють кількість продукованого формазану, щоб визначити відсоток інгібування для лікарського засобу. Визначали ефекти інгібування росту клітин, що викликаються доцетакселом і сполукою згідно з даним винаходом, приймаючи за 0% значення, одержане при обробці одним тільки ДМСО. Як видно з таблиці 3, сполука згідно з даним винаходом володіла чудовим інгібуючим ефектом у відношенні росту клітин, а також синергічною дією з протипухлинним засобом типу таксану, таким як доцетаксел, у відношенні ракових клітин, одержаних від людини (HeLa S3). 41 На основі наведених вище даних передбачається, що сполука згідно з даним винаходом повинна бути застосовна як протипухлинний засіб, оскільки вона володіє не тільки чудовою інгібуючою активністю у відношенні росту клітин, основаною на селективній інгібуючій активності у відношенні Аврори А, але також володіє синергічною дією при комбінованому застосуванні з іншим протипухлинним засобом. Тому передбачається, що фармацевтична композиція або селективний інгібітор Аврори А, що містять нове амінопіридинове похідне згідно з даним винаходом, або його фармацевтично прийнятну сіль або складний ефір, або протипухлинний засіб, що містить сполуку за винаходом або її фармацевтично прийнятну сіль або складний ефір, ефективні при лікуванні пацієнтів з раковим захворюванням. 95972 42 Згадані вище фармацевтична композиція й інгібітор, і згаданий вище протипухлинний засіб можуть містити фармацевтично прийнятний носій або розріджувач. У даному описі термін "фармацевтично прийнятний носій або розріджувач" стосується ексципієнтів (наприклад, жирів, восків, напівтвердих і рідких поліолів, природних або гідрогенізованих олій і т.д.); води (наприклад, дистильованої воді, зокрема, дистильованої воді для ін'єкції і т.д.), фізіологічного сольового розчину, спирту (наприклад, етанолу), гліцерину, поліолів, водного розчину глюкози, маніту, рослинних олій т.д.); добавок (наприклад, наповнювача, дезінтегруючого засобу, зв'язуючого, лубриканту, зволожуючого засобу, стабілізатору, емульгатору, диспергуючої добавки, консерванту, підслолоджувача, барвника, засоба для поліпшення смаку або ароматизатора, концентруючого засоба, розріджува 43 ча, буферної речовини, розчинника або солюбілізуючого засоба, хімічної речовини для забезпечення ефекту збереження, солі для модифікації осмотичного тиску, засоба для покриття або антіоксиданту) і т.п. Вважається, що прикладом придатної пухлини, для якої може бути проілюстрований терапевтичний ефект сполуки згідно з даним винаходом, є солідний рак людини. Приклади солідного раку людини включають рак мозку, рак голови і шиї, рак стравоходу, рак щитовидної залози, дрібноклітинну карциному, недрібноклітинну карциному, рак молочної залози, рак шлунка, рак жовчного міхура і жовчної протоки, рак печінки, рак підшлункової залози, рак ободової кишки, рак прямої кишки, рак яєчника, хоріонепітеліому, рак матки, рак шийки матки, рак ниркової балії і сечоводу, рак сечового міхура, рак передміхурової залози, рак статевого члена, рак яєчка, ембріональний рак, пухлина Вільмса, рак шкіри, злоякісну меланому, нейробластому, остеосаркому, пухлину Юїнга, саркому м'яких тканин і т.п. Далі буде пояснений описаний вище термін "фармацевтично прийнятна сіль або складний ефір". Коли сполуку згідно з даним винаходом застосовують як протипухлинний засіб або т.п., її можна також застосовувати у формі фармацевтично прийнятної солі. Типові приклади фармацевтично прийнятної солі включають сіль лужного металу, такого як натрій і калій; сіль неорганічної кислоти, такої як гідрохлорид, сульфат, нітрат, фосфат, карбонат, гідрокарбонат і перхлорат; сіль органічної кислоти, такої як ацетат, пропіонат, лактат, малеат, фумарат, тартат, манат, цитрат і аскорбат; сіль сульфонової кислоти, такої як метансульфонат, ізотіонат, бензолсульфонат і толуолсульфонат; кислу сіль двохосновної амінокислоти, такої як аспартат і глутамат; і т.п. Фармацевтично прийнятна сіль сполуки (І) переважно являє собою сіль неорганічної кислоти, такої як гідрохлорид, сульфат, нітрат, фосфат, карбонат, гідрокарбонат і перхлорат; більш переважно - гідрохлорид. Спосіб одержання фармацевтично прийнятної солі сполуки згідно з даним винаходом можна здійснювати за допомогою відповідної комбінації тих способів, що традиційно застосовуються в галузі органічної синтетичної хімії. Конкретним прикладом такого способу є спосіб, при якому розчин сполуки згідно з даним винаходом в його вільній формі піддається титруванню для нейтралізації розчином лугу або розчином кислоти. Приклади складного ефіру сполуки згідно з даним винаходом включають складний метиловий ефір і складний етиловий ефір. Такі складні ефіри можна одержувати етерифікацією вільної карбоксильної групи відповідно до традиційного способу. Що стосується кожного препарату комбінованого препарату згідно з даним винаходом, можна вибрати різні форми препарату, і такі приклади включають препарати для перорального введення, такі як таблетки, капсули, порошки, гранули або рідини, або стерилізовані рідкі препарати для парентерального введення, такі як розчини або суспензії, супозиторії, мазі і т.п. 95972 44 Тверді препарати можна одержувати у формі таблетки, капсули, гранули і порошку без якихнебудь добавок, або одержувати, застосовуючи відповідні носії (добавки). Приклади таких носіїв (добавок) можуть включати сахариди, такі як лактоза або глюкоза; кукурудзяний, пшеничний або рисовий крохмаль; жирні кислоти, такі як стеаринова кислота; неорганічні солі, такі як метаалюмосилікат магнію або безводний фосфат кальцію; синтетичні полімери, такі як полівінілпіролідон або поліалкіленгліколь; спирти, такі як стеариловий спирт або бензиловий спирт; синтетичні похідні целюлози, такі як метилцелюлоза, карбоксиметилцелюлоза, етилцелюлоза або гідроксипропілметилцелюлоза; і інші традиційно застосовувані добавки, такі як желатин, тальк, рослинні олії і гуміарабік. Зазначені тверді препарати, такі як таблетки, капсули, гранули і порошки, звичайно можуть містити як активний інгредієнт, наприклад, від 0,1 до 100% по масі, і переважно, від 5 до 98% по масі сполуки описаної вище формули (І), у розрахунку на загальну масу препарату. Рідкі препарати виробляють у формі суспензії, сиропу, ін'єкції й вливання за допомогою крапельниці (внутрішньовенна рідина), застосовуючи відповідні добавки, що традиційно застосовуються в рідких препаратах, такі як вода, спирт або олії рослинного походження, такі як соєва олія, арахісова олія і кунжутна олія. Зокрема, коли препарат вводиться парентерально у формі внутрішньом'язової ін'єкції, внутрішньовенної ін'єкції або підшкірної ін'єкції, відповідний розчинник або розріджувач можна проілюструвати прикладом у вигляді дистильованої води для ін'єкції, водного розчину гідрохлориду лідокаїну (для внутрішньом'язової ін'єкції), фізіологічного сольового розчину, водного розчину глюкози, етанолу, поліетиленгліколю, пропіленгліколю, рідини для внутрішньовенної ін'єкції (наприклад, водний розчин лимонної кислоти, цитрату натрію і т.п.) або електролітичного розчину (для внутрішньовенного вливання за допомогою крапельниці і внутрішньовенної ін'єкції) або їх змішаного розчину. Така ін'єкція може бути у формі попередньо приготовленого розчину, або у формі порошку як такого або порошку, зв'язаного з придатним носієм (добавкою), що розчиняється під час застосування. Рідина для ін'єкції може містити, наприклад, від 0,1 до 10% по масі активного інгредієнта, у розрахунку на загальну масу препарату. Рідкі препарати, такі як суспензія або сироп для перорального введення, можуть містити, наприклад, від 0,1 до 10% по масі активного інгредієнта, у розрахунку на загальну масу препарату. Кожен препарат у комбінованому препараті згідно з даним винаходом може бути одержаний фахівцем у даній галузі відповідно до традиційних способів або загальновідомих методик. Наприклад, препарат, що містить інший протипухлинний засіб, що застосовують у комбінації зі сполукою, представленою описаною вище загальною формулою (І), можна одержати, у тому випадку, якщо препарат є препаратом для перорального введен 45 ня, наприклад, шляхом змішування відповідної кількості протипухлинного засобу з відповідною кількістю лактози і заповнення одержаною сумішшю твердих желатинових капсул, що підходять для перорального введення. З іншого боку, одержання можна здійснювати, у тому випадку, якщо препарат, що містить протипухлинний засіб, являє собою ін'єкцію, наприклад, шляхом змішування відповідної кількості протипухлинного засобу з відповідною кількістю 0,9%-ного фізіологічного сольового розчину і заповнення одержаною сумішшю ампул для ін'єкції. Також у випадку комбінованого препарату, що містить сполуку згідно з даним винаходом, представлену описаною вище загальною формулою (І), і інший протипухлинний засіб, фахівець у даній галузі може легко одержати препарат відповідно до традиційних способів або загальновідомих методик. У способі згідно з даним винаходом переважна терапевтична доза може змінюватися, наприклад, у залежності від способу введення сполуки, представленої загальною формулою (І), типу застосовуваної сполуки, представленої загальною формулою (І), і дозованої форми застосовуваної сполуки, представленої загальною формулою (І); типу, способу введення і дозованої форми іншого протипухлинного засобу, застосовуваного в комбінації; і типу клітин, що піддаються лікуванню, стану пацієнта і т.п. Оптимальне лікування в даних умовах може визначити фахівець у даній галузі, ґрунтуючись на встановленій традиційній терапевтичній дозі і/або ґрунтуючись на змісті даного опису винаходу. У способі згідно з даним винаходом терапевтична доза сполуки, представленої описаною вище загальною формулою (І), може змінюватися, особливо в залежності від типу застосовуваної сполуки, типу комбінованої композиції, частоти застосування і конкретного місця, що підлягає лікуванню, важкості захворювання, віку пацієнта, діагнозу лікаря, типу раку або т.п. Однак, як типова рекомендація, у випадку перорального введення добова доза для дорослої людини може знаходитися, наприклад, у діапазоні від 1 до 1000 мг. У випадку парентерального введення, переважно, внутрішньовенного введення, і більш переважно, внутрішньовенного вливання за допомогою крапельниці добова доза може знаходитися, наприклад, у діапазоні від 1 до 100 мг/м (площа поверхні тіла). Тут у випадку внутрішньовенного вливання за допомогою крапельниці введення можна здійснювати безупинно, наприклад, протягом часу від 1 до 48 годин. Крім того, частоту введення можна змінювати в залежності від способу введення і симптомів, наприклад, від одного до п'яти разів на день. Альтернативно, при визначеному способі введення також можна використовувати введення через визначені проміжки часу, таке як введення через день, введення кожні два дні або т.п. Період припинення введення лікарського засобу у випадку парентерального введення складає, наприклад, від 1 до 6 тижнів. Хоча терапевтична доза іншого протипухлинного засобу, застосовуваного в комбінації зі сполу 95972 46 кою, представленою загальною формулою (І), спеціально не обмежується, якщо необхідно, вона може визначатися фахівцем у даній галузі згідно з відомими літературними даними. Приклади можуть бути наступними. Терапевтична доза 5-фторурацилу (5-FU) така, що у випадку перорального введення, наприклад, щодня вводять від 200 до 300 мг послідовно від одного до трьох разів на день, і у випадку ін'єкції, наприклад, шляхом внутрішньовенної ін'єкції або внутрішньовенного вливання за допомогою крапельниці щодня вводять від 5 до 15 мг/кг в день протягом перших 5 днів підряд і потім шляхом внутрішньовенної ін'єкції або внутрішньовенного вливання за допомогою крапельниці один раз в день вводять від 5 до 7,5 мг/кг через день (дозу можна відповідним чином збільшувати або зменшувати). Терапевтична доза S-1 (Тегафур, Гіместат і Остат калію) така, що наприклад, вихідна доза (разова доза) встановлюється, виходячи зі стандартної кількості в залежності від площі поверхні тіла, і її вводять перорально два рази на день після сніданку і після обіду протягом 28 днів підряд з наступним припиненням введення лікарського засобу протягом 14 днів. Це відповідає одному курсу введення, що повторюється. Вихідна стандартна кількість на одиницю площі поверхні тіла (еквівалент Тегафура) складає 40 мг при одному введен2 ні для площі менш 1,25 м ; 50 мг при одному вве2 2 денні для площі від 1,25 м до площі менше 1,5 м ; 2 60 мг при одному введенні для площі 1,5 м або більше. Зазначена доза відповідним чином збільшується або зменшується в залежності від стану пацієнта. Терапевтична доза гемцитабіну складає, на2 приклад, 1 г гемцитабіну/м за одне введення, що вводиться шляхом внутрішньовенного вливання за допомогою крапельниці протягом 30 хвилин, і одне введення в тиждень продовжується протягом 3 тижнів з наступним припиненням введення лікарського засобу протягом четвертого тижня. Це відповідає одному курсу введення, що повторюється. Зазначена доза відповідним чином зменшується відповідно до віку, симптомів або розвитку побічних ефектів. Терапевтична доза доксорубіцину (наприклад, гідрохлориду доксорубіцину), наприклад, така, що у випадку внутрішньовенної ін'єкції один раз в день шляхом внутрішньовенного однократного введення вводять 10 мг (0,2 мг/кг) (титр) протягом 4-6 днів підряд з наступним припиненням введення лікарського засобу протягом 7-10 днів. Це відповідає одному курсу введення, що повторюється два або три рази. Тут сумарна доза переважно 2 складає 500 мг (титр)/м (площа поверхні тіла) або менше, і її можна відповідним чином збільшувати або зменшувати всередині діапазону. Терапевтична доза етопозиду, наприклад, така, що у випадку внутрішньовенної ін'єкції протя2 гом 5 днів підряд вводять від 60 до 100 мг/м (площа поверхні тіла) в день з наступним припиненням введення лікарського засобу протягом трьох тижнів (дозу можна відповідним чином збільшувати або зменшувати). Це відповідає одному 47 курсу введення, що повторюється. При цьому, у випадку перорального введення, наприклад, протягом 5 днів підряд вводять від 175 до 200 мг в день з наступним припиненням введення лікарського засобу протягом трьох тижнів (дозу можна відповідним чином збільшувати або зменшувати). Це відповідає одному курсу введення, що повторюється. Терапевтична доза доцетакселу (гідрат доцетакселу), наприклад, така, що один раз в день шляхом внутрішньовенного вливання за допомо2 гою крапельниці вводять 60 мг доцетакселу/м (площа поверхні тіла) протягом 1 години або більше з інтервалом від 3 до 4 тижнів (дозу можна відповідним чином збільшувати або зменшувати). Терапевтична доза паклітакселу, наприклад, така, що один раз в день шляхом внутрішньовенного вливання за допомогою крапельниці вводять 2 210 мг/м (площа поверхні тіла) протягом 3 годин, з наступним припиненням введення лікарського засобу протягом, щонайменше, 3 тижнів. Це відповідає одному курсу введення, що повторюється. Дозу можна відповідним чином збільшувати або зменшувати. Терапевтична доза цисплатину, наприклад, така, що у випадку внутрішньовенної ін'єкції один 2 раз в день вводять від 50 до 70 мг/м (площа поверхні тіла) з наступним припиненням введення лікарського засобу протягом 3 тижнів або більше (дозу можна відповідним чином збільшувати або зменшувати). Це відповідає одному курсу введення, що повторюється. Терапевтична доза карбоплатину, наприклад, така, що один раз в день шляхом внутрішньовенного вливання за допомогою крапельниці вводять 2 від 300 до 400 мг/м протягом 30 хвилин або більше з наступним припиненням введення лікарського засобу протягом, щонайменше, 4 тижнів (дозу можна відповідним чином збільшувати або зменшувати). Це відповідає одному курсу введення, що повторюється. Терапевтична доза оксаліплатину така, що один раз в день шляхом внутрішньовенної ін'єкції 2 вводять 85 мг/м з наступним припиненням введення лікарського засобу протягом двох тижнів. Це відповідає одному курсу введення, що повторюється. Терапевтична доза іринотекану (наприклад, гідрохлорид іринотекану), наприклад, така, що один раз в день шляхом внутрішньовенного вливання 2 за допомогою крапельниці вводять 100 мг/м за 3 або 4 прийоми з інтервалом в один тиждень з наступним припиненням введення лікарського засобу протягом, щонайменше, двох тижнів. Терапевтична доза топотекану, наприклад, така, що один раз в день шляхом внутрішньовенного вливання за допомогою крапельниці вводять 1,5 2 мг/м протягом 5 днів з наступним припиненням введення лікарського засобу протягом, щонайменше, 3 тижнів. Терапевтична доза циклофосфаміду, наприклад, така, що у випадку внутрішньовенної ін'єкції один раз в день шляхом внутрішньовенної ін'єкції вводять по 100 мг протягом декількох днів підряд. Якщо пацієнт може терпіти, добову дозу можна 95972 48 збільшувати до 200 мг. Сумарна доза, яку можна відповідним чином збільшувати або зменшувати, складає від 3000 до 8000 мг. Якщо необхідно, можна вводити шляхом внутрішньом'язової, інтраторакальної або внутрішньопухлинної ін'єкції або вливання. З іншого боку, у випадку перорального введення, наприклад, щодня вводять від 100 до 200 мг. Терапевтична доза гефітинібу така, що вводять перорально по 250 мг один раз на день. Терапевтична доза цетуксимабу, наприклад, така, що в перший день шляхом внутрішньовенного вливання за допомогою крапельниці вводять 2 400 мг/м і потім щотижня шляхом внутрішньовенного вливання за допомогою крапельниці вводять 2 по 250 мг/м . Терапевтична доза бевацизумабу, наприклад, така, що щотижня шляхом внутрішньовенного вливання за допомогою крапельниці вводять 3 мг/кг. Терапевтична доза трастузумабу, наприклад, така, що звичайно дорослій людині спочатку вводять один раз в день 4 мг трастузумабу/кг (вага тіла) з наступним внутрішньовенним вливанням за допомогою крапельниці 2 мг/кг протягом 90 хвилин або більше щотижня з другого введення. Терапевтична доза екземестану, наприклад, така, що звичайно дорослій людині перорально вводять 25 мг один раз на день після їжі. Терапевтична доза лейпрореліну (наприклад, ацетату лейпрореліну), наприклад, така, що звичайно дорослій людині підшкірно вводять 11,25 мг один раз на 12 тижнів. Терапевтична доза іматинібу, наприклад, така, що звичайно дорослій людині в хронічній фазі хронічної мієлогенної лейкемії перорально вводять 400 мг один раз в день після їжі. Терапевтична доза комбінації 5-FU і лейковорину, наприклад, така, що з першого дня до п'ятого дня шляхом внутрішньовенного вливання за 2 допомогою крапельниці вводять 425 мг/м 5-FU і 2 200 мг/м лейковорину і повторюють такий курс з інтервалом 4 тижні. Терапевтична доза сорафенібу, наприклад, така, що два рази на день перорально вводять по 200 мг (400 мг в день), щонайменше, за 1 годину до їжі або через 2 години після їжі. Терапевтична доза сунітинібу, наприклад, така, що один раз в день перорально вводять 50 мг протягом чотирьох тижнів, за якими йде пропуск 2 тижні. Експериментальні приклади У прикладах і довідкових прикладах при проведенні тонкошарової хроматографії застосовували силікагель Silica gel60F254 (Merck) у вигляді пластини, а як спосіб детектування застосовувався УФ-детектор. Як силікагель для колонки застосовували Biotage FLASH column (SI, NH). При препаративній рідинній хроматографії із зворотною фазою як колонку застосовували колонку XBridge Prep СІ 8 (Waters), а для рухомої фази застосовували 0,1% водний розчин трифтороцтової кислоти і 0,1% розчин трифтороцтової кислоти в ацетонітрилі. МС-спектри вимірювали, застосовуючи Waters micromass ZQ2000 (ESI, ESCi). Спектри ЯМР 49 95972 вимірювали за допомогою спектрометра типу JEOL JNM-AL400 (400 МГц) або Varian MERCURY400 (400 МГц), і всі значення представлені в м.ч. Температури плавлення вимірювали в умовах підвищення температури зі швидкістю 1°С/хв., застосовуючи комбінацію Mettler Toledo FP82HT Hot Stage і NIKON Eclipse E600 POL. Значення абревіатур наступні. с: синглет д: дуплет дд: подвійний дуплет т: триплет дт: подвійний триплет кв: квартет квін: квінтет м: мультиплет уш.: розширення J: константа взаємодії Гц: Герц ДМСО-d6: диметилсульфоксид-d6 TBS: трет-бутил(диметил)силільна група MOM: метоксиметильна група TBDPS: трет-бутил(дифеніл)силільна група TsOH: п-толуолсульфонова кислота SEM: (2-(триметилсиліл)етокси)метильна група Приклад 1 Синтез гідрохлориду транс-4-(3-хлор-2фторфенокси)-1 -((6-(1,3-тіазол-2-іламіно)піридин2-іл)метил )циклогексанкарбонової кислоти (1) Синтез 2-бром-6-(((трет-бутил тил)силіл)окси)метил )піридину 50 Суміш 15,92 г 2-бром-6-(((трет-бутил (диметил)силіл)окси)метил)піридину, 5,53 г 2амінотіазолу, 3,04 г 9,9-диметил-4,5біс(дифенілфосфіно)ксантену, 2,72 г комплексу трис(дибензиліденацетон)дипаладій(0)хлороформ, 18,86 г карбонату цезію і 100 мл толуолу перемішували при 120°С протягом ночі з наступним охолодженням до кімнатної температури й відфільтровували нерозчинну речовину за допомогою целіту. Одержаний толуольний розчин промивали водою. Органічний шар сушили над безводним сульфатом магнію і фільтрували. Фільтрат концентрували у вакуумі, одержуючи при цьому сирий (неочищений) продукт. Готували суспензію одержаного сирого (неочищеного) продукту в 100 мл хлороформу, і потім при охолодженні льодом послідовно додавали 13,7 мл Н,Н-діізопропілетиламіну і 4,8 мл простого хлорметилметилового ефіру з наступним перемішуванням реакційної суміші при кімнатній температурі протягом ночі. Хлороформ видаляли у вакуумі і до залишку додавали воду з наступною екстракцією етилацетатом. Одержаний етилацетатний розчин сушили над безводним сульфатом магнію і фільтрували. Фільтрат концентрували у вакуумі. Одержаний залишок очищали за допомогою колонкової хроматографії на силікагелі (елюент: від гексана до суміші гексан/етилацетат = 5/1), одержуючи при цьому зазначену в заголовку сполуку у вигляді блідо-жовтої твердої речовини. (3) Синтез (6-(((2Z)-3-(метоксиметил)-1,3тіазол-2(3Н)-іліден)аміно)піридин-2-іл)метанолу (диме До розчину 10 г (6-бромпіридин-2-іл)метанолу в 50 мл N,N-диметилформаміду послідовно додавали 4 г імідазолу і 8,4 г третбутилдиметилсилілхлориду при кімнатній температурі з наступним перемішуванням реакційної суміші при кімнатній температурі протягом 2 годин. Після додавання до реакційної суміші води суміш екстрагували н-гексаном. Одержаний гексановий розчин сушили над безводним сульфатом магнію і фільтрували. Фільтрат концентрували у вакуумі, одержуючи при цьому зазначену в заголовку сполуку у вигляді безбарвної олії. (2) Синтез 6-(((третбутил(диметил)силіл)окси)метил)-N-((2Z)-3(метоксиметил)-1,3-тіазол-2(3Н)-іліден)піридин-2аміну До розчину 14,28 г 6-(((третбутил(диметил)силіл)окси)метил)-N-((2Z)-3(метоксиметил)-1,3-тіазол-2(3Н)-іліден)піридин-2аміну в 30 мл хлороформу і 30 мл метанолу додавали 30 мл трифтороцтової кислоти при охолодженні льодом з наступним перемішуванням реакційної суміші при кімнатній температурі протягом ночі. Реакційну суміш упарювали у вакуумі. Одержаний залишок нейтралізували насиченим водним розчином бікарбонату натрію й екстрагували етилацетатом. Одержаний етилацетатний розчин сушили над безводним сульфатом магнію і фільтрували. Фільтрат концентрували у вакуумі. Одержаний залишок очищали за допомогою колонкової хроматографії на силікагелі (елюент: від гексану до суміші гексан/етилацетат = 1/1), одержуючи при цьому зазначену в заголовку сполуку у вигляді блідо-жовтої твердої речовини. (4) Синтез 6-(бромметил)-N-((2Z)-3(метоксиметил)-1,3-тіазол-2(3Н)-іліден) піридин-2аміну 51 До розчину 4,43 г (6-(((2Z)-3-(метоксиметил)1,3-тіазол-2(3Н)-іліден)аміно)піридин-2іл)метанолу в 40 мл тетрагідрофурану послідовно додавали 3,2 мл триетиламіну і 1,5 мл метилсульфонілхлориду при охолодженні льодом з наступним перемішуванням реакційної суміші при кімнатній температурі протягом 1 години. При кімнатній температурі послідовно додавали 0,74 мл триетиламіну і 0,27 мл метилсульфонілхлориду з наступним перемішуванням реакційної суміші при кімнатній температурі протягом 1 години. Осад відфільтровували, промивали тетрагідрофураном і потім концентрували фільтрат у вакуумі. До розчину одержаного залишку в 30 мл N,Nдиметилформаміду додавали 4,58 г броміду літію при охолодженні льодом з наступним перемішуванням реакційної суміші при кімнатній температурі протягом ночі. До реакційної суміші додавали воду й екстрагували етилацетатом. Одержаний етилацетатний розчин послідовно промивали водою і насиченим розчином солі, сушили над безводним сульфатом магнію і фільтрували. Фільтрат концентрували у вакуумі. Одержаний залишок очищали за допомогою колонкової хроматографії на силікагелі (елюент: від хлороформу до суміші хлороформ/етилацетат = 10/1), одержуючи при цьому зазначену в заголовку сполуку у вигляді блідо-жовтої твердої речовини. (5) Синтез трет-бутил-цис-4-((третбутил(дифеніл)силіл)окси)-1-((6-(((2Z)-3(метоксиметил)-1,3-тіазол-2(3Н)іліден)аміно)піридин-2-іл)метил) циклогексанкарбоксилату До розчину 3,8 мл діізопропіламіну в тетрагідрофурані додавали 17,3 мл гексанового розчину, що містить 1,58М н-бутиллітію при охолодженні льодом з наступним перемішуванням реакційної суміші протягом 30 хвилин. Після охолодження до -78°С до розчину додавали 12 г трет-бутил-4((третбутил(дифеніл)силіл)окси)циклогексанкарбоксилату, одержаного по посиланню 1, у 30 мл тетрагідрофурану і перемішували одержаний розчин протягом 2 годин при -78°С. До реакційної суміші додавали розчин 2,87 г 6-(бромметил)-N-((2Z)-3(метоксиметил)-1,3-тіазол-2(3Н)-іліден)піридин-2аміну і 7,9 мл гексаметилфосфораміду в 20 мл тетрагідрофурану з наступним поступовим нагріванням реакційної суміші до кімнатної температури. Реакційну суміш перемішували при кімнатній температурі протягом ночі. До реакційної суміші додавали насичений водний розчин хлориду амо 95972 52 нію з наступною екстракцією етилацетатом. Одержаний етилацетатний шар промивали насиченим розчином солі, сушили над безводним сульфатом магнію, фільтрували. Фільтрат концентрували у вакуумі. Одержаний залишок очищали за допомогою колонкової хроматографії на силікагелі (елюент: від гексану до суміші гексан/етилацетат =10/14/1), одержуючи при цьому зазначену в заголовку сполуку у вигляді блідо-жовтої олії. (6) Синтез трет-бутил-цис-4-гідрокси- 1-((6(((2Z)-3-(метоксиметил)-1,3-тіазол-2(3Н)іліден)аміно)піридин-2-іл)метил )циклогексанкарбоксилату До розчину 5,56 г трет-бутил-цис-4-((третбутил(дифеніл)силіл)окси)-1-((6-(((2Z)-3(метоксиметил)-1,3-тіазол-2(3Н)іліден)аміно)піридин-2іл)метил)циклогексанкарбоксилату в 100 мл тетрагідрофурану додавали 49,6 мл ЇМ розчину фториду тетрабутиламонію в тетрагідрофурані при кімнатній температурі з наступним перемішуванням реакційної суміші при 60°С протягом ночі. Реакційну суміш охолоджували до кімнатної температури з наступним розведенням етилацетатом. Одержаний розчин послідовно промивали розчином фосфатного буфера з рН 6,8 і насиченим розчином солі, сушили над безводним сульфатом магнію, фільтрували. Фільтрат концентрували у вакуумі. Одержаний залишок очищали за допомогою колонкової хроматографії на силікагелі (елюент: від гексану до суміші гексан/етилацетат = 1/2), одержуючи при цьому зазначену в заголовку сполуку у вигляді блідо-жовтої олії. (7) Синтез трет-бутил-транс-4-(3-хлор-2фторфенокси)-1-((6-(((2Z)-3-(метоксиметил)-1,3тіазол-2(3Н)-іліден)аміно)піридин-2-іл)метил) циклогексанкарбоксилату До розчину суміші, що складається з 4,34 г трет-бутил-цис-4-гідрокси-1-((6-(((2Z)-3(метоксиметил)-1,3-тіазол-2(3Н)іліден)аміно)піридин-2-іл)метил) циклогексанкарбоксилату, 2,93 г З-хлор-2-фторфенолу і 5,24 г трифенілфосфіну, у 70 мл тетрагідрофурану додавали 3,94 мл діізопропілазодикарбоксилату при охолодженні льодом з наступним перемішуванням реакційної суміші при кімнатній температурі протягом 1 години. До реакційної суміші додавали воду й екстрагували етилацетатом. Одержаний етилацетатний шар промивали насиченим розчином солі, сушили над безводним сульфатом магнію і фільтрували. Фільтрат концентрували у вакуумі. Одержаний залишок очищали за допомогою коло 53 нкової хроматографії на силікагелі (елюент: від гексану до суміші гексан/етилацетат = 3/1), одержуючи при цьому зазначену в заголовку сполуку у вигляді блідо-жовтої олії. (8) Синтез гідрохлориду транс-4-(3-хлор-2фторфенокси)-1-(6-(1,3-тіазол-2-іламіно)піридин-2іл)метил)циклогексанкарбонової кислоти До 3,9 г трет-бутил-транс-4-(3-хлор-2фторфенокси)-1-((6-(((2Z)-3-(метоксиметил)-1,3тіазол-2(3Н)-іліден)аміно)піридин-2-іл)метил) циклогексанкарбоксилату додавали 100 мл 4М розчину хлористого водню в 1,4-діоксані з наступним перемішуванням реакційної суміші при 90°С протягом 5 годин. Після охолодження реакційної суміші до кімнатної температури до суміші додавали 100 мл простого трет-бутилметилового ефіру. Одержаний осад збирали фільтруванням і промивали простим трет-бутилметиловим ефіром, одержуючи при цьому безбарвну тверду речовину. Одержану безбарвну тверду речовину розчиняли в 1,2 л етанолу при 80°С. Етанол видаляли дистиляцією, щоб зменшити об'єм розчину приблизно до однієї третини. Одержаний розчин охолоджували до кімнатної температури з наступним перемішуванням при кімнатній температурі протягом ночі. Одержану тверду речовину збирали фільтруванням і промивали охолодженим етанолом, одержуючи при цьому зазначену в заголовку сполуку у вигляді безбарвної кристалічної речовини. 1 Н-ЯМР (ДМСО-d6) :1,60-1,92 (8Н, м), 3,03 (2Н, с), 4,62 (1H, ушир.с), 6,90 (1H, д, J=7,4 Гц), 7,05-7,22 (5Н, м), 7,53 (1H, д, J=4,1 Гц), 7,74 (1Н, т, + J-7,8 Гц). Mac: 462,464 (M+1) Приклад 2 Синтез транс-4-(3-хлор-2-фторфенокси)-1-(6(1,3-тіазол-2-іламіно)піридин-2іл)метил)циклогексанкарбонової кислоти Спосіб А До 47,9 мг гідрохлориду транс-4-(3-хлор-2фторфенокси)-1-(6-(1,3-тіазол-2-іламіно)піридин-2іл)метил)циклогексанкарбонової кислоти, одержаного за прикладом 1, послідовно додавали 4 мл води і 4 мл етанолу з наступним перемішуванням реакційної суміші при кімнатній температурі протягом 12 годин. Одержаний осад збирали фільтруванням і промивали водою, одержуючи при цьому зазначену в заголовку сполуку у вигляді безбарвних голчастих кристалів (т.пл.: 202-222°С). 1 Н-ЯМР (ДМСО-d6) : 1,60-1,92 (8Н, м), 2,98 (2Н, с), 4,61 (1H, ушир.с), 6,71 (1H, д, J=7,2 Гц), 95972 54 6,90 (1Н, д, J=8,2 Гц), 6,98 (1H, д, J=3,5 Гц), 7,107,22 (3Н, м), 7,38 (1Н, д, J=3,5 Гц), 7,60 (1Н, т, + J=7,6 Гц). Маc: 462,464 (М+1) Спосіб В До 460 мг гідрохлориду транс-4-(3-хлор-2фторфенокси)-1-(6-(1,3-тіазол-2-іламіно)піридин-2іл)метил)циклогексанкарбонової кислоти, одержаного за прикладом 1, послідовно додавали 40 мл води і 40 мл етанолу з наступним перемішуванням реакційної суміші при кімнатній температурі протягом 4 днів. Одержаний осад збирали фільтруванням і промивали водою, одержуючи при цьому зазначену в заголовку сполуку у вигляді безбарвних пластинок (т.шт.: 224-242°C). 1 H -ЯМР (ДМСО-d6) :1,60-1,92 (8H, м), 2,98 (2Н, с), 4,61 (1H, ушир.с), 6,71 (1Н, д, J=7,2 Гц), 6,90 (1Н, д, J=8,2 Гц), 6,98 (1Н, д, J=3,5 Гц), 7,107,22 (3Н, м), 7,38 (1Н, д, J=3,5 Гц), 7,60 (1Н, т, + J=7,6 Гц). Маc: 462,464 (М+1) Приклад 3 Синтез гідрохлориду транс-4-(2,3дифторфенокси)1-((6-(1,3-тіазол-2іламіно)піридин-2-іл)метил )циклогексанкарбонової кислоти Зазначену в заголовку сполуку одержували у вигляді білої твердої речовини за прикладом 1, застосовуючи 2,3-дифторфенол замість З-хлор-2фторфенолу, що застосовувався на стадії 1 (7) прикладу 1. 1 H -ЯМР (ДМСО-d6) :1,60-1,92 (8Н, м), 3,02 (2Н, с), 4,62 (1Н, ушир.с), 6,84 (1H, д, J=8,4 Гц), 6,97-7,15 (5Н, м), 7,49 (1H, д, J=3,7 Гц), 7,70 (1H, т, + J=7,8 Гц). Mac: 446 (M+1) Приклад 4 Синтез гідрохлориду транс-4-(2-фтор-3(трифторметил)фенокси)-1-((6-(1,3-тіазол-2іламіно)піридин-2-іл)метил) циклогексанкарбонової кислоти Зазначену в заголовку сполука одержували у вигляді білої твердої речовини за прикладом 1, застосовуючи 2-фтор-3-(трифторметил)фенол замість 3-хлор-2-фторфенолу, що застосовувався на стадії 1(7) прикладу 1. 55 H -ЯМР (ДМСО-d6) :1,62-1,95 (8Н, м), 3,03 (2Н, с), 4,68 (1H, ушир.с), 6,89 (1H, д, J=7,2 Гц), 7,07 (1Н, д, J=8,4 Гц), 7,15 (1H, д, J=3,7 Гц), 7,287,35 (2Н, м), 7,52 (1H, д, J=3,7 Гц), 7,56 (1Н, т, + J=6,8 Гц), 7,73 (1H, т, J=7,8 Гц). Маc: 496 (М+1) Приклад 5 Синтез гідрохлоридутранс-4-(2,3дихлорфенокси)-1-((6-(1,3-тіазол-2іламіно)піридин-2-іл)метил)циклогексанкарбонової кислоти 1 95972 56 6,85 (1Н, д, J=8,4 Гц), 6,94 (2Н, д, J=3,1 Гц), 7,057,20 (3Н, м), 7,25 (1H, с), 7,35 (1Н, Д, J=3,5 Гц), 7,55 (1Н, т, J=7,8 Гц), 11,13 (1H, с). Мас: 461,463 + (М+1) Приклад 7 Синтез трифторацетату транс-4-(2-фтор-3(трифторметил)фенокси)-1-((6-(1H -піразол-3іламіно)піридин-2-іл)метил)циклогексанкарбонової кислоти (1) Синтез 2-бром-6-(бромметил)піридину Зазначену в заголовку сполуку одержували у вигляді білої твердої речовини за прикладом 1, застосовуючи 2,3-дихлорфенол замість 3-хлор-2фторфенолу, що застосовувався на стадії 1 (7) прикладу 1. 1 H -ЯМР (ДМСО-d6) : 1,51-1,66 (2Н, м), 1,691,89 (6Н, м), 2,97 (2Н, с), 4,72 (1Н, ушир.с), 6,756,85 (1H, м), 6,95-7,10 (2Н, м), 7,10-7,16 (2Н, м), 7,25 (1H, т, J=8,2 Гц), 7,42-7,49 (1Н, м), 7,62-7,72 + (1H, м). Мас: 478,480 (М+1) Приклад 6 Синтез транс-4-(3-хлор-2-фторфенокси)-1-((6(1,3-тіазол-2-іламіно)піридин-2іл)метил)циклогексанкарбоксаміду До розчину 20 мг гідрохлориду транс-4-(3хлор-2фторфенокси)-1-((6-(1,3-тіазол-2іламіно)піридин-2-іл)метил)циклогексанкарбонової кислоти, одержаного за прикладом 1, у 3 мл хлороформу при кімнатній температурі послідовно додавали 21 мг хлориду амонію, 0,056 мл триетиламіну, 31 мг гідрату гідроксибензотриазолу і 38 мг гідрохлориду 1-(3-диметиламінопропіл)-3етилкарбодііміду з наступним перемішуванням реакційної суміші при кімнатній температурі протягом ночі. Після додавання до реакційної суміші насиченого водного розчину бікарбонату натрію суміш екстрагували етилацетатом. Одержаний етилацетатний розчин сушили над безводним сульфатом магнію і фільтрували. Фільтрат концентрували у вакуумі. Одержаний залишок очищали за допомогою препаративної тонкошарової хроматографії (Kieselgel™60F254, Art5744 (Merck), хлороформ/метанол = 10/1), одержуючи при цьому зазначену в заголовку сполуку у вигляді білої твердої речовини. 1 H -ЯМР (ДМСО-d6) : 1,63-1,93 (8Н, м), 2,92 (2Н, с), 4,55 (1H, ушир, с), 6,68 (1H, д, J=7,4 Гц), До розчину 498 мг (6-бромпіридин-2іл)метанолу в 6 мл Н,Н-диметилформаміду при охолодженні льодом послідовно додавали 1,15 мл діізопропілетиламіну і розчин 695 мг метансульфонового ангідриду в 2 мл Н,Н-диметилформаміду з наступним перемішуванням реакційної суміші при кімнатній температурі протягом 20 хвилин. Потім до розчину додавали 693 мг броміду літію з наступним перемішуванням реакційної суміші при кімнатній температурі протягом 1 години. Після додавання до реакційної суміші насиченого водного розчину бікарбонату натрію суміш екстрагували етилацетатом. Одержаний етилацетатний розчин сушили над безводним сульфатом магнію і фільтрували. Фільтрат концентрували у вакуумі. Одержаний залишок очищали за допомогою колонкової хроматографії на силікагелі (елюент: гексан/етилацетат = 20/1-3/2), одержуючи при цьому зазначену в заголовку сполуку у вигляді блідожовтої твердої речовини. (2) Синтез трет-бутил-цис-1-((6-бромпіридин-2іл)метил)-4-((третбутил(дифеніл)силіл)окси)циклогексанкарбоксилату До розчину 0,82 мл діізопропіламіну в 20 мл тетрагідрофурану при охолодженні льодом додавали 3,7 мл гексанового розчину, що містить 1,58М н-бутиллітію, з наступним перемішуванням реакційної суміші протягом 30 хвилин. Після охолодження реакційної суміші до -78°С к розчину додавали розчин 2,67 г трет-бутил-4-((третбутил(дифеніл)силіл)окси)циклогексанкарбоксилату, 57 одержаного по посиланню 1, у 10 мл тетрагідрофурану й одержаний розчин перемішували протягом 1 години при -78°С. До реакційної суміші додавали розчин 980 мг 2-бром-6-(бромметил)піридину і 2,7 мл гексаметилфосфораміду в 5 мл тетрагідрофурану з наступним поступовим нагріванням реакційної суміші до кімнатної температури і потім перемішували реакційну суміш при кімнатній температурі протягом ночі. До реакційної суміші додавали насичений водний розчин хлориду амонію з наступною екстракцією хлороформом. Одержаний хлороформний розчин сушили над безводним сульфатом магнію і фільтрували. Фільтрат концентрували у вакуумі. Одержаний залишок очищали за допомогою колонкової хроматографії на силікагелі (елюент: гексан/етилацетат = 100/1-9/1), одержуючи при цьому зазначену в заголовку сполуку у вигляді блідо-жовтої олії. (3) Синтез трет-бутил-цис-1-((6-бромпіридин-2іл)метил)-4-гідроксициклогексанкарбоксилату До розчину 1,6 г трет-бутил-цис-1-((6бромпіридин-2-іл)метил)-4-((третбутил(дифеніл)силіл)окси)циклогексанкарбоксилату в 30 мл тетрагідрофурану при кімнатній температурі додавали 16 мл тетрагідрофуранового розчину, що містить 1М фториду тетрабутиламонію, з наступним перемішуванням реакційної суміші при 60°С протягом ночі. Реакційну суміш охолоджували до кімнатної температури з наступним розведенням хлороформом. Одержаний розчин послідовно промивали розчином фосфатного буфера з рН 6,8 і насиченим розчином солі, сушили над безводним сульфатом магнію і фільтрували. Фільтрат концентрували у вакуумі. Одержаний залишок очищали за допомогою колонкової хроматографії на силікагелі (елюент: від суміші гексан/етилацетат = 8/1 до етил ацетата), одержуючи при цьому зазначену в заголовку сполуку у вигляді блідо-жовтої твердої речовини. (4) Синтез трет-бутил-транс-1-((6бромпіридин-2-іл)метил)-4-(2-фтор-3(трифторметил)фенокси)циклогексанкарбоксилату До розчину 150 мг трет-бутил-цис-1-((6бромпіридин-2-іл)метил)-4гідроксициклогексанкарбоксилату, 219 мг 2-фтор3-(трифторметил)фенолу і 320 мг трифенілфосфіну в 2,5 мл тетрагідрофурану при охолодженні льодом додавали 0,24 мл діізопропілазодикарбоксилату з наступним перемішуванням реакційної суміші при кімнатній температурі протягом 15 хвилин. Реакційну суміш концентрували у вакуумі й очищали одержаний залишок за допомогою коло 95972 58 нкової хроматографії на силікагелі (елюент: суміш гексан/етилацетат = 50/1-4/1), одержуючи при цьому зазначену в заголовку сполуку у вигляді блідо-жовтої олії. (5) Синтез трет-бутил-транс-1-((6-((1-третбутил-1Н-піразол-5-іл)аміно)піридин-2-іл)метил)-4(2-фтор-3-(трифторметил)фенокси) циклогексанкарбоксилату Суміш, що складається з 140 мг трет-бутилтранс-1-((6-бромпіридин-2-іл)метил)-4-(2-фтор-3(трифторметил)фенокси)циклогексанкарбоксилату, 102 мг 1трет-бутил-1Н-піразол-5-амін-птолуолсульфонату, одержаного по посиланню 4, 25,4 мг 9,9-диметил-4,5біс(дифенілфосфіно)ксантену, 21,6 мг комплексу трис(дибензиліденацетон)дипаладій(0)хлороформу, 139 мг фосфату калію і 4 мл 1,4діоксану перемішували при 100°С протягом ночі з наступним охолодженням до кімнатної температури. Нерозчинну речовину відфільтровували за допомогою целіту і промивали етилацетатом. Одержаний етилацетатний розчин промивали водою, сушили над безводним сульфатом натрію і фільтрували. Фільтрат концентрували у вакуумі. Одержаний залишок очищали за допомогою колонкової хроматографії на силікагелі (елюент: гексан/етилацетат = 20/1- 3/2), одержуючи при цьому зазначену в заголовку сполуку у вигляді блідожовтої олії. (6) Синтез трифторацетату транс-4-(2-фтор-3(трифторметил)фенокси)-1-((6-(1Н-піразол-3іламіно)піридин-2-іл)метил)циклогексанкарбонової кислоти Розчин 88,8 мг трет-бутил-транс-1-((6-((1-третбутил-1Н-піразол-5-іл)аміно)піридин-2-іл)метил)-4(2-фтор-3-(трифторметил)фенокси) циклогексанкарбоксилату в 1 мл мурашиної кислоти перемішували при 110°С протягом 1 години. Реакційну суміш охолоджували до кімнатної температури з наступним концентруванням у вакуумі. Одержаний залишок очищали за допомогою препаративної рідинної хроматографії із зворотною фазою з наступним концентруванням одержаної фракції у вакуумі, одержуючи при цьому зазначену в заголовку сполуку у вигляді блідо-жовтої твердої речовини. 1 H -ЯМР (CD3OD) : 1,82-2,17 (8Н, м), 3,24 (2Н, с), 4,70 (1H, с), 6,18 (1Н, д, J=2,8 Гц), 7,05 (1H, д, J=7,2 Гц), 7,19-7,31 (3Н, м), 7,45 (1H, дт, J=8,4, 2,8 Гц), 7,78 (1H, д, J=2,4 Гц), 8,06 (1H, дд, J=8,8, 7,2 + Гц). Мас: 479 (М+1) 59 95972 60 Приклад 8 Синтез трифторацетатутранс-4-(3-хлор-2фторфенокси)-1-((6-(1Н-піразол-3-іламіно)піридин2-іл)метил)циклогексанкарбонової кислоти (1) Синтез 1H -(1-трет-бутил-1H -піразол-5-іл)6-хлорпіразин-2-аміну Зазначену в заголовку сполуку одержували у вигляді білої твердої речовини за прикладом 7, застосовуючи 3-хлор-2-фторфенол замість 2фтор-3-(трифторметил)фенолу, що застосовувався на стадії 7(4) прикладу 7. 1 Н-ЯМР (CD3OD) : 1,79-2,15 (8Н, м), 3,20 (2Н, с), 4,62 (1H, с), 6,18 (1Н, д, J=2,4 Гц), 7,01-7,15 (4Н, м), 7,20 (1H, д, J=8,8 Гц), 7,79 (1Н, д, J=2,4 Гц), 8,04 (1Н, дд, J=8,8, 7,2 Гц). + Mac: 445,447 (M+l) Приклад 9 Синтез транс-4-(3-хлор-2-фторфенокси)-1-((6(1H -піразол-3-іламіно)піридин-2-іл)метил )циклогексанкарбоксаміду До розчину 32,1 мг трифторацетату транс-4-(3хлор-2фторфенокси)-1-((6-(1Н-піразол-3іламіно)піридин-2-іл)метил)циклогексанкарбонової кислоти, одержаного за прикладом 8, у 1 мл диметилсульфоксиду при кімнатній температурі послідовно додавали 7,5 мг хлориду амонію, 0,038 мл триетиламіну, 20,2 мг гідрати гідроксибензотриазолу і 24,6 мг гідрохлориду 1-(3диметиламінопропіл)-3-етилкарбодііміду з наступним перемішуванням реакційної суміші при кімнатній температурі протягом ночі. Реакційну суміш очищали за допомогою препаративної рідинної хроматографії із зворотною фазою з наступним застосуванням препаративної тонкошарової хроматографії (NH-PLC05 (FUJI SILYSIA CHEMICAL), хлороформ/метанол = 20/1), одержуючи при цьому зазначену в заголовку сполуку у вигляді білої твердої речовини. 1 H -ЯМР (CD3OD) :1,82-2,00 (8Н, м), 3,04 (2Н, с), 4,55 (1H, с), 5,75 (1H, ушир.с), 6,60-6,80 (2Н, м), 7,00-7,10 (3Н, м), 7,44 (1Н, ушир.с), 7,50 (1H, т, J8,0 Гц). + Мас: 444,446 (M+1) Приклад 10 Синтез трифторацетату транс-4-(3-хлор-2фторфенокси)-1-((6-(1H -піразол-3-іламіно)піразин2-іл)метил )циклогексанкарбонової кислоти Суміш 60,6 г 2,6-дихлорпіразину, 62,2 г 1-третбутил-1H -піразол-5-аміну, одержаного по посиланню 3, 23,5 г 9,9-диметил4,5біс(дифенілфосфіно)ксантену, 21,0 г комплексу трис(дибензиліденацетон)дипаладій(0)хлороформ, 172,6 г фосфату калію і 1,17 л 1,4діоксану перемішували при 100°С протягом ночі з наступним охолодженням до кімнатної температури. Нерозчинну речовину відфільтровували за допомогою целіту і промивали етилацетатом. Одержаний етилацетатний розчин промивали водою і насиченим розчином солі, сушили над безводним сульфатом магнію і фільтрували. Фільтрат концентрували у вакуумі. Одержаний залишок очищали за допомогою колонкової хроматографії на силікагелі (елюент: гексан/етилацетат = 4/12/1), одержуючи при цьому зазначену в заголовку сполуку у вигляді жовтої твердої речовини. (2) Синтез N-(1-трет-бутил-1H -піразол-5-іл)-6вінілпіразин-2-аміну Суміш, що складається з 65,04 г N-(1-третбутил-1Н-піразол-5-іл)-6-хлорпіразин-2-аміну, 41,6 г вінілгрифторборату калію, 4,22 г комплексу (1,1’біс(дифенілфосфіно)фероцен)дихлорпаладій(II) в дихлорметані, 72 мл триетиламіну і 685 мл 1пропанолу, перемішували при 110°С протягом ночі з наступним охолодженням до кімнатної температури і концентрували у вакуумі. Одержаний залишок розбавляли етилацетатом і відфільтровували нерозчинну речовину за допомогою целіту. Одержаний етилацетатний розчин промивали водою, сушили над безводним сульфатом магнію і фільтрували. Фільтрат концентрували у вакуумі. З одержаного залишку готували суспензію в 100 мл етилацетату і додавали до суміші 400 мл простого діізопропілового ефіру. Одержаний осад збирали, одержуючи при цьому зазначену в заголовку сполуку у вигляді блідо-коричневої твердої речовини. (3) Синтез 6-((1-трет-бутил-1Н-піразол-5іл)аміно)піразин-2-карбальдегіду
ДивитисяДодаткова інформація
Назва патенту англійськоюAminopyridine derivatives having aurora a selective inhibitory action
Автори англійськоюIwasawa, Yoshikazu, Kato, Tetsuya, Kawanishi, Nobuhiko, Masutani, Kouta, Mita, Takashi, Nonoshita, Katsumasa, Ohkubo, Mitsuru
Назва патенту російськоюАминопиридиновые производные с селективной ингибирующей активностью в отношении авроры а
Автори російськоюИвасава Йосиказу, Като Тецуя, Каваниси Нобухико, Масутани Коута, Мита Такаси, Ноносита Кацумаса, Охкубо Мицуру
МПК / Мітки
МПК: A61P 35/00, A61K 31/4439, C07D 401/12, C07D 403/12, C07D 417/12, A61P 43/00, A61K 45/00, A61K 31/497
Мітки: аврори, відношенні, інгібуючою, похідні, селективною, амінопіридинові, активністю
Код посилання
<a href="https://ua.patents.su/42-95972-aminopiridinovi-pokhidni-iz-selektivnoyu-ingibuyuchoyu-aktivnistyu-u-vidnoshenni-avrori-a.html" target="_blank" rel="follow" title="База патентів України">Амінопіридинові похідні із селективною інгібуючою активністю у відношенні аврори а</a>
Попередній патент: Термозварювальна багатошарова плівка, її застосування та спосіб виготовлення пакувального матеріалу (варіанти), пакувальний матеріал (варіанти) та його застосування
Наступний патент: Система подачі бетону з щоглою розподілу бетону, що переставляється по висоті
Випадковий патент: Спосіб оперативного лікування посттравматичної променевої косорукості