Метаботропічні антагоністи рецептора глутамату, спосіб їх одержання (варіанти), фармацевтична композиція та спосіб її одержання
Номер патенту: 76726
Опубліковано: 15.09.2006
Автори: Купа Софі, Венет Марк Гастон, Лезаж Анне Сімон Жозефін, Понцелет Алан Філіп, Мабіре Домінік Жан-П'єр
Формула / Реферат
1. Сполука формули
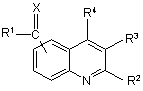 (I-A) або
(I-A) або
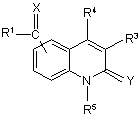 (I-B),
(I-B),
її N-оксидна форма, фармацевтично прийнятна адитивна сіль, четвертинний амін та стереохімічно ізомерна форма, де
X є O; C(R6)2, де R6 є воднем, арилом або C1-6алкілом необов’язково заміщеним аміногрупою або моно- або ді(C1-6алкіл)аміногрупою; S або N-R7, де R7 є аміногрупою або гідроксигрупою;
R1 є C1-6алкілом; тіонілом; хінолінілом; циклоC3-12алкілом або (циклоC3-12алкіл)C1-6алкілом, де циклоC3-12алкільна складова необов’язково може містити подвійний зв’язок, та де один атом вуглецю у циклоC3-12алкільній складовій може бути заміщений атомом кисню або NR8-складовою, де R8 є воднем, бензилом або C1-6алкілоксикарбонілом; де один або більше атомів водню у C1-6алкільній складовій або у циклоC3-12алкільній складовій необов’язково можуть бути заміщені C1-6алкілом, гідроксіC1-6алкілом, галоC1-6алкілом, аміноC1-6алкілом, гідроксигрупою, C1-6алкілоксигрупою, арилC1-6алкілоксигрупою, галогеном, C1-6алкілоксикарбонілом, арилом, аміногрупою, моно- або ді(C1-6алкілом)аміногрупою, C1-6алкілоксикарбоніламіногрупою, галогеном, піперазинілом, піридинілом, морфолінілом, тієнілом або бівалентним радикалом формули -O-, -O-CH2-O або -O-CH2-CH2-O-,
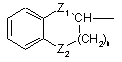
або радикалом формули (a-1)
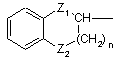 , (a-1)
, (a-1)
де Z1 є єдиним ковалентним зв’язком, O, NH або CH2;
Z2 є єдиним ковалентним зв’язком, O, NH або CH2;
n є цілим числом 0, 1 , 2 або 3;
та де кожний атом водню у фенільному кільці незалежно може необов’язково бути заміщений галогеном, гідроксигрупою, C1-6алкілом, C1-6алкілоксигрупою або гідроксіC1-6алкілом;
або X та R1 можуть бути узяті разом з атомом вуглецю, до якого X та R1 приєднані, для утворення радикала формули (b-1), (b-2) або (b-3);
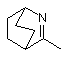 , (b-1)
, (b-1)
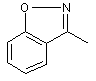 , (b-2)
, (b-2)
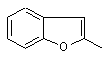 , (b-3)
, (b-3)
R2 є воднем; галогеном; ціаногрупою; C1-6алкілом; C1-6алкілоксигрупою; C1-6алкілтіогрупою; C1-6алкілкарбонілом; C1-6алкілоксикарбонілом; C1-6алкілкарбонілоксіC1-6алкілом; C2-6алкенілом; гідроксіC2-6алкенілом; C2-6алкінілом; гідроксіC2-6алкінілом; три(C1-6алкіл)силанC2-6алкінілом; аміногрупою; моно- або ді(C1-6алкіл)аміногрупою; моно- або ді(C1-6алкілоксіC1-6алкіл)аміногрупою; моно- або ді(C1-6алкілтіоC1-6алкіл)аміногрупою; арилом; арилC1-6алкілом; арилC2-6алкінілом; C1-6алкілоксіC1-6алкіламіноC1-6алкілом; амінокарбонілом необов’язково заміщеним C1-6алкілом, C1-6алкілоксиC1-6алкілом, C1-6алкілоксикарбонілC1-6алкілом або піридинілC1-6алкілом;
гетероциклом, вибраним з тієнілу, фуранілу, піролілу, тіазолілу, оксазолілу, імідазолілу, ізотіазолілу, ізоксазолілу, піразолілу, піридилу, піразинілу, піридазинілу, піримідинілу, піперидинілу та піперазинілу, необов’язково N-заміщеного C1-6алкілоксіC1-6алкілом, морфолінілом, тіоморфолінілом, діоксанілом або дитіанілом;
радикалом -NH-C(=O)R9, де R9 є
C1-6алкілом необов’язково заміщеним циклоC3-12алкілом, C1-6алкілокси групою, C1-6алкілоксикарбонілом, арилом, арилоксигрупою, тієнілом, піридинілом, моно- або ді(C1-6алкіл)аміногрупою, C1-6алкілтіогрупою, бензилтіогрупою, піридинілтіогрупою або піримідинілтіогрупою;
циклоC3-12алкілом; циклогексенілом; аміногрупою; арилциклоC3-12алкіламіногрупою; моно- або ді(C1-6алкіл)аміногрупою; моно- або ді(C1-6алкілоксикарбонілC1-6алкіл)аміногрупою; моно- або ді(C1-6алкілоксикарбоніл)аміногрупою; моно- або ді(C2-6алкеніл)аміногрупою; моно- або ді(арилC1-6алкіл)аміногрупою; моно- або діариламіногрупою; арилC2-6алкенілом; фуранілC2-6алкенілом; піперидинілом; піперазинілом; індолілом; фурилом; бензофурилом; тетрагідрофурилом; інденілом; адамантилом; піридинілом; піразинілом; арилом; арилC1-6алкілтіогрупою або радикалом формули (a-1) ;
сульфонамідом -NH-SO2-R10, де R10 є C1-6алкілом, моно- або полігалоC1-6алкілом, арилC1-6алкілом, арилC2-6алкенілом, арилом, хінолінілом, ізоксазолілом або ді(C1-6алкіл)аміногрупою;
R3 є воднем; галогеном; гідроксигрупою; ціаногрупою; C1-6алкілом; C1-6алкілоксигрупою; C1-6алкілоксіC1-6алкілом; C1-6алкілкарбонілом; C1-6алкілоксикарбонілом; C2-6алкенілом; гідроксіC2-6алкенілом; С2-6алкінілом; гідроксіC2-6алкінілом; три(C1-6алкіл)силанC2-6алкінілом; аміногрупою; моно- або ді(C1-6алкіл)аміногрупою; моно- або ді(C1-6алкілоксіC1-6алкіл)аміногрупою; моно- або ді(C1-6алкілтіоC1-6алкіл)аміногрупою; арилом; морфолінілC1-6алкілом або піперидинілC1-6алкілом;
R4 є воднем; галоген; ціаногрупою; C1-6алкілом; C1-6алкілоксіC1-6алкілом; C1-6алкілкарбонілом; C1-6алкілоксикарбонілом; C2-6алкенілом; гідроксіC2-6алкенілом; С2-6алкінілом; гідроксіC2-6алкінілом; три(C1-6алкіл)силанC2-6алкінілом; моно- або ді(C1-6алкіл)аміногрупою; моно- або ді(C1-6алкілоксіC1-6алкіл)аміногрупою; моно- або ді(C1-6алкілтіоC1-6алкіл)аміногрупою; морфолінілC1-6алкілом або піперидинілC1-6алкілом; або
R2 та R3 можуть бути узяті разом для утворення -R2-R3-, який є бівалентним радикалом формули -(CH2)3-, -(CH2)4-, -(CH2)5-, -(CH2)6-, -CH=CH-CH=CH-, -Z4-CH=CH-, -CH=CH-Z4-, -Z4-CH2-CH2-CH2-, -CH2-Z4-CH2-CH2-, -CH2-CH2-Z4-CH2-, -CH2-CH2-CH2-Z4-, -Z4-CH2-CH2-, -CH2-Z4-CH2- або -CH2-CH2-Z4-, де Z4 є O, S, SO2 або NR11, де R11 є воднем, C1-6алкілом, бензилом або
C1-6алкілоксикарбонілом; та де кожний бівалентний радикал є необов’язково заміщеним C1-6алкілом,
або R3 та R4 можуть бути узяті разом для утворення бівалентного радикала формули -CH=CH-CH=CH- або -CH2-CH2-CH2-CH2-;
R5 є воднем; циклоC3-12алкілом; піперидинілом; оксотієнілом; тетрагідротієнілом, арилC1-6алкілом; C1-6алкілоксіC1-6алкілом; C1-6алкілоксикарбонілC1-6алкілом або C1-6алкілом, необов’язково заміщеним радикалом C(=O)NRxRy, де Rx та Ry, кожний незалежно є воднем, циклоC3-12алкілом, C2-6алкінілом або C1-6алкілом необов’язково заміщеним ціаногрупою, C1-6алкілоксигрупою, C1-6алкілоксикарбонілом, фуранілом, піролідинілом, бензилтіогрупою, піридинілом, піролілом або тієнілом;
Y є O або S;
або Y та R5 можуть бути узяті разом для утворення =Y-R5-, який є радикалом формули
-CH=N-N= (c-1);
-N=N-N= (c-2) або
-N-CH=CH- (c-3);
арил є фенілом або нафтилом, необов’язково заміщеним одним або більше замісниками, вибраними з галогену, гідроксигрупи, C1-6алкілу, C1-6алкілоксигрупи, фенілоксигрупи, нітрогрупи, аміногрупи, тіогрупи, C1-6алкілтіогрупи, галоC1-6алкілу, полігалоC1-6алкілу, полігалоC1-6алкілоксигрупи, гідроксіC1-6алкілу, C1-6алкілоксіC1-6алкілу, аміноC1-6алкілу, моно- або ді(C1-6алкіл)аміногрупи;
моно- або ді(C1-6алкіл)аміноC1-6алкілом, ціаногрупою, -CO-R12, -CO-OR13, -NR13SO2R12, -SO2-NR13R14, -NR13C(O)R12, -C(O)NR13R14, -SOR12, -SO2R12; де кожний R12, R13 та R14 незалежно є C1-6алкілом; циклоC3-6алкілом; фенілом; фенілом заміщеним галогеном, гідроксигрупою, C1-6алкілом, C1-6алкілоксигрупою, галоC1-6алкілом, полігалоC1-6алкілом, фуранілом, тієнілом, піролілом, імідазолілом, тіазолілом або оксазолілом;
та коли R1-C(=X) складова зв’язана з іншим положенням ніж 7 або 8 положення, тоді згадані 7 та 8 положення можуть бути заміщені R15 та R16, де один з них або обидва з R15 та R16 є C1-6алкілом, C1-6алкілоксигрупою, або R15 та R16 узяті разом можуть утворювати бівалентний радикал формули -CH=CH-CH=CH-.
2. Сполука за п. 1, яка відрізняється тим, що
X є O, C(R6)2, де R6 є воднем або арилом, або N-R7, де R7 є аміногрупою або гідроксигрупою,
R1 являє собою C1-6алкіл; тієніл; хінолініл; циклоC3-12алкіл або
(циклоC3-12алкіл)C1-6алкіл, де циклоC3-12алкільна складова необов’язково може містити подвійний зв’язок, та де один атом вуглецю у циклоC3-12алкільній складовій може бути заміщений атомом кисню або NR8-складовою, де R8 є бензилом або C1-6алкілоксикарбонілом; де один або більше атомів водню у C1-6алкільній складовій або у циклоC3-12алкільній складовій необов’язково можуть бути заміщені C1-6алкілом, галоC1-6алкілом, гідроксигрупою, C1-6алкілоксигрупою, арилC1-6алкілоксигрупою, галогеном, арилом, моно- або ді(C1-6алкілом)аміногрупою, C1-6алкілоксикарбоніламіногрупою, галогеном, піперазинілом, піридинілом, морфолінілом, тієнілом або бівалентним радикалом формули -O- або -O-CH2-CH2-O-,
або радикал формули (a-1)
 , (a-1)
, (a-1)
де Z1 є єдиним ковалентним зв’язком, O або CH2,
Z2 є єдиним ковалентним зв’язком, O або CH2,
n є цілим числом 0, 1 або 2;
та де кожний атом водню у фенільному кільці, незалежно, може бути необов’язково заміщеним галогеном або гідроксигрупою,
або X та R1 можуть бути узяті разом з атомом вуглецю, до якого X та R1 приєднані, для утворення радикала формули (b-1), (b-2) або (b-3);
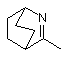 , (b-1)
, (b-1)
 , (b-2)
, (b-2)
 , (b-3)
, (b-3)
R2 є воднем; галогеном; ціаногрупою; C1-6алкілом; C1-6алкілоксигрупою; C1-6алкілтіогрупою; C1-6алкілкарбонілом; C1-6алкілоксикарбонілом; C2-6алкенілом; гідроксіC2-6алкенілом; C2-6алкінілом; гідроксіC2-6алкінілом; три(C1-6алкіл)силанC2-6алкінілом; аміногрупою; моно- або ді(C1-6алкіл)аміногрупою, моно- або ді(C1-6алкілоксіC1-6алкіл)аміногрупою, моно- або ді(C1 6алкілтіоC1-6алкіл)аміногрупою; арилом; арилC1-6алкілом; арилC2-6алкінілом; C1-6алкілоксіC1-6алкіламіноC1-6алкілом; амінокарбонілом, необов’язково заміщеним C1-6алкілоксикарбонілC1-6алкілом; гетероциклом, вибраним з тієнілу, фуранілу, тіазолілу та піперидинілу, необов’язково N-заміщеним морфолінілом або тіоморфолінілом;
радикалом -NH-C(=O)R9, де R9 є C1-6алкілом необов’язково заміщеним циклоC3-12алкілом, C1-6алкілоксигрупою, C1-6алкілоксикарбонілом, арилом, арилоксигрупою, тієнілом, піридинілом, моно- або ді(C1-6алкіл)аміногрупою, C1-6алкілтіогрупою, бензилтіогрупою, піридинілтіогрупою або піримідинілтіогрупою; циклоC3-12алкілом; циклогексенілом; аміногрупою; арилциклоC3-12алкіламіногрупою; моно- або -ді(C1-6алкіл)аміногрупою; моно- або ді(C1-6алкілоксикарбонілC1-6алкіл)аміногрупою; моно- або ді(C1-6алкілоксикарбоніл)аміногрупою; моно- або ді(C2-6алкеніл)аміногрупою; моно- або ді(арилC1-6алкіл)аміногрупою; моно- або діариламіногрупою; арилC2-6алкенілом; фуранілC2-6алкенілом; піперидинілом; піперазинілом; індолілом; фурилом; бензофурилом; тетрагідрофурилом; інденілом; адамантилом; піридинілом; піразинілом; арилом або радикалом формули (a-1);
сульфонамідом -NH-SO2-R10, де R10 є C1-6алкілом, моно- або полігалоC1-6алкілом, арилC1-6алкілом або арилом;
R3 та R4 кожний незалежно є воднем; C1-6алкілом, C1-6алкілоксіC1-6алкілом, C1-6алкілоксикарбонілом; або
R2 та R3 можуть бути узяті разом для утворення -R2-R3-, який є бівалентним радикалом формули -(CH2)4-, -(CH2)5-, -Z4-CH=CH-, -Z4-CH2-CH2-CH2- або -Z4-CH2-CH2-, де Z4 є O, S, SO2 або NR11, де R11 є воднем, C1-6алкілом, бензилом або C1-6алкілоксикарбонілом; та де кожний бівалентний радикал необов’язково заміщений C1-6алкілом;
або R3 та R4 можуть бути узяті разом для утворення бівалентного радикала формули -CH=CH-CH=CH- або -CH2-CH2-CH2-CH2-;
R5 є воднем; піперидинілом; оксотієнілом; тетрагідротієнілом, арилC1-6алкілом; C1-6алкілоксикарбонілC1-6алкілом або C1-6алкілом, необов’язково заміщеним радикалом C(=O)NRxRy, де Rx та Ry, кожний незалежно є воднем, циклоC3-12алкілом, C2-6алкінілом або C1-6алкілом, необов’язково заміщеним ціаногрупою, C1-6алкілоксигрупою або C1-6алкілоксикарбонілом;
Y є O або S;
або Y та R5 можуть бути узяті разом для утворення =Y-R5 -, який є радикалом формули
-CH=N-N= (c-1) або
-N=N-N= c(c-2);
арил є фенілом або нафтилом, необов’язково заміщеним одним або більше замісниками, вибраними з галогену, C1-6алкілоксигрупи, фенілоксигрупи, моно- або ді(C1-6алкіл)аміногрупи та ціаногрупи,
та коли R1-C(=X) складова зв’язана з іншим положенням ніж 7 або 8 положення, тоді згадані 7 та 8 положення можуть бути заміщені R15 та R16, де один з них або обидва з R15 та R16 є C1-6алкілом, або R15 та R16 узяті разом можуть утворювати бівалентний радикал формули -CH=CH-CH=CH-.
3. Сполука за п. 1, яка відрізняється тим, що
X є O,
R1 є C1-6алкілом, циклоC3-12алкілом або (циклоC3-12алкіл)C1-6алкілом, де один або більше атомів вуглецю у C1-6алкільній складовій або у циклоC3-12алкільній складовій можуть бути заміщені C1-6алкілоксигрупою, арилом, галогеном або тієнілом,
R2 є воднем, галогеном, C1-6алкілом або аміногрупою,
R3 та R4 кожний незалежно є воднем або C1-6алкілом, або
R2 та R3 можуть бути узяті разом для утворення -R2-R3-, який є бівалентним радикалом формули -Z4-CH2-CH2-CH2- або -Z4-CH2-CH2-, де Z4 є O або NR11, де R11 є C1-6алкілом, та де кожний бівалентний радикал є необов’язково заміщений C1-6алкілом,
або R3 та R4 можуть бути узяті разом для утворення бівалентного радикала формули -CH2-CH2-CH2-CH2-,
R5 є воднем,
Y є O, та
арил є фенілом, необов’язково заміщеним галогеном,
4. Cполука за п. 1, яка відрізняється тим, що R1-C(=X) складова зв’язана з хіноліном або хіноліноновою складовою у положенні 6.
5. Сполука за п. 1 для застосування як лікарський засіб.
6. Застосування сполуки за будь-яким з пп. 1–4 для виробництва лікарського засобу для лікування або запобігання викликаних глутаматом хвороб центральної нервової системи.
7. Застосування за п. 6, яке відрізняється тим, що викликаною глутаматом хворобою центральної нервової системи є морфінізм або абстиненція (залежність, опіоїдна толерантність, опіоїдна абстиненція), гіпоксичні, аноксичні та ішемічні ураження (ішемічний інсульт, зупинка серця), біль (невропатичний біль, біль викликаний запаленням, гіпералгезія), гіпоглікемія, хвороби пов’язані з неврональним пошкодженням, травмою головного мозку, травмою голови, пошкодженням спинного мозку, міелопатія, деменція, занепокоєння, шизофренія, депресія, послаблена когнітивна здатність, амнезія, біполярні розлади, поведінкові розлади, хвороба Альцгеймера, мультиінфарктна деменція, змішані (Альцгеймера та мультиінфарктна) деменції, хвороба Леві, делірій або сплутаність, хвороба Паркінсона, хвороба Хантингтона, синдром Дауна, епілепсія, старіння, бічний аміотрофічний склероз, розсіяний склероз, СНІД (синдром набутого імунодефіциту) та СНІД-асоційований комплекс (СПК).
8. Фармацевтична композиція, яка містить фармацевтично прийнятний носій, та, як активний інгредієнт, терапевтично ефективну кількість сполуки за будь-яким з пп. 1-4.
9. Спосіб отримання композиції за п. 8, який відрізняється тим, що фармацевтично прийнятний носій ретельно перемішують з терапевтично ефективною кількістю сполуки за будь-яким з пп. 1-4.
10. Спосіб отримання сполуки формули (I-A) або (I-B) за п. 1, який відрізняється тим, що виконують
а) окислення проміжної сполуки формули (II) у присутності прийнятного окислювального агента
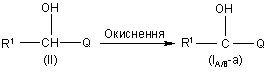 ,
,
де R1 визначено у п. 1 та Q є хіноліном або хіноліноновою складовою сполуки формули (I-A) або (I-B),
b) та, якщо бажано, сполуки формули (I-A) або (I-B) перетворюють одну на іншу за допомогою відомих з рівня техніки реакцій перетворення, або, якщо бажано, перетворюють сполуки формули (I-A) або (I-B) у терапевтично активну нетоксичну кислотно-адитивну сіль шляхом обробки кислотою, або навпаки, перетворюють кислотно-адитивну форму солі у вільну основу шляхом обробки лугом, та, якщо бажано, отримують стереохімічно ізомерні форми, четвертинні аміни або їх N-оксидні форми.
11. Спосіб отримання сполуки формули (I-A) або (I-B) за п. 1, який відрізняється тим, що виконують
а) реакцію проміжної сполуки формули (III) з проміжною сполукою формули (IV)
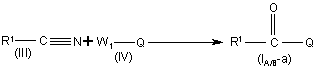 ,
,
де R1 визначено у п. 1, Q є хіноліном або хіноліноновою складовою сполуки формули (I-A) або (I-B), та W1 є прийнятною кінцевою групою,
b) та, якщо бажано, сполуки формули (I-A) або (I-B) перетворюють одну на іншу за допомогою відомих з рівня техніки реакцій перетворення, або, якщо бажано, перетворюють сполуки формули (I-A) або (I-B) у терапевтично активну нетоксичну кислотно-адитивну сіль шляхом обробки кислотою, або навпаки, перетворюють кислотно-адитивну форму солі у вільну основу шляхом обробки лугом, та, якщо бажано, отримують стереохімічно ізомерні форми, четвертинні аміни або їх N-оксидні форми.
12. Спосіб отримання сполуки формули (I-A) або (I-B) за п. 1, який відрізняється тим, що виконують
а) реакцію проміжної сполуки формули (V) з проміжною сполукою формули (IV)
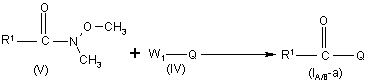 ,
,
де R1 визначено у п. 1, Q є хіноліном або хіноліноновою складовою сполуки формули (I-A) або (I-B), та W1 є прийнятною кінцевою групою,
b) та, якщо бажано, сполуки формули (I-A) або (I-B) перетворюють одну на іншу за допомогою відомих з рівня техніки реакцій перетворення, або, якщо бажано, перетворюють сполуки формули (I-A) або (I-B) у терапевтично активну нетоксичну кислотно-адитивну сіль шляхом обробки кислотою, або навпаки, перетворюють кислотно-адитивну форму солі у вільну основу шляхом обробки лугом, та, якщо бажано, отримують стереохімічно ізомерні форми, четвертинні аміни або їх N-оксидні форми.
13. Спосіб отримання сполуки формули (I-A) або (I-B) за п. 1, який відрізняється тим, що виконують
а) реакцію проміжної сполуки формули (VI) з проміжною сполукою формули (VII) у присутності прийнятної кислоти
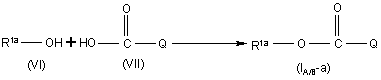 ,
,
де R1а визначено як і R1 у п. 1, за умови, що R1 є зв’язаним з карбонільною складовою через атом кисню та Q є хіноліном або хіноліноновою складовою сполуки формули (I-A) або (I-B),
b) та, якщо бажано, сполуки формули (I-A) або (I-B) перетворюють одну на іншу за допомогою відомих з рівня техніки реакцій перетворення, або, якщо бажано, перетворюють сполуки формули (I-A) або (I-B), у терапевтично активну нетоксичну кислотно-адитивну сіль шляхом обробки кислотою, або навпаки, перетворюють кислотно-адитивну форму солі у вільну основу шляхом обробки лугом, та, якщо бажано, отримують стереохімічно ізомерні форми, четвертинні аміни або їх N-оксидні форми.
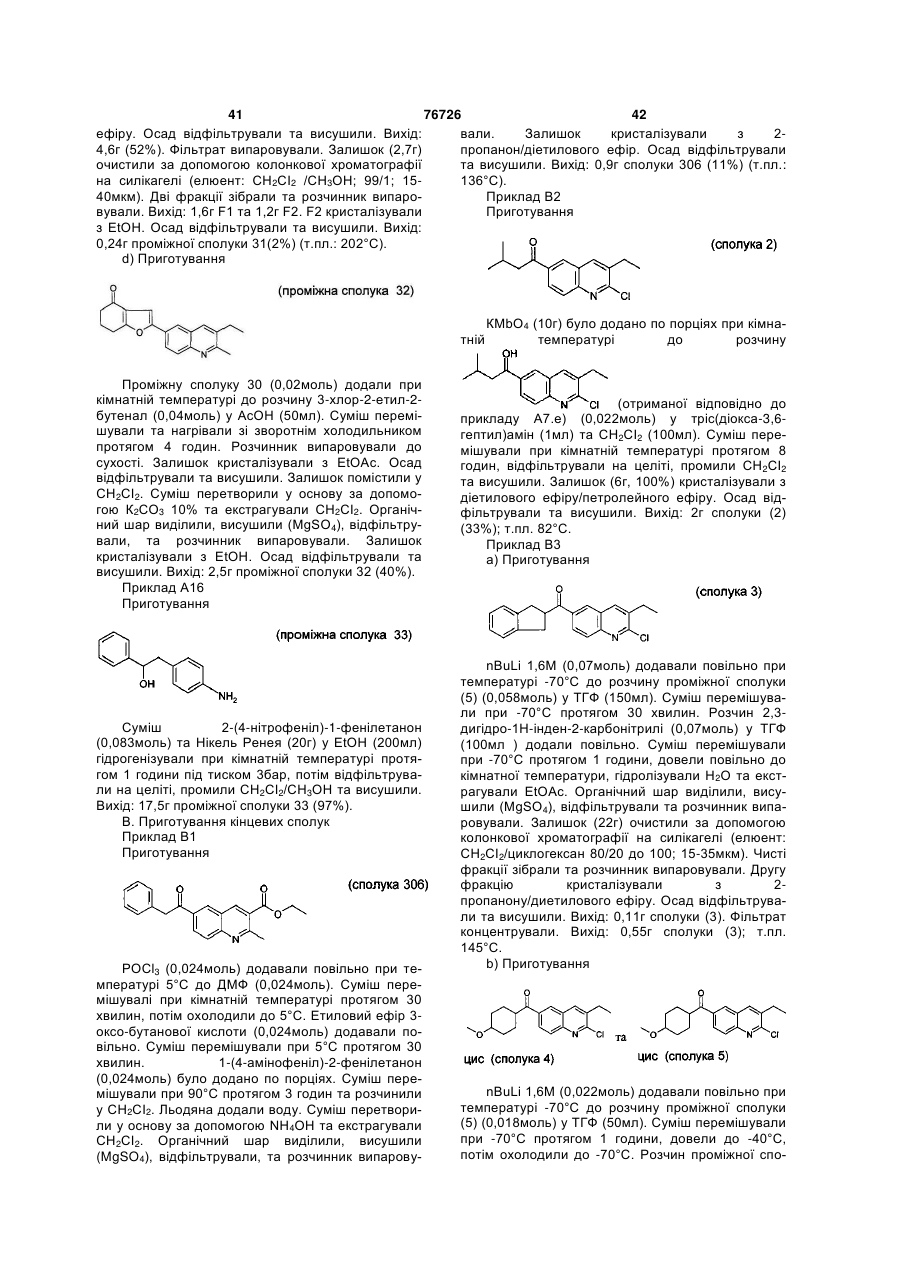
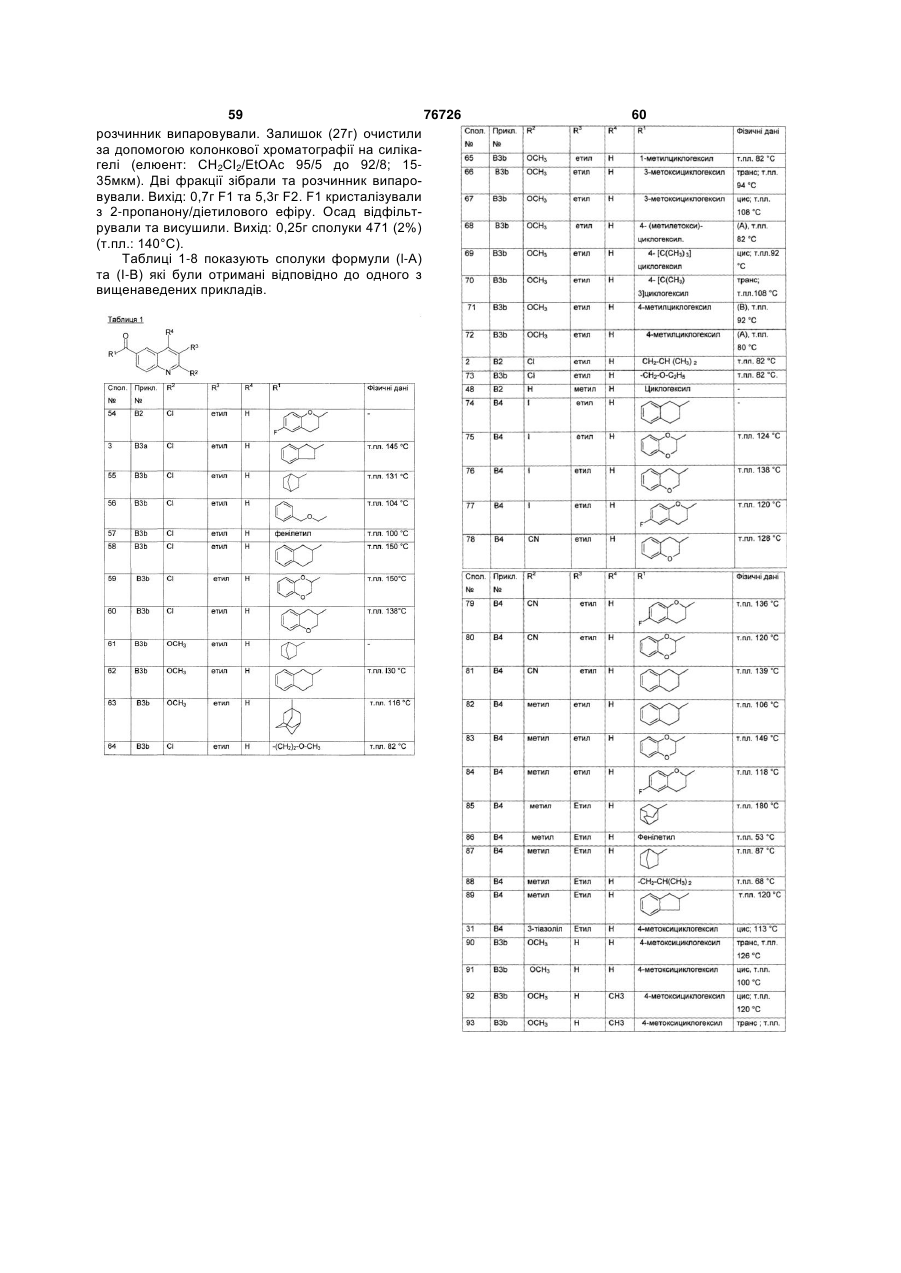
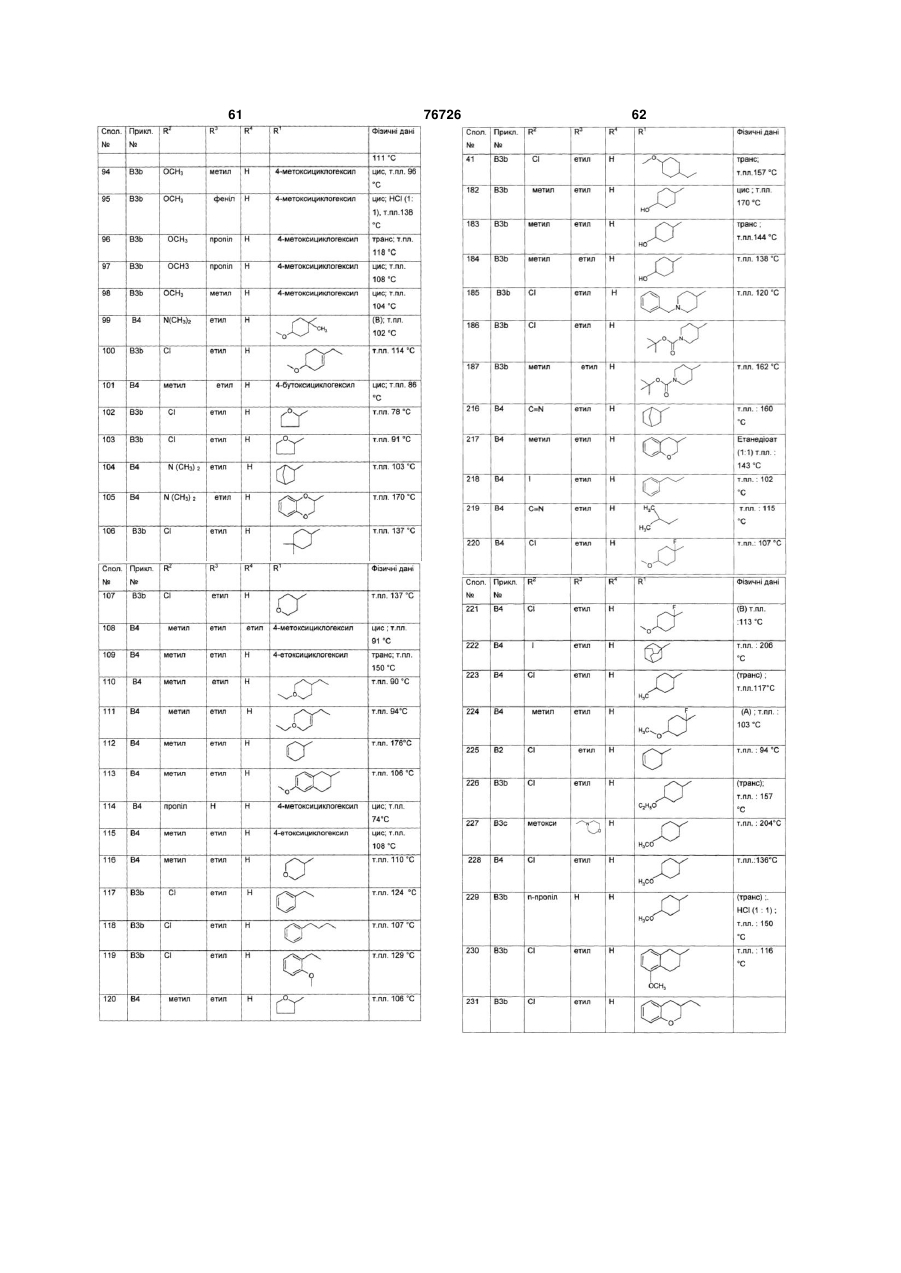
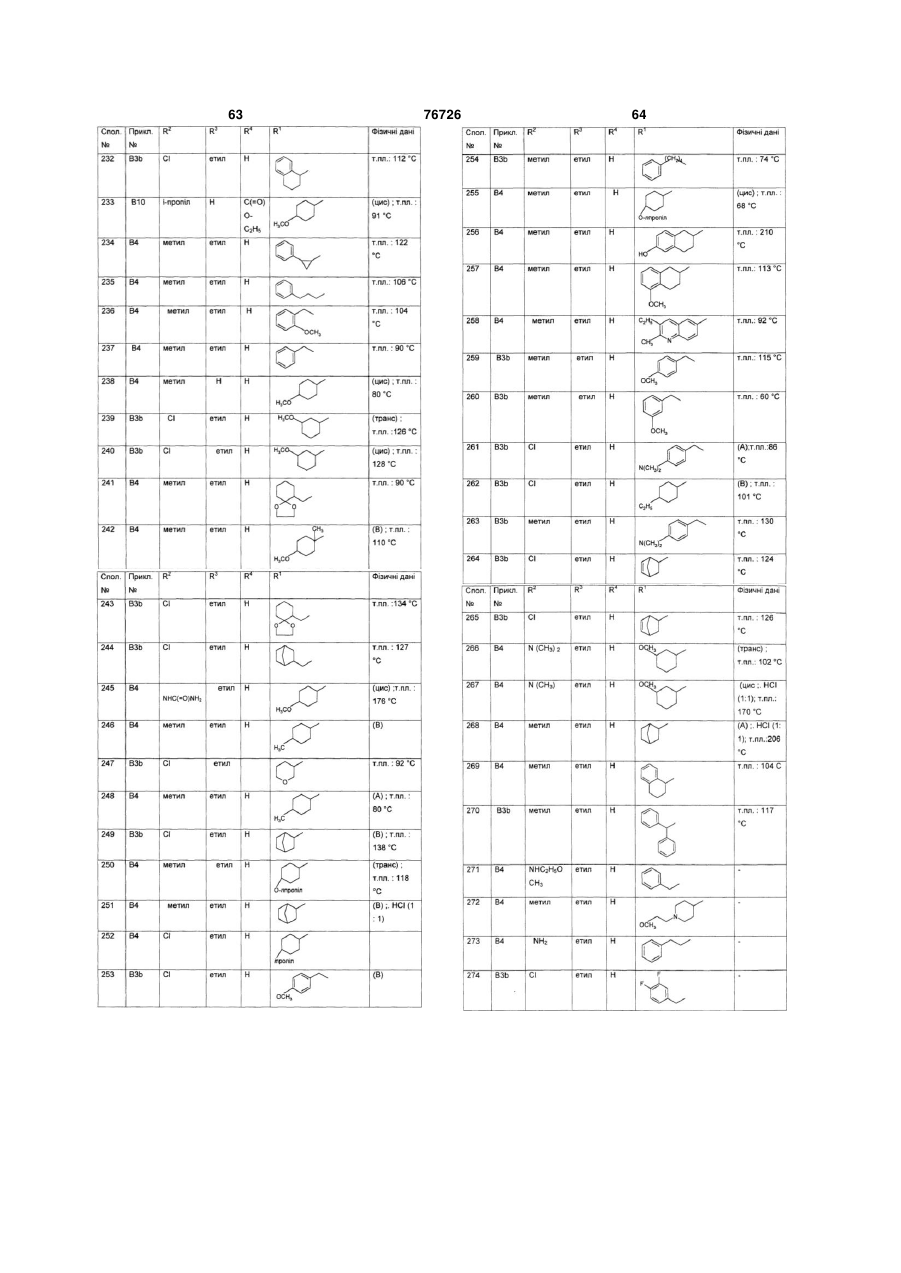
Текст
1. Сполука формули X R4 R1 С R3 N X R1 (I-A) або (b-1) O , N , (b-2) , (b-3) R3 (I-B), N N R2 R4 С 4 Y R5 її N-оксидна форма, фармацевтично прийнятна адитивна сіль, четвертинний амін та стереохімічно ізомерна форма, де 6 6 X є O; C(R )2, де R є воднем, арилом або C1-6 алкілом необов’язково заміщеним аміногрупою або моно- або ді(C1-6алкіл)аміногрупою; S або N-R7, де R7 є аміногрупою або гідроксигрупою; R1 є C1-6алкілом; тіонілом; хінолінілом; циклоC312алкілом або (циклоC3-12алкіл)C1-6алкілом, де циклоC3-12алкільна складова необов’язково може містити подвійний зв’язок, та де один атом вуглецю у циклоC3-12алкільній складовій може бути заміще8 8 ний атомом кисню або NR -складовою, де R є воднем, бензилом або C1-6алкілоксикарбонілом; де один або більше атомів водню у C1-6алкільній складовій або у циклоC3-12алкільній складовій необов’язково можуть бути заміщені C1-6алкілом, гідроксіC1-6алкілом, галоC1-6алкілом, аміноC1гідроксигрупою, C1-6алкілоксигрупою, 6алкілом, арилC1-6алкілоксигрупою, галогеном, C16алкілоксикарбонілом, арилом, аміногрупою, моноабо ді(C1-6алкілом)аміногрупою, C16алкілоксикарбоніламіногрупою, галогеном, піперазинілом, піридинілом, морфолінілом, тієнілом або бівалентним радикалом формули -O-, -O-CH2O або -O-CH2-CH2-O-, або радикалом формули (a-1) Z1 CH (a-1) (CH2) n Z2 , де Z1 є єдиним ковалентним зв’язком, O, NH або CH2; Z2 є єдиним ковалентним зв’язком, O, NH або CH2; n є цілим числом 0, 1 , 2 або 3; та де кожний атом водню у фенільному кільці незалежно може необов’язково бути заміщений галогеном, гідроксигрупою, C1-6алкілом, C1-6 алкілоксигрупою або гідроксіC1-6алкілом; або X та R1 можуть бути узяті разом з атомом вуглецю, до якого X та R1 приєднані, для утворення радикала формули (b-1), (b-2) або (b-3); O R2 є воднем; галогеном; ціаногрупою; C1-6алкілом; C1-6алкілоксигрупою; C1-6алкілтіогрупою; C1C1-6алкілоксикарбонілом; C16алкілкарбонілом; 6алкілкарбонілоксіC1-6алкілом; C2-6алкенілом; гідроксіC2-6алкенілом; C2-6алкінілом; гідроксіC26алкінілом; три(C1-6алкіл)силанC2-6алкінілом; аміногрупою; моно- або ді(C1-6алкіл)аміногрупою; моно- або ді(C1-6алкілоксіC1-6алкіл)аміногрупою; моноабо ді(C1-6алкілтіоC1-6алкіл)аміногрупою; арилом; арилC1-6алкілом; арилC2-6алкінілом; C1-6 алкілоксіC1-6алкіламіноC1-6алкілом; амінокарбонілом необов’язково заміщеним C1-6алкілом, C1-6 алкілоксиC1-6алкілом, C1-6алкілоксикарбонілC1-6 алкілом або піридинілC1-6алкілом; гетероциклом, вибраним з тієнілу, фуранілу, піролілу, тіазолілу, оксазолілу, імідазолілу, ізотіазолілу, ізоксазолілу, піразолілу, піридилу, піразинілу, піридазинілу, піримідинілу, піперидинілу та піперазинілу, необов’язково N-заміщеного C1-6 алкілоксіC1-6алкілом, морфолінілом, тіоморфолінілом, діоксанілом або дитіанілом; радикалом -NH-C(=O)R9, де R9 є C1-6алкілом необов’язково заміщеним циклоC3-12 алкілом, C1-6алкілокси групою, C1-6 алкілоксикарбонілом, арилом, арилоксигрупою, тієнілом, піридинілом, моно- або ді(C1-6 алкіл)аміногрупою, C1-6 алкілтіогрупою, бензилтіогрупою, піридинілтіогрупою або піримідинілтіогрупою; циклоC3-12алкілом; циклогексенілом; аміногрупою; арилциклоC3-12алкіламіногрупою; моно- або ді(C1-6 алкіл)аміногрупою; моно- або ді(C1-6 алкілоксикарбонілC1-6алкіл)аміногрупою; моно- або ді(C1-6 алкілоксикарбоніл)аміногрупою; моно- або ді(C2-6 алкеніл)аміногрупою; моноабо ді(арилC1-6 алкіл)аміногрупою; моно- або діариламіногрупою; арилC2-6алкенілом; фуранілC2-6алкенілом; піперидинілом; піперазинілом; індолілом; фурилом; бензофурилом; тетрагідрофурилом; інденілом; адамантилом; піридинілом; піразинілом; арилом; арилC1-6алкілтіогрупою або радикалом формули (a-1) ; сульфонамідом -NH-SO2-R10, де R10 є C1-6алкілом, моно- або полігалоC1-6алкілом, арилC1-6алкілом, арилC2-6алкенілом, арилом, хінолінілом, ізоксазолілом або ді(C1-6алкіл)аміногрупою; 3 R є воднем; галогеном; гідроксигрупою; ціаногрупою; C1-6алкілом; C1-6алкілоксигрупою; C1-6 алкілоксіC1-6алкілом; C1-6алкілкарбонілом; C1-6 алкілоксикарбонілом; C2-6алкенілом; гідроксіC2-6 алкенілом; С2-6алкінілом; гідроксіC2-6алкінілом; три(C1-6 алкіл)силанC2-6алкінілом; аміногрупою; моно- або ді(C1-6алкіл)аміногрупою; моно- або ді(C1-6 алкілок 5 76726 6 сіC1-6алкіл)аміногрупою; моно- або ді(C1-6 алкіл2. Сполука за п.1, яка відрізняється тим, що тіоC1-6алкіл)аміногрупою; арилом; морфолінілC1-6 X є O, C(R6)2, де R6 є воднем або арилом, або Nалкілом або піперидинілC1-6алкілом; R7, де R7 є аміногрупою або гідроксигрупою, 4 R є воднем; галоген; ціаногрупою; C1-6алкілом; R1 являє собою C1-6алкіл; тієніл; хінолініл; цикло C1-6алкілоксіC1-6алкілом; C1-6алкілкарбонілом; C1-6 C3-12алкіл або алкілоксикарбонілом; C2-6алкенілом; гідроксіC2-6 (циклоC3-12алкіл)C1-6алкіл, де циклоC3-12алкільна алкенілом; С2-6алкінілом; гідроксіC2-6алкінілом; складова необов’язково може містити подвійний три(C1-6алкіл)силанC2-6алкінілом; моно- або ді(C1-6 зв’язок, та де один атом вуглецю у циклоC3-12 алкіалкіл)аміногрупою; моно- або ді(C1-6алкілоксіC1-6 льній складовій може бути заміщений атомом кисалкіл)аміногрупою; моно- або ді(C1-6алкілтіоC1-6 ню або NR8-складовою, де R8 є бензилом або C1-6 алкіл)аміногрупою; морфолінілC1-6алкілом або алкілоксикарбонілом; де один або більше атомів піперидинілC1-6алкілом; або водню у C1-6алкільній складовій або у циклоC3-12 R2 та R3 можуть бути узяті разом для утворення алкільній складовій необов’язково можуть бути R2-R3-, який є бівалентним радикалом формули заміщені C1-6алкілом, галоC1-6алкілом, гідроксигру(CH2)3-, -(CH2)4-, -(CH2)5-, -(CH2)6-, -CH=CH-CH=CHпою, C1-6алкілоксигрупою, арилC1-6 алкілоксигру, -Z4-CH=CH-, -CH=CH-Z4-, -Z4-CH2-CH2-CH2-, -CH2пою, галогеном, арилом, моно- або ді(C1-6 алкіZ4-CH2-CH2-, -CH2-CH2-Z4-CH2-, -CH2-CH2-CH2-Z4-, лом)аміногрупою, C1-6 Z4-CH2-CH2-, -CH2-Z4-CH2- або -CH2-CH2-Z4-, де Z4 алкілоксикарбоніламіногрупою, галогеном, піперає O, S, SO2 або NR11, де R11 є воднем, C1-6алкілом, зинілом, піридинілом, морфолінілом, тієнілом або бензилом або бівалентним радикалом формули -O- або -O-CH2C1-6алкілоксикарбонілом; та де кожний бівалентCH2-O-, ний радикал є необов’язково заміщеним C1-6 алкіабо радикал формули (a-1) лом, Z1 CH або R3 та R4 можуть бути узяті разом для утворен(a-1) ня бівалентного радикала формули -CH=CH(CH2)n CH=CH- або -CH2-CH2-CH2-CH2-; Z2 , R5 є воднем; циклоC3-12алкілом; піперидинілом; де Z1 є єдиним ковалентним зв’язком, O або CH2, оксотієнілом; тетрагідротієнілом, арилC1-6алкілом; Z2 є єдиним ковалентним зв’язком, O або CH2, C1-6алкілоксіC1-6алкілом; C1-6алкілоксикарбонілC1-6 n є цілим числом 0, 1 або 2; алкілом або C1-6алкілом, необов’язково заміщеним та де кожний атом водню у фенільному кільці, нерадикалом C(=O)NRxRy, де Rx та Ry, кожний незазалежно, може бути необов’язково заміщеним галежно є воднем, циклоC3-12алкілом, C2-6 алкінілом логеном або гідроксигрупою, або C1-6алкілом необов’язково заміщеним ціаногабо X та R1 можуть бути узяті разом з атомом вугрупою, C1-6алкілоксигрупою, C1-6 алкілоксикарбонілецю, до якого X та R1 приєднані, для утворення лом, фуранілом, піролідинілом, бензилтіогрупою, радикала формули (b-1), (b-2) або (b-3); піридинілом, піролілом або тієнілом; Y є O або S; або Y та R5 можуть бути узяті разом для утворення =Y-R5-, який є радикалом формули -CH=N-N= (c-1); -N=N-N= (c-2) або -N-CH=CH- (c-3); арил є фенілом або нафтилом, необов’язково заміщеним одним або більше замісниками, вибраними з галогену, гідроксигрупи, C1-6алкілу, C1-6 алкілоксигрупи, фенілоксигрупи, нітрогрупи, аміногрупи, тіогрупи, C1-6алкілтіогрупи, галоC1-6 алкілу, полігалоC1-6алкілу, полігалоC1-6 алкілоксигрупи, гідроксіC1-6алкілу, C1-6алкілоксіC1-6алкілу, аміноC1-6 алкілу, моно- або ді(C1-6алкіл)аміногрупи; моно- або ді(C1-6алкіл)аміноC1-6алкілом, ціаногрупою, -CO-R12, -CO-OR13, -NR13SO2R12, -SO2NR13R14, -NR13C(O)R12, -C(O)NR13R14, -SOR12, SO2R12; де кожний R12, R13 та R14 незалежно є C1-6 алкілом; циклоC3-6алкілом; фенілом; фенілом заміщеним галогеном, гідроксигрупою, C1-6алкілом, C1-6алкілоксигрупою, галоC1-6алкілом, полігалоC1-6 алкілом, фуранілом, тієнілом, піролілом, імідазолілом, тіазолілом або оксазолілом; 1 та коли R -C(=X) складова зв’язана з іншим положенням ніж 7 або 8 положення, тоді згадані 7 та 8 положення можуть бути заміщені R15 та R16, де один з них або обидва з R15 та R16 є C1-6алкілом, C1-6алкілоксигрупою, або R15 та R16 узяті разом можуть утворювати бівалентний радикал формули -CH=CH-CH=CH-. N (b-1) O , N , (b-2) , (b-3) O R2 є воднем; галогеном; ціаногрупою; C1-6алкілом; C1-6алкілоксигрупою; C1-6алкілтіогрупою; C1-6 алкілкарбонілом; C1-6алкілоксикарбонілом; C2-6 алкенілом; гідроксіC2-6алкенілом; C2-6алкінілом; гідроксіC2-6алкінілом; три(C1-6алкіл)силанC2-6 алкінілом; аміногрупою; моно- або ді(C1-6алкіл)аміногрупою, моно- або ді(C1-6алкілоксіC1-6алкіл)аміногрупою, моно- або ді(C1 6алкілтіоC1-6алкіл)аміногрупою; арилом; арилC1-6алкілом; арилC2-6алкінілом; C1-6 алкілоксіC1-6алкіламіноC1-6алкілом; амінокарбонілом, необов’язково заміщеним C1-6 алкілоксикарбонілC1-6алкілом; гетероциклом, вибраним з тієнілу, фуранілу, тіазолілу та піперидинілу, необов’язково N-заміщеним морфолінілом або тіоморфолінілом; 7 76726 8 радикалом -NH-C(=O)R9, де R9 є C1-6алкілом неоR2 є воднем, галогеном, C1-6алкілом або аміногрубов’язково заміщеним циклоC3-12алкілом, C1-6 алкіпою, локсигрупою, C1-6алкілоксикарбонілом, арилом, R3 та R4 кожний незалежно є воднем або C1-6 алкіарилоксигрупою, тієнілом, піридинілом, моно- або лом, або ді(C1-6алкіл)аміногрупою, C1-6алкілтіогрупою, бенR2 та R3 можуть бути узяті разом для утворення 2 3 зилтіогрупою, піридинілтіогрупою або піримідинілR -R -, який є бівалентним радикалом формули тіогрупою; циклоC3-12алкілом; циклогексенілом; Z4-CH2-CH2-CH2- або -Z4-CH2-CH2-, де Z4 є O або аміногрупою; арилциклоC3-12алкіламіногрупою; NR11, де R11 є C1-6алкілом, та де кожний бівалентмоно- або -ді(C1-6алкіл)аміногрупою; моно- або ний радикал є необов’язково заміщений C1-6 алкіді(C1-6алкілоксикарбонілC1-6алкіл)аміногрупою; лом, моно- або ді(C1-6алкілоксикарбоніл)аміногрупою; або R3 та R4 можуть бути узяті разом для утворенмоно- або ді(C2-6алкеніл)аміногрупою; моно- або ня бівалентного радикала формули -CH2-CH2-CH2ді(арилC1-6алкіл)аміногрупою; моно- або діарилаCH2-, міногрупою; арилC2-6алкенілом; фуранілC2-6 алкеR5 є воднем, нілом; піперидинілом; піперазинілом; індолілом; Y є O, та фурилом; бензофурилом; тетрагідрофурилом; арил є фенілом, необов’язково заміщеним галогеінденілом; адамантилом; піридинілом; піразинілом; ном, арилом або радикалом формули (a-1); 4. Cполука за п.1, яка відрізняється тим, що R110 10 сульфонамідом -NH-SO2-R , де R є C1-6алкілом, C(=X) складова зв’язана з хіноліном або хіноліномоно- або полігалоC1-6алкілом, арилC1-6алкілом новою складовою у положенні 6. або арилом; 5. Сполука за п.1 для застосування як лікарський R3 та R4 кожний незалежно є воднем; C1-6алкілом, засіб. C1-6алкілоксіC1-6алкілом, C1-6алкілоксикарбонілом; 6. Застосування сполуки за будь-яким з пп.1–4 для або виробництва лікарського засобу для лікування або R2 та R3 можуть бути узяті разом для утворення запобігання викликаних глутаматом хвороб R2-R3-, який є бівалентним радикалом формули центральної нервової системи. (CH2)4-, -(CH2)5-, -Z4-CH=CH-, -Z4-CH2-CH2-CH2- або 7. Застосування за п. 6, яке відрізняється тим, що -Z4-CH2-CH2-, де Z4 є O, S, SO2 або NR11, де R11 є викликаною глутаматом хворобою центральної воднем, C1-6алкілом, бензилом або C1-6 алкілоксинервової системи є морфінізм або абстиненція карбонілом; та де кожний бівалентний радикал (залежність, опіоїдна толерантність, опіоїдна абснеобов’язково заміщений C1-6алкілом; тиненція), гіпоксичні, аноксичні та ішемічні ураабо R3 та R4 можуть бути узяті разом для утворенження (ішемічний інсульт, зупинка серця), біль ня бівалентного радикала формули -CH=CH(невропатичний біль, біль викликаний запаленням, CH=CH- або -CH2-CH2-CH2-CH2-; гіпералгезія), гіпоглікемія, хвороби пов’язані з невR5 є воднем; піперидинілом; оксотієнілом; тетрагірональним пошкодженням, травмою головного дротієнілом, арилC1-6алкілом; C1-6 алкілоксикарбомозку, травмою голови, пошкодженням спинного нілC1-6алкілом або C1-6алкілом, необов’язково замозку, міелопатія, деменція, занепокоєння, шизоміщеним радикалом C(=O)NRxRy, де Rx та Ry, френія, депресія, послаблена когнітивна здатність, кожний незалежно є воднем, циклоC3-12алкілом, амнезія, біполярні розлади, поведінкові розлади, C2-6алкінілом або C1-6алкілом, необов’язково заміхвороба Альцгеймера, мультиінфарктна деменція, щеним ціаногрупою, C1-6алкілоксигрупою або C1-6 змішані (Альцгеймера та мультиінфарктна) демеалкілоксикарбонілом; нції, хвороба Леві, делірій або сплутаність, хвороY є O або S; ба Паркінсона, хвороба Хантингтона, синдром або Y та R5 можуть бути узяті разом для утворенДауна, епілепсія, старіння, бічний аміотрофічний ня =Y-R5 -, який є радикалом формули склероз, розсіяний склероз, СНІД (синдром набу-CH=N-N= (c-1) або того імунодефіциту) та СНІД-асоційований ком-N=N-N= c(c-2); плекс (СПК). арил є фенілом або нафтилом, необов’язково за8. Фармацевтична композиція, яка містить фармаміщеним одним або більше замісниками, вибрацевтично прийнятний носій, та, як активний інгреними з галогену, C1-6алкілоксигрупи, фенілоксигрудієнт, терапевтично ефективну кількість сполуки пи, моноабо ді(C1-6алкіл)аміногрупи та за будь-яким з пп.1-4. ціаногрупи, 9. Спосіб отримання композиції за п. 8, який відріта коли R1-C(=X) складова зв’язана з іншим полозняється тим, що фармацевтично прийнятний ноженням ніж 7 або 8 положення, тоді згадані 7 та 8 сій ретельно перемішують з терапевтично ефекположення можуть бути заміщені R15 та R16, де тивною кількістю сполуки за будь-яким з пп.1-4. один з них або обидва з R15 та R16 є C1-6алкілом, 10. Спосіб отримання сполуки формули (I-A) або або R15 та R16 узяті разом можуть утворювати бі(I-B) за п.1, який відрізняється тим, що виконують валентний радикал формули -CH=CH-CH=CH-. а) окислення проміжної сполуки формули (II) у 3. Сполука за п.1, яка відрізняється тим, що присутності прийнятного окислювального агента X є O, OH OH R1 є C1-6алкілом, циклоC3-12алкілом або (циклоC3-12 Окиснення я алкіл)C1-6алкілом, де один або більше атомів вугCH Q R1 R1 C Q лецю у C1-6алкільній складовій або у циклоC3-12 (IA/B-a) (II) алкільній складовій можуть бути заміщені C1-6 ал, кілоксигрупою, арилом, галогеном або тієнілом, 9 76726 10 O де R1 визначено у п.1 та Q є хіноліном або хіноліO O CH3 ноновою складовою сполуки формули (I-A) або (IR1 C N B), R1 + W1 Q C Q CH3 b) та, якщо бажано, сполуки формули (I-A) або (I(IV) (V) (IA/B-a) , B) перетворюють одну на іншу за допомогою відоде R1 визначено у п.1, Q є хіноліном або хіноліномих з рівня техніки реакцій перетворення, або, новою складовою сполуки формули (I-A) або (I-B), якщо бажано, перетворюють сполуки формули (Iта W1 є прийнятною кінцевою групою, A) або (I-B) у терапевтично активну нетоксичну b) та, якщо бажано, сполуки формули (I-A) або (Iкислотно-адитивну сіль шляхом обробки кислотою, B) перетворюють одну на іншу за допомогою відоабо навпаки, перетворюють кислотно-адитивну мих з рівня техніки реакцій перетворення, або, форму солі у вільну основу шляхом обробки луякщо бажано, перетворюють сполуки формули (Iгом, та, якщо бажано, отримують стереохімічно A) або (I-B) у терапевтично активну нетоксичну ізомерні форми, четвертинні аміни або їх Nкислотно-адитивну сіль шляхом обробки кислотою, оксидні форми. або навпаки, перетворюють кислотно-адитивну 11. Спосіб отримання сполуки формули (I-A) або форму солі у вільну основу шляхом обробки лу(I-B) за п.1, який відрізняється тим, що виконують гом, та, якщо бажано, отримують стереохімічно а) реакцію проміжної сполуки формули (III) з проізомерні форми, четвертинні аміни або їх Nміжною сполукою формули (IV) оксидні форми. O 13. Спосіб отримання сполуки формули (I-A) або (I-B) за п.1, який відрізняється тим, що виконують C R1 N+ W 1 R1 C Q Q а) реакцію проміжної сполуки формули (VI) з про(III) (IV) (IA/B-a) , міжною сполукою формули (VII) у присутності приде R1 визначено у п.1, Q є хіноліном або хінолінойнятної кислоти O O новою складовою сполуки формули (I-A) або (I-B), та W1 є прийнятною кінцевою групою, R1a OH + HO C C O Q Q R1a b) та, якщо бажано, сполуки формули (I-A) або (I(VII) (VI) (IA/B-a) B) перетворюють одну на іншу за допомогою відо, мих з рівня техніки реакцій перетворення, або, де R1а визначено як і R1 у п.1, за умови, що R1 є якщо бажано, перетворюють сполуки формули (Iзв’язаним з карбонільною складовою через атом A) або (I-B) у терапевтично активну нетоксичну кисню та Q є хіноліном або хіноліноновою складокислотно-адитивну сіль шляхом обробки кислотою, вою сполуки формули (I-A) або (I-B), або навпаки, перетворюють кислотно-адитивну b) та, якщо бажано, сполуки формули (I-A) або (Iформу солі у вільну основу шляхом обробки луB) перетворюють одну на іншу за допомогою відогом, та, якщо бажано, отримують стереохімічно мих з рівня техніки реакцій перетворення, або, ізомерні форми, четвертинні аміни або їх Nякщо бажано, перетворюють сполуки формули (Iоксидні форми. A) або (I-B), у терапевтично активну нетоксичну 12. Спосіб отримання сполуки формули (I-A) або кислотно-адитивну сіль шляхом обробки кислотою, (I-B) за п.1, який відрізняється тим, що виконують або навпаки, перетворюють кислотно-адитивну а) реакцію проміжної сполуки формули (V) з проформу солі у вільну основу шляхом обробки луміжною сполукою формули (IV) гом, та, якщо бажано, отримують стереохімічно ізомерні форми, четвертинні аміни або їх Nоксидні форми. Даний винахід стосується хіноліну та похідних хіноліну, які демонструють антагоністичну активність відносно метаботропних глутаматних рецепторів та їх отримання; винахід додатково стосується композицій які містять їх, також як їх використання як лікарських засобів. Нейромедіатор глутамат вважається найважливішим нервовим нейромедіатором центральної нервової системи ссавців. Зв'язування цього нейромедіатору з метаботропними глутаматними рецепторами (mGluRs), які є підродиною з'єднаних з G-білком рецепторів та які включають 8 відмінних підтипів mGluR, а саме mGluRI, що через mGluR8, активізує ряд систем внутрішньоклітинного вторинного месенджеру. mGluR можуть бути розділені на 3 групи, виходячи з гомології послідовностей амінокислоти, системи внутрішньоклітинного вторинного месенджеру, що використовується рецеп торами та фармакологічних характеристик. Группа І mGluR, яка включає mGluR подтипу 1 та 5, зв'язується з фосфоліпазою С та їх активація призводить до внутрішньоклітинної кальцій-іонної активації. Группа II mGluR (mGluR2 та 3) та група III mGluR (mGluR4, 6, 7 та 8) зв'язуються з аденилатциклазою та їх активація викликає зниження вторинному месенджері сАМР та, таким чином, скидання нейронної активності. Лікування антагоністами Групи І mGluR було показано для транслювання у пресинапсі до зменшеного виділення нейромедіатора глутамата та зменшення опосередкованого глутаматом нейронного збудження крізь постсинаптичний механізм. Зважаючи на те, що патофізіологічні процеси та стани хвороби, що уражають центральну нервову систему, вважаються, такими, що є наслідком надмірного збудження глутаматом нейронів центральної 11 76726 12 нервової системи, антагоністи Групи І mGluR можуть бути терапевтично корисні при лікуванні хвороб центральної нервової системи. Міжнародна публікація WO 99/26927 розкриває антагоністи mGlu рецепторів Групи І для лікування неврологічних хвороб та розладів, засновані - поміж інших - на хіноліновій структурі. Міжнародна публікація WO 99/03822 розкриває біциклічні ліганди метаботропного глутаматноR2 являє собою водень; галоген; ціаногрупу; го рецептору, ні один з них засновано на хіноліноС1-6алкіл; С1-6алкілоксигрупу ; С1-6алкілтіогрупу ; вій структурі або хіноліні. С1-6алкілкарбоніл ; С1-6алкілоксикарбоніл ; С1Даний винахід стосується сполук формули 6алкілкарбонілоксиС1-6алкіл; С2-6алкеніл ; гідроксиС2-6алкеніл ; С2-6алкініл; гідроксиС2-6алкініл; три(С1-6алкіл)сіланС2-6алкініл; аміногрупу; моноабо ді(С1-6алкіл)аміногрупу; моно- або ді(С16алкілоксиС1-6алкіл)аміногрупу ; моно- або ді(С16алкілтіоС1-6алкіл)аміногрупу; арил; арилС1-6алкіл ; арилС1-6алкініл ; С1-6алкілоксиС1-6алкіламіноС16алкіл; амінокарбоніл необов'язково заміщений С1їх N-оксидних форм, фармацевтично прийнятС1-6алкілоксиС1-6алкілом, С16алкілом, них адитивних солей, четвертинних амінів та стеабо піридинілС16алкілоксикарбонілС1-6алкілом реохімічно ізомерних форм, де 6алкілом; гетероцикл обраний з тієнілу, фуранілу, X являє собою О; C(R6)2 де R6 є воднем, арипірролілу, тіазолілу, оксазолілу, імідазолілу, ізотіалом або С1-6алкілом необов'язково заміщеним амізолілу, ізоксазолілу, піразолілу, піридилу, піразиніногрупою або моно- або ді(С1-6алкіл)аміногрупою; лу, піридазинілу, піримідинілу, піперидинілу та S або N-R7 де R7 є аміногрупою або гідроксигрупіперазинілу, необов'язково Ν-заміщений С1пою; 6алкілоксиС1-6алкілом, морфолінілом, тіоморфолі1 R являє собою С1-6алкіл; арил; тієніл; хінолінілом, діоксанілом або дитіанілом; ніл; циклоС3-12алкіл або (циклоС3-12алкіл)С1-6алкіл, радикал -NH-C(=O)R9 де R9 являє собою де циклоС3-12алкільна складова необов'язково моС1-6алкіл необов'язково заміщений циклоС3же містити подвійний зв'язок та де один атом вуг12алкілом, С1-6алкілокси, С1-6алкілоксикарбонілом, лецю у циклоС3-12алкільній складовій може бути арилом, арилоксигрупою, тієнілом, піридинілом, заміщений атомом кисню або NR8-складовою де моно-або ді(С1-6алкіл)аміногрупою, С1R8 є воднем, бензилом або С16алкілтіогрупою, бензилтіогрупою, піридинілтіогрупою або піримідинілтіогрупою; циклоС3-12алкіл; 6алкілоксикарбонілом; де один або більше атомів водню у С1-6алкільній-складовій або у циклоС3циклогексеніл; аміногрупу; арилциклоС3моноабо -ді(С112алкільній-складовій необов'язково можуть бути 12алкіламіногрупу; заміщені С1-6алкілом, гідроксиС1-6алкілом, галоС1моноабо ді(С16алкіл)аміногрупу; 6алкілом, аміноС1-6алкілом, гідроксигрупою, С16алкілоксикарбонілС1-6алкіл)аміногрупу; моно- або ді(С1-6алкілоксикарбоніл)аміногрупу; моно- або 6алкілоксигрупою, арилС1-6алкілоксигрупою, галогеном, С1-6алкілоксикарбонілом, арилом, аміногруді(С2-6алкеніл)аміногрупу; моно- або ді(арилС1пою, моно- або ді(С1-6алкілом)аміногрупою, С16алкіл)аміногрупу; моно- або діариломаміногрупу; арилС2-6алкеніл; фуранілС2-6алкеніл; піперидиніл; 6алкілоксикарбоніламіногрупою, галогеном, піперазинілом, піридинілом, морфолінілом, тієнілом піперазиніл; індоліл; фуріл; бензофуріл; тетрагідабо бівалентним радикалом формули -О-, -О-СН2рофуріл; інденіл; адамантіл; піридиніл; піразиніл; О або -О-СН2-СН2-О-; арил; арилС1-6алкілтіогрупу або радикал формули або радикал формули (а-1) (а-1); сульфонамід -NH-SO2-R10 де R10 являє собою С1-6алкіл, моно- або полігалоС1-6алкіл, арилС16алкіл, арилС2-6алкеніл, арил, хінолініл, ізоксазоліл або ді(С1-6алкіл)аміногрупу; R3 та R4 кожний незалежно являє собою водень; галоген; гідроксигрупу; ціаногрупу; С1-6алкіл; С1-6алкілоксигрупу; С1-6алкілоксиС1-6алкіл; С1де Z1 є одним ковалентним зв'язком, О, NH 6алкілкарбоніл; С1-6алкілоксикарбоніл; С2-6алкеніл; або СН2; гідроксиС2-6алкеніл; С2-6алкініл; гідроксиС2-6алкініл; Z2 є одним ковалентним зв'язком, О, NH або три(С1-6алкіл)силанС2-6алкініл; аміногрупу; моноСН2; або ді(С1-6алкіл)аміногрупу; моно- або ді(С1n є цілим числом 0, 1, 2 або 3; та де кожний балкілоксиС1-6алкіл)аміногрупу; моно- або ді(С1атом водню у фенільному кільці, незалежно, може 6алкілтіоС1-6алкіл)аміногрупу; арил; морфолінілС1необов'язково бути заміщений галогеном, гідрок6алкіл або піперидинілС1-6алкіл; або сигрупою, С1-6алкілом, С1-6алкілокси або гідрокR2 та R3 можуть бути взяті разом для утворенсиС1-6алкілом; ня -R2-R3-, який являє собою бівалентний радикал або X та R1 можуть бути взяті разом з атомом формули -(СН2)3-, -(СН2)4-, -(СН2)5-, -(СН2)6-, вуглецю до якого X та R1 приєднані для утворення СН=СН-СН=СН-, -Z4-CH=CH-, -CH=CH-Z4-, -Z4радикалу формули (b-1), (b-2) або (b-3); 13 76726 14 CH2-CH2-CH2-, -CH2-Z4-CH2-CH2-, -СН2-СН2-Z4-СН2такі як етиніл, пропініл, бутиніл, пентиніл, гексиніл, , -СН2-СН2-СН2Z4-, -Z4-CH2-CH2-, -CH2-Z4-CH2- або 3-метилбутиніл та т.п.; циклоС3-6алкіл охоплює CH2-CH2-Z4-, де Z4 являє собою О, S, SO2 або NR11 моноциклічні алкільні кільцеві структури, такі як де R11 є воднем, С1-6алкілом, бензилом або С1циклопропіл, циклобутил, циклопентил, та циклогексил; циклоС3-12алкіл охоплює моно-, бі- або 6алкілоксикарбонілом; та де кожний бівалентний радикал є необов'язково заміщений С1-6алкілом. трициклічні алкільні кільцеві структури та є загальабо R3 та R4 може бути взяті разом для утворення ним для наприклад циклопропілу, циклобутилу, бівалентного радикалу формули циклопентилу, циклогексилу, циклогептилу, цикло-СН=СН-СН=СН- або -СН2-СН2-СН2-СН2-; октилу, норборнанілу, адамантілу. R5 являє собою водень; циклоС3-12алкіл; піпеТермін галоген є загальним для фтору, хлору, ридиніл; оксо-тієніл; тетрагідротієніл, арилС1брому та йоду. Як використовується вище та далі С1-6алкілоксиС1-6алкіл ; С1по тексту, полігалоС1-6алкіл як група або частина 6алкіл; групи визначається як моно- або полігалозаміще6алкілоксикарбонілС1-6алкіл або C1-6алкіл необов'язково заміщений радикалом C(=O)NRxRy, де Rx ний С1-6алкіл, зокрема метил з одним або більше та Ry, кожний незалежно є воднем, циклоС3атомами фтору, наприклад, дифторметил або трифторметил. У випадку коли більш ніж один 12алкілом, С2-6алкінілом або С1-6алкілом необов'язково заміщеним ціаногрупою, С1-6алкілоксигрупою, атом галогену приєднані до алкільної групи, в меС1-6алкілоксикарбонілом, фуранілом, пірролідиніжах визначення полігалоС1-6алкілу, вони можуть лом, бензилтіогрупою, піридинілом, пірролілом або бути однаковими або різними. тієнілом; Коли будь-яка перемінна, наприклад арил, Υ являє собою О або S; або Υ та R5 можуть трапляється більш ніж один раз у будь якій частибути взяті разом для утворення =Y-R5-який являє ні, кожне визначення є незалежним. собою радикал формули Коли будь-який зв'язок проведено у кільцеву -CH=N-N= (с-1); структуру, це означає, що відповідний замісник -N=N-N= (с-2); може бути приєднаний до будь якого атому згадаабо ної кільцевої структури. Це означає, наприклад, -N-CH=CH(с-3); що R1-C(=X) складова може приєднана до хіноліарил являє собою феніл або нафтіл необов'янової або хінолінонової складової у положенні 5, 6, зково заміщений одним або більше замісниками 7, 8 але також у положенні 3 або положенні 4. обраними з галогену, гідроксигрупи, С1-6алкілу, С1Для терапевтичного використання, солі сполук формули (l-А) та (І-В) є такими де протиіон є фар6алкілоксигрупи, фенілоксигрупи, нітрогрупи, аміногрупи, тіогрупи, С1-6алкілтіогрупи, галоС1-6алкілу, мацевтично прийнятним. Проте, солі кислот та полігалоС1-6алкілу, полігалоС1-6алкілоксигрупи, основ, які не фармацевтично прийнятними можуть гідроксиС1-6алкілу, С1-6алкілоксиС1-6алкілу, амітакож знайти застосування, наприклад, при пригоноС1-6алкілу, моно- або ді(С1-6алкілу)аміногрупи; туванні або очищенні фармацевтично прийнятних моно- або ді(С1-6алкіл)aміноС1-6алкілу, ціаногрупи, сполук. Усі солі, як фармацевтично прийнятні так і -CO-R12, -CO-OR13, -NR13SO2R12, -SO2-NR13R14, не фармацевтично прийнятні входять в межі даноNR13C(O)R12, -C(O)NR13R14, -SOR12, -SO2R12; де го винаходу. кожний R12, R13 та R14 незалежно являє собою С1Передбачається, що фармацевтично прийнятні адитивні солі, які було згадано вище, включають 6алкіл; циклоС3-6алкіл; феніл; феніл заміщений галогеном, гідроксигрупою, С1-6алкілом, С1терапевтично активні нетоксичні форми кислотногалоС1-6алкілом, полігалоС1адитивних солей, які здатні утворювати сполуки 6алкілоксигрупою, формули (l-А) та (І-В). Останні можуть бути зручно 6алкілом, фуранілом, тієнілом, пірролілом, імідазолілом, тіазолілом або оксазолілом; одержані шляхом обробки основної форми такими та коли R1-C(=X) складова зв'язана з іншим придатними кислотами як, наприклад, галоїдводположенням ніж 7 або 8 положення, тоді згадані 7 неві кислоти, наприклад, хлористоводнева, брота 8 положення можуть бути заміщені R15 та R16 де мистоводнева кислота і т.п. ; сірчана кислота, азоодин з них або обидва з R15 та R16 являють собою тна кислота; фосфорна кислота і т.п., або органічні С1-6алкіл, С1-6алкілоксигрупу R15 та R16 взяті разом кислоти, такі як, наприклад, оцтова, пропанова, можуть утворювати бівалентний радикал формули оксиоцтова, 2-оксипропанова, 2-оксопропанова, -СН=СН-СН=СН-. щавлева, малонова, бурштинова, малеїнова, фуПри використанні у вищенаведених визначенмарова, яблучна, винна, 2-гідрокси-1,2,3нях та далі по тексту С1-6алкіл як група або частипропантрикарбонова, метансульфонова, етансуна групи охоплює насичені вуглеводневі радикали льфонова, бензолсульфонова, 4з лінійним та розгалуженим ланцюгом, які мають метилбензолсульфонова, циклогексансульфамівід 1 до 6 атомів вуглецю такі як, наприклад, менова, 2-гідроксибензойна, 4-аміно-2тил, етил, пропіл, бутил, пентил або гексил; С2гідроксибензойна i т.п. кислоти. Навпаки, форма солі може бути перетворена шляхом обробки лу6алкеніл як група або частина групи охоплює насичені вуглеводневі радикали з лінійним та розгалугом у форму вільної основи. женим ланцюгом, які мають від 2 до 6 атомів вугСполуки формули (l-А) та (І-В), що містять килецю та мають подвійний зв'язок, такі які етеніл, слотні протони, можуть бути також перетворені в пропеніл, бутеніл, пентеніл, гексеніл, 3їх нетоксичні або адитивні форми солей металу метилбутеніл та т.п.; С2-6алкініл як група або часабо аміна шляхом обробки відповідними органічтина групи позначає вуглеводневі радикали з ліними або неорганічними основами. Відповідні оснійним та розгалуженим ланцюгом, які мають від 2 новні сольові форми включають, наприклад, амодо 6 атомів вуглецю та мають потрійний зв'язок, нієві солі, солі лужних та лужноземельних металів, 15 76726 16 наприклад, літію, натрію, калію, магнію, кальцію і Проте, згадані "А" та "В" стереоізомерні форми подібні, солі з органічними основами, наприклад, можуть бути однозначно охарактеризовані фізикобензатином, N-метил-D-глюкаміном, 2-аміно-2хімічними характеристиками такими як їх обертан(гідроксиметил)-1,3-пропандіолом, гідрабамінові ня площини обертання поляризації світла у випадсолі та солі з амінокислотами, такими, наприклад, ку коли "А" та "В" мають енантіономерну залежяк аргінін, лізин, холін і подібними. Навпаки форма ність. Спеціаліст у даній галузі здатен визначити солі може бути перетворена у форму вільної кисабсолютну конфігурацію таких сполук використолоти шляхом обробки кислотою. вуючи загальновідомі методи такі як, наприклад, Термін "адитивна сіль" також включає гідрати дифракція на рентгенівських променях. У випадку та адитивні форми розчинника, які сполуки форколи "А" та "В" є стереоізомерними сумішами, вони мули (I-А) та (І-В) здатні утворювати. Прикладами можуть бути далі розділені завдяки чому відповідні таких форм є, наприклад, гідрати, алкоголяти та перші виділені фракції позначені як "А1" та "В1" та т.п. друга як "А2" та "В2", без подальшого посилання Термін "четвертинний амін" який використовуна дійсну стереохімічну конфігурацію. ється вище, позначає солі четвертинного амонію, N-оксидні форми сполук за даним винаходом, які сполуки формули (I-А) та (І-В) здатні утворюваяк передбачається, включають сполуки формули ти за допомогою реакції між азотистою основою (I-А) та (І-В) де один або кілька атомів азоту окиссполуки формули (I-А) або (І-В) та прийнятним лені до так званого N-оксиду. четвертинним агентом, таким як, наприклад, неДеякі з сполук формули (I-А) та (І-В) можуть обов'язково заміщений алкілгалід, арилгалід або також існувати у їх таутомерній формі. Такі форми, арилалкілгалід, наприклад метилйодид або бензихоча неявно вказані у вищенаведеній формули, лйодид. Інші реактанти з добре відщеплюваними передбачаються включеними в межі даного винагрупами можуть також бути використані, такі як ходу. алкіл трифторметансульфонати, алкіл метансуУ будь-який раз при використанні далі, передльфонати, та алкіл р-толуолсульфонати. Четвербачається, що термін "сполуки формули (I-А) та (Ітинний амін позитивно заряджений азот. ФармаВ)" також включає їх N-оксидні форми, їх солі, їх цевтично прийнятні протиіони включають хлор, четвертинні аміни та їх стереохімічно ізомерні фобром, йод, трифторацетат та ацетат. Кращий прорми. Особливий інтерес викликають ті сполуки тиіон може бути введений використовуючи смоли формули (I-А) та (І-В), які є стереохімічно чистими. іонного обміну. Цікавою групою сполук є ті сполуки формули Цінним є те, що деякі з сполук формули (I-А) (I-А) та (І-В) де та (І-В) та їх N-оксиди, солі, четвертинні аміні та X являє собою О; C(R6)2 де R6 є воднем або 7 7 стереохімічно ізомерні форми можуть містити один арилом; або N-R де R є аміногрупою або гідрокабо більше центри хіральності та існують як стесигрупою; реохімічно ізомерні форми. R1 являє собою С1-6алкіл; арил; тієніл; хіноліТермін "стереохімічно ізомерні форми", у тому ніл; циклоС3-12алкіл або (циклоС3-12алкіл)С1-6алкіл, значенні, що використовувалось вище, визначає де циклоС3-12алкільна складова необов'язково моусі можливі ізомерні форми, які можуть мати споже містити подвійний зв'язок та де один атом вуглуки формул (I-А) та (І-В), та їх N-оксиди, солі, челецю у циклоС3-12алкільній складовій може бути твертинні аміни або фізіологічно функціональні заміщений атомом кисню або NR8-складовою де похідні можуть мати. Якщо не вказано інше, хімічні R8 є бензилом або С1-6алкілоксикарбонілом; де назви сполук позначають суміш усіх можливих один або більше атомів водню у С1-6алкільнійстереохімічно ізомерних форм, причому вказані складовій або у циклоС3-12алкільній-складовій несуміші містять усі діастереомери та енантіомери обов'язково можуть бути заміщені С1-6алкілом, основної молекулярної структури так же як кожна з галоС1-6алкілом, гідроксигрупою, С1окремих ізомерних форм формули (I-А) та (І-В) та 6алкілоксигрупою, арилС1-6алкілоксигрупою, галоїх N-оксиди, солі, сольвати або четвертинні аміни геном, арилом, моноабо ді(С1загалом вільні, тобто пов'язані з менш ніж 10%, С16алкілом)аміногрупою, переважно менше ніж 5%, зокрема менше ніж 2% 6алкілоксикарбоніламіногрупою, галогеном, піпета більш бажано менше ніж 1% інших ізомерів. разинілом, піридинілом, морфолінілом, тієнілом Передбачається, що стереохімічно ізомерні форми або бівалентним радикалом формули -О- або -Осполук . формули (I-А) та (І-В) включені у межі даСН2-СН2-О-; ного винаходу. Теж саме стосується проміжних або радикал формули (а-1) сполук, які описані при цьому, та використовуються для приготування кінцевих сполук формули (IА) та (І-В). Терміни цис та транс використовуються відповідно до номенклатури Chemical Abstracts. У деяких сполук формули (I-А) та (І-В) та у проміжних сполук, що використовуються при їх приготування, абсолютна стереохімічна конфігуде Z1 є одним ковалентним зв'язком, О або рація не була визначена. У цих випадках, стереоіСН2; зомерна форма яка була першою виділена познаZ2 є одним ковалентним зв'язком, О або СН2; чається як "А" та виділена другою "В", без n є цілим числом 0,1 або 2; додаткового посилання на фактичну стереохімічну та де кожний атом водню у фенільному кільці, конфігурацію. незалежно, може необов'язково бути заміщений 17 76726 18 галогеном або гідроксигрупою; або Υ та R5 можуть бути взяті разом для утвоабо X та R1 можуть бути взяті разом з атомом рення =Y-R5 - який являє собою радикал формули 1 вуглецю до якого X та R приєднані для утворення -CH=N-N= (c-1); радикалу формули (b-1), (b-2) або (b-3); або -N=N-N= (c-2); арил являє собою феніл або нафтіл необов'язково заміщений одним або більше замісниками обраними з галогену, С1-6алкілоксигрупи, фенілоксигрупи, моно- або ді(С1-6алкіл)аміногрупи та ціаногрупи; та коли R1-C(=X) складова зв'язана з іншим положенням ніж 7 або 8 положення, тоді згадані 7 та 8 положення можуть бути заміщені R15 та R16 де 2 R являє собою водень; галоген; ціаногрупу; один з них або обидва з R15 та R16 являють собою С1-6алкіл; С1-6алкілоксигрупу; С1-6алкілтіогрупу; С1С1-6алкіл або R15 та R16 взяті разом можуть утво6алкілкарбоніл; С1-6алкілоксикарбоніл; С2-6алкеніл; рювати бівалентний радикал формули -СН=СНгідроксиС2-6алкеніл; С2-6алкініл; гідроксиС2-6алкініл; СН=СН-. три(С1-6алкіл)сіланС2-6алкініл ; аміногрупу ; моноДодатково, найбільш цікава група сполук або ді(С1-6алкіл)аміногрупу; моно- або ді(С1включає ті сполуки формули (l-А) та (І-В) де X яв6алкілокси С1-6алкіл)аміногрупу; моно- або ді(С1ляє собою О; 6алкілтіоС1-6алкіл)аміногрупу; арил; арилС1-6алкіл; R1 являє собою С1-6алкіл; циклоС3-12алкіл або арилС2-6алкініл; С1-6алкілоксиС1-6алкіламіноС1(циклоС3-12алкіл)С1-6алкіл, де один або більше 6алкіл; амінокарбоніл необов'язково заміщений С1атом вуглецю у С1-6алкільній складовій або у цикалкілоксикарбонілС1-6алкілом; гетероцикл обра6 лоС3-12алкільній складовій може бути заміщений ний з тієнілу, фуранілу, тіазолілу та піперидинілу, С1-6алкілоксигрупою, арилом, гало або тієнілом; необов'язково N-заміщений морфолінілом або R2 являє собою водень; галоген; С1-6алкіл або тіоморфолінілом; аміногрупу; радикал -NH-C(=O)R9 де R9 являє собою С1R3 та R4 кожний незалежно являє собою воалкіл необов'язково заміщений циклоС3-12алкілом, 6 день або С1-6алкіл; або С1-6алкілокси, С1-6алкілоксикарбонілом, арилом, R2 та R3 можуть бути взяті разом для утворенарилоксигрупою, тієнілом, піридинілом, моно- або ня -R2-R3-, який являє собою бівалентний радикал ді(С1-6алкіл)аміногрупою, С1-6алкілтіогрупою, бенформули -Z4-CH2-CH2-CH2- або -Z4-CH2-CH2-, де зилтіогрупою, піридинілтіогрупою або піримідиніл11 11 Z4, являє собою О або NR де R є С1-6алкілом; тіогрупою; циклоС3-12алкіл; циклогексеніл; аміногта де кожний бівалентний радикал є необов'язково рупу; арилциклоС3-12алкіламіногрупу; моно- або заміщений С1-6алкілом, ді(С1-6алкіл)аміногрупу; моноабо ді(С1або R3 та R4 можуть бути взяті разом для 6алкілоксикарбонілС1-6алкіл)аміногрупу; моно- або утворення бівалентного радикалу формули -СН2ді(С1-6алкілоксикарбоніл)аміногрупу; моно- або СН2-СН2-СН2-; ді(С2-6алкеніл)аміногрупу; моно- або ді(арилС1R5 являє собою водень; 6алкіл)аміногрупу ; моно- або діариломаміногрупу; Υ являє собою О; та арилС2-6алкеніл; фуранілС2-6алкеніл; піперидиніл; арил являє собою феніл необов'язково заміпіперазиніл; індоліл; фуріл; бензофуріл; тетрагідщений галогеном; рофуріл; інденіл; адамантіл; піридиніл; піразиніл; Додатково, цікава групою сполук включає ті арил або радикал формули (а-1); сполуки формули (I-А) та (І-В) де R1-С(=Х) складо10 10 сульфонамід -NH-SO2-R де R являє собою ва зв'язана з хіноліновою або хіноліноновою склаС1-6алкіл, моно- або полігалоС1-6алкіл, арилС1довою у 6 положенні. 6алкіл або арил; Для того, щоб спростити структурне представ2 3 R та R можуть бути взяті разом для утворенлення деяких зі сполук та проміжних сполук за 2 3 ня -R -R -, який являє собою бівалентний радикал даним винаходом, у наступних процедурах пригоформули -(СН2)4-, -(СН2)5-, -Z4-CH=CH-, -Z4-CH2тування, хінолінова або хінолінонова складова CH2-CH2- або -Z4-CH2-CH2-, де Z4 являє собою О, буде при цьому представлена символом Q. 11 11 S, SO2 або NR де R є воднем, С1-6алкілом, бензилом або С1-6алкілоксикарбонілом; та де кожний бівалентний радикал є необов'язково заміщений С1-6алкілом, або R3 та R4 можуть бути взяті разом для утворення бівалентного радикалу формули СН=СН-СН=СН- або -СН2-СН2-СН2-СН2-; Сполуки формули (I-А) або (І-В), де X являє R5 являє собою водень; піперидиніл; оксособою О, згадані сполуки представлені формулою тієніл; тетрагідротієніл, арилС1-6алкіл; С1(IA/B-а), можуть бути отримані за допомогою окислення проміжної сполуки формули (II) у присутнос6алкілоксикарбонілС1-6алкіл або С1-6алкіл необов'язково заміщений радикалом C(=O)NRxRy, де Rx ті прийнятного окислювального агенту, такого як та Ry, кожний незалежно є воднем, циклоС3перманганат калію, та прийнятного каталізатору фазового переносу, такого як тріс(діокса-3,612алкілом, С2-6алкінілом або С1-6алкілом необов'язково заміщеним ціаногрупою, С1-6алкілоксигрупою гептеніл)амін, у прийнятному реакційно-інертному або С1-6алкілоксикарбонілом; розчиннику, такому як наприклад дихлорметан. Υ являє собою О або S; 19 76726 20 галузі трансформацій. Сполуки формули (I-А) де R2 є атомом галогену, таким як хлор, можуть бути перетворені у сполуку формули (I-А), де R2 є іншім атомом галогену, таким як фтор або йод, за допомогою реакції з прийнятним галогенувальним агентом, таким як наприклад фторид калію або йодид натрію, у присутності прийнятного реакційно-інертного розчинСполуки формули (ІА, В-а) можуть також бути нику, наприклад диметил сульфоксиду або ацетоодержані за допомогою реакції проміжної сполуки нітрилу та необов'язково у присутності ацетил формули (III) з проміжною сполукою формули (IV), хлориду. де W1 являє собою атом галогену, наприклад Сполуки формули (I-А), де R2 є прийнятною вібром, у присутності бутил літію та прийнятного дхідною групою, такого як атом галогену, наприреакційно-інертного розчиннику, такого як наприклад хлор, йод, згадана відхідна група представклад тетрагідрофуран. лена by W2 та згадані сполуки представлені формулою (І-А-2), можуть бути перетворені у сполуку формули (I-А) де R2 є ціаногрупою, згадана сполука представлена формулою (І-А-3), за допомогою реакції з прийнятним агентом, що вводить ціаногрупу, таким як наприклад триметилсиланкарбонітрил, у присутності прийнятної основи такої як Ν,Ν-диетилетанамін та прийнятного каталізатоАльтернативно, сполуки формули (ІА/В-а) мору, такого як наприклад тетражуть також бути одержані за допомогою реакції кіс(трифенілфосфін)паладій. проміжної сполуки формули (V) з проміжною споСполуки формули (І-А-2) також можуть бути лукою формули (IV) у присутності бутил літію та перетворені у сполуку формули (І-А-4) за допомоприйнятного реакційно-інертному розчиннику, тагою реакції з С2-6алкінілтри(С1-6алкіл)силаном у кого як наприклад тетрагідрофуран. присутності Cul, прийнятної основи, такої як наприклад Ν,Ν-диетилетанаміну, та прийнятного каталізатору, такого як наприклад тетракіс(трифенілфосфін)паладій. Сполуки формули (ІА-4) можуть навпаки бути перетворені у сполуку формули (І-А-5) за допомогою реакції з фторидом калію у присутності прийнятної кислоти такої як оцтова кислота, або за допомогою реакції з прийнСполуки формули (ІA/B-а), де R1 замісник зв'яятною основою, такого як гідроксид калію, у присузаний з карбонільною складовою через атом кис1 1a тності прийнятного реакційно-інертного розчинниню, згаданий R замісник представлений O-R та ку, такого як спирт, наприклад метанол і т.п. згадані сполуки формулою (ІA/B-а-1), можуть бути Сполуки формули (І-А-2) можуть також бути отримані реакцією проміжної сполуки формули (VI) перетворені у сполуку формули (І-А-6) за допомоз проміжною сполукою формули (VII) у присутності гою реакції з проміжною сполукою формули (IX) у прийнятної кислоти, такої як сірчана кислота. присутності Cul, прийнятної основи, такої як наприклад Ν,Ν-диетилетанамін, та прийнятного каталізатору такого як тетракіс(трифенілфосфін)паладій. Сполуки формули (І-А-2) можуть також бути перетворені у сполука де R2 є С1-6алкілом, згадана сполука представлена формулою (І-А-8), у присутСполуки формули (I-А), де R2 являє собою меності прийнятного алкіл увал ьного агенту, такого тилкарбоніл, згадані сполуки представлені формуяк наприклад Sn(С1-6алкіл)4, або у сполуку де R2 є лою (І-А-1), можуть бути отримані реакцією проміС2-6алкенілом, згадана сполука представлена фожної сполуки формули (VIII) у присутності рмулою (І-А-9) у присутності прийнятного алкеніприйнятної кислоти, такої як соляна кислота, та лувального агенту, такого як наприклад Sn(С2прийнятного реакційно-інертного розчиннику, тако6алкеніл)(С1-6алкілом)3, обидві реакції проводять у го як наприклад тетрагідрофуран. присутності прийнятного каталізатору, такого як наприклад тетракіс(трифенілфосфін)паладій та реакційно-інертного розчиннику, такого як наприклад толуол або діоксан. Сполуки формули (І-А-2) можуть також бути перетворені у сполуку формули (І-А-7) де Ζ являє собою О або S, за допомогою реакції з проміжною сполукою формули (X) необов'язково у присутності прийнятної основи такої як двокалієвий карбонат та реакційно-інертного розчиннику, такого як Ν,Νдиметил формафід. Сполуки формули (І) можуть також бути переСполуки формули (І-А-2) можуть також бути творені одна у іншу за допомогою відомих у цій 21 76726 22 перетворені у сполуку формули (l-А), де R2 є С16алкілоксикарбонілом, згадана сполука представлена формулою (I-А-10)та сполуку формули (l-А), де R2 є воднем, згадана сполука представлена формулою (І-А-11), за допомогою реакції з а прийнятним спиртом формули С1-6алкілОН та СО у присутності прийнятного каталізатору, такого як наприклад паладій (ІІ)ацетат, трифенілфосфін, прийнятної основи, такої як двокалієвий карбонат Сполуки формули (І-А-2) можуть також бути та реакційно-інертного розчиннику, такого як Ν,Νперетворені у сполуку формули (І-В), де Υ та R5 диметилформафід. взяті разом для утворення радикалу формули (b-1) Сполуки формули (І-А-11) можуть також бути або (b-2), згадана сполука представлена формуодержані за допомогою реакції сполуки формули лою (І-В-1) або (І-В-2), за допомогою реакції з гід(І-А-2) з Zn у присутності прийнятної кислоти такої разинкарбоксальдегідом або азидом натрію у прияк оцтова кислота. йнятному реакційно-інертному розчиннику, такому Сполуки формули (І-А-2) можуть також бути як спирт, наприклад бутанол, або Ν,Νперетворені у сполуку формули (l-А), де R2 є аміно диметилформафід. карбонілом заміщеним С1-6алкілоксикарбонілС16алкілом, згадана сполука представлена формулою (І-А-12), за допомогою реакції з проміжною сполукою формули Н2N-С1-6алкіл-С(=О)-О-С16алкіл у присутності CO, прийнятного каталізатору такого як тетракіс(трифенілфосфін)паладій, прийнятної основи, такої як наприклад Ν,Νдиетилетанамін, та прийнятного реакційноінертного розчиннику, такого як наприклад толуол. Сполуки формули (І-А-11) можуть бути перетворені у відповідний N-оксид, представлений формулою (І-А-14), за допомогою реакції з прийнятним пероксидом, таким як 3-хлорбензолкарбопероксойна кислота, у прийнятному реакційно-інертному розчиннику, такому як наприклад метилен хлорид, згадана сполука формули (ІА-14) може надалі бути перетворена у сполуку формули (І-В), де R5e воднем, згадана сполука представлена формулою (І-В-3), за допомогою реакції з 4-метил-бензол сульфоніл хлоридом у присутності прийнятної основи, такої як наприклад, двокалієвий карбонат та прийнятного реакційно-інертного розчиннику, такого як наприклад метилен хлорид. Сполуки формули (І-А-2) можуть також бути перетворені у сполуку формули (I-А) де R2 є арилом або гетероциклом, що обрано з групи, яка описана у визначенні R2 вище, згадана R2 представлена за допомогою R2a та згадана сполука формулою (І-А-13), за допомогою реакції з проміжною сполукою формули (XI), (XII) або (XIII) у присутності прийнятного каталізатору такого як, наприклад, тетракіс(трифенілфосфін)паладій та прийнятного реакційно-інертного розчиннику, такого як наприклад діоксан. Сполуки формули (І-В-3) можуть також бути одержані з сполуки формули (Θ-Α), де R2 є С16алкілоксигрупою, згадана сполука представлена 23 76726 формулою (І-А-15), за допомогою реакції з прийнятною кислотою, такою як соляна кислота, у присутності прийнятного реакційно-інертного розчиннику, такого як наприклад тетрагідрофуран. Сполуки формули (І-В-3) можуть бути перетворені у сполукуформули (І-В), де R5 являє собою С1-6алкілом, згадана сполука представлена формулою (І-В-4), за допомогою реакції з прийнятним алкілувальним агентом, таким як, наприклад, проміжна сполука формули (XIV), де W3 являє собою прийнятну відхідну групу, таку як атом галогену, наприклад, йод, у присутності терт-бутоксиду калію та у присутності прийнятного реакційноінертного розчиннику, такого як наприклад тетрагідрофуран. Сполуки формули (І-В-3) можуть також бути перетворені у сполука формули (І-В), де R5 є С16алкілоксикарбонілС1-6алкіл або арилС1-6алкілом, згаданий R5 представлений за допомогою R5a та згадана сполука представлена формулою (І-В-5), за допомогою реакції з проміжною сполукою формули (XV), де W4 являє собою прийнятну відхідну групу, таку як атом галогену, наприклад бром, хлор і т.п., у присутності прийнятної основи, такої як наприклад гідрид натрію та прийнятного реакційно-інертного розчиннику, такого як наприклад Ν,Ν-диметилформафід. 24 Сполуки формули (І-А-2) можуть також бути перетворені у сполуку формули (І-В), де R5 є воднем та Υ є S, згадана сполука представлена формулою (І-В-6), за допомогою реакції з H2N-C(=S)NH2 у присутності прийнятної основи, такої як гідроксид калію, та прийнятного реакційно-інертного розчиннику, такого як спирт, наприклад етанол, або води. Сполуки формули (І-В-6) можуть надалі бути перетворені у сполуку формули (l-А), де R2 є С1-6алкілтіо, згадана сполука представлена формулою (І-А-16), за допомогою реакції з прийнятним С1-6алкілгалідом, таким як наприклад С16алкілйодид, у присутності прийнятної основи, такої як двокалієвий карбонат, та прийнятного розчиннику, такого як наприклад ацетон. Сполуки формули (ІA/B-а) можуть бути перетворені у сполуки формули (l-А) або (І-В), де X є NR7, згадана сполука представлена формулою (ІA/Bb), за допомогою реакції з проміжною сполукою формули (XVI), необов'язково у присутності прийнятної основи, такої як наприклад Ν,Νдиетилетанамін, та у присутності прийнятного реакційно-інертного розчиннику, такого як спирт, наприклад етанол. Як вже вказано у процедурах приготування сполук формули (І-А-13), описаних вище, сполуки формули (І) можуть також бути перетворені у відповідну N-оксидну форму у відповідності з відомими у даній галузі процедурами перетворення тривалентного азоту у його N-оксидну форму. Згадана реакція N-окислення може, загалом, здійснюватись шляхом реакції вихідного матеріалу формули (І) з відповідним органічним або неорганічним пероксидом. Відповідні неорганічні пероксиди включають, наприклад, пероксид водню, пероксиди 25 76726 26 лужних або лужноземельних металів, наприклад, формули (XXI) з проміжною сполукою формули пероксид натрію, пероксид калію; відповідні орга(XXII) у присутності 3-нітро-бензол сульфонат нанічні пероксиди можуть включати пероксикислоти, трію, прийнятної кислоти, такої як сірчана кислота, такі як, наприклад, бензолкарбопероксонова киста прийнятного спирту, наприклад метанолу, еталота або галозаміщена бензолкарбопероксонова нолу, пропанолу, бутанолу і т.п. кислота, наприклад, 3хлорбензолкарбопероксонова кислота, пероксиалканові кислоти, наприклад, пероксиоцтова кислота, алкілгідропероксиди, наприклад, трет-бутил гідропероксид. Придатними розчинниками є, наприклад, вода, нижчі алканоли, наприклад, етанол Альтернативно, проміжні сполуки формули (II) та їм подібні, вуглеводні, наприклад, толуол, кетоможуть також бути одержані за допомогою реакції ни, наприклад, 2-бутанон, галогеновані вуглеводні, проміжної сполуки формули (XXIII) з проміжною наприклад, діхлорметан, та суміш таких розчиннисполукою формули (XXIV), де W6 є прийнятною ків. відхідною групою, такого як атом галогену, наприДеякі з проміжних сполук та вихідні матеріали, клад бром, хлор і т.п., у присутності прийнятного що використовуються у вищенаведених реакціях є агенту, такого як бутил літій та прийнятного реаккомерційно доступними, або можуть бути синтезоційно-інертного розчиннику, такого як тетрагідровані відповідно до процедур вже описаних у літефуран. ратурі. Проміжні сполуки формули (II) можуть бути одержані за допомогою реакції проміжної сполуки формули (XVII) з проміжною сполукою формули (XVIII), де W5 являє собою прийнятну відхідну групу таку як атом галогену, наприклад хлор, бром і т.п., у присутності магнію, диетилефіру та прийнятного реакційно-інертного розчиннику, такого як Проміжні сполуки формули (XXIII) можуть бути диетилефір. отримані за допомогою окислення проміжної сполуки формули (XXV) використовуючи окислення за Моффатом Фіцнером або Сверном (диметилсульфоксидні продукти приєднання з дегідрататійними агентами наприклад DCC, Ас2О, SO3, P4O10, СОСІ2 або СІ-СО-СОСІ) у інертному розчиннику такому як метилен хлорид. Проміжні сполуки формули (XVII) можуть бути одержані за допомогою окислення проміжної сполуки формули (XIX) у присутності прийнятного окислювального агенту, такого як МnО2, та прийнятного реакційно-інертного розчиннику, такого як метилен хлорид. Проміжні сполуки формули (XIX) можуть бути отримані за допомогою відновлення проміжної сполуки формули (XX) у присутності прийнятного відновлювальний агенту такого як алюмогідрид літію, та прийнятного реакційно-інертного розчиннику, такого як тетрагідрофуран. Проміжні сполуки формули (XX), де Q являє собою хінолінову складову необов'язково заміщену у 3 положенні С1-6алкілом та де карбонільна складова розташована у 6 положенні, згадані проміжні сполуки представлені формулою (XX-а), можуть бути отримані реакцією проміжної сполуки Проміжні сполуки формули (XXV) можуть бути отримані за допомогою відновлення проміжна сполука формули (XXVI) у присутності прийнятного відновлювального агенту, такого як наприклад алюмогідрид літію та прийнятного реакційноінертного розчиннику, такого як бензол. Проміжні сполуки формули (XXVI) можуть бути отримані з проміжної сполуки формули (XXVII) за допомогою етеріфікація у присутності прийнятного спирту, такого як метанол, етанол, пропанол, бутанол і т.п., та прийнятної кислоти, такої як сірчана кислота. 27 76726 28 Проміжні сполуки формули (XXVII), де R1 явΝ,Ν-диетилетанамін, та прийнятного реакційноляє собою радикал формули (а-1) з Z1 яке є О, Z2 інертного розчиннику, такого як метилен хлорид. яке є СН2 та n яке є 1, згадані проміжні сполуки представлені формулою (XXVII-a), можуть бути отримані за допомогою відновлення проміжної сполуки формули (XXVII) у присутності прийнятного відновлювального агенту такого як водень, та прийнятного каталізатору, такого як паладій вугіллі, та прийнятного кислоти такої як оцтова кислота. Коли R1 проміжної сполуки (XXVII) являє собою Проміжні сполуки формули (IV-a) можуть бути необов'язково заміщену фенільну складову, вона перетворені у проміжну сполуку формули (IV-c) за може також бути перетворена у необов'язково допомогою реакції з проміжною сполукою формузаміщену циклогексильну складову за допомогою ли (XXXII) у присутності прийнятного реакційновідновлення у присутності прийнятного відновлюінертного розчиннику, такого як спирт, наприклад вального агенту такого як родій на АІ2О3, та приметанол і т.п. йнятного реакційно-інертного розчиннику, такого як тетрагідрофуран. Проміжні сполуки формули (IV), де Q являє собою хінолінову складову заміщену у 2 положенні галогеном, наприклад хлором, згадані проміжні сполуки представлені формулою (IV-a), можуть бути отримані реакцією проміжної сполуки формули (IV), де Q являє собою хінолінонову складову з R5 яка є воднем, згадана проміжна сполука представлена формулою (IV-b), у присутності РОСl3. Проміжні сполуки формули (IV-a) можуть також бути перетворені у проміжну сполуку формули (IV-d-1) за допомогою реакції з прийнятним аміном формули (ХХХІІІ-а), де Z3 та Z4 кожний незалежно являє собою водень, С1-6алкіл, С1-6алкілоксиС16алкіл, С1-6алкілтіоС1-6алкіл або у проміжну сполуку формули (IV-d-2) за допомогою реакції з прийнятним аміном формули (ХХХІІІ-b), де Z3 та Z4 взяті разом для утворення гетероциклу як визначено вище у визначенні R2 при умові, що гетероцикл включає принаймні один атом азоту, у присутності прийнятної основи, такої як наприклад двокалієвий карбонат, та реакційно-інертного розчиннику, такого як Ν,Ν-диметилформафід. Проміжні сполуки формули (IV-a), де R4 є воднем, згадані проміжні сполуки представлені формулою (IV-a-1), можуть також бути одержані за допомогою реакції проміжної сполуки формули (XXIX) з РОСl3 у присутності Ν,Νдиметилформафіду (формілірування за Вілсмейер-Хааком, що супроводжується циклізацією). Проміжні сполуки формули (XXIX) можуть бути одержані за допомогою реакцією проміжної сполуки формули (XXX) з проміжною сполукою формули (XXXI), де W7 являє собою прийнятну відхідну групу, таку як атом галогену, наприклад хлор, у присутності прийнятної основи, такої як наприклад Проміжні сполуки формули (IV-a), де R3 являє собою СН2-СН2-СН2-СІ, згадані проміжні сполуки представлені формулою (IV-a-2), можуть також бути перетворені у проміжну сполуку формули (IV), де R2 та R3 взяті разом для утворення бівалентного радикалу формули -О-СН2-СН2-СН2-, згадана проміжна сполука представлена формулою (IV-e-1), за допомогою реакції з прийнятної кислотою, такою як соляна кислота і т.п. Проміжні сполуки формули (IV-a-2) можуть також бути перетво 29 76726 рені у проміжну сполуку формули (IV), де R2 та R3 взяті разом для утворення бівалентного радикалу формули -S-CH2-CH2-CH2-, згадана проміжна сполука представлена формулою (IV-e-2), за допомогою реакції з H2N-C(=S)-NH2 у присутності прийнятного реакційно-інертного розчиннику, такого як спирт, наприклад етанол. Проміжні сполуки формули (V) можуть бути одержані за допомогою реакції проміжної сполуки формули (XXVII) з проміжною сполукою формули СНз-NH-O-СН3 у присутності 1,1'карбонілдіімідазолу та прийнятного реакційноінертного розчиннику, такого як метиленхлорид. Проміжні сполуки формули (VII), де Q являє собою хінолінову складову, зокрема хінолінова складова де R2 є етилом, R3 є метилом та R4 є воднем, та карбоксильна складова є розташована у 6 положенні, згадані проміжні сполуки представлені формулою (Vll-a), можуть бути отримані за допомогою реакції проміжної сполуки формули (XXXIV) у присутності прийнятного альдегіду, такого як СН3-СН2-СН(=О), (CH2O)n, ZnCl2, FeCl3 та прийнятного реакційно-інертного розчиннику, такого як спирт, наприклад етанол. Проміжні сполуки формули (VIII) можуть бути отримані реакцією проміжної сполуки формули (XXXV) з проміжною сполукою формули (XXXVI) у присутності прийнятного каталізатору, такого як наприклад тетракіс(трифенілфосфін)паладій та прийнятного реакційно-інертного розчиннику, такого як, наприклад, діоксан. 30 Крім того деякі інші способи отримання можуть бути винайдені, деякі з них описані далі у цій заявці разом з Прикладами. Чисті стереохімічно ізомерні форми сполук та проміжних сполук за даним винаходом можуть бути отримані за допомогою застосування відомих у даній галузі способів. Діастереомери можуть бути розділені за допомогою фізичних методів, таких як селективна кристалізація або хроматографічні методи, наприклад, рідинною хроматографією з використанням хіральної стаціонарної фази. Енантіомери можуть бути відділенні один від одного за допомогою селективної кристалізації їх діастереомерних солей з оптично активними кислотами. Альтернативно, енентіомери можуть бути виділені за допомогою хроматографічних методів з використанням хіральних стаціонарних фаз. Згадані чисті стереоізомерні форми можуть також бути отримані з відповідних чистих стереоізомерних форм відповідних вихідних матеріалів, при умові, що реакція проходить стереоселективно або стереоспецифічно. Бажано, якщо специфічний стереоізомер є бажаним, щоб згадана сполука була синтезована за допомогою стереоселективних або стерео специфічних способів приготування. Ці способи будуть переважно використовувати хірально чисті вихідні матеріали. Стереоізомери і форми сполук формули (І) безперечно належать до обсягу патентних домагань даного винаходу. Стереоізомер сполуки формули (l-А) або (І-В) такого, як цис-форма, може бути перетворений у іншій стереоізомер такий як відповідна трансформа реакцією сполуки з прийнятною кислотою, такою як соляна кислота, у присутності прийнятного реакційно-інертного розчиннику, такого як наприклад тетрагідрофуран. Сполуки формули (l-А) та (І-В), їх N-оксиди, фармацевтично прийнятні адитивні солі, четвертинні аміни та стереохімічно ізомерні форми показують mGluR антагоністичну активність, більш особливо Група І mGluR антагоністичну активність. Група І mGluR яка специфічно антагонізується за допомогою даної сполуки є mGluRL mGluRI антагоністична активність сполук за даним винаходом може бути показана у Сигнальній трансдукції на кодованих mGluRI пацюків у тесті СНО клітин та Cold allodynia тесті у пацюків з зшиванням Беннетта, як описано надалі. Дякуючи mGluR антагоністичній активності, зокрема їх Групи І mGluR антагоністичній активності, та особливо, їх mGluRI антагоністичній активності, сполуки формули (l-А) або (І-В), їх N-оксиди, фармацевтично прийнятні адитивні солі, четвертинні аміни та стереохімічно ізомерні форми є корисними при лікуванні або запобіганні викликаних глутаматом хвороб центральної нервової системи. Хвороби, у яких була показана роль глутамата, включають морфінізм або абстиненцію (залеж 31 76726 32 ність, опіойдну толерантність, опіойдну абстиненпри приготуванні композицій або дозованих форм, цію), гіпоксичні, аноксичні та ішемічні ураження будь-які з звичайних фармацевтичних середовищ (ішемічний інсульт, зупинку серця), біль (невропаможуть бути застосовані, такі як, наприклад, вода, тичний біль, біль викликаний запаленням, гіпералгликолі, олії, спирти і т.п. у випадку оральних рідгезія), гіпоглікемію, хвороби пов'язані з неврональких препаратів таких як суспензії, сиропи, емульсії, ним пошкодженням, травмою головного мозку, еліксири та розчини: або тверді носії такі як крохтравмою голови, пошкодженням спинного мозку, малі, цукор, каолін, лубриканти, зв'язуючи речовиміелопатію, деменцію, занепокоєння, шизофренію, ни, дизінтегранти і т.п. у випадку порошків, пігулок, депресію, послаблену когнітивну здатність, амнекапсул та таблеток. Завдяки їх легкому введенню, зію, біполярні розлади, поведінкові розлади, хвотаблетки та капсули є більш бажаними одиничниробу Альцгеймера, мультиінфарктну деменцію, ми дозованими формами, у випадку яких тверді змішану (Альцгеймера та мультиінфарктна) демефармацевтичні носії зазвичай застосовуються. нції, хворобу Леві, делирій або сплутаність, хвороДля перентеральних композицій, носій буде звибу Паркінсона, хворобу Хантингтона, синдром Дачайно включати стерильну воду, принаймні велику уна, епілепсію, старіння, боковий аміотрофічний частину, відносно інших інгредієнтів, наприклад, склероз, розсіяний склероз, СНІД (синдром набудля того, щоб забезпечити розчинність, може бути того імунодефіцита ) та СНІД-асоційований комвключено. Ін'єкційні розчини, наприклад, можуть плекс (СПК). бути отримані, у цьому випадку носій включає соЗавдяки корисності сполук формули (l-А) та (Іляний розчин, розчин глюкози або суміш сольовоВ), забезпечується спосіб лікування теплокровних го та глюкозного розчинів. Ін'єкційні суспензії мотварин, включаючи людину, які потерпають від жуть також бути отримані, у цьому випадку можуть хвороб центральної нервової системи викликаних бути використані прийнятні рідкі носії, суспендуваглутаматом. Згаданий спосіб включає введення, льні агенти і т.п. Також включаються тверді форми бажано пероральне введення, ефективної кількоспрепаратів, які, як передбачається, перетворюють, ті сполуки формули (Θ-Α) або (І-В), її N-оксидної за короткий проміжок часу до використання, на форми, фармацевтично прийнятної адитивної сорідкі форми препаратів. Як прийнятні композиції лі, четвертинного аміну або можливих стереоізодля місцевого застосування можуть бути згадані мерних форм, теплокровним тваринам, включаюусі композиції, що звичайно застосовують для місчи людину. цевого введення лікарських засобів наприклад Завдяки вищенаведеним фармакологічним кремів, гелю, пов'язок, шампунів, настойок, мазей, властивостям, сполуки формули (l-А) та (І-В) або притирань, бальзамів, порошків і т.п. У композицібудь-які їх субгрупи, їх N-оксиди, фармацевтично ях прийнятних для підшкірного введення, носій прийнятні адитивні солі, четвертинні аміни та стенеобов'язково включає речовину, що сприяє прореохімічно ізомерні форми, можуть бути викорисникненню та/або прийнятний зволожуючий агент, тані як лікарські засоби. Зокрема, забезпечується необов'язково поєднаний з прийнятним добавками використання сполуки формули (l-А) та (І-В) у вибудь-якого походження у незначних пропорціях, ці робництві медичного засобу для лікування або добавки не спричиняють значну небезпечну дію на запобігання хвороб центральної нервової системи шкіру. Згадані добавки можуть сприяти введенню викликаних глутаматом. Більш особливо, сполуки до шкіри та/або може допомагати приготуванню за даним винаходом можуть бути використані як бажаних композицій. Ці композиції можуть бути нейропротективні засоби, анальгетикі або проти введені різноманітними шляхами, наприклад, як судомні засоби. трансдермальні пластири, як намазування, як приДаний винахід також забезпечує композиції тирання. для лікування або запобігання хвороб центральної Особливо зручно виготовляти фармацевтичні нервової системи викликаних глутаматом, які композиції за винаходом у дозованих лікарських включають терапевтично ефективну кількість споформах для простоти введення та постійності доз. луки формули (l-А) або (І-В) та фармацевтично "Дозована лікарська форма" у тому значенні, що прийнятний носій або розріджувач. використовується тут, стосується фізично дискреТаким чином, сполуки за даним винаходом тних одиниць, придатних для використання як раабо будь-які підгрупи можуть бути використані у зові дози, причому кожна одиниця містить поперерізноманітних фармацевтичних формах, залежно дньо визначену кількість активного інгредієнта, від цілей введення. Як композиції можуть бути розраховану на те, щоб викликати бажаний теравказані усі композиції, що звичайно застосовують певтичний ефект, у поєднанні з потрібним фармадля лікарських засобів, що вводяться систематичцевтичним носієм. Прикладами таких дозованих но. Для приготування фармацевтичних композицій лікарських форм є таблетки (включаючи таблетки за даним винаходом, терапевтично ефективна з надрізом чи таблетки з покриттям), капсули, пікількість окремих сполук, у формі основи або солі, люлі, порошки у пакетиках, облатки, розчини чи як активний інгредієнт поєднують у ретельно песуспензії для ін'єкцій, доза у вигляді повної чайної ремішаній суміші з фармацевтично прийнятним ложки, доза у вигляді повної столової ложки і т.п., носієм, цей носій може мати велику різноманітта упаковки з кратними дозами. ність форм, залежно від форми препарату, бажаТерапевтично ефективна доза або частота ної для введення. Ці фармацевтичні композиції введення залежить від окремої сполуки формули бажано виготовляють у вигляді одиничних дозова(l-А) або (І-В), що використовується, конкретного них форм прийнятних, бажано, для введення пестану, що лікується, серйозності стану, що лікуєтьрорально, ректально, місцевого застосування, ся, віку, ваги, статі, наповненості або сталості стапідшкірної або парентеральної ін'єкції. Наприклад, ну, та загального фізичного стану конкретного па 33 76726 34 цієнта так само, як може бути застосовано інше екстрагували СН2СІ2. Органічний шар виділили, лікування особи, як добре відомо спеціалісту у промили концентрованим розчином NH4OH та воданій галузі. да, висушили (MgSO4), відфільтрували та розчинБільш того, очевидно, що згадана терапевтичник випаровували. Залишок (60г) кристалізували з но ефективна доза або ефективна денна доза модиетилефіру. Осад відфільтрували та висушили. же бути зменшена або підвищена залежно від реЗалишок (35г, 63 %) помістили у СН2СІ2. Органічакції суб'єкта, що лікується та/або залежно від ний шар виділили, промили а 10% К2СО3 розчиоцінки медичного описання сполуки за даним вином, промили водою, висушили (MgSO4), відфільнаходом. Можу бути прийнятно вводити необхідну трували та розчинник випаровували. Вихід: 30г дозу як дві, три, чотири або більше субдоз через проміжної сполуки (3) (54%). прийнятні інтервали протягом дня. Згадані субдози Приклад А4 можуть бути складені як одиничні дозовані форми. Приготування Наступні приклади показані для ілюстрації даного винаходу. Експериментальна частина Надалі, "ДМФ" позначає Ν,Νдиметилформамід, "ДІПЕ" позначає діізопропіловий ефір, "ДМСО" позначає диметилсульфоксид, Суміш 6-бром-2(1Н)-хінолінону (0,089моль) у "ВНТ" позначає 2,6-біс(1,1-диметилетил)-4РОСІ3 (55мл) перемішували при 60°С протягом метилфенол, та "ТГФ" позначає тетрагідрофуран. ночі, потім при температурі 100°С протягом 3 гоПриготування проміжних сполук дин та розчинник випаровували. Залишок помістиПриклад А1 ли у СН2СІ2, вилили у льодяну воду, перетворили Приготування у основу за допомогою концентрованої ΝΗ4ΟΗ, відфільтрували на целіті та екстрагували СН2СІ2. Органічний шар виділили, висушили (MgSO4), відфільтрували та розчинник випаровували. Вихід: 14,5г проміжної сполуки (4) (67%). Приклад А5 a) Приготування Суміш 4-(1-метилетокси)бензойної кислоти (0,083моль) та Rh/AI2O3 5% (10г) у ТГФ (220мл) гідрогенізували при температурі 50°С (під тиском Н2 у 3бар) протягом 1 ночі. Суміш відфільтрували на целіті, промили ТГФ та випаровували. Вихід: 16г проміжної сполуки 1 (100%). ДМФ (37мл) додавали по краплях при темпеПриклад А2 ратурі 10°С під потоком N2 до РОСl3 (108мл). Після Приготування 2-етил-3-метил-6закінчення додавання, суміші дозволили нагрітися хінолінкарбоксилової кислоти (проміжна сполука 2) до кімнатної температури. N-(4Суміш 4-амінобензойної кислоти (0,299моль) у бромфеніл)бутанаміду (0,33моль) було додано по етанолі (250мл) перемішували при кімнатній темпорціях. Суміш перемішували при 85°С протягом пературі. Додали ZnCI2 (0,0367моль) та (СН2О)n ночі, потім дозволили охолонути до кімнатної тем(10г). FeCI3·6H2O (0,5моль) було додано по порціях ператури та вилили на лід (екзотермічна реакція). та температуру підвищували до 60-65°С. ПропаОсад відфільтрували, промили невеликою кількіснал (30мл) додавали по краплях більше 2 годиннотю води та висушили (вакуум). Залишок промили го періоду. Суміш нагрівали зі зворотнім холодиЕtOАс/діетилового ефіру ом та висушили. Вихід: льником протягом 2 годин та витримували при 44,2г проміжної сполуки (5) (50%). кімнатній температурі протягом 12 годин. Суміш b) Приготування вилили у воду та відфільтрували крізь целіт. Фільтрат було підкислено до рН=7 за допомогою НСІ 6N та суміш випаровували до сухості. Залишок використали без подальшого очищення. Вихід: 56,1г 2-етил-3-метил-6-хінолінкарбоксилової кислоти (проміжна сполука 2). Приклад A3 Суміш проміжної сполуки (5) (0,162моль) у меПриготування танолі (600мл), та розчин метанольної повареної Пентаноіл хлорид (0,2784моль) додавали при температурі 5°С до суміші 4-бромбензенамін (0,232моль) та Ν,Ν-диетилетанамін (0,2784моль) у СН2СІ2 (400мл). Суміш перемішували при кімнатній температурі протягом ночі, вилили у воду та солі у метанолі при 35% (154мл) перемішували та нагрівали зі зворотнім холодильником протягом ночі. Суміш вилили на лід. Осад відфільтрували, промили невеликою кількістю води та помістили у СН2СІ2. Додали К2СО3 10% та суміш екстрагували СН2СІ2. Органічний шар виділили, промили водою, висушили (MgSO4), відфільтрували та розчинник випаровували. Вихід: 31,9г проміжної сполуки (6) (74%). 35 76726 36 дженого (-60°С; 2-пропанон/СО2 ванна) суміші етандиоіл діхлориду (0,1моль) у СН2СІ2 (350мл) додавали сульфінілбіс[метан] (30мл) протягом 10 хвилин. Після перемішування протягом 10 хвилин, суміш проміжної сполуки 10 у СН2СІ2 (90мл) додавали протягом 5 хвилин. Після перемішування протягом 15 хвилин, додали Ν,Ν-диетилетанаміну (125мл). Потім суміш нагріли до кімнатної температури, потім вилили у воду. Продукт екстрагували 1,1'-карбонілбіс-1Н-імідазол (0,074моль) додаСН2СІ2. Органічний шар промили водою, НСІ (1М), вали по порціях до суміші 4водою, NaHCO3 (10%) та знову водою, висушили метоксициклогексанкарбоксилової кислоти та випаровували. Залишок розчинили у діетилово(0,063моль) у СН2СІ2 (200мл). Суміш перемішуваго ефіру і, промили водою, висушили, відфільтрули при кімнатній температурі протягом 1 години. вали та випаровували. Залишок очистили за доПотім додали N-метоксиметанаміну (0,074моль). помогою колонкової хроматографії на силікагелі Суміш перемішували при кімнатній температурі (елюент: СНСІ3). Бажану фракцію зібрали та елюпротягом ночі, вилили у Н2О та екстрагували ент випаровували. Вихід: 21,6г 6-фтор-3,4-дигідроСН2СІ2. Органічний шар виділили, промили кілька 2Н-1-бензопіран-2-карбоксальдегід (проміжна споразів Н2О, висушили (MgSO4), відфільтрували та лука 11). розчинник випаровували. Вихід: 12,6г проміжної e) Приготування сполуки 7. Приклад А7 a) Суміш 6-фтор-4-оксо-4Н-1-бензопіран-2карбоксилової кислоти (0,30моль) у оцтовій кислоті (400мл ) гідрогенізували за допомогою Pd/C (3г) як каталізатором. Після поглинення Н2 (3 еквівалента), каталізатор відфільтрували. Фільтрат виnБутиллітій 1,6Μ (0,056моль) додавали повіпаровували. Залишок перемішували у петролейльно при температурі -70°С до розчину проміжної ному ефірі. Осад відфільтрували та висушили сполуки (5) (0,046моль) у ТГФ (100мл). Суміш пе(вакуум; 70°С). Після рекристалізації ремішували при -70°С протягом 30 хвилин. ПовіСНСІ3/СН3ОН, осад відфільтрували та висушили льно додавали суспензію проміжної сполуки 11 (вакуум; 80°С та глибокий вакуум; 85°С). Вихід: (0,056моль) у ТГФ (100мл). Суміш перемішували 8,8г 6-фтор-3,4-дигідро-2Н-1-бензопіран-2при -70°С протягом 1 години, потім довели до кімкарбоксилової кислоти (проміжна сполука 8) натної температури, вилили у Н2О та екстрагували (15,0%). ЕtOАс. Органічний шар виділили, висушили b) Суміш проміжної сполуки (8) (0,255моль) у (MgSO4), відфільтрували та розчинник випаровуетанолі (400мл ) та H2SO4 (5мл) перемішували та вали. Залишок (21 г) очистили за допомогою колонагрівали зі зворотнім холодильником протягом 8 нкової хроматографії на силікагелі (елюент: циклогодин. Розчинник випаровували до сухості. Залигексан/ ЕtOАс 80/10; 15-35, мкм). Чисті фракції шок розчинили у СН2СІ2. Органічний шар виділили, зібрали та розчинник випаровували. Вихід: 9,5г промили К2СО3 10%, висушили (MgSO4), відфільтпроміжної сполуки 12 (55%). рували та розчинник випаровували. Вихід: 45г Приклад А8 етил 6-фтор-3,4-дигідро-2Н-1-бензопіран-2а) Приготування карбоксилату (проміжна сполука 9) (79%). c) Реакція під N 2. Суміш біс(2метоксиетокси)алюмінійгідрид натрію, 70ваг.% розчину у метилбензолі 3,4Μ (0,44моль) у бензолі (150мл ) (нагрівання зі зворотнім холодильником) додавали по краплях протягом 1 години до нагрітої зі зворотнім холодильником суміші проміжної сполуки 9 (0,22моль) та бензолу (600мл). Після Суміш проміжної сполуки (5) (0,1127моль), 2перемішування протягом 2,5 годин при температуметоксиетанамін (0,2254моль) та К2СО3 рі нагрівання зі зворотнім холодильником, суміш (0,2254моль) у ДМФ (500мл) перемішували при охолодили до 15°С. Суміш розклали за допомогою 120°С протягом 15 годин та потім охолодили. Роздодавання по краплях етанолу (30мл) та вода чинник випаровували. Залишок помістили у СН2СІ2 (10мл). Цю суміш вилили на лід/воду та цю суміш та Н2О. Органічний шар виділили, висушили підкислили концентрованою соляною кислотою. (MgSO4), відфільтрували та розчинник випаровуЦю суміш екстрагували діетилового ефіру ом вали до сухості. Залишок (33,53г) очистили за до(500мл). Виділений органічний шар промили вопомогою колонкової хроматографії на силікагелі дою, висушили, відфільтрували та розчинник ви(елюент: СН2СІ2/СН3ОН 99,5/0,5; 15-40мкм). Дві паровували. Залишок очистили за допомогою кофракції зібрали та їх розчинники випаровували. лонкової хроматографії на силікагелі (елюент: Вихід: 5,7г проміжної сполуки 14 (38%) та проміжСНСІ3). Бажану фракцію зібрали та елюент випаної сполуки 13 (34%). ровували. Вихід: 34г 6-фтор-3,4-дигідро-2Н-1b) Приготування бензопіран-2-метанолу (проміжна сполука 10) (85%). d) Реакція під N2. До перемішаного та охолоПриклад А6 Приготування 37 Суміш проміжної сполуки (5) (0,0751моль), тіоморфолін (0,0891моль) та К2СО3 (0,15моль) у ДМФ (200мл) перемішували при 120°С протягом 12 годин. Розчинник випаровували до сухості. Залишок помістили у СН2СІ2 та Н2О. Органічний шар виділили, висушили (MgSO4), відфільтрували та розчинник випаровували. Залишок (26г) очистили за допомогою колонкової хроматографії на силікагелі (елюент: циклогексан/ЕtOАс 80/20; 20-45мкм). Дві фракції зібрали та їх розчинники випаровували. Дві фракції поєднали. Вихід: 9,4г проміжної сполуки 15 (37%); т.пл. 82°С. Приклад А9 a) 4-амінобензойної кислоти (0,219моль) додавали до розчину 3-нітробензолсульфонату натрію (0,118моль) у H2SO4 70% (230мл) та суміш перемішували та нагрівали зі зворотнім холодильником. 2-пропен-1,1-діол, 2-метил-, діацетат (0,216моль) додавали по краплях та суміш нагрівали зі зворотнім холодильником протягом 4 годин. Етанол (200мл) додали та суміш перемішували при 80°С протягом 48 годин. Суміш випаровували, залишок вилили у льодяна вода/NH4OH та екстрагували СН2СІ2. Органічний шар висушили (MgSO4) та випаровували. Залишок очистили за допомогою колонкової хроматографії на силікагелі (елюент: СН2СІ2/2-пропанол 99/1). Чисті фракції зібрали та випаровували. Вихід: 21г етил 3-метил-6-хінолінкарбоксилату (проміжна сполука 16) (45%). b) Проміжна сполука 16 (0,098моль) у ТГФ (270мл ) додали при температурі 0°С до розчину LiAIH4 (0,098моль) у ТГФ під N2. По закінченні додавання, вода (10мл) додали. Осад відфільтрували та промили СН2СІ2. Органічний шар висушили (MgSO4), відфільтрували та випаровували. Продукт використали без подальшого очищення. Вихід: 16,71г 3-метил-6-хінолінметанолу (проміжна сполука 17). c) МnО2 (0,237моль) додали до розчину проміжної сполуки 17 (0,096моль) у СН2СІ2 (200мл) та суміш перемішували при кімнатній температурі протягом 12 годин. Суміш відфільтрували крізь целіт та фільтрат перемішували знову з МnО2 (20г) протягом 12 годин. МnО2 (10г) додали знову. Суміш перемішували протягом 12 годин. Суміш відфільтрували крізь целіт та випаровували. Продукт використали без подальшого очищення. Вихід: 11,71г 3-метил-6-хінолінкарбоксальдегіду (71%) (проміжна сполука 18). d) Розчин бромциклогексилу (0,14моль) у 1,1'оксибісетані (50мл ) та Мg перетворення (50мл) додали при температурі 10°С до суміші ТГФ (0,14моль) у 1,1'-оксибісетані (10мл). Розчин проміжної сполуки 18 (0,07моль) у Мg перетворення (100мл) додали обережно при 5°С, суміш вилили у льодяну воду та екстрагували ЕtOАс. Вихід: 11,34г (±)-а-циклогексил-3-метил-6-хінолінметанолу (63%) (проміжна сполука 19). Приклад А10 Приготування 76726 38 Суміш сполуки (5) (0,001507моль), трибутил (1-етоксиетеніл)станнану (0,00226моль) та Pd (РРh3)4 (0,000151моль) у 1,4-діоксані (5мл) перемішували при 80°С протягом 3 годин. Додали воду. Суміш екстрагували ЕtOАс. Органічний шар виділили, висушили (MgSO4), відфільтрували та розчинник випаровували. Цей продукт використали без подальшого очищення. Вихід: 1,4г проміжної сполуки 20. Приклад А11 Приготування Суміш сполуки (45) (отриману відповідно до В6) (0,00125моль) у NaOH 3N (5мл) та iРrOН (1,7мл) перемішували при кімнатній температурі протягом ночі, потім вилили у Н2О, підкислено НСІ 3N та екстрагували ЕtOАс. Органічний шар виділили, висушили (MgSO4), відфільтрували та розчинник випаровували. Залишок помістили у диетиловому ефірі. Осад відфільтрували та висушили. Вихід: 0,26г проміжної сполуки 23 (56%). (т.пл.: 232°С) Приклад А12 a) Приготування Суміш 5-бром-1Н-індол-2,3-діон (0,221моль) у NaOH 3N (500мл) перемішували при 80°С протягом 30 хвилин, довели до кімнатної температури та додали 2-пентанон (0,221моль). Суміш перемішували та нагрівали зі зворотнім холодильником протягом 1 години та 30 хвилин та підкислили АсОН до досягнення рН=5. Осад відфільтрували, промили водою та висушили. Вихід: 52,3г проміжної сполуки 24 та проміжної сполуки 25. (Загальний вихід: 80%). b) Приготування nBuLi 1,6Μ (0,0816моль) додавали по краплях 39 76726 40 при -78°С до суспензії проміжної сполуки 25 ремішували та нагрівали зі зворотнім холодильни(0,034моль) та проміжної сполуки 26 (0,034моль) у ком протягом 8 годин, довели до кімнатної темпеТГФ (300мл ) під потоком N2. Суміш перемішували ратури та випаровували до сухості. Продукт криспри -78°С протягом 30 хвилин. nBuLi 1,6Μ талізували з ЕtOАс. Осад відфільтрували, (0,0816моль) додавали покраплях. Суміш переміпромили К2СО3 10% та помістили у СН2СІ2. Оргашували протягом 1 години. Суміш проміжної спонічний шар виділили, висушили (MgSO4), відфільлуки 9 (0,102моль) у ТГФ (250мл) додали повільно. трували, та розчинник випаровували. Вихід: 4,6г Суміш перемішували при температурі від -78°С до проміжної сполуки 28 (54%). -20°С, вилили у Н2О/НСІ 3Ν та екстрагували Приклад А 15 ЕtOАс. Органічний шар виділили, висушили a) Приготування (MgSO4), відфільтрували, та розчинник випаровували до сухості. Вихід: 20,89г проміжна сполуки 26 та проміжної сполуки 27 (86%). Приклад А13 a) Приготування 4-аміно-3-метоксибензойну кислоту (0,054моль) додавали по порціях при кімнатній температурі до розчину 3-хлор-2-етил-2-бутенал (0,065моль) у АсОН (100мл). Суміш перемішували та нагрівали зі зворотнім холодильником протягом 8 годин та випаровували до сухості. Залишок помістили у СН2СІ2, додали воду та розчин перетворили у основу за допомогою Et3N. Органічний шар виділили, висушили (MgSO4), відфільтрували, та розчинник випаровували. Залишок кристалізували з 2-пропанону. Осад відфільтрували та висушили. Вихід: 2,5г проміжної сполуки 26 (18%). b) Приготування CDI (0,012моль) додали при кімнатній температурі до розчину проміжної сполуки 26 (0,011моль) у СН2СІ2 (30мл). Суміш перемішували при кімнатній температурі протягом 1 години. Метоксиамінометил (0,012моль) додали та суміш перемішували при кімнатній температурі протягом 8 годин. Додали Н2О. Осад відфільтрували. Фільтрат екстрагували СН2СІ2. Органічний шар виділили, висушили (MgSO4), відфільтрували, та розчинник випаровували. Залишок кристалізували з диетилового ефіру. Осад відфільтрували та висушили. Вихід: 0,95г проміжної сполуки 27 (31%) (т.пл.: 148°С). Приклад А14 Приготування 4-Бромбензенамін (0,034моль) додали при кімнатній температурі до розчину 3-хлорид-2-етил2-бутанал (0,041моль) у АсОН (60мл). Суміш пе Розчин КОН (0,326моль) у Н2О (150мл) додавали повільно при 5°С до розчину 1,3циклогександіону (0,268моль) у Н2О (150мл). Температура не повинна досягати 12°С. КΘ (2г) потім 2бром-1-(4-нітрофеніл)етанон (0,294моль) було додано по порціях. Суміш перемішували при кімнатній температурі протягом 48 годин. Осад відфільтрували, промили Н2О потім диетиловим ефіром та висушили. Вихід: 63г (85%). Частину цієї фракції (1г) кристалізували з ЕtOН. Осад відфільтрували та висушили. Вихід: 0,5г проміжної сполуки 29 (42%) (т.пл.: 100°С). b) Приготування Суміш проміжної сполуки 29 (0,145моль) у H2SO4 (40мл) перемішували при кімнатній температурі протягом 1 години, вилили у лід, перетворили у основу за допомогою NH4OH та екстрагували СН2СІ2. Органічний шар виділили, висушили (MgSO4), відфільтрували, та розчинник випаровували. Залишок кристалізували з ЕtOН. Осад відфільтрували та висушили. Вихід: 31г (58%). Частину цієї фракції (1г) кристалізували з ЕtOН. Осад відфільтрували та висушили. Вихід: 0,7г проміжної сполуки 30 (58%) (т.пл.: 200°С). c) Приготування Суміш проміжної сполуки 30 (0,039моль), нікеля Ренея (10г) у ЕtOН (100мл) гідрогенізовали при кімнатній температурі під тиском у 3бар протягом 1 години. Суміш відфільтрували на целіті та промили СН2СІ2. Органічний шар виділили, висушили (MgSO4), відфільтрували, та розчинник випаровували. Залишок (9,5г) кристалізували з диетилового 41 76726 42 ефіру. Осад відфільтрували та висушили. Вихід: вали. Залишок кристалізували з 24,6г (52%). Фільтрат випаровували. Залишок (2,7г) пропанон/діетилового ефір. Осад відфільтрували очистили за допомогою колонкової хроматографії та висушили. Вихід: 0,9г сполуки 306 (11%) (т.пл.: на силікагелі (елюент: СН2СІ2 /СН3ОН; 99/1; 15136°С). 40мкм). Дві фракції зібрали та розчинник випароПриклад В2 вували. Вихід: 1,6г F1 та 1,2г F2. F2 кристалізували Приготування з ЕtOН. Осад відфільтрували та висушили. Вихід: 0,24г проміжної сполуки 31(2%) (т.пл.: 202°С). d) Приготування тній Проміжну сполуку 30 (0,02моль) додали при кімнатній температурі до розчину 3-хлор-2-етил-2бутенал (0,04моль) у АсОН (50мл). Суміш перемішували та нагрівали зі зворотнім холодильником протягом 4 годин. Розчинник випаровували до сухості. Залишок кристалізували з ЕtOАс. Осад відфільтрували та висушили. Залишок помістили у СН2СІ2. Суміш перетворили у основу за допомогою К2СО3 10% та екстрагували СН2СІ2. Органічний шар виділили, висушили (MgSO4), відфільтрували, та розчинник випаровували. Залишок кристалізували з ЕtOН. Осад відфільтрували та висушили. Вихід: 2,5г проміжної сполуки 32 (40%). Приклад А16 Приготування Суміш 2-(4-нітрофеніл)-1-фенілетанон (0,083моль) та Нікель Ренея (20г) у ЕtOН (200мл) гідрогенізували при кімнатній температурі протягом 1 години під тиском 3бар, потім відфільтрували на целіті, промили СН2СІ2/СН3ОН та висушили. Вихід: 17,5г проміжної сполуки 33 (97%). В. Приготування кінцевих сполук Приклад В1 Приготування РОСl3 (0,024моль) додавали повільно при температурі 5°С до ДМФ (0,024моль). Суміш перемішувалі при кімнатній температурі протягом 30 хвилин, потім охолодили до 5°С. Етиловий ефір 3оксо-бутанової кислоти (0,024моль) додавали повільно. Суміш перемішували при 5°С протягом 30 хвилин. 1-(4-амінофеніл)-2-фенілетанон (0,024моль) було додано по порціях. Суміш перемішували при 90°С протягом 3 годин та розчинили у СН2СІ2. Льодяна додали воду. Суміш перетворили у основу за допомогою NH4OH та екстрагували СН2СІ2. Органічний шар виділили, висушили (MgSO4), відфільтрували, та розчинник випарову КМbО4 (10г) було додано по порціях при кімнатемпературі до розчину (отриманої відповідно до прикладу А7.е) (0,022моль) у тріс(діокса-3,6гептил)амін (1мл) та СН2СІ2 (100мл). Суміш перемішували при кімнатній температурі протягом 8 годин, відфільтрували на целіті, промили СН2СІ2 та висушили. Залишок (6г, 100%) кристалізували з діетилового ефіру/петролейного ефіру. Осад відфільтрували та висушили. Вихід: 2г сполуки (2) (33%); т.пл. 82°С. Приклад В3 a) Приготування nBuLi 1,6Μ (0,07моль) додавали повільно при температурі -70°С до розчину проміжної сполуки (5) (0,058моль) у ТГФ (150мл). Суміш перемішували при -70°С протягом 30 хвилин. Розчин 2,3дигідро-1Н-інден-2-карбонітрилі (0,07моль) у ТГФ (100мл ) додали повільно. Суміш перемішували при -70°С протягом 1 години, довели повільно до кімнатної температури, гідролізували Н2О та екстрагували ЕtOАс. Органічний шар виділили, висушили (MgSO4), відфільтрували та розчинник випаровували. Залишок (22г) очистили за допомогою колонкової хроматографії на силікагелі (елюент: СН2СІ2/циклогексан 80/20 до 100; 15-35мкм). Чисті фракції зібрали та розчинник випаровували. Другу фракцію кристалізували з 2пропанону/диетилового ефіру. Осад відфільтрували та висушили. Вихід: 0,11г сполуки (3). Фільтрат концентрували. Вихід: 0,55г сполуки (3); т.пл. 145°С. b) Приготування nBuLi 1,6M (0,022моль) додавали повільно при температурі -70°С до розчину проміжної сполуки (5) (0,018моль) у ТГФ (50мл). Суміш перемішували при -70°С протягом 1 години, довели до -40°С, потім охолодили до -70°С. Розчин проміжної спо 43 76726 44 луки 7 (0,018моль) у ТГФ (40мл) додали повільно. 503 (15%). Суміш перемішували при -70°С протягом 1 години, Приклад В4: приклади модифікацій кінцевої потім довели до -20°С, гідролізували Н2О та екстгрупи рагували ЕtOАс. Органічний шар виділили, висуa) Приготування шили (MgSO4), відфільтрували та розчинник випаровували. Залишок (6,5г) очистили за допомогою колонкової хроматографії на силікагелі (елюент: толуол/ЕtOАс 90/10; 1540, мкм). Дві фракції (F1 та F2) зібрали та розчинник випаровували. F1 (2,4г) кристалізували з диетилового ефіру. Осад відфільтрували та висушили. Вихід: 1,8г сполуки (4) (29%); т.пл. 123°С. F2 (0,9г) кристалізували з диетиловогу ефіру. Осад відфільтрували та висушиСуміш ли. Вихід: 0,2г сполуки (5) (3%); т.пл. 120°С. c) Приготування nBuLi 1,6Μ у гексані (0,107моль) додавали по краплях при -78°С під потоком Ν2 до суміші проміжної сполуки (6) (0,089моль) у ТГФ. Суміш була перемішана при температурі -78°С протягом 1 години. Суміш проміжної сполуки 7 (150мл) додали при температурі -78°С під потоком N2. Суміш перемішували при -78°С протягом 2 годин, довели до 0°С, вилили у Н2О та екстрагували ЕtOАс. Органічний шар виділили, висушили (MgSO4), відфільтрували та розчинник випаровували. Залишок (31г) очистили за допомогою колонкової хроматографії на силікагелі (елюент: циклогексан/ЕtOАс 85/15; 20-45мкм). Дві чисті фракції зібрали та їх розчинники випаровували. Вихід: 11г сполуки (7) (38%) та 8,2г сполуки (8) (28%). d) Приготування Розчин хлорметилбензен (0,0069моль) у диетиловом ефірі (8мл) додавали повільно до суспензії Мg (0,0069моль) у невеликій кількості диетилового ефіру. Суміш перемішували при кімнатній температурі протягом 30 хвилин (нерівність Мg), потім охолодили до 5°С. Розчин проміжної сполуки 27 (0,0027моль) у ТГФ (8мл) додали повільно. Суміш перемішували при 5С° протягом 15 хвилин, потім при кімнатній температурі протягом 2 годин, вилили у Н2О та відфільтрували на целіті. Осад промили ЕtOАс. Фільтрат екстрагували ЕtOАс. Органічний шар виділили, висушили (MgSO4), відфільтрували, та розчинник випаровували. Залишок (1г) було очищено за допомогою колонкової хроматографії на кромазіл (елюент: СН2СІ2 100 до СН2СІ2/СН3ОН 99/1; 15-40мкм). Чисті фракції зібрали та розчинник випаровували. Залишок (0,5г, 56%) кристалізували з діетилового ефіру. Осад відфільтрували та висушили. Вихід: 0,14г сполуки (отримана відповідно до прикладу В3.с) (0,018моль) у НСІ 3N (60мл) та ТГФ (60мл) перемішували при 60°С протягом ночі. Суміш перетворили у основу за допомогою 10% розчину К2СО3 та екстрагували СН2СІ2. Органічний шар виділили, висушили (MgSO4), відфільтрували та розчинник випаровували. Вихід: 4,6г сполуки (156) (82%). b) Приготування Суміш (отримана відповідно до прикладу В3.с) (0,0122моль) у НСІ 3N (40мл) та ТГФ (40мл) перемішували та нагрівали зі зворотнім холодильником протягом ночі, виліли у воду, перетворили у основу за допомогою К2СО3 10% та екстрагували СН2СІ2. Органічний шар виділили, висушили (MgSO4), відфільтрували та розчинник випаровували. Залишок очистили за допомогою колонкової хроматографії на силікагелі (елюент: циклогексан/ЕtOАс 40/60; 15-40мкм). Чисті фракції зібрали та розчинник випаровували. Вихід: 2г сполуки (9) (52%); т.пл. 226°С. c) Приготування Суміш сполуки (4) (0,0015моль), 2метоксиетанамін (0,003моль) та К2СО3 (0,003моль) у ДМФ (5мл) перемішували при 140°С протягом 48 годин. Додали Н2О. Суміш екстрагували ЕtOАс. Органічний шар виділили, висушили (MgSO4), від 45 76726 46 фільтрували та розчинник випаровували. Залишок (MgSO4), відфільтрували та розчинник випарову(1г) очистили за допомогою колонкової хроматогвали. Залишок (4,4г) очистили за допомогою колорафії на силікагелі (елюент: циклогексан/ЕtOАс нкової хроматографії на силікагелі (елюент: цикло60/40; 15-40мкм). Дві фракції зібрали та розчинник гексан/ЕtOАс 70/30; 15-40, мкм). Одну фракцію випаровували. Обидві фракції були кристалізовані зібрали та розчинник випаровували. Цю фракцію роздільно з пентану. Осад відфільтрували та ви(3г, 73%) кристалізували з діетилового ефіру. Осад сушили. Вихід: 0,05г сполуки (10) (9%; т.пл. 115°С) відфільтрували та висушили. Вихід: 2,45г сполуки та 0,057г сполуки (11) (10%; т.пл 107°С). (15) (60%); т.пл. 132°С. d) Приготування g) Приготування Суміш сполуки (4) (0,0015моль) у 2(метилтіо)етанамін (2мл) перемішували при 120°С протягом 8 годин. К2СО3 10% додали. Суміш екстрагували СН2СІ2. Органічний шар виділили, висушили (MgSO4), відфільтрували та розчинник випаровували. Залишок (2,2г) очистили за допомогою колонкової хроматографії на силікагелі (елюент: циклогексан/ЕtOАс 70/30; 15-40, мкм). Дві фракції зібрали та розчинник випаровували. Першу фракцію кристалізували з діетилового ефіру /петролейного ефіру. Осад відфільтрували та висушили. Вихід: 0,08г сполуки (12) (14%); т.пл. 120°С. Другу фракцію кристалізували з діетилового ефіру. Осад відфільтрували та висушили. Вихід: 0,18г сполуки (13) (31%); т.пл. 125°С. e) Приготування Суміш сполуки (4) (0,001507моль), етинілтриметилсилан (0,003013моль), Cul (0,000151моль) та Pd (PPh3)4 (0,000151моль) у N,N-диетилетанаміні (5мл) перемішували при 100°С протягом 24 годин. Додали воду. Суміш відфільтрували на целіті, промили ЕtOАс та фільтрат екстрагували ЕtOАс. Органічний шар виділили, висушили (MgSO4), відфільтрували та розчинник випаровували. Залишок (1,3г) очистили за допомогою колонкової хроматографії на силікагелі (елюент: циклогексан/ЕtOАс 85/15; 15-40, мк). Чисті фракції зібрали та розчинник випаровували. Залишок (0,3г) кристалізували з пентану. Осад відфільтрували та висушили. Вихід: 0,11г сполуки (14) (18%); т.пл. 114°С. f) Приготування Суміш сполуки (14) (0,013моль) та KF (0,038моль) у оцтовій Кислоті (50мл) перемішували при кімнатній температурі протягом 2 годин. Н2О додали та суміш екстрагували діетиловим ефіром. Органічний шар виділили, висушили Суміш отримана відповідно до прикладу В.7.а) (0,0056моль) у КОН [1М, Н2О] (10мл) та метанол (30мл) перемішували при кімнатній температурі протягом 1 години, вилили у воду та екстрагували ЕtOАс. Органічний шар виділили, висушили (MgSO4), відфільтрували та розчинник випаровували. Залишок (2,2 г) очистили за допомогою колонкової хроматографії на силікагелі (елюент: циклогексан/ЕtOАс 85/15 to 70/30 ; 15-40мкм). Дві фракції зібрали та розчинник випаровували. Першу фракцію кристалізували з діетилового ефіру. Осад відфільтрували та висушили. Вихід: 0,2г сполуки (15) (11%); т.пл. 133°С. Другу фракцію кристалізували з діетилового ефіру. Осад відфільтрували та висушили. Вихід: 0,3г сполуки (17) (16%); т.пл. 128°С. h) Приготування Суміш сполуки (4) (0,001205моль), 2-пропін-1ол (0,002411моль), Pd(PPh3)4 (0,000121моль) та Cul (0,000121моль) у Ν,Ν-диетилетанаміні (5мл) перемішували при 100°С протягом 2 годин. Додали воду. Суміш відфільтрували на целіті, промили ЕtOАс та екстрагували ЕtOАс. Органічний шар виділили, висушили (MgSO4), відфільтрували та розчинник випаровували. Залишок (0,7г) очистили за допомогою колонкової хроматографії на силікагелі (елюент: СН2СІ2СН3ОН 98/2; 15-40, мкм). Чисті фракції зібрали та розчинник випаровували. Залишок кристалізували з петролейного ефіру та діетилового ефіру. Осад відфільтрували та висушили. Вихід: 0,1г сполуки (18) (23%); т.пл. 113°С. i) Приготування 47 Суміш сполуки (4) (0,006027моль) та KF (0,024108моль) у ДМСО (20мл) перемішували при 140°С. Розчинник випаровували до сухості. Залишок піддали застиганню у воді та діетилового ефірі. Суміш екстрагували діетиловим ефіром. Органічний шар виділили, промили діетиловим ефіром, промили насиченим розчином NaCI, висушили (MgSO4) відфільтрували та розчинник випаровували. Залишок (1,7г) очистили за допомогою колонкової хроматографії на силікагелі (елюент: циклогексан/ЕtOАс 85/15; 15-40, мкм). Три фракції зібрали та їх розчинники випаровували. Першу фракцію кристалізували з петролейного ефіру. Осад відфільтрували та висушили. Вихід: 0,21г сполуки (19) (11%); т.пл. 92°С. Другу фракцію кристалізували з петролейного ефіру. Осад відфільтрували та висушили. Вихід: 0,33г сполуки (20) (17%); т.пл. 114°С. j) Приготування Суміш сполуки (4) (0,003013моль), ацетил хлориду (0,003315моль) та йодиду натрію (0,006027моль) у CN3CN (10мл) перемішували та нагрівали зі зворотнім холодильником протягом 1 години. Додали К2СО3 10%. Суміш екстрагували СН2СІ2. Органічний шар виділили, висушили (MgSO4), відфільтрували та розчинник випаровували. Залишок (1 г) очистили за допомогою колонкової хроматографії на силікагелі (елюент: циклогексан/ЕtOАс 80/20; 15-40, мкм). Дві фракції зібрали та їх розчинники випаровували. Першу фракцію кристалізували з петролейного ефіру. Осад відфільтрували та висушили. Вихід: 0,12г сполуки (21); т.пл. 110°С. k) Приготування Суміш сполуки (21) (0,000898моль), триметилсиланкарбонітрил (0,001347моль) та Pd(PPh3)4 (0,00009моль) у Ν,Ν-диетилетанаміні (5мл) перемішували при 100°С протягом 2 годин. Додали воду. Суміш екстрагували EtOAc. Органічний шар виділили, висушили (MgSO4), відфільтрували та розчинник випаровували. Залишок (0,4г) очистили за допомогою колонкової хроматографії на силікагелі (елюент: циклогексан/ЕtOАс 80/20; 15-40мкм). Чисті фракції зібрали та розчинник випаровували. Залишок (0,18г, 62%) кристалізували з петролей 76726 48 ного ефіру. Осад відфільтрували та висушили. Вихід: 0,13г сполуки (22) (45%); т.пл. 138°С. l) Приготування Суміш сполуки (4) (0,00603моль), Pd(OAc)2 (0,000603моль), PPh3 (0,00904моль) та К2СО3 (0,012054моль) у CO (газ) та метанол (40мл) перемішували при 90°С протягом 8 годин під тиском СО у 5бар. Додали Н2О. Суміш екстрагували EtOAc. Органічний шар виділили, висушили (MgSO4), відфільтрували та розчинник випаровували. Залишок (6г) очистили за допомогою колонкової хроматографії на силікагелі (елюент: СН2СІ2/СН3ОН 100/0 до 98/2; 15-35мкм). Чотири фракції (F1-F4) зібрали та розчинник випаровували. Вихід: 0,13г (цис) F1; 0,02г F2 (цис, сполука 25); 0, 055г F3 (транс, 3%) та 0,11г F4 (транс; сполука 26). F1 кристалізували з петролейного ефіру. Осад відфільтрували та висушили. Вихід: 0,03г сполуки (23) (1%); т.пл. 91°С. F3 кристалізували з петролейного ефіру. Осад відфільтрували та висушили. Вихід: 0,035г сполуки (24) (1%); т.пл. 99°С. m) Приготування Суміш сполуки (4) (0,009моль) та Zn (0,027моль) у оцтовій кислоті (30мл) перемішували при 60°С протягом 4 годин, відфільтрували на целіті, промили СН2СІ2, випаровували до сухості, розчинили у СН2СІ2 та промили К2СО3 10%. Органічний шар виділили, висушили (MgSO4), відфільтрували та розчинник випаровували. Залишок (4г) очистили за допомогою колонкової хроматографії на силікагелі (елюент: циклогексан/ЕtOАс 75/25; 15-40, мкм). Одну фракцію зібрали та розчинник випаровували. Цю фракцію (1г 37%) кристалізували з петролейного ефіру. Осад відфільтрували та висушили. Вихід: сполука (25); т.пл. 88°С. n) Приготування Суміш сполуки (4) (0,001502моль), Sn(CH3)4 (0,003004моль) та Pd(PPh3)4 (0,00015моль) у метилбензол (5мл) перемішували та нагрівали зі 49 76726 50 зворотнім холодильником протягом 3 годин. К2СО3 10% додали. Суміш екстрагували ЕtOАс. Органічний шар виділили, висушили (MgSO4), відфільтрували та розчинник випаровували. Залишок (0,7г) очистили за допомогою колонкової хроматографії на силікагелі (елюент: циклогексан/ЕtOАс 85/15; 15-40мкм). Дві фракції (F1 та F2) зібрали та їх розчинники випаровували. Вихід: 0,27г (F1, вихідний Суміш сполуки (4) (0,001507моль), трибутил-2матеріал) та 0,14г (F2). F2 кристалізували з пентан тієнілстанан (0,00226моль) та Pd(PPh3)4 та петролейний ефір. Осад відфільтрували та ви(0,0001507моль) у діоксані (5мл) перемішували сушили. Вихід: 0,08г сполуки (27) (17%); т.пл. при 80°С протягом 8 годин. Додали К2СО3 10%. 110°С. Суміш екстрагували ЕtOАс. Органічний шар видіo) Приготування лили, висушили (MgSO4), відфільтрували та розчинник випаровували. Залишок (1,7г) очистили за допомогою колонкової хроматографії на силікагелі (елюент: циклогексан/ЕtOАс 85/15; 15-40, мкм). Чисті фракції зібрали та розчинник випаровували. Залишок (0,65г) кристалізували з діетилового ефіру. Осад відфільтрували та висушили. Вихід: 0,35г сполуки (30) (61%); т.пл. 142°С. r) Приготування Суміш сполуки (4) (0,001507моль), трибутилетенілстанан (0,002260моль) та Pd(РРh3)4 (0,000151моль) у діоксані (5мл) перемішували при 80°С протягом 8 годин. Додали воду. Суміш відфільтрували на целіті, промили ЕtOАс та екстрагували ЕtOАс. Органічний шар виділили, висушили (MgSO4), відфільтрували та розчинник випаровували. Залишок (0,65г) очистили за допомогою колонкової хроматографії на силікагелі (елюент: циСуміш сполуки (4) (0,0015моль), 3клогексан/ЕtOАс 90/10; 15-40мкм). Чисті фракції тієнілборонової кислоти (0,00226моль), Pd(PPh3)4 зібрали та розчинник випаровували. Залишок кри(0,00015моль) та діоксан перемішували та нагрісталізували з петролейного ефіру. Осад відфільтвали зі зворотнім холодильником протягом 24 горували та висушили. Вихід: 0,07г сполуки (28) дин. Додали К2СО3 10%. Суміш екстрагували (14%); т.пл. 108°С. ЕtOАс. Органічний шар виділили, висушили p) Приготування (MgSO4), відфільтрували та розчинник випаровували. Залишок (0,8г) очистили за допомогою колонкової хроматографії на силікагелі (елюент: циклогексан/ЕtOАс 80/20; 15-40мкм). Чисті фракції зібрали та розчинник випаровували. Залишок (0,4г, 70%) кристалізували з петролейного ефіру. Осад відфільтрували та висушили. Вихід: 0,39г сполуки (31) (68%); т.пл. 113°С. s) Приготування Суміш сполуки (5) (0,001507моль), трифеніл(фенілметил)станан (0,002260моль) та Рd(РРh3)4 (0,000151моль) у діоксані (5мл) перемішували при 80°С протягом 8 годин. Додали воду. Суміш екстрагували EtOAc. Органічний шар виділили, висушили (MgSO4), відфільтрували та розчинник випаровували. Залишок (1,4г) очистили за допомогою колонкової хроматографії на силікагелі (елюент: СН2СІ2/ЕtOАс 96/4; 15-40, мкм). Чисті фракції зібрали та розчинник випаровували. Залишок (0,38г) кристалізували з петролейного ефіру. Осад відфільтрували та висушили. Вихід: 0,16г сполуки (29) (28%); т.пл. 112°С. q) Приготування Суміш сполуки (4) (0,003моль), гліцин метиловий складний ефір моногідрохлориду (0,0066моль) та Pd(PPh)4 (0,0003моль) у Et3N (2мл) та толуол (10мл) перемішували при 100°С під тиском СО у 5бар протягом 8 годин, відфільтрували на целіті, промили СН2СІ2 та випаровували. Залишок (2г) очистили за допомогою колонкової хроматографії на силікагелі (елюент: циклогексан/ЕtOАс 80/20; 75-35, мкм). Одну фракцію зібрали та розчинник випаровували. Цю фракцію (1г 80%) кристалізували з діетилового ефіру. Осад відфільтрували та висушили. Вихід: 0, 46г сполуки (32) (37%). t) Приготування 51 Суміш сполуки (4) (0,003моль) та гідразинкарбоксальдегід (0,0045моль) у 1-бутанолі (15мл) перемішували та нагрівали зі зворотнім холодильником протягом ночі, вилили у воду та екстрагували СН2СІ2. Органічний шар виділили, висушили (MgSO4), відфільтрували та розчинник випаровували. Залишок очистили за допомогою колонкової хроматографії на силікагелі (елюент: СН2СІ2/CH3OH/NH4OH 95/5/0,1; 15-40, мкм). Дві фракції (F1 та F2) зібрали та їх розчинники випаровували. Вихід: 0,3г F1 та 0,3г F2. F1 кристалізували з CH3CN та діетилового ефіру. Осад відфільтрували та висушили. Вихід: 0,102г сполуки (33); т.пл. 224°С. F2 кристалізували з CH3CN та діетилового ефіру. Осад відфільтрували та висушили. Вихід: 0,2г сполуки (34); т.пл. 185°С. u) Приготування Суміш сполуки 4 (0,015моль) та NaN3 (0,045моль) у ДМФ (50мл ) перемішували при 140°С протягом 2 годин. Додали К2СО3 10% та суміш екстрагували EtOAc. Органічний шар виділили, висушили (MgSO4), відфільтрували та розчинник випаровували. Залишок (6г) очистили за допомогою колонкової хроматографії на силікагелі (елюент: циклогексан/EtOAc 60/40; 15-40мкм). Першу фракцію зібрали та розчинник випаровували. Залишок кристалізували з діетилового ефіру. Осад відфільтрували та висушили. Вихід: 1,26г сполуки (35) (24%); т.пл. 160°С. v) Приготування Суміш сполуки (4) (0,009моль) та тіосечовини (0,0099моль) у етиловому спирті (30мл) перемішували та нагрівали зі зворотнім холодильником протягом 12 годин та розчин КОН (0,0149моль) у Н2О (5мл) додали повільно. Суміш перемішували та нагрівали зі зворотнім холодильником протягом 1 години, вилили у воду та екстрагували СН2СІ2. Органічний шар виділили, висушили (MgSO4), відфільтрували та розчинник випаровували. Залишок очистили за допомогою колонкової хроматографії на силікагелі (циклогексан/EtOAc 70/30; 15-40, мкм). Чисті фракції зібрали та розчинник випаровували. Вихід: 1,1г F1 (37%) та 0,4г F2 (13%). F1 кристалізували з 2-пропанону. Осад відфільтрува 76726 52 ли та висушили. Вихід: сполука (36). F2 кристалізували з 2-пропанону. Осад відфільтрували та висушили. Вихід: сполука (37). w) Приготування СН3І (0,0034моль) додали повільно при кімнатній температурі до розчину сполуки (36) (0,0015моль), сполука (37) (0,0015моль) та К2СО3 (0,0034моль) у ацетон (15мл). Суміш перемішували при кімнатній температурі протягом 8 годин. Додали воду та суміш екстрагували СН2СІ2. Органічний шар виділили, висушили (MgSO4), відфільтрували та розчинник випаровували. Залишок (1,2г) очистили за допомогою колонкової хроматографії на силікагелі (елюент: циклогексан/EtOAc 85/15; 15-40мкм). Чисті фракції зібрали та розчинник випаровували. Вихід: 0,6г F1 (57%), та 0,18г F2 (17%). F1 кристалізували з діетилового ефіру. Осад відфільтрували та висушили. Вихід: 0,28г сполука (38) (27%). F2 кристалізували з діетилового ефіру. Осад відфільтрували та висушили. Вихід: 0,065г сполуки (39) (6%). x) Приготування Суміш отриманої відповідно до прикладу В3b (0,0014моль) у НСІ 3N (5мл) та ТГФ (5мл) перемішували та нагрівали зі зворотнім холодильником протягом двох днів, потім вилили у Н2О, перетворили у основу за допомогою К2СО3 та екстрагували СН2СІ2. Органічний шар виділили, висушили (MgSO4), відфільтрували та розчинник випаровували. Вихід: 0,5г F. Цю фракцію F кристалізували з 2-пропанону. Осад відфільтрували та висушили. Вихід: 0,35г сполуки (40) (74%). y) Приготування Суміш сполуки (5) (0,045моль), ацетамід (0,90013моль) та К2СО3 (0,225моль) перемішували та нагрівали зі зворотнім холодильником при 200°С протягом 2 годин, охолоджували при кімнатній температурі, вилили у Н2О/СН2СІ2; та екстрагували СН2СІ2. Органічний шар виділили, висушили (MgSO4), відфільтрували та розчинник 53 76726 54 випаровували до сухості. Залишок (14,4г) кристагодин потім охолодили до кімнатної температури, лізували з СН3ОН. Осад відфільтрували та висувилили у Н2О та екстрагували EtOAc. Органічний шили. Фільтрат випаровували. Залишок (11,27г) шар виділили, висушили (MgSO4), відфільтрували, очистили за допомогою колонкової хроматографії та розчинник випаровували до сухості. Залишок на силікагелі (елюент: СН2СІ2/CH3OH/NH4OH (1,1г) очистили за допомогою колонкової хромато96/4/0,1; 15-35мкм). Чисті фракції зібрали та розграфії на силікагелі (елюент: циклогексан/EtOAc; чинник випаровували. Вихід: 4,2г сполуки (188) 40/60; 15-40мкм). Дві фракції зібрали та розчинник (65%). випаровували. Вихід: 0,3г F1 та 0,5г F2 (50%) F2 z) Приготування кристалізували з діетилового ефіру/петролейного ефіру. Осад відфільтрували та висушили. Вихід: 0,26г F1 кристалізували з пентану. Осад відфільтрували та висушили. Вихід: 0,19г. Цю фракцію очистили за допомогою колонкової хроматографії на силікагелі (елюент: СН2СІ2/СН3ОН ; 98/2; 1540мкм). Чисті фракції зібрали та розчинник випаровували. Вихід: 0,11г. Цю фракцію була очищена за допомогою колонкової хроматографії на кромазіл (елюент: СН3ОН/Н2О; 70/30). Чисті фракції зібрали та розчинник випаровували. Вихід: 0,09г. Суміш сполуки (188) (0,00032моль), бензойна (9%) Цю фракцію кристалізували з діетилового кислота (1,5 еквівалента, 0,00048моль), 1-етил-3ефіру. Осад відфільтрували та висушили. Вихід: (3'-диметиламінопропіл)карбодіімід. НСІ (1:1) (1,5 0,08г сполуки 419 (8%). еквівалента, 0,00048моль), NПриклад В5 гідроксибензотриазол (1,5 еквівалента, Приготування 0,00048моль) та Et3N (1 еквівалента, 0,00032моль) у СН2СІ2 (2мл) перемішували при кімнатній температурі протягом 15 годин. Розчинник випаровували. Залишок очистили за допомогою рідинної хроматографії високого тиску та отримані фракції зібрали та розчинник випаровували. Вихід: 0,066г сполуки (205) (49,50%). aa) Приготування Суміш проміжної сполуки 20 (0,001507моль) у НСІ 3N (10мл) та ТГФ (10мл) перемішували при кімнатній температурі протягом 8 годин, перетворили у основу за допомогою 10% К2СО3 та екстрагували СН2СІ2. Органічний шар виділили, висушили (MgSO4), відфільтрували та розчинник випаровували. Залишок (1,2г) очистили за допомогою колонкової хроматографії на силікагелі (елюент: циклогексан/EtOAc 85/15; 15-40мкм). Чисті фракції зібрали та розчинник випаровували. Залишок (0,4г) кристалізували з петролейного ефіру. Осад відфільтрували та висушили. Вихід: 0,3г сполуки (6) (58%); т.пл. 108°С. ab) Приготування Суміш сполуки 213 (отриману відповідно до В4) (0,00305моль) та CH3ONa (30% у СН3ОН) (0,00916моль) у СН3ОН (25мл) перемішували та нагрівали зі зворотнім холодильником протягом 15 Йодометан (0,00456моль) додали при температурі 5°С до суміші сполука (9) (0,0019моль), сполука (8) (0,0019моль) та tBuOK (0,00456моль) у ТГФ (30мл ) під потоком N2. Суміш перемішували при кімнатній температурі протягом ночі, вилили у Н2О та екстрагували СН2СІ2. Органічний шар виділили, висушили (MgSO4), відфільтрували та розчинник випаровували. Залишок очистили за допомогою колонкової хроматографії на силікагелі (елюент: циклогексан/EtOAc 65/35; 15-40мкм). Дві фракції зібрали та розчинник випаровували. Вихід: 0,35г сполуки (42) (30%; т.пл. 125°С) та 0,35г сполуки (43) (30% ; т.пл. 116°С). Приклад В6 a) Приготування NaH 60% (0,01068моль) додали при температурі 0 °С під потоком N2 до суміші сполуки (8) та сполуки (9) (0,0089моль). Суміш перемішували протягом 30 хвилин. Етил бромацетат (0,01068моль) додали при температурі 0°С. Суміш перемішували при кімнатній температурі протягом 1 години, гідролізували вода та екстрагували EtOAc. Органічний шар виділили, висушили (MgSO4), відфільтрували та розчинник випаровували. Залишок очистили за допомогою колонкової хроматографії на силікагелі (елюент: циклогек 55 76726 56 сан/EtOAc 60/40; 15-40мкм). Бажану фракції (F1F4) зібрали та розчинник випаровували. Вихід: Суміш сполуки (7) (0,0229моль), гідроксиламі0,11г F1; 0,13г F2; 0,75г F3 та 0,8г F4. F3 кристаліну (0,0252моль) та Ν,Ν-диетилетанаміну зували з діетилового ефіру. Осад відфільтрували (0,0252моль) у етанолі (100мл) перемішували та та висушили. Вихід: сполука (44); т.пл. 152°С. F4 нагрівали зі зворотнім холодильником протягом 6 кристалізували з діетилового ефіру. Осад відфільгодин, вилили у воду та екстрагували СН2СІ2. Ортрували та висушили. Вихід: сполука (45); т.пл. ганічний шар виділили, висушили (MgSO4), відфі147°С. льтрували та розчинник випаровували. Залишок b) Приготування кристалізували з CH3CN. Осад відфільтрували та висушили . Залишок очистили за допомогою колонкової хроматографії на силікагелі (елюент: СН2СІ2/EtOAc 80/20; 15-40мкм). Дві фракції зібрали та розчинник випаровували. Вихід: 2,8г сполуки (44) (36%; т.пл. 133°С) та 3г сполуки (45) (38%; т.пл. 142°С). b) Приготування Бромметилбензол (0,007моль) додавали по краплях при 0°С під потоком N2 до розчину сполуки (8) та сполуки (9) (0,0064моль) та NaH 60% (0,007моль) у ДМФ (40мл). Суміш перемішували при кімнатній температурі протягом 1 години, гідролізували водою та екстрагували EtOAc. Органічний шар виділили, промили водою, висушили (MgSO4), відфільтрували та розчинник випаровували. Залишок очистили за допомогою колонкової хроматографії на силікагелі (елюент: циклогексан/EtOAc 70/30; 15-40мкм). Бажані фракції (F1-F4) зібрали та розчинник випаровували. Вихід: 0,15г F1, 0,11г F2, 0,6г F3 (23%) та 0,8г F4. F3 кристалізували з діетилового ефіру. Осад відфільтрували та висушили. Вихід: 0,13г сполуки (46); т.пл. 137°С. F4 кристалізували з ДІПЕ та петролейного ефіру. Осад відфільтрували та висушили. Вихід: сполука (47); т.пл. 130°С. Приклад В7 а) 3-Хлорбензолкарбопероксойна кислота (0,088моль) додали при температурі 0°С до розчину сполуки (48) (отримана відповідно до прикладу В2) (0,044моль) у СН2СІ2 (200мл) та суміш перемішували при кімнатній температурі протягом 12 годин. Суміш промили К2СО3 10%. Органічний шар висушили (MgSO4), відфільтрували та випаровували. Залишок рекристалізували з (С2Н5)2О. Вихід: 8,2г циклогексил (3-метил-6-хінолініл)метанон, 1оксид (сполука 49) (69%). b) 4-Метилбензолсульфонілхлорид (0,043моль) додали до розчину сполуки (49) (0,028моль) у К2СО3 (400мл ) та СН2СІ2 (400мл) та суміш перемішували при кімнатній температурі протягом 1 години. Суміш екстрагували СН2СІ2. Органічний шар висушили (MgSO4), відфільтрували та випаровували. Залишок рекристалізували з (С2Н5)2О. Вихід: 6,64г 6-(циклогексилкарбоніл)-3метил-2-(1Н)-хінолінон (сполука 50) (85%); т.пл. 256,1°С. Приклад В8 a) Приготування Гідразин (0,41моль) додали при кімнатній температурі до розчину сполуки (7) (0,015моль) у етанолі (75мл). Суміш перемішували та нагрівали зі зворотнім холодильником протягом ночі, вилили у воду та екстрагували СН2СІ2. Органічний шар виділили, висушили (MgSO4), відфільтрували та розчинник випаровували. Залишок очистили за допомогою колонкової хроматографії на силікагелі (елюент: CH2CI2/CH3OH/NH4OH 98/2/0,1). Чисті фракції зібрали та розчинник випаровували. Залишок кристалізували з діетилового ефіру. Осад відфільтрували та висушили. Вихід: 0,8г сполуки (53) (15%);т.пл. 110°С. Приклад В9 Приготування Процедура для сполук 400, 401, 402, 403, 404 та 405. Суміш проміжної сполуки 21 (отриману відповідно до А11) (0,000269моль), амантадин гідрохлорид (0,000404моль; 1,5 еквівалента), N'(етилкарбонімідоіл)-N,N-диметил-1,3пропандиамін гідрохлорид (0,000404моль; 1,5 еквівалента), 1-гідрокси-1Н-бензотриазол (0,000404моль; 1,5 еквівалента) та Et3N (0,000269моль) у СН2СІ3 (2мл) перемішували при кімнатній температурі протягом 12 годин. Розчинник випаровували. Залишок очистили за допомогою рідинної хроматографії високого тиску. Отримані фракції зібрали та розчинник випаровували. Вихід: 0,063г сполуки 520 (46,37%). Приклад В10 Приготування 57 Суміш проміжної сполуки 27 (0,0026моль) та проміжної сполуки 26 (0,0026моль) у EtOH (380мл) та концентрованої H2SO4 (19мл) перемішували та нагрівали зі зворотнім холодильником протягом 15 годин, охолодили до кімнатної температури, вилили у льодяну воду, перетворили у основу за допомогою К2СО3 та екстрагували EtOAc. Органічний шар виділили, висушили (MgSO4), відфільтрували, та розчинник випаровували. Залишок (17,9г) очистили за допомогою колонкової хроматографії на силікагелі (елюент: циклогексан/EtOAc; 80/20; 1535мкм). Чисті фракції зібрали та розчинник випаровували. Вихід: 0,85г F1, 1,1г F2 та 11,5г F3. F1 та F2 були кристалізовані окремо з петролейного ефіру. Осад відфільтрували та висушили. Вихід: 0,34г сполуки 233. Приклад В11 Приготування Суміш сполуки 22 (отриману відповідно до В4) (0,004 моль) у НСІ (3N) (20мл) та ТГФ (20мл) перемішували та нагрівали зі зворотнім холодильником протягом 8 годин,вилили на лід, перетворили у основу за допомогою NAH та екстрагували СН2СІ2. Органічний шар виділили, висушили (MgSO4), відфільтрували, та розчинник випаровували. Залишок (1,2г) очистили за допомогою колонкової хроматографії на силікагелі (елюент: СН2СІ2/CH3OESNH4OH; 93/7/0,5; 15-40мкм). Дві фракції зібрали та розчинник випаровували. Вихід: 0,5г F1 (41%) та 0,4г F2. F1 кристалізували з петролейного ефіру. Осад відфільтрували та висушили. Вихід: 0,17г сполуки 511 (14%). Приклад В12 Приготування Суміш сполуки 524 (отриману відповідно до В9а) (0,0018моль) та КОН 85% (0,0094моль) у ЕtOН (15мл) перемішували та нагрівали зі зворотнім холодильником протягом 24 годин, вилили у Н2О та екстрагували СН2СІ2. Органічний шар виділили, висушили (MgSO4), відфільтрували, та розчинник випаровували. Залишок очистили за допомогою колонкової хроматографії на силікагелі (елюент: СН2СІ2/циклогексан 80/20; 15-40мкм). Дві фракції зібрали та розчинник випаровували. Вихід: 0,35г F1 (64%) та 0,17г (SM) F1 кристалізували з діетилового ефіру. Осад відфільтрували та висушили. Вихід: 0,33г сполуки 514 (60%) (т.пл.: 76726 185°С). Приклад В 13 Приготування 58 Суміш проміжної сполуки 28 (0,019моль), 2бензофуранілборонозої кислота (0,028моль), Рd(РРh3)4 (0,001моль) та ВНТ (невелика кількість) у діоксані (25мл ) та Na2СО3 [2] (25мл) перемішували та нагрівали зі зворотнім холодильником протягом 8 годин та екстрагували EtOAc. Водяний шар перетворили у основу за допомогою NН4ОН та екстрагували СН2СІ2. Органічний шар виділили, висушили (MgSO4), відфільтрували, та розчинник випаровували. Залишок (3,6г) очистили за допомогою колонкової хроматографії на силікагелі (елюент: СН2СІ2/СН3ОН 99/1; 15-40мкм). Чисті фракції зібрали та розчинник випаровували. Вихід: 1,8г (33%). Цю фракцію кристалізували з 2пропанон/діетилового ефіру. Осад відфільтрували та висушили. Вихід: 0,39г сполуки 515 (7%) (т.пл.: 134°С). Приклад В14 Приготування Триетилсилан (0,0012моль) додали повільно при кімнатній температурі до розчину проміжної сполуки 32 (0,004моль) у CF3COOH (5мл) та АсОН (10мл). NaBH4 (0,0012моль) було додано по порціях під потоком N2. Суміш перемішувалі при кімнатній температурі протягом 8 годин, вилили на лід, перетворили у основу за допомогою К2СО3 та екстрагували СН2СІ2. Органічний шар виділили, висушили (MgSO4), відфільтрували, та розчинник випаровували. Залишок (1,2г) очистили за допомогою колонкової хроматографії на силікагелі (елюент: СН2СІ2/СН3ОН 99/1; 15-40мкм). Дві фракції зібрали та розчинник випаровували. Вихід: 0,5г F1 (43%) та 0,4г F2. F1 розчинили у iРrOН. Додали НСІ/іРrОН (1 еквівалент). Осад відфільтрували та висушили; Вихід: 0,32г сполуки 526 (т.пл.: 248°С). Приклад В15 Приготування Суміш проміжної сполуки 33 (0,082моль) та 3хлор-2-етил-2-бутенал (0,098моль) у АсОН (200мл) перемішували та нагрівали зі зворотнім холодильником протягом 8 годин. Розчинник випаровували до сухості. Залишок розчинили у СН2СІ2 та промили К2СО3 10%. Органічний шар виділили, висушили (MgSO4), відфільтрували, та 59 76726 розчинник випаровували. Залишок (27г) очистили за допомогою колонкової хроматографії на силікагелі (елюент: СН2СІ2/EtOAc 95/5 до 92/8; 1535мкм). Дві фракції зібрали та розчинник випаровували. Вихід: 0,7г F1 та 5,3г F2. F1 кристалізували з 2-пропанону/діетилового ефіру. Осад відфільтрували та висушили. Вихід: 0,25г сполуки 471 (2%) (т.пл.: 140°С). Таблиці 1-8 показують сполуки формули (l-А) та (І-В) які були отримані відповідно до одного з вищенаведених прикладів. 60
ДивитисяДодаткова інформація
Назва патенту англійськоюMetabotropic antagonists of glutamate receptor, process for preparing thereof (variants), pharmaceutical composition and process for preparing thereof
Назва патенту російськоюМетаботропические антагонисты рецептора глутамата, способ их получения (варианты), фармацевтическая композиция и способ ее получения
МПК / Мітки
МПК: A61K 31/47, A61P 25/28, A61P 9/10, A61K 31/4704, C07D 215/18, C07D 219/00, C07D 215/36, C07D 215/12, C07D 221/10, C07D 215/38, A61P 25/30, C07F 7/08, C07D 215/227, C07D 215/60, A61P 43/00, C07D 487/04, A61P 25/08, C07D 215/48, A61K 31/4709, C07D 471/04, A61P 25/22, A61K 31/4745, C07D 453/00, C07D 215/14, A61K 31/506, A61K 31/473, C07D 495/04, A61P 25/18, A61P 25/16, C07D 409/04, C07D 215/22, A61P 3/08, C07D 417/04, A61K 31/4743, C07D 417/06, C07D 491/052, C07D 215/04, A61K 31/541, A61P 25/00, A61P 29/00, A61K 31/4741, A61P 25/14, A61P 25/20, C07D 405/04, C07D 221/16, C07D 401/06, A61P 25/04, C07D 409/12, C07D 405/12, C07D 491/048, A61K 31/5377, C07D 221/12, A61P 5/00, C07D 409/06, C07D 405/06, C07D 491/04, A61P 25/24, C07D 215/50, C07D 401/12, C07D 401/04, C07D 413/12, C07D 215/54
Мітки: фармацевтична, антагоністи, глутамату, композиція, варіанти, одержання, спосіб, метаботропічні, рецептора
Код посилання
<a href="https://ua.patents.su/43-76726-metabotropichni-antagonisti-receptora-glutamatu-sposib-kh-oderzhannya-varianti-farmacevtichna-kompoziciya-ta-sposib-oderzhannya.html" target="_blank" rel="follow" title="База патентів України">Метаботропічні антагоністи рецептора глутамату, спосіб їх одержання (варіанти), фармацевтична композиція та спосіб її одержання</a>
Попередній патент: Пакувальний ламінований матеріал та виготовлений з нього пакувальний контейнер
Наступний патент: Пристрій для іонізації газового середовища
Випадковий патент: Спосіб годівлі молодняку м'ясних перепелів