6-алкеніл- та 6-фенілалкілзаміщені 2-хінолінони та 2-хіноксалінони як інгібітори полі(адф-рибоза)полімерази
Номер патенту: 86777
Опубліковано: 25.05.2009
Автори: Мабір Домінік Жан-Пьер, Сомерс Марія Вікторіна Франціска, Воутерс Валтер Боудевіджн Леопольд, Жільмон Жером Еміль Жорж, ван Дун Якобус Алфонсус Джосепхус
Формула / Реферат
1. Сполука формули (І)
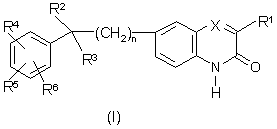 ,
,
її N-оксидні форми, солі приєднання та стереохімічно ізомерні форми, де
n дорівнює 0, 1 або 2;
X позначає N або CR7, де R7 позначає гідроген, або, взятий разом з R1, може утворювати двовалентний радикал формули -СН=СН-СН=СН-;
R1 позначає С1-6-алкіл або тіофеніл;
R2 позначає гідроген, гідрокси, С1-6-алкіл, С3-6-алкініл, або, взятий разом з R3, може утворювати =O;
R3 позначає радикал, вибраний з
-(CH2)s-NR8R9, (а-1)
-O-Н, (а-2)
-O-R10, (а-3)
-S-R11 (а-4) або
-C![]() N, (а-5)
N, (а-5)
де s дорівнює 0, 1, 2 або 3;
R8, R10 та R11 кожен незалежно вибирають з -СНО, С1-6-алкілу, гідроксі-С1-6-алкілу, С1-6-алкілкарбонілу, аміно, С1-6-алкіламіно, ді-(С1-6-алкіл)аміно-С1-6-алкілу, С1-6-алкілоксикарбонілу, С1-6-алкілкарбоніламіно-С1-6-алкілу, піперидиніл-С1-6-алкіламінокарбонілу, піперидинілу, піперидиніл-С1-6-алкілу, С1-6-алкілокси, тіофеніл-С1-6-алкілу, піроліл-С1-6-алкілу, арил-С1-6-алкілпіперидинілу, арилкарбоніл-С1-6-алкілу, арилкарбонілпіперидиніл-С1-6-алкілу, галогеніндазолілпіперидиніл-С1-6-алкілу, арил-С1-6-алкіл-(С1-6-алкіл)аміно-С1-6-алкілу, і
R9 позначає гідроген або С1-6-алкіл;
або R3 є групою формули
-(CH2)t-Z, (b-1)
де
t дорівнює 0, 1, 2 або 3;
Z є гетероциклічною кільцевою системою, вибраною з 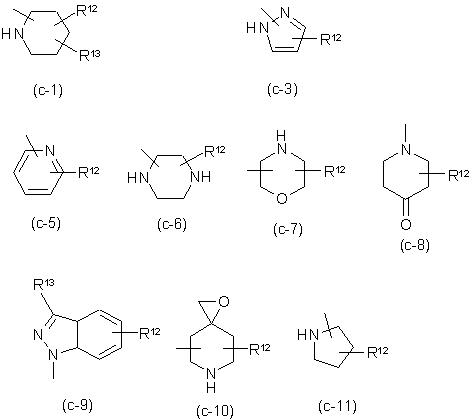 ,
,
де R12 позначає гідроген, галоген, С1-6-алкіл, амінокарбоніл, аміно, гідрокси, арил,  ,
, 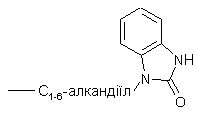 , С1-6-алкіламіно-С1-6-алкілокси, С1-6-алкілоксі-С1-6-алкіл,С1-6-алкілоксі-С1-6-алкіламіно, арил-С1-6-алкіл, ди(феніл-С2-6-алкеніл), піперидиніл, піперидиніл-С1-6-алкіл, С3-10-циклоалкіл, С3-10-циклоалкіл-С1-6-алкіл, арилокси(гідроксі)-С1-6-алкіл, галогеніндазоліл, арил-С1-6-алкіл, арил-С2-6-алкеніл, арил-С1-6-алкіламіно, морфоліно, С1-6-алкілімідазоліл, піридиніл-С1-6-алкіламіно; і
, С1-6-алкіламіно-С1-6-алкілокси, С1-6-алкілоксі-С1-6-алкіл,С1-6-алкілоксі-С1-6-алкіламіно, арил-С1-6-алкіл, ди(феніл-С2-6-алкеніл), піперидиніл, піперидиніл-С1-6-алкіл, С3-10-циклоалкіл, С3-10-циклоалкіл-С1-6-алкіл, арилокси(гідроксі)-С1-6-алкіл, галогеніндазоліл, арил-С1-6-алкіл, арил-С2-6-алкеніл, арил-С1-6-алкіламіно, морфоліно, С1-6-алкілімідазоліл, піридиніл-С1-6-алкіламіно; і
R13 позначає гідроген, піперидиніл або арил;
R4, R5 та R6 кожен незалежно вибирають з гідрогену, галогену, тригалогенметилу, тригалогенметокси, С1-6-алкілу, С1-6-алкілокси, аміно, аміно-С1-6-алкілу, ді-(С1-6-алкіл)аміно, ді-(С1-6-алкіл)аміно-С1-6-алкілокси або С1-6-алкілоксикарбонілу, або С1-6-алкілу, заміщеного 1, 2 або 3 замісниками, незалежно вибраними з гідрокси, С1-6-алкілокси або аміно-С1-6-алкілокси; або
коли R5 та R6 знаходяться в суміжних положеннях, узяті разом, вони можуть утворювати двовалентний радикал формули
-О-СН2-О, (d-1)
-О-(СН2)2-О-, (d-2)
-СН=СН-СН=СН- (d-3) або
-NH-C(O)-NR14=CH-, (d-4)
де R14 позначає С1-6-алкіл;
арил є фенілом, фенілом, заміщеним галогеном, С1-6-алкілом або С1-6-алкілокси;
за умови, що 6-бензоїл-3-метил-2(1Н)-хіноксалінон є виключеним.
2. Сполука за п. 1, де
R1 позначає С1-6-алкіл;
R3 позначає радикал, вибраний з (а-1), (а-2), (а-3) чи (а-5), або є групою формули (b-1); s дорівнює 0, 1 або 2;
R8 та R10 кожен незалежно вибирають з -СНО, С1-6-алкілу, гідроксі-С1-6-алкілу, ді-(С1-6-алкіл)аміно-С1-6-алкілу, С1-6-алкілкарбоніламіно-С1-6-алкілу, піперидиніл-С1-6-алкілу, піперидиніл-С1-6-алкіламінокарбонілу, С1-6-алкілокси, тіофеніл-С1-6-алкілу, піроліл-С1-6-алкілу, арил-С1-6-алкілпіперидинілу, арилкарбоніл-С1-6-алкілу, арилкарбонілпіперидиніл-С1-6-алкілу, галогеніндазолілпіперидиніл-С1-6-алкілу або арил-С1-6-алкіл-(С1-6-алкіл)аміно-С1-6-алкілу;
t дорівнює 0 або 2;
Z є гетероциклічною кільцевою системою, вибраною з (с-1), (с-6), (с-8), (с-9) або (с-11);
R12 позначає гідроген, С1-6-алкіл, амінокарбоніл, 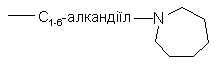 , С1-6-алкілоксі-С1-6-алкіламіно, ди(феніл-С2-6-алкеніл), піперидиніл-С1-6-алкіл, С3-10-циклоалкіл, С3-10-циклоалкіл-С1-6-алкіл, галогеніндазоліл або арил-С2-6-алкеніл;
, С1-6-алкілоксі-С1-6-алкіламіно, ди(феніл-С2-6-алкеніл), піперидиніл-С1-6-алкіл, С3-10-циклоалкіл, С3-10-циклоалкіл-С1-6-алкіл, галогеніндазоліл або арил-С2-6-алкеніл;
R4, R5 та R6 кожен незалежно вибирають з гідрогену, галогену, тригалогенметилу, тригалогенметокси, С1-6-алкілу, С1-6-алкілокси, ді-(С1-6-алкіл)аміно, ді-(С1-6-алкіл)аміно-С1-6-алкілокси або С1-6-алкілоксикарбонілу; і
коли R5 та R6 знаходяться в суміжних положеннях, узяті разом, утворюють двовалентний радикал формули (d-1) або (d-2).
3. Сполука за будь-яким з пп. 1-2, де n дорівнює 0; X позначає СН; R1 позначає С1-6-алкіл; R2 позначає гідроген; R3 є групою формули (b-1); t дорівнює 2; Z є гетероциклічною кільцевою системою, вибраною з (с-1); R12 позначає гідроген; R13 позначає гідроген; і R5 та R6 знаходяться в суміжних положеннях, і, узяті разом, вони можуть утворювати двовалентний радикал формули (d-2).
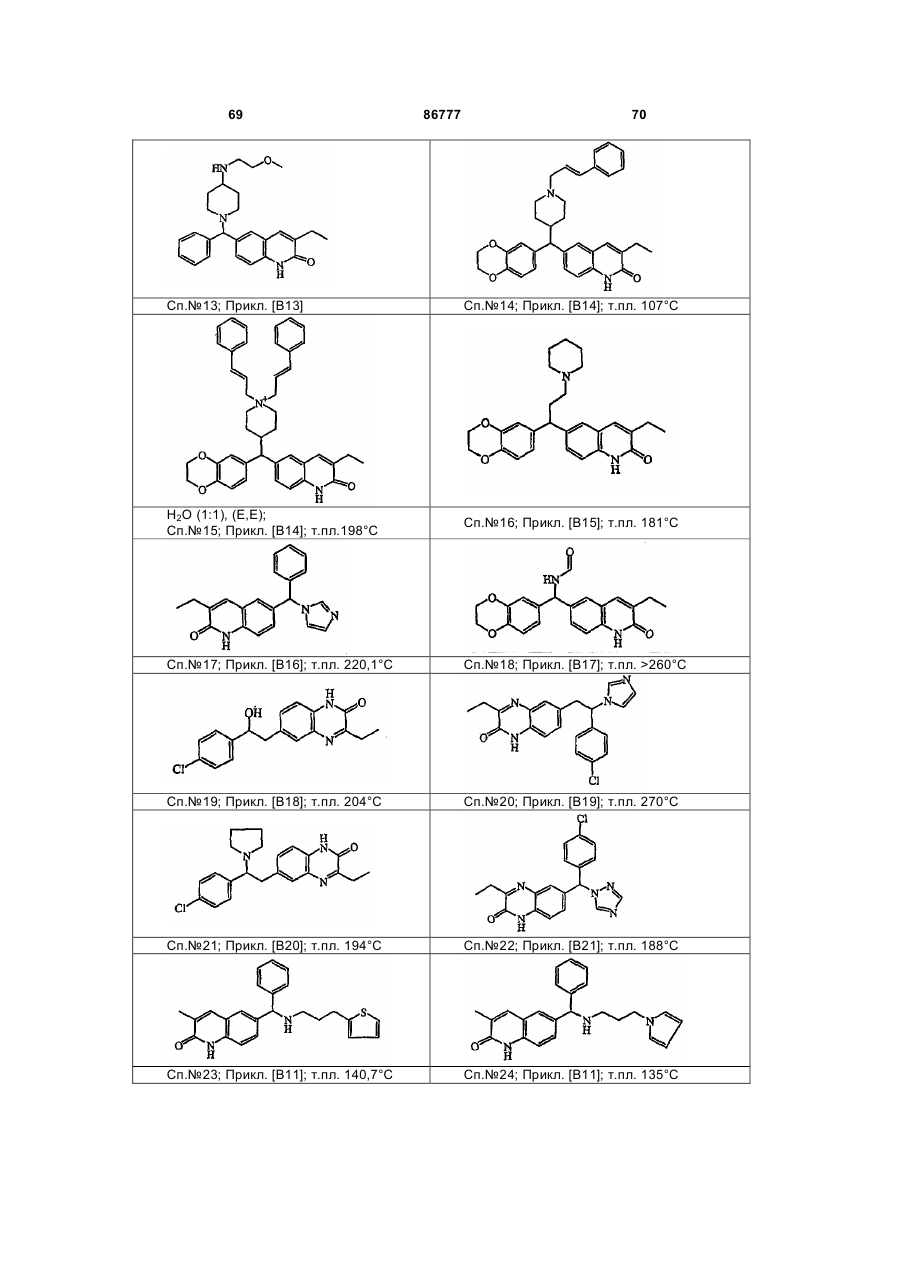
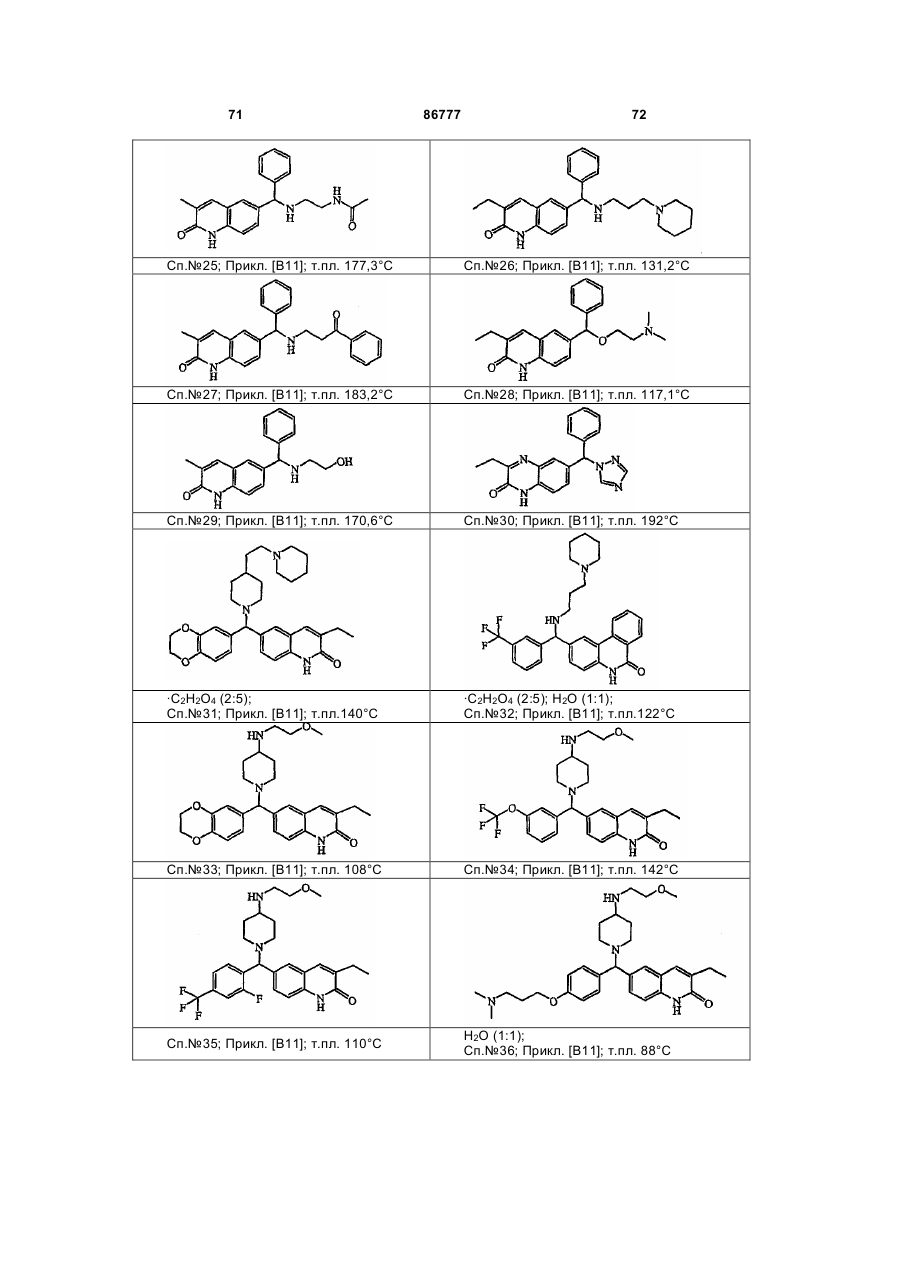
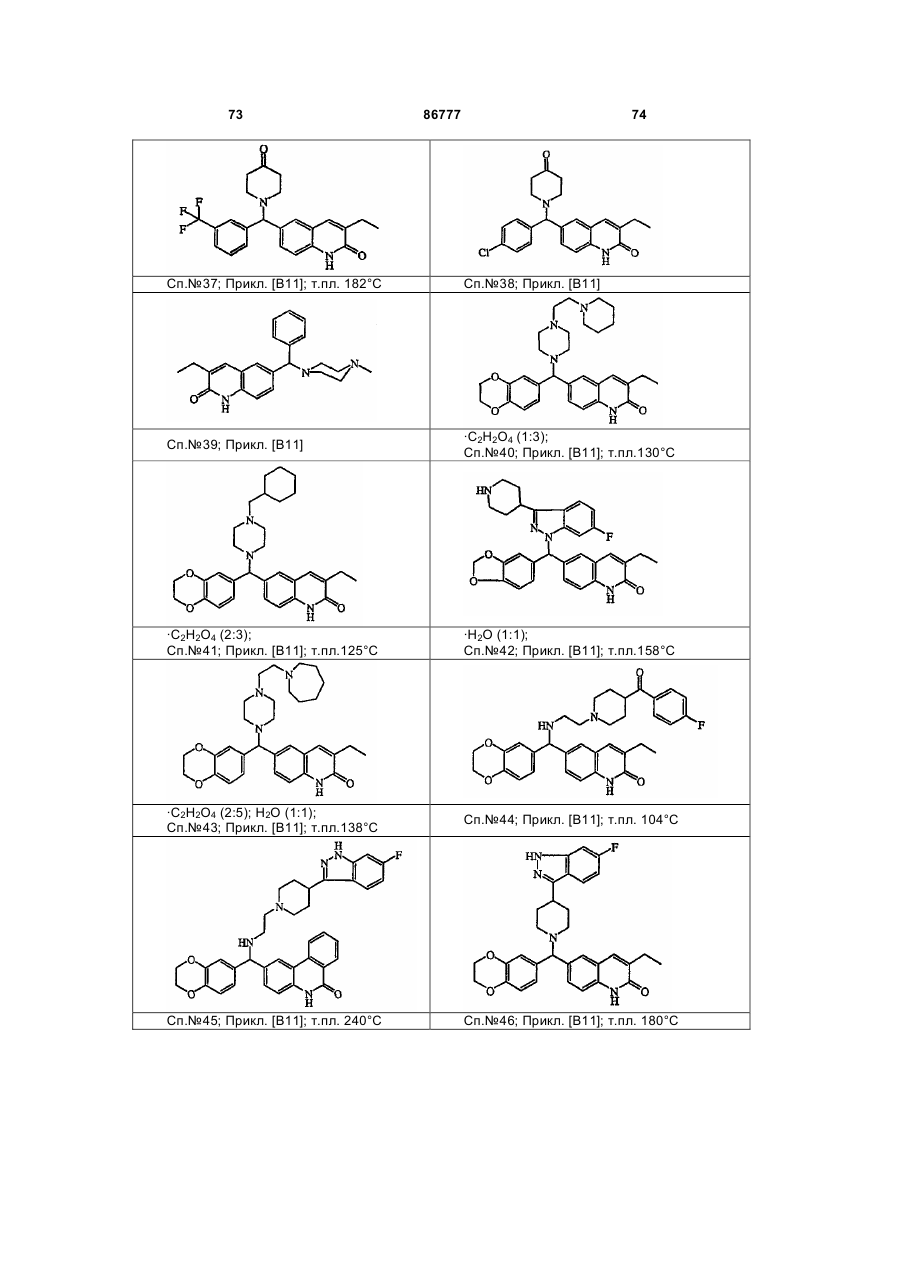
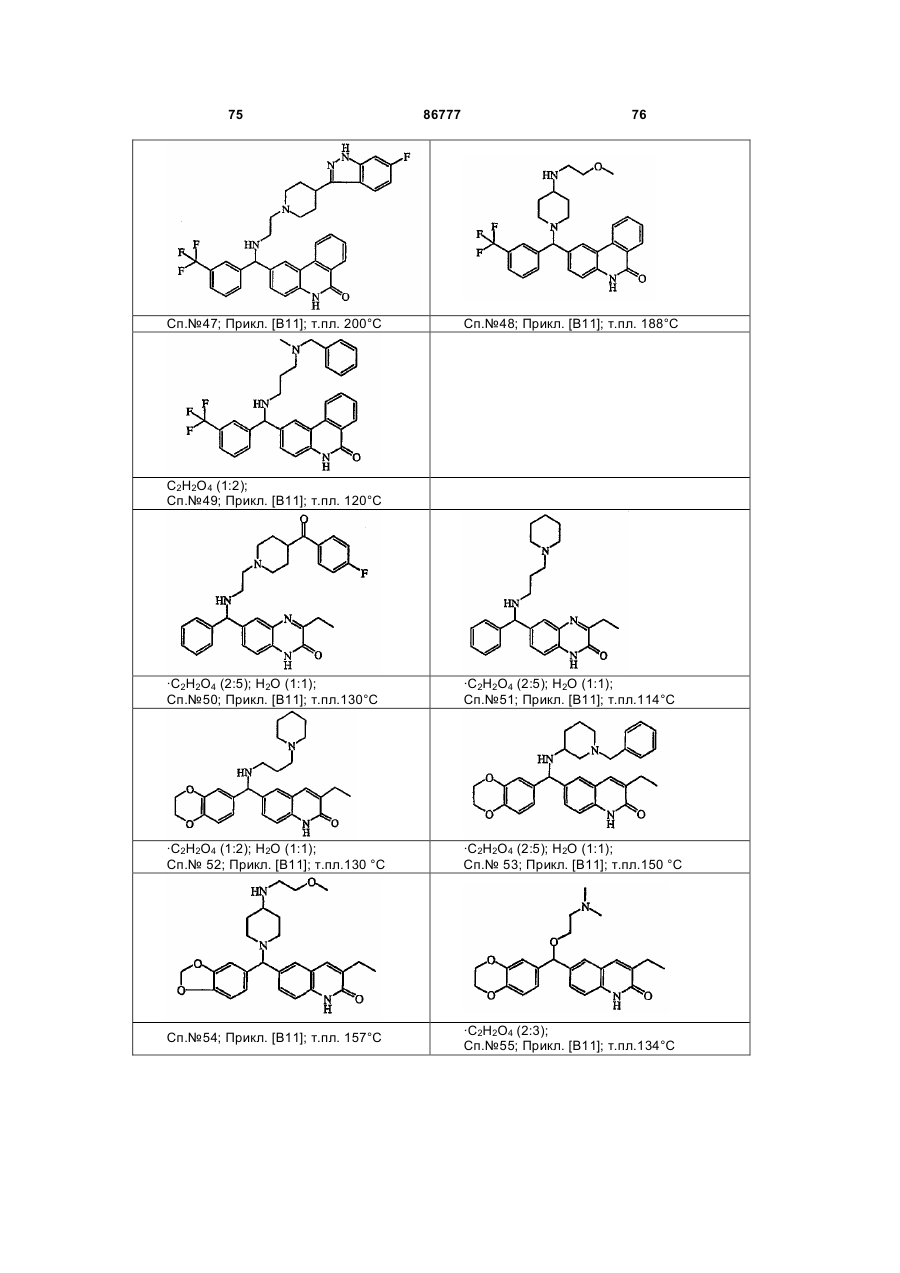
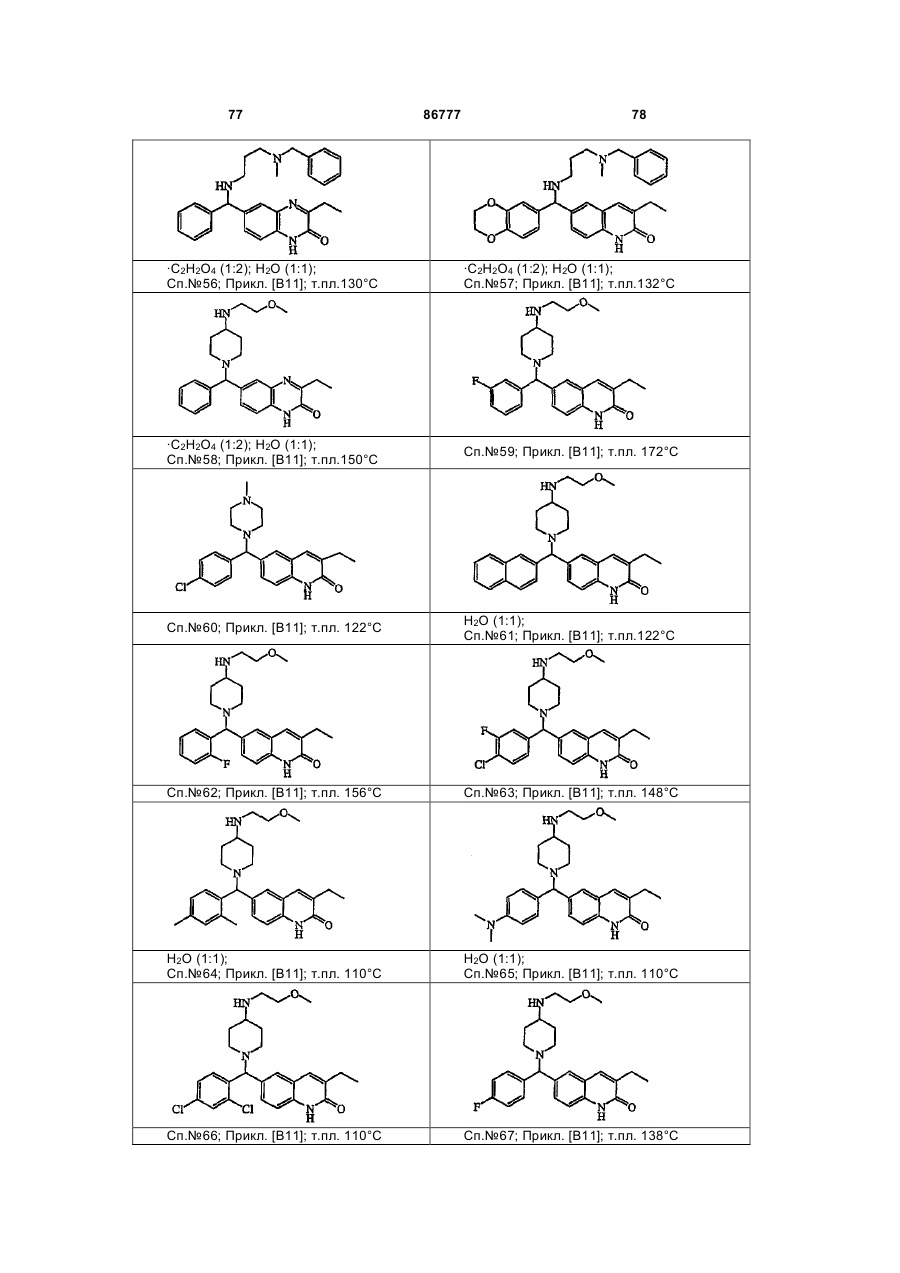
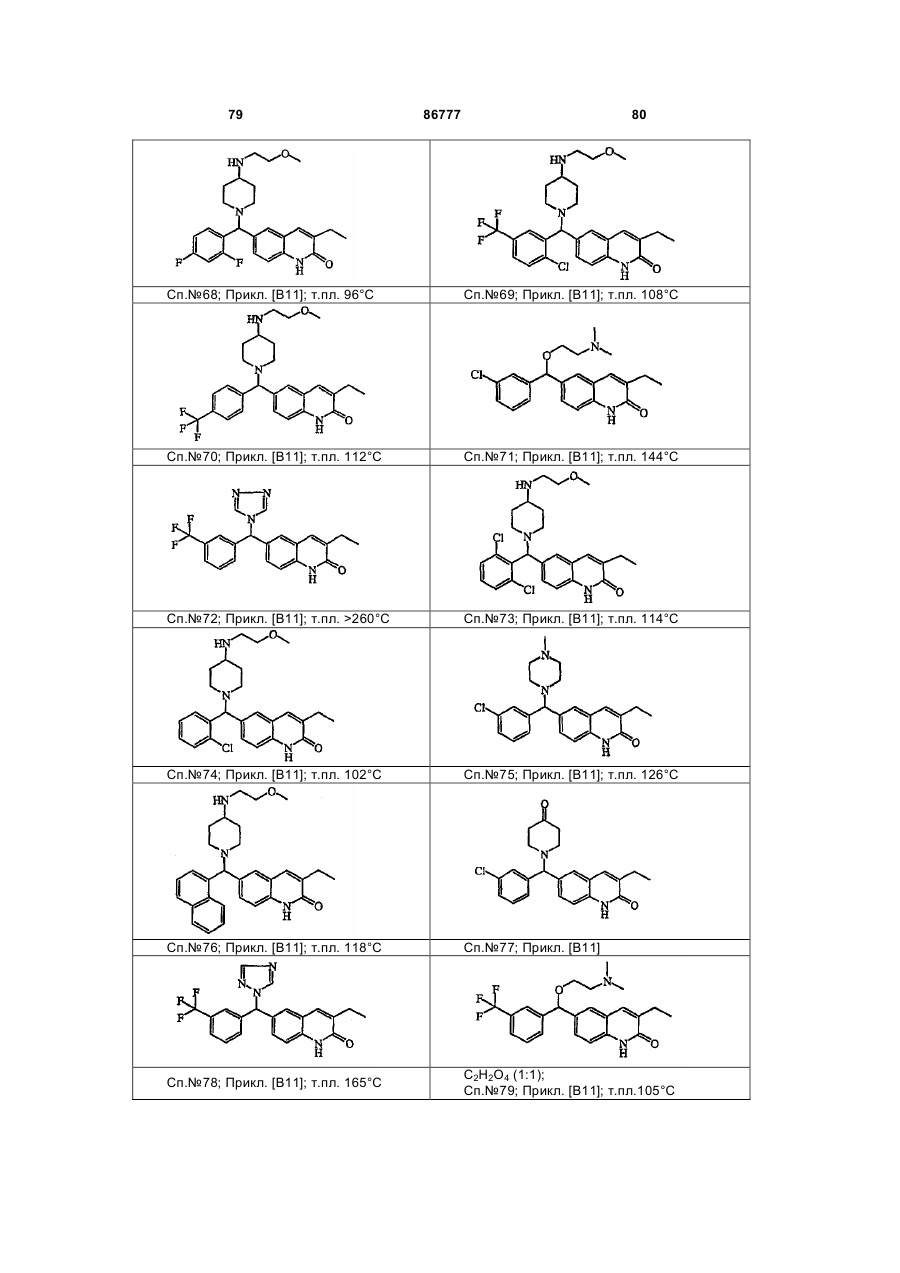
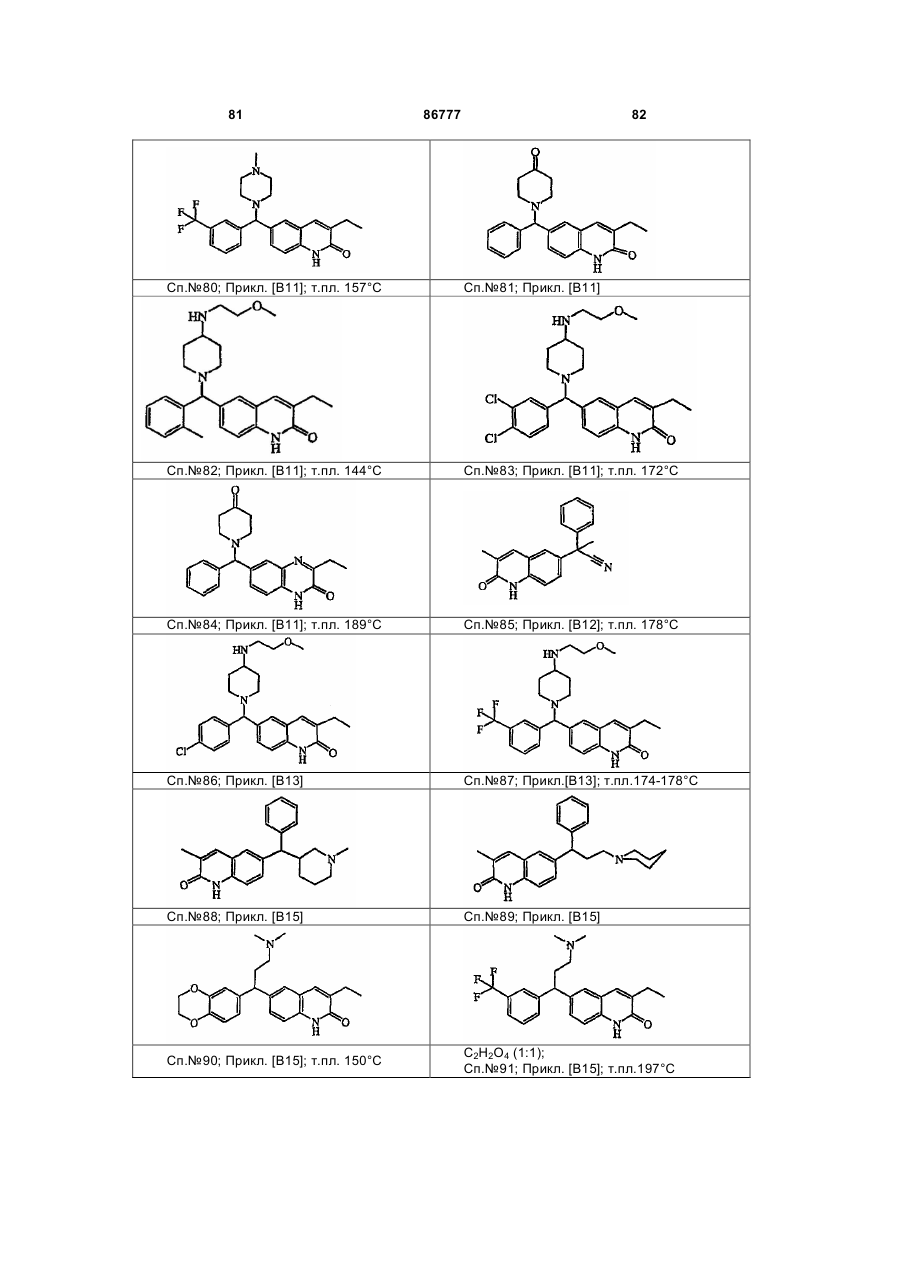
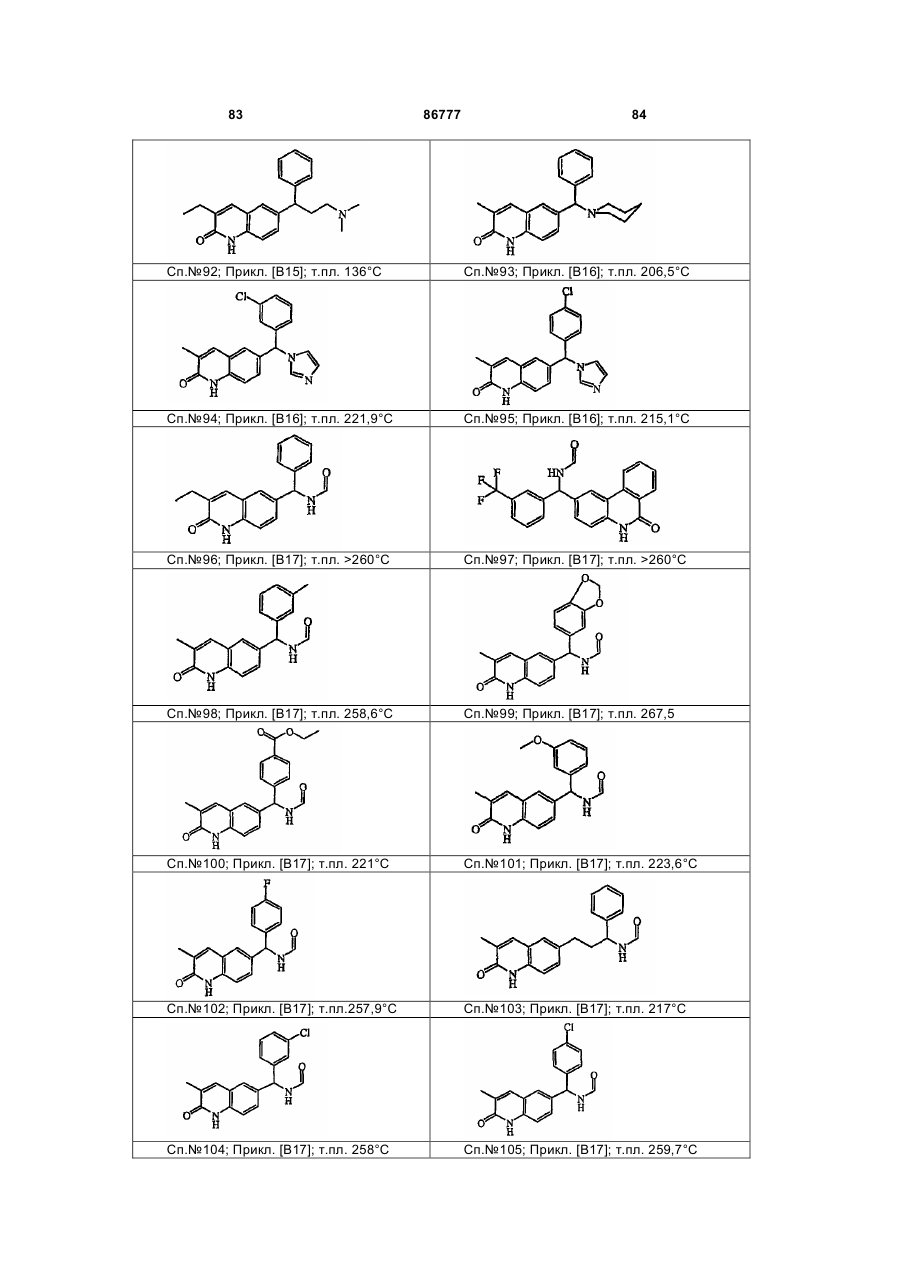
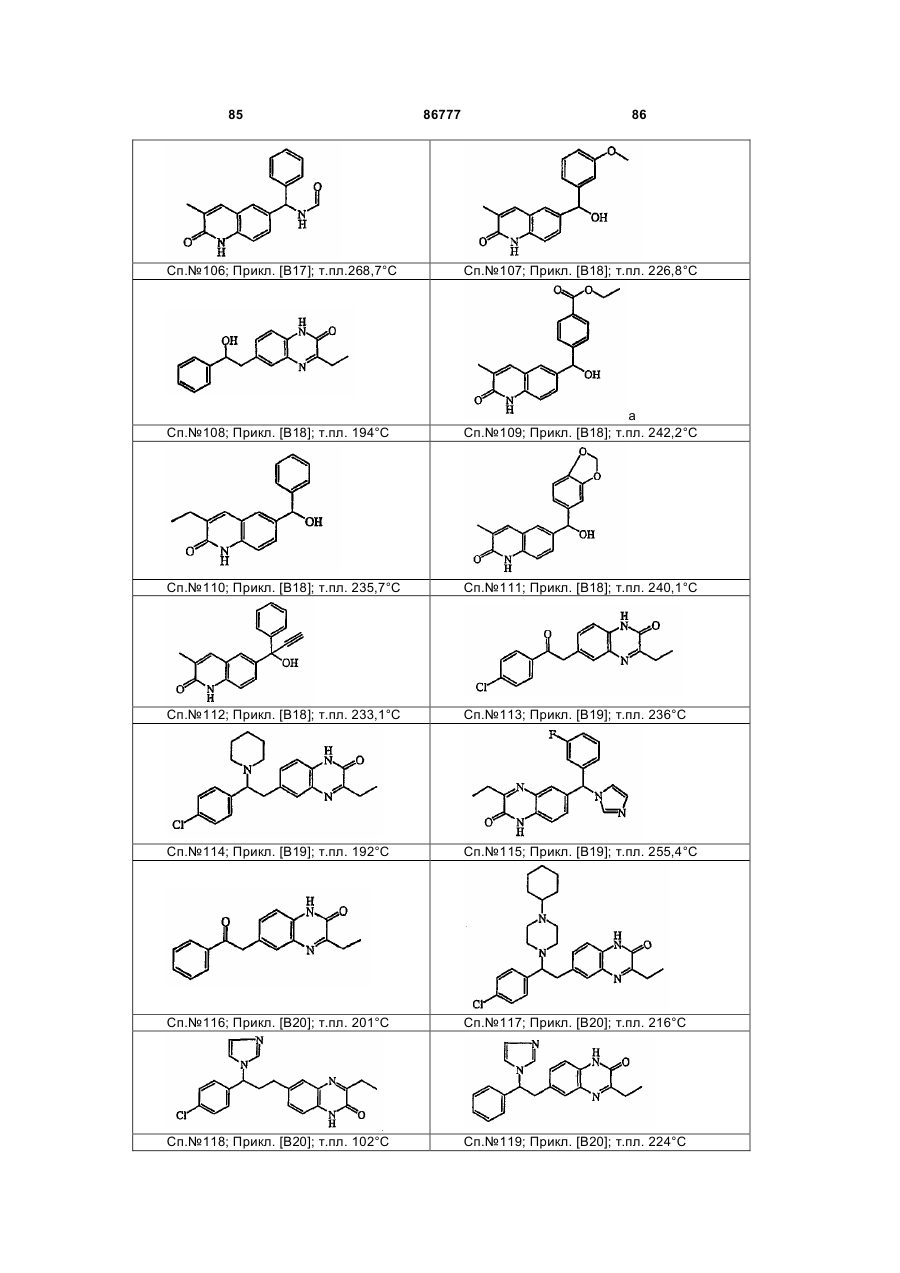
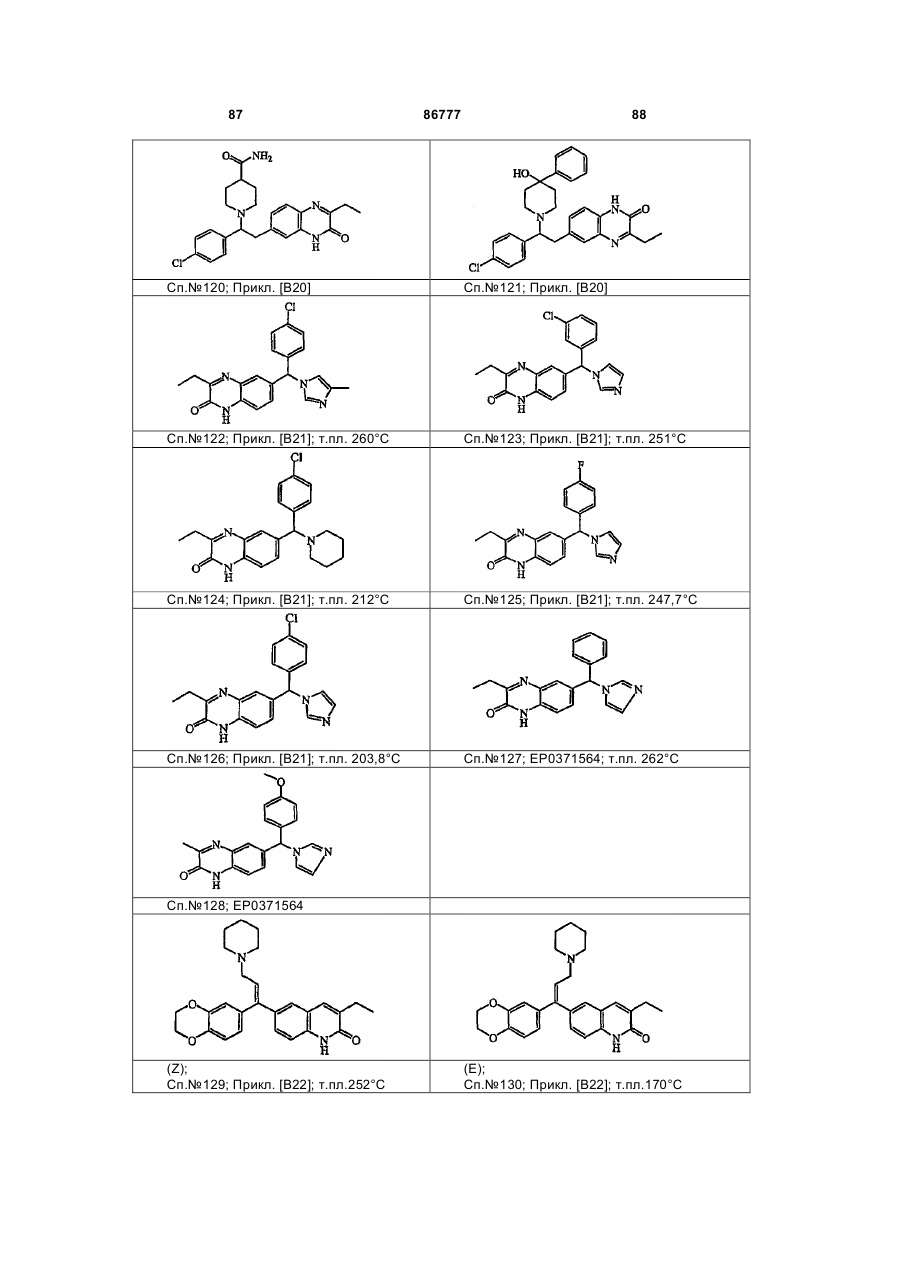
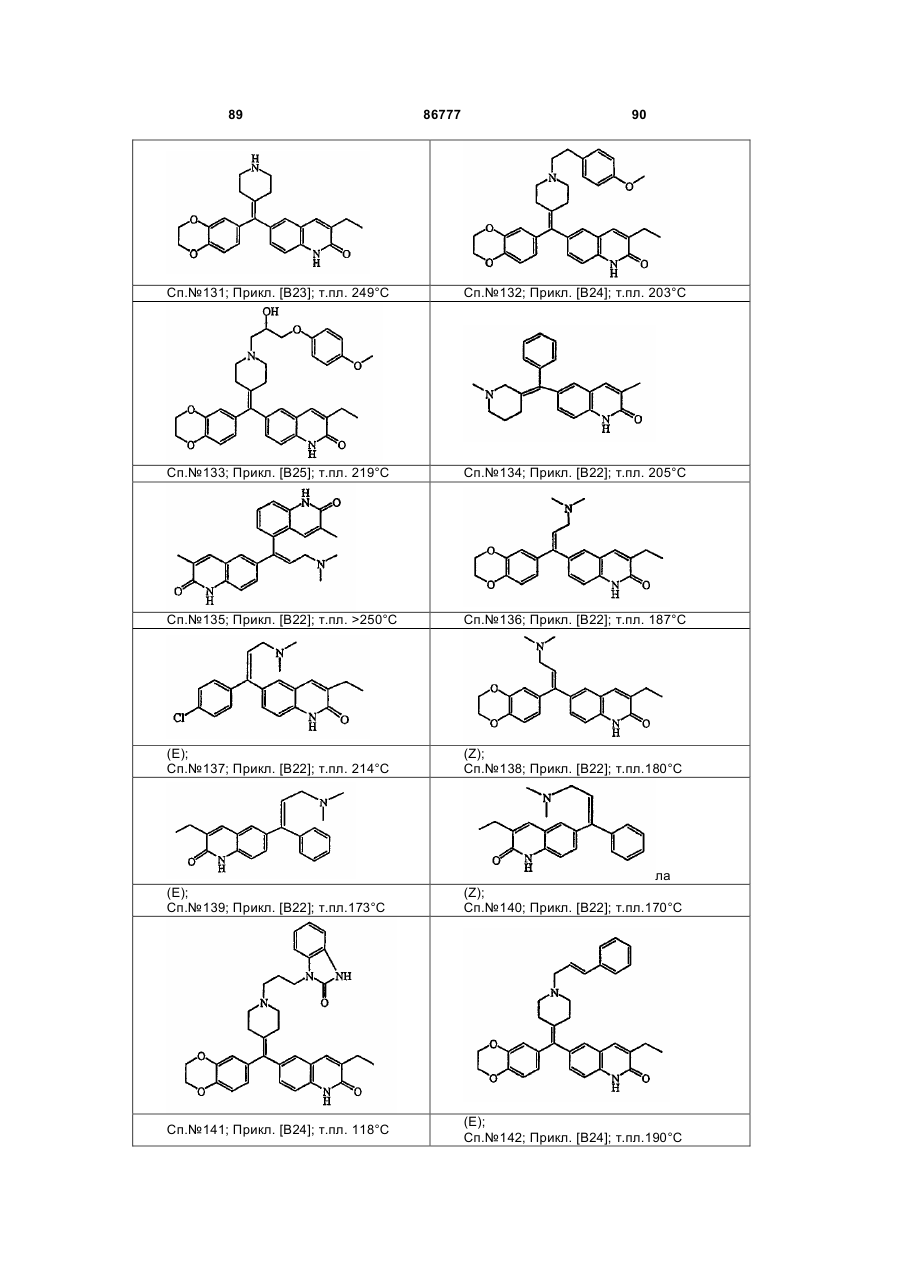
4. Сполука за будь-яким з пп. 1, 2 та 3, де сполукою є сполука № 16, сполука № 144 і сполука № 145.
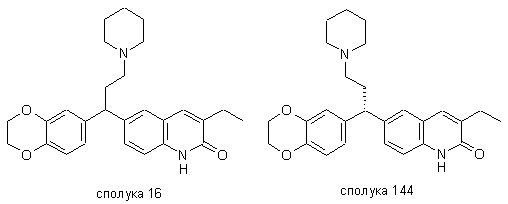
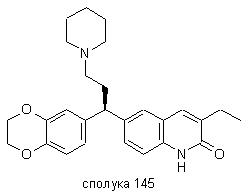 .
.
5. Сполука формули (VII-a)
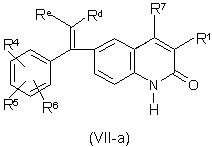 ,
,
її N-оксидні форми, солі приєднання та стереохімічно ізомерні форми,
де
R1, R4, R5, R6, R7 та арил є такими, як визначено в п. 1;
Re позначає гідроген, або, взятий разом з Rd, може утворювати двовалентний радикал формули
-(CH2)2-NR15-(CH2)2- (е-1) або
-CH2-NR16-(CH2)3-, (е-2)
де R15 та R16 кожен незалежно вибирають з гідрогену, С1-6-алкілу, 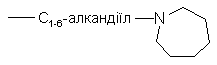 ,
, 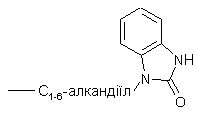 , С1-6-алкілоксі-С1-6-алкілу, піперидиніл-С1-6-алкілу, С3-10-циклоалкіл-С1-6-алкілу, арилокси(гідроксі)-С1-6-алкілу, арил-С1-6-алкілу або арил-С2-6-алкенілу; або
, С1-6-алкілоксі-С1-6-алкілу, піперидиніл-С1-6-алкілу, С3-10-циклоалкіл-С1-6-алкілу, арилокси(гідроксі)-С1-6-алкілу, арил-С1-6-алкілу або арил-С2-6-алкенілу; або
Rd є ді-(С1-6-алкіл)аміно-С1-6-алкілом або піперидиніл-С1-6-алкілом.
6. Сполука, вказана в будь-якому з пп. 1-5, для застосування як лікарський препарат.
7. Фармацевтична композиція, яка містить фармацевтично прийнятні носії та терапевтично ефективну кількість сполуки, вказаної в будь якому з пп. 1-5, як активний інгредієнт.
8. Спосіб одержання фармацевтичної композиції, вказаної в п. 7, де фармацевтично прийнятні носії та сполуки за будь яким з пп. 1-5 ретельно змішують.
9. Застосування сполуки вказаної в будь якому з пп. 1-5 для виробництва лікарського засобу для лікування PARP опосередкованого захворювання.
10. Застосування за п. 9, де сполукою є сполука за будь-яким з пп. 1-4.
11. Застосування за пп. 9 або 10, де лікування включає хіміосенсибілізацію.
12. Застосування за пп. 9 або 10, де лікування включає радіосенсибілізацію.
13. Комбінація сполуки з хіміотерапевтичним засобом, у якій зазначеною сполукою є сполука, вказана в будь-якому з пп. 1-5, і де зазначений хіміотерапевтичний засіб вибрано з групи, що включає 5-фторурацил, лейковорин, 5'-аміно-5'-дезокситимідин, кисень, карбоген, перфторкарбони (наприклад, Fluosol 10 DA), 2,3-DPG, BW12C, блокатор кальцієвих каналів, пентоксифілін, сполука, що пригнічує ріст судин, гідралазин, LBSO, адріаміцин, камтотецин, карбоплатин, цисплатин, даунорубіцин, доцетаксел, доксорубіцин, інтерферон (альфа, бета, гамма), інтерлейкін-2, іринотекан, паклітаксел, топотекан та їхні похідні, метилувальний засіб, інгібітор топоізомерази І, блеоміцин.
14. Комбінація по п. 13 де сполукою є сполука за будь-яким з пп. 1-4.
15. Спосіб одержання сполуки, вказаної в пп. 1 або 5, при якому
перетворюють проміжні сполуки формули (VII) селективним гідруванням зазначеної проміжної сполуки відповідним відновлювальним агентом і відповідним відновником у відповідному розчиннику з утворенням сполук формули (І), де R2 позначає гідроген і де R3 є групою формули (b-1) або радикалом формули (а-1), де s не є 0, називані Rg, називані сполуками формули (І-і)
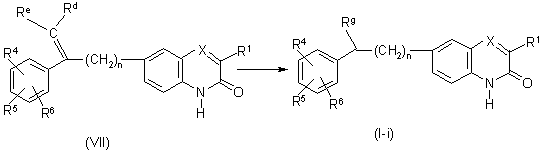 ,
,
де R1, R4-R6, X, n є такими, як визначено в п. 1; Re та Rd є такими, як визначено в п. 5.
16. Спосіб одержання сполуки, вказаної в п. 5, при якому здійснюють
a) взаємодію сполуки формули (VII-а), де Re, узятий разом з Rd, утворює двовалентний радикал формули (е-1) або (е-2) і R15 або R16 позначає гідроген, називані сполуками формули (VII-a-2), з проміжною сполукою формули (XIX), де W є відповідною відхідною групою і R15 або R16 не є гідрогеном, з утворенням сполук формули (VII-a-1), визначених як сполуки формули (VII-а), де Re, узятий разом з Rd, утворює двовалентний радикал формули (е-1) або (е-2) і R15 або R16 не є гідрогеном, в реакційноінертному розчиннику;
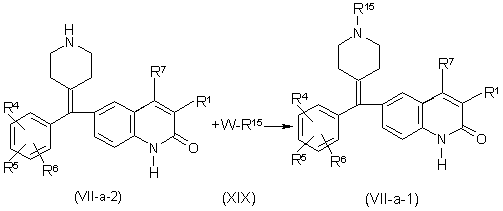 ,
,
де R1, R4-R7 є такими, як визначено в п. 5, або
b) взаємодію сполуки формули (VII-a-2) з проміжною сполукою формули (XX), де R є відповідним замісником, з утворенням сполук формули (VII-а), де R15 або R16 є арилокси(гідроксі)-С1-6-алкілом, називані сполуками формули (VII-a-3), в присутності 2-пропанолу
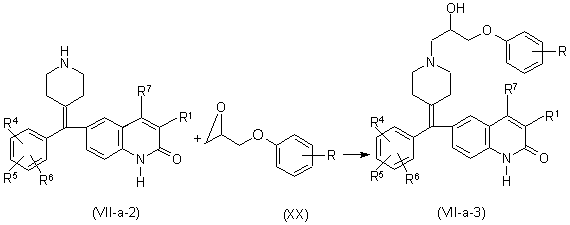 ,
,
де R1, R4-R7 є такими, як визначено в п. 5.
Текст
1. Сполука формули (І) 2 (19) 1 3 86777 t дорівнює 0, 1, 2 або 3; Z є гетероциклічною кільцевою системою, вибраною R12 HN HN N R12 R13 (c-3) (c-1) N H N R12 R12 N R12 NH HN R12 4 ридиніл-С1-6-алкілу, піперидиніл-С1-6алкіламінокарбонілу, С1-6-алкілокси, тіофеніл-С1-6алкілу, піроліл-С1-6-алкілу, арил-С1-6алкілпіперидинілу, арилкарбоніл-С1-6-алкілу, арилкарбонілпіперидиніл-С1-6-алкілу, галогеніндазолілпіперидиніл-С1-6-алкілу або арил-С1-6-алкіл-(С1-6алкіл)аміно-С1-6-алкілу; t дорівнює 0 або 2; Z є гетероциклічною кільцевою системою, вибраною з (с-1), (с-6), (с-8), (с-9) або (с-11); R12 позначає гідроген, С1-6-алкіл, амінокарбоніл, O (c-5) (c-6) C1-6-алкандіїл O (c-8) (c-7) R13 O R12 N R12 N HN R12 N H (c-9) (c-11) (c-10) з , 12 де R позначає гідроген, галоген, С1-6-алкіл, амінокарбоніл, аміно, гідрокси, арил, C1-6-алкандіїл N NH C1-6-алкандіїл N O , , С1-6-алкіламіно-С1-6-алкілокси, С1-6-алкілоксі-С1-6алкіл, С1-6-алкілоксі-С1-6-алкіламіно, арил-С1-6алкіл, ди(феніл-С2-6-алкеніл), піперидиніл, піперидиніл-С1-6-алкіл, С3-10-циклоалкіл, С3-10-циклоалкілС1-6-алкіл, арилокси(гідроксі)-С1-6-алкіл, галогеніндазоліл, арил-С1-6-алкіл, арил-С2-6-алкеніл, арилС1-6-алкіламіно, морфоліно, С1-6-алкілімідазоліл, піридиніл-С1-6-алкіламіно; і R13 позначає гідроген, піперидиніл або арил; R4, R5 та R6 кожен незалежно вибирають з гідрогену, галогену, тригалогенметилу, тригалогенметокси, С1-6-алкілу, С1-6-алкілокси, аміно, аміно-С1-6алкілу, ді-(С1-6-алкіл)аміно, ді-(С1-6-алкіл)аміно-С1-6алкілокси або С1-6-алкілоксикарбонілу, або С1-6алкілу, заміщеного 1, 2 або 3 замісниками, незалежно вибраними з гідрокси, С1-6-алкілокси або аміно-С1-6-алкілокси; або коли R5 та R6 знаходяться в суміжних положеннях, узяті разом, вони можуть утворювати двовалентний радикал формули -О-СН2-О, (d-1) -О-(СН2)2-О-, (d-2) -СН=СН-СН=СН- (d-3) або -NH-C(O)-NR14=CH-, (d-4) де R14 позначає С1-6-алкіл; арил є фенілом, фенілом, заміщеним галогеном, С1-6-алкілом або С1-6-алкілокси; за умови, що 6-бензоїл-3-метил-2(1Н)-хіноксалінон є виключеним. 2. Сполука за п.1, де R1 позначає С1-6-алкіл; R3 позначає радикал, вибраний з (а-1), (а-2), (а-3) чи (а-5), або є групою формули (b-1); s дорівнює 0, 1 або 2; R8 та R10 кожен незалежно вибирають з -СНО, С16-алкілу, гідроксі-С1-6-алкілу, ді-(С1-6-алкіл)аміно-С16-алкілу, С1-6-алкілкарбоніламіно-С1-6-алкілу, піпе N , С1-6-алкілоксі-С1-6алкіламіно, ди(феніл-С2-6-алкеніл), піперидиніл-С1С3-10-циклоалкіл, С3-10-циклоалкіл-С1-66-алкіл, алкіл, галогеніндазоліл або арил-С2-6-алкеніл; R4, R5 та R6 кожен незалежно вибирають з гідрогену, галогену, тригалогенметилу, тригалогенметокси, С1-6-алкілу, С1-6-алкілокси, ді-(С1-6-алкіл)аміно, ді-(С1-6-алкіл)аміно-С1-6-алкілокси або С1-6алкілоксикарбонілу; і коли R5 та R6 знаходяться в суміжних положеннях, узяті разом, утворюють двовалентний радикал формули (d-1) або (d-2). 3. Сполука за будь-яким з пп.1-2, де n дорівнює 0; X позначає СН; R1 позначає С1-6-алкіл; R2 позначає гідроген; R3 є групою формули (b-1); t дорівнює 2; Z є гетероциклічною кільцевою системою, вибраною з (с-1); R12 позначає гідроген; R13 позначає гідроген; і R5 та R6 знаходяться в суміжних положеннях, і, узяті разом, вони можуть утворювати двовалентний радикал формули (d-2). 4. Сполука за будь-яким з пп.1, 2 та 3, де сполукою є сполука № 16, сполука № 144 і сполука № 145. N N O O O N H O N H O O сполука 144 сполука 16 N O N H O O . 5. Сполука формули (VII-a) сполука 145 Re Rd R7 R1 R4 N R5 R6 O H (VII-a) , її N-оксидні форми, солі приєднання та стереохімічно ізомерні форми, де R1, R4, R5, R6, R7 та арил є такими, як визначено в п.1; 5 86777 Re позначає гідроген, або, взятий разом з Rd, може утворювати двовалентний радикал формули -(CH2)2-NR15-(CH2)2- (е-1) або -CH2-NR16-(CH2)3-, (е-2) де R15 та R16 кожен незалежно вибирають з гідроC1-6-алкандіїл гену, С1-6-алкілу, N , 6 15. Спосіб одержання сполуки, вказаної в пп.1 або 5, при якому перетворюють проміжні сполуки формули (VII) селективним гідруванням зазначеної проміжної сполуки відповідним відновлювальним агентом і відповідним відновником у відповідному розчиннику з утворенням сполук формули (І), де R2 позначає гідроген і де R3 є групою формули (b-1) або радикалом формули (а-1), де s не є 0, називані Rg, називані сполуками формули (І-і) Rd Re NH C1-6-алкандіїл N O , С1-6-алкілоксі-С1-6алкілу, піперидиніл-С1-6-алкілу, С3-10-циклоалкіл-С16-алкілу, арилокси(гідроксі)-С1-6-алкілу, арил-С1-6алкілу або арил-С2-6-алкенілу; або Rd є ді-(С1-6-алкіл)аміно-С1-6-алкілом або піперидиніл-С1-6-алкілом. 6. Сполука, вказана в будь-якому з пп.1-5, для застосування як лікарський препарат. 7. Фармацевтична композиція, яка містить фармацевтично прийнятні носії та терапевтично ефективну кількість сполуки, вказаної в будь якому з пп.15, як активний інгредієнт. 8. Спосіб одержання фармацевтичної композиції, вказаної в п.7, де фармацевтично прийнятні носії та сполуки за будь яким з пп.1-5 ретельно змішують. 9. Застосування сполуки вказаної в будь якому з пп.1-5 для виробництва лікарського засобу для лікування PARP опосередкованого захворювання. 10. Застосування за п.9, де сполукою є сполука за будь-яким з пп.1-4. 11. Застосування за пп.9 або 10, де лікування включає хіміосенсибілізацію. 12. Застосування за пп.9 або 10, де лікування включає радіосенсибілізацію. 13. Комбінація сполуки з хіміотерапевтичним засобом, у якій зазначеною сполукою є сполука, вказана в будь-якому з пп.1-5, і де зазначений хіміотерапевтичний засіб вибрано з групи, що включає 5фторурацил, лейковорин, 5'-аміно-5'дезокситимідин, кисень, карбоген, перфторкарбони (наприклад, Fluosol 10 DA), 2,3-DPG, BW12C, блокатор кальцієвих каналів, пентоксифілін, сполука, що пригнічує ріст судин, гідралазин, LBSO, адріаміцин, камтотецин, карбоплатин, цисплатин, даунорубіцин, доцетаксел, доксорубіцин, інтерферон (альфа, бета, гамма), інтерлейкін-2, іринотекан, паклітаксел, топотекан та їхні похідні, метилувальний засіб, інгібітор топоізомерази І, блеоміцин. 14. Комбінація по п.13 де сполукою є сполука за будь-яким з пп.1-4. Даний винахід належить до інгібіторів полі(АДФ-рибоза)полімерази (PARP) і пропонує сполуки та композиції, які містять сполуки, що розкриваються. Крім того, даний винахід пропонує способи застосування інгібіторів PARP, що розкриваються, наприклад, як лікарських засобів. Rg C R5 X (CH2)n R6 O R1 O (CH2)n R5 H X N R4 R1 N R4 R6 H (I-i) , де R , R -R , X, n є такими, як визначено в п.1; Re та Rd є такими, як визначено в п.5. 16. Спосіб одержання сполуки, вказаної в п.5, при якому здійснюють a) взаємодію сполуки формули (VII-а), де Re, узятий разом з Rd, утворює двовалентний радикал формули (е-1) або (е-2) і R15 або R16 позначає гідроген, називані сполуками формули (VII-a-2), з проміжною сполукою формули (XIX), де W є відповідною відхідною групою і R15 або R16 не є гідрогеном, з утворенням сполук формули (VII-a-1), визначених як сполуки формули (VII-а), де Re, узятий разом з Rd, утворює двовалентний радикал формули (е-1) або (е-2) і R15 або R16 не є гідрогеном, в реакційноінертному розчиннику; (VII) 1 4 6 R15 H N N R7 R7 + N R5 R6 W-R15 O N R5 H (VII-a-2) R1 R4 R1 R4 R6 (XIX) O H (VII-a-1) , де R , R -R є такими, як визначено в п.5, або b) взаємодію сполуки формули (VII-a-2) з проміжною сполукою формули (XX), де R є відповідним замісником, з утворенням сполук формули (VII-а), де R15 або R16 є арилокси(гідроксі)-С1-6-алкілом, називані сполуками формули (VII-a-3), в присутності 2-пропанолу 1 4 7 OH O H N R N R7 R7 R1 R4 + N R5 R6 O R O N R5 H (VII-a-2) R1 R4 O (XX) R6 O H (VII-a-3) де R1, R4-R7 є такими, як визначено в п.5. , Передумови створення винаходу Ядерний фермент полі(АДФрибоза)полімераза-1 (PARP-1) є представником сімейства PARP ферментів, що складається з PARP-1 і декількох недавно ідентифікованих нових полі(АДФ-рибозилюючих) ферментів. PARP також 7 називається полі(аденозин-5'дифосфорибоза)полімеразою або PARS (полі(АДФ-рибоза)синтетазою). PARP-1 є головним ядерним білком з молекулярною масою 116кДа, що складається із трьох доменів: N-кінцевого ДНК зв’язувального домену, який містить два "цинкових пальці", аутомодифікуючого домену та C-кінцевого каталітичного домену. Він присутній майже у всіх еукаріотів. Фермент синтезує полі(АДФ-рибозу), розгалужений полімер, який може складатися з більш ніж 200 одиниць АДФ-рибози. Акцептори полі(АДФ-рибози) білка безпосередньо або опосередковано беруть участь в підтриманні цілісності ДНК. Вони включають гістони, топоізомерази, ДНК і РНК полімерази, ДНК лігази та Ca2+- і Mg2+-залежні ендонуклеази. PARP білок експресується на високому рівні в багатьох тканинах, найбільш помітно - в імунній системі, серці, мозку та зародкових клітинах. В нормальних фізіологічних умовах активність PARP мінімальна. Однак ушкодження ДНК викликає негайне підвищення активності PARP до 500 разів. Серед багатьох функцій, приписуваних PARP, і особливо PARP-1, головною є його роль у полегшенні репарації ДНК шляхом АДФ-рибозилювання і, тому, координації ряду білків репарованої ДНК. В результаті активації PARP значно знижуються рівні NAD+. Екстенсивна активація PARP веде до різкого зниження NAD+ у клітинах, що зазнали масового ушкодження ДНК. Короткий період напівжиття полі(АДФ-рибози) приводить до високої інтенсивності циклу. Одразу після утворення полі(АДФрибози) вона швидко деградує під дією постійно активної полі(АДФ-рибоза)глюкогідролази (PARG), разом з фосфодіестеразою та (АДФ-рибозою) білка ліази. PARP та PARG формують цикл, який перетворює велику кількість NAD+ на АДФ-рибозу. Менш ніж через годину, надмірне стимулювання PARP може викликати падіння NAD+ та АТФ до значення нижче 20% від нормального рівня. Такий сценарій особливо небезпечний при ішемії, коли втрата кисню вже різко порушила енергоутворення в клітинах. Припускають, що наступне утворення вільного радикала при реперфузії є головною причиною ушкодження тканини. Частково падіння АТФ, що є типовим у багатьох органах при ішемії та реперфузії, могло б бути пов'язане з падінням вмісту NAD+ через цикл полі(АДФ-рибози). Таким чином, очікується, що інгібування PARP або PARG буде зберігати енергетичний рівень клітин, тим самим, потенціюючи виживання ішемічних тканин після ушкодження. Синтез полі(АДФ-рибози) також залучений до індукованої експресії ряду генів, важливих для запальної реакції. Інгібітори PARP пригнічують продукцію синтази індуцибельного оксиду азоту (iNOS) у макрофагах, P-селектину та молекул міжклітинної адгезії-1 (ICAM-1) в ендотеліальних клітинах. Така активність підкреслює сильну протизапальну дію, що проявляється інгібіторами PARP. Інгібування PARP здатне знизити некроз в результаті запобігання переміщенню та інфільтрації нейтрофілів в уражені тканини. PARP активується ушкодженими фрагментами ДНК і, один раз активувавшись, катализує приєд 86777 8 нання до 100 одиниць АДФ-рибози до множини ядерних білків, включаючи гістони та сам PARP. При значних клітинних стресах екстенсивна активація PARP може швидко призвести до ушкодження або загибелі клітин через виснаження запасів енергії. Оскільки на кожну молекулу регенерованої NAD+ витрачаються чотири молекули АТФ, NAD+ виснажується в результаті масивної активації PARP; при спробах ресинтезувати NAD+, АТФ також може виснажитися. Повідомлялося, що активація PARP відіграє ключову роль як в NMDA-, так і в NO-індукованій нейротоксичності. Це було продемонстровано на кортикальних культурах і гіпокампальних зрізах, в яких запобігання токсичності прямо корелює з ефективністю інгібування PARP. Таким чином, визнана потенційна роль інгібіторів PARP при лікуванні нейродегенеративних захворювань і травми голови, хоча точний механізм їхньої дії ще не з'ясований. Аналогічно, було показано, що однократні ін'єкції інгібіторів PARP зменшували розмір інфаркту, викликаного ішемією та реперфузією серцевого або кістякового м'яза у кроликів. В цих дослідженнях однократна ін'єкція 3-амінобензаміду (10 мг/кг) за одну хвилину до закупорки або за одну хвилину до реперфузії викликала аналогічні зменшення розміру інфаркту в серці (32-42%), у той час як 1,5дигідроксіізохінолін (1 мг/кг), інший інгібітор PARP, зменшував розмір інфаркту в порівнянному ступені (38-48%). Ці результати дозволяють припустити, що інгібітори PARP могли б поліпшити заздалегідь стан ішемічного серця або реперфузійну травму тканини кістякового м'яза. Активація PARP може також бути використана як міра оцінки ушкодження внаслідок нейротоксичних ушкоджень, отриманих під дією будь-якого з таких індукторів, як глутамат (через стимуляцію NMDA рецептора), проміжні продукти реактивного кисню, амілоїдний b-білок, N-метил-4-феніл-1,2,3,6-тетрагідропіридин (MPTP) або його активний метаболіт N-метил-4фенілпіридин (МФП+), які беруть участь в патологічних станах, таких як удар, хвороба Альцгеймера та хвороба Паркінсона. Інші дослідження продовжили вивчення ролі активації PARP у нервових клітинах мозочка in vitro та в нейротоксичності MPTP. Надлишкова нейральна експозиція для глутамату, який служить домінуючим нейротрансмітером центральної нервової системи і діє на Nметил-D-аспартат (NMDA) рецептори та інші підвиди рецепторів, найчастіше відбувається в результаті удару або інших нейродегенеративних процесів. Позбавлені кисню нейрони виділяють у великих кількостях глутамат при ішемічному ураженні мозку, такому як удар, або при серцевому нападі. Це надлишкове виділення глутамату, в свою чергу, викликає надмірну стимуляцію (токсичне збудження) N-метил-D-аспартатних (NMDA), AMPA, Kainate та MGR рецепторів, які відкривають іонні канали та дають неконтрольований потік іонів (наприклад, Ca2+ та Na+ у клітини та K+ з клітин), що приводить до надмірної стимуляції нейронів. Надмірно стимульовані нейрони виділяють більше глутамату, створюючи петлю зворотного зв'язку або ефект доміно, що в остаточному підсумку при 9 веде до ушкодження або загибелі клітин в силу продукування протеаз, ліпаз та вільних радикалів. Надлишкова активація рецепторів глутамату спричиняє різні неврологічні захворювання та стани, що включають епілепсію, удар, хворобу Альцгеймера, хворобу Паркінсона, бічний аміотрофічний склероз (ALS), хворобу Хантингтона, шизофренію, хронічний біль, ішемію та загибель нейронів внаслідок гіпоксії, гіпоглікемії, ішемії, травми і нервового ушкодження. Експозиція та стимуляція глутамату також приводить до компульсивних порушень, зокрема, до лікарської залежності. Доказ включає одержані дані на багатьох видах тварин, так само як і на церебральних кортикальних культурах, оброблених глутаматом або NMDA, що антагоністи рецептора глутамату (наприклад, сполуки, які блокують глутамат від зв'язування або активації його рецептора) блокують неврологічне ушкодження у зв'язку із судинним ударом. Спроби запобігання токсичного збудження шляхом блокування NMDA, AMPA, Kainate та MGR рецепторів виявилися складною справою, тому що кожен рецептор має множину місць, до яких глутамат може приєднуватися і, отже, знаходження ефективної суміші антагоністів або універсального антагоніста для запобігання зв'язування глутамату з усім рецептором та можливість перевірки цієї теорії викликала великі складнощі. Крім того, багато які з композицій, що є ефективними для блокування рецепторів, є також токсичними для тварин. По суті, в цей час немає відомого ефективного лікування відхилень від норми глутамату. Стимуляція NMDA рецепторів глутаматом, наприклад, активує фермент нейронної синтази оксиду азоту (nNOS), приводячи до утворення оксиду азоту (NO), що також медіює нейротоксичність. NMDA нейротоксичність може бути відвернена в результаті лікування інгібіторами синтази оксиду азоту (NOS) або через спрямований генетичний розрив nNOS in vitro. Іншим застосуванням інгібіторів PARP є лікування ушкоджень периферичних нервів, в результаті яких розвивається синдром патологічного болю, відомий як невропатичний біль, такий як викликаний хронічним стискаючим ушкодженням (ХСП) загального сідничного нерва, і при якому відбувається транссинаптична альтерація сірої речовини спинного мозку, що характеризується гіперхроматозом цитоплазми та нуклеоплазми (так звані "чорні" нейрони). Існує також доказ, що інгібітори PARP можуть застосовуватися для лікування запальних захворювань кишечнику, таких як коліт. Наприклад, коліт викликали у пацюків шляхом внутрішньопросвітного введення гаптентринітробензолсульфонової кислоти в 50% етанолі. Піддані лікуванню пацюки одержували 3-амінобензамід, специфічний інгібітор PARP активності. Інгібування PARP активності зменшувало запальну реакцію і відновлювало морфологію та енергетичний статус дистальної ободової кишки. Додатковий доказ наводить на думку, що інгібітори PARP можуть застосовуватися для лікування артритів. Крім того, очевидно, інгібітори PARP є придатними для лікування діабету. Було показано, 86777 10 що інгібітори PARP можуть застосовуватися для лікування ендотоксичного шоку або септичного шоку. Інгібітори PARP можуть також застосовуватися для розширення ресурсу та проліферативної здатності клітин, включаючи лікування таких захворювань, як старіння шкіри, хвороба Альцгеймера, атеросклероз, остеоартрит, остеопороз, м'язова дистрофія, дегенеративні хвороби кістякових м'язів, що включають реплекативне старіння, вікову дегенерацію м'язів, старіння імунної системи, ВІЛ та інші імунні захворювання, пов'язані зі старінням; і для зміни експресії гена старіючих клітин. Також відомо, що інгібітори PARP, такі як 3амінобензамід, впливають на повну репарацію ДНК у відповідь, наприклад, на дію перекису водню або іонізуючої радіації. Чітко встановлена основна роль PARP у репарації розривів ланцюгів ДНК, особливо, коли вони викликані безпосередньо іонізуючим випромінюванням або, опосередковано, після ферментативної репарації ушкоджень ДНК, викликаних метилювальними агентами, інгібіторами топоізомераз I та іншими хіміотерапевтичними засобами, такими як циспластин і блеоміцин. Численні дослідження з використанням "нокаутованих" мишей, моделей транс-домінантного інгібування (надмірної експресії ДНК-зв’язувального домену), антисмислових інгібіторів та інгібіторів з малою молекулярною масою, продемонстрували роль PARP у репарації та виживанні клітин після індукування ушкодження ДНК. Інгібування ферментативної активності PARP повинно приводити до підвищеної чутливості пухлинних клітин до лікування ушкоджень ДНК. Повідомлялося, що інгібітори PARP є ефективними для радіосенсибілізації (гіпоксичної) пухлинних клітин та ефективними для запобігання пухлинних клітин від відновлення потенційно летального та сублетального ушкодження ДНК після променевої терапії, імовірно, за рахунок їхньої здатності запобігати з'єднанню розриву ланцюга ДНК і за рахунок впливу на кілька сигнальних шляхів ушкодження ДНК. Інгібітори PARP застосовували для лікування раку. Крім того, в патенті США № 5177075 обговорюються деякі ізохіноліни для посилення летальної дії іонізуючого випромінювання або хіміотерапевтичних засобів на пухлинні клітини. Weltin et al., в "Effect of 6 (5-Phenanthridinone, an Inhibitor of Poly (ADP-ribose) Polymerase, on Cultured Tumor Cells", Oncol. Res., 6:9, 399-403 (1994), обговорюють інгібування активності PARP, зниження проліферації пухлинних клітин та явний синергетичний ефект при одночасній обробці пухлинних клітин алкілувальними лікарськими препаратами. Недавній вичерпний огляд досягнень в цій області був опублікований Li та Zhang в журналі Drugs 2001, 4(7): 804-812. Існує постійна потреба в ефективних та сильнодіючих інгібіторах PARP, і, більш конкретно, інгібіторах PARP-1, які мають мінімальні побічні ефекти. Даний винахід пропонує сполуки, композиції та способи інгібування активності PARP для лікування раку та/або для запобігання клітинних ушкоджень, ушкоджень тканин та/або органів, що вини 11 86777 кають в результаті ушкодження або загибелі клітин через, наприклад, некроз або апоптоз. Сполуки та композиції за даним винаходом є особливо придатними для підвищення ефективності хіміотерапії та променевої терапії, у випадку коли первинний ефект лікування викликає ушкодження ДНК у цільових клітинах. [В Європейському патенті 371564, опублікованому 6 червня 1990р.], розкриваються (1H-азол-1ілметил)заміщений хінолін, хіназолін або похідні хіноксаліну. Описані сполуки пригнічують елімінацію з плазми ретиноєвих кислот. Більш конкретно, розкриті сполуки 6-[(1H-імідазол-1-іл)-(4метоксифеніл)метил]-3-метил-2(1H)-хіноксалінон (сполука № 128 даної заявки), 3-етил-6-(1Hімідазол-1-ілфенілметил)-2(1H)-хіноксалінон (сполука № 127 даної заявки) і 6-[(4-хлорфеніл)-1Hімідазол-1-ілметил]-3-метил-2(1H)-хіноксалінон (сполука № 146 даної заявки). Сполука 128 12 алкіл)аміно-С1-6-алкілу, C1-6-алкілоксикарбонілу, C1-6-алкілкарбоніламіно-С1-6-алкілу, піперидинілC1-6-алкіламінокарбонілу, піперидинілу, піперидиніл-C1-6-алкілу, C1-6-алкілокси, тіофеніл-C1-6-алкілу, піроліл-C1-6-алкілу, арил-C1-6-алкілпіперидинілу, арилкарбоніл-C1-6-алкілу, арилкарбонілпіперидиніл-C1-6-алкілу, галогеніндазолілпіперидиніл-C1-6алкілу або арил-C1-6-алкіл-(C1-6-алкіл)аміно-C1-6алкілу; і R9 позначає гідроген або C1-6-алкіл; або R3 є групою формули -(CH2)t-Z (b-1), де t дорівнює 0, 1, 2 або 3; -Z є гетероциклічною кільцевою системою, вибраною з Сполука 127 Сполука 146 де R12 позначає гідроген, галоген, C1-6-алкіл, амінокарбоніл, аміно, гідрокси, арил, Даний винахід стосується сполук формули (I) , їхніх N-оксидних форм, солей приєднання та стереохімічно ізомерних форм, де n дорівнює 0, 1 або 2; X позначає N або CR7, де R7 є гідрогеном або, взятий разом з R1, може утворювати двовалентний радикал формули -CH=CH-CH=CH-; R1 позначає C1-6-алкіл або тіофеніл; R2 позначає гідроген, гідроксил, C1-6-алкіл, C3-6-алкеніл або, взятий разом з R3, може утворювати =O; R3 позначає радикал, вибраний з -(CH2)s-NR8R9 (a-1), -O-H (a-2), -O-R10 (a-3), -S-R11 (a-4), або -C≡N (a-5), де s дорівнює 0, 1, 2 або 3; R8, R1 та R11 кожен незалежно вибирають з CHO, C1-6-алкілу, гідроксі-С1-6-алкілу, C1-6алкілкарбонілу, аміно, C1-6-алкіламіно, ді-(C1-6 , C1-6-алкіламіно-C1-6алкілокси, C1-6-алкілокси-C1-6-алкіл, C1-6-алкілоксиC1-6-алкіламіно, арил-C1-6-алкіл, ди(феніл-C2-6алкеніл), піперидиніл, піперидиніл-C1-6-алкіл, C3-10циклоалкіл, C3-10-циклоалкіл-C1-6-алкіл, арилокси(гідроксі)-C1-6-алкіл, галогеніндазоліл, арил-C1-6алкіл, арил-C2-6-алкеніл, арил-C1-6-алкіламіно, морфоліно, C1-6-алкілімідазоліл або піридиніл-C1-6алкіламіно; R13 позначає гідроген, піперидиніл або арил; R4, R5 та R6 кожен незалежно вибирають з гідрогену, галогену, тригалогенметилу, тригалогенметокси, C1-6-алкілу, C1-6-алкілокси, аміно, аміноC1-6-алкілу, ді-(C1-6-алкіл)аміно, ді-(C1-6-алкіл)аміноC1-6-алкілокси або C1-6-алкілоксикарбонілу, або C1-6-алкілу, заміщеного 1, 2 або 3 замісниками, незалежно вибраними з гідрокси, C1-6-алкілокси або аміно-C1-6-алкілокси; або коли R5 та R6 находяться у суміжних положен 13 нях, узяті разом, вони можуть утворювати двовалентний радикал формули -O-CH2-O (d-1), -O-(CH2)2-O(d-2), -CH=CH-CH=CH(d-3), або -NH-C(O)-NR14=CH(d-4), де R14 позначає C1-6-алкіл; арил є фенілом, фенілом, заміщеним галогеном, C1-6-алкілом або C1-6-алкілокси; за умови, що коли n дорівнює 0, X позначає N, R1 позначає C1-6-алкіл, R2 позначає гідроген, R3 є групою формули (b-1), t дорівнює 0, Z є гетероциклічною кільцевою системою (c-2), де зазначена гетероциклічна кільцева система Z приєднана до решти молекули атомом нітрогену, і R12 позначає гідроген або C1-6-алкіл; тоді щонайменше, один із замісників R4, R5 або R6 не є гідрогеном, галогеном, C1-6-алкілокси та тригалогенметилом. Коли ж гетероциклічна кільцева система Z містить -CH2-, -CH= або -NH- фрагмент, замісники R12 та R13 або залишок молекули можуть бути приєднані до атома карбону або нітрогену, у цьому випадку один або обидва водневих атома заміщені. Сполуки формули (I) можуть існувати в таутомерних формах. Хоча такі форми спеціально не визначені у вищенаведеній формулі, передбачається, що вони входять до обсягу даного винаходу. Ряд термінів, використовуваних у вище та нижчеподаних визначеннях, пояснюються нижче по тексту. Ці терміни використовуються іноді або самі по собі, або в комбінованих термінах. При використанні в попередніх визначеннях і надалі, галоген є загальним терміном для фтору, хлору, брому та йоду; C1-6-алкіл позначає лінійні або розгалужені насичені вуглеводневі радикали, що містять від 1 до 6 атомів карбону, такі як, наприклад, метил, етил, пропіл, бутил, пентил, гексил, 1-метилетил, 2-метилпропіл, 2-метилбутил, 2метилпентил і подібні; C1-6-алкандіїл позначає двовалентні лінійні та розгалужені насичені вуглеводневі радикали, що містять від 1 до 6 атомів карбону, такі як, наприклад, метилен, 1,2-етандіїл, 1,3-пропандіїл, 1,4-бутандіїл, 1,5-пентандіїл, 1,6гександіїл, та їхні розгалужені ізомери, такі як, 2метилпентандіїл, 3-метилпентандіїл, 2,2диметилбутандіїл, 2,3-диметилбутандіїл і подібні; тригалогенметил позначає метил, що містить три однакових або різних галогенових замісники, наприклад, трифторметил; C2-6-алкеніл позначає лінійні або розгалужені вуглеводневі радикали, що містять один подвійний зв'язок і від 2 до 6 атомів карбону, такі як, наприклад, етеніл, 2-пропеніл, 3бутеніл, 2-пентеніл, 3-пентеніл, 3-метил-2-бутеніл і подібні; C3-6-алкініл позначає лінійні та розгалужені вуглеводневі радикали, що містять один потрійний зв'язок та від 3 до 6 атомів карбону, такі як, наприклад, 2-пропініл, 3-бутиніл, 2-бутиніл, 2-пентиніл, 3-пентиніл, 3-гексиніл, і подібні; C3-10-циклоалкіл включає циклічні вуглеводневі групи, що містять від 3 до 10 атомів карбону, такі як циклопропіл, циклобутил, циклопентил, циклопентеніл, циклогексил, циклогексеніл, циклогептил, циклооктил і подібні. 86777 14 Термін "сіль приєднання" стосується солей, які сполуки формули (I) можуть утворювати з органічними або неорганічними основами, такими як аміни, основи лужних металів та основи лужноземельних металів, або четвертинні амонієві основи, або з органічними чи неорганічними кислотами, такими як мінеральні кислоти, сульфокислоти, карбонові кислоти або фосфорвмісні кислоти. Термін "сіль приєднання", крім того, стосується фармацевтично прийнятних солей, комплексів металів і сольватів та їхніх солей, які можуть утворювати сполуки формули (I). Термін "фармацевтично прийнятні солі" позначає фармацевтично прийнятні солі приєднання кислот або основ. Це означає, що фармацевтично прийнятні солі приєднання кислот або основ, зазначені вище, включають терапевтично активні нетоксичні форми солей приєднання кислоти та основи, які сполуки формули (I) можуть утворювати. Сполуки формули (I), які мають основні властивості, можуть бути перетворені на їхні фармацевтично прийнятні солі приєднання кислоти шляхом обробки названої основної форми відповідною кислотою. До відповідних кислот належать, наприклад, неорганічні кислоти, такі як галоїдводневі кислоти, наприклад, хлористоводнева або бромистоводнева кислота; сірчана; азотна; фосфорна та інші подібні кислоти; або органічні кислоти, такі як, наприклад, оцтова, пропіонова, гліколева, молочна, піровиноградна, щавлева, малонова, бурштинова (тобто бутандіова кислота), малеїнова, фумарова, яблучна, винна, лимонна, метансульфонова, етансульфонова, бензолсульфонова, п-толуолсульфонова, цикламінова, саліцилова, п-аміносаліцилова, памоєва та подібні кислоти. Сполуки формули (I), які мають кислотні властивості, можуть бути перетворені на їхні фармацевтично прийнятні солі приєднання основи шляхом обробки названої кислотної форми відповідною органічною або неорганічною основою. До відповідних форм основної солі належать, наприклад, солі амонію, солі лужних і лужноземельних металів, наприклад, солі літію, натрію, калію, магнію, кальцію та подібні, солі з органічними основами, наприклад, солі бензатину, N-метил-D-глюкаміну, гідрабаміну, і солі з амінокислотами, такими як, наприклад, аргінін, лізин і подібні. Терміни сіль приєднання кислоти або основи також стосується гідратних та сольватних форм приєднання, які сполуки формули (I) можуть утворювати. Прикладами таких форм є, наприклад, гідрати, алкоголяти та подібні. Термін "комплекси металів" позначає комплекс, утворений сполукою формули (I) з однією чи більше органічною або неорганічною сіллю або солями металу. Приклади зазначених органічних або неорганічних солей включають галогеніди, нітрати, сульфати, фосфати, ацетати, трифторацетати, трихлорацетати, пропіонати, тартрати, сульфонати, наприклад, метилсульфонати, 4метилфенілсульфонати, саліцилати, бензоати та подібні, солі металів другої головної групи періодичної системи, наприклад, солі магнію та кальцію, третьої та четвертої головних груп, напри 15 клад, алюмінію, олова, свинцю, а також від першої до восьмої перехідних груп періодичної системи, таких як, наприклад, хрому, марганцю, заліза, кобальту, нікелю, міді, цинку та подібних. Термін стереохімічно ізомерні форми сполук формули (I), використовуваний вище, позначає всі можливі сполуки, які складені з тих самих атомів, з'єднаних такою саме послідовністю зв'язків, але мають різні тривимірні структури, що не є взаємозамінними, які сполуки формули (I) можуть мати. Якщо не наведено або зазначено інше, хімічне позначення сполуки охоплює суміш всіх можливих стереохімічно ізомерних форм, які має зазначена сполука. Зазначена суміш може містити всі діастереоізомери та/або енантіомери основної молекулярної структури зазначеної сполуки. Передбачається, що всі стереохімічно ізомерні форми сполук формули (I), як у чистій формі, так і в суміші одна з одною, входять до обсягу даного винаходу. N-оксидні форми сполук формули (I) означають такі сполуки формули (I), у яких один або кілька атомів нітрогену окиснені до так званого Nоксиду, особливо такі N-оксиди, в яких один або більше нітрогенів піперидину, піперазину або піридазинілу є N-окисненими. При використанні в даному описі, термін "сполуки формули (I)" означає, що він включає також N-оксидні форми, фармацевтично прийнятні солі приєднання кислоти або основи та всі стереоізомерні форми. Сполуки, [описані в ЕP 371564], пригнічують елімінування з плазми ретиноєвих кислот. В ЕP 371564 були розкриті 6-[(1H-імідазол-1-іл)-(4метоксифеніл)метил]-3-метил-2(1H)-хіноксалінон (сполука № 128 даної заявки), 3-етил-6-(1Hімідазол-1-ілфенілметил)-2(1H)-хіноксалінон (сполука № 127 даної заявки) та 6-[(4-хлорфеніл)-1Hімідазол-1-ілметил]-3-метил-2(1H)-хіноксалінон (сполука № 146 даної заявки). Несподівано було виявлено, що сполуки за даним винаходом виявляють інгібуючу активність по відношенню до PARP. Перша група цікавих сполук складається з таких сполук формули (I), на які накладаються одне або більше з таких обмежень: a) R1 позначає C1-6-алкіл; b) R3 позначає радикал, вибраний з (a-1), (a-2), (a-3) або (a-5), або групу формули (b-1); c) s дорівнює 0, 1 або 2; d) R8 та R10 кожен незалежно вибирають з CHO, C1-6-алкілу, гідрокси-C1-6-алкілу, ді-(C1-6алкіл)аміно-C1-6-алкілу, C1-6-алкілкарбоніламіноC1-6-алкілу, піперидиніл-C1-6-алкілу, піперидинілC1-6-алкіламінокарбонілу, C1-6-алкілокси, тіофенілC1-6-алкілу, піроліл-C1-6-алкілу, арил-C1-6алкілпіперидинілу, арилкарбоніл-C1-6-алкілу, арилкарбонілпіперидиніл-C1-6-алкілу, галогеніндазолілпіперидиніл-C1-6-алкілу або арил-C1-6-алкіл-(C1-6алкіл)аміно-C1-6-алкілу; e) t дорівнює 0 або 2; f) Z позначає гетероциклічну кільцеву систему, вибрану з (c-1), (c-2), (c-4), (c-6), (c-8), (c-9) або (c-11); g) R12 позначає гідроген, C1-6-алкіл, амінокар 86777 16 боніл, , C1-6-алкілокси C1-6-алкіламіно, ди(феніл-C2-6-алкеніл), піперидиніл-C1-6-алкіл, C3-10-циклоалкіл, C3-10-циклоалкілC1-6-алкіл, галогеніндазоліл або арил-C2-6-алкеніл; h) R4, R5 та R6 кожен незалежно вибирають з гідрогену, галогену, тригалогенметилу, тригалогенметокси, C1-6-алкілу, C1-6-алкілокси, ді-(C1-6алкіл)аміно, ді-(C1-6-алкіл)аміно-C1-6-алкілокси або C1-6-алкілоксикарбонілу; і i) коли R5 та R6 находяться в суміжних положеннях, узяті разом, вони можуть утворювати двовалентний радикал формули (d-1) або (d-2). Друга група цікавих сполук складається з таких сполук формули (I), на які накладаються одне або більше з таких обмежень: a) n дорівнює 0; b) X позначає CR7, де R7 позначає гідроген, або, взятий разом з R1, може утворювати двовалентний радикал формули -CH=CH-CH=CH-; c) R1 позначає C1-6-алкіл; d) R2 позначає гідроген; e) R3 позначає радикал, вибраний з (a-1), (a-2) чи (a-3), або є групою формули (b-1); f) s дорівнює 0 або 2; g) R8 та R10 кожен незалежно вибирають з CHO, C1-6-алкілу, ді-(C1-6-алкіл)аміно-C1-6-алкілу, піперидиніл-C1-6-алкілу, арилкарбонілпіперидинілC1-6-алкілу, галогеніндазолілпіперидиніл-C1-6алкілу або арил-C1-6-алкіл-(C1-6-алкіл)аміно-C1-6алкілу; h) t дорівнює 0 або 2; i) Z є гетероциклічною кільцевою системою, вибраною з (c-1), (c-2) або (c-6); j) R12 позначає гідроген, , C1-6-алкілокси-C1-6 алкіламіно або піперидиніл-C1-6-алкіл; k) R13 позначає гідроген або арил; l) R4, R5 та R6 кожен незалежно вибирають з гідрогену або тригалогенметилу; і m) коли R5 та R6 находяться в суміжних положеннях, узяті разом, можуть утворювати двовалентний радикал формули (d-1) або (d-2). Третя група цікавих сполук складається з таких сполук формули (I), першої групи цікавих сполук або другої групи цікавих сполук, де Z позначає гетероциклічну кільцеву систему, відмінну від гетероциклічної кільцевої системи формули (c-2) або (c-4). Група кращих сполук складається зі сполук формули (I), де R1 позначає C1-6-алкіл; R3 позначає радикал, вибраний з (a-1), (a-2), (a-3) чи (a-5), або є групою формули (b-1); s дорівнює 0, 1 або 2; R8 та R10 кожен незалежно вибирають з -CHO, C1-6-алкілу, гідрокси-C1-6-алкілу, ді-(C1-6алкіл)аміно-C1-6-алкілу, C1-6-алкілкарбоніламіноC1-6-алкілу, піперидиніл-C1-6-алкілу, піперидинілC1-6-алкіламінокарбонілу, C1-6-алкілокси, тіофенілC1-6-алкілу, піроліл-C1-6-алкілу, арил-C1-6алкілпіперидинілу, арилкарбоніл-C1-6-алкілу, арил 17 86777 карбонілпіперидиніл-C1-6-алкілу, галогеніндазолілпіперидиніл-C1-6-алкілу або арил-C1-6-алкіл-(C1-6алкіл)аміно-C1-6-алкілу; t дорівнює 0 або 2; Z є гетероциклічною кільцевою системою, вибраною з (c-1), (c-2),(c-4), (c-6), (c-8), (c-9) або (c-11); R12 позначає гідроген, C1-6-алкіл, амінокарбоніл, , C1-6-алкілокси-C1-6 алкіламіно, ди(феніл-C2-6-алкеніл), піперидинілC1-6-алкілалкіл, C3-10-циклоалкіл, C3-10-циклоалкілC1-6-алкіл, галогеніндазоліл або арил-C2-6-алкеніл; R4, R5 та R6 кожен незалежно вибирають з гідрогену, галогену, тригалогенметилу, тригалогенметокси, C1-6-алкілу, C1-6-алкілокси, ді-(C1-6-алкіл)аміно, ді-(C1-6-алкіл)аміно-C1-6-алкілокси або C1-6алкілоксикарбонілу; і коли R5 та R6 находяться в суміжних положеннях, узяті разом, вони можуть утворювати двовалентний радикал формули (d-1) або (d-2). Додаткова група кращих сполук складається з таких сполук формули (I), де n дорівнює 0; X позначає CR7, де R7 позначає гідроген, або, взятий разом з R1, може утворювати двовалентний радикал формули -CH=CH-CH=CH-; R1 позначає C1-6алкіл; R2 позначає гідроген; R3 позначає радикал, вибраний з (a-1), (a-2) чи (a-3) або є групою формули (b-1); s дорівнює 0 або 2; R8 та R10 кожен незалежно вибирають з -CHO, C1-6-алкілу, ді-(C1-6алкіл)аміно-C1-6-алкілу, піперидиніл-C1-6-алкілу, арилкарбонілпіперидиніл-C1-6-алкілу, галогеніндазолілпіперидиніл-C1-6-алкілу або арил-C1-6-алкіл(C1-6-алкіл)аміно-C1-6-алкілу; t дорівнює 0 або 2; Z є гетероциклічною кільцевою системою, вибраною з (c-1), (c-2) або (c-6); R12 позначає гідроген, , C1-6-алкілокси-C1-6 алкіламіно або піперидиніл-C1-6-алкіл; R13 позначає гідроген або арил; R4, R5 та R6 кожен незалежно вибирають з гідрогену або тригалогенметилу; і коли R5 та R6 находяться в суміжних положеннях, узяті разом, вони можуть утворювати двовалентний радикал формули (d-1) або (d-2). Інша додаткова група кращих сполук складається з таких сполук формули (I), групи кращих Сполуки формули (I), де R3 позначає гідроксильну групу, називані сполуками формули (I-c), можуть бути одержані перетворенням кетонового фрагмента сполук формули (I-a) на гідроксильну 18 сполук або додаткової групи кращих сполук, у яких Z є гетероциклічною кільцевою системою, відмінною від системи формули (с-2) або (с-4). Група ще кращих сполук складається з тих сполук формули (I), де n дорівнює 0; X позначає CH; R1 позначає C1-6-алкіл; R2 позначає гідроген; R3 є групою формули (b-1); t дорівнює 2; Z є гетероциклічною кільцевою системою, вибраною з (с-1); R12 позначає гідроген; R13 позначає гідроген; і R5 та R6 находяться в суміжних положеннях та узяті разом утворюють двовалентний радикал формули (d-2). Найкращими сполуками є сполука №16, сполука № 144 і сполука № 145. N N O O N H O O N H O O сполука 144 сполука 16 N O O N H O сполука 145 Сполуки формули (I) можуть бути одержані загальними способами, описаними в ЕP 371564. Ряд таких способів одержання будуть описані нижче більш докладно. Інші способи одержання цільових сполук формули (I) описані в прикладах. Сполуки формули (I), де R2 позначає гідроген і R3 позначає -NR9-CHO, де R9 позначає гідроген або метил, називані сполуками формули (I-b), можуть бути одержані, виходячи із сполук формули (I), де R2, узятий разом з R3, утворює =O, називаних сполуками формули (I-a), в присутності формаміду або метилформаміду, називаних проміжними сполуками формули (II), і мурашиної кислоти. групу, з відповідним відновником, наприклад, боргідридом натрію, в придатному розчиннику, наприклад, метанолі та тетрагідрофурані. 19 86777 20 Сполуки формули (I-a) можуть бути одержані перетворенням сполук формули (1-c), де R2 позначає гідроген, називаних сполуками формули (Ic-1), в присутності відповідного окисника, такого як триоксид хрому, і кислоти, такої як сірчана кислота, в придатному розчиннику, такому як 2пропанон. Сполуки формули (I), де R2 позначає гідроген і R позначає радикал формули (с-1), називані сполуками формули (1-f), можуть бути одержані взаємодією сполук формули (I), де R2 позначає гідроген і R3 позначає радикал формули (с-8), називаних сполуками формули (I-d), з аміном формули (III), де Ra є відповідним радикалом, в присутності придатного розчинника, такого як метанол, і придатного реагенту, такого як ціаноборгідрид натрію. Проміжні сполуки формули (IV), де W є відповідною відхідною групою, такою як, наприклад, хлор, бром, метансульфонілокси або бензолсульфонілокси, можуть бути одержані із сполук формули (I-c-1) шляхом обробки зазначених сполук відповідним реагентом, наприклад, метансульфонілоксихлоридом або бензолсульфонілоксихлоридом, або галогенувальним агентом, таким як, наприклад, POCl3 або SOCl2. Сполуки формули (I), визначені як сполуки формули (I), де Rb є таким, як визначено в R8, і Rс є таким, як визначено в R9, або Rb та Rс, узяті разом з нітрогеном, до якого вони приєднані, утворюють відповідну гетероциклічну кільцеву систему, як визначено в Z, називані сполуками формули (Ih), можуть бути одержані реакцією проміжної спо луки формули (IV) з проміжною сполукою формули (V). Реакція може бути здійснена в реакційноінертному розчиннику, такому як диметилформамід або ацетонітрил, необов'язково, в присутності відповідної основи, такої як, наприклад, карбонат натрію, карбонат калію або триетиламін. Сполуки формули (I) можуть бути також перетворені одна на одну шляхом відомих у даній області реакцій або трансформацій функціональних груп.Ряд таких трансформацій вже описаний вище. Іншими прикладами є гідроліз складних ефірів карбонових кислот до відповідних карбонових кислот або спиртів; гідроліз амідів до відповідних карбонових кислот або амінів; гідроліз нітрилів до відповідних амідів; аміногрупи на імідазолі або фенілі можуть бути заміщені гідрогеном шляхом відомих в даній області реакцій діазотування та наступної заміни діазогрупи гідрогеном; спирти можуть бути перетворені на складні та прості ефіри; первинні аміни можуть бути перетворені на вторинні та третинні аміни; подвійні зв'язки можуть бути прогідровані до відповідного одинарного зв'язку; йодний радикал на фенільній групі може бути перетворений на складноефірну групу шляхом введення монооксиду карбону в присутності відповідного паладієвого каталізатора. Тому, сполуки формули (I), (I-a), (I-a-l), (I-b), (Ic), (I-c-1), (I-d), (I-e), (I-f), (I-h), (I-i) і (I-j) можуть не 3 21 86777 22 обов'язково бути піддані одному або більше з таких перетворень в будь-якому бажаному порядку: i) перетворення однієї сполуки формули (I) на іншу сполуку формули (I); ii) перетворення сполуки формули (I) на відповідну прийнятну її сіль або N-оксид; iii) перетворення фармацевтично прийнятної солі або N-оксиду формули (I) на вихідну сполуку формули (I); iv) одержання стереохімічно ізомерної форми сполуки формули (I) або її фармацевтично прийнятної солі або N-оксиду. Проміжні сполуки формули (VII), де Rd та Re є відповідними радикалами або, взяті разом з атомом карбону, до якого вони приєднані, утворюють гетероциклічну кільцеву систему, як визначено в Z, можуть бути одержані гідролізом проміжних сполук формули (VI), де R3 є групою формули (b-1) або радикалом формули (a-1), де s не дорівнює нулю, позначеним як Rg, відомими в даній області способами, такими як перемішування проміжної сполуки (VI) у водному розчині кислоти в присутності реакційноінертного розчинника, наприклад, тетрагідрофурану. Відповідною кислотою є, наприклад, хлористоводнева кислота. Сполуки формули (I), де R2 позначає гідроген і Rg визначений вище, називані сполуками формули (I-i), можуть бути одержані, виходячи із проміжних сполук формули (VII), шляхом селективного гідрування зазначеної проміжної сполуки відповідним відновником, таким як, наприклад, каталізатор на основі благородного металу, такого як платина на активованому вугіллі, палладій на активованому вугіллі та подібні, і відповідним відновником, таким як водень, у відповідному розчиннику, такому як метанол. Сполуки формули (I) можуть бути одержані гідролізом проміжних сполук формули (VIII) відомими в даній області способами, шляхом взаємодії проміжних сполук формули (VIII) з відповідними реагентами, такими як хлорид олова, оцтова кислота та хлористоводнева кислота, в присутності реакційноінертного розчинника, наприклад, тетрагідрофурану. Сполуки формули (I) можуть бути одержані, виходячи з N-оксидів (IX) шляхом перетворення проміжних сполук формули (IX) в присутності при датного реагенту, такого як карбонат натрію або оцтовий ангідрид, і, коли це необхідно, у розчиннику, такому як дихлорметан. Сполуки формули (I), де X позначає CH, називані сполуками формули (I-j), можуть бути також одержані шляхом циклізації проміжної сполуки формули (X). Реакція циклізації проміжних сполук формули (X) може бути здійснена відомими в даній області способами циклізації. Краще реакцію проводити в присутності відповідної кислоти Льюїса, наприклад, хлориду алюмінію, в чистому виді або у відповідному розчиннику, такому як, напри клад, ароматичний вуглеводень, наприклад, бензол, хлорбензол, метилбензол і подібні; галогеновані вуглеводні, наприклад, трихлорметан, тетрахлорметан і подібні; простий ефір, наприклад, тетрагідрофуран, 1,4-діоксан і подібні; або в суміші таких розчинників. При деяких підвищених температурах, краще, в інтервалі 70-100°C, і перемішуванні може збільшуватися швидкість реакції. 23 86777 24 Сполуки формули (I), де X позначає N, і R2, узятий разом з R3, утворює =O, називані сполуками формули (I-a-1), можуть бути одержані шляхом конденсації відповідного ортобензолдіаміну формули (XI) зі складним ефіром формули (XII), де Rh позначає C1-6-алкіл. Конденсація заміщеного ортодіаміну формули (XI) і складного ефіру формули (XII) може бути проведена в присутності карбонової кислоти, наприклад, оцтової кислоти та подібної, мінеральної кислоти, такої як, наприклад, хлористоводнева кислота, сірчана кислота, або сульфонової кислоти, такої як, наприклад, метансульфонова кислота, бензолсульфонова кислота, 4-метилбензолсульфонова кислота та подібні. При деяких підвищених температурах може збільшуватися швидкість реакції і в деяких випадках реакція може здійснюватися при температурі кипіння реакційної суміші зі зворотним холодильником. Вода, що виділяється при конденсації, може бути видалена із суміші азеотропною перегонкою, відгонкою і подібними способами. Проміжні сполуки формули (XI) можуть бути одержані реакцією відновлення нітрогрупи до аміногрупи, виходячи із проміжної сполуки формули (XIII) в присутності каталізатора на основі металу, такого як нікель Ренея, і відповідного відновника, такого як водень, в придатному розчиннику, такому як метанол. Проміжні сполуки формули (XIII) можуть бути одержані гідролізом проміжних сполук формули (XIV) відомими в даній області способами, такими як перемішування проміжної сполуки (XIV) у вод ному розчині кислоти в присутності реакційноінертного розчинника, наприклад, тетрагідрофурану. Відповідною кислотою є, наприклад, хлористоводнева кислота. Проміжні сполуки формули (X) зручно одержувати взаємодією аніліну формули (XV) з галогенідом формули (XVI) в присутності основи, такої як піридин, в придатному розчиннику, такому як дихлорметан. Проміжні сполуки формули (VIII), де R2 позначає гідроген або гідроксил і, коли R2 позначає гідроген, R3 є гідроксилом, називані проміжними сполуками формули (VIII-a), можуть бути одержані обробкою проміжної сполуки формули (XVII), де W позначає галоген, літійорганічним реагентом, таким як н-бутиллітій, в реакційноінертному розчиннику, наприклад, тетрагідрофурані, і наступною 25 86777 26 взаємодією зазначеної проміжної сполуки з проміжною сполукою формули (XVIII), де Ri позначає гідроген або радикал, як визначено в R3. Даний винахід також стосується сполуки формули (VII), де n дорівнює 0, X позначає CR7, і Re та Rd, значення яких будуть визначені нижче, називаних сполуками формули (VII-a) e) арил є фенілом або фенілом, заміщеним галогеном чи C1-6-алкілокси. Друга група цікавих сполук формули (VII-a) складається зі сполук формули (VII-a), на які накладається одне та більше з таких обмежень: a) R1 позначає C1-6-алкіл; b) Re позначає гідроген або, взятий разом з Rd, може утворювати двовалентний радикал формули (e-1); c) R15 та R16 кожен незалежно вибирають з гідрогену або арил-C2-6-алкенілу; d) R4, R5 та R6 кожен незалежно вибирають з гідрогену; e) коли R5 та R6 находяться в суміжних положеннях, узяті разом, вони можуть утворювати двовалентний радикал формули (b-2); і f) арил є фенілом, заміщеним галогеном або C1-6-алкіломокси. Група кращих сполук складається з таких сполук формули (VII-a), де R1 позначає C1-6-алкіл; коли Re позначає радикал формули (a-1) чи (a-2), тоді R15 та R16 кожен незалежно вибирають з гід її N-оксидних форм, солей приєднання та стереохімічно ізомерних форм, де R1, R4, R5, R6, R7 та арил є такими, як визначено для сполук формули (I); Re позначає гідроген, або, взятий разом з Rd, може утворювати двовалентний радикал формули -(CH2)2-NR15-(CH2)2(e-1) або -CH2-NR16-(CH2)3(e-2), де R15 та R16 кожен незалежно вибирають з гідрогену, C1-6-алкілу, , , C1-6-алкілокси-C1-6 алкілу, C1-6-алкілокси-C1-6-алкілу, піперидиніл-C1-6алкілу, C3-10-циклоалкіл-C1-6-алкілу, арилокси(гідроксі)-C1-6-алкілу, арил-C1-6-алкілу або арилC2-6-алкенілу; або Rd позначає ді-(C1-6-алкіл)аміно-C1-6-алкіл або піперидиніл-C1-6-алкіл. Перша група цікавих сполук формули (VII-a) складається з тих сполук формули (VII-a), на які накладається одне та більше з таких обмежень: a) R1 позначає C1-6-алкіл; b) R15 та R16 кожен незалежно вибирають з гі дрогену, C1-6-алкілу, , арилокси(гідроксі)-C1-6-алкілу, арил-C1-6-алкілу або арил-C2-6-алкенілу; c) R4, R5 та R6 кожен незалежно вибирають з гідрогену або галогену; d) коли R5 та R6 находяться в суміжних положеннях, узяті разом, вони можуть утворювати двовалентний радикал формули (b-2) та (b-4); і рогену, C1-6-алкілу, , арилокси(гідроксі)-C1-6-алкілу, арил-C1-6-алкілу або арил-C2-6-алкенілу; R4, R5 та R6 кожен незалежно вибирають з гідрогену або галогену, або коли R5 та R6 находяться в суміжних положеннях, узяті разом, вони можуть утворювати двовалентний радикал формули (b-2) чи (b-4); і арил є фенілом або фенілом, заміщеним галогеном чи C1-6-алкілокси. Додаткова група кращих сполук складається з таких сполук формули (VII-a), де R1 позначає C1-6алкіл; Re позначає гідроген, або, взятий разом з Rd, може утворювати двовалентний радикал формули (a-1); R15 та R16 кожен незалежно вибирають з гідрогену або арил-C2-6-алкенілу; R4, R5 та R6 кожен незалежно вибирають з гідрогену, або, коли R5 та R6 находяться в суміжних положеннях, узяті разом, вони можуть утворювати двовалентний радикал формули (b-2); і арил є фенілом, заміщеним галогеном або C1-6-алкілокси. Сполуки формули (VII-a-1), визначені як сполуки формули (VII-a), у яких Re, узятий разом з Rd, утворює двовалентний радикал формули (e-1) або (e-2) (наприклад, двовалентний радикал формули (e-1)), і R15 або R16 (наприклад, R15) не є гідрогеном, можуть бути одержані взаємодією сполуки формули (VII-a), де Re, узятий разом з Rd, утворює двовалентний радикал формули (e-1) або (e-2) (наприклад, двовалентний радикал формули (e 27 86777 28 1)), і R15 або R16 (наприклад, R15) позначає гідроген, називаною сполукою формули (VII-a-2), з проміжною сполукою формули (XIX), де W є відповідною відхідною групою, такою як, наприклад, хлор, бром, метансульфонілокси або бензолсульфоні локси, і R15 або R16 (наприклад, R15) не позначає гідроген. Реакція може бути здійснена в реакційноінертному розчиннику, такому як, наприклад, карбонат натрію, карбонат калію або триетиламін. Сполуки формули (VII-a), де R15 або R16 (наприклад, R15) є арилокси(гідроксі)-C1-6-алкілом, називані сполуками формули (VII-a-3), можуть бу ти одержані взаємодією сполуки формули (VII-a-2) з проміжною сполукою формули (XX), де R є відповідним замісником, в присутності 2-пропанолу. Даний винахід також стосується сполук формули (I) або формули (VII-a), визначених вище, для застосування як лікарський засіб. Сполуки за даним винаходом мають здатність до інгібування PARP, як буде видно далі з експериментальної частини. Даний винахід також пропонує застосування сполук для виробництва лікарського засобу для лікування одного або більше описаних в даному описі захворювань і розладів у тварини, де зазначеною сполукою є сполука формули (I) -C≡N (a-5), де s дорівнює 0, 1, 2 або 3; R8, R10 та R11 кожен незалежно вибирають з CHO, C1-6-алкілу, гідрокси-C1-6-алкілу, C1-6алкілкарбонілу, аміно, C1-6-алкіламіно, ді-(C1-6алкіл)аміно-C1-6-алкілу, C1-6-алкілоксикарбонілу, C1-6-алкілкарбоніламіно-C1-6-алкілу, піперидинілC1-6-алкіламінокарбонілу, піперидинілу, піперидиніл-C1-6-алкілу, C1-6-алкілокси, тіофеніл-C1-6-алкілу, піроліл-C1-6-алкілу, арил-C1-6-алкілпіперидинілу, арилкарбоніл-C1-6-алкілу, арилкарбонілпіперидиніл-C1-6-алкілу, галогеніндазолілпіперидиніл-C1-6алкілу, арил-C1-6-алкіл-(C1-6-алкіл)аміно-C1-6-алкілу, і R9 позначає гідроген або C1-6-алкіл; або R3 є групою формули -(CH2)t-Z (b-1), де t дорівнює 0, 1, 2 або 3; -Z є гетероциклічною кільцевою системою, вибраною з її N-оксидні форми, солі приєднання та стереохімічно ізомерні форми, де n дорівнює 0, 1 або 2; X позначає N або CR7, де R7 позначає гідроген, або, взятий разом з R1, може утворювати двовалентний радикал формули -CH=CH-CH=CH-; R1 позначає C1-6-алкіл або тіофеніл; R2 позначає гідроген, гідрокси, C1-6-алкіл, C3-6алкініл, або, взятий разом з R3, може утворювати =O; R3 позначає радикал, вибраний з -(CH2)s-NR8R9 (a-1), -O-H (a-2), -O-R10 (a-3), -S-R11 (a-4) або 29 86777 де R12 позначає гідроген, галоген, C1-6-алкіл, амінокарбоніл, аміно, гідрокси, арил, , , C1-6-алкіламіно-C1-6 алкілокси, C1-6-алкілокси-C1-6-алкіл, C1-6-алкілоксиC1-6-алкіламіно, арил-C1-6-алкіл, ди(феніл-C2-6алкеніл), піперидиніл, піперидиніл-C1-6-алкіл, C3-10циклоалкіл, C3-10-циклоалкіл-C1-6-алкіл, арилокси(гідроксі)-C1-6-алкіл, галогеніндазоліл, арил-C1-6алкіл, арил-C2-6-алкеніл, арил-C1-6-алкіламіно, морфоліно, C1-6-алкілімідазоліл, піридиніл-C1-6алкіламіно; і R13 позначає гідроген, піперидиніл або арил; R4, R5 та R6 кожен незалежно вибирають з гідрогену, галогену, тригалогенметилу, тригалогенметокси, C1-6-алкілу, C1-6-алкілокси, аміно, аміноC1-6-алкілу, ді-(C1-6-алкіл)аміно, ді-(C1-6-алкіл)аміноC1-6-алкілокси або C1-6-алкілоксикарбонілу, або C1-6-алкілу, заміщеного 1, 2 або 3 замісниками, незалежно вибраними з гідрокси, C1-6-алкілокси або аміно-C1-6-алкілокси; або коли R5 та R6 находяться в суміжних положеннях, узяті разом, вони можуть утворювати двовалентний радикал формули -O-CH2-O (d-1), -O-(CH2)2-O(d-2), -CH=CH-CH=CH(d-3) або -NH-C(O)-NR14=CH(d-4), де R14 позначає C1-6-алкіл; арил є фенілом, фенілом, заміщеним галогеном, C1-6-алкілом або C1-6-алкілокси. Даний винахід також пропонує застосування сполук формули (I) для виробництва лікарського засобу для лікування одного або більше описаних вище захворювань у тварини, де сполукою є сполука формули (I-k) її N-оксидні форми, солі приєднання та стереохімічно ізомерні форми, де n дорівнює 0; X позначає N; R1 є метилом або етилом; R2 позначає гідроген; R3 є групою формули (b-1); 30 t дорівнює 0; -Z є гетероциклічною кільцевою системою (с-2), у якій зазначена гетероциклічна кільцева система -Z приєднана до решти молекули атомом нітрогену; R12 позначає гідроген або C1-6-алкіл; і R17 є галогеном або C1-6-алкілокси, або, якщо 1 R є етилом, R17 може бути гідрогеном. Більш конкретно, сполукою формули (I-k) є 6-[(1H-імідазол-1-іл)-(4-метоксифеніл)метил]-3метил-2(1H)-хіноксалінон (сполука № 128), 3-етил6-(1H-імідазол-1-ілфенілметил)-2(1H)-хіноксалінон (сполука № 127) і 6-[(4-хлорофеніл)-1H-імідазол-1ілметил]-3-метил-2(1H)-хіноксалінон (сполука № 146). Даний винахід також пропонує застосування сполук формули (VII-a) для виробництва лікарського засобу для лікування одного або більше описаних в даному описі захворювань у тварини. Сполуки за даним винаходом можуть лікувати або запобігати ушкодженню тканини в результаті ушкодження або загибелі клітин через некроз або апоптоз; можуть виправляти ушкодження нервової або серцево-судинної тканини, які включають вогнищеву ішемію, інфаркт міокарда та травму в результаті реперфузії; можуть лікувати різні захворювання та стани, викликані або загострені активністю PARP; можуть продовжувати або збільшувати ресурс або проліферативну здатність клітин; можуть змінювати експресію генів старіючих клітин; можуть радіосенсибілізувати та/або хіміосенсибілізувати клітини. Звичайно, інгібування активності PARP охороняє клітини від енергетичних втрат, запобігаючи, у випадку нервових клітин, необоротній деполяризації нейронів, і таким чином, забезпечує нейрозахисну дію. У зв'язку з вищевказаним, даний винахід, крім того, стосується способу введення терапевтично ефективної кількості ідентифікованих вище сполук в кількості, достатній для інгібування активності PARP, для лікування або запобігання ушкодженню тканини в результаті ушкодження або загибелі клітин через некроз або апоптоз, для впливу на нейронну активність, не опосередковану NMDA токсичністю, для впливу на нейронну активність, опосередковану NMDA токсичністю, для лікування ушкодження нервової тканини в результаті ішемії та репефузійної травми, неврологічних розладів і нейродегенеративних захворювань; для запобігання або лікування судинних порушень; для лікування або запобігання серцево-судинних захворювань; для лікування інших станів та/або розладів, таких як вікове переродження м'язів, СНІД та інші імунні вікові захворювання, запалення, подагра, артрит, атеросклероз, кахексія, рак, дегенеративні захворювання кістякових м'язів, що включають реплекативне старіння, діабет, головна травма, запальні захворювання кишечнику (такі як коліт і хвороба Крона), м'язова дистрофія, остеоартрит, остеопороз, хронічний та/або гострий біль (такий як невропатичний біль), ниркова недостатність, ішемія сітківки, септичний шок (такий як ендотоксичний шок) і старіння шкіри, для збільшення ресурсу та проліферативної здатності клітин; для зміни експресії генів старіючих клітин; або хемосе 31 нсибілізації та/або радіосенсибілізації (гіпоксичних) пухлинних клітин. Даний винахід також стосується лікування захворювань і станів у тварини, яке включає введення зазначеній тварині терапевтично ефективної кількості ідентифікованих вище сполук. Зокрема, даний винахід стосується способу лікування, запобігання або інгібування неврологічного захворювання у тварини, який включає введення зазначеній тварині терапевтично ефективної кількості ідентифікованих вище сполук. Неврологічний розлад вибирають з групи, що складається з периферичної невропатії, викликаної фізичним ушкодженням або хворобливим станом, травматичного ушкодження мозку, фізичного ушкодження спинного мозку, удару, пов'язаного з ушкодженням мозку, вогнищевої ішемії, глобальної ішемії, реперфузійного ушкодження, демієлінізуючого захворювання та неврологічного розладу, пов'язаного з нейродегенерацією. Даний винахід також пропонує застосування сполук формули (I) і сполук формули (VII-a) для інгібування активності PARP, для лікування, запобігання або інгібування ушкодження тканини в результаті ушкодження або загибелі клітин через некроз або апоптоз, для лікування, запобігання або інгібування неврологічного розладу у тварини. Термін "запобігання нейродегенерації" включає здатність запобігати нейродегенерації у пацієнтів з повторно поставленим діагнозом нейродегенеративного захворювання або при ризику розвитку нового дегенеративного захворювання, та для запобігання додаткової нейродегенерації у пацієнтів, які вже страждають або мають симптоми нейродегенеративного захворювання. Термін "лікування", використовуваний в описі, охоплює будь-яке лікування захворювання та/або стану у тварини, особливо, у людини, і включає: (i) запобігання виникненню захворювання та/або стану у суб'єкта, який може бути схильним до захворювання та/або стану, але якому ще не поставлений діагноз про те, що він хворий; (ii) інгібування захворювання та/або стану, наприклад, зупинення його розвитку; (iii) полегшення перебігу хвороби та/або стану, наприклад, таке, що приводить до регресії захворювання та/або стану. Термін "радіосенсибілізатор", використовуваний в описі, визначає молекулу, краще, з низькою молекулярною масою, яку вводять тварині в терапевтично ефективних кількостях для збільшення чутливості клітин до іонізуючого випромінювання та/або для прискорення лікування захворювань, які піддаються лікуванню іонізуючим випромінюванням. Такі захворювання включають захворювання з новоутвореннями, доброякісні та злоякісні пухлини, і ракові клітини. Іонізуюча променева терапія для інших захворювань, не вказаних в описі, також пропонуються даним винаходом. Термін "хіміосенсибілізатор", використовуваний в описі, визначає молекулу, краще, з низькою молекулярною масою, яку вводять тварині в терапевтично ефективних кількостях для збільшення чутливості клітин до хіміотерапії та/або для прискорення лікування захворювань, які піддаються лікуванню хіміотерапією. Захворювання, які підда 86777 32 ються лікуванню хіміотерапією, включають захворювання з новоутвореннями, доброякісні та злоякісні пухлини, і ракові клітини. Хіміотерапія для інших захворювань, не згаданих в описі, також пропонуються даним винаходом. Сполуки, композиції та способи за даним винаходом є особливо корисними для лікування або запобігання ушкодженню тканини в результаті ушкодження або загибелі клітин через некроз або апоптоз. Сполуки за даним винаходом можуть бути "протираковими засобами", термін, що також включає "засоби проти росту пухлинних клітин" та "протипухлинні засіб". Наприклад, способи за винаходом є корисними для лікування раку та чутливих до хіміо- та/або променевої терапії пухлинних клітин при злоякісних новоутвореннях, таких як АКТГ-продукуючі пухлини, гострий лімфобластний лейкоз, гострий нелімфобластний лейкоз, рак кори надниркової залози, рак сечового міхура, рак мозку, рак молочної залози, рак шийки матки, хронічний лімфолейкоз, хронічний мієлолейкоз, колоректальний рак, шкірна Т-клітинна лімфома, рак ендометрію, рак стравоходу, саркома Юїнга, рак жовчного міхура, лейкоз ворсистих клітин, рак голови та шиї, лімфома Ходжкіна, саркома Капоші, рак нирки, рак печінки, рак легенів (дрібноклітинний та/або недрібноклітинний), злоякісний перитонеальний випот, злоякісний плевральний випот, меланома, мезотеліома, множинна мієлома, нейробластома, неходжкінська лімфома, остеосаркома, рак яєчників, рак яєчників (гермінальноклітинний), рак передміхурової залози, рак підшлункової залози, рак полового члена, ретинобластома, рак шкіри, саркома м'яких тканин, плоскоклітинний рак, рак шлунка, рак яєчок, рак щитовидної залози, трофобластичні пухлини, рак матки, рак піхви, рак вульви та пухлина Вільмса. Тому, сполуки за даним винаходом можуть бути використані як "радіосенсибілізатор" та/або "хіміосенсибілізатор". Відомо, що радіосенсибілізатори збільшують чутливість ракових клітин до токсичної дії іонізуючого випромінювання. В літературі було запропоновано кілька механізмів дії радіосенсибілізаторів, включаючи: радіосенсибілізатори гіпоксичної клітини (наприклад, сполуки 2-нітроімідазолу та сполуки діоксиду бензотриазину), які імітують кисень або, альтернативно, проявляють себе як біовідновлювальні засоби при гіпоксії; радіосенсибілізатори негіпоксичної клітини (наприклад, галогеновані піримідини) можуть бути аналогами основ ДНК і краще вбудовуються в ДНК ракових клітин та у такий спосіб прискорюють викликуваний випромінюванням розпад молекул ДНК та/або перешкоджають нормальним механізмам репарації ДНК; і були висунуті гіпотези з приводу інших різних механізмів дії радіосенсибілізаторів при лікуванні захворювання. У багатьох схемах лікування раку постійно використовують радіосенсибілізатори в сполученні з рентгенівським випромінюванням. Приклади радіосенсибілізаторів, активованих рентгенівським випромінюванням, включають, без обмеження, метронідазол, мізонідазол, дезметилмізонідазол, пімонідазол, етанідазол, німоразол, 33 мітоміцин C, RSU 1069, SR 4233, EO9, RB 6145, нікотинамід, 5-бромдезоксиуридин (BUdR), 5йоддезоксиуридин (IUdR), бромдезоксицитидин, фтордезоксиуридин (FUdR), гідроксисечовину, цисплатин та їхні терапевтично ефективні аналоги і похідні. Фотодинамічна терапія (ФТП) раку використовує видиме світло як радіаційний активатор сенсибілізатора. Приклади фотодинамічних радіосенсибілізаторів включають, без обмеження ними, похідні гематопорфірину, фотофрин (Photofrin), похідні бензопорфірину, етіопорфірин олова, феоборбід-a, бактеріохлорофіл-a, нафталоціаніни, фталоціаніни, фталоціанін цинку та їхні терапевтично ефективні аналоги і похідні. Радіосенсибілізатори можуть вводитися в сполученні з терапевтично ефективною кількістю однієї або більше інших сполук, включаючи, без обмеження ними, сполуки, які прискорюють включення радіосенсибілізаторів в клітини-мішені; сполуки, які регулюють потік ліків, живильних речовин та/або кисню до клітин-мішеней; хіміотерапевтичні засоби, які діють на пухлину з або без додаткового опромінення; або інші терапевтично ефективні сполуки для лікування раку та інших захворювань. Приклади додаткових терапевтичних засобів, які можуть бути використані в сполученні з радіосенсибілізаторами, включають, без обмеження ними, 5-фторурацил, лейковорин, 5'аміно-5'-дезокситимідин, кисень, карбоген, переливання еритроцитарної маси, перфторкарбони (наприклад, Fluosol 10 DA), 2,3-DPG, BW12C, блокатори кальцієвих каналів, пентоксифілін, сполуки, що пригнічують ріст судин, гідралазин та LBSO. Приклади хіміотерапевтичних засобів, які можуть бути використані в сполученні з радіосенсибілізаторами, включають, без обмеження ними, адріаміцин, камтотецин, карбоплатин, цисплатин, даунорубіцин, доцетаксел, доксорубіцин, інтерферон (альфа, бета, гамма), інтерлейкін-2, іринотекан, паклітаксел, топотекан та їхні терапевтично ефективні аналоги і похідні. Хіміосенсибілізатори можуть бути введені в сполученні з терапевтично ефективною кількістю однієї або більше сполук, включаючи, без обмеження ними, сполуки, які прискорюють включення хіміосенсибілізаторів в клітини-мішені; сполуки, які регулюють потік ліків, живильних речовин та/або кисню до клітин-мішеней; хіміотерапевтичні засоби, які діють на пухлину, або інші терапевтично ефективні сполуки для лікування раку та інших захворювань. Приклади додаткових терапевтичних засобів, які можуть бути використані в сполученні з хіміосенсибілізаторами, включають, без обмеження ними, метилювальні засоби, інгібітори топоізомерази I та інші хіміотерапевтичні засоби, такі як цисплатин і блеоміцин. Сполуки формули (I) і сполуки формули (VII-a) можуть також застосовуватися для виявлення або ідентифікації PARP, і особливо, PARP-1 рецептора. З цією метою в сполуки може бути введена мітка. Зазначена мітка може бути вибрана з групи, яка включає радіоізотоп, спінову мітку, антигенну мітку, ферментну мітку флуоресцентної групи або хемілюмінесцентної групи. Для одержання фармацевтичних композицій 86777 34 за даним винаходом, ефективну кількість конкретної сполуки, у формі солі приєднання основи або кислоти, як активний інгредієнт, поєднують в однорідну суміш із фармацевтично прийнятним носієм, який може набувати різних форм залежно від бажаної для введення форми препарату. Бажано, щоб ці фармацевтичні композиції находилися в одиничній дозованій формі, зручній, краще, для перорального, ректального, підшкірного введення або для парентеральної ін'єкції. Наприклад, при одержанні композицій в пероральній дозованій формі може бути використане будь-яке звичайне фармацевтичне середовище, таке як, наприклад, вода, гліколі, масла, спирти та подібні, у випадку пероральних рідких препаратів, таких як суспензії, сиропи, еліксири та розчини; або тверді носії, такі як крохмалі, цукри, каолін, лубриканти, зв’язуючі, дезинтегруючі речовини та подібні, у випадку порошків, пігулок, капсул і таблеток. Через зручність введення таблетки та капсули є найзручнішими пероральними одиничними дозованими формами, очевидно, в тому випадку, коли використовують тверді фармацевтичні носії. Для парентеральних композицій носій звичайно містить стерильну воду, щонайменше, як основний компонент, хоча можуть бути включені й інші інгредієнти, наприклад, для поліпшення розчинності. Розчини для ін'єкцій, наприклад, можуть бути приготовлені в носії, що містить фізіологічний розчин, розчин глюкози або суміш фізіологічного розчину з розчином глюкози. Суспензії для ін'єкцій можуть бути також приготовлені у відповідних рідких носіях, можуть застосовуватися суспендувальні та подібні засоби. В композиціях, зручних для підшкірного введення, носій необов'язково містить засіб, що посилює проникнення, та/або придатний зволожуючий агент, необов'язково поєднуваний з придатними добавками будь-якої природи в невеликих кількостях, які не викликають значного шкідливого впливу на шкіру. Зазначені добавки можуть полегшувати введення в шкіру та/або можуть бути корисними для одержання бажаних композицій. Ці композиції можуть бути введені різними способами, наприклад, у вигляді трансдермального пластиру, у вигляді наклейки, у вигляді мазі. Особливо зручно складати вищевказані фармацевтичні композиції в дозованій одиничній формі для полегшення введення та сталості дози. «Дозована одинична форма», відповідно до опису та формули винаходу, позначає фізично дискретні одиниці, зручні як разові дози, кожна з яких містить задану кількість активного інгредієнта, обчислену для досягнення бажаної терапевтичної дії, в сполученні з необхідним фармацевтичним носієм. Прикладами таких дозованих одиничних форм є таблетки (включаючи таблетки з насічкою та таблетки з покриттям), капсули, пігулки, пакетики з порошком, галети, розчини або суспензії для ін'єкцій, чайні ложки, столові ложки та подібні, і поділені на кратні частини. Для фахівця в даній області не важко визначити ефективну кількість на основі представлених в описі результатів тестів. Звичайно вважають, що ефективна кількість становить від 0,001 до 100мг/кг маси тіла, і, зокрема, від 0,005 до 10мг/кг маси тіла. Зручно вводити необхідну дозу у вигля 35 ді двох, трьох, чотирьох або більше субдоз через відповідні інтервали протягом дня. Зазначені субдози можна готовити у вигляді одиничних дозованих форм, які містять, наприклад, від 0,05мг до 500мг, і, зокрема, від 0,1мг до 200мг, активного інгредієнта на одиничну дозовану форму. Експериментальна частина Далі в описі "BuLi" позначає бутиллітій, "MeOH" позначає метанол, "ДІПЕ" позначає діізопропіловий ефір, "ДМФА" позначає N,Nдиметилформамід, "ДХМ" позначає дихлорметан, "ДМСО" позначає диметилсульфоксид, "EtOAc" позначає етилацетат, "ТГФ" позначає тетрагідрофуран, "МЕК" позначає метилетилкетон. A. Одержання проміжних сполук Приклад A1 a) Одержання проміжної сполуки 1 Розчин бромбензолу (0,316моль) в діетиловому ефірі додавали по краплях до розчину Mg стружки (0,316моль) в діетиловому ефірі при кімнатній температурі і суміш перемішували протягом 1 години 30хв. Суміш охолоджували до 0°C, додавали по краплях 3-метил-6-хінолінкарбоксальдегід (0,263 моль) у ТГФ (200мл) і суміш перемішували протягом 2 годин. Суміш виливали в насичений водний розчин хлориду амонію та екстрагували ДХМ. Органічний шар осушали (MgSO4), фільтрували та випарювали досуха. Залишок (65,65г) кристалізували з ДІПЕ. Продукт використовували без додаткового очищення, одержуючи 45,92г (70%) проміжної сполуки 1. b) Одержання проміжної сполуки 2 Перманганат калію (0,24моль) додавали порціями до розчину проміжної сполуки 1 (0,16моль) у ДХМ (300мл) та триетаноламінтрис(2метоксіетил)овому ефірі (5мл) і суміш перемішували протягом 2 годин. Суміш фільтрували через целіт і випарювали досуха, одержуючи 35г (88%) проміжної сполуки 2. c) Одержання проміжної сполуки 3 Розчин проміжної сполуки 2 (0,142моль) у ДХМ 86777 36 (200мл) додавали по краплях до розчину 3хлорбензолпероксокарбонової кислоти (0,283моль) у ДХМ при кімнатній температурі та суміш перемішували протягом 12 годин. Суміш виливали у воду, підлуговували карбонатом калію та екстрагували ДХМ. Органічний шар осушали (MgSO4), фільтрували та випарювали досуха, одержуючи 32,68г (87%) проміжної сполуки 3. d) Одержання проміжної сполуки 4 Тозилхлорид (0,145моль) додавали порціями до суміші проміжної сполуки 3 (0,121моль) у ДХМ (300мл) та карбонаті калію 10% (665мл) і суміш перемішували протягом 1 години 30хв. Додавали ДХМ і воду, суміш фільтрували через целіт та екстрагували ДХМ. Органічний шар осушали (MgSO4), фільтрували та випарювали досуха. Залишок (36,43г) очищали хроматографією на колонці з силікагелем (елюент: ДХМ/MeOH 98/2). Чисті фракції збирали та випарювали. Залишок (4,09г) кристалізували з 2-пропанону, одержуючи 1,67г (5%) проміжної сполуки 4, температура плавлення 264,60°C. e) Одержання проміжної сполуки 5 Суміш проміжної сполуки 4 (0,037моль) і Nметилформаміду (1,85моль) у мурашиній кислоті (15мл) перемішували та нагрівали при 160°C протягом 48 годин. Суміш охолоджували до кімнатної температури, виливали в льодяну воду, підлуговували карбонатом калію 10% та екстрагували EtOAc. Органічний шар осушали (MgSO4), фільтрували та випарювали. Залишок кристалізували з діетилового ефіру. Частину (3г) залишку (7г) перекристалізовували із суміші ДХМ/діетиловий ефір, одержуючи 2,15г проміжної сполуки 5, температура плавлення 189,8°C. Приклад A2 Одержання проміжної сполуки 6 n-BuLi 1,6М у гексані (0,0382моль) додавали по краплях при 60°C в потоці N2 до суміші 6-бром3-етил-2-метоксихіноліну (0,03моль) у ТГФ (50мл). Суміш перемішували при -60°C протягом 1 години. Додавали по краплях розчин 2,3-дигідро-1,4бензодіоксин-6-карбоксальдегіду (0,0361моль) у ТГФ (50мл). Суміш перемішували при -60°C протя 37 гом 2 годин, потім при -40°C протягом 1 години, виливали у воду і гідроксид амонію та екстрагували ДХМ. Органічний шар відокремлювали, осушали (MgSO4), фільтрували та розчинник випарювали. Продукт використовували без додаткового очищення, одержуючи 10,56г проміжної сполуки 6. b) Одержання проміжної сполуки 7 Суміш проміжної сполуки 6 (0,0398моль) у хлористоводневій кислоті 3Н (100мл) і ТГФ (20мл) перемішували при 60°C протягом 12 годин, потім виливали в льодяну воду та гідроксид амонію і екстрагували ДХМ. Органічний шар відокремлювали, осушали (MgSO4), фільтрували та розчинник випарювали. Осад поміщали в 2-пропанон і ДІПЕ, відфільтровували та сушили, одержуючи 6,2г (47%) проміжної сполуки 7, температура плавлення 232°C. Приклад A3 а) Одержання проміжної сполуки 8 n-BuLi 1,6M (0,102моль) додавали по краплях при -78°C до розчину 6-бром-2-хлор-3-етилхіноліну (0,085моль) у ТГФ (200мл) в потоці N2. Суміш перемішували при -78°C протягом 1 години. Додавали по краплях розчин N-метокси-Nметилбензаміду (0,085моль) у ТГФ (50мл) при -78°C. Суміш перемішували при температурі від -78°C до 0°C протягом 2 годин 30хв., гідролізували водою та екстрагували EtOAc. Органічний шар відокремлювали, осушали (MgSO4), фільтрували та розчинник випарювали. Залишок очищали хроматографією на колонці з силікагелем (15-35мкм) (елюент: циклогексан/EtOAc 93/7). Чисті фракції збирали та розчинник випарювали. Залишок (7,5г, 30%) кристалізували з 2-пропанону. Осад відфільтровували та сушили, одержуючи 7,15г (28%) проміжної сполуки 8, температура плавлення 94°C. b) Одержання проміжної сполуки 9 Суміш проміжної сполуки 8 (0,169моль) у хлористоводневій кислоті 3Н (250мл) перемішували та кип'ятили зі зворотним холодильніком протягом 12 годин. Суміш охолоджували до кімнатної температури та фільтрували. Осад промивали водою, потім 2-пропаноном, а потім діетиловим ефіром. 86777 38 Продукт використовували без додаткового очищення, одержуючи 26г (55%) проміжної сполуки 9. с) Одержання проміжної сполуки 10 Гідроборат натрію (0,018моль) додавали порціями при 0°C в атмосфері N2 до розчину проміжної сполуки 9 (0,018моль) в MeOH (100мл), суміш перемішували при 5°C протягом 1 години, а потім при кімнатній температурі протягом 1 години. Суміш виливали в льодяну воду та фільтрували. Осад промивали 2-пропаноном та діетиловим ефіром і перекристалізовували із суміші 2пропанон/MeOH, одержуючи 2,6г (52%) проміжної сполуки 10, температура плавлення 235,7°C. Приклад A4 a) Одержання проміжної сполуки 11 2-Метил-2-пропанол, сіль калію (0,21моль), а потім MeOH (10,5мл) додавали при 0°C до розчину тозилметилізоціаніду (0,085моль) у ДМСО (300мл). Додавали проміжну сполуку 2 (0,06моль) при 5°C і суміш перемішували при 5°C протягом 1 години. Суміш виливали в льодяну воду та екстрагували ДХМ. Органічний шар промивали 3Н розчином хлористоводневої кислоти та випарювали досуха. Залишок перекристалізовували з діетилового ефіру, одержуючи 6,3г (40%) проміжної сполуки 11. b) Одержання проміжної сполуки 12 Розчин 3-хлорбензолпероксокарбонової кислоти (0,048моль) у ДХМ додавали при 0°C до розчину проміжної сполуки 11 (0,024моль) в ДХМ і суміш перемішували при кімнатній температурі протягом 12 годин. Суміш промивали 10% карбонатом калію та екстрагували ДХМ. Органічний шар осушали (MgSO4), фільтрували та випарювали, одержуючи 6,28г (94%) проміжної сполуки 12. Приклад A5 a) Одержання проміжної сполуки 13. 39 Розчин проміжної сполуки 1 (0,08моль) у ДХМ (300мл) охолоджували до 0°C. Додавали по краплях тіонілхлорид (0,4моль) і суміш перемішували при кімнатній температурі протягом 12 годин. Суміш виливали в льодяну воду, підлуговували гідроксидом амонію та екстрагували ДХМ. Органічний шар осушали (MgSO4), фільтрували та випарювали досуха. Продукт використовували без додаткового очищення, одержуючи 21,5г проміжної сполуки 13. b) Одержання проміжної сполуки 14 Суміш проміжної сполуки 13 (0,08моль), 1H1,2,4-триазолу (0,24моль) і карбонату калію (0,24моль) в ацетонітрилі (200мл) перемішували та нагрівали при 80°C протягом 48 годин. Суміш виливали у воду та екстрагували ДХМ. Органічний шар осушали (MgSO4), фільтрували та випарювали досуха. Залишок (25,22г) очищали хроматографією на колонці з силікагелем (елюент: ДХМ/MeOH 97/3). Чисті фракції збирали та випарювали, одержуючи 14,3г (60%) проміжної сполуки 14. c) Одержання проміжної сполуки 15 Розчин проміжної сполуки 14 (0,043моль) і 3хлорбензолпероксокарбонової кислоти (0,086моль) у ДХМ (150мл) перемішували при кімнатній температурі протягом 12 годин. Суміш виливали у воду, підлуговували гідроксидом амонію та екстрагували ДХМ. Органічний шар осушали (MgSO4), фільтрували та упарювали досуха. Продукт використовували без додаткового очищення, одержуючи 14г проміжної сполуки 15. Приклад A6 a) Одержання проміжної сполуки 16 86777 40 Суміш проміжної сполуки 4 (0,076моль) у формаміді (300мл) та мурашиній кислоті (100мл) перемішували при 160°C протягом тижня і виливали в льодяну воду. Осад відфільтровували, промивали водою, потім діетиловим ефіром і сушили. Залишок кристалізували із ДХМ/MeOH. Осад відфільтровували та сушили, одержуючи 14,5г (65%) проміжної сполуки 16, температура плавлення >260°C. b) Одержання проміжних сполук 17 та 18 Проміжна сполука 17 та Проміжна сполука 18 Суміш проміжної сполуки 16 (0,044моль) в 6Н хлористоводневій кислоті (290мл) перемішували при 100°C протягом 4 годин 30 хвилин, а потім доводили до кімнатної температури. Осад відфільтровували, промивали водою, потім діетиловим ефіром, одержуючи 13,5г (100%) проміжної сполуки 18 у вигляді моногідрохлоридної солі, температура плавлення >260°C. Частину цієї фракції (11,8г) підлуговували гідроксидом натрію та екстрагували ДХМ. Органічний шар відокремлювали, осушали (MgSO4), фільтрували та розчинник випарювали, одержуючи 9,95г проміжної сполуки 17. Приклад A7 Одержання проміжної сполуки 19 Суміш 1,1'-карбонілбіс-1H-імідазолу (0,0794моль) у ТГФ (100мл) перемішували при кімнатній температурі протягом 15хв. Повільно додавали суміш проміжної сполуки 18 (0,0265моль) у ТГФ (100мл). Суміш перемішували 41 86777 42 при кімнатній температурі протягом 2 годин. Продукт використовували без додаткового очищення, одержуючи 7,7г (100%) проміжної сполуки 19. Приклад A8 a) Одержання проміжної сполуки 20 Суміш проміжної сполуки 12 (0,022моль) і тозилхлориду (0,033моль) в 10% карбонаті калію (100мл) і ДХМ (100мл) перемішували при кімнатній температурі протягом 1 години. Суміш екстрагували ДХМ. Органічний шар осушали (MgSO4), фільтрували та випарювали. Залишок перекристалізовували з діетилового ефіру, одержуючи 5г (84%) проміжної сполуки 20, температура плавлення 227,5°C b) Одержання проміжної сполуки 21 Проміжну сполуку 20 (0,015моль) в MeOH/NH3 7Н (100мл) гідрували на нікелі Ренея (4г) як каталізаторі при кімнатній температурі протягом 6 годин при тиску 3 бар, і колбу продували N2. Після поглинання H2 (2екв.) каталізатор відфільтровували та фільтрат упарювали. Залишок очищали хроматографією на колонці з силікагелем (елюент: ДХМ/MeOH/NH4OH 90/10/0,1). Чисті фракції збирали та випарювали, одержуючи 3г (73%) проміжної сполуки 21. Приклад A9 a) Одержання проміжної сполуки 22 Гідроборат натрію (0,15моль) додавали порціями при 5°C в атмосфері N2 до суміші проміжної сполуки 4 (0,075моль) в MeOH (500мл) і ТГФ (500мл). Суміш перемішували при 5°C протягом 1 години, а потім при кімнатній температурі протягом 1 години. Суміш виливали на лід та екстрагували ДХМ. Органічний шар осушали (MgSО4), фільтрували та випарювали. Частину (3г) залишку (36,82г, 92%) перекристалізовували з діетилового ефіру та ТГФ, одержуючи 2г проміжної сполуки 22, температура плавлення 237,7°C. b) Одержання проміжної сполуки 23 Тіонілхлорид (10мл) додавали по краплях до розчину проміжної сполуки 22 (0,0162моль) у ДХМ (200мл) при 0°C. По закінченні додавання суміш перемішували при кімнатній температурі протягом 12 годин. Суміш випарювали у вакуумі, і продукт використовували без додаткового очищення, одержуючи 4,6г (100%) проміжної сполуки 23. Приклад A10 a) Одержання проміжної сполуки 24 Суміш проміжної сполуки 4 (0,076моль) у фосфорилхлориді (60мл) перемішували при 60°C протягом 5 годин. Суміш випарювали досуха, залишок переносили на лід, підлуговували NaHCO3 та екстрагували EtOAc. Органічний шар осушали (MgSО4), фільтрували та випарювали. Продукт використовували без додаткового очищення, одержуючи 18г (86%) проміжної сполуки 24. b) Одержання проміжної сполуки 25 Метилат натрію (0,16моль) додавали до розчину проміжної сполуки 24 (0,035моль) в MeOH (100мл) і суміш перемішували та кип'ятили зі зворотним холодильніком протягом 5 годин. Суміш охолоджували до кімнатної температури, виливали в льодяну воду та екстрагували EtOAc. Органічний шар осушали (MgSО4), фільтрували та випарювали. Залишок кристалізували з діетилового ефіру, одержуючи 7г (72%) проміжної сполуки 25. c) Одержання проміжної сполуки 26 n-BuLi (0,0539моль) повільно додавали при 70°C в потоці N2 до розчину 1-метил-1H-імідазолу (0,0539моль) у ТГФ (80мл). Суміш перемішували при -70°C протягом 30хв. Додавали хлортриетилсилан (0,0539моль). Давали суміші нагрітися до кімнатної температури, а потім охолоджували до 70°C. Повільно додавали n-BuLi (0,0539моль). Су 43 міш перемішували при -70°C протягом 1 години, потім давали суміші нагрітися до -15°C і охолоджували до -70°C. Додавали розчин проміжної сполуки 25 (0,0414 моль) у ТГФ (50мл). Давали суміші нагрітися до кімнатної температури, а потім перемішували при кімнатній температурі протягом ночі. Додавали воду. Суміш екстрагували EtOAc. Органічний шар відокремлювали, осушали (MgSО4), фільтрували та розчинник випарювали. Залишок (28г) очищали хроматографією на колонці з силікагелем (20-45мкм) (елюент: ДХМ/MeOH/NH4OH 96,5/3,5/0,1). Чисті фракції збирали, і розчинник випарювали, одержуючи 9,7г (65%) проміжної сполуки 26. Приклад A11 a) Одержання проміжної сполуки 27 Суміш N-(2-метоксіетил)-1-(фенілметил)-4піперидинаміну (0,0402моль) в етанолі (100мл) гідрували при 40°C протягом 2 годин, а потім при кімнатній температурі при тиску 3 бар протягом 3 годин на Pd/C 10% (1г) як каталізаторі. Після поглинання H2 (1екв.) каталізатор відфільтровували через целіт, каталізатор промивали етанолом і фільтрат випарювали. Продукт використовували без додаткового очищення, одержуючи 6,5г (99%) проміжної сполуки 27. b) Одержання проміжної сполуки 28 30% метилат натрію в MeOH (138мл) додавали до суміші 2-бром-6-хлорфенантридину (0,124моль) в MeOH (413мл). Суміш перемішували та кип'ятили зі зворотним холодильніком протягом ночі, потім виливали на лід та екстрагували ДХМ. Осад відфільтровували та сушили. Фільтрат осушали (MgSО4), фільтрували та випарювали. Залишок (19,7г) очищали хроматографією на колонці з силікагелем (20-45мкм) (елюент: ДХМ/циклогексан 30/70). Чисті фракції збирали та розчинник випарювали, одержуючи 9,6г (27%) проміжної сполуки 28. c) Одержання проміжної сполуки 29 n-BuLi 1,6M (0,028моль) додавали по краплях при -78°C в потоці N2 до суміші проміжної сполуки 28 (0,014моль) у ТГФ (40мл). Суміш перемішували при -78°C протягом 1 години. Додавали суміш 2,3дигідро-1,4-бензодіоксин-6-карбоксальдегіду (0,0305моль) у ТГФ (40мл). Суміш перемішували при -78°C протягом 1 години, гідролізували та екстрагували EtOAc. Відокремлювали органічний шар, осушали (MgSО4), фільтрували, та розчинник випарювали. Залишок (11,2г) очищали хроматог 86777 44 рафією на колонці з силікагелем (15-35мкм) (елюент: циклогексан/EtOAc 70/30). Чисті фракції збирали та розчинник випарювали, одержуючи 4г (77%) проміжної сполуки 29. d) Одержання проміжної сполуки 30 Суміш проміжної сполуки 29 (0,0107моль) в 3Н хлористоводневій кислоті (40л) і ТГФ (10мл) перемішували, кип'ятили зі зворотним холодильніком протягом ночі та виливали у воду. Осад відфільтровували та сушили, одержуючи 3,7г (97%) проміжної сполуки 30. e) Одержання проміжної сполуки 31 Тіонілхлорид (10мл) додавали при кімнатній температурі до суміші проміжної сполуки 30 (0,0028 моль) у ДХМ (10мл). Суміш перемішували при кімнатній температурі протягом ночі. Розчинник випарювали досуха. Продукт використовували без додаткового очищення, одержуючи 1,3г (кількісно) проміжної сполуки 31. Приклад A12 Одержання проміжної сполуки 32 n-BuLi 1,6M (0,0451моль) повільно додавали при -78°C в потоці N2 до розчину 6-бром-3-етил-2метоксихіноліну (0,0376моль) у ТГФ (200мл). Суміш перемішували протягом 90хв. і знову охолоджували до -78°C. Додавали по краплях суміш піперонілальдегіду (0,0376моль) у ТГФ (100мл). Суміш перемішували протягом 2 годин, виливали у воду та хлорид амонію і екстрагували EtOAc. Органічний шар відокремлювали, осушали (MgSО4), фільтрували та розчинник випарювали досуха. Залишок (14,9г) очищали хроматографією на колонці з силікагелем (15-35мкм) (елюент: ДХМ/MeOH 99/1). Чисті фракції збирали та розчинник випарювали. Залишок кристалізували з діетилового ефіру. Осад відфільтровували та сушили, одержуючи 1г проміжної сполуки 32, температура плавлення 116°C. Приклад A13 a) Одержання проміжної сполуки 33 45 Тіонілхлорид (0,069моль) додавали по краплях при 10°C в атмосфері N2 до розчину проміжної сполуки 10 (0,0183моль) у ДХМ (50мл) і суміш перемішували при 10°C протягом 1 години та при кімнатній температурі протягом ночі. Суміш упарювали і залишок поміщали в ДХМ. Суміш підлуговували 10% карбонатом калію та екстрагували ДХМ. Органічний шар осушали (MgSО4), фільтрували та випарювали, одержуючи 5,10г (94%) проміжної сполуки 33. b) Одержання проміжної сполуки 34 Суміш гідрохлориду 4,4-піперидиндіолу (0,1974моль) і карбонату калію (0,396моль) у ДМФА (150мл) перемішували при 40°C в потоці N2 протягом 15хв. і потім швидко додавали при 40°C в потоці N2 до розчину проміжної сполуки 33 (0,0987моль) у ДМФА (150мл). Суміш перемішували в потоці N2 протягом 12 годин. Розчинник випарювали досуха. Залишок поміщали у воду та ДХМ, промивали 3Н хлористоводневою кислотою та декантували. Водний шар підлуговували гідроксидом амонію та екстрагували ДХМ. Об'єднані органічні шари осушали (MgSО4), фільтрували та розчинник випарювали. Залишок (17г) очищали хроматографією на колонці з силікагелем (1540мкм) (елюент: ДХМ/MeOH/NH4OH 97/25/0,5). Чисті фракції збирали та розчинник випарювали. Залишок кристалізували із суміші 2пропанон/ДІПЕ. Осад відфільтровували та сушили, одержуючи 3,2г проміжної сполуки 34. Приклад A14 a) Одержання проміжної сполуки 35 1-Ацетил-4-піперидинкарбонілхлорид (0,1227моль) повільно додавали при 5°C до суміші хлориду алюмінію (0,2699 моль) в 1,2-дихлоретані (25л). Суміш нагрівали до 65°C. Додавали 2,3дигідро-1,4-бензодіоксин (0,18405моль). Суміш перемішували при 65°C протягом 15 годин, охолоджували до кімнатної температури, виливали у воду та екстрагували ДХМ. Органічний шар відокремлювали, осушали (MgSО4), фільтрували та розчинник випарювали досуха. Залишок (44,44г) очищали хроматографією на колонці з силікагелем (15-35мкм) (елюент: ДХМ/MeOH 97,5/2,5). Чисті фракції збирали та розчинник випарювали. Частину (0,2г) залишку (27г, 76%) кристалізували з МЕК і ДІПЕ. Осад відфільтровували та сушили, одержуючи проміжну сполуку 35, температура плавлення 102°C. b) Одержання проміжної сполуки 36 86777 46 n-BuLi 1,6M у гексані (0,09моль) повільно додавали при -78°C в потоці N2 до розчину 6-бром-3етил-2-метоксихіноліну (0,075моль) у ТГФ (200мл). Суміш перемішували протягом 1 години. Суміш проміжної сполуки 35 (0,075моль) у ТГФ (100мл) додавали по краплях при -78°C. Суміш перемішували при -30°C протягом 2годин, виливали у воду та хлорид амонію та екстрагували EtOAc. Органічний шар відокремлювали, осушали (MgSО4), фільтрували та розчинник випарювали досуха. Залишок (37,1г) очищали хроматографією на колонці з силікагелем (15-35мкм) (елюент: ДХМ/MeOH/NH4OH 97/3/0,15). Потрібні фракції збирали та випарювали розчинник. Залишок кристалізували з ДІПЕ. Осад відфільтровували та сушили, одержуючи 0,8г проміжної сполуки 36, температура плавлення 114°C. c) Одержання проміжної сполуки 37. Суміш проміжної сполуки 36 (0,0504моль) в 3Н хлористоводневій кислоті (400мл) і ТГФ (200мл) перемішували та кип'ятили зі зворотним холодильніком протягом 12 годин, потім виливали в льодяну воду, підлуговували гідроксидом амонію та екстрагували ДХМ. Органічний шар відокремлювали, осушали (MgSО4), фільтрували та розчинник випарювали. Залишок очищали хроматографією на колонці з силікагелем (елюент: ДХМ/MeOH/NH4ОH 90/10/0,1). Чисті фракції збирали та розчинник випарювали. Залишок кристалізували з ДІПЕ. Осад відфільтровували та сушили, одержуючи 7,45г (37%) проміжної сполуки 37, температура плавлення 249°C. d) Одержання проміжної сполуки 38 Суміш проміжної сполуки 37 (0,015моль) в MeOH (100мл) гідрували при 50°C при тиску 20 бар протягом 15 годин на Pd/C 10% (1,3г) як каталізаторі. Після поглинання H2 каталізатор відфільтровували. Гідрування продовжували. Після поглинання H2 каталізатор відфільтровували та фільтрат випарювали досуха. Залишок (5,4г) очи 47 щали хроматографією на колонці з силікагелем (15-40мкм) (елюент: ДХМ/MeOH/NH4ОH 85/15/1). Потрібні фракції збирали та розчинник випарювали, одержуючи 3,5г (54%) проміжної сполуки 38. Приклад A15 a) Одержання проміжної сполуки 39 n-BuLi 1,6M (0,02986моль) додавали при -78°C в потоці N2 до розчину 6-бром-3-етил-2метоксихіноліну (0,02488моль) у ТГФ (120мл). Суміш перемішували при -30 °C протягом 1 години та знов охолоджували до -70°C. Повільно додавали суміш 1-(2,3-дигідро-1,4-бензодіоксин-6-іл)-3-(1піперидиніл)-1-пропанону (0,02488моль) у ТГФ (60мл). Суміш перемішували при -70 °C протягом 1 години, виливали у воду та хлорид амонію і екстрагували EtOAc. Органічний шар відокремлювали, осушали (MgSО4), фільтрували та розчинник випарювали досуха. Залишок (14,92г) очищали хроматографією на колонці з силікагелем (15-35мкм) (елюент: ДХМ/MeOH/NH4ОH 94/6/0,1). Потрібні фракції збирали та розчинник випарювали, одержуючи 7,2г (63%) проміжної сполуки 39. b) Одержання проміжних сполук 40, 41 та 42 Проміжна сполука 40 (суміш Е + Z ізомерів) Проміжна сполука 41 (Е ізомер) 86777 48 Проміжна сполука 4 (Z ізомер) Суміш проміжної сполуки 39 (0,0123моль) в 6Н хлористоводневій кислоті (95мл) і ТГФ (38мл) перемішували та кип'ятили зі зворотним холодильніком протягом 15 годин, охолоджували до кімнатної температури, виливали на лід, підлуговували концентрованим розчином гідроксиду амонію та екстрагували ДХМ. Органічний шар відокремлювали, осушали (MgSО4), фільтрували та розчинник випарювали досуха. Залишок очищали хроматографією на колонці з силікагелем (5-35мкм) (елюент: ДХМ/MeOH/NH4ОH 94/6/0,5). Три потрібних фракції збирали та їхні розчинники випарювали, одержуючи 2,1г F1 (E ізомер), 2г F2 (Z ізомер) і 0,67г проміжної сполуки 40 (суміш E+Z ізомерів). Фракції F1 та F2 кристалізували з 2-пропанону. Осад відфільтровували та сушили, одержуючи 0,7г проміжної сполуки 41 (E) і 0,7г проміжної сполуки 42 (Z). Приклад A16 Одержання проміжної сполуки 43 a-Етилцинамоїлхлорид (0,107моль) додавали при 0°C до розчину 4-(1H-імідазол-1ілфенілметил)бензаміну (0,089моль) у піридині (20мл) та ДХМ (150мл) і суміш перемішували протягом 4 годин. Суміш випарювали досуха, залишок підлуговували гідроксидом амонію та екстрагували ДХМ. Органічний шар осушали (MgSО4), фільтрували та випарювали досуха. Продукт використовували без додаткового очищення, одержуючи проміжну сполуку 43. Приклад A17 а) Одержання проміжної сполуки 44 До розчину 1-(4-хлорфеніл)-2-(4нітрофеніл)етанону (0,09064моль) в MeOH (500мл) додавали нікель Ренея (25г). Суміш перемішували при зниженому тиску (3 бар) протягом 30 хвилин. Потім гарячу реакційну суміш фільтрували. Розчинник випарювали, одержуючи проміжну сполуку 44. b) Одержання проміжної сполуки 45 До розчину проміжної сполуки 44 (0,252моль) у ДХМ (600мл) додавали по краплях ангідрид оцтової кислоти (71,5мл). Суміш перемішували протя 49 гом 1 години при кімнатній температурі. Потім суміш виливали в холодну воду, нейтралізували концентрованим гідроксидом амонію, декантували, промивали, сушили та розчинник випарювали, одержуючи 72г (99%) проміжної сполуки 45, температура плавлення 190°C. c) Одержання проміжної сполуки 46 До суміші проміжної сполуки 45 (0,25моль) в ангідриді оцтової кислоти (500мл) при кімнатній температурі, додавали порціями азотну кислоту (димлячу) (39,6мл). Суміш перемішували протягом 1 години. Потім суміш виливали в льодяну воду, нейтралізували концентрованим гідроксидом амонію, фільтрували, промивали МЕК і сушили, одержуючи 47г (56,5%) проміжної сполуки 46, температура плавлення 145°C. d) Одержання проміжної сполуки 47 Суміш проміжної сполуки 46 (0,1202моль) в 3Н хлористоводневій кислоті (100мл) і ТГФ (300мл) перемішували при 60°C протягом 12 годин, виливали у воду та екстрагували три рази ДХМ (3´80мл). Органічний шар відокремлювали, осушали (MgSО4), фільтрували та розчинник випарювали, одержуючи 34г (97%) проміжної сполуки 47, температура плавлення 112°C. e) Одержання проміжної сполуки 48 Суміш проміжної сполуки 47 (0,0103моль) в MeOH (350мл) гідрували при кімнатній температурі при тиску 3 бар протягом 90хв. на нікелі Ренея (34г) як каталізаторі. Після поглинання H2 (3екв.) каталізатор відфільтровували через целіт, промивали MeOH і фільтрат випарювали, одержуючи 23г (75%) проміжної сполуки 48, температура плавлення 128°C. f) Одержання проміжних сполук 49 та 50 Проміжна сполука 49 та 86777 50 Проміжна сполука 50 Суміш проміжної сполуки 48 (0,0882моль) у воді (160мл) перемішували при 0°C. Додавали порціями розчин 2-оксомасляної кислоти (0,112моль) в оцтовій кислоті (70мл) при 0°C. Суміші давали нагрітися до кімнатної температури, потім перемішували при кімнатній температурі протягом 12 годин, виливали у воду та 3Н гідроксид натрію і екстрагували ДХМ та MeOH. Органічний шар відокремлювали, осушали (MgSО4), фільтрували та розчинник випарювали. Залишок (33г) розчиняли в суміші ДХМ/MeOH/NH4OH 97/3/0,1. Осад відфільтровували(*) і двічі кристалізували з MeOH і ДХМ. Осад відфільтровували та сушили, одержуючи 0,64г (3%) проміжної сполуки 49, температура плавлення 228°C. (*) Фільтрат очищали хроматографією на колонці з силікагелем (20-45мкм) (елюент: ДХМ/MeOH/NH4OH 97/3/0,1). Потрібні фракції збирали та розчинник випарювали. Залишок кристалізували з 2-пропанону та діетилового ефіру. Осад відфільтровували та сушили, одержуючи 1,5г (5%) проміжної сполуки 50, температура плавлення 236°C. Приклад A18 a) Одержання проміжної сполуки 51 До розчину проміжної сполуки 46 (0,141моль) в MeOH (500мл), охолодженого до 10°C, додавали порціями гідроборат натрію (0,0141 моль). Потім додавали воду та осад відфільтровували, промивали і сушили, одержуючи 44г (93,2%) проміжної сполуки 51. b) Одержання проміжної сполуки 52 До розчину проміжної сполуки 51 (0,131моль) у ДХМ (400мл) додавали триетиламін (36,6мл). Суміш охолоджували до 0°C. Потім додавали по краплях метансульфонілхлорид (20,35мл). Суміш перемішували протягом ночі при кімнатній температурі. Потім суміш виливали в льодяну воду, декантували, промивали, осушали (MgSО4) і розчинник випарювали, одержуючи 58г (100%) проміжної сполуки 52. c) Одержання проміжної сполуки 53 51 86777 52 порціями гідроборат натрію (0,0141моль). Потім додавали воду та відфільтровували осад, промивали і сушили, одержуючи 44г (93,2%) проміжної сполуки 56. b) Одержання проміжної сполуки 57 Суміш проміжної сполуки 52 (0,131моль) в ацетонітрилі (400мл), 1H-імідазолі (0,658 моль) і карбонаті калію (89,06г) перемішували при 80°C протягом ночі. Розчинник випарювали досуха, а потім осад поміщали в ДХМ, декантували, промивали, сушили та розчинник випарювали. Залишок (35г) очищали хроматографією на колонці з силікагелем (елюент: ДХМ/MeOH 98/2), одержуючи 13г (27,6%) проміжної сполуки 53, температура плавлення 131°C. d) Одержання проміжної сполуки 54 Суміш проміжної сполуки 53 (0,0352моль) в 2Н гідроксиді натрію (130мл) та етанолі (13мл) перемішували при кімнатній температурі протягом 24 годин, потім реакційну суміш нейтралізували хлористоводневою кислотою та екстрагували ДХМ. Органічний шар промивали водою, осушали (MgSО4), фільтрували та розчинник випарювали. Залишок кристалізували із суміші ДІПЕ/2-пропанон і збирали осад, що утворився, одержуючи 10г (82,8%) проміжної сполуки 54, температура плавлення 153°C. e) Одержання проміжної сполуки 55 Метилсульфонілхлорид (0,048моль) повільно додавали при 0°C до розчину проміжної сполуки 56 (0,0239 моль) і триетаноламіну (0,048моль) у ДХМ (80мл). Суміші давали нагрітися до кімнатної температури протягом 4 годин. Розчинник випарювали досуха. Продукт використовували без додаткового очищення, одержуючи проміжну сполуку 57. c) Одержання проміжної сполуки 58 Суміш проміжної сполуки 57 (0,0291моль), піролідину (0,0871моль) і карбонату калію (0,0868 моль) в ацетонітрилі (150мл) перемішували та кип'ятили зі зворотним холодильніком протягом 12 годин, потім охолоджували, фільтрували, промивали ацетонітрилом, знову фільтрували та розчинник випарювали досуха. Залишок поміщали в ДХМ і воду. Органічний шар відокремлювали, осушали (MgSO4), фільтрували та розчинник випарювали. Залишок (12г) очищали хроматографією на колонці з силікагелем (15-40мкм) (елюент: ДХМ/MeOH/NH4ОH 99/1/0,1). Чисті фракції збирали та розчинник випарювали, одержуючи 1,7г (15%) проміжної сполуки 58. d) Одержання проміжної сполуки 59 Суміш проміжної сполуки 54 (0,0292моль) в MeOH (100мл) гідрували при кімнатній температурі протягом 1 години на нікелі Ренея (10г) як каталізаторі. Після поглинання H2 (3екв.) розчин фільтрували через целіт, і розчинник випарювали (у вакуумі), одержуючи 9,1г проміжної сполуки 55 (використовуваної в наступній реакції без додаткового очищення). Приклад A19 a) Одержання проміжної сполуки 56 Суміш проміжної сполуки 58 (0,00438моль) в 3Н гідроксиді натрію (80мл) і етанолі (20мл) перемішували при кімнатній температурі протягом 12 годин, виливали у воду та екстрагували ДХМ. Органічний шар відокремлювали, осушали (MgSО4), фільтрували та розчинник випарювали, одержуючи 1,2г (80%) проміжної сполуки 59. e) Одержання проміжної сполуки 60 До розчину проміжної сполуки 46 (0,141моль) в MeOH (500мл), охолодженого до 10°C, додавали Суміш проміжної сполуки 59 (0,00347моль) в MeOH (80мл) гідрували при кімнатній температурі при тиску 3 бар протягом 30хв. на нікелі Ренея 53 (1,2г) як каталізаторі. Після поглинання водню H2 (3екв.) каталізатор відфільтровували через целіт, промивали MeOH і фільтрат випарювали. Продукт використовували без додаткового очищення, одержуючи 0,98г проміжної сполуки 60. Приклад A20 a) Одержання проміжної сполуки 61 Реакція (I): Суміш 4-хлор-3-нітробензойної кислоти (0,125моль) у тіонілхлориді (30мл) і хлороформі (60мл) перемішували та кип'ятили зі зворотним холодильніком протягом 4,5 годин, а потім реакційну суміш концентрували досуха з одержанням залишку (I). Реакція (II): Залишок (I) розчиняли в хлорбензолі (65мл) і розчин, що утворився, додавали по краплях при охолодженні (льодяна баня) до перемішуваної суспензії хлориду алюмінію (0,188моль) у хлорбензолі (65мл). Реакційну суміш перемішували протягом ночі при кімнатній температурі та виливали у воду з льодом, потім екстрагували ДХМ. Екстракт промивали розчином NaHCO3 і водою, потім осушали (MgSО4) і концентрували (у вакуумі) досуха. Залишок кристалізували з 2-пропанолу і потрібний продукт збирали, одержуючи 23,7г проміжної сполуки 61, температура плавлення 83,4°C. b) Одержання проміжної сполуки 62 Суміш проміжної сполуки 61 (0,06моль) і NH3 (10г) в MeOH (180мл) та діоксиді тіофану (20мл) нагрівали протягом ночі в нагрівальній трубці при 120-130°C, потім відганяли MeOH при зниженому тиску і залишок перемішували в киплячому розчині розведеної хлористоводневої кислоти. Суміш охолоджували, і осад, що утворився, відфільтровували, потім промивали водою та перекристалізовували з етанолу. Нарешті, потрібнний продукт збирали, одержуючи 12г (72,3%) проміжної сполуки 62,температура плавлення 200,9°C. c) Одержання проміжної сполуки 63 Суміш проміжної сполуки 62 (0,0686моль) у ДХМ (200мл) та ацетилхлориді (20мл) перемішували протягом 12 годин при кімнатній температурі, а потім розчинник випарювали досуха. Залишок поміщали в діетиловий ефір (50мл), потім потрібн 86777 54 ний продукт відфільтровували та сушили, одержуючи 21,6г (99%) проміжної сполуки 63, температура плавлення 138°C. d) Одержання проміжної сполуки 64 Суміш проміжної сполуки 63 (0,066моль) в MeOH (200мл) перемішували при 0°C і по краплях додавали розчин гідроборату натрію (0,066моль) у воді, потім реакційну суміш перемішували протягом 1 години при кімнатній температурі та розчинник випарювали. Залишок екстрагували ДХМ/MeOH/H2О і екстракт осушали (MgSО4). Нарешті, розчинник випарювали і потрібний продукт збирали, одержуючи 20,4г (97%) проміжної сполуки 64, температура плавлення 198°C. e) Одержання проміжної сполуки 65 У тригорлій реакційній колбі (500мл), обладнаній краплинною лійкою та термометром, суміш проміжної сполуки 64 (0,062моль) та триетиламіну (0,125моль) у ДХМ (200мл) охолоджували до 0°C і додавали по краплях метилсульфонілхлорид (0,12 моль), підтримуючи температуру 0-5°C, потім реакційну суміш перемішували протягом 4 годин при кімнатній температурі та виливали у воду (1000мл). Органічний шар відокремлювали, осушали (MgSО4), фільтрували та розчинник випарювали, одержуючи 18г (масляниста рідина, 85%) проміжної сполуки 65. f) Одержання проміжної сполуки 66 Суміш проміжної сполуки 65 (0,0490моль), 1Н1,2,4-триазолу (0,265моль) і карбонату калію (0,267моль) в ацетонітрилі (200мл) перемішували та кип'ятили зі зворотним холодильніком протягом 2 годин, потім розчинник випарювали досуха і залишок розподіляли між водою та ДХМ. Органічний шар відокремлювали, осушали (MgSО4), фільтрували та розчинник випарювали. Залишок очищали високоефективною рідинною хроматографією на силікагелі (елюент: ДХМ/MeOH 98/2). Чисті фракції збирали та розчинник випарювали, одержуючи 14г (71%) проміжної сполуки 66. g) Одержання проміжної сполуки 67 55 Суміш проміжної сполуки 66 (0,0376моль) в 3Н хлористоводневій кислоті (80мл) перемішували при кімнатній температурі протягом 12 годин і додавали воду (200мл), потім реакційну суміш нейтралізували карбонатом калію та екстрагували ДХМ/MeOH. Органічний екстракт осушали (MgSО4) і розчинник випарювали. Залишок (12г) очищали хроматографією на колонці з силікагелем (елюент: ДХМ/MeOH 98/2). Фракції продукту збирали та розчинник випарювали, одержуючи 7,2г (58%) проміжної сполуки 67. h) Одержання проміжної сполуки 68 Суміш проміжної сполуки 67 (0,0218моль) в MeOH (100мл) гідрували протягом 1 години на нікелі Ренея (7г) як каталізаторі. Після поглинання H2 (3екв.) H2 видували за допомогою N2, і каталізатор відфільтровували через целіт. Залишок, що утворився, використовували на наступній стадії реакції без додаткової обробки, одержуючи 6,54г проміжної сполуки 68. Приклад A21 Одержання проміжної сполуки 69 n-BuLi 1,6M (0,02986 моль) додавали при -78°C в потоці N2 до розчину 6-бром-3-етил-2метоксихіноліну (0,02488моль) у ТГФ (120мл). Суміш перемішували при -30°C протягом 1 години та знову охолоджували до -70°C. Повільно додавали суміш 1-(2,3-дигідро-1,4-бензодіоксин-6-іл)-3-(1піперидиніл)-1-пропанону (0,02488моль) у ТГФ (60мл). Суміш перемішували при -70°C протягом 1 години, виливали у воду та хлорид алюмінію і екстрагували EtOAc. Органічний шар відокремлювали, осушали (MgSО4), фільтрували та розчинник випарювали досуха. Залишок (14,92г) очищали хроматографією на колонці з силікагелем (1535мкм) (елюент: ДХМ/MeOH/NH4ОH 94/6/0,1). Потрібні фракції збирали та розчинник випарювали, одержуючи 7,2г (63%) проміжної сполуки 69. Приклад A22 Одержання проміжної сполуки 70 n-BuLi 1,6M у гексані (0,09моль) повільно додавали при -78°C в потоці N2 до розчину 6-бром-3 86777 56 етил-2-метоксихіноліну (0,075моль) у ТГФ (200мл). Суміш перемішували протягом 1 години. Додавали по краплях суміш 1-ацетил-4-[(2,3-дигідро-1,4бензодіоксин-6-іл)карбоніл]піперидину (0,075моль) у ТГФ (100мл) при -78°C. Суміш перемішували при -30°C протягом 2 годин, виливали у воду та хлорид амонію та екстрагували EtOAc. Органічний шар відокремлювали, осушали (MgSО4), фільтрували та розчинник випарювали досуха. Залишок (37,1г) очищали хроматографією на колонці з силікагелем (15-35мкм) (елюент: ДХМ/MeOH/NH4OH 97/3/0,15). Потрібні фракції збирали та розчинник випарювали. Залишок кристалізували з ДІПЕ. Осад відфільтровували та сушили, одержуючи 0,8г проміжної сполуки 70, температура плавлення 114°C. B. Одержання кінцевих сполук Приклад B1 Одержання сполуки 1 Суміш проміжної сполуки 5 (0,013моль) в 6Н хлористоводневій кислоті (40мл) і 2-пропанолі (40мл) перемішували та нагрівали при 80°C протягом 6 годин. Суміш охолоджували до кімнатної температури, виливали в льодяну воду, підлуговували NH4OH та екстрагували ДХМ. Органічний шар осушали (MgSО4), фільтрували та випарювали. Залишок очищали хроматографією на колонці з силікагелем (15-40мкм) (елюент: ДХМ/MeOH/NH4OH 97/3/0,1). Чисті фракції збирали та випарювали. Залишок (3,9г) кристалізували з EtOAc, одержуючи 2,47г (27%) сполуки 1, температура плавлення 174,3°C. Приклад B2 Одержання сполуки 2 Сірчану кислоту (1мл) додавали при 0°C до розчину оксиду хрому(VI) (0,01186моль) у воді (2,2мл). Одержану суміш потім додавали при 0°C до суспензії проміжної сполуки 7 (0,00593моль) в 2-пропаноні (40мл). Суміш перемішували при кімнатній температурі протягом 3 годин, виливали в 10% водний розчин карбонату калію та екстрагували ДХМ. Осад відфільтровували та промивали киплячою сумішшю ДХМ та MeOH (50/50). Об'єднані органічні шари осушали (MgSО4), фільтрували та розчинник випарювали досуха. Залишок кристалізували з MeOH. Осад відфільтровували та сушили, одержуючи 0,69г сполуки 2, температура плавлення 255°C. Приклад B3 Одержання сполуки 3 57 86777 58 Суміш проміжної сполуки 10 (0,01432моль) в ангідриді оцтової кислоти (50мл) перемішували при 100°С протягом 3 годин. Суміш виливали на лід, підлуговували гідроксидом амонію та екстрагували EtOAc. Органічний шар промивали водою, осушали (MgSО4), фільтрували та випарювали досуха. Залишок очищали хроматографією на колонці з силікагелем (15-40мкм) (елюент: ДХМ/MeOH/NH4OH 97/3/0,1). Чисті фракції збирали та розчинник випарювали. Залишок кристалізували з діетилового ефіру, одержуючи 65г (36%) сполуки 3, температура плавлення 168,2°C. Приклад B4 Одержання сполуки 4 Формальдегід (0,189моль) і ціантригідроборат натрію (0,028моль) додавали до суміші проміжної сполуки 17 (0,00945моль) в ацетонітрилі (50мл). Обережно додавали оцтову кислоту (0,019моль) протягом 10хв. і суміш перемішували при кімнатній температурі протягом 3 годин. Суміш екстрагували діетиловим ефіром і промивали 3Н гідроксидом натрію. Органічний шар осушали (MgSО4), фільтрували та випарювали. Залишок перекристалізовували з 2-пропанону, одержуючи 1,6г (76%) сполуки 6, температура плавлення 226,7°C. Приклад B7 Одержання сполуки 7 Суміш проміжної сполуки 12 (0,022моль) і тозилхлориду (0,033моль) в 10% карбонаті калію (100мл) і ДХМ (100мл) перемішували при кімнатній температурі протягом 1 години. Суміш екстрагували ДХМ. Органічний шар осушали (MgSO4), фільтрували та випарювали. Залишок перекристалізовували з діетилового ефіру, одержуючи 5г (84%) сполуки 4, температура плавлення 227,5°C. Приклад B5 Одержання сполуки 5 1-Піперидинпропанамін (0,0794моль) додавали до розчину проміжної сполуки 19 (0,0265моль) у ТГФ (200мл). Суміш перемішували при кімнатній температурі протягом 4 годин. Розчинник випарювали досуха. Залишок промивали кілька разів водою та поміщали в ДХМ/MeOH 98/2. Органічний шар осушали (MgSО4), фільтрували та розчинник випарювали. Залишок (4г) очищали хроматографією на колонці з силікагелем (35-70мкм) (елюент: ДХМ/MeOH/NH4OH 90/10/1). Чисті фракції збирали та розчинник випарювали. Залишок промивали діетиловим ефіром і сушили. Залишок (2,8г) поміщали в 10% карбонат калію та ДХМ і екстрагували ДХМ. Органічний шар відокремлювали, осушали (MgSО4), фільтрували і розчинник випарювали. Залишок (2,2г) кристалізували з діетилового ефіру. Осад відфільтровували та сушили, одержуючи 1,85г (16%) сполуки 7 у вигляді гідрату (1:1). Приклад B8 Одержання сполуки 8 Розчин проміжної сполуки 15 (0,044моль) в ангідриді оцтової кислоти (100мл) перемішували та кип'ятили зі зворотним холодильніком протягом 12 годин. Суміш випарювали досуха. Залишок поміщали у воду, підлуговували гідроксидом амонію та екстрагували ДХМ. Органічний шар осушали (MgSО4), фільтрували та випарювали досуха. Залишок (13,49г) очищали хроматографією на колонці з силікагелем (елюент: ДХМ/MeOH/NH4OH 97/3/0,1). Чисті фракції збирали та випарювали. Залишок (3г, 22%) додавали до розчину активованого вугілля та MeOH. Суміш перемішували, фільтрували через целіт і випарювали досуха. Осад кристалізували з МЕК, одержуючи 1,77г (13%) сполуки 5, температура плавлення 254,2°C. Приклад B6 Одержання сполуки 6 Ацетилхлорид (0,012моль) у ДХМ додавали при 0°C до розчину проміжної сполуки 21 (0,01моль) у ДХМ (52мл) та піридині (3мл) і суміш перемішували при кімнатній температурі протягом 2 годин. Додавали воду та продукт екстрагували ДХМ. Органічний шар промивали водною 1Н HCl, потім водним 10% карбонатом калію, осушали (MgSО4), фільтрували та випарювали. Залишок (3,02г) перекристалізовували з EtOAc і діетилового ефіру, одержуючи 1,7г (51%) сполуки 8, темпера 59 тура плавлення 206,2°C. Приклад B9 Одержання сполуки 9 Розчин проміжної сполуки 23 (0,0088моль) в MeOH (50мл) перемішували та кип'ятили зі зворотним холодильніком протягом 4 годин. Суміш охолоджували до кімнатної температури та випарювали у вакуумі. Залишок поміщали в EtOAc/ДХМ/MeOH і перемішували з активованим вугіллям. Осад відфільтровували через целіт і фільтрат випарювали. Залишок перекристалізовували із ДХМ/MeOH, одержуючи 1,5г (62%) сполуки 9, температура плавлення 207,3°C. Приклад B10 Одержання сполуки 10 12Н Хлористоводневу кислоту (20мл) і хлорид олова(II) (0,0888моль) додавали до суміші проміжної сполуки 26 (0,0148 моль) в оцтовій кислоті (80мл). Суміш перемішували при 120°C протягом 24 годин, виливали у воду, підлуговували гідроксидом амонію, фільтрували через целіт і промивали ДХМ. Органічний шар відокремлювали, осушали (MgSO4), фільтрували та розчинник випарювали. Залишок (4,86г) кристалізували з 2пропанону та діетилового ефіру. Осад відфільтровували та сушили. Залишок (4,05г, 83%) поміщали в ДХМ. Суміш промивали водою та фільтрували через целіт. Органічний шар відокремлювали, осушали (MgSО4), фільтрували та розчинник випарювали. Залишок (3,46г) кристалізували з 2пропанону та діетилового ефіру. Осад відфільтровували та сушили, одержуючи 2,71г сполуки 10 у вигляді гідрату (1:1), температура 240°C. Приклад B11 Одержання сполуки 11 Суміш проміжної сполуки 31 (0,0028моль), проміжної сполуки 27 (0,0056моль) і карбонату калію (0,0084моль) в ацетонітрилі (10мл) перемішували при 80°C протягом 2 годин. Додавали воду. Суміш екстрагували EtOAc. Органічний шар відокремлювали, осушали (MgSО4), фільтрували та розчинник випарювали. Залишок (1,1г) очищали хроматографією на колонці з силікагелем (15 86777 60 40мкм) (елюент: ДХМ/MeOH/NH4ОH 94/6/0,2). Чисті фракції збирали та розчинник випарювали. Залишок (0,6г, 43%) кристалізували з діетилового ефіру. Осад відфільтровували та сушили, одержуючи 0,201г (14%) сполуки 11, температура плавлення 116°C. Приклад B12 Одержання сполуки 12 Суміш проміжної сполуки 32 (0,0235моль) в 3Н хлористоводневій кислоті (132мл) і ТГФ (80мл) перемішували та кип'ятили зі зворотним холодильніком протягом 4 годин, охолоджували до кімнатної температури та виливали в льодяну воду. Осад відфільтровували, промивали водою та діетиловим ефіром і сушили. Частину (1г) залишку (5,7г) кристалізували з 2-пропанону. Осад відфільтровували, промивали діетиловим ефіром і сушили, одержуючи 0,5г сполуки 12, температура плавлення 211°C. Приклад B13 Одержання сполуки 13 Ціантригідроборат натрію (0,0147моль) додавали порціями до розчину проміжної сполуки 34 (0,0147моль) і 2-метоксіетанаміну (0,0176моль) в MeOH (80мл) при перемішуванні при 0°C в потоці N2. Суміші давали нагрітися до кімнатної температури протягом 30хв., потім виливали у воду та екстрагували двічі ДХМ (2´100мл). Об'єднані органічні шари осушали (MgSО4), фільтрували та розчинник випарювали. Залишок (5г) очищали хроматографією на колонці з силікагелем (15-40мкм) (елюент: ДХМ/MeOH/NH4OH 95/5/0,3). Чисті фракції збирали та розчинник випарювали. Залишок кристалізували. Осад відфільтровували та сушили. Осад перекристалізовували з діетилового ефіру та петролейного ефіру. Осад відфільтровували та сушили, одержуючи 2,1г (34%) сполуки 13. Приклад B14 Одержання сполук 14 та 15 Сполука 14 та
ДивитисяДодаткова інформація
Назва патенту англійською6-alkenyl and 6-phenylalkyl substituted 2-quinolinones and 2-quinoxalinones as poly(adp-ribose) polymerase inhibitors
Автори англійськоюMabire Dominique Jean-Pierre, Guillemont Jerome Emile George, van Dun Jacobus Alphonsus Josephus, Somers Maria Victorina Francis, Wouters Walter Boudewijn Leopold
Назва патенту російською6-алкенил- и 6-фенилалкилзамещенные 2-хинолиноны и 2-хиноксалиноны как ингибиторы поли(адф-рибоза)полимеразы
Автори російськоюМабир Доминик Жан-Пьер, Жильмон Жером Эмиль Жорж, ван Дун Якобус Алфонсус Джосепхус, Сомерс Мария Викторина Франциска, Воутерс Валтер Боудевиджн Леопольд
МПК / Мітки
МПК: A61P 21/00, C07D 215/227, C07D 405/14, C07D 407/12, A61P 1/04, C07D 407/06, A61P 19/02, A61P 25/28, C07D 241/44, A61K 31/4704, A61K 31/498, C07D 405/06, A61P 13/12, C07D 403/06, C07D 401/06
Мітки: інгібітори, 6-фенілалкілзаміщені, полі(адф-рибоза)полімерази, 6-алкеніл, 2-хінолінони, 2-хіноксалінони
Код посилання
<a href="https://ua.patents.su/48-86777-6-alkenil-ta-6-fenilalkilzamishheni-2-khinolinoni-ta-2-khinoksalinoni-yak-ingibitori-poliadf-ribozapolimerazi.html" target="_blank" rel="follow" title="База патентів України">6-алкеніл- та 6-фенілалкілзаміщені 2-хінолінони та 2-хіноксалінони як інгібітори полі(адф-рибоза)полімерази</a>
Попередній патент: Похідні бензімідазолу, фармацевтична композиція, яка їх містить, спосіб їх отримання та застосування
Наступний патент: Пристрій для застосування лікарського засобу
Випадковий патент: Пастоподібний плавлений сир функціонального призначення